Номенклатура аминокислот | Химия онлайн
Номенклатура аминокислот
Для названия аминокислот используют три типа номенклатуры – тривиальную, рациональнцю и IUPAC.
По систематической номенклатуре (IUPAC) названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Нумерация углеродной цепи начинается с атома углерода карбоксильной группы.
По рациональной номенклатуре к тривиальному названию карбоновой кислоты добавляется приставка амино с указанием положения аминогруппы буквой греческого алфавита.
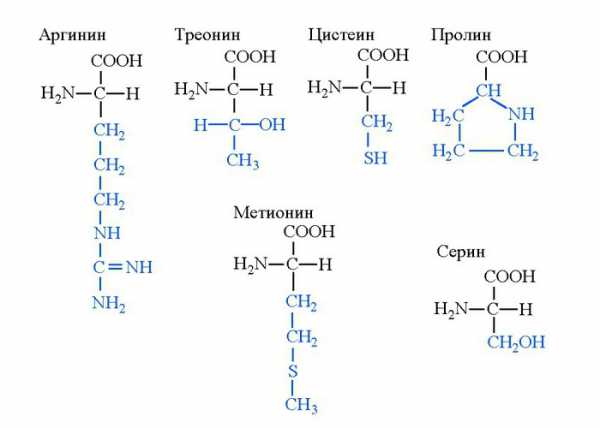
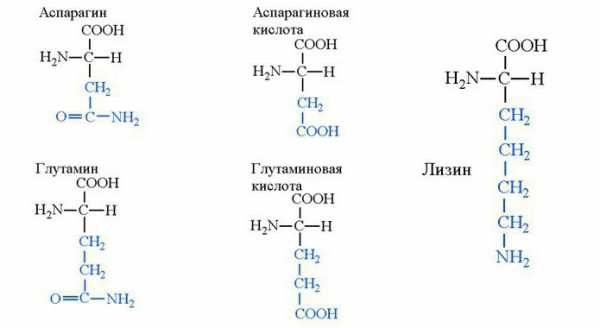
Формулы и названия некоторых α-аминокислот, остатки которых входят в состав белков
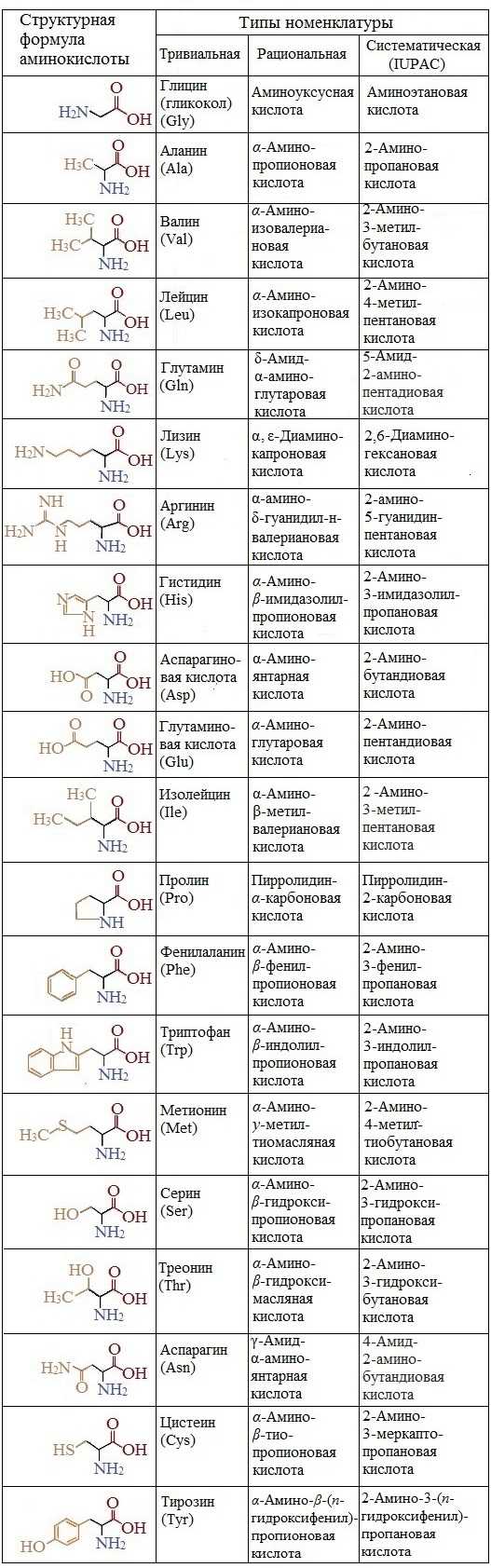
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка
Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота.
Аминокислоты
himija-online.ru
10 класс. Химия. Аминокислоты. Названия и свойства аминокислот — Аминокислоты. Названия и свойства аминокислот
Комментарии преподавателя
Среди азотсодержащих органических веществ имеются соединения с двойственной функцией. Особенно важными из них являются аминокислоты.
В клетках и тканях живых организмов встречается около 300 различных аминокислот, но только 20 (α-аминокислоты) из них служат звеньями (мономерами), из которых построены пептиды и белки всех организмов (поэтому их называют белковыми аминокислотами). Последовательность расположения этих аминокислот в белках закодирована в последовательности нуклеотидов соответствующих генов. Остальные аминокислоты встречаются как в виде свободных молекул, так и в связанном виде. Многие из аминокислот встречаются лишь в определенных организмах, а есть и такие, которые обнаруживаются только в одном из великого множества описанных организмов. Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты; животные и человек не способны к образованию так называемых незаменимых аминокислот, получаемых с пищей. Аминокислоты участвуют в обмене белков и углеводов, в образовании важных для организмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотиков и т. д.; некоторые аминокислоты служат посредниками при передаче нервных импульсов.
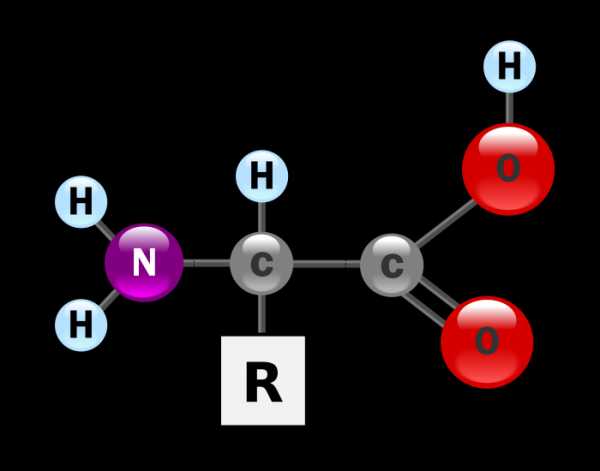
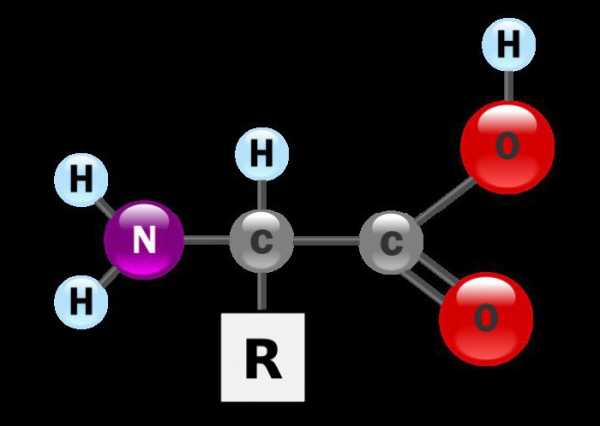
Аминокислоты — органические амфотерные соединения, в состав которых входят карбоксильные группы – СООН и аминогруппы -Nh3.
Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых атом водорода в радикале замещен аминогруппой.
КЛАССИФИКАЦИЯ
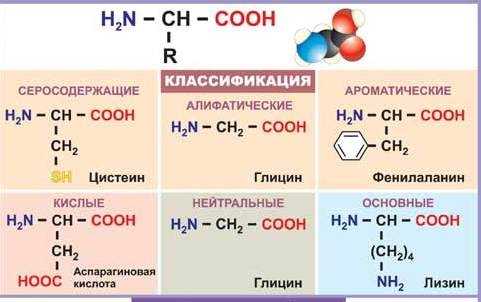
Аминокислоты классифицируют по структурным признакам.
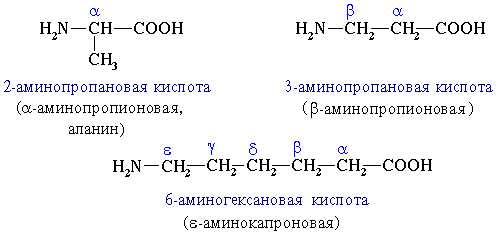
1. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
2. В зависимости от количества функциональных групп различают кислые, нейтральные и основные.
3. По характеру углеводородного радикала различают алифатические (жирные),ароматические, серосодержащие
и гетероциклические аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.Примером ароматической аминокислоты может служить пара-аминобензойная кислота:
Примером гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота
НОМЕНКЛАТУРА
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.
Например:
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
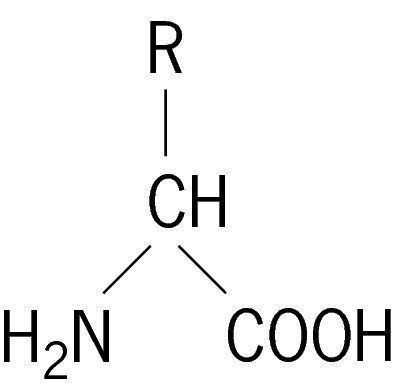
Для α-аминокислот R-CH(Nh3)COOH
, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Таблица. Некоторые важнейшие α-аминокислоты
|
Аминокислота |
Сокращённое обозначение |
Строение радикала ( R )
|
|
Глицин |
Gly (Гли) |
H — |
|
Аланин |
Ala (Ала) |
Ch4 — |
|
Валин |
Val (Вал) |
(Ch4)2CH — |
|
Лейцин |
Leu (Лей) |
(Ch4)2CH – Ch3 — |
|
Серин |
Ser (Сер) |
OH- Ch3 — |
|
Тирозин |
Tyr (Тир) |
HO – C6h5 – Ch3 — |
|
Аспарагиновая кислота |
Asp (Асп) |
HOOC – Ch3 — |
|
Глутаминовая кислота |
Glu (Глу) |
HOOC – Ch3 – Ch3 — |
|
Цистеин |
Cys (Цис) |
HS – Ch3 — |
|
Аспарагин |
Asn (Асн) |
O = C – Ch3 – │ Nh3 |
|
Лизин |
Lys (Лиз) |
Nh3 – Ch3- Ch3 – Ch3 — |
|
Фенилаланин |
Phen (Фен) |
C6H5 – Ch3 — |
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино-, три группы Nh3 – триамино- и т.д.
Пример:
Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диоваяили -триовая кислота:
ИЗОМЕРИЯ
1. Изомерия углеродного скелета
2. Изомерия положения функциональных групп
3. Оптическая изомерия
α-аминокислоты, кроме глицина NН2-Ch3-COOH.
ФИЗИЧЕСКИЕ СВОЙСТВА
Аминокислоты представляют собой кристаллические вещества с высокими (выше 250°С) температурами плавления, которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны. Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в воде и нерастворимы в органических растворителях, чем они похожи на неорганические соединения. Многие аминокислоты обладают сладким вкусом.
ПОЛУЧЕНИЕ
3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α — аминокислоты белков.
ХИМИЧЕСКИЕ СВОЙСТВА
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
Видео-опыт «Свойства аминоуксусной кислоты»
I. Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
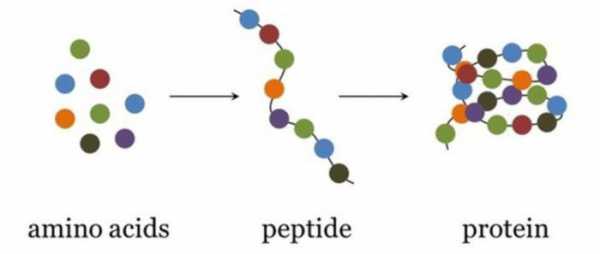
2. Поликонденсация → образуются полипептиды (белки):
При взаимодействии двух α-аминокислот образуется дипептид.
3. Разложение → Амин + Углекислый газ:
Nh3-Ch3-COOH → Nh3-Ch4 + CO2↑
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
Nh3-Ch3-COOH + NaOH → Nh3-Ch3-COONa + h3O
Nh3-Ch3-COONa — натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации): Nh3-Ch3-COOH + Ch4O
Nh3-Ch3-COOCh4 — метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
Nh3-CH(R)-COOH + H-Nh3 → Nh3-CH(R)-CONh3 + h3O
4. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-Ch3-Nh3 + HCl → [HOOC-Ch3-Nh4]Cl
или HOOC-Ch3-Nh3*HCl
2. С азотистой кислотой (подобно первичным аминам):
Nh3-CH(R)-COOH +
www.kursoteka.ru
Название — аминокислота — Большая Энциклопедия Нефти и Газа, статья, страница 1
Название — аминокислота
Cтраница 1
Названия аминокислот образуются добавлением приставки амино — к названию карбоновой кислоты. [1]
Названия аминокислот произошли в основном от исходных материалов, из которых они были впервые выделены; например, аспарагин ( от лат. Gluten — клейковина) — из клейковины пшеницы, серии ( от греч. Другие названия связаны с методами выделения. [2]
Названия аминокислот по заместительной номенклатуре производят из названия кислоты с приставкой амино -; положение аминогруппы указывается цифрой обычно принятым способом. [3]
Названия аминокислот, входящих в состав комплексных солей металлов: Gly — глицин; Dap-L — или D L-a, р-диаминопропионовая кислота; Asp — аспарагиновая кислота; Val — валии; Ala — аланин. [4]
Названия аминокислот, входящих в состав комплексных солей Со: Gly — глицин; Sar — саркозин; Leu — лейцин; Nleu — норлейцин; Пей — изолейцин; Glu — глутаминовая кислота; a — Iabu — а-ами-ноизомасляная кислота; Val — валин; GluOMe — метиловый эфир глутаминовой кислоты. [5]
При названии аминокислот по рациональной номенклатуре слово амино добавляется к тривиальному названию карбоновой кислоты, а положение аминогруппы обозначают буквами греческого алфавита. [6]
ЭВМ сообщает номера пиков, названия аминокислот, время, прошедшее с момента начала анализа до момента выхода пика соответствующей кислоты в минутах и секундах, тип разрешения пика, площадь пика, количество соединения в наномолях, калибровочный коэффициент, используемый для расчетов, и уровень нулевой линии для того пика, для которого проводились расчеты. [7]
При замене аминокислотного остатка в пептиде название аминокислоты, которая замещает другую, а также положение замены указывают в квадратных скобках перед тривиальным названием соответствующего пептида. В краткой форме, которую применяют только в таблицах, место замены указывается цифрой, стоящей сверху у символа заменяющей аминокислоты. [8]
Подобное структурное сходство дает основание ожидать, что названия аминокислот уже говорят о природе их радикалов. К сожалению, тривиальные названия не позволят сделать заключение о природе радикала, если мы не знаем заранее, какой структуре соответствует данное название. Вот почему мы вынуждены запоминать для каждой аминокислоты ее название и структуру. Возможно, удобнее было бы пользоваться номенклатурой TUPAC для обозначения аминокислот, однако тривиальные названия уже прочно вошли в обиход органической химии и, что еще важнее, биохимии. [9]
Реакции окислительного дезаминирования катализируются ферментами, которые получили название оксидаз аминокислот. Они представляют собой двухкомпонентные ферменты, в состав активной группы которых входит флавинаденин-динуклеотид. Эти ферменты характеризуются высокой специфичностью. [10]
Отметим, что первая часть названия дипептида образуется из названия аминокислоты, связанной по своей карбоксильной группе, и суффикса — ил, а вторая его часть-из названия аминокислоты, связанной по своей аминогруппе. [11]
Но в обиход прочно вошли эмпирические ( тривиальные) названия аминокислот, которыми широко пользуются в химии, в биологических науках и в технологии, а также в сельскохозяйственной науке и практике. [12]
Название пептида формируется путем последовательного перечисления, начиная с N-конца, названий аминокислот, включенных в пептид; при этом суффикс — ин заменяется на суффикс — ил для всех аминокислот, кроме С-концевой. Для описания структур пептидов применяют не традиционные структурные формулы, а сокращенные обозначения, позволяющие сделать запись более компактной. Для этого остатку каждой природной аминокислоты присвоено трехбуквенное обозначение ( см. с. При описании структуры пептида последовательно перечисляют трехбуквенные обозначения остатков аминокислот, начиная с N-конца. [13]
У гидроксиаминокислот после первых двух букв Ну от латинского слова hydro следует первая буква названия аминокислоты, например для гидроксилизина — Hyl или для гидроксипролина — Hyp. Однако более удобен пятибуквенный символ: Hylys и Нурго соответственно. Для аминокислот небелкового происхождения также введены сокращения. [14]
Аминокислотами называются органические соединения, в молекулах которых одновременно содержатся аминогруппы — Nh3 и карбоксильные группы — СООН Названия аминокислот строятся из названий соответствующих карбоновых кислот с прибавлением приставки амино — и с указанием положения аминогруппы цифрой или греческой буквой. [15]
Страницы: 1 2
www.ngpedia.ru
названия, формулы, значение. Аланин, валин, серин, лизин, пролин, тирозин :: SYL.ru
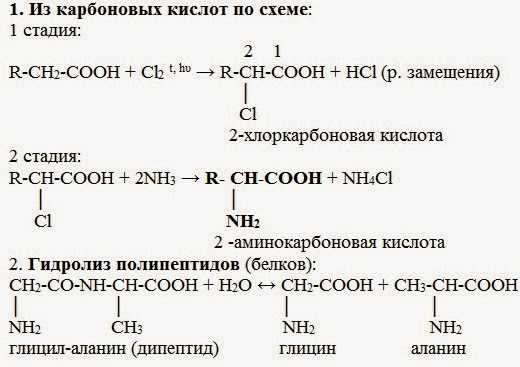
Химические вещества, содержащие структурные компоненты молекулы карбоновой кислоты и амина, называются аминокислотами. Это общее название группы органических соединений, в составе которых присутствует углеводородная цепь, карбоксильная группа (-СООН) и аминогруппа (-Nh3). Их предшественниками являются карбоновые кислоты, а молекулы, у которых водород у первого углеродного атома замещен аминогруппой, называются альфа-аминокислотами.
Всего 20 аминокислот имеют ценность для ферментативных реакций биосинтеза, протекающих в организме всех живых существ. Эти вещества называются стандартными аминокислотами. Существуют также нестандартные аминокислоты, которые включены в состав некоторых специальных белковых молекул. Они не встречаются повсеместно, хотя выполняют важную функцию в живой природе. Вероятно, радикалы этих кислот модифицируются уже после биосинтеза.
Общая информация и список веществ
Известны две большие группы аминокислот, которые были выделены по причине закономерностей их нахождения в природе. В частности, существуют 20 аминокислот стандартного типа и 26 нестандартных аминокислот. Первые находят в составе белков любого живого организма, тогда как вторые являются специфическими для отдельных живых организмов.
20 аминокислот стандартных делятся на 2 типа в зависимости от способности синтезироваться в человеческом организме. Это заменимые, которые в клетках человека способны образовываться из предшественников, и незаменимые, для синтеза которых не существует ферментных систем или субстрата. Заменимые аминокислоты могут не присутствовать в пище, так как их организм может синтезировать, восполняя их количество при необходимости. Незаменимые аминокислоты не могут быть получены организмом самостоятельно, а поэтому должны поступать с пищей.
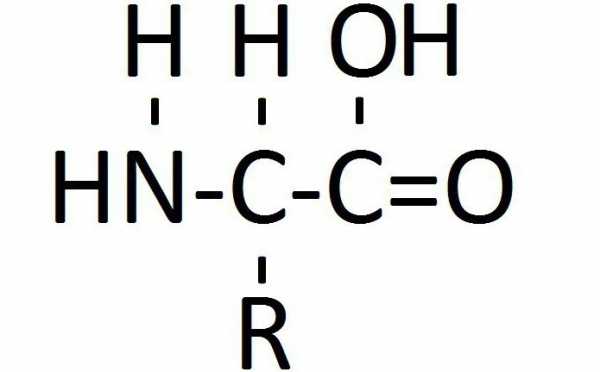
Биохимиками определены названия аминокислот из группы незаменимых. Всего их известно 8:
- метионин;
- треонин;
- изолейцин;
- лейцин;
- фенилаланин;
- триптофан;
- валин;
- лизин;
- также часто сюда относят гистидин.
Это вещества с различным строением углеводородного радикала, но обязательно с наличием карбоксильной группы и аминогруппы у альфа-С-атома.
В группе заменимых аминокислот присутствует 11 веществ:
- аланин;
- глицин;
- аргинин;
- аспарагин;
- кислота аспарагиновая;
- цистеин;
- кислота глютаминовая;
- глютамин;
- пролин;
- серин;
- тирозин.
В основном их химическое строение проще, нежели у незаменимых, поэтому их синтез дается организму легче. Большинство незаменимых аминокислот невозможно получить только из-за отсутствия субстрата, то есть молекулы-предшественника путем реакции переаминирования.
Глицин, аланин, валин
В биосинтезе белковых молекул наиболее часто используется глицин, валин и аланин, (формула каждого вещества указана ниже на рисунке). Эти аминокислоты самые простые по химической структуре. Вещество глицин и вовсе является простейшим в классе аминокислот, то есть помимо альфа-углеродного атома соединение не имеет радикалов. Однако даже простейшая по структуре молекула играет важную роль в обеспечении жизнедеятельности. В частности, из глицина синтезируется порфириновое кольцо гемоглобина, пуриновые основания. Порфировое кольцо — это белковый участок гемоглобина, призванный удерживать атомы железа в составе целостного вещества.
Глицин участвует в обеспечении жизнедеятельности головного мозга, выступая тормозным медиатором ЦНС. Это означает, что он в большей степени участвует в работе коры головного мозга — его наиболее сложно организованной ткани. Что важнее, глицин является субстратом для синтеза пуриновых оснований, нужных для образования нуклеотидов, которые кодируют наследственную информацию. Вдобавок глицин служит источником для синтеза других 20 аминокислот, тогда как сам может быть образован из серина.
У аминокислоты аланин формула немногим сложнее, чем у глицина, так как она имеет метильный радикал, замененный на один атом водорода у альфа-углеродного атома вещества. При этом аланин также остается одной из самых часто вовлекаемых в процессы биосинтеза белков молекулой. Она входит в состав любого белка в живой природе.
Неспособный синтезироваться в организме человека валин — аминокислота с разветвленной углеводородной цепочкой, состоящей из трех углеродных атомов. Изопропиловый радикал придает молекуле больший вес, однако из-за этого невозможно найти субстрат для биосинтеза в клетках человеческих органов. Поэтому валин должен обязательно поступать с пищей. Он присутствует преимущественно в структурных белках мышц.
Результаты исследований подтверждают, что валин необходим для функционирования центральной нервной системы. В частности, за счет его способности восстанавливать миелиновую оболочку нервных волокон он может использоваться в качестве вспомогательного средства при лечении рассеянного склероза, наркоманий, депрессий. В большом количестве содержится в мясных продуктах, рисе, сушеном горохе.
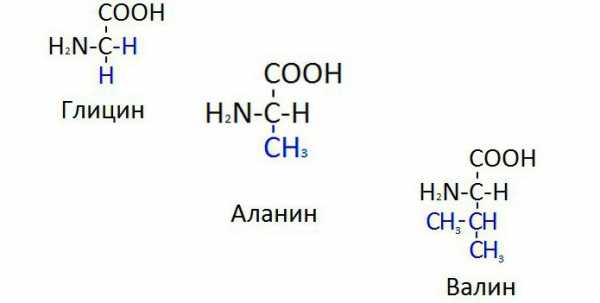
Тирозин, гистидин, триптофан
В организме тирозин способен синтезироваться из фенилаланина, хотя в большом количестве поступает с молочной пищей, преимущественно с творогом и сырами. Входит в состав казеина — животного белка, в избытке содержащемся в творожных и сырных продуктах. Ключевое значение тирозина в том, что его молекула становится субстратом синтеза катехоламинов. Это адреналин, норадреналин, дофамин — медиаторы гуморальной системы регуляции функций организма. Тирозин способен быстро проникать и через гематоэнцефалический барьер, где быстро превращается в дофамин. Молекула тирозина участвует в меланиновом синтезе, обеспечивая пигментацию кожи, волос и радужки глаза.
Аминокислота гистидин входит в состав структурных и ферментных белков организма, является субстратом синтеза гистамина. Последний регулирует желудочную секрецию, участвует в иммунных реакциях, регулирует заживление повреждений. Гистидин является незаменимой аминокислотой, и организм восполняет ее запасы только из пищи.
Триптофан так же неспособен синтезироваться организмом из-за сложности своей углеводородной цепочки. Он входит в состав белков и является субстратом синтеза серотонина. Последний является медиатором нервной системы, призванным регулировать циклы бодрствования и сна. Триптофан и тирозин — эти названия аминокислот следует помнить нейрофизиологам, так как из них синтезируются главные медиаторы лимбической системы (серотонин и дофамин), обеспечивающие наличие эмоций. При этом не существует молекулярной формы, обеспечивающей накопление незаменимых аминокислот в тканях, из-за чего они должны присутствовать в пище ежедневно. Белковая еда в количестве 70 граммов в сутки полностью обеспечивает эти потребности организма.
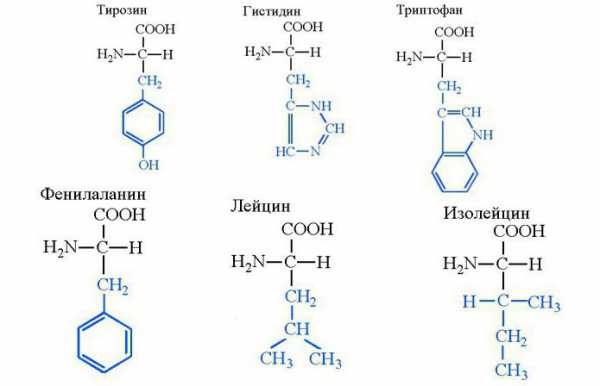
Фенилаланин, лейцин и изолейцин
Фенилаланин примечателен тем, что из него синтезируется аминокислота тирозин при ее недостатке. Сам фенилаланин является структурным компонентом всех белков в живой природе. Это метаболический предшественник нейромедиатора фенилэтиламина, обеспечивающий ментальную концентрацию, подъем настроения и психостимуляцию. В РФ в концентрации свыше 15% оборот данного вещества запрещен. Эффект фенилэтиламина схожий с таковым у амфетамина, однако первый не отличается пагубным воздействием на организм и отличается лишь развитием психической зависимости.
Одно из главных веществ группы аминокислот — лейцин, из которого синтезируются пептидные цепи любого белка человека, включая ферменты. Соединение, применяемое в чистом виде, способно регулировать функции печени, ускорять регенерацию ее клеток, обеспечивать омоложение организма. Поэтому лейцин — аминокислота, которая выпускается в виде лекарственного препарата. Она отличается высокой эффективностью в ходе вспомогательного лечения цирроза печени, анемии, лейкоза. Лейцин — аминокислота, существенно облегчающая реабилитацию пациентов после химиотерапии.

Изолейцин, как и лейцин, не способен синтезироваться организмом самостоятельно и относится к группе незаменимых. Однако это вещество не является лекарственным средством, так как организм испытывает в нем небольшую потребность. В основном в биосинтезе участвует только один его стереоизомер (2S,3S)-2-амино-3-метилпентановая кислота.
Пролин, серин, цистеин
Вещество пролин — аминокислота с циклическим углеводородным радикалом. Ее основная ценность в наличии кетонной группы цепочки, из-за чего вещество активно используется в синтезе структурных белков. Восстановление кетона гетероцикла до гидроксильной группы с образованием гидроксипролина формирует множественные водородные связи между цепочками коллагена. В результате нити этого белка сплетаются между собой и обеспечивают прочную межмолекулярную структуру.
Пролин — аминокислота, обеспечивающая механическую прочность тканей человека и его скелета. Наиболее часто она находится в коллагене, входящем в состав костей, хряща и соединительной ткани. Как и пролин, цистеин является аминокислотой, из которой синтезируется структурный белок. Однако это не коллаген, а группа веществ альфа-кератинов. Они образуют роговой слой кожи, ногти, имеются в составе чешуек волос.
Вещество серин — аминокислота, существующая в виде оптических L и D-изомеров. Это заменимое вещество, синтезируемое из фосфоглицерата. Серин способен образовываться в ходе ферментативной реакции из глицина. Данное взаимодействие обратимое, а поэтому глицин может образовываться из серина. Основная ценность последнего в том, что из серина синтезируются ферментативные белки, точнее их активные центры. Широко серин присутствует в составе структурных белков.
Аргинин, метионин, треонин
Биохимиками определено, что избыточное потребление аргинина провоцирует развитие заболевания Альцгеймера. Однако помимо негативного значения у вещества присутствуют и жизненно-важные для размножения функции. В частности, за счет наличия гуанидиновой группы, пребывающей в клетке в катионной форме, соединение способно образовывать огромное количество водородных межмолекулярных связей. Благодаря этому аргинин в виде цвиттер-иона обретает способность связаться с фосфатными участками молекул ДНК. Результатом взаимодействия является образование множества нуклеопротеидов — упаковочной формы ДНК. Аргинин в ходе изменения рН ядерного матрикса клетки может отсоединяться от нуклеопротеида, обеспечивая раскручивание цепи ДНК и начало трансляции для биосинтеза белка.
Аминокислота метионин в своей структуре содержит атом серы, из-за чего чистое вещество в кристаллическом виде имеет неприятный тухлый запах из-за выделяемого сероводорода. В организме человека метионин выполняет регенераторную функцию, способствуя заживлению мембран печеночных клеток. Поэтому выпускается в виде аминокислотного препарата. Из метионина синтезируется и второй препарат, предназначенный для диагностики опухолей. Синтезируется он путем замещения одного углеродного атома на его изотоп С11. В таком виде он активно накапливается в опухолевых клетках, давая возможность определять размеры новообразований головного мозга.
В отличие от указанных выше аминокислот, треонин имеет меньшее значение: аминокислоты из него не синтезируются, а его содержание в тканях невелико. Основная ценность треонина — включение в состав белков. Специфических функций эта аминокислота не имеет.
Аспарагин, лизин, глутамин
Аспарагин — распространенная заменимая аминокислота, присутствующая в виде сладкого на вкус L-изомера и горького D-изомера. Из аспарагина образуются белки организма, а путем глюконеогенеза синтезируется оксалоацетат. Это вещество способно окисляться в цикле трикарбоновых кислот и давать энергию. Это означает, что помимо структурной функции аспарагин выполняет и энергетическую.
Неспособный синтезироваться в организме человека лизин — аминокислота с щелочными свойствами. Из нее в основном синтезируются иммунные белки, ферменты и гормоны. При этом лизин — аминокислота, самостоятельно проявляющая антивирусные средства против вируса герпеса. Однако вещество в качестве препарата не используется.
Аминокислота глутамин присутствует в крови в концентрациях, намного превышающих содержание прочих аминокислот. Она играет главную роль в биохимических механизмах азотистого обмена и выведения метаболитов, участвует в синтезе нуклеиновых кислот, ферментов, гормонов, способна укреплять иммунитет, хотя в качестве лекарственного препарата не используется. Но глутамин широко применяется среди спортсменов, так как помогает восстанавливаться после тренировок, удаляет метаболиты азота и бутирата из крови и мышц. Этот механизм ускорения восстановления спортсмена не считается искусственным и справедливо не признается допинговым. Более того, лабораторные способы уличения спортсменов в таком допинге отсутствуют. Глутамин также в значительном количестве присутствует в пище.
Аспарагиновая и глутаминовая кислота
Аспарагиновая и глутаминовая аминокислоты чрезвычайно ценные для организма человека из-за своих свойств, активирующих нейромедиаторов. Они ускоряют передачу информации между нейронами, обеспечивая поддержание работоспособности структур мозга, лежащих ниже коры. В таких структурах важна надежность и постоянство, ведь эти центры регулируют дыхание и кровообращение. Поэтому в крови присутствует огромное количество аспарагинивой и глутаминовой аминокислоты. Пространственная структурная формула аминокислот указана на рисунке ниже.
Аспарагиновая кислота участвует в синтезе мочевины, устраняя аммиак из головного мозга. Она является значимым веществом для поддержания высокой скорости размножения и обновления клеток крови. Разумеется, при лейкозе этот механизм вреден, а поэтому для достижения ремиссии используются препараты ферментов, разрушающих аспарагиновую аминокислоту.
Одну четвертую часть от числа всех аминокислот в организме составляет глутаминовая кислота. Это нейромедиатор постсинаптических рецепторов, необходимый для синаптической передачи импульса между отростками нейронов. Однако для глутаминовой кислоты характерен и экстрасинаптический путь передачи информации — объемная нейротансмиссия. Такой способ лежит в основе памяти и представляет собой нейрофизиологическую загадку, ведь пока не выяснено, какие рецепторы определяют количество глутамата вне клетки и вне синапсов. Однако предполагается, что именно количество вещества вне синапса имеет важность для объемной нейротрансмиссии.
Химическая структура
Все нестандартные и 20 стандартных аминокислот имеют общий план строения. Она включает циклическую или алифатическую углеводородную цепочку с наличием радикалов или без них, аминогруппу у альфа-углеродного атома и карбоксильную группу. Углеводородная цепочка может быть любой, чтобы вещество имело реакционную способность аминокислот, важно расположение основных радикалов.
Аминогруппа и карбоксильная группа должны быть присоединены к первому углеродному атому цепочки. Согласно принятой в биохимии номенклатуре, он называется альфа-атомом. Это важно для образования пептидной группы — важнейшей химической связи, благодаря которой существуют белок. С точки зрения биологической химии, жизнью называется способ существования белковых молекул. Главное значение аминокислот — это образование пептидной связи. Общая структурная формула аминокислот представлена в статье.
Физические свойства
Несмотря на схожую структуру углеводородной цепи, аминокислоты по физическим свойствам значительно отличаются от карбоновых кислот. При комнатной температуре они являются гидрофильными кристаллическими веществами, хорошо растворяются в воде. В органическом растворителе из-за диссоциации по карбоксильной группе и отщепления протона аминокислоты растворяются плохо, образуя смеси веществ, но не истинные растворы. Многие аминокислоты имеют сладкий вкус, тогда как карбоновые кислоты — кислые.
Указанные физические свойства обусловлены наличием двух функциональных химических групп, из-за которых вещество в воде ведет себя как растворенная соль. Под действием молекул воды от карбоксильной группы отщепляется протон, акцептором которого является аминогруппа. За счет смещения электронной плотности молекулы и отсутствия свободно двигающихся протонов рН (показатель кислотности) раствор остается достаточно стабильным при добавлении кислот или щелочей с высокими константами диссоциации. Это означает, что аминокислоты способны образовывать слабые буферные системы, поддерживая гомеостаз организма.
Важно, что модуль заряда диссоциированной молекулы аминокислоты равен нулю, так как протон, отщепленный от гидроксильной группы, принимается атомом азота. Однако на азоте в растворе формируется положительный заряд, а на карбоксильной группе — отрицательный. Способность диссоциировать напрямую зависит от кислотности, а поэтому для растворов аминокислот существует изоэлектрическая точка. Это рН (показатель кислотности), при котором наибольшее количество молекул имеют нулевой заряд. В таком состоянии они неподвижны в электрическом поле и не проводят ток.
www.syl.ru
Аминокислоты – для чего они нужны :: типы, преимущества и противопоказания
Аминокислоты представляют собой органические молекулы важны, которые выполняют различные биологические функции.
Давайте посмотрим, для чего они нужны, какие существуют виды, какие синтезируются в организме и какие можно получить только из пищи.
Для чего нужны аминокислоты
Аминокислотами называются веществами с низкой молекулярной массой, которые являются строительными блоками белков. Они образуются, по крайней мере, из одной группы органической кислоты (карбоксильная) и, по меньшей мере, одной аминогруппы. Обладают свойством связываться друг с другом через пептидную связь.

Аминокислоты, полученные с пищей, распадаются на простые основания, затем всасываются в тонком кишечнике и используются организмом для выполнения нескольких важных функций:
- участвуют в синтезе белка и, следовательно, необходимы для обновления клеток организма
- производят энергию (разветвленные аминокислоты)
- участвуют в синтезе других соединений, в которых играют роль нейромедиатора, то есть передают информацию между клетками нервной системы
Типы аминокислот
Известно около 500 различных форм аминокислот, отличаемых в зависимости от химических связей, которые их характеризуют, но в нашем ДНК закодировано только 20 и они делятся на две большие категории:
- Незаменимые аминокислоты, которые не синтезируются организмом и поступают исключительно благодаря питанию: лизин, триптофан, лейцин, изолейцин, фенилаланин, треонин, метионин, гистидин и валин
- Заменимые аминокислоты, которые организм может производить самостоятельно из других органических молекул: цистеин, аланин, аргинин, аспарагиновая кислота, глутамат, тирозин, глицин, пролин, гистидин, серин, аспарагин
В дополнение к упомянутой, используют другую классификацию аминокислот:
- Разветвленные аминокислоты (изолейцин, лейцин и валин): имеют разветвленную структуру и играют важную роль в пластической фазе, т.е. образовании и реконструкции мышцы, кроме того, замедляют процесс разложения белков, способствуют также поддержке мышц при интенсивных нагрузках;
- Полунезаменимые аминокислоты (цистеин и тирозин), которые синтезируются в организме из других незаменимых аминокислот: метионина и фенилаланина;
- Условно незаменимые аминокислоты (аргинин, глицин, пролин, таурин и глютамин,), так называются, потому что организм может быть не в состоянии синтезировать их в некоторые периоды жизни (дети, беременность) или при наличии заболеваний, таких как фенилкетонурия.
В каких продуктах находятся аминокислоты
Как сказано выше, заменимые аминокислоты синтезируются непосредственно в организме, а незаменимые должны поступать с питанием. Они являются очень важными для человека, поэтому правильное питание подразумевает соответствующее потребление белка.
Потребность в белке меняется в зависимости от пола, возраста, стиля жизни, индивидуального обмена веществ, спортивной деятельности и может варьироваться от минимального в 0,8 грамма на кг веса до гораздо более высоких значений для людей, которые практикуют интенсивные спортивные занятия.
Сбалансированное питание должно содержать ⅔ белков животного происхождения и ⅓ белков растительного происхождения.
Продукты, богатые незаменимыми аминокислотами являются:
лейцин | кукуруза, яйца, молоко, курица |
фенилаланин | яйца, коричневый рис, зерна |
треонин | кукуруза, яйца, соя |
метионин | яйца, пшеница, мясо |
гистидин | рыба, мясо, сыр |
валин | яйца, молоко, кукуруза, сыр |
лизин | говядина, молоко, соя |
изолейцин | яйца, кукуруза, картофель, курица |
триптофан | молоко, яйца, маниока |
Преимущества и противопоказания аминокислот
Основной функцией аминокислот является образование белков, необходимых для обновления клеток организма. Однако, некоторые аминокислоты могут нести в себе вполне конкретные преимущества.
- Аспарагин и глутамат участвуют в синтезе нейромедиаторов, которые улучшают некоторые функции головного мозга, такие как память и обучаемость.
- Аргинин способствует выработке гормона роста и, следовательно, помогает развитию мышц и усиливает иммунитет.
- Карнитин, благодаря свойству стимулировать метаболизм жиров, полезен для борьбы с ожирением и профилактики сердечно-сосудистых заболеваний.
- Цистеин, глицин и пролин стимулируют выработку коллагена, поэтому они полезны для укрепления волос и защиты кожи от преждевременного старения.
- Метионин и цистеин содержат серу и предшественники глутатиона, антиоксиданта, который борется со свободными радикалами и уменьшает уровень холестерина в крови.
- Таурин, благодаря антиоксидантным свойствами, эффективен против старения клеток.
- Тирозин защищает щитовидную железу и, следовательно, полезен в борьбе с тревожностью и депрессией.
- Триптофан является предшественником серотонина и мелатонина, гормонов, которые регулирует ритм сна и бодрствования, и поэтому полезен в борьбе с бессонницей и для лечения мигрени.
- Изолейцин, лейцин и валин, помимо стимуляции роста мышц и насыщения энергией, улучшают чувствительность к инсулину, защищают мозг от старения и способствуют регенерации печени.
- Креатин и карнитин – аминокислоты очень известные в области спорта, так как увеличивают анаэробную и транспортную емкость липидов в митохондриях.
Риски дефицита аминокислотДефицит даже одной аминокислоты может нарушить весь белковый метаболизм со всеми последствиями, которые могут возникнуть в случае дефицита белка: потеря мышечного тонуса, снижение иммунитета, потеря памяти и концентрации, снижение массы тела. Кроме того, учитывая важность аминокислот для других процессов, дефицит каждого из типов несёт в себе и другие риски:
|
Противопоказания к употреблению аминокислот
Аминокислоты, будучи основными элементами белков, очень важны для правильной работы организма. Такие вещества, если принимать их в умеренных количествах, вряд ли могут причинить вред, но всё равно, приём синтетических аминокислот должен проводится под строгим контролем врача.
Прием большого количества аминокислот (рекомендуемая дозировка грамм на каждый килограмм веса тела), на самом деле, может быть вреден для печени и почек.
Людям, страдающим от заболеваний почек, следует ограничивать потребление белка и, таким образом, аминокислот. Как и те, кто страдает от заболеваний печени, таких как цирроз или гепатит, потому что больная печень не может правильно усваивать белки и аминокислоты.
vseznam.ru
Общая формула аминокислот
Аминокислоты, формулы которых рассматриваются в курсе химии старшей школы, являются важными веществами для человеческого организма. Белки, состоящие из аминокислотных остатков, необходимы человеку для полноценной жизнедеятельности.
Определение
Аминокислоты, формулы которых будут рассмотрены ниже, являются органическими соединениями, в молекулах которых содержатся амино- и карбоксильные группы. Карбоксил состоит из карбонильной и гидроксильной группировки.
Можно рассматривать аминокислоты в качестве производных карбоновых кислот, где атом водорода замещен на аминогруппу.
Особенности химических свойств
Аминокислоты, общая формула которых может быть представлена в виде Cnh3nNh3COOH, являются амфотерными химическими соединениями.
Присутствие в их молекулах двух функциональных групп объясняет возможность проявления этими органическими веществами основных и кислотных свойств.
Их водные растворы имеют свойства буферных растворов. Цвиттер-ион — это молекула аминокислоты, где аминогруппа имеет вид Nh4+, а карбоксил представлен как -COO-. Молекула подобного вида обладает существенным дипольным моментом, при этом суммарный заряд равен нулю. На таких молекулах выстроены кристаллы многих аминокислот.
Среди важнейших химических свойств данного класса веществ можно выделить процессы поликонденсации, в результате которых образуются полиамиды, включая белки, пептиды, нейлон.
Аминокислоты, общая формула которых имеет вид Cnh3nNh3COOH, реагируют с кислотами, основаниями, оксидами металлов, солями слабых кислот. Особый интерес представляют взаимодействия аминокислот со спиртами, относящиеся к этерификации.

Особенности изомерии
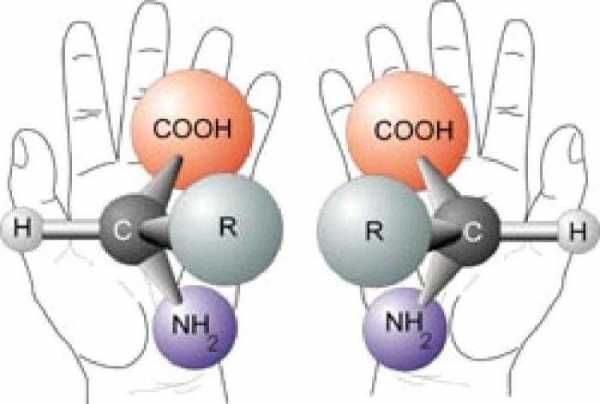
Для того чтобы записать структурные формулы аминокислот, отметим, что многие аминокислоты, принимающие участие в биохимических превращениях, содержат аминогруппу в a-положении от карбоксильной группы. Такой углеродный атом является хиральным центром, а аминокислоты считают оптическими изомерами.
Структурная формула аминокислот дает представление о расположении основных функциональных групп, входящих в состав данного вещества, относительно активного углеродного атома.
Природные аминокислоты, которые входят в состав белковых молекул, являются представителями L-ряда.
Для оптических изомеров аминокислот характерна самопроизвольная медленная неферментативная рацемизация.
Особенности a-соединений
Любая формула веществ этого вида предполагает расположение аминогруппы у второго углеродного атома. 20 аминокислот, формулы которых рассматривают даже в школьном курсе биологии, также принадлежат к этому виду. Например, к ним относится аланин, аспарагин, серин, лейцин, тирозин, фенилаланин, валин. Именно эти соединения составляют генетический код человека. Помимо стандартных соединений? также в белковых молекулах обнаружены нестандартные аминокислоты, являющиеся их производными.
Классификация по синтезу
Как можно разделить незаменимые аминокислоты? Формулы этого класса подразделяют по физиологическому признаку на полузаменимые, способные синтезироваться в человеческом организме. Выделяют и обычные соединения, синтезируемые в любом живом организме.
Подразделение по радикальным и функциональным группам
Формула аминокислот отличается по строению радикала (боковой группы). Существует деление на неполярные молекулы, содержащие гидрофобный неполярный радикал, а также на заряженные полярные группы. В качестве отдельной группы в биохимии рассматривают ароматические аминокислоты: гистидин, триптофан, тирозин. В зависимости от функциональных групп выделяют несколько групп. Алифатические соединения представлены:
- моноаминомонокарбоновыми соединениями, в качестве которых можно рассматривать глицин, валин, аланин, лейцин;
- оксимонокаминокарбоновыми веществами: треонином, серином;
- моноаминокарбоновыми: глутаминовой, аспарагиновой кислотой;
- серосодержащими соединениями: метионином, цистеином;
- диаминомонокарбоновыми веществами: лизином, гистидином, аргинином;
- гетероциклическими: пролином, гистидином, трпитофаном/
Любая формула аминокислот может быть записана в общем виде, отличаться будут только радикальные группы.
Качественное определение
Для того чтобы обнаружить незначительные количества аминокислот, проводится нингидриновая реакция. В процессе нагревания аминокислот с избыточным количеством нингидрина получается лиловый продукт, если кислота имеет свободную a-аминогруппу, а для защищенной группы характерно получение желтого продукта. Данная методика имеет высокую чувствительность, применяется для колориметрического выявления аминокислот. На ее основе были создан метод распределительной хроматографии на бумаге, внедренный Мартином в 1944 году.
Эту же химическую реакцию применяют в автоматическом анализаторе аминокислот. Прибор, созданный Муром, Шпакманом, Стейном, основывается на разделении аминокислотной смеси в колонках, которые заполнены ионообменными смолами. Из колонки поступает ток элюента в смеситель, сюда же идет нингидрин.
По интенсивности получаемой окраски судят о количественном содержании аминокислот. Показания фиксирует фотоэлектроколориметр, регистрирует самописец.
Подобная технология в настоящее время используется в клинической практике при проведении анализов крови, спинномозговой жидкости, мочи. Она позволяет дать полную картину качественного состава аминокислот, содержащихся в биологических жидкостях, определить в них нестандартные азотсодержащие вещества.
Особенности номенклатуры
Как правильно назвать аминокислоты? Формулы и названия этих соединений дают по международной номенклатуре ИЮПАК. К соответствующей карбоновой кислоте добавляют положение аминогруппы, начиная нумерацию с углеводорода, стоящего при карбоксильной группе.
Например, 2-аминоэтановая кислота. Помимо международной номенклатуры есть тривиальные названия, которыми пользуются в биохимии. Так, аминоуксусная кислота — это глицин, используемый в современной медицине.
При наличии в молекуле двух карбоксильных групп в названии добавляется суффикс -дионовая. Например, 2-аминобутандионовая кислота.
Для всех представителей этого класса характерна структурная изомерия, обусловленная изменениями в строении углеродной цепи, а также расположением карбоксильной и аминогрупп. Помимо глицина (простейшего представителя данного класса кислородсодержащих органических веществ)? остальные соединения имеют зеркальные антиподы (оптические изомеры).
Применение
Аминокислоты распространены в природе, они являются основой для построения животных и растительных белков. Эти соединения применяются в медицине в случае сильного истощения организма, например после сложных хирургических операций. Глутаминовая кислота помогает бороться с нервными заболеваниями, для лечения язвы желудка используется гистидин. При синтезе синтетических волокон (капрона, энанта) в качестве исходного сырья выступает аминокапроновая и аминоэнантоваяя кислота.
Заключение
Аминокислоты являются органическими соединениями, которые в своем составе имеют две функциональные группы. Именно особенности строения объясняют двойственность их химических свойств, а также специфику их использования. По результатам научно-исследовательских экспериментов удалось установить, что биомасса живых организмов, которые живут на нашей планете, в сумме составляет 1,8·1012-2,4·1012 тонны сухого вещества. Аминокислоты являются исходными мономерами в биосинтезе белковых молекул, без которого невозможно существование человека и животных.
В зависимости от физиологических признаков существует подразделение всех аминокислот на незаменимые вещества, синтез которых не осуществляется в организме человека и млекопитающих. Для того чтобы не возникало нарушений в обменных процессах, важно употреблять продукты питания, в которых есть эти аминокислоты.
Именно эти соединения являются своеобразными «кирпичиками», которые используются для построения биополимеров-белков. В зависимости от того, какие именно аминокислотные остатки, в какой последовательности будут выстраиваться в структуру белка, образующийся белок имеет определенные физические и химические свойства и области применения. Благодаря качественным реакциям на функциональные группы биохимики определяют состав белковых молекул, ищут новые пути синтеза индивидуальных биополимеров, необходимых для организма человека.
fb.ru
для чего нужны? Аминокислоты в продуктах. Реакции и свойства аминокислот
В природе существуют две группы веществ: органические и неорганические. К последним относятся такие соединения, как углеводороды, алкины, алкены, спирты, липиды, нуклеиновые и другие кислоты, белки, углеводы, аминокислоты. Для чего нужны эти вещества, мы и расскажем в этой статье. В состав всех органических соединений непременно входят атомы карбона и гидрогена. Также они могут содержать и оксиген, сульфур, нитроген и другие элементы. Наука, изучающая белки, кислоты, оксиды, аминокислоты, — химия. Она исследует свойства и особенности каждой группы веществ.
Аминокислоты — для чего нужны эти вещества?
Они очень важны для организма любого живого существа на планете, так как являются составляющей самых значимых веществ — белков. Всего существует двадцать одна аминокислота, из которых образуются данные соединения. В состав каждой входят атомы гидрогена, нитрогена, карбона и оксигена. Химическая структура данных веществ имеет аминогруппу Nh3, от которой и происходит название.
Как из аминокислот складываются белки?
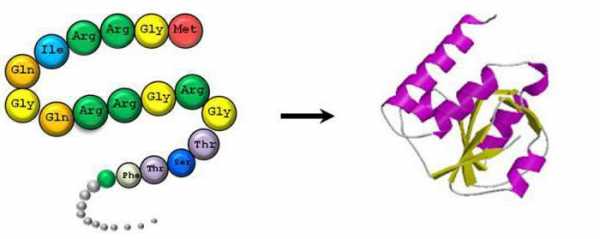
Данные органические вещества формируются в четыре этапа, их строение состоит из первичной, вторичной, третичной и четвертичной структур. От каждой из них зависят определенные свойства белка. Первичная определяет количество и порядок размещения аминокислот, находящихся в полипептидной цепи. Вторичная представляет собой альфа-спираль либо бета-структуры. Первые образуются вследствие закручивания полипептидной цепи и возникновения водородных связей в пределах одной.  Вторые — по причине возникновения связей между группами атомов разных полипептидных цепей. Третичная структура — это соединенные между собой альфа-спирали и бета-структуры. Она может быть двух видов: фибриллярная и глобулярная. Первая представляет собой длинную нить. Белками с такой структурой являются фибрин, миозин, находящиеся в мышечных тканях, а также другие. Вторая имеет вид клубка, к глобулярным белкам относятся, к примеру, инсулин, гемоглобин и многие другие. В организме живых существ за синтез белков из аминокислот отвечают специальные органеллы клетки — рибосомы. Информация о белках, которые должны быть выработаны, зашифрована в ДНК и переносится к рибосомам с помощью РНК.
Вторые — по причине возникновения связей между группами атомов разных полипептидных цепей. Третичная структура — это соединенные между собой альфа-спирали и бета-структуры. Она может быть двух видов: фибриллярная и глобулярная. Первая представляет собой длинную нить. Белками с такой структурой являются фибрин, миозин, находящиеся в мышечных тканях, а также другие. Вторая имеет вид клубка, к глобулярным белкам относятся, к примеру, инсулин, гемоглобин и многие другие. В организме живых существ за синтез белков из аминокислот отвечают специальные органеллы клетки — рибосомы. Информация о белках, которые должны быть выработаны, зашифрована в ДНК и переносится к рибосомам с помощью РНК.
Какие бывают аминокислоты?
Соединений, из которых образуются белки, всего в природе двадцать одно. Некоторые из них человеческий организм способен синтезировать в ходе метаболизма (обмена веществ), а другие — нет. Вообще, в природе существуют такие аминокислоты: гистидин, валин, лизин, изолейцин, лейцин, треонин, метионин, фенилаланин, триптофан, цистеин, тирозин, аргинин, аланин, глутамин, аспарагин, глицин, пролин, карнитин, орнитин, таурин, серин. Первые девять из перечисленных выше аминокислот являются незаменимыми. Также существуют условнонезаменимые — те, которые организм может использовать вместо незаменимых в крайних случаях. Это, к примеру, тирозин и цистеин. Первая может быть использована вместо фенилаланина, а вторая — если нет метионина. Незаменимые аминокислоты в продуктах — обязательное условие здорового питания.
В какой еде они содержатся?
- Валин — мясо, рыба.
- Гистидин — гречневая каша, злаки, красная рыба, свинина, птица.
- Изолейцин — яйца, мясо, рыба, молоко, сыр, творог.
- Лейцин — те же, что и изолейцин.
- Метионин — злаки, арахис, грецкие орехи, фисташки, зерновые.
- Треонин — мясо, крупы, грибы.
- Триптофан — индейка, кролик, свинина, ставрида.
- Фенилаланин — мясо, фасоль, горох, чечевица, соя, рыба, творог, молоко, сыр.

Все остальные аминокислоты в продуктах, потребляемых человеком, могут и не содержаться, так как организм способен вырабатывать их самостоятельно, однако все-таки желательно, чтобы какая-то их часть поступала и с пищей. Большинство заменимых аминокислот содержатся в тех же продуктах, что и незаменимые, то есть мясе, рыбе, молоке — той еде, которая богата белком.
Роль каждой аминокислоты в организме человека
Каждое из этих веществ выполняет в организме определенную функцию. Самыми необходимыми для полноценной жизнедеятельности аминокислотами являются незаменимые, поэтому очень важно употреблять продукты с их содержанием в достаточном количестве.  Так как главным строительным материалом для нашего организма является белок, то можно сказать, что самыми важными и нужными веществами являются аминокислоты. Для чего нужны незаменимые, мы сейчас вам расскажем. Как уже было написано выше, к этой группе аминокислот относятся гистидин, валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан. Каждое из этих химических соединений играет свою специфическую роль в организме. Так, валин необходим для полноценного роста, поэтому продукты с высоким его содержанием обязательно должны содержаться в достаточном количестве в рационе детей, подростков и спортсменов, которым нужно увеличить концентрацию мышечной массы. Гистидин также выполняет немаловажную роль — участвует в процессе регенерации тканей, входит в состав гемоглобина (вот почему при низком его содержании в крови рекомендуют увеличить количество употребляемой гречневой каши). Лейцин нужен организму для того, чтобы синтезировать белки, а также чтобы поддерживать активность иммунной системы на должном уровне.
Так как главным строительным материалом для нашего организма является белок, то можно сказать, что самыми важными и нужными веществами являются аминокислоты. Для чего нужны незаменимые, мы сейчас вам расскажем. Как уже было написано выше, к этой группе аминокислот относятся гистидин, валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан. Каждое из этих химических соединений играет свою специфическую роль в организме. Так, валин необходим для полноценного роста, поэтому продукты с высоким его содержанием обязательно должны содержаться в достаточном количестве в рационе детей, подростков и спортсменов, которым нужно увеличить концентрацию мышечной массы. Гистидин также выполняет немаловажную роль — участвует в процессе регенерации тканей, входит в состав гемоглобина (вот почему при низком его содержании в крови рекомендуют увеличить количество употребляемой гречневой каши). Лейцин нужен организму для того, чтобы синтезировать белки, а также чтобы поддерживать активность иммунной системы на должном уровне. Лизин — без данного вещества в организме просто не будет усваиваться кальций, поэтому нельзя допускать нехватки этой аминокислоты — нужно включить в свой рацион больше рыбы, сыра и других молокопродуктов. Триптофан нужен для выработки витамина В, а также гормонов, которые регулируют чувство голода и настроение. Это вещество входит в состав препаратов, способствующих успокоению и устранению бессонницы. Фенилаланин используется организмом для выработки таких гормонов, как тирозин и адреналин. Данное вещество также может входить в состав медицинских препаратов, которые назначаются при бессоннице либо депрессии.
Лизин — без данного вещества в организме просто не будет усваиваться кальций, поэтому нельзя допускать нехватки этой аминокислоты — нужно включить в свой рацион больше рыбы, сыра и других молокопродуктов. Триптофан нужен для выработки витамина В, а также гормонов, которые регулируют чувство голода и настроение. Это вещество входит в состав препаратов, способствующих успокоению и устранению бессонницы. Фенилаланин используется организмом для выработки таких гормонов, как тирозин и адреналин. Данное вещество также может входить в состав медицинских препаратов, которые назначаются при бессоннице либо депрессии.
Аминокислоты с точки зрения химии
Вы уже знаете, что составляющие белков и жизненно необходимые для человека вещества — это аминокислоты. Для чего нужны данные соединения, мы уже рассмотрели, теперь перейдем к их химическим свойствам.
Химические свойства аминокислот
У каждой из них они немного индивидуальны, хотя и имеют общие черты. Так как состав аминокислот может быть разным и включать в себя различные химические элементы, то и свойства будут слегка отличаться. Общим для всех веществ данной группы признаком является способность к конденсации с образованием пептидов. Также аминокислоты могут реагировать с азотистой кислотой, образуя при этом гидроксикислоты, воду и азот.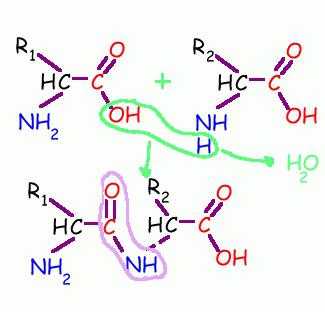 Кроме того, они вступают во взаимодействие и со спиртами. При этом образуется хлороводородная соль какого-либо эфира и вода. Для такой реакции необходимо присутствие в качестве катализатора соляной кислоты в газообразном агрегатном состоянии.
Кроме того, они вступают во взаимодействие и со спиртами. При этом образуется хлороводородная соль какого-либо эфира и вода. Для такой реакции необходимо присутствие в качестве катализатора соляной кислоты в газообразном агрегатном состоянии.
Как выявить их наличие?
Для определения присутствия данных веществ существуют специальные качественные реакции аминокислот. К примеру, чтобы обнаружить цистеин, нужно добавить ацетат свинца, а также использовать нагревание и щелочную среду. При этом должен образоваться сульфид свинца, который выпадает в осадок черного цвета. Также количество аминокислоты в растворе можно определить, добавив к нему азотистую кислоту. Узнают это по объему выделившегося азота.
fb.ru

