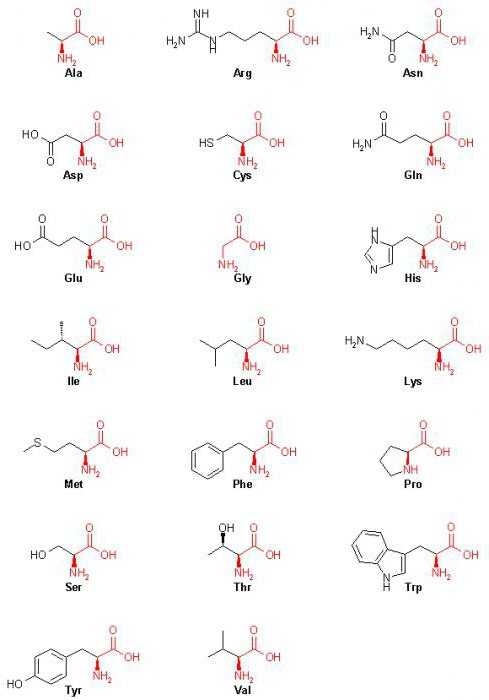
Биоорганическая химияАминокислоты.Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные (-COOH) и аминные группы (-NH2). Строение аминокислот можно выразить приведённой ниже общей формулой, (где R – углеводородный радикал, который может содержать и различные функциональные группы). Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы (-Nh3). В качестве примера можно привести простейшие: аминоуксусную кислоту, или глицин, и аминопропионовую кислоту или аланин: Химические свойства аминокислотАминокислоты – амфотерные соединения, т.е. в зависимости от условий они могут проявлять как основные, так и кислотные свойства. За счёт карбоксильной группы (-COOH) они образуют соли с основаниями. За счёт аминогруппы (-NH2) образуют соли с кислотами. Ион водорода, отщепляющийся при диссоциации от карбоксила (-ОН) аминокислоты, может переходить к её аминогруппе с образованием аммониевой группировки (NH3+). Таким образом, аминокислоты существуют и вступают в реакции также в виде биполярных ионов (внутренних солей). Этим объясняется, что растворы аминокислот, содержащих одну карбоксильную и одну аминогруппу, имеют нейтральную реакцию. Альфа-аминокислотыИз молекул аминокислот строятся молекулы белковых веществ или белков, которые при полном гидролизе под влиянием минеральных кислот, щелочей или ферментов распадаются, образуя смеси аминокислот. Общее число встречающихся в природе аминокислот достигает 300, однако некоторые из них достаточно редки. Среди аминокислот выделяется группа из 20 наиболее важных. Они встречаются во всех белках и получили название альфа-аминокислот. Альфа-аминокислоты – кристаллические вещества, растворимые в воде. Многие из них обладают сладким вкусом. Это свойство нашло отражение в названии первого гомолога в ряду альфа-аминокислот – глицина, явившегося также первой альфа-аминокислотой, обнаруженной в природном материале. Ниже приведена таблица с перечнем альфа-аминокислот:
Незаменимые аминокислотыОсновным источником альфа-аминокислот для животного организма служат пищевые белки. Многие альфа-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков альфа-аминокислоты в организме не синтезируются и должны поступать извне, с продуктами питания. Такие аминокислоты называют незаменимыми. Вот их список:
При некоторых, часто врождённых, заболеваниях перечень незаменимых кислот расширяется. Например, при фенилкетонурии человеческий организм не синтезирует ещё одну альфа-аминокислоту — тирозин, который в организме здоровых людей получается при гидроксилировании фенилаланина. Использование аминокислот в медицинской практикеАльфа-аминокислоты занимают ключевое положение в Так, глутаминовая кислота применяется для лечения заболеваний центральной нервной системы, метионин и гистидин – лечения и предупреждения заболеваний печени, цистеин – глазных болезней. | ОглавлениеОрганическая химияКосметическая химияКоллоидная химияБиохимияБелки• Аминокислоты • Белки и пептиды • Нуклеиновые кислоты — Строение нуклеиновых кислот. Нуклеотиды и нуклеозиды. — Структура и простран- ственная организация нуклеиновых кислот Углеводы. Их роль и классификация.• Моносахариды (глюкоза и фруктоза). • Олигосахариды (сахароза).• Полисахариды (крахмал и целлюлоза). Липиды. Классификация.• Структурные компоненты липидов — Жирные кислоты и спирты, — Полиспирты, глицерин. • Простые омыляемые липиды: — Воски, — Жиры и масла. • Сложные омыляемые липиды. Классификация. — Фосфолипиды, лецитин, — Сфинголипиды, церамиды, — Гликолипиды. • Неомыляемые липиды: — Терпены, — Стероиды — стерины, холестерин, — желчные кислоты, — стероидные гормоны, — сердечные гликозиды. — Низкомолекулярные био- регуляторы липидной природы — Жирорастворимые витамины, — Простагландины. | |
xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai
Как выглядит формула аминокислот :: SYL.ru
Общая формула аминокислот подтверждает наличие в молекуле атомов углерода, водорода, кислорода, а также содержание двух функциональных групп: карбоксильной и аминогруппы. Именно они объясняют амфортерный характер этих соединений, двойственность их структуры.
Значимость соединений
Все процессы, связанные с жизнедеятельностью организмов, происходят на молекулярном уровне. Именно поэтому так важно иметь полное представление об особенностях всех органических веществ, их физических и химических свойствах.
Рассмотрим некоторые аминокислоты, формулы и названия которых знакомы даже современным школьникам.
На протяжении нескольких десятилетий наблюдается стремительное развитие биохимии. Благодаря инновационным методам исследования удалось объяснить сложные превращения, связанные с синтезом белковых молекул. Информация, полученная в специализированных научных лабораториях, используется в медицинской, фармацевтической промышленности.

Особенности биохимии
Эта наука занимается изучением химического состава живых организмов, их строения, превращений. Именно благодаря биохимии была выведена общая формула аминокислот, углеводов, жиров. Зародившись в девятом веке, только сегодня биохимия стала союзником в лечении сложных наследственных заболеваний.
Свойства и строение аминокислот
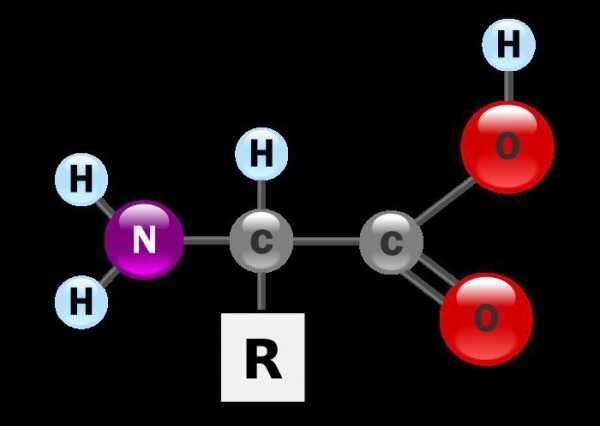
Любая формула аминокислот представляет собой производную аммиака и карбоновой кислоты. В настоящее время выделяют около трехсот представителей данного класса, встречающихся в живой природе. Любая формула аминокислот, независимо от особенностей углеродной цепочки, в своем составе имеет сразу две функциональные группы. Каждая из них накладывает свой отпечаток на общие химические свойства этих соединений. Общая формула аминокислот имеет вид Nh3-CH(R)-COOH
Радикал, входящий в состав молекулы, является производной предельного углеводорода.
Существуют заменимые и незаменимые аминокислоты, формулы их рассматриваются в курсе органической химии.
Двадцать представителей данного класса входят в состав белковых молекул, считаются их обязательным структурным компонентом.
Среди тех соединений, которые должны знать выпускники средней школы, выделим: аланин, пролин, лейцин, глицин, глутамин, валин, аспарагиновую кислоту.
Классификация аминокислот
В зависимости от того, какой вид имеет формула аминокислот, могут быть некоторые отличия в названии. В наше время выделяют соединения, имеющие неполярные радикалы. Среди них выделим аланин, пролин, валин, изолейцин, триптофан, фенилаланин. Кроме того, есть и аминокислоты, которые имеют полярные незаряженные радикалы: серин, цистеин, глутамин, аспарагин.
Стандартные соединения являются составными компонентами полипептидных белковых цепей, выступая в виде L-пространственных изомеров. Практически все они содержат в структуре ассиметричный углеродный атом, объясняющий свободное пространственное вращение аминокислот.
Эти соединения включены в микробные клетки, обнаружены в составе антибиотиков.
Процесс взаимного превращения стереоизомеров называется рацемизацией. Кроме стандартных представителей данного класса, в белковые молекулы входят и нестандартные аминокислоты.
В зависимости от того, какова особенность белковой молекулы, в ее образовании принимают участие только определенные аминокислоты. Например, в составе коллагена присутствует оксипролин.
Все аминокислоты являются слабыми электролитами, поэтому в водном растворе подвергаются только частичной диссоциации. Возможность соединений находиться в виде полярных ионов применяется при проведении анализа биологических объектов с целью выявления аминокислотного состава. Для этого подходят такие методы, как электрофорез, ионообменная хроматография.
Именно последовательность аминокислот определяет особенности первичной структуры белковых молекул. Среди основных областей применения данного класса органических веществ можно отметить использование в органическом синтезе, фармацевтической промышленности. Аминокислоты применяют и в качестве подкормки для крупного рогатого скота.
www.syl.ru
Формулы аминокислот
- Подробности
Протеиногенные α аминокислоты
|
Основной ряд моноаминомонокарбоновых кислот (алифатические) |
|
Глицин (гли) |
Аланин (ала) |
Валин (вал)
|
Лейцин (лей)
|
Изолейцин (илей) |
|
Оксиаминокислоты |
Тиоаминокислоты |
|||
|
Треонин(тре)
|
Серин (сер) |
Метионин (мет) |
Цистеин (цис) |
|
|
Дикарбоновые аминокислоты и их амиды |
||||
|
Аспарагиновая кислота(асп) |
Глутаминовая кислота (Глу) |
Аспарагин (асн) |
Глутамин (глн) |
|
|
Диаминокислоты |
||||
|
Лизин (Лиз)
|
Оксилизин (олиз)
|
Орнитин (орн)
|
Аргинин (арг) (гуанидо-аминокислота) |
Гистидин (гис) (Гетероциклическая |
|
Ароматические аминокислоты |
Гетероциклические иминокислоты |
|||
|
Фенилаланин (фен) |
Тирозин (тир) |
Триптофан (три) (Гетероциклическая) |
Пролин (про) |
Оксипролин (опро) |
Формулы аминокислот — 2.3 out of 5 based on 4 votes
Добавить комментарий
po-teme.com.ua
20 аминокислот: формулы, таблица, названия
Ни для кого не секрет, что человеку для поддержания жизнедеятельности на высоком уровне необходим белок – своеобразный строительный материал для тканей организма; в состав белков входят 20 аминокислот, названия которых вряд ли что-то скажут обычному офисному работнику. Каждый человек, особенно если говорить о женщинах, хоть раз слышал о коллагене и кератине – это протеины, которые отвечают за внешний вид ногтей, кожи и волос.
Аминокислоты (или же аминокарбоновые кислоты; АМК; пептиды) – органические соединения, на 16 % состоящие из аминов – органических производных аммония, — что отличает их от углеводов и липидов. Они участвуют в биосинтезе белка организмом: в пищеварительной системе под влиянием ферментов все белки, поступающие с едой, разрушаются до АМК. Всего в природе существует около 200 пептидов, но в построении организма человека участвуют всего 20 основных аминокислот, которые подразделяются на заменимые и незаменимые; иногда встречается и третий вид – полузаменимые (условно заменяемые).
Заменимые аминокислоты
Заменимыми называют те аминокислоты, которые как потребляются с продуктами питания, так и воспроизводятся непосредственно в теле человека из других веществ.
- Аланин – мономер большого числа биологических соединений и белков. Осуществляет один из главенствующих путей глюкогенеза, то есть в печени превращается в глюкозу, и наоборот. Высокоактивный участник метаболических процессов в организме.
- Аргинин – АМК, способная синтезироваться в организме взрослого, но не способная к синтезу в теле ребёнка. Содействует выработке гормонов роста и других. Единственный переносчик азотистых соединений в организме. Содействует увеличению мышечной массы и уменьшению жировой.
- Аспарагин – пептид, участвующий в азотном обмене. В ходе реакции с ферментом аспарагиназой отщепляет аммониак и превращается в аспарагиновую кислоту.
- Аспарагиновая кислота – принимает участие в создании иммуноглобулина, деактивирует аммиак. Необходим при сбоях в работе нервной и сердечно-сосудистой систем.
- Гистидин – используется для профилактики и лечения болезней ЖКТ; оказывает положительную динамику при борьбе со СПИДом. Уберегает организм от пагубного воздействия стресса.
- Глицин – нейромедиаторная аминокислота. Применяется в качестве мягкое успокоительное и антидепрессивное средство. Усиливает действие некоторых ноотропных препаратов.
- Глутамин – в большом объёме входит в состав гемоглобина. Активатор процессов восстановления тканей.
- Глутаминовая кислота – обладает нейромедиаторным действием, а также стимулирует метаболические процессы в ЦНС.
- Пролин – является одним из составляющих практически всех протеинов. Им особенно богаты эластин и коллаген, отвечающие за эластичность кожи.
- Серин – АМК, что содержится в нейронах головного мозга, а также способствует выделению большого количества энергии. Является производной глицина.
- Тирозин – составляющая тканей животных и растений. Может воспроизводиться из фенилаланина под действием фермента фенилаланингидроксилазы; обратного процесса не происходит.
- Цистеин – один из компонентов кератина, отвечающего за упругость и эластичность волос, ногтей, кожи. Ещё он является антиоксидантом. Может производиться из серина.
Аминокислоты, не способные к синтезу в организме, — незаменимые
Незаменимыми аминокислотами называют те, которые не способные генерироваться в организме человека и способны поступать только с продуктами питания.
- Валин – АМК, которая содержится практически во всех белках. Повышает координацию мышц и снижает чувствительность организма к температурным перепадам. Поддерживает гормон серотонин на высоком уровне.
- Изолейцин – естественный анаболик, который в процессе окисления насыщает энергией мышечную и мозговую ткани.
- Лейцин – аминокислота, улучшающая метаболизм. Является своеобразным «строителем» структуры белка.
- Эти три АМК входят в так называемый комплекс BCAA, особо востребованный среди спортсменов. Вещества этой группы выступают в качестве источника для увеличения объема мышечной массы, уменьшения жировой массы и поддержания хорошего самочувствия при особо интенсивных физических нагрузках.
- Лизин – пептид, ускоряющий регенерацию тканей, выработку гормонов, ферментов и антител. Отвечает за прочность сосудов, содержится в мышечном белке и коллагене.
- Метионин – пронимает участие в синтезе холина, недостаток которого может привести к усиленному накоплению жира в печени.
- Треонин – придает эластичность и силу сухожилиям. Очень положительно влияет на сердечную мышцу и зубную эмаль.
- Триптофан – поддерживает эмоциональное состояние, так как в организме преобразуется в серотонин. Незаменим при депрессиях и других психологических расстройствах.
- Фенилаланин – улучшает внешний вид кожи, нормализуя пигментацию. Поддерживает психологическое благополучие, улучшая настроение и привнося ясность в мышление.
Другие методы классификации пептидов
С научной стороны 20 незаменимых аминокислот подразделяют, основываясь на полярности их боковой цепи, то есть радикалов. Таким образом, выделяются четыре группы: неполярные, полярные (но не имеющие заряда), положительно заряженные и отрицательно заряженные.
Неполярными являются: валин, аланин, лейцин, изолейцин, метионин, глицин, триптофан, фенилаланин, пролин. В свою очередь, к полярным, имеющим отрицательный заряд относят аспарагиновую и глутаминовую кислоты. Полярными, имеющими положительный заряд, называют аргинин, гистидин, лизин. К аминокислотам, обладающим полярностью, но не имеющим заряда, относят непосредственно цистеин, глутамин, серин, тирозин, треонин, аспарагин.
20 аминокислот: формулы (таблица)
Аминокислота | Аббревиатура | Формула |
Аланин | Ala, A | C3H7NO2 |
Аргинин | Arg, R | C6h24N4O2 |
Аспарагин | Asn, N | C4H8N2O3 |
Аспарагиновая кислота | Asp, D | C4H7NO4 |
Валин | Val, V | C5h21NO2 |
Гистидин | His, H | C6H9N3O2 |
Глицин | Gly, G | C2H5N1O2 |
Глутамин | Gln, Q | С5Н10N2O3 |
Глутаминовая кислота | Glu, E | C5H9NO4 |
Изолейцин | Ile, I | C6h23O2N |
Лейцин | Leu, L | C6h23NO2 |
Лизин | Lys, K | C6h24N2O2 |
Метионин | Met, M | C5h21NO2S |
Пролин | Pro, P | C5H7NO3 |
Серин | Ser, S | C3H7NO3 |
Тирозин | Tyr, Y | C9h21NO3 |
Треонин | Thr, T | C4H9NO3 |
Триптофан | Trp, W | C11h22N2O2 |
Фенилаланин | Phe, F | C9h21NO2 |
Цистеин | Cys, C | C3H7NO2S |
Основываясь на этом, можно отметить, что все 20 аминокислот (формулы в таблице выше) имеют в своем составе углерод, водород, азот и кислород.
Аминокислоты: участие в жизнедеятельности клетки
Аминокарбоновые кислоты участвуют в биологическом синтезе белка. Биосинтез белка – процесс моделирования полипептидной («поли» — много) цепи из остатков аминокислот. Протекает процесс на рибосоме – органелле внутри клетки, отвечающей непосредственно за биосинтез.
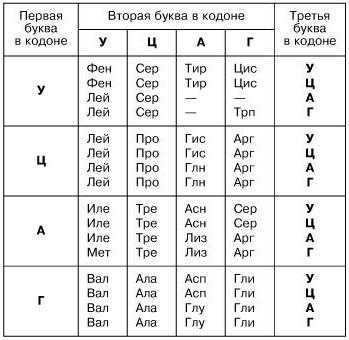
Информация считывается с участка цепи ДНК по принципу комплементарности (А-Т, Ц-Г), при создании м-РНК (матричная РНК, или и-РНК – информационная РНК – тождественно равные понятия) азотистое основание тимин заменяется на урацил. Далее всё по тому же принципу создается т-РНК (транспортная РНК), переносящая молекулы аминокислот к месту синтеза. Т-РНК закодирована триплетами (кодонами) (пример: УАУ), и если знать, какими азотистыми основаниями представлен триплет, можно узнать, какую именно аминокислоту он переносит.
Группы продуктов питания с наибольшим содержанием АМК
В молочных продуктах и яйцах содержатся такие важные вещества, как валин, лейцин, изолейцин, аргинин, триптофан, метионин и фенилаланин. Рыба, белое мясо обладают высоким содержанием валина, лейцина, изолейцина, гистидина, метионина, лизина, фенилаланина, триптофана. Бобовые, зерновые и крупы богаты на валин, лейцин, изолейцин, триптофан, метионин, треонин, метионин. Орехи и различные семена насытят организм треонином, изолейцином, лизином, аргинином и гистидином.
Ниже приведено содержание аминокислот в некоторых продуктах.
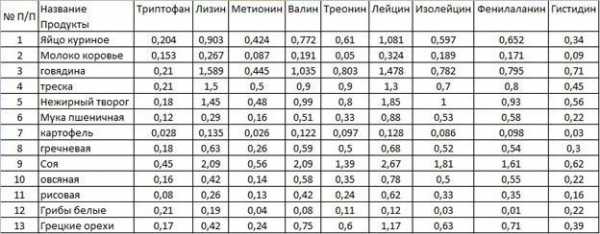
Наибольшее количество триптофана и метионина можно обнаружить в твёрдом сыре, лизина – в мясе кролика, валина, лейцина, изолейцина, треонина и фенилаланина – в сое. При составлении рациона, основанного на поддержании АМК в норме, стоит обратить внимание на кальмаров и горох, а наиболее бедными в плане содержания пептидов можно назвать картофель и коровье молоко.
Нехватка аминокислот при вегетарианстве
То, что существуют такие аминокислоты, которые содержатся исключительно в продуктах животного происхождения, – миф. Более того, учёные выяснили, что белок растительного происхождения усваивается человеческим организмом лучше, чем животного. Однако при выборе вегетарианства как стиля жизни очень важно следить за рационом. Основная проблема такова, что в ста граммах мяса и в таком же количестве бобов содержится разное количество АМК в процентном соотношении. На первых порах необходимо вести учёт содержания аминокислот в потребляемой пище, затем уже это должно дойти до автоматизма.
Какое количество аминокислот нужно потреблять в день
В современном мире абсолютно во всех продуктах питания содержатся нужные для человека питательные вещества, поэтому не следует переживать: все 20 белковых аминокислот благополучно поступают с пищей, и этого количества хватает для человека, ведущего обычный образ жизни и хоть немного следящего за своим питанием.

Рацион спортсмена же необходимо насыщать белками, потому что без них просто невозможно построение мышечной массы. Физические упражнения ведут к колоссальному расходу запаса аминокислот, поэтому профессиональные бодибилдеры вынуждены принимать специальные добавки. При интенсивном построении мышечного рельефа количество белков может доходить до ста граммов белков в день, но такой рацион не подходит для ежедневного потребления. Любая добавка к пище подразумевает инструкцию с содержанием разных АМК в дозе, с которой перед применением препарата необходимо ознакомиться.
Влияние пептидов на качество жизни обычного человека
Потребность в белках присутствует не только у спортсменов. Например, белки эластин, кератин, коллаген влияют на внешний вид волос, кожи, ногтей, а также на гибкость и подвижность суставов. Ряд аминокислот влияет на метаболические процессы в организме, сохраняя баланс жира на оптимальном уровне, предоставляют достаточное количество энергии для повседневной жизни. Ведь в процессе жизнедеятельности даже при самом пассивном образе жизни затрачивается энергия, хотя бы для осуществления дыхания. Вдобавок невозможна и когнитивная деятельность при нехватке определенных пептидов; поддержание психоэмоционального состояния осуществляется в том числе за счет АМК.
Аминокислоты и спорт
Диета профессиональных спортсменов предполагает идеально сбалансированные питание, которое помогает поддерживать мышцы в тонусе. Очень облегчают жизнь аминокислотные комплексы, разработанные специально для тех спортсменов, которые работают на набор мышечной массы.
Как уже писалось ранее, аминокислоты – основной строительный материал белков, необходимых для роста мышц. Также они способны ускорять метаболизм и сжигать жир, что тоже важно для красивого мышечного рельефа. При усердных тренировках необходимо увеличивать потребление АМК ввиду того, что они увеличивают скорость наращивания мышц и уменьшают боли после тренировок.
20 аминокислот в составе белков могут потребляться как в составе аминокарбоновых комплексов, так и из пищи. Если выбирать сбалансированное питание, то нужно учитывать абсолютно все граммовки, что трудно реализовать при большой загруженности дня.
Что происходит с организмом человека при нехватке или переизбытке аминокислот
Основными симптомами нехватки аминокислот считаются: плохое самочувствие, отсутствие аппетита, ломкость ногтей, повышенная утомляемость. Даже при нехватке одной АМК возникает огромное количество неприятных побочных эффектов, которые значительно ухудшают самочувствие и продуктивность.
Перенасыщение аминокислотами может повлечь за собой нарушения в работе сердечно-сосудистой и нервной систем, что, в свою очередь, не менее опасно. В свой черед могут появиться симптомы, схожие с пищевым отравлением, что тоже не влечет за собой ничего приятного.
Во всем надо знать меру, поэтому соблюдение здорового образа жизни не должно приводить к переизбытку тех или иных «полезных» веществ в организме. Как писал классик, «лучшее – враг хорошего».
В статье мы рассмотрели формулы и названия всех 20 аминокислот, таблица содержания основных АМК в продуктах приведена выше.
autogear.ru
Общая характеристика. — Аминокислоты — Азотосодержащие органические соединения — Органическая химия
Многие биологически активные молекулы включают несколько химически различных функциональных групп, способных к взаимодействию между собой или с функциональными группами других молекул. Один из примеров — моносахариды, в состав которых входят несколько гидроксильных групп и одна карбонильная группа. Другой важный пример бифункциональных природных соединений — аминокислоты.
Аминокислоты — это органические бифункциональные соединения, в состав которых входят карбоксильная группа -СООН и аминогруппа -NН2. В зависимости от взаимного расположения обеих функциональных групп различают α-, β-, γ-аминокислоты:
α-аминопропионовая β-аминопропионовая
кислота кислота
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Здесь будут рассматриваться только α-аминокислоты/>, поскольку другие аминокислоты в природе не встречаются.
В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия.
Иминокислота пролин (молекулярная формула C5H9NO2) имеет структуру
Простейшая аминокислота — глицин (аминоуксусная кислота). Остальные природные аминокислоты можно разделить на следующие основные группы:
α-Аминокислоты общей формулы
| Аминокислота | Обозначение (трёх- и одно- буквенное) | —R | Молеку-лярная формула |
| Глицин | Gly(G) | -H | C2H5NO2 |
Аланин | Ala(A) | -CH3 | C3H7NO2 |
Валил | Val(V) | -CH(CH3)2 | C5H11NO2 |
Лейцин | Leu(L) | -CH2-CH(CH3)2 | C6H13NO2 |
Изолейцин | Ile(I) | -CH2-CH(CH3)-C2H5 | C7H15NO2 |
Цистеин | Cys(C) | -CH2-SH | C3H7SNO2 |
Метионин | Met(M) | -CH2-CH2-S-CH3 | C5H11SNO2 |
Серин | Ser(S) | -CH2-OH | C3H7NO3 |
Треонин | Thr(t) | -CH(OH)-CH3 | C4H9NO3 |
Фенилаланин | Phe(F) | -CH2-C6H5 | C9H11NO2 |
Тирозин | Tyr(Y) | C9H11NO3 | |
Триптофан | Trp(W) | C11H12N2O2 | |
Аспарагиновая кислота | Asp(D) | —CH2COOH | C4H7NO4 |
Глутаминовая кислота | Glu(E) | -CH2-CH2-COOH | C5H9NO4 |
Аспарагин | Asn(N) | -CH2-CO-NH2 | C4H8N2O3 |
Глутамин | Gln(Q) | -CH2-CH2-CO-NH2 | C5H10N2O3 |
Гистидин | His(H) | C6H9N3O2 | |
Лизин | Lys(K) | -(CH2)4-NH2 | C6H14N2O2 |
Аргинин | Arg(R) | C6H14N4O2 |
1) гомологи глицина — аланин, валин, лейцин, изолейцин;
2) серосодержащие аминокислоты — цистеин, метионин;
3) аминокислоты с алифатической гидроксильной группой — серин, треонин;
4) ароматические аминокислоты — фенилаланин, тирозин, триптофан;
5) аминокислоты с кислотным радикалом — аспарагиновая и глутаминовая кислоты;
6) аминокислоты с амидной группой — аспарагин, глутамин;
7) аминокислоты с основным радикалом — гистидин, лизин, аргинин.
www.himhelp.ru
Общая формула аминокислот
Аминокислоты, формулы которых рассматриваются в курсе химии старшей школы, являются важными веществами для человеческого организма. Белки, состоящие из аминокислотных остатков, необходимы человеку для полноценной жизнедеятельности.
Аминокислоты, формулы которых будут рассмотрены ниже, являются органическими соединениями, в молекулах которых содержатся амино- и карбоксильные группы. Карбоксил состоит из карбонильной и гидроксильной группировки.
Можно рассматривать аминокислоты в качестве производных карбоновых кислот, где атом водорода замещен на аминогруппу.
Аминокислоты, общая формула которых может быть представлена в виде Cnh3nNh3COOH, являются амфотерными химическими соединениями.
Присутствие в их молекулах двух функциональных групп объясняет возможность проявления этими органическими веществами основных и кислотных свойств.
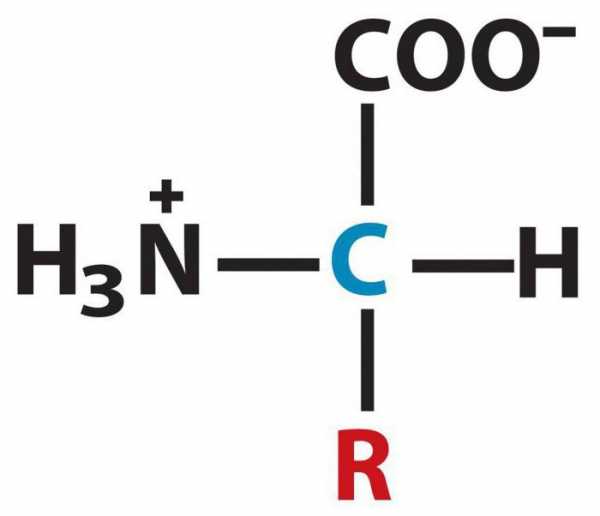
Их водные растворы имеют свойства буферных растворов. Цвиттер-ион — это молекула аминокислоты, где аминогруппа имеет вид Nh4+, а карбоксил представлен как -COO-. Молекула подобного вида обладает существенным дипольным моментом, при этом суммарный заряд равен нулю. На таких молекулах выстроены кристаллы многих аминокислот.

Особенности изомерии
Для того чтобы записать структурные формулы аминокислот, отметим, что многие аминокислоты, принимающие участие в биохимических превращениях, содержат аминогруппу в a-положении от карбоксильной группы. Такой углеродный атом является хиральным центром, а аминокислоты считают оптическими изомерами.
Структурная формула аминокислот дает представление о расположении основных функциональных групп, входящих в состав данного вещества, относительно активного углеродного атома.
Природные аминокислоты, которые входят в состав белковых молекул, являются представителями L-ряда.
Для оптических изомеров аминокислот характерна самопроизвольная медленная неферментативная рацемизация.
Особенности a-соединений
Любая формула веществ этого вида предполагает расположение аминогруппы у второго углеродного атома. 20 аминокислот, формулы которых рассматривают даже в школьном курсе биологии, также принадлежат к этому виду. Например, к ним относится аланин, аспарагин, серин, лейцин, тирозин, фенилаланин, валин. Именно эти соединения составляют генетический код человека. Помимо стандартных соединений? также в белковых молекулах обнаружены нестандартные аминокислоты, являющиеся их производными.
Классификация по синтезу
Как можно разделить незаменимые аминокислоты? Формулы этого класса подразделяют по физиологическому признаку на полузаменимые, способные синтезироваться в человеческом организме. Выделяют и обычные соединения, синтезируемые в любом живом организме.
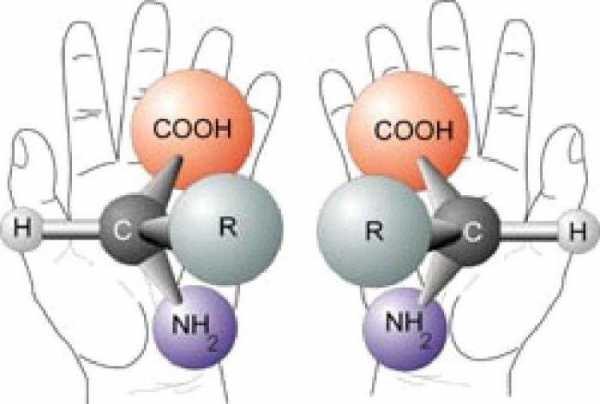
Подразделение по радикальным и функциональным группам
Формула аминокислот отличается по строению радикала (боковой группы). Существует деление на неполярные молекулы, содержащие гидрофобный неполярный радикал, а также на заряженные полярные группы. В качестве отдельной группы в биохимии рассматривают ароматические аминокислоты: гистидин, триптофан, тирозин. В зависимости от функциональных групп выделяют несколько групп. Алифатические соединения представлены:
- моноаминомонокарбоновыми соединениями, в качестве которых можно рассматривать глицин, валин, аланин, лейцин;
- оксимонокаминокарбоновыми веществами: треонином, серином;
- моноаминокарбоновыми: глутаминовой, аспарагиновой кислотой;
- серосодержащими соединениями: метионином, цистеином;
- диаминомонокарбоновыми веществами: лизином, гистидином, аргинином;
- гетероциклическими: пролином, гистидином, трпитофаном/
Любая формула аминокислот может быть записана в общем виде, отличаться будут только радикальные группы.
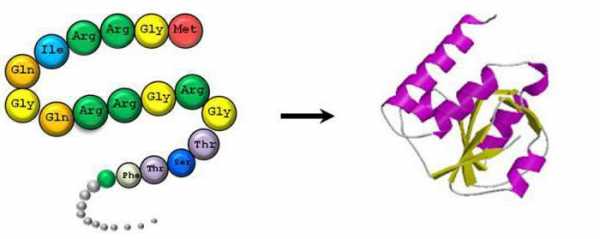
Качественное определение
Для того чтобы обнаружить незначительные количества аминокислот, проводится нингидриновая реакция. В процессе нагревания аминокислот с избыточным количеством нингидрина получается лиловый продукт, если кислота имеет свободную a-аминогруппу, а для защищенной группы характерно получение желтого продукта. Данная методика имеет высокую чувствительность, применяется для колориметрического выявления аминокислот. На ее основе были создан метод распределительной хроматографии на бумаге, внедренный Мартином в 1944 году.
Эту же химическую реакцию применяют в автоматическом анализаторе аминокислот. Прибор, созданный Муром, Шпакманом, Стейном, основывается на разделении аминокислотной смеси в колонках, которые заполнены ионообменными смолами. Из колонки поступает ток элюента в смеситель, сюда же идет нингидрин.
По интенсивности получаемой окраски судят о количественном содержании аминокислот. Показания фиксирует фотоэлектроколориметр, регистрирует самописец.
Подобная технология в настоящее время используется в клинической практике при проведении анализов крови, спинномозговой жидкости, мочи. Она позволяет дать полную картину качественного состава аминокислот, содержащихся в биологических жидкостях, определить в них нестандартные азотсодержащие вещества.
Особенности номенклатуры
Как правильно назвать аминокислоты? Формулы и названия этих соединений дают по международной номенклатуре ИЮПАК. К соответствующей карбоновой кислоте добавляют положение аминогруппы, начиная нумерацию с углеводорода, стоящего при карбоксильной группе.
Например, 2-аминоэтановая кислота. Помимо международной номенклатуры есть тривиальные названия, которыми пользуются в биохимии. Так, аминоуксусная кислота — это глицин, используемый в современной медицине.
При наличии в молекуле двух карбоксильных групп в названии добавляется суффикс -дионовая. Например, 2-аминобутандионовая кислота.
Для всех представителей этого класса характерна структурная изомерия, обусловленная изменениями в строении углеродной цепи, а также расположением карбоксильной и аминогрупп. Помимо глицина (простейшего представителя данного класса кислородсодержащих органических веществ)? остальные соединения имеют зеркальные антиподы (оптические изомеры).
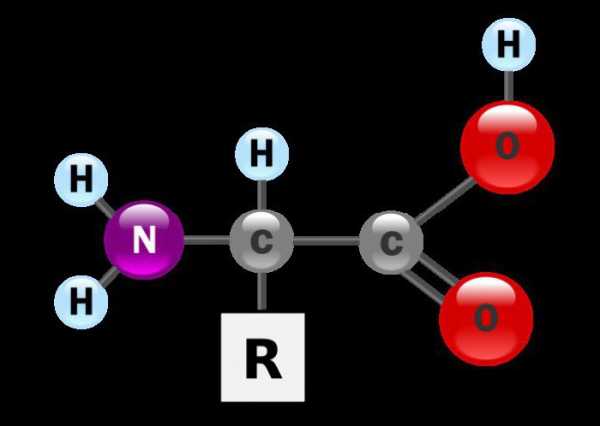
Применение
Аминокислоты распространены в природе, они являются основой для построения животных и растительных белков. Эти соединения применяются в медицине в случае сильного истощения организма, например после сложных хирургических операций. Глутаминовая кислота помогает бороться с нервными заболеваниями, для лечения язвы желудка используется гистидин. При синтезе синтетических волокон (капрона, энанта) в качестве исходного сырья выступает аминокапроновая и аминоэнантоваяя кислота.
Заключение
Аминокислоты являются органическими соединениями, которые в своем составе имеют две функциональные группы. Именно особенности строения объясняют двойственность их химических свойств, а также специфику их использования. По результатам научно-исследовательских экспериментов удалось установить, что биомасса живых организмов, которые живут на нашей планете, в сумме составляет 1,8·1012-2,4·1012 тонны сухого вещества. Аминокислоты являются исходными мономерами в биосинтезе белковых молекул, без которого невозможно существование человека и животных.
В зависимости от физиологических признаков существует подразделение всех аминокислот на незаменимые вещества, синтез которых не осуществляется в организме человека и млекопитающих. Для того чтобы не возникало нарушений в обменных процессах, важно употреблять продукты питания, в которых есть эти аминокислоты.
Именно эти соединения являются своеобразными «кирпичиками», которые используются для построения биополимеров-белков. В зависимости от того, какие именно аминокислотные остатки, в какой последовательности будут выстраиваться в структуру белка, образующийся белок имеет определенные физические и химические свойства и области применения. Благодаря качественным реакциям на функциональные группы биохимики определяют состав белковых молекул, ищут новые пути синтеза индивидуальных биополимеров, необходимых для организма человека.
autogear.ru
Про АМИНОКИСЛОТЫ — Знакомство с аминокислотами 🙂
Здравствуйте, уважаемые читатели сайта о здоровье! Сегодня мы поговорим об основных аминокислотах, участвующих в белковом метаболизме!
Пара слов Про АМИНОКИСЛОТЫ
Дорогие друзья! Я решил написать небольшую анонсирующую статью про аминокислоты, ибо о них мы с Вами часто будем упоминать, составляя различные диеты, рационы питания и так далее.
В этой статье я не буду рассказывать про все разновидности аминокислот, которые встречаются в нашей матушке-природе, а расскажу Вам только про протеиногенные аминокислоты — то есть, про те самые 20 *(в некоторых источниках — 22) аминокислот, которые постоянно участвуют в белковом метаболизме нашего тела.
Поэтому, если Вас интересуют различные химические и физические свойства аминокислот, их амфотерность, изомерия и так далее — то не в этот раз. Дело в том, что нас читают не профессиональные физики и химики, а обычные люди, следящие за своим здоровьем.
Иными словами, я буду рассказывать об аминокислотах не с точки зрения биохимии, а с точки зрения нутрициологии и диетологии.
В этой статье мы вкратце рассмотрим:
- Что такое аминокислоты
- Общий список протеиногенных аминокислот
В общем, ПОЕХАЛИ
Что такое аминокислоты?
Давайте же определимся, что же такое аминокислоты. Итак:
Аминокислоты, или, как их еще называют, аминокарбоновые кислоты — это органические азотсодержащие вещества, чьи молекулы включают в себя две неизменяемые функциональные химические группы:
- Карбоксильная группа
- Аминогруппа
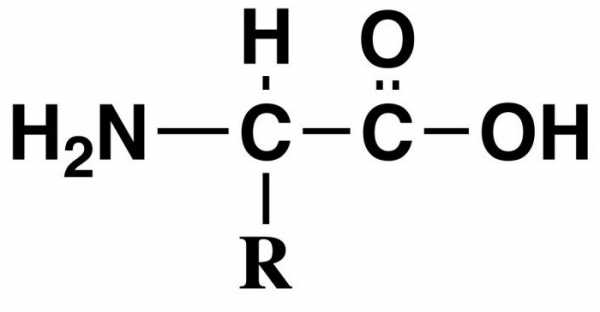
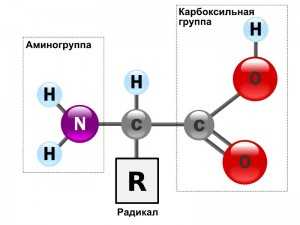
Общая формула аминокислот выглядит так: «R-CH (Nh3) -COOH», где:
- «COOH» — это та самая карбоксильная группа
- «Nh3» — это аминогруппа
- «R» — это радикал. Это единственная часть молекулы, которая изменяется. Именно по радикалу различаются аминокислоты!
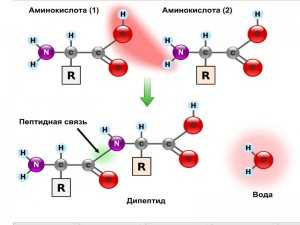
Аминокислоты связываются между собой так называемыми «пептидными связями» — это когда «Nh3»-группа одной аминокислоты взаимодействует с «COOH»-группой другой аминокислоты. Посредством подобной связи образуется своеобразная цепочка!
Цепочка, образованная из 2-10 аминокислот — это пептид. Если в такой цепочке связаны 10-20 аминокислот, то это — олигопептид. Если пептидная цепочка связывает 20-40 аминокислотных остатков — то это полипептид. Ну а пептидная цепочка, насчитывающая свыше 40 аминокислот — это, собственно говоря, белок! *по некоторым данным молекула белка должна насчитывать от 50 аминокислот, а по некоторым другим — от 30, поэтому данные различных источников очень сильно разнятся.
Для чего нам нужны аминокислоты?
Дорогие друзья! В предыдущей статье про белки и их основные функции мы с Вами пришли к выводу, что нашему организму нужны не сами белки, получаемые с пищей, а их мономеры, то есть, составные части — аминокислоты.
Если Вы хотите знать, для чего нужны аминокислоты нашему телу — то обязательно прочитайте нашу предыдущую статью, где я описывал функции белков. Все функции белков, перечисленные в том выпуске, можно смело отождествлять с функциями аминокислот.
Дело в том, что все белки, потребляемые с пищей, должны сначала расщепиться до свободных аминокислот (в нашей пищеварительной системе), и лишь потом из получившихся свободных аминокислот наш организм будет синтезировать собственные белки.
Помимо этого, каждая аминокислота имеет свои особенности. О них мы поговорим в отдельных выпусках.
Список протеиногенных аминокислот
Классифицировать аминокислоты можно по многим критериям, однако мы с Вами в рамках нашего блога будем рассматривать только две классификации, которые, на мой взгляд, необходимо учитывать при составлении рациона питания. Это:
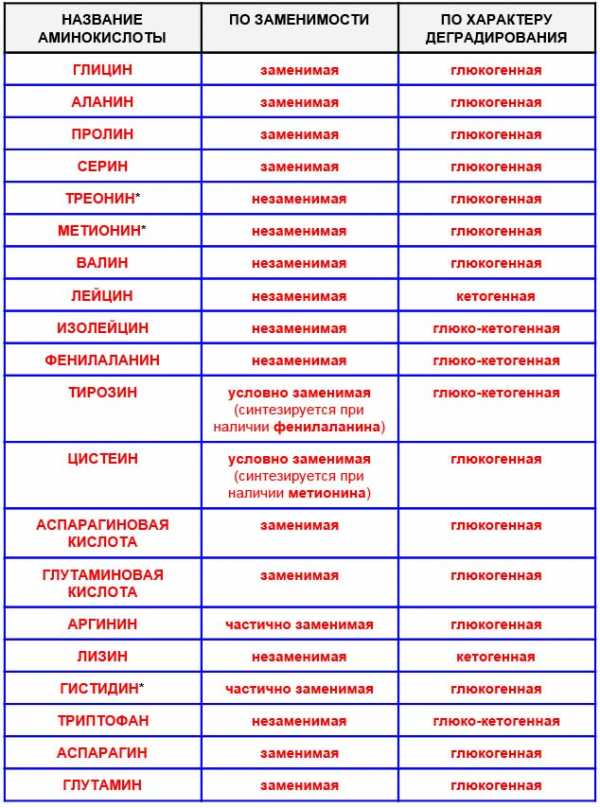
- По способности синтезироваться в самом организме человека из других веществ (по незаменимости): заменимые и незаменимые
- По характеру деградирования (разрушения) в нашем теле: глюкогенные (могут деградировать, превращаясь в глюкозу), кетогенные (деградируют, превращаясь в липиды) и глюко-кетогенные (могут деградировать обоими путями).
Подробнее о каждом из этих критериев я напишу в ближайшее время. Ниже я нарисовал таблицу со списком аминокислот, участвующих в белковом метаболизме нашего тела:
*Примечание
- Составляя данную таблицу я использовал множество источников, однако по данным одного из авторов такие аминокислоты, как Треонин, Метионин и Гистидин — не только глюкогенные, но и кетогенные — то есть, глюко-кетогенные (*Барановский А.Ю. — «Диетология»).
- Аминокислоты Аргинин и Гистидин я пометил, как «частично заменимые», так как Гистидин у детей до одного года является незаменимым, а Аргинин плохо вырабатывается у детей и у пожилых людей. Поэтому данные аминокислоты все равно нужно принимать с пищей, несмотря на то, что во многих источниках их причисляют к заменимым.
- Под условно заменимыми аминокислотами я имею в виду заменимые аминокислоты, которые синтезируются только при наличии определенной незаменимой аминокислоты.
- Помимо аминокислот, перечисленных выше, недавно стали выделять так называемые «21-ю» и «22-ю» аминокислоту — это аминокислоты Селеноцистеи́н и Пирролизин.
Читайте также:
atis-life.ru
