Цистеин формула — Справочник химика 21
Напишите структурную формулу трипептида, при полном гидролизе которого образуются глицин, аланин и цистеин, а при частичном гидролизе—аланилглицин и глицилцистеин. [c.214]Напишите структурные формулы глицина, лейцина, аланина, цистеина, [c.383]
Установлен ряд аминокислот по их комплексообразующей способности цистеин > гистидин > аспарагин > метионин > глицин, аланин, валин, фенилаланин. Определен состав твердых соединений, выделенных из золотосодержащих растворов гистидина и фенилаланина золото в них находится в состоянии окисления (I), состав соединений отвечает формулам с соотношением золота к аминокислоте 1 1. Методом ИК-спектроскопии установлены связь металла с карбоксильной и аминогруппами в соединении золота с фенилаланином и связь металла с аминогруппой и азотом имидазольного кольца в соединении с гистидином. [c.154]
Выход цистеина определяют ио формуле
 13]
13]Данные табл. 4 показывают также, что константы ассоциации тех лигандов, которые содержат более одного участка, доступного для связывания с ионом металла, во много раз превышают константы лигандов с одним реакционноспособным участком. Более того, константы ассоциации лиганда с двумя активными участками больше суммы констант ассоциации двух отдельных лигандов, содержащих эти активные участки. Так, например, глицин связывает ионы металлов сильнее, чем смесь уксусной кислоты и аммиака. В тех случаях, когда ион металла связывается с двумя или более атомами одного лиганда, говорят об образовании хелатного комплекса. Все аминокислоты, например, способны образовывать с ионами металлов хелат-пые комплексы. Особый интерес представляют с этой точки зрёния гистидин и цистеин, поскольку эти аминокислоты могут давать целый ряд хелатных структур. Ниже приведены формулы хелатных комплексов, образуемых цистеином. [c.24]
Напишите формулу полипептида, состоящего из аланина, аргинина, триптофана и цистеина, и назовите его. [c.24]
[c.24]
При синтезе пептидов, содержащих цистеин, ЗН-группу можно защитить, обработав хлоргидрат цистеина трифенилметилхлоридом. а) Напишите структурную формулу цистеина с защищенной тиогруппой и механизм реакции. [c.416]
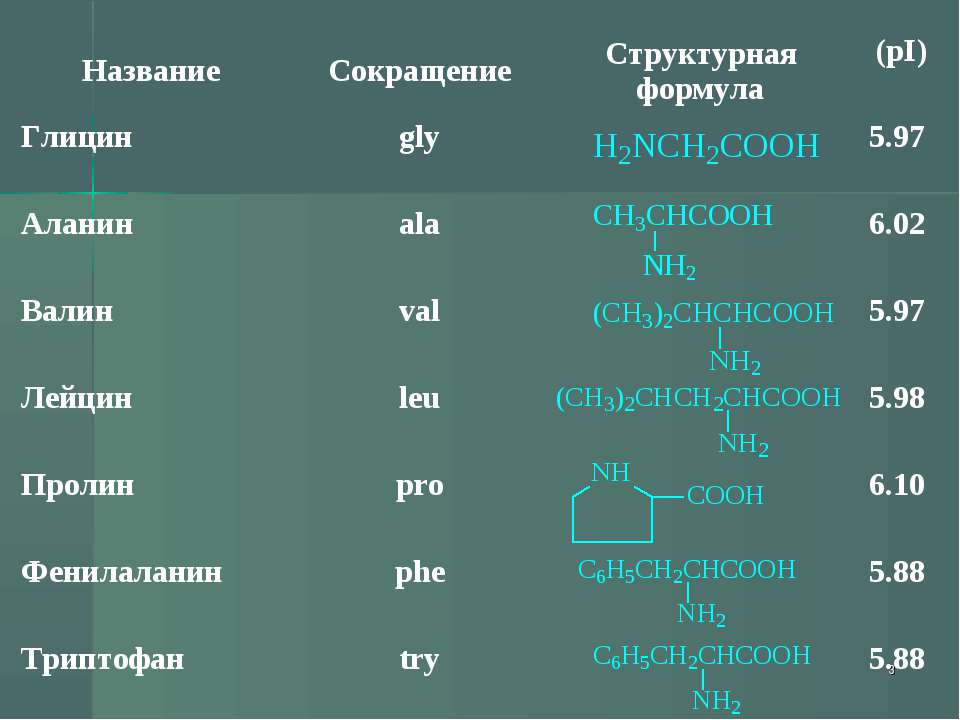
Все ферменты являются белками. Белки представляют собой линейные полимеры, точнее, сополимеры, построенные из связанных между собой остатков аминокислот. В состав большинства белков входят 20 важнейших аминокислот — глицин, аланин, валин, лейцин, изолейцин, аспарагиновая кислота, глутаминовая кислота, серин, треонин, лизин, аргинин, гистидин, фенилаланин, тирозин, триптофан, цистеин, цистин, метионин, пролин и оксипролин их химические формулы и обозначения приведены в таблице на стр. 5. Молекула каждой аминокислоты (1) достаточно проста и обязательно содержит две реакционноспособные группировки — одну, обладающую основными свойствами (аминогруппа HgN—) и другую, имеющую кислотные, свойства (карбоксильная группа — СООН), f.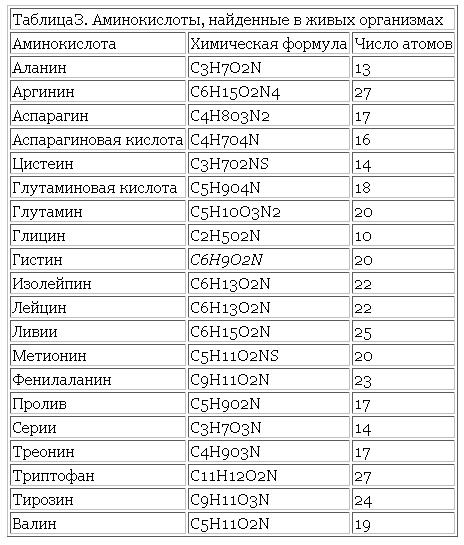
Опорой ДЛЯ определения конфигураций соединений с аминогруппой у асимметрического центра может служить доказанная рентгенографическим методом абсолютная конфигурация природного (правовращающего) аланина (см. стр. 186). Например, в 1907 г. Э. Фишер действием пятихлористого фосфора заменил гидроксильную группу (—)-серина на атом хлора и этот промежуточный продукт далее восстановил в (И-)-аланин, а действием Ва(ЗН)2 превратил в (—)-цистеин. Это позволяет для названных аминокислот написать следующие проекционные формулы [c.192]
Напишите формулу полипептида, в состав которого входят аспарагиновая и глютаминовая кислоты, цистеин и тирозин. Напишите его название. Подчеркните пунктиром свободные аминные, карбоксильные, фенольные и сульфгидрильные группы и укажите, какой преобладающий заряд несет молекула этого полипептида в водном растворе. [c.44]
Одними из первых природных полипептидов, строение которых было полностью установлено и подтверждено синтезом, были белковые гормоны окситоцин и вазопрессин.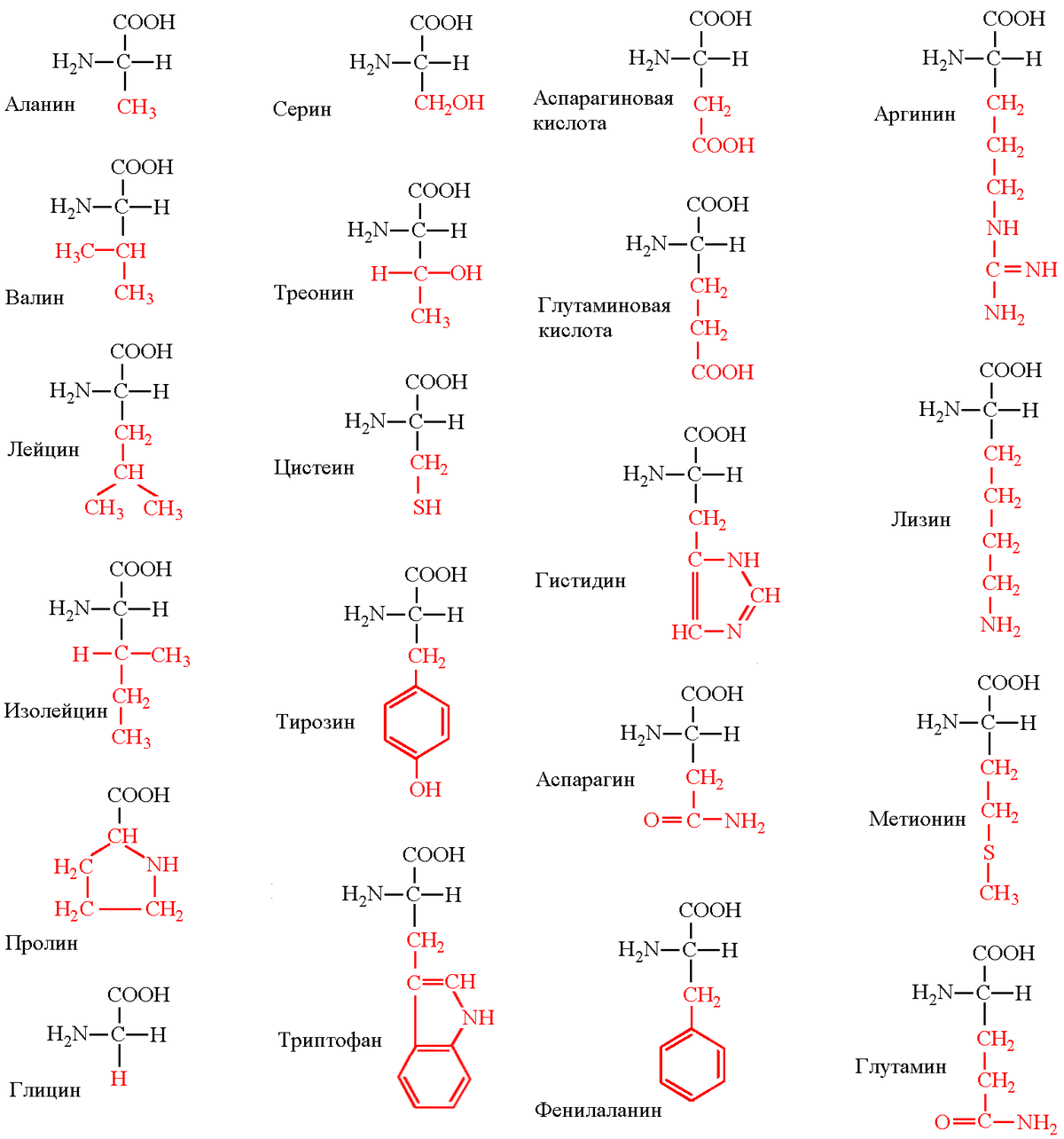 Оба вещества построены сходно, различие отмечается лишь в двух звеньях полипептидной цепи (эти места отмечены в приводимых формулах стрелками), в то время как физиологическое действие обоих гормонов резко отлично цистеин —цистеин -,
Оба вещества построены сходно, различие отмечается лишь в двух звеньях полипептидной цепи (эти места отмечены в приводимых формулах стрелками), в то время как физиологическое действие обоих гормонов резко отлично цистеин —цистеин -,
Сравнение частот включения этих двух аминокислот относительно фенилаланина с ожидаемыми частотами встречаемости триплетов У А, УАг и Аз относительно фенилаланинового кодона Уд в случайной последовательности УА показывает, что кодоны тирозина и изолейцина, вероятнее всего, отвечают эмпирической формуле УаА. В-третьих, аналогичный анализ результатов по включению аминокислот под влиянием поли-] Ц и поли-УГ позволил Ниренбергу заключить, что кодонами серина и пролина соответственно являются УаЦ и УЦ, (хотя в опытах с поли-Ц было показано, что пролин кодируется также Цд)» кодонами валина и цистеина — У2Г и что триптофан и глицин кодируются кодонами УГз. Особый интерес представляют данные] по включению лейцина, так как включение лейцина стимулируется как поли-УЦ, так и поли-УГ. Это означает, что лейцин кодируется по крайней мере двумя различными кодонами — УаЦ и У Г. [c.437]
Это означает, что лейцин кодируется по крайней мере двумя различными кодонами — УаЦ и У Г. [c.437]
Образующийся цистеин, как уже указывалось (стр. 379—381), участвует в образовании ряда веществ в организме. Наряду с этим, он также используется для обезвреживания в организме определенных ароматических соединений, давая замещенные меркаптаны с общей формулой [c.385]
В химии белков и полипептидов для сокращения принято писать формулы, обозначая остатки аминокислот буквами (таблица с такими обозначениями приведена на стр. 485). Например, Glu — обозначение глутаминовой кислоты, Суз—SH—цистеина, Gly — глицина и т. д. Сокращенная формула глутатиона будет в таком изображении [c.507]
Аланил Цистеинил Валин Рис. 4.1. Структурная формула трипептида. Пептидные связи для наглядности затенены. [c.33]
Аскорбиновая кислота содержит два асимметричных атома углерода в 4-м и 5-м положениях, что позволяет образовать четыре оптических изомера.
 Аскорбиновая кислота оказалась необходимым пищевым фактором для человека, обезьян, морских свинок и некоторых птиц и рыб. Все другие животные не нуждаются в пищевом витамине С, поскольку он легко синтезируется в печени из глюкозы. Как оказалось, ткани витамин-С-чувствительных животных и человека лишены одного-единственного фер- [c.238]
Аскорбиновая кислота оказалась необходимым пищевым фактором для человека, обезьян, морских свинок и некоторых птиц и рыб. Все другие животные не нуждаются в пищевом витамине С, поскольку он легко синтезируется в печени из глюкозы. Как оказалось, ткани витамин-С-чувствительных животных и человека лишены одного-единственного фер- [c.238]Приведите структурные формулы кислот а) аминоуксусной (глицина) б) а-аминопропионовой (аланина) в) 2-амино-3-метилбутановой (валина) г) 2-амино-4-метилпентановой (лейцина) д) 2-амино-З-фенилпропановой (фенилаланина) е) 2-амино-3-гйдроксипроиановой (серина) ж) 2-амино-З-меркаитоироиановвй (цистеина). [c.213]
Установлено, что важными составляющими белков являются двадцать три аминокислоты. Названия этих кислот приведены в табл. 14.1 там же указаны формулы характеристических групп К. Некоторые аминокислоты имеют дополнительную карбоксильную группу или дополнительную аминогруппу. Так, имеется двухосновная диаминокислота — цистин, очень близкая к простой аминокислоте цистеину.
Подтверждение формулы кофермента А (LI) получено на основании его биохимического синтеза. Пантотеновая кислота (I) конденсируется с цистеином в пантотенилцистеин (LXII) [c.75]
При необходимости описать строение более длинных молекул можно также воспользоваться однобуквенньпл кодом, в котором каждой аминокислоте присвоена одна заглавная буква латинского алфавита аланин — А, аспарагин — N, аспарагиновая кислота О, аргинин — Я, валин — V, гистидин — Н, глицин — О, глутамин О, глутаминовая кислота — Е, изолейцин — I, лейцин — Ь, лизин — К, метионин — М, пролин — Р, серии — 8, тирозин — V, треонин Т, триптофан — фенилаланин — Р, цистеин » С.
 С использованием этого кода вместо громоздкой структурной формулы, написанной в начале страницы, можно записать УЯМ. [c.54]
С использованием этого кода вместо громоздкой структурной формулы, написанной в начале страницы, можно записать УЯМ. [c.54]Реакции алкилирования этилениминов наиболее быстро проходят с соединениями, содержащими сульфгидрильную группу. Так, в случае цистеина образуются тиоэфиры общей формулы XXVIII [c.59]
Относительная. конфигурация а-аминокислот определяется как и у гидроксикислот, по конфигурационному стандарту -глицериновому альдегиду — с использованием гидроксикислот ного ключа. Расположение в (правильно построенной ) проеь ционной формуле Фишера аминогруппы слева (как ОН-группы L-глицериновом альдегиде) соответствует L-конфигурации, спрг ва — D-конфигурации хирального атома углерода (см. 3.2.4) По R, S-системе обозначений а-углеродный атом у всех а-амин( кислот L-ряда имеет S-, а у D-ряда — R-конфигурацию (исклн чение составляет цистеин).
Эти остатки R могут быть неполярными (например, лейцин в приведенной выше формуле), полярными (тирозин), кислыми (глутаминовая кислота) или основными (аргинин, лизин).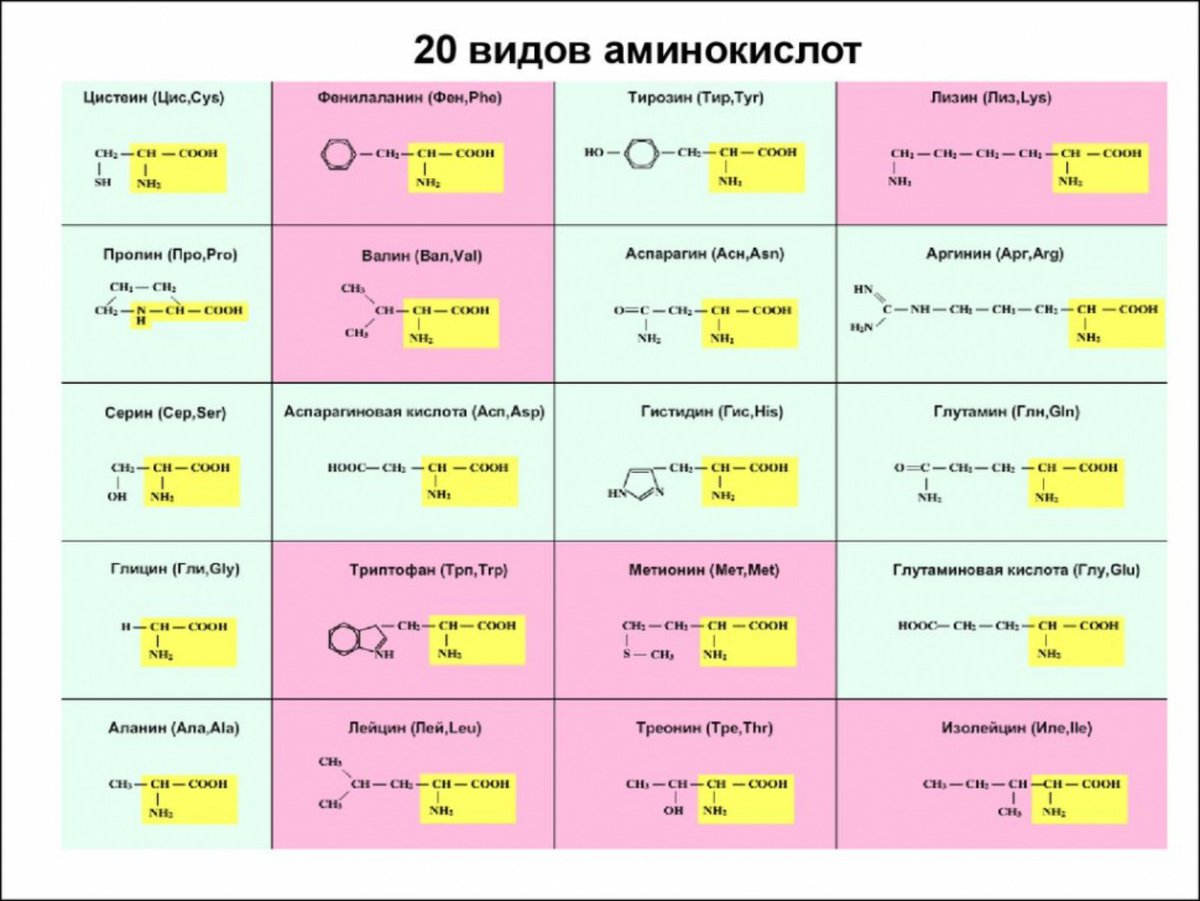 Неполярные группы R (происходяш ие из моноаминомонокарбоновых кислот) притягиваются другими аналогичными груннами только вандерваальсовыми силами. Гидроксилсодержащие остатки R (происходящие из оксиаминокислот) могут связываться с аналогичными группами других цепей при помощи водородных связей, а кислые и основные группы R — электростатическими связями. Несколько иначе ведет себя группа SH (остатков R, происходящих из цистеина), ввиду того что эта группа является единственной, которая может образовать ковалентные, а именно дисульфид-ные связи S—S с аналогичными группами других цепей. [c.425]
Неполярные группы R (происходяш ие из моноаминомонокарбоновых кислот) притягиваются другими аналогичными груннами только вандерваальсовыми силами. Гидроксилсодержащие остатки R (происходящие из оксиаминокислот) могут связываться с аналогичными группами других цепей при помощи водородных связей, а кислые и основные группы R — электростатическими связями. Несколько иначе ведет себя группа SH (остатков R, происходящих из цистеина), ввиду того что эта группа является единственной, которая может образовать ковалентные, а именно дисульфид-ные связи S—S с аналогичными группами других цепей. [c.425]
Серин IV, как показывает эквивалентная предыдущей формула 1Уа, является 5-серином (большинство природных аминокислот принадлежат к 5-ряду), но -цистеин V является исключением, так как порядковый номер серы больше порядкового номера кислорода, и поэтому группа СНгЗН старше, чем группа СООН [c.96]
Дезагрегацию молекулы кератина при воздействии восстанавливающих агентов, например сульфита, приписывают тому, что эти агенты разрывают мостики, образованные дисульфидными группами цистина (формула II).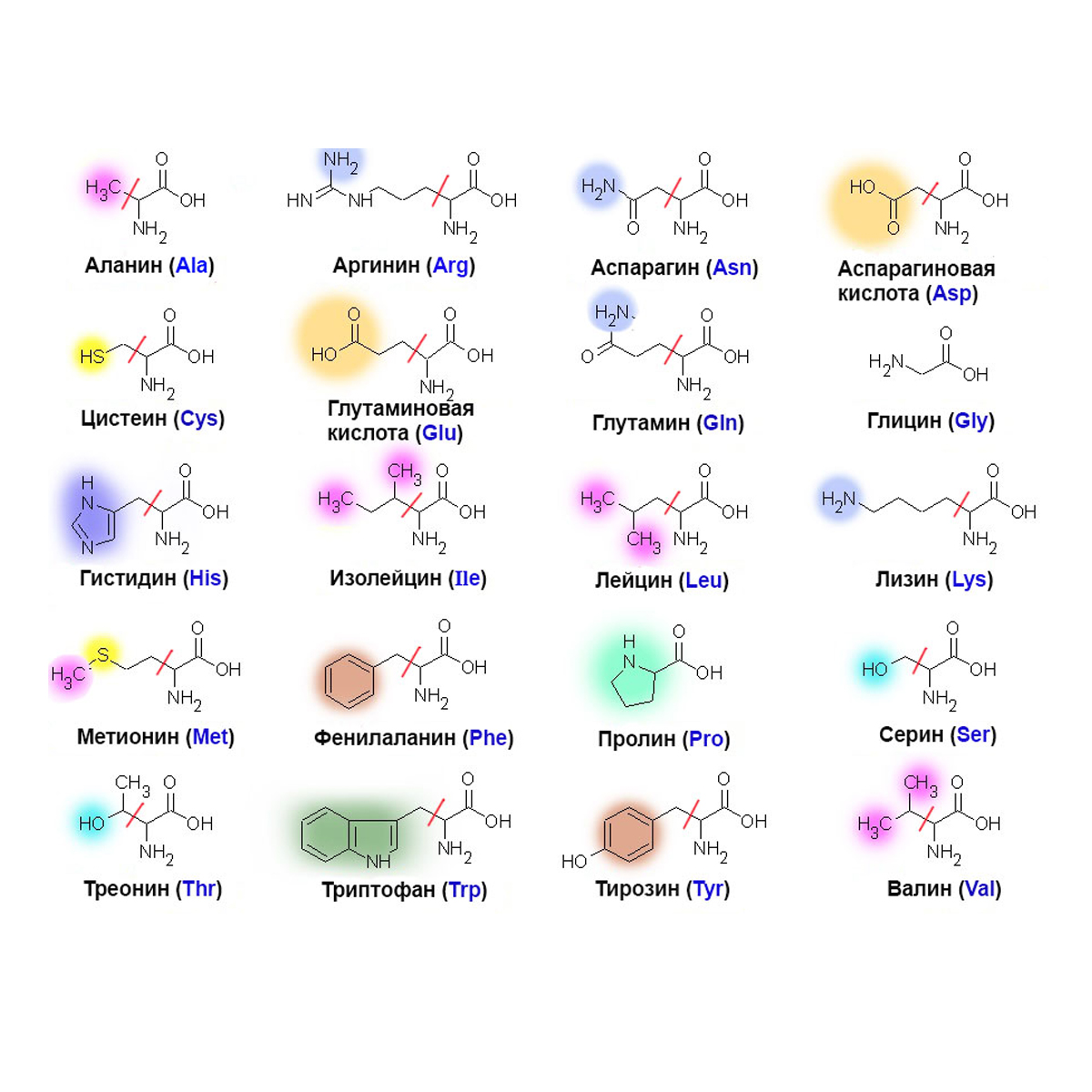 Однако при окислении входящих в состав яичного альбумина сульфгидрильных групп цистеина с образованием дисульфидных групп цистина молекулярный вес яичного альбумина не меняется [79]. Заметно не меняется и вязкость растворов яичного или сывороточного альбумина после обработки их перйодатом, обусловливающим полное окисление дисульфидных мостиков цистина [80, 81]. Эти данные свиде-татьствуют о том, что структура указанных белков скорее соответствует формуле (III), чем формуле (II). Такое заключение [c.133]
Однако при окислении входящих в состав яичного альбумина сульфгидрильных групп цистеина с образованием дисульфидных групп цистина молекулярный вес яичного альбумина не меняется [79]. Заметно не меняется и вязкость растворов яичного или сывороточного альбумина после обработки их перйодатом, обусловливающим полное окисление дисульфидных мостиков цистина [80, 81]. Эти данные свиде-татьствуют о том, что структура указанных белков скорее соответствует формуле (III), чем формуле (II). Такое заключение [c.133]
Как видно из приведенной выше общей формулы полипептидной цепи белковой молекулы, на одном ее конце в остатке аминокислоты сохраняется незамещенная аминогруппа —ЫНг эту аминокислоту называют Н-концевой аминокислотой. На другом конце цепи в остатке аминокислоты сохраняется карбоксил —СООН это С-концевая аминокислота. Из той же общей формулы полипептидной цепи видно, что такая цепь содержит множество боковых ответвлений —К, т. е. тех частей аминокислотных остатков, которые непосредственно в цепь не входят. Чтобы пояснить это, представим себе некоторый отрезок полипептидной цепи белковой молекулы, составленный из остатков различных а-аминокислот, например аланина, глутаминовой кислоты, серина, лизина, цистеина и т. п. (формулы этих а-аминокислот приведены в табл. 14) [c.331]
Чтобы пояснить это, представим себе некоторый отрезок полипептидной цепи белковой молекулы, составленный из остатков различных а-аминокислот, например аланина, глутаминовой кислоты, серина, лизина, цистеина и т. п. (формулы этих а-аминокислот приведены в табл. 14) [c.331]
Однако если раствор аминокислоты обработать фосфатом меди, то отношение между а-аминным азотом и медью в растворе никогда не будет равным 0,44 [203], как это имело бы место, если бы составу комплекса действительно соответствовала формула А2Си (для гистидина это отношение равно 0,25 для аспараги-новой кислоты — 0,39, для лизина — 0,52 и т. д.). Указанные расхождения возникают благодаря существованию двух упомянутых выше равновесий, а также вследствие того, что в некоторых аминокислотах (гистидине, цистеине, орнитине и т. д.) вторая группа также способна связывать металл. В результате этого образуются интрамолекулярные комплексы, примером которых может служить гистидиновый комплекс [c.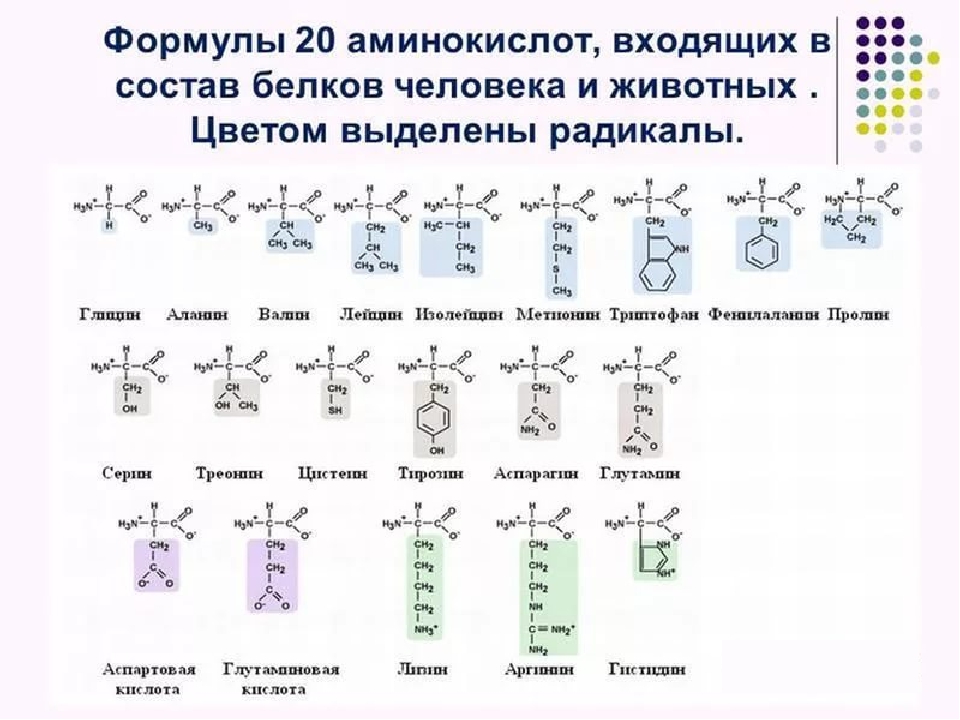 129]
129]
Как видно из формулы, серин представляет собой оксиамино-пропионовую кислоту. Существуют также аминокислоты, содержащие кроме аминогруппы группу—5Н, то есть тиоаминокислоты. Примером такой кислоты может служить цистеин. [c.320]
Если конечной стадией является сочетание тиоловой группы остатка цистеина с остатком а-аминоакрило-вой кислоты, то непонятно, почему последний должен образоваться из цистина, а не из серина. Интересна в этой связи работа Николе и Шинна [95], сочетавших бензилмеркаптан с остатками серина в обработанном щелочью фиброине шелка (с образованием остатка 5-бензилцистеина). Точно так же можно ожидать, что остатки треонина дадут образование -метиллантио-нина. Кюстер и Ирион [96] выделили из шерсти, которая обрабатывалась сернистым натро-м, вещество, которому 0 щ приписывают следующую формулу [c.53]
Как видно из структурных формул, приведенных на фиг. 15, двадцать стандартных аминокислот (которые часто обозначаются, как это показано на фиг. 15, тремя первыми буквами их полных названий) можно разбить на несколько подгрупп в соответствии с природой их заместителей (боковых цепей) в основной цепи. Глицин, аланин, валив, лейиин, изо-лейиин, серии и треонин содержат простые алифатические заместители, а фенилаланин и тирозин — простые ароматические заместители. Цистеин и метионин содержат серу. Лизин, аргинин и гистидин имеют в своих алифатических боковых цепях вторую аминогруппу. У аспарагиновой и глутиминовой кислот в алифатических боковых цепях имеется вторая карбоксильная группа. Аспарагин и глутамин представляют собой простые амиды аспарагиновой и глутаминовой кислот. Наконец, триптофан, пролин и гистидин обладают гетероциклическими боковыми пенями. [c.40]
15, тремя первыми буквами их полных названий) можно разбить на несколько подгрупп в соответствии с природой их заместителей (боковых цепей) в основной цепи. Глицин, аланин, валив, лейиин, изо-лейиин, серии и треонин содержат простые алифатические заместители, а фенилаланин и тирозин — простые ароматические заместители. Цистеин и метионин содержат серу. Лизин, аргинин и гистидин имеют в своих алифатических боковых цепях вторую аминогруппу. У аспарагиновой и глутиминовой кислот в алифатических боковых цепях имеется вторая карбоксильная группа. Аспарагин и глутамин представляют собой простые амиды аспарагиновой и глутаминовой кислот. Наконец, триптофан, пролин и гистидин обладают гетероциклическими боковыми пенями. [c.40]
Когда такой полинуклеотид был использован в качестве матрицы в бесклеточной системе синтеза белка, наблюдалось образование чередующегося полипептида-валин-цистеин-валин-цистеин-, очевидно определяемого последовательностью кодонов-УГУ-ГУГ-УГУ-ГУГ-. Этот результат позволил заключить, что лейциновый кодон с формулой УгГ в действительности не УГУ и что кодоны триптофана и глицина с формулами УГа— не ГУГ. Стало также ясно, что либо валиновый кодон с формулой УаГ — это УГУ и тогда ГУГ является вторым кодоном для цистеина, либо цисте-иновый кодон с формулой УаГ — это УГУ и тогда ГУГ является вторым кодоном для валина. Помимо этого, образование чередующегося полипептида на чередующейся полинуклеотидной матрице окончательно доказало, что кодон содержит нечетное число нуклеотидов, т. е. состоит из трех, а не из шести нуклеотидов слабые сомнения в этом еще оставались после работ Крика и Бреннера, доказывающих триплетность кода. [c.439]
Этот результат позволил заключить, что лейциновый кодон с формулой УгГ в действительности не УГУ и что кодоны триптофана и глицина с формулами УГа— не ГУГ. Стало также ясно, что либо валиновый кодон с формулой УаГ — это УГУ и тогда ГУГ является вторым кодоном для цистеина, либо цисте-иновый кодон с формулой УаГ — это УГУ и тогда ГУГ является вторым кодоном для валина. Помимо этого, образование чередующегося полипептида на чередующейся полинуклеотидной матрице окончательно доказало, что кодон содержит нечетное число нуклеотидов, т. е. состоит из трех, а не из шести нуклеотидов слабые сомнения в этом еще оставались после работ Крика и Бреннера, доказывающих триплетность кода. [c.439]
Как видно из приведенной выше формулы, окситоцин содержит цикл, замыкающийся в результате возникновения дисульфидной связи между 1-м и 6-м остатками цистеина в его молекуле. [c.449]
строение и классификация аминокислот: таблицы с формулами
Строение основных аминокислот: 20 «магических», входящих в состав белка. Структура. Классификации. Таблицы с формулами. Название и международные сокращения протеиногенных аминокислот. С вами я, Галина Баева, 20 «магических» аминокислот и красивые таблицы со структурными формулами природных аминокислот.
Структура. Классификации. Таблицы с формулами. Название и международные сокращения протеиногенных аминокислот. С вами я, Галина Баева, 20 «магических» аминокислот и красивые таблицы со структурными формулами природных аминокислот.
Природные аминокислоты — это структурные единицы (мономеры) белков. В состав белков входят всего 20 т.н. «магических» аминокислот, которые также называются протеиногенными. Все они имеют сходное строение.
Кроме протеиногенных аминокислот в организме присутствуют и непротеиногенные, которые выполняют различную работу, в основном это промежуточные соединения в биохимическом конвейере, как например, орнитин, сигнальные молекулы, как β-аланин или нейромедиаторы, как ГАМК.
Особенности строения природных аминокислот
Строение аминокислот тесно связано с их функциями. Сходные по химической структуре вещества делают сходную работу. Попробуем разобраться, чтобы потом не путаться в аннотациях к препаратам.
Все аминокислоты слеплены по одному лекалу.
Голова – аминный остаток, содержащий азот N.
Углеродный скелет, состоящий из цепочки атомов углерода (в простейшем случае – один углерод, к которому «спереди» прицеплен аминный остаток, а сзади – карбоновый хвост)
Хвост – остаток карбоновой кислоты – СООН
Сбоку к углеродному скелету может быть присоединена еще какая-нибудь химическая группировка, которая придает данному веществу особые свойства.
Углеродная цепочка вместе с кислотным хвостом, присоединенная к аминной голове, называется мудреным словом «алифатический радикал».
Номенклатура аминокислот
Углеродная цепочка (скелет) может состоять как из 1 атома углерода, так и из нескольких. В последнем случае имеет значение, к какому атому углерода, начиная счет от карбоксильной группы, присоединится аминная голова. Это может быть как 1-ый атом углерода, так и 2-ой, 3-ий и далее. Химики договорились обозначать атомы углерода не цифрами, а буквами греческого алфавита: α — 1-ый атом углерода, начиная с карбоксильного хвоста, β— 2-ой, γ — 3-й, и т.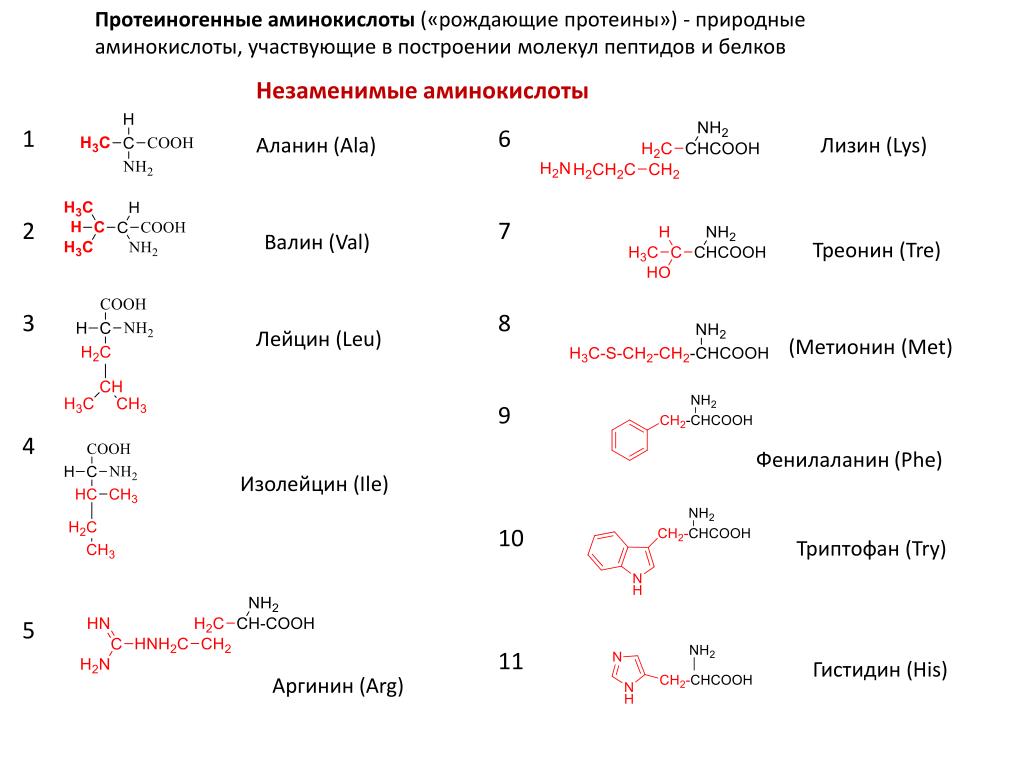 д.
д.
Если аминогруппа присоединяется к углероду в α-положении, такую аминокислоту называют α-аминокислотой, соответственно, если аминогруппа присоединена в β-положении — то это β-аминокислота, если в γ — то γ -аминокислота.
Все 20 природных протеиногенных аминокислот относятся к группе α -аминокислот.
Из β — аминокислот наиболее известен β-аланин, а из γ-аминокислот наиболее известна γ-аминомасляная кислота (ГАМК). Их структурные формулы приведены ниже.
Таблица 1 Строение протеиногенных аминокислот
Таблица 2 Структурные формулы аминокислот
Таблица 3 Модели структурных формул аминокислот
Классификация аминокислот
Существует несколько классификаций аминокислот:
- В зависимости от строения алифатического радикала, аминокислоты подразделяются на следующие группы:
- Просто аминокислоты с алифатическим радикалом, т.
 е. такие, у которых углеродная цепочка не содержит дополнительных затей. Их называют МоноАминоМоноКарбоновые: глицин и аланин
е. такие, у которых углеродная цепочка не содержит дополнительных затей. Их называют МоноАминоМоноКарбоновые: глицин и аланин - Аминокислоты с разветвленной боковой цепью, у которых углеродный скелет образует боковые вилки: валин, лейцин, изолейцин. Изолейцин по химическому составу не отличим от лейцина, но его углеродный скелет по-другому загнут, т.е. он является стереоизомером. Иногда его выделяют в отдельную аминокислоту, а иногда – нет. Аминокислоты с разветвленной боковой цепью тоже относятся к группе МоноАминоМоноКарбоновых аминокислот.
- Аминокислоты, у которых в алифатическом радикале имеются разные группировки:
Спиртовая – ОН. Их называют ОксиМоноАминоМоноКарбоновые: серин и треонин
Карбоксильная, т. е. второй кислотный хвост. Это МоноАминоДиКарбоновые аминокислоты: аспарагиновая кислота (аспартат) и глутаминовая кислота (глутамат). Их называют еще Кислые аминокислоты, этакое «масло масляное».
е. второй кислотный хвост. Это МоноАминоДиКарбоновые аминокислоты: аспарагиновая кислота (аспартат) и глутаминовая кислота (глутамат). Их называют еще Кислые аминокислоты, этакое «масло масляное».
Амидная. Карбоксильный хвост отрастил себе вторую аминную голову: аспарагин и глутамин. Кажется, понятным, что это производные соответственно аспартата и глутамата. Их называют Амиды МоноАминоДиКарбоновых аминокислот
Аминная. Вторая аминная голова присоединилась к углеродному скелету: лизин
Гуанидиновая: дополнительные аминные вставки — аргинин
Лизин и Аргинин относят также к группе ДиАминоМоноКарбоновых аминокислот, ибо у них есть по второй аминной группе.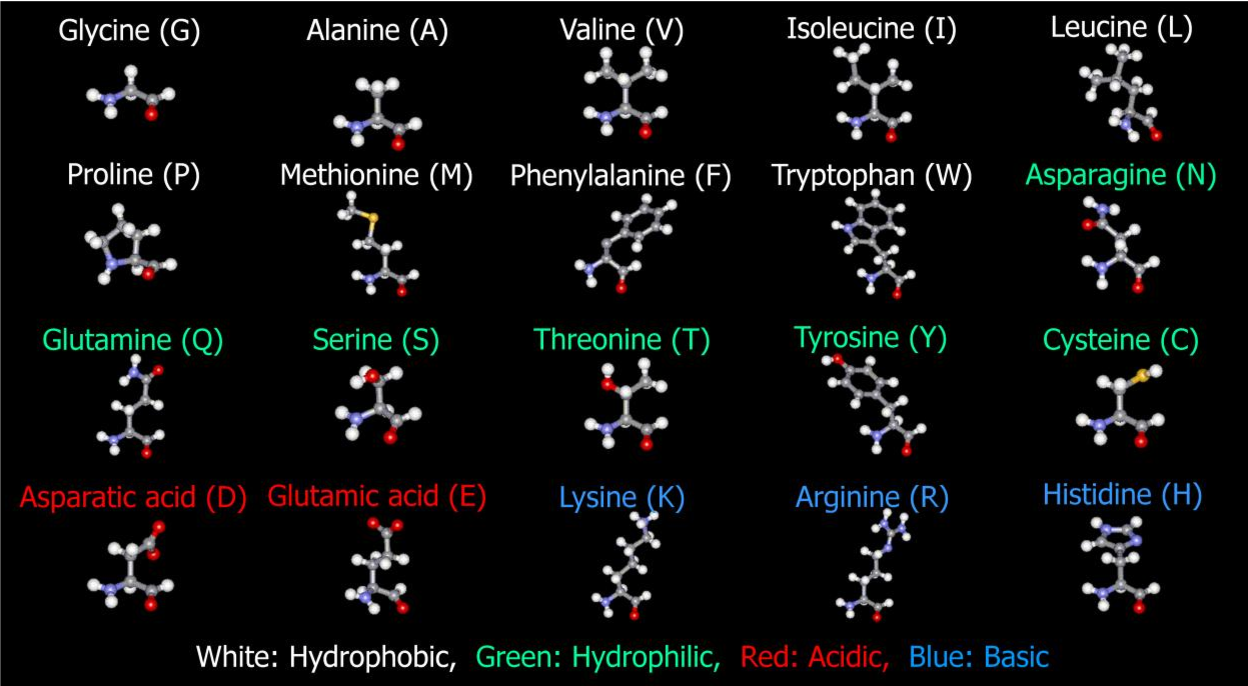 Поскольку эти аминокислоты в нейтральной среде (вода, рН=7), проявляют щелочные (основные) свойства, повышая водородный показатель (рН становится › 7), то их относят к группе Основных аминокислот
Поскольку эти аминокислоты в нейтральной среде (вода, рН=7), проявляют щелочные (основные) свойства, повышая водородный показатель (рН становится › 7), то их относят к группе Основных аминокислот
Серосодержащие аминокислоты. Имеют в радикале атом серы S: цистеин, метионин
Аминокислоты, содержащие ароматический радикал– углеродное колечко или Ароматические аминокислоты фенилаланин, тирозин, триптофан
Аминокислоты с гетероциклическим радикалом – колечко с атомом азота вместо углерода, поэтому он «гетеро» — «разнообразный»: триптофан и гистидин.
Нетрудно заметить, что триптофан входит в группу как ароматических аминокислот, так и в группу аминокислот с гетероциклическим радикалом, а все потому, что у него есть как гетороциклический радикал, так и ароматический.
Иминокислоты – углеродный скелет не вытянут в цепочку, а замкнут в колечко, из которого торчат аминная голова и рядом кислотный хвост: пролин и оксипролин
2. Классификация, в основу которой положена полярность алифатического радикала.
Классификация, в основу которой положена полярность алифатического радикала.
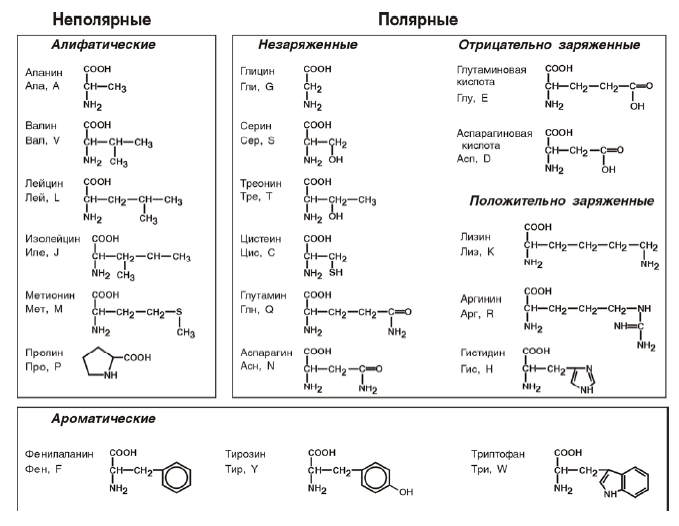
- Неполярные (гидрофобные) аминокислоты. Они имеют неполярные связи между атомами C-C, C-H. Это глицин, аланин, валин, лейцин, изолейцин, пролин, триптофан — 8 аминокислот
- Полярные незаряженные (гидрофильные) аминокислоты. Они имеют полярные связи между атомами С-О, C-N, O-H, S-H. Это серин, аспарагин, глутамин, треонин, метионин — 5 аминокислот
- Полярные отрицательно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН = 7) заряжены отрицательно, т.е. они выступают как отрицательно-заряженный ион (анион). Это аспарагиновая и глутаминовая кислоты, тирозин, цистеин — 4 аминокислоты
- Полярные положительно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН=7) заряжены положительно, т.е. они выступают как положительно-заряженный ион (катион).
 Это лизин, аргинин, гистидин — 3 аминокислоты.
Это лизин, аргинин, гистидин — 3 аминокислоты.
Чем больше в белке аминокислот, обладающих полярностью, тем выше способность белка к химическим реакциям, т.е. его реактогенность. С реактогенностью белка непосредственно связаны его функции. Белки соединительной ткани, например кератин, входящий в состав волос и ногтей, имеет мало полярных аминокислот. Напротив, ферменты — белки-катализаторы биохимических реакций, обладают аминокислотным составом с множеством полярных групп.
3. Классификация по отношению к водородному показателю (рН)
- Аминокислоты, обладающие нейтральными свойствами с рН 5,97 – 6,02. Это глицин, аланин, серин, валин, лейцин, изолейцин,треонин, цистин, метионин — 9 аминокислот. Они имеют одну аминную голову и один карбоксильный хвост
- Аминокислоты, обладающие слабокислыми свойствами рН 3,0 – 5,7. Это аспарагиновая и глутаминовая кислоты. Они имеют одну аминную голову, но два карбоксильных хвоста, поэтому их называют «кислотами».

- Аминокислоты, обладающие щелочными свойствами с рН 9,7 – 10,7. У них две аминные головы и один карбоксильный хвост. Это лизин, аргинин, гистидин.
4. Классификация по способности к синтезу в организме человека и животных.
- Заменимые аминокислоты: глицин, серин, аланин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин
- Условно-заменимые аминокислоты: аргинин, гистидин, тирозин, цистеин
- Незаменимые аминокислоты: валин, лейцин, изолейцин, треонин, лизин, триптофан, фенилаланин, метионин
Подробнее о них рассказывается здесь: Аминокислоты заменимые и незаменимые: где взять.
5. Классификация аминокислот по путям биосинтеза.
В живых организмах аминокислоты могут производится (синтезироваться) из других соединений. Путь биосинтеза — это последовательность химических реакций, которые обусловлены наследственной (генетической) матрицей. Он записан в генетическом коде и обусловлен наличием ферментов, запускающих данные реакции. Биосинтез идет не хаотично, а количество исходных и промежуточных соединений ограничено. Так из всего многообразия природных аминокислот для синтеза белка используются только 20. Соответственно, исходные и промежуточные соединения на путях биосинтеза отдельных аминокислот образуют кластеры или семейства, где соединения могут преобразовываться друг в друга.
Он записан в генетическом коде и обусловлен наличием ферментов, запускающих данные реакции. Биосинтез идет не хаотично, а количество исходных и промежуточных соединений ограничено. Так из всего многообразия природных аминокислот для синтеза белка используются только 20. Соответственно, исходные и промежуточные соединения на путях биосинтеза отдельных аминокислот образуют кластеры или семейства, где соединения могут преобразовываться друг в друга.
- Семейство аспартата: аспарагиновая кислота (аспартат), аспарагин, изолейцин, лизин, треонин, метионин
- Семейство глутамата: глутаминовая кислота (глутамат), глутамин, пролин, аргинин
- Семейство пирувата: аланин, валин, лейцин
- Семейство серина: серин, глицин, цистеин
- Семейство пентоз: гистидин, триптофан, фенилаланин, тирозин
- Семейство шикимата: триптофан, фенилаланин, тирозин
Надо сказать, что данные пути метаболизма реализуются в биологических системах, но не все они имеются в организме человека. Так высшие животные и человек не способны синтезировать ароматическое кольцо, поэтому путь шикимата — это не для нас. Аналогично с другими путями синтеза незаменимых аминокислот. Для наглядности незаменимые аминокислоты выделены жирным шрифтом.
Так высшие животные и человек не способны синтезировать ароматическое кольцо, поэтому путь шикимата — это не для нас. Аналогично с другими путями синтеза незаменимых аминокислот. Для наглядности незаменимые аминокислоты выделены жирным шрифтом.
6. Классификация аминокислот по путям катаболизма
Катаболизм — процесс распада, противоположен анаболизму или процессу синтеза. В организме катаболизм также обусловлен генетической программой и набором ферментов. Конечным итогом деградации аминокислот является аммиак, вода и углекислый газ, а также выделяется энергия в виде тепла или связанная в молекулах АТФ. В зависимости от промежуточных соединений, дающих энергию, аминокислоты подразделяются на следующие группы:
- Глюкогенные: дающие метаболиты (промежуточные соединения), из которых может быть синтезирована глюкоза: глицин, аланин, серин, треонин, валин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, аргинин, гистидин, цистин, метионин
- Кетогенные: распадающиеся до ацетоацетилКоА и ацетилКоА, из которых могут быть синтезированы кетонные тела: лизин, лейцин
- Промежуточные: при распаде этих аминокислот образуются метаболиты обоих типов: изолейцин, триптофан, фенилаланин, тирозин
Подробнее о глюкогенных и кетогенных аминокислотах можно прочитать здесь: Гликогенные аминокислоты
Правые и левые аминокислоты
В зависимости от прикрепления аминогруппы по отношению к карбоксильному хвосту в углеродной цепочке, аминокислоты могут быть «правыми» или «левыми», иначе говоря, их относят к D- или L- изомерам. Такие формы называют оптически активными, они не отличаются по химическому составу, но в пространстве относятся друг другу, как левая и правая рука.
Такие формы называют оптически активными, они не отличаются по химическому составу, но в пространстве относятся друг другу, как левая и правая рука.
В белковые молекулах присутствуют только L (левые) -изомеры аминокислот, правые (D) -изомеры могут обладать особыми свойствами и выступать как медиаторы, т.е. сигнальные молекулы, но чаще они образуют балласт. В обычных продуктах питания D-аминокислот практически нет. Они образуются при химическом синтезе и могут встречаться в искусственных протеинах, используемых в спортивном питании или в качестве биологически-активных добавок к пище. D-аминокислоты с трудом расщепляются ферментами, ибо они не физиологичны. В печени и почках содержится особый фермент — оксидаза D-аминокислот, предполагают, что она превращает нефизиологичные правые аминокислоты в физиологичные левые. Количество ее невелико, т.к. обычно в пище содержится очень мало D-аминокислот.
При химическом синтезе образуется равное количество D- и L- изомеров, но в синтезе белка участвуют аминокислоты только L – ряда.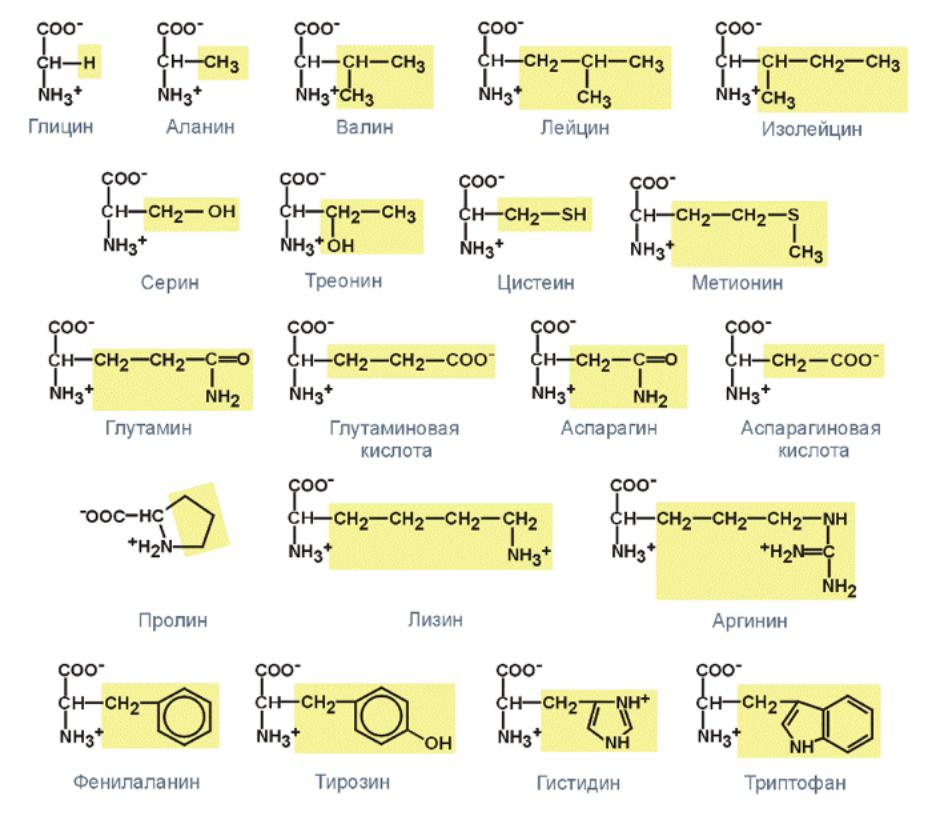 Это следует учитывать лицам, принимающим препараты аминокислот: L-аминокислоты будут существенно дороже из-за необходимости их выделения из смеси, но эффект от их применения будет существенно выше
Это следует учитывать лицам, принимающим препараты аминокислот: L-аминокислоты будут существенно дороже из-за необходимости их выделения из смеси, но эффект от их применения будет существенно выше
Читайте далее о том, что делает в организме каждая аминокислота. Поверьте, им есть, чем заняться. С вами была Галина Батуро. Делитесь информацией в соц.сетях, оставляйте комментарии.
13 игр и приложений для изучения химии / Newtonew: новости сетевого образования
Не так давно мы предложили вашему вниманию 13 игр и приложений для изучения физики. Но это не единственная наука, над популяризацией которой сегодня трудятся разработчики. И, конечно, их внимание не прошло мимо химии – интереснейшей науки о строении веществ, которая обычно вызывает у детей ужас перед непонятными элементами и формулами. Но, кажется, дело, как всегда, в подходе. Возможно, если разнообразить изучение таблицы Менделеева использованием различных игр и познакомить детей с понятием химической валентности с помощью красочного и понятного приложения, то и сам предмет не будет им казаться скучным или недоступным. Так что предлагаем вашему вниманию подборку приложений и игр для изучения химии.
Так что предлагаем вашему вниманию подборку приложений и игр для изучения химии.
Источник: Flickr.com.
The Elements
Приложение для знакомства с химическими элементами, о котором однажды английский писатель и актёр Стивен Фрай отозвался следующим образом: «Ради этого приложения стоит купить iPad!». The Elements – это своеобразная база данных основных химических элементов, представленных в виде высококлассных 3D-моделей. Приложение основано на книге «Элементы» Теодора Грея, автора рубрики Gray Matter в журнале Popular Science Magazine, но возможности The Elements выходят далеко за пределы печатного издания.
Источник: iTunes.
Для каждого элемента подобран пример, который представлен в виде вращающейся 3D-модели (например, оловянный солдатик – для олова, слиток золота для золота и т.д.), которую можно самостоятельно запускать, переворачивать, увеличивать – в общем, исследовать со всех сторон. Рядом с каждым элементом представлена колонка данных и фактов, детально рассказывающих о его особенностях. Разработчики так характеризуют свой продукт:
Разработчики так характеризуют свой продукт:
The Elements не является приложением-справкой; это богатая и увлекательная история любви к периодической таблице, пересказанная в словах и картинках и позволяющая вам, как никогда ранее, испытать красоту и величество кирпичиков, из которых состоит наша Вселенная.
Многократно признанная одной из лучших программ для изучения химии, The Elements стоит всего лишь $4,99. Приложение можно скачать на iTunes. К сожалению, видео-обзор доступен только на английском, но даже визуального ряда достаточно, чтобы понять, насколько хороша эта программа.
Источник: The Tech Review Channel.
Molecules
В этом бесплатном приложении вы найдёте трёхмерные модели различных веществ. В Molecules есть несколько режимов визуализации, которые позволяют пользователям вращать модели, изменять масштаб молекулы, увеличивать/уменьшать размер и т. д. Само приложение обладает весьма приличной базой молекулярных моделей, но в то же время у пользователя есть возможность загружать примеры со специализированных сайтов международных хранилищ биологических молекул и их трехмерных моделей. Для этого необходимо в строке поиска ввести название вещества (Water, Gold, Insulin и т.д.). Конечно же, о каждой молекуле и молекулярном соединении здесь представлена исчерпывающая информация: полное название молекулярной структуры (а помните ли вы, что чаще всего вещества называются сокращённо, а полное название обычно известно только специалистам?), количество и виды аминокислот в случае белков, нуклеотидные последовательности для ДНК и РНК, имена исследователей соединения и многое другое. Приложение доступно на iTunes.
д. Само приложение обладает весьма приличной базой молекулярных моделей, но в то же время у пользователя есть возможность загружать примеры со специализированных сайтов международных хранилищ биологических молекул и их трехмерных моделей. Для этого необходимо в строке поиска ввести название вещества (Water, Gold, Insulin и т.д.). Конечно же, о каждой молекуле и молекулярном соединении здесь представлена исчерпывающая информация: полное название молекулярной структуры (а помните ли вы, что чаще всего вещества называются сокращённо, а полное название обычно известно только специалистам?), количество и виды аминокислот в случае белков, нуклеотидные последовательности для ДНК и РНК, имена исследователей соединения и многое другое. Приложение доступно на iTunes.
Источник:iTunes.
Chemical Valence
Созданное профессором химии из Мичигана, это приложение помогает понять пользователям принцип соединения молекул. Геймплей состоит из пяти уровней, на каждом из которых игроку необходимо составлять 2D-точечные структуры Льюиса.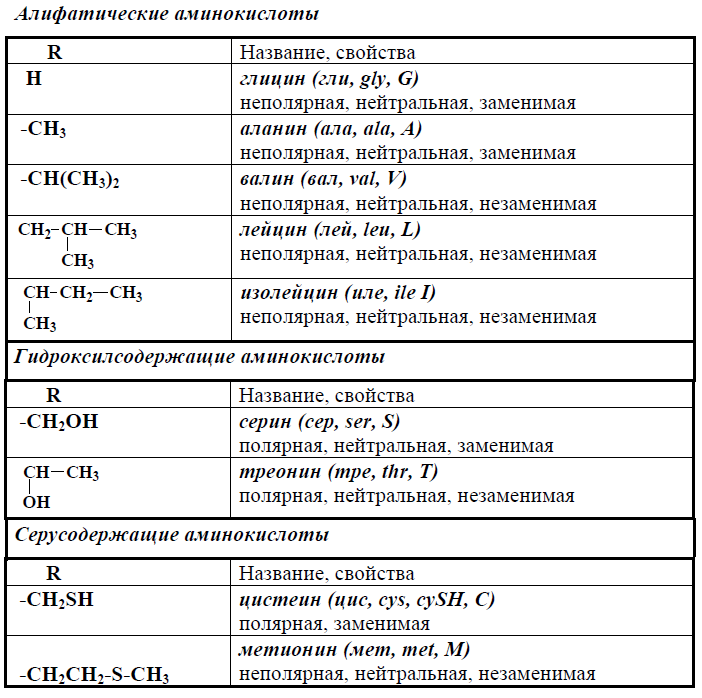 Тот, кто справился с заданием, будет вознаграждён превращением 2D-структуры в 3D-модель. Кроме того, в конце каждого уровня приложение выдаст вам философский риторический вопрос об устройстве Вселенной и её веществ, так что даже если не удастся постигнуть валентность, философия химии станет вам немного ближе. Скачать Chemical Valence можно в в App Store за $0,99.
Тот, кто справился с заданием, будет вознаграждён превращением 2D-структуры в 3D-модель. Кроме того, в конце каждого уровня приложение выдаст вам философский риторический вопрос об устройстве Вселенной и её веществ, так что даже если не удастся постигнуть валентность, философия химии станет вам немного ближе. Скачать Chemical Valence можно в в App Store за $0,99.
Источник: iTunes.
Chemist
Это своеобразная виртуальная химическая лаборатория в вашем мобильном устройстве. Здесь можно проводить опыты с различными веществами и наблюдать самые неожиданные реакции. Как вы понимаете, в виртуальном пространстве можно экспериментировать даже со взрывчатыми и радиоактивными веществами. Результаты опытов моделируются в реальном времени, при этом программа учитывает кучу параметров: состав воздуха, температуру окружающей среды, массу и объёмы смешиваемых веществ и т.д. Чтобы облегчить задачу начинающему химику, в приложении доступна база основных реакций по каждому веществу из таблицы Менделеева. Впрочем, можно «химичить» и открывать свои собственные реакции. Лаборатория Chemist доступна на iTunes, её цена — $4,99. Но есть и бесплатная ознакомительная версия.
Впрочем, можно «химичить» и открывать свои собственные реакции. Лаборатория Chemist доступна на iTunes, её цена — $4,99. Но есть и бесплатная ознакомительная версия.
Источник: THIX.
Chem Lab
Думаете, ещё одна химическая лаборатория? Не угадали! Chem Lab – это забавный тест, который проверит ваше знание базовых химических формул. Пользователю предлагается выполнить поочерёдно 5 заданий (перетянуть в пробирку нужные элементы для получения газа или соединить подходящие вещества и т.д.). В конце экспериментов показываются требуемые результаты по каждому заданию и сравниваются с вашими достижениями. Будьте осторожны – при неудачной реакции может что-нибудь взорваться или загореться. Конечно, работа в приложении безопасна, но взрыв как минимум говорит о том, что в реальности не стоит повторять подобный опыт. Приложение есть в App Store и стоит всего лишь $0,99.
Источник: iTunes.
Talking Ben the Dog
Talking Ben the Dog – игра для самых маленьких. Говорящий пёс Бен – профессор химии на пенсии, который порядком подустал от жизни. Всё, что он делает – ест, пьёт и читает газеты. Можно пытаться расшевелить его, а можно просто нажать на кнопочку «Химия» и отправить старого профессора в лабораторию, чтобы проводить с ним простейшие химические опыты (смешать две жидкости и наблюдать за реакцией). Ничего особо познавательного, зато ребёнок как минимум узнает, что смешивание двух веществ может привести к неожиданной реакции. Кажется, неплохое начало для рассказа ребёнку о химии как науке. Приложение бесплатно доступно в iTunes и в Google Play.
Источник: AppCrawlr.
Chemik
Ещё один инструмент для изучения химии, который позволяет знакомиться с активностью элементов, изучать окислительно-восстановительные реакции, решать задачи по химии, получать конечные продукты реакции и уравнивать коэффициенты. В приложении есть описание реакций более полутора тысяч химических соединений. Интерфейс приложения предельно прост, впрочем, как и работа в нём: для реакции достаточно выбрать из таблицы необходимые элементы и соединить их. Приложение можно скачать в Google Play бесплатно.
В приложении есть описание реакций более полутора тысяч химических соединений. Интерфейс приложения предельно прост, впрочем, как и работа в нём: для реакции достаточно выбрать из таблицы необходимые элементы и соединить их. Приложение можно скачать в Google Play бесплатно.
Источник: Google Play.
Elements Quiz
Приложение-игра для изучения химии. Теперь не нужно заставлять вашего ребёнка зубрить химические элементы, достаточно установить ему Elements Quiz, где таблица Менделеева изучается в простой игровой форме. Основные правила игры – искать в таблице предлагаемые программой химические элементы. Что может быть проще? Зато ребёнок в процессе такого поиска постепенно запоминает название элемента, его символ и место в таблице – те основы, которые необходимы для дальнейшего успешного изучения предмета. Для более продвинутых пользователей в приложение встроены викторины, с которыми не так-то легко справиться. Кроме того, приложение связано с Википедией, так что всегда можно получить дополнительную информацию о том или ином элементе в бесплатной энциклопедии.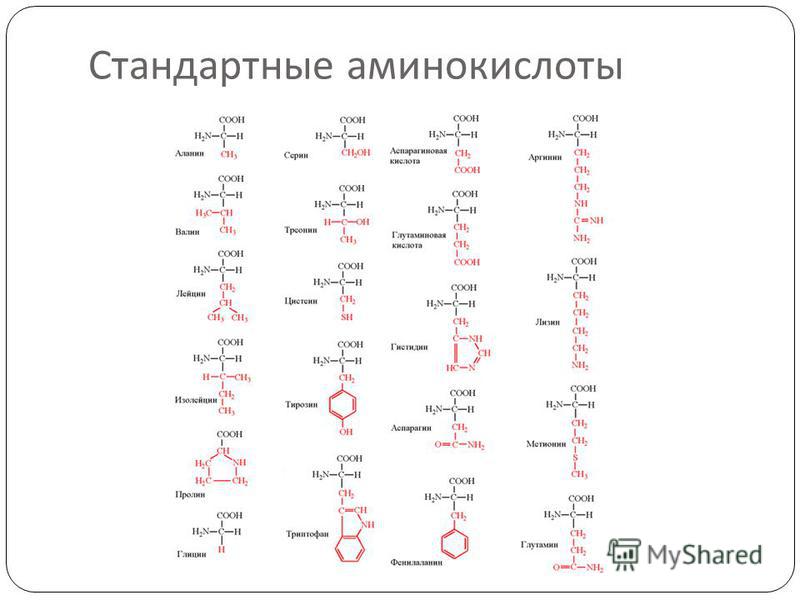
Источник: iTunes.
MolPrime+
Это приложение, которое позволяет без лишнего труда рисовать формулы органических соединений. Но, как отмечают пользователи, в программе невозможно описывать и изображать полноценные реакции, так что MolPrime+ можно пока использовать только в качестве редактора формул. Кстати, своими достижениями в приложении легко делиться с друзьями через твиттер и электронную почту, так что можно соревноваться в мастерстве. MolPrime+ легко скачать с iTunes.
Источник: iTunes.
Chem By Design
Ещё одна база данных химических элементов с коллекцией изображений молекулярных структур и последовательностей реакций. В программу встроено больше 600 последовательностей, для каждой из которых есть дополнительные задания и тесты. Приложение доступно бесплатно в App Store и в Play Mаrket.
Источник: Play Mаrket.
«Химия»
Бесплатное приложение на русском языке, которое включает всю таблицу Менделеева, поиск по всевозможным реакциям и таблицу растворимости химических элементов. Для особенно требовательных пользователей в приложение встроен калькулятор молекулярных масс, так что «Химия» — это простой и незаменимый инструмент для всех, кто занимается изучением этой науки. Его можно скачать бесплатно в iTunes.
Для особенно требовательных пользователей в приложение встроен калькулятор молекулярных масс, так что «Химия» — это простой и незаменимый инструмент для всех, кто занимается изучением этой науки. Его можно скачать бесплатно в iTunes.
Источник: iTunes.
Periodic table of videos
Это не приложение и не игра. Periodic table of videos – это ресурс, на котором размещена серия весёлых и экстремальных видео с химическими опытами, подготовленных учёными Ноттингемского университета. В главной роли – известный в Великобритании профессор химии Мартин Полякофф, который прославился своими исследованиями в области зелёной химии, инфракрасной спектроскопии и сверхкритических флюидов.
Источник: Periodic table of videos.
Обладая всеми чертами «безумного профессора», Мартин Полякофф в занимательной и доступной форме рассказывает о секретах химии, иллюстрируя свои слова весьма характерными опытами. Как, например, в этом видео, где профессор рассказывает о том, почему взрываются водородные пузыри при соприкосновении с раскалёнными предметами.
Источник: Periodic Videos.
Chemical Engineering AppSuite HD
Это уникальное приложение разработано командой инженеров-химиков как для профессионалов, так и для студентов. В приложение встроена база данных более тысячи промышленных и лабораторных химических веществ, конверторы температуры, давления, длины, площади и времени, а также специальные инструменты для решения задач гидродинамики и расчётов горения топлива. Кроме того, здесь представлены физические характеристики для тысячи различных соединений и элементов, включая показатели плотности, давления, теплоёмкости, вязкости. Программа позволяет делать быстрые расчёты уравнений состояния Пэнга-Робинсона, уравнений состояния газа Ван-дер-Ваальса и других.
Источник: iTunes.
В Chemical Engineering также представлено множество электронных таблиц, графические инструменты со встроенными калькуляторами, данные различной статистики и многое-многое другое. Впечатляющий инструмент для тех, кто чувствует себя в науке о химии как рыба в воде. Всё это богатство на iTunes стоит всего лишь $0,99.
Впечатляющий инструмент для тех, кто чувствует себя в науке о химии как рыба в воде. Всё это богатство на iTunes стоит всего лишь $0,99.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Соотнесение функций аминокислот, кодируемых кодонами, с порядком расположения гексаграмм по Вэнь-вану (Correlation of Functions of Amino Acids Encoded by Codons with Wen-Wang Hexagrams Order) / Доклады независимых авторов. Выпуск 35, 2016, с. 5-16
но не понят [1]. В частности, все еще выполняются исследования с
целью получения обоснований существования многоуровневой
системы генетических алфавитов, включающих 4-символьный
алфавит азотистых оснований (нуклеотидов), 64-символьный
алфавит кодонов (кодирующих тринуклеотидов), 20-символьный
алфавит аминокислот и другие алфавиты [2]. Например,
обоснования могут базироваться на теории помехоустойчивого
кодирования [3,4], на принципе экономии свободной энергии
цепочек нуклеотидов [5], на принципе комплементарности [6], на
тенденции генома к повышению информационной емкости,
проявлением которой являются механизмы альтернативного
сплайсинга [7], и др.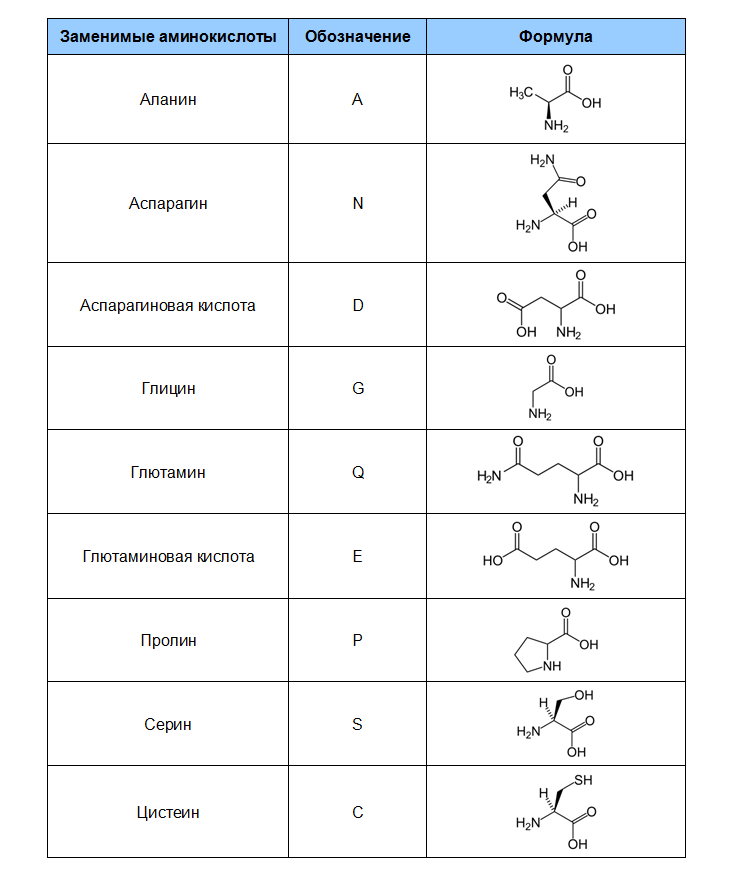 Результаты недавних исследований генома
Результаты недавних исследований генома
показали наличие новых еще более глубоких уровней кодирования
информации, связанных со скоростью синтеза белков [8], что
требует формирования новых и пересмотра ранее предложенных
теоретических обоснований, касающихся, например,
предполагаемой избыточности 64-символьного алфавита кодонов.
Для решения этих задач оказывается полезным сопоставление
кодонного алфавита с 64-символьным алфавитом гексаграмм,
описанных в классической китайской «Книге перемен» («И цзин»).
Алфавит гексаграмм можно рассматривать как двухуровневый,
поскольку гексаграммы состоят из шести линий, каждая из которых
может быть прерывистой или сплошной, образуя 2-символьный
алфавит линий. То есть способ кодирования гексаграмм похож на
способ кодирования кодонов, отличаясь, по существу, лишь
системами счисления. Порядок расположения линий на
гексаграммах, группы линий гексаграмм, гексаграммы целиком и
порядки расположения гексаграмм могут ассоциироваться с
различными аспектами жизни людей, в том числе со структурой и
функциями человеческого организма [9].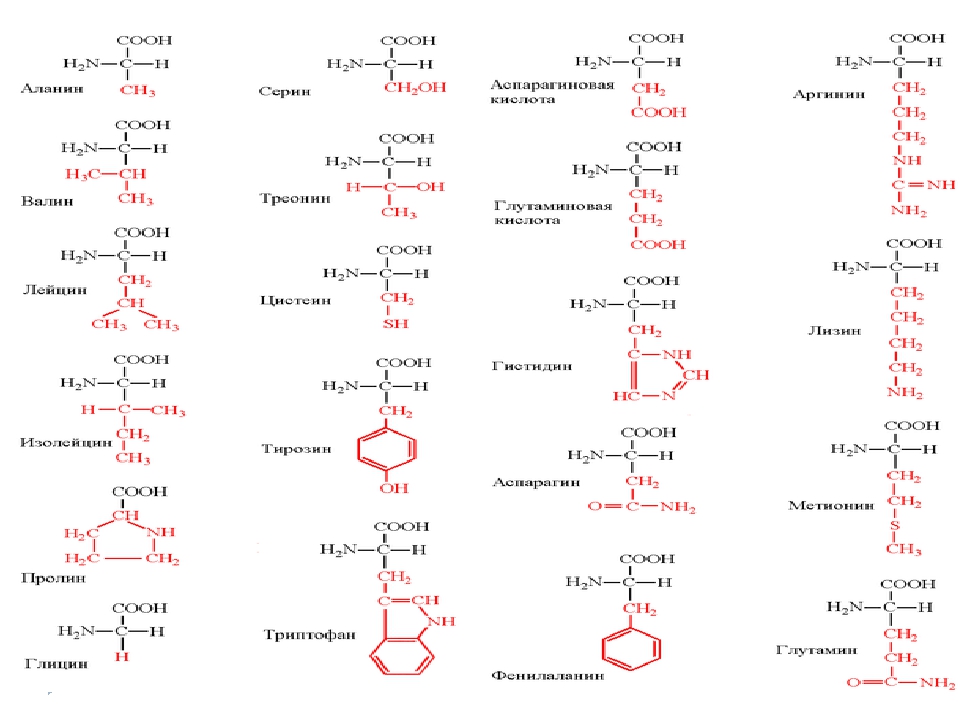 Вместе с тем, некоторые
Вместе с тем, некоторые
принципы, положенные в основу «Книги перемен», в частности,
связанные с порядком расположения гексаграмм по Вэнь-вану, пока
еще остаются не известными [10]. Поэтому нахождение связей
между этими двумя системами кодирования информации позволяет
лучше понять как смысл, заложенный в «Книге перемен», так и
принципы, на которых построен генетический код.
Результаты некоторых исследований, проведенных в данном
направлении, представлены в работах [3,4,6]. Пожалуй, наиболее
интересной является работа С.В. Петухова [3], в которой предложен
подход к сопоставлению кодонов и гексаграмм, основанный на
«алгебре бисексов». К сожалению, в этом подходе не принимаются
Вкус, относительная вкусовая привлекательность и компоненты смесей на основе гидролизата коровьего молока и смесей на основе аминокислот | Italian Journal of Pediatrics
Выбор замещающей смеси для конкретного ребенка с аллергией на коровье молоко должен основываться на характеристиках пациента (возраст и симптомы) и свойствах смеси, в первую очередь подтвержденной гипоаллергенностью и адекватностью питания [25,26].
Однако важно также учитывать приемлемость формул, которые мешают соблюдению режима лечения в клинической практике.
В связи с этим вкусовые качества гидролизованных смесей плохо исследованы. Это исследование было сосредоточено в первую очередь на вкусе и относительной вкусовой привлекательности гидролизованной смеси и смесей на основе аминокислот. Кроме того, целью исследования также было исследование корреляции между компонентами гидролизованных смесей, отличными от пептидов, и вкусовыми качествами.
Наши результаты показали значительные различия во вкусе различных сильно гидролизованных смесей с казеином или сывороткой в качестве источника азота, а также между смесями на основе eHF и аминокислот.В целом, сывороточные eHF были признаны более вкусными, чем казеиновые eHF и AAF (p < 0,05).
Следует отметить, что сыворотка eHF была оценена по-разному среди них по органолептическим характеристикам и оценке общей вкусовой привлекательности. Органолептические признаки, которые больше всего влияли на общее суждение о вкусовых качествах, были вкус и послевкусие, соответственно.
Результаты также свидетельствуют о том, что вкусовые качества улучшались с увеличением содержания лактозы и альфа-линоленовой кислоты. Что касается лактозы, то с точки зрения питания она имеет несколько полезных эффектов.Метаболические исследования с использованием изотопных методов на людях показали, что присутствие лактозы усиливает абсорбцию и удержание кальция [27] и других минералов, таких как магний и цинк [28].
Лактоза естественным образом влияет на микрофлору кишечника, поскольку избирательно способствует развитию популяции предполагаемых полезных бактерий в нижней части кишечника [29]. Несмотря на несколько вышеупомянутых и хорошо известных полезных эффектов лактозы, лактозу по-прежнему исключают из большинства смесей на основе гидролизованного коровьего молока.
Побочные реакции на лактозу при аллергии на коровье молоко в литературе не подтверждаются, и полное исключение лактозы при CMA больше не гарантируется. EhF, содержащие очищенную лактозу, теперь доступны и признаны безопасными и эффективными при лечении CMA [30,31].
Что касается линоленовой кислоты, наши результаты согласуются с данными на животных моделях, которые показали, что растворы линолевой кислоты предпочтительнее олеиновой кислоты, а линоленовая кислота предпочтительнее линолевой кислоты [32].
Физиологические и пищевые последствия определения жира включают секрецию желудочной липазы, модулирование желудочно-кишечного транзита, экзокринную секрецию поджелудочной железы, высвобождение гормонов кишечника, мобилизацию накопленных липидов из энтероцитов, эндокринную секрецию поджелудочной железы и изменение активности липопротеинлипазы [33]. Благодаря вышеперечисленным действиям воздействие орального жира может влиять на реакцию аппетита, потребление пищи, состояние питания и риск заболевания.
Таким образом, содержание жирных кислот в специальных рецептурах требует дальнейшего изучения по всем вышеперечисленным аспектам.
Новизна нашего исследования заключалась в изучении корреляции между составляющими гидролизованных смесей, кроме пептидов, и вкусовыми качествами.
Сила этого исследования заключается в большом количестве участников (> 50) для получения статистически достоверных данных [34].
Основным ограничением этого исследования является то, что оно проводилось у молодых людей.
Несмотря на различия во вкусовых предпочтениях между младенцами и взрослыми [35], в ряде исследований сообщается, что человеческие младенцы способны различать различные вкусовые качества с рождения и реагируют на раздражители, особенно на сладкое и горькое, по образцу ответы, аналогичные наблюдаемым у взрослых [36].
Предпочтение младенцами и маленькими детьми сладкого и отвращение к горькому и кислому сходно с таковым у большинства взрослых жителей Запада [37].
Основные различия между взрослыми и младенцами заключаются в большей предпочтительности сладкого вкуса (это означает, что младенцы обычно предпочитают более высокие концентрации сладких растворов, чем взрослые) и большее отвращение к горькому [38,39], отчасти из-за генетических вариаций и культурных различий. [40].
[40].
Однако важно отметить, что, поскольку предпочтения вкусовых стимулов, как правило, в большей степени зависят от врожденных факторов, предпочтения вкусовых соединений, распознаваемых обонянием, в большей степени зависят от обучения, особенно в раннем возрасте [41].
Экспериментальные исследования, проведенные Mennella [42], показали, что младенцы, которым до 4 месячного возраста вводили гидролизованные смеси, характеризующиеся горьким вкусом и неприятным запахом летучих веществ, с большей готовностью принимали их, чем младенцы более старшего возраста, и характер принятия, который развивается у младенцев, специфичен к вкусовому профилю в первые месяцы жизни [43].
Однако, учитывая, что кормление гидролизованными смесями нередко начинают после четырехмесячного возраста, вполне реально, что плохие вкусовые качества гидролизованных смесей продолжают оставаться причиной плохой приверженности в клинической практике [18].
Другим ограничением было то, что ингредиенты формул не подвергались независимой обработке.
В рамках этих ограничений данное исследование подчеркивает, что среди гидролизованных смесей существует широкий диапазон вкусов, который, по-видимому, зависит не только от содержания пептидов и молекулярной массы, но также и от других составляющих, например. содержание липидов и лактозы.
Набор задач # ключ ответа
Набор задач # ключ ответа Химия 333Структура и функция белков
Осень 2001 г. Набор задач #1 Ключ ответа
1.
| Аминокислота | заправка при pH 2 | заправка при pH 7 | заправка при pH 12 |
| Глутаминовая кислота | 0 | -1 | -1 |
| Кислота аспарагиновая | 0 | -1 | -1 |
| Лизин | +1 | +1 | 0 |
| Аргинин | +1 | +1 | +1 (50%) |
| Гистидин | +1 | +1 (25%) | 0 |
| Тирозин | 0 | 0 | -1 |
| Цистеин | 0 | 0 | -1 |
2. При pH = 7,8 гистидины будут иметь нейтрально заряженный
боковой цепи, поэтому полипептид будет менее растворим в воде, чем при pH 5,5, где гистидины будут
имеют чистый положительный заряд.
При pH = 7,8 гистидины будут иметь нейтрально заряженный
боковой цепи, поэтому полипептид будет менее растворим в воде, чем при pH 5,5, где гистидины будут
имеют чистый положительный заряд.
3. (г), pH = 9. Для решения этой задачи определите заряд каждой функциональной группы при каждом рН. Например, при рН=9 заряд концевого карбоксила равен -1, заряд концевого амино равно 0, а заряд боковой цепи равен +1.
4. Валин занимает больше места, чем аланин, поэтому конформация внутренняя часть белка, вероятно, значительно изменяется когда Ала меняется на Вал.Вторая мутация компенсирует уменьшение размера другого остатка в салоне, замена больший Ile с меньшим Gly.
5. При pH 7 Arg имеет полностью протонированную боковую цепь и способен
быть только донором водородной связи (см. Stryer, стр. 33). Любое амино
кислотная боковая цепь, способная принимать водородную связь, может водород
связь с Arg при pH = 7. Это включает E, D, N, Q, S, T, Y и
H (т. е. любая боковая цепь с неподеленной парой электронов на
атом O или N).
K и R полностью протонированы при pH = 7, поэтому не могут быть приняты водородная связь с другим R (когда они полностью протонированы, у них нет неподеленных пар электронов на N, которые могут принимать водородная связь).Триптофан также может служить только водородом. донор связи, поэтому он не может водородно связываться с полностью протонированным аргинин.
6.
A. Для этой задачи мы хотим выяснить заряд каждого
боковая цепь аминокислоты, а затем сложите их, чтобы получить общую чистую
оплата:
Все K равны +1; есть 4 K, и поэтому они вносят +4 к общему заряду пептида.
Все R равны +1; есть 3 R, и поэтому они дают +3 к общий заряд пептида.
Все Е равны -1; есть 4 E, поэтому они вносят -4 в общий заряд пептида.
Все D равны -1; есть 2 D, и поэтому они вносят -2 в общий заряд пептида.Итак, после суммирования K, R, D и E у нас есть чистая из +1 до сих пор.
Гистидин имеет рКа, близкое к нашему рН (рН = 7, рКа = 6,0 от таблицу в Страйере).
Используя уравнение Хендерсона-Хаслебаха, мы можем определить, что около 9% гистидинов имеют положительный обвинение; к общему вкладу формы гистидина составляет 9% от +1 = +0,09
Все другие боковые цепи будут нейтральными при рН 7; итак, всего вклад боковых цепей в общий заряд +1.09
Теперь рассмотрим вклады от терминалов.
При pH = 7 карбоксильный конец будет иметь полный заряд -1.
При pH = 7 нам нужно использовать метод Хендерсона-Хассельбаха для определения пропорция N концов, которые заряжены; начиная с pKa Конец N — 7,8, используя Хендерсон — Хассельбах, мы получаем сеть заряд ~+0,86.
Для общей чистой стоимости:
Боковые цепи +1,09
Термини: -0.14
Итого: +0,95
B. Чтобы рецептор мог связать этот пептид, его заряд должен быть
дополнительный; другими словами, поскольку пептид имеет чистый положительный
заряд, вы могли бы ожидать, что рецептор будет иметь чистый отрицательный заряд.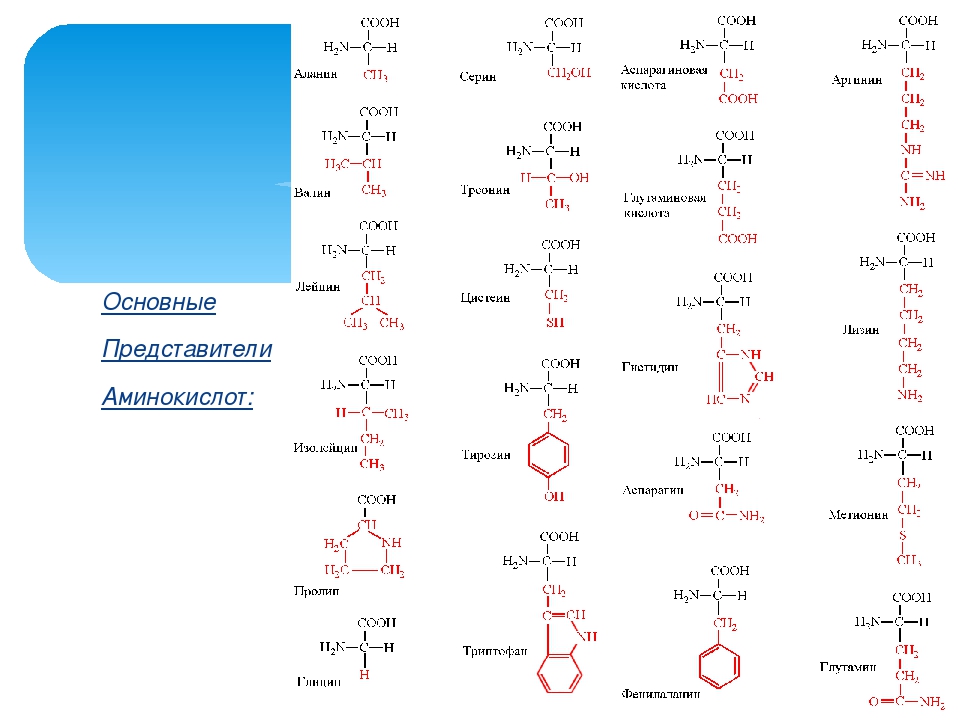 Итак, рецептор должен содержать кислотные остатки (кислые остатки,
подобно Asp и Glu, имеют суммарный отрицательный заряд при pH 7).
Итак, рецептор должен содержать кислотные остатки (кислые остатки,
подобно Asp и Glu, имеют суммарный отрицательный заряд при pH 7).
7. Мы можем использовать уравнение Хендерсона-Хассельбаха, чтобы определить доля гистидинов, протонированных при pKa 7.4, и фракция, протонированная, когда pKa составляет 7,0.
, когда pKa равно 7,4, pKa = pH; так что доля гистидинов протонированный 0,5.
Когда pKa равно 7,0, мы можем определить долю протонированных Н от:
Количество протонов, полученных при снижении pKa с 7,0 к 7,4 дается разностью 0,5 — 0,28 = 0,21.
Итак, улавливается 0,21 протона/молекула гемоглобина.
8. ЭЛВИС жив и здоров (найден в ~21 эпизоде).
9. Ответы будут разными.
10. Последовательности №1 и №3 должны показать наибольшее сходство в
выравнивание. Я получаю идентичность ~ 40% и оценку 576 (положительный результат).
оценка хорошая). Для № 1 и № 2 я получаю идентичность 16,9% с -453.
оценка (плохо). Для № 2 и № 3 я получаю идентичность 16,7% с -151.
оценка (тоже плохая).
Для № 2 и № 3 я получаю идентичность 16,7% с -151.
оценка (тоже плохая).
Все три белка представляют собой сериновые протеазы; №1 и №3 — субтилизины взяты из двух разных видов; эти два белка гомологичны. Последовательность № 2 представляет собой трипсин и не связана последовательностью с субтилизин (хотя, как мы узнаем позже, его функция аналогична).При сканировании PROSITE этих последовательностей вы должны были обнаружить несколько паттернов для каждой последовательности — самое главное, №1 и №3 должен содержать паттерны из семейства субтилаз, а #2 из семейство трипсина.
Сравнительный анализ: жирные кислоты и аминокислоты
С годами индустрия косметики и средств личной гигиены стала более сложной. В дополнение к химии биохимия, биофизика и микробиология стали очень важными для разработки продуктов, отвечающих потребностям потребителей.
Поскольку не все составители рецептур имеют одинаковый опыт, в наших дискуссиях доминируют такие термины, как жирная кислота , триглицерид , аминокислота , гидроксикислота и т. п. Этот выпуск «Сравнительно говоря» призван прояснить их.
п. Этот выпуск «Сравнительно говоря» призван прояснить их.
Аминокислоты
Аминокислоты представляют собой органические соединения, в молекуле которых присутствуют как аминогруппа, так и карбоксильная группа. Они имеют структуру, показанную на Рисунок 1 .Аминокислоты являются строительными блоками (мономерами), которые соединяются вместе, образуя белки. Белки выполняют множество функций в нашем организме. Одним из основных классов белков являются ферменты, и они необходимы для большей части нашего метаболизма.
Рисунок 1. Структура аминокислот 1
Аминокислоты в белках составляют второй по величине процент веса человека, уступая только воде. Аминокислоты образуются реакцией аминогруппы одной молекулы аминокислоты и карбоксильной группы другой (см. Таблицу 1 ).Полученное соединение, называемое в органической химии амидом , упоминается как пептид . Таблица 1. Структура аминокислот Биологический синтез белка контролируется ДНК и осуществляется в результате сложного набора реакций.
Жирные кислоты
Жирные кислоты представляют собой класс соединений, которые обычно получают из триглицеридов.Как правило, жирная кислота состоит из прямой цепи из четного числа атомов углерода, с атомами водорода по длине цепи и на одном ее конце и карбоксильной группой на другом конце. 3 Структура: R-C(O)-OH.
Триглицериды, также называемые триацилглицеринами , представляют собой триэфиры глицерина с тремя эквивалентами жирной кислоты. Жирные кислоты определяются как кислоты, имеющие алкильные или алкиленовые группы C-5 и выше. При омылении триглицеридов высвобождаются жирные кислоты и глицерин. Омыление — это общий термин, обозначающий химическую реакцию, которая разрушает сложноэфирную связь. Реакция омыления показана на рис. 2 .
Рисунок 2. Реакция омыления 4
Триглицериды перевариваются организмом, чтобы обеспечить энергию для метаболизма, или запасаются организмом, когда имеется избыток.
Триглицериды являются наиболее распространенной формой жира в организме и являются основным ингредиентом растительных масел и животных жиров.Составы жирных кислот некоторых обычных пищевых жиров и масел показаны в таблицах 2 и 3 .
Таблица 2. Композиции жирных кислот общих съедобных жиров и масел 5
Таблица 3. Общие жирные кислоты 6
Список литературы
1. HTTPS: // biochem.oregonstate.edu/content/biochemistry-free-and-easy
2. https://www.technologynetworks.com/applied-sciences/articles/essential-amino-acids-chart-abbreviations-and-structure-324357
3. Британская энциклопедия (2020, 12 мая). Жирная кислота . Доступно на https://www.britannica.com/science/fatty-acid
4. https://www.hielscher.com/fr/ultrasonic-saponification.htm
5. https://i.pinimg.com/736x/c8/f4/34/c8f434c95e93b5253ec2800037987a94. jpg
jpg
6. http://www.scientificspectator.com/documents/book%20service/Oils_of_Nature.pdf
Создайте пять функций и форматированную таблицу (которая выводится на экран) из отсортированного списка (от самого легкого к самому тяжелому… —
Вам предоставляется файл данных с именем aminoacids.dat, содержащий таблицу аминокислот и составляющих их молекулярных составов. Файл содержит столбцы, которые содержат название аминокислоты, количество атомов углерода, количество атомов водорода, количество атомов кислорода, количество атомов азота и количество атомов серы, как показано ниже, AminoAcid,C,H,O,N, S Аланин,3,7,2,1,0 Аргинин,6,15,2,4,0 Аспарагин,4,8,3,2,0 Аспарагин,4,6,4,1,0 Цистеин,3,7 ,2,1,1 Глутаминовая,5,8,4,1,0 Глутаминовая,5,10,3,2,0 Глицин,2,5,2,1,0 Гистидиновая,6,10,2,3,0 Изолейцин,6,13,2,1,0 Лейцин,6,13,2,1,0 Лизин,6,15,2,2,0 Метионин,5,11,2,1,1 Фенилаланин,9,11, 2,1,0 Пролин, 5,10,2,1,0 Серин, 3,7,3,1,0 Треонин, 4,9,3,1,0 Триптофан, 11,11,2,2,0 Тирозин ,9,11,3,1,0 Valine,5,11,2,1,0 У вас также есть другой файл данных, называемый elements. dat, который содержит список символов элементов (один символ) и атомные массы необходимых элементов: водород, углерод, азот, кислород и сера. Этот файл имеет формат: H,1.00794 C,12.011 N,14.00674 O,15.9994 S,32.066 Используйте MATLAB для выполнения следующей задачи: 1. Создайте функцию с именем read_data_files для чтения этих двух файлов данных. Используйте низкоуровневую функцию fgetl форматированного ввода-вывода для чтения данных. Поместите результаты в две структуры (одну для структуры аминокислот и одну для данных об элементах). Имена полей для аминокислоты должны быть имя, элемент, масса, а для элемента — элемент, mw.2. Создайте функцию calc_molec_wt для определения молекулярной массы отдельных аминокислот. Результат помещается в аминокислотную структуру. 3. Создайте функцию sort_data для сортировки аминокислот по весу (используйте функцию сортировки MATLAB). Поместите результаты обратно в аминокислотную структуру. 4. Создайте функцию с именем medium_amino_acid для определения среднего веса аминокислот и определения того, какая из этих аминокислот ближе всего к этому весу.
dat, который содержит список символов элементов (один символ) и атомные массы необходимых элементов: водород, углерод, азот, кислород и сера. Этот файл имеет формат: H,1.00794 C,12.011 N,14.00674 O,15.9994 S,32.066 Используйте MATLAB для выполнения следующей задачи: 1. Создайте функцию с именем read_data_files для чтения этих двух файлов данных. Используйте низкоуровневую функцию fgetl форматированного ввода-вывода для чтения данных. Поместите результаты в две структуры (одну для структуры аминокислот и одну для данных об элементах). Имена полей для аминокислоты должны быть имя, элемент, масса, а для элемента — элемент, mw.2. Создайте функцию calc_molec_wt для определения молекулярной массы отдельных аминокислот. Результат помещается в аминокислотную структуру. 3. Создайте функцию sort_data для сортировки аминокислот по весу (используйте функцию сортировки MATLAB). Поместите результаты обратно в аминокислотную структуру. 4. Создайте функцию с именем medium_amino_acid для определения среднего веса аминокислот и определения того, какая из этих аминокислот ближе всего к этому весу. Верните веса аминокислот в аминокислотную структуру.5. Создайте функцию с именем output_data для создания таблицы результатов, как показано ниже. Требуются следующие задачи: (a) Внутри этой функции создайте подфункцию для составления строки, содержащей молекулярную формулу. (b) Эта функция выведет таблицу на экран (отформатированную) и выведет ее в файл с именем aminoacids.out с помощью fprintf. (c) Эта функция также выводит на экран среднюю молекулярную массу и название аминокислоты, наиболее близкой к этой средней массе.Перечисленные выше функции имеют следующие входные и выходные параметры. См. прилагаемую таблицу. название аминокислоты (с левой стороны), молекулярная масса и химическая формула, как показано в примере ниже. 2. Укажите среднюю молекулярную массу и сообщите, какая аминокислота наиболее близка к этой средней массе (как показано ниже). 3 ENCP 100: Инженерное программирование # Аминокислота Молекулярная масса Молекулярная формула 01 amino_acid_name xxx.xx CxHxOxNxSx 02 название_аминокислоты xxx.
Верните веса аминокислот в аминокислотную структуру.5. Создайте функцию с именем output_data для создания таблицы результатов, как показано ниже. Требуются следующие задачи: (a) Внутри этой функции создайте подфункцию для составления строки, содержащей молекулярную формулу. (b) Эта функция выведет таблицу на экран (отформатированную) и выведет ее в файл с именем aminoacids.out с помощью fprintf. (c) Эта функция также выводит на экран среднюю молекулярную массу и название аминокислоты, наиболее близкой к этой средней массе.Перечисленные выше функции имеют следующие входные и выходные параметры. См. прилагаемую таблицу. название аминокислоты (с левой стороны), молекулярная масса и химическая формула, как показано в примере ниже. 2. Укажите среднюю молекулярную массу и сообщите, какая аминокислота наиболее близка к этой средней массе (как показано ниже). 3 ENCP 100: Инженерное программирование # Аминокислота Молекулярная масса Молекулярная формула 01 amino_acid_name xxx.xx CxHxOxNxSx 02 название_аминокислоты xxx. xx CxHxOxNxSx …. …. …. 19 название_аминокислоты xxx.xx CxHxOxNxSx 20 название аминокислоты xxx.xx CxHxOxNxSx Средняя молекулярная масса аминокислот: xxx.xx Ближайшая аминокислота к среднему весу : название аминокислоты Примечание: кроме команд clear all и clc и различных комментариев в вашем коде, ваша основная программа может содержать только вызовы ваших функций!
xx CxHxOxNxSx …. …. …. 19 название_аминокислоты xxx.xx CxHxOxNxSx 20 название аминокислоты xxx.xx CxHxOxNxSx Средняя молекулярная масса аминокислот: xxx.xx Ближайшая аминокислота к среднему весу : название аминокислоты Примечание: кроме команд clear all и clc и различных комментариев в вашем коде, ваша основная программа может содержать только вызовы ваших функций!
ОТЧЕТНЫЙ ЛИСТ ЛАБОРАТОРИЯ Аминокислоты 33 Заполните следующую таблицу Сокращенные структурные формулы (ионизированные) аминокислот Глицин Аланин Серин Полярный или неполярный? Сокращенные структурные формулы аминокислот в 30 кислом растворе Сокращенные структурные формулы аминокислот в основном растворе
Стенограмма видео
В этом вопросе нам предлагается определить характеристики аминокислот, которые мы рассмотрели в предыдущем вопросе.Итак, для начала мы должны обозначить эти аминокислоты как полярные или неполярные. Итак, начиная с mckinnon, mckinnon вводит группу серы в цепь относительно далеко от нашей аминокислоты. Из-за этого сера относительно электроотрицательна. Таким образом, это вносит полярность в молекулу. Так что мы можем пойти дальше и назвать это столь же полярным, как и мы. Наша полярная боковая цепь, которая является боковой цепью, будет иметь своего рода ученика. И поэтому, глядя на наш следующий один, в котором есть группа металлов, а металл, являющийся углеводородом, неполярен.Вы можете пойти дальше и пометить этот неполярный раствор I так же, как углеводород, и его больше, поэтому он также неполярен. И, наконец, алунан, наконец, представляет собой бензольное кольцо. Итак, наше ароматическое кольцо um также является углеводородом. Поэтому он также помечен как неполярный. И отсюда, двигаясь дальше, нам нужно только обозначить, является ли наша группа нейтральной, эстетической или основной, если наши молекулы полярны. Итак, мы смотрим на Матиаса, и единственный, который мы пометили как полярный, питается при физиологическом рН нейтрально. Итак, мы знаем это, потому что да, сера не будет легко протеинироваться при рН около семи, что является физиологическим рН, поэтому она остается просто нейтральной.
Из-за этого сера относительно электроотрицательна. Таким образом, это вносит полярность в молекулу. Так что мы можем пойти дальше и назвать это столь же полярным, как и мы. Наша полярная боковая цепь, которая является боковой цепью, будет иметь своего рода ученика. И поэтому, глядя на наш следующий один, в котором есть группа металлов, а металл, являющийся углеводородом, неполярен.Вы можете пойти дальше и пометить этот неполярный раствор I так же, как углеводород, и его больше, поэтому он также неполярен. И, наконец, алунан, наконец, представляет собой бензольное кольцо. Итак, наше ароматическое кольцо um также является углеводородом. Поэтому он также помечен как неполярный. И отсюда, двигаясь дальше, нам нужно только обозначить, является ли наша группа нейтральной, эстетической или основной, если наши молекулы полярны. Итак, мы смотрим на Матиаса, и единственный, который мы пометили как полярный, питается при физиологическом рН нейтрально. Итак, мы знаем это, потому что да, сера не будет легко протеинироваться при рН около семи, что является физиологическим рН, поэтому она остается просто нейтральной. И теперь, глядя на это, мы можем решить, являются ли какие-либо из них гидрофобными или гидрофобными. Таким образом, все наши неполярные аминокислоты будут гидрофобными, поскольку они имеют большие неполярные боковые цепи. Таким образом, он останется довольно гидрофобным, что означает, что они, вероятно, будут в центре белков или свернуты. Таким образом, он не подвергается внешнему решению acquis. Итак, мы можем пойти дальше и обозначить все это как гидрофобные. И затем, глядя на нашу полярную молекулу, полярность Metheny действительно вносит немного гидрофильного элемента в mckinnon, поскольку полярная природа лучше взаимодействует в водном растворе, чем неполярный заместитель.И поэтому мы можем пойти дальше и обозначить это как гидрафильное, даже если оно не будет таким гидрафильным, как они заряжены. Замените целые числа, которые мы видим. Президент и пять других аминокислот. Хорошо, спасибо.
И теперь, глядя на это, мы можем решить, являются ли какие-либо из них гидрофобными или гидрофобными. Таким образом, все наши неполярные аминокислоты будут гидрофобными, поскольку они имеют большие неполярные боковые цепи. Таким образом, он останется довольно гидрофобным, что означает, что они, вероятно, будут в центре белков или свернуты. Таким образом, он не подвергается внешнему решению acquis. Итак, мы можем пойти дальше и обозначить все это как гидрофобные. И затем, глядя на нашу полярную молекулу, полярность Metheny действительно вносит немного гидрофильного элемента в mckinnon, поскольку полярная природа лучше взаимодействует в водном растворе, чем неполярный заместитель.И поэтому мы можем пойти дальше и обозначить это как гидрафильное, даже если оно не будет таким гидрафильным, как они заряжены. Замените целые числа, которые мы видим. Президент и пять других аминокислот. Хорошо, спасибо.


 е. такие, у которых углеродная цепочка не содержит дополнительных затей. Их называют МоноАминоМоноКарбоновые: глицин и аланин
е. такие, у которых углеродная цепочка не содержит дополнительных затей. Их называют МоноАминоМоноКарбоновые: глицин и аланин Это лизин, аргинин, гистидин — 3 аминокислоты.
Это лизин, аргинин, гистидин — 3 аминокислоты.
 Используя уравнение Хендерсона-Хаслебаха,
мы можем определить, что около 9% гистидинов имеют положительный
обвинение; к общему вкладу формы гистидина составляет 9% от +1
= +0,09
Используя уравнение Хендерсона-Хаслебаха,
мы можем определить, что около 9% гистидинов имеют положительный
обвинение; к общему вкладу формы гистидина составляет 9% от +1
= +0,09