Аминокислоты для оптимального синтеза кишечного муцина (слизи) и защиты кишечника в здоровом и патологическом состояниях
Департамент питания и здравоохранения Лозанна, Швейцария
Электронная почта: [email protected]
Список сокращений
ASR: Cкорость абсолютного синтеза ( Absolute Synthesis Rate)
ВЗК: Воспалительные заболевания кишечника
FSR: Скорость фракционного синтеза (Fractional Synthesis Rate)
MUC2: муцин-2 ген
Muc2: муцин-2 протеин
Обзор
Требования к количественному и качественному аминокислотному составу определены для здоровых животных. В патологических ситуациях, включая воспаление кишечника, защита организма связана с анаболическими реакциями, вовлекающими внутренние органы и особенно кишечник. Процессы защиты и восстановления кишечника резко увеличивают скорость синтеза белков, участвующих в барьерной функции кишечника, таких как муцины.
Введение
Желудочно-кишечный тракт является одним из наиболее активных в метаболическом отношении органов организма, что отражает его многочисленные важнейшие биологические функции. В то время как желудочно-кишечный тракт составляет от 3% до 6% массы тела млекопитающих, на его долю приходится более 20% оборота белка всего тела. Это происходит главным образом из-за высокой скорости синтеза белка и непрерывной высокой секреторной активности. Таким образом повышается необходимость в определенных аминокислотах, необходимых для синтеза белка. Такое высокое требование было приписано поддержке неспецифического кишечного барьера, в частности синтеза кишечных муцинов.
Неиммунный кишечный барьер
Защита кишечника обеспечивается как кишечной иммунной системой, так и физическим, неиммунным кишечным барьером. Кишечный барьер обеспечивает защиту от внешней среды (кишечных патогенов, вредных агентов и др.) пока происходит адекватная абсорбция питательных веществ для снабжения ими всего организма. Нормальная функция барьера базируется на близком взаимодействии нескольких компонентов. Ключевыми компонентами являются: равновесие комменсальной кишечной микробиоты, которая противодействует адгезии потенциально патогенных бактерий; слой кишечной слизи, который покрывает и защищает эпителиальные клетки; сам кишечный эпителий, обеспечивающий разделение между внутрипросветным содержимым и нижележащими тканями; клетки Панэта, продуцирующие антимикробные пептиды; плотные контакты между эпителиальными клетками, способствующие модуляции парацеллюлярных путей; и кишечная нервная система, недавно признанная ключевым регулятором целостности эпителиального барьера.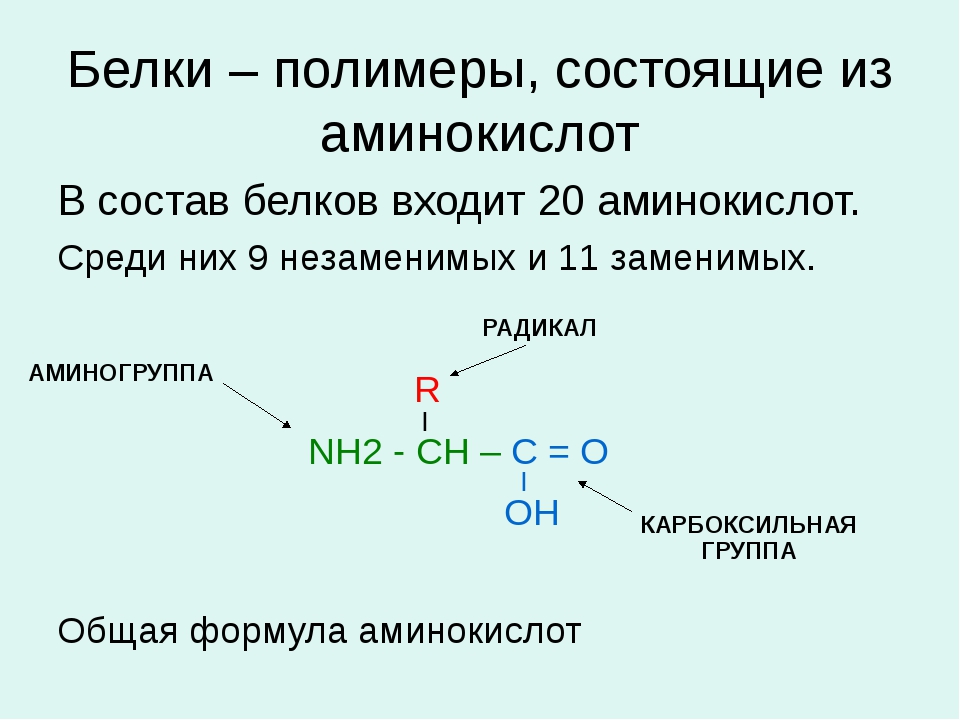
Сложные регуляторные механизмы обеспечивают тонкое равновесие между различными компонентами неиммунного кишечного барьера. Оптимальная диетическая поддержка имеет решающее значение для обеспечения кишечного гомеостаза, способствуя поддержанию здоровья всего организма и предотвращая заболевания, связанные с желудочно-кишечным трактом.
Состав и роль кишечной слизи
Желудочно-кишечный эпителий покрыт вязкоупругим гелеобразным слоем слизи, состоящим из: сложной смеси гликопротеинов, называемых муцинами; пептидов, включая трефойловый пептид (фактор «трилистника») и антимикробные пептиды; воды; макромолекул, таких как секреторный иммуноглобулин А; электролитов; микроорганизмов; и отшелушенных клеток. Гелеобразная слизь представляет собой первую линию врожденной защиты хозяина; одной из его основных функций является защита эпителиальных поверхностей от механических нагрузок и воздействия пищеварительных соков, микроорганизмов и токсинов. Ее защитный эффект напрямую связан с его толщиной и составом.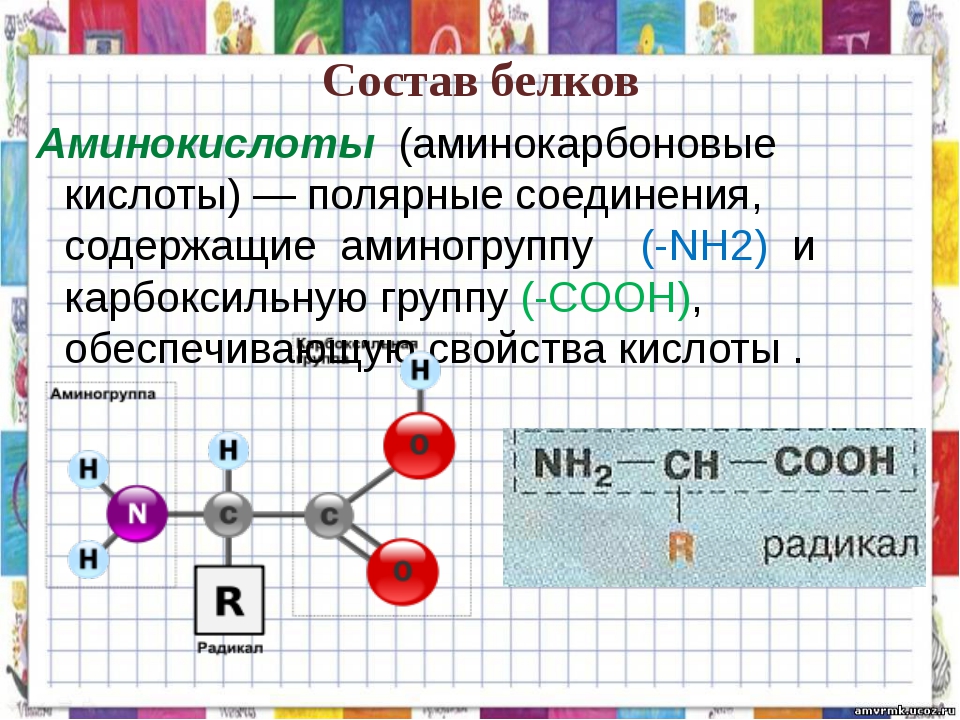
Толщина слоя слизи, ее состав и защитное действие изменяются в желудочно-кишечном тракте по всей его длине в результате дифференциальной выработки различных отдельных муцинов и динамического баланса между анаболическими (экспрессия, синтез и секреция из бокаловидных клеток) и катаболическими (физическая и протеолитическая деградация) процессами. В желудке и толстой кишке определяется самый толстый слой слизи, необходимый для того, чтобы обеспечить хорошую защиту от кислого субстрата (желудок) и микробиоты (толстая кишка). В тонком кишечнике – напротив, он самый тонкий, вероятно, чтобы не препятствовать усвоению питательных веществ.
Внутренний, прочно прикрепленный слой слизи, состоящий из мембраносвязанных муцинов, прилипает к апикальной стороне эпителиальных клеток и способствует образованию гликокаликса, полисахаридного матрикса, покрывающего поверхность эпителиальных клеток кишечника.
Растворимый, слабо прикрепленный наружный слой слизи, состоящий из секретируемых гелеобразующих муцинов, покрывает внутренний слой слизи. Этот растворимый слой способствует созданию и поддержанию баланса комменсальной микробиоты, которая противостоит потенциально патогенным бактериям.
Характеристика кишечных муцинов
На сегодняшний день идентифицирован 21 ген муцина, из которых 15 экспрессируются в желудочно-кишечном тракте человека. Муцины кишечника обладают некоторыми особенностями строения. Это обычно крупные полипептиды (10% -20% от общей массы муцина), которые очень сильно гликозилированы (до 80% -90% от массы муцина). Олигосахаридные боковые цепи в основном состоят из N-ацетилгалактозамина, N-ацетилглюкозамина, галактозы и фукозы, связанных преимущественно с сериновыми и треониновыми остатками муцинового полипептидного ядра через O-гликозидные связи. Посттрансляционные модификации, включая сиалирование и сульфатирование, завершают макромолекулу.
Размер полипептида муцина обычно колеблется от 200 КДА до 900 КДА, за исключением слюнной формы MUC7 (39 КДА). По сравнению с другими белками млекопитающих муцины особенно обогащены аминокислотами треонином, серином и пролином, которые составляют до 28%, 14% и 13% соответственно от общего аминокислотного состава муцинов. Для сравнения, среднее содержание треонина в белках организма колеблется от 3% до 7% от общего количества аминокислот. Остатки треонина, серина и пролина концентрируются в центральных тандемных повторах PTS (proline, threonine, serine), состоящих из консервативных последовательностей, повторенных примерно 100 раз. Насыщенные цистеином домены также присутствуют на полипептидах муцина. Они позволяют муцинам собираться в гомо-олигомеры через межмолекулярные дисульфидные связи, образованные между богатыми цистеином доменами, которые придают вязкоупругое защитное свойство гелеобразной слизи.
По сравнению с другими белками млекопитающих муцины особенно обогащены аминокислотами треонином, серином и пролином, которые составляют до 28%, 14% и 13% соответственно от общего аминокислотного состава муцинов. Для сравнения, среднее содержание треонина в белках организма колеблется от 3% до 7% от общего количества аминокислот. Остатки треонина, серина и пролина концентрируются в центральных тандемных повторах PTS (proline, threonine, serine), состоящих из консервативных последовательностей, повторенных примерно 100 раз. Насыщенные цистеином домены также присутствуют на полипептидах муцина. Они позволяют муцинам собираться в гомо-олигомеры через межмолекулярные дисульфидные связи, образованные между богатыми цистеином доменами, которые придают вязкоупругое защитное свойство гелеобразной слизи.
Среди 15 муцинов, экспрессируемых в желудочно-кишечном тракте человека, MUC2, MUC5AC, MUC5B, MUC6, MUC7 и MUC19 секретируются в основном специализированными бокаловидными клетками. В тонком и толстом кишечнике MUC2 является преобладающим гелеобразующим муцином.
В тонком и толстом кишечнике MUC3, MUC4, MUC13 и MUC17 являются преобладающими мембраносвязанными формами. Они простираются над поверхностью клетки и образуют гликокаликс. Предполагается, что мембранные муцины занимают особое место в антиадгезивных и сигнальных механизмах, восстановлении клеток кишечника и защите эпителиальных клеток от инфекции.
Для обеспечения адекватной экспрессии и секреции муцина, необходимого для оптимальной защиты кишечника применяются сложные регуляторные механизмы. Было выявлено, что эти механизмы включают нейронные, гормональные и паракринные пути. Статус питания, который позволяет обеспечить достаточное количество аминокислот, необходимых для синтеза муцина и микробиоты также является ключевым регулятором защиты кишечника.
Нарушения обмена веществ при заболеваниях кишечника ослабляют выработку муцина и защиту кишечника
Многие кишечные заболевания, предполагающие хроническое воспаление, такие как воспалительные заболевания кишечника (ВЗК), связаны с дисфункцией кишечного барьера. Два основных типа ВЗК — язвенный колит и болезнь Крона, сопровождаются повышением проницаемости тонкой и толстой кишки. Среди изменений, наблюдаемых на уровне кишечного барьера, были отмечены изменение состава микробиоты кишечника и качественное и количественное ухудшение слизистого слоя и продукции муцина. В частности, синтез зрелой, гликозилированной формы MUC2, первичного муцина, секретируемого в толстой кишке, снижается у больных язвенным колитом, что ухудшает слизистый барьер.
Сообщалось также об аномальном выделении секретируемых в ЖКТ муцинов в подвздошной и ободочной кишках, что может отражать адаптивный ответ на усиление защитной реакции. Было отмечено, что ухудшение защиты эпителия сопровождалось снижением выделения мембраносвязанных муцинов MUC3, MUC4 и MUC17.
Метаболические нарушения, связанные с острыми системными воспалительными реакциями, наблюдаемыми, например, при сепсисе, также влияют на барьерную функцию кишечника. Острое воспаление стимулирует синтез белков острой фазы в печени и слизистых оболочках, а также муцинов в кишечнике. Эти анаболические реакции являются важными адаптациями, направленными на обеспечение защиты организма от первичных и вторичных патологических воздействий. Таким образом, ключевым фактором инициации и поддержания подобных защитных сил организма является способность хозяина поддерживать стимуляцию синтеза белка. В этом контексте наблюдается сильное увеличение потребности в аминокислотах, особенно, присутствующих в муцинах в большом количестве.
Требования к аминокислотам для оптимального синтеза муцина и защиты кишечника
Желудочно-кишечный тракт составляет от 3% до 6% массы тела млекопитающих, в то время как на его долю приходится более 20% всего оборота белка в организме. Это связано с его высокой пролиферативной и секреторной активностью, которые поддерживают неиммунную барьерную функцию кишечника, в частности быстрое обновление эпителиальных клеток и непрерывный синтез кишечных муцинов. Аминокислотный состав синтезируемых и секретируемых белков в значительной степени влияет на аминокислотные потребности кишечника, которые должны быть обеспечены при помощи питания и эндогенным синтезом (при недостатке аминокислот).
В нормальных условиях
Треонин является незаменимой аминокислотой, что означает, что он не может быть синтезирован организмом и поэтому должен поступать с пищей.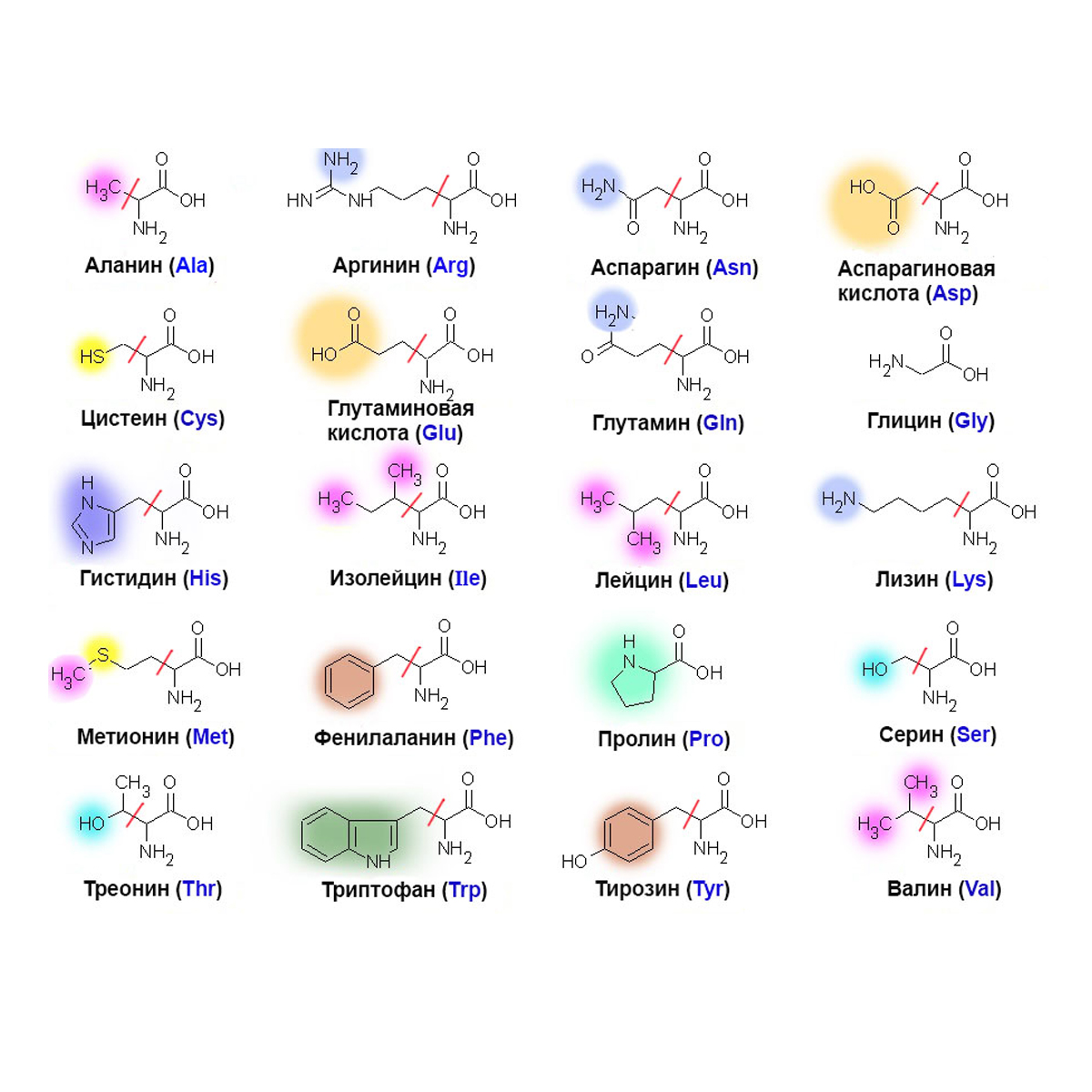 В нормальных условиях треонин является ключевой аминокислотой для поддержания здоровья кишечника. Действительно, по сравнению с другими незаменимыми аминокислотами, большая доля пищевого треонина (до 60%) остается в здоровом кишечнике свиньи или человека. Поскольку основной белок кишечных муцинов содержит большое количество треонина (до 30% от их аминокислотного состава), их непрерывный синтез объясняет высокую скорость утилизации треонина желудочно-кишечным трактом. Размышляя в том же направлении, недостаток Muc2 у подопытных мышей действительно индуцирует метаболическое окисление неиспользованного треонина, которое связано с его избыточным поступлением, происходящим в отсутствие синтеза Muc2.
В нормальных условиях треонин является ключевой аминокислотой для поддержания здоровья кишечника. Действительно, по сравнению с другими незаменимыми аминокислотами, большая доля пищевого треонина (до 60%) остается в здоровом кишечнике свиньи или человека. Поскольку основной белок кишечных муцинов содержит большое количество треонина (до 30% от их аминокислотного состава), их непрерывный синтез объясняет высокую скорость утилизации треонина желудочно-кишечным трактом. Размышляя в том же направлении, недостаток Muc2 у подопытных мышей действительно индуцирует метаболическое окисление неиспользованного треонина, которое связано с его избыточным поступлением, происходящим в отсутствие синтеза Muc2.
И наоборот, когда поступление треонина с пищей ниже потребности, треонин может стать лимитирующей аминокислотой для синтеза кишечных муцинов, как показано на крысах и свиньях и поросятах. Действительно, было определено, что скорость фракционного синтеза муцина, определяемая как % муцинов, синтезируемых в сутки, уменьшается наполовину в верхней части тонкого кишечника крыс, получавших диету, покрывающую только 30% их потребности в треонине (Рис. 1). Тем не менее, такой дефицит не оказывает существенного ограничивающего влияния на общий синтез белка слизистой оболочки (Рис.1), причем эти остальные белки слизистой содержат примерно в семь раз меньше треонина, чем Muc2. Поскольку муцины особенно устойчивы к действию пищеварительных ферментов, рециркуляция треонина из муцинов, секретируемых в верхних отделах желудочно-кишечного тракта, очень низка, а его потеря очень высока по отношению к потребности в треонине всего организма. В здоровых условиях крайне важно, чтобы поступление треонина с пищей точно соответствовало потребностям в нем организма, поддерживая таким образом оптимальный синтез муцина и защиту кишечника, способствуя общему здоровому состоянию организма и предотвращая заболевания, связанные с кишечником.
1). Тем не менее, такой дефицит не оказывает существенного ограничивающего влияния на общий синтез белка слизистой оболочки (Рис.1), причем эти остальные белки слизистой содержат примерно в семь раз меньше треонина, чем Muc2. Поскольку муцины особенно устойчивы к действию пищеварительных ферментов, рециркуляция треонина из муцинов, секретируемых в верхних отделах желудочно-кишечного тракта, очень низка, а его потеря очень высока по отношению к потребности в треонине всего организма. В здоровых условиях крайне важно, чтобы поступление треонина с пищей точно соответствовало потребностям в нем организма, поддерживая таким образом оптимальный синтез муцина и защиту кишечника, способствуя общему здоровому состоянию организма и предотвращая заболевания, связанные с кишечником.
Схема 1. Скорость фракционного синтеза (FSR), выраженный в %/сутки, муцинов и общих белков слизистой оболочки в верхнем тонком кишечнике (а) и толстом кишке (Б) крыс, получавших полусинтетические диеты, удовлетворяющие 30%, 60% или 100% их потребности в треонине для роста. Рационы были изонитрогенными (скорректированными с аланином) и вводились крысам в течение 14 дней. Все группы крыс получали питание парно для усреднения потребления крысами из группы 30%. Синтез белка in vivo измеряли с использованием метода флудинг-доз после инъекции L-(1-13C) — валина. Значения-средние ± SEM, n=8. Для каждой составляющей кишечника (муцины или белки слизистой оболочки).
Рационы были изонитрогенными (скорректированными с аланином) и вводились крысам в течение 14 дней. Все группы крыс получали питание парно для усреднения потребления крысами из группы 30%. Синтез белка in vivo измеряли с использованием метода флудинг-доз после инъекции L-(1-13C) — валина. Значения-средние ± SEM, n=8. Для каждой составляющей кишечника (муцины или белки слизистой оболочки).
При воспалительных заболеваниях
Как показано на моделях животных и людях, воспалительные ситуации, такие как наблюдаемые при ВЗК (хроническое воспаление) и сепсис (острое воспаление), связаны с общей повышенной анаболической реакцией, происходящей в основном в кишечнике и печени, соответственно. Этот анаболический ответ увеличивает использование аминокислот, в частности, присутствующих в больших количествах в кишечных и печеночных протеинах. Поэтому потребности в треонине и других аминокислотах, таких как серин и цистеин, сильно повышаются. Доступность первично лимитирующих (треонин) и вторично лимитирующих (серин, цистеин) аминокислот для синтеза кишечных муцинов, может оказаться слишком низка из-за недостаточного качества питания (недостаточный уровень этих аминокислот) и количества (плохой аппетит) потребления пищи.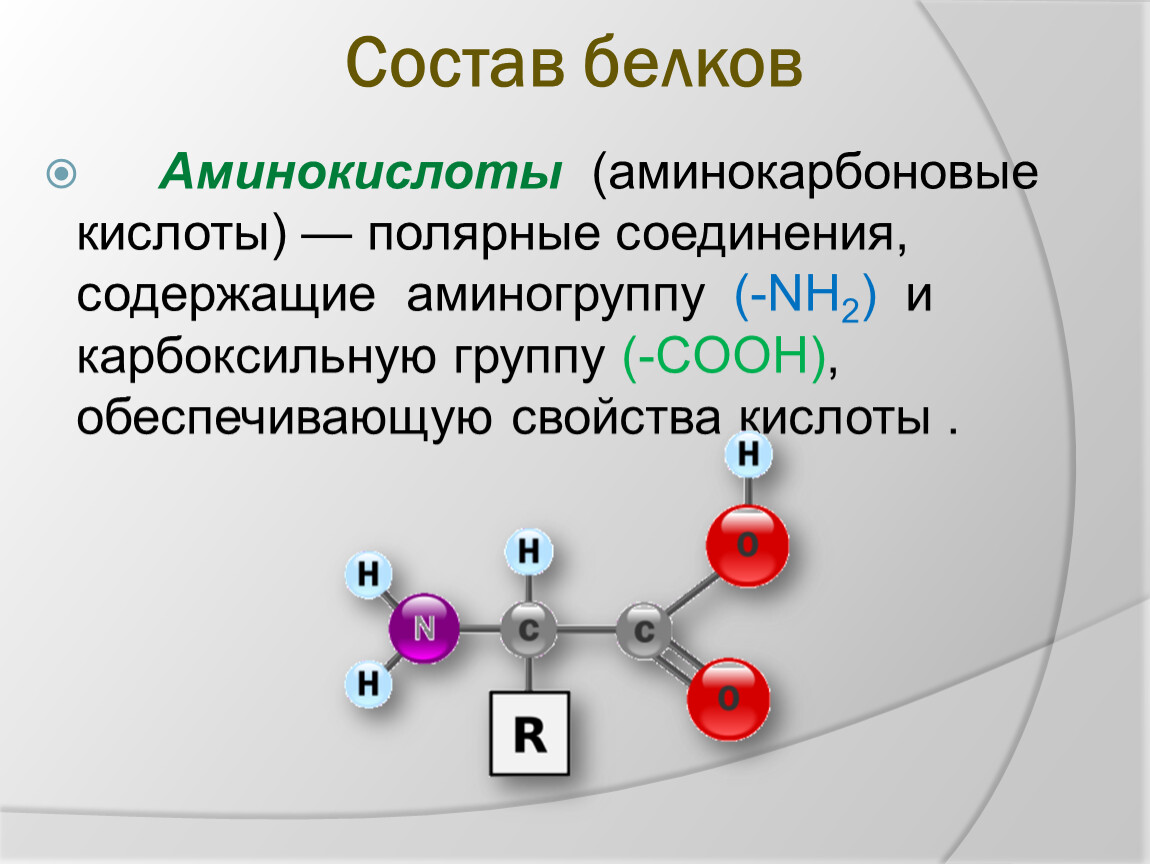 Например, через два дня после заражения было показано, что использование треонина для синтеза муцинов в кишечнике крыс на 70% больше, чем у крыса контрольной группы. В целом, суточное абсолютное потребление треонина для синтеза белков кишечника (стенки кишечника) и белков плазмы (минус альбумин) увеличилось на 23%, что в 2,6 раза превышало пищевое потребление. Аналогичным образом, пролин, который хорошо представлен в составе кишечных муцинов (13% 3,48 по сравнению с 4% -7% в белках организма, кроме коллагена), также может служить вторичной лимитирующей аминокислотой для синтеза муцина.
Например, через два дня после заражения было показано, что использование треонина для синтеза муцинов в кишечнике крыс на 70% больше, чем у крыса контрольной группы. В целом, суточное абсолютное потребление треонина для синтеза белков кишечника (стенки кишечника) и белков плазмы (минус альбумин) увеличилось на 23%, что в 2,6 раза превышало пищевое потребление. Аналогичным образом, пролин, который хорошо представлен в составе кишечных муцинов (13% 3,48 по сравнению с 4% -7% в белках организма, кроме коллагена), также может служить вторичной лимитирующей аминокислотой для синтеза муцина.
Таким образом, при воспалительных состояниях необходима адекватная и хорошо сбалансированная нутритивная поддержка для стимуляции защитного ответа, механизмов регенерации и, следовательно, поддержания или восстановления эффективной барьерной функции кишечника. Определение «адекватного и хорошо сбалансированного питания» будет зависеть от метаболического состояния, связанного с болезнью, и определенно будет разниться с таковым для здорового состояния.
Как ранее наблюдалось в моделях животных с ВЗК, кишечная продукция муцина не усиливалась с помощью здорового, сбалансированного питания. Однако было показано, что увеличение содержания треонина, серина, пролина и цистеина в рационе крыс на модели колита эффективно способствует синтезу муцина толстой кишки в зависимости от дозы, не оказывая при этом влияния на общие белки слизистой оболочки (Рис.2).Более высокая доза аминокислот увеличивала присутствие Muc2-содержащих бокаловидных клеток в поверхностном эпителии изъязвленной области. Она также способствовала росту всех тестируемых популяций комменсальных бактерий, включая лактобацилл.
Схема 2. Скорость абсолютного синтеза (ASR), выраженные в мг/сут, муцинов и белков слизистой оболочки в толстой кишке крыс, получавших декстран сульфат натрия (DSS). Крыс кормили в течение 28 дней изонитрогенными (скорректированными с аланином) полусинтетическими порошковыми диетами, обеспечивающими следующие уровни состава по сравнению с потребностями крыс: DSSM1; двукратное увеличение треонина, пролина, серина и цистеина; DSSM2; четырехкратное увеличение треонина и пролина; и трехкратное увеличение серина и цистеина. Значения-средние ± SEM (n=8). Для каждой составляющей кишечника (муцины или белки слизистой оболочки) средства без общей буквы различаются, Р
Значения-средние ± SEM (n=8). Для каждой составляющей кишечника (муцины или белки слизистой оболочки) средства без общей буквы различаются, Р
Вывод
Содержание аминокислот треонина, серина, пролина и цистеина относительно высоки в составе кишечных муцинов, что отчасти объясняет их высокое потребление кишечником. А значит адаптированная диетическая поддержка с точным регулированием количества этих четырех аминокислот, имеет решающее значение для поддержания эффективной барьерной функции кишечника. Патологические ситуации, включая воспаление кишечника, процессы защиты кишечника и восстановление тканей, еще больше увеличивают потребность организма в перечисленных выше аминокислотах. В таких ситуациях рекомендуется увеличить поступление с пищей треонина, серина, пролина и цистеина, чтобы стимулировать синтез муцина, способствовать росту и равновесию комменсальной микробиоты и, таким образом усилить неспецифическую неиммунную функцию кишечного барьера.
Автор перевода: Анатолий Черников – главный ветеринарный врач, Клиника «101 Далматинец», Москва
Список литературы
1. Reeds PJ, Burin DG, Stoll B, van Goudoever JB. Consequences and regulation of gut metabolism. In Lobley GE, White A, MacRae JC (eds). Proceedings of the VIIIth International Symposium on Protein Metabolism and Nutrition. Aberdeen, UK. Wageningen Press, Wageningen, Netherlands. 1999:127–153.
Reeds PJ, Burin DG, Stoll B, van Goudoever JB. Consequences and regulation of gut metabolism. In Lobley GE, White A, MacRae JC (eds). Proceedings of the VIIIth International Symposium on Protein Metabolism and Nutrition. Aberdeen, UK. Wageningen Press, Wageningen, Netherlands. 1999:127–153.
2. Sharma R, Young C, Neu J. Molecular modulation of intestinal epithelial barrier: contribution of microbiota. J Biomed Biotechnol. 2010 (In press).
3. Neutra MR, Forstner JF. Gastrointestinal mucus: synthesis, secretion and function. In Leonard R.Johnson (eds). Physiology of the Gastrointestinal Tract. Raven Press, New York. 1987:975-1,009.
4. Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol. 2006;169:1,901-1,909.
5. Vereecke L, Beyaert R, Van Loo G. Enterocyte death and intestinal barrier maintenance in homeostasis and disease. Trends Mol Med. 2011;17:584-593.
6. Yu QH, Yang Q. Diversity of tight junctions (TJs) between gastrointestinal epithelial cells and their function in maintaining the mucosal barrier. Cell Biol Int. 2009;33:78-82.
Cell Biol Int. 2009;33:78-82.
7. Snoek SA, Verstege MI, Boeckxstaens GE, et al. The enteric nervous system as a regulator of intestinal epithelial barrier function in health and disease. Expert Rev Gastroenterol Hepatol. 2010; 4:637-651.
8. Johansson ME, Ambort D, Pelaseyed T, et al. Composition and functional role of the mucus layers in the intestine. Cell Mol Life Sci. 2011;68:3,635-3,641.
9. Forstner JF, Oliver MG, Sylvester FA. Production, structure and biologic relevance of gastrointestinal mucins. In Blaser MJ, Smith PD, Ravdin JI, Greenberg HB, Guerrant RL (eds). Infections of the Gastrointestinal Tract. Raven Press, New York. 1995:71–88.
10. Atuma C, Strugala V, Allen A, Holm L. The adherent gastro — intestinal mucus gel layer: thickness and physical state in vivo. Am J Physiol Gastrointest Liver Physiol. 2001;280:G922-G929.
11. Johansson ME, Larsson JM, Hansson GC. The two mucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host-microbial interactions. Proc Natl Acad Sci USA. 2011;108:4,659-4,665.
Proc Natl Acad Sci USA. 2011;108:4,659-4,665.
12. McGuckin MA, Lindén SK, Sutton P, Florin TH. Mucin dynamics and enteric pathogens. Nat Rev Microbiol. 2011;9:265-278.
13. Sheng YH, Hasnain SZ, Florin TH, McGuckin MA. Mucins in inflammatory bowel diseases and colorectal cancer. J Gastroenterol Hepatol. 2012;27:28-38
14.Van Klinken BJ, Einerhand AW, Büller HA, Dekker J. Strategic biochemical analysis of mucins. Anal Biochem. 1998;265:103-116.
15. Van der Sluis M, De Koning BA, De Bruijn AC, et al. Muc2- deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology. 2006;131:117-129.
16. Carraway KL, Theodoropoulos G, Kozloski GA, Carothers Carraway CA. Muc4/MUC4 functions and regulation in cancer. Future Oncol. 2009;5:1,631-1,640.
17. Luu Y, Junker W, Rachagani S, et al. Human intestinal MUC17 mucin augments intestinal cell restitution and enhances healing of experimental colitis. Int J Biochem Cell Biol. 2010;42:996-1,006.
2010;42:996-1,006.
18. Resta-Lenert S, Das S, Batra SK, Ho SB. Muc17 protects intestinal epithelial cells from enteroinvasive E. coli infection by promoting epithelial barrier integrity. Am J Physiol Gastrointest Liver Physiol. 2011;300:G1144-G1155.
19. Allen A. Gastrointestinal mucus. In Handbook of Physiology: The Gastrointestinal System. Salivary, Gastric, Pancreatic, and Hepatobiliary Secretion. Am Physiol Soc, Bethesda, MD. 1989:359-382.
20. Forstner G. Signal transduction, packaging and secretion of mucins. Annu Rev Physiol. 1995;57:585-605.
21. Plaisancié P, Barcelo A, Moro F, et al. Effects of neurotransmitters, gut hormones, and inflammatory mediators on mucus discharge in rat colon. Am J Physiol Gastrointest Liver Physiol. 1998;275:G1073-G1084.
22. Sherman P, Forstner J, Roomi N, et al. Mucin depletion in the intestine of malnourished rats. Am J Physiol. 1985;248:G418- G4123.
23. Faure M, Moennoz D, Montigon F, et al. Dietary threonine restriction specifically reduces intestinal mucin synthesis in rats. J Nutr. 2005;135:486-491.
J Nutr. 2005;135:486-491.
24. Law GK, Bertolo RF, Adjiri-Awere A, et al. Adequate oral threonine is critical for mucin production and gut function in neonatal piglets. Am J Physiol Gastrointest Liver Physiol. 2007;292: G1293-G1301.
25. Wang X, Qiao S, Yin Y, et al. A deficiency or excess of dietary threonine reduces protein synthesis in jejunum and skeletal muscle of young pigs. J Nutr. 2007;137:1,442-1,446.
26. Nichols NL, Bertolo RF. Luminal threonine concentration acutely affects intestinal mucosal protein and mucin synthesis in piglets. J Nutr. 2008;138:1,298-1,303.
27. Comelli EM, Simmering R, Faure M, et al. Multifaceted transcriptional regulation of the murine intestinal mucus layer by endogenous microbiota. Genomics. 2008;91:70-77.
28. Jenkins RT, Ramage JK, Jones DB, et al. Small bowel and colonic permeability to 51Cr-EDTA in patients with active inflammatory bowel disease. Clin Invest Med. 1988;11:151-155
29. Arslan G, Atasever T, Cindoruk M, Yildirim IS. (51)CrEDTA colonic permeability and therapy response in patients with ulcerative colitis. Nucl Med Commun. 2001;22:997-1,001.
(51)CrEDTA colonic permeability and therapy response in patients with ulcerative colitis. Nucl Med Commun. 2001;22:997-1,001.
30. Mahida YR, Rolfe VE. Host-bacterial interactions in inflammatory bowel disease. Clin Sci (Lond). 2004;107:331-431.
31. Ott SJ, Musfeldt M, Wenderoth DF, et al. Reduction in diversity of the colonic mucosa associated bacterial microflora in patients with active inflammatory bowel disease. Gut. 2004;53:685-693.
32. Kim YS, Ho SB. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr Gastroenterol Rep. 2010;12:319-330.
33. Sheng YH, Lourie R, Lindén SK, et al. The MUC13 cellsurface mucin protects against intestinal inflammation by inhibiting epithelial cell apoptosis. Gut. 2011;60:1,661-1,670.
34. Ruot B, Bechereau F, Bayle G, et al. The response of liver albumin synthesis to infection in rats varies with the phase of the inflammatory process. Clin Sci (Lond). 2002;102:107–114.
35. Faure M, Choné F, Mettraux C, et al. Threonine utilization for synthesis of acute phase proteins, intestinal proteins, and mucins is increased during sepsis in rats. J. Nutr. 2007;137:1,802–1,807.
36. Reeds PJ, Jahoor F. The amino aicd requirements of disease. Clin Nutr. 2001;1:15-22.
37. Breuille D, Rose F, Arnal M, et al. Sepsis modifies the contribution of different organs to whole-body protein synthesis in rats. Clin Sci (Lond). 1994;86:663-669.
38. Stoll B, Henry J, Reeds PJ, et al. Catabolism dominates the first-pass intestinal metabolism of dietary essential amino acids in milk protein-fed piglets. J Nutr. 1998;128:606-614.
39. Fuller MF, Milne A, Harris CI, et al. Amino acid losses in ileostomy fluid on a protein-free diet. Am J Clin Nutr. 1994;59: 70-73.
40.Van der Sluis M, Schaart MW, de Koning BA, et al.Threonine metabolism in the intestine of mice: loss of mucin 2 induces the threonine catabolic pathway. J Pediatr Gastroenterol Nutr. 2009;49: 99-107.
41.Van Der Schoor SR, Reeds PJ, Stoll B, et al. The high metabolic cost of a functional gut. Gastroenterology. 2002;123:1,931-1,940.
42. Gaudichon C, Bos C, Morens C, et al. Ileal losses of nitrogen and amino acids in humans and their importance to the assessment of amino acid requirements. Gastroenterology. 2002;123:50-59.
43. Heys SD, Park KG, McNurlan MA, et al. Protein synthesis rates in colon and liver: stimulation by gastrointestinal pathologies. Gut. 1992;33:976-981.
44. Breuille D, Arnal M, Rambourdin F, et al. Sustained modifications of protein metabolism in various tissues in a rat model of long-lasting sepsis. Clin Sci (Lond). 1998;94:413-423.
45. Mercier S, Breuille D, Mosoni L, et al. Chronic inflammation alters protein metabolism in several organs of adult rats. J Nutr. 2002;132:1,921-1,928.
46. El Yousfi M, Breuille D, Papet I, et al. Increased tissue protein synthesis during spontaneous colitis in HLA-B27 rats implies different underlying mechanisms. Clin Sci (Lond). 2003;105:437-446.
47. Breuillé D, Bechereau F, Buffiere C, et al. Beneficial effect of amino acid supplementation, especially cysteine, on body nitrogen economy in septic rats. Clin Nutr. 2006;25:634-642.
48. Faure M, Moënnoz D, Montigon F, et al. Development of a rapid and convenient method to purify mucins and determine their in vivo synthesis rate in rats. Anal Biochem. 2002;15(307):244-251.
49.Tytgat KM, Van der Wal JW, Einerhand AW, et al. Quantitative analysis of MUC2 synthesis in ulcerative colitis. Biochem Biophys Res Commun. 1996;224:397-405.
50. Faure M, Moënnoz D, Montigon F, et al. Mucin production and composition is altered in dextran sulfate sodium-induced colitis in rats. Dig Dis Sci. 2003;48:1,366-1,373.
51. Faure M, Moënnoz D, Mettraux C, et al. The chronic colitis developed by HLA-B27 transgenic rats is associated with altered in vivo mucin synthesis. Dig Dis Sci. 2004;49:339-346.
52. Faure M, Mettraux C, Moennoz D, et al. Specific amino acids increase mucin synthesis and microbiota in dextran sulfate sodium-treated rats. J Nutr. 2006;136:1,558-1,564.
Статья на нашем канале Яндекс Дзен.
Четыре правила – и никакого подсчета калорий! — ФГБУ «НМИЦ ТПМ» Минздрава России
Извечный вопрос: как есть и не толстеть? Можно ли сохранять вес или даже худеть, не прибегая к изнурительным диетам? Да, можно, если придерживаться четырех правил здорового питания. О том, как снизить калорийность дневного меню без специальных диет и утомительного подсчета калорий, рассказала врач-диетолог Клиники коррекции веса и сна Национального медицинского исследовательского центра терапии и профилактической медицины Софья Елиашевич.
1. В нашем ежедневном рационе обязательно должны присутствовать три полноценных белковых блюда – нежирное мясо, рыба, творог и яичный белок – на завтрак, обед и на ужин. Именно белки обеспечивают ощущение сытости в течение долгого времени. Помимо этого, белки состоят из аминокислот, некоторые из них мы получаем только с пищей, в организме они не синтезируются, являясь незаменимыми.
2. Калорийность любимых блюд можно уменьшить двумя способами: меняя способ приготовления и ингредиенты. Как известно, жирная еда содержит больше калорий, так как энергетическая ценность жиров (9 ккал на 1 г) в два с лишним раза выше, чем у белков и углеводов (4 ккал на 1 г). Заменив в салате жирный майонез маложирным йогуртом, можно заметно (в 7-8 раз) снизить общую калорийность блюда. Жарку лучше заменить другими способами приготовления пищи, отдайте предпочтение отвариванию, тушению (без масла), приготовлению продуктов на пару.
3. В режиме питания необходимо делать упор на первую половину дня. Во время ужина желательно ограничиться белковым блюдом и овощами. Если от какой-то любимой калорийной еды мы никак не можем отказаться, то переносим ее на первую половину дня, например на завтрак.
4. На нашем столе обязательно должны присутствовать овощи, как минимум дважды в день – в обед и на ужин. А идеальный перекус – это фрукты. Современный человек должен в сутки съедать по 400 граммов фруктов и овощей.
Если вам нужна индивидуальная консультация с диетологом, приглашаем в нашу Клинику коррекции веса и сна. Записаться можно в регистратуре Национального медицинского следовательского центра терапии и профилактической медицины Минздрава России или по телефону +7 (495) 790-71-72.
Обнаружена связь между обменом аминокислот и гиперподвижностью суставов при аутизме
Исследователи обнаружили повышенный уровень аминокислоты гидроксипролина у детей с расстройством аутистического спектра (РАС). Медики предполагают, что это может быть связано с гиперподвижностью суставов — симптомом, который часто наблюдается у пациентов с РАС. Эти данные могут помочь в лечении заболевания.
Аминокислоты — это своеобразные «кирпичи», которые образуют белки. Из белков состоят не только мышцы и внутренние органы, но и ферменты и гормоны. Они управляют жизнедеятельностью человека, обеспечивают его здоровый рост и развитие. Недостаток или избыток аминокислот в организме ведет к проблемам со здоровьем. Нарушить баланс аминокислот может, например, расстройство аутистического спектра (РАС). Оно проявляется в раннем детстве и сопровождает человека на протяжении всей жизни. До сих пор неизвестно, как именно РАС влияет на аминокислотный состав и какие последствия это несет для организма. Исследователи выяснили, что содержание аминокислоты гидроксипролина в организме детей с РАС превышает нормальные показатели — это может быть связано с гиперподвижностью суставов, которая часто наблюдается у пациентов с РАС.
«Существующие данные об уровне аминокислот при РАС довольно противоречивы. Эти противоречия могут возникать из-за возрастных, гендерных различий, особенностей клиники и других параметров. Данные об уровне одновременно нескольких аминокислот могут помочь выявить особенности метаболизма при РАС, поэтому целью нашего исследования стало изучение уровня аминокислот в сыворотке крови у детей», — говорит кандидат медицинских наук Алексей Тиньков, преподаватель кафедры элементологии РУДН и ЯрГУ.
В исследовании участвовало 97 мальчиков в возрасте от 3 до 14 лет. У 64 из них было диагностировано расстройство аутистического спектра. Уровень аминокислот в сыворотке крови исследователи измеряли с помощью высокоэффективной жидкостной хроматографии с УФ-детектированием. Этот метод позволяет проводить разделение проб на составляющие их компоненты и измерять их концентрацию.
Больше всего с РАС оказались связаны 4 аминокислоты — лейцин, серин, тирозин и гидроксипролин. Последний входит в состав коллагена, который составляет основу соединительных тканей — сухожилий, костей, хрящей. Поэтому исследователи предположили, что повышенное содержание гидроксипролина может быть причиной гипермобильности суставов — по разным оценкам этот диагноз встречается у 15%-50% детей с РАС. У здоровых детей уровень гидроксипролина составлял 0,87 мг на литр, у детей с расстройствами аутистического спектра — 1,7 мг. Медики также выяснили, что у детей с РАС на 15-28% снижено содержание аминокислот аргинина, глутамина, гистидина, лейцина, лизина, фенилаланина, серина, таурина, триптофана и треонина. Они отвечают, например, за рост и восстановление тканей. Медики отмечают, что дефицит этих аминокислот может влиять на психомоторное развитие ребенка.
«Мы предположили, что повышенное содержание гидроксипролина может быть связано с гипермобильностью суставов. Дефицит других аминокислот может влиять на нейрональную дисфункцию. Дальнейшее исследование поможет найти потенциальные мишени для профилактической терапии. Гипотетически, нормализация аминокислотного баланса может стать дополнительным инструментом для лечения РАС», — доктор медицинских наук, профессор Анатолий Скальный, заведующий кафедрой медицинской элементологии РУДН.
Работа опубликована в журнале Research in Autism Spectrum Disorders.
Синтетическая биология: новые аминокислоты, новые белки | Научные открытия и технические новинки из Германии | DW
Первые в истории человечества искусственные постройки были сооружены, конечно же, из природных материалов — глины, древесины, камней. Сегодня строители располагают поистине необъятным ассортиментом искусственных материалов — от бетона и стали до пластмасс и стекла. Столь широкий выбор стройматериалов и связанные с ними новые возможности предопределили и изменения в архитектуре сооружений. Похоже, сходные метаморфозы ждут нас и в биологии.
Новые задачи требуют новых белков
Природа создала практически все живые организмы — от бактерии до человека — по одному рецепту: наследственная информация, закодированная в генах, определяет состав и последовательность синтеза белков в клетках. Именно белки, собственно, и являются основой жизни — по крайней мере, в той форме, в которой она существует на Земле. Белки же представляют собой высокомолекулярные органические вещества, состоящие преимущественно из аминокислот. Набор аминокислот, образующих белки, невелик: их всего 20, так что все гигантское многообразие свойств белковых молекул определяется лишь различными комбинациями этих аминокислот.
Так задумала природа. Однако эти рамки представляются некоторым исследователям слишком узкими. В их числе и Недилько Будиша (Nediljko Budiša), хорватский ученый, работающий в Германии, в Институте биохимии Общества Макса Планка в Мартинсриде близ Мюнхена: «Все живые организмы используют эти 20 основных кирпичиков для синтеза белков, — поясняет ученый. — Но природа не могла предусмотреть, что мы поставим перед собой какие-то новые цели и начнем развивать биотехнологии».
Это и побудило исследователя взяться за создание новых аминокислот — с тем, чтобы использовать их в качестве составных элементов новых белков. Он начал с того, что сконструировал две не существующие в природе аминокислоты, а затем ему удалось заставить бактерии производить белки, в состав которых вошли и эти самые искусственные субстанции. Сегодня ученый уже владеет богатым ассортиментом приемов, с помощью которых он может заставить бактерии встраивать в синтезируемые ими белки самые разные химические элементы, природой там отнюдь не предусмотренные.
Фторопласты, липазы и катализаторы
«Фтор — это элемент, который природа практически никогда не использовала, или использовала крайне редко, — говорит Недилько Будиша. — Так, в организме человека фтор содержится разве что в зубной эмали. Это связано, прежде всего, с тем, что фториды — кристаллические соединения, в форме которых фтор встречается в природе, — нерастворимы в воде. Между тем, за последние годы и десятилетия в мире сформировалось целое направление органической химии, занимающееся фторсодержащими соединениями. Это чрезвычайно перспективное направление, здесь уже имеются весьма значительные достижения. Если мы искусственно создадим фторсодержащую аминокислоту и встроим ее в белок, то такой белок может и в органических растворителях быть таким же активным, как в воде».
Химической промышленности такие фторсодержащие белки будут как нельзя более кстати. Ведь сегодня фторопласты, то есть полимеры, содержащие атомы фтора и обладающие поэтому высокой химической стойкостью, получают чисто химическим путем, используя метод электролиза. Между тем, в биореакторах синтез фторопластов был бы более экологичным и обходился бы дешевле, — уверен Недилько Будиша.
Еще один пример — это липазы, водорастворимые ферменты, помогающие расщеплять жиры. Они широко применяются в моющих средствах и стиральных порошках. Путем внедрения в состав этих ферментов целого ряда специальных, не существовавших ранее в природе, аминокислот исследователю удалось существенно повысить эффективность моющих средств.
«Если говорить о важных в промышленном отношении ферментах, то их эффективность — как, например, в случае с этими липазами, — можно повысить ни много ни мало в 10 раз, — подчеркивает Недилько Будиша. — Ну, скажем, в 10 раз уменьшить расход катализаторов, необходимых для поддержания технологических процессов. Ведь эти катализаторы чрезвычайно дороги, и вот появляется возможность повысить их эффективность в 10 раз».
То, что поначалу выглядело — а возможно, и было, — забавой, сегодня стало уже серьезной инновацией. Казалось бы, промышленность должна двумя руками ухватиться за эту разработку. Но не тут-то было, — сетует Недилько Будиша: «Сравнивая свою ситуацию с ситуацией моих американских коллег, я должен сказать, что немецкая промышленность не проявляет особого интереса к новым технологиям. Она берет только то, что полностью готово к внедрению и не требует никаких дополнительных капиталовложений».
Впрочем, 20-ти аминокислотам потребовалось 3,5 миллиарда лет на то, чтобы прочно занять свое место в составе белков. Ясно, что новичкам приходится туго.
Автор: Владимир Фрадкин
Редактор: Дарья Брянцева
Ножницы для ДНК. За что дали Нобелевскую премию по химии?
- Николай Воронин
- Корреспондент по вопросам науки
Автор фото, Getty Images
Нобелевская премия по химии за 2020 год присуждена работающей в Берлине француженке Эммануэль Шарпантье и американке Дженифер Дудне за разработку метода редактирования генома, получившего неофициальное название «генетические ножницы».
Шарпантье, которой 51 год, и 56-летняя Дудна — лишь шестая и седьмая лауреатки Нобелевской премии по химии за всю ее историю (на 168 лауреатов-мужчин). В этом году награду впервые разделили две женщины.
Как сказано в решении Нобелевского комитета, созданная ими технология CRISPR-Cas9 произвела настоящую революцию в биологии и медицине. Она уже используется для лечения раковых больных, а в будущем, возможно, позволит навсегда забыть о наследственных заболеваниях.
Русская служба Би-би-си коротко (в 100 словах) и чуть подробнее (в 500) объясняет, в чем суть этого революционного открытия, удостоенного во вторник высшей награды научного мира.
Любой живой организм состоит из клеток, в каждой из которых свернута в клубок ДНК — двойная спираль генетического года.
У человека эта спираль — это цепочка информации длиной в шесть миллиардов звеньев (если быть точным, две цепочки по 3 миллиарда), накопленных нашими предками за сотни миллионов лет эволюции.
Изобретенные Шарпантье и Дудной «ножницы» позволяют вырезать из этой цепи нужный фрагмент. После операции удаленные звенья можно заменить «заплаткой», вставив вместо них другой генетический код, а можно просто «сшить» ДНК обратно — словно там ничего не было.
Автор фото, EPA
Подпись к фото,Эммануэль Шарпантье
В некотором смысле это позволяет ученым вернуться в прошлое и избавить организм от «багажа», накопленного в результате естественного отбора, если спустя тысячи или даже миллионы лет он перестал быть нужным и начал создавать проблемы.
С помощью той же технологии можно генетически модифицировать живые организмы, придавая им практически любые заданные характеристики — от выбора нужной окраски до создания сельхозкультур, устойчивых к изменениям климата.
Цепочка ДНК называется генетическим кодом, поскольку в ней зашифрована последовательность аминокислот, из которых состоят белки — основной строительный материал клетки.
Хотя в теории количество белков практически бесконечно (в теле человека их порядка 10 тысяч видов), все они собраны всего из 20 аминокислот.
Каждая из них, в свою очередь, зашифрована набором из трех нуклеотидов с одним из четырех азотистых оснований на конце.
Достаточно изменить всего лишь одно из них — и код изменится. В результате клетка соберет «незапланированную» белковую молекулу с совершенно другими свойствами.
Автор фото, Reuters
Подпись к фото,Дженнифер Дудна
Именно эта способность изменяться на генетическом уровне — то есть мутировать — и есть главное свойство живых организмов, отличающее их от неживой природы.
Мутации могут происходить как под воздействием внешней среды (например, радиации), так и в результате внутренних поломок — «ошибок при сборке» клеткой собственных копий. Так или иначе организм накапливает их на протяжении всей жизни и передает своим потомкам.
Если изменения в ДНК помогают следующему поколению выжить, то со временем мутация окончательно закрепляется на генетическом уровне. Если нет, организм погибает. Так происходит естественный отбор.
По ходу эволюции цепочка ДНК накапливала все новую и новую информацию, при этом какие-то фрагменты потеряли свою изначальную функцию.
Так происходило на протяжении миллионов лет — пока в XXI веке люди не научились вносить изменения ДНК искусственным образом, редактируя генетический код.
Шарпантье и Дудна — мягко говоря, не первые ученые, которым пришло в голову вносить изменения в ДНК. Способы редактирования генома существовали и раньше.
Только в позапрошлом году американка Фрэнсис Арнольд получила Нобелевскую премию по химии за разработанную ей почти 20 лет назад технологию направленной эволюции, основанную именно на искусственно созданных мутациях.
Однако именно лауреаты этого года изобрели метод, позволяющий редактировать генетический код настолько точно, чтобы в него можно было вносить многочисленные прицельные изменения.
Технология CRISPR-Cas9 была разработана всего восемь лет назад, но ее уже давно используют в генетических лабораториях по всему миру — как в медицинских целях, так и для усовершенствования методов сельского хозяйства и т.д.
Именно с помощью этой технологии китайский профессор Хэ Цзянькуй в 2018 году отредактировал ДНК человеческих эмбрионов, в результате чего на свет впервые появились генетически модифицированные дети.
Последовавший скандал привел к тому, что на редактирование ДНК человека был фактически наложен мораторий.
Однако исследования продолжаются. В мае этого года технологию CRISPR опробовали для лечения слепоты. А в будущем, как надеются ученые, эта технология может полностью избавить человечество от любых наследственных заболеваний.
Глоссарий | EXCEMED
Этот глоссарий призван обеспечить точные определения ключевых терминов. Слова, выделенные курсивом, имеют отдельные пояснения. Если вы считаете, что некоторые термины должны быть добавлены в словарь, пожалуйста, отправьте сообщение по электронной почте [email protected] с вашим предложением.
Кликните на одно сообщение выше, чтобы перейти на страницу, начиная с этого сообщения.
B
- Bh5
- Сокращенное название тетрагидробиоптерина (кофактора фенилаланингидроксилазы ), который часто используется в медицинских исследованиях.
См.: Сапроптерин
Синонимы: tetrahydrobiopterin
Перейти к началу
H
- HPA
Распространенное сокращенное название гиперфенилаланинемии.
Перейти к началу
I
- IQ
«Коэффициент умственного развития», широко распространенный показатель умственного развития, который определяется при помощи тестов. IQ представляет собой соотношение умственного и физического развития человека, которое выражается в процентах.
Перейти к началу
P
- PEG-PAL
Аммиаклиаза фенилаланина — это фермент , получаемый из растений, который расщепляет фенилаланин , но при этом не требует тетрагидробиоптерин в качестве кофермента . PEG-PAL — это пегилированный инъекционный состав аммиаклиазы фенилаланина, который исследуется в клинических условиях на людях с фенилкетонурией. В данный момент PEG-PAL еще не утвержден как официальное терапевтическое средство.
- Phe
- Сокращенное название фенилаланина.
Перейти к началу
А
- Аминокислота
Аминокислоты — это маленькие молекулы с определенной структурой, с карбоксильными и аминными группами, отделенными от центрального атома углерода с боковой связью, которая позволяет различать разные аминокислоты. Все белки состоят их цепочек аминокислот, связанных вместе, некоторые аминокислоты имеют огромное значение для нервной системы. Существует около 20 аминокислот, которые важны для физиологии человека. MБольшинство из них синтезируется в теле человека, но некоторые не синтезируются, а должны поступать извне в процессе питания (« Незаменимые аминокислоты «). Люди, которые страдают фенилкетонурией и соблюдают диету с низким содержанием фенилаланина, не могут получать с пищей достаточное количество белков; для получения незаменимых аминокислот им могут потребоваться продукты лечебного питания
- Аммиаклиаза фенилаланина
См.: PEG-PAL
- Аспартам
Аспартам — это искусственный заменитель сахара, имеет разные коммерческие названия. Аспартам высвобождает фенилаланин в процессе обмена веществ, поэтому людям с фенилкетонурией следует избегать его употребления.
- Атипичная гиперфенилаланинемия
Этот термин используется в отношении к пациентам с недостатком тетрагидробиоптерина, а также для того, чтобы охарактеризовать людей с легкой формой гиперфенилаланинемии , которая возникает в результате определенной мутации гена фенилаланингидроксилазы.
- Аутосомно-рецессивная наследственность
Вид наследования мутации гена, который несущественно влияет на фенотип человека, из-за того что другая (немутированная) копия гена обеспечивает достаточную активность белка, кодированного геном . Например, у пациентов с одной мутированной и одной нормальной копией фенилаланингидроксилазы (один из родителей является носителем мутации гена) не выражается клинический фенотип фенилкетонурии, характеризуемый гиперфенилаланинемией . Наследование двух мутированных копий (по одной от каждого родителя) в результате будет выражено фенотипом фенилкетонурии.
Перейти к началу
Б
- Белое вещество
В ЦНС содержится «серое вещество», которое образовано телами нервных клеток, и «белое вещество», которое состоит в основном из нервных волокон (аксонов). Недостаточная регуляция фенилаланина в крови в течение длительного времени может негативно повлиять на белое вещество в головном мозге.
- Болезнь Фёллинга
Ранний термин для обозначения фенилкетонурии, связанный с именем врача Асбьёрна Фёллинга, который открыл зависимость синдрома прогрессирующей умственной отсталости , известной в наше время как фенилкетонурия , от избытка фенилаланина .
- Большие нейтральные аминокислоты
- Этот термин описывает некоторые аминокислоты в соответствии с их химической структурой (большие неионизированные боковые цепи) и, как правило, относится к: фенилаланину, тирозину , триптофану, валину, изолейцину, лейцину, метионину и гистидину. Людям с фенилкетонурией иногда назначают добавки с LNAA.
Синонимы: LNAA
Перейти к началу
В
- Веконосовые складки
Складки кожи верхнего века, которые закрывают внутренние уголки глаз.
- Восприимчивый к тетрагидробиоптерину
Этот термин используется для описания людей с фенилкетонурией, которые положительно реагируют на лечение сапроптерином или на нагрузочную пробу на тетрагидробиоптерин . Такие люди с медицинской точки зрения потенциально подходят для долгосрочного лечения сапроптерином с целью регуляции уровня фенилаланина в крови.
- Вставка
- Мутация , при которой дополнительная ДНК (одна или более пар оснований) выпадает из гена.
Перейти к началу
Г
- Ген
- Последовательность ДНК, которая определяет структуру определенного белка. Количество мутаций в гене фенилаланингидроксилазы , которые, как известно, например, ухудшают способность фермента преобразовывать фенилаланин в тирозин , приводя тем самым к фенилкетонурии.
- Генетическая гетерогенность
Каждый человек уникален в отношении его ДНК. Генетическая гетерогенность — это термин, который используется для описания ряда мутаций в определенном гене у разных индивидуумов одной группы. Много разных мутаций генов могут вызвать фенилкетонурию, поэтому данная численность людей обладает генетической гетерогенностью высокой степени.
- Генная терапия
Метод лечения, в котором применяется изменение самого генетического кода пациента. Например, в экспериментальных исследованиях производится поиск метода генной терапии, который позволит создать рабочую копию фенилаланингидроксилазы для пациентов с фенилкетонурией, которые страдают от недостатка этого фермента . Однако, в настоящее время эти исследования являются теоретическими, а использование их результатов для лечения фенилкетонурии возможно лишь в далеком будущем.
- Генотип
- Данный термин описывает образец мутаций , которые присутствуют в определенных генах на уровне ДНК индивидуума. Генотип пациентов с фенилкетонурией во многом, хотя не полностью, прогнозирует их фенотип фенилкетонурии. Например, мутации R408W или IVS-12 существенно снижают активность фенилаланингидроксилазы и приводят к среднему или тяжелому фенотипу фенилкетонурии. Другие мутации , как, например, E390G, Y414C, или A300S, не столь сильно угнетают активность фермента , поэтому питательная переносимость фенилаланина выше, а фенотип фенилкетонурии является менее тяжелым. У пациентов с фенилкетонурии часто наблюдаются разные мутации в каждой копии гена фенилаланингидроксилазы .
- Гетерозиготный
- У каждого из нас есть две копии каждого гена . Организм с определенной мутацией только одного гена (при отсутствии мутации другого) называется гетерозиготным в отношении данной мутации.
- Гипертония
Повышенный мышечный тонус.
- Гиперфенилаланинемия
Повышенный уровень фенилаланина в крови. Уровень фенилаланина в крови, который разделяет нормальное содержание фенилаланина в крови и гиперфенилаланинемию , в соответствии с положениями рекомендаций , изменяется с возрастом.
- Гиперфенилаланинемия без фенилкетонурии
У людей с гиперфенилаланинемией без фенилкетонурии наблюдается незначительное повреждение фенилаланингидроксилазы . Это часто возникает по причине мутации только одной из двух имеющихся копий гена фенилаланингидроксилазы или по причине мутаций, которые незначительно ухудшают функцию фермента . При этом наблюдается слегка повышенный уровень фенилаланина в крови, который является недостаточным для диагностирования фенилкетонурии и, как правило, не требует лечения.
- Гипотония
Пониженный мышечный тонус.
- Гликопротеин
Источник белка, полученный из молочной сыворотки, в которой не содержится фенилаланина . Гликопротеин иногда используется в качестве белковой пищевой добавки ( продукта лечебного питания ) для пациентов с фенилкетонурией.
- Гомозиготный
- У каждого из нас есть две копии каждого гена . Организм с идентичной мутацией обоих генов называется гомозиготным в отношении данной мутации.
- Губной желобок
Желобок посредине над верхней губой, который тянется от носа до верха губы.
Перейти к началу
Д
- Двигательные навыки
Способность групп мышц выполнять контролируемые точные движения. Измерение двигательных навыков иногда назначается в качестве нейропсихологических тестов , для того чтобы следить за развитием людей с фенилкетонурией.
- Делеция
Мутация , при которой ДНК (одна или более пар оснований) выпадает из гена.
- Дефицит тетрагидробиоптерина
См.: Недостаток тетрагидробиоптерина
- Диагностирующий тест(ы)
- Диагностирующие тесты используются для определения болезней у населения. В большинстве стран все новорожденные дети проверяются на наличие фенилкетонурии и других наследственных нарушений обмена веществ в первые дни или недели жизни. При необходимости может быть назначено лечение с целью предотвратить долгосрочные негативные последствия болезни.
- Диарея
Симптом, для которого характерны частые ежедневные испражнения и жидкий стул. Диарея может быть вызвана разными факторами: у больных фенилкетонурией причиной диареи может быть сохранение низких концентраций фенилаланина в крови в течение длительного времени. Более длительный период низких концентраций фенилаланина может привести к снижению скорости роста, атрофии кожи (которое можно ошибочно принять за экзему) и диарее, которая может свидетельствовать о слабой функции кишечника или неспособности кишечника синтезировать новые клетки. С другой стороны, диарея, так же как рвота или повышение температуры, может стать причиной катаболизма и последующего повышения концентрации фенилаланина в крови.
- Диета с низким содержанием фенилаланина
Фенилкетонурия характеризуется неспособностью регулировать уровень фенилаланина в крови, при этом в обычном режиме питания данный уровень может подняться до токсического. Следовательно, пациентам требуется специальная диета с низким содержанием фенилаланина , которая обычно дополняется назначением продуктов лечебного питания.
- Допустимая норма фенилаланина
- Количество фенилаланина , которое пациент может принять с пищей без риска последующего превышения допустимого уровня фенилаланина в крови.
- Дофамин
- Важный нейромедиатор в ЦНС . Дофамин участвует во многих функциях ЦНС , включая точное управление движениями (недостаток дофаминергических клеток наблюдается при болезни Паркинсона) и когнитивную деятельность. По предположению, вызванное недостатком миелина нарушение функций переднего мозга, регулируемых дофамином, при долговременном заболевании гиперфенилаланинемией может стать причиной повреждения когнитивной функции . Для осуществления биосинтеза дофамина требуется тирозин . Высокий уровень фенилаланина в крови сдерживает проникновение тирозина в мозг (для фенилаланина и тирозина требуется один и тот же переносчик больших нейтральных аминокислот в гематоэнцефалический барьер). Это может быть очередным фактом негативного воздействия гиперфенилаланинемии на функцию дофаминергических систем мозга.
Перейти к началу
З
- Заменитель белка
Пациенты с фенилкетонурией, как правило, не могут принимать в пищу продукты — натуральные источники белка, в которых содержится фенилаланин . Заменители белка ( продукты лечебного питания ) являются источниками белка, в которых нет фенилаланина , но есть другие аминокислоты , необходимые для полноценного питания.
Перейти к началу
И
- Интроны
- Интроны — это последовательности ДНК в гене , которые не переносятся в зрелый белок. Последовательности РНК, возникающие на основе интронов, выпадают во время процессинга начальной ДНК для формирования окончательного мессенджера РНК, который будет использоваться для трансляции в белок.
- Исполнительная функция
- Термин, который описывает некоторые из высших функций головного мозга. К исполнительным функциям относятся воля, понимание, суждение, согласованное использование ресурсов (например, памяти) для достижения поставленных целей, планирование задач, разработка стратегий или создание комплекса действий для выполнения более объемной задачи, исправление ошибок, решение проблем, выработка соответствующего поведения с учетом полученной информации, реагирование на действия, которые еще не изучены, надлежащее поведение в ситуациях, в которых требуется преодолеть искушение или силу привычки. Исследования людей с фенилкетонурией выявили ухудшени исполнительной функции в сравнении с людьми, которые не страдают данным заболеванием.
Перейти к началу
К
- Классическая фенилкетонурия
Этот термин обычно используется для описания пациентов с мутациями гена фенилаланингидроксилазы , который приводит к снижению активности ферментов , вплоть до отсутствия таковой. Вполне вероятно, что у таких пациентов будет развиваться тяжелая форма гиперфенилаланинемии (уровень фенилаланина в крови, как правило, выше 1200 μmol/л) и при этом будет необходима диета с низким содержанием фенилаланина . Для пациентов с классической фенрилкетонурией нехарактерна восприимчивость к лечению сапроптерином .
- Кофактор
Некоторым ферментам требуется другая молекула для передачи их функции — кофактор. Тетрагидробиоптерин является кофактором фенилаланингидроксилазы ( фермента , недостаток которого наблюдается при фенилкетонурии).
- Куван (Kuvan®)
- Kuvan® — это дигидрохлорид сапроптерина фармацевтическая композиция тетрагидробиоптерина(растворимые таблетки), которая официально применяется для лечения фенилкетонурии во многих странах.
Перейти к началу
Л
- Легкая форма гиперфенилаланинемии
К легкой форме гиперфенилаланинемии относятся небольшие концентрации фенилаланина в крови, которые считаются недостаточными для диагностирования фенилкетонурии и применения диеты с низким содержанием фенилаланина .
- Легкая форма фенилкетонурии
Низкий или средний уровень фенилаланина в крови, который обнаруживается у людей с мутациями гена фенилаланингидроксилазы и только частично подавляет функцию фермента.
Перейти к началу
М
- Материнская фенилкетонурия
Если мать болеет фенилкетонурией, то развивающийся плод подвергается негативному воздействию высокого уровня фенилаланина в крови. Женщинам с фенилкетонурией в период беременности или во время планирования беременности следует принять меры для регуляции уровня фенилаланина в крови. Для плода последствия материнской фенилкетонурии с отсутствием регуляции (если уровень фенилаланина в крови выше 1200 μmol/л) представляют высокий риск (более 90% случаев) умственной отсталости и микроцефалии . Также возможны физические недостатки ( нарушение строения лица) или врожденный порок сердца.
- Меланин
Меланин — это гормон, который вызывает потемнение кожи, например, при реакции на солнечный свет. Высокий уровень фенилаланина в крови человека, не соблюдающего лечение фенилкетонурии, подавляет выработку меланина в организме. В результате этого у пациентов с фенилкетонурией часто бывает светлая кожа.
- Метаболит
Химическое вещество, которое вырабатывается в организме, обычно в результате функционирования ферментов . Обычно эти вещества используются в последующих биохимических реакциях, расщепляются дальше или выводятся с мочой. Например, птерины в моче (измеряются для диагностики дефицита тетрагидробиоптерина ) являются метаболитами тетрагидробиоптерина.
- Миелин
Оболочка, которая состоит из определенных клеток (олигодендроцитов в ЦНС , шванновских клеток — в периферийной), которые покрывают и изолируют нервы, а также повышают скорость передачи нервных импульсов. Недостаточная регуляция уровня фенилаланина в крови в течение длительного времени, как известно, может вызвать повреждение миелина в головном мозге. Однако, остается неясным, каким образом данное явление связано с подавлением исполнительных и когнитивных функций, что наблюдается у пациентов с фенилкетонурией.
- Миссенс-мутация
Миссенс- мутация — это мутация одного основания гена , при которой в конечном белке одна аминокислота заменяется другой. Например, миссенс- мутация R408W изменяет ДНК таким образом, что нуклеотид CGG (аргинин) заменяется на TGG (триптофан). Эта замена аминокислоты значительно подавляет активность фенилаланингидроксилазы в образовавшемся белке.
- Молчащая мутация
Не все мутации ДНК меняют активность получаемого белка. Например, нуклеотид, изменяясь с ЦAA на ЦАГ, производит в итоговом белке глутамин, в любом случае, и белок будет идентичен любому генотипу. Данная молчащая мутация была описана применительно к фенилаланингидроксилазе .
Перейти к началу
Н
- Нагрузочная проба
См.: Нагрузочная проба на тетрагидробиоптерин
- Нагрузочная проба на тетрагидробиоптерин
Медицинское исследование с целью обнаружить у людей восприимчивость к лечению сапроптерином . Положительный результат определяется согласно количеству снижения фенилаланина в крови после лечения (обычно, но не всегда, 30%-снижение уровня фенилаланина в крови сравнивается с уровнем, измеренным непосредственно перед лечением). В данный момент в разных центрах используются разные виды нагрузочных проб.
- Нарушение строения
Нарушенное физическое развитие. Распространенным последствием материнской фенилкетонурии является нарушение строения лица, для которого характерна широкая переносица, веконосовые складки, широкий губной желобок, низко расположенные уши, поднятые ноздри и меленькие губы.
- Натуральный белок
Натуральный белок — это белок, который содержится в обычных продуктах питания, в отличие от искусственного белка в продуктах лечебного питания.
- Недостаток тетрагидробиоптерина
Состояние, при котором генные мутации ослабляют выработку тетрагидробиоптерина, кофермента фенилаланингидроксилазы . Активность любого из нескольких ферментов может стать неполноценной (ГТФ циклогидролаза I; 6-пирувоил- тетрагидробиоптерин синтаза; сепиаптеринредуктаза 1; дигадроптеринредуктаза). Некоторые, но не все формы недостатка тетрагидробиоптерина являются признаками гиперфенилаланинемии , что требует диеты с низким содержанием фенилаланина . Около 1-2% случаев гиперфенилаланинемии обнаружены при обычном осмотре новорожденных по выявленному дефициту тетрагидробиоптерина.
Тетрагидробиоптерин также требует продуцирования ключевых нейромедиаторов в ЦНС , а некоторые формы дефицита тетрагидробиоптерина имеют симптомы, возникающие вследствие измененной активности нейромедиаторов .
- Незаменимые аминокислоты
Аминокислоты , которые не синтезируются в организме и должны быть получены с питанием. Для пациентов с фенилкетонурией источником незаменимых аминокислот являются продукты лечебного питания.
- Нейропсихологическое тестирование
Долговременная гиперфенилаланинемия нарушает функцию головного мозга. Для отслеживания развития головного мозга у молодых людей, страдающих фенилкетонурией, а также для измерения ряда фугкций головного мозга, как, например, когнитивная функция , память, двигательные навыки и др. необходимо проведение нейропсихологических тестов.
- Нейротоксический
Вызывающий повреждение нервных клеток. Долговременное повышение уровня фенилаланина при отсутствии лечения или несвоевременном лечении фенилкетонурии является нейротоксическим для головного мозга и вызывает умственную отсталость или прочие отрицательные последствия.
- Несвоевременное лечение
В контексте фенилкетонурии несвоевременное лечение — это отсутствие диеты с низким содержанием фенилаланина у людей с фенилкетонурией с первых дней или недель жизни. Несвоевременное лечение людей с фенилкетонурией почти всегда приводит к нарушениям развития, которые характерны при фенилкетонурии (как, например, тяжелая умственная отсталость).
- Нонсенс-мутация
Нонсенс-мутацией называется преобразование нуклеотида аминокислоты в терминирующий кодон (стоп-кодон) . В результате этого образуется укороченный белок, у которого отсутствует биологическая активность. Мутация R111X изменяет нуклеотид ДНК с ЦГА (аргинин) на ТГА (стоп).
- Носитель (мутации гена)
- У ребенка может развиться классическая фенилкетонурия , если он наследует от своих родителей (по одной копии от каждого) два мутированных гена фенилаланингидроксилазы , фермента , которого недостаточно у людей с фенилкетонурией. Люди с одной мутацией гена не страдают от фенилкетонурии, однако, они являются носителями мутации. Два носителя мутации гена фенилаланингидроксилазы (который подавляет активность фермента ) в результате получают: — В одном случае из четырех у них рождается ребенок с фенилкетонурией (две мутированные копии гена ), — в одном случае из четырех у них рождается ребенок без мутаций , вызывающих фенилкетонурию (нет мутированных копий гена), и — в одном случае из двух у них рождается ребенок-носитель первой или второй мутации .
Перейти к началу
О
- Обменное поглощение
См.: Обменное поглощение фенилаланина
- Обменное поглощение фенилаланина
Показатели обменного поглощения фенилаланина — это информация о продуктах, которая указывает, сколько фенилаланина в них содержится. Эти показатели помогают людям с фенилкетонурией планировать свою диету и определить, какую пищу можно есть свободно (в пределах разумного), какую — только в строго регулируемых количествах, а от какой пищи вообще следует отказаться.
Перейти к началу
П
- Переносчик больших нейтральных аминокислот
Головной мозг отделен от остального организма барьером (гематоэнцефалическим барьером), который выполняет многие функции, включая точную модуляцию химической среды ЦНС . Большие нейтральные аминокислоты (в том числе и фенилаланин ) необходимы для полноценной деятельности мозга, например, синтеза важных нейромедиаторов, таких как дофамин , норэпинефрин (норадреналин) или серотонин (5-окситриптамин). LNAA переносятся через гематоэнцефалический барьер в мозг при помощи особого белка-переносчика и могут затем использоваться нервными клетками.
- Приверженность лечению
- Термин «приверженность лечению» помогает описать, насколько точно пациент следует программе, которую ему назначил специалист. Следовательно, люди могут хорошо или плохо соблюдать назначения врача (напр., принимать прописанные лекарства в нужном количестве в нужное время), специальную диету (напр., прием рекомендуемых продуктов питания в правильных количествах и отказ от нежелательных продуктов, и т.д.). Это касается людей с фенилкетонурией, которые соблюдают диету с низким содержанием фенилаланина или проходят сапроптериновую терапию , к примеру. Термины «приверженность лечению» и « соблюдение указаний врача » являются взаимозаменяемыми.
- Проба Гатри
- Метод массового скрининга новорожденных на фенилкетонурию, который до сих пор используется в некоторых странах. Для этого теста берут пробу крови из пятки, помещают ее на фильтровальную бумагу и отправляют в лабораторию. Из бумаги внутри пятна крови выбивают маленькие круглые кусочки, которые помещают на агаровый гель с содержащимися в нем бактериями Bactilis subtilis , для роста которых требуется фенилаланин . В состав геля также входит β-2-тиенилаланин — вещество, которое подавляет рост бактерий путем сдерживания использования фенилаланина этими бактериями. Повышение локальной концентрации фенилаланина (в крови младенца, больного гиперфенилаланинемией ) позволяет преодолеть подавление роста бактерий, и в течение одного дня вокруг положительного образца наблюдается рост кольца бактерий. По диаметру бактериальной колонии можно оценить степень концентрации фенилаланина в образце. Во многих странах проба Гатри заменена более новыми методами, например, тандемной масс-спектрометрией.
- Продукты лечебного питания
Пациенты с фенилкетонурией, как правило, не могут принимать в пищу продукты — натуральные источники белка, поскольку в них содержится фенилаланин . Продукты лечебного питания (иногда их называют заменителями белка ) являются источниками белка, в которых нет фенилаланина , но есть другие аминокислоты , необходимые для полноценного питания.
- Птерины (в моче)
- Группа веществ ( метаболитов ), которые вырабатываются в организме в процессе расщепления тетрагидробиоптерина . При недостатке тетрагидробиоптерина у пациентов измеряются свойства птеринов в моче, для того чтобы определить, у какого из ферментов, участвующих в выработке тетрагидробиоптерина, нарушена функция. См. тж. дефицит тетрагидробиоптерина .
См.: Недостаток тетрагидробиоптерина
- Пяточная проба
Проба крови для скрининга новорожденных на фенилкетонурию, а также на другие заболевания обычно берется из пятки младенца при помощи укола иглой.
Перейти к началу
Р
- Развитие
- Термин с широким значением, охватывает физические и когнитивные изменения, которые происходят вместе с ростом человека; термин обычно относится к молодым людям. Для поддержки нормального развития людей, страдающих фенилкетонурией, важна оптимизация питания — например, диета с низким содержанием фенилаланина.
- Разновидность фенилкетонурии
Термин обычно используется для описания пациентов с фенилкетонурией с некоторой остаточной активностью фенилаланингидроксилазы . Уровень фенилаланина в крови обычно ниже, чем в случае классической фенилкетонурии, хотя диета с низким содержанием фенилаланинина в большинстве случаев все еще необходима. Люди с остаточной активностью фенилаланингидроксилазы в большей степени поддаются лечению с помощью сапроптерина, чем люди с классической формой фенилкетонурии.
- Рекомендация
- С точки зрения медицины к рекомендациям обычно относятся документы, в которых установлены оптимальные методы и режим лечения в определенной области. В рекомендациях обычно содержатся подробные обзоры медицинских заключений, которыми подтверждаются определенные методы лечения с указаниями по их оптимальному применению. Врачи не обязаны следовать всем этим рекомендациям, в отдельных случаях они могут выносить свою клиническую оценку.
Перейти к началу
С
- Сапроптерин
Химическое название формы тетрагидробиоптерина ( Bh5 ): вещество, возникающее естественным образом, необходимое для активности фенилаланингидроксилазы ( фермента , недостаток которого наблюдается при фенилкетонурии). В группе пациентов с фенилкетонурией ( восприимчивый к тетрагидробиоптерину фенотип — обычно, но не обязательно — пациенты с более легкой формой фенилкетонурии), лечение сапроптерином повышает активность фенилаланингидроксилазы и обеспечивает регуляцию фенилаланина в крови.
- Своевременное лечение
В контексте фенилкетонурии своевременное лечение — это назначение и поддержка диеты с низким содержанием фенилаланина с первых дней или недель жизни человека для смягчения негативного воздействия повышенного уровня фенилаланина в крови на развитие человека.
- Сдвиг рамки считывания
- В синтезе белка ДНК вначале считывается матричной РНК, созданной из цепочки нуклеотидов. В генетическом коде набор из трех смежных оснований (нуклеотидов) в цепочке РНК кодирует каждую аминокислоту белка. Нуклеотиды также обеспечивают другую информацию, например, о завершении. Рамка считывания состоит из последовательности этих нуклеотидов . Если количество пар оснований, которые вставляются или удаляются из ДНК, не кратно трем, то происходит мутация со сдвигом рамки. С этого момента происходит изменение рамки считывания. Например, рассмотрим следующую цепочку РНК, в которой основания показаны как рамка считывания шести нуклеотидов, которые завершаются стоп-кодоном. … UUA UAC AGU AAA GCC UAG Лейцин Тирозин Серин Лизин Аланин СТОП Теперь предположим, что вставляется дополнительное отдельное основание ( миссенс-мутация , выделена красным): … UUC AUA CAG UAA AGC CUA Фенилаланин Изолейцин Глутамин СТОП Не считан
- Скрининг новорожденных
Процедура тестирования всех новорожденных на определенные заболевания, как, например, фенилкетонурию, для своевременного оказания медицинской помощи с целью предотвращения длительного вредного воздействия выявленного заболевания на ребенка. Также называется « скрининг новорожденных ».
- Скрининг новорожденных
См.: Скрининг новорожденных
- Соблюдение указаний врача
- По значению подобно приверженности лечению, употребляется для того, чтобы охарактеризовать, насколько пациент соблюдает программу лечения, согласованную между ним и его лечащим врачом. Соблюдение диеты с низким содержанием фенилаланина — главный аспект лечения фенилкетонурии, например, когда недостаточное соблюдение указаний врача зачастую может привести к гиперфенилаланинемии, и при этом повышает риск осложнений при фенилкетонурии со стороны нервной системы, как, например, ухудшение исполнительной и когнитивной деятельности.
- Содержание фенилаланина/тирозина
Большая часть тирозина в организме обычно вырабатывается из фенилаланина с помощью фермента — фенилаланингидроксилазы . Если функция фенилаланингидроксилазы нарушена, как при фенилкетонурии, то уровни этих двух аминокислот могут быть нарушены (высокий уровень фенилаланина , низкий уровень тирозина ). Это имеет важное значение, в особенности для функции головного мозга, для обеспечения которой требуются и фенилаланин , и тирозин . Для некоторых людей, страдающих фенилкетонурией, достижение нормального соотношения между уровнями фенилаланина и тирозина может быть важнейшим аспектом их лечения с применением диеты с низким содержанием фенилаланина и, в некоторых случаях, продуктов лечебного питания с добавкой тирозина.
- Специальная диета
- Пациенты с фенилкетонурией должны строго регулировать прием фенилаланина, им необходима специальная диета с низким содержанием фенилаланина (см. Продукты лечебного питания ).
См.: Продукты лечебного питания
- Сращивание
Прерывание последовательности пар оснований ДНК для ввода новой ДНК или удаления уже существующей. Процесс мутации сращивания IVS10 распространен среди населения с фенилкетонурией, при этом активность фенилаланингидроксилазы существенно уменьшается.
Перейти к началу
Т
- Тандемная масс-спектрометрия
Передовая техника для массового осмотра новорожденных, которая позволяет сделать анализ крови младенцев на фенилкетонурию, а также другие наследственные заболевания. Это наиболее продвинутая методология скрининга из всех доступных сегодня, которая во многих странах почти заменила старые методы ( проба Гатри , флуорометрическое обследование ).
- Терминирующий кодон (стоп-кодон)
Последовательность трех нуклеотидов (оснований) в ДНК/РНК, которая дает команду, чтобы остановить транскрипцию ДНК в РНК или выработку белка.
- Тетрагидробиоптерин
Вещество, возникающее естественным образом, необходимое для активности фенилаланингидроксилазы ( фермента , недостаток которого наблюдается при фенилкетонурии). В Японии доступна фармакологическая технология изготовления тетрагидробиоптерина.
- Тир
- Сокращенное название тирозина, аминокислоты , которая главным образом вырабатывается с помощью преобразования фенилаланина ферментом фенилаланингидроксилазой.
См.: Фенилкетонурия
- Триплет (кодон)
Последовательность из трех нуклеотидов в ДНК/РНК, которая кодирует отдельную аминокислоту или определяет окончание синтеза цепи ( стоп-кодон ).
Перейти к началу
У
- Умственная отсталость
- Недостаточное развитие интеллектуальных способностей. Если не проводить лечение фенилкетонурии в раннем детстве, то это может привести к серьезной умственной отсталости.
См.: Cretinism
- Уровень фенилаланина
Измеряемый уровень фенилаланина в крови. Показатель уровня фенилаланина в крови используется для диагностики фенилкетонурии и в случае подтверждения — для назначения диеты с низким содержанием фенилаланина или другого лечения фенилкетонурии. Рекомендуемый уровень фенилаланина в крови может изменяться в зависимости от возраста.
Перейти к началу
Ф
- Фенилаланингидроксилаза
- Это фермент ( ген EC 1.14.16.1, локус 12q24.1), который преобразует фенилаланин (полученный из продуктов питания) в другую аминокислоту , тирозин . У людей с фенилкетонурией в генах фенилаланингидроксилазы имеется мутация , которая сокращает или совсем блокирует ее активность. Мутации в обеих копиях гена фенилаланингидроксилазы являются причиной клинической фенилкетонурии.
Синонимы: PAH
- Фенилкетонурия
- Наследственное аутосомно-рецессивное заболевание, вызванное мутацией гена фермента фенилаланингидроксилазы , который в обычном состоянии преобразовывает фенилаланин в тирозин . Возникающая вследствие этого концентрация фенилаланина в крови является токсичной для центральной нервной системы , если уровень фенилаланина не регулируется при помощи специальной диеты или другого метода лечения (см. Сапроптерин , Аминокислоты ).
См.: Аминокислота Сапроптерин
- Фенотип
Данный термин служит для характеристики внешности человека в медицинском смысле. Например, тех людей, у которых реакция на лечение сапроптерином выражается в значительном снижении уровня фенилаланина в крови, можно охарактеризовать как «фенотип с восприимчивостью к тетрагидробиоптерину при фенилкетонурии».
- Ферменты
- Ферменты — это белки, которые действуют в качестве катализатора жизненно важных биохимических реакций. Фенилаланингидроксилаза — это фермент, который отвечает за преобразование фенилаланина в тирозин , недостаток которого возникает при фенилкетонурии.
- Флуориметрический анализ
Этот метод применяется в некоторых странах для скрининга новорожденных на фенилкетонурию и другие наследственные нарушения обмена веществ. Подобно другим методам, с его помощью измеряется уровень фенилаланина в крови. Во многих странах данный метод был заменен тандемной масс-спектрометрией.
Перейти к началу
Ц
- ЦНС
- центральная нервная система: головной и спинной мозг.
Перейти к началу
Ш
- Шаперон («наставник»)
Шаперон (молекулярный шаперон) служит для сохранения структуры и функции другой молекулы, как правило, протеина. Например, тетрагидробиоптерин является коферментом для фенилаланингидроксилазы . Подгруппа пациентов (обычно, но не исключительно, с легкой формой фенилкетонурии) реагирует на лечение тетрагидробиоптерином , что выражается в повышении активности фенилаланингидроксилазы и снижении уровня фенилаланина в крови. Считается, что мутация фенилаланингидроксилазы изменяет ее активность путем изменения ее 3-мерной структуры. Тетрагидробиоптерин , как считают исследователи, помогает сохранить структуру мутантного белка фенилаланингидроксилазы таким образом, что активность фермента сохраняется. Это может также предотвратить разрушение белка фенилаланингидроксилазы или его инактивацию другими ферментами . Таким образом, тетрагидробиоптерин действует как «молекулярный шаперон».
Перейти к началу
Э
- Экзема
Экзема — это состояние кожи, которое характеризуется воспалением, сухостью, шелушением и зудом. Как правило, наблюдается образование везикул (пузырьков), после чего может возникнуть эритема (покраснение), эдема (припухлости), появление бугорков на коже (папул), а затем утолщение и огрубение кожи. Экзема является широко распространенной особенностью фенилкетонурии, если при этом не соблюдается диета с низким содержанием фенилаланина с первых дней жизни.
- Экзоны
Экзоны и интроны являются частями генов в их последовательности ДНК. Экзон — это участок гена, который будет представлен в образованном белке. Участки РНК, к которым относятся интроны , удаляются из гена для формирования зрелой РНК, которая переводится в белок.
- Эпилепсия
Эпилепсия — это состояние, при котором несогласованная электрическая активность в мозге приводит к потере сознания и судорогам. Эпилепсия является широко распространенной особенностью фенилкетонурии, если при этом не соблюдается диета с низким содержанием фенилаланина с первых дней жизни.
Перейти к началу
Nitro Pure Whey — BioTechUSA
ОписаниеМы рекомендуем Nitro Pure Whey, если вы:
- ищете превосходный источник белка; за счет высокого содержания белка (78%) способствует поддержанию и росту мышечной массы и сохранению здоровых костей
- хотите, чтобы белковый порошок для посттренировочного восстановления всасывался мгновенно
- чувствительны к глютену
- любите изысканные, кремовые и разнообразные вкусы
Белковая сывороточная основа Nitro Pure Whey – это профессионально подобранный комплекс, содержащий изоляты и пептиды, полученные из самых чистых источников сывороточного белка. Благодаря применению холодной технологии микрофильтрации в поперечном потоке белки, используемые в Nitro Pure Whey, не подвергаются химическим превращениям и сохраняют свою естественную форму и легко всасываются.
Белки – незаменимые строительные элементы нашего тела, источник питательных веществ. Они состоят из аминокислот, которые вырабатываются нашим организмом и поступают с пищей, поэтому мы должны ежедневно принимать белки, чтобы поддерживать свой организм. Белки помогают сохранить мышцы во время тренировки, строгой диеты и в повседневной жизни. Вам необходимо больше белка, если вы регулярно тренируетесь, хотите увеличить мышечную массу, а также по мере увеличения вашего возраста. Быстрый, удобный и очень эффективный способ пополнения белков – это прием белковых пищевых добавок; все, что вам нужно, – это протеиновый порошок, шейкер и немного воды или молока. Белковый порошок легко переваривается и, в отличие от мяса, потребляемого в большом количестве, не закисляет организм. Белковый порошок может быть получен из молока, а также из животных или растительных источников или их комбинации. Всасывание белков может быть быстрым (30-40 минут), средним (1-2 часа) или медленным (более 2 часов).
- Высокое содержание белка: 78%
- Высокое содержание аминокислот
- Легкое и быстрое всасывание
- Низкое содержание жиров и углеводов
- Без добавления сахара
- Со стевией
- Без глютена
Снабжение мышц высококачественными питательными веществами имеет огромное значение для их нормальной функции, поддержания и роста мышечной массы. Как и мы, наши мышцы любят «хорошо поесть». Побалуйте их и себя вкуснейшим сливочным белковым порошком Nitro Pure Whey! Nitro Pure Whey – это быстро всасываемый сывороточный белковый комплекс с отличным соотношением цены и эффективности и с 78%-ным содержанием белка (смесь изолята и концентрата сывороточного протеина).
Выбирайте Nitro Pure Whey и заряжайте свои мышцы!
Как и все продукты BioTech USA, Nitro Pure Whey состоит из безопасных, тщательно отобранных ингредиентов.
Способ примененияСмешайте 1 порцию (28 г, 1 мерная ложка = 2 столовые ложки с верхом) с 250 мл воды и выпивайте по 2 порции в день.
ИнгредиентыBanana: Nitro Pure Whey Blend 78% [whey protein concentrate, whey protein isolate, AminoBlend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl, L-valine)], flavour enhancer(glycine), palm fat, flavours, thickener (sodium carboxymethyl cellulose), acid (citric acid),salt, sweeteners (sucralose, steviol glycosides), colour (tartrazine)*. * Tartrazine: May havean adverse effect on activity and attention in children.Made in a plant that also manufactures soy, egg and mustard containing foods.
Caramel–cappuccino: Nitro Pure Whey Blend 78% [whey protein concentrate, whey protein isolate,Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl, L-valine)], flavourenhancer (glycine), palm fat, cocoa powder, thickener (sodium carboxymethylcellulose), flavours, instant coffee, salt, sweeteners (sucralose, steviol glycosides).Made in a plant that also manufactures soy, egg and mustard containing foods.
Chocolate: Nitro Pure Whey Blend 78% [whey protein concentrate, whey protein isolate,Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl, L-valine)],cocoa powder, flavour enhancer (glycine), palm fat, flavour, thickener (sodiumcarboxymethyl cellulose), emulsifier (soy lecithin), salt, vanillin, sweeteners(sucralose, steviol glycosides).
Coconut–chocolate: Nitro Pure Whey Blend 78% [whey protein concentrate, whey protein isolate,Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl, L-valine)],flavour enhancer (glycine), cocoa powder, flavours, thickener (sodiumcarboxymethyl cellulose), coconut fat, emulsifier (soy lecithin), salt, vanillin,sweeteners (sucralose, steviol glycosides).Made in a plant that also manufactures egg and mustard containing foods.
Hazelnut: Nitro Pure Whey Blend 78% [whey protein concentrate, whey proteinisolate, Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl,L-valine)], flavour enhancer (glycine), cocoa powder, palm fat, thickener(sodium carboxymethyl cellulose), salt, flavour, vanillin, sweeteners (sucralose,steviol glycosides).Made in a plant that also manufactures soy, egg and mustard containing foods.
Lemon-yogurt: Nitro Pure Whey Blend 78% [whey protein concentrate, whey proteinisolate, Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl,L-valine)], flavour enhancer (glycine), palm fat, flavours, thickener (sodiumcarboxymethyl cellulose), acid (citric acid), salt, sweeteners (sucralose, steviolglycosides), colour (tartrazine)*. * Tartrazine: May have an adverse effect onactivity and attention in children.Made in a plant that also manufactures soy, egg and mustard containing foods.
Melon: Nitro Pure Whey Blend 78% [whey protein concentrate, whey protein isolate,Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl, L-valine)],flavour enhancer (glycine), palm fat, thickener (sodium carboxymethyl cellulose),flavour, acid (citric acid), salt, sweeteners (sucralose, steviol glycosides), colours(tartrazine, Ponceau 4R)*. * Tartrazine, Ponceau 4R: May have an adverse effect onactivity and attention in children.Made in a plant that also manufactures soy, egg and mustard containing foods.
Sour-cherry-jogurt: Nitro Pure Whey Blend 78% [whey protein concentrate, whey protein isolate,Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl, L-valine)],flavour enhancer (glycine), palm fat, flavours, thickener (sodium carboxymethylcellulose), acid (citric acid), salt, colours (indigotine, Ponceau 4R*, azorubine*),sweeteners (sucralose, steviol glycosides).* Ponceau 4R, azorubine: May have an adverse effect on activity and attention in children.Made in a plant that also manufactures soy, egg and mustard containing foods.
Strawberry: Nitro Pure Whey Blend 78% [whey protein concentrate, whey proteinisolate, Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl,L-valine)], flavour enhancer (glycine), palm fat, flavours, thickener (sodiumcarboxymethyl cellulose), acid (citric acid), salt, sweeteners (sucralose, steviolglycosides), colour (Ponceau 4R)*.* Ponceau 4R: May have an adverse effect on activity and attention in children.Made in a plant that also manufactures soy, egg and mustard containing foods.
Vanilla: Nitro Pure Whey Blend 78% [whey protein concentrate, whey proteinisolate, Amino Blend (L-isoleucine, L-leucine, L-glutamine, L-arginine HCl,L-valine,)], flavour enhancer (glycine), palm fat, thickener (sodium carboxymethylcellulose), flavours, vanillin, salt, sweeteners (sucralose, steviol glycosides),colour (tartrazine)*.* Tartrazine: May have an adverse effect on activity and attention in children.Made in a plant that also manufactures soy, egg and mustard containing foods.
Первичная структура: аминокислоты связаны пептидными связями с образованием полипептидных цепей — биохимия
Белки представляют собой линейных полимеров , образованных путем связывания α-карбоксильной группы одной аминокислоты с α-аминогруппой другой аминокислоты с пептидная связь (также называемая амидной связью ). Образование дипептида из двух аминокислот сопровождается потерей молекулы воды (). Равновесие этой реакции находится на стороне гидролиза, а не синтеза.Следовательно, биосинтез пептидных связей требует ввода свободной энергии. Тем не менее, пептидные связи кинетически стабильны; время жизни пептидной связи в водном растворе в отсутствие катализатора приближается к 1000 лет.
Рис. 3.18
Образование пептидной связи. Связывание двух аминокислот сопровождается потерей молекулы воды.
Ряд аминокислот, соединенных пептидными связями, образуют полипептидную цепь , , и каждая аминокислотная единица в полипептиде называется остатком .Полипептидная цепь имеет полярность , потому что ее концы разные, с α-аминогруппой на одном конце и α-карбоксильной группой на другом. По соглашению, за амино-конец принимается за начало полипептидной цепи, , и поэтому последовательность аминокислот в полипептидной цепи записывается, начиная с аминоконцевого остатка. Таким образом, в пентапептиде Tyr-Gly-Gly-Phe-Leu (YGGFL) фенилаланин является амино-концевым (N-концевым) остатком, а лейцин — концевым карбоксильным (C-концевым) остатком ().Leu-Phe-Gly-Gly-Tyr (LFGGY) — это другой пентапептид с разными химическими свойствами.
Рисунок 3.19
Аминокислотные последовательности имеют направление. Эта иллюстрация пентапептида Tyr-Gly-Gly-Phe-Leu (YGGFL) показывает последовательность от аминоконца до карбоксильного конца. Этот пентапептид, лей-энкефалин, представляет собой опиоидный пептид, который модулирует восприятие (подробнее …)
Полипептидная цепь состоит из регулярно повторяющейся части, называемой основной цепью , или основной цепью, и вариабельной частью, включающей отличительные боковые цепи ().Основа полипептида богата потенциалом водородных связей. Каждый остаток содержит карбонильную группу, которая является хорошим акцептором водородных связей, и, за исключением пролина, группу NH, которая является хорошим донором водородных связей. Эти группы взаимодействуют друг с другом и с функциональными группами из боковых цепей для стабилизации конкретных структур, как будет подробно описано.
Рисунок 3.20.
Компоненты полипептидной цепи. Полипептидная цепь состоит из постоянной основной цепи (показана черным) и вариабельных боковых цепей (показана зеленым).
Большинство природных полипептидных цепей содержат от 50 до 2000 аминокислотных остатков и обычно обозначаются как белков . Пептиды, состоящие из небольшого количества аминокислот, называются олигопептидами или просто пептидами . Средняя молекулярная масса аминокислотного остатка составляет около 110, поэтому молекулярная масса большинства белков составляет от 5500 до 220 000. Мы также можем относиться к массе белка, которая выражается в дальтонах; один дальтон равен одной атомной единице массы.Белок с молекулярной массой 50 000 имеет массу 50 000 дальтон или 50 кД (килодальтон).
Дальтон—
Единица массы, почти равная единице массы атома водорода. Назван в честь Джона Далтона (1766-1844), который разработал атомную теорию материи.
В некоторых белках линейная полипептидная цепь сшита. Наиболее распространенными поперечными связями являются дисульфидных связей, образующихся в результате окисления пары остатков цистеина (). Полученная единица связанных цистеинов называется цистин .Внеклеточные белки часто имеют несколько дисульфидных связей, тогда как внутриклеточные белки их обычно не имеют. В некоторых белках редко присутствуют недисульфидные поперечные связи, происходящие из других боковых цепей. Например, таким образом укрепляются коллагеновые волокна в соединительной ткани и фибриновые сгустки крови.
Килодальтон (кД) —
Единица массы, равная 1000 дальтон.
Рисунок 3.21
Перекрестные ссылки. Образование дисульфидной связи из двух остатков цистеина является реакцией окисления.
3.2.1. Белки имеют уникальные аминокислотные последовательности, которые определяются генами
В 1953 году Фредерик Сэнджер определил аминокислотную последовательность инсулина, белкового гормона (). Эта работа является вехой в биохимии, поскольку она впервые показала, что белок имеет точно определенную аминокислотную последовательность . Более того, он продемонстрировал, что инсулин состоит только из 1 аминокислот, связанных пептидными связями между α-амино и α-карбоксильными группами. Это достижение побудило других ученых провести исследования последовательностей широкого спектра белков.Действительно, сейчас известны полные аминокислотные последовательности более чем 100 000 белков. Поразительным фактом является то, что каждый белок имеет уникальную, точно определенную аминокислотную последовательность . Аминокислотную последовательность белка часто называют его первичной структурой .
Серия точных исследований, проведенных в конце 1950-х и начале 1960-х годов, показала, что аминокислотные последовательности белков детерминированы генетически. Последовательность нуклеотидов в ДНК, молекула наследственности, определяет комплементарную последовательность нуклеотидов в РНК, которая, в свою очередь, определяет аминокислотную последовательность белка.В частности, каждая из 20 аминокислот репертуара кодируется одной или несколькими конкретными последовательностями из трех нуклеотидов (раздел 5.5).
Знание аминокислотных последовательностей важно по нескольким причинам. Во-первых, знание последовательности белка обычно необходимо для выяснения механизма его действия (например, каталитического механизма фермента). Более того, белки с новыми свойствами могут быть получены путем изменения последовательности известных белков. Во-вторых, аминокислотные последовательности определяют трехмерную структуру белков.Аминокислотная последовательность — это связь между генетическим посланием в ДНК и трехмерной структурой, которая выполняет биологическую функцию белка. Анализ отношений между аминокислотными последовательностями и трехмерными структурами белков раскрывает правила, которые управляют складыванием полипептидных цепей. В-третьих, определение последовательности — это компонент молекулярной патологии, быстро развивающейся области медицины. Изменения в аминокислотной последовательности могут вызвать нарушение функции и заболевание.Тяжелые, а иногда и смертельные заболевания, такие как серповидно-клеточная анемия и кистозный фиброз, могут быть результатом изменения одной аминокислоты в белке. В-четвертых, последовательность белка многое говорит о его эволюционной истории (см. Главу 7). Белки похожи друг на друга по аминокислотной последовательности только в том случае, если у них есть общий предок. Следовательно, молекулярные события в эволюции можно проследить по аминокислотным последовательностям; молекулярная палеонтология — это процветающая область исследований.
3.2.2. Полипептидные цепи гибки, но ограничены конформацией
Изучение геометрии белкового остова выявляет несколько важных особенностей.Во-первых, пептидная связь по существу плоская (). Таким образом, для пары аминокислот, связанных пептидной связью, шесть атомов лежат в одной плоскости: α-атом углерода и группа CO от первой аминокислоты и группа NH и α-атом углерода от второй аминокислоты. Природа химической связи внутри пептида объясняет это геометрическое предпочтение. Пептидная связь имеет значительный характер двойной связи , который предотвращает вращение вокруг этой связи.
Рис. 3.23
Пептидные связи плоские.В паре связанных аминокислот шесть атомов (C α , C, O, N, H и C α ) лежат в одной плоскости. Боковые цепи показаны зелеными шарами.
Неспособность связи вращаться ограничивает конформацию пептидного остова и объясняет планарность связи. Этот характер двойной связи также выражается в длине связи между группами CO и NH. Расстояние C-N в пептидной связи обычно составляет 1,32 Å, что находится между значениями, ожидаемыми для одинарной связи C-N (1.49 Å) и двойной связи C = N (1,27 Å), как показано на. Наконец, пептидная связь не заряжается, что позволяет полимерам аминокислот, связанных пептидными связями, образовывать плотно упакованные глобулярные структуры.
Рис. 3.24
Типичная длина связи внутри пептидной единицы. Пептидная единица показана в транс-конфигурации.
Для плоской пептидной связи возможны две конфигурации. В транс-конфигурации два α-углеродных атома находятся на противоположных сторонах пептидной связи. В цис-конфигурации эти группы находятся на одной стороне пептидной связи. Почти все пептидные связи в белках являются транс-. Такое предпочтение транс-цис-формы можно объяснить тем, что стерические столкновения между группами, присоединенными к α-атомам углерода, препятствуют образованию цис-формы, но не происходят в транс-конфигурации (). Безусловно, наиболее распространенными цис-пептидными связями являются связи X-Pro. Такие связи менее предпочтительны для транс-конфигурации, поскольку азот пролина связан с двумя тетраэдрическими атомами углерода, ограничивая стерические различия между транс- и цис-формами ().
Рисунок 3.25
Транс- и цис-пептидные связи. Трансформация пользуется большой популярностью из-за стерических конфликтов, которые происходят в цис-форме.
Рис. 3.26
Облигации Trans- и Cis X-Pro. Энергии этих форм относительно сбалансированы, поскольку стерические столкновения происходят в обеих формах.
В отличие от пептидной связи, связи между аминогруппой и α-атомом углерода, а также между α-атомом углерода и карбонильной группой являются чистыми одинарными связями. Две соседние жесткие пептидные единицы могут вращаться вокруг этих связей, принимая различную ориентацию. Эта свобода вращения вокруг двух связей каждой аминокислоты позволяет белкам складываться разными способами . Повороты вокруг этих связей могут быть заданы двугранными углами (). Угол поворота вокруг связи между атомами азота и α-углерода называется phi (φ). Угол поворота вокруг связи между α-углеродом и карбонильными атомами углерода называется psi (ψ). Поворот по часовой стрелке вокруг любой связи, если смотреть спереди на заднюю группу, соответствует положительному значению.Углы φ и ψ определяют путь полипептидной цепи.
Двугранный угол —
Мера поворота вокруг связи, обычно принимаемая в пределах от -180 ° до + 180 °. Двугранные углы иногда называют торсионными углами.
Рис. 3.27
Вращение связей в полипептиде. Структуру каждой аминокислоты в полипептиде можно регулировать вращением вокруг двух одинарных связей. (A) Phi (φ) — угол поворота вокруг связи между атомами азота и α-углерода, (подробнее…)
Возможны ли все комбинации φ и ψ? Г. Н. Рамачандран признал, что многие комбинации запрещены из-за стерических столкновений между атомами. Допустимые значения могут быть визуализированы на двумерном графике, который называется диаграммой Рамачандрана (). Три четверти возможных комбинаций (φ, ψ) исключаются просто из-за локальных стерических столкновений. Стерическое исключение, тот факт, что два атома не могут находиться в одном и том же месте в одно и то же время, может быть мощным организующим принципом .
Рисунок 3.28
Диаграмма Рамачандрана, показывающая значения φ и ψ. Не все значения φ и ψ возможны без столкновений между атомами. Наиболее благоприятные регионы показаны темно-зеленым; пограничные области показаны светло-зеленым. (подробнее …)
Способность биологических полимеров, таких как белки, складываться в четко определенные структуры, является замечательной термодинамически. Рассмотрим равновесие между развернутым полимером, который существует как случайный клубок, то есть как смесь многих возможных конформаций, и свернутой формой, которая принимает уникальную конформацию.Благоприятная энтропия, связанная с большим количеством конформаций в развернутой форме, препятствует сворачиванию и должна преодолеваться взаимодействиями, благоприятствующими свернутой форме. Таким образом, очень гибкие полимеры с большим количеством возможных конформаций не складываются в уникальные структуры. Жесткость пептидной единицы и ограниченный набор допустимых углов φ и ψ ограничивает количество структур, доступных для развернутой формы, в достаточной степени, чтобы позволить сворачиванию белка происходить .
Как производятся аминокислоты | Улучшение жизни с помощью аминокислот | О нас | Глобальный веб-сайт Ajinomoto Group
Аминокислоты производятся из растительных ингредиентов.Ферментированные продукты, такие как мисо и соя, производятся путем ферментации сои или пшеницы с использованием культуры коджи. В процессе ферментации белок расщепляется и превращается в аминокислоты. Мисо и соя — примеры того, как аминокислоты давно стали частью японской диеты и как японцы пытались приготовить вкусную еду. Аминокислоты, используемые в аминокислотных продуктах, в основном производятся путем ферментации растительных ингредиентов таким же образом, как и мисо и соевый соус.
При ферментации аминокислот аминокислоты производятся путем ферментации ингредиентов с помощью микроорганизмов (например, пробиотических бактерий).Эти микроорганизмы превращают ингредиенты в пищу и другие вещества, в которых нуждаются микроорганизмы. При ферментации такие ингредиенты, как патока, добавляются в среду, в которой культивируются микроорганизмы. Это помогает микроорганизмам размножаться и производить аминокислоты. Микроорганизмы содержат ферменты, которые ускоряют реакции разложения и синтеза новых веществ. Процесс ферментации представляет собой серию реакций, в которых участвует от 10 до 30 типов ферментов.
Чтобы производить аминокислоты с помощью микроорганизмов, мы сначала должны найти микроорганизмы, которые обладают сильным потенциалом для производства аминокислот.В одном грамме естественной почвы содержится около 100 миллионов микроорганизмов. Исходя из этого, мы должны определить, какие микроорганизмы наиболее эффективны.
Когда найден нужный микроорганизм, необходимо разработать его лучшие штаммы, чтобы получить микроорганизмы с наилучшим потенциалом. Количество производимых аминокислот зависит от количества и качества ферментов. Можно производить больше аминокислот, если ферменты, необходимые для производства нужных аминокислот, содержатся в идеальных условиях. Однако при отсутствии этих условий можно добиться меньшего.Допустим, у микроорганизма есть метаболический путь A → (a) → B → (b) → C → (c) → D, где (a), (b) и (c) — ферменты. Чтобы производить большие количества аминокислоты C, ферменты (a) и (b) должны быть более активными, а фермент (c) не должен быть активным. Это может быть достигнуто путем создания улучшенных сортов с помощью различных методов.
Для производства аминокислот резервуары для брожения заполняются патокой и сахарными ингредиентами, такими как сахарный тростник, кукуруза и маниока. Достигнуты идеальные условия для перемешивания, подачи кислорода, температуры и уровня pH.Затем из этого ферментированного бульона очищают желаемые аминокислоты.
Помимо ферментации, существуют и другие способы получения аминокислот, например ферментативная реакция, экстракция и синтез.
В процессе ферментативной реакции один или два типа ферментов используются для превращения предшественника аминокислоты в нужную аминокислоту. В этом методе нет необходимости размножать микроорганизмы путем преобразования определенной аминокислоты, и нет длительного процесса, начинающегося с глюкозы.Процесс ферментативной реакции идеален, если вещество-предшественник имеет низкую стоимость.
Аминокислоты можно получить путем расщепления белков, известного как метод экстракции. Однако количество аминокислот в исходном белке ограничивает количество производимых аминокислот. Экстракция не подходит для получения массовых количеств определенных аминокислот.
Synthesis использует химические реакции для производства аминокислот и широко использовался на ранних этапах разработки способов получения аминокислот. Проблема с синтезом состоит в том, что в результате химических реакций образуются равные количества L- и D-аминокислот.В результате полученные D-аминокислоты должны затем превращаться в L-аминокислоты. Следовательно, этот более дорогостоящий метод требует дополнительных этапов обработки и оборудования, поэтому его производство постепенно прекращалось. Однако он все еще используется для производства глицина, которого нет в D- и L-формах, и для аминокислот, где нет разницы, являются ли они D- или L-формами при использовании.
Преимущество ферментации заключается в том, что она позволяет нам производить массовые количества аминокислот по низкой цене с относительно небольшими производственными мощностями.Использование ферментации для производства аминокислот помогло расширить рынок аминокислот. В 1960-е годы производство глутамата перешло от экстракции к ферментации, а затем последовало производство других аминокислот.
| ||||||||||||||||||||||||||||||||||||||||||||||
Важные биомолекулы
Важные биомолекулыМолекулы жизни
Белки
Белки являются основным строительным материалом тело.Ваши волосы, кожа, мышцы и органы в основном состоят из белки. Белки сильные, но гибкие, и у них есть комплекс 3-D структура. Аминокислоты — это основные строительные блоки белков. Аминокислоты имеют NH 2 (аминную) группу на одном конце, H-O-C = O (карбоксильная) группа на другом конце, что делает его кислым, и группа R который простирается от центрального атома углерода. Химический состав этой группы R варьируется от одной аминокислоты к другой и придает каждой аминокислоте уникальные свойства.Есть 20 аминокислот, которые важны для человека, и все белки состоят из комбинаций этих подразделений. Цепочки аминокислот называют пептидами. Можете ли вы увидеть в полипептидной цепи, показанной ниже, отдельные аминокислоты, которые связаны вместе в повторяющемся паттерне N-C-C? Между концом C одной аминокислоты и N следующей аминокислоты энергия АТФ используется для извлечения ОН из C и H из N, образуя H 2 O и соединяя их пептидной связью, удлинение цепи.Когда мы перейдем к разделу курса генетики, мы будем изучать синтез белка. Это процесс, с помощью которого инструкции ДНК транскрибируют в РНК, которая затем транслирует в аминокислоты, которые связаны вместе, образуя длинные полипептидные цепи. Эти цепи затем сплетаются вместе, как нити в веревке или как нити в одеяле, с образованием различных белков. Когда пища потребляется, белки расщепляются на составляющие их аминокислоты и перестраиваются в белки организма.Однако избыток аминокислот не сохраняется для использования в будущем, и организм начинает расщеплять собственные белки только во время голодания, когда обычные источники топлива (жиры и углеводы) недоступны.
Аминокислота, образующая пептидную связь с растущей полипептидной цепью, высвобождающая H 2 O
Обезвоживание, синтез и гидролиз: Белки, жиры и углеводы используют эти две общие реакции с участием воды для сборки и разборки молекулы.Когда два атома водорода и один кислород удаляются из двух отдельных молекул и в результате получается одна молекула и вода, это называется реакцией синтеза дегидратации. Молекулы «обезвоживаются», потому что вода удаляется, и они синтезируются (объединяются) в одну большую молекулу. Когда одна большая молекула расщепляется (лизис означает расщепление) на две молекулы с добавлением воды и энергии, реакция называется гидролизом. На каждой из иллюстраций эти противоположные реакции показаны красным.
Жиры (липиды)
Жиры являются основными молекулами, долгосрочно хранящими энергию тело. Жиры очень компактны и легки, поэтому они эффективный способ хранения избыточной энергии. Жир состоит из глицерина, который присоединен к 1–3 цепям жирных кислот. Большая часть энергии жиров поступает из множества углеродных связей в этих длинных цепочках жирных кислот. Жирные кислоты соединяются с глицерином в области, где каждая молекула имеет группу -O-H. Два атома водорода и один кислород отщепляются, образуя H-O-H (воду), и длинная углеродная цепь присоединяется к глицерину.Каждый глицерин может нести до трех цепей жирных кислот, что делает его «триглицеридом». Когда каждая жирная кислота присоединяется к глицерину, образуется молекула воды. Чтобы повернуть реакцию вспять и отделить жирную кислоту от глицерина, просто добавьте воду и энергию.
Жиры состоят из глицерина (слева) и до трех жирных кислот
Здоровье сердца и жиры : Насыщенные жирные кислоты имеют нет двойных связей и, следовательно, содержат максимальное количество атомов водорода.Другими словами, углерод «насыщен» водородом. Ненасыщенный жирные кислоты имеют двойные связи и поэтому содержат меньше водороды. Насыщенные жиры не так полезны, как ненасыщенные жиры. Насыщенные жиры — это длинные прямые молекулы, которые могут закупорить артерии, тогда как более ненасыщенные жиры из-за дополнительных двойных связей более гибкие и с меньшей вероятностью забивают мелкие кровеносные сосуды. Это похоже на разницу между попыткой проглотить сырые палочки для спагетти и приготовленную лапшу для спагетти.
Углеводы
Глюкоза, 6-углеродный сахар, представляет собой простой углевод или «моносахарид». Сахар является источником быстрой энергии для организма, потому что он легко метаболизируется (расщепляется). Более крупные и «сложные углеводы» получают путем соединения цепочек субъединиц глюкозы в дисахариды, трисахариды, полисахариды. Крахмал — это сложный углевод, который растения создают для хранения энергии, и является наиболее распространенным углеводом в рационе человека. Такие продукты, как картофель, кукуруза, рис и пшеница, богаты крахмалом.Животные снова расщепляют крахмалы на субъединицы глюкозы и превращают глюкозу в гликоген для хранения. Гликоген — это сложная запасная молекула, созданная из глюкозы с использованием инсулина. Диабетики, которым не хватает инсулина, не могут вырабатывать гликоген, поэтому они выделяют избыток сахара с мочой. Глюкоза расщепляется посредством процесса, называемого гликолизом (лизис означает расщепление), чтобы высвободить энергию, хранящуюся в углерод-углеродных связях.
Глюкоза (слева) и крахмал
Нуклеиновые кислоты
Эти молекулы содержат генетический код, в котором есть вся информация, необходимая для построения тела.Базовый единица называется нуклеотидом, который состоит из сахарно-фосфатного скелет прикреплен к одному из четырех азотистых оснований; цитозин, гуанин, аденин или тимин. C соединяется с G и G с C тремя водородными связями, обозначенными пунктирными линиями. A соединяется с T и T с A двумя водородными связями. Обратите внимание, что молекула ДНК, показанная ниже, является двухцепочечной, и что две цепи идут в противоположных направлениях, обозначенных концами 3 ‘и 5’. Хотя нуклеиновые кислоты важны как молекулы, несущие информацию, они не важны с точки зрения питания.
Нуклеотид ДНК и двойная спираль ДНК
Explainer: Пептиды против белков — в чем разница? — Институт молекулярной биологии
Если вы ищете разницу между пептидами и белками, краткий ответ — «размер».
И пептиды, и белки состоят из цепочек основных строительных блоков организма — аминокислот — и удерживаются вместе пептидными связями. В основном разница в том, что пептиды состоят из более мелких цепочек аминокислот, чем белки.
Но определение и то, как ученые используют каждый термин, немного расплывчато. Как правило, пептид содержит две или более аминокислот. И, чтобы немного усложнить задачу, вы часто будете слышать, как ученые называют полипептидов — цепочку из 10 или более аминокислот.
Доктор Марк Бласкович из Института молекулярной биологии (IMB) Университета Квинсленда в Австралии говорит, что примерно 50–100 аминокислот — это граница между пептидом и белком.Но большинство пептидов, обнаруженных в организме человека, намного короче — цепи примерно из 20 аминокислот.
Существует также важный вариант пептида, называемый циклотидом . Как и пептид и белок, циклотид также состоит из цепочки аминокислот, но в отличие от других концы циклотида соединены вместе, образуя круг.
Как мы обсудим ниже, эта структура важна при производстве терапевтических препаратов на основе пептидов.
Что касается белков, биохимики обычно оставляют термин для больших пептидных молекул, которые могут быть либо одной длинной цепью из 100 или более аминокислот — «сложным полипептидом», если хотите, — либо они могут состоять из нескольких соединенных цепочек аминокислот. все вместе.
Гемоглобин, содержащийся в красных кровяных тельцах и необходимый для переноса кислорода, является таким белком. Он состоит из четырех различных аминокислотных цепочек — двух по 141 аминокислоту в каждой и двух по 146 аминокислот в каждой.
Почему пептиды — это «следующая важная вещь» в медицинских исследованиях
Биохимики восхищены возможностями, которые предоставляют пептиды и белки в качестве фармацевтических препаратов, потому что они часто точно имитируют поведение естественного лиганда — вещества, которое взаимодействует с рецептором фермента или клетки, вызывая биологический процесс.
Это дает пептидным лекарствам возможность более точного нацеливания с меньшим количеством побочных эффектов, чем у низкомолекулярных лекарств.
В организме существует множество различных гормонов, которые вступают в реакцию с клетками и запускают различные биологические процессы. Часто это пептиды, либо циклические версии, либо прямые, линейные.
И затем вопрос о том, насколько быстро этот пептид распадается, что вызывает некоторые проблемы со стабильностью, но с точки зрения безопасности это может быть положительным моментом.
«Мы думаем, что пептиды — это будущее лекарств, потому что они более селективны, более эффективны и потенциально безопаснее, потому что, когда пептид в конечном итоге расщепляется, он просто распадается на аминокислоты, а аминокислоты — это, в основном, пища», — говорит профессор Дэвид. Крейк, который возглавляет Центр Клайва и Веры Рамачотти IMB по производству фармацевтических препаратов на растениях.
Есть также соображения производства, которые делают пептиды привлекательными — их длина позволяет им синтезировать химическим путем, в отличие от белков, которые обычно экспрессируются в клетках дрожжей или млекопитающих.
Итак, пептиды. Каковы применения белков?
Наиболее многообещающее применение белков — это антитела, которые сами по себе являются формой белка.
В частности, в противораковых применениях существует много антител либо в клинике, либо в стадии разработки.Двумя хорошо известными примерами являются Герцептин (трастузумаб) при раке груди и Хумира (адалимумаб) при ревматоидном артрите и других аутоиммунных заболеваниях.
Преимущество использования белков такое же, как и при применении пептидов в лекарствах: они имитируют что-то естественное в организме или заменяют то, что отсутствует или повреждено.
В случае антител белковые препараты используют ту же стратегию, что и организм, для нацеливания на объекты. Таким образом, лекарство может обеспечить требуемую специфичность, а также избежать нецелевых эффектов, которые могут иметь небольшие молекулы лекарства, вызывая тяжелые побочные эффекты.
Когда мы увидим новые препараты на основе пептидов?
Стабильность может быть проблемой, поскольку пептиды могут очень быстро разлагаться, а это означает, что может быть трудно дозировать пациенту пептид.
Согласно вашему организму, пептиды и белки — это в основном просто пища, что делает прием пептидных препаратов в пероральной форме довольно трудным, поскольку организм их быстро переваривает.
«Вот почему разработчики лекарств часто пытаются перейти от пептида и вместо этого имитировать его с помощью небольшой молекулы, потому что небольшая молекула потенциально имеет лучшие свойства для лекарства, где небольшая молекула остается в организме дольше и может вводиться перорально», — сказал доктор Бласкович.
Но задача состоит в том, чтобы заставить небольшую молекулу имитировать пептид.
«Фармацевтическая промышленность тратит на это миллиарды, — добавил д-р Бласкович. «Вот почему, если вы можете создавать лекарства, которые представляют собой пептиды, вместо того, чтобы превращать их в небольшие непептидные молекулы, это потенциально гораздо более быстрый способ разработать сильнодействующее, селективное и подходящее лекарство».
Фармацевтическая промышленность по-прежнему настроена скептически, в основном из-за проблем со стабильностью, но также из-за сложности получения перорально вводимых пептидов, которые преодолевают барьер кишечника и попадают в кровоток.
Но внутривенное и подкожное использование пептидов в качестве лекарств становится все более распространенным явлением. На рынке имеется около 60 одобренных FDA пептидных препаратов, около 140 пептидных препаратов проходят клинические испытания и более 500 находятся в стадии доклинических (до испытаний на людях) разработки.
Есть и сельскохозяйственные применения
Хотя стабильность пептидов является проблемой, которую необходимо преодолеть при использовании человеком, это палка о двух концах, которая может быть преимуществом в некоторых сельскохозяйственных целях. Скорость разложения пептидов, используемых в качестве инсектицидов или фунгицидов, означает, что они не сохранятся в окружающей среде.
Таким образом, повышение стабильности пептидов может работать в обоих направлениях.
Если можно настроить стабильность пептида, то можно сделать так, чтобы он сохранялся достаточно долго, чтобы воздействовать на урожай, но затем также и его разложение.
Это означает, что это не вызовет долгосрочных проблем с ДДТ, например, которые могут существовать сотни лет.
Почему эксперты так взволнованы пептидными препаратами?
Циклотиды — центральное направление работы Крейка — обладают большим потенциалом для решения проблем стабильности пептидных препаратов.
Поскольку они структурно образуют круг, циклотиды не имеют слабых концов — свободных концов, которые ускоряют разложение пищеварительными ферментами. Они дополнительно стабилизируются несколькими взаимосвязанными поперечными связями, образуя компактную, очень стабильную структуру. Это помогает им достичь своей цели в целости и сохранности, даже при пероральном приеме.
ГруппаБласкович работает над двумя многообещающими антибиотиками на основе пептидов для борьбы с растущей устойчивостью к антибиотикам.
Первым из них является усиление гликопептида (пептиды с молекулами сахара на них) антибиотика ванкомицина, пытаясь превратить его в суперванкомицин, более избирательно поражающий бактериальные клетки.Этот подход начинается с ванкомицина в качестве ядра с добавлением дополнительных групп для избирательного взаимодействия с бактериальной клеткой, а не с клеткой млекопитающего.
Цель состоит в том, чтобы повысить его эффективность в уничтожении бактерий и уменьшить нежелательные побочные эффекты, которые он оказывает на клетки человека.
Вторая исследовательская программа направлена на разработку антибиотиков, которые атакуют грамотрицательные бактерии, с которыми, как правило, бороться труднее. Эти пептиды представляют собой циклические липопептиды (пептиды с присоединенной жирной кислотой или липидом) с 8-10 аминокислотами.
Возможно, вы уже принимали пептидный препарат
Одним из самых известных препаратов на основе пептидов является эксенатид, который продается под названием Byetta. Он используется для контроля уровня сахара в крови у пациентов с диабетом 2 типа.
Он работает за счет увеличения выработки инсулина в ответ на прием пищи и представляет собой синтетическую форму пептида, содержащегося в яде чудовища Гила — вида ядовитых ящериц, обитающих в США и Мексике.
Это линейный пептид, содержащий 39 аминокислот, который был разработан около 10 лет назад и сейчас широко используется.
Что такое белок? Биолог объясняет
Примечание редактора: Натан Альгрен — доцент кафедры биологии в Университете Кларка. В этом интервью он подробно объясняет, что такое белки, как они производятся, а также широкий спектр функций, которые они выполняют в организме человека.
Натан Альгрен объясняет, что делают белки в нашем организме.Что такое белок?
Белок — это основная структура, которая встречается во всем живом.Это молекула. И главное в белке — это то, что он состоит из более мелких компонентов, называемых аминокислотами. Мне нравится думать о них как о бусинах разного цвета. Каждая бусина представляет собой аминокислоту, представляющую собой более мелкие молекулы, содержащие атомы углерода, кислорода, водорода и иногда атомы серы. Итак, белок — это, по сути, цепочка, состоящая из этих маленьких отдельных аминокислот. Есть 22 различных аминокислоты, которые вы можете комбинировать по-разному.
Белок обычно не существует в виде цепочки, но фактически сворачивается в определенную форму, в зависимости от порядка и того, как эти разные аминокислоты взаимодействуют друг с другом.Эта форма влияет на то, что белок делает в нашем организме.
Откуда берутся аминокислоты?
Аминокислоты в нашем организме поступают из пищи, которую мы едим. Мы также производим их в нашем теле. Например, другие животные производят белки, а мы их едим. Наше тело берет эту цепочку и разбивает ее на отдельные аминокислоты. Затем он может преобразовать их в любой белок, который нам нужен.
После того, как белки расщепляются на аминокислоты в пищеварительной системе, они попадают в наши клетки и как бы плавают внутри клетки, как эти маленькие отдельные шарики в нашей аналогии.А внутри клетки ваше тело в основном связывает их вместе, чтобы вырабатывать белки, необходимые вашему организму.
Примерно половину необходимых нам аминокислот мы можем производить самостоятельно, а остальные мы должны получать из пищи.
Что делают белки в нашем организме?
Ученые не совсем уверены, но большинство из них согласны с тем, что в нашем организме около 20 000 различных белков. Некоторые исследования предполагают, что их может быть даже больше. Они выполняют множество функций — от некоторых метаболических преобразований до удержания ваших клеток вместе и заставляя ваши мышцы работать.
Их функции делятся на несколько широких категорий. Один структурный. Ваше тело состоит из множества различных структур — представьте себе струнные структуры, шарики, якоря и т. Д. Они образуют материал, который скрепляет ваше тело. Коллаген — это белок, который придает структуру вашей коже, костям и даже зубам. Интегрин — это белок, который обеспечивает гибкие связи между вашими клетками. Ваши волосы и ногти состоят из протеина, называемого кератином.
Еще одна важная роль, которую они берут на себя, — это биохимия — то, как ваше тело выполняет определенные реакции в вашей клетке, такие как расщепление жиров или аминокислот.Помните, я сказал, что наше тело расщепляет белок из пищи, которую мы едим? Даже эту функцию выполняют такие белки, как пепсин. Другой пример — гемоглобин — белок, переносящий кислород в крови. Итак, они проводят эти особые химические реакции внутри вас.
Белки также могут обрабатывать сигналы и информацию, например белки циркадных часов, которые отслеживают время в наших клетках, но это несколько основных категорий функций, которые белки выполняют в клетке.
Почему белок часто ассоциируется с мышцами и мясом?
Разные продукты имеют разное содержание белка. В таких растениях, как пшеница и рис, много углеводов, но они менее богаты белком. Но в мясе вообще больше белка. Для создания мышц вашего тела требуется много белка. Вот почему белок часто ассоциируется с употреблением мяса и наращиванием мышечной массы, но на самом деле белки участвуют в гораздо большем, чем это.
[ Получайте удовольствие от разговора каждые выходные. Подпишитесь на нашу еженедельную рассылку.]
аминокислот — Classroom Partners
Знайте, что такое аминокислота. Знайте, сколько там аминокислот.
Знайте, что разные белки имеют разные аминокислоты (например, яичный альбумин — один из немногих «полных» белков).
Привет всем, сегодня мы собираемся узнать о строительных блоках, структурах и ролях белков.Особое внимание уделяется аминокислотам.
Белки являются одними из самых распространенных органических молекул в живых системах и гораздо более разнообразны по структуре и функциям, чем другие классы макромолекул. Одна клетка может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Хотя их структуры, как и их функции, сильно различаются, все белки состоят из одной или нескольких цепочек аминокислот.
(потяните цифру аминокислот ниже)
Аминокислоты — это мономеры, из которых состоят белки.Белок состоит из одной или нескольких линейных цепочек аминокислот, каждая из которых называется полипептидом. В белках обычно встречаются 20 типов аминокислот.
Мы вернемся к аминокислотам и полипептидам, я просто хотел, чтобы вы на секунду задумались о них и узнали, что их 20 обычно встречаются.
Сейчас мы быстро перейдем к ферментам и гормонам,
Ферменты действуют как катализаторы биохимических реакций, то есть ускоряют их.Каждый фермент распознает один или несколько субстратов, молекул, которые служат исходным материалом для реакции, которую он катализирует. Различные ферменты участвуют в разных типах реакций и могут разрушать, связывать или перестраивать свои субстраты.
Одним из примеров фермента, обнаруженного в вашем организме, является амилаза слюны, которая расщепляет амилозу (разновидность крахмала) на более мелкие сахара. Амилоза не очень сладкая, поэтому крахмалистые продукты часто становятся слаще, если пережевывать их дольше: вы даете амилазе слюны время, чтобы приступить к работе.
Еще один пример фермента — лактаза. Люди с непереносимостью молочных продуктов или лактозы не могут переваривать лактозу, потому что их организм не вырабатывает фермент, лактазу. — Примечание. Если у вас есть эта проблема, есть безрецептурные добавки, которые можно принимать перед употреблением молочных продуктов с добавлением лактазы, что позволяет употреблять молочные продукты без побочных эффектов.
Теперь перейдем к гормонам. Гормоны — это химические сигналы на дальние расстояния, посылаемые эндокринными клетками (например, клетками гипофиза).Они контролируют определенные физиологические процессы, такие как рост, развитие, обмен веществ и размножение. В то время как некоторые гормоны основаны на стероидах, другие представляют собой белки, обычно называемые пептидными гормонами.
Например, инсулин — важный пептидный гормон, который помогает регулировать уровень глюкозы в крови. Когда уровень глюкозы в крови повышается (например, после еды), специализированные клетки поджелудочной железы выделяют инсулин. Инсулин связывается с клетками печени и других частей тела, заставляя их поглощать глюкозу.Этот процесс помогает вернуть сахар в крови к его нормальному уровню покоя.
Форма белка имеет решающее значение для его функции, многие различные типы химических связей могут быть важны для поддержания этой формы. Изменения температуры и pH, а также присутствие определенных химикатов могут нарушить форму белка и привести к потере его функциональности — процесс, известный как денатурация.
Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).Возвращаясь к аминокислотам, когда вы смотрите на этот рисунок, знайте, что это основная структура аминокислоты, состоящая из центрального атома углерода, также известного как альфа (α) углерод, связанного с аминогруппой (Nh3), карбоксильная группа (COOH), а также атом водорода.
На самом деле это не то состояние, в котором обычно находится аминокислота. При физиологическом pH, который составляет (7,2-7,4), аминогруппа обычно протонирована и несет положительный заряд, в то время как карбоксильная группа обычно депротонирована и несет отрицательный заряд.Каждая аминокислота имеет другой атом или группу атомов, связанных с центральным атомом, известную как R-группа. Это определяет идентичность аминокислоты.
(вот цифра, на которую можно быстро взглянуть, чтобы вспомнить пронацию и депротонацию)
Difference Between Protonation and Deprotonation
Одним из примеров аминокислоты является то, что если группа R представляет собой атом водорода, тогда аминокислота представляет собой глицин, а если это метильная группа (Ch4), аминокислота представляет собой аланин.В этой таблице показаны 20 распространенных аминокислот.
21 протеиногенная α-аминокислота, обнаруженная у эукариот, сгруппированная в соответствии со значениями pKa их боковых цепей и зарядами, переносимыми при физиологическом pH (7,4)Свойства боковой цепи определяют химическое поведение аминокислоты (то есть, считается ли она кислотной, основной, полярной или неполярной). Например, аминокислоты, такие как валин и лейцин, неполярны и гидрофобны, тогда как аминокислоты, такие как серин и глутамин, имеют гидрофильные боковые цепи и полярны.Некоторые аминокислоты, такие как лизин и аргинин, имеют боковые цепи, которые имеют положительный заряд при физиологическом pH и считаются основными аминокислотами. С другой стороны, аспартат и глутамат имеют отрицательный заряд при физиологическом pH и считаются кислотными.
Теперь мы переходим к пептидным облигациям. Каждый белок в ваших клетках состоит из одной или нескольких полипептидных цепей. Каждая из этих полипептидных цепей состоит из аминокислот, связанных вместе в определенном порядке. Полипептид — это что-то вроде длинного слова, которое само по себе «записано» аминокислотными буквами.Химические свойства и порядок аминокислот являются ключевыми в определении структуры и функции полипептида и белка, частью которого он является. Но как на самом деле аминокислоты связаны в цепи, спросите вы? -Хан / добавлено слов
Аминокислоты полипептида связаны со своими соседями ковалентными связями, известными как пептидные связи. Каждая связь образуется в реакции дегидратационного синтеза или (конденсации). Во время синтеза белка, о котором пойдет речь в другой лекции, карбоксильная группа аминокислоты на конце растущей полипептидной цепи вступает в реакцию с аминогруппой входящей аминокислоты, высвобождая молекулу воды.
