Аминовен инструкция по применению: показания, противопоказания, побочное действие – описание Aminoven р-р д/инф. 15%: фл. 500 мл 10 шт. с держателями пластиковыми или без них (12829)
Следует контролировать уровень электролитов, баланс жидкости и функции почек.
В случае гипокалиемии и/или гипонатремии следует одновременно вводить достаточные количества калия и/или натрия.
Введение любых растворов аминокислот может спровоцировать острый дефицит фолатов, поэтому больным следует ежедневно вводить фолиевую кислоту.
Следует проявлять осторожность при инфузии больших объемов жидкости больным с сердечной недостаточностью.
Любая инфузия в периферическую вену может вызвать раздражение стенки сосуда и тромбофлебит. Поэтому рекомендуется ежедневно осматривать место установки катетера. Если больному также назначено введение жировой эмульсии, то ее следует вводить по возможности одновременно с Аминовеном для снижения риска развития флебита.
Выбор места установки катетера (центральная или периферическая вена) определяется конечной осмолярностью смеси — для инфузии в периферическую вену предел осмолярности составляет 800-900 мосмоль/л.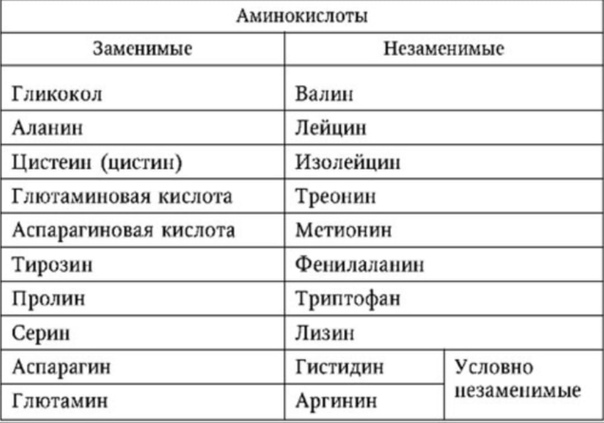
Следует строго соблюдать правила асептики, особенно при установке катетера в центральную вену.
Инструкция по применению
Использовать сразу после вскрытия флакона. Только для однократного применения. Не используйте препарат с истекшим сроком годности. Используйте только прозрачный, не содержащий частиц раствор из неповрежденного контейнера. Весь неиспользованный остаток раствора во флаконе и всю смесь, оставшуюся после инфузии следует уничтожить.
Использование в педиатрии
Клинических исследований применения Аминовена у новорожденных, грудных детей и детей до 2 лет не проводилось, поэтому Аминовен не следует назначать пациентам данных возрастных групп. Для парентерального питания новорожденных, грудных детей и детей до 2-х лет следует использовать адаптированные детские препараты аминокислот, состав которых специально разработан для удовлетворения метаболических потребностей детей (Аминовен Инфант).
Не рекомендуется назначать Аминовен 15% у детей (до 18 лет) из-за отсутствия достаточного опыта клинического применения у данной возрастной группы.
Скрининг новорождённых. «ПЯТОЧКА» (анализ спектра аминокислот и ацилкарнитинов)
Метод определенияТандемная масс-спектрометрия с ионизацией в электроспрее.
Исследуемый материал Капиллярная кровь, собранная на специальную карточку-фильтр №903
Доступен выезд на дом
Что такое нарушения метаболизма? Наследственные нарушения метаболизма или по-другому обмена веществ — это около 500 различных заболеваний, которые обусловлены нарушением работы особых биохимических катализаторов – ферментов. Ферменты обеспечивают процессы расщепления аминокислот, органических кислот, жирных кислот и других биомолекул. Многие ошибочно считают, что поскольку заболевания этой группы встречаются крайне редко, то и исключать их нужно в последнюю очередь. Однако по данным литературы*, наследственными нарушениями метаболизма страдает один из 3000 новорождённых!
Ферменты обеспечивают процессы расщепления аминокислот, органических кислот, жирных кислот и других биомолекул. Многие ошибочно считают, что поскольку заболевания этой группы встречаются крайне редко, то и исключать их нужно в последнюю очередь. Однако по данным литературы*, наследственными нарушениями метаболизма страдает один из 3000 новорождённых!
 Этот метод позволяет определить в небольшом количестве биологического материала (капля высушенной крови) около 40 различных соединений, что позволяет с определённой вероятностью заподозрить наследственное заболевание. В некоторых странах этим методом проводится обследование всех новорождённых на 10-30 наследственных нарушений метаболизма. Другими словами, все новорождённые подвергаются специальному биохимическому исследованию называемому скрининг. * Vilarinho L, Rocha H, Sousa C, Marcão A, Fonseca H, Bogas M, Osório RV. Four years of expanded newborn screening in Portugal with tandem mass spectrometry. J Inherit Metab Dis. 2010 Feb 23 ** Olpin SE The metabolic investigation of sudden infant death. Ann Clin Biochem, 2004, Jul 41 (Pt4), 282-293 **Opdal SH, Rognum TO The sudden Infant Death Syndrome Gene: Does It Exist? Pediatrics, 2004, V.114, N.4, pp. e506-e512 Что такое скрининг? Скрининг (от англ. Screening – просеивание) — это массовое обследование пациентов для выявления различных заболеваний, ранняя диагностика которых позволяет предотвратить развитие тяжёлых осложнений и инвалидности.
Этот метод позволяет определить в небольшом количестве биологического материала (капля высушенной крови) около 40 различных соединений, что позволяет с определённой вероятностью заподозрить наследственное заболевание. В некоторых странах этим методом проводится обследование всех новорождённых на 10-30 наследственных нарушений метаболизма. Другими словами, все новорождённые подвергаются специальному биохимическому исследованию называемому скрининг. * Vilarinho L, Rocha H, Sousa C, Marcão A, Fonseca H, Bogas M, Osório RV. Four years of expanded newborn screening in Portugal with tandem mass spectrometry. J Inherit Metab Dis. 2010 Feb 23 ** Olpin SE The metabolic investigation of sudden infant death. Ann Clin Biochem, 2004, Jul 41 (Pt4), 282-293 **Opdal SH, Rognum TO The sudden Infant Death Syndrome Gene: Does It Exist? Pediatrics, 2004, V.114, N.4, pp. e506-e512 Что такое скрининг? Скрининг (от англ. Screening – просеивание) — это массовое обследование пациентов для выявления различных заболеваний, ранняя диагностика которых позволяет предотвратить развитие тяжёлых осложнений и инвалидности.
На какие заболевания можно обследовать ребёнка дополнительно? Скрининга новорождённых, направленного на диагностику нарушений метаболизма методом ТМС, в России на настоящий момент не проводится. В России это исследование пока проводится по назначению врача при наличии подозрений на наследственные болезни обмена веществ, хотя многие из заболеваний этой группы проявляют себя не сразу после рождения, но при этом уже есть у новорождённого.
 Их клинические проявления схожи с проявлениями аминоацидопатий. Лечение заключается в назначении специальной диеты и/или витаминов. К сожалению, некоторые заболевания из этой группы не поддаются лечению. Дефекты ß-окисления жирных кислот ß-окисление жирных кислот – многоступенчатый процесс их расщепления, в результате которого образуется энергия, необходимая для жизнедеятельности клетки. Каждый шаг процесса окисления производится под действием специфических ферментов. При отсутствии одного из ферментов процесс нарушается. Симптомы: сонливость, кома, рвота, низкий уровень сахара в крови, поражение печени, сердца, мышц. Лечение заключается в назначении низкожировой диеты с частым и дробным кормлением, других специализированных диетических продуктов, а также, левокарнитина. Полный перечень выявляемых наследственных болезней обмена веществ
Их клинические проявления схожи с проявлениями аминоацидопатий. Лечение заключается в назначении специальной диеты и/или витаминов. К сожалению, некоторые заболевания из этой группы не поддаются лечению. Дефекты ß-окисления жирных кислот ß-окисление жирных кислот – многоступенчатый процесс их расщепления, в результате которого образуется энергия, необходимая для жизнедеятельности клетки. Каждый шаг процесса окисления производится под действием специфических ферментов. При отсутствии одного из ферментов процесс нарушается. Симптомы: сонливость, кома, рвота, низкий уровень сахара в крови, поражение печени, сердца, мышц. Лечение заключается в назначении низкожировой диеты с частым и дробным кормлением, других специализированных диетических продуктов, а также, левокарнитина. Полный перечень выявляемых наследственных болезней обмена веществ- Болезнь с запахом кленового сиропа мочи (лейциноз).
- Цитрулинемия тип 1, неонатальная цитрулинемия.
- Аргининосукциновая ацидурия (АСА)/ недостаточность аргининосукцинат лиазы лиазы.

- Недостаточность орнитин транскарбамилазы.
- Недостаточность карбамилфосфат синтазы.
- Недостаточность N-ацетилглютамат синтазы.
- Некетотическая гиперглицинемия.
- Тирозинемия тип 1.
- Тирозинемия тип 2.
- Гомоцистинурия/недостаточность цистатионин бета-синтетазы.
- Фенилкетонурия.
- Аргининемия/недостаточность аргиназы.
- Пропионовая ацидемия (недостаточность пропионил КоА карбоксилазы).
- Метилмалоновая ацидемия.
- Изовалериановая ацидемия (недостаточность изовалерил КоА дегидрогеназы).
- Недостаточность 2-метилбутирил КоА дегидрогеназы.
- Недостаточность изобутирил КоА дегидрогеназы.
- Глутаровая ацидемия тип 1 (недостаточность глутарил КоА дегидрогеназы тип 1).
- Недостаточность 3-метилкротонил КоА карбоксилазы.
- Множественная карбоксилазная недостаточность.
- Недостаточность биотинидазы.
- Малоновая ацидемия (недостаточность малонил КоА декарбоксилазы).

- Недостаточность митохондриальной ацетоацетил КоА тиолазы.
- Недостаточность 2-метил-3-гидроксибутирил КоА дегидрогеназы.
- Недостаточность 3-гидрокси-3-метилглутарил КоА лиазы.
- Недостаточность 3-метилглутаконил КоА гидратазы.
- Недостаточность среднецепочечной ацил-КоА дегидрогеназы.
- Недостаточность очень длинноцепочечной ацил-КоА дегидрогеназы.
- Недостаточность короткоцепочечной ацил-КоА дегидрогеназы.
- Недостаточность длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы (дефект трифункционального белка).
- Глутаровая ацидемия тип II (недостаточность глутарил КоА дегидрогеназы тип II), множественная недостаточность ацил-КоА дегидрогеназ.
- Нарушение транспорта карнитина.
- Недостаточность карнитин палмитоил трансферазы тип I.
- Недостаточность карнитин палмитоил трансферазы тип II.
- Недостаточность карнитин/ацилкарнитин транслоказы.
- Недостаточность 2,4-диеноил КоА редуктазы.
- Недостаточность среднецепочечной 3-кетоацил-КоА тиолазы.

- Недостаточность средне-/короткоцепочечной ацил-КоА дегидрогеназы.
Материал для исследования: капиллярная кровь, собранная на специальную карточку-фильтр №903.
источник незаменимых аминокислот, полезные свойства овса и овсяных продуктов.
Белки условно можно разделить на белки животного происхождения и на получаемые из растительной пищи.
Наличие источников таких аминокислот в рационе критично важно: их дефицит нарушает синтез белков и может привести к серьезным последствиям — ослаблению функций памяти, снижению иммунитета, нарушению кроветворения и другим.
Белки условно можно разделить на белки животного происхождения и на получаемые из растительной пищи. Белки животного происхождения, которые мы получаем при употреблении в пищу таких продуктов как молоко, куриное яйцо и мясо, универсальны и содержат все необходимые для организма аминокислоты. Например, молочный белок почти полностью (на 98%) усваивается организмом: разумеется, если нет аллергии на белок коровьего молока. Однако поступление незаменимых аминокислот можно обеспечить и при помощи растительного белка — сочетая его различные источники. В этом отношении одним из самых ценных продуктов, как для людей, которые по той или иной причине избегают потребления в пищу белков животного происхождения, так и тех, кто предпочитает комбинированное использование растительных и животных белков, является овёс.
Однако поступление незаменимых аминокислот можно обеспечить и при помощи растительного белка — сочетая его различные источники. В этом отношении одним из самых ценных продуктов, как для людей, которые по той или иной причине избегают потребления в пищу белков животного происхождения, так и тех, кто предпочитает комбинированное использование растительных и животных белков, является овёс.
37% аминокислот в овсяном белке являются незаменимыми — это больше, чем, например, в пшеничном или гороховом белке. Овёс богат серосодержащими аминокислотами, а также лейцином, необходимым для поддержания мышечного здоровья — именно эта аминокислота помогает восстанавливать мышцы после активного занятия спортом. При этом овсяный белок по степени усвоения человеческим организмом почти близок к молочному: усваивается более чем на 90 %. Также это прекрасный источник клетчатки, поэтому овёс часто является неотъемлемой частью диеты по контролю аппетита и снижению массы тела. Овёс богат не только ценными растительными белками.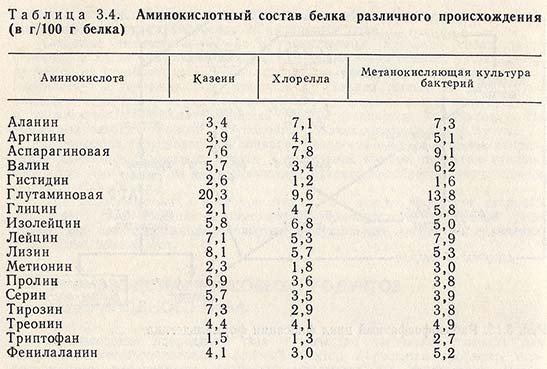 Являясь полноценным источником энергии, он отличается оптимальным содержанием витаминов В1, В2, Е, а также калия, кальция, фосфора, железа и магния.
Являясь полноценным источником энергии, он отличается оптимальным содержанием витаминов В1, В2, Е, а также калия, кальция, фосфора, железа и магния.
Valio Oddlygood — напитки, произведенные из овса, представляют собой пример источника растительного протеина и, как следствие, незаменимых аминокислот.
При отказе от белков животного происхождения диетологи рекомендуют сочетать в рационе овсяный и гороховый белки — таким образом можно добиться оптимального соотношения аминокислот.
Гороховый белок — на 42% состоит из незаменимых аминокислот, в том числе это источник аминокислоты лизина, содержание которой лимитировано в овсе. Взаимодополняющий аминокислотный состав делают овсяный и гороховый белки незаменимыми в питании спортсменов, пожилых людей, в детском питании, в питании людей, придерживающихся веганского или вегетарианского типов питания.
Оптимальное содержание (сложных) медленных углеводов, умеренное количество жиров, высокое содержание витаминов и микроэлементов, низкая калорийность делают Valio Oddlygood также прекрасным напитком для восстановления сил после тренировки для закрытия «белково-углеводного окна».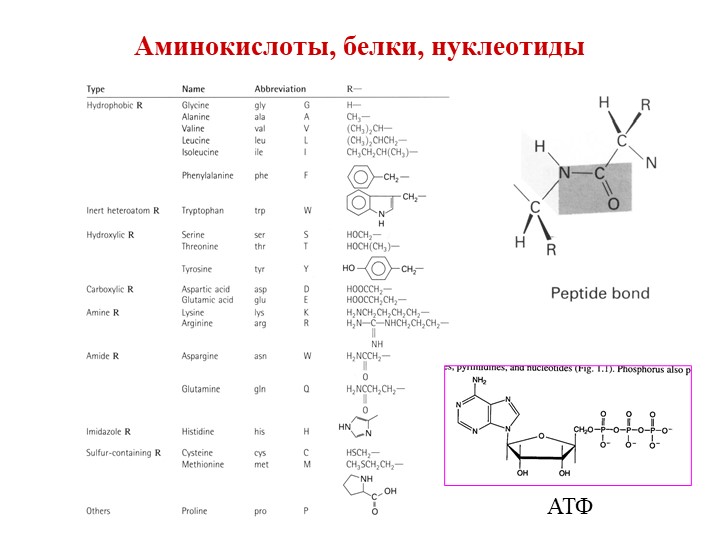
Состав Oddlygood можно найти здесь.
Смесь Nutrilon Аминокислоты Syneo 400г c 0месяцев
Специализированный продукт детского диетического лечебного питания для детей раннего возраста – сухая смесь на основе аминокислот c бифидобактериями и пищевыми волокнами «Syneo» («Синео») — «Nutrilon» 0-12 месяцев Аминокислоты
Состав: сухой сироп глюкозы, рафинированные растительные масла (кокосовое масло (источник среднецепочечных триглицеридов), пальмовое масло (источник среднецепочечных триглицеридов), высокоолеиновое подсолнечное масло, рапсовое масло, подсолнечное масло), пищевые волокна (олигофруктоза, инулин), L-аргинина L-аспартат, L-лейцин, L-лизина ацетат, L-глутамин, L-пролин, L-валин, эмульгатор (Е472с), L-изолейцин, глицин, L-треонин, дикалий гидрофосфат, L-фенилаланин, L-тирозин, L-серин, L-гистидин, L-аланин, кальция фосфат двухосновный, трикалий цитрат, натрия хлорид, кальция карбонат, холина битартрат, L-цистин, кальция глицерофосфат, L-триптофан, кальция цитрат, магния хлорид, L-метионин, масло из Crypthecodinium cohnii, кальция фосфат трехосновный, масло из Mortierella alpina, магния L-аспартат, инозитол, L-аскорбиновая кислота, антиокислители (лецитины (подсолнечный), аскорбилпальмитат), таурин, бифидобактерии Bifidobacterium breve M-16V, железа сульфат, цинка сульфат, L-карнитин, DL-α-токоферола ацетат, уридина 5’-монофосфат натриевая соль, цитидина 5’-монофосфат, никотинамид, D-пантотенат кальция, инозина 5’-монофосфат натриевая соль, аденозина 5’-монофосфат, гуанозина 5’-монофосфат натриевая соль, меди сульфат, тиамина мононитрат, рибофлавин, пиридоксин гидрохлорид, ретинола ацетат, калия йодид, марганца сульфат, фолиевая кислота, фитоменадион, натрия селенит, хрома хлорид, натрия молибдат, D-биотин, холекальциферол, цианокобаламин.
Содержание бифидобактерий Bifidobacterium breve M-16V – 1х1010 КОЕ/100 г.
Способы приготовления:
- Тщательно вымойте руки и подготовьте зону для приготовления смеси. Простерилизуйте бутылочку и соску.
- Вскипятите воду в течение 5 минут или до выключения электрического чайника, влейте необходимое количество воды в простерилизованную бутылку, закройте бутылочку крышкой и дайте воде остыть в течение минимум 30 минут. Проверьте температуру воды, капнув несколько капель на запястье.
- Наполните прилагаемую мерную ложку сухой смесью. Снимите горку сухой смеси тыльной стороной сухого чистого ножа. Не спрессовывайте сухую смесь в ложке. Используйте только прилагаемую мерную ложку.
- Добавьте необходимое количество ложек сухой смеси в воду. Закройте бутылочку крышкой и встряхните до полного растворения смеси.
- Перед применением проверьте температуру готовой смеси на внутренней стороне запястья (37 °С), капнув несколько капель на запястье.

- Остатки готовой смеси подлежат утилизации через час после приготовления. Повторное подогревание смеси запрещено.
Внимание! Сухая смесь не является стерильной. Разведение сухой смеси должно происходить непосредственно перед применением. Запрещено кипятить либо нагревать в микроволновой печи приготовленную смесь, а также воду для приготовления смеси. Некорректное приготовление и нагревание смеси может снизить активность и пользу бифидобактерий Bifidobacterium breve M-16V.
Срок годности, дни: 548.
Условия хранения: хранить в сухом месте при температуре от 5 °C до 25 °C (не в холодильнике). После использования всегда закрывайте банку крышкой. Используйте содержимое открытой упаковки в течение 2 недель. Упаковано в защитной сфере.
ЛизиДЖЕМ — лизин для здоровья молочных коров
Лизин — незаменимое питательное вещество
Незаменимые аминокислоты, такие как лизин и метионин, нужны молочным коровам для синтеза молочного и мышечного белка и белков, необходимых для развития плода. Без обеспечения достаточного количества основных аминокислот очень трудно осуществить цели в области питания. Лизин считается одной из основных лимитирующих аминокислот, необходимых для оптимальной продуктивности животных.
Без обеспечения достаточного количества основных аминокислот очень трудно осуществить цели в области питания. Лизин считается одной из основных лимитирующих аминокислот, необходимых для оптимальной продуктивности животных.
ЛизиДЖЕМ — это кормовая добавка защищенного от разрушения в рубце лизина, представляющая собой экономически эффективное решение для обеспечения сбалансированного содержания аминокислот в рационе молочных коров. ЛизиДЖЕМ, способный проходить через рубец баз разрушения, является источником такого количества биодоступного и усвояемого лизина, которое требуется жвачным животным.
Особенности:
- Источник биодоступного кормового лизина для молочных коров
- Высококонцентрированный продукт
- Сыпучий продукт, устойчивый к физическим повреждениям, обычно сопровождающим процессы обработки, смешивания и гранулирования корма
Почему баланс аминокислот в рационе молочных коров так важен?
Все больше молочных ферм уделяют внимание задаче балансирования аминокислот (АК) в рационе молочных коров. Рост интереса к балансированию АК обусловлен стремлением сократить содержание белка в рационе, высокими ценами на белковые добавки, а также постоянным улучшением и усовершенствованием пищевых моделей.
Рост интереса к балансированию АК обусловлен стремлением сократить содержание белка в рационе, высокими ценами на белковые добавки, а также постоянным улучшением и усовершенствованием пищевых моделей.
SmartMILK (программа СмартМИЛК): Балансирование АК при помощи инкапсулированного лизина способствует повышению молочного надоя, уровней компонентов молока и прибыльности стада молочных предприятий.
Лимитирующие аминокислоты (АК)
В организме жвачных животных наличие АК обеспечивается синтезирующимся в рубце микробиологическим белком, не расщепляемым в рубце белком (НРБ) и в меньшей степени эндогенным белком. Большая часть аминокислот, как правило, обеспечивается микробиологическим белком. Однако НРБ может предоставить более 50% усвояемых аминокислот в организме высокопродуктивных коров, которые получают высококонцентрированный корм. Количество аминокислот, полученных в результате выделения эндогенного белка, ниже; считается, что на него приходится менее 10% общего количества усвояемых аминокислот (NRC (Совет по пищевым нормам), 2001 и H. Lapierre, личная переписка).
Lapierre, личная переписка).
Эффективность использования усвояемого белка напрямую зависит от аминокислотного состава корма. При недостатке одной АК невозможно использование другой АК, следовательно, будет отмечаться избыток последней. В результате, они будут разрушены, что повысит азотную нагрузку на организм молочных коров и отрицательно скажется на производительности животных и окружающей среде.
Незаменимое питательное вещество лизин
Аминокислоты нужны молочным коровам для синтеза молочного и мышечного белка, белков, необходимых для развития плода, а также белков для поддержания собственной жизнедеятельности (например, энзимов для переваривания корма). Поэтому в зависимости от этапа лактации коровы, ее развития и периода беременности организму животного будет требоваться разное количество каждой незаменимой аминокислоты. Без обеспечения достаточного количества основных аминокислот, таких как лизин и метионин, очень трудно осуществить цели в области питания.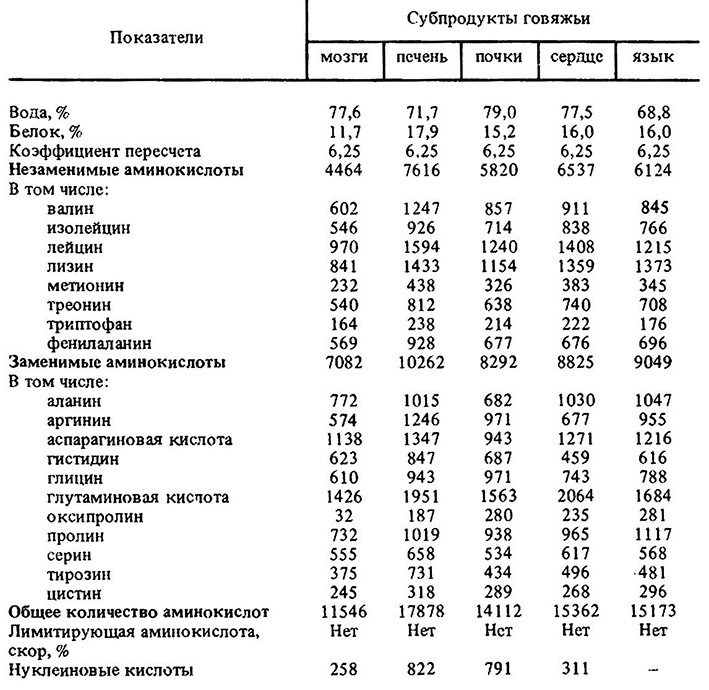 Кроме того, это признак возможного нарушения синтеза в организме других важных белков (рисунок 1).
Кроме того, это признак возможного нарушения синтеза в организме других важных белков (рисунок 1).
Рисунок 1. Основные белки, присутствующие в организме животного
Нехватка лизина в рационе
Метионин и лизин чаще всего называют в качестве двух наиболее лимитирующих аминокислот для лактирующих молочных коров, основу рациона которых составляет кукуруза (NRC, 2001). Эта информация была подтверждена в результате исследования, проведенного после публикации заключения NRC (2011). Метионин и лизин являются первыми двумя лимитирующими аминокислотами в большинстве примеров рационов, что не удивительно, учитывая их низкое содержание в белке большинства кормов по сравнению с их концентрацией в бактериях рубца, молоке и белке тканей (график 1).
График 1. Сравнительное содержание лизина и метионина в сыром белке в нежировой ткани, молоке, бактериях рубца и наиболее распространенных кормовых продуктах (NRC, 2001).
*Некоторые утверждения могут не распространяться на все географические регионы. Маркировка продукции и связанные с ней требования могут отличаться в зависимости от государственных требований
Ученые обнаружили у COVID способность маскировать белки под человеческие — РБК
Кроме того, «маскирующиеся» под человеческие белки могут объяснять высокую частоту аутоиммунных реакций у заразившихся, когда иммунная система начинает воспринимать собственные ткани как чужеродные и повреждать их.
К такому выводу ученые пришли, когда обнаружили восемь участков, идентичных человеческим, в малом оболочечном (E) белке коронавируса. Там также нашли последовательности, совпадающие с белками кишечных бактерий и нескольких видов злаковых сельскохозяйственных растений. Эти участки коронавирус мог приобрести не только от организма хозяина, но и от его кишечной микробиоты.
Читайте на РБК Pro
VideoПоследовательности в E-белке коронавирус вряд ли может использовать для «маскировки» от иммунитета, считают ученые.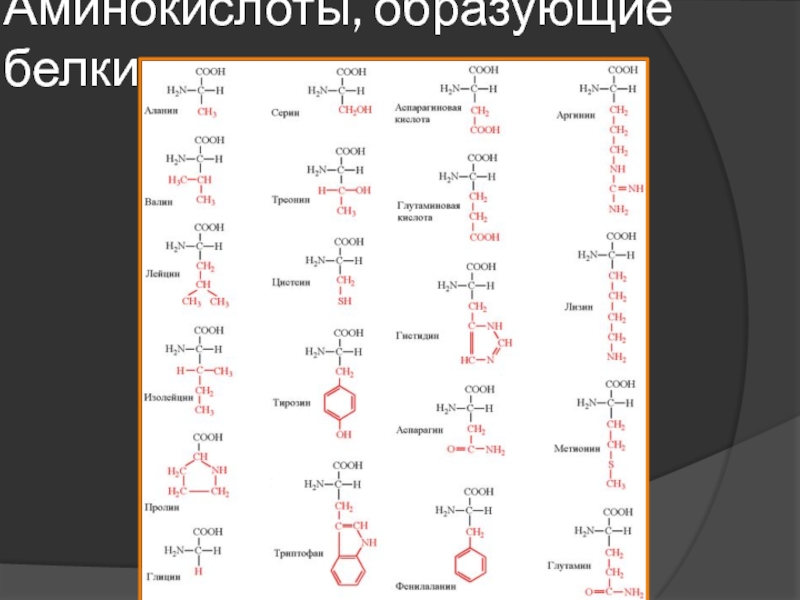 Однако именно участки малого мембранного и некоторых других белков могут провоцировать аутоиммунную реакцию, поскольку защитная система организма атакует не только их, но и аналогичные последовательности в собственных белках, полагают исследователи.
Однако именно участки малого мембранного и некоторых других белков могут провоцировать аутоиммунную реакцию, поскольку защитная система организма атакует не только их, но и аналогичные последовательности в собственных белках, полагают исследователи.
По словам ученых, полученные данные можно использовать при разработке вакцин. Чтобы снизить вероятность аутоиммунных процессов, желательно, чтобы препараты приводили к формированию антител против участков вирусных белков, наименее похожих на человеческие, сказал Марьянович.
Сам механизм заражения коронавирусом ученые раскрыли в августе прошлого года. Вирус прикрепляется к клетке с помощью своих «шипов» и сливается с ее мембраной, чтобы проникнуть внутрь, выяснили исследователи из Европейской лаборатории молекулярной биологии (EMBL) в Гейдельберге, Института биофизики Макса Планка, Института Пауля Эрлиха и Франкфуртского университета Гете.
По оценке ученых, на поверхности одного коронавируса может находиться до 40 таких «шипов».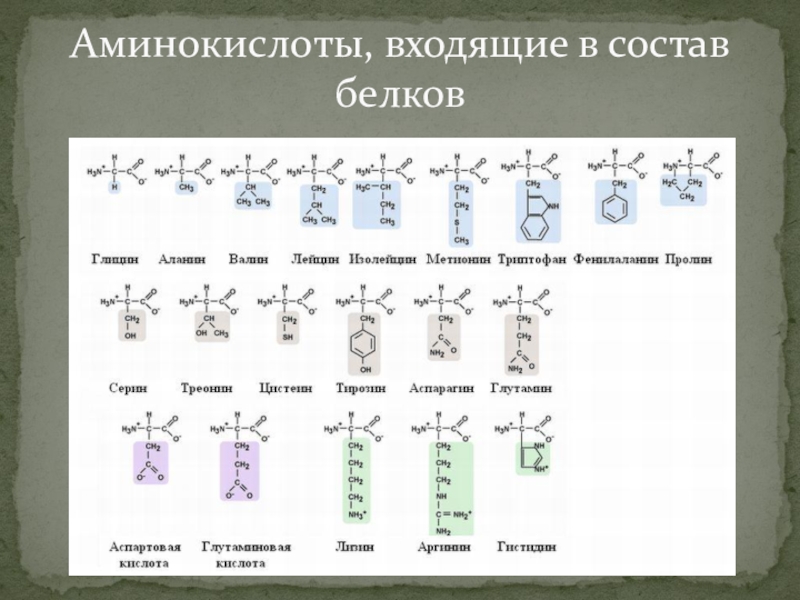 Кроме того, они покрыты молекулами гликанов (полисахаридов), образующих защитную оболочку, которая скрывает «шипы» от антител, выяснили ученые.
Кроме того, они покрыты молекулами гликанов (полисахаридов), образующих защитную оболочку, которая скрывает «шипы» от антител, выяснили ученые.
Диагностика фенилкетонурии — сдать анализ в СЗЦДМ
Фенилкетонурия (ФКУ) ― наследственное нарушение метаболизма аминокислот, в первую очередь фенилаланина (ФА), входящего в состав белков. Вещество участвует в укладке белка и стабилизации белковых структур.
Первые симптомы: частое срыгивание, рвота, экземы, судороги, исходящий от мочи и кожи запах плесени. Ребенок может был вялым либо, наоборот, гиперактивным. Отстает в психомоторном развитии, наблюдаются признаки олигофрении. Диагноз может быть поставлен в родильном доме. Все дети с фенилкетонурией безусловно получают статус «ребенок-инвалид».
Лечение заболевания заключено в соблюдении специальной низкобелковой диете, не содержащей продукты с ФА.
Фенилкетонурия ― это врожденная, генетическая патология, подразумевающая нарушения гидроксилирования фенилаланина. Характеризуется накоплением в организме аминокислоты и продуктов ее метаболизма, что ведет к тяжелым поражениям центральной нервной системы. Впервые заболевание было описано норвежским врачом И. А. Феллингом в 1934 году.
Изучая болезнь специалисты установили, что за наличие болезни отвечает единственный ген фенилаланингидроксилазы. Первое успешное лечение было разработано и проведено в 1950 году в Англии.
В неонатальном периоде клиника отсутствует. Патология проявляется в первые полгода жизни ребенка. В дальнейшем накопление вещества приводит к тяжелым нарушениям развития. Поэтому крайне важно сразу после рождения выявить дефект и не допустить употребление продуктов, содержащих фенилаланин. Более позднее соблюдение диеты не устранит полученные нарушения, но не допустит развития новых.
Более позднее соблюдение диеты не устранит полученные нарушения, но не допустит развития новых.
Патология одинаково часто встречается среди лиц обоих полов. Расовых особенностей не выявлено. Большое количество больных в таких странах как Китай, Турция, Ирландия. В среднем по России с фенилкетонурией рождается каждый 7-ми тысячный ребенок.
Существует три типа генетического отклонения, первый считается классическим, поскольку диагностируется в более чем 90% случаев. Второй и третий ― более редкая форма патологии. Симптоматика схожа во всех типах, заболевание приводит к умственной отсталости. При классической форме фенилкетонурии избежать этого можно диетотерапией, но атипичные варианты, к сожалению, коррекции не подлежат.
-
Классическая фенилкетонурия (I тип) ― это низкая выработка фенилаланингидроксилазы (ФАГ), что приводит к собиранию в естественных жидкостях организма фенилаланина и продуктов его расщепления.
 Патология вызвана мутированным геном РАН.
Патология вызвана мутированным геном РАН.
-
Фенилкетонурия II типа ― недостаток дигидроптеридинредуктазы, что препятствует преобразованию фенилаланина в тирозин. Патология из-за мутации гена QDPR.
-
Фенилкетонурия III типа ― недостаток 6-пирувоилтетрагидроптеринсинтазы, нужной для синтеза тетрагидробиоптерина. Патология вызвана мутированным PTS-геном.
Все формы заболевания наследуются по аутосомно-рецессивной форме. Это означает, что генетический дефект может быть унаследован у одного из родителей. Половая принадлежность родителя и ребенка не играет роли.
Фенилкетонурия в настоящее время не имеет общепризнанной мировой классификации. Над этим вопросом ведутся дебаты, наравне с изучением заболевания. Чуть ранее, до расшифровки генов, считалось, что степень поражения интеллектуальных способностей зависит от степени активности фермента. Поэтому текущая квалификация признана устаревшей. Не учитывает она и другие симптоматические факторы.
Поэтому текущая квалификация признана устаревшей. Не учитывает она и другие симптоматические факторы.
При диагностировании ставят:
-
I тип (дефицит ФАГ) ― концентрация ФА больше 20 мг/дл.
-
Средняя форма ФКУ ― ФА от 8,1 до 20 мг/дл.
-
Легкая форма ГФА-уровень ― ФА от 2,1 до 8,0 мг/дл.
При уровне до 8,0 мг/дл фенилкетонурию считают доброкачественной. Она не требует специального лечения, но необходимо наблюдение первый год жизни ребенка. Контролирует состояние врач-педиатр, невролог, генетик.
Выделяют также еще одну форму фенилкетонурии, не требующую коррекции. Это транзиторная форма ГФА в период новорожденности. Возникает, как правило, при недоношенности, что обусловлено функциональной незрелостью организма. Транзиторная фенилкетонурия ― это временное повышение ФА-уровня, способное подняться до критических значений. При этом клиника отсутствует либо проявления весьма незначительны. Через несколько месяцев биохимические показатели приходя в норму.
Транзиторная фенилкетонурия ― это временное повышение ФА-уровня, способное подняться до критических значений. При этом клиника отсутствует либо проявления весьма незначительны. Через несколько месяцев биохимические показатели приходя в норму.
Механизм зарождения и развития фенилкетонурии связан с нарушением обмена органического соединения ― аминокислоты фенилаланина. Метаболический блок препятствует преобразованию фенилаланина в тирозин. Аминокислота не только не преобразуется, а накапливается в виде токсичных метаболитов:
-
фенилмолочная кислота;
-
фенилпировиноградная кислота;
-
фенилуксусная кислота;
-
фенилэтиламин и прочее.
Скопление фенил-веществ оказывает токсическое действие на ЦНС. В настоящий момент механизм еще до конца не изучен, врачам не известен патогенез дисфункции головного мозга.
В настоящий момент механизм еще до конца не изучен, врачам не известен патогенез дисфункции головного мозга.
Существуют предположения, что поражение нервной системы является результатом ряда факторов. Среди них как прямое токсического воздействие фенилаланина, так и нарушение обмена белков, липопротеидов и гликопротеидов, сбой гомонального метаболизмеа и мембранного транспорта аминокислот. Все это в комплексе имеет важное значение для созревания и правильного функционирования ЦНС.
I тип. Первые признаки у ребенка проявляются в возрасте от 2 месяцев до полугода.
-
Апатичность либо, наоборот, повышенная раздражительность.
-
Отсутствие интереса к окружению, людям, предметам, обстановке.
-
Частое срыгивание.

-
Аллергический дерматит.
-
Нарушение мышечного тонуса.
-
Пониженное давление.
-
Судороги.
-
Иногда развивается микроцефалия (малый размер черепа относительно других частей тела) и гидроцефалия (избыточная жидкость, омывающая головной мозг).
К характерным симптомам относятся гипопигментация кожи, волос, радужной оболочки глаз. Моча имеет специфический запах плесени или его еще называют «мышиным» запахом. Эпилептические припадки наблюдаются у половины больных, часто является первым выраженным клиническим симптомом. Приступ характеризуется «салаамовыми» судорогами, напоминающими кивки. Они случаются часто, плохо поддаются антиконвульсантному лечению.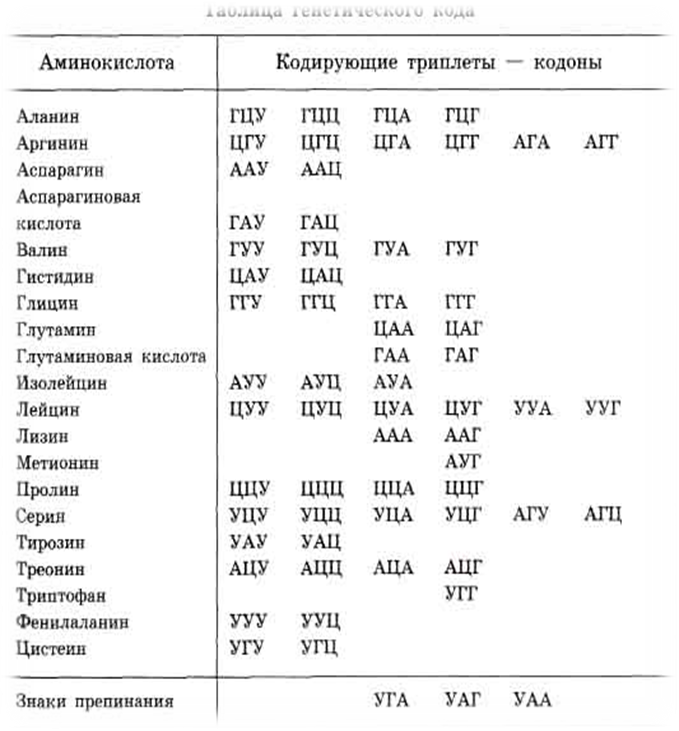
Если не корректировать концентрацию ФА, болезнь прогрессирует. Как правило, уровень IQ у таких детей не превышает 20, при норме от 85. Умственная отсталость настолько сильная, что отсутствуют эмоциональные реакции, наблюдаются психопатии и шизофреноподобные расстройства.
II тип. Первая симптоматика проявляется на первом году жизни.
-
Повышенная возбудимость.
-
Задержка развития.
-
Обильное слюнотечение.
-
Сниженное артериальное давление.
-
Частое повышение температуры тела.
-
Сухожильная гиперрефлексия (повышение рефлексов) или спастический тетрапарез (обессиливание всех четырех конечностей).

-
Миоклоническая эпилепсия (генерализованные приступы, преимущественно возникающие после пробуждения).
-
Микроцефалия.
Отличительная особенность второго типа ― гибель нейронов, нарушение метаболизма фолатов, а также кальцификация в различных отделах головного мозга. Болезнь быстро прогрессирует, может привести к смерти ребенка в течение 2 — 3 лет.
III тип. Симптомы дефицита пирувоилтетрагидроптеринсинтетазы схож с проявлениями болезни Паркинсона:
-
Постуральная нестабильность и трудности походки. Сложно либо невозможно поддерживать определенное положение всего тела или конечностей.
-
Гипокинезия (низкая двигательная активность, ограниченный темп и объем движений).

-
Гиперсаливация (повышенное слюноотделение).
-
Нарушения глотания.
-
Окулогирные кризы (симметричное отклонение обоих глаз, обычно направленное вверх).
В 80% случаев этот тип заболевания сопровождается снижением количества биогенных аминов в ликворе. Лечение затруднено тем, что раннее снижение концентрации ФА может вызвать серьезные патологические изменения. Несоблюдение диетотерапии приведет к замедлению развития речи, низкому интеллекту, проблемам с памятью.
Выявить фенилкетонурию можно в первые дни после рождения до появления какой-либо симптоматики. Для определение концентрации фениламина в крови проводят:
-
микробиологический тест;
-
хроматографию;
-
флюориметрию;
-
масс-спектрометрию.

Во всех случаях биологическим материалом выступают сухие пятна капиллярной крови младенца.
С недавнего времени анализ на фенилкетонурию входит в программу неонатального скрининга. Его проводят всем новорожденным, особенно важно исследование для недоношенных детей. Критерий диагностирования ― повышенная концентрация фенилаланина при норме 0 — 2 мг/дл. Повышенный уровень требует проведения уточняющей диагностики. Потребуется установить сам факт наличия фенилкетонурии и выявить ее причину.
-
Если скрининг-тест показал высокие результаты уровня ФА, дополнительно может быть назначено:
-
Фенилаланин-нагрузочная диагностика для выявления нозологической формы заболевания.
-
Молекулярно-генетический анализ для установления формы: классическая, II или III тип.

-
Секвенирование гена РАН, если молекулярно-генетическая диагностика дала отрицательный результат по гену ФАГ.
-
Анализ на птерины в урине для исключения птерин-зависимых форм.
Дифференциальное диагностирование фенилкетонурии проводят с такими патологиями, как нарушение функции печени, галактоземия и с другими заболеваниями.
Симптоматическая терапия при любой формой фенилкетонурии неэффективна. Существует только один способ предотвратить негативные последствия заболевания ― диетотерапия. Из рациона исключают высокобелковые и содержащие фенилаланин продукты. Недостающее количество белка восполняют специализированным лечебным питанием, с максимально низким содержанием аминокислоты ФА или полностью ее лишенным. Следует учитывать, что эффективность терапии напрямую зависит от времени начала коррекции и уже произошедших патологических изменений.
Цель лечебного питания при классической форме заболевания ― это предотвращение развития нарушений ЦНС, физического и умственного развития. Легкая форма ГФА допускает расширение диеты под строгим наблюдением врача за состоянием ребенка и биохимическими показателями. Под запретом: мясо, рыба, орехи, шоколад и бобовые, все виды яиц, творог и сыры. Также следует исключить продукты, содержащие искусственный подсластитель аспартам.
Критерий эффективности лечения ― уровень ФА в крови.
Проведения массового скрининга в родильных домах позволяет своевременно выявить генетическое отклонение. Вовремя начать соблюдение диетотерапии и, как следствие, предотвратить тяжелые последствия. В противном случае прогноз в отношении умственного развития неблагоприятный.
Классическая ФКУ имеет благоприятный прогноз если диагностирована в первые недели жизни ребенка и соблюдаются все требования врачей. Такие дети ходят в обычные школы, способны получить высшее образовании и вести нормальный образ жизни.
Такие дети ходят в обычные школы, способны получить высшее образовании и вести нормальный образ жизни.
Во время подготовки к беременности пара должна пройти предварительное генетическое тестирование на наличие мутаций в гене РАН. Если у одного из родителей есть дефектный ген, шанс родить ребенка с ФКУ 1:4 и 100% если оба родителя больны.
Женщины с установленной фенилкетонурией при беременности и грудном вскармливании должны соблюдать строгую диету. Высокая концентрация аминокислоты в крови и околоплодных водах оказывает серьезное тератогенное воздействие на плод.
Сдать анализ на уровень ФА можно в подразделениях АО «СЗЦДМ» Здесь вас ждет:
-
квалифицированных и доброжелательный персонал;
-
новейшее оборудование, отправка результатов исследований по эл.
 почте;
почте;
-
несколько вариантов получения данных анализов;
-
удобное расположение терминалов;
-
отсутствие очередей, условия конфиденциальности.
Лаборатории находятся в Санкт-Петербурге и других города Ленинградской области, а также в Великом Новгороде, Новгородской обл., Пскове, Калининграде.
перейти к анализам
Сколько аминокислот требуется организму? | Здоровое питание
Автор: Andra Picincu Обновлено 6 декабря 2018 г.
Белок является строительным блоком ваших клеток и тканей. Вашему организму он нужен для наращивания мышц, борьбы с микробами и восстановления после болезней. Некоторые белки помогают транспортировать кислород и передавать сообщения между клетками. Другие способствуют производству энергии и способствуют определенным химическим реакциям. Это питательное вещество состоит из аминокислот, которые могут быть незаменимыми, несущественными или условными.
Другие способствуют производству энергии и способствуют определенным химическим реакциям. Это питательное вещество состоит из аминокислот, которые могут быть незаменимыми, несущественными или условными.
Роль аминокислот
Аминокислоты — это органические соединения, которые служат источником энергии и выполняют различные функции организма, такие как синтез гормонов и восстановление клеток. Они связаны друг с другом пептидными связями. Некоторые из этих питательных веществ поступают из продуктов питания и напитков, а другие могут вырабатываться человеческим организмом.
При приеме внутрь белок расщепляется на аминокислоты. Есть 20 аминокислот, и каждая играет свою роль. Все они нужны вашему организму в разной степени.Лизин, например, способствует выработке коллагена, гормонов и антител. Это также помогает поддерживать мышечную массу в периоды стресса.
Лейцин, одна из важнейших аминокислот, играет ключевую роль в синтезе белка.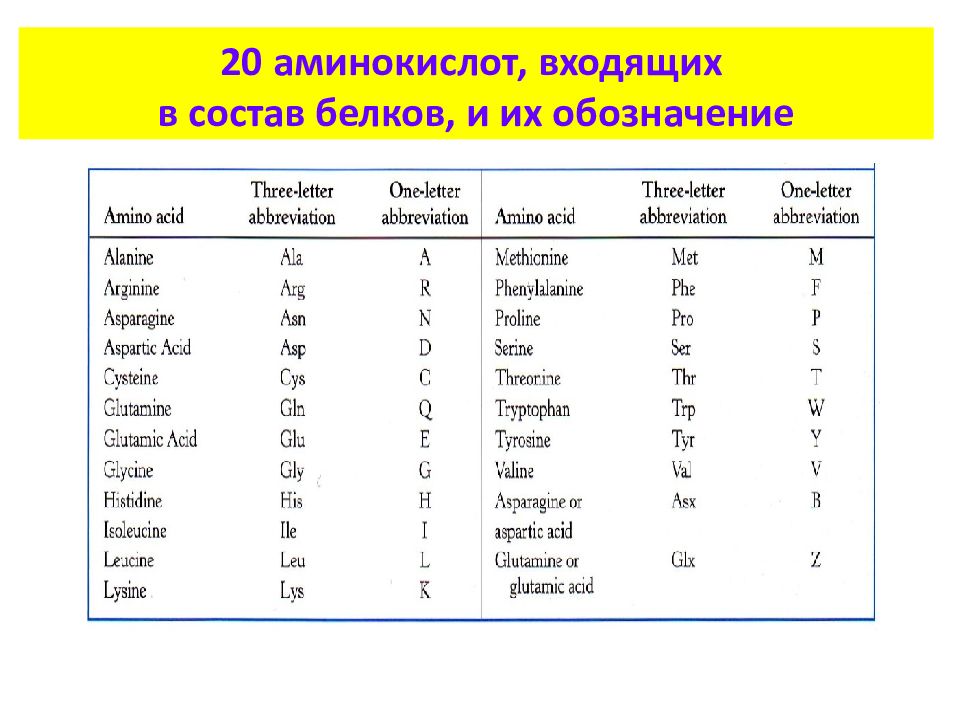 Он помогает наращивать и сохранять мышцы, снижает катаболизм и способствует энергетическому обмену. Спортсмены и бодибилдеры принимают добавки лейцина, чтобы быстрее восстанавливаться после тренировок и предотвратить потерю мышечной массы.
Он помогает наращивать и сохранять мышцы, снижает катаболизм и способствует энергетическому обмену. Спортсмены и бодибилдеры принимают добавки лейцина, чтобы быстрее восстанавливаться после тренировок и предотвратить потерю мышечной массы.
Аргинин способствует выработке энергии и синтезу оксида азота.Он также помогает вывести из организма аммиак, поддерживает работу сердца и регулирует кровяное давление. При использовании в форме добавки он дает энергию во время упражнений и увеличивает приток крови к мышцам.
Было доказано, что бета-аланин улучшает физическую работоспособность и снижает мышечную усталость. Он также стимулирует синтез белка, увеличивает мышечную выносливость и способствует росту мышц. Это питательное вещество часто используется в составе предтренировочных смесей из-за его способности повышать энергию и выносливость.
Все аминокислоты имеют решающее значение для правильного функционирования вашего тела. Даже малейший дефицит может привести к гормональному дисбалансу и нарушению обмена веществ. Сколько каждого из них вам нужно, зависит от вашего возраста, пола, уровня активности и целей в отношении здоровья.
Сколько каждого из них вам нужно, зависит от вашего возраста, пола, уровня активности и целей в отношении здоровья.
Типы аминокислот
Эти питательные вещества можно разделить на три основные категории: незаменимые, заменимые и условные аминокислоты. Девять из них названы незаменимыми, потому что они не могут быть произведены человеческим организмом и должны быть получены с пищей.К ним относятся:
- Лизин
- Лейцин
- Изолейцин
- Валин
- Треонин
- Триптофан
- Метионин
- Фенилаланин
- Гистидин Источником полноценного мяса и мяса являются гистидин. потому что они содержат все девять незаменимых аминокислот. За некоторыми исключениями, в большинстве продуктов растительного происхождения не хватает одного или нескольких из этих питательных веществ.Гречка, киноа, соя, куорн, сейтан и другие веганские продукты содержат полноценные белки.
 Вы также можете комбинировать два или более источника неполного белка, таких как молочные продукты и орехи или бобовые и зерновые, чтобы получить полноценный белок.
Вы также можете комбинировать два или более источника неполного белка, таких как молочные продукты и орехи или бобовые и зерновые, чтобы получить полноценный белок.Некоторые аминокислоты могут вырабатываться организмом из глюкозы, жирных кислот и других аминокислот. По этой причине их называют «несущественными». К ним относятся серин, аспарагиновая кислота, бета-аланин, глутаминовая кислота и другие.
Организм человека может самостоятельно синтезировать орнитин, аргинин, тирозин, глицин, глутамин, цистеин и пролин при определенных обстоятельствах.Эти питательные вещества называют условно незаменимыми аминокислотами. Когда вы болеете, испытываете стресс или усердно тренируетесь, ваше тело может не производить эти аминокислоты в оптимальных количествах. Следовательно, они должны поступать с пищей.
Рекомендуемая суточная доза
Рекомендуемая суточная доза аминокислот варьируется от человека к человеку. Спортсменам и активным людям, например, требуется большее количество аминокислот для достижения максимальной производительности. То же самое и с теми, кто болеет или восстанавливается после операции.Сбалансированная диета, обеспечивающая оптимальные дозы аминокислот, может ускорить заживление и уменьшить потерю мышечной массы.
То же самое и с теми, кто болеет или восстанавливается после операции.Сбалансированная диета, обеспечивающая оптимальные дозы аминокислот, может ускорить заживление и уменьшить потерю мышечной массы.
Для начала попробуйте определить суточное потребление белка. Эксперты в области здравоохранения рекомендуют от 0,8 до 1,6 грамма белка на килограмм веса тела. Однако мнения неоднозначны. Нет ничего необычного в том, чтобы увидеть спортсменов, которые потребляют до трех граммов белка на килограмм веса тела. Как показывает практика, чем больше вы активны, тем больше белка вам нужно.
Диета, обеспечивающая достаточное количество белка, также обеспечивает оптимальное количество аминокислот.Нацельтесь на 8-10 миллиграммов гистидина, до 12 миллиграммов лизина, 14 миллиграммов фенилаланина и 16 миллиграммов лейцина на килограмм веса тела. Если у вас есть особые диетические потребности, проконсультируйтесь с диетологом, который поможет вам разработать индивидуальный план питания.
Аминокислоты в регуляции старения и связанных со старением заболеваний
https://doi. org/10.1016/j.tma.2019.09.001Получить права и содержание
org/10.1016/j.tma.2019.09.001Получить права и содержаниеРеферат
Аминокислоты являются строительными блоками белка, но также играют важную роль в передаче сигналов в клетках.Механизмы, с помощью которых ощущаются измененные уровни многих аминокислот и передаваемые сигналы, все еще в значительной степени неизвестны. Все больше данных показывает, что эти сигналы могут влиять на процесс старения. В этом отношении ограничение метионина, по-видимому, является эволюционно законсервированным механизмом для замедления старения, а добавление глицина может имитировать ограничение метионина для увеличения продолжительности жизни у грызунов. Ограничение триптофана также может активировать определенные пути замедления старения, но может влиять на когнитивные функции.При физических упражнениях потребление пищевых аминокислот с разветвленной цепью (BCAA) может быть полезным для наращивания мышечной массы, но высокие уровни BCAA, а также тирозина и фенилаланина в кровотоке связаны с метаболическими заболеваниями, такими как инсулинорезистентность. Индивидуальное добавление или ограничение нескольких различных аминокислот показало многообещающие при лечении инсулинорезистентности у грызунов. Большой прогресс в отношении влияния аминокислот на долголетие был достигнут с использованием дрожжей, нематод и плодовых мух.Очевидно, что необходимы гораздо больше исследований, чтобы понять сигнальные пути, активируемые аминокислотным дисбалансом, прежде чем можно будет разработать эффективные и хорошо переносимые диетические вмешательства для лечения старения человека и связанных со старением заболеваний. В этом обзоре обсуждаются механизмы, посредством которых измененные диетические и клеточные уровни двадцати протеогенных аминокислот влияют на старение или связанные со старением нарушения.
Индивидуальное добавление или ограничение нескольких различных аминокислот показало многообещающие при лечении инсулинорезистентности у грызунов. Большой прогресс в отношении влияния аминокислот на долголетие был достигнут с использованием дрожжей, нематод и плодовых мух.Очевидно, что необходимы гораздо больше исследований, чтобы понять сигнальные пути, активируемые аминокислотным дисбалансом, прежде чем можно будет разработать эффективные и хорошо переносимые диетические вмешательства для лечения старения человека и связанных со старением заболеваний. В этом обзоре обсуждаются механизмы, посредством которых измененные диетические и клеточные уровни двадцати протеогенных аминокислот влияют на старение или связанные со старением нарушения.
Ключевые слова
Аминокислоты
Старение
Продолжительность жизни
Дрожжи
C.elegans
Рекомендуемые статьиЦитирующие статьи (0)
© 2019 Авторы. Производство и хостинг компанией Elsevier B. V. от имени KeAi Communication Co., Ltd.
V. от имени KeAi Communication Co., Ltd.
Рекомендуемые статьи
Цитирующие статьи
Аминокислотные свойства
Аминокислотные свойства
Роберт Б. Рассел (1), Мэтью Дж. Беттс (2) и Майкл Р. Барнс (3)| 1. EMBL Meyerhofstrasse 1 D-69012, Heidelberg Германия Домашняя страница | 2.DeCODE Genetics Bioinformatics Sturlugoetu 8 101 Рейкьявик Исландия | 3. GlaxoSmithKline Bioinformatics NFSP-N, 3rd Avenue Harlow, Essex CM19 5AW U.K. |
Цитата: М.Дж. Беттс, Р. Б. Рассел. Аминокислотные свойства и последствия замен.
In Bioinformatics for Geneticists , M.R. Barnes, I.C. Серый ред., Wiley, 2003. Купите это в Wiley или Amazon.
Введение и предостережения Роба
Большая часть того, что содержится на этих страницах, является точкой зрения одного человека.Наверное я слишком доверяю своим знаниям принципов протеина структура и функции, а также публикации и тому подобное перешли в мою голова. Поэтому, пожалуйста, прочтите эти страницы с учетом этих предостережений. Я не знаю все, и это во многом перспектива, основанная на моем собственном опыт и знания. Сказав это, я посмотрел на много белковых последовательностей и структур в свое время, поэтому я предвижу и надеюсь, что эти страницы будут полезны тем, кто не так уж много знает о структуре и (например) задается вопросом, каковы последствия может быть конкретная мутация.
Подробности, такие как замена или предпочтения активного сайта, выводятся систематически, поэтому им можно доверять в пределах того, как они скомпилированы. Существует много тысяч различных числовых схем для сравнения. аминокислоты, но важно помнить, что ни одна не может охватить огромное количество альтернативных сред, в которых аминокислоты могут оказаться внутри белков.
Эти страницы получают порядка 30 000 посещений в месяц (и их количество растет; это хит примерно каждую минуту в среднем), и тем не менее на сегодняшний день я получил только несколько электронных писем.Если у вас есть комментарии или вопросы, пришлите их мне ([email protected]). Меня особенно интересует, как можно улучшить сайт в зависимости от того, для чего люди его используют.
Теперь этот сайт работает достаточно долго и достаточно популярен, чтобы делать некоторую статистику. В таблице ниже показано, сколько раз каждая страница для каждой аминокислоты была открыта за последние 12 месяцев. (Май 2003 г. — апрель 2004 г.). Затем я сравнил процент попаданий с фактическим содержанием аминокислоты. кислота. Соотношение этих двух дает некоторое представление о аминокислотах, которые больше всего используются людьми. увлекающийся.Например, Trp, Cys, His и Arg — все большие победители: они попадают во много раз больше, чем можно было бы ожидать, по сравнению с их изобилием в белках. Леу, Иле и Сер, напротив, — настоящие скучные неудачники. А моя старая скучная любимица Ала скучно посередине.
| AA | ударов | % ударов | % Обилие | Отношение | |||||||||
| Trp | 1550 | 5.05 | 1,34 | 1 | 21 | 1,76 | 3,53 | ||||||
| His | 1695 | 5,52 | 2,26 | 2,44 | |||||||||
| Arg | 3093 | 10.08 | 3,59 | 2,32 | 1,55 | ||||||||
| Tyr | 1525 | 4,97 | 3,25 | 1,53 | |||||||||
| Gln | 1830 | 5.96 | 3,96 | 1,51 | |||||||||
| Phe | 1616 | 5,27 | 4,12 | 1,28 | |||||||||
| Asp | 1691 | 1691 | 5,5101 | 5,21 | 5,00 | 1,04 | |||||||
| Ala | 2018 | 6,58 | 7,34 | 0,90 | |||||||||
| Asn | 1103 | 3.59 | 4,57 | 0,79 | |||||||||
| Lys | 1366 | 4,45 | 5,81 | 0,77 | |||||||||
| Glu | 1471 | 4,79 | 1471 | 6,29 | 4,52 | 6,89 | 0,66 | ||||||
| Thr | 1147 | 3,74 | 5,85 | 0,64 | |||||||||
| Вал | 1225 | 3.99 | 6,48 | 0,62 | |||||||||
| Иле | 1033 | 3,37 | 5,76 | 0,58 | |||||||||
| Сер | 1206 | 3,67 | 9,36 | 0,39 |
Обзор свойств аминокислот
На рисунке под диаграммой Венна аминокислоты сгруппированы в соответствии с их свойствами.Это было адаптировано из Ливингстон и Бартон, КАБИОС , 9 , 745-756, 1993 (PubMed), и является лишь одной из многих возможных классификаций, но, вероятно, именно ее Согласен, охватывает большинство белковых контекстов.
(Теперь кликабельно!)
Для получения более подробной информации, пожалуйста, обратитесь к страницам по каждой аминокислоте:| Ala, A | Cys, C | Асп, D | Glu, E | Phe, F |
| Gly, G | His, H | Иль, Иле | Lys, К | лей, L |
| Мет, M | Асн, № | Pro, P | Gln, Q | Арг, R |
| Ser, S | Thr, Т | Вал, В | Trp, Вт | Tyr, Y |
Или к тем, кто касается различных свойств аминокислот:
Пожалуйста, также обратитесь к общей странице объяснения, чтобы понять, что различные разделы на этих страницы означают, или как они получены.
Очень сложно поместить все аминокислоты одного типа в инвариантную группу. Помни это каждая аминокислота находится в другом белковом окружении, и ее роль в белке, как правило, очень велика. сложнее, чем что-либо, что может быть определено набором группировок, подобных приведенным выше. Хотя группы обычно правильные, очень важно учитывать, является ли ваша аминокислота играет особую роль в белке, такую как участие в активном сайте или такие вещи, как связывание с кофактор или сахар и т. д.
Одна критически важная вещь, которую следует учитывать, — сохраняется ли интересующая аминокислота. через известные гомологи. Инвариантные положения или положения, демонстрирующие сохранение определенных свойств остатка (например, заряд, гидрофобность и т. д.) менее склонны переносить мутации, чем те, в которых белок семейство допускает мутации в большом количестве аминокислот. При этом также помните о важных различие между ортологами , которые являются белками с одинаковой функцией у разных видов, и паралогов , которые являются результатом дупликаций внутри вида (т.е. гомологи, вероятно, исполняют разные функции). Положение, сохраняющееся у ортологов, может быть вовлечено во многие аспекты структуры и функции, включая специфичность, в то время как один консервативный у всех паралогов можно только предположить вовлеченным в структуру, и более общие функциональные особенности, такие как каталитический механизм.
Нет простого способа автоматически различать ортологи и паралоги, особенно если рассматривать большие эволюционные расстояния (например, человек и дрожжи), но два белка от разных видов часто считаются быть ортологичными, если они обнаруживают друг друга как наиболее подходящие во время (скажем) поисков Blast, и если нет других белков с оценками в том же диапазоне.
Есть некоторые общие тенденции в отношении аминокислот, которые предпочитают находиться в функциональных центрах, но имейте в виду, что это средние значения, и важность того или иного типа аминокислоты для функционирования варьируется. в значительной степени с функциональным контекстом.
Особо следует отметить две позиции цистеина (C-SS и C-SH). Они обозначают две степени окисления цистеинов. C-SS обозначает те цистеины, которые участвуют в дисульфидных облигации (т.е.связаны друг с другом). Обратите внимание, что эти связи чрезвычайно редки во внутриклеточных белках, поэтому, если ваш белок внутриклеточный, цистеины, скорее всего, будут свободными (C-SH). Этот означает, что цистеины обладают совершенно разными свойствами во внеклеточной и внутриклеточной средах. Более подробную информацию можно найти здесь.
Другие ресурсы об аминокислотах
На главную
Аминокислоты с разветвленной цепью и синтез мышечного белка у человека: миф или реальность? | Журнал Международного общества спортивного питания
В общей сложности мышечный белок состоит из двадцати аминокислот.Девять из двадцати считаются незаменимыми аминокислотами (EAA), что означает, что они не могут вырабатываться организмом в физиологически значимых количествах и, следовательно, являются важными компонентами сбалансированной диеты. Мышечный белок находится в постоянном состоянии обмена, что означает, что синтез белка происходит непрерывно, чтобы заменить белок, потерянный в результате распада белка. Для синтеза нового мышечного белка все EAA вместе с одиннадцатью незаменимыми аминокислотами (NEAA), которые могут вырабатываться в организме, должны присутствовать в адекватных количествах.Аминокислоты с разветвленной цепью лейцин, изолейцин и валин являются тремя из девяти EAA. Лейцин является не только предшественником синтеза мышечного белка, но также может играть роль регулятора внутриклеточных сигнальных путей, которые участвуют в процессе синтеза белка (например, [1]).
Идея о том, что BCAA могут обладать уникальной способностью стимулировать синтез мышечного белка, выдвигалась более 35 лет. Данные, подтверждающие эту гипотезу, были получены при изучении ответов крыс.В 1981 г. Бузе [2] сообщил, что у крыс BCAA могут ограничивать скорость синтеза мышечного белка. Дополнительные исследования подтвердили концепцию уникального влияния BCAA на синтез мышечного белка у крыс, хотя лишь немногие изучали реакцию на пероральное употребление только BCAA. Гарлик и Грант показали, что введение смеси BCAA крысам увеличивает скорость синтеза мышечного белка в ответ на инсулин [3], но они не измеряли эффекты только BCAA. Введение крысам только BCAA Kobayashi et al.[4], как было показано, вызывает увеличение синтеза мышечного белка, но ответ был временным. Предположительно скорость синтеза быстро стала ограничиваться доступностью других EAA.
Исследования синтеза мышечного белка у крыс имеют ограниченное отношение к реакции человека. Скелетные мышцы составляют гораздо меньший процент от общей массы тела у крыс по сравнению с людьми, и регулирование синтеза мышечного белка во многих отношениях отличается. Так, в своей знаменательной книге по метаболизму белков Уотерлоу и его коллеги на основании имеющихся данных пришли к выводу, что пищевые аминокислоты не стимулируют синтез мышечного белка у крыс [5].Хотя недавняя работа ставит под сомнение это утверждение, ограниченный стимулирующий эффект пищевых аминокислот на синтез белка у крыс отражает тот факт, что в нормальных постабсорбтивных условиях имеются избыточные эндогенные аминокислоты, которые позволяют увеличить синтез белка, если активность внутриклеточных факторы, участвующие в инициации синтеза белка, стимулируются. Выражаясь по-другому, синтез мышечного белка у крысы, по-видимому, ограничивается скорее процессом инициации, чем процессом трансляции.Напротив, как будет описано ниже, у людей этого не происходит. Еще одно важное различие между исследованиями, изучающими влияние аминокислот на синтез мышечного белка у людей и крыс, связано с обычно используемыми методологиями. В исследованиях на крысах обычно использовался метод «затопляющей дозы» [6]. Эта процедура включает измерение включения индикатора аминокислот в мышечный белок в течение очень короткого промежутка времени, часто всего 10 минут. Этот подход не делает различий между кратковременной и устойчивой стимуляцией синтеза белка.С физиологической точки зрения важна только длительная стимуляция синтеза. Потребление несбалансированной смеси аминокислот, такой как BCAA, может временно стимулировать синтез белка за счет использования эндогенных запасов других предшественников синтеза белка. Однако эндогенные запасы аминокислот, например, в плазме и свободных внутриклеточных пулах, весьма ограничены и могут быстро истощиться. Если стимуляция синтеза белка не может быть продолжена, это не имеет большого физиологического значения.Следовательно, метод дозирования наводнения, обычно используемый для измерения синтеза мышечного белка у крыс, дает результаты, не имеющие отношения к питанию человека. Поскольку пищевые добавки BCAA предназначены для употребления в пищу человеком, в центре внимания этого краткого обзора будут исследования на людях.
Продажа BCAA в качестве пищевых добавок превратилась в бизнес с многомиллионным оборотом. В основе маркетинга этих продуктов лежит широко распространенное мнение о том, что потребление BCAA стимулирует синтез мышечного белка и, как следствие, вызывает анаболический ответ.BCAA также можно употреблять с целью улучшения «умственной сосредоточенности», но мы не будем рассматривать это применение. Основная цель этой статьи — оценить утверждение, что только BCAA являются анаболическими, — адекватно подтверждена теоретически или эмпирически исследованиями на людях. Неявным в нашей оценке будет исследование того, играет ли состояние фосфорилирования эукариотических факторов инициации роль регулятора скорости в регуляции синтеза мышечного белка у людей.
Оборот мышечного белка и потребление белка с пищей
Мышечный белок находится в постоянном состоянии оборота, что означает, что новый белок постоянно вырабатывается, в то время как старые белки расщепляются. Анаболическое состояние не имеет конкретного определения, но обычно относится к обстоятельствам, при которых скорость синтеза мышечного белка превышает скорость распада мышечного белка. Результат — набор мышечной массы. Обычно считается, что анаболическое состояние вызывается стимуляцией синтеза мышечного белка, но теоретически оно также может быть результатом ингибирования распада мышечного белка.
Основная метаболическая цель приема добавок BCAA — максимизировать анаболическое состояние. Широко распространено мнение, что BCAA вызывают анаболическое состояние, стимулируя синтез мышечного белка. Обильная доступность всех EAA является необходимым условием для значительной стимуляции синтеза мышечного белка [7]. Синтез мышечного белка будет ограничен из-за отсутствия каких-либо EAA, тогда как нехватка NEAA может быть компенсирована увеличением de novo продукции дефицитных NEAA [7].В постпрандиальном состоянии после приема пищи, содержащей белок, все предшественники ЕАА, необходимые для синтеза нового мышечного белка, могут быть получены либо из повышенных концентраций в плазме, возникающих в результате переваривания потребленного белка, либо в результате его рециркуляции в результате распада белка. В этом случае обильной доступности EAA скорость синтеза мышечного белка превышает скорость распада, что приводит к анаболическому состоянию. В постабсорбтивном состоянии уровни EAA в плазме падают ниже постпрандиальных значений, потому что аминокислоты больше не всасываются.В результате EAA больше не поглощаются мышцами, а высвобождаются мышцами в плазму [8]. Это катаболическое состояние мышечного белка в постабсорбтивном состоянии обеспечивает постоянную доступность EAA для других тканей для поддержания скорости синтеза белка за счет мышечного белка, который можно рассматривать как резервуар EAA для остальных. тела, чтобы опираться.
Так как EAA не могут продуцироваться в организме и есть чистое высвобождение EAA из мышц, в постабсорбтивном состоянии единственным источником предшественников EAA для синтеза мышечного белка являются внутриклеточные EAA, полученные в результате распада мышечного белка [8].Помимо того, что они повторно включаются в мышечный белок посредством синтеза, некоторые EAA, высвобождаемые в результате распада мышечного белка, могут частично окисляться в мышцах, что делает их недоступными для повторного включения в мышечный белок. EAA, высвобождаемые в результате распада мышечного белка, которые не включаются в мышечный белок или не окисляются в мышечной ткани, высвобождаются в плазму, после чего они могут либо поглощаться другими тканями в качестве предшественников для синтеза белка, либо необратимо окисляться [9].Таким образом, скорость синтеза мышечного белка всегда будет ниже, чем скорость распада мышечного белка в состоянии после абсорбции, из-за чистого потока EAA от распада белка в плазму и по окислительным путям. Другими словами, синтез мышечного протеина не может превышать скорость распада мышечного протеина, когда его предшественники полностью получены в результате распада протеина, и, таким образом, анаболическое состояние не может возникнуть без поступления экзогенных аминокислот.
Являются ли BCAA анаболическими в состоянии после абсорбции?
Теоретические соображения
Все предшественники EAA для синтеза мышечного белка в постабсорбирующем состоянии являются производными от распада мышечного белка.Постоянно сообщалось, что у нормальных людей после абсорбции скорость распада мышечного белка превышает скорость синтеза мышечного белка примерно на 30% [10]. Потребление только BCAA (то есть без других EAA) может только увеличить синтез мышечного белка в постабсорбтивном состоянии за счет повышения эффективности рециркуляции EAA из расщепления белка обратно в синтез белка, в отличие от их высвобождения в плазму или окисленный. Это связано с тем, что все 9 EAA (а также 11 NEAA) необходимы для производства мышечного белка, а EAA не могут производиться в организме.Если потребляются только 3 EAA, как в случае с BCAA, то распад белка является единственным источником оставшихся EAA, необходимых в качестве предшественников для синтеза мышечного белка. Следовательно, потребление только BCAA теоретически невозможно для создания анаболического состояния, при котором синтез мышечного белка превышает распад мышечного белка. Если сделать щедрое предположение, что потребление BCAA повышает эффективность рециркуляции EAA от распада мышечного белка до синтеза мышечного белка на 50%, то это приведет к увеличению скорости синтеза мышечного белка на 15% (30% рециркулируется в базовом режиме). состояние X 50% улучшение рециркуляции = 15% увеличение синтеза).Кроме того, снижение на 50% высвобождения ЕАА в плазму из мышц также уменьшило бы плазменный и внутриклеточный пулы свободных ЕАА. Рисунок Рис. 1 схематически иллюстрирует эти принципы. Поскольку повышение эффективности рециркуляции на 50% будет примерно разумным максимальным пределом, это означает, что максимальная стимуляция синтеза мышечного белка не может превышать 15%. Это соответствовало бы увеличению фракционной скорости синтеза мышцы от базального значения около 0,050% / ч в базовом состоянии до 0.057% / час, и эту разницу во фракционной скорости синтеза (FSR) белка будет трудно точно измерить [11].
Рис. 1Схематическое изображение рециркуляции незаменимых аминокислот (EAA) из распада мышечного белка в синтез мышечного белка в постабсорбтивном состоянии. Произвольные единицы используются для простоты и основаны на измеренных скоростях каждого пути у людей после абсорбции [10]. a Нормальное состояние после абсорбции.Примерно 70% EAA, образующихся при распаде мышечного белка, повторно используется в синтезе белка [10]. В результате распада белка происходит чистый отток примерно 85% EAA, которые могут либо поглощаться и включаться в белок в других тканях, либо окисляться. Около 15% EAA от распада белка частично окисляются в мышцах и недоступны для синтеза белка. Показатели внешнего потока и внутриклеточного окисления ЕАА являются средними, поскольку некоторые ЕАА, такие как фенилаланин, совсем не окисляются в мышцах. b Представление 50% увеличения эффективности рециркуляции EAA от распада мышечного белка в синтез белка. В этом примере синтез увеличится с 70 до 80 единиц, или на 20%. Синтез белка никогда не может превышать распад белка в постабсорбционном состоянии, поскольку расщепление белка является единственным источником EAA
.Эмпирические результаты
BCAA вводили внутривенно в единственных исследованиях, определяющих реакцию метаболизма мышечных белков у людей только на BCAA.Хотя вливание BCAA не является общепринятым способом употребления пищевой добавки, было показано, что вводимые внутривенно и перорально аминокислоты вызывают сопоставимые эффекты на синтез мышечного белка в других обстоятельствах [12]. Следовательно, есть смысл оценить статьи, в которых описывается ответ синтеза мышечного белка на внутривенное вливание BCAA у людей.
Louard et al. [13] использовали метод баланса предплечий для количественной оценки реакции на внутривенное вливание смеси BCAA в течение 3 часов у 10 субъектов после абсорбции.Метод баланса предплечья включает измерение поглощения и высвобождения индивидуальных EAA (в данном случае лейцина и фенилаланина) и их изотопно-меченных аналогов. Рассчитаны скорости исчезновения (Rd) и появления (Ra) фенилаланина и лейцина. При условии, что баланс лейцина и фенилаланина в мышцах является репрезентативным для всех EAA, Rd. Считается, что фенилаланин отражает синтез мышечного белка, поскольку синтез белка — единственная судьба фенилаланина, поглощаемого мышцами из плазмы.Rd. лейцина нельзя интерпретировать с точки зрения синтеза белка, поскольку лейцин, поглощаемый мышцами, может окисляться, а также включаться в белок. Трехчасовая инфузия BCAA увеличила плазменные концентрации всех 3 BCAA в четыре раза, в то время как концентрации других EAA снизились [13]. Синтез мышечного белка снизился с 37 +/- 3 до 21 +/- 2 нмоль / мин / 100 мл ноги (статистически значимо, p <0,05) [13], вместо того, чтобы стимулироваться инфузией BCAA. Не было значительных изменений в чистом балансе фенилаланина, что указывает на то, что распад мышечного белка также уменьшился на величину, аналогичную сокращению синтеза мышечного белка.Баланс между синтезом и распадом мышечного белка оставался отрицательным, что означало, что катаболическое состояние сохранялось, а анаболическое состояние не производилось. Одновременное снижение синтеза и распада мышечного белка во время инфузии BCAA можно охарактеризовать как снижение оборота мышечного белка.
Аналогичные результаты были получены теми же исследователями, когда они увеличили продолжительность инфузии BCAA до 16 часов у 8 нормальных добровольцев и определили, стимулирует ли хроническое повышение BCAA синтез мышечного белка [14].Для расчета синтеза и распада мышечного белка использовалась та же методика баланса предплечий, что и в предыдущем исследовании. 16-часовая инфузия увеличивает концентрацию BCAA от 5 до 8 раз [14], что почти вдвое превышает уровни, достигаемые при пероральном приеме нормальной дозы BCAA [15]. Как и в предыдущем исследовании, синтез мышечного белка (отраженный фенилаланином Rd) был снижен у субъектов, получавших BCAA, по сравнению с инфузией физиологического раствора с 36 +/- 5 до 27 +/- 2 нмоль / мин / 100 мл. также снизился, а это означает, что оборот мышечного белка также снизился, и катаболическое состояние сохранялось.
Из этих двух исследований мы можем сделать вывод, что инфузия BCAA не только не увеличивает скорость синтеза мышечного белка у людей, но фактически снижает скорость синтеза мышечного белка и скорость обмена мышечного белка. Катаболическое состояние не было обращено в анаболическое состояние ни в одном исследовании. Кроме того, можно ожидать, что устойчивое снижение скорости оборота мышечного белка будет иметь пагубный эффект на мышечную силу, даже если мышечная масса сохраняется. Оборот мышечного белка обновляет мышечные волокна и приводит к увеличению эффективности сокращения на уровне отдельных волокон [16], что отражается в увеличении силы in vivo, независимо от мышечной массы [17, 18].
Неспособность синтеза мышечного белка значительно увеличиться в ответ на инфузию только BCAA, как и ожидалось в соответствии с теоретическими соображениями, обсужденными выше и проиллюстрированными на рис. 1, в отношении требования для всех EAA поддерживать увеличение. Вместо этого, поскольку распад мышечного белка уменьшился, доступность EAA также упала, что, в свою очередь, фактически снизило скорость синтеза мышечного белка.
Ограничивают ли анаболические сигнальные факторы скорость в постабсорбционном состоянии?
Утверждение о том, что синтез мышечного белка стимулируется BCAA, по крайней мере частично, связано с наблюдением усиления внутриклеточной анаболической передачи сигналов, включая состояние активации ключевых факторов, участвующих в инициации синтеза белка [1].Теория о том, что активация внутриклеточных анаболических сигнальных факторов вызывает повышенную скорость синтеза мышечного белка, прочно вошла в современные концепции регуляции синтеза мышечного белка. Повышенная анаболическая передача сигналов в ответ на BCAA была приведена в качестве доказательства стимуляции синтеза мышечного белка даже в отсутствие измерения синтеза мышечного белка (например, [1]). Однако активация анаболических сигнальных путей может совпадать с повышенным синтезом мышечного белка только при наличии достаточного количества EAA, обеспечивающего необходимые предшественники для производства полноценного белка.
Диссоциация состояния фосфорилирования сигнальных факторов и синтеза мышечного белка у людей была показана в различных обстоятельствах, когда доступность всех EAA ограничена. Например, повышение концентрации инсулина (например, в результате приема глюкозы) является мощным активатором анаболических сигнальных путей, но это не может увеличить мышечный FSR из-за дефицита EAA [19]. Напротив, потребление небольшого количества (3 г) EAA стимулирует синтез мышечного белка, не влияя на активность фактора инициации e.g., Akt, киназа S6 и 4E – BP1 [20]. Небольшое увеличение концентрации ЕАА в плазме не имело бы никакого эффекта, если бы синтез белка ограничивался состоянием активации факторов инициации. В упомянутых выше исследованиях, в которых BCAA вводили внутривенно, разумно предположить, что такое большое увеличение концентраций BCAA могло активировать сигнальные факторы, но синтез мышечного белка фактически снизился из-за отсутствия EAA в результате уменьшения расщепление белков.Таким образом, у людей введение ЕАА может увеличить синтез мышечного белка при отсутствии каких-либо изменений в активации факторов инициации, а активация факторов инициации при отсутствии потребления всех ЕАА не влияет на синтез мышечного белка. Эти результаты можно интерпретировать только как демонстрацию того, что ограничивающий скорость контроль синтеза базальных мышечных белков у людей — это доступность всех EAA, а не активность анаболического сигнального фактора. Этот вывод ставит под сомнение роль пищевых добавок, содержащих только BCAA, как стимуляторов синтеза мышечного белка.
Когда все доказательства и теории рассматриваются вместе, можно сделать вывод об отсутствии достоверных доказательств того, что прием одной пищевой добавки с BCAA приводит к физиологически значимой стимуляции мышечного белка. Фактически, имеющиеся данные показывают, что BCAA действительно снижают синтез мышечного белка. Все EAA должны быть доступны в изобилии, чтобы усиление анаболической передачи сигналов приводило к ускоренному синтезу мышечного белка.
Одновременное употребление BCAA с другими питательными веществами
В центре внимания этого обзора была реакция только на BCAA, поскольку это логическая цель пищевых добавок BCAA.Как и в случае потребления только BCAA, существует ограниченное количество исследований совместного приема BCAA с другими питательными веществами. Когда BCAA или изоазотная смесь треонина, метионина и гистидина вводились людям вместе с углеводами, скорость синтеза мышечного белка снижалась одинаково в обеих группах, что указывает на отсутствие уникальной роли BCAA [21]. Точно так же потребление смеси BCAA с углеводами после упражнений с отягощениями не увеличивало анаболические сигнальные факторы в большей степени, чем одни углеводы [22].Таким образом, имеющиеся данные не поддерживают идею об особом анаболическом эффекте BCAA при приеме с углеводами.
В отличие от отсутствия взаимодействия между BCAA и углеводами, BCAA могут усиливать анаболический эффект белковой пищи. Например, добавление 5 г BCAA к напитку, содержащему 6,25 г сывороточного протеина, увеличивало синтез мышечного протеина до уровня, сопоставимого с уровнем, вызываемым 25 г сывороточного протеина [23]. Этот результат предполагает, что один или несколько BCAA могут ограничивать скорость для стимуляции синтеза мышечного белка сывороточным белком или что дополнительные BCAA индуцируют больший потенциал анаболического ответа мышц на сывороточный белок за счет активации факторов инициации.В любом случае реакция BCAA в сочетании с интактным белком — это другая проблема, чем эффект только BCAA, поскольку интактный белок обеспечивает все EAA, необходимые для производства интактного белка.
Индивидуальные эффекты лейцина, валина и изолейцина
В этой статье мы рассмотрели только реакцию на смеси BCAA. Ответы на отдельные BCAA (например, лейцин, валин или изолейцин) могут отличаться от комбинации этих трех по нескольким причинам.Доказательства указывают на то, что лейцин сам по себе может вызывать анаболический ответ (например, [24]), в то время как таких данных не существует для изолейцина или валина. Таким образом, можно было ожидать, что один лейцин будет более эффективным, чем комбинация всех BCAA. Однако есть два существенных ограничения пищевой добавки, содержащей только лейцин. Во-первых, те же проблемы, которые ограничивают степень стимуляции синтеза мышечного белка только BCAA в отношении доступности других EAA, необходимых для производства неповрежденного мышечного белка, также ограничивают ответ только на лейцин.Во-вторых, повышение концентрации лейцина в плазме активирует метаболический путь, который окисляет все BCAA. В результате прием одного лейцина приводит к снижению плазменных концентраций валина и изолейцина. Таким образом, доступность валина и изолейцина может ограничивать скорость синтеза мышечного белка, когда потребляется только лейцин. Возможно, поэтому долгосрочные исследования результатов с добавлением лейцина в рацион не дали положительных результатов [25].Основное обоснование для диетической добавки, содержащей все BCAA, в отличие от одного лейцина, состоит в том, чтобы преодолеть снижение концентраций валина и изолейцина в плазме, которое могло бы произойти при приеме только лейцина.
В то время как пищевая добавка со всеми BCAA преодолевает снижение концентрации, вызванное потреблением только лейцина, добавление валина и изолейцина, тем не менее, может ограничивать эффективность одного лейцина из-за конкуренции за перенос в мышечные клетки.Все BCAA активно транспортируются в клетки, включая мышечные, с помощью одной и той же транспортной системы. Следовательно, при совместном использовании BCAA конкурируют друг с другом за транспортировку в клетки. Если один из BCAA (например, лейцин) ограничивает скорость синтеза белка, добавление двух других BCAA может ограничить стимуляцию синтеза белка из-за снижения проникновения лейцина в клетку. BCAA также конкурируют за транспорт с другими аминокислотами, включая фенилаланин, и эта конкуренция может повлиять на внутримышечную доступность других EAA.В результате конкуренции за переносчики, возможно, что один лейцин, например, может оказывать временное стимулирующее действие на синтез мышечного белка (например, [21]), когда BCAA не могут вызвать такой ответ [13, 14].
Сколько аминокислот в организме: незаменимые и второстепенные
Химическая структура неионизированной альфа-аминокислоты. Фото: GYassineMrabetTalk✉ Это векторное изображение, не указанное в W3C, было создано с помощью Inkscape. — Собственная работа, общественное достояние, https: // commons.wikimedia.org/w/index.php?curid=2551977Аминокислоты — это соединения, которые содержат функциональные группы амин и карбоксил и состоят в основном из элементов водорода, кислорода, азота и углерода, хотя некоторые другие элементы находят свое применение. in. В клетках эукариотических организмов содержится 21 незаменимая аминокислота, в том числе и в организме человека.
Давайте рассмотрим различные типы аминокислот, включая 21 незаменимую аминокислоту и некоторые заменимые аминокислоты.
Структура аминокислот
Аминокислоты используются рибосомами для создания белков. Хотя точная структура будет варьироваться между конкретными аминокислотами, в общем, аминокислоты имеют атом углерода, расположенный рядом с карбоксильной группой, и это образование называется структурой α-углерод (альфа-углерод). Те, которые содержат аминогруппу, связанную с этим альфа-углеродом, называются альфа-аминокислотами.
pKa связаны со шкалой pH, и разные аминокислоты могут иметь разный уровень кислотности.Фото: Колледж OpenStax — анатомия и физиология, веб-сайт Connexions. https://openstax.org/books/anatomy-and-physiology/pages/1-introduction, 19 июня 2013 г., CC BY 3.0, https://commons.wikimedia.org/w/index.php?curid= 30131151Аминокислоты разделены на отдельные группы. Аминокислоты сгруппированы частично на основе их константы кислотной диссоциации, обычно представленной как pKa. Значение pKa группы связано со значением pH кислот, в частности, это значение pH, при котором количество молекул в протонированной группе равно количеству молекул в непротонированной группе аминокислот.Основная аминогруппа обычно имеет значение pKa около девяти или 10. Напротив, кислотная альфа-карбоксильная группа имеет значения pKa около двух.
При pH от 7 до 7,4 свободные аминокислоты обычно представляют собой так называемые «цвиттерионы» (в переводе с немецкого «гибридные ионы») или диполярные ионы. Каждый белок и любая свободная аминокислота будет иметь pH, при котором он становится цвиттерионом. Другими словами, все белки и аминокислоты имеют изменение значения pH, что приводит к тому, что они имеют равное количество отрицательных и положительных зарядов.Значение pH, при котором возникает это равновесие, называется изоэлектрической точкой.
Когда белки и аминокислоты растворяются в воде, они в основном находятся в изоэлектрической форме. Изоэлектрическая точка — это когда молекулы имеют чистый нулевой заряд, хотя не существует значения pH, при котором молекулы имеют нулевой общий заряд или полное отсутствие отрицательных и положительных зарядов. Это означает, что белки и аминокислоты всегда будут в форме ионов и всегда будут иметь групповые заряды — положительные или отрицательные.
Различные группы аминокислот
Общие аминокислоты сгруппированы на основе полярности аминокислот с полярностью на основе боковой цепи или R-группы.
Аминокислоты группы 1
Аминокислоты группы 1 включают пролин, фенилаланин, метионин, валин, лейцин, глицин, аланин, триптофан, изолейцин и пролин. Эти аминокислоты группы 1 являются гидрофобными по природе, что означает, что они отталкивают воду. Эти белки способны складываться в трехмерную форму и охватывать гидрофобные боковые цепи внутри белка.
Изолейцин имеет в себе два атома углерода и представляет собой модифицированную молекулу обычного лейцина. Фенилаланин состоит из аланиновой группы и фенильной группы, как следует из названия. Метионин — это белок, содержащий атом серы, и он связан с трансляцией или биосинтезом белка. Метионин — это аминокислота, которая почти всегда запускает процесс трансляции. Уникальность пролина заключается в том, что это единственная аминокислота среди стандартных аминокислот, у которой нет свободной альфа-карбоксильной группы и свободной альфа-амино.
Аминокислоты группы 2
В то время как аминокислоты группы 1 неполярны, аминокислоты группы 2 полярны и незаряжены. Аминокислоты группы 3 включают глутамин, тирозин, серин, аспарагин, цистеин и треонин. Большинство этих аминокислот имеют атомы, которые могут создавать водородные связи с водой или другими молекулами. Тирозин является производным фенола и имеет гидроксильную группу. И треонин, и серин имеют алифатические гидроксильные группы. Цистеин имеет атом серы, хотя в отличие от атома серы, обнаруженного в метионине, сера цистеина химически активна.И глутамин, и аспарагин имеют амидные R-группы.
Аминокислоты 3-й группы
Аминокислоты 3-й группы являются кислыми аминокислотами. В этой группе всего две аминокислоты: глутаминовая кислота и аспарагиновая кислота. Обе эти кислоты имеют боковую цепь, содержащую карбоновую кислоту. Когда аминокислоты находятся при физиологическом pH и в водном растворе, функциональные части кислот ионизируются. В результате две аминокислоты получают общий заряд -1. Аминокислоты называются глутаматом и аспартатом в их ионных формах.
Боковые цепи аспартата и глутамата способны образовывать солевые мостики или ионные мостики. Эти боковые цепи также способны действовать как акцепторы водородных связей. Металлопротеины — это белки, которые связывают ионы металлов вместе, и они имеют глутаматные или аспартатные боковые цепи в областях связывания с металлами. И глутамин, и глутамат участвуют в метаболизме аминокислот, а глутамат — нейромедиатор, обнаруженный в центральной нервной системе.
Аминокислоты группы 4
Химическая структура аминокислоты лизина.Фото: NEUROtiker — собственная работа, Public Domain, https://commons.wikimedia.org/w/index.php?curid=1637097Аминокислоты группы 4 являются основными аминокислотами, в их число входят лизин, аргинин и гистидин. . Основная природа боковых цепей означает, что они способны принимать протоны. Общий заряд аргинина и лизина равен +1, когда они находятся при физиологическом pH. Аргинин имеет гуанидиногруппу в боковой цепи и из всех R-групп является самой основной. Лизин и аргинин похожи на глутамат и аспартат, поскольку они способны образовывать ионные связи со своими боковыми цепями.
Гистидин имеет имидазольную боковую цепь, которая позволяет ему функционировать как в качестве основного, так и в качестве кислотного катализатора, когда pH близок к физиологическому. Поскольку другие стандартные аминокислоты не обладают такой способностью, гистидин является аминокислотой, которая часто служит активной областью для белковых ферментов.
Протеиногенные аминокислоты
Аминокислоты, которые создают белки во время трансляции, известны как протеиногенные аминокислоты. Его природа содержит 22 генетически закодированных аминокислоты, хотя у эукариот есть только 21 из этих аминокислот, 20 из которых являются частью их обычного кода ДНК.Люди способны производить 12 из этих аминокислот из различных молекул, и эти аминокислоты, которые могут метаболизироваться, называются заменимыми аминокислотами. Остальные девять аминокислот должны быть получены путем употребления в пищу других организмов, и они называются незаменимыми аминокислотами.
21 аминокислота, непосредственно продуцируемая путем синтеза белка:
Аргинин, гистидин, лизин, аспарагиновая кислота, глутаминовая кислота, серин, треонин, аспарагин, глутамин, цистин, селеноцистеин, глицин, пролин, аланин, изолейцин, Лейцин, метионин, фенилаланин, триптофан, тирозин, валин
Незаменимые аминокислоты
21 аминокислота, которую используют человеческие клетки.Фото: Dancojocari — собственная работа Распечатайте это здесь Это векторное изображение, не указанное W3C, было создано с помощью Adobe Illustrator. I Исходный код этого SVG действителен. CC BY-SA 3.0, https://commons.wikimedia.org/w/index. php? curid = 9176441Незаменимыми аминокислотами являются валин, триптофан, метионин, лейцин, изолейцин, лизин, гистидин, фенилаланин, треонин. Эти белки необходимо получать, поедая другие организмы.
Фенилаланин используется для создания норадреналина, адреналина, тирозина и дофамина.Валин используется для регенерации клеток, выработки энергии и ускорения роста мышц. Треонин участвует в производстве эластина и коллагена, которые являются важными частями соединительной ткани и кожи. Триптофан необходим для регулирования настроения, сна и аппетита. Метионин — еще одна аминокислота, необходимая для роста тканей. Метионин также позволяет организму усваивать селен и цинк.
Лейцин необходим для регулирования уровня сахара в крови, выработки гормонов роста и заживления ран, так как он необходим как для восстановления мышц, так и для синтеза белка.Изолейцин — это модифицированная версия лейцина, он необходим для метаболизма в мышцах (он также содержится в больших концентрациях в мышечной ткани). Лизин участвует в абсорбции кальция, производстве различных ферментов и гормонов и синтезе белков. Лизин также важен для иммунной системы, выработки эластина и коллагена и выработки энергии.
Гистидин необходим для производства гистамина. Гистамин необходим для многих различных неврологических функций, поскольку он является нейромедиатором.В частности, гистидин участвует в контроле циклов сна и бодрствования, пищеварения, реакций иммунной системы и сексуальной функции. Гистидин также необходим для поддержания миелиновой оболочки, которая изолирует и защищает нервные клетки от деградации. Недавние исследования показывают, что гистидин может вырабатываться организмом, если он имеет достаточное количество восьми других аминокислот.
Хотя это основные незаменимые аминокислоты, есть несколько аминокислот, которые необходимы только при определенных условиях, например, если вы больны или находитесь в состоянии сильного стресса, и ваше тело не может удовлетворить потребность в этих аминокислотах.



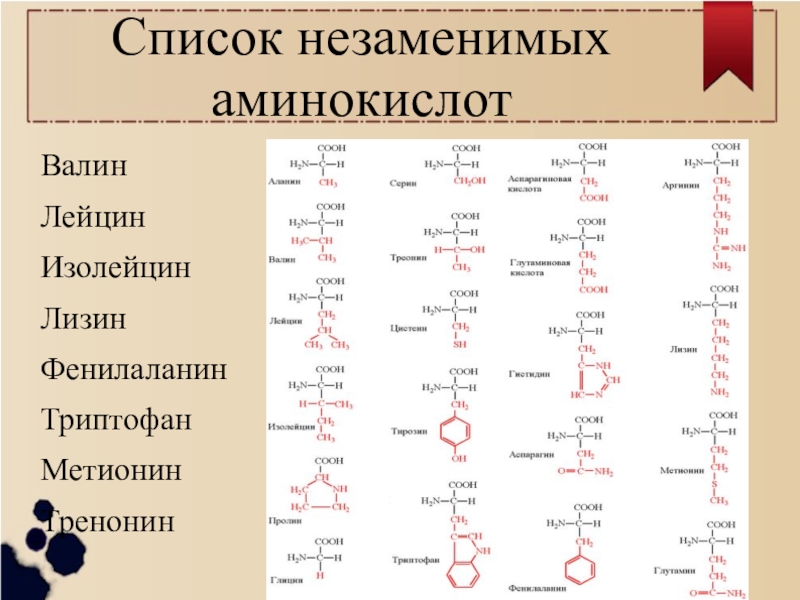

 Патология вызвана мутированным геном РАН.
Патология вызвана мутированным геном РАН.


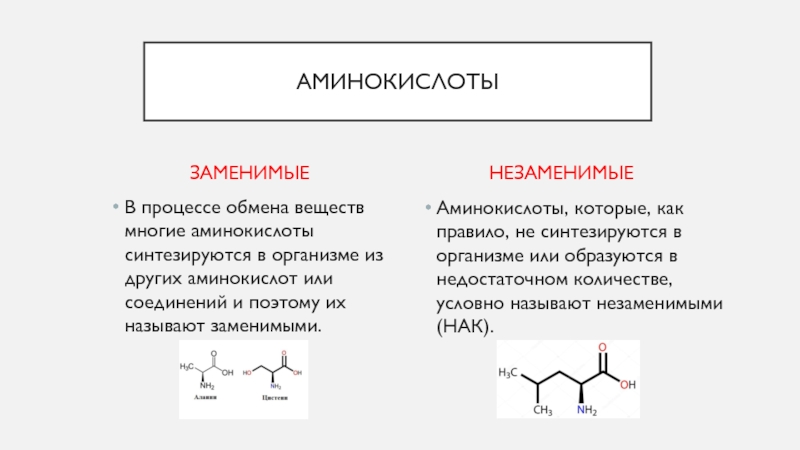


 почте;
почте;