Десять причин включить гранат в свой рацион
Сегодня речь пойдет о том, зачем включать гранат в свой ежедневный рацион. Хотя чистить его довольно непросто, это вовсе не повод отказываться от столь полезного продукта.
Не зря на Востоке гранат называют королем всех плодов, ведь он обладает поистине фантастическим химическим составом, который способен укрепить иммунную систему человека и помочь справиться со многими проблемами и даже серьезными заболеваниями.
Особенно богат гранат витаминами А, Е, С и группы В, фосфором и кальцием, йодом и железом, а также калием, натрием и магнием. Но давайте подробнее рассмотрим этот уникальный и идеально сбалансированный состав, а также его влияние на различные системы нашего организма.
1. Аминокислоты
Как известно, именно аминокислоты являются тем самым строительным материалом для всех клеток нашего организма, и большую часть из них мы получаем, употребляя в пищу мясо, курицу и яйца. Однако ученые выяснили, что в гранате содержится 15 различных аминокислот, некоторые из которых в растительной пище встречаются крайне редко. Именно поэтому для вегетарианцев гранат может стать абсолютно незаменимым продуктом.
Именно поэтому для вегетарианцев гранат может стать абсолютно незаменимым продуктом.
2. Семейные радости
Гранат можно с уверенностью назвать семейным фруктом, ведь ни один другой плод не действует на мужской и женский организмы одинаково позитивно, как этот. Он помогает восстановить гормональный фон как у женщин, так и у мужчин, а следовательно, наладить сексуальную жизнь. Кроме того, женщинам употребление граната помогает при болезненных менструациях и в период климакса. А вот мужчины, регулярно пьющие гранатовый сок, навсегда могут забыть о проблемах с потенцией.
3. Острое зрение
В современном мире неблагоприятное воздействие на глаза увеличивается с каждым днем и в наших силах его минимизировать не только сократив время перед экранами компьютеров и телевизоров, но и оказав организму необходимую витаминную поддержку. Отличным вариантом для этого является гранат. Благодаря витамину А и антоцианам, входящим в состав граната, активизируются обменные процессы в тканях глаза, что способствует улучшению зрения. Это актуально всегда, но особенно часто специалисты советуют есть гранат или пить гранатовый сок пожилым людям для предупреждения развития куриной слепоты и катаракты.
Это актуально всегда, но особенно часто специалисты советуют есть гранат или пить гранатовый сок пожилым людям для предупреждения развития куриной слепоты и катаракты.
4. Помощь худеющим
Гранат — просто незаменимый продукт для худеющих. Помимо достаточно низкой калорийности (около 60 ккал на 100 граммов), он улучшает метаболизм, выводит токсины и улучшает пищеварение. А эти 3 процесса являются основой здорового похудения. Достаточно добавить всего несколько зернышек граната в салат или полить гранатовым соусом мясо — и можете быть уверены, что вся пища переварится, а не отложится под кожей в виде жира.
5. Косметичка в одном фрукте
Советуем обратить особое внимание на гранат людям с проблемной кожей. Входящие в его состав лимонная, яблочная, щавелевая и другие органические кислоты помогут вам избавиться от веснушек, пигментных пятен и угревой сыпи, сделав кожу светлее и ровнее. Попробуйте, например, смешать небольшое количество сметаны с чайной ложкой свежевыжатого гранатового сока и нанести такую маску на лицо на 10 минут. Но будьте осторожны и проверьте сначала на закрытом участке кожи, нет ли у вас аллергии.
Но будьте осторожны и проверьте сначала на закрытом участке кожи, нет ли у вас аллергии.
6. Помощь сердцу и сосудам
О кавказском здоровье и долголетии ходят легенды, а между тем регулярное употребление в пищу гранатов играет здесь не последнюю роль. Вспомните, как часто используются их зерна, например, в грузинской кухне. Гранат имеет свойство снижать артериальное давление за счет выведения лишнего холестерина и очищения сосудов. Кроме того, он является отличным профилактическим средством против атеросклероза.
7. Антиоксидант
Наличие витаминов С и Е в химическом составе гранатов уже говорит об антиоксидантных свойствах этого фрукта. Но помимо них, гранат содержит уникальное вещество пуникалагин, которое в тандеме с эллаговой кислотой, также присутствующей в составе этого экзотического плода, является не просто мощным антиоксидантом, а еще и обладает способностью выводить радиацию из организма. Так что для людей, работающих на вредных производства, гранат — необходимый элемент рациона.
8. Вяжущее и дезинфицирующее действие
Благодаря высокому содержанию дубильных веществ, гранат рекомендуют при расстройствах желудка. И хотя максимальное количество этих веществ сосредоточено в коре, соке и гранатовых корках, их достаточно для борьбы с такой проблемой, как диарея. Также отваром из корок можно полоскать горло при ангине или рот при кровоточивости десен.
9. Природное жаропонижающее
Ученые доказали способность граната снижать высокую температуру и облегчать течение острых вирусных заболеваний. Важен и тот факт, что добавление граната в ежедневный рацион, особенно в зимний период, укрепляет иммунитет и помогает предотвратить простудные заболевания.
10. И немного о противопоказаниях
С особой осторожностью к гранатам стоит отнестись беременным и кормящим грудью женщинам и по возможности проконсультироваться с врачом. Постарайтесь ограничить потребление этого фрукта, если у вас пониженное давление или склонность к аллергии. А тем, кто страдает серьезными проблемами с пищеварительной системой, такими как язва, панкреатит или гастрит в стадии обострения, а также геморрой, от гранатов лучше полностью отказаться.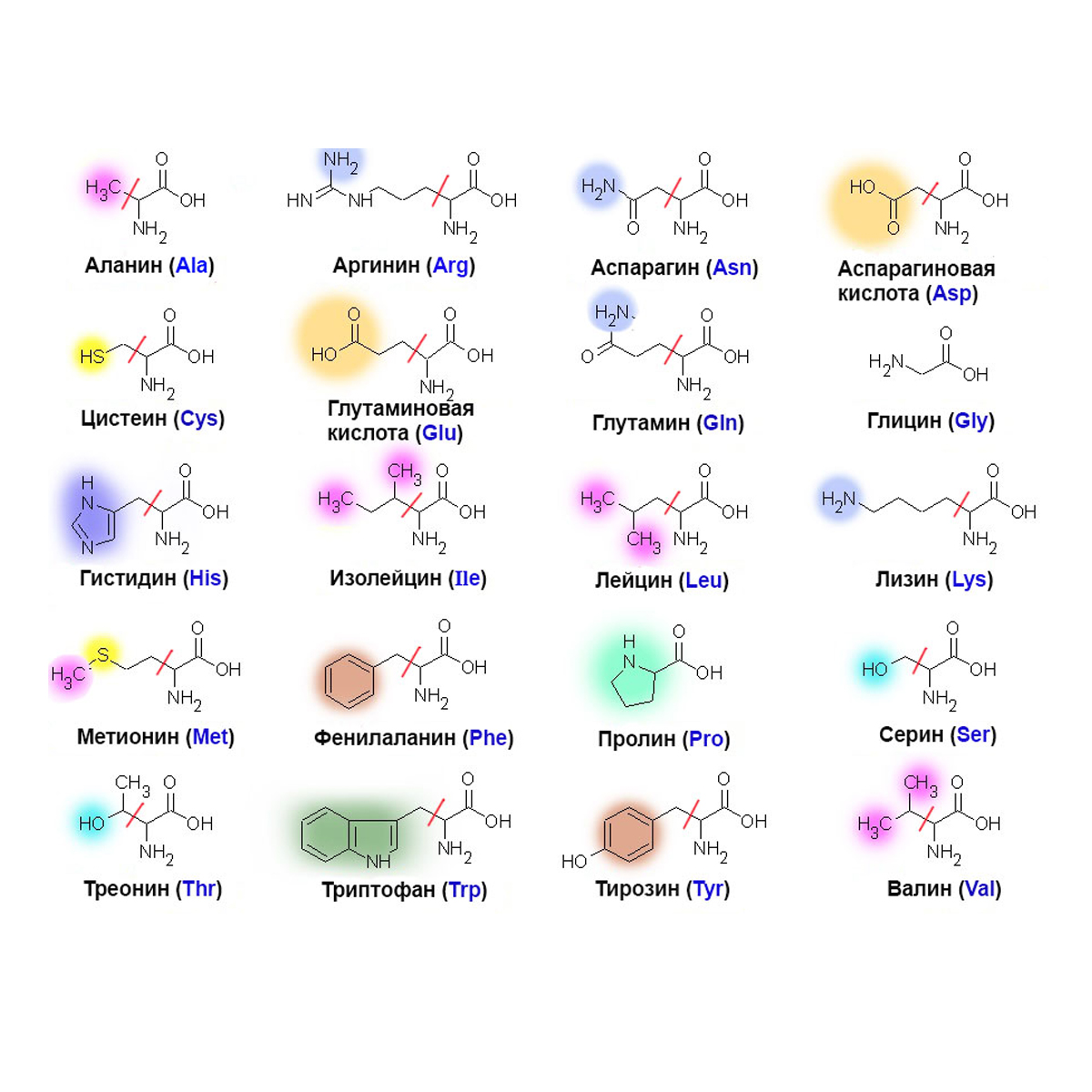
#нацпроектдемография89
L-лизин для профилактики и лечения рака, заболеваний кишечника, мозга, герпеса
L-лизин: полезные свойства, побочные эффекты
Знали ли Вы, что белок может помочь справиться со множеством недугов, от герпеса до рака? А L-лизин просто незаменим при его формировании.
L-лизин используется для лечения вируса герпеса и восстановления после тренировок. Однако полезных свойств у этой кислоты намного больше.
L-лизин может быть полезен во многих случая, среди которых лечение тревожности и диабета. Эта аминокислота присутствует в продуктах питания, ее также можно приобрести в виде пищевой добавки.
Что такое L-лизин?
L-лизин — незаменимая аминокислота. Некоторые аминокислоты известны как «строительные блоки белка» и необходимы для правильной работы множества процессов, в том числе и роста.
L-лизин был открыт немецким ученым Дрешелем в 1889 году.
Среди сотен аминокислот, присутствующих в природе, 20 необходимы для синтеза и роста белка, и лишь половина из этих двадцати организм человека может производить сам. Оставшиеся 10 называются «незаменимыми», потому что для поддержания здоровья человеку необходимо получать их пищи.
Дефицит аминокислот может привести к деградации внутренних клеток и появлению серьезных проблем со здоровьем, поэтому так важно следить за их достатком. Особенно часто встречается дефицит лизина и глютамина.
Незаменимые аминокислоты, как правило, являются стереоизомерами, то есть они существуют в двух вариантах, зеркально похожих друг на друга. Эти аминокислоты имеют D- и L-формы, L-формы используются для синтеза белка, они присутствуют в пище и пищевых добавках. Часто это питательное вещество называют просто «лизин».
L-лизин обладает множеством полезных свойств, он используется для лечения герпеса и тревожности. В качестве БАДа его можно применять перорально, однако лучше всего это вещество усваивается из продуктов питания. Он в большой концентрации присутствует в мясе, бобах, сыре и яйцах.
В качестве БАДа его можно применять перорально, однако лучше всего это вещество усваивается из продуктов питания. Он в большой концентрации присутствует в мясе, бобах, сыре и яйцах.
L-лизин очень важен для производства карнитина, который преобразует аминокислоты в энергию и снижает уровень холестерина в крови. Он также играет свою роль в усвоении кальция и производстве коллагена, который способствует росту и поддержанию здоровья костей и соединительных тканей, в том числе и кожи.
Польза для здоровья
Как природный противовоспалительный агент L-лизин помогает организму человека несколькими способами, многие из которых были изучены учеными относительно недавно.
1. Может уменьшить частоту появления герпеса
Часто L-лизин упоминается при разговоре о природных средствах против герпеса. Герпес возникает как результат действия вируса простого герпеса 1 типа (ВПГ-1). Около 67% населения нашей планеты младше 50 лет заражены этим вирусом, даже если они никогда не наблюдали у себя симптомов.
ВПГ-2 вызывает генитальный герпес, при этом 85% носителей этого заболевания даже не подозревают об этом.
Несмотря на противоречивость исследований по данному вопросу большинство людей, использующих L-лизин для лечения герпеса, считают его очень эффективным. Некоторые исследования говорят о том, что L-лизин способствует уменьшению частоты вспышек ВПГ, в то время как другие говорят о сохранении частоты возникновения, однако они наблюдали уменьшение периода обострения заболевания.
Большинство экспертов согласны, что L-лизин не может избавить от герпеса, но он способствует снижению частоты и/или тяжести его протекания.
Одно исследование, использовавшее крем, сочетающий в себе L-лизин, лекарственные травы и цинк, показало, что у 87% пациентов герпес исчез на шестой день лечения. Эти результаты особенно примечательны, так как обычно вспышки длятся около 21 дня.
Принцип, согласно которому это вещество избавляет от герпеса, не до конца понятен. Одной из причин может быть взаимодействие с аргинином, другой аминокислотой, которая производится в организме в небольшом количестве. Аргинин демонстрирует увеличение скорости репликации клеток вируса герпеса, а большое количество L-лизина в организме уменьшает активность аргинина.
Одной из причин может быть взаимодействие с аргинином, другой аминокислотой, которая производится в организме в небольшом количестве. Аргинин демонстрирует увеличение скорости репликации клеток вируса герпеса, а большое количество L-лизина в организме уменьшает активность аргинина.
L-лизин способен воздействовать не только на ВПГ-1, но и на ВПГ-2, смягчая протекание генитального герпеса. Однако необходимы более тщательные исследования.
2. Может помочь в лечении рака
Ученые активно ищут натуральные методы лечения рака, так как традиционное лечение (например, химиотерапия или лучевая терапия) оказывают сильное негативное действие не только на больные, но и на здоровые клетки. Ученые сделали большой прорыв в этой области, открыв множество способов использования питательных веществ, присутствующих в продуктах питания и окружающей среде, в терапевтических целях, в частности, для уничтожения злокачественных клеток в обход здоровых.
В 2007 году ученые из Университета штата Флорида, США, изучили влияние «конъюгатов лизина» на поврежденные нити ДНК, похожие на те, что присутствуют в раке. Оказалось, что это вещество может найти поврежденную нить путем идентификации в ней «расщепления» (поврежденного участка) и отделения остальной части нити. Клетка, как правило, не способна восстанавливать это повреждение, таким образом происходит апоптоз, смерть клетки.
Оказалось, что это вещество может найти поврежденную нить путем идентификации в ней «расщепления» (поврежденного участка) и отделения остальной части нити. Клетка, как правило, не способна восстанавливать это повреждение, таким образом происходит апоптоз, смерть клетки.
Чем больше мы узнаем о лизине, тем лучше понимаем, как эффективен он может быть для лечения онкологических заболеваний. Противораковые свойства конъюгатов лизина активируются только при воздействии определенных типов света. Это позволяет ученым и врачам применять лечение точечно и непосредственно на раковые клетки, активируя вещества там, где они действительно нужны.
Ученые Университета штата Флорида обнаружили от 25% до 90% уничтоженных раковых клеток. Это поразительные результаты!
Действие лизиноксидазы было изучено в 2014 году на примере колоректального рака у мышей. В ходе этого исследования инъекции лизиноксидазы привели к нулевой смертности и значительному уменьшению крупных опухолей. Результаты говорят об этом веществе, как о многообещающем агенте для лечения колоректального рака в будущем.
Результаты говорят об этом веществе, как о многообещающем агенте для лечения колоректального рака в будущем.
Согласно предварительным исследованиям, рак, связанный с костным мозгом, например, лейкемия, может также быть чувствителен к лечению L-лизином. Ученые полагают, что инъекции L-лизина способствуют предотвращению генотоксичности (повреждений ДНК и РНК) в клетках, находящихся под воздействием прораковых веществ.
3. Борется с чувством тревоги и другими психологическими симптомами
Помимо потребления продуктов, богатых витаминами группы В, магнием и омега-3 жирными кислотами, прием L-лизина также способствует снятию тревожности. Одним из главных принципов лечения тревожности L-лизином заключен в том, что он способствует усвоению кальция, который успокаивает нервную систему.
Помимо более эффективного усвоения кальция L-лизин выступает в роли антагониста серотониновых рецепторов. Это означает, что он частично связывается с рецепторами серотонина, предотвращая развитие чувства тревоги.
Так, одно исследование выявило, что L-лизин помогает уменьшить тревожную реакцию вызванную стрессом (в том числе диарею).
Это особенно важно в странах, где основным продуктом питания является пшеница. В таких странах люди страдают дефицитом L-лизин гораздо чаще.
Ученые полагают, что коррекция рациона питания в странах с высоким потреблением пшеницы способствует снижению тревожности, вызванной стрессом, и, как результат, появления диареи.
L-лизин может быть эффективен при лечении шизофрении, которая является одним из наиболее серьезных последствий тревоги. Предварительные результаты исследований говорят о том, что добавка в виде L-лизина на фоне традиционной терапии может уменьшить симптомы шизофрении. Однако стоит отметить, что рекомендованная дозировка и продолжительность лечения еще не установлены.
4. Способствует усвоению кальция
Потребление L-лизина связано с повышенной усвояемостью кальция, защитой костей и снижением риска развития остеопороза.
На самом деле, кальций нужен не только костям. Достаточное потребление кальция связано с:
- Нормальным весом
- Профилактикой рака
- Снятием симптомов ПМС
- Здоровьем зубов
- Крепкими мышцами
- Здоровой нервной системой
- Профилактикой диабета
Спортсмены часто принимают L-лизин в качестве добавки для повышения выносливости. Это тоже может быть связано с тем, что L-лизин способствует усвоению кальция.
5. Борется с осложнениями, вызванными диабетом
Все пациенты, страдающие диабетом, сталкиваются с повышенным риском развития инфекции и другими проблемами. В последнее время все больше внимания уделяется присутствию конечных продуктов гликирования (КПГ).
Эти КПГ участвуют в процессе старения, но у пациентов, страдающих диабетом, они присутствуют в особенно большом количестве. Они связаны со множеством недугов, вызванных диабетом, что заставило ученых начать поиски путей предотвращения накопления КПГ в организме.
Исследования предполагают, что L-лизин может способствовать замедлению формирования КПГ у диабетиков путем блокировки специфических путей гликирования, которые их производят. Это поможет защитить организм от инфекции. Таким образом, в диабетическое питание просто необходимо включать L-лизин в виде продуктов или пищевых добавок.
6. Поддерживает здоровье кишечника
Синдром «дырявого» кишечника является очень распространенным недугом, о котором многие даже не знают. При этом заболевании слизистая пищеварительного тракта позволяет частицам более крупного размера выходить из пищеварительной системы и попадать в другие части тела. Это вызывает аллергические реакции, потерю энергии, боль в суставах, аутоиммунные заболевания и проблемы с щитовидной железой.
Недавно было обнаружено, что форма L-лизина под названием поли-L-лизин оказывает противовоспалительное действие на поверхность кишечника. Конечно, чтобы понять как именно эта аминокислота способна улучшить состояние кишечника и предотвратить развитие синдрома «дырявого» кишечника, необходимы дальнейшие исследования.
Известно также, что L-лизин подавляет развитие панкреатита, воспаление поджелудочной железы.
Пищевые источники
Самым эффективным способом поддержания высокого уровня лизина в организме является потребление продуктов, богатых этой аминокислотой.
При этом стоит отметить, что традиционные методы приготовления продуктов могут понизить их питательную ценность. К таким методам относится восстановление с помощью сахаросодержащих веществ, нагревание в присутствии дрожжей или сахарозы, обработка в отсутствии жидкости.
Самым высоким содержанием лизина обладают следующие продукты:
- Нежирная говядина и баранина — 3 582 мг/100 грамм (171% от РСН)
- Сыр пармезан — 3 306 мг/100 грамм (157% от РСН)
- Индейка и курица — 3 110 мг/100 грамм (148% от РСН)
- Свинина — 2 757 мг/100 грамм (131% от РСН)
- Жареные соевые бобы — 2 634 мг/100 грамм (125% от РСН)
- Тунец — 2 590 мг/100 грамм (123% от РСН)
- Креветки — 2 172 мг/100 грамм (103% от РСН)
- Семена тыквы — 1 386 мг/100 грамм (66% от РСН)
- Яйца — 912 мг/100 грамм (43% от РСН)
- Белые бобы — 668 мг/100 грамм (32% от РСН)
Несмотря на то, что все эти продукты богаты лизином, мы рекомендуем по возможности избегать потребления свинины, сои и креветок, так как они часто содержат токсины. Что касается других видов мяса, сыров и яиц, убедитесь, что на Вашем столе присутствуют органические продукты высокого качества.
Что касается других видов мяса, сыров и яиц, убедитесь, что на Вашем столе присутствуют органические продукты высокого качества.
Дозировка
Все питательные вещества всегда лучше получать из продуктов питания, а не из пищевых добавок. В этом случае Ваш организм получает больше веществ без риска передозировки.
Однако БАДы могут быть очень полезны в случае, когда Вы не можете получить рекомендуемую норму какого-то определенного вещества из пищи.
Среднестатистический человек (весом около 70 кг) должен получать от 800 до 3 000 мг L-лизина каждый день.
При герпесе его количество в виде пищевой добавки должно быть 1-3 грамма ежедневно. Лизин также доступен в форме крема, который наносят непосредственно на пораженный герпесом участок.
Риски и побочные эффекты
Дополнительный прием L-лизина связан с рядом незначительных побочных действий, в то время как опасность пищевого лизина не доказана. К таким побочным действиям относятся боль в желудке и диарея.
К таким побочным действиям относятся боль в желудке и диарея.
Был также зафиксирован один случай заболевания почек, связанного с приемом лизина, по этой причине людям, страдающим заболеваниями почек и печени следует принимать L-лизин с осторожностью и под наблюдением специалиста.
Женщинам в период беременности и кормления грудью следует отказаться от дополнительного приема лизина, так как ученые пока не обладают достаточной информацией о действии добавки L-лизина на женщин в этот период.
Несмотря на положительное действие на ряд заболеваний существует информация о том, что L-лизин способен увеличить вирусную нагрузку у пациентов с ВИЧ. Мы советуем людям, страдающим ВИЧ/СПИД, полностью отказаться от L-лизина в форме пищевых добавок и получать это вещество только из пищи (она, вероятно, не оказывает подобного действия).
Однако ученые также заметили, что это свойство можно использовать для ускорения тестирования методов лечения ВИЧ.
Финальные выводы
- L-лизин или L-форма лизина необходима организму для синтеза белка. Эта незаменимая аминокислота не производится человеком, ее можно получить только из продуктов питания и/или пищевых добавок. L-лизин также выпускается в форме крема для наружного применения.
- Чаще всего L-лизин используется для лечения вируса простого герпеса. Однако он обладает рядом свойств, которые помогают ему бороться с онкологическими заболеваниями, уменьшая размер новообразований и вызывая смерть раковых клеток, не повреждая при этом здоровые.
- Потребление продуктов, богатых лизином, является самым эффективным способом увеличить уровень аминокислоты в организме и получить от нее максимум пользы.
- Человеку в среднем необходимо 800-3 000 мг L-лизина в сутки.
Оставьте свою заявку на нашем сайте, и мы с Вами свяжемся.
Флуоресценция белка может быть эффективным индикатором химической и радиационной токсичности
Красноярские ученые предложили использовать для изучения и регистрации токсичности простейшую биологическую систему — целентерамид-содержащие флуоресцентные белки.
Механизмы токсических эффектов представляют собой наиболее злободневный предмет фундаментальных исследований в области токсикологии. Известно, что токсичность — биологическое понятие; оно означает подавление физиологических функций организмов под действием химических агентов или радиации. Количественно токсичность определяется с помощью биотестовых систем; в качестве таких систем возможно использование организмов различной сложности — начиная от высших и заканчивая клеточными.
Обычно наибольший интерес вызывает токсическое воздействие на сложные биосистемы, такие как человеческий организм или высшие животные. Вместе с тем, изучение токсических эффектов с использованием более простых «кирпичиков» этих организмов — клеток или ферментативных реакций — позволяет понять механизмы токсических эффектов, соответственно, на клеточном или биохимическом уровне. Так, например, понимание биохимических механизмов токсичности дает возможность создавать лекарственные препараты направленного действия.
Недавно красноярские ученые предложили использовать для изучения токсичности еще более простую биологическую систему — особые флуоресцентные белки. Они полагают, что использование этих белков способно перевести понимание токсических эффектов на базовый уровень — уровень элементарных физико-химических процессов.
Сотрудники Института биофизики КНЦ СО РАН и Сибирского федерального университета (Красноярск) давно изучают токсические эффекты с помощью биотестовых систем, способных испускать свет — люминесцировать. Люминесценция — физическое явление, ее интенсивность регистрируется с помощью простых физических приборов. Именно поэтому люминесцентное биотестирование токсичности широко распространено в мировой практике. Наиболее часто используются люминесцентные морские бактерии — одноклеточные организмы, которые встречаются в море как в свободном виде, так и в светящихся органах рыб. В последние десятилетия набирают популярность ферментативные люминесцентные биотесты, то есть ферментативные реакции светящихся бактерий. Недавно сибирскими учеными предложено использование целентерамид-содержащих флуоресцентных белков, которые являются продуктами биолюминесцентных реакций некоторых морских светящихся кишечнополостных — медуз, полипов. В отличие от «зеленых» флуоресцентных белков, которые в настоящее время широко используются в качестве флуоресцентных меток в медицинских и биологических исследованиях, целентерамид-содержащие белки не получили широкого признания, и их потенциал явно недооценен. Спектры флуоресценции этих белков могут варьироваться за счет формирования различных флуоресцентных форм. Соотношение между этими формами определяется эффективностью фотохимического переноса протона, а она, в свою очередь, зависит от воздействия токсичных веществ на белковый комплекс.
Известно, что флуоресцентные белки состоят из ароматического флуорофора и полипептида. Флуорофором целентерамид-содержащих белков, как следует из их названия, является молекула целентерамида, образующая комплекс с полипептидом. Входящая в состав комплекса молекула целентерамида, фотохимически активна; при возбуждении светом она способна к отдаче протона, как показано на рис. 1.
Перенос протона меняет цвет флуоресценции целентерамида: форма целентарамида, содержащая протон, характеризующаяся «фиолетовой» флуоресценцией, депротонированная форма характеризуется «сине-зеленой» флуоресценцией.
Ученые Красноярска показали, что термические, химические и радиационные воздействия изменяют спектры флуоресценции целентерамид-содержащего белка. В качестве примера такого белка они использовали «разряженный обелин» — продукт биолюминесцентной реакции морского кишечнополостного обелии. На рис. 2 представлены спектры флуоресценции этого белка. Из рисунка видно, что воздействие химических агентов или радиации изменяет вклады цветных компонент — увеличивает вклад фиолетовой и уменьшает вклад сине-зеленой флуоресценции. Токсический эффект оценивается именно по изменению вкладов этих компонент.
Возможность использования целентерамид-содержащих белков для оценки химической и радиационной токсичности обоснована в недавнем обзоре красноярских ученых (Talanta, 2017). Преимущества использования этих белков связаны с их фотобиологической активностью: так как перенос протона в возбужденном состоянии — чрезвычайно быстрый (наносекундный) процесс, скорость одного измерения лимитируется только длительностью регистрации спектра флуоресценции. Причем воспроизводимость этих измерений высока; она соответствует воспроизводимости физических экспериментов. Это важно для решения проблемы воспроизводимости биологических измерений, которая всегда возникает при использовании организмов и ферментативных реакций.
Последнее исследование красноярских ученых было связано с изучением воздействия на флуоресцентный белок низкодозовой радиации. Оно выполнено в сотрудничестве с коллегами из Московского государственного университета (кафедра радиохимии), результаты опубликованы в журнале Analytical&Biochemical Chemistry. В качестве радиоактивного элемента в этих экспериментах выбран тритий, бета-излучающий изотоп водорода, который принято считать одним из наименее токсичных радиоизотопов.
На рис. 3 показано изменение вкладов фиолетовой и сине-зеленой компонент спектра флуоресценции белка под действием трития. Тритий входил в состав тритиевой воды, которую добавляли в раствор белка. Наблюдения проводили в течение 18 суток. Максимальная доза радиоактивности, накопленная образцом белка, оказалась равной 0,28 Грей, что близко к условной границе малых доз. Из рисунка видно, что воздействие трития приводит к увеличению вклада фиолетовой и уменьшению вклада сине-зеленой компонент по сравнению с контрольными образцами. Видно также, что даже сутки воздействия трития (соответствующего дозе 0,03 Грей) вызывают заметные изменения вкладов цветных компонент, что указывает на высокую чувствительность белка к низкодозовому излучению.
Таким образом, красноярскими учеными предложен принципиально новый подход к изучению токсичности с использованием простейшей биотестовой системы — флуоресцентного белка, его фотобиологических свойств и регистрации флуоресценции «цветных» компонент фотобиологического процесса. Предлагаемый подход переводит понимание токсических эффектов на уровень элементарных физико-химических процессов.
Надежда Кудряшева, доктор физико-математических наук, ведущий научный сотрудник Института биофизики Сибирского отделения РАН, ФИЦ КНЦ СО РАН
Тритий и его биологическая активность
Тритий в малых количествах всегда присутствует в окружающей среде, в основном в виде тритиевой воды, так как он постоянно образуется под действием космического излучения в верхних слоях атмосферы. До начала ядерной эры концентрация трития в природной воде была достаточно низкой — один атом трития на 1018 атомов нерадиоактивного изотопа водорода, протия. Однако после проведения испытаний термоядерного оружия в атмосфере (конец 50-х — начало 60-х годов ХХ века) концентрация трития повысилась почти в 1000 раз. И хотя после прекращения испытаний концентрация трития снижалась, в последние годы наблюдается локальное увеличение содержания трития в окружающей среде как результат работы атомных электростанций.
В процессе распада тритий (3H) превращается в положительно заряженный изотоп гелия-3 с испусканием электрона и антинейтрино. Максимальный пробег образующихся при распаде бета-частиц (электронов) в воздухе 5,8 мм при 20?С, в биологической ткани — 6,5 мкм. Бета-частицы трития полностью поглощаются роговыми слоями кожи, так что внешнее облучение организма тритием и его соединениями не представляет опасности. Опасно его попадание в организм через кожу, легкие или при приеме пищи и воды и распад уже в организме. Являясь изотопом водорода, тритий химически ведет себя так же, как и нерадиоактивный водород (протий), и поэтому способен замещать его во всех соединениях с кислородом, серой, азотом, легко проникая в протоплазму любой клетки. В этом случае распад трития способен серьезно повредить внутриклеточные структуры, включая генетический аппарат клеток.
Предложенный красноярскими учеными подход переводит понимание токсических эффектов на уровень элементарных физико-химических процессов
Важную роль в физико-химических процессах, сопровождающих распад трития, играет перераспределение электронной плотности в среде. При распаде трития возникает бета-частица и положительно заряженный ион гелия-3. Последняя частица чрезвычайно активна, она склонна к акцептированию электрона из окружающей среды (например, ближайшей органической молекулы) с образованием устойчивой оболочки инертного газа. При этом инициируются катион-радикалы различной активности. Таким образом, продукты бета-распада трития способны запускать (или активизировать) цепи переноса заряда/электрона в биохимических процессах. В результате описанных процессов локальное воздействие при распаде трития может быть достаточно эффективным. Поэтому изучение биологических эффектов трития является одной из актуальных задач современной биофизики и радиобиологии и имеет практическое значение для безопасного развития атомной индустрии.
Словарь
Флуорофор — фрагмент молекулы, придающий ей флуоресцентные свойства.
Пептид, полипептид, белок —
Аминокислоты способны соединяться связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40-50 аминокислот — полипептид, если аминокислот больше — белок.
Грей — единица поглощенной дозы ионизирующего излучения в Международной системе единиц. Доза равна одному грею, если в результате поглощения ионизирующего излучения вещество получило один джоуль энергии на один килограмм массы.
Белки сравнили со Вселенной. Почему белковая цепь находит единственно верную укладку среди многих вариантов
Как сворачиваются белкиКаждая клетка нашего тела является фабрикой по производству белков. Часть из них производится для внутреннего пользования, для поддержания жизни клетки, а другая часть «идет на экспорт». Все свойства белковых молекул (в том числе способность изумительно точно катализировать превращения других молекул в клетке) зависят от пространственной структуры белка, причем структура каждого белка уникальна.
Пространственная структура образуется уникальной укладкой белковой цепи, состоящей из разных аминокислотных остатков (бусинок разных цветов — рис. 1). Последовательность аминокислот в цепи белка определяется его геномом и синтезируется рибосомой, после чего пространственная структура цепи формируется «сама собой» в ходе сворачивания белковой цепи, которая выходит из рибосомы еще практически неупорядоченной.
Образование уникальной белковой глобулы из неупорядоченной цепи (как и ее разворачивание) требует преодоления «барьера», имеющего вид нестабильной «полусвернутой» глобулы (рис.1). Источник: Алексей Финкельштейн.
Сворачивают эту цепь взаимодействия ее аминокислот, причем в одну и ту же структуру — как в организме, так и в пробирке. Разнообразие возможных укладок одной и той же цепи невообразимо велико. Но у заданной последовательности аминокислот есть, как правило, только одна стабильная («правильная») структура, которая и придает белку его уникальные свойства. Стабильна же она потому, что именно она обладает минимальной энергией.
Тот же принцип действует при образовании кристаллов: вещество приобретает ту структуру, энергия связей в которой минимальна.
Что общего у белка и ВселеннойЗдесь перед учеными возник вопрос: как белковая цепь может спонтанно «найти» свою единственную стабильную структуру, если перебор колоссального числа всех вариантов (порядка 10100 для цепи из 100 аминокислотных остатков) занял бы времени больше, чем время жизни Вселенной. Этот «парадокс Левинталя», сформулированный полвека назад, был решен только теперь. Для его решения пришлось привлечь методы теоретической физики.
Кристаллы различных белков, выращенные на космической станции «Мир» и во время полетов шаттлов NASA. Источник: NASA Marshall Space Flight Center
Ученые из Института белка Российской академии наук (ИБ РАН) создали теорию скоростей образования пространственных структур молекул белка. Результаты работы были недавно опубликованы в журналах AtlasofScience, ChemPhysChem и «Биофизика». Работа поддержана грантом Российского научного фонда (РНФ).
«Способность белков спонтанно формировать свои пространственные структуры за считаные секунды или минуты — давняя загадка молекулярной биологии.
В нашей работе представлена физическая теория, позволяющая оценить скорость этого процесса в зависимости от величины белков и сложности их устройства», — начинает рассказ о своей работе член-корреспондент РАН, доктор физико-математических наук, главный научный сотрудник Института белка РАН, руководитель гранта РНФ Алексей Финкельштейн.
«Давно известно, что белковая цепь приобретает свою уникальную структуру при одних условиях среды, а при других (например, при подкислении или подогреве раствора) эта структура разворачивается. На стыке этих условий уникальная структура белка находится в динамическом равновесии с развернутой формой его цепи, — продолжает он. — Процессы сворачивания и разворачивания там сосуществуют, их физика наиболее прозрачна. Поэтому мы сосредоточились именно на таких равновесных и квазиравновесных условиях — в отличие от других исследователей, которые как будто резонно (но ошибочно, как оказалось) полагали, что путь к тайне сворачивания белка надо искать там, где оно протекает наиболее быстро».
Развернуть белок — хорошее начало, но не выход«Первый подход к проблеме Левинталя был разработан нами давно, — рассказывает Алексей Финкельштейн, — и заключался в следующем: так как теоретически проследить путь сворачивания белка очень трудно, нужно изучать процесс его разворачивания. Звучит парадоксально, но в физике существует принцип «детального равновесия», который гласит: любой процесс в равновесной системе протекает по тому же пути и с той же скоростью, что и обратный ему. И так как в динамическом равновесии скорости сворачивания и разворачивания одинаковы, мы рассмотрели более простой процесс разворачивания белка (ведь разломать проще, чем сделать) и охарактеризовали тот «барьер» (см. картинку 1), нестабильность которого определяет скорость процесса».
Следуя принципу детального равновесия, ученые из Института белка РАН оценили и «сверху», и «снизу» скорость сворачивания белков — как больших, так и маленьких, как с простой, так и со сложной укладкой цепи. Небольшие и просто устроенные белки сворачиваются быстрее (оценка скорости «сверху»), а большие и/или сложно устроенные — медленнее (оценка «снизу»). Значения всех остальных возможных скоростей сворачивания заключены между ними.
Однако не все биологи были удовлетворены полученным решением, так как, во-первых, их интересовал путь сворачивания (а не разворачивания) белка, а во-вторых, физический «принцип детального равновесия» был, по-видимому, им плохо понятен.
И работы продолжались: на этот раз учеными из ИБ РАН были произведены расчеты сложности сворачивания белка. Давно известно, что взаимодействия в белках связаны в основном с так называемыми вторичными структурами. Вторичные структуры — это стандартные, довольно крупные локальные «строительные блоки» белковой структуры, определяемые в основном локальными аминокислотными последовательностями в них. Количество возможных вариантов укладки таких блоков в структуру свернутого белка можно подсчитать, что и было сделано учеными из ИБ РАН. Число таких вариантов огромно — порядка 1010 (но далеко не 10100!) для цепи из порядка 100 аминокислот, и белковая цепь может, согласно теоретическим оценкам, «просканировать» их за минуты или — для более длинных цепей — за часы. Так была получена самая верхняя оценка времени сворачивания белка.
Регулярная вторичная структура – альфа-спираль. Источник: WillowW
Результаты, полученные двумя способами (т.е. при анализе и разворачивания, и сворачивания белка), сходятся и подтверждают друг друга.
«Наша работа имеет фундаментальное значение для конструирования в будущем новых белков для нужд фармакологии, биоинженерии, нанотехнологии, — заключает Алексей Финкельштейн.
— Вопросы скорости сворачивания белков актуальны, когда речь идет о предсказании структуры белка по его аминокислотной последовательности, а особенно — о дизайне новых, не встречающихся в природе белков».
«Что изменилось после получения гранта РНФ? Появилась возможность закупить новое современное оборудование и реактивы для работы (ведь наша лаборатория в основном экспериментальная, хотя я здесь рассказал только о нашей теоретической работе). Но главное: грант РНФ позволил специалистам заниматься наукой, а не искать подработку на стороне или в дальних краях», — говорит Алексей Финкельштейн.
TST + GH — Тестостерон
Описание- Комбинация специфических аминокислот
- С добавлением цинка, магния и витаминов группы В
- Безопасен, не содержит допинга
- Не содержит углеводов
- Не содержит гормонов и прогормонов
- Без глютена и аспартама
- Без консервантов
Повышает ваш потенциал до максимума естественным образом.
Гормон роста (ГР) – это белок, продуцируемый в передней доле гипофиза и состоящий 191 аминокислоты. Этот гормон способствует росту тела в подростковом возрасте. Во время сна – точнее, во время глубокого сна – гипоталамус регулирует секрецию ГР, который можно считать «положительным» гормоном, поскольку он стимулирует синтез белка и способствует сокращению жировых отложений. В возрастом, начиная с 35-40 лет, мышечная масса с каждым годом постепенно уменьшается. В то же время, с такой же интенсивностью начинают расти жировые запасы. Этот процесс объясняется резким снижением количества гормона роста. Наиболее эффективным и безопасным способом повышения уровня этого гормона является поддержание его производства в организме.
Тестостерон – самый важный мужской гормон.
У мужчин тестостерон образуется в семенниках, в то время как у женщин – в яичниках и надпочечниках, где производится минимальное количество тестостерона. Основная функция тестостерона, как известно, заключается в поддержании и усилении сексуальной активности, но он также играет важную роль в наращивании мышечной массы и формировании здорового тела. Тестостерон улучшает настроение у мужчин, повышая его энергетические уровни. Однако, с течением времени организм вырабатывает все меньше и меньше тестостерона, поэтому рекомендуется усилить его производство естественным путем – через упражнения, здоровое питание и пищевые добавки.
TST + GH содержит D-аспарагиновую кислоту, аргинин-альфа-кетоглютарат (ААКГ), L-глютамин, L-карнитин, L-тартрат, L-орнитина гидрохлорид и L-лизин и обогащен витаминами B5 и B6, магнием и цинком. Глютамин играет важную роль в метаболизме аминокислот. Это энергетический источник и аминокислота, необходимая для синтеза белка. Почти 2/3 мышечной ткани состоит из аминокислот, поэтому пищевая добавка глютамина так популярна среди спортсменов. Витамин B6 регулирует гормональную активность. Цинк помогает поддерживать нормальный уровень тестостерона в крови. Витамин B5 участвует в синтезе и метаболизме стероидных гормонов, витамина D и некоторых нейромедиаторов, снижает утомляемость и усталость.
В одной порции (6 г):
- 2940 мг D-аспарагиновой кислоты
- 720 мг ААКГ
- 480 мг L-глютамина
- 500 мг L-карнитина
- 350 мг L-орнитина гидрохлорида
- 480 мг L-лизина гидрохлорида
- 5,4 мг витамина В3
- 0,97 мг витамина В6
- 57 мг магния2.83 мг цинка
Мы рекомендуем TST + GH, если вы:
- хотите улучшить свое телосложение (нарастить мышечную массу и снизить жировые отложения)
- хотите нарастить сухие мышцы
- регулярно тренируетесь
- хотите ослабить эффект перетренировки
- старше 40 лет
- не переносите лактозу
- чувствительны к глютену
- предпочитаете порошковые препараты
Зачем нам нужны аминокислоты?
Аминокислоты можно найти повсюду в человеческом теле, они являются компонентами белка, который является основным питательным веществом человека. Человеческое тело способно производить некоторые аминокислоты (они называются «заменимые аминокислоты»), в то время как потребление других (незаменимых) аминокислот обеспечивается через пищу. Существует 20 разных аминокислот, которые играют определенную роль в развитии белковых структур. Аминокислоты являются жизненно важными для всех телесных функций, таких как пищеварение, работа печени или заживление ран. Аминокислоты необходимы для поддержания здоровой кожи, связок, мышц, сухожилий, внутренних органов, желез, волос и ногтей. Аминокислоты участвуют в производстве гормонов, нейромедиаторов и ферментов. Кроме того, они выступают в качестве прямого источника энергии.
Как и все продукты BioTech USA, TST + GH состоит из безопасных, тщательно отобранных ингредиентов.
Способ применения
примите перед сном 1 порцию (6 г = одна мерная ложка или столовая ложка с верхом) с 200 мл воды.
Ингредиенты
D-aspartic acid, L-carnitine L-tartrate,L-arginine alpha-ketoglutarate, L-lysine hydrochloride,L-glutamine, L-ornithine hydrochloride, magnesium oxide,flavours, sweeteners (sucralose, steviol glycosides),anti-caking agent (silicon dioxide), acidity regulator (potassiumtartrates), D-calcium pantothenate, zinc oxide, colour(indigotine), pyridoxine hydrochloride. Made in a plant thatalso manufactures milk, egg, gluten, soy, celery, crustaceans,sulphur dioxide and nuts containing foods.
Почему после сытного обеда хочется спать?
- Клаудиа Хаммонд
- BBC Future
Автор фото, Thinkstock
Существует мнение, что некоторые продукты питания вызывают сонливость. Обозреватель BBC Future выяснила, имеет ли эта теория научную основу.
Считается, что наибольшую сонливость у человека вызывает жареная индейка. Если вы позволяете себе лишнего за праздничным столом, эти ощущения вам должны быть знакомы. Однако справедливы ли подобные предположения?
Дело в том, что мясо индейки содержит вещество L-триптофан. В составе некоторых продуктов, однако, этой аминокислоты может быть значительно больше. В почках морского льва, например, или в других более повседневных продуктах питания: в яичном белке, треске или свином стейке.
Сложно придумать рецепт блюда, который соединил бы все эти составляещие. Однако, даже если вам это удастся, эффект от этого яства вряд ли был бы усыпляющим.
Мысль о том, что некоторые блюда могут вызвать сонливость, очевидно, не совсем верна. Чтобы понять почему, нужно разобраться в том, как тело и мозг поглощают питательные вещества.
L-триптофан является незаменимой амино-кислотой, которую наш организм не умеет производить самостоятельно. Именно поэтому вещество добывается из питания, а в дальнейшем служит для выработки серотонина.
Серотонин, как известно, является «гормоном счастья», но мало кто знает, что он также способствует выработке дрозофила — «гормона сна», который и приводит к повышенной сонливости у людей.
Это позволяет предположить, что прием триптофана поможет в борьбе с бессонницей, и такие его фармакологические качества, на самом деле, подтверждают результаты исследований, проведенных до 1986 года. В последующие годы свойства триптофана почти не изучались, однако один эксперимент 2002 года показал, что снижение уровня триптофана ухудшает сон.
Впрочем, свойства триптофана в фармакологических исследованиях, безусловно, отличаются от эффекта, который он производит, попадая в организм вместе с пищей, ведь в продуктах питания он взаимодействует с другими веществами.
Автор фото, Thinkstock
Підпис до фото,Считается, что наибольшую сонливость у человека вызывает жареная индейка
В состав белка, содержащегося в продуктах питания, входят большие нейтральные аминокислоты (LNAA), которые «конкурируют» с триптофаном за прохождение через гематоэнцефалический барьер и фактически препятствуют попаданию в мозг большей части триптофана.
Чтобы триптофан, содержащийся в пище, мог превратиться в серотонин, вы не только должны употребить его на голодный желудок, где он не будет «конкурировать» с другими питательными элементами, но и само блюдо также не должно содержать другие аминокислоты. Однако это невозможно.
Впрочем, есть одно условие, при котором триптофан может проникнуть в мозг. В одном канадском исследовании участникам, страдающим от бессонницы, предлагали батончики с семенами мускатной тыквы с высоким содержанием триптофана.
Когда в батончики добавляли сахар глюкозы, сон у участников исследования улучшался (в эксперименте участвовала пара однояйцевых близнецов).
Причина, по которой глюкоза изменила результаты исследования, заключается в том, что сладкие углеводы вызывают выделение инсулина. Он стимулирует всасывание других аминокислот в тканях, тогда как путь к мозгу остается свободным для триптофана.
Впрочем, даже если вы подберете правильную комбинацию продуктов питания, вы совсем не обязательно достигните нужного эффекта. В 40-ка контролируемых исследованиях, проведенных до 1982 года, добавка L-триптофана действительно повышала у участников чувство сонливости и способствовала быстрому засыпанию.
Автор фото, Thinkstock
Підпис до фото,Триптофан в виде лекарственных препаратов может способствовать хорошему сну, однако в составе продуктов питания он действует иначе
При этом препарат не влиял на количество часов сна, особенно если человек не страдал от бессонницы. А если нарушения сна были значительными, триптофан не помогал.
Итак, возможно, дело не в празничной индейке, а в сочетании продуктов.
Хотя причин для ощущения усталости может быть множество: аврал на работе перед праздниками, приготовление ужина для гостей и чересчур активный отдых.
Если вы хорошо поели, да еще и запили алкоголем, нет ничего удивительного в том, что после обеда возникает неудержимое желание вздремнуть, даже если L-триптофан так и не добрался до вашего мозга.
Прочитать оригинал этой статьи на английском языке вы можете на сайтеBBC Future.
Amino Acids Reference Tool
Аминокислоты — это органические соединения, содержащие в основном атомы углерода, водорода, кислорода и азота. У них также есть аминные (–NH 2 ) и карбоксильные (–COOH) функциональные группы с боковыми цепями (R-группы), которые отличают одну аминокислоту от другой. Сера и другие дополнительные элементы можно найти в некоторых боковых цепях.
Аминокислоты — это строительные блоки белков. Они могут соединяться пептидными связями с образованием полипептидных цепей. В зависимости от взаимодействия соседних аминокислот и их боковых цепей полипептиды сворачиваются и образуют трехмерные молекулы, известные как белки.Форма белка и его аминокислотные компоненты помогут определить его функцию.
Помимо своей важной роли в образовании белка, аминокислоты важны для биосинтеза, транспорта нейротрансмиттеров и других биохимических процессов.
Категории аминокислот
Существует около 500 аминокислот, но только 20 присутствуют в нашем генетическом коде. Эти 20 протеиногенных аминокислот известны как стандартные аминокислоты.
Полярность аминокислоты зависит от структуры ее боковых цепей.Молекула будет более полярной, если разница в электроотрицательности между атомами больше. Например, алкановые ответвления и бензольные кольца считаются неполярными, а спирты и амины полярными.
Аминокислоты классифицируются по:
- Заряд (положительный против отрицательного)
- pH (кислотный против основного)
- Растворимость (полярный против неполярного)
- Расположение основной функциональной группы: альфа (α), бета (β), гамма (γ) или дельта (δ)
- Структура боковой цепи (алифатическая, ароматическая и т. д.))
Гидрофобность
| Очень гидрофобная | Гидрофобная | Нейтральная | Гидрофильная | ||
|---|---|---|---|---|---|
| Фенилаланин | Тирозин | Треонин | Аргинин | L | L Изолейцин Изолейцин Изолейцин|
| Триптофан | Аланин | Глицин | Аспарагин | ||
| Лейцин | Серин | Глутаминовая кислота | |||
| Валин | Глютамин | Пролин | |||
На основе значений при pH 7.
Справочная таблица аминокислот
AlanineAla & nbsp A9.872.35
| Полярность боковой цепи | Неполярная |
| Заряд | Нейтральная |
| Молекулярная масса | 8945|
| Классификация | Алкил |
Описание: Аланин представляет собой небольшую заменимую аминокислоту с относительно нереактивной одной боковой цепью метильной группы.Это одна из простейших аминокислот и вторая по содержанию белков. Он кодируется кодонами, которые начинаются с GC.
Магазинный аланин и производные
ArginineArg & nbsp R9.092.18
| Полярность боковой цепи | Полярность | ||
| Заряд | Положительный | ||
| Молекулярный вес (г / моль) | Классификация | Основной |
Описание: Аргинин представляет собой химически сложную аминокислоту с 3-углеродной алифатической боковой цепью, оканчивающейся гуанидиновой группой.Обычно он опосредует взаимодействия между белками и отрицательно заряженными остовами ДНК и РНК.
Магазин Аргинин и производные
AsparagineAsn & nbsp N8.802.02
| Полярность боковой цепи | Полярность |
| Заряд | Нейтральный |
| Молекулярный вес | |
| Классификация | Нейтрально |
Описание: Аспарагин — это аминокислота с карбоксамидной боковой цепью.Амидная группа сохраняет свою полярность и является богатым источником водородных связей, что делает аспарагин обычным сайтом связывания белка и субстратом для гликозилтрансфераз.
Магазин аспарагин и производные
Аспарагиновая кислота Asp & nbsp D9.601.88
| Полярность боковой цепи | Полярность |
| Заряд | Отрицательный |
| Молекулярная масса | (г / моль)|
| Классификация | Кислый |
Описание: Аспарагиновая кислота имеет боковую цепь карбоновой кислоты, которая реагирует с другими аминокислотами, ферментами и белками.Его отрицательный заряд и большой потенциал водородных связей позволяют ему участвовать во многих молекулярных взаимодействиях.
CysteineCys & nbsp C10.781.71
| Полярность боковой цепи | Полярность | |
| Заряд | Нейтраль | |
| Молекулярный вес (г / моль) | 121,16 | Нейтральный класс |
Описание: Цистеин — это полузаменимая протеиногенная аминокислота с тиоловой боковой цепью, которая участвует в ферментативных реакциях.Его сульфгидрильная группа образует дисульфидные связи с другими цистеинами или молекулами со свободными сульфгидрилами.
Glutamic AcidGlu & nbsp E9.672.19
| Полярность боковой цепи | Полярность | |
| Заряд | Отрицательный | |
| Молекулярный вес (г / моль) | 147,13 | |
| 147,13 | ||
Описание: Глутаминовая кислота имеет одну амино и две карбоксильные группы, которые придают ей отрицательный заряд практически во всех биологических системах.Это позволяет глутаминовой кислоте взаимодействовать с положительно заряженными объектами, включая ионы металлов.
Магазин глутаминовой кислоты и производных
GlutamineGln & nbsp Q9.132.17
| Полярность боковой цепи | Полярность |
| Заряд | Нейтральный |
| Молекулярный вес | (г / моль)|
| Классификация | Нейтрально |
Описание: Глютамин имеет боковую цепь, аналогичную глутаминовой кислоте; одна карбоксильная группа просто заменяется амидом.Он важен для метаболизма азота и помогает регулировать токсический уровень аммиака в организме.
Магазин глутамина и производных
GlycineGly & nbsp G9.602.34
| Полярность боковой цепи | Неполярная |
| Заряд | Нейтральный |
| Молекулярный вес | (г / моль)|
| Классификация | Алкил |
Описание: Глицин — простейшая аминокислота с одним атомом водорода в боковой цепи.Это делает его идеальным для размещения крутых поворотов некоторых полипептидных цепей. Глицин также действует как тормозящий нейротрансмиттер.
HistidineHis & nbsp H8.971.78
| Полярность боковой цепи | Полярность |
| Заряд | Положительный |
| Молекулярный вес (г / моль) | 155,16 |
| Классификация |
Описание: Гистидин встречается редко и имеет частично протонированную ароматическую имидазольную боковую цепь.Он может быть нейтральным или положительно заряженным и может служить естественным катализатором или преобладающим остатком в активных центрах ферментов благодаря своему потенциалу связывания.
Магазин гистидин и производные
ИзолейцинIle & nbsp I9.762.32
| Полярность боковой цепи | Неполярный |
| Заряд | Нейтральный |
| Молекулярный вес | (г / моль)|
| Классификация | Алкил |
Описание: Изолейцин имеет разветвленную углеводородную боковую цепь, расположенную в L-образной форме, и считается одной из крупнейших алифатических аминокислот.Он сконцентрирован в мышечной ткани и кодируется кодонами AUU, AUC и AUA.
Магазин Изолейцин и производные
LeucineLeu & nbsp L9.602.36
| Полярность боковой цепи | Неполярная | |
| Заряд | Нейтральный | |
| Молекулярный вес | Молекулярный вес | |
| Классификация | Алкил |
Описание: Лейцин имеет боковую цепь изобутильной группы с четырьмя полностью протонированными атомами углерода, расположенными в виде объемной буквы «Y».Это также самая распространенная аминокислота в белках и одна из крупнейших алифатических аминокислот.
LysineLys & nbsp K10.288.90
| Полярность боковой цепи | Полярность | |
| Заряд | Положительный | |
| Молекулярный вес (г / моль) | 146,19 | |
| Базовая классификация |
Описание: Лизин является незаменимой аминокислотой с лизильной боковой цепью.Он важен для протеиногенеза, сшивания полипептидов коллагена, поглощения минеральных питательных веществ и выработки карнитина, ключевого для метаболизма жирных кислот.
MethionineMet & nbsp M9.212.28
| Полярность боковой цепи | Неполярная | |
| Заряд | Нейтральная | |
| Молекулярная масса (г / моль) | 149,21 | |
Описание: Метионин имеет линейную боковую цепь и содержит сульфидную группу.Это позволяет метионину быть плодовитым донором метильных групп. Он также играет важную роль в обмене веществ, росте новых кровеносных сосудов и восстановлении тканей.
Магазин метионина и производных
PhenylalaninePhe & nbsp F9.242.58
| Полярность боковой цепи | Неполярная |
| Заряд | Нейтральный |
| Молекулярный вес | Молекулярный вес|
| Классификация | Ароматическая |
Описание: Фенилаланин содержит боковую цепь бензильной группы и считается самой простой и наиболее распространенной ароматической аминокислотой в белках.Это предшественник синтеза тирозина, дофамина, норадреналина, адреналина и меланина.
Shop Фенилаланин и производные
ProlinePro & nbsp P10.601.99
| Полярность боковой цепи | Неполярная |
| Заряд | Нейтральный |
| Молекулярный вес | (г / моль)|
| Классификация | Алкил |
Описание: Пролин представляет собой протеиногенную аминокислоту с циклической пирролидиновой боковой цепью.Он не является незаменимым для человека и может быть синтезирован из глутаминовой кислоты. Незаменим для иммунной системы, пролин также играет ключевую роль в функционировании суставов и сухожилий.
Магазин Пролин и производные
SerineSer & nbsp S9.152.21
| Полярность боковой цепи | Полярность | |||
| Заряд | Нейтраль | |||
| Молекулярный вес (г / моль) | 105 900 | 105 900 | Классификация | Нейтрально |
Описание: Серин — это аминокислота с боковой цепью гидроксиметильной группы.Это простейшая гидроксиламинокислота и третья по распространенности в белках. Серин можно синтезировать из глицина и некоторых других метаболитов.
Магазин-серин и производные
ThreonineThr & nbsp T9.122.15
| Полярность боковой цепи | Полярность | ||
| Заряд | Нейтральная | ||
| Молекулярная масса (г / моль) | Классификация | Нейтральная |
Описание: Треонин — незаменимая аминокислота, которая содержит гидроксильную группу, что делает ее полярной и незаряженной.Он имеет много общих свойств с серином и является субстратом киназ и гликозилтрансфераз. Он кодируется кодонами, начинающимися с AC.
TryptophanTrp & nbsp W9.392.38
| Полярность боковой цепи | Неполярный | |
| Заряд | Нейтральный | |
| Молекулярный вес (г / моль) | 204,23 | 204,23 | Ароматический
Описание: Триптофан — самая большая и самая редкая аминокислота, содержащаяся в белках.Обычно находящийся в гидрофобной сердцевине белков, триптофан часто участвует в ароматической укладке. В его боковой цепи преобладает индольная группа.
TyrosineTyr & nbsp Y9.112.20
| Полярность боковой цепи | Полярность |
| Заряд | Нейтральный |
| Молекулярный вес (г / моль) | 181,19 | Класс Нейтральный | Класс Нейтральный |
Описание: Тирозин представляет собой ароматическую аминокислоту, подобную фенилаланину с гидроксильной группой вместо фенильной группы в пара-положении.Он обладает уникальными химическими свойствами и служит катализатором и субстратом для множества киназ.
ValineVal & nbsp V9.722.29
| Полярность боковой цепи | Неполярный |
| Заряд | Нейтральный |
| Молекулярный вес (г / моль) | 117,15 |
| Классификация Алкил |
Описание: Валин представляет собой алифатическую аминокислоту умеренного размера с боковой цепью, состоящей из пропильной группы, присоединенной к СА в положении C2.Как и другие алифатические остатки, валин часто находится в гидрофобных ядрах белков.
Незаменимые аминокислоты
Организм человека может производить 10 из 20 необходимых аминокислот. Другая половина, называемая незаменимыми аминокислотами, поступает из вашего рациона и должна потребляться регулярно.
| Производится организмом (несущественное) | Поставляется продуктами питания (обязательно) | ||
|---|---|---|---|
| Аланин | Глютамин | Аргинин ** | Метионин |
| Аспарагин | Глицин | 45 Гистид45 Фенилаланин||
| Аспарагиновая кислота | Пролин | Изолейцин | Треонин |
| Цистеин | Серин | Лейцин | Триптофан |
Глутаминовая кислота043 | Тирозин * * Для производства требуется фенилаланин. |||
