Ученые выяснили, как поддерживать тонус мышц без упражнений
https://ria.ru/20200113/1563364326.html
Ученые выяснили, как поддерживать тонус мышц без упражнений
Ученые выяснили, как поддерживать тонус мышц без упражнений — РИА Новости, 13.01.2020
Ученые выяснили, как поддерживать тонус мышц без упражнений
Ученые обнаружили белок, от которого зависит выносливость организма и эффективность физических упражнений. Результаты исследования опубликованы в журнале Nature РИА Новости, 13.01.2020
2020-01-13T14:15
2020-01-13T14:15
2020-01-13T15:56
наука
спорт
мичиганский университет
открытия — риа наука
здоровье
биология
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/150960/84/1509608463_0:160:3072:1888_1920x0_80_0_0_5384534bbc01ceea68521d988df9af1d.jpg
МОСКВА, 13 янв — РИА Новости. Ученые обнаружили белок, от которого зависит выносливость организма и эффективность физических упражнений. Результаты исследования опубликованы в журнале Nature Communications.Американские ученые, проводя эксперименты на мухах-дрозофилах и мышах, обнаружили, что экспрессия белков семейства сестринов вызывает тот же эффект, что и физические упражнения.Известно, что сестрин накапливается в мышцах после тренировок. В то же время любые длительные физические нагрузки повышают выносливость мышц и организма в целом, улучшают чувствительность к инсулину, благотворно влияют на все метаболические процессы. Исследователи выяснили, что активация сестрина имитирует как молекулярные, так и физиологические последствия упражнений. То есть этот белок является тем самым медиатором, от которого зависит эффект тренировок.В течение трех недель авторы наблюдали за мухами, которые по своеобразной беговой дорожке пытались выбраться из пробирки, и сравнивали результаты обычных мух и насекомых с выключенным геном сестрина.»Мухи обычно бегают от четырех до шести часов, и физические способности нормальных мух за этот период улучшались, — приводятся в пресс-релизе Мичиганского университета слова руководителя исследования Джуна Хи Ли (Jun Hee Lee).
Результаты исследования опубликованы в журнале Nature Communications.Американские ученые, проводя эксперименты на мухах-дрозофилах и мышах, обнаружили, что экспрессия белков семейства сестринов вызывает тот же эффект, что и физические упражнения.Известно, что сестрин накапливается в мышцах после тренировок. В то же время любые длительные физические нагрузки повышают выносливость мышц и организма в целом, улучшают чувствительность к инсулину, благотворно влияют на все метаболические процессы. Исследователи выяснили, что активация сестрина имитирует как молекулярные, так и физиологические последствия упражнений. То есть этот белок является тем самым медиатором, от которого зависит эффект тренировок.В течение трех недель авторы наблюдали за мухами, которые по своеобразной беговой дорожке пытались выбраться из пробирки, и сравнивали результаты обычных мух и насекомых с выключенным геном сестрина.»Мухи обычно бегают от четырех до шести часов, и физические способности нормальных мух за этот период улучшались, — приводятся в пресс-релизе Мичиганского университета слова руководителя исследования Джуна Хи Ли (Jun Hee Lee). — Мухам без сестрина упражнения не помогали». Насекомые с выключенным сестрином не только обладали худшей выносливостью, у них снижалась аэробная функция дыхания и отсутствовал эффект сжигания жиров, связанный с физическими занятиями.»Мы предполагаем, что сестрин координирует эти биологические действия, включая или отключая различные метаболические пути, необходимые для достижения эффекта упражнений», — говорит ученый.Когда ученые создали сверхэкспрессию сестрина, увеличив его уровень в мышцах, даже без тренировок мышцы нормальных мух выглядели лучше, чем у тех же мух после физических упражнений.Полученные результаты открывают путь для дальнейших исследований, которые могут иметь реальный практический эффект. По мнению авторов, сестрин способен предотвращать атрофию мышц при длительной иммобилизации, а также бороться со старческим истощением.»Это очень важно для будущих исследований и будет способствовать лечению людей, которые не могут заниматься спортом», — говорит первый автор исследования Мёнджин Ким (Myungjin Kim), доцент кафедры молекулярной и интегративной физиологии Мичиганского университета.
— Мухам без сестрина упражнения не помогали». Насекомые с выключенным сестрином не только обладали худшей выносливостью, у них снижалась аэробная функция дыхания и отсутствовал эффект сжигания жиров, связанный с физическими занятиями.»Мы предполагаем, что сестрин координирует эти биологические действия, включая или отключая различные метаболические пути, необходимые для достижения эффекта упражнений», — говорит ученый.Когда ученые создали сверхэкспрессию сестрина, увеличив его уровень в мышцах, даже без тренировок мышцы нормальных мух выглядели лучше, чем у тех же мух после физических упражнений.Полученные результаты открывают путь для дальнейших исследований, которые могут иметь реальный практический эффект. По мнению авторов, сестрин способен предотвращать атрофию мышц при длительной иммобилизации, а также бороться со старческим истощением.»Это очень важно для будущих исследований и будет способствовать лечению людей, которые не могут заниматься спортом», — говорит первый автор исследования Мёнджин Ким (Myungjin Kim), доцент кафедры молекулярной и интегративной физиологии Мичиганского университета. При этом ученые замечают, что до создания препарата или пищевой добавки, содержащей сестрин, еще очень далеко.»Сестрины — это сложные вещества. Сейчас мы пытаемся найти небольшие молекулы, которые будут работать как модуляторы этого белка», — отмечает Ли.
При этом ученые замечают, что до создания препарата или пищевой добавки, содержащей сестрин, еще очень далеко.»Сестрины — это сложные вещества. Сейчас мы пытаемся найти небольшие молекулы, которые будут работать как модуляторы этого белка», — отмечает Ли.
https://ria.ru/20181024/1531387399.html
https://ria.ru/20181128/1533677345.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21. img.ria.ru/images/150960/84/1509608463_171:0:2902:2048_1920x0_80_0_0_4096da909272c6df1657e6eb51f446fd.jpg
img.ria.ru/images/150960/84/1509608463_171:0:2902:2048_1920x0_80_0_0_4096da909272c6df1657e6eb51f446fd.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
спорт, мичиганский университет, открытия — риа наука, здоровье, биология
МОСКВА, 13 янв — РИА Новости. Ученые обнаружили белок, от которого зависит выносливость организма и эффективность физических упражнений. Результаты исследования опубликованы в журнале Nature Communications.Американские ученые, проводя эксперименты на мухах-дрозофилах и мышах, обнаружили, что экспрессия белков семейства сестринов вызывает тот же эффект, что и физические упражнения.
Известно, что сестрин накапливается в мышцах после тренировок. В то же время любые длительные физические нагрузки повышают выносливость мышц и организма в целом, улучшают чувствительность к инсулину, благотворно влияют на все метаболические процессы.
Исследователи выяснили, что активация сестрина имитирует как молекулярные, так и физиологические последствия упражнений. То есть этот белок является тем самым медиатором, от которого зависит эффект тренировок.
В течение трех недель авторы наблюдали за мухами, которые по своеобразной беговой дорожке пытались выбраться из пробирки, и сравнивали результаты обычных мух и насекомых с выключенным геном сестрина.
«Мухи обычно бегают от четырех до шести часов, и физические способности нормальных мух за этот период улучшались, — приводятся в пресс-релизе Мичиганского университета слова руководителя исследования Джуна Хи Ли (Jun Hee Lee). — Мухам без сестрина упражнения не помогали».
24 октября 2018, 16:23НаукаУченые выяснили, как физические нагрузки помогают укреплять памятьНасекомые с выключенным сестрином не только обладали худшей выносливостью, у них снижалась аэробная функция дыхания и отсутствовал эффект сжигания жиров, связанный с физическими занятиями.
«Мы предполагаем, что сестрин координирует эти биологические действия, включая или отключая различные метаболические пути, необходимые для достижения эффекта упражнений», — говорит ученый.
Когда ученые создали сверхэкспрессию сестрина, увеличив его уровень в мышцах, даже без тренировок мышцы нормальных мух выглядели лучше, чем у тех же мух после физических упражнений.
Полученные результаты открывают путь для дальнейших исследований, которые могут иметь реальный практический эффект. По мнению авторов, сестрин способен предотвращать атрофию мышц при длительной иммобилизации, а также бороться со старческим истощением.
«Это очень важно для будущих исследований и будет способствовать лечению людей, которые не могут заниматься спортом», — говорит первый автор исследования Мёнджин Ким (Myungjin Kim), доцент кафедры молекулярной и интегративной физиологии Мичиганского университета.
При этом ученые замечают, что до создания препарата или пищевой добавки, содержащей сестрин, еще очень далеко.
«Сестрины — это сложные вещества. Сейчас мы пытаемся найти небольшие молекулы, которые будут работать как модуляторы этого белка», — отмечает Ли.
28 ноября 2018, 12:26НаукаУченые выяснили, какие виды спорта продлевают жизньТренируемся дома: как поддерживать тонус
Чаще всего именно дома нам трудно собраться с силами и заставить себя заниматься спортом. И это зря, ведь наша активность напрямую связана со здоровьем.
И это зря, ведь наша активность напрямую связана со здоровьем.
Екатерина Соколюк, тренер BODYART / FITNESS, дала рекомендации, как поддерживать тонус дома.
Придерживайтесь график тренировок
Прежде всего, нужно помнить, что нет необходимости заниматься каждый день. Вашему телу нужно время на восстановление и отдых.
Для домашних тренировок подойдет график три раза в неделю. Для удобства рекомендуем распределить тренировки по дням (например, понедельник / среда / пятница, или вторник / четверг / суббота). Следуя графику, результат не заставит себя ждать — тело станет более выносливым.
Можно чередовать силовые и циклические нагрузки. Предположим, понедельник можно выделить как день для силовых тренировок, а среду — для легких кардиотренировок в течение 30 минут. При соблюдении подобного принципа, на фоне легкой аэробной нагрузки результат от силовой тренировки увеличивается.
Выполняйте упражнения в домашних условиях
Продолжительность тренировки зависит от уровня подготовки.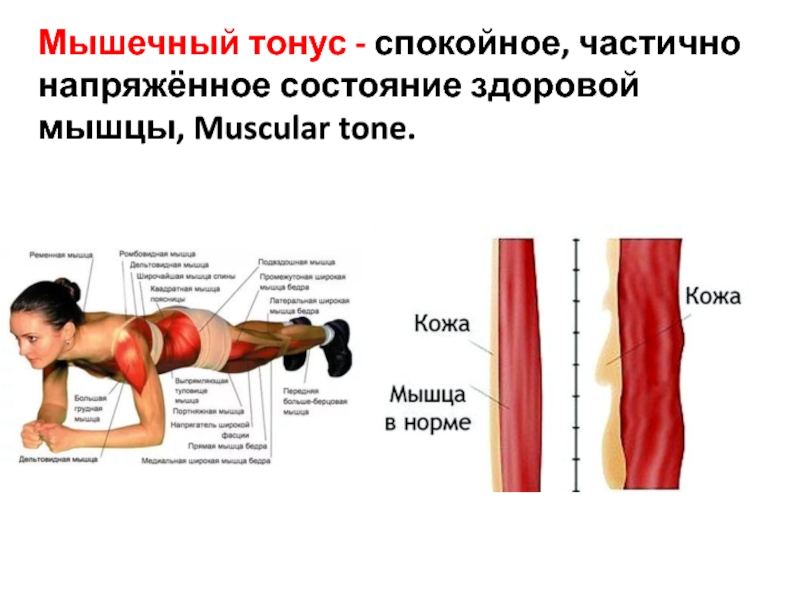 С учетом разминки и заминки, средняя продолжительность занятия — 60 минут.
С учетом разминки и заминки, средняя продолжительность занятия — 60 минут.
Во время тренировки нужно ориентироваться прежде всего на свои ощущения. В начале бывает сложно отличить лень от усталости. Первое время нужно себя заставлять отрабатывать положенное время.
Тем не менее, не нужно продолжать тренировку, если чувствуете боль в спине, суставах (коленном или локтевом), или сердце начинает «выпрыгивать» из груди.
Эти упражнения можно выполнять без оборудования:
- Приседания (укрепление нижней части тела)
- Приседания с прыжком (способствует усилению мышц и суставов)
- Выпады (укрепление мышц ног и ягодиц)
- Бурпи (функциональное динамическое упражнение, сочетает в себе элементы приседаний, планки, отжиманий от пола и прыжков вверх, задействует все группы мышц)
- Отжимания (развитие грудных мышц, трицепсов, всего плечевого пояса)
- Пресс (укрепление мышц живота)
- Планка (укрепление мышц, стабилизирующих корпус: косые мышцы живота, поперечная и прямая мышцы, малые и средние ягодичные, мышцы задней поверхности бедра, клювовидно-плечевой)
Поддерживайте водный баланс
Во время активных тренировок вода необходима для терморегуляции и нормальной работы обменных процессов в организме.
За одну тренировку организм теряет от 1 до 2-3 литров жидкости. Это количество зависит от интенсивности нагрузки, размеров тела и температуры окружающей среды.
Чтобы не допустить обезвоживания, необходимо своевременное потребление чистой воды. Например, 200-400 мл воды за час до тренировки обеспечивает правильный «разогрев» организма.
Если тренировка длится 1,5-2 часа, необходимо выпивать 0,5-1 литров воды. Это количество нужно разделять на несколько приемов и пить маленькими глотками каждые 10-15 минут.
Не менее важно пить достаточное количество воды в дни отдыха между тренировками. Чай, кофе, соки и газированные напитки не восполняют потребности человека. Только чистая вода способна сразу пройти всасывание пищеварительным трактом и попасть в кровь, обеспечить свободный трансфер активных и отработанных веществ, помочь организму избавиться от токсинов и шлаков.
Присоединяйтесь к Instagram-странице BODYART / FITNESS, где мы публикуем тренировки и рекомендации по питанию.
КЛУБ® | Что такое «тонусные столы»
Тонусные столы представляют собой комплекс тренажеров, каждый из них состоит из неподвижной части, которая служит удобной опорой телу, и подвижной части или частей, приводимых в движение мотором, а также регулятора частоты, позволяющего задать нужный режим тренировки.
- Тонусные столы – тренажеры, которые выполняют основную работу за вас!
Каждый стол задает правильное направление движений и помогает выполнять упражнения любой сложности. При помощи многократных медленно повторяющихся плавных движений тренажеры прорабатывают каждую группу мышц.
- 1 час тренировки сопоставим по эффекту с 7 часами занятий в фитнес-зале!
В течение часа на тренировке вы будете перемещаться по 6 или 8 тонусным столам, дающим последовательную нагрузку на все группы мышц. При этом ненужная и вредная нагрузка на позвоночник, суставы, мускулатуру и сердечно-сосудистую систему полностью исключена. Упражнения доступны людям любого возраста и любого уровня физической подготовки.
Упражнения доступны людям любого возраста и любого уровня физической подготовки.
- Тонусные столы незаменимы для тех, кто:
— не любит изнурительных тренировок, но хочет иметь стройную фигуру и упругие мышцы;
— не имеет возможности заниматься активными видами спорта по состоянию здоровья;
— хочет возобновить занятия после длительного перерыва.
— снижение лишнего веса — при занятиях 2 раза в неделю видимых результатов можно добиться в течение двух-трех месяцев, занимающиеся не ощущают усталости ни во время, ни после занятий;
— уменьшение целлюлита;
— повышение упругости и эластичности мышц, формирование мышечного корсета, повышение гибкости всего тела, формирование изящных линий фигуры;
— положительное воздействие на позвоночник, снятие усталости спины, что особенно важно для людей ведущих малоподвижный образ жизни, а также страдающих нарушениями осанки и остеохондрозом, облегчение болей в спине, улучшение осанки;
— снятие стресса и избавление от синдрома хронической усталости — отдых на столе для релаксации не только снимает накопившуюся усталость, но и улучшает кровообращение и обмен веществ, ускоряет лимфоотток;
— повышение общего тонуса организма;
— повышение двигательной активности.
- История возникновения тонусных столов:
История тонусных столов начинается в 1930-х годах. Они были изобретены и запатентованы известным американским профессором медицины Бернардом Стаффером и предназначались для реабилитации пациентов, страдающих заболеваниями опорно–двигательного аппарата, а так же тех, кто в силу различных причин не мог заниматься активными физическими упражнениями. Однако на практике оказалось, что изобретенные столы также эффективны для борьбы с лишним весом и для формирования красивой фигуры. Господин Стаффер вместе со своей сестрой открыл первый салон тонусных столов в Лос-Анджелесе. Вскоре тонусные столы стали самыми популярными тренажерами в Голливуде. В настоящее время тонусные столы широко распространены как в Америке, так и во всей Европе.
- Описание тонусных столов
| Тонусный стол № 1 для мышц бедер и ягодиц + растяжка Ритмичными движениями упражнения на столе расслабляют мышцы в области крестцового отдела позвоночника, улучшают тонус мышц пояснично-крестцовой области, укрепляют косые мышцы живота, бедер, ягодиц, мышцы, образующие корсет талии, а также мышцы ног, включая внутреннюю и внешнюю поверхности бедра.  |
|
| Тонусный стол № 2 для мышц живота Занятия укрепляют абдоминальные мышцы и мышцы диафрагмы, тренируют мышцы брюшного пресса и поясничного отдела позвоночника. Воздействие на мышцы брюшного пресса способствует усилению обмена веществ, избавлению от запоров и очищению организма. Укрепляет мышцы живота, делая его плоским и подтянутым. |
|
| Тонусный стол № 3 для живота, бедер и ягодиц Занятия сочетают физическую нагрузку и массаж, действие которых направлено на область живота, бедер и ягодиц, оказывают общеукрепляющее действие на организм. |
|
| Тонусный стол № 4 для спины, поясницы и косых мышц живота Тренировки развивают подвижность плечевых суставов, улучшают осанку и укрепляют косые мышцы живота. Рекомендуется в начале тренировочного цикла, так как упражнения на этом тренажере разогревают мышцы, способствуют насыщению крови кислородом и ускорению обмена веществ.  |
|
| Тонусный стол № 5 для бедер и ягодиц Занятия тренируют большие ягодичные мышцы, оказывают положительное воздействие на суставы и поясничный отдел позвоночника. Вращательные движения, создаваемые педалями, усиливают лимфоток и кровообращение в икроножных и ягодичных мышцах. |
|
| Тонусный стол № 6 для косых мышц живота Занятия способствуют растяжке косых и боковых мышц живота, в связи с чем стол рекомендуется к использованию в конце тренировочного цикла. Способствует укреплению брюшного пресса, нижних мышц спины, формированию талии и повышению тонуса тела. Меняя положение во время занятий, можно усилить воздействие на нужные группы мышц. |
|
| Тонусный стол № 7 для внешней и внутренней поверхности бедер Занятия рекомендуются при слабости мускулатуры внешней и внутренней стороны бедер или после длительного неактивного образа жизни.  Создавая противодействие сходящимся и расходящимся площадкам для ног при максимально возможной амплитуде, занимающийся сочетает стретчинг и силовую нагрузку. Занятия могут проходить как в положении сидя, так и в положении лежа на животе. Создавая противодействие сходящимся и расходящимся площадкам для ног при максимально возможной амплитуде, занимающийся сочетает стретчинг и силовую нагрузку. Занятия могут проходить как в положении сидя, так и в положении лежа на животе. |
|
| Тонусный стол № 8 для мышц плечевого пояса Представляет собой многопрофильный тренажер. В первую очередь он воздействует на мышцы плечевого пояса, формирует красивые мышцы рук и укрепляет мышцы груди. Плавные упражнения развивают подвижность плечевого сустава и улучшают осанку, помогают избавиться от излишков жировой ткани в области талии и спины. |
Упражнения для тонуса мышц: 7 лучших вариантов
Содержание
Сидячий образ жизни не лучшим образом сказывается на внешности: мышцы теряют тонус, кожа становится менее упругой и эластичной. А если вы допускаете погрешности в питании, то при отсутствии достаточной активности велик риск набрать вес.
BeautyHack рассказывает, как зарядиться бодростью и подтянуть тело, и предлагает вам подборку лучших упражнений для тонуса мышц.
ПланкаОдно из самых эффективных упражнений, которое укрепляет мышцы всего тела и поддерживает их в тонусе, – планка. Его суть заключается в том, что нужно продержаться в определенном статическом положении как можно дольше.
Чтобы выполнить упражнение, примите упор лежа и обопритесь на локти и пальцы ног. Держитесь над полом ровно, напрягая мышцы живота, – тело должно образовывать единую ровную линию без прогибов.
Начинать стоять в планке нужно с 10 секунд, а затем постепенно увеличивать время (еще несколько жиросжигающих упражнений, которые помогут добиться красивой фигуры, вы найдете в этом материале).
Боковая планкаЕсли в классическом варианте планки четыре точки опоры, то в боковом их всего две – такое упражнение более эффективно для поддержания мышц в тонусе.
Чередуйте стороны тела, поочередно опираясь только на внешнюю сторону стопы, ладонь или локоть. Боковая планка эффективнее классического варианта – в упражнении задействовано большее количество мышц.
Выпады в сторонуПодтянутые стройные ноги – мечта многих женщин. Добиться такого результата помогут выпады в стороны. Такое упражнение укрепит мышцы ног и ягодицы.
Чтобы его выполнить, встаньте прямо и поставьте ноги на ширине плеч. Отведите одну ногу в сторону и начинайте приседать, слегка нагибая корпус вперед, – спина при этом должна быть абсолютно прямая. Повторите упражнение для каждой ноги (как быстро восстановиться после тренировки, вы узнаете здесь).
Подъемы тазаЛето – хорошее время, чтобы хвастаться красивым прессом. Тем более, что укрепить мышцы живота можно, не выходя из дома.
Лягте на спину и поднимите ноги вверх на 90 градусов. Теперь начинайте отрывать таз от пола – во время упражнения старайтесь не возвращаться в исходное положение и не дотрагиваться ягодицами до коврика, чтобы добавить мышам напряжения. Сделайте не менее 15 подъемов за один подход (какие еще способы помогут сделать живот плоским, вы узнаете в этом материале).
Сделайте не менее 15 подъемов за один подход (какие еще способы помогут сделать живот плоским, вы узнаете в этом материале).
Икроножным мышцам тоже следует уделять внимание. Подъем на носочки – простое и эффективное упражнение, которое поможет держать их в тонусе.
Чтобы его выполнить, встаньте на край ступеньки или любой другой поверхности и зафиксируйтесь в этом положении. Теперь опустите пятку ниже того уровня, на котором вы стоите, после чего быстрым движением поднимитесь на носочки. Опускаться старайтесь медленно, чтобы максимально растянуть голеностопные связки.
Ягодичный мостЕще одно эффективное упражнение для ног и ягодиц – ягодичный мостик. Выполняется легко, а эффект не заставит себя долго ждать, если делать его регулярно.
Лежа на спине, расположите руки вдоль тела ладонями вниз. Поставьте ноги на ширине плеч и согните их в коленях – упор должен быть на стопы. Поднимайте ягодицы вверх, опираясь на лопатки, и задерживаясь в этом положении на несколько секунд. Сделайте упражнение 5-10 раз.
Сделайте упражнение 5-10 раз.
Мышцам спины тоже нужна физическая нагрузка – упражнение «Кошка» идеально подойдет для поддержания их в тонусе. Также оно избавит вас от болей в пояснице и поможет выровнять осанку.
Встаньте на колени и поставьте ладони на пол – во время упражнения руки должны быть выпрямлены, а ноги согнуты под прямым углом. Сделайте глубокий выдох и выгните спину вверх, округляя ее и опуская голову вниз. На вдохе вернитесь в исходное положение. Теперь повторите то же самое, только в обратном направлении: глубоко вдохните и прогните спину вниз, поднимая голову вверх. Завершите упражнение глубоким вдохом, вернувшись в исходное положение. Выполните не менее 5-10 повторов.
Включите эти упражнения в свою ежедневную зарядку, чтобы достичь максимальных результатов. А чтобы эффект был заметнее, не забывайте придерживаться правильного питания.
Текст: Диана СнетковаФизиология и нарушения мышечного тонуса
Токсины (Базель). 2021 апрель; 13(4): 282.
2021 апрель; 13(4): 282.
Поступила в редакцию 1 апреля 2021 г.; Принято 14 апреля 2021 г.
Эта статья была процитирована другими статьями в PMC.Abstract
Простое определение тонуса как сопротивления пассивному растяжению физиологически представляет собой сложную переплетенную сеть, охватывающую нейронные цепи в головном мозге, спинном мозге и мышечном веретене. Нарушения мышечного тонуса могут возникать из-за дисфункции этих путей и проявляться гипертонией или гипотонией.Утрата супраспинальных механизмов контроля приводит к гипертонии, приводящей к спастичности или ригидности. С другой стороны, дистония и паратония также проявляются нарушением мышечного тонуса, но возникают в большей степени из-за дисфункции сети между базальными ганглиями и таламо-мозжечково-кортикальными связями. В этом обзоре мы обсудили нормальные гомеостатические механизмы поддержания тонуса и патофизиологию спастичности и ригидности с их анатомическими коррелятами. После этого мы также выделили феномен сетевой дисфункции, коркового растормаживания и нейропластических изменений, приводящих к дистонии и паратонии.
Ключевые слова: спастичность, ригидность, дистония, паратония
1. Введение
Мышечный тонус представляет собой сложное и динамичное состояние, возникающее в результате иерархической и реципрокной анатомической связности. Он регулируется системами ввода и вывода и критически зависит от требований к мощности и производительности задач. Тон — это, по сути, конструкция моторного контроля, на которой внутренне уравновешивается мощность. Эта иерархия моторного контроля включает в себя кору (обширные возможности обработки с наивысшей степенью свободы), базальные ганглии (обучение и обучение контекстно-зависимым задачам с меньшими степенями свободы), мозжечок (точная настройка), ретикулярную систему ствола мозга (общий путь для восхождения). и нисходящие пути), спинной мозг (основной путь для восходящих и нисходящих путей) и мышечное веретено (конечный общий путь с наименьшей степенью свободы).В этом обзоре мы обсудили противоречия, касающиеся определения мышечного тонуса и его классификации, а также механизмы и пути, ответственные за поддержание тонуса. Спастичность и ригидность, два типа гипертонии, были разработаны в контексте дисфункции супраспинальных путей и взаимодействия между спинным мозгом и мышечным веретеном. Два других нарушения тонуса, а именно дистония и паратония, не совсем связаны с физиологической дисфункцией проводящих путей тонуса.В системе управления моторикой спастичность и ригидность являются преимущественно проблемой выходной системы, тогда как дистония является проблемой обработки на системном уровне. Дистония и паратония изменяют тонус вследствие нарушения сети в базальных ганглиях, таламокортикальных цепях и их соединениях. Механизмы, лежащие в их основе, обсуждались впоследствии, поскольку они важны как клинически, так и патофизиологически с точки зрения двигательных расстройств.
Спастичность и ригидность, два типа гипертонии, были разработаны в контексте дисфункции супраспинальных путей и взаимодействия между спинным мозгом и мышечным веретеном. Два других нарушения тонуса, а именно дистония и паратония, не совсем связаны с физиологической дисфункцией проводящих путей тонуса.В системе управления моторикой спастичность и ригидность являются преимущественно проблемой выходной системы, тогда как дистония является проблемой обработки на системном уровне. Дистония и паратония изменяют тонус вследствие нарушения сети в базальных ганглиях, таламокортикальных цепях и их соединениях. Механизмы, лежащие в их основе, обсуждались впоследствии, поскольку они важны как клинически, так и патофизиологически с точки зрения двигательных расстройств.
2. Определение мышечного тонуса
Мышечный тонус традиционно определяют как «напряжение в расслабленной мышце» или «сопротивление, ощущаемое исследователем при пассивном растяжении сустава, когда мышцы находятся в состоянии покоя» [1]. Это определение тона имеет некоторые неясности, например, неясно, что означает «сопротивление пассивному растяжению», а «ощущаемое исследователем» открывает дверь для субъективных вариаций во время клинического обследования и изменчивости оценки между пациентами [2]. Исследования с электромиографической (ЭМГ) оценкой часто приравнивают мышечный тонус к исходному уровню ЭМГ в расслабленном состоянии. Однако помимо активного или сократительного компонента, возникающего в результате активации двигательной единицы и обнаруживаемого с помощью ЭМГ, мышечный тонус также имеет пассивный или вязкоупругий компонент, независимый от нервной активности, который не может быть обнаружен с помощью ЭМГ.Вязкоупругий компонент, в свою очередь, зависит от множества факторов, таких как саркомерные актин-миозиновые поперечные мостики, вязкость, эластичность и растяжимость сократительных филаментов, филаментное соединение саркомерных несократительных белков (например, десмин, тайтин), осмотическое давление. клеток, а также на окружающие соединительные ткани [3,4].
Это определение тона имеет некоторые неясности, например, неясно, что означает «сопротивление пассивному растяжению», а «ощущаемое исследователем» открывает дверь для субъективных вариаций во время клинического обследования и изменчивости оценки между пациентами [2]. Исследования с электромиографической (ЭМГ) оценкой часто приравнивают мышечный тонус к исходному уровню ЭМГ в расслабленном состоянии. Однако помимо активного или сократительного компонента, возникающего в результате активации двигательной единицы и обнаруживаемого с помощью ЭМГ, мышечный тонус также имеет пассивный или вязкоупругий компонент, независимый от нервной активности, который не может быть обнаружен с помощью ЭМГ.Вязкоупругий компонент, в свою очередь, зависит от множества факторов, таких как саркомерные актин-миозиновые поперечные мостики, вязкость, эластичность и растяжимость сократительных филаментов, филаментное соединение саркомерных несократительных белков (например, десмин, тайтин), осмотическое давление. клеток, а также на окружающие соединительные ткани [3,4].
Математически мышечный тонус можно интерпретировать как изменение сопротивления или силы на единицу изменения длины (Δ сила/Δ смещение ткани) [5].В расслабленном состоянии сопротивление внешнему движению (R TOT ) зависит от инерции (R IN ), кажущейся жесткости (сопротивление растяжению/R ST ) и демпфирования (сопротивление скорости/R DA ). : Р ТОТ = Р ИН + Р ДА + Р СТ [6]. Однако все эти определения имеют общее заблуждение, предполагающее, что человек находится в полностью расслабленном состоянии, чего зачастую невозможно достичь без применения миорелаксантов.
В отличие от этого общего представления Бернштейн подчеркнул тот факт, что мышечный тонус может фактически отражать состояние готовности к движению, и, таким образом, может быть невозможно оценить мышечный тонус, когда человека просят расслабиться и не совершать никаких движений. [7].Бернштейн в своей иерархической модели построения движения (тонус, синергия, пространство, действие) постулировал, что мышечный тонус является адаптивной функцией нейромоторного аппарата, адекватно реагирующего на команды, поступающие с верхних уровней построения движения, путем тонкой настройки возбудимости сенсорные и моторные клетки для задач активного управления позой или движением [6,7]. Это определение делает мышечный тонус активным участником двигательных и постуральных задач. Точно так же Карпентер и соавт.дали клиническое определение тонуса как «постоянной мышечной активности, которая необходима в качестве фона для фактического движения, чтобы поддерживать основное положение тела, особенно против силы тяжести» [8]. Таким образом, тон может быть конструкцией, необходимой для управления моторикой, чтобы как статические, так и динамические задачи могли безопасно выполняться наиболее термодинамически эффективным способом.
Это определение делает мышечный тонус активным участником двигательных и постуральных задач. Точно так же Карпентер и соавт.дали клиническое определение тонуса как «постоянной мышечной активности, которая необходима в качестве фона для фактического движения, чтобы поддерживать основное положение тела, особенно против силы тяжести» [8]. Таким образом, тон может быть конструкцией, необходимой для управления моторикой, чтобы как статические, так и динамические задачи могли безопасно выполняться наиболее термодинамически эффективным способом.
3. Классификация мышечного тонуса
Мышечный тонус можно разделить на «постуральный» и «фазовый».Постуральный тонус наблюдается в аксиальных мышцах, где гравитация является наиболее важным провоцирующим фактором. Это происходит в результате постоянного растяжения мышц и сухожилий и проявляется в виде длительного сокращения мышц. Напротив, фазный тонус обычно оценивается клинически в конечностях как быстрый и кратковременный ответ. Это происходит в результате быстрого растяжения сухожилия и прикрепленной к нему мышцы, а точнее мышечного веретена [9]. Кроме того, мышечный тонус можно разделить на активный и пассивный компоненты, как это уже было описано выше.
Кроме того, мышечный тонус можно разделить на активный и пассивный компоненты, как это уже было описано выше.
4. Анатомия, лежащая в основе регуляции мышечного тонуса
Мышечный тонус регулируется спинальными и супраспинальными механизмами. В то время как спинальный контроль зависит от взаимодействия между мышечным веретеном и спинным мозгом вместе с интернейронами, супраспинальный контроль регулируется фасилитационными и тормозными длинными путями и мозжечком.
4.1. Контроль позвоночника
4.1.1. Взаимодействие между мышечным веретеном и спинным мозгом
Сенсорная обратная связь со спинным мозгом от мышцы в отношении ее длины и напряжения необходима для регуляции мышечного тонуса.Интрафузальные волокна передают информацию о длине мышцы или скорости ее изменения, в то время как сухожильные органы Гольджи передают информацию о натяжении сухожилий или скорости изменения натяжения [10]. Афференты типа Ia определяют скорость изменения длины мышцы во время растяжения (динамическая реакция).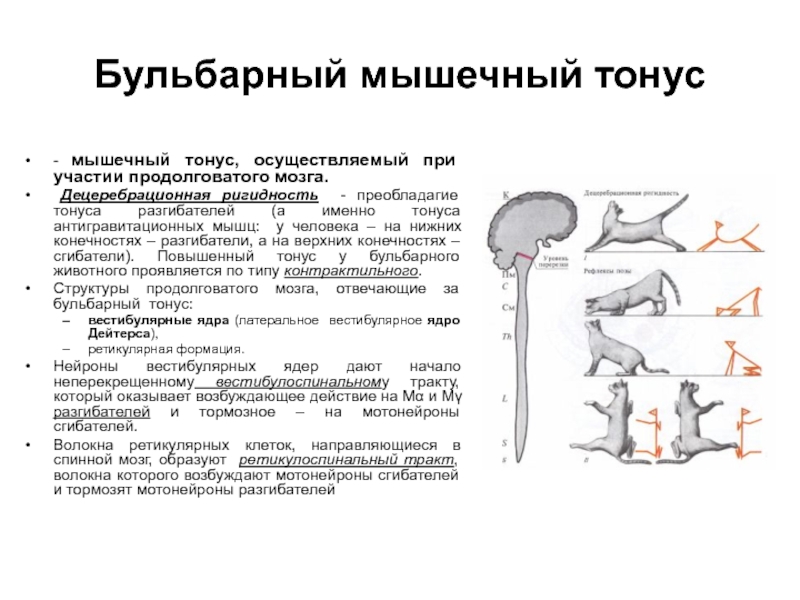 Однако при тонической активности афферентов Iа и II типов выявляют установившуюся длину мышцы (статический ответ). Афференты типа Ib посылают информацию от сухожильных органов Гольджи.
Однако при тонической активности афферентов Iа и II типов выявляют установившуюся длину мышцы (статический ответ). Афференты типа Ib посылают информацию от сухожильных органов Гольджи.
Мышечное веретено генерирует тонус, активируя рефлекс растяжения.Когда моторная команда посылается на альфа-моторные волокна (снабжающие экстрафузальные волокна), гамма-волокна (снабжающие интрафузальные волокна) также будут возбуждаться (альфа-гамма-коактивация), что приводит к сокращению как экстрафузальных, так и интрафузальных волокон [8,10]. ]. Рефлекс растяжения может быть двух типов: (а) динамический и (б) статический. Внезапное быстрое растяжение мышцы стимулирует волокна ядерного мешка (реагируют на скорость или скорость растяжения), а афференты Ia (кольцеспиральные окончания) передают динамический сигнал в спинной мозг.Эфферентный сигнал от спинного мозга (альфа-мотонейрона) поступает через альфа-эфференты к экстрафузальным волокнам, что приводит к внезапному сокращению мышцы (рефлекс динамического растяжения). Это лежит в основе клинического выявления глубоких сухожильных рефлексов. С другой стороны, продолжительное растяжение мышцы стимулирует волокна ядерной цепи, и афференты типа II (окончания цветочных брызг) передают сигнал к спинному мозгу. Эфферентный сигнал от спинного мозга проходит через альфа-эфференты к экстрафузальным волокнам. Однако на этот раз будет происходить асинхронное сокращение экстрафузальных мышечных волокон (двигательные единицы не разряжаются все вместе), что приведет к мягкому устойчивому сокращению этих волокон, пока они растягиваются.Эта статическая рефлекторная реакция на растяжение является физиологической основой поддержания мышечного тонуса [8,10,11].
Это лежит в основе клинического выявления глубоких сухожильных рефлексов. С другой стороны, продолжительное растяжение мышцы стимулирует волокна ядерной цепи, и афференты типа II (окончания цветочных брызг) передают сигнал к спинному мозгу. Эфферентный сигнал от спинного мозга проходит через альфа-эфференты к экстрафузальным волокнам. Однако на этот раз будет происходить асинхронное сокращение экстрафузальных мышечных волокон (двигательные единицы не разряжаются все вместе), что приведет к мягкому устойчивому сокращению этих волокон, пока они растягиваются.Эта статическая рефлекторная реакция на растяжение является физиологической основой поддержания мышечного тонуса [8,10,11].
С другой стороны, существует порог, когда чем сильнее растягивается мышца, тем сильнее рефлекторное сокращение. После пересечения порога сокращение прекращается, и мышца расслабляется. Это известно как «рефлекс обратного растяжения» и опосредовано сухожильным органом Гольджи, присутствующим в пучках сухожилия [11].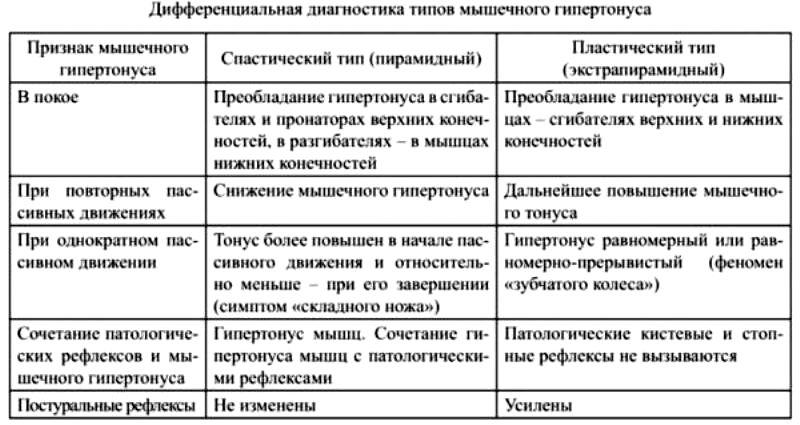
4.1.2. Интернейроны
Интернейроны являются неотъемлемой частью дуги рефлекса растяжения () и играют важную роль в поддержании мышечного тонуса.Они ингибируются или возбуждаются несколькими системами нисходящих волокон. Существует несколько межнейронных путей, и их роль в спастичности обсуждается позже. Среди них рекуррентное ингибирование клетками Реншоу, реципрокное ингибирование Ia мышцами-антагонистами, невзаимное ингибирование Ib сухожильным органом Гольджи и пресинаптическое ингибирование наиболее важны для поддержания мышечного тонуса [10,11,12,13,14].
Основные интернейроны в регуляции мышечного тонуса.
4.2. Супраспинальный контроль посредством нисходящих длинных путей
У человека супраспинальное воздействие на мышечный тонус и рефлексы растяжения в основном модулируется взаимодействием (обсуждается позже) двух тормозных и двух облегчающих нисходящих путей [10] ().
Нисходящие длинные пути в регуляции схемы рефлекса растяжения и мышечного тонуса у людей. Жирным шрифтом выделены основные участки регуляции тонуса.
Жирным шрифтом выделены основные участки регуляции тонуса.
4.2.1. Тормозные пути
Корково-спинномозговой путь/КСТ (из моторной коры)
Кортикоретикулярный (из премоторной коры) и дорсальный ретикулоспинальный тракт/дорсальный РСТ (из медуллярной ретикулярной формации) 9.205238 Содействующие тракты
Вестибулоспинальный тракт/VST (из латерального вестибулярного или ядра Дейтерса)
Медиальный ретикулоспинальный тракт/медиальный RST (в основном из ретикулярной формации моста)
4.3. Роль мозжечка
Медиальная часть передней доли мозжечка активирует медуллярную ретикулярную формацию, откуда возникает дорсальный RST. Следовательно, область мозжечка ингибирует мышечный тонус опосредованно через ингибирование гамма-мотонейронов через дорсальный RST. Однако латеральная часть передней доли активирует ретикулярную формацию моста.
 Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17].
Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17].5. Спастичность
JW Lance в 1980 г. определил спастичность как «моторное расстройство, характеризующееся зависимым от скорости повышением тонических рефлексов растяжения (мышечного тонуса) с усиленными сухожильными подергиваниями, возникающими в результате повышенной возбудимости рефлекса растяжения, как одного из компонентов синдром верхнего двигательного нейрона» [18].Однако спастичность зависит не только от скорости, но и от длины мышцы. Спастичность разгибателей коленного сустава (четырехглавой мышцы) больше, когда мышца короткая, но в сгибателях верхних конечностей (например, бицепс) и разгибателях голеностопного сустава (икроножная, камбаловидная) спастичность больше, когда мышцы длинные.
 Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями.
Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями. Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.
Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.Спастичность может быть классифицирована как «фазовая» и «тоническая» на основе преобладающего участия либо фазических (динамических), либо тонических (статических) компонентов рефлексов растяжения мышц.После травмы позвоночника у амбулаторных пациентов развивается «фазовая» спастичность с быстрыми рефлексами растяжения и клонусом. Однако у пациентов, не способных передвигаться, развивается «тоническая» спастичность, демонстрируемая пассивным растяжением голеностопного сустава и тестированием вибрационно-тонического рефлекса [10, 21].
В следующем разделе мы обсудим спинальные и супраспинальные факторы, способствующие спастичности, включая роль сенсорной обратной связи, о чем свидетельствуют недавние исследования, а также патофизиологию феномена складного ножа и клонуса.

6. Факторы, способствующие спастичности
6.1. Влияние позвоночника
Влияние позвоночника на спастичность может быть связано как с усилением возбуждения, так и со снижением торможения. Повышенная фузимоторная активность [22], денервационная гиперчувствительность [23], прорастание аксонов [24,25], повышенная возбудимость альфа-мотонейронов [25], возбуждение интернейронов [25] и повышение кожных рефлексов растяжения [10] ответственны за повышенное возбуждающее влияние. на спастичность. Модели на животных показали роль мембранных свойств мотонейрона в спастичности.Зависимый от напряжения постоянный внутренний ток (PIC), опосредованный через каналы Na + и Ca 2+ , может вызывать длительную деполяризацию (потенциал плато), модулируемую нисходящей серотонинергической и норадренергической активностью [10,25]. Нисходящий моноаминергический драйв в норме оказывает возбуждающее действие на альфа-мотонейроны в вентральных рогах через рецепторы 5HT2 и NEα1, тогда как он оказывает тормозящее действие на дорсальные рога через рецепторы 5HT1b/d и NEα2 [25].
 В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности.
В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности.Помимо возбуждающих механизмов, способствующих спастичности, в недавних исследованиях все больше оценивается роль измененных спинальных тормозных цепей [10]. Растормаживание альфа-мотонейрона при спастичности может происходить из-за снижения пресинаптического торможения афферентов Ia [26], снижения дисинаптического реципрокного афферентного торможения Ia от группы мышц-антагонистов [27,28], снижения афферентно-опосредованного торможения Ib сухожильным органом Гольджи [29].
 , измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30].
, измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30].6.2. Супраспинальное влияние
В норме мышечный тонус человека в критической степени уравновешивается тормозным импульсом CST и дорсальным RST и стимулирующим импульсом (на разгибательный тонус) медиальным RST и в некоторой степени VST [10]. Среди них дорсальный RST также ингибирует афферентные рефлексы сгибателей (FRA). В спинном мозге латеральный канатик содержит кортикоспинальный тракт (CST) и дорсальный RST, тогда как передний канатик содержит VST и медиальный RST. Исходя из этого, влияние поражений коры и спинного мозга на мышечный тонус можно резюмировать следующим образом.
6.2.1. Поражения коры
Изолированное вовлечение КСТ недостаточно для возникновения спастичности [31,32]. Поражения коры головного мозга вызывают спастичность из-за ассоциированного вовлечения кортико-ретикулярных волокон, связи между премоторной корой и медуллярной ретикулярной формацией, откуда берет начало дорсальная RST.
 Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST.
Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST.6.2.2. Поражения спинного мозга
Неполная/частичная миелопатия с вовлечением латерального канатика: при вовлечении только КСТ это приводит к слабости, гипотонии и утрате поверхностных рефлексов. Если есть дополнительное вовлечение дорсального RST, спастичность и гиперрефлексия будут развиваться из-за беспрепятственной активности медиального RST. Спастичность будет преобладать в антигравитационных мышцах и приведет к параплегии при разгибании и спазмам разгибателей. Спазмы сгибателей могут возникать, если FRA активируются пролежнями.С другой стороны, если вовлекается дорсальная RST только с щадящей CST, будет спастичность без выраженной слабости.
Полная миелопатия с поражением всех четырех трактов: спастичность в этом случае будет меньше из-за отсутствия облегчающего воздействия медиальных RST и VST.
 Растормаживание FRA приведет к параплегии при сгибании и спазмам сгибателей.
Растормаживание FRA приведет к параплегии при сгибании и спазмам сгибателей.
6.3. Роль сенсорной обратной связи
Недавние исследования показали, что коактивация мышц-антагонистов, жесткая поза и жесткая походка при спастичности могут быть адаптацией для стабилизации сустава и позы на фоне снижения мышечной силы, тогда как гипервозбудимые рефлексы играют незначительную или никакой роли [33,34].Спастические двигательные расстройства могут возникать из-за неадекватного прогнозирования сенсорных последствий движений [35,36]. Из-за отсутствия надежного прогноза соматосенсорной обратной связи от движущейся конечности пациенту с поражением ВМН будет трудно оптимизировать движение. Таким образом, совместное сокращение мышц вокруг сустава может быть стратегией минимизации случайных движений и максимально возможной стабилизации движения [33]. Следовательно, спастическое двигательное расстройство скорее может быть компенсацией слабости.Эта концепция может быть реализована при неосложненной наследственной спастической параплегии (HSP), когда происходит потеря проприоцептивной чувствительности крупных волокон наряду с поражением корково-спинномозгового тракта (CST).
 Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.
Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.6.4. Non-Neural Factors
Как обсуждалось ранее, изменения не-нейральных факторов, таких как вязкоупругие свойства ткани (например, упругая жесткость, вязкостное демпфирование), также могут способствовать возникновению спастичности [38,39].

7. Патофизиология феномена складного ножа
При пассивном растяжении мышцы ощущается большее сопротивление в начальной части растяжения, но при продолжении растяжения происходит внезапное ослабление сопротивления, описываемое как «феномен складного ножа».Из-за зависимости спастичности от длины сначала при сгибании колена (квадрицепсы короткие) ощущается повышенное сопротивление (больше спастичность). Однако при продолжении растяжения (удлиняется квадрицепс) после достижения критической длины сопротивление резко снижается [40,41,42]. Возбуждение медленно проводящих высокопороговых тормозных афферентов мышц III и IV групп (часть афферентов сгибательных рефлексов/FRA) также может быть ответственно за этот феномен [43].
8. Патофизиология клонуса
Клонус определяется как «регулярные, повторяющиеся, ритмичные сокращения мышцы, подвергаемой внезапному, сохраняющемуся растяжению» [11].Клонус, сохраняющийся в течение пяти и более ударов, считается клинически ненормальным.
 Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается.
Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается.9. Ригидность
Ригидность, в отличие от спастичности, не зависит от скорости движения. Он в равной степени влияет на сгибатели и разгибатели и вызывает равномерное сопротивление пассивному растяжению во всех направлениях, известное как феномен «свинцовой трубы».
 Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].
Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].Таблица 1
Разница между спастичностью и ригидностью.

Дифференциация пунктов Спастичность Риждость Нажимая скорость Да № Устойчивость к движению в одном направлении (сгибание или расширение) в обоих направлениях Длина зависимости Да NO NO Тип Hypertonicity Тип Hypertonicity Класс-нож Сведящая труба или зубчатое колесо В следующем разделе мы обсудим факторы, способствующие жесткости, а затем патофизиология активационного маневра (проба Фроманта).

10. Факторы, влияющие на жесткость
10.1. Преувеличение долголатентных рефлексов растяжения (LLSR)
Первоначальные исследования показали, что паркинсоническая ригидность, вероятно, имеет спинномозговое рефлекторное происхождение, что подтверждается тем фактом, что ригидность улучшилась после резекции спинного мозга [51]. Считалось, что основной причиной является усиление реакции мышечных рецепторов на пассивное растяжение. Однако последующие исследования с микронейрографическими записями показали, что увеличение мышечного афферентного разряда из-за усиленной фузимоторной активности недостаточно для возникновения ригидности [52].Моносинаптические сегментарные рефлексы на растяжение существенно не отличались между пациентами с БП и здоровыми субъектами в исследованиях с использованием электрофизиологического анализа [53,54]. Скорее, афферентно-опосредованные спинальные рефлексы Ia, такие как сухожильные рефлексы, H-рефлекс и тонический вибрационный рефлекс, оказались в основном нормальными у пациентов с БП [55,56].
 Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53].
Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53].10.2. Усиленная реакция укорочения (SR) и торможение, вызванное растяжением (SII)
Преувеличенная LLSR может объяснить гипертонус при БП, но не может объяснить сопротивление пассивному растяжению, одинаковое во всем диапазоне движения (характер «свинцовой трубы»)? Аномальная реакция в укорачивающейся мышце была впервые отмечена Вестфалем и впоследствии названа Шеррингтоном «реакцией укорочения» (СР) [58].
 Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].
Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].10.3. Роль ствола мозга
Роль недофаминергической системы при БП все чаще подчеркивается в последних исследованиях. Недавно Линн-Эванс и соавт. отметили повышенную и более симметричную ригидность верхних конечностей у пациентов с БП в состоянии бодрствования, у которых наблюдается быстрый сон без атонии (PD-RSWA+), по сравнению с пациентами с атонией (PD-RSWA-) и контрольной группой [62]. Цепь ствола мозга, отвечающая за тонус в фазе быстрого сна, перекрывается с цепью, поддерживающей возбудимость двигательных нейронов и постуральный контроль в состоянии бодрствования [63].
 При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66].
При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66]. Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62].
Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62].Нейромодуляторы в патофизиологии ригидности.
10.4. Ненервные факторы
Как обсуждалось ранее, вязкоупругие свойства мышечных волокон и окружающих соединительных тканей также могут способствовать паркинсонической ригидности. Уоттс и др. отметили, что у пациентов с БП даже с легкими двигательными симптомами ригидность верхних конечностей была больше, чем у контроля в расслабленном состоянии, но без какой-либо ЭМГ-активности [67]. Исследование подчеркнуло роль пассивных механических свойств для жесткости.Ся и др. также отметили вклад как нервных, так и не-нейральных факторов в паркинсоническую ригидность, в то время как нервный вклад преобладает [68].
10.5. Сетевая гипотеза паркинсоновской ригидности
Baradaran et al. [69] исследовали изменение функциональных связей в сетях мозга в связи с паркинсонической ригидностью.
 По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип.
По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип.11. Патофизиологические основы активационного маневра
Интересным, но еще не до конца изученным явлением, наблюдаемым при БП, является увеличение ригидности при сокращении мышц (изометрических/ритмических) в контралатеральной конечности.Возможные объяснения, описанные в литературе для этого феномена: (1) усиление LLSR через транскортикальный путь [71,72], (2) изменение возбудимости спинальных мотонейронов, опосредованное перекрестной сенсорной афферентной обратной связью через афферентный вход lb, что приводит к уменьшению реакции укорочения (SR).
 ) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73].
) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73].12. Дистония
12.1. Патофизиология и механизмы
Дистония определяется как «устойчивые или прерывистые мышечные сокращения, приводящие к аномальным, часто повторяющимся движениям, позам или тому и другому» [74]. Эти движения обычно шаблонны, могут быть дрожащими или скручивающими и усиливаться при произвольных действиях [75]. Дистония может быть фокальной, сегментарной, ограниченной одной половиной тела (гемидистония) или генерализованной. Гетерогенные проявления и различная этиология, начиная от генетических причин и заканчивая нейродегенеративными расстройствами, указывают на многочисленные механизмы, которые способствуют патофизиологии дистонии.Гипотеза при обсуждении механизмов дистонии в основном сосредоточена вокруг схемы базальных ганглиев, таламо и коры головного мозга.
 Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции.
Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции.12.2. Анатомические корреляты дистонии
Базальные ганглии и их аномальные связи считаются наиболее важными структурами, связанными с дистонией.Вторичные дистонии из-за поражений базальных ганглиев являются ярким примером этой ассоциации в течение длительного времени [74,75]. Леводопа, улучшающая дистонию, реагирующую на дофа (DRD), или глубокая стимуляция мозга внутреннего сегмента бледного шара, которая улучшает некоторые случаи дистонии, являются дополнительными указателями на центральную роль базальных ганглиев в происхождении дистонии [76,77,78]. Дистония не часто обнаруживается при спиноцеребеллярной атаксии (SCA), но редко является клиническим симптомом, когда мозжечковая атрофия является характерным признаком с сохранением базальных ганглиев.
 SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79].
SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79].Таким образом, совершенно ясно, что ни один анатомический коррелят не отвечает за дистонию. Скорее, дистонию вызывают аномальные сетевые связи между базальными ганглиями, мозжечком, таламусом и корой.
 В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию.
В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию.12.3. Механизмы дистонии
В отсутствие моделей дистонии на животных понимание патофизиологических механизмов, вызывающих дистонию, прояснилось с появлением транскраниальной магнитной стимуляции (ТМС) и повторяющейся транскраниальной магнитной стимуляции (рТМС). Протоколы ТМС, разработанные в качестве инструмента исследования, выявили следующие физиологические дисфункции у пациентов с дистонией.
12.3.1. Потеря торможения
Отсутствие объемного торможения, совместное сокращение мышц-антагонистов и перелив активности в мышцы, не предназначенные для действия, — все это происходит из-за физиологической потери торможения [80,81]. Окружающее торможение — это явление, управляемое корой, при котором мышцы вокруг активных сокращающихся мышц активно тормозятся, чтобы предотвратить избыточное сокращение [81,82]. Сон и др. др. описали это явление у здоровых добровольцев с помощью одиночного импульса ТМС.
 При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87].
При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87]. Нарушение реципрокного торможения приводит к совместному сокращению противоположных мышц, что обычно наблюдается при дистонии. Предполагается, что нарушения спинномозговых рефлексов при дистонии связаны с дисфункциональными нисходящими входами от высших центров [88].
Нарушение реципрокного торможения приводит к совместному сокращению противоположных мышц, что обычно наблюдается при дистонии. Предполагается, что нарушения спинномозговых рефлексов при дистонии связаны с дисфункциональными нисходящими входами от высших центров [88].12.3.2. Аномальная сенсорная функция
Боль является общепризнанным симптомом дистонии, о ней сообщалось примерно в 70% случаев при цервикальной дистонии. При отсутствии явных сенсорных аномалий при клиническом обследовании у этих пациентов отмечаются сенсорные феномены, такие как фотосенсибилизация при блефароспазме или боль в шее до цервикальной дистонии [89].Наиболее захватывающим явлением при дистонии является «geste antagoniste» или сенсорный трюк. Это добровольный маневр, выполняемый пациентом для уменьшения тяжести дистонии. Сенсорный трюк, облегчающий дистонию, ошибочно идентифицировал расстройство как психогенное по происхождению [90]. Однако впоследствии было показано, что аномальная сенсорная функция и нарушение сенсомоторной интеграции являются важным физиологическим изменением, наблюдаемым при дистонии.
 Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92].
Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92].Задача ориентации решетки (GOT) измеряет остроту пространственного различения. Он наносится на кончики пальцев обеих рук и определяет наименьшую ширину гребня решетки, для которой можно точно определить ориентацию [93].Многочисленные исследования выявили аномалии GOT с повышенным порогом пространственной дискриминации у пациентов с фокальной дистонией рук, блефароспазмом и цервикальной дистонией [94,95,96].
 Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR.
Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR. Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии.
Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии.12.3.3. Аномальная синаптическая пластичность
Аномальная сенсорная обратная связь и потеря торможения вызывают кратковременные и долговременные изменения в корково-подкорковых цепях. Byl et al. провели эксперименты на обезьянах, чтобы оценить роль травм от повторяющихся напряжений, вызывающих фокальную дистонию, чтобы подчеркнуть нейропластичность / обучаемость происхождения дистонии. Они постулировали, что эта деградация сенсорной обратной связи при травмах с повторяющимся напряжением была результатом пластичности нейронов и существенно влияла на первичную моторную область, вызывая дистонию [98].
 Этот феномен чрезмерной выраженности реакций пластичности и неспецифической топографии распространения (аномальное распространение) также был продемонстрирован в экспериментах на людях и представляет собой важный механизм, лежащий в основе дистонии [99]. Важность долговременной потенциации (ДП) и долговременной депрессии (ДД) в пластичности коры широко признана, и считается, что они изменяют рецептивные сенсорные поля и двигательные представления в мозге. Эксперименты с ТМС с использованием парной ассоциативной стимуляции (ПАС), где низкочастотная стимуляция срединного нерва и ТМС сочетаются, исследуют синаптические изменения в моторной коре [100].В исследовании «случай-контроль» у пациентов с писчими спазмами PAS выполняли на доминантном полушарии с электрической стимуляцией срединного или локтевого нерва в сочетании с ТМС, доставляемой в контралатеральную кору через 21,5 мс или 10 мс после стимуляции периферического нерва. Двигательную реакцию измеряли по мышцам, отводящим большой палец (APB) и мышце, приводящей минимальную мизинец (ADM).
Этот феномен чрезмерной выраженности реакций пластичности и неспецифической топографии распространения (аномальное распространение) также был продемонстрирован в экспериментах на людях и представляет собой важный механизм, лежащий в основе дистонии [99]. Важность долговременной потенциации (ДП) и долговременной депрессии (ДД) в пластичности коры широко признана, и считается, что они изменяют рецептивные сенсорные поля и двигательные представления в мозге. Эксперименты с ТМС с использованием парной ассоциативной стимуляции (ПАС), где низкочастотная стимуляция срединного нерва и ТМС сочетаются, исследуют синаптические изменения в моторной коре [100].В исследовании «случай-контроль» у пациентов с писчими спазмами PAS выполняли на доминантном полушарии с электрической стимуляцией срединного или локтевого нерва в сочетании с ТМС, доставляемой в контралатеральную кору через 21,5 мс или 10 мс после стимуляции периферического нерва. Двигательную реакцию измеряли по мышцам, отводящим большой палец (APB) и мышце, приводящей минимальную мизинец (ADM). У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности.
У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности. Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103].
Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103].12.4. Движения зеркал при дистонии
Движения зеркал представляют собой выражение моторного переполнения у пациентов с дистонией. Он определяется как появление аномальной позы в пораженной конечности, когда контралатеральная здоровая конечность занята определенной задачей [104]. Это помогает отличить истинные дистонические движения от любых компенсаторных движений, непроизвольно выполняемых для уменьшения инвалидности. Межполушарное торможение было продемонстрировано при функциональной нейровизуализации и электрофизиологических исследованиях, и его потеря была связана с зеркальными движениями.Мерелло и др. На функциональной МРТ показано, что у больного с писчим спазмом и зеркальными движениями при письме пораженной рукой наблюдается контралатеральная и ипсилатеральная активация задней теменной коры и скорлупы и ипсилатеральная активация нижней лобной извилины.
 Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106].
Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106].12.5. Дистония как сетевое расстройство
Анатомические корреляты и механизмы, рассмотренные выше, противоречат ранее предложенному представлению о дистонии как о чистом расстройстве базальных ганглиев. Существует повышенное признание корково-подкорковых цепей, а именно паллидоталамокортикальной и мозжечково-таламокортикальной, в патофизиологии дистонии. Эта сетевая модель (1) может хорошо объяснить неправильную обработку сенсорной информации наряду с возбудимостью тормозных путей на разных уровнях нейрооси, что может привести к аномальной пластичности и явной дистонии.
Сетевая модель дистонии.
 Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть.
Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть.Сетевая гипотеза также объясняет очаговое начало и постепенное сегментарное или генерализованное распространение аномалии [107]. Базальные ганглии и их таламокортикальные соединения посредством прямого и непрямого пути и гиперпрямого пути от коры к субталамическому ядру были хорошо описаны ранее [87,108]. Прямой путь облегчает, а непрямой тормозит движение.Гиперактивность прямого пути была показана Симоняном и соавт. при фокальных дистониях. Доступность рецепторов D1 была значительно увеличена в скорлупе у пациентов с писчим спазмом и дистонией гортани, и это подтверждает аномальную стриато-таламо-кортикальную возбудимость при дистонии [109]. Другим примером, указывающим на сетевой механизм, является успешная глубокая стимуляция мозга (DBS) внутреннего сегмента бледного шара при дистонии. Вызванные DBS изменения в нейронных паттернах подавляют патологические всплески и колебания в сети, что приводит к улучшению сенсомоторной обработки и улучшению симптомов [110].
 Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии.
Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии.Таким образом, недавние экспериментальные данные изменили наше представление о дистонии как психиатрическом диагнозе как о заболевании, характеризующемся изменениями в различных узлах головного мозга.
 Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии.
Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии.13. Паратония
Двигательные расстройства высшего порядка – это нарушения двигательного поведения, предшествующие произвольному выполнению движений. К ним относятся расстройства растормаживания, двигательной интенции, синдромы чужеродных конечностей и зеркальных движений [113].В контексте двигательных расстройств зеркальные движения обсуждались в разделе о дистонии. Явления чужеродных конечностей и расстройства двигательной интенции — корковые феномены, хорошо описанные при паркинсонизме, но выходящие за рамки настоящего обсуждения нарушений тонуса. Тем не менее, мы хотели бы кратко обсудить здесь расстройство растормаживания, паратонию, поскольку известно, что ботулинический токсин снимает непроизвольное сопротивление, наблюдаемое при паратонии.
 Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].
Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].14. Патофизиология паратонии
Beversdorf et al.продемонстрировали, что облегчающая паратония была формой эхопраксии, при которой испытуемые имитировали движения исследователя. Они пришли к выводу, что это форма дефектного торможения реакции, вторичного по отношению к дисфункции лобных долей. Орбитофронтальное повреждение и лобно-подкорковая дисфункция связаны с нарушением торможения реакции [116].
 Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114].
Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114]. Однако электромиографическая оценка больных с паратонией не выявила совместного сокращения противостоящей группы мышц при паратонии. Дрент и др. предложил еще одно периферическое биохимическое изменение, которое может способствовать повышению резистентности тканей у пациентов с деменцией и паратонией.Было обнаружено, что конечные продукты повышенного гликирования (AGE), измеренные с помощью аутофлуоресценции кожи, значительно повышены у пациентов с паратонией и имеют прямую связь с тяжестью паратонии. КПГ увеличивают жесткость тканей за счет образования поперечных связей в мышечном коллагене, нарушают функцию скелетных мышц и могут играть роль в патогенезе паратонии [118]. Основные патофизиологические механизмы, ответственные за спастичность, ригидность, дистонию и паратонию, выделены в .
Однако электромиографическая оценка больных с паратонией не выявила совместного сокращения противостоящей группы мышц при паратонии. Дрент и др. предложил еще одно периферическое биохимическое изменение, которое может способствовать повышению резистентности тканей у пациентов с деменцией и паратонией.Было обнаружено, что конечные продукты повышенного гликирования (AGE), измеренные с помощью аутофлуоресценции кожи, значительно повышены у пациентов с паратонией и имеют прямую связь с тяжестью паратонии. КПГ увеличивают жесткость тканей за счет образования поперечных связей в мышечном коллагене, нарушают функцию скелетных мышц и могут играть роль в патогенезе паратонии [118]. Основные патофизиологические механизмы, ответственные за спастичность, ригидность, дистонию и паратонию, выделены в .Таблица 2
Патофизиологические основы спастичности, ригидности, дистонии и паратонии.
. [PubMed] [CrossRef] [Google Scholar] 118. Дрент Х., Зуидема С., Баутманс И., Хоббелен Х. Роль воспалений и конечных продуктов гликирования при паратонии у пациентов с деменцией. Эксп. Геронтол. 2020;142:111125. doi: 10.1016/j.exger.2020.111125. [PubMed] [CrossRef] [Google Scholar]Нарушения тонуса Базовая патофизиология Спастичность Нарушение возбуждения и торможения спинного мозга, ведущее к повышенному возбуждению и снижению торможения сенсорная обратная связь
Ненервные факторы, такие как вязкоупругие свойства мышечного волокна и окружающих соединительных тканей
Ригидность Повышение долголатентных рефлексов растяжения (LLSR)
Усиление реакции укорочения (SR) и индуцированное растяжением торможение (SII) locus coeruleus, каудальный шов и мостовидное ядро (PPN)
Изменение функциональных связей в сетях мозга, включая лобно-теменное соединение, премоторно-преклиновидное соединение
Ненейральные факторы, такие как вязкоупругие свойства мышечных волокон и окружающих соединительных тканей
Дистония Отсутствие ингибирования объемного звучания
ненормальная сенсорно-моторная интеграция
аномалий в паллидо-таламо-корковице и мозжечко-таламо-кортикальной сети
Paratonia Дефектное торможение реакции из-за орбитофронтального повреждения и лобно-подкорковой дисфункции
Ненервные: повышение жесткости тканей из-за отложения конечных продуктов гликирования (AGE)Выводы
Тонус поддерживается сложным взаимодействием спинальных и супраспинальных механизмов, нарушения которых приводят к спастичности и ригидности.
 Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.
Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.Благодарности
В этом разделе вы можете отметить любую оказанную поддержку, не охваченную разделами вклада автора или финансирования. Это может включать административную и техническую поддержку или пожертвования в натуральной форме (например, материалы, используемые для экспериментов).
Вклад авторов
Концептуализация, Дж.Г. и М.Дж.; написание — подготовка первоначального проекта, J.G., D.K. и М.А.; написание — обзор и редактирование, MJ; авторский надзор, M.J. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получило внешнего финансирования.

Заявление Институционального контрольного совета
Неприменимо.
Заявление об информированном согласии
Неприменимо.
Заявление о доступности данных
В этом исследовании не создавались и не анализировались новые данные. Обмен данными не применим к этой статье.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Сноски
Примечание издателя: MDPI остается нейтральным в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Ссылки
1. Кэмпбелл В.В., Барон Р.Дж. ДеДжонга «Неврологическое обследование». 7-е изд. Липпинкотт Уильямс и Уилкинс; Филадельфия, Пенсильвания, США: 2019. Мышечный тонус; стр. 467–474. [Google Академия]2. Shortland AP Мышечный тонус не является четко определенным термином. Дев. Мед. Детский Нейрол. 2018;60:637. doi: 10.1111/dmcn.13707. [PubMed] [CrossRef] [Google Scholar]3. Кэмпбелл К. С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В.
С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В. Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0.
Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0. [PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С.
[PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С. , Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г.
, Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г. М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом.
М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом. Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)
Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)
 Спастическое двигательное расстройство: следует ли нам забыть гипервозбудимые рефлексы растяжения и начать говорить о неадекватном прогнозировании сенсорных последствий движения? Эксп. Мозг Res. 2020; 238:1627–1636. doi: 10.1007/s00221-020-05792-0. [PubMed] [CrossRef] [Google Scholar] 34. Дитц В., Синкьяер Т. Спастическое двигательное расстройство: нарушение рефлекторной функции и измененная мышечная механика.Ланцет Нейрол. 2007; 6: 725–733. doi: 10.1016/S1474-4422(07)70193-X. [PubMed] [CrossRef] [Google Scholar] 36. Шадмер Р., Смит М.А., Кракауэр Дж.В. Исправление ошибок, сенсорное предсказание и адаптация в управлении двигателем. Анну. Преподобный Нейроски. 2010; 33:89–108. doi: 10.1146/annurev-neuro-060909-153135. [PubMed] [CrossRef] [Google Scholar] 37. ДеЛука Г.К., Эберс Г.К., Эсири М.М. Степень потери аксонов в длинных путях при наследственной спастической параплегии. невропатол. заявл. Нейробиол. 2004; 30: 576–584. дои: 10.1111/j.1365-2990.2004.00587.x. [PubMed] [CrossRef] [Google Scholar] 38.
Спастическое двигательное расстройство: следует ли нам забыть гипервозбудимые рефлексы растяжения и начать говорить о неадекватном прогнозировании сенсорных последствий движения? Эксп. Мозг Res. 2020; 238:1627–1636. doi: 10.1007/s00221-020-05792-0. [PubMed] [CrossRef] [Google Scholar] 34. Дитц В., Синкьяер Т. Спастическое двигательное расстройство: нарушение рефлекторной функции и измененная мышечная механика.Ланцет Нейрол. 2007; 6: 725–733. doi: 10.1016/S1474-4422(07)70193-X. [PubMed] [CrossRef] [Google Scholar] 36. Шадмер Р., Смит М.А., Кракауэр Дж.В. Исправление ошибок, сенсорное предсказание и адаптация в управлении двигателем. Анну. Преподобный Нейроски. 2010; 33:89–108. doi: 10.1146/annurev-neuro-060909-153135. [PubMed] [CrossRef] [Google Scholar] 37. ДеЛука Г.К., Эберс Г.К., Эсири М.М. Степень потери аксонов в длинных путях при наследственной спастической параплегии. невропатол. заявл. Нейробиол. 2004; 30: 576–584. дои: 10.1111/j.1365-2990.2004.00587.x. [PubMed] [CrossRef] [Google Scholar] 38. Groep K.L.D.G.-V.D., De Vlugt E., De Groot J.H., Van Der Heijden-Maessen H.C., Wielheesen D.H., Van Wijlen-Hempel R.S., Arendzen J.H., Meskers C.G. Дифференциация между не-нейральными и нервными факторами тугоподвижности голеностопного сустава при церебральном параличе. Дж. Нейроэнг. Реабилит. 2013; 10:1–8. дои: 10.1186/1743-0003-10-81. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Сюй Д., У Ю., Гэблер-Спира Д., Гао Ф., Клегг Н.Дж., Дельгадо М.Р., Чжан Л. Нервные и не-невральные факторы спастичности голеностопного сустава у детей с церебральным параличом. Дев. Мед. Детский Нейрол. 2020;62:1040–1046. doi: 10.1111/dmcn.14506. [PubMed] [CrossRef] [Google Scholar]40. Берк Д., Гиллис Дж.Д., Лэнс Дж.В. Рефлекс растяжения четырехглавой мышцы при спастичности человека. Дж. Нейрол. Нейрохирург. Психиатрия. 1970; 33: 216–223. doi: 10.1136/jnnp.33.2.216. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]41. Tardieu G., Tardieu C., Colbeau-Justin P., Bret MD. Влияние длины мышц на повышенный рефлекс растяжения у детей с церебральным параличом.
Groep K.L.D.G.-V.D., De Vlugt E., De Groot J.H., Van Der Heijden-Maessen H.C., Wielheesen D.H., Van Wijlen-Hempel R.S., Arendzen J.H., Meskers C.G. Дифференциация между не-нейральными и нервными факторами тугоподвижности голеностопного сустава при церебральном параличе. Дж. Нейроэнг. Реабилит. 2013; 10:1–8. дои: 10.1186/1743-0003-10-81. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Сюй Д., У Ю., Гэблер-Спира Д., Гао Ф., Клегг Н.Дж., Дельгадо М.Р., Чжан Л. Нервные и не-невральные факторы спастичности голеностопного сустава у детей с церебральным параличом. Дев. Мед. Детский Нейрол. 2020;62:1040–1046. doi: 10.1111/dmcn.14506. [PubMed] [CrossRef] [Google Scholar]40. Берк Д., Гиллис Дж.Д., Лэнс Дж.В. Рефлекс растяжения четырехглавой мышцы при спастичности человека. Дж. Нейрол. Нейрохирург. Психиатрия. 1970; 33: 216–223. doi: 10.1136/jnnp.33.2.216. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]41. Tardieu G., Tardieu C., Colbeau-Justin P., Bret MD. Влияние длины мышц на повышенный рефлекс растяжения у детей с церебральным параличом. Дж. Нейрол. Нейрохирург. Психиатрия. 1982; 45: 348–352. doi: 10.1136/jnnp.45.4.348. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]42. Кампер Д.Г., Шмит Б.Д., Раймер В.З. Влияние мышечной биомеханики на количественную оценку спастичности. Анна. Биомед. англ. 2001; 29:1122–1134. дои: 10.1114/1.1424918. [PubMed] [CrossRef] [Google Scholar]43. Раймер В.З., Хоук Дж.К., Краго П.Е. Механизмы складного ножевого рефлекса изучены на животной модели. Эксп. Мозг Res. 1979; 37: 93–113. doi: 10.1007/BF01474257. [PubMed] [CrossRef] [Google Scholar]45.Гильоне П., Мутани Р., Чио А. Жесткость зубчатого колеса. Арка Нейрол. 2005; 62: 828–830. doi: 10.1001/archneur.62.5.828. [PubMed] [CrossRef] [Google Scholar]46. Финдли Л.Дж., Грести М.А., Халмаги Г.М. Тремор, феномен зубчатого колеса и клонус при болезни Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1981; 44: 534–546. doi: 10.1136/jnnp.44.6.534. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Фан С., Янкович Х.М. Принципы и практика двигательных расстройств.
Дж. Нейрол. Нейрохирург. Психиатрия. 1982; 45: 348–352. doi: 10.1136/jnnp.45.4.348. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]42. Кампер Д.Г., Шмит Б.Д., Раймер В.З. Влияние мышечной биомеханики на количественную оценку спастичности. Анна. Биомед. англ. 2001; 29:1122–1134. дои: 10.1114/1.1424918. [PubMed] [CrossRef] [Google Scholar]43. Раймер В.З., Хоук Дж.К., Краго П.Е. Механизмы складного ножевого рефлекса изучены на животной модели. Эксп. Мозг Res. 1979; 37: 93–113. doi: 10.1007/BF01474257. [PubMed] [CrossRef] [Google Scholar]45.Гильоне П., Мутани Р., Чио А. Жесткость зубчатого колеса. Арка Нейрол. 2005; 62: 828–830. doi: 10.1001/archneur.62.5.828. [PubMed] [CrossRef] [Google Scholar]46. Финдли Л.Дж., Грести М.А., Халмаги Г.М. Тремор, феномен зубчатого колеса и клонус при болезни Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1981; 44: 534–546. doi: 10.1136/jnnp.44.6.534. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Фан С., Янкович Х.М. Принципы и практика двигательных расстройств. Эльзевир; Амстердам, Нидерланды: 2011.Паркинсонизм: клиника и дифференциальная диагностика; стр. 66–92. [Google Академия] 49. Дональдсон И., Марсден К.Д., Шайндер Б.К. Книга Марсдена о двигательных расстройствах. Издательство Оксфордского университета; Оксфорд, Великобритания: 2012 г. Болезнь Паркинсона; стр. 159–370. [Google Академия]50. Bhidayasiri R., Sringean J., Reich S.G., Colosimo C. Фенотипирование настораживающих факторов: систематический обзор клинических признаков атипичных паркинсонических расстройств. Парк. Относ. Беспорядок. 2019;59:82–92. doi: 10.1016/j.parkreldis.2018.10.009. [PubMed] [CrossRef] [Google Scholar]51.Фёрстер О. Цур анализирует и патофизиологически дер striären bewegungsstörungen. Z. Gesamte Neurol. психиатр. 1921; 73: 1–169. doi: 10.1007/BF02895293. [CrossRef] [Google Scholar]52. Берк Д., Хагбарт К.Э., Валлин Б.Г. Рефлекторные механизмы при паркинсонической ригидности. Сканд. Дж. Реабилит. Мед. 1977; 9: 15–23. [PubMed] [Google Scholar]53. Ротвелл Дж. К., Обесо Дж.
Эльзевир; Амстердам, Нидерланды: 2011.Паркинсонизм: клиника и дифференциальная диагностика; стр. 66–92. [Google Академия] 49. Дональдсон И., Марсден К.Д., Шайндер Б.К. Книга Марсдена о двигательных расстройствах. Издательство Оксфордского университета; Оксфорд, Великобритания: 2012 г. Болезнь Паркинсона; стр. 159–370. [Google Академия]50. Bhidayasiri R., Sringean J., Reich S.G., Colosimo C. Фенотипирование настораживающих факторов: систематический обзор клинических признаков атипичных паркинсонических расстройств. Парк. Относ. Беспорядок. 2019;59:82–92. doi: 10.1016/j.parkreldis.2018.10.009. [PubMed] [CrossRef] [Google Scholar]51.Фёрстер О. Цур анализирует и патофизиологически дер striären bewegungsstörungen. Z. Gesamte Neurol. психиатр. 1921; 73: 1–169. doi: 10.1007/BF02895293. [CrossRef] [Google Scholar]52. Берк Д., Хагбарт К.Э., Валлин Б.Г. Рефлекторные механизмы при паркинсонической ригидности. Сканд. Дж. Реабилит. Мед. 1977; 9: 15–23. [PubMed] [Google Scholar]53. Ротвелл Дж. К., Обесо Дж. А., Трауб М. М., Марсден К. Д. Поведение долголатентного рефлекса растяжения у пациентов с болезнью Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1983; 46: 35–44.doi: 10.1136/jnnp.46.1.35. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]54. Берги М., Лопиано Л., Палья Г., Кватроколо Г., Скарцелла Л., Бергамаско Б. Рефлекс растяжения четырехглавой мышцы бедра и его связь с ригидностью при болезни Паркинсона. Акта Нейрол. Сканд. 1992; 86: 226–229. doi: 10.1111/j.1600-0404.1992.tb05075.x. [PubMed] [CrossRef] [Google Scholar]55. Дитрихсон П. Тонический лодыжечный рефлекс при паркинсоновской ригидности и спастичности. Акта Нейрол. Сканд. 1971; 47: 163–182. doi: 10.1111/j.1600-0404.1971.tb07474.х. [PubMed] [CrossRef] [Google Scholar]56. Берк Д., Эндрюс С.Дж., Лэнс Дж.В. Тонический вибрационный рефлекс при спастичности, болезни Паркинсона и в норме. Дж. Нейрол. Нейрохирург. Психиатрия. 1972; 35: 477–486. doi: 10.1136/jnnp.35.4.477. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]57.
А., Трауб М. М., Марсден К. Д. Поведение долголатентного рефлекса растяжения у пациентов с болезнью Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1983; 46: 35–44.doi: 10.1136/jnnp.46.1.35. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]54. Берги М., Лопиано Л., Палья Г., Кватроколо Г., Скарцелла Л., Бергамаско Б. Рефлекс растяжения четырехглавой мышцы бедра и его связь с ригидностью при болезни Паркинсона. Акта Нейрол. Сканд. 1992; 86: 226–229. doi: 10.1111/j.1600-0404.1992.tb05075.x. [PubMed] [CrossRef] [Google Scholar]55. Дитрихсон П. Тонический лодыжечный рефлекс при паркинсоновской ригидности и спастичности. Акта Нейрол. Сканд. 1971; 47: 163–182. doi: 10.1111/j.1600-0404.1971.tb07474.х. [PubMed] [CrossRef] [Google Scholar]56. Берк Д., Эндрюс С.Дж., Лэнс Дж.В. Тонический вибрационный рефлекс при спастичности, болезни Паркинсона и в норме. Дж. Нейрол. Нейрохирург. Психиатрия. 1972; 35: 477–486. doi: 10.1136/jnnp.35.4.477. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]57. Берарделли А., Сабра А.Ф., Халлетт М. Физиологические механизмы ригидности при болезни Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1983; 46: 45–53. doi: 10.1136/jnnp.46.1.45. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58.Шеррингтон К. С. О пластическом тонусе и проприоцептивных рефлексах. QJ Exp. Физиол. 1909; 2: 109–156. doi: 10.1113/expphysiol.1909.sp000032. [CrossRef] [Google Scholar] 59. Делвейд П.Дж., Пепин Дж.Л., Де Нордхаут А.М. Коротколатентное аутогенное торможение у пациентов с паркинсонической ригидностью. Анна. Нейрол. 1991; 30:83–89. doi: 10.1002/ana.410300115. [PubMed] [CrossRef] [Google Scholar] 60. Ся Р. Этиология и патофизиология болезни Паркинсона. ИнТех; Вена, Австрия: 2011. Физиологический и биомеханический анализ ригидности при болезни Паркинсона.[Перекрестная ссылка] [Академия Google] 61. Ся Р., Пауэлл Д., Раймер В.З., Хэнсон Н., Фанг Х., Трелкельд А.Дж. Дифференциация вклада реакции укорочения и торможения, вызванного растяжением, в ригидность при болезни Паркинсона.
Берарделли А., Сабра А.Ф., Халлетт М. Физиологические механизмы ригидности при болезни Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1983; 46: 45–53. doi: 10.1136/jnnp.46.1.45. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58.Шеррингтон К. С. О пластическом тонусе и проприоцептивных рефлексах. QJ Exp. Физиол. 1909; 2: 109–156. doi: 10.1113/expphysiol.1909.sp000032. [CrossRef] [Google Scholar] 59. Делвейд П.Дж., Пепин Дж.Л., Де Нордхаут А.М. Коротколатентное аутогенное торможение у пациентов с паркинсонической ригидностью. Анна. Нейрол. 1991; 30:83–89. doi: 10.1002/ana.410300115. [PubMed] [CrossRef] [Google Scholar] 60. Ся Р. Этиология и патофизиология болезни Паркинсона. ИнТех; Вена, Австрия: 2011. Физиологический и биомеханический анализ ригидности при болезни Паркинсона.[Перекрестная ссылка] [Академия Google] 61. Ся Р., Пауэлл Д., Раймер В.З., Хэнсон Н., Фанг Х., Трелкельд А.Дж. Дифференциация вклада реакции укорочения и торможения, вызванного растяжением, в ригидность при болезни Паркинсона. Эксп. Мозг Res. 2011; 209: 609–618. doi: 10.1007/s00221-011-2594-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]62. Линн-Эванс М.Э., Петруччи М.Н., Хаффмастер С.Л.А., Чанг Дж.В., Туите П.Дж., Хауэлл М.Дж., Виденович А., Маккиннон К.Д. Быстрый сон без атонии связан с повышенной ригидностью у пациентов с болезнью Паркинсона легкой и средней степени тяжести.клин. Нейрофизиол. 2020;131:2008–2016. doi: 10.1016/j.clinph.2020.04.017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]63. Boeve B.F., Silber M.H., Saper C.B., Ferman T.J., Dickson D.W., Parisi J.E., Benarroch E.E., Ahlskog J.E., Smith G.E., Caselli R.C., et al. Патофизиология расстройства поведения во время быстрого сна и связь с нейродегенеративным заболеванием. Мозг. 2007; 130: 2770–2788. doi: 10.1093/brain/awm056. [PubMed] [CrossRef] [Google Scholar]64. Браак Х., Бол Дж.Р., Мюллер С.М., Рюб У., Де Вос Р.А., Дель Тредичи К. Стэнли Фан, лекция 2005 г.: Пересмотр процедуры стадирования патологии телец включения, связанной со спорадической болезнью Паркинсона.
Эксп. Мозг Res. 2011; 209: 609–618. doi: 10.1007/s00221-011-2594-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]62. Линн-Эванс М.Э., Петруччи М.Н., Хаффмастер С.Л.А., Чанг Дж.В., Туите П.Дж., Хауэлл М.Дж., Виденович А., Маккиннон К.Д. Быстрый сон без атонии связан с повышенной ригидностью у пациентов с болезнью Паркинсона легкой и средней степени тяжести.клин. Нейрофизиол. 2020;131:2008–2016. doi: 10.1016/j.clinph.2020.04.017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]63. Boeve B.F., Silber M.H., Saper C.B., Ferman T.J., Dickson D.W., Parisi J.E., Benarroch E.E., Ahlskog J.E., Smith G.E., Caselli R.C., et al. Патофизиология расстройства поведения во время быстрого сна и связь с нейродегенеративным заболеванием. Мозг. 2007; 130: 2770–2788. doi: 10.1093/brain/awm056. [PubMed] [CrossRef] [Google Scholar]64. Браак Х., Бол Дж.Р., Мюллер С.М., Рюб У., Де Вос Р.А., Дель Тредичи К. Стэнли Фан, лекция 2005 г.: Пересмотр процедуры стадирования патологии телец включения, связанной со спорадической болезнью Паркинсона. Мов. Беспорядок. 2006;21:2042–2051. doi: 10.1002/mds.21065. [PubMed] [CrossRef] [Google Scholar] 65. Делвейд П. Дж. Паркинсоновская ригидность. Функц. Нейрол. 2001; 16: 147–156. [PubMed] [Google Scholar]66. Хекман К., Моттрам К., Куинлан К., Тайсс Р., Шустер Дж. Возбудимость мотонейронов: важность нейромодуляторных воздействий. клин. Нейрофизиол.2009;120:2040–2054. doi: 10.1016/j.clinph.2009.08.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]67. Уоттс Р.Л., Вигнер А.В., Янг Р.Р. Эластические свойства мышц, измеренные в локтевом суставе у человека: II. Пациенты с паркинсонической ригидностью. Дж. Нейрол. Нейрохирург. Психиатрия. 1986; 49: 1177–1181. doi: 10.1136/jnnp.49.10.1177. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]68. Ся Р., Радович М., Трелкельд А.Дж., Мао З.-Х. Системный подход к идентификации и моделированию ригидности при болезни Паркинсона: нейронные и ненейронные вклады; Материалы 4-й Международной конференции по биоинформатике и биомедицинской инженерии 2010 г .
Мов. Беспорядок. 2006;21:2042–2051. doi: 10.1002/mds.21065. [PubMed] [CrossRef] [Google Scholar] 65. Делвейд П. Дж. Паркинсоновская ригидность. Функц. Нейрол. 2001; 16: 147–156. [PubMed] [Google Scholar]66. Хекман К., Моттрам К., Куинлан К., Тайсс Р., Шустер Дж. Возбудимость мотонейронов: важность нейромодуляторных воздействий. клин. Нейрофизиол.2009;120:2040–2054. doi: 10.1016/j.clinph.2009.08.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]67. Уоттс Р.Л., Вигнер А.В., Янг Р.Р. Эластические свойства мышц, измеренные в локтевом суставе у человека: II. Пациенты с паркинсонической ригидностью. Дж. Нейрол. Нейрохирург. Психиатрия. 1986; 49: 1177–1181. doi: 10.1136/jnnp.49.10.1177. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]68. Ся Р., Радович М., Трелкельд А.Дж., Мао З.-Х. Системный подход к идентификации и моделированию ригидности при болезни Паркинсона: нейронные и ненейронные вклады; Материалы 4-й Международной конференции по биоинформатике и биомедицинской инженерии 2010 г . ; Чэнду, Китай.18–20 июня 2010 г.; стр. 1–4. [Google Академия] 69. Эбарадаран Н., Этан С.Н., Элиу А., Эашури А., Палмер С.Дж., Эванг З.Дж., Оиши М.М.К., Маккеун М.Дж. Ригидность при болезни Паркинсона: связь с мозговой связью и двигательной активностью. Передний. Нейрол. 2013;4:67. doi: 10.3389/fneur.2013.00067. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Канн С.Дж., Чанг К., Манза П., Леунг Х.-К. Акинетические ригидные симптомы связаны со снижением корковой двигательной сети при болезни Паркинсона. Парк НПЖ.Дис. 2020;6:1–8. doi: 10.1038/s41531-020-00120-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]71. Карсон Р., Риек С., Макки Д.К., Мейхенбаум Д.П., Уиллмс К., Форнер М., Библоу В.Д. Изменения возбудимости корково-спинномозговых проекций предплечья человека и спинномозговых рефлекторных путей во время ритмичных произвольных движений противоположной конечности. Дж. Физиол. 2004; 560:929–940. doi: 10.1113/jphysiol.2004.069088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]72.
; Чэнду, Китай.18–20 июня 2010 г.; стр. 1–4. [Google Академия] 69. Эбарадаран Н., Этан С.Н., Элиу А., Эашури А., Палмер С.Дж., Эванг З.Дж., Оиши М.М.К., Маккеун М.Дж. Ригидность при болезни Паркинсона: связь с мозговой связью и двигательной активностью. Передний. Нейрол. 2013;4:67. doi: 10.3389/fneur.2013.00067. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Канн С.Дж., Чанг К., Манза П., Леунг Х.-К. Акинетические ригидные симптомы связаны со снижением корковой двигательной сети при болезни Паркинсона. Парк НПЖ.Дис. 2020;6:1–8. doi: 10.1038/s41531-020-00120-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]71. Карсон Р., Риек С., Макки Д.К., Мейхенбаум Д.П., Уиллмс К., Форнер М., Библоу В.Д. Изменения возбудимости корково-спинномозговых проекций предплечья человека и спинномозговых рефлекторных путей во время ритмичных произвольных движений противоположной конечности. Дж. Физиол. 2004; 560:929–940. doi: 10.1113/jphysiol.2004.069088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]72. Хортобадьи Т., Тейлор Дж.Л., Петерсен Н.Т., Рассел Г., Гандевиа С.К. Изменения в сегментарной и моторной корковой активности при контралатеральных сокращениях мышц и измененных сенсорных входах у людей. Дж. Нейрофизиол. 2003;90:2451–2459. doi: 10.1152/jn.01001.2002. [PubMed] [CrossRef] [Google Scholar]73. Пауэлл Д., Хэнсон Н., Трелкелд А.Дж., Фанг Х., Ся Р. Усиление паркинсонической ригидности с активацией контралатеральной руки. клин. Нейрофизиол. 2011; 122:1595–1601. doi: 10.1016/j.clinph.2011.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]75.Рибо Б., Аупи Дж., Видайле М., Мазер Дж., Пизани А., Безар Э., Гуэль Д., Бурбо П. Дистония и дофамин: от феноменологии к патофизиологии. прог. Нейробиол. 2019;182:101678. doi: 10.1016/j.pneurobio.2019.101678. [PubMed] [CrossRef] [Google Scholar]76. Каджи Р., Бхатия К., Грейбиел А.М. Патогенез дистонии: мозжечкового или базального происхождения? Дж. Нейрол. Нейрохирург. Психиатрия. 2017; 89: 488–492. doi: 10.1136/jnnp-2017-316250.
Хортобадьи Т., Тейлор Дж.Л., Петерсен Н.Т., Рассел Г., Гандевиа С.К. Изменения в сегментарной и моторной корковой активности при контралатеральных сокращениях мышц и измененных сенсорных входах у людей. Дж. Нейрофизиол. 2003;90:2451–2459. doi: 10.1152/jn.01001.2002. [PubMed] [CrossRef] [Google Scholar]73. Пауэлл Д., Хэнсон Н., Трелкелд А.Дж., Фанг Х., Ся Р. Усиление паркинсонической ригидности с активацией контралатеральной руки. клин. Нейрофизиол. 2011; 122:1595–1601. doi: 10.1016/j.clinph.2011.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]75.Рибо Б., Аупи Дж., Видайле М., Мазер Дж., Пизани А., Безар Э., Гуэль Д., Бурбо П. Дистония и дофамин: от феноменологии к патофизиологии. прог. Нейробиол. 2019;182:101678. doi: 10.1016/j.pneurobio.2019.101678. [PubMed] [CrossRef] [Google Scholar]76. Каджи Р., Бхатия К., Грейбиел А.М. Патогенез дистонии: мозжечкового или базального происхождения? Дж. Нейрол. Нейрохирург. Психиатрия. 2017; 89: 488–492. doi: 10.1136/jnnp-2017-316250. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]77.Драгански Б., Тун-Хохенштейн С., Богдан У., Винклер Дж., Мэй А. Изменения серого вещества «моторного контура» при идиопатической цервикальной дистонии. Неврология. 2003;61:1228–1231. doi: 10.1212/01.WNL.0000094240.93745.83. [PubMed] [CrossRef] [Google Scholar]78. Бауэр А., Ханакава Т., Ву Т., Кансаку К., Халлетт М. Изменения анатомии головного мозга при фокальной дистонии рук. Анна. Нейрол. 2004; 55: 736–739. doi: 10.1002/ana.20113. [PubMed] [CrossRef] [Google Scholar]79. Дельмер К., Видайхет М., Эльбаз А., Бурден Ф., Блетон Дж.P., Sangla S., Meunier S., Terrier A., Lehericy S. Структурные нарушения в мозжечке и сенсомоторной цепи при писчем спазме. Неврология. 2007; 69: 376–380. doi: 10.1212/01.wnl.0000266591.49624.1a. [PubMed] [CrossRef] [Google Scholar]80. Фазано А., Морганте Ф. Дистония: Руководство для клинициста по диагностике, патофизиологии и лечению. Медицина будущего ООО; Лондон, Великобритания: 2014. [Google Scholar]81.
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]77.Драгански Б., Тун-Хохенштейн С., Богдан У., Винклер Дж., Мэй А. Изменения серого вещества «моторного контура» при идиопатической цервикальной дистонии. Неврология. 2003;61:1228–1231. doi: 10.1212/01.WNL.0000094240.93745.83. [PubMed] [CrossRef] [Google Scholar]78. Бауэр А., Ханакава Т., Ву Т., Кансаку К., Халлетт М. Изменения анатомии головного мозга при фокальной дистонии рук. Анна. Нейрол. 2004; 55: 736–739. doi: 10.1002/ana.20113. [PubMed] [CrossRef] [Google Scholar]79. Дельмер К., Видайхет М., Эльбаз А., Бурден Ф., Блетон Дж.P., Sangla S., Meunier S., Terrier A., Lehericy S. Структурные нарушения в мозжечке и сенсомоторной цепи при писчем спазме. Неврология. 2007; 69: 376–380. doi: 10.1212/01.wnl.0000266591.49624.1a. [PubMed] [CrossRef] [Google Scholar]80. Фазано А., Морганте Ф. Дистония: Руководство для клинициста по диагностике, патофизиологии и лечению. Медицина будущего ООО; Лондон, Великобритания: 2014. [Google Scholar]81. Халлетт М. Дистония: ненормальные движения возникают в результате потери торможения. Доп. Нейрол. 2004; 94:1–9.[PubMed] [Google Scholar]82. Lozeron P., Poujois A., Richard A., Masmoudi S., Meppiel E., Woimant F., Kubis N. Вклад TMS и rTMS в понимание патофизиологии и лечения дистонии. Передний. Нейронный круг. 2016;10:90. doi: 10.3389/fncir.2016.00090. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]83. Sohn YH, Hallett M. Surround торможение в двигательной системе человека. Эксп. Мозг Res. 2004; 158: 397–404. doi: 10.1007/s00221-004-1909-y. [PubMed] [CrossRef] [Google Scholar]84.Sohn YH, Hallett M. Нарушение объемного торможения при фокальной дистонии рук. Анна. Нейрол. 2004; 56: 595–599. doi: 10.1002/ana.20270. [PubMed] [CrossRef] [Google Scholar]85. Икома К., Самии А., Меркури Б., Вассерманн Э.М., Халлетт М. Аномальная моторная возбудимость коры головного мозга при дистонии. Неврология. 1996; 46:1371. doi: 10.1212/WNL.46.5.1371. [PubMed] [CrossRef] [Google Scholar]86. Рона С.
Халлетт М. Дистония: ненормальные движения возникают в результате потери торможения. Доп. Нейрол. 2004; 94:1–9.[PubMed] [Google Scholar]82. Lozeron P., Poujois A., Richard A., Masmoudi S., Meppiel E., Woimant F., Kubis N. Вклад TMS и rTMS в понимание патофизиологии и лечения дистонии. Передний. Нейронный круг. 2016;10:90. doi: 10.3389/fncir.2016.00090. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]83. Sohn YH, Hallett M. Surround торможение в двигательной системе человека. Эксп. Мозг Res. 2004; 158: 397–404. doi: 10.1007/s00221-004-1909-y. [PubMed] [CrossRef] [Google Scholar]84.Sohn YH, Hallett M. Нарушение объемного торможения при фокальной дистонии рук. Анна. Нейрол. 2004; 56: 595–599. doi: 10.1002/ana.20270. [PubMed] [CrossRef] [Google Scholar]85. Икома К., Самии А., Меркури Б., Вассерманн Э.М., Халлетт М. Аномальная моторная возбудимость коры головного мозга при дистонии. Неврология. 1996; 46:1371. doi: 10.1212/WNL.46.5.1371. [PubMed] [CrossRef] [Google Scholar]86. Рона С. , Берарделли А., Вакка Л., Ингиллери М., Манфреди М. Изменения моторного коркового торможения у пациентов с дистонией.Мов. Беспорядок. 1998; 13:118–124. doi: 10.1002/mds.870130123. [PubMed] [CrossRef] [Google Scholar]87. Минк Дж.В. Базальные ганглии: целенаправленный отбор и торможение конкурирующих моторных программ. прог. Нейробиол. 1996; 50: 381–425. doi: 10.1016/S0301-0082(96)00042-1. [PubMed] [CrossRef] [Google Scholar]88. Берарделли А., Ротвелл Дж. К., Халлетт М., Томпсон П. Д., Манфреди М., Марсден К. Д. Патофизиология первичной дистонии. Мозг. 1998; 121:1195–1212. doi: 10.1093/мозг/121.7.1195. [PubMed] [CrossRef] [Google Scholar]90.Poisson A., Krack P., Thobois S., Loiraud C., Serra G., Vial C., Broussolle E. История симптома «антагонистического жеста» при цервикальной дистонии. Дж. Нейрол. 2012; 259:1580–1584. doi: 10.1007/s00415-011-6380-7. [PubMed] [CrossRef] [Google Scholar]91. Йонеда Ю., Рим С., Сагар Х.Дж., Грюневальд Р.А. Аномальное восприятие тонического вибрационного рефлекса при идиопатической фокальной дистонии.
, Берарделли А., Вакка Л., Ингиллери М., Манфреди М. Изменения моторного коркового торможения у пациентов с дистонией.Мов. Беспорядок. 1998; 13:118–124. doi: 10.1002/mds.870130123. [PubMed] [CrossRef] [Google Scholar]87. Минк Дж.В. Базальные ганглии: целенаправленный отбор и торможение конкурирующих моторных программ. прог. Нейробиол. 1996; 50: 381–425. doi: 10.1016/S0301-0082(96)00042-1. [PubMed] [CrossRef] [Google Scholar]88. Берарделли А., Ротвелл Дж. К., Халлетт М., Томпсон П. Д., Манфреди М., Марсден К. Д. Патофизиология первичной дистонии. Мозг. 1998; 121:1195–1212. doi: 10.1093/мозг/121.7.1195. [PubMed] [CrossRef] [Google Scholar]90.Poisson A., Krack P., Thobois S., Loiraud C., Serra G., Vial C., Broussolle E. История симптома «антагонистического жеста» при цервикальной дистонии. Дж. Нейрол. 2012; 259:1580–1584. doi: 10.1007/s00415-011-6380-7. [PubMed] [CrossRef] [Google Scholar]91. Йонеда Ю., Рим С., Сагар Х.Дж., Грюневальд Р.А. Аномальное восприятие тонического вибрационного рефлекса при идиопатической фокальной дистонии. Евро. Дж. Нейрол. 2000; 7: 529–533. doi: 10.1046/j.1468-1331.2000.t01-1-00102.x. [PubMed] [CrossRef] [Google Scholar]92. Тинацци М., Россо Т., Фиаски А. Роль соматосенсорной системы в первичной дистонии. Мов. Беспорядок. 2003; 18: 605–622. doi: 10.1002/mds.10398. [PubMed] [CrossRef] [Google Scholar]93. Конте А., ДеФацио Г., Халлетт М., Фаббрини Г., Берарделли А. Роль сенсорной информации в патофизиологии фокальных дистоний. Нац. Преподобный Нейрол. 2019;15:224–233. doi: 10.1038/s41582-019-0137-9. [PubMed] [CrossRef] [Google Scholar]94. Бара-Хименес В., Шелтон П., Халлетт М. Пространственная дискриминация ненормальна при фокальной дистонии рук.Неврология. 2000; 55: 1869–1873. doi: 10.1212/WNL.55.12.1869. [PubMed] [CrossRef] [Google Scholar]95. Моллой Ф.М., Зеунер К.Е., Дамброзия Дж.М., Карр Т.Д., Халлетт М. Аномалии пространственной дискриминации при фокальной и генерализованной дистонии. Мозг. 2003; 126: 2175–2182. doi: 10.1093/мозг/awg219. [PubMed] [CrossRef] [Google Scholar]96. Уолш Р.
Евро. Дж. Нейрол. 2000; 7: 529–533. doi: 10.1046/j.1468-1331.2000.t01-1-00102.x. [PubMed] [CrossRef] [Google Scholar]92. Тинацци М., Россо Т., Фиаски А. Роль соматосенсорной системы в первичной дистонии. Мов. Беспорядок. 2003; 18: 605–622. doi: 10.1002/mds.10398. [PubMed] [CrossRef] [Google Scholar]93. Конте А., ДеФацио Г., Халлетт М., Фаббрини Г., Берарделли А. Роль сенсорной информации в патофизиологии фокальных дистоний. Нац. Преподобный Нейрол. 2019;15:224–233. doi: 10.1038/s41582-019-0137-9. [PubMed] [CrossRef] [Google Scholar]94. Бара-Хименес В., Шелтон П., Халлетт М. Пространственная дискриминация ненормальна при фокальной дистонии рук.Неврология. 2000; 55: 1869–1873. doi: 10.1212/WNL.55.12.1869. [PubMed] [CrossRef] [Google Scholar]95. Моллой Ф.М., Зеунер К.Е., Дамброзия Дж.М., Карр Т.Д., Халлетт М. Аномалии пространственной дискриминации при фокальной и генерализованной дистонии. Мозг. 2003; 126: 2175–2182. doi: 10.1093/мозг/awg219. [PubMed] [CrossRef] [Google Scholar]96. Уолш Р. , О’Двайер Дж. П., Шейх И. Х., О’Риордан С., Линч Т., Хатчинсон М. Спорадическая дистония у взрослых: сенсорные аномалии как эндофенотип у незатронутых родственников.Дж. Нейрол. Нейрохирург. Психиатрия. 2007; 78: 980–983. doi: 10.1136/jnnp.2006.105585. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]97. Брэдли Д., Уилан Р., Уолш Р., Рейли Р.Б., Хатчинсон С., Моллой Ф. Временной порог дискриминации: свидетельство VBM эндофенотипа при первичной торсионной дистонии у взрослых. Мозг. 2009;132:2327–2335. doi: 10.1093/мозг/awp156. [PubMed] [CrossRef] [Google Scholar]98. Был Н.Н., Мерценич М.М., Дженкинс В.М. Модель генезиса приматов фокальной дистонии и повторяющихся повреждений напряжения.Неврология. 1996; 47: 508–520. doi: 10.1212/WNL.47.2.508. [PubMed] [CrossRef] [Google Scholar]99. Садницка А., Кассаветис П., Пареес И., Меппелинк А.М., Батлер К., Эдвардс М. Специфическая дистония: патофизиология и лечение. Дж. Нейрол. Нейрохирург. Психиатрия. 2016; 87: 968–974. doi: 10.1136/jnnp-2015-311298.
, О’Двайер Дж. П., Шейх И. Х., О’Риордан С., Линч Т., Хатчинсон М. Спорадическая дистония у взрослых: сенсорные аномалии как эндофенотип у незатронутых родственников.Дж. Нейрол. Нейрохирург. Психиатрия. 2007; 78: 980–983. doi: 10.1136/jnnp.2006.105585. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]97. Брэдли Д., Уилан Р., Уолш Р., Рейли Р.Б., Хатчинсон С., Моллой Ф. Временной порог дискриминации: свидетельство VBM эндофенотипа при первичной торсионной дистонии у взрослых. Мозг. 2009;132:2327–2335. doi: 10.1093/мозг/awp156. [PubMed] [CrossRef] [Google Scholar]98. Был Н.Н., Мерценич М.М., Дженкинс В.М. Модель генезиса приматов фокальной дистонии и повторяющихся повреждений напряжения.Неврология. 1996; 47: 508–520. doi: 10.1212/WNL.47.2.508. [PubMed] [CrossRef] [Google Scholar]99. Садницка А., Кассаветис П., Пареес И., Меппелинк А.М., Батлер К., Эдвардс М. Специфическая дистония: патофизиология и лечение. Дж. Нейрол. Нейрохирург. Психиатрия. 2016; 87: 968–974. doi: 10.1136/jnnp-2015-311298. [PubMed] [CrossRef] [Google Scholar] 100. Стефан К., Кунеш Э., Бенеке Р., Коэн Л.Г., Классен Дж. Механизмы повышения возбудимости моторной коры человека, вызванные интервенционной парной ассоциативной стимуляцией.Дж. Физиол. 2002; 543: 699–708. doi: 10.1113/jphysiol.2002.023317. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]101. Вайзе Д., Шрамм А., Стефан К., Вольтерс А., Райнерс К., Науманн М., Классен Дж. Две стороны ассоциативной пластичности при писательском спазме. Мозг. 2006; 129: 2709–2721. doi: 10.1093/brain/awl221. [PubMed] [CrossRef] [Google Scholar] 102. Куартароне А., Морганте Ф., Сант-Анджело А., Риццо В., Баньято С., Терранова С., Зибнер Х., Берарделли А., Гирланда П. Аномальная пластичность сенсомоторных цепей распространяется за пределы пораженной части тела в фокальной области. дистония.Дж. Нейрол. Нейрохирург. Психиатрия. 2008; 79: 985–990. doi: 10.1136/jnnp.2007.121632. [PubMed] [CrossRef] [Google Scholar] 103. Латорре А., Кокко А., Бхатия К.П., Эрро Р.
[PubMed] [CrossRef] [Google Scholar] 100. Стефан К., Кунеш Э., Бенеке Р., Коэн Л.Г., Классен Дж. Механизмы повышения возбудимости моторной коры человека, вызванные интервенционной парной ассоциативной стимуляцией.Дж. Физиол. 2002; 543: 699–708. doi: 10.1113/jphysiol.2002.023317. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]101. Вайзе Д., Шрамм А., Стефан К., Вольтерс А., Райнерс К., Науманн М., Классен Дж. Две стороны ассоциативной пластичности при писательском спазме. Мозг. 2006; 129: 2709–2721. doi: 10.1093/brain/awl221. [PubMed] [CrossRef] [Google Scholar] 102. Куартароне А., Морганте Ф., Сант-Анджело А., Риццо В., Баньято С., Терранова С., Зибнер Х., Берарделли А., Гирланда П. Аномальная пластичность сенсомоторных цепей распространяется за пределы пораженной части тела в фокальной области. дистония.Дж. Нейрол. Нейрохирург. Психиатрия. 2008; 79: 985–990. doi: 10.1136/jnnp.2007.121632. [PubMed] [CrossRef] [Google Scholar] 103. Латорре А., Кокко А., Бхатия К.П., Эрро Р. , Антельми Э., Конте А., Ротвелл Дж.К., Рокки Л. Дефектное соматосенсорное торможение и пластичность не требуются для развития дистонии. Мов. Беспорядок. 2020;2020:1–8. doi: 10.1002/mds.28427. [PubMed] [CrossRef] [Google Scholar] 104. Кокс Б.К., Чинкотта М., Эспей А.Дж. Зеркальные движения при двигательных расстройствах: обзор. Тремор Другое Hyperkinet Mov.2012;2:тре-02-59-398-1. doi: 10.5334/том.113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]105. Мерелло М., Карпинтьеро С., Каммарота А., Мели Ф., Лейгуарда Р. Двусторонние зеркальные письменные движения (зеркальная дистония) у пациента с писчим спазмом: функциональные корреляты. Мов. Беспорядок. 2006; 21: 683–689. doi: 10.1002/mds.20736. [PubMed] [CrossRef] [Google Scholar] 106. Бек С., Шамим Э.А., Ричардсон С.П., Шуберт М., Халлетт М. Межполушарное торможение нарушается при зеркальной дистонии. Евро.Дж. Нейроски. 2009; 29: 1634–1640. doi: 10.1111/j.1460-9568.2009.06710.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]108.
, Антельми Э., Конте А., Ротвелл Дж.К., Рокки Л. Дефектное соматосенсорное торможение и пластичность не требуются для развития дистонии. Мов. Беспорядок. 2020;2020:1–8. doi: 10.1002/mds.28427. [PubMed] [CrossRef] [Google Scholar] 104. Кокс Б.К., Чинкотта М., Эспей А.Дж. Зеркальные движения при двигательных расстройствах: обзор. Тремор Другое Hyperkinet Mov.2012;2:тре-02-59-398-1. doi: 10.5334/том.113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]105. Мерелло М., Карпинтьеро С., Каммарота А., Мели Ф., Лейгуарда Р. Двусторонние зеркальные письменные движения (зеркальная дистония) у пациента с писчим спазмом: функциональные корреляты. Мов. Беспорядок. 2006; 21: 683–689. doi: 10.1002/mds.20736. [PubMed] [CrossRef] [Google Scholar] 106. Бек С., Шамим Э.А., Ричардсон С.П., Шуберт М., Халлетт М. Межполушарное торможение нарушается при зеркальной дистонии. Евро.Дж. Нейроски. 2009; 29: 1634–1640. doi: 10.1111/j.1460-9568.2009.06710.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]108. Делонг М.Р. Модели двигательных расстройств базального ганглийского происхождения у приматов. Тренды Нейроси. 1990; 13: 281–285. doi: 10.1016/0166-2236(90)
Делонг М.Р. Модели двигательных расстройств базального ганглийского происхождения у приматов. Тренды Нейроси. 1990; 13: 281–285. doi: 10.1016/0166-2236(90)-V. [PubMed] [CrossRef] [Google Scholar] 109. Симонян К., Чо Х., Сичани А.Х., Рубиен-Томас Э., Халлетт М. Гиперфункция прямого пути базальных ганглиев при фокальной дистонии. Мозг. 2017;140:3179–3190. doi: 10.1093/мозг/awx263.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]111. Аргелан М., Карбон М., Нитхаммер М., Улуг А.М., Восс Х.У., Брессман С.Б., Дхаван В., Эйдельберг Д. Церебеллоталамокортикальная связь регулирует пенетрантность при дистонии. Дж. Нейроски. 2009;29:9740–9747. doi: 10.1523/JNEUROSCI.2300-09.2009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]112. Аккал Д., Дум Р.П., Стрик П.Л. Дополнительная моторная зона и предварительная моторная зона: цели базальных ганглиев и мозжечкового выхода. Дж.Неврологи. 2007; 27:10659–10673. doi: 10.1523/JNEUROSCI.3134-07.2007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]113.
 Койович М., Бхатия К.П. Приведение в порядок двигательных расстройств высшего порядка. Дж. Нейрол. 2018; 266:797–805. doi: 10.1007/s00415-018-8974-9. [PubMed] [CrossRef] [Google Scholar] 114. Дрент Х., Зуидема С., Баутманс И., Маринелли Л., Кляйнер Г., Хоббелен Х. Паратония при деменции: систематический обзор. Дж. Альцгеймер Дис. 2020; 78: 1615–1637. doi: 10.3233/JAD-200691. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]115.Маринелли Л., Мори Л., Пардини М., Беверсдорф Д., Кочито Л., Курра А., Фаттаппоста Ф., Гиларди М.Ф., Аббруццезе Г., Тромпетто С. Электромиографическая оценка паратонии. Эксп. Мозг Res. 2016; 235:949–956. doi: 10.1007/s00221-016-4854-7. [PubMed] [CrossRef] [Google Scholar] 116. Беверсдорф Д.К., Хейлман К.М. Фасилитарная паратония и функционирование лобных долей. Неврология. 1998; 51: 968–971. doi: 10.1212/WNL.51.4.968. [PubMed] [CrossRef] [Google Scholar] 117. Лермитт Ф. Человеческая автономия и лобные доли.Часть II: Поведение пациента в сложных и социальных ситуациях: синдром зависимости от окружающей среды? Анна.
Койович М., Бхатия К.П. Приведение в порядок двигательных расстройств высшего порядка. Дж. Нейрол. 2018; 266:797–805. doi: 10.1007/s00415-018-8974-9. [PubMed] [CrossRef] [Google Scholar] 114. Дрент Х., Зуидема С., Баутманс И., Маринелли Л., Кляйнер Г., Хоббелен Х. Паратония при деменции: систематический обзор. Дж. Альцгеймер Дис. 2020; 78: 1615–1637. doi: 10.3233/JAD-200691. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]115.Маринелли Л., Мори Л., Пардини М., Беверсдорф Д., Кочито Л., Курра А., Фаттаппоста Ф., Гиларди М.Ф., Аббруццезе Г., Тромпетто С. Электромиографическая оценка паратонии. Эксп. Мозг Res. 2016; 235:949–956. doi: 10.1007/s00221-016-4854-7. [PubMed] [CrossRef] [Google Scholar] 116. Беверсдорф Д.К., Хейлман К.М. Фасилитарная паратония и функционирование лобных долей. Неврология. 1998; 51: 968–971. doi: 10.1212/WNL.51.4.968. [PubMed] [CrossRef] [Google Scholar] 117. Лермитт Ф. Человеческая автономия и лобные доли.Часть II: Поведение пациента в сложных и социальных ситуациях: синдром зависимости от окружающей среды? Анна. Нейрол. 1986; 19: 335–343. doi: 10.1002/ana.4101
Нейрол. 1986; 19: 335–343. doi: 10.1002/ana.4101Физиология и нарушения мышечного тонуса
Токсины (Базель).2021 апрель; 13(4): 282.
Поступила в редакцию 1 апреля 2021 г.; Принято 14 апреля 2021 г.
Эта статья была процитирована другими статьями в PMC.Abstract
Простое определение тонуса как сопротивления пассивному растяжению физиологически представляет собой сложную переплетенную сеть, охватывающую нейронные цепи в головном мозге, спинном мозге и мышечном веретене. Нарушения мышечного тонуса могут возникать из-за дисфункции этих путей и проявляться гипертонией или гипотонией. Утрата супраспинальных механизмов контроля приводит к гипертонии, приводящей к спастичности или ригидности.
 С другой стороны, дистония и паратония также проявляются нарушением мышечного тонуса, но возникают в большей степени из-за дисфункции сети между базальными ганглиями и таламо-мозжечково-кортикальными связями. В этом обзоре мы обсудили нормальные гомеостатические механизмы поддержания тонуса и патофизиологию спастичности и ригидности с их анатомическими коррелятами. После этого мы также выделили феномен сетевой дисфункции, коркового растормаживания и нейропластических изменений, приводящих к дистонии и паратонии.
С другой стороны, дистония и паратония также проявляются нарушением мышечного тонуса, но возникают в большей степени из-за дисфункции сети между базальными ганглиями и таламо-мозжечково-кортикальными связями. В этом обзоре мы обсудили нормальные гомеостатические механизмы поддержания тонуса и патофизиологию спастичности и ригидности с их анатомическими коррелятами. После этого мы также выделили феномен сетевой дисфункции, коркового растормаживания и нейропластических изменений, приводящих к дистонии и паратонии.Ключевые слова: спастичность, ригидность, дистония, паратония
1. Введение
Мышечный тонус представляет собой сложное и динамичное состояние, возникающее в результате иерархической и реципрокной анатомической связности. Он регулируется системами ввода и вывода и критически зависит от требований к мощности и производительности задач. Тон — это, по сути, конструкция моторного контроля, на которой внутренне уравновешивается мощность. Эта иерархия моторного контроля включает в себя кору (обширные возможности обработки с наивысшей степенью свободы), базальные ганглии (обучение и обучение контекстно-зависимым задачам с меньшими степенями свободы), мозжечок (точная настройка), ретикулярную систему ствола мозга (общий путь для восхождения).
 и нисходящие пути), спинной мозг (основной путь для восходящих и нисходящих путей) и мышечное веретено (конечный общий путь с наименьшей степенью свободы).В этом обзоре мы обсудили противоречия, касающиеся определения мышечного тонуса и его классификации, а также механизмы и пути, ответственные за поддержание тонуса. Спастичность и ригидность, два типа гипертонии, были разработаны в контексте дисфункции супраспинальных путей и взаимодействия между спинным мозгом и мышечным веретеном. Два других нарушения тонуса, а именно дистония и паратония, не совсем связаны с физиологической дисфункцией проводящих путей тонуса.В системе управления моторикой спастичность и ригидность являются преимущественно проблемой выходной системы, тогда как дистония является проблемой обработки на системном уровне. Дистония и паратония изменяют тонус вследствие нарушения сети в базальных ганглиях, таламокортикальных цепях и их соединениях. Механизмы, лежащие в их основе, обсуждались впоследствии, поскольку они важны как клинически, так и патофизиологически с точки зрения двигательных расстройств.
и нисходящие пути), спинной мозг (основной путь для восходящих и нисходящих путей) и мышечное веретено (конечный общий путь с наименьшей степенью свободы).В этом обзоре мы обсудили противоречия, касающиеся определения мышечного тонуса и его классификации, а также механизмы и пути, ответственные за поддержание тонуса. Спастичность и ригидность, два типа гипертонии, были разработаны в контексте дисфункции супраспинальных путей и взаимодействия между спинным мозгом и мышечным веретеном. Два других нарушения тонуса, а именно дистония и паратония, не совсем связаны с физиологической дисфункцией проводящих путей тонуса.В системе управления моторикой спастичность и ригидность являются преимущественно проблемой выходной системы, тогда как дистония является проблемой обработки на системном уровне. Дистония и паратония изменяют тонус вследствие нарушения сети в базальных ганглиях, таламокортикальных цепях и их соединениях. Механизмы, лежащие в их основе, обсуждались впоследствии, поскольку они важны как клинически, так и патофизиологически с точки зрения двигательных расстройств.
2. Определение мышечного тонуса
Мышечный тонус традиционно определяют как «напряжение в расслабленной мышце» или «сопротивление, ощущаемое исследователем при пассивном растяжении сустава, когда мышцы находятся в состоянии покоя» [1].Это определение тона имеет некоторые неясности, например, неясно, что означает «сопротивление пассивному растяжению», а «ощущаемое исследователем» открывает дверь для субъективных вариаций во время клинического обследования и изменчивости оценки между пациентами [2]. Исследования с электромиографической (ЭМГ) оценкой часто приравнивают мышечный тонус к исходному уровню ЭМГ в расслабленном состоянии. Однако помимо активного или сократительного компонента, возникающего в результате активации двигательной единицы и обнаруживаемого с помощью ЭМГ, мышечный тонус также имеет пассивный или вязкоупругий компонент, независимый от нервной активности, который не может быть обнаружен с помощью ЭМГ.Вязкоупругий компонент, в свою очередь, зависит от множества факторов, таких как саркомерные актин-миозиновые поперечные мостики, вязкость, эластичность и растяжимость сократительных филаментов, филаментное соединение саркомерных несократительных белков (например, десмин, тайтин), осмотическое давление.
 клеток, а также на окружающие соединительные ткани [3,4].
клеток, а также на окружающие соединительные ткани [3,4].Математически мышечный тонус можно интерпретировать как изменение сопротивления или силы на единицу изменения длины (Δ сила/Δ смещение ткани) [5].В расслабленном состоянии сопротивление внешнему движению (R TOT ) зависит от инерции (R IN ), кажущейся жесткости (сопротивление растяжению/R ST ) и демпфирования (сопротивление скорости/R DA ). : Р ТОТ = Р ИН + Р ДА + Р СТ [6]. Однако все эти определения имеют общее заблуждение, предполагающее, что человек находится в полностью расслабленном состоянии, чего зачастую невозможно достичь без применения миорелаксантов.
В отличие от этого общего представления Бернштейн подчеркнул тот факт, что мышечный тонус может фактически отражать состояние готовности к движению, и, таким образом, может быть невозможно оценить мышечный тонус, когда человека просят расслабиться и не совершать никаких движений.
 [7].Бернштейн в своей иерархической модели построения движения (тонус, синергия, пространство, действие) постулировал, что мышечный тонус является адаптивной функцией нейромоторного аппарата, адекватно реагирующего на команды, поступающие с верхних уровней построения движения, путем тонкой настройки возбудимости сенсорные и моторные клетки для задач активного управления позой или движением [6,7]. Это определение делает мышечный тонус активным участником двигательных и постуральных задач. Точно так же Карпентер и соавт.дали клиническое определение тонуса как «постоянной мышечной активности, которая необходима в качестве фона для фактического движения, чтобы поддерживать основное положение тела, особенно против силы тяжести» [8]. Таким образом, тон может быть конструкцией, необходимой для управления моторикой, чтобы как статические, так и динамические задачи могли безопасно выполняться наиболее термодинамически эффективным способом.
[7].Бернштейн в своей иерархической модели построения движения (тонус, синергия, пространство, действие) постулировал, что мышечный тонус является адаптивной функцией нейромоторного аппарата, адекватно реагирующего на команды, поступающие с верхних уровней построения движения, путем тонкой настройки возбудимости сенсорные и моторные клетки для задач активного управления позой или движением [6,7]. Это определение делает мышечный тонус активным участником двигательных и постуральных задач. Точно так же Карпентер и соавт.дали клиническое определение тонуса как «постоянной мышечной активности, которая необходима в качестве фона для фактического движения, чтобы поддерживать основное положение тела, особенно против силы тяжести» [8]. Таким образом, тон может быть конструкцией, необходимой для управления моторикой, чтобы как статические, так и динамические задачи могли безопасно выполняться наиболее термодинамически эффективным способом.3. Классификация мышечного тонуса
Мышечный тонус можно разделить на «постуральный» и «фазовый».
 Постуральный тонус наблюдается в аксиальных мышцах, где гравитация является наиболее важным провоцирующим фактором. Это происходит в результате постоянного растяжения мышц и сухожилий и проявляется в виде длительного сокращения мышц. Напротив, фазный тонус обычно оценивается клинически в конечностях как быстрый и кратковременный ответ. Это происходит в результате быстрого растяжения сухожилия и прикрепленной к нему мышцы, а точнее мышечного веретена [9]. Кроме того, мышечный тонус можно разделить на активный и пассивный компоненты, как это уже было описано выше.
Постуральный тонус наблюдается в аксиальных мышцах, где гравитация является наиболее важным провоцирующим фактором. Это происходит в результате постоянного растяжения мышц и сухожилий и проявляется в виде длительного сокращения мышц. Напротив, фазный тонус обычно оценивается клинически в конечностях как быстрый и кратковременный ответ. Это происходит в результате быстрого растяжения сухожилия и прикрепленной к нему мышцы, а точнее мышечного веретена [9]. Кроме того, мышечный тонус можно разделить на активный и пассивный компоненты, как это уже было описано выше.4. Анатомия, лежащая в основе регуляции мышечного тонуса
Мышечный тонус регулируется спинальными и супраспинальными механизмами. В то время как спинальный контроль зависит от взаимодействия между мышечным веретеном и спинным мозгом вместе с интернейронами, супраспинальный контроль регулируется фасилитационными и тормозными длинными путями и мозжечком.
4.1. Контроль позвоночника
4.1.1. Взаимодействие между мышечным веретеном и спинным мозгом
Сенсорная обратная связь со спинным мозгом от мышцы в отношении ее длины и напряжения необходима для регуляции мышечного тонуса.
 Интрафузальные волокна передают информацию о длине мышцы или скорости ее изменения, в то время как сухожильные органы Гольджи передают информацию о натяжении сухожилий или скорости изменения натяжения [10]. Афференты типа Ia определяют скорость изменения длины мышцы во время растяжения (динамическая реакция). Однако при тонической активности афферентов Iа и II типов выявляют установившуюся длину мышцы (статический ответ). Афференты типа Ib посылают информацию от сухожильных органов Гольджи.
Интрафузальные волокна передают информацию о длине мышцы или скорости ее изменения, в то время как сухожильные органы Гольджи передают информацию о натяжении сухожилий или скорости изменения натяжения [10]. Афференты типа Ia определяют скорость изменения длины мышцы во время растяжения (динамическая реакция). Однако при тонической активности афферентов Iа и II типов выявляют установившуюся длину мышцы (статический ответ). Афференты типа Ib посылают информацию от сухожильных органов Гольджи.Мышечное веретено генерирует тонус, активируя рефлекс растяжения.Когда моторная команда посылается на альфа-моторные волокна (снабжающие экстрафузальные волокна), гамма-волокна (снабжающие интрафузальные волокна) также будут возбуждаться (альфа-гамма-коактивация), что приводит к сокращению как экстрафузальных, так и интрафузальных волокон [8,10]. ]. Рефлекс растяжения может быть двух типов: (а) динамический и (б) статический. Внезапное быстрое растяжение мышцы стимулирует волокна ядерного мешка (реагируют на скорость или скорость растяжения), а афференты Ia (кольцеспиральные окончания) передают динамический сигнал в спинной мозг.
 Эфферентный сигнал от спинного мозга (альфа-мотонейрона) поступает через альфа-эфференты к экстрафузальным волокнам, что приводит к внезапному сокращению мышцы (рефлекс динамического растяжения). Это лежит в основе клинического выявления глубоких сухожильных рефлексов. С другой стороны, продолжительное растяжение мышцы стимулирует волокна ядерной цепи, и афференты типа II (окончания цветочных брызг) передают сигнал к спинному мозгу. Эфферентный сигнал от спинного мозга проходит через альфа-эфференты к экстрафузальным волокнам. Однако на этот раз будет происходить асинхронное сокращение экстрафузальных мышечных волокон (двигательные единицы не разряжаются все вместе), что приведет к мягкому устойчивому сокращению этих волокон, пока они растягиваются.Эта статическая рефлекторная реакция на растяжение является физиологической основой поддержания мышечного тонуса [8,10,11].
Эфферентный сигнал от спинного мозга (альфа-мотонейрона) поступает через альфа-эфференты к экстрафузальным волокнам, что приводит к внезапному сокращению мышцы (рефлекс динамического растяжения). Это лежит в основе клинического выявления глубоких сухожильных рефлексов. С другой стороны, продолжительное растяжение мышцы стимулирует волокна ядерной цепи, и афференты типа II (окончания цветочных брызг) передают сигнал к спинному мозгу. Эфферентный сигнал от спинного мозга проходит через альфа-эфференты к экстрафузальным волокнам. Однако на этот раз будет происходить асинхронное сокращение экстрафузальных мышечных волокон (двигательные единицы не разряжаются все вместе), что приведет к мягкому устойчивому сокращению этих волокон, пока они растягиваются.Эта статическая рефлекторная реакция на растяжение является физиологической основой поддержания мышечного тонуса [8,10,11].С другой стороны, существует порог, когда чем сильнее растягивается мышца, тем сильнее рефлекторное сокращение.
 После пересечения порога сокращение прекращается, и мышца расслабляется. Это известно как «рефлекс обратного растяжения» и опосредовано сухожильным органом Гольджи, присутствующим в пучках сухожилия [11].
После пересечения порога сокращение прекращается, и мышца расслабляется. Это известно как «рефлекс обратного растяжения» и опосредовано сухожильным органом Гольджи, присутствующим в пучках сухожилия [11].4.1.2. Интернейроны
Интернейроны являются неотъемлемой частью дуги рефлекса растяжения () и играют важную роль в поддержании мышечного тонуса.Они ингибируются или возбуждаются несколькими системами нисходящих волокон. Существует несколько межнейронных путей, и их роль в спастичности обсуждается позже. Среди них рекуррентное ингибирование клетками Реншоу, реципрокное ингибирование Ia мышцами-антагонистами, невзаимное ингибирование Ib сухожильным органом Гольджи и пресинаптическое ингибирование наиболее важны для поддержания мышечного тонуса [10,11,12,13,14].
Основные интернейроны в регуляции мышечного тонуса.
4.2. Супраспинальный контроль посредством нисходящих длинных путей
У человека супраспинальное воздействие на мышечный тонус и рефлексы растяжения в основном модулируется взаимодействием (обсуждается позже) двух тормозных и двух облегчающих нисходящих путей [10] ().

Нисходящие длинные пути в регуляции схемы рефлекса растяжения и мышечного тонуса у людей. Жирным шрифтом выделены основные участки регуляции тонуса.
4.2.1. Тормозные пути
Корково-спинномозговой путь/КСТ (из моторной коры)
Кортикоретикулярный (из премоторной коры) и дорсальный ретикулоспинальный тракт/дорсальный РСТ (из медуллярной ретикулярной формации) 9.205238 Содействующие тракты
Вестибулоспинальный тракт/VST (из латерального вестибулярного или ядра Дейтерса)
Медиальный ретикулоспинальный тракт/медиальный RST (в основном из ретикулярной формации моста)
4.3. Роль мозжечка
Медиальная часть передней доли мозжечка активирует медуллярную ретикулярную формацию, откуда возникает дорсальный RST. Следовательно, область мозжечка ингибирует мышечный тонус опосредованно через ингибирование гамма-мотонейронов через дорсальный RST.
 Однако латеральная часть передней доли активирует ретикулярную формацию моста. Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17].
Однако латеральная часть передней доли активирует ретикулярную формацию моста. Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17].5. Спастичность
JW Lance в 1980 г. определил спастичность как «моторное расстройство, характеризующееся зависимым от скорости повышением тонических рефлексов растяжения (мышечного тонуса) с усиленными сухожильными подергиваниями, возникающими в результате повышенной возбудимости рефлекса растяжения, как одного из компонентов синдром верхнего двигательного нейрона» [18].Однако спастичность зависит не только от скорости, но и от длины мышцы. Спастичность разгибателей коленного сустава (четырехглавой мышцы) больше, когда мышца короткая, но в сгибателях верхних конечностей (например, бицепс) и разгибателях голеностопного сустава (икроножная, камбаловидная) спастичность больше, когда мышцы длинные.
 Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями.
Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями. Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.
Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.Спастичность может быть классифицирована как «фазовая» и «тоническая» на основе преобладающего участия либо фазических (динамических), либо тонических (статических) компонентов рефлексов растяжения мышц.После травмы позвоночника у амбулаторных пациентов развивается «фазовая» спастичность с быстрыми рефлексами растяжения и клонусом. Однако у пациентов, не способных передвигаться, развивается «тоническая» спастичность, демонстрируемая пассивным растяжением голеностопного сустава и тестированием вибрационно-тонического рефлекса [10, 21].
В следующем разделе мы обсудим спинальные и супраспинальные факторы, способствующие спастичности, включая роль сенсорной обратной связи, о чем свидетельствуют недавние исследования, а также патофизиологию феномена складного ножа и клонуса.

6. Факторы, способствующие спастичности
6.1. Влияние позвоночника
Влияние позвоночника на спастичность может быть связано как с усилением возбуждения, так и со снижением торможения. Повышенная фузимоторная активность [22], денервационная гиперчувствительность [23], прорастание аксонов [24,25], повышенная возбудимость альфа-мотонейронов [25], возбуждение интернейронов [25] и повышение кожных рефлексов растяжения [10] ответственны за повышенное возбуждающее влияние. на спастичность. Модели на животных показали роль мембранных свойств мотонейрона в спастичности.Зависимый от напряжения постоянный внутренний ток (PIC), опосредованный через каналы Na + и Ca 2+ , может вызывать длительную деполяризацию (потенциал плато), модулируемую нисходящей серотонинергической и норадренергической активностью [10,25]. Нисходящий моноаминергический драйв в норме оказывает возбуждающее действие на альфа-мотонейроны в вентральных рогах через рецепторы 5HT2 и NEα1, тогда как он оказывает тормозящее действие на дорсальные рога через рецепторы 5HT1b/d и NEα2 [25].
 В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности.
В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности.Помимо возбуждающих механизмов, способствующих спастичности, в недавних исследованиях все больше оценивается роль измененных спинальных тормозных цепей [10]. Растормаживание альфа-мотонейрона при спастичности может происходить из-за снижения пресинаптического торможения афферентов Ia [26], снижения дисинаптического реципрокного афферентного торможения Ia от группы мышц-антагонистов [27,28], снижения афферентно-опосредованного торможения Ib сухожильным органом Гольджи [29].
 , измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30].
, измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30].6.2. Супраспинальное влияние
В норме мышечный тонус человека в критической степени уравновешивается тормозным импульсом CST и дорсальным RST и стимулирующим импульсом (на разгибательный тонус) медиальным RST и в некоторой степени VST [10]. Среди них дорсальный RST также ингибирует афферентные рефлексы сгибателей (FRA). В спинном мозге латеральный канатик содержит кортикоспинальный тракт (CST) и дорсальный RST, тогда как передний канатик содержит VST и медиальный RST. Исходя из этого, влияние поражений коры и спинного мозга на мышечный тонус можно резюмировать следующим образом.
6.2.1. Поражения коры
Изолированное вовлечение КСТ недостаточно для возникновения спастичности [31,32]. Поражения коры головного мозга вызывают спастичность из-за ассоциированного вовлечения кортико-ретикулярных волокон, связи между премоторной корой и медуллярной ретикулярной формацией, откуда берет начало дорсальная RST.
 Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST.
Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST.6.2.2. Поражения спинного мозга
Неполная/частичная миелопатия с вовлечением латерального канатика: при вовлечении только КСТ это приводит к слабости, гипотонии и утрате поверхностных рефлексов. Если есть дополнительное вовлечение дорсального RST, спастичность и гиперрефлексия будут развиваться из-за беспрепятственной активности медиального RST. Спастичность будет преобладать в антигравитационных мышцах и приведет к параплегии при разгибании и спазмам разгибателей. Спазмы сгибателей могут возникать, если FRA активируются пролежнями.С другой стороны, если вовлекается дорсальная RST только с щадящей CST, будет спастичность без выраженной слабости.
Полная миелопатия с поражением всех четырех трактов: спастичность в этом случае будет меньше из-за отсутствия облегчающего воздействия медиальных RST и VST.
 Растормаживание FRA приведет к параплегии при сгибании и спазмам сгибателей.
Растормаживание FRA приведет к параплегии при сгибании и спазмам сгибателей.
6.3. Роль сенсорной обратной связи
Недавние исследования показали, что коактивация мышц-антагонистов, жесткая поза и жесткая походка при спастичности могут быть адаптацией для стабилизации сустава и позы на фоне снижения мышечной силы, тогда как гипервозбудимые рефлексы играют незначительную или никакой роли [33,34].Спастические двигательные расстройства могут возникать из-за неадекватного прогнозирования сенсорных последствий движений [35,36]. Из-за отсутствия надежного прогноза соматосенсорной обратной связи от движущейся конечности пациенту с поражением ВМН будет трудно оптимизировать движение. Таким образом, совместное сокращение мышц вокруг сустава может быть стратегией минимизации случайных движений и максимально возможной стабилизации движения [33]. Следовательно, спастическое двигательное расстройство скорее может быть компенсацией слабости.Эта концепция может быть реализована при неосложненной наследственной спастической параплегии (HSP), когда происходит потеря проприоцептивной чувствительности крупных волокон наряду с поражением корково-спинномозгового тракта (CST).
 Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.
Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.6.4. Non-Neural Factors
Как обсуждалось ранее, изменения не-нейральных факторов, таких как вязкоупругие свойства ткани (например, упругая жесткость, вязкостное демпфирование), также могут способствовать возникновению спастичности [38,39].

7. Патофизиология феномена складного ножа
При пассивном растяжении мышцы ощущается большее сопротивление в начальной части растяжения, но при продолжении растяжения происходит внезапное ослабление сопротивления, описываемое как «феномен складного ножа».Из-за зависимости спастичности от длины сначала при сгибании колена (квадрицепсы короткие) ощущается повышенное сопротивление (больше спастичность). Однако при продолжении растяжения (удлиняется квадрицепс) после достижения критической длины сопротивление резко снижается [40,41,42]. Возбуждение медленно проводящих высокопороговых тормозных афферентов мышц III и IV групп (часть афферентов сгибательных рефлексов/FRA) также может быть ответственно за этот феномен [43].
8. Патофизиология клонуса
Клонус определяется как «регулярные, повторяющиеся, ритмичные сокращения мышцы, подвергаемой внезапному, сохраняющемуся растяжению» [11].Клонус, сохраняющийся в течение пяти и более ударов, считается клинически ненормальным.
 Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается.
Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается.9. Ригидность
Ригидность, в отличие от спастичности, не зависит от скорости движения. Он в равной степени влияет на сгибатели и разгибатели и вызывает равномерное сопротивление пассивному растяжению во всех направлениях, известное как феномен «свинцовой трубы».
 Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].
Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].Таблица 1
Разница между спастичностью и ригидностью.

Дифференциация пунктов Спастичность Риждость Нажимая скорость Да № Устойчивость к движению в одном направлении (сгибание или расширение) в обоих направлениях Длина зависимости Да NO NO Тип Hypertonicity Тип Hypertonicity Класс-нож Сведящая труба или зубчатое колесо В следующем разделе мы обсудим факторы, способствующие жесткости, а затем патофизиология активационного маневра (проба Фроманта).

10. Факторы, влияющие на жесткость
10.1. Преувеличение долголатентных рефлексов растяжения (LLSR)
Первоначальные исследования показали, что паркинсоническая ригидность, вероятно, имеет спинномозговое рефлекторное происхождение, что подтверждается тем фактом, что ригидность улучшилась после резекции спинного мозга [51]. Считалось, что основной причиной является усиление реакции мышечных рецепторов на пассивное растяжение. Однако последующие исследования с микронейрографическими записями показали, что увеличение мышечного афферентного разряда из-за усиленной фузимоторной активности недостаточно для возникновения ригидности [52].Моносинаптические сегментарные рефлексы на растяжение существенно не отличались между пациентами с БП и здоровыми субъектами в исследованиях с использованием электрофизиологического анализа [53,54]. Скорее, афферентно-опосредованные спинальные рефлексы Ia, такие как сухожильные рефлексы, H-рефлекс и тонический вибрационный рефлекс, оказались в основном нормальными у пациентов с БП [55,56].
 Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53].
Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53].10.2. Усиленная реакция укорочения (SR) и торможение, вызванное растяжением (SII)
Преувеличенная LLSR может объяснить гипертонус при БП, но не может объяснить сопротивление пассивному растяжению, одинаковое во всем диапазоне движения (характер «свинцовой трубы»)? Аномальная реакция в укорачивающейся мышце была впервые отмечена Вестфалем и впоследствии названа Шеррингтоном «реакцией укорочения» (СР) [58].
 Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].
Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].10.3. Роль ствола мозга
Роль недофаминергической системы при БП все чаще подчеркивается в последних исследованиях. Недавно Линн-Эванс и соавт. отметили повышенную и более симметричную ригидность верхних конечностей у пациентов с БП в состоянии бодрствования, у которых наблюдается быстрый сон без атонии (PD-RSWA+), по сравнению с пациентами с атонией (PD-RSWA-) и контрольной группой [62]. Цепь ствола мозга, отвечающая за тонус в фазе быстрого сна, перекрывается с цепью, поддерживающей возбудимость двигательных нейронов и постуральный контроль в состоянии бодрствования [63].
 При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66].
При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66]. Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62].
Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62].Нейромодуляторы в патофизиологии ригидности.
10.4. Ненервные факторы
Как обсуждалось ранее, вязкоупругие свойства мышечных волокон и окружающих соединительных тканей также могут способствовать паркинсонической ригидности. Уоттс и др. отметили, что у пациентов с БП даже с легкими двигательными симптомами ригидность верхних конечностей была больше, чем у контроля в расслабленном состоянии, но без какой-либо ЭМГ-активности [67]. Исследование подчеркнуло роль пассивных механических свойств для жесткости.Ся и др. также отметили вклад как нервных, так и не-нейральных факторов в паркинсоническую ригидность, в то время как нервный вклад преобладает [68].
10.5. Сетевая гипотеза паркинсоновской ригидности
Baradaran et al. [69] исследовали изменение функциональных связей в сетях мозга в связи с паркинсонической ригидностью.
 По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип.
По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип.11. Патофизиологические основы активационного маневра
Интересным, но еще не до конца изученным явлением, наблюдаемым при БП, является увеличение ригидности при сокращении мышц (изометрических/ритмических) в контралатеральной конечности.Возможные объяснения, описанные в литературе для этого феномена: (1) усиление LLSR через транскортикальный путь [71,72], (2) изменение возбудимости спинальных мотонейронов, опосредованное перекрестной сенсорной афферентной обратной связью через афферентный вход lb, что приводит к уменьшению реакции укорочения (SR).
 ) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73].
) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73].12. Дистония
12.1. Патофизиология и механизмы
Дистония определяется как «устойчивые или прерывистые мышечные сокращения, приводящие к аномальным, часто повторяющимся движениям, позам или тому и другому» [74]. Эти движения обычно шаблонны, могут быть дрожащими или скручивающими и усиливаться при произвольных действиях [75]. Дистония может быть фокальной, сегментарной, ограниченной одной половиной тела (гемидистония) или генерализованной. Гетерогенные проявления и различная этиология, начиная от генетических причин и заканчивая нейродегенеративными расстройствами, указывают на многочисленные механизмы, которые способствуют патофизиологии дистонии.Гипотеза при обсуждении механизмов дистонии в основном сосредоточена вокруг схемы базальных ганглиев, таламо и коры головного мозга.
 Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции.
Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции.12.2. Анатомические корреляты дистонии
Базальные ганглии и их аномальные связи считаются наиболее важными структурами, связанными с дистонией.Вторичные дистонии из-за поражений базальных ганглиев являются ярким примером этой ассоциации в течение длительного времени [74,75]. Леводопа, улучшающая дистонию, реагирующую на дофа (DRD), или глубокая стимуляция мозга внутреннего сегмента бледного шара, которая улучшает некоторые случаи дистонии, являются дополнительными указателями на центральную роль базальных ганглиев в происхождении дистонии [76,77,78]. Дистония не часто обнаруживается при спиноцеребеллярной атаксии (SCA), но редко является клиническим симптомом, когда мозжечковая атрофия является характерным признаком с сохранением базальных ганглиев.
 SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79].
SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79].Таким образом, совершенно ясно, что ни один анатомический коррелят не отвечает за дистонию. Скорее, дистонию вызывают аномальные сетевые связи между базальными ганглиями, мозжечком, таламусом и корой.
 В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию.
В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию.12.3. Механизмы дистонии
В отсутствие моделей дистонии на животных понимание патофизиологических механизмов, вызывающих дистонию, прояснилось с появлением транскраниальной магнитной стимуляции (ТМС) и повторяющейся транскраниальной магнитной стимуляции (рТМС). Протоколы ТМС, разработанные в качестве инструмента исследования, выявили следующие физиологические дисфункции у пациентов с дистонией.
12.3.1. Потеря торможения
Отсутствие объемного торможения, совместное сокращение мышц-антагонистов и перелив активности в мышцы, не предназначенные для действия, — все это происходит из-за физиологической потери торможения [80,81]. Окружающее торможение — это явление, управляемое корой, при котором мышцы вокруг активных сокращающихся мышц активно тормозятся, чтобы предотвратить избыточное сокращение [81,82]. Сон и др. др. описали это явление у здоровых добровольцев с помощью одиночного импульса ТМС.
 При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87].
При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87]. Нарушение реципрокного торможения приводит к совместному сокращению противоположных мышц, что обычно наблюдается при дистонии. Предполагается, что нарушения спинномозговых рефлексов при дистонии связаны с дисфункциональными нисходящими входами от высших центров [88].
Нарушение реципрокного торможения приводит к совместному сокращению противоположных мышц, что обычно наблюдается при дистонии. Предполагается, что нарушения спинномозговых рефлексов при дистонии связаны с дисфункциональными нисходящими входами от высших центров [88].12.3.2. Аномальная сенсорная функция
Боль является общепризнанным симптомом дистонии, о ней сообщалось примерно в 70% случаев при цервикальной дистонии. При отсутствии явных сенсорных аномалий при клиническом обследовании у этих пациентов отмечаются сенсорные феномены, такие как фотосенсибилизация при блефароспазме или боль в шее до цервикальной дистонии [89].Наиболее захватывающим явлением при дистонии является «geste antagoniste» или сенсорный трюк. Это добровольный маневр, выполняемый пациентом для уменьшения тяжести дистонии. Сенсорный трюк, облегчающий дистонию, ошибочно идентифицировал расстройство как психогенное по происхождению [90]. Однако впоследствии было показано, что аномальная сенсорная функция и нарушение сенсомоторной интеграции являются важным физиологическим изменением, наблюдаемым при дистонии.
 Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92].
Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92].Задача ориентации решетки (GOT) измеряет остроту пространственного различения. Он наносится на кончики пальцев обеих рук и определяет наименьшую ширину гребня решетки, для которой можно точно определить ориентацию [93].Многочисленные исследования выявили аномалии GOT с повышенным порогом пространственной дискриминации у пациентов с фокальной дистонией рук, блефароспазмом и цервикальной дистонией [94,95,96].
 Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR.
Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR. Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии.
Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии.12.3.3. Аномальная синаптическая пластичность
Аномальная сенсорная обратная связь и потеря торможения вызывают кратковременные и долговременные изменения в корково-подкорковых цепях. Byl et al. провели эксперименты на обезьянах, чтобы оценить роль травм от повторяющихся напряжений, вызывающих фокальную дистонию, чтобы подчеркнуть нейропластичность / обучаемость происхождения дистонии. Они постулировали, что эта деградация сенсорной обратной связи при травмах с повторяющимся напряжением была результатом пластичности нейронов и существенно влияла на первичную моторную область, вызывая дистонию [98].
 Этот феномен чрезмерной выраженности реакций пластичности и неспецифической топографии распространения (аномальное распространение) также был продемонстрирован в экспериментах на людях и представляет собой важный механизм, лежащий в основе дистонии [99]. Важность долговременной потенциации (ДП) и долговременной депрессии (ДД) в пластичности коры широко признана, и считается, что они изменяют рецептивные сенсорные поля и двигательные представления в мозге. Эксперименты с ТМС с использованием парной ассоциативной стимуляции (ПАС), где низкочастотная стимуляция срединного нерва и ТМС сочетаются, исследуют синаптические изменения в моторной коре [100].В исследовании «случай-контроль» у пациентов с писчими спазмами PAS выполняли на доминантном полушарии с электрической стимуляцией срединного или локтевого нерва в сочетании с ТМС, доставляемой в контралатеральную кору через 21,5 мс или 10 мс после стимуляции периферического нерва. Двигательную реакцию измеряли по мышцам, отводящим большой палец (APB) и мышце, приводящей минимальную мизинец (ADM).
Этот феномен чрезмерной выраженности реакций пластичности и неспецифической топографии распространения (аномальное распространение) также был продемонстрирован в экспериментах на людях и представляет собой важный механизм, лежащий в основе дистонии [99]. Важность долговременной потенциации (ДП) и долговременной депрессии (ДД) в пластичности коры широко признана, и считается, что они изменяют рецептивные сенсорные поля и двигательные представления в мозге. Эксперименты с ТМС с использованием парной ассоциативной стимуляции (ПАС), где низкочастотная стимуляция срединного нерва и ТМС сочетаются, исследуют синаптические изменения в моторной коре [100].В исследовании «случай-контроль» у пациентов с писчими спазмами PAS выполняли на доминантном полушарии с электрической стимуляцией срединного или локтевого нерва в сочетании с ТМС, доставляемой в контралатеральную кору через 21,5 мс или 10 мс после стимуляции периферического нерва. Двигательную реакцию измеряли по мышцам, отводящим большой палец (APB) и мышце, приводящей минимальную мизинец (ADM). У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности.
У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности. Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103].
Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103].12.4. Движения зеркал при дистонии
Движения зеркал представляют собой выражение моторного переполнения у пациентов с дистонией. Он определяется как появление аномальной позы в пораженной конечности, когда контралатеральная здоровая конечность занята определенной задачей [104]. Это помогает отличить истинные дистонические движения от любых компенсаторных движений, непроизвольно выполняемых для уменьшения инвалидности. Межполушарное торможение было продемонстрировано при функциональной нейровизуализации и электрофизиологических исследованиях, и его потеря была связана с зеркальными движениями.Мерелло и др. На функциональной МРТ показано, что у больного с писчим спазмом и зеркальными движениями при письме пораженной рукой наблюдается контралатеральная и ипсилатеральная активация задней теменной коры и скорлупы и ипсилатеральная активация нижней лобной извилины.
 Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106].
Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106].12.5. Дистония как сетевое расстройство
Анатомические корреляты и механизмы, рассмотренные выше, противоречат ранее предложенному представлению о дистонии как о чистом расстройстве базальных ганглиев. Существует повышенное признание корково-подкорковых цепей, а именно паллидоталамокортикальной и мозжечково-таламокортикальной, в патофизиологии дистонии. Эта сетевая модель (1) может хорошо объяснить неправильную обработку сенсорной информации наряду с возбудимостью тормозных путей на разных уровнях нейрооси, что может привести к аномальной пластичности и явной дистонии.
Сетевая модель дистонии.
 Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть.
Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть.Сетевая гипотеза также объясняет очаговое начало и постепенное сегментарное или генерализованное распространение аномалии [107]. Базальные ганглии и их таламокортикальные соединения посредством прямого и непрямого пути и гиперпрямого пути от коры к субталамическому ядру были хорошо описаны ранее [87,108]. Прямой путь облегчает, а непрямой тормозит движение.Гиперактивность прямого пути была показана Симоняном и соавт. при фокальных дистониях. Доступность рецепторов D1 была значительно увеличена в скорлупе у пациентов с писчим спазмом и дистонией гортани, и это подтверждает аномальную стриато-таламо-кортикальную возбудимость при дистонии [109]. Другим примером, указывающим на сетевой механизм, является успешная глубокая стимуляция мозга (DBS) внутреннего сегмента бледного шара при дистонии. Вызванные DBS изменения в нейронных паттернах подавляют патологические всплески и колебания в сети, что приводит к улучшению сенсомоторной обработки и улучшению симптомов [110].
 Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии.
Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии.Таким образом, недавние экспериментальные данные изменили наше представление о дистонии как психиатрическом диагнозе как о заболевании, характеризующемся изменениями в различных узлах головного мозга.
 Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии.
Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии.13. Паратония
Двигательные расстройства высшего порядка – это нарушения двигательного поведения, предшествующие произвольному выполнению движений. К ним относятся расстройства растормаживания, двигательной интенции, синдромы чужеродных конечностей и зеркальных движений [113].В контексте двигательных расстройств зеркальные движения обсуждались в разделе о дистонии. Явления чужеродных конечностей и расстройства двигательной интенции — корковые феномены, хорошо описанные при паркинсонизме, но выходящие за рамки настоящего обсуждения нарушений тонуса. Тем не менее, мы хотели бы кратко обсудить здесь расстройство растормаживания, паратонию, поскольку известно, что ботулинический токсин снимает непроизвольное сопротивление, наблюдаемое при паратонии.
 Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].
Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].14. Патофизиология паратонии
Beversdorf et al.продемонстрировали, что облегчающая паратония была формой эхопраксии, при которой испытуемые имитировали движения исследователя. Они пришли к выводу, что это форма дефектного торможения реакции, вторичного по отношению к дисфункции лобных долей. Орбитофронтальное повреждение и лобно-подкорковая дисфункция связаны с нарушением торможения реакции [116].
 Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114].
Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114]. Однако электромиографическая оценка больных с паратонией не выявила совместного сокращения противостоящей группы мышц при паратонии. Дрент и др. предложил еще одно периферическое биохимическое изменение, которое может способствовать повышению резистентности тканей у пациентов с деменцией и паратонией.Было обнаружено, что конечные продукты повышенного гликирования (AGE), измеренные с помощью аутофлуоресценции кожи, значительно повышены у пациентов с паратонией и имеют прямую связь с тяжестью паратонии. КПГ увеличивают жесткость тканей за счет образования поперечных связей в мышечном коллагене, нарушают функцию скелетных мышц и могут играть роль в патогенезе паратонии [118]. Основные патофизиологические механизмы, ответственные за спастичность, ригидность, дистонию и паратонию, выделены в .
Однако электромиографическая оценка больных с паратонией не выявила совместного сокращения противостоящей группы мышц при паратонии. Дрент и др. предложил еще одно периферическое биохимическое изменение, которое может способствовать повышению резистентности тканей у пациентов с деменцией и паратонией.Было обнаружено, что конечные продукты повышенного гликирования (AGE), измеренные с помощью аутофлуоресценции кожи, значительно повышены у пациентов с паратонией и имеют прямую связь с тяжестью паратонии. КПГ увеличивают жесткость тканей за счет образования поперечных связей в мышечном коллагене, нарушают функцию скелетных мышц и могут играть роль в патогенезе паратонии [118]. Основные патофизиологические механизмы, ответственные за спастичность, ригидность, дистонию и паратонию, выделены в .Таблица 2
Патофизиологические основы спастичности, ригидности, дистонии и паратонии.
. [PubMed] [CrossRef] [Google Scholar] 118. Дрент Х., Зуидема С., Баутманс И., Хоббелен Х. Роль воспалений и конечных продуктов гликирования при паратонии у пациентов с деменцией. Эксп. Геронтол. 2020;142:111125. doi: 10.1016/j.exger.2020.111125. [PubMed] [CrossRef] [Google Scholar]Нарушения тонуса Базовая патофизиология Спастичность Нарушение возбуждения и торможения спинного мозга, ведущее к повышенному возбуждению и снижению торможения сенсорная обратная связь
Ненервные факторы, такие как вязкоупругие свойства мышечного волокна и окружающих соединительных тканей
Ригидность Повышение долголатентных рефлексов растяжения (LLSR)
Усиление реакции укорочения (SR) и индуцированное растяжением торможение (SII) locus coeruleus, каудальный шов и мостовидное ядро (PPN)
Изменение функциональных связей в сетях мозга, включая лобно-теменное соединение, премоторно-преклиновидное соединение
Ненейральные факторы, такие как вязкоупругие свойства мышечных волокон и окружающих соединительных тканей
Дистония Отсутствие ингибирования объемного звучания
ненормальная сенсорно-моторная интеграция
аномалий в паллидо-таламо-корковице и мозжечко-таламо-кортикальной сети
Paratonia Дефектное торможение реакции из-за орбитофронтального повреждения и лобно-подкорковой дисфункции
Ненервные: повышение жесткости тканей из-за отложения конечных продуктов гликирования (AGE)Выводы
Тонус поддерживается сложным взаимодействием спинальных и супраспинальных механизмов, нарушения которых приводят к спастичности и ригидности.
 Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.
Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.Благодарности
В этом разделе вы можете отметить любую оказанную поддержку, не охваченную разделами вклада автора или финансирования. Это может включать административную и техническую поддержку или пожертвования в натуральной форме (например, материалы, используемые для экспериментов).
Вклад авторов
Концептуализация, Дж.Г. и М.Дж.; написание — подготовка первоначального проекта, J.G., D.K. и М.А.; написание — обзор и редактирование, MJ; авторский надзор, M.J. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получило внешнего финансирования.

Заявление Институционального контрольного совета
Неприменимо.
Заявление об информированном согласии
Неприменимо.
Заявление о доступности данных
В этом исследовании не создавались и не анализировались новые данные. Обмен данными не применим к этой статье.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Сноски
Примечание издателя: MDPI остается нейтральным в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Ссылки
1. Кэмпбелл В.В., Барон Р.Дж. ДеДжонга «Неврологическое обследование». 7-е изд. Липпинкотт Уильямс и Уилкинс; Филадельфия, Пенсильвания, США: 2019. Мышечный тонус; стр. 467–474. [Google Академия]2. Shortland AP Мышечный тонус не является четко определенным термином. Дев. Мед. Детский Нейрол. 2018;60:637. doi: 10.1111/dmcn.13707. [PubMed] [CrossRef] [Google Scholar]3. Кэмпбелл К. С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В.
С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В. Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0.
Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0. [PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С.
[PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С. , Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г.
, Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г. М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом. Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)
М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом. Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)
-V. [PubMed] [CrossRef] [Google Scholar] 109. Симонян К., Чо Х., Сичани А.Х., Рубиен-Томас Э., Халлетт М. Гиперфункция прямого пути базальных ганглиев при фокальной дистонии. Мозг. 2017;140:3179–3190. doi: 10.1093/мозг/awx263.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]111. Аргелан М., Карбон М., Нитхаммер М., Улуг А.М., Восс Х.У., Брессман С.Б., Дхаван В., Эйдельберг Д. Церебеллоталамокортикальная связь регулирует пенетрантность при дистонии. Дж. Нейроски. 2009;29:9740–9747. doi: 10.1523/JNEUROSCI.2300-09.2009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]112. Аккал Д., Дум Р.П., Стрик П.Л. Дополнительная моторная зона и предварительная моторная зона: цели базальных ганглиев и мозжечкового выхода. Дж.Неврологи. 2007; 27:10659–10673. doi: 10.1523/JNEUROSCI.3134-07.2007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]113. Койович М., Бхатия К.П. Приведение в порядок двигательных расстройств высшего порядка. Дж. Нейрол. 2018; 266:797–805. doi: 10.1007/s00415-018-8974-9. [PubMed] [CrossRef] [Google Scholar] 114. Дрент Х., Зуидема С., Баутманс И., Маринелли Л., Кляйнер Г., Хоббелен Х. Паратония при деменции: систематический обзор. Дж. Альцгеймер Дис. 2020; 78: 1615–1637. doi: 10.3233/JAD-200691. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]115.Маринелли Л., Мори Л., Пардини М., Беверсдорф Д., Кочито Л., Курра А., Фаттаппоста Ф., Гиларди М.Ф., Аббруццезе Г., Тромпетто С. Электромиографическая оценка паратонии. Эксп. Мозг Res. 2016; 235:949–956. doi: 10.1007/s00221-016-4854-7. [PubMed] [CrossRef] [Google Scholar] 116. Беверсдорф Д.К., Хейлман К.М. Фасилитарная паратония и функционирование лобных долей. Неврология. 1998; 51: 968–971. doi: 10.1212/WNL.51.4.968. [PubMed] [CrossRef] [Google Scholar] 117. Лермитт Ф. Человеческая автономия и лобные доли.Часть II: Поведение пациента в сложных и социальных ситуациях: синдром зависимости от окружающей среды? Анна. Нейрол. 1986; 19: 335–343. doi: 10.1002/ana.4101
Физиология и нарушения мышечного тонуса
Токсины (Базель).2021 апрель; 13(4): 282.
Поступила в редакцию 1 апреля 2021 г.; Принято 14 апреля 2021 г.
Эта статья была процитирована другими статьями в PMC.Abstract
Простое определение тонуса как сопротивления пассивному растяжению физиологически представляет собой сложную переплетенную сеть, охватывающую нейронные цепи в головном мозге, спинном мозге и мышечном веретене. Нарушения мышечного тонуса могут возникать из-за дисфункции этих путей и проявляться гипертонией или гипотонией. Утрата супраспинальных механизмов контроля приводит к гипертонии, приводящей к спастичности или ригидности.С другой стороны, дистония и паратония также проявляются нарушением мышечного тонуса, но возникают в большей степени из-за дисфункции сети между базальными ганглиями и таламо-мозжечково-кортикальными связями. В этом обзоре мы обсудили нормальные гомеостатические механизмы поддержания тонуса и патофизиологию спастичности и ригидности с их анатомическими коррелятами. После этого мы также выделили феномен сетевой дисфункции, коркового растормаживания и нейропластических изменений, приводящих к дистонии и паратонии.
Ключевые слова: спастичность, ригидность, дистония, паратония
1. Введение
Мышечный тонус представляет собой сложное и динамичное состояние, возникающее в результате иерархической и реципрокной анатомической связности. Он регулируется системами ввода и вывода и критически зависит от требований к мощности и производительности задач. Тон — это, по сути, конструкция моторного контроля, на которой внутренне уравновешивается мощность. Эта иерархия моторного контроля включает в себя кору (обширные возможности обработки с наивысшей степенью свободы), базальные ганглии (обучение и обучение контекстно-зависимым задачам с меньшими степенями свободы), мозжечок (точная настройка), ретикулярную систему ствола мозга (общий путь для восхождения). и нисходящие пути), спинной мозг (основной путь для восходящих и нисходящих путей) и мышечное веретено (конечный общий путь с наименьшей степенью свободы).В этом обзоре мы обсудили противоречия, касающиеся определения мышечного тонуса и его классификации, а также механизмы и пути, ответственные за поддержание тонуса. Спастичность и ригидность, два типа гипертонии, были разработаны в контексте дисфункции супраспинальных путей и взаимодействия между спинным мозгом и мышечным веретеном. Два других нарушения тонуса, а именно дистония и паратония, не совсем связаны с физиологической дисфункцией проводящих путей тонуса.В системе управления моторикой спастичность и ригидность являются преимущественно проблемой выходной системы, тогда как дистония является проблемой обработки на системном уровне. Дистония и паратония изменяют тонус вследствие нарушения сети в базальных ганглиях, таламокортикальных цепях и их соединениях. Механизмы, лежащие в их основе, обсуждались впоследствии, поскольку они важны как клинически, так и патофизиологически с точки зрения двигательных расстройств.
2. Определение мышечного тонуса
Мышечный тонус традиционно определяют как «напряжение в расслабленной мышце» или «сопротивление, ощущаемое исследователем при пассивном растяжении сустава, когда мышцы находятся в состоянии покоя» [1].Это определение тона имеет некоторые неясности, например, неясно, что означает «сопротивление пассивному растяжению», а «ощущаемое исследователем» открывает дверь для субъективных вариаций во время клинического обследования и изменчивости оценки между пациентами [2]. Исследования с электромиографической (ЭМГ) оценкой часто приравнивают мышечный тонус к исходному уровню ЭМГ в расслабленном состоянии. Однако помимо активного или сократительного компонента, возникающего в результате активации двигательной единицы и обнаруживаемого с помощью ЭМГ, мышечный тонус также имеет пассивный или вязкоупругий компонент, независимый от нервной активности, который не может быть обнаружен с помощью ЭМГ.Вязкоупругий компонент, в свою очередь, зависит от множества факторов, таких как саркомерные актин-миозиновые поперечные мостики, вязкость, эластичность и растяжимость сократительных филаментов, филаментное соединение саркомерных несократительных белков (например, десмин, тайтин), осмотическое давление. клеток, а также на окружающие соединительные ткани [3,4].
Математически мышечный тонус можно интерпретировать как изменение сопротивления или силы на единицу изменения длины (Δ сила/Δ смещение ткани) [5].В расслабленном состоянии сопротивление внешнему движению (R TOT ) зависит от инерции (R IN ), кажущейся жесткости (сопротивление растяжению/R ST ) и демпфирования (сопротивление скорости/R DA ). : Р ТОТ = Р ИН + Р ДА + Р СТ [6]. Однако все эти определения имеют общее заблуждение, предполагающее, что человек находится в полностью расслабленном состоянии, чего зачастую невозможно достичь без применения миорелаксантов.
В отличие от этого общего представления Бернштейн подчеркнул тот факт, что мышечный тонус может фактически отражать состояние готовности к движению, и, таким образом, может быть невозможно оценить мышечный тонус, когда человека просят расслабиться и не совершать никаких движений. [7].Бернштейн в своей иерархической модели построения движения (тонус, синергия, пространство, действие) постулировал, что мышечный тонус является адаптивной функцией нейромоторного аппарата, адекватно реагирующего на команды, поступающие с верхних уровней построения движения, путем тонкой настройки возбудимости сенсорные и моторные клетки для задач активного управления позой или движением [6,7]. Это определение делает мышечный тонус активным участником двигательных и постуральных задач. Точно так же Карпентер и соавт.дали клиническое определение тонуса как «постоянной мышечной активности, которая необходима в качестве фона для фактического движения, чтобы поддерживать основное положение тела, особенно против силы тяжести» [8]. Таким образом, тон может быть конструкцией, необходимой для управления моторикой, чтобы как статические, так и динамические задачи могли безопасно выполняться наиболее термодинамически эффективным способом.
3. Классификация мышечного тонуса
Мышечный тонус можно разделить на «постуральный» и «фазовый».Постуральный тонус наблюдается в аксиальных мышцах, где гравитация является наиболее важным провоцирующим фактором. Это происходит в результате постоянного растяжения мышц и сухожилий и проявляется в виде длительного сокращения мышц. Напротив, фазный тонус обычно оценивается клинически в конечностях как быстрый и кратковременный ответ. Это происходит в результате быстрого растяжения сухожилия и прикрепленной к нему мышцы, а точнее мышечного веретена [9]. Кроме того, мышечный тонус можно разделить на активный и пассивный компоненты, как это уже было описано выше.
4. Анатомия, лежащая в основе регуляции мышечного тонуса
Мышечный тонус регулируется спинальными и супраспинальными механизмами. В то время как спинальный контроль зависит от взаимодействия между мышечным веретеном и спинным мозгом вместе с интернейронами, супраспинальный контроль регулируется фасилитационными и тормозными длинными путями и мозжечком.
4.1. Контроль позвоночника
4.1.1. Взаимодействие между мышечным веретеном и спинным мозгом
Сенсорная обратная связь со спинным мозгом от мышцы в отношении ее длины и напряжения необходима для регуляции мышечного тонуса.Интрафузальные волокна передают информацию о длине мышцы или скорости ее изменения, в то время как сухожильные органы Гольджи передают информацию о натяжении сухожилий или скорости изменения натяжения [10]. Афференты типа Ia определяют скорость изменения длины мышцы во время растяжения (динамическая реакция). Однако при тонической активности афферентов Iа и II типов выявляют установившуюся длину мышцы (статический ответ). Афференты типа Ib посылают информацию от сухожильных органов Гольджи.
Мышечное веретено генерирует тонус, активируя рефлекс растяжения.Когда моторная команда посылается на альфа-моторные волокна (снабжающие экстрафузальные волокна), гамма-волокна (снабжающие интрафузальные волокна) также будут возбуждаться (альфа-гамма-коактивация), что приводит к сокращению как экстрафузальных, так и интрафузальных волокон [8,10]. ]. Рефлекс растяжения может быть двух типов: (а) динамический и (б) статический. Внезапное быстрое растяжение мышцы стимулирует волокна ядерного мешка (реагируют на скорость или скорость растяжения), а афференты Ia (кольцеспиральные окончания) передают динамический сигнал в спинной мозг.Эфферентный сигнал от спинного мозга (альфа-мотонейрона) поступает через альфа-эфференты к экстрафузальным волокнам, что приводит к внезапному сокращению мышцы (рефлекс динамического растяжения). Это лежит в основе клинического выявления глубоких сухожильных рефлексов. С другой стороны, продолжительное растяжение мышцы стимулирует волокна ядерной цепи, и афференты типа II (окончания цветочных брызг) передают сигнал к спинному мозгу. Эфферентный сигнал от спинного мозга проходит через альфа-эфференты к экстрафузальным волокнам. Однако на этот раз будет происходить асинхронное сокращение экстрафузальных мышечных волокон (двигательные единицы не разряжаются все вместе), что приведет к мягкому устойчивому сокращению этих волокон, пока они растягиваются.Эта статическая рефлекторная реакция на растяжение является физиологической основой поддержания мышечного тонуса [8,10,11].
С другой стороны, существует порог, когда чем сильнее растягивается мышца, тем сильнее рефлекторное сокращение. После пересечения порога сокращение прекращается, и мышца расслабляется. Это известно как «рефлекс обратного растяжения» и опосредовано сухожильным органом Гольджи, присутствующим в пучках сухожилия [11].
4.1.2. Интернейроны
Интернейроны являются неотъемлемой частью дуги рефлекса растяжения () и играют важную роль в поддержании мышечного тонуса.Они ингибируются или возбуждаются несколькими системами нисходящих волокон. Существует несколько межнейронных путей, и их роль в спастичности обсуждается позже. Среди них рекуррентное ингибирование клетками Реншоу, реципрокное ингибирование Ia мышцами-антагонистами, невзаимное ингибирование Ib сухожильным органом Гольджи и пресинаптическое ингибирование наиболее важны для поддержания мышечного тонуса [10,11,12,13,14].
Основные интернейроны в регуляции мышечного тонуса.
4.2. Супраспинальный контроль посредством нисходящих длинных путей
У человека супраспинальное воздействие на мышечный тонус и рефлексы растяжения в основном модулируется взаимодействием (обсуждается позже) двух тормозных и двух облегчающих нисходящих путей [10] ().
Нисходящие длинные пути в регуляции схемы рефлекса растяжения и мышечного тонуса у людей. Жирным шрифтом выделены основные участки регуляции тонуса.
4.2.1. Тормозные пути
Корково-спинномозговой путь/КСТ (из моторной коры)
Кортикоретикулярный (из премоторной коры) и дорсальный ретикулоспинальный тракт/дорсальный РСТ (из медуллярной ретикулярной формации) 9.205238 Содействующие тракты
Вестибулоспинальный тракт/VST (из латерального вестибулярного или ядра Дейтерса)
Медиальный ретикулоспинальный тракт/медиальный RST (в основном из ретикулярной формации моста)
4.3. Роль мозжечка
Медиальная часть передней доли мозжечка активирует медуллярную ретикулярную формацию, откуда возникает дорсальный RST. Следовательно, область мозжечка ингибирует мышечный тонус опосредованно через ингибирование гамма-мотонейронов через дорсальный RST. Однако латеральная часть передней доли активирует ретикулярную формацию моста. Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17].
5. Спастичность
JW Lance в 1980 г. определил спастичность как «моторное расстройство, характеризующееся зависимым от скорости повышением тонических рефлексов растяжения (мышечного тонуса) с усиленными сухожильными подергиваниями, возникающими в результате повышенной возбудимости рефлекса растяжения, как одного из компонентов синдром верхнего двигательного нейрона» [18].Однако спастичность зависит не только от скорости, но и от длины мышцы. Спастичность разгибателей коленного сустава (четырехглавой мышцы) больше, когда мышца короткая, но в сгибателях верхних конечностей (например, бицепс) и разгибателях голеностопного сустава (икроножная, камбаловидная) спастичность больше, когда мышцы длинные. Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями.Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.
Спастичность может быть классифицирована как «фазовая» и «тоническая» на основе преобладающего участия либо фазических (динамических), либо тонических (статических) компонентов рефлексов растяжения мышц.После травмы позвоночника у амбулаторных пациентов развивается «фазовая» спастичность с быстрыми рефлексами растяжения и клонусом. Однако у пациентов, не способных передвигаться, развивается «тоническая» спастичность, демонстрируемая пассивным растяжением голеностопного сустава и тестированием вибрационно-тонического рефлекса [10, 21].
В следующем разделе мы обсудим спинальные и супраспинальные факторы, способствующие спастичности, включая роль сенсорной обратной связи, о чем свидетельствуют недавние исследования, а также патофизиологию феномена складного ножа и клонуса.
6. Факторы, способствующие спастичности
6.1. Влияние позвоночника
Влияние позвоночника на спастичность может быть связано как с усилением возбуждения, так и со снижением торможения. Повышенная фузимоторная активность [22], денервационная гиперчувствительность [23], прорастание аксонов [24,25], повышенная возбудимость альфа-мотонейронов [25], возбуждение интернейронов [25] и повышение кожных рефлексов растяжения [10] ответственны за повышенное возбуждающее влияние. на спастичность. Модели на животных показали роль мембранных свойств мотонейрона в спастичности.Зависимый от напряжения постоянный внутренний ток (PIC), опосредованный через каналы Na + и Ca 2+ , может вызывать длительную деполяризацию (потенциал плато), модулируемую нисходящей серотонинергической и норадренергической активностью [10,25]. Нисходящий моноаминергический драйв в норме оказывает возбуждающее действие на альфа-мотонейроны в вентральных рогах через рецепторы 5HT2 и NEα1, тогда как он оказывает тормозящее действие на дорсальные рога через рецепторы 5HT1b/d и NEα2 [25]. В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности.
Помимо возбуждающих механизмов, способствующих спастичности, в недавних исследованиях все больше оценивается роль измененных спинальных тормозных цепей [10]. Растормаживание альфа-мотонейрона при спастичности может происходить из-за снижения пресинаптического торможения афферентов Ia [26], снижения дисинаптического реципрокного афферентного торможения Ia от группы мышц-антагонистов [27,28], снижения афферентно-опосредованного торможения Ib сухожильным органом Гольджи [29]. , измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30].
6.2. Супраспинальное влияние
В норме мышечный тонус человека в критической степени уравновешивается тормозным импульсом CST и дорсальным RST и стимулирующим импульсом (на разгибательный тонус) медиальным RST и в некоторой степени VST [10]. Среди них дорсальный RST также ингибирует афферентные рефлексы сгибателей (FRA). В спинном мозге латеральный канатик содержит кортикоспинальный тракт (CST) и дорсальный RST, тогда как передний канатик содержит VST и медиальный RST. Исходя из этого, влияние поражений коры и спинного мозга на мышечный тонус можно резюмировать следующим образом.
6.2.1. Поражения коры
Изолированное вовлечение КСТ недостаточно для возникновения спастичности [31,32]. Поражения коры головного мозга вызывают спастичность из-за ассоциированного вовлечения кортико-ретикулярных волокон, связи между премоторной корой и медуллярной ретикулярной формацией, откуда берет начало дорсальная RST. Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST.
6.2.2. Поражения спинного мозга
Неполная/частичная миелопатия с вовлечением латерального канатика: при вовлечении только КСТ это приводит к слабости, гипотонии и утрате поверхностных рефлексов. Если есть дополнительное вовлечение дорсального RST, спастичность и гиперрефлексия будут развиваться из-за беспрепятственной активности медиального RST. Спастичность будет преобладать в антигравитационных мышцах и приведет к параплегии при разгибании и спазмам разгибателей. Спазмы сгибателей могут возникать, если FRA активируются пролежнями.С другой стороны, если вовлекается дорсальная RST только с щадящей CST, будет спастичность без выраженной слабости.
Полная миелопатия с поражением всех четырех трактов: спастичность в этом случае будет меньше из-за отсутствия облегчающего воздействия медиальных RST и VST. Растормаживание FRA приведет к параплегии при сгибании и спазмам сгибателей.
6.3. Роль сенсорной обратной связи
Недавние исследования показали, что коактивация мышц-антагонистов, жесткая поза и жесткая походка при спастичности могут быть адаптацией для стабилизации сустава и позы на фоне снижения мышечной силы, тогда как гипервозбудимые рефлексы играют незначительную или никакой роли [33,34].Спастические двигательные расстройства могут возникать из-за неадекватного прогнозирования сенсорных последствий движений [35,36]. Из-за отсутствия надежного прогноза соматосенсорной обратной связи от движущейся конечности пациенту с поражением ВМН будет трудно оптимизировать движение. Таким образом, совместное сокращение мышц вокруг сустава может быть стратегией минимизации случайных движений и максимально возможной стабилизации движения [33]. Следовательно, спастическое двигательное расстройство скорее может быть компенсацией слабости.Эта концепция может быть реализована при неосложненной наследственной спастической параплегии (HSP), когда происходит потеря проприоцептивной чувствительности крупных волокон наряду с поражением корково-спинномозгового тракта (CST). Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.
6.4. Non-Neural Factors
Как обсуждалось ранее, изменения не-нейральных факторов, таких как вязкоупругие свойства ткани (например, упругая жесткость, вязкостное демпфирование), также могут способствовать возникновению спастичности [38,39].
7. Патофизиология феномена складного ножа
При пассивном растяжении мышцы ощущается большее сопротивление в начальной части растяжения, но при продолжении растяжения происходит внезапное ослабление сопротивления, описываемое как «феномен складного ножа».Из-за зависимости спастичности от длины сначала при сгибании колена (квадрицепсы короткие) ощущается повышенное сопротивление (больше спастичность). Однако при продолжении растяжения (удлиняется квадрицепс) после достижения критической длины сопротивление резко снижается [40,41,42]. Возбуждение медленно проводящих высокопороговых тормозных афферентов мышц III и IV групп (часть афферентов сгибательных рефлексов/FRA) также может быть ответственно за этот феномен [43].
8. Патофизиология клонуса
Клонус определяется как «регулярные, повторяющиеся, ритмичные сокращения мышцы, подвергаемой внезапному, сохраняющемуся растяжению» [11].Клонус, сохраняющийся в течение пяти и более ударов, считается клинически ненормальным. Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается.
9. Ригидность
Ригидность, в отличие от спастичности, не зависит от скорости движения. Он в равной степени влияет на сгибатели и разгибатели и вызывает равномерное сопротивление пассивному растяжению во всех направлениях, известное как феномен «свинцовой трубы». Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].
Таблица 1
Разница между спастичностью и ригидностью.
Дифференциация пунктов Спастичность Риждость Нажимая скорость Да № Устойчивость к движению в одном направлении (сгибание или расширение) в обоих направлениях Длина зависимости Да NO NO Тип Hypertonicity Тип Hypertonicity Класс-нож Сведящая труба или зубчатое колесо В следующем разделе мы обсудим факторы, способствующие жесткости, а затем патофизиология активационного маневра (проба Фроманта).
10. Факторы, влияющие на жесткость
10.1. Преувеличение долголатентных рефлексов растяжения (LLSR)
Первоначальные исследования показали, что паркинсоническая ригидность, вероятно, имеет спинномозговое рефлекторное происхождение, что подтверждается тем фактом, что ригидность улучшилась после резекции спинного мозга [51]. Считалось, что основной причиной является усиление реакции мышечных рецепторов на пассивное растяжение. Однако последующие исследования с микронейрографическими записями показали, что увеличение мышечного афферентного разряда из-за усиленной фузимоторной активности недостаточно для возникновения ригидности [52].Моносинаптические сегментарные рефлексы на растяжение существенно не отличались между пациентами с БП и здоровыми субъектами в исследованиях с использованием электрофизиологического анализа [53,54]. Скорее, афферентно-опосредованные спинальные рефлексы Ia, такие как сухожильные рефлексы, H-рефлекс и тонический вибрационный рефлекс, оказались в основном нормальными у пациентов с БП [55,56]. Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53].
10.2. Усиленная реакция укорочения (SR) и торможение, вызванное растяжением (SII)
Преувеличенная LLSR может объяснить гипертонус при БП, но не может объяснить сопротивление пассивному растяжению, одинаковое во всем диапазоне движения (характер «свинцовой трубы»)? Аномальная реакция в укорачивающейся мышце была впервые отмечена Вестфалем и впоследствии названа Шеррингтоном «реакцией укорочения» (СР) [58].Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].
10.3. Роль ствола мозга
Роль недофаминергической системы при БП все чаще подчеркивается в последних исследованиях. Недавно Линн-Эванс и соавт. отметили повышенную и более симметричную ригидность верхних конечностей у пациентов с БП в состоянии бодрствования, у которых наблюдается быстрый сон без атонии (PD-RSWA+), по сравнению с пациентами с атонией (PD-RSWA-) и контрольной группой [62]. Цепь ствола мозга, отвечающая за тонус в фазе быстрого сна, перекрывается с цепью, поддерживающей возбудимость двигательных нейронов и постуральный контроль в состоянии бодрствования [63].При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66]. Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62].
Нейромодуляторы в патофизиологии ригидности.
10.4. Ненервные факторы
Как обсуждалось ранее, вязкоупругие свойства мышечных волокон и окружающих соединительных тканей также могут способствовать паркинсонической ригидности. Уоттс и др. отметили, что у пациентов с БП даже с легкими двигательными симптомами ригидность верхних конечностей была больше, чем у контроля в расслабленном состоянии, но без какой-либо ЭМГ-активности [67]. Исследование подчеркнуло роль пассивных механических свойств для жесткости.Ся и др. также отметили вклад как нервных, так и не-нейральных факторов в паркинсоническую ригидность, в то время как нервный вклад преобладает [68].
10.5. Сетевая гипотеза паркинсоновской ригидности
Baradaran et al. [69] исследовали изменение функциональных связей в сетях мозга в связи с паркинсонической ригидностью. По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип.
11. Патофизиологические основы активационного маневра
Интересным, но еще не до конца изученным явлением, наблюдаемым при БП, является увеличение ригидности при сокращении мышц (изометрических/ритмических) в контралатеральной конечности.Возможные объяснения, описанные в литературе для этого феномена: (1) усиление LLSR через транскортикальный путь [71,72], (2) изменение возбудимости спинальных мотонейронов, опосредованное перекрестной сенсорной афферентной обратной связью через афферентный вход lb, что приводит к уменьшению реакции укорочения (SR). ) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73].
12. Дистония
12.1. Патофизиология и механизмы
Дистония определяется как «устойчивые или прерывистые мышечные сокращения, приводящие к аномальным, часто повторяющимся движениям, позам или тому и другому» [74]. Эти движения обычно шаблонны, могут быть дрожащими или скручивающими и усиливаться при произвольных действиях [75]. Дистония может быть фокальной, сегментарной, ограниченной одной половиной тела (гемидистония) или генерализованной. Гетерогенные проявления и различная этиология, начиная от генетических причин и заканчивая нейродегенеративными расстройствами, указывают на многочисленные механизмы, которые способствуют патофизиологии дистонии.Гипотеза при обсуждении механизмов дистонии в основном сосредоточена вокруг схемы базальных ганглиев, таламо и коры головного мозга. Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции.
12.2. Анатомические корреляты дистонии
Базальные ганглии и их аномальные связи считаются наиболее важными структурами, связанными с дистонией.Вторичные дистонии из-за поражений базальных ганглиев являются ярким примером этой ассоциации в течение длительного времени [74,75]. Леводопа, улучшающая дистонию, реагирующую на дофа (DRD), или глубокая стимуляция мозга внутреннего сегмента бледного шара, которая улучшает некоторые случаи дистонии, являются дополнительными указателями на центральную роль базальных ганглиев в происхождении дистонии [76,77,78]. Дистония не часто обнаруживается при спиноцеребеллярной атаксии (SCA), но редко является клиническим симптомом, когда мозжечковая атрофия является характерным признаком с сохранением базальных ганглиев.SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79].
Таким образом, совершенно ясно, что ни один анатомический коррелят не отвечает за дистонию. Скорее, дистонию вызывают аномальные сетевые связи между базальными ганглиями, мозжечком, таламусом и корой.В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию.
12.3. Механизмы дистонии
В отсутствие моделей дистонии на животных понимание патофизиологических механизмов, вызывающих дистонию, прояснилось с появлением транскраниальной магнитной стимуляции (ТМС) и повторяющейся транскраниальной магнитной стимуляции (рТМС). Протоколы ТМС, разработанные в качестве инструмента исследования, выявили следующие физиологические дисфункции у пациентов с дистонией.
12.3.1. Потеря торможения
Отсутствие объемного торможения, совместное сокращение мышц-антагонистов и перелив активности в мышцы, не предназначенные для действия, — все это происходит из-за физиологической потери торможения [80,81]. Окружающее торможение — это явление, управляемое корой, при котором мышцы вокруг активных сокращающихся мышц активно тормозятся, чтобы предотвратить избыточное сокращение [81,82]. Сон и др. др. описали это явление у здоровых добровольцев с помощью одиночного импульса ТМС.При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87].Нарушение реципрокного торможения приводит к совместному сокращению противоположных мышц, что обычно наблюдается при дистонии. Предполагается, что нарушения спинномозговых рефлексов при дистонии связаны с дисфункциональными нисходящими входами от высших центров [88].
12.3.2. Аномальная сенсорная функция
Боль является общепризнанным симптомом дистонии, о ней сообщалось примерно в 70% случаев при цервикальной дистонии. При отсутствии явных сенсорных аномалий при клиническом обследовании у этих пациентов отмечаются сенсорные феномены, такие как фотосенсибилизация при блефароспазме или боль в шее до цервикальной дистонии [89].Наиболее захватывающим явлением при дистонии является «geste antagoniste» или сенсорный трюк. Это добровольный маневр, выполняемый пациентом для уменьшения тяжести дистонии. Сенсорный трюк, облегчающий дистонию, ошибочно идентифицировал расстройство как психогенное по происхождению [90]. Однако впоследствии было показано, что аномальная сенсорная функция и нарушение сенсомоторной интеграции являются важным физиологическим изменением, наблюдаемым при дистонии. Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92].
Задача ориентации решетки (GOT) измеряет остроту пространственного различения. Он наносится на кончики пальцев обеих рук и определяет наименьшую ширину гребня решетки, для которой можно точно определить ориентацию [93].Многочисленные исследования выявили аномалии GOT с повышенным порогом пространственной дискриминации у пациентов с фокальной дистонией рук, блефароспазмом и цервикальной дистонией [94,95,96]. Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR.Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии.
12.3.3. Аномальная синаптическая пластичность
Аномальная сенсорная обратная связь и потеря торможения вызывают кратковременные и долговременные изменения в корково-подкорковых цепях. Byl et al. провели эксперименты на обезьянах, чтобы оценить роль травм от повторяющихся напряжений, вызывающих фокальную дистонию, чтобы подчеркнуть нейропластичность / обучаемость происхождения дистонии. Они постулировали, что эта деградация сенсорной обратной связи при травмах с повторяющимся напряжением была результатом пластичности нейронов и существенно влияла на первичную моторную область, вызывая дистонию [98].Этот феномен чрезмерной выраженности реакций пластичности и неспецифической топографии распространения (аномальное распространение) также был продемонстрирован в экспериментах на людях и представляет собой важный механизм, лежащий в основе дистонии [99]. Важность долговременной потенциации (ДП) и долговременной депрессии (ДД) в пластичности коры широко признана, и считается, что они изменяют рецептивные сенсорные поля и двигательные представления в мозге. Эксперименты с ТМС с использованием парной ассоциативной стимуляции (ПАС), где низкочастотная стимуляция срединного нерва и ТМС сочетаются, исследуют синаптические изменения в моторной коре [100].В исследовании «случай-контроль» у пациентов с писчими спазмами PAS выполняли на доминантном полушарии с электрической стимуляцией срединного или локтевого нерва в сочетании с ТМС, доставляемой в контралатеральную кору через 21,5 мс или 10 мс после стимуляции периферического нерва. Двигательную реакцию измеряли по мышцам, отводящим большой палец (APB) и мышце, приводящей минимальную мизинец (ADM). У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности. Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103].
12.4. Движения зеркал при дистонии
Движения зеркал представляют собой выражение моторного переполнения у пациентов с дистонией. Он определяется как появление аномальной позы в пораженной конечности, когда контралатеральная здоровая конечность занята определенной задачей [104]. Это помогает отличить истинные дистонические движения от любых компенсаторных движений, непроизвольно выполняемых для уменьшения инвалидности. Межполушарное торможение было продемонстрировано при функциональной нейровизуализации и электрофизиологических исследованиях, и его потеря была связана с зеркальными движениями.Мерелло и др. На функциональной МРТ показано, что у больного с писчим спазмом и зеркальными движениями при письме пораженной рукой наблюдается контралатеральная и ипсилатеральная активация задней теменной коры и скорлупы и ипсилатеральная активация нижней лобной извилины. Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106].
12.5. Дистония как сетевое расстройство
Анатомические корреляты и механизмы, рассмотренные выше, противоречат ранее предложенному представлению о дистонии как о чистом расстройстве базальных ганглиев. Существует повышенное признание корково-подкорковых цепей, а именно паллидоталамокортикальной и мозжечково-таламокортикальной, в патофизиологии дистонии. Эта сетевая модель (1) может хорошо объяснить неправильную обработку сенсорной информации наряду с возбудимостью тормозных путей на разных уровнях нейрооси, что может привести к аномальной пластичности и явной дистонии.
Сетевая модель дистонии. Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть.
Сетевая гипотеза также объясняет очаговое начало и постепенное сегментарное или генерализованное распространение аномалии [107]. Базальные ганглии и их таламокортикальные соединения посредством прямого и непрямого пути и гиперпрямого пути от коры к субталамическому ядру были хорошо описаны ранее [87,108]. Прямой путь облегчает, а непрямой тормозит движение.Гиперактивность прямого пути была показана Симоняном и соавт. при фокальных дистониях. Доступность рецепторов D1 была значительно увеличена в скорлупе у пациентов с писчим спазмом и дистонией гортани, и это подтверждает аномальную стриато-таламо-кортикальную возбудимость при дистонии [109]. Другим примером, указывающим на сетевой механизм, является успешная глубокая стимуляция мозга (DBS) внутреннего сегмента бледного шара при дистонии. Вызванные DBS изменения в нейронных паттернах подавляют патологические всплески и колебания в сети, что приводит к улучшению сенсомоторной обработки и улучшению симптомов [110].Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии.
Таким образом, недавние экспериментальные данные изменили наше представление о дистонии как психиатрическом диагнозе как о заболевании, характеризующемся изменениями в различных узлах головного мозга.Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии.
13. Паратония
Двигательные расстройства высшего порядка – это нарушения двигательного поведения, предшествующие произвольному выполнению движений. К ним относятся расстройства растормаживания, двигательной интенции, синдромы чужеродных конечностей и зеркальных движений [113].В контексте двигательных расстройств зеркальные движения обсуждались в разделе о дистонии. Явления чужеродных конечностей и расстройства двигательной интенции — корковые феномены, хорошо описанные при паркинсонизме, но выходящие за рамки настоящего обсуждения нарушений тонуса. Тем не менее, мы хотели бы кратко обсудить здесь расстройство растормаживания, паратонию, поскольку известно, что ботулинический токсин снимает непроизвольное сопротивление, наблюдаемое при паратонии. Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].
14. Патофизиология паратонии
Beversdorf et al.продемонстрировали, что облегчающая паратония была формой эхопраксии, при которой испытуемые имитировали движения исследователя. Они пришли к выводу, что это форма дефектного торможения реакции, вторичного по отношению к дисфункции лобных долей. Орбитофронтальное повреждение и лобно-подкорковая дисфункция связаны с нарушением торможения реакции [116]. Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114]. Однако электромиографическая оценка больных с паратонией не выявила совместного сокращения противостоящей группы мышц при паратонии. Дрент и др. предложил еще одно периферическое биохимическое изменение, которое может способствовать повышению резистентности тканей у пациентов с деменцией и паратонией.Было обнаружено, что конечные продукты повышенного гликирования (AGE), измеренные с помощью аутофлуоресценции кожи, значительно повышены у пациентов с паратонией и имеют прямую связь с тяжестью паратонии. КПГ увеличивают жесткость тканей за счет образования поперечных связей в мышечном коллагене, нарушают функцию скелетных мышц и могут играть роль в патогенезе паратонии [118]. Основные патофизиологические механизмы, ответственные за спастичность, ригидность, дистонию и паратонию, выделены в .
Таблица 2
Патофизиологические основы спастичности, ригидности, дистонии и паратонии.
. [PubMed] [CrossRef] [Google Scholar] 118. Дрент Х., Зуидема С., Баутманс И., Хоббелен Х. Роль воспалений и конечных продуктов гликирования при паратонии у пациентов с деменцией. Эксп. Геронтол. 2020;142:111125. doi: 10.1016/j.exger.2020.111125. [PubMed] [CrossRef] [Google Scholar]Нарушения тонуса Базовая патофизиология Спастичность Нарушение возбуждения и торможения спинного мозга, ведущее к повышенному возбуждению и снижению торможения сенсорная обратная связь
Ненервные факторы, такие как вязкоупругие свойства мышечного волокна и окружающих соединительных тканей
Ригидность Повышение долголатентных рефлексов растяжения (LLSR)
Усиление реакции укорочения (SR) и индуцированное растяжением торможение (SII) locus coeruleus, каудальный шов и мостовидное ядро (PPN)
Изменение функциональных связей в сетях мозга, включая лобно-теменное соединение, премоторно-преклиновидное соединение
Ненейральные факторы, такие как вязкоупругие свойства мышечных волокон и окружающих соединительных тканей
Дистония Отсутствие ингибирования объемного звучания
ненормальная сенсорно-моторная интеграция
аномалий в паллидо-таламо-корковице и мозжечко-таламо-кортикальной сети
Paratonia Дефектное торможение реакции из-за орбитофронтального повреждения и лобно-подкорковой дисфункции
Ненервные: повышение жесткости тканей из-за отложения конечных продуктов гликирования (AGE)Выводы
Тонус поддерживается сложным взаимодействием спинальных и супраспинальных механизмов, нарушения которых приводят к спастичности и ригидности. Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.
Благодарности
В этом разделе вы можете отметить любую оказанную поддержку, не охваченную разделами вклада автора или финансирования. Это может включать административную и техническую поддержку или пожертвования в натуральной форме (например, материалы, используемые для экспериментов).
Вклад авторов
Концептуализация, Дж.Г. и М.Дж.; написание — подготовка первоначального проекта, J.G., D.K. и М.А.; написание — обзор и редактирование, MJ; авторский надзор, M.J. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получило внешнего финансирования.
Заявление Институционального контрольного совета
Неприменимо.
Заявление об информированном согласии
Неприменимо.
Заявление о доступности данных
В этом исследовании не создавались и не анализировались новые данные. Обмен данными не применим к этой статье.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Сноски
Примечание издателя: MDPI остается нейтральным в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Ссылки
1. Кэмпбелл В.В., Барон Р.Дж. ДеДжонга «Неврологическое обследование». 7-е изд. Липпинкотт Уильямс и Уилкинс; Филадельфия, Пенсильвания, США: 2019. Мышечный тонус; стр. 467–474. [Google Академия]2. Shortland AP Мышечный тонус не является четко определенным термином. Дев. Мед. Детский Нейрол. 2018;60:637. doi: 10.1111/dmcn.13707. [PubMed] [CrossRef] [Google Scholar]3. Кэмпбелл К.С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В.Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0. [PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С., Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г.М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом. Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)
-V. [PubMed] [CrossRef] [Google Scholar] 109. Симонян К., Чо Х., Сичани А.Х., Рубиен-Томас Э., Халлетт М. Гиперфункция прямого пути базальных ганглиев при фокальной дистонии. Мозг. 2017;140:3179–3190. doi: 10.1093/мозг/awx263.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]111. Аргелан М., Карбон М., Нитхаммер М., Улуг А.М., Восс Х.У., Брессман С.Б., Дхаван В., Эйдельберг Д. Церебеллоталамокортикальная связь регулирует пенетрантность при дистонии. Дж. Нейроски. 2009;29:9740–9747. doi: 10.1523/JNEUROSCI.2300-09.2009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]112. Аккал Д., Дум Р.П., Стрик П.Л. Дополнительная моторная зона и предварительная моторная зона: цели базальных ганглиев и мозжечкового выхода. Дж.Неврологи. 2007; 27:10659–10673. doi: 10.1523/JNEUROSCI.3134-07.2007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]113. Койович М., Бхатия К.П. Приведение в порядок двигательных расстройств высшего порядка. Дж. Нейрол. 2018; 266:797–805. doi: 10.1007/s00415-018-8974-9. [PubMed] [CrossRef] [Google Scholar] 114. Дрент Х., Зуидема С., Баутманс И., Маринелли Л., Кляйнер Г., Хоббелен Х. Паратония при деменции: систематический обзор. Дж. Альцгеймер Дис. 2020; 78: 1615–1637. doi: 10.3233/JAD-200691. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]115.Маринелли Л., Мори Л., Пардини М., Беверсдорф Д., Кочито Л., Курра А., Фаттаппоста Ф., Гиларди М.Ф., Аббруццезе Г., Тромпетто С. Электромиографическая оценка паратонии. Эксп. Мозг Res. 2016; 235:949–956. doi: 10.1007/s00221-016-4854-7. [PubMed] [CrossRef] [Google Scholar] 116. Беверсдорф Д.К., Хейлман К.М. Фасилитарная паратония и функционирование лобных долей. Неврология. 1998; 51: 968–971. doi: 10.1212/WNL.51.4.968. [PubMed] [CrossRef] [Google Scholar] 117. Лермитт Ф. Человеческая автономия и лобные доли.Часть II: Поведение пациента в сложных и социальных ситуациях: синдром зависимости от окружающей среды? Анна. Нейрол. 1986; 19: 335–343. doi: 10.1002/ana.4101
Физиология и нарушения мышечного тонуса
Токсины (Базель).2021 апрель; 13(4): 282.
Поступила в редакцию 1 апреля 2021 г.; Принято 14 апреля 2021 г.
Эта статья была процитирована другими статьями в PMC.Abstract
Простое определение тонуса как сопротивления пассивному растяжению физиологически представляет собой сложную переплетенную сеть, охватывающую нейронные цепи в головном мозге, спинном мозге и мышечном веретене. Нарушения мышечного тонуса могут возникать из-за дисфункции этих путей и проявляться гипертонией или гипотонией. Утрата супраспинальных механизмов контроля приводит к гипертонии, приводящей к спастичности или ригидности.С другой стороны, дистония и паратония также проявляются нарушением мышечного тонуса, но возникают в большей степени из-за дисфункции сети между базальными ганглиями и таламо-мозжечково-кортикальными связями. В этом обзоре мы обсудили нормальные гомеостатические механизмы поддержания тонуса и патофизиологию спастичности и ригидности с их анатомическими коррелятами. После этого мы также выделили феномен сетевой дисфункции, коркового растормаживания и нейропластических изменений, приводящих к дистонии и паратонии.
Ключевые слова: спастичность, ригидность, дистония, паратония
1. Введение
Мышечный тонус представляет собой сложное и динамичное состояние, возникающее в результате иерархической и реципрокной анатомической связности. Он регулируется системами ввода и вывода и критически зависит от требований к мощности и производительности задач. Тон — это, по сути, конструкция моторного контроля, на которой внутренне уравновешивается мощность. Эта иерархия моторного контроля включает в себя кору (обширные возможности обработки с наивысшей степенью свободы), базальные ганглии (обучение и обучение контекстно-зависимым задачам с меньшими степенями свободы), мозжечок (точная настройка), ретикулярную систему ствола мозга (общий путь для восхождения). и нисходящие пути), спинной мозг (основной путь для восходящих и нисходящих путей) и мышечное веретено (конечный общий путь с наименьшей степенью свободы).В этом обзоре мы обсудили противоречия, касающиеся определения мышечного тонуса и его классификации, а также механизмы и пути, ответственные за поддержание тонуса. Спастичность и ригидность, два типа гипертонии, были разработаны в контексте дисфункции супраспинальных путей и взаимодействия между спинным мозгом и мышечным веретеном. Два других нарушения тонуса, а именно дистония и паратония, не совсем связаны с физиологической дисфункцией проводящих путей тонуса.В системе управления моторикой спастичность и ригидность являются преимущественно проблемой выходной системы, тогда как дистония является проблемой обработки на системном уровне. Дистония и паратония изменяют тонус вследствие нарушения сети в базальных ганглиях, таламокортикальных цепях и их соединениях. Механизмы, лежащие в их основе, обсуждались впоследствии, поскольку они важны как клинически, так и патофизиологически с точки зрения двигательных расстройств.
2. Определение мышечного тонуса
Мышечный тонус традиционно определяют как «напряжение в расслабленной мышце» или «сопротивление, ощущаемое исследователем при пассивном растяжении сустава, когда мышцы находятся в состоянии покоя» [1].Это определение тона имеет некоторые неясности, например, неясно, что означает «сопротивление пассивному растяжению», а «ощущаемое исследователем» открывает дверь для субъективных вариаций во время клинического обследования и изменчивости оценки между пациентами [2]. Исследования с электромиографической (ЭМГ) оценкой часто приравнивают мышечный тонус к исходному уровню ЭМГ в расслабленном состоянии. Однако помимо активного или сократительного компонента, возникающего в результате активации двигательной единицы и обнаруживаемого с помощью ЭМГ, мышечный тонус также имеет пассивный или вязкоупругий компонент, независимый от нервной активности, который не может быть обнаружен с помощью ЭМГ.Вязкоупругий компонент, в свою очередь, зависит от множества факторов, таких как саркомерные актин-миозиновые поперечные мостики, вязкость, эластичность и растяжимость сократительных филаментов, филаментное соединение саркомерных несократительных белков (например, десмин, тайтин), осмотическое давление. клеток, а также на окружающие соединительные ткани [3,4].
Математически мышечный тонус можно интерпретировать как изменение сопротивления или силы на единицу изменения длины (Δ сила/Δ смещение ткани) [5].В расслабленном состоянии сопротивление внешнему движению (R TOT ) зависит от инерции (R IN ), кажущейся жесткости (сопротивление растяжению/R ST ) и демпфирования (сопротивление скорости/R DA ). : Р ТОТ = Р ИН + Р ДА + Р СТ [6]. Однако все эти определения имеют общее заблуждение, предполагающее, что человек находится в полностью расслабленном состоянии, чего зачастую невозможно достичь без применения миорелаксантов.
В отличие от этого общего представления Бернштейн подчеркнул тот факт, что мышечный тонус может фактически отражать состояние готовности к движению, и, таким образом, может быть невозможно оценить мышечный тонус, когда человека просят расслабиться и не совершать никаких движений. [7].Бернштейн в своей иерархической модели построения движения (тонус, синергия, пространство, действие) постулировал, что мышечный тонус является адаптивной функцией нейромоторного аппарата, адекватно реагирующего на команды, поступающие с верхних уровней построения движения, путем тонкой настройки возбудимости сенсорные и моторные клетки для задач активного управления позой или движением [6,7]. Это определение делает мышечный тонус активным участником двигательных и постуральных задач. Точно так же Карпентер и соавт.дали клиническое определение тонуса как «постоянной мышечной активности, которая необходима в качестве фона для фактического движения, чтобы поддерживать основное положение тела, особенно против силы тяжести» [8]. Таким образом, тон может быть конструкцией, необходимой для управления моторикой, чтобы как статические, так и динамические задачи могли безопасно выполняться наиболее термодинамически эффективным способом.
3. Классификация мышечного тонуса
Мышечный тонус можно разделить на «постуральный» и «фазовый».Постуральный тонус наблюдается в аксиальных мышцах, где гравитация является наиболее важным провоцирующим фактором. Это происходит в результате постоянного растяжения мышц и сухожилий и проявляется в виде длительного сокращения мышц. Напротив, фазный тонус обычно оценивается клинически в конечностях как быстрый и кратковременный ответ. Это происходит в результате быстрого растяжения сухожилия и прикрепленной к нему мышцы, а точнее мышечного веретена [9]. Кроме того, мышечный тонус можно разделить на активный и пассивный компоненты, как это уже было описано выше.
4. Анатомия, лежащая в основе регуляции мышечного тонуса
Мышечный тонус регулируется спинальными и супраспинальными механизмами. В то время как спинальный контроль зависит от взаимодействия между мышечным веретеном и спинным мозгом вместе с интернейронами, супраспинальный контроль регулируется фасилитационными и тормозными длинными путями и мозжечком.
4.1. Контроль позвоночника
4.1.1. Взаимодействие между мышечным веретеном и спинным мозгом
Сенсорная обратная связь со спинным мозгом от мышцы в отношении ее длины и напряжения необходима для регуляции мышечного тонуса.Интрафузальные волокна передают информацию о длине мышцы или скорости ее изменения, в то время как сухожильные органы Гольджи передают информацию о натяжении сухожилий или скорости изменения натяжения [10]. Афференты типа Ia определяют скорость изменения длины мышцы во время растяжения (динамическая реакция). Однако при тонической активности афферентов Iа и II типов выявляют установившуюся длину мышцы (статический ответ). Афференты типа Ib посылают информацию от сухожильных органов Гольджи.
Мышечное веретено генерирует тонус, активируя рефлекс растяжения.Когда моторная команда посылается на альфа-моторные волокна (снабжающие экстрафузальные волокна), гамма-волокна (снабжающие интрафузальные волокна) также будут возбуждаться (альфа-гамма-коактивация), что приводит к сокращению как экстрафузальных, так и интрафузальных волокон [8,10]. ]. Рефлекс растяжения может быть двух типов: (а) динамический и (б) статический. Внезапное быстрое растяжение мышцы стимулирует волокна ядерного мешка (реагируют на скорость или скорость растяжения), а афференты Ia (кольцеспиральные окончания) передают динамический сигнал в спинной мозг.Эфферентный сигнал от спинного мозга (альфа-мотонейрона) поступает через альфа-эфференты к экстрафузальным волокнам, что приводит к внезапному сокращению мышцы (рефлекс динамического растяжения). Это лежит в основе клинического выявления глубоких сухожильных рефлексов. С другой стороны, продолжительное растяжение мышцы стимулирует волокна ядерной цепи, и афференты типа II (окончания цветочных брызг) передают сигнал к спинному мозгу. Эфферентный сигнал от спинного мозга проходит через альфа-эфференты к экстрафузальным волокнам. Однако на этот раз будет происходить асинхронное сокращение экстрафузальных мышечных волокон (двигательные единицы не разряжаются все вместе), что приведет к мягкому устойчивому сокращению этих волокон, пока они растягиваются.Эта статическая рефлекторная реакция на растяжение является физиологической основой поддержания мышечного тонуса [8,10,11].
С другой стороны, существует порог, когда чем сильнее растягивается мышца, тем сильнее рефлекторное сокращение. После пересечения порога сокращение прекращается, и мышца расслабляется. Это известно как «рефлекс обратного растяжения» и опосредовано сухожильным органом Гольджи, присутствующим в пучках сухожилия [11].
4.1.2. Интернейроны
Интернейроны являются неотъемлемой частью дуги рефлекса растяжения () и играют важную роль в поддержании мышечного тонуса.Они ингибируются или возбуждаются несколькими системами нисходящих волокон. Существует несколько межнейронных путей, и их роль в спастичности обсуждается позже. Среди них рекуррентное ингибирование клетками Реншоу, реципрокное ингибирование Ia мышцами-антагонистами, невзаимное ингибирование Ib сухожильным органом Гольджи и пресинаптическое ингибирование наиболее важны для поддержания мышечного тонуса [10,11,12,13,14].
Основные интернейроны в регуляции мышечного тонуса.
4.2. Супраспинальный контроль посредством нисходящих длинных путей
У человека супраспинальное воздействие на мышечный тонус и рефлексы растяжения в основном модулируется взаимодействием (обсуждается позже) двух тормозных и двух облегчающих нисходящих путей [10] ().
Нисходящие длинные пути в регуляции схемы рефлекса растяжения и мышечного тонуса у людей. Жирным шрифтом выделены основные участки регуляции тонуса.
4.2.1. Тормозные пути
Корково-спинномозговой путь/КСТ (из моторной коры)
Кортикоретикулярный (из премоторной коры) и дорсальный ретикулоспинальный тракт/дорсальный РСТ (из медуллярной ретикулярной формации) 9.205238 Содействующие тракты
Вестибулоспинальный тракт/VST (из латерального вестибулярного или ядра Дейтерса)
Медиальный ретикулоспинальный тракт/медиальный RST (в основном из ретикулярной формации моста)
4.3. Роль мозжечка
Медиальная часть передней доли мозжечка активирует медуллярную ретикулярную формацию, откуда возникает дорсальный RST. Следовательно, область мозжечка ингибирует мышечный тонус опосредованно через ингибирование гамма-мотонейронов через дорсальный RST. Однако латеральная часть передней доли активирует ретикулярную формацию моста. Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17].
5. Спастичность
JW Lance в 1980 г. определил спастичность как «моторное расстройство, характеризующееся зависимым от скорости повышением тонических рефлексов растяжения (мышечного тонуса) с усиленными сухожильными подергиваниями, возникающими в результате повышенной возбудимости рефлекса растяжения, как одного из компонентов синдром верхнего двигательного нейрона» [18].Однако спастичность зависит не только от скорости, но и от длины мышцы. Спастичность разгибателей коленного сустава (четырехглавой мышцы) больше, когда мышца короткая, но в сгибателях верхних конечностей (например, бицепс) и разгибателях голеностопного сустава (икроножная, камбаловидная) спастичность больше, когда мышцы длинные. Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями.Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.
Спастичность может быть классифицирована как «фазовая» и «тоническая» на основе преобладающего участия либо фазических (динамических), либо тонических (статических) компонентов рефлексов растяжения мышц.После травмы позвоночника у амбулаторных пациентов развивается «фазовая» спастичность с быстрыми рефлексами растяжения и клонусом. Однако у пациентов, не способных передвигаться, развивается «тоническая» спастичность, демонстрируемая пассивным растяжением голеностопного сустава и тестированием вибрационно-тонического рефлекса [10, 21].
В следующем разделе мы обсудим спинальные и супраспинальные факторы, способствующие спастичности, включая роль сенсорной обратной связи, о чем свидетельствуют недавние исследования, а также патофизиологию феномена складного ножа и клонуса.
6. Факторы, способствующие спастичности
6.1. Влияние позвоночника
Влияние позвоночника на спастичность может быть связано как с усилением возбуждения, так и со снижением торможения. Повышенная фузимоторная активность [22], денервационная гиперчувствительность [23], прорастание аксонов [24,25], повышенная возбудимость альфа-мотонейронов [25], возбуждение интернейронов [25] и повышение кожных рефлексов растяжения [10] ответственны за повышенное возбуждающее влияние. на спастичность. Модели на животных показали роль мембранных свойств мотонейрона в спастичности.Зависимый от напряжения постоянный внутренний ток (PIC), опосредованный через каналы Na + и Ca 2+ , может вызывать длительную деполяризацию (потенциал плато), модулируемую нисходящей серотонинергической и норадренергической активностью [10,25]. Нисходящий моноаминергический драйв в норме оказывает возбуждающее действие на альфа-мотонейроны в вентральных рогах через рецепторы 5HT2 и NEα1, тогда как он оказывает тормозящее действие на дорсальные рога через рецепторы 5HT1b/d и NEα2 [25]. В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности.
Помимо возбуждающих механизмов, способствующих спастичности, в недавних исследованиях все больше оценивается роль измененных спинальных тормозных цепей [10]. Растормаживание альфа-мотонейрона при спастичности может происходить из-за снижения пресинаптического торможения афферентов Ia [26], снижения дисинаптического реципрокного афферентного торможения Ia от группы мышц-антагонистов [27,28], снижения афферентно-опосредованного торможения Ib сухожильным органом Гольджи [29]. , измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30].
6.2. Супраспинальное влияние
В норме мышечный тонус человека в критической степени уравновешивается тормозным импульсом CST и дорсальным RST и стимулирующим импульсом (на разгибательный тонус) медиальным RST и в некоторой степени VST [10]. Среди них дорсальный RST также ингибирует афферентные рефлексы сгибателей (FRA). В спинном мозге латеральный канатик содержит кортикоспинальный тракт (CST) и дорсальный RST, тогда как передний канатик содержит VST и медиальный RST. Исходя из этого, влияние поражений коры и спинного мозга на мышечный тонус можно резюмировать следующим образом.
6.2.1. Поражения коры
Изолированное вовлечение КСТ недостаточно для возникновения спастичности [31,32]. Поражения коры головного мозга вызывают спастичность из-за ассоциированного вовлечения кортико-ретикулярных волокон, связи между премоторной корой и медуллярной ретикулярной формацией, откуда берет начало дорсальная RST. Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST.
6.2.2. Поражения спинного мозга
Неполная/частичная миелопатия с вовлечением латерального канатика: при вовлечении только КСТ это приводит к слабости, гипотонии и утрате поверхностных рефлексов. Если есть дополнительное вовлечение дорсального RST, спастичность и гиперрефлексия будут развиваться из-за беспрепятственной активности медиального RST. Спастичность будет преобладать в антигравитационных мышцах и приведет к параплегии при разгибании и спазмам разгибателей. Спазмы сгибателей могут возникать, если FRA активируются пролежнями.С другой стороны, если вовлекается дорсальная RST только с щадящей CST, будет спастичность без выраженной слабости.
Полная миелопатия с поражением всех четырех трактов: спастичность в этом случае будет меньше из-за отсутствия облегчающего воздействия медиальных RST и VST. Растормаживание FRA приведет к параплегии при сгибании и спазмам сгибателей.
6.3. Роль сенсорной обратной связи
Недавние исследования показали, что коактивация мышц-антагонистов, жесткая поза и жесткая походка при спастичности могут быть адаптацией для стабилизации сустава и позы на фоне снижения мышечной силы, тогда как гипервозбудимые рефлексы играют незначительную или никакой роли [33,34].Спастические двигательные расстройства могут возникать из-за неадекватного прогнозирования сенсорных последствий движений [35,36]. Из-за отсутствия надежного прогноза соматосенсорной обратной связи от движущейся конечности пациенту с поражением ВМН будет трудно оптимизировать движение. Таким образом, совместное сокращение мышц вокруг сустава может быть стратегией минимизации случайных движений и максимально возможной стабилизации движения [33]. Следовательно, спастическое двигательное расстройство скорее может быть компенсацией слабости.Эта концепция может быть реализована при неосложненной наследственной спастической параплегии (HSP), когда происходит потеря проприоцептивной чувствительности крупных волокон наряду с поражением корково-спинномозгового тракта (CST). Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.
6.4. Non-Neural Factors
Как обсуждалось ранее, изменения не-нейральных факторов, таких как вязкоупругие свойства ткани (например, упругая жесткость, вязкостное демпфирование), также могут способствовать возникновению спастичности [38,39].
7. Патофизиология феномена складного ножа
При пассивном растяжении мышцы ощущается большее сопротивление в начальной части растяжения, но при продолжении растяжения происходит внезапное ослабление сопротивления, описываемое как «феномен складного ножа».Из-за зависимости спастичности от длины сначала при сгибании колена (квадрицепсы короткие) ощущается повышенное сопротивление (больше спастичность). Однако при продолжении растяжения (удлиняется квадрицепс) после достижения критической длины сопротивление резко снижается [40,41,42]. Возбуждение медленно проводящих высокопороговых тормозных афферентов мышц III и IV групп (часть афферентов сгибательных рефлексов/FRA) также может быть ответственно за этот феномен [43].
8. Патофизиология клонуса
Клонус определяется как «регулярные, повторяющиеся, ритмичные сокращения мышцы, подвергаемой внезапному, сохраняющемуся растяжению» [11].Клонус, сохраняющийся в течение пяти и более ударов, считается клинически ненормальным. Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается.
9. Ригидность
Ригидность, в отличие от спастичности, не зависит от скорости движения. Он в равной степени влияет на сгибатели и разгибатели и вызывает равномерное сопротивление пассивному растяжению во всех направлениях, известное как феномен «свинцовой трубы». Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].
Таблица 1
Разница между спастичностью и ригидностью.
Дифференциация пунктов Спастичность Риждость Нажимая скорость Да № Устойчивость к движению в одном направлении (сгибание или расширение) в обоих направлениях Длина зависимости Да NO NO Тип Hypertonicity Тип Hypertonicity Класс-нож Сведящая труба или зубчатое колесо В следующем разделе мы обсудим факторы, способствующие жесткости, а затем патофизиология активационного маневра (проба Фроманта).
10. Факторы, влияющие на жесткость
10.1. Преувеличение долголатентных рефлексов растяжения (LLSR)
Первоначальные исследования показали, что паркинсоническая ригидность, вероятно, имеет спинномозговое рефлекторное происхождение, что подтверждается тем фактом, что ригидность улучшилась после резекции спинного мозга [51]. Считалось, что основной причиной является усиление реакции мышечных рецепторов на пассивное растяжение. Однако последующие исследования с микронейрографическими записями показали, что увеличение мышечного афферентного разряда из-за усиленной фузимоторной активности недостаточно для возникновения ригидности [52].Моносинаптические сегментарные рефлексы на растяжение существенно не отличались между пациентами с БП и здоровыми субъектами в исследованиях с использованием электрофизиологического анализа [53,54]. Скорее, афферентно-опосредованные спинальные рефлексы Ia, такие как сухожильные рефлексы, H-рефлекс и тонический вибрационный рефлекс, оказались в основном нормальными у пациентов с БП [55,56]. Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53].
10.2. Усиленная реакция укорочения (SR) и торможение, вызванное растяжением (SII)
Преувеличенная LLSR может объяснить гипертонус при БП, но не может объяснить сопротивление пассивному растяжению, одинаковое во всем диапазоне движения (характер «свинцовой трубы»)? Аномальная реакция в укорачивающейся мышце была впервые отмечена Вестфалем и впоследствии названа Шеррингтоном «реакцией укорочения» (СР) [58].Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].
10.3. Роль ствола мозга
Роль недофаминергической системы при БП все чаще подчеркивается в последних исследованиях. Недавно Линн-Эванс и соавт. отметили повышенную и более симметричную ригидность верхних конечностей у пациентов с БП в состоянии бодрствования, у которых наблюдается быстрый сон без атонии (PD-RSWA+), по сравнению с пациентами с атонией (PD-RSWA-) и контрольной группой [62]. Цепь ствола мозга, отвечающая за тонус в фазе быстрого сна, перекрывается с цепью, поддерживающей возбудимость двигательных нейронов и постуральный контроль в состоянии бодрствования [63].При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66]. Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62].
Нейромодуляторы в патофизиологии ригидности.
10.4. Ненервные факторы
Как обсуждалось ранее, вязкоупругие свойства мышечных волокон и окружающих соединительных тканей также могут способствовать паркинсонической ригидности. Уоттс и др. отметили, что у пациентов с БП даже с легкими двигательными симптомами ригидность верхних конечностей была больше, чем у контроля в расслабленном состоянии, но без какой-либо ЭМГ-активности [67]. Исследование подчеркнуло роль пассивных механических свойств для жесткости.Ся и др. также отметили вклад как нервных, так и не-нейральных факторов в паркинсоническую ригидность, в то время как нервный вклад преобладает [68].
10.5. Сетевая гипотеза паркинсоновской ригидности
Baradaran et al. [69] исследовали изменение функциональных связей в сетях мозга в связи с паркинсонической ригидностью. По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип.
11. Патофизиологические основы активационного маневра
Интересным, но еще не до конца изученным явлением, наблюдаемым при БП, является увеличение ригидности при сокращении мышц (изометрических/ритмических) в контралатеральной конечности.Возможные объяснения, описанные в литературе для этого феномена: (1) усиление LLSR через транскортикальный путь [71,72], (2) изменение возбудимости спинальных мотонейронов, опосредованное перекрестной сенсорной афферентной обратной связью через афферентный вход lb, что приводит к уменьшению реакции укорочения (SR). ) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73].
12. Дистония
12.1. Патофизиология и механизмы
Дистония определяется как «устойчивые или прерывистые мышечные сокращения, приводящие к аномальным, часто повторяющимся движениям, позам или тому и другому» [74]. Эти движения обычно шаблонны, могут быть дрожащими или скручивающими и усиливаться при произвольных действиях [75]. Дистония может быть фокальной, сегментарной, ограниченной одной половиной тела (гемидистония) или генерализованной. Гетерогенные проявления и различная этиология, начиная от генетических причин и заканчивая нейродегенеративными расстройствами, указывают на многочисленные механизмы, которые способствуют патофизиологии дистонии.Гипотеза при обсуждении механизмов дистонии в основном сосредоточена вокруг схемы базальных ганглиев, таламо и коры головного мозга. Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции.
12.2. Анатомические корреляты дистонии
Базальные ганглии и их аномальные связи считаются наиболее важными структурами, связанными с дистонией.Вторичные дистонии из-за поражений базальных ганглиев являются ярким примером этой ассоциации в течение длительного времени [74,75]. Леводопа, улучшающая дистонию, реагирующую на дофа (DRD), или глубокая стимуляция мозга внутреннего сегмента бледного шара, которая улучшает некоторые случаи дистонии, являются дополнительными указателями на центральную роль базальных ганглиев в происхождении дистонии [76,77,78]. Дистония не часто обнаруживается при спиноцеребеллярной атаксии (SCA), но редко является клиническим симптомом, когда мозжечковая атрофия является характерным признаком с сохранением базальных ганглиев.SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79].
Таким образом, совершенно ясно, что ни один анатомический коррелят не отвечает за дистонию. Скорее, дистонию вызывают аномальные сетевые связи между базальными ганглиями, мозжечком, таламусом и корой.В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию.
12.3. Механизмы дистонии
В отсутствие моделей дистонии на животных понимание патофизиологических механизмов, вызывающих дистонию, прояснилось с появлением транскраниальной магнитной стимуляции (ТМС) и повторяющейся транскраниальной магнитной стимуляции (рТМС). Протоколы ТМС, разработанные в качестве инструмента исследования, выявили следующие физиологические дисфункции у пациентов с дистонией.
12.3.1. Потеря торможения
Отсутствие объемного торможения, совместное сокращение мышц-антагонистов и перелив активности в мышцы, не предназначенные для действия, — все это происходит из-за физиологической потери торможения [80,81]. Окружающее торможение — это явление, управляемое корой, при котором мышцы вокруг активных сокращающихся мышц активно тормозятся, чтобы предотвратить избыточное сокращение [81,82]. Сон и др. др. описали это явление у здоровых добровольцев с помощью одиночного импульса ТМС.При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87].Нарушение реципрокного торможения приводит к совместному сокращению противоположных мышц, что обычно наблюдается при дистонии. Предполагается, что нарушения спинномозговых рефлексов при дистонии связаны с дисфункциональными нисходящими входами от высших центров [88].
12.3.2. Аномальная сенсорная функция
Боль является общепризнанным симптомом дистонии, о ней сообщалось примерно в 70% случаев при цервикальной дистонии. При отсутствии явных сенсорных аномалий при клиническом обследовании у этих пациентов отмечаются сенсорные феномены, такие как фотосенсибилизация при блефароспазме или боль в шее до цервикальной дистонии [89].Наиболее захватывающим явлением при дистонии является «geste antagoniste» или сенсорный трюк. Это добровольный маневр, выполняемый пациентом для уменьшения тяжести дистонии. Сенсорный трюк, облегчающий дистонию, ошибочно идентифицировал расстройство как психогенное по происхождению [90]. Однако впоследствии было показано, что аномальная сенсорная функция и нарушение сенсомоторной интеграции являются важным физиологическим изменением, наблюдаемым при дистонии. Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92].
Задача ориентации решетки (GOT) измеряет остроту пространственного различения. Он наносится на кончики пальцев обеих рук и определяет наименьшую ширину гребня решетки, для которой можно точно определить ориентацию [93].Многочисленные исследования выявили аномалии GOT с повышенным порогом пространственной дискриминации у пациентов с фокальной дистонией рук, блефароспазмом и цервикальной дистонией [94,95,96]. Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR.Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии.
12.3.3. Аномальная синаптическая пластичность
Аномальная сенсорная обратная связь и потеря торможения вызывают кратковременные и долговременные изменения в корково-подкорковых цепях. Byl et al. провели эксперименты на обезьянах, чтобы оценить роль травм от повторяющихся напряжений, вызывающих фокальную дистонию, чтобы подчеркнуть нейропластичность / обучаемость происхождения дистонии. Они постулировали, что эта деградация сенсорной обратной связи при травмах с повторяющимся напряжением была результатом пластичности нейронов и существенно влияла на первичную моторную область, вызывая дистонию [98].Этот феномен чрезмерной выраженности реакций пластичности и неспецифической топографии распространения (аномальное распространение) также был продемонстрирован в экспериментах на людях и представляет собой важный механизм, лежащий в основе дистонии [99]. Важность долговременной потенциации (ДП) и долговременной депрессии (ДД) в пластичности коры широко признана, и считается, что они изменяют рецептивные сенсорные поля и двигательные представления в мозге. Эксперименты с ТМС с использованием парной ассоциативной стимуляции (ПАС), где низкочастотная стимуляция срединного нерва и ТМС сочетаются, исследуют синаптические изменения в моторной коре [100].В исследовании «случай-контроль» у пациентов с писчими спазмами PAS выполняли на доминантном полушарии с электрической стимуляцией срединного или локтевого нерва в сочетании с ТМС, доставляемой в контралатеральную кору через 21,5 мс или 10 мс после стимуляции периферического нерва. Двигательную реакцию измеряли по мышцам, отводящим большой палец (APB) и мышце, приводящей минимальную мизинец (ADM). У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности. Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103].
12.4. Движения зеркал при дистонии
Движения зеркал представляют собой выражение моторного переполнения у пациентов с дистонией. Он определяется как появление аномальной позы в пораженной конечности, когда контралатеральная здоровая конечность занята определенной задачей [104]. Это помогает отличить истинные дистонические движения от любых компенсаторных движений, непроизвольно выполняемых для уменьшения инвалидности. Межполушарное торможение было продемонстрировано при функциональной нейровизуализации и электрофизиологических исследованиях, и его потеря была связана с зеркальными движениями.Мерелло и др. На функциональной МРТ показано, что у больного с писчим спазмом и зеркальными движениями при письме пораженной рукой наблюдается контралатеральная и ипсилатеральная активация задней теменной коры и скорлупы и ипсилатеральная активация нижней лобной извилины. Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106].
12.5. Дистония как сетевое расстройство
Анатомические корреляты и механизмы, рассмотренные выше, противоречат ранее предложенному представлению о дистонии как о чистом расстройстве базальных ганглиев. Существует повышенное признание корково-подкорковых цепей, а именно паллидоталамокортикальной и мозжечково-таламокортикальной, в патофизиологии дистонии. Эта сетевая модель (1) может хорошо объяснить неправильную обработку сенсорной информации наряду с возбудимостью тормозных путей на разных уровнях нейрооси, что может привести к аномальной пластичности и явной дистонии.
Сетевая модель дистонии. Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть.
Сетевая гипотеза также объясняет очаговое начало и постепенное сегментарное или генерализованное распространение аномалии [107]. Базальные ганглии и их таламокортикальные соединения посредством прямого и непрямого пути и гиперпрямого пути от коры к субталамическому ядру были хорошо описаны ранее [87,108]. Прямой путь облегчает, а непрямой тормозит движение.Гиперактивность прямого пути была показана Симоняном и соавт. при фокальных дистониях. Доступность рецепторов D1 была значительно увеличена в скорлупе у пациентов с писчим спазмом и дистонией гортани, и это подтверждает аномальную стриато-таламо-кортикальную возбудимость при дистонии [109]. Другим примером, указывающим на сетевой механизм, является успешная глубокая стимуляция мозга (DBS) внутреннего сегмента бледного шара при дистонии. Вызванные DBS изменения в нейронных паттернах подавляют патологические всплески и колебания в сети, что приводит к улучшению сенсомоторной обработки и улучшению симптомов [110].Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии.
Таким образом, недавние экспериментальные данные изменили наше представление о дистонии как психиатрическом диагнозе как о заболевании, характеризующемся изменениями в различных узлах головного мозга.Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии.
13. Паратония
Двигательные расстройства высшего порядка – это нарушения двигательного поведения, предшествующие произвольному выполнению движений. К ним относятся расстройства растормаживания, двигательной интенции, синдромы чужеродных конечностей и зеркальных движений [113].В контексте двигательных расстройств зеркальные движения обсуждались в разделе о дистонии. Явления чужеродных конечностей и расстройства двигательной интенции — корковые феномены, хорошо описанные при паркинсонизме, но выходящие за рамки настоящего обсуждения нарушений тонуса. Тем не менее, мы хотели бы кратко обсудить здесь расстройство растормаживания, паратонию, поскольку известно, что ботулинический токсин снимает непроизвольное сопротивление, наблюдаемое при паратонии. Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].
14. Патофизиология паратонии
Beversdorf et al.продемонстрировали, что облегчающая паратония была формой эхопраксии, при которой испытуемые имитировали движения исследователя. Они пришли к выводу, что это форма дефектного торможения реакции, вторичного по отношению к дисфункции лобных долей. Орбитофронтальное повреждение и лобно-подкорковая дисфункция связаны с нарушением торможения реакции [116]. Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114]. Однако электромиографическая оценка больных с паратонией не выявила совместного сокращения противостоящей группы мышц при паратонии. Дрент и др. предложил еще одно периферическое биохимическое изменение, которое может способствовать повышению резистентности тканей у пациентов с деменцией и паратонией.Было обнаружено, что конечные продукты повышенного гликирования (AGE), измеренные с помощью аутофлуоресценции кожи, значительно повышены у пациентов с паратонией и имеют прямую связь с тяжестью паратонии. КПГ увеличивают жесткость тканей за счет образования поперечных связей в мышечном коллагене, нарушают функцию скелетных мышц и могут играть роль в патогенезе паратонии [118]. Основные патофизиологические механизмы, ответственные за спастичность, ригидность, дистонию и паратонию, выделены в .
Таблица 2
Патофизиологические основы спастичности, ригидности, дистонии и паратонии.
. [PubMed] [CrossRef] [Google Scholar] 118. Дрент Х., Зуидема С., Баутманс И., Хоббелен Х. Роль воспалений и конечных продуктов гликирования при паратонии у пациентов с деменцией. Эксп. Геронтол. 2020;142:111125. doi: 10.1016/j.exger.2020.111125. [PubMed] [CrossRef] [Google Scholar]Нарушения тонуса Базовая патофизиология Спастичность Нарушение возбуждения и торможения спинного мозга, ведущее к повышенному возбуждению и снижению торможения сенсорная обратная связь
Ненервные факторы, такие как вязкоупругие свойства мышечного волокна и окружающих соединительных тканей
Ригидность Повышение долголатентных рефлексов растяжения (LLSR)
Усиление реакции укорочения (SR) и индуцированное растяжением торможение (SII) locus coeruleus, каудальный шов и мостовидное ядро (PPN)
Изменение функциональных связей в сетях мозга, включая лобно-теменное соединение, премоторно-преклиновидное соединение
Ненейральные факторы, такие как вязкоупругие свойства мышечных волокон и окружающих соединительных тканей
Дистония Отсутствие ингибирования объемного звучания
ненормальная сенсорно-моторная интеграция
аномалий в паллидо-таламо-корковице и мозжечко-таламо-кортикальной сети
Paratonia Дефектное торможение реакции из-за орбитофронтального повреждения и лобно-подкорковой дисфункции
Ненервные: повышение жесткости тканей из-за отложения конечных продуктов гликирования (AGE)Выводы
Тонус поддерживается сложным взаимодействием спинальных и супраспинальных механизмов, нарушения которых приводят к спастичности и ригидности. Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.
Благодарности
В этом разделе вы можете отметить любую оказанную поддержку, не охваченную разделами вклада автора или финансирования. Это может включать административную и техническую поддержку или пожертвования в натуральной форме (например, материалы, используемые для экспериментов).
Вклад авторов
Концептуализация, Дж.Г. и М.Дж.; написание — подготовка первоначального проекта, J.G., D.K. и М.А.; написание — обзор и редактирование, MJ; авторский надзор, M.J. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получило внешнего финансирования.
Заявление Институционального контрольного совета
Неприменимо.
Заявление об информированном согласии
Неприменимо.
Заявление о доступности данных
В этом исследовании не создавались и не анализировались новые данные. Обмен данными не применим к этой статье.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Сноски
Примечание издателя: MDPI остается нейтральным в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Ссылки
1. Кэмпбелл В.В., Барон Р.Дж. ДеДжонга «Неврологическое обследование». 7-е изд. Липпинкотт Уильямс и Уилкинс; Филадельфия, Пенсильвания, США: 2019. Мышечный тонус; стр. 467–474. [Google Академия]2. Shortland AP Мышечный тонус не является четко определенным термином. Дев. Мед. Детский Нейрол. 2018;60:637. doi: 10.1111/dmcn.13707. [PubMed] [CrossRef] [Google Scholar]3. Кэмпбелл К.С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В.Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0. [PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С., Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г.М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом. Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)
-V. [PubMed] [CrossRef] [Google Scholar] 109. Симонян К., Чо Х., Сичани А.Х., Рубиен-Томас Э., Халлетт М. Гиперфункция прямого пути базальных ганглиев при фокальной дистонии. Мозг. 2017;140:3179–3190. doi: 10.1093/мозг/awx263.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]111. Аргелан М., Карбон М., Нитхаммер М., Улуг А.М., Восс Х.У., Брессман С.Б., Дхаван В., Эйдельберг Д. Церебеллоталамокортикальная связь регулирует пенетрантность при дистонии. Дж. Нейроски. 2009;29:9740–9747. doi: 10.1523/JNEUROSCI.2300-09.2009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]112. Аккал Д., Дум Р.П., Стрик П.Л. Дополнительная моторная зона и предварительная моторная зона: цели базальных ганглиев и мозжечкового выхода. Дж.Неврологи. 2007; 27:10659–10673. doi: 10.1523/JNEUROSCI.3134-07.2007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]113. Койович М., Бхатия К.П. Приведение в порядок двигательных расстройств высшего порядка. Дж. Нейрол. 2018; 266:797–805. doi: 10.1007/s00415-018-8974-9. [PubMed] [CrossRef] [Google Scholar] 114. Дрент Х., Зуидема С., Баутманс И., Маринелли Л., Кляйнер Г., Хоббелен Х. Паратония при деменции: систематический обзор. Дж. Альцгеймер Дис. 2020; 78: 1615–1637. doi: 10.3233/JAD-200691. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]115.Маринелли Л., Мори Л., Пардини М., Беверсдорф Д., Кочито Л., Курра А., Фаттаппоста Ф., Гиларди М.Ф., Аббруццезе Г., Тромпетто С. Электромиографическая оценка паратонии. Эксп. Мозг Res. 2016; 235:949–956. doi: 10.1007/s00221-016-4854-7. [PubMed] [CrossRef] [Google Scholar] 116. Беверсдорф Д.К., Хейлман К.М. Фасилитарная паратония и функционирование лобных долей. Неврология. 1998; 51: 968–971. doi: 10.1212/WNL.51.4.968. [PubMed] [CrossRef] [Google Scholar] 117. Лермитт Ф. Человеческая автономия и лобные доли.Часть II: Поведение пациента в сложных и социальных ситуациях: синдром зависимости от окружающей среды? Анна. Нейрол. 1986; 19: 335–343. doi: 10.1002/ana.4101
ICS | Мышечный тонус
Редактор: Jennifer Voelkl Guevara
Последнее обновление: август 2018 г.Текущее определение: (1,2)
«Состояние мышцы, обычно определяемое ее напряжением в покое, клинически определяемое сопротивлением пассивному движению.Мышечный тонус имеет два компонента: сократительный компонент, создаваемый низкочастотной активацией небольшого числа двигательных единиц, и вязкоупругий компонент, не зависящий от нервной активности и отражающий пассивные физические свойства эластического напряжения мышечного волокна. элементы и осмотическое давление клеток».
История:
Мышечный тонус также можно назвать жесткостью, которая соответствует изменению сопротивления или силы на единицу изменения длины (Δ сила/Δ смещение ткани) (3)
В скелетных мышцах с нормальной иннервацией тонус включает активный и пассивный компоненты (4).Мышечная активность, возникающая в результате мышечного сокращения (т. е. электрогенного сокращения), обнаруживается среди активных компонентов, способствующих мышечному тонусу; он создается низкочастотной активацией небольшого числа двигательных единиц (2).
Пассивный компонент не зависит от нервной активности и отражает пассивные физические свойства вязкоупругого напряжения элементов мышечных волокон и осмотического давления клеток (2).
Мышечный тонус клинически оценивается как сопротивление, оказываемое мышцей при воздействии на нее давления/деформации или растяжения; оно может быть изменено при наличии или отсутствии боли (1)
Пальцевая пальпация, ультразвуковое исследование, манометрия давления, динамометрия и оценка ЭМГ были описаны несколькими авторами как методы оценки тонуса мышц тазового дна; каждый метод может измерять различные аспекты тонуса, такие как активность в покое, жесткость или эластичность; однако не существует стандартного метода оценки, который бы охватывал оба компонента мышечного тонуса.(2,5)Другие термины:
• Гипертонус: общее повышение мышечного тонуса, которое может быть связано либо с повышенной сократительной активностью, либо с пассивной ригидностью мышц (4), и может наблюдаться при полном отсутствии мышечной активности. Стандартизация терминологии ICS в отношении синдромов хронической тазовой боли предлагает использовать термин «повышенный тонус» при наличии ненейрогенной причины. Другие авторы предполагают нейрогенный гипертонус и ненейрогенный гипертонус (1).
• Гипотонус: общее снижение мышечного тонуса, которое может быть связано либо со снижением сократительной активности, либо с пассивной ригидностью мышц. Поскольку причина часто неизвестна, рекомендуются термины нейрогенная гипотония и ненейрогенная гипотония (4), однако Комитет по стандартизации терминологии ICS предлагает использовать термин «снижение тонуса» (1)
• Спазм: электромиографическая (ЭМГ) запись повышенного напряжения с укорочением или без укорочения мышцы из-за непроизвольной двигательной активности нерва.Спазм идентифицируется по потенциалам двигательных единиц, которые не могут быть прекращены произвольным расслаблением, и он может быть или не быть болезненным (4). Авторы утверждают, что этот термин отличается от контрактуры. (6). Спазм также может быть определен как: постоянное сокращение поперечно-полосатой мышцы, которое не может быть освобождено произвольно. Если сокращение болезненно, это обычно описывается как судорога. Спазмы возникают через неравные промежутки времени, с различной частотой и степенью, и в течение нескольких дней или недель могут привести к контрактуре (1)
• Контрактура: физиологическая контрактура (или ригидность) – это состояние мышечной сократительной активности, обычно пальпируемая тугая полоса (также называемая триггерной точкой), не сопровождающаяся электрической активностью.(4)Споры
Термины «спам», «гипертонус», «гиперактивность» и «контрактура» часто используются взаимозаменяемо, сбивая с толку пациентов и медицинских работников, ищущих стратегии лечения. Пациентам с несократительным повышенным тонусом, проверенным с помощью ЭМГ, сказали, что дисфункции PFM нет, что заставило их задаться вопросом, не «все ли это в моей голове». Эти термины указывают на отдельные и отличные условия. Хотя некоторые подходы к лечению пересекаются, в каждом случае есть уникальные методы лечения, которые улучшают успех и функцию.Для медицинских работников важно быть конкретными в отношении этих терминов.
К сожалению, эти усилия осложняются отсутствием исследований и инструментов. Не существует устоявшегося стандарта для клинической оценки мышечного тонуса, а также референтных или нормативных значений. Большинство доступных инструментов измеряют глобальный тон PFM (т. е. суммарный вклад активных и пассивных компонентов). В этой области необходимы дополнительные исследования.
Каталожные номера:
Бё, К., Фроули Х., Хейлен Б.Т., Абрамов Ю., Алмейда Ф., Бергманс Б., … Уэллс А. (2017). Совместный отчет Международной урогинекологической ассоциации (IUGA)/Международного общества по борьбе с недержанием мочи (ICS) о терминологии консервативного и немедикаментозного лечения дисфункции тазового дна у женщин. Международный журнал урогинекологии и дисфункция тазового дна, стр. 1–27. http://doi.org/10.1007/s00192-016-3140-3
Доггвейлер Р., Уитмор К.Е., Мейлинк Дж.М., Дрейк М.Дж., Фроули Х., Нордлинг Дж. и др.Стандарт терминологии синдромов хронической тазовой боли: отчет рабочей группы по хронической тазовой боли Международного общества воздержания. Нейроурол Уродин [Интернет]. 2016 г., 26 августа [цитировано 16 октября 2016 г.]; Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/27564065
.Тибо-Ганьон, С., и Морен, М. (2015). Активные и пассивные компоненты тонуса мышц тазового дна у женщин с спровоцированной вестибулодинией: точка зрения, основанная на обзоре литературы.
Саймонс, Д.Г. и Менсе С. (1998). Понимание и измерение мышечного тонуса в связи с клинической мышечной болью. Боль, 75(1), 1–17. http://doi.org/10.1016/S0304-3959(97)00102-4
Падоа, А., и Розенбаум, Т. (2016). Гиперактивное тазовое дно. Гиперактивное тазовое дно. http://doi.org/10.1007/978-3-319-22150-2
Трэвелл, Дж., и Саймонс, Д. (2012). Миофасциальные боли и дисфункции. Руководство по триггерным точкам. Верхние конечности (2-е изд.). Уилкинс, Липпинкотт Уильямс и.
Низкий мышечный тонус – что это такое и что это значит для моего ребенка?
Низкий мышечный тонус – что это такое и что это значит для моего ребенка?
Низкий мышечный тонус — это термин, который легко и часто неправильно понимают как родители, так и медицинские работники. Этот пост направлен на то, чтобы пролить свет на то, что такое низкий мышечный тонус, и что он означает для детей с низким мышечным тонусом.
Что такое мышечный тонус?
Мышечный тонус относится к величине лежащего в основе напряжения в мышце.Он описывает, насколько сильно напряжена мышца, когда она расслаблена. Уровень мышечного тонуса у человека зависит от двух факторов: количества импульсной активности мышечных волокон, а также жесткости соединительных тканей внутри и вокруг мышц.
Мышечный тонус можно описать как происходящий по спектру. У одних людей мышечный тонус ниже, у других мышечный тонус выше. Наличие мышечного тонуса на любом конце спектра не обязательно означает, что что-то не так, это просто отражение физиологического строения человека, как будто у всех нас разный метаболизм.
Мышечный тонус является одним из факторов, влияющих на нашу способность держать тело в вертикальном положении, контролировать движения и нашу выносливость при выполнении действий.
Что такое низкий мышечный тонус?
У детей низкий мышечный тонус используется для описания того, что у младенца или ребенка мышцы кажутся более вялыми или менее жесткими, чем это обычно ожидается от ребенка их возраста. Детям с низким мышечным тонусом часто нужно прилагать больше усилий, чтобы их мышцы двигались оптимально при выполнении упражнений, особенно в вертикальном положении.У детей с низким мышечным тонусом часто возникают трудности с движением и осанкой. Поскольку их мышцы менее напряжены, когда они начинают движение или деятельность, им часто приходится прикладывать больше усилий, чтобы их мышцы достаточно двигались при выполнении действий. Затруднения движения, обычно наблюдаемые у детей с низким мышечным тонусом, могут быть одним или несколькими из следующих:
- Позднее достижение основных моторных вех (например: сидение, ползание, стояние, ходьба) – но не всегда
- Поздно или с трудом достигаются двигательные навыки более высокого уровня, такие как прыжки, прыжки, подпрыгивание, подъем и спуск по лестнице, лазание и игра на оборудовании игровой площадки
- Неуклюжесть — они могут падать чаще, чем их сверстники, чаще травмироваться и испытывать трудности с владением мячом
- Плохая осанка – они могут сутулиться или сидеть в позе w-sit, когда сидят на полу, или они могут предпочитать лежать на полу, они могут сутулиться или опираться на одну руку, когда рисуют и пишут за столом, они могут стоять с выпяченный живот (после детского возраста, когда «пузатый живот» является нормальным явлением)
- Плоскостопие, может жаловаться на боль в стопе или ноге после ходьбы или физических упражнений.Они могут испытывать боль в коленях или ногах по ночам
- Плохая выносливость — они могут очень быстро устать, не любят ходить очень далеко, могут хотеть, чтобы их подняли и несли их родители больше, чем другие дети их возраста,
- Проблемы с почерком и рисованием – им трудно правильно держать карандаш, они могут нажимать слишком сильно или слишком легко, и их руки могут быстро утомляться (т. е. их почерк начинается аккуратно, но после нескольких строк он становится неряшливым, или они часто меняют хват карандаша, пытаясь справиться с усталостью)
- Проблемы со ртом и челюстью — это может включать в себя удерживание рта открытым и слюнотечение, особенно при концентрации внимания, трудности с переходом на жевательную пищу, а у некоторых детей проблемы с обучением говорить и ясностью речи
Мышечный тонус в зависимости от мышечной силы
Важно знать, что мышечный тонус отличается от мышечной силы.Мышечный тонус — это базовый уровень активности, который естественным образом проявляется в мышцах вашего ребенка. Однако мышечная сила — это способность мышц затем генерировать силу, особенно при сопротивлении.
Дети с низким мышечным тонусом, естественно, часто слабее. Их мышцы в покое менее эластичны, поэтому, когда приходит время двигаться, их мышцам приходится сокращаться сильнее, чтобы генерировать достаточную силу для движения.
Низкий мышечный тонус НЕЛЬЗЯ изменить. Но мышечная сила, двигательный контроль и физическая выносливость вашего ребенка МОГУТ измениться.
Что означает, если у моего ребенка был описан низкий мышечный тонус?
Для многих детей низкий мышечный тонус – это то, чем они устроены. У обоих моих детей низкий мышечный тонус. И низкий мышечный тонус может присутствовать в семьях — если у вас был низкий мышечный тонус в детстве или он сохраняется во взрослом возрасте, вполне возможно, что ваш ребенок унаследует ту же генетику, что и вы. Для этих детей низкий мышечный тонус просто означает, что они могут медленнее достигать своих основных вех в развитии крупной моторики, они могут быть не очень хороши в физической активности, и их, возможно, нужно поощрять к участию и отработке своих навыков крупной моторики.
У небольшого числа детей низкий мышечный тонус может быть частью основного генетического или неврологического заболевания. Для этих детей низкий мышечный тонус может быть патологическим, а это означает, что он оказывает значительное влияние на их способность функционировать. Кроме того, их низкий мышечный тонус, как правило, сопровождается другими признаками и симптомами, которые могут включать в себя специфические генетические особенности, трудности в обучении или другие медицинские признаки и симптомы, которые требуют или могут помочь в лечении.Важно, чтобы эти дети были осмотрены медицинским работником, чтобы попытаться поставить четкий диагноз основного заболевания и назначить соответствующее лечение.
Итак, у вашего ребенка низкий мышечный тонус. Что вы можете сделать, чтобы помочь?
Ниже приведены предложения по занятиям или стратегиям, которые родители могут попробовать дома, чтобы помочь ребенку с низким мышечным тонусом улучшить двигательные навыки и участие:
- Поощряйте вашего ребенка участвовать в различных физических упражнениях, которые задействуют все его тело, чтобы помочь ему развить общую силу.Мероприятия, которые помогут вашему ребенку развить силу, включают скалолазание, занятия на игровой площадке (например, лестницы и перекладины для обезьян), прогулки с животными (прогулка с медведем, прогулка с крабом, прыжки с лягушки), плавание, верховая езда, боевые искусства, гимнастика и танцы.
- Если ваш ребенок еще не ходит, поощряйте его быть как можно более активным на полу. Лучшее место для вашего ребенка с низким мышечным тонусом — на животе, так как это позволяет ему использовать все свое тело, чтобы научиться передвигаться по полу.
- «Разогрейте» мышцы перед выполнением действий, требующих точного контроля, сидения на месте или концентрации. Разогрев мышц помогает усилить активацию мышц вашего ребенка при подготовке к движению. Например, прыжки на батуте перед тем, как сесть за стол, могут помочь вашему ребенку сидеть прямее, а прогулка с животными или сжимание или разминание пластилина могут помочь вашему ребенку лучше или дольше держать карандаш.
- Дайте ребенку возможность делать перерывы в движении во время занятий сидя или если ему необходимо удерживать устойчивую позу.Это поможет вашему ребенку сделать небольшой перерыв и дать мышцам отдохнуть от этой позы.
- Используйте темп, чтобы помочь ребенку не «переусердствовать» и не устать и не заболеть. Темп включает в себя обеспечение того, чтобы ваш ребенок регулировал свой день периодами активности, а также периодами отдыха. Например, если у вашего ребенка активное и занятое утро, вы можете сделать так, чтобы он проводил некоторое время, занимаясь спокойными делами днем, чтобы он не испытывал боли в суставах ночью.
- Убедитесь, что ваш ребенок сидит в оптимальной позе во время занятий за столом. Оптимальное сидячее положение гарантирует, что ноги вашего ребенка полностью поддерживаются, его бедра и колени находятся под прямым углом, а высота стола находится на уровне локтей или чуть ниже.
- Некоторым детям будет полезно использовать наклонную доску, более толстые карандаши или мелки или специальные держатели для карандашей, которые помогут им дольше удерживать карандаш.
- Поддерживающие и понимающие родители и педагоги – дети с низким мышечным тонусом иногда могут считаться ленивыми, плаксивыми, суетливыми, плохо обращающими внимание из-за поведения и стратегий, которые они используют, чтобы справиться со своим низким мышечным тонусом и усталостью.Реальность, однако, такова, что эти дети не ленивы, они не манипулируют и не капризничают — они буквально просто физически не в состоянии выполнять действия так же хорошо, как их сверстники, или так же долго, как их сверстники. . В наших силах изменить деятельность или приспособить ее к потребностям ребенка.
Почему вы можете обратиться за помощью к специалисту в области здравоохранения при низком мышечном тонусе вашего ребенка?
Если низкий мышечный тонус вашего ребенка влияет на его способность делать то, что ему нужно делать в повседневной жизни, возможно, стоит обратиться за помощью к медицинскому работнику.Медицинский работник поможет вам и вашему ребенку определить стратегии, которые помогут им улучшить свои навыки и справиться с любой усталостью или трудностями, которые у них могут возникнуть.
Наши терапевты работают с детьми с пониженным мышечным тонусом практически каждый день. Если вы обеспокоены тем, что у вашего ребенка низкий мышечный тонус, который вызывает двигательные трудности, усталость или боль, позвоните нам, чтобы узнать, как мы можем помочь вашему ребенку.
У моего ребенка диагностирован низкий мышечный тонус.Что это значит?
Автор Пэм Версфельд Магистр (физиология) UCT, физиотерапевт Подробнее
Низкий мышечный тонус часто используется для объяснения трудностей, с которыми некоторые дети сталкиваются при выполнении повседневных задач, сидят прямо с легкостью и комфортом или имеют низкую выносливость, силу и умственную выносливость. В этой статье я предлагаю альтернативное объяснение этих трудностей.
У младенца или ребенка будет диагностирован низкий мышечный тонус, когда:
- Мышцы кажутся менее крепкими, чем обычно
- Ребенок кажется вялым и у него разболтались суставы
- Ребенок кажется менее бдительным, у него плохая осанка и внимание
Более подробное техническое обсуждение см. в разделе «Переосмысление низкого мышечного тонуса»
.► Может запоздать с достижением основных вех, но не всегда
► Может поздно научиться ходить
► Трудно сидеть прямо и работать за столом — склонен сидеть с округлой спиной, может опираться на одну руку при рисовании и письме
► Может иметь плоскостопие и жаловаться на боль в стопах при ходьбе
► С трудом сидит на месте, склонен ерзать, не выполняет школьные задания
► Есть трудности с письмом и рисованием
► Может очень быстро устать, не любит далеко ходить, с трудом поднимается по лестнице
► Может быть хорош в играх, включающих короткие рывки бега, но испытывает трудности с осанкой при сидении, рисовании и письме — эти задачи требуют постоянной активности постуральных мышц
► Садится между ног на полу (w-сидя), не любит сидеть со скрещенными ногами
► Похоже, плохо концентрирует внимание или концентрируется, легко сдается
► Не может висеть на перекладине, не любит лазить по джунглям, боится
► Жалобы на боли в ногах после физической нагрузки, боли в коленях по ночам.
► Имеют слабые мышцы кора и плохую стабильность кора
► Испытываете трудности с обучением игре с мячом
Низкий мышечный тонус не вызывает ни одной из этих моторных проблем
Первое, что нужно понять, это то, что низкий мышечный тонус – это не состояние и не диагноз . Существует ряд состояний, поражающих мозг и мышцы, симптомом которых является гипотония (низкий мышечный тонус). Ребенок кажется вялым, и есть другие признаки и симптомы, указывающие на то, что у ребенка есть неврологическое расстройство, включая значительную задержку развития, измененные рефлексы и когнитивные трудности.
Низкий мышечный тонус не является диагнозом
Важно понимать, что низкий мышечный тонус ни в коем случае нельзя использовать в качестве диагноза .
- Нет состояния здоровья, называемого низким мышечным тонусом.
- Не существует диагностических критериев для описания такого состояния.
- Низкий мышечный тонус не может быть измерен.
Нигде вы не найдете веской причины, по которой у вашего ребенка низкий мышечный тонус. Вы также не найдете описанного эффективного лечения.
Так почему же мой врач или терапевт сказал, что у моего ребенка низкий мышечный тонус?
Термин «низкий мышечный тонус» до сих пор широко используется врачами, физиотерапевтами и специалистами по трудотерапии. Это связано с тем, что в течение многих лет причина, по которой дети с не выявленными мышечными или неврологическими расстройствами, имеют проблемы с движением и осанкой, задержку развития и слабость, не была хорошо понята.
Однако сегодня хорошо задокументировано влияние гипермобильности суставов на мышцы, осанку и движение и даже на поведение.Мы также знаем, что тонус мышц обеспечивается гигантским мышечным белком, называемым тайтином.
Для получения более подробных и справочных аргументов о неправильном использовании диагноза низкого мышечного тонуса и важности тайтина см.: Переосмысление низкого мышечного тонуса
Помогите своему ребенку: начните сегодня
Если это не низкий мышечный тонус, что вызывает двигательные трудности у моего ребенка?
Большинство детей с низким тонусом обычно имеют одно или несколько из следующих довольно распространенных состояний: генерализованная гипермобильность суставов, нарушение координации развития, связанное с очень осторожным, пугливым характером.
Гипермобильность суставов — наиболее частая причина диагностики низкого мышечного тонуса Гипермобильность суставов, вероятно, является наиболее распространенным состоянием, которое вызывает трудности у детей с диагнозом низкий мышечный тонус.
Гипермобильность суставов просто означает, что структуры, удерживающие сустав вместе, более гибкие, чем обычно, и обеспечивают меньшую поддержку суставов.
Однако в большинстве случаев укрепление мышц не только обеспечивает дополнительную поддержку, необходимую суставам для хорошей осанки и движения, но также увеличивает внутреннюю жесткость мышц и соединительной ткани суставов.
Есть еще один очень важный аспект гипермобильности суставов. Несмотря на повышенную гибкость, у ребенка обычно напряжены мышцы. По этой причине у детей с генерализованной гипермобильностью суставов наблюдается скованность в мышцах бедра, в том числе скованность подколенных сухожилий и скованность в мышцах, пересекающих нижнюю часть спины по бокам бедер. эта теснота затрудняет сидение прямо. и неудобно.
Таким образом, для большинства детей с диагнозом низкий мышечный тонус лучшим подходом к улучшению осанки и двигательного контроля является программа упражнений для укрепления слабых мышц, с одной стороны, и растяжения напряженных мышц, с другой.Программа фитнес-тренировок особенно важна для малоподвижных детей, подверженных риску ожирения и низкой плотности костной ткани. Подробнее
Распознавание гипермобильности суставов
Локти и колени сгибаются назад.
У ребенка может быть впалая спина и плоскостопие, а также неправильная осанка.
Суставы запястья и пальцев сгибаются больше, чем обычно.
Нарушение координации развития (DCD) Есть группа детей, у которых есть трудности с координацией и обучением новым навыкам, что влияет на их функционирование и участие дома, в школе и на игровой площадке.
У детей с DCD есть трудности с контролем осанки, с задачами на равновесие и ловкость, а также с мелкой моторикой и почерком. Они также могут избегать участия в играх на игровой площадке и, как следствие, иметь плохой уровень физической подготовки.
Исследования показали, что наиболее эффективными подходами к улучшению координации у детей с DCD являются программы вмешательства, ориентированные на конкретные задачи, нацеленные на конкретные навыки. Подробнее
Очень осторожная/тревожная натура: очень чувствительный ребенок Дети с низким мышечным тонусом, гипермобильностью суставов и DCD часто имеют очень осторожный, а иногда и пугливый характер, что приводит к множеству эмоциональных и поведенческих трудностей, которые мешают повседневной и школьной деятельности.
Признание и понимание влияния страха и беспокойства на поведение позволяет родителям реализовывать стратегии, чтобы помочь своим детям преодолеть свои страхи и научиться преодолевать трудности. Подробнее
Низкий мышечный тонус не вызван нарушением сенсорной обработки
У детей, у которых диагностирован низкий мышечный тонус, также часто диагностируют нарушение сенсорной обработки. Однако нет веских научных аргументов, связывающих мышечный тонус с неупорядоченной сенсорной обработкой.Подробнее
Гипермобильные суставы и напряженные мышцы Иногда гипермобильность суставов упускают из виду, потому что у ребенка напряжены мышцы. Важно понимать, что напряженные мышцы являются общим признаком гипермобильности суставов , особенно в мышцах, пересекающих заднюю и боковые стороны бедер. Также важно понимать, что это мышечное напряжение может быть важной причиной некоторых трудностей, с которыми сталкиваются дети с «диагнозом» низкого мышечного тонуса.
Плохая осанка при сидении обычно вызвана сочетанием скованности, слабости и иногда плохой координации. Мой ребенок не может сидеть прямо и много ерзает в школе. Какова причина?
Как быть с младенцами, у которых диагностирован низкий мышечный тонус?
Младенцам, которые кажутся вялыми, имеют очень слабые суставы и медленно достигают своих основных вех вовремя, часто ставят диагноз «низкий мышечный тонус». Очень часто у таких младенцев сочетается преждевременное рождение, гипермобильность суставов, очень осторожный характер, а иногда и ранние симптомы аутизма.
Какова бы ни была основная причина затруднений движений вашего ребенка, раннее вмешательство важно. Раннее вмешательство помогает предотвратить долгосрочное влияние задержки развития на проблемы с вниманием и координацией, которые часто проявляются, когда ребенок идет в школу. Подробнее
Подробнее о мышечном тонусе
Термин мышечный тонус относится к двум аспектам структуры и функции мышц:
- Присущая мышце жесткость — ее сопротивление растяжению и твердость при пальпации (сдавливании).
- Готовность мышцы (или группы мышц) к действию — реакция мышцы на сигналы мозга и сенсорную обратную связь.
Термин низкий мышечный тонус используется, когда жесткость мышц меньше, чем обычно (т.е. низкая) и готовность к действию также низкая (мышцы реагируют медленно).
Термин «мышечный тонус» относится к двум аспектам структуры и функции мышц.
- Свойственная мышце жесткость — ее сопротивление растяжению и твердость при пальпации (сдавливании).
- Готовность мышц к действию — реакция мышц на сигналы мозга и сенсорную обратную связь
Термин «низкий мышечный тонус» используется, когда жесткость мышц меньше, чем обычно (т.е. она низкая), и готовность к действию также низкая (мышцы реагируют медленно).
Как проверяется упругость (тонус) мышц?
Клиницист может судить о твердости мышц и присущей им жесткости по:
- Сжатие мышцы для ощущения сопротивления сжатию
- Подъем и движение конечностей и ощущение сопротивления этому движению
Проблема с этими тестами в том, что они ненадежны и не дают никакой полезной информации.
От чего зависит упругость мышц?
Прочность мышцы определяется ее присущей жесткостью, а это, в свою очередь, зависит от жесткости соединительнотканных оболочек, покрывающих каждое мышечное волокно, скрепляющих пучки мышечных волокон и соединяющих мышцу с сухожилиями.
У детей с гипермобильными суставами соединительная ткань менее жесткая, чем обычно. (У него больше упругости и он легче растягивается).
Эта склонность к менее жесткой соединительной ткани, что приводит к гипермобильности (слабости) мышц и суставов, определяется генетически.Около 10-15% людей гипермобильны.
Другой очень важной структурой, определяющей упругость мышц и сопротивление растяжению, является гигантская молекула титин.
Титин – это очень большая эластичная молекула, обнаруженная в мышечной клетке. Размер и сила молекул тайтина определяются объемом работы, которую мышца вынуждена выполнять на регулярной основе. Сильные мышцы имеют более крупные и жесткие молекулы титина, и это делает мышцы более упругими и жесткими.Мышца имеет лучший тонус.
Вообще говоря, сильные мышцы более упругие и имеют лучший тонус. Это распространенное заблуждение, что у вас могут быть сильные мышцы, но при этом «низкий тонус». Укрепление мышцы делает ее более упругой и изменяет форму титина, входящего в состав мышечного волокна, обеспечивающего напряжение и сокращение мышцы.
Сильные мышцы всегда имеют хороший «тонус»
Существует распространенное заблуждение, что мышца может быть сильной и иметь низкий тонус. Это неверно . Укрепление мышцы повышает ее сопротивляемость растяжению и готовность к действию. Эластичный мышечный белок тайтин увеличивается в размерах при тренировке, что делает мышцу менее устойчивой к удлинению (растяжению) и увеличивает ее жесткость. Тренировка также увеличивает силу компонентов соединительной ткани мышц, а также силу и жесткость сухожилий.
Мышечный тонус, бдительность и готовность к действию
Термин «мышечный тонус» также используется для описания готовности мышц к действию . Задается настороженностью ребенка, общим уровнем возбуждения и готовности к действию.
Мозг настраивает мышцы на действие, посылая сигналы сенсорным рецепторам мышц. В результате сенсорные рецепторы становятся более бдительными, обеспечивают более эффективную сенсорную обратную связь и реагируют быстрее. Это позволяет быстро корректировать положение, необходимое для поддержания баланса и постуральной устойчивости.
SfA Руководство по обучению фитнесу и координации
Вся информация, необходимая вам для того, чтобы стать тренером и адвокатом вашего ребенка
20 долл. США за 12-месячную подпискуПодпишитесь здесь
Отказ от ответственности Контент на этом сайте предоставляется только в целях общей информации и не является профессиональным советом.Всякая ответственность исключается в максимальной степени, разрешенной законом, в отношении любых убытков или ущерба, прямых, косвенных или косвенных, которые возникают в связи с использованием или доверием к любому контенту, составляющему часть этого сайта.

 Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17].
Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17]. Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями.
Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями. Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.
Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.
 В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности.
В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности. , измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30].
, измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30]. Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST.
Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST. Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.
Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.
 Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается.
Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается. Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].
Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].

 Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53].
Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53]. Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].
Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61]. При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66].
При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66]. Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62].
Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62]. По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип.
По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип. ) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73].
) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73]. Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции.
Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции. SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79].
SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79]. В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию.
В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию. При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87].
При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87]. Нарушение реципрокного торможения приводит к совместному сокращению противоположных мышц, что обычно наблюдается при дистонии. Предполагается, что нарушения спинномозговых рефлексов при дистонии связаны с дисфункциональными нисходящими входами от высших центров [88].
Нарушение реципрокного торможения приводит к совместному сокращению противоположных мышц, что обычно наблюдается при дистонии. Предполагается, что нарушения спинномозговых рефлексов при дистонии связаны с дисфункциональными нисходящими входами от высших центров [88]. Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92].
Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92]. Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR.
Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR. Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии.
Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии. Этот феномен чрезмерной выраженности реакций пластичности и неспецифической топографии распространения (аномальное распространение) также был продемонстрирован в экспериментах на людях и представляет собой важный механизм, лежащий в основе дистонии [99]. Важность долговременной потенциации (ДП) и долговременной депрессии (ДД) в пластичности коры широко признана, и считается, что они изменяют рецептивные сенсорные поля и двигательные представления в мозге. Эксперименты с ТМС с использованием парной ассоциативной стимуляции (ПАС), где низкочастотная стимуляция срединного нерва и ТМС сочетаются, исследуют синаптические изменения в моторной коре [100].В исследовании «случай-контроль» у пациентов с писчими спазмами PAS выполняли на доминантном полушарии с электрической стимуляцией срединного или локтевого нерва в сочетании с ТМС, доставляемой в контралатеральную кору через 21,5 мс или 10 мс после стимуляции периферического нерва. Двигательную реакцию измеряли по мышцам, отводящим большой палец (APB) и мышце, приводящей минимальную мизинец (ADM).
Этот феномен чрезмерной выраженности реакций пластичности и неспецифической топографии распространения (аномальное распространение) также был продемонстрирован в экспериментах на людях и представляет собой важный механизм, лежащий в основе дистонии [99]. Важность долговременной потенциации (ДП) и долговременной депрессии (ДД) в пластичности коры широко признана, и считается, что они изменяют рецептивные сенсорные поля и двигательные представления в мозге. Эксперименты с ТМС с использованием парной ассоциативной стимуляции (ПАС), где низкочастотная стимуляция срединного нерва и ТМС сочетаются, исследуют синаптические изменения в моторной коре [100].В исследовании «случай-контроль» у пациентов с писчими спазмами PAS выполняли на доминантном полушарии с электрической стимуляцией срединного или локтевого нерва в сочетании с ТМС, доставляемой в контралатеральную кору через 21,5 мс или 10 мс после стимуляции периферического нерва. Двигательную реакцию измеряли по мышцам, отводящим большой палец (APB) и мышце, приводящей минимальную мизинец (ADM). У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности.
У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности. Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103].
Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103]. Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106].
Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106]. Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть.
Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть. Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии.
Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии. Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии.
Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии. Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].
Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115]. Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114].
Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114].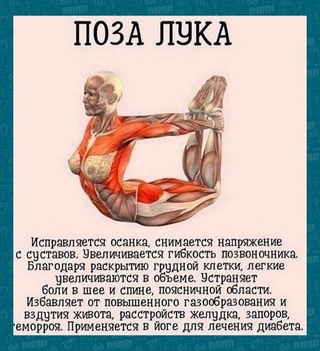 Однако электромиографическая оценка больных с паратонией не выявила совместного сокращения противостоящей группы мышц при паратонии. Дрент и др. предложил еще одно периферическое биохимическое изменение, которое может способствовать повышению резистентности тканей у пациентов с деменцией и паратонией.Было обнаружено, что конечные продукты повышенного гликирования (AGE), измеренные с помощью аутофлуоресценции кожи, значительно повышены у пациентов с паратонией и имеют прямую связь с тяжестью паратонии. КПГ увеличивают жесткость тканей за счет образования поперечных связей в мышечном коллагене, нарушают функцию скелетных мышц и могут играть роль в патогенезе паратонии [118]. Основные патофизиологические механизмы, ответственные за спастичность, ригидность, дистонию и паратонию, выделены в .
Однако электромиографическая оценка больных с паратонией не выявила совместного сокращения противостоящей группы мышц при паратонии. Дрент и др. предложил еще одно периферическое биохимическое изменение, которое может способствовать повышению резистентности тканей у пациентов с деменцией и паратонией.Было обнаружено, что конечные продукты повышенного гликирования (AGE), измеренные с помощью аутофлуоресценции кожи, значительно повышены у пациентов с паратонией и имеют прямую связь с тяжестью паратонии. КПГ увеличивают жесткость тканей за счет образования поперечных связей в мышечном коллагене, нарушают функцию скелетных мышц и могут играть роль в патогенезе паратонии [118]. Основные патофизиологические механизмы, ответственные за спастичность, ригидность, дистонию и паратонию, выделены в . Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.
Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.
 С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В.
С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В. Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0.
Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0. [PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С.
[PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С. , Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г.
, Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г. М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом.
М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом. Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)
Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79) Спастическое двигательное расстройство: следует ли нам забыть гипервозбудимые рефлексы растяжения и начать говорить о неадекватном прогнозировании сенсорных последствий движения? Эксп. Мозг Res. 2020; 238:1627–1636. doi: 10.1007/s00221-020-05792-0. [PubMed] [CrossRef] [Google Scholar] 34. Дитц В., Синкьяер Т. Спастическое двигательное расстройство: нарушение рефлекторной функции и измененная мышечная механика.Ланцет Нейрол. 2007; 6: 725–733. doi: 10.1016/S1474-4422(07)70193-X. [PubMed] [CrossRef] [Google Scholar] 36. Шадмер Р., Смит М.А., Кракауэр Дж.В. Исправление ошибок, сенсорное предсказание и адаптация в управлении двигателем. Анну. Преподобный Нейроски. 2010; 33:89–108. doi: 10.1146/annurev-neuro-060909-153135. [PubMed] [CrossRef] [Google Scholar] 37. ДеЛука Г.К., Эберс Г.К., Эсири М.М. Степень потери аксонов в длинных путях при наследственной спастической параплегии. невропатол. заявл. Нейробиол. 2004; 30: 576–584. дои: 10.1111/j.1365-2990.2004.00587.x. [PubMed] [CrossRef] [Google Scholar] 38.
Спастическое двигательное расстройство: следует ли нам забыть гипервозбудимые рефлексы растяжения и начать говорить о неадекватном прогнозировании сенсорных последствий движения? Эксп. Мозг Res. 2020; 238:1627–1636. doi: 10.1007/s00221-020-05792-0. [PubMed] [CrossRef] [Google Scholar] 34. Дитц В., Синкьяер Т. Спастическое двигательное расстройство: нарушение рефлекторной функции и измененная мышечная механика.Ланцет Нейрол. 2007; 6: 725–733. doi: 10.1016/S1474-4422(07)70193-X. [PubMed] [CrossRef] [Google Scholar] 36. Шадмер Р., Смит М.А., Кракауэр Дж.В. Исправление ошибок, сенсорное предсказание и адаптация в управлении двигателем. Анну. Преподобный Нейроски. 2010; 33:89–108. doi: 10.1146/annurev-neuro-060909-153135. [PubMed] [CrossRef] [Google Scholar] 37. ДеЛука Г.К., Эберс Г.К., Эсири М.М. Степень потери аксонов в длинных путях при наследственной спастической параплегии. невропатол. заявл. Нейробиол. 2004; 30: 576–584. дои: 10.1111/j.1365-2990.2004.00587.x. [PubMed] [CrossRef] [Google Scholar] 38. Groep K.L.D.G.-V.D., De Vlugt E., De Groot J.H., Van Der Heijden-Maessen H.C., Wielheesen D.H., Van Wijlen-Hempel R.S., Arendzen J.H., Meskers C.G. Дифференциация между не-нейральными и нервными факторами тугоподвижности голеностопного сустава при церебральном параличе. Дж. Нейроэнг. Реабилит. 2013; 10:1–8. дои: 10.1186/1743-0003-10-81. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Сюй Д., У Ю., Гэблер-Спира Д., Гао Ф., Клегг Н.Дж., Дельгадо М.Р., Чжан Л. Нервные и не-невральные факторы спастичности голеностопного сустава у детей с церебральным параличом. Дев. Мед. Детский Нейрол. 2020;62:1040–1046. doi: 10.1111/dmcn.14506. [PubMed] [CrossRef] [Google Scholar]40. Берк Д., Гиллис Дж.Д., Лэнс Дж.В. Рефлекс растяжения четырехглавой мышцы при спастичности человека. Дж. Нейрол. Нейрохирург. Психиатрия. 1970; 33: 216–223. doi: 10.1136/jnnp.33.2.216. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]41. Tardieu G., Tardieu C., Colbeau-Justin P., Bret MD. Влияние длины мышц на повышенный рефлекс растяжения у детей с церебральным параличом.
Groep K.L.D.G.-V.D., De Vlugt E., De Groot J.H., Van Der Heijden-Maessen H.C., Wielheesen D.H., Van Wijlen-Hempel R.S., Arendzen J.H., Meskers C.G. Дифференциация между не-нейральными и нервными факторами тугоподвижности голеностопного сустава при церебральном параличе. Дж. Нейроэнг. Реабилит. 2013; 10:1–8. дои: 10.1186/1743-0003-10-81. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Сюй Д., У Ю., Гэблер-Спира Д., Гао Ф., Клегг Н.Дж., Дельгадо М.Р., Чжан Л. Нервные и не-невральные факторы спастичности голеностопного сустава у детей с церебральным параличом. Дев. Мед. Детский Нейрол. 2020;62:1040–1046. doi: 10.1111/dmcn.14506. [PubMed] [CrossRef] [Google Scholar]40. Берк Д., Гиллис Дж.Д., Лэнс Дж.В. Рефлекс растяжения четырехглавой мышцы при спастичности человека. Дж. Нейрол. Нейрохирург. Психиатрия. 1970; 33: 216–223. doi: 10.1136/jnnp.33.2.216. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]41. Tardieu G., Tardieu C., Colbeau-Justin P., Bret MD. Влияние длины мышц на повышенный рефлекс растяжения у детей с церебральным параличом.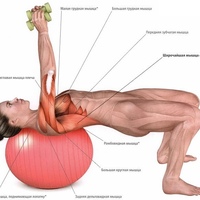 Дж. Нейрол. Нейрохирург. Психиатрия. 1982; 45: 348–352. doi: 10.1136/jnnp.45.4.348. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]42. Кампер Д.Г., Шмит Б.Д., Раймер В.З. Влияние мышечной биомеханики на количественную оценку спастичности. Анна. Биомед. англ. 2001; 29:1122–1134. дои: 10.1114/1.1424918. [PubMed] [CrossRef] [Google Scholar]43. Раймер В.З., Хоук Дж.К., Краго П.Е. Механизмы складного ножевого рефлекса изучены на животной модели. Эксп. Мозг Res. 1979; 37: 93–113. doi: 10.1007/BF01474257. [PubMed] [CrossRef] [Google Scholar]45.Гильоне П., Мутани Р., Чио А. Жесткость зубчатого колеса. Арка Нейрол. 2005; 62: 828–830. doi: 10.1001/archneur.62.5.828. [PubMed] [CrossRef] [Google Scholar]46. Финдли Л.Дж., Грести М.А., Халмаги Г.М. Тремор, феномен зубчатого колеса и клонус при болезни Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1981; 44: 534–546. doi: 10.1136/jnnp.44.6.534. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Фан С., Янкович Х.М. Принципы и практика двигательных расстройств.
Дж. Нейрол. Нейрохирург. Психиатрия. 1982; 45: 348–352. doi: 10.1136/jnnp.45.4.348. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]42. Кампер Д.Г., Шмит Б.Д., Раймер В.З. Влияние мышечной биомеханики на количественную оценку спастичности. Анна. Биомед. англ. 2001; 29:1122–1134. дои: 10.1114/1.1424918. [PubMed] [CrossRef] [Google Scholar]43. Раймер В.З., Хоук Дж.К., Краго П.Е. Механизмы складного ножевого рефлекса изучены на животной модели. Эксп. Мозг Res. 1979; 37: 93–113. doi: 10.1007/BF01474257. [PubMed] [CrossRef] [Google Scholar]45.Гильоне П., Мутани Р., Чио А. Жесткость зубчатого колеса. Арка Нейрол. 2005; 62: 828–830. doi: 10.1001/archneur.62.5.828. [PubMed] [CrossRef] [Google Scholar]46. Финдли Л.Дж., Грести М.А., Халмаги Г.М. Тремор, феномен зубчатого колеса и клонус при болезни Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1981; 44: 534–546. doi: 10.1136/jnnp.44.6.534. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Фан С., Янкович Х.М. Принципы и практика двигательных расстройств. Эльзевир; Амстердам, Нидерланды: 2011.Паркинсонизм: клиника и дифференциальная диагностика; стр. 66–92. [Google Академия] 49. Дональдсон И., Марсден К.Д., Шайндер Б.К. Книга Марсдена о двигательных расстройствах. Издательство Оксфордского университета; Оксфорд, Великобритания: 2012 г. Болезнь Паркинсона; стр. 159–370. [Google Академия]50. Bhidayasiri R., Sringean J., Reich S.G., Colosimo C. Фенотипирование настораживающих факторов: систематический обзор клинических признаков атипичных паркинсонических расстройств. Парк. Относ. Беспорядок. 2019;59:82–92. doi: 10.1016/j.parkreldis.2018.10.009. [PubMed] [CrossRef] [Google Scholar]51.Фёрстер О. Цур анализирует и патофизиологически дер striären bewegungsstörungen. Z. Gesamte Neurol. психиатр. 1921; 73: 1–169. doi: 10.1007/BF02895293. [CrossRef] [Google Scholar]52. Берк Д., Хагбарт К.Э., Валлин Б.Г. Рефлекторные механизмы при паркинсонической ригидности. Сканд. Дж. Реабилит. Мед. 1977; 9: 15–23. [PubMed] [Google Scholar]53. Ротвелл Дж. К., Обесо Дж.
Эльзевир; Амстердам, Нидерланды: 2011.Паркинсонизм: клиника и дифференциальная диагностика; стр. 66–92. [Google Академия] 49. Дональдсон И., Марсден К.Д., Шайндер Б.К. Книга Марсдена о двигательных расстройствах. Издательство Оксфордского университета; Оксфорд, Великобритания: 2012 г. Болезнь Паркинсона; стр. 159–370. [Google Академия]50. Bhidayasiri R., Sringean J., Reich S.G., Colosimo C. Фенотипирование настораживающих факторов: систематический обзор клинических признаков атипичных паркинсонических расстройств. Парк. Относ. Беспорядок. 2019;59:82–92. doi: 10.1016/j.parkreldis.2018.10.009. [PubMed] [CrossRef] [Google Scholar]51.Фёрстер О. Цур анализирует и патофизиологически дер striären bewegungsstörungen. Z. Gesamte Neurol. психиатр. 1921; 73: 1–169. doi: 10.1007/BF02895293. [CrossRef] [Google Scholar]52. Берк Д., Хагбарт К.Э., Валлин Б.Г. Рефлекторные механизмы при паркинсонической ригидности. Сканд. Дж. Реабилит. Мед. 1977; 9: 15–23. [PubMed] [Google Scholar]53. Ротвелл Дж. К., Обесо Дж. А., Трауб М. М., Марсден К. Д. Поведение долголатентного рефлекса растяжения у пациентов с болезнью Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1983; 46: 35–44.doi: 10.1136/jnnp.46.1.35. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]54. Берги М., Лопиано Л., Палья Г., Кватроколо Г., Скарцелла Л., Бергамаско Б. Рефлекс растяжения четырехглавой мышцы бедра и его связь с ригидностью при болезни Паркинсона. Акта Нейрол. Сканд. 1992; 86: 226–229. doi: 10.1111/j.1600-0404.1992.tb05075.x. [PubMed] [CrossRef] [Google Scholar]55. Дитрихсон П. Тонический лодыжечный рефлекс при паркинсоновской ригидности и спастичности. Акта Нейрол. Сканд. 1971; 47: 163–182. doi: 10.1111/j.1600-0404.1971.tb07474.х. [PubMed] [CrossRef] [Google Scholar]56. Берк Д., Эндрюс С.Дж., Лэнс Дж.В. Тонический вибрационный рефлекс при спастичности, болезни Паркинсона и в норме. Дж. Нейрол. Нейрохирург. Психиатрия. 1972; 35: 477–486. doi: 10.1136/jnnp.35.4.477. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]57.
А., Трауб М. М., Марсден К. Д. Поведение долголатентного рефлекса растяжения у пациентов с болезнью Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1983; 46: 35–44.doi: 10.1136/jnnp.46.1.35. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]54. Берги М., Лопиано Л., Палья Г., Кватроколо Г., Скарцелла Л., Бергамаско Б. Рефлекс растяжения четырехглавой мышцы бедра и его связь с ригидностью при болезни Паркинсона. Акта Нейрол. Сканд. 1992; 86: 226–229. doi: 10.1111/j.1600-0404.1992.tb05075.x. [PubMed] [CrossRef] [Google Scholar]55. Дитрихсон П. Тонический лодыжечный рефлекс при паркинсоновской ригидности и спастичности. Акта Нейрол. Сканд. 1971; 47: 163–182. doi: 10.1111/j.1600-0404.1971.tb07474.х. [PubMed] [CrossRef] [Google Scholar]56. Берк Д., Эндрюс С.Дж., Лэнс Дж.В. Тонический вибрационный рефлекс при спастичности, болезни Паркинсона и в норме. Дж. Нейрол. Нейрохирург. Психиатрия. 1972; 35: 477–486. doi: 10.1136/jnnp.35.4.477. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]57. Берарделли А., Сабра А.Ф., Халлетт М. Физиологические механизмы ригидности при болезни Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1983; 46: 45–53. doi: 10.1136/jnnp.46.1.45. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58.Шеррингтон К. С. О пластическом тонусе и проприоцептивных рефлексах. QJ Exp. Физиол. 1909; 2: 109–156. doi: 10.1113/expphysiol.1909.sp000032. [CrossRef] [Google Scholar] 59. Делвейд П.Дж., Пепин Дж.Л., Де Нордхаут А.М. Коротколатентное аутогенное торможение у пациентов с паркинсонической ригидностью. Анна. Нейрол. 1991; 30:83–89. doi: 10.1002/ana.410300115. [PubMed] [CrossRef] [Google Scholar] 60. Ся Р. Этиология и патофизиология болезни Паркинсона. ИнТех; Вена, Австрия: 2011. Физиологический и биомеханический анализ ригидности при болезни Паркинсона.[Перекрестная ссылка] [Академия Google] 61. Ся Р., Пауэлл Д., Раймер В.З., Хэнсон Н., Фанг Х., Трелкельд А.Дж. Дифференциация вклада реакции укорочения и торможения, вызванного растяжением, в ригидность при болезни Паркинсона.
Берарделли А., Сабра А.Ф., Халлетт М. Физиологические механизмы ригидности при болезни Паркинсона. Дж. Нейрол. Нейрохирург. Психиатрия. 1983; 46: 45–53. doi: 10.1136/jnnp.46.1.45. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58.Шеррингтон К. С. О пластическом тонусе и проприоцептивных рефлексах. QJ Exp. Физиол. 1909; 2: 109–156. doi: 10.1113/expphysiol.1909.sp000032. [CrossRef] [Google Scholar] 59. Делвейд П.Дж., Пепин Дж.Л., Де Нордхаут А.М. Коротколатентное аутогенное торможение у пациентов с паркинсонической ригидностью. Анна. Нейрол. 1991; 30:83–89. doi: 10.1002/ana.410300115. [PubMed] [CrossRef] [Google Scholar] 60. Ся Р. Этиология и патофизиология болезни Паркинсона. ИнТех; Вена, Австрия: 2011. Физиологический и биомеханический анализ ригидности при болезни Паркинсона.[Перекрестная ссылка] [Академия Google] 61. Ся Р., Пауэлл Д., Раймер В.З., Хэнсон Н., Фанг Х., Трелкельд А.Дж. Дифференциация вклада реакции укорочения и торможения, вызванного растяжением, в ригидность при болезни Паркинсона. Эксп. Мозг Res. 2011; 209: 609–618. doi: 10.1007/s00221-011-2594-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]62. Линн-Эванс М.Э., Петруччи М.Н., Хаффмастер С.Л.А., Чанг Дж.В., Туите П.Дж., Хауэлл М.Дж., Виденович А., Маккиннон К.Д. Быстрый сон без атонии связан с повышенной ригидностью у пациентов с болезнью Паркинсона легкой и средней степени тяжести.клин. Нейрофизиол. 2020;131:2008–2016. doi: 10.1016/j.clinph.2020.04.017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]63. Boeve B.F., Silber M.H., Saper C.B., Ferman T.J., Dickson D.W., Parisi J.E., Benarroch E.E., Ahlskog J.E., Smith G.E., Caselli R.C., et al. Патофизиология расстройства поведения во время быстрого сна и связь с нейродегенеративным заболеванием. Мозг. 2007; 130: 2770–2788. doi: 10.1093/brain/awm056. [PubMed] [CrossRef] [Google Scholar]64. Браак Х., Бол Дж.Р., Мюллер С.М., Рюб У., Де Вос Р.А., Дель Тредичи К. Стэнли Фан, лекция 2005 г.: Пересмотр процедуры стадирования патологии телец включения, связанной со спорадической болезнью Паркинсона.
Эксп. Мозг Res. 2011; 209: 609–618. doi: 10.1007/s00221-011-2594-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]62. Линн-Эванс М.Э., Петруччи М.Н., Хаффмастер С.Л.А., Чанг Дж.В., Туите П.Дж., Хауэлл М.Дж., Виденович А., Маккиннон К.Д. Быстрый сон без атонии связан с повышенной ригидностью у пациентов с болезнью Паркинсона легкой и средней степени тяжести.клин. Нейрофизиол. 2020;131:2008–2016. doi: 10.1016/j.clinph.2020.04.017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]63. Boeve B.F., Silber M.H., Saper C.B., Ferman T.J., Dickson D.W., Parisi J.E., Benarroch E.E., Ahlskog J.E., Smith G.E., Caselli R.C., et al. Патофизиология расстройства поведения во время быстрого сна и связь с нейродегенеративным заболеванием. Мозг. 2007; 130: 2770–2788. doi: 10.1093/brain/awm056. [PubMed] [CrossRef] [Google Scholar]64. Браак Х., Бол Дж.Р., Мюллер С.М., Рюб У., Де Вос Р.А., Дель Тредичи К. Стэнли Фан, лекция 2005 г.: Пересмотр процедуры стадирования патологии телец включения, связанной со спорадической болезнью Паркинсона.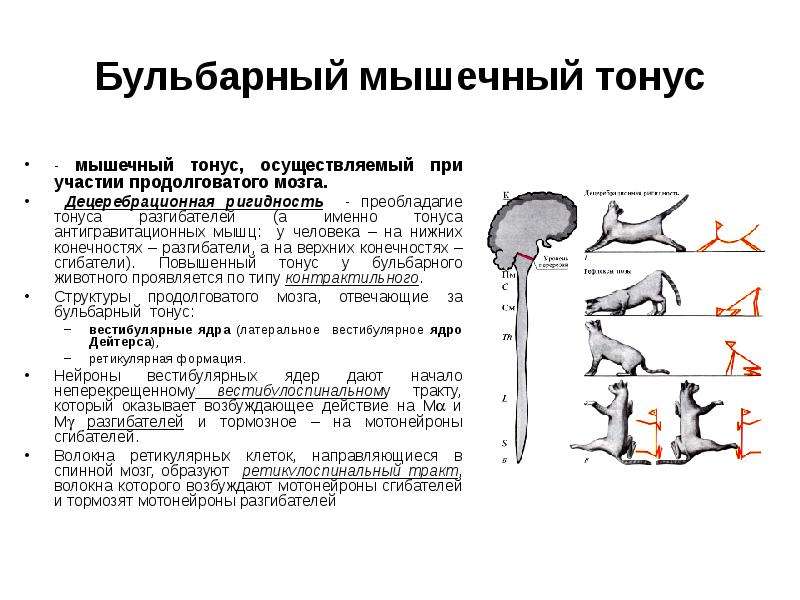 Мов. Беспорядок. 2006;21:2042–2051. doi: 10.1002/mds.21065. [PubMed] [CrossRef] [Google Scholar] 65. Делвейд П. Дж. Паркинсоновская ригидность. Функц. Нейрол. 2001; 16: 147–156. [PubMed] [Google Scholar]66. Хекман К., Моттрам К., Куинлан К., Тайсс Р., Шустер Дж. Возбудимость мотонейронов: важность нейромодуляторных воздействий. клин. Нейрофизиол.2009;120:2040–2054. doi: 10.1016/j.clinph.2009.08.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]67. Уоттс Р.Л., Вигнер А.В., Янг Р.Р. Эластические свойства мышц, измеренные в локтевом суставе у человека: II. Пациенты с паркинсонической ригидностью. Дж. Нейрол. Нейрохирург. Психиатрия. 1986; 49: 1177–1181. doi: 10.1136/jnnp.49.10.1177. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]68. Ся Р., Радович М., Трелкельд А.Дж., Мао З.-Х. Системный подход к идентификации и моделированию ригидности при болезни Паркинсона: нейронные и ненейронные вклады; Материалы 4-й Международной конференции по биоинформатике и биомедицинской инженерии 2010 г .
Мов. Беспорядок. 2006;21:2042–2051. doi: 10.1002/mds.21065. [PubMed] [CrossRef] [Google Scholar] 65. Делвейд П. Дж. Паркинсоновская ригидность. Функц. Нейрол. 2001; 16: 147–156. [PubMed] [Google Scholar]66. Хекман К., Моттрам К., Куинлан К., Тайсс Р., Шустер Дж. Возбудимость мотонейронов: важность нейромодуляторных воздействий. клин. Нейрофизиол.2009;120:2040–2054. doi: 10.1016/j.clinph.2009.08.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]67. Уоттс Р.Л., Вигнер А.В., Янг Р.Р. Эластические свойства мышц, измеренные в локтевом суставе у человека: II. Пациенты с паркинсонической ригидностью. Дж. Нейрол. Нейрохирург. Психиатрия. 1986; 49: 1177–1181. doi: 10.1136/jnnp.49.10.1177. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]68. Ся Р., Радович М., Трелкельд А.Дж., Мао З.-Х. Системный подход к идентификации и моделированию ригидности при болезни Паркинсона: нейронные и ненейронные вклады; Материалы 4-й Международной конференции по биоинформатике и биомедицинской инженерии 2010 г . ; Чэнду, Китай.18–20 июня 2010 г.; стр. 1–4. [Google Академия] 69. Эбарадаран Н., Этан С.Н., Элиу А., Эашури А., Палмер С.Дж., Эванг З.Дж., Оиши М.М.К., Маккеун М.Дж. Ригидность при болезни Паркинсона: связь с мозговой связью и двигательной активностью. Передний. Нейрол. 2013;4:67. doi: 10.3389/fneur.2013.00067. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Канн С.Дж., Чанг К., Манза П., Леунг Х.-К. Акинетические ригидные симптомы связаны со снижением корковой двигательной сети при болезни Паркинсона. Парк НПЖ.Дис. 2020;6:1–8. doi: 10.1038/s41531-020-00120-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]71. Карсон Р., Риек С., Макки Д.К., Мейхенбаум Д.П., Уиллмс К., Форнер М., Библоу В.Д. Изменения возбудимости корково-спинномозговых проекций предплечья человека и спинномозговых рефлекторных путей во время ритмичных произвольных движений противоположной конечности. Дж. Физиол. 2004; 560:929–940. doi: 10.1113/jphysiol.2004.069088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]72.
; Чэнду, Китай.18–20 июня 2010 г.; стр. 1–4. [Google Академия] 69. Эбарадаран Н., Этан С.Н., Элиу А., Эашури А., Палмер С.Дж., Эванг З.Дж., Оиши М.М.К., Маккеун М.Дж. Ригидность при болезни Паркинсона: связь с мозговой связью и двигательной активностью. Передний. Нейрол. 2013;4:67. doi: 10.3389/fneur.2013.00067. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Канн С.Дж., Чанг К., Манза П., Леунг Х.-К. Акинетические ригидные симптомы связаны со снижением корковой двигательной сети при болезни Паркинсона. Парк НПЖ.Дис. 2020;6:1–8. doi: 10.1038/s41531-020-00120-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]71. Карсон Р., Риек С., Макки Д.К., Мейхенбаум Д.П., Уиллмс К., Форнер М., Библоу В.Д. Изменения возбудимости корково-спинномозговых проекций предплечья человека и спинномозговых рефлекторных путей во время ритмичных произвольных движений противоположной конечности. Дж. Физиол. 2004; 560:929–940. doi: 10.1113/jphysiol.2004.069088. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]72. Хортобадьи Т., Тейлор Дж.Л., Петерсен Н.Т., Рассел Г., Гандевиа С.К. Изменения в сегментарной и моторной корковой активности при контралатеральных сокращениях мышц и измененных сенсорных входах у людей. Дж. Нейрофизиол. 2003;90:2451–2459. doi: 10.1152/jn.01001.2002. [PubMed] [CrossRef] [Google Scholar]73. Пауэлл Д., Хэнсон Н., Трелкелд А.Дж., Фанг Х., Ся Р. Усиление паркинсонической ригидности с активацией контралатеральной руки. клин. Нейрофизиол. 2011; 122:1595–1601. doi: 10.1016/j.clinph.2011.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]75.Рибо Б., Аупи Дж., Видайле М., Мазер Дж., Пизани А., Безар Э., Гуэль Д., Бурбо П. Дистония и дофамин: от феноменологии к патофизиологии. прог. Нейробиол. 2019;182:101678. doi: 10.1016/j.pneurobio.2019.101678. [PubMed] [CrossRef] [Google Scholar]76. Каджи Р., Бхатия К., Грейбиел А.М. Патогенез дистонии: мозжечкового или базального происхождения? Дж. Нейрол. Нейрохирург. Психиатрия. 2017; 89: 488–492. doi: 10.1136/jnnp-2017-316250.
Хортобадьи Т., Тейлор Дж.Л., Петерсен Н.Т., Рассел Г., Гандевиа С.К. Изменения в сегментарной и моторной корковой активности при контралатеральных сокращениях мышц и измененных сенсорных входах у людей. Дж. Нейрофизиол. 2003;90:2451–2459. doi: 10.1152/jn.01001.2002. [PubMed] [CrossRef] [Google Scholar]73. Пауэлл Д., Хэнсон Н., Трелкелд А.Дж., Фанг Х., Ся Р. Усиление паркинсонической ригидности с активацией контралатеральной руки. клин. Нейрофизиол. 2011; 122:1595–1601. doi: 10.1016/j.clinph.2011.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]75.Рибо Б., Аупи Дж., Видайле М., Мазер Дж., Пизани А., Безар Э., Гуэль Д., Бурбо П. Дистония и дофамин: от феноменологии к патофизиологии. прог. Нейробиол. 2019;182:101678. doi: 10.1016/j.pneurobio.2019.101678. [PubMed] [CrossRef] [Google Scholar]76. Каджи Р., Бхатия К., Грейбиел А.М. Патогенез дистонии: мозжечкового или базального происхождения? Дж. Нейрол. Нейрохирург. Психиатрия. 2017; 89: 488–492. doi: 10.1136/jnnp-2017-316250. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]77.Драгански Б., Тун-Хохенштейн С., Богдан У., Винклер Дж., Мэй А. Изменения серого вещества «моторного контура» при идиопатической цервикальной дистонии. Неврология. 2003;61:1228–1231. doi: 10.1212/01.WNL.0000094240.93745.83. [PubMed] [CrossRef] [Google Scholar]78. Бауэр А., Ханакава Т., Ву Т., Кансаку К., Халлетт М. Изменения анатомии головного мозга при фокальной дистонии рук. Анна. Нейрол. 2004; 55: 736–739. doi: 10.1002/ana.20113. [PubMed] [CrossRef] [Google Scholar]79. Дельмер К., Видайхет М., Эльбаз А., Бурден Ф., Блетон Дж.P., Sangla S., Meunier S., Terrier A., Lehericy S. Структурные нарушения в мозжечке и сенсомоторной цепи при писчем спазме. Неврология. 2007; 69: 376–380. doi: 10.1212/01.wnl.0000266591.49624.1a. [PubMed] [CrossRef] [Google Scholar]80. Фазано А., Морганте Ф. Дистония: Руководство для клинициста по диагностике, патофизиологии и лечению. Медицина будущего ООО; Лондон, Великобритания: 2014. [Google Scholar]81.
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]77.Драгански Б., Тун-Хохенштейн С., Богдан У., Винклер Дж., Мэй А. Изменения серого вещества «моторного контура» при идиопатической цервикальной дистонии. Неврология. 2003;61:1228–1231. doi: 10.1212/01.WNL.0000094240.93745.83. [PubMed] [CrossRef] [Google Scholar]78. Бауэр А., Ханакава Т., Ву Т., Кансаку К., Халлетт М. Изменения анатомии головного мозга при фокальной дистонии рук. Анна. Нейрол. 2004; 55: 736–739. doi: 10.1002/ana.20113. [PubMed] [CrossRef] [Google Scholar]79. Дельмер К., Видайхет М., Эльбаз А., Бурден Ф., Блетон Дж.P., Sangla S., Meunier S., Terrier A., Lehericy S. Структурные нарушения в мозжечке и сенсомоторной цепи при писчем спазме. Неврология. 2007; 69: 376–380. doi: 10.1212/01.wnl.0000266591.49624.1a. [PubMed] [CrossRef] [Google Scholar]80. Фазано А., Морганте Ф. Дистония: Руководство для клинициста по диагностике, патофизиологии и лечению. Медицина будущего ООО; Лондон, Великобритания: 2014. [Google Scholar]81. Халлетт М. Дистония: ненормальные движения возникают в результате потери торможения. Доп. Нейрол. 2004; 94:1–9.[PubMed] [Google Scholar]82. Lozeron P., Poujois A., Richard A., Masmoudi S., Meppiel E., Woimant F., Kubis N. Вклад TMS и rTMS в понимание патофизиологии и лечения дистонии. Передний. Нейронный круг. 2016;10:90. doi: 10.3389/fncir.2016.00090. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]83. Sohn YH, Hallett M. Surround торможение в двигательной системе человека. Эксп. Мозг Res. 2004; 158: 397–404. doi: 10.1007/s00221-004-1909-y. [PubMed] [CrossRef] [Google Scholar]84.Sohn YH, Hallett M. Нарушение объемного торможения при фокальной дистонии рук. Анна. Нейрол. 2004; 56: 595–599. doi: 10.1002/ana.20270. [PubMed] [CrossRef] [Google Scholar]85. Икома К., Самии А., Меркури Б., Вассерманн Э.М., Халлетт М. Аномальная моторная возбудимость коры головного мозга при дистонии. Неврология. 1996; 46:1371. doi: 10.1212/WNL.46.5.1371. [PubMed] [CrossRef] [Google Scholar]86. Рона С.
Халлетт М. Дистония: ненормальные движения возникают в результате потери торможения. Доп. Нейрол. 2004; 94:1–9.[PubMed] [Google Scholar]82. Lozeron P., Poujois A., Richard A., Masmoudi S., Meppiel E., Woimant F., Kubis N. Вклад TMS и rTMS в понимание патофизиологии и лечения дистонии. Передний. Нейронный круг. 2016;10:90. doi: 10.3389/fncir.2016.00090. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]83. Sohn YH, Hallett M. Surround торможение в двигательной системе человека. Эксп. Мозг Res. 2004; 158: 397–404. doi: 10.1007/s00221-004-1909-y. [PubMed] [CrossRef] [Google Scholar]84.Sohn YH, Hallett M. Нарушение объемного торможения при фокальной дистонии рук. Анна. Нейрол. 2004; 56: 595–599. doi: 10.1002/ana.20270. [PubMed] [CrossRef] [Google Scholar]85. Икома К., Самии А., Меркури Б., Вассерманн Э.М., Халлетт М. Аномальная моторная возбудимость коры головного мозга при дистонии. Неврология. 1996; 46:1371. doi: 10.1212/WNL.46.5.1371. [PubMed] [CrossRef] [Google Scholar]86. Рона С. , Берарделли А., Вакка Л., Ингиллери М., Манфреди М. Изменения моторного коркового торможения у пациентов с дистонией.Мов. Беспорядок. 1998; 13:118–124. doi: 10.1002/mds.870130123. [PubMed] [CrossRef] [Google Scholar]87. Минк Дж.В. Базальные ганглии: целенаправленный отбор и торможение конкурирующих моторных программ. прог. Нейробиол. 1996; 50: 381–425. doi: 10.1016/S0301-0082(96)00042-1. [PubMed] [CrossRef] [Google Scholar]88. Берарделли А., Ротвелл Дж. К., Халлетт М., Томпсон П. Д., Манфреди М., Марсден К. Д. Патофизиология первичной дистонии. Мозг. 1998; 121:1195–1212. doi: 10.1093/мозг/121.7.1195. [PubMed] [CrossRef] [Google Scholar]90.Poisson A., Krack P., Thobois S., Loiraud C., Serra G., Vial C., Broussolle E. История симптома «антагонистического жеста» при цервикальной дистонии. Дж. Нейрол. 2012; 259:1580–1584. doi: 10.1007/s00415-011-6380-7. [PubMed] [CrossRef] [Google Scholar]91. Йонеда Ю., Рим С., Сагар Х.Дж., Грюневальд Р.А. Аномальное восприятие тонического вибрационного рефлекса при идиопатической фокальной дистонии.
, Берарделли А., Вакка Л., Ингиллери М., Манфреди М. Изменения моторного коркового торможения у пациентов с дистонией.Мов. Беспорядок. 1998; 13:118–124. doi: 10.1002/mds.870130123. [PubMed] [CrossRef] [Google Scholar]87. Минк Дж.В. Базальные ганглии: целенаправленный отбор и торможение конкурирующих моторных программ. прог. Нейробиол. 1996; 50: 381–425. doi: 10.1016/S0301-0082(96)00042-1. [PubMed] [CrossRef] [Google Scholar]88. Берарделли А., Ротвелл Дж. К., Халлетт М., Томпсон П. Д., Манфреди М., Марсден К. Д. Патофизиология первичной дистонии. Мозг. 1998; 121:1195–1212. doi: 10.1093/мозг/121.7.1195. [PubMed] [CrossRef] [Google Scholar]90.Poisson A., Krack P., Thobois S., Loiraud C., Serra G., Vial C., Broussolle E. История симптома «антагонистического жеста» при цервикальной дистонии. Дж. Нейрол. 2012; 259:1580–1584. doi: 10.1007/s00415-011-6380-7. [PubMed] [CrossRef] [Google Scholar]91. Йонеда Ю., Рим С., Сагар Х.Дж., Грюневальд Р.А. Аномальное восприятие тонического вибрационного рефлекса при идиопатической фокальной дистонии. Евро. Дж. Нейрол. 2000; 7: 529–533. doi: 10.1046/j.1468-1331.2000.t01-1-00102.x. [PubMed] [CrossRef] [Google Scholar]92. Тинацци М., Россо Т., Фиаски А. Роль соматосенсорной системы в первичной дистонии. Мов. Беспорядок. 2003; 18: 605–622. doi: 10.1002/mds.10398. [PubMed] [CrossRef] [Google Scholar]93. Конте А., ДеФацио Г., Халлетт М., Фаббрини Г., Берарделли А. Роль сенсорной информации в патофизиологии фокальных дистоний. Нац. Преподобный Нейрол. 2019;15:224–233. doi: 10.1038/s41582-019-0137-9. [PubMed] [CrossRef] [Google Scholar]94. Бара-Хименес В., Шелтон П., Халлетт М. Пространственная дискриминация ненормальна при фокальной дистонии рук.Неврология. 2000; 55: 1869–1873. doi: 10.1212/WNL.55.12.1869. [PubMed] [CrossRef] [Google Scholar]95. Моллой Ф.М., Зеунер К.Е., Дамброзия Дж.М., Карр Т.Д., Халлетт М. Аномалии пространственной дискриминации при фокальной и генерализованной дистонии. Мозг. 2003; 126: 2175–2182. doi: 10.1093/мозг/awg219. [PubMed] [CrossRef] [Google Scholar]96. Уолш Р.
Евро. Дж. Нейрол. 2000; 7: 529–533. doi: 10.1046/j.1468-1331.2000.t01-1-00102.x. [PubMed] [CrossRef] [Google Scholar]92. Тинацци М., Россо Т., Фиаски А. Роль соматосенсорной системы в первичной дистонии. Мов. Беспорядок. 2003; 18: 605–622. doi: 10.1002/mds.10398. [PubMed] [CrossRef] [Google Scholar]93. Конте А., ДеФацио Г., Халлетт М., Фаббрини Г., Берарделли А. Роль сенсорной информации в патофизиологии фокальных дистоний. Нац. Преподобный Нейрол. 2019;15:224–233. doi: 10.1038/s41582-019-0137-9. [PubMed] [CrossRef] [Google Scholar]94. Бара-Хименес В., Шелтон П., Халлетт М. Пространственная дискриминация ненормальна при фокальной дистонии рук.Неврология. 2000; 55: 1869–1873. doi: 10.1212/WNL.55.12.1869. [PubMed] [CrossRef] [Google Scholar]95. Моллой Ф.М., Зеунер К.Е., Дамброзия Дж.М., Карр Т.Д., Халлетт М. Аномалии пространственной дискриминации при фокальной и генерализованной дистонии. Мозг. 2003; 126: 2175–2182. doi: 10.1093/мозг/awg219. [PubMed] [CrossRef] [Google Scholar]96. Уолш Р. , О’Двайер Дж. П., Шейх И. Х., О’Риордан С., Линч Т., Хатчинсон М. Спорадическая дистония у взрослых: сенсорные аномалии как эндофенотип у незатронутых родственников.Дж. Нейрол. Нейрохирург. Психиатрия. 2007; 78: 980–983. doi: 10.1136/jnnp.2006.105585. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]97. Брэдли Д., Уилан Р., Уолш Р., Рейли Р.Б., Хатчинсон С., Моллой Ф. Временной порог дискриминации: свидетельство VBM эндофенотипа при первичной торсионной дистонии у взрослых. Мозг. 2009;132:2327–2335. doi: 10.1093/мозг/awp156. [PubMed] [CrossRef] [Google Scholar]98. Был Н.Н., Мерценич М.М., Дженкинс В.М. Модель генезиса приматов фокальной дистонии и повторяющихся повреждений напряжения.Неврология. 1996; 47: 508–520. doi: 10.1212/WNL.47.2.508. [PubMed] [CrossRef] [Google Scholar]99. Садницка А., Кассаветис П., Пареес И., Меппелинк А.М., Батлер К., Эдвардс М. Специфическая дистония: патофизиология и лечение. Дж. Нейрол. Нейрохирург. Психиатрия. 2016; 87: 968–974. doi: 10.1136/jnnp-2015-311298.
, О’Двайер Дж. П., Шейх И. Х., О’Риордан С., Линч Т., Хатчинсон М. Спорадическая дистония у взрослых: сенсорные аномалии как эндофенотип у незатронутых родственников.Дж. Нейрол. Нейрохирург. Психиатрия. 2007; 78: 980–983. doi: 10.1136/jnnp.2006.105585. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]97. Брэдли Д., Уилан Р., Уолш Р., Рейли Р.Б., Хатчинсон С., Моллой Ф. Временной порог дискриминации: свидетельство VBM эндофенотипа при первичной торсионной дистонии у взрослых. Мозг. 2009;132:2327–2335. doi: 10.1093/мозг/awp156. [PubMed] [CrossRef] [Google Scholar]98. Был Н.Н., Мерценич М.М., Дженкинс В.М. Модель генезиса приматов фокальной дистонии и повторяющихся повреждений напряжения.Неврология. 1996; 47: 508–520. doi: 10.1212/WNL.47.2.508. [PubMed] [CrossRef] [Google Scholar]99. Садницка А., Кассаветис П., Пареес И., Меппелинк А.М., Батлер К., Эдвардс М. Специфическая дистония: патофизиология и лечение. Дж. Нейрол. Нейрохирург. Психиатрия. 2016; 87: 968–974. doi: 10.1136/jnnp-2015-311298. [PubMed] [CrossRef] [Google Scholar] 100. Стефан К., Кунеш Э., Бенеке Р., Коэн Л.Г., Классен Дж. Механизмы повышения возбудимости моторной коры человека, вызванные интервенционной парной ассоциативной стимуляцией.Дж. Физиол. 2002; 543: 699–708. doi: 10.1113/jphysiol.2002.023317. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]101. Вайзе Д., Шрамм А., Стефан К., Вольтерс А., Райнерс К., Науманн М., Классен Дж. Две стороны ассоциативной пластичности при писательском спазме. Мозг. 2006; 129: 2709–2721. doi: 10.1093/brain/awl221. [PubMed] [CrossRef] [Google Scholar] 102. Куартароне А., Морганте Ф., Сант-Анджело А., Риццо В., Баньято С., Терранова С., Зибнер Х., Берарделли А., Гирланда П. Аномальная пластичность сенсомоторных цепей распространяется за пределы пораженной части тела в фокальной области. дистония.Дж. Нейрол. Нейрохирург. Психиатрия. 2008; 79: 985–990. doi: 10.1136/jnnp.2007.121632. [PubMed] [CrossRef] [Google Scholar] 103. Латорре А., Кокко А., Бхатия К.П., Эрро Р.
[PubMed] [CrossRef] [Google Scholar] 100. Стефан К., Кунеш Э., Бенеке Р., Коэн Л.Г., Классен Дж. Механизмы повышения возбудимости моторной коры человека, вызванные интервенционной парной ассоциативной стимуляцией.Дж. Физиол. 2002; 543: 699–708. doi: 10.1113/jphysiol.2002.023317. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]101. Вайзе Д., Шрамм А., Стефан К., Вольтерс А., Райнерс К., Науманн М., Классен Дж. Две стороны ассоциативной пластичности при писательском спазме. Мозг. 2006; 129: 2709–2721. doi: 10.1093/brain/awl221. [PubMed] [CrossRef] [Google Scholar] 102. Куартароне А., Морганте Ф., Сант-Анджело А., Риццо В., Баньято С., Терранова С., Зибнер Х., Берарделли А., Гирланда П. Аномальная пластичность сенсомоторных цепей распространяется за пределы пораженной части тела в фокальной области. дистония.Дж. Нейрол. Нейрохирург. Психиатрия. 2008; 79: 985–990. doi: 10.1136/jnnp.2007.121632. [PubMed] [CrossRef] [Google Scholar] 103. Латорре А., Кокко А., Бхатия К.П., Эрро Р. , Антельми Э., Конте А., Ротвелл Дж.К., Рокки Л. Дефектное соматосенсорное торможение и пластичность не требуются для развития дистонии. Мов. Беспорядок. 2020;2020:1–8. doi: 10.1002/mds.28427. [PubMed] [CrossRef] [Google Scholar] 104. Кокс Б.К., Чинкотта М., Эспей А.Дж. Зеркальные движения при двигательных расстройствах: обзор. Тремор Другое Hyperkinet Mov.2012;2:тре-02-59-398-1. doi: 10.5334/том.113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]105. Мерелло М., Карпинтьеро С., Каммарота А., Мели Ф., Лейгуарда Р. Двусторонние зеркальные письменные движения (зеркальная дистония) у пациента с писчим спазмом: функциональные корреляты. Мов. Беспорядок. 2006; 21: 683–689. doi: 10.1002/mds.20736. [PubMed] [CrossRef] [Google Scholar] 106. Бек С., Шамим Э.А., Ричардсон С.П., Шуберт М., Халлетт М. Межполушарное торможение нарушается при зеркальной дистонии. Евро.Дж. Нейроски. 2009; 29: 1634–1640. doi: 10.1111/j.1460-9568.2009.06710.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]108.
, Антельми Э., Конте А., Ротвелл Дж.К., Рокки Л. Дефектное соматосенсорное торможение и пластичность не требуются для развития дистонии. Мов. Беспорядок. 2020;2020:1–8. doi: 10.1002/mds.28427. [PubMed] [CrossRef] [Google Scholar] 104. Кокс Б.К., Чинкотта М., Эспей А.Дж. Зеркальные движения при двигательных расстройствах: обзор. Тремор Другое Hyperkinet Mov.2012;2:тре-02-59-398-1. doi: 10.5334/том.113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]105. Мерелло М., Карпинтьеро С., Каммарота А., Мели Ф., Лейгуарда Р. Двусторонние зеркальные письменные движения (зеркальная дистония) у пациента с писчим спазмом: функциональные корреляты. Мов. Беспорядок. 2006; 21: 683–689. doi: 10.1002/mds.20736. [PubMed] [CrossRef] [Google Scholar] 106. Бек С., Шамим Э.А., Ричардсон С.П., Шуберт М., Халлетт М. Межполушарное торможение нарушается при зеркальной дистонии. Евро.Дж. Нейроски. 2009; 29: 1634–1640. doi: 10.1111/j.1460-9568.2009.06710.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]108. Делонг М.Р. Модели двигательных расстройств базального ганглийского происхождения у приматов. Тренды Нейроси. 1990; 13: 281–285. doi: 10.1016/0166-2236(90)
Делонг М.Р. Модели двигательных расстройств базального ганглийского происхождения у приматов. Тренды Нейроси. 1990; 13: 281–285. doi: 10.1016/0166-2236(90)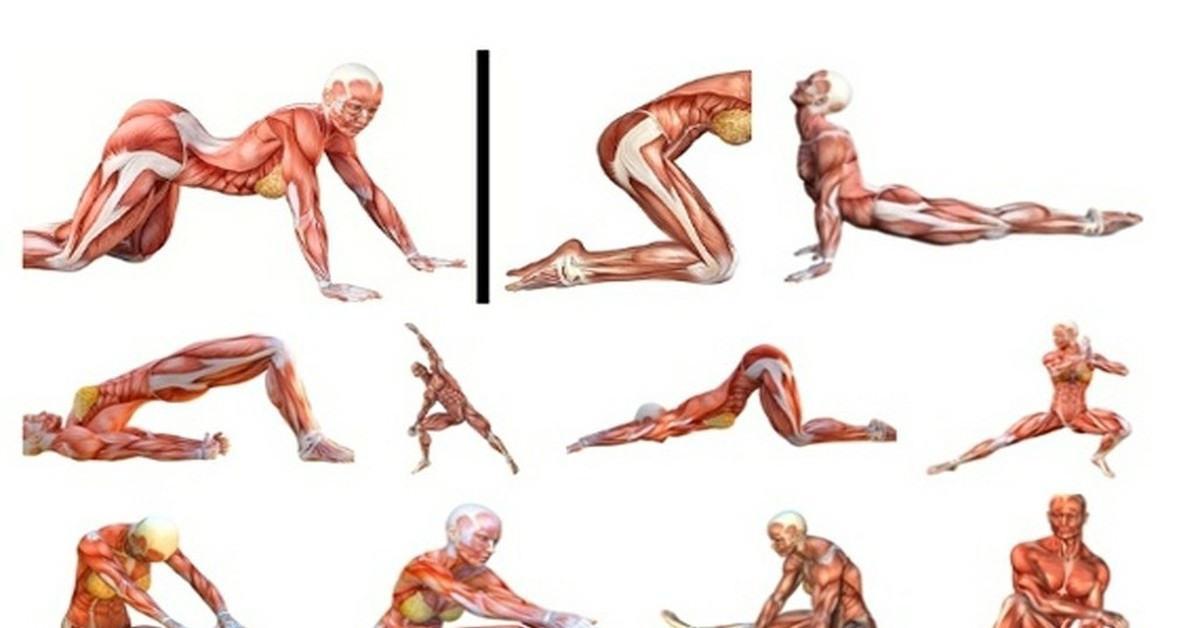 Койович М., Бхатия К.П. Приведение в порядок двигательных расстройств высшего порядка. Дж. Нейрол. 2018; 266:797–805. doi: 10.1007/s00415-018-8974-9. [PubMed] [CrossRef] [Google Scholar] 114. Дрент Х., Зуидема С., Баутманс И., Маринелли Л., Кляйнер Г., Хоббелен Х. Паратония при деменции: систематический обзор. Дж. Альцгеймер Дис. 2020; 78: 1615–1637. doi: 10.3233/JAD-200691. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]115.Маринелли Л., Мори Л., Пардини М., Беверсдорф Д., Кочито Л., Курра А., Фаттаппоста Ф., Гиларди М.Ф., Аббруццезе Г., Тромпетто С. Электромиографическая оценка паратонии. Эксп. Мозг Res. 2016; 235:949–956. doi: 10.1007/s00221-016-4854-7. [PubMed] [CrossRef] [Google Scholar] 116. Беверсдорф Д.К., Хейлман К.М. Фасилитарная паратония и функционирование лобных долей. Неврология. 1998; 51: 968–971. doi: 10.1212/WNL.51.4.968. [PubMed] [CrossRef] [Google Scholar] 117. Лермитт Ф. Человеческая автономия и лобные доли.Часть II: Поведение пациента в сложных и социальных ситуациях: синдром зависимости от окружающей среды? Анна.
Койович М., Бхатия К.П. Приведение в порядок двигательных расстройств высшего порядка. Дж. Нейрол. 2018; 266:797–805. doi: 10.1007/s00415-018-8974-9. [PubMed] [CrossRef] [Google Scholar] 114. Дрент Х., Зуидема С., Баутманс И., Маринелли Л., Кляйнер Г., Хоббелен Х. Паратония при деменции: систематический обзор. Дж. Альцгеймер Дис. 2020; 78: 1615–1637. doi: 10.3233/JAD-200691. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]115.Маринелли Л., Мори Л., Пардини М., Беверсдорф Д., Кочито Л., Курра А., Фаттаппоста Ф., Гиларди М.Ф., Аббруццезе Г., Тромпетто С. Электромиографическая оценка паратонии. Эксп. Мозг Res. 2016; 235:949–956. doi: 10.1007/s00221-016-4854-7. [PubMed] [CrossRef] [Google Scholar] 116. Беверсдорф Д.К., Хейлман К.М. Фасилитарная паратония и функционирование лобных долей. Неврология. 1998; 51: 968–971. doi: 10.1212/WNL.51.4.968. [PubMed] [CrossRef] [Google Scholar] 117. Лермитт Ф. Человеческая автономия и лобные доли.Часть II: Поведение пациента в сложных и социальных ситуациях: синдром зависимости от окружающей среды? Анна. Нейрол. 1986; 19: 335–343. doi: 10.1002/ana.4101
Нейрол. 1986; 19: 335–343. doi: 10.1002/ana.4101 С другой стороны, дистония и паратония также проявляются нарушением мышечного тонуса, но возникают в большей степени из-за дисфункции сети между базальными ганглиями и таламо-мозжечково-кортикальными связями. В этом обзоре мы обсудили нормальные гомеостатические механизмы поддержания тонуса и патофизиологию спастичности и ригидности с их анатомическими коррелятами. После этого мы также выделили феномен сетевой дисфункции, коркового растормаживания и нейропластических изменений, приводящих к дистонии и паратонии.
С другой стороны, дистония и паратония также проявляются нарушением мышечного тонуса, но возникают в большей степени из-за дисфункции сети между базальными ганглиями и таламо-мозжечково-кортикальными связями. В этом обзоре мы обсудили нормальные гомеостатические механизмы поддержания тонуса и патофизиологию спастичности и ригидности с их анатомическими коррелятами. После этого мы также выделили феномен сетевой дисфункции, коркового растормаживания и нейропластических изменений, приводящих к дистонии и паратонии. и нисходящие пути), спинной мозг (основной путь для восходящих и нисходящих путей) и мышечное веретено (конечный общий путь с наименьшей степенью свободы).В этом обзоре мы обсудили противоречия, касающиеся определения мышечного тонуса и его классификации, а также механизмы и пути, ответственные за поддержание тонуса. Спастичность и ригидность, два типа гипертонии, были разработаны в контексте дисфункции супраспинальных путей и взаимодействия между спинным мозгом и мышечным веретеном. Два других нарушения тонуса, а именно дистония и паратония, не совсем связаны с физиологической дисфункцией проводящих путей тонуса.В системе управления моторикой спастичность и ригидность являются преимущественно проблемой выходной системы, тогда как дистония является проблемой обработки на системном уровне. Дистония и паратония изменяют тонус вследствие нарушения сети в базальных ганглиях, таламокортикальных цепях и их соединениях. Механизмы, лежащие в их основе, обсуждались впоследствии, поскольку они важны как клинически, так и патофизиологически с точки зрения двигательных расстройств.
и нисходящие пути), спинной мозг (основной путь для восходящих и нисходящих путей) и мышечное веретено (конечный общий путь с наименьшей степенью свободы).В этом обзоре мы обсудили противоречия, касающиеся определения мышечного тонуса и его классификации, а также механизмы и пути, ответственные за поддержание тонуса. Спастичность и ригидность, два типа гипертонии, были разработаны в контексте дисфункции супраспинальных путей и взаимодействия между спинным мозгом и мышечным веретеном. Два других нарушения тонуса, а именно дистония и паратония, не совсем связаны с физиологической дисфункцией проводящих путей тонуса.В системе управления моторикой спастичность и ригидность являются преимущественно проблемой выходной системы, тогда как дистония является проблемой обработки на системном уровне. Дистония и паратония изменяют тонус вследствие нарушения сети в базальных ганглиях, таламокортикальных цепях и их соединениях. Механизмы, лежащие в их основе, обсуждались впоследствии, поскольку они важны как клинически, так и патофизиологически с точки зрения двигательных расстройств.
 клеток, а также на окружающие соединительные ткани [3,4].
клеток, а также на окружающие соединительные ткани [3,4]. [7].Бернштейн в своей иерархической модели построения движения (тонус, синергия, пространство, действие) постулировал, что мышечный тонус является адаптивной функцией нейромоторного аппарата, адекватно реагирующего на команды, поступающие с верхних уровней построения движения, путем тонкой настройки возбудимости сенсорные и моторные клетки для задач активного управления позой или движением [6,7]. Это определение делает мышечный тонус активным участником двигательных и постуральных задач. Точно так же Карпентер и соавт.дали клиническое определение тонуса как «постоянной мышечной активности, которая необходима в качестве фона для фактического движения, чтобы поддерживать основное положение тела, особенно против силы тяжести» [8]. Таким образом, тон может быть конструкцией, необходимой для управления моторикой, чтобы как статические, так и динамические задачи могли безопасно выполняться наиболее термодинамически эффективным способом.
[7].Бернштейн в своей иерархической модели построения движения (тонус, синергия, пространство, действие) постулировал, что мышечный тонус является адаптивной функцией нейромоторного аппарата, адекватно реагирующего на команды, поступающие с верхних уровней построения движения, путем тонкой настройки возбудимости сенсорные и моторные клетки для задач активного управления позой или движением [6,7]. Это определение делает мышечный тонус активным участником двигательных и постуральных задач. Точно так же Карпентер и соавт.дали клиническое определение тонуса как «постоянной мышечной активности, которая необходима в качестве фона для фактического движения, чтобы поддерживать основное положение тела, особенно против силы тяжести» [8]. Таким образом, тон может быть конструкцией, необходимой для управления моторикой, чтобы как статические, так и динамические задачи могли безопасно выполняться наиболее термодинамически эффективным способом. Постуральный тонус наблюдается в аксиальных мышцах, где гравитация является наиболее важным провоцирующим фактором. Это происходит в результате постоянного растяжения мышц и сухожилий и проявляется в виде длительного сокращения мышц. Напротив, фазный тонус обычно оценивается клинически в конечностях как быстрый и кратковременный ответ. Это происходит в результате быстрого растяжения сухожилия и прикрепленной к нему мышцы, а точнее мышечного веретена [9]. Кроме того, мышечный тонус можно разделить на активный и пассивный компоненты, как это уже было описано выше.
Постуральный тонус наблюдается в аксиальных мышцах, где гравитация является наиболее важным провоцирующим фактором. Это происходит в результате постоянного растяжения мышц и сухожилий и проявляется в виде длительного сокращения мышц. Напротив, фазный тонус обычно оценивается клинически в конечностях как быстрый и кратковременный ответ. Это происходит в результате быстрого растяжения сухожилия и прикрепленной к нему мышцы, а точнее мышечного веретена [9]. Кроме того, мышечный тонус можно разделить на активный и пассивный компоненты, как это уже было описано выше. Интрафузальные волокна передают информацию о длине мышцы или скорости ее изменения, в то время как сухожильные органы Гольджи передают информацию о натяжении сухожилий или скорости изменения натяжения [10]. Афференты типа Ia определяют скорость изменения длины мышцы во время растяжения (динамическая реакция). Однако при тонической активности афферентов Iа и II типов выявляют установившуюся длину мышцы (статический ответ). Афференты типа Ib посылают информацию от сухожильных органов Гольджи.
Интрафузальные волокна передают информацию о длине мышцы или скорости ее изменения, в то время как сухожильные органы Гольджи передают информацию о натяжении сухожилий или скорости изменения натяжения [10]. Афференты типа Ia определяют скорость изменения длины мышцы во время растяжения (динамическая реакция). Однако при тонической активности афферентов Iа и II типов выявляют установившуюся длину мышцы (статический ответ). Афференты типа Ib посылают информацию от сухожильных органов Гольджи. Эфферентный сигнал от спинного мозга (альфа-мотонейрона) поступает через альфа-эфференты к экстрафузальным волокнам, что приводит к внезапному сокращению мышцы (рефлекс динамического растяжения). Это лежит в основе клинического выявления глубоких сухожильных рефлексов. С другой стороны, продолжительное растяжение мышцы стимулирует волокна ядерной цепи, и афференты типа II (окончания цветочных брызг) передают сигнал к спинному мозгу. Эфферентный сигнал от спинного мозга проходит через альфа-эфференты к экстрафузальным волокнам. Однако на этот раз будет происходить асинхронное сокращение экстрафузальных мышечных волокон (двигательные единицы не разряжаются все вместе), что приведет к мягкому устойчивому сокращению этих волокон, пока они растягиваются.Эта статическая рефлекторная реакция на растяжение является физиологической основой поддержания мышечного тонуса [8,10,11].
Эфферентный сигнал от спинного мозга (альфа-мотонейрона) поступает через альфа-эфференты к экстрафузальным волокнам, что приводит к внезапному сокращению мышцы (рефлекс динамического растяжения). Это лежит в основе клинического выявления глубоких сухожильных рефлексов. С другой стороны, продолжительное растяжение мышцы стимулирует волокна ядерной цепи, и афференты типа II (окончания цветочных брызг) передают сигнал к спинному мозгу. Эфферентный сигнал от спинного мозга проходит через альфа-эфференты к экстрафузальным волокнам. Однако на этот раз будет происходить асинхронное сокращение экстрафузальных мышечных волокон (двигательные единицы не разряжаются все вместе), что приведет к мягкому устойчивому сокращению этих волокон, пока они растягиваются.Эта статическая рефлекторная реакция на растяжение является физиологической основой поддержания мышечного тонуса [8,10,11]. После пересечения порога сокращение прекращается, и мышца расслабляется. Это известно как «рефлекс обратного растяжения» и опосредовано сухожильным органом Гольджи, присутствующим в пучках сухожилия [11].
После пересечения порога сокращение прекращается, и мышца расслабляется. Это известно как «рефлекс обратного растяжения» и опосредовано сухожильным органом Гольджи, присутствующим в пучках сухожилия [11].
 Однако латеральная часть передней доли активирует ретикулярную формацию моста. Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17].
Однако латеральная часть передней доли активирует ретикулярную формацию моста. Следовательно, он косвенно повышает мышечный тонус через медиальный RST, стимулируя гамма-мотонейроны [15,16]. У человека, поскольку латеральная часть передней части мозжечка более развита, поражения мозжечка обычно вызывают гипотонию.С другой стороны, вестибуло-мозжечок связан с вестибулярным ядром, которое стимулирует альфа-мотонейроны. Таким образом, мозжечок также является важным местом регуляции «альфа-гамма-связи» [17]. Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями.
Определение Ланса также игнорирует роль сенсорного входа (обсуждается позже) в спастичности. В 2005 г. в рамках проекта «Программа поддержки сборки базы данных для измерения спастичности» (СПАЗМ) спастичность была переопределена как «нарушение сенсорно-моторного контроля, возникающее в результате поражения верхнего двигательного нейрона, проявляющееся в виде прерывистой или устойчивой непроизвольной активации мышц» [19].Определение включало роль дефектного сенсорного входа (не только двигательного) в спастичности. Недавно, в 2018 году, Междисциплинарная рабочая группа IAB по двигательным расстройствам определила спастичность в более широком смысле как «непроизвольную мышечную гиперактивность при наличии центрального пареза» [20]. В этом определении «непроизвольная мышечная гиперактивность» описывается как спектр, состоящий из: (i) «Спастичности Sensu Strictu», вызванной быстрыми пассивными движениями в суставах, (ii) «ригидности», вызванной медленными пассивными движениями в суставах, (iii) «дистония», когда непроизвольная мышечная гиперактивность является спонтанной и (iv) «спазмы», вызванные сенсорными или акустическими раздражителями. Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.
Группа также предложила осевой подход к спастичности — клиническое описание (ось 1), этиологию (ось 2), локализацию (ось 3) и дополнительные нарушения центральной нервной системы (ось 4) [20]. Тяжесть мышечной гиперактивности можно описать по модифицированной шкале Эшворта, шкале Тардье и шкале частоты спазмов.
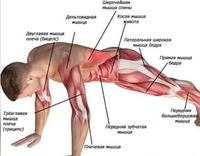 В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности.
В острой стадии после травмы позвоночника из-за потери этого нисходящего моноаминергического влияния возникает гиповозбудимость мотонейронов в передних рогах, тогда как растормаживание и возбуждение сенсорного входа в задних рогах.Однако спастичность не развивается остро, несмотря на межнейронную возбудимость, пока двигательные нейроны не восстановят возбудимость. В хронической стадии возникает денервационная гиперчувствительность мотонейронов вентральных рогов к оставшемуся моноаминергическому входу и активируется ПИК, что в свою очередь приводит к развитию спастичности. , измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30].
, измененное рекуррентное ингибирование клетками Реншоу (сомнительная роль) [30]. Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST.
Гемиплегия со спастичностью и антигравитационной позой возникает из-за безальтернативного облегчающего действия медиальной RST при отсутствии тормозящего влияния дорсальной RST. Растормаживание FRA приведет к параплегии при сгибании и спазмам сгибателей.
Растормаживание FRA приведет к параплегии при сгибании и спазмам сгибателей. Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.
Как обсуждалось ранее, селективной потери CST недостаточно, чтобы вызвать значительную спастичность, а не слабость. Таким образом, дефектная сенсорная обратная связь может также играть роль в клинических проявлениях выраженной спастичности, непропорциональной слабости при ПШГ. ДеЛука и др. подчеркнуто, что при HSP потеря аксонов происходит как в больших (> 3 мкм 2 ), так и в нервных волокнах малого (<3 мкм 2 ) диаметра двигательных (CST) и чувствительных (задний столб) трактов, тогда как при рассеянном склерозе (МС) преимущественно поражаются волокна малого диаметра [37].Таким образом, поражение нервных волокон большого диаметра может быть причиной преобладания спастичности, наблюдаемой при ПШГ, по сравнению с РС, где преобладает слабость.
 Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается.
Патологическая основа была объяснена в литературе несколькими способами: (1) последовательность рефлекса растяжения — обратная последовательность рефлекса растяжения, (2) разрушение клетки Реншоу и ингибирующий интернейрон типа Ia, опосредованное ингибированием антагониста → повторяющееся последовательное сокращение агониста и антагониста → результаты клонуса, (3) гиперактивность мышечных веретен → активация всех мотонейронов из-за импульсов, исходящих от веретена → последующее сокращение мышц останавливает разряд веретена → во время поддержания длительного растяжения мышца снова растягивается, как только по мере расслабления мышцы → снова стимулируются веретена [11,44].Однако точная патофизиология все еще обсуждается. Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].
Отмечено также, что гипертонус при БП регулярно прерывается по типу «зубчатого колеса» на частоте 6–9 Гц, что выше частоты тремора покоя (4–5 Гц) и постурального тремора (5–6 Гц) [45]. ,46].Согласно недавнему консенсусу, наложенный тремор или «основной, еще не видимый тремор» [47] приводит к прерывистому повышению тонуса во время пассивных движений сустава и вызывает ригидность по типу «зубчатого колеса» при БП [48]. Таким образом, зубчатое колесо может присутствовать, даже если нет явного тремора [49]. Ригидность — один из кардинальных признаков БП. Он присутствует в обоих фенотипах БП («акинетически-ригидный» и «доминантный тремор»), но более выражен в первом фенотипе. В то время как аппендикулярная ригидность обычно больше, чем аксиальная ригидность при идиопатической болезни Паркинсона (ИПБ), выраженная аксиальная ригидность указывает на атипичный паркинсонизм, такой как прогрессирующий надъядерный паралич (ПНП) [50].
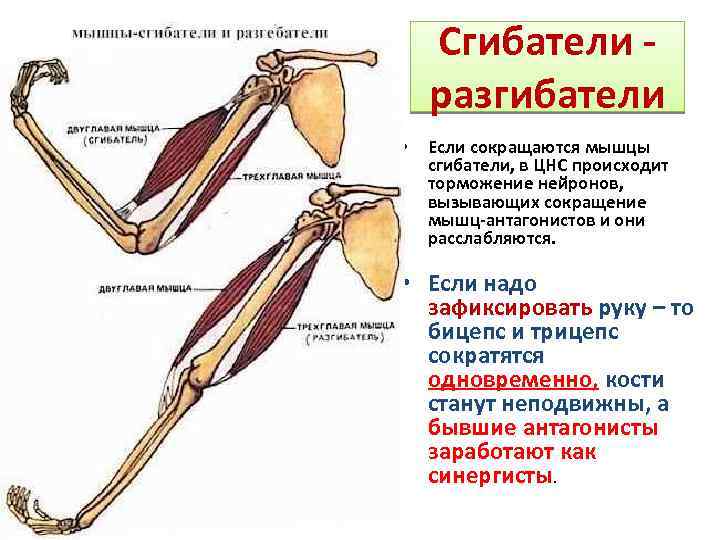
 Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53].
Таким образом, понятие постепенно сместилось к преувеличенному длиннопетлевому или долголатентному рефлексу растяжения (супраспинальное влияние) на паркинсоническую ригидность, а не к спинально-опосредованным рефлексам.Берарделли и др. отметили корреляцию между увеличением LLSR с ригидностью и подозревали роль афферентов группы II в этом отношении [57]. Ротвелл и др., хотя и отметили усиление LLSR при БП, не смогли найти какой-либо количественной корреляции этого с ригидностью. Они предположили, что LLSR не является единственной причиной паркинсонической ригидности, и усиление поздних полисинаптических рефлексов, опосредованных кожными афферентами, также может быть важным [53]. Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].
Изменение путей коротколатентного аутогенного торможения, опосредованное изменением возбудимости спинальных интернейронов Ia и Ib, может быть причиной феномена СР [59]. С другой стороны, внезапное снижение сопротивления наблюдается при постоянном растяжении или удлинении мышцы за пределами критического угла сустава. Это явление называется «реакцией удлинения» или торможением, индуцированным растяжением (SII) [60]. Комбинированный эффект SR и SII создает эффект «свинцовой трубы» при исследовании тонуса конечностей при БП [61].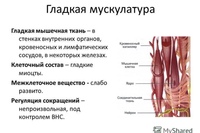 При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66].
При БП имеются данные об отложении альфа-синуклеина в ядрах обоих кругов, включая сублатеродорсальное ядро (отвечающее за регуляцию тонуса в фазе быстрого сна), гигантоцеллюлярное ретикулярное ядро (NRGC), голубое пятно, каудальный шов и мостовидное ядро (PPN) [4]. 64]. Каудальный PPN дает холинергические возбуждающие входы в NRGC, откуда берет начало дорсальный или латеральный ретикулоспинальный тракт (дорсальный RST) и активирует интернейроны Ib спинного мозга, которые, в свою очередь, ингибируют альфа-мотонейроны (4). PPN также получает ингибирующие сигналы от внутреннего бледного шара (GPi).При БП дегенерация PPN и NRGC снижает возбуждение спинальных интернейронов Ib, что, в свою очередь, растормаживает альфа-мотонейроны и может приводить к ригидности [65]. Повышение тормозного тонуса от GPi до PPN при БП также может приводить к тому же явлению. Хекман и др. также подчеркнули роль норадренергического и серотонинергического влияния голубого пятна и каудального шва соответственно на возбудимость двигательных нейронов, способствуя возбуждению посредством постоянного внутреннего тока (PIC) [66]. Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62].
Поражение этих путей при БП может приводить к изменению паттерна импульсации двигательного нейрона в ответ на входящие сигналы и может способствовать ригидности [62]. По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип.
По мере прогрессирования ригидности отмечали прогрессирующее нарушение премоторно-преклиновидной связи (патологическое изменение), а мозжечково-премоторная связь приближалась к нормальным значениям (компенсаторный механизм).Канн и др. [70] предположили, что значительная потеря серого вещества и аберрантная функциональная связность в лобно-теменных сетях (критически важных для планирования и выполнения движений) при акинетико-ригидном подтипе БП ответственны за более агрессивное течение функционального спада по сравнению с тремор-доминантным типом. подтип. ) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73].
) и повышенная чувствительность к пассивному растяжению [73], (3) облегчение двусторонней нисходящей ретикулоспинальной проекции [62] и (4) эквивалент «маневра Джендрасика», когда сокращение мышц в другой части тела облегчает H-рефлекс и усиливает рефлекторную реакцию на растяжение. [73]. Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции.
Однако передовые методы визуализации и электрофизиологические эксперименты расширили нейроанатомические корреляты, способствующие дистонии. Явления сенсорных уловок и движений зеркала, наблюдаемые при дистонии, указывают на аномалии в сенсорной обработке и сенсомоторной интеграции. SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79].
SCA-6 имеет чисто мозжечковую патологию и обычно проявляется как фенотип чистой мозжечковой атаксии. Однако у этих пациентов можно наблюдать дистонию, которую нельзя объяснить дисфункцией базальных ганглиев [76]. Драгански и др. в исследованиях, основанных на вокселах, показали повышенную плотность серого вещества во внутреннем бледном шаре, моторной коре и скоплении мозжечка [77]. Гарро и др. продемонстрировали значительное увеличение объема серого вещества в области представительства рук у пациентов с фокальной дистонией рук с помощью исследований морфометрии на основе вокселей.Это перироландическое увеличение также наблюдалось в дорсолатеральной префронтальной коре, нижних теменных областях и мозжечке, но не в чечевицеобразном ядре [78]. Сходные структурные аномалии при писчем спазме были отмечены в первичной сенсомоторной коре, мозжечке и пульвинарных ядрах таламуса [79]. В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию.
В следующем разделе мы обсудим нейрофизиологические изменения, постулируемые в этой схеме, которые вызывают дистонию. При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87].
При произвольном сгибании указательного пальца, иннервируемого срединным нервом, моторный вызванный потенциал (МВП), регистрируемый на ТМС от иннервируемого локтевой кости abductor digiti minimi (ADM), был снижен [83]. Та же группа авторов продемонстрировала, что у семи пациентов с фокальной дистонией кисти по сравнению с контрольной группой амплитуды ВМО АДМ увеличивались до 270% при сгибании указательного пальца, что свидетельствует об отсутствии объемного торможения [84]. Аналогичным образом Ikoma et.al., что свидетельствует о большем количестве возбужденных двигательных единиц [85]. Электрофизиологически внутрикорковое торможение оценивается путем измерения периода коркового молчания (CSP), прерывания произвольной электромиографической мышечной активности после надпорогового импульса ТМС. Рона и др. al., обнаружили, что CSP был короче при дистонии у десяти пациентов с дистонией, в большей степени при дистонии, специфичной для задачи, чем при генерализованной дистонии [86]. При дистонии моносинаптические и долголатентные рефлексы растяжения, обсуждавшиеся ранее, удлиняются при более медленном растяжении и часто вызывают рефлекторную активность в удаленных мышцах, что свидетельствует о переполнении [87]. Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92].
Следовательно, чрескожная вибрация на мышцу с частотой 50–120 Гц вызывает тонический вибрационный рефлекс (ТВР), полисинаптический рефлекс спинного мозга с участием афферентов мышечного веретена и гамма-мотонейронов.Существует сниженное восприятие TVR, что указывает на аномальную обработку афферентов мышечного веретена 1a при идиопатической фокальной дистонии не только в симптоматических частях тела, но и в непораженных областях [91]. Существует гипотеза, что сенсорный трюк работает за счет уменьшения гамма-драйва к веретенам по сравнению с активностью альфа-мотонейронов [92]. Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR.
Соматосенсорный временной порог различения (STDT) измеряет временную обработку сенсорной информации и представляет собой кратчайший интервал, при котором два тактильных стимула, доставленных к одной и той же части тела, могут быть распознаны во времени отдельно [93]. Брэдли и др. исследовали STDT у тридцати пяти первичных взрослых и сорока двух здоровых родственников первой степени родства с помощью морфометрии на основе вокселей (VBM) для оценки объемов скорлупы у родственников с аномальными и нормальными TDT.У тридцати двух пациентов и двадцати двух здоровых родственников STDT был ненормальным. VBM у тринадцати здоровых участников с аномальными STDT и у двадцати здоровых участников с нормальными STDT показал двустороннее увеличение объема серого вещества в скорлупе у пациентов с аномальными STDT. Авторы пришли к выводу, что STDT отражает эффективную обработку сенсорных стимулов скорлупой, что ненормально у пациентов с дистонией [97]. Таким образом, сенсорная дисфункция при дистонии включает не только соматосенсорную обработку, но и периферические сенсорные аномалии, как это видно в исследованиях GOT и TVR. Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии.
Нарушения в обработке сенсорной информации приводят к нарушению связи между подкорковыми структурами (базальными ганглиями, таламусом, верхним двухолмием) и первичной соматосенсорной зоной (S1). Таламус играет ключевую роль в интеграции сенсорных входов с базальными ганглиями и выходами мозжечка, в то время как базальные ганглии служат привратником для сенсорных входов. Таким образом, аномальная сенсомоторная интеграция играет важную роль в патогенезе дистонии. У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности.
У контрольных испытуемых моторные потенциалы, зарегистрированные через 21,5 мс, увеличивались по амплитуде, если афферентный ПАС-компонент исходил из гомологичной периферической области.Однако у пациентов с писчим спазмом как срединная, так и локтевая PAS на 21,5 мс увеличивали амплитуды потенциала двигательных единиц APB и ADM. Рост числа случаев был выше по величине, начался раньше и был более продолжительным. Авторы пришли к выводу, что пациенты демонстрировали аномальные динамические ответы на протоколы PAS, предполагающие пластичность нейронов разной полярности, согласующиеся с LTP и LTD [101]. Точно так же эксперименты с PAS, проведенные Quartarone et al. показали, что у пациентов с дистонией имело место более сильное и продолжительное фасилитаторное повышение кортикоспинальной возбудимости наряду с потерей топографической специфичности ПАС с облегчением как в срединной, так и в локтевой иннервируемых мышцах [102].Этот эксперимент еще раз подтверждает тот факт, что явления переполнения или совместного сжатия могут быть связаны с аномалиями пространственных свойств ассоциативной пластичности. Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103].
Таким образом, дистония может быть вызвана аномальной чрезмерной связью между сенсорными входами и моторными выходами. Однако недавнее исследование показало, что, в отличие от первичной дистонии, снижение соматосенсорного торможения и повышенная пластичность коры могут не требоваться для клинического проявления вторичной дистонии [103]. Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106].
Однако при письме здоровой рукой наблюдалась большая активация ипсилатерально, что свидетельствовало об ослаблении транскаллозального торможения и тормозных интракортикальных цепей [105]. Бек и др. использовали ТМС, чтобы показать отсутствие межполушарного торможения дистонической моторной коры во время премоторной фазы, чего не наблюдается у пациентов без зеркальных движений [106]. Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть.
Белые стрелки: паллидо-таламо-кортикальная сеть, черные стрелки: мозжечково-таламо-корково-мозжечковая сеть. Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии.
Мозжечковые связи при дистонии изучались Argyelan et al. с использованием магнитно-диффузионной тензорной визуализации и вероятностной трактографии у носителей мутаций DYT1 и DYT 6. Они показали снижение целостности трактов мозжечково-таламокортикальных волокон как у носителей манифестной, так и неманифестной мутации, с большим дефицитом в первой группе [111]. Авторы пришли к выводу, что нарушения мозжечкового оттока могут приводить к отсутствию коркового торможения при дистонии. Как базальные ганглии, так и мозжечок проецируются на SMA и pre-SMA, с большим вкладом паллидных нейронов базальных ганглиев, как показано Akkal et al.с использованием ретроградного транснейронного транспорта нейротропного вируса у обезьян [112]. Таким образом, согласно сети, не только анатомическая дисфункция в базальных ганглиях или таламусе вызывает дистонию, но и функциональное нарушение проводящих путей, обсуждавшихся выше, что важно в патофизиологии дистонии. Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии.
Базальные ганглии играют центральную роль в развитии дистонии, но другие области моторного контура вносят свой вклад в ее патофизиологию. Аномалии в сетях, включающих базальные ганглии, мозжечок, таламус и кору, зависят от аномального сенсорного входа, играя ключевую роль в аномальной сенсомоторной интеграции, приводящей к дистонии. Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].
Паратония, впервые описанная Фридлендером в 1828 г., а затем Дюпре в 1910 г., описывается как повышение мышечного тонуса в ответ на пассивное движение, пропорциональное силе применяемого раздражителя.Степень сопротивления зависит от скорости движения. Это может быть облегчением на ранних стадиях, когда пациент активно помогает пассивным движениям и становится оппозиционным с прогрессирующей патологией, когда сопротивление увеличивается с увеличением движений [113,114]. В отличие от ригидности, паратония не зависит от скорости, а отсутствие захвата и тот факт, что паратония может быть вызвана в любом направлении движения, отличает ее от спастичности [115].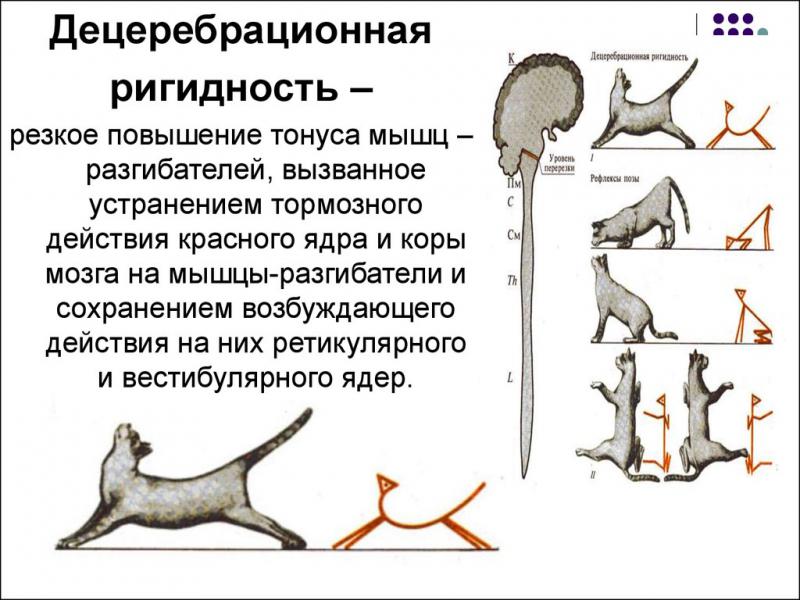 Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114].
Целенаправленное движение опосредовано двумя цепями, сходящимися в первичной моторной коре: цепь пре-дополнительной моторной области (Pre-SMA) — первичная моторная область и цепь теменно-премоторной — первичной моторной области.Первый получает входные сигналы от префронтальной коры и базальных ганглиев и модулирует произвольные моторные движения, управляемые изнутри. Последний контур участвует в объектно-ориентированных действиях, таких как хватание или следование визуальным или вербальным сигналам. Две схемы обычно сбалансированы, что позволяет плавно выполнять целевые задачи. Пре-СМА обычно ингибирует парието-премоторную цепь, и это нарушается при дисфункции лобных долей. Результатом является расторможенное поведение, и человек зависит от визуальной и тактильной стимуляции для управления двигательными движениями с дефектным торможением, что способствует паратонии облегчения [113,117].Также была выдвинута гипотеза о периферическом механизме, способствующем возникновению паратонии. На реципрокное торможение на уровне позвоночника влияет пожилой возраст, что вызывает совместное сокращение агониста и антагониста, воспринимаемое как увеличение сопротивления движению [114]. Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.
Однако измененный тонус можно наблюдать при дистонии и паратонии, расстройствах, возникающих из-за сетевой дисфункции, аномальной сенсомоторной интеграции и расторможенности в головном и спинном мозге. В клиническом сценарии гипертонии дифференциация этих четырех нарушений имеет первостепенное значение с патофизиологической и терапевтической точек зрения.
 С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В.
С., Лаки М. Механизм поперечного моста может объяснить тиксотропный эластичный компонент ближнего действия расслабленной скелетной мышцы лягушки.Дж. Физиол. 1998; 510:941–962. doi: 10.1111/j.1469-7793.1998.941bj.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]4. Ван К., Маккартер Р., Райт Дж., Беверли Дж., Рамирес-Митчелл Р. Вязкоупругость саркомерного матрикса скелетных мышц. Композитная нить титин-миозин представляет собой двухступенчатую молекулярную пружину. Биофиз. Дж. 1993; 64: 1161–1177. doi: 10.1016/S0006-3495(93)81482-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Саймонс Г.Д., Менс С. Понимание и измерение мышечного тонуса в связи с клинической мышечной болью.Боль. 1998; 75: 1–17. doi: 10.1016/S0304-3959(97)00102-4. [PubMed] [CrossRef] [Google Scholar]6. Латаш М.Л., Зациорский В.М. Мышечный тонус. Биомех. Блок управления двигателем. 2016; 2016: 85–98. doi: 10.1016/b978-0-12-800384-8.00005-3. [Перекрестная ссылка] [Академия Google] 7. Профета В.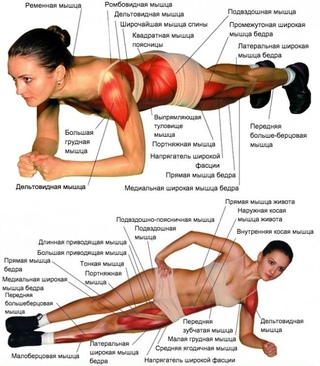 Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0.
Л., Турвей М.Т. Уровни конструкции движения Бернштейна: современная перспектива. Гум. Мов. науч. 2018;57:111–133. doi: 10.1016/j.humov.2017.11.013. [PubMed] [CrossRef] [Google Scholar]8. Карпентер Р., Редди Б. Нейрофизиология: концептуальный подход.КПР Пресс; Бока-Ратон, Флорида, США: 2012. [Google Scholar]9. Кеннет Ф., Свайман Дж. П. Детская неврология Сваймана. 6-е изд. Эльзевир; Амстердам, Нидерланды: 2017. Нарушения мышечного тонуса и походки. [Google Академия] 11. Барретт К., Барман С., Бойтано С., Обзор медицинской физиологии Брукса Х. Ганонга. 25-е изд. Макгроу-Хилл; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]12. Халтборн Х., Линдстрем С., Вигстрем Х. О функции рекуррентного торможения в спинном мозге. Эксп. Мозг Res. 1979; 37: 399–403.doi: 10.1007/BF00237722. [PubMed] [CrossRef] [Google Scholar] 13. Халтборн Х. Передача пути реципрокного торможения Ia мотонейронам и его контроль во время тонического рефлекса растяжения. прог. Мозг Res. 1976; 44: 235–255. doi: 10.1016/s0079-6123(08)60736-0. [PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С.
[PubMed] [CrossRef] [Google Scholar] 14. Рудомин П., Шмидт Р.Ф. Пресинаптическое торможение в спинном мозге позвоночных. Эксп. Мозг Res. 1999; 129:1–37. doi: 10.1007/s002210050933. [PubMed] [CrossRef] [Google Scholar] 15. Доу Р.S. Некоторые аспекты физиологии мозжечка. Дж. Нейрохирург. 1961; 18: 512–530. doi: 10.3171/jns.1961.18.4.0512. [PubMed] [CrossRef] [Google Scholar] 16. Гилман С. Механизм мозжечковой гипотонии. Мозг. 1969; 92: 621–638. doi: 10.1093/мозг/92.3.621. [PubMed] [CrossRef] [Google Scholar] 18. Лэнс Дж. Симпозиум Синопсис. Ежегодник Медицинских Издателей; Чикаго, Иллинойс, США: 1980. Спастичность: нарушение моторного контроля. [Google Академия] 19. Берридж Дж., Вуд Д., Херменс Х.Дж., Воерман Г., Джонсон Г., Ван Вийк Ф., Платц Т., Грегорик М., Хичкок Р., Пандян А. Теоретические и методологические аспекты измерения спастичности. Инвалид. Реабилит. 2005; 27: 69–80. doi: 10.1080/09638280400014592. [PubMed] [CrossRef] [Google Scholar] 20. Дресслер Д., Бхидаясири Р., Болега С. , Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г.
, Чана П., Чиен Х.Ф., Чанг Т.М., Колозимо К., Эбке М., Федорофф К., Франк Б. и др. Определение спастичности: новый подход, учитывающий текущую терминологию двигательных расстройств и терапию ботулотоксином. Дж. Нейрол. 2018; 265: 856–862.doi: 10.1007/s00415-018-8759-1. [PubMed] [CrossRef] [Google Scholar] 21. Берк Д., Ноулз Л., Эндрюс С., Эшби П. Спастичность, децеребрационная ригидность и феномен складного ножа: экспериментальное исследование у кошек. Мозг. 1972; 95: 31–48. doi: 10.1093/мозг/95.1.31. [PubMed] [CrossRef] [Google Scholar] 22. Элдред Э., Гранит Р., Мертон П.А. Супраспинальный контроль мышечных веретен и его значение. Дж. Физиол. 1953; 122: 498–523. doi: 10.1113/jphysiol.1953.sp005017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23.Дитунно Дж.Ф., Литтл Дж.В., Тесслер А., Бернс А.С. Новый взгляд на спинальный шок: четырехэтапная модель. Спинной. Шнур. 2004; 42: 383–395. doi: 10.1038/sj.sc.3101603. [PubMed] [CrossRef] [Google Scholar] 24. Маккауч Г.П., Остин Г. М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом. Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)
М., Лю С.Н., Лю С.Ю., Лю С.Н., Лю С.Ю. Прорастание как причина спастичности. Дж. Нейрофизиол. 1958; 21: 205–216. doi: 10.1152/jn.1958.21.3.205. [PubMed] [CrossRef] [Google Scholar] 25. Елбасьюни С.М., Мороз Д., Бакр М.М., Мушахвар В.К. Лечение спастичности после травмы спинного мозга: современные методы и направления на будущее.Нейрореабилитация. Нейронный ремонт. 2010; 24:23–33. doi: 10.1177/1545968309343213. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Берк Д., Эшби П. Подавляются ли спинальные «пресинаптические» тормозные механизмы при спастичности? Дж. Нейрол. науч. 1972; 15: 321–326. doi: 10.1016/0022-510X(72)-1. [PubMed] [CrossRef] [Google Scholar] 27. Крон К., Нильсен Дж. Центральный контроль дисинаптического взаимного торможения у людей. Акта Физиол. Сканд. 1994; 152: 351–363. doi: 10.1111/j.1748-1716.1994.tb09817.x. [PubMed] [CrossRef] [Google Scholar] 28.Crone C., Petersen NT, Giménez-Roldan S., Lungholt B., Nyborg K., Nielsen J.B. Снижение реципрокного торможения наблюдается только в спастических конечностях у пациентов с нейролатиризмом. Эксп. Мозг Res. 2007; 181:193–197. doi: 10.1007/s00221-007-0993-1. [PubMed] [CrossRef] [Google Scholar] 29. Pierrot-Deseilligny E., Katz R., Morin C. Доказательства ингибирования lb у людей. Мозг Res. 1979; 166: 176–179. doi: 10.1016/0006-8993(79)