Миофибриллы
Миофибриллы
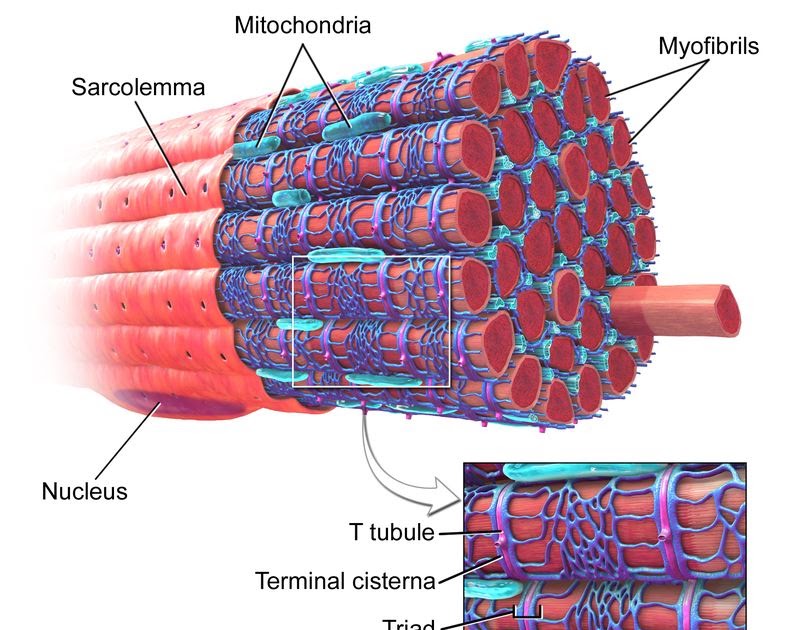
Поперечная исчерченность волокон скелетной и сердечной мышц обусловлена особым распределением в их цитоплазме многочисленных толстых и тонких «нитей» (филаментов), объединяющихся в цилиндрические пучки диаметром 1-2 мкм, — миофибриллов ( рис. 30.4 ). Мышечное волокно практически заполнено миофибриллами, они тянутся по всей его длине и на обоих его концах соединены с сухожилиями .
Миофибриллы — цилиндрические нити толщиной 1 — 2 мкм, идущие вдоль от
одного конца мышечного волокна до
другого. Изолированная миофибрилла способна сокращаться в присутствии АТФ , именно она и есть сократимый
элемент мышечной клетки .
Миофибриллы содержат сократительные- элементы —
миофиламенты
, среди которых различают
толстые (миозиновые)
, занимающие диск А, и
тонкие (актиновые)
, лежащие в диске I и прикрепляющиеся к телофрагмам, причем концы их
проникают в диск А между толстыми филаментами.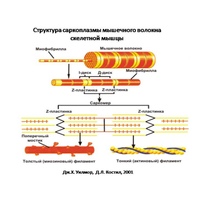
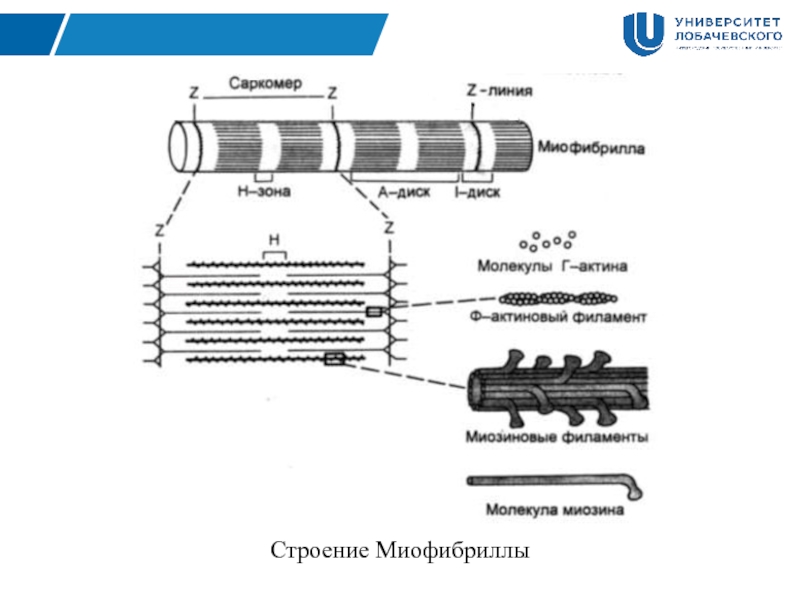
Сократимые единицы миофибрил легко различимы в световом микроскопе, именно они обусловливают полосатость скелетных мышц . Каждая из таких единиц — саркомеров — имеет длину около 2,5 мкм. Границы саркомеров в соседних миофибриллах совпадают, поэтому вся мышечная клетка приобретает регулярную исчерченность. На продольном срезе мышцы при большом увеличении в пределах каждого саркомера видны чередующиеся светлые и темные полосы. Темные полосы называются А-дисками , светлые — I-дисками . Плотная линия в центре I-диска, отделяющая один саркомер от другого, называется Z-линией , или Z-диском . См. рис.1-6А миофибрилла сердечной мышцы
Каждый саркомер состоит из множества параллельных белковых филаментов (нитей). Существуют
филаменты двух типов — толстые
(длиной около 1,6 мкм м толщиной 15 нм), которые тянутся от одного края
А-диска до другого, и тонкие
(длиной около 1 мкм и толщиной 8 нм), которые идут от Z-линии через I-диск
и заходят в А-диск в промежутки между толстыми филаментами.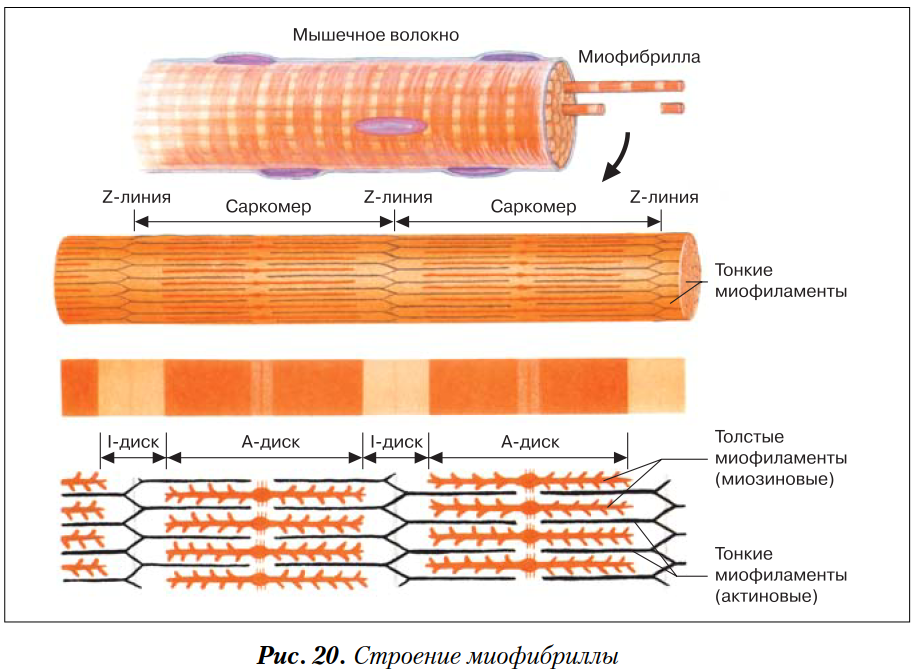
При мышечном сокращении каждый саркомер укорачивается пропорционально всей мышце. Например, если миофибрилла , состоящая из 20 тыс. саркомеров, укоротится с 5 до 4 см, (т.е. на 20%), то длина каждого саркомера уменьшится соответственно с 2,5 до 2 мкм.
При
уменьшении длины саркомера сжимается только I-диск , тогда как плотный А-диск не изменяет своих размеров.
Это легко объяснить, предположив, что сокращение миофибрилы происходит в
результате скольжения толстых филаментов относительно тонких, причем длина
тех и других остается неизменной. Эта модель скользящих нитей
подтверждается экспериментальными данными. Электронно — микроскопические
исследования показали, что укорочение мышцы не сопровождается изменением
собственной длины филаментов. Судя по данным ренгеноструктурного анализа,
характер упаковки субъединиц, образующих филаменты обоих типов, также не
изменяется.
При помощи электронного микроскопа удалось увидеть на толстых филаментах множество боковых отростков, образующих поперечные мостики между толстыми филаментами и расположенными на расстоянии 13 нм от них тонкими филаментами. В настоящее время известно, что при сокращении мышцы толстые и тонкие нити перемещаются относительно друг друга именно с помощью этих поперечных мостиков, которые работают циклично. Взаимодействующие белки толстых и тонких филаментов были выделены и получили названия соответственно миозин и актин .
Кроме них, в миофибриллах имеется еще целый ряд вспомогательных белков. Предполагается, что белок альфа-актинин обеспечивает надлежащую упаковку филаментов в саркомере , а десмин связывает между собой соседние саркомеры.
См. « Скелетные мышцы: структура «.
Аденилосукцинатлиаза (4.3.2.2)
Ссылки:
Все ссылкиСтроение и принцип работы скелетных мышц
На основе: http://tvoytrening. ru/2/2-mishci
ru/2/2-mishciМышечная ткань скелетной мускулатуры представляет собой клеточную структуру. Но у мышечных клеток есть отличия от обычных клеток, состоящих, как правило, из ядра, цитоплазмы, органелл в ней и мембраны (клеточной оболочки). Во-первых, мышечная клетка имеет многоядерное строение, причем ядра расположены на периферии клетки, а во-вторых, она наполнена сократительными структурами – миофибриллами. Назначение миофибрилл – стягивание мышечного волокна под действием нервного импульса.
Миофибрилла включает огромное количество нитей двух белков: миозина (темные полосы — А-диск) и актина (светлые полосы — I-диск), которые располагаются вдоль миофибриллы. Причем, миозин – толстые нити, а актин – тонкие нити. Этим и объясняется светло-темное полосатое строение миофибриллы.
Этим и объясняется светло-темное полосатое строение миофибриллы.
Актиновые нити крепятся к так называемой Z-линии, которая расположена в центре I-диска. Сегмент миофибриллы между Z-линииями, включающий миозиновый А-диск называется саркомером, который можно считать некой сократительной единицей миофибриллы.
Мышечные клетки образуют пучки, из которых, собственно, и состоят мышцы. Каждая мышечная клетка в таком пучке окружена соединительной тканью. В ней находятся лимфатические сосуды, кровеносные сосуды и нервные волокна. Совокупность пучков мышечных клеток заключена в оболочке соединительной ткани. У основания мышцы, эта соединительная ткань образует сухожилия, посредством которых мышца крепится к кости. Усилие, создаваемое нашими мышцами, через сухожилия передается костям скелета, в результате чего наши кости перемещаются относительно друг друга – осуществляется движения.
Существует два типа мышечного волокна – красное и белое.
Красные волокна (малого диаметра) окружены огромным количеством капилляров, а названием своим обязаны белку миоглобину, повышенное содержание которого и придает волокну красный цвет.

Белые волокна (большего диаметра) содержат множество гранул гликогена, из которого образуется глюкоза. Они также получили название быстрые мышечные волокна.
Сокращение мышц происходит под воздействием нервных импульсов, поступающих от центральной нервной системы к нервным клеткам спинного мозга — мотонейронам, ответвления которых — аксоны подведены к мышце.
Каждый мотонейрон управляет группой мышечных клеток (в подчинении каждого мотонейрона находится только один тип мышечного волокна). Такие группы получили название – нейромоторные единицы, благодаря которым человек может задействовать в работе часть мышцы. Поэтому, человек может сознательно контролировать скорость и силу сокращения мышц.
Как только нервный импульс через мотонейрон подается в мышцу, происходит смена полярности заряда мембраны мышечной клетки, в результате чего саркоплазма клетки насыщается ионами кальция (Ca++), которые высвобождаются из специальных хранилищ, находящихся вдоль каждой миофибриллы.
Тонкая нить актина представляет собой двойную спираль актиновых нитей, между которыми расположена двойная цепь тропомиозина. | |
Саркомер сокращается так: при помощи боковых ответвлений (мостиков) толстые нити миозина втягивают вдоль себя тонкие нити актина. |
Энергия для сократительных процессов в мышце берется при расщеплении молекулы аденезинтрифосфата (АТФ) головками миозиновых мостиков при взаимодействии с нитью актина. АТФ же — это внутриклеточный источник энергии, поддерживающий все процессы, происходящие в клетке.
 Органеллы клеток митохондрии обеспечивают энергетические процессы клетки, такие как окисление жирных кислот и углеводов. В ходе окисления происходит выделение энергии. Данная энергия направлена на объединение Аденезиндифосфата (АДФ) и третьей фосфатной группы, в результате чего и образуется АТФ.
Органеллы клеток митохондрии обеспечивают энергетические процессы клетки, такие как окисление жирных кислот и углеводов. В ходе окисления происходит выделение энергии. Данная энергия направлена на объединение Аденезиндифосфата (АДФ) и третьей фосфатной группы, в результате чего и образуется АТФ.В ходе распада АТФ выделяется ортофосфорная кислота, а АТФ превращается обратно в аденезиндифосфат (АДФ).
Содержание «запасных» молекул АТФ в нашем организме невелико и восполнение энергетических ресурсов в мышце осуществляется тремя основными путями:
1. Расщепление креатинфосфата. В ходе такой реакции, молекула креатинфосфата отдает свою фосфатную группу молекуле аденезиндифосфата (АДФ), в следствие чего АДФ снова превращается в АТФ, а креатинфосфат – в креатин.
Однако такая энергетическая подпитка длится весьма ограниченное время, поддерживая энергетический баланс мышц лишь в самом начале их работы. Связано это с малым запасом креатинфосфата в мышечных клетках.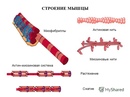 Далее в работу включаются гликолиз и окисление в митохондриях.
Далее в работу включаются гликолиз и окисление в митохондриях.
2. Гликолиз. В ходе данного химического процесса в мышце образуется две молекулы молочной кислоты – в результате распада молекулы глюкозы. Распад глюкозы происходит в саркоплазме при участии десяти специальных ферментов.
Распад одной молекулы глюкозы способен пополнить энергетические запасы двух молекул АТФ. Гликолиз весьма быстро восполняет мышечные запасы АТФ, т.к. происходит без участия кислорода (анаэробный процесс).
В мышечной ткани основной субстрат гликолиза – гликоген. Гликоген – сложный углевод, состоящий из разветвленных цепей глюкозных единиц. Основная масса углеводов в нашем организме накапливается в виде гликогена, сосредоточенного в скелетной мускулатуре и печени. Запасы гликогена во многом определяют объемы нашей мускулатуры и энергетический потенциал мышц.
3. Окисление органических веществ. Данный процесс происходит в митохондриях при участии кислорода (аэробный процесс), также для его протекания необходимо присутствие специальных ферментов. Доставка кислорода занимает определенное время, поэтому данный процесс запускается после расщепления креатинфосфата и гликолиза.
Доставка кислорода занимает определенное время, поэтому данный процесс запускается после расщепления креатинфосфата и гликолиза.
Окисление органических веществ осуществляется поэтапно: запускается процесс гликолиза, но еще несформировавшиеся молекулы молочной кислоты (молекулы пирувата) направляются в митохондрии для дальнейших окислительных процессов, в результате которых образуется энергия с выделением воды (Н2О) и углекислого газа (СО2). При помощи образовавшейся энергии формируется 38 молекул АТФ.
Если в результате анаэробного распада глюкозы (гликолиза) восстанавливается 2 молекулы АТФ, то аэробный процесс (окисление в митохондриях) способен восстановить в 19 раз больше молекул АТФ.Каждому типу мышечного волокна (красному, белому, смешанному) соответствует свой способ восстановления запасов АТФ, который преобладает над другими способами.
Красные мышечные волокна (медленные) восполняют свои запасы АТФ, в основном, путем окисления жирных кислот и углеводов в митохондриях мышечных клеток. Для поддержания работоспособности, им не требуется быстрое восполнение запасов АТФ. Соответственно, их можно назвать низко утомляемыми, что позволяет им довольно долго поддерживать небольшие усилия.
Для поддержания работоспособности, им не требуется быстрое восполнение запасов АТФ. Соответственно, их можно назвать низко утомляемыми, что позволяет им довольно долго поддерживать небольшие усилия.
В белых мышечных волокнах (быстрых) энергия расходуется значительно быстрее, поэтому здесь необходим быстрый способ восполнения АТФ – гликолиз. Гликолиз, протекает без участия кислорода, что ускоряет воспроизводство энергии в мышце, однако конечным продуктом гликолиза является молочная кислота, которая служит причиной быстрой утомляемости белого мышечного волокна.
В смешанном типе волокон запасы АТФ пополняются окислительно-гликолитическим путем.
Сила и скорость сокращения мышцы взаимосвязаны: чем выше скорость сокращения, тем меньше его сила. При фиксированном положении мышцы (статическое напряжение) сила волокна увеличивается. А при негативных движениях мышцы (когда волокно удлиняется), сила волокна максимальна.
Соответственно, чем большую нагрузку Вы приложите к мышце, тем медленнее она будет сокращаться.
Высокая сила мышцы при статической нагрузке и негативном движении объясняется тем, что миозиновые мостики еще находятся в зацеплении с нитью актина и, как бы, оказывают сопротивление обратному движению, тем самым поддерживая нагрузку, не давая мышце мгновенно расслабиться.
Организм автоматически определяет степень нагрузки и подключает сначала медленные волокна, а при дальнейшем росте нагрузки – быстрые, вплоть до утомления мышц и прекращения работы.
В нашем организме предусмотрены механизмы защиты от чрезмерных мышечных напряжений – это сухожильные рецепторы (органы Гольджи), которые при критических нагрузках «останавливают» мотонейроны во-избежании травм. Сухожильные рецепторы блокируются лишь в экстремальных условиях, тогда мышцы способны преодолевать «нечеловеческие» нагрузки.
Как работает мышечное волокно?
Хорошие результаты в бодибилдинге, вопреки расхожему мнению, возможны только при наличии знаний касающихся основных биохимических процессов организма.
Принято считать, что для увеличения мускулатуры достаточно регулярно посещать тренажерный зал, выполняя сгибания и разгибания конечностей с тем или иным отягощением. Увы, не все так просто, как кажется на первый взгляд.
Для получения желаемого телосложения, прежде всего, необходимо овладеть базовой теорией, как и в любом другом виде спорта. Одной из основополагающих тем является работа мышечного волокна.
Мышечное волокно (мышечная клетка, симпласт) – это своеобразный «цилиндр», который заполнен огромным количеством внутренних органов, таких как митохондрии, лизосомы, ферменты, рибосомы, и, конечно же, миофибриллы.
Довольно часто мышечную клетку представляют как огромное количество пучков миофибрилл. Их особое строение позволяет нашим мышцам сокращаться и расслабляться. Рассмотрим этот процесс более подробно.
Миофибриллы – это сократительные элементы с особым строением клеток. Их главное свойство – возможность менять свою длину. Общее число миофибрилл в одном волокне может достигать нескольких тысяч.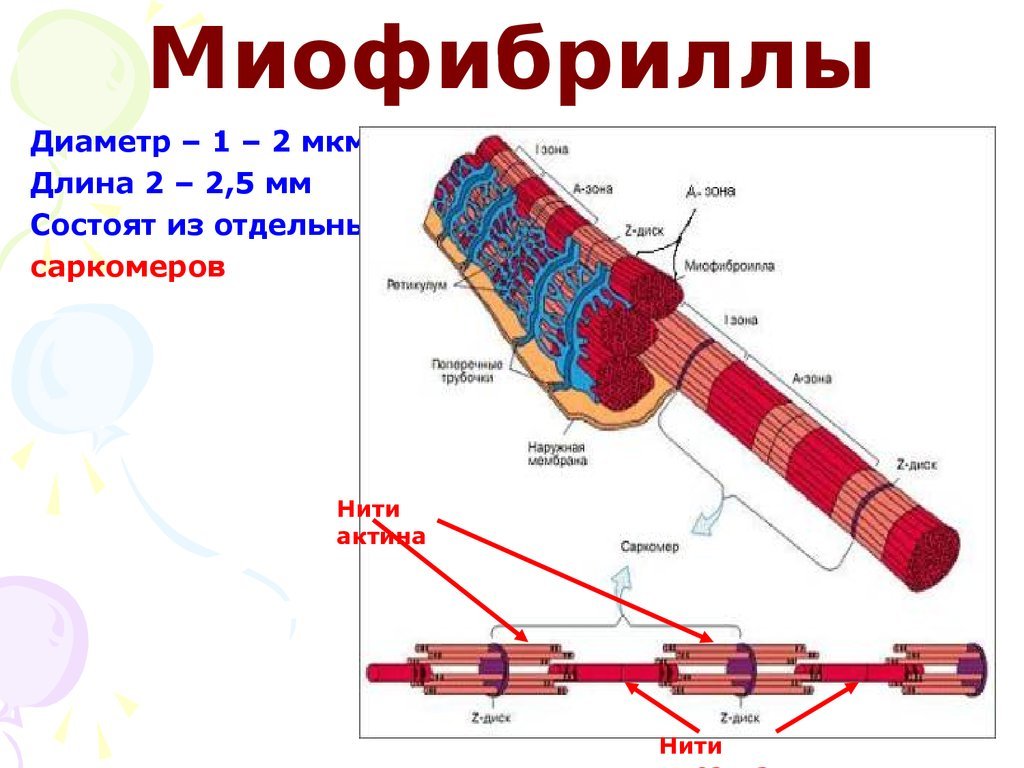
Основные элементы миофибрилл — актин и миозин
Сами миофибриллы представлены толстыми (миозин) и тонкими белковыми нитями (актин). Темный участок одной миофибриллы, окруженный вокруг двумя светлыми участками принято называть саркомером.
Сокращение мышц происходит благодаря уменьшению длины саркомера. Дело в том, что миозин содержится только в темных участках, в светлых — он попросту отсутствует.
Изменение структуры саркомера происходит довольно простым способом: тонкие нити актина втягиваются между толстыми нитями миозина.
Скольжение вдоль возможно благодаря особым боковым ответвлениям миозина – мостикам белковой структуры. Грубо говоря, данные мостики проталкивают нить актина между миозиновыми волокнами. Смотрите видео:
Увы, это лишь общий взгляд на механизм работы мышечной клетки. Для более детального анализа следует рассмотреть этот процесс более подробно. Актин – это лишь условное название спирали закрученной из двух нитей тонкого типа.
Актин – это лишь условное название спирали закрученной из двух нитей тонкого типа.
Представьте аналогию с обыкновенной греблей на байдарках или каноэ. Тонкая нить актина в этом случае будет олицетворять плот с веслами. В то же время вода – это грубый пример толстых нитей миозина.
Для того чтобы продвинуться вперед, спортсменам на каноэ нужно производить гребковые поступательные движения. Аналогичное действие выполняет актин, с той лишь разницей, что как таковых весел у него нет.
Мостики располагаются на миозиновых нитях. Головки таких ответвлений при контакте с актином меняют свой угол, то есть проталкивают светлую нить вперед, так же как и вода позволяет байдарке плыть. Стоит отметить, что движения мостиков миозина происходят хаотично, т.е. полностью асинхронно. Именно так в общих чертах выглядит сокращение саркомера.
Также следует отметить, что в двойной спирали актина залегает другая двойная спираль меньшего размера, ее называют тропомиозином. В состоянии покоя именно тропомиозин мешает сцеплению актина с миозином. Без него, человек не смог бы контролировать сокращение тех или иных мышц. Грубо говоря, это предохранитель, снять который можно лишь при помощи сигналов ЦНС.
В состоянии покоя именно тропомиозин мешает сцеплению актина с миозином. Без него, человек не смог бы контролировать сокращение тех или иных мышц. Грубо говоря, это предохранитель, снять который можно лишь при помощи сигналов ЦНС.
Создавая тот или иной частотный импульс, вы передаете его по каналам в мотонейроны, а оттуда он по аксонам поступает к мышце. Такой сигнал меняет полярность отсеков заполненных ионами кальция, расположенных вдоль всей миофибриллы.
Высвободившиеся ионы кальция (Ca++) вынуждают тропомиозин сократить свою длину, вследствие чего появляется место для сцепления актина и миозина.
Стоит отметить, что кальций буквально с первых секунд начинает возвращаться обратно в отсеки хранения. Вследствие чего концентрация его ионов в саркоплазме стремительно падает, а это ведет к постепенному удлинению тропомиозина. Именно так прекращается сокращение мышечной группы.
Во время выполнения упражнения, ЦНС посылает множество сигналов, каждый из которых вновь высвобождает кальций.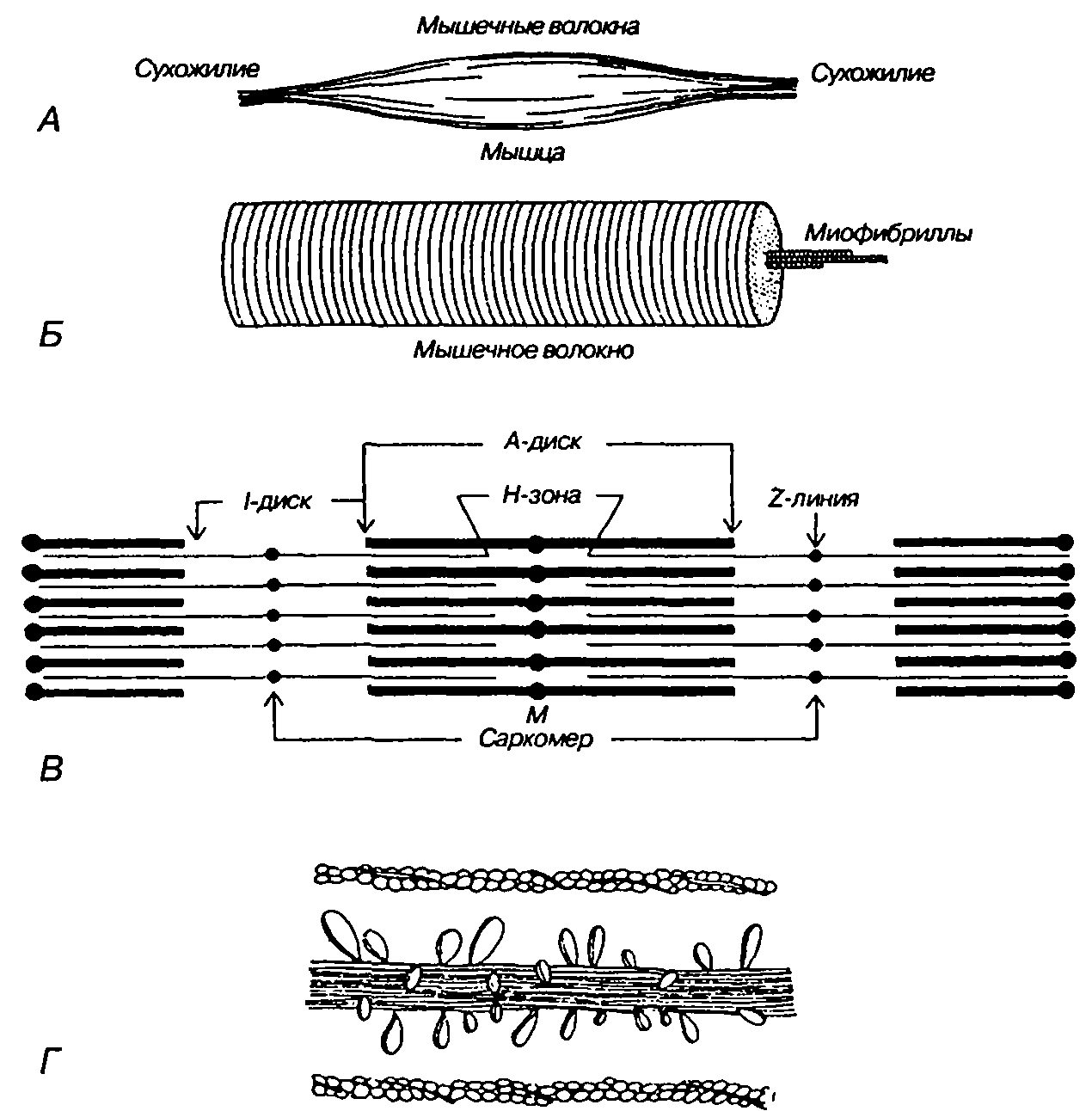 При довольно сильной частоте (более 20 Гц) все отдельные сокращения сливаются в одно непрерывное движение, которое известно в физиологии как тетанус – безостановочная работа мышц в любой фазе движения.
При довольно сильной частоте (более 20 Гц) все отдельные сокращения сливаются в одно непрерывное движение, которое известно в физиологии как тетанус – безостановочная работа мышц в любой фазе движения.
Энергетический обмен
Разумеется, на все вышеперечисленные процессы нужна энергия, а как известно, универсальным «топливом» являются молекулы АТФ (аденозинтрифосфата).
Миозиновые мостики на конце имеют так называемую головку, которая обладает АТФазной активностью, то есть она может расщеплять АТФ и получать таким образом энергию. Стоит отметить, что она несет в себе заряд АТФ еще до контакта с актином.
При сокращении мышечной группы происходит высвобождение АТФ за счет гидролиза, что способствует соответствующему изменение угла мостика. Именно это заставляет актин двигаться вперед.
Для того чтобы продолжить движение, нить актина должна отцепить от себя недавно прикрепленные мостики миозина, а на это разумеется, нужна энергия.
Увы, весь имеющийся запас АТФ тратится на сцепление тонкой и толстой нити. Для того чтобы отделиться актин использует АТФ полученный благодаря системе креатинфосфата (КрФ) или гликолиза, т.е. не из головки миозина.
Необходимо понимать, что радиус действия АТФазы миозиновой головки ограничен, и низкий уровень КрФ колоссально замедляет процесс последующего движения нити актина. В то же время, наличие множества свободного АТФ, которое наблюдается при высоком уровне КрФ, позволяет актину выполнять быстрое движение вперед, без всевозможных задержек. Именно так количество АТФ и КрФ влияет на силу человека.
При наличии огромного количества энергетических фосфатов, актин за единицу времени может преодолеть гораздо большее расстояние, так как практически не тратит время на отсоединение мостиков миозина. При равной нагрузке, мышечной волокно с высоким уровнем АТФ всегда будет сильнее.
Практические выводы
Многим читателям вышеприведенная теория покажется абсолютно бесполезной в свете их основной цели – построение невероятных мышечных объемов.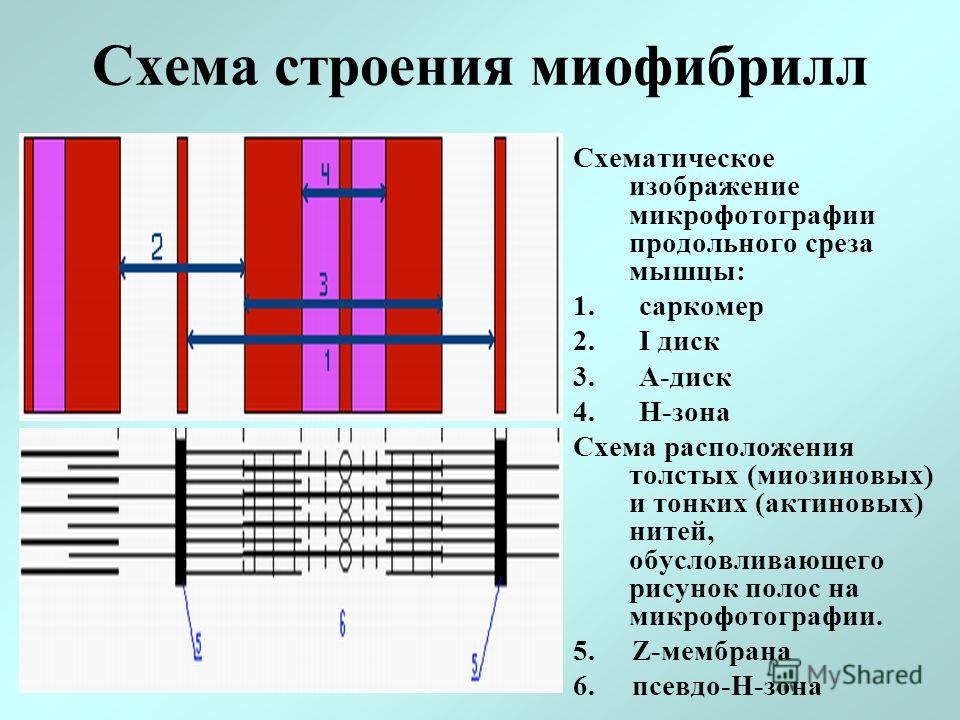 Однако такое суждение будет ошибочным. Как вы наверняка знаете, цель любой тренировки заключается в банальном нанесении травм мышечному волокну на клеточном уровне, но мало кто знает, что на самом деле является такой травмой. На данный момент одной из самых основных гипотез является теория повреждения миозиновых мостиков.
Однако такое суждение будет ошибочным. Как вы наверняка знаете, цель любой тренировки заключается в банальном нанесении травм мышечному волокну на клеточном уровне, но мало кто знает, что на самом деле является такой травмой. На данный момент одной из самых основных гипотез является теория повреждения миозиновых мостиков.
Как уже говорилось выше, для отцепления от актина мостиков миозина нужна энергия. Однако, что будет, если этой энергии нет?!
Такую картину можно наблюдать при достаточно большом рабочем весе, который за считанные секунды тратит весь запас КрФ. Итогом такого дефицита энергии станет обыкновенный отказ мышцы!
Проанализировав этот процесс на клеточном уровне, эксперты обнаружили, что не отсоединённые мостики попросту ломаются во время тренировки, ведь нить актина в любом случае вернется в исходную позицию. Принято считать, что именно такие повреждения ведут к заветным микротравмам, которые впоследствии вызывают рост мышц.
На эту гипотезу опираются все те, кто верят в феномен гиперплазии – увеличение числа мышечных клеток. Считается, что такие травмы ведут к самой агрессивной адаптационной реакции – высвобождению клеток сателлитов (миобластов), которые перерождаются и тем самым создают новое мышечное волокно. К сожалению, прямых доказательств существования или отсутствия таких процессов пока нет. Наука попросту не шагнула настолько далеко.
Считается, что такие травмы ведут к самой агрессивной адаптационной реакции – высвобождению клеток сателлитов (миобластов), которые перерождаются и тем самым создают новое мышечное волокно. К сожалению, прямых доказательств существования или отсутствия таких процессов пока нет. Наука попросту не шагнула настолько далеко.
Страница не найдена |
Страница не найдена | 404.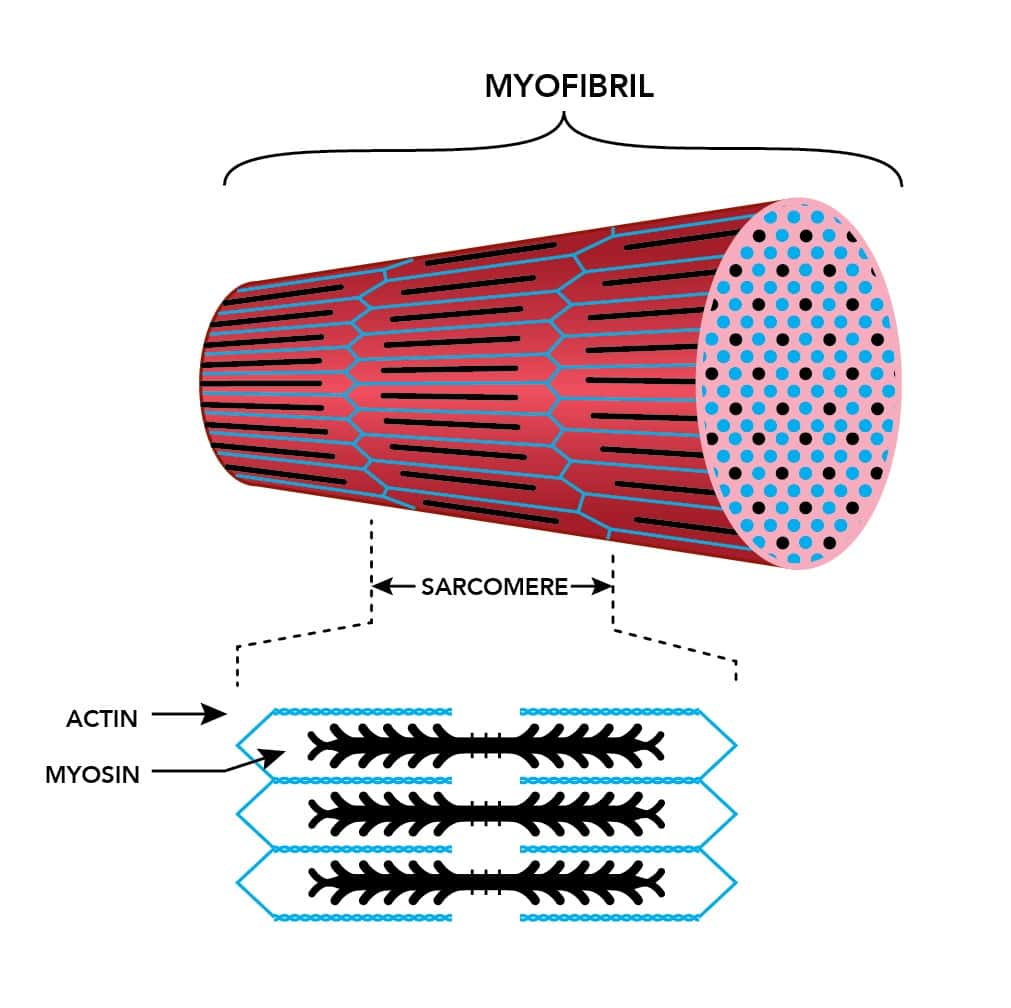 Страница не найдена
Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
22232425262728
2930
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Урок на тему » Строение мышечные волокна»
Урок на тему: «Строение мышечной ткани».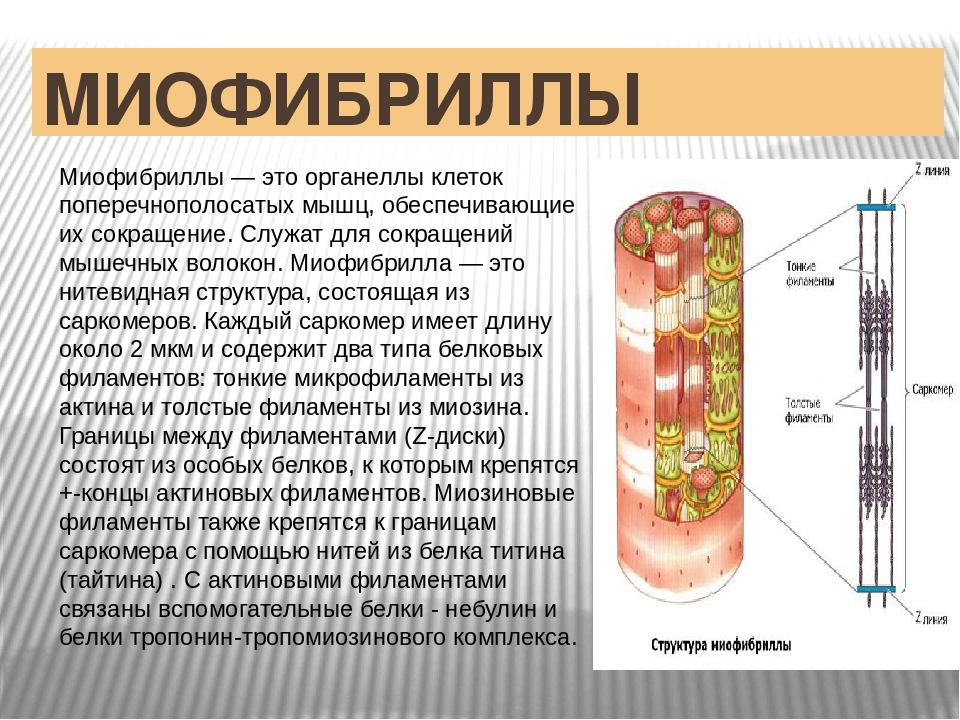
Класс: 10
Учитель КГУ «Средняя школа № 26» города Актобе : Жалгасбаева Венера Аскаровна
Здравствуйте ребята!
Слайд 1.
Тема нашего урока «Строение поперечно- полосатой мышечной ткани. Структура миофибрилл(зоны , диски, саркомеры, актин, миозин»
Слайд 2.
Сегодня вы узнаете Строение поперечно- полосатой мышечной ткани. Структура миофибрилла (зоны , диски, саркомеры, актин, миозин»
Вы научитесь исследовать ультраструктуру поперечно – полосатых мышц.
Слайд 3.
Эпиграфом к нашему уроку хочу предложить слова знаменитого философа Оливера Уэнделла Холмса «Главное в этом мире не то, где мы стоим, а то, в каком направлении движемся.»
Слайд 4.
Движения постоянно окружают нас. А благодаря чему человек движется? правильно Благодаря мышцам
Слайд 5
В организме человека различают 3 вида мышечной ткани. Скелетную,гладкую..поперечно-полосатую
Скелетную,гладкую..поперечно-полосатую
Слайд 6
.Мышечные ткани— это ткани, для которых способность к сокращению является главным свойством.) Благодаря данной способности, мышечные ткани беспечивают: изменение положения в пространстве частей тела или тела в целом, а также изменение формы и объёма отдельных органов.
Слайд 7.
1.Состоят из множества мышечных волокон или мышечных клеток
2.Имеют цилиндрическую форму и располагаются параллельно друг другу.
3.Многоядерные клетки.
4.Ядра в волокне расположены около его поверхности.
5.Пучки мышечных волокон окружены коллагеновыми волокнами.
Слайд 8
В скелетных мышцах волокна – это многоядерные симпласты. Поэтому для них вместо термина «цитоплазма» используется термин «саркоплазма«Поперечная исчерченность обусловлена тем, что значительную часть объёма каждого волокна составляют миофибриллы — специальные сократительные органеллы с регулярно повторяющейся организацией и располагающиеся вдоль длинной оси волокна.
Слайд 9
Рассмотрим строение мышечной клетки. Саркоплазма-цитоплазма гладко мышечных клеток, поперечнополосатых и сердечных мышечных волокон. Сарколемма- по строению схожа с обычной плазматической мембранной. Саркомер –это структурная единица миофибриллы, главная функция которого превращение химической энергии в мышечное сокращение. Миофибрилла— специальные сократительные органеллы.
Слайд 10.
Каждая миофибрилла состоит в среднем из 2500 протофибрилл. Толстые протофибриллы состоят из белка миозина, а тонкие из белка актина.
Слайд 11.
Белки в миофибрилле чередуются ,что создает поперечную исчерченность. Актиновые и миозиновые участки соседних миофибрилл располагаются напротив друг друга и образуют светлые диски ( изотропные)-актиновые и темные ( анизотропные диски)-миозиновые.
Слайд 12.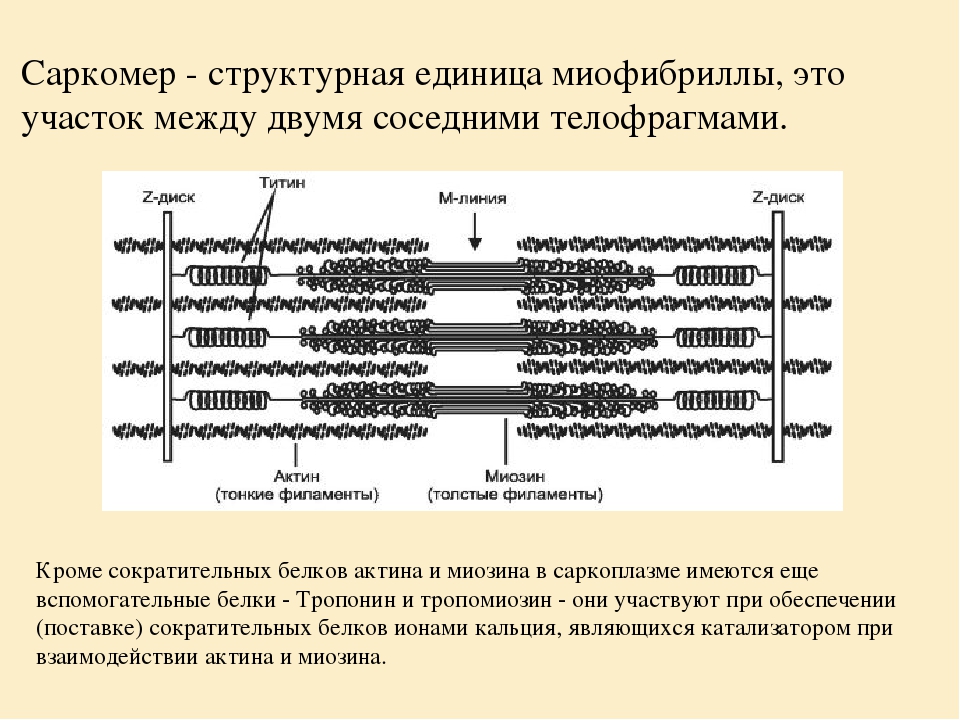
В свою очередь миофибриллы состоят из белковых нитей 2 х типов: тонких (актиновых )миофилламентов и толстых ( миозиновых) миофилламентов
Слайд 13 .
Давайте, посмотрим как выглядит молекула Миозина (толстого филамента).Молекула миозина состоит из 2 –х частей : длинного палочкообразного «хвоста» и присоединенного к одному из концов глобулярного участка, который представлен 2-мя одинаковыми « головками»Молекулы миозина расположены в миозиновой нити таким образом , что головки распределяются по всей ее длине, кроме небольшого срединного участка,где их нет.Там где нити актина и миозина перекрываются ,миозиновые головки могут прикрепляться к актиновым нитям, в результате происходит укорочение мышцы Молекула Актина- образована 2мя спиральными тяжами из глобулярных молекул актина(G- актина).,закрученными один вокруг другого.Весь комплекс актиновых молекул называется фибриллярным актином .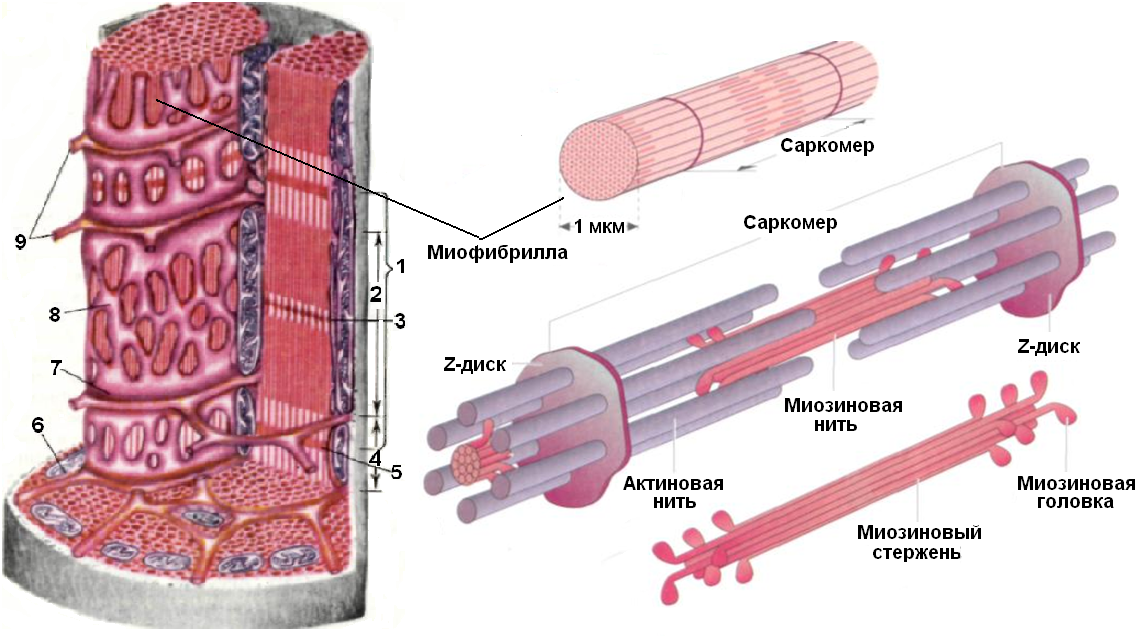 (F-актином).С каждой молекулой F-актина связана молекула АТФ.
(F-актином).С каждой молекулой F-актина связана молекула АТФ.
Актиновые филаменты состоят из F-актина,и 2-х вспомогательных белков тропонина и тропомиозина.Тропонин- глобулярный белок, состоящий из 3 х субъединиц. Тропонина С –который образует связь с ионами кальция.Тропонин Т- соединяет тропонин с тропомиозином и Тропонин который блокирует образование мостовидных связей между миозином и актином.
А тропомиозин служит для включения и выключения сократительного механизма.В мышечном волокне содержатся и другие белки.Их функцией является поддержание структурной организации внутренних компонентов мышечного волокна.
Слайд 14. Поперек волокон и между миофибриллами проходит система трубочек, называемая Т- системой.В плазмалемме они образуют глубокие каналообразные выпячивания.Они идут в поперечном направлении вокруг миофибрилл.В области Т-трубочек участки ретикулума расширяются в конечные цистерны.Цистерны сопровождают каждую Т – трубочку с двух сторон. Комплекс из 1 трубочки и 2-х цистерн называются триадой.Цистерны участвуют в захвате и высвобождении ионов кальция ,концентрация которых влияет на сократительную функцию.
Комплекс из 1 трубочки и 2-х цистерн называются триадой.Цистерны участвуют в захвате и высвобождении ионов кальция ,концентрация которых влияет на сократительную функцию.
Слайд 15.Миофибриллы разделены на диски –правильно чередующиеся участки.Под микроскопом мы видим чередование темных и светлых участков..Темный участок называется анизотропным.и обозначается буквой А.Светлый участок называют изотропным диском и обозначается буквой I.В середине участка А проходит светлая полоса Н.А посередине диска I- темная полоса Z.Участок между 2- мя линиями Z называется саркомером.
Слайд 16.Давайте закрепим наши знания.
— Что такое миофибриллы?.Правильно – это специальные сократительные органеллы
Актин – это? Правильно.Это тонкий филамент.
Миозин – это …правильно…. толстый филамент.
Саркомер – это….правильно..участок между 2- мя линиями Z
Слайд 17. А теперь Факты о мышцах. Всего в человеческом теле 640 мышц.
А теперь Факты о мышцах. Всего в человеческом теле 640 мышц.
Самой выносливой мышцей в нашем теле является сердце.
Самая сильная мышца — это язык.
Самая быстрая мышца в теле человека — та, что отвечает за моргание.
Мы можем выражать чувства благодаря мышцам лица, причём они формируются ещё до нашего рождения.
Полное восстановление мышц после нагрузок происходит спустя 44-48 часов
Слайд 18. Когда мы ходим прогулочным шагом, задействованы порядка 200 мышц. ..
У некоторых людей есть рудиментарная мышца на ладони, такая же, какая есть, например, у кошек, которые с её помощью убирают и выпускают когти.
Примерно половина всей энергии, которую мы потребляем ежедневно, уходит на работу мускулатуры.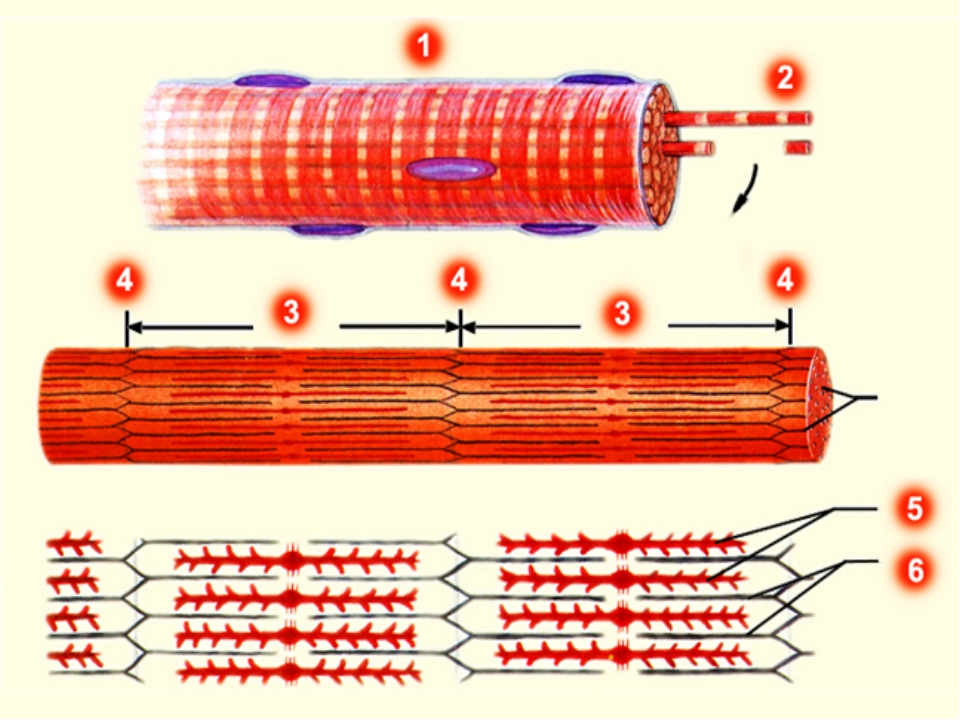
Когда человек улыбается — работают 17 мышц, когда злится — 43.
Когда человек злится или плачет, задействуется втрое больше мышц, чем когда он улыбается.
2.Задание на закрепление :
1.Заполнить таблицу. « Отличительные особенности молекул актина и миозина»
№п.п | Актин | Миозин |
2.Что происходит при сокращении мышечных волокон?.Охарактеризуйте механизм сокращения волокон.
Домашнее задание : параграф 111
3. Рефлексия. «Дерево пожеланий»
Рефлексия. «Дерево пожеланий»
На этом мы заканчиваем наш урок.
.
Тренировки по науке. Часть первая
Тренировки по науке. Часть первая
Автор: Антонов Андрей
Железный Мир. №3.2012г.
Сегодняшней
публикацией мы открываем цикл бесед с профессором
Виктором
Николаевичем Селуяновым
посвященный современным биологически обоснованным научным методам
тренировок. Сразу скажу, что многие поклонники «железной игры»
воспримут ряд положений в штыки. Слишком разительно отличаются
научные методы от общепринятых в силовом мире положений, считающихся
незыблемыми. С поразительной легкостью Виктор Николаевич разбивает
устоявшиеся стереотипы, но делает это с убийственной логикой,
основанной на глубоких знаниях анатомии, физиологии и биохимии. Поэтому не спешите бросать чтение, и возвращаться к трудам практиков.
Поверьте, наука, особенно, если она использует для вывода положений
умозрительные и математические модели, смотрит в «корень»,
объясняет причины явлений. Вот только связь передовой науки и
практики пока оставляет желать лучшего. Переиздаются давно морально
устаревшие учебники теории и методики физической культуры и спорта.
Труды Матвеева, Зациорского, Верхошанского, грешат эмпирическим
подходом, поэтому содержат формально-логические рекомендации без
биологического обоснования. И это не вина авторов, на момент
написания ими своих трудов не было такого объема биологической
информации, методов исследования, технического оборудования, как
сейчас, и им приходилось додумывать, выдвигать гипотезы, которые
потом перешли в разряд устоявшихся положений, хотя изначально они не
были обоснованы теоретически. И эти некорректные обобщения
переписываются из учебника в учебник на протяжении более полувека, а
современные научные биологические исследования так и остаются в
узкоспециализированных научных изданиях и не выходят не только на
массового читателя, но даже на издателей книг по спортивным темам.
Поэтому не спешите бросать чтение, и возвращаться к трудам практиков.
Поверьте, наука, особенно, если она использует для вывода положений
умозрительные и математические модели, смотрит в «корень»,
объясняет причины явлений. Вот только связь передовой науки и
практики пока оставляет желать лучшего. Переиздаются давно морально
устаревшие учебники теории и методики физической культуры и спорта.
Труды Матвеева, Зациорского, Верхошанского, грешат эмпирическим
подходом, поэтому содержат формально-логические рекомендации без
биологического обоснования. И это не вина авторов, на момент
написания ими своих трудов не было такого объема биологической
информации, методов исследования, технического оборудования, как
сейчас, и им приходилось додумывать, выдвигать гипотезы, которые
потом перешли в разряд устоявшихся положений, хотя изначально они не
были обоснованы теоретически. И эти некорректные обобщения
переписываются из учебника в учебник на протяжении более полувека, а
современные научные биологические исследования так и остаются в
узкоспециализированных научных изданиях и не выходят не только на
массового читателя, но даже на издателей книг по спортивным темам. И
пропасть между теорией – биологическими науками, и практикой
продолжает увеличиваться. Сегодня мы начнем с азов. Мы не будем
детально изучать строение, биологию и биохимию клетки, но ряд
основных положений нам надо разобрать, чтобы понимать, какие процессы
происходят в мышцах под воздействием различных тренировок. Надо
построить модели систем и органов человека и на этой основе описывать
и предсказывать адаптационные процессы. Итак, начнем…
И
пропасть между теорией – биологическими науками, и практикой
продолжает увеличиваться. Сегодня мы начнем с азов. Мы не будем
детально изучать строение, биологию и биохимию клетки, но ряд
основных положений нам надо разобрать, чтобы понимать, какие процессы
происходят в мышцах под воздействием различных тренировок. Надо
построить модели систем и органов человека и на этой основе описывать
и предсказывать адаптационные процессы. Итак, начнем…
Железный Мир: Виктор Николаевич, хотелось бы начать разговор с основных понятий, необходимых нам для понимания биологических процессов в мышце.
Виктор
Селуянов:
Начнем с клетки. Мышечная клетка, или как ее еще называют, мышечное
волокно представляет
собой большую клетку имеющую форму удлиненного цилиндра и по длине
чаще всего соответствующей длине целой мышцы и диаметром от 12 до 100
мкм.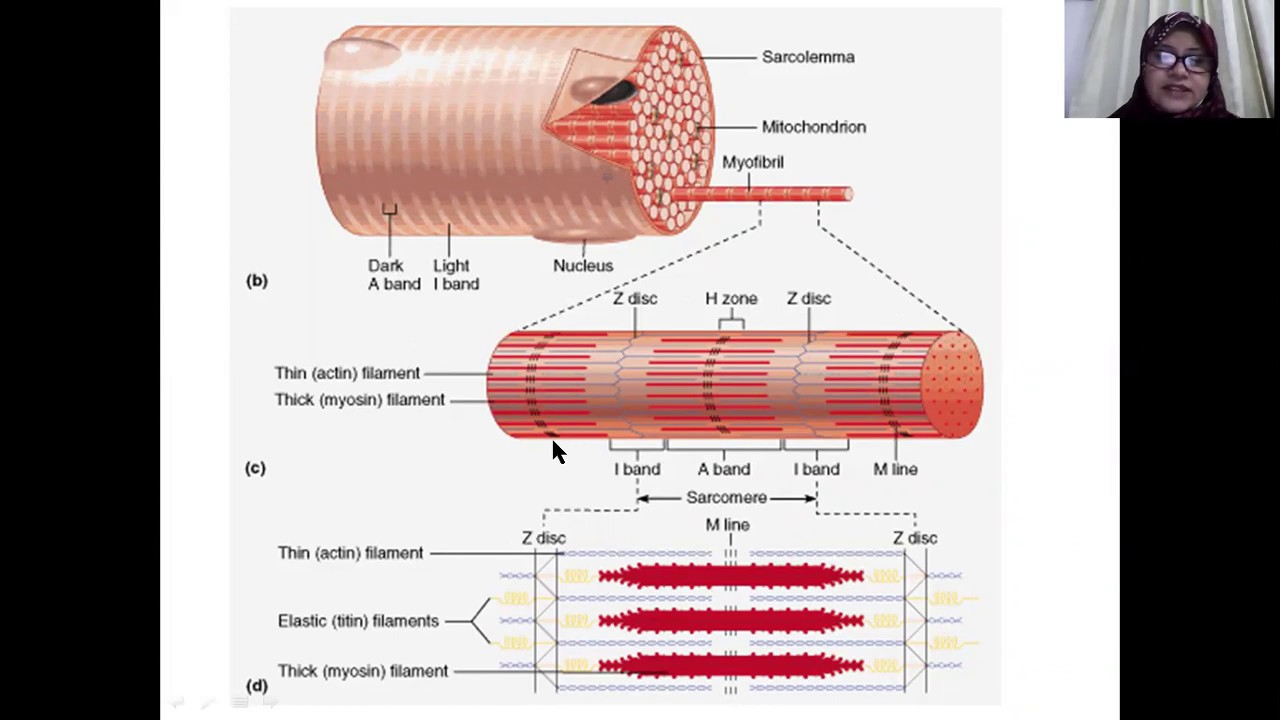 Группы мышечных волокон образуют пучки, которые, в свою очередь,
объединяются в целую мышцу, помещенную в плотный чехол соединительной
ткани, переходящей на концах мышцы в сухожилия, крепящиеся к кости.
Группы мышечных волокон образуют пучки, которые, в свою очередь,
объединяются в целую мышцу, помещенную в плотный чехол соединительной
ткани, переходящей на концах мышцы в сухожилия, крепящиеся к кости.
Сократительным
аппаратом мышечного волокна являются специальные органеллы —
миофибриллы,
которые у всех животных имеют примерно равное поперечное сечение,
колеблющееся от 0,5 до 2 мкм. Число миофибрилл в волокне достигает
двух тысяч. Состоят миофибриллы из последовательно соединенных
саркомеров, каждый из которых включает нити (миофиламенты) актина и
миозина. Миозин крепится к ЗЕТ пластинкам титином. При растяжении
мышцы титин растягивается и может порваться, что приводит к
разрушению миофибриллы, усилению катаболизма. Между филаментами
актина и миозина могут образовываться мостики и при затрате энергии,
заключенной в АТФ, может происходить поворот мостиков, т.е.
сокращение миофибриллы, сокращение мышечного волокна, сокращение
мышцы и разрыв его. Основная энергия молекул АТФ тратится именно на
разрыв мостиков. Мостики образуются в присутствии в саркоплазме ионов
кальция. Увеличение количества миофибрилл (гиперплазия) в мышечном
волокне приводит к увеличению поперечного сечения (гипертрофии), а,
следовательно, силы и скорости сокращения при преодолении
существенной внешней нагрузки. Удельная сила, приходящаяся на
поперечное сечение мышечных волокон у всех людей примерно одинаковая,
будь — то старушка или суперпаурлифтер.
Основная энергия молекул АТФ тратится именно на
разрыв мостиков. Мостики образуются в присутствии в саркоплазме ионов
кальция. Увеличение количества миофибрилл (гиперплазия) в мышечном
волокне приводит к увеличению поперечного сечения (гипертрофии), а,
следовательно, силы и скорости сокращения при преодолении
существенной внешней нагрузки. Удельная сила, приходящаяся на
поперечное сечение мышечных волокон у всех людей примерно одинаковая,
будь — то старушка или суперпаурлифтер.
Кроме миофибрилл огромное значение для нас имеют такие органеллы как митохондрии, энергетические станции клетки, в которых с помощью кислорода идет превращение жиров или глюкозы в углекислый газ (СО2), воду и энергию, заключенную в молекулах АТФ. Для увеличения мышечной массы и силы нам необходимо увеличивать количество миофибрилл в мышечных волокнах, а для увеличения выносливости – количество в них митохондрий.
ЖМ:
Расскажите об энергетике мышечных волокон.
ВС: Обычно описываются энергетические процессы в организме, т.е. весь организм представляется в виде пробирки, в которой разворачиваются биохимические процессы. Поэтому, логически корректно — в соответствии с принятой моделью, рождаются представления о МПК, АнП одинаковые для всех видов упражнений, а причиной появления АнП недостаток кислорода в крови. Однако, совершенно ясно, что биохимические процессы в организме идти не могут, они могут идти в определенных клетках. Поэтому интерпретация физиологических явлений с применением простейшей модели ведет к ошибочным представлениям. Увеличение сложности модели расширяет круг явлений, доступных к корректной интерпретации.
Биоэнергетические
процессы проходят в клетках. В клетке энергия используется только в
виде аденозинтрифосфорной кислоты (АТФ). Освобождение энергии
заключенной в АТФ, осуществляется благодаря ферменту АТФ-аза, которая
имеется во всех местах, где требуется энергия. Именно по активности
этого фермента в головках миозина мышечные волокна разделяют на
быстрые и медленные. Активность миозиновой АТФ-азы предопределена
ДНК, а информация о строительстве быстрой или медленной изоформы
АТФ-азы зависит от частоты приходящих к МВ импульсов от мотонейронов
спинного мозга. От размера мотонейрона зависит максимальная частота
импульсации, поскольку размер мотонейрона поменять невозможно, то
мышечная композиция наследуется и практически не меняется под
действием тренировочного процесса. С помощью электростимуляции можно
временно изменить мышечную композицию.
Именно по активности
этого фермента в головках миозина мышечные волокна разделяют на
быстрые и медленные. Активность миозиновой АТФ-азы предопределена
ДНК, а информация о строительстве быстрой или медленной изоформы
АТФ-азы зависит от частоты приходящих к МВ импульсов от мотонейронов
спинного мозга. От размера мотонейрона зависит максимальная частота
импульсации, поскольку размер мотонейрона поменять невозможно, то
мышечная композиция наследуется и практически не меняется под
действием тренировочного процесса. С помощью электростимуляции можно
временно изменить мышечную композицию.
Энергии
одной молекулы АТФ достаточно для одного поворота (гребка) миозиновых
мостиков. Мостики расцепляются с актиновым филаментом, возвращаются в
исходное положение, сцепляются с новым участком актина и делают
гребок. Энергия АТФ в основном требуется для разъединения. Для
очередного гребка требуется новая молекула АТФ. В волокнах с высокой
АТФ-азной активностью расщепление АТФ происходит быстрее, и за
единицу времени происходит большее количество гребков мостиками, то
есть мышца сокращается быстрее.
Доказательством использования АТФ для расцепления актин-миозиновых мостиков являются эксперименты с определением энергозатрат при подъеме по лестнице и спуске. При подъеме вверх КПД составляет 20–23%, а при спуске метаболические затраты практически исчезают, остаются затраты только на уровне покоя – основного обмена. Поэтому, при той же механической мощности, КПД на спуске превышает 100%. Это означает, что при выполнении эксцентрических упражнений (растяжение мышц разгибателей коленного сустава) механическая энергия тратится на разрыв актин-миозиновых мостиков, а химическая энергия молекул АТФ не тратится. Причем правильно тренированная мышца после таких упражнений не болит, следовательно, разрушений в мышечных волокнах не происходит.
Количество
АТФ в миофибриллах хватает на одну–две секунды
высокоинтенсивной работы. Под воздействием миозиновой АТФ-азы АТФ
распадается на АДФ, фосфор, высвобождая большое количество энергии и
ион водорода. Но с первой же секунды работы в мышце разворачивается
процесс ресинтеза миофибриллярных АТФ за счет КрФ. Креатинфосфат
распадается на головке миозина, поскольку там же имеется фермент
креатифосфокиназа. Образуется свободный креатин, фосфор и энергия,
достаточная для соединения АДФ, фосфора, иона водорода. Молекулы АТФ
крупные, поэтому они не могут перемещаться по клетке. Перемещаются по
клетке КрФ, Кр, Ф. Это явление назвали креатинфосфатным шунтом.
Ресинтез КрФ может выполняться только с помощью молекул АТФ.
Митохондриальные молекулы АТФ ресинтезируют КрФ, а АДФ, Ф и ион
водорода проникают обратно в митохондрию. Молекулы АТФ,
ресинтезируемые в ходе гликолиза, могут также использоваться для
ресинтеза КрФ.
Но с первой же секунды работы в мышце разворачивается
процесс ресинтеза миофибриллярных АТФ за счет КрФ. Креатинфосфат
распадается на головке миозина, поскольку там же имеется фермент
креатифосфокиназа. Образуется свободный креатин, фосфор и энергия,
достаточная для соединения АДФ, фосфора, иона водорода. Молекулы АТФ
крупные, поэтому они не могут перемещаться по клетке. Перемещаются по
клетке КрФ, Кр, Ф. Это явление назвали креатинфосфатным шунтом.
Ресинтез КрФ может выполняться только с помощью молекул АТФ.
Митохондриальные молекулы АТФ ресинтезируют КрФ, а АДФ, Ф и ион
водорода проникают обратно в митохондрию. Молекулы АТФ,
ресинтезируемые в ходе гликолиза, могут также использоваться для
ресинтеза КрФ.
ЖМ: Что такое мышечная композиция?
ВС:
Классифицировать мышечные волокна можно минимум двумя способами.
Первый способ — по скорости сокращения мышцы. В этом случае все
волокна делятся на быстрые и медленные. Это метод определяет
наследственно обусловленную мышечную композицию. Надо заметить, что
обычно мышечную композицию определяют с помощью взятия из латеральной
головки мышцы бедра биопробы. Но данные полученные для данной мышцы
не коррелируют с биопробами других мышц. Например, бегуны на средние
и длинные дистанции имеют большую долю ММВ (медленных мышечных
волокон) в латеральной головке мышцы бедра, в мышцах задней
поверхности бедра и икроножной мышце больше БМВ. У стайера все мышцы
ног имеют преимущественно ММВ.
Это метод определяет
наследственно обусловленную мышечную композицию. Надо заметить, что
обычно мышечную композицию определяют с помощью взятия из латеральной
головки мышцы бедра биопробы. Но данные полученные для данной мышцы
не коррелируют с биопробами других мышц. Например, бегуны на средние
и длинные дистанции имеют большую долю ММВ (медленных мышечных
волокон) в латеральной головке мышцы бедра, в мышцах задней
поверхности бедра и икроножной мышце больше БМВ. У стайера все мышцы
ног имеют преимущественно ММВ.
Существует
и второй способ классификации. Если в первом случае оценка идет по
ферменту миофибрилл (миозиновая АТФ-аза), то во втором — по
ферментам аэробных процессов, по ферментам митохондрий. В этом случае
мышечные волокна делят на окислительные и гликолитические. Те
мышечные волокна, в которых преобладают митохондрии, называют
окислительными. В них молочная кислота практически не образуется.
В гликолитических волокнах, наоборот, очень мало митохондрий, поэтому в них образуется много молочной кислоты.
Так
вот в этих классификациях и начинается путаница. Почему-то
большинство читателей понимают так, что быстрые волокна всегда
гликолитические, а медленные – окислительные и ставит знак
равенства в этих классификациях, а это далеко не так. При правильно
построенном тренировочном процессе быстрые волокна можно сделать
окислительными, значительно увеличив в них количество митохондрий, и
они не будут утомляться, то есть перестанут образовывать молочную
кислоту. Почему это происходит? Потому что промежуточные продукты,
например, пируват, не превращается в лактат, а поступает в
митохондрии, где окисляется до воды и углекислого газа. Такие
спортсмены показывают выдающиеся результаты, в видах спорта,
требующих выносливости, если нет других лимитирующих факторов.
Например, выдающиеся велосипедисты профессионалы – Меркс,
Индурайн, Армстронг, при выполнении ступенчатого теста до МПК
закисляются только до 6мМ/л лактата в крови.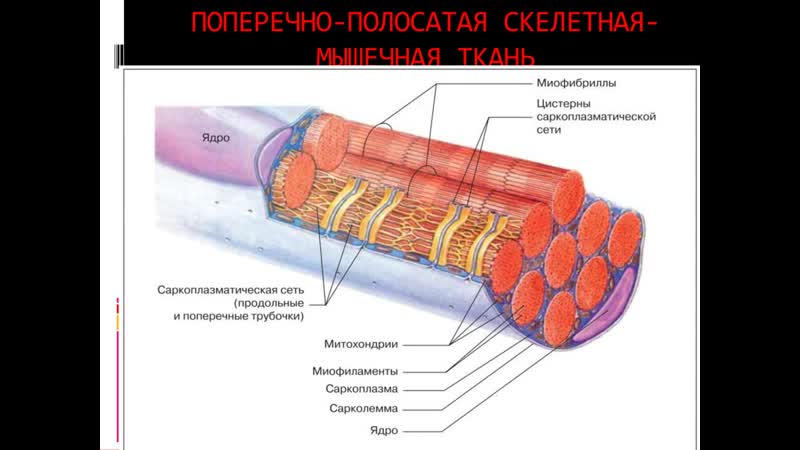 У обычных гонщиков
концентрация лактата достигает 12–20мМ/л.
У обычных гонщиков
концентрация лактата достигает 12–20мМ/л.
И
наоборот, медленные волокна тоже могут быть гликолитическими, хотя
этот вариант в литературе не описывается. Но мы знаем, что если
человек лежит в больнице предоперационный период, а потом ещё и
послеоперационный период, то потом уже и встать не может, ходить не
может. Первая причина — координация нарушается, а вторая
причина — мышцы «уходят». И самое главное, уходят,
прежде всего, митохондрии из медленных мышечных волокон (период их
«полураспада» всего 20–24 дня). Если человек пролежал
50 дней, то от митохондрий почти ничего не останется, МВ превратятся
в медленные гликолитические, поскольку медленные или быстрые
наследуется, а митохондрии стареют, а создаются только когда начинают
активно функционировать. Поэтому сначала даже медленная ходьба
вызывает закисление крови, что и доказывает наличие в мышцах только
ГМВ, а вовсе не отсутствие кислорода в крови.
ЖМ: Расскажите подробнее о молочной кислоте. Из чего она состоит и какую пользу и вред может принести накопление ее составляющих в мышцах.
ВС:
Молочная кислота состоит из аниона – отрицательно заряженной
молекулы лактата и катиона – положительно заряженного иона
водорода. Лактат крупная молекула, поэтому не может участвовать в
химических реакциях без участия ферментов, поэтому не может повредить
клетке. Ион водорода самый маленький атом, заряженный, поэтому
проникает в сложные структуры и приводит к существенным химическим
разрушениям. При очень большой концентрации ионов водорода разрушение
могут привести к катаболизму с помощью еще и ферментов лизосом.
Лактат с помощью лактатдегидрогеназы сердечного типа может
преобразоваться обратно в пируват, а тот, с помощью фермента —
пируватдегидрогеназы, превращается в ацетилкоэнзим-А, который
поступает в митохондрию и становится субстратом окисления.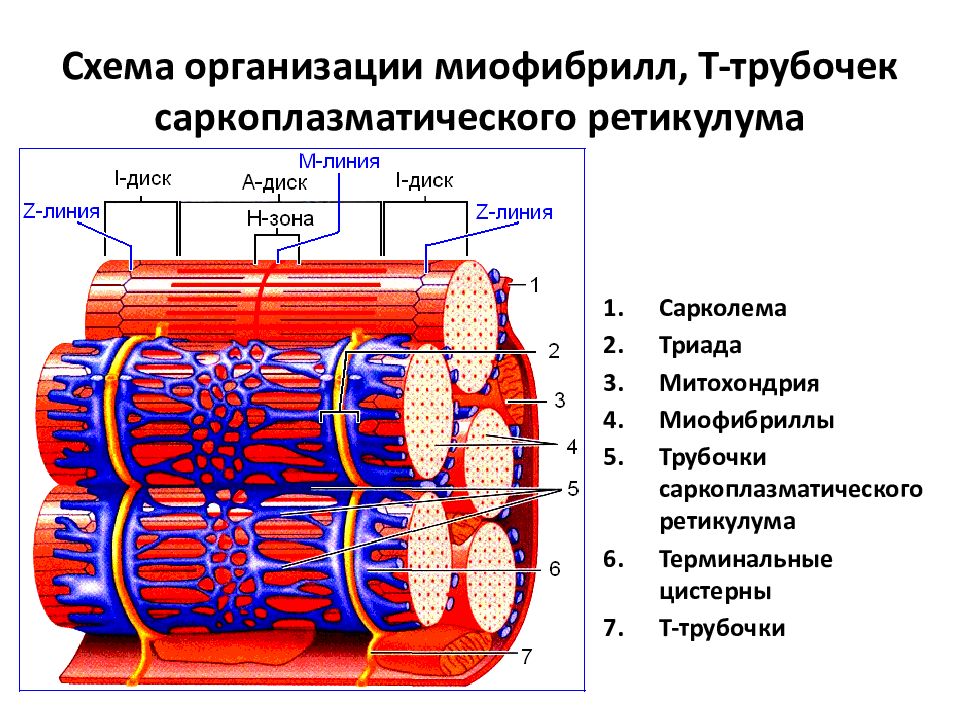 Следовательно, лактат является углеводородом, источником энергии для
митохондрий ОМВ, а ион водорода вызывает существенные разрушения в
клетке, усиливая катаболизм..
Следовательно, лактат является углеводородом, источником энергии для
митохондрий ОМВ, а ион водорода вызывает существенные разрушения в
клетке, усиливая катаболизм..
ЖМ: Как на практике определить мышечную композицию?
ВС: Международный стандарт — берут кусочек мышечной ткани (как правило, из мышц бедра — наружной головки) и биохимическими методами определяют, сколько быстрых и сколько медленных волокон. Часть той же самой порции подвергают еще одному анализу, при котором определяют количество ферментов митохондрий.
В
нашей лаборатории, еще под руководством Ю. В. Верхошанского,
были разработаны опосредованные, косвенные, методы. Тестирование
выполнялось на универсальном динамографическом стенде (УДС). Мы на
нем определяли скорость нарастания силы, и оказалось, что она связана
с количеством быстрых и медленных волокон. Потом такие же
исследования выполнил Коми в Финляндии. Он нашел корреляционную
зависимость между мышечной композицией (быстрые и медленные МВ) и
крутизной нарастания силы. Но мы пошли дальше и разделили градиент
силы на саму силу, то есть получили относительный показатель, который
хорошо работает. Мало того, может быть, это более точный метод, чем
биопсия, поскольку мы прямо измеряем скорость напряжения мышцы.
Он нашел корреляционную
зависимость между мышечной композицией (быстрые и медленные МВ) и
крутизной нарастания силы. Но мы пошли дальше и разделили градиент
силы на саму силу, то есть получили относительный показатель, который
хорошо работает. Мало того, может быть, это более точный метод, чем
биопсия, поскольку мы прямо измеряем скорость напряжения мышцы.
Мы, например, разделяем бегунов стайеров и бегунов на средние дистанции по этому показателю. У стайеров медленными мышцами являются как передние, так и мышцы задней поверхности бедра, а у бегунов на 800 м — мышцы передней поверхности бедра такие же медленные, а задние — быстрые, как у хороших спринтеров. Поэтому они быстро бегут 100 м с ходу, и именно эти мышечные волокна берегут до самого финиша. За 100–150 м до финиша они изменяют технику бега, сами спортсмены говорят, что они «переключают скорость» как в автомобиле.
ЖМ: Значит, если мы берем биопсию из четырехглавой мышцы бедра, то мы можем порой ошибаться? Соотношение волокон в разных мышцах неодинаково?
ВС:
Совершенно верно. В последнее время накопилось много материалов,
которые свидетельствуют, что если одна мышца медленная, скажем,
прямая мышца бедра, то не обязательно, что и все остальные такие же.
Интересно, что у спринтеров передняя поверхность бедра не быстрая и
не медленная, а вот задней поверхности – быстрая и, тем более,
икроножная и камбаловидная, иначе быть не может, но биопсию все равно
берут из боковой поверхности бедра и результаты, например, для
спринта получаются некорректные — неинформативные.
В последнее время накопилось много материалов,
которые свидетельствуют, что если одна мышца медленная, скажем,
прямая мышца бедра, то не обязательно, что и все остальные такие же.
Интересно, что у спринтеров передняя поверхность бедра не быстрая и
не медленная, а вот задней поверхности – быстрая и, тем более,
икроножная и камбаловидная, иначе быть не может, но биопсию все равно
берут из боковой поверхности бедра и результаты, например, для
спринта получаются некорректные — неинформативные.
ЖМ: А по вашему методу?
ВС:
По нашему методу все нормально. Для измерения силы и градиента силы
нет ограничений, невозможно нанести вред мышцам, как это бывает при
взятии биопсии. Для реализации нашего метода сейчас имеется в наличии
изокинетический динамометр (БИОДЕКС). Измерения показали, что у
спринтеров и передняя довольно быстрая и очень сильная, а задняя тем
более. Если же взять прыгунов, то у них до 90% быстрых волокон в
передней поверхности бедра — это главная для них мышца. Но в
беге все-таки более важна задняя поверхность, она и рвется поэтому.
Например, при обследовании сборной команды горнолыжников мы нашли
только двух одаренных спортсменов (очень сильных и быстрых), которые
и сейчас продолжают успешно выступать в Российских соревнованиях, а
вот среди женщин не было ни одной, поэтому и нет успехов на
международной арене. Никакие иностранные тренеры не помогут таким
спортсменкам.
Если же взять прыгунов, то у них до 90% быстрых волокон в
передней поверхности бедра — это главная для них мышца. Но в
беге все-таки более важна задняя поверхность, она и рвется поэтому.
Например, при обследовании сборной команды горнолыжников мы нашли
только двух одаренных спортсменов (очень сильных и быстрых), которые
и сейчас продолжают успешно выступать в Российских соревнованиях, а
вот среди женщин не было ни одной, поэтому и нет успехов на
международной арене. Никакие иностранные тренеры не помогут таким
спортсменкам.
ЖМ: Вы можете привести усредненные данные по соотношению быстрых и медленных волокон в основных мышечных группах?
ВС:
Хорошо
известно, что в среднем у человека мышцы ног имеют больше медленных
МВ (I тип
50%, II тип 50%),
а в мышцах рук меньше медленных (I тип
30%, II тип
70%). При этом имеется индивидуальное разнообразие, которое лежит в
основе профессионального отбора в спорте.
ЖМ: Насколько резко выражен переход от быстрых волокон к медленным в отдельно взятой мышце?
ВС: Мышечная композиция определяется по данным биопсии, по строго определенным методикам биохимической обработки пробы мышечной ткани. В рамках установленного метода определяют 2 типа МВ и еще 2–4 подтипа. Однако, при изменении методики обработки биопробы можно получить существенно большее количество типов МВ. Для практики спорта отработанная методика классификации МВ остается пока удовлетворительной.
ЖМ: На этом мы завершим первую нашу беседу с Виктором Николаевичем. В следующем номере журнала мы подробно поговорим о методах гиперплазии миофибрилл в мышечных волокнах и особенно подробно об этом процессе в гликолитических мышечных волокнах.
Миофибрилла — обзор | Темы ScienceDirect
Миофибриллы
Отдельные миофибриллы четко видны на рис. 2.3 и рис. 2.4. Наиболее яркой особенностью сердечных миофибрилл является их разветвленная природа (рис. 2.7A) и, как следствие, их переменный диаметр (от 0,1 до 3,5 мкм только в желудочке лягушки). Однако конструкция миофибриллы и ее саркомерная организация очень похожа на то, что наблюдается в скелетных мышцах (Fig. 2.7B). Хорошо видны обычные полосы A и I, диск Z и зона H.Из данных, собранных вместе в Таблице 2.3, можно видеть, что актиновые и миозиновые филаменты и их орбитальные конфигурации в сердечной мышце как у позвоночных, так и у беспозвоночных мало отличаются от диапазона, обнаруженного в скелетных мышцах, и никаких дальнейших комментариев не требуется.
2.3 и рис. 2.4. Наиболее яркой особенностью сердечных миофибрилл является их разветвленная природа (рис. 2.7A) и, как следствие, их переменный диаметр (от 0,1 до 3,5 мкм только в желудочке лягушки). Однако конструкция миофибриллы и ее саркомерная организация очень похожа на то, что наблюдается в скелетных мышцах (Fig. 2.7B). Хорошо видны обычные полосы A и I, диск Z и зона H.Из данных, собранных вместе в Таблице 2.3, можно видеть, что актиновые и миозиновые филаменты и их орбитальные конфигурации в сердечной мышце как у позвоночных, так и у беспозвоночных мало отличаются от диапазона, обнаруженного в скелетных мышцах, и никаких дальнейших комментариев не требуется.
РИС. 2.7. Миофибриллы желудочкового волокна лягушки. A, обзорная микрофотография, показывающая саркомерное строение миофибриллы; B — одиночный саркомер, явно состоящий из толстых и тонких нитей с полосами A и I, диском Z и зоной H.Увеличение при печати: A, × 7000; B, × 60 000. H. Huddart, ранее не публиковалось.
ТАБЛИЦА 2. 3. НЕКОТОРЫЕ ХАРАКТЕРИСТИКИ МИОФИБРИЛЛЯРНЫХ БЕЛКОВ КЛЕТК СЕРДЕЧНЫХ МЫШЦ
3. НЕКОТОРЫЕ ХАРАКТЕРИСТИКИ МИОФИБРИЛЛЯРНЫХ БЕЛКОВ КЛЕТК СЕРДЕЧНЫХ МЫШЦ
| Животное | Диаметр актина (Å) | Диаметр миозина (Å) | Орбита актина / миозина | Ссылка | Кат. 70 | 100–150 | 6: 1 | Фосетт и Макнатт (1969) |
|---|---|---|---|---|
| Pleuronectes (Teleost) | 50–80 | 180–250 | 6: 1 | Santer and Cobb ( 1972) |
| Limulus (Arachnida) | 50 | 200 | 7–8: 1 | Sperelakis (1971) |
| Hyalophora (Insecta) | 60 | 200 | 10 –12: 1 | Сэнгер и Макканн (1968a) |
| Лобстер (Crustaceae) | 50–70 | 150–200 | 6: 1 | Смит и Андерссон (1972) |
| Unto (Mollusca) | 50 | 300 | 10: 1 | Кавагути (1963e) |
В своем важном исследовании желудочковой папиллярной мышцы кошки Фосетт и Макнатт (1969) дали некоторые полезные данные о тонкой структуре миофиламентов. Как и в летающих мышцах насекомых и других быстрых скелетных мышцах, толстые нити желудочковых волокон кошек упакованы гексагонально с относительно постоянным межцентровым расстоянием 400–450 Å. В более толстом центральном сегменте миозиновой нити (составляющем зону M-полосы), шириной около 850-900 A, можно увидеть пять тонких линий толщиной 30-50 мкм, расположенных на расстоянии около 220 A друг от друга. Эти периодические линии представляют собой межмиозиновые поперечные мостики, образованные из материала с совершенно другими ферментативными свойствами, чем миозин (Karnovsky and Hug, 1963).По обе стороны от M-полосы на латеральном расстоянии около 180 Å миозиновая нить обнажена, и это, вероятно, все еще находится в области примыкания мономеров миозина «хвост к хвосту». Шарнирные головки миозина, составляющие поперечные перемычки для взаимодействия с актином, заполняют остальную часть филамента, расположенного по спирали. Актиновые нити сердечной мышцы и их связь с Z-диском и его субструктурой кажутся похожими на таковые в скелетных мышцах, описанные в предыдущей главе.
Как и в летающих мышцах насекомых и других быстрых скелетных мышцах, толстые нити желудочковых волокон кошек упакованы гексагонально с относительно постоянным межцентровым расстоянием 400–450 Å. В более толстом центральном сегменте миозиновой нити (составляющем зону M-полосы), шириной около 850-900 A, можно увидеть пять тонких линий толщиной 30-50 мкм, расположенных на расстоянии около 220 A друг от друга. Эти периодические линии представляют собой межмиозиновые поперечные мостики, образованные из материала с совершенно другими ферментативными свойствами, чем миозин (Karnovsky and Hug, 1963).По обе стороны от M-полосы на латеральном расстоянии около 180 Å миозиновая нить обнажена, и это, вероятно, все еще находится в области примыкания мономеров миозина «хвост к хвосту». Шарнирные головки миозина, составляющие поперечные перемычки для взаимодействия с актином, заполняют остальную часть филамента, расположенного по спирали. Актиновые нити сердечной мышцы и их связь с Z-диском и его субструктурой кажутся похожими на таковые в скелетных мышцах, описанные в предыдущей главе.
В активно дифференцирующихся прекардиальных клетках цыплят была описана третья и несколько гетерогенная группа филаментов в диапазоне размеров 85–130 Å (Rash et al. , 1970). Эти нити остаются после химического разрушения нормальных толстых и тонких нитей, и ясно, что их нельзя легко приравнять ни к одной из миофибриллярных составляющих взрослых сердечных клеток. Ни функция, ни судьба этих филаментов не выяснены — они могут участвовать в синтезе микротрубочек, или они могут деградировать или взаимно превращаться в поддерживающую ткань скелета для взрослой клетки.
В то время как кардиальный миозин, по-видимому, подобен скелетному миозину на общем структурном уровне, между ними есть некоторые важные биохимические различия, особенно касающиеся их соответствующих АТФазных активностей (см. Barany et al. , 1964). Например, в скелетном миозине, актомиозине и миофибриллах активность Са-АТФазы, Са-ИТФазы и ЭДТА-АТФазы примерно в три раза выше, чем активности сердечного миозина, актомиозина и миофибрилл, а активность сердечной АТФазы, в отличие от активности скелетных мышц. , не увеличиваются резко при значениях pH выше 8.0. Однако способность сердечного и скелетного миозина соединяться с актином как при высокой, так и при низкой ионной силе по существу одинакова. Есть также некоторые различия в аминокислотном составе между двумя миозинами. Кардиальный миозин, например, содержит гораздо меньше остатков цистеина, чем скелетный миозин.
, не увеличиваются резко при значениях pH выше 8.0. Однако способность сердечного и скелетного миозина соединяться с актином как при высокой, так и при низкой ионной силе по существу одинакова. Есть также некоторые различия в аминокислотном составе между двумя миозинами. Кардиальный миозин, например, содержит гораздо меньше остатков цистеина, чем скелетный миозин.
Анализ миофибриллярной структуры и сборки с использованием флуоресцентно меченных сократительных белков
J Cell Biol. 1 марта 1984 г .; 98 (3): 825–833.
Эта статья распространяется на условиях лицензии Attribution – Noncommercial – Share Alike – No Mirror Sites в течение первых шести месяцев после даты публикации (см. Http: // www.rupress.org/terms). Через шесть месяцев он становится доступным по лицензии Creative Commons License (Attribution – Noncommercial – Share Alike 4.0 Unported License, как описано на http://creativecommons.org/licenses/by-nc-sa/4.0/).Эта статья была процитирована. другими статьями в PMC.
Abstract
Чтобы изучить, как сократительные белки организуются в саркомерные единицы в поперечно-полосатых мышцах, мы подвергли глицериновые миофибриллы воздействию флуоресцентно меченого актина, альфа-актинина и тропомиозина. В этой системе in vitro альфа-актинин, связанный с Z-полосами, и связывание не могло быть насыщено предварительным добавлением избытка немеченого альфа-актинина.Однако известные условия, предотвращающие самоассоциацию альфа-актинина, блокируют связывание флуоресцентно меченного альфа-актинина с Z-полосами. Когда тропомиозин был удален из миофибрилл, альфа-актинин затем добавлялся к тонким филаментам, а также к Z-полосам. Актин связывался в виде дублета с областями миозиновых филаментов, где были свободные поперечные мостики, т. Е. В той части A-полосы, которая свободна от встречных нативных тонких нитей, но не в центре A-полосы, в которой отсутствуют поперечные мостики. мосты.В присутствии 0,1-0,2 мМ АТФ связывание актина не происходило. Когда немеченый альфа-актинин был добавлен сначала к миофибриллам, а затем был добавлен меченый актин, флуоресценция происходила не в виде дуплета, а по всей длине миофибриллы. Тропомиозин не связывался с миофибриллами, если только существующий тропомиозин не был сначала удален, и в этом случае он добавлялся к тонким филаментам в l-полосе. Однако тропомиозин связывался с экзогенно добавленным актином, свободным от тропомиозина, который локализуется в виде дублета в А-полосе.Эти результаты показывают, что альфа-актинин, присутствующий в Z-полосах миофибрилл, полностью образует комплекс с актином, но может связывать экзогенный альфа-актинин, и, если актин добавляется впоследствии, экзогенный альфа-актинин в Z-полосе будет связывать новый образуются флуоресцентные актиновые филаменты. Миофибриллярные актиновые филаменты не увеличиваются в длине, когда G-актин присутствует в условиях полимеризации, и они не связывают какой-либо добавленный тропомиозин. Эти наблюдения обсуждаются с точки зрения структуры и сборки миофибрилл in vivo.
Тропомиозин не связывался с миофибриллами, если только существующий тропомиозин не был сначала удален, и в этом случае он добавлялся к тонким филаментам в l-полосе. Однако тропомиозин связывался с экзогенно добавленным актином, свободным от тропомиозина, который локализуется в виде дублета в А-полосе.Эти результаты показывают, что альфа-актинин, присутствующий в Z-полосах миофибрилл, полностью образует комплекс с актином, но может связывать экзогенный альфа-актинин, и, если актин добавляется впоследствии, экзогенный альфа-актинин в Z-полосе будет связывать новый образуются флуоресцентные актиновые филаменты. Миофибриллярные актиновые филаменты не увеличиваются в длине, когда G-актин присутствует в условиях полимеризации, и они не связывают какой-либо добавленный тропомиозин. Эти наблюдения обсуждаются с точки зрения структуры и сборки миофибрилл in vivo.
Полный текст
Полный текст этой статьи доступен в формате PDF (1.0M).
Избранные ссылки
Эти ссылки находятся в PubMed. Это может быть не полный список ссылок из этой статьи.
Это может быть не полный список ссылок из этой статьи.
- ARONSON J. Размер саркомера в развивающихся мышцах тарсонемидного клеща. J Biophys Biochem Cytol. 1961 Октябрь; 11: 147–156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Brandtzaeg P. Конъюгаты иммуноглобулина G с различными флуорохромами.I. Характеристика с помощью анионообменной хроматографии. Scand J Immunol. 1973; 2 (3): 273–290. [PubMed] [Google Scholar]
- Чоураши П.К., Пепе Ф.А. Z-полоса: 85000 дальтон аморфин и альфа-актинин и их связь со структурой. J Cell Biol. 1982 сентябрь; 94 (3): 565–573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Devlin RB, Emerson CP., Jr. Координационная регуляция синтеза сократительных белков во время дифференцировки миобластов. Клетка. 1978, апрель; 13 (4): 599–611. [PubMed] [Google Scholar]
- Feramisco JR, Burridge K.Быстрая очистка гладкой мускулатуры от альфа-актинина, филамина и белка весом 130 000 дальтон. J Biol Chem. 1980 10 февраля; 255 (3): 1194–1199.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - Гейгер Б. Связь меченного родамином альфа-актинина с актиновыми связками в демембранных клетках. Cell Biol Int Rep., Июнь 1981; 5 (6): 627–634. [PubMed] [Google Scholar]
- Glacy SD. Картина и динамика включения родамина-актина в сердечные миоциты. J Cell Biol. 1983 апр; 96 (4): 1164–1167. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Goldspink G.Изменения поперечно-полосатых мышечных волокон во время сокращения и роста с особым упором на расщепление миофибрилл. J Cell Sci. 1971 июл; 9 (1): 123–137. [PubMed] [Google Scholar]
- Goli DE, Suzuki A, Temple J, Holmes GR. Исследования очищенного -актинина. I. Влияние температуры и тропомиозина на взаимодействие -актинин-F-актин. J Mol Biol. 1972, 28 июня; 67 (3): 469–488. [PubMed] [Google Scholar]
- Хаяши Т., Сильвер РБ, ИП У, Кайер М.Л., Смит Д.С. Актин-миозиновое взаимодействие. Самостоятельная сборка в биполярный «сократительный блок».J Mol Biol. 1977, апрель; 111 (2): 159–171.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - HOLTZER H, MARSHALL JM, Jr, FINCK H. Анализ миогенеза с использованием флуоресцентного антимиозина. J Biophys Biochem Cytol. 1957 25 сентября; 3 (5): 705–724. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Jockusch BM, Isenberg G. Взаимодействие альфа-актинина и винкулина с актином: противоположные эффекты на формирование сети филаментов. Proc Natl Acad Sci U S. A. 1981 May; 78 (5): 3005–3009. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kreis TE, Birchmeier W.Саркомеры стрессовых волокон фибробластов сократительны. Клетка. 1980, ноябрь; 22 (2, часть 2): 555–561. [PubMed] [Google Scholar]
- Наг А.С., Ченг М. Дифференциация типов волокон в экстраокулярной мышце крысы. J Embryol Exp Morphol. 1982 Октябрь; 71: 171–191. [PubMed] [Google Scholar]
- Парди Дж. Д., Спудич Дж. А. Очищение мышечного актина. Методы Cell Biol. 1982; 24: 271–289. [PubMed] [Google Scholar]
- Сэнгер Дж. У. Изменение паттернов локализации актина при делении клеток.
 Proc Natl Acad Sci U S A.1975 Май; 72 (5): 1913–1916. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A.1975 Май; 72 (5): 1913–1916. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Sanger JW. Наличие актина во время движения хромосом. Proc Natl Acad Sci U S. A. 1975 июн; 72 (6): 2451–2455. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Статьи из The Journal of Cell Biology любезно предоставлены The Rockefeller University Press
Сборка и динамика миофибрилл
Abstract
Мы рассматриваем некоторые проблем в определении того, как могут быть собраны миофибриллы, и, что не менее важно, как эта сократительная структура может обновляться саркомерными белками, перемещающимися между саркомером и цитоплазмой.В этом личном обзоре мы также обращаемся к недавним свидетельствам, указывающим на то, что сборка и динамика миофибрилл сохраняются независимо от того, анализируются ли клетки in situ или в условиях культуры ткани. Мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли он in situ или in vitro .
1. Введение
Миофибриллы поперечно-полосатой мышцы характеризуются группами белков, организованными в сократительные единицы, или саркомеры, которые состоят из отдельных субъединиц, повторяющихся по длине мышечной клетки.Хотя саркомеры поперечно-полосатых мышц различаются у разных видов по длине и по некоторым белковым компонентам, все они имеют сходное расположение субъединиц из трех основных компонентов: тонких нитей, толстых нитей и Z-полос, каждая из которых формируется в результате множественных взаимодействий между белками, производящими и управление сжатием (). Скелет позвоночных и сердечные саркомеры в состоянии покоя составляют 2,5 микрона в длину, тогда как саркомеры поперечно-полосатых мышц в мире беспозвоночных широко варьируются от одного микрона у медузы [1] до 25 микрон в глотке силлидного червя [2].Длина А-полосы толстых нитей и длина тонких нитей зависят от размера саркомера: самая короткая — 0,6 мкм и 0,5 мкм соответственно у медуз, самая длинная — 20 мкм и 12 мкм, соответственно, у силлидного червя и 1,6 мкм.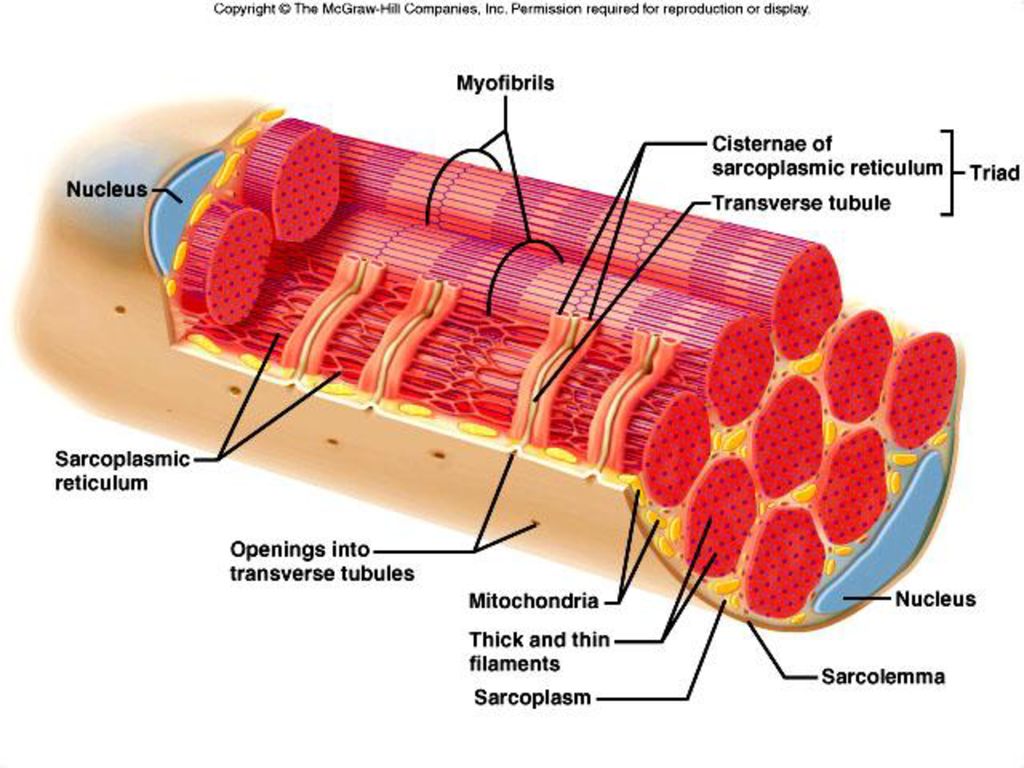 микрон и 1,0 микрон в скелетных мышцах позвоночных [3]. В желудочковых мышцах позвоночных длина тонких филаментов варьируется до одного микрона [4].
микрон и 1,0 микрон в скелетных мышцах позвоночных [3]. В желудочковых мышцах позвоночных длина тонких филаментов варьируется до одного микрона [4].
Премиофибрилльная модель миофибриллогенеза. Сборка начинается на краях мышечных клеток с премиофибрилл, состоящих из минисаркомеров (ограниченных альфа-актинином, содержащими z-тела) с мышечным актином и актин-связывающими белками и немышечной изоформой миозина II.Добавляются мышечный миозин и тайтин, и z-тела выравниваются в регистре, образуя зарождающиеся миофибриллы с Z-полосами в виде бусинок. По мере того, как формируются зрелые миофибриллы, бисерные Z-полосы постепенно становятся линейными, немышечный миозин теряется, а миозин-связывающие белки (C-белок и миомезин) включаются в выровненные A-полосы [5-8]. Диаграмма модифицирована из Stout et al. [8].
Несмотря на все, что известно о связывании миофибриллярных белков друг с другом в биохимических анализах, многое неизвестно о множественности взаимодействий, которые поддерживают образование и стабильность миофибрилл в живой клетке.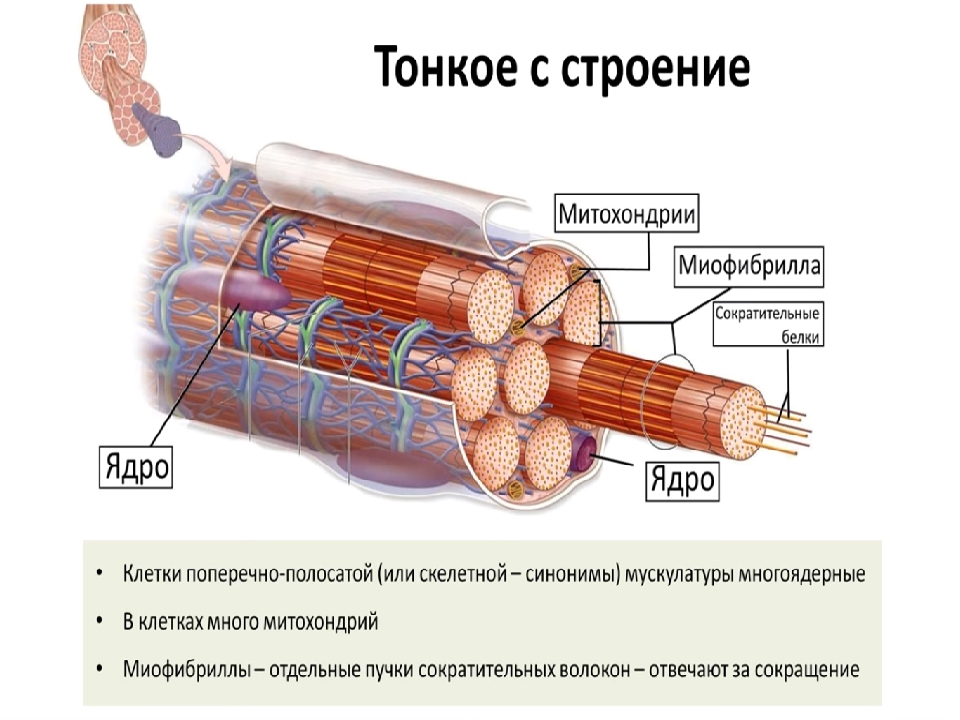 Важность взаимодействий миофибриллярных белков для здоровья сердца была подтверждена осознанием того, что мутировавшие саркомерные белки участвуют во все большем числе кардиомиопатий [9, 10]. Взаимодействия основных белков, ответственных за производство силы в субъединицах тонких и толстых филаментов, были подробно описаны [11]. Белки Z-полосы, области саркомера, где все еще открываются новые белки и новые взаимодействия известных белков [12, 13], представляют собой особенно сложную сеть потенциальных множественных взаимодействий, многие из которых были определены биохимическими методами. не методами внутри живой клетки ().Z-полоса функционирует как каркас, который последовательно связывает саркомерные сократительные единицы, закрепляя тонкие и титиновые филаменты соседних саркомеров. Z-полосы также закрепляют концы миофибрилл в специализированных соединениях, называемых интеркалированными дисками в клетках сердечной мышцы, и они соединяют саркомеры латерально с клеточной мембраной через костамерные белки [14, 15].
Важность взаимодействий миофибриллярных белков для здоровья сердца была подтверждена осознанием того, что мутировавшие саркомерные белки участвуют во все большем числе кардиомиопатий [9, 10]. Взаимодействия основных белков, ответственных за производство силы в субъединицах тонких и толстых филаментов, были подробно описаны [11]. Белки Z-полосы, области саркомера, где все еще открываются новые белки и новые взаимодействия известных белков [12, 13], представляют собой особенно сложную сеть потенциальных множественных взаимодействий, многие из которых были определены биохимическими методами. не методами внутри живой клетки ().Z-полоса функционирует как каркас, который последовательно связывает саркомерные сократительные единицы, закрепляя тонкие и титиновые филаменты соседних саркомеров. Z-полосы также закрепляют концы миофибрилл в специализированных соединениях, называемых интеркалированными дисками в клетках сердечной мышцы, и они соединяют саркомеры латерально с клеточной мембраной через костамерные белки [14, 15].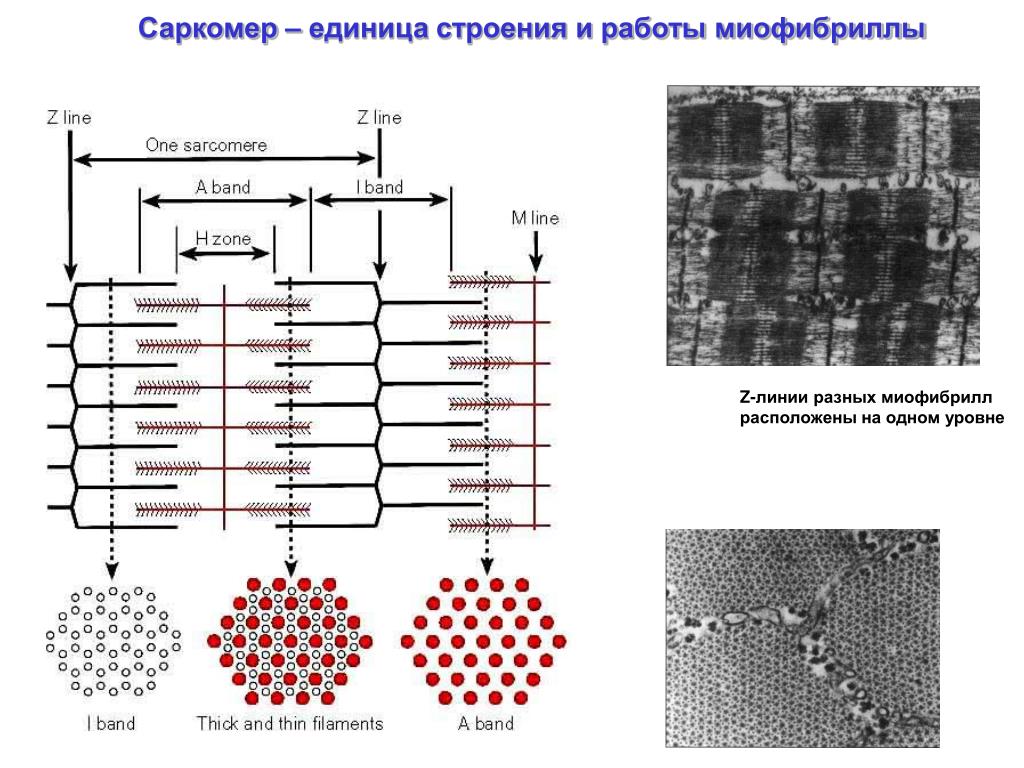 Многофункциональная природа Z-полосы отражается в разнообразии белков, которые колокализуются в этой структуре: каналы, сигнальные молекулы, ферменты, комплекс цитоскелетных филаментов, который взаимодействует с клеточной мембраной, и саркомерные филаменты, необходимые для сокращения () [11, 16 , 17].Два из самых неожиданных недавних сообщений о новых белках Z-диапазона касаются (а) белков теплового шока в скелетных мышцах рыбок данио (обзор приведен в [12]) и (б) белка CLOCK, который участвует в регуляции циркадных ритмов в кардиомиоцитах новорожденных крыс. (рассмотрено в [13]).
Многофункциональная природа Z-полосы отражается в разнообразии белков, которые колокализуются в этой структуре: каналы, сигнальные молекулы, ферменты, комплекс цитоскелетных филаментов, который взаимодействует с клеточной мембраной, и саркомерные филаменты, необходимые для сокращения () [11, 16 , 17].Два из самых неожиданных недавних сообщений о новых белках Z-диапазона касаются (а) белков теплового шока в скелетных мышцах рыбок данио (обзор приведен в [12]) и (б) белка CLOCK, который участвует в регуляции циркадных ритмов в кардиомиоцитах новорожденных крыс. (рассмотрено в [13]).
Диаграмма некоторых белков, которые, как сообщается, находятся в Z-полосах зрелых миофибрилл. Z-полосы зрелых миофибрилл прикрепляются через костамерные белки к мембране мышечных клеток.
2. Формирование миофибрилл
По мере того, как список белков миофибрилл и их реакций связывания растет, пути сборки, по которым взаимодействующие белковые комплексы образуют миофибриллы, имеют все большее значение для понимания проблем аберрантного образования и поддержания миофибрилл, содержащих мутировавшие саркомеры.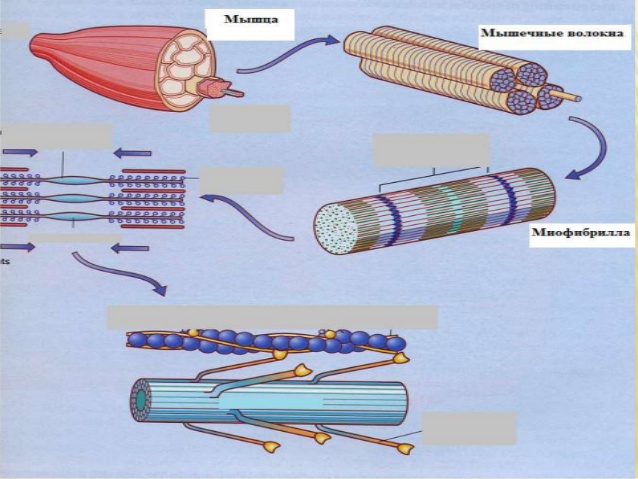 белки [9, 10, 16, 18].В начале 1900-х годов Хайденхайн [19] исследовал фиксированные мышцы в световом микроскопе и заметил гладкие волокна около клеточной мембраны развивающихся скелетных мышц форели до того, как были обнаружены поперечно-полосатые структуры, которые, как мы теперь знаем, были Z-полосами и A-полосами. Электронные микрофотографии формирующихся мышц цыплят показали гладкие волокна около клеточной мембраны, а также до появления полосатых миофибрилл (см. Обзор Sanger et al. [6]). Рост длины А-полосы до зрелого размера также наблюдали с помощью электронной микроскопии мышц эмбриональной мухи, фиксируемой с ежедневными интервалами.Первые наблюдаемые волокна были гладкими с плотными телами, но без толстых нитей, за ними следовали волокна с Z-полосами и короткими A-полосами, а затем волокна с A-полосами длины зрелой мышцы [20]. Поперечно-полосатые саркомеры в формировании мышц клещей, которые были проанализированы с помощью поляризованного света у живых животных, увеличились за 30-часовой период с 2,2 до 4 микрон в длину, что сопровождалось увеличением длины А-полосы с 1,4 до 3 микрон [21] .
белки [9, 10, 16, 18].В начале 1900-х годов Хайденхайн [19] исследовал фиксированные мышцы в световом микроскопе и заметил гладкие волокна около клеточной мембраны развивающихся скелетных мышц форели до того, как были обнаружены поперечно-полосатые структуры, которые, как мы теперь знаем, были Z-полосами и A-полосами. Электронные микрофотографии формирующихся мышц цыплят показали гладкие волокна около клеточной мембраны, а также до появления полосатых миофибрилл (см. Обзор Sanger et al. [6]). Рост длины А-полосы до зрелого размера также наблюдали с помощью электронной микроскопии мышц эмбриональной мухи, фиксируемой с ежедневными интервалами.Первые наблюдаемые волокна были гладкими с плотными телами, но без толстых нитей, за ними следовали волокна с Z-полосами и короткими A-полосами, а затем волокна с A-полосами длины зрелой мышцы [20]. Поперечно-полосатые саркомеры в формировании мышц клещей, которые были проанализированы с помощью поляризованного света у живых животных, увеличились за 30-часовой период с 2,2 до 4 микрон в длину, что сопровождалось увеличением длины А-полосы с 1,4 до 3 микрон [21] .
Появление зондов для флуоресцентного обнаружения белков внутри клеток позволило охарактеризовать волокна в немышечных клетках и эмбриональных мышечных клетках.В немышечных клетках многие стрессовые волокна, ранее описанные как гладкие в [22, 23], как было показано, состоят из повторяющихся концентраций альфа-актинина и немышечного миозина II, распределенных в чередующихся полосах вдоль перекрывающихся актиновых филаментов [24-28]. В краткой презентации трехстраничный отчет, опубликованный в книге, описывающей протоколы коротких бесед в честь покойного Джона Маршалла, Куликовски и Манасека [29], описывает, как зародышевые культивированные кардиомиоциты цыплят появляются при окрашивании мышечно-специфическими антителами к миозину II. через разные периоды времени в культуре.Они отметили появление гладких непрерывных миозиновых волокон в кардиомиоцитах в первые дни культивирования. Эти волокна были описаны как имеющие «… морфологию, подобную стрессовому волокну…». В более старых культурах авторы записали типичные миофибриллы с А-полосами. Они пришли к выводу, что миофибриллы могут «… собираться заново через промежуточные соединения, подобные стрессовым волокнам, в культивируемых сердечных миоцитах».
Они пришли к выводу, что миофибриллы могут «… собираться заново через промежуточные соединения, подобные стрессовым волокнам, в культивируемых сердечных миоцитах».
Было впервые показано, что немышечная изоформа миозина II присутствует в клетках скелетных мышц рядом с мембраной в волокнах, отличных от зрелых миофибрилл [30].Эти волокна позже были названы «наподобие стрессовых волокон» Dlugosz et al. [31]. Три изоформы немышечного миозина II были с тех пор обнаружены в волокнах поперечнополосатых мышечных клеток позвоночных [32–34]. Последующие исследования различались по поводу роли, которую эти «стрессовые волокна-подобные» волокна могут играть в миофибриллогенезе. Лаборатория Хольцера предложила им функционировать как шаблоны, на которых собираются мышечные белки и образуют поперечно-полосатые миофибриллы [31]. Предполагалось, что шаблоны затем будут разобраны с повторной сборкой субъединиц в другой области ячейки, чтобы перезапустить процесс создания шаблона.Таким образом, одна структура, подобная стрессовому волокну, была предложена в качестве шаблона для каждой новой миофибриллы миофибрилл.
Было обнаружено, что волокна, которые были гладкими при окрашивании F-актина фаллоидином, образовывали мини-саркомеры, когда флуоресцентный альфа-актинин вводили в живые клетки или перфузировали в проницаемые мышечные клетки [35–37]. Небольшие точки альфа-актинина располагались с интервалом от 0,3 до 1,5 микрон. В живых клетках, инъецированных флуоресцентным альфа-актинином, расстояние между точками увеличивается со временем [37], как было подтверждено более поздним исследованием на эмбриональных клетках сердца, трансфицированных GFP-альфа-актинином, в которых маленькие точки альфа-актинина выровнены латерально и Z- полосы сначала выглядели как бусинки, а потом стали гладкими [38].Были обнаружены полосы немышечного миозина II, чередующиеся с плотностями саркомерного альфа-актинина (z-тела) в этих волокнах [39]. Идентичные минисаркомерные паттерны чередующихся z-тел (саркомерный альфа-актинин) и полос немышечного миозина II были также обнаружены в эксплантатах прекардиальной мезодермы цыплят [5] и в окрашенных интактных сердцах ранних куриных эмбрионов [40].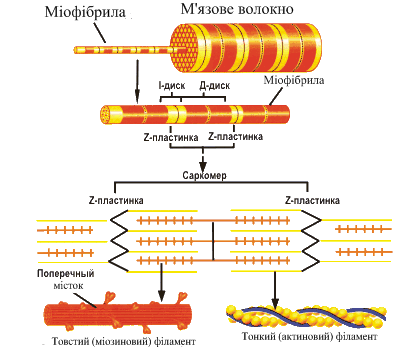 Таким образом, не было различий между культивированными и интактными сердцами в обнаружении пути миофибриллогенеза (). Мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли он in situ или in vitro .
Таким образом, не было различий между культивированными и интактными сердцами в обнаружении пути миофибриллогенеза (). Мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли он in situ или in vitro .
Немышечные легкие цепи миозина II, которые были флуоресцентно помечены и введены в культивируемые клетки из эмбриональных мышц птиц, также были локализованы в небольших периодически расположенных полосах вдоль самых тонких волокон актина около клеточной мембраны [27]. Кроме того, легкие цепи также локализованы в А-полосах миофибрилл в эмбриональных клетках и в виде гладкого рисунка по длине других актиновых волокон [27]. Гладкий узор представляет собой зарождающиеся миофибриллы (). Неровный узор является результатом перекрывания толстых филаментов в формирующихся миофибриллах [5-7].При делении кардиомиоцитов птиц Conrad et al. [41] обнаружили, что немышечный миозин II, но не мышечный миозин II, присутствует в бороздах дробления.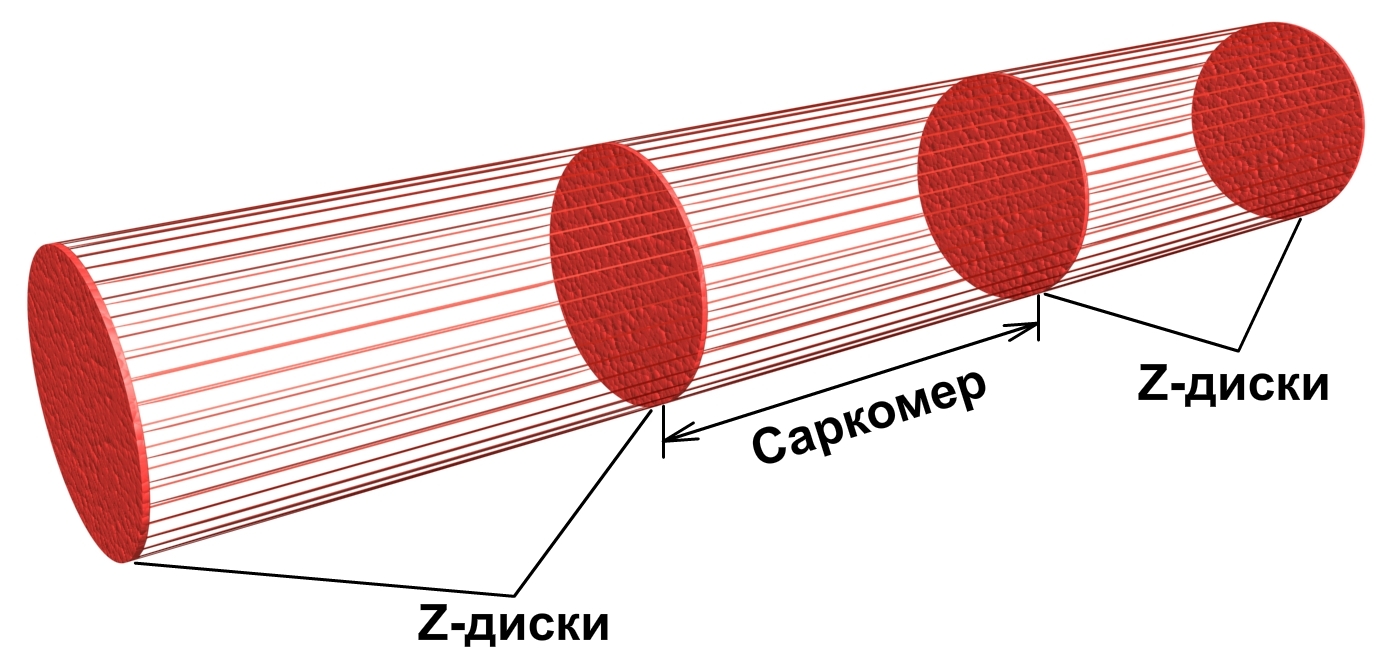 В настоящее время известно, что немышечный миозин II в кардиомиоцитах птиц является изоформой IIB [39, 42]. Антитело к II A не реагирует с эмбриональными кардиомиоцитами цыплят [39], и ранние сообщения показали, что волокна с минисаркомерными полосами немышечного миозина не присутствовали в кардиомиоцитах птиц [43, 44]), потому что использовались антитела к II A.Малый диаметр и гладкий внешний вид волокон с окрашивающими фаллоидином волокнами напоминают таковые у стресс-волокон, отсюда и термин «стрессовые волокноподобные структуры» [31]. Однако теперь мы знаем, что большинство белков в этих волокнах являются мышечно-специфическими белками, например, альфа-актинином, актином, тропомиозином и так далее [7, 39, 45, 46]. Они также менее чувствительны, чем стрессовые волокна, к ряду различных ингибиторов (гельсолин [47], ДНКаза1, витамин-D-связывающий белок [48] и латрункулин-A [49]).J. M. Sanger и J. W. Sanger [50] продемонстрировали, что борозды дробления содержат противоположно поляризованные актиновые филаменты, пересекающиеся с немышечными II-подобными филаментами в минисаркомерных структурах, подобных таковым в стрессовых волокнах интерфазных клеток.
В настоящее время известно, что немышечный миозин II в кардиомиоцитах птиц является изоформой IIB [39, 42]. Антитело к II A не реагирует с эмбриональными кардиомиоцитами цыплят [39], и ранние сообщения показали, что волокна с минисаркомерными полосами немышечного миозина не присутствовали в кардиомиоцитах птиц [43, 44]), потому что использовались антитела к II A.Малый диаметр и гладкий внешний вид волокон с окрашивающими фаллоидином волокнами напоминают таковые у стресс-волокон, отсюда и термин «стрессовые волокноподобные структуры» [31]. Однако теперь мы знаем, что большинство белков в этих волокнах являются мышечно-специфическими белками, например, альфа-актинином, актином, тропомиозином и так далее [7, 39, 45, 46]. Они также менее чувствительны, чем стрессовые волокна, к ряду различных ингибиторов (гельсолин [47], ДНКаза1, витамин-D-связывающий белок [48] и латрункулин-A [49]).J. M. Sanger и J. W. Sanger [50] продемонстрировали, что борозды дробления содержат противоположно поляризованные актиновые филаменты, пересекающиеся с немышечными II-подобными филаментами в минисаркомерных структурах, подобных таковым в стрессовых волокнах интерфазных клеток.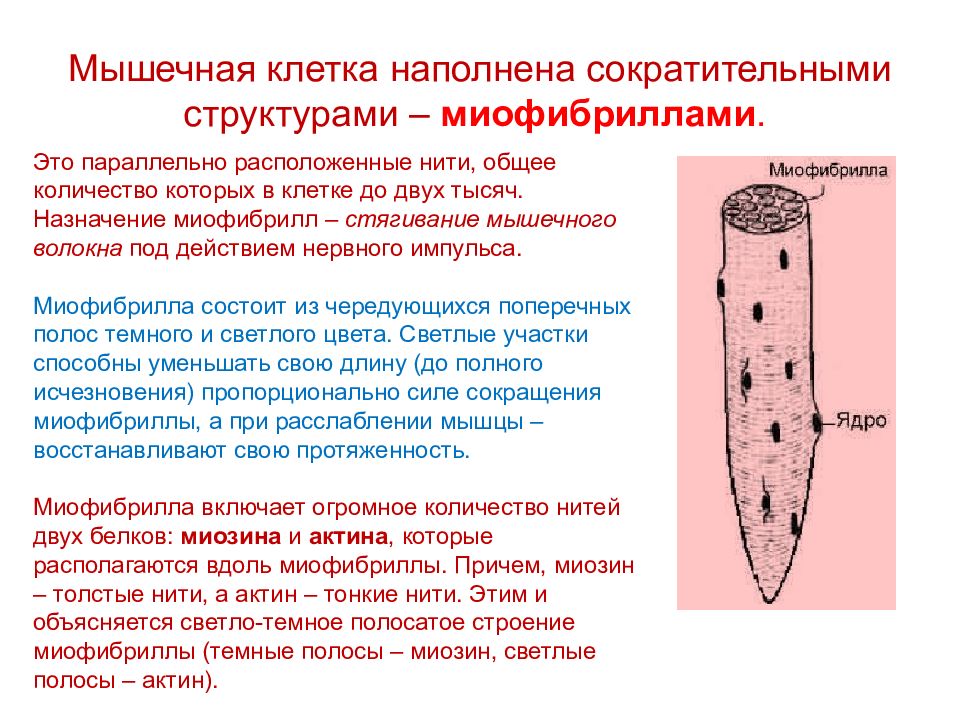
Мы предположили, что волокна с минисаркомерными связями немышечного миозина II в мышечных клетках являются премиофибриллами, предшественниками миофибрилл (см. [7, 39];). Мы рассматриваем мелкие точки z-телец альфа-актинина, предшественников Z-диапазонов.Закономерности локализации миозина II в эмбриональных кардиомиоцитах цыплят, зафиксированные в разное время после распространения и реформирования миофибрилл в культуре, указывают на три типа волокон (). Премиофибриллы состоят из тонких нитей с периодическими мини-А-полосами, расположенными между точками альфа-актинина (z-тельцами). Возникающие миофибриллы обладают двумя типами окрашивания миозина II: небольшими периодическими мини-А-полосами немышечного миозина IIB и несвязанным окрашиванием мышечно-специфичного миозина II. Зрелые миофибриллы окрашивают только один тип миозина II, то есть мышечно-специфический миозин II в A-полосах. Таким образом, исходное несвязанное окрашивание волокон фаллоидином, которое Dlugosz et al. [31], первоначально названные стрессовыми волокнами, представляют собой как пре-, так и зарождающиеся миофибриллы. Последующие наблюдения группы Хольцера за формированием мышц в фиксированных эмбриональных птичьих миоцитах привели их к предложению дополнительной модели, в которой сборка миофибрилл происходила посредством независимой сборки толстых нитей и Z-полос, связанных с их связанными тонкими нитями (кистями IZI) [43, 44 ].Было предложено связать Титина с кистями I-Z-I, захватить мышечные волокна миозина II и выровнять их в A-полосы, а также соединить A-полосы и I-Z-I кисти в саркомерные единицы без вовлечения стрессовых волоконоподобных структур. Однако теперь известно, что предшественники Z-полос (z-тел) и связанный с ними актин не разбросаны в клетке, а выровнены минисаркомерным расположением немышечных миозинов II, то есть премиофибрилл (; [7, 39 , 51]). Минисаркомерное устройство борозд дробления, стресс-волокон и премиофибрилл, по-видимому, возникло очень рано [27, 28, 50, 52, 53].
[31], первоначально названные стрессовыми волокнами, представляют собой как пре-, так и зарождающиеся миофибриллы. Последующие наблюдения группы Хольцера за формированием мышц в фиксированных эмбриональных птичьих миоцитах привели их к предложению дополнительной модели, в которой сборка миофибрилл происходила посредством независимой сборки толстых нитей и Z-полос, связанных с их связанными тонкими нитями (кистями IZI) [43, 44 ].Было предложено связать Титина с кистями I-Z-I, захватить мышечные волокна миозина II и выровнять их в A-полосы, а также соединить A-полосы и I-Z-I кисти в саркомерные единицы без вовлечения стрессовых волоконоподобных структур. Однако теперь известно, что предшественники Z-полос (z-тел) и связанный с ними актин не разбросаны в клетке, а выровнены минисаркомерным расположением немышечных миозинов II, то есть премиофибрилл (; [7, 39 , 51]). Минисаркомерное устройство борозд дробления, стресс-волокон и премиофибрилл, по-видимому, возникло очень рано [27, 28, 50, 52, 53]. Визуализация живых клеток позволила нам проследить миофибриллогенез от отложения премиофибрилл в формирующиеся миофибриллы до зрелых миофибрилл в культивируемых кардиомиоцитах, клетках скелетных мышц и у живых рыбок данио [37, 38, 49, 53–56]. Визуализация живых клеток мышечных клеток, трансфицированных усеченными участками Z-полосы тайтина, продемонстрировала важность тайтина для миофибриллогенеза [57, 58]. Мы смогли использовать воздействие на ранние миобласты различных концентраций этилметансульфоната для остановки миофибриллогенеза на стадии премиофибрилл или зарождающейся миофибриллы [55].Удаление этого ингибитора привело к возобновлению процесса сборки, что привело к образованию зрелых миофибрилл (). Роль немышечного миозина II, по-видимому, важна для выравнивания тонких филаментов в премиофибриллах и возникающих миофибриллах [5, 6, 49]. Нарушение образования немышечных филаментов миозина II с помощью ингибитора фосфорилирования легких цепей миозина, которые необходимы для сборки филаментов, приводит к потере премиофибрилл и неорганизованному массиву миозиновых толстых филаментов [5].
Визуализация живых клеток позволила нам проследить миофибриллогенез от отложения премиофибрилл в формирующиеся миофибриллы до зрелых миофибрилл в культивируемых кардиомиоцитах, клетках скелетных мышц и у живых рыбок данио [37, 38, 49, 53–56]. Визуализация живых клеток мышечных клеток, трансфицированных усеченными участками Z-полосы тайтина, продемонстрировала важность тайтина для миофибриллогенеза [57, 58]. Мы смогли использовать воздействие на ранние миобласты различных концентраций этилметансульфоната для остановки миофибриллогенеза на стадии премиофибрилл или зарождающейся миофибриллы [55].Удаление этого ингибитора привело к возобновлению процесса сборки, что привело к образованию зрелых миофибрилл (). Роль немышечного миозина II, по-видимому, важна для выравнивания тонких филаментов в премиофибриллах и возникающих миофибриллах [5, 6, 49]. Нарушение образования немышечных филаментов миозина II с помощью ингибитора фосфорилирования легких цепей миозина, которые необходимы для сборки филаментов, приводит к потере премиофибрилл и неорганизованному массиву миозиновых толстых филаментов [5]. Удаление ингибитора ML-7 привело к реформированию премиофибрилл и возникающих миофибрилл и к сборке упорядоченных массивов толстых филаментов в A-полосах зрелых миофибрилл [5].
Удаление ингибитора ML-7 привело к реформированию премиофибрилл и возникающих миофибрилл и к сборке упорядоченных массивов толстых филаментов в A-полосах зрелых миофибрилл [5].
Как перекрывающиеся толстые филаменты, состоящие из гексамеров мышечного миозина II в формирующихся миофибриллах, выстраиваются в A-полосы зрелых миофибрилл, не ясно. Было высказано предположение, что титин, белки M-диапазона и другие белки, такие как обскурин, играют роль в этом процессе [59–62]. Есть миофибриллы, у которых отсутствуют М-полосы, но при этом их А-полосы полностью выровнены.Lange et al. [63] недавно сообщили, что A-Bands и миофибриллы обычно образуются у мышей с нокаутом, скрывающих видимость. Они действительно обнаружили, что продольные массивы саркоплазматического ретикулума (SR) были изменены, поддерживая роль соединения SR с миофибриллами.
Модель премиофибрилл () не была принята повсеместно, потому что она кажется несовместимой с несколькими опубликованными статьями (см. Обзор Sanger et al. [7]). В частности, один из двух отчетов лаборатории Адельштейна показал, что мыши с нулевым уровнем немышечного миозина IIB [64], если они доживали до рождения, имели аномальные сердце и мозг и умирали в день рождения.Тем не менее, аномальные сердца действительно содержали нормальные миофибриллы, что позволяет предположить, что немышечный миозин IIB не был необходим для образования всех миофибрилл. Однако западные исследования геля на нескольких выживших животных показали, что у половины выживших новорожденных изоформа миозина IIA была активирована, и, таким образом, изоформа IIA могла занять место изоформы IIB. Эмбриональные клетки скелетных мышц имеют обе изоформы немышечного миозина IIA и IIB. Таким образом, клетки скелетных мышц были нормальными при этих нокаутах IIB, предположительно из-за присутствия IIA.Недавняя статья Лу и др. [34] сообщает, что обе изоформы немышечного миозина II, A и B, присутствуют в ранних сердцах мышей. В другой статье группа Adelstein сообщила, что немышечный миозин II является белком Z-диапазона как в клетках сердечных (IIB), так и в скелетных (A и B) мышечных клетках [65].
[7]). В частности, один из двух отчетов лаборатории Адельштейна показал, что мыши с нулевым уровнем немышечного миозина IIB [64], если они доживали до рождения, имели аномальные сердце и мозг и умирали в день рождения.Тем не менее, аномальные сердца действительно содержали нормальные миофибриллы, что позволяет предположить, что немышечный миозин IIB не был необходим для образования всех миофибрилл. Однако западные исследования геля на нескольких выживших животных показали, что у половины выживших новорожденных изоформа миозина IIA была активирована, и, таким образом, изоформа IIA могла занять место изоформы IIB. Эмбриональные клетки скелетных мышц имеют обе изоформы немышечного миозина IIA и IIB. Таким образом, клетки скелетных мышц были нормальными при этих нокаутах IIB, предположительно из-за присутствия IIA.Недавняя статья Лу и др. [34] сообщает, что обе изоформы немышечного миозина II, A и B, присутствуют в ранних сердцах мышей. В другой статье группа Adelstein сообщила, что немышечный миозин II является белком Z-диапазона как в клетках сердечных (IIB), так и в скелетных (A и B) мышечных клетках [65]. Они также сообщили в той же статье, что изоформа IIB была локализована во вставленных дисках фиксированных и окрашенных клеток сердечной мышцы. После публикации этих двух исследований из лабораторий Адельштейна была открыта третья изоформа немышечного миозина IIC [32, 33].Эта изоформа также присутствует в сердце, скелетных мышцах и некоторых органах. Роль немышечного миозина IIC в миофибриллогенезе еще предстоит изучить. Использование нами антител, направленных против немышечных II A или B в клетках сердечных и скелетных мышц, никогда не обнаружило эти антигены ни в Z-полосах, ни в интеркалированных дисках [5, 39, 40, 56]. Наши предварительные результаты показывают, что клетки сердца и скелетных мышц котрансфицировались церулеановым флуоресцентным белком (CeFP) и одной из трех изоформ немышечного миозина II (зеленый флуоресцентный белок (GFP) — немышечный миозин II A или B или C), что противоречит результатам Takeda et al.[65] бумага. GFP-немышечные миозины II не были локализованы в Z-полосах ни одного типа мышечных клеток, ни во вставленных дисках клеток сердечной мышцы.
Они также сообщили в той же статье, что изоформа IIB была локализована во вставленных дисках фиксированных и окрашенных клеток сердечной мышцы. После публикации этих двух исследований из лабораторий Адельштейна была открыта третья изоформа немышечного миозина IIC [32, 33].Эта изоформа также присутствует в сердце, скелетных мышцах и некоторых органах. Роль немышечного миозина IIC в миофибриллогенезе еще предстоит изучить. Использование нами антител, направленных против немышечных II A или B в клетках сердечных и скелетных мышц, никогда не обнаружило эти антигены ни в Z-полосах, ни в интеркалированных дисках [5, 39, 40, 56]. Наши предварительные результаты показывают, что клетки сердца и скелетных мышц котрансфицировались церулеановым флуоресцентным белком (CeFP) и одной из трех изоформ немышечного миозина II (зеленый флуоресцентный белок (GFP) — немышечный миозин II A или B или C), что противоречит результатам Takeda et al.[65] бумага. GFP-немышечные миозины II не были локализованы в Z-полосах ни одного типа мышечных клеток, ни во вставленных дисках клеток сердечной мышцы. Три немышечные изоформы миозина II были локализованы в областях клеток в линейных массивах, в чередующихся массивах с z-тельцами, содержащими CeFP-альфа-актинин, то есть премиофибриллами.
Три немышечные изоформы миозина II были локализованы в областях клеток в линейных массивах, в чередующихся массивах с z-тельцами, содержащими CeFP-альфа-актинин, то есть премиофибриллами.
Есть две другие статьи, которые были названы несовместимыми с премиофибриллярной моделью миофибриллогенеза. Ehler et al. [59] и Rudy et al.[66] сообщили об их неспособности обнаружить присутствие премиофибрилл или возникающих миофибрилл ни в интактных фиксированных эмбриональных сердцах птиц, ни в эксплантатах прекардиальной мезодермы. Однако улучшенная фиксация и иммунофлуоресцентные методы привели к обнаружению немышечного миозина II B в организованных массивах в обоих типах препаратов [5, 40], которые были идентичны премиофибриллам и возникающим миофибриллам, первоначально обнаруженным в культивируемых эмбриональных кардиомиоцитах [39]. Кроме того, Du et al. [5] смогли обратимо ингибировать сборку зрелых миофибрилл с помощью ML-7, ингибитора киназы легких цепей миозина, фермента, который отвечает за фосфорилирование немышечных легких цепей и является необходимым условием для способности немышечный миозин II с образованием филаментов. Удаление этого ингибитора привело к реформированию премиофибрилл с их массивами мини-А-полос немышечного миозина II B и возобновлению миофибриллогенеза, что привело к образованию зрелых миофибрилл. Все эти результаты подтверждают общую модель миофибриллогенеза в кардиомиоцитах, будь то в интактном сердце, эксплантатах прекардиальной мезодермы или в культуре ткани, как показано на рисунке. Нити немышечного миозина II могут связывать актиновые филаменты, прикрепленные к z-тельцам, с образованием организованных линейных массивов, которые мы назвали премиофибриллами [7, 39], первая стадия, которая приводит к образованию зрелых миофибрилл ().
Удаление этого ингибитора привело к реформированию премиофибрилл с их массивами мини-А-полос немышечного миозина II B и возобновлению миофибриллогенеза, что привело к образованию зрелых миофибрилл. Все эти результаты подтверждают общую модель миофибриллогенеза в кардиомиоцитах, будь то в интактном сердце, эксплантатах прекардиальной мезодермы или в культуре ткани, как показано на рисунке. Нити немышечного миозина II могут связывать актиновые филаменты, прикрепленные к z-тельцам, с образованием организованных линейных массивов, которые мы назвали премиофибриллами [7, 39], первая стадия, которая приводит к образованию зрелых миофибрилл ().
3. Оптические методы исследования миофибриллогенеза
Флуоресцентная микроскопия флуоресцентно меченных саркомерных белков (красителей или меток GFP) позволила обнаружить сборку миофибрилл в живых клетках сердца и скелетных мышц [37, 38, 49]. Методика восстановления флуоресценции после фотообесцвечивания (FRAP) показала, что наложение на добавление вновь синтезированных белков к комплексам z-тела и Z-полосы представляет собой активный обмен между молекулами в цитоплазматическом пуле и молекулами того же вида, находящимися в z- тела и Z-полосы [46, 56, 67–69]. В общем, степень и половина времени обмена флуоресцентными молекулами, анализируемые с помощью методов FRAP, являются функцией связывающего взаимодействия белка в клеточном комплексе, где он сконцентрирован, причем более короткое время восстановления указывает на более низкое сродство [70]. Wang et al. [46] продемонстрировали, что семь различных белков Z-полосы обмениваются независимо друг от друга и что обмен не зависит от синтеза белка и молекулярной массы. Кроме того, динамика тех же белков в z-тельцах премиофибрилл была снижена в Z-полосах зрелых миофибрилл.Было высказано предположение, что это снижение связано с включением дополнительных белков в формирование Z-полосы (; [46]). Эти наблюдения были распространены на клетки скелетных мышц у живых рыбок данио [56], где отслеживались пять различных Z-полос (актин, альфа-актинин, FATZ, миотилин и телетонин). Их порядок обмена был подобен обмену тех же белков в культивируемых клетках скелетных мышц перепела, что указывает на то, что поведение в условиях культивирования было сравнимо с поведением в клетках живого животного.
В общем, степень и половина времени обмена флуоресцентными молекулами, анализируемые с помощью методов FRAP, являются функцией связывающего взаимодействия белка в клеточном комплексе, где он сконцентрирован, причем более короткое время восстановления указывает на более низкое сродство [70]. Wang et al. [46] продемонстрировали, что семь различных белков Z-полосы обмениваются независимо друг от друга и что обмен не зависит от синтеза белка и молекулярной массы. Кроме того, динамика тех же белков в z-тельцах премиофибрилл была снижена в Z-полосах зрелых миофибрилл.Было высказано предположение, что это снижение связано с включением дополнительных белков в формирование Z-полосы (; [46]). Эти наблюдения были распространены на клетки скелетных мышц у живых рыбок данио [56], где отслеживались пять различных Z-полос (актин, альфа-актинин, FATZ, миотилин и телетонин). Их порядок обмена был подобен обмену тех же белков в культивируемых клетках скелетных мышц перепела, что указывает на то, что поведение в условиях культивирования было сравнимо с поведением в клетках живого животного. На рисунках и представлены примеры этого процесса обмена в клетках скелетных мышц по бокам рыбок данио с использованием YFP-миотилина. Модель премиофибрилл с ее постулатами о трех стадиях образования миофибрилл предполагает механизмы репозиции молекул, поскольку премиофибриллы трансформируются в зрелые миофибриллы в течение нескольких часов [7, 38]. Обмен молекулами в формирующиеся миофибриллы и из них позволил бы это преобразование ().
На рисунках и представлены примеры этого процесса обмена в клетках скелетных мышц по бокам рыбок данио с использованием YFP-миотилина. Модель премиофибрилл с ее постулатами о трех стадиях образования миофибрилл предполагает механизмы репозиции молекул, поскольку премиофибриллы трансформируются в зрелые миофибриллы в течение нескольких часов [7, 38]. Обмен молекулами в формирующиеся миофибриллы и из них позволил бы это преобразование ().
FRAP YFP-миотилина в Z-полосах зрелых миофибрилл в двух разных мышечных клетках у живых рыбок данио (трехдневного возраста), предварительное отбеливание, отбеливание и через 1 и 10 минут после фотообесцвечивания.К концу десятиминутного периода восстановление почти завершено. Масштаб = 10 мкм.
Сравнение динамики YFP-миотилина после фотообесцвечивания в Z-полосах зрелых миофибрилл в клетках скелетных мышц в культуре ткани по сравнению с клетками скелетных мышц по бокам эмбриональных рыбок данио. Обратите внимание на сходство восстановления одного и того же белка Z-полосы у двух разных животных в двух разных условиях.
Хотя флуоресцентная микроскопия широко используется для изучения совместной локализации белков в клетках, предел разрешения микроскопии в видимом свете составляет порядка 200 нм, что намного больше, чем шкала длины межбелковых связей.В последние годы метод визуализации флуоресцентного резонансного переноса энергии (FRET) появился как способ улучшить разрешение обычной световой микроскопии [10, 71]. FRET был назван «спектроскопической линейкой», потому что с помощью соответствующей теории можно сделать вывод о расстоянии между донором и акцептором из полученных сигналов FRET в фиксированных и живых клетках. Обычно измеримые сигналы FRET возникают только тогда, когда донор и акцептор находятся в пределах ~ 10 нм друг от друга.По мере развития технологии флуоресцентной визуализации растет интерес к использованию FRET для картирования меж- и внутримолекулярных взаимодействий в клетках. Стаут и др. [8] использовали методы FRET на живых клетках скелетных мышц, чтобы продемонстрировать, что существуют перестройки молекул альфа-актинина и FATZ, когда z-тела сливаются и перестраиваются с образованием Z-полос.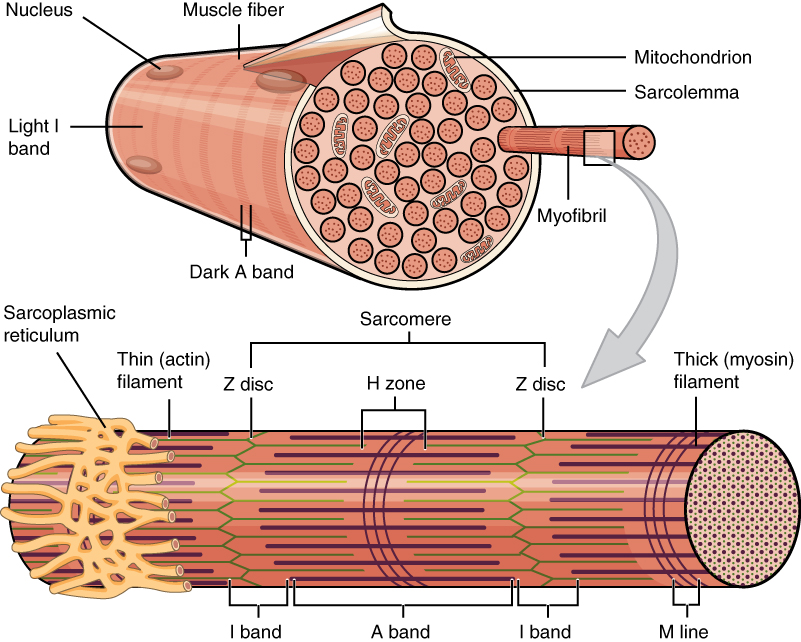 Эти результаты FRET подтверждают интерпретацию экспериментов FRAP во время миофибриллогенеза [46] и модель премиофибрилл (). Текущее развитие микроскопов, которые нарушают дифракционный предел света [72], должно раскрыть дальнейшее понимание расположения белковых сетей в миофибриллах и изменений, которым они подвергаются в процессах сборки и разборки.
Эти результаты FRET подтверждают интерпретацию экспериментов FRAP во время миофибриллогенеза [46] и модель премиофибрилл (). Текущее развитие микроскопов, которые нарушают дифракционный предел света [72], должно раскрыть дальнейшее понимание расположения белковых сетей в миофибриллах и изменений, которым они подвергаются в процессах сборки и разборки.
Таким образом, наша цель — понять, как миофибриллы собираются, реконструируются и поддерживаются (рисунки и). Мы используем белки дикого типа и мутировавшие саркомерные белки для исследования сборки (конфокальный и деконволюционный микроскопы), динамики и ремоделирования (FRAP) и взаимодействий (FRET) белков в миофибриллах в живом состоянии. Стандартные анализы биохимического связывания будут использоваться для подтверждения недавно выявленных взаимосвязей FRET, обнаруженных в живых мышечных клетках. Мы также сможем проверить идею о том, что миофибриллогенез имеет один и тот же путь и молекулярные саркомерные взаимодействия, независимо от того, происходит ли сборка в культуре ткани или у живого животного, такого как рыбки данио.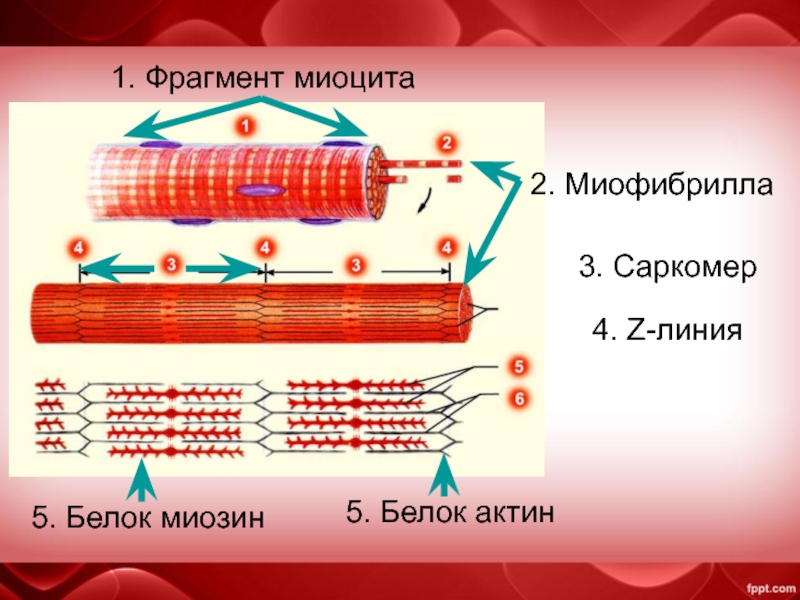 Другими словами, мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли in situ или in vitro .
Другими словами, мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли in situ или in vitro .
Компоненты, внешний вид, структура, функции и ответы на вопросы
Миофибрилла также известна как мышечная фибрилла. Миофибрилла — это основная палочковидная единица мышечной клетки. Миоциты — это трубчатые клетки, из которых состоят мышцы. Миоциты также известны как мышечные волокна в поперечно-полосатой мышце, и эти клетки также содержат множество цепочек миофибрилл.Считается, что в процессе миогенеза миоциты создаются на стадии эмбрионального развития.
Миофибриллы в основном состоят из многих длинных белков, таких как миозин, актин и тайтин, а также есть другие белки, которые удерживают их вместе. Все эти белки организованы в толстые и тонкие нити, которые называются миофиламентами. Миофиламенты повторяются по длине миофибриллы в секции, называемой саркомерами. Сокращение мышц происходит при скольжении толстых (миозиновых) и тонких (актиновых) нитей друг с другом.
Сокращение мышц происходит при скольжении толстых (миозиновых) и тонких (актиновых) нитей друг с другом.
В этой статье мы обсудим мышцу, определение миофибриллы, ее структуру, функцию, а также ответим на несколько часто задаваемых вопросов.
Мышцы
Большую часть общей массы тела у людей составляют полосатые или поперечно-полосатые мышцы. поддержание осанки тела и движений ягодиц осуществляется при сокращении поперечно-полосатых мышц. Поперечно-полосатые мышцы также называют скелетными мышцами, поскольку оба конца поперечно-полосатых мышц составляют скелет.Скелетные или поперечно-полосатые мышцы прикреплены к костям с помощью сухожилий, которые обладают эластичностью, обеспечиваемой белком коллагеном и эластичностью, которые считаются основными компонентами сухожилий.
С каждой поперечно-полосатой мышцей связаны кровеносные сосуды и нервы. Эти кровеносные сосуды помогают транспортировать кровь к мышцам и от них, а также поставляют кислород и другие питательные вещества, а также удаляют из крови ненужный углекислый газ и другие отходы.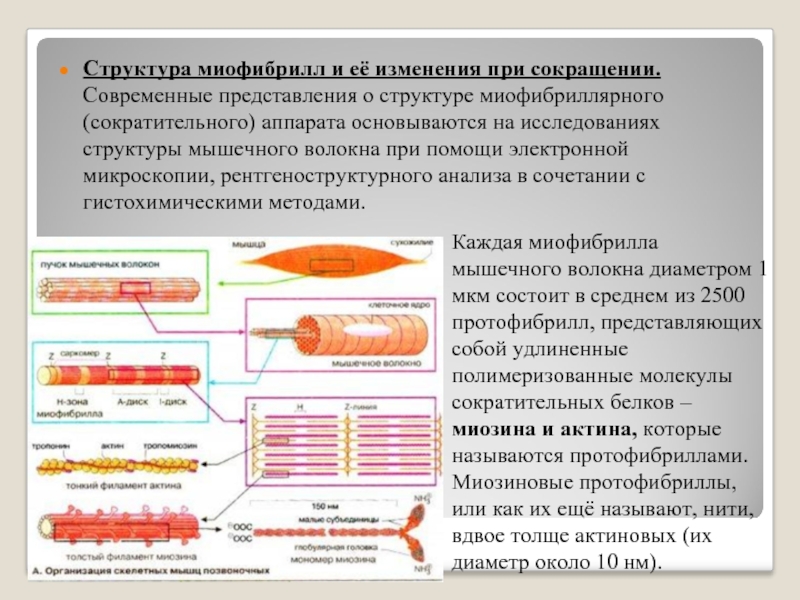 Через двигательные нервы передаются сигналы от центральной нервной системы к мышцам, которые инициируют сокращение мышц. Существует также реакция мышц на гормоны, вырабатываемые железами внутренней секреции. Эти гормоны также взаимодействуют с дополнительными рецепторами, которые присутствуют на поверхности клеток, что помогает инициировать специфическую реакцию.
Через двигательные нервы передаются сигналы от центральной нервной системы к мышцам, которые инициируют сокращение мышц. Существует также реакция мышц на гормоны, вырабатываемые железами внутренней секреции. Эти гормоны также взаимодействуют с дополнительными рецепторами, которые присутствуют на поверхности клеток, что помогает инициировать специфическую реакцию.
С каждой мышцей связаны важные сенсорные структуры, называемые рецепторами растяжения, которые помогают контролировать состояние мышцы, а также возвращают всю информацию в центральную нервную систему.Изменение длины мышцы и скорости движения мышцы — это две вещи, к которым чувствительны рецепторы растяжения. Рецепторы растяжения отвечают за завершение системы обратной связи, которая позволяет центральной нервной системе оценивать движение мышц, а также регулировать двигательные сигналы в свете движения.
Миофибрилла Определение
Миофибрилла является компонентом скелетных мышц животного. Миофибриллы — это очень тонкие сократительные волокна, и многие группы миофибрилл вытянуты в виде параллельных столбов вдоль поперечно-полосатых мышечных волокон.Миофибриллы и образующиеся миофибриллы могут достигать нескольких сантиметров в длину. Миофибриллы состоят из множества толстых и тонких миофиламентов, которые помогают придать мышцам поперечно-полосатый вид. Толстые волокна состоят из миозина, а тонкие волокна состоят из актина, а также содержат другие мышечные белки, такие как тропомиозин и тропонин. Миофибриллы состоят из повторяющихся субъединиц, которые называются саркомерами.
Миофибриллы — это очень тонкие сократительные волокна, и многие группы миофибрилл вытянуты в виде параллельных столбов вдоль поперечно-полосатых мышечных волокон.Миофибриллы и образующиеся миофибриллы могут достигать нескольких сантиметров в длину. Миофибриллы состоят из множества толстых и тонких миофиламентов, которые помогают придать мышцам поперечно-полосатый вид. Толстые волокна состоят из миозина, а тонкие волокна состоят из актина, а также содержат другие мышечные белки, такие как тропомиозин и тропонин. Миофибриллы состоят из повторяющихся субъединиц, которые называются саркомерами.
Мышечное сокращение происходит из-за взаимодействия между актином и миозиновыми нитями, когда они временно связываются и высвобождаются.Мышечные волокна представляют собой одиночные многоядерные клетки, которые обычно объединяются, образуя мышцу.
Структура миофибрилл
Есть два типа миофибрилл, из которых состоят миофибриллы —
Тонкие нити: Тонкие нити в основном состоят из протеина актина, который свернут с нити небулина.
 Когда происходит полимеризация актиновой нити, образуется лестница, по которой миозиновая нить поднимается для создания движения.
Когда происходит полимеризация актиновой нити, образуется лестница, по которой миозиновая нить поднимается для создания движения.Толстая нить: Толстая нить в основном состоит из белка, называемого миозином. Ответственность за протеин миозин лежит в принудительном генерировании. Миозин состоит из глобулярной головки, которая имеет как аденозинтрифосфат (АТФ), так и сайты связывания актина, а также длинный хвост, который участвует в его полимеризации в миозиновых филаментах.
Акриномиозин — это название белкового комплекса, который состоит как из актина, так и из миозина.
Поперечно-полосатая мышца, такая как скелетная и сердечная мышца, имеет актиновые и миозиновые филаменты, которые имеют определенную и постоянную длину, которая составляет порядка нескольких миллиметров.
 Они очень маленькие по сравнению с удлиненными мышечными клетками, длина которых измеряется сантиметрами.
Они очень маленькие по сравнению с удлиненными мышечными клетками, длина которых измеряется сантиметрами.Миофиламенты организованы в повторяющиеся субъединицы по длине миофибрилл. Эти субъединицы называются саркомерами.
Миофибриллы заполняют мышечные клетки, которые проходят параллельно друг другу по длинной оси клетки.
Саркомерные субъединицы одной миофибриллы идеально выровнены с миофибриллами, которые находятся рядом с ней, и это выравнивание заставляет клетки выглядеть полосатыми или полосатыми.
В случае гладкомышечных клеток выравнивание отсутствует, следовательно, нет полос и, следовательно, клетки называются гладкими.
Как маркировать миофибриллу и ее компоненты?
На приведенной ниже схеме показано, как маркировать миофибриллы и ее компоненты.
[Изображение будет загружено в ближайшее время]
Клетки скелетных мышц длинные и цилиндрические, их также называют мышечными волокнами или миофибриллами. Волокна скелетных мышц очень большие по сравнению с другими клетками. Они имеют длину до 30 см и диаметр до 100 микрометров, и это пример портняжной мышцы верхней части ноги.
Волокна скелетных мышц содержат клеточные органеллы, обнаруженные в других клетках, таких как митохондрии, которые также называют электростанцией клеточной мембраны.
Плазматическая мембрана мышечных волокон называется сарколеммой. Сарколемма происходит от греческого слова «сарко», что означает плоть. Цитоплазма сарколеммы называется саркоплазмой.
Внутри мышечных волокон присутствуют миофибриллы, которые хранят белки организованным образом.
 Миофибриллы, которые проходят по длине клетки, содержат саркомеры, соединенные последовательно.
Миофибриллы, которые проходят по длине клетки, содержат саркомеры, соединенные последовательно.Существуют сотни и тысячи миофибрилл, которых всего около 1.2 микрометра в диаметре, которые имеют тысячи саркомеров и которые находятся внутри одного мышечного волокна.
В мышечном волокне саркомер считается наименьшей функциональной единицей, а также имеет очень организованное расположение сократительных, регуляторных и структурных белков.
Укорочение отдельных саркомеров приводит к сокращению отдельных мышечных волокон.
Внешний вид миофибрилл
При просмотре в световой микроскоп видно, что есть различные подобласти саркомеров.Названия подобластей саркомера основаны на их относительном более темном или более светлом цвете при просмотре в световой микроскоп.

Есть две темные полосы, называемые Z-диском или Z-линией, которыми ограничен каждый саркомер.
Z-диск или Z-линии представляют собой плотные белковые диски, которые не пропускают свет. Т-канальцы находятся в области Z-диска.
Область между Z-диском дополнительно разделена на две светлые полосы с обоих концов, которые называются I-полосами, а в средней области присутствует более темная сероватая полоса, называемая A -группа.
I-полосы кажутся очень светлыми, потому что эта область саркомера в основном содержит очень тонкие актиновые филаменты, которые имеют очень маленький диаметр, что позволяет свету проходить между ними. I в полосе I означает изотропный. Изотропия означает наличие одинаковых значений свойства во всех направлениях.

Полоса A в основном состоит из миозиновых волокон. Миозиновая нить имеет очень большой диаметр и, как следствие, ограничивает прохождение света.A в полосе A означает анизотропный. Анизотропия — это свойство материала, которое позволяет ему изменять или принимать различные свойства в определенном направлении.
Часть между полосой А и полосой I занята как актиновыми, так и миозиновыми филаментами.
В A-диапазоне присутствует относительно более яркая центральная область, называемая H-зоной. Когда мышца находится в расслабленном положении, нет перекрытия действия и миозина в H-зоне.H в H-зоне — это немецкое слово helle, которое означает яркий.
M-линия — это темная центральная линия, которая делит пополам H-зону.
 Буква M в строке M происходит от немецкого слова mittel, что означает середина. M-линия также содержит ферменты, которые помогают в энергетическом обмене.
Буква M в строке M происходит от немецкого слова mittel, что означает середина. M-линия также содержит ферменты, которые помогают в энергетическом обмене.
Функции миофибрилл
Саркомеры считаются строительными блоками миофибрилл, которые являются функциональной единицей мышцы.
Основная функция миофибрилл — сокращение мышц.Когда мышца находится в состоянии покоя, наблюдается неполное перекрытие тонких и толстых нитей.
Когда происходит сокращение мускулов, длина саркомеров укорачивается из-за скольжения толстых и тонких нитей друг над другом, что приводит к перекрытию между нитями, а также к сокращению длины саркомеров. зона H и полоса I. Длина миофиламентов не изменяется даже при уменьшении длины саркомера во время сокращения мышцы.
Гидролиз аденозинтрифосфата (АТФ) до аденозиндифосфата (АДФ) и других неорганических фосфатов приводит в движение миофиламент.

Молекула АТФ прикрепляется к глобулярной миозиновой головке на нитях, когда она находится в состоянии покоя, а когда АТФ гидролизуется, миозиновая головка меняет конформацию и образует соединение, известное как поперечный мостик с тонкой нитью.
Головка миозина снова меняет конформацию и подталкивает тонкую нить к центру саркомера, как только высвобождаются молекулы АДФ и фосфата.
Головка миозина затем снова связывается с новой молекулой АТФ, после чего головка возвращается к своей исходной конформации, а затем высвобождает тонкую нить в своем новом положении ближе к центральной М-линии.
Этот цикл повторяется, когда молекула АТФ гидролизуется в АДФ и неорганический фосфат, и головка миозина меняет конформацию, что приводит к образованию тонкой нити, которая проталкивается к центру саркомера.

Каждая толстая нить имеет сотни миозиновых головок, которые способны образовывать поперечные мостики с тонкими нитями примерно пять раз в секунду. Сокращение мышц происходит из-за непрерывных сокращений миофибрилл.
АТФ работает за счет мышечных сокращений. Мышечные волокна способны накапливать лишь очень небольшое количество АТФ, в результате чего возникает потребность в энергии, которая удовлетворяется двумя другими соединениями, хранящимися в мышцах, а именно креатинфосфатом и гликогеном.
Чтобы обеспечить кратковременный прилив энергии в течение почти двадцати секунд, используется АТФ, который хранится в мышечных волокнах, и АТФ, который образуется креатинфосфатом.
Гликоген также может использоваться в качестве долговременного источника энергии, поскольку гликоген расщепляется на глюкозу, которая позже превращается в АТФ в процессе гликолиза и аэробного дыхания.

Сборка и динамика миофибрилл
Мы рассматриваем некоторые из проблем, связанных с определением того, как миофибриллы могут быть собраны, и, что не менее важно, как эта сократительная структура может обновляться саркомерными белками, перемещающимися между саркомером и цитоплазмой.В этом личном обзоре мы также обращаемся к недавним свидетельствам, указывающим на то, что сборка и динамика миофибрилл сохраняются независимо от того, анализируются ли клетки in situ или в условиях культуры ткани. Мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли он in situ или in vitro .
1. Введение
Миофибриллы поперечно-полосатой мышцы характеризуются группами белков, организованными в сократительные единицы, или саркомеры, которые состоят из отдельных субъединиц, повторяющихся по длине мышечной клетки.Хотя саркомеры поперечно-полосатых мышц различаются у разных видов по длине и по некоторым белковым компонентам, все они имеют сходное расположение субъединиц из трех основных компонентов: тонких нитей, толстых нитей и Z-полос, каждая из которых формируется в результате множественных взаимодействий между белками, производящими и контролировать сокращение (рис. 1). Скелет позвоночных и сердечные саркомеры в состоянии покоя составляют 2,5 микрона в длину, тогда как саркомеры поперечно-полосатых мышц в мире беспозвоночных широко варьируются от одного микрона у медузы [1] до 25 микрон в глотке силлидного червя [2].Длина А-полосы толстых нитей и длина тонких нитей зависят от размера саркомера: самая короткая — 0,6 мкм и 0,5 мкм соответственно у медуз, самая длинная — 20 мкм и 12 мкм, соответственно, у силлидного червя и 1,6 мкм. микрон и 1,0 микрон в скелетных мышцах позвоночных [3]. В желудочковых мышцах позвоночных длина тонких филаментов варьируется до одного микрона [4].
Несмотря на все, что известно о связывании миофибриллярных белков друг с другом в биохимических анализах, многое неизвестно о множественности взаимодействий, которые поддерживают образование и стабильность миофибрилл в живой клетке.Важность взаимодействий миофибриллярных белков для здоровья сердца была подтверждена осознанием того, что мутировавшие саркомерные белки участвуют во все большем числе кардиомиопатий [9, 10]. Взаимодействия основных белков, ответственных за производство силы в субъединицах тонких и толстых филаментов, были подробно описаны [11]. Белки Z-полосы, области саркомера, где все еще открываются новые белки и новые взаимодействия известных белков [12, 13], представляют собой особенно сложную сеть потенциальных множественных взаимодействий, многие из которых были определены биохимическими методами. не методами внутри живой клетки (рис. 2).Z-полоса функционирует как каркас, который последовательно связывает саркомерные сократительные единицы, закрепляя тонкие и титиновые филаменты соседних саркомеров. Z-полосы также закрепляют концы миофибрилл в специализированных соединениях, называемых интеркалированными дисками в клетках сердечной мышцы, и они соединяют саркомеры латерально с клеточной мембраной через костамерные белки [14, 15]. Многофункциональная природа Z-полосы отражается в разнообразии белков, которые колокализуются в этой структуре: каналы, сигнальные молекулы, ферменты, комплекс цитоскелетных филаментов, который взаимодействует с клеточной мембраной, и саркомерные филаменты, необходимые для сокращения (Рисунок 2) [11]. , 16, 17].Два из самых неожиданных недавних сообщений о новых белках Z-диапазона касаются (а) белков теплового шока в скелетных мышцах рыбок данио (обзор приведен в [12]) и (б) белка CLOCK, который участвует в регуляции циркадных ритмов в кардиомиоцитах новорожденных крыс. (рассмотрено в [13]).
2. Формирование миофибрилл
По мере того, как список белков миофибрилл и их реакций связывания растет, пути сборки, по которым взаимодействующие белковые комплексы образуют миофибриллы, имеют все большее значение для понимания проблем аберрантного образования и поддержания миофибрилл, содержащих мутировавшие саркомерные белки [9, 10, 16, 18].В начале 1900-х годов Хайденхайн [19] исследовал фиксированные мышцы в световом микроскопе и заметил гладкие волокна около клеточной мембраны развивающихся скелетных мышц форели до того, как были обнаружены поперечно-полосатые структуры, которые, как мы теперь знаем, были Z-полосами и A-полосами. Электронные микрофотографии формирующихся мышц цыплят показали гладкие волокна около клеточной мембраны, а также до появления полосатых миофибрилл (см. Обзор Sanger et al. [6]). Рост длины А-полосы до зрелого размера также наблюдали с помощью электронной микроскопии мышц эмбриональной мухи, фиксируемой с ежедневными интервалами.Первые наблюдаемые волокна были гладкими с плотными телами, но без толстых нитей, за ними следовали волокна с Z-полосами и короткими A-полосами, а затем волокна с A-полосами длины зрелой мышцы [20]. Поперечно-полосатые саркомеры в формировании мышц клещей, которые были проанализированы с помощью поляризованного света у живых животных, увеличились за 30-часовой период с 2,2 до 4 микрон в длину, что сопровождалось увеличением длины А-полосы с 1,4 до 3 микрон [21] .
Появление зондов для флуоресцентного обнаружения белков внутри клеток позволило охарактеризовать волокна в немышечных клетках и эмбриональных мышечных клетках.В немышечных клетках многие стрессовые волокна, ранее описанные как гладкие в [22, 23], как было показано, состоят из повторяющихся концентраций альфа-актинина и немышечного миозина II, распределенных в чередующихся полосах вдоль перекрывающихся актиновых филаментов [24-28]. В краткой презентации трехстраничный отчет, опубликованный в книге, описывающей протоколы коротких бесед в честь покойного Джона Маршалла, Куликовски и Манасека [29], описывает, как зародышевые культивированные кардиомиоциты цыплят появляются при окрашивании мышечно-специфическими антителами к миозину II. через разные периоды времени в культуре.Они отметили появление гладких непрерывных миозиновых волокон в кардиомиоцитах в первые дни культивирования. Эти волокна были описаны как имеющие «морфологию стрессовых волокон». В более старых культурах авторы регистрировали типичные миофибриллы с A-полосами. Они пришли к выводу, что миофибриллы могут «собираться заново через промежуточные соединения, подобные стрессовым волокнам, в культивируемых сердечных миоцитах».
Было впервые показано, что немышечная изоформа миозина II присутствует в клетках скелетных мышц рядом с мембраной в волокнах, отличных от зрелых миофибрилл [30].Эти волокна позже были названы «наподобие стрессовых волокон» Dlugosz et al. [31]. Три изоформы немышечного миозина II были с тех пор обнаружены в волокнах поперечнополосатых мышечных клеток позвоночных [32–34]. Последующие исследования различались по поводу роли, которую эти «стрессовые волокна-подобные» волокна могут играть в миофибриллогенезе. Лаборатория Хольцера предложила им функционировать как шаблоны, на которых собираются мышечные белки и образуют поперечно-полосатые миофибриллы [31]. Предполагалось, что шаблоны затем будут разобраны с повторной сборкой субъединиц в другой области ячейки, чтобы перезапустить процесс создания шаблона.Таким образом, одна структура, подобная стрессовому волокну, была предложена в качестве шаблона для каждой новой миофибриллы миофибрилл.
Было обнаружено, что волокна, которые были гладкими при окрашивании F-актина фаллоидином, образовывали мини-саркомеры, когда флуоресцентный альфа-актинин вводили в живые клетки или перфузировали в проницаемые мышечные клетки [35–37]. Небольшие точки альфа-актинина располагались с интервалом от 0,3 до 1,5 микрон. В живых клетках, инъецированных флуоресцентным альфа-актинином, расстояние между точками увеличивается со временем [37], как было подтверждено более поздним исследованием на эмбриональных клетках сердца, трансфицированных GFP-альфа-актинином, в которых маленькие точки альфа-актинина выровнены латерально и Z- полосы сначала выглядели как бусинки, а потом стали гладкими [38].Были обнаружены полосы немышечного миозина II, чередующиеся с плотностями саркомерного альфа-актинина (z-тела) в этих волокнах [39]. Идентичные минисаркомерные паттерны чередующихся z-тел (саркомерный альфа-актинин) и полос немышечного миозина II были также обнаружены в эксплантатах прекардиальной мезодермы цыплят [5] и в окрашенных интактных сердцах ранних куриных эмбрионов [40]. Таким образом, не было различий между культивированными и интактными сердцами в обнаружении пути миофибриллогенеза (рис. 1).Мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли он in situ или in vitro .
Немышечные легкие цепи миозина II, которые были флуоресцентно мечены и введены в культивируемые клетки из эмбриональных мышц птиц, также были локализованы в небольших периодически расположенных полосах вдоль самых тонких волокон актина около клеточной мембраны [27]. Кроме того, легкие цепи также локализованы в А-полосах миофибрилл в эмбриональных клетках и в виде гладкого рисунка по длине других актиновых волокон [27].Гладкий узор представляет собой зарождающиеся миофибриллы (рис. 1). Неровный узор является результатом перекрывания толстых филаментов в формирующихся миофибриллах [5-7]. При делении кардиомиоцитов птиц Conrad et al. [41] обнаружили, что немышечный миозин II, но не мышечный миозин II, присутствует в бороздах дробления. В настоящее время известно, что немышечный миозин II в кардиомиоцитах птиц является изоформой IIB [39, 42]. Антитело к II A не реагирует с эмбриональными кардиомиоцитами цыплят [39], и ранние сообщения показали, что волокна с минисаркомерными полосами немышечного миозина не присутствовали в кардиомиоцитах птиц [43, 44]), потому что использовались антитела к II A.Малый диаметр и гладкий внешний вид волокон с окрашивающими фаллоидином волокнами напоминают таковые у стресс-волокон, отсюда и термин «стрессовые волокноподобные структуры» [31]. Однако теперь мы знаем, что большинство белков в этих волокнах являются мышечно-специфическими белками, например, альфа-актинином, актином, тропомиозином и так далее [7, 39, 45, 46]. Они также менее чувствительны, чем стрессовые волокна, к ряду различных ингибиторов (гельсолин [47], ДНКаза1, витамин-D-связывающий белок [48] и латрункулин-A [49]).J. M. Sanger и J. W. Sanger [50] продемонстрировали, что борозды дробления содержат противоположно поляризованные актиновые филаменты, пересекающиеся с немышечными II-подобными филаментами в минисаркомерных структурах, подобных таковым в стрессовых волокнах интерфазных клеток.
Мы предположили, что волокна с минисаркомерными полосами немышечного миозина II в мышечных клетках являются премиофибриллами, предшественниками миофибрилл (см. [7, 39]; Рисунок 1). Мы рассматриваем мелкие точки z-телец альфа-актинина, предшественников Z-диапазонов.Паттерны локализации миозина II в эмбриональных кардиомиоцитах цыплят, зафиксированные в разное время после распространения и реформирования миофибрилл в культуре, указывают на три типа волокон (рис. 1). Премиофибриллы состоят из тонких нитей с периодическими мини-А-полосами, расположенными между точками альфа-актинина (z-тельцами). Возникающие миофибриллы обладают двумя типами окрашивания миозина II: небольшими периодическими мини-А-полосами немышечного миозина IIB и несвязанным окрашиванием мышечно-специфичного миозина II. Зрелые миофибриллы окрашивают только один тип миозина II, то есть мышечно-специфический миозин II в A-полосах. Таким образом, исходное несвязанное окрашивание волокон фаллоидином, которое Dlugosz et al. [31], первоначально названные стрессовыми волокнами, представляют собой как пре-, так и зарождающиеся миофибриллы. Последующие наблюдения группы Хольцера за формированием мышц в фиксированных эмбриональных птичьих миоцитах привели их к предложению дополнительной модели, в которой сборка миофибрилл происходила посредством независимой сборки толстых нитей и Z-полос, связанных с их связанными тонкими нитями (кистями IZI) [43, 44 ].Было предложено связать Титина с кистями I-Z-I, захватить мышечные волокна миозина II и выровнять их в A-полосы, а также соединить A-полосы и I-Z-I кисти в саркомерные единицы без вовлечения стрессовых волоконоподобных структур. Однако теперь известно, что предшественники Z-полос (z-тел) и связанный с ними актин не разбросаны в клетке, а выровнены минисаркомерным расположением немышечных миозинов II, то есть премиофибрилл (рис. 1; [7]). , 39, 51]). Минисаркомерное устройство борозд дробления, стресс-волокон и премиофибрилл, по-видимому, возникло очень рано [27, 28, 50, 52, 53].Визуализация живых клеток позволила нам проследить миофибриллогенез от отложения премиофибрилл в формирующиеся миофибриллы до зрелых миофибрилл в культивируемых кардиомиоцитах, клетках скелетных мышц и у живых рыбок данио [37, 38, 49, 53–56]. Визуализация живых клеток мышечных клеток, трансфицированных усеченными участками Z-полосы тайтина, продемонстрировала важность тайтина для миофибриллогенеза [57, 58]. Мы смогли использовать воздействие на ранние миобласты различных концентраций этилметансульфоната для остановки миофибриллогенеза на стадии премиофибрилл или зарождающейся миофибриллы [55].Удаление этого ингибитора привело к возобновлению процесса сборки, что привело к образованию зрелых миофибрилл (рис. 1). Роль немышечного миозина II, по-видимому, важна для выравнивания тонких филаментов в премиофибриллах и возникающих миофибриллах [5, 6, 49]. Нарушение образования немышечных филаментов миозина II с помощью ингибитора фосфорилирования легких цепей миозина, которые необходимы для сборки филаментов, приводит к потере премиофибрилл и неорганизованному массиву миозиновых толстых филаментов [5].Удаление ингибитора ML-7 привело к реформированию премиофибрилл и возникающих миофибрилл и к сборке упорядоченных массивов толстых филаментов в A-полосах зрелых миофибрилл [5].
Как перекрывающиеся толстые филаменты, состоящие из гексамеров мышечного миозина II в формирующихся миофибриллах, выстраиваются в A-полосы зрелых миофибрилл, не ясно. Было высказано предположение, что титин, белки M-диапазона и другие белки, такие как обскурин, играют роль в этом процессе [59–62]. Есть миофибриллы, у которых отсутствуют М-полосы, но при этом их А-полосы полностью выровнены.Lange et al. [63] недавно сообщили, что A-Bands и миофибриллы обычно образуются у мышей с нокаутом, скрывающих видимость. Они действительно обнаружили, что продольные массивы саркоплазматического ретикулума (SR) были изменены, поддерживая роль соединения SR с миофибриллами.
Модель премиофибрилл (Рис. 1) не была принята повсеместно, потому что она кажется несовместимой с несколькими опубликованными статьями (см. Обзор Sanger et al. [7]). В частности, один из двух отчетов лаборатории Адельштейна показал, что мыши с нулевым уровнем немышечного миозина IIB [64], если они доживали до рождения, имели аномальные сердце и мозг и умирали в день рождения.Тем не менее, аномальные сердца действительно содержали нормальные миофибриллы, что позволяет предположить, что немышечный миозин IIB не был необходим для образования всех миофибрилл. Однако западные исследования геля на нескольких выживших животных показали, что у половины выживших новорожденных изоформа миозина IIA была активирована, и, таким образом, изоформа IIA могла занять место изоформы IIB. Эмбриональные клетки скелетных мышц имеют обе изоформы немышечного миозина IIA и IIB. Таким образом, клетки скелетных мышц были нормальными при этих нокаутах IIB, предположительно из-за присутствия IIA.Недавняя статья Лу и др. [34] сообщает, что обе изоформы немышечного миозина II, A и B, присутствуют в ранних сердцах мышей. В другой статье группа Adelstein сообщила, что немышечный миозин II является белком Z-диапазона как в клетках сердечных (IIB), так и в скелетных (A и B) мышечных клетках [65]. Они также сообщили в той же статье, что изоформа IIB была локализована во вставленных дисках фиксированных и окрашенных клеток сердечной мышцы. После публикации этих двух исследований из лабораторий Адельштейна была открыта третья изоформа немышечного миозина IIC [32, 33].Эта изоформа также присутствует в сердце, скелетных мышцах и некоторых органах. Роль немышечного миозина IIC в миофибриллогенезе еще предстоит изучить. Использование нами антител, направленных против немышечных II A или B в клетках сердечных и скелетных мышц, никогда не обнаружило эти антигены ни в Z-полосах, ни в интеркалированных дисках [5, 39, 40, 56]. Наши предварительные результаты показывают, что клетки сердца и скелетных мышц котрансфицировались церулеановым флуоресцентным белком (CeFP) и одной из трех изоформ немышечного миозина II (зеленый флуоресцентный белок (GFP) — немышечный миозин II A или B или C), что противоречит результатам Takeda et al.[65] бумага. GFP-немышечные миозины II не были локализованы в Z-полосах ни одного типа мышечных клеток, ни во вставленных дисках клеток сердечной мышцы. Три немышечные изоформы миозина II были локализованы в областях клеток в линейных массивах, в чередующихся массивах с z-тельцами, содержащими CeFP-альфа-актинин, то есть премиофибриллами.
Есть две другие статьи, которые были названы несовместимыми с премиофибриллярной моделью миофибриллогенеза. Ehler et al. [59] и Rudy et al.[66] сообщили об их неспособности обнаружить присутствие премиофибрилл или возникающих миофибрилл ни в интактных фиксированных эмбриональных сердцах птиц, ни в эксплантатах прекардиальной мезодермы. Однако улучшенная фиксация и иммунофлуоресцентные методы привели к обнаружению немышечного миозина II B в организованных массивах в обоих типах препаратов [5, 40], которые были идентичны премиофибриллам и возникающим миофибриллам, первоначально обнаруженным в культивируемых эмбриональных кардиомиоцитах [39]. Кроме того, Du et al. [5] смогли обратимо ингибировать сборку зрелых миофибрилл с помощью ML-7, ингибитора киназы легких цепей миозина, фермента, который отвечает за фосфорилирование немышечных легких цепей и является необходимым условием для способности немышечный миозин II с образованием филаментов.Удаление этого ингибитора привело к реформированию премиофибрилл с их массивами мини-А-полос немышечного миозина II B и возобновлению миофибриллогенеза, что привело к образованию зрелых миофибрилл. Все эти результаты подтверждают общую модель миофибриллогенеза в кардиомиоцитах, будь то в интактном сердце, эксплантатах прекардиальной мезодермы или в культуре ткани, как показано на рисунке 1. Нити немышечного миозина II могут связывать актиновые нити, прикрепленные к z-тельцам, с образуют организованные линейные массивы, которые мы назвали премиофибриллами [7, 39], первая ступень, которая приводит к образованию зрелых миофибрилл (Figure 1).
3. Оптические методы исследования миофибриллогенеза
Флуоресцентная микроскопия флуоресцентно меченных саркомерных белков (красителей или меток GFP) позволила обнаружить сборку миофибрилл в живых клетках сердца и скелетных мышц [37, 38, 49]. Методика восстановления флуоресценции после фотообесцвечивания (FRAP) показала, что наложение на добавление вновь синтезированных белков к комплексам z-тела и Z-полосы представляет собой активный обмен между молекулами в цитоплазматическом пуле и молекулами того же вида, находящимися в z- тела и Z-полосы [46, 56, 67–69].В общем, степень и половина времени обмена флуоресцентными молекулами, анализируемые с помощью методов FRAP, являются функцией связывающего взаимодействия белка в клеточном комплексе, где он сконцентрирован, причем более короткое время восстановления указывает на более низкое сродство [70]. Wang et al. [46] продемонстрировали, что семь различных белков Z-полосы обмениваются независимо друг от друга и что обмен не зависит от синтеза белка и молекулярной массы. Кроме того, динамика тех же белков в z-тельцах премиофибрилл была снижена в Z-полосах зрелых миофибрилл.Было высказано предположение, что это снижение связано с включением дополнительных белков в формирование Z-полосы (рис. 1; [46]). Эти наблюдения были распространены на клетки скелетных мышц у живых рыбок данио [56], где отслеживались пять различных Z-полос (актин, альфа-актинин, FATZ, миотилин и телетонин). Их порядок обмена был подобен обмену тех же белков в культивируемых клетках скелетных мышц перепела, что указывает на то, что поведение в условиях культивирования было сравнимо с поведением в клетках живого животного.Рисунки 3 и 4 представляют собой примеры этого процесса обмена в клетках скелетных мышц по бокам рыбок данио с использованием YFP-миотилина. Модель премиофибрилл с ее постулатами о трех стадиях образования миофибрилл предполагает механизмы репозиции молекул, поскольку премиофибриллы трансформируются в зрелые миофибриллы в течение нескольких часов [7, 38]. Обмен молекулами в формирующиеся миофибриллы и из них может позволить эту трансформацию (Рис. 1).
Хотя флуоресцентная микроскопия широко используется для исследования колокализации белков в клетках, предел разрешения микроскопии в видимом свете составляет порядка 200 нм, что намного больше, чем шкала длины межбелковых связей.В последние годы метод визуализации флуоресцентного резонансного переноса энергии (FRET) появился как способ улучшить разрешение обычной световой микроскопии [10, 71]. FRET был назван «спектроскопической линейкой», потому что с помощью соответствующей теории можно сделать вывод о расстоянии между донором и акцептором из полученных сигналов FRET в фиксированных и живых клетках. Обычно измеримые сигналы FRET возникают только тогда, когда донор и акцептор находятся в пределах 10 нм друг от друга.По мере развития технологии флуоресцентной визуализации растет интерес к использованию FRET для картирования меж- и внутримолекулярных взаимодействий в клетках. Стаут и др. [8] использовали методы FRET на живых клетках скелетных мышц, чтобы продемонстрировать, что существуют перестройки молекул альфа-актинина и FATZ, когда z-тела сливаются и перестраиваются с образованием Z-полос. Эти результаты FRET подтверждают интерпретацию экспериментов FRAP во время миофибриллогенеза [46] и модель премиофибрилл (Рисунок 1). Текущее развитие микроскопов, которые нарушают дифракционный предел света [72], должно раскрыть дальнейшее понимание расположения белковых сетей в миофибриллах и изменений, которым они подвергаются в процессах сборки и разборки.
Таким образом, наша цель состоит в том, чтобы понять, как миофибриллы собираются, реконструируются и поддерживаются (Рисунки 1 и 3). Мы используем белки дикого типа и мутировавшие саркомерные белки для исследования сборки (конфокальный и деконволюционный микроскопы), динамики и ремоделирования (FRAP) и взаимодействий (FRET) белков в миофибриллах в живом состоянии. Стандартные анализы биохимического связывания будут использоваться для подтверждения недавно выявленных взаимосвязей FRET, обнаруженных в живых мышечных клетках. Мы также сможем проверить идею о том, что миофибриллогенез имеет один и тот же путь и молекулярные саркомерные взаимодействия, независимо от того, происходит ли сборка в культуре ткани или у живого животного, такого как рыбки данио.Другими словами, мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли он in situ или in vitro .
Выражение признательности
Эта работа была поддержана грантами NIH Жану М. Сэнгеру и Джозефу В. Сэнгеру.
Единая миофибриллярная матрица для создания силы в мышцах
Разветвляющиеся саркомеры приводят к соединенной миофибриллярной матрице
Для оценки сократительной структуры мышцы мы использовали сканирующую электронную микроскопию с фокусированным ионным пучком (FIB-SEM) 19,20,22 для изображения объемов мышц мыши с разрешением 10 нм в 3D (дополнительный фильм 1).Первоначально мы попытались визуализировать отдельные миофибриллы внутри неповрежденной быстро сокращающейся мышечной клетки, выбрав саркомер из поперечного сечения мышцы (дополнительный рис.1) и проследив его форму и форму каждого последующего саркомера, последовательно соединенных через z-диски. по длине мышцы. Однако мы обнаружили, что саркомеры часто разветвлялись под углом и приводили к сильно связанному миофибриллярному матриксу, а не к линейной трубчатой структуре миофибрилл из учебников (Fig. 1, Supplementary Movie 1).В результате мы изменили нашу процедуру отслеживания, чтобы отделить каждый миофибриллярный сегмент в миофибриллярной матрице в точках ветвления (рис. 1, дополнительный ролик 2). Не было очевидной связи между точками ветвления саркомера и конкретными саркомерными областями, такими как I-полоса (актин, но без миозина), A-полоса (актин и миозин перекрываются) или H-зона (миозин, но без актина) как саркомер. Точки ветвления можно было увидеть во всех трех областях, а также непосредственно перед и после z-дисков (рис.1). Кроме того, ветви саркомера, по-видимому, не изменяли нормальных пространственных отношений между саркомером и митохондриями (дополнительный фильм 3) или саркотубулярными системами (дополнительный фильм 4).
Рис. 1: Миофибриллы мышц образуют прочно связанный матрикс.a 3D-рендеринг 115 напрямую связанных саркомеров в миофибриллярной матрице быстро сокращающейся мышцы. Отдельные цвета представляют разные миофибриллярные сегменты, связанные ветвящимися саркомерами. b — d Трехмерная визуализация в разных ракурсах подчеркивает нелинейность и связи между миофибриллярными сегментами. Представитель 7707 саркомеров из четырех томов от четырех мышей. Масштабные линейки, 2 мкм.
Чтобы исключить возможность того, что ветви саркомера были вызваны повреждением мышц или артефактами фиксации ткани, мы внимательно исследовали структуры мышечных клеток на наличие аномалий. Митохондрии, саркоплазматический ретикулум и t-канальцы были нормальными по внешнему виду без признаков набухания, что позволяет предположить, что физиологические осмотические и ионные условия поддерживались посредством фиксации образца (дополнительный фильм 1).Сократительные структуры были непрерывными и плотно прилегающими друг к другу, а видимое присутствие I-образных полос подтвердило, что мышцы не были сильно сокращены. Более того, z-диски были правильно выровнены параллельно для саркомеров как с ветвлением, так и без него (Дополнительный ролик 5, верхний), и, по-видимому, имели место случаи смещения по Вернье листов z-диска 23,24 (Дополнительный ролик 5, нижний) с гораздо меньшей частотой и гораздо большим масштабом, чем разветвление отдельных саркомеров, что дополнительно указывает на то, что присутствие миофибриллярного матрикса не связано с повреждением мышц или патологией.Эти данные демонстрируют, что сократительный аппарат здоровых, быстро сокращающихся клеток скелетных мышц состоит из сильно связанного нелинейного миофибриллярного матрикса, связанного вместе разветвляющимися саркомерами.
Развитие, регуляция ветвления саркомера по типу волокон
Чтобы определить, ограничен ли миофибриллярный матрикс быстросокращающимися мышечными волокнами или повсеместным для всех типов мышц, мы затем оценили сократительные структуры из медленно сокращающихся и сердечных мышечных клеток. Оба медленно сокращающихся мышечных волокна, характеризующиеся более вытянутой и извилистой формой поперечного сечения саркомера, высоким содержанием митохондрий и более толстыми z-дисками по сравнению с быстро сокращающимися волокнами 25,26 (дополнительный фильм 1) и сердечными миоцитами (Инжир.2а) также содержат часто ветвящиеся саркомеры, что указывает на присутствие миофибриллярного матрикса во всех зрелых типах поперечно-полосатых мышц. Чтобы оценить, были ли миофибриллярные матричные структуры преобладающей сократительной структурой в мышечных клетках, мы оценили, насколько часто возникают ветвящиеся миофибриллярные структуры по сравнению с количеством не ветвящихся отдельных миофибрилл. Начав с каждого параллельного саркомера на одном конце набора данных (см. Дополнительный рисунок 1) и отслеживая его структуру по длине мышцы в поле зрения (дополнительный фильм 1, слева), мы определили, есть ли какие-либо из серийных саркомеров разветвленная или если была очевидна одиночная трубчатая миофибрилла.Почти все миофибриллярные структуры (96,1 ± 1,4%, 99,4 ± 0,6% и 94,4 ± 2,5% быстросокращающихся, медленных и сердечных миофибрилл, среднее значение ± стандартная ошибка, n = 4, 3 и 5 объемов мышц и 468, 299 и 344 миофибрилл соответственно) содержали по крайней мере один ветвящийся саркомер в поле зрения, указывая на то, что миофибриллярный матрикс был первичной сократительной структурой в каждом типе взрослых мышц (рис. 2b). Чтобы дополнительно оценить степень связности миофибриллярного матрикса, мы измерили, как часто происходит ветвление саркомера для каждого типа мышц.На каждые десять саркомеров в серии 1,6 ± 0,2 саркомера содержали ветви в быстро сокращающейся мышце ( n = 4 мышечных объема, 193 миофибриллы, 3477 саркомеров), 2,2 ± 0,2 ветви саркомера встречались в сердечной мышце ( n = 5 мышц. объемы, 167 миофибрилл, 2114 саркомеров) и 4,3 ± 0,4 разветвления саркомеров в медленно сокращающихся мышцах ( n = 3 объема мышц, 110 миофибрилл, 1396 саркомеров), что значительно выше, чем сердечная или быстро сокращающаяся мышца (рис. 2в).Эти данные показывают, что, хотя миофибриллярный матрикс повсеместно присутствует в мышцах всех типов, степень связности регулируется в соответствии с типом мышечных волокон.
Рис. 2: Разветвление саркомеров обширное, но варьируется в зависимости от типа мышц и стадий развития.3D-рендеринг 77 напрямую связанных саркомеров в миофибриллярной матрице волокна сердечной мышцы. Отдельные цвета представляют разные миофибриллярные сегменты, связанные ветвящимися саркомерами. b Процент миофибрилл с хотя бы одним саркомером ветвления в различных типах мышечных волокон. N значения: ранний постнатальный — 141 миофибрилла, 1796 саркомеров, 3 мышцы, 3 мыши; поздний постнатальный — 150 миофибрилл, 1401 саркомер, 3 мышцы, 3 мыши; быстрое сокращение — 468 миофибрилл, 7707 саркомеров, 4 мышцы, 3 мыши; медленное сокращение — 299 миофибрилл, 3990 саркомеров, 3 мышцы, 3 мыши; сердечная — 344 миофибриллы, 4473 саркомера, 5 мышц, 5 мышей. c Частота ветвления саркомера по типу мышц. N значения: ранний постнатальный — 141 миофибрилла, 1796 саркомеров, 3 мышцы, 3 мыши; поздний постнатальный — 150 миофибрилл, 1401 саркомер, 3 мышцы, 3 мыши; быстрое сокращение — 193 миофибриллы, 3477 саркомеров, 4 мышцы, 3 мыши; медленное сокращение — 110 миофибрилл, 1396 саркомеров, 3 мышцы, 3 мыши; кардиальный — 167 миофибрилл, 2114 саркомеров, 5 мышц, 5 мышей. d Трехмерный рендеринг 43 напрямую связанных саркомеров в миофибриллярном матриксе мышечного волокна позднего новорожденного (P14). Отдельные цвета представляют разные миофибриллярные сегменты, связанные ветвящимися саркомерами.Представитель трех мышц от трех мышей. Масштабные линейки, 2 мкм. Знак плюс (+): Значительно отличается (односторонний дисперсионный анализ, P <0,05) от послеродового раннего возраста. Звездочка (*): Значительно отличается от позднего послеродового периода. Знак фунта (#): значительно отличается от медленного. Значения: среднее ± SE.
Чтобы дополнительно продемонстрировать, что унифицированный миофибриллярный матрикс является нормальной структурой зрелых клеток скелетных мышц, мы оценили миофибриллярные структуры в наборах данных FIB-SEM большой мышцы бедра трех взрослых людей (<40 лет), опубликованных в рамках Baltimore Продольное исследование старения 27 .В мышцах человека разветвление саркомеров произошло в 100% оцениваемых нами миофибрилл ( n = 60 миофибрилл, три объема мышц). Более того, анализ структур саркомеров быстро сокращающихся мышц человека ( n = 906 саркомеров, три объема мышц) показал, что ветвление саркомеров происходило с частотой 2,4 ± 0,2 ветви на 10 саркомеров (дополнительный рис. у зрелых мышей быстросокращающиеся мышцы. Эти данные демонстрируют присутствие сильно разветвленного миофибриллярного матрикса в стабильных скелетных мышцах взрослого человека.
Чтобы исследовать формирование миофибриллярного матрикса и частоту ветвления саркомеров во время постнатального развития мышц, мы оценили сократительные структуры в раннем (постнатальный день 1 (P1)) и позднем (P14) (рис. 2d) постнатальном периодах. Подобно взрослым мышцам, 97,9 ± 1,2% ранних постнатальных миофибриллярных структур ( n = 3 мышечных объема, 150 миофибрилл) имели по крайней мере один саркомер ветвления (рис. 2b), демонстрируя, что миофибриллярный матрикс уже был преобладающей сократительной структурой на момент рождения. время рождения.Однако частота ветвления саркомеров в мышцах в раннем постнатальном периоде (2,8 ± 0,2 ветви на 10 саркомеров, n = 3 мышечных объема, 150 миофибрилл, 1401 саркомер, рис. 2c) была выше, чем у быстро сокращающихся мышц, но ниже, чем у медленных. -ключают мышцы, предполагая, что ветвление саркомера регулируется в процессе развития. В отличие от взрослых и ранних постнатальных мышц, только 70,0 ± 3,1% поздних постнатальных миофибриллярных структур ( n = 3 мышечных объема, 141 миофибрилла) содержали по крайней мере один ветвящийся саркомер в пределах нашего поля зрения (рис.2b), предполагая, что ветвление саркомеров может быть подавлено во время перехода от неонатальных сократительных изоформ к взрослым, который происходит в этот период 28 . Соответственно, частота ветвления саркомеров в поздних постнатальных мышцах (1,3 ± 0,2 ветви на 10 саркомеров, n = 3 объема мышц, 141 миофибрилла, 1796 саркомеров, рис. 2c) была самой низкой из всех оцениваемых типов мышц. Взятые вместе, эти данные указывают на многоступенчатую регуляцию ветвления саркомера внутри миофибриллярного матрикса во время постнатального развития мышц, когда частота ветвления саркомера самая низкая в период наибольшего роста мышц в процессе развития 29 .
Ветвление саркомера происходит путем расщепления или передачи содержимого
Чтобы исследовать механизмы ветвления саркомера, мы более подробно сосредоточились на физических средствах, с помощью которых происходит ветвление (Рис. 3). Наиболее распространенный тип ветвления саркомера происходит через механизм расщепления (рис. 3a, b, дополнительный фильм 6), когда некоторые миофиламенты в одном саркомере отделяются от остальных, что приводит к образованию двух различных миофибриллярных структур. Непосредственно на месте расщепления саркомера не наблюдалось никаких специфических структур, которые, по-видимому, вызывали разделение сократительных структур, что позволяет предположить, что расщепление может быть результатом более дистальных сил, действующих на миофибриллы 30 или что цитоскелетные структуры не визуализируются с помощью нашего FIB-SEM подход может быть задействован.Различия в частоте расщепления саркомера между типами мышц были почти идентичны различиям в разветвлении саркомера, где медленные волокна имели самую высокую частоту, а поздние послеродовые и быстро сокращающиеся волокна имели самую низкую частоту (рис. 3b), что дополнительно указывает на то, что волокна- Типовое регулирование этих событий.
Рис. 3: Типы ветвления саркомера.3D-рендеринг саркомера. Отдельные цвета представляют разные миофибриллярные сегменты, связанные ветвящимися саркомерами.Представитель 1766 расщеплений, 18 мышц, 16 мышей. b Частота расколов саркомера. c Трехмерный рендеринг переноса миофиламентов от одного саркомера к другому. d 3D-рендеринг переноса миофиламентов между двумя саркомерами. c , d представляют 525 переносов, 18 мышц, 16 мышей. e Частота переносов миофиламентов. f Процент переносов миофиламентов относительно общего количества ветвей саркомера. N значения для b , e , f : ранний постнатальный — 141 миофибрилла, 1796 саркомеров, 3 мышцы, 3 мыши; поздний постнатальный — 150 миофибрилл, 1401 саркомер, 3 мышцы, 3 мыши; быстрое сокращение — 193 миофибриллы, 3477 саркомеров, 4 мышцы, 3 мыши; медленное сокращение — 110 миофибрилл, 1396 саркомеров, 3 мышцы, 3 мыши; кардиальный — 167 миофибрилл, 2114 саркомеров, 5 мышц, 5 мышей. Плюс (+): Значительно отличается (односторонний дисперсионный анализ, P <0,05) от раннего послеродового периода. Знак фунта (#): значительно отличается от медленного.): Существенно отличается от быстрого. Масштабные линейки, 1 мкм. Значения: среднее ± SE.
Второй, менее частый тип ветвления саркомера происходил через механизм переноса, когда некоторые миофиламенты в одном саркомере отделялись от остальных и присоединялись к соседнему параллельному саркомеру (Рис. 3c). Таким образом, в отличие от расщепления саркомера, перенос миофиламентов не приводил к дополнительным миофибриллярным структурам. Вместо этого саркомеры переносят перераспределенные миофиламенты между соседними саркомерами, тем самым изменяя размер и форму образующихся миофибриллярных структур в дополнение к обеспечению прямой связи между ними, генерирующей силу.Перенос миофиламентов также наблюдался двунаправленным образом, когда миофиламенты, по-видимому, обменивались между двумя соседними саркомерами (рис. 3d, дополнительный ролик 7). Не было различий в частоте переносов миофиламентов между типами мышц (рис. 3e). Однако в быстро сокращающейся мышце большая часть общего количества ветвей саркомера (34,8 ± 5,6%, n = 4 объема мышц, 193 миофибриллы, 3477 саркомеров) была обусловлена переносом миофиламентов (рис.3f) по сравнению с медленными мышцами (15,2 ± 3,4%, n = 3 мышечных объема, 110 миофибрилл, 1396 саркомеров) или сердечными мышцами (13,8 ± 2,1%, n = 5 мышечных объемов, 167 миофибрилл, 2114 саркомеров) ), предполагая, что прямая связь, генерирующая силу между параллельными миофибриллярными структурами, создаваемыми переносом миофиламентов, может иметь функциональное преимущество и быть регулируемой по сравнению с расщеплением саркомера в высокоскоростных волокнах, генерирующих быстрое сокращение.
Разветвление саркомера объединяет всю клетку
Хорошо известно, что миофибриллярные структуры связаны по всей длине мышечного волокна, обеспечивая прямой, продольный путь генерации и передачи силы 6,7 .Чтобы определить степень, в которой миофибриллярный матрикс обеспечивает путь для передачи силы вдоль боковой оси, мы оценили, может ли ветвление саркомера также напрямую связывать сократительный аппарат по всей ширине мышечной клетки. В ранних постнатальных мышечных волокнах, которые все еще имеют централизованные ядра, мы обнаружили, что частые ответвления саркомеров приводили к объединенной миофибриллярной сети как по длине, так и по ширине мышцы в пределах нашего поля зрения (рис. 4a – c, дополнительный фильм 8). .Эти данные предполагают, что единичный миофибриллярный матрикс, непосредственно соединяющий весь сократительный аппарат по всей мышечной клетке, уже формируется при рождении даже до того, как ядро перемещается к периферии клетки 31 . Чтобы проверить, связан ли миофибриллярный матрикс также напрямую по всей ширине зрелого мышечного волокна, мы дополнительно оценили возможность соединения медленно сокращающихся волокон, которые из-за их высокой частоты ветвления (рис. 2c), скорее всего, будут простираются по всей ширине мышцы в пределах поля зрения наших наборов данных.Действительно, отслеживая миофибриллярные связи через z-диски, как описано для фиг. 1 и 2, но только следуя минимальному пути соединения, а не следуя каждой ветви саркомера, мы смогли продемонстрировать напрямую связанный миофибриллярный путь по всей ширине медленно сокращающегося мышечного волокна (рис. 4d – f, дополнительный фильм 9 ). Таким образом, миофибриллярный матрикс также напрямую связан по всей длине и ширине взрослой мышечной клетки. Эти результаты предполагают, что поперечно-полосатые мышечные клетки млекопитающих образуют единый миофибриллярный матрикс, который обеспечивает прямой путь для генерации латеральной и продольной активной силы по всей клетке.
Рис. 4: Миофибриллярный матрикс напрямую связан по всей ширине мышечного волокна.a 3D-рендеринг напрямую связанных саркомеров миофибриллярного матрикса в раннем постнатальном мышечном волокне. Миофибриллярные сегменты: разного цвета, ядра: полупрозрачный голубой, границы клеток: полупрозрачный зеленый. b , c Трехмерные визуализации различных перспектив подчеркивают связь миофибриллярного матрикса по всей клетке на ранней постнатальной стадии. d Трехмерный рендеринг напрямую связанных саркомеров миофибриллярного матрикса через медленно сокращающееся мышечное волокно. Сократительные структуры: оранжевый, z-диски: темно-синий, ядра: голубой, граница клетки: зеленый. В целях визуализации показаны не все связанные саркомеры, отображается только минимальный путь связи через ячейку. e , f Трехмерные визуализации различных перспектив подчеркивают взаимосвязь медленно сокращающейся миофибриллярной матрицы по всей клетке.Изображения, представляющие три набора данных от трех мышей. Масштабные линейки, 2 мкм. См. Также: Дополнительные фильмы 8 и 9.
Миофибриллы | Структура, клинические условия, возбуждение
Введение
Скелетные мышцы — самые распространенные ткани, встречающиеся у животных. Они составляют более 40% от общего веса среднего человека. Эти мышцы отвечают за все виды движений человека. Они находятся под добровольным контролем, что означает, что мы можем сознательно контролировать их сокращения.
Скелетные мышцы состоят из параллельных волокон, называемых волокнами скелетных мышц. Каждое волокно представляет собой многоядерную клетку, содержащую от сотен до тысяч миофибрилл. Миофибриллы — это тонкие волокна, состоящие из нитей актина и миозина, которые присутствуют в цитоплазме волокон скелетных мышц. Это сократительные единицы, отвечающие за сокращение скелетных мышц. Каждое волокно скелетных мышц иннервируется отдельным аксоном и может сокращаться независимо от других клеток.
В этой статье мы обсудим общую структуру волокна скелетных мышц, структуру миофибрилл, их основные компоненты, механизм сокращения и некоторые основные заболевания, связанные с ними. Итак, продолжайте читать.
Общая структура волокна скелетных мышц
Волокна скелетных мышц представляют собой цилиндрические клетки с некоторыми специальными модификациями, которые помогают им сокращаться. Как и другие клетки животных, они имеют плазматическую мембрану и другие органеллы, такие как рибосомы, митохондрии, эндоплазматический ретикулум и т. Д.У них есть несколько ядер в одной клетке. Некоторые из важных особенностей этих ячеек заключаются в следующем.
Саркоплазма
Цитоплазма клеток скелетных мышц называется саркоплазмой. Снаружи он окружен плазматической мембраной, называемой сарколеммой. В саркоплазме много митохондрий, которые обеспечивают энергию в форме АТФ, необходимую для мышечных сокращений. У них есть несколько ядер, плоско лежащих на периферии волокна. Ядра находятся рядом с сарколеммой клеток.
Миофибриллы расположены параллельно в волокнах скелетных мышц, разделенных саркоплазмой. Митохондрии располагаются близко к миофибриллам, так что энергия может передаваться этим сократительным волокнам.
Саркоплазматический ретикулум
Это сеть богатой сети эндоплазматического ретикулума, обнаруженная только в волокнах скелетных мышц. Его функция — накапливать ионы кальция и высвобождать их при возбуждении для сокращения скелетных мышц.
Он выглядит как сложная сеть канальцев, присутствующих среди миофибрилл.Эти канальцы имеют терминальные расширения или мешочки, называемые терминальными цистернами. Между этими цистернами имеются впячивания сарколеммы. Эти инвагинации переносят потенциал действия в саркоплазматический ретикулум, так что они возбуждаются и высвобождают ионы кальция.
Т-канальцы
Это инвагинации сарколеммы, имеющие ту же концентрацию ионов, что и во внеклеточной жидкости. Потенциал действия, генерируемый в любой точке по длине сарколеммы, переносится этими канальцами к сердцевине мышечных волокон.Они связаны с терминальными цистернами саркоплазматического ретикулума и отвечают за высвобождение ионов кальция и за связь сокращения скелетных мышц с возбуждением.
Структура миофибрилл
После понимания общей структуры волокна скелетных мышц, давайте теперь изучим структуру миофибрилл. Как упоминалось ранее, каждое волокно скелетных мышц состоит из сотен и тысяч миофибрилл, простирающихся по всей длине волокна. Это сократительные структуры скелетных мышц.Сокращение этих миофибрилл вызывает сокращение скелетных мышц.
Некоторые важные особенности миофибрилл описаны ниже.
Состав
Каждая миофибрилла состоит из двух типов сократительных нитей;
- Тонкие или светлые нити
- Толстые или темные нити
Количество этих нитей варьируется в отдельных миофибриллах. Каждая миофибрилла содержит около 3000 тонких нитей и 1500 толстых нитей. Эти светлые и темные нити расположены внутри миофибриллы таким образом, что они пересекаются и придают ей полосатый вид.Эти полосы миофибрилл ответственны за общую полосатость скелетных мышц.
Тонкие филаменты
Тонкие филаменты также называют актиновыми филаментами. Они состоят из трех типов белка;
Поскольку миофибриллы состоят из пересекающихся толстых и тонких волокон, части, содержащие только тонкие волокна, выглядят как светлые полосы, называемые полосами I . Их называют полосами I, потому что они изотропны поляризованному свету.
Актин
Актин представляет собой сократительный нитчатый белок, который составляет основу актиновых волокон.Этот белок нитчатого актина состоит из филаментов F-актина, каждая из которых состоит из полимеризованных молекул G-актина. Два филамента F-актина намотаны друг на друга, образуя спираль в тонких филаментах.
Молекула АДФ связана с каждой молекулой G-актина. Эти молекулы АДФ действуют как активные центры для образования поперечных мостиков (образованных ассоциацией толстых и тонких нитей).
Тропомиозин
Тропомиозин еще один нитчатый белок, присутствующий в тонких филаментах миофибрилл.Две тропомиозиновые нити обернуты вокруг двойной спирали, образованной F-актином. Нити тропомиозина намотаны таким образом, что они лежат в бороздках двойной спирали F-актина.
Нити тропомиозина покрывают активные центры на молекулах F-актина и предотвращают образование актин-миозиновых перекрестных мостиков в состоянии покоя.
Тропонин
Тропонин — это нефиламентозный белок, связанный с тонкими филаментами. Обнаружено, что он прикреплен к молекулам тропомиозина в периодических участках по длине миофибриллы.Белок тропонина соединяет тропомиозин с F-актином в тонких или актиновых филаментах.
Каждая молекула тропонина состоит из трех субъединиц;
- Тропонин I, имеющий высокое сродство к филаментам F-актина
- Тропонин T, имеющий сродство к филаментам тропомиозина
- Тропонин C, имеющий высокое сродство к иону кальция
Тропонин также служит для инициации процесса сокращения путем устранение тропомиозина и обнажение миозин-связывающих сайтов на актиновых филаментах.Его функция будет подробно рассмотрена в разделе о сокращении.
Толстые филаменты
Их также называют миозиновыми филаментами, поскольку они состоят из молекул миозина. Миозин — это нитчатый белок, который полимеризуется с образованием толстых нитей в миофибриллах. На концах толстых нитей есть небольшие выступы, известные как миозиновые поперечные мостики. Сокращение скелетных мышц происходит в результате взаимодействия между актиновыми филаментами и поперечными мостиками миозиновых филаментов.
Одна толстая нить или миозиновая нить состоит примерно из 200 молекул миозина, расположенных по спирали вокруг друг друга. Каждая из этих молекул миозина состоит из шести полипептидных цепей, двух тяжелых цепей и четырех легких цепей.
Две тяжелые цепи молекул миозина намотаны друг на друга, образуя двойную спираль, образующую хвост из толстых нитей миозина. Каждый конец этих тяжелых цепей сложен, образуя глобулярную структуру. Эта структура включает две легкие цепи, образующие миозиновые головки.На конце каждого хвоста присутствуют две миозиновые головки.
Миозиновые поперечные мостики толстых филаментов состоят из миозиновых головок и плеч, с помощью которых они прикреплены к толстому филаменту. Пара поперечных перемычек присутствует вместе, поскольку они выступают из основной нити накала. Последовательные перемычки расположены таким образом, что между двумя парами существует угол 120 градусов.
Участки миофибрилл, содержащие миозиновые нити вместе с концами актина или тонкими нитями, имеют темный вид.Поэтому они известны как темные полосы. Их также называют полосами A , поскольку они анизотропны при воздействии поляризованного света.
Z-Disk
Это нитевидные структуры, к которым концы тонких нитей прикрепляются в миофибриллах. Актин или тонкие филаменты отходят от этих Z-дисков и пересекаются с миозиновыми филаментами.
Z-диски также состоят из нитевидного белка, который не является сократительным. Из-за своей неконтрактильной природы этот белок имеет другую структуру по сравнению с белками актина или миозина.
Z-диски не только связывают тонкие нити, но и служат для соединения миофибрилл, когда они проходят от одной миофибриллы к следующей. Между двумя последовательными Z-дисками чередуются светлые, темные и светлые полосы. Такой же рисунок наблюдается во всех миофибриллах, что придает им полосатый вид. Из-за этого полосатого вида скелетные мышцы называются поперечнополосатыми мышцами.
Саркомеры
Саркомеры — это сократительные единицы миофибрилл, расположенные между двумя последовательными Z-дисками.Каждый саркомер состоит из двух полос I, разделенных полосой А в центре. Все толстые и тонкие нити в миофибриллах организованы в виде саркомеров.
В центре саркомера присутствует слабый свет, называемый зоной H. Он кажется немного светлым по сравнению с окружающей темной полосой, поскольку имеет только толстые волокна. Остальная часть темной полосы по обе стороны от зоны H имеет пересекающиеся толстые и тонкие волокна и кажется более темной. Зона H делится пополам линией, называемой линией M.Он делит саркомер на две половины.
Длина саркомеров не остается постоянной, поскольку она изменяется, когда мышцы сокращаются или расслабляются. Его длина уменьшается при сокращении и увеличивается при расслаблении. В полностью сокращенном состоянии каждый саркомер в волокнах скелетных мышц имеет минимальную длину 2 микрометра. В этом состоянии актиновые нити полностью перекрывают миозиновые нити, и H-зона исчезает. Когда мышца расслабляется, зона H начинает появляться снова, поскольку пересечение волокон уменьшается.
Титиновых нитей
Титин — еще один нитевидный белок, который служит для удержания актиновых и миозиновых нитей на месте.Его волокна очень эластичны и пружинят.
Один конец филамента тайтина прикреплен к Z-диску, а другой конец прикреплен к филаментам миозина, находящимся в центре саркомера. Конец, прикрепленный к Z-диску, очень эластичный и пружинящий. Он действует как пружина, длина которой может изменяться во время циклов сжатия и расслабления. Это помогает удерживать толстые и тонкие нити на месте после каждого цикла сокращения.
Возбуждение
Напомним, что сокращение мышцы начинается только тогда, когда она возбуждается двигательным нейроном.Сокращение скелетных мышц происходит в результате сокращения саркомеров. Они не стимулируются непосредственно мотонейронами. Итак, как саркомеры в миофибриллах узнают, когда начинать сокращение? Ответ на этот вопрос обсуждается в этом заголовке.
Когда волокно скелетных мышц возбуждено, потенциал действия переносится Т-канальцами к саркоплазматической сети. Активация рецепторов DHP в саркоплазматическом ретикулуме высвобождает ионы кальция в саркоплазму мышечных клеток.
Эти ионы кальция связываются с субъединицей тропонина-C и вызывают изменение ее конфигурации. В результате он изменяет расположение белков актина и тропомиозина в тонких филаментах. Сайты связывания миозина на актиновых филаментах обнажаются, и могут образовываться поперечные мостики, вызывающие сокращение.
Таким образом, повышение содержания внутриклеточных ионов кальция дает сигнал для начала процесса сокращения. Этот рост ионов кальция ответственен за обнажение сайтов связывания миозина, единственный метод, с помощью которого миофибриллы узнают, что пора сокращаться.
Сокращение
Сокращение миофибрилл отвечает за сокращение скелетных мышц. Это происходит с помощью модели скользящей нити и включает следующие этапы;
- К головкам миозина прикреплена молекула АТФ. Эта молекула АТФ гидролизуется, чтобы зарядить миозиновые поперечные мостики. Энергия накапливается в головках миозина, поскольку АДФ и неорганический фосфат остаются прикрепленными к ним.
- Эти заряженные миозиновые поперечные мостики прикрепляются к сайтам связывания миозина на актиновых филаментах, что приводит к образованию актин-миозиновых поперечных мостиков.
- Следующий шаг называется рабочим ходом. Во время этой фазы головки миозина наклоняются к центру саркомера, создавая тянущее усилие. В результате нити актина тянутся к центру саркомера, и его длина уменьшается. Это вызывает сокращение мышц.
- Когда мышца собирается расслабиться или должна начать новый цикл сокращения, к головкам миозина присоединяется другая молекула АТФ. Это вызывает отслоение миозиновых головок от актиновых нитей.
- Гидролиз этого АТФ снова заряжает миозиновые головки, и цикл продолжается.
Молекулы АТФ, необходимые для сокращения миофибрилл, обеспечиваются обильными митохондриями, присутствующими в соседних областях саркоплазмы.
Клинические условия
После понимания структуры и механизма сокращения миофибрилл, давайте теперь обсудим некоторые заболевания, связанные с ними.
Миофибриллярные миопатии
Это группа заболеваний, связанных с миофибриллами скелетных мышц.Они являются частью более разнообразной группы мышечных заболеваний, называемых мышечными дистрофиями.
Миофибриллярные миопатии могут возникать в результате мутаций в различных генах, которые кодируют сократительные и неконтрактильные белки, обнаруженные в миофибриллах. Было обнаружено, что с этими расстройствами связаны шесть генов. Мутация в любом из этих генов может вызвать аномальную структуру и функцию миофибрилл.
Мышечная слабость — главный признак этих расстройств. Чаще всего встречается в среднем возрасте, но может встречаться и в других фазах жизни.Слабость мышц начинается в руках и ногах, а затем распространяется на более высокие части тела. Слабость лицевых мышц может вызвать затруднения в процессе глотания. Со временем становится и хуже.
Заболевание можно диагностировать с помощью различных генетических тестов, проводимых в разных клинических лабораториях.
Резюме
Скелетные мышцы — самая многочисленная ткань человеческого тела. Они отвечают за все виды движений.
Скелетные мышцы состоят из многоядерных волокон скелетных мышц, расположенных параллельно друг другу по всей длине мышцы.Сократительные белки внутри мышечных волокон расположены в форме миофибрилл.
Миофибриллы внутри клетки окружены цитоплазмой, называемой саркоплазмой.
- Энергия сокращения миофибрилл обеспечивается обильными митохондриями, присутствующими в окружающей саркоплазме.
- Ионы кальция, необходимые для начала сокращения, накапливаются и поставляются саркоплазматической сетью.
- Потенциал действия переносится глубоко в саркоплазматический ретикулум по Т-канальцам.
Миофибриллы рассредоточены в саркоплазме и проходят по всей длине мышечных волокон. Они состоят из двух типов нитей; актиновые нити и миозиновые нити.
Актиновые филаменты состоят из трех типов белков;
- Две цепи молекул F-актина закручиваются, образуя двойную спираль, которая действует как основа актиновых филаментов. Молекулы f-актина имеют участки связывания с головками миозина.
- Две цепочки тропомиозина обвивают двойную спираль F-актина и помещаются в бороздки, так что все сайты связывания миозина покрываются.
- Тропонин удерживает актин и тропомиозин связанными друг с другом.
Филаменты миозина состоят из двух тяжелых цепей и четырех легких цепей молекул миозина.
- Тяжелые цепи образуют двойную спираль, которая действует как хвост филамента
- Концы тяжелых цепей вместе с легкими цепями образуют миозиновые головки
Саркомеры — это основные сократительные единицы, которые образованы характерным расположением актина и молекулы миозина между двумя последовательными z-дисками.
Возбуждение миофибрилл происходит, когда ионы кальция связываются с тропонином, а тропомиозин вытесняется, обнажая участки связывания для головок миозина.
Сокращение происходит через модель скользящей филамента, где образуются актин-миозиновые поперечные мостики и актиновые филаменты тянутся к центру саркомера.
Миофибриллярные миопатии — это группа заболеваний, связанных с аномальными белками в миофибриллах. Они характеризуются мышечной слабостью и возникают из-за мутаций в некоторых специфических генах.
Ссылки
- McCracken, Thomas (1999). Новый атлас анатомии человека. Китай: Metro Books.

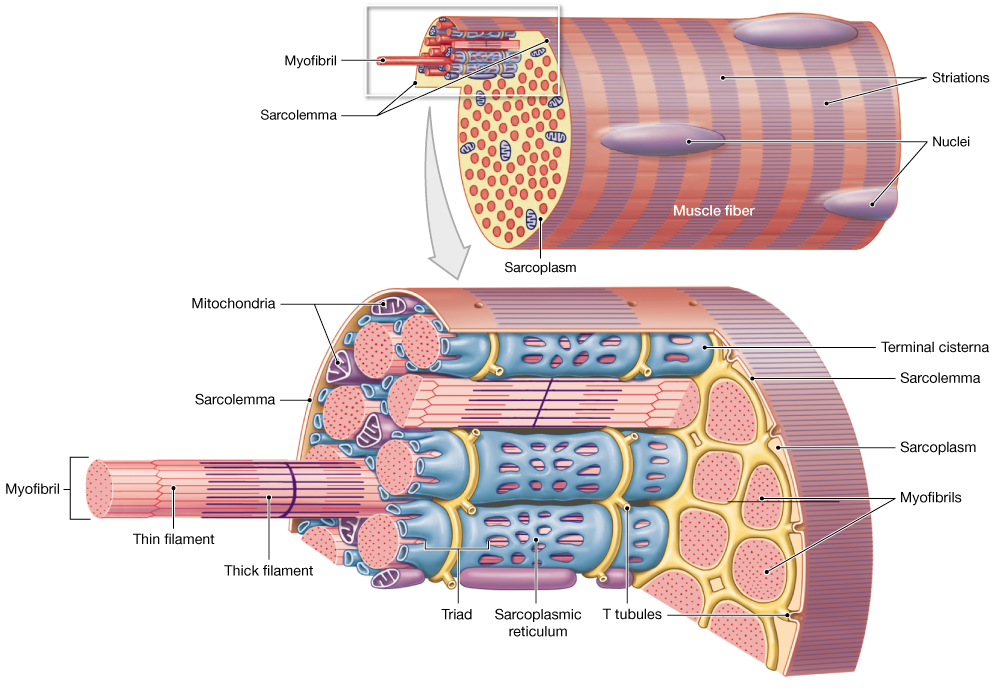 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] [PubMed] [Google Scholar]
[PubMed] [Google Scholar] Proc Natl Acad Sci U S A.1975 Май; 72 (5): 1913–1916. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A.1975 Май; 72 (5): 1913–1916. [Бесплатная статья PMC] [PubMed] [Google Scholar] Когда происходит полимеризация актиновой нити, образуется лестница, по которой миозиновая нить поднимается для создания движения.
Когда происходит полимеризация актиновой нити, образуется лестница, по которой миозиновая нить поднимается для создания движения. Они очень маленькие по сравнению с удлиненными мышечными клетками, длина которых измеряется сантиметрами.
Они очень маленькие по сравнению с удлиненными мышечными клетками, длина которых измеряется сантиметрами.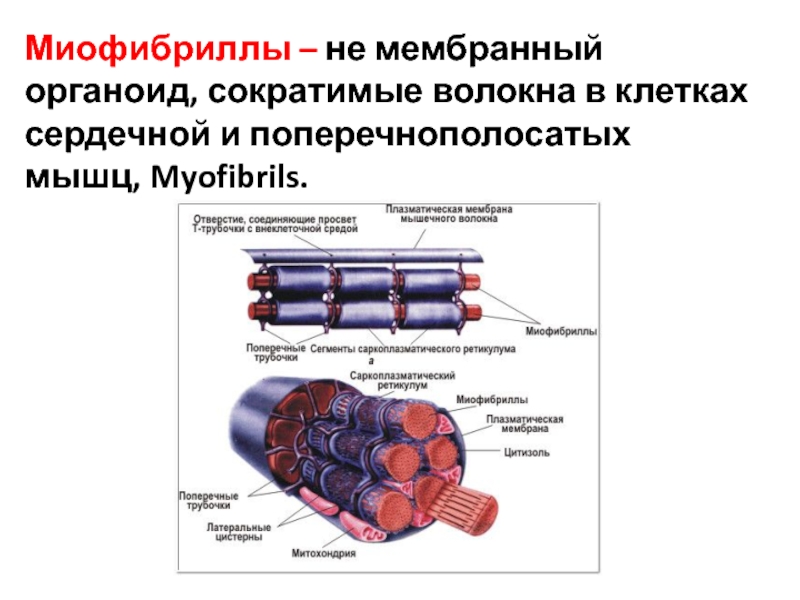 Миофибриллы, которые проходят по длине клетки, содержат саркомеры, соединенные последовательно.
Миофибриллы, которые проходят по длине клетки, содержат саркомеры, соединенные последовательно.

 Буква M в строке M происходит от немецкого слова mittel, что означает середина. M-линия также содержит ферменты, которые помогают в энергетическом обмене.
Буква M в строке M происходит от немецкого слова mittel, что означает середина. M-линия также содержит ферменты, которые помогают в энергетическом обмене.