Что означает формула E=mc2 и как с ее помощью раздобыть много энергии — T&P
Все знают формулу E=mc
2, и все слышали, что ее Эйнштейн придумал. Многие даже знают, что Е обозначает энергию, m — массу, а c — скорость света. Но что все это означает?Если взять обычную пальчиковую батарейку из пульта от телевизора, и превратить ее в энергию, то точно такую же энергию можно получить от 250 миллиардов таких же батареек, если использовать их по-старинке. Не очень хороший получается КПД.
А то и означает, что масса и энергия — это одно и то же. То есть масса — это частный случай энергии. Энергию, заключенную в массе чего угодно, можно посчитать по этой простой формуле.
Скорость света — это очень много. Это 299 792 458 метров в секунду или, если вам так удобнее, 1 079 252 848,8 километров в час. Из-за этой большой величины получается, что если превратить чайный пакетик целиком в энергию, то этого хватит, чтобы вскипятить 350 миллиардов чайников.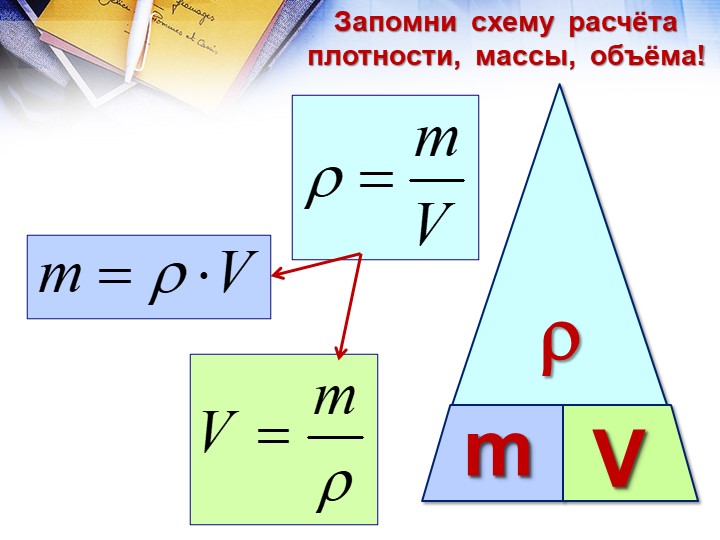
У меня есть пара грамм вещества, где мне получить мою энергию?
Перевести всю массу предмета в энергию можно, только если вы где-нибудь найдете столько же антиматерии. А ее получить в домашних условиях проблематично, этот вариант отпадает.
Термоядерный синтез
Существует очень много природных термоядерных реакторов, вы можете их наблюдать, просто взглянув на небо. Солнце и другие звезды — это и есть гигантские термоядерные реакторы.
Другой способ откусить от материи хоть сколько-то массы и превратить ее в энергию — это произвести термоядерный синтез. Берем два ядра водорода, сталкиваем их, получаем одно ядро гелия. Весь фокус в том, что масса двух ядер водорода немного больше, чем масса одного ядра гелия. Вот эта масса и превращается в энергию.
Но тут тоже не так все просто: ученые еще не научились поддерживать реакцию управляемого ядерного синтеза, промышленный термоядерный реактор фигурирует только в самых оптимистичных планах на середину этого столетия.
Ядерный распад
Ближе к реальности — реакция ядерного распада. Она вовсю используется в ядерных электростанциях. Это когда два больших ядра атома распадаются на два маленьких. При такой реакции масса осколков получается меньше массы ядра, пропавшая масса и уходит в энергию.
Ядерный взрыв — это тоже ядерный распад, но неуправляемый, прекрасная иллюстрация этой формулы.
Горение
Превращение массы в энергию вы можете наблюдать прямо у вас в руках. Зажгите спичку — и вот она. При некоторых химических реакциях, например, горения, выделяется энергия от потери массы. Но она очень мала по сравнению с реакцией распада ядра, и вместо ядерного взрыва у вас в руках происходит просто горение спички.
Более того, когда вы поели, еда через сложные химические реакции благодаря мизерной потере массы отдает энергию, которую вы потом используете, чтобы сыграть в настольный теннис, ну или на диване перед телеком, чтобы поднять пульт и переключить канал.
Так что, когда вы едите бутерброд, часть его массы превратится в энергию по формуле E=mc2.
Молекулярная физика — Физика — Теория, тесты, формулы и задачи
Оглавление:
Основные теоретические сведения
Основные положения МКТ
К оглавлению…
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения:
- Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы (соответственно: катионы и анионы).

- Атомы и молекулы находятся в непрерывном хаотическом движении и взаимодействии, скорость которого зависит от температуры, а характер – от агрегатного состояния вещества.
- Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Атом – наименьшая химически неделимая частица элемента (атом железа, гелия, кислорода). Молекула – наименьшая частица вещества, сохраняющая его химические свойства. Молекула состоит из одного и более атомов (вода – Н2О – 1 атом кислорода и 2 атома водорода). Ион – атом или молекула, у которых один или несколько электронов лишние (или электронов не хватает).
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах молекулы конденсируются в жидкое или твердое вещество. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах молекулы конденсируются в жидкое или твердое вещество. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10–8 м, то есть в сотни раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10–8 м, то есть в сотни раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
Идеальный газ – это газ, молекулы которого не взаимодействуют друг с другом, за исключением процессов упругого столкновения и считаются материальными точками.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).

Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории. Количество вещества определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА, или как отношение массы к молярной массе:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы
m0 одной молекулы данного вещества на постоянную Авогадро (то есть на количество частиц в одном моле). Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. В таблице Менделеева молярная масса указана в граммах на моль. Таким образом имеем еще одну формулу:где: M – молярная масса, NA – число Авогадро, m0 – масса одной частицы вещества, N – число частиц вещества содержащихся в массе вещества m. Кроме этого понадобится понятие концентрации (количество частиц в единице объема):
Кроме этого понадобится понятие концентрации (количество частиц в единице объема):
Напомним также, что плотность, объем и масса тела связаны следующей формулой:
Если в задаче идет речь о смеси веществ, то говорят о средней молярной массе и средней плотности вещества. Как и при вычислении средней скорости неравномерного движения, эти величины определяются полными массами смеси:
Не забывайте, что полное количество вещества всегда равно сумме количеств веществ, входящих в смесь, а с объемом надо быть аккуратными. Объем смеси газов не равен сумме объемов газов, входящих в смесь. Так, в 1 кубометре воздуха содержится 1 кубометр кислорода, 1 кубометр азота, 1 кубометр углекислого газа и т.д. Для твердых тел и жидкостей (если иное не указано в условии) можно считать, что объем смеси равен сумме объемов ее частей.
Основное уравнение МКТ идеального газа
К оглавлению…
При своем движении молекулы газа непрерывно сталкиваются друг с другом. Из-за этого характеристики их движения меняются, поэтому, говоря об импульсах, скоростях, кинетических энергиях молекул, всегда имеют в виду средние значения этих величин.
Из-за этого характеристики их движения меняются, поэтому, говоря об импульсах, скоростях, кинетических энергиях молекул, всегда имеют в виду средние значения этих величин.
Число столкновений молекул газа в нормальных условиях с другими молекулами измеряется миллионами раз в секунду. Если пренебречь размерами и взаимодействием молекул (как в модели идеального газа), то можно считать, что между последовательными столкновениями молекулы движутся равномерно и прямолинейно. Естественно, подлетая к стенке сосуда, в котором расположен газ, молекула испытывает столкновение и со стенкой. Все столкновения молекул друг с другом и со стенками сосуда считаются абсолютно упругими столкновениями шариков. При столкновении со стенкой импульс молекулы изменяется, значит на молекулу со стороны стенки действует сила (вспомните второй закон Ньютона). Но по третьему закону Ньютона с точно такой же силой, направленной в противоположную сторону, молекула действует на стенку, оказывая на нее давление. Совокупность всех ударов всех молекул о стенку сосуда и приводит к возникновению давления газа.
Поскольку давление есть следствие ударов молекул о стенку сосуда, очевидно, что его величина должна зависеть от характеристик отдельно взятых молекул (от средних характеристик, конечно, Вы ведь помните про то, что скорости всех молекул различны). Эта зависимость выражается основным уравнением молекулярно-кинетической теории идеального газа:
где: p — давление газа, n — концентрация его молекул, m0 — масса одной молекулы, vкв — средняя квадратичная скорость (обратите внимание, что в самом уравнении стоит квадрат средней квадратичной скорости). Физический смысл этого уравнения состоит в том, что оно устанавливает связь между характеристиками всего газа целиком (давлением) и параметрами движения отдельных молекул, то есть связь между макро- и микромиром.
Физический смысл этого уравнения состоит в том, что оно устанавливает связь между характеристиками всего газа целиком (давлением) и параметрами движения отдельных молекул, то есть связь между макро- и микромиром.
Следствия из основного уравнения МКТ
Как уже было отмечено в предыдущем параграфе, скорость теплового движения молекул определяется температурой вещества. Для идеального газа эта зависимость выражается простыми формулами для средней квадратичной скорости движения молекул газа:
где: k = 1,38∙10–23 Дж/К – постоянная Больцмана, T – абсолютная температура. Сразу же оговоримся, что далее во всех задачах Вы должны, не задумываясь, переводить температуру в кельвины из градусов Цельсия (кроме задач на уравнение теплового баланса). Закон трех постоянных:
где: R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная. Следующей важной формулой является формула для средней кинетической энергии поступательного движения молекул газа:
Оказывается, что средняя кинетическая энергия поступательного движения молекул зависит только от температуры, одинакова при данной температуре для всех молекул. Ну и наконец, самыми главными и часто применяемыми следствиями из основного уравнения МКТ являются следующие формулы:
Ну и наконец, самыми главными и часто применяемыми следствиями из основного уравнения МКТ являются следующие формулы:
Измерение температуры
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какого-либо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании).
В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании).
Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными. Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении. По температурной шкале Цельсия точке плавления льда приписывается температура 0°С, а точке кипения воды: 100°С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0°С и 100°С принимается равным 1°С.
Английский физик У.Кельвин (Томсон) в 1848 году предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута:
При этом изменение температуры на 1ºС соответствует изменению температуры на 1 К. Изменения температуры по шкале Цельсия и Кельвина равны. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К. Например, комнатная температура TС = 20°С по шкале Кельвина равна TК = 293 К. Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Изменения температуры по шкале Цельсия и Кельвина равны. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К. Например, комнатная температура TС = 20°С по шкале Кельвина равна TК = 293 К. Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
К оглавлению…
Уравнение состояние идеального газа является очередным следствие из основного уравнения МКТ и записывается в виде:
Данное уравнение устанавливает связь между основными параметрами состояния идеального газа: давлением, объемом, количеством вещества и температурой. Очень важно, что эти параметры взаимосвязаны, изменение любого из них неизбежно приведет к изменению еще хотя бы одного. Именно поэтому данное уравнение и называют уравнением состояния идеального газа. Оно было открыто сначала для одного моля газа Клапейроном, а впоследствии обобщено на случай большего количество молей Менделеевым.
Оно было открыто сначала для одного моля газа Клапейроном, а впоследствии обобщено на случай большего количество молей Менделеевым.
Если температура газа равна Tн = 273 К (0°С), а давление pн = 1 атм = 1·105 Па, то говорят, что газ находится при нормальных условиях.
Газовые законы
К оглавлению…
Решение задач на расчет параметров газа значительно упрощается, если Вы знаете, какой закон и какую формулу применить. Итак, рассмотрим основные газовые законы.
1. Закон Авогадро. В одном моле любого вещества содержится одинаковое количество структурных элементов, равное числу Авогадро.
2. Закон Дальтона. Давление смеси газов равно сумме парциальных давлений газов, входящих в эту смесь:
Парциальным давлением газа называют то давление, которое он бы производил, если бы все остальные газ внезапно исчезли из смеси. Например, давление воздуха равно сумме парциальных давлений азота, кислорода, углекислого газа и прочих примесей. При этом каждый из газов в смеси занимает весь предоставленный ему объем, то есть объем каждого из газов равен объему смеси.
При этом каждый из газов в смеси занимает весь предоставленный ему объем, то есть объем каждого из газов равен объему смеси.
3. Закон Бойля-Мариотта. Если масса и температура газа остаются постоянными, то произведение давления газа на его объем не изменяется, следовательно:
Процесс, происходящий при постоянной температуре, называют изотермическим. Обратите внимание, что такая простая форма закона Бойля-Мариотта выполняется только при условии, что масса газа остается неизменной.
4. Закон Гей-Люссака. Сам закон Гей-Люссака не представляет особой ценности при подготовке к экзаменам, поэтому приведем лишь следствие из него. Если масса и давление газа остаются постоянными, то отношение объема газа к его абсолютной температуре не изменяется, следовательно:
Процесс, происходящий при постоянном давлении, называют изобарическим или изобарным. Обратите внимание, что такая простая форма закона Гей-Люссака выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
Не забывайте про перевод температуры из градусов Цельсия в кельвины.
5. Закон Шарля. Как и закон Гей-Люссака, закон Шарля в точной формулировке для нас не важен, поэтому приведем лишь следствие из него. Если масса и объем газа остаются постоянными, то отношение давления газа к его абсолютной температуре не изменяется, следовательно:
Процесс, происходящий при постоянном объеме, называют изохорическим или изохорным. Обратите внимание, что такая простая форма закона Шарля выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
6. Универсальный газовый закон (Клапейрона). При постоянной массе газа отношение произведения его давления и объема к температуре не изменяется, следовательно:
Обратите внимание, что масса должна оставаться неизменной, и не забывайте про кельвины.
Итак, существует несколько газовых законов. Перечислим признаки того, что нужно применять один из них при решении задачи:
- Закон Авогадро применяется во всех задачах где речь идет о количестве молекул.

- Закон Дальтона применяется во всех задачах, в которых идет речь о смеси газов.
- Закон Шарля применяют в задачах, когда объем газа остается неизменным. Обычно это или сказано явно, или в задаче присутствуют слова «газ в закрытом сосуде без поршня».
- Закон Гей-Люссака применяют, если неизменным остается давление газа. Ищите в задачах слова «газ в сосуде, закрытом подвижным поршнем» или «газ в открытом сосуде». Иногда про сосуд ничего не сказано, но по условию понятно, что он сообщается с атмосферой. Тогда считается, что атмосферное давление всегда остается неизменным (если в условии не сказано иного).
- Закон Бойля-Мариотта. Тут сложнее всего. Хорошо, если в задаче написано, что температура газа неизменна. Чуть хуже, если в условии присутствует слово «медленно». Например, газ медленно сжимают или медленно расширяют. Еще хуже, если сказано, что газ закрыт теплонепроводящим поршнем. Наконец, совсем плохо, если про температуру не сказано ничего, но из условия можно предположить, что она не изменяется.
 Обычно в этом случае ученики применяют закон Бойля-Мариотта от безысходности.
Обычно в этом случае ученики применяют закон Бойля-Мариотта от безысходности. - Универсальный газовый закон. Его используют, если масса газа постоянна (например, газ находится в закрытом сосуде), но по условию понятно, что все остальные параметры (давление, объем, температура) изменяются. Вообще, часто вместо универсального закона можно применять уравнение Клапейрона-Менделеева, вы получите правильный ответ, только в каждой формуле будете писать по две лишние буквы.
Графическое изображение изопроцессов
К оглавлению…
Во многих разделах физики зависимость величин друг от друга удобно изображать графически. Это упрощает понимание взаимосвязи параметров, происходящих в системе процессов. Такой подход очень часто применяется и в молекулярной физике. Основными параметрами, описывающими состояние идеального газа, являются давление, объем и температура. Графический метод решения задач и состоит в изображении взаимосвязи этих параметров в различных газовых координатах. Существует три основных типа газовых координат: (p; V), (p; T) и (V; T). Заметьте, что это только основные (наиболее часто встречающиеся типы координат). Фантазия составителей задач и тестов не ограничена, поэтому Вы можете встретить и любые другие координаты. Итак, изобразим основные газовые процессы в основных газовых координатах.
Существует три основных типа газовых координат: (p; V), (p; T) и (V; T). Заметьте, что это только основные (наиболее часто встречающиеся типы координат). Фантазия составителей задач и тестов не ограничена, поэтому Вы можете встретить и любые другие координаты. Итак, изобразим основные газовые процессы в основных газовых координатах.
Изобарный процесс (p = const)
Изобарным процессом называют процесс, протекающий при неизменным давлении и массе газа. Как следует из уравнения состояния идеального газа, в этом случае объем изменяется прямо пропорционально температуре. Графики изобарического процесса в координатах р–V; V–Т и р–Т имеют следующий вид:
Обратите внимание на то, что продолжение графика в V–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как при очень низких температурах газ превращается в жидкость и зависимость объема от температура меняется.
Изохорный процесс (V = const)
Изохорный процесс – это процесс нагревания или охлаждения газа при постоянном объеме и при условии, что количество вещества в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа изменяется прямо пропорционально его абсолютной температуре. Графики изохорного процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Обратите внимание на то, что продолжение графика в p–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как газ при очень низких температурах превращается в жидкость.
Изотермический процесс (T = const)
Изотермическим процессом называют процесс, протекающий при постоянной температуре. Из уравнения состояния идеального газа следует, что при постоянной температуре и неизменном количестве вещества в сосуде произведение давления газа на его объем должно оставаться постоянным. Графики изотермического процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Графики изотермического процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Заметим, что при выполнении заданий на графики в молекулярной физике не требуется особой точности в откладывании координат по соответствующим осям (например, чтобы координаты p1 и p2 двух состояний газа в системе p(V) совпадали с координатами p1 и p2 этих состояний в системе p(T). Во–первых, это разные системы координат, в которых может быть выбран разный масштаб, а во–вторых, это лишняя математическая формальность, отвлекающая от главного – от анализа физической ситуации. Основное требование: чтобы качественный вид графиков был верным.
Неизопроцессы
К оглавлению…
В задачах этого типа изменяются все три основных параметра газа: давление, объем и температура. Постоянной остается только масса газа.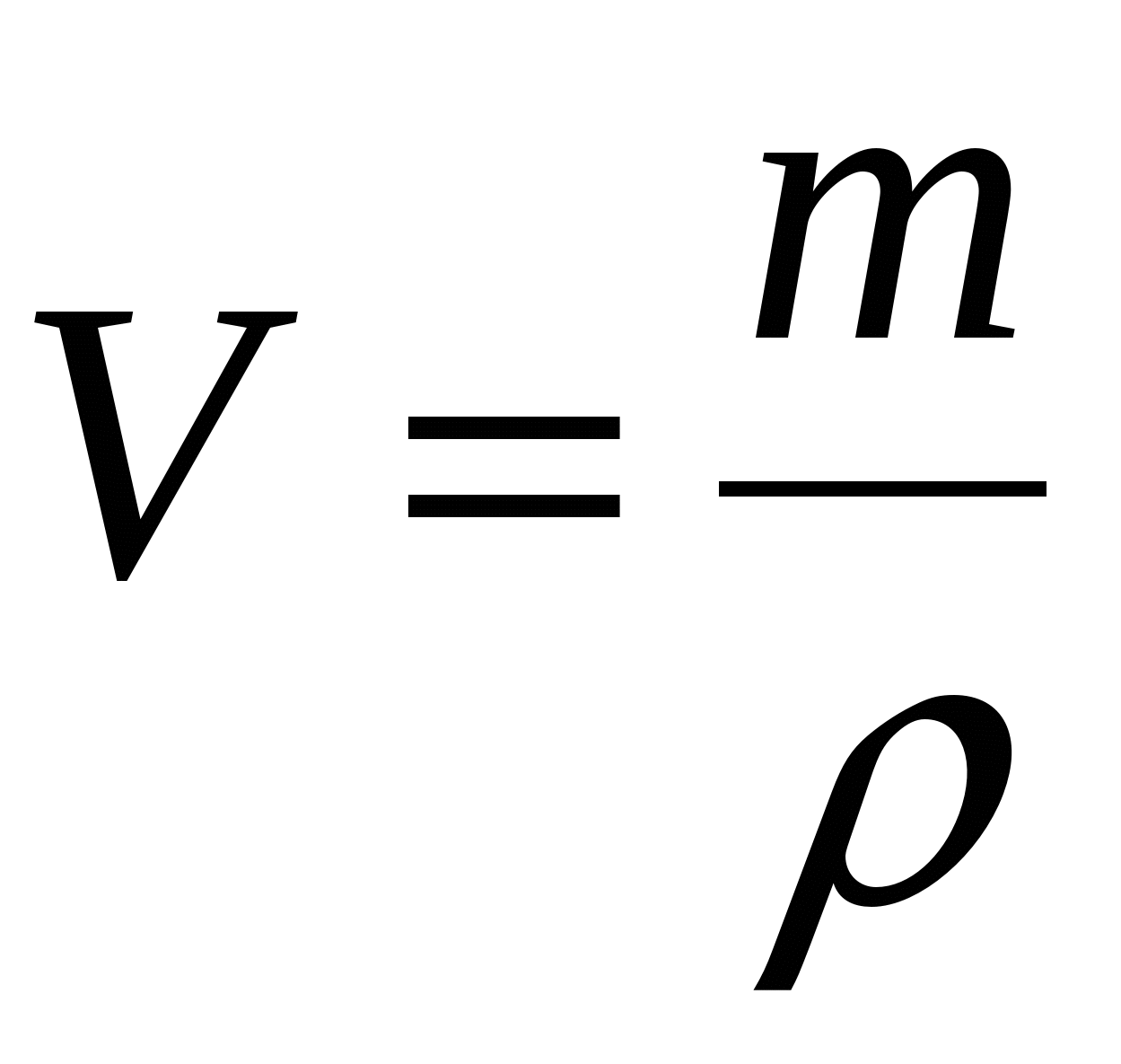 Наиболее простой случай, если задача решается «в лоб» с помощью универсального газового закона. Чуть сложнее, если Вам надо отыскать уравнение процесса, описывающего изменение состояния газа, или проанализировать поведение параметров газа по данному уравнению. Тогда действовать надо так. Записать данное уравнение процесса и универсальный газовый закон (или уравнение Клапейрона-Менделеева, что Вам удобнее) и последовательно исключать ненужные величины из них.
Наиболее простой случай, если задача решается «в лоб» с помощью универсального газового закона. Чуть сложнее, если Вам надо отыскать уравнение процесса, описывающего изменение состояния газа, или проанализировать поведение параметров газа по данному уравнению. Тогда действовать надо так. Записать данное уравнение процесса и универсальный газовый закон (или уравнение Клапейрона-Менделеева, что Вам удобнее) и последовательно исключать ненужные величины из них.
Изменение количества или массы вещества
К оглавлению…
В сущности, ничего сложного в таких задачах нет. Надо только помнить, что газовые законы не выполняются, так как в формулировках любых из них записано «при постоянной массе». Поэтому действуем просто. Записываем уравнение Клапейрона-Менделеева для начального и конечного состояний газа и решаем задачу.
Перегородки или поршни
К оглавлению…
В задачах этого типа опять применяются газовые законы, при этом необходимо учесть следующие замечания:
- Во-первых, газ через перегородку не проходит, то есть масса газа в каждой части сосуда остается неизменной, и таким образом, для каждой части сосуда выполняются газовые законы.

- Во-вторых, если перегородка теплонепроводящая, то при нагревании или охлаждении газа в одной части сосуда температура газа во второй части останется неизменной.
- В-третьих, если перегородка подвижна, то давления по обе ее стороны равны в каждый конкретный момент времени (но это равное с обоих сторон давление может меняться со временем).
- А дальше пишем газовые законы для каждого газа по отдельности и решаем задачу.
Газовые законы и гидростатика
К оглавлению…
Специфика задач состоит в том, что в давлении надо будет учитывать «довески», связанные с давлением столба жидкости. Какие тут могут быть варианты:
- Сосуд с газом погружен под воду. Давление в сосуде будет равно: p = pатм + ρgh, где: h – глубина погружения.
- Горизонтальная трубка закрыта от атмосферы столбиком ртути (или другой жидкости). Давление газа в трубке точно равно: p = pатм атмосферному, так как горизонтальный столбик ртути не оказывает давления на газ.

- Вертикальная трубка с газом закрыта сверху столбиком ртути (или другой жидкости). Давление газа в трубке: p = pатм + ρgh, где: h – высота столбика ртути.
- Вертикальная узкая трубка с газом повернута открытым концом вниз и заперта столбиком ртути (или другой жидкости). Давление газа в трубке: p = pатм – ρgh, где: h – высота столбика ртути. Знак «–» ставится, так как ртуть не сжимает, а растягивает газ. Часто ученики спрашивают, почему ртуть не вытекает из трубки. Действительно, если бы трубка была широкой, ртуть бы стекла вниз по стенкам. А так, поскольку трубка очень узкая, поверхностное натяжение на дает ртути разорваться посередине и пропустить внутрь воздух, а давление газа внутри (меньшее, чем атмосферное) удерживает ртуть от вытекания.
Как только Вы сумели правильно записать давление газа в трубке, применяйте какой-либо из газовых законов (как правило, Бойля-Мариотта, так как большинство таких процессов изотермические, или универсальный газовый закон). Применяйте выбранный закон для газа (ни в коем случае не для жидкости) и решайте задачу.
Применяйте выбранный закон для газа (ни в коем случае не для жидкости) и решайте задачу.
Тепловое расширение тел
К оглавлению…
При повышении температуры возрастает интенсивность теплового движения частиц вещества. Это приводит к тому, что молекулы более «активно» отталкиваются друг от друга. Из-за этого большинство тел увеличивает свои размеры при нагревании. Не совершите типичную ошибку, сами атомы и молекулы не расширяются при нагревании. Увеличиваются лишь пустые промежутки между молекулами. Тепловое расширение газов описывается законом Гей-Люссака. Тепловое расширение жидкостей подчиняется следующему закону:
где: V0 – объем жидкости при 0°С, V – при температуре t, γ – коэффициент объемного расширения жидкости. Обратите внимание, что все температуры в этой теме нужно брать в градусах Цельсия. Коэффициент объемного расширения зависит от рода жидкости (и от температуры, что не учитывается в большинстве задач). Обратите внимание, что численное значение коэффициента, выраженное в 1/°С или в 1/К, одинаково, так как нагреть тело на 1°С это то же самое, что нагреть его на 1 К (а не на 274 К).
Обратите внимание, что численное значение коэффициента, выраженное в 1/°С или в 1/К, одинаково, так как нагреть тело на 1°С это то же самое, что нагреть его на 1 К (а не на 274 К).
Для расширения твердых тел применяются три формулы, описывающие изменение линейных размеров, площади и объема тела:
где: l0, S0, V0 – соответственно длина, площадь поверхности и объем тела при 0°С, α – коэффициент линейного расширения тела. Коэффициент линейного расширения зависит от рода тела (и от температуры, что не учитывается в большинстве задач) и измеряется в 1/°С или в 1/К.
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.
* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда:
(I)
(2)
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
Поскольку А = Vp, формула (1) будет иметь вид:
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4)
(5)
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
(6)
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
(7)
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(8)
(9)
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
(11)
Объем воды (в мл) для разбавления: b = V2 — V1
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:
Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
К оглавлению
см. также
37- 38 Бір заттың массасы, заттар саны, жалпы масса арасындағы тәуелділікке есептер. | Математика пәнінен 3-класқа арналған күнделекті сабақ жоспарларының үлгілері
37- 38 Бір заттың массасы, заттар саны, жалпы масса арасындағы тәуелділікке есептер.
05.06.2013 12823 0Сабақтың тақырыбы : 37- 38 Бір заттың массасы, заттар саны, жалпы масса арасындағы тәуелділікке есептер.
Мақсаты: .
Шамалар туралы түсініктерін жетілдіру. Бір заттың массасы, заттар саны,
жалпы масса арасындағы тәуелділікке есептерді шығарып үйрену. Алған білімдерін
бекіту. Ой- өрісін дамыту
Алған білімдерін
бекіту. Ой- өрісін дамыту
Сабақтың барысы : 1.Ұйымдастыру кезеңі
Білім.1. 1 пакет ұнның массасы 2кг, осындай 4 пакет ұн сатып алынды. Сатып алынған ұнның жалпы массасы қандай? 2кг *4 =8
3. Сабақтың тақырыбы мен мақсаты хабарланады.
4.Түсіну. Жалпы масса бір заттың массасының заттардың санына көбейтіндісіне тең.
Бір заттың массасын табу үшін жалпы массаны заттар санына бөлу керек.
Заттар санын табу үшін, жалпы массаны бір заттың массасына бөлу керек№
1 пакеттің массасы | Пакеттер саны | Жалпы массасы |
2кг | 4 | ? кг |
?кг | 3 | 9кг |
6кг | ? | 18кг |
5. ҚОЛДАНУ. №4
ҚОЛДАНУ. №4
Кестені пайдаланып есеп құрастыр және шығар:
1 пакеттің массасы | Пакеттер саны | Жалпы массасы |
9кг | 3 | ? кг |
?кг | 4 | 36кг |
8кг | ? | 24 кг |
1. Жинақтау. № 5 Ауызша есептеу кестелік көбейту.
№ 7 Есепте және тексер
№ 8 есепті шығар
№ 10 теңдеулерді шеш:
7. Рефлексия
8.Үйге тапсырма : № 6, 9 , 12 – 69 бет
38 –сабақ сынып үлгерімінің
деңгейіне, мұғалімнің шығармашылығына қарай жоспарланады.
2,2-диметил-3-этилпентан, структурная формула, свойства
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Тетраспан 6
Тетраспан 6 является лекарственным препаратом, отпускаемым по рецепту. Информация на данной странице предназначена исключительно для специалистов здравоохранения — для медицинских и фармацевтических работников. Полная информация по применению препарата Тетраспан 6 содержится в инструкции по медицинскому применению.
1000 мл раствора содержит:
Концентрация электролитов:
Физико-химические характеристики: теоретическая осмолярность 296 мОсм/л, рН от 5,6 до 6,4
Описание: бесцветный или бледно-желтый, слегка опалесцирующий раствор
Фармакотерапевтическая группа: плазмозамещающее средство
Код АТХ: В05АА07
Тетраспан 6 — коллоидный плазмозамещающий раствор, содержащий 6 % гидроксиэтилкрахмала (ГЭК) в сбалансированном растворе электролитов. Средняя молекулярная масса ГЭК составляет 130 000 дальтон, степень молярного замещения равна 0,42.
Средняя молекулярная масса ГЭК составляет 130 000 дальтон, степень молярного замещения равна 0,42.
Тетраспан 6 является изоонкотическим раствором, волемический эффект которого составляет 100 %. Продолжительность волемического эффекта главным образом зависит от степени молярного замещения ГЭК и, в меньшей степени, от средней молекулярной массы ГЭК. Продукты гидролиза ГЭК представляют собой онкотически активные молекулы, выводящиеся почками.
Тетраспан 6 может снижать показатели гематокрита и вязкости плазмы.
При изоволемическом введении объемозамещающий эффект сохраняется не менее 6 часов.
Состав катионов в Тетраспане 6 идентичен физиологической концентрации электролитов в плазме. Анионы представлены хлоридами, ацетатами и малатами, задачей которых является минимизировать риск гиперхлоремии и ацидоза. Добавление ацетатов и малатов вместо лактатов обусловливает уменьшение риска возникновения молочнокислого ацидоза.
Лечение гиповолемии при острой кровопотере, если применение растворов кристаллоидов является недостаточным.
Полная информация по применению препарата Тетраспан 6 содержится в инструкции по медицинскому применению.
Для внутривенного введения.
Суточная доза и скорость введения зависят от величины кровопотери и параметров гемодинамики.
Первые 10–20 мл инфузии необходимо вводить медленно при тщательном наблюдении за состоянием пациента с целью раннего выявления возможных анафилактических/анафилактоидных реакций.
Перед применением препарата необходимо подтвердить состояние гиповолемии, например, оценив положительность ответа пациента на инфузионную терапию.
Максимальная суточная доза
До 50 мл/кг массы тела Тетраспана 6 (что соответствует 3,0 г/кг массы тела ГЭК), если пациент в состоянии гиповолемии, например, отвечает на инфузионную терапию. Это соответствует 3500 мл Тетраспана 6 для пациента, весящего 70 кг. Необходим постоянный мониторинг гемодинамического статуса пациента.
До 30 мл/кг массы тела Тетраспана 6 в случае, если невозможно осуществлять мониторинг гемодинамического статуса пациента.
Максимальная скорость введения
Максимальная скорость введения зависит от клинической ситуации. Пациентам в острой фазе шока можно вводить до 20 мл/кг массы тела в час (что соответствует 0,33 мл/кг массы тела в минуту или 1,2 г/кг массы тела ГЭК в час).
При состояниях, угрожающих жизни, возможно быстрое введение 500 мл раствора (под давлением).
Должна быть использована наименьшая эффективная доза препарата. Лечение должно сопровождаться непрерывным мониторингом гемодинамики, а при достижении необходимого результата инфузию следует прекратить. Не следует превышать максимальную суточную дозу.
Продолжительность терапии
Продолжительность терапии зависит от длительности и выраженности гиповолемии, гемодинамического эффекта в результате проводимой терапии и уровня гемодилюции.
Длительность применения ГЭК должна быть ограничена начальной фазой восполнения объема циркулирующей крови и не должна превышать 24 ч.
Применение в педиатрии
Опыт применения у детей ограничен, в связи с чем применение препаратов ГЭК у данной возрастной группы не рекомендуется.
и молекулярная масса — Оксфордская стипендия
Страница из
НАПЕЧАТАНО ИЗ ОНЛАЙН-СТИПЕНДИИ ОКСФОРДА (oxford.universitypressscholarship.com). (c) Авторские права Oxford University Press, 2021. Все права защищены. Отдельный пользователь может распечатать одну главу монографии в формате PDF в OSO для личного использования. дата: 05 января 2022 г.
- Раздел:
- 4 (стр.41) Формула и молекулярная масса
- Источник:
- Химия на количественном языке
- Автор (ы):
Кристофер О.Ориахи
- Издатель:
- Oxford University Press
DOI: 10.1093 / oso / 9780195367997.003.0008
Многие химики используют термины «формульная масса» и «молекулярная масса» как взаимозаменяемые, когда имеют дело с химическими соединениями известной формулы. Но между этими двумя терминами есть небольшая разница, как объясняется ниже. Формульная масса соединения — это сумма атомных масс всех атомов в формульной единице соединения, будь то ионная или молекулярная (ковалентная).Формула массы основана на соотношении различных элементов в формуле, в отличие от молекулярной массы, которая зависит от фактического количества атомов каждого типа (сравните раздел 6.2, «Эмпирическая формула»). Формулы масс являются относительными, поскольку они выводятся из относительных атомных масс. Например, формульная масса фосфорной кислоты h4PO4 составляет 97,98 атомных единиц массы (а.е.м.), что получается путем сложения атомных масс (взятых из периодической таблицы) элементов в одну формульную единицу (т. Е. 3 H + 1 P + 4 O).(3 × Ат. Масса H) + (1 × Ат. Масса P) + (4 × Ат. Масса O) = (3 × 1,00) + (1 × 30,97) + (4 × 16,00) = 97,97 Когда фактическая формула химического вещества известна, молекулярная масса может быть определена аналогично вычислению формулы массы.
Но между этими двумя терминами есть небольшая разница, как объясняется ниже. Формульная масса соединения — это сумма атомных масс всех атомов в формульной единице соединения, будь то ионная или молекулярная (ковалентная).Формула массы основана на соотношении различных элементов в формуле, в отличие от молекулярной массы, которая зависит от фактического количества атомов каждого типа (сравните раздел 6.2, «Эмпирическая формула»). Формулы масс являются относительными, поскольку они выводятся из относительных атомных масс. Например, формульная масса фосфорной кислоты h4PO4 составляет 97,98 атомных единиц массы (а.е.м.), что получается путем сложения атомных масс (взятых из периодической таблицы) элементов в одну формульную единицу (т. Е. 3 H + 1 P + 4 O).(3 × Ат. Масса H) + (1 × Ат. Масса P) + (4 × Ат. Масса O) = (3 × 1,00) + (1 × 30,97) + (4 × 16,00) = 97,97 Когда фактическая формула химического вещества известна, молекулярная масса может быть определена аналогично вычислению формулы массы. Молекулярная масса соединения — это сумма атомных масс всех атомов в одной молекуле соединения. Этот термин применяется только к соединениям, существующим в виде молекул, таким как h3O, SO2 и глюкоза, C6h22O6. Например, молекулярная масса этанола C2H5OH составляет: (2 × C) + (6 × H) + (1 × O) (2 × 12.0) + (6 × 1.0) + (1 × 16.0) = 46 Когда ионные соединения, такие как NaCl, Zn (NO3) 2 иNh5Cl, находятся в кристаллическом состоянии или в форме раствора, они не содержат физически различных незаряженных молекулярных единиц. . Поэтому химики часто используют термин «формула массы» для обозначения общего состава таких веществ. Пример 4.1. Рассчитайте формулу массы (FM) NaOH, используя таблицу атомных масс (AM).
Молекулярная масса соединения — это сумма атомных масс всех атомов в одной молекуле соединения. Этот термин применяется только к соединениям, существующим в виде молекул, таким как h3O, SO2 и глюкоза, C6h22O6. Например, молекулярная масса этанола C2H5OH составляет: (2 × C) + (6 × H) + (1 × O) (2 × 12.0) + (6 × 1.0) + (1 × 16.0) = 46 Когда ионные соединения, такие как NaCl, Zn (NO3) 2 иNh5Cl, находятся в кристаллическом состоянии или в форме раствора, они не содержат физически различных незаряженных молекулярных единиц. . Поэтому химики часто используют термин «формула массы» для обозначения общего состава таких веществ. Пример 4.1. Рассчитайте формулу массы (FM) NaOH, используя таблицу атомных масс (AM).
Ключевые слова: формула масса, молярная масса, молекулярная масса
Oxford Scholarship Online требует подписки или покупки для доступа к полному тексту книг в рамках службы.Однако публичные пользователи могут свободно искать на сайте и просматривать аннотации и ключевые слова для каждой книги и главы.
Пожалуйста, подпишитесь или войдите для доступа к полному тексту.
Если вы считаете, что у вас должен быть доступ к этому заголовку, обратитесь к своему библиотекарю.
Для устранения неполадок, пожалуйста, проверьте наш FAQs , и если вы не можете найти там ответ, пожалуйста связаться с нами .
Формула Масса
3.5 Формула массы
Цель обучения
- Определите формульную массу ионного соединения.
Один навык, который понадобится в будущих главах, — это способность определять массу формулы ионного соединения. Это количество называется формулой массы — сумма масс элементов в формуле ионного соединения. Формула массы получается путем сложения масс каждого отдельного атома в формуле соединения. Поскольку правильная формула является электрически нейтральной (без получения или потери чистых электронов), ионы можно рассматривать как атомы для целей вычисления формулы массы.
Поскольку правильная формула является электрически нейтральной (без получения или потери чистых электронов), ионы можно рассматривать как атомы для целей вычисления формулы массы.
Начнем с расчета формулы массы хлорида натрия (NaCl). Эта формула массы представляет собой сумму атомных масс одного атома натрия и одного атома хлора, которую мы находим из периодической таблицы; здесь мы используем массы до двух десятичных знаков:
| Na: | 22.99 u |
| Класс: | + 35.45 u |
| Всего: | 58,44 u |
С точностью до двух знаков после запятой формула массы NaCl равна 58,44 ед.
Если ионное соединение имеет более одного аниона или катиона, вы должны не забыть использовать точное кратное атомной массы для рассматриваемого элемента. Для формулы массы фторида кальция (CaF 2 ) мы должны умножить массу атома фтора на 2, чтобы учесть два атома фтора в химической формуле:
Для формулы массы фторида кальция (CaF 2 ) мы должны умножить массу атома фтора на 2, чтобы учесть два атома фтора в химической формуле:
| Ca: | 1 × 40.08 | 40.08 u |
| Ф: | 2 × 19,00 = | + 38.00 из |
| Всего: | 78.08 u |
Формульная масса CaF 2 равна 78,08 ед.
Для ионных соединений с многоатомными ионами сумма должна включать количество и массу каждого атома в формуле многоатомного иона.Например, нитрат калия (KNO 3 ) имеет один атом калия, один атом азота и три атома кислорода:
| К: | 1 × 39,10 | 39,10 и |
| №: | 1 × 14,00 | + 14. 00 из 00 из |
| О: | 3 × 16,00 = | + 48.00 u |
| Всего: | 101.10 u |
Формульная масса KNO 3 равна 101,10 ед.
Примечание
Нитрат калия является ключевым ингредиентом пороха и используется в клинических условиях как мочегонное средство.
Если формула содержит более одной многоатомной единицы в химической формуле, как в Ca (NO 3 ) 2 , не забудьте умножить атомную массу каждого атома в круглых скобках на нижний индекс вне скобок.Это необходимо, потому что нижний индекс относится ко всему многоатомному иону . Таким образом, для Ca (NO 3 ) 2 нижний индекс 2 означает два полных нитрат-иона, поэтому мы должны суммировать массы двух (1 × 2) атомов азота и шести (3 × 2) атомов кислорода, а также масса одного атома кальция:
| Ca: | 1 × 40,08 | 40. 08 u 08 u |
| №: | 2 × 14.00 = | + 28.00 из |
| О: | 6 × 16,00 = | + 96.00 u |
| Всего: | 164.08 u |
Ключом к вычислению формулы массы ионного соединения является правильный подсчет каждого атома в формуле и соответствующее умножение атомных масс его атомов.
Пример 9
Используйте атомные массы (округленные до двух десятичных знаков) с внутренней стороны обложки этой книги, чтобы определить формулу массы для каждого ионного соединения.
- FeCl 3
- (NH 4 ) 3 PO 4
Решение
Fe: 55.  85 u
85 uКласс: 3 × 35,45 = + 106.35 u Всего: 162.20 u Формульная масса FeCl 3 равна 162,20 ед.
Когда мы распределяем индекс 3 через круглые скобки, содержащие формулу для иона аммония, мы видим, что у нас есть 3 атома азота и 12 атомов водорода.Таким образом, мы устанавливаем сумму так:
№: 3 × 14,00 = 42,00 и В: 12 × 1,00 = + 12.  00 из
00 изп: + 30.97 u О: 4 × 16,00 = + 64.00 из Всего: 148.97 u Формула массы для (NH 4 ) 3 PO 4 составляет 148,97 ед.
Упражнение по развитию навыков
Используйте атомные массы (округленные до двух десятичных знаков) с внутренней стороны обложки этой книги, чтобы определить формулу массы для каждого ионного соединения.
Для вашего здоровья: увлажняет
Некоторые ионные соединения содержат воду (H 2 O), входящую в их формульную единицу.Эти соединения, называемые гидратами и , имеют характерное количество водных единиц, связанных с каждой формульной единицей соединения. Гидраты — это твердые вещества, а не жидкости или растворы, несмотря на содержащуюся в них воду.
Чтобы написать химическую формулу гидрата, запишите количество единиц воды на формульную единицу соединения после его химической формулы. Две химические формулы разделены точкой с вертикальным центром. Гидрат сульфата меди (II) имеет пять единиц воды, связанных с каждой формульной единицей, поэтому он записывается как CuSO 4 · 5H 2 O. Название этого соединения — пентагидрат сульфата меди (II) с префиксом пента- , указывающим на присутствие пяти единиц воды на формульную единицу сульфата меди (II).
Название этого соединения — пентагидрат сульфата меди (II) с префиксом пента- , указывающим на присутствие пяти единиц воды на формульную единицу сульфата меди (II).
Гидраты находят различное применение в индустрии здравоохранения. Полугидрат сульфата кальция (CaSO 4 · ½H 2 O), известный как Парижский гипс, используется для изготовления слепков для сломанных костей. Английская соль (MgSO 4 · 7H 2 O) используется как соль для купания и слабительное средство. Гексагидрат хлорида алюминия является активным ингредиентом антиперспирантов.В прилагаемой таблице перечислены некоторые полезные гидраты.
Таблица 3.4 Названия и формулы некоторых широко используемых гидратов
| Формула | Имя | Использует |
|---|---|---|
| AlCl 3 · 6H 2 O | гексагидрат хлорида алюминия | антиперспирант |
| CaSO 4 · ½H 2 O | полугидрат сульфата кальция (гипс) | слепки (для переломов и отливок) |
| CaSO 4 · 2H 2 O | дигидрат сульфата кальция (гипс) | гипсокартон |
| CoCl 2 · 6H 2 O | гексагидрат хлорида кобальта (II) | осушитель, индикатор влажности |
| CuSO 4 · 5H 2 O | Пентагидрат сульфата меди (II) | фунгицид, альгицид, гербицид |
| MgSO 4 · 7H 2 O | Гептагидрат сульфата магния (соли Эпсома) | слабительное, соль для купания |
| Na 2 CO 3 · 10H 2 O | декагидрат карбоната натрия (сода стиральная) | добавка для стирки / очиститель |
Упражнения по обзору концепции
Какая связь между атомной массой и формульной массой?
Как индексы используются для определения формулы массы, если в химической формуле присутствует более одного многоатомного иона?
ответы
Формула массы — это сумма атомных масс атомов в формуле.

Нижний индекс в круглых скобках определяет общее количество атомов в формуле.
Ключевые вынос
- Формульные массы ионных соединений можно определить по массам атомов в их формулах.
Упражнения
Какова формула массы ионного соединения, образованного каждой парой ионов?
- Na + и Br —
- мг 2+ и Br —
- Mg 2+ и S 2-
Какова формула массы ионного соединения, образованного каждой парой ионов?
- K + и Cl —
- мг 2+ и класс —
- Mg 2+ и Se 2-
Какова формула массы ионного соединения, образованного каждой парой ионов?
- Na + и N 3-
- Mg 2+ и N 3-
- Al 3+ и S 2-
Какова формула массы ионного соединения, образованного каждой парой ионов?
- Li + и N 3-
- Mg 2+ и P 3-
- Li + и P 3-
Какова формула массы каждого соединения?
- FeBr 3
- FeBr 2
- Au 2 S 3
- Au 2 S
Какова формула массы каждого соединения?
- Cr 2 O 3
- CrO
- PbCl 2
- PbCl 4
Какова формула массы каждого соединения?
- Cr (НЕТ 3 ) 3
- Fe 3 (PO 4 ) 2
- CaCrO 4
- Al (OH) 3
Какова формула массы каждого соединения?
- NH 4 НЕТ 3
- H 2 Cr 2 O 7
- Cu 2 CO 3
- NaHCO 3
Какова формула массы каждого соединения?
- Al (HSO 4 ) 3
- мг (HSO 4 ) 2
Какова формула массы каждого соединения?
- Co (HCO 3 ) 2
- LiHCO 3
ответы
- 102.
 90 u
90 u - 184.11 u
- 56,38 u
- 102.
- 83,00 u
- 100.93 u
- 150,17 u
- 295.50 u
- 215,60 u
- 490,30 и
- 426.10 и
- 238,00 u
- 357,49 u
- 156.
 08 u
08 u - 78.01 и
Формула массы соединения: определение и формула — видео и стенограмма урока
Расчет формулы массы
Давайте рассмотрим несколько примеров того, как рассчитать формулу массы молекул.В нашем первом примере возьмем воду или h3. Чтобы вычислить формулу массы, вам потребуется доступ к периодической таблице элементов.
На этом изображении изображена вода. Красные шары — это атомы водорода, а серый шар — кислород.
Взгляните на массовое число , которое сообщает массу атома в периодической таблице.
Массовое число — это десятичное число, которое находится над символом элемента на этом изображении.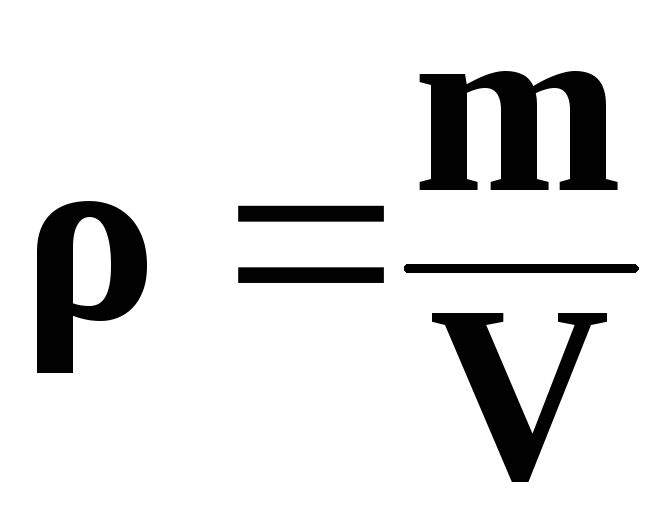 (В зависимости от периодической таблицы массовое число может быть выше или ниже символа.) Теперь, когда вы нашли массовое число, вы готовы вычислить формулу массы
(В зависимости от периодической таблицы массовое число может быть выше или ниже символа.) Теперь, когда вы нашли массовое число, вы готовы вычислить формулу массы
- Шаг 1: Определите массовое число для каждого атома в молекуле и округлите это число до ближайшего целого числа:
- Водород: 1,00794 раундов до 1
- Кислород: 15,9994 выстрелов до 16
- Шаг 2: Определите количество каждого атома в молекуле. Исходя из формулы воды или h3 O, имеется 2 атома водорода и 1 атом кислорода.Нижний индекс или крошечное число, установленное ниже символа элемента, сообщает вам, сколько атомов каждого атома находится в молекуле.
- Шаг 3: При необходимости умножьте. Вам нужно умножить количество атомов на округленную атомную массу:
- Водород: 2 * 1 = 2
- Кислород: 1 * 16 = 16
- Шаг 4: Сложите массу для каждого.
Теперь мы собираемся найти формулу массы для серной кислоты, или h3 SO 4:
- Шаг 1: Определите массовое число для каждого атома в соединении и округлите это число до ближайшего целого числа:
- Водород: 1.
 00794 округляется до 1
00794 округляется до 1 - Сера: 32,065 раундов до 32
- Кислород: 15,9994 выстрелов до 16
- Водород: 1.
- Шаг 2: Определите количество каждого атома в молекуле. Согласно формуле серной кислоты, есть 2 атома водорода, 1 атом серы и 4 атома кислорода.
- Шаг 3: При необходимости умножьте. Вам нужно умножить количество атомов на округленную атомную массу:
- Водород: 2 * 1 = 2
- Сера: 1 * 32 = 32
- Кислород: 4 * 16 = 64
- Шаг 4: Сложите массу для каждого.
Формульная масса серной кислоты 98.
Масс-спектроскопия
Допустим, у вас есть образец загадочной молекулы, и вы хотите выяснить, из каких атомов она состоит. Вы можете использовать масс-спектрометр , который использует устройство, называемое масс-спектрометром, для определения массы и заряда атомов в вашем образце. Это позволяет вам идентифицировать атомы в вашей молекуле. Довольно аккуратно, да?
Давайте посмотрим, как это работает.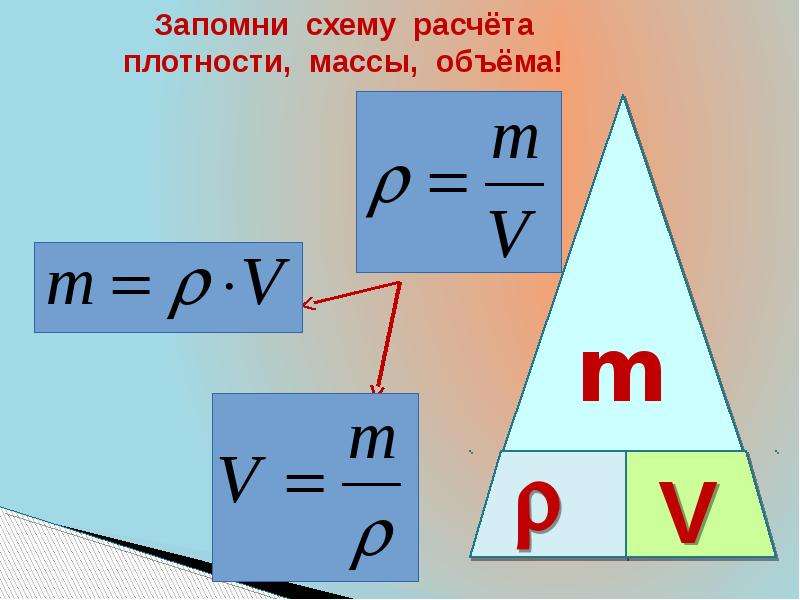 Вы начинаете с того, что вставляете образец в масс-спектрометр, а затем этот образец становится ионизированным .Это просто означает, что атомы, которые находятся в образце, превращаются в атомы с зарядом, или ионов, . В большинстве случаев это достигается отводом электронов от атомов, в результате чего создается катион , или атом с положительным зарядом. Это достигается бомбардировкой образца электронами. Эти электроны способны сбивать окружающие образец электроны, создавая катионы. Вау! Сумасшедший, правда?
Вы начинаете с того, что вставляете образец в масс-спектрометр, а затем этот образец становится ионизированным .Это просто означает, что атомы, которые находятся в образце, превращаются в атомы с зарядом, или ионов, . В большинстве случаев это достигается отводом электронов от атомов, в результате чего создается катион , или атом с положительным зарядом. Это достигается бомбардировкой образца электронами. Эти электроны способны сбивать окружающие образец электроны, создавая катионы. Вау! Сумасшедший, правда?
Затем эти катионы ускоряются, а затем подвергаются воздействию магнитного поля, которое заставляет их отклоняться на своем пути.Это отклонение зависит от размера и заряда катиона. Например, более легкие катионы отклоняются сильнее, и чем больше заряд, тем больше отклонение. Итак, магнитное поле может сортировать катионы по размеру и заряду.
Наконец, прибор определит величину отклонения ионов и запишет это как отношение массы к заряду, которое отображается в виде графика на приборе для масс-спектроскопии.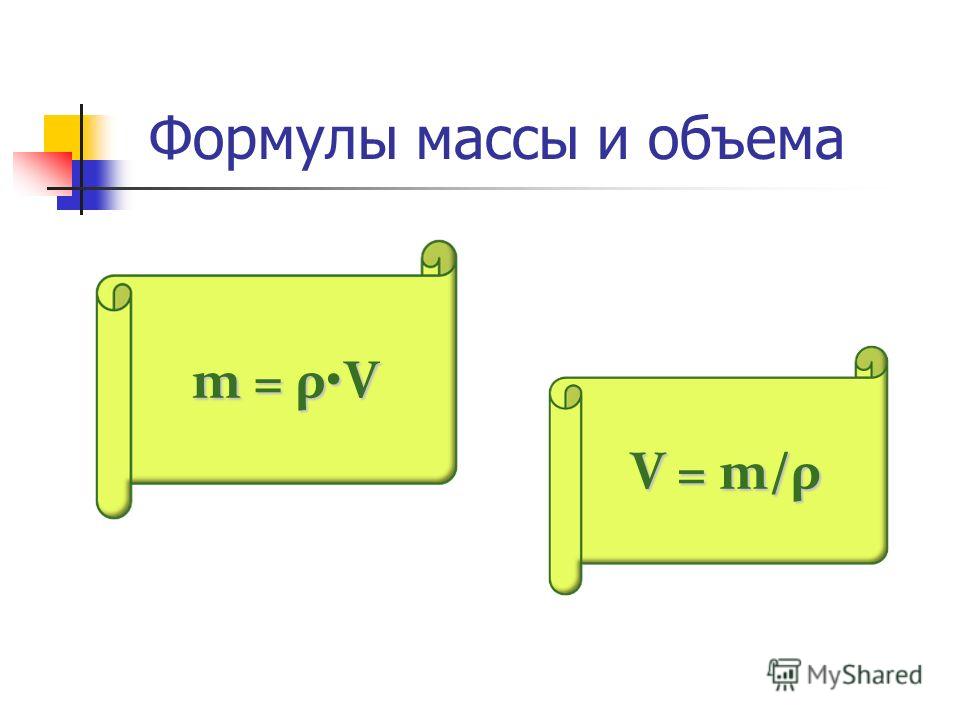 График может выглядеть как набор линий, но на самом деле он показывает вам тип атомов в вашей молекуле.Химики, изучавшие масс-спектроскопию, действительно хорошо определяют, что означают эти линии.
График может выглядеть как набор линий, но на самом деле он показывает вам тип атомов в вашей молекуле.Химики, изучавшие масс-спектроскопию, действительно хорошо определяют, что означают эти линии.
Резюме урока
Давайте на минутку рассмотрим, как вычислить формулу массы соединения:
- Шаг 1: Используйте периодическую таблицу, чтобы определить массовое число для каждого атома в молекуле. Округлите каждое массовое число до ближайшего целого числа.
- Шаг 2: Определите количество каждого атома в молекуле.
- Шаг 3: Умножьте количество атомов на массовое число этого атома.
- Шаг 4: Сложите каждое массовое число (некоторые из которых были умножены), и это ваша формула массы.
Но что, если вы не знаете формулу своей молекулы? Если у ученых есть образец, и они хотят увидеть, какие атомы составляют его, они могут использовать масс-спектрометрию , в которой используется машина, называемая масс-спектрометром, чтобы определить, сколько и каких типов атомов составляет образец.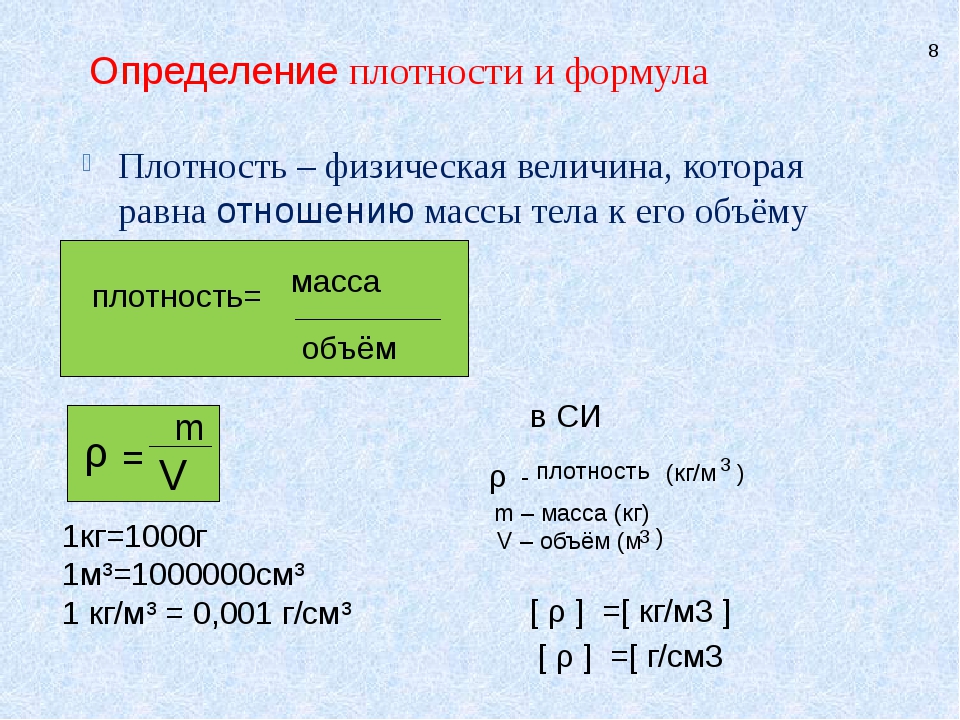 Используя масс-спектрометр, молекула ионизируется, и составляющие ее атомы разделяются по размеру и заряду.Разве наука не удивительна ?!
Используя масс-спектрометр, молекула ионизируется, и составляющие ее атомы разделяются по размеру и заряду.Разве наука не удивительна ?!
Формула массы и молярные концепции соединений
3.8: Формула массы и молярные концепции соединений
Формульная масса ковалентных соединений
Химические формулы представляют собой элементный состав веществ. Для ковалентных соединений формула представляет количество и типы атомов, составляющих одну молекулу вещества; следовательно, формульную массу можно правильно называть молекулярной массой.Молекулярная формула хлороформа (CHCl 3 ), ковалентного соединения, указывает на то, что одна молекула содержит один атом углерода, один атом водорода и три атома хлора. Средняя молекулярная масса молекулы хлороформа равна сумме средних атомных масс этих атомов:
Формула массы ионных соединений
Ионные соединения состоят из дискретных катионов и анионов, которые объединены в соотношениях для получения электрически нейтрального основного вещества. Формульная масса для ионного соединения рассчитывается так же, как формульная масса для ковалентных соединений: путем суммирования средних атомных масс всех атомов в формуле соединения. Однако формула ионного соединения не представляет собой состав отдельной молекулы, поэтому ее нельзя правильно называть «молекулярной массой».
Формульная масса для ионного соединения рассчитывается так же, как формульная масса для ковалентных соединений: путем суммирования средних атомных масс всех атомов в формуле соединения. Однако формула ионного соединения не представляет собой состав отдельной молекулы, поэтому ее нельзя правильно называть «молекулярной массой».
Например, обычная поваренная соль или хлорид натрия (NaCl) — это ионное соединение, состоящее из катионов натрия (Na + ) и анионов хлора (Cl — ), объединенных в соотношении 1: 1.Формула массы для этого соединения вычисляется путем сложения средних атомных масс составляющих его элементов:
При вычислении формулы массы ионного соединения использовались средние массы нейтральных атомов натрия и хлора, а не массы катионов натрия и анионов хлора. Несмотря на то, что катион натрия имеет немного меньшую массу, чем атом натрия (поскольку у него отсутствует электрон), это различие будет компенсировано тем фактом, что хлорид-анион немного массивнее атома хлора (из-за дополнительного электрона). .Более того, масса электрона ничтожно мала по сравнению с массой типичного атома.
.Более того, масса электрона ничтожно мала по сравнению с массой типичного атома.
Массовый процентный состав
Элементный состав соединения определяет его химическую идентичность, а химические формулы являются наиболее кратким способом представления этого элементного состава. Процент по массе каждого элемента в соединении называется массовым процентом этого конкретного элемента. Процентный состав можно рассчитать, разделив массу каждого элемента на общую массу соединения, а затем преобразовав в проценты.
Процентный состав полезен для оценки относительного содержания данного элемента в различных соединениях известных формул. Если молекулярная или эмпирическая формула рассматриваемого соединения известна, процентный состав может быть получен из атомных или молярных масс элементов соединения.
Например, одна молекула азотной кислоты (HNO 3 ) содержит один атом азота весом 14,01 а.е.м., один атом водорода весом 1,008 а.е.м. и три атома кислорода весом (3 × 16. 00 а.е.м.) = 48,00 а.е.м. Таким образом, формульная масса азотной кислоты (14,01 а.е.м. + 1,008 а.е.м. + 48,00 а.е.м.) = 63,02 а.е.м., а ее процентный состав:
00 а.е.м.) = 48,00 а.е.м. Таким образом, формульная масса азотной кислоты (14,01 а.е.м. + 1,008 а.е.м. + 48,00 а.е.м.) = 63,02 а.е.м., а ее процентный состав:
Этот текст адаптирован из Openstax, Chemistry 2e, Section 3.1: Formula Mass and the Mole Concept и Openstax, Chemistry 2e, Section 3.2: Determining Empirical and Molecular Formulas.
Расчет относительных масс по формуле — Расчет массы по формуле и молей — Редакция GCSE Chemistry (Single Science) — Другое
Относительная масса по формуле
Относительные атомные массы можно использовать для нахождения относительной массы по формуле соединения.
Чтобы найти относительную формульную массу (M 0.1:0.1.0.$0.$2.$2.$1″> r ) соединения, необходимо сложить значения относительной атомной массы (значения A r ) для всех атомов в его формуле.
Вот два примера:
- Вопрос
Найдите M r окиси углерода, CO.
- Выявите ответ
Углерод A r равен 3.$0.$3″> 12 и A r кислорода — это 16 .
M r окиси углерода составляет 12 + 16 = 28 .
- Вопрос
Найдите M r оксида натрия, Na 2 О.
- Выявите ответ
- 2aoxckd4kbe.0.0.0.1:0.1.0.$0.$2.$5.3″>
A r натрия составляет 23 и A r кислорода 16 .
M r оксида натрия составляет (23 × 2) + 16 = 62 .
Относительная формульная масса вещества, выраженная в граммах, называется на один моль этого вещества.Таким образом, один моль оксида углерода имеет массу 28 г, а один моль оксида натрия имеет массу 62 г.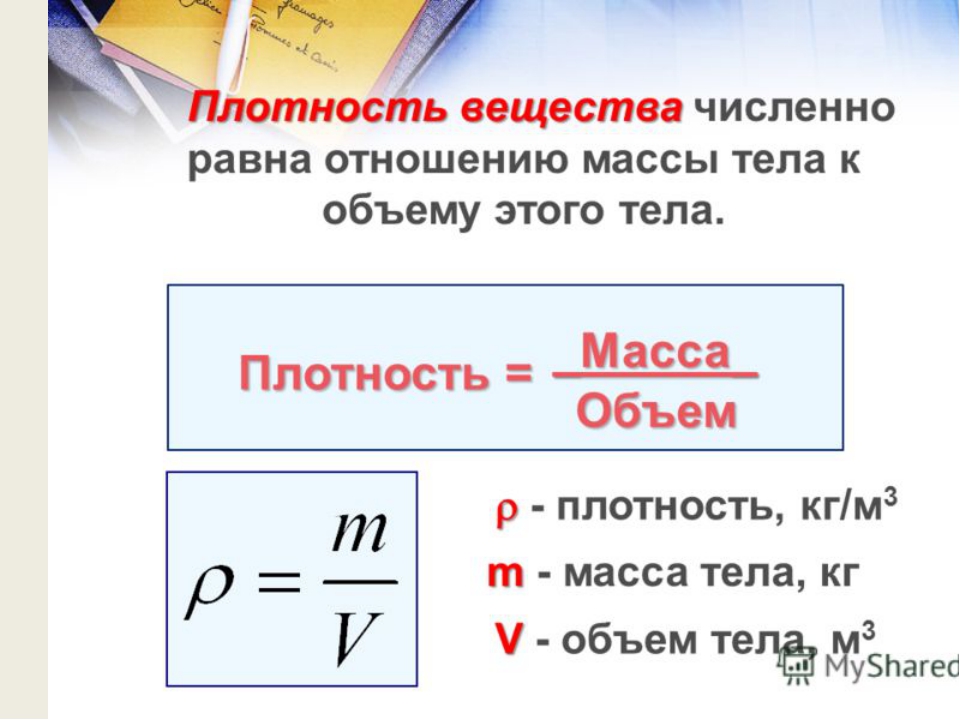
В таблице приведены еще несколько примеров расчета относительной формулы массы с использованием значений относительной атомной массы, приведенных в нижней части страницы.
Формула массы — учебник по химии
В более ранней главе этого текста описывалось развитие атомной единицы массы, концепции средних атомных масс и использование химических формул для представления элементного состава веществ.Эти идеи можно расширить, чтобы вычислить формульную массу вещества, суммируя средние атомные массы всех атомов, представленных в формуле вещества.
Формульная масса ковалентных веществ
Для ковалентных веществ формула представляет количество и типы атомов, составляющих одну молекулу вещества; следовательно, формульную массу можно правильно называть молекулярной массой. Рассмотрим хлороформ (CHCl 3 ), ковалентное соединение, которое когда-то использовалось в качестве хирургического анестетика, а теперь в основном используется в производстве тетрафторэтилена, строительного блока для «антипригарного» полимера, тефлона.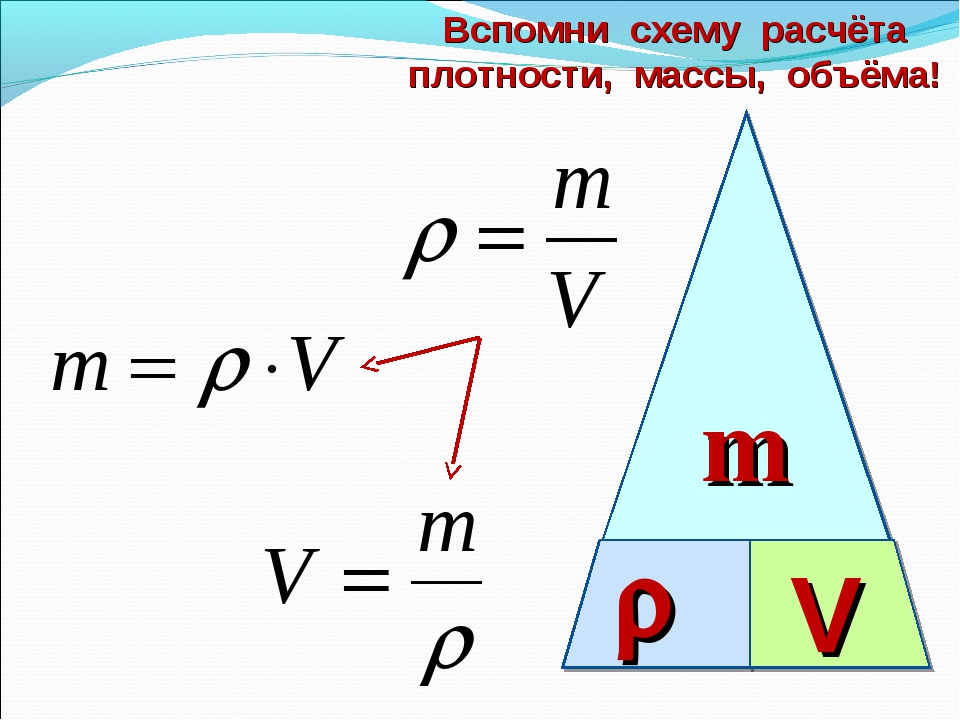 Молекулярная формула хлороформа указывает на то, что одна молекула содержит один атом углерода, один атом водорода и три атома хлора. Таким образом, средняя молекулярная масса молекулы хлороформа равна сумме средних атомных масс этих атомов. [ссылка] описывает расчеты, использованные для определения молекулярной массы хлороформа, которая составляет 119,37 а.е.м.
Молекулярная формула хлороформа указывает на то, что одна молекула содержит один атом углерода, один атом водорода и три атома хлора. Таким образом, средняя молекулярная масса молекулы хлороформа равна сумме средних атомных масс этих атомов. [ссылка] описывает расчеты, использованные для определения молекулярной массы хлороформа, которая составляет 119,37 а.е.м.
Аналогичным образом, молекулярная масса молекулы аспирина, C 9 H 8 O 4 , представляет собой сумму атомных масс девяти атомов углерода, восьми атомов водорода и четырех атомов кислорода, что составляет 180,15 а.е.м. ([ссылка на сайт]).
Средняя масса молекулы аспирина составляет 180,15 а.е.м. Модель показывает молекулярную структуру аспирина, C 9 H 8 O 4 .
Расчет молекулярной массы ковалентного соединения
Ибупрофен, C 13 H 18 O 2 , является ковалентным соединением и активным ингредиентом в нескольких популярных безрецептурных обезболивающих, таких как Адвил и Мотрин.Какова молекулярная масса (а.е.м.) этого соединения?
Раствор
Молекулы этого соединения состоят из 13 атомов углерода, 18 атомов водорода и 2 атомов кислорода. Следуя описанному выше подходу, средняя молекулярная масса этого соединения составляет:
Проверьте свои знания
Ацетаминофен, C 8 H 9 NO 2 , является ковалентным соединением и активным ингредиентом в нескольких популярных безрецептурных обезболивающих, таких как тайленол.Какова молекулярная масса (а.е.м.) этого соединения?
Ответ: 151,16 а.е.м.
Формула массы для ионных соединений
Ионные соединения состоят из дискретных катионов и анионов, объединенных в соотношении, чтобы получить электрически нейтральное объемное вещество. Формульная масса для ионного соединения рассчитывается так же, как формульная масса для ковалентных соединений: путем суммирования средних атомных масс всех атомов в формуле соединения. Однако имейте в виду, что формула ионного соединения не представляет собой состав дискретной молекулы, поэтому ее нельзя правильно называть «молекулярной массой».”
Формульная масса для ионного соединения рассчитывается так же, как формульная масса для ковалентных соединений: путем суммирования средних атомных масс всех атомов в формуле соединения. Однако имейте в виду, что формула ионного соединения не представляет собой состав дискретной молекулы, поэтому ее нельзя правильно называть «молекулярной массой».”
В качестве примера рассмотрим хлорид натрия, NaCl, химическое название обычной поваренной соли. Хлорид натрия — это ионное соединение, состоящее из катионов натрия Na + и анионов хлора Cl — , объединенных в соотношении 1: 1. Формула массы для этого соединения рассчитана как 58,44 а.е.м. (см. [Ссылка]).
Поваренная соль NaCl содержит набор ионов натрия и хлора, объединенных в соотношении 1: 1. Его формульная масса составляет 58,44 а.е.м. Обратите внимание, что в этом расчете использовались средние массы нейтральных атомов натрия и хлора, а не массы катионов натрия и анионов хлора.Такой подход вполне приемлем при вычислении формульной массы ионного соединения. Несмотря на то, что катион натрия имеет немного меньшую массу, чем атом натрия (поскольку у него отсутствует электрон), это различие будет компенсировано тем фактом, что хлорид-анион немного массивнее атома хлора (из-за дополнительного электрона). . Более того, масса электрона ничтожно мала по сравнению с массой типичного атома. Даже при вычислении массы изолированного иона недостающие или дополнительные электроны, как правило, можно игнорировать, поскольку их вклад в общую массу пренебрежимо мал и отражается только в незначительных цифрах, которые будут потеряны при правильном округлении вычисленной массы.Несколько исключений из этого правила — очень легкие ионы, полученные из элементов с точно известными атомными массами.
Несмотря на то, что катион натрия имеет немного меньшую массу, чем атом натрия (поскольку у него отсутствует электрон), это различие будет компенсировано тем фактом, что хлорид-анион немного массивнее атома хлора (из-за дополнительного электрона). . Более того, масса электрона ничтожно мала по сравнению с массой типичного атома. Даже при вычислении массы изолированного иона недостающие или дополнительные электроны, как правило, можно игнорировать, поскольку их вклад в общую массу пренебрежимо мал и отражается только в незначительных цифрах, которые будут потеряны при правильном округлении вычисленной массы.Несколько исключений из этого правила — очень легкие ионы, полученные из элементов с точно известными атомными массами.
Расчет формулы массы для ионного соединения
Сульфат алюминия, Al 2 (SO 4 ) 3 , представляет собой ионное соединение, которое используется в производстве бумаги и в различных процессах очистки воды.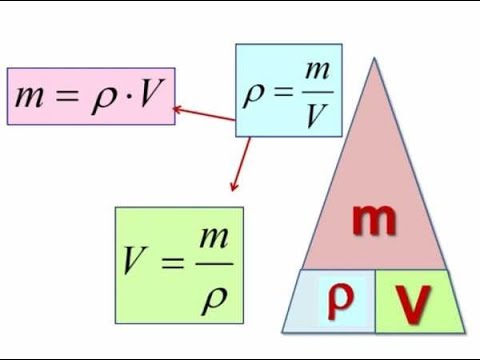 Какова формула массы (а.е.м.) этого соединения?
Какова формула массы (а.е.м.) этого соединения?
Раствор
Формула этого соединения показывает, что оно содержит ионы Al 3+ и SO 4 2- в сочетании в соотношении 2: 3.Для вычисления формулы массы полезно переписать формулу в более простом формате: Al 2 S 3 O 12 . Следуя описанному выше подходу, формула массы для этого соединения рассчитывается следующим образом:
Проверьте свои знания
Фосфат кальция, Ca 3 (PO 4 ) 2 , представляет собой ионное соединение и обычный агент против слеживания, добавляемый в пищевые продукты. Какова формула массы (а.е.м.) фосфата кальция?
Ответ: 310.18 а.е.
Объяснитель урока: Формула массы | Nagwa
В этом пояснителе мы узнаем, как определить массу по формуле и вычислить ее значение для данных молекулярных формул с использованием атомных масс.
Атомы, молекулы и соединения имеют массу. Однако масса отдельного атома
или молекула невероятно мала. Масса атома углерода-12 примерно равна
1,99 × 10 грамм. Чтобы с этим числом было удобнее работать при расчетах,
химики разработали
единая атомная единица массы.Они решили, что атом углерода-12 весит ровно
12 единых атомных единиц массы,
12 шт. Единые атомные единицы массы
(u) похожи на
атомные единицы массы
(аму). Тем не менее
атомная единица массы
(аму)
определяется относительным
к кислороду-16 и больше не используется.
Однако масса отдельного атома
или молекула невероятно мала. Масса атома углерода-12 примерно равна
1,99 × 10 грамм. Чтобы с этим числом было удобнее работать при расчетах,
химики разработали
единая атомная единица массы.Они решили, что атом углерода-12 весит ровно
12 единых атомных единиц массы,
12 шт. Единые атомные единицы массы
(u) похожи на
атомные единицы массы
(аму). Тем не менее
атомная единица массы
(аму)
определяется относительным
к кислороду-16 и больше не используется.
Атомная масса углерода-12 равна
12 u по определению,
но это также соответствует количеству объединенных протонов и нейтронов. Один
атомная единица массы
приблизительно равна массе отдельного нейтрона или единственного
протон.Атомы углерода-12 имеют 6 протонов и 6 нейтронов с массовым числом 12,
в то время как более тяжелый изотоп углерода-13 имеет атомы с 6 протонами и 7 нейтронами
и массовое число 13. Идентификационный номер изотопа относится к массе
количество этого изотопа.
Идентификационный номер изотопа относится к массе
количество этого изотопа.
Определение: атомная масса
Атомная масса — это масса одного атома элемента в единые атомные единицы массы.
Определение: Массовое число
Массовое число — это сумма протонов и нейтронов в ядре атома. элемента.
Пример 1: Определение массы атома фтора в унифицированных единицах атомной массы
Единая единица атомной массы (u) определяется как 112-я часть массы атома углерод-12. Какова масса атома фтора-19 в единые атомные единицы массы?
Ответ
Атом фтора-19 имеет массу
19 унифицированных атомных единиц массы. Каждый нейтрон и протон имеют атомную массу примерно
1 единица атомной массы,
поэтому протоны и нейтроны фтора-19 имеют массу
19 унифицированных атомных единиц массы.Цифра 19 во фторе-19 относится к его атомной массе,
так что правильный ответ
19 шт.
Атомная масса атома углерода-12 равна 12 шт. Если мы посмотрим на некоторые периодические таблицы, мы фактически обнаружим, что атомная масса углерода равна задано как 12.011 ед. Это число представляет собой среднее значение всех атомных масс атомов в образце. углерода. Большинство атомов углерода представляют собой атомы углерода-12, но небольшие количества более тяжелые. атомы углерода-13 и углерода-14 увеличивают среднюю массу выше 12 шт.Поскольку соотношение этих различных изотопов фиксировано, мы можем надежно использовать 12.011 ед. Как среднее масса атома углерода при взгляде на образец углерода. Часто средний атомная масса округлена до целых значений.
Когда атомы объединяются в молекулы или соединения, мы можем вычислить
средняя масса этих молекул или соединений. Мы делаем это, складывая вместе
атомные массы составляющих атомов. Для молекулярного соединения мы называем
это значение «молекулярной массы». ”Для формульной единицы
ионное соединение, мы называем это значение «формулой массы».
”Для формульной единицы
ионное соединение, мы называем это значение «формулой массы».
Иногда мы называем эти значения «относительной молекулярной массой». или «относительная формула массы» с использованием символа «Мистер», хотя и с ключом разница. Относительные значения — это безразмерные отношения, в то время как нереляционные значения используют единые атомные единицы массы.
Определение: относительная атомная масса
Относительная атомная масса — это средняя масса одного атома элемента на шкала, в которой атом углерода-12 имеет массу 12.
Формульная масса или молекулярная масса соединения — это просто сумма
атомные массы составляющих его атомов. Например, молекула воды
содержит два атома водорода и один атом кислорода. Согласно периодическому
таблица, в которой используются целые числа, атомная масса водорода равна
1 u, а атомная
масса кислорода
16 шт.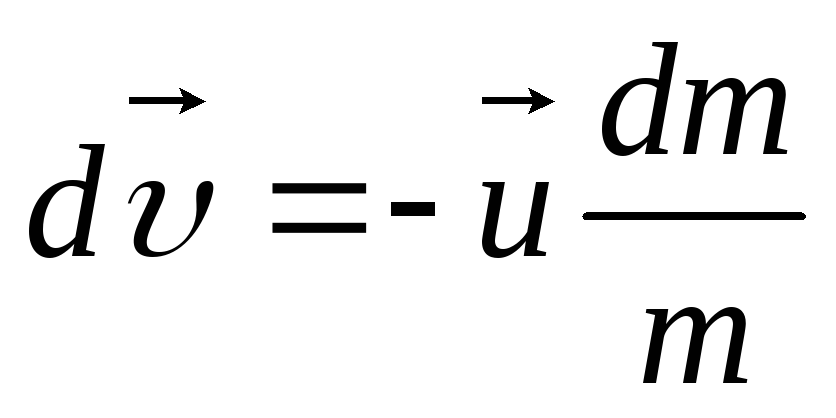 Молекулярный
Массу молекулы воды можно рассчитать по следующему уравнению:
16+ (2 × 1) = 18.uuu
Молекулярный
Массу молекулы воды можно рассчитать по следующему уравнению:
16+ (2 × 1) = 18.uuu
Когда мы объединяем массу одного атома кислорода и двух атомов водорода, мы заканчиваем вверх с 18 u, что молекулярная масса воды. Обратите внимание, что различные таблицы Менделеева круглые атомные массы с разным десятичным знаком. Вы можете увидеть атомную массу водорода указано как 1.01, 1.008 или 1. Округление до другого десятичного знака может немного изменить окончательный ответ расчета.
Определение: молекулярная масса
Молекулярная масса — это средняя масса одной молекулы элемента или соединение в единые атомные единицы массы.
Определение: относительная молекулярная масса
Относительная молекулярная масса — это отношение средней массы одной молекулы элемента или соединения до одной двенадцатой массы атома углерода-12.
Пример 2: Расчет относительной молекулярной массы дифторида ксенона из Его химическая формула
Что такое г-н дифторид ксенона (XeF) 2? [Xe = 131, F = 19]
Ответ
Чтобы найти Mr, или относительную молекулярную
массы XeF2, нам нужно сослаться на
таблица Менделеева, чтобы найти относительные атомные массы составляющих ее атомов.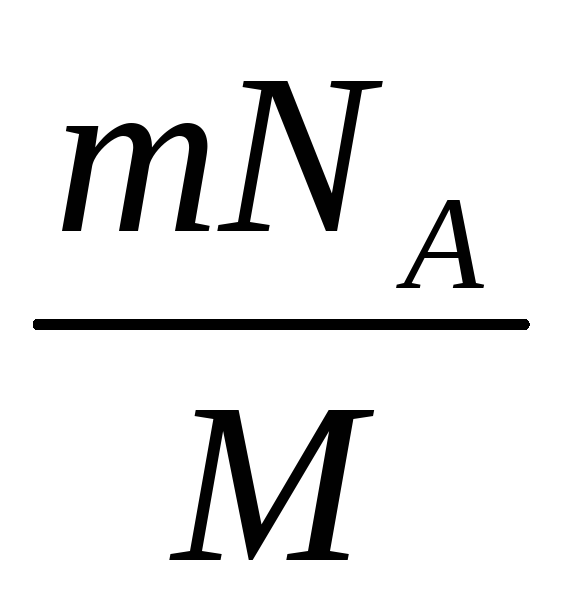 Затем нам нужно добавить относительные атомные массы атомов в
соединение.
Затем нам нужно добавить относительные атомные массы атомов в
соединение.
Относительная атомная масса ксенона равна 131. Относительная атомная масса фтора равно 19. Мы можем использовать эти значения для расчета относительной молекулярной массу соединения по следующему уравнению: Mr = 131 + (2 × 19) = 169.
Поскольку относительная молекулярная масса является безразмерным значением, правильным значением является 169. отвечать.
Процесс расчета массы соединения в основном работает
так же и для ионных соединений, только мы используем название
«Формульная масса» вместо «молекулярная масса».«Например, чтобы рассчитать формульную массу хлорида натрия, нам нужно
знать, что атомная масса натрия равна
23 u, а атомная
масса хлора составляет
35,5 шт. Масса
формульная единица NaCl, содержащая один
атом натрия и один атом хлора можно рассчитать, сложив эти два
ценности вместе:
23 + 35. 5 = 58.5.uuu
5 = 58.5.uuu
Таким образом, 58.5 u равно формула массы хлорида натрия.
Определение: Формула массы
Формула массы — это средняя масса в единые атомные единицы массы формульной единицы ионного соединения.
Пример 3: Расчет относительной формулы массы фторида магния
Что такое относительная формула массы () Г-н фторида магния (MgF) 2? [Mg = 24, F = 19]
Ответ
Чтобы найти относительную формульную массу соединения, нам нужно сложить относительные атомные массы составляющих его атомов. В этой проблеме приведены относительные атомные массы элементов.
Для магния относительная атомная масса равна 24, а для фтора — относительная атомная масса 19.
Формульная единица MgF2 состоит из одного
ион магния и два иона фтора. Мы можем вычислить относительную формулу
масса соответственно:
Mr = 24 + (2 × 19) = 62.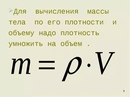
Обратите внимание, что относительная масса по формуле является безразмерной мерой. Таким образом, правильный ответ 62.
Пример 4: Расчет относительной формулы массы 1,3,5-трибромциклогексана на основе его структурной формулы
Отображаемая формула для 1,3,5-трибромциклогексана показана ниже.Какова его относительная формульная масса? Дайте свой ответ ближайшему целому номер. [C = 12, H = 1, Br = 80]
CCHCHHBrCHCBrCHHHHBrH
Ответ
Чтобы вычислить относительную формульную массу этого соединения, нам необходимо определить химическая формула соединения. Затем нам нужно вычислить относительную формула массы путем сложения относительных атомных масс атомов в соединение.
Во-первых, нам нужно найти химическую формулу соединения.Мы можем
Определите это с помощью визуального подсчета. Есть кольцо из шести атомов углерода
в центре девять атомов водорода снаружи и еще три
атомы брома снаружи. Химическая формула этого соединения:
CHBr693.
Химическая формула этого соединения:
CHBr693.
Из периодической таблицы мы можем найти относительные атомные массы этих три элемента. Округленное до ближайшего целого числа относительное атомное масса углерода 12, водорода 1, брома 80 лет.
Чтобы вычислить относительную массу по формуле, мы можем сложить относительные атомные массы отдельных атомов в соединении путем умножения каждой относительной атомной массы на количество атомов этого типа в сложный: (6 × 12) + (9 × 1) + (3 × 80) = 72 + 9 + 240 = 321.
Поскольку относительная масса по формуле является безразмерной величиной, правильный ответ: 321.
Давайте подведем итог тому, что мы узнали в этом объяснении.
Ключевые точки
- Единая атомная единица массы составляет 112-ю часть массы атома углерода-12.
- Единая единица атомной массы
примерно соответствует массе протона или нейтрона.

- Атомная масса элемента — это средняя масса атома в образце. этого элемента.
- Молекулярная масса молекулы — это объединенная атомная масса ее составляющие атомы.
- Формульная масса ионного соединения — это объединенная атомная масса атомы, составляющие одну формульную единицу соединения.
- Относительная молекулярная масса и относительная формульная масса имеют те же значения, что и неродственные молекулярные и формульные массы, только относительные версии безразмерны вместо использования единые атомные единицы массы.
- Обозначение относительной молекулярной массы или относительной формулы массы: Г-н




 Обычно в этом случае ученики применяют закон Бойля-Мариотта от безысходности.
Обычно в этом случае ученики применяют закон Бойля-Мариотта от безысходности.

 85 u
85 u 00 из
00 из
 90 u
90 u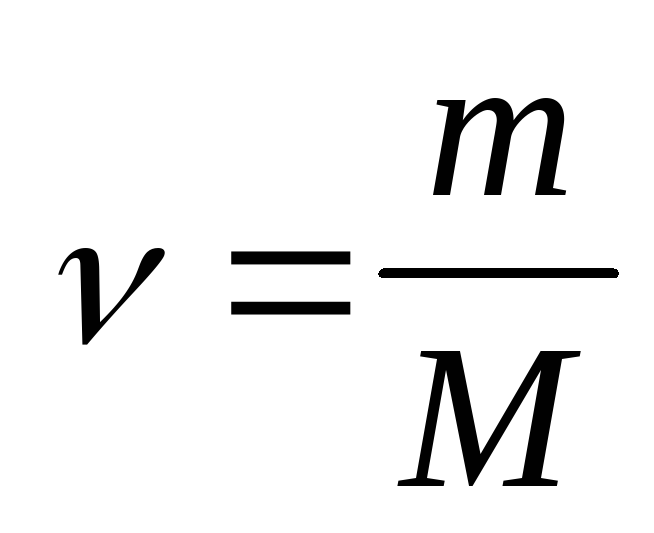 08 u
08 u 00794 округляется до 1
00794 округляется до 1