Маркеры обмена веществ позволяют определить, не слишком ли резко вы взяли старт
Олимпиада, приближение весны или скидки на клубные карты — есть много факторов, побуждающих нас вступить на путь оздоровления. Тут только надо убедиться, что эта дорога, выложенная, без сомнения, добрыми намерениями, ведет именно туда – к здоровью.
Всем нам свойственно бросаться в новое дело очертя голову. Вы чувствуете себя спортсменом и полны решимости перепробовать все тренажеры в спортзале – отлично, а организм об этом знает? И даже если на первые занятия взяли опытного тренера (что разумно), он не всегда может сделать из ваших слов правильные выводы.
Скажем, после тренировки все болит — это хорошо или плохо? Это смотря как болит, может, это показатель хорошей тренировки, а может, человек на пути к инфаркту.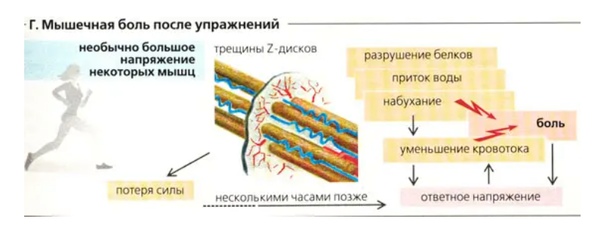
Если у вас появились новые нагрузки, значит, клеткам нужно больше питания, больше кислорода, быстрее надо удалять отходы, и организм честно старается все это обеспечить, а значит, меняется что? Состав крови.
Самое интересное, что эти показатели работают для всех, кто начал регулярно заниматься спортом, не важно, включили вас в олимпийскую сборную или вы неделю назад не могли без одышки донести тарелку до раковины. Казалось бы, как же так, ведь показатели крови должны быть такие разные?! Признаемся честно: они у всех людей разные. За редким исключением значение имеет изменение данных конкретного человека во времени.
Пять способов оценить адекватность нагрузки
Молочная кислота (лактат) — «отход производства», знакомый всем без исключения. Стоит позаниматься чуть больше обычной нормы, и мышцы сводит ноющая боль. Откуда она берется? Когда мышцы работают больше обычного, им нужно больше энергии.
При увеличении нагрузки кислорода не хватает и глюкоза окисляется не до углекислого газа, а только до молочной кислоты. А потом откладывается в мышцах и причиняет дискомфорт, пока организм ее тоже потихоньку не усвоит. При регулярных тренировках поступление кислорода в организм растет и уровень лактата снижается. Снова увеличили нагрузку – содержание лактата снова растет, пока организм не адаптируется.
Слабо тренированным людям бывает трудно отличить эту боль от дискомфорта в растянутых мышцах. А вот спортсмены часто воспринимают эти ощущения как приятные, особенно после перерыва в тренировках – им организм так говорит: «Молодец, отлично потренировался».
Мочевина – очень простое и крайне интересное вещество. Повышение уровня мочевины в крови говорит о том, что организм под действием стресса утилизирует собственные белки, не в силах ждать, когда ему поставят те самые запасы глюкозы. Обмен веществ после увеличения нагрузки похож на неопытного спортсмена, который, вернувшись из спортзала, набрасывается на холодильник, сметая с полок все без разбора. При равномерной нагрузке организм разбирает, что к чему, налаживает поставки дополнительной глюкозы, и уровень мочевины снижается.
Повышение уровня мочевины в крови говорит о том, что организм под действием стресса утилизирует собственные белки, не в силах ждать, когда ему поставят те самые запасы глюкозы. Обмен веществ после увеличения нагрузки похож на неопытного спортсмена, который, вернувшись из спортзала, набрасывается на холодильник, сметая с полок все без разбора. При равномерной нагрузке организм разбирает, что к чему, налаживает поставки дополнительной глюкозы, и уровень мочевины снижается.
Креатинкиназа. Простые сигналы закончились. Итак, увеличение нагрузки – стресс для организма, ему не хватает энергии, и он не знает, где ее взять. Кто приходит на помощь в этот момент? Креатинкиназа – фермент — «антикризисный управляющий», он работает в скелетных мышцах, сердце, легких, мозге, то есть во всех ключевых точках, и отвечает за энергоснабжение клеток, пока организм перестраивается под новые условия. Неудивительно, что высокий уровень этого белка сигнализирует о чрезмерных нагрузках, инфаркте и травмах. При равномерных нагрузках организм стабилизирует обмен веществ, и уровень фермента падает.
При равномерных нагрузках организм стабилизирует обмен веществ, и уровень фермента падает.
Миоглобин – родной брат гемоглобина, только он переносит кислород не в крови, а в мышцах. Забирает кислород у гемоглобина и отдает его клеткам для получения энергии, в которой они так нуждаются. Миоглобин – то самое редкое исключение, чей уровень в крови не уникален для каждого человека. Потому что в норме количество его в крови минимальное, его вообще не должно быть. Более того, в крови он токсичен для организма.
Повышенное содержание миоглобина в крови кричит о повреждении мышц, а значит, стоит внимательно отнестись к своим нагрузкам.
Тропонин I – если миоглобин сигналит о повреждении любых мышц, то тропонин I, специфический маркер повреждения сердечной мышцы, предупреждает, что дело серьезное. Высокий уровень тропонина — всегда негативный признак и веский повод обратиться к врачу. Человек при этом может не ощущать никаких тревожных симптомов, и даже опытный тренер не найдет повода для беспокойства, но если уровень тропонина I высок, знайте: вы очень круто взяли. Он как предупреждающий знак на дороге – требует снизить скорость, потому что впереди опасность.
Он как предупреждающий знак на дороге – требует снизить скорость, потому что впереди опасность.
Есть, как нетрудно догадаться, две основные группы риска: спортсмены с серьезными амбициями, которые испытывают высокую кардионагрузку, и любители спорта на диване, внезапно решившие взять с места в карьер, не посоветовавшись с организмом.
Татьяна Мельникова, терапевт, врач-консультант Независимой лаборатории ИНВИТРО, отмечает: «Главное в спортивных тренировках – равномерные нагрузки, адекватные состоянию вашего организма. Человек может выдержать очень высокий темп тренировок, главное — повышать его постепенно. Увеличили нагрузку – задержитесь на ней, дайте организму адаптировать метаболизм, проконтролируйте свое состояние и только после этого двигайтесь дальше.
Ознакомиться с другими новостями, материалами и статистикой вы можете на странице летних видов спорта.
Что такое выносливость и как ее тренировать
Каждого спортсмена-любителя, занимающегося такими видами спорта, как: горные и беговые лыжи, бег, сноубординг, спортивный туризм, альпинизм, скалолазание интересует такая категория физической формы, как «выносливость». Многим хочется быть «выносливыми» и легко справляться с задачами физического плана, достигая целей в спорте.
В этой статье мы подробно разберем что это за категория – «выносливость», какие ее особенности, какие процессы происходят в организме человека и как ими управлять?
В статье будет некоторое количество не очень знакомых для любителей терминов из мира биологии, физиологии, но без них крайне сложно обойтись, чтобы объяснить – что с нами происходит в процессе нагрузки и еще сложнее понять – что делать, чтобы тренировать эту самую «выносливость»?
Мы упростили объяснение всех процессов до максимума, дав ссылки на специальные разделы в Wikipedia, по которым интересующиеся могут пройти и разобраться, при желании, более детально.
После прочтения у вас сложится целостная картина и мы уверены, что не так все и сложно, просто прочтите статью до конца.
Для базового планирования тренировок достаточно разобраться в двух различных терминах, которые описывают физическую форму спортсмена:
Сила и выносливость. Это — не одно и то же.
Сила — это способность человека совершить разовое моментальное максимальное усилие.
Выносливость — это способность повторять это максимальное усилие на протяжении длительного времени.
Сила без выносливости не имеет никакого смысла и выносливость без силы также бесполезна.
Давайте разберемся более подробно – что же такое выносливость?
Выносливость – это способность мышц совершать работу. Эта способность зависит от интенсивности снабжения клеток мышц питательными веществами которая, в свою очередь, зависит от способности организма эти вещества вырабатывать. Вырабатываются они разными способами, в зависимости от интенсивности и длительности нагрузки.
С развитием силы все достаточно просто. Есть комплексы упражнений на разные группы мышц — на консультации с профессиональным тренером можно подобрать базовую нагрузку и делать определенное количество повторений с увеличением нагрузки, после чего надо отслеживать динамику и корректировать состав упражнений и нагрузку, если динамика результатов не удовлетворяет. Т.е., принцип простой – больше и чаще.
С развитием выносливости тоже все не сложно, если есть понимание внутренних процессов питания клеток и понимание режимов тренировок этих процессов. Давайте с этим и разберемся.
Кстати!
Если вы – спортсмен, активно и постоянно занимающийся спортом, если вы – любитель, регулярно участвующий в соревнованиях, то для вас у нас есть специальные дисконтные карты, которые позволяют получать существенные скидки на необходимый вам инвентарь, обувь или одежду.
Как и чем питаются мышцы?
Мышцы, если коротко, питаются в процессе выполнения работы одним единственным веществом АТФ — Аденозинтрифосфатом или Аденозинтрифосфорной кислотой.
В наших клетках всегда есть запас АТФ, который постоянно расходуется и постоянно пополняется. Этот запас нам дарован природой, механизм сформировался много миллионов лет назад, он существует для обеспечения обыденной функциональности человека и так же связан с нашей способностью выживать во внезапных экстремальных условиях. Даже без физической нагрузки наши мышцы постоянно работают и потребляют АТФ: сердце бьется, руки ноги двигаются — элементарное движение пальцем – это работа мышц и потребление клетками АТФ. Запас АТФ рассчитан на средние показатели эффективности человека- на тот ритм жизни, который свойственен конкретному человеку – у профессиональных спортсменов – он один, у «любителей диванов» – другой.
Если вы ведете малоактивный образ жизни, то и запас АТФ в клетках будет соответственно небольшим, но достаточным для текущего ритма жизни. Как только мы даем организму спортивную нагрузку, мышцам нужно больше АТФ и запас, который есть в клетках, быстро кончается. Обычно, средне статистически, запаса АТФ хватает на 3-5 секунд интенсивной нагрузки.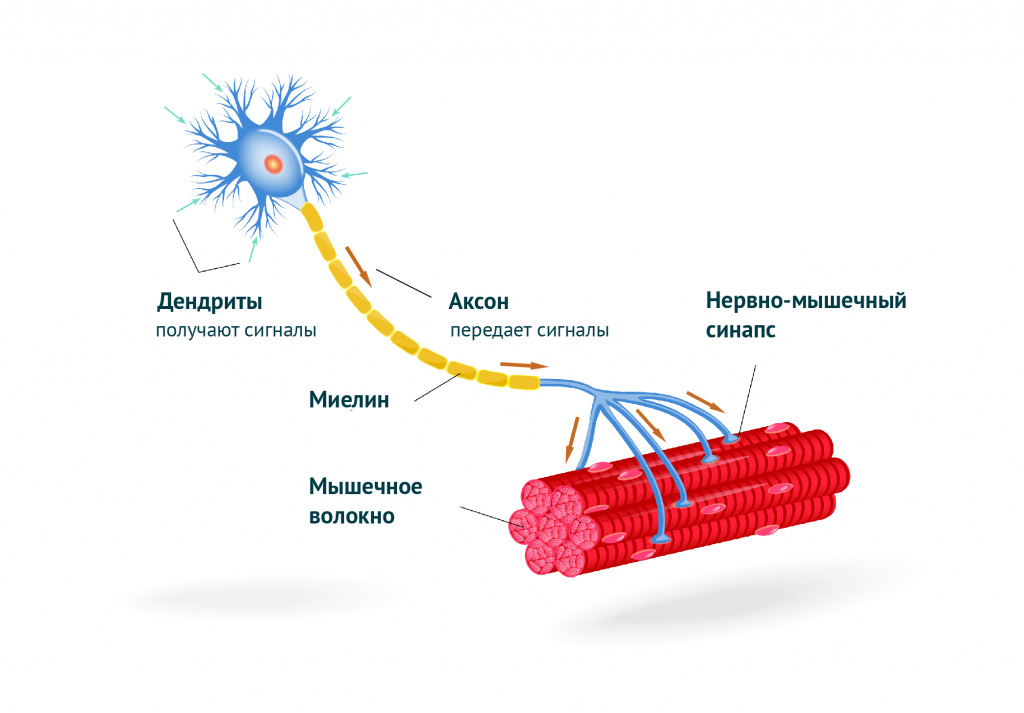 Если вы резко встанете с дивана и попробуете пробежать в даль, то запаса АТФ в ваших клетках хватит на 20-25 метров бега – те самые 5 секунд, максимум.
Если вы резко встанете с дивана и попробуете пробежать в даль, то запаса АТФ в ваших клетках хватит на 20-25 метров бега – те самые 5 секунд, максимум.
Далее, если движение продолжается, то организму надо где-то брать для питания мышц АТФ, и он его вырабатывает при помощи креатинфосфата, который постоянно находится в мышечных и нервных тканях. Этого источника энергии хватает еще на несколько секунд.
Итого, прямо сейчас в ваших клетках есть энергии на10-12 секунд очень интенсивного движения.
После того как это топливо для движения израсходовано, в организме включается самый мощный источник получения питания для клеток, гликолиз – процесс окисления глюкозы, содержащейся в вашем организме.
Первые 2-5 минут интенсивной нагрузки гликолиз происходит в анаэробном режиме, без активного использования кислорода, но с активным выделением молочной кислоты (лактата), концентрация которой в организме резко вырастает в этот период активного движения.
После 5 минут активного движения в энергообеспечение клеток включаются жирные кислоты, начинается аэробный режим обеспечения питания клеток с большим потреблением кислорода. Организм начинает восстанавливать запасы АТФ, креатинфосфата и растворять молочную кислоту.
Организм начинает восстанавливать запасы АТФ, креатинфосфата и растворять молочную кислоту.
Несложно догадаться, что для улучшения физических возможностей нам надо развивать все составляющие процесса питания клеток. Только так можно существенно улучшить свою физическую форму и прокачать выносливость.
Что тренировать?
Как видно, есть четыре основных принципа питания клеток на разной стадии движения:
- Остаточный АТФ
- Креатинфосфат
- Анаэробный гликолиз
- Аэробный гликолиз и жирные кислоты.
Чтобы улучшить вашу выносливость (напомним, что это — способность повторять это максимальное усилие на протяжении длительного времени), необходимо тренировать каждую из этих составляющих. Однообразные тренировки, по развитию одной составляющей не имеют никакого смысла. Не бывает так, что работает один способ питания клеток. В циклических видах спорта нет доминирующего способа питания — работают все, потому что нагрузка не равномерная, а в большинстве своем рваная и импульсная. Даже если вы бежите марафон по идеальному асфалдьту, то вы сначала стоите на месте и ваш баланс траты АТФ = 0, потом начинается двигаться и тратите только остаточный АТФ, разгоняетесь и потратив весь запас АТФ подключаете креатинфосфат для увеличения мощности работы мышц – для выхода на планируемый темп бега, вы вбегаете в крутой подъем и работать надо сильнее – вы сбиваете дыхание и уводите организм в жесткий анаэроб, затем трасса выполаживается и вы опять возвращаетесь в аэробный режим…И так – постоянно, потому что не существует идеально ровных трасс.
Даже если вы бежите марафон по идеальному асфалдьту, то вы сначала стоите на месте и ваш баланс траты АТФ = 0, потом начинается двигаться и тратите только остаточный АТФ, разгоняетесь и потратив весь запас АТФ подключаете креатинфосфат для увеличения мощности работы мышц – для выхода на планируемый темп бега, вы вбегаете в крутой подъем и работать надо сильнее – вы сбиваете дыхание и уводите организм в жесткий анаэроб, затем трасса выполаживается и вы опять возвращаетесь в аэробный режим…И так – постоянно, потому что не существует идеально ровных трасс.
Работают все принципы питания и тренировать надо все.
Хорошо подготовить мышцы к нагрузке, быстро восстановить их после напряженной тренировки или соревнований помогут специальные кремы OXD. Про то – какие они бывают и как их применять, у нас есть специальная статья.
Как тренировать?
Тренировать надо каждый принцип по отдельности, с пониманием специфики тренировки.
Остаточный АТФ
Точнее его количество в клетках — можно увеличить добавлением регулярной физической активности в жизненный ритм. Чем больше и чаще человек двигается, тем больше запаса АТФ в клетках. Просто больше и чаще давайте себе разнообразные, пусть и не самые тяжелые нагрузки. Организм поймет, что нагрузки – это постоянно и будет также постоянно иметь «запас топлива» на их обеспечение.
Аэробный кислородный режим
Тренируется длительными (60-90 минут) и слабыми по интенсивности тренировками. Небыстрый, но продолжительный бег, прогулки на велосипеде, пешие прогулки. Такие тренировки хорошо восстанавливают организм и очищают его от избыточной концентрации лактата, который образуется в результате анаэробных тренировок.
Анаэробный режим
Тренируется повторением коротких по продолжительности и нагруженных нагрузок с восстановлением между повторениями для того, чтобы при следующем повторении включился именно анаэробный режим питания клеток, а не аэробный.
Лучшая форма тренировки анаэробного режима — классические «интервалы», фартлек, бег по пересеченной местности с разным темпом.
Между анаэробными тренировками (особенно у любителей) следует делать перерывы, достаточные для восстановления и утилизации накопленного лактата в мышцах. Обычно, достаточно паузы в два-три дня для восстановления, продолжительность восстановления зависит от состояния человека и формата восстановления — аэробные тренировки помогают восстановиться.
Кстати! Когда ваш знакомый или близкий человек только начинает заниматься спортом, то поддержать его морально очень важно. Но важно также это сделать и материально – подарив ему какой-то нужный для него аксессуар, например – удобную бандану BUFF.
Если вы не уверены в правильности своего выбора по цвету, размеру, функциональности, то в этом случае лучше всего купить и подарить специальные сертификаты.
Начинающий спортсмен будет вам крайне благодарен!
Как определять нагрузку?
Все несложно, но для тренировок того или иного режима питания нужна определенная нагрузка. Питание клеток – это реакция организма на нагрузку, следовательно, выбирать надо те нагрузки, на которые организм реагирует включением нужного нам режима питания. То есть, важна не нагрузка, не скорость бега, не вес штанги, а реакция организма на нагрузку. Что может помочь нам определить реакцию организма на нагрузку?
Питание клеток – это реакция организма на нагрузку, следовательно, выбирать надо те нагрузки, на которые организм реагирует включением нужного нам режима питания. То есть, важна не нагрузка, не скорость бега, не вес штанги, а реакция организма на нагрузку. Что может помочь нам определить реакцию организма на нагрузку?
Пульс
Именно частота сокращений сердечной мышцы отлично информирует нас о том, какой режим питания работает в организме. Именно по пульсу достаточно точно можно корректировать нагрузку для тренировок того или иного режима питания клеток. Измерять пульс в процессе тренировок позволяют специальные спортивные часы с пульсометром.
Точно оперативно измерить ваш пульс как во время тренировок, так и во время отдыха (и даже во время сна) вам помогут специальные спортивные часы.
Все спортивные часы в «Канте»
А в этой статье можно прочитать про спортивные часы Suunto – какие в них есть важные «фишки» и необходимые функции.
Рекомендуемые модели:
Эффективно тренировать разные режимы питания клеток без контроля пульса невозможно. Именно поэтому пульсометрами пользуются все спортсмены и любители, которым важна эффективность тренировок.
Изменение физиологических реакций на разные нагрузки и на разный режим питания клеток
- При использовании запаса АТФ в организме никакие процессы не включаются и, ни дыхание, ни пульс человека резко не меняются.
- При использовании креатинфосфата все процессы обогащения происходят непосредственно в клетке с выделением углекислого газа — дыхание учащается для освобождения организма от углекислого газа, пульс учащается незначительно, но экспоненциально, для вывода углекислого газа из клеток через кровь в легкие.
- При включении гликолиза пульс серьезно учащается для вывода лактата и углекислого газа из клеток.

- При включении питания за счет жирных кислот в организме запускаются обменные процессы, в результате чего дыхание усиливается для обеспечения обменных процессов кислородом и для вывода большого количества углекислого газа — повышается частота сердечных сокращений (пульс) для доставки кислорода из легких к мышцам и вывода углекислого газа, выделяющегося при расщеплении жира.
Если вы хотите качественно тренироваться и прогрессировать, то мы рекомендуем обратиться к нашим партнерам – компаниям, отлично зарекомендовавшим себя в организации тренинговых процессов:
При нагрузке более пяти минут в организме полноценно запускается и работает кислородный режим обогащения клеток и если ритм нагрузки не увеличивается и мышцам достаточно вырабатываемого таким образом АТФ, то пульс снижается и нормализуется.
Если же, в таком состоянии, увеличить нагрузку, то потребление АТФ усиливается и к уже работающему кислородному обогащению добавляются все те же процессы, которые работают в начале физической активности — опять начинает расходоваться уже восстановленный запас АТФ, включается использование креатинфосфата и запускается аэробный гликолиз — в крови снова повышается концентрация лактата (молочной кислоты), а пульс и дыхание учащаются.
Если нагрузка не снижается и кислородного обогащения недостаточно, то работают одновременно и кислородный, и анаэробный процессы обогащения. В таком случае пульс серьезно растет и дыхание существенно учащается.
Порог пульса, при достижении которого кислородного обогащения не хватает для работы и даже при равномерной нагрузке включается анаэробный гликолиз, называется порогом анаэробного обмена (ПАНО). Он у каждого человека свой и определяется опытным путем измерения пульса с изменением нагрузки. Именно по ПАНО и можно строить план тренировок развития разных режимов обогащения мышц, потому как именно ПАНО является границей режимов кислородного и анаэробного обогащения клеток.
Существуют пять зон нагрузки в зависимости от пульса, соответствующему порогу анаэробного обогащения клеток (ПАНО):
До достижения ПАНО — работает кислородное обогащение, выше ПАНО — и кислородное, и анаэробное.
Теперь понимая, как устроены процессы от которых зависит выносливость, можно детально разобрать принципы построения конкретных тренировочных планов. Эта тема рассматривается нами в отдельной, специальной статье – «Как правильно составить план беговых тренировок?».
Эта тема рассматривается нами в отдельной, специальной статье – «Как правильно составить план беговых тренировок?».
Без правильно подобранного снаряжения, одежды и обуви точно нельзя обойтись, если вы серьезно хотите заниматься спортом и прогрессировать. Здесь также важен элемент осознанности, тем более, если у вас серьезные цели – полумарафон, марафон, длинные трейловые забеги.
Разобраться в изобилии предложений вам помогут наши профессиональные продавцы в магазинах «Канта», а также – специальные, подробные статьи:
Полезные ссылки, которые вас приведут прямо специальные разделы на нашем сайте, где вы можете выбрать для себя все необходимое для бега, что поможет вам качественно выполнить любой тренировочный план:
При покупке через Интернет у нас возможны различные системы оплаты:
- наличными курьеру
- банковским переводом
- по карте
- с помощью рассрочки
- с помощью подарочного сертификата
Все подробности по разным формам оплаты
Новинки в «Канте»:
🧬 Почему болит голова после тренировки
Этот неприятный симптом может возникать как после кардиозанятий, так и после силовых тренировок. А иногда — и после уроков йоги. Почему? И что делать, если после тренировки болит голова?
А иногда — и после уроков йоги. Почему? И что делать, если после тренировки болит голова?
Виды головной боли после тренировок
Врачи выделяют два вида головных болей после тренировки.
1. Боли, которые возникают как реакция на интенсивную нагрузку
Их называют первичными болями, и появляться они могут у абсолютно здоровых людей.
«Первичные головные боли обычно безобидные, не связанны с заболеваниями, и с ними можно справиться, просто приняв лекарство или изменив интенсивность нагрузки», — комментирует Федор Михневич, семейный врач GMS Clinic.
Такая головная боль зачастую ощущается как пульсирующая, возникает во время или после усиленной тренировки. Обычно это двусторонняя боль — например, ощущение, что у вас «стучит» в висках после интенсивной пробежки.
«Чаще всего этот симптом возникает от высокоинтенсивных в виде бега, кардио или плиометрических упражнений (это упражнения, позволяющие одновременно повысить мышечную силу, общую выносливость и сжечь максимальное количество жира)», — говорит Григорий Жежа, врач ЛФК и спортивной медицины клиники «СпортМедика».

2. Боли, которые связаны с хроническими заболеваниями
Их называют вторичными.
«Они обусловлены проблемами со здоровьем: связанными с головным мозгом (кровотечением, опухолью), или внемозговыми (например, заболеваниями артерий сердца). Вторичные головные боли могут потребовать экстренной медицинской помощи», — отмечает Федор Михневич.
По ощущениям вторичные головные боли бывают похожи на первичные, но нередко сопровождаются и другими симптомами: рвотой, потерей сознания, двоением в глазах, чрезмерным напряжением шейных мышц сзади.
«Первичные головные боли могут возникнуть уже через пять минут от начала тренировки, но длятся не особенно долго. Вторичные — будут мучить вас минимум день, а иногда и несколько дней после нагрузки», — комментирует Федор Михневич.
«Причины, по которым развивается головная боль после физических тренировок, могут различными, — объясняет Константин Махинов, врач-невролог Европейского медицинского центра (ЕМС).
— Это могут быть как жизнеугрожающие состояния (субарахноидальное кровоизлияние), так и приступы уже имеющихся болевых синдромов (мигрень). Чаще, как правило, развиваются приступы доброкачественной боли, однако терять бдительность тоже не стоит».
Почему после тренировки болит голова
Первичная головная боль после тренировки может возникать по многим причинам. Рассмотрим основные.
«Возможных причин несколько: повышение давления в организме от получения нагрузки (может возникать в совокупности с реакцией на повышение атмосферного давления), сужение сосудов (вместе с сосудами головного мозга), различные ограничения подвижности позвонков шейного отдела (сдавливание каналов и пучков нервной системы). С самим типом нагрузки головные боли связаны мало, так как возникать могут на разных тренировках — кардио, силовых, даже функциональных», — говорит Руслан Панов, эксперт-методист сети X-Fit в России.

Перенапряжение мышц плечевого пояса
Это наиболее частая причина.
«Во время силовых нагрузок в указанной области может возникнуть мышечный спазм, который проявляется в виде дискомфорта, боли, ограничения движений в шейном отделе позвоночника, — объясняет Юлия Хазиме, врач-невролог отделения МЕДСИ Premium Клинико-диагностического центра МЕДСИ на Красной Пресне. — Распространяясь от спазмированных мышц шеи, боль может отдаваться умеренной ноющей головной болью, которая обычно сохраняется некоторое время после нагрузки. При систематическом перенапряжении мышц в области плечевого пояса и шеи такие приступы могут повторяться».
«Причиной перенапряжения может стать неправильная техника выполнения упражнений. Скажем, мышцы шеи могут страдать при беге. При чрезмерных нагрузках может появиться мышечный спазм, в результате которого после пробежки вы почувствуете боль в затылке», — добавляет Федор Михневич.

Общее физическое переутомление
Если вы в целом устали на занятии (или уже пришли в спортзал в таком состоянии), будьте готовы к головной боли после тренировки.
«Чаще всего по такому сценарию развивается мигренозная головная боль у предрасположенных к ней людей, — отмечает Юлия Хазиме. — Иногда человек, игнорируя легкое общее недомогание и не замечая симптомов приближающейся мигрени, идет на интенсивную тренировку и к ее концу получает полноценный приступ. Головная боль, усиливающаяся при физической нагрузке, является одним из диагностических критериев мигренозной головной боли».
Насморк
Любая заложенность носа может привести к головной боли после занятия фитнесом. Чем бы ни был вызван насморк — ОРВИ или сезонной аллергией — интенсивных нагрузок нужно избегать. Ну или быть готовым к головной боли по завершении тренировки!
Заболевания глаз
«При глаукоме (повышение внутриглазного давления) как в процессе, так и после тренировки может развиться интенсивный приступ головной боли.
Чаще всего такая боль локализуется в лобной области или непосредственно в глазах», — говорит Юлия Хазиме.
Гипогликемия
Тренируетесь натощак? Это обстоятельство тоже может вызывать головную боль.
«Интенсивная физическая нагрузка ведет к гипогликемии (снижению уровня сахара в крови), что сопровождается общей слабостью, иногда тошнотой и головокружением, а также ноющей головной болью после тренировки», — отмечает Юлия Хазиме.
Неправильная техника дыхания
Во время тренировок важно не задерживать дыхание, а основное усилие совершать на выдохе.
«Нарушая эти правила, можно провоцировать головную боль, — объясняет Федор Михневич. — Ведь если в мозг не поступает достаточное количество кислорода, повышается кровяное давление».
Другие причины
Вызвать головную боль во время или после занятия также может обезвоживание или перегрев — если, например, вы тренируетесь на жаре или в душном помещении.
«Занятия высоко над уровнем моря также могут стать причиной головных болей», — добавляет Федор Михневич.
«Также к факторам риска можно отнести наличие в анамнезе первичной головной боли, артериальной гипертензии, травмы во время тренировок, не только повреждение головы, но и шейного отдела позвоночника, дополнительно боль может развиться при недостаточном сне или недостаточном питании в течение дня», — добавляет Константин Махинов.
Головная боль после тренировки: когда к врачу?
Врачи категоричны: если голова болит после каждой тренировки, не следует затягивать с визитом к специалисту.
«При любой систематически возникающей головной боли будет правильным обратиться к неврологу, чтобы разобраться в причинах происходящего и проанализировать все опасения, которые обычно тревожат людей с этим симптомом, научиться правильно справляться с приступами головной боли, а также получить рекомендации по их профилактике», — считает Юлия Хазиме.

Также нужно посетить врача, если после занятия вы заметили странные ощущения.
«Если головная боль после обычной тренировки возникла впервые и отличается от той, что вы испытывали ранее, или если помимо нее есть и какие-то другие симптомы», — уточняет Юлия Хазиме.
Чувствуете сильную головную боль на тренировке? Возможно, это признак сосудистых нарушений.
«Такую боль еще называют «громоподобной». Ее отличает необычайная сила: 10 баллов из 10-ти. Любой приступ «громоподобной» головной боли требует обязательной консультации врача. А если сразу после тренировки к ней присоединяются другие неврологические симптомы, например, утрата сознания или судороги, неукротимая рвота и так далее — следует срочно вызвать «скорую», — предупреждает Юлия Хазиме.
«Красными флажками (симптомы опасности) являются ассоциированные симптомы с головной болью, например, слабость с одной стороны тела, угнетение сознания, смена паттерна головной боли, нарастания тонуса в шее (невозможности довести подбородок до грудины), что требует немедленного обращения за медицинской помощью», — говорит Константин Махинов.

Болит голова после тренировки: что делать?
Симптом возникает не впервые? Обратите внимание на мышцы плечевого пояса.
«Если при выполнении упражнения они напряжены и болят, попробуйте снизить нагрузку или совершить то или иное движение за счет других мышц. Если вы занимаетесь с тренером, обратите его внимание на указанные ощущения, чтобы вовремя скорректировать нагрузку и не фиксировать неправильный двигательный стереотип», — советует Юлия Хазиме.
В некоторых случаях допустимо выпить таблетку.
«Если головная боль не отличается чем-то необычным и не сопровождается настораживающими симптомами (онемение, слабость в руках, ногах, зрительные нарушения, утрата сознания) — вполне допустимо принять обезболивающее. Это должно существенно облегчить состояние, но в случае затяжного приступа головной боли все же следует обратиться к врачу», — говорит Юлия Хазиме.

Профилактика головных болей после тренировки
Правильно проведенная тренировка — залог хорошего самочувствия. Не хотите, чтобы после занятия у вас заболела голова? Следуйте этим рекомендациям врачей:
- Не тренируйтесь в жару, при повышенной влажности и на высоте, если у вас есть предрасположенность к головным болям, связанным с физической нагрузкой.
- Добавьте аэробных нагрузок.
«Я рекомендую кардиотренировки, которые направлены на укрепление сердечной мышцы. При подобных упражнениях артериальное давление повышается несильно, пульс остаётся в пределах нормы и не вызывает гипертрофию сердечной мышцы. Таким образом, если человек после тренировки чувствует себя плохо, значит, данная нагрузка для него велика, и ему необходимы кардиотренировки. Чтобы проверить их эффективность, существуют нагрузочные пробы, например, проба Мартине-Кушелевского — это оценочный тест, определяющий способность сердечно-сосудистой системы переносить нагрузки и восстанавливаться после физических упражнений.
 Он показывает, есть ли положительная динамика у тренировки», — говорит Григорий Жежа.
Он показывает, есть ли положительная динамика у тренировки», — говорит Григорий Жежа.
- Дышите правильно: в спокойном темпе, без задержек. Основное усилие совершайте на выдохе.
- Не пропускайте разминку.
«Она стимулирует сердечный ритм и дает время сосудам подготовиться к дальнейшей активности», — говорит Федор Михневич.
- Пейте больше жидкости!
«Не менее 200 мл воды перед пробежкой или началом тренировки, а также после нее, чтобы избежать обезвоживания. Вода способствует насыщению клеток организма кислородом», — добавляет Федор Михневич.
- Правильно готовьтесь к занятию.
«Перед фитнес-уроком соблюдайте общие правила: не принимайте тяжелую пищу менее, чем за 2 часа до тренировки. В идеале на занятие нужно подходить после достаточного сна и в хорошем самочувствии», — подытоживает Юлия Хазиме.

Следуя этим рекомендациям, вы снизите риск появления головных болей после тренировки.
Роддом №9 :: Физическое восстановление
Современный мир беспощаден даже к беременной женщине. Она пытается соответствовать современным веяниям моды и быть «продвинутой». Часто пренебрегая не только своим здоровьем, но и здоровьем своего ребенка.
Часто беременные работают и в декретном отпуске и приступают к работе сразу же после родов; или наоборот, женщина настолько поглощена своим здоровьем, что отстраняется от повседневной жизни. Правда жизни такова, что сколько бы врачи и научные исследователи не писали рекомендаций о том, что для здоровья беременной женщины вредно как гипер-(излишние физические и психоэмоциональные) нагрузки, так и гипоактивность (недостаточная двигательная деятельность), все таки возникает необходимость искать более современные пути решения проблемы.
Наиболее остро возникает проблема быстрого восстановления после родов.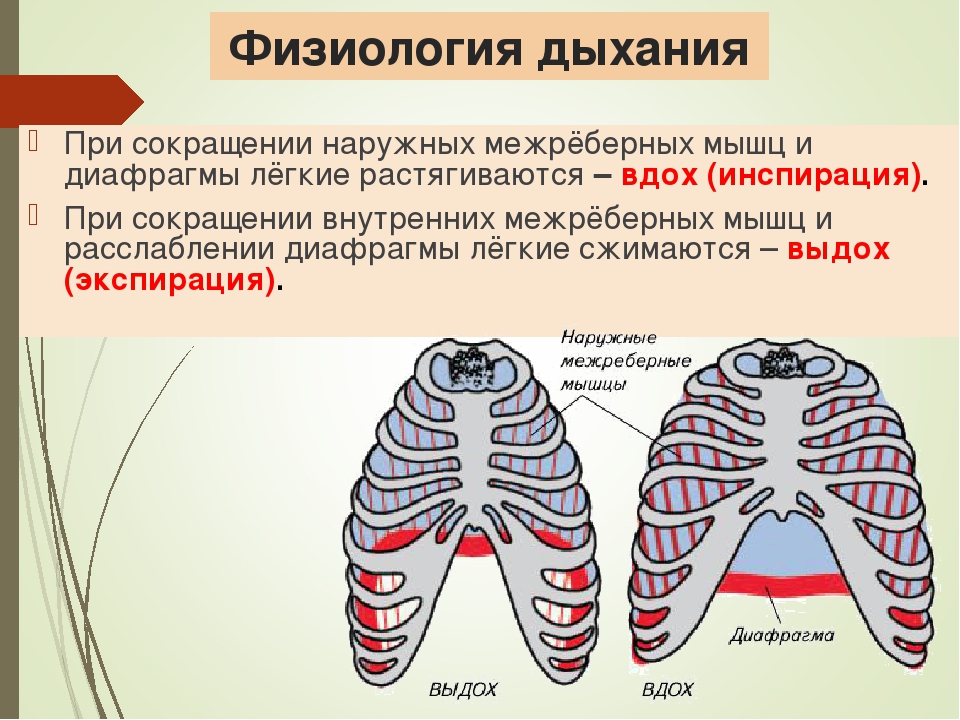 Но в наше, казалось бы, суперсовременное время, в послеродовой период не так много мест, куда женщина может обратиться за консультацией или даже провести в полном объеме курс восстановительной гимнастики уже в более ранний период. Родильный дом №9 с радостью готов предложить Вам «фитнесс — программу послеродового восстановления» для женщин уже с 10-12 недель после родов, где Вы не опасаясь, что излишняя нагрузка скажется вредно для лактации, окрепнете, станете энергичнее, укрепите мышцы брюшного пресса, спины, тазового дна и ног.
Но в наше, казалось бы, суперсовременное время, в послеродовой период не так много мест, куда женщина может обратиться за консультацией или даже провести в полном объеме курс восстановительной гимнастики уже в более ранний период. Родильный дом №9 с радостью готов предложить Вам «фитнесс — программу послеродового восстановления» для женщин уже с 10-12 недель после родов, где Вы не опасаясь, что излишняя нагрузка скажется вредно для лактации, окрепнете, станете энергичнее, укрепите мышцы брюшного пресса, спины, тазового дна и ног.
Но до 10 недель необходимо заниматься физическими упражнениями самостоятельно, они способствуют восстановлению функционального состояния организма родильницы и повышению ее адаптации к предстоящим физическим нагрузкам после выписки из род.дома. Начинать заниматься можно только после осмотра врача и получения соответствующих рекомендаций. Противопоказания к физическим упражнениям — значительная кровопотеря в родах, повышение температуры тела выше 37,5 С, повышение артериального давления, глубокие разрывы промежности, различные заболевания сердечно-сосудистой системы и др. Если роды прошли с осложнениями необходимо проконсультироваться с врачом о том, когда можно начинать заниматься гимнастикой.
Если роды прошли с осложнениями необходимо проконсультироваться с врачом о том, когда можно начинать заниматься гимнастикой.
Можно начинать заниматься с 2-3-х суток после родов. Количество, сложность упражнений увеличиваются изо дня в день, начиная выполнять с 5-6 самых простых упражнений, повторение каждого с 3-4 раз.
Не рекомендуется выполнять упражнения из исходных положений сидя и упражнения с большим напряжением (натуживанием) — увеличивающие внутрибрюшное давление (особенно при тренировке мышц брюшного пресса одновременно подъем двух прямых ног от пола, подъем корпуса из положения лежа на спине в положение сидя до 3-6-и недель после родов) до 1-2 недели, даже, если у Вас не было «разреза» промежности.
Продолжительность занятий увеличивать постепенно от 10-15 минут увеличивать до 30-40 минут. Выполнять в любое удобное время, но не раньше 1-1,5 часа после еды, через 20-30 минут после кормления малыша грудью, в удобной, не стесняющей движения одежде, в хорошо проветренном помещении, после занятий принять душ.
Не изматывайте себя большой нагрузкой! Морально Вы готовы на «подвиги». Помните, при беременности изменения в организме происходили в течение очень длительного времени и как бы Вы не хотели, организм человека не способен восстановиться за считанные дни.
При беременности растягиваются мышцы брюшного пресса из-за увеличенной беременной матки. В связи с родами мышцы тазового дна становятся слабыми (восстанавливаются примерно к 5-7 дню), матка продолжает восстанавливаться до 6-8 недель после родов, новая функция в организме женщины- лактация выводит организм на новый гормональный уровень.
«Слушайте» свой организм. Наблюдайте за общим самочувствием, настроением и аппетитом, работой кишечника и мочевого пузыря, изменениями со стороны сердечно-сосудистой системы: измеряйте пульс (после занятий он должен восстановиться до цифр в начале). При выполнении любого сложного движения или при его быстром выполнении пульс не должен превышать 12-14 ударов за 10 секунд, не более 140 ударов за минуту, если превышает, надо снизить нагрузку за счет темпа или количества повторений упражнения.
Красивой можно считать фигуру той женщины, у обладательницы которой ровная и гордая осанка. Это не только красота, но и здоровье.
Осанка — это привычная поза, манера держаться в положении сидя и стоя.
Во время кормления малыша, положение женщины вынужденное, т.е. чтобы ребенка удержать на руках приходиться сутулиться, к тому же при увеличении выработки грудного молока под весом молочных желез грудная клетка сдавливается, происходит нарушение дыхания (оно как и при беременности становиться поверхностным, нарушая газообмен в легких), что может привести к различным заболеваниям.
Женщины часто не замечают нарушенную осанку (стоят и ходят с опущенной головой, и сжатой грудной клеткой, при этом таз подан вперед и живот выпячен). Данную проблему можно не только устранить, но и вовремя предупредить, так как это не только не красиво и вызывает застойные явления в легких, но и вредно для мышц спины.
Во-первых, с первых дней после родов надо научиться чувствовать положение головы (не опущенное), плеч (разведены в стороны), лопаток (сведены, углы прижаты к спине), усилием воли поддерживать правильную осанку.
Во-вторых, выполнять укрепляющие упражнения для мышц спины и мышц брюшного пресса, участвующих в поддержании правильного положения позвоночника (они создают «мышечный корсет»).
Многие женщины болезненно переживают, что у них грудь станет отвислая, если они будут долго кормить ребенка грудным молоком.
Дорогие женщины! Ничто не сравниться с тем, что получает ребенок с грудным молоком. Это не только весь комплекс витаминов, питательных веществ, защитных антител от заболеваний, но и тепло и заботу матери, от которой зависит дальнейшее становление ребенка как личности. Именно в первый год жизни продолжает созревать нервная система ребенка, которая к моменту рождения младенца, так не совершенна. Малыш нуждается в тепле и прикосновениях, часто разговариваете с ним, целуйте и обнимайте, держите на руках.
Если женщина набирает излишний вес (общая прибавка веса за беременность составит более 12 — 14 кг от изначального), то ее грудь увеличивается уже к концу беременности за счет жировой ткани, вследствие чего грудь может стать менее упругой и иметь несовершенную форму), а после родоразрешения — за счет усиленного выделения молока. Помните! В молочных железах мышц нет! и важно ухаживать за молочными железами, чтобы обратный процесс изменений в молочных железах при подавлении лактации (прекращении кормления грудью) не был длительным и связан с большими переживаниями. Все рекомендации по уходу за железами и правильным кормлением можно получить у специалистов родильного дома (акушерки, врача акушера-гинеколога, неонатолога).
Помните! В молочных железах мышц нет! и важно ухаживать за молочными железами, чтобы обратный процесс изменений в молочных железах при подавлении лактации (прекращении кормления грудью) не был длительным и связан с большими переживаниями. Все рекомендации по уходу за железами и правильным кормлением можно получить у специалистов родильного дома (акушерки, врача акушера-гинеколога, неонатолога).
Чтобы грудь была красивой, следите за осанкой, всегда держите грудную клетку приподнятой, выполняйте дыхательные упражнения (руки через стороны вверх вдох, выдох через нос опустить руки вниз; можно выполнять в положении стоя и лежа) и любые круговые движения руками. Молочные железы расположены на большой и малой грудных мышцах, именно их укрепление создает высоту (полноту) и окружность бюста.
Помните, в первый месяц после родов нагрузка на грудные мышцы должна быть сведена к минимуму. Запрещается использовать любые виды амортизаторов (отягощений: резинка, эспандер, гантели). Если данную рубрику читает женщина, планирующая беременность или беременная ранних сроков, то примите к сведению, что чем раньше вы начнете укреплять под контролем инструктора мышцы рук и груди, тем более далекими будут для Вас проблемы послеродового периода.
Во второй половине беременности часто беспокоят отеки ног, как из-за увеличения веса, снижения двигательной активности, варикозного расширения вен нижних конечностей и ряда других причин, в связи с чем происходит нарушение питания мышц и возникает эффект онемения, судорог или «хруста» суставов, что встречается нередко и не только в связи с беременностью. В первые дни после родов отеки могут сохраняться.
Как справиться с этой трудностью? Упражнения на улучшение подвижности суставов ног и усиление кровотока в нижних конечностях. Упражнения для ступней очень распространены и известны с детства; расположение женщины при выполнении упражнения на боку, лежа или позже сидя: сгибание и разгибание пальцев ног, вращение ступнями наружу и внутрь, захватывание пальцами предметов разного размера и фактуры, и конечно же массаж и самомассаж всей ступни.
Но, говоря о ногах, не стоит останавливаться только на самой нижней части. К сожалению, увеличить длину дог с помощью физических упражнений нельзя, но можно подкорректировать их форму. Легче нарастить мышечную массу, но вот уменьшить их объем (особенно справиться с проблемными зонами в области бедер) в полной мере представится возможность в более поздний период после родов, когда можно будет увеличить нагрузку — лучшее средство для этого бег трусцой и упражнения на растягивания мышц, длительностью не менее 15 минут.
Легче нарастить мышечную массу, но вот уменьшить их объем (особенно справиться с проблемными зонами в области бедер) в полной мере представится возможность в более поздний период после родов, когда можно будет увеличить нагрузку — лучшее средство для этого бег трусцой и упражнения на растягивания мышц, длительностью не менее 15 минут.
Как только Вы успешно родоразрешились, то «ОХ! Ужас — это, выпяченный живот! Его даже не скроешь эластичным утягивающим бельем!» — слышится от каждой женщины, которая не знакома с информацией о том, как восстанавливается организм женщины в первые дни после родов.
Не переживайте — это норма! Матка не может сократиться до прежних размеров — это дело не 2-х и даже не 3-х дней. Форма живота зависит как от жирового слоя, так и силы мышц брюшного пресса. Жир откладывается как на мышцах живота, так и в брюшной полости. Начиная выполнять упражнения для данных групп мышц уже со 2-х суток можно постепенно привести переднюю брюшную стенку в норму.
Самые простые упр. : из исходного положения, лежа на спине поочередное поднимание прямых ног или велосипедное движение одной затем другой ногой, приподнимание головы и верхнего плечевого пояса только до лопаток.
: из исходного положения, лежа на спине поочередное поднимание прямых ног или велосипедное движение одной затем другой ногой, приподнимание головы и верхнего плечевого пояса только до лопаток.
Мышцы брюшной стенки и тазового дна играют важную роль в поддержании нормального расположения органов брюшной полости и малого таза (матки, влагалища и т.д.). Их развитие влияет как на течение беременности, так и родов. В родах мышцы растягиваются и становятся дряблыми, их значительная слабость может привести к опущению внутренних органов и нарушению функции кишечника. Но мышцы ослабевают только в том случае, если их не тренировать! Одно из специфических упражнений для укрепления мышц тазового дна — упражнения Кегеля и разнообразные его модификации.
Важную задачу выполняет поперечная мышца живота. Она опоясывает брюшную полость, располагаясь перпендикулярно прямой мышце. Мышца укрепляется с первых дней после родов при втягивании брюшной стенки (глубокое брюшное дыхание). На вдохе через нос — надуть брюшную стенку как купол, на выдохе через нос — втянуть.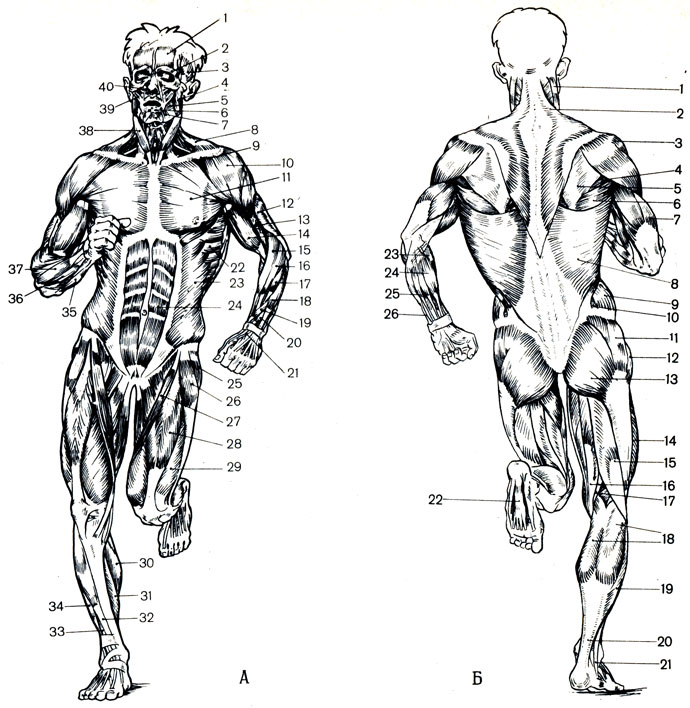 Начинать выполнение упражнение с 15-20 раз, в течение дня, увеличивая каждый день на 10 раз и более. Тот же эффект достигается при расположении женщины на животе с первых часов после родов. Это очень важное укрепляющее упражнение, которое в свою очередь улучшает перистальтику кишечника.
Начинать выполнение упражнение с 15-20 раз, в течение дня, увеличивая каждый день на 10 раз и более. Тот же эффект достигается при расположении женщины на животе с первых часов после родов. Это очень важное укрепляющее упражнение, которое в свою очередь улучшает перистальтику кишечника.
Достоинство женщины — стройная талия, но где же Вы видели беременную с такой талией это физиологически не возможно!
Но после родов это самый благодарный пластический материал для укрепления. Прежде всего, чтобы талия стала тоньше, необходимо укреплять косые (боковые) мышцы (наклоны туловища из разных положений: лежа, сидя, стоя, на четвереньках), но важно сочетать с упражнениями для прямых мышц живота.
Помните! Начинать интенсивные тренировки можно только после установления регулярного менструального цикла и полного прекращения кормления грудью.
Раньше всего можно заниматься ходьбой, бегом трусцой. Избегайте активных видов аэробики, силовых видов упражнений. Полезно начинать заниматься теннисом. Волейболом, лыжами и т.п. исключая экстремальные виды (прыжки с трамплинов, прыжки в воду, подводное плавание и т.п.).
Волейболом, лыжами и т.п. исключая экстремальные виды (прыжки с трамплинов, прыжки в воду, подводное плавание и т.п.).
Важно понять, что в период после родов не рекомендуются виды физической активности, снижающие значительно вес, потому что это сказывается негативно на лактации (возможно меньшее выделение грудного молока) и на состоянии здоровья женщины — излишние нагрузки ведут к изнеможению нервной, эндокринной и сердечно-сосудистой систем, что в свою очередь ведет к обратному эффекту. Вместо заряда бодрости, эмоционального подъема и физической легкости во всех отделах человеческого организма — нарастает утомление, боль в мышцах, отказ от дальнейших занятий и т.п.
Рациональное питание, физические упражнения, здоровый образ жизни ведут к реальному результату: красоте и здоровью! Но, если Вы тренируетесь в одиночестве Вам трудно сохранить мотивацию (интерес) к регулярным занятиям. В группе выполнение любой нагрузки значительно легче, поэтому, если Вы настроены решительно и Вам нужно восстановиться быстро и эффективно, записывайтесь на занятия по программе разработанной специалистами родильного дома с учетом медицинских особенностей послеродового периода по тел. 923-03-02, 726-78-75.
923-03-02, 726-78-75.
Не превращайте занятия в неинтересный и каторжный труд. Получайте удовольствия от двигательных действий!
Свои вопросы и предложения размещайте на сайте
«Реабилитация после коронавируса необходима каждому» | Статьи
Люди, переболевшие коронавирусом, не выходят из больниц абсолютно здоровыми, рассказала «Известиям» начальник Центра реабилитации и восстановительного лечения ЦКБ, доктор медицинских наук, профессор Елена Гусакова. В ее практике были случаи, когда молодые, ранее здоровые люди восстанавливались после COVID-19 четыре недели. Последствия этого вируса могут быть самыми разными — от нарушений сна и подавленного состояния до инсульта и фиброза легких. При этом мы еще не знаем отдаленных проявлений, которые могут наступить через год, пять или десять лет. Восстановление требуется начинать как можно раньше — даже на ИВЛ. А вот с выходом на работу после болезни лучше не спешить, считает реабилитолог.
Постковидный синдром
— Каждому ли, переболевшему коронавирусом, требуется реабилитация?
— Я не знаю ни одного человека, который бы, выписавшись из больницы после лечения новой коронавирусной инфекции, чувствовал себя абсолютно здоровым. Даже переболевшим в легкой форме требуется как минимум психологическая реабилитация. После болезни у всех пациентов сохраняется астенизация, слабость, головная боль, одышка, повышенная потливость и подавленное настроение. Мы дали этому симптомокомплексу условное название «постковидный синдром».
Реабилитация после коронавируса необходима каждому переболевшему вне зависимости от степени тяжести заболевания. Пациенты же, которые перенесли среднетяжелую и тяжелую формы коронавирусной пневмонии, нуждаются в обязательной комплексной реабилитации.
Фото: ИЗВЕСТИЯ/Дмитрий Коротаев
— Какие последствия вызывает ковид даже в самых легких формах?
— На самом деле нам еще предстоит изучить отдаленные последствия перенесенной новой коронавирусной инфекции — как она отразится на здоровье людей через год, пять, десять лет.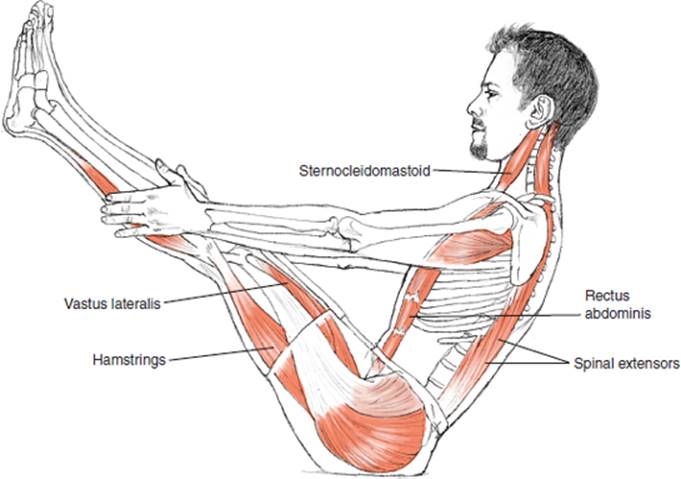 К примеру, вирус гепатита С называется «ласковый убийца». Он приводит к медленному развитию рака печени. Вирус папилломы человека вызывает рак шейки матки. Вирус Эбола, обнаруженный спустя много месяцев в глазной жидкости у выживших пациентов, впоследствии вызывает слепоту. Вирус герпеса, у человека много лет назад переболевшего ветряной оспой, может спровоцировать развитие болезненного опоясывающего лишая.
К примеру, вирус гепатита С называется «ласковый убийца». Он приводит к медленному развитию рака печени. Вирус папилломы человека вызывает рак шейки матки. Вирус Эбола, обнаруженный спустя много месяцев в глазной жидкости у выживших пациентов, впоследствии вызывает слепоту. Вирус герпеса, у человека много лет назад переболевшего ветряной оспой, может спровоцировать развитие болезненного опоясывающего лишая.
Уже сейчас известно, что у людей, страдающих хроническими заболеваниями легких, сердца, почек и крови, заболевание протекает тяжелее и зачастую осложняется декомпенсацией функций органов, развитием миокардитов (воспаление сердечной мышцы), аритмий, инсультов и инфарктов. Причем в сердечной мышце могут развиться необратимые изменения.
Уже доказано, что новый вирус обладает выраженной нейротропностью и нейротоксичностью с развитием аносмии — внезапной потери обоняния, головной боли, нарушений сна, а также когнитивных нарушений в виде снижения памяти и умственной работоспособности. Причем при реабилитации больных мы наблюдаем все эти проявления и у пациентов, перенесших новую коронавирусную инфекцию в легкой форме.
Причем при реабилитации больных мы наблюдаем все эти проявления и у пациентов, перенесших новую коронавирусную инфекцию в легкой форме.
— Почему это происходит?
— Нервная и иммунная системы имеют тесную взаимосвязь и образуют единую систему управления организмом. Эта связь осуществляется посредством цитокинов и нейропептидов. В научных исследованиях доказано, что введение цитокинов (даже в лечебных целях) сопровождается депрессией центральной нервной системы и мышечной слабостью. Это мы и наблюдаем при коронавирусной инфекции и «цитокиновом шторме». В свою очередь, депрессия провоцирует выброс гормона стресса — кортизола, который подавляет иммунную систему, а также выброс адреналина и норадреналина, которые подавляют активность лимфоцитов. Имеются данные, что на пике стресса у спортсменов и студентов происходит снижение иммуноглобулинов всех классов, то есть человек испытывает иммунодефицит.
Гимнастика на ИВЛ
— Когда нужно начинать реабилитацию?
— В самом разгаре заболевания. И в первую очередь в палатах реанимации и интенсивной терапии для профилактики пролежней, тромбозов, атонии мышц. Специалисты пытаются начать реабилитацию как можно раньше, даже когда пациент находится на искусственной вентиляции легких.
И в первую очередь в палатах реанимации и интенсивной терапии для профилактики пролежней, тромбозов, атонии мышц. Специалисты пытаются начать реабилитацию как можно раньше, даже когда пациент находится на искусственной вентиляции легких.
С пациентом проводится лечебная, респираторная гимнастика, позиционирование больного — смена положения. Сейчас в арсенале реабилитологов имеется большое количество разнообразного оборудования для ранней реабилитации — прикроватные тренажеры мотомеды, вертикализаторы для постепенного перевода тяжелого пациента из лежачего положения в вертикальное, аппаратная физиотерапия для стимуляции дыхательных мышц и диафрагмы для ускорения перевода с ИВЛ на собственное дыхание.
Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
Помимо респираторной и физической реабилитации не менее важна реабилитация психологическая: нужно не только успокоить пациента, но и мотивировать его на необходимость занятий лечебной и дыхательной гимнастикой. Ведь при тяжелом течении ковида формируется порочный круг — пациент ослаблен, ему тяжело заниматься с реабилитологом, следовательно развивается мышечная гипо- и атония, которая еще больше усугубляет его состояние и пациент еще больше теряет физическую форму.
Ведь при тяжелом течении ковида формируется порочный круг — пациент ослаблен, ему тяжело заниматься с реабилитологом, следовательно развивается мышечная гипо- и атония, которая еще больше усугубляет его состояние и пациент еще больше теряет физическую форму.
У многих пациентов на фоне гипоксии (нехватки кислорода) и прямого нейротоксичного воздействия коронавирусной инфекции на ЦНС, головной мозг ухудшается память, внимание и скорость мышления. Для уменьшения этих проявлений нужно не только разгадывание ребусов и кроссвордов, но и работа с нейропсихологом, а также двигательная активность с кинезиотерапевтом или инструктором по лечебной физкультуре. Астения и депрессия также очень хорошо лечатся двигательной активностью.
От нарушений сна до инсульта
— С какими последствиями ковида сталкиваются люди, перенесшие его?
— Самыми разнообразными. Если заболевание протекало тяжело, могут нарушиться функции абсолютно любого органа или системы организма — нервной, сердечно-сосудистой, почек, печени. Очень часто встречаются нарушения сна, психо-эмоциональные расстройства.
Очень часто встречаются нарушения сна, психо-эмоциональные расстройства.
У пациентов, поступавших к нам на реабилитацию, мы видели, что сохраняются очаговые инфильтративные изменения в легких, несмотря на отрицательные тесты и отсутствие вируса в организме. Это проявляется одышкой при небольшой физической нагрузке, ходьбе в медленном темпе. Если не проводить реабилитационные мероприятия, то существует риск развития фиброза легких, в основе которого лежит разрастание соединительной ткани в результате воспаления альвеолярной стенки.
По данным факультета интенсивной терапии FICM британской профессиональной медицинской организации, занимающейся обучением врачей-реаниматологов, пациенты с тяжелой формой ковида могут получить столь сильные повреждения легких, что на восстановление им понадобится более 10 лет.
Фото: ИЗВЕСТИЯ/Павел Бедняков
— Может ли ковид приводить к инвалидности?
— К нам на реабилитацию поступали молодые мужчины, у которых на фоне ковида и нарушений свертывающей системы крови развилось острое нарушение мозгового кровообращения, то есть инсульт с парезами (двигательными расстройствами) верхних и нижних конечностей, серьезными нарушениями речи, когнитивными расстройствами. Пациенты были настолько тяжелые, что поступали на каталках.
Пациенты были настолько тяжелые, что поступали на каталках.
— Встречаются ли случаи, когда реабилитация после ковида требуется детям?
— Известно, что у детей коронавирусная инфекция может привести к развитию синдрома Кавасаки с развитием системного васкулита, поражением артериального русла, кожи, глаз, сердца, а также с развитием инфекционно-токсического шока. Если ребенок длительное время находился на постельном режиме и у него развились функциональные нарушения органов или систем организма, ему также показан курс реабилитационного лечения.
Уникальной технологии нет
— Какие традиционные методы физиотерапии успешно помогают восстанавливаться после ковида?
— Классические программы пульмонологической реабилитации после тяжелых острых респираторных инфекций, в том числе и после коронавирусной пневмонии, базируются на трех китах: дозированная физическая нагрузка под контролем специалиста, аппаратная физиотерапия и методы респираторной реабилитации, когда воздействие происходит непосредственно на слизистую оболочку дыхательной системы.
Несмотря на мощное развитие технологий в мире в последнее десятилетие, никакой одной уникальной технологии для реабилитации последствий коронавирусной инфекции не существует, также как и нет никакой секретной пилюли для быстрого восстановления. Мы восстанавливаем не одну какую-то проблему, а весь организм человека в целом. Мультидисциплинарная команда разрабатывает индивидуальный план реабилитационной программы, в которую входит комплекс процедур: лечебная гимнастика, дыхательная гимнастика с применением респираторных тренажеров, массаж, психо- и диетотерапия, физиотерапия, включая ингаляции, электро- и магнитотерапию, вибротерапию, гипербарическую оксигенацию, рефлексотерапию и т.д.
В отличие от классической дыхательной гимнастики основной комплекс упражнений после ковида должен быть направлен не на работу с сопротивлением на выдохе, а на улучшение вентиляционной функции легких за счет увеличения подвижности грудной клетки, экскурсии диафрагмы, укрепления дыхательных мышц, поэтому традиционные дыхательные методики (например, надувание воздушных шариков), направленные на раздувание объема легких, не могут считаться основными.
Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
— Показано ли после ковида санаторное лечение?
— В нашей стране большой опыт лечения пациентов с болезнями органов дыхания с помощью климатотерапии. Климат леса усиливает противовоспалительный, антибактериальный и противовирусный эффект проводимого лечения.
Климатотерапия в условиях гор помогает после перенесенной пневмонии, осложненной фиброзом легких, а также с сопутствующими заболеваниями сердечно-сосудистой системы.
Морской климат с высоким содержанием минеральных солей и аэроионов показан пациентам с нарушениями дренажной функции бронхов.
Но если у пациента было тяжелое течение ковида, лучше всего восстанавливаться в местных санаториях, так как при переезде в другую климатическую зону может произойти срыв адаптации и обострение хронических заболеваний.
Работа подождет
— Возможно ли полное восстановление после тяжело перенесенного коронавируса?
— Смотря что мы считаем полным восстановлением. У нас на реабилитации были молодые пациенты, не имевшие до коронавирусной инфекции никаких хронических заболеваний. У них был высокий реабилитационный потенциал, но, несмотря на это, для полного восстановления им потребовалось около четырех недель, и у некоторых из них продолжали оставаться слабость и явления астении. Понятно, что чем моложе пациент и чем правильнее был его образ жизни до болезни, тем быстрее и эффективнее проходит реабилитация.
У нас на реабилитации были молодые пациенты, не имевшие до коронавирусной инфекции никаких хронических заболеваний. У них был высокий реабилитационный потенциал, но, несмотря на это, для полного восстановления им потребовалось около четырех недель, и у некоторых из них продолжали оставаться слабость и явления астении. Понятно, что чем моложе пациент и чем правильнее был его образ жизни до болезни, тем быстрее и эффективнее проходит реабилитация.
Ничего в жизни само собой не происходит. Поэтому, даже если вы восстанавливаетесь после болезни дома, постарайтесь делать ежедневную лечебную дыхательную гимнастику, небольшой комплекс упражнений для нижних конечностей и верхнего плечевого пояса, начните вести здоровый образ жизни — бросьте курить, откажитесь от алкоголя, начните правильно питаться и контролировать артериальное давление, сатурацию, глюкозу в крови и холестерин.
Необходимо начать реабилитацию как можно раньше, так как появляющийся после болезни фиброз легких не имеет обратного развития. Это медленный необратимый процесс замещения легочной, альвеолярной ткани плотной, соединительной тканью. Клинически он проявляется прогрессирующей одышкой.
Это медленный необратимый процесс замещения легочной, альвеолярной ткани плотной, соединительной тканью. Клинически он проявляется прогрессирующей одышкой.
Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
— Чем рискуют люди, перенесшие ковид, при быстром возвращении к интенсивной работе?
— Нельзя забывать, что мы живем в эпоху Evidence Based Medicine, или в эпоху доказательной медицины, а ковид — патология молодая. Одна из основных особенностей ковида, про которую многие забывают, — это отсутствие достаточного количества подтвержденной научной информации. Для развернутого ответа на вопрос следует также подчеркнуть, что для ковида характерен полиморфизм клинических симптомов и его проявления могут быть очень индивидуальны. Необходимо учитывать и форму перенесенного заболевания. Несмотря на то что патология протекает так «лично» и зависит от многих обстоятельств, для всех случаев характерны нарушения иммунного ответа, после которых может возникнуть картина «полизаболевания», то есть присоединение другой патологии. Только учитывая все приведенные факты, можно объективно оценить опасность быстрого возвращения к работе.
Только учитывая все приведенные факты, можно объективно оценить опасность быстрого возвращения к работе.
Ишемическая болезнь сердца. Стенокардия / Заболевания / Клиника ЭКСПЕРТ
Термин «Ишемическая болезнь сердца» включает в себя группу заболеваний:
- инфаркт миокарда
- атеросклеротический кардиосклероз
- стенокардию.
Стенокардия (синоним Грудная жаба) характеризуется приступами резкой загрудинной боли и дискомфортом в области грудной клетки вследствие недостатка кровоснабжения определенного участка сердца. Сила приступов различна, в редких случаях он заканчивается смертью. Основная причина болезни – атеросклероз венечных артерий сердца.
Для постановки точного диагноза следует исключить и ряд других заболеваний, которые могут проявляться болью в области сердца: остеохондроз позвоночника, опоясывающий герпес, болезни пищевода и желудка, заболевания легких, кардионевроз, перикардит.
Виды стенокардии
Существуют следующие виды заболевания, которые зависят от клинической картины:
Стенокардия напряжения
Одно из основных проявлений ИБС. В результате несоответствия между потребностью миокарда в кислороде и его доставкой по суженным вследствие атеросклероза артериям возникает ишемия миокарда, которая проявляется болью за грудиной или одышкой и резкой утомляемостью при нагрузках.
В результате несоответствия между потребностью миокарда в кислороде и его доставкой по суженным вследствие атеросклероза артериям возникает ишемия миокарда, которая проявляется болью за грудиной или одышкой и резкой утомляемостью при нагрузках.
Стабильная стенокардия напряжения подразделяется на четыре функциональных класса. Функциональные классы стенокардии разработаны для точной диагностики и включают самую разнообразную клиническую информацию (например, ходьба без особых физических затрат по ровной местности и подъем в быстром темпе по лестнице).
Вариантная (спонтанная) стенокардия
Характеризуется непредсказуемым появлением, т.е. боль может появляться и в покое. Она не возникает как ответ сердца на эмоциональную и физическую нагрузку и отличается от стенокардии напряжения тем, что в ее основе, как правило, лежит спазм венечных артерий сердца, а не только атеросклеротическое их поражение.
Нестабильная стенокардия
Требует безотлагательной госпитализации, есть высокая вероятность развития инфаркта миокарда.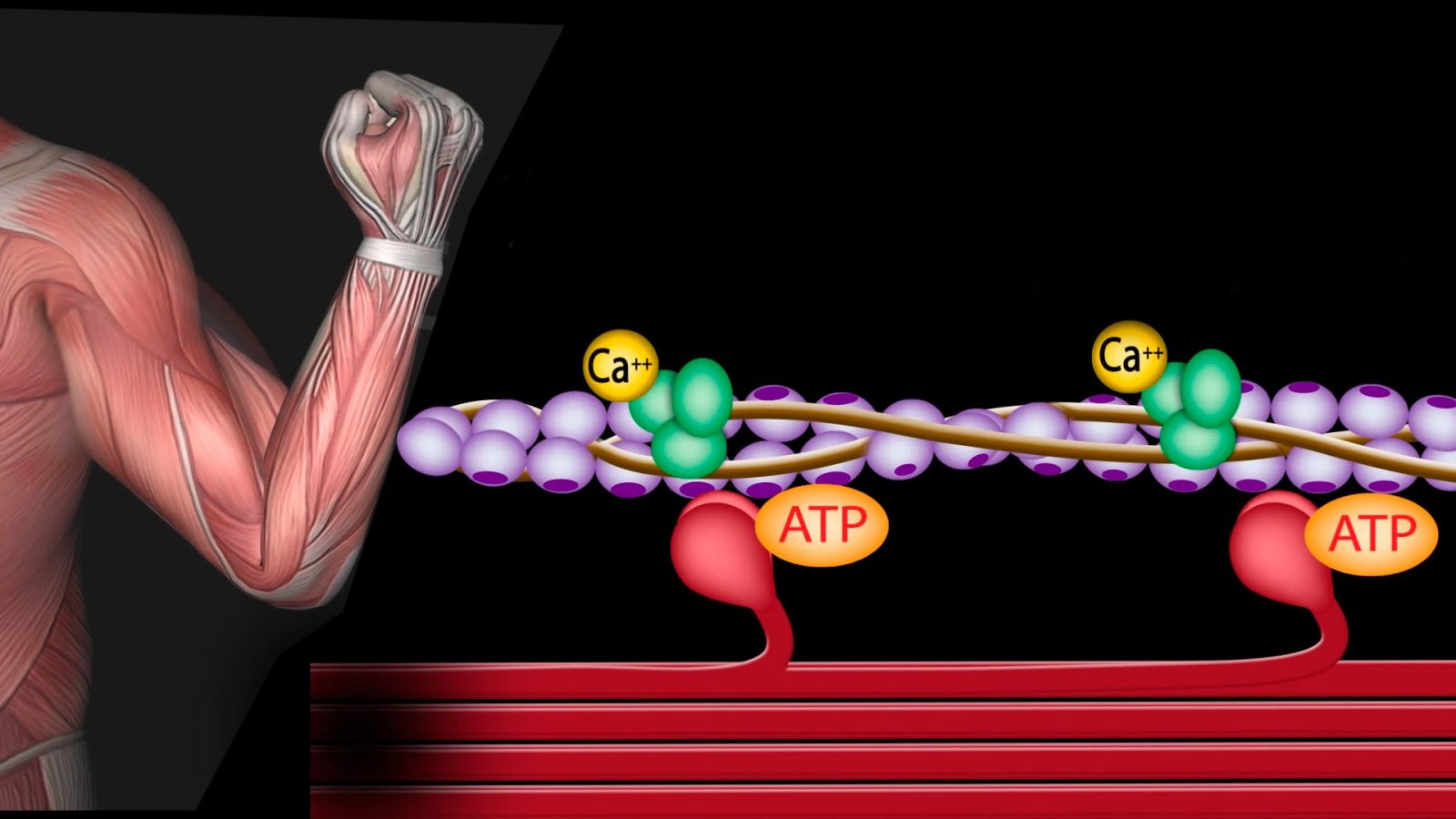
Симптомы
Основные симптомы включают:
- острую загрудинную боль, иррадиирущую с левой (или правой) стороны в нижнюю челюсть, руку, лопатку
- одышку
- ощущение удушья и нехватки воздуха
- чувство страха, тревоги
- усиление болезненности в левой загрудинной области при попытке глубокого вдоха
- повышенная потливость
- тахикардию
- отклонение артериального давления от нормы (низкое или высокое).
Основные факторы развития заболевания, при которых возникают симптомы стенокардии, включают в себя
- возраст (чаще после 40 лет)
- пол (мужчины заболевают ИБС в среднем на 10 лет раньше женщин)
- наследственный фактор.
Большую роль в формировании заболевания играет избыточная масса тела, наличие в анамнезе таких болезней как: сахарный диабет, артериальная гипертензия, повышенная свертываемость крови, метаболический сидром, эмоциональная лабильность, недостаток физической активности, курение и алкоголизм.
Диагностика
В диагностике стенокардии необходим взвешенный и грамотный подход, т.к. при нестабильной стенокардии возможно ухудшение состояния пациента вплоть до развития инфаркта миокарда. Каждое исследование должно быть обоснованным.
- ЭКГ
- суточное мониторирование ЭКГ
- велоэргометрия или тредмил (нагрузочная проба с одновременной регистрацией ЭКГ)
- ЭхоКГ
- стресс-ЭхоКГ
- коронарная ангиография
- сцинтиграфия миокарда
В Клинике ЭКСПЕРТ врачи кардиологи являются также врачами функциональной диагностики. Они взвесят все риски перед проведением обследования.
Лечение
Цели лечения – улучшение прогноза (профилактика инфаркта) и устранение симптомов заболевания. Применяют немедикаментозные (спорт, диета), медикаментозные (таблетированные препараты и капельные инфузии) и хирургические методы лечения.
В Клинике ЭКСПЕРТ у пациентов есть возможность получить полноценную консультацию врача кардиолога по изменению образа жизни и модификации факторов риска. При необходимости возможно лечение в дневном стационаре под наблюдением опытного медицинского персонала.
При необходимости возможно лечение в дневном стационаре под наблюдением опытного медицинского персонала.
Прогноз
Для составления точной картины необходимо учитывать множество показателей, которые дадут возможность врачу оценить степень повреждения миокарда.
Не стоит рисковать своей жизнью. Помощь при стенокардии может включать лишь временные меры для облегчения состояния больного перед обращением к квалифицированному врачу кардиологу.
Обращение к врачу при признаках ишемической болезни сердца должно быть немедленным!
Рекомендации
Для предотвращения приступов стенокардии необходимо:
- бросить курить
- контроль уровня холестерина, при необходимости диета с низким содержанием жиров
- выполнять дозированный и подобранный врачом комплекс физических упражнений
- избегать стрессов
- вести здоровый образ жизни
Рациональное питание, дозированные физические нагрузки и регулярное наблюдение у квалифицированного врача способны спасти больного стенокардией от операции на сердце.
Часто задаваемые вопросы
Как избежать возникновения стенокардии?
Чтобы не было стенокардии, нужно по возможности препятствовать развитию атеросклероза, т.к. в подавляющем большинстве случаев именно он является причиной стенокардии. Как известно, многие факторы непосредственно влияют на образование атерослеротических бляшек. Пол, возраст, наследственность — это предрасполагающие факторы, которые не поддаются изменениям, однако другие факторы можно контролировать и даже предотвращать:
- высокое артериальное давление
- курение
- высокий уровень холестерина
- избыточный вес
- диабет
- низкая физическая активность
- стрессы
Изменить эти факторы в Ваших руках!
Можно ли полностью излечиться от стенокардии?
Стенокардия, как правило, возникает в результате поражения коронарных артерий, кровоснабжающих миокард, атеросклерозом, а это хронический неизлечимый процесс. Однако, при правильно подобранной схеме лечения можно добиться того, что наступит длительная ремиссия и приступы стенокардии беспокоить не будут. Также в настоящее время при необходимости возможна установка стента в суженный просвет сосуда для восстановления кровообращения или операция МКШ/АКШ — это хирургическое вмешательство, в результате которого восстанавливается кровоток сердца ниже места сужения сосуда. При этой хирургической манипуляции вокруг места сужения создают другой путь для кровотока к той части сердца, которая не снабжалась кровью.
Также в настоящее время при необходимости возможна установка стента в суженный просвет сосуда для восстановления кровообращения или операция МКШ/АКШ — это хирургическое вмешательство, в результате которого восстанавливается кровоток сердца ниже места сужения сосуда. При этой хирургической манипуляции вокруг места сужения создают другой путь для кровотока к той части сердца, которая не снабжалась кровью.
Где болит при приступе стенокардии?
Характерной именно для стенокардии является приступообразная боль за грудиной, по центру грудной клетки. Боль сжимающего, давящего характера, чаще связана с физической или психоэмоциональной нагрузкой и проходит при ее прекращении. Боль может отдаваться в левую руку, лопатку, нижнюю челюсть и ключицу. Если используются нитраты, то эффект при стенокардии не отсроченный, он развивается незамедлительно, в течение 1-2 минут.
Есть ли способы справиться с приступом стенокардии без лекарственных средств?
Поскольку у многих людей приступы стенокардии возникают при физической нагрузке, то иногда просто прекращение нагрузки (ходьбы и т. д.) и отдых могут привести к прекращению боли. Однако люди, страдающие стенокардией, должны всегда иметь при себе нитроглицерин или нитроспрей, для того чтобы в течение одной-двух минут купировать приступ боли. Не следует задерживать время до приема нитроглицерина, так как боль – это проявление ишемии миокарда (недостаточности его кровоснабжения), и если она сохраняется, то могут возникнуть очаги некроза в миокарде (клетки миокарда могут погибнуть). Если приступы стенокардии участились, необходимо срочно обратиться к врачу кардиологу.
Какие препараты помогут при приступе стенокардии?
Приступ стенокардии необходимо купировать как можно раньше от момента его возникновения, т.к. затянувшаяся ишемия приведет к развитию некроза, т.е. инфаркта миокарда. Если приступ возник впервые в жизни, вызовите скорую помощь. Самостоятельно можно принять таблетку нитроглицерина или использовать нитроспрей под язык. Эффект наступит в течение 1-2 минут и длится недолго, 10-15 минут. Принимать препарат лучше сидя или лежа, так как может возникнуть кратковременное снижение артериального давления, головокружение, головная боль, шум в ушах – эти симптомы безопасны и являются следствием действия нитроглицерина. При возобновлении болей можно принять нитроглицерин повторно, т.к. он не кумулируется в организме, в течение суток возможен многократный прием препарата (до 6 таблеток в сутки). При повышенном давлении необходимо снизить его до нормальных цифр.
Всем больным, перенесшим приступ стенокардии, необходимо выполнение ЭКГ и решение вопроса врачом кардиологом о госпитализации в стационар.
Почему необходимо отказаться от курения? Как курение усугубляет течение стенокардии?
Если вы курите и у вас есть стенокардия, то самое лучшее, что вы можете сделать в помощь своему сердцу, это бросить курить!
Исследования показали, что уровень смертности у тех больных стенокардией, которые бросили курить, в 2 раза снизился по сравнению с теми, кто продолжает курить. Почему? В основе стенокардии лежит нехватка кислорода в сердечной мышце, а курение повышает уровень углекислоты в крови, и она вытесняет кислород в крови. Это приводит к кислородному голоданию сердечной мышцы. Также курение способствует повышению вязкости крови. Курение учащает и отягощает приступы стенокардии, многократно увеличивает риск возникновения инфаркта миокарда. Прекращение курения устраняет неблагоприятное воздействие никотина на коронарные артерии, приступы стенокардии исчезают или становятся реже.
Важно: замена сигарет сигарами и трубочным табаком, переход на сигареты с меньшим содержанием смол и никотина не уменьшают сердечно-сосудистый риск!
Вопреки расхожему мнению, резкий отказ от курения не вреден, преодоление этой вредной привычки дает бесспорный положительный эффект независимо от стажа курения.
Нужно быть готовым к тому, что иногда при отказе от курения возникает депрессия, раздражительность, в этом случае вы можете обратиться за помощью к врачу психотерапевту.
Страдаю стенокардией, но мечтаю избавиться от лишнего веса. Какие физические нагрузки допустимы для людей с такими проблемами?
Для людей, страдающих стенокардией, рекомендованы физические нагрузки по 30–45 минут в день. Наилучшим выбором является ходьба (желательно быстрым шагом) или скандинавская ходьба с лыжными палками, езда на велосипеде, плавание. Важно, чтобы упражнения не вызывали болей, сердцебиения, одышки. При занятиях плаванием или аквааэробикой следует помнить о том, что холодная вода может провоцировать приступы стенокардии, поэтому температура воды в бассейне должна быть для вас комфортной. Лучше заниматься аквааэробикой под контролем тренера и по программе, специально адаптированной для людей, имеющих кардиологические проблемы. При этом нагрузки должны увеличиваться очень постепенно.
Однако для снижения массы тела необходима не только физическая нагрузка, но и правильное питание, подобрать подходящее меню поможет на консультации врач диетолог.
Может ли быть стенокардия, если нет боли?
К сожалению, да. К примеру, при сахарном диабете развивается диабетическая полинейропатия, и больной может не чувствовать боль, это так называемая безболевая ишемия. Это состояние опасно тем, что больной не примет мер вовремя, и разовьется инфаркт миокарда. Эквивалентом боли в некоторых случаях может считаться одышка при физических нагрузках, так можно заподозрить наличие стенокардии и прийти на обследование к врачу кардиологу.
История лечения
Случай №1
Кирилл, 57 лет. Курильщик со стажем, гипертоник («рабочее» давление 150/95 мм рт ст). Пять лет назад, со слов больного, были проблемы с сердцем и давлением, обследовался, назначенные препараты принимал полгода, затем самостоятельно прекратил их прием. Во время обращения в клинику появились приступы загрудинной боли при физических нагрузках, которые проходят при прекращении нагрузки. На приеме врача АД — 170/100 мм рт ст, частый пульс 90 уд в мин. Выполнено обследование больного – выявлено повышение уровня «плохого» холестерина, ЭКГ и УЗИ сердца без признаков ишемии, а на суточном мониторе ЭКГ в момент значительной физической нагрузки была зарегистрирована ишемия, т.е. имеется стенокардия напряжения.
Больному подобрана схема лечения при стенокардии, на фоне которой за 3 месяца нормализовались цифры АД, уровень холестерина, значительно увеличилась переносимость физических нагрузок. С помощью психотерапевта больной решился бросить курить, занялся скандинавской ходьбой с постепенным увеличением нагрузок под наблюдением кардиолога. В течение последнего года приступы стенокардии не беспокоят. Рекомендовано продолжать прием препаратов и регулярно проходить профилактическое обследование.
Благодаря сотрудничеству с врачами и желанию чувствовать себя лучше, пациент смог изменить образ жизни, не допустить осложнений заболевания и продлить свою жизнь на долгие годы.
Сильная одышка
Одышка — распространенная проблема, заставляющая обращаться к врачу1. Она возникает на фоне различных состояний и заболеваний, в том числе и редких, таких как болезнь Помпе. Эта наследственная патология может проявляться в любом возрасте. При болезни Помпе возникает дефицит фермента, расщепляющего гликоген. Он накапливается в составляющих клеток организма, лизосомах, что приводит к их разрушению2.
Заболевание проявляется прогрессирующей мышечной слабостью, особенно мышц ног, нарастающей одышкой при физической нагрузке, одышкой при ходьбе, утомляемостью, изменением осанки2. Но чаще сильная одышка становится симптомом более распространенных патологий. Почему она возникает и к какому врачу обращаться при ее появлении?
Что такое одышка?Под термином «одышка» (или диспноэ) понимают комплекс неоднородных ощущений затруднения дыхания или дыхательного дискомфорта, имеющих различную интенсивность1.
Одышка очень распространена: на нее жалуются 50% больных, поступивших в стационар, и примерно 25% пациентов, обращающихся к врачу амбулаторно, в поликлиниках1.
Люди, испытывающие дискомфорт при дыхании, описывают свое состояние как сильное стеснение в груди, ощущение нехватки воздуха, затрудненного дыхания, удушья. Иногда одышка возникает и у здорового человека, испытывающего очень тяжелые физические нагрузки, подвергающегося действию экстремальных температур или находящегося на большой высоте над уровнем моря. В остальных случаях одышка — признак проблем со здоровьем3.
По данным исследования, в 75% случаев причиной одышки становятся заболевания легких и сердца1.
Распространенные причины одышки: болезни легкихСамые распространенные заболевания дыхательных путей, при которых появляется этот симптом, — астма, пневмония и хроническая обструктивная болезнь легких (ХОБЛ).
Бронхиальная астма — хроническое воспалительное заболевание дыхательных путей, основным проявлением которого становятся эпизодические приступы удушья, свистящие хрипы, ощущение стеснения в грудной клетке и кашель. Выраженность ощущений зависит от степени тяжести заболевания: при легкой обструкции («заложенности») дыхательных путей возникает чувство стеснения в груди, в запущенных случаях больному нужно делать усилие, чтобы вдохнуть4,5.
Симптомы при астме появляются и исчезают спонтанно или после лечения средствами, расширяющими дыхательные пути. Болезнь может развиваться в любом возрасте и становиться причиной одышки у детей и взрослых4.
Распространенная причина сильной одышки — острое инфекционное воспаление легких, или пневмония, которая развивается чаще из-за бактериальной инфекции. При пневмонии диспноэ возникает в комплексе с лихорадкой (выше 38°С), кашлем, потливостью, слабостью6.
Одышка также относится к симптомам хронической обструктивной болезни легких (ХОБЛ). Это воспалительное заболевание дыхательных путей обычно развивается у курильщиков. Больные испытывают длительную одышку и продуктивный влажный кашель, которые обостряются после физической нагрузки5.
Другие причины диспноэОдышка при малой нагрузке, без нагрузок, а также при тяжелых физических нагрузках может быть признаком ряда других заболеваний:
- заболевания дыхательных путей — рак легкого, туберкулез, легочная гипертензия, фиброз легких5;
- болезни сердца — ишемическая болезнь сердца, хроническая сердечная недостаточность, инфаркт миокарда, нарушение ритма сердца; диспноэ в таких случаях может сопровождаться сильным сердцебиением, болью в груди7;
- тромбоэмболия легочной артерии — потенциально опасное для жизни заболевание, проявления которого могут варьировать от постепенно развивающихся симптомов до молниеносной катастрофы8;
- отравление угарным газом — одышка сопровождается кашлем, осиплостью, першением горла9;
- анемия — в таких случаях одышка появляется при физической нагрузке, а в тяжелых случаях и в покое (одышка лежа)10;
- психиатрические расстройства, в частности, тревожные состояния, панические атаки4;
- некоторые редкие наследственные заболевания, например, болезнь Помпе2 и другие патологии.
При беременности одышка, тахикардия (учащение сердечных сокращений) может быть признаком железодефицитной анемии или других патологий11.
Сигналы тревогиОдышка может быть симптомом угрожающих здоровью и даже жизни заболеваний, требующих немедленной медицинской помощи. Тревожные признаки, при появлении которых уместно вызвать скорую помощь2:
- сильная одышка, которая появилась внезапно;
- одышка сопровождается болью в груди, обмороком, тошнотой, посинением губ или ногтей, изменением умственной активности.
Эти симптомы могут свидетельствовать о развитии острого состояния — инфаркта миокарда или легочной эмболии, поэтому медлить в таких случаях нельзя2.
К какому врачу обращаться?Поскольку одышка может быть связана с самыми различными заболеваниями, в первую очередь уместно проконсультироваться с врачом-терапевтом или педиатром, если проблема возникла у ребенка. На основании анамнеза, описания проблемы, физикального осмотра доктор сможет сделать предположение, почему одышка возникла, и направить пациента к узким специалистам — пульмонологу, кардиологу, гематологу, психиатру и другим. В зависимости от того, какое заболевание выявлено, врач назначает схему лечения.
Справочная литература- Мартыненко Т. И. и др. Оптимизация ранней нозологической верификации одышки легочного или сердечного генеза //Пульмонология – 2014. – № 1. – С. 27-31.
- Shortness of breath. Mayo clinic (дата обращения 16.07.2019). URL: https://www.mayoclinic.org/
symptoms/ shortness-of-breath/ basics/ definition/ sym-20050890. - Княжеская Н. П. Бронхиальная астма: сложности диагностики //Практическая пульмонология – 2011. – № 1.
- Чикина С. Ю. Принципы оценки одышки в практике пульмонолога //Практическая пульмонология – 2006. – № 2.
- Таточенко В. К. и др. Пневмония //Педиатрическая фармакология – 2006. – Т. 3. – № 4.
- Полтавская М. Г. и др. Хроническая одышка у кардиологических больных: распространенность и этиология //Клиническая медицина – 2007. – Т. 85. – № 6. – С. 37-42.
- Полозова Е. В., Шилов В. В., Кузнецов О. А. Основные клинические проявления поражения дыхательной системы при острых тяжелых отравлениях угарным газом, осложненным термохимическим поражением дыхательных путей //Эфферентная терапия – 2009. – Т. 15. – № 3-4. – С. 35-39.
- Авдеев С. Н. Тромбоэмболия легочных артерий //Практическая пульмонология – 2009. – № 3.
- Савенко И. А. и др. Клиническая фармакология лекарственных средств, для терапии анемий в образовательном процессе //Международный журнал экспериментального образования – 2013. – № 8. – С. 132-134.
- Немеров Е. В. и др. Анализ клинических случаев с синдромом одышки //Сибирский медицинский журнал (Томск) – 2013. – Т. 28. – № 2.
- Мравян С. Р., Протопопова Т. А. Диагностика и лечение сердечно-сосудистых заболеваний при беременности – 2010.
GZEA.PD.18.09.0435j
Актин, миозин и движение клеток — клетка
Нити актина, обычно связанные с миозином, ответственны за многие типы клеточных движений. Миозин является прототипом молекулярного мотора — белка, который преобразует химическую энергию в форме АТФ в механическую энергию, создавая таким образом силу и движение. Самая поразительная разновидность такого движения — сокращение мышц, которое предоставило модель для понимания взаимодействий актин-миозин и двигательной активности молекул миозина.Однако взаимодействия актина и миозина ответственны не только за сокращение мышц, но и за различные движения немышечных клеток, включая деление клеток, поэтому эти взаимодействия играют центральную роль в клеточной биологии. Более того, актиновый цитоскелет отвечает за ползучие движения клеток по поверхности, которые, по-видимому, непосредственно управляются полимеризацией актина, а также взаимодействиями актин-миозин.
Сокращение мышц
Мышечные клетки в высшей степени специализированы для выполнения одной задачи — сокращения, и именно эта специализация в структуре и функциях сделала мышцы прототипом для изучения движения на клеточном и молекулярном уровнях.У позвоночных есть три различных типа мышечных клеток: скелетные мышцы, отвечающие за все произвольные движения; сердечная мышца, перекачивающая кровь от сердца; и гладкие мышцы, отвечающие за непроизвольные движения таких органов, как желудок, кишечник, матка и кровеносные сосуды. Как в скелетных, так и в сердечных мышцах сократительные элементы цитоскелета представлены высокоорганизованными массивами, которые дают начало характерным узорам поперечных полос. Именно характеристика этих структур в скелетных мышцах привела к нашему нынешнему пониманию сокращения мышц и других движений клеток, основанных на актине, на молекулярном уровне.
Скелетные мышцы представляют собой пучки из мышечных волокон , которые представляют собой отдельные большие клетки (приблизительно 50 мкм в диаметре и до нескольких сантиметров в длину), образованные в результате слияния многих отдельных клеток во время развития (). Большая часть цитоплазмы состоит из миофибрилл , которые представляют собой цилиндрические пучки двух типов филаментов: толстые филаменты миозина (около 15 нм в диаметре) и тонкие филаменты актина (около 7 нм в диаметре). Каждая миофибрилла организована в виде цепочки сократительных единиц, называемых саркомерами, которые отвечают за поперечнополосатый вид скелетных и сердечных мышц.
Рисунок 11.18
Структура мышечных клеток. Мышцы состоят из пучков отдельных крупных клеток (называемых мышечными волокнами), которые образуются путем слияния клеток и содержат несколько ядер. Каждое мышечное волокно содержит множество миофибрилл, которые представляют собой пучки актиновых и миозиновых нитей, организованных (подробнее …)
Саркомеры (длиной примерно 2,3 мкм) состоят из нескольких отдельных участков, различимых с помощью электронной микроскопии, что дало критическую информацию о них. механизм сокращения мышц ().Концы каждого саркомера обозначены Z-диском. Внутри каждого саркомера темные полосы (называемые полосами А, потому что они являются низотропными на и при просмотре в поляризованном свете) чередуются со светлыми полосами (называемыми полосами I для сотропов и ). Эти полосы соответствуют наличию или отсутствию миозиновых филаментов. Полосы I содержат только тонкие (актиновые) филаменты, тогда как полосы A содержат толстые (миозиновые) филаменты. Миозиновые и актиновые филаменты перекрываются в периферических областях полосы A, тогда как средняя область (называемая зоной H) содержит только миозин.Актиновые филаменты своими плюсовыми концами прикреплены к Z-диску, который включает сшивающий белок α-актинин. Миозиновые нити закреплены на линии М в середине саркомера.
Рисунок 11.19
Структура саркомера. (A) Электронная микрофотография саркомера. (B) Диаграмма, показывающая организацию актиновых (тонких) и миозиновых (толстых) филаментов в указанных областях. (A, Frank A. Pepe / Biological Photo Service.)
Два дополнительных белка ( титин и небулин ) также вносят вклад в структуру и стабильность саркомера ().Титин — чрезвычайно большой белок (3000 кДа), и отдельные молекулы тайтина простираются от линии M до Z диска. Считается, что эти длинные молекулы тайтина действуют как пружины, которые удерживают миозиновые нити в центре саркомера и поддерживают напряжение покоя, которое позволяет мышце отскочить назад при чрезмерном растяжении. Нити небулина связаны с актином и, как полагают, регулируют сборку нитей актина, действуя как линейки, определяющие их длину.
Рисунок 11.20
Титин и небулин.Молекулы тайтина простираются от диска Z до линии M и действуют как пружины, удерживая миозиновые волокна в центре саркомера. Молекулы небулина отходят от Z диска и, как полагают, определяют длину связанных актиновых филаментов. (подробнее …)
Основой для понимания мышечного сокращения является модель скользящей нити , впервые предложенная в 1954 году Эндрю Хаксли и Ральфом Нидергерке, а также Хью Хаксли и Джин Хансон (). Во время сокращения мышцы каждый саркомер укорачивается, сближая Z-диски.Ширина полосы A не меняется, но и полосы I, и зона H почти полностью исчезают. Эти изменения объясняются скольжением актиновых и миозиновых нитей друг за другом, так что актиновые нити перемещаются в полосу А и зону Н. Таким образом, сокращение мышц является результатом взаимодействия актиновых и миозиновых нитей, которое вызывает их движение относительно друг друга. Молекулярной основой этого взаимодействия является связывание миозина с актиновыми филаментами, что позволяет миозину функционировать как двигатель, который управляет скольжением филаментов.
Рисунок 11.21
Модель мышечного сокращения со скользящими нитями. Нити актина скользят мимо миозиновых нитей к середине саркомера. В результате саркомер укорачивается без изменения длины нити.
Тип миозина, присутствующего в мышцах ( миозин II ), представляет собой очень большой белок (около 500 кДа), состоящий из двух идентичных тяжелых цепей (около 200 кДа каждая) и двух пар легких цепей (около 20 кДа каждая) ( ). Каждая тяжелая цепь состоит из области глобулярной головки и длинного α-спирального хвоста.Α-Спиральные хвосты двух тяжелых цепей закручиваются друг вокруг друга в структуру спиральной спирали с образованием димера, а две легкие цепи связываются с шейкой каждой области головы с образованием полной молекулы миозина II.
Рисунок 11.22
Миозин II. Молекула миозина II состоит из двух тяжелых цепей и двух пар легких цепей (называемых основными и регуляторными легкими цепями). Тяжелые цепи имеют шаровидные области головы и длинные α-спиральные хвосты, которые наматываются друг на друга (более…)
Толстые мышечные волокна состоят из нескольких сотен молекул миозина, связанных в параллельный шахматный массив посредством взаимодействий между их хвостами (). Шаровидные головки миозина связывают актин, образуя поперечные мостики между толстыми и тонкими нитями. Важно отметить, что ориентация молекул миозина в толстых филаментах меняется на противоположную по линии M саркомера. Полярность актиновых филаментов (которые прикреплены к Z-дискам своими плюс-концами) аналогично меняется на противоположную по линии M, поэтому относительная ориентация миозиновых и актиновых филаментов одинакова на обеих половинах саркомера.Как обсуждается ниже, двигательная активность миозина перемещает его головные группы вдоль актиновой нити в направлении положительного конца. Это движение сдвигает актиновые нити с обеих сторон саркомера к линии M, укорачивая саркомер и вызывая сокращение мышц.
Рисунок 11.23
Организация толстых нитей миозина. Толстые филаменты образованы объединением нескольких сотен молекул миозина II в шахматном порядке. Шаровидные головки миозина связывают актин, образуя поперечные мостики между миозиновыми и актиновыми филаментами.(Подробнее …)
Помимо связывания актина, миозиновые головки связывают и гидролизуют АТФ, который обеспечивает энергию для движения филаментов. Это преобразование химической энергии в движение опосредуется изменениями формы миозина в результате связывания АТФ. Общепринятая модель (модель качающегося поперечного моста) состоит в том, что гидролиз АТФ запускает повторяющиеся циклы взаимодействия между головками миозина и актином. Во время каждого цикла конформационные изменения миозина приводят к перемещению миозиновых головок по актиновым филаментам.
Хотя молекулярные механизмы до сих пор полностью не изучены, правдоподобная рабочая модель функции миозина была получена как из исследований in vitro движения миозина по актиновым филаментам (система, разработанная Джеймсом Спудичем и Майклом Шитцем), так и из определения трехмерная структура миозина Ивана Реймента и его коллег (). Цикл начинается с миозина (в отсутствие АТФ), прочно связанного с актином. Связывание АТФ диссоциирует комплекс миозин-актин, и гидролиз АТФ затем вызывает конформационное изменение миозина.Это изменение влияет на шейную область миозина, которая связывает легкие цепи (см.), Которая действует как рычаг, смещающий головку миозина примерно на 5 нм. Продукты гидролиза (АДФ и P и ) остаются связанными с миозиновой головкой, которая, как говорят, находится в «взведенном» положении. Затем миозиновая головка снова соединяется в новом положении на актиновой нити, что приводит к высвобождению АДФ и P и и запускает «силовой удар», при котором миозиновая головка возвращается к своей исходной конформации, тем самым сдвигая актин. нить к линии M саркомера.
Рисунок 11.24
Модель действия миозина. Связывание АТФ отделяет миозин от актина. Затем гидролиз АТФ вызывает конформационное изменение, которое вытесняет головную группу миозина. После этого происходит привязка миозиновой головки к новому положению на актиновой нити (подробнее …)
Сокращение скелетных мышц запускается нервными импульсами, которые стимулируют высвобождение Ca 2+ из саркоплазматического ретикулума. — специализированная сеть внутренних мембран, аналогичная эндоплазматическому ретикулуму, в которой хранятся высокие концентрации ионов Ca 2+ .Высвобождение Ca 2+ из саркоплазматического ретикулума увеличивает концентрацию Ca 2+ в цитозоле приблизительно с 10 -7 до 10 -5 M . Повышенная концентрация Ca 2+ сигнализирует о сокращении мышц за счет действия двух дополнительных белков, связанных с актиновыми филаментами: тропомиозина и тропонина (). Тропомиозин — это волокнистый белок, который связывается вдоль бороздки актиновых филаментов. В поперечно-полосатых мышцах каждая молекула тропомиозина связана с тропонином, который представляет собой комплекс из трех полипептидов: тропонина C (связывание Ca 2+ ), тропонин I (ингибирующий) и тропонин T (связывание тропомиозина).Когда концентрация Ca 2+ низкая, комплекс тропонинов с тропомиозином блокирует взаимодействие актина и миозина, поэтому мышца не сокращается. При высоких концентрациях связывание Ca 2+ с тропонином C сдвигает положение комплекса, снимая это ингибирование и позволяя сокращению продолжаться.
Рисунок 11.25
Ассоциация тропомиозина и тропонинов с актиновыми филаментами. (A) Тропомиозин связывается вдоль нитей актина и в поперечно-полосатой мышце связан с комплексом из трех тропонинов: тропонина I (TnI), тропонина C (TnC) и тропонина T (TnT).В (подробнее …)
Сократительные сборки актина и миозина в немышечных клетках
Сократительные сборки актина и миозина, похожие на мелкомасштабные версии мышечных волокон, присутствуют также в немышечных клетках. Как и в мышцах, актиновые филаменты в этих сократительных ансамблях пересекаются с биполярными филаментами миозина II, состоящими из 15-20 молекул миозина II, которые вызывают сокращение, сдвигая актиновые филаменты относительно друг друга (). Актиновые филаменты в сократительных пучках немышечных клеток также связаны с тропомиозином, который облегчает их взаимодействие с миозином II, вероятно, за счет конкуренции с филамином за сайты связывания на актине.
Рисунок 11.26
Сократительные узлы в немышечных клетках. Биполярные филаменты миозина II вызывают сокращение за счет скольжения актиновых филаментов в противоположных направлениях.
Два примера сократительных сборок в немышечных клетках, стрессовых волокнах и адгезионных поясах, обсуждались ранее относительно прикрепления актинового цитоскелета к областям межклеточных контактов и межклеточных контактов (см. И). Сокращение напряженных волокон создает напряжение в клетке, позволяя клетке тянуть за субстрат (например,g., внеклеточный матрикс), к которому он прикреплен. Сокращение адгезионных лент изменяет форму слоев эпителиальных клеток: процесс, который особенно важен во время эмбрионального развития, когда слои эпителиальных клеток складываются в такие структуры, как трубки.
Однако наиболее ярким примером сокращения актин-миозина в немышечных клетках является цитокинез — деление клетки на две после митоза (). К концу митоза в клетках животных сократительное кольцо, состоящее из актиновых филаментов и миозина II, собирается прямо под плазматической мембраной.Его сокращение постепенно тянет плазматическую мембрану внутрь, сужая центр клетки и сдавливая ее надвое. Интересно, что толщина сократительного кольца остается постоянной при его сокращении, это означает, что актиновые филаменты разбираются по мере сокращения. Затем кольцо полностью рассеивается после деления клетки.
Рисунок 11.27
Цитокинез. После завершения митоза (деления ядра) сократительное кольцо, состоящее из актиновых нитей и миозина II, делит клетку на две части.
Регулирование актин-миозинового сокращения в поперечно-полосатых мышцах, обсуждавшееся ранее, опосредуется связыванием Ca 2+ с тропонином. Однако в немышечных клетках и в гладких мышцах сокращение регулируется в первую очередь фосфорилированием одной из легких цепей миозина, называемой регуляторной легкой цепью (). Фосфорилирование регуляторной легкой цепи в этих клетках имеет по крайней мере два эффекта: оно способствует сборке миозина в филаменты и увеличивает каталитическую активность миозина, позволяя сокращению продолжаться.Фермент, который катализирует это фосфорилирование, называемый киназой легкой цепи миозина , сам регулируется путем ассоциации с кальмодулином, связывающимся с Ca 2+ . Увеличение цитозольного Ca 2+ способствует связыванию кальмодулина с киназой, что приводит к фосфорилированию регуляторной легкой цепи миозина. Таким образом, повышение цитозольного Ca 2+ , хотя и косвенно, отвечает за активацию миозина в гладкомышечных и немышечных клетках, а также в поперечно-полосатых мышцах.
Рисунок 11.28
Регулирование миозина путем фосфорилирования. Ca 2+ связывается с кальмодулином, который, в свою очередь, связывается с киназой легкой цепи миозина (КЛЦМ). Активный комплекс кальмодулин-КЛЦМ затем фосфорилирует регуляторную легкую цепь миозина II, превращая миозин из неактивного (подробнее …)
Нетрадиционные миозины
Помимо миозина II («традиционный» двуглавый миозин), есть несколько других типов миозина находятся в немышечных клетках. В отличие от миозина II, эти «нетрадиционные» миозины не образуют филаментов и, следовательно, не участвуют в сокращении.Однако они могут участвовать во множестве других видов клеточных движений, таких как транспорт мембранных пузырьков и органелл по актиновым филаментам, фагоцитоз и распространение псевдопод у амеб (см.).
Наиболее изученными из этих нетрадиционных миозинов являются члены семейства myosin I (). Белки миозина I содержат группу шаровидных головок, которая действует как молекулярный мотор, как у миозина II. Однако члены семейства миозина I представляют собой гораздо меньшие молекулы (около 110 кДа в клетках млекопитающих), которые лишены длинного хвоста миозина II и не образуют димеры.Вместо этого их хвосты могут связываться с другими структурами, такими как мембранные везикулы или органеллы. Затем движение миозина I вдоль актиновой нити может транспортировать прикрепленный к нему груз. Одна из функций миозина I, обсуждавшаяся ранее, состоит в формировании боковых плеч, которые связывают актиновые пучки с плазматической мембраной микроворсинок кишечника (см.). В этих структурах двигательная активность миозина I может перемещать плазматическую мембрану вдоль пучков актина к верхушке микроворсинки. Дополнительные функции миозина I могут заключаться в транспортировке пузырьков и органелл вдоль актиновых филаментов и в движении плазматической мембраны во время фагоцитоза и расширения псевдопод.
Рисунок 11.29
Миозин I. Миозин I содержит головную группу, подобную миозину II, но имеет сравнительно короткий хвост и не образует димеров или нитей. Хотя он не может вызывать сокращение, миозин I может двигаться по актиновым филаментам (к положительному концу), неся (подробнее …)
В дополнение к миозинам I и II, по крайней мере, 12 других классов нетрадиционных миозинов (с III по XIV) были идентифицированы. Некоторые из этих нетрадиционных миозинов являются двуглавыми, как миозин II, тогда как другие одноголовыми, как миозин I.Функции большинства этих нетрадиционных миозинов еще предстоит определить, но было ясно показано, что некоторые из них играют важную роль в движении органелл (миозины V и VI) и в сенсорных функциях, таких как зрение (миозин III) и слух (миозины VI и VII). ).
Cell Crawling
Ползание клеток по поверхности представляет собой базовую форму клеточного передвижения, используемую множеством различных типов клеток. Примеры включают перемещение амеб, миграцию эмбриональных клеток во время развития, вторжение лейкоцитов в ткани для борьбы с инфекцией, миграцию клеток, участвующих в заживлении ран, и распространение раковых клеток во время метастазирования злокачественных опухолей.Подобные типы движения также ответственны за фагоцитоз и за расширение процессов нервных клеток во время развития нервной системы. Все эти движения основаны на динамических свойствах актинового цитоскелета, хотя подробные задействованные механизмы еще предстоит полностью понять.
Сканирование ячеек включает в себя скоординированный цикл движений, который можно разделить на три этапа. Во-первых, от переднего края клетки должны выходить такие выступы, как псевдоподии, ламеллиподии или микрошипы (см.) ().Во-вторых, эти расширения должны прикрепляться к субстрату, по которому перемещается клетка. Наконец, задний край клетки должен отделяться от субстрата и втягиваться в тело клетки.
Рисунок 11.30
Сканирование ячеек. Ползание клеток по поверхности можно рассматривать как три этапа скоординированных движений: (1) расширение переднего края, (2) прикрепление переднего края к субстрату и (3) втягивание задней части клетки. (подробнее …)
Различные эксперименты показывают, что расширение переднего края включает полимеризацию и сшивание актиновых филаментов.Например, ингибирование полимеризации актина (например, обработкой цитохалазином) блокирует образование выступов на клеточной поверхности. Регулируемый оборот актиновых филаментов, как показано на фиг., Ведет к расширению таких процессов, как филоподии и ламеллиподии на переднем крае клетки, и как кофилин, так и белки Arp2 / 3, по-видимому, участвуют в этом процессе. Нетрадиционные миозины могут также участвовать в расширении отростков на переднем крае: миозин I необходим для расширения псевдоподий у амебы Dictyostelium и Myosin V для расширения филоподий в нейронах.
Следуя своему расширению, выступы от переднего края должны прикрепляться к субстрату, чтобы функционировать при перемещении клеток. Для медленно движущихся клеток, например фибробластов, прикрепление предполагает образование очаговых спаек (см.). Более быстро движущиеся клетки, такие как амебы или белые кровяные тельца, образуют более диффузные контакты с субстратом, молекулярный состав которого неизвестен.
Третий этап обхода ячеек, втягивание задней кромки, является наименее понятным.Прикрепления задней кромки к субстрату нарушаются, и задняя часть клетки отскакивает в тело клетки. Этот процесс, по-видимому, требует развития напряжения между передней и задней частью клетки, создавая сократительную силу, которая в конечном итоге тянет заднюю часть клетки вперед. Этот аспект клеточной локомоции нарушен у мутантов Dictyostelium , лишенных миозина II, что согласуется с ролью миозина II в сокращении актиновой коры и генерировании силы, необходимой для втягивания заднего края.
Механотрансдукция в скелетных мышцах
Abstract
Механические сигналы имеют решающее значение для развития и поддержания скелетных мышц, но механизмы, которые преобразуют эти изменения формы в биохимические сигналы, неизвестны. Когда на мышцу накладывается деформация, изменения в клеточных и молекулярных конформациях связывают механические силы с биохимическими сигналами, и тесная интеграция механических сигналов с электрическими, метаболическими и гормональными сигналами может замаскировать аспект реакции, специфичный для механические силы.Механически индуцированное конформационное изменение может напрямую активировать передачу сигналов ниже по течению и может запускать системы мессенджеров для активации передачи сигналов косвенно. Основные эффекторы механотрансдукции включают повсеместную митоген-активированную протеинкиназу (MAP) и фосфатидилинозитол-3 ’киназу (PI-3K), которые имеют хорошо описанные рецептор-зависимые каскады, но цепочка событий, ведущих от механической стимуляции к биохимическому каскаду, не ясна. В этом обзоре обсуждается механика биологической деформации, нагрузки клеточных и молекулярных структур, а также некоторые из основных сигнальных механизмов, связанных с механотрансдукцией.
Ключевые слова: Скелетная мышца, механотрансдукция, растяжение
2. ВВЕДЕНИЕ
Обнаружение физических сил и реакция на них важны для всех клеток, но особенно актуальны для тех, которые играют фундаментально механическую роль. Изначальная природа клеточного взаимодействия с физическим миром предполагает, что его контроль должен быть строго регулируемым и специфическим, и что реакция должна включать многие аспекты клеточной физиологии. Пути, участвующие в обнаружении и производстве сил в мышцах, перекрывают те, которые участвуют в определении доступности питательных веществ (1, 2), внутриклеточного энергетического статуса (3, 4) и окислительного статуса (5, 6).Сигнальные пути, модулируемые силой, инсулином и инсулиноподобным фактором роста I (IGF-I) (7), аденозинмонофосфат (AMP) зависимой киназой (AMPK) (8), активными формами кислорода (ROS) (9) и простагландинами (PG) (10) кажутся неразрывно связанными.
Адаптация скелетных мышц к механическим сигналам была широко описана, и заинтересованный читатель может отсылать к нескольким недавним обзорам (11-14). Физиологическое увеличение способности генерировать силу, связанное с активностью, и увеличение гибкости, связанное с растяжкой, были признаны в древности, но механизмы, с помощью которых проявляются эти изменения, до сих пор неясны.Настоящее намерение состоит в том, чтобы рассмотреть изменения формы и силы, связанные с механическими сигналами, и сопоставить их с наблюдаемыми изменениями в биохимической передаче сигналов, чтобы определить, что может способствовать клеточному восприятию механических сигналов.
Тщательное рассмотрение механической среды — первый шаг к тому, чтобы разобраться в этом лабиринте сигнализации. Когда кто-то рассматривает механизмы, с помощью которых можно почувствовать механическую среду, принято думать о «силе» и «деформации» по отдельности.Иногда это различие правомерно, но иногда оно может скрывать лежащие в основе физические отношения. У упругой стальной пружины есть фиксированное соотношение между силой и деформацией: для получения любой желаемой деформации сила точно указывается, а для получения любой желаемой силы точно указывается деформация. Напротив, форма вязкоупругих полимеров, таких как Gortex или Silly Putty, зависит как от приложенной силы, так и от того, как долго эта сила прилагается. Биологические ткани могут проявлять оба типа поведения.
Это разделение между «силой» и «деформацией» усиливается в скелетных мышцах из-за особого свойства активной сократительной матрицы. Активное состояние означает, что мышечное волокно может иметь такую же форму, будучи подверженным ряду внешних сил. Как и в случае искусственных механических систем, некоторые молекулы и структуры внутри клетки будут иметь конформацию, определяемую формой клетки, в то время как конформация других молекул будет зависеть от состояния нагрузки, даже если вся клетка будет принудительно чтобы сохранить ту же форму.Уровень генерации активной силы в мышечном волокне зависит от внутриклеточного кальция (15), но сократительный матрикс закреплен на внеклеточном матриксе через сеть растяжимых промежуточных филаментов, молекул адгезии и дополнительных белков (14, 16). Во время создания силы укорачивание сократительной матрицы может происходить за счет удлинения элементов якорной сети.
Повышенная сила — не единственная особенность активного состояния. Генерация активного напряжения требует огромных затрат химической энергии и, следовательно, изменяет концентрацию мощных регуляторов функции клетки, включая аденозинмоно- и трифосфат (АМФ, АТФ), АФК и промежуточные звенья цикла трикарбоновой кислоты (ТСА) (17). .Генерация силы регулируется кальцием и может увеличивать внутриклеточную концентрацию этого повсеместного регулятора в 100 раз. Сложные отношения между формой мышц, силой, метаболическим статусом и кальциевым статусом очень затрудняют абстрагирование механотрансдукции от более широкого контекста клетки. Важно точно распознать, какие аспекты «силы» действительно задействованы в том или ином конкретном наблюдении. В этом обзоре будут изучены пути передачи силы, последующие клеточные и молекулярные деформации и сопутствующие механизмы передачи сигналов.Будут выделены точки взаимодействия с другими основными сигнальными механизмами.
3. ПРИМЕНЕНИЕ ДЕФОРМАЦИИ
3.1 Механические концепции
Чтобы наиболее четко описать механику деформации ячеек, в этом обзоре будут использоваться строгие определения механических концепций. Эта терминология несет в себе определенные значения, которые могут немного отличаться от разговорного использования, и имеет смысл выражать конкретные предполагаемые значения. Сила — это нагрузка, приложенная к конструкции, которая измеряется в ньютонах (Н).Напряжение — это сила, нормализованная к площади, на которую она действует, и измеряется в ньютонах на квадратный метр или паскалях (Па). Это означает, что и сила, и поверхность необходимы для определения напряжения, которое имеет важное следствие, заключающееся в том, что сила (или ее компоненты) могут быть либо перпендикулярными к поверхности, либо в плоскости поверхности. Составляющая силы, перпендикулярная поверхности, на которую она действует, создает растягивающее или сжимающее напряжение, в зависимости от направления, в то время как компоненты силы в плоскости поверхности создают напряжения сдвига.
Различие между напряжением сдвига и растяжения важно. Нагрузка на растяжение и предел прочности на разрыв — простые, знакомые концепции. Канаты нагружены при растяжении, и их прочность определяется пределом прочности на разрыв составляющих волокон. Эта веревка получает свою гибкость из-за способности этих жестких волокон скользить относительно друг друга. Расположение волокон каната приводит к образованию структуры, которая имеет сильное растяжение из-за прочности отдельных волокон, но слабое при сдвиге из-за отсутствия связи между соседними волокнами.Соединительная ткань и спайки, которые закрепляют клетку, относительно сильны при сдвиге, но относительно слабы при растяжении, благодаря чему миофибриллы легче отделяются при отслаивании, чем при скольжении (18, 19).
Деформация — это грубое изменение формы объекта, измеряемое в метрах (м), или, как правило, в сотовых системах — очень небольшой его части. Деформация — это деформация, приведенная к начальному размеру объекта и технически не имеющая единиц измерения, хотя ее обычно выражают в «микродеформациях» (10 -3 м / м) или в «процентах» (10 -2 м). / м).Наиболее известная деформация возникает в результате растягивающего напряжения и проявляется в изменении длины объекта. Деформация, возникающая в результате напряжения сдвига, вызывает деформацию скручивания, которая обычно описывается как изменение угла, что означает, что квадрат в состоянии покоя становится параллелограммом под действием напряжения сдвига. Деформации сдвига связаны с изменением формы без изменения объема. Многие материалы, включая мышцы, деформируются с постоянным объемом. Если мышца подвергается напряжению в одном направлении, в ней возникают внутренние напряжения, вызывающие сжатие в перпендикулярной плоскости.Напротив, сжимающие напряжения в поперечной плоскости создают внутренние напряжения, вызывающие удлинение.
Ткани деформируются только в ответ на некоторую силу, приложенную либо изнутри, либо извне, и важно точно учитывать, какие силы действуют на мышцу или мышечную клетку, а также путь, по которому эти силы действуют на клетку. И деформация, и способ приложения силы могут резко отличаться между неповрежденными мышцами и изолированными или культивированными волокнами.
3.2 Модели механической стимуляции
Методы, которые можно использовать для деформации или приложения силы к мышечным клеткам, практически безграничны, но этот обзор будет сосредоточен на трех наиболее распространенных темах. Самый важный метод деформации — это метод, который происходит in vivo, , в интактной системе, который будет обозначаться как « in vivo ». Модель in vitro , которая, вероятно, наиболее точно имитирует эту деформацию, представляет собой изолированный мышечный препарат, который будет называться «изолированной мышцей».Системы культивирования незрелых мышечных трубок, полученные из клеток-предшественников мышц и поддерживаемые на эластичном субстрате, являются общими моделями и будут называться «моделями культивирования». Также следует отметить, но не должны рассматриваться в настоящей работе, отдельные волокна, изолированные путем ферментативной диссоциации или микродиссекции, которые лишены гомогенизирующего влияния соседних клеток или субстрата, и трехмерные культуры, полученные из клеток-предшественников мышц, встроенных в обширную искусственная матрица, и свойства матрицы могут доминировать над механическим откликом.
Система in vivo довольно сложна. Любая конкретная мышца подвергается нагрузкам, передаваемым через ее сухожилия, через распределенные прикрепления к кости, через давления, возникающие при контакте с костью, фасциальными структурами и другими мышцами, а также через адгезию соединительной ткани к прилегающим тканям, что в последнее время называется передачей миофасциальной силы ( 20, 21). Детали деформации в этих условиях будут широко варьироваться среди мышц, будут зависеть от состояния, i.е. активации близлежащих мышц и практически не поддается лечению. Ограниченное прямое измерение деформации мышц во время создания силы, обычно ограниченное двухмерным анализом, демонстрирует эту сложность (22, 23). В общем, мышца in vivo будет подвергаться значительным поперечным нагрузкам и нагрузкам изгиба, которые не присутствуют изолированно, в дополнение к нагрузкам и деформациям изолированной мышцы, все из которых могут усиливаться или ослабляться напряжениями сдвига, возникающими в результате объединения. с прилегающими тканями.
Хотя отдельные волокна обычно укорачиваются во время создания силы, они также могут скручиваться и вращаться (24, 25). Деформации всей мышцы чрезвычайно трудно определить количественно напрямую, хотя экспериментальные наблюдения начинают появляться (23, 24). Несколько авторов представили континуальные или конечно-элементные модели мышц во время генерации силы (26-29). Каждая из этих моделей подтверждает, что распределение деформации внутри мышцы неравномерно и что деформации сдвига, как параллельные, так и перпендикулярные оси волокна, вносят свой вклад в общую деформацию ().
Чрезмерные деформации мышц (A), одноосное растяжение (B) и двухосное растяжение (C) на макроскопическом уровне (верхний ряд) и клеточном уровне (нижний ряд). Безнапряженное состояние показано пунктирными линиями, а деформированное состояние — соответствующими сплошными линиями. Растяжение веретенообразной мышцы (A) вызывает удлинение, а внутренние напряжения приводят к поперечному сужению, что в целом связано с зависимым от формы распределением деформаций сдвига. Эти деформации возникают в трех измерениях и не требуют внешнего сжатия.Одноосное натяжение, приложенное к упругой мембране, жестко закрепленной на ее концах (B), также вызывает удлинение вдоль этой оси, сжатие в поперечном направлении и сдвиг в плоскости. Степень поперечного сужения определяется свойствами субстрата и может вызывать дополнительные внешние напряжения прилипших клеток. Точная деформация зависит от ориентации ячейки относительно оси растяжения, и проиллюстрированный случай относится к волокну, идеально выровненному с осью растяжения.Равноосное растяжение расширяет ячейку одинаково в обоих плоских размерах без сдвига (C). Деформация клетки не зависит от ориентации.
Режим нагрузки, который наиболее быстро приходит на ум в мышцах, — это нагрузка, вызванная созданием активной силы. Сила, создаваемая действием актина и миозина, объединяется жесткими креплениями на Z-дисках, а Z-диски связаны с цитоскелетом как вдоль, так и перпендикулярно оси волокна (30, 31). Хотя есть четкие морфологические особенности мышечно-сухожильного сочленения, которые предполагают, что он играет важную роль в передаче этой силы на внеклеточный матрикс (ВКМ) и сухожилие (32, 33), также ясно, что передача силы сдвигом, что часто называют как «передача боковой силы» способствует передаче всей мышечной силы (19, 34).Наличие эластичной ткани, будь то сухожилие, апоневроз или перимизий, последовательно с сократительной тканью означает, что генерация активной силы приведет к укорочению миофибрилл во время активации фиксированной конечной точки (35, 36) и, возможно, во время активации удлинения (37, 38). . Это означает, что номинально изометрические активации связаны с отрицательной или сжимающей деформацией по сравнению с пассивным состоянием и подчеркивают осторожность, необходимую при расшифровке силы и растяжения в мышцах. Вполне возможно, что «растяжение» во время создания большой силы будет связано с уменьшением длины, в то время как для создания аналогичных уровней силы в пассивной мышце требуется экстремальное растяжение, часто выходящее за рамки физиологического диапазона.
Сжимающие нагрузки могут участвовать в деформации, особенно расслабленной мышцы. Хотя тайтин широко признан как основной фактор, влияющий на жесткость отдельных волокон, его вклад в жесткость всей мышцы менее очевиден (39). Механические свойства внутримышечной соединительной ткани особенно трудно определить, поэтому распределение пассивного напряжения между пассивными миофибриллами и матрицей практически невозможно оценить (40-42). Структура этого пассивного матрикса представляет собой сплетенную сеть жестких коллагеновых фибрилл, а механическое поведение расслабленных мышц согласуется с переориентацией этого матрикса вокруг изоволюмических миофибрилл (42, 43), предполагая, что передача нагрузки на пассивные мышечные волокна может быть аналог китайской ловушки для пальцев.Этот механизм является основой «искусственной мышцы» Мак-Киббена, которая использует тканевую сетку для преобразования давления в надувном пузыре в натяжение (44, 45), и Гален предложил его в качестве механизма действия мышц почти 2000 лет назад. Актуальность этого механизма для настоящей темы состоит в том, что он предполагает, что волокна могут подвергаться деформации удлинения в результате поперечных сжимающих сил, а не растяжения или сдвига в результате молекулярных адгезий. Также стоит отметить, что это иллюстрация «тенсегрити», идеи о том, что локальные изменения формы структуры зависят от глобальной интеграции этой структуры (46, 47).
Главной особенностью, которая отличает цельную мышцу от культивируемых мышечных трубок, является интеграция с трехмерным (3-D) внеклеточным матриксом и обширные связи между соседними волокнами. Эта механическая интеграция приводит к гомогенизирующим деформациям, а это означает, что градиенты изменения формы будут меньше, чем они могли бы быть в изолированном волокне. Целая мышца больше похожа на армированный волокнами композит, чем на связку спагетти (19, 42). На механические свойства всей мышцы будут влиять объемные доли и свойства ECM, пассивных и активных волокон.По оси волокон материаловедческий анализ показывает, что напряжение, воспринимаемое каждой группой, будет пропорционально ее жесткости и объемной доле (48), что означает, что очень небольшое напряжение будет передаваться пассивным волокнам в частично активированной мышце. . Возможно даже, что из-за внутримышечного давления, создаваемого активными волокнами (28), основная нагрузка, которую несут пассивные волокна, представляет собой поперечное сжатие, а не осевое растяжение.
Модели нагрузки культуры отличаются от модели in vivo и изолированной нагрузки на мышцы как в биологическом, так и в геометрическом аспектах.Клеточные адгезии динамичны, и ремоделирование этих адгезий может способствовать быстрой релаксации клеток, подвергшихся статическому растяжению в культуре (49). Хотя это ремоделирование не является уникальным для моделей культуры, свобода волокна перемещаться относительно его прикреплений есть. Кроме того, сила передается от мышечного волокна к окружающей ткани по всей его поверхности, где сила передается культивируемой клетке только вдоль базальной поверхности через ее прикрепление к субстрату, что может вызвать крутой градиент напряжения сдвига, отсутствующий в целая мышца.Прилипшая клетка будет быстро сокращаться, если эти адгезии нарушены, что позволяет предположить, что субстрат выдерживает высокое напряжение даже на номинально покоящихся культурах, наблюдение, которое поддерживает модель тенсегрити клеточной структуры (47). Культуры, поддерживаемые в течение любого периода времени, будут синтезировать и собирать свои собственные ECM (50), но структура этого матрикса и его роль в стабилизации клетки во время деформации не ясны. Фактически, трехмерная деформация, которой подвергается клетка при деформации своей подложки, не ясна.
Различные системы культивирования клеток являются привлекательными моделями для изучения механотрансдукции, и путь, по которому сила и деформация передаются прикрепленным клеткам, относительно ясен. Клетки, растущие на поверхности эластичной мембраны, прикрепляются к этой мембране через молекулы адгезии (дистрогликан, интегрины, и т.д., ), которые связывают цитоскелет с молекулами ЕСМ, прикрепленными к мембране. Деформация мембраны перемещает молекулы ЕСМ, что вызывает сдвигающее усилие на молекулы адгезии и напряжение в цитоскелете, деформируя клетку.Это привлекательная модель, потому что она имитирует ожидаемые пути передачи силы, используемые во время генерации силы во всей мышце.
Субстрат, к которому прилипают культивируемые клетки, значительно более жесткий, чем сами клетки. Это несоответствие жесткости означает, что деформация определяется субстратом, а не клетками, и системы нагрузки на основе культуры, включая одноосные системы, ограничивают оба размера адгезионной поверхности, которая может двигаться совершенно иначе, чем in vivo или изолированная мышца деформация.В культуре базальная поверхность претерпевает очень ту же деформацию, что и эластичный субстрат (), но обращенная к среде поверхность, которая не испытывает напряжения сдвига, может быть другой. Чтобы клетка оставалась изоволюмической во время растяжения, она должна сжиматься по своему единственному свободному измерению. Это резко контрастирует с растяжением in vivo , в котором окружающие клетки плохо сопротивляются поперечному сжатию, что приводит к деформации, которая задана в одном измерении, но относительно свободна в ортогональной плоскости.Можно ожидать, что клетки, подвергнутые растяжению в двумерной культуральной системе, будут подвергаться необычным поперечным деформациям.
Общие парадигмы нагружения в культуре можно разделить на одноосные и двухосные, включая особый случай равноосного растяжения, основанного на значительной приложенной деформации. Одноосные системы применяют растяжение вдоль номинальной одной оси, обычно за счет натяжения за концы листа силиконовой резины. Если края подложки не стеснены, внутренние напряжения, возникающие в подложке, вызывают поперечное сужение, а также могут вызывать деформацию сдвига (51).Если свойства материала субстрата не соответствуют свойствам прикрепленных клеток, поперечное сужение мембраны будет оказывать поперечное напряжение на клетку в дополнение к номинальному одноосному напряжению. Миотрубки трансверсально изотропны, что означает, что они различаются по своей длинной оси, а не по диаметру, и можно было бы ожидать другого клеточного ответа на растяжение вдоль, а не поперек этой оси (52). В двухосных системах большие деформации возникают в двух измерениях, часто за счет приложения давления к силиконовой мембране, закрепленной как пластина барабана.Деформация в этом случае может быть достаточно сложной (53) и может варьироваться по поверхности культуры. В частном случае, когда давление прикладывается большим плоским индентором, деформации равны как в радиальном, так и в тангенциальном направлениях, и рисунок называется равноосным (54). Особенностью равноосных деформаций является отсутствие ориентации в плоскости, так что миотрубка, прикрепленная в любом направлении, подвергается одинаковому изменению формы.
4. КЛЕТОЧНАЯ ДЕФОРМАЦИЯ
Клеточная или молекулярная деформация является критическим событием, включающим механотрансдукцию.Чтобы сигнализировать о механическом возмущении, должно быть что-то, что претерпевает изменение, связанное с возмущением. Это кажется тривиальным наблюдением, но оно дает основу для рассмотрения потенциальных датчиков. Наиболее очевидные механические изменения в скелетных мышцах связаны с адгезивными комплексами и сократительным аппаратом, но сарколемма и цитоскелет также деформируются, и определенные молекулы, вероятно, будут подвергаться растяжению, вызванному нагрузкой.
Молекулярные пути, с помощью которых сила передается от ЕСМ к цитоскелету и сократительному аппарату, подробно рассмотрены в других работах (16, 19).Обычно считается, что передача силы происходит в основном через специализированные структуры, костамеры или фокальные адгезии, которые богаты как адгезионными, так и сигнальными молекулами (55, 56). Основными молекулами адгезии в скелетных мышцах являются дистрогликан и интегрин, оба из которых являются рецепторами ламинина (57, 58). Связывание дистрогликана или интегрина с их мишенями ECM одновременно вызывает конденсацию фокальной адгезионной бляшки и полимеризацию сети ECM (57, 59).Адгезионные бляшки соединяются с сократительной матрицей через сеть промежуточных нитей (16), хотя сократительная матрица обычно плохо развивается в культуральных моделях. Обширная сеть биохимических сигналов, включая митоген-активированные протеинкиназы (MAPK) и фосфатидилинозитол-3′-киназу (PI-3K), связана с лигированием интегрина (46, 60), и эта передача сигналов модулируется деформацией и приложенной нагрузкой (61, 62).
Сократительный аппарат является наиболее заметной структурой мышечного волокна и может быть хорошим маркером деформации тела клетки.Встречающиеся друг с другом массивы толстых и тонких нитей жестко иммобилизованы M- и Z-дисками соответственно, а толстые нити прикреплены тайтином к Z-диску. По мере удлинения волокна нити скользят относительно друг друга. Титин связывает как толстые нити, так и Z-диск, нагружается и удлиняется по мере удлинения саркомера (41, 63). Есть некоторые свидетельства того, что члены семейства белков с анкириновыми повторами (ARP) могут перемещаться путем растяжения от тайтина к ядру (64), где они образуют комплексы с факторами транскрипции YB-1 и p53 (64, 65).
Если прикреплены какие-либо перемычки, легкость скольжения в диапазонах A и I будет уменьшена. Напряжение будет развиваться в миофиламентах, M- и Z-дисках и молекулах, которые закрепляют эти структуры на внеклеточном матриксе, в то время как другие структуры, включая тайтин, могут быть защищены от деформации. И толстые, и тонкие филаменты умеренно растяжимы (66, 67), а сложные структуры M- и Z-дисков содержат ряд биологически активных молекул (68, 69), активность или локализация которых может модулироваться механическими сигналами. (70, 71).Матрикс саркомера прикреплен к внеклеточному матриксу с помощью адгезии, содержащей как интегрины, так и дистрогликаны (72, 73), и механическая нагрузка может запускать активацию передачи сигналов, связанных с этими комплексами.
Механика говорит нам, что деформация изгиба должна сопровождаться изгибающим моментом, а сила сдвига должна сопровождать неоднородный изгибающий момент. В мышечном волокне это означает, что миофибриллы на выпуклой стороне волокна будут испытывать немного большее напряжение, чем миофибриллы на вогнутой стороне.Это означает, что будет действовать поперечная сила, перпендикулярная оси волокна. Обе эти нагрузки имеют тенденцию разделять соседние миофибриллы, но Z-диски соседних миофибрилл поддерживают согласованный реестр в широком диапазоне длин саркомеров (74, 75). Промежуточный филамент десмин, который связывает соседние Z-диски (76), необходим для поддержания реестра саркомеров во время генерации силы (74), что предполагает, что десмин подвергается нагрузке и растяжению во время деформации клетки, но не требуется для индуцированного растяжения. рост (77).
Деформация сарколеммы, по-видимому, сильно локализована, предлагая возможность того, что даже небольшие деформации целой клетки могут вызвать драматические, но сильно локализованные изменения формы сарколеммы и цитоскелета (75). Белки в сарколемме, в первую очередь катионные каналы, активируемые растяжением, могут быть деформированы за счет натяжения мембраны, что позволяет создавать токи транссарколеммы и селективный приток ионов. Растяжение и генерация силы также связаны с временным увеличением проницаемости сарколеммы (78, 79), что согласуется с физическим разрушением сарколеммы клетки (80, 81).Сама сарколемма представляет собой извилистую структуру, покрытую глубокими складками и впячиваниями (56, 75, 82). Эти структуры становятся менее заметными дискретным, квантовым образом при большей длине саркомера (75, 83) и связаны с тонким покрытием кавеолина (84), которое может быть механизмом преобразования механической деформации в активацию киназы (85, 86). Также утверждалось, что клеточные деформации могут осуществляться без каких-либо изменений в площади клеточной поверхности (43), что является экономным с учетом относительной нерастяжимости липидного бислоя.Это не означает, что липидный бислой не деформируется, но что сам бислой будет поддерживать только небольшую величину расширения площади (87) по сравнению с растяжимостью волокнистых белков.
5. СИГНАЛЬНЫЕ КАСКАДЫ
Эти соображения показывают, что существует много способов, с помощью которых деформация миофибрилл может быть преобразована в биохимический сигнал. Вдали от этого исходного триггера механическая передача сигналов была связана с ростом мышц, повышенным синтезом белка, активацией сателлитных клеток и высвобождением факторов роста (12, 13).Процесс перекрывается с метаболической сигнализацией, сигнализацией потенциала действия и окислительной сигнализацией, каждый из которых может модулироваться как часть механического опыта клетки. Несколько основных сигнальных каскадов участвуют в продолжительном ответе на механические сигналы, включая PI-3K, различные MAPK, кальций, через кальмодулин (CaM) и кальциневрин (Cn), киназу гликогенсинтазы (GSK) и киназу, активированную AMP (AMPK) (4 , 8, 88-90). Эти каскады можно рассматривать как нижестоящие эффекторы события механотрансдукции, и их анализ может выявить нити взаимодействия.
5.1 PI-3K
Синтез из литературы предполагает, что PI-3K играет центральную роль в контроле роста клеток (). Каноническая PI-3K представляет собой димерную инозитолкиназу, состоящую из регуляторной субъединицы 85 кДа (p85) и каталитической субъединицы 110 кДа (p110), и действует несколькими путями для увеличения скорости синтеза белка. Субъединица p85 рекрутируется в активированные рецепторные тирозинкиназы (RTK) с помощью домена гомологии src (Sh3), и это связывание увеличивает киназную активность субъединицы p110 (91).Активный PI-3K фосфорилирует 3 ’углерод инозитольной группы инозитолфолипидов и, будучи наиболее активным по отношению к PI-4,5-P 2 , увеличивает плотность сарколеммы PI-3,4,5P 3 . PIP3 привлекает вторичные киназы в сарколемму через их домены гомологии плекстрина (PH), в частности серин / треонинкиназы, фосфоинозитид-зависимую киназу 1 (PDK1), интегрин-связанную киназу (ILK) и протеинкиназу B (PKB или Akt).
Передача сигналов через каскад PLA2. Механическая или электрическая стимуляция увеличивает внутриклеточный кальций, который активирует cPLA2.PLA2 генерирует АК и лизофосфатидилхолин (LPC), которые могут запускать высвобождение факторов роста. АА метаболизируется до PGE2 и PGF2a, которые действуют через рецепторы FP, увеличивая активность PI-3K, MAPK и PLC, что приводит к росту.
PDK1 фосфорилирует членов киназ семейства AGC, включая PKB, циклические-AMP и -GMP-зависимые киназы (PKA и PKG) и протеинкиназу C (PKC), но важно помнить, что его действие пространственно ограничено по ассоциации с сарколеммой.Одной из ключевых мишеней PDK1 является киназа субъединицы S6 рибосомы 70 кДа (p70S6K), которая фосфорилируется на Thr229 с помощью PDK1 (92). В свою очередь, фосфорилирование p70S6K рибосомной субъединицы S6 увеличивает эффективность трансляции мРНК, содержащих 5’-тракт олигопиримидинов (5’-TOP), который включает большую часть аппарата трансляции (93).
Активность PKB зависит от фосфорилирования Thr308 с помощью PDK1 (94) и Ser473 с помощью интегрин-связанной киназы (ILK) (95) и канонически фосфорилирует мишень рапамицина (mTOR) и киназы гликогенсинтазы (GSK3) у млекопитающих.MTOR был описан как связующее звено контроля трансляции (96, 97), будучи вовлеченным в фосфорилирование связывающего белка eIF4E (4E-BP или PHAS-1), p70S6K (98) и киназы eEF2 (99). In vivo элементы каскада PI-3K активируются инсулином и IGF-1, упражнениями и генерацией силы и регулируются нутриентным и окислительным статусом (4, 96, 100-102). В изолированной мышце механическое растяжение может приводить к фосфорилированию эффекторов PI-3K без фосфорилирования PKB или mTOR (103).Наблюдение за тем, что mTOR может фосфорилироваться с помощью p70S6K, напоминает нам, что этот каскад не является строгой линейной цепью (104). Есть веские основания полагать, что mTOR и его непосредственные эффекторы являются ключевыми модуляторами клеточного роста (96, 100, 101), но механизм, с помощью которого механические нагрузки активируют каскад, не ясен. Некоторые авторы продемонстрировали, что растяжение связано с активацией IGF-1, мощным стимулятором PI-3K, и что кондиционированная среда может имитировать эффекты растяжения (7, 105, 106), предполагая, что вызванная растяжением активация PI- 3K может быть вторичным эффектом высвобождения фактора роста.Другие продемонстрировали, что кондиционированная среда неадекватна или что активация p70S6K не зависит от PI-3K (88, 107). Отчасти это несоответствие, вероятно, происходит из-за условий культивирования, поскольку совсем не ясно, достаточно ли количества IGF-1 или других диффундирующих факторов, высвобождаемых из клеток во время растяжения, для повышения концентрации в кондиционированной среде до биологически активных уровней. Отчасти это несоответствие может быть результатом условий растяжения, поскольку результаты одноосного и двухосного растяжения часто отличаются (52, 107).
Помимо стимуляции процессов, способствующих росту, активный PKB подавляет дегенеративные и апоптотические процессы. Нижестоящие эффекторы PKB включают семейство факторов транскрипции forkhead (FOXO) (108), которые инактивируются PKB, снижая экспрессию мышечных убиквитинлигаз, мышечного белка безымянного пальца (MuRF) и мышечного атрогеноподобного белка F-бокса ( Mafbx) (109). Фосфорилирование PKB также приводит к фосфорилированию BAD и подавлению апоптоза в эндотелиальных клетках (110).
Одно из возникающих взаимодействий между каноническим, активируемым рецептором каскадом PI-3K и механическими силами включает интегрин-связанную киназу (ILK) и фосфатазу и гомолог тензина, обнаруженные на хромосоме 10 (PTEN, также известный как MMAC1). ILK связывает β1-хвосты лиганд-связанных интегринов и PIP 3 , что делает его привлекательным интегратором механической и гормональной передачи сигналов (111). PTEN и родственная Sh3-содержащая инозитол-5 ’фосфатаза (SHIP) дефосфорилирует PIP 3 , противодействуя PI-3K (112, 113), но также дефосфорилирует FAK (114, 115).PTEN широко изучается в области рака, где инактивирующие мутации признаны триггером трансформации клеток и неограниченного роста (112), а недавнее подавление PTEN, специфичное для мышц, модулирует стимулированное инсулином фосфорилирование PKB специфическим для типа волокон способом (116). . В отсутствие PTEN активации ILK достаточно для активации Akt (117), что позволяет предположить, что PI-3K и интегрины взаимодействуют в контроле этого каскада. Сходным образом сверхэкспрессия PTEN ингибирует активность ILK и способствует разборке фокальных спаек (115, 118).PTEN также считается негативным регулятором механически индуцированных митоген-активированных протеинов (MAP) киназ (119, 120). Хотя регуляция активности PTEN осуществляется в основном на уровне транскрипции (121), она, по-видимому, ингибируется обратимой окислительной модификацией (122), обеспечивая механизм, связывающий окислительный стресс с механической передачей сигналов.
5.2 MAP-киназы
MAP-киназы представляют собой разнообразное семейство, канонически представленное киназами, регулируемыми внеклеточными сигналами (ERK), N-концевыми киназами c-jun (JNK) и p38 MAPK, и характеризуются триплексным каскадом MAP-киназ. киназа киназы (MEKK), киназа MAP (MAPKK или MEK) и киназа MAP (123).
Рецептор-опосредованная активация ERK инициируется рекрутированием Shc, белка 2, связанного с рецептором фактора роста (Grb2), и его сына-младшего (Sos) к фосфорилированным остаткам тирозина (124). Этот комплекс способствует обмену нуклеотидов на ras и последовательному фосфорилированию raf (MEKK), MEK и ERK (125). Активация Raf также может осуществляться множеством механизмов, включая протеинкиназу C и фосфолипазу A2 (PLA2). Канонически активная ERK перемещается в ядро и фосфорилирует факторы транскрипции, включая c-Myc, c-Jun, c-Fos и Elk-1, но также может фосфорилировать биологически активные цитоплазматические мишени, включая PLA2, p90S6K и белок, активированный киназой MAP. киназы (MAPKAP) (126).После лигирования интегрина shc также может быть задействован в фосфорилированной киназе фокальной адгезии (FAK), а PTEN блокирует каскад выше MEK (120). ERK быстро фосфорилируется и активируется после механических событий (89, 127), но он также реагирует на окислительный стресс (128) и кальций через PKC. ERK, особенно p42 / p44, обладают потенциалом интеграции механических, метаболических сигналов и сигналов активности.
Канонический каскад JNK связывает рецептор с активацией MEKK с помощью адапторного комплекса, состоящего либо из ASK и TRAF, либо из Mck и Rho.Киназы смешанного происхождения (MLK), ASK и другие затем фосфорилируют MKK7 или MKK4, которые фосфорилируют JNK (129). Субстраты для JNK включают элементы AP-1, JunD и p53 (129), поэтому существует большое функциональное перекрытие между семействами JNK и ERK. JNK канонически активируется воспалительными цитокинами и стрессом и часто связан с негативными или дегенеративными клеточными процессами, включая апоптоз (129). Передача сигналов интегрина и PTEN, по-видимому, не влияет напрямую на активацию JNK (120), хотя и JNK, и ERK сильно активируются за счет растяжения и генерации силы в мышцах (52, 89, 130).
Семейство киназ p38 MAP более тесно связано с JNK, чем с ERK, и четыре изоформы p38 фосфорилируются с помощью MEK3 или MEK6 в ответ на аналогичные стимулы, включая цитокины и стрессоры окружающей среды (123). Субстраты для p38 снова включают многие элементы AP-1 и MAPKAPK, а также небольшие белки теплового шока (131). Существует некоторая дискуссия о том, фосфорилируются ли изоформы p38 механическими сигналами (89, 103, 127, 130), но они, по-видимому, участвуют в контроле структуры цитоскелета (131) и модулируются интегрин-зависимой передачей сигналов (119).
5.3 Фосфолипазы
Передача сигналов фосфолипидов играет важную роль в передаче сигналов механическими (10, 132). Фосфолипазы (PL) отщепляют полярную головную группу от мембранного фосфолипида, оставляя растворимый второй продукт и модифицированный липидный остаток. Растворимый продукт может быть активным вторичным мессенджером, а липидный остаток может закрепить другой фермент на мембране и повысить его активность. Они классифицируются как PLA, PLC или PLD в зависимости от сайта расщепления.
Существует три формы PLA: кальций-независимая iPLA, секретируемая sPLA и кальций-зависимая цитозольная cPLA.Обозначение A указывает, что они отщепляют жирную кислоту от основной цепи глицерина. Большинство из них специфичны для жирной кислоты в положении sn-2 и обозначаются PLA2 (133). Семейство cPLA2 особенно важно в механической передаче сигналов из-за их ассоциации с простаноидами (2). Эти ферменты очень благоприятствуют фосфолипидам с арахидоновой кислотой (АК) в sn-2 положении и являются этапом, ограничивающим скорость синтеза эйкозаноидов, включая простагландин (PG) F2a, PGE2, PGI2 и тромбоксан.Механическая стимуляция быстро увеличивает активность cPLA2, что приводит к синтезу и высвобождению PGE2 и PGF2a (132, 134). PLA2 рекрутируется на мембрану и активируется кальцием, а для механической активации требуется внеклеточный кальций, но не активная деполяризация. Синтез PGF2a может подавляться токсином коклюша (135), что указывает на второй уровень контроля. Остаточный лизофосфатидилхолин участвует в экзоцитозе (136, 137), предполагая механизм, с помощью которого растяжение может запускать высвобождение факторов роста.
PGE2 — мощный ингибитор синтеза белка, действующий через рецепторы EP. В нормальных скелетных мышцах основным рецептором является EP3 (138), который связан с Gi и ингибирует аденилатциклазу. PGF2a наиболее прочно связывается с рецептором FP, запуская Gq и активируя PLC (139). Обработка PGF2a также приводит к увеличению активности PI-3K, ERK и JNK, хотя механизм менее ясен. PGF2a накапливается в мышцах во время растяжения (10), является мощным стимулятором роста и дифференцировки (140, 141), а ингибиторы синтеза простагландинов, по-видимому, блокируют индуцированный растяжением рост in vitro (10, 134), но не обязательно в vivo (142).
Семейство фосфолипаз C специфично для фосфатидилинозитолов и отщепляет сахарную головную группу от глицеринового остова, оставляя диацилглицерин (DAG) и растворимый инозитолтрифосфат (IP3) (143). IP3 канонически связывает рецепторы IP3 в сарко / эндоплазматическом ретикулуме, запуская локализованное высвобождение кальция. DAG с кальцием привлекает к мембране белки, содержащие домен C2, в первую очередь обычные протеинкиназы C (cPKC). PKC, в свою очередь, фосфорилирует p53 (остановка клеточного цикла), raf (ERK) и фосфолипазу D, среди прочих (144).Циклическое растяжение активирует PLC во многих типах клеток (132, 145), по-видимому, через рецептор-опосредованный механизм (145), и это может быть механизмом для усиления притока кальция из внеклеточного пространства.
Большая часть фосфолипазы D неспецифически расщепляет фосфолипиды, оставляя фосфатную группу, прикрепленную к основной цепи глицерина, с образованием фосфатидной кислоты и, как правило, свободного холина (146). Активность PLD увеличивается после растяжения, потенциально активируясь PKC, но также потенциально ганглиозидами или RhoA (146).В мышечных трубках активность PLD, индуцированная растяжением, блокируется коклюшным токсином, ингибитором G-белка (135), что снова указывает на то, что это относительно зависимый аспект механического каскада. Фосфатидная кислота может быть впоследствии преобразована в DAG или лизофосфатидную кислоту, что может продлить активацию процессов, инициированных PLA2 и PLC (147).
5.4 Кальций
Кальций всегда распознается как необходимый для механической передачи сигналов (14, 148), что неудивительно, учитывая повсеместную природу кальцийсвязывающих доменов.Кальций участвует в механической реакции, по крайней мере, по трем основным механизмам. Наиболее очевидный механизм — это переходный процесс с большим содержанием кальция, который сопровождает выработку потенциала действия и активной силы. Концентрация кальция во время тетанической стимуляции может повышаться до 5 мкМ (15). Механическая деформация клетки может способствовать притоку кальция через активируемые растяжением каналы (149) или прямое повреждение сарколеммы (150). ПЛК, генерируемый IP 3 , может вызвать локальное высвобождение внутриклеточного кальция.Хотя существует множество эффекторов кальция, внимание было сосредоточено на кальциневрине (Cn), кальмодулинзависимых киназах (CaMK) и кальпаинах (Cp).
Кальциневрин — это кальций- и кальмодулин-зависимая фосфатаза, также известная как протеинфосфатаза 2B. Половина максимальной активации требует 1 мкМ Ca2 +, при этом наномолярный кальмодулин увеличивает как чувствительность к кальцию, так и активность фосфатазы (151). Cn дефосфорилирует ряд мишеней, включая киназу фосфорилазы, ингибитор протеинфосфатазы-1 и регуляторную легкую цепь миозина, хотя в последнее время интерес сосредоточен на семействе факторов транскрипции NFAT (152).Cn может также дефосфорилировать членов семейства MEF2 (153, 154), а транскрипция специфичных для мышц генов, безусловно, регулируется NFAT, MEF2, миогенными регуляторными факторами (MRF) и взаимодействиями между этими факторами (153, 155-157). Транскрипция, зависимая от NFAT / MEF2, трудно расшифровать. Дефосфорилирование NFAT с помощью Cn необходимо для ядерной транслокации (158), но NFAT не нужно связывать ДНК для модуляции транскрипции (159). Cn-зависимое дефосфорилирование MEF2, по-видимому, увеличивает скорость MEF2-зависимой транскрипции (154), как и p38 / PKC / CaMK-зависимое фосфорилирование (158).Похоже, что сложный, специфичный для остатков паттерн фосфорилирования MEF2 (160) модулирует его взаимодействие с гистондеацетилазами класса II (HDAC) (161) и NFAT (162), а также его транскрипционную активность. Кальциневрин, безусловно, играет важную роль в развитии мышц, гипертрофии и передаче механических сигналов (155, 156, 163, 164), хотя природа этой роли омрачена сложностью его эффекторов (165, 166).
Кальмодулин-зависимые киназы (CaMK), особенно CaMKII, по-видимому, противодействуют передаче сигналов Cn (167, 168).Кальмодулин, как и кальциневрин, связывает Ca2 + с Kd ~ 1 мкМ (169), но Ca2 + -CaM имеет гораздо более высокое сродство к CaMK, чем к Cn (170). CaMKII отличается своей способностью к аутофосфорилированию и отделению от кальция, так что комбинация Cn и CaMKII может действовать как сенсор интегрированного внутриклеточного кальция (171). Электрическая стимуляция, имитирующая стереотипные паттерны быстрых и медленных двигательных единиц, была использована для модуляции ядерного транспорта NFAT и HDAC4 во временной шкале от десятков минут до часов (172, 173).Таким образом, MEF2-зависимая транскрипция, по-видимому, чувствительна к уровню активности через Cn / CaMK и к чисто механическим стимулам через адгезию / p38.
Кальпаины (Cp) представляют собой кальций-зависимые протеазы, которые делятся на мю- и м-кальпаины в зависимости от их чувствительности к кальцию (174, 175). Mu-Cp обычно активируется Ca 2+ порядка 10 мкМ, тогда как M-Cp активируется миллимолярным кальцием. Оба они явно выше, чем уровни Ca2 +, ожидаемые при нормальной активности, что позволяет предположить, что они активируются либо узконаправленными процессами передачи сигналов, либо патологическими событиями.Кальпаины специфически разрушают структурные белки, включая тайтин, филамин и десмин, что является первым шагом на пути к разборке саркомерного матрикса (176). Кальпаины 1 (mu) и 2 (m) участвуют в атрофической дегенерации мышц (177, 178), тогда как кальпаины 2 и 3, по-видимому, играют необходимую роль в слиянии и дифференцировке миобластов (179, 180).
5.5 Другие сигналы
Вышеупомянутые каскады никоим образом не являются исчерпывающим каталогом механизмов, связанных с механически стимулированным ростом и развитием.У них есть общая черта, заключающаяся в том, что они являются преимущественно посттрансляционными механизмами, которые могут быть немедленно изменены такими временными стимулами, как мышечные подергивания, что делает их особенно актуальными для рассмотрения восприятия механических сигналов. Более длительный ответ также связан с активацией и высвобождением факторов роста, включая изоформы IGF-1 (7, 181), и с активацией сателлитных клеток (9, 182). Эти процессы имеют решающее значение для развития или роста ткани, но, похоже, не входят в число непосредственных датчиков механических стимулов.Точно так же описанным выше путям, способствующим росту, противостоят механизмы деградации, причем путь убиквитин-протеасома стоит особо отметить (183, 184), но участие этих механизмов в ответе на механическую стимуляцию неясно и может быть второстепенным. к ПИ-3К (109).
6. ПЕРСПЕКТИВА
Очевидно, что в механической передаче сигналов участвует широкий спектр факторов и каскадов, и задача состоит в том, чтобы организовать их разумно. Мы попытаемся сделать это в контексте особого внимания к последствиям клеточной деформации и попытаемся разделить последствия деполяризации и генерации активной силы, хотя последние, безусловно, являются мощными модуляторами передачи сигналов, индуцированных деформацией.
Несколько исследователей показали, что ингибирование определенных каскадов способно нарушить нормальную реакцию на деформацию. Увеличение синтеза белка может быть заблокировано путем ингибирования рецепторов, связанных с G-белком, чувствительных к коклюшному токсину (135), синтеза простагландинов (134), синтазы оксида азота (NOS) (185), Rho GTPases (186, 187), роста основных фибробластов. фактор (bFGF) (79) и катионные каналы, активируемые растяжением (102). Секреция диффундирующих факторов явно важна для длительного роста, но, вероятно, это вторичный эффект деформации, хотя для высвобождения bFGF был предложен прямой механический механизм (79).Если растяжение вызывает временное разрушение клеточной мембраны, это может быть механизмом высвобождения цитоплазматического bFGF и может обеспечить локальный приток огромных количеств кальция. Поскольку и кальций, и bFGF, по-видимому, необходимы для роста, индуцированного растяжением, это экономный механизм (79).
Недавняя работа в лаборатории Sheetz показала, что даже проницаемые «цитоскелетные призраки» способны отвечать на растяжение путем привлечения и фосфорилирования фокальных молекул адгезии и малых GTPases в фибробластах (62, 188).Как отмечалось выше, ILK и FAK могут быть мощными стимуляторами каскадов MAP-киназ и PI-3K, предполагая, что зависимая от деформации, независимая от клеточной мембраны активация передачи сигналов, опосредованной интегрином, может быть достаточной для механотрансдукции. Хорошо известно, что интегрины участвуют в росте и развитии мышц (189, 190), но неясно, активна это или разрешающая роль. Обнаружение того, что деформация адгезионного комплекса адекватна рекрутированию активных киназ, предполагает активное участие.
Другие структурные молекулы могут выполнять параллельные регуляторные роли. Белки с анкириновыми повторами (MARP, CARP, Ankrd2 и др.) Локализуются либо в ядре, либо в тайтине, предполагая, что они могут вытесняться из тайтина посредством деформации, чтобы действовать как регуляторы транскрипции (64, 65). Десмин, который, по-видимому, является значительной структурной опорой (31), не требуется для механотрансдукции (77). Множественные механические датчики могут опосредовать различие между сигналами продольного и поперечного роста. Увеличение длины мышечных волокон, стимулированное хроническим растяжением in vivo , по-видимому, не зависит от иннервации, и мышца, поддерживающая растяжение, может увеличиваться в длине, даже если она атрофируется в обхвате (191, 192).Некоторые исследователи предположили, что увеличение длины мышцы может отражать пассивное заполнение пустот в сократительном аппарате, открываемых длительным разгибанием (193).
Передача сигналов, индуцированных деформацией, несомненно, отличается от передачи сигналов, связанных с генерацией активной силы. Это часто демонстрируется путем сравнения клеточных событий после генерации силы в сочетании с укорочением или удлинением (89, 127, 194), что оказывается чрезвычайно сложной парадигмой.Как отмечалось выше, генерация активной силы вызывает метаболический, кальциевый и, вероятно, окислительный стресс в дополнение к механическому стрессу. Немеханические стрессоры, по-видимому, не являются адекватными для воспроизведения физиологической реакции, поскольку блокирование взаимодействия актин-миозин снижает трансляционную активность и экспрессию генов (195, 196). Аналогичным образом, приложение одинаковых уровней силы к активным и пассивным мышцам приводит к разным ответам (130). Различные аспекты клеточной среды обладают синергетическим действием, и при оценке реакции ткани важно учитывать всю среду в целом.
Физиология скелетных мышц | BJA Education
Ключевые точки
Скелетные мышцы составляют 40% мышечной массы. Нарушение функции мышц может иметь серьезные системные последствия.
Физиологическое сокращение скелетных мышц требует генерации и распространения потенциала действия мембраны, преобразования электрической энергии во внутриклеточный химический сигнал, который, в свою очередь, запускает взаимодействие миофиламентов.
Внутриклеточные белки цитоскелета, структуры клеточных мембран и связанный с ними внеклеточный матрикс гликопротеинов важны для поддержания клеточной архитектуры и передачи силы.
Плавные и ступенчатые изменения силы сокращения достигаются путем суммирования ответов на последовательные стимулы и задействования двигательных единиц.
Устойчивое сокращение мышц требует de novo синтеза АТФ, который в основном является аэробным или анаэробным, в зависимости от типа мышечных волокон.
Скелетные мышцы являются исполнительными органами опорно-двигательной системы. Они находятся под произвольным контролем, хотя большая часть их деятельности регулируется подсознательно. Скелетные мышцы и сердечные мышцы описываются как поперечно-полосатые мышцы из-за их микроскопического вида в виде полос.Этот вид является результатом упорядоченного и регулярного расположения субклеточных сократительных элементов. В отличие от сердечной мышцы, скелетная мышца не обладает собственной спонтанной активностью, поскольку в ней отсутствуют ионные каналы, ответственные за спонтанную деполяризацию мембраны. Следовательно, стимул для физиологической активности скелетных мышц всегда происходит от нервного импульса. Подавляющее большинство волокон скелетных мышц получают нервные импульсы от единичных центральных вздутий волокон, известных как моторные замыкательные пластинки.Некоторые мышцы, особенно некоторые из лицевых мышц, более диффузно иннервируются по длине их волокон; такая мультифокальная иннервация может объяснить, почему эти мышцы реагируют более выраженным начальным увеличением напряжения после введения сукцинилхолина.
Однако, независимо от типа иннервации, плотность заряда, поступающего на окончание двигательного нерва, недостаточна для непосредственной активации гораздо более крупных мышечных волокон. Электрический нейрональный импульс усиливается в нервно-мышечном соединении, механизм которого выходит за рамки данного обзора.Возникающая в результате генерация потенциала замыкательной пластинки является первым шагом в сокращении мышц.
Муфта возбуждения-сжатия
Этот термин охватывает процессы, посредством которых потенциал действия поверхностной мембраны приводит к взаимодействию внутриклеточных сократительных элементов. Т-трубчатая мембрана содержит самую высокую плотность сайтов связывания дигидропиридиновых соединений, таких как нифедипин.Первоначально предполагалось, что это открытие указывает на то, что прибытие потенциала действия в t-канальцы открывает потенциал-управляемые каналы Ca 2+ . Теперь мы знаем, что, хотя t-тубулярные дигидропиридиновые рецепторы демонстрируют заметную аминокислотную гомологию с потенциалозависимыми каналами L-типа Ca 2+ других тканей, они не функционируют как каналы Ca 2+ . Их роль в скелетных мышцах — это датчики напряжения. Когда потенциал действия достигает t-канальца, изменение мембранного потенциала приводит к конформационному изменению α-субъединицы дигидропиридинового рецептора.Эта субъединица состоит из четырех трансмембранных доменов, каждый из шести сегментов (рис. 1). Первый и шестой сегменты соседних доменов связаны чередующимися внеклеточными и цитоплазматическими петлями аминокислот. Индуцированное напряжением конформационное изменение приводит к проецированию цитоплазматической петли между вторым и третьим трансмембранными доменами глубже в цитоплазму. Здесь заряженные аминокислотные остатки цитоплазматической петли приближаются к остаткам белка, выступающего к цитоплазматической поверхности t-канальца из прилегающего концевого набухания саркоплазматического ретикулума.
Рис. 1
Субъединица α1 дигидропиридинового рецептора. Каждый из четырех трансмембранных доменов (I – IV) состоит из шести сегментов (1–6). Цитоплазматическая петля между шестым сегментом домена II и первым сегментом домена III взаимодействует с белком рецептора рианодина, вызывая высвобождение Ca 2+ из саркоплазматического ретикулума.
Рис. 1
Субъединица α1 дигидропиридинового рецептора.Каждый из четырех трансмембранных доменов (I – IV) состоит из шести сегментов (1–6). Цитоплазматическая петля между шестым сегментом домена II и первым сегментом домена III взаимодействует с белком рецептора рианодина, вызывая высвобождение Ca 2+ из саркоплазматического ретикулума.
Саркоплазматический ретикулум является внутриклеточным хранилищем Ca 2+ , а белок, который выступает от поверхности его конечной цистерны к t-канальцу, является его каналом высвобождения Ca 2+ (рис.2). Этот канал Ca 2+ часто называют рианодиновым рецептором в честь растительного алкалоида, который использовался для его выделения и характеристики. Ген рецептора рианодина является основным геном, вызывающим злокачественную гипертермию.
Рис. 2
Ключевые структуры, участвующие в взаимодействии возбуждения и сжатия. Изменение мембранного потенциала t-канальцев вызывает изменение конформации α1-субъединицы дигидропиридинового рецептора (DHPR).Это, в свою очередь, вызывает изменение конформации рианодинового рецептора (RYR), который является каналом высвобождения Ca 2+ саркоплазматического ретикулума (SR), что приводит к открытию канала и высвобождению Ca 2+ из SR, где он хранится связанным с кальсеквестрином.
Рис. 2
Ключевые структуры, участвующие в взаимодействии возбуждения и сжатия. Изменение мембранного потенциала t-канальцев вызывает изменение конформации α1-субъединицы дигидропиридинового рецептора (DHPR).Это, в свою очередь, вызывает изменение конформации рианодинового рецептора (RYR), который является каналом высвобождения Ca 2+ саркоплазматического ретикулума (SR), что приводит к открытию канала и высвобождению Ca 2+ из SR, где он хранится связанным с кальсеквестрином.
Результатом взаимодействия дигидропиридиновых и рианодиновых рецепторов является открытие поры канала последнего. Ca 2+ перетекает из саркоплазматического ретикулума вниз по градиенту концентрации в цитоплазму, где он действует как пусковой механизм для сокращения.
Сократительные конструкции
Сокращение мышц является результатом взаимодействия двух нитчатых белков, актина и миозина. Когда актин и миозин смешиваются как единственные два компонента в системе in vitro, между ними возникает сильная связь. В скелетных мышцах миозин и актин организованы в регулярную структуру в саркомерах, которые являются сократительными единицами. Каждый саркомер формируется между соседними листами Z-белков (видимых как Z-линии на микроскопии), которые представляют собой структурные белки, проходящие поперек волокна.Перпендикулярно от каждого из двух обращенных друг к другу листов Z-белков к центру саркомера выступают тонкие миофиламенты, которые в основном состоят из двух спирально свернутых актиновых филаментов. Тонкие волокна пересекаются с толстыми, которые также проходят параллельно длинной оси волокна, но лежат в центральной части саркомера. Толстые нити образованы пучками миозиновых нитей. Архитектура саркомера поддерживается белками Z и другими важными структурными белками (рис.3). Белки M-линии образуют структурную сетку по средней линии саркомера, где они закрепляют непосредственно хвосты миозиновых нитей и косвенно, через соединяющие белки (в основном небулин), центральный конец тонких нитей. Толстые нити поддерживаются тайтином, крупнейшим полипептидом, описанным у позвоночных. Каждая молекула тайтина занимает половину саркомера между белками Z и M. Саркомерная архитектура закреплена в цитоскелете клетки, который образован в основном сеткой актиновых цепей: актин, следовательно, является наиболее распространенным белком в скелетных мышцах.
Рис. 3
Схематическая диаграмма саркомера, показывающая расположение толстых и тонких нитей и их основных поддерживающих белков. Полосы A и I были названы по их появлению на микроскопии, где полоса A кажется темной (анизотропной) по сравнению с более легкой полосой I (изотропной).
Рис. 3
Схематическая диаграмма саркомера, показывающая расположение толстых и тонких филаментов и их основных поддерживающих белков.Полосы A и I были названы по их появлению на микроскопии, где полоса A кажется темной (анизотропной) по сравнению с более легкой полосой I (изотропной).
На ультраструктурном сечении частей саркомера, где тонкие и толстые волокна перекрываются, можно видеть, что каждая толстая нить окружена шестью тонкими нитями. Молекулы миозина состоят из длинного хвоста с шаровидной головкой. Внутри толстой нити головки миозина расположены так, что они радиально выступают наружу к тонким нитям.Головки миозина содержат сайты связывания для актина, но в состоянии покоя связывание актин-миозин предотвращается регуляторными белками на тонких филаментах. Тропомиозин — это нитчатый белок, который проходит в бороздке, образованной двумя нитями актина. Кроме того, рядом с каждым сайтом связывания миозина на актиновых цепях находится тропониновый комплекс, состоящий из субъединиц T (связывание тропомиозина), I (ингибирующее) и C (связывание Ca 2+ ). Связывание актин-миозин предотвращается комбинацией тропомиозина и тропонина-I.
Когда Ca 2+ высвобождается из саркоплазматического ретикулума в цитоплазму, Ca 2+ аллостерически связывается с тропонином-C, что приводит к конформационным изменениям других субъединиц тропонина, которые открывают сайты связывания миозина на актиновой цепи.
В состоянии покоя головка миозина образует комплекс с АДФ и неорганическим фосфатом. Связывание миозина с актином вытесняет неорганический фосфат, что, в свою очередь, приводит к повороту головки миозина в месте ее соединения с хвостом молекулы, тем самым перемещая тонкую нить к центру саркомера.Это храповидное движение тонких филаментов к M белкам сближает соседние Z листы и укорачивает саркомер (Fig. 4). Но укорачивание саркомера, вызванное одним из этих мощных ударов, будет незначительным, и поэтому должно произойти несколько циклов взаимодействия актин-миозин. Для этого требуется АТФ. Конформационное изменение, присущее повороту головки миозина, способствует замене АТФ на АДФ на головке миозина. Головка миозина обладает АТФазной активностью, и энергии, выделяемой этой ферментативной активностью, достаточно для преодоления связей актин-миозин, возвращая миозину его исходную форму, связанную с АДФ и неорганическим фосфатом, с потенциалом связываться с дополнительным участком актина в продолжающемся наличие высоких цитоплазматических концентраций Ca 2+ .
Рис. 4
Деталь взаимодействия тонких и толстых нитей. Показаны три миозиновых головки, последовательно изображающие три стадии, движущиеся слева направо, силового удара (обратите внимание, что это нереалистичное изображение, поскольку в жизни стадии будут скоординированными, происходящими одновременно во всех миозиновых головках). Все указанные стадии происходят после связывания Ca 2+ с тропонином C и последующего воздействия сайтов связывания миозина на актин.Это позволяет связывать миозин (левая миозиновая головка) с последующим высвобождением неорганического фосфата (средняя миозиновая головка) и последующей активацией шарнирного соединения миозиновой головки (правая миозиновая головка).
Рис. 4
Деталь взаимодействия тонких и толстых нитей. Показаны три миозиновых головки, последовательно изображающие три стадии, движущиеся слева направо, силового удара (обратите внимание, что это нереалистичное изображение, поскольку в жизни стадии будут скоординированными, происходящими одновременно во всех миозиновых головках).Все указанные стадии происходят после связывания Ca 2+ с тропонином C и последующего воздействия сайтов связывания миозина на актин. Это позволяет связывать миозин (левая миозиновая головка) с последующим высвобождением неорганического фосфата (средняя миозиновая головка) и последующей активацией шарнирного соединения миозиновой головки (правая миозиновая головка).
Следовательно, взаимодействие актин-миозин продолжается, пока цитоплазматическая концентрация Ca 2+ остается достаточно высокой. Расслабление мышц происходит, когда удаление Ca 2+ из цитоплазмы превышает высвобождение в нее Ca 2+ .В физиологических условиях большая часть Ca 2+ возвращается обратно в саркоплазматический ретикулум под действием насоса SERCA (саркоплазматический / эндоплазматический ретикулум Ca 2+ АТФазы). Когда концентрация Ca 2+ в цитоплазме падает, Ca 2+ диссоциирует от тропонина C, сайты связывания миозина на актиновых цепях становятся недоступными, позволяя саркомерам вернуться к своей длине покоя. Решающим для релаксации является тайтин, который ведет себя как пружина, плотно скручиваясь во время укорачивания саркомера и впоследствии отскакивая, когда освобождаются связи актин-миозин.
Усилие трансмиссии
Еще 20 лет назад считалось, что сила сокращения, создаваемая внутри саркомеров, передается последовательно через мышечно-сухожильные вставки волокна. Теперь очевидно, что значительная часть силы, создаваемой волокном (> 70% в некоторых экспериментах), зависит от передачи силы последовательно через структурные внутриклеточные белки к сарколемме и внеклеточному матриксу.Внеклеточный матрикс вокруг каждого волокна образует эндомизий, соединительную ткань, которая связывает соседние волокна и поддерживает капиллярную сеть мышцы. Эндомизий непрерывен с более толстой соединительной тканью, перимизием, который удерживает группы волокон внутри пучков. Все пучки мышцы заключены в еще более толстую соединительную ткань, эпимизий, который является продолжением внешнего слоя сухожилия.
Решающее значение для эффективной передачи сил от саркомера на внеклеточный матрикс имеют комплексы интегрина и дистрогликана, которые связывают последний с цитоскелетными элементами саркомера.Важность дистрогликанового комплекса (рис. 5) стала очевидной с открытием, что некоторые из наследственных дистрофий являются результатом аномальных компонентов этого комплекса. Пока нет ассоциации болезни с аномалиями комплекса интегринов, но все попытки ввести мутации генов комплекса интегринов у трансгенных мышей оказались несовместимыми с жизнью.
Рис. 5
Дистрогликановый комплекс, который формирует решающее структурное и функциональное звено между внутриклеточным цитоскелетом (актином) и внеклеточным матриксом.
Рис. 5
Дистрогликановый комплекс, который формирует решающее структурное и функциональное звено между внутриклеточным цитоскелетом (актином) и внеклеточным матриксом.
Определители силы сжатия
Для одиночного мышечного волокна сила сокращения пропорциональна количеству образованных актин-миозиновых связей. Это будет оптимальным, если исходная длина саркомера такова, что все миозиновые головки перекрываются тонкими нитями.Если саркомер растянут слишком далеко, центральные миозиновые головки будут лишними. Если саркомер слишком короткий, расстояние между сайтами связывания актина и миозина увеличивается, и их выравнивание также может быть искажено, что снижает эффективность сокращения.
Однако, в отличие от сердечной мышцы, волокна скелетных мышц поддерживаются на уровне, близком к оптимальной длине в их рабочем диапазоне; следовательно, соотношение длины и натяжения Фрэнка-Старлинга не является основным фактором физиологии скелетных мышц.Следовательно, сила, создаваемая одним волокном скелетных мышц, будет зависеть как от площади поперечного сечения, так и от длины волокна. То же самое относится и к мышце в целом. Конечно, было бы не очень полезно, если бы каждая мышца могла сокращаться только с максимальной силой. Постепенное сокращение мышц достигается за счет двух основных механизмов: суммирования и набора.
Суммирование
Суммирование сокращений волокон скелетных мышц возможно, потому что абсолютный рефрактерный период сарколеммы значительно меньше, чем продолжительность повышенной цитоплазматической концентрации Ca 2+ и последующего образования напряжения.Если второй стимул применяется к мышце до того, как она полностью расслабится по сравнению с первым, реакция на второй стимул добавится к остаточной реакции первого стимула. Это суммирование достигает пика, когда второй стимул возникает примерно через 20 мс после первого, что соответствует частоте стимула 50 Гц. Между частотами стимула 20–50 Гц суммарные ответы образуют плавное постепенное нарастание напряжения или тетанический ответ. Обычная частота возбуждения мотонейронов позвоночных находится в пределах тетанического диапазона.
Набор персонала
Одиночные двигательные нейроны иннервируют несколько мышечных волокон. Моторный нейрон и мышечные волокна, которые он иннервирует, вместе называются двигательной единицей. Количество мышечных волокон в двигательной единице варьируется внутри мышц и между ними. Наименьшие двигательные единицы, содержащие всего 3–10 мышечных волокон, находятся в мышцах, используемых для тонких сложных движений. В мышцах, используемых для крупных энергичных движений, преобладают гораздо более крупные двигательные единицы, содержащие до нескольких сотен мышечных волокон.
Когда мышце требуется прогрессивное увеличение напряжения, первоначально, когда нагрузка, прикладываемая к мышце, мала, используются самые маленькие двигательные единицы внутри мышцы. По мере увеличения нагрузки задействуются все большие и большие двигательные единицы, так что, когда нагрузка является максимальной, достижимой для этой мышцы, все ее двигательные единицы будут работать.
Энергия сжатия
Мы видели, что АТФ необходим для развития значительного напряжения, а также имеет решающее значение для расслабления мышц.Однако АТФ является относительно нестабильным соединением, и мгновенно доступный АТФ способен поддерживать сокращение в течение <1 с. В мышцах есть специальные средства для хранения высокоэнергетического фосфата в форме креатинфосфата. АТФ образуется из креатинфосфата под действием креатинкиназы, но полученного таким образом АТФ достаточно, чтобы поддерживать сокращение только в течение следующих 5-8 секунд. Более продолжительная сократительная активность требует синтеза АТФ посредством промежуточного метаболизма. При аэробном метаболизме 1 моля глюкозы образуется 38 моль АТФ, но даже максимальная доставка кислорода недостаточна для удовлетворения требований энергичной мышечной активности.Анаэробный метаболизм менее эффективен, поскольку 1 моль глюкозы производит только 2 моля АТФ, но произведенный АТФ более доступен. Однако это происходит за счет накопления лактата, который является важным фактором развития мышечной усталости.
Типы мышечных волокон
Диаметр мышечных волокон колеблется от 10 до 100 мкм. Большинство мышц человека содержат смесь волокон в этом диапазоне. Более тонкие волокна относятся к типу I и приспособлены для продолжительной деятельности, требующей создания субмаксимального напряжения.Самые толстые волокна (тип IIb) приспособлены к коротким всплескам активности, близкой к максимальной. Мышцы, в которых преобладают волокна типа I, имеют более глубокий красный цвет, чем мышцы с небольшим количеством волокон типа I, потому что волокна типа I имеют высокое содержание миоглобина. Миоглобин пигментирован из-за фрагмента гема, который отвечает за его способность связывать кислород. Миоглобин обеспечивает запас кислорода в мышечных клетках; его сродство к кислороду больше, чем у гемоглобина, что способствует доставке кислорода к мышцам, но таково, что кислород высвобождается для аэробного метаболизма при увеличении потребности.Волокна типа IIa имеют средний размер и содержание миоглобина. Другие физические и метаболические характеристики различных типов волокон описаны в таблице 2.
Таблица 2Физические, сократительные и метаболические характеристики различных типов мышечных волокон
9044 Обильный йоглобин 9044 904 Быстро 9044 . 9044 Обильный йоглобин 904 909 Быстрый 944 9044 сократительные и метаболические характеристики различных типов мышечных волокон. | Тип I . | Тип IIa . | Тип IIb . | ||||
|---|---|---|---|---|---|---|---|
| Диаметр | Малый | Промежуточный | Большой | ||||
| Размер моторного блока | Маленький | Промежуточный | Большой | ||||
| 9044 9044 9044 9044 9044 Сокращение | Медленное | Быстрое | Быстрое | ||||
| Twitch | Длинное | Короткое | Короткое | ||||
| Ca 2+ секвестрация | Медленное | Быстрое | |||||
| Быстрое | |||||||
| Промежуточный | Редкий | ||||||
| Гликолитическая емкость | Низкая | Промежуточная | Высокая | ||||
| Окислительная способность | Высокая | Низкая | Низкая | Низкая | Высокий | Промежуточный | Низкий |
| Гликоген | Низкий | Промежуточный | Высокий | ||||
| Миозин-АТФаза | 904 904 Быстро | Тип I . | Тип IIa . | Тип IIb . | |||
| Диаметр | Малый | Промежуточный | Большой | ||||
| Размер моторного блока | Маленький | Промежуточный | Большой | ||||
| 9044 9044 9044 9044 9044 Сокращение | Медленное | Быстрое | Быстрое | ||||
| Twitch | Длинное | Короткое | Короткое | ||||
| Ca 2+ секвестрация | Медленное | Быстрое | |||||
| Быстрое | |||||||
| Промежуточный | Редкий | ||||||
| Гликолитическая емкость | Низкая | Промежуточная | Высокая | ||||
| Окислительная способность | Высокая | Низкая | Низкая | Низкая | Высокий | Промежуточный | Низкий |
| Гликоген | Низкий | Промежуточный | Высокий | ||||
| Миозин-АТФаза |
Кларк К.А., Макэлхинни А.С., Беккерл М.С., Грегорио С.К. Цитоархитектура поперечно-полосатых мышц: сложная сеть форм и функций.
Ann Rev Cell Dev Biol
2002
;18
:637
–7062.Хопкинс П.М. Произвольные двигательные системы — скелетные мышцы, рефлексы и контроль движений. В: Hemmings HC & Hopkins PM, eds. Основы анестезии, 2-е изд. Мосби, Лондон
2005
3.Huxley AF. Обзорная лекция: сокращение мышц.
J Physiol
1974
;243
:1
–434.Мосс Р.Л., Диффи ГМ, Гризер М.Л. Сократительные свойства волокон скелетных мышц по отношению к изоформам миофибриллярного белка.
Rev Physiol Biochem Pharmacol
1995
;126
:1
–635.Риос Э., Брам Дж. Вовлечение дигидропиридиновых рецепторов в сопряжение возбуждения-сокращения в скелетных мышцах.
Nature
1987
;325
:717
–20Повышение квалификации в области анестезии, интенсивной терапии и боли | Том 6, номер 1, 2006 г. © Правление и попечители Британского журнала анестезии [2006].Все права защищены. Для получения разрешений обращайтесь по электронной почте: journals.permissions@oxfordjournals.org
.Мышечная ткань — Knowledge @ AMBOSS
Последнее обновление: 23 сентября 2021 г.
Резюме
Мышечная ткань — это мягкая ткань, которая в основном состоит из длинных мышечных волокон. Скоординированное взаимодействие миофиламентов актина и миозина внутри миоцитов дает мышечной ткани способность сокращаться. В зависимости от внутриклеточного расположения этих миофиламентов мышечная ткань классифицируется как поперечно-полосатая (скелетная и сердечная) или гладкая (гладкая).Миофиламенты поперечно-полосатой мышцы расположены в саркомеры, в то время как миофиламенты гладких мышц не имеют определенного расположения. Основные механизмы сокращения (связь возбуждения-сокращения и механизм скользящей нити) аналогичны для всех типов мышц. Скелетные мышцы находятся под произвольным контролем соматической нервной системы. Гладкая мышца находится под непроизвольным контролем вегетативной нервной системы и внешних раздражителей (например, химических, механических). Он обладает большей эластичностью и присутствует в стенках полых органов (напр.g., желудок, мочевой пузырь, матка), стенки сосудов, дыхательных и мочевыводящих путей. Сердечная мышца также находится под непроизвольным контролем кардиостимуляторов и образует стенки камер сердца (миокарда).
Мышечные клетки (миоциты)
Обзор
[1]- Классификация
- Функция: сокращение мышц или напряжение, чтобы двигаться или сопротивляться нагрузке.
- Происхождение: мезодерма
Структуры мышечных клеток
[1]Сарколемма (миолемма)
- Определение: мембрана мышечной клетки; , который содержит мембранные впячивания
- Характеристики
Саркоплазма
Саркоплазматический ретикулум (SR)
- Определение: эндоплазматический ретикулум мышечных клеток, который образует сеть L-канальцев.
- Характеристики
- Магазины Ca 2+
Миофиламенты
Сравнение типов мышечных клеток
[1]Миофиламенты
Миофиламенты — это белковые волокна, состоящие из толстых (миозин) и тонких (актин) нитей, которые отвечают за сократительные свойства мышечных клеток.
Структура
Функция
Белки тропонина в сердечной мышце имеют другую структуру, чем в скелетных мышцах. При инфаркте миокарда сердечные миоциты повреждаются в результате абсолютного дефицита кислорода и выбрасывают свое внутриклеточное содержимое в кровоток. Таким образом, повышение уровня сердечного тропонина в крови указывает на повреждение ткани сердечной мышцы.
Структура
- Содержит около 250 молекул миозина
- Молекулы мышечного миозина (миозин II) [2]
- Различные изоформы встречаются в разных типах мышц и определяют скорость сокращения
- Состоит из двух тяжелых и двух легких белковых цепей.
- Домены
- Голова: имеет сайт связывания как актина, так и АТФ (который также обладает активностью АТФазы)
- Шея: две легкие белковые цепи прикрепляются к тяжелым белковым цепям, которые служат для регулирования миозиновой головки.
- Хвост: тяжелые цепи миозина намотаны друг на друга в виде спирали, с головками миозина, выступающими с обеих сторон.
- Головки миозина имеют сайт связывания для актина и сайт связывания для АТФ (который также обладает активностью АТФазы).
Функция
Как поперечнополосатые, так и гладкомышечные клетки опосредуют сокращения через актин и миозин.
Мутации в генах, кодирующих цепь тяжелого белка β-миозина или кардиомиозинсвязывающий белок C, являются основной причиной семейной аутосомно-доминантной гипертрофической обструктивной кардиомиопатии.
Сравнение сократительных нитей между мышечными клетками
[1]Сокращение миофиламентов
Обзор
- Поперечно-полосатые и гладкие мышцы имеют схожие механизмы сокращения, но с некоторыми важными различиями.
- В этом разделе представлен общий обзор основных принципов мышечного сокращения.
- Подробнее об отдельных типах мышц см. Разделы ниже.
Муфта возбуждения-сжатия
[1] [3]- Определение: процесс, при котором инициирующий стимул (например,g., AP, химический стимул) вызывает повышение внутриклеточного Ca 2+ и последующее укорочение миофиламентов, что приводит к сокращению мышц.
- Типы
- Описание
В состоянии покоя актин и миозин не могут взаимодействовать, потому что они ингибируются регуляторными белками. Необходим инициирующий стимул для взаимодействия между миофиламентами.
Модель скользящей нити
[5] [6]Сравнение стимуляции и сокращения
[1]Энергетическое обеспечение сокращения мышц
- Мышечным клеткам требуется АТФ в качестве источника энергии для: [1]
- Поддержание структуры и ионных градиентов
- Взаимодействие между головкой миозина и актином, которое приводит к сокращению мышц
- Производство АТФ в мышечных клетках [1]
- См. «Пути синтеза АТФ.”
Глюкозо-аланинский цикл обеспечивает скелетные мышцы глюкозой в качестве источника энергии. Производство мочевины в качестве побочного продукта требует много энергии, поэтому оно менее эффективно, чем цикл молочной кислоты.
Скелетная мышца
Обзор
[1]- Тип: поперечно-полосатая мышечная ткань
- Структура
- Соединенные мышечные клетки образуют мышечные волокна, окруженные эндомизием.
- Пучки мышечных волокон образуют пучки, окруженные перимизием.
- Множественные пучки образуют мышцу, окруженную эпимизием.
- Мышцы и эпимизий покрыты фасцией.
- Мышцы прикрепляются к костям с помощью сухожилий.
- Регуляция сокращения
- Под произвольным контролем соматической нервной системы
- Стимуляция происходит на моторной замыкательной пластинке.
- Функция: отвечает за движение скелета
Микроскопическая анатомия
[1]- Макияж
- Регенерация: через миосателлитные клетки, которые вкраплены между мышечными волокнами
«Слишком (2) быстро, чтобы продолжаться; светлый и белый, лишнего воздуха нет.«Наиболее важными характеристиками волокон скелетных мышц 2 типа являются быстрое сокращение, кратковременная активность, белый цвет и анаэробный гликолиз (отсутствие воздуха).
Саркомеры
[1]Компоненты для электронной микроскопии
- Полоса Z
- Отделяет один саркомер от другого
- Действует как точка крепления
- Полосы Z сближаются во время сжатия
- Полоса M: центр зоны H, к которой с противоположных сторон прикреплены миозиновые нити
- I группа
- Группа;
- Состоит из трех сегментов: бледный центральный сегмент (зона H), окруженный двумя темными внешними сегментами
Полоса I и зона H укорачиваются во время сокращения, тогда как полоса A остается той же длины.
Анкоридж
Связь между возбуждением и сокращением в скелетных мышцах
Сокращение скелетных мышц является результатом притока внутриклеточного кальция из запасов в SR. Это объясняет способность скелетных мышц сокращаться, несмотря на лечение блокаторами кальциевых каналов, которые могут блокировать приток внеклеточного кальция через DHPR, но не могут влиять на способность определения напряжения DHPR или результирующее высвобождение внутриклеточного кальция.
Мутация гена рецептора рианодина поперечно-полосатых мышечных клеток приводит к образованию рецептора рианодина, который может активироваться некоторыми веществами, такими как ингаляционные наркотики (например, изофлуран). Эта активация приводит к неконтролируемому высвобождению Ca 2+ из SR, что приводит к непрерывному сокращению, которое значительно увеличивает потребление энергии и кислорода мышечными клетками. У больных наблюдается лактоацидоз из-за повышенного анаэробного гликолиза и гипертермии из-за повышенного мышечного метаболизма.Это опасное для жизни состояние называется злокачественной гипертермией.
Этапы цикла сокращения (перекрестный цикл)
[1]- Образование перекрестного моста: высвобожденный внутриклеточный Ca 2+ связывается с тропонином C и вызывает конформационные изменения → тропомиозин удаляется от сайта связывания миозина актиновая нить → миозиновая головка связывает актин под углом 90 °, образуя поперечный мост
- Силовой удар миозиновой головки: миозиновая головка высвобождает фосфат (P i ) → миозиновая головка наклоняется на 45 °, тянет миозин вдоль актина → мышца укорачивается (сокращается) → высвобождается АДФ
- Ослабление поперечного мостика: новый АТФ связывается с головкой миозина → головка миозина отделяется от актиновой нити → миозин возвращается в исходное положение
- Переориентация миозиновой головки: гидролиз АТФ до АДФ и P и (оба остаются на миозиновой головке) → миозиновая головка изменяет свою конформацию (переходит в «взведенное состояние») → миозин возвращается в исходное положение (готов к снова связываются с актином)
- Репликация цикла
- Если концентрация Ca 2+ в мышечной клетке остается повышенной, новый цикл начинается с образования поперечных мостиков.
- В зависимости от активности АТФазы (скорости расщепления АТФ в единицу времени) тяжелой цепи миозина может происходить ~ 10–100 циклов перекрестных мостиков в секунду.
- Чем больше циклов перемычки в единицу времени, тем быстрее и сильнее усадка.
Трупное окоченение — это жесткость мускулов после смерти, вызванная стойким прикреплением актина к миозину из-за нехватки АТФ.
Типы мышечных сокращений
- Изометрическое сокращение: мышца сокращается и генерирует силу, но не укорачивается и не удлиняется.
- Изотоническое сокращение: длина мышцы изменяется, а сила мышц остается постоянной.
- Концентрическое сокращение: мышца укорачивается
- Эксцентрическое сокращение: мышца удлиняется
- Ауксотоническое сокращение: одновременное изменение силы и длины мышц
Рефлексы
Гладкая мышца
Обзор
[1]- Тип: гладкая мышечная ткань
- Расположение
- Регуляция сокращения: под непроизвольным контролем вегетативной нервной системы и внешних раздражителей (например,г., химический, механический)
- Функция
Микроскопическая анатомия
[1]Гладкомышечные клетки не имеют саркомеров.
Муфта возбуждения-сжатия
- Стимулы: контролируют сокращение и расслабление (различаются от органа к органу)
- Клетки кардиостимулятора (например, интерстициальные клетки Кахаля вызывают ритмическую перистальтику в желудочно-кишечном тракте)
- Механические стимулы (например, растяжение)
- Нейротрансмиттеры вегетативной нервной системы (ацетилхолин или норадреналин) возле гладких мышц
- Метаболические стимулы (значение pH, O 2 )
- Гормоны; (е.g., NO, адреналин, гистамин, серотонин, окситоцин, вазопрессин, вазоактивный полипептид кишечника)
Гладкомышечные клетки не имеют моторных замыкательных пластинок.
Ступени сжатия
- Стимул открывает потенциалзависимые каналы L-типа Ca 2+ в сарколемме → приток Ca 2+ из внеклеточного пространства в гладкомышечные клетки (Ca 2+ также высвобождается из SR, дополнительно увеличивая внутриклеточная концентрация Ca 2+ )
- Ca 2+ связывается с кальмодулином в саркоплазме, что приводит к активации кальмодулина.
- Ca 2+ -Кальмодулин-комплекс активирует киназу легкой цепи миозина (КЛЦМ).
- КЛЦМ фосфорилирует головку легкой цепи миозиновой нити.
- Активность АТФазы в фосфорилированном миозине способствует образованию перекрестных мостиков с актином, что приводит к сокращению мышц. (см. «Велосипедный спорт по мосту» выше)
Очень медленное прикрепление и отсоединение поперечных мостиков между актином и миозином позволяет гладким мышцам поддерживать длительное тоническое сокращение, потребляя при этом мало АТФ и O 2 .
Концентрация Ca 2+ определяет силу сокращения гладких мышц: чем выше приток Ca 2+ , тем больше силы создается.
Шаги расслабления
- Стимулы
- Повышенная активность фосфатазы легкой цепи миозина (MLCP) и / или снижение активности MLCK
- MLCP дефосфорилирует миозин → миозин больше не взаимодействует с актином → прекращается сокращение
Скольжение нитей и расщепление АТФ миозин-АТФазой в гладких мышцах происходит в 100–1000 раз медленнее, чем в скелетных.Таким образом, максимальная скорость сокращения гладких мышц значительно ниже, чем у скелетных мышц.
КЛЦМ фосфорилирует миозин, что приводит к сокращению гладких мышц. MLCP дефосфорилирует миозин, что приводит к расслаблению гладких мышц.
Клетки гладких мышц контактируют с Ca 2+ и расслабляются, когда НЕТ стресса.
Сердечная мышца
Обзор
[1]Микроскопическая анатомия
[1]Соединение возбуждения-сокращения
Сокращение
Клиническая значимость
- Мышечные состояния
- Аутоиммунные заболевания
- Новообразования
- Фармакология
- Неврологические симптомы / обследование
- Разное
Развитие мышц
Развитие мышцМышца
Мышечные клетки , как и нейроны, могут возбуждаться химически, электрически, механически для создания потенциала действия вдоль их клеточной мембраны.
В отличие от нейронов у них есть сократительный механизм, активируемый потенциалом действия и опосредованный сократительными белками актин и миозин .
Мышцы делятся на 3 типа:
скелетные (как в соматической мускулатуре)
сердечные (составляющие миокард)
гладкие (как внутренние органы)
Скелетная мышца состоит из отдельных мышечных волокон, многоядерных, длинных и цилиндрических по форме.
Мышечные волокна расположены параллельно между концами сухожилий, так что сила сокращения каждой отдельной единицы складывается.
Каждое волокно состоит из фибрилл , а эти волокна организованы в саркомеров , состоящих из белков: миозина и актина (во время сокращения миозин и актин разрушают и реформируют сшивки), тропомиозин и тропонин (последние 2 «расслабляющих белка» образуют комплекс, который ингибирует взаимодействие миозина и актина)
Шаги сокращения
1) разряд мотонейрона на мионевральной пластинке (замыкательной пластине)2) высвобождение нейромедиатора ацетилхолина на замыкательной пластинке
3) связывание ацетилхолина с его рецепторами
4) повышенная проводимость Na + и K + в мембране замыкательной пластинки
5) образование потенциал действия на замыкательной пластинке
6) генерирование потенциала действия вдоль мышечных волокон
7) распространение потенциала вдоль мышечных волокон
8) высвобождение Ca ++ из саркоплазматического ретикулума (внеклеточное пространство, окружающее мышечные волокна) и диффузия в толстые и тонкие волокна
9) связывание Са ++ в тропонин и тем самым раскрывает сайты связывания миозина на актине
10) образование перекрестных связей между актином и миозином и скольжение тонких волокон по толстым нитям, вызывая укорачивание мышц
Шаги расслабления
1) Са ++ закачивается обратно в саркоплазматический ретикулум2) высвобождение Са ++ из тропонина
3) прекращение взаимодействия между актином и миозином
В скелетных мышцах есть как минимум 2 типа волокон:
ТИП 1, МЕДЛЕННЫЕ, КРАСНЫЕ МЫШЦЫ (e.грамм. длинные мышцы спины):
с длительным латентным периодом
адаптированы для медленных сокращений с поддержанием осанки и имеют средний диаметр
с высокой окислительной способностью
с большим кровоснабжением
ТИП IIB, БЫСТРЫЕ, БЕЛЫЕ МЫШЦЫ (например, мышцы рук):
с короткой задержкой
адаптированы для тонких, умелых движений и имеют большой диаметр
низкая окислительная способность
меньше кровоснабжения
Мышца отличается от мезодермы
Первая мышечная активность, зарегистрированная у 8-недельного эмбриона
Узнаваемые сокращения, наблюдаемые через 16-18 недель плода, когда:
* нервные волокна к мышцам развиваются
* нервные волокна достигли контакта с мышечными клетками (мио -невральное соединение) и нейротрансмиссионный аппарат (ацетилхолин / холинэстераза) разработано
Эксперименты с перекрестной иннервацией:
* определенное вещество секретируется в нервных окончаниях, или
* набор нервных импульсов на мышечных волокнах действует, чтобы ограничить скорость сокращения
Скелетно-мышечное (M-S) развитие в подростковом возрасте
Разработка MS включает несколько систем:
Мышцы : размер, сила, метаболизм, мощность
ЦНС : координация двигательной активности, произвольная, вегетативная, мотивация, усталость
Дыхание : обеспечивает O2, удаляет CO2
Циркуляция : циркулирует O2, питательные вещества
Регулирование температуры : во время упражнений выработка тепла X20 выше, чем в состоянии покоя
Стресс : кортикоиды
Гормоны : инсулин, GH, IGF-I, T3, кальцитонин, ПТГ, андрогены, эстрогены
Число мышечных волокон практически фиксировано при рождении
Увеличение массы или Гипертрофия (иногда до 50%) происходит из-за увеличения длины и площади поперечного сечения мышечных волокон из-за увеличения количества миофибрилл (от От 75 до более 1000)
Способность к пластичности и регенерации в ответ на нервные, гормональные и пищевые воздействия
Развитие мышечных клеток
Читатель, стр.287-293
Раннее развитие:
мезодермальное происхождение:
* миобласты (без различимых признаков)
* 4-й месяц, миотубулы (миофибриллы, некоторая двигательная активность)
* увеличение миозина, актина, каналов Са ++
С дальнейшим развитием:
* 1-7 лет, медленный рост
* 8-17 лет, ускоренный рост
* 18-25 лет, медленный рост
* увеличение количества миофибрилл
* увеличение количества ядер
* гиперплазия, гипертрофия
* нет встроенного ограничения по времени на потенциал толщины / силы (повышенные физические нагрузки, гимнастика)
При рождении все мышцы конечностей имеют одинаковую скорость сокращения.
После рождения скорость различается в быстрых и медленных мышцах в зависимости от иннервации, уровня / активности ACh, AChE, увеличения электролитов, метаболических изменений.
Развитие мионеврального соединения (MJ)
* Число MJ увеличивается с развитием
* повышенный уровень ацетилхолина (ACh)
* рецепторов
До рождения чувствительность Ach распространяется по длине мышцы;
После рождения локализуется у MJ.
Выходная мощность = скорость выполнения работы
Работа: перемещение силы на расстоянии
Сокращение может быть:
изометрическим: мышца не укорачивается, но производит силу
изотоническая: сила остается постоянной, но мышца укорачивается
Плохо изученные аспекты сокращения поперечно-полосатых мышц
Сокращение мышц является результатом циклических взаимодействий между сократительными белками миозином и актином, обусловленных обменом аденозинтрифосфата (АТФ).Несмотря на интенсивные исследования, некоторые молекулярные события в процессе сокращения плохо изучены, в том числе взаимосвязь между генерацией силы и высвобождением фосфата в обмене АТФ. Различные аспекты перехода, генерирующего силу, отражаются в изменениях в развитии напряжения мышечных клеток, миофибрилл и отдельных молекул при изменении температуры, изменении концентрации фосфата или пертурбациях длины. Было общеизвестно трудным объяснить все эти события в рамках данной теоретической основы и однозначно соотнести наблюдаемые события с атомными структурами миозинового мотора.Другие не до конца понятые вопросы включают роль двух головок миозина II и структурные изменения в актиновых филаментах, а также важность трехмерного порядка. Здесь мы рассматриваем эти вопросы в связи с противоречиями относительно основных физиологических свойств поперечно-полосатой мышцы. Мы также кратко рассматриваем эффекты мутации актомиозина в функции сердца и скелетных мышц и возможность лечения этих дефектов с помощью лекарств.
1. Введение
Сокращение мышц является результатом циклических взаимодействий между сократительными белками миозина и актина, обусловленных обменом аденозинтрифосфата (АТФ) [1–8].В поперечно-полосатых мышцах позвоночных (сердце и скелетные мышцы) актин и миозин организованы с несколькими вспомогательными белками в высокоупорядоченные наборы пересекающихся тонких и толстых филаментов, соответственно, формируя повторяющиеся саркомеры длиной 2,0–2,5 мкм и м [2]. Функциональные единицы мышц — полусаркомеры. Они соединены последовательно друг с другом, образуя миофибриллы шириной ~ 1 мкм (рис.1 (а) и 1 (b)), которые проходят по всей длине мышечной клетки (мышечное волокно) и параллельно пересекают мышечные волокна. -раздел.Во время сокращения мышц глобулярные двигательные домены миозина (головки) отходят от толстых филаментов, чтобы циклически взаимодействовать с сайтами связывания актина на тонких филаментах, образуя так называемые поперечные мостики (Рис. 1 (b)). Упорядоченное расположение на разных иерархических уровнях в мышцах очень полезно для эффективности сократительного процесса, что отражается в независимой эволюции [9] подобных саркомерных организаций у филогенетически далеких организмов, таких как млекопитающие и книдарии (например.г., медузы). Некоторые из преимуществ такого расположения очевидны, например, эффективное суммирование изменений длины, производимых саркомерами, расположенными последовательно, и сил в поперечном сечении мышцы. Однако, вероятно, есть дополнительные, тонкие преимущества и даже встроенные недостатки упорядоченного расположения, как было обнаружено, имеют физиологическое значение [10–12].
В целом, был достигнут значительный прогресс [6, 13–16] в понимании функции поперечнополосатых мышц с момента выяснения ее основных принципов [2, 17–19].Первоначально этот прогресс опирался в основном на механические и ультраструктурные исследования мышечных клеток и биохимические исследования изолированного актина и растворимых моторных фрагментов миозина. Ключевые события конца восьмидесятых и начала девяностых существенно изменили эту область, сместив акцент на более редукционистский подход (рассмотренный в [13]) и добавив дополнительные идеи, полученные в результате исследований ряда недавно открытых немышечных миозинов. Одним из основных технических достижений этого периода был анализ подвижности in vitro [7, 20], в котором наблюдаются флуоресцентные актиновые филаменты [21], которые продвигаются миозином или, чаще, протеолитическими моторными фрагментами миозина (рис. 1 (c)), такими как субфрагмент 1 (S1) или тяжелый меромиозин (HMM).Последний содержит две миозиновые головки, то есть два полных каталитических домена, каждый с плечом рычага и две легкие цепи, соединенные с хвостовым доменом в виде спиральной спирали. Другие ключевые разработки включают (i) механику одиночных молекул (на основе оптического пинцета [22-24]) и методы флуоресцентной микроскопии одиночных молекул [25], связанные с анализами подвижности in vitro, (ii) кристаллизацию актина [26] и миозиновый двигатель. домен (S1) [5, 27], позволяющий определять их молекулярную структуру с атомным разрешением, и, наконец, (iii) разработка методов генной инженерии миозина [28, 29].В то время как недавний технический прогресс позволил решить ряд давних проблем (см. [30]), некоторые важные особенности сокращения мышц остаются не до конца понятыми. Сюда входят такие центральные вопросы, как (1) молекулярная основа высокой максимальной выходной мощности [31, 32], (2) механизм эффективного сопротивления растяжению активной мышцы [33–35] и (3) механизмы при котором мутации миопатии [36–43] и некоторые лекарства влияют на функцию мышц.
Трудности решения проблем (1) — (3) связаны с ограниченным пониманием важных молекулярных механизмов взаимодействия актомиозина.Это ограничение, в свою очередь, связано с проблемами при интеграции информации, полученной в результате исследований на разных уровнях иерархического порядка (например, мышечные клетки по сравнению с отдельными молекулами) или с использованием различных методов (например, исследования биохимических растворов в сравнении с механикой мышечных клеток или механикой отдельных молекул). . В этой статье мы рассмотрим недостаточно изученные аспекты взаимодействия актомиозина. Другие общие аспекты физиологии и регуляции мышц не включены — вместо этого читатель отсылается к предыдущим исчерпывающим обзорам [15, 44, 45] и ссылкам в них.
2. Молекулярные основы сокращения мышц: текущий взгляд
Молекулярные двигатели можно классифицировать как процессивные или непроцессивные, в зависимости от того, делают ли они несколько шагов или только один шаг по своей траектории перед отсоединением. Типичным примером процессивного мотора является немышечный миозин V, играющий роль в определенных формах внутриклеточного транспорта, например, в нервной системе [46]. Этот мотор характеризуется медленным и сильно зависящим от напряжения отрывом от актинового филамента и соответствующей координацией двух его моторных доменов (головок).Такие характеристики позволяют двигателю процессивно перемещаться на несколько шагов по актиновой нити.
Мотор мышцы миозина II, обычно обозначаемый ниже «миозином», с другой стороны, классифицируется как непроцессивный. Таким образом, каждый моторный домен миозина II тратит большую часть своего времени цикла АТФазы в отрыве от актина, и считается, что единственный миозиновый мотор делает только один-единственный шаг вдоль актинового филамента перед отсоединением. Таким образом, эффективная работа мышц зависит от большой совокупности двигателей миозина II, работающих вместе.Следовательно, производство силы и смещения актомиозином в поперечно-полосатых мышцах является результатом циклических взаимодействий миллиардов моторных доменов миозина с актиновыми филаментами. Эффективность и контроль этого процесса оптимизируются сборкой актина, миозина и дополнительных (например, регуляторных) белков в высокоупорядоченные структуры на разных уровнях иерархической организации (рисунок 1). Циклы генерирующего силу взаимодействия между актином и миозином приводятся в действие оборотом MgATP (обозначенного ниже АТФ) и, за исключением реакции на быстрые изменения длины или напряжения [47–49], асинхронны между различными двигателями, что является основой для плавное укорачивание и развитие силы.
Основные принципы генерирующего силу цикла поперечного моста в поперечно-полосатых мышцах были выяснены на основе биохимических, механических и структурных данных [1, 2, 4–6, 23, 27, 47, 50–68]. Связывание АТФ с двигательным доменом миозина сначала вызывает структурные изменения с поворотом плеча миозинового рычага («ход восстановления», нижний рисунок 2), который подготавливает миозиновую головку к выполнению силового удара при следующем связывании с актин. Это событие также связано с изменением расположения петель (переключатель 1, переключатель 2 и P-loop) на каталитическом сайте (см. Ниже).Впоследствии АТФ гидролизуется до АДФ и неорганического фосфата (P i ), но продукты гидролиза остаются связанными с активным центром миозина. Следующим критическим шагом в цикле генерации силы является связывание миозиновой головки с актиновым филаментом, образуя так называемый поперечный мостик. Начальное связывание неспецифично [69, 70] и динамически неупорядочено с диапазоном азимутальных и аксиальных углов как моторного домена, так и плеча рычага связывания легкой цепи [71-73] относительно актинового филамента.Кроме того, это начальное слабое связывание имеет в основном электростатическую природу [69, 70] с присоединенным и отсоединенным состояниями в быстром равновесии. Было высказано предположение, что переход от начального слабо и нестереоспецифично связанного состояния миозиновой головки к стереоспецифически связанному состоянию включает в себя средний перекатный переход миозиновой головки на актиновом филаменте [72–74] с последующим блокированием стереоспецифически прикрепленное состояние. Этот переход «свернуть и зафиксировать» может как увеличить эффективную скорость прикрепления [75], так и способствовать перемещению тонких нитей [71], а также восстановлению натяжения после быстрых скачков длины [72, 74].
Связывание миозиновой головки с актиновым филаментом вызывает ~ 100-кратную активацию скорости высвобождения P i . В отсутствие актина высвобождение P и , или, скорее, предшествующий конформационный переход, связанный с реверсированием цикла восстановления, ограничивает скорость обмена АТФ с помощью миозина. Высвобождение P i из миозина, связанного с актином, связано с сильно увеличенным сродством к актомиозину и большим падением свободной энергии. Кроме того, наблюдается заметное структурное изменение, которое в отсутствие или при наличии противодействующей нагрузки вызывает колебание плеча рычага миозина, связывающего легкую цепь, или тенденцию к такому колебанию, соответственно.Этот поворот плеча рычага, часто называемый силовым ударом (рис. 2, этап 4), является основой для создания силы мышц и индуцированного миозином скользящего движения между тонкими и толстыми нитями в саркомере. Тип структурного изменения, которое фактически происходит в этом процессе, зависит от растяжения эластичных элементов в головке миозина и в других местах, и, как только что упоминалось, величина структурного изменения варьируется в зависимости от внешней нагрузки на поперечный мост (см. Ниже). .
В определенных физиологических условиях мышца не производит никакой механической энергии, несмотря на активные циклы поперечного моста, например, во время изометрических сокращений (без изменения длины), что эквивалентно изоволюметрическому сокращению сердечной мышцы, сокращающейся против закрытых клапанов.Кроме того, эксцентрическое сокращение, когда мышца растягивается во время активности, связано с работой, выполняемой над мышцей, а не с мышцей [76]. Такие эксцентрические сокращения физиологически происходят в скелетных и сердечных мышцах [77]. Во время эксцентрических сокращений происходит образование актомиозиновых перекрестных мостиков, но биохимический цикл на Рисунке 2 не завершается, что очевидно из очень низкого оборота АТФ в этих условиях [78]. Вместо этого миозиновые поперечные мостики принудительно разрушаются [34, 79–82] после оттягивания их эластичного элемента назад (что соответствует повороту плеча рычага против часовой стрелки на Рисунке 2).Т.о., в конце концов, обратное притяжение приводит к более высокому натяжению поперечного мостика, чем поддерживается актомиозиновой связью [81, 83–87]. Затем миозиновая головка отделяется от актина без высвобождения АДФ и последующего повторного связывания АТФ, в отличие от ситуации во время укорочения и изометрического сокращения. В самом деле, отслойка поперечного моста также довольно медленная во время изометрического сокращения, связанного с ключевыми свойствами состояния на рисунке 2. Это состояние долгое время предполагалось в скелетных мышцах [88–91], но его подробные свойства были сначала изучены более непосредственно с использованием различных медленные гладкие мышечные миозины [92–99].Однако совсем недавно состояние с аналогичными свойствами было обнаружено в скелетных мышцах [61, 100]. Также было важно включить в модели сокращения поперечнополосатой мышцы данные о том, что высвобождение АДФ происходит в два этапа, где первым этапом является реакция изомеризации, которая ускоряется отрицательным напряжением в плече миозинового рычага (соответствует повороту по часовой стрелке на рис. 2). Это приводит к открытию кармана связывания нуклеотидов (с зависящей от штамма () константой скорости; см.Рисунок 2) до того, как АДФ уйдет быстро с постоянной скоростью.
Числовое значение считается высоким для низких значений (доминирующее при быстром сокращении), промежуточным при промежуточных значениях (доминирующее при изометрическом сокращении) и очень низким для больших значений (доминирующее при принудительном удлинении). Ясно, что состояние и деформационно-зависимый переход ответственны за различия в кинетике поперечного мостика в разных условиях. Например, при высокой физиологической концентрации АТФ, если [101] и если она велика (), общая константа диссоциации определяется как Это относится к головкам миозина, которые попадают в область перетаскивания-удара (нм) во время укорочения, где они сопротивляются скольжению.Напротив, во время изометрического и эксцентрического сокращения, когда оно мало, то в этой связи представляет интерес рассмотреть концепцию коэффициента заполнения [102], то есть долю времени оборота АТФ, которую молекулы миозина проводят прикрепленными к актину. Это отношение (см. Далее [103, 104]), которое близко к 1 для непрерывных двигателей и <0,5 для непроцессорных двигателей, аппроксимируется следующим выражением: где и - константа скорости присоединения и отсоединения поперечного моста, соответственно.Вместе с (1) - (2) это предполагает, что коэффициент заполнения миозина II, будучи низким во время быстрого укорочения (например, ~ 0,05 в ненагруженном сокращении), может быть довольно высоким при изометрическом и эксцентрическом сокращении, а также очень медленном сокращении (с низкий ).
3. Плохо изученные явления при сокращении мышц
Поскольку сокращение мышц происходит из-за действия очень большого набора актомиозиновых двигателей, необходимо использовать статистические модели для установления связи сократительных свойств, таких как соотношение силы и скорости, с взаимодействием актомиозина. кинетика и механика [1, 105–108].Было разработано несколько моделей этого типа, часто включающих упомянутые выше принципы [31, 49, 109–111] и дополнительное предположение, что все миозиновые головки действуют независимо. Последнее предположение заслуживает пояснения. В большинстве современных моделей поперечных мостиков предполагается, что (i) головки миозина (даже две головки одной молекулы миозина) не конкурируют за один и тот же сайт на актине и (ii) связывание одной головки не влияет на кинетика (или ее зависимость от деформации) для любого перехода с участием другой головы (независимо от того, принадлежит ли она той же молекуле миозина или нет).Эта точка зрения аналогична определению, подробно изложенному Хиллом [105, 106]. Это означает, что наблюдаемые свойства мышечных волокон могут быть легко получены из средних значений, рассчитанных из заданного числа вероятностей состояний, без изменения параметров модели между различными условиями. Например, если предполагается, что миозиновые головки действуют независимо, это означает, что ни распространяющиеся структурные изменения в тонких филаментах, ни последовательные действия двух головок-партнеров не предполагают изменения любого значения параметра, такого как скорость прикрепления.Важно, однако, что эта независимость не препятствует взаимодействию (взаимодействию) миозиновых головок посредством коллективного изменения напряжения др. Головок, которые прикреплены к данной поверхности или толстым филаментам, мимо которых движутся актиновые филаменты [1, 49, 112–114].
Статистические модели поперечных мостов с независимыми генераторами силы, основанные на кинетической схеме, подобной рис. 2, но где каждое биохимическое состояние существует для ряда эластичных деформаций, хорошо учитывают несколько сократительных явлений.Это включает богатую информацией взаимосвязь между скоростью и нагрузкой на мышцу (соотношение нагрузка-скорость или сила-скорость; Рисунок 3; [115]). Однако некоторые ключевые аспекты функции мышц не могут быть объяснены однозначно с помощью самых последних моделей поперечных мостовидных протезов. Например, если низкая скорость прикрепления миозина к актину, предполагаемая скоростью роста изометрической силы, включена в статистическую модель (например, [1] или [31]), скорость ниже, чем наблюдаемая экспериментально, предсказывается для укорачивание при промежуточных нагрузках.Таким образом, высокая максимальная выходная мощность при сокращении мышц [116] не учитывается ([31, 32] и ссылки в них; см. Также рисунок 3). Низкая скорость прикрепления также не согласуется с высоким устойчивым сопротивлением насильственному удлинению при эксцентрических сокращениях [79, 80, 110, 117]. В связи со сложностью учета высокой выходной мощности во время укорачивания, также трудно учесть быстрое сокращение рабочего хода после быстрого шага длины, то есть тот факт, что амплитуда ослабления натяжения при быстром отпускание восстанавливается значительно быстрее, чем натяжение после этапа отпускания заправки.Эти явления могут быть воспроизведены путем модификации существующих моделей (например, [110]), чтобы сделать скорость прикрепления зависимой от скорости так, чтобы она была низкой во время изометрического сокращения, промежуточной во время укорачивания и быстрой во время удлинения [33–35, 79, 80, 110 ]. Однако скорость прикрепления, зависящая от скорости, не является разумной с физической точки зрения. Поэтому было предложено несколько альтернативных механизмов, объясняющих кажущуюся зависимость этой скорости от скорости [31, 35, 75, 110, 118–124]. Некоторые из альтернативных предложений сохранили идею независимых миозиновых головок, но значительно увеличили количество состояний и / или включили возможность для миозиновых головок быстро «прыгать» между соседними участками на актиновых филаментах.Другие вместо этого взяли на себя важную роль сотрудничества между двумя головками данной молекулы миозина. Однако до сих пор нет единого мнения об этих моделях. Третья возможность состоит в том, что кажущаяся зависимость скорости прикрепления от скорости связана со структурными изменениями, вызванными миозином или напряжением вдоль актинового филамента [21, 125–133]. Они могут совместно изменять свойства связывания миозина соседних или даже отдаленных сайтов актина. Рассмотренные выше альтернативные объяснения более подробно рассматриваются ниже.
Другой малоизученной проблемой является патогенез наследственных саркомерных миопатий, которые обычно возникают из-за точечных мутаций миозина или регуляторных белков. Разработка методов экспрессии белков миозина II поперечно-полосатой мускулатуры [134–137] позволила изучить лежащий в основе функциональный дефицит на молекулярном уровне. Однако сложный и многомерный патогенез заболеваний [36–43] является результатом нарушения функции на уровне всей мышцы / сердца.Это требует новых экспериментальных подходов к изучению функций ансамбля на саркомерных или даже суперсаркомерных уровнях [43]. В то время как редукционистский подход даст важные ключи к разгадке механизмов болезни, полное понимание, вероятно, потребует исследований на разных уровнях организации.
Проблемы с пониманием миопатий очень похожи на проблемы с пониманием эффектов лекарств. Лекарства, влияющие на сокращение мышц, представляют интерес по нескольким причинам. Например, существуют соединения с активирующим потенциалом [138, 139], которые стимулируют активность актомиозин-АТФазы и усиливают сократительную способность или даже действуют как своего рода химический шаперон, который реактивирует неправильно свернутые молекулы миозина [140].Эти вещества представляют новое поколение лекарств, и повышение их эффективности может обеспечить новые стратегии лечения заболеваний, направленные против различных наследственных миопатий, острой или хронической сердечной недостаточности и других форм сердечно-сосудистых заболеваний. С другой стороны, ингибиторы миозина могут быть полезны для лечения миопатий, вызванных мутациями миозина, которые увеличивают активную силу при одновременном снижении эффективности сократительной способности мышц [37, 141, 142].
В целом, любое небольшое химическое соединение, которое эффективно связывается с моторным доменом миозина и аллостерически модулирует функциональные характеристики, представляет большой интерес для исследований миозина и мышц [87, 100, 111, 143–157].В отличие от точечных мутаций, специфические эффекты лекарств можно изучать не только с использованием экспрессированных одиночных молекул или неупорядоченных ансамблей, но также с использованием препаратов мышечных волокон с сохранением порядка решетки миофиламентов.
4. Различные экспериментальные системы
Ниже мы рассмотрим, почему исследования с использованием различных методов и на разных уровнях иерархической организации дают результаты, которые иногда сложно согласовать друг с другом (см. Также [158]). Мы также рассматриваем модельные исследования [1, 47, 52, 105, 107, 108, 112], потому что они способствовали преодолению разрыва между различными уровнями иерархической организации и интегрированной информацией из разных экспериментальных систем и из разных научных дисциплин.Разработки в этом направлении включают исследования [109, 117], пытающиеся объединить молекулярные структурные модели, биохимические схемы и результаты механики мышц. Более того, в последнее время были предприняты попытки добиться детального соответствия предсказаний модели диапазону экспериментальных данных [31, 75, 103, 110, 111, 121, 122, 159].
Проблемы интеграции результатов различных типов исследований связаны с конкретными особенностями и ограничениями, которые различают разные экспериментальные системы и подходы, как указано ниже.
4.1. Исследования биохимических растворов
Исследования биохимических растворов [4, 6, 50–54, 56–58, 63–65] позволили расшифровать доминирующие части кинетической схемы обмена АТФ миозином и актином (рис. 2; обзор в [16] , 55, 57, 104]). В большинстве этих исследований использовался субфрагмент 1 миозина (S1), который содержит каталитические и актин-связывающие сайты миозина и часть плеча рычага (рис. 1 (c)). С помощью этого препарата состояния актомиозина обычно исследуются в условиях низкой ионной силы и без напряжения, что соответствует положению эластичного равновесия в мышцах [107].Отсутствие эластической деформации контрастирует с ситуацией при сокращении мышц, где эластическая деформация является основой для развития силы и влияния силы на константы скорости перехода актомиозина.
Принимая во внимание, что зависимые от напряжения переходы не могут быть исследованы в исследованиях раствора с использованием S1, они могут быть изучены с помощью механики одиночных молекул и тестов подвижности in vitro, где моторные фрагменты миозина иммобилизованы на поверхностных субстратах (Рисунок 4). Некоторые аспекты зависимых от штамма переходов также могут быть исследованы в растворе с использованием моторных фрагментов тяжелого меромиозина (HMM) [99, 100, 160], потому что оба его моторных домена могут связываться с актиновыми филаментами.Это приводит к деформации между головками, хотя, скорее всего, отличной от той, которая присутствует в упорядоченной решетке саркомера.
Интересная модель, так называемая модель 3G, была предложена в двух влиятельных статьях [57, 58], основанных на доказательствах того, что связывание головки миозина с актином происходит в два этапа. Это привело к идее, что каждое биохимическое состояние (рис. 2) существует в трех различных структурных состояниях с высоким, низким и очень низким сродством к актину. Модель 3G, кроме того, предполагает, что равновесие между этими состояниями зависит от занятости активного центра нуклеотидами.Эти идеи имеют отношение к пониманию создания силы в мышцах и были включены в несколько более продвинутых статистических моделей поперечных мостов (см. Ниже).
4.2. Анализы подвижности in vitro и механические измерения малых ансамблей и одиночных молекул
Анализы подвижности in vitro можно рассматривать как продолжение исследований биохимических растворов с тем ключевым отличием, что двигательные фрагменты миозина иммобилизуются на поверхности. В то время как иммобилизация поверхности может влиять на функцию белка и усложнять некоторые аспекты интерпретации данных ([161, 162]), она обеспечивает сохранение зависимости взаимодействия актомиозина от штамма.Следовательно, он также позволяет развивать движение и силы. Методы анализа подвижности in vitro [7] позволяют наблюдать отдельные актиновые филаменты [21] при взаимодействии с различным количеством моторных фрагментов миозина и в различных экспериментальных условиях, например, концентрации АТФ и ионной силе [163, 164]. Позднее этот анализ был дополнен «лазерной ловушкой» (техника «оптического пинцета» [22–24, 68, 165, 166]). В этой системе предположительно одна молекула миозина прикрепляется к актиновой нити, которая захватывается на концах шариками, «захваченными» между двумя сфокусированными лазерными лучами (рис. 4).При взаимодействии миозин-актин смещение актиновых филаментов можно измерить, отслеживая положение шариков, показывая, что миозин II производит силы 1-10 пН и максимальные смещения ~ 10 нм за одно взаимодействие с актином [23, 94, 167 –171]. Однако в физиологических условиях сила и смещения, производимые миозином и любым другим молекулярным двигателем, находятся под сильным влиянием внешней нагрузки, которая определяет их функционирование и механику.
Зависимость рабочего хода от нагрузки в исследованиях одиночных молекул исследовалась в основном на процессорных двигателях (например,g., миозин V) из-за медленной кинетики и процессивности отслоения, что предъявляет меньшие требования к временному разрешению. Механика миозина V была изучена, когда двигатель подвергался воздействию «толкающих» и «тянущих» сил, что соответствует уменьшенной и увеличенной внешней нагрузке соответственно. Продолжительность прикрепления между двигателем и актиновыми филаментами уменьшалась, когда двигатели толкались, и увеличивалась, когда двигатели тянулись [168, 172–174]. Более того, время прикрепления укорачивается с увеличением концентрации АТФ, предполагая, что прикрепление прекращается, когда АТФ связывается с миозином после высвобождения АДФ [168, 172–175].Последующие исследования миозинов I и V и миозина II гладких мышц [94, 97, 98, 175, 176] предполагают, что увеличение нагрузки задерживает высвобождение АДФ, что приводит к более длительному времени прикрепления.
Изучение механики одиночных молекул с использованием миозина II скелетных мышц [23, 169–171, 177, 178] является сложной задачей из-за высокой скорости отслоения и связанного с этим низкого коэффициента заполнения . Следовательно, изучение эффектов нагрузки миозином II должно происходить во время чрезвычайно коротких прикреплений актомиозина. Исследование, проведенное с миозином гладких мышц, который имеет более длительное среднее время прикрепления, чем миозин поперечно-полосатых мышц, показало, что увеличение нагрузки увеличивает это время [98].Предполагая, что общий цикл прикрепления / отсоединения не изменяется во время цикла актомиозина, увеличение времени прикрепления приводит к увеличению продолжительности включения. Авторы [98] также исследовали кинетику зависимости времени прикрепления от нагрузки и различают две фазы прикрепления миозина, что согласуется со структурными исследованиями, показывающими две различные конформации миозиновых связей: одна конформация в присутствии (фаза 1), а другая — в присутствии миозина. отсутствие (фаза 2) связанного АДФ. Увеличение нагрузок увеличивало продолжительность фазы 1, но не влияло на фазу 2, предполагая, что зависимость от нагрузки может быть отнесена к переходу между состоянием актомиозина с и без связанного АДФ (см.на рисунке 2). Позже, используя систему лазерной ловушки с улучшенным временным разрешением [61], аналогичные результаты были получены с использованием быстрого и медленного миозина II из скелетных мышц.
Анализы подвижности in vitro и связанные с ними методы измерения силы ответили на ряд основных вопросов, касающихся сокращения поперечно-полосатых мышц, предполагая, что (i) только одна головка миозина II необходима для создания движения и силы [8, 179, 180 ], (ii) ненагруженное смещение на 5–10 нм производится моторным доменом миозина при связывании с актиновым филаментом [23, 61, 67, 168, 171, 177] с самыми высокими значениями в этом диапазоне для двуглавого препараты миозина и оптимизированная ориентация, (iii) максимальная сила около 10 пН активно развивается моторным доменом миозина [23, 170], (iv) есть зоны-мишени с сайтами, расположенными на расстоянии ~ 36 нм друг от друга, вдоль актинового филамента для который иммобилизованный мотор миозина II связывается легче [177, 181], чем с другими сайтами (см. также [71, 74]), и (v) смещение, индуцированное данным сильно прикрепленным к актину моторным доменом, происходит в два этапа [61 ], где вторая стадия, как полагают, связана с деформационно-зависимым переходом от в состояние AMADP.Наконец, недавние разработки [182] позволили довольно детально исследовать силовую зависимость нескольких кинетических ступеней в актомиозиновом обороте АТФ.
Трудно переоценить важность поверхностных анализов. Однако сложно связать данные о механике одиночных молекул с механикой мышечных клеток или миофибрилл, где очень большие ансамбли миозиновых моторов взаимодействуют одновременно с актиновыми филаментами (см. Ниже). Более того, ключевые аспекты функции мышц, такие как подробная форма зависимости силы от скорости и кажущаяся зависимость константы скорости прикрепления от скорости, не были рассмотрены, потому что они являются результатом взаимодействий большого ансамбля моторных доменов миозина с актиновыми филаментами в заказанная аранжировка.Лишь в нескольких случаях взаимодействие между несколькими (но не большим количеством) моторов и актиновой нитью было исследовано с помощью оптического пинцета [183]. Более того, даже если можно было бы изучить взаимодействие большого количества миозиновых моторов с актиновыми филаментами, трудно правильно оценить кооперативные явления. К таким явлениям относятся явления, связанные с ролью двух миозиновых головок и их возможным взаимодействием с двумя актиновыми филаментами [160], или то, что связано с упорядоченным расположением миозиновых моторов в трех измерениях вокруг каждого актинового филамента.
Статистические и кинетические модели упомянутого выше типа (например, [1, 103, 108]) образуют отличную основу для объяснения результатов как мышечных клеток, так и обычных анализов подвижности in vitro и механических исследований отдельных молекул. Однако при сравнении результатов этих различных экспериментальных систем существует опасность путаницы. Примером этого является расстояние рабочего хода миозина (рабочий ход), как показано ниже. Во-первых, мы определяем это расстояние как среднее смещение актиновой нити, активно производимой, когда одна миозиновая головка связывается с актином и завершает свой оборот АТФ в отсутствие противодействующей нагрузки.Это расстояние будет таким, какое измеряется в исследованиях с помощью оптического пинцета для одиночных молекул с низкой жесткостью ловушки. Он не включает сдвиг эластичности миозиновой головки в деформации с отрицательными силами (которые сопротивляются скольжению), то есть в область перетаскивания [184]. Это значение рабочего хода будет идентично значению: полученному из скорости скольжения in vitro () и миозина во времени () при нулевой деформации (например, измеренной в растворе), если предположить, что за один раз принимается ровно одна головка миозина. продвигает актиновую нить.Эти условия подразумевают немедленное выполнение силового удара (для достижения его упругого равновесия с нулевой деформацией) после присоединения миозиновой головки к актину и последующего отсоединения с постоянной времени, за которым сразу, но не предшествует, присоединение новой миозиновой головки и повторение цикла. . В действительности такие идеальные условия не выполняются. Следовательно, величина длины шага, полученная из скоростей, измеренных в лабораторных исследованиях подвижности и исследованиях с помощью оптического пинцета, различается до ~ 2 раз.Это становится ясно, если исследовать состояние с помощью очень большого ансамбля миозиновых головок, которые работают вместе, чтобы продвигать актиновую нить. Это условие выполняется в мышечных клетках и приблизительно выполняется в анализе подвижности in vitro, если актиновая нить перемещается по поверхности с насыщающей плотностью моторных фрагментов миозина. В этих условиях эластичный элемент большей части миозиновых головок будет укорачен до такой степени, что эти поперечные мостики будут сопротивляться скольжению в направлении укорачивания (выполнить удар перетаскивания).Во время установившегося укорачивания без нагрузки отрицательные поперечные силы, которые противодействуют скольжению, точно уравновешиваются положительными силами, возникающими из-за поперечных перемычек, которые подвергаются силовому ходу. Эти уровни силы определяются средней деформацией отрицательно () и положительно () деформированных поперечных перемычек, соответственно, каждый коэффициент, умноженный на жесткость поперечной перемычки. Если жесткость гука, значения жесткости в левой и правой частях уравнения сокращаются и. Это выражение обманчиво похоже на выражение для, приведенное выше.Однако всегда меньше, чем [103, 111, 184], как правило, согласованное с которым, в свою очередь, согласуется с (см. (1) — (2)).
Эти отношения могут быть дополнительно расширены, если учесть также и, определяемые как среднее расстояние скольжения и время, соответственно, в течение которых данная миозиновая головка остается прикрепленной к актиновой нити при приложении сначала положительной, а затем отрицательной силы (выполнение рабочего удара с последующим перетаскиванием) в большом ансамбле. Естественно, это относится и к этому.Наконец, легко показать (см. [103]), что и, где последнее неравенство является приближенным.
4.3. Механика мышечных волокон и статистические модели
В области механики мышц используются механические и оптические сенсорные системы, чтобы связать изменения длины мышечных саркомеров с жесткостью и силами, развиваемыми мышечными клетками (мышечными волокнами). Эксперименты можно проводить как на интактных [19, 185, 186], так и на ободранных [187–189] мышечных волокнах. Неповрежденные мышечные клетки отделяют от живой мышцы микромеханическими инструментами (ножницами, щипцами, иглами и т. Д.).) оставляя клеточную мембрану нетронутой. Напротив, мембрана сегментов мышечных клеток, покрытых кожей, удаляется химическим или механическим способом, что позволяет контролировать среду миофиламентов из жидкости ванны.
Центральное значение в механике мышц имеют исследования, связывающие постоянную нагрузку на мышечную клетку с результирующей постоянной скоростью изменения длины или, что эквивалентно, силой, развиваемой при наложении изменения длины в форме пандуса с заданной скоростью [1, 32, 115, 187, 190–195].Соотношения силы и скорости, полученные любым из этих способов, продемонстрировали, хотя и косвенно, что увеличение нагрузки увеличивает продолжительность силового удара миозина [1, 196–198]. Скорость в ответ на возрастающие нагрузки непрерывно уменьшается, примерно в соответствии с прямоугольной гиперболой [190] (однако см. [191]) от максимального значения при сокращении без нагрузки до нуля при изометрическом сокращении (без изменения длины). В этот момент производная постоянной скорости от постоянной нагрузки является непрерывной [191], когда нагрузка увеличивается выше изометрической силы, чтобы вызвать удлинение с постоянной скоростью (отрицательная скорость сокращения; Рисунок 3 (b)).Когда растяжка выполняется на низких скоростях (менее 2 длин мышц с -1 ; с -1 ), увеличение силы во время увеличения длины имеет два компонента: (i) быстрая фаза, в которой сила увеличивается. существенно более нескольких нанометров на полусаркомер и (ii) медленная фаза, в которой сила увеличивается на небольшую величину или остается неизменной [79, 80, 86, 199–204]. Последняя фаза приближается к постоянной силе во время удлинения. Переход между этими двумя фазами происходит при критической амплитуде растяжения ~ 10 нм полусаркомера, что обычно связано с критической деформацией прикрепленных поперечных мостиков, за пределами которой они принудительно отделяются от актина [33, 34, 79, 80, 85, 86, 199–202, 204–206].
Механизм увеличения усилия во время растяжения все еще остается спорным. Некоторые исследователи предположили, что это в первую очередь связано с увеличением силы на поперечный мост (повышенная деформация) во время растяжения [33, 34, 80, 86, 207]. Было сделано предположение, что этот эффект вызван перекрестными мостиками перед силовым ударом в состоянии, предшествующем высвобождению фосфата [86, 201, 202, 208, 209]. Интересно, что в этой связи недавние исследования дифракции рентгеновских лучей [124] показали повышенную долю нестерео-специфически связанных миозиновых головок во время растяжения, свойства, обычно приписываемые слабосвязанным поперечным мостикам предпускового удара.Однако идею о повышенном силовом сопротивлении, приписываемом слабосвязанным головкам миозина, нелегко согласовать с вышеупомянутой критической деформацией ~ 10 нм. Тем не менее, любая модель должна учитывать выводы о том, что аналоги фосфата ванадат и фторид алюминия (AlF 4 ), которые, как известно, смещают поперечные мосты в положение предварительного силового удара, уменьшают изометрическую силу волокон, обработанных полиэтиленгликолем (что способствует миозин-актиновые взаимодействия) значительно больше, чем силы растяжения [86, 208].Аналогичным образом, препараты бутандионмоноксим (БДМ) [207, 210], бензилтолуолсульфонамид (БТС) [202] и блеббистатин [197], которые, как считается, ингибируют основные переходные процессы, генерирующие силу, имеют аналогичные эффекты. В этой связи также интересно отметить, что повышенный тонус внеклеточного раствора, вызывающий сокращение объема интактных мышечных клеток, заметно снижает максимальное изометрическое напряжение, не влияя на максимальную силу во время растяжения [80, 204]. Аналогичный результат наблюдается при пониженной температуре [211].
На многие аспекты механики мышц сильное влияние оказала новаторская работа А.Ф. Хаксли как с теоретической [1, 47], так и с экспериментальной [19, 47, 212–215] точки зрения. Соответственно, исследования механики мышц часто интерпретируются в терминах моделей поперечных мостов, которые включают особенности моделей Хаксли и Симмонса (1971; [47]) и Хаксли (1957; [1]). Последняя модель объясняет основные стационарные свойства мышцы (такие как соотношение силы и скорости), тогда как модель Хаксли и Симмонса (1971) (рис. 5) учитывает реакции натяжения на быстрые изменения длины, наложенные на мышечную клетку.Комбинация этих двух моделей хорошо объясняет несколько аспектов мышечной функции [216].
Модель Хаксли и Симмонса была вдохновлена моделью качающегося поперечного моста, предложенной Х. Э. Хаксли [2] на основе ультраструктурных данных. Интересно, что подобно более поздним результатам, основанным на атомной структуре миозина [5], модель включает идеи с увеличивающимся числом точек прикрепления между актином и миозином, которые стабилизируют состояния высокой силы. Однако модель также вызывает критические вопросы.Во-первых, в актомиозиновом цикле однозначно не идентифицирована независимая эластическая структура. Изгибание всей легкой цепи стабилизированного альфа-спирального плеча рычага [217] или структурные изменения в соседних регионах в конвертерном домене [141, 218], как предполагается, представляют эластичный элемент (см. Также [219]). Однако эта область также считается основным компонентом, который колеблется во время восстановления силы после длинного шага [66, 220].
Эта так называемая модель плеча качающегося рычага следовала модели качающегося поперечного моста после накопления доказательств против крупномасштабных изменений ориентации всего двигательного домена миозина во время генерации силы [30] (однако, см. [71]).Вторая проблема с моделью Хаксли и Симмонса [47] связана с количеством необходимых состояний и структурных переходов, генерирующих силы. В их оригинальной работе предполагалось два стабильных прикрепленных состояния, в которых переход от состояния с низкой силой к состоянию с высокой силой сопровождался удлинением упругого элемента на ~ 10 нм. Как уже было указано авторами, двух состояний недостаточно, чтобы учесть высокую выходную мощность мышцы, а также скорость переходных процессов напряжения с использованием модели с независимым упругим элементом.Эта проблема становится все более сложной после появления доказательств того, что жесткость упругого элемента находится где-то в диапазоне 1,7–3,3 пН / нм [32, 67, 221], что значительно выше, чем считалось ранее.
В то время как жесткость поперечной перемычки ~ 1,7 пН / нм кажется совместимой с двумя этапами создания напряжения [114, 222], для жесткости поперечной перемычки ~ 3 пН требуется большее количество структурно и механически различных состояний. / нм [75, 121, 122, 222, 223]. Имеются ограниченные доказательства такого большого количества состояний с различными устойчивыми положениями плеча рычага.Возможно, проблема будет решена, если повороту плеча рычага будет предшествовать переход всей миозиновой головки «качение и фиксация», который также способствует восстановлению силы после шага по длине ([72]; см. Выше). Однако для любой модели с большим количеством состояний проверка затруднительна, потому что широкий диапазон экспериментальных результатов может быть воспроизведен с несколькими свободными параметрами независимо от того, верна модель или нет. Последнее осложнение, связанное с моделью Хаксли и Симмонса [47], состоит в том, что скорости соответствующих биохимических переходов, наблюдаемые при исследованиях растворов, значительно ниже, чем скорости, необходимые для учета быстрых переходных процессов напряжения.Это осложнение связано с не до конца понятой взаимосвязью между быстрыми переходными процессами напряжения в ответ на шаги длины и этапом высвобождения P — в обороте АТФ актомиозином, то есть биохимический переход, наиболее тесно связанный с генерирующим силу структурным изменение актомиозинового моста (см. ниже). Это подтверждается сравнением результатов исследований растворов и быстрых возмущений сокращения в неповрежденных мышечных клетках и клетках с кожей, включая быстрые шаги длины (см. Выше) и синусоидальные колебания [89, 224, 225], быстрые изменения нагрузки [48, 122], температуры ( скачки температуры; [209, 225–231]), гидростатическое давление (скачок давления; [232]) и концентрация фосфата (скачок фосфата; [151, 233–235]).Более того, в волокнах с оболочкой понимание этапа создания силы и его взаимосвязи, например, с высвобождением P и (см. Ниже), было получено путем исследования [P i ] -зависимости изометрической устойчивости в стационарном состоянии. данные о растяжении и силе-скорости ([122, 192, 209, 236]).
Проблема, которая серьезно усложнила интерпретацию большого количества исследований механики мышц, — это возможность нелинейной (не гуковской) эластичности поперечных мостов [67, 111, 237] и / или миофиламентов [33, 238]. –242] или наличие неизменного во времени параллельно-упругого элемента, возможно, связанного с фиксированным числом поперечных перемычек [243].Эти вопросы (рассмотренные в [222]) были недавно рассмотрены [244], но еще не решены, что затрудняет интерпретацию данных жесткости с точки зрения количества прикрепленных поперечных мостов. Эта неопределенность подчеркивается экспериментами по исследованию количества прикрепленных поперечных перемычек во время укорачивания с разными скоростями [32, 85] и во время медленного растяжения [33, 35, 120]. Во время укорачивания измерения жесткости (после поправки на предполагаемую линейную последовательную упругость) показывают, что сила и количество прикрепленных поперечных перемычек приблизительно пропорциональны (по крайней мере, при нагрузках, близких к изометрической) [32].Напротив, альтернативный подход для получения количества прикрепленных поперечных мостов, основанный на реакции максимального натяжения на очень быстрое растяжение [206], предполагает отсутствие такой пропорциональности [85]. Более того, предположение о линейной эластичности филаментов предполагает ([35] и позже [120]), что сопротивление медленному растяжению активной мышцы в основном объясняется повышенным набором поперечных мостиков. Напротив, Nocella et al. [33] обнаружили доказательства нелинейной податливости филаментов, предполагающие, что увеличение силы во время растяжения в основном связано с увеличением средней деформации поперечного моста (см. Также [34, 80]).Другой тип исследований, которые не всегда легко интерпретировать, — это исследования, основанные на малоугловом рассеянии рентгеновских лучей с временным разрешением от сокращающихся мышечных клеток. Хотя эти исследования привели к новым важным открытиям [217, 220, 238, 239, 245], в некоторых случаях существуют противоречивые взгляды на интерпретацию [246]. Заинтересованный читатель может найти подробности в других обзорных статьях [247–249].
Эксперименты с мышечными волокнами имеют преимущество в сохранении трехмерного расположения между миофиламентами в полусаркомерах и сохранении дополнительных белков, которые могут влиять на сокращение.С другой стороны, большое количество белковых компонентов заставляет использовать статистические модели [1, 105] для интерпретации экспериментальных результатов, и несколько различных моделей, вероятно, объясняют данный набор данных. Кроме того, интерпретация механических и структурных данных мышц (например, из малоугловой дифракции рентгеновских лучей) с точки зрения свойств поперечного моста часто основывается на высокой степени однородности между полусаркомерами по длине исследуемого мышечного волокна и более. поперечный разрез мышцы.В отсутствие такого порядка и единообразия возможны непредсказуемые эмерджентные свойства. Модельные исследования показали, что неоднородности могут вызывать увеличение остаточной силы после растяжения [250] и подавление колебательного движения при определенных условиях [43, 49]. Различные типы неоднородностей между сегментами мышечных клеток также наблюдались экспериментально [11, 19, 251–254] и, как было установлено, играют важную физиологическую роль, например, в ускорении расслабления после изометрического сокращения [10] (см. Также [255] , 256]) и вносят свой вклад в аспекты реакции натяжения на растяжение [11, 12, 257].
На результаты экспериментов с мышечными волокнами может непредсказуемым образом влиять тип мышечного волокна, то есть использование быстрых или медленных мышц (например, [61, 101, 258–260]) или смеси изоформ миозина. в данной ячейке [251, 254] (см. также [261, 262]). Более того, уровень активации и присутствие регуляторных белков ([151, 187, 263]) могут по-разному влиять на кинетику взаимодействия актомиозина. Наконец, ряд посттрансляционных модификаций может повлиять на функцию.Это расширяющееся поле здесь не рассматривается, но стоит упомянуть, что лекарственный препарат блеббистатин по-разному влиял на скорость разгруженного укорочения в кожных волокнах в присутствии и в отсутствие фосфорилирования регуляторных легких цепей миозина [264].
4.4. Myofibril Mechanics
Миофибриллы могут быть изолированы как от скелетных, так и от сердечных мышц и установлены для измерения силы и изменения длины (например, [207, 256, 265, 266]). Миофибриллы представляют особый интерес для изучения, потому что они являются наименьшими экспериментальными единицами, которые поддерживают трехмерно упорядоченную решетку миофиламентов поперечно-полосатой мышцы.Миофибриллы образованы в основном саркомерами, расположенными последовательно и со всеми основными белками (т.е. миозином, актином, тропонином, тропомиозином, тайтином и миозин-связывающим белком С). Результаты исследований миофибрилл были использованы для связи исследований отдельных молекул или белков в растворе с исследованиями, проведенными с использованием мышечных волокон. Длину исследуемых сегментов миофибрилл исследователи могут практически выбрать, а их диаметр существенно меньше (~ 1,0–1,5 мкм м), чем у мышечных волокон (~ 10 мкм мкм).Это важно, потому что это делает время диффузии во время активации миофибрилл очень коротким, устраняя градиенты активации от периферии к сердцевине препарата. Напротив, более длинные диффузионные расстояния в мышечных волокнах могут вызывать значительные градиенты не только в уровне активации, но также и в концентрациях АТФ, АДФ и P — , что делает интерпретацию на уровне комплекса актомиозина.
Разработка методов быстрой смены раствора во время экспериментов с миофибриллами позволяет точно определять скорость развития силы и расслабления во время сокращения, важных показателей взаимодействия актомиозина.Кроме того, использование активации миофибрилл в сочетании с быстрыми изменениями длины, накладываемыми на препарат, позволяет точно оценить скорость восстановления силы (Ktr) в соответствии с протоколом укорачивания-растяжения [265], который первоначально был разработан для применения к мышечным волокнам [265]. 267]. Ktr эффективно использовался для определения кинетики перекрестных мостиков, переходящих между слабосвязанными и сильно связанными состояниями. Ktr, определенный с высоким временным разрешением, использовался не только для исследования этапов цикла актомиозина, но и для сравнения кинетики миозина в мышцах с разными состояниями, здоровьем и болезнями (например,г., [268–270]). Наконец, исследования миофибрилл позволяют исследователям выяснить детальную взаимосвязь между развитием силы, расслаблением и динамикой саркомеров. Поскольку миофибриллы образованы одной цепочкой саркомеров, сила, создаваемая миофибриллами на обоих концах, может создаваться и распределяться только этими взаимосвязанными структурами. Такая структурная геометрия была исследована, чтобы сделать вывод о механическом поведении миофибрилл при активации и во время / после нагрузок, которые прилагаются к препарату [257, 266].
Недавно были проведены исследования с использованием отдельных саркомеров [271] и изолированных полусаркомеров [272], препаратов, которые по своей природе избегают неоднородности длины саркомера и, таким образом, открывают возможности для исследования сократительной способности без искажающих эффектов. Ограничением этих препаратов является их хрупкость — практически невозможно активировать отдельные саркомеры более чем за 5-6 циклов активации.
4.5. Молекулярная структура: рентгеновская кристаллография и крио-электронная микроскопия
Структурное понимание (рис. 6 (а)) взаимодействия актомиозина было получено путем объединения кристаллографических данных для моторного домена миозина с информацией, полученной с помощью электронной микроскопии и малых углов. Изучение рассеяния рентгеновских лучей на актиновых филаментах, декорированных миозином [27, 59, 273–275].Рентгеновские структуры моторных доменов миозина, кристаллизовавшиеся к настоящему времени, делятся на три категории в зависимости от структурного состояния, которое они представляют в цикле АТФазы (Рис. 2). Различия сделаны на основе относительного положения элементов активного сайта (переключатель 1 и переключатель 2 замкнуты или разомкнуты; Рисунок 6 (b)), ориентации плеча рычага (вверх или вниз) и конформации актин-связывающего элемента. расщелина (открытая, закрытая или частично закрытая). Переключающие элементы действуют как нуклеотидные сенсоры, ответственные за связь между связывающим нуклеотидом карманом и сайтами связывания актина.Их обратимое переключение между двумя конформациями открывает и закрывает активный сайт вокруг γ -фосфата, обеспечивая гидролиз и связывание внутренних конформационных изменений с более крупными перестройками и движениями твердого тела субдоменов в двигателе миозина, которые в конечном итоге приводят к генерации силы. При рассмотрении состояний на основе рассеяния рентгеновских лучей и криоэлектронной микроскопии важно подчеркнуть, что они захватывают только метастабильные структурные состояния.
Большинство структур миозина кристаллизовалось с помощью АДФ.Аналоги P и представляют состояние предсилового удара после гидролиза АТФ со слабым сродством миозинового мостика к актину [157, 274, 276–279]. Расщелина в большинстве этих структур частично закрыта. Кроме того, переключатель 1 и переключатель 2 принимают закрытое положение, а плечо рычага находится в верхнем положении. Во вторую группу структур входят состояния моторного домена миозина, обозначенные как постригор [280–283]. Считается, что они представляют состояние до гидролиза (см. Рис. 2) миозина, из которого происходит ход восстановления, переводя двигатель в состояние каталитически компетентного предпускового хода.В постригорных состояниях расщелина открыта, переключатель 2 замкнут, переключатель 2 разомкнут, а плечо рычага опущено. Третья группа структур, определяемая как ригориподобные, была получена для миозина V и миозина VI [284–286]. В соответствии с функциональными свойствами этих миозинов с высоким коэффициентом заполнения, кристаллические состояния, как полагают, представляют связывание с высоким сродством к актину во время после того, как произошел силовой удар. Для большинства этих безнуклеотидных структур характерна конформация с закрытой щелью и плечом вниз.Здесь важно то, что подобная окоченению структура была также получена для мышечного и немышечного миозина II [287, 288]. Несмотря на небольшие различия, наблюдаемые в протяженности и местоположении закрытия щели между различными структурами, подобными окоченению, становится очевидным, что закрытие щели, хотя и энтальпически неблагоприятно [289], важно для облегчения высвобождения продуктов гидролиза.
Не существует кристаллической структуры моторного домена миозина, связанного с актином, но все структуры, подобные ригористике, обнаруживают черты связанного с актином состояния, и криоэлектронная микроскопия с высоким разрешением поддерживает эту точку зрения [290, 291].Другими ограничениями доступных структурных данных является отсутствие кристаллических структур, показывающих состояния между состояниями предпускового удара и состоянием, подобным строгому.
Ввиду ограниченной доступности структурных данных, определение последовательности событий, посредством которых миозиновый поперечный мостик генерирует силу, стало возможным только благодаря объединенному анализу структурной информации и биохимических данных кинетики раствора вместе с построением модели, включая молекулярные динамическое моделирование.В отсутствие АТФ миозин образует комплекс с высоким сродством с актином (рис. 6 (а)). В этом сильно связанном состоянии окоченения элементы активного сайта, switch 1 и switch 2, как полагают, принимают открытую конформацию с плечом рычага в нижнем положении (Figure 2) [59]. Состояние впоследствии переходит в состояние низкого сродства, поскольку Mg 2+ -ATP необратимо связывается с активным сайтом миозина [292].
Связывание Mg 2+ -АТФ вызывает замыкание переключателя 1, что приводит к образованию нескольких новых взаимодействий, таких как солевой мостик между переключателем 1 и переключателем 2, который помогает в стабилизации β -фосфата и позволяет координация иона Mg 2+ и правильное расположение окружающих молекул воды для гидролиза АТФ.Кинетические исследования с мутантами миозина, у которых образование солевого мостика нарушено, не способны к гидролизу, подчеркивая критическую роль взаимодействия switch 1 / switch 2 [293–296]. В то же время перестройки активного сайта, индуцированные связыванием Mg 2+ -АТФ, связаны с искажением семицепочечного β -листа, заставляя верхний субдомен 50 кДа претерпевать большое движение, что уменьшает контакт области и ослабляет сродство к актину. Это делает возможным открытие расщелины и полную диссоциацию актомиозинового комплекса [297].Диссоциированное состояние — это компетентное к гидролизу состояние миозина. Согласно современным данным, реакция гидролиза требует включения переключателя 2 [298, 299], что связано с более крупными перестройками релейной спирали и преобразователя [300–302]. Сдвиг на 6 Å переключателя 2 — как видно между структурами состояний постригорного и предпускового хода (рис. 6 (c)) — вызывает частичное раскручивание релейной спирали и изгиб. Поскольку кончик релейной спирали соединен водородными связями и гидрофобными взаимодействиями с преобразователем, относительно небольшое перемещение переключателя 2 усиливается через релейную спираль до поворота преобразователя на 65 ° и поворота плеча рычага от первоначального положения. вниз в верхнее положение.Этот структурный переход известен как инсульт восстановления [275, 282, 303–309].
Верхнее положение плеча рычага — это начальная точка силы, производящей рабочий или силовой ход, который требует повторного связывания миозина с актином (рис. 2). В противном случае P i высвобождается из миозина без связывания с актином после поворота плеча рычага, который представляет собой реверсирование рабочего хода и бесполезен в отношении производства силы [62].
Характеристика актин-связывающих элементов с помощью мутационного анализа предполагает, что связывание актина происходит последовательно за счет участия по крайней мере шести гибких миозиновых петель (рис. 6 (b), увеличенное изображение), которые модулируют нуклеотид-зависимым образом сила взаимодействия и связь с актином [296, 310–315] (см. также [316]).Согласно кинетике раствора, связывание миозиновых головок с актиновым филаментом происходит двумя разными способами, слабым и сильным [57, 58, 317], что не может быть полностью объяснено текущим набором структур. Структуры, подобные строгости, позволяют предсказать, как закрытие щели, вызванное связыванием актина, ускоряет высвобождение продукта [284, 287]. Однако то, что не может быть выведено из подобного строгости структурного состояния, это детали конформационных изменений, которые инициируют энергетический удар и которые сопровождают переход от исходного слабо связанного актомиозин-АДФ.Состояние P и актин-миозинового комплекса окоченения (рис. 2). Априори существует несколько возможностей [62], включая наличие состояния начала силового удара, в котором двигательный домен миозина сильно связан с актином, а плечо рычага находится в верхнем положении. Структурное моделирование этого предполагаемого состояния [318] предполагает, что силовой удар не является обращением восстановления-такта, потому что сильное связывание актина ограничивает относительное движение верхнего и нижнего 50K домена [59].Напротив, считается, что рабочий такт реализуется, по меньшей мере, в два этапа, включая переход от состояния предварительного рабочего хода к предлагаемому состоянию начала рабочего хода. Это может быть достигнуто вращательным движением нижнего домена 50 К (рис. 6 (d)), которое впоследствии закрывает щель, тем самым создавая скручивающую деформацию на 4-прядь β центрального листа β через W-спираль заставляет молекулу впоследствии выпрямлять релейную спираль, которая, в свою очередь, приводит в движение рабочий ход.Точное положение переключающих элементов активного сайта в этом переходном состоянии и их взаимное взаимодействие в следующих состояниях относительно дополнительных связанных перестроек релейной спирали и β -цепи ядра невозможно точно предсказать из существующих структур и моделей. С помощью кинетических исследований можно сделать некоторые предположения о серии движений переключателя, связанных с силовым ходом [319, 320]. Однако необходима дополнительная структурная и биохимическая работа, чтобы определить точный путь коммуникации, который связывает связывание актина с производством силы.
5. Плохо изученные молекулярные механизмы по отношению к сократительным свойствам
Для объяснения плохо изученных явлений при сокращении мышц (раздел 3) требуется лучшее понимание не полностью изученных молекулярных механизмов, рассматриваемых ниже.
5.1. Присоединение миозиновой головки к актину, высвобождение фосфата и основной генерирующий силу переход
В настоящее время существует довольно неполное понимание биохимических, механических и структурных событий, связанных с прикреплением миозиновой головки к актину и последующим производством силы.
Принимая во внимание, что здесь мы сосредоточены на переходе, генерирующем силу, уместно описать некоторые неопределенности относительно этапа ограничения скорости для цикла оборота АТФ, который был помещен где-то между этапом гидролиза АТФ и этапом высвобождения P i (рис. 2) [16, 55, 65, 108, 321, 322]. Этот вопрос важен для объяснения повышенной очевидной скорости прикрепления во время укорачивания при промежуточных нагрузках по сравнению с изометрическим сокращением (см. Выше). Например, если скорость присоединения ограничена скоростью процесса гидролиза, а не стадией присоединения или высвобождением P и , можно предвидеть более высокую кажущуюся скорость присоединения во время укорочения.Это происходит из-за завершения стадии гидролиза в то время, когда сайты-мишени актина (с разделением 36 нм) проходят мимо миозиновых головок, которые неправильно ориентированы для связывания. Это означает, что любое стерически выполнимое крепление поперечного моста в этих условиях выполняется быстрее, чем при изометрическом сокращении. Ситуация аналогична, если ступень ограничения скорости находится между так называемым огнеупорным и неогнеупорным состояниями M.ADP.P и . Так было в модели Eisenberg et al. [108], и это основа способности данной модели учитывать быстрое исправление рабочего хода за счет быстрого повторного прикрепления поперечных мостов из неуплотненного M.ADP.P i в состояние с низкой силой, которое способно претерпеть переход, генерирующий силу, на шаге длины [118].
Что касается взаимосвязи между переходом, генерирующим силу, и выпуском P i , несколько вопросов являются спорными. Во-первых, основной компонент быстрого восстановления натяжения в ответ на скачки длины [47, 212, 225] на порядок быстрее, чем реакция натяжения на внезапные изменения в концентрации P и [233] гидростатического давления [232], температура ([228–230], обзор в [209]), и процесс генерации силы, обнаруженный в спектроскопических исследованиях [323].Кроме того, скорость восстановления натяжения после длинных ступеней зависела от концентрации фосфата после растяжения, но не после быстрого ослабления. Таким образом, очевидно, что физическая основа реакции натяжения на шаги длины и другие возмущения не идентична, и взаимосвязь между реакциями возмущения длины и высвобождением фосфата является сложной. Идея о различных молекулярных основах реакции натяжения на скачки длины и скачки температуры согласуется с различными структурными изменениями в соответствии с картинами дифракции рентгеновских лучей мышечных волокон с кожей [217], но взаимосвязь сложна.Таким образом, реакция натяжения на скачки температуры, по-видимому, соответствует медленной фазе релаксации натяжения в ответ на быстрые шаги длины [225, 229, 230], а общая скорость реакции натяжения на скачки длины увеличивается с температурой. Наблюдаемые сложности (см. Также [230]) добавляют к опасениям [114, 158], что довольно большое количество состояний, необходимых для объяснения реакции длины шага [122, 152], не всегда ассоциируется с состояниями, наблюдаемыми в биохимических и структурных исследованиях. исследования.
Чтобы прояснить очевидную несоизмеримость между результатами различных исследований возмущений, можно более подробно рассмотреть характеристики наблюдаемых откликов на растяжение. Во-первых, доминирующая скорость, наблюдаемая в реакции натяжения на скачки давления и температуры, довольно похожа [209], и реакция на скачки концентрации P i имеет аналогичную скорость. Соответственно, скачки температуры, как утверждается, влияют на эндотермический переход, генерирующий силу [209], последовательно с быстрым равновесием P — -связывание.В то время как большинство доступных данных предполагают, что генерирующий силу переход происходит до выпуска P и (см. Таблицу 1), существуют значительные разногласия по поводу точного временного соотношения (Таблица 1), и также была рассмотрена возможность того, что P Выпуск i более или менее слабо связан с переходом, генерирующим силу [75, 121, 122]. Более того, происходит ли генерация силы до или после высвобождения фосфата, существуют разногласия относительно точного количества подшагов и их скорости [122, 151, 209, 229, 230, 236, 321, 323, 324].Если высвобождение P и происходит до перехода к возникновению силы (Таблица 1), то кажется, что высвобождение P и должно быть ограничивающим скорость для создания силы, потому что прямые измерения высвобождения P и в растворе [65] дают такую же скорость, что и при возникновении напряжения после скачков температуры, скачков фосфата и т. д. Медленное высвобождение P i также было одобрено на основе кинетического моделирования [324], но в этом случае считалось, что высвобождение P i происходит после перехода, генерирующего силу.В таких условиях состояние AM.ADP.P i будет основным генерирующим силу состоянием, а высвобождение фосфата будет ограничивать скорость отделения поперечного мостика. Это согласуется с открытиями, что состояние AM.ADP.P i является доминирующим биохимическим видом в сокращающихся миофибриллах [325], и со спектроскопическими исследованиями движения эстафетной спирали в каталитическом домене миозина Dictyostelium II [323]. Последнее движение предшествует более медленному выпуску P i . Однако многие другие находки предполагают, что высвобождение P и происходит быстро [122, 209, 236] и что это AM.Состояние ADP (на рисунке 2), а не состояние AM.ADP.P и доминирует во время устойчивого состояния сокращения [89, 100, 326, 327].
. | Тип I . | Тип IIa . | Тип IIb . | ||||
|---|---|---|---|---|---|---|---|
| Диаметр | Малый | Промежуточный | Большой | ||||
| Размер моторного блока | Маленький | Промежуточный | Большой | ||||
| 9044 9044 9044 9044 9044 Сокращение | Медленное | Быстрое | Быстрое | ||||
| Twitch | Длинное | Короткое | Короткое | ||||
| Ca 2+ секвестрация | Медленное | Быстрое | |||||
| Быстрое | |||||||
| Промежуточный | Редкий | ||||||
| Гликолитическая емкость | Низкая | Промежуточная | Высокая | ||||
| Окислительная способность | Высокая | Низкая | Низкая | Низкая | Высокий | Промежуточный | Низкий |
| Гликоген | Низкий | Промежуточный | Высокий | ||||
| Миозин-АТФаза | 904 904 Быстро | Тип I . | Тип IIa . | Тип IIb . | |||
| Диаметр | Малый | Промежуточный | Большой | ||||
| Размер моторного блока | Маленький | Промежуточный | Большой | ||||
| 9044 9044 9044 9044 9044 Сокращение | Медленное | Быстрое | Быстрое | ||||
| Twitch | Длинное | Короткое | Короткое | ||||
| Ca 2+ секвестрация | Медленное | Быстрое | |||||
| Быстрое | |||||||
| Промежуточный | Редкий | ||||||
| Гликолитическая емкость | Низкая | Промежуточная | Высокая | ||||
| Окислительная способность | Высокая | Низкая | Низкая | Низкая | Высокий | Промежуточный | Низкий |
| Гликоген | Низкий | Промежуточный | Высокий | ||||
| Миозин-АТФаза | 905 9 Быстрый |
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Трудности согласования результатов экспериментальных систем с различной ионной силой, зависимостью от деформации и т.д. различные взгляды на временные отношения между высвобождением P и и созданием силы.Важность деформации, например, отражается в 500-кратном более быстром обмене 18 O (отражающем P i -обмен) при изометрическом сокращении покрытых оболочкой волокон, чем в acto-S1 в растворе [328]. Более того, высвобождение P и подавлялось во время растяжения сердечной мышцы [329] и, наконец, концентрация P i влияла на восстановление напряжения после быстрого растяжения, но не после быстрого расслабления ([225]; см. Также [330] ]).
Другая возможность состоит в том, что противоречивые интерпретации связаны с моделями, которые не отражают некоторые критические особенности работы поперечного моста.Более того, отсутствие общности и строгости в определении таких терминов, как «этап создания основной силы» и «рабочий ход», усугубляют проблемы. Эти термины по-разному используются исследователями и между подобными областями, такими как механика мышц, механика одиночных молекул, а также структурная биология и биохимия актомиозина. Неоднозначность отражена в обсуждении расстояния рабочего хода в разделе 4.2 (см. Также [67, 114, 184, 222]).
Прямая идентичность генерирующего силу перехода, связанного с высвобождением P и , и скачками длины предполагалась в некоторых ранних модельных исследованиях [52, 107, 331] до появления широкой доступности данных из исследований возмущений, кроме шагов длины.Упрощение также использовалось в последних моделях [111, 114], где связь между высвобождением P и и созданием силы не рассматривалась. В этих случаях с ключевыми состояниями модели и их свободной энергией, показанными на рисунке 7, интересно отметить, что модель имела высокую объясняющую способность, учитывающую как реакции скачка длины, так и ряд устойчивых свойств, например соотношение сила-скорость как в присутствии, так и в отсутствие лекарственного средства, влияющего на штамм-зависимый переход от АМ к АМ.Состояние ADP [100, 110]. Более поздние разработки той же модели [111] также учитывали эффекты различных концентраций АТФ и АДФ. Хотя скачок температуры и P i -эффекты не учитывались, было обнаружено, что некоторые температурные эффекты могут быть объяснены увеличением свободной энергии между AM.ADP.P i и состояниями [111]. Эти модели, однако, не могут учитывать высокую выходную мощность мышц во время устойчивого укорачивания или высокое устойчивое сопротивление удлинению без предположения скорости прикрепления, зависящего от скорости (Раздел 3).Кроме того, из-за очень быстрого отрыва от претензионных состояний AM.ADP.P и , предложенного исследованиями отдельных молекул [182], и связанного с этим слабого актинового сродства этих состояний, кажется маловероятным, что предсиловой удар AM.ADP.P i состояний могут объяснить высокое сопротивление медленному растяжению. Таким образом, при медленном растяжении сила разрыва большинства силостойких поперечных перемычек оказывается высокой и с заметной упругой деформацией [33, 81], что, по-видимому, несовместимо со свойствами AM.ADP.P и состояний. Однако будущие модели должны согласовать этот вывод с результатами (см. Выше), основанными на эффектах аналогов нуклеотидов и лекарств [197, 202, 208, 210], различной температуре и измененной концентрации P и [209], предполагая, что Поперечные мосты предпускового хода в состоянии AM.ADP.P и вносят заметный вклад в реакцию на растяжение.
Другая проблема существующих моделей для создания силы, как указывалось выше, состоит в том, что они предполагают независимый упругий элемент и требуют, чтобы переход, генерирующий силу, происходил за большое количество шагов.Интересная альтернативная возможность, аналогичная первоначально предложенной в [107], состоит в том, чтобы принять упругий элемент, который не является независимым от компонента качания и который деформируется субнанометровым структурным изменением (в отличие от ~ 10 нм в модели Хаксли и Симмонса. ). Это можно назвать моделью типа Эйринга [104, 110], где локальное химическое изменение вызывает переход в новое состояние с последующей релаксацией упругого элемента на ~ 10 нм до минимума свободной энергии нового состояния.Одна из моделей того, как это могло произойти, схематически проиллюстрирована на рисунке 8. Здесь локализованные структурные изменения деформируют упругий элемент. Последнее здесь объясняется изгибом плеча рычага, но изгиб также может происходить в области преобразователя [141, 218]. С другой стороны, локализованные структурные изменения включают тепловые флуктуации структурных доменов (например, связанных с релейной спиралью, конвертерным доменом, центральным бета-листом и петлями вокруг сайта связывания нуклеотидов), флуктуации, которые могут предшествовать P i выпуск [323].Отличие от исходной модели Хаксли и Симмонса [47] заключается в очень малой амплитуде структурных изменений, которые приводят к высокому силовому состоянию на рисунке 8, что существенно снижает энергетический барьер, который необходимо преодолеть. Этот механизм Эйринга [104] отличается от более крамерсовского процесса, когда крупномасштабное диффузионное деформирование упругого элемента против нагрузки (как в модели Хаксли и Симмонса [47]) предшествует химическому изменению.
Что-то, что еще больше затрудняет наше понимание перехода, генерирующего силу, — это тот факт, что атомные структурные корреляты высвобождения P и и генерирования силы в ответ на различные возмущения четко не определены.Во-первых, вопрос о механизме спуска P i , включая точный момент времени в цикле ATPase (предшествует ли выпуск P i рабочему такту или рабочий ход предшествует выпуску P i ?), Не может быть легко решен. ответил с настоящими структурными моделями (см. раздел 4.5). С другой стороны, структурная информация и компьютерный анализ реакции гидролиза постулируют различные одинаково возможные пути выхода [62]. Однако, как упоминалось выше, недавнее исследование, основанное на кинетике раствора и экспериментах с временным разрешением резонансного переноса энергии флуоресценции (FRET), показало, что связывание актина выпрямляет релейную спираль перед диссоциацией фосфата, предполагая, что удар мощности происходит до высвобождения P и . [323].Структурные детали состояния высвобождения миозина P i необходимы для понимания того, как актин запускает высвобождение продукта и как переключающие элементы активного сайта перестраиваются, чтобы облегчить высвобождение P i .
Трудность кристаллизации связанного с актином состояния миозина помешала детальному пониманию механизма производства силы. Одним из возможных способов преодоления этой проблемы могло бы стать получение стабильных димерных или тримерных олигомеров актина. Это минимальное количество субъединиц актина может образовывать функциональный и кристаллизующийся комплекс строгости для детального анализа.Таким путем можно решить как точный интерфейс связывания актина-миозина, так и структурное состояние и взаимодействия между актином и второй головкой миозина [332], разрешая функциональную роль последней. Эксперименты с оптическими ловушками с нативным миозином II показали, что степень гибкости головок достаточна, чтобы позволить прикрепление по крайней мере к трем последующим сайтам связывания на одном актиновом филаменте [181].
Чтобы объяснить некоторые явно противоречивые доказательства, интересно рассмотреть идеи о том, что каждое биохимическое состояние существует в различных механических / структурных состояниях в быстром равновесии друг с другом [57, 58, 215, 333] (ср.Рисунки 5 и 8). Позднее эти идеи получили дополнительную поддержку [334] и были включены в довольно полные модели поперечных мостов [75, 109, 117, 121, 122]. В последних типах моделей каждое биохимическое состояние на рисунке 2 будет состоять из нескольких подсостояний, которые различаются механически и структурно разным протяжением их эластичного элемента, разной степенью завершения поворота рычага-плеча и разным сродством между актином и миозином (см. Рисунки 5 и 8).
В терминах такой модели реакция натяжения на шаги длины происходит из-за очень быстрых переходов между механическими / структурными состояниями (аналогично тем, что на Рисунке 5) без переходов между биохимическими состояниями (горизонтальные переходы на Рисунке 8).
Реакция натяжения на другие возмущения, например, скачки температуры и фосфата, происходит из-за более медленных химических реакций, например, изомеризации перед высвобождением фосфата, которая может зависеть или не зависеть от деформации.
Принимая во внимание, что модели этого типа хорошо объясняют несколько экспериментальных явлений, будет важно ограничить количество состояний до абсолютного минимума и четко определить свойства этих состояний, включая деформационную зависимость переходов между состояниями, на основе диапазона разные эксперименты.Дальнейшая проблема будет заключаться в том, чтобы связать структурный ход событий, определенный с помощью рентгеновской кристаллографии, с событиями, наблюдаемыми в ответ на эксперименты с быстрыми возмущениями, такими как скачки в длину, скачки P и и скачки температуры в мышечных волокнах. Возможно, механические эксперименты на разных уровнях иерархической организации от отдельных молекул над небольшими упорядоченными ансамблями и миофибрилл до мышечных клеток могут помочь преодолеть разрыв, если они сочетаются со спектроскопическими методами, например, одномолекулярным FRET.
5.2. Количество актиновых сайтов в пределах досягаемости для данной миозиновой головки
Несколько моделей мышечного сокращения предполагают, что только один сайт связывания на актиновой нити находится в пределах досягаемости для связывания данной миозиновой головки. Это приближение позволяет моделировать большинство аспектов сокращения мышц без серьезных ограничений [110]. Однако некоторые дополнительные явления могут быть учтены, если доступно больше сайтов связывания. По стерическим причинам, таким как спиральное расположение сайтов связывания актина на актиновых филаментах, вероятно, что только группы из нескольких (3-5) соседних сайтов в 5.Расстояние между участками 5 нм достигается головками миозина, принадлежащими данной коронке на толстой нити. Эта идея была подтверждена исследованиями с использованием лазерных ловушек, показывающих зоны-мишени для связывания миозина, соответствующие спиральному повторению 36–38 нм актинового филамента. Присутствие соседних сайтов на одном и том же филаменте позволяет расширить описанные выше модели, такие как быстрое повторное прикрепление к соседнему сайту связывания актина миозиновой головки, принудительно отщепляемой в состояние MADPP и во время укорочения или растяжения [75, 121, 122] .Такое поведение может служить основой для кажущейся зависимости скорости прикрепления перемычки.
5.3. Роль двух головок миозина
Роль второй головки в димерной молекуле миозина II остается загадочной, например, независимо от того, являются ли две головки независимыми или кооперативными в своем взаимодействии с актином и существует ли чередующееся ступенчатое поведение, когда головки впоследствии связываются с актином процессивным образом, таким образом увеличивая выход силы [160, 335–339].
Некоторые исследования показали, что межголовочная кооперация между двумя головками каждой молекулы миозина II может не быть важной и эти две головки часто рассматриваются как независимые генераторы сил ([68, 171, 179]; см. Выше). Однако существует ряд экспериментальных результатов, предполагающих различные формы сотрудничества двух голов [74, 100, 124, 160, 168, 338, 340, 341]. Одна из возможностей — отрицательная кооперативность между двумя головками, то есть связывание одной головки с актином ингибирует связывание другой [342] или одна головка предотвращает диссоциацию другой головки.Отрицательная кооперативность последнего типа позволит поддерживать напряжение без энергозатрат.
С другой стороны, также была предложена положительная кооперативность [110, 160, 168, 341]. Это может принимать разные формы, но одна возможность состоит в том, что связывание одной головки способствует связыванию другой таким образом, что стимулируются последовательные действия двух головок [110, 160]. Такие эффекты могут играть роль в объяснении явно более высокой скорости прикрепления поперечных мостиков во время укорачивания и во время удлинения.Например, механизм с прикреплением второй головки был предложен [35] на основе данных дифракции рентгеновских лучей на мышцах (см. Также [120]) для учета эффективного сопротивления удлинению. Сходная модель была предложена позже [124], но с дополнительными деталями, предполагающими, что большая часть актомиозиновых поперечных мостиков во время растяжения не является стереоспецифичной связью (см. Также выше). С другой стороны, идея о том, что заметное сопротивление растяжению активных мышц объясняется в основном увеличением количества прикрепленных миозиновых головок, не может быть подтверждена в другом недавнем исследовании [33].
Моделирование, основанное на данных, показывающих двухголовое прикрепление быстрого миозина II [100], намекало [110], что последовательные действия двух головок миозина II могут стать важными для укорочения при промежуточных нагрузках [60, 110] (промежуточных скоростях), когда мощность максимальная. Упомянутое выше быстрое исправление рабочего хода [203] также объясняется на этом основании. В то время как недавние тесты на подвижность in vitro [111] не подтвердили идею последовательных движений головой, они не смогли с уверенностью опровергнуть гипотезу.Таким образом, предсказанные изменения, которые искали, были небольшими, и возможно, что потеря клеточного порядка в анализе подвижности in vitro была причиной неспособности обнаружить кооперативность [160]. Кроме того, для эффективного межголового взаимодействия может также потребоваться связывание двух миозиновых головок с соседними актиновыми филаментами на расстояниях между филаментами, как в мышцах [160], или могут быть другие формы межголового сотрудничества, когда наличие двух головок облегчает прикрепление одной из них. но там, где не происходит последовательных действий, создающих силу [168, 340, 341].
5.4. Роль структурных изменений в актиновых нитях
Активная роль миозина в выработке силы актомиозином общепризнана, но актиновые филаменты, как правило, [6], за исключением их аллостерической активации высвобождения фосфата из миозина, рассматриваемой как веревочная партнеры пассивного взаимодействия. Однако структура актиновых филаментов очень динамична и изменяется во время процесса генерации силы [21, 129, 132, 343, 344]. Следовательно, разумно предположить, что структурные изменения в актиновом филаменте важны для эффективной генерации силы и мощности.Некоторые авторы даже предположили доминирующую роль актиновых филаментов, напр., В обеспечении грубых структурных изменений, которые вызывают трансляцию актина по сравнению с миозином или асимметричный потенциал для смещенной диффузии миозиновой головки. Однако есть твердые доказательства большей фасилитирующей и модулирующей роли актиновых филаментов. Т.о., несколько исследований [21, 127–133, 345, 346] предполагают, что связывание миозина с актином или натяжение актинового филамента вызывает структурные изменения, которые распространяются вдоль актинового филамента.
6. Понимание функции мышц требует сочетания разборки сверху вниз и сборки механизма сокращения снизу вверх
При рассмотрении неполностью понятых молекулярных механизмов сокращения мышц критически важно объединить результаты экспериментальных систем на разных уровнях иерархической организации. Также будет важно использовать строгую совместную терминологию, чтобы ключевые понятия, такие как «силовой удар», имели одинаковое значение среди физиологов, биохимиков, биофизиков одиночных молекул и структурных биологов.Такой комплексный подход должен привести к моделям с минимальным количеством состояний, которые объединяют структурную, биохимическую и механическую информацию от волокон и отдельных молекул, тем самым закладывая прочную основу для понимания плохо изученных явлений при нормальном сокращении мышц, а также эффектов воздействия препараты и мутации миопатии.
Естественно, любые кооперативные взаимодействия между миозиновыми моторами теряются в исследованиях отдельных молекул, но подробную однозначную информацию о зависимости скорости переходов от деформации [61, 98, 182] легче получить, используя одиночные молекулы, чем ансамбли.Такие исследования теперь также возможны с использованием экспрессированного миозина II из поперечно-полосатой мышцы человека, как нормального, так и с мутациями миопатии [135]. С другой стороны, соотношение силы и скорости поперечно-полосатой мышцы является свойством упорядоченного ансамбля, которое не может быть полностью охарактеризовано с помощью одиночных миозиновых двигателей. Однако исследованиям мышечных клеток и миофибрилл мешают другие проблемы. Таким образом, могут быть неопределенности в интерпретации механических и структурных данных из мышечных волокон и механики миофибрилл из-за не полностью охарактеризованных эластичных компонентов, возникающих свойств в большом ансамбле двигателей [347], которые нелегко экстраполировать обратно на взаимодействия актомиозина или связанные эффекты саркомерные неоднородности.Ясно, что новые типы экспериментов будут представлять большой интерес для преодоления разрыва между исследованиями упорядоченных систем и отдельных молекул. Можно рассмотреть два дополнительных подхода. Во-первых, разборка сверху вниз или, скорее, комбинированная разборка сверху вниз и сборка снизу вверх сократительной системы может быть достигнута, начав с покрытых кожей волокон или миофибрилл [66, 348, 349] и удалив все больше и больше компонентов, возможно с последующим восстановлением. Другой подход — это чистая сборка упорядоченных сократительных систем из отдельных молекул снизу вверх.Простые версии таких экспериментальных систем, например, с использованием разного количества миозиновых моторов, случайным образом адсорбированных на поверхности [183, 350] или включенных в синтетические миозиновые филаменты на пьедестале [67, 171], позволили бы изучить взаимосвязь между силой и скоростью упорядоченных и неупорядоченные ансамбли миозиновых моторов с одной или двумя головками [179], взаимодействующие с актиновыми филаментами. Далее, может иметь значение добавление одной молекулы за другой другие белковые компоненты, такие как тропонин, тропомиозин и белок С.
На более продвинутом уровне можно рассмотреть использование каркасов ДНК-оригами (см. [351]) и спроектированных точек крепления двигателей [135] для создания четко определенных упорядоченных массивов. Более того, если каркас может быть получен внутри полой нанопроволоки [352], возможно даже создание аналитических систем in vitro с поддерживаемым трехмерным порядком, аналогичным таковому в решетке миофиламентов. Наконец, представляет интерес использование широко сконструированных миозинов [353–355] для исследования специфических свойств.
Интересные вопросы, на которые можно будет ответить, объединив исследования отдельных молекул и моделирование с новыми экспериментальными системами, включающими от нескольких или многих белковых компонентов в различных упорядоченных структурах, будут следующие. (I) В целом, появляются ли новые свойства при переходе от отдельных молекул упорядоченным ансамблям или свойства ансамбля полностью характеризуются на основе компонентов одной молекулы? (ii) Какова роль двух головок в отдельных молекулах и в упорядоченных ансамблях разного размера? (iii) Какова роль трехмерного порядка, например, возможность данного двуглавого миозинового двигателя взаимодействовать с двумя или более актиновыми филаментами на тех же расстояниях между филаментами, что и в мышечной клетке? (iv) Каковы роли различных вспомогательных белков? (v) Что такое важность различий между полусаркомерами в перекрытии между толстыми и тонкими нитями и другие различия в сократительных свойствах по поперечному сечению волокна и по длине миофибриллы? (vi) Каковы механизмы, определяющие соотношение силы и скорости, например, роль двухмиозиновых головок, структурные изменения в актиновых филаментах, трехмерный порядок и одиночные миозиновые головки, быстро «прыгающие» с одного актинового участка на следующий, когда они будут частью ансамбля.Эти вопросы могут быть доступны путем изучения взаимосвязи силы и скорости упорядоченных ансамблей разного размера с использованием одноголовых и двуглавых фрагментов миозина и миозиновых моторов с критическими мутациями, например, влияющими на свойства прикрепления или высвобождение P и (vii). Можно ли предсказать совокупные эффекты мутаций миопатии и лекарств на основе исследований отдельных молекул и биохимии раствора?
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Альф Монссон выражает благодарность факультету здравоохранения и наук о жизни Университета Линнея за финансирование и Фонду Веннера-Грина за финансирование творческого отпуска в лаборатории Дилсона Рассье в Университете Макгилла, в течение которого проводилось настоящее исследование. инициирован. Дилсон Рассье выражает признательность NSERC Канады за поддержку, а Георгиос Циавалиарис выражает благодарность Немецкому исследовательскому фонду и земле Нижняя Саксония за финансирование.
Trichinella spiralis: образование медсестер с акцентом на аналогии с восстановлением мышечных клеток | Паразиты и переносчики
Паразиты изменяют физиологию и / или морфологию хозяев, чтобы выжить в новой среде.Примечательно, как некоторые паразиты создают новую архитектуру в ткани хозяина путем морфологического ремоделирования. Trichinella spiralis — типичный пример. Паразиты строят свой собственный дом в инфицированных мышцах. Дом — это капсула, состоящая из коллагеновой стенки и клеточных компонентов. Стена обеспечивает некоторую защиту паразита и клеточного компонента, который заботится о паразитах с точки зрения метаболизма. Из-за своей функции клеточные компоненты получили название «медсестра».И стенка, и медсестра являются хозяевами, а не паразитами. Некоторые паразитологи предпочитают термин «комплекс клеток-медсестер» или капсула, а не термин «киста», потому что термин «киста» используется для обозначения клеток паразитарного происхождения.
Капсула выступает в инфицированной мышце; Даже неподготовленный патологоанатом не пропустит это при микроскопическом исследовании. В первую очередь возникает вопрос, как Trichinella изменяет клетки-хозяева и создает такое уникальное место для жизни? Есть ли у Trichinella какие-то неизвестные специфические инструменты?
Несмотря на обширные исследования, это оставалось загадкой.Еще в 1966 году Майер и Займан прокомментировали сходство между некоторыми изменениями, которые происходят во время формирования клеток-медсестер, и изменениями при регенерации мышечных клеток [1]. Стюард и Рид [2] представили подробное сравнение ультраструктурных и биохимических изменений, которые происходят во время двух процессов, упомянутых выше, и обнаружили, что они очень похожи. Они выдвинули гипотезу о том, что процесс регенерации играет важную роль в начальном развитии питательной клетки. Серия недавних исследований предоставляет дополнительные доказательства, подтверждающие их идеи о том, что Trichinella использует процесс восстановления мышечных клеток для создания капсулы.Другими словами, после травмы, вызванной вторжением паразитов, мышечные клетки начинают восстанавливаться, как и после любой травмы. Trichinella заимствует только начальную часть этого процесса ремонта, чтобы построить свой собственный дом.
Despommier [3] уже элегантно рассмотрел процесс образования капсулы с акцентом на образование медсестер. В данной обзорной статье рассматривается весь процесс формирования капсулы, но больше внимания уделяется аналогии между образованием медсестер и восстановлением мышечных клеток.
Аналогия между формированием медсестер и восстановлением мышечных клеток
Есть много общего между процессами образования медсестер после заражения Trichinella и регенерацией мышечных клеток после травмы.
Клетка скелетных мышц восприимчива к повреждению в результате прямой травмы или косвенных причин, таких как неврологическая дисфункция или врожденные генетические дефекты. Из-за своей замечательной способности к регенерации поврежденная мышечная клетка инициирует точно организованный набор клеточных реакций, приводящих к регенерации хорошо иннервируемого, полностью васкуляризованного и сократительного мышечного аппарата.Процесс регенерации включает четыре этапа, как описано Возняком и др. . [4]: 1) активация сателлитных клеток; 2) пролиферация сателлитных клеток; 3) дифференциация и слияние; и 4) самообновление спутниковой соты.
Инвазия новорожденных личинок Trichinella также вызывает повреждение мышечных клеток, которое инициирует активацию сателлитных клеток, подвергающихся пролиферации и повторной дифференцировке [5, 6]. В этом случае мышечная клетка, пораженная инфекцией Trichinella , инициирует де-дифференцировку, повторный вход в клеточный цикл и остановку [7–11].
Во время этого процесса многие события похожи как в формировании питательных клеток, так и в регенерации мышц, например, увеличение количества саркоплазматического матрикса, размера и количества ядер, которые мигрируют к центру мышечного волокна с периферии, размера пораженных миофибрилл, количества митохондрий, содержания ДНК и РНК, а также увеличения свободных рибосом и интенсивной пролиферации грубого эндоплазматического ретикулума и гладкого саркоплазматического ретикулума [2].
Развитие и регенерация мышц: обзор
Краткий обзор мышечного генезиса и процесса регенерации предоставит основную информацию для понимания процесса формирования медсестер.
Генезис мышц
Скелетные мышцы происходят из мезодермальных клеток-предшественников, которые происходят из сомитов. Во время эмбрионального развития мезодермальные клетки-предшественники специфичны для миогенного происхождения (известные как миобласты). Пролиферирующие миобласты выходят из клеточного цикла и окончательно дифференцируются в миоциты. Наконец, мононуклеарные миоциты специфически сливаются друг с другом, образуя многоядерный синцитий, который в конечном итоге созревает в мышечные волокна [12]. В ходе развития мышц отдельная субпопуляция миобластов не может дифференцироваться, но остается ассоциированной с поверхностью развивающегося миофибрилла как покоящиеся мышечные сателлитные клетки [13-15].
Восстановление мышц
Ранними событиями после мышечного повреждения являются некроз мышечных клеток и накопление воспалительных клеток в поврежденном месте, что является процессом дегенерации. Активированные мононуклеарные клетки выделяют факторы, которые обеспечивают хемотаксические сигналы другим воспалительным клеткам [16–18]. Первыми появляются нейтрофилы, за ними следуют макрофаги, которые фагоцитируют клеточный мусор и влияют на другие аспекты регенерации мышц, активируя миогенные клетки [19–21].
После дегенерации мышц активируется процесс восстановления мышц.Активация и разрастание сателлитных клеток являются важными событиями, необходимыми для регенерации мышц. Размножение сателлитных клеток обеспечивает достаточный источник новых миоядер для восстановления мышц. Клетки-сателлиты дифференцируются и сливаются друг с другом или с существующими поврежденными волокнами для восстановления с образованием новых миофибрилл [4, 22]. Основные морфологические характеристики заключаются в том, что новообразованные миофибриллы имеют небольшой калибр с центрально расположенными миоядерными ядрами (рис. 1).
Рисунок 1Регенерация мышечных клеток: A: Нормальные мышечные клетки с миоядрами и сателлитными клетками; B: поврежденная мышечная клетка.Мышечное повреждение вызывает воспалительную реакцию, и мононуклеарные клетки мобилизуются; C: На поврежденном участке возникает некроз. Макрофаги проникают в поврежденную ткань для очистки клеточного мусора. Спутниковые ячейки активированы; D: Активированные сателлитные клетки размножаются, дифференцируются и сливаются друг с другом или с существующими поврежденными мышечными волокнами; E: регенерированная новая мышечная клетка меньшего калибра с центрально расположенными миоядрами и обновленными сателлитными клетками. Рисунок модифицирован из учебника МИОЛОГИИ Энгеля и Францини-Армстронга.Формирование медсестры: F: Инвазия личинки Trichinella вызывает растворение и полную потерю миофибриллярной организации; G: Спутниковые ячейки активированы. В инфицированной мышечной клетке происходит базофильная трансформация. Формируется перегородка, чтобы ограничить поврежденную область; H: Активированные сателлитные клетки пролиферируют, дифференцируются и сливаются друг с другом или с инфицированной мышечной клеткой, что обеспечивает эозинофильную цитоплазму. Инфицированные мышечные клетки дедифференцируются, повторно входят в клеточный цикл и останавливаются на уровне G2 / M.Есть много ядер гипертрофии; I и J: эозинофильная цитоплазма (которая обеспечивается сателлитными клетками) увеличивается в объеме, а базофильная цитоплазма (которая происходит из инфицированной мышечной клетки) уменьшается в объеме; К. Формируется зрелая медсестра. Цитоплазма медсестры эозинофильная.
Формирование капсулы
Формирование капсулы (также известное как цистогенез) широко изучалось многими авторами. Он включает в себя сложные этапы и события, которые происходят в течение 20-дневного периода с момента первоначального вторжения личинок до завершения камеры-медсестры [3].
Инфекция вызывает глубокие изменения в мышечных клетках хозяина, некоторые из которых вначале похожи на те, которые участвуют в регенерации мышц. После инвазии новорожденной личинки происходит растворение и полная потеря миофибриллярной организации [23]. Формируется перегородка, чтобы отделить пораженный участок (базофильную цитоплазму) от интактной области той же мышечной клетки [5]. Инфекция вызывает активацию, пролиферацию и дифференцировку сателлитных клеток, которые развиваются в эозинофильную цитоплазму [5, 6].
Недавние молекулярно-биологические исследования показали, что многие гены и сигнальные пути задействованы в образовании медсестер, например, сигнальный путь апоптоза, опосредованный митохондриальным путем, и путь рецептора смерти, сигнальный путь TGF-β, а также гены, связанные с дифференцировкой клеток. , пролиферация, контроль клеточного цикла и апоптоз [6, 9–11, 24–27]. Окончательно дифференцированные мышечные клетки повторно входят в клеточный цикл и затем останавливаются в очевидном G2 / M [7, 8, 23]. Развитая питательная клетка содержит до 100 сильно увеличенных ядер с хорошо развитыми ядрышками [28] и окружена стенкой коллагеновой капсулы и кровеносной сеткой [29, 30].
В следующих параграфах каждый этап формирования капсулы подробно рассматривается в сравнении с регенерацией мышечных клеток.
Динамические изменения в цитоплазме инфицированных мышечных клеток
Мышечная клетка распадается, если повреждение настолько велико, что клетка не может быть восстановлена, что называется некрозом. Эта мертвая зона удаляется клетками-мусорщиками, такими как макрофаги, в процессе фагоцитоза. Когда повреждение невелико, мышечная клетка может подвергнуться апоптозу или восстановиться после повреждения путем самовосстановления.В случае инфекции Trichinella , инвазия сама по себе не вызывает серьезных повреждений мышечной клетки. Таким образом, инфицированная мышечная клетка не подвергается некрозу, а вместо этого подвергается апоптозу. В следующем абзаце обсуждается недавний прогресс в отношении судьбы инфицированных и поврежденных мышечных клеток, поскольку такая информация кажется необходимой для лучшего понимания процесса формирования клеток-медсестер.
Прежде всего, в процессе формирования питающей клетки необходимо распознавать существование двух видов цитоплазмы внутри питающей клетки: базофильной и эозинофильной цитоплазмы [5].Базофильная цитоплазма образуется в результате трансформации инфицированной мышечной клетки после инвазии новорожденных личинок («базофильная трансформация») [31, 32]. Эозинофильная цитоплазма происходит из сателлитных клеток и присоединяется к медсестре (это обсуждается ниже). В начале образования медсестер доминирует базофильная цитоплазма, и по мере продолжения образования медсестер базофильная цитоплазма уменьшается в размере, а эозинофильная цитоплазма увеличивается в размерах, причем соотношение изменяется реципрокным образом.Следовательно, базофильная цитоплазма исчезает из питающей клетки (рис. 1).
Что касается базофильной цитоплазмы, то имеются морфологические и молекулярно-биологические данные. Начальные изменения включают распад саркомеров, лизис миофиламентов, увеличение количества грубого и гладкого эндоплазматического ретикулума и гипертрофию ядер [31, 32]. Морфологические признаки идентифицируют как апоптоз [5, 24]. В базофильной цитоплазме имеются ядра неправильной формы с разбросанным и плотным гетерохроматином.Митохондрии набухли и исчезли на ранней стадии инфекции и были заменены новыми митохондриями, которые были меньше по размеру, чем в нормальных мышечных клетках, и имели матрицу повышенной плотности, что хорошо согласуется с особенностями митохондриального пикноза при апоптозе [ 33, 34]. Анализ TUNEL показал, что в некоторых увеличенных ядрах произошла фрагментация ДНК [27].
Больше света на механизмы апоптоза в базофильной цитоплазме пролили молекулярные эксперименты, которые показали, что вовлечено много генов, связанных с апоптозом (Рис. 2 и Таблица 1).Существует два основных пути инициации апоптоза: митохондриальный путь и путь рецептора смерти [35]. Активная экспрессия факторов апоптоза, опосредованных митохондриальным путем (Bcl-2-связанный белок X: BAX, фактор активации апоптотической протеазы 1: Apaf-1 и каспаза 9) и факторов апоптоза, опосредованных рецептором смерти (фактор некроза опухоли-альфа: TNF- α, рецептор I TNF, смерть-повреждение, ассоциированная с рецептором TNF: TRADD, каспаза 8 и каспаза 3) наблюдались в базофильной цитоплазме инфицированных мышечных клеток, что позволяет предположить, что оба сигнальных пути активируются в цитоплазме (Рис. 2) [24– 27].
Рисунок 2Схематическое изображение участия пути рецептора смерти (правая половина) и митохондриального пути опосредованного (левая половина) апоптоза в формировании медсестер. После связывания с TNF-α TNF-RI рекрутирует TRADD, который функционирует как адаптер платформы, который рекрутирует несколько сигнальных молекул. Привлечение TRADD и FADD приводит к автокаталитической активации прокаспазы 8. Активированная каспаза 8 расщепляет эффекторную прокаспазу 3, которая играет роль в апоптозе в базофильной цитоплазме мышечных клеток, инфицированных Trichinella .С другой стороны, связывание TNF-α и TNF-RI вызывает последовательное привлечение TRADD, TRAF2 и RIP, что приводит к активации NF-kB. Активированный NF-kB действует против апоптоза в базофильной цитоплазме. В митохондриальном пути Bax вызывает апоптоз, образуя мембранные поры в митохондриях, из которых высвобождается цитохром c. Цитохром с активирует каспазу 9, которая, в свою очередь, активирует каспазу 3, чтобы вызвать апоптоз в инфицированных мышечных клетках. В качестве кофактора Apaf-1 играет роль с каспазой 9 в апоптозе базофильной цитоплазмы.С другой стороны, Akt играет антиапоптозную роль в эозинофильной цитоплазме, инактивируя проапоптотические белки, такие как Bad и каспаза 9. Этот рисунок относится к обзору Gupta [35].
Таблица 1 Изменение экспрессии генов, связанных с апоптозом, после инфицирования TrichinellaТаким образом, судьба базофильной цитоплазмы ясна; он исчезает в процессе апоптоза, несмотря на активацию генов антиапоптоза (фактор 2, связанный с рецептором TNF: TRAF2, и белок взаимодействия с рецептором: RIP).Фактически, активность кислой фосфатазы оказалась высокой в базофильной цитоплазме, что свидетельствует о наличии деструктивных процессов [36]. С другой стороны, эозинофильная цитоплазма, кажется, говорит о другом. Эта цитоплазма, по-видимому, метаболически активна, участвуя в некотором метаболическом переносе, потому что в эозинофильной цитоплазме была обнаружена активность щелочной фосфатазы, а не активность кислой фосфатазы [36].
Эозинофильная цитоплазма также подвергается стрессу со стороны паразита, и гены апоптоза подвергаются активации.Интересно, однако, что антиапоптозные гены также активируются [24–26]. Таким образом, эозинофильная цитоплазма характеризуется сосуществованием апоптотических и антиапоптотических механизмов и сохраняет свою активность в результате баланса между апоптозом и антиапоптозом.
Анализ микроматрицыкДНК показал, что некоторые другие гены могут участвовать в апоптозе инфицированных мышечных клеток, например, Bcl6, кластерин (CLU), Bcl2-взаимодействующий киллероподобный (Biklk), белок запрограммированной гибели клеток 11 (Pdcd11) , пролиндегидрогеназа 1 (Prodh2) и Prodh3 [11].Эти гены индуцируют апоптоз или предотвращают апоптоз и связаны с ростом и выживанием клеток [37–46]. Активная экспрессия этих генов предполагает, что они участвуют в апоптозе и антиапоптозе в инфицированной мышечной клетке посредством различных механизмов.
Активация, пролиферация и дифференцировка сателлитных клеток
Каждое миофибрилло окружено одним листом (базальной пластинкой). На этом листе есть еще одна ячейка, спутниковая ячейка. Как упоминалось в предыдущем абзаце, сателлитные клетки — это миобласты, которые дифференцируются в новую мышечную клетку при повреждении мышцы.Повреждение мышц запускает такую активацию и разрастание сателлитных клеток. Таким образом, сателлитные клетки могут непрерывно поставлять новые мышечные клетки, даже если мышца повреждена. Некоторые из этих событий типичны для миопатии, спровоцированной инфекцией Trichinella .
1. Сателлитные клетки в регенерации мышц
Активация мышечных сателлитных клеток, по-видимому, является важным этапом в способности мышц к регенерации. В процессе регенерации мышц сателлитные клетки сначала выходят из нормального состояния покоя, чтобы начать размножаться.После нескольких раундов пролиферации большинство сателлитных клеток дифференцируются и сливаются, образуя новые миофибриллы или восстанавливая поврежденные [22, 47]. Процесс активации и дифференцировки сателлитных клеток во время регенерации мышц напоминает развитие эмбриональных мышц. В частности, критическая роль миогенных регуляторных факторов (MRFs: MyoD, myogenin, Myf5 и MRF4) и парных box-генов (Pax 3 и Pax 7) наблюдается в обоих процессах [48-50].
На молекулярном уровне активация сателлитных клеток характеризуется быстрой активацией двух MRF, Myf5 и MyoD.После мышечного повреждения повышающая регуляция MyoD и Myf5 проявляется рано, и активация экспрессии наблюдалась в различных моделях in vivo для регенерации мышц и в различных типах мышц [15, 51–55]. MRF4, вероятно, играет роль в созревании регенерированных миофибрилл. После фазы пролиферации сателлитных клеток происходит активация миогенина и MRF4 в клетках, начинающих свою программу терминальной дифференцировки. За этим следует активация белка остановки клеточного цикла p21 (ингибитор циклин-зависимой киназы 1A) и постоянный выход из клеточного цикла.Затем программа дифференцировки завершается активацией мышечных белков, таких как MGC, и слиянием с поврежденными мышечными клетками [56-59].
2. Сателлитная клетка в образовании медсестры
Активация и пролиферация сателлитных клеток происходит в мышцах, инфицированных Trichinella . Линейное выравнивание ядер клеток-сателлитов наблюдается на периферии инфицированных клеток вдоль их длинной оси миофибрилл [5]. Миогенные регуляторные факторы (MyoD и миогенин) были чрезмерно экспрессированы в инфицированной мышечной ткани T.spiralis и T. pseudospiralis , а фактор MyoD высоко экспрессируется в сателлитных клетках инфицированных мышечных клеток [6].
Анализ микроматрицы кДНКпоказал, что несколько других генов, важных для дифференцировки сателлитных клеток, активируются во время развития медсестер, как показано в таблице 2, включая Pax7, десмин, M-кадгерин, Numb, гомолог маниакальной бахромы (Mfng), Deltex 1 (Dtx1), миоцит-специфический энхансерный фактор 2C (MEF2), фактор транскрипции пре-B-клеточного лейкоза 1 (Pbx1) и ядерный фактор активированных Т-клеток (NFAT) [9–11].
Таблица 2 Изменение экспрессии генов, связанных с развитием мышц, миогенезом и регенерацией после заражения TrichinellaPax7 и десмин специфически экспрессируются в покоящихся и активированных мышечных сателлитных клетках и используются в качестве молекулярного маркера мышечных сателлитных клеток [ 60, 61]. Сверхэкспрессия Pax7 и десмина указывает на то, что сателлитные клетки в инфицированной мышце были активированы и пролиферировали.
М-кадгерин, маркер сателлитных клеток и экспрессируемый на клеточной поверхности пролиферирующих сателлитных клеток, высоко экспрессируется во время пренатального развития в миогенных клетках соматического происхождения, в миобластах, образующих небольшие мышечные пучки в развивающихся зачатках конечностей, в миобластах и в регенерирующих скелетных мышцах [62, 63].Сверхэкспрессия М-кадгерина наблюдалась в T. pseudospiralis , но не в T. spiralis , что позволяет предположить, что дифференциальная экспрессия может играть роль в патологии, вызванной T. pseudospiralis , регулируя сателлитные клетки. инфицированных мышечных клеток.
Множественные механизмы могут участвовать в регуляции дифференцировки, инициированной инфекцией Trichinella . Одним из них является сигнальный путь Notch. Передача сигналов Notch играет важную роль в морфогенезе тканей как во время развития, так и во время постнатальной регенерации скелетных мышц [64].Numb, Mfng и Dtx1, регуляторы сигнального пути Notch [64–67], были активированы в мышечных тканях, инфицированных T. spiralis и T. pseudospiralis , что позволяет предположить, что этот сигнальный путь, вероятно, участвует в активация и дифференцировка сателлитных клеток или инфицированных мышечных клеток.
Фактор MEF2 участвует в активации экспрессии специфичных для мышц генов и действует совместно с MRFs в дифференцировке мышечных клеток [12, 68]. Фактор NFAT играет роль в регуляции экспрессии MRF в сателлитных клетках [69].
Фактор MRF4 ведет себя иначе. Во время регенерации мышечных клеток MRF4 играет роль в созревании регенерированных миофибрилл [58, 68]. После травмы происходит активация MRF4 после запуска программы терминальной дифференцировки. При инфекции Trichinella не наблюдалось изменения экспрессии MRF4 во время образования медсестер [6]. Это различие может отражать тот факт, что сателлитная клетка не может «созреть» как новая мышечная клетка, а вместо этого де-дифференцируется до кормящей клетки.
Роль инсулиноподобного фактора роста (IGF) в активации и дифференцировке сателлитных клеток
Сигнальный путь IGF I в мышечной биологии представляет собой интересную проблему в результате того факта, что IGF I индуцирует как пролиферацию, так и дифференцировку через тип I рецептор [70]. В качестве ключевого фактора IGF-I включает пролиферацию и дифференцировку сателлитных клеток во время регенерации мышц [71–73]. В мышечной ткани, инфицированной Trichinella , наблюдается избыточная экспрессия IGF, например, IGF I, рецептора IGF I, IGF-связывающего белка 2 (IGFBP2), IGFBP4 и IGFBP5 [9, 11], что позволяет предположить, что эти факторы, вероятно, играют роль важная роль в формировании клеток медсестры.
Связывание IGF-I с рецептором IGF-I вызывает фосфорилирование рецептора, которое затем в основном функционирует на 3 различных уровнях.
Во-первых, было показано, что IGF-I активирует пролиферацию миобластов через сигнальный путь митоген-активируемой протеинкиназы (MAP-киназы), который активирует маркеры развития клеточного цикла, такие как циклин D, циклин-зависимая киназа 4 (CDK4), c- fos, c-jun [74–76]. Было обнаружено, что в мышце, инфицированной Trichinella , была повышена экспрессия IGF-I, рецептора IGF-I, IGFBP, киназы MAP-киназы, циклина D2, циклина D3, CDK4 и c-jun [9, 11] , предполагая, что IGF-I, вероятно, играет роль в пролиферации сателлитных клеток и повторном входе в клеточный цикл инфицированных мышечных клеток во время образования питательных клеток посредством передачи сигналов киназы MAP (Рис. 3).
Рисунок 3Схематическое изображение пути передачи сигналов IGF-I в образовании медсестер. Связывание IGF-I с рецептором IGF-I вызывает фосфорилирование рецептора, которое действует через киназу MAP-киназы и / или PI3-K. Через путь киназы MAP он активирует гены прогрессии клеточного цикла (циклин D, cdc4, c-fos и c-jun ), которые пролиферируют сателлитные клетки после заражения Trichinella . Посредством пути PI3-K / Akt он модулирует экспрессию генов мышечной дифференцировки (p21, MyoD, Mef-2 и миогенин), которые участвуют в повторной дифференцировке сателлитных клеток и дифференцировке инфицированных мышечных клеток.Также активация PI3-K / Akt ингибирует проапоптоз семейством Bcl-2 (Bax, Bad) и индуцирует антиапоптозную функцию семейства Bcl-2 (Bcl-X), что способствует выживанию клеток-медсестер. Эта цифра относится к обзору Муркиоти и Розенталя [70].
Во-вторых, IGF индуцирует дифференцировку миобластов через путь фосфатидилинозитол-3-киназы (PI3-K), который активирует Akt и впоследствии модулирует экспрессию маркеров терминальной дифференцировки мышц, таких как p21, MyoD, миогенин и MEF2 [74, 75, 77 ].При инфекции Trichinella экспрессия Akt, MyoD, миогенина и p21 значительно увеличивалась в течение 13–28 dpi [6, 24–26]. Иммуноокрашивание показало, что повышенная экспрессия Akt ограничена в эозинофильной цитоплазме, которая происходит из сателлитных клеток [24], а MyoD ограничена в сателлитных клетках инфицированных мышечных клеток [6]. Анализ микроматрицы кДНК показал, что экспрессия MEF2 была повышена в мышечной ткани, инфицированной T. spiralis [9, 11]. Следовательно, через сигнальный путь PI3-K-Akt IGF-I, вероятно, будет играть роль в дифференцировке активированных сателлитных клеток после инфекции Trichinella (Рис. 3).
В-третьих, через сигнальный путь PI3-K / Akt IGF-I также влияет на выживаемость клеток, ингибируя проапоптотические белки семейства Bcl-2 (Bax и Bad) и индуцируя антиапоптотические белки Bcl-2. семейство (Bcl-X) [78, 79]. При инфекции Trichinella наблюдалась повышенная экспрессия белка Bax в базофильной цитоплазме инфицированной мышечной клетки на ранней стадии инфекции (18 точек на дюйм), но экспрессия снижалась до неопределяемого уровня на поздней стадии инфекции (48 точек на дюйм). ) [24].Кинетика экспрессии этого гена соответствовала процессу образования питательных клеток [24–26]. Следовательно, IGF-I может участвовать в модуляции апоптоза и антиапоптоза, что приводит к выживанию инфицированных мышечных клеток (рис. 3).
Факторы повторного входа и остановки клеточного цикла
После инвазии новорожденных личинок инфицированная мышечная клетка выходит из клеточного цикла G0 и снова входит в клеточный цикл [7]. Увеличенные ядра содержат примерно 4N комплемента ДНК. Повышенный синтез ДНК завершается на 5 точек на дюйм, а затем приостанавливается на протяжении всего заражения, что указывает на остановку клеточного цикла на уровне G2 / M.Молекулярный механизм повторного входа и остановки клеточного цикла во время инфекции остается неясным, но недавние исследования предоставили дополнительные сведения.
Феномен остановки клеточного цикла может быть уникальным для формирования клеток-медсестер, поскольку, насколько известно авторам, не сообщалось о сравнительных явлениях в генезе мышц или процессах восстановления мышц.
1. Гены, связанные с регуляцией клеточного цикла в образовании медсестер
Как показано в таблице 3, изменение экспрессии многих факторов, связанных с клеточным циклом, наблюдалось в мышечной ткани, инфицированной Trichinella , например, ретинобластоме (Rb) , CDK4, циклин C, циклин B2, циклин D2 и циклин D3, CLU, переключающий ген 2 G0 / G1 (G0S2), ингибитор связывания ДНК 2 (Id2), онкоген миелобластоза (Myb) и регулируемый ниже ген 2 N-myc (Ndrg2) [9, 11].Эти факторы уже разрабатывались другими авторами. Например, разные циклины специфически связываются с разными CDK с образованием различных комплексов на определенных фазах клеточного цикла и тем самым переводят клетку от одной стадии цикла к другой [80, 81]. При стимуляции циклины D-типа собирают CDK4 и CDK6 с образованием комплексов, которые способствуют выходу клеток из фазы G0 и повторному входу в клеточный цикл фазы клеточного цикла G1 [82–84]. Следовательно, повышенная экспрессия циклина D2, циклина D3 и CDK4, вероятно, участвует в повторном входе в клеточный цикл после инфекции.
Таблица 3 Изменение экспрессии генов, связанных с регуляцией клеточного цикла после заражения TrichinellaС другой стороны, повышенная экспрессия ретинобластомы (Rb), p21, p27 (ингибитор циклин-зависимой киназы 1B) и p57 ( ингибитор циклин-зависимой киназы 1C) может быть ответственным за остановку клеточного цикла инфицированной мышечной клетки [9, 26]. Известно, что эти виды факторов играют важную роль в остановке роста дифференцирующихся клеток, поскольку они специфически ингибируют CDK, что приводит к выходу клеток из цикла и дифференцировке [85–87].
Как ингибитор циклинзависимой киназы, p21 является критическим фактором остановки клеточного цикла при G2 / M [88]. Клетки, дефицитные по p21, не могут поддерживать стабильность остановки цикла [89]. Введение нефункционального p21 или антисмыслового олигонуклеотида p21 уменьшало фенотип остановки G2 / M в клетках [90, 91]. При инфекции Trichinella экспрессия p21 была повышена, которая увеличивалась с 13 dpi, достигала пика при 18 dpi и затем снижалась на поздней стадии инфекции [25, 26].Следовательно, p21 является важным фактором остановки клеточного цикла во время образования медсестер.
Изменения экспрессии нескольких других генов, связанных с клеточным циклом, также наблюдались при инфекции Trichinella , например, CLU и G0S2. Экспрессия CLU повышалась, а экспрессия G0S2 подавлялась [11]. Известно, что оба гена играют роль в регуляции клеточного цикла. Сверхэкспрессия CLU приводит к увеличению накопления клеток в фазах G0 / G1 клеточных циклов, что сопровождается замедлением прогрессирования клеточного цикла и снижением синтеза ДНК [92].Высокий уровень CLU вызывает остановку клеточного цикла [93, 94]. G0S2 временно индуцируется при повторном входе клеток в фазу G1 клеточного цикла [95, 96]. Следовательно, UCL и G0S2 могут участвовать в остановке инфицированных мышечных клеток.
2. Участие сигнального пути TGF-β в остановке клеточного цикла
Одним из важных сигнальных путей, участвующих в остановке клеточного цикла, является сигнальный путь TGF-β (трансформирующий фактор роста). TGF-β — это распространенный цитокин, регулирующий дифференцировку, пролиферацию, апоптоз и морфогенез клеток [97].Посредством серии белков Smad (Smad 2, Smad 3 и Smad 4) сигнальный путь TGF-β заставляет клетки прекращать пролиферацию и подавлять гены, которые способствуют развитию клеточного цикла через S-фазу, что приводит к остановке клеточный цикл (рис. 4).
Рисунок 4Схематическое изображение участия c-Ski и пути передачи сигналов TGF-β в формировании медсестер. Связывание TGF-β рецептором типа II на поверхности клетки инициирует каскад сигнальных событий.Активированный рецептор I типа фосфорилирует Smad2 и Smad3 в цитоплазме, образуя комплекс с Smad4. Комплекс Smad2 / 3/4 перемещается в ядро и функционально взаимодействует с различными факторами транскрипции, чтобы включить или выключить транскрипцию многих TGF-β-чувствительных генов. C-Ski действует как корепрессор для отключения транскрипции, что приводит к остановке клеточного цикла и трансформации мышечных клеток, инфицированных Trichinella . Эта цифра относится к обзору Ши и Массага [97].
Недавние исследования показали, что экспрессия генов факторов сигнального пути TGF-β (TGF-β, Smad2 и Smad4) и c-ski , репрессора сигнального пути, была повышена в мышцах, инфицированных Trichinella . клетки [9–11]. Анализ кинетики экспрессии показал, что экспрессия этих генов увеличивалась при 13 dpi, достигала пика при 23 dpi, а затем снижалась, что соответствует процессу развития питательных клеток. Иммуногистохимический анализ показал, что на ранних стадиях инфекции повышенная экспрессия белка c-Ski ограничивалась эозинофильной цитоплазмой, тогда как на более поздней стадии инфекции белок c-Ski ограничивался увеличенными ядрами в базофильной цитоплазме. а не эозинофильная цитоплазма [10].Эти данные свидетельствуют о том, что сигнальный путь TGF-β участвует в остановке клеточного цикла и трансформации инфицированных мышечных клеток.
Дедифференцировка инфицированных мышечных клеток и происхождение ядер гипертрофии
Инвазия новорожденных личинок вызывает дедифференцировку инфицированных мышечных клеток с признаками потери характеристик мышечных клеток, изменением экспрессии мышечных генов и повышением регуляции экспрессия генов, связанных с дифференцировкой клеток (таких как MyoD, myogenin, MEF2, Pbx1, Numb, Pax7, Msx и NFAT) в инфицированных мышечных тканях [7, 9, 98–100].После стимуляции инвазии личинок инфицированные мышечные клетки выходят из клеточного цикла G0 и повторно входят в клеточный цикл.
Принято считать, что вновь регенерированные волокна образуются путем слияния активированных сателлитных клеток во время регенерации мышц. Исследования, однако, показали, что терминально дифференцированные мышечные трубочки могут де-дифференцироваться и Msx гены могут быть одним из факторов, вносящих вклад в этот процесс [101-105]. Раннее событие дедифференцировки инфицированной мышечной клетки может следовать механизму дедифференцировки при регенерации мышечных клеток, который характеризовался аналогичными явлениями, например, потерей миофибриллярной структуры, увеличенными ядрами и повторным входом в клеточный цикл. [7, 28, 98, 106–108].Повышенная экспрессия Msx1 и Msx2 в инфицированной мышечной ткани поддерживает предположение, что де-дифференцировка инфицированной мышцы обеспечивает гипертрофические ядра [9, 11].
Анализ микроматрицыкДНК показал, что некоторые другие гены могут участвовать в дедифференцировке инфицированных мышечных клеток, например, галектин 1 и галектин 3, Nanog [11]. Экспрессия галектина 1 и галектина 3 повышалась при инфекции Trichinella . Оба гена индуцируют некоммитированные миогенные клетки в дерме для экспрессии миогенных маркеров, увеличивают терминальную дифференцировку коммитированных миогенных клеток и играют роль в детерминации, дифференцировке и регенерации скелетных мышц [109–111], что свидетельствует об их потенциальном участии в деформации. -дифференциация инфицированных мышечных клеток.
В центральной части базофильной цитоплазмы находится до 100 гипертрофических ядер. Было высказано предположение, что гипертрофические ядра происходят от миоядер, а не от сателлитных клеток [7, 8]. Однако недавние открытия продемонстрировали присутствие мультипотенциальных стволовых клеток в различных тканях взрослого человека. Взрослые стволовые клетки, выделенные из различных тканей, по-видимому, дифференцируются в несколько клонов в зависимости от сигналов окружающей среды [112–116]. Было показано, что взрослые стволовые клетки мышечного происхождения дифференцируются в мышечные клетки in vitro и вносят вклад в регенерацию мышц in vivo [105, 109, 117].Эти отчеты предполагают, что стволовые клетки, полученные из мышц, должны быть дополнительно исследованы как дополнительный источник гипертрофических ядер в инфицированных мышечных клетках.
В ответ мышечных клеток на повреждение личинкой Trichinella происходит де-дифференцировка. Однако процесс де-дифференцировки мышечных клеток не сопровождается тем же процессом, что и при регенерации мышечных клеток после травмы, а приводит к созданию среды для развития, роста и выживания личинки. Личинки Trichinella растут в мышечной клетке с поразительной скоростью, увеличивая ее объем примерно на 40% в день [23].Поэтому такое развитие и рост требует большого потребления питательных веществ. Метаболизм белка, глюкозы и жира в «медсестре» увеличивается во время формирования «медсестры» [118]. Личинки используют де-дифференцировку мышечных клеток, чтобы создать подходящую среду для их кормления.
Коллагеновая капсула
Стенка капсулы представляет собой заметную неклеточную структуру, и поэтому можно подумать, что она уникальна только для инфекции Trichinella и не разделяется нормальными мышечными клетками.Однако ультраструктурное исследование показало, что стенка капсулы представляет собой своего рода простое утолщение базальной пластинки, которое есть у нормальных мышечных клеток. В нормальных мышцах клеточные компоненты, мышечные клетки и связанные с ними миобласты (сателлитные клетки) обернуты вместе одним неклеточным листом, базальной пластинкой.
Стенка капсулы двухслойная; внутреннее и внешнее. Первый продуцируется клеткой-медсестрой, а второй — фибробластами вокруг капсулы. Пространственное соотношение между неклеточной структурой и клеточными компонентами остается неизменным до и после образования капсулы.
Паразиты используют клеточно-биологические системы хозяев для установления паразитизма
В этом обзоре подчеркивается аналогия между процессами образования медсестер и восстановления мышечных клеток. По крайней мере, самые ранние события мобилизации сателлитных клеток кажутся обычными, но судьба пролиферированных миобластных клеток различна. В первом случае сателлитная клетка дифференцируется в мышечную клетку, но во втором случае она неправильно дифференцируется с кормящей клеткой. На ум приходит идея, что Trichinella , чтобы создать свой собственный дом, в основном использует клеточно-биологическую систему хозяина, которая оборудована для восстановления мышечных клеток.Поскольку сателлитная клетка является клеткой-предшественником, расположенной внутри стенки капсулы, новая клетка может непрерывно поступать из миобласта, даже если существующая клетка-медсестра умирает. Это объясняет, почему медсестра долгие годы выглядит неповрежденной и активной, несмотря на внутриклеточный паразитизм. Таким образом, Trichinella может использовать хозяина для собственного выживания.
Как паразит использует биологическую систему клетки-хозяина для строительства своего жилища — это интересный вопрос для паразитологов.Деспомье [3] предложил «паракины» в качестве мессенджеров для осуществления связи между паразитом и клетками-хозяевами посредством молекулярного перекрестного общения, чтобы обеспечить сосуществование на протяжении всей жизни. Было высказано предположение, что паракины управляют специфическим клеточным поведением, воздействуя на сигнальные пути, как это делают цитокины в клетке-хозяине млекопитающего.
К настоящему времени было предпринято множество попыток идентифицировать и охарактеризовать паракины, некоторые из которых предоставили косвенные доказательства в поддержку гипотезы.Ранние исследования показали, что антигенных эпитопов Trichinella были обнаружены в ядрах гипертрофии инфицированных мышечных клеток [119, 120]. Были идентифицированы и охарактеризованы некоторые ядерные антигены (например, белки 79, 86 и 97 кДа), которые взаимодействуют с моноклональными антителами к экскреторно-секреторным (ES) продуктам Trichinella , и их потенциальные эффекты в регулировании ядерной функции клетки-хозяина были выявлены. изучены [121–123]. Василатис и др. . [100] клонировали специфический 43 кДа гликопротеин ES мышечной личинки, который принадлежит к семейству ДНК-связывающих белков основной спираль-петля-спираль (bHLH).Семейство bHLH включает миогенные регуляторные факторы, предполагая, что белок ES 43 кДа может играть роль в дифференцировке клеток-хозяев. Мак и Ко [124] обнаружили новый ДНК-связывающий белок из продуктов ES, который может участвовать в геномном репрограммировании хозяина. Нагано и др. . [125–127] клонировали и охарактеризовали несколько белков ES, включая сериновую протеиназу, ингибитор сериновой протеиназы и Rcd1 (Необходимая дифференцировка клеток 1) — подобный белок, который может участвовать в дифференцировке мышечных клеток хозяина.Тан и др. . [128] и Wu et al . [129] сообщили, что Trichinella продуцирует ингибитор миграции макрофагов (MIF), цитокин, который может защищать паразита от иммунной атаки хозяина.
Хотя многие белки продуктов Trichinella ES были клонированы и охарактеризованы, их точное влияние на каждый этап образования медсестер (активация, пролиферация и повторная дифференцировка сателлитных клеток, де-дифференцировка инфицированных мышечных клеток) все еще неясно. .Некоторые из белков ES Trichinella являются стадиоспецифичными. Большинство исследованных белков — это белки, продуцируемые поздней стадией личинок (например, более 30 дней). Особого внимания заслуживают продукты ES из других ступеней Trichinella . Джасмер и Нири [8] сообщили, что полное развитие стихоцитов не требуется для повторного входа в цикл клетки-хозяина, предполагая, что продукты генов паразитизма, отвечающие на репрограммирование генетической транскрипции хозяина, продуцируются на очень ранней стадии инфекции.


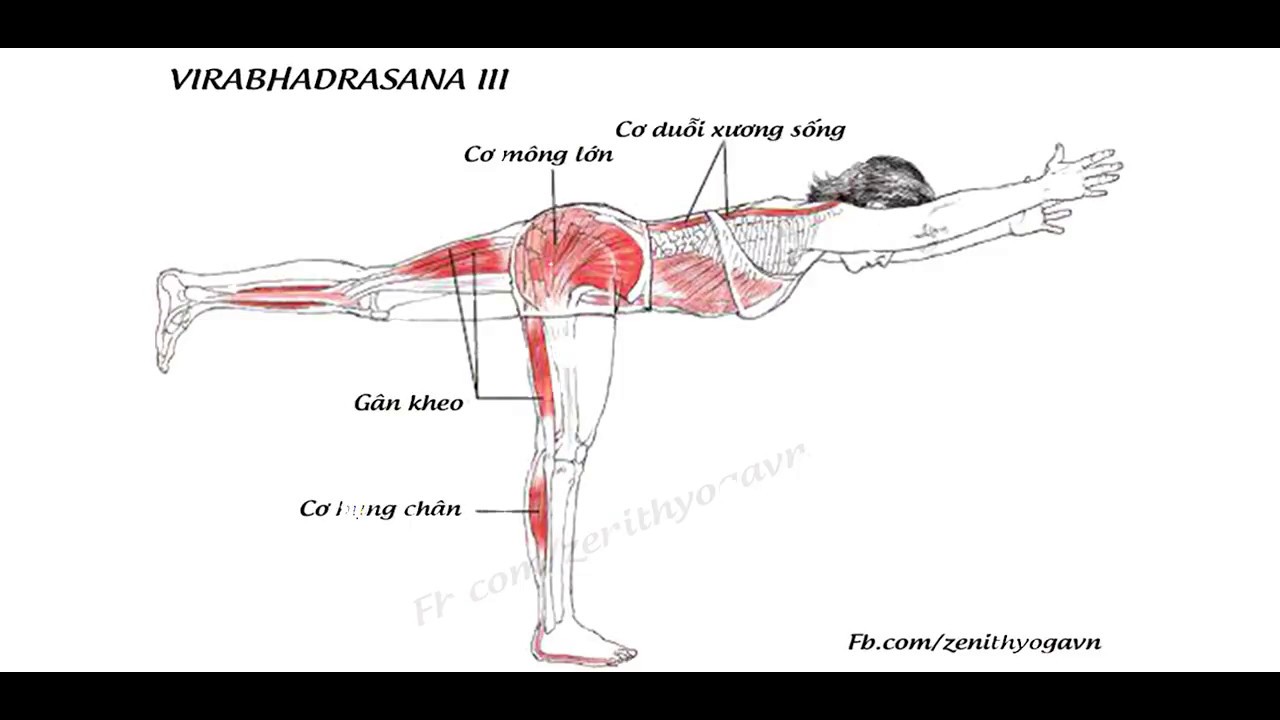

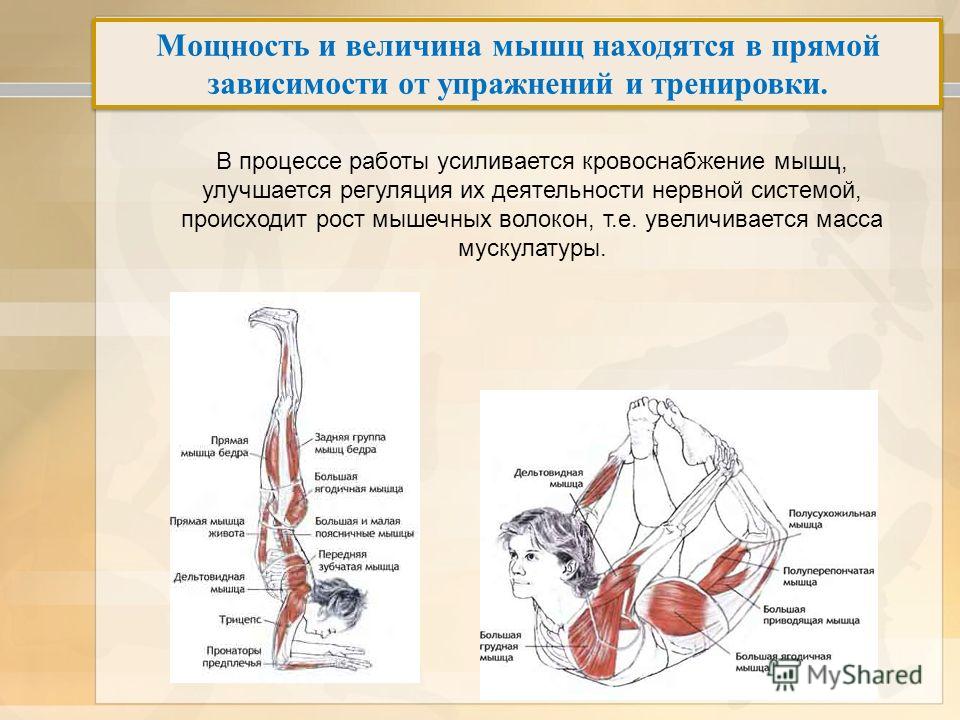 — Это могут быть как жизнеугрожающие состояния (субарахноидальное кровоизлияние), так и приступы уже имеющихся болевых синдромов (мигрень). Чаще, как правило, развиваются приступы доброкачественной боли, однако терять бдительность тоже не стоит».
— Это могут быть как жизнеугрожающие состояния (субарахноидальное кровоизлияние), так и приступы уже имеющихся болевых синдромов (мигрень). Чаще, как правило, развиваются приступы доброкачественной боли, однако терять бдительность тоже не стоит».


 Чаще всего такая боль локализуется в лобной области или непосредственно в глазах», — говорит Юлия Хазиме.
Чаще всего такая боль локализуется в лобной области или непосредственно в глазах», — говорит Юлия Хазиме.


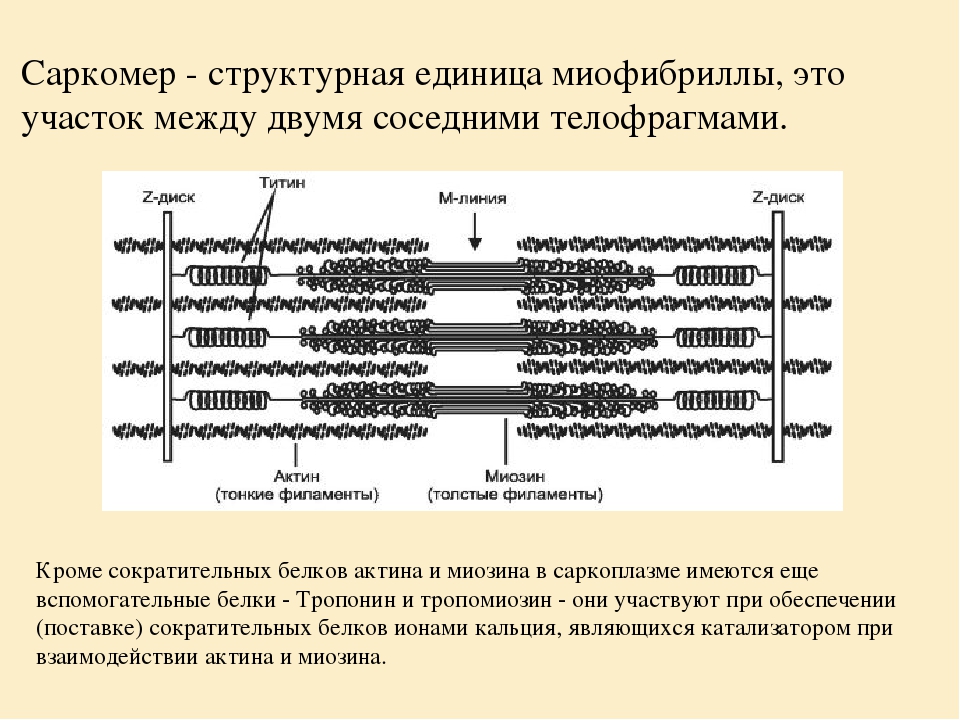 Он показывает, есть ли положительная динамика у тренировки», — говорит Григорий Жежа.
Он показывает, есть ли положительная динамика у тренировки», — говорит Григорий Жежа.
