| 1. |
Формула аминокислоты
Сложность: лёгкое |
1 |
| 2. |
Функциональные группы аминокислот
Сложность: лёгкое |
1 |
3.
|
Функции белков
Сложность: лёгкое |
1 |
| 4. |
Строение и химические свойства аминокислот
Сложность: среднее |
2 |
5. |
Строение и свойства белков
Сложность: среднее |
2 |
| 6. |
Термины по теме «Белки»
Сложность: среднее |
2 |
7.
|
Реакции белков
Сложность: среднее |
2 |
| 8. |
Сравнение белков и жиров
Сложность: среднее |
2 |
9.
|
Цветные реакции белков Сложность: среднее | 2 |
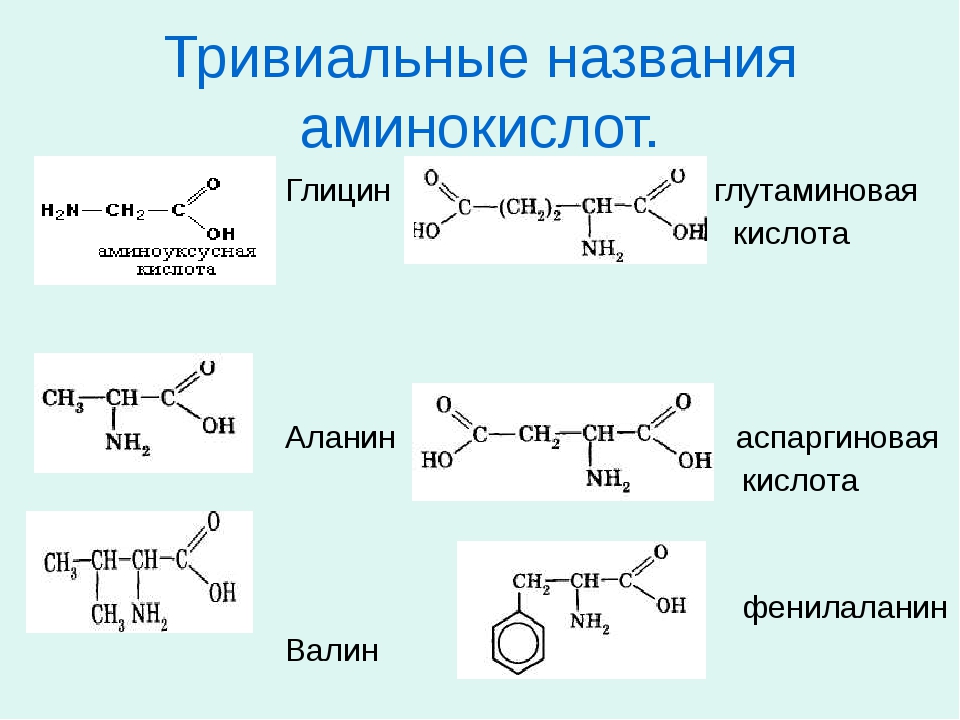
Аминокислоты
Как получить рацемическую аминокислоту, ясно. А что делать, если нужна оптически чистая аминокислота, такая, как в Природе? Один путь понятен – у Природы же ее и позаимствовать. Выделить из гидролизата какого-нибудь легкодоступного белка (этот путь условно можно назвать – из рогов и копыт, так как это как раз и есть легкодоступные белковые материалы). Но этот путь подразумевает необходимость разделения смесей аминокислот.
А если без помощи Природы. Тогда нужно разделять рацемические смеси на отдельные энантиомеры – заняться расщеплением. Основная проблема здесь в том, что индивидуальные энантиомеры обладают совершенно одинаковыми свойствами по отношению ко всему нехиральному. Поэтому их просто так нельзя разделить обычными физическими методами – перегонкой, хроматографией, перекристаллизацией. С перекристаллизацией есть некоторая зацепка, потому что иногда смесь энантиомеров кристаллизуются не в виде рацемата, а отдельными кристаллами (это называется спонтанным расщеплением), – получается смесь кристаллов, которую можно попробовать разделить визуально, потому что у кристаллов и форма тоже бывает асимметрическая и можно найти кристаллики, которые являются зеркальным отражением друг друга.

Кристаллизация диастереомерных производных
Более удобный и универсальный метод состоит в разделении не энантиомеров, а диастереомеров или веществ, похожих на диастереомеры. В очередной раз повторим, что в отличие от энантиомеров, диастереомеры обладают разными, иногда очень сильно различающимися свойствами, совершенно всеми свойствами, включая растворимость. Поэтому если мы сможем превратить энантиомеры в диастереомеры, то точно сможем их разделить, подобрав условия кристаллизации. Можно получить какие-то производные или по амино-группе (амид с оптически активной кислотой) или карбоксильной (сложный эфир с оптически активным спиртом), раскристаллизовать их на два диастереомера, и провести гидролил, чтобы достать уже оптически активную кислоту. Просто как пример посмотрим на эфиры с легкодоступным природным энантиомерно чистым спиртом, ментолом (это та самая штука, которая отвечает за мятный вкус и странное ощущение так называемой “свежести” везде и всюду, от конфет и жвачки до лекарств, шампуней и зубной пасты). Получают эфиры с помощью тех же методов сшивки, как и в синтезе пептидов, предварительно закрыв амино-группу, чтоб не мешалась, ацилированием. У ментола есть еще две группы с точным расположением в пространстве (это RSR-стереоизомер), но это не важно, потому что мы расщепляем не ментол, а аминокислоту, поэтому обратим внимание только на расположение гидроксила.
Просто как пример посмотрим на эфиры с легкодоступным природным энантиомерно чистым спиртом, ментолом (это та самая штука, которая отвечает за мятный вкус и странное ощущение так называемой “свежести” везде и всюду, от конфет и жвачки до лекарств, шампуней и зубной пасты). Получают эфиры с помощью тех же методов сшивки, как и в синтезе пептидов, предварительно закрыв амино-группу, чтоб не мешалась, ацилированием. У ментола есть еще две группы с точным расположением в пространстве (это RSR-стереоизомер), но это не важно, потому что мы расщепляем не ментол, а аминокислоту, поэтому обратим внимание только на расположение гидроксила.
Получаем смесь диастереомерных эфиров, которую можно раскристаллизовать, потому что диастереомеры имеют разную растворимость. Растворитель и условия подбирают экспериментально.
Обратим внимание на то, что задача изначально непроста, потому что обычно перекристаллизацией отделяют вещество, которое преобладает в смеси, а все остальное является примесями. В этом же случае есть два вещества (диастереомеры), содержание которых в начальной смеси заведомо одинаково, а разница в растворимости вряд ли очень велика, так как вещества опять таки заведомо очень похожи. Поэтому кристаллизацию нельзя вести так, как мы это обычно делаем в практикуме – растворяем в кипящем растворителе (и хорошо если в минимально возможном количестве, а то, как мы любим, так и вообще “на глазок”) и просто охлаждаем вплоть до льда, чтобы побольше выпало. Это даже в простых случаях техника плохая, но она оправдана, когда нужно просто убрать несколько процентов примесей в основном веществе. Но в случае раскристаллизации диастереомеров это заведомо обречено на провал. В этом случае важно даже не минимальное количество растворителя, а медленное и осторожное охлаждение, лучше при перемешивании, что создает максимально близкие к равновесным условия – даем молекулам в растворе возможность образовать однородные по составу зародыши, на которых будут расти кристаллы. И отделяем кристаллическую фазу без форсированного охлаждения, лучше отобрать несколько фракций, образующихся при постепенном снижении температуры.
В этом же случае есть два вещества (диастереомеры), содержание которых в начальной смеси заведомо одинаково, а разница в растворимости вряд ли очень велика, так как вещества опять таки заведомо очень похожи. Поэтому кристаллизацию нельзя вести так, как мы это обычно делаем в практикуме – растворяем в кипящем растворителе (и хорошо если в минимально возможном количестве, а то, как мы любим, так и вообще “на глазок”) и просто охлаждаем вплоть до льда, чтобы побольше выпало. Это даже в простых случаях техника плохая, но она оправдана, когда нужно просто убрать несколько процентов примесей в основном веществе. Но в случае раскристаллизации диастереомеров это заведомо обречено на провал. В этом случае важно даже не минимальное количество растворителя, а медленное и осторожное охлаждение, лучше при перемешивании, что создает максимально близкие к равновесным условия – даем молекулам в растворе возможность образовать однородные по составу зародыши, на которых будут расти кристаллы. И отделяем кристаллическую фазу без форсированного охлаждения, лучше отобрать несколько фракций, образующихся при постепенном снижении температуры.
Точно так же экспериментально определяют, какой диастереомер выкристаллизовывается, и какая на нем висит аминокислота. В растворе остается смесь, сильно обогащенная другим диастереомером. После уже дополнительными перекристаллизациями достигают желаемой оптической чистоты каждого из диастереомеров. Повторные перекристаллизации позволяют дочистить до высокой чистоты как тот диастереомер, который выпал в первой перекристаллизации, так и второй, который остался в растворе в смеси с остатками того, который выпал. Это очевидно, потому что повторные перекристаллизации уже проходят в обычном режиме, когда в смеси преобладает одно вещество, а второе является примесью. Опытный и упорный экспериментатор может достичь почти полного разделения смеси, но это требует высокого мастерства и тонкого понимания процесса кристаллизации.
Перекристаллизация (как и любой другой физический или химический процес разделения) никогда не может дать чистых диастереомеров (энантиомеров) со 100%-ным содержанием.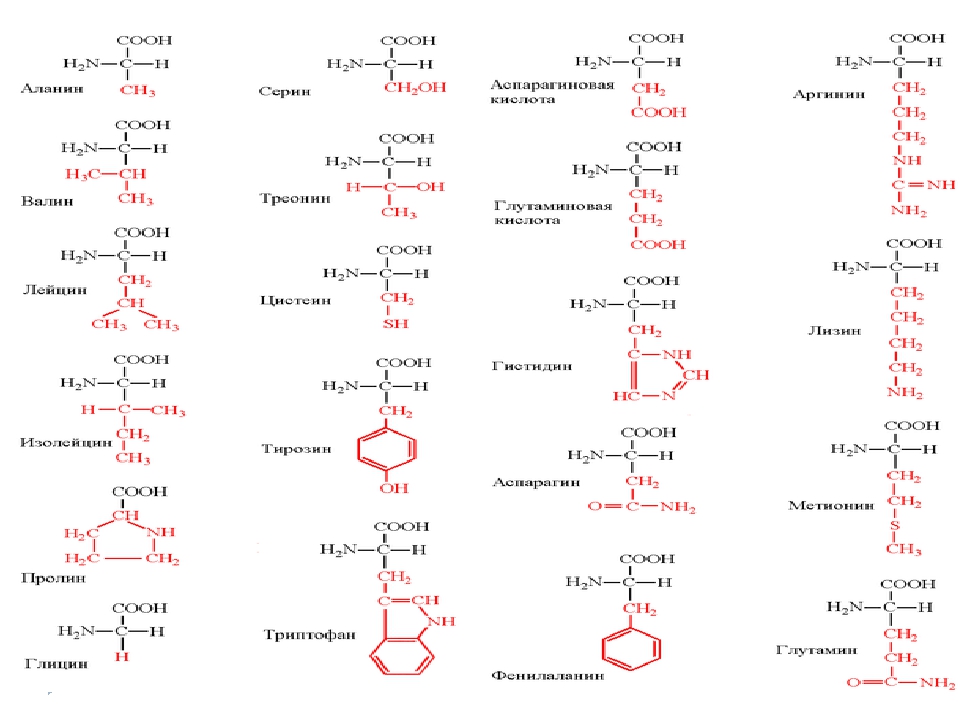 Довольно легко и быстро достигается 85-90% разделение, а дальше уже требуется то самое высокое мастерство, чтобы получить 97-98%. Что это за проценты? Это не выход чистого диастереоизомера, а оптическая чистота или энантиомерный избыток, сокращается ee. Это очень простая и очевидная характеристика, измеряемая в процентах, как и обычный выход. Даже если мы забыли, что это такое, моментально вспомним, просто имея в виду очевидную вещь – она равна 0% для рацемической смеси и 100%, если энантиомер совершенно чист. Такую величину очевидно можно получить, просто определив разность между содержанием того энантиомера, которого больше, и того, которого меньше. А экспериментально это элементарно определяется измерением угла вращения смеси. У рацемата она равна 0, у чистого энантиомера – удельному углу вращения этого энантиомера. В промежутке имеем простую линейную зависимость как раз от энантиомерного избытка.
Довольно легко и быстро достигается 85-90% разделение, а дальше уже требуется то самое высокое мастерство, чтобы получить 97-98%. Что это за проценты? Это не выход чистого диастереоизомера, а оптическая чистота или энантиомерный избыток, сокращается ee. Это очень простая и очевидная характеристика, измеряемая в процентах, как и обычный выход. Даже если мы забыли, что это такое, моментально вспомним, просто имея в виду очевидную вещь – она равна 0% для рацемической смеси и 100%, если энантиомер совершенно чист. Такую величину очевидно можно получить, просто определив разность между содержанием того энантиомера, которого больше, и того, которого меньше. А экспериментально это элементарно определяется измерением угла вращения смеси. У рацемата она равна 0, у чистого энантиомера – удельному углу вращения этого энантиомера. В промежутке имеем простую линейную зависимость как раз от энантиомерного избытка.
Кристаллизация солей с оптически активными кислотами или основаниями
Раскристаллизация диастереомерных производных – метод хороший, но очень трудоемкий.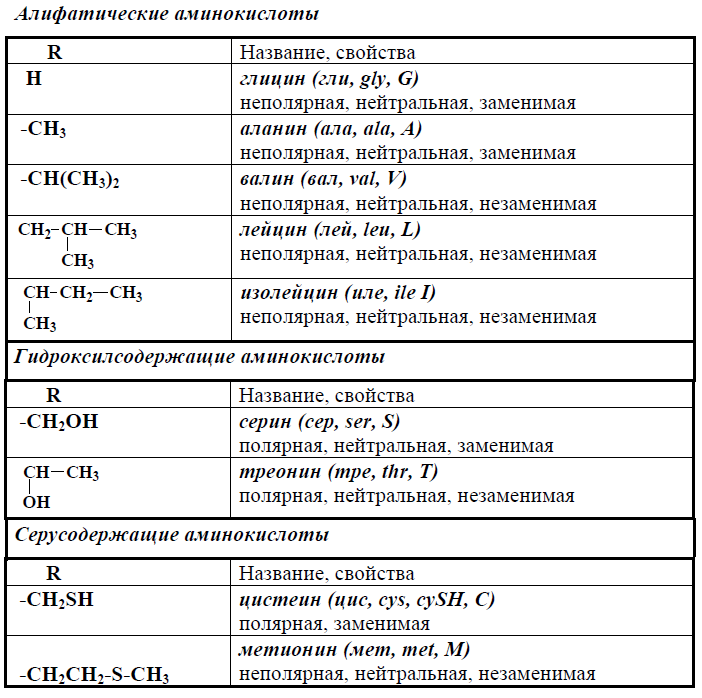 Производные нужно сначала получить, потом раскристаллизовать, потом обратно превратить в аминокислоту. Есть способ проще, хотя и еще более чувствительный к качеству работы экспериментатора. Это кристаллизация солей с оптически активными кислотами или основаниями. Если то, что вам нужно разделить – кислота, то выбираем основание, Если основание – то кислоту. А если, как в случае аминокислот, и то, и то? То и выбрать можно и то, и то, но гораздо удобнее сначала сделать аминокислоту только кислотой (подавив основность амино-группы, например, ацилированием), или только основанием (убрав свободный карбоксил в сложный эфир). То есть, все равно какую-то химическую работу сделать нужно, но это очень простая работа. Вот как-тот так: берем рацемическую аминокислоту, обрабатываем ее уксусным ангидридом, убираем основную амино-группу, добавляем оптически чистое основание в количестве, необходимом для образования соли из обеих энантиомеров рацемата, и создаем условия кристаллизации (концентрируем раствор до начала кристаллизации, охлаждаем, трём стенки стеклянной палочкой, и т.
Производные нужно сначала получить, потом раскристаллизовать, потом обратно превратить в аминокислоту. Есть способ проще, хотя и еще более чувствительный к качеству работы экспериментатора. Это кристаллизация солей с оптически активными кислотами или основаниями. Если то, что вам нужно разделить – кислота, то выбираем основание, Если основание – то кислоту. А если, как в случае аминокислот, и то, и то? То и выбрать можно и то, и то, но гораздо удобнее сначала сделать аминокислоту только кислотой (подавив основность амино-группы, например, ацилированием), или только основанием (убрав свободный карбоксил в сложный эфир). То есть, все равно какую-то химическую работу сделать нужно, но это очень простая работа. Вот как-тот так: берем рацемическую аминокислоту, обрабатываем ее уксусным ангидридом, убираем основную амино-группу, добавляем оптически чистое основание в количестве, необходимом для образования соли из обеих энантиомеров рацемата, и создаем условия кристаллизации (концентрируем раствор до начала кристаллизации, охлаждаем, трём стенки стеклянной палочкой, и т. п.) и в случае успеха получаем кристаллы и маточник. Для обоих определяем удельный угол вращения (или, если мы в 21 веке и у нас есть хроматограф с хиральной колонкой, определяем стереоизомерный состав хроматографически), и пытаемся понять, во-первых, получается ли вообще разделение, или падает смесь, не обогащенная ни ожним из энантиомеров, и, во-вторых, если получается, то где какой энантиомер. Предсказать это невозможно, если только вы просто не воспроизводите уже известную методику. Если все получается, продолжаем кристаллизацию, собираем фракции, кристаллизуем их еще раз или несколько раз, так, как это описано выше для кристаллизации диастереомерных производных. В конце обрабатываем соль щелочью для отделения хирального основания (которое собирают, чистят и используют для следующих разделений), гидролизуем защиту аминогруппы и перекристаллизовываем уже чистый энантиомер аминокислоты.
п.) и в случае успеха получаем кристаллы и маточник. Для обоих определяем удельный угол вращения (или, если мы в 21 веке и у нас есть хроматограф с хиральной колонкой, определяем стереоизомерный состав хроматографически), и пытаемся понять, во-первых, получается ли вообще разделение, или падает смесь, не обогащенная ни ожним из энантиомеров, и, во-вторых, если получается, то где какой энантиомер. Предсказать это невозможно, если только вы просто не воспроизводите уже известную методику. Если все получается, продолжаем кристаллизацию, собираем фракции, кристаллизуем их еще раз или несколько раз, так, как это описано выше для кристаллизации диастереомерных производных. В конце обрабатываем соль щелочью для отделения хирального основания (которое собирают, чистят и используют для следующих разделений), гидролизуем защиту аминогруппы и перекристаллизовываем уже чистый энантиомер аминокислоты.
Что такое оптически активные основания для этой работы? Это могут быть и очень простые вещи типа 1-фенилэтиламина, энантиомеры которого можно недорого купить (смотрим в каталог реактивов, вот (S)-энатиомер 99% оптической чистоты около тысячи долларов за полкило, (R)-энантиомер вообще почти даром, грамм за доллар). А могут быть и вещи посложнее, природные вещества, в растениях полно всяких энантиомерно чистых азотистых оснований, называемых алкалоидами. Особенно популярен алкалоид бруцин, который вместе с всем известным стрихнином выделяют из плодов тропического дерева рвотный орех. Это очень сложное и красивое энантиомерно чистое соединение, и, кстати, совсем недорогое, просто потому что его выделяют вместе со стрихнином из этих орехов в очень больших количествах. Во, какое чудище.
А могут быть и вещи посложнее, природные вещества, в растениях полно всяких энантиомерно чистых азотистых оснований, называемых алкалоидами. Особенно популярен алкалоид бруцин, который вместе с всем известным стрихнином выделяют из плодов тропического дерева рвотный орех. Это очень сложное и красивое энантиомерно чистое соединение, и, кстати, совсем недорогое, просто потому что его выделяют вместе со стрихнином из этих орехов в очень больших количествах. Во, какое чудище.
Я насчитал 6 хиральных атомов углерода и один хиральный азот, верхний, то самый, который и протонируется и отвечает за основность бруцина (нижний, который индольный, он плоский, нехиральный). Но сколько там стереогенных центров не важно, важно то, что в целом эта молекула очень сильно асимметрична, и когда, в протонированном виде, образует соль с асимметричным анионом, то разные энантиомеры по разному взаимодействуют с такой сложной формой. Любопытства ради посмотрим, как выглядит эта молекула в пространстве (по данным рентгеноструктурного анализа, структура 197896 Кебриджской базы данных), и чтобы было яснее, покрутим ее. Видим, что она сильно неплоская, и напоминает такой затейливый кривой черпачок, или даже такую полуоткрытую горсть руки, и это хорошее сравнение, потому что хиральность всегда ассоциируется с асимметрией руки. Представьте теперь две другие несимметричные штуковины, совершенно одинаковые по форме, но представляющие собой отражения в зеркале – пойдут, например, руки другого человека, левая и правая (если найдете что-то другое того же типа, пойдет и это). Попробуйте вложить в раскрытую горсть по очереди два таких объекта, левый и правый – сразу увидите, насколько по разному они вписываются в асимметричную горсть. Вот это ровно то, что нужно – это показывает, что взаимодействие одного асимметричного объекта с парой взаимно зеркальных других асимметричных объектов, сильно отличается. А когда что-то отличается, то всегда одно будет лучше другого (в одной паре взаимодействия будут сильнее чем в другой паре). Так приблизительно и работает различение (дискриминация) двух энантиомеров одной молекулы другой хиральной молекулой.
Видим, что она сильно неплоская, и напоминает такой затейливый кривой черпачок, или даже такую полуоткрытую горсть руки, и это хорошее сравнение, потому что хиральность всегда ассоциируется с асимметрией руки. Представьте теперь две другие несимметричные штуковины, совершенно одинаковые по форме, но представляющие собой отражения в зеркале – пойдут, например, руки другого человека, левая и правая (если найдете что-то другое того же типа, пойдет и это). Попробуйте вложить в раскрытую горсть по очереди два таких объекта, левый и правый – сразу увидите, насколько по разному они вписываются в асимметричную горсть. Вот это ровно то, что нужно – это показывает, что взаимодействие одного асимметричного объекта с парой взаимно зеркальных других асимметричных объектов, сильно отличается. А когда что-то отличается, то всегда одно будет лучше другого (в одной паре взаимодействия будут сильнее чем в другой паре). Так приблизительно и работает различение (дискриминация) двух энантиомеров одной молекулы другой хиральной молекулой. Молекула бруцина в этом смысле очень хороша, она большая, имеет очень сложную форму и при этом ее соли хорошо кристаллизуются, поэтому бруцин очень часто применяют для расщепления на энантиомеры рацемических смесей всяких органических кислот. Единственный ее недостаток – очень большой молекулярный вес, нужно много (в граммах) бруцина, чтобы расщепить несколько граммов органической кислоты. Более простые оптически активные основания типа уже упомянутого 1-фенилэтиламина тоже используют, и принцип их действия тот же – взаимодействие асимметричного катиона фенилэтиламина с энантиомерами анионов какой-то хиральной кислоты попарно различается, одна пара будет лучше другой, энергия взаимодествия будет больше, кристалл получится прочнее, а более прочный кристалл (кристалл с большей энергией кристаллической решетки) менее растворим и легче выкристаллизовывается. Но когда асимметрия не так сильно выражена, как у того же бруцина, разница будет меньше, разница растворимостей меньше, и раскристаллизовать труднее.
Молекула бруцина в этом смысле очень хороша, она большая, имеет очень сложную форму и при этом ее соли хорошо кристаллизуются, поэтому бруцин очень часто применяют для расщепления на энантиомеры рацемических смесей всяких органических кислот. Единственный ее недостаток – очень большой молекулярный вес, нужно много (в граммах) бруцина, чтобы расщепить несколько граммов органической кислоты. Более простые оптически активные основания типа уже упомянутого 1-фенилэтиламина тоже используют, и принцип их действия тот же – взаимодействие асимметричного катиона фенилэтиламина с энантиомерами анионов какой-то хиральной кислоты попарно различается, одна пара будет лучше другой, энергия взаимодествия будет больше, кристалл получится прочнее, а более прочный кристалл (кристалл с большей энергией кристаллической решетки) менее растворим и легче выкристаллизовывается. Но когда асимметрия не так сильно выражена, как у того же бруцина, разница будет меньше, разница растворимостей меньше, и раскристаллизовать труднее.
И если уж мы сюда заехали, то разберемся еще в одной вещи, почему-то всегда вызывающей вопросы. Соли, состоящие из энантиомерно чистого основания и пары энантиомерных кислот не являются диастереомерами в строгом смысле этого слова, по крайней мере, в растворе, где ионы достаточно свободны или даже совсем свободны. Растворите такую пару солей, и в растворе ионы тут же перемешаются. Разделение происходит только при кристаллизации. А в кристалле это можно назвать диастереомером? Нет. Если вы когда-нибудь видели, как устроены кристаллы органических соединений, то понимаете, что молекулы там расположены в большом порядке, каждая на своем месте, и если это ионы, то и ионы будут занимать определенные положения, и каждый будет на своем месте, – но сказать, какой катион принадлежит какому аниону невозможно. Хотя мы тут развели всякие метафоры про черпачки и горсти, но реальность сильно сложнее – энергия кристаллической фазы определяется не только парными взаимодействиями анион-катион, но всей суммой взаимодействий находящихся рядом в кристалле молекул и ионов.-(Aminokisloty-Belki)-otvet-na-vopros-3.jpg) Кристалл – это чертовски сложная вещь, и анализ взаимодействий в ней – невероятно сложная задача. Именно поэтому кислоты или основания для кристаллизации подбирают только экспериментально, и сказать заранее, какой из раделяемых энантиомеров пойдет в кристалл, а какой останется в растворе, невозможно.
Кристалл – это чертовски сложная вещь, и анализ взаимодействий в ней – невероятно сложная задача. Именно поэтому кислоты или основания для кристаллизации подбирают только экспериментально, и сказать заранее, какой из раделяемых энантиомеров пойдет в кристалл, а какой останется в растворе, невозможно.
Аминокислоты. Строение аминокислот. Изомерия и номенклатура. Физические и химические свойства
Физические и химические свойства. Получение аминокислот и их применение».
Цель урока: Дать понятие об аминокислотах на основе межпредметных связей с биологией.
Образовательные задачи:
- изучение строения, свойств аминокислот;
- формирование умения составлять структурные формулы изомеров и называть их;
- формирование знаний о способах получения и областях применения аминокислот.
Развивающие задачи: формирование приемов сравнения, сопоставления, анализа и обобщения знаний.
Воспитательные задачи:
- показ важности и практической применимости знаний по химии;
- совершенствование учебных умений, навыков, развитие любви к предмету и к науке.
Тип урока: урок изучения нового материала.
Место данного урока в теме: первый урок в данной теме.
Метод: комбинированный (словесно — наглядно — практический).
Структура урока:
I. Организационный момент. Постановка задачи.
II. Изучение нового материала по плану:
- Актуализация знаний.
- Формирование новых понятий.
- Формирование умений и навыков.
III. Проверка усвоения темы.
IV. Заключение, выводы.
V. Краткий инструктаж по домашнему заданию. Подведение итогов работы учащихся, объявление оценок.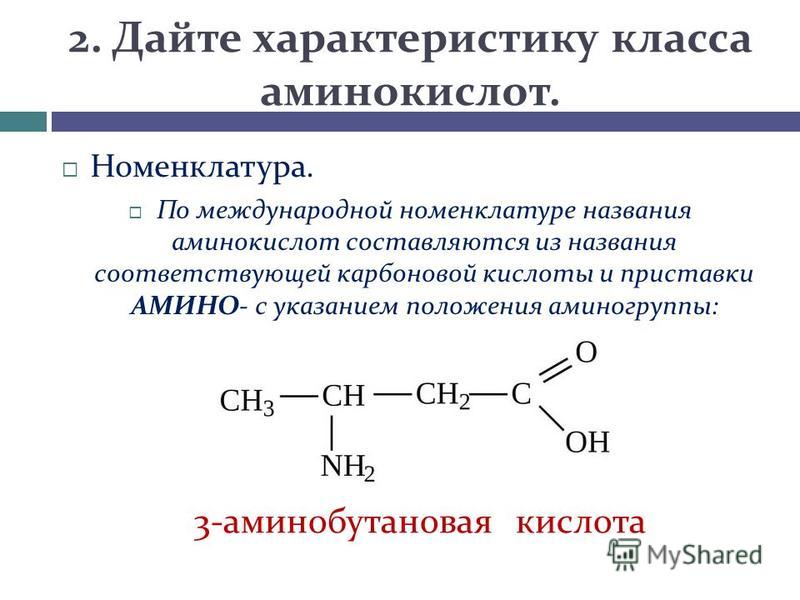
На дом: Л.А. Цветков § 41. И.Г. Хомченко «Сборник задач и упражнений по химии для средней школы» № 28.21, 28.22, 28.24, 28.25, 28.32* – 28.35*
Список литературы:
- Настольная книга учителя. Химия 10 класс, О.С. Габриелян, И.Г. Остроумов
- Химия внутри нас. Введение в бионеорганическую и биоорганическую химию. А.С. Егоров, Н.М. Иванченко, К.П. Шацкая.
- Тесты по химии для школьников и абитуриентов. Е.В. Барковский А.И. Врублевский
- Репетитор по химии под редакцией А.С. Егорова
- Подготовка к экзамену по химии с контролем на ЭВМ. Ф.А. Чмиленко, И.Г, Винниченко, Т.С. Чмиленко
Приложение 1
Приложение 2
Номенклатура аминокислот — Справочник химика 21
По заместительной номенклатуре аминокислоты называют по соответствующей карбоновой кислоте с добавлением приставки амино-. Положение аминогруппы указывают соответствующей цифрой [c.409]
Положение аминогруппы указывают соответствующей цифрой [c.409]Изомерия и номенклатура аминокислот. Изомерия аминокислот обусловлена положением функциональной группы ЫН2, а также строением углеродного скелета. [c.254]
Изомерия и номенклатура аминокислот, содержащих первичную аминогруппу —NHa, соверщенно аналогичны изомерии и номенклатуре оксикислот (см. стр. 560). Как и для оксикислот, различают а-, -, у- и т. д. аминокислоты, например [c.769]
Для унификации номенклатуры аминокислот была предложена новая система, согласно которой для обозначения конфигурации а-углеродного атома используют прописные буквы L и D [c.81]
Номенклатура. Изомерия. Для наименования аминокислот широко применяются тривиальные названия. По рациональной номенклатуре аминокислоты рассматривают как производные соответствующих органических кислот, положение аминогруппы указывается буквами а, р, у и т. д. (табл. 21). По ИЮПАК, для наименования аминокислот группу МНг называют приставкой амино , указывая цифрой номер углеродного атома, с которым она связана, затем следует название соответствующей кислоты. [c.179]
д. (табл. 21). По ИЮПАК, для наименования аминокислот группу МНг называют приставкой амино , указывая цифрой номер углеродного атома, с которым она связана, затем следует название соответствующей кислоты. [c.179]
До недавнего времени аминокислоты, приведенные в табл. 2, настолько доминировали в изученных природных соединениях, что все другие аминокислоты рассматривались исследователями как неприродные , редкие или случайные . В дальнейшем было обнаружено, что белки некоторых бактерий, а также ряд природных физиологически активных веществ содержат и другие аминокислоты. Некоторые другие аминокислоты были найдены и в свободном состоянии в растениях и в животных организмах (см. табл. 3). Они отличаются гораздо более широким ассортиментом функциональных групп, многие из них относятся к О-ряду. Вероятно, номенклатура аминокислот, входящих в состав белков, вряд ли подвергнется серьезному изменению, что же касается списка аминокислот, найденных в физиологически активных [c. 438]
438]
По принятой для обозначения пространственного строения номенклатуре аминокислоты с такой конфигурацией относятся к Ь-ряду. Аминокислоты противоположной О-конфигурации в белках, как правило, не встречаются. Есть, однако, весьма примечательные исключения О-аминокислоты входят в состав некоторых микроорганизмов (бактерии сибирской язвы), антибиотиков, т. е. необычных, не имеющих широкого распространения форм жизни и их продуктов. [c.279]
Дальнейшее обсуждение номенклатуры аминокислот вы найдете позднее в этой главе. [c.189]
Номенклатура аминокислот и пептидов [c.388]
Номенклатура аминокислот имеет две особенности. Во-первых, в биохимии применяется ряд тривиальных названий для аминокислот. Такая терминология проста и весьма удобна в этой области, как и в любой другой специальной области науки, необходимо знать общепринятый профессиональный [c.9]
Изомерия и номенклатура аминокислот, содержащих первичную аминогруппу —Nh3, совершенно аналогичны изомерии и номенклатуре оксикислот. [c.664]
[c.664]
Номенклатура аминокислот. Для рационального наименования аминокислот к названию соответствующей карбоновой кислоты добавляют приставку амино, указывая, если необходимо, положение аминогруппы по отношению к карбоксильной группе. В ряду аминопроизводных карбоновых кислот жирного ряда для этой цели применяют буквы греческого алфавита, в ароматическом же ряду — обычные обозначения о-, м- или Для важнейших аминокислот весьма часто применяют укоренившиеся тривиальные название. [c.371]
Обозначения В и ь были введены в номенклатуру аминокислот для указания конфигурации аналогично обозначениям в рядах оксикислот и углеводов. [c.244]
В этом номере журнала опубликованы также разработанные ШРАС Правила номенклатуры аминокислот, стероидов, витаминов и каротиноидов (стр. 5575), Руководство по физико-химическим обозначениям и терминологии (стр. 5517) и Правила номенклатуры неорганических соединений (стр.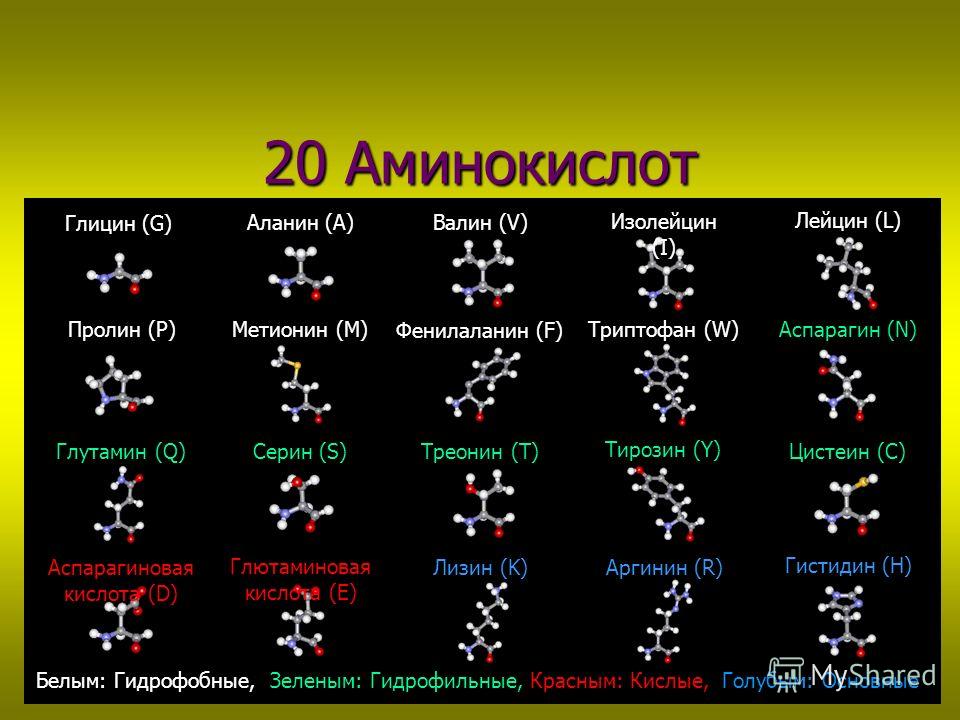 5523). [c.304]
5523). [c.304]
Углеводы известны уже довольно давно, и поэтому каждый из пих имеет тривиальное название. К сожалению, эти названия почти не отран ают структуру соответствующего соединения (так же, как и номенклатура аминокислот). [c.420]
В случае абсолютной конфигурации по Кану, Ингольду н Прелогу заместители хирального С-атома располагаются в убывающем порядке и о-аминокислотам соответствует обозначение (Я)-, а L-aминoки лoтaм — (8)-. Хотя эта система универсальна, она до сих пор не получила признания в номенклатуре аминокислот. [c.26]
Особенностью номенклатуры аминокислот является широкое распространение тривиальных названий. По мере открытия аминокислот, выделяемых из гидролизатов белков, они получали названия в соответствии с их происхождением или свойствами. Названия, составленные на основании правил химической номенклатуры, мало употребительны, что в значительной степени связано с их громоздкостью. Так, например, триптофан следует называть а-амино- 3-индолилпропионовой кислотой, тирозин — а-амино-р-( г-оксифенил)-пропионовой кислотой и т. д. Но даже тривиальные названия аминокислот оказываются слишком длинными при обозначении аминокислотной последовательности полипептидов. В связи с этим приняты международные сокращенные обозначения аминокислот (табл. 1) [c.27]
д. Но даже тривиальные названия аминокислот оказываются слишком длинными при обозначении аминокислотной последовательности полипептидов. В связи с этим приняты международные сокращенные обозначения аминокислот (табл. 1) [c.27]
Аминокислоты, пептиды, белки
Аминокислотами называются карбоновые кислоты, в углеводородном радикале которых один или несколько атомов водорода замещены аминогруппами. В зависимости от взаимного расположения карбоксильной и аминогрупп различают a-, b-, g- и т.д. аминокислоты. Например,
b
Ch4– a
CH–COOH a- аминопропионовая кислота
I
Nh3
b
Ch3–
I
Nh3 a
Ch3–COOH b- аминопропионовая кислота
Чаще всего термин «аминокислота» применяют для обозначения карбоновых кислот, аминогруппа которых находится в a- положении, т.е. для a- аминокислот. Общую формулу a- аминокислот можно представить следующим образом:
h3N–
CH–COOH
I
R
В зависимости от природы радикала (R) – аминокислоты делятся на алифатические, ароматические и гетероциклические.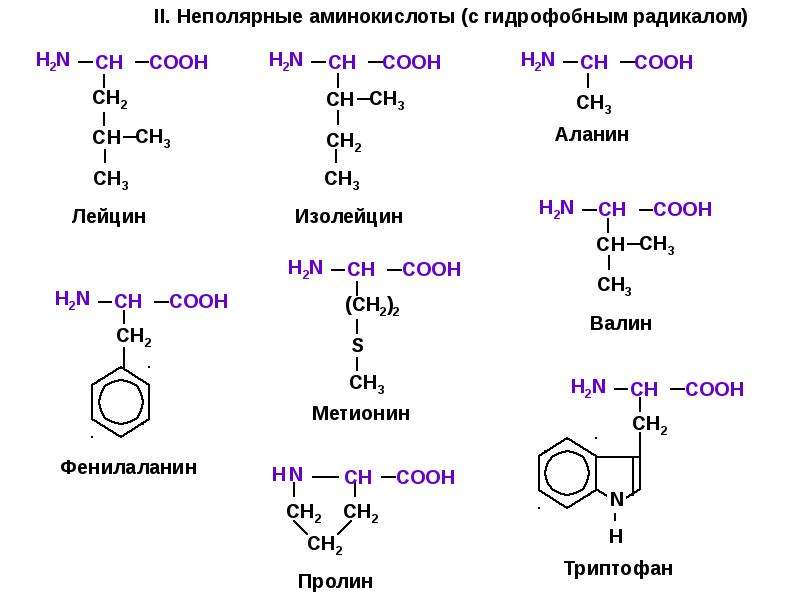
В таблице представлены важнейшие — аминокислоты, входящие в состав белков.
Таблица. Важнейшие a- аминокислоты
| Аминокислота | Сокращенное (трехбуквенное) название аминокислотного остатка в макромолекулах пептидов и белков. |
Строение R |
| Алифатические | ||
| Глицин |
Gly |
H– |
| Аланин |
Ala |
CH3– |
| Валин* |
Val |
(CH3)2CH– |
| Лейцин* |
Leu |
(CH3)2CH–CH2– |
| Изолейцин* |
Ile |
CH3–CH2–CH– I CH3 |
| Содержащие OH– группу | ||
| Серин |
Ser |
HO–CH2– |
| Треонин* |
Thr |
CH3–CH(OH)– |
| Содержащие COOH– группу | ||
| Аспарагиновая |
Asp |
HOOC–CH2– |
| Глутаминовая |
Glu |
HOOC–CH2–CH2– |
| Содержащие NH2CO– группу | ||
| Аспарагин |
Asn |
NH2CO–CH2– |
| Глутамин |
Gln |
NH2CO–CH2–CH2– |
| Содержащие NH2– группу | ||
| Лизин* |
Lys |
NH2–(CH2)3–CH2– |
| Аргинин |
Arg |
NH2–C–NH–(CH2)2–CH2– II NH |
| Серусодержащие | ||
| Цистеин |
Cys |
HS–CH2– |
| Метионин* |
Met |
CH3–S–CH2–CH2– |
| Ароматические | ||
| Фенилаланин* |
Phe |
|
| Тирозин |
Tyr |
|
| Гетероциклические | ||
| Триптофан* |
Trp |
|
| Гистидин |
His |
|
| Иминокислота | ||
| Пролин |
Pro |
*Незаменимые a- аминокислоты
Изомерия
Наряду с изомерией, обусловленной строением углеродного скелета и положением функциональных групп, для a- аминокислот характерна оптическая (зеркальная) изомерия. Все a- аминокислоты, кроме глицина, оптически активны. Например, аланин имеет один асимметрический атом углерода (отмечен звездочкой),
Все a- аминокислоты, кроме глицина, оптически активны. Например, аланин имеет один асимметрический атом углерода (отмечен звездочкой),
h3N –
H
I
C*–COOH
I
Ch4
а значит, существует в виде оптически активных энантиомеров:
H-
COOH
+-Nh3
Ch4
D- аланин
h3N-
COOH
+-H
Ch4
L- аланин
Все природные a- аминокислоты относятся к L– ряду.
Получение
1) Важнейший источник аминокислот – природные белки, при гидролизе которых образуются смеси a- аминокислот. Разделение этой смеси – довольно сложная задача, однако по обыкновению одна или две аминокислоты образуются в значительно больших количествах, чем все другие, и их удается выделить достаточно просто.
2) Синтез аминокислот из галогенозамещенных кислот действием аммиака
Cl–
CH–COOH + 2Nh4 ® h3N–
I
R CH–COOH + Nh5Cl
I
R
3) Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют a- аминокислоты белков.
Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют a- аминокислоты белков.
Физические свойства
Аминокислоты представляют собой кристаллические вещества с высокими (выше 250°С) температурами плавления, которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны. Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в воде и нерастворимы в органических растворителях, чем они похожи на неорганические соединения. Многие аминокислоты обладают сладким вкусом.
Химические свойства
1) Некоторые свойства аминокислот, в частности высокая температура плавления, объясняется своеобразным их строением. Кислотная (–COOH) и основная (–Nh3) группы в молекуле аминокислоты взаимодействуют друг с другом, образуя внутренние соли (биполярные ионы). Например, для глицина
h3N-Ch3-COOH « h4N+-Ch3-COO-
2) Вследствие наличия в молекулах аминокислот функциональных групп кислотного и основного характера a- аминокислоты являются амфотерными соединениями, т.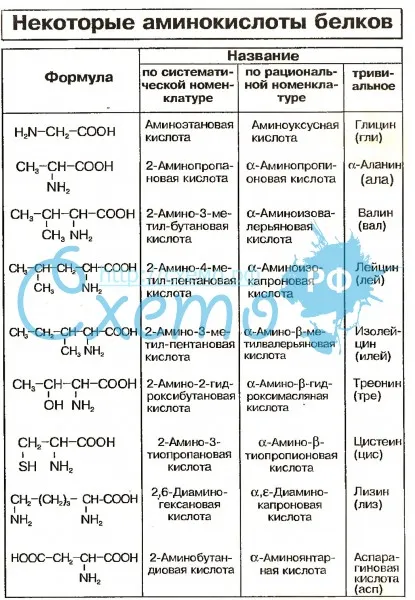 е. они образуют соли как с кислотами, так и со щелочами.
е. они образуют соли как с кислотами, так и со щелочами.
h3N–
CH–COOH + HCl ® [h4N+–
I
R CH–COOH]Cl-(хлористоводородная соль a-аминокислоты)
I
R
h3N–
CH–COOH + NaOH ® h3N–
I
R CH–COO-Na+(натриевая соль a-аминокислоты) + h3O
I
R
3) В реакции со спиртами образуются сложные эфиры.
Этиловый эфир аланина
4) a- Аминокислоты можно ацилировать, в частности, ацетилировать, действуя уксусным ангидридом или хлористым ацетилом. В результате образуются N- ацильные производные a- аминокислот (символ «N» означает, что ацил связан с атомом азота).
N – ацетилаланин
5) a- Аминокислоты вступают друг с другом в реакцию поликонденсации, приводя к амидам кислот. Продукты такой конденсации называются пептидами. При взаимодействии двух аминокислот образуется дипептид:
При взаимодействии двух аминокислот образуется дипептид:
h3N–
H
I
CH– O
II
C–OH + H–NH– Ch4
I
CH– O
II
C–OH ®
глицин аланин
® h3N– H
I
CH– O
II
C–NH– Ch4
I
CH– O
II
C–OH + h3O
глицилаланин
При конденсации трех аминокислот образуется трипептид и т.д.
Связь – O
II
C–NH – называется пептидной связью.
Пептиды. Белки
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков a- аминокислот, соединенных между собой пептидными связями.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.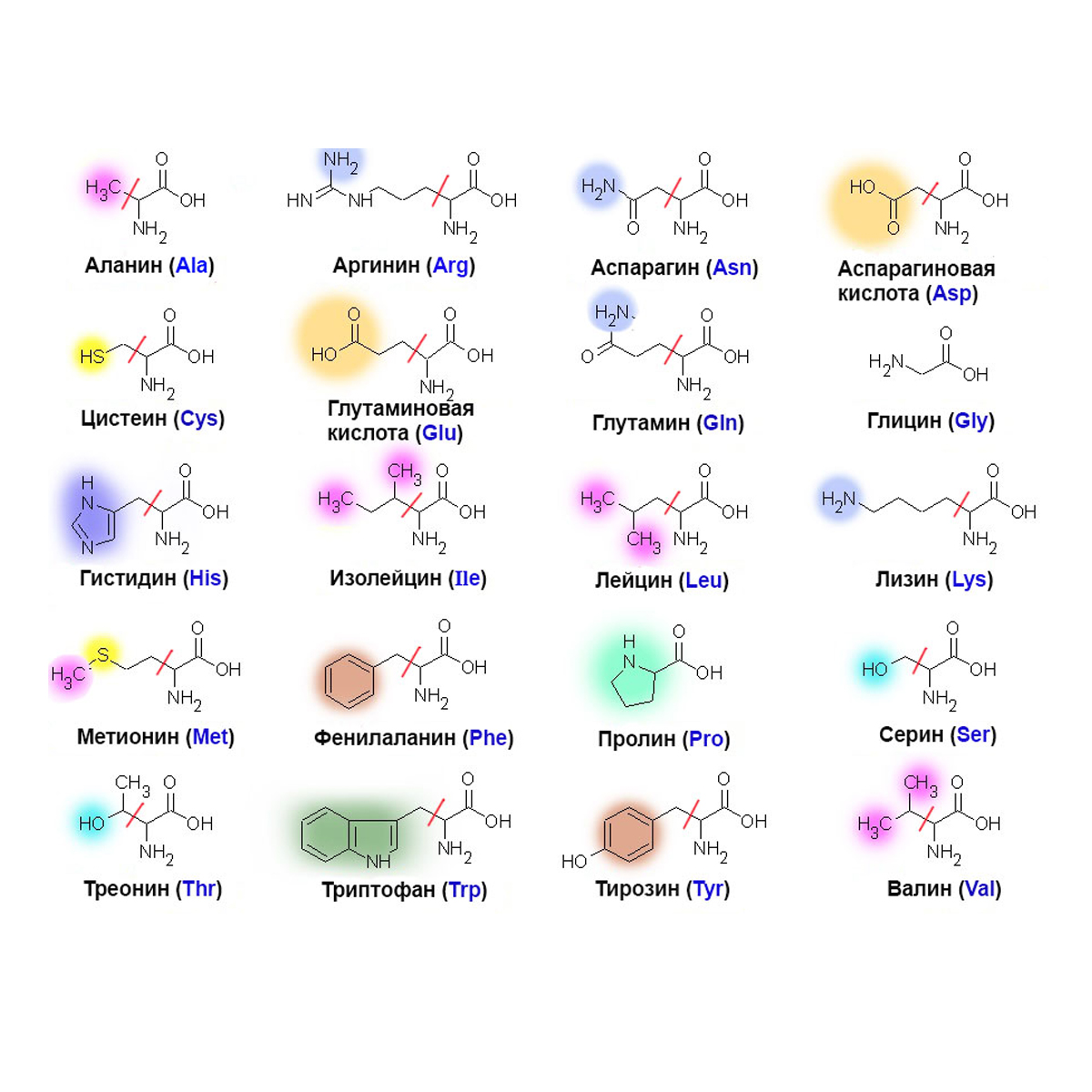 д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником a- аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают a- аминокислоты. Многие a- аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков a- аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см.таблицу). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником a- аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают a- аминокислоты. Многие a- аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков a- аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см.таблицу). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
Пептиды и белки различают в зависимости от величины молекулярной массы. Условно считают, что пептиды содержат в молекуле до 100 (соответствует молекулярной массе до 10000), а белки — свыше 100 аминокислотных остатков (молекулярная масса от 10000 до нескольких миллионов). При этом в пептидах различают олигопептиды, содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, содержащие до 100 аминокислотных остатков.
Конструкция полипептидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся метиновых (CH) и пептидных (CONH) групп. Различия такой цепи заключаются в боковых радикалах, связанных с метиновой группой, и характеризующих ту или иную аминокислоту. Один конец цепи со свободной аминогруппой называется N– концом, другой, на котором находится аминокислота со свободной карбоксильной группой, называется C– концом. Пептидные и белковые цепи записываются с N– конца. Иногда пользуются специальными обозначениями: на N– конце пишется NH– группа или только атом водорода –H, а на C– конце — либо карбоксильная COOH– группа, либо только гидроксильная OH– группа.
Для полипептидов и белков характерны четыре уровня пространственной организации, которые принято называть первичной, вторичной, третичной и четвертичной структурами.
Первичная структура белка — специфическая аминокислотная последовательность, т. е. порядок чередования a- аминокислотных остатков в полипептидной цепи.
е. порядок чередования a- аминокислотных остатков в полипептидной цепи.
Вторичная структура белка — конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO. Одна из моделей вторичной структуры – a- спираль.
Третичная структура белка — трехмерная конфигурация закрученной спирали в пространстве, образованная за счет дисульфидных мостиков –S–S– между цистеиновыми остатками и ионных взаимодействий.
Четвертичная структура белка — структура, образующаяся за счет взаимодействия между разными полипептидными цепями. Четвертичная структура характерна лишь для некоторых белков, например гемоглобина.
Химические свойства
1) Денатурация. Утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции, называется денатурацией. С точки зрения структуры белка – это разрушение вторичной и третичной структур белка, обусловленное воздействием кислот, щелочей, нагревания, радиации и т. д. Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина при варке яиц.
д. Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина при варке яиц.
2) Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию a- аминокислот, из которых он был составлен.
3) Качественные реакции на белки:
a) Биуретовая реакция – фиолетовое окрашивание при действии солей меди (II) в щелочном растворе. Такую реакцию дают все соединения, содержащие пептидную связь.
b) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).
38
Аминокислоты.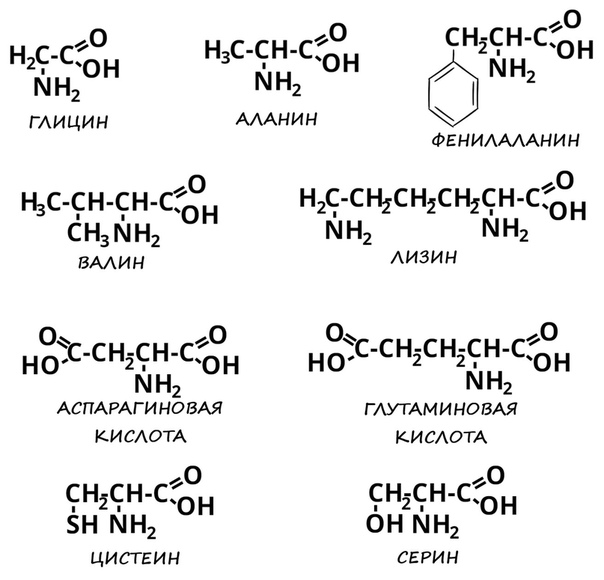 Свойства аминокислот. Пептиды. Белки.
Первичные, вторичные и третичные структуры белков. Понятие о ферментах и
ферментативном катализе.
Свойства аминокислот. Пептиды. Белки.
Первичные, вторичные и третичные структуры белков. Понятие о ферментах и
ферментативном катализе.
Аминокислоты – гетерофункциональные соединения, содержащие карбоксильную и аминогруппы. По взаимному расположению функциональных групп различают a-,b-, g- и т.д. аминокислоты. Аминокислоты, содержащие аминогруппу на конце цепи, называют w-аминокислотами.
Методы получения.
1) Аммонолиз галогензамещенных кислот.
2) Метод используется для синтеза a-аминокислот из доступных a-галогензамещенных кислот.
3) Метод Штеккера- Зелинского.
Включает стадии образования аминонитрила
при взаимодействии альдегида с HCN и NH3 c последующим гидролизом его в аминокислоту. В качестве
реагента применяют смесь NaCN и NH4Cl.
Метод применим для синтеза только a-аминокислот.
4) Алкилирование N-фталимидмалонового эфира.
5) Присоединение аммиака к a,b-непредельным карбоновым кислотам.
Метод применим для синтеза b-аминокислот.
6) Из оксимов циклических кетонов перегруппировкой Бекмана.
Метод используется для синтеза w-аминокислот.
Химические свойства.
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того, проявляют специфические свойства, которые определяются наличием двух функциональных групп и их взаимным расположением.
Кислотно-основные свойства.
Аминокислоты содержат кислотный и основный центры и
являются амфотерными соединениями. В кристаллическом
состоянии они существуют в виде внутренних солей (биполярных ионов), которые
образуются в результате внутримолекулярного переноса протона от более слабого
основного центра (СОО—) к более сильному
основному центру (NH2).
Ионное строение аминокислот подтверждается их физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Форма существования аминокислот в водных растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.
При некотором значении рН,
строго определенном для каждой аминокислоты, она существует преимущественно в
виде биполярного иона. Это значение рН называют изоэлектрической точкой (рI). В изоэлектрической точке аминокислота не имеет заряда
и обладает наименьшей растворимостью в воде. Катионная форма аминокислоты
содержит два кислотных центра (COOH и NH3+) и характеризуется двумя константами диссоциации рКа1 и рКа2. Значение рI определяется по уравнению:
Значение рI определяется по уравнению:
Реакции по аминогруппе.
Дезаминирование.
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную.
RCH(NH2)COOH + HNO2® RCH(OH)COOH + N2 + H2O
Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и арилирование.
При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в активированном ароматическом кольце.
Реакция используется для установления аминокислотной
последовательности в пептидах.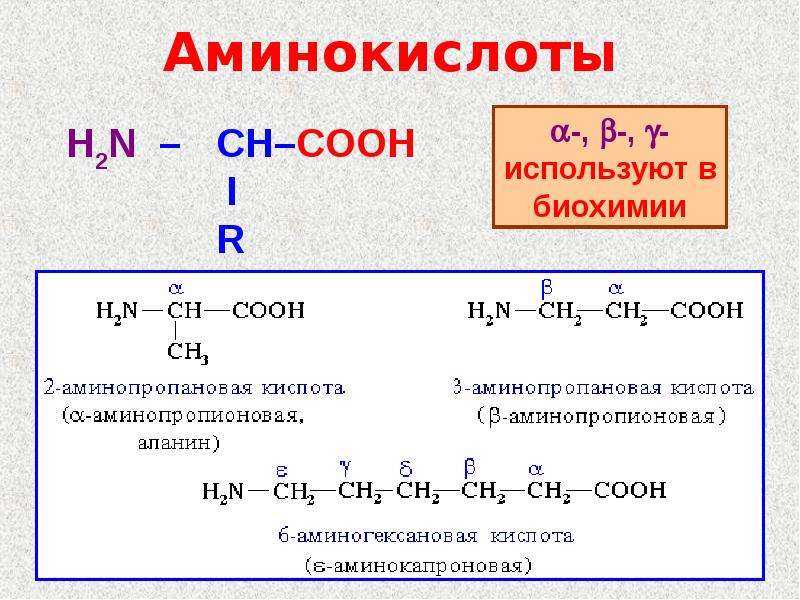
Ацилирование.
Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы в синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно, гидролизуются в жестких условиях. При разработке методов синтеза пептидов были найдены защитные группы, которые легко удаляются путем гидролиза или гидрогенолиза.
Карбобензоксизащита:
трет-Бутоксикарбонильная защита (БОК-защита).
Легкость снятия защиты обусловлена устойчивостью бензил- и трет-бутил-катионов, которые образуются в качестве интермедиатов.
2.3. Реакции по карбоксильной группе
Декарбоксилирование.
При сухой перегонке в присутствии гидроксида бария аминокислоты декарбоксилируются с образованием аминов.
RCH(NH2)COOH RCH2NH2 + CO2
Этерификация.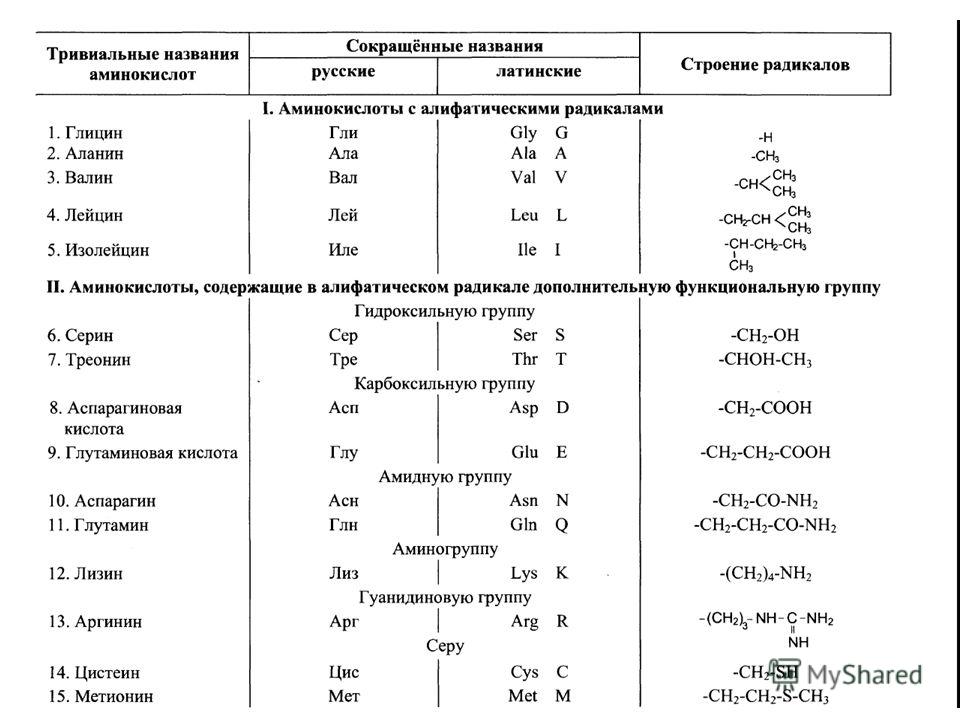
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения и могут быть разделены путем перегонки или газожидкостной хроматографии, что используется для анализа и разделения смесей аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и ангидридов.
При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной группы при нуклеофильном замещении. Чаще для этой цели получают смешанные ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в синтезе пептидов.
Специфические реакции аминокислот.
Реакции с одновременным участием карбоксильной и аминогрупп идут, как правило, с образованием продуктов, содержащих термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
Комплексообразование.
a-Аминокислоты образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr и др.).
Отношение аминокислот к нагреванию.
Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов
a-Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины.
b-Аминокислоты при нагревании переходят a,b-непредельные кислоты.
RCH(NH2)CH2COOH RCH=CHCOOH
g- и d-Аминокислот
претерпевают внутримолекулярное ацилирование с образованием
циклических амидов – лактамов.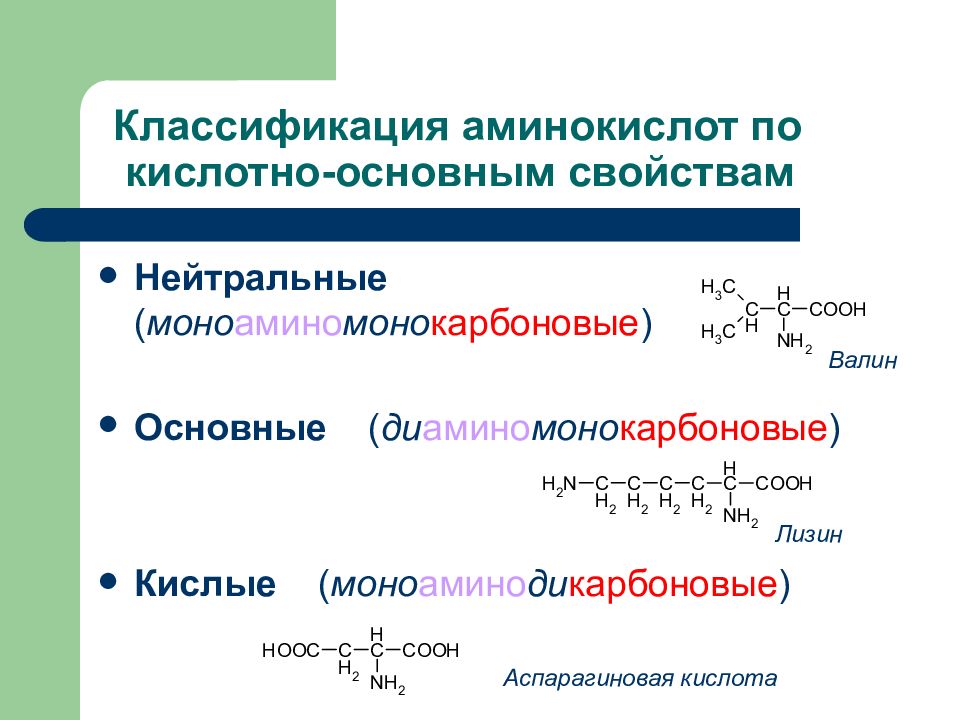
Нингидриновая реакция.
При взаимодействии a-аминокислот с трикетоном – нингидрином происходит одновременное окислительное дезаминирование и декарбоксилирование с образованием альдегида и окрашенного продукта конденсации.
Реакция используется для количественного анализа аминокислот методом фотометрии.
a-Аминокислоты, входящие в состав белков.
Строение и классификация.
Природные аминокислоты отвечают общей формуле RCH(NH2)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (см. таблицу).
Таблица. Важнейшие a—аминокислоты RCH(NH2)COOH
|
Формула |
Название |
Обозначение |
pI |
|
|
Аминокислоты, содержащие неполярный радикал R |
||||
|
Глицин |
Gly |
5,97 |
||
|
Аланин |
Ala |
6,0 |
||
|
Валин |
Val |
5,96 |
||
|
Лейцин |
Leu |
5,98 |
||
|
Изолейцин |
Ile |
6,02 |
||
|
Фенилаланин |
Phe |
5,48 |
||
|
Триптофан |
Trp |
5,89 |
||
|
Пролин |
Pro |
6,30 |
||
|
Метионин |
Met |
5,74 |
||
|
Цистин |
(Cys)2 |
5,0 |
||
|
Аминокислоты, содержащие полярный неионогенный радикал R |
||||
|
Серин |
Ser |
5,68 |
||
|
Треонин |
Thr |
5,60 |
||
|
Гидроксипролин |
Hyp |
5,8 |
||
|
Аспаргин |
Asn |
5,41 |
||
|
Глутамин |
Gln |
5,65 |
||
|
Аминокислоты, содержащие полярный положительно заряженный радикал R |
||||
|
Лизин |
Lys |
9,74 |
||
|
5-Гидроксилизин |
|
9,15 |
||
|
Аргинин |
Arg |
10,76 |
||
|
Гистидин |
His |
7,59 |
||
|
Аминокислоты, содержащие полярный отрицательно заряженный радикал R |
||||
|
Аспаргиновая кислота |
Asp |
2,77 |
||
|
Глутаминовая кислота |
Gly |
3,22 |
||
|
Тирозин |
Tyr |
5,66 |
||
|
Цистеин |
Cys |
5,07 |
||
Аминокислоты,
содержащие неполярный радикал R. Такие группы располагаются внутри
молекулы белка и обуславливают гидрофобные взаимодействия.
Такие группы располагаются внутри
молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно заряженных групп. Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.
В белках ионогенные группы
этих аминокислот располагаются, как правило, на поверхности молекулы и
обуславливают электростатические взаимодействия.
Стереоизомерия.
Все природные a-аминокислоты (кроме глицина) являются хиральными соединениями. По конфигурации хирального центра в положении 2 аминокислоты относят D- или L-ряду
Природные аминокислоты относятся к L-ряду.
Большинство аминокислот содержат один хиральный центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют (кроме цистина) 4 стереоизомера, из которых только один встречается в составе белков.
Так, из 4-х стереоизомеров треонина в природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только одного вида стереоизомеров имеет важное значение для формирования их пространственной структуры и обеспечения биологической активности.
a-Аминокислоты, полученные синтетическим путем,
представляют рацемические смеси, которые необходимо разделять. Наиболее
предпочтительным является ферментативный способ разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные производные только L-a-аминокислот. Ферментативное расщепление проводят по следующей схеме.
Наиболее
предпочтительным является ферментативный способ разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные производные только L-a-аминокислот. Ферментативное расщепление проводят по следующей схеме.
Сначала рацемическую аминокислоту ацилируют уксусным ангидридом:
N-ацетил-L-аминокислота
D,L-аминокислота + N-ацетил-D-аминокислота
Затем рацемическую смесь ацетильных производных подвергают ферментативной обработке. При этом гидролизуется ацетильное производное только L-аминокислоты:
|
N-ацетил-L-аминокислота |
|
L-аминокислота |
|
+ |
+ |
|
|
N-ацетил-D-аминокислота |
|
N-ацетил-D-аминокислота |
Полученная после ферментативного
смесь легко разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в щелочах,
а ацилированная — только в щелочах.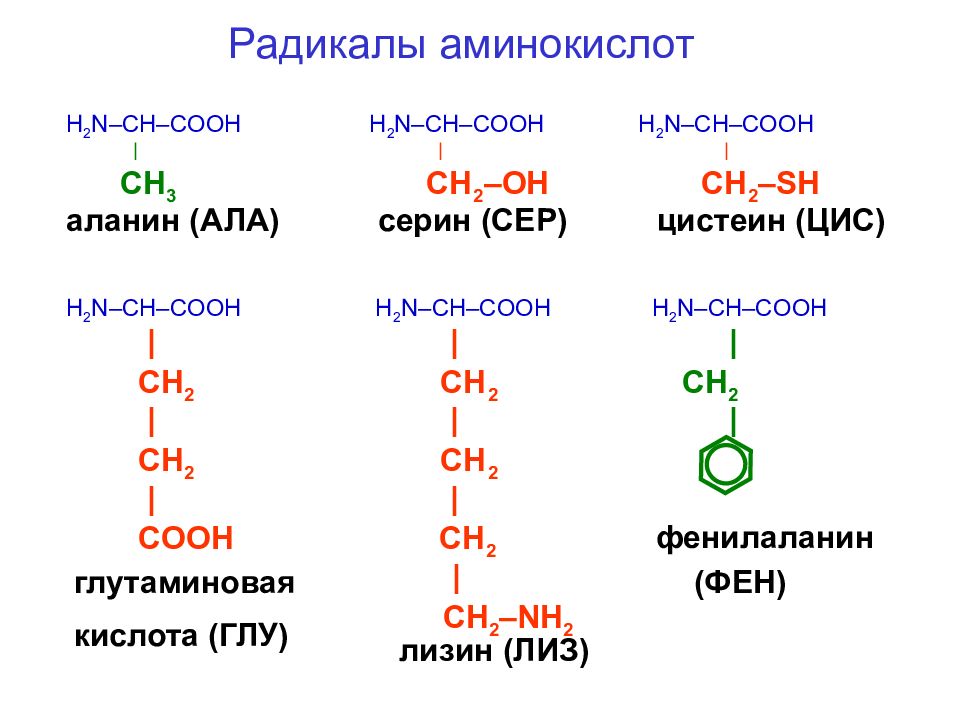
Кислотно-основные свойства.
По кислотно-основным свойствам аминокислоты разделяют на три группы.
Нейтральные аминокислоты не содержат в радикале R дополнительных кислотных или основных центров, способных к ионизации в водной среде. В кислой среде они существуют в виде однозарядного катиона и являются двухосновными кислотами по Бренстеду. Как видно на примере аланина, изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале 5,5 – 6,3.
pI=1/2(2,34+9,69)=6,01
Основные аминокислоты содержат в радикале R дополнительный основный центр. К ним относятся лизин, гистидин и аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере лизина, лежит в области рН выше 7.
pI= ½(9,0+10,05)=9,74
Кислые
аминокислоты содержат в радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и глутаминовая кислоты.
В кислой среде они существуют в виде катиона и являются трехосновными
кислотами. Изоэлектрическая точка этих аминокислот лежит в области рН много ниже 7.
К ним относятся аспаргиновая и глутаминовая кислоты.
В кислой среде они существуют в виде катиона и являются трехосновными
кислотами. Изоэлектрическая точка этих аминокислот лежит в области рН много ниже 7.
pI= ½(2,09+3,86)=2,77
Тирозин и цистеин содержат в боковых радикалах слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при физиологическом значении рН (~7) ни одна аминокислота не находится в изоэлектрической точке. В организме все аминокислоты ионизированы, что обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах используется
для разделения аминокислот методом электрофореза и ионообменной хроматографии.
При данном значении рН разные аминокислоты могут
иметь разный по величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду,
а аланин находится в изоэлектрической точке и не
перемещается в электрическом поле. Таким образом при рН6
они могут быть разделены с помощью электрофореза.
Таким образом при рН6
они могут быть разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной хроматографии используют катионообменные смолы (сульфированный полистирол). Процесс ведут в кислой среде, когда аминокислоты находятся катионной форме.
Скорость продвижения аминокислот по хроматографической колонке зависит от силы их
электростатических и гидрофобных взаимодействий со смолой. Наиболее прочно
связываются со смолой основные аминокислоты, имеющие наибольший положительный
заряд, наименее прочно – кислые аминокислоты. Наибольшим гидрофобным
связыванием со смолой обладают аминокислоты с неполярными боковыми радикалами,
особенно ароматическими. Таким образом, порядок элюирования аминокислот
следующий. Легче других элюируются кислые
аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные
неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются аминокислоты с
неполярными боковыми радикалами (Phe, Trp, Ile и др. ) и в последнюю
очередь элюируются основные аминокислоты (His, Lys, Arg).
) и в последнюю
очередь элюируются основные аминокислоты (His, Lys, Arg).
Пептиды.
Петиды – это полиамиды, построенные из a-аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
Строение пептидов.
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.
Аминокислотные остатки в пептиде связаны амидными (пептидными) связями. Один конец цепи, на
котором находится аминокислота со свободной аминогруппой, называют N-концом.
Другой конец, на котором находится аминокислота со свободной карбоксильной группой,
называют С-концом. Пептиды принято
записывать и называть, начиная с N-конца.
Пептиды принято
записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс «ин» заменяют на суффикс «ил». Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот.
Пептид характеризуется аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает
несколько пептидов.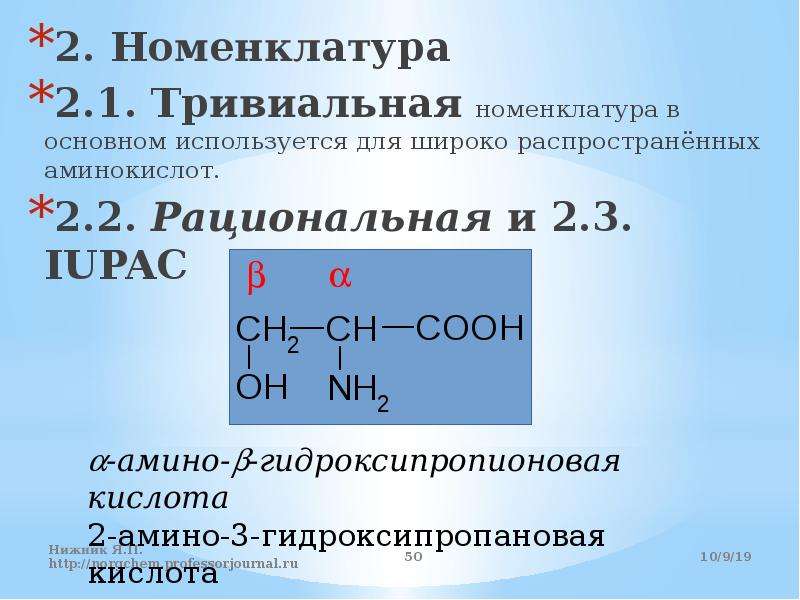 Так, из 2-х разных аминокислот может быть построено 2
дипептида, из трех разных аминокислот – 6 трипептидов,
из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие
6 трипептидов.
Так, из 2-х разных аминокислот может быть построено 2
дипептида, из трех разных аминокислот – 6 трипептидов,
из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие
6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность.
Определение аминокислотной последовательности.
Для определения аминокислотной последовательности используют комбинацию двух методов: определение концевых аминокислот и частичный гидролиз.
Определение N-концевых аминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ),
а затем полностью гидролизуют. Из гидролизата
выделяют и идентифицируют ДНФ-производное N-концевой аминокислоты.
Метод Эдмана состоит во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи «меченой» концевой аминокислоты в виде фенилгидантоинового (ФТГ) производного.
Преимущество этого метода состоит в том, что при отщеплении N-концевой аминокислоты пептид не разрушается и операцию по отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе – секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления, идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной хроматографии.
Частичный гидролиз полипептидов.
При частичном гидролизе пептиды расщепляются с
образованием более коротких цепей. Частичный гидролиз проводят с помощью
ферментов, которые гидролизуют пептидные связи
избирательно, например, только с N-конца (аминопептидазы)
или только с С-конца (карбоксипептидазы).
Существуют ферменты, расщепляющие пептидные связи только между определенными аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные фрагменты, которые перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного пептида. Рассмотрим простейший пример установления структуры трипептида. Частичный гидролиз по двум разным направлениям трипептида неизвестного строения дает продукты представленные на схеме.
Единственный трипептид, структура которого не противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная задача, которая требует комбинации различных методов.
Синтез петидов.
Синтез пептида с заданной аминокислотной
последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза
дипептида из 2-х разных аминокислот возможно образование 4-х разных продуктов.
В простейшем случае синтеза
дипептида из 2-х разных аминокислот возможно образование 4-х разных продуктов.
В настоящее время разработана стратегия синтеза пептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтеза дипептида включает следующие стадии:
1) защита аминогруппы N-концевой аминокислоты;
2) активация карбоксильной группы N-концевой аминокислоты;
3) конденсация модифицированных аминокислот
4) снятие защитных групп
Таким образом, последовательно присоединяя аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень длителен, трудоемок и дает низкий выход конечного продукта. Основные потери связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее время твердофазный синтез пептидов. На первой
стадии защищенная по аминогруппе С-концевая
аминокислота закрепляется на твердом полимерном носителе (полистироле, модифицированном
введением групп –CH2Cl). После снятия защиты проводят ацилирование
аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая
содержит активированную карбоксильную и защищенную аминогруппу. После снятия
защиты проводят следующую стадию ацилирования. Отмывание
продукта от примесей проводят прямо на носителе и лишь после окончания синтеза
полипептид снимают с носителя действием бромистоводородной
кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов –
автоматических синтезаторов.
На первой
стадии защищенная по аминогруппе С-концевая
аминокислота закрепляется на твердом полимерном носителе (полистироле, модифицированном
введением групп –CH2Cl). После снятия защиты проводят ацилирование
аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая
содержит активированную карбоксильную и защищенную аминогруппу. После снятия
защиты проводят следующую стадию ацилирования. Отмывание
продукта от примесей проводят прямо на носителе и лишь после окончания синтеза
полипептид снимают с носителя действием бромистоводородной
кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов –
автоматических синтезаторов.
Методом твердофазного синтеза получено большое количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных остатка).
Аминокислоты по правилу C-421
Аминокислоты по правилу C-421Используйте возможности именования IUPAC на вашем рабочем столе!
ACD / Name (версия для химиков) предлагает стандартизированный набор функций для быстрого и простого создания имен IUPAC и структур на основе имен. Это усовершенствованная версия нашего популярного программного обеспечения ACD / Name.
Это усовершенствованная версия нашего популярного программного обеспечения ACD / Name.
Посмотрите полное описание и цены в нашем интернет-магазине.
Карбоновые кислоты и их производные
Аминокислоты Правило C-421
421.1 — В таблице VIII приведены примеры тривиальных имен для -amino карбоновые кислоты. Название радикала, полученного удалением гидроксила из карбоксильной группы, происходит от тривиального названия аминокислоты путем замены окончания «-ine» на «-yl».
421.2 — Также рекомендуются следующие имена, радикальные имена являются исключениями из предыдущего правила:
| Цистеин | Цистинил | |
| Гомоцистеин | Гомоцистенил | |
| Триптофан | Триптофил |
 (c) The
производные одновалентные ацильные радикалы называются аспартилом и глутамилом, в то время как соответствующие двухвалентные ацильные радикалы называются аспартоилом и глутамоилом (сравните Правило C-403.1 и
С-405.2). (d) Моноамиды этих кислот, в которых карбоксильная группа с номером I не повреждена, называются соответственно аспарагином и глутамином, а одновалентные ацильные радикалы соответствуют
к этим одноосновным кислотам относятся аспарагинил и глутаминил (см. Таблицу IX).
(c) The
производные одновалентные ацильные радикалы называются аспартилом и глутамилом, в то время как соответствующие двухвалентные ацильные радикалы называются аспартоилом и глутамоилом (сравните Правило C-403.1 и
С-405.2). (d) Моноамиды этих кислот, в которых карбоксильная группа с номером I не повреждена, называются соответственно аспарагином и глутамином, а одновалентные ацильные радикалы соответствуют
к этим одноосновным кислотам относятся аспарагинил и глутаминил (см. Таблицу IX).421,4 — Также сохранены следующие тривиальные имена:
См. Рекомендации’93 R-5.7.1
- Далее:
- Аминовые кислоты Правило C-431
Правило пероксикислот C-441
Правило об имидной, гидразоновой и гидроксамовой кислотах C-451
Соли и сложные эфиры Правило C-461, Правило C-462, Правило C-463, Правило C-464
Лактоны, лактиды, лактамы и лактимы Правило C-471, Правило C-472, Правило C-473, Правило C-474, Правило C-475
Правило ацилгалогенидов C-481
Правило ангидридов кислот C-491
Это HTML-воспроизведение разделов A, B и C «Синей книги» ИЮПАК максимально приближено к опубликованная версия [см.
 Номенклатуру органической химии , разделы A, B, C, D, E, F и H , Pergamon Press, Oxford, 1979.Copyright 1979 IUPAC.] Если вам нужно процитировать эти правила, пожалуйста, процитируйте эту ссылку как их источник.
Номенклатуру органической химии , разделы A, B, C, D, E, F и H , Pergamon Press, Oxford, 1979.Copyright 1979 IUPAC.] Если вам нужно процитировать эти правила, пожалуйста, процитируйте эту ссылку как их источник.Опубликовано с разрешения IUPAC компанией Advanced Chemistry Development, Inc. , www.acdlabs.com, +1(416)368-3435 тел, +1(416)368-5596 факс. Для комментариев или предложений обращайтесь по адресу [email protected]
Понимание названий органических соединений
Сложные эфиры
Сложные эфиры являются одним из ряда соединений, известных под общим названием производные кислоты .В них кислотная группа каким-то образом модифицирована. В сложном эфире водород в группе -COOH заменен алкильной группой (или, возможно, какой-либо более сложной углеводородной группой).
Пример 1: Напишите структурную формулу для метилпропаноата .
Название сложного эфира состоит из двух частей — части, которая происходит от кислоты (пропаноат), и части, обозначающей алкильную группу (метил).
Для начала подумайте о пропановой кислоте — трехуглеродной кислоте без двойных углерод-углеродных связей.
Водород в группе -COOH заменен алкильной группой, в данном случае метильной группой.
Имена сложного эфира сбивают с толку, потому что имя написано в обратном направлении от того, как нарисована структура. Этого не избежать — нужно просто привыкнуть!
В сокращенной версии эта формула будет записана как CH 3 CH 2 COOCH 3 .
Пример 2: Напишите структурную формулу для этилэтаноата .
Это, вероятно, наиболее часто используемый пример сложного эфира. Он основан на этановой кислоте (следовательно, этаноат) — 2-угольной кислоте. Водород в группе -COOH заменен этильной группой.
Убедитесь, что этильная группа нарисована правильно. Довольно частая ошибка — попытка присоединить группу CH 3 к кислороду. Если вы посчитаете связи, если вы это сделаете, вы обнаружите, что и углерод CH 3 , и углерод CH 2 имеют неправильное количество связей.
Если вы посчитаете связи, если вы это сделаете, вы обнаружите, что и углерод CH 3 , и углерод CH 2 имеют неправильное количество связей.
Ацилхлориды (хлорангидриды)
Ацилхлорид — другое производное кислоты. В этом случае группа -ОН кислоты заменяется на -Cl. Все ацилхлориды содержат группу -COCl:
Пример: Напишите структурную формулу для этаноилхлорида .
Ацилхлориды обозначены окончанием Оилхлорид . Итак, этаноилхлорид основан на 2-углеродной цепи без двойных углерод-углеродных связей и группе -COCl.Углерод в этой группе считается частью цепи. В более длинной цепи с присоединенными боковыми группами углерод -COCl занимает позицию номер 1.
Ангидриды кислот
Еще одно производное кислоты! Ангидрид кислоты — это то, что вы получаете, если обезвоживаете кислоту, то есть удаляете из нее воду.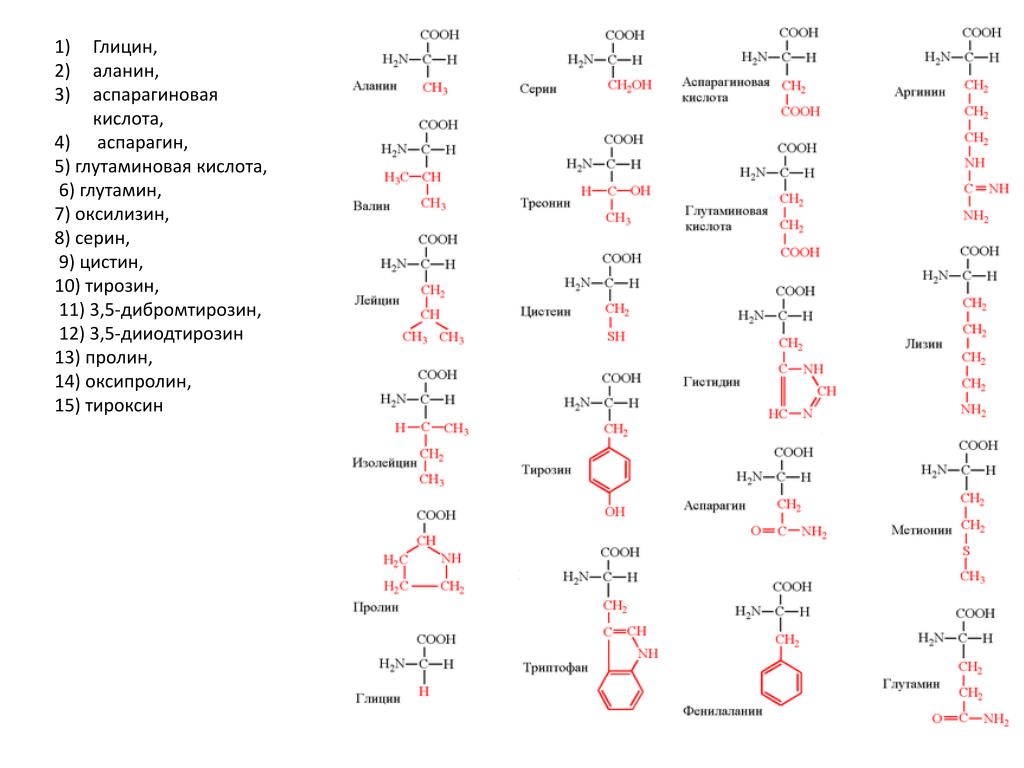
Пример: Напишите структурную формулу для пропанового ангидрида .
Их проще всего решить, записав на клочке бумаги следующим образом:
Нарисуйте две молекулы кислоты, расположенные так, чтобы группы -ОН располагались рядом друг с другом.Выделите молекулу воды, а затем присоедините то, что осталось. В этом случае, поскольку вам нужен пропановый ангидрид, вы рисуете две молекулы пропановой кислоты.
Амиды
Еще одно производное кислоты! Амиды содержат группу -CONH 2 , где -ОН кислоты заменен на -NH 2 .
Пример: Напишите структурную формулу для пропанамида .
Это основано на трехуглеродной цепи без двойных углерод-углеродных связей.В конце цепочки находится группа -CONH 2 . Углерод в этой группе считается частью цепи.
Нитрилы
Нитрилы содержат группу -CN и раньше назывались цианидами.
Пример 1: Напишите структурную формулу для этаннитрила .
Название показывает двухуглеродную цепь без двойной углерод-углеродной связи. нитрил показывает группу -CN в конце цепи.Как и в предыдущих примерах с кислотами и производными кислот, не забывайте, что углерод в группе -CN считается частью цепи.
Старое название для этого — метилцианид . Вы можете подумать, что это проще, но как только цепочка усложняется, она не работает — как показывает следующий пример.
Пример 2: Напишите структурную формулу для 2-гидроксипропаннитрила .
Здесь у нас есть трехуглеродная цепь, без двойных углерод-углеродных двойных связей и группа -CN на конце цепи.Углерод в группе -CN считается углеродом номер 1. На атоме углерода номер 2 находится группа -ОН ( гидрокси ). Обратите внимание, что вы не можете использовать окончание ol , потому что у вас уже есть окончание nitrile .
Первичные амины
Первичный амин содержит группу -NH 2 , присоединенную к углеводородной цепи или кольцу. Вы можете рассматривать амины в целом как производные аммиака, NH 3 .В первичном амине один из атомов водорода заменен углеводородной группой.
Пример 1: Напишите структурную формулу для этиламина .
В этом случае этильная группа присоединена к группе -NH 2 .
Это имя (этиламин) подходит, если у вас есть только короткая цепочка, в которой нет никакой двусмысленности в том, где находится группа -NH 2 . Но предположим, что у вас есть трехуглеродная цепь — в этом случае группа -NH 2 может быть на конце или на среднем углероде.Как решить эту проблему, показано в следующем примере.
Пример 2: Напишите структурную формулу для 2-аминопропана .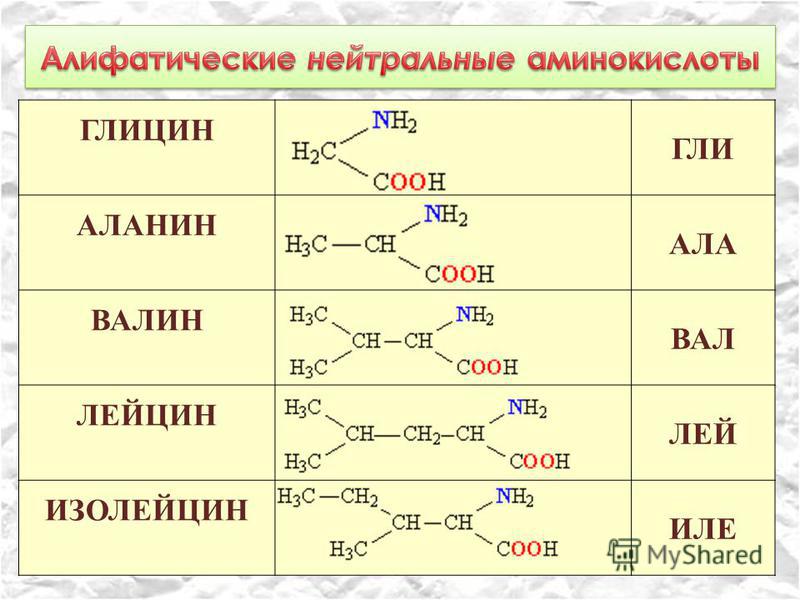
Название показывает трехуглеродную цепь с аминогруппой, присоединенной ко второму атому углерода. амино показывает группу -NH 2 .
Этиламин (пример 1 выше) с таким же успехом можно было бы назвать аминоэтаном.
Вторичные и третичные амины
Вероятно, вы встретите только простые примеры.Во вторичном амине два атома водорода в молекуле аммиака заменены углеводородными группами. В третичном амине заменены все три атома водорода.
Пример 1: Напишите структурную формулу для диметиламина .
В этом случае два атома водорода в аммиаке заменены метильными группами.
Пример 2: Напишите структурную формулу для триметиламина .
Здесь все три атома водорода в аммиаке заменены метильными группами.
Аминокислоты
Аминокислота содержит как аминогруппу, -NH 2 , так и группу карбоновой кислоты, -COOH, в одной и той же молекуле. Как и у всех кислот, углеродная цепь пронумерована так, что углерод в группе -COOH считается числом 1.
Как и у всех кислот, углеродная цепь пронумерована так, что углерод в группе -COOH считается числом 1.
Пример: Напишите структурную формулу 2-аминопропановой кислоты .
Имеет трехуглеродную цепь без двойных углерод-углеродных связей. На втором углероде (считая углерод -COOH как номер 1) есть аминогруппа, -NH 2 .
Протеиногенные аминокислоты
Протеиногенные аминокислотыПротеиногенные аминокислоты
Все 20 протеиногенных аминокислот
имеют общую структуру ниже
Группы R и названия для каждой аминокислоты перечислены в таблице.
Имя и | Р | pKa1 | pKa2 | пКа | Изоэлектрический |
Аланин | 2. | 9,69 | х | 6.01 | |
Аспарагин | 2,02 | 8,80 | х | 5,41 | |
Цистеин | 1.96 | 10,28 | 8,08 | 5.07 | |
Глютамин | 2,17 | 9,13 | х | 5.65 | |
Глицин | 2,34 | 9,60 | х | 5,97 | |
Изолейцин | 2. | 9,60 | х | 6,02 | |
Лейцин | 2,36 | 9,60 | х | 5,98 | |
Метионин | 2.28 | 9,21 | х | 5,74 | |
Фенилаланин | 1,83 | 9,13 | х | 5,48 | |
Пролин | 1. | 10,60 | х | 6,30 | |
Серин | 2,21 | 9,15 | х | 5,68 | |
Треонин | 2.09 | 9,10 | х | 5.60 | |
Триптофан | 2,83 | 9,39 | х | 5,89 | |
Тирозин | 2. | 9,11 | 10.07 | 5,66 | |
Валин | 2,32 | 9,62 | х | 5.96 |
R | pKa1 | pKa2 | пКа | Изоэлектрический | |
Аспарагиновая кислота | 1. | 9,60 | 3,65 | 2,77 | |
Глутаминовая кислота | 2,19 | 9,67 | 4.25 | 3,22 |
Название и | R | pKa1 | pKa2 | пКа | Изоэлектрический |
Аргинин | 2. | 9,04 | 12,48 | 10,76 | |
1,82 | 9,17 | 6,00 | 7.59 | ||
2,18 | 8,95 | 10,53 | 9,74 |
Идентификация аминокислот — биохимия
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает
или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту.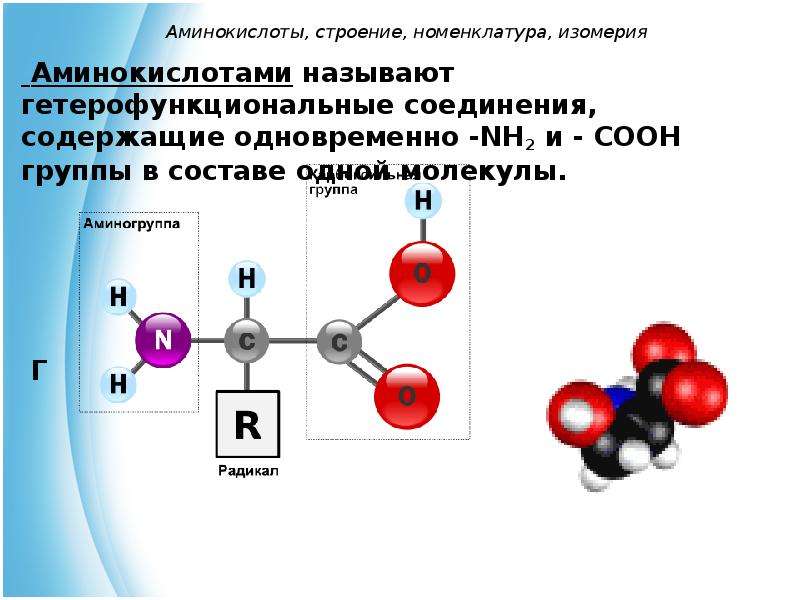 Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в качестве ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т.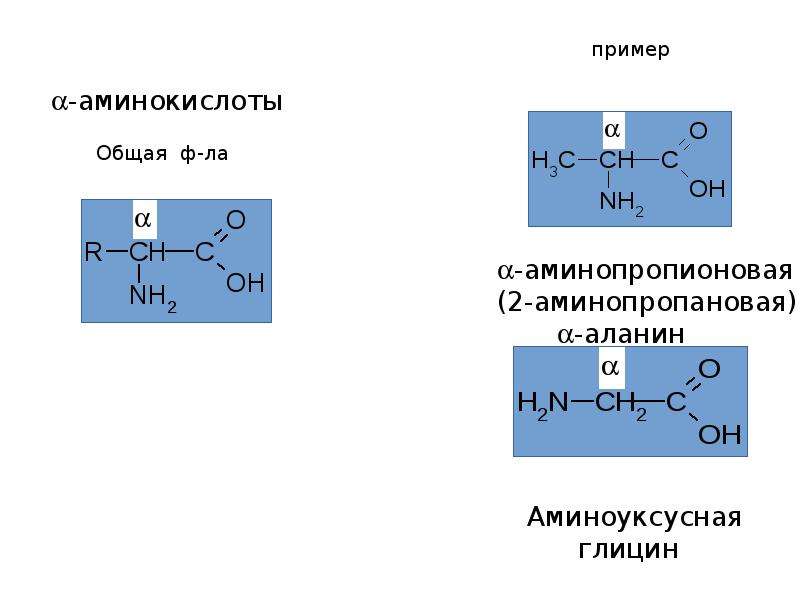 д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Свойства аминокислот
18.1 Свойства аминокислот
Цель обучения
- Распознавайте аминокислоты и классифицируйте их на основе характеристик их боковых цепей.

Белки всех живых организмов, от бактерий до людей, состоят из одного и того же набора из 20 аминокислот — молекулы, которая содержит аминогруппу и карбоксильную группу, так называемые, потому что каждая из них содержит аминогруппу, присоединенную к карбоновой кислоте. (Для получения дополнительной информации об аминогруппах см. Главу 15 «Органические кислоты и основания и некоторые из их производных», раздел 15.1 «Функциональные группы карбоновых кислот и их производных».) Аминокислоты в белках представляют собой α-аминокислоты, которые означает, что аминогруппа присоединена к α-углероду карбоновой кислоты.(Для получения дополнительной информации об α-углероде см. Главу 15 «Органические кислоты и основания и некоторые из их производных», раздел 15.2 «Карбоновые кислоты: структура и названия».) Люди могут синтезировать только около половины необходимых аминокислот; оставшаяся часть должна быть получена с пищей и известна как незаменимые аминокислоты. Аминокислота, которая должна быть получена с пищей, потому что она не может быть синтезирована организмом в достаточных количествах.
Примечание
Еще две аминокислоты были обнаружены в белках в ограниченных количествах.Селеноцистеин был открыт в 1986 году, а пирролизин — в 2002 году.
Аминокислоты представляют собой бесцветные нелетучие кристаллические твердые вещества, плавящиеся и разлагающиеся при температуре выше 200 ° C. Эти температуры плавления больше похожи на температуры неорганических солей, чем у аминов или органических кислот, и указывают на то, что структуры аминокислот в твердом состоянии и в нейтральном растворе лучше всего представлены как имеющие как отрицательно заряженную группу, так и положительно заряженную группу.Такой вид известен как цвиттерион — электрически нейтральное соединение, которое содержит как отрицательно, так и положительно заряженные группы.
Классификация
Помимо амино и карбоксильных групп, аминокислоты имеют боковую цепь или группу R, присоединенную к α-углероду. Каждая аминокислота имеет уникальные характеристики, обусловленные размером, формой, растворимостью и ионизационными свойствами ее группы R.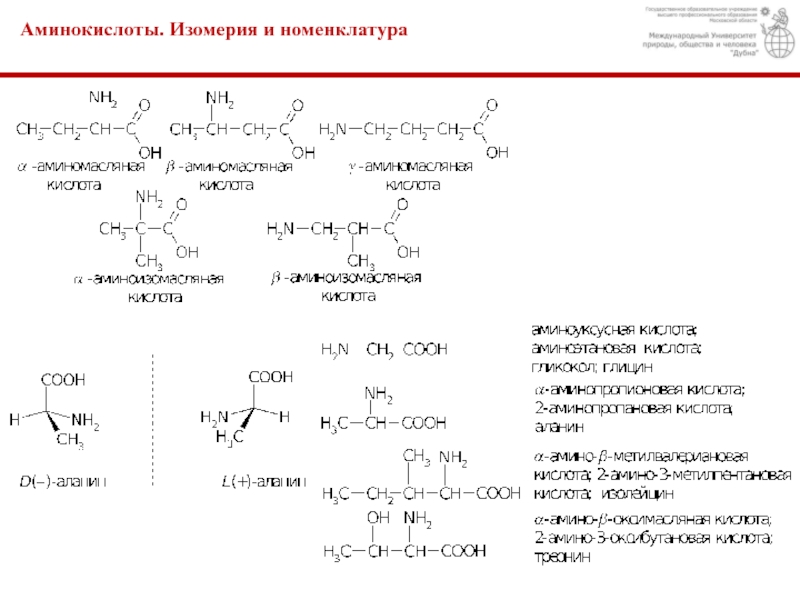 В результате боковые цепи аминокислот оказывают сильное влияние на структуру и биологическую активность белков.Хотя аминокислоты можно классифицировать по-разному, один общий подход состоит в том, чтобы классифицировать их в зависимости от того, является ли функциональная группа боковой цепи при нейтральном pH неполярной, полярной, но незаряженной, отрицательно заряженной или положительно заряженной. Структура и названия 20 аминокислот, их одно- и трехбуквенные сокращения, а также некоторые их отличительные особенности приведены в Таблице 18.2 «Общие аминокислоты, обнаруженные в белках».
В результате боковые цепи аминокислот оказывают сильное влияние на структуру и биологическую активность белков.Хотя аминокислоты можно классифицировать по-разному, один общий подход состоит в том, чтобы классифицировать их в зависимости от того, является ли функциональная группа боковой цепи при нейтральном pH неполярной, полярной, но незаряженной, отрицательно заряженной или положительно заряженной. Структура и названия 20 аминокислот, их одно- и трехбуквенные сокращения, а также некоторые их отличительные особенности приведены в Таблице 18.2 «Общие аминокислоты, обнаруженные в белках».
Таблица 18.2 Общие аминокислоты, обнаруженные в белках
Первой выделенной аминокислотой в 1806 году был аспарагин.Он был получен из белка, содержащегося в соке спаржи (отсюда и название). Глицин, основная аминокислота, содержащаяся в желатине, был назван из-за его сладкого вкуса (по-гречески glykys , что означает «сладкий»). В некоторых случаях аминокислота, содержащаяся в белке, на самом деле является производным одной из 20 обычных аминокислот (одним из таких производных является гидроксипролин). Модификация происходит после того, как аминокислота была собрана в белок.
Модификация происходит после того, как аминокислота была собрана в белок.
Конфигурация
Примечание в таблице 18.2 «Общие аминокислоты, обнаруженные в белках», глицин является единственной аминокислотой, у которой α-углерод , а не хиральный. Следовательно, за исключением глицина, аминокислоты теоретически могут существовать либо в D-, либо в L-энантиомерной форме и вращать плоско-поляризованный свет. Как и в случае с сахарами, химики используют глицеральдегид в качестве эталонного соединения для определения конфигурации аминокислот. (Дополнительные сведения о стереоизомерах и конфигурации см. В главе 16 «Углеводы», раздел 16.2 «Классы моносахаридов».) Его структура очень напоминает структуру аминокислоты, за исключением того, что в последней аминогруппа занимает место группы ОН на хиральном углероде сахара.
В главе 16 «Углеводы» мы узнали, что все встречающиеся в природе сахара принадлежат к D-серии. Поэтому интересно, что почти все известные растительные и животные белки полностью состоят из L-аминокислот. Однако некоторые бактерии содержат D-аминокислоты в своих клеточных стенках и несколько антибиотиков (например,g., актиномицин D и грамицидины) содержат различные количества D-лейцина, D-фенилаланина и D-валина.
Поэтому интересно, что почти все известные растительные и животные белки полностью состоят из L-аминокислот. Однако некоторые бактерии содержат D-аминокислоты в своих клеточных стенках и несколько антибиотиков (например,g., актиномицин D и грамицидины) содержат различные количества D-лейцина, D-фенилаланина и D-валина.
Упражнения по обзору концепции
Какова общая структура α-аминокислоты?
Укажите аминокислоту, которая подходит под каждое описание.
- также известен как аспартат
- почти такое же сильное основание, как гидроксид натрия
- не имеет хирального углерода
ответы
- аспарагиновая кислота
- аргинин
- глицин
Ключевые выводы
- Аминокислоты можно классифицировать на основе характеристик их отличительных боковых цепей как неполярные, полярные, но незаряженные, отрицательно заряженные или положительно заряженные.

- Аминокислоты, содержащиеся в белках, являются L-аминокислотами.
Упражнения
Напишите боковую цепь каждой аминокислоты.
- серин
- аргинин
- фенилаланин
Напишите боковую цепь каждой аминокислоты.
- аспарагиновая кислота
- метионин
- валин
Изобразите структуру каждой аминокислоты.
- аланин
- цистеин
- гистидин
Изобразите структуру каждой аминокислоты.

- треонин
- глутаминовая кислота
- лейцин
Укажите аминокислоту, боковая цепь которой содержит (n)
- амидная функциональная группа.
- ароматическое кольцо.
- карбоксильная группа.
Укажите аминокислоту, боковая цепь которой содержит (n)
- ОН группа
- разветвленная цепь
- аминогруппа
ответы
- CH 2 OH —
- аспарагин или глутамин
- фенилаланин, тирозин или триптофан
- аспарагиновая кислота или глутаминовая кислота
Найдите коды аминокислот, целые числа, сокращения, названия, и кодоны
Синтаксис
com/namespace/tmwbook/function»> aminolookup
aminolookup ( SeqAA )
aminolookup ('Code', CodeValue )
aminolookup ('Integerviation' , AbbreviationValue )
aminolookup ('Name', NameValue )
Description
aminolookup отображает таблицу аминокислот
коды, целые числа, сокращения, имена и кодоны.
Поиск аминокислот
| Код | Целое число | Сокращение | Амино Кислотное имя | Кодоны | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
A | 1 | Ala | Аланин | GCU GCC GCA GCG | ||||||
| Аргинин | CGU CGC CGA CGG AGA AGG | |||||||||
N | 3 | Asn | Аспарагин | | Аспарагин | AA25 914 914 914 914 AAC 4 | Asp | Аспарагиновая кислота (аспартат) | GAU GAC | |
C | 5 | Cys | Cysteine | |||||||
| Cysteine | ||||||||||
Q | 6 | Gln 914 53 | Глютамин | CAA CAG | ||||||
E | 7 | Glu | Глутаминовая кислота (глутамат) | GAA GAG | ||||||
Gly | Глицин | GGU GGC GGA GGG | ||||||||
H | 9 | His | Histidine | | Гистидин | 914 914 914 914 914 CAC | 10 | Ile | Изолейцин | AUU AUC AUA |
L | 11 | Leu | UUG CU UUG CU UUG CU | |||||||
К | 12 | Лиз | Лизин | AAA AAG | ||||||
M | 13 | Мет | Метионин | AUG | 924 Phe | Фенилаланин | UUU UUC | |||
P | 15 | Pro | Пролин | CCU | 16 | Ser | Serine | UCU UCC UCA UCG AGU AGC | ||
T | 17 | Thr AC | ||||||||
Вт | 18 | Trp | Триптофан | UGG | ||||||
Y | 19 | Tyr | Тирозин | 20 | Вал | Валин | GUU GUC GUA GUG | |||
B | 21 | Asx | Аспарагин или аспарагиновая кислота AAC GAU GAC | |||||||
Z | 22 | Glx | Глутамин или глутаминовая кислота (глутамат) | CAA CAG GAA GAG | Xaa | Любая аминокислота | Все кодоны | |||
* | 24 | КОНЕЦ | Кодон терминации (остановка трансляции) | UAA UAG UGA | ||||||
- | 25 | APПромежуток неизвестной длины | NA |
aminolookup ( конвертирует между
однобуквенные коды и трехбуквенные сокращения для аминокислотной последовательности. SeqAA ) 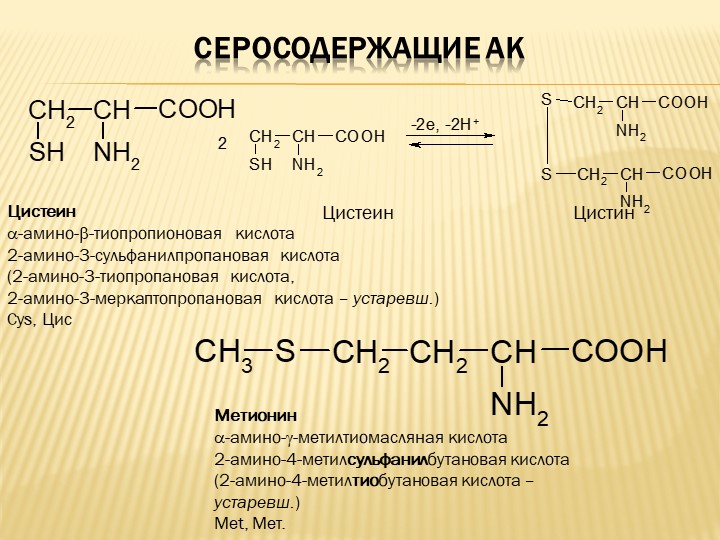 Если
ввод - это вектор символов или строка однобуквенных кодов, тогда вывод - это
вектор символов трехбуквенных сокращений. Если ввод - это вектор символов или
строка трехбуквенных сокращений, то на выходе получается вектор символов
соответствующие однобуквенные коды.
Если
ввод - это вектор символов или строка однобуквенных кодов, тогда вывод - это
вектор символов трехбуквенных сокращений. Если ввод - это вектор символов или
строка трехбуквенных сокращений, то на выходе получается вектор символов
соответствующие однобуквенные коды.
Если ввести один из неоднозначных однобуквенных кодов B , Z ,
или X , эта функция отображает соответствующий
сокращение от неоднозначного символа аминокислоты.
aminolookup ('abc')
ans =
AlaAsxCys aminolookup ('Code', отображает
соответствующие трехбуквенные аббревиатуры и название аминокислоты. CodeValue )
aminolookup ('Integer', отображает
соответствующий однобуквенный код аминокислоты, трехбуквенное сокращение,
и имя. IntegerValue )
aminolookup ('Abbreviation', отображает
соответствующий однобуквенный код и название аминокислоты. AbbreviationValue ) 

 34
34  36
36 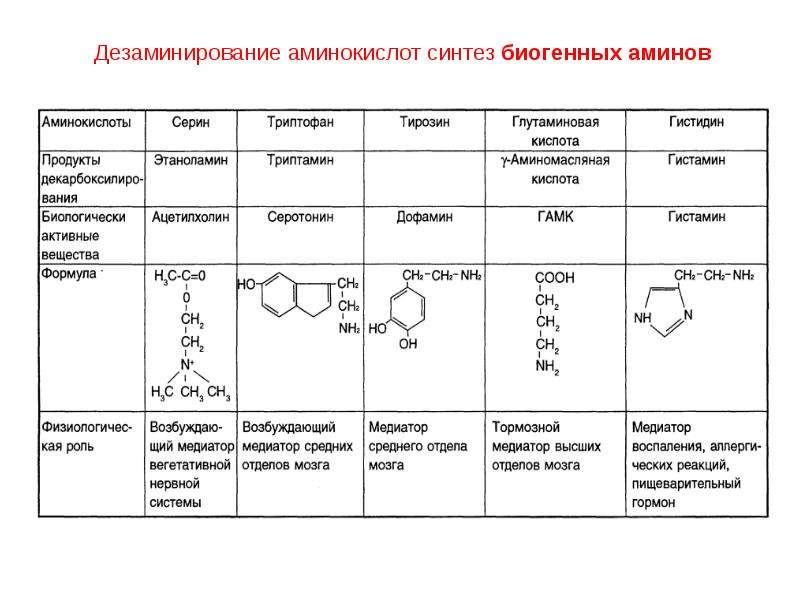 99
99  20
20  88
88 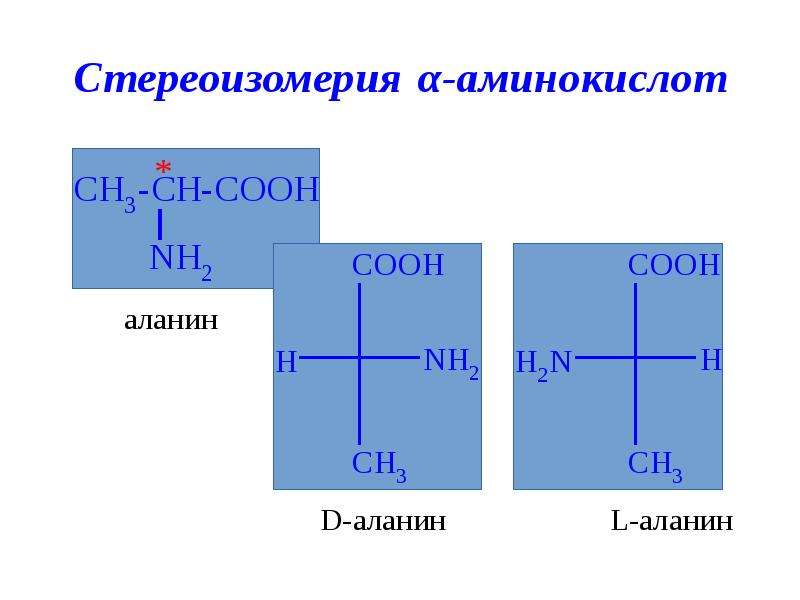 17
17 

