Растереть на аминокислоты
«Нужно обязательно употреблять белки!» — подобные рекомендации хотя бы раз в жизни слышал каждый. По идее, эти вещества мы можем спокойно получить из пищи — организм тут же займется расщеплением для дальнейшего усвоения. А что делать людям, желудочно-кишечный тракт которых не способен переработать их самостоятельно? Или любителям спорта, не успевающим «заправиться» после активных упражнений?Несбалансированное питание является важной проблемой для организма. Недостаточное или избыточное употребление белков, жиров, углеводов, микроэлементов приводит к нарушению обмена веществ и тяжелым заболеваниям: сахарному диабету, болезням сердца и сосудов. Кроме того, люди нередко испытывают значительный дефицит микронутриентов (питательных веществ) — до 80 % населения РФ, как показывают исследования Роспотребнадзора.
— Немаловажное значение в регуляции обмена веществ играют аминокислоты и олигопептиды, — рассказывает старший научный сотрудник Института химии твердого тела и механохимии СО РАН кандидат химических наук Алексей Леонидович Бычков.
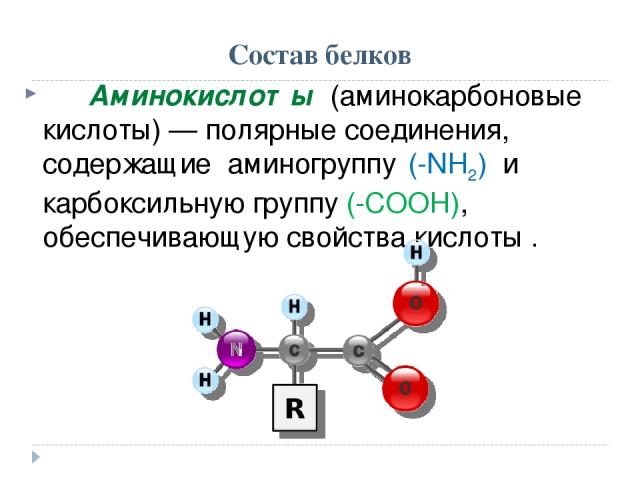
— Аминокислоты — это органические соединения, из которых состоят все белки, а олигопептиды — промежуточные соединения, где находится до 7—10 аминокислот.
Заменимые аминокислоты способны синтезироваться в организме, а вот незаменимые человек получает только из пищи, содержащей полноценные белки. Однако желудок не всегда может расщеплять их до более коротких молекул из-за ряда расстройств или после хирургического вмешательства. Для этого и разрабатывается питание с уже разделенными на части белками.
Чтобы получить востребованный продукт должного качества, нужны консультации экспертов из других областей. Ученые ИХТТМ СО РАН сотрудничают с двумя организациями: кафедрой технологии организации пищевых производств Новосибирского государственного технического университета и Институтом экспериментальной ветеринарии Сибири и Дальнего Востока Россельхозакадемии. Уже были проведены предварительные эксперименты: исследователи извлекли и расщепили белки из гороха, пищевики сделали супы-пюре и хлебцы, а в ИЭВСиДВ продукты испытали на животных (спойлер — всё прошло хорошо).
— Человек не может синтезировать все аминокислоты самостоятельно: приходится искать их в пище, — поясняет Алексей Бычков. — Есть такая научная шутка: как химику узнать, из чего состоит рояль? Нужно его растворить! Однако проблема в том, что не все вещества могут растворяться и реагировать друг с другом с нужной скоростью. В таких случаях и помогает химия твердого тела: проводя механохимическую обработку, можно добиться повышения реакционной способности материала. Здесь прежде всего необходимо не измельчение, а более тонкие процессы, меняющие структуру объекта.
При механическом воздействии с помощью специальных мельниц-активаторов в твердом теле возникает напряжение: в результате появляется трещина и происходит разрыв, деформация. Кроме того, разрушается кристаллическая структура вещества, рвутся химические связи. «Перемешав» кристаллические решетки, какую-то часть связей легче порвать.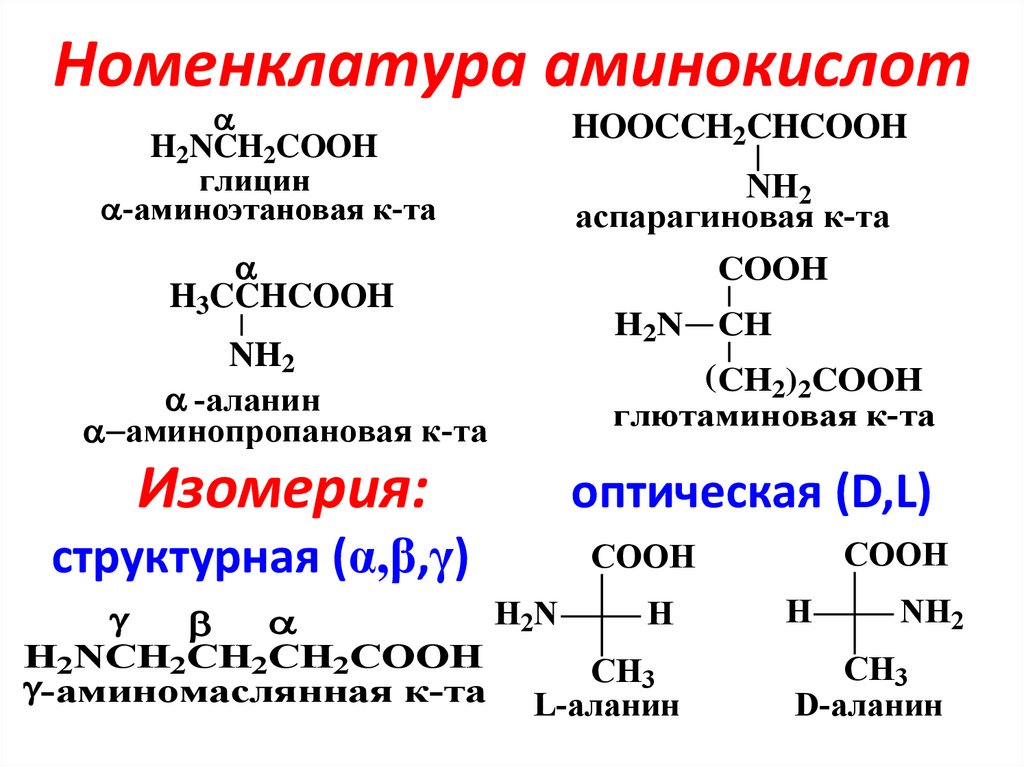 Структура аморфизуется, и ферменты относительно легко гидролизуют субстраты. Происходит химическая реакция, итог которой — образование новых соединений (в том числе необходимых аминокислот и олигопептидов).
Структура аморфизуется, и ферменты относительно легко гидролизуют субстраты. Происходит химическая реакция, итог которой — образование новых соединений (в том числе необходимых аминокислот и олигопептидов).
— Если смешать зеленый и красный пластилин и помять его, даже не измельчая, в итоге кусок станет разноцветным, — рассказывает Алексей Бычков. — То же с растительным сырьем: нам больше интересно не измельчение, а получаемая внутренняя структура: как упакованы полимеры, упорядочены они или нет, взаимодействуют они между собой. Это во многом определяет реакционную способность.
Сибирские исследователи направляют свои разработки на тех людей, у которых есть потребность в подобных продуктах по состоянию здоровья. Другой вариант — спортивное питание, ведь в России практически нет своих производств.
— Большая часть потребителей спортпита — люди, которые ходят в тренажерный зал, — добавляет ученый.
— В основном этот рынок представлен либо изолятами (белки, выделенные из сырья без расщепления), либо гидролизатами. Последние более эффективны, потому что в них молекулы расщеплены, но при этом дороже и не столь доступны обыкновенным спортсменам-энтузиастам.
На разработку ученых ИХТТМ выделен грант РНФ (в рамках президентской программы поддрежки исследований — прим. ред. сайта rscf.ru). Полученные данные позволят не только создавать компоненты продуктов функционального и лечебно-профилактического питания, но будут востребованы при решении проблем переработки других природных веществ — полимеров.
Теги
СМИ о Фонде, Новости Фонда, Президентская программа, Математика, Биология, Медицина, Химия и материалы, Науки о Земле, Гуманитарные науки, Инженерные науки, Спецпроект, Инициативные проекты
D-аминокислоты: не только в Зазеркалье
03 октября 2009
Обзор
С какой стороны зеркального стекла? В последнее время стали открывать все больше примеров функций D-аминокислот не только в бактериях, но и в эукариотах. Так что, по-видимому, представление о том, что D-аминокислоты во вселенной белков, построенных из L-аминокислот, являются аутсайдерами, постепенно отходит в прошлое.
Так что, по-видимому, представление о том, что D-аминокислоты во вселенной белков, построенных из L-аминокислот, являются аутсайдерами, постепенно отходит в прошлое.
[11] (M. Twombly)
Автор
- Антон Чугунов
Редакторы
- Антон Чугунов
- Андрей Панов
Темы
- Биомолекулы
- Структурная биология
По до сих пор неизвестным причинам в состав белков живых организмов входят преимущественно L-энантиомеры (оптические изомеры) аминокислот, — за довольно редкими и разрозненными исключениями вроде пептидных веществ, образующихся в грибах и бактериях путём нерибосомного синтеза. (Зато сахара находятся преимущественно в D-форме.) Новое исследование выводит D-аминокислоты из «зазеркалья»: обнаружено, что некоторые бактерии — в частности, холерный вибрион и сенная палочка, — синтезируют D-формы аминокислот. Они используются бактериями как связующий компонент пептидогликанового слоя, а также регулируют работу ферментов, ответственных за армирование клеточных стенок.
(Зато сахара находятся преимущественно в D-форме.) Новое исследование выводит D-аминокислоты из «зазеркалья»: обнаружено, что некоторые бактерии — в частности, холерный вибрион и сенная палочка, — синтезируют D-формы аминокислот. Они используются бактериями как связующий компонент пептидогликанового слоя, а также регулируют работу ферментов, ответственных за армирование клеточных стенок.
Верно ли, что Оспод и Погг, не ограничиваясь обычным загрязнением беззащитной, пустынной планеты, решили, по пьяному делу, учинить на ней, самым бесстыдным и возмутительным образом, биологическую эволюцию, какой еще свет не видывал? <…> Верно ли, что эти безобразники, лишенные всякого чувства приличия и нравственных тормозов, вылили на скалы безжизненной Земли шесть бочек заплесневелого желатинового клея и два ведра испорченной альбуминовой пасты, подсыпали туда забродившей рыбозы, пентозы и левуллозы и, словно им мало было всех этих гадостей, добавили три больших бидона с раствором прокисших аминокислот, а получившееся месиво взболтали угольной лопатой, скособоченной влево, и кочергой, скрученной в ту же сторону, в результате чего белки всех будущих земных существ стали ЛЕВОвращающими?!
С.Лем,
«Звездные дневники Ийона Тихого. Путешествие восьмое» (1966 г.)
 Пары таких молекул называются стереоизомерами (или оптическими изомерами, или энантиомерами), и по одной из классификаций обозначаются L- и D-аминокислотами (см. рисунок в заглавии).
Пары таких молекул называются стереоизомерами (или оптическими изомерами, или энантиомерами), и по одной из классификаций обозначаются L- и D-аминокислотами (см. рисунок в заглавии).Одной из самых интересных загадок зарождения жизни является преимущественное использование в качестве «строительных блоков» белков именно L-аминокислот, в то время как их D-аналоги долгое время считались чуть ли не биохимическим недоразумением, которым можно с чистой совестью пренебречь [2–4]. (Впрочем, определённые соображения на этот счет все же есть: см. эпиграф. — А. Ч.) Однако, время не стоит на месте: в журнале Science появилась статья, авторы которой бросают вызов этому устаревшему представлению и показывают, что D-аминокислоты играют важную роль в жизни бактерий, управляя их реакцией на различные пищевые стимулы [5].
Если вернуться к Алисе, то её сомнения насчет молока были отнюдь не беспочвенными: ведь пара «зеркальных» молекул, хотя во многих отношениях и идентична (например, молекулярная масса, углы и длины связей у них равны), может иметь разительно отличающиеся биологические характеристики. В частности, Алисе вряд ли удалось бы переварить молоко, белки которого состоят исключительно из D-аминокислот. Такое смещение «равновесия» в сторону L-аминокилот, безусловно, ставит вопрос: а играют ли D-аминокислоты какую-то роль в природе? Исследование Губерта Лэма (Hubert Lam) [5] — учёного из Гарварда и Института Ховарда Хьюза в США, — а также его коллег, показывает, что неизвестное — не значит «не существующее»: согласно их данным, D-аминокислоты управляют у бактерий таким важным процессом как «сборка» клеточной стенки.
В частности, Алисе вряд ли удалось бы переварить молоко, белки которого состоят исключительно из D-аминокислот. Такое смещение «равновесия» в сторону L-аминокилот, безусловно, ставит вопрос: а играют ли D-аминокислоты какую-то роль в природе? Исследование Губерта Лэма (Hubert Lam) [5] — учёного из Гарварда и Института Ховарда Хьюза в США, — а также его коллег, показывает, что неизвестное — не значит «не существующее»: согласно их данным, D-аминокислоты управляют у бактерий таким важным процессом как «сборка» клеточной стенки.
Клеточная стенка является, по сути, «крепостной стеной» бактериальной клетки, защищая её от разнообразных неблагоприятных факторов окружающей среды. Состоит она главным образом из пептидогликана — эластичного полимера, в котором сахара и аминокислоты «сшиваются» между собой подобно сетке и охватывают бактериальную мембрану целиком. Одна из ролей D-аминокислот здесь — образовывать поперечные пептидные сшивки между длинными углеводными тяжами пептидогликанов; эти сшивки обогащены D-аланином и D-глутаминовой кислотой, роль которых предположительно заключается в противостоянии расщеплению клеточной стенки враждебными ферментами-гидролазами, «настроенными» только на L-аминокислоты.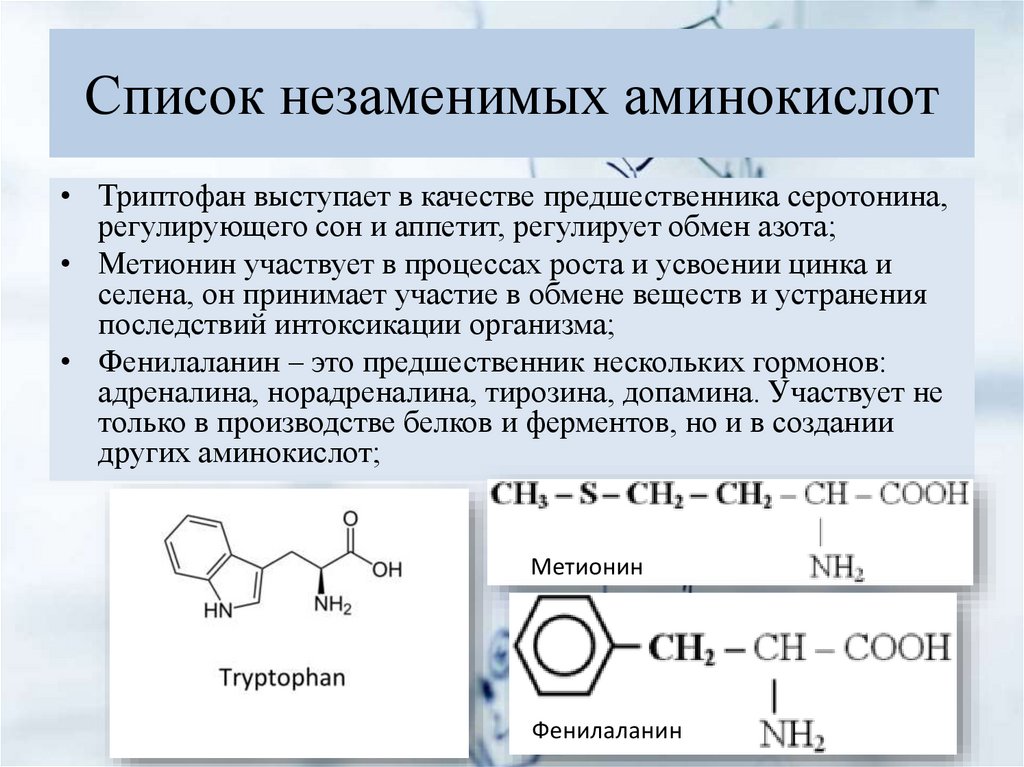
Для успешного роста и процветания микроорганизмов пептидогликан должен обладать незаурядной пластичностью: ведь бактерии, оказавшись в богатой питательными веществами среде, немедленно начинают делиться, и клеточная стенка должна делиться вместе с ними, чтобы не оставить потомство без защиты. В период
Одним из объектов, с которым работала команда Лэма, является бактерия Vibrio cholerae, или холерный вибрион, являющийся возбудителем острой кишечной инфекции. Исследователи отметили, что состояние клеточной стенки бактерии меняется в зависимости от содержания в питательной среде определённых аминокислот. К удивлению учёных, D- (а не L-!) энантиомеры метионина и лейцина вызывали замедление синтеза пептидогликана и смену «режима» образования поперечных сшивок в клеточной стенке.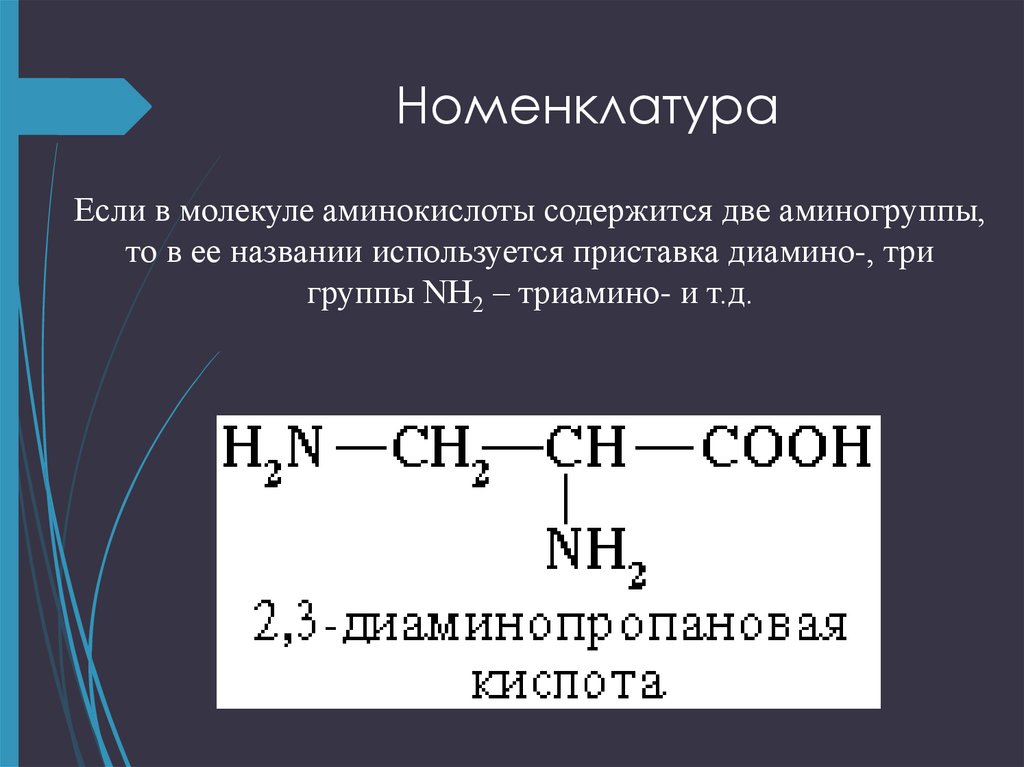
Как именно под действием D-аминокислот происходит перестройка клеточной стенки, пока в точности не ясно. По-видимому, увеличение их содержания как-то влияет на частоту и/или длину сшивок пептидогликана и, следовательно, на прочность и гибкость. Нельзя исключить также возможность, что D-аминокислоты регулируют активность периплазматических ферментов, синтезирующих и перестраивающих клеточную стенку.
Постепенно накапливаются и другие примеры функциональной важности D-аминокислот. У некоторых видов бацилл образование вегетативных клеток из спор регулируется именно относительным содержанием в среде L- и D-аминокислот, которые, соответственно, индуцируют или замедляют проращивание посредством взаимодействия со специальными рецепторами на поверхности спор [6].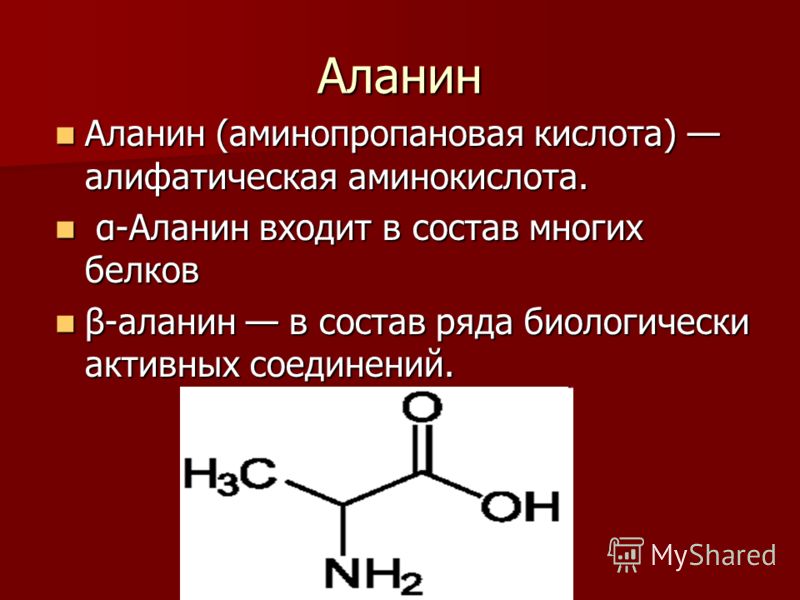
Хотя еще совсем недавно D-аминокислоты считались исключительно «артефактом» бактерий и грибов, появляются данные и о роли этих веществ у эукариот. Эндогенный D-серин выполняет в мозгу млекопитающих функцию нейротрансмиттера [9]. D-аспарагиновая кислота найдена в нейроэндокринных тканях млекопитающих, где она модулирует гормональную секрецию [10].
Возвращаясь напоследок снова к Алисе — точнее, к её создателю Чарлзу Доджсону, — можно высказать предположение, что он (Доджсон) всё-таки знал о вопросах, возникающих в стереохимии, поскольку Луи Пастер (знаменитый химик и микробиолог) был его современником. Пастер к тому моменту уже опубликовал несколько работ по хиральным свойствам винной кислоты, найденной на дне бутылки во многих восхитительных яствах по эту сторону зеркального стекла, — например, в винах и некоторых фруктах и растениях.
Открытия новых функций D-аминокислот, несомненно, продолжатся, и несправедливой дискриминации этих неплохих, в сущности, соединений недолго ещё осталось жить на Земле 🙂
По материалам рубрики «Перспектива» Science [11].
- Кэррол Л. Сквозь зеркало и что там увидела Алиса, или Алиса в Зазеркалье. М.: «Наука», 1991;
- Victor S Lamzin, Zbigniew Dauter, Keith S Wilson. (1995). How nature deals with stereoisomers.
- Stephen F. Mason. (1984). Origins of biomolecular handedness. Nature. 311, 19-23;
- V Prelog. (1976). Chirality in chemistry. Science. 193, 17-24;
- H. Lam, D.-C. Oh, F. Cava, C. N. Takacs, J. Clardy, et. al.. (2009). D-Amino Acids Govern Stationary Phase Cell Wall Remodeling in Bacteria. Science. 325, 1552-1555;
- M.
 T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734;
T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734; - J. W. Ezzell, S. L. Welkos. (1999). The capsule of Bacillus anthracis, a review. J Appl Microbiol. 87, 250-250;
- J. Grunewald, M. A. Marahiel. (2006). Chemoenzymatic and Template-Directed Synthesis of Bioactive Macrocyclic Peptides. Microbiology and Molecular Biology Reviews. 70, 121-146;
- Aude Panatier, Dionysia T. Theodosis, Jean-Pierre Mothet, Bastien Touquet, Loredano Pollegioni, et. al.. (2006). Glia-Derived d-Serine Controls NMDA Receptor Activity and Synaptic Memory. Cell. 125, 775-784;
- A. S. Huang. (2006). D-Aspartate Regulates Melanocortin Formation and Function: Behavioral Alterations in D-Aspartate Oxidase-Deficient Mice.
 Journal of Neuroscience. 26, 2814-2819;
Journal of Neuroscience. 26, 2814-2819; - S. R. Blanke. (2009). Expanding Functionality Within the Looking-Glass Universe. Science. 325, 1505-1506.
аминокислот | Изучайте науку в Scitable
Amino кислоты представляют собой небольшие молекулы, которые являются строительными блоками белков. Белки служат структурной опорой внутри клетки и выполняют многие жизненно важные функции. химические реакции. Каждый белок представляет собой молекулу, состоящую из различных комбинации 20 типов более мелких и простых аминокислот. Белковые молекулы длинные цепочки аминокислот, свернутые в трехмерную форму.
Химически,
аминокислота представляет собой молекулу, которая имеет карбоксильную группу и аминогруппу
каждый из которых присоединен к атому углерода, называемому α-углеродом. Каждый из 20
аминокислоты имеют специфическую боковую цепь, известную как группа R, которая также
присоединен к α-углероду.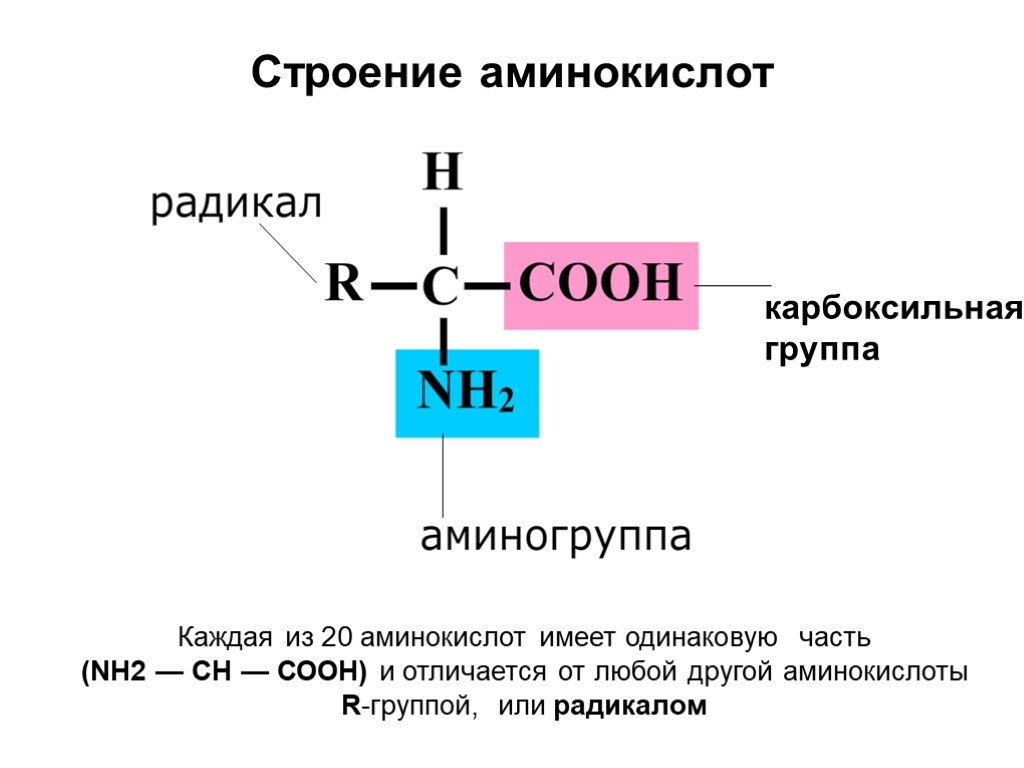 Группы R имеют разнообразные формы, размеры,
заряды и реактивность. Это позволяет сгруппировать аминокислоты по
химические свойства их боковых цепей. Например, некоторые аминокислоты.
имеют полярные боковые цепи, растворимые в воде; примеры включают серин,
треонин и аспарагин. Другие аминокислоты избегают воды и называются
гидрофобные, такие как изолейцин, фенилаланин и валин. Аминокислота
цистеин имеет химически реактивную боковую цепь, которая может образовывать связи с другими
цистеин. Аминокислоты также могут быть основными, как лизин, или кислыми, как глутаминовая кислота.
кислота. Последовательность и взаимодействие между боковыми цепями этих различных
аминокислоты позволяют каждому белку складываться в определенную трехмерную форму
и выполняют биологические функции.
Группы R имеют разнообразные формы, размеры,
заряды и реактивность. Это позволяет сгруппировать аминокислоты по
химические свойства их боковых цепей. Например, некоторые аминокислоты.
имеют полярные боковые цепи, растворимые в воде; примеры включают серин,
треонин и аспарагин. Другие аминокислоты избегают воды и называются
гидрофобные, такие как изолейцин, фенилаланин и валин. Аминокислота
цистеин имеет химически реактивную боковую цепь, которая может образовывать связи с другими
цистеин. Аминокислоты также могут быть основными, как лизин, или кислыми, как глутаминовая кислота.
кислота. Последовательность и взаимодействие между боковыми цепями этих различных
аминокислоты позволяют каждому белку складываться в определенную трехмерную форму
и выполняют биологические функции.
Дальнейшее исследование
Концептуальные ссылки для дальнейшего изучения
белок | мутация со сдвигом рамки | бессмысленная мутация | генетический код | перевод | тРНК | мутация | гель-электрофорез | Вестерн-блот | SNP | рибосома | пептид | кодон
Связанные понятия (13)
Генетика
Клеточная биология
Научная коммуникация
Планирование карьеры
Определение, типы и примеры, структура
Наш геном удивителен.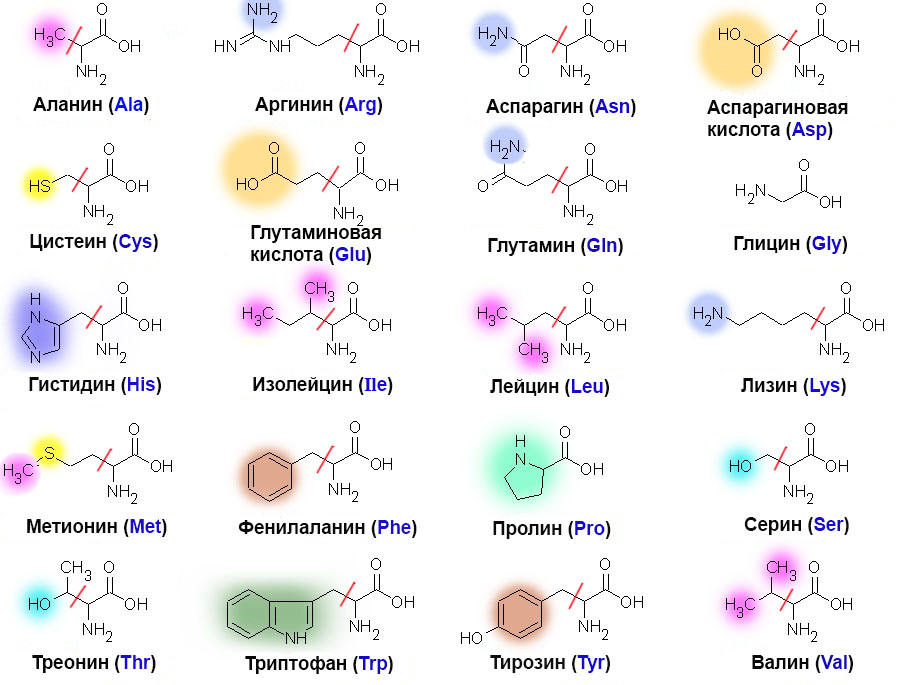 Он состоит всего из четырех субъединиц: оснований, называемых А, , С, , Т, и 9.0032 Г . Фактически, эти четыре основания составляют всю ДНК на Земле. Основания организованы в группы по три, называемые кодонами , и каждый кодон инструктирует клетку ввести одну конкретную молекулу. Эти молекулы называются аминокислотами , и наша ДНК может кодировать только 20 из них.
Он состоит всего из четырех субъединиц: оснований, называемых А, , С, , Т, и 9.0032 Г . Фактически, эти четыре основания составляют всю ДНК на Земле. Основания организованы в группы по три, называемые кодонами , и каждый кодон инструктирует клетку ввести одну конкретную молекулу. Эти молекулы называются аминокислотами , и наша ДНК может кодировать только 20 из них.
Аминокислоты представляют собой органические молекулы, которые содержат как аминовые (), так и карбоксильные () функциональные группы. Они являются строительными блоками белки .
Аминокислоты соединены вместе в длинные цепи, образуя белка. Подумайте об огромном количестве белков на Земле — от структурных белков до гормонов и ферментов. Все они закодированы ДНК. Это означает, что каждый отдельный белок на Земле был закодирован только этими четырьмя основаниями и состоял всего из 20 аминокислот. В этой статье мы собираемся узнать больше об аминокислотах, от их структуры до их связи и их типов.
В этой статье мы собираемся узнать больше об аминокислотах, от их структуры до их связи и их типов.
- Эта статья о аминокислоты по химии.
- Мы начнем с рассмотрения общей структуры аминокислот, прежде чем исследовать, как они могут действовать как кислоты и основания.
- Затем мы перейдем к идентификации аминокислот с помощью тонкослойной хроматографии .
- Далее мы рассмотрим связывание аминокислот с образованием полипептидов и белков .
- Наконец, мы изучим различные типы аминокислот, и вы узнаете о протеиногенных , стандарт , незаменимые аминокислоты и .
Структура аминокислот
Как мы упоминали выше, аминокислоты содержат как аминовые (), так и карбоксильные () функциональные группы. На самом деле, все аминокислоты, которые мы сегодня рассмотрим, имеют одинаковую базовую структуру, показанную ниже:
Рис. 1. Структура аминокислот
1. Структура аминокислот
Давайте рассмотрим структуру более подробно.
- 9Аминогруппа 0032 и карбоксильная группа связаны с одним и тем же углеродом, выделенным зеленым цветом. Этот углерод иногда называют центральным углеродом . Поскольку аминогруппа также связана с первым атомом углерода, присоединенным к карбоксильной группе, эти конкретные аминокислоты представляют собой альфа-аминокислоты .
- Также к центральному углероду присоединены атом водорода и группа R. Группа R может варьироваться от простой метильной группы до бензольного кольца, и это то, что отличает аминокислоты — разные аминокислоты имеют разные группы R.
Рис. 2 – Примеры аминокислот. Их группы R выделены
Именование аминокислот
Когда дело доходит до именования аминокислот, мы склонны игнорировать номенклатуру IUPAC. Вместо этого мы называем их их общими именами. Мы уже показали аланин и лизин выше, но есть еще несколько примеров, включая треонин и цистеин. Используя номенклатуру IUPAC, это соответственно 2-амино-3-гидроксибутановая кислота и 2-амино-3-сульфгидрилпропановая кислота.
Используя номенклатуру IUPAC, это соответственно 2-амино-3-гидроксибутановая кислота и 2-амино-3-сульфгидрилпропановая кислота.
Рис. 3. Дополнительные примеры аминокислот с выделенными группами R
Свойства аминокислот
Давайте теперь перейдем к изучению некоторых свойств аминокислот. Чтобы полностью понять их, нам сначала нужно взглянуть на цвиттериона.
Цвиттерионы
Цвиттерионы представляют собой молекулы, которые содержат как положительно заряженную часть, так и отрицательно заряженную часть, но в целом нейтральны.
В большинстве штатов аминокислоты образуют цвиттерионов . Почему это так? У них вроде нет заряженных частей!
Еще раз взгляните на их общую структуру. Как известно, аминокислоты содержат как аминогруппу, так и карбоксильную группу. Это делает аминокислоты амфотерными .
Амфотерные вещества представляют собой вещества, которые могут действовать как кислота, так и как основание.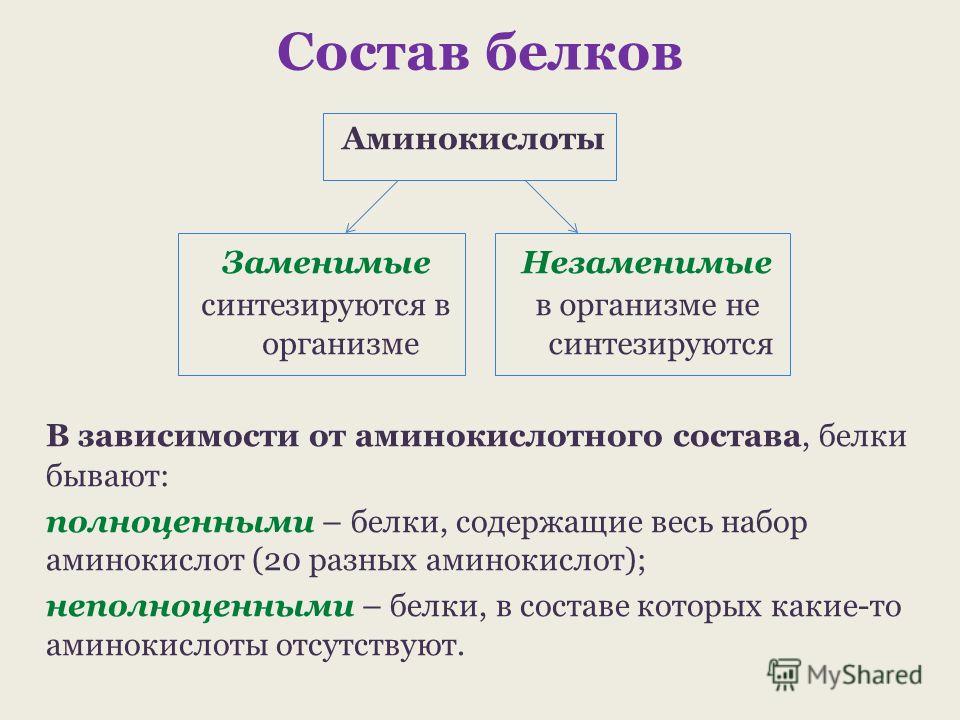
Карбоксильная группа действует как кислота, теряя атом водорода, который на самом деле является просто протоном. Аминогруппа действует как основание, приобретая этот протон. Результирующая структура показана ниже:
Рис. 4 – Цвиттер-ион
Теперь аминокислота имеет положительно заряженную группу и отрицательно заряженную группу. Это цвиттерион-ион.
Поскольку они образуют цвиттер-ионы, аминокислоты обладают некоторыми несколько неожиданными свойствами. Мы сосредоточимся на их температурах плавления и кипения, растворимости, поведении в качестве кислоты и в качестве основания. Мы также рассмотрим их хиральность.
Температуры плавления и кипения
Аминокислоты имеют высокие температуры плавления и кипения. Можете ли вы догадаться, почему?
Как вы уже догадались, это потому, что они образуют цвиттерионы. Это означает, что вместо того, чтобы просто испытывать слабые межмолекулярные силы между соседними молекулами, аминокислоты на самом деле испытывают сильное ионное притяжение. Это удерживает их вместе в решетке и требует много энергии для преодоления.
Это удерживает их вместе в решетке и требует много энергии для преодоления.
Растворимость
Аминокислоты растворимы в полярных растворителях, таких как вода, но нерастворимы в неполярных растворителях, таких как алканы. Опять же, это потому, что они образуют цвиттерионы. Между молекулами полярного растворителя и ионными цвиттер-ионами существует сильное притяжение, которое способно преодолеть ионное притяжение, удерживающее цвиттер-ионы вместе в решетке. Напротив, слабые притяжения между неполярными молекулами растворителя и цвиттерионами недостаточно сильны, чтобы разорвать решетку. Следовательно, аминокислоты нерастворимы в неполярных растворителях.
Поведение кислоты
В основных растворах цвиттер-ионы аминокислот действуют как кислоты, отдавая протон из своей группы. Это снижает рН окружающего раствора и превращает аминокислоту в отрицательный ион:
Рис. 5 – Цвиттер-ион в щелочном растворе. Обратите внимание, что молекула теперь образует отрицательный ион
Поведение как основание
В кислом растворе происходит обратное — цвиттерионы аминокислот действуют как основание.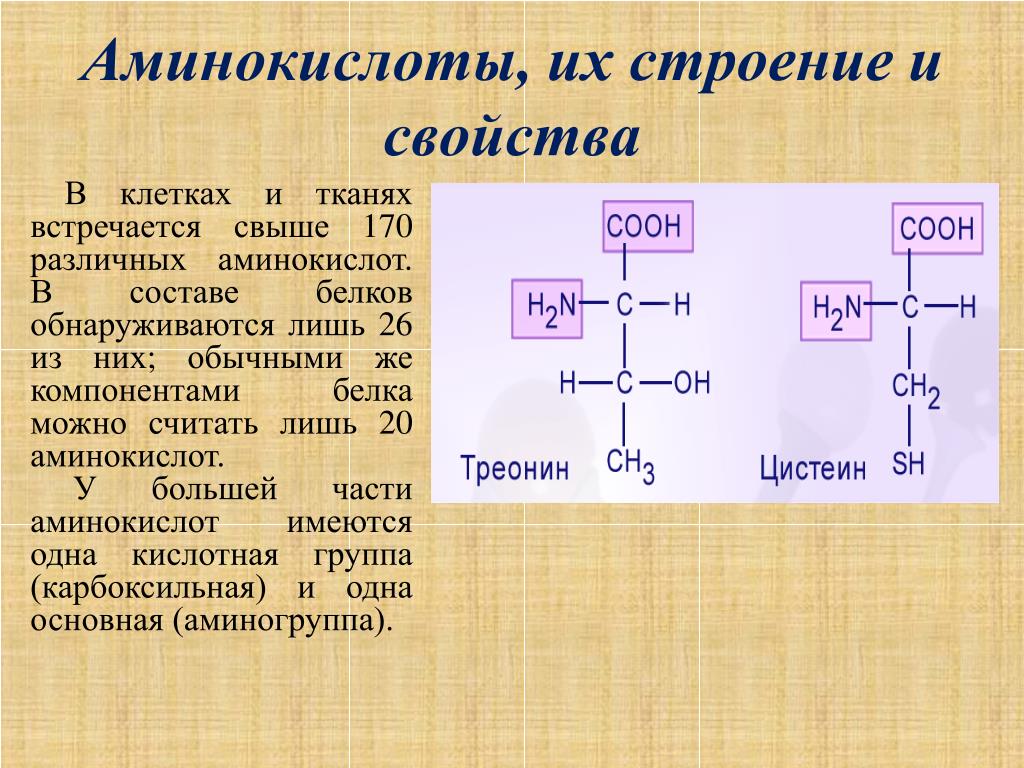 Отрицательная группа получает протон, образуя положительный ион:
Отрицательная группа получает протон, образуя положительный ион:
Рис. 6. Цвиттер-ион в кислом растворе
Изоэлектрическая точка
Теперь мы знаем, что если поместить аминокислоты в кислый раствор, они образуют положительные ионы. Если вы поместите их в щелочной раствор, они образуют отрицательные ионы. Однако в растворе где-то посередине все аминокислоты будут образовывать цвиттер-ионы — у них не будет общего заряда. pH, при котором это происходит, известен как изоэлектрическая точка .
Изоэлектрическая точка — это pH, при котором аминокислота не имеет электрического заряда.
Различные аминокислоты имеют разные изоэлектрические точки в зависимости от их R-групп.
Оптическая изомерия
Все распространенные аминокислоты, за исключением глицина, проявляют стереоизомерию . Более конкретно, они показывают оптическую изомерию .
Взгляните на центральный атом углерода в аминокислоте.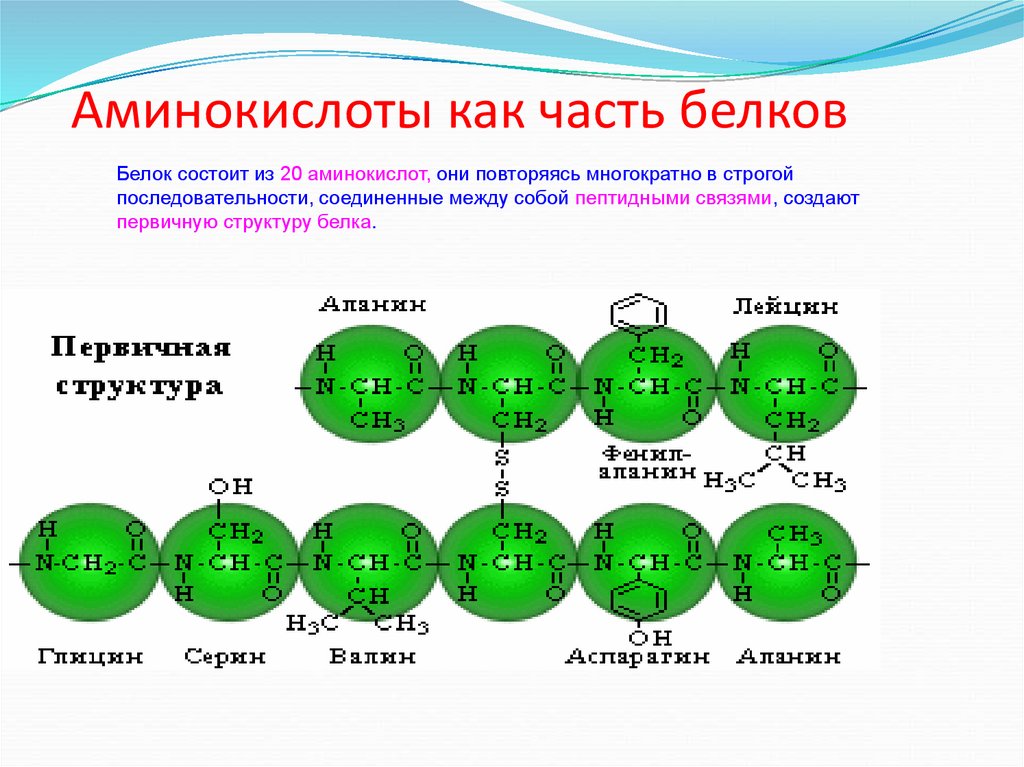 Он связан с четырьмя различными группами — аминогруппой, карбоксильной группой, атомом водорода и группой R. Это означает, что это хиральный центр . Он может образовывать две несовместимые друг с другом зеркальные молекулы, называемые энантиомерами , которые различаются расположением групп вокруг этого центрального углерода.
Он связан с четырьмя различными группами — аминогруппой, карбоксильной группой, атомом водорода и группой R. Это означает, что это хиральный центр . Он может образовывать две несовместимые друг с другом зеркальные молекулы, называемые энантиомерами , которые различаются расположением групп вокруг этого центрального углерода.
Рис. 7 – Два основных стереоизомера аминокислот
Мы называем эти изомеры буквами L- и D-. Все встречающиеся в природе аминокислоты имеют L-форму, которая представляет собой левостороннюю конфигурацию, показанную выше.
Глицин не проявляет оптической изомерии. Это потому, что его группа R представляет собой просто атом водорода. Следовательно, у него нет четырех разных групп, связанных с его центральным атомом углерода, и, следовательно, у него нет хирального центра.
Узнайте больше о хиральности в Оптическая изомерия .
Идентификация аминокислот
Представьте, что у вас есть раствор, содержащий неизвестную смесь аминокислот. Они бесцветны и, кажется, их невозможно различить. Как узнать, какие аминокислоты присутствуют? Для этого можно использовать тонкослойную хроматографию .
Они бесцветны и, кажется, их невозможно различить. Как узнать, какие аминокислоты присутствуют? Для этого можно использовать тонкослойную хроматографию .
Тонкослойная хроматография , также известная как ТСХ , представляет собой метод хроматографии, используемый для разделения и анализа растворимых смесей.
Чтобы определить аминокислоты, присутствующие в вашем растворе, выполните следующие действия.
- Нарисуйте линию карандашом на дне пластины, покрытой тонким слоем силикагеля.
- Возьмите свой неизвестный раствор и другие растворы, содержащие известную аминокислоту, чтобы использовать их в качестве эталонов. Поместите небольшое пятно каждого вдоль линии карандаша.
- Поместите планшет в химический стакан, частично заполненный растворителем, так, чтобы уровень растворителя был ниже карандашной линии. Накройте стакан крышкой и оставьте установку в покое, пока растворитель не пройдет почти весь путь до верхней части пластины.

- Снимите пластину со стакана. Отметьте положение фронта растворителя карандашом и дайте пластине высохнуть.
Эта пластина теперь является вашей хроматограммой . Вы будете использовать его, чтобы узнать, какие аминокислоты присутствуют в вашем растворе. Каждая аминокислота в вашем растворе пройдет свое расстояние вверх по пластине и образует пятно. Вы можете сравнить эти пятна с пятнами, полученными от ваших эталонных растворов, содержащих известные аминокислоты. Если какие-либо пятна находятся в одном и том же месте, это означает, что они вызваны одной и той же аминокислотой. Однако вы могли заметить проблему — аминокислотные пятна бесцветны. Для их просмотра нужно опрыскать тарелку веществом типа нингидрин . Это окрашивает пятна в коричневый цвет.
Рис. 8 – Установка для идентификации аминокислот ТСХ. Растворы, содержащие известные аминокислоты, пронумерованы для удобства поиска
Рис. 9 – Готовая хроматограмма, обработанная нингидрином
Вы можете видеть, что неизвестный раствор дал пятна, соответствующие аминокислотам 1 и 3. Раствор поэтому должны содержать эти аминокислоты. Неизвестный раствор также содержит другое вещество, которое не соответствует ни одному из четырех аминокислотных пятен. Это должно быть вызвано другой аминокислотой. Чтобы узнать, какая это аминокислота, вы можете провести эксперимент еще раз, используя различные растворы аминокислот в качестве эталонов.
Раствор поэтому должны содержать эти аминокислоты. Неизвестный раствор также содержит другое вещество, которое не соответствует ни одному из четырех аминокислотных пятен. Это должно быть вызвано другой аминокислотой. Чтобы узнать, какая это аминокислота, вы можете провести эксперимент еще раз, используя различные растворы аминокислот в качестве эталонов.
Для более подробного ознакомления с тонкослойной хроматографией ознакомьтесь с тонкослойной хроматографией, где вы изучите лежащие в ее основе принципы и некоторые области применения этой техники.
Связь между аминокислотами
Давайте перейдем к изучению связи между аминокислотами. Это, возможно, более важно, чем сами аминокислоты, поскольку именно благодаря этому соединению аминокислоты образуют белков .
Белки представляют собой длинные цепи аминокислот, соединенных пептидными связями.
Когда всего две аминокислоты соединяются вместе, они образуют молекулу, называемую дипептидом .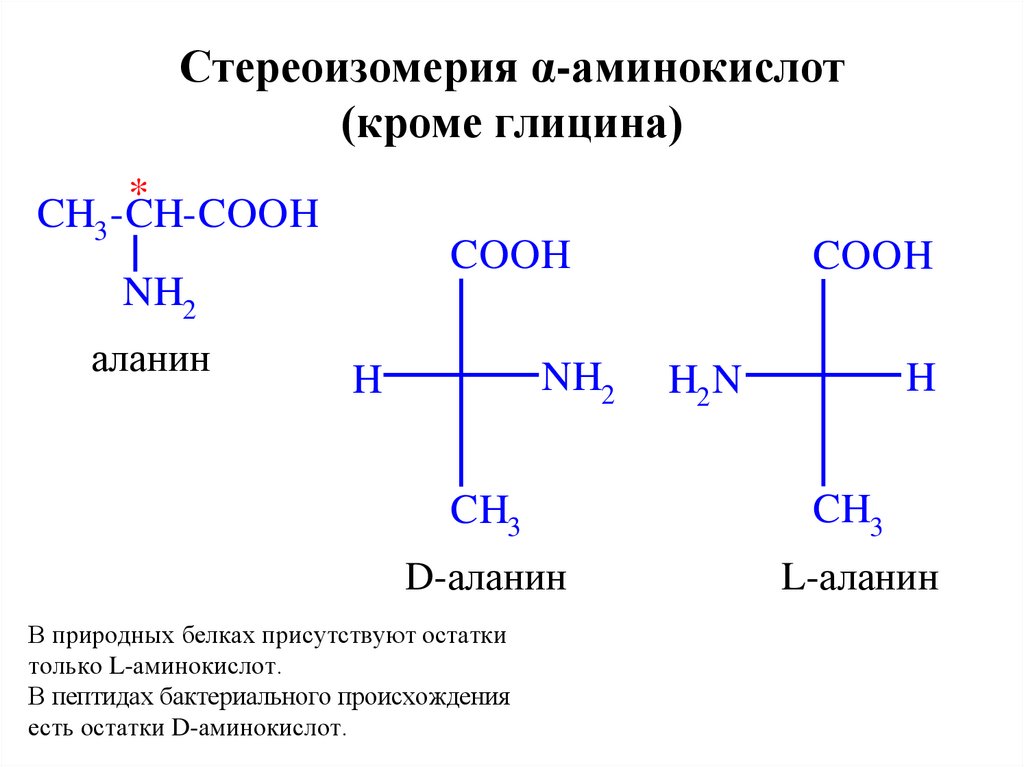 Но когда множество аминокислот соединяются в длинную цепь, они образуют полипептид . Они соединяются вместе с помощью пептидных связей . Пептидные связи образуются в результате реакции конденсации между карбоксильной группой одной аминокислоты и аминогруппой другой. Поскольку это реакция конденсации, она высвобождает воду. Взгляните на диаграмму ниже.
Но когда множество аминокислот соединяются в длинную цепь, они образуют полипептид . Они соединяются вместе с помощью пептидных связей . Пептидные связи образуются в результате реакции конденсации между карбоксильной группой одной аминокислоты и аминогруппой другой. Поскольку это реакция конденсации, она высвобождает воду. Взгляните на диаграмму ниже.
Рис. 10 – Связь между аминокислотами
Здесь атомы, которые удаляются, обведены синим, а атомы, которые связываются вместе, обведены красным. Вы можете видеть, что атом углерода из карбоксильной группы и атом азота из аминогруппы соединяются вместе, образуя пептидную связь. Эта пептидная связь является примером амидной связи , .
Попробуйте нарисовать дипептид, образованный аланином и валином. Их группы R равны и соответственно. Есть две разные возможности, в зависимости от того, какую аминокислоту вы рисуете слева и какую аминокислоту вы рисуете справа.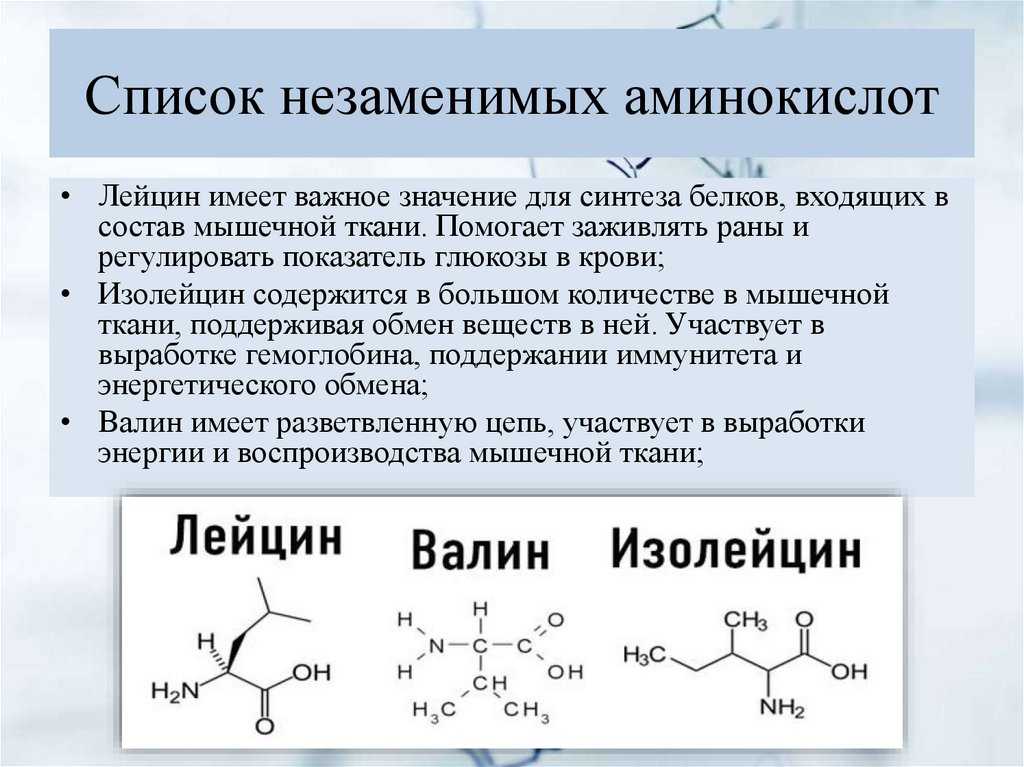 Например, верхний дипептид, показанный внизу, содержит аланин слева и валин справа. Но у нижнего дипептида слева валин, а справа аланин! Мы выделили функциональные группы и пептидную связь, чтобы сделать их понятными для вас.
Например, верхний дипептид, показанный внизу, содержит аланин слева и валин справа. Но у нижнего дипептида слева валин, а справа аланин! Мы выделили функциональные группы и пептидную связь, чтобы сделать их понятными для вас.
Рис. 11. Два дипептида, образованные из аланина и валина
Гидролиз пептидных связей
Вы могли заметить, что когда две аминокислоты соединяются вместе, они выделяют воду. Чтобы разорвать связь между двумя аминокислотами в дипептиде или полипептиде, нам нужно снова добавить воду. Это пример реакции гидролиза , для которой требуется кислотный катализатор. Он восстанавливает две аминокислоты.
Вы узнаете больше о полипептидах в разделе «Биохимия белков».
Типы аминокислот
Существует несколько различных способов группировки аминокислот. Ниже мы рассмотрим некоторые из них.
Узнайте, хочет ли ваша экзаменационная комиссия, чтобы вы знали какие-либо из этих типов аминокислот. Даже если эти знания не требуются, все равно интересно узнать!
Протеиногенные аминокислоты
Протеиногенные аминокислоты — это аминокислоты, которые превращаются в белки во время трансляции ДНК.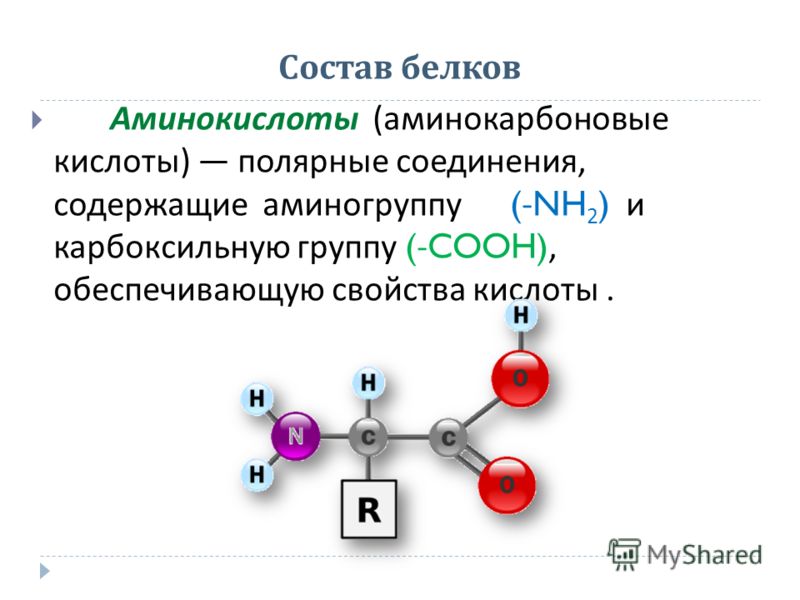
В начале статьи мы рассказали, насколько прекрасна ДНК. Возьмите любую известную жизнь, распутайте ее ДНК, и вы обнаружите, что она кодирует всего 20 различных аминокислот. Эти 20 аминокислот являются протеиногенные аминокислоты . Вся жизнь основана на этой скудной горстке молекул.
Ладно, это еще не все. На самом деле существует 22 протеиногенных белка, но ДНК кодирует только 20 из них. Два других производятся и включаются в белки с помощью специальных механизмов трансляции.
Первым из этих раритетов является селеноцистеин. Кодон UGA обычно действует как стоп-кодон, но при определенных условиях специальная последовательность мРНК, называемая элементом SECIS, заставляет кодон UGA кодировать селеноцистеин. Селеноцистеин похож на аминокислоту цистеин, но с атомом селена вместо атома серы.
Рис. 12 – Цистеин и селеноцистеин
Другой протеиногенной аминокислотой, не кодируемой ДНК, является пирролизин. Пирролизин при определенных условиях кодируется стоп-кодоном UAG.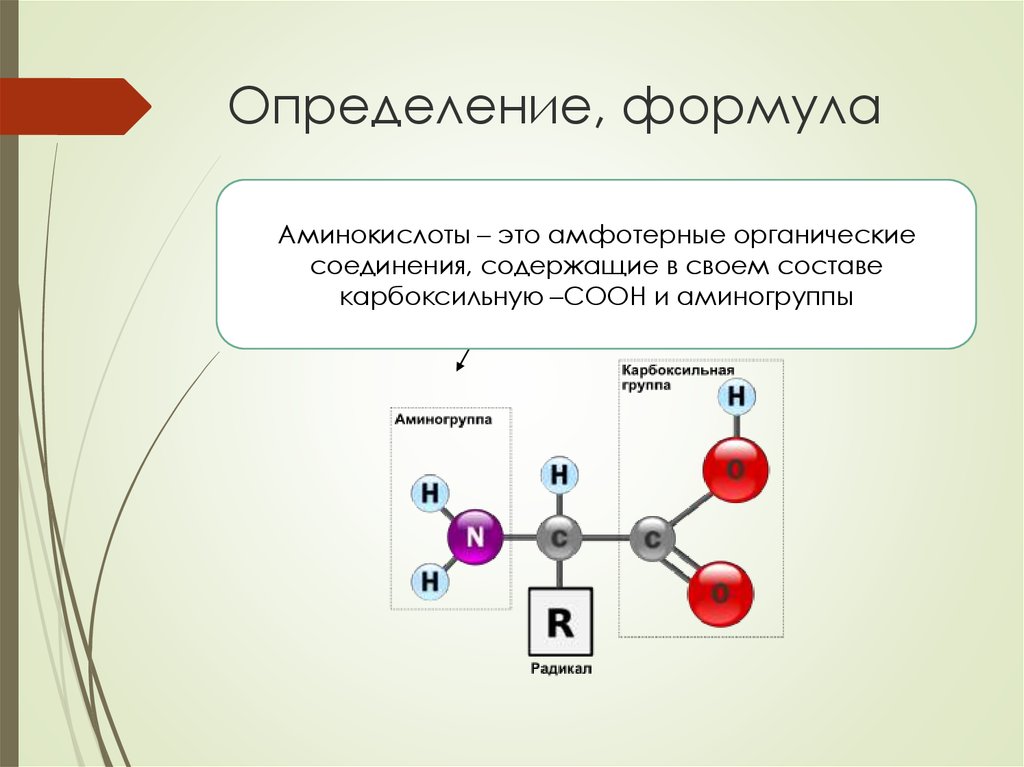 Только определенные метаногенные археи (микроорганизмы, вырабатывающие метан) и некоторые бактерии производят пирролизин, поэтому вы не найдете его у людей.
Только определенные метаногенные археи (микроорганизмы, вырабатывающие метан) и некоторые бактерии производят пирролизин, поэтому вы не найдете его у людей.
Рис. 13 – Пирролизин
Мы называем 20 аминокислот, закодированных в ДНК стандартными аминокислотами , а все остальные аминокислоты нестандартные аминокислоты. Селеноцистеин и пирролизин являются единственными двумя протеиногенными нестандартными аминокислотами.
При представлении протеиногенных аминокислот мы можем давать им однобуквенные или трехбуквенные сокращения. Вот удобная таблица.
Рис. 14 – Таблица аминокислот и их сокращений. Две нестандартные аминокислоты выделены розовым цветом
Незаменимые аминокислоты
Хотя наша ДНК кодирует все 20 стандартных аминокислот, девять из них мы не можем синтезировать достаточно быстро, чтобы удовлетворить потребности нашего организма. Вместо этого мы должны получать их, расщепляя белок из нашего рациона.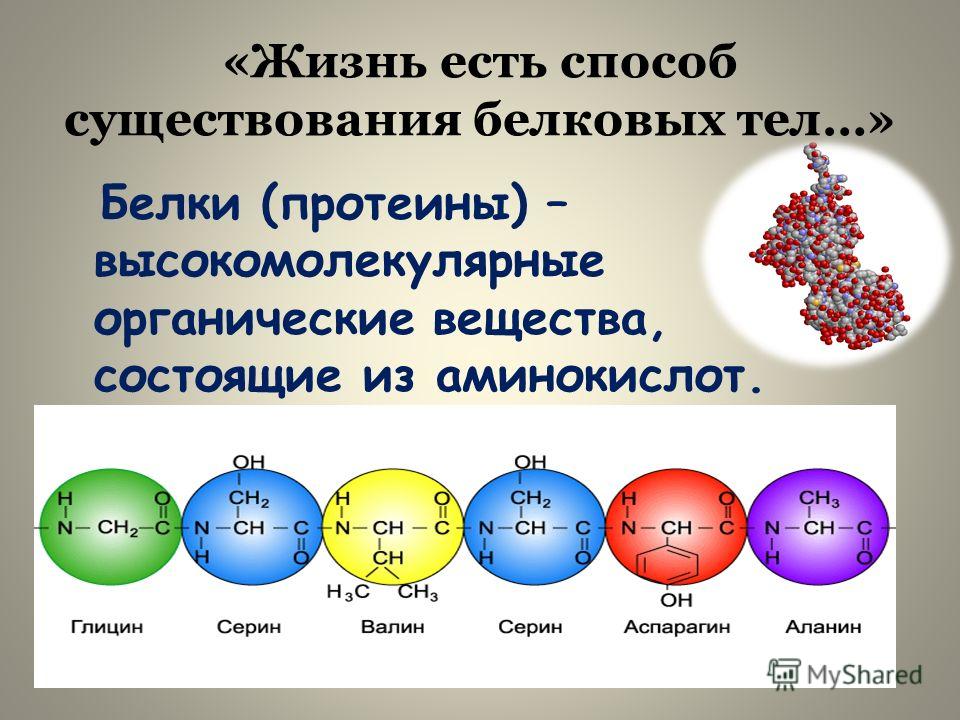 Эти девять аминокислот называются 9.0032 незаменимые аминокислоты — важно, чтобы мы потребляли их в достаточном количестве, чтобы должным образом поддерживать наш организм.
Эти девять аминокислот называются 9.0032 незаменимые аминокислоты — важно, чтобы мы потребляли их в достаточном количестве, чтобы должным образом поддерживать наш организм.
Незаменимые аминокислоты – это аминокислоты, которые не могут быть синтезированы организмом достаточно быстро, чтобы удовлетворить их потребности, и вместо этого должны поступать с пищей.
9 незаменимых аминокислот:
- Гистидин (HIS)
- изолецин (ILE)
- Лейцин (LEU)
- Лизин (Lys)
- Метеонин (MET)
- 060060 фенилтин (PHE)
- (MET)
- 060060060060060. Фенилтин.0063
- Треонин (Thr)
- Триптофан (Trp)
- Валин (Val)
Продукты, содержащие все девять незаменимых аминокислот, называются полноценными белками . К ним относятся не только животные белки, такие как все виды мяса и молочных продуктов, но и некоторые растительные белки, такие как соевые бобы, лебеда, семена конопли и гречка.
Однако вам не нужно беспокоиться о том, чтобы получать полноценные белки с каждым приемом пищи. Употребление определенных продуктов в сочетании друг с другом также обеспечит вас всеми незаменимыми аминокислотами. Сочетание любой фасоли или бобовых с орехами, семенами или хлебом даст вам все девять незаменимых аминокислот. Например, у вас может быть хумус и питта, бобовый чили с рисом или жаркое с арахисом.
Этот жареный продукт содержит все необходимые вам незаменимые аминокислоты. Изображение предоставлено: pixabay.com
Аминокислоты — основные выводы
- Аминокислоты — это органические молекулы, которые содержат как аминовую (), так и карбоксильную () функциональные группы. Они являются строительными блоками белков.
- Все аминокислоты имеют одинаковую общую структуру.
- В большинстве штатов аминокислоты образуют цвиттерионы. Это нейтральные молекулы с положительно заряженной частью и отрицательно заряженной частью.


 — Аминокислоты — это органические соединения, из которых состоят все белки, а олигопептиды — промежуточные соединения, где находится до 7—10 аминокислот.
— Аминокислоты — это органические соединения, из которых состоят все белки, а олигопептиды — промежуточные соединения, где находится до 7—10 аминокислот. — В основном этот рынок представлен либо изолятами (белки, выделенные из сырья без расщепления), либо гидролизатами. Последние более эффективны, потому что в них молекулы расщеплены, но при этом дороже и не столь доступны обыкновенным спортсменам-энтузиастам.
— В основном этот рынок представлен либо изолятами (белки, выделенные из сырья без расщепления), либо гидролизатами. Последние более эффективны, потому что в них молекулы расщеплены, но при этом дороже и не столь доступны обыкновенным спортсменам-энтузиастам.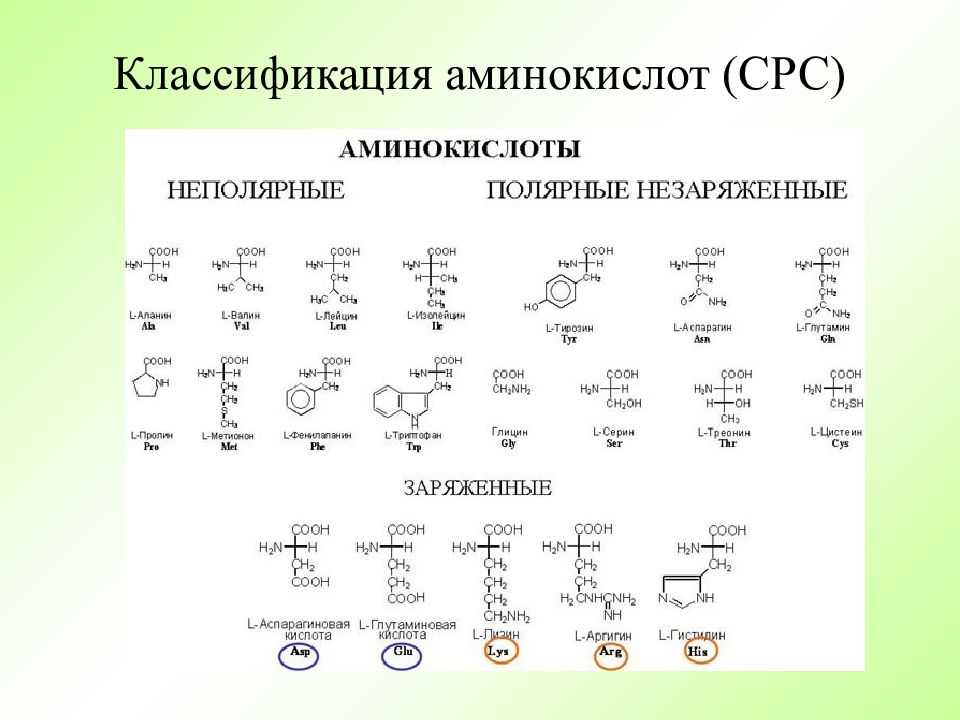 Лем,
Лем,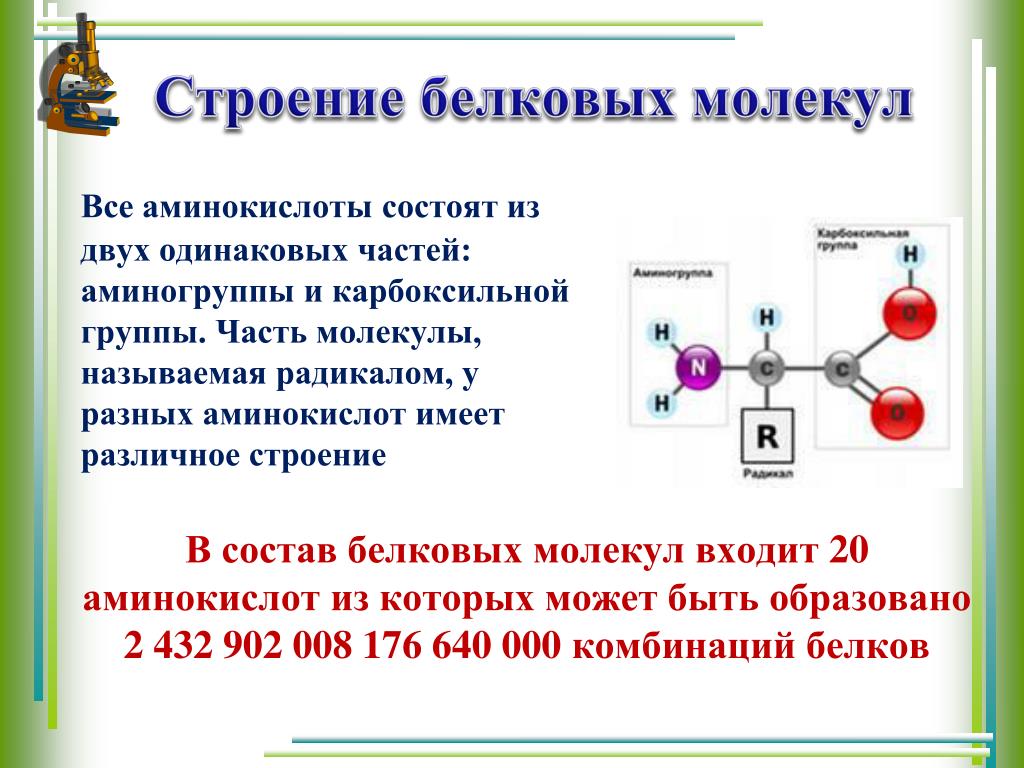 T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734;
T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734;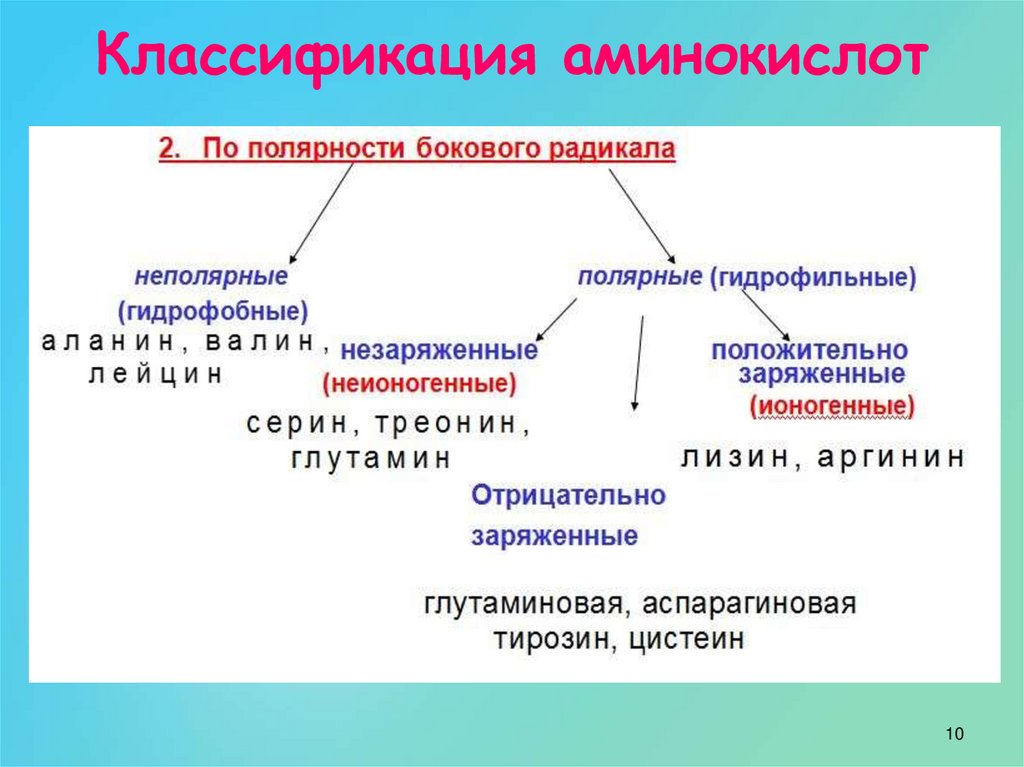 Journal of Neuroscience. 26, 2814-2819;
Journal of Neuroscience. 26, 2814-2819;