Биологические функции аминокислот
Выберите разделВ помощь кондитеруКак применятьПолезно знатьРецептуры и технологииРецептыРецепты кондитера
Этот блог не предназначен для предоставления диагностики, лечения или медицинской консультации. Контент, представленный в этом блоге, предназначен только для информационных целей. Пожалуйста, проконсультируйтесь с врачом или другим медицинским работником относительно любых медицинских или связанных со здоровьем диагнозов или вариантов лечения. Информация в этом блоге не должна рассматриваться в качестве замены консультации с медицинским работником. Утверждения, сделанные о конкретных продуктах в этом блоге, не одобрены для диагностики, лечения, лечения или профилактики заболеваний.
В человеческом организме находится около трехсот аминокислот, биологическая роль которых неоценима. Без достаточного уровня данного жизненного материала организм не может эффективно развиваться. Именно поэтому существуют оптимальные суточные нормы употребления аминокислот, которые обеспечивают сбалансированные обменные процессы и заряжают организм дополнительной энергией.
Все существующие аминокислоты подразделяют на три большие группы: заменимые, незаменимые и те, которые можно заместить частично. Первые организм человека способен синтезировать самостоятельно, вторые – нет, поэтому важно обеспечивать их рациональное потребление вместе с пищей.
Биологические функции аминокислот следующие:
- синтез целого комплекса биологически важных веществ в организме человека для его оптимального роста и развития;
- выполнение строительных обязанностей в теле человека, стимуляция его деятельности;
- активизация умственных способностей, координации, поддержка иммунной системы;
- помощь в распаде холестерина, переработка лишних жировых тканей в энергию;
- предотвращение заболеваний почек, печени, органов кишечного и пищеварительного тракта;
- выполнение антидепресантных, гликогенных действий;
- аминокислоты способствуют регенерации тканей, защищают человеческий организм от усталости;
- стимулирование работы мозга, улучшение память, зрение;
- восполнение недостаточное количество глюкозы;
- помощь в развитии мышечных клеток, образовании коллагена, сохраняют молодость организма;
- быстрое заживление ран, порезов и других видов травм.

Таким образом, уникальные биологические функции аминокислот позволяют организму человека расти, развиваться и нормально функционировать на протяжении всей жизни. Обмен веществ, синтезирование белка, пластические их свойства защищают организм от сбоев и нарушений важных химических реакций. Аминокислоты являются главными и первичным строительным материалом. Они незаменимы во всех процессах жизнедеятельности человека.
Чтобы и вы получили такой ошеломительный эффект, покупайте кондитерские ингредиенты по промокоду BLOG со скидкой в 10%, который распространяется на все заказы до 15 кг! И до встреч в новых статьях!
Заменимые и незаменимые аминокислоты — Vimo.Fitness
Аминокислоты, из которых состоят белки регулируют большинство процессов в организме. Таблица из 20 важнейших аминокислот, продукты богатые полноценным и неполноценным белком – всё это можно найти в статье.
Таблица из 20 важнейших аминокислот, продукты богатые полноценным и неполноценным белком – всё это можно найти в статье.
У большинства людей слово аминокислоты ассоциируется с разновидностью спортивного питания. И действительно, одним из основных товаров в этом сегменте являются комплексы аминокислот и в частности – аминокислоты ВСАА
. Возникает закономерный вопрос: для чего нужны аминокислоты, кому и откуда их можно получить? Чтобы в этом разобраться, нужно сначала определиться с тем, что из себя изначально представляют эти вещества.Что такое аминокислоты?
Аминокислоты – это органические соединения, являющиеся структурным компонентом белка. Т.е. когда мы говорим, о том, что белок является основным строительным материалом тканей организма, что он необходим для роста мышечной массы и незаменим при жиросжигании – всё это, на самом деле, об аминокислотах, из которых и состоит белок. Утрированно, можно сказать, что аминокислоты – это белки.
В природе существует огромное количество разновидностей аминокислот и, соответственно, их классификаций. Однако всё это из области химии. Как правило, выделяют 20 «основных» аминокислот
Однако всё это из области химии. Как правило, выделяют 20 «основных» аминокислот
Почему в качестве «важнейших» аминокислот выбрали именно их не совсем понятно. Однако для нас важно, что эти двадцать аминокислот делят на два класса в зависимости от того, может ли организм самостоятельно их синтезировать (производить): заменимые и незаменимые.
Виды аминокислот: заменимые и незаменимые
Заменимые аминокислоты – это те, которые организм может получить двумя способами: либо в готовом виде из продуктов питания, либо производить самостоятельно из других видов аминокислот и веществ, поступающих в организм.
К заменимым аминокислотам относятся: аргинин, аспарагин, глутамин, глутаминовая кислота, глицин, карнитин, орнитин, таурин (иногда в этот список вносят пролин и серин).
Незаменимые аминокислоты – эти аминокислоты организм не в состоянии синтезировать сам и может получать только из продуктов питания.
К незаменимым аминокислотам относятся: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
К условно незаменимым аминокислотам относятся: тирозин, цистеин, гистидин, аланин.
В разных источниках аминокислоты в этих классификациях могут немного отличаться. Иногда этот список дополняют несколькими другими элементами. Иногда «степень важности» некоторых ставят под сомнение, но, тем не менее, этот перечень можно назвать основным.
Источники аминокислот
Естественно, главным источником аминокислот являются продукты питания, богатые белком. Однако на основании содержания тех или иных аминокислот белки, содержащиеся в пище, можно разделить на полноценные и неполноценные.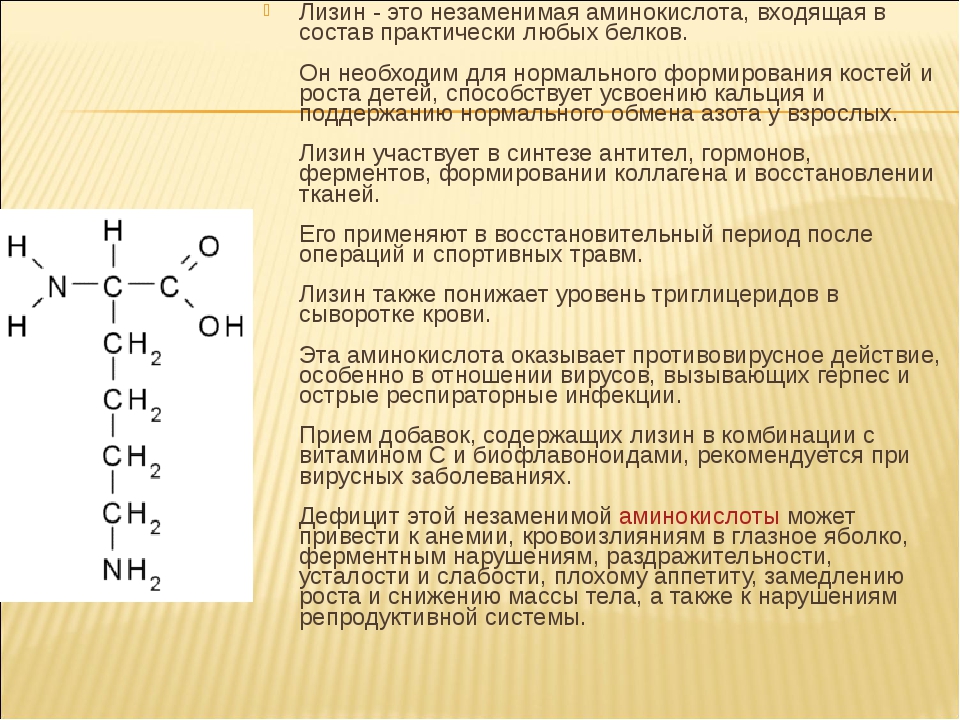
Полноценные белки содержат в себе все незаменимые аминокислоты. К таким продуктам относятся, главным образом, продукты животного происхождения: мясо, птица, рыба, яйца, молочные продукты. К растительным источникам полноценного белка относится соя.
Среди всех продуктов наиболее качественным источником полноценных белков считается куриное яйцо, так как в нём не только полный набор незаменимых аминокислот, но и лучшее их соотношение.
Неполноценные белки – в их составе отсутствует хотя бы одна незаменимая кислота. Соответственно, по своему «качеству» неполноценные белки могут сильно отличаться. Ведь к одной и той же группе «неполноценных» будет относится тот белок, в котором только одна незаменимая аминокислота, и тот, в котором их семь. Источником неполноценных белков являются главным образом продукты растительного происхождения: бобовые, злаки, орехи и семечки.
Хочу обратить внимание на один нюанс, который обычно становится камнем преткновения в спорах вегетарианцев и тех, кто ест мясо и продукты животного происхождения: белок содержится практически во всех продуктах. А если учитывать даже его микродозы, то, скорее всего, во всех. Вопрос в другом: в качестве белка (полноценный или неполноценный) и его количестве. Белок есть и в брокколи и в куриной грудке. Просто в капусте его 3 г на 100 г продукта, а в курином мясе 23 г.
А если учитывать даже его микродозы, то, скорее всего, во всех. Вопрос в другом: в качестве белка (полноценный или неполноценный) и его количестве. Белок есть и в брокколи и в куриной грудке. Просто в капусте его 3 г на 100 г продукта, а в курином мясе 23 г.
Чтобы эта информация была более наглядной, я приведу пример. Допустим, есть человек, который занимается спортом и весит 70 кг. Ему необходимо, допустим, 1,2 г белка на кг массы тела, соответственно хотя бы 84 г. Он может получить их из 360-ти г курицы, либо из 2, 8 кг брокколи. И это только количественный показатель. Качество животного белка будет Выше.
Функции аминокислот в организме
В широком смысле, аминокислоты, из которых состоит белок, являются строительным материалом всех структур организма. Каждая аминокислота в отдельности выполняет свою незаменимую роль. Однако, обобщив, можно выделить следующие основные функции аминокислот:
- синтез белка
- поддержание активности умственных процессов (аминокислоты выполняют функцию нейромедиаторов, являясь проводниками нервных импульсов)
- регуляция работы ЦНС (центральной нервной системы)
- формирование мышечных волокон
- восстановление тканей и органов после травм
- являясь основным компонентом ферментов, регулируют обменные процессы в организме (в том числе углеводный и липидный обмены)
- регулируют гормональный фон
И это только основные из них. Я не преувеличу, если скажу, что аминокислоты участвуют абсолютно во всех процессах, происходящих в организме.
Я не преувеличу, если скажу, что аминокислоты участвуют абсолютно во всех процессах, происходящих в организме.
Оптимальное соотношение аминокислот
Мне так и не удалось найти более-менее достоверного источника информации о том, каким всё-таки должно быть соотношение белков в рационе человека. Упоминается диапазон соотношения животных белков к растительным от 65:35 до 45:55. Думаю, что стоит ровняться на золотую середину и придерживаться пропорции 50:50.
Но важно также понимать, что такой подсчёт не обязательно даст Вам полный спектр необходимых аминокислот. Ведь даже если мы говорим о полноценном белке, содержащем все незаменимые аминокислоты, то играет роль также количество и пропорции этих аминокислот в данном продукте. Они могут быть там все, но просто в малом количестве или наблюдаться дефицит какой-то конкретной аминокислоты.
Безусловно, немногие из нас будут сидеть и скрупулёзно подсчитывать количество всех аминокислот и их пропорции в своём рационе. Именно поэтому достаточное употребление белка и соблюдение соотношения 50:50 животных к растительным белкам, предположительно, должно покрыть Вашу норму в аминокислотах.
Намного более сложная ситуация складывается у вегетарианцев. Им нужно очень серьёзно продумывать свой рацион, чтобы более-менее восполнить недостаток незаменимых аминокислот из растительных источников.
Растительный и животный белок: какой лучше?
Именно такая формулировка вопроса очень часто появляется при обсуждении животного и растительного белка, и она в корне не верна. Нет «плохого» или «хорошего» белка, они разные и организму нужны и первые и вторые в достаточном количестве. Как говорилось выше, все белки имеют разный аминокислотный состав. И нам нужны ВСЕ аминокислоты. Каждая из них выполняет свою функцию и, соответственно, недостаток какой-либо из них рано или поздно негативно скажется на работе организма.
Кто-то скажет, что полноценные белки важнее, потому что содержат незаменимые аминокислоты. Но если кушать только белок животного происхождения, человек всё равно будет испытывать недостаток тех кислот, которые в них не содержатся. Кроме того польза продуктов определяется не только наличием аминокислот. Огромную роль также играет соотношение белков, «хороших» и «плохих» жиров и углеводов. Ведь если продукт будет богат незаменимыми аминокислотами, но при этом содержать много животных жиров – его «полезность» существенно уменьшится даже для тех, кто не следит за фигурой. Поэтому вывод один — рацион должен быть максимально разнообразным, чтобы полностью покрыть потребность в аминокислотах.
Но если кушать только белок животного происхождения, человек всё равно будет испытывать недостаток тех кислот, которые в них не содержатся. Кроме того польза продуктов определяется не только наличием аминокислот. Огромную роль также играет соотношение белков, «хороших» и «плохих» жиров и углеводов. Ведь если продукт будет богат незаменимыми аминокислотами, но при этом содержать много животных жиров – его «полезность» существенно уменьшится даже для тех, кто не следит за фигурой. Поэтому вывод один — рацион должен быть максимально разнообразным, чтобы полностью покрыть потребность в аминокислотах.
Количество аминокислот необходимых человеку, занимающемуся спортом, резко увеличивается. Соответственно нужно либо строго контролировать их поступление с пищей, либо принимать дополнительные порции аминокислот в виде добавок спортивного питания (например, ВСАА).
Но это не значит, что добавки являются обязательными. Свой рацион вполне можно выстроить таким образом, чтобы покрыть все потребности в аминокислотах. У спортивного питания есть свои плюсы, но если Вы не соревнующийся спортсмен, его приём не является сверхнеобходимостью.
У спортивного питания есть свои плюсы, но если Вы не соревнующийся спортсмен, его приём не является сверхнеобходимостью.
Ниже в таблицах Вы можете найти информацию об основных аминокислотах, их функциях и источниках получения. Среди продуктов, указаны только те, в которых каждая из аминокислот встречается в более-менее значимых количествах.
[table class=»table-default»]
[/table]
[table class=»table-default»]
| Аминокислота | Функции | Источники |
|---|---|---|
| Тирозин |
|
|
| Цистеин |
|
|
| Гистидин |
|
|
[/table]
[table class=»table-default»]
[/table]
Понравилась статья? Скажите «спасибо» автору и поделитесь ей в социальных сетях, нажав на соответствующую иконку в правом нижнем углу.
А чтобы получать больше полезной информации каждый день, подпишитесь на наш instagram.
#белки#протеин
Биологическая роль аминокислот | Химия онлайн
Известно около 200 природных аминокислот, но только 20 из них играют важнейшую роль в жизни человека. Эти аминокислоты называют протеиногенными — строящими белки.
Первые аминокислоты были открыты в начале XIX века.
В пищевых продуктах наиболее распространены 22 аминокислоты.
В составе белков найдено 20 различных α-аминокислот (одна из них – пролин, является не амино- , а иминокислотой), поэтому их называют белковыми аминокислотами.
Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
Многие из них найдены только в определенных организмах, а некоторые – только в одном каком-либо организме.
Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты, животные и человек не способны к образованию так называемых незаменимых аминокислот, получаемых с пищей.
К заменимым относятся аминокислоты, присутствие которых в пище не обязательно для нормального развития организма. В случае их недостаточности они могут синтезироваться из других аминокислот или из небелковых компонентов. Аминокислоты валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан и фенилаланин являются незаменимыми почти для всех видов животных.
Аминокислоты являются наиболее важной составной частью организма. Аминокислоты – строительные блоки, из которых строятся белковые структуры, мышечные волокна. Организм использует их для собственного роста, восстановления, укрепления и выработки различных гормонов, антител и ферментов.
Они содержатся в ядре, протоплазме и стенках клеток, где выполняют разнообразные функции жизнедеятельности.
Аминокислоты участвуют в обмене белков и углеводов, в образовании важных для организмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотиков и т. д.
Некоторые аминокислоты служат посредниками при передаче нервных импульсов.
С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма.
Главными продуктами разложения аминокислот являются аммиак, мочевина и мочевая кислота. Восполнение потерь аминокислот происходит в основном в результате расщепления белков.
Аминокислоты обеспечивают:— основные метаболические процессы: синтез и утилизация витаминов, липотропное (жиромобилизующее) действие, гликолиз и гликонеогенез;
— процессы детоксикации организма, в том числе при токсикозе беременных; — формирование иммунной системы организма;
— энергетические потребности клеток и, прежде всего, мозга, участвуют в образовании нейромедиаторов, обладают антидепрессантной активностью, улучшают память;
— метаболизм углеводов, участвуют в образовании и накоплении гликогена в мышцах и печени, обеспечивают наращивание мышечной массы, cнижают утомляемость, улучшают работоспособность;
— стимулируют работу гипофиза, увеличивают выработку гормона роста, гормонов щитовидной железы, надпочечников;
— участвуют в образовании коллагена и эластина, способствуют восстановлению кожи и костной ткани, а также заживлению ран;
— принимают участие в кроветворении, и, прежде всего, в выработке гемоглобина.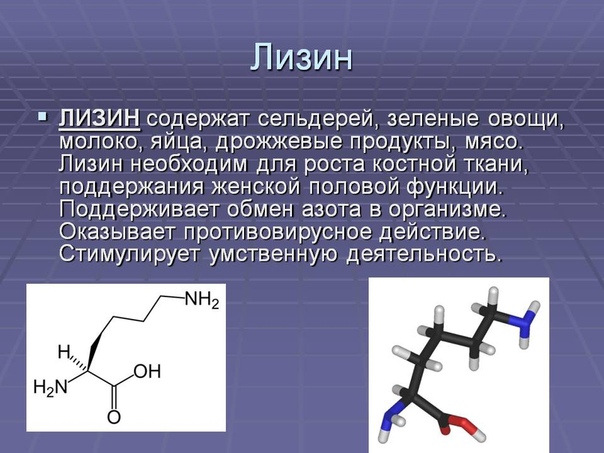
Интересно знать
Во время беременности повышается потребность женского организма в триптофане и лизине, у грудных детей – в триптофане и изолейцине.
Особенно увеличивается потребность организма в незаменимых аминокислотах после больших потерь крови, ожогов, а также вовремя других процессов, сопровождаемых регенерацией тканей.
Для птиц незаменимой аминокислотой является глицин.
У жвачных животных биосинтез всех незаменимых аминокислот производится микроорганизмами кишечного тракта.
Для человека высокую «биологическую ценность» имеют лишь немногие животные белки, такие, как белок куриного яйца или белок материнского молока. Они содержат незаменимые аминокислоты не только в достаточном количестве, но и в необходимом для человека соотношении.
Низкая ценность многочисленных растительных белков связана с небольшим содержанием в них отдельных незаменимых аминокислот (главным образом лизина и метионина). В белке соевой муки мало метионина, в кукурузе – лизина и триптофана.
При недостаточном количестве аминокислотных соединений в организме формируется дисбаланс белкового обмена, в результате которого недостающие элементы «извлекаются» из соединительной ткани, мышц, крови и печени.
В первую очередь высвобожденные белки используются для питания мозга и обеспечения работы сердечно-сосудистой системы.
Расходуя собственные аминокислоты и не получая их с пищей, организм начинает слабеть и истощаться, это приводит к сонливости, выпадению волос, анемии, потере аппетита, ухудшению состояния кожи, задержке роста и умственному развитию.
Аминокислоты
Физиологические функции аминокислот в организме. Специфические пути обмена некоторых аминокислот
Аминокислоты
— органические соединения, содержащие
одновременно и аминогруппу, и карбоксильную
группу. Этим объясняется и своеобразие
физико-химических свойств АК и разнообразие
реакций, в которых они участвуют.
Этим объясняется и своеобразие
физико-химических свойств АК и разнообразие
реакций, в которых они участвуют.
В природных соединениях и в живых организмах встречаются, в основном, α-аминокислоты из них только 20входят в состав белков и называются протеиногенными. Другое важнейшее свойство белковых АК связано с оптической активностью – все они являются L-изомерами.
Аминокислоты кроме карбонильной и аминной группировок содержат боковые радикалы, причем именно эти химические группировки определяют большинство свойств той или иной аминокислоты. В общем виде формула аминокислоты может быть представлена следующим образом:
Для одной из протеиногенных аминокислот, а именно для глицина, R представлен атомом водорода, для других аминокислот их боковая цепь имеет более сложное строение.
Кроме
20 наиболее часто встречающихся, имеется
ряд минорных аминокислот, являющихся
компонентами лишь некоторых белков. Каждая из этих минорных аминокислот
представляет собой химическую модификацию
основных протеиногенныхаминокислот,
например гидроксипролин или
гидроксилизин.
Вжной биологической
ролью аминокислот является способность
поддерживать определенные буферные
свойства клеточного содержимого,
поскольку аминокислоты содержат
функциональные группы, ионизирующиеся
при различных значениях pH.
Важнейшая функциональная роль аминокислот
состоит в том, что они являются
предшественниками очень многих биомолекул
– не только белков и пептидов, но и
углеводов, некоторых липидов, гетероциклов,
многих молекул биорегуляторов
(рис.3.3).
Это объясняется тем, что
аминокислоты вступают в самые разнообразные
реакции.
Каждая из этих минорных аминокислот
представляет собой химическую модификацию
основных протеиногенныхаминокислот,
например гидроксипролин или
гидроксилизин.
Вжной биологической
ролью аминокислот является способность
поддерживать определенные буферные
свойства клеточного содержимого,
поскольку аминокислоты содержат
функциональные группы, ионизирующиеся
при различных значениях pH.
Важнейшая функциональная роль аминокислот
состоит в том, что они являются
предшественниками очень многих биомолекул
– не только белков и пептидов, но и
углеводов, некоторых липидов, гетероциклов,
многих молекул биорегуляторов
(рис.3.3).
Это объясняется тем, что
аминокислоты вступают в самые разнообразные
реакции.
Рис. 3.3 Основные функции аминокислот в организме
В тканях организма легко осуществляется ферментативная окислительно-восстановительная реакция, обусловленная наличием в цистеине реакционноспособной SH-группы:
цистеинредуктаза
Свойство данной аминокислоты окисляться придает ей защитные и радиопротекторные свойства. В присутствии цистеина снижается интенсивность окислительных процессов в липидах и белках, повышается устойчивость организма к ионизирующим излучениям и стабилизируется качество принимаемых лекарственных препаратов. При участии двух остатков цистеина в полипептидных цепях образуются дусильфидные связи, которые обуславливают биологическую активность или функциональные свойства белков в составе пищи. Особо важную роль дусильфидные связи играют в белках пшеницы, так как они придают клейковине упругие свойства (см. Белки злаков).
Основная физиологическая роль другой серосодержащей аминокислоты – метионина – связана с наличием лабильной метильной группы. Отдавая группу – CH3 через образование S-аденозилметионина, метионин принимает участие в синтезе глицерофосфолипидов.
Серин синтезируется их глицина под действием фермента, содержащего тетрагидрофиолевую кислоту (ТГФК).
Глицин является предшественником пуринового кольца гемв крови и образует так называемые парные соединения. С желудочными кислотами, например холевой кислотой, он образует гликохолевую кислоту, с бензойной кислотой – гиппуровую кислоту:
Бензойная кислота
глицин
Гиппуровая кислота
Гликохолевая кислота принимает участие в процессе усвоения липидов, а в форме гиппуровой кислоты из организма выводится токсичная бензойная кислота.
Три аминокислоты – аргинин, глицин и метионин – участвуют в синтезе креатина – соединения, с помощью которого в мышечной ткани происходит непрерывный ресинтез макроэрга АТФ.
При участии креатина в организме человека и животных образуется креатинофосфат, который по мере необходимости отдает свою фосфатную группу молекулам АДФ, превращаясь в креатинин:
Креатин +ATP Креатинфосфат + ADP
креатинфосфат
креатинин
Креатин и циклический креатинин входят в состав мясного экстракта, их соотношение зависит от pH среды и температуры. Так, при нагревании мяса в кислой среде в экстракте преобладает креатинин.
Реакции декарбоксилирования аминокислот приводят к образованию биогенных аминов. Это биологически активные соединения, которые выполняют различные регуляторные функции. Примером могут быть биогенные амины, образующиеся из тирозина, триптофана, глутаминовой кислоты или гистидина. Так, гистамин известен своим участием в различных аллергических реакциях, а производные тирамина гидроксилируются и превращаются в ряд соединений, называемых катехоламинами (ДОФА, норадреналин, адреналин), которые известны как медиаторы возбуждающего действия в нервной системе.
Ниже приведены реакции образования катехоламинов из тирозина.
тирозин
ДОФА
дофамин
норадреналин
адреналин
Катехоламины обладают разносторонним физиологическим действием, например адреналин усиливает работу сердечной мышцы, снижает кровяное давление, регулирует углеводный обмен.
Другой пример образования биогенных аминов и их производных приведен на схеме, показывающей реакции метаболизма триптофана (рис. 3.4). Биогенные амины, образующиеся из триптофана, называют индоламинами, они оказывают тормозное влияние на многие физиологические процессы (например, у животных, впадающих в спячку, повышено содержание серотонина в крови), они влияют на поведение при психических заболеваниях или являются галлюциногенами (например, N, N-диметилсеротонин).
Производное триптофана – N-ацетил-5-метокситриптамин – это гормон щитовидной железы (эпифиза), влияющий на поведение.
5-гидрокситриптофан
гидроксилирование
триптофан
5-гидрокситриптамин
(серотонин)
триптамин
Из тирозина и триптофана, содержащихся в пище, при участии микробных ферментов в кишечнике образуются ядовитые продукты – крезол, фенол, скатол, индол, обезвреживание которых происходит в печени путем связывания с серной или глюкуроновой кислотой с образованием нетоксичных (парных) кислот, например фенолсерной кислоты.
Н
норадреналин
езаменимая аминокислота триптофан служит предшественником никотиновой кислоты – гормона роста растений. Серотонин, обладая сосудосдерживающим действием, синтезируется в клетках кишечника и нервной ткани. Из организма он выводится в виде индолилуксуснойуксусной кислоты (ГИУК).Фундаментальную роль в обмене веществ живых организмов играют глутаминовая и аспарагиновая кислоты. Они участвуют в процессах расщепления, синтеза и переноса, часто в форме амидов.
Глутамин, например, является основной формой переноса аммиака в крови человека и вместе с аспарагиновой кислотой служит предшественником пиримидинового кольца нуклеотидов. Азот 1 происходит из аспарагиновой кислоты, азот 3 – из глутамина, углерод 4, 5, 6 кольцу отдает аспарагиновая кислота, а углерод 2 происходит от CO2. Предварительно молекула CO2 и амидная группа глутамина образуют карбамоилфосфат:
Реакции декарбоксилирования глутаминовой кислоты с образованием γ-аминомасляной кислоты(ГАМК), относящейся к группе медиаторов, отводится важная роль в обмене веществ мозга и нервной ткани.
ГАМК – тормозной нейромедиатор, влияющий на передачу импульсов в нервной системе, при этом глутаминовая кислота и ГАМК действуют как антагонисты: первая активирует, а ГАМК ингибирует передачу нервных импульсов.
Цекарбоксилирование аспаргиновой кислоты обеспечивает синтез β-аланина, являющегося составной частью биологически активных соединений – КоА и АПБ, а декарбоксилирование лизина и орнитина под влиянием ферментов кишечной микрофлоры приводит к образованию ядовитых диаминов – кадаверина и путресцина. В здоровом организме оба амина полностью обезвреживаются в слизистой оболочке кишечника.
Декарбоксилирование гистидина приводит к гистамину, который образуется в организме в ответ на действие аллергенов и вызывает аллергическую реакцию, вследствие чего лекарственные средства против аллергии получили название антигистаминных препаратов. Вследствие того, что антигистаминные препараты тормозят декарбоксилирование гистидина, аллергические реакции ослабевают. Кроме того, гистамин образуется также при болевых реакциях.
Реакция гидроксилирования тирозина является ключевой при образовании гормонов щитовидной железы (трииодотиронина, тироксина) (рис. 3.5).
3, 3′, 5′ – трийодтиронин (Т3)
Аминокислоты и их роль в организме. Биологическая химия
Аминокислоты и их роль в организме
Аминокислоты – органические карбоновые кислоты, у которых как минимум один из атомов водорода углеводородной цепи замещен на аминогруппу.
В природе встречается примерно 300 аминокислот. Многие из них найдены только в определенных организмах, а некоторые – только в одном каком-либо организме. В организме человека содержится около 60 различных аминокислот и их производных.
Аминокислоты делятся на две группы: протеиногенные (входящие в состав белков – их 20) и непротеиногенные (не участвующие в образовании белков).
Приняты три классификации аминокислот:
1. Структурная – по строению бокового радикала;
2. Электрохимическая – по кислотно-основным свойствам;
3. Биологическая – по степени незаменимости аминокислот для организма.
Незаменимые аминокислоты не могут синтезироваться организмом из других соединений, поэтому они обязательно должны поступать с пищей. Абсолютно незаменимых аминокислот для человека восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.
Частично заменимыми аминокислотами являются – аргинин и гистидин.
Модифицированные аминокислоты, присутствующие в белках
Модификация аминокислотных остатков осуществляется уже в составе белков, т. е. только после окончания их синтеза.
В молекуле коллагена присутствуют:
1. 4-гидроксипролин
2. 5-гидроксилизин
Введение дополнительных функциональных групп в структуру аминокислот придает белкам свойства, необходимые для выполнения ими специфических функций. Так ?-карбоксиглутаминовая к-та входит в состав белков, участвующих в свертывании крови. Две близко лежащие карбоксильные группы необходимы для связывания белка с ионами Са2+. Нарушение карбоксилирования глутамата приводит к снижению свертывания крови.
Аминокислоты как лекарственные препараты
Аминокислоты нашли самостоятельное применение в качестве лекарственных средств. Ниже приводится их краткая фармакологическая характеристика.
Глутаминовая кислота стимулирует процессы окисления в организме, способствует обезвреживанию и выведению из организма аммиака, активирует синтез ацетилхолина и АТФ, является медиатором, стимулирующим передачу возбуждения в синапсах ЦНС. Применяется главным образом при лечении заболеваний ЦНС: эпилепсии, реактивных состояний, протекающих с явлениями истощения и депрессии, церебральных параличей, болезни Дауна и др.
Метионин – незаменимая аминокислота, необходимая для поддержания роста и азотистого баланса организма, обладает липотропным действием, повышает антитоксическую функцию печени. Применяют метионин для лечения и предупреждения заболеваний и токсических поражений печени, а также при хроническом алкоголизме, сахарном диабете, атеросклерозе и др.
Орнитин снижает концентрацию аммиака в плазме крови, способствует нормализации кислотно-щелочного равновесия в организме. Назначают для лечения гепатита, цирроза печени, печеночной энцефалопатии, печеночной комы, поражений печени алкогольного генеза.
Гистидин – незаменимая аминокислота, в организме подвергается декарбоксилированию с образованием гистамина. Гистидина гидрохлорид предложен для лечения язвенной болезни желудка и двенадцатиперсной кишки, а также атеросклероза.
Глицин – центральный нейромедиатор тормозного типа, оказывает успокаивающее действие, улучшает метаболические процессы в тканях мозга. Рекомендован как средство, ослабляющее влечение к алкоголю, уменьшающее явление абстиненции у больных хроническим алкоголизмом.
Цистеин участвует в обмене веществ хрусталика глаза и предложен для задержки развития катаракты и просветления хрусталика при начальных формах катаракты.
Таурин способствует улучшению энергетических процессов в организме, в ЦНС играет роль тормозного нейромедиатора, обладает противосудорожной активностью. Одной из характерных особенностей таурина является его способность стимулировать репаративные процессы при дистрофических нарушениях сетчатки глаза, травматических поражениях тканей глаза.
Цитруллин – аминокислота, участвующая в биосинтезе мочевины в орнитиновом цикле. Способствует нормализации обмена веществ и активации неспецифических защитных факторов организма. Применяется для симптоматической терапии функциональной астенин (при переутомлении, усталости, в послеоперационном периоде, у спортсменов и т.п.).
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесАминокислоты для здоровья | Гомельский областной ЦГЭ и ОЗ
В природе существует более 500 различных аминокислот, из них всего 20 входят в состав белка. Аминокислотами называют гетерофункциональные соединения, содержащие одновременно амино- и карбоксильную группы в составе одной молекулы. Они хорошо растворимы в воде и нерастворимы в органических растворителях.
Аминокислоты участвуют во всех жизненных процессах. Это те самые кирпичики из которых состоит белок. В человеческом теле практически все органы состоят из белков – это и мышцы, и различные соединительные ткани, внутренние органы, железы, ногти, волосы, кожа, кости и жидкости. Некоторые белки содержат все незаменимые аминокислоты в количестве, достаточном для организма человека и животных. Такие белки называются биологически полноценными.
Организм синтезирует аминокислоты самостоятельно. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты являются незаменимыми. Всего насчитывается 8 незаменимых аминокислот: лейцин, валин, изолейцин, лизин, фенилаланин, треонин, метионин и триптофан. Такие аминокислоты должны поступать в организм извне. В случае отсутствия или недостатка в рационе питания незаменимых аминокислот в организме нарушается белковый синтез.
Условно-незаменимые аминокислоты синтезируются в организме в небольшом количестве. Этого недостаточно для здорового функционирования организма, поэтому они должны дополнительно поступать либо с пищей, либо с пищевыми добавками. К этой группе относятся аргинин и гистидин.
Аргинин – аминокислота, которая вырабатывается организмом здорового взрослого человека самостоятельно, но у младенцев и пожилых людей синтез этого вещества существенно снижен. Аргинин выступает стимулятором роста у детей и подростков, а также может быть показан при беременности при малом весе плода. Основная функция аргинина состоит в его способности повышать уровень оксида азота, т.е. он обеспечивает гибкость сосудов, поддерживает их тонус, улучшает циркуляцию крови, что приводит к лучшему снабжению тканей и органов (орехи, особенно арахис и кедровые орехи, тыквенные и кунжутные семечки, немного меньше его в рыбе, птице, в мясных и молочных продуктах).
Гистидин способствует восстановлению поврежденных тканей, образованию лейкоцитов и эритроцитов, строительству миелиновых оболочек клеток. Эта аминокислота необходима в период с рождения до двадцати одного года, а также в периоды восстановления после перенесенных тяжелых заболеваний и травм. Дефицит гистидина может спровоцировать проблемы со слухом, а избыток – развитие неврозов и даже психозов (орехи, семечки, бананы, сухофрукты, бобовые, молочные продукты (особенно сыр), рыба (особенно лосось и тунец), мясе домашней птицы, говядине (филе), свинине (вырезка).
В отдельную группу выделяют условно-заменимые аминокислоты – цистеин и тирозин, их синтез осуществляется при наличии незаменимых аминокислот. При недостатке предшественников эти аминокислоты могут стать незаменимыми.
Цистеин в организме производится из незаменимой аминокислоты метионин и при его недостатке также может стать незаменимой аминокислотой. Цистеин необходим организму для производства таурина, который регулирует работу нервной системы, и глутатиона, отвечающего за иммунную систему организма. Цистеин входит в состав коллагена, кератина, инсулина, при необходимости может трансформироваться в глюкозу, наполняя организм энергией, регулирует давление, снижает холестерин в крови, выводит из организма токсические вещества.
Тирозин вырабатывается в здоровом организме из незаменимой аминокислоты фенилаланин. Он регулирует синтез гормонов щитовидной железы, надпочечников, гипофиза. Улучшает мыслительные процессы, памяти, помогает противостоять стрессовым ситуациям, а также поддерживает хорошее настроение. Отвечает за выработку пигмента меланина, благодаря которому мы имеет тот или иной цвет волос, кожи. Для спортсменов важно также, что тирозин участвуя в синтезе белка, способствует росту мышечных тканей, ускоряет восстановление после тяжелой физической нагрузки.
Незаменимые аминокислоты
| Аминокислота | Значение | Содержание |
| Лейцин | выработка инсулина, строительный материал для белка мышц | соевый белок, молочный белок – казеин и сывороточный белок. |
| Изолейцин | в меньшей степени активирует рост мышечной ткани, в большей снабжает их глюкозой, участвует в синтезе гемоглобина, для усвоение изолейцина и лейцина необходим биотин (витамин B7) | миндаль, кешью, куриное мясо, нут, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, сои. |
| Метионин | необходим для выработки и таурина, для синтеза креатина, коллагена, участвует в синтезе серотонина, а также способствует выработке адреналина. помогает печени в переработке жиров, выведению тяжелых металлов, метионин снижает уровень гистамина в крови | бразильские орехи, говядина, свинина, курица, кролик, морская рыба, бобовые, яйцах, творог, молоко, кефир, сыр твердых сортов |
| Фенилаланин | тирозин вырабатывается только из фенилаланина, образует дофамин и другие катехоламины, снижает депрессивные симптомы, продукты метаболизма фенилаланина обладают токсическим эффектом и при значительном избытке этой аминокислоты возможно негативное влияние на нервную систему | белки сои, сыр твердых сортов, орехи и семена растений, мясо (говядина, птица) и рыба (тунец), яйца, молочные продукты, фасоль и зерновые культуры |
| Триптофан | триптофан (точнее примерно 1 % от общего количества, поступающего с пищей) перерабатывается в серотонин, часть которого преобразуется в мелатонин (гормон сна). При недостатке сокращается синтез белков и ниацина (витамин B3), как следствие может развиться пеллагра. Серотонин способен повышать болевой порог и снимать состояния тревожности, беспокойства, а мелатонин понижает интенсивность многих физиологических процессов и способствует наступлению глубокого и спокойного сна. | икра (красная и черная), голландский сыр, арахис и другие орехи, соевые бобы и другие бобовые (фасоль, горох), мясо курицы, кролика и индейки, кальмары, ставрида, сельдь, лосось и треска, а также куриные яйца, творог (и другие молочные продукты) и шоколад. |
| Треонин | необходим для синтеза серина и глицина, треонин входит в состав зубной эмали, избыток приводит к накоплению мочевой кислоты | мясо, птица, яйца, сыр, жирная морская рыба, морепродукты, грибах, чечевица, фасоль, пшеница, рожь, гречка, орехи. |
| Лизин | синтез почти всех видов белков, он выполняет важнейшие функции в организме – в частности, обеспечивает работу иммунной системы, составляя существенную часть коллагена, поддерживает необходимый баланс азота, участвует в усвоении кальция в пищеварительном тракте, без лизина невозможен синтез многих гормонов, ферментов | бобовые, куриц, сом говядина, молоко и молочные продукты, яйца, семечки и орехи |
| Валин | участвует в синтезе белка, защищает миелиновые оболочки нервных волокон, улучшает нервные процессы, участвует в азотистом обмене, защищает миелиновые оболочки нервных волокон, препятствует снижению уровня серотонина, участвует в азотистом обмене. | яйца, сыр, икра красная, соя (зерно), чечевица, арахис, горбуша, фисташки, молоко сухое. |
Толкачёва Екатерина Александровна,
отдел общественного здоровья государственного учреждения
«Гомельский областной центр гигиены, эпидемиологии и общественного здоровья»
Аминокислоты в питании человека Текст научной статьи по специальности «Фундаментальная медицина»
lectures
АМИНОКИСЛОТЫ В ПИТАНИИ ЧЕЛОВЕКА
Лысиков Ю.А.
ГУ Институт питания РАМН, Москва
Лысиков Юрий Александрович 109240 Москва, Устьинский проезд, д. 2/14 E-mail: yl20@mail.ru
РЕЗЮМЕ
В статье представлены данные о метаболизме аминокислот в организме человека. Рассмотрена структура и свойства аминокислот, критерии незаменимости, вклад аминокислот в энергетику организма, специфические функции аминокислот, потребность в аминокислотах.
SUMMARY
The article presents data on amino acids metabolism in human organism. The review described structure and function of amino acids, essentiality criteria, amino acids energy source role, amino acids specific functions, amino acids requirements.
CO CO
СТРУКТУРА И СВОЙСТВА АМИНОКИСЛОТ
Известно около 200 природных аминокислот, из них только 20 входят в состав белков. Эти аминокислоты называют протеиногенными — строящими белки. В организме человека наряду с протеиногенными аминокислотами можно найти и другие, которые играют иную роль, например, орнитин, в-аланин, таурин и др.. Многие из протеиноген-ных аминокислот в организме человека выполняют важные самостоятельные функции, например, глицин, глютаминовая и аспарагиновая кислоты являются биологически активными соединениями, фенилаланин, тирозин и триптофан служат источником образования биогенных аминов и других биорегуляторов, глицин и таурин входят в состав желчных кислот.
Первая аминокислота, аспарагин, была открыта еще в 1806 году. Последней из обнаруженных известных аминокислот оказался треонин, который
соон
Н — С — 1ЧН2
Рис. 1. Общая структурная формула аминокислоты
удалось выделить лишь в 1938 году. Каждая аминокислота имеет тривиальное (традиционное) название, иногда связанное с источником происхождения. Например, аспарагин впервые был обнаружен в аспарагусе, глютаминовая кислота — в клейковине (глютене) пшеницы. Глицин был назван так за сладкий вкус (от греческого glykos — сладкий). В пищевых продуктах наиболее распространены 22 аминокислоты.
Все 20 аминокислот, которые входят в состав белка, характеризуются общей структурной особенностью — наличием карбоксильной группы (-СООН) и аминогруппы (-№И2), связанной с одним и тем же атомом углерода и различаются структурой боковых цепей групп) (рис. 1). Почти все аминокислоты содержат по одной карбоксильной и аминогруппе. Однако имеются аминокислоты, которые могут содержать две карбоксильные (дикарбоновые аминокислоты) или две аминогруппы (диаминоами-нокислоты). Большинство аминокислот являются а-аминокислотами, в отличие от в-аминокислот, таких как в-аланин и таурин.
Стереоизомеры аминокислот. Из-за асимметрии молекулы все а-аминокислоты, за исключением
глицина, могут существовать в форме двух Б- или Ь-стереоизомеров — оптических изомеров, которые представляют собой зеркальные изображения друг друга. В ходе биосинтеза белка в его состав попадают только Ъ-аминокислоты. Следует подчеркнуть, что присутствие в составе белка Ъ-аминокислот определяет его структуру и свойства. Б-аминокислоты никогда не включаются в белки в процессе биосинтеза. В то же время в составе белка можно обнаружить и Б-аминокислоты. Причина этого парадокса
заключается в том, что для аминокислот характерна медленная самопроизвольная неферментативная рацемизация, в результате которой в составе белка появляются Б-аминокислоты. По этой причине структура белка со временем начинает меняться, могут изменяться и его свойства. Это является одним из механизмов старения белков, что вызывает необходимость их непрерывного обновления.
Таблица 1
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ [2; 3]
Химическая структура Полярность боковой цепи Изоэлектри-ческая точка р! Молекулярная масса , г/моль Степень гидрофильности Полярность боковой цепи
1. Алифатические Высокогидрофильные
Алании -1,9 6,0 89 Глютамин +9,4
Валин* -2,0 6,0 117 Аспарагин +9,7
Глицин -2,4 6,0 75 Глютаминовая кислота +10,2
Изолейцин* -2,2 5,9 131 Гистидин +10,3
Лейцин* -2,3 6,0 131 Аспарагиновая кислота +11,0
2. Серосодержащие Лизин* +15,0
Метионин* -1,5 5,7 149 Аргинин +20,0
Цистеин -1,2 5,0 121 Умеренно гидрофильные
3. Ароматические Треонин* +4,9
Тирозин +6,1 5,7 181 Серин +5,1
Триптофан* +5,9 5,9 204 Триптофан* +5,9
Фенилаланин* +0,8 5,5 165 Пролин +6,0
4. Оксиаминокислоты Тирозин +6,1
Серин +5,1 5,7 105 Высокогидрофобные
Треонин* +4,9 5,6 119 Цистеин -1,2
5. Дикарбоновые (кислые) Метионин* -1,5
Аспарагиновая кислота +11,0 2,8 133 Аланин -1,9
Глютаминовая кислота +10,2 3,2 147 Валин* -2,0
6. Амиды дикарбоновых кислот Изолейцин* -2,2
Аспарагин +9,7 5,4 132 Лейцин* -2,3
Глютамин +9,4 5,7 146 Глицин -2,4
7. Диаминоаминокислоты (основные) Фенилаланин* +0,8
Аргинин +20,0 10,9 174
Гистидин +10,3 7,6 155
Лизин* +15,0 9,7 146
8. Иминокислота
Пролин +6,0 6,3 115
о
СО
Примечание: * — незаменимые аминокислоты.
сэ
о
Биосинтез Ь-аминокислот в клетках организма происходит с помощью стереоспецифических ферментов, которые имеют асимметричные активные центры. При химическом синтезе аминокислот с одинаковой скоростью образуются как Б-, так и Ь-стереоизомеры. В результате получается рацемическая (одинаковая по составу) смесь разных стереоизомеров аминокислот. Рацемическую смесь аминокислот можно разделить на Б- и Ь-стереоизомеры, но это дорого. Поэтому полученные искусственным путем препараты аминокислот могут содержать не только необходимые организму Ь-аминокислоты, но и Б-стереоизомеры. Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
По химической структуре можно выделить 8 классов аминокислот (табл. 1):
1. Алифатические аминокислоты (аланин, ва-лин, глицин, изолейцин и лейцин) отличаются тем, что их боковые цепи содержат лишь атомы углерода и водорода.
У валина, изолейцина и лейцина боковая цепь разветвляется, их еще называют аминокислотами с разветвленной цепью.
2. Серосодержащие аминокислоты (метионин и цистеин) содержат атомы серы. При этом место серы может занимать атом селена.
3. Ароматические аминокислоты (тирозин, триптофан и фенилаланин) содержат ароматические циклические группы.
4. Оксиаминокислоты (серин и треонин) содержат -ОН-группы.
5. Дикарбоновые аминокислоты (аспарагино-вая и глютаминовая кислоты) содержат две карбоксильные группы
6. Амиды дикарбоновых аминокислот (аспа-рагин и глютамин) содержат атом азота в составе второй карбоксильной группы.
7. Диамино-, или двуосновные, аминокислоты (аргинин, гистидин и лизин) содержат две аминогруппы.
8. «Аминокислота» пролин занимает особое положение, поскольку, аминокислотой не является. По своей структуре это иминокислота и включает циклическое имидазольное кольцо. Благодаря циклической группе пролин вызывает изгибы в полипептидной цепочке белка, что очень важно, например, для структуры белка соединительной ткани коллагена, где пролина очень много.
Благодаря наличию карбоксильной и аминогруппы в водных растворах все аминокислоты ионизированы и ведут себя одновременно как кислоты и как основания. В водной среде организма свободные аминокислоты играют роль буферных веществ, стабилизируя рН среды. При этом растворимость в воде и степень гидрофильности разных аминокислот существенно различается. По степени
гидрофильности — способности связывать молекулы воды аминокислоты можно разделить на [2]:
1. Высокогидрофильные: аспарагин, аспара-гиновая кислота, аргинин, гистидин, глютамин, глютаминовая кислота и лизин, которые почти всегда располагаются на внешней поверхности молекул белка.
2. Умеренно гидрофильные: пролин, серин, тирозин, треонин и триптофан. Они занимают промежуточное положение, отличаясь определенной гидрофильностью.
3. Гидрофобные: аланин, валин, глицин, изо-лейцин, лейцин, метионин, цистеин и фенилала-нин, которые располагаются в основном внутри молекул белка.
Гидрофильность аминокислот во многом зависит от их полярности, которая связана с величиной заряда их боковых групп. Пять алифатических аминокислот (аланин, валин, глицин, изолейцин и лейцин) содержат слабо полярные боковые группы. Слабую полярность имеют серосодержащие аминокислоты (метионин и цистеин), а также одна из ароматических аминокислот — фенилаланин. Благодаря гидрофобности эти аминокислоты плохо растворяются в воде. Остальные аминокислоты содержат заряженные положительно полярные боковые группы и поэтому они более гидрофильны и хорошо растворяются в воде. Полярность аминокислот оказывают существенное влияние на структуру белка, его свойства и функции. Следует подчеркнуть, что большинство гидрофобных аминокислот являются незаменимыми (валин, изолейцин, лейцин, метионин и фенилаланин). Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Онкотическое давление. Гидрофобные аминокислоты, как правило, располагаются внутри молекулы белка, тогда как гидрофильные — на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка. Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток. Гидрофильность белков крови обеспечивают онкотическое давление, которое удерживает жидкость в кровеносных сосудах. При уменьшении содержания белка в организме человека в первую очередь уменьшается количество плазменных белков, что приводит к снижению он-котического давления крови, выходу жидкости из кровеносной системы в межклеточное пространство, что может приводить к возникновению безбелковых (голодных) отеков. Гидрофильность пищевых белков обеспечивает их способность набухать, образовывать студни, эмульсии и пены. Гидрофильность белков клейковины злаков определяет качество зерна и его хлебопекарные свойства.
Нестандартные аминокислоты в составе белка. Кроме 20 стандартных аминокислот, которые присутствуют почти во всех белках, существуют так называемые нестандартные аминокислоты, которые
встречаются лишь в некоторых из них. Причем, каждая из этих аминокислот представляет собой производное одной из обычных. К нестандартным аминокислотам относят: производное пролина — 4-гидроксипролин и 5-гидроксипролин. Обе аминокислоты входят в состав коллагена. В мышечном белке миозине присутствует производное лизина — Nметиллизин. Другое производное лизина — аминокислота десмозин (комплекс из четырех молекул лизина — тетрапептид) содержится только в фибриллярном белке соединительной ткани — эластине. В белке протромбине, а также в некоторых других белках, которые активно связывают ионы кальция, присутствует у-карбоксиглютаминовая кислота.
Особо следует остановиться на серосодержащей аминокислоте цистеине. Она может находиться в составе белка в двух формах: либо в форме цисте-ина, либо в форме дипептида — цистина, который представляет собой комплекс из двух молекул ци-стеина, ковалентно связанных друг с другом при помощи дисульфидного мостика. Благодаря этому свойству цистеин выполняет важную функцию по стабилизации структуры белковой молекулы. Цистеин играет ключевую роль в формировании инсулина и иммуноглобулинов (антител). В этих белках благодаря дисульфидным цистеиновым мостикам соединяются разные полипептидные цепи в одну молекулу белка. Такие поперечные связи обычно отсутствуют во внутриклеточных белках, но широко представлены в секреторных белках. Разрушение дисульфидных связей в кератине, формирующем структуру волос, лежит в основе процесса химической завивки. Для этого используют тиоловые соединения, под действием которых происходит разрыв поперечных дисульфидных связей в кератине. После укладки волос действие кислорода воздуха приводит к образованию новых поперечных связей, которые закрепляют новую форму волос.
Функциональная классификация аминокислот. С физиологических позиций аминокислоты можно разделить на:
• Протеиногенные, которые входят в состав белка (20 аминокислот), и непротеиногенные, не входящие в состав белка, но выполняющие в организме человека другие важные функции.
• Заменимые (8 аминокислот) и незаменимые (12 аминокислот). О них мы будем говорить ниже.
• Глюкогенные, которые превращаются в глюкозу и далее в гликоген или расщепляются по пути метаболизма глюкозы с образованием АТФ. Глюкогенными, в той или иной степени, являются подавляющее большинство — 19 аминокислот, за исключением лейцина.
• Кетогенные, которые могут превращаться в кетоновые тела (короткоцепочечные жирные кислоты). Кетогенными являются 6 аминокислот: изолейцин, лейцин, лизин, тирозин, триптофан и фенилаланин.
АМИНОКИСЛОТЫ КАК ИСТОЧНИКИ ЭНЕРГИИ
Известно, что при полном окислении 1 г белка (или смеси аминокислот) в калориметрической бомбе в среднем образуется 5,65 ккал. Углерод аминокислот окисляется до СО2, водород — до Н2О, а азот — до NО2. Однако в организме человека энергию в форме АТФ можно получить только при окислении углеводородной составляющей аминокислот. Поэтому из 5,65 ккал организму будут доступны только 4,3 ккал, а оставшаяся часть (1,3 ккал) является энергией окисления азота. В настоящее время установлено, что действительная энергетическая ценность белка колеблется от 1,82 до 4,27 ккал/г, однако за эталон принимают цифру 4,0 ккал/г [4]. Существенные различия в энергетической ценности белка связаны, с одной стороны, с различной молекулярной массой аминокислот, а с другой — с разными путями и механизмами их окислительного метаболизма (рис. 2).
Считают, что белки (аминокислоты) могут обеспечить 11-14% энергии суточного рациона. Например, при суточной калорийности в 2500 ккал на белок может приходиться 275-350 ккал, что должно соответствовать 69-88 г белка. Однако все пищевые аминокислоты не могут полностью окисляться с образованием энергии. Значительная часть энергии теряется в процессе кругооборота и метаболизма аминокислот. Поэтому эффективность использования энергии пищи организмом человека, как полагают, составляет около 20-25% [4].
Аминокислоты мышечных белков, а также сывороточные и другие белки являются важным источником образования глюкозы и метаболической энергии в форме АТФ. При длительном голодании это приводит к массивному распаду мышечного белка и снижения содержания белка и его фракций в сыворотке крови. Диеты с низким (недостаточным) количеством углеводов также ведут к деградации мышечных и сывороточных белков.
В биосинтезе глюкозы участвуют в основном заменимые аминокислоты — 10-25% и только 1% незаменимых аминокислот. В организме человека углеродные скелеты некоторых аминокислот могут непосредственно превращаться в пируват или в промежуточные продукты цитратного цикла (окса-лоацетат, сукцинил-КоА, кетоглутарат и фума-рат) с освобождением энергии в дыхательной цепи митохондрий (табл. 2). При этом оксалоацетат может превращаться в фосфоенолпируват и по пути глюконеогенеза — в глюкозу. Источником глюкозы может стать и пируват [5]. Таким образом, разные глюкогенные аминокислоты могут включаться в пути обмена глюкозы (гликолиз и глюконеогенез) на разных его этапах. Судьба разных аминокислот
го
О 2
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолп и руват
оксалоацетат
го
го
0 ^
2
го
1
I
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолпируват
оксалоацетат
Пируват
аминокислоты
Ацетил-КоА
I
ЦИТРАТНЫЙ ЦИКЛ сукцинил КоА, кетоглутарат, фумарат, оксалоацетат
ДЫХАТЕЛЬНАЯ ЦЕПЬ
ЭНЕРГИЯ
Рис. 2. Пути метаболизма глюкогенных аминокислот
о
неодинакова: одни из них могут превращаться в глюкозу и далее в гликоген, тогда как другие, минуя глюкозу, могут непосредственно окисляться до СО2 и Н2О с образованием АТФ.
Установлено, что из 100 г аминокислот может образовываться только 57 г глюкозы. При голодании в первые 3-4 дня из аминокислот в среднем в сутки образуется около 41 г глюкозы, а спустя несколько недель голодания образование глюкозы снижается до 16 г в сутки. При сахарном диабете 2-го типа превращение глюкогенных аминокислот в глюкозу происходит с гораздо большей скоростью, чем у здоровых людей [5]. Как следствие этого у больных диабетом с мочой выводится большое количество мочевины, которая образуется при дезаминировании глюкогенных аминокислот. В критических состояниях скорость глюконеогенеза с использованием аминокислот также существенно возрастает.
Среди аминокислот наиболее эффективно превращаются в глюкозу серин, аланин и пролин, тогда как глютамин, который широко используется в энтеральном и парентеральном питании, стоит на четвертом месте (табл. 3).
Важную роль в процессах глюконеогенеза играет так называемый цикл аланина, который характерен для мышечной ткани (рис. 3). При дефиците глюкозы в организме или при голодании усиливается катаболизм мышечных белков с освобождением свободных аминокислот, около 50% которых составляет аланин [2]. Аланин поступает в печень, где из него образуется пируват, который включается в глюконеогенез. Когда в мышечной ткани возобновляется биосинтез белка, возникает потребность в аланине, который начинает синтезироваться из пирувата. В свою очередь источником пирувата является глюкоза, из которой он образуется в результате гликолиза. Таким образом, аланин завершает свой кругооборот:
НЕЗАМЕНИМОСТЬ АМИНОКИСЛОТ
Говоря о значении различных аминокислот для организма человека, необходимо рассмотреть понятие незаменимости. Основным критерием в определении биологической ценности аминокислот является их способность поддерживать рост животных и человека, что связано с биосинтезом белка в организме. Исключение из пищевого рациона хотя бы одной из таких аминокислот, при сохранении содержания остальных, влечет за собой задержку роста и снижение массы тела растущего организма. Поэтому незаменимыми аминокислотами считают такие, которые «либо не синтезируются в организме, или синтезируются со скоростью, недостаточной или не соответствующей обмену веществ,
S Lr
обеспечивающих пластические и регенера- sj
тивные процессы, связанные с образованием ц
новых клеток и тканей» [6]. <
Согласно классическим исследованиям Rose, для взрослого здорового человека жизненно необходимыми являются 8 аминокислот, которые стали считать незаменимыми (табл. 4). Полагают, что эти аминокислоты не образуются в организме человека и обязательно должны поступать с пищей.
Остальные 12 аминокислот считают заменимыми. К ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, гистидин, глицин, глютамин, глютами-новую кислоту, пролин, серин, тирозин и цистеин. Эти аминокислоты, как полагают,
катаболизм белка t! глюконеогенез
БЕЛОК аланин пируват ГЛЮКОЗА
анаболизм белка МЫШЕЧНАЯ ТКАНЬ гликолиз ПЕЧЕНЬ
Рис. 3. Цикл аланина Таблица 2
СУДЬБА ГЛЮКОГЕННЫХ АМИНОКИСЛОТ [5]
Аминокислоты Превращаются в: Результат
Аланин, глицин, серин, треонин, цистеин Пируват Глюкоза/АТФ
Аспарагин, аспарагиновая кислота Оксалоацетат Глюкоза/АТФ
Валин, изолейцин, метионин, триптофан Сукцинил-КоА АТФ
Аргинин, гистидин, глутамин, глутаминовая кислота, пролин Кетоглутарат АТФ
Аспарагиновая кислота, тирозин, фенилаланин Фумарат АТФ
Таблица 3
СКОРОСТЬ ГЛЮКОНЕОГЕНЕЗА В ПЕЧЕНИ ИЗ РАЗЛИЧНЫХ ПРЕДШЕСТВЕННИКОВ [5]
Предшественник Образование глюкозы мк моль/мин г ткани Предшественник Образование глюкозы, мкмоль/мин г ткани
Фруктоза 2,68 Глутамин 0,45
Диоксиацетон 2,07 Треонин* 0,40
Лактат 1,06 Глутамат 0,31
Пируват 1,02 Аргинин 0,27
Серин 0,98 Аспартат 0,23
Аланин 0,66 Изолейцин* 0,22
Пролин 0,55 Орнитин 0,19
Глицерин 0,48 Валин* 0,12
Примечание: * — незаменимые аминокислоты.
m
о
способны синтезироваться в организме человека в достаточном количестве. Наряду с этим выделяют группу аминокислот, которые необходимы человеку в определенные периоды развития и в некоторых физиологических и клинических ситуациях. Эти аминокислоты относят к условно незаменимым (табл. 5).
Другим критерием значимости и биологической ценности аминокислот считают степень их участия в обеспечении азотистого равновесия. Имеются данные о целесообразности выделения третьей группы аминокислот, обладающих свойствами ускорять рост. К их числу относят 7 аминокислот: аргинин, глютаминовую кислоту, пролин, серин, тирозин, триптофан и цистеин.
Заслуживает внимание классификация аминокислот, предложенная Josue de Castro, который разделил их на две группы. В первую группу вошли 5 аминокислот, обеспечивающие рост: аргинин, гистидин, лизин, пролин и цистеин. Во вторую — другие 5 аминокислот, которые необходимы для регенерации тканей: аспарагиновая и глютаминовая кислоты, тирозин, триптофан и фенилаланин [6].
А.Э. Шарпенак относил к незаменимым 12 аминокислот: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, тирозин, треонин, триптофан, фенилаланин и цистеин. По данным Eagle, для культивирования клеток животных и человека необходимы те же 12 аминокислот, но с заменой треонина на глютамин [6].
Таблица 4
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ [6]
Автор Rose Условно незаменимые Ускоряют рост Jose de Castro А.Э. Шарпенак Eagle, 1958
Число 8 6 7 10 12 12
Валин Аспартат Аргинин Рост Аргинин Аргинин
Изолейцин Гистидин Глютамат Аргинин Валин Валин
Лейцин Глютамин Пролин Гистидин Гистидин Гистидин
ЛИЗИН* Таурин Серин Лизин Изолейцин Изолейцин
Метионин Тирозин Тирозин Пролин Лейцин Лейцин
Ами- ТРЕОНИН* Цистеин Триптофан Цистеин Лизин Лизин
лоты Триптофан Цистеин Регенерация Метионин Метионин
Фенилаланин Аспартат Тирозин Тирозин
Абсолютно Глютамат Треонин Глютамин
заменимые Тирозин Триптофан Триптофан
ГЛЮТАМАТ Триптофан Фенилаланин Фенилаланин
СЕРИН Фенилаланин Цистеин Цистеин
Примечание: * — абсолютно незаменимые аминокислоты.
Таблица 5
ФУНКЦИИ УСЛОВНО НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
Аминокислота Функции в организме
Аспартат Необходим для процессов регенерации
Гистидин Необходим для маленьких детей, у которых эндогенный синтез недостаточен
Глютамин Необходим для процессов регенерации, является важным энергетическим субстратом в критических состояниях
Таурин Необходим для новорожденных, у которых эндогенный синтез недостаточен, а также для больных в критических состояниях. Дефицит возникает при недостатке метионина и цистеина
Тирозин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. При нарушении функции почек снижено образование тирозина из фенилаланина
Цистеин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. Дефицит возникает при недостаточном содержании метионина в питании. Крайне необходим при нарушениях функции печени и для больных в критических состояниях
В основе разноголосицы в определении важности и незаменимости тех или иных аминокислот лежат особенности их биосинтеза и метаболизма в организме человека. За исключением двух аминокислот — лизина и треонина, которые являются у человека абсолютно незаменимыми, остальные «незаменимые» аминокислоты в определенных количествах могут синтезироваться за счет реакций трансаминирования, но объем их синтеза является недостаточным.
Ряд незаменимых аминокислот являются предшественниками для синтеза заменимых. Например, из незаменимой аминокислоты фенилаланина синтезируется заменимая аминокислота тирозин, а из незаменимого метионина — заменимый цистеин. Установлено, что до 80-89% метионина может трансформироваться в цистеин, а 70-75% фенилаланина — в тирозин [2]. По этой причине незаменимых аминокислот метионина и фенилаланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищей цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети-онине и фенилаланине.
С метаболических позиций абсолютно заменимыми являются глютаминовая кислота и серин, которые в необходимых количествах синтезируются из кетокислот. Биосинтез остальных «заменимых» аминокислот в организме человека ограничен. По этой и другим причинам полностью обеспечить потребность организма только за счет биосинтеза большинства заменимых аминокислот невозможно. Важно подчеркнуть, что потребность организма в белке, а, стало быть, в аминокислотах — есть величина переменная, которая изменяется на протяжении жизни и может резко возрастать при очень многих физиологических и патологических состояниях.
Подводя итог спорам о важности и незаменимости тех или иных аминокислот, следует подчеркнуть:
• Во-первых, ценность тех или иных аминокислот определяется возможностью их биосинтеза в организме. При этом часть незаменимых аминокислот может синтезироваться в организме, но объем их биосинтеза недостаточен. Разумеется, те аминокислоты, которые ни при каких условиях не образуются в организме и являются абсолютно незаменимыми, должны непрерывно поступать с пищей. Возможности запасания и резервирования лимитирующих аминокислот в составе мышечных белков, альбумина или других белков ограничены.
• Во-вторых, некоторая часть незаменимых аминокислот, помимо пищи, может образовываться при микробиологическом синтезе кишечной микрофлорой и поступать во внутреннюю среду организма.
• В-третьих, физиологическая потребность в незаменимых аминокислотах есть величина переменная и может изменяться в зависимости от активности процессов анаболизма и катаболизма белка, которые, в свою очередь, зависят от уровня физической активности, особенностей обмена веществ, состояния здоровья.
• В-четвертых, обеспечение организма белком и незаменимыми аминокислотами зависит не только от качества, но и режима питания, а также от содержания других компонентов пищевого рациона, например, углеводов. Заменимые аминокислоты занимают
достаточно большой удельный вес в составе белков пищи — до 2/3 суммы аминокислот. В организме человека они выполняют весьма важные функции, причем многие из них играют не меньшую роль, чем незаменимые аминокислоты. Следует подчеркнуть, что хотя заменимые аминокислоты могут образовываться в организме, однако за счет эндогенного биосинтеза обеспечивается лишь минимальная потребность организма. Более того, установлено, что при небольшом потреблении белка в том случае, когда потребность в незаменимых аминокислотах удовлетворяется полностью, лимитирующими становятся заменимые аминокислоты I II [6]. Для обеспечения стабильного азотистого равновесия в организме необходимо примерно в 2 раза больше качественного белка, чем для того, чтобы закрыть потребность в незаменимых аминокислотах. Таким образом, хотя заменимые аминокислоты не являются лимитирующим фактором в белковом питании, но их присутствие в питании также является обязательным. Поступление достаточного количества заменимых аминокислот в составе белков пищи является тем путем, с помощью которого можно обеспечить их оптимальную физиологическую потребность, более легкое и быстрое использования для нужд организма.
ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОТДЕЛЬНЫХ АМИНОКИСЛОТ
В организме человека аминокислоты, помимо строительства белковых молекул, выполняют еще целый ряд важных функций:
• Участвуют в образовании других аминокислот.
• Входят в состав разных природных соединений — коферментов, желчных кислот, антибиотиков.
• Участвуют в образовании гормонов, медиаторов и нейротрансмиттеров.
• Являются источниками метаболитов, принимающих участие в обмене веществ.
К числу медиаторов относятся некоторые аминокислоты (глютаминовая и аспарагиновая кислоты, глицин и дофа), а также биогенные амины.
1-Л
о
<3
о
Биогенные амины образуются при отщеплении от аминокислот карбоксильной группы (реакция декарбоксилирования). К их числу относятся: у-аминомасляная кислота, дофамин, норадреналин, адреналин, серотонин, гистамин. Из триптофана через промежуточный продукт 5-гидрокситриптофан образуется нейромедиатор серотонин. Из глютамино-вой кислоты образуется у-аминомасляная кислота.
Гистамин — важнейший медиатор и нейромедиатор, образуется в основном в тучных клетках и нейтрофильных лейкоцитах и участвует в развитии аллергических и воспалительных реакций. При аллергических реакциях высвобождение гистамина происходит под действием аллергенов, лекарств, некоторых тканевых гормонов. В ЦНС гистамин действует как нейромедиатор. Важным системным эффектом гистамина является расширение кровеносных сосудов, снижение артериального давления и частоты сердечных сокращений. Гистамин также стимулирует секрецию соляной кислоты.
Таблица 6
Адреналин — гормон коры надпочечников, где он образуется из аминокислоты тирозина. Адреналин является ключевым гормоном стресса — «аварийным гормоном» и действует на обмен веществ и сердечно-сосудистую систему: повышает сердечную функцию; сужает сосуды, повышая артериальное давление; расширяет бронхи, увеличивая снабжение кислородом; ускоряет расщепление гликогена до глюкозы, обеспечивая энергией мышечную ткань.
Катехоламины — группа биогенных аминов, которые содержат в качестве общего фрагмента производное фенилаланина — катехол. Все эти вещества берут свое начало от аминокислоты тирозина, из которой первоначально образуется аминокислота дофа (3,4-дигидроксифенилаланин). При ее декар-боксилировании образуется дофамин, который в дальнейшем может превращаться в норадреналин и далее в адреналин. Адреналин выполняет функции, как медиатора, так и гормона [2].
ПРОДУКТЫ МЕТАБОЛИЗМА И СПЕЦИФИЧЕСКИЕ ФУНКЦИИ ОТДЕЛЬНЫХ АМИНОКИСЛОТ [8]
Аминокислота Метаболиты аминокислот Физиологическая функция
Аргинин Образования N0 Креатин Полиамины Молекулярный биорегулятор Предшественник креатинфосфата Экспрессия генов
Аспарагиновая кислота Основа нуклеотида пиримидина Входит в состав нуклеотидов и нуклеиновых кислот
Гистидин Гистамин Нейромедиатор, медиатор воспаления, стимуляция секреции соляной кислоты
Глицин Основа нуклеотида пурина Порфирин Креатин Гиппуровая кислота Гликохолевая желчная кислота Входит в состав нуклеотидов и нуклеиновых кислот Входит в состав гемоглобина и цитохрома Предшественник креатинфосфата Связывание токсических соединений — детоксикация Эмульгирование липидов
Глютаминовая кислота Глютамин у-аминомасляная кислота Транспорт азота в организме, важный источник энергии, предшественник глутатиона Нейромедиатор
Лизин Гидроксилизин Карнитин Составная часть коллагена Транспорт жирных кислот в клетке
Метионин Холин Составная часть фосфолипидов
Серин Этаноламин Холин-ацетилхолин Составная часть фосфолипидов Нейромедиатор
Тирозин Норадреналин-адреналин Тироксин Меланин Нейромедиатор, гормон Гормон щитовидной железы Пигмент кожи и волос
Триптофан Серотонин Никотиновая кислота Нейромедиатор Витамин, составная часть пуриновых нуклеотидов, NAD и NADH
Цистеин Таурин Таурохолевая желчная кислота Антиокислительная активность Предшественник глутатиона
В процессе обмена веществ отдельные аминокислоты превращаются в метаболиты, которые выполняют важные функции в организме человека.-имидазолилпролиновая кислота) выделен в 1896 году. В значительном количестве содержится в гемоглобине, а также входит в состав карнозина и ансерина. По этой причине недостаток гистидина приводит к снижению уровня гемоглобина. Гемоглобин является одним из резервов гистидина в организме и при недостатке гистидина происходит повышенное разрушение гемоглобина, в результате которого высвобождается гистидин. При декарбоксилировании гистидина образуется гистамин. В ряде продуктов при их хранении, например в рыбе и сыре, происходит микробиологическое декарбоксилирование гисти-дина с образованием и накоплением больших количеств гистамина, что может иметь клинические последствия.
Лейцин (а-аминоизокапроновая кислота) впервые получен из сыра в 1819 году. Его много в составе белка (в среднем 10%). При недостатке лейцина в
Таблица 7
питании у детей происходит задержка роста и снижение массы тела, отмечают изменения в почках и щитовидной железе.
Лизин (а,е-диаминокапроновая кислота) выделен в 1889 году из казеина. Недостаточное содержание лизина в широко распространенных зерновых продуктах и сравнительно высокая потребность в нем организма (3-5 г в сутки) делают его одной из наиболее важных незаменимых аминокислот. Его недостаток в питании приводит к уменьшению числа эритроцитов и снижению гемоглобина, возникают дистрофические изменения в мышцах, в печени и в легких, нарушается кальцификация костей. Наиболее богат лизином мышечный белок — миозин, а также гемоглобин.
Метионин (а-амино-у-метилтиомасля-ная кислота) впервые был выделен в 1922 году из казеина. Метионин относится к серосодержащим аминокислотам и играет исключительно важную роль в обмене веществ и в процессах метилирования и трансметилирования. Метионин является основным донатором метильных групп. В процессе деметилирования метионина образуется гомоцистеин. Метильные группы метионина используются для синтеза хо-лина, который участвует в обмене липидов. Метионин, также как и холин, относится к липотропным веществам, оказывая влияние на обмен липидов и фосфолипидов, он важен в профилактике атеросклероза. При высоком уровне метионина наиболее полно проявляется
I
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Валин Легко переаминируется и теряется, восстанавливает мышцы после физической нагрузки Гипертензия, атаксия
Гистидин Синтез фолиевой кислоты, нуклеиновых кислот, гемоглобина и карнозина, важна при уремии, усиливает секрецию соляной кислоты и пепсина Анемия, нехватка карнози-на, нарушение умственного развития у детей
Изолейцин Много в составе иммуноглобулинов, ключевая роль в утилизации пищи Потеря массы тела, высокий диурез
Лейцин Активирует эндокринную систему, важная роль для иммунной системы Задержка роста и физического развития
Лизин Содержится во всех белках, обеспечивает рост костной ткани, стимулирует митозы, поддерживает половую функцию у женщин, снижает уровень триглицеридов, противовирусное действие Головная боль, тошнота, снижение слуха, медленный рост костной ткани
Метионин Защита печени, детоксикация организма, защита от токсикоза беременных, антиоксидантное действие, синтез гемоглобина, функция щитовидной железы, рост Ожирение, цирроз печени, анемия, кровотечения, атрофия мышц
Треонин Усвоение пищевого белка, липотропное действие, обмен коллагена и эластина, повышает иммунитет Потеря веса, высокий диурез
Фенилала-нин 50% идет на синтез белка, синтез адреналина и тирозина, умственная активность, память, улучшает работу печени и поджелудочной железы Нарушение функции щитовидной железы и надпочечников, гипотония
г^.
о
СО
о
биологическое действие витамина В и фолиевой кислоты. В свою очередь эти витамины стимулируют деметилирование метионина и образование холина. Метионин играет важную роль в функции надпочечников, он необходим для синтеза адреналина. Имеются данные о профилактическом действии метионина при лучевых поражениях и бактериальной интоксикации.
Треонин (а-амино-в-оксимасляная кислота) получен в 1935 году из фибрина. Дефицит треонина вызывает задержку роста и снижение массы тела.
Триптофан (а-амино-в-индолилпропионовая кислота) выделен в 1901 году. Важнейшая из незаменимых аминокислот необходим для роста и поддержания азотистого равновесия, участвует в биосинтезе белков сыворотки крови и гемоглобина. Триптофан играет важную роль в образовании никотиновой кислоты (витамина РР).
Фенилаланин (а-амино-в-фенилпропионовая кислота) выделен в 1879 году. Фенилаланин регулирует функцию щитовидной железы и надпочечников. Из него образуется гормон тироксин, а также аминокислота тирозин, из которого, в свою очередь, образуется адреналин. Тирозин может образовываться из фенилаланина, однако обратного образования фенилаланина из тирозина не происходит.
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ЗАМЕНИМЫХ АМИНОКИСЛОТ
Аргинин (амино-$-гуанидин валериановая кислота) открыт в 1886 году. Играет очень важную роль в обмене веществ. Белки ядер сперматозоидов содержат до 80% аргинина. Аргинин является предшественником оксида азота (N0), который является важным молекулярным биорегулятором. Введение аргинина приводит к расширению сосудов и существенному снижению артериального давления при гипертонической болезни. Регулярное назначение аргинина способствует улучшению клинического состояния больных ишемической болезнью сердца. Помимо этого он снижает вязкость крови и уменьшает риск тромбоза сосудов. При физической нагрузке аргинин способствует улучшению кровотока в коронарных артериях. Аргинин ускоряет регенерацию печени при ее токсическом поражении и может применяться при лечении цирроза печени и жирового гепатоза. Ингаляционное назначение аргинина при муковис-цидозе приводит к быстрому улучшению функции легких, он помогает при астматическом бронхите.
Известно, что аргинин стимулирует активность Т-лимфоцитов, предотвращает возрастное угнетение фагоцитоза макрофагами. Неспецифическая стимуляция иммунной функции аргинином сопровождается снижение частоты рака толстой кишки и молочной железы у экспериментальных животных. Назначение аргинина больным сахарным диабетом 2-го типа существенно повышает чувствительность к инсулину рецепторов клеток организма. У пациентов
с сахарным диабетом он ингибирует гликозилиро-вание гемоглобина, снижая развитие осложнений. У лиц с повышенной физической нагрузкой аргинин усиливает действие инсулина и увеличивает рост кровеносных капилляров в скелетных мышцах. Аргинин стимулирует выработку соматотропного гормона (гормона роста), способствует уменьшению жировых отложений, росту мышечной массы, увеличивает активность и физическую выносливость, улучшает настроение. Он повышает половую функцию, увеличивают выработку сперматозоидов.
Аргинин не рекомендуют беременным и кормящим женщинам, больным шизофренией. Он может стимулировать свободнорадикальные процессы, поэтому его следует принимать в сопровождении антиоксидантов.
Глицин (аминоуксусная кислота) — наиболее простая из аминокислот, в большом количестве содержится в клетках головного и спинного мозга. Он является метаболитом широкого спектра действия, специфическим регулятором активности нервных клеток, тормозным медиатором. Глицин способен связывать различные эндогенные и экзогенные (лекарства) соединения. В настоящее время его применяют как успокаивающее (седативное) средство, он улучшает мозговую функцию. Менее известна его способность нормализовать синтез коллагена и соединительной ткани.
Глютамин (8-амид-а-аминоглутаровая кислота) — самая распространенная свободная аминокислота в организме человека (в мышечной ткани содержание свободного глютамина составляет 67%). Очень активно обменивается в организме и является наиболее важной для переноса азота в печень и другие органы. Однако содержание глютамина в составе белка сравнительно небольшое — 5-7% (на лейцин приходится 10%). Глютамин является важным энергетическим субстратом для клеток печени, эпителиальных клеток тонкой кишки и иммунных клеток. Введение глютамина тяжелым больным ослабляет потерю мышечной массы улучшает функцию всасывания. Наличие глютамина является необходимым условием синтеза нуклео-тидов — пиринов и пиримидинов.
Глютамин играет ключевую роль в регуляции синтеза глутатиона — трипептида, состоящего из глютаминовой кислоты, цистеина и глицина. Глутатион является важнейшим эндогенным анти-оксидантом и защищает клетки от окислительного повреждения. Потребность в глютамине возрастает при окислительном стрессе.
Глютаминовая кислота (аминоглютаровая кислота) выделена в 1866 году из эндосперма пшеницы. Глютаминовая кислота играет активную роль в обмене белка и в удалении из организма продуктов распада. Глютаминовая кислота является единственной аминокислотой, поддерживающей дыхание клеток головного мозга. Аминокислоту применяют при лечении некоторых нервных и психических заболеваний. Глютаминовая кислота
участвует в поддержании кислотно-щелочного го-меостаза в крови и тканях.
Пролин (пирролидин-а-карбоновая кислота) — способствует заживлению ран, укрепляет сухожилия, связки и суставы, увеличивает физическую работоспособность, укрепляет сердечную мышцу.
Тирозин (а-амино-в-параоксифенилпропионовая кислота) — способствует функционированию щитовидной железы (синтез тироксина), гипофиза, надпочечников, снижает раздражительность, усталость, стресс, укрепляет сон.
Цистеин (ди-а-амино-в-тиопропионовая кислота) — способствует заживлению ожогов и ран, регенерации кожи, активирует иммунную систему, обладает антиоксидантной активностью.
ПОТРЕБНОСТЬ В АМИНОКИСЛОТАХ
Физиологическая потребность в аминокислотах окончательно не установлена. Проведенные исследования позволили выявить ориентиры потребности в незаменимых аминокислотах, отражающие минимальную потребность, «безусловно достаточное количество» и минимальные показатели суточной потребности [6]. Считают, что может быть «только один уровень физиологической потребности в незаменимых аминокислотах для здорового человека, хотя этот уровень для разных людей и в разное время может быть различным». ФАО/ВОЗ предложил в качестве идеального белка аминокислотную шкалу, в которой представлены незаменимые аминокислоты в расчете на 100 г стандартного белка. Однако данная шкала далека от идеального белка, о чем мы будем говорить ниже.
Поскольку заменимые аминокислоты могут образовываться в организме, определение их физиологической потребности также непросто. В 2004 году в РФ предложены (на основе расчета) значения адекватного и верхнего уровня потребности для заменимых и незаменимых аминокислот, табл. 9.
Как видно из таблицы, в 2004 году по сравнению с 1971-м суточная потребность примерно для половины аминокислот была пересмотрена как в сторону повышения (аспарагиновая кислота, серин и аланин), так и в сторону снижения (фенилаланин, валин, метионин, триптофан и глютами-новая кислота). При этом суточная потребность в заменимых аминокислотах выше (в 2,5 раза), чем в незаменимых, и в настоящее время составляет 56,9 г/сутки (72%), против 22,6 г/сутки (28%) для незаменимых аминокислот. В соответствии с современными нормами потребности среди незаменимых аминокислот доминируют: лейцин, фенилаланин и лизин, тогда как среди заменимых: глютамин (включая глютамат), аспарагин (включая аспартат) и серин. Следует подчеркнуть, что в соответствии с нормами потребности заменимых аминокислот должно быть в 2-2,5 раза больше, чем незаменимых.
Аминокислотный скор. Качество белка можно оценивать, сравнивая его аминокислотный состав с составом стандартного (идеального) белка. Такой расчет называют аминокислотным скором (оценкой). Аминокислотный скор определяют по формуле:
I
Таблица 8
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ ЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Аргинин Образование мочевины, регулирует рост, тормозит рост опухолей за счет стимуляции иммунитета, детоксикация печени Нарушение роста, риск развития сахарного диабета, эректильная дисфункция
Глицин Синтез коллагена и соединительной ткани, седативное действие, нормализует мозговую функцию и сон, связывание аммиака. Увеличивает синтез лецитина Артрозы и артриты Повышенная возбудимость
Глютамин Переносчик аминных групп, важный энергетический субстрат для печени, тонкой кишки и иммунной системы, играет ключевую роль в регуляции синтеза глутатиона Быстрая потеря мышечной массы у больных, окислительный стресс
Пролин Синтез коллагена и соединительной ткани
Таурин Незаменим у детей, необходим в критических состояниях Нарушение развития мозга, миокарда, ЖКТ
Тирозин Синтез тироксина, пигмента кожи меланина, норадренали-на и адреналина Нарушение пигментации кожи
Триптофан Образование альбумина, выработка серотонина, снижает содержание жира, гипотензивное действие, синтез альбумина и глобулинов, гормона роста, антидепрессант, улучшает сон, снижает аппетит Анемия, стерильность, выпадение волос, депрессия, тревожность
Цистеин Процессы регенерации и заживления ожогов и ран Длительное заживление ран
о о
CD CD
(содержание аминокислоты данного белка (г/100 г) / содержание аминокислоты стандартного белка (г/100 г)) х 100.
Если в исследуемом белке содержание какой-либо аминокислоты будет менее 100%, то эта аминокислота окажется лимитирующей. Для взрослого человека в качестве идеального белка применяют шкалу ФАО/ВОЗ, в которой указано содержание каждой из незаменимых аминокислот в расчете на 100 г белка. Однако для человека и животных существует другие белки, которые в определенные периоды жизни являются единственным источником аминокислот для растущего организма. Среди белков животного происхождения к ним относятся белки молока и яйца. Среди растительных белков
Таблица 9
такими белками являются, например, белки сои, орехов, зародыша пшеницы и др. Сравним состав незаменимых аминокислот женского молока, который можно считать эталонным, с составом аминокислот известных животных (табл. 10) и растительных (табл. 11) белков [9].
Как видно из таблицы, состав незаменимых аминокислот женского молока является достаточно уникальным и не похожим как по составу, так и по соотношению аминокислот среди аналогичных по значимости белков коровьего молока и куриного яйца. В составе коровьего молока незаменимых аминокислот на 11% меньше, чем в женском молоке, в белке коровьего молока на 30% меньше валина, хотя метионина на 61% больше. Куриное яйцо по
РЕЙТИНГ ПОТРЕБНОСТИ ВЗРОСЛОГО ЧЕЛОВЕКА В АМИНОКИСЛОТАХ (г/сутки)
Аминокислоты А.Э. Шарпенак [6] Rous, Mesy, Block [6] ФАО/ВОЗ г/100 г белка [4] О.П. Молчанова, 1971 [6] Адекватный уровень (РФ, 2004) Верхний уровень (РФ, 2004)
Незаменимые
Лейцин 10,0*** 9,1 6,6 4-6 4,6 7,3
Фенилаланин 4,5 4,4 6,3* 2-4 4,4* 6,9*
Лизин 8,0 5,2 5,8 3-5 4,1 6,4
Валин 6,0 3,8 3,5 4,0 2,5 3,9
Треонин — 3,5 3,4 2-3 2,4 3,7
Изолейцин — 3,3 2,8 3-4 2,0 3,1
Метионин 2,5 3,8** 2,5** 2-4 1,8** 2,8**
Триптофан 1,6 1,1 1,1 1,0 0,8 1,2
Суммарно, г/сутки 32,6 34,2 32,0 26 22,6 35,3
% аминокислот 32% 34% 28% 28%
Заменимые
Глютамин + глютаминовая кислота 16,0 13,6 21,8
Аспарагин + аспарагиновая кислота 6,0 12,2 19,9
Серин 3,0 8,3 13,3
Аланин 3,0 6,6 10,6
Аргинин 6,0 6,1 9,8
Пролин 5,0 4,5 7,2
Глицин 3,0 3,5 5,6
Гистидин 2,0 2,1 3,4
Тирозин 3-4
Цистеин 2-3
Суммарно, г/сутки 68 50 56,9 91,6
% аминокислот 68% 66% 72% 72%
Сумма всех аминокислот 100 76 79,5 126,9
заменимые : незаменимые 2,12 1,92 2,5 2,6
Примечание:* — фенилаланин + тирозин; ** — метионин + цистеин; *** — лейцин + изолейцин.
Таблица 10
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И ЖИВОТНЫХ БЕЛКОВ
Аминокислоты Женское молоко Коровье молоко Куриное яйцо Рыба Мясо ФАО/ВОЗ
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 9,7 95 9,2 90 9,1 89 8,7 85 6,6 65
Валин 9,9 6,9 70 7,3 74 6,1 62 5,9 60 3,5 35
Лизин 8,5 7,5 88 7,9 93 9,5 112 8,6 101 5,8 68
Изолейцин 7,6 6,2 82 8,0 105 6,0 79 4,5 59 2,8 37
Фенилаланин 5,9 5,7 97 7,3 124 4,8 81 4,5 76 6,3* —
Треонин 5,0 4,6 92 5,9 118 5,1 102 5,3 106 3,4 68
Метионин 2,3 3,7 161 4,1 178 2,6 113 3,2 139 2,5** —
Триптофан 1,9 1,6 84 1,5 79 0,8 42 1,2 63 1,1 58
Аргинин*** 5,0 4,3 86 6,5 130 8,1 162 6,5 130 — —
Гистидин*** 2,7 2,5 93 2,1 78 2,6 96 3,0 111 — —
Суммарно 51,3 45,9 89 51,2 100 44,0 86 41,9 82 32,0 62
Заменимые 48,7 54,1 48,8 56,0 58,1 68,0
Заменимые : незаменимые 0,94 1,18 0,95 1,27 1,39 2,13
Примечание: * — фенилаланин + тирозин; ** — метионин + цистеин; *** — заменимые аминокислоты.
Таблица 11
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И РАСТИТЕЛЬНЫХ БЕЛКОВ
Аминокислоты Женское молоко Соевые бобы Овсяные хлопья Пшеничная мука Картофель
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 7,7 75 7,7 75 6,2 61 10* 56
Валин 9,9 5,3 54 5,3 54 4,3 43 4,0 40
Лизин 8,5 6,9 81 3,0 35 2,5 29 2,6 31
Изолейцин 7,6 5,8 76 5,3 70 3,1 41
Фенилаланин 5,9 5,0 85 4,6 78 4,8 81 6,4 108
Треонин 5,0 4,4 88 3,5 70 2,8 56 3,1 62
Метионин 2,3 1,3 57 1,2 52 1,2 52 1,5 65
Триптофан 1,9 1,3 68 1,3 68 1,3 68 0,6 32
Аргинин** 5,0 7,3 146 7,4 148 4,5 90 1,4 28
Гистидин** 2,7 2,5 93 2,0 74 2,0 74 0,6 22
Суммарно 51,3 37,7 73 31,9 62 26,2 51 28,2 55
Заменимые 48,7 62,3 68,1 73,8 71,8
Заменимые : незаменимые 0,94 1,65 2,13 2,82 2,55
Примечание: * — лейцин + изолейцин; ** — заменимые аминокислоты. а белку женского молока, и кроме фенилаланина, ™ являются дефицитными практически по всем не° а__заменимым аминокислотам, особенно по лизину
(29-35%), валину (40-54%) и метионину (52-65%). Среди наиболее распространенных растительных белков, безусловно, лучшим является белок сои, который содержит существенно больше незаменимых аминокислот, чем другие растительные белки. Однако белок сои дефицитен по валину (54%), метионину (57%) и изолейцину (76%). Обращает на себя внимание доминирование в растительном белке заменимых аминокислот, которых больше чем незаменимых в 1,6-2,5 раза.
Сравнивая состав незаменимых аминокислот «идеального» белка ФАО/ВОЗ с белками женского или коровьего молока, а также яйца, можно увидеть, что последние отличаются принципиально иным составом и соотношением заменимых и незаменимых аминокислот близким к 1,0. Тогда как в «идеальном» белке ФАО/ВОЗ, а также в современных отечественных нормах это соотношение больше 2,0 (2,12-2,5), что характерно для белков растительного происхождения. Таким образом, по составу незаменимых аминокислот к идеальному белку наиболее близки белки яиц и молока. Белки рыбы
и мяса по содержанию аминокислот существенно отличаются от идеала, а растительные белки имеют еще более низкую биологическую ценность.
Биологическая ценность белка — доля задержки азота в организме от всего белка, попавшего в кровь. Мерой биологической ценности является такое количество белка, которое необходимо для поддержания азотистого равновесия в организме человека или животных. Если в белке есть все необходимые организму незаменимые и заменимые аминокислоты в нужном количестве и в необходимых пропорциях, и они полностью всасываются в желудочно-кишечном тракте, то его биологическая ценность будет равна 100. Когда в составе белка соотношение аминокислот неоптимальное, имеется дефицит отдельных незаменимых аминокислот или если белок плохо усваивается, то его биологическая ценность будет заведомо ниже (табл. 12).
Кругооборот белка в организме человека — явление физиологическое и связано с необходимостью обновления белка. Дело в том, что большинство белков и, прежде всего ферменты, живут недолго и могут разрушаться через несколько часов после биосинтеза. Значительно более долговечны структурные белки, гистоны, гемоглобин или компоненты цитоскелета клетки. Полупериод жизни белков в организме человека в среднем составляет 2-8 дней. Постоянное обновление белка играет важную роль в обмене веществ и является весьма эффективным механизмом регуляции активности ферментов, обновления пула иммуноглобулинов, удаления дефектных и ненужных в данное время белков. Быстрое разрушение требуется для удаления из организма биологически активных пептидов и пептидных гормонов. Постоянное разрушение и ресинтез новых белков позволяет клеткам «быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов» [2]. Ориентировочно в организме взрослого человека ежедневно в результате протеолиза деградирует до аминокислот 300-400 г белка. В то же время примерно столько же аминокислот включается во вновь
Таблица 12
ОЛ
сэ
КАЧЕСТВО НЕКОТОРЫХ ПИЩЕВЫХ БЕЛКОВ ОТНОСИТЕЛЬНО БЕЛКОВ ЖЕНСКОГО МОЛОКА
Пищевой белок Химическая ценность, % Биологическая ценность, % Дефицитные аминокислоты
Женское молоко 100 95 Нет
Яйцо куриное 100 87 Валин (74%), триптофан (79%)
Говядина 98 93 Изолейцин (59%), валин (60%), триптофан (63%), фенилала-нин (76%)
Коровье молоко 95 80-82 Валин (70%)
Рыба 61-86 Триптофан (42%), валин (62%), изолейцин (79%)
Соя 61-73 Валин (64%), метионин (57%), лейцин (75%), изолейцин (76%)
Белый хлеб 47 30 Лизин (29%), изолейцин (41%), валин (43%), метионин (52%), треонин (56%), лейцин (61%), триптофан (68%)
образованные белки. Оба эти процесса формируют кругооборот белка в организме. Учитывая, что в организме содержится около 10 кг различных белков, текущий протеолиз затрагивает всего 3% белка [2].
В результате протеолиза образуются аминокислоты, которые могут быть использованы клеткой для биосинтеза новых белков или поступают в кровь, формируя пул свободных аминокислот, объем которого составляет около 100 г. Деградация белка в клетках осуществляется с помощью двух специализированных систем: лизосом и протеосом. Важную роль в осуществлении деградации белков организма играет система пищеварения, в которой переваривается, а затем реутилизируется значительная часть плазматических и других эндогенных белков, а также белки, которые попадают в просвет кишки при слущивании завершивших свою работу эпителиальных клеток. В ходе деградации белка может накапливаться аминный азот, который, в отличие от углеводородной части аминокислот, непригоден для получения энергии. Поэтому аминогруппы, которые не могут быть использованы повторно, например, в реакциях трансаминирования, превращаются в аммиак, а затем — в мочевину.
В организме человека существует весьма эффективный механизм регуляции уровня белка. Чем выше дефицит белка в организме, тем лучше
Таблица 13
усваивается пищевой белок, и тем меньше будут потери аминокислот с калом и мочой. С другой стороны, чем больше белка содержится в пище, тем хуже он будет усваиваться. При отсутствии дефицита белка в организме его усвоение в желудочно-кишечном тракте также снижается. Механизм регуляции уровня белка в организме человека также связан с увеличением кругооборота белка и аминокислот при его дефиците и снижением кругооборота и усилением катаболизма белка при его избыточном поступлении с пищей. Таким образом, организм способен в определенной степени сглаживать дефицит белка, в то же время препятствуя перегрузке организма пищевым белком. Например, после приема пищи с высоким содержанием белка более половины аминокислот (57%), поступающих в печень, превращается в мочевину, 14% аминокислот остаются в печени и 23% — выходят в кровь и поступают в пул свободных аминокислот. Только 6% аминокислот используется печенью для синтеза белков [2].
Свободные аминокислоты, находящиеся в крови, захватываются печенью, почками, поджелудочной железой, тонкой кишкой,
РЕЙТИНГ СОДЕРЖАНИЯ АМИНОКИСЛОТ В КРОВИ И В МОЧЕ ЧЕЛОВЕКА [10]
Аминокислота Содержание в крови, мг/100 мл Экскреция с мочой в сутки, мг
Незаменимые диапазон в среднем
Валин 2,88 4-6 5,0
Лизин 2,72 7-48 27,5
Лейцин 1,86 9-26 17,5
Треонин 1,67 15-53 34,0
Изолейцин 1,34 14-28 21
Триптофан 1,27
Метионин 0,52 5-10 7,5
Заменимые
Аланин 3,40 21-71 46
Пролин 2,36 Менее 10 10
Аргинин 1,62
Глицин 1,50 21-71 46
Цистеин 1,47 10-21 15,5
Гистидин 1,38 113-320 217
Серин 1,12 27-73 50
Тирозин 1,04 15-49 32
Глютамат 0,70 8-40 24
Аспартат 0,03 Менее 10 10
т
сэ
более 85% свободных аминокислот покидает систему кровообращения в течение 5-15 минут, поэтому концентрация аминокислот в крови достаточно низкая — 35-70 мг/100 мл [2] (табл. 13).
ЗАКЛЮЧЕНИЕ
Таким образом, потребность человека в белке во многом зависит от качественного состава аминокислот, и прежде всего незаменимых. Поэтому белков животного происхождения, которые наиболее близки по составу аминокислот к белкам организма человека, требуется меньше, чем белков растительных, аминокислотный состав которых существенно отличается от оптимального для человека. Например, при употреблении белков с высокой биологической ценностью (мяса, молока, яиц) для удовлетворения потребности взрослого человека достаточно 0,75 г/ кг массы тела (52,5 г белка/сутки). При употреблении смешанного рациона (белки животного и растительного происхождения) потребность в белке будет составлять 0,85-1,0 г кг массы тела (59,5-70,0 г белка/сутки). Более того, при потреблении животных белков с калом теряется 2,5-3,0% азота, тогда как употреблении в пищу растительных продуктов, богатых клетчаткой (овощи, зерновые) — до 40% пищевого азота [6].
Низкие нормы потребности в белке, которые в свое время предлагали Ро и Читтенден, а затем и Вильямс, были основаны на классических представлениях об азотистом балансе (равновесии). Согласно этим представлениям для поддержания азотистого (белкового) равновесия в организме большинства взрослых людей, которые здоровы и находятся в покое, может быть достаточно 30 г белка/сутки. Читтенден, который изучал белковый обмен у молодых людей (студентов, солдат, спортсменов), показал, что азотистое равновесие вполне может обеспечить 55-60 г белка/сутки [7].
В принципе для поддержания азотистого равновесия у взрослого и здорового человека на минимальном уровне достаточно 36,9 г молочного белка/ сутки. С учетом высокого качества белка куриного яйца минимальная потребность в белке для поддержания азотистого равновесия может составлять 0,34-0,43 г белка/кг массы тела в сутки, или 28 г яичного белка в сутки [11]. Однако для обеспечения «надежного уровня потребления», белка требуется больше — 56,25-57,5 г белка казеина в сутки при калорийности пищевого рациона около 3000 ккал/ сутки. Для нормального физического развития, повышения работоспособности и устойчивости к неблагоприятным внешним воздействиям, а также сопротивляемости организма к инфекции белка нужно еще больше, чем то количество, которое всего лишь «обеспечивает поддержание азотистого равновесия». В этой связи выделяют «оптимальную потребность человека в белке», которая должна превышать надежный уровень на 50% и будет составлять 84,4-87,5 г белка/сутки [7].
Таким образом, потребность в белке должна складываться из некоего минимального количества — «безопасного уровня белка», который обеспечивает «надежный уровень потребления», и «дополнительного количества белка», который учитывает особенности обмена веществ, состояние здоровья и качественный состав пищевого рациона. Безопасный уровень белка обеспечивает надежное поддержание азотистого равновесия в организме определенного числа людей, а введение дополнительного количества белка необходимо для заполнения так называемых «лабильныхрезервов белка».
В 1973 году ФАО/ВОЗ путем расчета определило, что величина средней потребности в белке населения развитых стран должно составлять 48,5-56,6 г/ сутки (при относительной биологической ценности 70-80%). Для развивающихся стран, в питании которых присутствует большая доля низкокачественного растительного белка (относительная биологическая ценность — 60-70%), средняя потребность в белке была определена равной 56,6-65,5 г в сутки [11].
Чем ниже биологическая ценность белка, тем больше его требуется. Однако в этом случае некоторые аминокислоты будут поступать в организм человека в избыточном количестве, превышающем текущие потребности, связанные с биосинтезом белка и специфическим метаболизмом отдельных аминокислот. Белки и аминокислоты не способны запасаться в организме, поэтому лишние аминокислоты будут либо выводиться из организма, либо подвергаться метаболической деградации. Содержащийся в аминокислотах азот будет превращаться в мочевину и креатинин и выделяться с почками, углеродный скелет — использоваться для биосинтеза глюкозы или жирных кислот, а другая его часть — окисляться до углекислого газа и воды с образованием АТФ.
Потребность в белке во многом зависит от калорийности и состава других компонентов пищевого рациона — углеводов и липидов (табл. 14). Низкокалорийные диеты или диеты с недостаточным количеством углеводов увеличивают потребность в белке, поскольку часть белка начинает расходоваться для образования глюкозы и кетоновых тел. При отсутствии в пищевом рационе углеводов и жиров для достижения азотистого равновесия пищевого белка требуется в 5 раз больше [6]. С увеличением калорийности пищевого рациона потребность в белке снижается.
Таким образом, рассматривая потребность организма в белке и аминокислотах, можно сделать следующие выводы:
• Белок пищи необходим не только для биосинтеза белков организма, но и для решения энергетических проблем, особенно в критических ситуациях.
• Отдельные аминокислоты пищевого белка выполняют в организме самостоятельную функцию, что необходимо учитывать при назначении
Таблица 14
ВЛИЯНИЕ КАЛОРИЙНОСТИ РАЦИОНА НА ПОТРЕБНОСТЬ В БЕЛКЕ ДЛЯ ПОДДЕРЖАНИЯ АЗОТИСТОГО РАВНОВЕСИЯ [12]
Калорийность рациона Потребность в белке для нулевого баланса Безопасный уровень потребления белка
ккал/кг кал/70 кг г/кг г/70 кг г/кг г/70 кг
40 2800 0,78 54,6 1,02 71,4
45 3150 0,56 39,2 0,74 51,8
48 3360 0,51 35,7 0,62 43,4
57 4000 0,42 29,4 0,50 35
Рекомендуемая норма потребления 0,80 56
I
аминокислот, используя отдельные аминокислоты для коррекции питания.
• Идеальными белками по составу и пропорциям незаменимых аминокислот являются белки молока и куриного яйца и в меньшей степени — белки мяса. Растительные белки содержат аминокислоты в иных пропорциях и дефицитны по большинству незаменимых аминокислот.
• Избыточное потребление белковой пищи «не идет нам впрок», поскольку лишние аминокислоты пищи будут разрушаться, а белковый азот удаляться из организма. Потребление белка
должно быть равномерным на протяжении суток, что позволяет оптимизировать его всасывание и утилизацию, а также свести к минимуму потери аминокислот.
• Умеренное потребление белка не является столь катастрофичным для организма человека, поскольку при этом снижаются потери аминокислот.
• Для достижения разных целей необходимы белковые модули с разным количеством и соотношением как заменимых, так и незаменимых аминокислот.
ЛИТЕРАТУРА
1. ЛенинджерА.Л. Основы биохимии. — М.: Мир, 1985. — Т. 1. — 365 с.
2. КольманЯ., РемК.-Г. Наглядная биохимия. — М.: Мир, 2000. — 469 с.
3. Попова Т.С., Шестопалов А.Е., Тамазашвили Т.Ш., Лейдерман И.Н. Нутритивная поддержка больных в критических состояниях. — М., 2002. — 320 с.
4. Мартинчик А.Н., Маев И.В., Петухов А.Б. Питание человека (основы нутрициологии). — М.: ГОУ ВУНМЦ МЗ РФ, 2002. — 572 с.
5. Ньюсхолм Э., Старт К. Регуляция метаболизма. — М.: Мир, 1977. — 408 с.
6. Гигиена питания / Под ред. К.С. Петровского. — М.: Медицина, 1971.— Т. 1. — 511 с.
7. Высоцкий В.Г. К оценке потребности человека в белке // Вопросы питания. — 1978. — № 6. — С. 8-17.
8. Основы клинического питания. — Петрозаводск: ИнтелТек, 2003. — 412 с.
9. Химический состав пищевых продуктов. Книга 2. — М.: ВО Агропромиздат, 1987. — 360 с.
10. Большая медицинская энциклопедия. — М.: Медицина, 1974. — Т. 1. — С. 364-371.
11. Energy and Protein Requirements // WHO Tech. Rep. Ser. — 1973. — No 522. — P. 40-72.
12. Общая нутрициология. — М.: МЕДпресс-информ, 2005. — 392 с.
LЛ
CD
Функция аминокислот
Подобно отдельным шарикам различной формы в цепи, аминокислоты соединяются вместе, образуя белки. Основная функция аминокислот — служить строительным материалом для белков. Белки обычно состоят из от 50 до 2000 аминокислот, соединенных встык во многих различных комбинациях.
Каждый белок имеет уникальные последовательности аминокислот в своей собственной скрученной и свернутой конфигурации. Функции белков обширны и многочисленны, потому что они практически необходимы для всех клеточных процессов нормального физиологического функционирования.
Существует 20 различных аминокислот, которые вместе создают впечатляющий набор химической универсальности белков. Аминокислоты могут быть незаменимыми, заменителями или условными. Они считаются незаменимыми, когда их нужно принимать с пищей, и несущественными, когда они могут быть получены организмом. Условные аминокислоты обычно требуются только при определенных обстоятельствах, таких как стресс или болезнь.
Способ или последовательность, в которой эти аминокислоты объединяются с образованием белка, определяет трехмерную структуру и функцию, уникальную для конкретного белка.Некоторые функции белков включают их роли в качестве антител, ферментов, мессенджеров, а также в транспортных / хранящих и структурных возможностях.
Антитела
Антитела — это белки, вырабатываемые иммунной системой. Они играют ключевую роль в обнаружении антигенов, которые представляют собой сложные белки, распознаваемые организмом как чужеродные и вредные. Вирусы, бактерии, грибки и паразиты, а также опасные химические вещества — все это примеры антигенов.
В некоторых неудачных случаях антитела могут также вырабатываться против здоровых тканей, когда организм ошибочно распознает их как чужеродные.Это явление известно как аутоиммунное заболевание. Антитела уникальны и обладают высокой степенью специфичности для защиты от каждого антигена, с которым сталкивается организм.
Ферменты
Белки, которые действуют как биологические катализаторы, называются ферментами. Они в первую очередь отвечают за катализ или ускорение химических реакций в организме, воздействуя на молекулы, называемые субстратами, для производства продуктов. Скорость реакции увеличивается за счет снижения энергии активации i.е. минимальное количество энергии, необходимое для инициирования реакции.
В отличие от большинства других катализаторов, ферменты представляют собой высокоспецифичные макромолекулы. Их активность может быть усилена молекулами, называемыми активаторами, и снижена молекулами, известными как ингибиторы. Более того, для правильного функционирования фермента необходимы оптимальные условия по температуре и pH. Ферменты находятся в каждом органе и клетке нашего тела, в первую очередь в крови и желудочно-кишечном тракте.
Прочие функции
Белки могут демонстрировать ряд химических паттернов передачи сообщений в виде гормонов, нейротрансмиттеров и нейропептидов.Гормоны вырабатываются железами, где они впоследствии транспортируются кровеносной системой для регулирования поведения и физиологии отдаленных органов и систем.
Они считаются посланниками дальнего действия. В отличие от гормонов, нейротрансмиттеры — это мессенджеры ближнего действия, которые обеспечивают связь между нервной клеткой и другой целевой нервной, железистой или мышечной клеткой. Нейропептиды также являются посредниками на коротком расстоянии между нервными клетками, однако, в отличие от других нейронных посредников, нейропептиды не возвращаются обратно в клетку после секреции.
Белки составляют фундаментальную часть клеточной структуры и поддержки. Примеры структурных белков включают коллаген, кератин и эластин. Коллаген — основной компонент соединительной ткани и самый распространенный белок в нашем организме.
Альфа-кератин жизненно важен для формирования волос и ногтей, тогда как эластин — очень эластичный белок, который позволяет тканям восстанавливать свою форму после некоторой степени деформации (например, сокращения или растяжения). В более широком смысле белки, содержащиеся в мышцах, позволяют нашему телу двигаться.
В дополнение ко всем своим вышеупомянутым функциям белки способны связывать и переносить атомы, а также небольшие молекулы внутри клеток и по всему нашему телу. В этом качестве они функционируют как форма хранения и транспортировки. Гемоглобин с помощью железа является одним из примеров переносчика белка, используемого для переноса кислорода. Примером внутриклеточного запасного белка является ферритин, который необходим для хранения железа.
Какова функция аминокислот в организме человека?
Какова функция аминокислот в организме человека?
Кредит изображения: asab974 / iStock / GettyImages
Аминокислоты создают белки, а белки являются макроэлементами, поддерживающими жизнь.Тем не менее, просто называть аминокислоты строительными блоками белка не оправдывает их ценность. В то время как некоторые аминокислоты производят только белки, другие выполняют множество функций, от поддержки метаболизма до защиты вашего сердца. Ваше тело также может использовать аминокислоты для получения энергии, когда вам не хватает углеводов и жиров.
Tip
Аминокислоты выполняют множество функций в вашем теле, в том числе вырабатывают белок, служат источником энергии и вырабатывают важные нейротрансмиттеры, которые помогают доставлять сообщения в ваш мозг.
Построить белок
Когда клеткам нужен белок, они следуют инструкциям ДНК, которые определяют конкретные аминокислоты и порядок, в котором они должны соединяться для построения белка. ДНК зависит от другой макромолекулы — РНК — для создания белка. РНК берет копию кода из вашей ДНК, покидает клетку, находит аминокислоты и возвращает их в клетку, где они связываются в цепочку. Каждая аминокислота должна быть доступна в то время, когда это необходимо, иначе белок не будет синтезирован.Когда цепочка завершена, она скручивается и складывается в особую форму. Химическая структура каждой аминокислоты определяет окончательную форму, а форма определяет функцию белка.
Синтезировать нейротрансмиттеры
Некоторые аминокислоты производят нейротрансмиттеры, но два хорошо известных примера — это аминокислоты триптофан и тирозин. Триптофан производит серотонин, который регулирует ваше настроение и вырабатывает гормон мелатонин. Тирозин используется для синтеза норадреналина и адреналина.Триптофан и тирозин конкурируют друг с другом за доступ к вашему мозгу. Когда вы едите много углеводов, больше триптофана попадает в ваш мозг и вызывает сонливость. По данным Института Франклина, еда с высоким содержанием белка увеличивает количество тирозина в вашем мозгу, что дает вам больше энергии.
Защитите сердечно-сосудистую систему
Ваше тело использует аминокислоту аргинин для производства оксида азота. Оксид азота помогает снизить кровяное давление, расслабляя мышцы кровеносных сосудов.Он вырабатывается сердечными мышцами, где регулирует сокращения. Он также может предотвратить атеросклероз, подавляя образование бляшек в артериях. Оксид азота является активным ингредиентом нитроглицерина, лекарства, используемого для облегчения стенокардии или боли в груди, вызванной ишемической болезнью сердца.
Ваше тело предпочитает использовать углеводы и жиры для получения энергии, но при необходимости аминокислоты метаболизируются для получения энергии. Три аминокислоты — глутаминовая кислота, цистеин и глицин — вместе образуют глутатион, который является антиоксидантом.Аминокислота гистидин вырабатывает ферменты, используемые для производства красных кровяных телец и поддержания здоровья нервов. Тирозин необходим для синтеза гормонов щитовидной железы, а метионин производит SAMe или S-аденозилметионин. SAMe необходим для метаболизма ДНК и нейромедиаторов.
Рекомендации и источники
Ваше тело может производить 11 аминокислот, которые ему необходимы. Остальные девять должны быть из вашего рациона. Продукты, содержащие определенное количество всех девяти белков, называются полноценными белками.Продукты животного происхождения, соевые бобы и киноа содержат полноценный белок. Большинству растительных продуктов не хватает одной или нескольких из девяти аминокислот. То, чего не хватает одному продукту, вы получите из другого, если будете есть различные продукты и потреблять рекомендуемую норму белка: 46 граммов в день для женщин и 56 граммов для мужчин.
Аминокислоты
Базовый
Структура Гли до Leu Asp к Gln Ала к Trp Тест
себя Автор
из 1 буквенных кодов | Химия аминокислот Введение Аминокислоты играют центральную роль как строительные блоки белков, так и как промежуточные звенья в метаболизме. 20 аминокислот, которые содержатся в белки обладают широким спектром химической универсальности. В точное содержание аминокислот и последовательность этих аминокислот конкретный белок, определяется последовательностью оснований в ген, кодирующий этот белок.Химические свойства аминокислот белков определяют биологическую активность белка. Белки не только катализируют все (или большую часть) реакций в живых клетках, они контролировать практически все клеточные процессы. Кроме того, белки содержат в их аминокислотных последовательностях необходимая информация для определения как этот белок сворачивается в трехмерную структуру, и устойчивость полученной конструкции.Поле сворачивания белка и стабильность была критически важной областью исследований в течение многих лет, и остается сегодня одной из величайших неразгаданных загадок. Однако это активно исследуются, и прогресс наблюдается каждый день. Когда мы узнаем об аминокислотах, важно помнить, что из наиболее важных причин для понимания структуры и свойств аминокислот уметь понимать структуру и свойства белка.Мы будем увидеть, что чрезвычайно сложные характеристики даже небольшого, относительно Простые белки — это совокупность свойств аминокислот, которые содержат белок. Верх 10 аминокислот, которые мы можем производить, это аланин, аспарагин, аспарагиновая кислота. кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин. Тирозин вырабатывается из фенилаланина, поэтому при дефиците в рационе в фенилаланине также потребуется тирозин.Незаменимая аминокислота кислоты — аргинин (необходим молодым, но не взрослым), гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, и валин. Эти аминокислоты необходимы в рационе. Растения, конечно, должен уметь производить все аминокислоты. С другой стороны, люди делают не иметь всех ферментов, необходимых для биосинтеза всех аминокислоты. Зачем изучать эти структуры
и свойства? | Атомов
в аминокислотах |
Что это такое, основные преимущества и зачем они вам нужны?
Внутривенные инфузии
Внутривенные инфузии обычно содержат специальные ингредиенты, смешанные в стерильном физиологическом растворе.Эти ингредиенты выбираются для достижения конкретных целей в отношении здоровья, поэтому точное содержание варьируется от одного IV к другому. Drip Hydration предлагает девять запатентованных смесей, которые могут помочь в борьбе со старением, похмельем и здоровьем ваших волос, кожи и ногтей. В дополнение к нашим девяти основным формулам мы можем проконсультироваться с вами, чтобы разработать индивидуальные смеси, адаптированные к вашим потребностям и потребностям вашего здоровья.
В то время как биодоступность (количество добавки, которое может использовать ваше тело) очень низкая в пероральных добавках, внутривенные инфузии на 100% усваиваются вашим организмом.Это связано с тем, что внутривенные инфузии доставляются прямо в кровоток, минуя пищеварительную систему и, таким образом, избегая проблем с абсорбцией. Ваше тело может использовать максимальное количество, которое ему нужно, а остальное выводить с мочой. Кроме того, ингредиенты для внутривенного введения немедленно становятся доступными для использования вашими клетками. Независимо от того, готовитесь ли вы к марафону или хотите сохранить силу и тонус мышц с возрастом, внутривенная терапия гарантирует, что вы почувствуете эффект инфузии аминокислот как можно быстрее.
Для введениявнутривенных инфузий обычно требуется 30–45 минут, но они имеют дополнительные преимущества, такие как увлажнение и введение других витаминов для более комплексного лечения. Внутривенная терапия также может детоксифицировать ваше тело, вымывая тяжелые металлы, которые могут способствовать повреждению клеток.
Помимо выведения тяжелых металлов, внутривенное лечение может помочь вашему организму перерабатывать свободные радикалы — незаряженные молекулы, которые организм производит естественным образом, особенно во время тренировок. Вы можете предотвратить накопление повреждений, которые могут способствовать длительному заболеванию или заболеванию в более позднем возрасте.
- Плюсы: 100% всасывание аминокислот и витаминов в формуле; дополнительные преимущества, такие как увлажнение и другие витамины; выводит токсины из организма, чтобы уменьшить повреждение клеток; доставлено непосредственно вам для вашего удобства.
- Минусы: В отличие от пилюли или напитка, для проглатывания которых требуется всего несколько секунд или минут, введение внутривенных инфузий занимает 30-45 минут; очень малая вероятность заражения в месте инъекции.
Незаменимые аминокислоты: определение, преимущества и продукты питания
Организму необходимо 20 различных аминокислот для поддержания хорошего здоровья и нормального функционирования.Люди должны получать девять из этих аминокислот, называемых незаменимыми аминокислотами, с пищей. Хорошие диетические источники включают мясо, яйца, тофу, сою, гречку, киноа и молочные продукты.
Аминокислоты — это соединения, которые образуют белки. Когда человек ест пищу, содержащую белок, его пищеварительная система расщепляет белок на аминокислоты. Затем организм комбинирует аминокислоты различными способами для выполнения функций организма.
Здоровый организм может производить другие 11 аминокислот, поэтому они обычно не нуждаются в поступлении в организм с пищей.
Аминокислоты укрепляют мышцы, вызывают химические реакции в организме, переносят питательные вещества, предотвращают болезни и выполняют другие функции. Дефицит аминокислот может привести к снижению иммунитета, проблемам с пищеварением, депрессии, проблемам с фертильностью, снижению умственной активности, замедлению роста у детей и многим другим проблемам со здоровьем.
Каждая из незаменимых аминокислот играет различную роль в организме, и симптомы дефицита соответственно различаются.
Существует много типов незаменимых аминокислот, в том числе:
Лизин
Лизин играет жизненно важную роль в наращивании мышц, поддержании прочности костей, восстановлении после травм или хирургических вмешательств, а также в регулировании гормонов, антител и ферментов.Он также может иметь противовирусное действие.
Существует не так много исследований дефицита лизина, но исследование на крысах показывает, что дефицит лизина может привести к вызванной стрессом тревоге.
Гистидин
Гистидин способствует росту, образованию клеток крови и восстановлению тканей. Он также помогает поддерживать особое защитное покрытие нервных клеток, которое называется миелиновой оболочкой.
В организме гистидин превращается в гистамин, который имеет решающее значение для иммунитета, репродуктивного здоровья и пищеварения.Результаты исследования, в котором приняли участие женщины с ожирением и метаболическим синдромом, показывают, что добавки гистидина могут снизить ИМТ и инсулинорезистентность.
Дефицит может вызвать анемию, а низкий уровень в крови чаще встречается у людей с артритом и заболеванием почек.
Треонин
Треонин необходим для здоровой кожи и зубов, поскольку он входит в состав зубной эмали, коллагена и эластина. Он помогает метаболизму жиров и может быть полезен людям с расстройством желудка, тревожностью и легкой депрессией.
Исследование 2018 года показало, что дефицит треонина у рыб привел к снижению устойчивости этих животных к болезням.
Метионин
Метионин и заменимая аминокислота цистеин играют важную роль в здоровье и эластичности кожи и волос. Метионин также помогает сохранять ногти крепкими. Он способствует правильному усвоению селена и цинка и удалению тяжелых металлов, таких как свинец и ртуть.
Валин
Валин необходим для умственной концентрации, координации мышц и эмоционального спокойствия.Люди могут использовать добавки валина для роста мышц, восстановления тканей и получения энергии.
Дефицит может вызвать бессонницу и снижение умственной функции.
Изолейцин
Изолейцин способствует заживлению ран, укреплению иммунитета, регуляции уровня сахара в крови и выработке гормонов. Он в основном присутствует в мышечной ткани и регулирует уровень энергии.
Пожилые люди могут быть более склонны к дефициту изолейцина, чем молодые люди. Этот недостаток может вызвать мышечное истощение и тряску.
Лейцин
Лейцин помогает регулировать уровень сахара в крови и способствует росту и восстановлению мышц и костей.Он также необходим для заживления ран и выработки гормона роста.
Дефицит лейцина может вызвать кожную сыпь, выпадение волос и усталость.
Фенилаланин
Фенилаланин помогает организму использовать другие аминокислоты, а также белки и ферменты. Организм превращает фенилаланин в тирозин, который необходим для определенных функций мозга.
Дефицит фенилаланина, хотя и встречается редко, может привести к плохой прибавке в весе у младенцев. Это также может вызвать экзему, усталость и проблемы с памятью у взрослых.
Фенилаланин часто входит в состав искусственного подсластителя аспартама, который производители используют для приготовления диетических газированных напитков. Большие дозы аспартама могут повышать уровень фенилаланина в головном мозге, вызывать беспокойство и нервозность, а также влиять на сон.
Люди с редким генетическим заболеванием, называемым фенилкетонурией (ФКУ), не могут метаболизировать фенилаланин. В результате им следует избегать употребления продуктов с высоким содержанием этой аминокислоты.
Триптофан
Триптофан необходим для нормального роста младенцев и является предшественником серотонина и мелатонина.Серотонин — нейромедиатор, регулирующий аппетит, сон, настроение и боль. Мелатонин также регулирует сон.
Триптофан является седативным средством и входит в состав некоторых снотворных. Одно исследование показывает, что добавление триптофана может улучшить умственную энергию и эмоциональную обработку у здоровых женщин.
Дефицит триптофана может вызвать состояние, называемое пеллагрой, которое может привести к слабоумию, кожной сыпи и проблемам с пищеварением.
Многие исследования показывают, что низкий уровень белка и незаменимых аминокислот влияет на мышечную силу и работоспособность.
Согласно исследованию 2014 года, недостаток незаменимых аминокислот может привести к снижению мышечной массы у пожилых людей.
Дополнительное исследование показывает, что аминокислотные добавки могут помочь спортсменам восстановиться после тренировки.
Раньше врачи считали, что люди должны есть продукты, содержащие все девять незаменимых аминокислот за один прием пищи.
В результате, если человек не ел мясо, яйца, молочные продукты, тофу или другую пищу со всеми незаменимыми аминокислотами, необходимо было комбинировать два или более растительных продукта, содержащих все девять, таких как рис и бобы.
Однако сегодня эта рекомендация иная. Люди, которые придерживаются вегетарианской или веганской диеты, могут получать свои незаменимые аминокислоты из различных растительных продуктов в течение дня, и им не обязательно есть их все вместе за один прием пищи.
Поделиться на Pinterest Человек должен поговорить со своим врачом, прежде чем принимать добавки с незаменимыми аминокислотами.Хотя 11 аминокислот являются несущественными, людям могут потребоваться некоторые из них, если они находятся в состоянии стресса или болеют. В это время организм может быть не в состоянии производить достаточное количество этих аминокислот, чтобы удовлетворить повышенную потребность.Эти аминокислоты являются «условными», что означает, что они могут потребоваться человеку в определенных ситуациях.
Иногда люди могут захотеть принимать добавки с незаменимыми аминокислотами. Лучше сначала посоветоваться с врачом относительно безопасности и дозировки.
Несмотря на то, что дефицит незаменимых аминокислот возможен, большинство людей может получить их в достаточном количестве, соблюдая диету, включающую белок.
Продукты из следующего списка являются наиболее распространенными источниками незаменимых аминокислот:
- Лизин содержится в мясе, яйцах, сое, черной фасоли, киноа и семенах тыквы.
- Мясо, рыба, птица, орехи, семена и цельные зерна содержат большое количество гистидина.
- Творог и зародыши пшеницы содержат большое количество треонина.
- Метионин содержится в яйцах, зернах, орехах и семенах.
- Валин содержится в сое, сыре, арахисе, грибах, цельнозерновых и овощах.
- Изолейцин содержится в мясе, рыбе, птице, яйцах, сыре, чечевице, орехах и семенах.
- Источниками лейцина являются молочные продукты, соя, фасоль и бобовые.
- Фенилаланин содержится в молочных продуктах, мясе, птице, сое, рыбе, бобах и орехах.
- Триптофан содержится в большинстве продуктов с высоким содержанием белка, включая зародыши пшеницы, творог, курицу и индейку.
Это лишь несколько примеров продуктов, богатых незаменимыми аминокислотами. Все продукты, содержащие белок, будь то растительного или животного происхождения, будут содержать по крайней мере некоторые из незаменимых аминокислот.
Потребление незаменимых аминокислот имеет решающее значение для хорошего здоровья.
Ежедневное употребление разнообразных продуктов, содержащих белок, — лучший способ для людей получать достаточное количество незаменимых аминокислот.При современной диете и доступе к большому разнообразию продуктов дефицит редко встречается у людей, которые в целом имеют хорошее здоровье.
Перед приемом пищевых добавок следует всегда проконсультироваться с врачом.
Строительные блоки белка в организме
Есть два типа аминокислот: незаменимые и заменимые. Человеческое тело не производит эти белки, хотя они жизненно важны для поддержания жизни человека. Это означает, что вы должны получать их с белком, содержащимся в растительной и животной пище.
Восемь незаменимых аминокислот:
- Изолейцин
- лейцин
- Лизин
- метионин
- фенилаланин
- Треонин
- Триптофан
- Валин
Кроме этих восьми, есть гистидин . Технически он принадлежит к списку незаменимых аминокислот. Однако детский организм не вырабатывает достаточного количества гистидина и поэтому должен получать добавки с пищей.
Продукты, богатые изолейцином Молоко и молочные продукты
Яйца
Курица
Говядина
Свинина
Орехи и семена
Бобовые, горох, фасоль и арахисовое масло
Сыр Пармезан
Соевые бобы
Куриная грудка
Тунец
Говядина
Орехи
Соевые бобы
Постная говядина
Свинина
Сыр пармезан
Индейка и курица
Тунец, приготовленный
Яйца
Белая фасоль
Рыба и моллюски
Сыр пармезан
Белая фасоль
Яйца
Индейка и курица
Постная говядина
Баранина
Сыр Пармезан
Молочные продукты
Постная говядина и баранина
Яйца
Бобы пинто
Соевые бобы
Белые бобы
Индейка и курица
Сыр пармезан
Постная говядина и баранина
Рыба и моллюски
Орехи
Белая фасоль
Соевые бобы
Семена и орехи
Баранина
Курица и индейка
Рыба и крабы
Фасоль
Говядина
Соя
Молочные продукты, сыр и яйца
Семена и орехи
Рыба
Свинина
Говядина
Фасоль
Курица и индейка
Рыба
Свинина
Фасоль
Яйца и молочные продукты
Семена и орехи
Индейка и курица
Соевые бобы
Не все эти источники равны.Некоторые содержат большее количество белка с более высокой биологической ценностью, особенно белки животных. Конечно, это не означает, что вы не можете получить необходимые белки и аминокислоты из вегетарианской диеты. Это означает, что вам нужно комбинировать разные источники, которые дополняют друг друга. Например, фасоль и тосты дополняют друг друга, помогая вашему организму более эффективно усваивать белки, содержащиеся в фасоли.
Аминокислоты, эволюция | Изучайте науку в Scitable
Бауманн, П.Биология бактериоцит-ассоциированных эндосимбионтов сокососущих насекомых растений. Ежегодный обзор микробиологии 59 , 155–189 (2005) DOI: 10.1146 / annurev.micro.59.030804.121041.
Бок, А. Биосинтез селенопротеидов — обзор. Биофакторы 11 , 77–78 (2000).
Fani, R. et al. Роль слияния генов в эволюция метаболических путей: случай биосинтеза гистидина. BMC Evolutionary Biology 7 Приложение 2 , S4 (2007) DOI: 10.1186 / 1471-2148-7-S2-S4.
Гордон, А. Х., Martin, A.J. и Synge, R.L. Распределительная хроматография в исследовании белковые составляющие. Биохимический журнал 37 , 79–86 (1943).
Эрнандес-Монтес, G. et al. Скрытый универсал распределение аминокислотных биосинтетических сетей: геномный взгляд на их происхождение и эволюция. Геном Биология 9 , R95 (2008) doi: 10.1186 / gb-2008-9-6-r95.
Горовиц, Н.H. Об эволюции биохимических синтезов. Труды Национального Академия наук 31 , 153-157 (1945).
Мерино, Э., Дженсен, Р. А. и Янофски, С. Эволюция бактериальных оперонов trp и их регуляция. Текущее мнение по микробиологии 11 , 78–86 (2008) doi: 10.1016 / j.mib.2008.02.005.
Миллер, С. Л. Производство аминокислот в возможных примитивных земных условиях. Наука 117 , 528–529 (1953).
Pal, C. et al. Случайность и необходимость в эволюция минимальных метаболических сетей. Природа 440 , 667–670 (2006) DOI: 10,1038 / природа04568.
Ридс, П. Дж. Незаменимые и незаменимые аминокислоты для человека. Журнал питания 130 , 1835С – 1840С (2000 г.).
Шигенобу, С. et al. Геномная последовательность внутриклеточный бактериальный симбионт тлей Buchnera sp. APS. Природа 407 , 81–86 (2000) DOI: 10.1038 / ng986.
Шринивасан, G., James, C.M. & Krzycki, J.A. Пирролизин, кодируемый UAG в архее: Зарядка специализированной тРНК, декодирующей UAG. Наука 296 , 1459–1462 (2002) DOI: 10.1126 / science.1069588.
Teichmann, S.A. et al. Эволюция и структурная анатомия низкомолекулярных путей метаболизма Escherichia coli . Журнал Молекулярная биология 311 , 693–708 (2001) DOI: 10.1006 / jmbi.2001. 4912.
Веласко, А. М., Легина, Дж. И., Ласкано, А. Молекулярная эволюция лизина. биосинтетические пути. Журнал Молекулярная эволюция 55 , 445–459 (2002) DOI: 10.

