строение белка, его функции и норма в день
Белки — строительный материал для нашего организма. В этой части узнаем, какова дневная норма белка и как не переусердствовать с ним в погоне за мышцами.
Это часть интерактивных уроков, подготовленных образовательной платформой Level One в сотрудничестве с крупнейшими российскими экспертами.
Еще 500 уроков по 15 направлениям, от истории и архитектуры до здоровья и кулинарии на levelvan.ru/plus
посмотреть все уроки
Автор урока
Софья Хабибова
Спортивный травматолог, тренер по фитнесу и нутрициолог, тренер проекта Norma Fit
Человек состоит из белков, как и другие животные. Если кто-то решит нас съесть, мы будем отличным источником белка — но лучше не надо! Рассказываем, как устроены белки.
Функции и расщепление 👇
🧱 Строительный материал.
🔋 Энергетическая ценность. Энергетическая ценность белка такая же, как и у углеводов — 4 килокалории на 1 грамм. Поэтому, если нужно, белки пойдут не на строительство: организм возьмет энергию из белков так же легко, как и из углеводов.
🦴 Как расщепляются белки. В кишечнике белок расщепляется до аминокислот, которые затем попадают в кровь. Дальше они расходятся по организму в качестве строительного материала. Организм сам оценивает, где нужны белки, и направляет их туда.
🥛 Как отправить белок в мышцы. После тренировки мышцам нужен белок, чтобы восстановить микротравмы в мышечной ткани. Мышца посылает запрос на строительный материал, и белок отправляется туда. Если тренировки не было, белок мышце нужен меньше — только, чтобы обновиться.
🧬 Строение белка
Белок — это макромолекула или, проще говоря, большая молекула. Она состоит из аминокислот. Всего аминокислот 20 и в разных белках они комбинируются по-разному.
Аминокислоты соединяются друг с другом и образуют цепочку. Цепочки соединяются в спирали, а спирали — в клубки. В итоге получается конечный белок: например, гемоглобин или мышечный белок.
Когда мы едим, происходит обратный процесс: клубок расщепляется до аминокислот, которые уже всасываются в кровь.
Телеграм-канал
Level One
Вдохновляющие посты, новые запуски и подарки только для подписчиков
подписаться
На картинке: слева — цепочка аминокислот, справа — готовый белок.
Белковое окно, повышенная норма белка при тренировках — считается, что эти правила помогают наращивать мышечную массу. Обсудим их.
Обсудим их.
Как есть белок 👇
🐟 Где искать белок. Белковые продукты — это мясо и субпродукты, рыба и птица, яичный белок, а также молочные продукты. Не забывайте про растительный белок: грибы, бобовые и орехи.
⚖️ Норма белка. Дневная норма белка — это 0,8 грамм на килограмм веса. Если вы активно тренируетесь, то норма вырастает до 1,2–1,5 граммов. Больше есть не надо: белок может откладываться в жир при избытке калорий так же, как углеводы. А еще лишний белок — это дополнительная нагрузка на почки.
🍴 Как есть белки. Идеально будет сделать упор на белковую пищу в течение двух часов после тренировки. Как раз в это время мышца активно синтезирует новый белок и восстанавливается после тренировки.
Новые данные говорят, что мышца восстанавливается намного дольше и активно потребляет белок еще несколько суток после тренировки. Вывод: не обязательно есть творог в спортзале. У нас умный организм и он достанет нужный ему белок.
курс Level One
Как улучшить качество жизни: научный подход к здоровью
На курсе мы познакомимся с процессами в нашем организме и поймем, как реагировать на его сигналы. Выясним, можно ли умереть от недосыпа, когда люди смогут редактировать свои гены и почему старение начинается еще до рождения. А еще попробуем последить за своим здоровьем и приобрести несколько полезных привычек прямо по ходу курса.
Выясним, можно ли умереть от недосыпа, когда люди смогут редактировать свои гены и почему старение начинается еще до рождения. А еще попробуем последить за своим здоровьем и приобрести несколько полезных привычек прямо по ходу курса.
Сегодня можно купить со скидкой 50%
подробнее о курсе
Содержание белков в мышце во время тренировок регулируется на различных уровнях
Подготовила
Елена Клещенко
Российские ученые исследовали, как изменение активности генов влияет на содержание их белковых продуктов в скелетных мышцах человека.
Подготовила
Елена Клещенко
Регулярные аэробные упражнения низкой интенсивности (аэробная тренировка) улучшают чувствительность к инсулину, углеводно-жировой обмен и предотвращают опасные нарушения метаболизма, такие как метаболический синдром и диабет второго типа. Частично это связано с тем, что упражнения увеличивают в скелетных мышцах объем и количество митохондрий и активность митохондриальных ферментов, что увеличивает способность мышц окислять углеводы и жиры. Большой интерес представляют молекулярные механизмы, лежащие в основе этих эффектов, в частности, та роль, которую играет увеличение активности генов в увеличении содержания митохондриальных белков. Помимо этого, скелетные мышцы человека — одна из немногих тканей, доступных для многократного взятия биопсических проб, что делает ее удобной моделью.
Частично это связано с тем, что упражнения увеличивают в скелетных мышцах объем и количество митохондрий и активность митохондриальных ферментов, что увеличивает способность мышц окислять углеводы и жиры. Большой интерес представляют молекулярные механизмы, лежащие в основе этих эффектов, в частности, та роль, которую играет увеличение активности генов в увеличении содержания митохондриальных белков. Помимо этого, скелетные мышцы человека — одна из немногих тканей, доступных для многократного взятия биопсических проб, что делает ее удобной моделью.
Сотрудники Института медико-биологических проблем РАН, факультета фундаментальной медицины МГУ, Института фундаментальной медицины и биологии КФУ из Казани и их коллеги исследовали изменения протеома и транскриптома в скелетной мышце у нетренированных мужчин после двух месяцев аэробных тренировок на велотренажере — по часу в день, пять дней в неделю. Пробы мышечной ткани из наружной головки четырехглавой мышцы бедра брали с помощью игольчатой биопсии, изменения транскриптома и протеома исследовали методами РНК-секвенирования и масс-спектрометрии.
В общей сложности было детектировано около 800 белков (14% протеома мышц, представленного в базе данных Human Protein Atlas). Главным образом это были высокопредставленные (с высокой массовой концентрацией) белки — окислительно-восстановительные ферменты, белки, связывающие нуклеиновые кислоты (преимущественно РНК), белки цитоскелета и теплового шока (шапероны), тогда как регуляторные белки — факторы транскрипции, сигнальные молекулы, рецепторы и транспортеры, были детектированы в малом количестве.
Сопоставление увеличения содержания белков, вызванное аэробными тренировками, с изменением уровня активности их генов позволило выяснить, что белки с различными функциями регулируются разными способами. Например, рост количества белков, внеклеточного матрикса сопровождается увеличением количества мРНК (активацией их генов), тогда как увеличение количества митохондриальных белков происходит без изменений количества их мРНК. Оказалось, что митохондриальные белки регулируются на другом уровне: увеличение содержания митохондриальных белков происходило на фоне увеличения содержания шаперонов — белков, ответственных за поддержание и восстановление правильной конформации других белков.
Авторы также упоминают другие возможные механизмы увеличения количества белков, не связанные с увеличением экспрессии мРНК, например, кэп-независимую регуляцию трансляции, которая позволяет увеличивать синтез белка только для специфичных мРНК.
На вопросы PCR.news отвечает ведущий автор статьи Даниил Попов (Институт медико-биологических проблем РАН, факультет фундаментальной медицины МГУ).
Эта работа имеет отношение к MUSCLE-FANTOM, о котором нам рассказывал Олег Гусев?
Это исследование было выполнено вместе с нашими коллегами из Казанского федерального университета — Олегом Гусевым и другими, — которые активно работают над проектом MUSCLE-FANTOM. Этот проект направлен на исследование работы регуляторных элементов генома в скелетных мышцах. Для этого используется специальный метод — CAGE (кэп-анализ экспрессии генов). В настоящем исследовании изменения транскриптома оценивались с помощью метода РНК-секвенирования, т.е. полученные данные напрямую к MUSCLE-FANTOM не относятся. Однако сейчас вместе с нашими казанскими коллегами мы проводим несколько исследований (в которых используем CAGE), результаты которых войдут в MUSCLE-FANTOM.
Этот проект направлен на исследование работы регуляторных элементов генома в скелетных мышцах. Для этого используется специальный метод — CAGE (кэп-анализ экспрессии генов). В настоящем исследовании изменения транскриптома оценивались с помощью метода РНК-секвенирования, т.е. полученные данные напрямую к MUSCLE-FANTOM не относятся. Однако сейчас вместе с нашими казанскими коллегами мы проводим несколько исследований (в которых используем CAGE), результаты которых войдут в MUSCLE-FANTOM.
Какие практические возможности даст информация о протеоме и транскриптоме работающих мышц?
Прежде всего, скелетная мышца человека — это очень удобная модель для изучения фундаментальных механизмов регуляции генной экспрессии и содержания белков в тканях человека. Во-первых, скелетная мышца очень пластична, то есть она относительно быстро меняет свои функциональные характеристики при увеличении или при снижении уровня двигательной активности; во-вторых, ее клетки легко «стрессировать», например, с помощью дозированной физической нагрузки.
Источник
Pavel A. Makhnovskii, et al. // Regulation of Proteins in Human Skeletal Muscle: The Role of Transcription. // Scientific Reports, 2020, 10, 3514; DOI: 10.1038/s41598-020-60578-2
Секвенирование Масс-спектрометрия Геномика Экспрессия генов Протеомика
белков | Определение, структура и классификация
синтез белка
Посмотреть все СМИ
- Ключевые люди:
- Джон Б.
 Фенн
Джордж П. Смит
Тасуку Хондзё
Ричард Хендерсон
Уильям Г. Кэлин-младший
Фенн
Джордж П. Смит
Тасуку Хондзё
Ричард Хендерсон
Уильям Г. Кэлин-младший
- Похожие темы:
- фермент интерферон фактор транскрипции прион фосфорилирование белка
- Выдающиеся лауреаты:
- Родни Роберт Портер
Просмотреть весь связанный контент →
Популярные вопросы
Что такое белок?
Белок представляет собой встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями. Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для последующего использования у животных. Когда животное потребляет избыточное количество белков, они превращаются в жиры (глюкозу или триглицериды) и используются для получения энергии или создания запасов энергии. Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной активности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Сводка
Прочтите краткий обзор этой темы
белок , очень сложное вещество, присутствующее во всех живых организмах. Белки имеют большую питательную ценность и принимают непосредственное участие в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios , что означает «занимающий первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios , что означает «занимающий первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Молекула белка очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных друг с другом в длинные цепи, подобно тому, как бусы расположены на нитке. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка исходя из его аминокислотной последовательности, установленные корреляции между структурой и функцией можно объяснить свойствами аминокислот, входящих в состав белков.
Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, которые обеспечивают азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, таким как жвачные (например, коровы), требуется очень большое количество растительного материала, который питается только растительным материалом для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0057 см. питание человека).
Содержание белка в органах животных обычно намного выше, чем в плазме крови. Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Викторина «Британника»
Викторина «Медицинские термины и пионеры»
Кто открыл основные группы крови? Что вызывает болезнь крови талассемию? Проверьте, что вы знаете о медицине, пройдя этот тест.
Высокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые наиболее важные белки, такие как ферменты и гормоны, встречаются в очень малых количествах. Важность белков связана главным образом с их функцией. Все ферменты, идентифицированные до сих пор, являются белками. Ферменты, являющиеся катализаторами всех метаболических реакций, позволяют организму накапливать необходимые для жизни химические вещества — белки, нуклеиновые кислоты, углеводы и липиды, превращать их в другие вещества и разлагать их. Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регулирующими функциями. У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Ферменты, являющиеся катализаторами всех метаболических реакций, позволяют организму накапливать необходимые для жизни химические вещества — белки, нуклеиновые кислоты, углеводы и липиды, превращать их в другие вещества и разлагать их. Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регулирующими функциями. У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Оценка роли распада мышечных белков в ответ на питание и физические упражнения у людей
1. Wolfe RR. Недооцененная роль мышц в здоровье и болезни. Am J Clin Nutr. 2006; 84: 475–482. [PubMed] [Google Scholar]
2. Witard OC, Wardle SL, Macnaughton LS, et al. Белки для оптимизации массы скелетных мышц у здоровых молодых и пожилых людей. Питательные вещества. 2016; 8:181. дои: 10.3390/nu8040181. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Типтон К.Д., Вулф Р.Р. Изменения белкового обмена, вызванные физической нагрузкой. Acta Physiol Scand. 1998; 162: 377–387. doi: 10.1046/j.1365-201X.1998.00306.x. [PubMed] [CrossRef] [Google Scholar]
Типтон К.Д., Вулф Р.Р. Изменения белкового обмена, вызванные физической нагрузкой. Acta Physiol Scand. 1998; 162: 377–387. doi: 10.1046/j.1365-201X.1998.00306.x. [PubMed] [CrossRef] [Google Scholar]
4. Типтон К.Д., Вулф Р.Р. Белки и аминокислоты для спортсменов. J Sports Sci. 2004; 22: 65–79. doi: 10.1080/0264041031000140554. [PubMed] [CrossRef] [Google Scholar]
5. Morton RW, McGlory C, Phillips SM. Пищевые вмешательства для увеличения гипертрофии скелетных мышц, вызванной тренировками с отягощениями. Фронт Физиол. 2015;6:245. дои: 10.3389/ффиз.2015.00245. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Pasiakos SM, Carbone JW. Оценка протеолиза скелетных мышц и регуляторной реакции на питание и физические упражнения. Жизнь ИУБМБ. 2014; 66: 478–484. doi: 10.1002/iub.1291. [PubMed] [CrossRef] [Google Scholar]
7. Biolo G, Maggi SP, Williams BD, et al. Увеличение скорости оборота мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol. 1995; 268:E514–E520. [PubMed] [Академия Google]
Am J Physiol. 1995; 268:E514–E520. [PubMed] [Академия Google]
8. Biolo G, Tipton KD, Klein S, et al. Обильный запас аминокислот усиливает метаболический эффект упражнений на мышечный белок. Am J Physiol. 1997; 273:E122–E129. [PubMed] [Google Scholar]
9. Мертон А., Константин Д., Гринхаф П. Участие убиквитиновой протеасомной системы в ремоделировании и атрофии скелетных мышц человека. Биохим Биофиз Акта. 2008; 1782: 730–743. doi: 10.1016/j.bbadis.2008.10.011. [PubMed] [CrossRef] [Google Scholar]
10. Токгоз З., Бонсак Р.Н., Хаас А.Л. Плейотропные эффекты АТФ·Mg 2+ связывание в каталитическом цикле убиквитин-активирующего фермента. Дж. Биол. Хим. 2006; 281:14729–14737. doi: 10.1074/jbc.M513562200. [PubMed] [CrossRef] [Google Scholar]
11. Lee I, Schindelin H. Структурное понимание катализируемой E1 активации убиквитина и переноса на конъюгирующие ферменты. Клетка. 2008; 134: 268–278. doi: 10.1016/j.cell.2008.05.046. [PubMed] [CrossRef] [Google Scholar]
12. Кравцова-Иванцив Ю., Чехановер А. Неканонические сигналы на основе убиквитина для протеасомной деградации. Дж. Клеточные науки. 2012;125:539–548. doi: 10.1242/jcs.093567. [PubMed] [CrossRef] [Google Scholar]
Кравцова-Иванцив Ю., Чехановер А. Неканонические сигналы на основе убиквитина для протеасомной деградации. Дж. Клеточные науки. 2012;125:539–548. doi: 10.1242/jcs.093567. [PubMed] [CrossRef] [Google Scholar]
13. Bodine SC, Latres E, Baumhueter S, et al. Идентификация убиквитинлигазы, необходимой для атрофии скелетных мышц. Наука. 2001; 294:1704–1708. doi: 10.1126/science.1065874. [PubMed] [CrossRef] [Google Scholar]
14. Lecker SH, Jagoe RT, Gilbert A, et al. Множественные типы атрофии скелетных мышц связаны с общей программой изменений в экспрессии генов. FASEB J. 2004; 18:39–51. doi: 10.1096/fj.03-0610com. [PubMed] [CrossRef] [Академия Google]
15. Соломон В., Гольдберг А.Л. Значение пути АТФ-убиквитин-протеасома в деградации растворимых и миофибриллярных белков в экстрактах мышц кролика. Дж. Биол. Хим. 1996; 271:26690–26697. doi: 10.1074/jbc.271.43.26690. [PubMed] [CrossRef] [Google Scholar]
16. Du J, Wang X, Miereles C, et al. Активация каспазы-3 является начальным этапом, запускающим ускоренный мышечный протеолиз в катаболических условиях. Джей Клин Инвест. 2004; 113:115–123. doi: 10.1172/JCI18330. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Джей Клин Инвест. 2004; 113:115–123. doi: 10.1172/JCI18330. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Джекман Р.В., Кандарян СК. Молекулярные основы атрофии скелетных мышц. Am J Physiol. 2004; 287:C834–C843. doi: 10.1152/ajpcell.00579.2003. [PubMed] [CrossRef] [Google Scholar]
18. Танида И., Вагури С. Измерение аутофагии в клетках и тканях. Методы Мол Биол. 2010;648:193–214. doi: 10.1007/978-1-60761-756-3_13. [PubMed] [CrossRef] [Google Scholar]
19. Mayer RJ. Стремительный подъем регулируемого внутриклеточного протеолиза. Nat Rev Mol Cell Biol. 2000; 1: 145–148. дои: 10.1038/35040090. [PubMed] [CrossRef] [Google Scholar]
20. Sorimachi H, Imajoh-Ohmi S, Emori Y, et al. Молекулярное клонирование новой кальций-зависимой протеазы млекопитающих, отличной как от m-, так и от mu-типа. Специфическая экспрессия мРНК в скелетных мышцах. Дж. Биол. Хим. 1989; 264:20106–20111. [PubMed] [Google Scholar]
21. Мерфи Р.М., Вербург Э., Лэмб Г. Д. Ca 2+ активация диффундирующих и связанных пулов му-кальпаина в скелетных мышцах крыс. Дж. Физиол. 2006; 576: 595–612. doi: 10.1113/jphysiol.2006.114090. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Д. Ca 2+ активация диффундирующих и связанных пулов му-кальпаина в скелетных мышцах крыс. Дж. Физиол. 2006; 576: 595–612. doi: 10.1113/jphysiol.2006.114090. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Dargelos E, Poussard S, Brule C, et al. Кальций-зависимая протеолитическая система и мышечные дисфункции: возможная роль кальпаинов при саркопении. Биохимия. 2008; 90: 359–368. doi: 10.1016/j.biochi.2007.07.018. [PubMed] [CrossRef] [Google Scholar]
23. Мерфи Р.М., Лэмб Г.Д. Эндогенная активация кальпаина-3 в первую очередь регулируется небольшим увеличением покоящейся цитоплазмы [Ca 2+ ] и не зависит от растяжения. Дж. Биол. Хим. 2009 г.;284:7811–7819. doi: 10.1074/jbc.M808655200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Saenz A, Leturcq F, Cobo AM, et al. LGMD2A: корреляции генотип-фенотип, основанные на большом мутационном исследовании гена кальпаина 3. Мозг. 2005; 128: 732–742. doi: 10.1093/brain/awh508. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
25. Wolfe RR, Chinkes DL, Wolfe RR. Изотопные индикаторы в метаболических исследованиях: принципы и практика кинетического анализа. 2. Хобокен: Уайли-Лисс; 2005. [Google Академия]
26. Thompson GN, Pacy PJ, Merritt H, et al. Быстрое измерение обмена белка всего тела и предплечья с использованием модели [2H5]фенилаланина. Am J Physiol. 1989; 256:E631–E639. [PubMed] [Google Scholar]
27. Thompson GN, Pacy PJ, Ford GC, et al. Практические соображения по использованию соединений, меченных стабильными изотопами, в качестве индикаторов в клинических исследованиях. Биомед Масс-спектр окружающей среды. 1989; 18: 321–327. doi: 10.1002/bms.1200180507. [PubMed] [CrossRef] [Google Scholar]
28. Biolo G, Chinkes D, Zhang XJ, et al. Новая модель для определения in vivo взаимосвязи между трансмембранным транспортом аминокислот и кинетикой белка в мышцах. J Парентер Энтерал Нутр. 1992;16:305–315. doi: 10.1177/0148607192016004305. [PubMed] [CrossRef] [Google Scholar]
29. Biolo G, Gastaldelli A, Zhang XJ, et al. Синтез и расщепление белка в коже и мышцах: модель ног кинетики аминокислот. Am J Physiol. 1994; 267:E467–E474. [PubMed] [Google Scholar]
Biolo G, Gastaldelli A, Zhang XJ, et al. Синтез и расщепление белка в коже и мышцах: модель ног кинетики аминокислот. Am J Physiol. 1994; 267:E467–E474. [PubMed] [Google Scholar]
30. Katsanos CS, Chinkes DL, Sheffield-Moore M, et al. Метод определения артериовенозного баланса белков мышц при нестационарных концентрациях аминокислот в крови и мышцах. Am J Physiol. 2005;289:E1064–E1070. [PubMed] [Google Scholar]
31. Tipton KD, Rasmussen BB, Miller SL, et al. Время приема аминокислот и углеводов изменяет анаболический ответ мышц на упражнения с отягощениями. Am J Physiol. 2001; 281:E197–E206. [PubMed] [Google Scholar]
32. Zhang XJ, Chinkes DL, Sakurai Y, et al. Изотопный метод измерения скорости фракционного распада мышечного белка in vivo. Am J Physiol. 1996; 270:E759–E767. doi: 10.1152/ajpcell.1996.270.5.C1326. [PubMed] [CrossRef] [Академия Google]
33. Чинкс Д.Л. Методы измерения скорости распада тканевых белков in vivo. Curr Opin Clin Nutr Metab Care. 2005; 8: 534–537. doi: 10.1097/01.mco.0000170754.25372.37. [PubMed] [CrossRef] [Google Scholar]
2005; 8: 534–537. doi: 10.1097/01.mco.0000170754.25372.37. [PubMed] [CrossRef] [Google Scholar]
34. Phillips SM, Tipton KD, Aarsland A, et al. Синтез и расщепление смешанного мышечного белка после упражнений с отягощениями у людей. Am J Physiol. 1997; 273:E99–E107. [PubMed] [Google Scholar]
35. Phillips SM, Tipton KD, Ferrando AA, et al. Тренировки с отягощениями уменьшают резкое увеличение оборота мышечного белка, вызванное физической нагрузкой. Am J Physiol. 1999;276:Е118–Е124. [PubMed] [Google Scholar]
36. Zhang XJ, Chinkes DL, Wolfe RR. Измерение фракционного синтеза и скорости распада мышечного белка после инъекции индикатора пульса. Am J Physiol. 2002; 283:E753–E764. doi: 10.1152/ajpcell.00048.2002. [PubMed] [CrossRef] [Google Scholar]
37. Tuvdendorj D, Chinkes DL, Herndon DN, et al. Новый метод индикатора стабильных изотопов для измерения скорости фракционного распада мышечного белка во время физиологического нестационарного состояния. Am J Physiol. 2013; 304:E623–E630. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2013; 304:E623–E630. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. McGlory C, Devries MC, Phillips SM. Тренировка скелетных мышц и силовых упражнений; роль синтеза белка в восстановлении и ремоделировании. J Appl Physiol. 2016; 122: 541–548. doi: 10.1152/japplphysiol.00613.2016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Witard OC, Jackman SR, Breen L, et al. Скорость синтеза миофибриллярного мышечного белка после еды в ответ на увеличение дозы сывороточного белка в покое и после упражнений с отягощениями. Am J Clin Nutr. 2014;99:86–95. doi: 10.3945/ajcn.112.055517. [PubMed] [CrossRef] [Google Scholar]
40. Vesali RF, Klaude M, Thunblad L, et al. Распад сократительного белка в скелетных мышцах ног человека по оценке [2h4]-3-метилгистидина: новый метод. Метаболизм. 2004; 53:1076–1080. doi: 10.1016/j.metabol.2004.02.017. [PubMed] [CrossRef] [Google Scholar]
41. Trappe T, Williams R, Carrithers J, et al. Влияние возраста и силовых упражнений на протеолиз скелетных мышц человека: подход микродиализа. Дж. Физиол. 2004; 554: 803–813. doi: 10.1113/jphysiol.2003.051755. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Физиол. 2004; 554: 803–813. doi: 10.1113/jphysiol.2003.051755. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Haus JM, Miller BF, Carroll CC, et al. Влияние интенсивных аэробных упражнений на миофибриллярный протеолиз скелетных мышц у человека. Scand J Med Sci Sports. 2007; 17: 260–266. [PubMed] [Google Scholar]
43. Hansen M, Trappe T, Crameri RM, et al. Миофибриллярный протеолиз в ответ на произвольное или электрически стимулированное сокращение мышц у человека. Scand J Med Sci Sports. 2009; 19:75–82. doi: 10.1111/j.1600-0838.2007.00766.x. [PubMed] [CrossRef] [Академия Google]
44. Rennie MJ, Phillips S, Smith K. Надежность результатов и интерпретация показателей 3-метилгистидина в мышечном интерстиции как маркера мышечного протеолиза. J Appl Physiol. 2008; 105:1380–1381. doi: 10.1152/japplphysiol.90782.2008. [PubMed] [CrossRef] [Google Scholar]
45. Holm L, O’Rourke B, Ebenstein D, et al. Определение скорости распада белка в равновесном состоянии in vivo по исчезновению связанных с белком меченых аминокислот: метод, применимый к людям. Am J Physiol. 2013;304:E895–E907. doi: 10.1152/ajpcell.00297.2012. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Am J Physiol. 2013;304:E895–E907. doi: 10.1152/ajpcell.00297.2012. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Holm L, Kjaer M. Измерение скорости распада отдельных белков in vivo. Curr Opin Clin Nutr Metab Care. 2010; 13: 526–531. doi: 10.1097/MCO.0b013e32833c3c64. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Wilkinson DJ, Atherton PJ, Phillips BE, et al. Применение оксида дейтерия (D 2 O) для метаболических исследований: просто D 2 O это? Зависит от того, как вы D 2 О, это! Am J Physiol. 2015;308:E847. [PubMed] [Google Scholar]
48. Wilkinson DJ, Cegielski J, Phillips BE, et al. Внутреннее сравнение между оксидом дейтерия (D 2 O) и L-[ кольцо -13C6] фенилаланином для острого измерения синтеза мышечного белка у людей. Physiol Rep. 2015;3:e12433. doi: 10.14814/phy2.12433. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Doherty MK, Brownridge P, Owen MA, et al. Стратегия протеомики для определения скорости синтеза и деградации отдельных белков у рыб. J протеом. 2012;75:4471–4477. doi: 10.1016/j.jprot.2012.03.025. [PubMed] [CrossRef] [Академия Google]
Стратегия протеомики для определения скорости синтеза и деградации отдельных белков у рыб. J протеом. 2012;75:4471–4477. doi: 10.1016/j.jprot.2012.03.025. [PubMed] [CrossRef] [Академия Google]
50. Camera DM, Burniston JG, Pogson MA, et al. Динамическое профилирование протеома отдельных белков в скелетных мышцах человека после диеты с высоким содержанием жиров и упражнений с отягощениями. FASEB J. 2017. (Электронная публикация перед печатью. PMID: 28855275) . [PubMed]
51. VanGuilder HD, Vrana KE, Freeman WM. Двадцать пять лет количественной ПЦР для анализа экспрессии генов. Биотехнологии. 2008; 44: 619–626. doi: 10.2144/000112776. [PubMed] [CrossRef] [Google Scholar]
52. Virtanen C, Takahashi M. Muscling in on microarrays. Appl Physiol Nutr Metab. 2008; 33: 124–129. дои: 10.1139/H07-150. [PubMed] [CrossRef] [Google Scholar]
53. Metzker ML. Технологии секвенирования — следующее поколение. Нат Рев Жене. 2010;11:31–46. doi: 10.1038/nrg2626.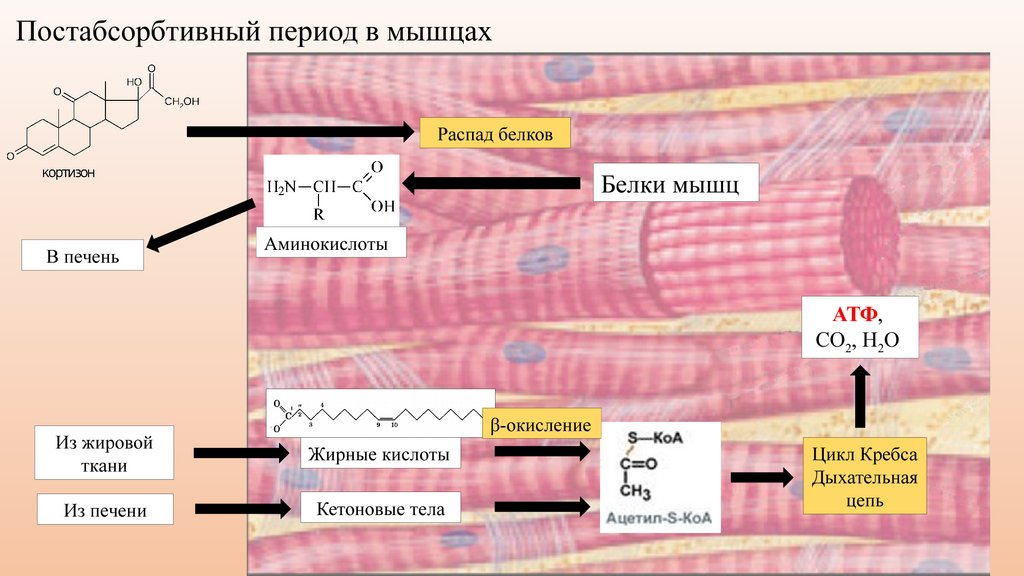 [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
54. Atherton PJ, Greenhaff PL, Phillips SM, et al. Контроль атрофии скелетных мышц в ответ на неиспользование: клинические/доклинические споры и ошибочные доказательства. Am J Physiol. 2016;311:e594–e604. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Reitelseder S, Agergaard J, Doessing S, et al. Положительный чистый баланс мышечного белка и дифференциальная регуляция экспрессии атрогена после упражнений с отягощениями и приема молочного белка. Евр Дж Нутр. 2014;53:321–333. дои: 10.1007/s00394-013-0530-х. [PubMed] [CrossRef] [Google Scholar]
56. Feasson L, Stockholm D, Freyssenet D, et al. Молекулярная адаптация белков, связанных с нервно-мышечными заболеваниями, в ответ на эксцентрические упражнения в скелетных мышцах человека. Дж. Физиол. 2002; 543: 297–306. doi: 10.1113/jphysiol.2002.018689. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Murphy RM, Goodman CA, McKenna MJ, et al. Кальпаин-3 автолизируется и, следовательно, активируется в скелетных мышцах человека через 24 часа после однократного эксцентрического упражнения. J Appl Physiol. 2007;103:926–931. doi: 10.1152/japplphysiol.01422.2006. [PubMed] [CrossRef] [Google Scholar]
J Appl Physiol. 2007;103:926–931. doi: 10.1152/japplphysiol.01422.2006. [PubMed] [CrossRef] [Google Scholar]
58. Areta JL, Burke LM, Ross ML, et al. Время и распределение потребления белка во время длительного восстановления после упражнений с отягощениями изменяет синтез миофибриллярного белка. Дж. Физиол. 2013;591:2319–2331. doi: 10.1113/jphysiol.2012.244897. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Coffey VG, Shield A, Canny BJ, et al. Взаимодействие сократительной активности и истории тренировок с содержанием мРНК в скелетных мышцах тренированных спортсменов. Am J Physiol. 2006;290:E849–E855. [PubMed] [Google Scholar]
60. Nedergaard A, Vissing K, Overgaard K, et al. Паттерны экспрессии генов компонентов атрогенных и убиквитиновых протеасом при физических нагрузках: влияние различных моделей нагрузки и повторяющихся упражнений. J Appl Physiol. 2007; 103:1513–1522. doi: 10.1152/japplphysiol.01445.2006. [PubMed] [CrossRef] [Google Scholar]
61. Huggett J, Dheda K, Bustin S, et al. нормализация ОТ-ПЦР в реальном времени; стратегии и соображения. Гены Иммун. 2005;6:279–284. doi: 10.1038/sj.gene.6364190. [PubMed] [CrossRef] [Google Scholar]
Huggett J, Dheda K, Bustin S, et al. нормализация ОТ-ПЦР в реальном времени; стратегии и соображения. Гены Иммун. 2005;6:279–284. doi: 10.1038/sj.gene.6364190. [PubMed] [CrossRef] [Google Scholar]
62. Chapman JR, Waldenstrom J. Со ссылкой на эталонные гены: систематический обзор эндогенных контролей в исследованиях экспрессии генов. ПЛОС Один. 2015;10:e0141853. doi: 10.1371/journal.pone.0141853. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Thomas KC, Zheng XF, Garces Suarez F, et al. Основанный на доказательствах выбор часто используемых эталонных генов RT-qPCR для анализа скелетных мышц мыши. ПЛОС Один. 2014;9:e88653. doi: 10.1371/journal.pone.0088653. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Hruz T, Wyss M, Docquier M, et al. RefGenes: идентификация надежных и специфических эталонных генов для нормализации данных RT-qPCR. Геномика BMC. 2011;12:156. дои: 10.1186/1471-2164-12-156. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Bustin SA, Benes V, Garson JA, et al. Руководство MIQE: минимальная информация для публикации количественных экспериментов ПЦР в реальном времени. Клин Хим. 2009 г.;55:611–622. doi: 10.1373/clinchem.2008.112797. [PubMed] [CrossRef] [Google Scholar]
Bustin SA, Benes V, Garson JA, et al. Руководство MIQE: минимальная информация для публикации количественных экспериментов ПЦР в реальном времени. Клин Хим. 2009 г.;55:611–622. doi: 10.1373/clinchem.2008.112797. [PubMed] [CrossRef] [Google Scholar]
66. Pfaffl MW, Tichopad A, Prgomet C, et al. Определение стабильных генов домашнего хозяйства, дифференциально регулируемых генов-мишеней и целостности образца: инструмент на основе BestKeeper–Excel с использованием парных корреляций. Биотехнологическая лат. 2004; 26: 509–515. doi: 10.1023/B:BILE.0000019559.84305.47. [PubMed] [CrossRef] [Google Scholar]
67. Vandesompele J, De Preter K, Pattyn F, et al. Точная нормализация количественных данных ОТ-ПЦР в реальном времени путем геометрического усреднения нескольких генов внутреннего контроля. Геном биол. 2002;18:3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Сандерленд К.Л., Робертс М.Д., Далбо В.Дж. и соавт. Эффекты старения и последовательных тренировок с отягощениями на экспрессию матричной РНК гена домашнего хозяйства в скелетных мышцах человека. J Прочность Конд Рез. 2013; 27:1–7. doi: 10.1519/JSC.0b013e3182779830. [PubMed] [CrossRef] [Google Scholar]
J Прочность Конд Рез. 2013; 27:1–7. doi: 10.1519/JSC.0b013e3182779830. [PubMed] [CrossRef] [Google Scholar]
69. Curtis RK, Oresic M, Vidal-Puig A. Пути анализа данных микрочипов. Тенденции биотехнологии. 2005; 23: 429–435. doi: 10.1016/j.tibtech.2005.05.011. [PubMed] [CrossRef] [Академия Google]
70. Subramanian A, Kuehn H, Gould J, et al. GSEA-P: настольное приложение для анализа обогащения набора генов. Биоинформатика. 2007; 23:3251–3253. doi: 10.1093/биоинформатика/btm369. [PubMed] [CrossRef] [Google Scholar]
71. Ashburner M, Ball CA, Blake JA, et al. Генная онтология: инструмент для объединения биологии. Консорциум генных онтологий. Нат Жене. 2000; 25: 25–29. дои: 10.1038/75556. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Croft D, O’Kelly G, Wu G, et al. Reactome: база данных реакций, путей и биологических процессов. Нуклеиновые Кислоты Res. 2011;39:D691–D697. doi: 10.1093/nar/gkq1018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Канехиса М. База данных для постгеномного анализа. Тенденции Жене. 1997; 13: 375–376. doi: 10.1016/S0168-9525(97)01223-7. [PubMed] [CrossRef] [Google Scholar]
Канехиса М. База данных для постгеномного анализа. Тенденции Жене. 1997; 13: 375–376. doi: 10.1016/S0168-9525(97)01223-7. [PubMed] [CrossRef] [Google Scholar]
74. Hector AJ, McGlory C, Damas F, et al. Выраженное ограничение энергии с повышенным потреблением белка не приводит к изменениям в протеолизе и снижению синтеза белка в скелетных мышцах, которые смягчаются упражнениями с отягощениями. ФАСЭБ Дж. 2017. (E-pub перед печатью. PMID: 28899879) . [PubMed]
75. Borgenvik M, Apro W, Blomstrand E. Потребление аминокислот с разветвленной цепью влияет на уровни мРНК MAFbx и общего белка MuRF-1 в мышцах человека в состоянии покоя и во время тренировки. Am J Physiol. 2012; 302:E510–E521. [PubMed] [Google Scholar]
76. Louis E, Raue U, Yang Y, et al. Динамика экспрессии генов протеолитиков, цитокинов и миостатина после интенсивной физической нагрузки в скелетных мышцах человека. J Appl Physiol. 2007; 103:1744–1751. doi: 10.1152/japplphysiol.00679.2007. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
77. Yang Y, Jemiolo B, Trappe S. Экспрессия протеолитической мРНК в ответ на острые упражнения с отягощениями в одиночных скелетных мышечных волокнах человека. J Appl Physiol. 2006; 101:1442–1450. doi: 10.1152/japplphysiol.00438.2006. [PubMed] [CrossRef] [Google Scholar]
78. Stefanetti RJ, Lamon S, Rahbek SK, et al. Влияние дивергентного режима сокращения упражнений и приема сывороточного протеина на атрогин-1, MuRF1 и FOXO1/3A в скелетных мышцах человека. J Appl Physiol. 2014;116:1491–1502. doi: 10.1152/japplphysiol.00136.2013. [PubMed] [CrossRef] [Google Scholar]
79. Mascher H, Tannerstedt J, Brink-Elfegoun T, et al. Повторяющиеся тренировки с отягощениями вызывают различные изменения в экспрессии мРНК MAFbx и MuRF-1 в скелетных мышцах человека. Am J Physiol. 2008;294:E43–E51. [PubMed] [Google Scholar]
80. Stefanetti RJ, Lamon S, Wallace M, et al. Регуляция молекулярных маркеров протеасомного пути убиквитина в ответ на упражнения и тренировки на выносливость и сопротивление. Арка Пфлюгера. 2015; 467:1523–1537. doi: 10.1007/s00424-014-1587-y. [PubMed] [CrossRef] [Академия Google]
Арка Пфлюгера. 2015; 467:1523–1537. doi: 10.1007/s00424-014-1587-y. [PubMed] [CrossRef] [Академия Google]
81. Dalbo VJ, Roberts MD, Hassell S, et al. Влияние питания перед тренировкой на концентрацию гормонов в сыворотке крови и биомаркеры активности протеасомного пути миостатина и убиквитина. Евр Дж Нутр. 2013; 52: 477–487. doi: 10.1007/s00394-012-0349-x. [PubMed] [CrossRef] [Google Scholar]
82. Phillips SM, Parise G, Roy BD, et al. Адаптация метаболизма белков скелетных мышц в состоянии сытости, вызванная тренировкой с отягощениями. Может J Physiol Pharmacol. 2002; 80: 1045–1053. дои: 10.1139/y02-134. [PubMed] [CrossRef] [Академия Google]
83. Trappe TA, Raue U, Tesch PA. Синтез белка камбаловидной мышцы человека после упражнений с отягощениями. Acta Physiol Scand. 2004; 182:189–196. doi: 10.1111/j.1365-201X.2004.01348.x. [PubMed] [CrossRef] [Google Scholar]
84. Carraro F, Stuart CA, Hartl WH, et al. Влияние физических упражнений и восстановления на синтез мышечного белка у людей. Am J Physiol. 1990; 259:E470–E476. [PubMed] [Google Scholar]
Am J Physiol. 1990; 259:E470–E476. [PubMed] [Google Scholar]
85. Sheffield-Moore M, Yeckel CW, Volpi E, et al. Метаболизм белка после тренировки у пожилых и молодых мужчин после аэробных упражнений средней интенсивности. Am J Physiol. 2004; 287:E513–E522. [PubMed] [Академия Google]
86. Carbone JW, Pasiakos SM, Vislocky LM, et al. Влияние кратковременного дефицита энергии на распад мышечного белка и внутримышечный протеолиз у молодых людей с нормальным весом. Appl Physiol Nutr Metab. 2014; 39: 960–968. doi: 10.1139/apnm-2013-0433. [PubMed] [CrossRef] [Google Scholar]
87. Kim HJ, Jamart C, Deldicque L, et al. Маркеры стресса эндоплазматического ретикулума и активность убиквитин-протеасомного пути в ответ на бег на 200 км. Медицинские спортивные упражнения. 2011;43:18–25. дои: 10.1249/MSS.0b013e3181e4c5d1. [PubMed] [CrossRef] [Google Scholar]
88. Pasiakos SM, McClung HL, McClung JP, et al. Молекулярные реакции скелетных мышц на умеренные упражнения на выносливость. Int J Sport Nutr Exerc Metab. 2010;20:282–290. doi: 10.1123/ijsnem.20.4.282. [PubMed] [CrossRef] [Google Scholar]
Int J Sport Nutr Exerc Metab. 2010;20:282–290. doi: 10.1123/ijsnem.20.4.282. [PubMed] [CrossRef] [Google Scholar]
89. Jamart C, Francaux M, Millet GY, et al. Модуляция аутофагии и убиквитин-протеасомных путей во время бега на сверхвыносливость. J Appl Physiol. 2012; 112:1529–1537. doi: 10.1152/japplphysiol.00952.2011. [PubMed] [CrossRef] [Google Scholar]
90. Deutz NE, Wolfe RR. Существует ли максимальный анаболический ответ на прием белка во время еды? Клин Нутр. 2013;32:309–313. doi: 10.1016/j.clnu.2012.11.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Glynn EL, Fry CS, Drummond MJ, et al. Распад мышечного белка играет незначительную роль в анаболическом ответе белка на потребление незаменимых аминокислот и углеводов после упражнений с отягощениями. Am J Physiol. 2010;299:R533–R540. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Dickinson JM, Reidy PT, Gundermann DM, et al. Влияние приема незаменимых аминокислот после тренировки на убиквитиновую протеасомную и аутофагосомно-лизосомную системы в скелетных мышцах пожилых мужчин. J Appl Physiol. 2017; 122:620–630. doi: 10.1152/japplphysiol.00632.2016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Appl Physiol. 2017; 122:620–630. doi: 10.1152/japplphysiol.00632.2016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
93. Biolo G, Williams BD, Fleming RY, et al. Действие инсулина на кинетику мышечного белка и транспорт аминокислот во время восстановления после упражнений с отягощениями. Диабет. 1999;48:949–957. doi: 10.2337/диабет.48.5.949. [PubMed] [CrossRef] [Google Scholar]
94. Koopman R, Beelen M, Stellingwerff T, et al. Совместное употребление углеводов с белком не увеличивает послетренировочный синтез мышечного белка. Am J Physiol. 2007; 293:E833–E842. doi: 10.1152/ajpcell.00194.2006. [PubMed] [CrossRef] [Google Scholar]
95. Staples AW, Burd NA, West DW, et al. Углеводы не увеличивают прирост белка, вызванный физическими упражнениями, по сравнению с одним белком. Медицинские спортивные упражнения. 2011;43:1154–1161. дои: 10.1249/MSS.0b013e31820751cb. [PubMed] [CrossRef] [Google Scholar]
96. Abdulla H, Smith K, Atherton PJ, et al.

 Фенн
Джордж П. Смит
Тасуку Хондзё
Ричард Хендерсон
Уильям Г. Кэлин-младший
Фенн
Джордж П. Смит
Тасуку Хондзё
Ричард Хендерсон
Уильям Г. Кэлин-младший