Какие белки и когда нужно потреблять
В погоне за набором мышечной массы вы поедаете кучу куриного филе, пьете литры протеина и все напрасно? Мышца – не растет? Тогда эта статья для вас.
Основная цель при занятиях в тренажерном зале – нарастить побольше мышц, для этого нам нужен строительный материал, в нашем случае – это протеин или белок.
Функции белков в организме: участвуют в обмене веществ, обеспечивают иммунитет, служат строительным материалом для клеток, участвуют в образовании ферментов и большинства гормонов, гемоглобина и других соединений, в процессе усвоения жиров, углеводов, минеральных веществ и витаминов.
Калорийность 1 грамма белка = 4ккал (4.46). Продукты с высоким содержанием белка – это мясо, рыба, моллюски, яйца, орехи, соя, творог. Все эти продукты можно разделить на 2 группы:
- Животного происхождения
- Растительного происхождения
Все белки состоят из аминокислот.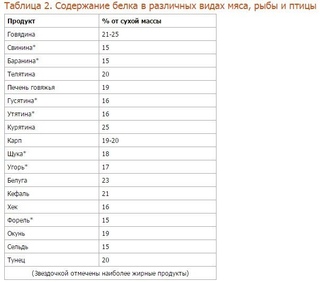
- Заменимые аминокислоты – могут синтезироваться в организме
- Незаменимые аминокислоты – не могут синтезироваться в организме (8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин, для детей незаменимыми также являются аргинин и гистидин.)
Белки животного происхождения содержат больше аминокислот, чем белки растительного происхождения. Поэтому они считаются более выгодными для строительства огромных мышц. Белки, получаемые из обычной пищи, можно подразделить по скорости усвояемости, так же как и протеин, получаемый из спортивного питания!
Яичный белок и изолят сывороточного или говяжьего протеина – 30 мин – 60 мин
Филе: говяжье, свиное, рыба и сывороточный протеин —2-3 часа
Растительный белок, орехи, соя и соевый или многокомпонентный протеин – 4-8 часов
Быстроусвояемые белки нужны после длительного голода:
- после пробуждения утром,
- после тренировки.

Медленные – нужны тогда, тогда когда длительное время нет возможности принять пищу: перед сном, в течение дня.
При потреблении белка надо учитывать некоторые правила, которые помогут грамотно и максимально эффективно им распорядиться.
Правило 1: за час может усвоиться 15-25 гр белка
Правило 2: в суммарное потребление белка рассчитываем по формуле: 1 кг веса тела умножаем на 2-3 гр белка. Если ваш вес 100 кг, то вам для телостроительства потребуется 200 гр белка.
Примерное меню по белковой составляющей может выглядеть таким образом.
- 5 белков и 2 желтка (25 гр белка) или 1 порция сывороточного или говяжьего изолята.
По ночам приемов пищи нет, а следовательно, и аминокислоты не поступают к нашим мышцам, и наблюдается аминокислотный голод. Его необходимо как можно быстрее подавить, загрузив себя быстроусвояемыми белками – ячный белок или протеиновый коктейль.
- 2 завтрак, обед, ужин:
300 гр куриного филе или 2 порции сывороточного протеина
Примерно в 300гр куриного филе содержится 60 гр белка, а скорость его усвояемости в среднем 3 часа, то каждый час будет усваиваться 20 гр белка.
Если говорить о двойной порции сыворотки, то скорость ее усвояемости от 1 до 2 часов, и получается аналогичная ситуация: каждый час будет усваиваться 25 грамм белка. - Поздний ужин:
творог 400 гр или казеин 3-я порция
Тут тоже все просто: данная категория продуктов усваивается длительное время, до 6-8 часов, всю ночь будет снабжать наши мышцы аминокислотами.
Нашей пищеварительной системой на различные виды белка выделяются определенные ферменты для его усвоения. И если вы с утра поели творог, закусив куриным филе, то в перспективе шансов, что и то, и то усвоится одинаково хорошо, достаточно мало. Поэтому лучше всего на практике при подготовке к соревнованиям оптимально на меня работает схема раздельного питания (курица отдельно, творог отдельно). Посудите сами: давайте представим, что ваша пищеварительная система – это большой плавучий корабль, на который одновременно поместили дюжину собак и дюжину кошек. Сомневаюсь, что они смогут мирно существовать и ни одно животное в процессе плавания не пострадает. То же самое и в вашем организме – лучше раздельно есть курицу и творог.
Посудите сами: давайте представим, что ваша пищеварительная система – это большой плавучий корабль, на который одновременно поместили дюжину собак и дюжину кошек. Сомневаюсь, что они смогут мирно существовать и ни одно животное в процессе плавания не пострадает. То же самое и в вашем организме – лучше раздельно есть курицу и творог.
Животные белки
Важность белков как составляющей части детского питания переоценить невозможно. Подробно об их ведущей роли в меню ребенка мы уже говорили. Необходимо прояснить вопрос – почему родители обязательно должны включать в меню ребенка белки именно животного происхождения и какие из них – лучшие.
Продукты животного происхождения – это источник полноценных, легкоусвояемых белков, витаминов и минеральных веществ. Однако не все они подходят детям. Некоторые виды мяса и рыбы до поры до времени ребенку тяжело переварить, так как пищеварительные функции желудка, кишечника, печени и поджелудочной железы еще не достигли полной зрелости.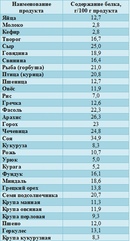
Яйца
Это один из значимых продуктов в детском меню, так как яйца содержат целый комплекс питательных веществ в легкой для усвоения форме (они усваиваются на 97-98%). Желток содержит комплекс жирорастворимых витаминов А, D, Е, фосфатиды, различные минеральные вещества и микроэлементы, а белок яйца имеет самую высокую пищевую ценность из всех белков животного происхождения. Можно сказать, что яйца – природный концентрат питательных веществ.
Как и любым другим концентратом, яйцами увлекаться нельзя. В детском рационе они должны быть ограничены: 1 яйцо через день для детей дошкольного и школьного возраста — вполне достаточно.
Мясо и рыба
Для детского питания подходят нежирные сорта мяса и рыбы.
Крольчатина — ценнейший диетический продукт, содержит мало соединительной ткани и сухожилий, легко переваривается. По сравнению с мясом других животных, в нем меньше холестерина, больше фосфолипидов и железа.
Индейка — низкокалорийное, но очень питательно мясо, содержит минеральные вещества, витамины (В2, В6, В12, РР), аминокислоты.
Телятина — нежное светлое мясо, считается диетическим.
Говядина — содержит много железа, поэтому полезна при железодефицитной анемии, но слишком старую говядину детям лучше не давать: она жирнее и хуже усваивается.
Баранина — содержит мало холестерина, но в бараньем жире – больше насыщенных жиров (по сравнению с другими).
Печень — содержит белки, а также является концентратом кроветворных микроэлементов – витаминов А, В2, В12, РР, холина, минеральных веществ. В печени много холестерина (в 3-4 раза больше, чем в мясе). Детям до двух лет лучше давать ее в виде паштета, старшим — тушить.
Рыба — различные сорта морских и речных рыб (судак, треска, хек, морской окунь). Белок рыб полноценный и легко усваивается, белки рыбы усваиваются на 93-98%, в то время как белки мяса – на 87-89%.
 Кроме того, рыба содержит необходимые организму омега-3 и омега-6 жирные кислоты.
Кроме того, рыба содержит необходимые организму омега-3 и омега-6 жирные кислоты. Икра рыб – продукт с высокой питательной ценностью. Все ее виды богаты белком, жиром и жирорастворимыми витаминами А и D, Е. Не стоит кормить ребенка икрой слишком часто: она может вызвать аллергию.
Специалисты рекомендуют давать детям продукты, содержащие животный белок, каждый день. Не забывайте, что источником белка также являются молочные продукты – творог, сыры.
Растительные белки тоже важны, и должны составлять 40% от всех белков. Богаты белком бобовые, орехи, цельные злаки, об этих продуктах мы поговорим подробнее в статье, посвященной растительным белкам.
Мясо и рыба не для детей
Колбаса и колбасные изделия — по большому счету, это не детские продукты, но обычно детьми очень любимые. Необходимо ограничивать колбасы и сосиски в детском рационе, так как они не имеют почти никакой питательной ценности, зато часто содержат чрезмерное количество жиров и соли.
Сырую рыбу давать маленьким детям нельзя, так как она тяжела для переваривания и может содержать паразитов. Дети 12-15 лет могут есть сырую рыбу, но в небольших количествах, проверенную и под строгим контролем родителей.
Сырые яйца не полезны детям. Белок сырых яиц гораздо хуже усваивается организмом, чем белок вареных, а кроме того, может содержать опасные для здоровья микроорганизмы, которые погибают при термической обработке.
Как готовить животные продукты для детей?
• выбирайте филейную часть мяса или рыбы;
• предпочитайте обжарке отваривание или запекание;
• перед приготовлением обрезайте с мяса видимый жир и снимайте кожу с птицы;
• рекомендуется охлаждать супы на мясном или рыбном бульоне, а затем удалять затвердевший на поверхности жир; • ограничивайте в рационе детей копченые продукты;
• варите яйца для детского питания не меньше 10 минут после закипания.
Может ли ребенок обойтись без животного белка?
Итак, организм ребенок нуждается в ежедневном поступлении белков, которые обеспечат его строительным материалом и энергией. Дефицит белка резко снижает устойчивость ребенка к инфекциям, страдают процессы кроветворения, нарушаются функции многих ферментов, принимающих участие в белковом обмене, и выработка гормонов. Доля животных белков в рационе детей дошкольного возраста должна составлять не менее 65% от общей потребности в белках, а у детей 7-14 лет – 60%, потому что животные продукты – источник самых полноценных белков, содержащих незаменимые аминокислоты.
|
Возраст |
Количество животного белка в сутки (г) |
|
3 — 10 лет |
35-38 |
|
11 — 14 лет (мальчики) |
45 |
|
11 – 14 лет (девочки) |
41 |
|
14 — 18 лет (мальчики) |
52 |
|
14 – 18 лет (девочки) |
45 |
Вот почему для ребенка может быть опасным увлечение родителей вегетарианством. Ему не навредят 1-2 вегетарианских дня в неделю, но полный отказ от мяса специалисты по питанию и педиатры не поддерживают.
Ему не навредят 1-2 вегетарианских дня в неделю, но полный отказ от мяса специалисты по питанию и педиатры не поддерживают.
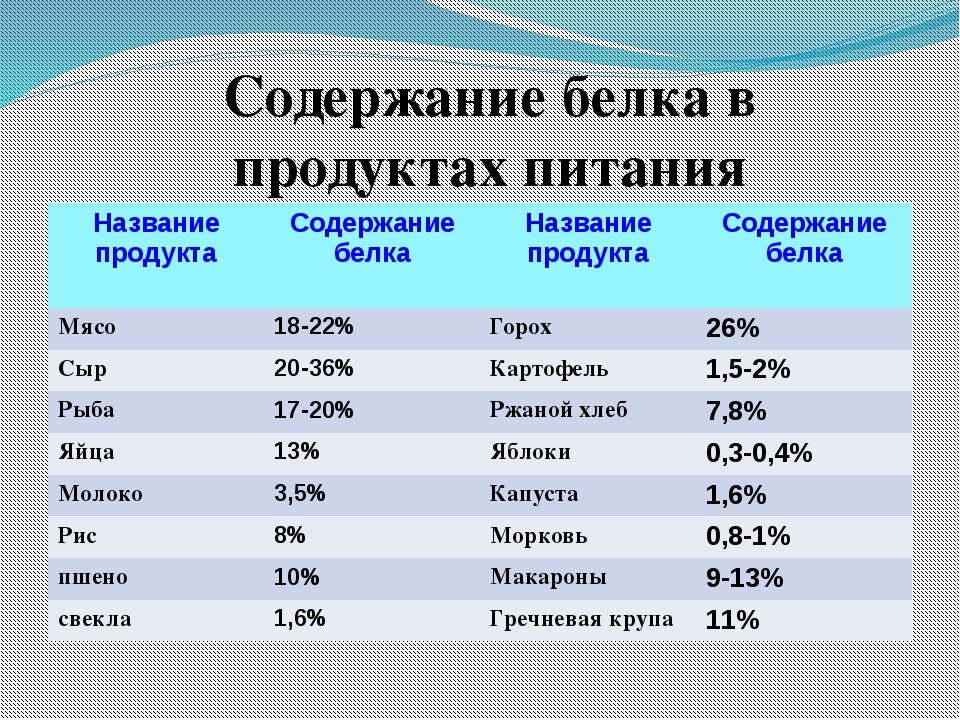
В каких продуктах самое большое содержание белка
Что такое белки и где они содержатся? Порой некоторые не знают ответ на этот вопрос. Так вот, белки (их называют еще протеинами) считаются важным элементом здорового питания. Без них организм человека попросту не может функционировать, поскольку белки – это ключевой материал для гормонов, тканей, органов. Они способствуют усвоению разного рода полезных соединений и формируют иммунитет.
В чем содержится белок
Что такое белки в еде? Этим вопросом задаются многие. Данный протеин должен присутствовать в рационе каждого человека вне зависимости от возрастной и половой принадлежности с учетом разнообразного рациона белковой пищи. Без правильного питания организм не может развиваться. Белки, получаемые с пищей, «заряжают» человека энергией, выносливостью, силой и сохраняют нормальный показатель сахара.
Если содержание белка в продукте очень мало, то они не считаются белковыми. В каких продуктах содержится белок? Больше всего белка содержится в еде животного происхождения. Это – мясные и рыбные изделия, а также творог. Также белки есть в таких пищевых продуктах как бобовые и орехи. Еще где содержится большое количество белка? И это грибы. Однако особо сильно увлекаться ими не стоит, поскольку их белок тяжеловато усваивается.
Где очень много белка
Итак, в каких продуктах белка больше всего?
Мясные продукты с высоким содержанием белка:
- Курица. В 150 граммах куриной грудки больше половины суточной нормы.
- Индейка. Она считается диетической пищей. Помимо этого в белом мясе индейки в большом объеме содержится докозагексаеновая кислота, а также Омега-3. Данные соединения помогают функционированию мозга, благотворно сказываются на настроении и предотвращают разрастание жировых клеток.
- Свинина. Делая выбор, крайне важно грамотно определиться с куском.
 К примеру, в небольшом куске свиной вырезки может находиться меньше жира в сравнении с куриной грудкой, которая считается диетической. Белка на 100 грамм продукта – порядка 20 грамм, а еще 70 грамм холина. Данное соединение ускоряет метаболизм, помогает лучше усваиваться таким витаминам как Е, К, А, Д, а также снизить показатель холестерина. В дополнении оно стабилизирует выработку инсулина. Так что, невзирая на запачканную репутацию, свинина благотворно сказывается на здоровье и даже помогает ускорить процесс похудения.
К примеру, в небольшом куске свиной вырезки может находиться меньше жира в сравнении с куриной грудкой, которая считается диетической. Белка на 100 грамм продукта – порядка 20 грамм, а еще 70 грамм холина. Данное соединение ускоряет метаболизм, помогает лучше усваиваться таким витаминам как Е, К, А, Д, а также снизить показатель холестерина. В дополнении оно стабилизирует выработку инсулина. Так что, невзирая на запачканную репутацию, свинина благотворно сказывается на здоровье и даже помогает ускорить процесс похудения. - Говядина. Она является наиболее постной с большим содержанием Омега-3. Блюда из говядины способствуют улучшению работы нервной, иммунной и сердечно-сосудистой систем.
В каких продуктах еще много белка? Рыбные изделия – это продукты, богатые белком. И если вы спросите, в каких именно рыбных продуктах много белка, то это:
- Тунец. Самое лучшее – это консервы. Тунец – это отличный источник докозагексаеновой кислоты и Омега-3, что предотвращает разрастание жировых отложений в области живота, а также способствует улучшению настроения.

- Лосось. Невзирая на довольно высокую жирность, лосось считается тем самым блюдом, которое рекомендовано худеющим. При длительном употреблении этой рыбы снижается показатель сахара и уменьшаются воспалительные процессы.
- Палтус. Эта рыба гораздо сытнее овощей и овсянки. Это продиктовано не только значительным объемом протеина, но еще и содержанием соединений, влияющих на выработку серотонина (гормон, который отвечает за аппетит).
В каких еще продуктах есть белок? И это:
- Молоко. Конечно, нет полезнее домашнего молока, поскольку в траве, которой питаются животные, содержится Омега-3, а также конъюгированная линолевая кислота. Данные соединения способствуют активизации иммунной системы, укрепляют кости, стабилизируют показатель глюкозы.
- Творог. Данный продукт содержит либо медленные, либо быстрые белки – это напрямую зависит от жирности творога. Он содержит довольно большой объем казеина, замедляющего переваривание других белков, подавляя аппетит.
 Если же цель похудение, тогда стоит приобретать обезжиренный творог.
Если же цель похудение, тогда стоит приобретать обезжиренный творог.
Во всех этих продуктах содержание белков высоко.
В каких продуктах растительного происхождения содержится протеин – список
Если вас интересует вопрос, «в чем содержится белок», то таблица продуктов питания с содержанием большого объема протеина растительного происхождения такова:
- Бобовые. Если вы задаетесь вопросом: «Где больше всего белка на 100 грамм?», то это чечевица – 27,6. Также богаты белком горох и соя.
- Мука (ржаная и пшеничная).
- Рисовая, ячменная, перловая, манная, гречневая и пшенная крупы.
- Овощи и зелень. Сюда входят шпинат, лук, цуккини, сладкий перец, чеснок, морковь, картофель, свекла, огурцы, красные томаты, спаржа, зеленый горошек, артишок.
- Капуста, в частности белокочанная, брокколи, цветная, кольраби, брюссельская.
- Грибы – опята, вешенки, лисички, белые.
- Сухофрукты – изюм, курага, сушеные яблоки, чернослив, финики.
- Семена и семечки – лен, мак, кунжут, тыква и подсолнечник.

- Орехи – это тоже источник белка. Богаты протеином фундук, кедровые орешки, миндаль, фисташки, бразильские, грецкие, арахис и кешью. Это и есть орехи, содержащие белок.
- Макароны – высшего сорта, первого сорта и яичные.
- Фрукты – яблоки, мандарины, лимоны, киви, бананы, апельсины.
Еще таблица продуктов с содержанием белка включает метличку (данный безглютеновый злак богат фосфором, магнием, аминокислотами), хлеб грубого помола (прекрасный источник клетчатки, минералов и витаминов), амарант (эта зерновая культура также богата полезными соединениями).
В каких продуктах самое большое содержание белка
Где больше белка? Что же касается морепродуктов и рыбы, то это икра, горбуша и семга. Касаемо мясных изделий, то это индейка, курятина и крольчатина. Относительно молочных продуктов, то это – сухое молоко, колбасный копченый сыр и твердый сыр. Из яиц – яичный порошок. Если отвечать на вопрос, еще где много белка, то это соя (на 100 грамм протеина 34,9).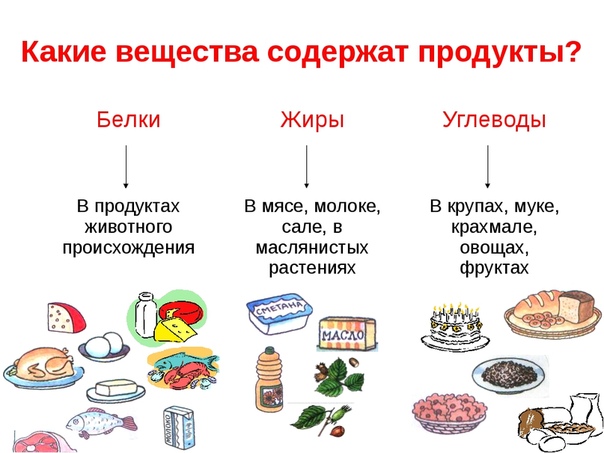 Белка в этих продуктах очень много. А еще огромное содержание белка в таких продуктах, как пищевой желатин и горчица молотая.
Белка в этих продуктах очень много. А еще огромное содержание белка в таких продуктах, как пищевой желатин и горчица молотая.
Так что, теперь вы знаете ответ на вопрос, «в каких продуктах большое содержание белка». Можно смело обогащать ими свой рацион, ведь белки в еде очень важны.
Белковые продукты можно с легкость приобрести в магазине, не готовя их при этом. Речь идет о нежирном твороге, сушенном мясе либо рыбе, йогурте либо кефире без наполнителей, протеиновом батончике, рыбных консервах. Так что, если вас интересовал вопрос «в каких блюдах много белка, то именно в этих, которые можно употреблять самостоятельно, без приготовления.
В каких сладостях много белка
Где содержится белок, помимо вышеперечисленных продуктов? И это сладости. А в каких же конкретно продуктах из категории «сладости» большое количество белка? И это: халва, ореховые батончики, крекеры, пряники, молочный шоколад, шоколадная паста, щербет ореховый.
Так что, если ранее вы не знали, в какой пище есть белки, то теперь знаете, в чем же есть протеины и какие продукты богаты им.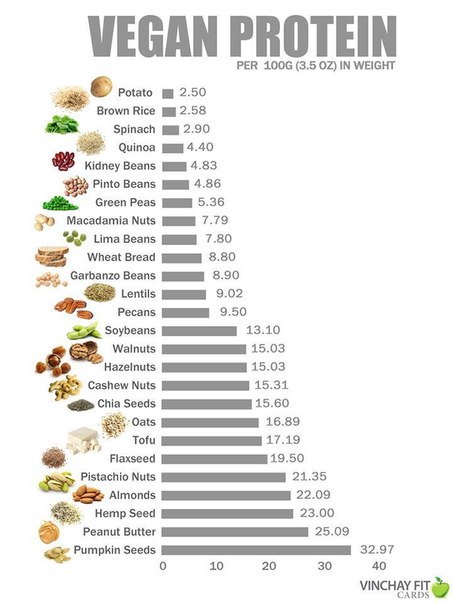 Это злаки, орехи, капуста, шпинат, бобовые, грибы и яйца. Поэтому, если вы хотите похудеть и «построить» красивое тело, тогда без протеина вам никак не обойтись. А при его дефиците в питании, мускулатура и мышцы станут попросту дряблыми.
Это злаки, орехи, капуста, шпинат, бобовые, грибы и яйца. Поэтому, если вы хотите похудеть и «построить» красивое тело, тогда без протеина вам никак не обойтись. А при его дефиците в питании, мускулатура и мышцы станут попросту дряблыми.
Питание подростка
Школьный возраст является тем ключевым периодом развития человеческого организма, в котором завершается формирование скелета и скелетной мускулатуры, происходит резкая гормональная перестройка, лежащая в основе полового созревания. Интенсивный рост и увеличение массы тела в подростковый период сопоставимы по своей интенсивности лишь с периодом раннего детства. Поступление с пищей достаточного количества белка, минеральных солей, витаминов, микроэлементов является необходимым условием нормального роста и формирования костной ткани, скелетно-мышечного аппарата и умственного развития. Глубокая эндокринная перестройка, происходящая в школьном возрасте, на фоне несбалансированного рациона питания создает определенные предпосылки для возникновения нарушений обмена веществ, развития избыточного веса и ожирения.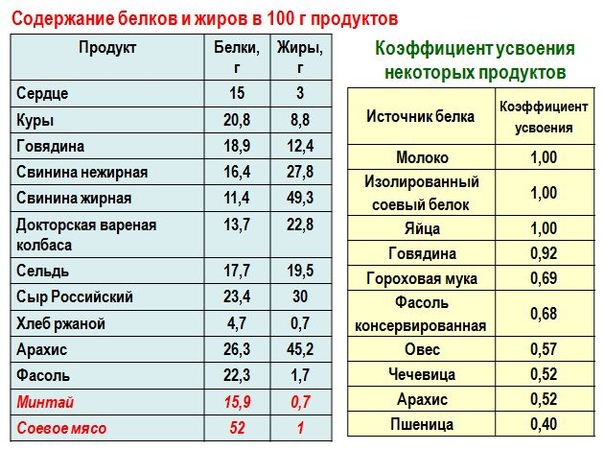
Организм подростка расходует много энергии на учебные занятия в школе, уроки физкультуры, посещение секций, работу на компьютере. Особенно с большими энергетическими затратами связаны движение, игры, занятия физкультурой и спортом.
Рацион питания
Основным источником энергии служит пища. Питание подростка должно быть разнообразным и включать продукты животного и растительного происхождения. Оптимальное соотношение белков, жиров и углеводов можно выразить как 1:1:4, то есть подросток должен получать углеводов в 4 раза больше, чем белков или жиров.
Белки идут на построение тканей и органов тела: мышц, нервов, крови, мозга, сердца. Особенно важны белки для образования защитных сил организма – так называемых иммунных тел. Белки содержатся в мясе, индейке, рыбе, молоке, яичном белке, твороге, сыре, орехах, в бобовых (зеленый горошек, фасоль, чечевица). В рацион школьника должно входить ежедневно по 200 грамм мяса или курицы, разделенное на два приема (обед, ужин).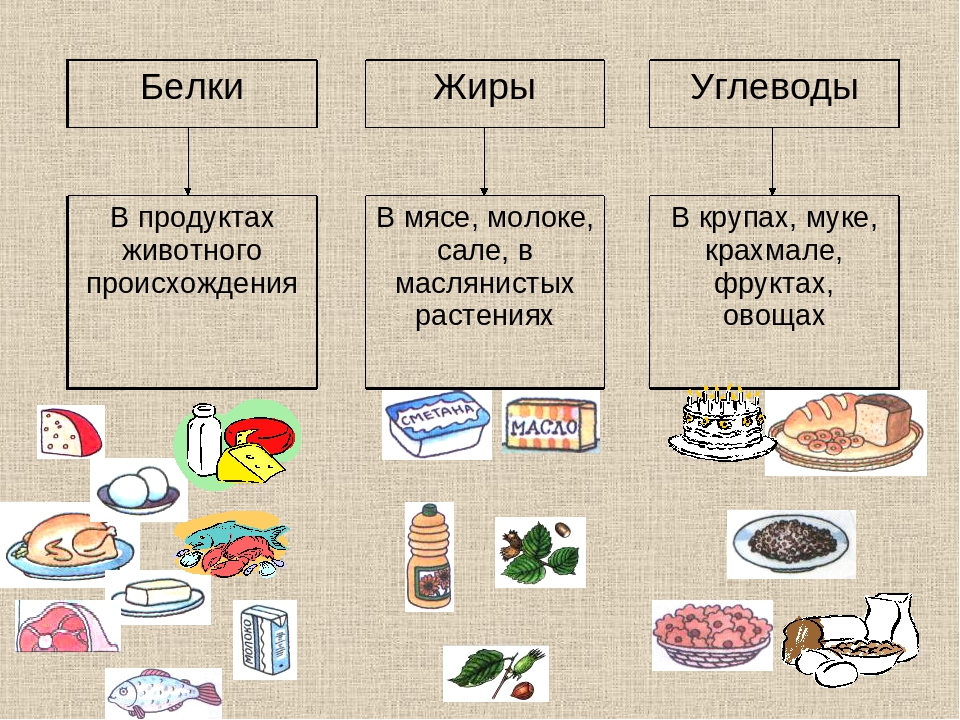 Рыбу стоит употреблять 2-3 раза в неделю по 100 г, творог – 3 раза в неделю по 100 г, сыр – ежедневно по 50 г, натуральный йогурт или кефир – 150мл.
Рыбу стоит употреблять 2-3 раза в неделю по 100 г, творог – 3 раза в неделю по 100 г, сыр – ежедневно по 50 г, натуральный йогурт или кефир – 150мл.
Жиры и углеводы играют существенную роль в обмене веществ организма подростка. Их количество в питании подростка отражается на его массе тела. Наиболее ценны для подростков молочные жиры (сливочное масло, сливки, сметана). Они хорошо усваиваются и являются источником витаминов A и D. В дневной рацион необходимо также включать 10 — 20 г растительного масла, содержащего важные для быстрорастущего организма жирные кислоты семейства Омега 6.
Углеводы содержатся преимущественно в продуктах растительного происхождения – в сахаре, хлебе, крупах, макаронах, картофеле, овощах, фруктах, ягодах. Каши полноценные, не из пакетика! Макароны из твердых сортов пшеницы, хлеб зерновой, картофель дадут энергию школьнику на 4 часа.
Много быстрых сахаров в конфетах, варенье, повидле, меде и других кондитерских изделиях. Употребляя их на завтрак, школьник уже через 2 часа будет голоден, у него ухудшится способность к обучению.
Торты, пирожные, вафли, шоколадки и шоколадные конфеты содержат не только много сахара, но и растительный жир. При производстве кондитерских изделий часто используются дешевые масла (пальмовое, кокосовое), которые оказывают негативное влияние на органы желудочно-кишечного тракта подростка и способствуют развития избыточного веса. Школьники должны быть ориентированы, сколько им можно потреблять сладостей: 2-3 конфеты в день, но только через 1,5 часа после полноценного приема пищи.
Значительная часть минеральных веществ, поступающих с пищей, используется для роста костей и образования зубов. Недостаток солей кальция и фосфора в питании приводит к неправильному развитию костей, порче зубов и нарушению деятельности центральной нервной системы подростка. Наиболее богаты кальцием и фосфором молоко, молочные продукты (особенно творог, сыр твердый). Рекомендуется детям давать молоко, творог, йогурт. Кефир с низким и средним процентом жирности, так как излишний жир блокирует всасывание кальция. С сыром – наоборот. Лучше давать детям твердые, выдержанные сорта сыра, чем плавленый сыр или мягкие сыры. Не забывайте, что кальций содержится также в рыбе. Порция рыбы (100грамм) снабдит организм подростка кальцием на 35% от суточной нормы.
С сыром – наоборот. Лучше давать детям твердые, выдержанные сорта сыра, чем плавленый сыр или мягкие сыры. Не забывайте, что кальций содержится также в рыбе. Порция рыбы (100грамм) снабдит организм подростка кальцием на 35% от суточной нормы.
Полезно готовить подросткам сырники, вареники, кашу с молоком, молочные супы, а к мясным и рыбным блюдам обязательно давать овощные гарниры. Это позволит регулировать правильное соотношение кальция и фосфора в организме подростка. Соли кальция, содержащиеся в растительных продуктах (орехи, сельдерей, зеленая фасоль, капуста, курага), плохо усваиваются организмом подростка. При сочетании продуктов растительного и животного происхождения (например, молоко с крупами) усвоение кальция значительно повышается.
Соли фосфора поступают в организм из продуктов животного и растительного происхождения (печень, сыр, рыба, бобы, орехи, крупы и др.). Они оказывают благоприятное действие на центральную нервную систему подростка, особенно в период напряженной умственной работы. Разнообразное питание удовлетворяет суточную потребность организма подростка в минеральных веществах, в частности в соли. Поваренная соль придает вкус пище, а также используется организмом подростка для выработки соляной кислоты, входящей в состав желудочного сока и играющей большую роль в переваривании пищи. В сутки подросток должен потреблять 8-10 г поваренной соли, лучше морской или йодированной. При ее недостатке у подростка могут возникнуть серьезные расстройства: нарушается работа сердца, появляются головокружение и обмороки.
Разнообразное питание удовлетворяет суточную потребность организма подростка в минеральных веществах, в частности в соли. Поваренная соль придает вкус пище, а также используется организмом подростка для выработки соляной кислоты, входящей в состав желудочного сока и играющей большую роль в переваривании пищи. В сутки подросток должен потреблять 8-10 г поваренной соли, лучше морской или йодированной. При ее недостатке у подростка могут возникнуть серьезные расстройства: нарушается работа сердца, появляются головокружение и обмороки.
Про витамины
Серьезной проблемой у подростков является дефицит на 30% витаминов А, Е, В1, В2, микроэлементов кальция, железа, цинка, селена, йода. Это ведет к возникновению у детей таких алиментарно-зависимых состояний как задержка роста, железодефицитная анемия, снижение способности к обучению, ухудшение зрительной и слуховой памяти. Дефицит витаминов А, Е, С и микроэлементов цинка, селена служит одной из причин снижения работы иммунной системы.
Отсутствие в пище подростка витамина А или каротина, который в организме превращается в витамин А, вызывает у подростка заболевание глаз (куриная слепота), снижает сопротивляемость организма к инфекционным заболеваниям; кожа лица и рук у подростка становится шершавой, неэластичной, волосы теряют блеск и выпадают. Содержится витамин А в молочных жирах, сливочном масле, яичном желтке, молоке, рыбьем жире, печени, моркови, помидорах, тыкве, абрикосах, хурме.
Витамин D необходим для роста и развития подростка, он участвует в минеральном обмене, нормализует отложение солей кальция и фосфора в костях. Витамин D содержится в яичном желтке, икре, молоке, сливочном масле.
Витамин В2 (рибофлавин) повышает усвояемость пищи, участвует в обмене веществ и кроветворении, оказывает влияние на рост подростка. Содержится витамин В2 в молоке и в молочных продуктах (творог, сыр), яйцах, дрожжах.
Недостаток в пище витамина С (аскорбиновая кислота) снижает сопротивляемость организма подростка к инфекционным заболеваниям, вызывает кровоточивость десен, сонливость, ослабляет внимание и память подростка. Длительное отсутствие в пище витамина С может привести к цинге. Витамин С содержится главным образом в свежих овощах, ягодах и фруктах (лук зеленый, черная смородина, шиповник, лимон, апельсин, салат, помидоры, капуста).
Длительное отсутствие в пище витамина С может привести к цинге. Витамин С содержится главным образом в свежих овощах, ягодах и фруктах (лук зеленый, черная смородина, шиповник, лимон, апельсин, салат, помидоры, капуста).
Распорядок приема пищи
Для нормального роста и развития подростка необходим правильный режим питания, предусматривающий соблюдение времени приема пищи, рациональное распределение ее по массе, калорийности и объему.
Прием пищи в одни и те же часы поддерживает у подростка хороший аппетит, способствует своевременному выделению желудочного сока. Подросток должен есть не реже 4-5 раз в день, то есть каждые 3-3,5 часа. Слишком большие перерывы между приемами пищи могут вызывать утомление, снижение работоспособности, головную боль.
Завтрак, должен содержать полноценное блюдо – кашу, омлет, творог, а также горячий напиток – чай, какао, отвар шиповника.
Второй завтрак может быть легким – фрукты, йогурт, бутерброд с сыром и обязательно вода.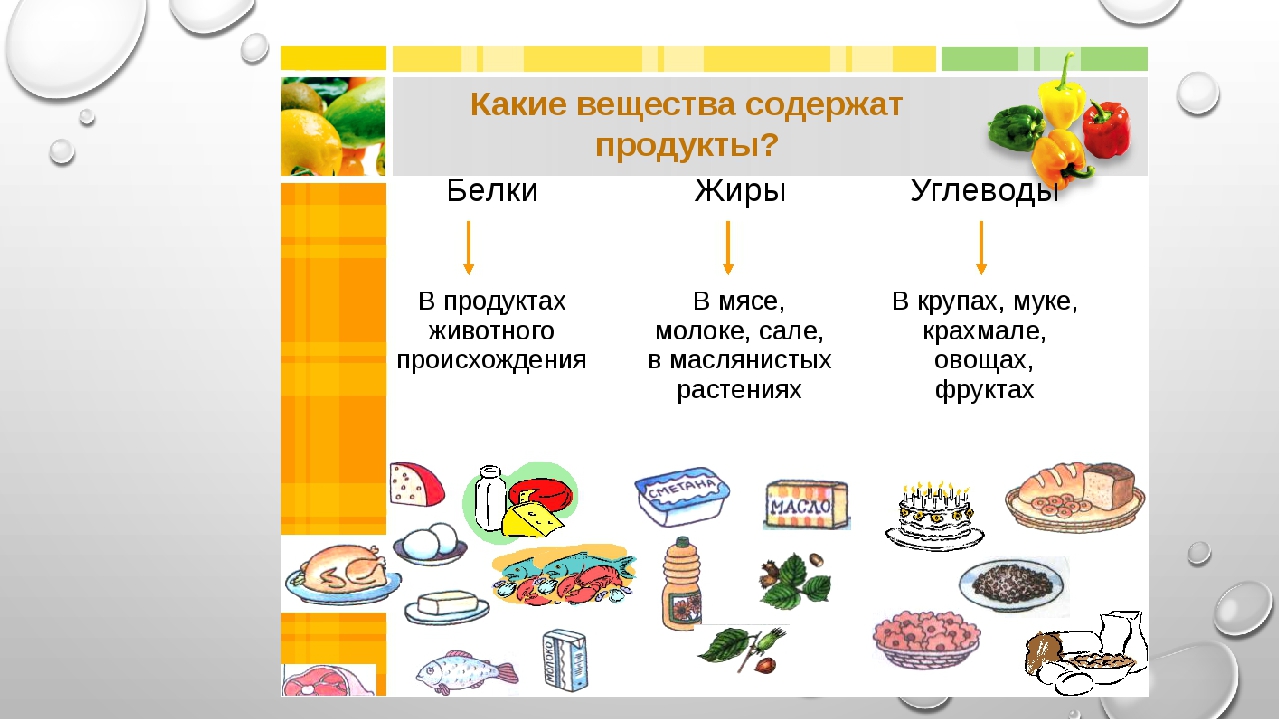 Обед: предпочтительно первое блюдо и обязательно второе мясное гарниром и салатом из овощей со сметаной или растительным маслом.
Обед: предпочтительно первое блюдо и обязательно второе мясное гарниром и салатом из овощей со сметаной или растительным маслом.
В промежутках между обедом и ужином рекомендуется употреблять фрукты, компоты из сухофруктов.
Ужин достаточно легкий, можно кашу, рыбное блюдо с гарниром или творожное блюдо.
За 1 час до сна, если школьник голоден, можно предложить кефир, йогурт или ряженку с булочкой, печеньем.
Не забывайте про чистую воду, подростку рекомендовано выпивать более 1 литра чистой воды, помимо чая, соков, супа и кефира.
Врач-диетолог Медицинского центра «Альтамед +» в Одинцово Кандидат медицинских наук Будко Елена Анатольевна.
Животный белок — в каких продуктах найти и чем заменить животный белок?
Первые против белков животного происхождения, постоянно рассуждают, чем заменить животный белок, вторые за животный белок в продуктах. Кто прав, решайте сами.
Кроме животного белка, яйца, говядина, курица и рыба – содержат и другие необходимые организму питательные вещества.
Белки — это те макроэлементы, которые нужны нам, что называется, в изобилии (в условиях дефицита белка наш организм начнет понемногу утрачивать способность синтезировать и восстанавливать ткани). Белки составляют около двадцати процентов веса сердца, скелетных мышц и печени и примерно десять процентов мозговой ткани. Качество белка, которое потребляет человек, может существенно повлиять на его здоровье. С увеличением числа вегетарианцев по всему миру, качество и сравнение белков животного происхождения и растительных белков является очень распространенной темой.
Белки любого происхождения состоят из аминокислот, которые необходимы для регулирования различных функций организма. Качество белка может быть определено в зависимости от содержания в нем аминокислот и их структуры. Белки животного происхождения содержат аминокислоты, которые больше удовлетворяют запросам организма. Напротив, у источников растительного белка низкая биологическая ценность, а зачастую и низкое содержание некоторых аминокислот, таких как лизин и цистеин.
Чем белки животного происхождения лучше белков растительных? Во многих растительных источниках белков содержится больше, чем в мясе, однако в них все равно не хватает ключевых аминокислот. В 100г говядины содержится от 20 до 25г белка, а в 100г лосося содержит 16,9г белка. Из всех растительных источников соя является наиболее биологически полной. Соевый белок и бобы содержат примерно 22г белка на 100г продукта, в то время как в таком же количестве арахиса белков около 40г.
Чем растительные белки лучше белков животного происхождения? В белках животного происхождения часто больше жира и холестерина, чем в белках, полученных из растительных источников. 100г говядины содержат до 25 процентов от рекомендуемой дневной нормы жира и до 30 процентов холестерина в крови. Растительные белки, такие как соя, не имеют холестерина и содержат только 1 процент от ежедневного рекомендуемого значения жира. Тесная связь между высоким содержанием жиров, высоким содержанием холестерина и болезнями сердца оставляет в этом отношении за растительными белками очевидное преимущество.
В каких продуктах содержится животный белок? Основные источники животного белка это почти виды мяса, морепродуктов и птицы. 100-граммовая порция мясного говяжьего фарша содержит в себе 21г белка, такое же количество тунца содержит 25г белка, а куриной грудки — 29г. Даже если вы не едите мясо, вы все еще можете получать животный белок продуктов: из яиц и молока, сыров, йогуртов. В этих продуктах содержится от 7 до 10г животного белка на 100-граммовую порцию. Некоторые пищевые продукты содержат белки животного происхождения в виде ингредиентов, таких как молоко, концентрат белка или белок молочной сыворотки.
Кроме животного белка, эти продукты – говядина, курица и рыба – содержат и другие необходимые организму питательные вещества. В первую очередь, они обеспечивают нас железом, важным для здоровых красных кровяных клеток минералом. Железо в таких продуктах содержится форме гема (так называется небелковая часть гемоглобина). Именно в такой форме человеческому организму легче всего их переварить. Другие содержащие животный белок продукты – молоко и жирная рыба – необходимы также и для здоровья костей, потому что в них есть кальций. Говядина, моллюски, молочные продукты и птица являются также хорошими источниками цинка. Кроме того, продукты с животными белками также обеспечивают нас витамином B12.
Другие содержащие животный белок продукты – молоко и жирная рыба – необходимы также и для здоровья костей, потому что в них есть кальций. Говядина, моллюски, молочные продукты и птица являются также хорошими источниками цинка. Кроме того, продукты с животными белками также обеспечивают нас витамином B12.
Различают также нежирные белки животного происхождения, источниками которым являются, например, обезжиренные молочные продукты, куриные грудки без кожи, яичные белки и постная говядина, с низким содержанием жира и калорий. Все эти продукты часто в диетах, чтобы лучше контролировать свой вес. Продукты с жирными белками животного происхождения, такие как цельный сыр, говядина с видимым жиром и курица с кожей, считаются нездоровыми с точки зрения содержания в них насыщенных жиров и холестерина. Но, например, жирная рыба с низким содержанием насыщенных жиров является для организма источником длинноцепочечных жирных кислот омега-3, которые помогают снизить риск сердечно-сосудистых заболеваний.
Конечно, мясо является для нас основным поставщиком белка. Но есть и другие ресурсы, которые не являются источниками животного происхождения. Чем же можно заменить животный белок?
Во-первых, заменить животный белок можно бобовыми. Например, 250-граммовая порция фасоли содержит 11,5г белка. Не так уж и мало! Для того, чтобы разнообразить вкус, можно чередовать или смешивать сорта бобовых нут, черная и красная фасоль тоже являются хорошими источниками белка.
Во-вторых, заменить животный белок можно орехами. Кроме белка, орехи снабжают нас витаминами, минералами и клетчаткой. Хотя разные орехи по содержанию белка различаются, во всех видах его достаточно, чтобы обеспечивать потребности организма. Например, 30г арахиса содержит 7,3г белка.
Третий способ заменить животный белок – это употребление мюслей. 150г смеси овса, орехов, пшеницы и фруктов содержит от 7 до 10г белка. Это может быть хорошим вариантом завтрака.
Наконец, еще один ответ на вопрос, чем заменить животный белок – соевый творог тофу. Средняя потребность взрослого человека в белке — от 45 до 55г в день. 150-граммовая порция тофу, который является производным от соевого растения, содержит 10,3г белка. Чтобы сделать тофу частью полноценного обеда, его можно перемешать с овощами и заправить соусом. Попробуйте сами!
Средняя потребность взрослого человека в белке — от 45 до 55г в день. 150-граммовая порция тофу, который является производным от соевого растения, содержит 10,3г белка. Чтобы сделать тофу частью полноценного обеда, его можно перемешать с овощами и заправить соусом. Попробуйте сами!
Источник
список продуктов богатых белком в таблице
Опубликовано: 05.10.2019Время на чтение: 5 минут7459
Зачем нужен белок
Когда белок называют основой жизни, в этом нет ни малейшего преувеличения. Но протеин – это не только «строительный материал», хотя эта часть его функций тоже важна: ни одна клетка нашего тела не может строиться, делиться и восстанавливаться без этого вещества. Однако белок – общее название для сложного химического соединения, которое может выполнять огромное количество функций и делает это ежесекундно. В теле человека различные виды белка отвечают за передачу наследственной информации, транспортируют биоактивные вещества, защищают организм от инфекций и др. Неудивительно, что протеин настолько важен для здоровья и самой жизни. Но так как его основной источник – пища, нужно знать, в каких продуктах содержится белок и как сделать его максимально доступным для организма.
Неудивительно, что протеин настолько важен для здоровья и самой жизни. Но так как его основной источник – пища, нужно знать, в каких продуктах содержится белок и как сделать его максимально доступным для организма.
Как повысить усвояемость веществаВажно: человек не может жить без потребления белка, т. к. это вещество участвует во всех жизненно-важных процессах. В его составе присутствуют 22 аминокислоты. Около половины из них организм сам выработать не может.
Диетологи и специалисты по спортивному питанию дают следующие рекомендации:
- продукты, содержащие белок, лучше приготовить на завтрак и обед. На утреннее время должно приходиться примерно 25 % от суточной нормы, а на обеденное – 45 %. Остальное количество примерно равными порциями можно распределить на перекусы и ужин.
- Белок достаточно сложно усваивается, и во второй половине дня лучше не перегружать пищеварительную систему, чтобы не нарушить ночной сон.
 Если такая схема по каким-либо причинам неудобна, следует разделить суточное количество на примерно равные порции, которые распределяются на 5-6 приемов пищи;
Если такая схема по каким-либо причинам неудобна, следует разделить суточное количество на примерно равные порции, которые распределяются на 5-6 приемов пищи; - лучшие партнеры для белка – продукты с высоким содержанием клетчатки. Хотя клетчатка сама по себе не оказывает значительного влияния на усваивание протеина, она эффективно справляется с продуктами метаболизма белка и его избытком. Улучшая работу кишечника и впитывая в себя различные соединения, клетчатка помогает предупредить так называемую белковую интоксикацию;
- для более качественного усвоения белка важно включать в рацион пищу, богатую витамином С и витаминами группы B, которые в числе прочего нормализуют белковый обмен.
Список продуктов, богатых белком, традиционно возглавляет соя. В зависимости от сорта, она может содержать от 36 до 42 г протеина на 100 г. Остальные составляющие рациона можно распределить следующим образом:
| Мясные продукты | Молочные продукты | Морепродукты | Злаки и другие растительные продукты |
| Мясо гуся – 27–29 г | Сыр твердых сортов – 23–29 г | Тунец – 29 г | Бобовые – 18–27 г |
| Говядина – 23–28 г | Творог – 14–20 г | Семга – 25–27 г | Овес – 13 г |
| Индейка – 24–26 г | Йогурт – 4–5 г | Горбуша – 23 г | Пшенная крупа – 11 г |
| Курица – 23–26 г | Молоко – 3 г | Кальмары – 20 г | Гречневая крупа – 11 г |
| Печень – 18–20 г | Кефир – 2,8–3,2 г | Креветки – 18 г | Арахис – 26 г |
Таблица продуктов, богатых белком, позволяет сформировать суточный рацион в зависимости от уровня физических нагрузок и, соответственно, потребности в питательных веществах и энергии.
Споры о том, какой белок предпочтительнее, не стихают уже несколько десятилетий. Одни утверждают, что только животные протеины способны обеспечить организм незаменимыми аминокислотами, а другие стоят на том, что растительный белок лучше усваивается и поэтому более ценный как источник протеина. Истина, как обычно, где-то посередине: оба типа белков в списке продуктов правильного питания должны быть распределены примерно поровну, и вот почему.
- Полным белком, в который входят все незаменимые аминокислоты, является только животный белок (мясо, рыба, молочные продукты, яйца и др.). Достаточно съесть порцию куриной грудки, кусочек сыра или выпить молочный коктейль, чтобы обеспечить организму базовые потребности в полном наборе аминокислот. Но того же результата можно достичь, комбинируя продукты, богатые белком растительного происхождения. Например, сочетание рис + бобы даст восполнит потребность в незаменимых аминокислотах так же, как и мясное или молочное блюдо.

- Растительный белок хуже усваивается. И если вы съели 100 г арахиса – это не значит, что все 26 г белка, входящие в его состав, усвоятся организмом. Список белковых продуктов для организации полноценного питания, особенно для сторонников вегетарианства и веганства, должен формироваться с учетом этого факта. В противном случае рано или поздно может развиться дефицит белка, при котором не стоит ждать ни наращивания мышечной массы, ни хорошего самочувствия.
- Доля белка в рационе должна составлять порядка 30 %. Оставшиеся 70 % следует распределить между жирами и углеводами (30 и 40 % соответственно). В этом случае организм будет получать все основные вещества, необходимые ему для бесперебойной работы, а вам – для энергии и отличного самочувствия.
Информация о том, в каких продуктах содержится больше всего белка, – безусловно, важна. Но не менее важно знать о коэффициенте усвояемости протеина, который у всех продуктов разный. Так, у цельного молока и изолированного соевого белка этот показатель достигает 100 %, у говядины и рыбы – 92 %, мяса птицы – 70 %, а у продуктов растительного происхождения – 27-68 %. Поэтому, формируя здоровый рацион, важно учитывать этот критерий: если в меню преобладает белок растительного происхождения, его количество следует увеличить пропорционально коэффициенту усвояемости. Если хочется добавить в рацион больше белка, но не хочется заниматься готовкой сложных блюд из мяса или рыбы, есть отличная альтернатива: компания Herbalife предлагает протеиновые коктейли, способные заменить полноценный прием пищи. Преимущества таких смесей – это:
Так, у цельного молока и изолированного соевого белка этот показатель достигает 100 %, у говядины и рыбы – 92 %, мяса птицы – 70 %, а у продуктов растительного происхождения – 27-68 %. Поэтому, формируя здоровый рацион, важно учитывать этот критерий: если в меню преобладает белок растительного происхождения, его количество следует увеличить пропорционально коэффициенту усвояемости. Если хочется добавить в рацион больше белка, но не хочется заниматься готовкой сложных блюд из мяса или рыбы, есть отличная альтернатива: компания Herbalife предлагает протеиновые коктейли, способные заменить полноценный прием пищи. Преимущества таких смесей – это:
- быстрое приготовление. Всего 2 минуты – и вкусный завтрак/обед/ужин в стакане готов! А еще на протеиновых коктейлях готовят панкейки и блинчики, получается очень вкусно и полезно;
- высокое содержание белка и минералов. Содержится клетчатка. 1 порция – 17 грамм белка, в том числе соевого, а также 30 % антиоксидантов от дневной нормы;
- большой выбор вкусов.
 Дыня, маракуйя, ваниль, клубника, шоколад – и это далеко не все!
Дыня, маракуйя, ваниль, клубника, шоколад – и это далеко не все!
Еще один важный нюанс. После тренировок или физических нагрузок иного рода следует отдать предпочтение животному протеину. Он эффективнее восстанавливает мышцы, чем белок растительного происхождения, что особенно актуально для тех, кто увлечен не просто похудением или здоровым образом жизни, а построением красивого тела. Поэтому лучше выбирать животные белки в продуктах, а растительные протеины предпочесть в относительно спокойные периоды физической активности.
Узнайте, как питатьсясбалансированно
и контролировать
свой весУзнать больше 2019-10-05
Автор: Будь в Форме
Оцените материал!
Добавить отзыв
Отзывы
Lissa | 10.12.2019 16:30Мне казалось, что продукты богатые белком это только мясо и молоко с яйцами. Здорово, что это не так. Времени на готовку нет совершенно, протеиновые коктейли в этом плане действительно здорово выручают!
Роль белков, жиров и углеводов в организме человека
2 Видеолекторий на тему: «Роль белков, жиров и углеводов в организме человека»
Белки, жиры и углеводы играют важную роль в организме человека.
Белки—сложные вещества, состоящие из аминокислот. Являются неизменной составляющей частью рациона. Это главный строительный материал, без которого невозможен рост мускулатуры и тканей в целом. Белки подразделяются на 2 категории:
Животный, который поступает из продуктов животного происхождения. К этой категории можно отнести мясо, птицу, рыбу, молоко, творог и яйца.
Растительный, который организм получает из растений. Здесь стоит выделить рожь, овсянку, грецкие орехи, чечевицу, фасоль, сою и морские водоросли.
Жиры — это органические соединения, отвечающие за «резервный фонд» энергии в организме, главные поставщики энергии в периоды дефицита пищи и болезней, когда организм получает малый объем питательных элементов или же не получает их вовсе. Жиры необходимы для эластичности кровеносных сосудов, благодаря чему полезные элементы быстрее проникают к тканям и клеткам, способствуют нормализации состояния кожных покровов, ногтевых пластин и волос. Жиры в больших количествах содержатся в орехах, масле сливочном, маргарине, жире свином, сыре твердом.
Углеводы — это главный источник энергии для людей. В зависимости от количества структурных единиц углеводы делятся на простые и сложные. Углеводы, называемые простыми или «быстрыми», легко усваиваются организмом и повышают уровень сахара в крови, что может повлечь набор лишнего веса и ухудшение метаболизма.
Сложные углеводы состоят из множества связанных сахаридов, включая в себя от десятков до сотен элементов. Подобные углеводы считаются полезными, поскольку при переваривании в желудке они отдают свою энергию постепенно, обеспечивая стабильное и долговременное чувство насыщения.
Также важную роль в организме играют витамины и микроэлементы, которые не включены в структуру тканей, однако без их участия не выполнялись бы многие жизненно важные функции, происходящие в человеческом организме.
Практически все жизненные процессы в нашем теле находятся в зависимости от того, что мы употребляем в пищу. Достаточно богаты углеводами свежие фрукты. Необходимо избегать чрезмерного употребления сладостей, мучных изделий, сахара. Рациональное питание имеет существенное значение – и это подразумевает не только своевременное употребление вкусно приготовленной еды, но и включение в ежедневный рацион оптимального соотношения таких важных для правильной жизнедеятельности веществ, как белки, жиры, углеводы, витамины и микроэлементы. От гармоничного сочетания всех этих веществ зависит поддержание нормальной жизнедеятельности человека.
Структура белка | Изучайте науку в Scitable
Строительными блоками белков являются аминокислоты, которые представляют собой небольшие органические молекулы, состоящие из альфа (центрального) атома углерода, связанного с аминогруппой, карбоксильной группы, атома водорода и вариабельного компонента, называемого боковой цепью (см. Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , тем самым образуя длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Белки состоят из набора всего из двадцати аминокислот, каждая из которых имеет уникальную боковую цепь. Боковые цепи аминокислот имеют разный химический состав. Самая большая группа аминокислот имеет неполярные боковые цепи. Некоторые другие аминокислоты имеют боковые цепи с положительными или отрицательными зарядами, в то время как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации.Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Рис. 1. Взаимосвязь между боковыми цепями аминокислот и конформацией белка
Определяющим признаком аминокислоты является ее боковая цепь (вверху — синий кружок; внизу — все цветные кружки). Когда аминокислоты соединяются серией пептидных связей, они образуют полипептид, другое слово для обозначения белка. Затем полипептид сворачивается в определенную конформацию в зависимости от взаимодействий (пунктирные линии) между его боковыми аминокислотными цепями.
Рисунок 2: Структура белка бактериородопсина
Бактериородопсин — это мембранный белок бактерий, который действует как протонный насос. Его форма важна для его функции. Общая структура белка включает как альфа-спирали (зеленый), так и бета-листы (красный).
Первичная структура белка — его аминокислотная последовательность — управляет складыванием и внутримолекулярным связыванием линейной аминокислотной цепи, что в конечном итоге определяет уникальную трехмерную форму белка. Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Известные как альфа-спирали и бета-листов , эти стабильные паттерны сворачивания составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим, менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.Окончательная форма, принятая вновь синтезированным белком, обычно является наиболее энергетически выгодной.Когда белки сворачиваются, они тестируют множество конформаций, прежде чем достичь своей окончательной формы, которая является уникальной и компактной. Сложенные белки стабилизированы тысячами нековалентных связей между аминокислотами. Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, растворенные в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, демонстрируют некоторые гидрофобные химические группы на своей поверхности, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембран. Однако важно отметить, что полностью свернутые белки не замораживаются. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Несмотря на то, что белки считаются макромолекулами, они слишком малы, чтобы их можно было визуализировать даже в микроскоп.Итак, ученые должны использовать косвенные методы, чтобы выяснить, как они выглядят и как сложены. Наиболее распространенным методом исследования структуры белков является рентгеновская кристаллография . С помощью этого метода твердые кристаллы очищенного белка помещаются в пучок рентгеновских лучей, и картина отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
Что такое белки и для чего они нужны ?: MedlinePlus Genetics
Белки — это большие сложные молекулы, которые играют важную роль в организме.Они выполняют большую часть работы в клетках и необходимы для структуры, функции и регулирования тканей и органов тела.
Белки состоят из сотен или тысяч более мелких единиц, называемых аминокислотами, которые связаны друг с другом длинными цепями. Существует 20 различных типов аминокислот, которые можно комбинировать для получения белка. Последовательность аминокислот определяет уникальную трехмерную структуру каждого белка и его конкретную функцию. Аминокислоты кодируются комбинациями трех строительных блоков ДНК (нуклеотидов), определяемых последовательностью генов.
Белки можно описать в соответствии с их широким спектром функций в организме, перечисленных в алфавитном порядке:
Функция | Описание | Пример |
|---|---|---|
Антитело | Антитела связываются с определенными инородными частицами, такими как вирусы и бактерии, чтобы защитить организм. | Иммуноглобулин G (IgG) |
Фермент | Ферменты осуществляют почти все тысячи химических реакций, протекающих в клетках. Они также помогают формированию новых молекул, считывая генетическую информацию, хранящуюся в ДНК. | Фенилаланингидроксилаза |
Мессенджер | Белки-мессенджеры, такие как некоторые типы гормонов, передают сигналы для координации биологических процессов между различными клетками, тканями и органами. | Гормон роста |
Конструктивный элемент | Эти белки обеспечивают структуру и поддержку клеток. В большем масштабе они также позволяют телу двигаться. | Актин |
Транспортировка / хранение | Эти белки связывают и переносят атомы и небольшие молекулы внутри клеток и по всему телу. | Ферритин |
Четыре типа структуры белка
Белки — это биологические полимеры, состоящие из аминокислот.Аминокислоты, связанные пептидными связями, образуют полипептидную цепь. Одна или несколько полипептидных цепей, скрученных в трехмерную форму, образуют белок. Белки имеют сложную форму, которая включает в себя различные складки, петли и изгибы. Сворачивание белков происходит спонтанно. Химическая связь между частями полипептидной цепи помогает удерживать белок вместе и придавать ему форму. Есть два основных класса белковых молекул: глобулярные белки и волокнистые белки. Глобулярные белки обычно компактны, растворимы и имеют сферическую форму.Волокнистые белки обычно имеют удлиненную форму и нерастворимы. Глобулярные и волокнистые белки могут иметь один или несколько из четырех типов белковой структуры.
Четыре типа структуры белка
Четыре уровня структуры белка отличаются друг от друга степенью сложности полипептидной цепи. Одна молекула белка может содержать один или несколько типов структуры белка: первичную, вторичную, третичную и четвертичную структуру.
1.Первичная структура
Первичная структура описывает уникальный порядок, в котором аминокислоты соединяются вместе с образованием белка. Белки состоят из 20 аминокислот. Обычно аминокислоты обладают следующими структурными свойствами:
- Углерод (альфа-углерод), связанный с четырьмя группами ниже:
- Атом водорода (H)
- Карбоксильная группа (-COOH)
- Аминогруппа (-Nh3)
- Группа «переменная» или группа «R»
Все аминокислоты имеют альфа-углерод, связанный с атомом водорода, карбоксильной группой и аминогруппой.Группа «R» варьируется среди аминокислот и определяет различия между этими мономерами белка. Аминокислотная последовательность белка определяется информацией, содержащейся в клеточном генетическом коде. Порядок аминокислот в полипептидной цепи уникален и специфичен для конкретного белка. Изменение одной аминокислоты вызывает мутацию гена, которая чаще всего приводит к нефункционирующему белку.
2. Вторичная структура
Вторичная структура относится к свертыванию или сворачиванию полипептидной цепи, которая придает белку его трехмерную форму.В белках наблюдаются два типа вторичных структур. Одним из типов является структура альфа (α) спирали . Эта структура напоминает спиральную пружину и закреплена водородными связями в полипептидной цепи. Второй тип вторичной структуры белков — это бета (β) складчатый лист . Эта структура выглядит складчатой или складчатой и удерживается вместе за счет водородных связей между полипептидными единицами сложенной цепи, которые лежат рядом друг с другом.
3.Третичная структура
Третичная структура относится к комплексной трехмерной структуре полипептидной цепи белка. Существует несколько типов связей и сил, удерживающих белок в его третичной структуре.
- Гидрофобные взаимодействия в значительной степени способствуют укладке и формированию белка. Группа «R» аминокислоты является гидрофобной или гидрофильной. Аминокислоты с гидрофильными группами «R» будут стремиться к контакту со своей водной средой, в то время как аминокислоты с гидрофобными группами «R» будут стремиться избегать воды и располагаться к центру белка.
- Водородная связь в полипептидной цепи и между аминокислотными «R» группами помогает стабилизировать структуру белка, удерживая белок в форме, установленной гидрофобными взаимодействиями.
- Из-за сворачивания белка ионная связь может возникать между положительно и отрицательно заряженными группами «R», которые находятся в тесном контакте друг с другом.
- Сворачивание также может приводить к ковалентному связыванию между группами «R» аминокислот цистеина.Этот тип связывания образует так называемый дисульфидный мостик . Взаимодействия, называемые силами Ван-дер-Ваальса, также способствуют стабилизации структуры белка. Эти взаимодействия относятся к силам притяжения и отталкивания, возникающим между поляризованными молекулами. Эти силы способствуют образованию связей между молекулами.
4. Четвертичная структура
Четвертичная структура относится к структуре макромолекулы белка, образованной взаимодействиями между несколькими полипептидными цепями.Каждая полипептидная цепь называется субъединицей. Белки с четвертичной структурой могут состоять более чем из одной белковой субъединицы одного типа. Они также могут состоять из разных субъединиц. Гемоглобин — это пример белка с четвертичной структурой. Гемоглобин, содержащийся в крови, представляет собой железосодержащий белок, связывающий молекулы кислорода. Он содержит четыре субъединицы: две альфа-субъединицы и две бета-субъединицы.
Как определить тип структуры белка
Трехмерная форма белка определяется его первичной структурой.Порядок аминокислот определяет структуру и конкретную функцию белка. Четкие инструкции по порядку аминокислот обозначаются генами в клетке. Когда клетка осознает потребность в синтезе белка, ДНК распадается и транскрибируется в РНК-копию генетического кода. Этот процесс называется транскрипцией ДНК. Затем копия РНК транслируется с образованием белка. Генетическая информация в ДНК определяет конкретную последовательность аминокислот и конкретный производимый белок.Белки являются примерами одного типа биологического полимера. Наряду с белками, углеводы, липиды и нуклеиновые кислоты составляют четыре основных класса органических соединений в живых клетках.
Новая вселенная мини-протеинов меняет клеточную биологию и генетику | Наука
Автор: Митч Лесли,
Мыши посрамляют бегунов-людей.Несмотря на скромные успехи, грызуны могут преодолевать 10 и более километров за ночь на колесе для упражнений. Но выделялись мыши, которых мышечный биолог Эрик Олсон из Юго-Западного медицинского центра Техасского университета в Далласе и его коллеги представили в 2015 году. На беговой дорожке мыши могли суетиться по крутому склону 10% в течение примерно 90 минут, прежде чем споткнуться, что на 31% дольше, чем у других грызунов. Эти железные мыши отличались от своих собратьев только одним небольшим отличием — исследователи генетически изменили животных так, чтобы им не хватало одного мышечного белка.Этого было достаточно, чтобы развязать превосходную мышечную производительность. «Как будто вы отключили тормоза», — говорит Олсон.
Столь же поразительной была природа важнейшего белка. В мышцах содержится огромное количество белков. Дистрофин, структурный белок, ген которого может нести мутации, вызывающие мышечную дистрофию, содержит более 3600 аминокислот. Титин, который действует как пружина, придавая мышцам эластичность, является крупнейшим известным белком, содержащим более 34 000 аминокислот. Белок, отключенный у мышей, имеет ничтожное значение 46.Хотя исследователи изучали, как работают мышцы более 150 лет, они полностью упустили из виду огромное влияние этого крошечного белка, называемого миорегулин, на функцию мышц.
Не только Олсон и его коллеги были ошеломлены белками лилипутов. Как теперь понимают ученые, их первоначальные правила анализа геномов дискриминировали идентификацию этих молекул размером с пинту. Теперь более широкие критерии и лучшие методы обнаружения позволяют обнаруживать крошечные белки тысячами, не только у мышей, но и у многих других видов, включая человека.«Впервые мы собираемся исследовать эту вселенную новых белков, — говорит биохимик Джонатан Вайсман из Калифорнийского университета в Сан-Франциско.
Биологи только начинают вникать в функции этих молекул, называемых микробелками, микропептидами или минипротеинами. Но их небольшой размер, кажется, позволяет им блокировать сложную работу более крупных белков, подавляя одни клеточные процессы и высвобождая другие. Ранние результаты показывают, что микробелки укрепляют иммунную систему, контролируют разрушение дефектных молекул РНК, защищают бактерии от жары и холода, определяют время цветения растений и обеспечивают токсичный удар для многих типов яда.«Вероятно, во всех биологических процессах будут участвовать небольшие [белки]. Мы просто не искали их раньше», — говорит биохимик Алан Сагателиан из Института биологических исследований Солка в Сан-Диего, Калифорния.
Яд этого хищного водяного клопа содержит более десятка мелких белков.
ЭНДРЮ УОКЕРМаленькие белки также обещают пересмотреть текущее понимание генома.Многие из них, по-видимому, закодированы в участках ДНК и РНК, которые, как считалось, не помогают строить какие-либо белки. Некоторые исследователи предполагают, что короткие участки ДНК могут быть генами новорожденных, которые эволюционируют в более крупные гены, которые производят полноразмерные белки. Отчасти благодаря небольшим белкам, «нам нужно переосмыслить, что такое гены», — говорит микробиолог и молекулярный биолог Гизела Сторц из Национального института здоровья детей и развития человека в Бетесде, штат Мэриленд.
Несмотря на остающуюся загадку, ученые уже исследуют потенциальные возможности использования этих молекул.Одна компания продает инсектициды, полученные из небольших белков яда австралийского воронкообразного паука. В ходе клинических испытаний оценивается агент визуализации на основе еще одного крошечного белка в яде скорпиона, предназначенный для выделения границ опухолей, чтобы хирурги могли удалить их более точно. «Многие фармацевтические компании сейчас ищут небольшие белки с медицинским потенциалом», — говорит биохимик Гленн Кинг из Университета Квинсленда в Сент-Люсии, Австралия. «Это одно из самых быстрорастущих направлений.«
Другие короткие аминокислотные цепи, часто называемые пептидами или полипептидами, изобилуют клетками, но они представляют собой урезанные остатки более крупных предшественников. Миорегулин и его миниатюрные собратья, напротив, рождаются маленькими. Насколько они могут быть крошечными, остается неясным. Как отмечает специалист по геномике микробов Ами Бхатт из Стэнфордского университета в Пало-Альто, Калифорния, плодовые мушки полагаются на микропротеин с 11 аминокислотами для роста нормальных ног, а некоторые микробы могут вырабатывать белки длиной менее 10 аминокислот.Но даже самые большие маленькие белки не соответствуют белкам среднего размера, таким как альфа-амилаза, фермент из 496 аминокислот в нашей слюне, который расщепляет крахмал.
До недавнего времени было обнаружено несколько небольших белков, поскольку критерий для идентификации генов был установлен около 20 лет назад. Когда ученые анализируют геном организма, они часто сканируют открытые рамки считывания (ORF), которые представляют собой последовательности ДНК, разграниченные сигналами, которые сообщают рибосомам клетки, ее линиям сборки белка, где начать и где остановиться.Отчасти для того, чтобы избежать большого количества данных, прошлые исследователи обычно исключали любую ORF, которая дала бы белок, содержащий менее 100 аминокислот у эукариот или 50 аминокислот у бактерий. Например, в дрожжах этот порог ограничивал список ORF примерно до 6000.
Ослабление этого критерия показывает, что клетки несут значительно больше ORF. Ранее в этом году постдок из Стэнфорда Хила Сберро Ливнат, Бхатт и его коллеги исследовали фрагменты генома микробов, населяющих четыре части человеческого тела, включая кишечник и кожу.Путем поиска небольших ORF, которые могут кодировать белки длиной от пяти до 50 аминокислот, исследователи идентифицировали около 4000 семейств потенциальных микропротеинов. Почти половина из них не похожи на известные белки, но последовательность для одной маленькой ORF предполагает, что соответствующий белок находится в рибосомах — это намек на то, что он может играть фундаментальную роль. «Не только гены с эзотерическими функциями были упущены из виду», когда ученые упускали из виду небольшие ОРС, — говорит Бхатт. «Это гены с ключевыми функциями.«
Впервые мы собираемся исследовать эту вселенную новых белков.
Джонатан Вайсман, Калифорнийский университет, Сан-Франциско
Другие клетки также содержат огромное количество коротких открытых рамок считывания — например, дрожжи могут производить более 260 000 молекул, содержащих от двух до 99 аминокислот. Но клетки почти наверняка не используют все эти открытые рамки считывания, и некоторые из производимых ими аминокислотных цепочек могут не работать. В 2011 году, обнаружив более 600000 коротких ORF в геноме плодовой мухи, генетик по вопросам развития Хуан Пабло Кузо из Университета Сассекса в Брайтоне, США.К. и коллеги пытались сократить число. Они рассудили, что, если конкретная ORF имеет идентичную или почти идентичную копию у родственного вида, вероятность того, что это геномный мусор, меньше. После поиска генома другой плодовой мушки и анализа других доказательств того, что последовательности транслируются, группа в конечном итоге получила более управляемую цифру в 401 короткую ORF, которая может давать микробелки. Это по-прежнему составляет значительную часть белкового репертуара насекомых — они содержат около 22 000 полноразмерных белков.
Вайсман и его коллеги обнаружили микробелки вторым путем, с помощью метода, который они изобрели, чтобы в целом определить, какие белки производят клетки. Чтобы создать любой белок, клетка сначала копирует ген в информационную РНК. Затем рибосомы считывают мРНК и соединяют аминокислоты в указанном порядке. Посредством секвенирования мРНК, прикрепленных к рибосомам, Вайсман и его команда точно определяют, какие клетки фактически превращаются в белки, а где на РНК рибосома начинает считываться. В исследовании Cell 2011 года он и его команда применили этот метод профилирования рибосом, также называемый Ribo-seq, к эмбриональным стволовым клеткам мыши и обнаружили, что клетки вырабатывают тысячи неожиданных белков, в том числе многие из них ниже 100-аминокислотной — отсечка кислоты.«Было совершенно ясно, что стандартное понимание игнорировало большую вселенную белков, многие из которых были короткими», — говорит Вайсман.
Сагательян и его коллеги применили третий подход, чтобы обнаружить кладезь микробелков в наших собственных клетках. Исследователи использовали масс-спектрометрию, которая включает разбиение белков на части, которые сортируются по массе, чтобы получить отличительный спектр для каждого белка. Сагателян, его тогдашний постдок Сара Славофф и коллеги применили этот метод к смесям белков из человеческих клеток, а затем вычли сигнатуры известных белков.Этот подход позволил выявить спектры 86 ранее не обнаруженных крошечных белков, самые маленькие из которых имеют длину всего 18 аминокислот, сообщили исследователи в 2013 году в статье Nature Chemical Biology .
Малый размер ограничивает возможности белка. Более крупные белки складываются в сложные формы, подходящие для определенной функции, например, для катализирования химических реакций. По словам химика Хулио Камареро из Университета Южной Калифорнии в Лос-Анджелесе, белки с размером меньше 50-60 аминокислот, вероятно, не складываются.Так что они, вероятно, не подходят в качестве ферментов или структурных белков.
Однако их миниатюрный размер также открывает новые возможности. «Они достаточно крошечные, чтобы поместиться в укромных уголках и трещинах более крупных белков, которые функционируют как каналы и рецепторы», — говорит Олсон. Маленькие белки часто разделяют короткие отрезки аминокислот со своими более крупными партнерами и поэтому могут связываться с этими белками и изменять их активность. Связанные микробелки также могут переносить более крупные молекулы в новые места, например, помогая им проникать в клеточные мембраны.
Микропротеин в яде скорпиона-ловца смерти был слит с флуоресцентным красителем, чтобы опухоли испускали свет в ближнем инфракрасном диапазоне. ( 1 ) Опухоль в видимом свете ( 2 ) Та же опухоль в видимом и ближнем инфракрасном свете
(Сверху вниз) ИВАН КУЗЬМИН / НАУЧНЫЙ ИСТОЧНИК; BLAZE BIOSCIENCE (2)Из-за их притяжения к более крупным белкам маленькие белки могут дать клеткам обратимый способ включать или выключать более крупные белки.В исследовании 2016 года, проведенном в PLOS Genetics , биолог по развитию растений Стефан Венкель из Копенгагенского университета и его коллеги генетически изменили растения Arabidopsis для производства дополнительных количеств двух небольших белков. Обычно растения зацветают, когда дни достаточно длинные, но когда они производят избыточное количество двух микробелков, их цветение откладывается. Маленькие белки вызвали эту задержку, блокируя здоровенный белок CONSTANS, который запускает цветение. Они привязывают CONSTANS к другим ингибирующим белкам, которые его отключают.«Клетка использует то, что помогает ей выжить. Если короткий белок выполняет свою работу, это нормально», — говорит Сагателян.
Эти задания включают в себя другие ключевые задачи. В 2016 году Славофф, Сагательян и его коллеги обнаружили, что человеческие клетки производят 68-аминокислотный белок, который они назвали NoBody, который может помочь управлять разрушением неисправных или ненужных молекул мРНК. Название NoBody отражает его роль в предотвращении образования процессинговых телец (P-телец), загадочных кластеров в цитоплазме, где может происходить распад РНК.Когда белок отсутствует, образуется больше Р-телец, что ускоряет разрушение РНК и изменяет внутреннюю структуру клетки. «Это показывает, что небольшие белки могут оказывать огромное влияние на клетку», — говорит Славофф.
Мышцы зависят от множества микробелков. Во время эмбрионального развития отдельные мышечные клетки сливаются в волокна, обеспечивающие сокращение. Миомиксер из 84 аминокислотных белков объединяется с более крупным белком, чтобы объединить клетки, сообщила группа Олсона в 2017 году в Science .Без него эмбриональные мыши не могут формировать мышцы и почти прозрачны.
Позже миорегулин начинает регулировать мышечную активность. Когда мышца получает стимул, клетки-хранилища высыпают кальций, заставляя волокна сокращаться и генерировать силу. Затем ионный насос SERCA начинает возвращать кальций в запасы, позволяя мышечным волокнам расслабиться. Команда Олсона обнаружила, что миорегулин связывается с SERCA и ингибирует его. Эффект ограничивает частоту сокращения мускулов мыши — возможно, гарантируя, что у животного есть запас мускулов на случай чрезвычайной ситуации, например, при побеге от хищника.Другой небольшой белок, DWORF, имеет противоположный эффект, высвобождая SERCA и позволяя мышце многократно сокращаться.
Даже широко изученные организмы, такие как кишечная бактерия Escherichia coli , содержат неожиданные небольшие белки, которые выполняют важные функции. В 2012 году Сторц и ее команда сообщили, что ранее неизвестный белок из 49 аминокислот под названием AcrZ помогает микробу выжить при некоторых антибиотиках, стимулируя насос, который выталкивает лекарства.
А яд, производимый множеством организмов, включая пауков, многоножек, скорпионов и ядовитых моллюсков, изобилует крошечными белками.Многие компоненты яда выводят из строя или убивают, блокируя каналы для натрия или других ионов, которые необходимы для передачи нервных импульсов. Маленькие белки «поражают эти ионные каналы с удивительной специфичностью и эффективностью», — говорит Кинг. «Они являются основными компонентами ядов и ответственны за большинство фармакологических и биологических эффектов».
Австралийский гигантский водяной клоп, убивающий рыбу, например, полагается не только на острые когти и похожие на копья рты, чтобы подчинить себе добычу. Он вводит своим жертвам смесь из более чем 130 белков, 15 из которых содержат менее 100 аминокислот, сообщили Кинг и его коллеги в прошлом году.
В отличие от гигантских белков, таких как антитела, микропротеины, доставляемые с помощью таблеток или инъекций, могут проникать в клетки и изменять их функции. Каптоприл, первый из класса лекарств от высокого кровяного давления, известных как ингибиторы ангиотензинпревращающего фермента, был разработан из небольшого белка в яде бразильской гадюки. Но лекарство, которое Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило для продажи в Соединенных Штатах в 1981 году, было обнаружено случайно, еще до того, как ученые выделили небольшие белки в отдельную группу.На данный момент только несколько микробелков вышли на рынок или в клинические испытания.
Исследователи рака пытаются извлечь выгоду из микробелка в яде скорпиона-ловца смерти ( Leiurus quinquestriatus ) из Африки и Ближнего Востока. Молекула имеет загадочное притяжение к опухолям. Объединив его с флуоресцентным красителем, ученые надеются осветить границы опухолей головного мозга, чтобы хирурги могли безопасно вырезать раковые ткани. «Он освещает опухоль. Вы можете увидеть края и метастазы», - говорит Кинг.В настоящее время проводится клиническое исследование, посвященное оценке того, может ли двойная молекула помочь хирургам удалять опухоли головного мозга у детей.
Насколько важны малые белки для медицины, пока неизвестно, но они уже опровергли несколько биологических предположений. Генетик Норберт Хюбнер из Центра молекулярной медицины Макса Дельбрюка в Берлине и его коллеги обнаружили десятки новых микробелков в клетках сердца человека. Группа проследила их до неожиданного источника: короткие последовательности в длинных некодирующих РНК, разновидность, которая, как считалось, не продуцирует белки.После идентификации 169 длинных некодирующих РНК, которые, вероятно, считывались рибосомами, Хюбнер и его команда использовали тип масс-спектрометрии, чтобы подтвердить, что более половины из них дают микробелки в клетках сердца, результат был сообщен ранее в этом году в Cell .
Бактерии, такие как Escherichia coli , также производят множество микробелков, хотя их функции во многих случаях остаются неясными.
KWANGSIN KIM / НАУЧНЫЙ ИСТОЧНИКПоследовательности ДНК других крошечных белков также встречаются в нетрадиционных местах.Например, некоторые из них находятся рядом с открытыми рамками считывания для более крупных белков. Ранее исследователи думали, что эти последовательности помогают управлять производством более крупных белков, но редко дают начало самим белкам. Некоторые кодирующие последовательности для недавно открытых микробелков даже вложены в последовательности, кодирующие другие, более длинные белки.
Эти геномные сюрпризы могут пролить свет на то, как возникают новые гены, говорит биолог-эволюционист Анн-Руксандра Карвунис из Университета Питтсбурга в Пенсильвании.Исследователи думали, что большинство новых генов возникает, когда существующие гены дублируются или сливаются, или когда виды обмениваются ДНК. Но для Карвуниса микробелки предполагают, что протогены могут образовываться, когда мутации создают новые сигналы запуска и остановки в некодирующей части генома. Если полученная в результате ORF продуцирует полезный белок, новые последовательности останутся в геноме и будут подвергаться естественному отбору, в конечном итоге превратившись в более крупные гены, которые кодируют более сложные белки.
В исследовании 2012 года Карвунис, который тогда был постдоком в лаборатории Марка Видаля в Институте рака Дана-Фарбер в Бостоне, и его коллеги обнаружили, что дрожжи транслируют более 1000 коротких ORF в белки, подразумевая, что эти последовательности являются протогенами.В новом исследовании Карвунис и ее команда проверили, могут ли молодые ORF быть полезными для клеток. Они генетически изменили дрожжи, чтобы увеличить выход 285 недавно разработанных ORF, большинство из которых кодируют молекулы, которые меньше стандартного порогового значения белка или чуть выше него. Для почти 10% белков увеличение их уровней усиливало рост клеток по крайней мере в одной среде. Результаты, опубликованные на сервере препринтов bioRxiv, предполагают, что эти последовательности могут стать полноценными генами, говорит Карвунис.
Славофф до сих пор вспоминает, как был поражен, когда во время собеседования на постдока с Сагательяном он спросил, не захочет ли она пойти на охоту за маленькими белками. «Я никогда не думал, что может существовать такой размер белков, который до сих пор был для нас темным».
Но ставка окупилась — теперь у нее есть собственная лаборатория по поиску микробелков. Недавно она рассказала некоторым из своих постдоков и аспирантов об одном из наиболее изученных организмов, штамме K12 E.coli. Вскоре команда обнаружила пять новых микробелков. «Мы, вероятно, только царапаем поверхность», — говорит она.
белков — Биология 2e
Цели обучения
К концу этого раздела вы сможете делать следующее:
- Опишите функции, которые белки выполняют в клетке и тканях
- Обсудить взаимосвязь между аминокислотами и белками
- Объясните четыре уровня белковой организации
- Опишите способы, которыми связаны форма и функция белка
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул.Белки могут быть структурными, регуляторными, сократительными или защитными. Они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка в живой системе может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой аминокислотные полимеры, расположенные в линейной последовательности.
Типы и функции белков
Ферменты, которые вырабатывают живые клетки, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки.Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Мы называем ферменты, расщепляющие субстраты, катаболическими ферментами. Те, которые строят более сложные молекулы из своих субстратов, являются анаболическими ферментами, а ферменты, которые влияют на скорость реакции, являются каталитическими ферментами. Обратите внимание, что все ферменты увеличивают скорость реакции и, следовательно, являются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Гормоны — это химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови. (Рисунок) перечислены основные типы и функции белков.
| Типы и функции белков | ||
|---|---|---|
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в пище за счет катаболизма питательных веществ до мономерных единиц |
| Транспорт | Гемоглобин, альбумин | Переносит вещества в крови или лимфе по всему телу |
| Строительный | Актин, тубулин, кератин | Создавать различные структуры, такие как цитоскелет. |
| Гормоны | Инсулин, тироксин | Координировать деятельность различных систем организма |
| Оборона | Иммуноглобулины | Защитить организм от инородных патогенов |
| Сокращение | Актин, миозин | Эффект сокращения мышц |
| Хранилище | Запасные белки бобовых, яичный белок (альбумин) | Обеспечивает питание на ранних этапах развития зародыша и проростков |
Белки имеют разную форму и молекулярную массу.Некоторые белки имеют шаровидную форму; тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, находящийся в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и многие различные типы химических связей поддерживают эту форму. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции или денатурации. Все белки содержат разные расположения одних и тех же 20 типов аминокислот.Недавно были открыты две редкие новые аминокислоты (селеноцистеин и пирролизин), и к этому списку могут быть добавлены новые открытия.
Аминокислоты
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода или альфа ( α ) углерода, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и водородом. атом. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R ((рисунок)).
Аминокислоты имеют центральный асимметричный атом углерода, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).
Ученые используют название «аминокислота», потому что эти кислоты содержат как аминогруппу, так и карбоксильную кислотную группу в своей основной структуре. Как мы уже упоминали, в белках присутствует 20 распространенных аминокислот. Девять из них являются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и мы получаем их из своего рациона.Для каждой аминокислоты группа R (или боковая цепь) отличается ((рисунок)).
Визуальное соединение
В белках обычно встречаются 20 общих аминокислот, каждая из которых имеет свою R-группу (вариантная группа), которая определяет его химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной).Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также являются основными аминокислотами. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи ((рисунок)).
Одна заглавная буква или трехбуквенное сокращение обозначают аминокислоты. Например, буква V или трехбуквенный символ val обозначают валин. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Эти незаменимые аминокислоты у человека включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к тем, которые необходимы для создания белков в организме, но не к тем, которые организм производит. Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Ковалентная связь или пептидная связь присоединяется к каждой аминокислоте, образуя реакцию дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь представляет собой пептидную связь ((Рисунок)).
Образование пептидной связи — это реакция синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты.В процессе он высвобождает молекулу воды.
Продукты, образующиеся при таких связях, являются пептидами. Чем больше аминокислот присоединяется к этой растущей цепи, получающаяся цепь представляет собой полипептид. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец является N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, а также C или карбоксильный конец. Хотя термины полипептид и белок иногда используются как взаимозаменяемые, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию.После синтеза (трансляции) белков большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Evolution Connection
Эволюционное значение цитохрома c Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он располагается в клеточной органелле, митохондрии.Этот белок имеет простетическую группу гема, и центральный ион гема поочередно восстанавливается и окисляется во время переноса электрона. Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился. Секвенирование белков показало, что существует значительная гомология аминокислотных последовательностей цитохрома с среди различных видов. Другими словами, мы можем оценить эволюционное родство, измеряя сходства или различия между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с из разных организмов, которые ученые секвенировали на сегодняшний день, 37 из этих аминокислот находятся в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе ученые не обнаружили разницы в последовательностях. Когда исследователи сравнили последовательности человека и макаки-резуса, единственное различие было в одной аминокислоте.В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Структура белка
Как мы обсуждали ранее, форма белка имеет решающее значение для его функции. Например, фермент может связываться со специфическим субстратом в активном центре. Если этот активный сайт изменяется из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи является ее первичной структурой. Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны между собой дисульфидными связями. N-концевая аминокислота A-цепи представляет собой глицин; тогда как С-концевой аминокислотой является аспарагин ((рисунок)). Аминокислотные последовательности в цепях A и B уникальны для инсулина.
Инсулин бычьей сыворотки — это белковый гормон, состоящий из двух пептидных цепей: A (длина 21 аминокислота) и B (длина 30 аминокислот).В каждой цепи трехбуквенные сокращения, которые представляют названия аминокислот в том порядке, в котором они присутствуют, указывают на первичную структуру. Аминокислота цистеин (cys) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи A и B вместе, а третья помогает цепи A свернуться в правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности мы изобразили их разного размера.
Ген, кодирующий белок, в конечном итоге определяет уникальную последовательность для каждого белка. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка. При серповидно-клеточной анемии цепь гемоглобина β (небольшая часть которой показана на рисунке) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка.В частности, валин в цепи β заменяет глутаминовую аминокислоту. Примечательно, что молекула гемоглобина состоит из двух альфа- и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Таким образом, молекула содержит около 600 аминокислот. Структурное различие между нормальной молекулой гемоглобина и молекулой серповидноклеточных клеток — что резко снижает продолжительность жизни — состоит в одной из 600 аминокислот. Что еще более примечательно, так это то, что каждый из трех нуклеотидов кодирует эти 600 аминокислот и одно изменение основания (точечная мутация), 1 из 1800 оснований вызывает мутацию.
Бета-цепь гемоглобина имеет длину 147 остатков, однако единственная аминокислотная замена приводит к серповидно-клеточной анемии. В нормальном гемоглобине аминокислота в седьмом положении — глутамат. В серповидно-клеточном гемоглобине глутамат заменяет валин.
Из-за этого изменения одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные красные кровяные тельца и заставляют их принимать форму полумесяца или «серпа», что закупоривает кровеносные сосуды ((( Фигура)).Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у людей, страдающих этим заболеванием.
В этом мазке крови, визуализированном при 535-кратном увеличении с помощью светлопольной микроскопии, серповидные клетки имеют форму полумесяца, тогда как нормальные клетки имеют форму диска. (кредит: модификация работы Эда Усмана; данные шкалы от Мэтта Рассела)
Вторичная структура
Локальное сворачивание полипептида в некоторых областях приводит к вторичной структуре белка.Наиболее распространенными являются α -спиральные и β -складчатые листовые структуры ((рисунок)). Обе структуры удерживаются в форме водородными связями. Водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Спираль α и складчатый лист β представляют собой вторичные структуры белков, которые образуются из-за водородных связей между карбонильной и аминогруппой в основной цепи пептида.Некоторые аминокислоты имеют склонность образовывать α -спираль, в то время как другие имеют склонность образовывать складчатый лист β .
Каждый виток альфа-спирали содержит 3,6 аминокислотных остатка. Группы R полипептида (группы вариантов) выступают из цепи α -спираль. В листе с складками β водородные связи между атомами в основной цепи полипептидной цепи образуют «складки». Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки.Складчатые сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидной основной цепи. Спиральные структуры α и складчатые пластинки β присутствуют в большинстве глобулярных и волокнистых белков и играют важную структурную роль.
Третичная структура
Уникальная трехмерная структура полипептида — это его третичная структура ((Рисунок)).Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R в задействованных аминокислотах может противодействовать образованию водородных связей, которые мы описали для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка; тогда как гидрофильные группы R расположены снаружи.Ученые также называют первые типы взаимодействия гидрофобными взаимодействиями. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственной ковалентной связи, которая образуется во время сворачивания белка.
Различные химические взаимодействия определяют третичную структуру белков. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образуются из нескольких полипептидов или субъединиц, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в форму шара. Инсулин начинается как отдельный полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи.Шелк (волокнистый белок), однако, имеет складчатую листовую структуру β , которая является результатом водородных связей между различными цепями.
(рисунок) иллюстрирует четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный).
Обратите внимание на четыре уровня белковой структуры на этих иллюстрациях. (кредит: модификация работы Национального исследовательского института генома человека)
Денатурация и сворачивание белка
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются химическими взаимодействиями.Если белок подвержен изменениям температуры, pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности, что ученые называют денатурацией. Денатурация часто обратима, поскольку первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, позволяя белку возобновить свою функцию. Иногда денатурация необратима, что приводит к потере функции. Одним из примеров необратимой денатурации белка является жарка яйца.Белок альбумина в жидком яичном белке денатурирует при помещении на горячую сковороду. Не все белки денатурируют при высоких температурах. Например, бактерии, которые выживают в горячих источниках, содержат белки, которые функционируют при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки как часть процесса пищеварения; однако пищеварительные ферменты желудка сохраняют свою активность в этих условиях.
Сворачивание белка имеет решающее значение для его функции. Первоначально ученые думали, что сами белки несут ответственность за процесс сворачивания.Только недавно исследователи обнаружили, что часто они получают помощь в процессе сворачивания от белков-помощников или шаперонов (или шаперонинов), которые связываются с целевым белком во время процесса сворачивания. Они действуют, предотвращая агрегацию полипептидов, которые составляют полную структуру белка, и они отделяются от белка, как только целевой белок сворачивается.
Ссылка на обучение
Чтобы получить дополнительную информацию о белках, просмотрите этот анимационный ролик под названием «Биомолекулы: белки.”
Сводка раздела
Белки — это класс макромолекул, которые выполняют широкий спектр функций для клетки. Они помогают метаболизму, действуя как ферменты, переносчики или гормоны, и обеспечивают структурную поддержку. Строительными блоками белков (мономеров) являются аминокислоты. Каждая аминокислота имеет центральный атом углерода, который связывается с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью. Существует 20 обычно встречающихся аминокислот, каждая из которых отличается по группе R.Пептидная связь связывает каждую аминокислоту с ее соседями. Длинная аминокислотная цепь — это полипептид.
Белки подразделяются на четыре уровня: первичный, вторичный, третичный и (необязательно) четвертичный. Первичная структура — это уникальная последовательность аминокислот. Локальная складчатость полипептида с образованием таких структур, как α -спираль и β -складчатый лист, составляет вторичную структуру. Общая трехмерная структура — это третичная структура. Когда два или более полипептида объединяются, чтобы сформировать полную структуру белка, конфигурация является четвертичной структурой белка.Форма и функция белка неразрывно связаны. Любое изменение формы, вызванное изменениями температуры или pH, может привести к денатурации белка и потере функции.
Вопросы о визуальном подключении
(Рисунок) Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
(Рисунок) Полярные и заряженные аминокислотные остатки (остаток после образования пептидной связи) с большей вероятностью будут обнаружены на поверхности растворимых белков, где они могут взаимодействовать с водой, и неполярные (например, неполярные).g., боковые цепи аминокислот) с большей вероятностью будут обнаружены внутри, где они изолированы от воды. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, в то время как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако бывают исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в кармане связывания лиганда.
Обзорные вопросы
Мономеры, из которых состоят белки, называются ________.
- нуклеотидов
- дисахариды
- аминокислот
- шаперонов
Спираль α и складчатый лист β являются частью какой белковой структуры?
- первичный
- вторичный
- высшее
- четвертичный
Коровье бешенство — это инфекционное заболевание, при котором один неправильно свернутый белок вызывает неправильное сворачивание всех других копий белка.Это пример болезни, влияющей на структуру ____.
- первичный
- вторичный
- высшее
- четвертичный
Вопросы о критическом мышлении
Объясните, что происходит, если в полипептидной цепи даже одна аминокислота заменяется другой. Приведите конкретный пример.
Изменение последовательности гена может привести к добавлению другой аминокислоты к полипептидной цепи вместо нормальной. Это вызывает изменение структуры и функции белка.Например, при серповидно-клеточной анемии цепь гемоглобина β имеет единственную аминокислотную замену — аминокислота глутаминовая кислота в шестом положении заменена валином. Из-за этого изменения молекулы гемоглобина образуют агрегаты, а красные кровяные тельца в форме диска принимают форму полумесяца, что приводит к серьезным проблемам со здоровьем.
Опишите различия в четырех белковых структурах.
Последовательность и количество аминокислот в полипептидной цепи — это ее первичная структура.Локальное сворачивание полипептида в некоторых областях является вторичной структурой белка. Трехмерная структура полипептида известна как его третичная структура, частично создаваемая химическими взаимодействиями, такими как водородные связи между полярными боковыми цепями, ван-дер-ваальсовы взаимодействия, дисульфидные связи и гидрофобные взаимодействия. Некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру.
Аквапорины — это белки, встроенные в плазматическую мембрану, которые позволяют молекулам воды перемещаться между внеклеточным матриксом и внутриклеточным пространством.Основываясь на его функции и расположении, опишите ключевые особенности формы белка и химические характеристики его аминокислот.
Белок должен образовывать канал в плазматической мембране, который позволяет воде проникать в клетку, поскольку вода не может проходить через плазматическую мембрану сама по себе. Поскольку аквапорины встроены в плазматическую мембрану и соединяются как с внутриклеточным, так и с внеклеточным пространством, он должен быть амфипатическим, как и плазматическая мембрана. Верх и низ белка должны содержать заряженные или полярные аминокислоты (гидрофильные) для взаимодействия с водной средой.Внешняя трансмембранная область должна содержать неполярные аминокислоты (гидрофобные), которые могут взаимодействовать с фосфолипидными хвостами. Однако внутри этого канала должны находиться гидрофильные аминокислоты, поскольку они будут взаимодействовать с движущимися молекулами воды.
Глоссарий
- структура альфа-спирали ( α -спираль)
- тип вторичной белковой структуры, образованной сворачиванием полипептида в форму спирали с водородными связями, стабилизирующими структуру
- аминокислота
- мономер белка; имеет центральный углерод или альфа-углерод, к которому присоединены аминогруппа, карбоксильная группа, водород и R-группа или боковая цепь; группа R различна для всех 20 распространенных аминокислот
- бета-гофрированный лист ( β -гофрированный)
- вторичная структура в белках, в которой водородные связи образуют «складки» между атомами в основной цепи полипептидной цепи
- шаперон Белок
- (также шаперонин), который помогает возникающему белку в процессе сворачивания
- денатурация
- потеря формы белка в результате изменений температуры, pH или химического воздействия
- фермент
- катализатор в биохимической реакции, который обычно представляет собой сложный или конъюгированный белок
- гормон
- химическая сигнальная молекула, обычно белок или стероид, секретируемая эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы
- пептидная связь
- Связь между двумя аминокислотами в результате реакции дегидратации
- полипептид
- длинная цепь аминокислот, которые связывают пептидные связи
- первичная структура
- линейная последовательность аминокислот в белке
- белок
- биологическая макромолекула, состоящая из одной или нескольких аминокислотных цепей
- четвертичная структура
- ассоциация дискретных полипептидных субъединиц в белке
- вторичная структура
- регулярная структура, которую белки образуют за счет внутримолекулярной водородной связи между атомом кислорода одного аминокислотного остатка и водородом, присоединенным к атому азота другого аминокислотного остатка
- третичная структура
- трехмерная конформация белка, включая взаимодействия между вторичными структурными элементами; образуется в результате взаимодействия между боковыми цепями аминокислот
Связь между наличием цистеина в белках и сложностью организмов | Молекулярная биология и эволюция
Абстрактные
Встречаемость и относительное положение остатков цистеина были исследованы в белках различных видов.Учитывая случайное математическое появление аминокислоты, кодируемой двумя кодонами (3,28%), цистеин недостаточно представлен во всех исследованных организмах. Представительство цистеина, по-видимому, положительно коррелирует со сложностью организма, варьируя от 2,26% у млекопитающих до 0,5% у некоторых представителей отряда Archeabacteria . Это наблюдение вместе с результатами, полученными при сравнении содержания цистеина в различных рибосомных белках, указывает на то, что эволюция использует преимущества увеличения использования остатков цистеина.Во всех изученных организмах, кроме растений, два цистеина часто обнаруживаются на расстоянии двух аминокислотных остатков (мотив C- (X) 2 -C). Известно, что такой мотив присутствует во множестве металлсвязывающих белков и оксидоредуктаз. Примечательно, что более 21% всех цистеинов было обнаружено в мотивах C- (X) 2 -C в Archea. Это наблюдение может указывать на то, что цистеин сначала появился в древних металлсвязывающих белках, а позже был введен в другие белки.
Введение
Цистеин уникален среди кодируемых аминокислот, потому что он содержит реактивную сульфгидрильную группу.Следовательно, два остатка цистеина могут образовывать цистин (дисульфидную связь) между различными частями одного и того же белка или между двумя отдельными полипептидными цепями. Образование дисульфидной связи связано со сворачиванием белка и поддерживается ферментами тиолдисульфид оксидоредуктаза и протеиндисульфидизомераза (Loferer and Hennecke 1994; Noiva 1994; Raina and Missiakas 1997). Известно, что цитозольные белки содержат относительно мало дисульфидных связей, а системы глутаредоксина и тиоредоксина участвуют в поддержании групп -SH в восстановленной форме (Derman et al.1993; Стюарт, Ослунд и Беквит, 1998 г .; Чжун и др. 1998).
Простые структурные ограничения также могут мешать взаимодействию цистеинов. Из-за жесткой планарной природы пептидной связи два соседних цистеина не могут взаимодействовать. То же самое верно, если два цистеина разделены только одной аминокислотой. Основываясь на физических размерах и выравнивании аминокислотных остатков в конфигурациях альфа-спирали и бета-поворотов, два цистеина наиболее близки друг к другу, когда они разделены двумя другими аминокислотами (C- (X) 2 -C мотив; X может стоять для любой кодированной аминокислоты).В самом деле, известно, что мотивы C- (X) 2 -C являются хорошо законсервированными частями различных железо-серных белков и оксидоредуктаз (Shuber et al. 1986; Ammendola et al. 1992). Однако мы признали, что появление доменов C- (X) 2 -C не ограничивается этими группами белков. Кроме того, количество доменов C- (X) 2 -C оказалось удивительно высоким в большой случайно выбранной популяции известных белков Saccharomyces cerevisae .
Эти наблюдения побудили нас проанализировать, возникли ли цистеины случайным образом или организованы преимущественно в мотивы C- (X) 2 -C в известных белках различных видов.Перед проведением такого анализа необходимо было проанализировать наличие цистеинов и других кодируемых аминокислот в белках различных видов. Цистеин кодируется триплетами кодонов UGU и UGC соответственно. Все известные организмы содержат цистеины в своих белках.
Поскольку все известные живые организмы содержат одни и те же 20 кодированных аминокислот, нет прямого способа узнать, была ли та или иная аминокислота введена раньше или позже в процессе эволюции. С другой стороны, жизнь на Земле могла возникнуть с примитивных организмов, содержащих известные 20 кодированных аминокислот.Доказательства, подтверждающие постепенное расширение генетического кода, в первую очередь основаны на аномальном распределении кодонов у различных видов (Osawa et al. 1992; Bauman and Oro 1993).
Кроме того, Doring и Marliere (1998) показали, что мутантные тРНК, которые включают цистеин в положениях, соответствующих кодонам изолейцина или метионина, могут сохраняться в Escherichia coli. Токсичность неправильного кодирования цистеина была низкой, что доказывает, что цистеин является приемлемой заменой в большинстве положений белка.Таким образом, включение цистеина может преодолеть стерические и полярные ограничения, которые ограничивают эволюцию генетического кода.
Таким образом, возможно, что цистеин был введен на относительно поздней стадии эволюции через захват некоторых кодонов другой аминокислоты (серин, глицин). Если синтез боковой цепи аминокислоты прогрессирует с помощью того же или аналогичного пути (путей) биосинтеза, полученные аминокислоты физико-химически подобны (например, Ile, Val, Leu, Phe, Tyr, Asp, Glu) (Miseta 1989) .Важно отметить, что физико-химически родственные аминокислоты занимают аналогичные кодоны (Jungck 1978; Weber and Lacey 1978). Следовательно, генетический код разработан таким образом, чтобы свести к минимуму вероятность того, что изменение одного нуклеотидного основания приведет к замене на физико-химически другую аминокислоту.
Результатом нецелевого введения цистеина должно было быть то, что многие цистеины оказались не в «оптимальных местах». Последующая эволюция должна была исправить эти «ошибки», оставив цистеины в положениях, в которых их физико-химические свойства могли быть использованы с пользой для организма.Одновременно мутации, приводящие к триплетам, кодирующим цистеин, способствовали развитию новых, более сложных белков.
На основании этой гипотезы можно было ожидать найти простые организмы с относительно небольшим количеством цистеинов и сложные организмы со значительно большим количеством цистеинов. Точно так же можно ожидать обнаружения цистеинов в ограниченном количестве белковых доменов у простых организмов.
В настоящем отчете мы пытаемся выделить взаимосвязь между сложностью различных организмов и наличием цистеина в их белках.
Материалы и методы
Последовательности белков, файлы данных последовательностей и анализ аминокислотного состава
Анализ последовательностей проводился на файлах данных последовательностей, созданных из последовательностей, хранящихся в базе данных SwissProt (CDPROT31). Файлы данных последовательности были созданы с помощью правила выбора. В правиле отбора указывается научное название вида. Если указано, также было указано субклеточное расположение белков.Затем были отредактированы файлы сохраненных данных, содержащие каталоги последовательностей белков. Это редактирование ограничивалось удалением нескольких поврежденных файлов последовательностей, для которых последующие программы анализа данных не могли работать.
Были созданы следующие файлы данных: Homo sapiens, (человек), 2681 последовательность белка; Mus musculus (мышь), 1727; Bos taurus (крупный рогатый скот), 719; Drosophila melanogaster (плодовая муха), 624; Caernorhabditis elegans, 690; Zea mays (кукуруза), 287; Orysa sativa (рис), 219; Lycopersicon esculentum (томат), 117; Saccharomyces cerevisiae (пекарские дрожжи), 3,127; E.coli, , 3151; Rhodobacter sphaeroides, 58; Pseudomonas aeruginosa, 214; Haloarcula marismortui ( ранее Halobacterium marismortui ), 62; и Thermus aquaticus, 88. В некоторых случаях для анализа использовались белки родственных видов. Файлы данных для различных Cyanobacteria содержали 556 последовательностей, файлы для Archea содержали 553 последовательности, а файлы для Sulpho-archea содержали 137 последовательностей.Файлы данных для рибосомных белков включали 66 последовательностей для людей, 134 последовательности для дрожжей, 59 последовательностей для E. coli, и 51 последовательность для H. marismortui.
Поскольку данные были сгенерированы и предназначались для сравнения между файлами данных, содержащими разное количество последовательностей белков, было важно рассчитать стандартные отклонения любых результатов для файлов данных меньшего и большего размера. Таким образом, мы сгенерировали пять файлов данных, каждый из которых содержит 50 последовательностей S. cerevisiae с помощью случайного генератора.Встречаемость 20 кодированных аминокислот была проанализирована в пяти файлах данных, и были рассчитаны средние значения и стандартные отклонения. Мы обнаружили, что в этом случае среднее значение SD для 20 аминокислот составляло 5,57%. Например, мы обнаружили 291,2 ± 36,8 остатков цистеина (среднее ± стандартное отклонение). Когда каждая из пяти баз данных S. cerevisiae содержала 100 или 200 случайно выбранных последовательностей белков вместо 50, средние значения SD снизились до 3,50% и 2,21% соответственно.
Несомненно, файлы данных меньшего размера не отражают средний белковый состав вида, а также более крупные.Мы также отмечаем, что эти файлы данных были созданы не генератором случайных чисел, а скорее специфическими интересами исследователей. По этой причине мы хотели быть максимально осторожными при интерпретации данных в небольших файлах данных. Файл данных, содержащий менее 50 последовательностей, не использовался. Кроме того, создание комбинированных файлов данных по родственным видам с большим количеством последовательностей было направлено на уменьшение стандартной ошибки.
Был проанализирован аминокислотный состав белков в файле данных, при этом общее количество 20 закодированных аминокислот составило 100%.Содержание цистеина (и любой другой аминокислоты) выражали как процент от общего количества аминокислот.
Корректировка данных аминокислотного состава для содержания ГХ по сравнению с содержанием AT кодирующей ДНК
Известно, что содержание GC по сравнению с содержанием AT кодирующих последовательностей варьируется в широком диапазоне у разных видов. Цистеин может кодироваться UGU или UGC. Следовательно, только содержание GC в положении первого и второго кодона влияет на появление цистеина.Общее количество кодирующих GC и усредненное содержание GC первой и второй буквы кодона (значения выделены курсивом) видов, перечисленных в отчете, следующие: люди — 52,75%, 49,24% ; крупный рогатый скот — 52,86%, 48,37% ; мыши — 52,76%, , 49,25%, ; D. melanogaster -54,53%, 48,95% ; C. elegans —42,37%, 43,94% ; кукуруза — 55,69%, , 50,67%, ; рис — 56,16%, 51,03% ; томаты — 42,74%, 45,26% ; С.cerevisae — 39,72%, 40,60% ; Цианобактерии — 32,36%, 41,8% ; E. coli —51,37%, 49,60% ; R. sphaeroides — 67,86%, 57,69% ; P. aureginosa —64,06%, 55,09% ; H. marismortui —63,69%, 55,00% ; T. aquaticus —66,57%, 55,45 %; Сульфоархея —43,12%, 45,71%.
Ожидается, что увеличение содержания GC в положении первого кодона окажет негативное влияние на содержание цистеина в биологических видах, поскольку первая буква кодона — U.Увеличение содержания GC второй буквы кодона должно иметь положительный эффект на содержание цистеина, потому что вторая буква кодона — G. Кроме того, (A + U) + (G + C) = 1 (где 1 — общее количество нуклеотидов. содержание вида). Поскольку (G + C) = 1 — (A + U), связь между вероятностью кодирования цистеина (Pcys) и содержанием (G + C) кодирующей ДНК может быть описана как Pcys = (G + C) * (1 — (G + C)). Поскольку кривая вероятности довольно плоская в диапазоне содержания GC от 40% до 60%, скорректированные значения никогда не отличаются от исходных данных более чем на 3.5%. В тексте и / или в подписях к рисункам указывается, были ли данные скорректированы с учетом фактического содержания GC для видов.
Анализ аминокислотного расстояния и гомологии белков
Вышеупомянутые файлы данных использовались для анализа встречаемости различных аминокислотных последовательностей. Анализировали наличие последовательности C- (X) n -C. C — однобуквенная метка для цистеина, X — любая другая аминокислота, и n — количество повторов, 0–22 в наших исследованиях.Поскольку последовательность зонда C- (X) n -C может быть наложена на любую последовательность заданной длины еще раз, чем последовательность зонда C- (X) n +1 -C, соответствующая коррекция может осуществляться. Однако мы обнаружили, что полученная поправка не повлияла существенно на наши результаты, и по этой причине она была опущена.
Для последовательности C- (X) 2 -C мы также проанализировали наличие всех индивидуальных последовательностей в файлах данных людей, плодовых мух, E.coli, и Archea. Выравнивание аминокислотных последовательностей проводили в соответствии с методом, разработанным Myers and Miller (1988). Мы использовали структурную генетическую матрицу, основанную на работе Фенга, Джонсона и Дулиттла (1984) со стоимостью открытого пробела 10 и стоимостью единицы пробела 5.
Результаты
Появление цистеина в белках разных видов
Сначала мы исследовали наличие цистеина в известных белках различных видов.Для этого были подсчитаны встречаемости 20 кодированных аминокислот в репрезентативных образцах (файлах данных) людей, крупного рогатого скота, мышей, плодовых мух, C. elegans, кукурузы, риса, томатов, дрожжей, Cyanobacteria, E. coli, R. sphaeroides, P. aeruginosa, H. marismortui, T. aquaticus, и Sulpho-archea. Сумма всех 20 кодированных аминокислот считалась 100%.
Цистеин — относительно редкая аминокислота в белках исследованных организмов (рис.1). Анализы белков человека, крупного рогатого скота и мыши выявили почти идентичные (2,26%) встречаемости цистеина. Белки плодовой мушки C. elegans содержали несколько меньше цистеина (1,90% и 1,97% соответственно). Белки кукурузы, риса и томатов содержат 1,62–1,69% цистеина. Среди исследованных эукариот дрожжи содержали меньше всего цистеина (1,21%).
Среди исследованных прокариот цианобактерий, E. coli, P. aeruginosa, и R. sphaeroides содержали 1.3–1,13% цистеина, что несколько меньше, чем у S. cerevisiae.
Были изучены также представители недавно созданного ордена Archea (Woese, Gupta, 1981; Woese, Kandler, and Wheelis, 1990). Мы обнаружили, что содержание цистеина у крайнего галофила H. marismortui и термофила T. aquaticus было самым низким среди исследованных видов (0,49% и 0,41% соответственно). Точно так же низкое представительство цистеина очевидно у Halobacterium salinarium (данные не показаны) и членов группы Sulpho-archea .Все данные были скорректированы с учетом фактического содержания ГХ видов (использованного в качестве фоновой вероятности), как описано в «Материалы и методы».
Отметим, что фактические и скорректированные по ГХ уровни цистеина были почти идентичны для большинства видов. (Наибольшая разница между этими значениями была у S. cerevisiae, , для которых фактическое содержание цистеина составляло 1,25%, тогда как скорректированный GC был 1,21%.)
В то время как белки порядка Archea могут содержать от четырех до В пять раз меньше цистеина, чем в белках млекопитающих, кажется, что цистеин недостаточно представлен во всех исследованных организмах.Учитывая, что у этих организмов 61 смысловой кодон и два кодона отнесены к цистеину, (100/61) × 2 = 3,28%. Диапазон вероятности с поправкой на GC составляет 3,23–3,28% для изученных видов.
Мы также подсчитали количество белков с хотя бы одним остатком цистеина и без него у некоторых видов. На рисунке 2 показано, что около 92% белков человека содержат один или несколько остатков цистеина. Аналогичные числа были получены для белков плодовой мухи и дрожжей. Умеренное увеличение количества белков, не содержащих цистеина, очевидно для E.coli, , но более 50% известных белков H. marismortui не содержат ни одного остатка цистеина. Аналогичные проценты могут быть получены для других родственных видов, перечисленных на рисунке 1.
Отметим, что средние длины белков не равны в разных файлах данных (видах) (подробности см. В Материалы и методы ).
Встречаемость цистеина в рибосомальных белках различных видов
Известно, что одна или несколько дисульфидных связей часто обнаруживаются в экскретируемых белках или белках плазматической мембраны.Напротив, цитозольные белки часто лишены дисульфидных связей. Известно, что цитозольные цистеины поддерживаются в тиоловой форме системами глутаредоксина и тиоредоксина, и по этой причине нехватка дисульфидных мостиков в цитозольных белках может приводить или не приводить к снижению содержания цистеина в белках. Однако одна из гипотетических причин повышенного количества цистеина в белках эукариот, особенно у млекопитающих, может заключаться в том, что сложные организмы могут содержать более широкий спектр внеклеточных белков, богатых цистеином.Поэтому мы изучили, содержат ли известные рибосомные белки млекопитающих больше цистеина, чем белки менее развитых организмов. Похоже, что рибосомные белки содержат меньше остатков цистеина у людей, плодовых мушек, дрожжей и E. coli , по сравнению со средним содержанием цистеина в их белках (рис. 3). Это не относится к H. maresmortui. Однако общая тенденция, то есть менее развитые организмы, содержащие меньше остатков цистеина, остается в силе.
Мы также выбрали 10 рибосомных белков человека, для которых можно получить родственные последовательности для дрожжей, E.coli, и H. marismortui (таблица 1). Мы обнаружили, что объединенные 10 рибосомных белков человека содержат 2404 аминокислоты и 30 цистеинов среди них. Таким образом, их содержание цистеина составляло 1,25%, что значительно меньше среднего содержания цистеина в человеческих белках (2,26%). Однако среднее содержание цистеина в их родственных рибосомных белках в дрожжах составляло 0,42%, за ними следовали E. coli с 0,19% и H. maresmortui с 0,11%. Поправка на содержание GC для различных видов существенно не повлияла на данные.Рибосомные белки, перечисленные в таблице 1, показали 60-78% идентичности / сходства между людьми и дрожжами (RL6 является исключением; он показывает незначительную идентичность / сходство между людьми и дрожжами). Несмотря на это, два из трех цистеинов были введены недавно в рибосомные белки человека.
Цистеины в белках человека были обнаружены вместо аланина ( n = 8), треонина ( n = 4), серина ( n = 4), валина ( n = 4), изолейцина ( n = 1), глицин ( n = 1,) и глутамин ( n = 1) в дрожжах.Часто эти замены обнаруживались в хорошо консервативных областях рибосомных белков.
В заключение, рибосомные белки относительно бедны цистеином, но общая взаимосвязь между их содержанием цистеина у различных видов (рис. 3) аналогична общей тенденции, показанной на рис. 1. Из этих данных следует, что эволюционная тенденция способствует включению большего количества остатков цистеина в белки более сложных организмов.
Содержание GC по сравнению с содержанием AU кодирующих ДНК и их связь с наличием цистеинов
Простейшим объяснением низкого содержания цистеина в белках у представителей Archea могло бы быть то, что содержание GC в ДНК коррелирует с наличием цистеина в белках различных видов.Поскольку многие представители Archea имеют ДНК с высоким содержанием GC, наличие аминокислот, которые кодируются триплетами, богатыми UA, не является предпочтительным. Однако цистеин может кодироваться триплетами UGU и UGC соответственно. Можно обнаружить сильную предвзятость к использованию C, а не U в позиции третьего кодона для кодирования цистеина у представителей , Archea и других видов, богатых GC (данные не показаны). Поскольку две важные буквы кодона для цистеина — это U и G, содержание GC в первых двух положениях кодона было использовано для корректировки наших данных, как описано в «Материалы и методы».
Кроме того, мы изучили, следуют ли вхождения других аминокислот, кодируемых UA- или GC-богатыми триплетами, тенденциям, аналогичным таковому для цистеина у различных видов. Таблица 2 показывает, что ни фенилаланин (кодоны UUU и UUC), ни тирозин (UAU и UAC), ни изолейцин (AUU, AUC и AUA) не следуют тенденциям, аналогичным тенденциям цистеина среди изученных видов. То же самое верно и для других аминокислот (данные не показаны).
Неслучайное присутствие остатков цистеина в белках разных видов
Затем мы исследовали некоторые аспекты пространственного распределения цистеинов в белках различных видов.Чтобы ответить на вопрос, существуют ли какие-либо предпочтительные положения двух цистеинов относительно друг друга, мы провели системный поиск в репрезентативных файлах данных о белках различных видов. В качестве зонда применялась поисковая строка C- (X) n -C. Здесь X обозначает любую аминокислоту, тогда как n — целое число от 0 до 22. Поскольку файлы данных для разных видов были очень разного размера, числа, представляющие появление C- (X) n Последовательности -C в диапазоне n = 0–22 усреднялись и считались 1 для каждого вида.
На рис. 4 показано наличие последовательностей C- (X) n -C у различных видов в диапазоне n = 0–8. Мы обнаружили, что последовательность C- (X) 2 -C чаще встречается у всех исследованных видов, кроме растений. Таким образом, человеческие последовательности (другие млекопитающие демонстрируют аналогичные паттерны) содержат более чем в 1,5 раза больше мотивов C- (X) 2 -C, чем мотивов C-X-C или C- (X) 3 -C. По сути, такая же картина наблюдалась у D.melanogaster и C. elegans. Примерно каждый пятый белок содержал одну или несколько последовательностей C- (X) 2 -C у этих видов (555 из 2681 белка человека и 131 из 624 белков плодовой мухи). Интересно, что белки растений не содержали выдающегося количества последовательностей C- (X) 2 -C, как показано на примере кукурузы. Чтобы выяснить, все ли растения похожи на кукурузу, мы также изучили белки пшеницы, риса и томатов. Мы нашли аналогичные результаты (данные не показаны), подтверждающие, что растительные белки не имеют высоких представлений последовательностей C- (X) 2 -C.Однако белки хлоропластов различных растений демонстрируют образцы C- (X) 2 -C, подобные таковым у бактерий (данные не показаны).
Свободноживущий организм S. cerevisiae, , который имеет более низкое содержание цистеина по сравнению с людьми (рис. 1), имеет более 5% общего содержания цистеина, организованного в мотивы C- (X) 2 -C .
Относительное количество мотивов C- (X) 2 -C было дополнительно увеличено у E. coli и других эубактерий, но наиболее заметное увеличение было у представителей Archea. Из 1063 цистеинов, обнаруженных в 553 известных белках, 232 остатка цистеина были обнаружены в мотивах C- (X) 2 -C. Таким образом, более 21% цистеинов расположены по этой конкретной схеме.
Чтобы выяснить, расположена ли какая-либо другая аминокислота по схеме, подобной структуре цистеина, мы исследовали другие 19 аминокислот в файлах данных S. cerevisiae и E. coli . Наши результаты показали, что ни одна другая аминокислота не показала распределение, подобное цистеину, в белках S.cerevisiae или E. coli (данные не показаны).
Затем мы проанализировали различные мотивы C- (X) 2 -C у людей, дрожжей, E. coli, и представителей Archea. Как и ожидалось, некоторые мотивы C- (X) 2 -C были более многочисленными, чем другие. У людей вместо X имеется много остатков глутаминовой кислоты (и других заряженных аминокислот). Белки цинковых пальцев, металлотионены и дегидрогеназы могут содержать несколько из этих мотивов. Однако 555 из 2681 исследованных белков человека содержат по крайней мере один мотив C- (X) 2 -C, и подробное описание и обсуждение их возможной взаимосвязи и сходства с их братьями и сестрами выходит за рамки настоящего отчета.Здесь достаточно заявить, что любая возможная комбинация аминокислот была найдена хотя бы один раз. Кроме того, наиболее распространенные мотивы C- (X) 2 -C в файлах данных людей, дрожжей, E. coli, и Archea отличаются, хотя некоторые характерные композиционные особенности определенно присутствуют. Одним из таких случаев является отмеченное предпочтительное наличие полярных заряженных аминокислот у млекопитающих. Дрожжи, E. coli, и Archea , по-видимому, также содержат ряд остатков C-P-X-C или C-X-P-C.
Обсуждение
Цистеин — единственная кодируемая аминокислота, которая несет реактивную сульфгидрильную группу. Образуя внутри- и межцепочечные дисульфидные связи, он играет особую роль в структуре белка (Noiva 1994; Raina and Missiakas 1997). По-видимому, не менее важно, чтобы большинство цистеинов цитозольных белков поддерживалось в восстановленной тиоловой форме (Derman et al. 1993).
В настоящей работе мы изучали наличие цистеина у разных видов.Мы обнаружили, что представление цистеина в различных организмах имеет одну общую черту: цистеин недостаточно представлен в белках всех исследованных видов (рис. 1). Однако содержание цистеина в белках различных видов может составлять всего 0,4–0,5% у Archea, , тогда как белки млекопитающих обычно содержат около 2,26% остатков цистеина.
Более высокое содержание цистеина в белках более сложных организмов может частично объясняться большим количеством нецитозольных белков, богатых дисульфидными связями.Естественно, относительное отсутствие дисульфидных связей указывает, но не доказывает, что цитозольные белки относительно бедны цистеином. Тем не менее, наши результаты показывают, что рибосомные белки бедны цистеином по сравнению со средним содержанием цистеина в белках, обнаруженных у идентичных видов (рис. 3).
Однако увеличение содержания цистеина в белках сложных видов организмов справедливо и для рибосомных белков. Мы продемонстрировали, что родственные рибосомные белки имеют тенденцию включать больше цистеинов у более развитых видов (рис.3 и таблица 1). Например, несмотря на большое сходство между рибосомными белками человека и дрожжей, первый содержит почти в три раза больше остатков цистеина. Следовательно, нельзя не отметить взаимосвязь между повышенной сложностью и повышенным представлением цистеина (рис. 1).
Важно отметить, что эта тенденция уникальна для цистеина, поскольку другие аминокислоты не следуют той же тенденции. Мы объясняем описанные выше явления, предполагая, что эволюция использует преимущества более широкого использования цистеина.Уникальная способность цистеина формировать структуру белка, вероятно, чаще используется в развитых организмах.
Повышенное использование цистеина в развитых организмах может быть исследовано в свете теорий о распределении кодонов. Короче говоря, возможно, что даже примитивные древние организмы использовали кодовую таблицу, очень похожую на ту, что используется в современных организмах. В качестве альтернативы, древняя кодовая таблица могла кодировать менее 20 аминокислот, а нынешнее распределение кода может быть результатом прогрессивного деления кода (Wong 1975, 1976, 1988).Во время этого гипотетического процесса кодоны, назначенные данной аминокислоте, были общими с другими аминокислотами. Аргументы за и против этих теорий выходят за рамки настоящего отчета. С одной стороны, проблема с «теорией совместного использования кода» состоит в том, что новое распределение кодона — даже если замещающая аминокислота является физико-химически родственным братом — вызовет широко распространенные структурные и функциональные изменения.
С другой стороны, тот факт, что некоторые организмы содержат «аномальное» распределение кода, поддерживает гипотезы об эволюции кода и совместном использовании кода (Osawa et al.1990, 1992; Джукс и Осава 1993). Также Doring и Marliere (1998) показали, что мутантные тРНК, которые включают цистеин в положениях, соответствующих изолейцину или метионину, могут сохраняться в E. coli. Токсичность неправильного кодирования цистеина была низкой, что доказывает, что цистеин является приемлемой заменой в большинстве положений белка.
Наши результаты показывают, что введение цистеина происходило постепенно в процессе эволюции (рис. 1), а прогрессирующие мутации привели к сдвигу в сторону увеличения использования цистеина.Следовательно, наше наблюдение не обеспечивает прямой поддержки совместного использования кодонов, но указывает на возможность того, что цистеин мог появиться «поздно» по сравнению с другими аминокислотами.
Мы также обнаружили своеобразную неслучайность в расположении цистеинов; а именно, два цистеина, разделенные двумя другими аминокислотами, встречаются с исключительно высокой частотой. Домен C- (X) 2 -C чрезмерно представлен в белках ряда видов. Это чрезмерное представительство становится все более и более выраженным среди примитивных организмов, в результате чего более 21% общего количества цистеинов находится в пределах мотивов C- (X) 2 -C у членов порядка Archea .
Наше объяснение этого явления состоит в том, что первый и четвертый аминокислотные остатки в альфа-спирали или в конформациях бета-витка наиболее близки друг к другу, соответственно. Обнаружено, что аминокислоты, которые наиболее распространены в β-поворотах, относятся к четко определенной части генетического кода. Поскольку эта группа аминокислот содержит биосинтетические предшественники других аминокислот, возможно, что эти аминокислоты и β-повороты были более многочисленны на ранней стадии эволюции (Jurka and Smith 1987).
C- (X) 2 -C мотивы являются важными доменами металлсвязывающих белков и оксидоредуктаз (Shuber et al. 1986; Ammendola et al. 1992). Каммак, Холл и Рао (1971) предположили, что ферредоксины играли важную роль в ранней эволюции.
Очень высокая распространенность мотивов C- (X) 2 -C в примитивных организмах, вероятно, связана с относительной важностью короткодействующих взаимодействий внутриполипептидных цепей, в отличие от дальнодействующих взаимодействий внутриполипептидных цепей и интерполипептидных цепей. взаимодействия.В то время как первое было более важным для древних организмов, последние два типа взаимодействий становятся все более важными в дальнейшем в эволюции. Это может объяснить наблюдение, что увеличение содержания цистеина привело к относительному снижению количества цистеинов, присутствующих в мотивах C- (X) 2 -C.
Несмотря на относительное уменьшение количества цистеинов в мотивах C- (X) 2 -C, мы обнаружили 555 таких мотивов в 2681 изученном человеческом белке. Факторы транскрипции, подобные цинковому пальцу или цинковому пальцу, используются в ряде белков, которые возникли в многоклеточных организмах.К ним относятся различные рецепторы гормонов. Следовательно, эволюция привела ко многим новым применениям белков с доменами C- (X) 2 -C, но еще больше белков приобрели цистеины в различных других положениях.
Таблица 1 Цистеин в белках рибосом разных видов
Таблица 1 Цистеин в белках рибосом разных видов
Таблица 2 Встречаемость аминокислотных остатков Phe, Tyr, Ile и Cys в белках различных видов (%)
Таблица 2 Встречаемость аминокислотных остатков Phe, Tyr, Ile и Cys в белках различных видов (%) )
Рис.1. — Наличие цистеина в белках различных видов. Содержание цистеина выражается в процентах (ось Y). Сумма всех 20 кодированных аминокислот считалась 100%. Все данные были скорректированы на содержание ГХ по сравнению с содержанием АТ видов, как описано в «Материалы и методы». Поскольку цистеин имеет 2 кодона из 61 смыслового кодона, математическая вероятность появления цистеина составляет 3,28% (последний столбец). Диапазон скорректированных данных GC составляет 3,23–3,28% для различных видов
Рис.1. — Наличие цистеина в белках различных видов. Содержание цистеина выражается в процентах (ось Y). Сумма всех 20 кодированных аминокислот считалась 100%. Все данные были скорректированы на содержание ГХ по сравнению с содержанием АТ видов, как описано в «Материалы и методы». Поскольку цистеин имеет 2 кодона из 61 смыслового кодона, математическая вероятность появления цистеина составляет 3,28% (последний столбец). Диапазон скорректированных данных ГХ составляет 3,23–3,28% для различных видов
Рис.2. — Белки с по крайней мере одним остатком цистеина и без него у различных видов. Черная часть сложенного столбца представляет белки с цистеином, а белая часть представляет белки без единого остатка цистеина. Сумма всех проанализированных белков принималась за 100% (ось Y).
Рис. 2. — Белки с минимум одним остатком цистеина и без него у различных видов. Черная часть сложенного столбца представляет белки с цистеином, а белая часть представляет белки без единого остатка цистеина.Сумма всех проанализированных белков считалась 100% (ось Y)
.Рис. 3. — Содержание цистеина в рибосомных белках (черные столбцы) различных видов. Также показано общее содержание цистеина в белках (пустые столбцы) различных видов. Содержание цистеина выражается в процентах от 20 кодированных аминокислот (ось Y). Данные скорректированы по ГХ.
Рис. 3. — Содержание цистеина в рибосомных белках (черные столбцы) различных видов. Также показано общее содержание цистеина в белках (пустые столбцы) различных видов.Содержание цистеина выражается в процентах от 20 кодированных аминокислот (ось Y). Данные скорректированы по GC
Рис. 4. — Относительное положение цистеинов (закрашенные квадраты) и глицинов (пустые квадраты) на участке аминокислот ≤8 ( n ≤ 8). Встречаемость остатков цистеина и глицина была проанализирована для n = 0–22, и средняя встречаемость была принята за 1. Общие значения встречаемости составили 24,484 для людей, 7,475 для Drosophila, 877 для кукурузы, 9,602 для S.cerevisae, 4515 для E. coli, и 545 для H. maresmortui. Фактическое вхождение отображается на оси Y; n отображается по оси X. Данные скорректированы с помощью ГХ.
Рис. 4. Относительные положения цистеинов (закрашенные квадраты) и глицинов (пустые квадраты) на участке аминокислот ≤8 ( n ≤ 8). Встречаемость остатков цистеина и глицина анализировалась для n = 0–22, и средняя встречаемость принималась за 1.Общие значения встречаемости составили 24 484 для человека, 7 475 для Drosophila, 90 263 877 для кукурузы, 9 602 для S. cerevisae, 4515 для E. coli, и 545 для H. maresmortui. Фактическое вхождение отображается на оси Y; n отображается по оси X. Данные скорректированы по GC
Мы благодарим докторов наук. Дэвида М. Бедвелла, Миклоша Келлермайера, Иштвана Саймона и Дениса Н. Уитли за критическое прочтение рукописи. Мы благодарим Андраша Раба за техническую помощь.Работа поддержана грантом Министерства здравоохранения Венгрии (T-04 035/99).
цитированная литература
Аммендола С., К. А. Райя, К. Карузо, Л. Камарделла, С. Д’Аурия, М. Де Роса и М. Росси.
1992
. Термостабильная НАД (+) — зависимая алкогольдегидрогеназа из Sulfolobus solfataricus: определение последовательности генов и белков и связь с другими алкогольдегидрогеназами. Биохимия 31 : 12514–12523.Baumann, U., и Дж. Оро.
1993
. Три этапа эволюции генетического кода. Биосистемы 29 : 133–141.Каммак Р., Д. Холл и К. Рао.
1971
. Ферредоксины: это живые окаменелости? New Sci. 23 : 696–698.Дерман, А. И., В. А. Принц, Д. Белин и Дж. Беквит.
1993
. Мутации, которые позволяют образовывать дисульфидные связи в цитоплазме Escherichia coli. Наука 262 : 1744–1747.Доринг В. и П.Марлиер.
1998
. Термостабильная НАД (+) — зависимая алкогольдегидрогеназа из Sulfolobus solfataricus : определение последовательности гена и белка и связь с другими алкогольдегидрогеназами. Генетика 150 : 543–551.Фэн Д. Ф., М. С. Джонсон и Р. Ф. Дулиттл.
1984
. Прогрессивное выравнивание аминокислотных последовательностей и построение из них филогенетических деревьев.J. Mol. Evol.
21
:112
–125.Джукс, Т. Х. и С. Осава.
1993
. Эволюционные изменения генетического кода.Комп. Biochem. Physiol. B Комп. Biochem.
106
:489
–494.Юнгк, Дж. Р.
1978
. Генетический код как периодическая таблица.J. Mol. Evol.
2
:211
–224.Юрка Дж. И Т. Ф. Смит.
1987
. β превращается в раннюю эволюцию: хиральность, генетический код и биосинтетические пути. Симпозиумы Колд-Спринг-Харбор по количественной биологии.Vol. LII. Симпозиум Колд-Спринг-Харбор по количественной биологии, Колд-Спринг-Харбор, Нью-Йорк.Лоферер, Х. и Х. Хеннеке.
1994
. Белковые дисульфид оксидоредуктазы у бактерий.Trends Biochem. Sci.
19
:169
–171.Мисета, А.
1989
. Роль молекул-предшественников аминокислот, связанных с белками, в организации генетических кодонов.Physiol. Chem. Phys.
21
:237
–242.Майерс, Э.W. и W. Miller.
1988
. Оптимальные выравнивания в линейном пространстве.Comput. Прил. Biosci.
4
:11
–17.Нойва, р.
1994
. Ферментативный катализ образования дисульфидов.Protein Expr. Purif.
5
:1
–13.Осава, С., Т. Х. Джукс, К. Ватанабэ и А. Муто.
1992
. Недавние доказательства эволюции генетического кода.Microbiol. Ред.
56
:229
–264.Осава С., А. Муто, Т. Х. Джукс и Т. Охама.
1990
. Эволюционные изменения генетического кода.Proc. R. Soc. Лондон. B Biol. Sci.
241
:19
–28.Райна, С., и Д. Миссиакас.
1997
. Образование и разрыв дисульфидных связей.Annu. Rev. Microbiol.
51
:179
–202.Шубер А. П., Э. К. Орр, М. А. Рекни, П. Ф. Шендель, Х. Д. Мэй, Н. Л. Шауэр и Дж. Г. Ферри.
1986
.Клонирование, экспрессия и нуклеотидная последовательность генов формиатдегидрогеназы из methanobacterium formicicum.J. Biol. Chem.
261
:12942
–12947.Стюарт, Э. Дж., Ф. Ослунд и Дж. Беквит.
1998
. Образование дисульфидной связи в цитоплазме Escherichia coli: изменение роли тиоредоксинов in vivo.EMBO J.
17
:5543
–5550.Вебер, А. Л., и Дж. К. Лейси.
1978
. Корреляции генетического кода: аминокислоты и их антикодоновые нуклеотиды.J. Mol. Evol.
2
:199
–210.Вёзе, К. Р. и Р. Гупта.
1981
. Архебактерии просто производные от «прокариот»? Природа 289 : 95–96.Вёзе, К. Р., О. Кандлер и М. Л. Уилис.
1990
. К естественной системе организмов: предложение о доменах Archaea, Bacteria и Eucarya. Proc. Natl. Акад. Sci. США 87 : 4576–4579.Вонг, Дж. Т. Ф.
1975
. Коэволюционная теория генетического кода.Proc. Natl. Акад. Sci. США 72 : 1909–1912.———.
1976
. Эволюция универсального генетического кода. Proc. Natl. Акад. Sci. США 73 : 2336–2340.———.
1988
. Эволюция генетического кода.Microbiol. Sci.
5
:174
–181.Чжун Л., Э. С. Арн-Эр, Дж. Люнг, Ф. Ослунд и А. Холмгрен.
1998
. Тиоредоксинредуктаза крысы и теленка гомологична глутатионредуктазе с удлинением на карбоксильном конце, содержащим консервативный каталитически активный предпоследний остаток селеноцистеина.J. Biol. Chem.
273
:8581
–8591.14.4: Белки — Chemistry LibreTexts
Навыки для развития
- Опишите четыре уровня структуры белка.
- Определите типы привлекательных взаимодействий, которые удерживают белки в их наиболее стабильной трехмерной структуре.
- Объясните, что происходит, когда белки денатурируются.
- Определите, как белок может быть денатурирован.
Каждый из тысяч встречающихся в природе белков имеет свой собственный характерный аминокислотный состав и последовательность, что приводит к уникальной трехмерной форме. С 1950-х годов ученые определили аминокислотные последовательности и трехмерную конформацию множества белков и, таким образом, получили важные сведения о том, как каждый белок выполняет свою конкретную функцию в организме.
Белки представляют собой соединения с высокой молярной массой, состоящие в основном или полностью из цепочек аминокислот.Из-за их большой сложности белковые молекулы не могут быть классифицированы на основе определенного структурного сходства, поскольку подразделяются углеводы и липиды. Две основные структурные классификации белков основаны на гораздо более общих качествах: является ли белок (1) волокнистым и нерастворимым или (2) глобулярным и растворимым. Некоторые белки, из которых состоят волосы, кожа, мышцы и соединительная ткань, похожи на волокна. Эти волокнистые белки нерастворимы в воде и обычно выполняют структурные, соединительные и защитные функции.Примерами волокнистых белков являются кератины, коллагены, миозины и эластины. Волосы и внешний слой кожи состоят из кератина. Соединительные ткани содержат коллаген. Миозины — это мышечные белки, способные сокращаться и расширяться. Эластины находятся в связках и эластичной ткани стенок артерий.
Глобулярные белки, другой основной класс, растворимы в водной среде. В этих белках цепи сложены так, что молекула в целом имеет примерно сферическую форму. Знакомые примеры включают яичный альбумин из яичных белков и сывороточный альбумин в крови.Сывороточный альбумин играет важную роль в транспортировке жирных кислот и поддержании надлежащего баланса осмотического давления в организме. Гемоглобин и миоглобин, которые важны для связывания кислорода, также являются глобулярными белками.
Уровни структуры белка
Структура белков обычно описывается как имеющая четыре организационных уровня. Первая из них — это первичная структура, которая представляет собой количество и последовательность аминокислот в полипептидной цепи или цепях белка, начиная со свободной аминогруппы и поддерживаемых пептидными связями, соединяющими каждую аминокислоту со следующей.Первичная структура инсулина, состоящая из 51 аминокислоты, показана на рисунке \ (\ PageIndex {1} \).
Рисунок \ (\ PageIndex {1} \): Первичная структура человеческого инсулина. Человеческий инсулин, аминокислотная последовательность которого показана здесь, является гормоном, который необходим для правильного метаболизма глюкозы.
Белковая молекула — это не случайный клубок полипептидных цепей. Вместо этого цепи расположены в уникальных, но специфических формах. Термин вторичная структура относится к фиксированному расположению основной цепи полипептида.На основе рентгеновских исследований Линус Полинг и Роберт Кори предположили, что определенные белки или их части скручиваются в спираль или спираль. Эта спираль стабилизирована внутрицепочечной водородной связью между карбонильным атомом кислорода одной аминокислоты и амидным атомом водорода на четыре аминокислоты вверх по цепи (расположенным на следующем витке спирали) и известна как правосторонняя α- спираль. Данные рентгеновского излучения показывают, что эта спираль делает один оборот на каждые 3,6 аминокислоты, а боковые цепи этих аминокислот выступают наружу из спиральной основной цепи (рис. \ (\ PageIndex {2} \)).Α-кератины, содержащиеся в волосах и шерсти, имеют исключительно α-спиральную форму. Некоторые белки, такие как гамма-глобулин, химотрипсин и цитохром с, имеют небольшую спиральную структуру или не имеют ее. Другие, такие как гемоглобин и миоглобин, имеют спиралевидную форму в одних областях, но не в других.
Рисунок \ (\ PageIndex {2} \) Шарообразная модель α-спирали. Эта шарообразная модель показывает внутрицепочечную водородную связь между карбонильными атомами кислорода и амидными атомами водорода.Каждый виток спирали охватывает 3,6 аминокислот. Обратите внимание, что боковые цепи (представленные зелеными сферами) указывают на спираль.
Другой распространенный тип вторичной структуры, называемый конформацией β-складчатый лист , представляет собой пластинчатую структуру, в которой две или более протяженных полипептидных цепей (или отдельные области на одной цепи) выровнены бок о бок. Выровненные сегменты могут быть параллельны или антипараллельны, то есть N-концы могут быть обращены в одном направлении на соседних цепочках или в разных направлениях — и соединены водородной связью между цепями (Рисунок \ (\ PageIndex {3} \ )).Β-складчатый лист особенно важен для структурных белков, таких как фиброин шелка. Это также наблюдается в частях многих ферментов, таких как карбоксипептидаза А и лизоцим.
Рисунок \ (\ PageIndex {3} \): Шарообразная модель структуры β-складчатого листа в белках. Боковые цепи проходят над или под листом и чередуются вдоль цепи. Белковые цепи удерживаются вместе за счет межцепочечных водородных связей.
Третичная структура относится к уникальной трехмерной форме белка в целом, которая возникает в результате складывания и изгиба основной цепи белка.Третичная структура тесно связана с правильным биохимическим функционированием белка. На рисунке \ (\ PageIndex {4} \) показано изображение трехмерной структуры инсулина.
Рисунок \ (\ PageIndex {4} \) : Ленточная модель трехмерной структуры инсулина. Спиральные области представляют участки полипептидной цепи, которые имеют α-спиральную структуру, а широкие стрелки представляют собой β-складчатые листовые структуры.
Четыре основных типа взаимодействий притяжения определяют форму и стабильность третичной структуры белков.Вы уже изучили несколько из них ранее.
- Ионная связь. Ионные связи возникают в результате электростатического притяжения между положительно и отрицательно заряженными боковыми цепями аминокислот. Например, взаимное притяжение между ионом карбоксилата аспарагиновой кислоты и ионом лизин-аммония помогает поддерживать конкретную складчатую область белка (часть (а) рисунка \ (\ PageIndex {5} \)).
- Водородная связь. Водородная связь образуется между сильно электроотрицательным атомом кислорода или атомом азота и атомом водорода, присоединенным к другому атому кислорода или атому азота, например, присутствующим в боковых цепях полярных аминокислот.Водородные связи (а также ионное притяжение) чрезвычайно важны как для внутри-, так и для межмолекулярных взаимодействий белков (часть (b) рисунка \ (\ PageIndex {5} \)). КОРРЕКТИРУЮЩЕЕ ПРИМЕЧАНИЕ: В верхней части рисунка пунктирная линия, представляющая взаимодействие, связывающее водородные связи, должна идти от водорода воды к кислороду в -CH 2 O H (не к углероду).
- Дисульфидные связи. Две аминокислотные единицы цистеина могут сближаться, когда молекула белка складывается.Последующее окисление и связывание атомов серы в высокореакционных сульфгидрильных (SH) группах приводит к образованию цистина (часть (c) рисунка \ (\ PageIndex {5} \)). Внутрицепочечные дисульфидные связи обнаруживаются во многих белках, включая инсулин (желтые полосы на рисунке \ (\ PageIndex {1} \)), и оказывают сильное стабилизирующее действие на третичную структуру.
- Рассеивающие силы. Дисперсионные силы возникают, когда обычно неполярный атом становится на мгновение полярным из-за неравномерного распределения электронов, что приводит к мгновенному диполю, который вызывает сдвиг электронов в соседнем неполярном атоме.Силы дисперсии слабые, но могут быть важны, когда другие типы взаимодействий отсутствуют или минимальны (заштрихованные части, отмеченные (d) на рисунке \ (\ PageIndex {5} \)). Так обстоит дело с фиброином, основным белком шелка, в котором большая часть аминокислот в белке имеет неполярные боковые цепи. Термин «гидрофобное взаимодействие» часто неправильно используется как синоним дисперсионных сил. Гидрофобные взаимодействия возникают из-за того, что молекулы воды участвуют в водородных связях с другими молекулами воды (или группами в белках, способными образовывать водородные связи).Поскольку неполярные группы не могут участвовать в водородных связях, белок сворачивается таким образом, что эти группы погружаются во внутреннюю часть структуры белка, сводя к минимуму их контакт с водой.
Рисунок \ (\ PageIndex {5} \): Взаимодействие третичной структуры белка. Четыре взаимодействия стабилизируют третичную структуру белка: (а) ионная связь, (б) водородная связь, (в) дисульфидные связи и (г) дисперсионные силы.
Если белок содержит более одной полипептидной цепи, каждая цепь называется субъединицей .Расположение нескольких субъединиц представляет четвертый уровень структуры, четвертичную структуру белка. Гемоглобин с четырьмя полипептидными цепями или субъединицами является наиболее часто цитируемым примером белка, имеющего четвертичную структуру (Рисунок \ (\ PageIndex {6} \)). Четвертичная структура белка продуцируется и стабилизируется теми же видами взаимодействий, которые производят и поддерживают третичную структуру. Схематическое изображение четырех уровней структуры белка показано на рисунке \ (\ PageIndex {7} \).
Рисунок \ (\ PageIndex {6} \) Четвертичная структура гемоглобина. Гемоглобин — это белок, который переносит кислород по всему телу.
Источник: Изображение из RCSB PDB (www.pdb.org) PDB ID 1I3D (RD Kidd, HM Baker, AJ Mathews, T. Brittain, EN Baker (2001) Олигомеризация и связывание лиганда в гомотетрамерном гемоглобине: два высоких разрешение кристаллических структур гемоглобина Барта (гамма (4)), маркера альфа-талассемии.Protein Sci. 1739–1749).
Рисунок \ (\ PageIndex {7} \): Уровни структуры в белках
Первичная структура состоит из определенной аминокислотной последовательности. Образовавшаяся пептидная цепь может скручиваться в α-спираль, которая является одним из типов вторичной структуры . Этот спиральный сегмент включен в третичную структуру свернутой полипептидной цепи. Единая полипептидная цепь представляет собой субъединицу, которая составляет четвертичную структуру белка, такого как гемоглобин, который имеет четыре полипептидных цепи.
Денатурация белков
Высокоорганизованные структуры белков — настоящие шедевры химической архитектуры. Но высокоорганизованные структуры, как правило, обладают определенной деликатностью, и это верно в отношении белков. Денатурация — это термин, используемый для любого изменения трехмерной структуры белка, которое делает его неспособным выполнять возложенную на него функцию. Денатурированный белок не может выполнять свою работу. (Иногда денатурация приравнивается к осаждению или коагуляции белка; наше определение немного шире.) Широкий спектр реагентов и условий, таких как тепло, органические соединения, изменения pH и ионы тяжелых металлов, могут вызвать денатурацию белка (Рисунок \ (\ PageIndex {1} \)).
| Метод | Влияние на структуру белка |
|---|---|
| Нагрев выше 50 ° C или ультрафиолетовое (УФ) излучение | Тепло или УФ-излучение снабжает молекулы белка кинетической энергией, заставляя их атомы вибрировать быстрее и разрушая относительно слабые водородные связи и силы дисперсии. |
| Использование органических соединений, таких как этиловый спирт | Эти соединения способны участвовать в межмолекулярных водородных связях с молекулами белка, нарушая внутримолекулярные водородные связи внутри белка. |
| Соли ионов тяжелых металлов, таких как ртуть, серебро и свинец | Эти ионы образуют прочные связи с карбоксилат-анионами кислых аминокислот или SH-группами цистеина, разрывая ионные связи и дисульфидные связи. |
| Алкалоидные реагенты, такие как дубильная кислота (используется при дублении кожи) | Эти реагенты сочетаются с положительно заряженными аминогруппами в белках, разрушая ионные связи. |
У любого, кто жарил яйцо, наблюдается денатурация. Прозрачный яичный белок становится непрозрачным, поскольку альбумин денатурирует и коагулирует. Никто еще не обратил вспять этот процесс. Однако при соответствующих обстоятельствах и достаточном времени белок, который развернулся в достаточно мягких условиях, может повторно свернуться и снова проявить биологическую активность (Рисунок \ (\ PageIndex {8} \)).Такие данные свидетельствуют о том, что, по крайней мере, для этих белков первичная структура определяет вторичную и третичную структуру. Кажется, что данная последовательность аминокислот естественным образом принимает свое трехмерное расположение при подходящих условиях.
Рисунок \ (\ PageIndex {8} \) : Денатурация и ренатурация белка. Изображены денатурация (разворачивание) и ренатурация (рефолдинг) белка. Красные прямоугольники представляют собой стабилизирующие взаимодействия, такие как дисульфидные связи, водородные связи и / или ионные связи.
Первичная структура белков довольно прочная. Как правило, для гидролиза пептидных связей необходимы довольно жесткие условия. Однако на вторичном и четвертичном уровнях белки весьма уязвимы для атак, хотя их уязвимость к денатурации различается. Изящно свернутые глобулярные белки денатурировать намного легче, чем жесткие волокнистые белки волос и кожи.
Сводка
Белки можно разделить на две категории: волокнистые, которые обычно нерастворимы в воде, и глобулярные, которые лучше растворяются в воде.Белок может иметь до четырех уровней структуры. Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы.Четыре основных типа взаимодействий притяжения определяют форму и стабильность свернутого белка: ионная связь, водородная связь, дисульфидные связи и дисперсионные силы. Широкий спектр реагентов и условий может вызвать разворачивание или денатурирование белка.
Упражнения по обзору концепции
Какая преобладающая сила притяжения стабилизирует образование вторичной структуры в белках?
Различают третичный и четвертичный уровни белковой структуры.
Кратко опишите четыре способа денатурирования белка.
Ответы
Третичная структура относится к уникальной трехмерной форме одной полипептидной цепи, в то время как четвертичная структура описывает взаимодействие между несколькими полипептидными цепями для белков, которые имеют более одной полипептидной цепи.
(1) нагревать белок выше 50 ° C или подвергать его воздействию УФ-излучения; (2) добавить к раствору белка органические растворители, такие как этиловый спирт; (3) добавить соли ионов тяжелых металлов, таких как ртуть, серебро или свинец; и (4) добавить алкалоидные реагенты, такие как дубильная кислота
Упражнения
Классифицируйте каждый белок как волокнистый или глобулярный.
- гемоглобин
- кератин
- фиброин
Белок имеет третичную структуру, образованную взаимодействиями между боковыми цепями следующих пар аминокислот. Для каждой пары определите наиболее сильный тип взаимодействия между этими аминокислотами.
- аспарагиновая кислота и лизин
- фенилаланин и аланин
- серин и лизин
- два цистеина
Какой уровень (уровни) структуры белка обычно нарушается при денатурации? Какого уровня (уровней) нет?
4.Какой класс белков денатурируется легче — волокнистый или глобулярный?
5. Известно, что определенный глобулярный белок функционирует в водной среде цитозоля клеток. (а) Вероятна ли боковая цепь лейцина внутри или снаружи свернутого белка? (б) Если один лейцин заменить треонином, белок будет менее эффективным, но все же функциональным. Какая аминокислота может заменить лейцин, которая может иметь незначительный эффект или не иметь никакого эффекта? Какая аминокислота может заменить лейцин, что, вероятно, будет иметь больший эффект, чем замена треонином?
ответов
- шаровидный
- волокнистый
- волокнистый
- ионная связь
- дисперсионные силы
- дисперсионные силы
- дисульфидная связь
3.Денатурация белка нарушает вторичный, третичный и четвертичный уровни структуры. Только первичная структура не подвержена денатурации.
4. Шаровидный
5. (a) Лейцин неполярен, поэтому он, вероятно, находится внутри глобулярного белка (а не за пределами очень полярных вод). (b) Замена другой неполярной аминокислотой, особенно такой же аминокислоты (например, изолейцина), вероятно, будет иметь наименьшее влияние. Если замена полярным треонином имеет отрицательный эффект, замена одной из заряженных аминокислот (asp, glu, his, lys, arg) может иметь большее влияние.
.


 К примеру, в небольшом куске свиной вырезки может находиться меньше жира в сравнении с куриной грудкой, которая считается диетической. Белка на 100 грамм продукта – порядка 20 грамм, а еще 70 грамм холина. Данное соединение ускоряет метаболизм, помогает лучше усваиваться таким витаминам как Е, К, А, Д, а также снизить показатель холестерина. В дополнении оно стабилизирует выработку инсулина. Так что, невзирая на запачканную репутацию, свинина благотворно сказывается на здоровье и даже помогает ускорить процесс похудения.
К примеру, в небольшом куске свиной вырезки может находиться меньше жира в сравнении с куриной грудкой, которая считается диетической. Белка на 100 грамм продукта – порядка 20 грамм, а еще 70 грамм холина. Данное соединение ускоряет метаболизм, помогает лучше усваиваться таким витаминам как Е, К, А, Д, а также снизить показатель холестерина. В дополнении оно стабилизирует выработку инсулина. Так что, невзирая на запачканную репутацию, свинина благотворно сказывается на здоровье и даже помогает ускорить процесс похудения.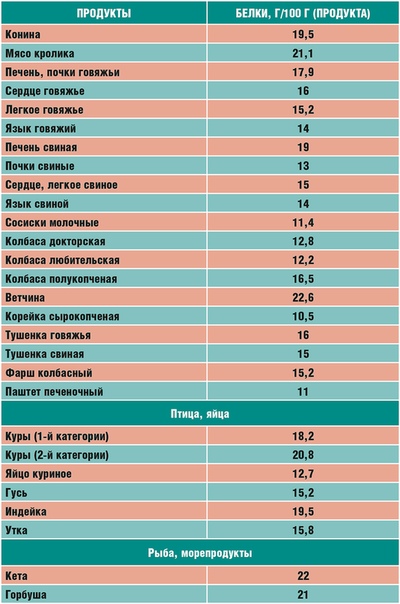
 Если же цель похудение, тогда стоит приобретать обезжиренный творог.
Если же цель похудение, тогда стоит приобретать обезжиренный творог. Если такая схема по каким-либо причинам неудобна, следует разделить суточное количество на примерно равные порции, которые распределяются на 5-6 приемов пищи;
Если такая схема по каким-либо причинам неудобна, следует разделить суточное количество на примерно равные порции, которые распределяются на 5-6 приемов пищи;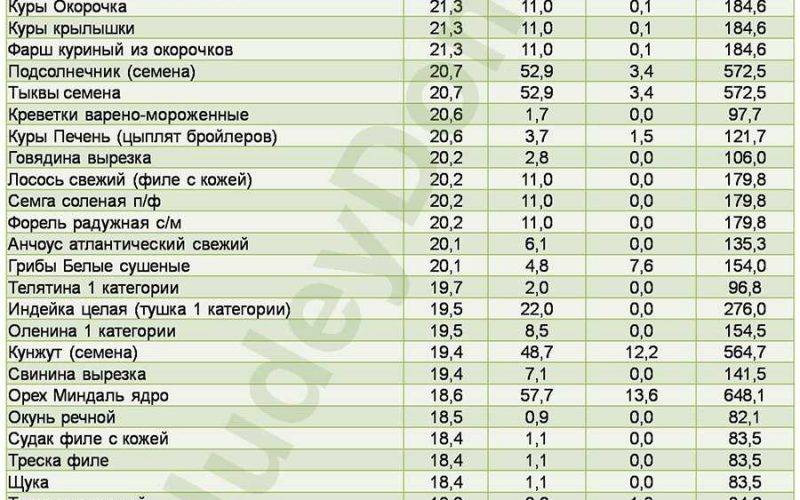
 Дыня, маракуйя, ваниль, клубника, шоколад – и это далеко не все!
Дыня, маракуйя, ваниль, клубника, шоколад – и это далеко не все!