Что такое гипертрофия мышц?
Очень часто задавая вопрос: «Что такое гипертрофия мышц?» я часто слышу в ответ что-то невразумительное. Многие думают, что это что-то связанное с заболеванием. Однако это не так.
Понятие гипертрофии мышц
Гипертрофия мышц — это увеличение их объема. Этот термин образован из греческих слов hyper – больше и trophe – питание, пища). Это именно то, что происходит с мышцами во время силовой тренировки или тренировки на выносливость. При силовой тренировке мышцы растут, увеличиваются в объеме. Вы хорошо знаете, как выглядят мышцы у спортсменов, занимающихся атлетическими видами спорта. Они большие, объемные или, другими словами – гипертрофированные.
Для тех, кто занимается фитнесом, пауэрлифтингом и другими видами атлетизма слово гипертрофия эквивалентно словосочетаниям: «накачка мышц», «рост мышц».
Если Вас интересует гипертрофия мышц, рекомендую обратить внимание на мою книгу «Гипертрофия скелетных мышц человека«
А вот если мышца уменьшилась в объеме — это называется атрофией мышцы. Атрофия мышцы возникает из-за целого ряда факторов, в том числе и связанных с определенными заболеваниями.
Атрофия мышцы возникает из-за целого ряда факторов, в том числе и связанных с определенными заболеваниями.
Доказано, что в пожилом и старческом возрасте скелетные мышцы людей также уменьшаются в объеме, падает их сила. Именно поэтому старики такие слабые. Для описания этого явления используется определенный термин – саркопения. То есть саркопения — это уменьшение объема мышц (атрофия мышц) у пожилых людей.
Виды гипертрофии мышц
Чаще всего гипертрофию скелетных мышц человека рассматривают как их долговременную адаптацию к физическим нагрузкам различной направленности.
Но бывает и кратковременная гипертрофия скелетных мышц – то есть изменение объема мышцы в результате одной силовой тренировки. Спортсмены, выступающие в соревнованиях по бодибилдингу или бодифитнесу хорошо знают, что объем мышц можно немного увеличить, если использовать специальный метод тренировки – пампинг.
Также различают миофибриллярную и саркоплазматическую гипертрофию. При миофибриллярной гипертрофии увеличение объема мышечных волокон происходит за счет увеличения объема и числа миофибрилл. При саркоплазматической гипертрофии увеличение объема мышечных волокон происходит за счет увеличения объема саркоплазмы.
Механизмы миофибриллярной гипертрофии мышц
В настоящее время рассматриваются три механизма миофибриллярной гипертрофии: повреждение мышц, метаболический стресс и механическое напряжение мышц (B. Schoenfeld, 2016). В учебном пособии «Гипертрофия скелетных мышц человека (А. В. Самсонова, 2018) подробно рассмотрен первый механизм, вызывающий гипертрофию скелетных мышц под воздействием силовой тренировки – а именно их повреждение. В учебном пособии «Гормоны и гипертрофия скелетных мышц человека» (А.В.Самсонова, 2019) рассматривается второй механизм, вызывающий гипертрофию скелетных мышц – а именно влияние гормонов на увеличение объёма и силы скелетных мышц.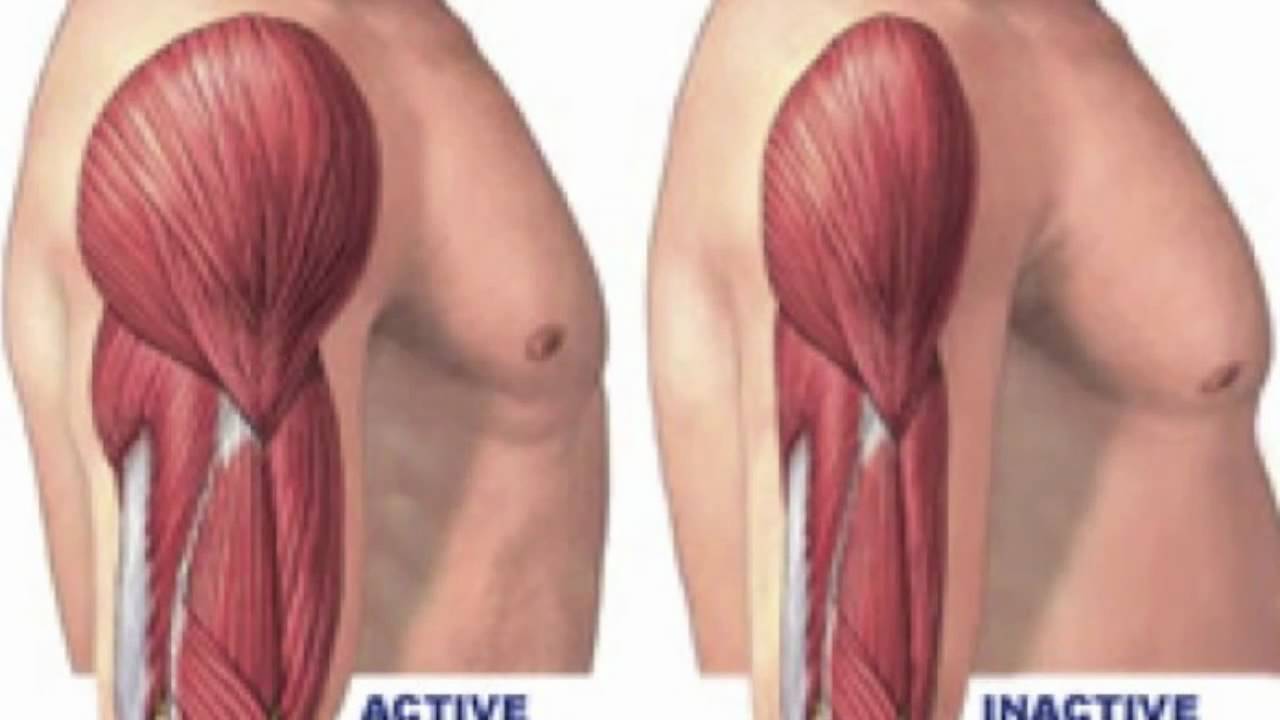
Литература
Самсонова, А.В. Гипертрофия скелетных мышц человека: Учеб. пособие. 5-е изд. /А.В. Самсонова.- СПб: Кинетика, 2018.-159 с.
Самсонова, А.В. Гормоны и гипертрофия скелетных мышц человека: Учеб. пособие. – СПб: Кинетика, 2019.– 204 c.: ил.
Если вы владеете английским языком, то рекомендую для прочтения вышедшую в 2016 году книгу Бреда Шоенфилда «Наука и гипертрофия мышц«.
С уважением, А.В. Самсонова
Рабочая гипертрофия мышц и атрофия от бездеятельности
Систематическая интенсивная работа мышцы способствует увеличению массы мышечной ткани.Это явление названо рабочей гипертрофией мышцы. В основе гипертрофии лежит увеличение массы цитоплазмы мышечных волокон и числа содержащихся в них миофибрилл, что приводит к увеличению диаметра каждого волокна. При этом в мышце происходит активация синтеза нуклеиновых кислот и белков и повышается содержание веществ, доставляющих энергию, используемую при мышечном сокращении,— аденозинтрифосфата и креатинфосфата, а также гликогена. В результате сила и скорость сокращения гипертрофированной мышцы возрастают.
В результате сила и скорость сокращения гипертрофированной мышцы возрастают.
Увеличению числа миофибрилл при гипертрофии способствует преимущественно статическая работа, требующая большого напряжения (силовая нагрузка). Даже кратковременных упражнений, проводимых ежедневно в условиях изометрического режима, достаточно для того, чтобы увеличилось количество миофибрилл. Динамическая мышечная работа, производимая без особых усилий, не вызывает гипертрофии мышцы.
У тренированных людей, у которых многие мышцы гипертрофированы, мускулатура может составлять до 50 % массы тела (вместо 35—40 % в норме).
Не нашли что искали?
Преподаватели спешат на помощь
Противоположным рабочей гипертрофии состоянием является атрофия мышц от бездеятельности. Она развивается во всех случаях, когда мышца почему-либо длительно не совершает нормальной работы. Это наблюдается, например, при обездвижении конечности в гипсовой повязке, долгом пребывании больного в постели, перерезке сухожилия, вследствие чего мышца перестает совершать работу, и т. п.
п.
При атрофии диаметр мышечных волокон и содержание в них сократительных белков, гликогена, АТФ и других важных для сократительной деятельности веществ уменьшаются. После возобновления нормальной работы мышцы атрофия постепенно исчезает.
Особый вид мышечной атрофии наблюдается при денервапии мышцы, т. е. после утраты ее связи с нервной системой, например при перерезке се двигательного нерва.
Похожие статьи
Медицина в статьях | Здоровье и красота
Перманентное воспаление желчного пузыря, иначе – холецистит, возникает по причине проникновения микробной флоры в резервуар для естественного накопления желчи или нарушения естественного оттока желчи. Холецистит также
read more »
Posted in Холецистит | Комментарии отключены
Одной из многочисленных важных функций Na/K-Hacoca является регуляция объема каждой клетки. Без функционирования этого насоса большинство клеток организма будут набухать, пока не лопнут. Механизм регуляции объема следующий: внутри клетки много белков
Без функционирования этого насоса большинство клеток организма будут набухать, пока не лопнут. Механизм регуляции объема следующий: внутри клетки много белков
Posted in Нервы и мышцы | Комментарии отключены
Влияние местных тканевых факторов и гормонов, вызывающее сокращение гладких мышц без потенциалов действия.
Вероятно, половина всех гладкомышечных сокращений инициируется стимулирующими факторами, действующими непосредственно на сократительный аппарат
read more »
Posted in Нервы и мышцы | Комментарии отключены
В покое нормальная концентрация ионов кальция (менее Ю моль/л) в цитозоле, омывающем мио-фибриллы, слишком мала для возникновения сокращения. В связи с этим тропонин-тропо-миозиновый комплекс продолжает тормозить актиновые нити, поддерживая расслабленное
read more »
Posted in Нервы и мышцы | Комментарии отключены
До сих пор мы обсуждали изменения натриевой и калиевой проницаемости мембраны при развитии потенциала действия, не объясняя, что стимулирует его возникновение. Перейдем к объяснению.
Перейдем к объяснению.
Порочный круг положительной обратной связи открывает натриевые каналы.
read more »
Posted in Нервы и мышцы | Комментарии отключены
Большинство скелетных мышц сокращаются и расслабляются быстро, но сокращения гладких мышц в основном являются длительными тоническими сокращениями, которые иногда продолжаются в течение нескольких часов или даже дней. Следовательно, можно ожидать, что
read more »
Posted in Нервы и мышцы | Комментарии отключены
read more »
Posted in Нервы и мышцы | Комментарии отключены
Изменение концентрации ионов кальция во внеклеточной жидкости практически не влияет на силу сокращения скелетных мышц, однако для большинства гладких мышц это не так. При снижении концентрации кальция во внеклеточной жидкости примерно до 1/3-1/10 нормы
При снижении концентрации кальция во внеклеточной жидкости примерно до 1/3-1/10 нормы
read more »
Posted in Нервы и мышцы | Комментарии отключены
Гипертрофия и атрофия мышц проблема гиподинамии. Гипертрофия мышц
Поскольку сила мышцы зависит от ее поперечника, увеличение его сопровождается ростом силы данной мышцы. Увеличение мышечного поперечника в результате физической тренировки называется рабочей гипертрофией мышцы (от греч. «тро-фос» — питание). Мышечные волокна, являющиеся высокоспециализированными дифференцированными клетками, по-видимому, не способны к клеточному делению с образованием новых волокон. Во всяком.случае, если деление мышечных клеток и имеет место, то только в особых случаях и в очень небольшом количестве. Рабочая гипертрофия мышцы происходит почти или исключительно за счет утолщения (увеличения объема) существующих мышечных волокон. Г1ри значительном утолщении мышечных волокон возможно их продольное механическое расщепление с образованием «дочерних» волокон с общим сухожилием. В процессе силовой тренировки число продольно расщепленных волокон увеличивается.
В процессе силовой тренировки число продольно расщепленных волокон увеличивается.Можно выделить два крайних типа рабочей гипертрофии мышечных волокон — саркоплазматический и миофибриллярный. Саркоплазматическая рабочая гипертрофия — это утолщение мышечных волокон за счет преимущественного увеличения объема саркоплазмы, т. е. несократительной их части. Гипертрофия этого типа происходит за счет повышения содержания несократительных (в частности, митохондриальных) белков и метаболических резервов мышечных волокон: гликогена, безазотистых веществ, креатинфосфата, миоглобина и др. Значительное увеличение числа капилляров в результате тренировки также может вызывать некоторое утолщение мышцы.
Наиболее предрасположены к саркоплазматической гипертрофии, по-видимому, медленные (I) и быстрые окислительные (II-А) волокна. Рабочая гипертрофия этого типа мало влияет на рост силы мышц, но зато значительно повышает способность к продолжительной работе, т. е. увеличивает их выносливость.
Миофибриллярная рабочая гипертрофия связана с увеличением числа и объема.миофибрилл, т. е собственно-сократительного аппарата мышечных волокон. При этом возрастает плотность укладки миофибрилл в мышечном волокне. Такая рабочая гипертрофия мышечных волокон ведет к значительному росту МС мышцы. Существенно увеличивается и абсолютная сила мышцы, а при рабочей гипертрофии первого типа она или совсем не изменяется, или даже несколько уменьшается. По-видимому, наиболее предрасположены к миофибриллярной гипертрофии быстрые (II-B) мышечные волокна.
В реальных ситуациях гипертрофия мышечных волокон представляет собой комбинацию двух названных типов с преобладанием одного из них. Преимущественное развитие того или иного типа рабочей гипертрофии определяется характером мышечной тренировки. Длительные динамические упражнения, развивающие выносливость, с относительно небольшой силовой нагрузкой на мышцы вызывают главным образом рабочую гипертрофию первого типа.. Упражнения с большими мышечными напряжениями (более 70%-от МПС тренируемых групп мышц), наоборот, способствуют развитию рабочей гипертрофии преимущественно второго типа.
В основе рабочей гипертрофии лежит интенсивный синтез и уменьшенный распад мышечных белков. Соответственно концентрация ДНК и РНК в гипертрофированной мышце больше, чем в нормальной. Креатин, содержание которого увеличивается в сокращающейся мышце, может стимулировать усиленный синтез актина и миозина и таким образом способствовать развитию рабочей гипертрофии мышечных волокон.
Очень важную роль в регуляции объема мышечной массы, в частности в развитии гипертрофии мышц, играют андрогены (мужские половые гормоны). У мужчин они вырабатываются половыми железами (семенниками) и в коре надпочечников, а у женщин — только в коре надпочечников. Соответственно у мужчин количество андрогенов в организме больше, чем у женщин. Роль андрогенов в увеличении мышечной массы проявляется в следующем.
Возрастное развитие мышечной массы идет параллельно с увеличением продукции андрогенных гормонов. Первое заметное утолщение мышечных волокон наблюдается в 6-7-летнем возрасте, когда усиливается образование андрогенов. С наступлением полового созревания (в 11 -15 лет). начинается интенсивный прирост мышечной массы у мальчиков, который продолжается и после периода полового созревания. У девочек развитие мышечной массы в основном заканчивается с периодом полового созревания. Соответствующий характер имеет и рост мышечной силы в школьном возрасте.
С наступлением полового созревания (в 11 -15 лет). начинается интенсивный прирост мышечной массы у мальчиков, который продолжается и после периода полового созревания. У девочек развитие мышечной массы в основном заканчивается с периодом полового созревания. Соответствующий характер имеет и рост мышечной силы в школьном возрасте.
Даже после коррекции показателей силы с размерами тела силовые показатели у взрослых женщин ниже, чем у мужчин (подробнее см. 1Х.2). Вместе с тем если у женщин в результате некоторых заболеваний, усиливается секреция андрогенов надпочечниками, то интенсивно увеличивается мышечная масса, появляется хорошо развитый мышечный рельеф, возрастает мышечная сила.
В опытах на животных установлено, что введение препаратов андрогенных гормонов (анаболиков) вызывает значительную интенсификацию синтеза мышечных белков, в результате чего увеличивается масса тренируемых мышц и как результат- их сила. Вместе с тем развитие рабочей гипертрофии скелетных мышц может происходить и без участия андрогенных и других гормонов (гормона роста, инсулина и тироидных гормонов).
Силовая тренировка, как и другие виды тренировки, по-видимому, не изменяет соотношения в мышцах двух основных типов мышечных волокон-быстрых и медленных. Вместе с тем она.способна изменять соотношение двух видов быстрых волокон, увеличивая процент быстрых гликолитических (Б.Г) и соответственно уменьшая процент быстрых окислительно-гликолитических (БОГ) волокон (табл. 7). При этом в результате силовой тренировки степень гипертрофии быстрых мышечных волокон значительно больше, чем5 медленных окислительных (МО) волокон, тогда как тренировка выносливости ведет к гипертрофии в первую очередь медленных волокон. Эти различия показывают, что степень рабочей гипертрофии мышечного волокна зависит, как от меры его использования в», процессе тренировок, так и от его способности к гипертрофии.
Силовая тренировка связана с относительно небольшим числом повторных максимальных или близких к ним мышечных сокращений, в которых участвуют как быстрые, так и медленные мышечные волокна. Однако и небольшого числа повторений достаточно для развития рабочей гипертрофии быстрых волокон, что указывает на их большую предрасположенность к развитию рабочей гипертрофии (по сравнению с медленными волокнами). Высокий процент быстрых волокон в мышцах служит важной предпосылкой для значительного роста мышечной силы при направленной силовой тренировке. Поэтому люди с высоким процентом быстрых волокон в мышцах имеют более высокие потенциальные возможности для развития силы и мощности.
Высокий процент быстрых волокон в мышцах служит важной предпосылкой для значительного роста мышечной силы при направленной силовой тренировке. Поэтому люди с высоким процентом быстрых волокон в мышцах имеют более высокие потенциальные возможности для развития силы и мощности.
Тренировка выносливости связана с большим числом повторных мышечных сокращений относительно небольшой силы, которые в основном обеспечиваются активностью медленных мышечных волокон. Поэтому понятна более выраженная рабочая гипертрофия медленных мышечных волокон при этом виде тренировки по сравнению с гипертрофией быстрых волокон, особенно быстрых гликолитических (см. табл. 7).
Таблица 7. Композиция четырехглавой мышцы бедра (наружной головки) и площадь поперечного сечения разных видов мышечных волокон у спортсменов разных специализаций и неспортсменов (Ф. Принс, и др., 1976)
studfiles.net
Гипертрофия и атрофия мышц
Систематическая интенсивная работа мышцы приводит к увеличению массы мышечной ткани. Это явление названо рабочей гипертрофией мышцы. В основе гипертрофии лежит увеличение массы протоплазмы мышечных волокон, приводящее к их утолщению. При этом повышается содержание белков и гликогена, а также веществ, доставляющих энергию, используемую при мышечном сокращении,- аденозинтрифосфата и креатинфосфата.
Это явление названо рабочей гипертрофией мышцы. В основе гипертрофии лежит увеличение массы протоплазмы мышечных волокон, приводящее к их утолщению. При этом повышается содержание белков и гликогена, а также веществ, доставляющих энергию, используемую при мышечном сокращении,- аденозинтрифосфата и креатинфосфата.
По-видимому, в связи с этим сила и скорость сокращения гипертрофированной мышцы выше, чем негипертрофированной.
Увеличение массы мышечной ткани у тренированных людей, у которых многие мышцы гипертрофированы, приводит к тому, что мускулатура тела может составлять 50% веса тела (вместо обычных 35-40%).
Гипертрофия развивается, если человек ежедневно на протяжении длительного времени производит мышечную работу, требующую большого напряжения (силовая нагрузка). Мышечная работа, производимая без особыхх усилий, даже если она продолжается очень долго, к гипертрофии мышцы не приводит.
Противоположным рабочей гипертрофии явлением служит атрофия мышцы от бездеятельности. Она развивается во всех случаях, когда мышца почему-либо утрачивает способность совершать свою нормальную работу. Это происходит, например, при длительном обездвиживании конечности в гипсовой повязке, при долгом пребывании больного в постели, при перерезке сухожилия, вследствие чего мышца перестает совершать работу против нагрузки, и т. д.
Она развивается во всех случаях, когда мышца почему-либо утрачивает способность совершать свою нормальную работу. Это происходит, например, при длительном обездвиживании конечности в гипсовой повязке, при долгом пребывании больного в постели, при перерезке сухожилия, вследствие чего мышца перестает совершать работу против нагрузки, и т. д.
При атрофии диаметр мышечных волокон и содержание в них сократительных белков, гликогена, АТФ и других важных для сократительной деятельности веществ резко падают.
При возобновлении нормальной работы мышцы атрофия постепенно исчезает.
Особый вид мышечной атрофии наблюдается при денервации мышцы, т. е. после перерезки ее двигательного нерва.
www.amedgrup.ru
Утомление мышцы
Утомлением называется временное понижение работоспособности клетки, органа или целого организма, наступающее в результате работы и исчезающее после отдыха.
Если длительно раздражать ритмическими электрическими стимулами изолированную мышцу, к которой подвешен небольшой груз, то амплитуда ее сокращений постепенно убывает до нуля. Регистрируемую при этом запись сокращений называют кривой утомления.
Регистрируемую при этом запись сокращений называют кривой утомления.
Наряду с изменением амплитуды сокращений при утомлении нарастает латентный период сокращения и удлиняется период расслабления мышцы. Однако все эти изменения возникают не тотчас после начала работы, а спустя некоторое время, в течение которого наблюдается увеличение амплитуды одиночных сокращений мышцы. Этот период называется периодом врабатывания. При дальнейшем длительном раздражении развивается утомление мышечных волокон.
Понижение работоспособности изолированной мышцы при ее длительном раздражении обусловлено двумя основными причинами. Первой из них является то, что во время сокращения в мышце накапливаются продукты обмена веществ (фосфорная, молочная кислоты и др.), оказывающие угнетающее действие на работоспособность мышечных волокон. Часть этих продуктов, а также ионы калия диффундируют из волокон наружу в околоклеточное пространство и оказывает угнетающее влияние на способность возбудимой мембраны генерировать потенциалы действия. Если изолированную мышцу, помещенную в небольшой объем жидкости Рингера, длительно раздражая довести до полного утомления, то достаточно только сменить омывающий ее раствор, чтобы восстановились сокращения мышцы.
Если изолированную мышцу, помещенную в небольшой объем жидкости Рингера, длительно раздражая довести до полного утомления, то достаточно только сменить омывающий ее раствор, чтобы восстановились сокращения мышцы.
Другая причина развития утомления изолированной мышцы — постепенное исто-
щение в ней энергетических запасов. При длительной работе изолированной мышцы происходит резкое уменьшение запасов гликогена, вследствие чего нарушаются процессы ресинтеза АТФ и креатинфосфата, необходимых для осуществления сокращения.
Следует подчеркнуть, что утомление изолированной скелетной мышцы при ее прямом раздражении является лабораторным феноменом. В естественных условиях утомление двигательного аппарата при длительной работе развивается более сложно и зависит от большого числа факторов. Обусловлено это, во-первых, тем, что в организме мышца непрерывно снабжается кровью и, следовательно, получает с ней определенное количество питательных веществ (глюкоза, аминокислоты) и освобождается от продуктов обмена, нарушающих нормальную жизнедеятельность мышечных волокон. Во-вторых, в целом организме утомление зависит не только от процессов в мышце, но и от процессов, развивающихся в нервной системе, участвующих в управлении двигательной деятельностью. Так, например, утомление сопровождается дискоординацией движений, возбуждением многих мышц, которые не участвуют в совершении работы.
Во-вторых, в целом организме утомление зависит не только от процессов в мышце, но и от процессов, развивающихся в нервной системе, участвующих в управлении двигательной деятельностью. Так, например, утомление сопровождается дискоординацией движений, возбуждением многих мышц, которые не участвуют в совершении работы.
И. М. Сеченов (1903) показал, что восстановление работоспособности утомленных мышц руки человека после длительной работы по подъему груза ускоряется, если в период отдыха производить работу другой рукой. Временное восстановление работоспособности мышц утомленной руки может быть достигнуто и при других видах двигательной активности, например при работе мышц нижних конечностей. В отличие от простого покоя такой отдых был назван И. М. Сеченовым активным. Он рассматривал эти факты как доказательство того, что утомление развивается прежде всего в нервных центрах.
Убедительным доказательством роли нервных центров в развитии утомления могут служить опыты с внушением. Так, находясь в состоянии гипноза, испытуемый может длительное время поднимать тяжелую гирю, если ему внушить, что в его руке находится легкая корзина. Наоборот, при внушении испытуемому, что ему дана тяжелая гиря, утомление быстро развивается при подъеме легкой корзины. При этом изменения пульса, дыхания и газообмена находятся в соответствии не с реальной работой, осуществляемой человеком, а с той, которая ему внушена.
Так, находясь в состоянии гипноза, испытуемый может длительное время поднимать тяжелую гирю, если ему внушить, что в его руке находится легкая корзина. Наоборот, при внушении испытуемому, что ему дана тяжелая гиря, утомление быстро развивается при подъеме легкой корзины. При этом изменения пульса, дыхания и газообмена находятся в соответствии не с реальной работой, осуществляемой человеком, а с той, которая ему внушена.
При выявлении причин утомления двигательного аппарата в применении к целостному организму в настоящее время нередко различают два вида двигательной деятельности: локальную, когда активно сравнительно небольшое количество мышц, и общую, когда большинство мышц тела участвует в работе. В первом случае среди причин утомления на первое место выступают периферические факторы, т. е. процессы в самой мышце;
во втором ведущее значение приобретают центральные факторы и недостаточность вегетативного обеспечения движений (дыхания, кровообращения). Исследованию механизмов утомления большое внимание уделяется в физиологии труда и спорта.
Эргография. Для изучения мышечного утомления у человека в лабораторных условиях пользуются эргографами — приборами для записи механограммы при движениях, ритмически выполняемых группой мышц. Такая запись позволяет определить количество выполняемой работы.
Примером такого простейшего прибора может служить эргограф Моссо, записывающий движение нагруженного пальца. Сгибая и разгибая палец при фиксированном положении руки, испытуемый поднимает и опускает подвешенный к пальцу груз в определенном, заданном ритме (например, в ритме ударов метронома).
Существуют эргографы, воспроизврдящие те или иные рабочие движения человека. Так, широко используются велоэргографы (велоэргометры). Человек ногами вращает педали прибора при различном, заданном заранее сопротивлении этому движению. Специальные датчики позволяют регистрировать параметры движения и количество выполненной работы. Одновременно можно регистрировать показатели дыхания, кровообращения, ЭКГ. Велоэргографы широко используются в медицине для определения функциональных возможностей организма человека.
Форма эргограммы и величина работы, произведенной человеком до наступления утомления, варьируют у разных лиц и даже у одного и того же лица при различных условиях. В этом отношении показательны эргограммы, записанные Моссо на самом себе до и после приема зачета у студентов. Эти эргограммы свидетельствуют о резком уменьшении работоспособности после напряженной умственной работы (рис. 39).
Рабочая гипертрофия мышц и атрофия от бездеятельности
Систематическая интенсивная работа мышцы способствует увеличению массы мышечной ткани. Это явление названо рабочей гипертрофией мышцы. В основе гипертрофии лежит увеличение массы цитоплазмы мышечных волокон и числа содержащихся в них миофибрилл, что приводит к увеличению диаметра каждого волокна. При этом в мышце происходит активация синтеза нуклеиновых кислот и белков и повышается содержание веществ, доставляющих энергию, используемую при мышечном сокращении, — аденозинтрифосфата и креатинфосфата, а также гликогена. В результате сила и скорость сокращения гипертрофированной мышцы возрастают.
Увеличению числа миофибрилл при гипертрофии способствует преимущественно статическая работа, требующая большого напряжения (силовая нагрузка). Даже кратковременных упражнений, проводимых ежедневно в условиях изометрического режима, достаточно для того, чтобы увеличилось количество миофибрилл. Динамическая мышечная работа, производимая без особых усилий, не вызывает гипертрофии мышцы.
У тренированных людей, у которых многие мышцы гипертрофированы, мускулатура может составлять до 50 % массы тела (вместо 35-40 % в норме).
Противоположным рабочей гипертрофии состоянием является атрофия мышц от бездеятельности. Она развивается во всех случаях, когда мышца почему-либо длительно не совершает нормальной работы. Это наблюдается, например, при обездвижении конечности в гипсовой повязке, долгом пребывании больного в постели, перерезке сухожилия, вследствие чего мышца перестает совершать работу, и т. п.
При атрофии диаметр мышечных волокон и содержание в них сократительных белков, гликогена, АТФ и других важных для сократительной деятельности веществ уменьшаются. После возобновления нормальной работы мышцы атрофия постепенно исчезает.
После возобновления нормальной работы мышцы атрофия постепенно исчезает.
Особый вид мышечной атрофии наблюдается при денервации мышцы, т. е. после утраты ее связи с нервной системой, например при перерезке ее двигательного нерва. Этот вид атрофии рассмотрен далее.
ПОСМОТРЕТЬ ЕЩЕ:
helpiks.org
Рабочая гипертрофия и атрофия от бездеятельности
Систематическая интенсивная работа мышц приводит к увеличению массы мышечной ткани. Это явление носит название рабочей гипертрофии мышцы. Рабочая гипертрофия мышцы происходит отчасти за счет продольного расщепления, а главным образом за счет утолщения (увеличения диаметра) мышечных волокон.
Можно выделить два основных типа рабочей гипертрофии мышечных волокон. Первый тип — саркоплазматический — утолщение мышечных волокон за счет преимущественного увеличения объема саркоплазмы, то есть несократительной части мышечных волокон. Этот тип гипертрофии приводит к повышению метаболических резервов мышцы: гликогена, безазотистых веществ, креатинфосфата, миоглобина и др. Значительное увеличение числа капилляров в результате тренировки также может в какой-то мере вызывать утолщение мышцы. Первый тип рабочей гипертрофии мало влияет на рост силы мышц, но зато значительно повышает способность их к продолжительной работе, то есть выносливость.
Значительное увеличение числа капилляров в результате тренировки также может в какой-то мере вызывать утолщение мышцы. Первый тип рабочей гипертрофии мало влияет на рост силы мышц, но зато значительно повышает способность их к продолжительной работе, то есть выносливость.
Второй тип рабочей гипертрофии — миофибриллярный- связан с увеличением объема миофибрилл, то есть собственно сократительного аппарата мышечных волокон. При этом мышечный поперечник может увеличиваться не очень значительно, так как в основном возрастает плотность укладки миофибрилл в мышечном волокне. Второй тип рабочей гипертрофии ведет к значительному росту максимальной силы мышцы. Существенно увеличивается и абсолютная сила мышцы, тогда как при первом типе рабочей гипертрофии она или совсем не изменяется, или даже несколько уменьшается.
Преимущественное развитие первого или второго типа рабочей гипертрофии определяется характером мышечной тренировки. Вероятно, длительные динамические упражнения с относительно небольшой нагрузкой вызывают рабочую гипертрофию главным образом первого типа (преимущественное увеличение объема саркоплазмы, а не миофибрилл). Изометрические упражнения с применением больших мышечных напряжений (более 2/3 от максимальной произвольной силы тренируемых мышечных групп), наоборот способствуют развитию рабочей гипертрофии второго типа (миофибриллярной гипертрофии).
Изометрические упражнения с применением больших мышечных напряжений (более 2/3 от максимальной произвольной силы тренируемых мышечных групп), наоборот способствуют развитию рабочей гипертрофии второго типа (миофибриллярной гипертрофии).
В основе рабочей гипертрофии лежит интенсивный синтез мышечных белков, ДНК и РНК. Очень важную роль в регуляции объема мышечной массы играют гормоны — андрогены.
У тренированных людей, у которых многие мышцы гипертрофированы, мускулатура может составлять до 50% массы тела (вместо 35-40% в норме).
Противоположным рабочей гипертрофии состоянием является атрофия мышц от бездеятельности. Она развивается во всех случаях, когда мышца почему-либо длительно не совершает нормальной работы. Это наблюдается, например, при обездвижении конечности в гипсовой повязке, долгом пребывании больного в постели, перерезке сухожилия, вследствие чего мышца перестает совершать работу.
При атрофии диаметр мышечных волокон и содержание в них сократительных белков, гликогена, АТФ и других, важных для сократительной деятельности веществ, уменьшаются. После возобновления нормальной работы атрофия мышцы постепенно исчезает.
После возобновления нормальной работы атрофия мышцы постепенно исчезает.
О дним из универсальных приспособительных и компенсаторных процессов в организме является гипертрофия. В самом общем виде этим термином обозначается увеличение размеров того или иного органа, связанное с ростом его специфической ткани. При этом функциональные возможности органа повышаются, благодаря чему он способен более эффективно выполнять присущую ему работу. Например, гипертрофия скелетной мышцы, развивающаяся при занятиях спортом за счет увеличения ее физиологического поперечника, способствует увеличению силы, с которой эта мышца способна сокращаться. Такая рабочая (физиологическая) гипертрофия может наблюдаться почти во всех органах человеческого организма.
Р анее
гипертрофии противопоставлялась
гиперплазия — увеличение органа за
счет увеличения числа составляющих его
клеточных элементов (без увеличения их
размеров). Однако в настоящее время в
общей патологии принято считать, что
«феномена гипертрофии как увеличения
чего-то однородного, цельного в принципе
вообще не может существовать и что в
основе увеличения любой структуры
организма в конечном счете лежит только
гиперплазия составляющих ее более
мелких структур» (Д. С. Саркисов и др.).
Это означает, что гипертрофия той же
скелетной мышцы есть результат увеличения
числа саркомеров, митохондрий, рибосом
и других ультраструктурных элементов.
В этих условиях не только увеличивается
число активных функционирующих единиц
органа или ткани, но и возможна
интенсификация их работы в зависимости
от предъявленных требований.
С. Саркисов и др.).
Это означает, что гипертрофия той же
скелетной мышцы есть результат увеличения
числа саркомеров, митохондрий, рибосом
и других ультраструктурных элементов.
В этих условиях не только увеличивается
число активных функционирующих единиц
органа или ткани, но и возможна
интенсификация их работы в зависимости
от предъявленных требований.
В условиях патологии гипертрофия имеет то же самое назначение, что и в норме. Однако при патологии гипертрофический процесс чаще всего развивается более интенсивно, и при этом энергетический запрос увеличенного органа не всегда может быть обеспечен достаточным кровоснабжением. В результате в гипертрофированном органе могут образоваться участки с относительно сниженным кислородным обеспечением и, как следствие, развиться некроз отдельных клеток с замещением их в последующем соединительной тканью. Очевидно, что в этих случаях эффективность гипертрофии органа начнет снижаться.
При заболеваниях, приводящих к снижению функции органа (например, при пороке сердца), развивается гипертрофия, обозначаемая как компенсаторная (рис. 4 ). Она обычно
длительное время поддерживает нарушенную
функцию на нормальном или близком к
нему уровне, способствует продлению
жизни больного. Вместе с тем со временем
происходит истощение функциональных
возможностей гипертрофированной ткани
органа, развивается его функциональная
недостаточность со всеми вытекающими
отсюда последствиями. Современная
хирургия уже на ранних стадиях этого
процесса предпринимает все более
успешные попытки заменить больной орган
на здоровый. Проблема трансплантации
органов, как уже говорилось (см. П.4.1),
осложнена активностью иммунной системы,
которая способствует отторжению
чужеродного биологического объекта.При хирургическом
лечении некоторых заболеваний развивается
так называемая заместительная, или
викарная, гипертрофия. Она наблюдается
при удалении одного из парных органов
(например, почки, легкого и др.). В этих
случаях сохранившийся орган берет на
себя функцию и удаленного; размеры его
увеличиваются, растет функциональная
способность. Викарная гипертрофия
обнаруживается и при1 врожденной
недоразвитости одного из парных органов
(рис.
4 ). Она обычно
длительное время поддерживает нарушенную
функцию на нормальном или близком к
нему уровне, способствует продлению
жизни больного. Вместе с тем со временем
происходит истощение функциональных
возможностей гипертрофированной ткани
органа, развивается его функциональная
недостаточность со всеми вытекающими
отсюда последствиями. Современная
хирургия уже на ранних стадиях этого
процесса предпринимает все более
успешные попытки заменить больной орган
на здоровый. Проблема трансплантации
органов, как уже говорилось (см. П.4.1),
осложнена активностью иммунной системы,
которая способствует отторжению
чужеродного биологического объекта.При хирургическом
лечении некоторых заболеваний развивается
так называемая заместительная, или
викарная, гипертрофия. Она наблюдается
при удалении одного из парных органов
(например, почки, легкого и др.). В этих
случаях сохранившийся орган берет на
себя функцию и удаленного; размеры его
увеличиваются, растет функциональная
способность. Викарная гипертрофия
обнаруживается и при1 врожденной
недоразвитости одного из парных органов
(рис. 5 ). Гипертрофия
некоторых эндокринных желез может
сопровождаться столь выраженной
гиперфункцией, что они начинают «работать»
в патологическом режиме, вредном для
организма. Это имеет место, например, у
больных базедовой болезнью.
5 ). Гипертрофия
некоторых эндокринных желез может
сопровождаться столь выраженной
гиперфункцией, что они начинают «работать»
в патологическом режиме, вредном для
организма. Это имеет место, например, у
больных базедовой болезнью.А трофия — процесс изменения клеток и тканей, противоположный тому, который происходит при гипертрофии. Уменьшение функциональной активности ткани (например, мышц конечности, на которую в связи с переломом костей наложен гипс) приводит к уменьшению числа структурных элементов клеток, их частичной деструкции. Размеры органа или ткани оказываются уменьшенными.
Ф изиологические гипертрофия и атрофия являются, как правило, процессами обратимыми. После устранения причин, их вызвавших, размеры органов и тканей нормализуются.
Д истрофией
обозначают структурные изменения
клеток, вызванные нарушениями обмена
веществ в ткани или самих клетках.
Конкретными причинами развития
дистрофических процессов являются
нарушения трофики (питания), связанные
с деятельностью как клеточных, так и
внеклеточных механизмов питания. Известный советский морфолог В. В. Серов
выделяет следующие причины: 1) энергетический
дефицит и нарушения ферментативных
процессов в клетке; 2) гипоксия; 3)
расстройства нейро-эндок-ринной регуляции
трофики. Первые две из них могут иметь
место при нерационально построенной
тренировочной работе со спортсменами.
В частности, дистрофические процессы
у спортсменов связываются с перенапряжениями,
вызванными чрезмерными физическими
нагрузками (А. Г. Дембо).
Известный советский морфолог В. В. Серов
выделяет следующие причины: 1) энергетический
дефицит и нарушения ферментативных
процессов в клетке; 2) гипоксия; 3)
расстройства нейро-эндок-ринной регуляции
трофики. Первые две из них могут иметь
место при нерационально построенной
тренировочной работе со спортсменами.
В частности, дистрофические процессы
у спортсменов связываются с перенапряжениями,
вызванными чрезмерными физическими
нагрузками (А. Г. Дембо).
Д истрофии — это чрезвычайно широкий класс клеточных повреждений. Они могут быть общими и местными. В связи с нарушениями обмена веществ выделяют белковые, жировые, углеводные и минеральные формы дистрофий. Каждая из этих форм подразделяется на частные формы. Так, к белковым дистрофиям относят зернистую дистрофию, гиалиноз, амилоидоз и т. д. Каждая из таких форм характеризуется специфическими структурными изменениями и нарушениями функции клеток, тканей и органов.
Амплитуда тетанического сокращения мышцы превышает высоту ее одиночного сокращения. Г. Гельмгольц (1847) назвал этот процесс суперпозицией , то есть наложением сокращений, полагая, что эффект двух следующих друг за другом раздражений равен алгебраической сумме одиночных сокращений.
Г. Гельмгольц (1847) назвал этот процесс суперпозицией , то есть наложением сокращений, полагая, что эффект двух следующих друг за другом раздражений равен алгебраической сумме одиночных сокращений.
Однако эти данные не соответствовали действительности. Н.Е. Введенский (1886) провел опыт, раздражая мышечное волокно пороговым раздражителем, возникало сокращение, дальнейшее раздражение подпороговыми раздражителями поддерживало амплитуду сокращения на первоначальном уровне. Н.Е Введенский объяснил это тем, что при сокращении мышца находится в состоянии повышенной возбудимости. Поэтому амплитуда второго ритмического сокращения становится больше, чем одиночного.
В настоящее время установлена зависимость амплитуды тетанических сокращений от фазы возбудимости, в которую попадает раздражитель. Это установлено при наложении всех трех кривых: кривой ПД, кривой Ферворна и кривой одиночного сокращения. Так, укорочение мышечного волокна начинается после достижения пика деполяризации, середина фазы укорочения совпадает с повышенной возбудимостью в фазу экзальтации, а, следовательно, и раздражитель, действующий в эту фазу, будет приводить к более сильному сокращению.
Полагают, что в основе увеличения силы сокращений при действии ритмических раздражителей лежит повышение концентрации кальция внутри клетки, что позволяет осуществляться реакции взаимодействия актина и миозина и генерации мышечной силы поперечными мостиками достаточно длительное время.
Утомление мышц. Причины утомления изолированной мышцы, нервно-мышечного препарата, утомления в естественных условиях
Утомлением называется временное понижение работоспособности клетки, органа или целого организма , наступающее в результате работы и исчезающее после отдыха.
Если длительно раздражать ритмическими электрическими стимулами изолированную мышцу, к которой подвешен груз, то амплитуда ее сокращений постепенно убывает, пока не дойдет до нуля. Полученная таким образом кривая называется кривой утомления.
Наряду с изменением амплитуды сокращения при утомлении нарастает латентный период сокращения и увеличиваются пороги раздражения и хронаксия, то есть понижается возбудимость. Эти изменение возникают не сразу после работы, а спустя некоторое время, в течение которого наблюдается увеличение амплитуды одиночных сокращений мышцы. Этот период называется периодом врабатывания. При дальнейшем длительном раздражении развивается утомление мышечных волокон.
Эти изменение возникают не сразу после работы, а спустя некоторое время, в течение которого наблюдается увеличение амплитуды одиночных сокращений мышцы. Этот период называется периодом врабатывания. При дальнейшем длительном раздражении развивается утомление мышечных волокон.
Понижение работоспособности изолированной из организма мышцы при ее длительном раздражении обусловлено двумя основными причинами: первой из них является то, что во время сокращений в мышце накапливаются продукты обмена веществ (в частности, молочная, фосфорная кислоты и т. д.), оказывающие угнетающее влияние на работоспособность мышцы. Часть этих продуктов, а также ионы калия диффундируют из волокон наружу в околоклеточное пространство и оказывают угнетающее влияние на способность возбудимой мембраны генерировать потенциалы действия.
Если изолированную мышцу, помещенную в раствор Рингера, довести длительным раздражением до полного утомления, то достаточно только сменить омывающую ее жидкость, чтобы восстановить сокращения мышцы.
Другой причиной развития утомления изолированной мышцы является постепенное истощение в ней энергетический запасов. При длительной работе изолированной мышцы происходит резкое уменьшение запасов гликогена, вследствие чего нарушаются процессы ресинтеза АТФ и креатинфосфата, необходимых для осуществления сокращения.
Утомление нервно-мышечного препарата обусловлено следующими причинами. При длительном раздражении нерва нарушение нервно-мышечной передачи развивается задолго до того, как мышца, а тем более нерв в силу утомления утрачивает способность к проведению возбуждения. Объясняется это тем, что в нервных окончаниях при длительном раздражении уменьшается запас «заготовленного» медиатора. Поэтому порции ацетилхолина, выделяющиеся в синапсах в ответ на каждый импульс , уменьшаются и постсинаптические потенциалы снижаются до подпороговых величин.
Наряду с этим при длительном раздражении нерва происходит постепенное понижение чувствительности постсинаптической мембраны мышечного волокна к ацетилхолину. В результате уменьшается величина потенциалов концевой пластинки. Когда их амплитуда падает ниже некоторого критического уровня, возникновение потенциалов действия в мышечном волокне прекращается. По этим причинам синапсы быстрее утомляются, чем нервные волокна и мышцы.
В результате уменьшается величина потенциалов концевой пластинки. Когда их амплитуда падает ниже некоторого критического уровня, возникновение потенциалов действия в мышечном волокне прекращается. По этим причинам синапсы быстрее утомляются, чем нервные волокна и мышцы.
Следует отметить, что нервные волокна обладают относительной неутомляемостью. Впервые Н.Е. Введенский показал, что нерв в атмосфере воздуха сохраняет способность к проведению возбуждений даже при многочасовом непрерывном раздражении (около 8 часов).
Относительная неутомляемость нерва отчасти зависит от того, что нерв тратит при своем возбуждении сравнительно мало энергии. Благодаря этому процессы ресинтеза в нерве в состоянии покрывать его относительно малые расходы при возбуждении даже в том случае, если это возбуждение длится много часов.
Необходимо отметить, что утомление изолированной скелетной мышцы при ее прямом раздражении является лабораторным феноменом. В естественных условиях утомление двигательного аппарата при длительной работе развивается более сложно и зависит от большего числа факторов.
1. В организме мышца непрерывно снабжается кровью, и, следовательно, получает с ней определенное количество питательных веществ (глюкоза, аминокислоты) и освобождается от продуктов обмена, нарушающих нормальную жизнедеятельность мышечных волокон.
2. В целом организме утомление зависит не только от процессов в мышце, но и от процессов, развивающихся в нервной системе, участвующих в управление двигательной деятельностью.
Так, например, утомление сопровождается дискоординацией движений, возбуждением многих мышц, которые не участвуют в совершении работы.
Активный отдых и его механизм. (И.М. Сеченов,
феномен Орбели-Гинецинского)
При выявлении причин утомления двигательного аппарата в применении к целостному организму в настоящее время нередко различают два вида двигательной деятельности: локальную, когда активно сравнительно небольшое количество мышц, и общую, когда в работе участвует большинство мышц тела. В первом случае среди причин утомления на первое место выступают периферические факторы, то есть процессы в самой мышце; во втором ведущее значение приобретают центральные факторы (нервная система) и недостаточность вегетативного обеспечения движений (дыхания, кровообращения).
Впервые И.М. Сеченов (1903) показал, что восстановление работоспособности утомленных мышц руки человека после длительной работы по подъему груза резко ускоряется, если в период отдыха производить работу другой рукой. Временное восстановление работоспособности мышц утомленной руки может быть достигнуто и при других видах двигательной активности , например, при работе различных мышц нижних конечностей. В отличие от простого покоя такой отдых был назван И.М. Сеченовым активным . Сеченов рассматривал эти факты как доказательство того, что утомление, прежде всего, развивается в нервных центрах.
Убедительным доказательством роли изменения состояния нервных центров в развитии утомления в целом организме служат опыты с внушением. Так, исследуемый может длительно поднимать тяжелую гирю, если ему внушить, что в его руке находится легкая корзина. Напротив, если внушить исследуемому, поднимающему легкую корзину, что ему дана тяжелая гиря, то быстро развивается утомление. При этом изменение пульса, дыхания и газообмена находится в соответствии не с реальной, осуществляемой человеком работой, а с той, которая ему внушена (В.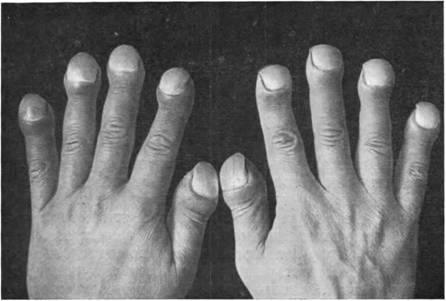 М. Василевский, Д.И. Шатенштейн).
М. Василевский, Д.И. Шатенштейн).
Феномен Орбели-Гинецинского был открыт в 1923 г. В опытах на нервно-мышечном препарате двигательные волокна раздражались электростимулятором. Изолированная мышца отвечала сокращением на каждое из ритмически повторяющихся раздражений, и на ленте кимографа регистрировалась типичная кривая мышечного сокращения. По мере утомления амплитуда кривой снижалась. После раздражения симпатических нервов, происходило увеличение амплитуды сокращений мышцы, и на кимограмме отмечалась новая волна повышенной активности. Позднее феномен был подтвержден и на мышцах млекопитающих в условиях нормального кровоснабжения.
Л.А. Орбели выдвинул представление об универсальной адаптационно-трофической функции симпатической нервной системы, регулирующей функциональные свойства всех органов и тканей, устанавливая их на оптимальный для данных условий уровень. Эта регуляция не ограничивается гладкими мышцами и железами , она охватывает все звенья рефлекторной дуги — рецепторы, центральную нервную систему, нервные проводники и скелетную мускулатуру.
В основе феномена Орбели-Гинецинского лежит активация симпатической нервной системы. Дальнейшие исследования позволили выявить общность влияния симпатической нервной системы и ретикулярной формации головного мозга на восстановление работоспособности мышц.
Рабочая гипертрофия и атрофия от бездеятельности
Систематическая интенсивная работа мышц приводит к увеличению массы мышечной ткани. Это явление носит название рабочей гипертрофии мышцы. Рабочая гипертрофия мышцы происходит отчасти за счет продольного расщепления, а главным образом за счет утолщения (увеличения диаметра) мышечных волокон.
Можно выделить два основных типа рабочей гипертрофии мышечных волокон. Первый тип — саркоплазматический — утолщение мышечных волокон за счет преимущественного увеличения объема саркоплазмы, то есть несократительной части мышечных волокон. Этот тип гипертрофии приводит к повышению метаболических резервов мышцы: гликогена, безазотистых веществ, креатинфосфата, миоглобина и др. Значительное увеличение числа капилляров в результате тренировки также может в какой-то мере вызывать утолщение мышцы. Первый тип рабочей гипертрофии мало влияет на рост силы мышц, но зато значительно повышает способность их к продолжительной работе, то есть выносливость.
Значительное увеличение числа капилляров в результате тренировки также может в какой-то мере вызывать утолщение мышцы. Первый тип рабочей гипертрофии мало влияет на рост силы мышц, но зато значительно повышает способность их к продолжительной работе, то есть выносливость.
Второй тип рабочей гипертрофии — миофибриллярный — связан с увеличением объема миофибрилл, то есть собственно сократительного аппарата мышечных волокон. При этом мышечный поперечник может увеличиваться не очень значительно, так как в основном возрастает плотность укладки миофибрилл в мышечном волокне. Второй тип рабочей гипертрофии ведет к значительному росту максимальной силы мышцы. Существенно увеличивается и абсолютная сила мышцы, тогда как при первом типе рабочей гипертрофии она или совсем не изменяется, или даже несколько уменьшается.
Преимущественное развитие первого или второго типа рабочей гипертрофии определяется характером мышечной тренировки. Вероятно, длительные динамические упражнения с относительно небольшой нагрузкой вызывают рабочую гипертрофию главным образом первого типа (преимущественное увеличение объема саркоплазмы, а не миофибрилл). Изометрические упражнения с применением больших мышечных напряжений (более 2/3 от максимальной произвольной силы тренируемых мышечных групп), наоборот способствуют развитию рабочей гипертрофии второго типа (миофибриллярной гипертрофии).
Изометрические упражнения с применением больших мышечных напряжений (более 2/3 от максимальной произвольной силы тренируемых мышечных групп), наоборот способствуют развитию рабочей гипертрофии второго типа (миофибриллярной гипертрофии).
В основе рабочей гипертрофии лежит интенсивный синтез мышечных белков, ДНК и РНК. Очень важную роль в регуляции объема мышечной массы играют гормоны — андрогены.
У тренированных людей, у которых многие мышцы гипертрофированы , мускулатура может составлять до 50% массы тела (вместо 35-40% в норме).
Противоположным рабочей гипертрофии состоянием является атрофия мышц от бездеятельности . Она развивается во всех случаях, когда мышца почему-либо длительно не совершает нормальной работы. Это наблюдается, например, при обездвижении конечности в гипсовой повязке, долгом пребывании больного в постели, перерезке сухожилия, вследствие чего мышца перестает совершать работу.
При атрофии диаметр мышечных волокон и содержание в них сократительных белков, гликогена, АТФ и других, важных для сократительной деятельности веществ, уменьшаются. После возобновления нормальной работы атрофия мышцы постепенно исчезает.
После возобновления нормальной работы атрофия мышцы постепенно исчезает.
Особенности физиологии возбудимых тканей у детей
Особенности физиологии нервов
Проводимость новорожденного ребенка ниже, чем у взрослого в два раза и скорость проведения возбуждения составляет около 50% от таковой у взрослых. Проведения возбуждения по нервным волокнам плохо изолировано.
В процессе взросления нервные волокна миелинизируются, увеличивается диаметр осевого цилиндра и волокна в целом, а чем толще становится волокно, тем меньше продольное сопротивление ионному току. Это приводит к тому, что скорость распространения ПД увеличивается. У детей он достигает показателей взрослого человека к 5-9 годам для разных нервных волокон. Так, передние спинномозговые корешки созревают к 2-5 году жизни, а задние спинномозговые корешки – к 5-9 году.
Возбудимость нервных волокон новорожденного значительно ниже, чем у взрослого. Характеристикой этого является хронаксия , величина которой в несколько раз выше; потенциал покоя, который у детей значительно ниже. Низкая величина потенциала покоя связана с тем, что клеточная мембрана имеет высокую ионную проницаемость и постоянно происходит утечка ионных токов. Это приводит к снижению трансмембранной разности ионов (градиенту концентрации) и приводит к формированию низкой амплитуды потенциала действия в сочетании с большей его продолжительностью и отсутствием реверсии.
Низкая величина потенциала покоя связана с тем, что клеточная мембрана имеет высокую ионную проницаемость и постоянно происходит утечка ионных токов. Это приводит к снижению трансмембранной разности ионов (градиенту концентрации) и приводит к формированию низкой амплитуды потенциала действия в сочетании с большей его продолжительностью и отсутствием реверсии.
В процессе роста проницаемость мембраны уменьшается и мембранный потенциал достигает показателей взрослого человека. Соответственно увеличивается и амплитуда потенциала действия, скорость проведения ПД возрастает, так как при высокой амплитуде легче вызвать возбуждение соседнего участка волокна.
У плода и ребенка первых лет жизни мякотные волокна плохо миелинизированы и каналы для натрия и калия располагаются равномерно. В онтогенезе волокно миелинизируется, ионные каналы концентрируются в перехватах Ранвье, расстояние между перехватами увеличивается. Это характеризует структурную зрелость мякотных волокон. В безмякотных волокнах распределение ионных каналов остается равномерным.
Лабильность нервных волокон новорожденных также низка. У детей более старшего возраста она увеличивается за счет снижения длительности рефрактерного периода и увеличения скорости проведения возбуждения.
Особенности физиологии мышц
У человека количество волокон в мышце устанавливается через 4-5 месяцев после рождения и затем практически не меняется на протяжении всей жизни. При рождении толщина их составляет примерно 1/5 толщины волокон у взрослых людей. Диаметр мышечных волокон может значительно меняться под воздействием тренировки.
Возбудимость мышц новорожденного очень низка. Показателем этого является высокая хронаксия и большой порог деполяризации.
У новорожденного МП миоцитов составляет -20-40мВ. Трансмембранная разность ионов К + и Nа + невысока. Поэтому и величина ПД также небольшая. Кроме того, отмечается длительность фаз абсолютной и относительной рефрактерности.
В процессе роста проницаемость мембраны уменьшается, работа ионных насосов улучшается и увеличивается МП и ПД.
Лабильность детей ниже, чем у взрослых вследствие большой длительности рефрактерных фаз. с возрастом происходит укорочение фаз абсолютной и относительной рефрактерности и как следствие возрастание скорости проведения возбуждения и увеличению быстроты движений.
Проводимость. Низкая у новорожденных скорость проведения ПД, с возрастом увеличивается. К этому приводит увеличение толщины мышечного волокна и увеличение амплитуды потенциала действия, так как снижается сопротивление ионному току и быстрее развивается возбуждение на соседнем участке мембраны.
Сократимость. Одиночные сокращения мышц новорожденного замедленны – как фаза укорочения, так и фаза расслабления — и характеризуется большим временем сокращения. В мышцах ребенка быстрее накапливаются продукты метаболизма и, поэтому, тетанус имеет пологое начало и постепенное расслабление, как тетанус утомленной мышцы. Мышцы отвечают тоническим сокращением на раздражители любой частоты и сокращаются без пессимального торможения столько, сколько действует раздражитель. Это связано с недостаточной зрелостью мионевральных синапсов.
У новорожденных отсутствует разделение мышц на быстрые и медленные, но уже с первых дней жизни у ребенка начинается постепенная дифференцировка, характерная для взрослых.
Эластичность мышц новорожденного выше, чем у взрослого и с возрастом уменьшается. А упругость и прочность , наоборот, увеличиваются.
На протяжении своей жизни человек испытывает различные физические нагрузки. Это могут быть как профессиональные силовые упражнения, так и просто сопутствующие нагрузки, которые встречаются при различных жизненных ситуациях.
При физических нагрузках мышцы, которые задействованы в процессе работы, увеличиваются. Происходит это за счет увеличения волокон, из которых состоит мышца. может быть во всю длину мышцы, а может быть и короче. Состоит мышечное волокно из большого количества сократительных элементов — миофибрилл. Внутри каждого элемента находятся еще более мелкие элементы — миофиаменты актин и миозин. И за счет этих элементов и происходит мышечное сокращение.
При регулярном поднятии тяжестей мышечные волокна увеличиваются, это и будет гипертрофией мышц.
Гипертрофия мышц — увеличение за счет «роста» мышечных волокон.
Чаще всего гипертрофия мышц присутствует у спортсменов, занимающихся бодибилдингом. Поскольку этот вид спорта направлен на совершенствование своего тела с помощью силовых нагрузок, высококалорийного питания и приема различных анаболических средств. В результате на теле формируется ярко выраженная рельефность мышц, то есть происходит гипертрофия мышц.
Процессы, происходящие в мышцах во время нагрузок
Основу строения организма человека составляет белок, он присутствует во всех его тканях. Поэтому изменения мышечной ткани зависит от синтеза и катаболизма белка в ткани.
При постоянных физических нагрузках происходит гипертрофия скелетных мышц. Когда организм испытывает нагрузки, в соответствующих мышцах возрастает содержание Однако, как научно установлено, во время физических воздействий на организм синтез белков приостанавливается, и катаболизм активизируется в первые минуты восстановительного процесса. Таким образом, гипертрофия мышц происходит за счет активизации синтеза белка, а не за счет снижения интенсивности распада белка при постоянном уровне интенсивности синтеза белка.
Гипертрофия скелетных мышц
Мышечная ткань человека выполняет двигательные функции, она и образует скелетные мышцы. Основная задача, которую выполняют скелетные мышцы, — сократимость, происходящая за счет изменения длины мышцы при воздействии на нее нервных импульсов. Используя свои мышцы, человек может «шевелиться». Каждая мышца выполняет «свое» конкретное действие, она может работать только в одном конкретном направлении при действии на сустав. Для обеспечения движения сустава вокруг своей оси задействована пара мышц, присутствующих с обеих сторон по отношению к суставу.
Определяет количество и толщина волокон, которые присутствуют в данной мышце. Они составляют анатомический поперечник мышцы (площадь поперечного разреза мышцы, сделанного перпендикулярно ее длине).
Также существует такой показатель, как физиологический поперечник (поперечный разрез мышцы, перпендикулярно ее волокнам).
Величина физиологического поперечника влияет на силу мышцы. Чем больше физиологический поперечник, тем большая сила будет присуща мышце.
Во время физических нагрузок увеличивается поперечник мышцы, это называется рабочей гипертрофией мышц.
Рабочая гипертрофия мышц присутствует, когда происходит увеличение в объеме мышечных волокон. При сильном утолщении волокон может произойти расщепление на несколько новых волокон с общим сухожилием. Рабочая гипертрофия возникает у здоровых людей при усиленной функции ткани или органа человека. Например, это гипертрофия скелетных мышц человека.
Причины гипертрофии мышц
Гипертрофию мышц, в большинстве случаев, вызывают регулярные физические нагрузки. Однако на увеличение объема мышечной массы влияет и количество потребляемых калорий. Если калорий не достаточно, большого объема мышц достичь не получится.
Сопутствуют достижению необходимого мышечного объема, то есть присутствует гипертрофия мышц, причины, в основе которых лежат такие принципы:
- Необходима постоянная нагрузка на все виды мышц, объем которых требуется увеличить.
- Время нагрузки выбирается индивидуально. Не стоит придерживаться стандартов. Необходимо заниматься столько, сколько позволяет организм, однако не до полного изнеможения.
- Не вызывать истощения нервной системы, работать сконцентрировано, спокойно и рассудительно.
- На начальных этапах тренировки может появляться боль в мышцах, однако это не должно быть предлогом приостановки занятия.
Также должно присутствовать полноценное и сбалансированное питание, обильное питье для поддержания водного баланса организма.
Увеличение жевательных мышц
За счет «лишних» движений челюсти может появиться гипертрофия жевательных мышц. человека прижимается к верхней за счет жевательных мышц. Они состоят из двух частей и находятся по обе стороны челюсти. Начинается мышца у нижнего края скуловой дуги и заканчивается у наружной поверхности ветви нижней.
Гипертрофия жевательных мышц вызывает нарушение в визуальном гармоничном сочетании верхней и нижней части лица, также вызывает боль в жевательных мышцах. Лицо становится «квадратным» или расширенным к низу. Гипертрофия мышц происходит за счет увеличения на них нагрузки.
Гипертрофию жевательных мышц может спровоцировать:
- бруксизм — скрежет зубами;
- постоянно сжатые челюсти, вплоть до стирания зубов;
- боль в жевательных мышцах.
Коррекция жевательных мышц
При гипертрофии жевательных мышц у человека появляется диспропорция черт лица. При этом также может присутствовать постоянный болевой синдром в районе челюсти. Для исправления этого дисбаланса человеку надо обратиться к специалисту для получения медикаментозного лечения. Для того, чтобы прошла гипертрофия мышц, лечение надо начинать вовремя.
При лечении в жевательную мышцу, в три — четыре места, вводится специальный препарат, который расслабляет мышцу и вызывает локальную мышечную релаксацию. Через несколько дней виден эффект, который продержится около полугода.
Гипертрофия сердечной мышцы
Бывают случаи, когда присутствует патологическое увеличение сердца, в основном это связано с увеличением толщины сердечной мышцы — миокарда.
Чаще встречается гипертрофия левых отделов сердца, чем правых.
Гипертрофия отделов сердца может появиться при:
- врожденных или приобретенных пороках сердца;
- гипертонической болезни;
- нарушении обмена веществ, в том числе и ожирении;
- резких нагрузках, когда ведется малоподвижный образ жизни.
Симптомы гипертрофии сердечной мышцы
Незначительная гипертрофия сердечной мышцы не вызывает никаких изменений в самочувствии человека и может остаться незамеченной. Чем больше стадия заболевания, тем отчетливее проявляются симптомы болезни. Один их лучших вариантов диагностирования заболевания — это ультразвуковое исследование сердца.
Предположить присутствие данного заболевания можно по наличию таких симптомов:
- тяжело дышать, дыхание затруднено;
- боли в области груди;
- быстрая утомляемость;
- нестабильный сердечный ритм.
Спровоцировать гипертрофию желудочка может повышенное давление. Сердце начинает работать быстрее, кровь, находящаяся в сердце, начинает давить сильнее на стенки, тем самым расширяя и и снижая эластичность стенок. Это приводит к невозможности сердца работать в прежнем режиме.
Лечение гипертрофии сердца
На начальной стадии гипертрофия сердца поддается медикаментозному лечению. Проводится диагностирование с целью выявления причины, спровоцировавшей развитие гипертрофии, и начинается ее устранение. Если, например, заболевание развилось из-за малоподвижного образа жизни и лишнего веса, то человеку назначаются небольшие физические нагрузки и корректируется его рацион. Продукты вводятся в соответствии с принципами здорового питания.
Если гипертрофия желудочка достигла больших размеров, проводится хирургическое вмешательство и гипертрофированный участок удаляют.
Атрофия мышц
Гипертрофия и атрофия мышц — это противоположные по значению понятия. Если гипертрофия означает увеличение мышечной массы, то атрофия — ее уменьшение. Волокна, составляющие мышцу, не получающие длительное время нагрузку, истончаются, уменьшается их количество и в тяжелых случаях могут вообще исчезнуть.
Атрофию мышц могут вызвать разные негативные процессы в организме человека, как наследственные, так и приобретенные. Это может быть, например:
- нарушение обмена веществ;
- последствие эндокринных заболеваний;
- осложнение после инфекционного заболевания;
- интоксикация организма;
- недостаточность ферментов;
- длительный послеоперационный покой мышц.
Лечение атрофии мышц
Результативность лечения зависит от того, на каком этапе находится заболевание. Если изменения в мышцах значительные, полностью восстановить их не удастся. Диагностируется причина, вызвавшая атрофию мышц, и назначается соответствующее медикаментозное лечение. Помимо медикаментозного лечения, обязательно рекомендуется:
- лечебная физкультура;
- физиотерапия;
- электролечение.
Чтобы поддерживать мышцы в тонусе, назначается массаж, который должен делаться регулярно.
Лечение направлено на приостановление разрушительных действий в мышцах, снятие симптоматики и улучшения обменных процессов в организме.
Обязательно присутствие полноценного питания с содержанием всех необходимых витаминных элементов.
Заключение
Таким образом, можно сделать вывод, что для получения гипертрофии скелетных мышц, необходимо приложить значительные физические усилия. Если это делается для достижения красивого тела с ярко выраженной мышечной массой, то от человека потребуется выполнение регулярных силовых упражнений. При этом его рацион должен быть построен на принципах правильного питания.
Однако существует вероятность получить нежелательную гипертрофию мышц, которая несет угрозу здоровью человека, это: гипертрофия сердечной мышцы и жевательных мышц. В большинстве случаев, появление этих заболеваний связано с отклонениями и нарушениями работы организма человека. Поэтому необходима своевременная диагностика и контроль над своим здоровьем для предотвращения появления и развития заболевания.
Здоровый образ жизни и правильное питание помогут человеку оставаться в хорошей спортивной форме и избежать возможных проблем со здоровьем.
РАЗНИЦА МЕЖДУ ГИПЕРТРОФИЕЙ И АТРОФИЕЙ | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ — ЖИЗНЬ
Гипертрофия и атрофия — два наиболее распространенных клеточных изменения, наблюдаемых как при физиологических, так и при патологических состояниях. Увеличение размера клеток, которое приводит к увели
Ключевое различие — гипертрофия против атрофииГипертрофия и атрофия — два наиболее распространенных клеточных изменения, наблюдаемых как при физиологических, так и при патологических состояниях. Увеличение размера клеток, которое приводит к увеличению размера пораженного органа, определяется как гипертрофия, тогда как уменьшение размера органа или ткани из-за уменьшения размера и количества клеток определяется как атрофия. При гипертрофии количество клеток пораженного органа остается прежним, несмотря на увеличение его размеров; однако при атрофии уменьшение размера органа сопровождается уменьшением количества функциональных клеток. Это ключевое различие между гипертрофией и атрофией.
1. Обзор и основные отличия
2. Что такое гипертрофия
3. Что такое атрофия
4. Сходства между гипертрофией и атрофией
5. Сравнение бок о бок — гипертрофия и атрофия в табличной форме
6. Резюме
Что такое гипертрофия?
Увеличение размера клеток, которое приводит к увеличению размера пораженного органа, определяется как гипертрофия. Количество ячеек не изменилось. Когда физиологическая или патологическая нагрузка на орган увеличивается, орган реагирует на это, пытаясь повысить эффективность своих функций за счет увеличения функциональной массы ткани. Клетки, способные к делению, достигают этого как за счет гиперплазии, так и за счет гипертрофии, но неделимые клетки увеличивают свою тканевую массу за счет гипертрофии.
Когда орган гипертрофирован в результате увеличения функциональной потребности или из-за стимуляции, исходящей от факторов роста или гормонов, это называется физиологической гипертрофией. Развитие мышц у бодибилдеров происходит в результате этой физиологической гипертрофии.
Увеличение матки во время беременности вызвано гормональной стимуляцией. Гипертрофия также связана с реактивацией фетальных или неонатальных форм белков.
Что такое атрофия?
Уменьшение размера органа или ткани из-за уменьшения размера и количества клеток определяется как атрофия. Атрофия может быть физиологической или патологической.
Физиологическая атрофия
Исчезновение хорды и вилочковой железы в процессе развития ребенка происходит в результате физиологической атрофии. Регресс размера матки также связан с этим событием.
Патологическая атрофия
Когда атрофия вызвана патологическими причинами, это называется патологической атрофией.
Причины патологической атрофии
- Снижение нагрузки
Распространено наблюдение, что мышцы, прикрепленные к сломанной кости, со временем становятся меньше. Это происходит из-за снижения нагрузки на эти мышцы.
- Потеря иннервации
Повреждение нервов, иннервирующих определенную структуру, может нарушить снабжение этой структуры питанием и кислородом. Это может привести к уменьшению размера пораженного органа или ткани.
- Снижение кровоснабжения
Когда кровоснабжение органа снижается, этот орган не получает достаточного количества питательных веществ для выполнения своих метаболических функций. В результате размер органа уменьшается.
- Неадекватное питание
- Потеря эндокринной стимуляции
- Давление
Механизмы атрофии
Атрофия может возникать либо из-за снижения синтеза белка, либо из-за увеличения деградации белков. Снижение синтеза белка вторично по отношению к снижению метаболической активности. Увеличение деградации белка часто происходит из-за активации пути убиквитин-протеасома.
В чем сходство между гипертрофией и атрофией?
- Оба эти изменения могут быть вызваны физиологическими или патологическими причинами.
В чем разница между гипертрофией и атрофией?
Гипертрофия против атрофии | |
| Увеличение размера клеток, которое приводит к увеличению размера пораженного органа, определяется как гипертрофия. | Уменьшение размера органа или ткани из-за уменьшения размера и количества клеток определяется как атрофия. |
| Размер органа | |
| Размер органа увеличивается при гипертрофии. | При атрофии размер органа уменьшается. |
| Количество ячеек | |
| Количество ячеек не изменилось. | При атрофии количество клеток уменьшается. |
Резюме — Гипертрофия против атрофии
Увеличение размера клеток, которое приводит к увеличению размера пораженного органа, определяется как гипертрофия, а уменьшение размера органа или ткани за счет уменьшения размера и количества клеток определяется. как атрофия. При гипертрофии количество клеток остается прежним, но при атрофии количество клеток уменьшается. Это можно рассматривать как главное различие между гипертрофией и атрофией.
Скачать PDF-версию гипертрофии против атрофии
Вы можете скачать PDF-версию этой статьи и использовать ее в автономных целях в соответствии с примечанием к цитированию. Пожалуйста, скачайте PDF-версию здесь Разница между гипертрофией и атрофией
причины, лечение, инвалидность и фото
На чтение 6 мин. Просмотров 206 Опубликовано Обновлено
Появление боли в области ягодиц вызвано заболеваниями позвоночника, внутренних органов и тазового кольца. Для каждой патологии характерны определенные симптомы, поэтому стоит разобраться, как проявляется атрофия, гипертрофия и дистрофия ягодичных мышц.
Формы заболевания и характерные симптомы
Важно понимать различия между атрофией, дистрофией и гипертрофией мышц. Понятия имеют массу отличий:
- Атрофией называются процессы, приводящие к истончению мышц и потере их функциональности. К патологии приводит множество наследственных болезней, а также минимальная активность мускулатуры.
- Дистрофия – понятие описывает группу наследственных заболеваний, которые приводят к некрозу мышечных волокон. Ими поражается скелетная мускулатура. В результате развития заболеваний возникает слабость и дегенерация волокон.
- Гипертрофия. Проявляется при росте объема мышечных волокон. Мышцы заметно увеличиваются в объеме и приобретают силу. Это состояние характерно для здоровых людей. Патологическое увеличение мышц называется псевдогипертрофией или ложной гипертрофией. В действительности такие заболевания относятся к дистрофическим.
Таким образом, миодистрофия (заболевание) может привести к атрофии (процессам отмирания мышечных волокон).
Симптомы различных патологий мышц ягодиц схожи во множестве случаев. Мускулатура нижней части спины ослабевает, теряет функциональность. Походка становится неестественной, ее еще называют «утиной». Визуально ягодицы уменьшаются, теряют свою естественную округлую форму. При дистрофических изменениях в мышцах они могут увеличиваться, однако не за счет роста волокон, а в результате отложения жира и разрастания соединительной ткани. Спустя 5-8 лет пациент может быть полностью обездвижен.
Распространенные дистрофические изменения в мышцах характерны для мальчиков, поскольку наследственные заболевания поражают мужскую половую хромосому (дистрофия Дюшена и Беккера). Существует несколько разновидностей наследственных дистрофических болезней, характерных для обоих полов.
Причины патологий ягодичных мышц
Атрофия большой ягодичной мышцы – это зачастую последствие травм и неврологических болезней. Больной теряет двигательную способность частично или полностью. В большинстве случаев болезнь наследственная. Мышечная ткань сокращается в объеме и истончается, затем заменяется жировой и соединительной. В некоторых случаях она полностью отмирает.
При консервативном лечении переломов требуется длительная иммобилизация, приводящая к атрофии мышцПричины гипотрофии ягодичных мышц:
- Первичная атрофия – нарушение снабжения мышцы нервами (иннервации). Мышечная ткань поражается после чрезмерных физических нагрузок, травм, неврологических заболеваний. Нервные клетки могут передавливаться онкологическими образованиями.
- Вторичная атрофия – тяжелые болезни, в результате которых гибнут клетки нервного ствола спинного мозга. Развивается в результате артрозов и артритов, остеохондроза поясничного отдела.
- Вынужденное бездействие человека после инсультов и параличей.
- Повреждение кровеносных сосудов, снабжающих ягодицы: возникает кислородное голодание мышц, и они отмирают.
- Хронический алкоголизм и наркомания.
- Старение организма.
- Неправильный выбор диеты. Спровоцировать мышечную атрофию может длительное голодание, при котором организм не получает нужных веществ.
У детей атрофия ягодичных мышц может быть вызвана полиомиелитом, родовой травмой, детским инсультом, травмой спины, хроническим воспалением мышечной ткани.
Ложная гипертрофия ягодичных мышц возникает при различных видах дистрофии (наследственных болезней). Генетические передаваемые поражения хромосом вызывают нарушение строения мышечных волокон, что ведет к их распадению.
Постановка диагноза
Когда в мышцах появляется слабость, следует немедленно обратиться к врачу. Диагностику заболеваний ягодичных мышц проводят неврологи и терапевты. Атрофия неизлечима и быстро прогрессирует при отсутствии лечения, поэтому для повышения качества жизни необходимо вовремя начать терапию.
Характерные нарушения мышечной ткани диагностируются такими методами:
- электромиография;
- анализы крови;
- проверка нервной проходимости мышц;
- осмотр эндокринолога для контроля щитовидной железы;
- биопсия мышц – назначается в редких случаях.
Чтобы поставить точный диагноз, может потребоваться консультация узкого специалиста.
Методы лечения
Атрофию лечат витаминами B1, B12, E, а также динатриевой солью аденозинтрифосфорной кислоты, диабазолом и прозерином. В некоторых случаях больному назначают переливание крови, лечение током. Полный курс терапии проводится за несколько месяцев. После комплексного лечения возможна полная стабилизация процесса атрофии.
Больным назначается комплексная терапия, включающая физиопрофедуры (электрофорез фосфора и кальция), щадящую лечебную физическую культуру и массаж мышц ягодиц — в качестве массажного масла используют лечебную мазь Актовегин. Консервативное лечение проводится курсами на протяжении 3-4 недель. В лечении делается интервал 1-2 месяца. Благодаря такому лечению мышечная атрофия замедляется, а пациент может сохранять работоспособность в течение многих лет.
При дистрофии пациенту вводят фетальные стволовые клетки, что позволяет замедлить патологический процесс. Также больному назначают кортикостероиды, участвующие в сокращениях мышечных волокон.
Лечение народными средствами
Среди основных народных средств от мышечной атрофии стоит выделить настройку кальция. Ее готовят из 6 куриных яиц с белой скорлупой. Яйца заливают соком 10 лимонов. Смесь оставляют в на несколько дней в закрытой стеклянной банке, накрытой марлей и обернутой бумагой. Банка помещается в сухое теплое место до полного растворения скорлупы. Лекарственный состав готовят из получившейся смеси и 300 г липового меда. Также в емкость заливают стакан коньяка. Вещество переливают в стеклянную тару темного цвета и оставляют в прохладном месте. После каждого приема пищи (3 раза в день) больной употребляет по 1 ч. л. лекарства.
Еще один народный рецепт борьбы с атрофией основан на использовании метелок камыша, которые можно набрать возле водоемов с октября по март. Перед использованием растения берут 2 жмени метелок и заливают кипятком на 45 минут. Затем воду сливают. Пораженные мышцы обкладывают камышом, закрепляя части растений марлевыми повязками, создавая компресс. Когда компресс остывает, пациенту делают массаж ног и пораженной области.
Упражнения
Курс ЛФК следует согласовать со своим врачом и физиотерапевтом. Эффективность тренировок можно оценить только при полном понимании состояния пациента. Общая последовательность выбора упражнений:
- При восстановлении после мышечной атрофии больным рекомендуется плавание – этот вид физической активности позволяет повысить тонус атрофированных мышц, не сильно их напрягая. Любые упражнения стоит проводить под контролем специалиста по ЛФК.
- Ходьба в бассейне. Пациент ходит по дну бассейна, находясь по пояс в воде. Упражнение длится 10 минут. Со временем продолжительность ходьбы и глубина погружения увеличивается.
- Подъем коленей в бассейне. Спиной во время упражнения опираются о стену.
- После того, как мышцы окрепнут, можно приступать к упражнениям на земле: наклоны, приседания, выпады.
Пациент проходит курс упражнений под контролем специалиста, чтобы не перенапрячь мышцы и не вызвать ухудшения их состояния.
Инвалидность при болезнях ягодичных мышц
Существует множество критериев инвалидности, по которым оценивают состояние ребенка с атрофией или дистрофией ягодичных мышц:
- Нарушение двигательных функций, которое вызывает нетрудоспособность, нарушение способностей к самостоятельному передвижению и обслуживанию.
- Социальная недостаточность и частичное нарушение жизнедеятельности.
- Нарушение двигательной функции конечностей.
При оценке состояния здоровья лиц старше 18 лет применяются другие критерии инвалидности МСЭ при атрофии тазобедренной мышцы:
- 1 группа – неспособность передвигаться и выполнять элементарные действия по самообслуживанию;
- 2 группа – ограниченная способность к передвижению, способность к трудовой деятельности 2-3 степени;
- 3 группа – умеренные атрофии, при которых человеку полагается сокращенное время работы и снижение квалификации.
Инвалидность дают бессрочно больным, которые имеют прогрессирующее течение заболевания, а также при неэффективности реабилитационных мер.
Поскольку атрофия и дистрофия мышц ягодиц может привести к полной неспособности человека передвигаться, стоит своевременно лечить все заболевания мышц, избегать их переохлаждения и перенапряжения.
Саркопения глазами эндокринолога | Мокрышева
Одним из синдромов, существенно влияющих на здоровье и жизнь пациента, является саркопения. Саркопения (от греч. sarx – тело, плоть + penia – снижение) – состояние, характеризующееся прогрессирующей и генерализованной утратой мышечной массы и силы с повышением риска неблагоприятных событий, таких как ухудшение качества жизни, инвалидизация и смерть (Европейский консенсус по саркопении 2010 г.) [1]. Снижение мышечной силы описывал еще Гиппократ, однако термин «саркопения» впервые предложил в 1989 г. американский профессор I. Rosenberg [2]. Диагностические, профилактические и лечебные мероприятия при саркопении должны разрабатываться с учетом повышения коморбидности с возрастом. Это особенно актуально в практике эндокринолога, так как множество эндокринопатий может приводить к формированию данного синдрома.
ЭПИДЕМИОЛОГИЯ
Распространенность саркопении в популяции по разным источникам варьирует от 4,3% до 73,3% и зависит от возрастных критериев включения и особенностей исследуемых групп (пациенты, получающие амбулаторную помощь, и жители домов престарелых имеют значимые отличия). Чаще встречаются данные о распространенности в диапазоне 5–13% среди лиц 60–70 лет и на уровне 50% – в группе старше 80 лет [3, 4]. В российской популяции частота составила 13% у пациентов старше 85 лет [5].
ЭТИОЛОГИЯ
Этиологически саркопению разделяют на первичную и вторичную. Первичную саркопению рассматривают в рамках возрастных изменений мышечной ткани, вторичную – как следствие других заболеваний и патологических состояний (онкологической патологии, сахарного диабета (СД) 2 типа, хронической сердечной недостаточности, гиподинамии и прочего, а также вследствие приема некоторых лекарственных препаратов).
Также обсуждается и генетическая предрасположенность к саркопении. Например, доказана связь генов ACE (кодирует ангиотензинпревращающий фермент), ACTN3 (кодирует альфаактинин 3), MSTN (кодирует миостатин), CNTF (кодирует цилиарный нейротрофический фактор), IGF1 (кодирует ИФР-1), IL-6 (кодирует интерлейкин 6) и VDR (кодирует рецептор витамина D) с силой и/или массой мышечной ткани. Особый интерес для изучения представляют такие гены-кандидаты, как GREM1 (кодирует Gremlin1), TRHR (кодирует рецептор тиреотропин-рилизинг-гормона), ACVR1B (кодирует рецептор активина 1B). В ряде двойных слепых исследований продемонстрировано, что наследуемость некоторых показателей мышечной массы и силы достигает 80% [6, 7].
ПАТОГЕНЕЗ
Саркопения – это мультиэтиологичный синдром со сложным патогенезом, в котором эндокринные факторы играют одну из ведущих ролей. Патогенез данного состояния изучен недостаточно, однако уже известно, что на развитие саркопении значимое влияние оказывает снижение уровня гормона роста (ГР), инсулиноподобного фактора роста-1 (ИФР-1), половых гормонов, витамина D, инсулинорезистентность. В то же время активно изучаются такие факторы, способствующие развитию саркопении, как особенности образа жизни (качество питания, физическая активность, иммобилизация) и пищевой статус. Снижение последнего приводит к недостаточному синтезу белка, развитию дегенеративных процессов, митохондриальной дисфункции и атрофии мышечных волокон, вследствие чего происходит потеря мышечной массы и силы [8]. На развитие саркопении также может влиять течение гестационного периода матери, окружающая среда в раннем детском возрасте, вес тела при рождении и в младенчестве, который прямо связан с мышечной массой и ее функциональными возможностями в старшем возрасте [6].
В основе патогенеза саркопении лежит утрата мышечной массы. Зрелые мышечные волокна состоят из многоядерных клеток, неспособных к делению, поэтому рост и регенерация мышц происходят за счет пролиферации клеток-сателлитов. При саркопении в первую очередь снижается количество клеток-сателлитов и волокон II типа, приводя к невозможности совершения пациентом быстрых движений [9]. Будучи ключевым звеном большинства клеточных процессов (обеспечение энергией, регуляция внутриклеточного гомеостаза кальция, активация клеточной пролиферации), митохондриальная дисфункция и дальнейшая потеря целостности митохондрий в миоцитах приводят к снижению окислительной способности, нарастанию уровня оксидативного стресса, повреждению клеток и развитию атрофии мышечных волокон (рис. 1).
Рис. 1. Этиология и патогенез саркопении.
Значительную роль играют системное воспаление, трансформация митохондрий и их взаимное усиление дегенеративного влияния на мышцы. В скелетных мышцах происходит повреждение транспортной цепи электронов, которое может определяться фокально в миоцитах или в дискретных областях отдельной клетки, и приводит к снижению активности цитохрома С-оксидазы и повышению активности сукцинатдегидрогеназы (СДГ) [10].
Доказательства, подтверждающие ключевую роль мутаций митохондриальной ДНК (мтДНК) в патогенезе старения, были получены в эксперименте на животных моделях, у которых имела место ошибка считывания в мтДНК-полимеразе γ (PolG), что проявлялось преждевременным старением, характеризующимся алопецией, кифозом, потерей слуха, остеопорозом, саркопенией и сокращением продолжительности жизни. У этих мышей накапливались соматические мутации мтДНК и демонстрировали системную дисфункцию митохондрий, включая снижение функции дыхательной цепи, ускоренный апоптоз в постмитотических тканях, при этом повышенного уровня окислительного стресса у них не наблюдалось. Интересно, что делеции мтДНК локализуются совместно с мутациями транспортной цепи электронов и при повышении определенного порога значений приводят к нарушению ее активности. В целом эти данные подтверждают гипотезу о том, что делеции мтДНК, накапливаясь в мышечных волокнах, компрометируют митохондриальную биоэнергетику и способствуют развитию атрофии мышц [10].
Другой путь, регулирующий метаболизм митохондрий во время старения, включает ИФР-1. Этот путь осуществляется путем фосфорилирования АТФ-цитрат-лиазы, фермента, катализирующего митохондриальное производное цитрат в оксалоацетат и ацетил-КоА. Предполагается, что возрастное снижение уровня ИФР-1 может нарушать митохондриальную активность посредством снижения АТФ-цитрат-лиазы, способствуя развитию саркопении [10].
Наличие воспалительной реакции также тесно связано с риском развития саркопении. Повышение фактора некроза опухоли-α способствует развитию воспаления через активацию ядерного фактора k-B, что приводит к потере мышечной массы (см. рис. 1) [11].
Таким образом, ИФР-1, механизмы контроля качества митохондрий и воспалительный путь являются основными звеньями, контролирующими мышечную массу.
Повреждения на любом уровне контроля состояния митохондрий сохраняются на протяжении их жизни, таким образом накапливаются поврежденные органеллы. Как следствие, увеличение отношения AMФ/ATФ и оксидативный стресс активируют катаболический путь, который приводит к атрофии мышц. Этот путь включает в себя как посредников, связанных с аутофагами, так и индукторов мышечного катаболизма (MuRF-1, атрогин), приводящих к деградации митохондрий и белка для обеспечения альтернативных источников энергии [11].
В исследовании, изучавшем взаимосвязь скелетной мышечной массы с сохранностью капиллярной сети при старении, сравнивались данные гистологического исследования мышечной ткани между группами молодых здоровых лиц (средний возраст – 22 года, мужчины (n=14), женщины (n=5)) и пожилых лиц (средний возраст – 74 года, мужчины (n=22), женщины (n=6)). Степень мышечной капилляризации и распределения капилляров определяли методом капиллярных доменов. Окислительную способность мышечных волокон оценивали с помощью количественной гистохимии. Обеспечение капиллярами волокон определялось главным образом размером волокна и лишь в малой степени окислительной способностью. Несмотря на атрофию волокон II типа на 18% (p=0,019) и снижение количества капилляров на одну клетку на 23% (р<0,002) у пожилых людей, существенных различий в распределении капилляров между молодыми и пожилыми людьми выявлено не было. При исследовании активности СДГ максимальное потребление кислорода, поддерживаемое капилляром, не сильно различалось между молодыми и пожилыми людьми, но волокна I типа имели, как и ожидалось, более высокую активность СДГ по сравнению с волокнами II типа [12].
КЛИНИЧЕСКАЯ КАРТИНА САРКОПЕНИИ
Клиническая картина характеризуется снижением объема мышц, их силы и общей активности пациента. Больные отмечают трудности в выполнении привычных действий, выраженную мышечную и общую слабость, боли в мышцах, невозможность самостоятельного передвижения и самообслуживания, что постепенно приводит к инвалидизации и снижению продолжительности жизни. С целью предотвращения таких тяжелых последствий необходимо выявлять данный синдром на самом раннем этапе его развития.
ДИАГНОСТИЧЕСКИЕ МЕТОДЫ
Заподозрить саркопению возможно с помощью опросников. Наиболее часто используются опросники SarQol (Sarcopenia and Quality of Life – качество жизни при саркопении) и SARC-F (Strength, Assistance with walking, Rise from a chair, Climb stairs and Falls – сила, помощь при ходьбе, подъем со стула, подъем по лестнице и падения). Опросник SarQol разработан в 2015 г. французской научной группой для пациентов старше 65 лет в целях оценки мышечной функции и качества жизни. Он состоит из 22 вопросов, разделенных на модули: физическое и психическое здоровье, активность, состав тела, функциональность, деятельность в повседневной жизни и во время досуга [3]. Опросник SARC-F состоит из 5 вопросов и является скрининговым методом обследования, позволяющим быстро оценить мышечную функцию (чувствительность 4–10%, специфичность 94–99%).
Европейская рабочая группа по изучению саркопении у пожилых людей (EWGSOP) рекомендует в качестве стандартного метода оценки физического состояния пациента определять скорость ходьбы на короткое расстояние (4 м). Отрезной точкой является скорость 0,8 м/с, ниже которой необходимо заподозрить саркопению. Вторым этапом следует анализ мышечной силы и массы. Сила мышц оценивается с помощью динамометрии, а масса – с помощью денситометрии (двухэнергетической рентгеновской абсорбциометрии, DXA) и биоимпедансного анализа [13]. Для оценки мышечной силы определяют силу сжатия кисти с помощью кистевых динамометров. Наиболее часто используется в зарубежных исследованиях динамометр Jamar. У пациентов с заболеваниями суставов более предпочтителен Martin Vigorimeter, который измеряет давление обхватывающей руки и не зависит от размера кисти. Для более достоверной оценки мышечной силы требуется выполнение двух методик. При проведении проспективного когортного исследования «Хрусталь» в Северо-Западном регионе России был произведен расчет возрастных норм результатов кистевой динамометрии для здоровых людей старше 65 лет. Средняя скорость снижения силы сжатия кисти в российской популяции у мужчин была выше, чем у женщин, и составила примерно 1 кг/год в возрасте от 65 до 76 лет и 0,5 кг/год в возрасте старше 76 лет. Средняя скорость снижения силы сжатия у женщин была 2 кг за 5 лет. Представленные результаты согласуются с результатами других исследований: например, средняя скорость снижения силы сжатия в исследовании H. Frederiksen и соавт., основанном на анализе трех крупных популяционных исследований, была также выше у мужчин по сравнению с женщинами и составила 0,65±0,02 кг/год, в то время как у женщин – 0,34±0,01 кг/год. В исследовании «Возраст и здоровье женщин II» (The Women’s Health and Aging Study II) скорость снижения силы сжатия у женщин была в среднем 1,10–1,31 кг в возрасте от 70 до 75 и 0,50–0,39 кг в возрасте старше 75 лет [14].
Однако кистевые динамометры не могут достоверно отобразить силу мышц верхних и нижних конечностей. В настоящее время ни один из инструментальных методов не может быть рекомендован для оценки мышечной силы в рутинной клинической практике. Функциональные тесты более информативны, однако также имеют ряд ограничений, например, у пациентов с заболеваниями суставов, неврологическими расстройствами, нарушением координации, головокружением и других. Тест SPPB (Short Physical Performance Battery – характеристика короткой физической активности) позволяет оценить кратковременную физическую активность и включает определение скорости ходьбы на короткое расстояние (4 м), а также 5-кратное вставание со стула и возможность удержания равновесия в положении стоя в течение 10 с [15].
При оценке индекса тощей массы (ИТМ) скелетных мышц с помощью двухэнергетической рентгеновской абсорбциометрии (денситометрии, DXA) рассчитывается частное аппендикулярной мышечной массы (АММ), полученной как сумма тощей массы рук и ног, и роста человека в квадратных метрах, то есть АММ/рост², и измеряется в кг/м². Саркопения диагностируется при снижении ИТМ более чем на 2 стандартных отклонения, что, по разным источникам, соответствует ИТМ у мужчин менее 7,26–8,5 кг/м², а у женщин – менее 5,5–5,75 кг/м² [16, 17].
Биоэлектрический импедансный анализ является альтернативой денситометрии, будучи более дешевым, легко воспроизводимым и мобильным методом диагностики. В таблице 1 представлены референсные значения ИТМ для диагностики саркопении.
Таблица 1. Критерии саркопении по данным биоимпедансного анализа.
ИТМ | Муж. | Жен. |
Норма | > 10,75 кг/м² | > 6,75 кг/м² |
Обратимая саркопения | 8,51–10,75 кг/м² | 5,76–6,75 кг/м² |
Выраженная саркопения | 8,5 кг/м² | 5,75 кг/м2 |
Вместе с тем биоимпедансный метод исследования недостаточно точен, особенно у пациентов с заболеваниями, проявляющимися отечным синдромом (хроническая сердечная недостаточность, почечная недостаточность и лимфедема). Антропометрические измерения, такие как окружность икроножной мышцы или толщина кожной складки, неточны главным образом потому, что ожирение, отеки, а также изменения в жировой ткани и потеря эластичности кожи, связанные с возрастом, снижают специфичность метода в оценке мышечной массы. Они не рекомендуются для использования в целях диагностики саркопении, но могут быть альтернативными в случае отсутствия других методов [16, 18]. Антропометрический метод недостаточно информативен и при саркопеническом ожирении, включающем критерии саркопении и увеличение объема подкожной жировой клетчатки у мужчин ≥25%, у женщин ≥35%. При данном состоянии наблюдается жировое перерождение клеток-сателлитов, жировая инфильтрация мышц, которые способствуют снижению силы нижних конечностей и гиподинамии – возникает порочный круг. Однако на данный момент невозможно оценить, что развивается первично: саркопения или ожирение, так как при ожирении наблюдается хроническое воспаление, которое, в свою очередь, приводит к снижению мышечной массы и силы [16].
ОСТЕОСАРКОПЕНИЯ
Остеосаркопения – это относительно новое понятие, включающее в себя сочетание низкой мышечной массы и сниженной минеральной плотности костной ткани (МПК), связанное со старением и общим патогенезом [19]. Учитывая повышение риска развития как саркопении, так и остеопороза у пожилых лиц, требуется оценка состояния мышечной ткани у таких пациентов [20].
Состав тела пациентов с остеосаркопенией характеризуется снижением мышечной массы, МПК, ИМТ и индекса общего жира по сравнению с пациентами с изолированным остеопорозом или саркопенией. Клинические проявления остеосаркопении характеризуются слабостью, низкой скоростью ходьбы, потерей подвижности. В настоящее время отсутствуют специфические маркеры остеосаркопении, однако отмечено, что у пациентов с данной патологией уровень тестостерона, витамина D и гемоглобина ниже, чем у пациентов с изолированным остеопорозом или саркопенией.
Помимо возраста, существует ряд других факторов, которые способствуют развитию остеосаркопении. Генетические полиморфизмы GLYAT, METTL21C, MSTN, ACTN3 PGC-1α и MEF-2C связаны с потерей костной и мышечной ткани. Эндокринные заболевания (в основном СД, нарушение функции щитовидной железы и низкий уровень витамина D, половых гормонов, ГР, ИФР-1), алиментарная недостаточность, ожирение и прием кортикостероидов также влияют на развитие остеосаркопении [19]. Отмечено, что саркопения и мышечная слабость, так же как и частота переломов, встречаются чаще у пациентов с СД 2 типа, чем у здоровых людей [21].
Жировая инфильтрация мышц у пожилых вносит свой вклад в развитие остеосаркопении, что, возможно, связано с отрицательным воздействием продукции воспалительных цитокинов костным мозгом и жировой тканью. Установлено, что пациенты с саркопенией и остеопенией имеют высокие концентрации воспалительных цитокинов, преобладание интерлейкина-6 (IL-6) и фактора некроза опухолей альфа (ФНО-α), которые связаны как с системной, так и с локальной липотоксичностью. Кроме того, изменения в костном мозге тесно ассоциированы с изменениями мышечной массы. Скелетная и мышечная ткань взаимодействуют механически, физически, а также биохимически посредством паракринных и эндокринных факторов. В этом процессе существует много возможных путей, которые могут объяснить развитие и прогрессирование остеосаркопении. Один из них включает остеокальцин, который стимулирует пролиферацию β-клеток, секрецию инсулина и действует непосредственно на скелетную мышцу, коррелируя с мышечной силой. Другим внутренним механизмом, связывающим мышцы и кость, является секреция сосудистого эндотелиального фактора роста (VEGF) с помощью мезенхимальных стромальных клеток костного мозга, что стимулирует пролиферацию миобластов. Мышцы также секретируют несколько гормонов и активных веществ, влияющих на кость, таких как ИФР-1, остеоглицин, ирисин, остеонектин, фактор роста фибробластов-2, IL-6, IL-15 и миостатин. Миостатин является членом надсемейства бета-трансформирующего фактора роста, экспрессируемого в основном в скелетных мышцах. Изучен его эффект на рост мышц и влияние на кость. Дефицит гена MSTN и системное введение ACVR2B-Fc (inhibitor of the Activin Receptor 2B – блокатора рецептора активина 2B) приводят к гипертрофии мышечной ткани и увеличению костной массы [18]. Мышечная ткань также секретирует декорин, который, связывая миостатин, способствует росту мышечной ткани. Обнаружен и его противоопухолевый эффект. При изучении генетически модифицированных животных с выключенным геном DCN, кодирующим декорин, зафиксирован спонтанный рост опухолей. Однако влияние этого белка на физиологию человека изучено недостаточно.
Постменопаузальная остеосаркопения, развитие которой обусловлено генетическими факторами, изменением состава тела, низкой физической активностью, дефицитом эстрогенов и витамина D, приводит к снижению мышечной массы, силы, функциональных возможностей, а также к снижению МПК, что в сочетании с коморбидностью пожилых пациентов реализуется в увеличении частоты переломов, инвалидизации и смертности [20].
Также существует такое понятие как остеосаркопеническое ожирение, критериями которого являются снижение МПК по Т-критерию ≤-1,0 SD по данным DXA, снижение ИТМ <5,5 кг/м2 для женщин и <7,23 кг/м2 для мужчин, повышение массы жира ≥38% для женщин и ≥28% для мужчин, а также соотношение висцерального/подкожного жирового соотношения >1 (для андроидного типа ожирения) или <1 (для гиноидного типа ожирения). Распространенность остеосаркопенического ожирения, по данным перекрестного исследования в Италии, составила 6,86%, из которых частота гиноидного и андроидного ожирения составила соответственно 2,1% и 4,7%.
В группе пациентов с остеосаркопеническим висцеральным ожирением (по сравнению с другими когортами) отмечен более высокий уровень С-реактивного белка (>2,34 мг/дл), гликемии (>112 мг/дл), а также более высокий риск переломов (FRAX>15%, r=0,316; p<0,05) [22].
САРКОПЕНИЯ И ВИТАМИН D
Установлено, что витамин D играет важную роль в метаболических процессах в мышечной и костной ткани. Так, снижение его уровня на 10 нг/мл приводит к увеличению частоты развития саркопении в 1,5 раза в течение последующих 5 лет. Однако результаты рандомизированных контролируемых исследований не смогли установить патогенетическую роль витамина D в развитии заболеваний мышечной системы [23].
Было показано, что прием витамина D в дозе от 700 до 800 МЕ/день повышает прочность мышц и костей, снижает риск падений, переломов бедренной кости и смертности, однако оптимальная доза приема витамина D все еще остается неопределенной. Европейское общество по клиническим и экономическим аспектам остеопороза, остеоартрита и скелетно-мышечных заболеваний (ESCEO) также оценивает адекватное потребление витамина D в 800 МЕ/день для поддержания сывороточного уровня 25-гидроксивитамина D>30 нг/мл (50 нмоль/л) [18]. Баланс между витамином D и паратиреоидным гормоном (ПТГ) является ключевым регулятором мышечной силы: ПТГ способен модулировать работу мышечной ткани через увеличение внутриклеточного кальция.
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА САРКОПЕНИИ
В настоящее время отсутствует специфическое лечение саркопении, первичной является профилактика. Физические упражнения, особенно постепенно увеличивающиеся силовые нагрузки, являются стимулом для синтеза мышечного белка. Выполнение физических упражнений в течение минимум 20 минут в неделю значительно повышает мышечную и костную массу, силу, снижает функциональные ограничения, предотвращает падения и переломы у пожилых людей. Однако у пациентов с тяжелыми сопутствующими заболеваниями (такими как нейрокогнитивные и сердечные-сосудистые патологии) могут возникнуть сложности в достижении рекомендуемого уровня физической активности [18].
В ходе метаанализа, включившего 37 исследований, 34 рандомизированных клинических исследования, оценивали влияние физических упражнений на мышечную массу у пожилых людей (почти в 80% случаев мышечная масса увеличилась с помощью физических упражнений). Влияние дополнительного питания на мышечную массу было зафиксировано только в 23,5% случаев. Мышечная сила увеличилась в 82,8% исследований после повышения физической активности, а пищевые добавки показали дополнительные преимущества только в небольшом количестве исследований (22,8%). Таким образом, физические упражнения оказывают положительное влияние на мышечную массу и силу или физическую работоспособность у здоровых лиц в возрасте от 60 лет и старше [24].
Белок пищи оказывает косвенное влияние на ключевые регуляторные белки и факторы роста, связанные со здоровьем мышц и костей, за счет увеличения абсорбции кальция, подавления ПТГ и увеличения секреции ИФР-I (костного и мышечного анаболического стимулятора). Потребление белка более 0,8 мг/кг массы тела в день, в основном животного происхождения, усиливает анаболизм мышечного белка наряду с защитой от возрастной потери мышц и костной ткани. У пациентов в возрасте 70–79 лет содержание белка в пище в количестве 1,1 г/кг массы тела в день приводит к отсутствию мышечной потери при 3-летнем наблюдении.
ESCEO рекомендует потребление белка с пищей от 1,0 до 1,2 г/кг массы тела в день, минимум 20–25 г чистого белка в каждой порции. Европейское общество клинического питания и обмена веществ (ESPEN) и Исследовательская группа PROT-AGE рекомендуют такое же потребление белка для здоровых людей старшего возраста, от 1,2 до 1,5 г/кг массы тела в день, а для пациентов с тяжелыми заболеваниями и недостаточным питанием – свыше 2 г/кг в сутки [18]. Пациенты с хронической болезнью почек (ХБП) додиализных стадий для профилактики саркопении должны снизить потребление белка до 0,2–0,5 г/кг в сутки (при СКФ <20 мл/мин/1,73 м²) вследствие возможного развития метаболического ацидоза [25]. Кроме того, потребление белка совместно с физическими упражнениями улучшает синтез мышечного белка и положительно влияет на состав тела, способствуя снижению жировой массы, увеличению или поддержанию мышечной ткани и сохранению кости [18] (табл. 2).
Таблица 2. Рекомендуемое количество потребления белка в сутки различным группам людей.
Критерий | Количество потребляемого белка в сутки, г/кг массы тела |
Здоровые люди старшего возраста | 1,0–1,2 |
Пациенты с острыми и хроническими заболеваниями | 1,2–1,5 |
Саркопения первичная (пожилые пациенты с недостаточным питанием) | свыше 2 |
Пациенты с ХБП С5 (до начала гемодиализа) | 0,2–0,5 |
ХБП С1–3 А2 | не более 1,0 |
ХБП С1–3 А3 | 0,6–0,8 |
ХБП С4 | 0,6–0,8 |
ХБП С5 | 0,2–0,5 |
ХБП С5Д (гемодиализ) | не более 1,2 |
ХБП С5Д (перитонеальный диализ) | не более 1,4 |
ХБП (после трансплантации почки) | 0,8–1,0 |
Таким образом для профилактики развития саркопении следует придерживаться рекомендаций ESCEO об оптимальном потреблении белка c пищей 1,0–1,2 г/кг тела в день с содержанием по меньшей мере 20–25 г белка на каждый основной прием пищи, об адекватном потреблении витамина D 800 МЕ/сут, а также потреблении кальция в дозе 1000 мг/сут в сочетании с регулярными физическими упражнениями 3–5 раз в неделю [26].
Активно изучаются возможности патогенетического лечения саркопении. Рандомизированное клиническое исследование 2 фазы показало, что введение антител к миостатину приводит к увеличению аппендикулярной мышечной массы по сравнению с плацебо. Однако остаются нерешенными вопросы о клинической эффективности и безопасности этого метода лечения, поскольку миостатин также присутствует в сердечной мышечной ткани, его ингибирование потенциально может привести к развитию кардиомиопатии. Исследование антител к миостатину все еще находится в экспериментальной фазе испытаний для оценки эффективности и безопасности данного лечения.
В экспериментальных условиях показано, что ACVR2B/Fc, блокатор рецептора активина 2B, сохраняет мышечную массу и увеличивает костную в животных моделях с несовершенным остеогенезом и мышечной дистрофией [27]. Применение цитруллина (непротеиногенная аминокислота), как показали исследования на крысах и молодых взрослых людях, увеличивает мышечную массу, синтез белка, а также липолиз в адипоцитах [28].
В результате экспериментального введения ГР мышам после длительной иммобилизации конечности наблюдалось увеличение мышечной массы, а введение ПТГ привело к улучшению микроархитектоники костей, повышению МПК. Комбинированная терапия ГР и ПТГ оказала более выраженное влияние на параметры костной ткани, не улучшив при этом показатели мышечной массы по сравнению с монотерапией ГР. Однако клинические исследования, проведенные на людях, не дали ожидаемого результата и по применению ГР: мышечная масса увеличилась незначительно [29].
Различные другие фармакологические препараты, такие как тестостерон, ИФР-1, витамин D, ПТГ и т.д., оцениваются как потенциальные средства для лечения саркопении, однако необходимый эффект не был достигнут [18]. Таким образом, в настоящее время можно говорить только о профилактике данного состояния, в которую входят адекватные физические нагрузки и питание с достаточным потреблением белка.
ЗАКЛЮЧЕНИЕ
Наиболее изученным последствием саркопении является повышение смертности: метаанализ 17 исследований показал, что риск смерти в 4 раза выше у пациентов с саркопенией, риск снижения функциональных возможностей мышц или инвалидности в 3 раза выше, чем у лиц того же возраста без данного синдрома [3]. Это подчеркивает клиническую и социальную значимость саркопении, необходимость тщательного изучения данного состояния, поиск ее предикторов и эффективного лечения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Данная статья является репринтом:
Мокрышева Н.Г., Крупинова Ю.А., Володичева В.Л., Мирная С.С., Мельниченко Г.А. Саркопения глазами эндокринолога // Ожирение и метаболизм. — 2018. — Т. 15. — №.3 — С. 21-27. doi: 10.14341/OMET9792
1. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010;39(4):412-423. doi: 10.1093/ageing/afq034.
2. Rosenberg I.H. Epidemiologic and methodologic problems in determining nutritional status of older persons. Proceedings of a conference. Albuquerque, New Mexico, October 19-21, 1988. Am. J. Clin. Nutr. 1989;50(5 Suppl):1121-1235.
3. Wright JM, Beaudart C, Zaaria M, et al. Health Outcomes of Sarcopenia: A Systematic Review and Meta-Analysis. PLoS One. 2017;12(1):e0169548. doi: 10.1371/journal.pone.0169548.
4. Morley JE, Anker SD, von Haehling S. Prevalence, incidence, and clinical impact of sarcopenia: facts, numbers, and epidemiology-update 2014. Journal of Cachexia, Sarcopenia and Muscle. 2014;5(4):253-259. doi: 10.1007/s13539-014-0161-y.
5. Safonova Y, Zotkin E, Lila A. Prevalence of sarcopenia in elderly northwestern region of the Russian Federation. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. p. 238. doi: 10.13140/RG.2.2.22677.01768
6. Scott D. Reducing the burden of sarcopenia: a healthy lifestyle throughout the lifetime D. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. p. 99.
7. Tan L-J, Liu S-L, Lei S-F, et al. Molecular genetic studies of gene identification for sarcopenia. Hum. Genet. 2011;131(1):1-31. doi: 10.1007/s00439-011-1040-7.
8. Ali S, Garcia JM. Sarcopenia, Cachexia and Aging: Diagnosis, Mechanisms and Therapeutic Options — A Mini-Review. Gerontology. 2014;60(4):294-305. doi: 10.1159/000356760.
9. Sayer AA, Robinson SM, Patel HP, et al. New horizons in the pathogenesis, diagnosis and management of sarcopenia. Age Ageing. 2013;42(2):145-150. doi: 10.1093/ageing/afs191.
10. Picca A, Calvani R, Bossola M, et al. Update on mitochondria and muscle aging: all wrong roads lead to sarcopenia. Biol. Chem. 2018;399(5):421-436. doi: 10.1515/hsz-2017-0331.
11. Radic M. Autoimmune sarcopenia – current knowledge and perspective. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 135
12. Barnouin Y, McPhee JS, Butler-Browne G, et al. Coupling between skeletal muscle fiber size and capillarization is maintained during healthy aging. Journal of Cachexia, Sarcopenia and Muscle. 2017;8(4):647-659. doi: 10.1002/jcsm.12194.
13. Ji H-M, Han J, Won Y-Y. Sarcopenia and Osteoporosis. Hip & Pelvis. 2015;27(2):72. doi: 10.5371/hp.2015.27.2.72.
14. Турушева А.В., Фролова Е.В., Дегриз Я.-М. Расчет возрастных норм результатов кистевой динамометрии для здоровых людей старше 65 лет в Северо-Западном регионе России: результаты проспективного когортного исследования «Хрусталь» // Российский семейный врач. – 2017. – Т. 21. – №4. – С. 29-35. [Turusheva AV, Frolova EV, Degryse J-M. Development of reference ranges of handgrip strength among healthy adults 65+ in Northwest Russia: a prospective population-based cohort Crystal study. Russian Family Doctor. 2017;21(4):29-35. (In Russ.)] doi: 10.17816/rfd2017429-35.
15. Bauer J. M. Principles for the standardization of the assessment of muscle strength and power. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 75.
16. Rolland Y, Czerwinski S, van Kan GA, et al. Sarcopenia: Its assessment, etiology, pathogenesis, consequences and future perspectives. The Journal of Nutrition Health and Aging. 2008;12(7):433-450. doi: 10.1007/bf02982704.
17. Carnevale V, Castriotta V, Piscitelli PA, et al. Assessment of Skeletal Muscle Mass in Older People: Comparison Between 2 Anthropometry-Based Methods and Dual-Energy X-ray Absorptiometry. J. Am. Med. Dir. Assoc. 2018;19(9):793-796. doi: 10.1016/j.jamda.2018.05.016.
18. Hirschfeld HP, Kinsella R, Duque G. Osteosarcopenia: where bone, muscle, and fat collide. Osteoporos. Int. 2017;28(10):2781-2790. doi: 10.1007/s00198-017-4151-8.
19. Frisoli A. Clinical and biochemical phenotype of osteosarcopenia. WCO-IOF-ESCEO World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2017 March 23-26, Florence, Italy. Springer; 2017. р.106.
20. Sirola J, Kröger H. Similarities in Acquired Factors Related to Postmenopausal Osteoporosis and Sarcopenia. Journal of Osteoporosis. 2011;2011:1-14. doi: 10.4061/2011/536735.
21. Trierweiler H, Kisielewicz G, Hoffmann Jonasson T, et al. Sarcopenia: a chronic complication of type 2 diabetes mellitus. Diabetol. Metab. Syndr. 2018;10(1). doi: 10.1186/s13098-018-0326-5.
22. Perna S, Spadaccini D, Nichetti M, et al. Osteosarcopenic Visceral Obesity and Osteosarcopenic Subcutaneous Obesity, Two New Phenotypes of Sarcopenia: Prevalence, Metabolic Profile, and Risk Factors. Journal of Aging Research. 2018;2018:1-8. doi: 10.1155/2018/6147426.
23. Bruyère O. Vitamin D and muscle function. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.124.
24. Beaudart C. Outcomes of the IOF-ESCEO sarcopenia working groups. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.77-78.
25. National Kidney F. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am. J. Kidney Dis. 2003;42(4 Suppl 3):S1-201.
26. Reginster J.-Y. Dairy products in the prevention and treatment of sarcopenia: outcomes of the ESCEO Working Groups. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р. 78.
27. Barreto R, Kitase Y, Matsumoto T, et al. ACVR2B/Fc counteracts chemotherapy-induced loss of muscle and bone mass. Sci. Rep. 2017;7(1). doi: 10.1038/s41598-017-15040-1.
28. Aubertin-Leheudre M. Citruline and muscle function. WCO-IOF-ESCEO. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases; 2018 April 19-22, Krakow, Poland. Springer; 2018. р.124.
29. Brent MB, Brüel A, Thomsen JS. PTH (1–34) and growth hormone in prevention of disuse osteopenia and sarcopenia in rats. Bone. 2018;110:244-253. doi: 10.1016/j.bone.2018.02.017.
Мышечная атрофия и гипертрофия | Фитнес и здоровье на всю жизнь
Атрофия мышц — уменьшение мышечной массы; мышечная гипертрофия — это увеличение мышечной массы за счет увеличения размера мышечных клеток.
ЦЕЛЬ ОБУЧЕНИЯ
К концу этого раздела вы сможете:
- Различия между мышечной атрофией и гипертрофией
Ключевые выводы
Ключевые моменты
- Атрофия мышц означает уменьшение мышечной массы, ведущее к мышечной слабости или снижению способности создавать силу.
- Атрофия возникает по нескольким причинам, включая болезнь, голод и простое неиспользование.
- Гипертрофия мышц отличается от гиперплазии мышц, которая представляет собой образование новых мышечных клеток.
- Ряд стимулов может вызвать гипертрофию мышечных клеток, включая силовые или анаэробные тренировки.
- Биологические факторы, такие как возраст и питание, могут влиять на гипертрофию мышц.
Глоссарий
атрофия : увядать или истощаться.
дистрофия : истощение тканей тела генетического происхождения или из-за неадекватного или неполноценного питания.
саркопения : Возрастная потеря скелетных мышц, приводящая к слабости. Часто обнаруживается вместе с остеопорозом, потерей костной ткани, которая также связана с процессом старения.
Мышечная атрофия — это снижение мышечной силы из-за уменьшения мышечной массы или количества мышечных волокон. Атрофия может быть частичной или полной, различающейся степенью мышечной слабости.Атрофия мышц часто является результатом таких заболеваний, как рак, СПИД, застойная сердечная недостаточность, хроническая обструктивная болезнь легких, почечная недостаточность и ожоги. Голодание также может привести к атрофии мышц. Простое неиспользование мышц из-за малоподвижного образа жизни или из-за постельного режима также может вызвать атрофию мышц.
Атрофия мышц в некоторой степени типична при старении. Атрофия со временем из-за старения известна как саркопения. Хотя это не совсем ясно, предполагается, что причиной саркопении является сочетание снижения количества сателлитных клеток для регенерации клеток волокон скелетных мышц, а также снижение чувствительности или доступности гормонов, включая факторы роста, которые стимулируют поддерживающие мышцы через регенерация клеток мышечных волокон из клеток-сателлитов.
Потеря мышечной массы не из-за атрофии или саркопении свидетельствует о заболеваниях, которые приводят к структурным дефектам мышц (мышечная дистрофия) или аутоиммунным реакциям, ухудшающим структуру мышц (миопатии).
Гипертрофия мышц — это увеличение размера мышцы за счет увеличения размера составляющих ее клеток. Он отличается от гиперплазии мышц, то есть образования новых мышечных клеток. В зависимости от типа тренировки гипертрофия может происходить из-за увеличения объема саркоплазмы или увеличения сократительных белков.
Ряд стимулов может увеличить объем мышечных клеток, в том числе силовая тренировка или анаэробная тренировка. Эти изменения происходят как адаптивная реакция, которая увеличивает способность создавать силу или противостоять утомлению в анаэробных условиях.
Несколько биологических факторов, таких как возраст и питание, могут влиять на гипертрофию мышц. В период полового созревания у мужчин гипертрофия происходит с повышенной скоростью. Естественная гипертрофия обычно прекращается при полном росте в позднем подростковом возрасте. Достаточное количество аминокислот необходимо для гипертрофии мышц.Поскольку тестостерон является одним из основных гормонов роста организма, в среднем мужчинам легче достичь гипертрофии, чем женщинам. Дополнительный прием тестостерона, как и в случае с анаболическими стероидами, улучшит результаты. Он также считается препаратом для повышения производительности, использование которого может привести к отстранению участников или запрету на участие в соревнованиях. Кроме того, в большинстве стран тестостерон является регулируемым медицинским веществом, поэтому его хранение без рецепта является незаконным.
Нормальные и атрофированные саркомеры: схема расположения волокон в нормальных функциональных саркомерах в сравнении с атрофированными саркомерами после 17-дневного космического полета
Мышечная атрофия и гипертрофия | Персональный фитнес-тренинг
Мышечная атрофия — это снижение мышечной силы из-за уменьшения мышечной массы или количества мышечных волокон.Атрофия может быть частичной или полной, различающейся степенью мышечной слабости. Атрофия мышц часто является результатом таких заболеваний, как рак, СПИД, застойная сердечная недостаточность, хроническая обструктивная болезнь легких, почечная недостаточность и ожоги. Голодание также может привести к атрофии мышц. Простое неиспользование мышц из-за малоподвижного образа жизни или из-за постельного режима также может вызвать атрофию мышц.
Атрофия мышц в некоторой степени типична при старении. Атрофия со временем из-за старения известна как саркопения.Хотя это не совсем ясно, предполагается, что причиной саркопении является сочетание снижения количества сателлитных клеток для регенерации клеток волокон скелетных мышц, а также снижение чувствительности или доступности гормонов, включая факторы роста, которые стимулируют поддерживающие мышцы через регенерация клеток мышечных волокон из клеток-сателлитов.
Потеря мышечной массы не из-за атрофии или саркопении свидетельствует о заболеваниях, которые приводят к структурным дефектам мышц (мышечная дистрофия) или аутоиммунным реакциям, ухудшающим структуру мышц (миопатии).
Гипертрофия мышц — это увеличение размера мышцы за счет увеличения размера составляющих ее клеток. Он отличается от гиперплазии мышц, то есть образования новых мышечных клеток. В зависимости от типа тренировки гипертрофия может происходить из-за увеличения объема саркоплазмы или увеличения сократительных белков.
Ряд стимулов может увеличить объем мышечных клеток, в том числе силовая тренировка или анаэробная тренировка. Эти изменения происходят как адаптивная реакция, которая увеличивает способность создавать силу или противостоять утомлению в анаэробных условиях.
Несколько биологических факторов, таких как возраст и питание, могут влиять на гипертрофию мышц. В период полового созревания у мужчин гипертрофия происходит с повышенной скоростью. Естественная гипертрофия обычно прекращается при полном росте в позднем подростковом возрасте. Достаточное количество аминокислот необходимо для гипертрофии мышц. Поскольку тестостерон является одним из основных гормонов роста организма, в среднем мужчинам легче достичь гипертрофии, чем женщинам. Дополнительный прием тестостерона, как и в случае с анаболическими стероидами, улучшит результаты.Он также считается препаратом для повышения производительности, использование которого может привести к отстранению участников или запрету на участие в соревнованиях. Кроме того, в большинстве стран тестостерон является регулируемым медицинским веществом, поэтому его хранение без рецепта является незаконным.
Нормальные и атрофированные саркомеры: схема расположения волокон в нормальных функциональных саркомерах в сравнении с атрофированными саркомерами после 17-дневного космического полета
Механизмы атрофии и гипертрофии мышц: последствия для здоровья и болезней
Баскин, К. К., Виндерс, Б. Р. и Олсон, Э. Н. Мышцы как «посредник» системного метаболизма. Cell Metab. 21 , 237–248 (2015).
CAS PubMed PubMed Central Статья Google ученый
Sandri, M. et al. PGC-1alpha защищает скелетные мышцы от атрофии, подавляя действие FoxO3 и транскрипцию специфичных для атрофии генов. Proc. Natl Acad. Sci. США 103 , 16260–16265 (2006).
ADS CAS PubMed Статья PubMed Central Google ученый
Brocca, L. et al. FoxO-зависимые атрогены различаются в зависимости от катаболических состояний и играют ключевую роль в атрофии мышц, вызванной подвешиванием задних конечностей. J. Physiol. 595 , 1143–1158 (2017).
CAS PubMed Статья PubMed Central Google ученый
Grumati, P. et al. Физические упражнения стимулируют аутофагию в нормальных скелетных мышцах, но вредны для мышц с дефицитом коллагена VI. Аутофагия 7 , 1415–1423 (2011).
CAS PubMed PubMed Central Статья Google ученый
Лю, Г. Ю. и Сабатини, Д. М. mTOR на стыке питания, роста, старения и болезней. Nat. Rev. Mol. Cell Biol. 21 , 183–203 (2020).
CAS PubMed Статья PubMed Central Google ученый
Musaro, A. et al. Локальная экспрессия трансгена Igf-1 поддерживает гипертрофию и регенерацию стареющих скелетных мышц. Nat. Genet. 27 , 195–200 (2001).
CAS PubMed Статья PubMed Central Google ученый
Ascenzi, F. et al.Влияние изоформ IGF-1 на рост мышц и саркопению. Ячейка старения 18 , e12954 (2019).
PubMed PubMed Central Статья CAS Google ученый
Murgia, M. et al. Ras участвует в зависимой от нервной активности регуляции мышечных генов. Nat. Cell Biol. 2 , 142–147 (2000).
CAS PubMed Статья PubMed Central Google ученый
Pallafacchina, G., Calabria, E., Serrano, A. L., Kalhovde, J. M. & Schiaffino, S. Зависимый от протеинкиназы B и чувствительный к рапамицину путь контролирует рост скелетных мышц, но не определяет тип волокна. Proc. Natl Acad. Sci. США 99 , 9213–9218 (2002).
ADS CAS PubMed Статья PubMed Central Google ученый
Blaauw, B. et al. Индуцируемая активация Akt увеличивает массу и силу скелетных мышц без активации сателлитных клеток. Faseb J. 23 , 3896–3905 (2009).
CAS PubMed Статья Google ученый
Bentzinger, C. F. et al. Специфическое для скелетных мышц удаление хищника, но не риктора, вызывает метаболические изменения и приводит к мышечной дистрофии. Cell Metab. 8 , 411–424 (2008).
CAS PubMed Статья Google ученый
Risson, V. et al. Мышечная инактивация mTOR вызывает метаболические и дистрофиновые дефекты, приводящие к тяжелой миопатии. J. Cell Biol. 187 , 859–874 (2009).
CAS PubMed PubMed Central Статья Google ученый
You, J. S. et al. Роль хищника в индуцированной механической нагрузкой регуляции передачи сигналов mTOR, синтеза белка и гипертрофии скелетных мышц. FASEB J. 33 , 4021–4034 (2019).
CAS PubMed Статья Google ученый
Zhang, Q. et al. Недостаток мышечной активности киназы mTOR вызывает раннее начало миопатии и нарушает гомеостаз всего тела. J. Cachexia Sarcopenia Muscle 10 , 35–53 (2019).
PubMed Статья Google ученый
Castets, P. et al. Устойчивая активация mTORC1 в скелетных мышцах подавляет конститутивную аутофагию и аутофагию, вызванную голоданием, и вызывает тяжелую миопатию с поздним началом. Cell Metab. 17 , 731–744 (2013).
CAS PubMed Статья Google ученый
Макферрон А.С., Лоулер А.М. и Ли С.Дж. Регулирование массы скелетных мышц у мышей новым членом суперсемейства TGF-бета. Nature 387 , 83–90 (1997).
ADS CAS PubMed Статья Google ученый
Sartori, R. et al. Факторы транскрипции Smad2 и 3 контролируют мышечную массу в зрелом возрасте. Am. J. Physiol. Cell Physiol. 296 , C1248 – C1257 (2009).
CAS PubMed Статья Google ученый
Winbanks, C.E. et al. Фоллистатин-опосредованная гипертрофия скелетных мышц регулируется Smad3 и mTOR независимо от миостатина. J. Cell Biol. 197 , 997–1008 (2012).
CAS PubMed PubMed Central Статья Google ученый
Sartori, R. et al. Передача сигналов BMP контролирует мышечную массу. Nat. Genet. 45 , 1309–1318 (2013).
CAS PubMed Статья Google ученый
Траоре М. и др. Эмбриональная изоформа CaVbeta1 способствует поддержанию мышечной массы посредством передачи сигналов GDF5 у взрослых мышей. Sci. Пер. Med. 11 , eaaw1131 (2019).
CAS PubMed Статья Google ученый
Winbanks, C.E. et al. Доставка гена Smad7 предотвращает мышечное истощение, связанное с раковой кахексией у мышей. Sci. Пер. Med. 8 , 348ra398 (2016).
Артикул CAS Google ученый
Дэви, Дж.R. et al. Комплексный анализ экспрессии мышечной гипертрофии определяет Asb2 как негативный регулятор мышечной массы. JCI Insight 1 , e85477 (2016).
PubMed PubMed Central Статья Google ученый
Winbanks, C.E. et al. Ось костного морфогенетического белка является положительным регулятором массы скелетных мышц. J. Cell Biol. 203 , 345–357 (2013).
CAS PubMed PubMed Central Статья Google ученый
Клайн, В. О., Панаро, Ф. Дж., Янг, Х. и Бодин, С. С. Рапамицин подавляет рост и эффекты кленбутерола в отношении сохранения мышц. J. Appl. Physiol. 102 , 740–747 (2007).
CAS PubMed Статья Google ученый
Goncalves, D. A. et al. Передача сигналов инсулина / IGF1 опосредует эффекты бета2-адренергического агониста на протеостаз и рост мышц. J. Cachexia Sarcopenia Muscle 10 , 455–475 (2019).
PubMed PubMed Central Статья Google ученый
Benoit, B. et al. Фактор роста фибробластов 19 регулирует массу скелетных мышц и уменьшает мышечное истощение у мышей. Nat. Med. 23 , 990–996 (2017).
CAS PubMed Статья Google ученый
Ост, Л. Дж., Кустерманн, М., Армани, А., Блаау, Б. и Романелло, В.Фактор роста фибробластов 21 контролирует митофагию и мышечную массу. J. Cachexia Sarcopenia Muscle 10 , 630–642 (2019).
PubMed PubMed Central Статья Google ученый
Коэн, С., Ли, Д., Чжай, Б., Гайги, С. П. и Голдберг, А. Л. Trim32 снижает передачу сигналов PI3K-Akt-FoxO при мышечной атрофии, способствуя диссоциации плакоглобина-PI3K. J. Cell Biol. 204 , 747–758 (2014).
CAS PubMed PubMed Central Статья Google ученый
Summermatter, S. et al. Блокада металлотионеинов 1 и 2 увеличивает массу и силу скелетных мышц. Мол. Cell Biol. 37 , e00305-16 (2017).
Wang, G. et al. Метастатический рак способствует кахексии за счет активации ZIP14 в скелетных мышцах. Nat. Med. 24 , 770–781 (2018).
CAS PubMed PubMed Central Статья Google ученый
Mammucari, C. et al. Митохондриальный унипортер кальция контролирует трофику скелетных мышц in vivo. Cell Rep. 10 , 1269–1279 (2015).
CAS PubMed PubMed Central Статья Google ученый
Ruas, J. L. et al. Изоформа PGC-1альфа, индуцированная тренировкой с отягощениями, регулирует гипертрофию скелетных мышц. Ячейка 151 , 1319–1331 (2012).
CAS PubMed PubMed Central Статья Google ученый
White, J. P. et al. Рецептор 56, связанный с G-белком, регулирует гипертрофию мышц, вызванную механической перегрузкой. Proc. Natl Acad. Sci. США 111 , 15756–15761 (2014).
ADS CAS PubMed Статья Google ученый
Das, S. et al. Цитратлиаза АТФ улучшает функцию митохондрий в скелетных мышцах. Cell Metab. 21 , 868–876 (2015).
CAS PubMed Статья Google ученый
Cai, X. et al. Альфа-кетоглутарат способствует гипертрофии скелетных мышц и синтезу белка через сигнальные пути Akt / mTOR. Sci. Отчетность 6 , 26802 (2016).
ADS CAS PubMed PubMed Central Статья Google ученый
Lahiri, S. et al. Микробиота кишечника влияет на массу и функцию скелетных мышц у мышей. Sci. Пер. Med. 11 , eaan5662 (2019).
Hunt, L.C. et al. Ключевая роль убиквитинлигазы UBR4 в гипертрофии миофибрилл у дрозофилы и мышей. Cell Rep. 28 , 1268–1281 e1266 (2019).
CAS PubMed PubMed Central Статья Google ученый
Conte, M. et al. Мышечно-специфическое подавление перилипина2 влияет на метаболизм липидов и вызывает гипертрофию миофибрилл. J. Cachexia Sarcopenia Muscle 10 , 95–110 (2019).
PubMed Статья Google ученый
Bodine, S.C. et al. Идентификация убиквитинлигаз, необходимых для атрофии скелетных мышц. Наука 294 , 1704–1708 (2001).
ADS CAS PubMed Статья Google ученый
Pankiv, S. et al. p62 / SQSTM1 связывается непосредственно с Atg8 / LC3, облегчая деградацию убиквитинированных белковых агрегатов за счет аутофагии. J. Biol. Chem. 282 , 24131–24145 (2007).
CAS PubMed Статья Google ученый
Сандри, М. Распад белка при истощении мышц: роль аутофагии-лизосомы и убиквитин-протеасомы. Внутр. J. Biochem Cell Biol. 45 , 2121–2129 (2013).
CAS PubMed PubMed Central Статья Google ученый
Коэн, С., Натан, Дж. А. и Голдберг, А. Л. Мышечное истощение при болезни: молекулярные механизмы и перспективные методы лечения. Nat. Rev. Drug Discov. 14 , 58–74 (2015).
CAS PubMed Статья Google ученый
Cadena, S. M. et al. Скелетные мышцы мышей, нулевых по MuRF1, не защищены в условиях низкой гравитации, что указывает на то, что атрофия происходит с помощью уникальных механизмов в космосе. Sci. Отчетность 9 , 9397 (2019).
ADS PubMed PubMed Central Статья CAS Google ученый
Баер, Л. М., Ферлоу, Дж. Д. и Бодин, С. С. Сохранение мускулов в мышцах Нулевых мышей RING finger 1: ответ на синтетические глюкокортикоиды. J. Physiol. 589 , 4759–4776 (2011).
CAS PubMed PubMed Central Статья Google ученый
Хви, Д. Т., Баер, Л. М., Филп, А., Баар, К. и Бодин, С. С. Поддержание мышечной массы и индуцированный нагрузкой рост в мышцах нулевых мышей RING Finger 1 с возрастом. Ячейка старения 13 , 92–101 (2014).
CAS PubMed Статья PubMed Central Google ученый
Sandri, M. et al. Сигнальные пути, регулирующие мышечную массу в стареющих скелетных мышцах. Роль пути IGF1-Akt-mTOR-FoxO. Биогеронтология 14 , 303–323 (2013).
CAS PubMed Статья PubMed Central Google ученый
Cohen, S., Zhai, B., Gygi, S.P. & Goldberg, A.L. Убиквитилирование с помощью Trim32 вызывает сопряженную потерю десмина, Z-полос и тонких нитей при атрофии мышц. J. Cell Biol. 198 , 575–589 (2012).
CAS PubMed PubMed Central Статья Google ученый
Di Rienzo, M. et al. Для индукции аутофагии в атрофических мышечных клетках требуется активация ULK1 с помощью TRIM32 через незакрепленные цепи полиубиквитина, связанные с K63. Sci. Adv. 5 , eaau8857 (2019).
ADS CAS PubMed PubMed Central Статья Google ученый
Paul, P. K. et al. Целенаправленное удаление TRAF6 подавляет истощение скелетных мышц у мышей. J. Cell Biol. 191 , 1395–1411 (2010).
CAS PubMed PubMed Central Статья Google ученый
Paul, P. K. et al. Убиквитинлигаза E3 TRAF6 вмешивается в вызванную голоданием атрофию скелетных мышц посредством множества механизмов. Мол. Cell Biol. 32 , 1248–1259 (2012).
CAS PubMed PubMed Central Статья Google ученый
Carnio, S.и другие. Нарушение аутофагии в мышцах вызывает дегенерацию нервно-мышечных соединений и преждевременное старение. Cell Rep. 8 , 1509–1521 (2014).
CAS PubMed PubMed Central Статья Google ученый
Bujak, A. L. et al. AMPK-активация мышечной аутофагии предотвращает гипогликемию и миопатию, вызванные голоданием, во время старения. Cell Metab. 21 , 883–890 (2015).
CAS PubMed PubMed Central Статья Google ученый
Raben, N. et al. Подавление аутофагии в скелетных мышцах раскрывает накопление убиквитинированных белков и их потенциальную роль в повреждении мышц при болезни Помпе. Hum. Мол. Genet. 17 , 3897–3908 (2008).
CAS PubMed PubMed Central Статья Google ученый
Немазаный И.И. и др. Дефекты Vps15 в скелетных мышцах приводят к аутофагической вакуолярной миопатии и лизосомной болезни. EMBO Mol. Med. 5 , 870–890 (2013).
CAS PubMed PubMed Central Статья Google ученый
Fuqua, J. D. et al. ULK2 необходим для деградации убиквитинированных белковых агрегатов и гомеостаза в скелетных мышцах. FASEB J 33 , 11735–12745 (2019).
Ryu, D. et al. Уролитин А вызывает митофагию и увеличивает продолжительность жизни у C.elegans и увеличивает мышечную функцию у грызунов. Nat. Med. 22 , 879–888 (2016).
CAS PubMed Статья Google ученый
Milan, G. et al. Регулирование аутофагии и убиквитин-протеасомной системы транскрипционной сетью FoxO во время мышечной атрофии. Nat. Commun. 6 , 6670 (2015).
ADS CAS PubMed PubMed Central Статья Google ученый
Ли Д., Такаяма С. и Голдберг А. Л. ZFAND5 / ZNF216 является активатором протеасомы 26S, который стимулирует общую деградацию белка. Proc. Natl Acad. Sci. США 115 , E9550 – E9559 (2018).
CAS PubMed Статья Google ученый
VerPlank, J. J. S., Lokireddy, S., Zhao, J. & Goldberg, A. L. 26S протеасомы быстро активируются различными гормонами и физиологическими состояниями, которые повышают цАМФ и вызывают фосфорилирование Rpn6. Proc. Natl Acad. Sci. США 116 , 4228–4237 (2019).
Piccirillo, R. & Goldberg, A. L. АТФаза p97 / VCP имеет решающее значение при атрофии мышц и ускоренной деградации мышечных белков. EMBO J. 31 , 3334–3350 (2012).
CAS PubMed PubMed Central Статья Google ученый
Wang, C. et al. Метилтрансферазоподобный 21c метилирует и стабилизирует белок теплового шока Hspa8 в миофибриллах I типа у мышей. J. Biol. Chem. 294 , 13718–13728 (2019).
CAS PubMed PubMed Central Статья Google ученый
Wiederstein, J. L. et al. Метилтрансфераза METTL21C, специфичная для скелетных мышц, триметилирует p97 и регулирует распад белка, связанный с аутофагией. Cell Rep. 23 , 1342–1356 (2018).
CAS PubMed Статья Google ученый
O’Neill, B.T. et al. Факторы транскрипции FoxO являются критическими регуляторами мышечной атрофии, связанной с диабетом. Диабет 68 , 556–570 (2019).
PubMed Статья CAS Google ученый
Segales, J. et al. Сестрин предотвращает атрофию вышедших из употребления и стареющих мышц, интегрируя анаболические и катаболические сигналы. Nat. Commun. 11 , 189 (2020).
ADS CAS PubMed PubMed Central Статья Google ученый
Beharry, A. W. et al. HDAC1 активирует FoxO и является достаточным и необходимым для атрофии скелетных мышц. J. Cell Sci. 127 , 1441–1453 (2014).
CAS PubMed PubMed Central Статья Google ученый
Бертаджа Э., Колетто Л. и Сандри М. Посттрансляционные модификации контролируют активность FoxO3 во время денервации. Am. J. Physiol. Cell Physiol. 302 , C587 – C596 (2012).
CAS PubMed Статья Google ученый
Браулт, Дж. Дж., Джесперсен, Дж. Г. и Голдберг, А. Л. Гамма-коактиватор рецептора, активируемого пролифератором пероксисом, гиперэкспрессия 1альфа или 1бета ингибирует деградацию мышечного белка, индукцию убиквитинлигаз и атрофию неиспользования. J. Biol. Chem. 285 , 19460–19471 (2010).
CAS PubMed PubMed Central Статья Google ученый
Raffaello, A. et al. Фактор транскрипции JunB поддерживает массу скелетных мышц и способствует гипертрофии. J. Cell Biol. 191 , 101–113 (2010).
CAS PubMed PubMed Central Статья Google ученый
Yin, J. et al. Dkk3-зависимая регуляция транскрипции контролирует возрастную атрофию скелетных мышц. Nat. Commun. 9 , 1752 (2018).
ADS PubMed PubMed Central Статья CAS Google ученый
Shimizu, N. et al. Перекрестные помехи между рецептором глюкокортикоидов и датчиком питания mTOR в скелетных мышцах. Cell Metab. 13 , 170–182 (2011).
CAS PubMed Статья Google ученый
Cai, D. et al. Активация IKKbeta / NF-kappaB вызывает тяжелое мышечное истощение у мышей. Cell 119 , 285–298 (2004).
CAS PubMed Статья Google ученый
Mittal, A. et al. Система TWEAK-Fn14 является критическим регулятором вызванной денервацией атрофии скелетных мышц у мышей. J. Cell Biol. 188 , 833–849 (2010).
CAS PubMed PubMed Central Статья Google ученый
Bonetto, A. et al. Ингибирование пути JAK / STAT3 блокирует истощение скелетных мышц ниже IL-6 и при экспериментальной раковой кахексии. Am. J. Physiol. Эндокринол.Метаб. 303 , E410 – E421 (2012).
CAS PubMed PubMed Central Статья Google ученый
Эберт, С. М. и др. Вызванная стрессом экспрессия Gadd45a в скелетных мышцах перепрограммирует миоядра и вызывает атрофию мышц. J. Biol. Chem. 287 , 27290–27301 (2012).
CAS PubMed PubMed Central Статья Google ученый
Gallot, Y. S. et al. PERK регулирует массу скелетных мышц и сократительную функцию у взрослых мышей. FASEB J. 33 , 1946–1962 (2019).
CAS PubMed Статья Google ученый
Bohnert, K. R. et al. Ось передачи сигналов toll-подобного рецептора / MyD88 / XBP1 опосредует истощение скелетных мышц во время раковой кахексии. Мол. Ячейка Биол . 39 , e00184-19 (2019).
Tezze, C. et al. Связанная с возрастом потеря OPA1 в мышцах влияет на мышечную массу, метаболический гомеостаз, системное воспаление и старение эпителия. Cell Metab. 25 , 1374–1389 e1376 (2017).
CAS PubMed PubMed Central Статья Google ученый
Favaro, G. et al. DRP1-опосредованная форма митохондрий контролирует гомеостаз кальция и мышечную массу. Nat. Commun. 10 , 2576 (2019).
ADS PubMed PubMed Central Статья CAS Google ученый
Choi, S. et al. Специфическая для скелетных мышц делеция Prmt1 вызывает атрофию мышц за счет нарушения регуляции оси PRMT6-FOXO3. Аутофагия 15 , 1069–1081 (2019).
CAS PubMed PubMed Central Статья Google ученый
Сегатто, М.и другие. Эпигенетическое нацеливание на белок бромодомена BRD4 противодействует раковой кахексии и продлевает выживаемость. Nat. Commun. 8 , 1707 (2017).
ADS PubMed PubMed Central Статья CAS Google ученый
Bowman, C.J., Ayer, D. E. и Dynlacht, B. D. Белки Foxk подавляют запуск программ атрофии и аутофагии, вызванных голоданием. Nat. Cell Biol. 16 , 1202–1214 (2014).
CAS PubMed PubMed Central Статья Google ученый
Sun, L. et al. Длинная некодирующая РНК Atrolnc-1 способствует истощению мышц у мышей с хроническим заболеванием почек. J. Cachexia Sarcopenia Muscle 9 , 962–974 (2018).
PubMed PubMed Central Статья Google ученый
Kravic, B. et al. В скелетных мышцах млекопитающих фосфорилирование TOMM22 протеинкиназой CSNK2 / CK2 контролирует митофагию. Аутофагия 14 , 311–335 (2018).
CAS PubMed PubMed Central Статья Google ученый
Pin, F. et al. PDK4 вызывает метаболические изменения и атрофию мышц при раковой кахексии. FASEB J. 33 , 7778–7790 (2019).
CAS PubMed PubMed Central Статья Google ученый
He, W. A. et al. Опосредованная NF-kappaB нарушение регуляции Pax7 в мышечном микроокружении способствует раковой кахексии. J. Clin. Расследование. 123 , 4821–4835 (2013).
CAS PubMed Статья Google ученый
Parajuli, P. et al. Активация Twist1 в мышечных клетках-предшественниках вызывает потерю мышечной массы, подобную раковой кахексии. Dev. Ячейка 45 , 712–725 e716 (2018).
CAS PubMed PubMed Central Статья Google ученый
Madaro, L. et al. Активированная денервацией передача сигналов STAT3-IL-6 в фибро-адипогенных предшественниках способствует атрофии и фиброзу миофибрилл. Nat. Cell Biol. 20 , 917–927 (2018).
CAS PubMed PubMed Central Статья Google ученый
Zhang, G. et al. Опухоль вызывает истощение мышц у мышей за счет высвобождения внеклеточных Hsp70 и Hsp90. Nat. Commun. 8 , 589 (2017).
ADS PubMed PubMed Central Статья CAS Google ученый
Ekelund, U. et al. Уменьшает ли физическая активность или даже устраняет вредную связь времени сидения со смертностью? Гармонизированный мета-анализ данных более чем 1 миллиона мужчин и женщин. Ланцет 388 , 1302–1310 (2016).
Артикул Google ученый
Чакраварти, Э. Ф., Хуберт, Х. Б., Лингала, В. Б. и Фрис, Дж. Ф. Снижение инвалидности и смертности среди стареющих бегунов: 21-летнее продольное исследование. Arch. Междунар. Med. 168 , 1638–1646 (2008).
PubMed PubMed Central Статья Google ученый
Hall, D. T. et al. Агонист AMPK 5-аминоимидазол-4-карбоксамид рибонуклеотид (AICAR), но не метформин, предотвращает связанное с воспалением кахектическое истощение мышц. EMBO Mol. Med. 10 , e8307 (2018).
PubMed PubMed Central Статья CAS Google ученый
Mills, K. F. et al. Длительное введение никотинамидмононуклеотида снижает физиологический спад у мышей, связанный с возрастом. Cell Metab. 24 , 795–806 (2016).
CAS PubMed PubMed Central Статья Google ученый
Wagner, K. R. et al. Испытание фазы I / II MYO-029 у взрослых с мышечной дистрофией. Ann. Neurol. 63 , 561–571 (2008).
CAS PubMed Статья Google ученый
Golan, T. et al. LY2495655, антитело к антимиостатину, при раке поджелудочной железы: рандомизированное исследование фазы 2. J. Cachexia Sarcopenia Muscle 9 , 871–879 (2018).
PubMed PubMed Central Статья Google ученый
Porporato, P.E. et al. Ацилированный и неацилированный грелин ухудшают атрофию скелетных мышц у мышей. J. Clin. Расследование. 123 , 611–622 (2013).
CAS PubMed Google ученый
Garcia, J. M. et al. Анаморелин для пациентов с раковой кахексией: комплексный анализ двух рандомизированных плацебо-контролируемых двойных слепых исследований фазы 2. Ланцет Онкол. 16 , 108–116 (2015).
CAS PubMed Статья Google ученый
Baraldo, M. et al. Скелетная мышца mTORC1 регулирует стабильность нервно-мышечного соединения. J. Cachexia Sarcopenia Muscle 11 , 208–225 (2019).
Pietrocola, F. et al. Спермидин вызывает аутофагию, ингибируя ацетилтрансферазу EP300. Cell Death Differ. 22 , 509–516 (2015).
CAS PubMed Статья Google ученый
Koeberl, D. D. et al. Коррекция биохимических нарушений и улучшение мышечной функции в клинических испытаниях фазы I / II кленбутерола при болезни Помпе. Мол. Ther. 26 , 2304–2314 (2018).
CAS PubMed PubMed Central Статья Google ученый
Adams, V. et al. Опосредованное низкими молекулами химическое подавление MuRF1 / MuRF2 и ослабление дисфункции диафрагмы при хронической сердечной недостаточности. J. Cachexia Sarcopenia Muscle 10 , 1102–1115 (2019).
PubMed PubMed Central Статья Google ученый
В чем разница между атрофией и гипертрофией
Основное различие между атрофией и гипертрофией состоит в том, что атрофия — это снижение функциональности органа с уменьшением количества клеток или объема, тогда как гипертрофия — это увеличение объема клеток. Кроме того, в мышцах атрофия возникает, когда они вообще не используются, в то время как гипертрофия возникает из-за чрезмерной работы.
Атрофия и гипертрофия — два условия развития. Как правило, они имеют как физиологическое, так и патологическое значение.
Основные зоны покрытия
1. Что такое атрофия
— Определение, особенности, важность
2. Что такое гипертрофия
— Определение, особенности, важность
3. Каковы сходства между атрофией и гипертрофией
— Краткое описание общих черт
4. В чем разница между атрофией и гипертрофией
— Сравнение основных различий
Ключевые термины
Атрофия, гипертрофия, гиперплазия, мышцы, саркопения
Что такое атрофия
Атрофия — это полное или частичное истощение части тела.Как правило, причины атрофии включают недостаточное снабжение питательными веществами или гормонами, плохое кровообращение, потерю нервного питания, недостаток физических упражнений, чрезмерный апоптоз и т. Д. Чтобы поддерживать части тела в нормальных условиях функционирования, должны быть трофические эффекты гормонального и нервного воздействия. Следовательно, уменьшение количества этих запасов вызывает атрофию. Между тем, атрофия вызывает уменьшение размера клеток, что, в свою очередь, уменьшает размер органа или ткани.
Рисунок 1: Мышь со спинальной мышечной атрофией (справа)
Кроме того, мышечная атрофия — это снижение мышечной силы из-за уменьшения мышечной массы.Обычно это происходит из-за рака, сердечной недостаточности, почечной недостаточности, ожогов, голодания, малоподвижного образа жизни, постельного режима и т. Д. С другой стороны, саркопения — это атрофия, возникающая из-за старения. Основная причина этого — снижение количества сателлитных клеток для регенерации клеток скелетных мышц.
Что такое гипертрофия
Гипертрофия — это состояние увеличения объема органа или ткани из-за чрезмерной работы. Обычно это происходит за счет увеличения объема клеток, а не за счет увеличения количества клеток в органе или ткани.Последнее состояние известно как гиперплазия.
Рисунок 2: Гипертрофия мышц, достигнутая за счет комбинации силовых тренировок, диеты и пищевых добавок
Кроме того, в зависимости от типа работы гипертрофия возникает либо за счет увеличения объема саркоплазмы, либо за счет количества сократительных белков в мышцах. Между тем, другие биологические факторы, такие как количество питательных веществ, также влияют на гипертрофию мышц. Более того, у мужчин гипертрофия мышц чаще возникает после полового созревания.Важно отметить, что достаточное количество гормонов роста, таких как тестостерон и аминокислоты, необходимо для мышечной гипертрофии.
Сходства между атрофией и гипертрофией
- Атрофия и гипертрофия — это два заболевания, связанные с развитием тканей и органов.
- Они возникают из-за разной степени использования.
- Они вызывают изменение размеров тканей и органов.
- Оба имеют физиологическое и патологическое значение.
Разница между атрофией и гипертрофией
Определение
Атрофия относится к уменьшению размера части тела, клетки, органа или другой ткани, в то время как гипертрофия относится к увеличению органа или ткани в результате увеличения размера его клеток.
Причина
Более того, атрофия возникает, когда органы или ткани вообще не используются, а гипертрофия возникает из-за чрезмерной работы.
результатов
В то время как атрофия приводит к уменьшению размера органа, гипертрофия приводит к увеличению размера органа.
Физиологическое значение
Старческая атрофия, атрофия тимуса после полового созревания и атрофия яичников и груди во время менопаузы являются физиологическими состояниями атрофии, в то время как мышцы бодибилдеров и матка у беременных женщин являются физиологическими состояниями гипертрофии.
Важность патологии
Хроническое недоедание и другие хронические заболевания вызывают атрофию, тогда как гипертрофия может быть адаптивной или компенсаторной.
Заключение
Атрофия — это состояние уменьшения размера органа или ткани, когда они не используются в течение длительного времени.Кроме того, причиной атрофии являются недоедание, хронические заболевания и старение. С другой стороны, гипертрофия — это состояние увеличения размера органа или ткани из-за чрезмерной работы. Обычно это происходит за счет увеличения объема ячейки. Например, у бодибилдеров наблюдается гипертрофия мышц. Поэтому основное различие между атрофией и гипертрофией — это тип изменения органов и тканей и причины.
Артикул:
1. Арагон, Пепе. «Мышечная атрофия и гипертрофия | Велнес HE 130.» ER Services , доступны здесь.
Изображение предоставлено:
1. «Мышь со спинальной мышечной атрофией» Национальным институтом здравоохранения США — Национальным институтом здравоохранения США (общественное достояние) через Commons Wikimedia
2. «Волосатая грудь — Фото Джованни Далл’Орто, 25 июля 2010a» Автор: G.dallorto — Собственная работа (Атрибуция) через Commons Wikimedia
Используй или потеряй
Часто говорят: «Если ты не используешь это, ты теряешь это», но редко обсуждают, что именно «это».
Поскольку наши тела настолько сложны, важно понимать, что происходит, когда мы набираем форму и когда мы начинаем движение по пути восстановления.
Что такое атрофия мышц?Атрофия мышц — это термин, используемый для описания потери мышечной массы. Атрофия может возникнуть в результате травмы, голодания, болезней, постельного режима, повреждения нервов и других проблем, связанных со здоровьем. Атрофия особенно часто встречается у пожилых людей, что называется саркопенией.
Чтобы понять, как атрофия мышц может повлиять на наши тела, нам нужно подумать о том, как мы полагаемся на наши мышцы.Мышечная система обеспечивает силу, выносливость в движении, стабилизацию и защиту.
Мышцы способны сокращаться и расслабляться, перемещать или стабилизировать суставы, которые они пересекают. Если произошла атрофия, то движение, которое обычно происходит в суставе, будет нарушено.
Это будет означать меньшую силу и выносливость во время движения, а также потенциально меньшую стабилизацию вокруг скрещенных суставов. Атрофия может привести к более высокому риску травмы нашего тела из-за отсутствия нервного контроля над мышцами, которые обычно отвечают за стабилизацию и координацию движений.
Вы теряете размер или силу?Когда происходит атрофия мышц, мы теряем только размер мышц или также теряем силу? Чтобы ответить на этот вопрос, нам нужно знать, что происходит в организме, когда мы набираем размер и силу .
Гипертрофия — это рост волокон скелетных мышц в ответ на преодоление силы от больших объемов напряжения. Это происходит, когда мышечные клетки регенерируют в результате программ прогрессивных тренировок с отягощениями (1).Гипертрофию также можно описать как увеличение площади поперечного сечения мышцы.
Этот результат является результатом увеличения размера и количества миофибрилл на мышечную клетку, а также увеличения структурно связанных мышечных тканей, таких как связки и сухожилия, а также увеличения запаса питательных веществ и ферментов в мышечных волокнах для разрушения. вниз и ресинтезировать АТФ (1). Мышцы также накапливают больше АТФ и ЦП.
Этот процесс помогает в действиях, требующих силы, мощности и скорости (2).При таком увеличении мышечной массы другие мягкие ткани будут более переносимы к большему количеству стресса без повреждений (3-5). Атрофия мышц свела бы на нет эти преимущества гипертрофии. Эта потеря мышц приведет к потере силы, стабилизации скелетной структуры и устойчивости сил сопротивления от противоположного напряжения.
Гипертрофия может происходить без значительного увеличения силы, но также была показана корреляция увеличения силы, а также площади поперечного сечения мышцы (6). NASM отмечает в своей личной программе тренировок, что сила — это способность нервно-мышечной системы создавать внутреннее напряжение, чтобы преодолевать внешнюю нагрузку (1). Способность набирать силу может возникнуть без резкого увеличения размера.
Увеличение силы, но не роста, напрямую связано с изменениями в нервной системе. Это увеличение связано с координацией мышц во время силовых тренировок — увеличением синхронизации, набора и активации двигательных единиц (2).
Существуют переменные, которые определяют, собираетесь ли вы набрать размер или максимальную силу. Поднимая тяжелые грузы, делая меньшее количество повторений (1-5), имея более длительные периоды отдыха (3-5 минут) и питая свое тело без излишка калорий, вы сможете улучшить силу практически без увеличения размер (1).
Если атрофия мышц происходит у людей, которые тренировались больше для силы, а не размера, они все равно будут страдать от тех же потерь, что и при тренировках для увеличения размера.Будет потеря силы, потеря нервно-мышечной координации, потеря выносливости и увеличение риска травм. Атрофия мышц — это не только потеря размера, это также потеря силы.
Превращаются ли мышцы в жир, если вы не тренируетесь?В течение многих лет многие думали о городской легенде о том, что мышцы превращаются в жир. Разговоры об этой концепции разнеслись по рядам тренажеров и стенам раздевалок.Пора наконец-то уйти от этой городской легенды и истории о призраках у костра у костра.
Когда мы углубляемся в тему атрофии мышц, многие думают, что если вы теряете мышцу, она должна куда-то уйти, поэтому должна превратиться в жир. Атрофия мышц чаще всего возникает из-за длительного отсутствия активности. Поскольку деградация белка превышает ресинтез белка, ваши мышцы сокращаются, и ваш метаболизм, вероятно, требует меньше калорий для поддержки мышц.
Если вы теряете мышечную массу и, кажется, у вас увеличивается жировая прослойка, чаще всего это происходит из-за избытка калорий из-за того, что вы не двигаетесь так много и потребляете слишком много калорий.Кажется, именно из-за этого сдвига люди предположили, что мышцы превращаются в жир.
Из-за нерегулярных силовых тренировок и отсутствия правильного плана питания для лечения гипертрофии вероятность увеличения жировых отложений гораздо выше. Это не потому, что ваши мышцы превратились в жир, а потому, что была создана идеальная среда для роста жировых запасов и худшая возможность для роста мышц.
какая минимальная тренировка необходима для поддержания силы (и размера)?Концепция минимума работы для поддержания размера и силы является сложной задачей из-за того, насколько сложны наши тела.В идеале, если бы мы правильно питали наши тела, используя правильное качество и количество того, что нам нужно, хорошо справлялись со стрессом, поддерживали надлежащий гомеостаз и все другие системы работали хорошо, средний человек мог бы поддерживать силу и размер своего тела всего за 2 секунды. до 3 силовых тренировок тренировок в неделю. (Не забывайте включать кардиотренировки в общую программу тренировок!)
Проблема в том, что мы живем не в идеальном сценарии, чтобы поддерживать себя в фазе обслуживания.Многие факторы превращаются в проблемы. Это включает в себя выход на плато, а это означает, что если ваше тело больше не получает усиленный стимул, который он когда-то получал во время тренировок, вы можете не испытать тех же преимуществ, что и раньше.
Если в вашей жизни усилился стресс, уровень кортизола может помешать вашей способности сохранять силу и размер. Если сон нарушен, это также может повлиять на ваш прогресс.
Знание самого минимума для поддержания силы — это хорошо, но не упускайте из виду, что фитнес-программы должны прогрессировать, обычно каждые 4-8 недель.Еще одно соображение — знать свои цифры и в других аспектах фитнеса и здоровья.
Знайте свой максимум 1 повторения (1 ПМ) для различных упражнений, свой VO 2 баллов по кардиотренировкам и процент жира в организме. Если у вас есть доступ к метаболическим тестам и анализу крови, это также важно знать. Проактивность — ключ к сохранению вашего размера и силы.
Как долго вы можете пройти, прежде чем сила начнет уменьшаться?Исследования показали, что в течение недели появляются молекулярные признаки атрофии.В зависимости от группы мышц время варьируется, при этом мышцы нижней части тела быстрее проявляют признаки атрофии (7-8).
Что делать, если нужно «уменьшить объем» ?Для тех, кто хочет «уменьшить мышечную массу» или уменьшить размер мышц, сначала обратите внимание на пункты, которые могут прояснить, если это действительно цель. На самом деле потерять мышцы намного проще, чем потерять жир, и еще труднее восстановить их. Если вы узнаете, отслеживая процентное содержание жира в организме, что вместо этого вы действительно можете сбросить жир, я бы порекомендовал сосредоточить усилия на достижении этой цели.
Если вам действительно нужно уменьшить мышечную массу, подумайте о самых здоровых способах сделать это. Избегайте стилей тренировок, которые способствуют набору мышечной массы, и вместо этого сосредоточьтесь на тех, которые концентрируются на силе или выносливости. Если вы следуете модели NASM OPT, пропустите фазу 3 (гипертрофия) и нацелитесь на более высокие диапазоны повторений для фаз 1 и 2 и более низкие диапазоны повторений в фазах 4 и 5 с соответствующими тренировочными переменными. Не забудьте также включить кардиотренировки.
Nutrition также играет важную роль в «уменьшении массы тела».«Вы выиграете от дефицита калорий, чтобы похудеть. В течение этого времени вы по-прежнему хотели бы есть как можно более здоровую пищу, состоящую из всех трех макроэлементов (белков, углеводов и жиров).
Подробнее об этой теме с точки зрения женщин читайте — Тяжелая атлетика для женщин
как контролировать атрофию мышцГомеостаз — это баланс нашей симпатической (полет или полет) системы и парасимпатической (отдых, восстановление и восстановление) системы.Для получения максимальных результатов и повышения производительности эти системы необходимо сбалансировать. Наши мышцы схожи в том, что нуждаются в мышечном гомеостазе.
Упражнения должны быть прогрессивными и сложными, но при этом позволять правильно восстанавливаться. Необходимо проводить оценки, чтобы гарантировать правильную механику тела во время упражнений. Если имеет место синергетическое доминирование, мышцы могут больше не участвовать в идеальном соотношении длины и напряжения, что может привести к атрофии компенсированных мышц. Обращаясь к этим компенсациям и включая необходимые методы их исправления, тело может вернуться в движение с большей эффективностью.
Когда я думаю об атрофии, я думаю о мрачном жнеце мясных голов. Как энтузиасты фитнеса, мы обычно боремся с атрофией любой ценой. Как и многие другие проблемы, с которыми мы сталкиваемся в своем стремлении повысить производительность и стать более здоровыми, это требует подхода всей жизни.
Каждый аспект вашей жизни играет роль в вашем успехе. Надеюсь, вы сможете избежать атрофии, развивая позитивные отношения с физической активностью и образом жизни.
Список литературы
- Clark M, Lucett S, McGill E, Montel I, Sutton B.(редакторы). (2018) NASM Essentials of Personal Fitness Training (6-е изд). Берлингтон, Массачусетс: Jones & Bartlett Learning.
- Бун Т. (2014) Введение в физиологию упражнений. Берлингтон, Массачусетс, Jones & Bartlett Learning.
- Almstedt H, Canepa J, Ramirez D, & Shoepe T. (2011) Изменения минеральной плотности костной ткани в ответ на 24 недели тренировок с отягощениями у мужчин и женщин студенческого возраста. J Strength Cond Res. 2011; 25: 1098–1103.
- Фолланд Дж. И Уильямс А. (2007) Адаптация к силовой тренировке: морфологический и неврологический вклад в увеличение силы.Спортивная медицина (Окленд, Новая Зеландия). 37. 145-68.
- Hinton P, Nigh P, & Thyfault J. (2015) Эффективность тренировок с отягощениями или прыжковых упражнений для увеличения минеральной плотности костной ткани у мужчин с низкой костной массой: 12-месячное рандомизированное клиническое испытание. Кость. Октябрь; 79: 203-12. DOI: 10.1016 / j.bone.2015.06.008.
- Maughan R, Watson J. & Weir J. (1983) Сила и площадь поперечного сечения скелетных мышц человека. Журнал физиологии, 338: 37-49.
- LeBlanc AD, Schneider VS, Evans HJ, et al.(1992) Региональные изменения мышечной массы после 17 недель постельного режима. Журнал прикладной физиологии. 1992; 73: 2172–2178.
- Саланова М., Гамбара Г., Мориджи М., Вассо М., Унгетуэм У., Белави Д., Фельзенберг Д., Черретелли П., Гельфи Сесилия, Блоттнер Д. (2015). Вибрационные механосигналы, наложенные на упражнения с сопротивлением, дают базовые профили транскриптома скелетных мышц после хронического неиспользования в постельном режиме. Научные отчеты. 5 (5): 17027. DOI: 10,1038 / srep17027.
Миостатин и сигнальные пути атрофии и гипертрофии скелетных мышц
Ruegg MA, Glass DJ (2011) Молекулярные механизмы и варианты лечения заболеваний, связанных с истощением мышц. Annu Rev Pharmacol Toxicol 51: 373–395. DOI: 10.1146 / annurev-pharmtox-010510-100537
PubMed CAS Статья Google ученый
Glass DJ (2005) Гипертрофия скелетных мышц и сигнальные пути атрофии. Int J Biochem Cell Biol 37 (10): 1974–1984. DOI: 10.1016 / j.biocel.2005.04.018
PubMed CAS Статья Google ученый
Sandri M (2008) Сигнализация при атрофии и гипертрофии мышц. Физиология (Bethesda) 23: 160–170. DOI: 10.1152 / Physiol.00041.2007
CAS Статья Google ученый
Эллиотт Б., Реншоу Д., Получение С., Маккензи Р. (2012) Центральная роль миостатина в гомеостазе скелетных мышц и всего тела. Acta Physiol (Oxf) 205 (3): 324–340. DOI: 10.1111 / j.1748-1716.2012.02423.x
CAS Статья Google ученый
McPherron AC, Lawler AM, Lee SJ (1997) Регулирование массы скелетных мышц у мышей новым членом суперсемейства TGF-бета. Nature 387 (6628): 83–90
PubMed CAS Статья Google ученый
Mosher DS, Quignon P, Bustamante CD, Sutter NB, Mellersh CS, Parker HG, Ostrander EA (2007) Мутация в гене миостатина увеличивает мышечную массу и улучшает спортивные результаты у гетерозиготных собак. PLoS Genet 3 (5): e79.DOI: 10.1371 / journal.pgen.0030079
PubMed PubMed Central Статья Google ученый
Grobet L, Martin LJ, Ponsel D, Pirottin D, Brouwers B, Riquet J, Schoeberlein A, Dunner S, Menissier F, Massabanda J, Fries R, Hanset R, Georges M (1997) делеция в Ген миостатина крупного рогатого скота вызывает у крупного рогатого скота фенотип с двумя мускулами. Нат Генет 17 (1): 71–74. DOI: 10.1038 / ng0997-71
PubMed CAS Статья Google ученый
Kambadur R, Sharma M, Smith TP, Bass JJ (1997) Мутации миостатина (GDF8) у двухмускулистого бельгийского голубого и пьемонтского скота. Genome Res 7 (9): 910–916
PubMed CAS Google ученый
Clop A, Marcq F, Takeda H, Pirottin D, Tordoir X, Bibe B, Bouix J, Caiment F, Elsen JM, Eychenne F, Larzul C, Laville E, Meish F, Milenkovic D, Tobin J , Charlier C, Georges M (2006) Мутация, создающая потенциально незаконный сайт-мишень микроРНК в гене миостатина, влияет на мускулатуру у овец.Нат Генет 38 (7): 813–818. DOI: 10.1038 / ng1810
PubMed CAS Статья Google ученый
Schuelke M, Wagner KR, Stolz LE, Hubner C, Riebel T, Komen W, Braun T, Tobin JF, Lee SJ (2004) Мутация миостатина, связанная с большой мышечной гипертрофией у ребенка. N Engl J Med 350 (26): 2682–2688. DOI: 10.1056 / NEJMoa040933
PubMed CAS Статья Google ученый
Szabo G, Dallmann G, Muller G, Patthy L, Soller M, Varga L (1998) Делеция в гене миостатина вызывает компактную (Cmpt) гипермышечную мутацию у мышей. Геном млекопитающего 9 (8): 671–672
PubMed CAS Статья Google ученый
Grobet L, Pirottin D, Farnir F, Ponsel D, Royo LJ, Brouwers B, Christians E, Desmecht D, Coignoul F, Kahn R, Georges M (2003) Регулирование массы скелетных мышц послеродовым, мышечным специфическая инактивация гена миостатина.Бытие 35 (4): 227–238. DOI: 10.1002 / gene.10188
PubMed CAS Статья Google ученый
Виттемор Л.А., Сонг К., Ли Х, Агаджанян Дж., Дэвис М., Гиргенрат С., Хилл Дж. Дж., Джаленак М., Келли П., Найт А., Мэйлор Р., О’Хара Д., Пирсон А., Квази А., Ryerson S, Tan XY, Tomkinson KN, Veldman GM, Widom A, Wright JF, Wudyka S, Zhao L, Wolfman NM (2003) Ингибирование миостатина у взрослых мышей увеличивает массу и силу скелетных мышц.Biochem Biophys Res Commun 300 (4): 965–971 (pii): S0006291X02029534
PubMed CAS Статья Google ученый
Rebbapragada A, Benchabane H, Wrana JL, Celeste AJ, Attisano L (2003) Сигналы миостатина через трансформирующий бета-подобный сигнальный путь фактора роста блокируют адипогенез. Mol Cell Biol 23 (20): 7230–7242
PubMed CAS PubMed Central Статья Google ученый
Lee SJ, McPherron AC (2001) Регулирование активности миостатина и роста мышц. Proc Natl Acad Sci USA 98 (16): 9306–9311
PubMed CAS PubMed Central Статья Google ученый
Derynck R, Zhang Y, Feng XH (1998) Smads: активаторы транскрипции ответов TGF-бета. Ячейка 95 (6): 737–740
PubMed CAS Статья Google ученый
Forbes D, Jackman M, Bishop A, Thomas M, Kambadur R, Sharma M (2006) Миостатин саморегулирует свою экспрессию с помощью петли обратной связи через Smad7-зависимый механизм. J Cell Physiol 206 (1): 264–272
PubMed CAS Статья Google ученый
Zhu X, Topouzis S, Liang LF, Stotish RL (2004) Передача сигналов миостатина через Smad2, Smad3 и Smad4 регулируется ингибирующим Smad7 с помощью механизма отрицательной обратной связи. Цитокин 26 (6): 262–272.DOI: 10.1016 / j.cyto.2004.03.007
PubMed CAS Статья Google ученый
Сартори Р., Милан Г., Патрон М., Маммукари С., Блаау Б., Абрахам Р., Сандри М. (2009) Факторы транскрипции Smad2 и 3 контролируют мышечную массу в зрелом возрасте. Am J Physiol Cell Physiol 296 (6): C1248 – C1257. DOI: 10.1152 / ajpcell.00104.2009
PubMed CAS Статья Google ученый
Trendelenburg AU, Meyer A, Rohner D, Boyle J, Hatakeyama S, Glass DJ (2009) Миостатин снижает передачу сигналов Akt / TORC1 / p70S6K, ингибируя дифференцировку миобластов и размер миотрубок. Am J Physiol Cell Physiol 296 (6): C1258 – C1270. DOI: 10.1152 / ajpcell.00105.2009
PubMed CAS Статья Google ученый
Sartori R, Schirwis E, Blaauw B, Bortolanza S, Zhao J, Enzo E, Stantzou A, Mouisel E, Toniolo L, Ferry A, Stricker S, Goldberg AL, Dupont S, Piccolo S, Amthor H , Sandri M (2013) Передача сигналов BMP контролирует мышечную массу.Нат Жене 45 (11): 1309–1318. DOI: 10,1038 / нг.2772
PubMed CAS Статья Google ученый
Лю В., Томас С.Г., Аса С.Л., Гонсалес-Кадавид Н., Бхасин С., Эззат С. (2003) Миостатин является мишенью для анаболического действия гормона роста в скелетных мышцах. J Clin Endocrinol Metab 88 (11): 5490–5496
PubMed CAS Статья Google ученый
Brill KT, Weltman AL, Gentili A, Patrie JT, Fryburg DA, Hanks JB, Urban RJ, Veldhuis JD (2002) Отдельные и комбинированные эффекты введения гормона роста и тестостерона на показатели состава тела, физической работоспособности, настроения, сексуальной функции , метаболизм костей и экспрессия мышечных генов у здоровых пожилых мужчин. J Clin Endocrinol Metab 87 (12): 5649–5657
PubMed CAS Статья Google ученый
Mendler L, Baka Z, Kovacs-Simon A, Dux L (2007) Андрогены негативно регулируют экспрессию миостатина в андроген-зависимых скелетных мышцах.Biochem Biophys Res Commun 361 (1): 237–242
PubMed CAS Статья Google ученый
Braga M, Bhasin S, Jasuja R, Pervin S, Singh R (2012) Тестостерон ингибирует передачу сигналов трансформирующего фактора роста-бета во время миогенной дифференцировки и пролиферации сателлитных клеток мыши: потенциальная роль фоллистатина в опосредовании действия тестостерона. Mol Cell Endocrinol 350 (1): 39–52. DOI: 10.1016 / j.mce.2011.11.019
PubMed CAS PubMed Central Статья Google ученый
Dubois V, Laurent MR, Sinnesael M, Cielen N, Helsen C, Clinckemalie L, Spans L, Gayan-Ramirez G, Deldicque L, Hespel P, Carmeliet G, Vanderschueren D, Claessens F (2014) Нокаут для конкретных спутниковых клеток рецептора андрогенов показывает, что миостатин является прямой мишенью для андрогенов в скелетных мышцах. FASEB J. doi: 10.1096 / fj.14-249748
PubMed Google ученый
Ким Дж. С., Кросс Дж. М., Бамман М. М. (2005) Влияние нагрузки сопротивлением на экспрессию миостатина и регуляцию клеточного цикла у молодых и пожилых мужчин и женщин.Am J Physiol Endocrinol Metab 288 (6): E1110 – E1119. DOI: 10.1152 / ajpendo.00464.2004
PubMed CAS Статья Google ученый
Мишель Р.Н., Данн С.Е., Чин Э.Р. (2004) Кальциневрин и рост скелетных мышц. Proc Nutr Soc 63 (2): 341–349
PubMed CAS Статья Google ученый
Ruas JL, White JP, Rao RR, Kleiner S, Brannan KT, Harrison BC, Greene NP, Wu J, Estall JL, Irving BA, Lanza IR, Rasbach KA, Okutsu M, Nair KS, Yan Z , Leinwand LA, Spiegelman BM (2012) Изоформа PGC-1alpha, индуцированная тренировкой с отягощениями, регулирует гипертрофию скелетных мышц.Cell 151 (6): 1319–1331. DOI: 10.1016 / j.cell.2012.10.050
PubMed CAS PubMed Central Статья Google ученый
Рот С.М., Мартель Г.Ф., Феррелл Р.Э., Меттер Э.Дж., Херли Б.Ф., Роджерс М.А. (2003) Экспрессия гена миостатина снижена у людей при силовых тренировках с отягощениями: краткое сообщение. Exp Biol Med (Maywood) 228 (6): 706–709
CAS Google ученый
Willoughby DS (2004) Влияние предполагаемой добавки, связывающей миостатин, и силовых тренировок на миостатин в сыворотке крови, мышечную силу и массу, а также состав тела. Int J Sport Nutr Exerc Exerc Exerc Metab 14 (4): 461–472
PubMed CAS Google ученый
Уиллоуби Д.С. (2004) Влияние тренировок с отягощениями на мРНК миостатина и экспрессию белка. Med Sci Sports Exerc 36 (4): 574–582 (pii): 00005768-200404000-00004
PubMed Статья Google ученый
Hayot M, Rodriguez J, Vernus B, Carnac G, Jean E, Allen D, Goret L, Obert P, Candau R, Bonnieu A (2011) Повышение регуляции миостатина связано с реакцией скелетных мышц на гипоксические стимулы. Mol Cell Endocrinol 332 (1-2): 38-47. DOI: 10.1016 / j.mce.2010.09.008
PubMed CAS Статья Google ученый
Yarasheski KE, Bhasin S, Sinha-Hikim I, Pak-Loduca J, Gonzalez-Cadavid NF (2002) Миостатин-иммунореактивный белок сыворотки повышен у 60–92-летних женщин и мужчин с мышечной атрофией.J Nutr Health Aging 6 (5): 343–348
PubMed CAS Google ученый
Раткявичюс А., Джойсон А., Селмер И., Дханани Т., Грирсон С., Томмази А.М., ДеВрис А., Рауххаус П., Кроутер Д., Алеши С., Яворски П., Гилберт Ф., Редпат Т.В., Брэди Дж., Феарон К.С. , Reid DM, Greig CA, Wackerhage H (2011) Концентрации миостатина и взаимодействующих с миостатином белков в сыворотке крови не различаются между молодыми и пожилыми мужчинами с саркопенией. Журнал «Геронтол Биол Науки Мед Науки» 66 (6): 620–626.DOI: 10.1093 / gerona / glr025
PubMed CAS Статья Google ученый
Siriett V, Platt L, Salerno MS, Ling N, Kambadur R, Sharma M (2006) Продолжительное отсутствие миостатина снижает саркопению. J Cell Physiol 209 (3): 866–873
PubMed CAS Статья Google ученый
Murphy KT, Koopman R, Naim T, Leger B, Trieu J, Ibebunjo C, Lynch GS (2010) Направленное антителами ингибирование миостатина у 21-месячных мышей обнаруживает новую роль передачи сигналов миостатина в скелетных мышцах структура и функции.FASEB J 24 (11): 4433–4442. DOI: 10.1096 / fj.10-159608
PubMed CAS Статья Google ученый
Кавада С., Тачи С., Исии Н. (2001) Содержание и локализация миостатина в скелетных мышцах мышей во время старения, механической разгрузки и перезагрузки. J Muscle Res Cell Motil 22 (8): 627–633
PubMed CAS Статья Google ученый
Baumann AP, Ibebunjo C, Grasser WA, Paralkar VM (2003) Экспрессия миостатина в возрастной и вызванной денервацией атрофии скелетных мышц. J Musculoskelet Neuronal Interact 3 (1): 8–16
PubMed CAS Google ученый
Carlson CJ, Booth FW, Gordon SE (1999) Экспрессия мРНК миостатина в скелетных мышцах специфична для типов волокон и увеличивается во время разгрузки задних конечностей. Am J Physiol 277 (2, часть 2): R601 – R606
PubMed CAS Google ученый
Oldham JM, Osepchook CC, Jeanplong F, Falconer SJ, Matthews KG, Conaglen JV, Gerrard DF, Smith HK, Wilkins RJ, Bass JJ, McMahon CD (2009) Снижение зрелого белка миостатина в мужских скелетных мышцах регулируется развитием гормон роста. J. Physiol 587 (Pt 3): 669–677. DOI: 10.1113 / jphysiol.2008.161521
PubMed CAS PubMed Central Статья Google ученый
Ohsawa Y, Hagiwara H, Nakatani M, Yasue A, Moriyama K, Murakami T., Tsuchida K, Noji S, Sunada Y (2006) Мышечная атрофия мышей с дефицитом кавеолина-3 устраняется ингибированием миостатина.J Clin Invest 116 (11): 2924–2934
PubMed CAS PubMed Central Статья Google ученый
Gilson H, Schakman O, Combaret L, Lause P, Grobet L, Attaix D, Ketelslegers JM, Thissen JP (2007) Делеция гена миостатина предотвращает индуцированную глюкокортикоидами атрофию мышц. Эндокринология 148 (1): 452–460
PubMed CAS Статья Google ученый
Salehian B, Mahabadi V, Bilas J, Taylor WE, Ma K (2006) Влияние глутамина на предотвращение атрофии скелетных мышц, вызванной глюкокортикоидами, связано с подавлением миостатина. Метаболизм 55 (9): 1239–1247. DOI: 10.1016 / j.metabol.2006.05.009
PubMed CAS Статья Google ученый
Циммерс Т.А., Дэвис М.В., Кониарис Л.Г., Хейнс П., Эскела А.Ф., Томкинсон К.Н., Макферрон А.С., Вольфман Н.М., Ли С.Дж. (2002) Индукция кахексии у мышей с помощью системно вводимого миостатина.Science 296 (5572): 1486–1488. DOI: 10.1126 / science.1069525
PubMed CAS Статья Google ученый
Durieux AC, Amirouche A, Banzet S, Koulmann N, Bonnefoy R, Pasdeloup M, Mouret C, Bigard X, Peinnequin A, Freyssenet D (2007) Эктопическая экспрессия миостатина вызывает атрофию скелетных мышц взрослого человека путем уменьшения экспрессия мышечных генов. Эндокринология 148 (7): 3140–3147
PubMed CAS Статья Google ученый
Amirouche A, Durieux AC, Banzet S, Koulmann N, Bonnefoy R, Mouret C, Bigard X, Peinnequin A, Freyssenet D (2009) Снижение регуляции пути передачи сигналов рапамицина Akt / млекопитающих в ответ на сверхэкспрессию миостатина в скелетных мышцах . Эндокринология 150 (1): 286–294. DOI: 10.1210 / en.2008-0959
PubMed CAS Статья Google ученый
McMahon CD, Popovic L, Oldham JM, Jeanplong F, Smith HK, Kambadur R, Sharma M, Maxwell L, Bass JJ (2003) Мыши с дефицитом миостатина теряют больше массы скелетных мышц, чем контрольные животные дикого типа во время подвеска задних конечностей.Am J Physiol Endocrinol Metab 285 (1): E82 – E87
PubMed CAS Google ученый
Бишофф Р., Хайнц С. (1994) Улучшение регенерации скелетных мышц. Дев Дин 201 (1): 41–54. DOI: 10.1002 / aja.1002010105
PubMed CAS Статья Google ученый
Schmalbruch H, al-Amood WS, Lewis DM (1991) Морфология длительно денервированной камбаловидной мышцы крысы и эффект хронической электростимуляции.J Physiol 441: 233–241
PubMed CAS PubMed Central Google ученый
Cooper RN, Tajbakhsh S, Mouly V, Cossu G, Buckingham M, Butler-Browne GS (1999) Активация сателлитных клеток in vivo через Myf5 и MyoD при регенерации скелетных мышц мыши. J Cell Sci 112 (Pt 17): 2895–2901
PubMed CAS Google ученый
McCroskery S, Thomas M, Maxwell L, Sharma M, Kambadur R (2003) Миостатин отрицательно регулирует активацию и самообновление сателлитных клеток.J Cell Biol 162 (6): 1135–1147. DOI: 10.1083 / jcb.200207056
PubMed CAS PubMed Central Статья Google ученый
Magee TR, Artaza JN, Ferrini MG, Vernet D, Zuniga FI, Cantini L, Reisz-Porszasz S, Rajfer J, Gonzalez-Cadavid NF (2006) Миостатин короткий мешающий перенос гена РНК шпильки увеличивает массу скелетных мышц . J Gene Med 8 (9): 1171–1181. DOI: 10.1002 / jgm.946
PubMed CAS Статья Google ученый
Amthor H, Otto A, Vulin A, Rochat A, Dumonceaux J, Garcia L, Mouisel E, Hourde C, Macharia R, Friedrichs M, Relaix F, Zammit PS, Matsakas A, Patel K, Partridge T (2009) Гипертрофия мышц вызванный блокадой миостатина, не требует активности стволовых клеток / клеток-предшественников. Proc Natl Acad Sci USA 106 (18): 7479–7484. DOI: 10.1073 / pnas.0811129106
PubMed CAS PubMed Central Статья Google ученый
Welle S, Mehta S, Burgess K (2011) Влияние истощения миостатина после развития на метаболизм миофибриллярных белков. Am J Physiol Endocrinol Metab 300 (6): E993 – E1001. DOI: 10.1152 / ajpendo.00509.2010
PubMed CAS PubMed Central Статья Google ученый
Lee SJ, Huynh TV, Lee YS, Sebald SM, Wilcox-Adelman SA, Iwamori N, Lepper C, Matzuk MM, Fan CM (2012) Роль сателлитных клеток по сравнению с миофибриллами в мышечной гипертрофии, вызванной ингибированием сигнальный путь миостатин / активин.Proc Natl Acad Sci USA 109 (35): E2353 – E2360. DOI: 10.1073 / pnas.1206410109
PubMed CAS PubMed Central Статья Google ученый
Rodriguez J, Vernus B, Toubiana M, Jublanc E, Tintignac L, Leibovitch S, Bonnieu A (2011) Инактивация миостатина увеличивает размер миостатина за счет регуляции механизма инициации трансляции. J Cell Biochem 112 (12): 3531–3542. DOI: 10.1002 / jcb.23280
PubMed CAS Статья Google ученый
Wang Q, McPherron AC (2012) Ингибирование миостатина вызывает гипертрофию мышечных волокон до активации сателлитных клеток. J. Physiol 590 (Pt 9): 2151–2165. DOI: 10.1113 / jphysiol.2011.226001
PubMed CAS PubMed Central Google ученый
Thomas M, Langley B, Berry C, Sharma M, Kirk S, Bass J, Kambadur R (2000) Миостатин, негативный регулятор роста мышц, действует путем ингибирования пролиферации миобластов.J Biol Chem 275 (51): 40235–40243
PubMed CAS Статья Google ученый
Риос Р., Карнейро И., Арсе В.М., Девеса Дж. (2002) Миостатин является ингибитором миогенной дифференцировки. Am J Physiol Cell Physiol 282 (5): C993 – C999
PubMed CAS Статья Google ученый
Taylor WE, Bhasin S, Artaza J, Byhower F, Azam M, Willard DH Jr, Kull FC Jr, Gonzalez-Cadavid N (2001) Миостатин подавляет пролиферацию клеток и синтез белка в мышечных клетках C2C12.Am J Physiol Endocrinol Metab 280 (2): E221 – E228
PubMed CAS Google ученый
Джулия Д., Бернарди Х., Гарандел В., Рабеноэлина Ф., Вернус Б., Кабелло Г. (2003) Механизмы, участвующие в ингибировании пролиферации и дифференцировки миобластов с помощью миостатина. Exp Cell Res 286 (2): 263–275 (pii): S0014482703000740
PubMed CAS Статья Google ученый
Yang W, Zhang Y, Li Y, Wu Z, Zhu D (2007) Миостатин индуцирует деградацию циклина D1, вызывая остановку клеточного цикла через путь фосфатидилинозитол-3-киназы / AKT / GSK-3 beta и противодействует инсулиноподобному росту фактор 1. J Biol Chem 282 (6): 3799–3808
PubMed CAS Статья Google ученый
Langley B, Thomas M, Bishop A, Sharma M, Gilmour S, Kambadur R (2002) Миостатин ингибирует дифференцировку миобластов путем подавления экспрессии MyoD.J Biol Chem 277 (51): 49831–49840
PubMed CAS Статья Google ученый
McFarlane C, Hui GZ, Amanda WZ, Lau HY, Lokireddy S, Xiaojia G, Mouly V, Butler-Browne G, Gluckman PD, Sharma M, Kambadur R (2011) Миостатин человека отрицательно регулирует рост миобластов человека и дифференциация. Am J Physiol Cell Physiol 301 (1): C195 – C203. DOI: 10.1152 / ajpcell.00012.2011
PubMed CAS PubMed Central Статья Google ученый
Amthor H, Huang R, McKinnell I, Christ B, Kambadur R, Sharma M, Patel K (2002) Регулирование и действие миостатина как негативного регулятора развития мышц во время эмбриогенеза птиц. Dev Biol 251 (2): 241–257
PubMed CAS Статья Google ученый
Салерно М.С., Томас М., Форбс Д., Уотсон Т., Камбадур Р., Шарма М. (2004) Молекулярный анализ типовой экспрессии мышиного промотора миостатина.Am J Physiol Cell Physiol 287 (4): C1031 – C1040
PubMed CAS Статья Google ученый
Yang W, Chen Y, Zhang Y, Wang X, Yang N, Zhu D (2006) Внеклеточный сигнально-регулируемый путь митоген-активируемой протеинкиназы 1/2 участвует в регулируемой миостатином репрессии дифференцировки. Cancer Res 66 (3): 1320–1326
PubMed CAS Статья Google ученый
Chelh I, Meunier B, Picard B, Reecy MJ, Chevalier C, Hocquette JF, Cassar-Malek I (2009) Молекулярные профили четырехглавой мышцы у мышей без миостатина выявляют PI3K и пути апоптоза в качестве мишеней миостатина. BMC Genom 10: 196
Статья Google ученый
Chelh I, Picard B, Hocquette JF, Cassar-Malek I (2011) Инактивация миостатина индуцирует подобную молекулярную сигнатуру мускулов у двумышечного крупного рогатого скота, как и у мышей.Животное 5 (2): 278–286. DOI: 10.1017 / S1751731110001862
PubMed CAS Статья Google ученый
Rommel C, Bodine SC, Clarke BA, Rossman R, Nunez L, Stitt TN, Yancopoulos GD, Glass DJ (2001) Медиация гипертрофии скелетных миотрубок, индуцированной IGF-1, с помощью PI (3) K / Akt / mTOR и PI (3) K / Akt / GSK3 пути. Nat Cell Biol 3 (11): 1009–1013. DOI: 10.1038 / ncb1101-1009
PubMed CAS Статья Google ученый
Bodine SC, Stitt TN, Gonzalez M, Kline WO, Stover GL, Bauerlein R, Zlotchenko E, Scrimgeour A, Lawrence JC, Glass DJ, Yancopoulos GD (2001) Путь Akt / mTOR является важным регулятором гипертрофии скелетных мышц и может предотвратить атрофию мышц in vivo. Nat Cell Biol 3 (11): 1014–1019
PubMed CAS Статья Google ученый
Pallafacchina G, Calabria E, Serrano AL, Kalhovde JM, Schiaffino S (2002) Зависимый от протеинкиназы B и чувствительный к рапамицину путь контролирует рост скелетных мышц, но не определение типа волокна.Proc Natl Acad Sci USA 99 (14): 9213–9218. DOI: 10.1073 / pnas.142166599
PubMed CAS PubMed Central Статья Google ученый
Wullschleger S, Loewith R, Hall MN (2006) Передача сигналов TOR в росте и метаболизме. Ячейка 124 (3): 471–484. DOI: 10.1016 / j.cell.2006.01.016
PubMed CAS Статья Google ученый
Хэй Н., Зоненберг Н. (2004) До и после mTOR. Genes Dev 18 (16): 1926–1945. DOI: 10.1101 / gad.1212704
PubMed CAS Статья Google ученый
Ma XM, Blenis J (2009) Молекулярные механизмы mTOR-опосредованного контроля трансляции. Nat Rev Mol Cell Biol 10 (5): 307–318. DOI: 10.1038 / nrm2672
PubMed Статья Google ученый
Tee AR, Blenis J (2005) mTOR, контроль трансляции и болезни человека. Semin Cell Dev Biol 16 (1): 29–37. DOI: 10.1016 / j.semcdb.2004.11.005
PubMed CAS Статья Google ученый
Meyuhas O (2000) Синтез трансляционного аппарата регулируется на трансляционном уровне. Eur J Biochem 267 (21): 6321–6330 (pii): ejb1719
PubMed CAS Статья Google ученый
Hannan KM, Brandenburger Y, Jenkins A, Sharkey K, Cavanaugh A, Rothblum L, Moss T, Poortinga G, McArthur GA, Pearson RB, Hannan RD (2003) mTOR-зависимая регуляция транскрипции рибосомного гена требует S6K1 и опосредуется фосфорилирование карбоксиконцевого домена активации ядрышкового фактора транскрипции UBF. Mol Cell Biol 23 (23): 8862–8877
PubMed CAS PubMed Central Статья Google ученый
Morissette MR, Cook SA, Buranasombati C, Rosenberg MA, Rosenzweig A (2009) Миостатин ингибирует IGF-I-индуцированную гипертрофию миотрубок через Akt. Am J Physiol Cell Physiol 297 (5): C1124 – C1132. DOI: 10.1152 / ajpcell.00043.2009
PubMed CAS Статья Google ученый
Lipina C, Kendall H, McPherron AC, Taylor PM, Hundal HS (2010) Механизмы, участвующие в усилении мишени млекопитающих передачи сигналов рапамицина и гипертрофии в скелетных мышцах мышей с дефицитом миостатина.FEBS Lett 584 (11): 2403–2408. DOI: 10.1016 / j.febslet.2010.04.039
PubMed CAS PubMed Central Статья Google ученый
Suryawan A, Frank JW, Nguyen HV, Davis TA (2006) Экспрессия лигандов семейства TGF-бета регулируется в процессе развития в скелетных мышцах новорожденных крыс. Педиатр Res 59 (2): 175–179. DOI: 10.1203 / 01.pdr.0000196718.47935.6e
PubMed CAS Статья Google ученый
Welle S, Bhatt K, Pinkert CA (2006) Синтез миофибриллярного белка у мышей с дефицитом миостатина. Am J Physiol Endocrinol Metab 290 (3): E409 – E415. DOI: 10.1152 / ajpendo.00433.2005
PubMed CAS Статья Google ученый
Welle S, Burgess K, Mehta S (2009) Стимуляция синтеза миофибриллярного белка в скелетных мышцах, фосфорилирование киназы p70 S6 и фосфорилирование рибосомного белка S6 путем ингибирования миостатина у зрелых мышей.Am J Physiol Endocrinol Metab 296 (3): E567 – E572. DOI: 10.1152 / ajpendo.
.2008PubMed CAS PubMed Central Статья Google ученый
Steelman CA, Recknor JC, Nettleton D, Reecy JM (2006) Транскрипционное профилирование мышей с нокаутом миостатина предполагает участие передачи сигналов Wnt в постнатальном росте и гипертрофии скелетных мышц. FASEB J 20 (3): 580–582. DOI: 10.1096 / fj.05-5125fje
PubMed CAS Google ученый
Csibi A, Cornille K, Leibovitch MP, Poupon A, Tintignac LA, Sanchez AM, Leibovitch SA (2010) Регулирующая субъединица трансляции eIF3f контролирует киназозависимую передачу сигналов mTOR, необходимую для дифференцировки мышц и гипертрофии у мышей. PLoS One 5 (2): e8994. DOI: 10.1371 / journal.pone.0008994
PubMed PubMed Central Статья Google ученый
Lagirand-Cantaloube J, Offner N, Csibi A, Leibovitch MP, Batonnet-Pichon S, Tintignac LA, Segura CT, Leibovitch SA (2008) Фактор инициации eIF3-f является основной мишенью для atrogin1 / MAFbx функция при атрофии скелетных мышц.EMBO J 27 (8): 1266–1276. DOI: 10.1038 / emboj.2008.52
PubMed CAS PubMed Central Статья Google ученый
Mayhew DL, Hornberger TA, Lincoln HC, Bamman MM (2011) Эукариотический фактор инициации 2B-эпсилон индуцирует cap-зависимую трансляцию и гипертрофию скелетных мышц. J. Physiol 589 (Pt 12): 3023–3037. DOI: 10.1113 / jphysiol.2010.202432
PubMed CAS PubMed Central Статья Google ученый
Sandri M, Sandri C, Gilbert A, Skurk C, Calabria E, Picard A, Walsh K, Schiaffino S, Lecker SH, Goldberg AL (2004) Факторы транскрипции Foxo индуцируют связанную с атрофией убиквитинлигазу атрогин-1 и вызывают скелетные мышцы атрофия. Ячейка 117 (3): 399–412 (pii): S0092867404004003
PubMed CAS PubMed Central Статья Google ученый
Stitt TN, Drujan D, Clarke BA, Panaro F, Timofeyva Y, Kline WO, Gonzalez M, Yancopoulos GD, Glass DJ (2004) Путь IGF-1 / PI3K / Akt предотвращает проявление мышечной атрофии — индуцировал убиквитинлигазы путем ингибирования факторов транскрипции FOXO.Mol Cell 14 (3): 395-403 (pii): S1097276504002114
PubMed CAS Статья Google ученый
McFarlane C, Plummer E, Thomas M, Hennebry A, Ashby M, Ling N, Smith H, Sharma M, Kambadur R (2006) Миостатин вызывает кахексию, активируя протеолитическую систему убиквитина через NF-kappaB- независимый, зависимый от FoxO1 механизм. J Cell Physiol 209 (2): 501–514
PubMed CAS Статья Google ученый
Allen DL, Unterman TG (2007) Регулирование экспрессии миостатина и дифференцировки миобластов факторами транскрипции FoxO и SMAD. Am J Physiol Cell Physiol 292 (1): C188 – C199
PubMed CAS Статья Google ученый
Lokireddy S, Mouly V, Butler-Browne G, Gluckman PD, Sharma M, Kambadur R, McFarlane C (2011) Миостатин способствует истощению культур миобластов человека, способствуя опосредованной убиквитин-протеасомным путем потере саркомерных белки.Am J Physiol Cell Physiol 301 (6): C1316 – C1324. DOI: 10.1152 / ajpcell.00114.2011
PubMed CAS Статья Google ученый
Lokireddy S, Wijesoma IW, Sze SK, McFarlane C, Kambadur R, Sharma M (2012) Идентификация белков, нацеленных на атрогин-1, во время индуцированного миостатином истощения скелетных мышц. Am J Physiol Cell Physiol 303 (5): C512 – C529. DOI: 10.1152 / ajpcell.00402.2011
PubMed CAS Статья Google ученый
Mendias CL, Kayupov E, Bradley JR, Brooks SV, Claflin DR (2011) Снижение удельной силы и выработки энергии мышечными волокнами у мышей с дефицитом миостатина связаны с подавлением деградации белка. J Appl Physiol 111 (1): 185–191. DOI: 10.1152 / japplphysiol.00126.2011
PubMed CAS PubMed Central Статья Google ученый
Sriram S, Subramanian S, Juvvuna PK, Ge X, Lokireddy S, McFarlane CD, Wahli W., Kambadur R, Sharma M (2014) Миостатин увеличивает экспрессию специфичного для мышц белка-1 безымянного пальца через NF- Независимый от kB механизм в нулевой мышце SMAD3.Молекулярный эндокринол 28 (3): 317–330. DOI: 10.1210 / me.2013-1179
PubMed CAS Статья Google ученый
Zhou X, Wang JL, Lu J, Song Y, Kwak KS, Jiao Q, Rosenfeld R, Chen Q, Boone T, Simonet WS, Lacey DL, Goldberg AL, Han HQ (2010) Обращение рака кахексия и истощение мышц из-за антагонизма ActRIIB приводит к увеличению продолжительности жизни. Ячейка 142 (4): 531–543. DOI: 10.1016 / j.cell.2010.07.011
PubMed CAS Статья Google ученый
Lee JY, Hopkinson NS, Kemp PR (2011) Миостатин индуцирует аутофагию в скелетных мышцах in vitro. Biochem Biophys Res Commun 415 (4): 632–636. DOI: 10.1016 / j.bbrc.2011.10.124
PubMed CAS Статья Google ученый
Seiliez I, Taty Taty GC, Bugeon J, Dias K, Sabin N, Gabillard JC (2013) Миостатин вызывает атрофию мышечных трубок форели за счет ингибирования передачи сигналов TORC1 и стимулирования путей деградации убиквитин-протеасомы и аутофагии-лизосомы.Gen Comp Endocrinol 186: 9–15. DOI: 10.1016 / j.ygcen.2013.02.008
PubMed CAS Статья Google ученый
Гарикипати Д.К., Роджерс Б.Д. (2012) Миостатин стимулирует дифференцировку миоспателлитных клеток в новой модельной системе: доказательства субфункционализации генов. Am J Physiol Regul Integr Comp Physiol 302 (9): R1059 – R1066. DOI: 10.1152 / ajpregu.00523.2011
PubMed CAS Статья Google ученый
Различные пути транскрипции атрофии-гипертрофии в мышцах, пораженных тяжелой и легкой спинальной мышечной атрофией | BMC Medicine
Лефевр С., Бурглен Л., Ребулле С., Клермон О, Бурле П., Виолле Л., Бенишу Б., Круод С., Мийассо П., Зевиани М., Ле Пелье Д., Фрезаль Дж., Коэн Д., Вайссенбах Дж., Мюнних А., Мелки Дж .: Идентификация и характеристика гена, определяющего мышечную атрофию позвоночника. Клетка. 1995, 80: 155-165.
CAS Статья PubMed Google ученый
Parsons DW, McAndrew PE, Iannaccone ST, Mendell JR, Burghes AHM: Внутригенные мутации telSMN: частота, распределение, доказательства эффекта основателя и модификация фенотипа спинномозговой мышечной атрофии по количеству копий cenSMN.Am J Hum Genet. 1998, 63: 1712-1723.
CAS Статья PubMed PubMed Central Google ученый
Coovert DD, Le TT, McAndrew PE, Strasswimmer J, Crawford TO, Mendell JR, Coulson SE, Androphy EJ, Prior TW, Burghes AH: белок двигательного нейрона выживания при спинальной мышечной атрофии. Hum Mol Genet. 1997, 6: 1205-1214.
CAS Статья PubMed Google ученый
Lefebvre S, Burlet P, Liu Q, Bertrandy S, Clermont O, Munnich A, Dreyfuss G, Melki J: Корреляция между тяжестью и уровнем белка SMN при спинальной мышечной атрофии. Нат Жене. 1997, 16: 265-269.
CAS Статья PubMed Google ученый
Lorson CL, Strasswimmeer J, Yao JM, Baleja JD, Hahnen E, Wirth B, Le T, Burghes AH, Androphy EJ: Дефект олигомеризации SMN коррелирует с серьезностью спинальной мышечной атрофии.Нат Жене. 1998, 19: 63-67.
CAS Статья PubMed Google ученый
Пеллиццони Л., Катаока Н., Шарру Б., Дрейфус Г.: Новая функция SMN, продукта гена мышечной атрофии позвоночника, в пре-сплайсинге мРНК. Клетка. 1998, 95: 615-624.
CAS Статья PubMed Google ученый
Briese M, Esmaeili B, Sattelle DB: Является ли спинальная мышечная атрофия результатом дефектов в процессах двигательных нейронов ?.Биологические исследования. 2005, 27: 946-957.
CAS Статья PubMed Google ученый
Эггерт С, Шари А, Лаггербауэр Б, Фишер У.: Спинальная мышечная атрофия: связь RNP. Тенденции Мол Мед. 2006, 12: 113-121.
CAS Статья PubMed Google ученый
Браун С., Кройза Б., Лагранж М.К., Пойндрон П., Уортер Дж. М.: Дегенерация сокультуры мышечных клеток с мышечной атрофией позвоночника и эксплантатов спинного мозга крысы не связана с секретируемыми факторами и не может быть предотвращена нейротрофинами.Мышечный нерв. 1997, 20: 953-960.
CAS Статья PubMed Google ученый
Cifuentes-Diaz C, Frugier T, Tiziano FD, Lacene E, Robot N, Joshi V, Moreau MH, Melki J: Удаление экзона 7 мышиного SMN, направленного на скелетные мышцы, приводит к тяжелой мышечной дистрофии. J Cell Biol. 2001, 152: 1107-1114.
CAS Статья PubMed PubMed Central Google ученый
Rajendra TK, Gonsalvez GB, Walker MP, Shpargel KB, Salz HK, Matera GA: Drosophila melanogaster Модель спинальной мышечной атрофии показывает функцию SMN в поперечно-полосатых мышцах. J Cell Biol. 2007, 176: 831-841.
CAS Статья PubMed PubMed Central Google ученый
Kandarian SC, Jackman RW: Внутриклеточная передача сигналов во время атрофии скелетных мышц. Мышечный нерв. 2006, 33: 155-165.
CAS Статья PubMed Google ученый
Glass DJ: Молекулярные механизмы, регулирующие мышечную массу. Тенденции Мол Мед. 2003, 9: 344-350.
CAS Статья PubMed Google ученый
Сарторелли В., Фулько М: Молекулярные и клеточные детерминанты атрофии и гипертрофии скелетных мышц. Sci STKE. 2004, re11-244
Lee SW, Dai G, Hu Z, Wang X, Du J, Mitch WE: Регулирование деградации мышечного белка: скоординированный контроль апоптотической и убиквитин-протеасомной систем с помощью фосфатидилинозитол-3-киназы.J Am Soc Nephrol. 2004, 15: 1537-1545.
CAS Статья PubMed Google ученый
Sandri M, Sandri C, Gilbert A, Skurk C, Calabria E, Picard A, Walsh K, Schiaffino S, Lecker SH, Goldberg AL: факторы транскрипции Foxo индуцируют связанную с атрофией убиквитинлигазу атрогин-1 и вызвать атрофию скелетных мышц. Клетка. 2004, 117: 399-412.
CAS Статья PubMed PubMed Central Google ученый
Миллер С.А., Дайкс Д.Д., Полесский Х.Ф.: Простая процедура высаливания для извлечения ДНК из ядерных клеток человека. Nucleic Acids Res. 1988, 16: 1215.
CAS Статья PubMed PubMed Central Google ученый
Steege Van der G, Grootscholten PM, Vlies van der P, Draaijers TG, Osinga J, Cobben JM, Scheffer H, Buyys CH: ДНК-тест на основе ПЦР для подтверждения клинического диагноза аутосомно-рецессивной спинальной мышечной атрофии.Ланцет. 1995, 345: 985-986.
CAS Статья PubMed Google ученый
Рой Н., Махадеван М.С., Маклин М., Шатлер Дж., Яраги З., Фарахани Р., Бэрд С., Беснер-Джонстон А., Лефевр С., Кан Х, Салих М., Обри Х., Тамай К., Гуан Х, Иоанну П., Кроуфорд Т.О., де Йонг П.Дж., Сурт Л., Икеда Дж., Корнелюк Р.Г., Маккензи А.: Ген белка ингибитора апоптоза нейронов частично удален у лиц со спинальной мышечной атрофией.Клетка. 1995, 80: 167-178.
CAS Статья PubMed Google ученый
Scheffer H, Cobben JM, Mensink RG, Stulp RP, Steege van der G, Buys CH: Тестирование носителя SMA — проверка делеции гемизиготного экзона 7 SMN для выявления носителей проксимальной спинной мышечной атрофии и пациентов с делеция единственного аллеля. Eur J Hum Genet. 2000, 8: 79-86.
CAS Статья PubMed Google ученый
Millino C, Bellin M, Fanin M, Romualdi C, Pegoraro E, Angelini C, Lanfranchi G: характеристика профиля экспрессии ламинин-альфа-2-положительного MDC. Biochem Biophys Res Commun. 2006, 350: 345-351.
CAS Статья PubMed Google ученый
Тибширани Р., Хасти Т.Дж., Нарасимхан Б., Чу Г.: Диагностика нескольких типов рака по уменьшенным центроидам экспрессии генов. Proc Natl Acad Sci USA. 2002, 99: 6567-6572.
CAS Статья PubMed PubMed Central Google ученый
Provenzano M, Mocellin S: Дополнительные методы: проверка данных экспрессии генов с помощью количественной ПЦР в реальном времени. Adv Exp Med Biol. 2007, 593: 66-73.
Артикул PubMed Google ученый
Lecker SH, Jagoe RT, Gilbert A, Gomes M, Baracos V, Bailey J, Price SR, Mitch WE, Goldberg AL: Множественные типы атрофии скелетных мышц включают общую программу изменений экспрессии генов.FASEB J. 2004, 18: 39-51.
CAS Статья PubMed Google ученый
Сандри М.: Апоптотическая передача сигналов в волокнах скелетных мышц во время атрофии. Curr Opin Clin Nutr Metab Care. 2002, 5: 249-253.
Артикул PubMed Google ученый
Waskiewicz AJ, Flynn A, Proud CG, Cooper JA: Митоген-активированные протеинкиназы активируют серин / треониновые киназы Mnk1 и Mnk2.EMBO J. 1997, 16: 1909-1920.
CAS Статья PubMed PubMed Central Google ученый
Jagoe RT, Lecker SH, Gomes M, Goldberg AL: Паттерны экспрессии генов в атрофированных скелетных мышцах: ответ на голодание. FASEB J. 2002, 16: 1697-1712.
CAS Статья PubMed Google ученый
Сусси-Яникостас Н., Бен Хамида К., Бежауи К., Хентати Ф., Бен Хамида М., Батлер-Браун Г.С.: Эволюция мышечных специфических белков при болезни Верднига-Хоффмана.J Neurol Sci. 1992, 109: 111-120.
CAS Статья PubMed Google ученый
Puig O, Marr MT, Ruhf ML, Tjian R: Контроль количества клеток с помощью Drosophila FOXO: регулирование пути инсулинового рецептора ниже по течению и с обратной связью. Genes Dev. 2003, 17 (16): 2006-2020.
CAS Статья PubMed PubMed Central Google ученый
Raffaello A, Laveder P, Romualdi C, Bean C, Toniolo L, Germinario E, Megighian A, Danieli-Betto D, Reggiani C, Lanfranchi G: Денервация быстро сокращающихся мышц мыши: краткосрочные физиологические изменения и временное профилирование выражения.Physiol Genomics. 2006, 25: 60-74.
CAS Статья PubMed Google ученый
Sacheck JM, Hyatt JP, Raffaello A, Jagoe RT, Roy RR, Edgerton VR, Lecker SH, Goldberg AL: быстрое неиспользование и атрофия денервации связаны с транскрипционными изменениями, аналогичными тем, которые возникают при истощении мышц при системных заболеваниях. FASEB J. 2007, 21: 140-155.
CAS Статья PubMed Google ученый
Saitoh M, Nishitoh H, Fujii M, Takeda K, Tobiume K, Sawada Y, Kawabata M, Miyazono K, Ichijo H: Тиоредоксин млекопитающих является прямым ингибитором киназы, регулирующей сигнал апоптоза (ASK) 1. EMBO J. 1998, 17: 2596-2606.
CAS Статья PubMed PubMed Central Google ученый
Kim SH, Han SY, Azam T, Yoon DY, Dinarello CA: Интерлейкин-32: цитокин и индуктор TNFalpha.
