Аминокислоты – общая формула, таблица (химия, 10 класс)
4
Средняя оценка: 4
Всего получено оценок: 748.
4
Средняя оценка: 4
Всего получено оценок: 748.
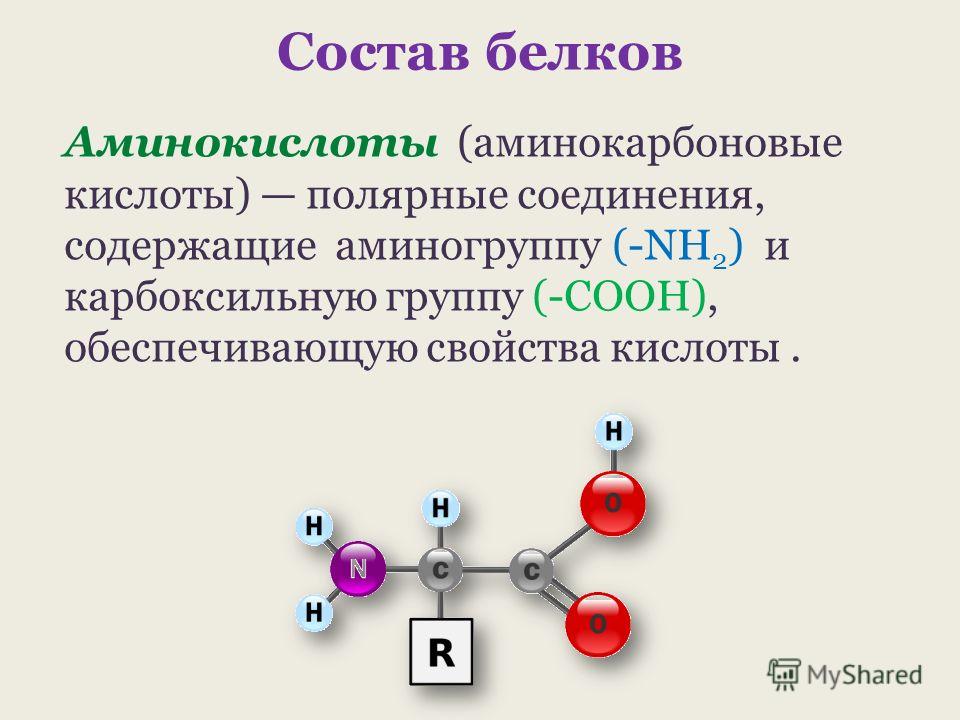
Органические вещества, в молекуле которых содержатся карбоксильные и аминные группы, называются аминокислотами или аминокарбоновыми кислотами. Это жизненно важные соединения, являющиеся основой построения живых организмов.
Строение
Аминокислота – мономер, состоящий из азота, водорода, углерода и кислорода. Также к аминокислоте могут присоединяться не углеводородные радикалы, например, сера или фосфор.
Условная общая формула аминокислот – NH2-R-COOH, где R – двухвалентный радикал. При этом аминогрупп в одной молекуле может быть несколько.
Рис. 1. Структурное строение аминокислот.С химической точки зрения аминокислоты – производные карбоновых кислот, в молекуле которых атомы водорода заменены аминогруппами.
Виды
Аминокислоты классифицируются по нескольким признакам.
Признак | Вид | Описание | Пример |
По расположению аминных и карбоксильных групп относительно друг друга | α-аминокислоты | Содержат один атом углерода между функциональными группами | Аланин |
β-, γ-, δ-, ε- и другие аминокислоты | Содержат несколько атомов углерода между функциональными группами | β-аминопропионовая кислота (два атома между группами), ε-аминокапроновая кислота (пять атомов) | |
По изменяемой части (радикалу) | Алифатические (жирные) | Не содержат ароматических связей. Бывают линейными и циклическими | Лизин, серин, треонин, аргинин |
Ароматические | Содержат бензольное кольцо | Фенилаланин, триптофан, тирозин | |
Гетероциклические | Содержат гетероатом – радикал, не являющийся углеродом или водородом | Триптофан, гистидин, пролин | |
Иминокислоты | Содержат иминогруппу NH | Пролин, оксипролин | |
По физико-химическим свойствам | Неполярные (гидрофобные) | Не взаимодействуют с водой | Глицин, валин, лейцин, пролин |
Полярные (гидрофильные) | Взаимодействуют с водой. | Лизин, серин, аспартат, глутамат, глутамин |
Названия формируются из структурных или тривиальных наименований карбоновых кислот с приставкой «амино-». Цифры показывают, где располагается аминогруппа. Также используются тривиальные названия, заканчивающиеся на «-ин». Например, 2-аминобутановая или α-аминомасляная кислота.
Свойства
Аминокислоты отличаются физическими свойствами от других органических кислот. Все соединения класса – кристаллические вещества, хорошо растворимые в воде, но плохо растворимые в органических растворителях. Они плавятся при высоких температурах, имеют сладковатый вкус и легко образуют соли.
Аминокислоты являются амфотерными соединениями. Благодаря наличию карбоксильной группы -СООН проявляют свойства кислот. Аминогруппа -NH2 обуславливает основные свойства.
Химические свойства соединений:
- горение:
4NH2CH2COOH + 13O2 → 8CO2 + 10H 2O + 2N2;
- гидролиз:
NH2CH2COOH + H2O ↔ NH3CH2COOH + OH;
- реакция с раствором щёлочи:
NH2CH2COOH + NaOH → NH2CH2COO-Na + H2O;
- реакция с раствором кислоты:
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4;
- этерификация:
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O.

Из аминокислотных мономеров образуются длинные полимеры – белки. Один белок может включать несколько разных аминокислот. Например, содержащийся в молоке белок казеин состоит из тирозина, лизина, валина, пролина и ряда других аминокислот. В зависимости от строения белки выполняют различные функции в организме.
Что мы узнали?
Из урока химии 10 класса узнали, что такое аминокислоты, какие вещества содержат, как классифицируются. Аминокислоты включают две функциональные группы – аминогруппу -NH2 и карбоксильную группу -COOH. Наличие двух групп обуславливает амфотерность аминокислот: соединения обладают свойствами оснований и кислот. Аминокислоты делятся по нескольким признакам и отличаются количеством аминогрупп, наличием или отсутствием бензольного кольца, присутствием гетероатома, взаимодействием с водой.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Будьте первым!
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 748.
А какая ваша оценка?
Незаменимая аминокислота триптофан и ее полезные свойства
Триптофан — протеиногенная аминокислота, входящая в состав белков всех известных живых организмов. Триптофан существует в виде двух оптических изомеров – D и L, а также в виде рацемата (DL).
Аминокислоты чрезвычайно важны для функционирования организма, поскольку они служат строительными блоками для синтеза белка. Триптофан — одна из девяти незаменимых аминокислот, которые не синтезируются в организме человека, а поступают исключительно из пищевых источников.
Пищевые источник триптофана – мясо индейки и курицы (имейте в виду: темное мясо содержит меньше триптофана, чем светлое мясо), семечки тыквы, кунжут, рыба (сельдь, лосось, скумбрия, сардины), яйца, молоко и молочные продукты, черный шоколад, какао-крупка, тофу и другие продукты из сои.
В организме L-триптофан превращается в серотонин, который помогает контролировать настроение и сон. Серотонин — важный нейротрансмиттер в организме. Снижение уровня серотонина может привести к тому, что у человека возникнут нарушение сна, повысится уровень стресса, возможно нарушение пищевого поведения. Эмоциональный дисбаланс, ухудшение состояния нервной системы и повышенный риск развития депрессии и симптомов тревоги – также являются последствиями низкого уровня серотонина.
Серотонин — важный нейротрансмиттер в организме. Снижение уровня серотонина может привести к тому, что у человека возникнут нарушение сна, повысится уровень стресса, возможно нарушение пищевого поведения. Эмоциональный дисбаланс, ухудшение состояния нервной системы и повышенный риск развития депрессии и симптомов тревоги – также являются последствиями низкого уровня серотонина.
Ряд исследований демонстрирует, что L-триптофан благотворно влияет на настроение. Также известно, что биологически активные добавки с L-триптофаном могут помочь в регулировании перепадов настроения, вызванных предменструальным синдромом (ПМС) или предменструальным дисфорическим расстройством (ПМДР). Существует теория, что ПМС или ПМДР связаны с нарушением обработки серотонина в организме. Триптофан необходим для синтеза ниацин (витамина B3). Этот витамин помогает поддерживать оптимальные уровни липидов крови, участвует в преобразовании углеводов в энергию и помогает поддерживать здоровье пищеварительной системы, кожи, волос и глаз.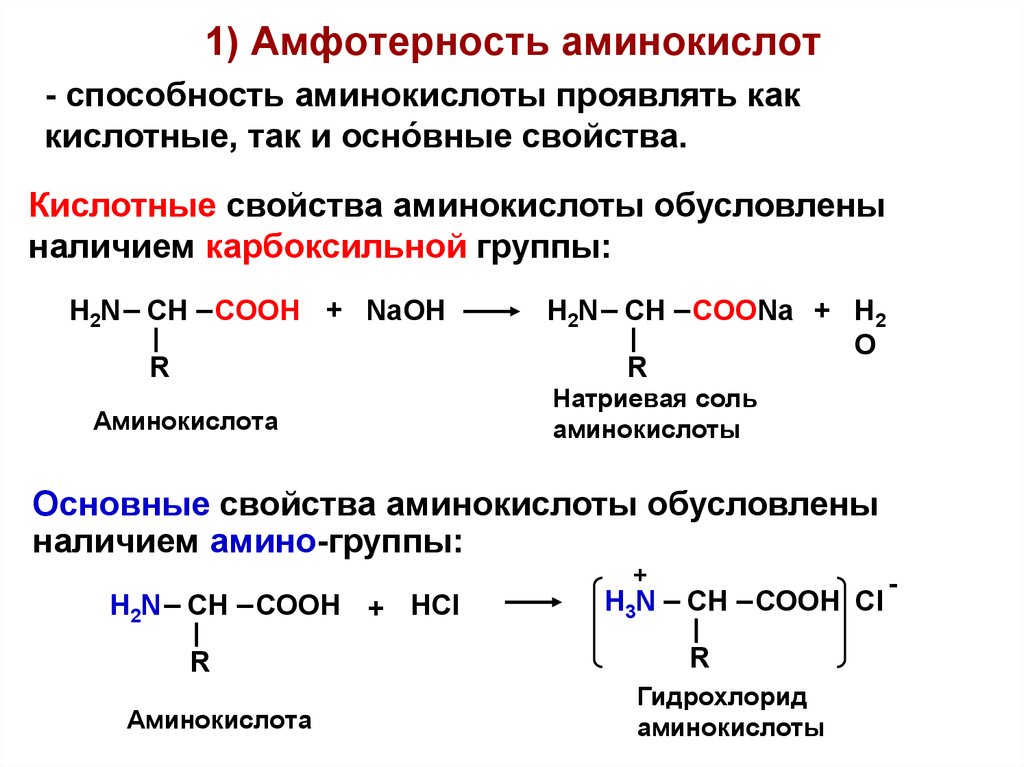
Для некоторых людей биологически активные добавки, содержащие триптофан или L-триптофан, могут быть полезны при различных нарушениях сна, поскольку триптофан улучшает засыпание, увеличивает продолжительность и качество сна.
Есть некоторые сведения, что триптофан может улучшить спортивные результаты. Триптофан чрезвычайно важен для нормального роста и развития нервной системы в детском возрасте. Он помогает в созревании мозга ребенка.
Большая часть существующих исследований, посвященных потенциальным возможностям L-триптофана и триптофана, сосредоточена на его влиянии на настроение и обучение. Так, одно исследование показало, что увеличение потребления триптофана с пищей может повлиять на состояние депрессии и настроение здоровых участников. Диета, в которой присутствовал триптофан, приводила к уменьшению депрессивных симптомов и улучшению настроения у людей. Наоборот, люди, которые потребляли меньше триптофана с пищей, проявляли более высокий уровень раздражения и тревожности. Другое исследование показало, что употребление L-триптофан улучшает распознавание эмоций у женщин. Биологически активные добавки L-триптофана также были изучены с точки зрения их влияния на уровень выносливости при выполнении физических упражнений. Прием биологически активных добавок, содержащих L-триптофан, увеличивает выносливость и удлиняет время тренировки почти на 50 %.
Другое исследование показало, что употребление L-триптофан улучшает распознавание эмоций у женщин. Биологически активные добавки L-триптофана также были изучены с точки зрения их влияния на уровень выносливости при выполнении физических упражнений. Прием биологически активных добавок, содержащих L-триптофан, увеличивает выносливость и удлиняет время тренировки почти на 50 %.
Прием триптофана может привести к появлению головокружений, сонливости, усталости, крапивнице, тошноте, тахикардии, нарушению координации. Наиболее неблагоприятным побочным эффектом триптофана является опасное и потенциально смертельное состояние, называемое синдромом эозинофилии-миалгии (СЭМ), которое проявляется повышенной утомляемостью, выраженными болями в мышцах, усиливающимися при движениях, слабостью, также в процесс может вовлекаться миокард, суставы, дыхательная и нервная система.
Биологически активные добавки, содержащие триптофан, также могут взаимодействовать с некоторыми лекарственными средствами, такими как антидепрессанты. Триптофан нужно использовать с осторожностью при циррозе печени.
Триптофан нужно использовать с осторожностью при циррозе печени.
Хотя биологически активные добавки, содержащие триптофан, зарекомендовали себя довольно хорошо, перед их применением необходимо проконсультироваться с врачом, учитывая возможные неблагоприятные последствия. Лучший способ получать достаточно триптофана – использовать в своем питании продукты, богатые им.
Источник: https://www.webmd.com/
Аминокислоты – преимущества, структура и функции
Определение
Аминокислоты являются строительными блоками полипептидов и белков и играют важную роль в метаболических путях, экспрессии генов и регуляции передачи клеточных сигналов. Одна молекула органической аминокислоты содержит две функциональные группы — аминовую и карбоксильную — и уникальную боковую цепь. Людям требуется двадцать различных аминокислот; одиннадцать синтезируются в организме и девять поступают из пищевых источников.
АминокислотыПолезные свойства аминокислот
Полезные свойства аминокислот легко назвать, потому что без аминокислот мы не можем существовать.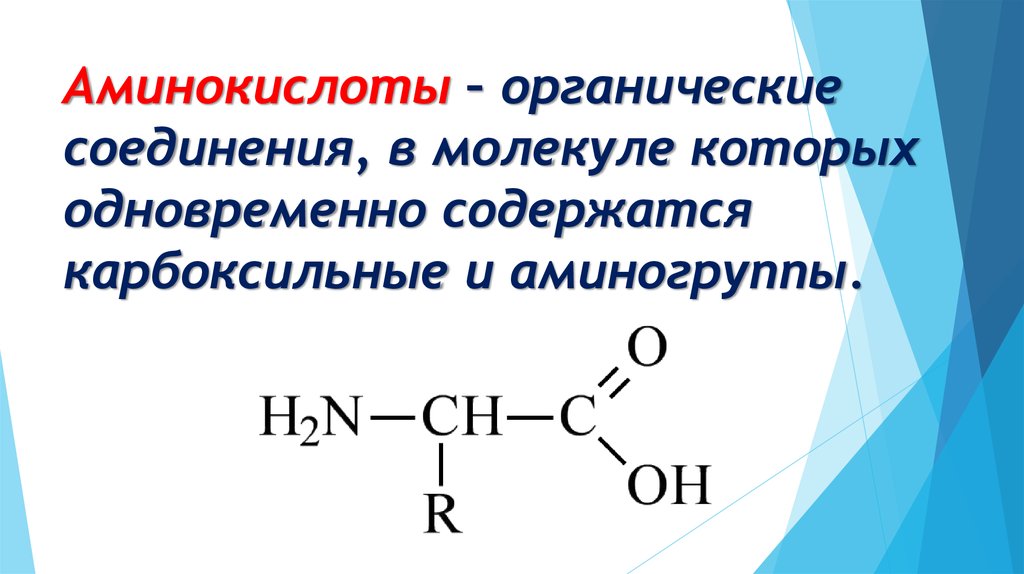 Каждая анатомо-физиологическая особенность живого организма возможна благодаря наличию аминокислот. Синтез заменимых с точки зрения питания аминокислот в организме человека — аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, пролина, серина и тирозина — происходит посредством построения de novo их углеродных скелетов. Тем не менее, недавние исследования показывают, что мы все еще можем извлечь пользу из приема заменимых аминокислот для поддержания оптимального здоровья и благополучия. Только когда количество незаменимых аминокислот и глюкозы достаточно и доступно, скорость синтеза заменимых аминокислот может увеличиться . Поэтому важно потреблять в рационе оба типа аминокислот, чтобы воспользоваться их многочисленными положительными, если не абсолютно необходимыми, эффектами.
Каждая анатомо-физиологическая особенность живого организма возможна благодаря наличию аминокислот. Синтез заменимых с точки зрения питания аминокислот в организме человека — аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, пролина, серина и тирозина — происходит посредством построения de novo их углеродных скелетов. Тем не менее, недавние исследования показывают, что мы все еще можем извлечь пользу из приема заменимых аминокислот для поддержания оптимального здоровья и благополучия. Только когда количество незаменимых аминокислот и глюкозы достаточно и доступно, скорость синтеза заменимых аминокислот может увеличиться . Поэтому важно потреблять в рационе оба типа аминокислот, чтобы воспользоваться их многочисленными положительными, если не абсолютно необходимыми, эффектами.
Преимущества незаменимых аминокислот
Девять незаменимых аминокислот: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Эти аминокислоты не могут быть произведены в организме, но имеют решающее значение для ошеломляющего ряда физиологических функций.
Эти аминокислоты не могут быть произведены в организме, но имеют решающее значение для ошеломляющего ряда физиологических функций.
Гистидин является предшественником различных гормонов и метаболитов, важных для функции почек, желудочной секреции, иммунной системы и нейротрансмиссии. Он помогает производить эритроциты и гемоглобин. Кроме того, гистидин катализирует действие большого количества ферментов и способствует противовоспалительным и антиоксидантным процессам. Дефицит гистидина приводит к анемии, дисфункции почек, окислительному стрессу и воспалительным заболеваниям.
Изолейцин — одна из трех аминокислот с разветвленной цепью (BCAA). Он помогает увеличить скорость синтеза белка и способствует формированию мышечной ткани. Кроме того, известно, что изолейцин увеличивает потребление глюкозы, развитие кишечника и иммунную функцию, хотя во многих исследованиях рассматривались BCAA в целом, а не отдельная аминокислота. Это означает, что лейцин и валин — обе незаменимые аминокислоты — могут иметь общие преимущества.
Лизин играет важную роль в делении и росте клеток, поскольку он является основным строительным блоком факторов роста. Ускоренное заживление ран с использованием растворенных веществ на основе лизина приводит к меньшему образованию рубцовой ткани, в то время как участки, которые получают мало кислорода и питательных веществ, в которые непосредственно вводятся факторы роста, выигрывают от ангиогенеза или развития новых кровеносных сосудов вокруг места инъекции. Кроме того, лизин способствует метаболизму жиров. Дефицит лизина может привести к анемии, нарушению метаболизма жирных кислот, замедлению заживления ран, снижению мышечной массы и образованию дефектных соединительных тканей; однако высокие уровни могут вызывать неврологические расстройства.
Метионин содержит серу, которая необходима для здоровья хрящей и печени, улучшает структуру волос и прочность ногтей. Редкие нарушения обмена веществ могут помешать организму использовать метионин, что в долгосрочной перспективе может привести к серьезному повреждению печени из-за окислительного повреждения.
Фенилаланин является предшественником тирозингидроксилазы, фермента, который ускоряет синтез катехоламинов и тем самым влияет на настроение. Фенилаланин также необходим для сигнализации доступности глюкозы и секреции глюкагона и инсулина. Он играет дополнительную роль в окислении жиров. Недостаток фенилаланина связан со спутанностью сознания, отсутствием энергии, потерей памяти и депрессией. Дозы выше 5000 мг в день являются токсичными и могут вызвать повреждение нервов.
Наличие треонина увеличивает поглощение других аминокислот, таких как фенилаланин, но также способствует балансу нейротрансмиттеров в мозге, производству мышечной ткани и функционированию иммунной системы. Было обнаружено, что у детей, которых кормили матери, принимающие добавки треонина, был более высокий уровень глицина в мозге с последующим риском дисфункции нейротрансмиттеров. Как и многие аминокислоты, правильные уровни добавок еще не являются фиксированной сущностью , и еще предстоит провести гораздо больше исследований.
Триптофан является молекулой-предшественником ниацина (витамина B 3 ), мелатонина и серотонина и поэтому необходим для сна и настроения. Как и все аминокислоты, кодон триптофана является строительным блоком для полипептидных цепей и белков. Недостаток триптофана часто проявляется бессонницей и депрессивным настроением.
Триптофан влияет на качество снаПреимущества незаменимых аминокислот
Преимущества незаменимых аминокислот, вырабатываемых организмом (de novo), столь же широки, как и у незаменимых аминокислот. В то время как эти аминокислоты производятся с нуля, диетические источники могут увеличить доступность и, таким образом, обеспечить более надежный и стабильный эффект .
Молекулы аланина и глютамина синтезируются в скелетных мышцах с использованием источников пирувата и высвобождаются для увеличения запасов энергии. Оба важны для здоровой нервной системы, а аланин необходим для синтеза триптофана. Более высокие уровни аланина защищают сердечно-сосудистую систему, в то время как низкие уровни глютамина увеличивают смертность у критических пациентов и способствуют значительной потере мышечной массы. Также известно, что глутамин является важным источником энергии для опухолевых клеток , уступая только глюкозе.
Более высокие уровни аланина защищают сердечно-сосудистую систему, в то время как низкие уровни глютамина увеличивают смертность у критических пациентов и способствуют значительной потере мышечной массы. Также известно, что глутамин является важным источником энергии для опухолевых клеток , уступая только глюкозе.
Аргинин классифицируется как условно незаменимая аминокислота для новорожденных и заменимая аминокислота для остального населения. Аргинин является одним из наиболее распространенных ингредиентов полипептидов и белков и помогает обеспечить здоровую иммунную систему за счет увеличения производства Т-клеток. Он помогает высвобождать инсулин и гормоны роста человека, нейтрализовать аммиак в печени, улучшать качество и заживление кожи и соединительной ткани. Он также содержится в семенной жидкости.
Аспарагин играет важную роль в синтезе гликопротеинов и здоровье печени. Низкий уровень ослабляет чувство усталости и означает, что эту аминокислоту часто называют тонизирующим средством.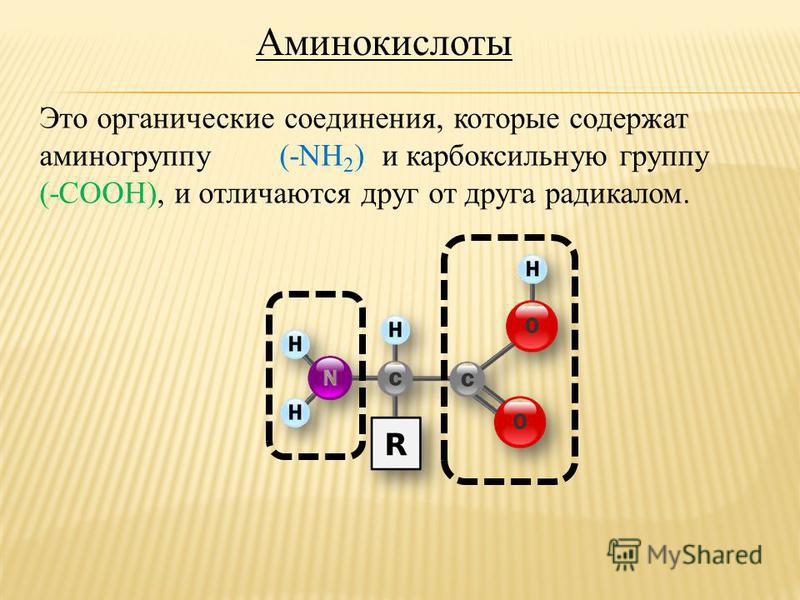 Тем не менее, его вклад в передачу сигналов и развитие центральной нервной системы так же важен, как и его способность повышать уровень энергии.
Тем не менее, его вклад в передачу сигналов и развитие центральной нервной системы так же важен, как и его способность повышать уровень энергии.
Аспарагиновая кислота работает в циклах лимонной кислоты и мочевины и является предшественником других аминокислот. Более того, он также является возбуждающим нейротрансмиттером ствола и спинного мозга, который увеличивает вероятность успешной деполяризации постсинаптической мембраны. Его ингибирующим партнером является аминокислота глицин. Обе эти незаменимые аминокислоты должны быть в балансе, чтобы быть полезными для центральной нервной системы . Глицин — простейшая аминокислота, и ее успокаивающее действие улучшает сон и снижает стремление к вознаграждению. Он может быть синтезирован путем деградации коллагена и является основным ингредиентом коллагена.
Цистеин, вторая и последняя серосодержащая аминокислота, добавляющая тиоловую группу (-SH) к карбоксильной и аминогруппам. Цистеин синтезируется из метионина, другой серосодержащей, но незаменимой аминокислоты, путем трансметилирования с образованием гомоцистеина, а затем с помощью транссульфирования с образованием цистеина.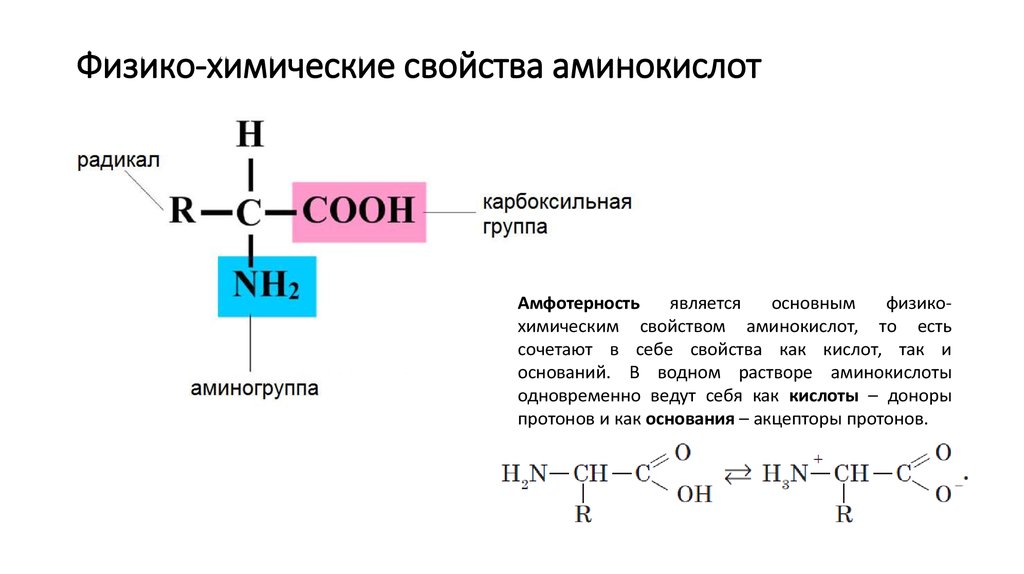 Цистеин используется для синтеза белка, синтеза кофермента А, глутатиона (антиоксиданта) и производства сероводорода. Является предшественником пирувата и таурина.
Цистеин используется для синтеза белка, синтеза кофермента А, глутатиона (антиоксиданта) и производства сероводорода. Является предшественником пирувата и таурина.
Глутаминовая кислота наиболее известна своей ролью предшественника гамма-аминомасляной кислоты (ГАМК), где происходит тормозящее действие, хотя сама глутаминовая кислота действует как возбуждающий нейротрансмиттер во всей центральной нервной системе. Это чрезвычайно распространенная диетическая аминокислота, которая также может снижать уровень артериального давления. Глутамат иногда добавляют в качестве двенадцатой заменимой аминокислоты, но он является производным глутаминовой кислоты.
Пролин может быть синтезирован из глютамина или получен в результате распада коллагена и является источником энергии, когда организм находится в состоянии стресса. Производство пролина может успешно происходить только в присутствии фермента пролилгидроксилазы и профакторов кислорода, железа и витамина С. Пролин также имеет решающее значение для синтеза коллагена. Фактически, коллаген требует присутствия восемнадцати различных аминокислот в различных количествах.
Фактически, коллаген требует присутствия восемнадцати различных аминокислот в различных количествах.
Серин необходим для переноса метильных групп в организме и, следовательно, необходим для производства таких веществ, как креатин, адреналин, ДНК и РНК. Это также было связано с ростом клеток рака молочной железы. В другой форме — D-серин — играет нейромодулирующую роль. Кроме того, без серина невозможно образование глицина, цистеина, таурина и фосфолипидов.
Тирозин широко рекламируется как когнитивная добавка, поскольку он является предшественником катехоламинов дофамина и норадреналина, а также тироксина и меланина. Однако его влияние на население в целом не доказано, и результаты, как правило, возникают у одних, а у других нет. Следовательно, действие тирозина должно быть зависит от наличия или отсутствия других химических веществ . Как и любая аминокислота, тирозин также является важным строительным блоком в синтезе полипептидов и белков.
Аминокислотная структура
Аминокислотная структура является одной из самых простых структур для распознавания, поскольку каждая органическая молекула имеет щелочную (или основную) функциональную аминогруппу (―Nh3), кислотную функциональную карбоксильную группу (―COOH) и органическую боковая цепь (R-цепь), уникальная для каждой аминокислоты. На самом деле название этой группы — это инкапсуляция центральных ингредиентов — альфа-амино[α-амино] и карбоновой кислоты.
На самом деле название этой группы — это инкапсуляция центральных ингредиентов — альфа-амино[α-амино] и карбоновой кислоты.
Все аминокислоты содержат один центральный атом углерода . Амино- и карбоксильные функциональные группы присоединены к этому центральному атому углерода, часто называемому α-углеродом. Это оставляет две из четырех углеродных связей свободными. Один присоединится к одному из многочисленных атомов водорода, находящихся поблизости, другой присоединится к органической боковой цепи или R-группе. Группы R обладают разнообразными формами, размерами, зарядами и реакциями, которые позволяют группировать аминокислоты в соответствии с химическими свойствами, обусловленными их боковыми цепями. Эти боковые цепи хорошо видны на изображении ниже.
Таблица аминокислотАлифатические аминокислоты
Алифатические аминокислоты неполярны и гидрофобны. По мере увеличения числа атомов углерода в боковой цепи гидрофобность увеличивается. Алифатические аминокислоты представляют собой аланин, глицин, изолейцин, лейцин, пролин и валин; хотя в глицине так мало атомов углерода, он не является ни гидрофильным, ни гидрофобным.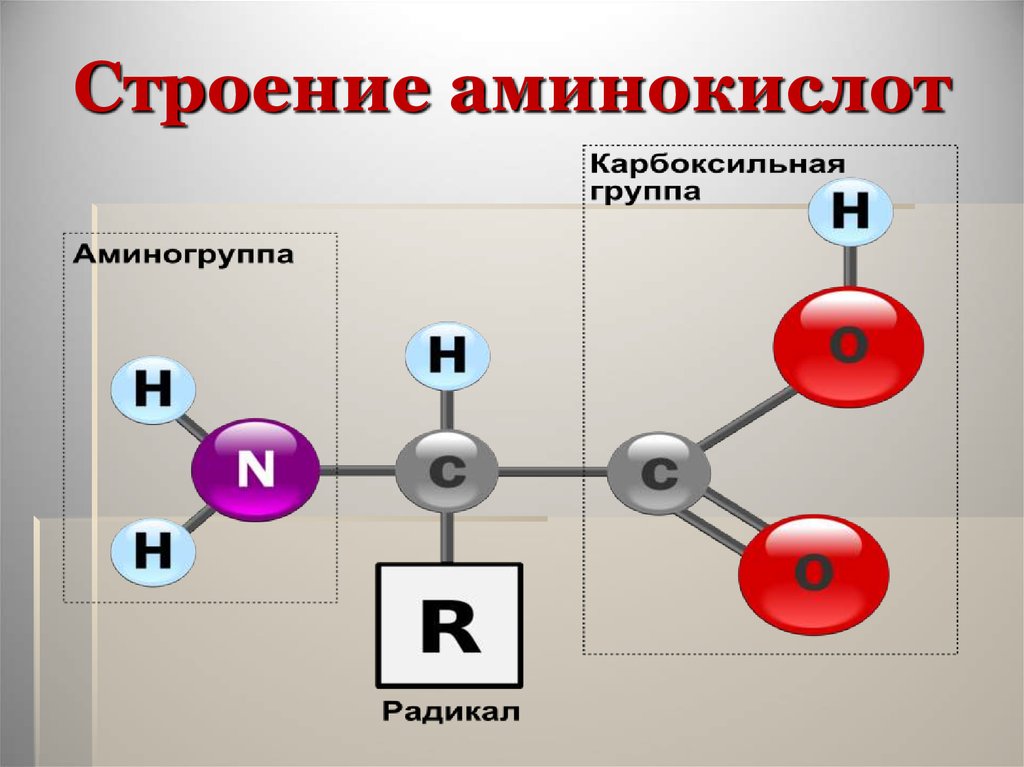 Метионин иногда называют почетным членом группы алифатических соединений. Его боковая цепь содержит атом серы вместо атомов углерода и водорода, но, как и алифатическая группа, не реагирует сильно в присутствии других молекул, поскольку алифатические аминокислоты не имеют положительного или отрицательного заряда, а имеют одинаковое распределение заряда по всей молекуле.
Метионин иногда называют почетным членом группы алифатических соединений. Его боковая цепь содержит атом серы вместо атомов углерода и водорода, но, как и алифатическая группа, не реагирует сильно в присутствии других молекул, поскольку алифатические аминокислоты не имеют положительного или отрицательного заряда, а имеют одинаковое распределение заряда по всей молекуле.
Ароматические аминокислоты
Ароматические аминокислоты включают фенилаланин, тирозин и триптофан и имеют не слишком низкий заряд. Эти молекулы могут быть гидрофобными (фенилаланин и триптофан) и негидрофобными (тирозин).
Структура фенилаланинаСлово «ароматический» относится к присоединению высокостабильного ароматического кольца , которое с трудом реагирует с другими соединениями или элементами . Ароматические соединения, также известные как арильные соединения, изобилуют человеческим организмом. Каждый нуклеотид в нашей ДНК и РНК состоит из ароматических молекул.
Гистидин иногда неправильно указывается в составе ароматической группы. Его аминогруппы могут быть ароматическими, но они реакционноспособны со слабым положительным зарядом и гидрофильными характеристиками.
Его аминогруппы могут быть ароматическими, но они реакционноспособны со слабым положительным зарядом и гидрофильными характеристиками.
Основные аминокислоты
Хотя их название указывает на то, что все аминокислоты обладают кислотными свойствами, некоторые из них имеют основные (щелочные) боковые цепи, содержащие азот. Эти основные R-цепи связываются с доступными протонами (молекулами водорода) и таким образом приобретают положительный заряд. Все аминокислоты этой группы гидрофильны.
Тремя основными аминокислотами являются аргинин, лизин и гистидин. Аргинин имеет самый сильный положительный заряд из всех аминокислот из-за трех групп азота, что необходимо для его способности синтезировать белки и катализировать функцию ферментов. Лизин также имеет сильный положительный заряд, в то время как гистидин имеет очень слабый положительный заряд из-за отсутствия азота в аминогруппе.
Кислые аминокислоты
Кислые аминокислоты состоят из аспарагиновой и глутаминовой кислот.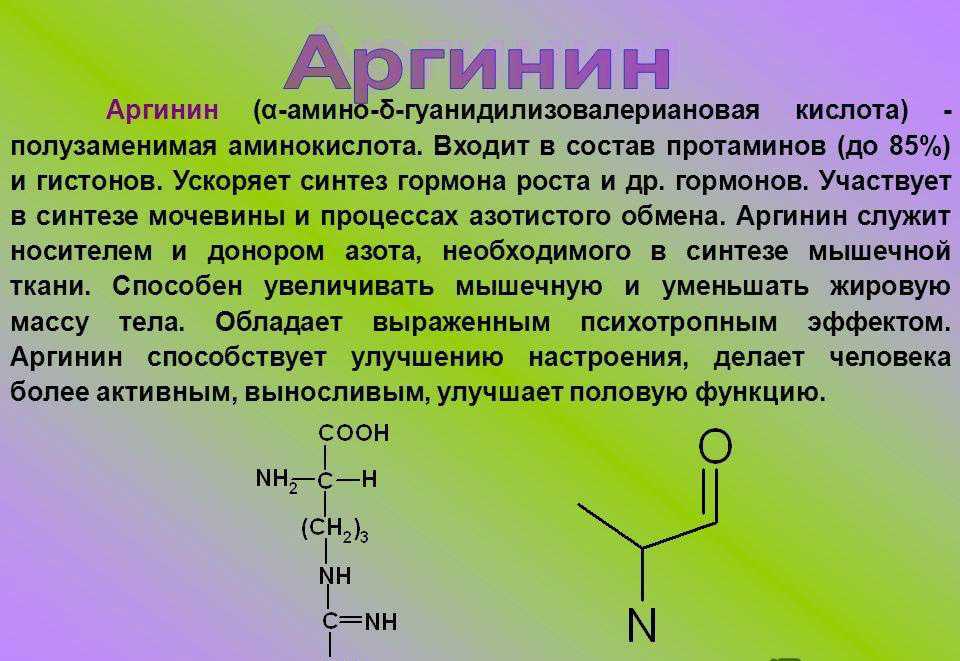 Естественно, их легко идентифицировать благодаря слову «кислота» в названии соединения, хотя иногда эти две аминокислоты называют аспартатом и глутаматом, что может сбивать с толку. Вместо азотистых групп кислые аминокислоты имеют карбоксильные группы в качестве боковых цепей. Как кислоты, они способны терять протоны в реакциях с другими соединениями или элементами и поэтому приобретают отрицательный заряд. Кислые аминокислоты гидрофильны
Естественно, их легко идентифицировать благодаря слову «кислота» в названии соединения, хотя иногда эти две аминокислоты называют аспартатом и глутаматом, что может сбивать с толку. Вместо азотистых групп кислые аминокислоты имеют карбоксильные группы в качестве боковых цепей. Как кислоты, они способны терять протоны в реакциях с другими соединениями или элементами и поэтому приобретают отрицательный заряд. Кислые аминокислоты гидрофильны
Гидроксильные аминокислоты
Другая небольшая группа, состоящая только из двух аминокислот, представляет собой группу гидроксильных аминокислот, представленных серином и треонином. Эти незаряженные полярные и гидрофильные молекулы имеют гидроксильную группу в качестве R-цепи.
Серосодержащие аминокислоты
Только цистеин и метионин содержат атомы серы и поэтому являются единственными членами этой группы. Цистеин может связываться с цистеином посредством дисульфидного мостика с образованием окисленного димера, называемого цистеином, который содержится в больших количествах в соединительной ткани, волосах, ногтях пальцев рук и ног.
В серосодержащих аминокислотах боковая цепь состоит из тиоловой группы (-SH). Когда вы заметите букву S в химической структуре аминокислоты, вы можете быть уверены, что это либо цистеин, либо метионин . Цистеин является меньшей из двух молекул и по существу представляет собой молекулу аланина с дополнительной тиоловой группой. Метионин содержит тиоловый эфир с двумя боковыми группами по обе стороны от атома серы, что делает его чрезвычайно гидрофобным.
Структура метионинаАмидные аминокислоты
Боковая цепь амидных аминокислот имеет амидную группу (-CONH 2 ), и не следует путать с боковой аминной группой аминокислот лизина, аргинина и гистидина.
Амид, образованный из глутаминовой кислоты, называется глутамин, а амид, образованный из аспарагиновой кислоты, называется аспарагин. Поэтому легко понять, почему амидные аминокислоты способны выполнять свою работу только в присутствии достаточного количества глутаминовой и аспарагиновой кислот.
Аспарагин представляет собой очень гидрофильный незаряженный амид аспарагиновой кислоты, который не реагирует с другими молекулами. Глутамин также не имеет заряда, является гидрофильным и представляет собой амид глутаминовой кислоты.
Белки и аминокислоты
Белки и аминокислоты по существу являются взаимозависимыми отношениями. Аминокислоты — это мономеры, молекулы, которые связываются с другими молекулами с образованием полимеров. В случае аминокислот они связываются с образованием олигопептидов не более чем из двадцати аминокислот или более длинных полипептидных цепей, которые затем могут складываться с образованием белков. Аминокислотные последовательности основаны на оригинальном участке генетического кода, взятого из ДНК.
Синтез белка происходит внутри клетки, где фрагменты генетического кода копируются внутри клеточного ядра и транспортируются через информационную РНК в цитоплазму клетки. Информационная РНК (мРНК) копируется после того, как она зафиксирована между большой и малой частями рибосомы.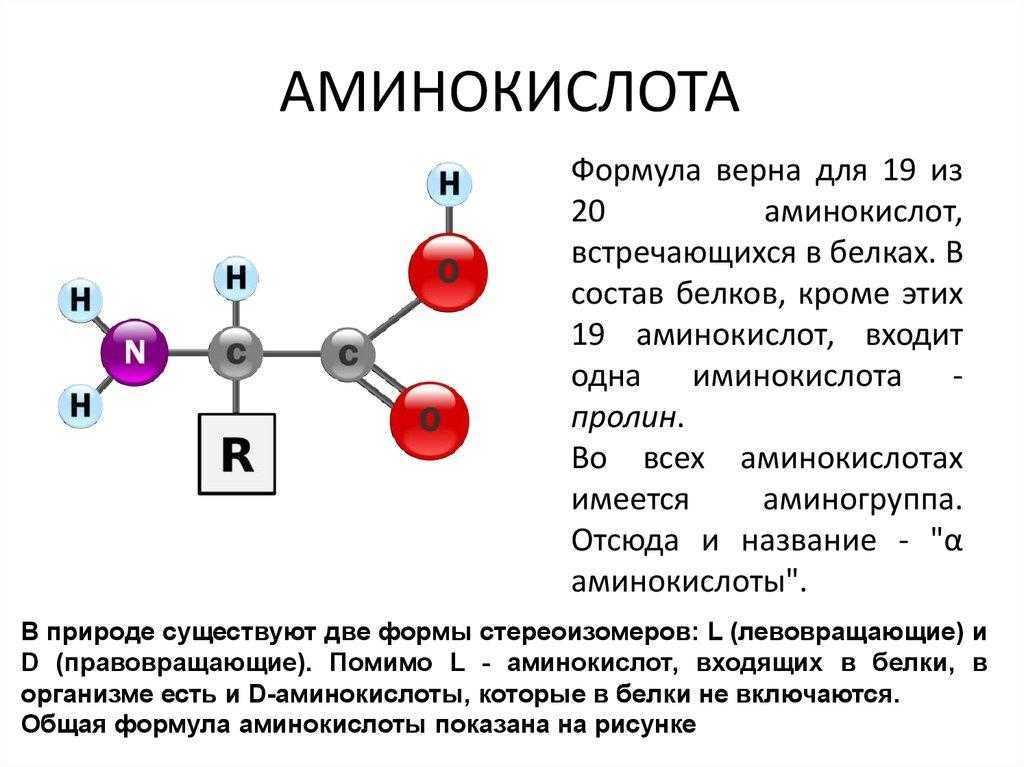 Это возможно благодаря действию транспортной РНК.
Это возможно благодаря действию транспортной РНК.
Транспортная РНК (тРНК) присоединяется к аминокислоте. Цепь мРНК содержит от десятков до сотен кодонов, каждый из которых содержит группу из трех нуклеотидов, составляющих код одной аминокислоты. Когда транспортная РНК распознает кодон, она откладывает присоединенную аминокислоту в рибосому, где она связывается с предыдущей аминокислотой, образуя цепь.
Последовательности кодонов аминокислотВ приведенной выше таблице каждая из заменимых аминокислот кодируется определенным количеством кодонов. Например, код, сообщающий тРНК, что нужно принести серин, имеет шесть различных форм: UCU, UCC, UCA, UCG, AGU и AGC.
Различные тРНК доставляют свои аминокислоты по очереди и в соответствии с каждым кодоном, представленным на цепи матричной РНК. В результате получается растущая олигопептидная или полипептидная цепь, построенная по определенной аминокислотной последовательности, которая соответствует инструкциям кода, скопированного из ядерной ДНК . После завершения цепь высвобождается из рибосомы и созревает в функциональный пептид или белок в зависимости от ее длины и формы.
После завершения цепь высвобождается из рибосомы и созревает в функциональный пептид или белок в зависимости от ее длины и формы.
Белковые структуры могут быть первичными, вторичными, третичными или четвертичными в зависимости от степени сворачивания. Первичная структура просто состоит из пептидных связей, образующихся между двумя частями рибосомы. Вторичная структура относится к водородным связям, которые образуют участки спиралей, которые конденсируют исходную цепную структуру. Третичная структура добавляет солевые мостики, дополнительные водородные связи и дисульфидные связи для создания еще более плотной упаковки. Наконец, четвертичная структура включает две или более полипептидных цепей, которые будут действовать как единое целое или мультимер. Эти четыре структуры просто представлены на изображении ниже.
4 структуры белкаФункции аминокислот
Функции аминокислот разнообразны. Последние годы показали, что аминокислоты являются не только строительными блоками и клеточными сигнальными молекулами, но также регуляторами экспрессии генов и каскада фосфорилирования белков. Мы также знаем, что они являются предшественниками гормонов и азотистых веществ и имеют беспрецедентное биологическое значение. Кроме того, некоторые аминокислоты регулируют ключевые метаболические пути, необходимые для поддержания, роста, размножения и иммунитета. Тем не менее, повышенный уровень аминокислот и результаты их синтеза в виде аммиака и гомоцистеина могут вызывать неврологические расстройства, окислительный стресс и сердечно-сосудистые заболевания.
Мы также знаем, что они являются предшественниками гормонов и азотистых веществ и имеют беспрецедентное биологическое значение. Кроме того, некоторые аминокислоты регулируют ключевые метаболические пути, необходимые для поддержания, роста, размножения и иммунитета. Тем не менее, повышенный уровень аминокислот и результаты их синтеза в виде аммиака и гомоцистеина могут вызывать неврологические расстройства, окислительный стресс и сердечно-сосудистые заболевания.
Мы все еще находимся в зачаточном состоянии исследований аминокислот, и их полный спектр функций все еще в значительной степени неизвестен, равно как и способность аминокислот работать как группа или в полной системе. Оптимальный баланс аминокислот в рационе имеет решающее значение, но в целом недостаточно изучен, поэтому невозможно опубликовать четкие рекомендации. Пищевые добавки с функциональными аминокислотами аргинином, цистеином, глутамином, лейцином, пролином и триптофаном оказались полезными при ряде заболеваний, связанных со здоровьем, на всех этапах жизни, от эмбрионального до гериатрического, дисфункции кишечника, ожирения, диабета, сердечно-сосудистых заболеваний. нарушения обмена веществ и бесплодие. Кроме того, аминокислоты потребляются любителями спорта и спортсменами для увеличения мышечной массы и уменьшения накопления жира; однако сообщалось о когнитивных побочных эффектах и повреждении почек в связи с добавками аминокислот.
нарушения обмена веществ и бесплодие. Кроме того, аминокислоты потребляются любителями спорта и спортсменами для увеличения мышечной массы и уменьшения накопления жира; однако сообщалось о когнитивных побочных эффектах и повреждении почек в связи с добавками аминокислот.
Примеры аминокислот
Примеры аминокислот можно найти в этой статье. Возможно, будет интереснее взглянуть на одну из самых популярных аминокислотных добавок на рынке и обсудить ее положительные и отрицательные эффекты.
Одна из самых популярных аминокислотных добавок представляет собой смесь аминокислот с разветвленной цепью (BCAA), а именно лейцина, изолейцина и валина. Говорят, что BCAA стимулируют синтез мышечного белка более чем на 30%. Это просто невозможно . Первая причина этого заключается в том, что для высвобождения незаменимых аминокислот должен быть определенный распад мышц; скорость производства новой мышечной ткани зависит от скорости деградации старых мышечных клеток. Во-вторых, более высокие диетические источники ограниченной группы аминокислот не будут работать на высоком уровне, когда уровни других аминокислот остаются нормальными или низкими. Поскольку исследованиям еще предстоит пройти долгий путь, любые рекомендации по питанию, касающиеся потребления аминокислот, следует принимать за чистую монету . Аминокислоты с разветвленной цепью действительно связаны с синтезом мышечной ткани, но каждая аминокислота, незаменимая и заменимая, так или иначе связана с одной и той же функцией. Хотя мышечный белок находится в состоянии постоянного оборота, значения и соотношения доступных аминокислот не всегда могут быть оптимальными. Более того, все аминокислоты конкурируют за одни и те же молекулы-носители. ВСАА используют ту же систему-носитель, которая транспортирует ароматические аминокислоты фенилаланин, тирозин и триптофан. Таким образом, производительность добавок также ограничена наличием транспорта; Насыщение добавки может помешать другим важным аминокислотам, присутствующим в нормальных количествах, достичь своей цели.
Во-вторых, более высокие диетические источники ограниченной группы аминокислот не будут работать на высоком уровне, когда уровни других аминокислот остаются нормальными или низкими. Поскольку исследованиям еще предстоит пройти долгий путь, любые рекомендации по питанию, касающиеся потребления аминокислот, следует принимать за чистую монету . Аминокислоты с разветвленной цепью действительно связаны с синтезом мышечной ткани, но каждая аминокислота, незаменимая и заменимая, так или иначе связана с одной и той же функцией. Хотя мышечный белок находится в состоянии постоянного оборота, значения и соотношения доступных аминокислот не всегда могут быть оптимальными. Более того, все аминокислоты конкурируют за одни и те же молекулы-носители. ВСАА используют ту же систему-носитель, которая транспортирует ароматические аминокислоты фенилаланин, тирозин и триптофан. Таким образом, производительность добавок также ограничена наличием транспорта; Насыщение добавки может помешать другим важным аминокислотам, присутствующим в нормальных количествах, достичь своей цели. Высокие уровни BCAA конкурируют с молекулами-носителями ароматических аминокислот, которые важны для синтеза нейротрансмиттеров. Результат может повлиять на настроение.
Высокие уровни BCAA конкурируют с молекулами-носителями ароматических аминокислот, которые важны для синтеза нейротрансмиттеров. Результат может повлиять на настроение.
Считается, что BCAA играют важную роль во внутриклеточных сигнальных путях, участвующих в синтезе белка. Это было доказано множеством способов, но основное внимание уделяется маленькому окну. Известно, что добавки BCAA облегчают симптомы, связанные с циррозом печени и хронической почечной недостаточностью. Другие утверждения еще не были удовлетворительно доказаны.
Следует также учитывать тот факт, что диабетики и люди, страдающие ожирением, имеют естественно высокий уровень BCAA и низкий уровень аланина. Спортсменам может быть интересно услышать, что повышенный уровень аммиака в крови присутствует после приема BCAA во время тренировки, что позволяет предположить, что добавки могут в конечном итоге оказать негативное влияние на мышечную производительность. Еще один тревожный эффект был обнаружен у больных раком, где BCAA способствуют росту рака и используются опухолями в качестве источника энергии.
Еще один тревожный эффект был обнаружен у больных раком, где BCAA способствуют росту рака и используются опухолями в качестве источника энергии.
Тест
1. Какие две аминокислоты входят в группу серосодержащих аминокислот?
A. Тирозин и триптофан
B. Глутамин и аспарагин
C. Глутаминовая кислота и аспартальная кислота
D. Cysteine и Methitinine
. аминокислота?
A. Аргинин
B. Глицин
C. Лейцин
D. Proline
3. Collagen is primarily composed of:
A. Glycine
B. Proline
C. Arginine
D. Alanine
4. Which из них является частью тиоловой группы?
A. -SH
B. -NH 2
C. -COOH
D. -Conh 2
5. свойство алифатических аминокислот?
A.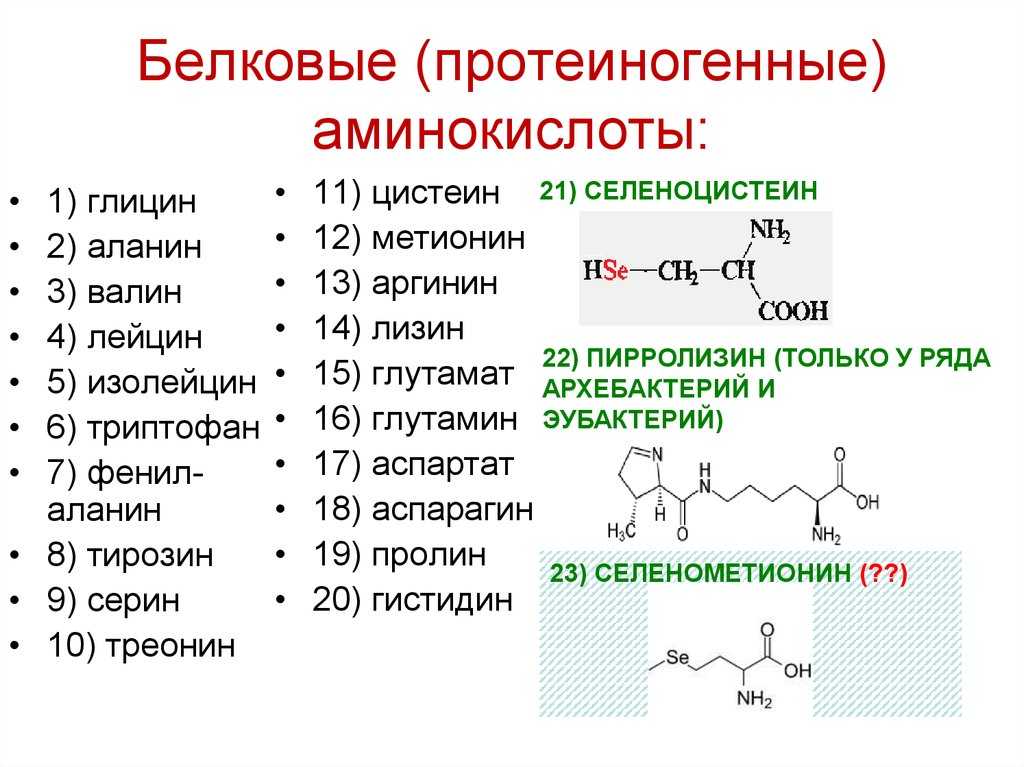
B. Нейтральный заряд
C. Гидрофобные
D. Polar
AMINO AININO AINDICS-HARIDES, СТРУКЦИЯ, СТРУКЦИЯ, СТРУКЦИЯ, СТРУКЦИЯ, СТРУКЦИЯ, СТРУКЦИЯ, СТРУКЦИЯ, СТРУКЦИЯ.
Сагар Арьял
Содержание
Что такое аминокислоты? Аминокислоты представляют собой группу нейтральных продуктов, четко отличающихся от других природных соединений химически, в основном из-за их амфолитных свойств, и биохимически, в основном из-за их роли в качестве компонентов белка. Аминокислота представляет собой карбоновую кислоту, содержащую алифатическую первичную аминогруппу в положении α к карбоксильной группе и обладающую характерной стереохимией. Белки биосинтезируются из 20 аминокислот в системе, включающей строгий генетический контроль. Таким образом, аминокислоты являются основной единицей белков. В природе встречается более 300 аминокислот, но только 20 аминокислот являются стандартными и присутствуют в белке, потому что они кодируются генами. Другие аминокислоты являются модифицированными аминокислотами и называются небелковыми аминокислотами. Некоторые представляют собой остатки, модифицированные после того, как белок был синтезирован путем посттрансляционных модификаций; другие представляют собой аминокислоты, присутствующие в живых организмах, но не входящие в состав белков.
Таким образом, аминокислоты являются основной единицей белков. В природе встречается более 300 аминокислот, но только 20 аминокислот являются стандартными и присутствуют в белке, потому что они кодируются генами. Другие аминокислоты являются модифицированными аминокислотами и называются небелковыми аминокислотами. Некоторые представляют собой остатки, модифицированные после того, как белок был синтезирован путем посттрансляционных модификаций; другие представляют собой аминокислоты, присутствующие в живых организмах, но не входящие в состав белков.
Рисунок: Аминокислоты для позвоночника.
Свойства аминокислот Физические свойства- Аминокислоты представляют собой бесцветные кристаллические вещества.
- Все аминокислоты имеют температуру плавления выше 200 o
- Растворимость: Они растворимы в воде, слабо растворимы в спирте и с трудом растворяются в метаноле, этаноле и пропаноле.
 Большую роль в растворимости играют R-группа аминокислот и рН растворителя.
Большую роль в растворимости играют R-группа аминокислот и рН растворителя. - При нагревании до высоких температур разлагаются.
- Все аминокислоты (кроме глицина) оптически активны.
- Образование пептидной связи: Аминокислоты могут соединяться пептидной связью с участием их амино- и карбоксилатных групп. Ковалентная связь, образованная между альфа-аминогруппой одной аминокислоты и альфа-карбоксильной группой другой, образующая -CO-NH-связь. Пептидные связи плоские и частично ионные.
- Свойство цвиттериона
Цвиттерион представляет собой молекулу с функциональными группами, по крайней мере одна из которых имеет положительный, а одна отрицательный электрический заряд. Суммарный заряд всей молекулы равен нулю. Аминокислоты являются наиболее известными примерами цвиттер-ионов. Они содержат аминогруппу (основную) и карбоксильную группу (кислотную). Группа -Nh3 является более сильным основанием, поэтому она захватывает H+ из группы -COOH, оставляя цвиттер-ион. (Нейтральный) цвиттер-ион представляет собой обычную форму аминокислот, существующих в растворе.
(Нейтральный) цвиттер-ион представляет собой обычную форму аминокислот, существующих в растворе.
- Амфотерность
Аминокислоты являются амфотерными по своей природе, то есть они действуют как кислоты и основания благодаря наличию двух аминогрупп и карбоксильных групп.
- Нингидриновый тест
При добавлении 1 мл раствора нингидрина к 1 мл раствора белка и нагревании образование фиолетовой окраски свидетельствует о наличии α-аминокислот.
- Ксантопротеидный тест
Ксантопротеидный тест проводят для обнаружения ароматических аминокислот (тирозина, триптофана и фенилаланина) в растворе белка. Нитрование бензоидных радикалов, присутствующих в цепи аминокислот, происходит за счет реакции с азотной кислотой, придающей раствору желтую окраску.
- Реакция с реактивом Сенгера
Реактив Сенгера (1-фтор-2,4-динитробензол) реагирует со свободной аминогруппой в пептидной цепи в слабощелочной среде в холодных условиях.
- Реакция с азотистой кислотой
Азотистая кислота реагирует с аминогруппой с высвобождением азота и образованием соответствующего гидроксила.
Структура аминокислотВсе 20 распространенных аминокислот являются альфа-аминокислотами. Они содержат карбоксильную группу, аминогруппу и боковую цепь (группу R), все они присоединены к α-углероду.
Исключения:
- Глицин, не имеющий боковой цепи. Его α-углерод содержит два атома водорода.
- Пролин, в котором азот является частью кольца.
- Таким образом, каждая аминокислота имеет аминогруппу на одном конце и кислотную группу на другом, а также характерную боковую цепь. Основная цепь одинакова для всех аминокислот, тогда как боковая цепь отличается от одной аминокислоты к другой.
- Все 20 аминокислот, кроме глицина, имеют L-конфигурацию, так как во всех аминокислотах, кроме одной, α-углерод представляет собой асимметричный углерод.
 Поскольку глицин не содержит асимметричного атома углерода, он оптически неактивен и, следовательно, не является ни D, ни L.
Поскольку глицин не содержит асимметричного атома углерода, он оптически неактивен и, следовательно, не является ни D, ни L.
- Неполярные, алифатические аминокислоты : Группы R в этом классе аминокислот являются неполярными и гидрофобными. Глицин, аланин, валин, лейцин, изолейцин, метионин, пролин.
- Ароматические аминокислоты: Фенилаланин, тирозин и триптофан с их ароматическими боковыми цепями относительно неполярны (гидрофобны). Все они могут участвовать в гидрофобных взаимодействиях.
- Полярные, незаряженные аминокислоты: R-группы этих аминокислот более растворимы в воде или более гидрофильны, чем группы неполярных аминокислот, поскольку они содержат функциональные группы, которые образуют водородные связи с водой. Этот класс аминокислот включает серин, треонин, цистеин, аспарагин и глютамин.
- Кислые аминокислоты: Аминокислоты, в которых R-группа является кислой или отрицательно заряженной.
 Глутаминовая кислота и аспарагиновая кислота
Глутаминовая кислота и аспарагиновая кислота - Основные аминокислоты: Аминокислоты, в которых R-группа является основной или положительно заряженной. Лизин, аргинин, гистидин
Девять аминокислот не могут синтезироваться в организме и поэтому должны присутствовать в пище чтобы происходил синтез белка.
Этими незаменимыми аминокислотами являются гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Заменимые аминокислоты (одиннадцать)Эти аминокислоты могут быть синтезированы в самом организме и, следовательно, не обязательно должны поступать с пищей.
Этими незаменимыми аминокислотами являются аргинин, глутамин, тирозин, цистеин, глицин, пролин, серин, орнитин, аланин, аспарагин и аспартат.
Классификация аминокислот на основе метаболической судьбы- Глюкогенные аминокислоты : Эти аминокислоты служат предшественниками глюконеогенеза для образования глюкозы.
 Глицин, аланин, серин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, валин, метионин, цистеин, гистидин и аргинин.
Глицин, аланин, серин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, валин, метионин, цистеин, гистидин и аргинин. - Кетогенные аминокислоты: Эти аминокислоты расщепляются с образованием кетоновых тел. Лейцин и лизин.
- Глюкогенные и кетогенные аминокислоты: Эти аминокислоты расщепляются с образованием предшественников как кетоновых тел, так и глюкозы. изолейцин, фенилаланин, триптофан и тирозин.
- В частности, 20 очень важных аминокислот имеют решающее значение для жизни, поскольку они содержат пептиды и белки и, как известно, являются строительными блоками для всех живых существ.
- Линейная последовательность аминокислотных остатков в полипептидной цепи определяет трехмерную конфигурацию белка, а структура белка определяет его функцию.
- Аминокислоты необходимы для поддержания здоровья человеческого организма. Они в значительной степени способствуют:
Выработке гормонов
• Структуре мышц
• Здоровому функционированию нервной системы человека
• Здоровью жизненно важных органов
• Нормальной клеточной структуре - Аминокислоты используются различными тканями для синтеза белков и производства азота -содержащие соединения (например, пурины, гем, креатин, адреналин), или они окисляются для получения энергии.

- При расщеплении пищевых и тканевых белков образуются азотсодержащие субстраты и углеродные скелеты.
- Азотсодержащие субстраты используются в биосинтезе пуринов, пиримидинов, нейромедиаторов, гормонов, порфиринов и заменимых аминокислот.
- Углеродные скелеты используются в качестве источника топлива в цикле лимонной кислоты, используются для глюконеогенеза или используются в синтезе жирных кислот.
- Ленингер, А. Л., Нельсон, Д. Л., и Кокс, М. М. (2000). Ленингеровские принципы биохимии. Нью-Йорк: издательство Worth.
- Смит, К.М., Маркс, А.Д., Либерман, Массачусетс, Маркс, Д.Б., и Маркс, Д.Б. (2005). Базовая медицинская биохимия Маркса: клинический подход. Филадельфия: Липпинкотт Уильямс и Уилкинс.
- Родвелл, В. В., Ботам, К. М., Кеннелли, П. Дж., Вейл, П. А., и Бендер, Д. А. (2015). Иллюстрированная биохимия Харпера (30-е изд.). Нью-Йорк, штат Нью-Йорк: McGraw-Hill Education LLC.


 Подразделяются на незаряженные, положительно и отрицательно заряженные
Подразделяются на незаряженные, положительно и отрицательно заряженные
 Большую роль в растворимости играют R-группа аминокислот и рН растворителя.
Большую роль в растворимости играют R-группа аминокислот и рН растворителя. Поскольку глицин не содержит асимметричного атома углерода, он оптически неактивен и, следовательно, не является ни D, ни L.
Поскольку глицин не содержит асимметричного атома углерода, он оптически неактивен и, следовательно, не является ни D, ни L. Глутаминовая кислота и аспарагиновая кислота
Глутаминовая кислота и аспарагиновая кислота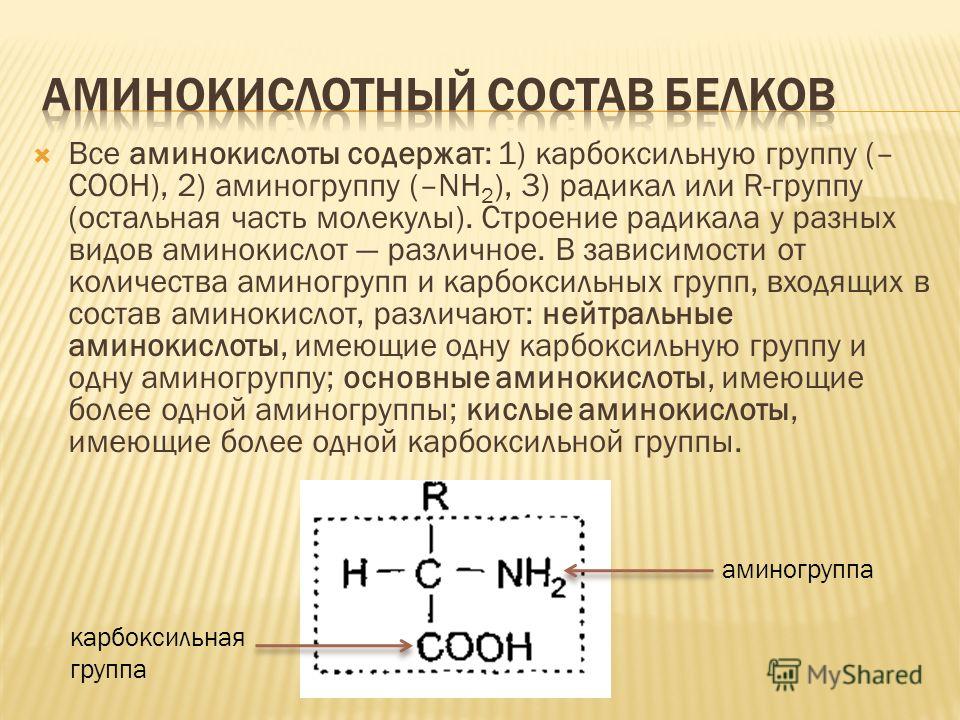 Глицин, аланин, серин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, валин, метионин, цистеин, гистидин и аргинин.
Глицин, аланин, серин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, валин, метионин, цистеин, гистидин и аргинин.
