Лизин формула — Справочник химика 21
Приведите структурные формулы следующих незаменимых аминокислот а) (Ч-)-валина б) (—)-лейцина в) ( + )-изо-лейцина г) ( + )-лизина д) (— )-треонина е) (—)-метионина [c.213]О р и и т и н представляет ближайший низший гомолог лизина он имеет формулу [c.317]
Химическое строение. Синтезируется он из аминокислоты лизина и имеет такую химическую формулу [c.125]
На рис. 2.1 приведены структурные формулы преобладающих при pH 7 ионизованных форм аминокислот. При таком значении pH а-аминогруппа протонирована, а карбоксильная группа депротонирована. Таким образом, при нейтральных pH аминокислоты не несут заряда, а существуют в виде цвиттерионов NH — HR— OO , обладающих значительным дипольным моментом. Четыре аминокислоты при pH 7 имеют дополнительные заряды на боковой группе аспарагиновая и глутаминовая кислоты — отрицательный, лизин и аргинин — положительный.
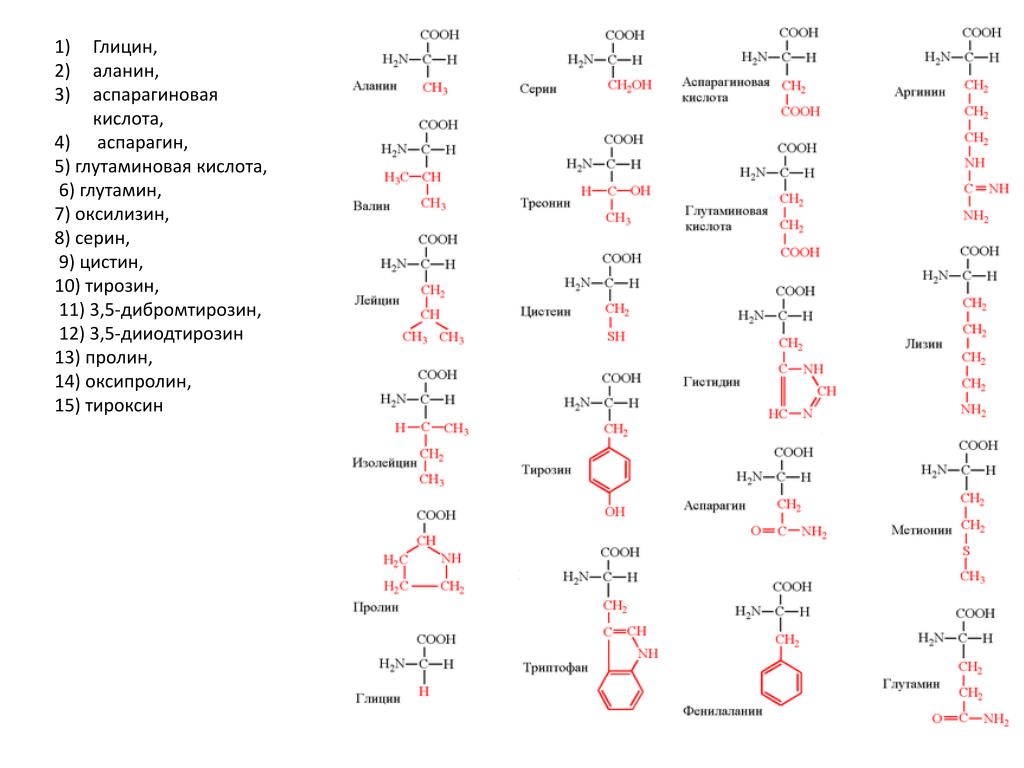
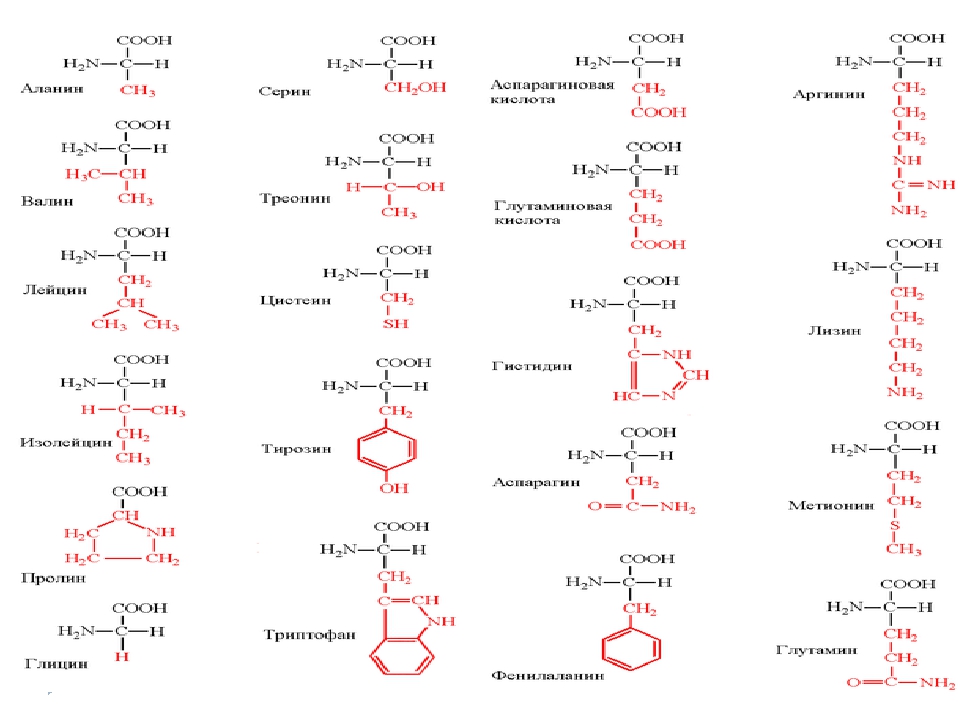
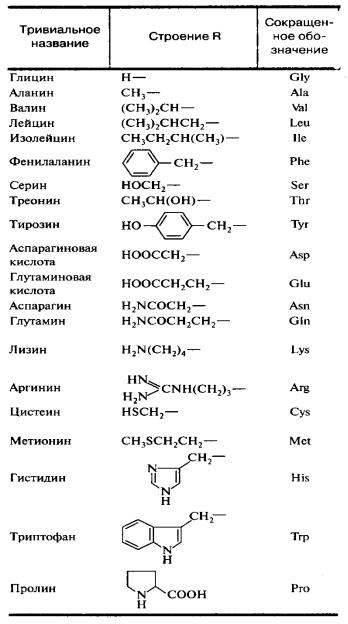
Все ферменты являются белками. Белки представляют собой линейные полимеры, точнее, сополимеры, построенные из связанных между собой остатков аминокислот. В состав большинства белков входят 20 важнейших аминокислот — глицин, аланин, валин, лейцин, изолейцин, аспарагиновая кислота, глутаминовая кислота, серин, треонин, лизин, аргинин, гистидин, фенилаланин, тирозин, триптофан, цистеин, цистин, метионин, пролин и оксипролин их химические формулы и обозначения приведены в таблице на стр. 5. Молекула каждой аминокислоты (1) достаточно проста и обязательно содержит две реакционноспособные группировки — одну, обладающую основными свойствами (аминогруппа HgN—) и другую, имеющую кислотные, свойства (карбоксильная группа — СООН), f. f. [c.39]
Напишите структурные формулы глицина, лейцина, аланина, ци-стеина, лизина. [c.387]
Лизин (а, е-диаминокапроновая кислота) имеет молекулярную массу 146,19.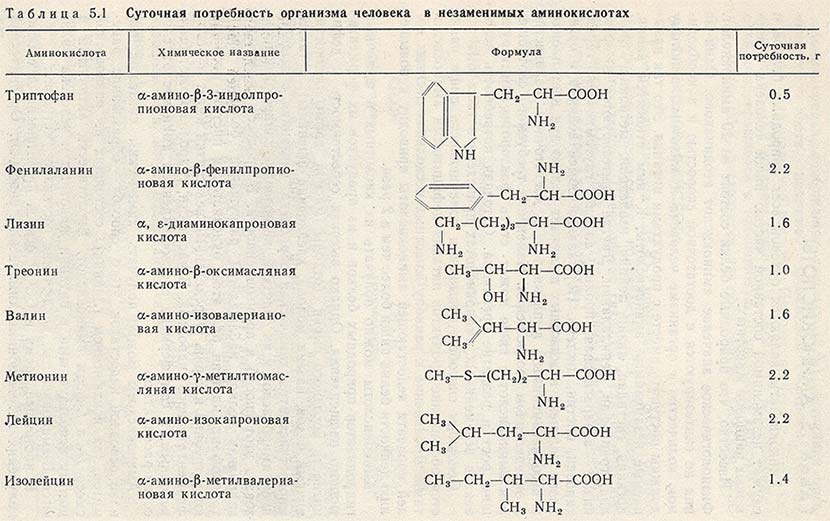 Хорошо растворим в воде, кислотах, основаниях трудно растворим в спирте и нерастворим в эфире. Разлагается при температуре 224—225°С. Кристаллизуется в виде гексагональных пластинок или бесцветных игл. Структурная формула [c.32]
Хорошо растворим в воде, кислотах, основаниях трудно растворим в спирте и нерастворим в эфире. Разлагается при температуре 224—225°С. Кристаллизуется в виде гексагональных пластинок или бесцветных игл. Структурная формула [c.32]
Так, например, была определена структура НЬ S, имеющего большую электрофоретическую подвижность, чем НЬ А, и отличающегося от НЬ А тем, что у него в положении 6 р-цепи глутаминовая мислота заменена валином формула этого гемоглобина а р . В НЬ G (afP ) глутаминовая кислота в положении 7 заменена глицином в НЬ Е глутаминовая кислота в положении 26 — лизином в НЬ Цюрих (а Р ) гистидин в положении 63 — аргинином. Возможны замещения аминокислот и в а-цепи.
Недавно из водного экстракта пекарских и пивных дрожжей была выделена новая аминокислота, имеющая строение, отвечающее формуле I. Она составлена из остатков -лизина и глутаровой кислоты и па- [c.634]
Расчет. Содержание L-лизина в абсолютно сухой пробе вычисляют по формуле [c. 223]
223]
Содержание примесей в лизине рассчитывают по формуле, приведенной на стр. 29. [c.106]
При необходимости описать строение более длинных молекул можно также воспользоваться однобуквенньпл кодом, в котором каждой аминокислоте присвоена одна заглавная буква латинского алфавита аланин — А, аспарагин — N, аспарагиновая кислота О, аргинин — Я, валин — V, гистидин — Н, глицин — О, глутамин О, глутаминовая кислота — Е, изолейцин — I, лейцин — Ь, лизин — К, метионин — М, пролин — Р, серии — 8, тирозин — V, треонин Т, триптофан — фенилаланин — Р, цистеин » С. С использованием этого кода вместо громоздкой структурной формулы, написанной в начале страницы, можно записать УЯМ. [c.54]
Эти остатки R могут быть неполярными (например, лейцин в приведенной выше формуле), полярными (тирозин), кислыми (глутаминовая кислота) или основными (аргинин, лизин). Неполярные группы R (происходяш ие из моноаминомонокарбоновых кислот) притягиваются другими аналогичными груннами только вандерваальсовыми силами. Гидроксилсодержащие остатки R (происходящие из оксиаминокислот) могут связываться с аналогичными группами других цепей при помощи водородных связей, а кислые и основные группы R — электростатическими связями. Несколько иначе ведет себя группа SH (остатков R, происходящих из цистеина), ввиду того что эта группа является единственной, которая может образовать ковалентные, а именно дисульфид-ные связи S—S с аналогичными группами других цепей.
Гидроксилсодержащие остатки R (происходящие из оксиаминокислот) могут связываться с аналогичными группами других цепей при помощи водородных связей, а кислые и основные группы R — электростатическими связями. Несколько иначе ведет себя группа SH (остатков R, происходящих из цистеина), ввиду того что эта группа является единственной, которая может образовать ковалентные, а именно дисульфид-ные связи S—S с аналогичными группами других цепей.
Аминокислоты существуют в водном растворе в виде динолярных ионов, называемых цвиттерионами . Например, в кислой среде глицин находится в форме СН2(МНз) СООН, а в щелочной среде — в форме h3(Nh3) OO-. В изоэлектрической точке суммарный заряд молекулы равен нулю, что можно отобразить формулой СН2(КЩз)+СОО». Глицин несет заряды на а-аминной и карбоксильной группах. Большинство аминокислот обладает только этими двумя группами, но ряд аминокислот имеет и другие способные к ионизации группы.
 Так, дикарбоновые аминокислоты (например, аспарагиновая кислота) имеют вторую карбоксильную группу, а диаминомонокарбоновые аминокислоты (например, лизин)— вторую аминную группу. [c.21]
Так, дикарбоновые аминокислоты (например, аспарагиновая кислота) имеют вторую карбоксильную группу, а диаминомонокарбоновые аминокислоты (например, лизин)— вторую аминную группу. [c.21]Укажем только на следующее для точного определения аминокислотного состава белка его нужно подвергнуть гидролизу (в вакуумированной запаянной ампуле с 6н. НС1 при температуре 110°) в течение 22 и 70 час [26]. При этом для глицина, аланина, валина, лейцина, изолейцина, метионина (с внесением поправки на 10%-е расщепление при хроматографии), фенилаланина, гистидина и лизина нужно использовать полученное при анализе содержание аминокислоты (в 22- или 70-часовом опыте). В то время как для аспарагиновой и глутаминовой кислоты, серина, треонина, пролина, тирозина и аргинина, которые частично разрушаются при гидролизе (по реакции 1-го порядка), их содержание рассчитывается путем экстраполяции на нулевое время по формуле [c.149]
Какие структурные формулы имеют следующие аминокислоты и их производные а) а-аминомасляная, б) 7-аминомасля-ная, в) р-аминовалериановая, г) у-аминовалериановая, д) ос-амино-изовалериановая, е) р-аминоглутаровая, ж) у-аминокапроновая, з) р-окси-а-аминопропионовая, и) а-аминоадипиновая, к) а-амино-Р,7,б-триметилкапроновая,, л) а,6-диаминовалериановая, м) а-аминоизокапроновая (лейцин), н) моноамид а-аминоянтар-ной кислоты (аспарагин), о) этиловый эфир гликоколя, п) нитрил 7-аминомасляной кислоты, р) а,е-диаминокапроновая кислота (лизин).
Неразвствленные пептидные цепи обладают лишь одной а-амино- и одной а-карбоксильной концевыми группами, тогда как разветвленные цепи, если они не образуют колец, имеют несколько таких концевых групп. При определении числа концевых а-аминогрупп нужно, однако, всегда помнить, что в боковых цепях, образованных лизином, присутствуют свободные в-аминогруппы (формула В) и что определение свободных аминогрупп по методу Ван-Слайка дает а-амино- и е-аминогрупп. [c.122]
Лизин входит в состав почти всех белков животного происхождения, но отсутствует или содержится в очень малых количествах в растительных белках. Выделен он впервые в 1889 г. Дрекселем из гидролизата казеина, однако вначале был нрпнят за диамин, и только в 1902 г. была установлена его истинная химическая формула [18—20]. [c.89]
Как видно из приведенной выше общей формулы полипептидной цепи белковой молекулы, на одном ее конце в остатке аминокислоты сохраняется незамещенная аминогруппа —ЫНг эту аминокислоту называют Н-концевой аминокислотой.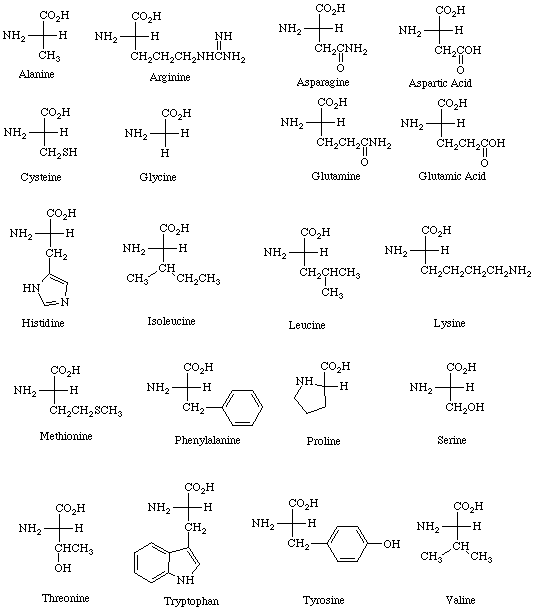 На другом конце цепи в остатке аминокислоты сохраняется карбоксил —СООН это С-концевая аминокислота. Из той же общей формулы полипептидной цепи видно, что такая цепь содержит множество боковых ответвлений —К, т. е. тех частей аминокислотных остатков, которые непосредственно в цепь не входят. Чтобы пояснить это, представим себе некоторый отрезок полипептидной цепи белковой молекулы, составленный из остатков различных а-аминокислот, например аланина, глутаминовой кислоты, серина, лизина, цистеина и т. п. (формулы этих а-аминокислот приведены в табл. 14)
На другом конце цепи в остатке аминокислоты сохраняется карбоксил —СООН это С-концевая аминокислота. Из той же общей формулы полипептидной цепи видно, что такая цепь содержит множество боковых ответвлений —К, т. е. тех частей аминокислотных остатков, которые непосредственно в цепь не входят. Чтобы пояснить это, представим себе некоторый отрезок полипептидной цепи белковой молекулы, составленный из остатков различных а-аминокислот, например аланина, глутаминовой кислоты, серина, лизина, цистеина и т. п. (формулы этих а-аминокислот приведены в табл. 14)
На адсорбенте на основе полистирола, содержащем остатки лизина или орнитина [формула (82)], расщеплена р-гидроксиаспарагиновая кислота [59]. [c.62]
Напишите структурные формулы глицина, аланина, лейцина, лизина и цистеииа. [c.361]
Двуокись углерода может реагировать непосредственно с аминогруппой молекул лизина, имеющихся в белковой части гемоглобина. Условно выделим эту аминогруппу, и тогда формула гемоглобина примет вид ННЬЫНг. Реакция гемоглобина с двуокисью углерода протекает по схеме [c.363]
Условно выделим эту аминогруппу, и тогда формула гемоглобина примет вид ННЬЫНг. Реакция гемоглобина с двуокисью углерода протекает по схеме [c.363]
Однако если раствор аминокислоты обработать фосфатом меди, то отношение между а-аминным азотом и медью в растворе никогда не будет равным 0,44 [203], как это имело бы место, если бы составу комплекса действительно соответствовала формула А2Си (для гистидина это отношение равно 0,25 для аспараги-новой кислоты — 0,39, для лизина — 0,52 и т. д.). Указанные расхождения возникают благодаря существованию двух упомянутых выше равновесий, а также вследствие того, что в некоторых аминокислотах (гистидине, цистеине, орнитине и т. д.) вторая группа также способна связывать металл. В результате этого образуются интрамолекулярные комплексы, примером которых может служить гистидиновый комплекс [c.129]
Как видно из структурных формул, приведенных на фиг. 15, двадцать стандартных аминокислот (которые часто обозначаются, как это показано на фиг. 15, тремя первыми буквами их полных названий) можно разбить на несколько подгрупп в соответствии с природой их заместителей (боковых цепей) в основной цепи. Глицин, аланин, валив, лейиин, изо-лейиин, серии и треонин содержат простые алифатические заместители, а фенилаланин и тирозин — простые ароматические заместители. Цистеин и метионин содержат серу. Лизин, аргинин и гистидин имеют в своих алифатических боковых цепях вторую аминогруппу. У аспарагиновой и глутиминовой кислот в алифатических боковых цепях имеется вторая карбоксильная группа. Аспарагин и глутамин представляют собой простые амиды аспарагиновой и глутаминовой кислот. Наконец, триптофан, пролин и гистидин обладают гетероциклическими боковыми пенями.
15, тремя первыми буквами их полных названий) можно разбить на несколько подгрупп в соответствии с природой их заместителей (боковых цепей) в основной цепи. Глицин, аланин, валив, лейиин, изо-лейиин, серии и треонин содержат простые алифатические заместители, а фенилаланин и тирозин — простые ароматические заместители. Цистеин и метионин содержат серу. Лизин, аргинин и гистидин имеют в своих алифатических боковых цепях вторую аминогруппу. У аспарагиновой и глутиминовой кислот в алифатических боковых цепях имеется вторая карбоксильная группа. Аспарагин и глутамин представляют собой простые амиды аспарагиновой и глутаминовой кислот. Наконец, триптофан, пролин и гистидин обладают гетероциклическими боковыми пенями.
Лизин С5Н,40аН2 разлагается при гниении на кадаверин или пентандиамин-1,5 (159) так как лизин, как кислота, содержит карбоксильную группу, то на основании этого расщепления для него вероятна формула [c.
 316]
316] Содержание уксусной кислоты в культуральной жидкости во время биосинтеза лизина на ацетатной среде может изменяться в определенных пределах. При введении уксусной кислоты в культуральную среду в процессе ферментации наряду с повышением концентрации ацетата одновременно происходит заметное снижение pH среды, т. е. существует тесная связь между подачей ацетата в ферментер и изменением pH культуральной жидкости. Для автоматизации подачи в начале процесса экспериментатор вводит в ЭВМ уставку по pH, которая передается на устройство управления ферментацией, и переменные калибровки насоса. Затем устройство управления поддерживает pH на определенном уровне, а ЭВМ подсчитывает поданный в ферментер объем ацетата до ввода экспериментатором результатов анализа по ацетату, азоту, лизнну. После ввода анализов ЭВМ переопределяет уставку pH, передает ее на устройство управления ферментацией и продолжает подсчитывать объем поданного ацетата до ввода данных по результатам анализов. Объем подсчитывается по формуле п [c.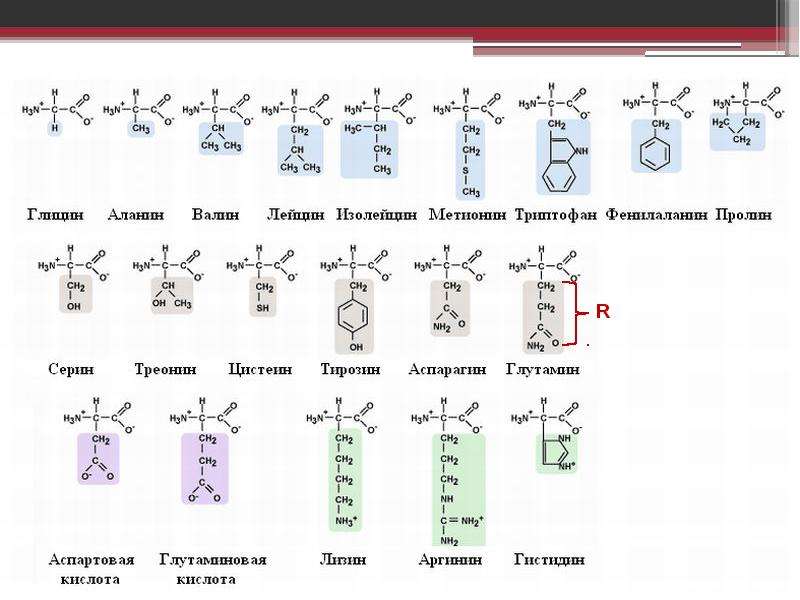 91]
91]
Обозначим переменные pH — уставка pH LLT1 — время работы насоса, с LV1 —объем, отработанный насосом в мл за время LLTI LLU — напряжение на насосе Т (LT4 = Т + 2) — текущее время LV — поданный объем ацетата LV2 — поданный объем ацетата за 2 с РН1 — массив запоминания уставок РН2 — счетчик числа изменения уставок СН — результат анализа по ацетату L — результат анализа по лизину N — результат анализа по азоту PH = 8.7 — 1,46/ (СН + 0.68) — формула переопределения уставки. Описание переменных и присвоение начальных данных [c.91]
Важным подтверждением существования антител против конформационных и секвенциальных детерминант нос тужили эксперименты с синтетическими полипептидами, выполненные в лаборатории М. Села (М. Sela, 1968). Были использованы два типа пептидов, каждый из которых имел в своем составе трипептид Туг — Ala — Glu (TAG). Один пептид обладал разветвленной структурой, будучи образован сополимером аланина и лизина (—А—L—), к е-аминогруппам которого апериодически были присоединены указанные трипептиды —TAG.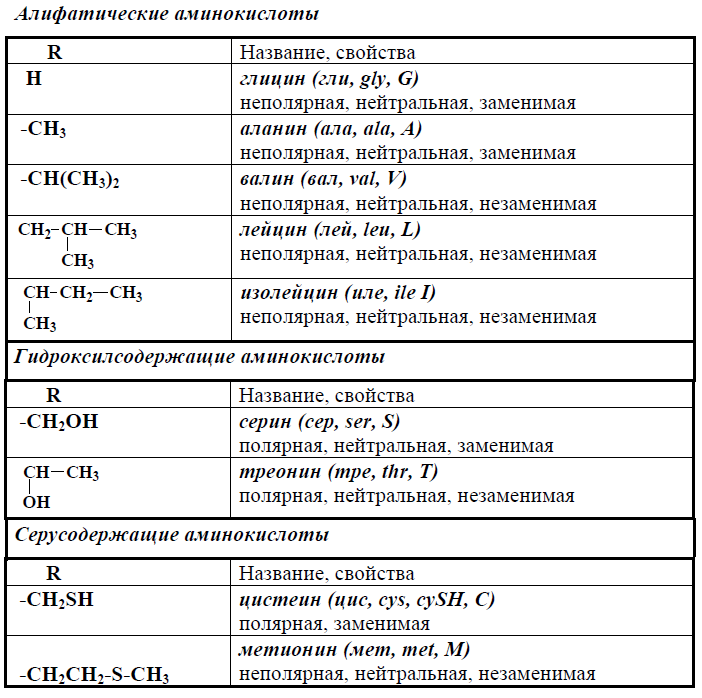 Второй пептид представлял собой периодический полимер в форме а-спирали с формулой (TAG) Как видно из рис. 7, при различной структуре оба полипептида имели в своем составе блоки TAG они характеризовались сходными молекулярными массами. [c.33]
Второй пептид представлял собой периодический полимер в форме а-спирали с формулой (TAG) Как видно из рис. 7, при различной структуре оба полипептида имели в своем составе блоки TAG они характеризовались сходными молекулярными массами. [c.33]
Этот подход в равной мере применим для других аминокислот с диссоциирующими группами в боковой цепи, например для лизина или гистидина. Выписав формулы для всех возможных заряженных форм основных аминокислот, лизина и аргинина, получаем [c.23]
При этом образуются такие структуры, как лизин-норлейцин и десмозин (см. формулы). [c.167]
Приложения по биологической химии
Биохимия необходима в медицине для понимания процессов, происходящих на микроуровне как в норме, так и патологии. Содержание этого сборника приложений составлено с учетом возможностей современных технологий, дающих преимущества в изучении этого предмета.
Содержание сборника:
- Biochemistry Dictionary — словарь по биохимии
- Аминокислоты — Все структуры
- Biochemistry — иллюстрированный учебник по биохимии
- Ферменты — краткая классификация
- Biochemistry Prep: Practice Tests and Flashcards — флешкарты по биохимии
- Стероиды — Химические формулы
- Аминокислоты — краткие описания
Biochemistry Dictionary — словарь по биохимии
«Biochemistry Dictionary» — большой словарь по биохимии, который Вы можете скачать бесплатно.
Особенности:
- Это приложение работает в автономном режиме — не требуя постоянного подключение к интернету.
- Тысячи Биохимических слов и терминов.
- Алфавитный список.
- Удобный поиск.
Язык программы — английский.
Android
Аминокислоты — Все структуры
Это приложение — самый простой и надежный способ выучить структуры и свойства 20 стандартных аминокислот и 14 родственных соединений.
Знаете ли Вы химическую формулу глицина?
Между прочим, знание структур и названий аминокислот — строительных блоков белков и пептидов — важно не только химикам, но и биологам, фармацевтам и вообще всем, кто изучает науку и/или медицину.
Это приложение — самый простой и надежный способ выучить структуры, сокращения и свойства 20 стандартных аминокислот (аргинин, гистидин и т.д.) и более 20 родственных соединений (таурин, L-ДОФА и т.п.).
- Все 22 аминокислоты, входящие в состав белков (20 стандартных + Селеноцистеин и Пирролизин).

- Цветные структурные формулы.
- Трех- и однобуквенные коды (сокращения).
- Изоэлектрические точки (pI).
- Незаменимые аминокислоты: фенилаланин, метионин и другие.
- Полярные (глутаминовая кислота) и гидрофобные (лейцин) аминокислоты.
- Нестандартные аминокислоты, такие как D-аланин.
- Дипептиды, такие как аспартам.
Выберите режим игры:
- Отгадайте слово по буквам: «Структура — Название».
- Тесты с вариантами ответов.
- Игра на время (дайте как можно больше ответов за 1 минуту).
Два обучающих режима:
- Флэш-карточки.
- Таблицы.
Идеальное приложение для изучающих:
- Биохимию
- Органическую химию
- Молекулярную биологию
Язык контента — русский. Скачивание- бесплатное.
Android iOS
Biochemistry — иллюстрированный учебник по биохимии
Загрузите бесплатно электронный, иллюстрированный учебник по биохимии, для легкого усвоения материала.
Охваченные основные темы, приведенные ниже, помогут изучить биохимию очень подробно.
Раздел 1: Основы органической химии
- Введение
- Важные элементы в биологии
- Гибридизация
- Форма воды и аммиака молекул кислот и щелочей
- PH
- Буферы
- Соли
- Важные функциональные группы в органической химии
- Нековалентных взаимодействий Общие типы реакций в биохимии
Раздел 2: Аминокислоты и белки
- Аминокислоты и протеины
- Классификация
- Оптическая изомерия
- Кислотно-основные свойства
- Пептиды, образование, связи и свойства
- Классификация белков
- Уровни структуры белка
Раздел 3: Углеводы
- Углеводы
- Классификация
- Классификация моносахаридов
- Структура и функции сахаров
- Дисахариды
- Полисахариды
- Гликоконъюгаты
Раздел 4: Нуклеиновые кислоты
- Структуры пуриновых и пирамидиновых оснований нуклеозидов
- Нуклеотиды
- РНК
- Типы ДНК РНК
- Структуры ДНК
Раздел 5: Липиды
- Введение
- Номенклатурная классификация
- Свойства и функции
- Жирные кислоты
- Мембранные липиды
- Стероиды
- Структура стероидного ядра
- Биологическая роль холестерина
- Биомембраны
Язык приложения — английский.
Android
Ферменты — краткая классификация
В приложении содержится описание ферментативных структур, собранных в алфавитном порядке.Интерфейс позволяет найти необходимое соединение благодаря удобному поиску (включая голосовой).
Приложение будет полезно как краткий справочник студентам медицинских ВУЗов, при подготовке к биологической химии и физиологии.
Язык контента — русский. Скачивание — бесплатное, но в приложении присутствуют покупки.
Android
Biochemistry Prep: Practice Tests and Flashcards — флешкарты по биохимии
«Biochemistry Prep: Practice Tests and Flashcards» бесплатная андроид — программа, которая предлагает мощные инструменты для изучения биохимии.Содержание:
- Диагностические тесты.
- Мнемонические карточки.
- Вопросы дня и многое другое, что может значительно помочь вам в вашей учебе.
Язык контента — английский.
Android iOS
Стероиды — Химические формулы
Это приложение поможет студентам, изучающим химию, биологию и фармацевтику познакомиться с химическими формулами важнейших природных и синтетических стероидов.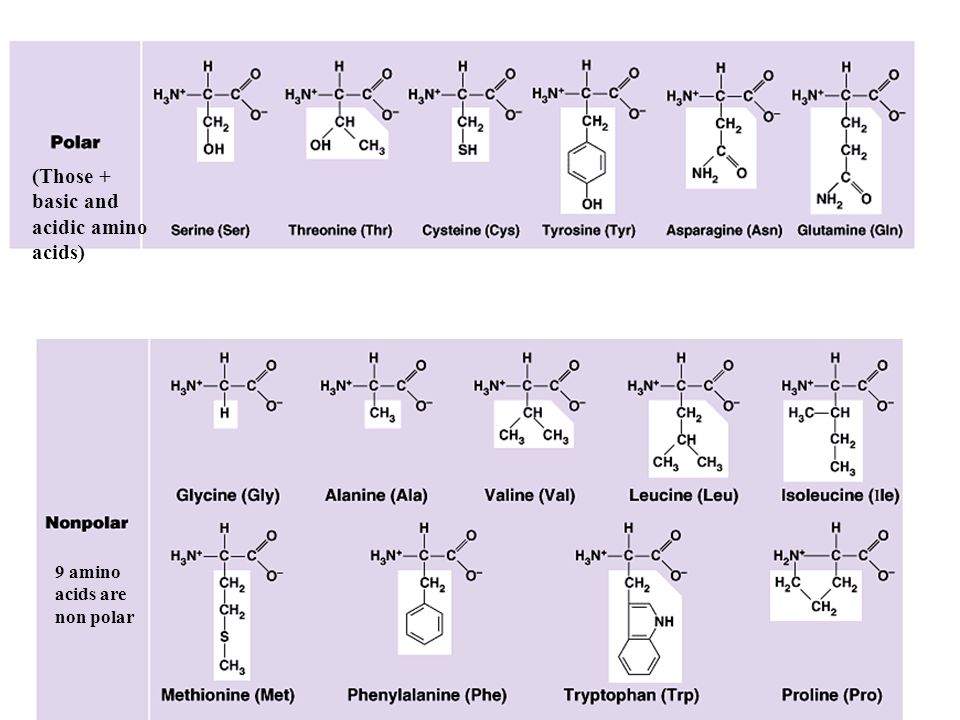
Стероиды — важный класс природных соединений с разнообразной биологической активностью: стероидные гормоны (эстрадиол, тестостерон), витамины (витамин D3), липиды (холестерин). Многие из них являются лекарствами, использующимися для лечения астмы, облысения, рака предстательной железы и как оральные контрацептивы.
Выберите режим игры:
- Отгадайте слово по буквам.
- Тесты с вариантами ответов.
Обучающий режим:
- Флэш-карточки.
Вы можете скачать эту программу и изучать важный раздел биохимии с легкостью и совершенно бесплатно. Язык контента — русский.
Android iOS
Аминокислоты — краткие описания
Приложение содержит краткие но емкие описание аминокислот.Программа включает в себя удобный поиск и возможность воспроизводить вслух текст, описывающий различные соединения.
Язык контента — русский. Скачивание — бесплатное.
Android
формулы и названия, значение в строении белка
Что такое аминокислоты
Где встречаются
Строительные блоки любой макромолекулы сходны по строению, т. е. имеют одинаковые химические группировки, своего рода скелет, характерный для каждого вида.
е. имеют одинаковые химические группировки, своего рода скелет, характерный для каждого вида.
Он образуется при соединении строительных блоков химической связью и состоит из повторяющихся одинаковых групп. В основе белковой молекулы лежит пептидная связь, возникающая при реакции аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. От неизменного пептидного скелета ответвляются боковые группы аминокислот, строение которых зависит от вида аминокислоты. Каждый белок имеет свой неповторимый аминокислотный состав и уникальный порядок соединения аминокислот, называемый первичной структурой белка.
Для удобства двадцать главных аминокислот обозначают символами, используя одну или первые три буквы русского или английского наименования, например, аланин — Ала или А, глицин — Гли или G. Белки разного размера включают в себя от нескольких десятков до нескольких сотен и даже тысяч аминокислот. В среднем длина белка — около 300 аминокислот. Одна часть молекул РНК, информационная, диктует последовательность аминокислот в белке, другая, рибосомная, способствует соединению аминокислот в белковую цепь. Хранится информация о составе белков в более прочных молекулах ДНК.
Хранится информация о составе белков в более прочных молекулах ДНК.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Основное значение
Для нормальной жизнедеятельности организм человека нуждается в полном наборе из двадцати основных аминокислот. Они участвуют в обмене веществ и используются в качестве сырья для получения многих биологически активных молекул: гормонов, алкалоидов, пигментов. В некоторых белках содержатся особые аминокислоты, не входящие в число двадцати стандартных. Они образуются модификацией нормальных аминокислот. Например, в белке соединительной ткани коллагене найдены 4-гидроксипролин и 5-гидроксилизин. От пролина и лизина они отличаются только гидроксильной группой. Эта группа необходима для образования прочных волокон коллагена.
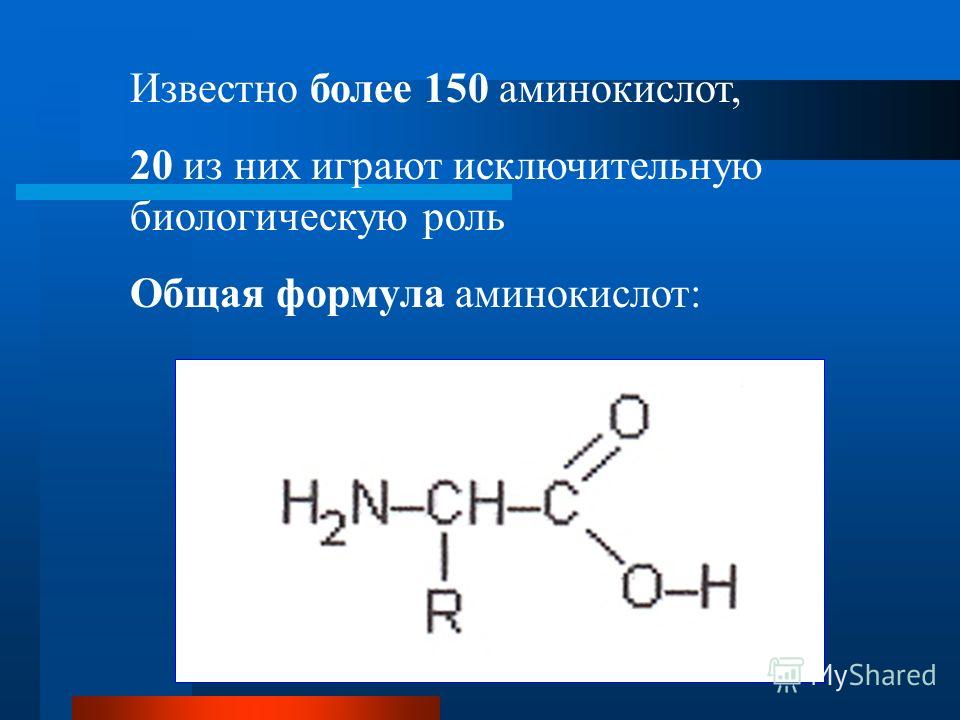
Общая формула аминокислот
Общим для всех аминокислот является наличие аминогруппы NH2.
Также в каждой их молекуле присутствует атом углерода, карбоксильная группа СООН, атом водорода и R-группа атомов, она же боковая цепь, различная для каждой аминокислоты. Благодаря наличию одновременно кислотной и аминной групп, всегда прикрепленных к одному и тому же атому углерода, аминокислоты способны проявлять как кислотные, так и щелочные свойства. Это позволяет их молекулам соединяться между собой.
Классификация
По радикалу
На основе химического строения радикала, R-группы, аминокислоты можно разделить на следующие группы:
- ароматические: триптофан, тирозин, фенилаланин;
- алифатические: глицин, аланин, валин, лейцин;
- серосодержащие: метионин, цистеин;
- гидроксилсодержащие: L-серин, L-трионин.
По функциональным группам
В этой классификации всем другим атомам углерода в молекуле даются обозначения в зависимости от степени их удаленности от карбоксильной группы в структурной формуле. Ближайший к ней атом называют \(\alpha\)-атомом, второй —\( \beta\)-атомом, следующий — \(\gamma\)-атомом и т. д. Атом углерода, который находится ближе всех к карбоксильной группе, \(\alpha\)-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют \(\alpha\)-аминокислотами. В природе встречаются аминокислоты, в которых аминная группа связана с более отдаленными от карбоксильной группы атомами углерода, но в построении белков участвуют именно\( \alpha\)-аминокислоты. Это обусловлено прежде всего тем, что только \(\alpha\)-аминокислоты, соединённые в длинные цепи, способны обеспечить достаточную прочность и устойчивость структуры больших белковых молекул.
Ближайший к ней атом называют \(\alpha\)-атомом, второй —\( \beta\)-атомом, следующий — \(\gamma\)-атомом и т. д. Атом углерода, который находится ближе всех к карбоксильной группе, \(\alpha\)-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют \(\alpha\)-аминокислотами. В природе встречаются аминокислоты, в которых аминная группа связана с более отдаленными от карбоксильной группы атомами углерода, но в построении белков участвуют именно\( \alpha\)-аминокислоты. Это обусловлено прежде всего тем, что только \(\alpha\)-аминокислоты, соединённые в длинные цепи, способны обеспечить достаточную прочность и устойчивость структуры больших белковых молекул.
Также существует классификация по количеству функциональных групп:
- моноаминомонокарбоновые — одна карбоксильная и одна аминная группа;
- моноаминодикарбоновые — две карбоксильные и одна аминная группа;
- диаминомонокарбоновые — одна карбоксильная и две аминные группы.

По классам
Условно основные аминокислоты делят на четыре класса:
- С неполярными боковыми цепями: аланин, валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, пролин.
- Содержащие полярную группу: серин, треонин, тирозин, цистеин, аспарагин, глутамин, глицин.
- С боковыми цепями, которые могут заряжаться положительно при физиологических значениях рН: лизин, аргинин, гистидин.
- С боковыми цепями, которые могут заряжаться отрицательно при физиологических значениях рН: аспарагиновая кислота, глутаминовая кислота.
R-группа глицина представляет собой просто атом водорода, и эту аминокислоту трудно отнести к какому-нибудь из четырех классов. Такая боковая группа не может нести ни положительный, ни отрицательный заряд, не способна участвовать во взаимодействиях полярных R-групп или образовании водородных связей. Но у глицина, входящего в состав аминокислотной цепочки, есть две полярные группы — >С=О и >N-H. Поэтому глицин условно можно отнести к полярным аминокислотам.
Поэтому глицин условно можно отнести к полярным аминокислотам.
По путям биосинтеза
Выделяют следующие биосинтетические семейства:
- аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин;
- глутамата: глутамат, глутамин, аргинин, пролин;
- пирувата: аланин, валин, лейцин;
- серина: серин, цистеин, глицин;
- пентоз: гистидин, фенилаланин, тирозин, триптофан.
По способности синтезировать из предшественников
Одни аминокислоты синтезируются в клетках самого организма, а другие должны поступать в готовом виде из пищевых продуктов. По биологической классификации аминокислоты делятся на три группы:
- заменимые, синтезирующиеся в организме человека: глицин, аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин;
- незаменимые: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан;
- условно незаменимые, синтезирующиеся в организме человека в недостаточном количестве: гистидин, аргинин.

По характеру катаболизма
По типу биодеградации аминокислоты делят на три группы:
- глюкогенные, метаболиты которых не повышают уровень кетоновых тел: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин;
- кетогенные, метаболиты которых повышают уровень кетоновых тел: лизин, лейцин;
- смешанные, образующие при распаде метаболиты обоих типов: триптофан, фенилаланин, изолейцин, тирозин.
Формулы важнейших аминокислот
Применение аминокислот
Аминокислоты используют для создания лекарственных препаратов и биологически активных протеиновых добавок, добавляют в корма для животных. Натриевая соль глутаминовой кислоты является усилителем мясного вкуса, поэтому ее можно встретить во многих пищевых продуктах, например, колбасах и консервах. Также аминокислоты используют в парфюмерной промышленности, в производстве красителей и моющих средств.
Аминокислоты
№______САБАҚТЫҢ ЖОСПАРЫ
ПЛАН ЗАНЯТИЯ №_______
Топ
Группа________________________________________
Күні
Дата____________________________________
Пәні
Дисциплина: Химия
Сабақтың тақырыбы:
Тема занятия: Аминокислоты. Изомерия и номенклатура аминокислот. Физические свойства аминокислот.
Цель урока: систематизировать знания учащихся о кислотах, аминах; дать представление об аминокислотах, познакомить со строением, амфотерными свойствами, физическими свойствами.
Задачи урока:
обучающая
— показать значение аминокислот. Рассмотреть биологическую роль аминокислот;
— научить учащихся записывать структурные формулы аминокислот, давать им названия;
развивающая
— развивать умение учащихся сравнивать, обобщать, проводить аналогию между неорганическими и органическими веществами;
— продолжить развитие навыков самообразования и самооценки;
— развивать общеучебные умения
(умение работать с учебником, составлять таблицы, оформлять наблюдения в
письменном виде, формулировать выводы во внутренней и внешней речи,
осуществлять самоконтроль, проводить самоанализ и т. п.)
п.)
воспитывающая
— воспитывать устойчивый интерес к предмету через изучение некоторых моментов роли аминокислот для жизнедеятельности человека;
— воспитывать интерес к здоровому образу жизни.
Тип урока: изучение нового материала
Оборудование: Периодическая Система химических элементов Д.И. Менделеева, таблица аминокислот.
Ход урока
1. Организационный момент.
2. Проверка домашнего задания.
3. Актуализация знаний.
· Какую группу органических соединений мы начали изучать на прошлом уроке? (Азотсодержащие органические вещества).
· С каким классом соединений мы познакомились? (Амины)
· Сегодня мы продолжаем знакомиться с азотсодержащими органическими соединениями.
Постановка темы урока.
4. Изучение нового материала
Что же представляют собой аминокислоты с точки зрения химии?
Аминокислоты – органические бифункциональные
соединения, в состав которых входят две функциональные группы: карбоксильная –
СООН и аминогруппа -NH2.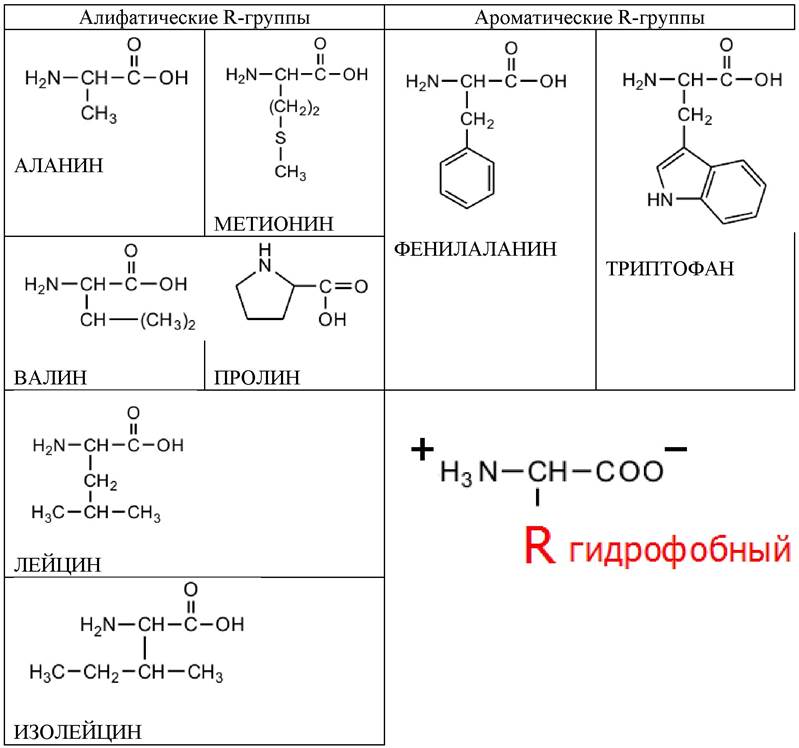
Аминокислоты – амфотерные соединения.
Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых один или несколько атомов водорода углеводородного радикала замещены аминогруппами.
В природе встречаются в основном α-аминокислоты, составляющих белки (кроме пролина). Они имеют общую формулу
где R – углеводородный радикал, который может содержать различные функциональные группы (-SH, –OH, –COOH, NH2) и кольца.
Специфичность каждой аминокислоты определяется строением радикала R.
Простейший представитель – H2N-CH2-COOH — аминоуксусная кислота (глицин).
СТРОЕНИЕ АМИНОКИСЛОТ
Аминокислоты, в отличие от ранее изученных органических веществ, содержат две функциональнее группы.
Каждая из
20 аминокислот имеет одинаковую часть (NH2-CH-COOH) и отличается от
любой другой аминокислоты R-группой, или радикалом. Строение радикала у разных
видов аминокислот — различное.
Строение радикала у разных
видов аминокислот — различное.
Структура лишь одной аминокислоты – пролина – не соответствует общей формуле. Это связано с тем, что пролин не является аминокислотой. Он представляет собой иминокислоту.
Например, в молекуле глицина R-радикал представлен атомом водорода:
В молекуле пролина радикал связан с α-углеродным атомом и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
НОМЕНКЛАТУРА АМИНОКИСЛОТ
Для названия аминокислот используют три типа номенклатуры –тривиальную, рациональнцю и IUPAC.
По систематической номенклатуре (IUPAC) названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Нумерация
углеродной цепи начинается с атома углерода карбоксильной группы.
По рациональной номенклатуре к тривиальному названию карбоновой кислоты добавляется приставка амино с указанием положения аминогруппы буквой греческого алфавита.
Формулы и названия некоторых α-аминокислот, остатки которых входят в состав белков
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино, три группы NH2 – триамино и т.д.
Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота.
ИЗОМЕРИЯ АМИНОКИСЛОТ
Для аминокислот известны два вида изомерии: структурная и пространственная (оптическая изомерия).
Структурная изомерия
Структурная
изомерия связана с особенностями строения углеродного скелета и взаимным расположением
функциональных групп.
1. Изомерия углеродного скелета
2. Изомерия положения аминогруппы
Оптическая изомерия
Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (a-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).
Оптическая изомерия природных α-аминокислот играет важную роль в процессах биосинтеза белка.
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты – бесцветные кристаллические вещества с высокой температурой плавления (выше 2500С). Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в воде и малорастворимы в органических растворителях. Многие α-аминокислоты имеют сладкий вкус. Водные растворы аминокислот проводят электрический ток.
5. Закрепление изученного материала.
Закрепление изученного материала.
Рассмотрение и изучение формул основных аминокислот
Задание
Напишите структурную формулу аминокислоты по названию и составьте изомер углеродного скелета, изомер положения аминогруппы, межклассовый изомер. Дайте название по систематической номенклатуре каждому веществу.
4-амино – 4- метилпентановая кислота
6. Подведение итогов урока. Рефлексия
7. Домашнее задание: Изучить формулы 20 основных аминокислот и физические свойства аминокислот. Повторить азотсодержащие органические соединения и их свойства.
Скачано с www.znanio.ru
Химические формулы аминокислот. Аминокислоты
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, является аминокислотой . Однако, чаще этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в a-положении к карбоксильной группе.
Аминокислоты, как правило, входят в состав полимеров — белков . В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся в табл. 1. Для больных фенилкетонурией незаменимой аминокислотой является также тирозин (см. табл. 1).
Таблица 1
Незаменимые аминокислоты R-CHNh3 COOH
Аминокислоты называют обычно как замещенные соответствующих карбоновых кислот, обозначая положение аминогруппы буквами греческого алфавита. Для простейших аминокислот обычно применяются тривиальные названия (глицин, аланин, изолейцин и т.д.). Изомерия аминокислот связана с расположением функциональных групп и со строением углеводородного скелета.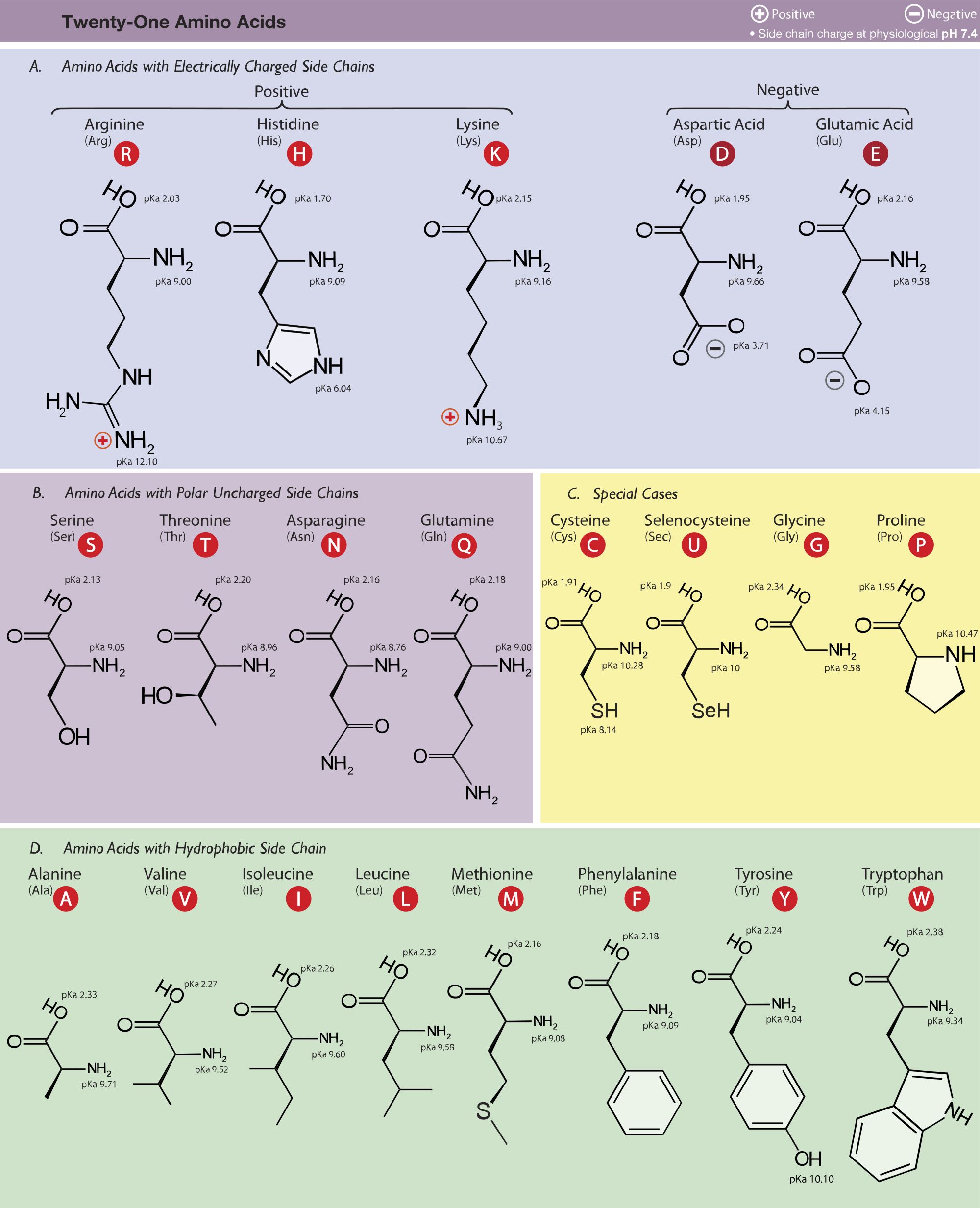 Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1. Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко – с помощью ионообменных смол.
2. Из галогензамещенных кислот. Один из наиболее распространенных методов синтеза a -аминокислот заключается в аммонолизе a -галогензамещенной кислоты, которую обычно получают по реакции Геля-Фольгарда-Зелинского:
Этот метод можно модифицировать, получая a-бромзамещенную кислоту через малоновый эфир:
Ввести аминогруппу в эфир a-галогензамещенной кислоты можно с помощью фталимида калия (синтез Габриэля ):
3. Из карбонильных соединений (синтез Штреккера ). Синтез a-аминокислот по Штреккеру состоит в реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия (это усовершенствование метода предложено Н.Д. Зелинским и Г.Л. Стадниковым).
Из карбонильных соединений (синтез Штреккера ). Синтез a-аминокислот по Штреккеру состоит в реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия (это усовершенствование метода предложено Н.Д. Зелинским и Г.Л. Стадниковым).
Реакции присоединения — отщепления с участием аммиака и карбонильного соединения дают имин, который реагирует с цианистым водородом, образуя a-аминонитрил. В результате его гидролиза образуется a-аминокислота.
Химические свойства аминокислот
Все a-аминокислоты, кроме глицина, содержат хиральный a-углеродный атом и могут встречаться в виде энантиомеров :
Было доказано, что почти все природные a-аминокислоты обладают одной и той же относительной конфигурацией при a-углеродном атоме. a-Углеродному атому (-)-серина была условно приписана L -конфигурация, а a-углеродному атому (+)-серина — D -конфигурация. При этом, если проекция a-аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R — внизу, у L -аминокислоты аминогруппа будет находиться слева, а у D -аминокислоты — справа.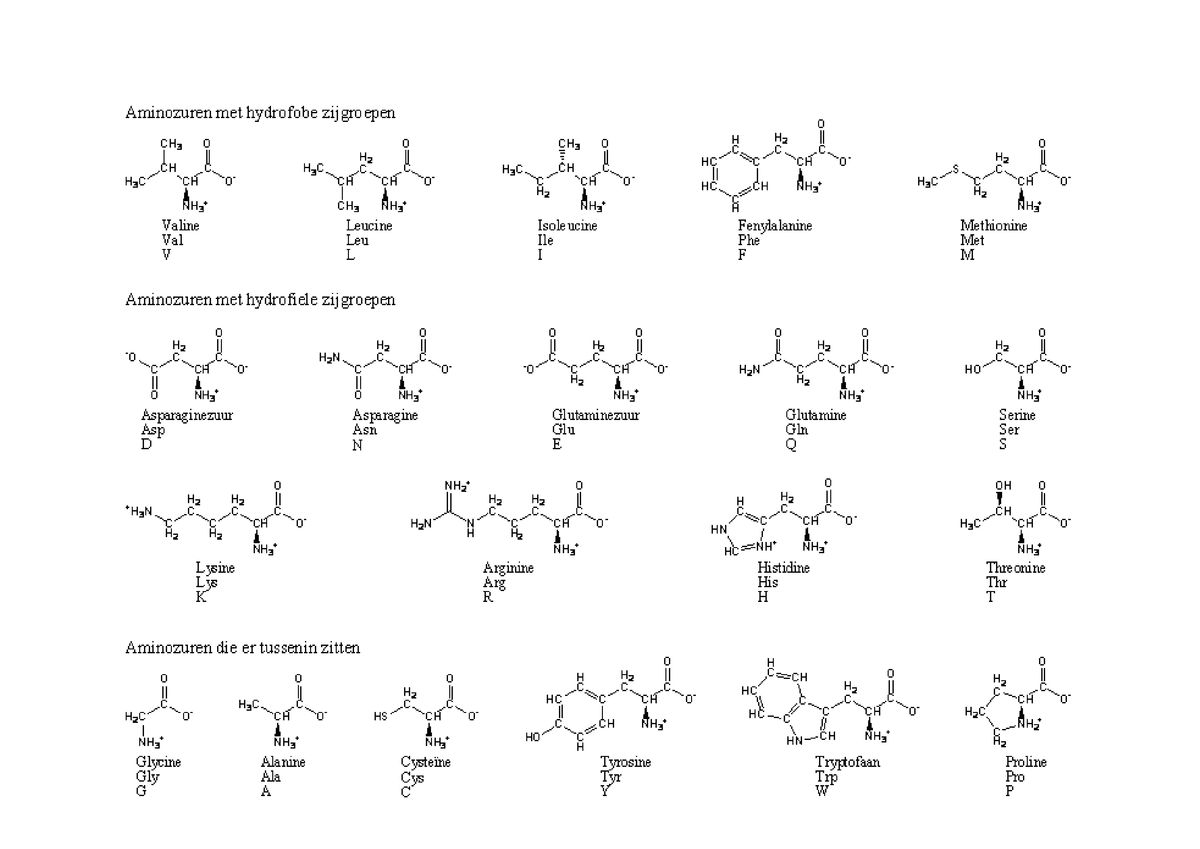 Схема Фишера для определения конфигурации аминокислоты применима ко всем a-аминокислотам, обладающим хиральным a-углеродным атомом.
Схема Фишера для определения конфигурации аминокислоты применима ко всем a-аминокислотам, обладающим хиральным a-углеродным атомом.
Из рисунка видно, что L -аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство a-аминокислот, встречающихся в природе, относится к L -ряду. Их энантиоморфы , т.е. D -аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами .
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при b-углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты — амфотерные вещества, которые могут существовать в виде катионов или анионов.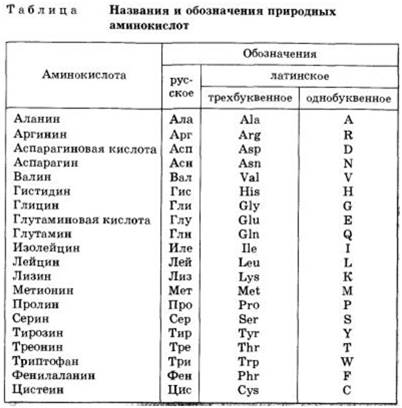 Это свойство объясняется наличием как кислотной (-СООН ), так и основной (— NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
Это свойство объясняется наличием как кислотной (-СООН ), так и основной (— NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей ). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах — к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.
РЕАКЦИИ АМИНОКИСЛОТ
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (in vitro ), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет -бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.
2. образование амидов по аминогруппе. При ацилировании аминогруппы a-аминокислоты образуется амид.
Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из a-аминокислот, называются пептидами или полипептидами . Амидная связь в таких полимерах называется пептидной связью . Полипептиды с молекулярной массой не меньше 5000 называют белками . В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка . Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы — фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные (отношение меньше 10). К фибриллярным белкам относится коллаген , наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов .
Аминокислоты
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, является аминокислотой . Однако, чаще этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в -положении к карбоксильной группе.
Аминокислоты, как правило, входят в состав полимеров — белков . В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся в табл. 1. Для больных фенилкетонурией незаменимой аминокислотой является также тирозин (см. табл. 1).
Таблица 1
Незаменимые аминокислоты R-CHNH 2 COOH
Название (сокращение) | ||
изолейцин (ile, ileu) | CH 3 CH 2 CH(CH) 3 — | |
лейцин (leu) | (CH 3 ) 2 CHCH 2 — | |
лизин (lys) | NH 2 CH 2 CH 2 CH 2 CH 2 — | |
метионин (met) | CH 3 SCH 2 CH 2 — | |
фенилаланин (phe) | C 6 H 5 CH 2 — | |
треонин (thr) | CH 3 CH(OH)- | |
триптофан (try) | ||
валин (val) | (CH 3 ) 2 CH- | |
тирозин (tyr) |
Аминокислоты называют обычно как замещенные соответствующих карбоновых кислот, обозначая положение аминогруппы буквами греческого алфавита. Для простейших аминокислот обычно применяются тривиальные названия (глицин, аланин, изолейцин и т.д.). Изомерия аминокислот связана с расположением функциональных групп и со строением углеводородного скелета. Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1. Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко — с помощью ионообменных смол.
2. Из галогензамещенных кислот. Один из наиболее распространенных методов синтеза -аминокислот заключается в аммонолизе -галогензамещенной кислоты, которую обычно получают по реакции Геля-Фольгарда-Зелинского:
Этот метод можно модифицировать, получая -бромзамещенную кислоту через малоновый эфир:
Ввести аминогруппу в эфир -галогензамещенной кислоты можно с помощью фталимида калия (синтез Габриэля ):
3. Из карбонильных соединений (синтез Штреккера ). Синтез -аминокислот по Штреккеру состоит в реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия (это усовершенствование метода предложено Н.Д. Зелинским и Г.Л. Стадниковым).
Реакции присоединения — отщепления с участием аммиака и карбонильного соединения дают имин, который реагирует с цианистым водородом, образуя -аминонитрил. В результате его гидролиза образуется -аминокислота.
Химические свойства аминокислот
Все -аминокислоты, кроме глицина, содержат хиральный -углеродный атом и могут встречаться в виде энантиомеров :
Было доказано, что почти все природные -аминокислоты обладают одной и той же относительной конфигурацией при -углеродном атоме. -Углеродному атому (-)-серина была условно приписана L -конфигурация, а -углеродному атому (+)-серина — D -конфигурация. При этом, если проекция -аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R — внизу, у L -аминокислоты аминогруппа будет находиться слева, а у D -аминокислоты — справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем -аминокислотам, обладающим хиральным -углеродным атомом.
Из рисунка видно, что L -аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство -аминокислот, встречающихся в природе, относится к L -ряду. Их энантиоморфы , т.е. D -аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами .
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при -углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты — амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН ), так и основной (— NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей ). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах — к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.
РЕАКЦИИ АМИНОКИСЛОТ
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (in vitro ), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет -бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.
2. образование амидов по аминогруппе. При ацилировании аминогруппы -аминокислоты образуется амид.
Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из -аминокислот, называются пептидами или полипептидами . Амидная связь в таких полимерах называется пептидной связью . Полипептиды с молекулярной массой не меньше 5000 называют белками . В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка . Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы — фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные (отношение меньше 10). К фибриллярным белкам относится коллаген , наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов .
Многие биологически активные молекулы включают несколь-ко химически различных функциональных групп, способных к взаимодействию между собой или с функциональными группами других молекул. Один из примеров — моносахариды , в состав которых входят несколько гидроксильных групп и одна карбонильная группа. Другой важный пример бифункциональных природных соединений — аминокислоты .
Аминокислоты
— это органические бифункциональные соеди-нения, в состав которых входят карбоксильная группа -СООН и аминогруппа -NН 2 . В зависимости от взаимного расположения обеих функциональных групп различают α-, β-, γ-аминокислоты:
β α β α
α-аминопропионовая β-аминопропионовая
кислота кислота
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Здесь будут рассматриваться только α-аминокислоты, поскольку другие аминокислоты в природе не встречаются.
В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия.
Иминокислота пролин (молекулярная формула C 5 H 9 NO 2) имеет структуру
Простейшая аминокислота — глицин (аминоуксусная кисло-та). Остальные природные аминокислоты можно разделить на следующие основные группы:
α-Аминокислоты общей формулы
| Аминокислота | Обозначение (трёх- и одно- буквенное) | Молеку-лярная формула | |
| Глицин | Gly (G ) | C 2 H 5 NO 2 | |
Ala(A) | CH 3 | C 3 H 7 NO 2 | |
Val(V) | CH(CH 3) 2 | C 5 H 11 NO 2 | |
Leu(L) | CH 2 -CH(CH 3) 2 | C 6 H 13 NO 2 | |
Изолейцин | Ile(I) | CH 2 -CH(CH 3)-C 2 H 5 | C 7 H 15 NO 2 |
Cys(C) | CH 2 -SH | C 3 H 7 SNO 2 | |
Метионин | Met (M ) | CH 2 -CH 2 -S-CH 3 | C 5 H 11 SNO 2 |
Ser(S) | CH 2 -OH | C 3 H 7 NO 3 | |
Thr(t) | CH(OH)-CH 3 | C 4 H 9 NO 3 | |
Фенилаланин | Phe(F) | CH 2 -C 6 H 5 | C 9 H 11 NO 2 |
Tyr(Y) | C 9 H 11 NO 3 | ||
Триптофан | Trp(W) | C 11 H 12 N 2 O 2 | |
Аспарагиновая кислота | Asp (D ) | CH 2 COOH | C 4 H 7 NO 4 |
Глутаминовая кислота | Glu(E) | CH 2 -CH 2 -COOH | C 5 H 9 NO 4 |
Аспарагин | Asn(N) | CH 2 -CO-NH 2 | C 4 H 8 N 2 O 3 |
| Глутамин | Gln(Q) | CH 2 -CH 2 -CO-NH 2 | C 5 H 10 N 2 O 3 |
Гистидин | His(H) | C 6 H 9 N 3 O 2 | |
Lys(K) | -(CH 2) 4 -NH 2 | C 6 H 14 N 2 O 2 | |
Arg(R) | C 6 H 14 N 4 O 2 |
1) гомологи глицина — аланин, валин, лейцин, изолейцин;
2) серосодержащие аминокислоты — цистеин, метионин;
3) аминокислоты с алифатической гидроксильной группой — серин, треонин;
4) ароматические аминокислоты — фенилаланин, тирозин, триптофан;
5) аминокислоты с кислотным радикалом — аспарагиновая и глутаминовая кислоты;
6) аминокислоты с амидной группой — аспарагин, глутамин;
7) аминокислоты с основным радикалом — гистидин, лизин, аргинин.
Изомерия. Физические свойства. Получение
Изомерия . Во всех α-аминокислотах, кроме глицина , α-углеродный атом связан с четырьмя разными заместителями, по-этому все эти аминокислоты могут существовать в виде двух изомеров (энантиомеров ), являющихся зеркальными отражения-ми друг друга (оптическая изомерия). Каждый изомер относят к D- или L- ряду в зависимости от того, совпадает его конфигурация с конфигурацией D-глицеринового альдегида или нет:
В состав белков животных организмов входят только L-аминокислоты.
Физические свойства . Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях. Многие ами-нокислоты имеют сладкий вкус.
Получение . Основной способ получения аминокислот — за-мещение атома галогена на аминогруппу в галогензамещенных кислотах. Этот способ аналогичен получению аминов из алкилгалогенидов иаммиака. Выделяющийся при замещении галогеноводород связывают избытком аммиака:
Cl-CH(R)-COOH + 2NH 3 → H 2 N-CH(R)-COOH + NH 4 Cl.
Химические свойства
Аминокислоты — это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: амино-группу с основными свойствами и карбоксильную группу с кис-лотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н 2 N -СН 2 -СООН + HCl → Сl [Н 3 N-СН 2 -СООН],
Н 2 N -СН 2 -СООН + NaOH → H 2 N-CH 2 -COONa + Н 2 О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода , который может присоединиться к ами-ногруппе. При этом образуется внутренняя соль, молекула кото-рой представляет собой биполярный ион:
H 2 N-CH 2 —СООН + Н 3 N -СН 2 —СОO — .
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:
Водные растворы аминокислот имеют нейтральную, щелоч-ную или кислую среду в зависимости от количества функцио-нальных групп. Так, глутаминовая кислота образует кислый рас-твор (две группы -СООН, одна -NH 2), лизин — щелочной (одна группа -СООН, две -NH 2).
Подобно первичным аминам, аминокислоты реагируют с азо-тистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка ).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H 2 N-CH(R)-COOH + R»OH H 2 N-CH(R)-COOR» + Н 2 О.
Сложные эфиры аминокислот не имеют биполярной структу-ры и являются летучими соединениями.
Важнейшее свойство аминокислот — их способность к кон-денсации с образованием пептидов.
Качественные реакции .
1) Все аминокислоты окисляются нингидрином
с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного опре-деления аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентри-рованной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос — жел-тый).
Аминокислотами называются органические соединения, содержащие в молекуле функциональные группы: амино- и карбоксильную.
Номенклатура аминокислот. По систематической номенклатуре названия аминокислот образуются из названий соответствующих карбоновых кислот и добавления слова «амино». Положение аминогруппы указывают цифрами. Отсчет ведется от углерода карбоксильной группы.
Изомерия аминокислот. Их структурная изомерия определяется положением аминогруппы и строением углеродного радикала. В зависимости от положенияNH 2 -группы различают-,- и-аминокислоты.
Из -аминокислот строятся молекулы белка.
Для них также характерна изомерия функциональной группы (межклассовыми изомерами аминокислот могут быть сложные эфиры аминокислот или амиды гидроксикислот). Например, для 2-аминопропановой кислоты СН 3 – СН(NH) 2 – COOHвозможны следующие изомеры
Физические свойства α-аминокислот
Аминокислоты – бесцветные кристаллические вещества, нелетучие (малое давление насыщенного пара), плавящиеся с разложением при высоких температурах. Большинство их хорошо растворимо в воде и плохо в органических растворителях.
Водные растворы одноосновных аминокислот имеют нейтральную реакцию. -Аминокислоты можно рассматривать как внутренние соли (биполярные ионы): + NH 3 CH 2 COO . В кислой среде они ведут себя как катионы, в щелочной – как анионы. Аминокислоты являются амфотерными соединениями, проявляющими одновременно кислотные и основные свойства.
Способы получения -аминокислот
1. Действие аммиака на соли хлорзамещенных кислот.
Cl CH 2 COONH 4 + NH 3
NH 2 CH 2 COOH
2. Действие аммиака и синильной кислоты на альдегиды.
3. Гидролизом белков получают 25 различных аминокислот. Разделение их – очень не простая задача.
Способы получения -аминокислот
1. Присоединение аммиака к непредельным карбоновым кислотам.
СН 2 = СН СООН + 2NH 3 NH 2 CH 2 CH 2 COONH 4 .
2. Синтез на базе двухосновной малоновой кислоты.
Химические свойства аминокислот
1. Реакции по карбоксильной группе.
1.1. Образование эфиров при действии спиртов.
2. Реакции по аминогруппе.
2.1. Взаимодействие с минеральными кислотами.
NH 2 CH 2 COOH + HCl H 3 N + CH 2 COOH + Cl
2.2. Взаимодействие с азотистой кислотой.
NH 2 CH 2 COOH + HNO 2 HO CH 2 COOH + N 2 + H 2 O
3. Превращение аминокислот при нагревании.
3.1.-аминокислоты образуют циклические амиды.
3.2.-аминокислоты отщепляют аминогруппу и атом водорода у-углеродного атома.
Отдельные представители
Глицин NH 2 CH 2 COOH(гликокол). Одна из наиболее распространенных аминокислот, входящих в состав белков. При обычных условиях – бесцветные кристаллы с Т пл = 232236С. Хорошо растворима в воде, нерастворима в абсолютном спирте и эфире. Водородный показатель водного раствора6,8; рК а = 1,510 10 ; рК в = 1,710 12 .
-аланин – аминопропионовая кислота
Широко распространена в природе. Встречается в свободном виде в плазме крови и в составе большинства белков. Т пл = 295296С, хорошо растворима в воде, плохо в этаноле, нерастворима в эфире. рК а (СООН)= 2,34; рК а (NH) = 9,69.
-аланин NH 2 CH 2 CH 2 COOH– мелкие кристаллы с Т пл = 200С, хорошо растворима в воде, плохо в этаноле, нерастворима в эфире и ацетоне. рК а (СООН) = 3,60; рК а (NH) = 10,19; в белках отсутствует.
Комплексоны. Этот термин используют для названия ряда -аминокислот, содержащих две или три карбоксильные группы. Наиболее простые:
Наиболее распространенный комплексон – этилендиаминтетрауксусная кислота.
Ее динатриевая соль – трилон Б – чрезвычайно широко применяется в аналитической химии.
Связь между остатками -аминокислот называют пептидной, а сами образующиеся соединения пептидами.
Два остатка -аминокислот образуют дипептид, три – трипептид. Много остатков образуют полипептиды. Полипептиды, как и аминокислоты, амфотерны, каждому свойственна своя изоэлектрическая точка. Белки — полипептиды.
Рекомендуем также
26.1 Структура аминокислот
Цели
После заполнения этого раздела вы сможете:
- идентифицируют структурные особенности, присутствующие в 20 аминокислотах, обычно встречающихся в белках.
Примечание: Вы не должны помнить подробные структуры всех этих аминокислот, но вы должны быть готовы нарисовать структуры двух простейших членов, глицина и аланина.
- изобразить формулу проекции Фишера указанного энантиомера данной аминокислоты.
Примечание: Для этого вы должны помнить, что в энантиомере S карбоксильная группа появляется вверху формулы проекции, а аминогруппа находится слева.
- классифицирует аминокислоту как кислотную, основную или нейтральную, учитывая ее Kekulé, конденсированную или сокращенную структуру.
- изобразить цвиттерионную форму данной аминокислоты.
- объясняет некоторые из типичных свойств аминокислот (например, высокие температуры плавления, растворимость в воде) с точки зрения образования цвиттериона.
- напишите соответствующие уравнения, чтобы проиллюстрировать амфотерную природу аминокислот.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте следующие ключевые термины.
- α ‑ аминокислоты
- амфотерный
- незаменимых аминокислот
- цвиттерион
Учебные заметки
Это хороший момент для обзора некоторых принципов стереохимии, представленных в главе 5.Обязательно в полной мере используйте молекулярные модели, когда возникают какие-либо стереохимические проблемы.
Следует понимать, что трехбуквенный сокращенный код часто используется для обозначения отдельных аминокислот. Вам не нужно запоминать этот код.
Различие между незаменимыми и заменителями аминокислот не так четко, как можно было бы предположить. Например, аргинин часто считается несущественным.
Знакомство с аминокислотами
Аминокислоты образуют полимеры в результате нуклеофильной атаки аминогруппы аминокислоты на электрофильный карбонильный углерод карбоксильной группы другой аминокислоты.Карбоксильная группа аминокислоты должна быть сначала активирована, чтобы обеспечить лучшую уходящую группу, чем OH —. (Мы обсудим эту активацию АТФ позже в ходе курса.) Результирующая связь между аминокислотами представляет собой амидную связь, которую биохимики называют пептидной связью. В этой реакции выделяется вода. В обратной реакции пептидная связь может расщепляться водой (гидролиз).
Когда две аминокислоты соединяются вместе, образуя амидную связь, полученная структура называется дипептидом.Точно так же у нас могут быть трипептиды, тетрапептиды и другие полипептиды. В какой-то момент, когда структура достаточно длинная, ее называют белком. Существует много разных способов представления структуры полипептида или белка, каждый из которых показывает разное количество информации.
Рисунок: Различные представления полипептида (гептапептида)
Рисунок: Аминокислоты реагируют с образованием белков
(Примечание: на рисунке выше представлена аминокислота в маловероятном состоянии протонирования с протонированной слабой кислотой и депротонированным слабым основанием для простоты демонстрации удаления воды при образовании пептидной связи и реакции гидролиза.) Белки представляют собой полимеры двадцати встречающихся в природе аминокислот. Напротив, нуклеиновые кислоты представляют собой полимеры всего из 4 различных мономерных нуклеотидов. И последовательность белка, и его общая длина отличают один белок от другого. Только для октапептида существует более 25 миллиардов различных возможных расположений аминокислот. Сравните это всего с 65536 различными олигонуклеотидами из 8 мономерных единиц (8мер). Следовательно, разнообразие возможных белков огромно.
Стереохимия
Все аминокислоты хиральные, за исключением глицина, боковая цепь которого представляет собой H.Как и в случае с липидами, биохимики используют номенклатуру L и D. Все встречающиеся в природе белки всех живых организмов состоят из L аминокислот. Абсолютная стереохимия связана с L-глицеральдегидом, как и в случае триацилглицеридов и фосфолипидов. Большинство встречающихся в природе хиральных аминокислот — это S, за исключением цистеина. Как показано на диаграмме ниже, абсолютная конфигурация аминокислот может быть показана с обозначением H, направленным назад, группами COOH, направленными влево, группой R, вправо и группой NH 3 , направленными вверх.Вы можете запомнить это с помощью анаграммы CORN.
Рисунок: Стереохимия аминокислот.
Почему биохимики до сих пор используют D и L для сахаров и аминокислот? Это объяснение (взято из приведенной ниже ссылки) кажется разумным.
«Кроме того, однако, химики часто нуждаются в однозначном определении конфигурации в отсутствие какого-либо эталонного соединения, и для этой цели идеально подходит альтернативная (R, S) система, поскольку она использует правила приоритета для определения конфигураций.Эти правила иногда приводят к абсурдным результатам, когда они применяются к биохимическим молекулам. Например, как мы видели, все распространенные аминокислоты являются L, потому что все они имеют точно такую же структуру, включая положение группы R, если мы просто запишем группу R как R. Однако не все они имеют та же конфигурация в системе (R, S): L-цистеин также является (R) -цистеином, но все остальные L-аминокислоты являются (S), но это просто отражает решение человека придать атому серы более высокий приоритет чем атом углерода, и не отражает реальной разницы в конфигурации.Более серьезные проблемы могут иногда возникать в реакциях замещения: иногда инверсия конфигурации может не привести к изменению префикса (R) или (S); а иногда сохранение конфигурации может привести к изменению префикса.
Отсюда следует, что не только консерватизм или непонимание системы (R, S) заставляет биохимиков продолжать использовать D и L: просто система DL удовлетворяет их потребности намного лучше. Как уже упоминалось, химики также используют D и L, когда они соответствуют их потребностям.Приведенное выше объяснение того, почему система (R, S) мало используется в биохимии, таким образом, почти полностью противоположно реальности. Эта система на самом деле является единственным практическим способом однозначного представления стереохимии сложных молекул с несколькими асимметричными центрами, но она неудобна для регулярных серий молекул, таких как аминокислоты и простые сахара. «
Природные α-аминокислоты
Гидролиз белков кипячением водной кислоты или основания дает набор небольших молекул, идентифицированных как α-аминокарбоновые кислоты.Выделено более двадцати таких компонентов, и наиболее распространенные из них перечислены в следующей таблице. Эти аминокислоты с названиями, окрашенными в зеленый цвет, представляют собой незаменимых диетических компонентов, поскольку они не синтезируются в процессе метаболизма человека. Лучшим источником этих питательных веществ является белок, но важно понимать, что не все белки имеют одинаковую питательную ценность. Например, арахис имеет более высокое массовое содержание белка, чем рыба или яйца, но доля незаменимых аминокислот в арахисовом белке составляет лишь треть от их двух других источников.По причинам, которые станут очевидными при обсуждении структур белков и пептидов, каждой аминокислоте присвоено одно или трехбуквенное сокращение.
Природные α-аминокислоты
Следует отметить некоторые общие черты этих аминокислот. За исключением пролина, все они являются 1º-аминами; и все они, за исключением глицина, хиральны. Конфигурации хиральных аминокислот такие же, когда они записаны в виде формулы проекции Фишера, как на рисунке справа, и это было определено Фишером как L-конфигурация .Заместитель R в этой структуре является остающимся структурным компонентом, который варьируется от одной аминокислоты к другой, а в пролине R представляет собой трехуглеродную цепь, которая соединяет азот с альфа-углеродом в пятичленном кольце. Применяя обозначение Кана-Ингольда-Прелога, все эти природные хиральные аминокислоты, за исключением цистеина, имеют конфигурацию S . Для первых семи соединений в левом столбце заместитель R представляет собой углеводород. Последние три записи в левом столбце содержат гидроксильные функциональные группы, а первые две аминокислоты в правом столбце включают тиоловые и сульфидные группы соответственно.Лизин и аргинин имеют основные аминные функции в своих боковых цепях; гистидин и триптофан имеют менее основные азотсодержащие гетероциклические кольца в качестве заместителей. Наконец, боковые цепи карбоновых кислот являются заместителями аспарагиновой и глутаминовой кислот, а последние два соединения в правом столбце являются их соответствующими амидами.
Формулы для аминокислот, приведенные выше, представляют собой простые ковалентные связи, основанные на предыдущем понимании монофункциональных аналогов. На самом деле формулы неверны .Это очевидно из сравнения физических свойств, перечисленных в следующей таблице. Все четыре соединения в таблице имеют примерно одинаковый размер, и все они обладают растворимостью в воде от умеренной до отличной. Первые две — простые карбоновые кислоты, а третья — аминоспирт. Все три соединения растворимы в органических растворителях (например, эфире) и имеют относительно низкие температуры плавления. Карбоновые кислоты имеют pK a около 4,5, а сопряженная кислота амина имеет pK a , равное 10.Последней записью идет простая аминокислота аланин. Напротив, он очень плавится (с разложением), нерастворим в органических растворителях и в миллион раз слабее кислоты, чем обычные карбоновые кислоты.
Физические свойства выбранных кислот и аминов
Соединение | Формула | Мол.Вес. | Растворимость в воде | Растворимость в эфире | Температура плавления | pK a |
|---|---|---|---|---|---|---|
| изомасляная кислота | (CH 3 ) 2 CHCO 2 H | 88 | 20 г / 100 мл | в сборе | -47 ºC | 5.0 |
| молочная кислота | CH 3 CH (OH) CO 2 H | 90 | в сборе | в сборе | 53 ºC | 3,9 |
| 3-амино-2-бутанол | CH 3 CH (NH 2 ) CH (OH) CH 3 | 89 | в сборе | в сборе | 9 ºC | 10.0 |
| аланин | CH 3 CH (NH 2 ) CO 2 H | 89 | 18 г / 100 мл | нерастворимый | ок. 300 ºC | 9,8 |
Цвиттерион
Эти различия, прежде всего, указывают на образование внутренней соли за счет переноса протона от кислой карбоксильной функции к основной аминогруппе.Полученная структура карбоксилата аммония, обычно называемая цвиттерионом , также подтверждается спектроскопическими характеристиками аланина.
| CH 3 CH (NH 2 ) CO 2 H | CH 3 CH (NH 3 ) (+) CO 2 (-) |
Как и ожидалось, исходя из его ионного характера, цвиттерион аланина является тугоплавким, нерастворимым в неполярных растворителях и имеет кислотную силу 1º-иона аммония.Примеры некоторых конкретных аминокислот также можно рассматривать в их предпочтительной нейтральной цвиттерионной форме. Обратите внимание, что в лизине аминовая функция, наиболее удаленная от карбоксильной группы, является более основной, чем у альфа-амина. Следовательно, положительно заряженный фрагмент аммония, образованный на конце цепи, притягивается к отрицательному карбоксилату, что приводит к спиральной конформации.
Структура аминокислоты позволяет ей действовать и как кислота, и как основание. Аминокислота обладает такой способностью, потому что при определенном значении pH (разном для каждой аминокислоты) почти все молекулы аминокислот существуют в виде цвиттерионов.Если к раствору, содержащему цвиттерион, добавляют кислоту, карбоксилатная группа захватывает ион водорода (H + ), и аминокислота становится положительно заряженной. Если добавлено основание, удаление иона H + из аминогруппы цвиттер-иона дает отрицательно заряженную аминокислоту. В обоих случаях аминокислота поддерживает pH системы, то есть удаляет добавленную кислоту (H + ) или основание (OH — ) из раствора.
Пример 26.1
- Изобразите структуру аниона, образующегося при реакции глицина (при нейтральном pH) с основанием.
- Изобразите структуру катиона, образующегося при реакции глицина (при нейтральном pH) с кислотой.
Решение
Основание удаляет H + из протонированной аминогруппы.
Кислота присоединяет H + к карбоксилатной группе.
Другие природные аминокислоты
Двадцать альфа-аминокислот, перечисленных выше, являются основными компонентами белков, их включение регулируется генетическим кодом.Существует много других встречающихся в природе аминокислот, и структуры некоторых из них показаны ниже. Некоторые из них, такие как гидроксилизин и гидроксипролин, представляют собой просто функционализированные производные ранее описанного соединения. Эти две аминокислоты содержатся только в коллагене, общем структурном белке. Гомосерин и гомоцистеин являются высшими гомологами своих однофамильцев. Аминогруппа в бета-аланине переместилась в конец трехуглеродной цепи. Это компонент пантотеновой кислоты, HOCH 2 C (CH 3 ) 2 CH (OH) CONHCH 2 CH 2 CO 2 H, член комплекса витамина B и важный питательное вещество.Ацетилкофермент А представляет собой пирофосфорилированное производное амида пантотеновой кислоты. Гомолог гамма-аминогруппы ГАМК является ингибитором нейротрансмиттеров и гипотензивным средством.
Многие необычные аминокислоты, включая D-энантиомеры некоторых распространенных кислот, производятся микроорганизмами. К ним относятся орнитин, который является компонентом антибиотика бацитрацина А, и статин, обнаруженный как часть пентапептида, который ингибирует действие пищеварительного фермента , пепсина .
Упражнения
Вопросы
Q26.1,1
Почему цистеин является единственной аминокислотой L с R-конфигурацией у альфа-углерода?
Q26.1.2
Изолейцин имеет два стереогенных центра.
(a) Изобразите проекцию Фишера изолейцина.
(b) Изобразите проекцию Фишера диастереомера изолейцина и обозначьте каждый стереоцентр буквой R или S.
Решения
S26.1.1
Атом серы в боковой цепи приводит к тому, что боковая цепь имеет более высокий приоритет, чем другие заместители.
S26.1.2
(а)
(б)
Авторы и авторство
аминокислот
Аминокислоты Следующий материал адаптирован из отличного Аминокислотный сайт , построенный Верой Хайнау и Буркхардом Кристе,Freien Universitat Berlin. Обратите внимание, что названия аминокислот связаны с дополнительной информацией.
Имя Сокр.Сводная структурная формула ____________________________________________________________ Аланин ala a CH 3 -CH (NH 2 ) -COOH Аргинин arg r HN = C (NH 2 ) -NH- (CH 2 ) 3 -CH (NH 2 ) -COOH Аспарагин asn n H 2 N-CO-CH 2 -CH (NH 2 ) -COOH Аспарагиновая кислота asp d HOOC-CH 2 -CH (NH 2 ) -COOH Цистеин cys c HS-CH 2 -CH (NH 2 ) -COOH Глутамин gln q H 2 N-CO- (CH 2 ) 2 -CH (NH 2 ) -COOH Глутаминовая кислота glu e HOOC- (CH 2 ) 2 -CH (NH 2 ) -COOH Глицин gly г NH 2 -CH 2 -COOH Гистидин his h NH-CH = N-CH = C-CH 2 -CH (NH 2 ) -COOH | __________ | Изолейцин ile i CH 3 -CH 2 -CH (CH 3 ) -CH (NH 2 ) -COOH Лейцин лей л (CH 3 ) 2 CH-CH 2 -CH (NH 2 ) -COOH Лизин лиз k H 2 N- (CH 2 ) 4 -CH (NH 2 ) -COOH Метионин met m CH 3 -S- (CH 2 ) 2 -CH (NH 2 ) -COOH Фенилаланин phe f Ph-CH 2 -CH (NH 2 ) -COOH Proline pro p NH- (CH 2 ) 3 -CH-COOH | _________ | Серин ser s HO-CH 2 -CH (NH 2 ) -COOH Треонин тр т CH 3 -CH (OH) -CH (NH 2 ) -COOH Триптофан trp w Ph-NH-CH = C-CH 2 -CH (NH 2 ) -COOH | ________ | Тирозин тир y p-HO-Ph-CH 2 -CH (NH 2 ) -COOH Валин val v (CH 3 ) 2 CH-CH (NH 2 ) -COOH
Структурные формулы
Быстрый прямой анализ недериватизированных аминокислот в детских смесях
- Простая одностадийная пробоподготовка для прямого анализа недериватизированных аминокислот.
- Одновременный анализ неполярных, полярных, положительно заряженных и отрицательно заряженных аминокислот за короткий 10-минутный цикл.
- Хорошо продуманный градиент отделяет загрязняющие вещества от целевых аналитов.
Чтобы обеспечить соблюдение требований к питанию, необходимы надежные аналитические методы для точного определения свободных аминокислот в смесях для младенцев. Предколоночная дериватизация с последующим обращенно-фазовым ЖХ-анализом является типичным подходом, при этом дериватизация необходима из-за отсутствия хроматографического удерживания и низкой чувствительности к свободным аминокислотам.Однако эти методы часто требуют много времени и трудозатрат. Использование перфторированных кислот в качестве ионно-парных реагентов для улучшения удерживания недериватизированных аминокислот на колонке C18 является еще одним распространенным методом, но эта практика может негативно повлиять на хроматографическую систему и масс-спектрометр.
В более простом подходе, показанном здесь, недериватизированные аминокислоты могут быть измерены напрямую — следуя одноэтапной процедуре подготовки образца — с использованием колонки Raptor Polar X в паре с детектором МС / МС.Колонки Raptor Polar X отличаются гибридным химическим составом фаз (HILIC и ионный обмен), который обеспечивает сбалансированное удерживание, необходимое для одновременного анализа широкого диапазона химических аналитов. Как было продемонстрировано, недериватизированные аминокислоты с неполярными, полярными, положительно заряженными и отрицательно заряженными боковыми цепями адекватно удерживались, а затем быстро элюировались с использованием 10-минутного градиента. Этот градиент также отделял загрязняющие вещества аминокислотной системы от целевых аналитов, повышая надежность метода.При использовании этого метода трудоемкие и трудоемкие процедуры подготовки образцов, которые могут включать в себя дорогостоящие наборы для дериватизации, заменяются простым осаждением белка и прямым анализом полученного экстракта. Прямой анализ недериватизированных аминокислот на колонке Raptor Polar X обеспечивает отличные результаты в быстром и простом рабочем процессе, что делает его выгодной альтернативой традиционным методам.
LC_FF0579| Raptor Polar X (кат.№ 9311A12) | |||||||||||||||||||||||||
| 100 мм x 2,1 мм ID | |||||||||||||||||||||||||
| 2,7 мкм | |||||||||||||||||||||||||
| 30 ° C | |||||||||||||||||||||||||
| 20:80 Вода: ацетонитрил, 0,01 9016 N HCl 9016 кислоты | |||||||||||||||||||||||||
| 5 мкл | |||||||||||||||||||||||||
| Вода, 0,5% муравьиная кислота | |||||||||||||||||||||||||
| Подвижная фаза B: 9: 1 Ацетонитрил: 20 мМ формиат аммония в воде (pH 3,0) (концентрация формиата аммония составляет 20 мМ относительно общего объема подвижной фазы B.Инструкции по разбавлению 200 мМ водного исходного раствора см. В примечаниях к приготовлению.) | |||||||||||||||||||||||||
|
| MS / MS |
| MS / MS |
| УВЭЖХ |
| Приготовление образца: Аликвоту 200 мкл формулы белкового гидролизата (Similac ALIMENTUM) смешивали с 800 мкл ацетонитрила и 10 мкл 1 н. HCl. После центрифугирования при 4000 об / мин в течение 5 минут супернатант разбавляли в 20 раз смесью 20:80 вода: ацетонитрил (0.01 N HCl) и вводили для анализа. Подвижная фаза B Приготовление: Чтобы приготовить 500 мл подвижной фазы B, отмерьте ~ 45 мл воды в небольшой химический стакан и добавьте 1 мл 10 М раствора формиата аммония. Довести pH до 3,0, добавив муравьиную кислоту, а затем довести объем до 50 мл водой. Для завершения приготовления смешайте этот 50 мл раствора формиата аммония (pH 3,0) с 450 мл ацетонитрила. |
рост и клинические параметры у поросят с ограниченным содержанием азота, которых кормили скорректированной смесью незаменимых аминокислот: влияние частично неизменных диет на основе белков | Журнал питания
Аннотация
Общие сведения
Текущие рекомендации по уровням протеина в детских смесях предназначены для обеспечения того, чтобы рост соответствовал или превышал рост детей, находящихся на грудном вскармливании, но мог обеспечить избыток аминокислот (АК).Недавние исследования младенцев с использованием смесей на основе АК поддерживают особую корректировку состава незаменимых аминокислот (EAA), что позволяет потенциально снизить уровень общего белка. Используя комбинацию интактного белка и свободных EAA, мы разработали формулу, которая отвечает этим скорректированным требованиям EAA для младенцев.
Цель
Наша цель заключалась в том, чтобы проверить, безопасна ли эта скорректированная формула и поддерживает ли она рост на модели поросят с ограниченным содержанием белка, а также показывает ли она лучший рост, чем изонитрогенная формула на основе свободных АК.
Методы
Доношенных поросят (Ландрас × Йоркшир × Дюрок, n = 72) скармливали 1 из 4 изоэнергетических смесей, содержащих 70% интактного белка и 30% смеси ЕАА или полный контроль на основе АК в течение 20 дней: стандартная формула (ST-100), ST-100 с 25% снижением белкового азота (ST-75), ST-75 с скорректированным составом EAA (O-75) или диета как O-75, приведенная как полная Диета на основе АК (O-75AA).
Результаты
После начального периода адаптации свиньи ST-75 и O-75 показали схожую скорость роста, обе ниже, чем свиньи ST-100 (∼25 по сравнению с 31 г · кг –1 · d –1 , соответственно).Свиньи O-75AA показали дальнейшее снижение скорости роста (15 г · кг –1 · сут –1 ) и доли жира (как P <0,05 по сравнению с O-75).
Выводы
Формула, частично основанная на интактном белке, превосходит формулу на основе АК в этой экспериментальной обстановке. Снижение на 25%, но скорректированное с учетом ЕАА, частично интактной смеси на основе протеина привело к аналогичному увеличению веса с сопутствующим повышенным катаболизмом АА по сравнению со стандартной смесью с пониженным содержанием алкоголя на 25% у искусственно выращенных поросят с ограниченным содержанием белка.Дальнейшие исследования должны выяснить, повлияют ли и как конкретные корректировки ЕАА, позволяющие снизить уровень общего белка, на рост и развитие состава тела у детей, вскармливаемых смесями.
Введение
Оптимальное питание в раннем возрасте, включая адекватное потребление белка, важно для поддержания нормального роста и развития. Грудное молоко считается оптимальным питанием на протяжении всего грудного возраста, но когда материнское молоко недоступно или плохо переносится, детская смесь может обеспечить адекватное питание.Поскольку детские смеси основаны на коровьем молоке и растительных пищевых источниках, качество и биодоступность питательных веществ, включая белок, могут существенно отличаться от грудного молока. Например, для удовлетворения потребностей младенцев в белке и незаменимых аминокислотах (EAA), а также для компенсации различий в качестве и биодоступности белка, детские смеси традиционно содержат уровни белка, превышающие уровни, обнаруженные в грудном молоке (1). Однако избыточное потребление белка связано с быстрым набором веса в младенчестве и с повышенным риском избыточного веса и метаболического синдрома в более позднем возрасте, что стимулирует попытки снизить уровень белка в детских смесях (2, 3).Текущая рекомендация по аминокислотному составу (АК) в смесях основана на анализе содержания АК и состава грудного молока (1). Однако серия исследований стабильных изотопов для оценки требований к ЕАА для роста здоровых доношенных детей в течение первого месяца жизни (4–9) предполагает, что профиль ЕАА стандартных смесей может быть дополнительно улучшен. Смесь для кормления с измененным профилем ЕАА потенциально позволяет снизить дневное потребление азота без ущерба для роста и развития.Недавно мы проверили эту гипотезу на молодых поросятах раннего отъема на диете с ограничением белка (10). Этих поросят кормили смесью, скорректированной на ЕАА, полностью основанной на свободных АК, при которой общая азотная нагрузка была снижена на 20%. Оптимизация состава EAA показала улучшенное использование белка с точки зрения увеличения массы тела на грамм поступления белка, снижение окисления AA и снижение уровня мочевины в плазме. Смеси, полностью основанные на свободных аминокислотах, показаны для детей с тяжелой аллергией на коровье молоко.Все согласны с тем, что такие формулы безопасны и поддерживают здоровье кишечника и нормальный рост тела (11–13). Однако энтеральное питание свободных АК приводит к снижению доступности АК в рационе для синтеза белка из-за первичного окисления АК в кишечнике (14-17). Следовательно, корректировки состава EAA в смеси, предназначенной для использования у здоровых, неаллергенных младенцев, необходимо будет протестировать в условиях, когда фракция азота, по крайней мере частично, основана на интактном белке. Важно знать, поддерживает ли такой скорректированный состав EAA нормальный рост и развитие и не приводит ли к неблагоприятным метаболическим эффектам.
В настоящем исследовании мы поэтому протестировали смесь, которая содержала 70% интактного белка и только 30% добавленных ЕАА, скорректированных в соответствии с исследованиями требований ЕАА у младенцев (4–8). Мы предположили, что эта скорректированная формула EAA будет поддерживать адекватный рост искусственно выращенных поросят с ограниченным ростом по сравнению с формулой, содержащей нескорректированный профиль EAA. Поскольку общий уровень белка и / или АК в тестируемых рационах был ограничен и адаптирован к потребностям младенца, мы ожидали субмаксимального роста у поросят.Наконец, мы сравнили эти частично интактные формулы на основе протеина с формулами, полностью основанными на АА, которые использовались в Lykke et al. (10), чтобы проверить, может ли формула, частично основанная на интактных белках, поддерживать лучший рост, здоровье кишечника и клинические параметры, чем изонитрогенная формула, основанная на свободных АК в этой экспериментальной парадигме.
Методы
Животные и жилище
Семьдесят два трехдневных поросенка (40 кобелей и 32 суки, Ландрас × Большой Белый × Дюрок) из 6 пометов были извлечены из свиноматок и отправлены в экспериментальную базу.По прибытии всех поросят взвешивали, вводили подкожно 1 мл декстрана железа (Hyofer 20%; Salfarm) и им присваивали идентификационный номер. Первоначально поросят размещали в группах по 3–5 однопометников, пока все поросята не научились пить молоко из открытой кормушки. Этот навык был приобретен в течение 12–24 часов, после чего их поместили в отдельные клетки. Все клетки были оборудованы нагревательной лампой, зоной отдыха, материалом для укоренения и доступом неограниченного количества воды из соска.
В течение начального периода в 4 дня после прибытия всем свиньям был предоставлен жидкий заменитель молока на основе сухого коровьего цельного молока (∼200 мл · кг –1 · d –1 , растворимый корм Arla 26%; Arla Группа пищевых ингредиентов P / S).После этого периода адаптации каждую свинью распределили на 1 из 4 диетических групп, как описано ниже. Критериями распределения были масса тела на момент прибытия, пол и помет происхождения. Эта стратегия распределения обеспечивала равное представительство полов и пометов, а также схожую среднюю массу тела среди групп с самого начала. Все 4 группы были размещены в одной комнате. Рацион скармливали в течение 20 дней. Суточный рацион для каждого поросенка составлял 200 мл · кг –1 · сут –1 , кормление было 9 приемов пищи каждые 2 часа с 08:00 до 24:00.Ежедневное потребление и любые остатки регистрировались для каждого поросенка. В течение периода адаптации (дни 1-11) все поросята получали два 3-х дневных курса лечения антибиотиками, то есть дни 2-4 и 9-10 (геноцин, 5 мг на поросенка перорально; Scanvet) и день 11 (Байтрил, 10 мг. на поросенка внутримышечно; Bayer Animal Health GmbH). Три поросенка (по одному в 3 из 4 групп) были умерщвлены до окончания исследования из-за постоянной диареи и потери веса и исключены из исследования.
Экспериментальные диеты
Четыре изоэнергетических экспериментальных молочных смеси были разработаны и произведены Nutricia Research (Утрехт).Уровни энергии, содержание макроэлементов и источники протеина для каждой формулы показаны в таблице 1. Источником азота была комбинация интактного протеина и добавленных определенных свободных EAA или полностью свободных AA. Все формулы были разработаны так, чтобы ограничивать белок для поросят, чтобы обеспечить высокую чувствительность к корректировкам, внесенным в профиль ЕАА, и к общему количеству белка. Были созданы четыре диетические группы, которые получали либо стандартное потребление белка 9,4 г · кг –1 · день –1 (ST-100, n = 19), либо сниженное на 25% потребление белка, соответствующее 7.0 г · кг –1 · d –1 либо стандартного профиля EAA (ST-75, n = 19), либо оптимально настроенного профиля EAA (O-75, n = 19). Стандартная диета (ST-100) была разработана таким образом, чтобы концентрация EAA была на уровне или выше, чем в стандартной диете по Lykke et al. (10). Обоснование снижения потребления белка на 25% было основано на ожидании того, что этого будет достаточно, чтобы увидеть четкую разницу по сравнению со свиньями, получавшими нормальный уровень белка. Наконец, одна группа получила сокращенный, но оптимально скорректированный профиль EAA, полностью состоящий из свободных AA (O-75AA, n = 15).
ТАБЛИЦА 1Содержание макронутриентов в экспериментальных изоэнергетических рационах 1
| . | СТ-100 . | СТ-75 . | О-75 . | О-75АА . |
|---|---|---|---|---|
| Энергия, ккал / 100 мл | 116 | 115 | 115 | 115 |
| Белок, г / 100 мл | 4.7 | 3,5 | 3,5 | 3,5 |
| Доля свободных АК,% | 30 | 30 | 30 | 100 |
| Углеводы, г / 100 мл | 90412,3 | 12,3 | ||
| Жир, г / 100 мл | 5,5 | 5,8 | 5,8 | 5,8 |
| . | СТ-100 . | СТ-75 . | О-75 . | О-75АА . | ||||
|---|---|---|---|---|---|---|---|---|
| Энергия, ккал / 100 мл | 116 | 115 | 115 | 115 | ||||
| Белок, г / 100 мл | 4,7 | 3,5 | 3,5 | 3,5 | Доля свободных АК,%30 | 30 | 30 | 100 |
| Углеводы, г / 100 мл | 12.0 | 12,3 | 12,3 | 12,3 | ||||
| Жир, г / 100 мл | 5,5 | 5,8 | 5,8 | 5,8 |
Макронутриент
Содержание диэтилового веществав эксперименте
| . | СТ-100 . | СТ-75 . | О-75 . | О-75АА . | ||||
|---|---|---|---|---|---|---|---|---|
| Энергия, ккал / 100 мл | 116 | 115 | 115 | 115 | ||||
| Белок, г / 100 мл | 4,7 | 3,5 | 3,5 | 3,5 | Доля свободных АА,%30 | 30 | 30 | 100 |
| Углеводы, г / 100 мл | 12,0 | 12,3 | 12,3 | 12,3 | ||||
| 5.5 | 5,8 | 5,8 | 5,8 |
| . | СТ-100 . | СТ-75 . | О-75 . | О-75АА . |
|---|---|---|---|---|
| Энергия, ккал / 100 мл | 116 | 115 | 115 | 115 |
| Белок, г / 100 мл | 4,7 | 3.5 | 3,5 | 3,5 |
| Доля свободных АК,% | 30 | 30 | 30 | 100 |
| Углеводы, г / 100 мл | 12,016 12,3 | 12,016 12,3 | 904 12,3||
| Жир, г / 100 мл | 5,5 | 5,8 | 5,8 | 5,8 |
Рост, клиническая оценка и состав тела
Поросят взвешивали каждый второй день и корректировали потребление корма в соответствии с массой тела.Также проводилась ежедневная оценка клинического состояния, тургора кожи и кала. Оценка кала основывалась на консистенции фекалий, наблюдаемых в домашней клетке (1 — твердый; 2 — пастообразный; 3 — кремообразный; 4 — водянистый). Оценка> 2 считалась диареей. На 19-й день состав тела каждого поросенка определяли с помощью двухэнергетической рентгеновской абсорбциометрии (сканер Lunar Prodigy, GE Healthcare). Перед сканированием поросят обезболивали внутримышечной инъекцией (0,1 мл / кг) с комбинацией золазепам / тилетамин (Золетил 50 мг / мл; Virbac), ксилазин (Narcoxyl 20 мг / мл; MSD Animal Health), кетамин (Ketaminol 100 мг / мл; MSD Animal Health) и буторфанол (Torbugesic 10 мг / мл; ScanVet).Сканирование проводилось на поросятах в положении лежа в вентральном положении.
Убийство и сбор тканей
На 20-й день поросят анестезировали, как описано выше, и отбирали образцы крови путем внутрисердечной пункции для определения клинического биохимического профиля и анализа аминокислот в плазме перед умерщвлением поросят пентобарбитоном натрия. Почки, кишечник, желудок, печень, селезенку, легкие и сердце вырезали и взвешивали. Для каждого поросенка один набор образцов из проксимальной части (т.е.е., 100 см дистальнее привратника) и дистальную часть (т. е. 100 см проксимальнее илеоцекального перехода) тонкой кишки вместе с образцами печени были взяты для гистологии и сохранены в 4% забуференном параформальдегиде. Другой набор из тех же мест был мгновенно заморожен в жидком азоте для последующего анализа. Все экспериментальные работы на животных в этом исследовании были одобрены Датской инспекцией экспериментов на животных (лицензия № 2009 / 561-1731).
Биохимия сыворотки и концентрация АК в плазме
Профиль биохимии сыворотки, включая альбумин, общий белок, щелочную фосфатазу (ALP), аланинаминотрансферазу (ALAT), аспаргинаминотрансферазу (ASAT), общий билирубин, холестерин, креатинин, креатинкиназу, железо, фосфат, азот мочевины BUN , γ-глутамилтрансфераза (GGT), кальций, магний, натрий и калий были получены с использованием химической системы Advia 1800 (Siemens Healthcare Diagnostics).Анализы на глюкозу, лактат, гематокрит и бикарбонат проводили на цельной крови, стабилизированной гепарином (GEM premier 3000). Анализ АК плазмы выполняли обращенно-фазовой ВЭЖХ производных фенилизотиоцината АК плазмы (Waters Pico-Tag).
Ферменты и гистология щеточной каймы кишечника
Чтобы задокументировать любое возможное влияние диеты на функцию слизистой оболочки кишечника, мы измерили активность пищеварительных ферментов кишечника. Быстро замороженные образцы тонкой кишки гомогенизировали и анализировали на активность дисахаридазы (лактазы, мальтазы и сахаразы) и пептидазы [аминопептидазы A (ApA), аминопептидазы N (ApN) и дипептидилпептидазы IV (DPP IV)], как ранее. описано (18).Для измерения высоты ворсинок и глубины крипт фиксированные параформальдегидом образцы тонкой кишки заключали в парафин, делали срезы (5 мкм), помещали на предметные стекла и окрашивали гематоксилином и эозином. Для каждого образца по меньшей мере 10 репрезентативных хорошо ориентированных крипт и ворсинок измеряли с помощью светового микроскопа Olympus BX45 с цифровой микроскопической камерой Olympus UC30 (Olympus America Inc) и программного обеспечения Aperio ImageScope версии 11.2 (Leica Microsystems GmbH).
Статистический анализ
Данные о весе были проанализированы с помощью модели повторных измерений с гауссовой структурой пространственной корреляции, включая соотношение диета × время и корректировка для пола, помета, поросенка и раунда эксперимента.Эффекты диеты оценивали с использованием тестов хи-квадрат отношения максимального правдоподобия для сравнения каждой диеты, а затем диеты сравнивали с использованием апостериорных тестов t ; P Значения <0,05 считались значимыми. Результаты по весу, эффективности роста, составу тела, весу органов, биохимии крови, активности кишечных ферментов и гистологическим измерениям были проанализированы с помощью линейных смешанных моделей, включая диету как фиксированную переменную и случайные эффекты для помета и раунда.Затем рационы сравнивали с использованием апостериорных тестов t со скорректированными значениями вероятности Тьюки-Крамера. Все данные были проверены на нормальное распределение, и для достижения нормальности было выполнено логарифмическое преобразование для нескольких переменных. Для всех статистических анализов использовался SAS Enterprise Guide 5.1 (SAS Institute Inc).
Результаты
Клинические наблюдения и рост
Эпизоды диареи и отсутствия аппетита наблюдались на протяжении всего периода вмешательства, особенно в период адаптации с 1 по 11 день.В течение этого периода наблюдалась высокая частота диареи (ST-100, 24%; ST-75, 33%; O-75, 21%; O-75AA, 49%), и во всех группах наблюдалась низкая прибавка в весе. После второго курса лечения антибиотиками (9-11 дни) частота диареи снизилась во всех группах (ST-100, 3%; ST-75, 8%; O-75, 3%; O-75AA, 6%) и наблюдалась более высокая скорость роста. Во время фазы адаптации (рис. 1A) поросята O-75 показали рост, сравнимый с поросятами ST-100, и численно выше, чем поросята ST-75, что привело к незначительному разнице в весе на 11-й день, т.е.е., начало периода оценки роста. Результаты роста были впоследствии проанализированы между 11 и 20 днями (фаза роста; Рисунок 1B). Группа ST-100, получавшая стандартную белковую смесь, имела значительно более высокую скорость роста, чем группа ST-75, получавшая стандартную, но с пониженным содержанием общего белка. Сопоставимый рост наблюдался между группой ST-75 и группой O-75, получавших формулу с поправкой на EAA (рис. 1B). Группа O-75AA, получавшая скорректированную, но свободную формулу на основе АК, показала самый низкий рост на протяжении фазы адаптации, а также периода фазы роста (рис. 1A, B).
РИСУНОК 1
Прирост веса с 1 по 11 день (фаза адаптации) (A) и с 11 по 20 день (фаза роста) (B) у свиней, получавших стандартный или скорректированный аминокислотный профиль. ST-100 ( n = 19), ST-75 ( n = 18), O-75 ( n = 18), O-75AA ( n = 14). Эффективность роста в фазе роста для каждой формулы рассчитывалась как грамм прироста массы тела на грамм пищевого белка (C). Значения представляют собой средние значения ± SEM, и группы без общей буквы значительно различаются ( P <0.001). O-75, группа интервенционной диеты с оптимально подобранным аминокислотным составом на уровне 75% от стандартного количества; O-75AA, группа интервенционной диеты с оптимально скорректированным профилем свободных аминокислот на уровне 75% от стандартного количества; СТ-100, группа стандартной диеты с обычным аминокислотным составом; ST-75, группа стандартной диеты с 75% стандартного белка.
РИСУНОК 1
Прирост массы с 1 по 11 день (фаза адаптации) (A) и с 11 по 20 день (фаза роста) (B) у свиней, получавших стандартный или скорректированный аминокислотный профиль.ST-100 ( n = 19), ST-75 ( n = 18), O-75 ( n = 18), O-75AA ( n = 14). Эффективность роста в фазе роста для каждой формулы рассчитывалась как грамм прироста массы тела на грамм пищевого белка (C). Значения представляют собой средние значения ± SEM, и группы без общей буквы значительно различаются ( P <0,001). O-75, группа интервенционной диеты с оптимально подобранным аминокислотным составом на уровне 75% от стандартного количества; O-75AA, группа интервенционной диеты с оптимально скорректированным профилем свободных аминокислот на уровне 75% от стандартного количества; СТ-100, группа стандартной диеты с обычным аминокислотным составом; ST-75, группа стандартной диеты с 75% стандартного белка.
Относительный дневной привес (г · кг -1 · день -1 ) в группе ST-100 имел тенденцию быть выше, чем у свиней ST-75 (+ 17,2%, P = 0,06, Таблица 2), тогда как эффективность роста (выраженная в граммах прибавки в весе на грамм потребления белка с пищей) не различалась между ST-100, ST-75 и O-75 (рис. 1C). Группа O-75AA показала значительно меньшую прибавку в весе и эффективность роста по сравнению со всеми другими группами. Зарегистрированное потребление белка было немного ниже целевого потребления во всех группах [ST-100: 8.4 по сравнению с 9,4 г белка · кг массы тела (МТ) –1 · d –1 ; ST-75, O-75 и O-75AA: 6,2–6,4 по сравнению с 7,0 г белка на кг массы тела –1 · день –1 ].
ТАБЛИЦА 2Масса тела на 1-й, 11-й и 20-й день, состав тела и относительная масса органов на 20-й день у поросят, получавших различные уровни и состав аминокислот и белка 1
| . | СТ-100 ( n = 19) . | СТ-75 ( н = 18) . | О-75 ( n = 18) . | О-75АА ( n = 14) . | ||
|---|---|---|---|---|---|---|
| BW, кг | ||||||
| сутки 1 | 2,48 ± 0,11 | 2,45 ± 0,12 | 2,55 ± 0,10 | 2,40 ± 0,14 | ||
| 900 0,11 | 900 0,11 | 9002,76 ± 0,14 ab | 3.00 ± 0,14 a | 2,50 ± 0,17 b | ||
| день 20 | 3,96 ± 0,20 a | 3,60 ± 0,18 a | 3,85 ± 0,18 a | a | 2,94 ± 0,29 b | |
| Прирост массы, 2 г / сут | 107 ± 8,48 a | 84,1 ± 6,99 b | 84,4 ± 6,99 b | 44,0 ± 8,97 c | Относительная прибавка в весе, 2 г · кг -1 · д -1 | 31.0 ± 1,43 a | 26,5 ± 1,50 ab | 24,7 ± 1,64 b | 14,8 ± 2,27 c |
| Масса жира,% от BW | 11.9 ± 0,44 | 11,7 ± 0,72 а13,5 ± 0,65 а | 8,08 ± 1,10 б | |||
| Масса без жира,% от МТ | 86,5 ± 0,43 б | 86,6 ± 0,72 б | 86,6 ± 0,72 б | 84.9 ± 0,64 b | 90,3 ± 1,07 a | |
| Минеральная плотность костной ткани,% от BW | 1,54 ± 0,02 b | 1,63 ± 0,03 a | 1,62 ± 0,03 ab | 1,59 ± 0,04 ab | ||
| Сердце, г / кг массы тела | 6,78 ± 0,16 ab | 7,12 ± 0,19 a | 6,57 ± 0,14 b | 6,71 ± 0,12 ab | ||
| Легкое, 3 г / кг массы тела | 13.3 ± 0,32 | 12,9 ± 0,40 | 12,8 ± 0,35 | 14,1 ± 0,83 | ||
| Печень, 3 г / кг МТ | 34,4 ± 0,79 ab | 32,4 ± 0,63 | 370058 90,3 ± 0,83 a | 36,4 ± 1,61 a | | ||
| Селезенка, г / кг массы тела | 3,91 ± 0,22 | 3,70 ± 0,26 | 3,41 ± 0,18 | 3,36 ± 0,33 | ||
| 6.32 ± 0,20 | 6,61 ± 0,19 | 6,63 ± 0,20 | 6,94 ± 0,29 | |||
| Желудок, г / кг МТ | 7,51 ± 0,21 | 7,86 ± 0,26 | 7164 | 7164 ± 0,24 | ||
| Кишечник, г / кг массы тела | 52,8 ± 1,39 ab | 49,4 ± 1,38 bc | 46,5 ± 0,83 c | 56,4 ± 1,31 a | ||
| a | ||||||
| / кг BW | 21.3 ± 0,64 б | 21,2 ± 0,61 б | 20,1 ± 0,91 б | 28,0 ± 1,30 а | ||
| . | СТ-100 ( n = 19) . | СТ-75 ( н = 18) . | О-75 ( n = 18) . | О-75АА ( n = 14) . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| BW, кг | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| сут 1 | 2.48 ± 0,11 | 2,45 ± 0,12 | 2,55 ± 0,10 | 2,40 ± 0,14 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| сутки 11 | 2,89 ± 0,14 a | 2,76 ± 0,14 ab | 3,00163 | 4 a 2,50 ± 0,17 b||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| день 20 | 3,96 ± 0,20 a | 3,60 ± 0,18 a | 3,85 ± 0,18 a | 2,94 ± 0,25 b | 107 ± 8.48 a | 84,1 ± 6,99 b | 84,4 ± 6,99 b | 44,0 ± 8,97 c | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Относительный прирост массы, 2 г · кг –1 · d — 1 | 31,0 ± 1,43 a | 26,5 ± 1,50 ab | 24,7 ± 1,64 b | 14,8 ± 2,27 c | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Масса жира,% от BW | 11,9 ± 0,4 а | 11.7 ± 0,72 a | 13,5 ± 0,65 a | 8,08 ± 1,10 b | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Масса без жира,% от BW | 86,5 ± 0,43 b | 86,6 ± 0,72 b | b84,9 ± 0,64 b | 90,3 ± 1,07 a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Минеральная плотность костной ткани,% от BW | 1,54 ± 0,02 b | 1,63 ± 0,03 a | 1,62 ± 0,03 ab | 1.59 ± 0,04 ab | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сердце, г / кг массы тела | 6,78 ± 0,16 ab | 7,12 ± 0,19 a | 6,57 ± 0,14 b | 6,71 ± 0,12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Легкое, 3 г / кг BW | 13,3 ± 0,32 | 12,9 ± 0,40 | 12,8 ± 0,35 | 14,1 ± 0,83 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Печень, 3 г / кг BW | 900 34,4 ab | 32.4 ± 0,63 б | 37,3 ± 0,83 а | 36,4 ± 1,61 а | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Селезенка, г / кг МТ | 3,91 ± 0,22 | 3,70 ± 0,26 | 3,41 ± 0,18 | 3,41 ± 0,18 ± 0,33 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Почка, г / кг массы тела | 6,32 ± 0,20 | 6,61 ± 0,19 | 6,63 ± 0,20 | 6,94 ± 0,29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Желудок, г / кг массы тела | ± 0,26 | 7.64 ± 0,24 | 8,02 ± 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кишечник, г / кг массы тела | 52,8 ± 1,39 ab | 49,4 ± 1,38 до н.э. | 46,5 ± 0,83 c | 56,4 ± 1,31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Двоеточие, 3 г / кг массы тела | 21,3 ± 0,64 b | 21,2 ± 0,61 b | 20,1 ± 0,91 b | 28,0 ± 1,30 a | 2 Масса тела на 1-й, 11-й и 20-й день, состав тела и относительная масса органов на 20-й день у поросят, получавших различные уровни и состав аминокислот и белка 1
Состав тела и масса органовГруппы ST-100, ST-75 и O-75 имели схожий состав жира и безжировой массы, а также плотность костей, тогда как группа O-75AA имела более низкий процент жира в организме (и, следовательно, относительно более высокая доля обезжиренной массы) по сравнению со всеми другими группами (Таблица 2).Что касается веса внутренних органов (относительно веса тела, таблица 2), вес печени был немного повышен в группе O-75, а вес сердца уменьшился по сравнению со свиньями ST-75. Группа O-75AA показала более высокий относительный вес кишечника и толстой кишки по сравнению с группой O-75 (+ 21% и + 39%, соответственно, P <0,05). Биохимия кровиДанные клинической биохимии (таблица 3) показали, что снижение поступления белка на 25% заметно не повлияло на химический состав крови, хотя альбумин был немного ниже, а ALAT был выше в группе ST-75, чем в группе ST-100 (обе P <0.05). По сравнению с ST-75 группа O-75 показала заметно более высокие значения азота мочевины крови (+ 124%), более низкие уровни альбумина, кальция и глюкозы и умеренно повышенные уровни общего билирубина, ASAT, BASP и холестерина (+ 10–50). %, все P <0,05). Для свиней O-75AA значения белка, альбумина и гематокрита были выше, а уровни ALP, ALAT, креатинина, фосфора и натрия были снижены по сравнению со значениями у свиней O-75. ТАБЛИЦА 3Значения клинической биохимии, измеренные в плазме на 20-й день у поросят, которых кормили различными уровнями и составом аминокислот и белка 1
Значения клинической биохимии, измеренные в плазме на 20-й день у поросят, которых кормили различными уровнями и составом аминокислот и белков 1
Наибольшие групповые различия уровней АК в плазме наблюдались для концентраций ВСАА и треонина (рис. 2А). Снижение потребления белка на 25% не оказало заметного влияния на уровни АК в плазме (за исключением умеренного снижения аргинина и изолейцина у свиней ST-75 по сравнению со свиньями ST-100). В группе O-75 уровни изолейцина и валина были заметно увеличены (> 200% по сравнению с ST-75), а треонин в плазме был почти истощен (<10% значений в ST-75; все P <0.05). Кроме того, наблюдалось умеренное повышение уровней аргинина и гистидина и снижение уровней лейцина по сравнению с ST-75 (все P <0,05). В группе O-75AA уровни треонина и лейцина были умеренно выше, а уровни изолейцина, метионина и триптофана ниже, чем у свиней O-75 (все P <0,05, рис. 2A). РИСУНОК 2 Уровни незаменимых АК в плазме на 20-й день (А) у свиней, получавших стандартные или скорректированные профили АК.ST-100 ( n = 19), ST-75 ( n = 18), O-75 ( n = 18), O-75AA ( n = 14). Значения представляют собой средние значения + SEM, и группы без общей буквы значительно различаются ( P <0,05). Профиль АК в экспериментальных диетах указан на панели B. AA, аминокислота; O-75, группа интервенционной диеты с оптимально подобранным аминокислотным составом на уровне 75% от стандартного количества; O-75AA, группа интервенционной диеты с оптимально скорректированным профилем свободных аминокислот на уровне 75% от стандартного количества; СТ-100, группа стандартной диеты с обычным аминокислотным составом; ST-75, группа стандартной диеты с 75% стандартного белка. РИСУНОК 2 Уровни незаменимых АК в плазме на 20-й день (А) у свиней, получавших стандартные или скорректированные профили АК. ST-100 ( n = 19), ST-75 ( n = 18), O-75 ( n = 18), O-75AA ( n = 14). Значения представляют собой средние значения + SEM, и группы без общей буквы значительно различаются ( P <0,05). Профиль АК в экспериментальных диетах указан на панели B. AA, аминокислота; O-75, группа интервенционной диеты с оптимально подобранным аминокислотным составом на уровне 75% от стандартного количества; O-75AA, группа интервенционной диеты с оптимально скорректированным профилем свободных аминокислот на уровне 75% от стандартного количества; СТ-100, группа стандартной диеты с обычным аминокислотным составом; ST-75, группа стандартной диеты с 75% стандартного белка. Активность кишечных пищеварительных ферментов не различалась ни в одной области между группами ST-100 и ST-75, а также между группами ST-75 и O-75. Однако для O-75AA активность DPP IV и лактазы в проксимальном отделе тонкой кишки была ниже (–31% и –48%, соответственно, P <0,05, рис. 3) по сравнению с O-75. Аналогичным образом, наблюдалась тенденция к снижению активности сахарозы, ApA и ApN для O-75AA по сравнению с O-75 в проксимальном отделе кишечника ( P = 0,06–0,10, рис. 3), тогда как в дистальном отделе кишечника было больше. активность сахарозы у свиней O-75AA выше, чем у свиней O-75 (4.6 ± 0,5 по сравнению с 2,2 ± 0,3 Ед / г, P <0,05). Для высоты ворсинок и глубины крипт, измеренных в проксимальном отделе кишечника, различий между 4 группами вмешательства не наблюдалось. РИСУНОК 3 Активность пищеварительных ферментов в проксимальном отделе кишечника на 20-й день у свиней, получавших стандартный или скорректированный аминокислотный профиль. ST-100 ( n = 19), ST-75 ( n = 18), O-75 ( n = 18), O-75AA ( n = 14). Значения представляют собой средние значения + SEM, и группы без общей буквы значительно различаются ( P <0.05). ApA, аминопептидаза A; ApN, аминопептидаза N; DPP IV, дипептидилпептидаза IV; O-75, группа интервенционной диеты с оптимально подобранным аминокислотным составом на уровне 75% от стандартного количества; O-75AA, группа интервенционной диеты с оптимально скорректированным профилем свободных аминокислот на уровне 75% от стандартного количества; СТ-100, группа стандартной диеты с обычным аминокислотным составом; ST-75, группа стандартной диеты с 75% стандартного белка. РИСУНОК 3 Активность пищеварительных ферментов в проксимальном отделе кишечника на 20-й день у свиней, получавших стандартный или скорректированный аминокислотный профиль.ST-100 ( n = 19), ST-75 ( n = 18), O-75 ( n = 18), O-75AA ( n = 14). Значения представляют собой средние значения + SEM, и группы без общей буквы значительно различаются ( P <0,05). ApA, аминопептидаза A; ApN, аминопептидаза N; DPP IV, дипептидилпептидаза IV; O-75, группа интервенционной диеты с оптимально подобранным аминокислотным составом на уровне 75% от стандартного количества; O-75AA, группа интервенционной диеты с оптимально скорректированным профилем свободных аминокислот на уровне 75% от стандартного количества; СТ-100, группа стандартной диеты с обычным аминокислотным составом; ST-75, группа стандартной диеты с 75% стандартного белка. ОбсуждениеИспользуя модель искусственно выращенных поросят с ограниченным содержанием белка, мы проверили, приведет ли новая детская смесь с поправкой на ЕАА с пониженным общим содержанием белка к росту, развитию органов и клинической биохимии, сравнимым со стандартной смесью. Мы сравнили формулу с поправкой на EAA, частично основанную на бесплатных AA, с формулой, полностью основанной на бесплатных AA. Диеты с скорректированным ЕАА и с контрольной формулой вызывали аналогичный рост тела, но скорректированный состав ЕАА был связан с изменениями, указывающими на усиление катаболизма АА (например,g., повышенный вес печени, уровень мочевины в крови и печеночных ферментов, а также более низкий уровень альбумина). Поросята, получавшие формулу с поправкой на АК, полностью основанную на свободных АК, показали заметно более медленный рост, что подтверждает мнение о важности не только общего состава АК, но и формы, в которой поступают АК (интактный белок или свободные АК). Физиологические условия искусственно выращенных поросят, отлученных от груди в раннем возрасте, могут не отражать метаболические условия растущих младенцев. Требования EAA для роста зависят от вида и стадии развития.Следовательно, наши результаты должны быть подтверждены исследованиями на младенцах, чтобы проверить рост, полученный с помощью диеты с поправкой на AA, по сравнению со стандартной диетой. Свиньи ранее использовались в качестве подходящих моделей питания для изучения развития младенцев на основании их сходства с людьми с точки зрения пищеварения и метаболизма (19–23). У свиней более высокие показатели АК и прироста мышечной ткани из-за более высокой скорости их роста по сравнению с младенцами. Однако высокая скорость роста поросят делает их чувствительной моделью для выявления влияния различий в потреблении АК на рост мышечной ткани в течение короткого периода времени (1-2 недели), как в текущем исследовании.Очевидно, что 25% -ное снижение содержания белка в детской смеси уменьшило рост поросят, подтверждая, что поступление белка ограничивало рост в данных экспериментальных условиях. Действительно, коровье молоко содержит 5–6% белка и ~ 147 ккал / 100 мл (24) по сравнению с 3,5–4,7% белка и 115 ккал / 100 мл в наших диетических смесях. Соответственно, скорость роста свиноматок и подсосных поросят достигает 180–240 граммов в день (24), тогда как мы обнаружили только 107 граммов в день при стандартном рационе (ST-100), около 84 граммов в день. в группах с пониженным содержанием протеина (ST-75, O-75) и только 44 грамма в день у поросят на основе полной AA (O-75AA).Потребление белка было снижено по сравнению с уровнями, вызывающими максимальный рост у поросят, чтобы повысить чувствительность к корректировкам в составе EAA. Относительно низкие темпы роста отчасти можно объяснить плохой адаптацией к новым диетам, возможно, из-за плохого вкусового восприятия и степени пищеварительного и метаболического стресса. Тем не менее, в данных экспериментальных условиях диета с поправкой на ЕАА не изменила эффективность роста (то есть O-75 по сравнению с ST-75), подтверждая предыдущие результаты этой модели с диетами, полностью основанными на АК (10). Данные биохимии крови показывают, что корректировка АК привела к более высокому катаболизму АК. Повышенный уровень мочевины в крови может указывать на более высокую долю дезаминированных аминокислот в печени. Более высокие уровни BCAA, изолейцина и валина в плазме в группе O-75 указывают на то, что эти АК могли способствовать этому. И наоборот, низкие уровни треонина в плазме в ответ на новую детскую смесь с поправкой на АА позволяют предположить, что свиньям в этом возрасте требуется более высокая потребность в треонине, чем та, которая содержится в рационе.Тем не менее, изменения уровней АК в плазме являются лишь ориентировочными, и необходимы подробные исследования окисления АК с мечеными АК для изучения вклада отдельных АК в общее окисление субстрата при различных уровнях потребления белка. Более высокий вес печени и уровни некоторых маркеров функции печени (билирубина, холестерина, ASAT и ALP) также подтверждают мнение о том, что АК в формуле O-75 не были идеально сбалансированы для поддержки использования белка у поросят. Измененная функция печени может приводить к снижению синтеза печеночного альбумина и продукции глюкозы и может частично объяснять наблюдаемое снижение уровня альбумина и глюкозы в плазме.Хотя все эти различия были статистически значимыми, важно отметить, что различия были относительно небольшими и оставались в пределах нормального эталонного диапазона для здоровых поросят (25). Основываясь на результатах роста, наши результаты подтвердили, что формулы с интактными белками превосходят формулы на основе свободных АК. Использование формулы 70% интактного белка в настоящей формуле увеличило относительную прибавку в весе до ~ 26 г · кг (–1 · сут –1 ) для групп O-75 и ST-75, что предполагает более низкую конверсию пищи. соотношение кормовых смесей на основе АК для роста поросят.Наблюдаемая ограниченная прибавка в весе в группе O-75AA (15 г · кг -1 · день -1 ) хорошо соответствовала таковой в нашем предыдущем исследовании, в котором использовались только диеты на основе АК (10). Некоторые исследования также указывают на более медленный рост младенцев в ответ на экстенсивно гидролизованные смеси по сравнению с обычными смесями на основе коровьего молока (11, 26, 27). Смеси на основе АК используются для облегчения симптомов аллергии (коровье молоко) и для поддержки роста детей грудного возраста, которые не переносят полимерные смеси (13).Предполагается, что АК легче всасываются из верхних отделов желудочно-кишечного тракта (28, 29), но имеются ограниченные данные о росте и пищеварении у здоровых младенцев, не страдающих тяжелой аллергией на коровье молоко. Свободные АК, добавленные в смеси, легко усваиваются тканями кишечника, и большая часть этих свободных АК может окисляться в слизистой оболочке по сравнению с АК, полученными из интактного белка (~ 20%) (14-17). При кормлении грудных детей смесями на основе АК это обычно компенсируется увеличением общего количества азота на ~ 20%.Следовательно, поскольку общее количество азота было одинаковым для формул O-75 и O-75AA, повышенное внутреннее окисление АК может объяснить, по крайней мере, часть снижения скорости роста, наблюдаемого у поросят O-75AA. Однако относительный прирост и эффективность протеина снизились примерно на 40% в группе O-75AA (по сравнению с O-75), предполагая, что помимо усиленного окисления АК слизистой оболочки наблюдаемые различия могли способствовать и другим факторам. Повышенный относительный вес кишечника и толстой кишки в O-75AA действительно предполагает повышенный синтез белка слизистой оболочки после приема формулы на основе АК.Предыдущие исследования показали, что на метаболическую судьбу отдельных АК в кишечнике влияет форма, в которой они попадают в организм (например, белок, пептиды, свободные АК), и что АК по-разному используются для синтеза белков кишечника или организма или для окисления ( 15, 17, 30). Предпочтительная потеря АК может также зависеть от способности внутренних тканей впитывать каждую АК (31), и способность поглощения могла быть превышена для определенных АК в группе O-75AA. Некоторые специфические АК или их метаболиты могли быть ограничивающими скорость в текущих условиях экспериментов с ограничением белка и способствовали более низкой скорости роста у поросят O-75AA.Треонин, уровни которого были низкими в группах O-75 и O-75AA, имеет особенно высокую скорость использования в кишечнике (30, 32, 33) и более высокую скорость роста в O-75, чем в O-75AA. свиньи могли приводить к более высокому использованию треонина в кишечнике, тем самым истощая системный пул треонина. Интересно отметить, что исследования требований к EAA у младенцев показали, что контрольная точка треонина была близка к текущим требованиям, основанным на анализе состава грудного молока, но что уровни треонина в стандартных смесях для младенцев почти вдвое выше и, таким образом, могут быть существенно снижены (9 ). По сравнению с полимерными формулами, элементарные рационы снижают рост поросят без заметного воздействия на рост или функцию кишечника (22). Снижение активности кишечных ферментов обычно наблюдается в связи с воспалением кишечника с повреждением эпителия слизистой оболочки или без него (34–36). Снижение ферментативной активности в нашем исследовании у поросят O-75AA может быть следствием повышенного обновления клеток незрелыми энтероцитами, которые не полностью дифференцировались для экспрессии максимальной активности фермента (36, 37).Мы обнаружили снижение активности лактазы и DPP IV в группе O-75AA, но без какой-либо явной атрофии ворсинок или увеличения глубины крипт. Низкая активность лактазы была связана с более высокой пролиферацией кишечных клеток и синтезом белка у поросят, получавших элементарную диету (22), что подтверждает гипотезу о том, что диета на основе АК для группы O-75AA привела к увеличению клеточного обмена в желудочно-кишечном тракте и росту тканей (кишечник , толстая кишка), возможно, за счет роста тела. Таким образом, поросята, получавшие молочную смесь с скорректированным диетическим составом ЕАА, основанные на исследованиях окисления АК у младенцев (4–8), имели рост и метаболизм, аналогичные тем, которые получали поросята, получавшие изоназотный рацион, без корректировки состава АК.Частично интактная белковая формула с поправкой на ЕАА увеличивала катаболизм АА, что свидетельствует о субмаксимальном использовании белка в данных экспериментальных условиях. Результаты подтверждают, что у поросят с ограниченным содержанием белка, формулы, частично основанные на интактном белке, превосходят формулы на основе АК. Текущие исследования на младенцах на искусственном вскармливании изучают безопасность и адекватность смеси с поправкой на ЕАА, содержащей более низкие уровни общего белка, для поддержки адекватного роста и развития оптимального состава тела. БлагодарностиОбязанности авторов — PSW, DGB и TT: провели исследование; EMvdB, MA-B и BJMvdH: предоставлены экспериментальные диеты; PSW: проанализировал данные; TT: нес основную ответственность за окончательное содержание; и все авторы: разработали исследование, написали статью, прочитали и утвердили окончательную рукопись. БанкнотыПри поддержке Седьмой рамочной программы Европейского Союза (FP7 / 2007-2013), проект Early Nutrition в рамках грантового соглашения 289346.Совместная финансовая поддержка была получена от Nutricia Research и Advanced Grant Европейского исследовательского совета META-GROWTH (ERC-2012-AdG 322605). Информация об авторах: MA-B, EMvdB и BJMvdH являются сотрудниками Nutricia Research; JBvG имеет два патента на скорректированный состав рациона, использованный в этом исследовании, является директором Национального банка человеческого молока в Нидерландах и получил несколько грантов, гонораров и консультационных услуг за лекции, спонсируемые компаниями по производству детских смесей. PSW, PTS, BK, DGB и TT, конфликта интересов нет. Сокращения:
Ссылки1.Потребность в белках и аминокислотах в питании человека .Представитель World Health Organ Tech Rep Ser 2007 ;1 —265 .2.Koletzko B ,von Kries R ,Closa R ,Escribano J ,Scaglioni S ,000 Mini Gi ,Demmelmair H ,Anton B ,Gruszfeld D et al.Может ли выбор кормления младенцев влиять на дальнейший риск ожирения? Am J Clin Nutr 2009 ;89 :1502 —8 .3.Монтейро PO ,Victora CG .Быстрый рост в младенчестве и детстве и ожирение в более позднем возрасте — систематический обзор .Obes Rev 2005 ;6 :143 —54 .4.de Groof F ,Huang L ,van Vliet I ,Voortman GJ ,Schierbeek H ,0003 000 Roksnoer ,Chen C ,Huang Y ,van Goudoever JB .Потребность в аминокислотах с разветвленной цепью для доношенных новорожденных, получающих энтеральное питание в первый месяц жизни .Am J Clin Nutr 2014 ;99 :62 —70 .5.de Groof F ,Huang L ,Twisk JW ,Voortman GJ ,Joemai W ,000 Hau 000000 Hau000 ,Chen C ,Huang Y ,van Goudoever JB .Новые взгляды на методологические вопросы метода окисления индикаторных аминокислот у недоношенных новорожденных .Pediatr Res 2013 ;73 :679 —84 .6.Huang L ,Hogewind-Schoonenboom JE ,de Groof F ,Twisk JW ,Voortman GJ , Voortman GJ H ,Boehm G ,Huang Y ,Chen C et al.Потребность в лизине доношенных детей на энтеральном вскармливании в первый месяц жизни .Am J Clin Nutr 2011 ;94 :1496 —503 .7.Huang L ,Hogewind-Schoonenboom JE ,van Dongen MJ ,de Groof F ,Voortman 000 GJ2000 GJ2000 GJ2000 GJ2000 JW ,Vermes A ,Chen C ,Huang Y et al.Потребность доношенного ребенка в метионине в первый месяц жизни в присутствии цистеина .Am J Clin Nutr 2012 ;95 :1048 —54 .8.Huang L ,Hogewind-Schoonenboom JE ,Zhu L ,Kraaijenga JV ,van Haren NP 00030002 NP H,Twisk JW ,Huang Y ,Chen Y et al.Потребность в триптофане доношенных детей, получающих энтеральное питание в первый месяц жизни .J Педиатр Гастроэнтерол Нутр 2014 ;59 :374 —9 .9.Hogewind-Schoonenboom JE ,Huang L ,de Groof F ,Zhu L ,Voortman GJ GJ , VoortmanGJ , A,Chen C ,Huang Y ,van Goudoever JB .Потребность в треонине доношенных детей, получающих энтеральное питание в первый месяц жизни .J Педиатр Гастроэнтерол Нутр 2015 ;61 :373 —9 . 10.Lykke M ,Sangild PT ,van Goudoever JB ,van Harskamp D ,Schierbeek 000 H000,000 Koletzko 000 000 Koletz3, 000 EM ,Abrahamse-Berkeveld M ,van de Heijning BJM ,Stoll B et al.Ростовые и клинические параметры у поросят с ограниченным содержанием азота, получавших скорректированную смесь незаменимых аминокислот: эффекты при использовании рационов на основе свободных аминокислот .J Nutr () .11.Borschel MW ,Ziegler EE ,Wedig RT ,Oliver JS .Рост здоровых доношенных детей, получавших детскую смесь на основе экстенсивно гидролизованного казеина или свободных аминокислот: рандомизированное двойное слепое контролируемое исследование .Clin Pediatr (Phila) 2013 ;52 :910 —7 .12.Isolauri E ,Sutas Y ,Makinen-Kiljunen S ,Oja SS ,Isosomppi R ma.Эффективность и безопасность гидролизованного коровьего молока и смесей на основе аминокислот для младенцев с аллергией на коровье молоко .J Pediatr 1995 ;127 :550 —7 .13.Американская академия педиатрии. Комитет по питанию .Гипоаллергенные смеси для младенцев .Педиатрия 2000 ;106 :346 —9 . 14.Daenzer M ,Petzke KJ ,Bequette BJ ,Metges CC .Метаболизм азота и внутренних аминокислот в организме крыс различается у крыс, получавших смешанный рацион, содержащий казеин или соответствующую ему смесь аминокислот .J Nutr 2001 ;131 :1965 —72 .15.Metges CC ,El-Khoury AE ,Selvaraj AB ,Tsay RH ,Atkinson MMA 000 000 Regan ,Янг VR .Кинетика L- [1- (13) C] лейцина при приеме внутрь со свободными аминокислотами, немеченым или внутренне меченным казеином .Am J Physiol Endocrinol Metab 2000 ;278 :1000 —9 . 16.Rerat A ,Nunes CS ,Mendy F ,Roger L .Всасывание аминокислот и выработка гормонов поджелудочной железы у свиней без анестезии после дуоденальных инфузий ферментативного гидролизата молока или свободных аминокислот .Br J Nutr 1988 ;60 :121 —36 .17.Riedijk MA ,van Goudoever JB .Спланхнический метаболизм проглоченных аминокислот у новорожденных .Curr Opin Clin Nutr Metab Care 2007 ;10 :58 —62 . 18.Li Y ,Ostergaard MV ,Jiang P ,Chatterton DE ,Thymann T ,000000Kvistgaard 9000 AS Kvistgaard 9000 Обработка сывороточного протеина влияет на созревание кишечника недоношенных свиней, вызванное смесью .J Nutr 2013 ;143 :1934 —42 . 19.Sangild PT ,Thymann T ,Schmidt M ,Stoll B ,Burrin DG , BuddingtonПриглашенный обзор: недоношенная свинья как модель в детской гастроэнтерологии .J Anim Sci 2013 ;91 :4713 —29 .20.Moughan PJ ,Birtles MJ ,Cranwell PD ,Smith WC ,Pedraza M .Поросенок как модельное животное для изучения аспектов пищеварения и абсорбции у грудных детей, вскармливаемых молоком .World Rev Nutr Diet 1992 ;67 :40 —113 .21.Stoll B ,Puiman PJ ,Cui L ,Chang X ,Benight NM ,Bauchart ,Bauchart-Thevmann B ,Holst JJ ,Burrin DG .Непрерывное парентеральное и энтеральное питание вызывает метаболическую дисфункцию у новорожденных свиней .JPEN J Parenter Enteral Nutr 2012 ;36 :538 —50 .22.Stoll B ,Цена PT ,Reeds PJ ,Chang X ,Henry JF ,van Goudoever van Goudoever van Goudoever JJ,Burrin DG .Кормление элементарной диетой вместо молочной смеси не снижает рост слизистой оболочки кишечника у молодых свиней .JPEN J Parenter Enteral Nutr 2006 ;30 :32 —9 .23.Elango R ,Ball RO ,Pencharz PB .Последние достижения в определении потребности человека в белках и аминокислотах .Br J Nutr 2012 ;108 :22 —30 .24.Hansen AV ,Strathe AB ,Kebreab E ,Франция J ,Theil PK .Прогнозирование надоев и состава молока у кормящих свиноматок: байесовский подход .J Anim Sci 2012 ;90 :2285 —98 . 25.Egeli AK ,Framstad T ,Morberg H .Клиническая биохимия, гематология и масса тела у поросят .Acta Vet Scand 1998 ;39 :381 —93 .26.Burks W ,Jones SM ,Berseth CL ,Harris C ,Sampson HA ,DM DM Гипоаллергенность и влияние на рост и толерантность новой формулы на основе аминокислот с докозагексаеновой кислотой и арахидоновой кислотой .J Pediatr 2008 ;153 :266 —71 .27.Mennella JA ,Ventura AK ,Beauchamp GK .Характер дифференцированного роста среди здоровых младенцев, получавших протеиновый гидролизат или смеси коровьего молока .Педиатрия 2011 ;127 :110 —8 . 28.Gropper SS ,Gropper DM ,Acosta PB .Аминокислотный ответ плазмы на прием L-аминокислот и цельного белка .J Pediatr Gastroenterol Nutr 1993 ;16 :143 —50 . 29.Gilbert ER ,Wong EA ,Webb KE Jr.Обзор, приглашенный Советом: абсорбция и использование пептидов: значение для питания и здоровья животных .J Anim Sci 2008 ;86 :2135 —55 .30.van der Schoor SR ,Wattimena DL ,Huijmans J ,Vermes A ,van Goudoever JB .Кишечник принимает почти все: кинетика треонина у младенцев .Am J Clin Nutr 2007 ;86 :1132 —8 .31.Gaudichon C ,Bos C ,Morens C ,Petzke KJ ,Mariotti F , Everwand000 R Dare S ,Tome D ,Metges CC .Незначительные потери азота и аминокислот у человека и их значение для оценки потребности в аминокислотах .Гастроэнтерология 2002 ;123 :50 —9 .32.Stoll B ,Henry J ,Reeds PJ ,Yu H ,Jahoor F ,Burrin DG Катаболизм определяет метаболизм незаменимых аминокислот в кишечнике первого прохождения у поросят, получавших молочный белок .J Nutr 1998 ;128 :606 —14 . 33.Schaart MW ,Schierbeek H ,van der Schoor SR ,Stoll B ,Burrin DG 0003, 000 Reeds 000000 Reeds 000 Reeds 000 Reeds 000 JB .Использование треонина в кишечнике поросят высокое .J Nutr 2005 ;135 :765 —70 .34.Lebenthal E ,Lee PC .Активность глюкоамилазы и дисахаридазы у здоровых субъектов и у пациентов с повреждением слизистой оболочки тонкой кишки .J Pediatr 1980 ;97 :389 —93 .35.Гупта SK ,Чонг SK ,Fitzgerald JF .Активность дисахаридазы у детей: нормальные значения и сравнение на основе симптомов и гистологических изменений .J Pediatr Gastroenterol Nutr 1999 ;28 :246 —51 .36.Hampson DJ ,Kidder DE .Влияние ползучего кормления и отъема на активность ферментов щеточной каймы в тонком кишечнике поросят .Res Vet Sci 1986 ;40 :24 —31 .37.Hedemann MS ,Hojsgaard S ,Jensen BB .Морфология тонкого кишечника и активность кишечных пептидаз у поросят в период отъема .J Anim Physiol Anim Nutr 2003 ;87 :32 —41 .© Американское общество питания, 2018 г. Формула на основе аминокислот — обзорКормление смесьюКак обсуждалось ранее, текущая рекомендация для младенцев с риском развития аллергических заболеваний — исключительно грудное вскармливание в течение первых 4–6 месяцев жизни (Friedman and Zeiger, 2005).Младенцы в группе риска определяются как младенцы, у которых есть хотя бы один родственник первой степени родства (родитель или брат или сестра) с атопическим состоянием. Было показано, что у детей, находящихся в группе риска, но не находящихся на исключительно грудном вскармливании в течение первых 4–6 месяцев жизни, определенные гидролизованные смеси более эффективны по сравнению с обычными смесями на основе коровьего молока (Alexander and Cabana, 2010). В продаже имеются следующие смеси: Составы на основе обычного коровьего молока (CM) : Обычные смеси для детского питания на основе коровьего молока содержат интактные белки коровьего молока и большие пептиды.Белок коровьего молока — один из самых распространенных пищевых аллергенов в младенчестве. Формулы частичного гидролизата сыворотки (pHF-W) : Частично гидролизованные смеси на основе сыворотки не считаются «гипоаллергенными», поскольку они содержат большие пептиды, способные вызывать аллергические реакции. Термин «гипоаллергенный» в Северной Америке зарезервирован для терапевтических формул, а не для формул, предназначенных для снижения риска атопического заболевания. Источником белка является сывороточный компонент коровьего молока, который расщепляется на большие пептиды. Смеси на основе высокогидролизованного казеина или сыворотки (eHF-C или eHF-W) : Эти смеси подвергаются интенсивному гидролизу или ультрафильтрации и содержат только небольшие пептиды, которые переносятся большинством детей (> 90%) с аллергией на коровье молоко. Составы с высокой степенью гидролиза обычно считаются гипоаллергенными и подходят для лечения атопического заболевания. Составы на основе соевого белка не содержат коровье молоко, но содержат соевые белки. Формулы на основе аминокислот являются наиболее близкими к неаллергенным, поскольку они не содержат пептидов, которые могут распознаваться В- или Т-клетками.Они рекомендуются детям с тяжелыми аллергическими заболеваниями и предшествующими реакциями на сильно гидролизованные смеси. Недостатком формул на основе аминокислот является их дороговизна и горький вкус. Формулы на основе аминокислот не изучались для предотвращения аллергии. Конкретные смеси и их влияние на профилактику аллергии у младенцев из группы риска изучались в рандомизированных контролируемых клинических испытаниях. Было проведено множество исследований по сравнению использования формул HF и CM.Также были опубликованы метаанализы, обобщающие доказательства. Крупнейшее исследование гидролизованных детских смесей на аллергию — это большое рандомизированное двойное слепое исследование, начатое в конце 1990-х годов, в котором сравнивались три гидролизованных смеси, которые различались по источнику белка (казеин или сыворотка) и степени гидролиза (частично или широко) с коровьим молоком. составы на основе смесей в течение первых четырех месяцев в отношении воздействия на аллергические проявления и атопический дерматит (исследование GINI). Он показал значительную пользу использования частично гидролизованной сыворотки и формул экстенсивно гидролизованного казеина для профилактики атопического дерматита в возрасте до 15 лет (Laubereau et al., 2004; Brockow et al., 2009; фон Берг и др., 2008; фон Берг и др., 2013). Согласно последнему 15-летнему анализу, частично гидролизованная сыворотка также значительно снизила распространенность аллергического ринита, в то время как смесь с экстенсивным гидролизом казеина также значительно снизила совокупную заболеваемость и распространенность аллергического ринита и распространенности астмы (von Berg et al., 2016). 15-летний анализ был первой временной точкой, показавшей различия в респираторных исходах, и должен быть подтвержден в будущих исследованиях.Исследователи из исследования GINI пришли к выводу, что у детей из группы высокого риска раннее вмешательство с использованием различных гидролизованных смесей оказывает различное профилактическое воздействие на астму, аллергический ринит и экзему вплоть до подросткового возраста. Результаты в отношении респираторных аллергий следует интерпретировать с осторожностью, пока они не будут подтверждены в будущих исследованиях. Ни одна из формул не влияла на сенсибилизацию IgE. Эффективность HF в профилактике пищевой аллергии была подтверждена Кокрановским обзором (Osborn and Sinn, 2006) и метаанализом (Szajewska and Horvath, 2010), включая исследования с участием пациентов, основанные на самооценке пищевой аллергии.Один метаанализ, включавший только исследования, в которых использовалось строгое определение пищевой аллергии, подтвержденной пищевым заражением, не подтвердил преимущества использования HF по сравнению с CM в профилактике пищевой аллергии (Schoetzau et al., 2001). Эти исследования различаются по дизайну и методологии. Эффективность eHF по сравнению с pHF в профилактике аллергии, астмы и пищевой аллергии у младенцев изучалась тремя группами, использующими частично гидролизованный сывороточный протеин / казеин и широко гидролизованный казеиновый состав (Oldaeus et al., 1997), частично гидролизованная формула сыворотки, экстенсивно гидролизованная сыворотка или экстенсивно гидролизованная казеиновая формула (Halken et al., 2000) и частично и экстенсивно гидролизованная формула сыворотки (Nentwich et al., 2001), но объединенные доказательства двух из этих исследований не дали результатов. чтобы показать преимущество использования одного над другим (Schoetzau et al., 2001). Не было обнаружено никакой роли использования соевых смесей вместо грудного молока или других смесей в профилактике аллергических заболеваний (Osborn and Sinn, 2004). Таблица структуры аминокислот — GenScriptАминокислоты составляют основу пептидов и белков.Все аминокислоты содержат как амино, так и карбоновые кислоты, а в некоторых случаях и боковые цепи. Свойства аминокислот определяются функциональными заместителями, связанными с боковыми цепями, которые чаще всего называют группами R. В приведенной здесь таблице аминокислот мы описываем 20 стандартных остатков, встречающихся в природе, а также универсальные генетические коды. Надежный пептидный сервис Новое обновление в GenScript готово для ускорения ваших исследований! Или вы можете связаться с пептидом @ genscript.com для любой технической поддержки.
Надежный пептидный сервис Новое обновление в GenScript готово для ускорения ваших исследований! Или вы можете связаться с [email protected] для получения любой технической поддержки. белковбелков Белки :Белки представляют собой сложную молекулу, состоящую из аминокислот и необходимых для химических процессов, происходящих в живых организмах. Белки являются основными составляющими всех живых организмов. Их центральная роль в биологических структурах и функционировании была признана химиками в начале 19 века, когда они придумали название для эти вещества от греческого слова proteios, что означает «сначала удерживать место ». Белки составляют около 80 процентов от сухой массы мышцы, 70 процентов кожи и 90 процентов крови. Внутреннее вещество растительных клеток также частично состоит из белки. Важность белков больше связана с их функции, чем их количество в организме или ткани.Все известные ферменты, например, являются белками и могут появиться в очень короткие сроки. суммы; тем не менее, эти вещества катализируют все метаболические реакции, позволяющие организмам накапливать химические вещества — другие белки, нуклеиновые кислоты, углеводы и липиды — необходимые для жизни. Белки иногда называют макромолекулярными полипептидами. потому что они очень большие молекулы и потому что аминокислоты которые они состоят, соединены пептидными связями. (Пептидная связь представляет собой связь между аминогруппой [-Nh3] одной аминокислоты и карбоксильная группа [-COOH] следующей аминокислоты в белковой цепи.) Хотя аминокислоты могут иметь другие формулы, в протеине неизменно имеют общую формулу RCH (Nh3) COOH, где C — углерод, H — водород, N — азот, O — кислород, R — группа, варьирующаяся по составу и структуре, называется боковой цепью. Аминокислоты соединены вместе в длинные цепочки; большинство обычных белков содержат более 100 аминокислот. Подавляющее большинство белков, обнаруженных в живых организмах, являются состоит всего из 20 различных видов аминокислот, повторяющихся многими раз и соединены в определенном порядке.Каждый тип протеина имеет свою уникальную последовательность аминокислот; эта последовательность, известная как его первичная структура фактически определяет форму и функцию белок. Взаимодействие между аминокислотами заставляет белковую цепь принимать характерная вторичная структура и, при некоторых обстоятельствах, третичная структура. Вторичная структура является функцией углы, образованные пептидными связями, которые связывают амино кислоты. Эти валентные углы удерживаются на месте за счет развития водородные связи между атомом водорода, связанным с азотом одной амино кислотная единица и атом кислорода другого.Обычно водород связи заставляют цепь принимать спиральную вторичную структуру, т. е. остов цепи напоминает веревку, спирально намотанную на воображаемая трубка. Третичная структура относится к петлеобразованию и складыванию белковая цепочка обратно на себя. Такая структура характеризует глобулярные белки (т.е. имеющие более или менее сферическую форму). Третичная структура в значительной степени определяется боковыми цепями аминокислоты. Некоторые боковые цепи настолько велики, что нарушают регулярная спиральная вторичная структура цепи, обуславливающая ее перегибы и изгибы.Кроме того, боковые цепи, несущие противоположные электрические заряды притягиваются друг к другу и образуют ионные связи; те с одинаковыми электрическими зарядами отталкиваются друг от друга. Гидрофобная сторона цепочки, то есть нерастворимые в воде, объединяются в центр свернутого белка, избегая воздействия водной среда. Гидрофильные боковые цепи, которые легко образуют водород связи с молекулами воды, остаются снаружи белка состав. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||