Задача для обсуждения 2.2. О последствиях для функционирования белка
Определена часть последовательности кодирующей цепи ДНК (состоит из 36 триплетов):
…ГАА ЦАА ГАГ ТАЦ ААТ ААА ЦАГ ГАА ЦАТ ТАЦ ГАА ГАГ ЦАГ ААГ ГАА ЦАА ГАГ ТАЦ ГАТ ААА ЦАГ ГАА ЦАТ ТАЦ ГАА ГАГ ЦАГ ААГ АГА ТТА ТГА ГТТ АГГ ТТГ ТГГ ГТЦ…
Воспользовавшись таблицей генетического кода, установите последовательность аминокислот в закодированном участке, и, по строению радикалов аминокислот, постарайтесь определить гидрофобные или гидрофильные свойства проявляет этот участок полипептида?
Исходя из строения, предположите, что из функций больше подходит для такого белка: внутриклеточный белок (например, фермент) или трансмембранный белок (например, рецептор)?
Какие последствия для функционирования белка будут иметь:
1) потеря нуклеотидов № 13, 14, 15
2) замена нуклеотида № 18 на «Г»
3) потеря нуклеотида № 29
4) замена нуклеотида № 14 на «Т»
Генетический код (иРНК)
Первое основание | Второе основание | Третье основание | |||
| У | Ц | А | Г |
|
У | Фен Фен Лей Лей | Сер Сер Сер Сер | Тир Тир — — | Цис Цис — Три | У Ц А Г |
Ц | Лей Лей Лей Лей | Про Про Про Про | Гис Гис Глн Глн | Арг Арг Арг Арг | У Ц А Г |
А | Иле Иле Иле Мет | Тре Тре Тре Тре | Асн Асн Лиз Лиз | Сер Сер Арг Арг | У Ц А Г |
Г | Вал Вал Вал Вал | Ала Ала Ала Ала | Асп Асп Глу Глу | Гли Гли Гли Гли | |
изолейцин — это.
 .. Что такое изолейцин?
.. Что такое изолейцин?изолейцин — изолейцин … Орфографический словарь-справочник
Изолейцин — Изолейцин … Википедия
ИЗОЛЕЙЦИН — Ch4Ch3CH(Ch4)CH(Nh3)COOH, алифатическая аминокислота. Входит в состав всех природных белков. Незаменимая аминокислота … Большой Энциклопедический словарь
ИЗОЛЕЙЦИН — (СН3СН2СН(Ch4)CH(Nh3)COOH). Одна из основных АМИНОКИСЛОТ, входящих в белок … Научно-технический энциклопедический словарь
изолейцин — сущ., кол во синонимов: 1 • аминокислота (36) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
изолейцин — СН3СН2СН(СН3)СН(Nh3)СООН, алифатическая аминокислота. Входит в состав всех природных белков. Незаменимая аминокислота. * * * ИЗОЛЕЙЦИН ИЗОЛЕЙЦИН, Ch4Ch3CH(Ch4)CH(Nh3)COOH, алифатическая аминокислота. Входит в состав всех природных белков.… … Энциклопедический словарь
изолейцин — isoleucine [Ile] изолейцин [иле]. Hезаменимая аминокислота, входящая в состав практически всех природных белков; кодоны АУУ, АУЦ, АУА. h3N CH(COOH) CH(Ch4) Ch3 Ch4 (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А.,… … Молекулярная биология и генетика. Толковый словарь.
Hезаменимая аминокислота, входящая в состав практически всех природных белков; кодоны АУУ, АУЦ, АУА. h3N CH(COOH) CH(Ch4) Ch3 Ch4 (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А.,… … Молекулярная биология и генетика. Толковый словарь.
изолейцин — izoleucinas statusas T sritis chemija formulė CH₃CH₂CH(CH₃)CH(NH₂)COOH santrumpa( os) Ile, I atitikmenys: angl. isoleucine rus. изолейцин ryšiai: sinonimas – 2 amino 3 metilpentano rūgštis … Chemijos terminų aiškinamasis žodynas
изолейцин — ( амино метил н валериановая кислота, незаменимая аминокислота, входящая в состав большинства белков; участвует в энергетическом обмене; при недостаточности ферментов, катализирующих декарбоксилирование И., возникает кетоацидурия … Большой медицинский словарь
Изолейцин — α амино β метилвалериановая кислота, C2H5CH(Ch4)CH(Nh3)COOH, аминокислота (См. Аминокислоты), открытая Ф.
ИЗОЛЕЙЦИН — (2 амино 3 метилпентановая к та, 2 амино 3 метилвалериановая к та, Ilе, I) Ch4Ch3CH(Ch4)CH(Nh3)COOH, мол. м. 131,17; бесцв. кристаллы (физ. св ва см. в табл.). Молекула содержит два асимметрич. атома С в положениях 2 и 3, что обусловливает… … Химическая энциклопедия
Изолейцин | Химия онлайн
Изолейцин — незаменимая аминокислота, которую необходимо вводить с пищей. Изолейцин содержится в белках в незначительном количестве.
Изолейцин – одна из трех разветвленных аминокислот, названных так за специфическое строение молекулы.
Изолейцин относится к числу гидрофобных аминокислот, т.к. обладает углеводородной боковой цепью, характерной особенностью которой является ее хиральность (другой такой аминокислотой является треонин).
Изолейцин относится к неполярным гидрофобным аминокислотам.
По строению соединений, получающихся при расщеплении углеродной цепи протеиногенных аминокислот, различают глюкопластичные (глюкогенные) и кетопластичные (кетогенные) аминокислоты. Изолейцин является глюкопластичным и кетопластичным.
Изолейцин — 2-амино-3-метилпентановая или α-амино-β-метилвалериановая кислота.
Изолейцин (Иле, Ile, I) — алифатическая α-аминокислота с химической формулой HO2CCH (NH2) CH (CH3) CH2CH3.
Изолейцин обнаружен Ф. Эрлихом в 1904 году в продуктах распада белка фибрина. Впервые был получен синтетическим путем в 1905 году.
Суточная потребность организма в изолейцине 3-4 грамма.
Физические свойстваИзолейцин – бесцветный кристаллический порошок. Изолейцин хорошо растворяется в воде, горячей уксусной кислоте и водных растворах щелочей, плохо растворяется в этаноле, не растворяется в диэтиловом эфире.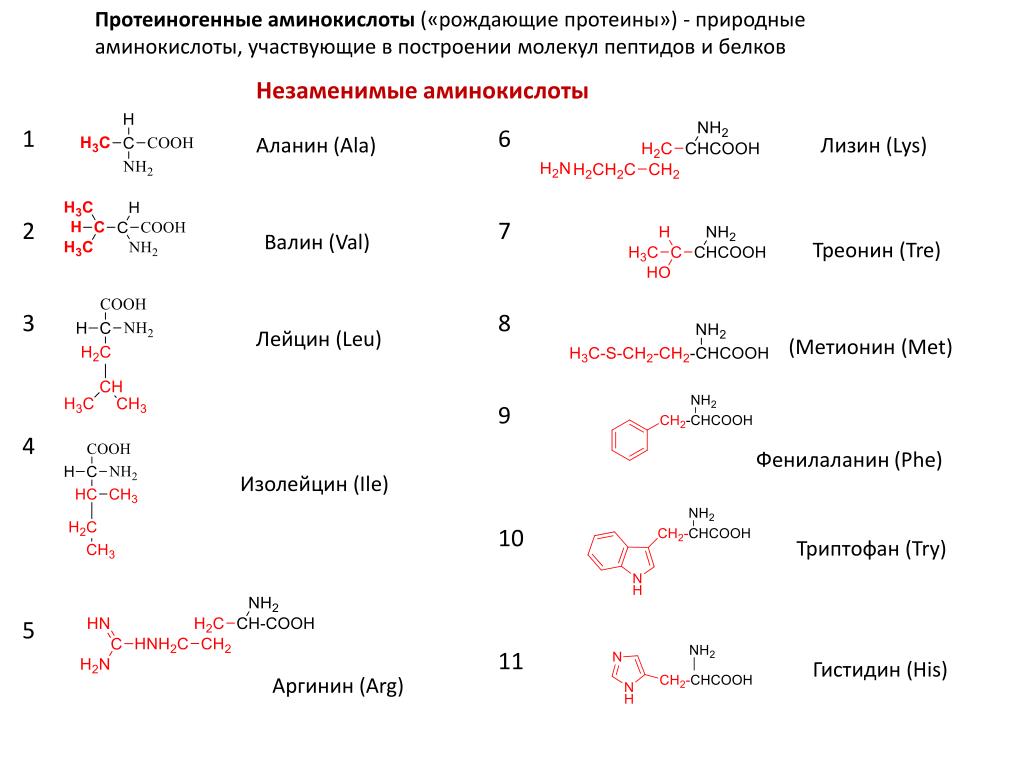 Температура плавления 2860С (с разл.).
Температура плавления 2860С (с разл.).
Снижает вес за счет уменьшения аппетита и ускорения метаболизма. Увеличивает физическую и психическую выносливость человека.
Обеспечивает мышечные ткани энергией. Содействует протеканию биохимических процессов, при которых вырабатывается энергия. Предотвращает чувство беспокойства, тревоги, страха.
Снижает излишнюю потливость. Предотвращает повышеник уровня инсулина в крови. Стабилизирует уровень сахара в крови и процессы энергообеспечения.
Способствует восстановлению мышечной ткани. Эффективен при лечении болезни Паркинсона. Играет ключевую роль в выработке гемоглобина.
Метаболизм изолейцина происходит в мышечной ткани.
Биологическая рольИзолейцин, как и все другие соединения, относящиеся к аминокислотам, участвует в создании белковых молекул.
Изолейцин благодаря своей разветвленной структуре участвует в энергетическом обмене, протекающем в организме.
Изолейцин способствует быстрейшему заживлению тканей, регулирует уровень глюкозы и холестерина в крови, позволяет мышцам восстанавливаться после физических нагрузок.
Изолейцин является обязательным участником энергетического обмена. Эта аминокислота – источник энергии для клеток мышц.
А также предотвращать перепроизводство серотонина в мозгу за счет ограничения доступности триптофана.
Изолейцин необходим при многих психических заболеваниях.
Изолейцин необходим для синтеза гемоглобина.
Изолейцин очень нужен спортсменам — BCAA (валин, лейцин и изолейцин), так как увеличивает выносливость и способствует восстановлению мышечной ткани.
Достаточное количество этой аминокислоты в организме обеспечивает нормальный набор мышечной массы и эффективную работу иммунной системы, предотвращает ткани организма от разрушения, обогащает мышцы и головной мозг необходимыми энергетическими ресурсами.
Природные источникиИзолейцин содержится в лактальбумине (белок молочной сыворотки), казеине, мясных белках, белке яиц, белке лесного ореха.
Большое количество изолейцина содержится в молоке и молочных продуктах (особенно в твердых сырах, твороге, брынзе), в морепродуктах (рыба, красная и черная икра). Изолейцин содержится в мясе и птице.
Из пищи растительного происхождения более богаты изолейцином соевые бобы, семена тыквы, подсолнечника, чечевицы, фасоли, а также орехи (кешью, миндаль), злаки. В небольших количествах изолейцин присутствует также в крупах и в макаронах. Примеры пищевых источников: миндаль, кешью, куриное мясо, турецкий горох, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, соевые белки.
Дефицит изолейцина выражается в потере мышечной массы. Так как он играет значительную роль в получении энергии за счет расщепления гликогена мышц, недостаток изолейцина также приводит к проявлению гипогликемии (понижения уровня сахара в крови), выражающейся вялостью и сонливостью.
Области примененияПрименение ВССА (лейцина, валина, изолейцина)
Напряженные тренировки влекут за собой износ и разрушение части сократительных белков. Дополнительно потребляя ВСАА (лейцина, валина,изолейцина), спортсмены быстрее восстанавливаются после тяжелого тренинга.
Дополнительно потребляя ВСАА (лейцина, валина,изолейцина), спортсмены быстрее восстанавливаются после тяжелого тренинга.
Мышечное утомление наступает из-за истощения запасов мышечного гликогена. По мере того, как эти запасы тают, печень начинает извлекать ВСАА из кровотока и направляет их к тренируемым мышцам, чтобы поддержать их энергетические потребности. Чем выше интенсивность тренировок, тем быстрее расходуется гликоген, тем более значительна роль, которую играют ВСАА как альтернативный источник «топлива».
Процесс утомления ускоряется в случае резкого истощения запасов гликогена и недостаточного поступления углеводов из пищи. Следовательно, использование дополнительных приемов ВСАА особенно важно для спортсменов, придерживающихся низкоуглеводной диеты (например, для культуристов при подготовке к соревнованиям).
ВСАА могут не только обеспечивать мышцы строительным материалом и энергией, но также замедлять катаболизм (разрушение) мышечного белка.
Больше всего это утверждение относится к лейцину, который служит субстратом мышечного метаболизма во время периодов истощения клеточной энергии.
Тренировки наносят своеобразный «ущерб» мышцам, и, чтобы продолжить свой рост, им нужно некоторое время на восстановление. У разных людей этот процесс занимает примерно от 40 до 96 часов. И если нет достаточного времени на отдых, негативные эффекты будут только накапливаться.
Мышечная масса не растет и тренировки не приносят удовлетворения. В этом случае помогут ВСАА, так они создают основу для построения мышечной массы и ускоряют обменные процессы, что в итоге приводит к сокращению восстановительного периода.
Еще одним плюсом ВСАА является тот факт, что они не только могут предотвращать утомление и распад мышечных структур, но и сглаживают гормональные колебания, вызванные интенсивной нагрузкой.
Прежде всего, не следует принимать каждую аминокислоту из ВСАА отдельно от другой. Их оптимальное соотношение 2:1:1, иначе произойдет нарушение аминокислотного баланса.
Некоторые принимают капсулы ВСАА до и после тренировки. Прием ВСАА до тренировки сможет подстраховать мышцы, если в печени будет недостаточное количество гликогена. А их непосредственное употребление после сможет достаточно быстро восстановить энергопотенциал клеток.
А их непосредственное употребление после сможет достаточно быстро восстановить энергопотенциал клеток.
В этом случае самым оптимальным временем приема аминокислот будут первые 30 минут.
Профессиональные спортсмены принимают ВСАА в очень большом количестве, до 30 грамм в день. Для среднестатистического качка это количество может быть уменьшено до 5-10 грамм.
Таким образом, если необходимо нарастить больше мышечной массы и оградить свой организм от разрушения мышечного протеина и снабдить его новой энергией, необходимо принимать ВСАА регулярно. В сочетании с тренировками разветвленные аминокислоты являются важнейшей предпосылкой для роста мышц.
БАДыИмеются биологически активные пищевые добавки, содержащие изолейцин. При этом необходимо соблюдать правильный баланс между изолейцином и двумя другими разветвленными аминокислотами – лейцином и валином. Наиболее эффективная комбинация разветвленных аминокислот – приблизительно 1 мг изолейцина на каждые 2 мг лейцина и 2 мг валина.
Anticatabolan Mega Caps – уникальный состав специально отобранных компонентов. Ингредиенты: L-валин, L-лейцин, L-изолейцин, ацетил-L-глютамин, L-аргинин пиридоксина гидрохлорид (витамин B6). Вспомогательные вещества — магния стеарат, желатин.
Лейцин, изолейцин и валин играют важнейшую роль для мышечных тканей, но они наиболее быстро распадаются при катаболизме (разрушении) белка. При постоянном приеме в виде пищевых добавок – быстро проникают в мышцы и угнетают активность катаболических ферментов.
Отличие ВСАА от других аминокислот
Это единственные аминокислоты, которые метаболизируются, прежде всего, в скелетных мышцах и в гораздо меньшей степени в печени. Аминокислоты ВСАА можно считать «топливом» для скелетной мускулатуры.
Аминокислоты
Классификация аминокислот
Кетогенные аминокислоты — Справочник химика 21
Гликогенные и кетогенные аминокислоты [c.
 449]
449]Гликогенные и кетогенные аминокислоты. К гликогенным аминокислотам относятся те аминокислоты, при катаболизме которых образуются непосредственные предшественники глюкозы, вовлекаемые в процесс глюконеогенеза — пируват, оксалоацетат, фосфоеноилпируват (таких аминокислот 14), либо в жиры (кетогенные, одна аминокислота), либо и в углеводы, и в жиры (гликогенные и кетогенные, 5 аминокислот). Таким образом, классификация [c.378]
Помимо прямых переходов метаболитов этих классов веществ друг в друга, существует тесная энергетическая связь, когда энергетические потребности могут обеспечиваться окислением какого-либо одного класса органических веществ при недостаточном поступлении с пищей других. Важность белков (в частности, ферментов, гормонов и др.) в обмене всех типов химических соединений слишком очевидна и не требует доказательств. Ранее было отмечено большое значение белков и аминокислот для синтеза ряда специализированных соединений (пуриновые и пиримидиновые нуклеотиды, порфирины, биогенные амины и др..PNG) ). Кетогенные аминокислоты, образующие в процессе обмена ацетоуксусную кислоту (ацетоацетил-КоА), могут непосредственно участвовать в синтезе жирных кислот и стеринов. Аналогично могут использоваться гликогенные аминокислоты через ацетил-КоА, но после предварительного превращения в пируват. Некоторые структурные компоненты специализированных липи- [c.546]
). Кетогенные аминокислоты, образующие в процессе обмена ацетоуксусную кислоту (ацетоацетил-КоА), могут непосредственно участвовать в синтезе жирных кислот и стеринов. Аналогично могут использоваться гликогенные аминокислоты через ацетил-КоА, но после предварительного превращения в пируват. Некоторые структурные компоненты специализированных липи- [c.546]
Кетогенные аминокислоты. Аминокислоты, углеродный скелет которых может служить предшественником кетоновых тел. [c.1012]
В 40-50-е годы XX в. было установлено, что углеродные скелеты 12 аминокислот могут превращаться в углеводы ( гликогенные аминокислоты аланин, аргинин, аспарагиновая кислота, глутаминовая кислота, глицин, гистидин, метионин, пролин, серин, треонин, валин, цистеин), в жиры ( кетогенная аминокислота — лейцин), а также в жиры и углеводы ( гликогенные и кетогенные аминокислоты — изолейцин, лизин, триптофан, тирозин, фенилаланин). [c.273]
Кетогенные аминокислоты Ацетил-КоА > Жирные кислоты [c. 445]
445]
Метаболиты, образующиеся из углеродных скелетов аминокислот, либо непосредственно включаются в цикл трикарбоновых кислот, либо превращаются в пируват и через ацетил-КоА деградируют до образования конечных продуктов — Oj и HjO. В зависимости от потребностей организма безазотистые метаболиты могут включаться в синтез глюкозы (гликогенные аминокислоты) либо в синтез высших жирных кислот (кетогенные аминокислоты). [c.378]
На рис. 24.8 представлены пути окислительного распада аминокислот с разветвленной цепью — кетогенной аминокислоты лейцина, а также валина и изолейцина, являющихся одновременно кетогенными и гликогенными. В процессе метаболических превращений валина происходит образование сукцинил-КоА, который через цикл ТКК и при участии некоторых других ферментов может превратиться в пируват, а затем в глюкозу. В то же время лейцин дает непосредственно кетопродукт ацетоацетат и, кроме того, аце-тил-КоА, из которого также может образовываться ацетоацетат.
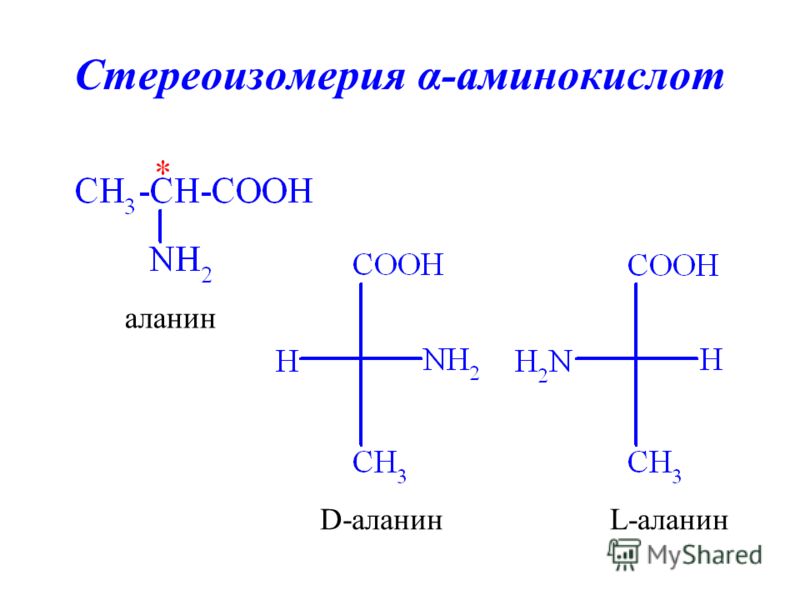 Изолейцин дает ацетил-КоА и пропионил-КоА. Через метилмалонил-КоА пропи-онил-КоА превращается в сукцинил-КоА, и, следовательно, его надлежит считать гликогенным, а так как ацетил-КоА — кетогенное соединение, то изолейцин можно отнести одновременно к обеим категориям. [c.379]
Изолейцин дает ацетил-КоА и пропионил-КоА. Через метилмалонил-КоА пропи-онил-КоА превращается в сукцинил-КоА, и, следовательно, его надлежит считать гликогенным, а так как ацетил-КоА — кетогенное соединение, то изолейцин можно отнести одновременно к обеим категориям. [c.379]Аминокислоты, из которых в процессе катаболизма образуется ацетоацетат или ацетил-КоА, называют кетогенными. Кетогенные аминокислоты в организме могут быть источниками кетоновых тел. Лизин может использоваться исключительно как кетогенная кислота. [c.385]
Кетогенные аминокислоты — Лиз, Лей, Иле, 1]ри, Фен, Ъ1р — в процессе катаболизма преврашаются в ацетоацетат или ацетил-КоА и могут быть источником кетоновых тел. [c.243]
Как упоминалось выше, лейцин-единственная чисто кетогенная аминокислота во всем [c.173]
Ацетил-СоА. Основные источники этого активированного двухуглеродного фрагмента — окислительное декарбоксилирование пирувата и (3-окисление жирных кислот (рис. 23.11). Кроме того, ацетил-СоА образуется из кетогенных аминокислот. [c.287]
23.11). Кроме того, ацетил-СоА образуется из кетогенных аминокислот. [c.287]
Углеродные скелеты аминокислот могут включаться в ЦТК через ацетил-КоА, пируват, оксалоацетат, а-кетоглутарат и сукцинил-КоА. Пять аминокислот (Фен, Лиз, Лей, Трп, Тир) считаются кетогенными , поскольку они являются предшественниками кетоновых тел, в частности ацетоуксусной кислоты, в то время как большинство других аминокислот, обозначаемых как гликогенные , служат в организме источником углеводов, в частности глюкозы. Подобный синтез углеводов de novo усиливается при некоторых патологических состояниях, например при сахарном диабете, а также при гиперфункции коркового вещества надпочечников и введении глюкокортикоидов (см. главу 8). Разделение аминокислот на кетогенные и гликогенные носит, однако, условный характер, поскольку отдельные участки углеродных атомов Лиз, Трп, Фен и Тир могут включаться и в молекулы предшественников глюкозы, например Фен и Тир —в фумарат. Истинно кетогенной аминокислотой является только лейцин. [c.440]
[c.440]
По тем же (рассмотренным выше) причинам, по которым прямое превращение жирных кислот в углеводы оказывается невозможным, исключается также возможность превращения жирных кислот в глюкогенные аминокислоты. Невозможно также обращение пути распада кетогенных аминокислот. Все они относятся к категории незаменимых аминокислот. Превращение углеродных скелетов глюкогенных аминокислот в жирные кислоты возможно либо путем образования пирувата и ацетил-СоА, либо путем обращения внемитохондриальных реакций цикла лимонной кислоты на участке от а- [c.296]
(PDF) Amino acid composition of soy protein
№ 4 2020
МЯСНЫЕ ТЕХНОЛОГИИ
29
МЕТОДЫ КОНТРОЛЯ
молока и соевого изолята, как показано на отдельных
примерах, выходят за рамки корреляций, характерных
для животных белков.
Для определения характерных природных корреляций
в составе аминокислот белков различных сортов сои
была сформирована электронная таблица, содержащая
данные об усредненном составе аминокислот соевых
изолятов. Всего для статистического анализа использо-
Всего для статистического анализа использо-
ваны 234 экспериментальные точки. В табл. 1 приведены
диапазоны содержания аминокислот в соевых белках,
согласно данным [2−8].
Обращает на себя внимание слишком большой раз-
брос данных по содержанию таких кислот, как валин,
пролин, фенилаланин, гистидин и триптофан. Содержа-
ние метионина и цистина (реже цистеина) приводится
в источниках, как правило, в виде суммы. Ранее нами уже
отмечались возможные проблемы хроматографического
анализа аминокислот, которые могут приводить к некор-
ректности отдельных данных [9, 10]. Это и заниженные
результаты, полученные из-за неколичественной дери-
ватизации аминокислот при пробоподготовке тем
или иным способом (например, пролина), частичное
разложение молекул триптофана при гидролизе бел-
ков. В источниках не приводятся ссылки на валидизиро-
ванные методики, с помощью которых выполнялся ами-
нокислотный анализ, или данные об аккредитованных
лабораториях, в которых измерения проводились по си-
стеме аутсорсинга. Отсутствие метрологической и нор-
Отсутствие метрологической и нор-
мативной информации затрудняет оценку достоверности
приводимых данных.
Проанализированный массив данных, строго говоря,
не является репрезентативным. Так, в нем отсутствуют
результаты исследований зарубежных специалистов,
не все доступные отечественные первоисточники взяты
для анализа. Вместе с тем были обнаружены тенденции
и тренды, которые можно уточнять и проверять в даль-
нейших исследованиях, хотя уже на этой стадии можно
сделать определенные выводы и использовать их в ана-
литической практике.
В табл. 2 приведены выявленные генотипические со-
отношения аминокислот соевых белков. Для них
Таблица 2. Частные линейные тренды для аминокислот белков сои у = ах + b и степени аппроксимации R2
Аминокислоты* Тренд R2Аминокислоты* Тренд R2
гли/вал 1,48х – 1,54 0,995 ала/вал 2,98х – 5,57 0,788
гли/лей 0,78х + 3,87 0,989 ала/лей 1,14х + 3,10 0,836
гли/иле 0,47х + 3,11 0,889 ала/про 2,09х – 3,19 0,915
гли/про 0,69х + 1,32 0,758 ала/тир 1,35х – 1,80 0,851
гли/арг 0,50х + 4,93 0,960 ала/асп 4,33х – 7,07 0,881
гли/гис 1,29х – 2,32 0,986 ала/глу 33,07 – 4,35х 0,937
гли/тре 0,41х + 1,15 0,879 ала/лиз 3,00х – 6,90 0,844
гли/три 0,92х – 2,17 0,982 ала/арг 1,72х + 1,30 0,757
иле/про 0,84х + 0,99 0,925 ала/гис 6,64х – 21,65 0,922
иле/лиз 0,99х + 0,87 0,873 ала/сер 1,64х – 1,51 0,971
иле/три 1,25х – 3,75 0,914 ала/тре 0,69х + 0,35 0,839
иле/арг 1,07х + 1,93 0,815 лей/иле 0,71х – 0,22 0,813
вал/лей 0,56х + 4,22 0,882 лей/про 0,76х – 0,81 0,813
вал/про 0,480х + 2,0 0,844 лей/лиз 0,85х – 0,61 0,973
вал/асп 0,27х + 9,46 0,831 лей/тре 0,44х – 0,11 0,891
вал/лиз 0,62х + 1,67 0,738 лей/три 0,96х – 4,91 0,861
вал/тре 0,24х + 1,79 0,769 лей/асп 1,11х + 1,5 0,620
вал/гис 0,92х – 0,82 0,837 тир/цис+мет 0,70х – 1,22 0,819
про/асп 1,33х + 03,34 0,924 тир/сер 1,40х – 0,56 0,610
про/лиз 1,13х – 0,03 0,885 асп/лиз 0,70х – 1,39 0,861
про/тре 0,54х + 0,51 0,799 лиз/тре 0,48х + 0,56 0,939
про/три 1,31х – 4,05 0,868 лиз/три 1,17х – 4,49 0,920
* Соотношение кислот х/у.
Анаэробное сбраживание ила с помощью различных предварительных обработок: изменения аминокислот и микробного сообщества
Appels L, Baeyens J, Degreve J, Dewil R (2008). Принципы и возможности анаэробного сбраживания активного ила отходов. Прогресс в области энергетики и науки о горении, 34 (6): 755–781
CAS Статья Google ученый
Astals S, Peces M, Batstone D J, Jensen P D, Tait S (2018). Описание и моделирование ингибирования свободного аммиака и аммония в анаэробных системах.Water Research, 143 (1): 127–135
CAS Статья Google ученый
Бардуэлл Дж. С. А., Макговерн К., Беквит Дж. (1991). Идентификация белка, необходимого для образования дисульфидной связи in vivo. Моб., 67 (3): 581–589
CAS Статья Google ученый
Карпентер А. В., Лаутон С. Н., Визнер М. Р. (2015). Повышенное производство биогаза из наноразмерных анаэробных биореакторов с нулевой валентностью с добавкой железа.Инженерная наука об окружающей среде, 32 (8): 647–655
CAS Статья Google ученый
Каррер Х., Дюма С., Баттимелли А., Батстон Д. Дж., Дельженес Дж. П., Стейер Дж. П., Феррер I. (2010). Методы предварительной обработки для улучшения анаэробной разлагаемости ила: обзор. Журнал опасных материалов, 183 (1–3): 1–15
Статья CAS Google ученый
Chen S S, Dong B, Dai X H, Wang H Y, Li N, Yang D H (2019).Влияние термогидролиза на метаболизм аминокислот в осадке сточных вод при анаэробном сбраживании. Управление отходами (Нью-Йорк, Нью-Йорк), 88 (2): 309–318
CAS Статья Google ученый
Чен С.С., Ян Д Х, Донг Б., Ли Н, Дай Х Х (2020). Возраст ила влияет на распределение, состояние присутствия и структуру органических соединений в активном иле и влияет на анаэробную способность к разложению. Журнал химической инженерии, 384 (1): 123261
CAS Статья Google ученый
Чен С. И, Донг Х З (2005). Proteiniphilum aceatigenes gen. nov., sp nov., из реактора UASB, очищающего сточные воды пивоваренного завода. Международный журнал систематической и эволюционной микробиологии, 55 (6): 2257–2261
CAS Статья Google ученый
Чишти С.С., Назрул Хаснаин С., Алтаф Хан М. (1992). Исследования по извлечению из осадка протеина. Water Research, 26 (2): 241–248
CAS Статья Google ученый
Кристенсен С., Макмахон Р. М., Мартин Дж. Л., Хьюстон В. М. (2019).Жизнь внутри и снаружи: создание и разрыв белковых дисульфидных связей у хламидий. Критические обзоры в микробиологии, 45 (1): 33–50
Статья Google ученый
Де Грааф Л. А (2000). Денатурация белков с точки зрения непищевых продуктов. Журнал биотехнологии, 79 (3): 299–306
CAS Статья Google ученый
Делеу Л. Дж., Ламбрехт М. А, Ван де Вондел Дж., Делькур Дж. А. (2019).Влияние щелочных условий на запасные белки зерновых и псевдозерновых. Current Opinion in Food Science, 25 (1): 98–103
Статья Google ученый
Гонсалес А., Хендрикс А. Т. У. М., Ван Лиер Дж. Б., Де Кройк М. (2018). Предварительная обработка для повышения способности к биологическому разложению отработанного активного ила: разъяснение этапа ограничения скорости. Успехи биотехнологии, 36 (5): 1434–1469
CAS Статья Google ученый
Грейс Дж. Б., Боллен К. А. (2005).Интерпретация результатов моделей множественной регрессии и структурных уравнений. Бюллетень Экологического общества Америки, 86 (4): 283–295
Статья Google ученый
Хао Л. П., Лу Ф., Хе П. Дж., Ли Л., Шао Л. М. (2011). Преобладающий вклад синтрофического окисления ацетата в образование термофильного метана при высоких концентрациях ацетата. Наука об окружающей среде и технологии, 45 (2): 508–513
CAS Статья Google ученый
Хван Дж., Чжан Л., Со С., Ли Ю. В., Джанг Д. (2008).Восстановление белка из избыточного ила для использования в качестве корма для животных. Технология биоресурсов, 99 (18): 8949–8954
CAS Статья Google ученый
Карими М., Игнасиак М. Т., Чан Б., Крофт А. К., Радом Л., Шиссер К. Х., Паттисон Д. И., Дэвис М. Дж. (2016). На реакционную способность дисульфидных связей заметно влияет структура и окружающая среда: влияние на модификацию и стабильность белка. Scientific Reports, 6 (1): 1–12
Статья CAS Google ученый
Лабиб Ф., Фергюсон Дж. Ф., Бенджамин М. М., Мери М., Рикер Л. Н. (1992).Анаэробное разложение бутирата в реакторе с псевдоожиженным слоем: эффекты повышенных концентраций водорода и ацетата. Наука об окружающей среде и технологии, 26 (2): 369–376
CAS Статья Google ученый
Ли Х, Джин И Й, Махар Р., Ван Зи И, Ни И Ф (2008). Эффекты и модель обработки щелочных отходов активным илом. Технология биоресурсов, 99 (11): 5140–5144
CAS Статья Google ученый
Ли Х, Чен С, Донг Б, Дай Х (2020).Новое понимание влияния термогидролиза на анаэробное сбраживание ила с высоким содержанием твердых частиц: путь превращения летучих соединений серы. Chemosphere, 244 (1): 125466
CAS Статья Google ученый
Ляо К. В., Ху Х Д, Ма С. Дж., Рен Х Кью (2019). Влияние микробной активности и структуры микробного сообщества на образование растворенного органического азота (ДОН) и биодоступного ДОН под воздействием низких температур. Water Research, 159 (2): 397–405
CAS Статья Google ученый
Лю Х., Чен И (2018).Повышенное производство метана из пищевых отходов с использованием цистеина для увеличения биотрансформации i-моносахарида, летучих жирных кислот и биогидрогена. Наука об окружающей среде и технологии, 52 (6): 3777–3785
CAS Статья Google ученый
Лю Р З, Ю Икс, Ю П Ф, Го Х С, Чжан Б., Сяо Би И (2019). Новые взгляды на влияние термической обработки на обезвоживание осадка. Наука об окружающей среде в целом, 656 (1): 1082–1090
CAS Статья Google ученый
Лю Д, Сяо К. К., Чен Й, Со И Н А, Чжоу Й (2018).Преобразование растворенных органических веществ, образующихся при предварительной щелочно-ультразвуковой обработке ила, при анаэробном сбраживании: от макро к микро. Water Research, 142 (2): 138–146
CAS Статья Google ученый
Масполим И, Чжоу Й, Го Ч., Сяо К. К., Нг В. Дж. (2015). Влияние pH на солюбилизацию органических веществ и структур микробного сообщества при ферментации ила. Технология биоресурсов, 190 (1): 289–298
CAS Статья Google ученый
Моусон А. Дж., Эрл Р. Л., Ларсен Ф. В. (1991).Разложение уксусной и пропионовой кислот при метановом брожении. Water Research, 25 (12): 1549–1554
CAS Статья Google ученый
Ренар Д., Лавенант-Гуржон Л., Лапп А, Ниген М., Санчес С. (2014). Исследования ферментативного гидролиза арабиногалактановой белковой структуры из камеди акации: гипотеза самоподобия сборки из общего строительного блока. Углеводные полимеры, 112 (4): 648–661
CAS Статья Google ученый
Шен Д С, Инь Дж, Ю Х Q, Ван М З, Лонг Й Й, Шэнту Дж, Чен Т. (2017).Характеристики ацидогенной ферментации различных типов богатых белком субстратов в пищевых отходах с образованием летучих жирных кислот. Технология биоресурсов, 227 (5): 125–132
CAS Статья Google ученый
Шейхфард А, Хагиги Ф (2020). Водитель отвлекает цифровые рекламные щиты? Моделирование структурным уравнением на основе данных исследования естественного вождения: пример Ирана. Journal of Safety Research, 72 (1): 1–8
Статья Google ученый
Тиан Х Б., Ван С., Трзцински А. П., Линь Л., Нг В. Дж. (2015).Интерпретация синергетического эффекта при комбинированной предварительной обработке осадка сточных вод ультразвуковой обработкой и озонированием. Chemosphere, 140 (1): 63–71
CAS Статья Google ученый
Ван Х, Ли И Б, Чжан И, Пан И Р, Ли Л, Лю Дж Х, Батлер Д. (2019). Пошаговое регулирование pH для обеспечения синергии химических и биологических процессов для увеличения производства короткоцепочечных жирных кислот в результате анаэробной ферментации ила. Water Research, 155 (2): 193–203
CAS Статья Google ученый
Вэнь Хью, Син Д Ф, Се Дж Дж, Инь Т М, Рен Н Кью, Лю Би Ф (2019).Повышенное фотоферментативное производство водорода за счет синергетического эффекта сформированной биопленки и добавленного L-цистеина. Возобновляемая энергия, 139 (3): 643–650
CAS Статья Google ученый
Ву Б Р, Ни Б Дж, Хорват К., Сонг Л И, Чай Х Л, Дай Х Х, Махаджан Д. (2017). Анализ состояния вхождения и молекулярной структуры внеклеточных белков с последствиями для обезвоживания активного ила отходов. Наука об окружающей среде и технологии, 51 (16): 9235–9243
CAS Статья Google ученый
Сяо К., Го Ц., Чжоу Й., Масполим И, Нг В. Дж. (2016a).Воздействие уксусной кислоты на метаногены на второй стадии двухступенчатой анаэробной системы. Chemosphere, 144 (3): 1498–1504
CAS Статья Google ученый
Сяо К. К., Чен И, Цзян Х, Сеу В. И, Хе Ц, Инь И, Чжоу Ю. (2017). Сравнение различных методов очистки солюбилизации белков из отработанного активного ила. Water Research, 122 (4): 492–502
CAS Статья Google ученый
Сяо К. К., Чен Ю., Цзян Х, Тяги В. К., Чжоу Ю. (2016b).Характеристика основных органических соединений, влияющих на обезвоживание ила во время обработки ультразвуком и подкисления. Water Research, 105 (3): 470–478
CAS Статья Google ученый
Сяо К. К., Го Ч., Чжоу Й., Масполим И., Нг В. Дж. (2016c). Воздействие уксусной кислоты на метаногены на второй стадии двухступенчатой анаэробной системы. Chemosphere, 144 (1): 1498–1504
CAS Статья Google ученый
Сяо К. К., Го Ч., Чжоу И, Масполим И, Ван Дж., Нг В. Дж. (2013).Ингибирование уксусной кислоты метаногенов в двухфазном анаэробном процессе. Журнал биохимической инженерии, 75 (2): 1–7
CAS Статья Google ученый
Ян Г, Чжан П И, Чжан Г М, Ван И Й, Ян А К (2015). Свойства разложения белков и углеводов при анаэробном сбраживании ила. Технология биоресурсов, 192 (3): 126–130
CAS Статья Google ученый
Цзэн В, Ли Би Х, Ван Х Д, Бай Х Л, Пэн И З (2016).Влияние накопления нитритов на популяционную структуру « Candidatus Accumulibacter » и усиление биологического удаления фосфора из городских сточных вод. Chemosphere, 144 (2): 1018–1025
CAS Статья Google ученый
Чжан Би Би, Сиань К. М., Чжу Дж. П, Ли А. М., Гонг Т. Т. (2015). Характеристика, образование DBP и мутагенность растворимых микробных продуктов (SMP) в сточных водах в смоделированных стрессовых условиях.Журнал химической инженерии, 279 (1): 258–263
CAS Google ученый
Судьба белков отработанного активного ила во время предварительной термической обработки щелочью с точки зрения извлечения белков ила
Ai S J, Liu H Y, Wu M J, Zeng G G, Yang C. P (2018). Роль кислотообразующих бактерий в анаэробном сбраживании отработанного активного ила. Frontiers of Environmental Science & Engineering, 12 (6): 3
Google ученый
APHA (2005).Стандартные методы исследования воды и сточных вод (21-е издание). Вашингтон, округ Колумбия: Американская ассоциация общественного здравоохранения, США
Google ученый
Боле Б, Цвельфер Б, Гератизаде А (2006). Приготовление продуктов, связанных с пыльцой березы: различные последствия для реактивности, опосредованной Ig E и Т-клетками, in vitro и in vivo. Журнал аллергии и клинической иммунологии, 118 (1): 242–249
CAS Google ученый
Чен И Г, Цзян С, Юань Х И, Чжоу Кью, Гу Г В (2007).Гидролиз и подкисление отработанного активного ила при различных значениях pH. Water Research, 41: 683–689
CAS Google ученый
Чишти С.С., Хаснаин С.Н., Хан М.А. (1992). Исследования по извлечению из осадка протеина. Water Research, 26 (2): 241–248
CAS Google ученый
Чо С., Шин Х, Ким Д. (2012). Гидролиз отработанного активного ила во время обработки ультразвуком: двухступенчатая дезинтеграция.Технология биоресурсов, 121: 480–483
CAS Google ученый
Дуань Й. Q, Чжоу А. Дж., Вэнь К. Л., Лю З. Х, Лю В. З., Ван А. Дж., Юэ Х П (2019). Улучшение биопроизводства ЛЖК из отработанного активного ила путем коферментации с остатками соевого соуса. Frontiers of Environmental Science & Engineering, 13 (1): 3
Google ученый
Дюбуа М., Жиль К. А., Гамильтон Дж. К., Реберс П. А., Смит Ф. (1951).Колориметрический метод определения сахаров. Природа, 28 (7): 167–168
Google ученый
Дуайер Дж., Старренбург Д., Тейт С., Барр К., Батстон Д. Дж., Лант П. (2008). Снижение температуры термогидролиза активного ила приводит к уменьшению цвета продукта без ухудшения разлагаемости. Water Research, 42 (18): 4699–4709
CAS Google ученый
Ева Л. Б., Станислав Л. (2001).Анализ РНК как метод определения жизнеспособной биомассы в органической фракции суспензии твердых бытовых отходов. Письма о биотехнологии, 23: 1057–1060
Google ученый
Гао X, Лю Н. (2011). Определение содержания аминокислот во всем растении Rumex dentatus с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии с использованием метода предколоночной дериватизации AccQ $ Tag. Наука о продуктах питания, 32 (20): 160–163 (на китайском языке)
CAS Google ученый
Хамид Х, Эскичиоглу С. (2013).Влияние микроволнового гидролиза на трансформацию стероидных гормонов при анаэробном сбраживании городского осадка. Water Research, 47: 4966–4977
CAS Google ученый
Хуанг X, Ю З, Ли Ц (2005). Продвинутая биохимия. Пекин: Химическая промышленность Press
Google ученый
Хван Дж., Чжан Л., Со С., Ли Ю. В., Джанг Д. (2008). Восстановление белка из избыточного ила для использования в качестве корма для животных.Технология биоресурсов, 99: 8949–8954
CAS Google ученый
Li Y Y, Noike T (1992). Улучшение анаэробного сбраживания отработанного активного ила путем предварительной термической обработки. Наука о воде и технологиях, 26 (3–4): 857–866
CAS Google ученый
Лю И, Конг С., Ли И, Цзэн Х (2009). Новая технология утилизации осадка сточных вод: Приготовление удобрения с аминокислотами, хелатными микроэлементами (AACTE).Журнал опасных материалов, 171 (1–3): 1159–1167
CAS Google ученый
Шиер В. Т., Пурвоно С. К. (1994). Экстракция одноклеточного белка из активированного ила сточных вод: термическая солюбилизация белка. Технология биоресурсов, 49: 157–162
CAS Google ученый
Танака С., Кобаяси Т., Камияма К., Билдан М.Л. Н.С. (1997). Влияние предварительной термохимической обработки на анаэробное сбраживание отработанного активного ила.Наука о воде и технологиях, 35 (8): 209–215
CAS Google ученый
Ван Х, Ли И, Лю Дж, Рен Н, Цюй Дж. (2016). Увеличение производства белковой уксусной кислоты за счет изменения структуры и конформации белка, вызванных воздействием тепла и щелочи. Water Research, 88: 595–603
CAS Google ученый
Уилсон К. А., Новак Дж. Т. (2009). Гидролиз высокомолекулярных компонентов первичного и вторичного осадка сточных вод методом термогидролитической предварительной обработки.Water Research, 43: 4489–4498
CAS Google ученый
Сяо К., Чен И, Цзян Х, Сеу В. И, Хе Ц, Инь И, Чжоу Ю. (2017). Сравнение различных методов очистки солюбилизации белков из отработанного активного ила. Water Research, 122: 492–502
CAS Google ученый
Загон Дж., Янсен Б., Кноппик М. (2010). Анализ транскрипции генов аллергенов моркови путем относительной количественной оценки с помощью одно- и дуплексной ПЦР с обратной транскрипцией в реальном времени.Аналитическая и биоаналитическая химия, 396 (1): 483–493
CAS Google ученый
Чжан П., Чжан Г, Ван В. (2007). Ультразвуковая обработка биологического ила: дезинтеграция хлопьев, лизис и инактивация клеток. Технология биоресурсов, 98: 207–210
CAS Google ученый
Чжао Дж, Ван Д, Ли Х, Ян Кью, Чен Х, Чжун Й, Цзэн Г (2015). Свободная азотистая кислота, используемая в качестве метода предварительной обработки для щелочной ферментации для увеличения производства короткоцепочечных жирных кислот из отработанного активного ила.Water Research, 78: 111–120
CAS Google ученый
Анализ внеклеточных белков активного ила и их функций на очистных сооружениях с помощью протеомики дробовика
Тойофуку, М., Рошицки, Б., Ридель, К. и Эберл, Л. Идентификация белков, связанных с Pseudomonas aeruginosa биопленка внеклеточного матрикса. J. Proteome Res. 11. С. 4906–4915 (2012).
CAS Статья Google ученый
Флемминг, Х.& Wingender, J. Матрица биопленки. Nat. Rev. Microbiol. 2010. Т. 8. С. 623–633.
CAS Статья Google ученый
Zhang, L. L., Feng, X. X., Zhu, N. W. & Chen, J. M. Роль внеклеточного белка в образовании и стабильности аэробных гранул. Enzyme Microbiol. Technol. 41, 551–557 (2007).
CAS Статья Google ученый
Lv, J.P. et al. Влияние чувствительности кворума и внеклеточных белков на микробное прикрепление аэробного гранулированного активного ила. Biresource Technol. 152, 53–58 (2014).
CAS Статья Google ученый
Moreau, J. W. et al. Внеклеточные белки ограничивают распространение биогенных наночастиц. Наука. 316, 1600–1603 (2007).
ADS CAS Статья Google ученый
Ван, З.К., Хесслер, К. М., Сюэ, З. и Сео, Ю. Роль внеклеточных полимерных веществ на сорбцию природного органического вещества. Water Res. 46. С. 1052–1060 (2012).
CAS Статья Google ученый
Guibaud, G., Tixier, N., Bouju, A. & Baudu, M. Связь между составом внеклеточных полимеров и их способностью образовывать комплекс Cd, Cu и Pb. Chemosphere. 52, 1701–1710 (2003).
ADS CAS Статья Google ученый
Парк, С., Новак, Дж. Т., Хелм, Р. Ф., Ан, Ю. и Эсен, А. Оценка внеклеточных белков в полноразмерных активированных илах. Water Res. 42, 3879–3889 (2008).
CAS Статья Google ученый
Силва, А. Ф., Карвалью, Г., Соареш, Р., Коэльо, А. В. и Баррето Креспо, М. Т. Пошаговая стратегия обогащения белков и протеомной характеристики внеклеточных полимерных веществ в системах очистки сточных вод.Appl Microbiol. Biotechnol. 95, 767–776 (2012).
CAS Статья Google ученый
Zhang, Y., Fonslow, B.R., Shan, B., Baek, M.C. & Yates, J.R. Анализ протеина методом дробовика / восходящей протеомики. Chem. Ред. 113, 2343–2394 (2013).
CAS Статья Google ученый
Сугахара, Д., Кадзи, Х., Сугихара, К., Асано, М., Наримацу, Х.Крупномасштабная идентификация целевых белков изофермента гликозилтрансферазы с помощью лектин-IGOT-LC / MS, гликопротеомного подхода на основе LC / MS. Sci Rep-UK. 2, 1–8 (2012).
Google ученый
Kragelund, C., Thomsen, T. R., Mielczarek, A. T. & Nielsen, P.H. Eikelboom Морфотип 0803 в активном иле принадлежит к роду Caldilinea в типе Chloroflexi . FEMS Microbiol. Ecol. 76. С. 451–462 (2011).
CAS Статья Google ученый
Maquelin, K. et al. Идентификация важных с медицинской точки зрения микроорганизмов с помощью вибрационной спектроскопии. J. Microbiol. Meth. 51, 255–271 (2002).
CAS Статья Google ученый
Бадиредди, А. Р. и др. Роль внеклеточных полимерных веществ в биофлокуляции микроорганизмов активного ила в условиях, контролируемых глюкозой.Water Res. 44, 4505–4516 (2010).
CAS Статья Google ученый
Фанг, Л. К., Цао, Ю. Ю., Хуанг, К. Ю., Уокер, С. Л. и Цай, П. Реакции между бактериальными экзополимерами и гетитом: комбинированное макроскопическое и спектроскопическое исследование. Water Res. 46. С. 5613–5620 (2012).
CAS Статья Google ученый
Ли, Б., Шин, Х. и Хур, Дж.Сравнение характеристик внеклеточных полимерных веществ для двух различных методов экстракции и условий образования осадка. Chemosphere. 90, 237–244 (2013).
ADS CAS Статья Google ученый
Ю, Г. Х., Хе, П. Дж. И Шао, Л. М. Характеристики фракций внеклеточных полимерных веществ (EPS) из избыточного ила и их влияние на биофлокулируемость. Biresource Technol. 100, 3193–3198 (2009).
CAS Статья Google ученый
Ashburner, M. et al. Генная онтология: инструмент для объединения биологии. Nat. Genet. 25, 25–29 (2000).
CAS Статья Google ученый
Jia, C. Y. et al. Разложение пирена в почвах внеклеточными полимерными веществами (ВПС), выделенными из жидких культур. Process Biochem. 46. С. 1627–1631 (2011).
CAS Статья Google ученый
Ван Дж.и другие. Усиленная биотрансформация нитробензола за счет синергии видов Shewanella и полиуретановой пены, функционализированной медиаторами. J. Hazard Mater. 252. С. 227–232 (2013).
Артикул Google ученый
He, J. G. et al. Эффективность лизоцима для повышения способности к биологическому разложению активного ила отходов. Biresource Technol. 170, 108–114 (2014).
CAS Статья Google ученый
Ким, Х.и другие. Гидролитическая активность внеклеточных ферментов в термофильных и мезофильных анаэробных секвенирующих реакторах периодического действия для обработки органических фракций твердых бытовых отходов. Biresource Technol. 110, 130–134 (2012).
CAS Статья Google ученый
Gao, J. F. et al. Вклад функциональных групп и внеклеточных полимерных веществ в биосорбцию красителей аэробными гранулами. Biresource Technol. 102, 805–813 (2011).
CAS Статья Google ученый
Mikutta, R., Baumgaertner, A., Schippers, A., Haumaier, L. & Guggenberger, G. Внеклеточные полимерные вещества из Bacillus Subtilis , связанные с минералами, изменяют степень и скорость сорбции тяжелых металлов. Environ. Sci. Technol. 46, 3866–3873 (2012).
ADS CAS Статья Google ученый
Сюй, Дж., Шенг, Г. П., Ма, Ю., Ван, Л. Ф. и Ю, Х. К. Роль внеклеточных полимерных веществ (EPS) в миграции и удалении сульфаметазина в системе активного ила. Water Res. 47. С. 5298–5306 (2013).
CAS Статья Google ученый
Луо, Х. В. и др. Экспериментальные и теоретические подходы к поверхностному взаимодействию между медью и микроорганизмами активного ила на молекулярном уровне. Sci Rep-UK. 4, 1–7 (2014).
Google ученый
Вилен Б. М. и Балмер П. Влияние концентрации растворенного кислорода на структуру, размер и гранулометрический состав хлопьев активного ила. Water Res. 33, 391–400 (1999).
CAS Статья Google ученый
Liu, X. M. et al. Вклад внеклеточных полимерных веществ (EPS) в агрегацию ила. Environ. Sci.Technol. 44, 4355–4360 (2010).
ADS CAS Статья Google ученый
Вилен, Б. М., Кейдинг, К. и Нильсен, П. Х. Анаэробная дефлокуляция и аэробная дефлокуляция активного ила. Water Res. 34, 3933–3942 (2000).
CAS Статья Google ученый
Guo, L. et al. Трехмерная флуоресцентная спектроскопия возбуждения-эмиссии (EEM) с анализом региональной интеграции для оценки гидролиза осадка отходов, обработанного мультиферментными и термофильными бактериями.Biresource Technol. 2014. Т. 171. С. 22–28.
CAS Статья Google ученый
Шенг, Г. П., Ю, Х. Q. и Ли, X. Y. Внеклеточные полимерные вещества (EPS) микробных агрегатов в системах биологической очистки сточных вод: обзор. Biotechnol Adv. 28. С. 882–894 (2010).
CAS Статья Google ученый
Ю, С. Ю., Чжан, Г. М., Ли, Дж. З., Чжао, З. В. и Кан, X. Р. Влияние предварительной обработки эндогенными гидролитическими ферментами на анаэробное разложение осадка. Biresource Technol. 146. С. 758–761 (2013).
CAS Статья Google ученый
Вишневски, Дж. Р., Зугман, А., Нагарадж, Н. и Манн, М. Универсальный метод подготовки проб для протеомного анализа. Nat. Методы. 6. С. 359–360 (2009).
CAS Статья Google ученый
Уошберн, М.П., Уолтерс, Д. и Йейтс, Дж. Р. Крупномасштабный анализ протеома дрожжей с помощью технологии многомерной идентификации белков. Nat. Biotechnol. 19, 242–247 (2001).
CAS Статья Google ученый
Хансен, С. Х., Стенсбалле, А., Нильсен, П. Х. и Хербст, Ф. Метапротеомика: оценка экстракции белка из активного ила. Протеомика. 14. С. 2535–2539 (2014).
CAS Статья Google ученый
Лю Дж.S., Zheng, S.C., Liu, L., Li, L. & Feng, Q.L. Профили белков средней кишки личинок Spodoptera litura на шестой стадии кормления с помощью ружья ESI-MS. J. Proteome Res. 9. С. 2117–2147 (2010).
CAS Статья Google ученый
Гупта, Н. и Певзнер, П. А. Частота ложных открытий идентификации белков: удар против правила двух пептидов. J. Proteome Res. 8, 4173–4181 (2009).
CAS Статья Google ученый
Обнаружение in situ гидролизующих белок микроорганизмов в активном иле | FEMS Microbiology Ecology
Абстрактные
Гидролиз белка играет важную роль в преобразовании органических веществ в установках очистки сточных вод с активным илом, но в настоящее время нет информации относительно идентичности и экофизиологии организмов, гидролизующих белок (PHO).В этом исследовании было применено флуоресцентное окрашивание in situ фермента казеином и бычьим сывороточным альбумином, конъюгированным с красителем BODIPY, и оно было оптимизировано для мечения PHO в установках с активным илом. Достигнуто сильное флуоресцентное мечение поверхности микроорганизмов, экспрессирующих протеазную активность. Метаболические ингибиторы применялись для подавления метаболической активности с целью предотвращения поглощения флуоресцентных гидролизатов бактериями, потребляющими олигопептиды. На пяти полномасштабных заводах по производству активного ила, удаляющих питательные вещества, доминирующими PHO всегда были разные морфотипы нитчатых бактерий и эпифлоры, прикрепленные ко многим из них.PHO были идентифицированы методом FISH с использованием ряда доступных олигонуклеотидных зондов. Нитевидные PHO принадлежали к типу кандидатов TM7, типу Chloroflexi и классу Betaproteobacteria . В сумме они составляли 1–5% биомера бактерий. Большинство эпифлоры-PHOs гибридизовались с зондом SAP-309, нацеленным на Saprospiraceae в филюме Bacteroidetes , и составляли 8–12% от общего бактериального биомера у большинства растений и, таким образом, являлись важной и доминирующей частью микробных сообществ.
Введение
Микробный гидролиз — это процесс, посредством которого макромолекулы гидролизуются до олигомеров и мономеров под действием микробов. Он играет важную роль не только в естественных биогеохимических циклах, но и в инженерных системах, таких как очистные сооружения с активным илом (Henze & Mladenovski, 1991). Органические вещества, содержащиеся в бытовых сточных водах, обычно состоят из 40–60% белков, 25–50% полисахаридов и 10–30% липидов (Nielsen et al., 1992), и все макромолекулы гидролизуются до их мономеров или олигомеров, таких как аминокислоты, пептиды, моносахариды и длинноцепочечные жирные кислоты, перед их дальнейшим разложением. Таким образом, микробный гидролиз является важным этапом разложения органических веществ на очистных сооружениях и часто является этапом, ограничивающим скорость процессов, связанных с удалением азота и фосфора (Dueholm et al. , 2001; Morgenroth et al. al. , 2002).
Микробный гидролиз осуществляется экзоферментами, выделяемыми гидролизующими микроорганизмами.Несколько исследований были сосредоточены на активности различных экзоферментов и расположении ферментов в активном иле (Frolund et al. , 1995; Gessesse et al. , 2003). Теперь ясно, что гидролитические ферменты в основном связаны с клеточными поверхностями, где гидролиз и высвобождение частично деградированных макромолекул повторяются до тех пор, пока гидролитические фрагменты не станут достаточно маленькими, чтобы их могли ассимилировать микроорганизмы (Confer & Logan, 1998; Goel et al. ). , 1998).
Сообщалось об активности различных экзоферментов в активном иле. К ним относятся активности протеаз, галактозидаз, глюкозидаз, липаз, хитиназ и фосфатаз (Teuber & Brodisch, 1977; Boczar et al. , 1992; Nybroe et al. , 1992). Связанная с поверхностью активность большинства этих ферментов может быть визуализирована с использованием подхода ELF ® 97 (ферментно-меченая флуоресценция, молекулярные зонды). Принцип заключается в том, что после гидролиза нефлуоресцирующего конъюгированного субстрата он образует флуоресцентный осадок на поверхности бактерий, выделяющих экзофермент.Подход ELF использовался в сочетании с FISH с использованием олигонуклеотидных зондов, нацеленных на ген 16S рРНК, для идентификации различных продуцирующих экзофермент микроорганизмов в активном иле. Некоторые представители филума Bacteroidetes экспрессируют фосфатазы (Kloeke & Geesey, 1999), а некоторые Thiothrix sp. филаментов и филаментов Bacteroidetes обнаруживали как фосфатазную, так и эстеразную активности (Kragelund et al. , 2005). Нитчатая бактерия Microthrix parvicella экспрессирует липазы и, как полагают, участвует в гидролизе липидов (Nielsen et al., 2002). Однако не существует метода определения активности протеазы на поверхности организмов, гидролизующих белок (PHO), хотя протеаза является наиболее доминирующим экзоферментом в активном иле (Frolund et al. , 1995). Важно расширить наши знания о деградации белка и участвующих в нем микроорганизмах, потому что аминокислоты, полученные в результате гидролиза белка, являются важными источниками углерода и энергии для организмов, накапливающих полифосфаты, которые не только отвечают за удаление фосфора, но также участвуют в N -удаление путем денитрификации (Kong et al., 2004, 2005).
В этом исследовании мы протестировали метод окрашивания флуоресценцией in situ ферментом с использованием субстратов, меченных флуоресцеином (FL) BODIPY, для окрашивания PHO в активном иле с последующей их идентификацией с помощью зондирования FISH. Красители BODIPY представляют собой замещенные производные 4-бора-3a, 4a-диаза- s -индацена, и если они ковалентно связаны с белками, они образуют стабильные конъюгаты, в которых флуоресценция красителя BODIPY может быть почти полностью погашена. Погашенная флуоресценция высвобождается в присутствии протеаз (Jones et al., 1997). На основании этого меченные красителем субстраты BODIPY [казеин и бычий сывороточный альбумин (BSA)] были использованы для измерения протеазной активности чистых ферментов (Welder et al. , 2002), а в последнее время также непосредственно в чистых культурах Gram- отрицательный Porphyromonas gingivalis (Yoshioka et al. , 2003). Однако помимо осаждения флуоресцентного красителя BODIPY на поверхности P . gingivalis также сообщалось о некотором внутриклеточном поглощении флуоресцентных гидролизатов, вызывающем флуоресценцию бактериальных клеток (Yoshioka et al., 2003). Это означает, что связанная с поверхностью протеазная активность может быть визуализирована только на микроорганизмах, выделяющих протеазу (PHO) в сложных экосистемах, если флуоресцентные сигналы, возникающие в результате гидролиза казеина BODIPY FL и BSA, можно отличить от сигналов, вызванных поглощением флуоресцентных гидролизатов. В этой статье мы описываем, как доминирующие микроорганизмы, гидролизующие казеин и БСА, в активном иле идентифицируются с помощью нового подхода, основанного на флуоресценции in situ ферментного окрашивания субстратами BODIPY FL в сочетании с FISH.
Материалы и методы
Источники активного ила
Образцы активированного ила, использованные в этом исследовании, были взяты с пяти датских очистных сооружений, Aalborg West (AAV), Aalborg East (AAE), Egaa, Aabybro и Skagen, с февраля 2006 года по июль 2006 года. Aabybro — завод по удалению азота, состоящий из резервуары для нитрификации и денитрификации, в то время как другие также улучшили биологическое удаление фосфора с конфигурацией Biodenipho ® (Seviour et al., 1999). Завод в Скагене в основном очищает промышленные сточные воды от рыбной промышленности до объема, эквивалентного объему населения в 280 000 человек. Заводы в Ольборге Западный, Эгаа и Восточный Ольборг в основном обрабатывают бытовые сточные воды, обслуживающие общины с населением 220 000, 100 000 и 100 человек. 000 соответственно. Aabybro в основном обрабатывает бытовые сточные воды из небольших городов с общей численностью населения 9800 человек. Пробы свежего ила были взяты из резервуаров для нитрификации и переданы в лабораторию в течение 0.2–1 ч.
Белки BODIPY FL и условия инкубации
Казеин BODIPY FL в наборе для анализа протеазы EnzChek ® (E6638) и BODIPY FL BSA в специальной упаковке DQ ™ Green BSA (D-12050) были приобретены у Molecular Probe (VWR International, Roedovre, Дания). Все рабочие растворы были подготовлены в соответствии с рекомендациями поставщика. Инкубацию активного ила с субстратами BODIPY FL проводили в бутылях для сыворотки емкостью 10 мл, а конечный использованный реакционный объем составлял 600 мкл.Затем 400 мкл свежей смешанной жидкости активированного ила [4 г л -1 смешанной жидкости взвешенных веществ (MLSS)] переносили в 1,5-мл пробирки Эппендорфа и центрифугировали (4500 г в течение 10 мин). Супернатант отбрасывали. В зависимости от конечной концентрации субстрата добавляли различные количества свежеприготовленного 1 × Tris-HCl буфера (10 мМ, pH 7,8), и смешанный раствор переносили в бутыль для сыворотки объемом 10 мл, где к смеси добавляли рабочий раствор Казеин BODIPY FL или BSA до конечного объема 600 мкл.При необходимости добавляли ингибиторы азид натрия, фторацетат натрия (от Sigma-Aldrich Logistik Gmbh, Германия) и йодацетат натрия (от Merck KGaA, Дармштадт, Германия) (из 50-кратного концентрированного исходного раствора) в трех различных комбинациях ингибиторов. Первый набор включал йодацетат + фторацетат + азид в конечных концентрациях 2, 1 и 2 мМ соответственно, набор два 3, 2 и 4 мМ и набор три 4, 3 и 8 мМ (конечные концентрации, соответственно). После добавления всех реагентов флаконы с сывороткой сразу же заворачивали в алюминиевую бумагу, чтобы исключить свет, и перемешивали на вращающемся диске (220 об.вечера. при 20 ± 1 ° С). Если использовались ингибиторы, образцы ила инкубировали с ингибиторами в течение 20 минут перед добавлением казеина BODIPY FL или BSA.
В некоторых экспериментах предварительную инкубацию образцов активного ила с немеченым казеином или БСА проводили в колбах на 100 мл в аэробных условиях. Пятьдесят миллилитров свежего ила (4 г л -1 MLSS) инкубировали с 200-500 мг л -1 (конечная концентрация) казеинатом кальция (Arla Foods Company, Дания) или BSA (Sigma-Aldrich Logistik Gmbh) на вращающийся диск, качающийся при 220 р.вечера. при 20 ± 1 ° C в течение 1–4 или 12 ч и трижды промывали супернатантом исходного образца активного ила перед использованием для инкубации с меченым субстратом.
Микроскопическое исследование
Образцы активированного ила, инкубированные с субстратами BODIPY FL, распределяли на покрытых желатином трехлуночных (10–15 мкл в каждой лунках) предметных стеклах с тефлоновой печатью (Electron Microscopy Sciences, Hatfield, PA) в темной комнате и давали высохнуть на воздухе при температуре комнатная температура. Слайды были закреплены с помощью CITI fluor (Citifluor Ltd, Лондон, Великобритания) и исследованы под микроскопом.Флуоресцентные сигналы образцов ила, окрашенных казеином BODIPY FL и BSA (максимумы возбуждения / испускания c , 505/513 нм), были визуализированы и захвачены через фильтр FLUOS (возбуждение 450–490 нм, испускание 515 нм) эпифлуоресценции. микроскоп (Axioskop 2 Plus, Zeiss), оборудованный камерой с зарядовой парой (CCD) (CoolSNAP HQ, Photometrics, Оберкохен, Германия).
Ферментное окрашивание в сочетании с FISH
Окрашивание ферментов объединяли с зондированием FISH для идентификации PHO.Флуоресцентные сигналы окрашенных образцов ила исследовали, как описано выше. Бактериальные клетки, окрашенные на протеазы, выявляли микроскопически и регистрировали их положение на трехлуночных предметных стеклах, покрытых желатином. Фтор CITI на предметных стеклах смывали осторожным ополаскиванием (в течение 1 мин) 70% этанолом перед фиксацией либо в 4% параформадегиде (для грамотрицательных бактерий), либо в 50% этаноле (для грамположительных бактерий) в течение 2 часов. При необходимости предметные стекла для FISH-исследования грамотрицательных бактерий также фиксировали в 50% этаноле в течение 2 часов вместо параформальдегида.FISH проводился согласно Amann (1995). Использовали меченные Cy3 олигонуклеотидные зонды. FISH-сигналы интересующих бактерий исследовали после перемещения. Чтобы идентифицировать PHO, прикрепленные к нитчатым бактериям (эпифлора-PHO), обнаруженные казеином BODIPY FL и BSA, по меньшей мере 50 нитей эпифлоры в различных микроскопических полях исследовали с помощью FISH-зондирования в каждом образце ила. Было невозможно выполнить FISH перед ферментным анализом, поскольку процедура фиксации подавляла активность экзоферментов.
Применяли следующие олигонуклеотидные зонды: смесь EUB338 [смесь EUB338 (Amann et al. , 1990), EUB338II и EUB338III (Daims et al. , 1999)], нацеленная на большинство бактерий, CFX1223 (Bjornsson et al. al. , 2002) и GNSB941 (Gich et al. , 2001), нацеленные на большинство представителей типа Chloroflexi , CFX784 и CFX109 (Bjornsson et al. , 2002), нацеленные на некоторых представителей рода Anaerolinea и некоторые члены семейства Chloroflexaceae , соответственно, все в пределах филума Chloroflexi , CHL1851, нацеленного на нитчатую бактерию Eikelboom типа 1851 из рода Roseiflexus , тип Chloroflexi Thomsen (, 2004), нацеленный на Aquaspirillum -родственные бактерии в классе Betaproteobacteria , тип Proteobacteria , TM7-905 (Hugenholtz et al. , 2001), нацеленный на кандидат типа Micro TM7, MPA-645 parvicella 906 Candidella ‘в филуме Actinobacteria (Erhart et al. , 1997), CF319a плюс CF319b нацелены на группу Cytophaga — Flavobacteria в филуме Bacteroidetes (Manz et al., 1996), SAP-309, нацеленный на большинство представителей Saprospiraceae в филуме Bacteroidetes (Schauer & Hahn, 2005), PAOmix (смесь PAO651, PAO846 и PAO432), нацеленный на родственные бета-протеобактерии -90- аккумулирующие организмы (PAO) (Crocetti et al. , 2000) и GB, нацеленные на группу GB гликоген-накапливающих организмов (GAO) в классе Gammaproteobacteria (Kong et al. , 2002).Подробная информация обо всех этих пробах дана в probeBase (Loy et al. , 2003). Все использованные зонды были помечены Cy3, за исключением EUB338mix, который был помечен FLUOS.
Определение процентного содержания нитчатых PHO в группе или типе зонда
Процент нитевидных PHO в определенной зондом группе или типе образца ила определяли путем подсчета количества нитевидных PHO среди по крайней мере 50 нитей, гибридизующихся с конкретным зондом.Для этого сначала регистрировали положения нитевидных PHO в различных микроскопических полях с последующим зондированием FISH с помощью специального зонда. Каждый подсчет повторяли три раза с использованием разных образцов ила, и процентные значения, полученные для каждого образца ила, выражали в виде процентного диапазона (таблица 1).
1Идентификация нитчатых PHO, окрашенных казеином BODIPY FL и BSA, с помощью FISH-зондирования на очистных сооружениях
| Название зонда | Специфичность | PHO и их присутствие на разных заводах | ||||||||||||
| AAV | EgaaAabybro | |||||||||||||
| TM7-905 | Тип-кандидат TM7 | + * | +++ * | — | ++ * | ++ | ++ | ++ | ++ | |||||
| CFX784 | Некоторые представители рода Anaerolinea , тип Chloroflexi | — † | ||||||||||||
| CHL1851 | Тип 1851 рода Roseiflexus , тип 906 39 Chloroflexi | — | — | — | — | |||||||||
| CFX109 | Семейство Chloroflexales , тип Chloroflexi | + b | Cytophaga – Flavobacteria группа, тип Bacteroidetes | — | — | — | — | |||||||
| MPA-645 | Microvicella парвицилла — | — | — | |||||||||||
| Aqs997 | Aquaspirillum -связанные бактерии, тип Proteobacteria | ++ | ++ | +++ | +++ | Название зонда | Специфичность | PHO и их наличие в разных пл. муравьи | ||||||
| AAV | AAE | Egaa | Aabybro | |||||||||||
| TM7-905 | Тип кандидата TM7 | 31 | GNSB941 и CFX1223 | Большинство членов типа Chloroflexi | ++ | ++ | ++ | ++ | ||||||
| CFX784 | Некоторые представители рода Chloroflexi — † | — | — | — | ||||||||||
| CHL1851 | Тип 1851, представители рода Roseiflexus , тип Chloroflexi | — | — | 319 | 9 Семья Chloroflexales , тип Chloroflexi | — | — | — | +++ | |||||
| CF319a + b | Cytophaga – Flavobacteria группа , тип Bacteroidetes | — | — | — | — | MPA- | MicroMPA- | тип Актинобактерии— | — | — | — | |||
| Aqs997 | Aquaspirillum родственные бактерии, тип Proteobacteria | ++ ++|||||||||||||
Идентификация нитчатых PHO, окрашенных казеином BODIPY FL и BSA, с помощью FISH-зондирования на очистных сооружениях
| Название зонда | Специфичность | PHO и их присутствие на различных заводах | |||||||||
| AAV | AAE | Egaa | Aabybro | ||||||||
| TM7-905 | Тип-кандидат TM7 | + * | +++ * | — | ++ * | ||||||
| GNSB941 & CFX1223 | Большинство членов группы | ++ | ++ | ++ | |||||||
| CFX784 | Некоторые представители рода Anaerolinea , тип Chloroflexi | — † | — | — | — | Тип 1851 рода Roseiflexus , тип Chloroflexi | — | — | — | — | |
| CFX109 | Семейство Chloroflexales 9024 — 9031 9024 — phyloflexales — 9031 | +++ | |||||||||
| CF319a + b | Cytophaga – Flavobacteria группа , тип 90 639 Bacteroidetes | — | — | — | — | ||||||
| MPA-645 | Microthrix parvicella , тип Actinobacteria | 824831831 831907 | Aquaspirillum -родственные бактерии, тип Proteobacteria | ++ | ++ | +++ | +++ | ||||
| Название зонда | на разных заводах|||||||||||
| AAV | AAE | Egaa | Aabybro | ||||||||
| TM7-905 | Тип кандидата TM7 | + * | —3131|||||||||
| GNSB941 & CFX1223 | Большинство членов типа Chloroflexi | + + | ++ | ++ | ++ | ||||||
| CFX784 | Некоторые представители рода Anaerolinea , тип Chloroflexi | — † | — | — † | — | CHL1851 | Тип 1851 рода Roseiflexus , тип Chloroflexi | — | — | — | — |
| CFX109 | |||||||||||
| CFX109 | семейство Chloroflex Chloroflex | — | +++ | ||||||||
| CF319a + b | Цитофаги – флавобактерии группа, тип Bacteroidetes | — | — | — | — | MP4 Microthrix parvicella , тип Актинобактерии— | — | — | — | ||
| Aqs997 | Aquaspirillum -связанные бактерии, тип Proteobacteria | ++ | ++ | +++ | +++ | Биологический объем эпифлоры-PHOs был определен с помощью FISH на очень тонком слое биомассы путем измерения процентного соотношения площади флуоресценции с помощью зонда SAP-309 по сравнению спроцент площади флуоресценции зондом EUBmix в том же микроскопическом поле. Биологические объемы нитчатых и кокковидных PHO были предварительно оценены путем измерения процентной доли флуоресцентной площади, вызванной нитевидными PHO и кокковидными PHO, соответственно, после окрашивания ферментом (путем тщательного выбора полей с в основном нитчатыми или кокковидными PHO) по сравнению с процентное соотношение площади флуоресценции с помощью EUBmix после перемещения. По крайней мере, 10 микроскопических полей (× 1000) были проанализированы для каждого подсчета по сравнению с исходными полями. РезультатыПрименение и оптимизация субстратов BODIPY FL в образцах активного илаДва субстрата BODIPY FL, казеин BODIPY FL и BSA, были применены в этом исследовании для определения активности протеаз в активном иле. Казеин BODIPY FL был сначала нанесен на образцы ила с завода AAV в соотношении 1: 1 [биомассу в 300 мкл образца ила (4 г л -1 MLSS) ресуспендировали в 1-кратном буфере для разложения до исходного объема + 300 мкл рабочего раствора казеина BODIPY FL] на основе протокола, рекомендованного поставщиком.Для BODIPY FL BSA не было предусмотрено протокола, поэтому он также использовался в соответствии с протоколом, предложенным для казеина. После 1 ч инкубации с казеином BODIPY FL или BSA при конечной концентрации субстрата 2,50 мг. -1 MLSS некоторые флуоресцентно меченые бактериальные клетки были видны под микроскопом. В основном это были крупные коккобациллы, некоторые нитчатые бактерии и некоторые эпифитные бактерии, прикрепленные к нитчатым бактериям, но также наблюдался сильный фон флуоресценции. Флуоресцентные клетки и фон не наблюдались в контрольных образцах, обработанных при 100 ° C в течение 15 минут, что указывает на то, что казеин и BSA в необработанных образцах гидролизуются с высвобождением продуктов, меченных красителем BODIPY.Тот же тест был повторен для образцов ила с заводов AAE, Abybro, Egaa и Skagen, и были получены аналогичные результаты. Эти первоначальные эксперименты показали, что субстраты BODIPY FL могут использоваться для маркировки или окрашивания PHO и / или потребителей флуоресцентных гидролизатов в активном иле. Чтобы найти оптимальное время инкубации, чтобы флуоресцентно окрашенные клетки можно было наблюдать на низком фоне, микроскопическое исследование окрашенных образцов проводили каждые 15 минут в течение 180 минут.В период наблюдения наблюдалось преобладание флуоресцирующих клеток разных морфотипов. Через 10–15 мин многие прикрепленные бактерии на нитях (эпифлоре) (рис. 1а и б) и нитях разных морфотипов сильно окрашивались у всех пяти исследованных растений. Через 30–60 мин окрашивались и некоторые крупные коккобациллы, а некоторые эпифлоры становились более слабыми. Через 120 мин (до 180 мин) многие крупные коккобациллы сильно окрашивались. Уровень фоновой флуоресценции увеличивался со временем инкубации, но флуоресцентные клетки все еще можно было наблюдать после c .3 ч. Аналогичные результаты были получены при использовании казеина BODIPY FL или BSA. 1 Окрашивание флуоресцентным ферментом BODIPY и изображения активного ила с помощью FISH. Эпифлора, показанная на панели (а) (изображение в светлом поле), окрашена BODIPY FL BSA на панели (b) (флуоресцентное изображение). Эпифлора, окрашенная BODIPY FL BSA на панели (c) (флуоресцентное изображение), гибридизуется с генным зондом SAP-309 (нацеленным на большинство представителей Saprospiraceae в типе Bacteroidetes ) на панели (d) (изображение FISH).Масштабная линейка на панели (а) представляет 10 мкм на панелях (а) и (б). Масштабная линейка на панели (c) представляет 10 мкм на панелях (c) и (d). на панелях (c) и (d) одни и те же бактериальные клетки обозначены стрелками, обозначенными одним и тем же номером. 1 Окрашивание флуоресцентным ферментом BODIPY и изображения активного ила с помощью FISH. Эпифлора, показанная на панели (а) (изображение в светлом поле), окрашена BODIPY FL BSA на панели (b) (флуоресцентное изображение). Эпифлора, окрашенная BODIPY FL BSA на панели (c) (флуоресцентное изображение), гибридизуется с генным зондом SAP-309 (нацеленным на большинство представителей Saprospiraceae в типе Bacteroidetes ) на панели (d) (изображение FISH).Масштабная линейка на панели (а) представляет 10 мкм на панелях (а) и (б). Масштабная линейка на панели (c) представляет 10 мкм на панелях (c) и (d). на панелях (c) и (d) одни и те же бактериальные клетки обозначены стрелками, обозначенными одним и тем же номером. Чтобы отличить PHO от потребителей гидролизата, которые также могут флуоресцировать из-за поглощения флуоресцентных гидролизатов, в инкубации добавляли различные метаболические ингибиторы, чтобы предотвратить поглощение и гарантировать, что все окрашенные красителем BODIPY бактерии были PHO (казеиновые или казеиновые). БСА-гидролизующие микроорганизмы).Йодацетат, фторацетат и азид добавляли для ингибирования гликолиза (Bickis & Quastel, 1965), цикла трикарбоновых кислот (TCA) (Peters et al. , 1953) и цепи переноса электронов (Myers & Nealson, 1988). Были протестированы три набора условий ингибитора: йодацетат + фторацетат + азид (см. Концентрации в разделе «Материалы и методы»). Все три набора дали одинаковые результаты при инкубации казеина BODIPY FL и BSA: только нитчатые бактерии, эпифлора и несколько коккобацилл были окрашены в течение 3 часов инкубации в активном иле на всех пяти очистных сооружениях.Это указывает на то, что эпифлора и некоторые нитчатые бактерии были основными PHO, способными гидролизовать казеин и BSA, в то время как большие коккобациллы, окрашенные при инкубации без добавления ингибиторов, вероятно, были потребителями гидролизатов (аминокислот или олигопептидов). Однако интенсивность флуоресценции, наблюдаемая для потенциальных PHO, снижалась по мере увеличения концентраций ингибитора, и при самых высоких концентрациях можно было наблюдать только слабые сигналы. Существенной разницы в уровне фоновой флуоресценции при разных концентрациях ингибитора не наблюдалось.Поэтому во всех экспериментах были добавлены метаболические ингибиторы средней концентрации для визуализации только PHO. Чтобы исключить возможность того, что для протеазной активности некоторых организмов, гидролизующих казеин или БСА, может потребоваться более длительное время индукции или что их протеазная активность in situ будет слишком слабой для обнаружения в течение 3 часов инкубации с окрашиванием ферментов, предварительная инкубация с немеченый казеин или BSA проводили перед инкубацией с субстратом BODIPY FL для индукции или усиления протеазной активности всех потенциальных PHO.Были протестированы периоды преинкубации 1–4 или 12 ч в аэробных условиях. Результаты показали, что одни и те же морфотипы по-прежнему окрашивались в образцах ила от всех исследованных растений, что указывает на то, что основные организмы, гидролизующие казеин и БСА, окрашивались через 10–180 мин инкубации, что делало предварительную инкубацию ненужной. Это также означало, что другие микроорганизмы в активном иле не могли быть индуцированы продуцировать протеазу в течение этих периодов времени. Чтобы получить сильный флуоресцентный сигнал PHO и низкий уровень фоновой флуоресценции, концентрация субстрата казеина BODIPY FL и BSA была оптимизирована путем микроскопического исследования отношения сигнал / шум при различных концентрациях субстрата (0.25, 0,50, 0,63, 0,75, 1,00, 1,25, 1,50, 1,88 и 2,50 мг г -1 MLSS) с использованием образцов ила из AAV и Egaa. Флуоресцентно меченые клетки гидролиза казеина и БСА можно было наблюдать при таких низких концентрациях, как 0,5 мг. -1 MLSS после всего лишь 10 мин инкубации. Флуоресцентные сигналы от клеток и от фона увеличивались с концентрацией субстрата, и было обнаружено, что оптимальные концентрации составляют от 0,50 до 1,25 мг г -1 MLSS после 15-30 мин инкубации.Изменение условий инкубации не повлияло на морфотипы РНО, окрашенные в течение 3 ч инкубации. Идентификация PHO в различных растениях с использованием ферментативного окрашивания в сочетании с FISHFISH-зондирование с использованием различных олигонуклеотидных зондов было использовано для идентификации PHO и потребителей гидролизата. Нитевидные PHO, окрашенные казеином BODIPY FL и BSA, были филогенетически разнообразны и включали бактерии из разных типов (таблица 1). Они включали нитчатые бактерии, принадлежащие к типу-кандидату TM7, гибридизующемуся с зондом TM7-905, типу Chloroflexi , гибридизующемуся со смешанным зондом GNSB941 и CFX1223, и классу Betaproteobacteria , гибридизующемуся с зондом Aqs997, нацеленным на Aquaspirillum , но они-релевантные бактерии. не включали нитчатые бактерии, принадлежащие к группе Cytophaga — Flavobacteria внутри филума Bacteroidetes , гибридизующегося со смесью CF319a и CF319b.Некоторые из нитчатых PHO также гибридизовались с более специфическим зондом Chloroflexi CFX109, нацеленным на семейство Chloroflexaceae , но ни один из них не гибридизировался с зондом CHL1851, специфически нацеленным на Eikelbooms типа 1851, и зондом CFX784, нацеленным на некоторых представителей рода Anaerolinea . На большинстве растений присутствовало много актинобактериальных нитчатых Candidatus « Microthrix parvicella » (нацеленных зондом MPA-645), но они не окрашивались казеином BODIPY FL или BSA.Доли нитчатых PHO в определенной зондом группе или типе также определялись с использованием BODIPY FL BSA, и результаты также представлены в таблице 1. На всех исследованных растениях 10-50% нитчатых бактерий, принадлежащих к типу Chloroflexi , гибридизирующийся со смесью зондов GNSB941 и CFX1223, представлял собой PHO. В Aabybro более 50% нитей Chloroflexaceae , гибридизующихся с CFX109 (присутствующих только в Aabybro), были PHO. Несколько родственных Aquaspirillum нитей, гибридизующихся с Aqs997, были PHO в растениях AAV и AAE (10–50%), и более 50% участвовали в гидролизе белка в Egaa и Aabybro.Фракция PHO нитей типа TM7, гибридизующихся с зондом TM7-905, значительно варьировала у разных растений: 10–50% у Aabybro, выше у AAE (> 50%), ниже у AAV (<10%) и отсутствует у Egaa. Все нитчатые PHO, за исключением TM7 PHO, которые не были обнаружены на Egaa, присутствовали на всех исследованных растениях. Были исследованы биологические объемы различных нитчатых РГО (табл. 2), и они составили 1–5% от общего бактериального биомера. 2Обилие различных морфотипов PHO на четырех очистных сооружениях
Обилие различных морфотипов PHO на четырех очистных сооружениях
| |||||
