Лейцин как незаменимая аминокислота — Справочник химика 21
Приведите структурные формулы следующих незаменимых аминокислот а) (Ч-)-валина б) (—)-лейцина в) ( + )-изо-лейцина г) ( + )-лизина д) (— )-треонина е) (—)-метионина [c.213]Человеческое тело может синтезировать 12 из 20 аминокислот. Остальные восемь должны поступать в организм в готовом виде вместе с белками пищи, поэтому они называются незаменимыми. Незаменимые аминокислоты включают изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин и (для детей) гистидин. При ограниченном поступлении такой аминокислоты в организм она становится лимитирующим веществом при построении любого белка, в состав которого она должна входить. Если такое случается, то единственное, что может предпринять организм, — это разрушить собственный белок, содержащий эту же аминокислоту. [c.262]
В состав природных белков обычно входят следующие аминокислоты аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глицин, глутаминовая кислота, гистидин, глутамин, изолейцин, лейцин, лизин, метионин, оксипролин, пролин, серии, тирозин, треонин, триптофан и валин.

Несмотря на то что в состав белков человеческого организма и вхог дят все аминокислоты, перечисленные в табл. 14.1, однако отнюдь не все они должны обязательно содержаться в пище. Экспериментально доказано, что для человека существенное значение имеют девять аминокислот. Такими незаменимыми аминокислотами являются гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Все остальные аминокислоты, которые называют зал1еныл1ьши аминокислотами, человеческий организм способен вырабатывать сам.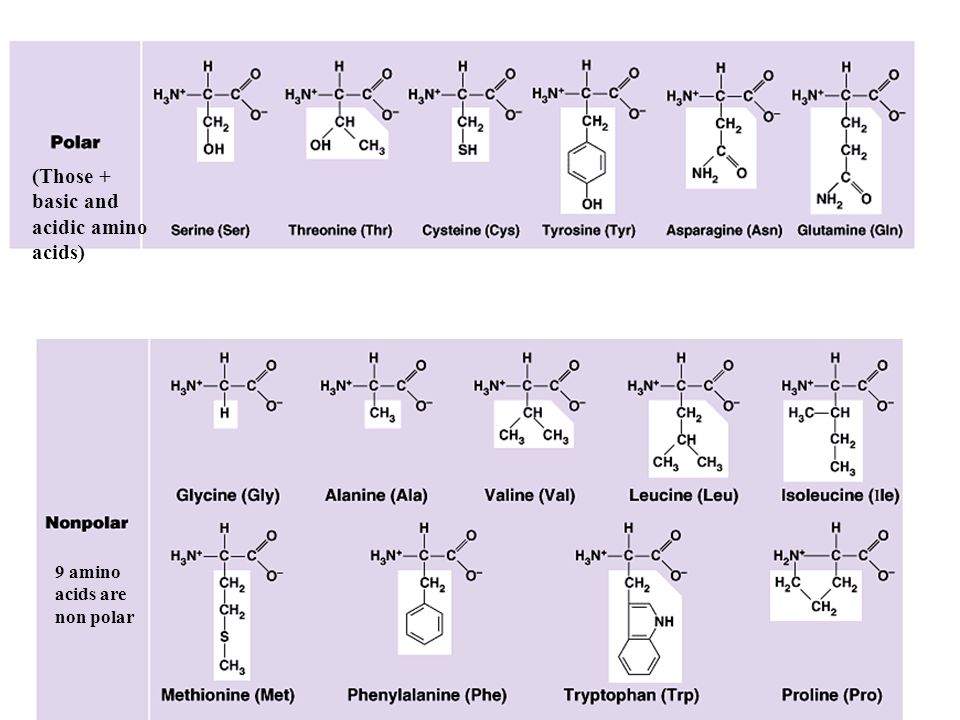
ТЫ — аминокислоты, которые не синтезируются в организме. Содержание их в пищевых продуктах необходимо для роста, развития и поддержания нормального физиологического состояния человека, животных и некоторых микроорганизмов. Аминокислоты, которые могут синтезироваться в организме, называются заменимыми аминокислотами. Основным источником аминокислот являются белки, которые расщепляются в н елу-дочно-кишечном тракте до аминокислот. Белки, в состав которых входят все Н. а., называются полноценными белки, которые не содержат хотя бы одну из незаменимых аминокислот, являются неполноценными. Н. а. богаты животные белки — молоко, мясо. Н. а. для человека и всех животных являются восемь аминокислот лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валии, изолейцин. Для роста молодых крыс, кроме того, необходим еще аргинин для роста цыплят необходимо до 15 аминокислот.
Необходимость их для животных и человека объясняется тем, что в животных организмах не могут синтезироваться соответствующие кетокислоты с разветвленной цепью. У растений же эти кетокислоты образуются довольно легко. Если при кормлении животных вместо валина, лейцина и изолейцина в рацион вводить соответственно а-кетоизовалериановую, а-кето-изокапроновую и а-кето-р-метилвалериановую кислоты, то организм полностью или почти полностью удовлетворяет свою потребность в незаменимых аминокислотах. Схемы реакций переаминирования, приводящие к образованию валина, лейцина и изолейцина, показаны ниже. Они являются общими как для растений, так и для животных
Как указывалось ранее, незаменимые аминокислоты не синтезируются в организме человека и животных, их необходимо включать в состав пищи для обеспечения оптимального роста и для поддержания азотистого баланса.

Необходимо подчеркнуть, что морковь, кроме каротиноидов, содержит важный набор незаменимых аминокислот (лизин, метионин, лейцин, треонин), а также бетаин (300 мг%), холин (11 мг%). Последние обладают липотропным действием и участвуют в биосинтезе метионина, фосфолипидов и в кроветворении. [c.398]
Для жизнедеятельности организма человека н животных необходимы белки, жиры и углеводы, являющиеся пластическими и энергетическими материалами, а также минеральные соли н витамины. Среди жиров и продуктов гидролиза белков имеются незаменимые органические вещества, поступление которых должно обеспечиваться с пищей, так как они не синтезируются организмом. По-видимому, по мере эволюционного развития животного мира отдельные виды постепенно теряли способность к биосинтезу некоторых простых органических соединений, участвующих в метаболических процессах, так как более эффективным для организма путем они могли получить их из окружающей органической природы — растений и микроорганизмов или с животной пищей.
Исключение какой-либо незаменимой аминокислоты из пищевой смеси сопровождается развитием отрицательного азотистого баланса, истощением, остановкой роста, нарушениями функции нервной системы и др. В опытах на крысах были установлены следующие величины незаменимых аминокислот, необходимых для оптимального роста, относительно триптофана, принятого за единицу лизина 5 лейцина 4 валина 3,5 фенилаланина 3,5 метионина 3 изолейцина 2,5 треонина 2,5 гистидина 2  414]
414]
Аминокислоты, которые не синтезируются в результате биохимических превращений в организме (и поэтому организм получает их исключительно с пищей), называются незаменимыми аминокислотами. Для человека это валин, лейцин, изолейцин, лизин, метионин, треонин, фенилаланин и триптофан. [c.187]
Незаменимые аминокислоты не синтезируются в организме животных и должны поступать извне — с пищей. К ним относятся гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин и аргинин. Организм некоторых животных обладает способностью синтезировать, хотя и недостаточно быстро, аргинин, необходимый для нормального роста. [c.23]
Белок семян подсолнечника характеризуется недостатком лизина и беднее некоторыми незаменимыми аминокислотами (треонин, изолейцин, лейцин, ароматические аминокислоты) по сравнению с соевым белком (табл. 12.7). Наоборот, он значительно богаче последнего серосодержащими аминокислотами и не имеет [c.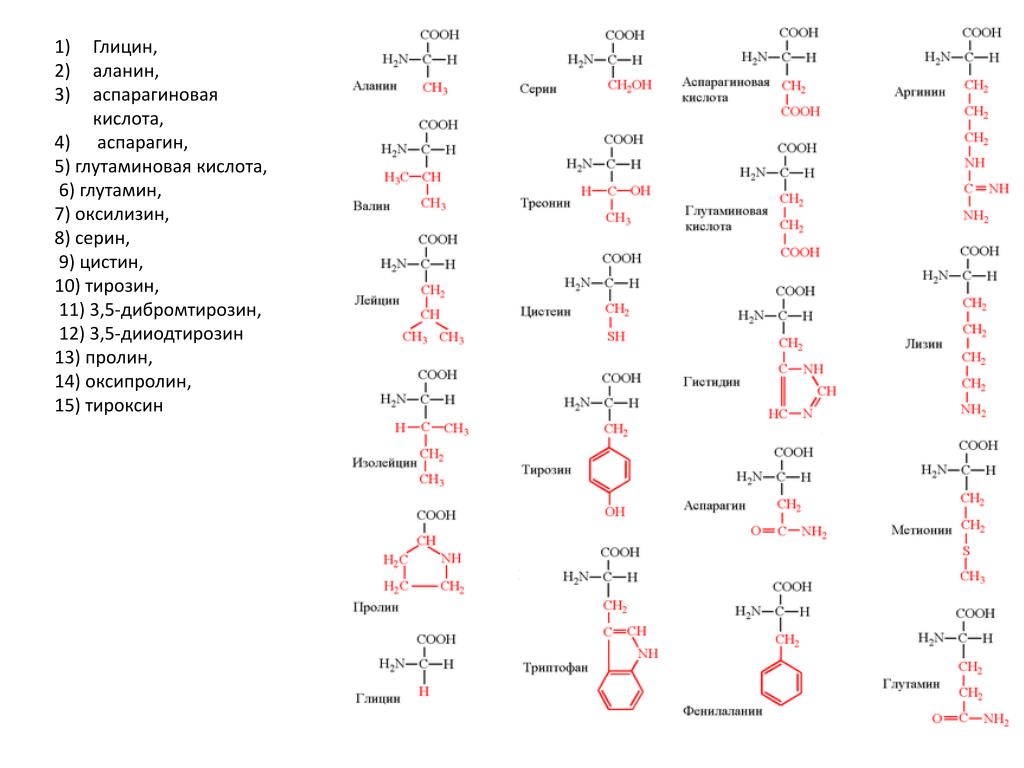 584]
584]
В процессе пищеварения Б. подвергаются гидролизу до аминокислот, к-рые и всасываются в кровь. Пищ ценность Б. зависит от их аминокислотного состава, содержания в них т. наз. незаменимых аминокислот, не синтезирующихся в организмах (для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин). В питательном отношении растит. Б. менее ценны,
Белки сами по себе не являются незаменимыми компонентами рациона человека. Для нормального питания необходимы лишь содержащиеся в них незаменимые аминокислоты (табл. 26-10). Для взрослых людей незаменимыми являются девять аминокислот, суточная потребность в которых варьирует от 0,5 г (для триптофана) до 2 г (для лейцина, фенил- [c.823]
Широкое распространение реакций переаминирования и участие в йих многочисленных аминокислот свидетельствуют о существенном значении этих реакций в обмене веществ. Роль реакций переаминирования в процессах окислительного дезаминирования L-аминокислот и мочевинообразования у млекопитающих рассмотрена выше (стр. 171). Возможность замещения незаменимых а-аминокислот в пищевом рационе растущих животных соответствующими кетокислотами определяется наличием в организме активных трансаминаз (стр. 137). Сравнительно недавно было показано, что молодые крысы растут примерно с одинаковой скоростью при кормлении синтетической диетой, содержащей 10 незаменимых аминокислот и глутаминовую кислоту, и рационом, в котором 5 незаменимых аминокислот (лейцин, изолейцин, валин, фенилаланин и метионин) заменены соответствующими кетокислотами и эквивалентным источником азота [321]. Эти данные свидетельствуют о том, что общая активность трансаминаз в организме крысы очень велика поскольку для синтеза белков необходимо одновременное присутствие всех аминокислот, приведенные выше факты говорят о том, что указанные пять а-кетокислот быстро подвергаются переаминированию. [c.
Роль реакций переаминирования в процессах окислительного дезаминирования L-аминокислот и мочевинообразования у млекопитающих рассмотрена выше (стр. 171). Возможность замещения незаменимых а-аминокислот в пищевом рационе растущих животных соответствующими кетокислотами определяется наличием в организме активных трансаминаз (стр. 137). Сравнительно недавно было показано, что молодые крысы растут примерно с одинаковой скоростью при кормлении синтетической диетой, содержащей 10 незаменимых аминокислот и глутаминовую кислоту, и рационом, в котором 5 незаменимых аминокислот (лейцин, изолейцин, валин, фенилаланин и метионин) заменены соответствующими кетокислотами и эквивалентным источником азота [321]. Эти данные свидетельствуют о том, что общая активность трансаминаз в организме крысы очень велика поскольку для синтеза белков необходимо одновременное присутствие всех аминокислот, приведенные выше факты говорят о том, что указанные пять а-кетокислот быстро подвергаются переаминированию. [c. 233]
233]
В тесной связи с вопросом о биологической ценности белка находится представление о так называемых жизненно необходимых, или незаменимых, аминокислотах. Значение определенных аминокислот для нормального роста было выяснено в опытах на людях и некоторых животных. В этих опытах потребность в белках удовлетворялась смесью чистых аминокислот, из которой исключались те или иные аминокислоты, и, в зависимости от того, тормозился при этом рост или совершался нормально, делали вывод о значении исследуемых аминокислот для роста. Так, было установлено, что жизненно необходимыми (незаменимыми) аминокислотами для роста крыс являются следующие 10 аминокислот валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин, гистидин, аргинин (рис. 40 и 41). Незаменимость указанных аминокислот для роста, видимо, связана с тем, что организм неспособен их синтезировать. Они должны быть введены извне вместе с пищей. Скорость синтеза аргинина, который может быть синтезирован в организме, невелика. Поэтому при отсутствии аргинина в пище рост не прекращается, но идет медленнее, чем при наличии аргинина. Отсутствие в пище остальных аминокислот (например, гликокола, аспарагиновой кислоты) не влияет на рост, так как организм способен их синтезировать. [c.308]
Поэтому при отсутствии аргинина в пище рост не прекращается, но идет медленнее, чем при наличии аргинина. Отсутствие в пище остальных аминокислот (например, гликокола, аспарагиновой кислоты) не влияет на рост, так как организм способен их синтезировать. [c.308]
Качественным эмиссионным анализом установлено содержание в соке следующих микроэлементов кальций, натрий, медь, магний, алюминий, кремний и титан. В наибольшем количестве содержатся магний, а затем кальций. Хроматографией на бумаге исследован аминокислотный состав сока [17]. Состав свободных аминокислот сока (мг%) цистеин — 5S0, а-аланин — 80, фенилаланин — 72, лейцин — 96. Из них фенилаланин и лейцин являются незаменимыми аминокислотами [16]. [c.374]
При биологическом синтезе белка в полипептидную цепь включаются остатки 20 аминокислот (в порядке, задаваемом генетическим кодом организма), а также их производных. Среди них есть такие, которые не синтезируются или синтезируются в недостаточном количестве самим организмом и вводятся в организм вместе с пищей эти вещества называются незаменимыми аминокислотами. К йим относятся (указаны в порядке уменьшающейся для человека потребности) лейцин, лизин, валик, фенилаланин, метионин, гистидин, триптофан, аргинин, треонин, изолейцин. [c.549]
К йим относятся (указаны в порядке уменьшающейся для человека потребности) лейцин, лизин, валик, фенилаланин, метионин, гистидин, триптофан, аргинин, треонин, изолейцин. [c.549]
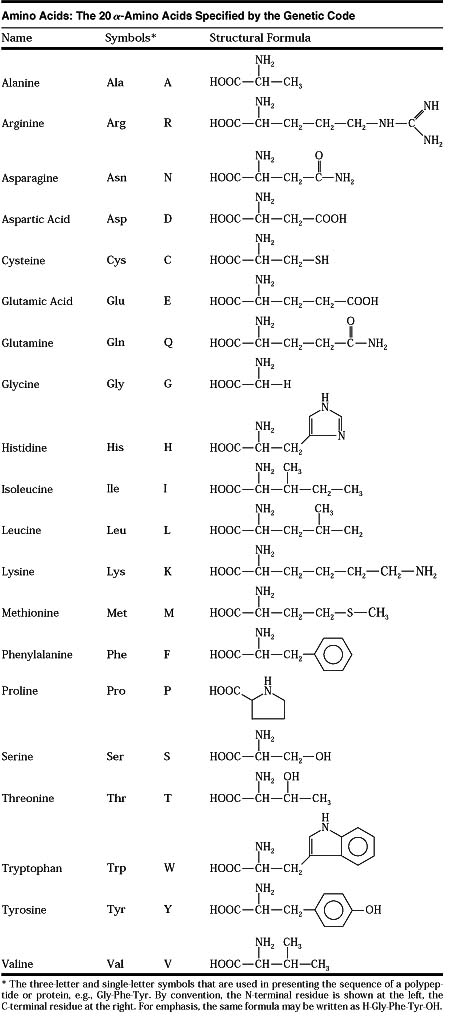
Для написания отдельных а-аминокислот (и их остатков) часто применяют сокращенные обозначения, представляющие собой первые три латинские буквы тривиального названия (см. табл. 3.3.1) [3.3.1]. Из природных аминокислот для нормального питания человека наиболее важны следующие восемь аминокислот (незаменимые аминокислоты, Розе, 1935 г.) фенилаланин, треонин, метионин, валин, лейцин, изолейцин, лизин и триптофан. [c.650]
Как известно, для синтеза белков и других биохимических реакций организм использует исключительно аминокислоты, а не белки, поступающие с пищей. Некоторые аминокислоты, необходимые для роста и нормального функционирования животных организмов, потребляются готовыми из пиш.н, так как скорость их синтеза отстает от скорости расхода. Такие аминокислоты называются незаменимыми аминокислотами, к ним относятся валив, лейцин, изолейцин, фенилаланин, аргинин, треонин, метионин, лизин, триптофан, гистидин. [c.261]
[c.261]
Хотя в состав белков человеческого организма и входят все аминокислоты, перечисленные в табл. 24.1, однако отнюдь не все они должны содержаться в пище. Экспериментально доказано, что для человека существенное значение имеют девять аминокислот. Такими незаменимыми аминокислотами являются гистидин, лизин, триптофан, фенилаланин, лейцин, изолейцин, треонин, метионин и валин. Человеческий организм, по-видимому, способен вырабатывать все остальные аминокислоты, которые называются необязательными аминокислотами. Некоторые организмы, обычно считающиеся более простыми, чем человек, значительно эффективнее вырабатывают все перечисленные аминокислоты из неорганических исходных веществ. Такой способностью обладает, например, красная хлебная плесень. В процессе эволюционного развития организмы утрачивают способность производить (с помощью ферментов) жизненно важные вещества, которые могут поступать в организм вместе с пищей. [c.677]
Лейцин — а-аминоизокапроновая кислота (СНз)2-СН-СН2- H (Nh3)-СООН.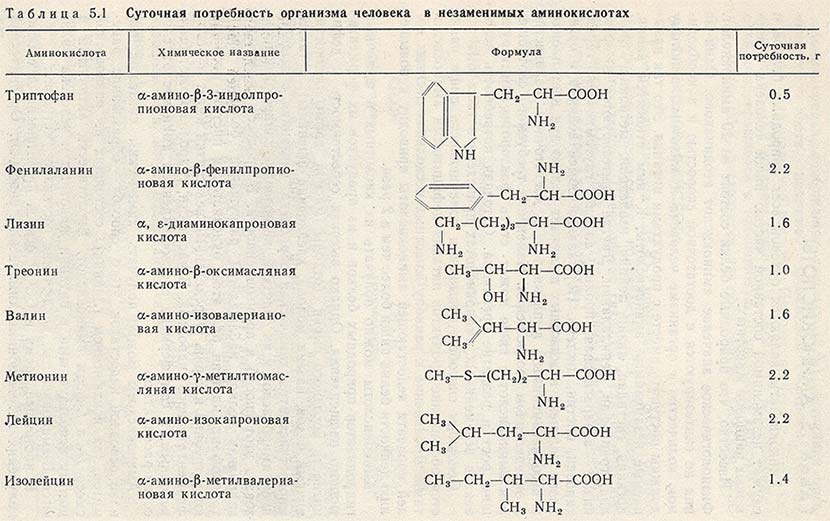 Левовращающий изомер лейцина входит в состав животных и растительных белков в количестве 10— 20%. Кристаллизуется в виде блестящих пластинок. Плохо растворим в воде. Незаменимая аминокислота. [c.80]
Левовращающий изомер лейцина входит в состав животных и растительных белков в количестве 10— 20%. Кристаллизуется в виде блестящих пластинок. Плохо растворим в воде. Незаменимая аминокислота. [c.80]
Организм человека ограничен в своих возможностях превращать одну аминокислоту в другую. Превращение происходит в печени с помощью процессов транс-аминирования. Посредством трансаминаз аминогруппы переносятся с одной молекулы на другую. В то же время существуют аминокислоты, синтез которых в организме невозможен, и они должны быть получены с пищей это так называемые незаменимые аминокислоты лейцин, изолейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин (для роста детей незаменимой аминокислотой является также гистидин). Только при поступлении таких аминокислот возможно со-.хранить азотистое равновесие. [c.7]
Древесная зелень по химическому составу сходна с травой, но содержит меньше каротина В расчете на сухую массу в хвое содержится 6—12% протеина и нуклеиновых кислот, 70—80 % углеводов В состав протеина древесной зелени входят около 20 аминокислот, в том числе лизин, лейцин, изолейцин, валин и другие незаменимые аминокислоты Поэтому витаминная мука, получаемая путем измельчения и высушивания древесной зе лени, является эффективной белково витаминной добавкой к корму для скота и птицы По питательной ценности древесная зелень сходна с пшеничной и ржаной соломой Однако надо иметь в виду, что древесная зелень в отличие от травы содер жит алкалоиды, смолистые и дубильные вещества, поэтому [c. 333]
333]
Разработан новый подход, с помошью которого можно будет обеспечивать крупный рогатый скот белком, обогашенным незаменимыми аминокислотами. Простое добавление белков в корм — дорогостоящий и не особенно эффективный способ, поскольку белки и аминокислоты разрушаются бактериями рубца еще до того, как животное успеет их использовать. Кроме того, основное количество белка они получают не с кормом его поставляют присутствующие в рубце микроорганизмы. Рацион животных можно обогатить, если направленно модифицировать эти бактерии. Для этого сначала был синтезирован белок с высоким содержанием остатков метионина, треонина, лизина и лейцина. Он состоял из 100 аминокислот, 57 из которых были незаменимыми, и имел стабильную а-спираль-ную конфигурацию. Затем с помощью 14 частично перекрывающихся олигонуклеотидов синтезировали его ген и сшили его с геном бел- [c.302]
В рационах сельскохозяйственных животных должно быть до 90—110 г перевариваемого протеина на 1 кормовую единицу. В грубых кормах его содержится не более 50—75 г, поэтому углеводсодержащие корма, несбалансированные по количеству и составу белка, используются нерационально. Кормовые дрожжи — необычный источник белка в рационах животных, они повышают биолог11ческую ценность белков других кормов вследствие того, что содержат не менее 20 аминокислот и все незаменимые аминокислоты (валин, лизин, лейцин, изолейцин, треонин, метионин, фенилаланин и триптофан). [c.369]
В грубых кормах его содержится не более 50—75 г, поэтому углеводсодержащие корма, несбалансированные по количеству и составу белка, используются нерационально. Кормовые дрожжи — необычный источник белка в рационах животных, они повышают биолог11ческую ценность белков других кормов вследствие того, что содержат не менее 20 аминокислот и все незаменимые аминокислоты (валин, лизин, лейцин, изолейцин, треонин, метионин, фенилаланин и триптофан). [c.369]
На основании главным образом опытов с отложением гликогена в печени при голодании пришли к заключению, что из незаменимых аминокислот лизин, метионин и лейцин не обладают способностью превращаться в углеводы в животном организме. [c.380]
Некоторые из аминокислот, входящих в состав бел ков, могут быть образованы из других близких по строению аминокислот, но имеется 8 так называемых незаменимых аминокислот, которые не могут быть получены в организме из других аминокислот и обязательно должны содержаться в белках пищи. Белки, не содержащие достаточного количества незаменимых аминокислот, являются неполноценными. К незаменимым относятся следующие аминокислоты триптофан, фенилаланин, треонин, метионин, лизин, валин, лейцин и изолейцин (стр. 235—236). [c.460]
Белки, не содержащие достаточного количества незаменимых аминокислот, являются неполноценными. К незаменимым относятся следующие аминокислоты триптофан, фенилаланин, треонин, метионин, лизин, валин, лейцин и изолейцин (стр. 235—236). [c.460]
Белки в питательном рационе вполне могут быть заменены аминокислотами. Оказалось также, что часть необходимых аминокислот животные могут вырабатывать сами из других азотосодержащих органических соединений. Другую часть аминокислот организм синтезировать не в состоянии, они должны поступать в готовом виде, в составе белков пищи. Такие аминокислоты получили название незаменимых. К ним относятся лизин, триптофан, фенилаланин, валин, метионин, треонин, лейцин, изолейцин, гистидин, аргинин. Белковая пища должна покрывать не только общую потребность в аминокислотах, но и содержать необходимые количества незаменимых аминокислот. При недостаточном поступлении этих аминокислот нормальное существование организма нарушается. Так, например, белок кукурузы зеин не содержит лизина и почти не содержит триптофана. В опытах с животными, которые получали с пищей один только этот белок, наблюдалось похудание, несмотря на обильное кормление. Отсутствие в пище триптофана может быть причиной тяжелого заболевания глаз — катаракты. [c.401]
В опытах с животными, которые получали с пищей один только этот белок, наблюдалось похудание, несмотря на обильное кормление. Отсутствие в пище триптофана может быть причиной тяжелого заболевания глаз — катаракты. [c.401]
Все а-аминокислоты, входящие в состав белков, разделяются на заменимые и незаменимые. Аминокислоты, не синтезирующиеся в живом организме, получили название незаменимых аминокислот. Для человека и всех видов животных незаменимыми являются следующие девять аминокислот лизин, треонин, триптофан, метионин, гистидин, фенилаланин, лейцин, валин и изолейцин. [c.5]
Хим состав сухих Д к (в %) 45,6 белков, 35,2 безазо-тистых экстрактивных в-в, 9,7 воды, 1,5 жиров, 0,2 целлюлозы, 7,8 золы В 100 кг Д к содержится 40-50 кг перевариваемого белка, в состав к-рого входят все незаменимые аминокислоты, в т ч (в расчете на белок) 5-8% лизина, 5-8% лейцина, 4-7% валина, 3-6% изолейцина, 0,6-1,0% триптофана По биол ценности Д к не уступают таким белково-витаминным концентратам, как рыбная мука [c. 120]
120]
Аминокислоты, необходимые для функционирования живого организма, поступают готовыми с пищей или синтезируются самим организмом из компонентов, поступающих с пищей Первые называют незаменимьши аминокислотами Для человека незаменимыми аминокислотами являются валин изолейцин лейцин лизин метионин фенилаланин треонин триптофан [c.863]
Гистидин, лизин, триптофан, фенилаланин, лейцин, изолейцин, треонин, метионин и валин считаются незаменимыми аминокислотами для человека. Что означает это утверждение Какое зна шние для человеческого организма имеют другие аминокислоты. Почему казеин является погсноценным, а желатина неполноценным белком [c.501]
Для осуществления белкового синтеза, так же как и для других синтетических процессов, о которых мы говорили выше, необходима энергия в форме АТФ. Цикл лимонной кислоты поставляет эту энергию. Кроме того, синтез белка требует запаса мономерных единиц (или их предшественников) — приблизительно двадцати видов природных аминокислот. Большинство В1дсших животных, включая человека и крысу, синтезируют в достаточном количестве лишь около половины этих аминокислот остальные аминокислоты — аргинин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин — не могут быть синтезированы в самом организме они должны поступать с пищей и потому называются незаменимыми. Растения и большинство микроорганизмов, напротив, способны синтезировать все или почти все аминокислоты. Незаменимые аминокислоты помечены на фиг. 102 звездочкой. Предшественники для синтеза соединений обеих групп — заменимых аминокислот у животных и большей части аминокислот у других организмов — опять-таки поставляются циклом лимонной кислоты. [c.364]
Большинство В1дсших животных, включая человека и крысу, синтезируют в достаточном количестве лишь около половины этих аминокислот остальные аминокислоты — аргинин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин — не могут быть синтезированы в самом организме они должны поступать с пищей и потому называются незаменимыми. Растения и большинство микроорганизмов, напротив, способны синтезировать все или почти все аминокислоты. Незаменимые аминокислоты помечены на фиг. 102 звездочкой. Предшественники для синтеза соединений обеих групп — заменимых аминокислот у животных и большей части аминокислот у других организмов — опять-таки поставляются циклом лимонной кислоты. [c.364]
К числу аминокислот несиптезируемых или слишко — медленно синтезируе.мых в организме высших животных относятся валин, лейцин, изолейцин, треонин, метионин, фен-кпаланин, триптофан аргинин, лизин и гистидин., Эти аминокислоты доллсостав пищевых белков, ценность которых определяется именно наличием в них незаменимых аминокислот. [c.192]
[c.192]
Организмы заметно различаются по своей способности синтезировать de novo аминокислоты, из которых строятся их белки. Большинство микроорганизмов и растений синтезируют все необходимые им аминокислоты, но животные по большей части около половины необходимых им аминокислот синтезировать не способны. Поэтому применительно к животным можно разбить аминокислоты на две группы заменимые и незаменимые. Разграничение заменимых и незаменимых аминокислот возможно на основе различных эксиериментальных критериев. Исходя из обычных критериев, аминокислоту можно считать незаменимой, если ее приходится включать в состав пищи для обеспечения оптимального роста или для поддержания азотистого баланса. В норме у взрослого животного количество азота, выводимого из организма за сутки, должно быть равно количеству азота, поступившему в организм за тот же период. Классическими исследованиями Розе было показано, что для белых крыс незаменимыми являются следующие аминокислоты лейцин, изолейцин, валин, лизин, метионин, фенилаланин, триптофан, треонин, гистидин и аргинин. Первые восемь из перечисленных [c.431]
Первые восемь из перечисленных [c.431]
Прежде чем обосновать процесс извлечения ферментов из культур плесневых грибов, укажем, что в состав ферментов, как и других белков, входит 20 так называемых магических , или незаменимых, аминокислот, к которым относятся кислоты с алкильными радикалами — глицин, аланин, валин, лейцин, изолейцин ароматические аминокислоты — фенилаланин, тирозин гетероциклические— триптофан кислые — аспарагиновая и глютаминовая кислоты содержащие оксигруппы — серии, треонин, серусодержащие аминокислоты — цистин, цистеин, метионин пирролсодержащие аминокислоты — пролин, оксипролин. В основную группу аминокислот входят лизин, аргинин и гистидин. [c.35]
Белок картофеля имеет высокую биологическую ценность, так как в нем довольно много незаменимых аминокислот. По данным Рейосига, в состав белков клубней картофеля входит следующее количество незаменимых аминокислот (граммов на 100 г белка) лизин — 6,3, метионин — 2,2, фенилаланин — 6,3, триптофан — 1,9, треонин — 5,3, валин—6, лейцин + изолейцин— [c. 418]
418]
20 незаменимых аминокислот формулы
20 аминокислот: формулы, таблица, названия
Ни для кого не секрет, что человеку для поддержания жизнедеятельности на высоком уровне необходим белок – своеобразный строительный материал для тканей организма; в состав белков входят 20 аминокислот, названия которых вряд ли что-то скажут обычному офисному работнику. Каждый человек, особенно если говорить о женщинах, хоть раз слышал о коллагене и кератине – это протеины, которые отвечают за внешний вид ногтей, кожи и волос.
Аминокислоты – что это такое?
Аминокислоты (или же аминокарбоновые кислоты; АМК; пептиды) – органические соединения, на 16 % состоящие из аминов – органических производных аммония, — что отличает их от углеводов и липидов. Они участвуют в биосинтезе белка организмом: в пищеварительной системе под влиянием ферментов все белки, поступающие с едой, разрушаются до АМК. Всего в природе существует около 200 пептидов, но в построении организма человека участвуют всего 20 основных аминокислот, которые подразделяются на заменимые и незаменимые; иногда встречается и третий вид – полузаменимые (условно заменяемые).
Заменимыми называют те аминокислоты, которые как потребляются с продуктами питания, так и воспроизводятся непосредственно в теле человека из других веществ.
- Аланин – мономер большого числа биологических соединений и белков. Осуществляет один из главенствующих путей глюкогенеза, то есть в печени превращается в глюкозу, и наоборот. Высокоактивный участник метаболических процессов в организме.
- Аргинин – АМК, способная синтезироваться в организме взрослого, но не способная к синтезу в теле ребёнка. Содействует выработке гормонов роста и других. Единственный переносчик азотистых соединений в организме. Содействует увеличению мышечной массы и уменьшению жировой.
- Аспарагин – пептид, участвующий в азотном обмене. В ходе реакции с ферментом аспарагиназой отщепляет аммониак и превращается в аспарагиновую кислоту.
- Аспарагиновая кислота – принимает участие в создании иммуноглобулина, деактивирует аммиак. Необходим при сбоях в работе нервной и сердечно-сосудистой систем.

- Гистидин – используется для профилактики и лечения болезней ЖКТ; оказывает положительную динамику при борьбе со СПИДом. Уберегает организм от пагубного воздействия стресса.
- Глицин – нейромедиаторная аминокислота. Применяется в качестве мягкое успокоительное и антидепрессивное средство. Усиливает действие некоторых ноотропных препаратов.
- Глутамин – в большом объёме входит в состав гемоглобина. Активатор процессов восстановления тканей.
- Глутаминовая кислота – обладает нейромедиаторным действием, а также стимулирует метаболические процессы в ЦНС.
- Пролин – является одним из составляющих практически всех протеинов. Им особенно богаты эластин и коллаген, отвечающие за эластичность кожи.
- Серин – АМК, что содержится в нейронах головного мозга, а также способствует выделению большого количества энергии. Является производной глицина.
- Тирозин – составляющая тканей животных и растений. Может воспроизводиться из фенилаланина под действием фермента фенилаланингидроксилазы; обратного процесса не происходит.

- Цистеин – один из компонентов кератина, отвечающего за упругость и эластичность волос, ногтей, кожи. Ещё он является антиоксидантом. Может производиться из серина.
Аминокислоты, не способные к синтезу в организме, — незаменимые
Незаменимыми аминокислотами называют те, которые не способные генерироваться в организме человека и способны поступать только с продуктами питания.
- Валин – АМК, которая содержится практически во всех белках. Повышает координацию мышц и снижает чувствительность организма к температурным перепадам. Поддерживает гормон серотонин на высоком уровне.
- Изолейцин – естественный анаболик, который в процессе окисления насыщает энергией мышечную и мозговую ткани.
- Лейцин – аминокислота, улучшающая метаболизм. Является своеобразным «строителем» структуры белка.
- Эти три АМК входят в так называемый комплекс BCAA, особо востребованный среди спортсменов. Вещества этой группы выступают в качестве источника для увеличения объема мышечной массы, уменьшения жировой массы и поддержания хорошего самочувствия при особо интенсивных физических нагрузках.

- Лизин – пептид, ускоряющий регенерацию тканей, выработку гормонов, ферментов и антител. Отвечает за прочность сосудов, содержится в мышечном белке и коллагене.
- Метионин – пронимает участие в синтезе холина, недостаток которого может привести к усиленному накоплению жира в печени.
- Треонин – придает эластичность и силу сухожилиям. Очень положительно влияет на сердечную мышцу и зубную эмаль.
- Триптофан – поддерживает эмоциональное состояние, так как в организме преобразуется в серотонин. Незаменим при депрессиях и других психологических расстройствах.
- Фенилаланин – улучшает внешний вид кожи, нормализуя пигментацию. Поддерживает психологическое благополучие, улучшая настроение и привнося ясность в мышление.
С научной стороны 20 незаменимых аминокислот подразделяют, основываясь на полярности их боковой цепи, то есть радикалов. Таким образом, выделяются четыре группы: неполярные, полярные (но не имеющие заряда), положительно заряженные и отрицательно заряженные.
Неполярными являются: валин, аланин, лейцин, изолейцин, метионин, глицин, триптофан, фенилаланин, пролин. В свою очередь, к полярным, имеющим отрицательный заряд относят аспарагиновую и глутаминовую кислоты. Полярными, имеющими положительный заряд, называют аргинин, гистидин, лизин. К аминокислотам, обладающим полярностью, но не имеющим заряда, относят непосредственно цистеин, глутамин, серин, тирозин, треонин, аспарагин.
20 аминокислот: формулы (таблица)
Аминокислота | Аббревиатура | Формула |
Аланин | Ala, A | C3H7NO2 |
Аргинин | Arg, R | C6h34N4O2 |
Аспарагин | Asn, N | C4H8N2O3 |
Аспарагиновая кислота | Asp, D | C4H7NO4 |
Валин | Val, V | C5h31NO2 |
Гистидин | His, H | C6H9N3O2 |
Глицин | Gly, G | C2H5N1O2 |
Глутамин | Gln, Q | С5Н10N2O3 |
Глутаминовая кислота | Glu, E | C5H9NO4 |
Изолейцин | Ile, I | C6h33O2N |
Лейцин | Leu, L | C6h33NO2 |
Лизин | Lys, K | C6h34N2O2 |
Метионин | Met, M | C5h31NO2S |
Пролин | Pro, P | C5H7NO3 |
Серин | Ser, S | C3H7NO3 |
Тирозин | Tyr, Y | C9h31NO3 |
Треонин | Thr, T | C4H9NO3 |
Триптофан | Trp, W | C11h32N2O2 |
Фенилаланин | Phe, F | C9h31NO2 |
Цистеин | Cys, C | C3H7NO2S |
Основываясь на этом, можно отметить, что все 20 аминокислот (формулы в таблице выше) имеют в своем составе углерод, водород, азот и кислород.
Аминокислоты: участие в жизнедеятельности клетки
Аминокарбоновые кислоты участвуют в биологическом синтезе белка. Биосинтез белка – процесс моделирования полипептидной («поли» — много) цепи из остатков аминокислот. Протекает процесс на рибосоме – органелле внутри клетки, отвечающей непосредственно за биосинтез.
Информация считывается с участка цепи ДНК по принципу комплементарности (А-Т, Ц-Г), при создании м-РНК (матричная РНК, или и-РНК – информационная РНК – тождественно равные понятия) азотистое основание тимин заменяется на урацил. Далее всё по тому же принципу создается т-РНК (транспортная РНК), переносящая молекулы аминокислот к месту синтеза. Т-РНК закодирована триплетами (кодонами) (пример: УАУ), и если знать, какими азотистыми основаниями представлен триплет, можно узнать, какую именно аминокислоту он переносит.
Группы продуктов питания с наибольшим содержанием АМК
В молочных продуктах и яйцах содержатся такие важные вещества, как валин, лейцин, изолейцин, аргинин, триптофан, метионин и фенилаланин.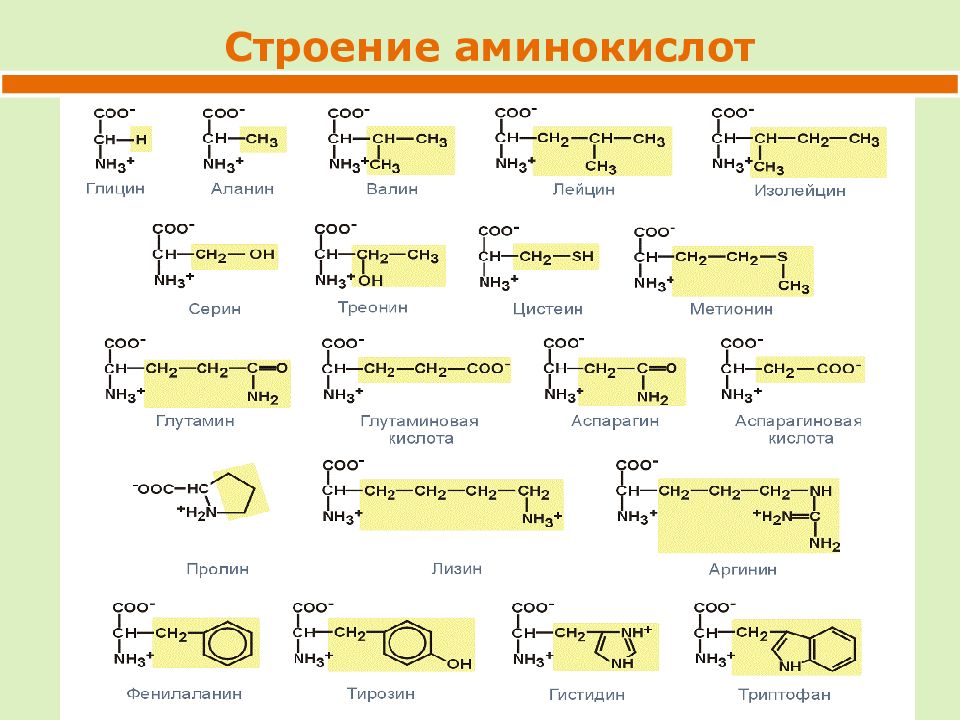 Рыба, белое мясо обладают высоким содержанием валина, лейцина, изолейцина, гистидина, метионина, лизина, фенилаланина, триптофана. Бобовые, зерновые и крупы богаты на валин, лейцин, изолейцин, триптофан, метионин, треонин, метионин. Орехи и различные семена насытят организм треонином, изолейцином, лизином, аргинином и гистидином.
Рыба, белое мясо обладают высоким содержанием валина, лейцина, изолейцина, гистидина, метионина, лизина, фенилаланина, триптофана. Бобовые, зерновые и крупы богаты на валин, лейцин, изолейцин, триптофан, метионин, треонин, метионин. Орехи и различные семена насытят организм треонином, изолейцином, лизином, аргинином и гистидином.
Ниже приведено содержание аминокислот в некоторых продуктах.
Наибольшее количество триптофана и метионина можно обнаружить в твёрдом сыре, лизина – в мясе кролика, валина, лейцина, изолейцина, треонина и фенилаланина – в сое. При составлении рациона, основанного на поддержании АМК в норме, стоит обратить внимание на кальмаров и горох, а наиболее бедными в плане содержания пептидов можно назвать картофель и коровье молоко.
Нехватка аминокислот при вегетарианстве
То, что существуют такие аминокислоты, которые содержатся исключительно в продуктах животного происхождения, – миф. Более того, учёные выяснили, что белок растительного происхождения усваивается человеческим организмом лучше, чем животного. Однако при выборе вегетарианства как стиля жизни очень важно следить за рационом. Основная проблема такова, что в ста граммах мяса и в таком же количестве бобов содержится разное количество АМК в процентном соотношении. На первых порах необходимо вести учёт содержания аминокислот в потребляемой пище, затем уже это должно дойти до автоматизма.
Однако при выборе вегетарианства как стиля жизни очень важно следить за рационом. Основная проблема такова, что в ста граммах мяса и в таком же количестве бобов содержится разное количество АМК в процентном соотношении. На первых порах необходимо вести учёт содержания аминокислот в потребляемой пище, затем уже это должно дойти до автоматизма.
В современном мире абсолютно во всех продуктах питания содержатся нужные для человека питательные вещества, поэтому не следует переживать: все 20 белковых аминокислот благополучно поступают с пищей, и этого количества хватает для человека, ведущего обычный образ жизни и хоть немного следящего за своим питанием.
Рацион спортсмена же необходимо насыщать белками, потому что без них просто невозможно построение мышечной массы. Физические упражнения ведут к колоссальному расходу запаса аминокислот, поэтому профессиональные бодибилдеры вынуждены принимать специальные добавки. При интенсивном построении мышечного рельефа количество белков может доходить до ста граммов белков в день, но такой рацион не подходит для ежедневного потребления. Любая добавка к пище подразумевает инструкцию с содержанием разных АМК в дозе, с которой перед применением препарата необходимо ознакомиться.
Любая добавка к пище подразумевает инструкцию с содержанием разных АМК в дозе, с которой перед применением препарата необходимо ознакомиться.
Влияние пептидов на качество жизни обычного человека
Потребность в белках присутствует не только у спортсменов. Например, белки эластин, кератин, коллаген влияют на внешний вид волос, кожи, ногтей, а также на гибкость и подвижность суставов. Ряд аминокислот влияет на метаболические процессы в организме, сохраняя баланс жира на оптимальном уровне, предоставляют достаточное количество энергии для повседневной жизни. Ведь в процессе жизнедеятельности даже при самом пассивном образе жизни затрачивается энергия, хотя бы для осуществления дыхания. Вдобавок невозможна и когнитивная деятельность при нехватке определенных пептидов; поддержание психоэмоционального состояния осуществляется в том числе за счет АМК.
Аминокислоты и спорт
Диета профессиональных спортсменов предполагает идеально сбалансированные питание, которое помогает поддерживать мышцы в тонусе. Очень облегчают жизнь аминокислотные комплексы, разработанные специально для тех спортсменов, которые работают на набор мышечной массы.
Очень облегчают жизнь аминокислотные комплексы, разработанные специально для тех спортсменов, которые работают на набор мышечной массы.
Как уже писалось ранее, аминокислоты – основной строительный материал белков, необходимых для роста мышц. Также они способны ускорять метаболизм и сжигать жир, что тоже важно для красивого мышечного рельефа. При усердных тренировках необходимо увеличивать потребление АМК ввиду того, что они увеличивают скорость наращивания мышц и уменьшают боли после тренировок.
20 аминокислот в составе белков могут потребляться как в составе аминокарбоновых комплексов, так и из пищи. Если выбирать сбалансированное питание, то нужно учитывать абсолютно все граммовки, что трудно реализовать при большой загруженности дня.
Что происходит с организмом человека при нехватке или переизбытке аминокислот
Основными симптомами нехватки аминокислот считаются: плохое самочувствие, отсутствие аппетита, ломкость ногтей, повышенная утомляемость. Даже при нехватке одной АМК возникает огромное количество неприятных побочных эффектов, которые значительно ухудшают самочувствие и продуктивность.
Перенасыщение аминокислотами может повлечь за собой нарушения в работе сердечно-сосудистой и нервной систем, что, в свою очередь, не менее опасно. В свой черед могут появиться симптомы, схожие с пищевым отравлением, что тоже не влечет за собой ничего приятного.
Во всем надо знать меру, поэтому соблюдение здорового образа жизни не должно приводить к переизбытку тех или иных «полезных» веществ в организме. Как писал классик, «лучшее – враг хорошего».
В статье мы рассмотрели формулы и названия всех 20 аминокислот, таблица содержания основных АМК в продуктах приведена выше.
fb.ru
Список аминокислот
Содержание:
Список аминокислот встречающихся в природе состоит примерно из 300 наименований. Многие найдены только в определенных организмах, а некоторые из них – только в одном. В организме человека насчитывается около 60 различных аминокислот и их производных, но только 20 участвует во внутриклеточном синтезе белков (образование белков).
Аминокислоты (аминокарбо́новые кисло́ты; АМК) – органические соединения, содержащие аминогруппы (-Nh4) и карбоксильные (-СООН) функциональные группы , а также боковую цепь (R-группу), специфичную для каждой аминокислоты.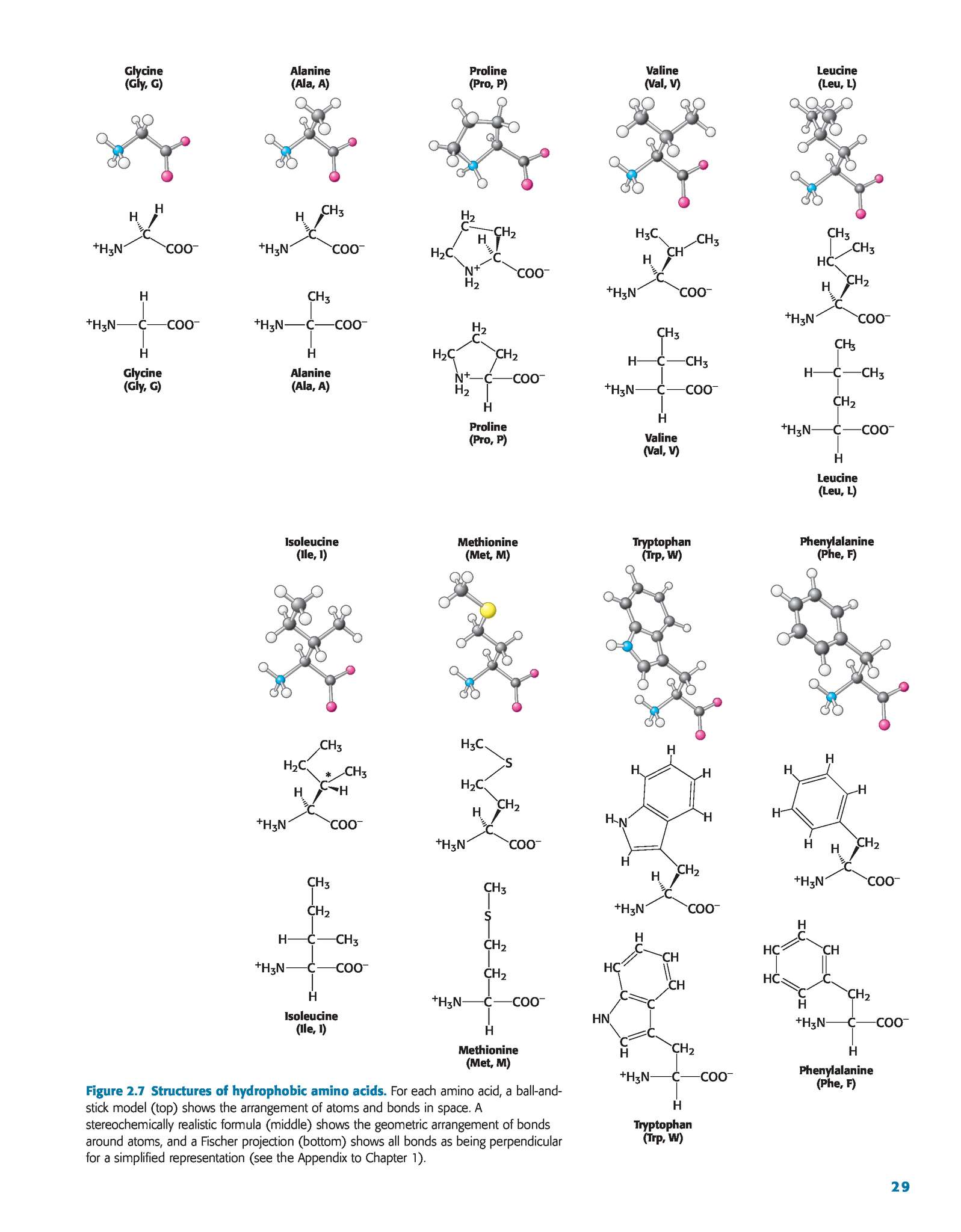
Аминокислоты: виды и свойства (функции) с краткой характеристикой
- Незаменимые аминокислоты – это необходимые аминокислоты, которые организм не способен синтезировать самостоятельно в достаточном количестве, может получать только с пищей и добавками.
- Условно незаменимые (частично заменимые) аминокислоты – синтезируются организмом самостоятельно, но в недостаточных для него количествах.
- Заменимые аминокислоты – организм может синтезировать самостоятельно из других источников. Дополнительный прием несет свои выгоды.
Аминокислоты делятся на две группы: протеиногенные (входящие в состав белков – их 20) и непротеиногенные (не участвующие в образовании белков).
Рекомендуемый ежедневный прием аминокислот ВОЗВсемирная организация здравоохранения и в США. Таблица.
| Гистидин (H) | 10 | 700 | 14 |
| Изолейцин (I) | 20 | 1400 | 19 |
| Лейцин (L) | 39 | 2730 | 42 |
| Лизин (K) | 30 | 2100 | 38 |
| Метионин (М) + Цистеин (C) | 10,4 + 4,1 (всего 15) | 1050 всего | 19 всего |
| Фенилаланин (F) + Тирозин (Y) | 25 (всего) | 1750 всего | 33 всего |
| Треонин (T) | 15 | 1050 | 20 |
| Триптофан (W) | 4 | 280 | 5 |
| Валин (V) | 26 | 1820 | 24 |
 Таблица.
Таблица.| Аланин (Ala, A) | C3H7NO2 | Alanine |
| Аргинин (Arg, R) | C6h34N4O2 | aRginine | Аспарагин (Asn, N) | C4H8N2O3 | asparagiNe | Аспарагиновая кислота (Asp, D) | C4H7NO4 | asparDic acid | Валин (Val, V) | C5h31NO2 | Valine | Гистидин (His, H) | C6H9N3O2 | Histidine | Глицин (Gly, G) | C2H5N1O2 | Glycine | Глутамин (Gln, Q) | С5Н10N2O3 | Q-tamine | Глутаминовая кислота (Glu, E) | C5H9NO4 | gluEtamic acid | Изолейцин (Ile, I) | C6h33O2N | Isoleucine | Лейцин (Leu, L) | C6h33NO2 | Leucine | Лизин (Lys, K) | C6h34N2O2 | before L | Метионин (Met, M) | C5h31NO2S | Methionine | Пролин (Pro, P) | C5H7NO3 | Proline | Серин (Ser, S) | C3H7NO3 | Serine | Тирозин (Tyr, Y) | C9h31NO3 | tYrosine | Треонин (Thr, T) | C4H9NO3 | Threonine | Триптофан (Trp, W) | C11h32N2O2 | tWo rings | Фенилаланин (Phe, F) | C9h31NO2 | Fenylalanine | Цистеин (Cys, C) | C3H7NO2S | Cysteine |
| Гидроксипролин (Hyp, hP) | C5H9NO3 | |
| Гидроксилизин (Hyl, hK) | C6h34N2O3 |
Структурные формулы 20 протеиногенных аминокислот
Незаменимые аминокислоты, свойства
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин; также часто к незаменимым относят гистидин; для детей также незаменимым является аргинин.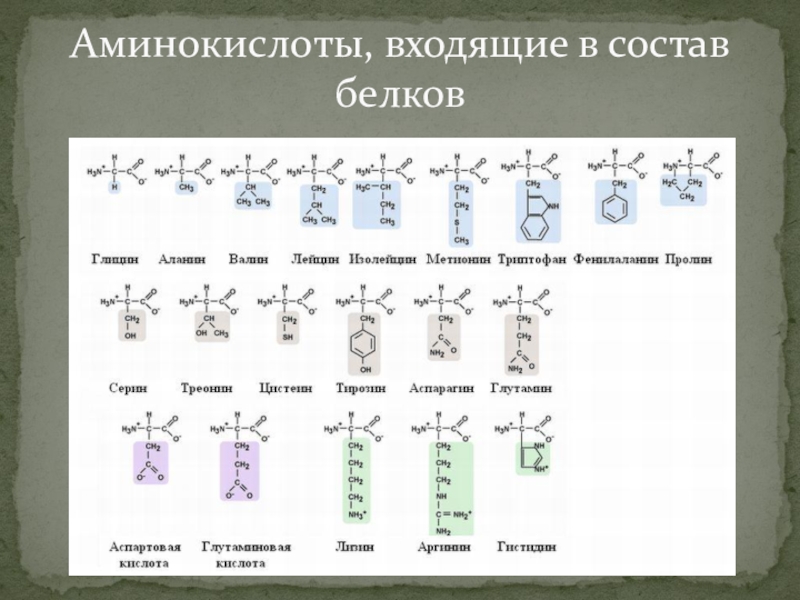
Валин.Один из главных компонентов необходимых для обменных процессов происходящих в мышцах, роста и синтеза тканей тела. Отмечена эффективность валина при регенерации тканей, в том числе тканей печени в случае повреждения (например, при токсическом гепатите). Валин способствует поддержанию надлежащего азотного баланса. Опыты показали, что валин повышает мышечную координацию и понижает чувствительность организма к боли, жаре и холоду.
- Дефицит валина приводит к нарушению координации движения и повышению чувствительности кожи.
- Источники валина: мясо, грибы, зерновые и молочные продукты (в основном продукты животного происхождения).
Изолейцин.Одна из аминокислот, необходимых для синтеза гемоглобина. Изолейцин также стабилизирует и регулирует уровень сахара в крови, участвует в выработке гемоглобина, повышает выносливость, дает возможность правильно распределять энергию, способствует активному росту мышц. Без изолейцина невозможна работа не только мышечной, но и мозговой ткани.
- Дефицит изолейцина может приводить к ощущению тревоги, возникновению беспокойств, повышенному утомлению.
- Источники изолейцина: сыр, рыба, мясо птицы, орехи, семечки, зародыши пшеницы (всем продукты, содержащие полноценный белок).
Лейцин.Стабилизирует уровень глюкозы в крови и стимулирует выделение гормона роста. Так же способствует заживлению ран, сращиванию костей, восстановлению кожи и мышц.
- Дефицит лейцина может привести к снижению нарушению процессов восстановления, роста тела, снижению обмена веществ и повышению уровня глюкозы в крови.
- Источники лейцина: молочные продукты, овёс, зародыши пшеницы, мясо (всем продукты, содержащие полноценный белок).
Лизин.Одна из важных составляющих в производстве карнитина. Лизин активно участвует в выработке антител, гормонов и ферментов, способен увеличивать выносливость мышц, задействован в формировании коллагена (одного из основных белков опорно-двигательного аппарата), обеспечивает усвоение кальция.
- Дефицит лизина может замедлить восстановление соединительной и мышечной тканей и привести к потери костной массы тела.
- Источники лизина: бобовые и молочные продукты, мясо птицы, рыба, арахис и зародыши пшеницы.
Метионин.Относится к антиоксидантам. Способствует понижению уровня холестерина оказывая положительное влияние на функционирование печени человека (усиливая выработку лецитина). Метионин важен в метаболизме жиров и белков, организм использует ее также для производства цистеина. Основной поставщик серы в организм, тем самым предотвращает заболевание кожи и ногтей, а так же влияет на рост волос.
- Дефицит метионина может вызывать снижение уровня гемоглобина и накопление жира в клетках печени.
- Источники метионина: мясо, яйца, красная икра, рыба, творог, твердые сыры, орехи и бобовые.
Треонин.Важная составляющая в синтезе пуринов, которые, в свою очередь, разлагают мочевину, побочный продукт синтеза белка. Так же необходима для формирования эластина и коллагена, эмали зубов. Треонин помогает обезвреживать токсины и предотвращает отложение жира в клетках печени.
Треонин помогает обезвреживать токсины и предотвращает отложение жира в клетках печени.
- Дефицит треонина приводит к появлению преждевременной усталости, а так же может привести к ожирению печени.
- Источники треонина: молочные продукты, мясо и яйца.
Триптофан.Является предшественником ниацина и серотонина (который, участвуя в мозговых процессах управляет аппетитом, сном, настроением и восприятием боли). Триптофан так же участвует в выработке мелатонина (гормона эпифиза – регулятора суточных ритмов), помогает бороться с бессонницей, состоянием беспокойства и депрессии, укрепляет иммунную систему. Совместно с Лизином борется за понижение уровня холестерина.
- Дефицит триптофана в организме ассоциирован с такими заболеваниями как хронические головные боли, нарушение сна и расстройства нервной системы.
- Источники триптофана: мясо индейки, молочные продукты, яйца, орехи, семечки.
Фенилаланин.Используется в организме для производства тирозина и трех важных гормонов – эпинефрина (адреналина), норэпинефрина и тироксина, а также нейромедиатора дофамина. Используется головным мозгом для производства норадреналина, который используется для передачи сигналов от нервных клеток к головному мозгу, поддерживает в состоянии бодрствования, уменьшает чувство голода, работает как антидепрессант и помогает улучшить работу памяти.
Используется головным мозгом для производства норадреналина, который используется для передачи сигналов от нервных клеток к головному мозгу, поддерживает в состоянии бодрствования, уменьшает чувство голода, работает как антидепрессант и помогает улучшить работу памяти.
- Дефицит фенилаланина зачастую приводит к развитию депрессии.
- Источники фенилаланина: мясные и молочные продукты, овёс, зародыши пшеницы.
Условнонезаменимые аминокислоты, свойства
К условнонезаменимым относятся (4): гистидин, аланин, цистеин, тирозин.
Тирозин.Используется организмом вместо фенилаланина при синтезе белка. Мозгом тирозин используется для выработки норэпинефрина, повышающего ментальный тонус. Результаты исследований показали, что тирозин может бороться с усталостью и стрессом, снизить тревожность и повысить общий тонус и настроение.
- Источники тирозина: молочные и мясные продукты, рыба.
Цистеин.Организм может использовать его вместо метионина для производства белка, при достаточном количество цистеина в рационе. В пищевой промышленности цистеин используют как антиоксидант для сохранения витамина С в готовых продуктах. Так же, цистеин стимулирует активность белых кровяных тел.
В пищевой промышленности цистеин используют как антиоксидант для сохранения витамина С в готовых продуктах. Так же, цистеин стимулирует активность белых кровяных тел.
- Источники цистеина: рыба, мясо, соевые продукты, пшеница, овёс.
Гистидин.Способствует росту и восстановлению тканей. Используется при лечении аллергий, ревматоидных артритов, язв и анемии.
- Источники гистидина: птица, сыр, свинина, говядина, рыба (лосось, тунец), пшеница, арахис, чечевица, соевые бобы.
- Недостаток гистидина может приводить к ослаблению слуха.
- Избыток гистидина может поспособствовать возникновению излишка меди в организме.
Аланин.Важный источник энергии для мышечных тканей, центральной нервной системы и головного мозга. Укрепляет иммунную систему путем выработки антител и активно участвует в процессах обмена углеводов и органических кислот.
- Источники аланина: бобы, соя, темный рис, кукуруза, овес, пшеница, морепродукты, молочные продукты.

- Существуют доказательства, что переизбыток аланина в организме, нарушает уровень содержания сахара в крови, что может приводить к развитию хронической усталости.
Заменимые аминокислоты, свойства
Заменимыми являются (10): аргинин, аспарагин, глутамин, глутаминовая кислота, глицин, карнитин, орнитин, пролин, серин, таурин.
Аргинин.Очищает печень. Л-Аргинин замедляет развития опухолей и раковых образований. Помогает выделению гормона роста, полезна при лечении расстройств и травм почек, способствует выработке спермы и укрепляет иммунную систему. Необходим для оптимального роста и синтеза протеина. Наличие Л-Аргинина в организме способствует приросту мышечной массы и снижению жировых запасов организма. Также полезен при расстройствах печени (цирроз печени).
- Источники аргинина: кунжутное семя, орехи, улитка, морепродукты, мясные продукты, рыба, птица.
- Аргинин не рекомендуется принимать беременными и кормящими женщинами.
Аспарагин.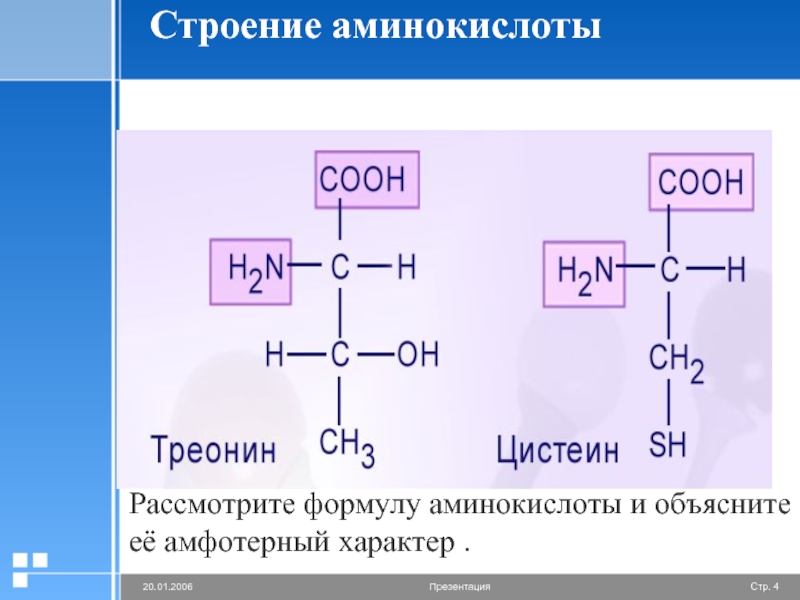 Активно участвует в выводе аммиака, вредного для центральной нервной системы, повышает сопротивляемость усталости, участвует в преобразовании углеводов в мышечную энергию.
Активно участвует в выводе аммиака, вредного для центральной нервной системы, повышает сопротивляемость усталости, участвует в преобразовании углеводов в мышечную энергию.
- Источники аспаргина: молочные продукты, мясо, морепродукты, яйца, рыба, бобовые, различные орехи, помидоры и спаржа.
Глутамин.Важен для повышении работоспособности мозга, нормализации уровня сахара, во время лечения импотенции или (и) алкоголизма, помогает бороться с усталостью, мозговыми расстройствами (эпилепсией, шизофренией и просто заторможенностью), необходим при лечении язвы желудка, и формирование здорового пищеварительного тракта. В мозгу преобразовывается в глутаминовую кислоту, важную для работы мозга.
- Источники глутамина: молочные продукты, мясо, рыба, бобовые, а так же содержится в 60% белков, вырабатываемых человеком.
При употреблении не следует путать глутамин с глутаминовой кислотой, по действию эти препараты отличаются друг от друга.
Глутаминовая кислота. Производит окислительные процессы, происходящие в мозге. Улучшает умственные способности, повышает сопротивляемость усталости, способствует ускорению лечения язв.
Производит окислительные процессы, происходящие в мозге. Улучшает умственные способности, повышает сопротивляемость усталости, способствует ускорению лечения язв.
- Источники глутаминовой кислоты: сыр, помидоры, морепродукты и рыба, грецкие орехи.
В человеческом организме все заменимые аминокислоты проходят стадию превращения в глутаминовую кислоту.
Глицин.Принимает активное участие в обеспечении кислородом, процесса образования новых клеток. Является важным участником выработки гормонов, отвечающих за усиление иммунной системы.
- Источники глицина: мясо (больше говядина), печень животных, желатин, рыба, яйца, молочные продукты. В организме самостоятельно вырабатывается печенью из холина или из таких аминокислот, как серин и треонин.
- При нехватке глицина появляется раздражительность, беспокойство, значительно затрудняется процесс концентрации.
Карнитин.Печень и почки вырабатывают карнитин в небольшом количестве из двух других аминокислот – лизина и метионина.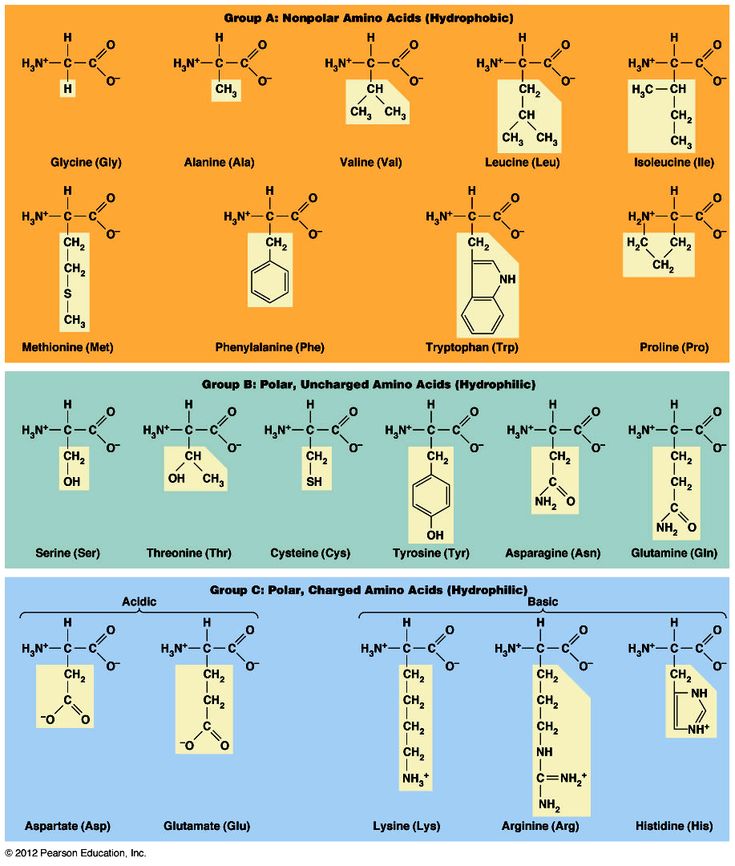 Карнитин – транспортный агент жирных кислот в митохондриальный матрикс. Предотвращая прирост жировых запасов эта аминокислота важна для уменьшения веса, снижения риска сердечных заболеваний. Организм вырабатывает Карнитин только в присутствии достаточного количества лизина, железа и энзимов В19 и В69. Вегетарианцы более чувствительны к дефициту карнитина, так как в их рационе гораздо меньше лизина. Карнитин также повышает эффективность антиоксидантов – витаминов С и Е.
Карнитин – транспортный агент жирных кислот в митохондриальный матрикс. Предотвращая прирост жировых запасов эта аминокислота важна для уменьшения веса, снижения риска сердечных заболеваний. Организм вырабатывает Карнитин только в присутствии достаточного количества лизина, железа и энзимов В19 и В69. Вегетарианцы более чувствительны к дефициту карнитина, так как в их рационе гораздо меньше лизина. Карнитин также повышает эффективность антиоксидантов – витаминов С и Е.
- Источники карнитина: мясо и молочные продукты.
Считается, что для наилучшей утилизации жира дневная норма карнитина должна составлять 1500 миллиграммов.
Орнитин.Орнитин способствует выработке гормона роста, который в комбинации с Л-Карнитином и Л-Аргинином способствует вторичному использованию излишков жира в обмене веществ. Необходим для работы печени и иммунной системы.
- Источники орнитина (вырабатывается из аргинина): кедровые орешки, тыквенные семечки, арахис и кунжутное семя.
Пролин. Является неотъемлемым компонентом коллагеновых белков (формируют основу всех тканей в организме человека), крайне важен для правильного функционирования связок и суставов, участвует в поддержании работоспособности и укреплении сердечной мышцы.
Является неотъемлемым компонентом коллагеновых белков (формируют основу всех тканей в организме человека), крайне важен для правильного функционирования связок и суставов, участвует в поддержании работоспособности и укреплении сердечной мышцы.
- Источники пролина: яйца, молочные продукты, мясо, пшеница, фруктовые соки. В организме вырабатывается из орнитина и глутаминовой кислоты.
Серин.Участвует в запасании печенью и мышцами гликогена; активно участвует в усилении иммунной системы, обеспечивая ее антителами; формирует жировые “чехлы” вокруг нервных волокон; стимулирует функции памяти и нервной системы.
- Источники серина: молочные и мясные продукты, арахисе, пшеничной клейковине и соевых продуктах. В организме вырабатывается из глицина и треонина.
Таурин.Оказывает благоприятное влияние на сердечно-сосудистую систему. Стабилизирует возбудимость мембран, что очень важно для контроля эпилептических припадков. Таурин и сульфур считаются факторами, необходимыми при контроле множества биохимических изменений, имеющих место в процессе старения. Таурин играет значительную роль в энергообмене, участвует в освобождении организма от засорения свободными радикалами.
Таурин играет значительную роль в энергообмене, участвует в освобождении организма от засорения свободными радикалами.
- Источники таурина: рыбные и молочные белки. В организме вырабатывается из цистеина с помощью витамина В6.
P.S. Несмотря на то, что самостоятельно организм не способен синтезировать незаменимые аминокислоты, их недостаток в некоторых случаях все же может быть частично компенсирован. Так, например, недостаток поступающего вместе с пищей незаменимого фенилаланина может быть частично замещен заменимым тирозином. Гомоцистеин вместе с необходимым количеством доноров метильных групп снижает потребности в метионине, а глутаминовая кислота частично замещает аргинин.
Источники: ☰- https://body-bar.ru/food/nutrients/list-of-amino-acids-and-their-brief-characteristics/
- http://sportwiki.to/%D0%A1%D0%BF%D0%B8%D1%81%D0%BE%D0%BA_%D0%B0%D0%BC%D0%B8%D0%BD%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82
- http://appteka.ru/encik/encik_a/aminokisloty.
 htm
htm
- Существенные аминокислоты
Все материалы носят ознакомительный характер. [Отказ от ответственности krok8.com]
krok8.com
20 основных заменимых и незаменимых аминокислот
Cодержание:
Виды аминокислот. Их особенности и назначение. Основные незаменимые и заменимые их разновидности. О важности аминокислот для организма каждого человека написано миллионы статей и тысячи книг. И действительно, переоценить пользу органических соединений, которые, по сути, являются основой белковых молекул, весьма сложно. Чтобы лучше понять значение аминокислот для организма, достаточно усвоить один факт: по важности они на втором месте после воды.
При этом не все знают, что аминокислоты бывают двух видов – незаменимые и заменимые. Первые не могут синтезироваться нашим организмом (это значит, что получить такие соединения можно только с пищей). Вторые – могут синтезироваться из других аминокислот или поступающих в организм веществ. При этом у каждого элемента свои формулы и задачи.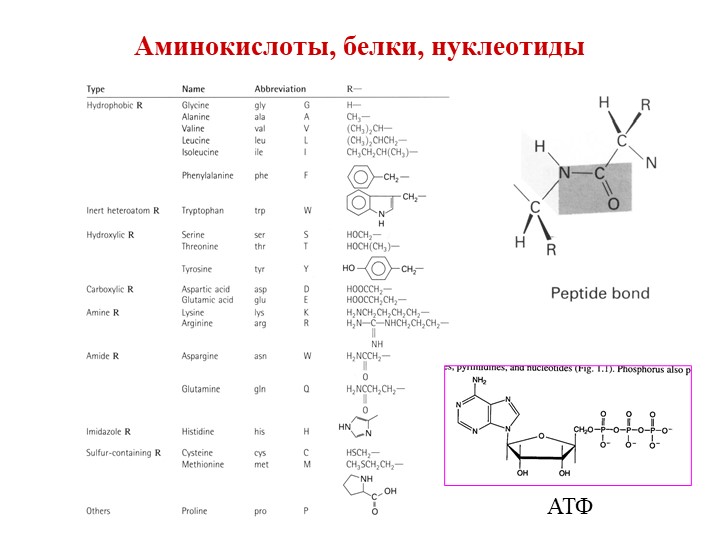
Виды и особенности
На сегодня можно выделить 20 основных аминокислот. Из них 9 – незаменимые и 11 – заменимые аминокислоты. Рассмотрим некоторые из них подробнее.
Незаменимые аминокислоты:
- Гистидин (His, H) содержится в тканях нашего тела. К его основным функциям можно отнести участие в создании красных и белых кровяных телец, организация обмена данными между периферическими тканями и нервной системой. Гистидин – это основа для создания крепкой иммунной системы. Он участвует в образовании желудочного сока, и нормализации пищеварительного процесса. Особенность данных аминокислот – быстрый расход, поэтому они нуждаются в постоянном пополнении.
- Изолейцин (Ile, I) относится к категории незаменимых и входит в 20 наиболее полезных для спортсменов аминокислот. Его основная функция – повышение выносливости спортсмена, помощь в восстановлении, участие в выработке энергии.
- Лейцин (Leu, L) играет одну из основных ролей в процессе восстановления мышечных волокон.
 К его особым свойствам можно отнести возможность превращения в глюкозу, что позволяет остановить катаболические процессы в организме. Кроме этого, лейцин принимает участие в восстановлении мышечных волокон, регулировании уровня сахара и сжигании жировых отложений.
К его особым свойствам можно отнести возможность превращения в глюкозу, что позволяет остановить катаболические процессы в организме. Кроме этого, лейцин принимает участие в восстановлении мышечных волокон, регулировании уровня сахара и сжигании жировых отложений. - Лизин (таблица аминокислот отражает его, как – Lys, K) известен своими талантами в борьбе с вирусными заболеваниями. При его активном участии синтезируются антитела, которые участвуют в укреплении иммунной системы, регулируют процессы роста мышечных волокон и обновляют костную ткань. С помощью лизина организм быстрее справляется с герпетическими инфекциями и простудой.
- Метионин (Met, M) – находится в 20 самых важных незаменимых аминокислот. Оказывает посильную помощь в борьбе с лишними жировыми отложениями. Участвует в производстве таурина, цистеина и глутатиона. Кроме этого, метионин играет активную роль в синтезе креатина, что непосредственно улучшает силу и выносливость мышц.
- Фенилаланин (таблица химических соединений отображает его, как Phe, F) – нормализует работу нервной системы спортсмена, помогает бороться с хронической болью, лечит различные неврологические заболевания.
 Прием данной аминокислоты способствует улучшению памяти и настроения. Часто применяется для лечения шизофрении и болезни Паркинсона.
Прием данной аминокислоты способствует улучшению памяти и настроения. Часто применяется для лечения шизофрении и болезни Паркинсона. - Треонин (Thr, T) – из 20 аминокислот считается одним из наиболее важных для роста мышечных волокон, образования эластина и коллагена. К функциям треонина можно отнести нормализацию белкового обмена и стимуляцию развития мышц. Кроме этого, данная аминокислота поддерживает почти все основные системы организма – иммунную, нервную и так далее.
- Триптофан (Trp, W) относится к категории незаменимых. Активно принимает участие в выработке серотонина и метионина. Улучшает сон, регулирует работу дыхательной системы и нормализует давление.
- Валин (Val, V) – один из лучших среди 20 аминокислот. Принимает участие в восстановлении тканей, снабжает организм необходимой энергией, не дает развиваться процессам катаболизма. Валин нормализует мышечную деятельность, оказывает помощь в лечении ряда заболеваний головного мозга и печени.
Заменимые аминокислоты:
- Аланин (Ala, A) также находится в 20 самых необходимых организму соединений.
 Данные заменимые аминокислоты – это мощный источник энергии и ускоритель процессов вывода токсинов из печени. Аланин препятствует распаду мышечных тканей и продлевает время существование клеток.
Данные заменимые аминокислоты – это мощный источник энергии и ускоритель процессов вывода токсинов из печени. Аланин препятствует распаду мышечных тканей и продлевает время существование клеток. - Аргинин (таблица аминокислот отражает его, как Arg, R) – по праву в 20 лучших аминокислот. Аргинин необходим для нормализации работы печени, поддержания мышц и кожи в идеальном состоянии. Имеет мощные восстановительные свойства, участвует в укреплении иммунной системы, улучшает обмен веществ.
- Аспарагин (Asn, N) относится к категории «заменимые аминокислоты». Имеет плотную связь с аспаргиновой кислотой. Активно применяется для синтеза аммиака.
- Аспаргиновая кислота (Asp, D) занимает почетное место в 20 самых необходимых химических соединений. К ее преимуществам можно отнести нормализацию обменных процессов, активизацию синтеза клеточной энергии, поддержку нервной системы.
- Цистеин (Cys, C) – относится к категории «заменимые аминокислоты». Участвует в нормализации структуры волос, ногтей и кожи.
 Оказывает помощь в борьбе с раком, бронхитом, септическим шоком.
Оказывает помощь в борьбе с раком, бронхитом, септическим шоком. - Глютамин (Gln, Q) эффективно удаляет токсины из печени и участвует в процессе роста мышц. Способствует повышению энергии, дает дополнительные силы и выносливость.
Но это не все заменимые аминокислоты. Стоит выделить пролин (стимулирует синтез коллагена), глицин (участвует в построении мышечной ткани и помогает набрать мышечную массу), пролин (ускоряет заживление тканей), серин (поддерживает работу ЦНС и головного мозга) и тирозин (способствует восстановлению всего организма).
Вывод
Итак, мы рассмотрели заменимые и незаменимые аминокислоты, необходимые каждому человеку для развития, крепкого здоровья и повышения спортивных показателей. Всего 20 химических соединений, и все они должны поступать в организм в полном объеме. Только так можно быть уверенным в результате и нормальном функционировании всех органов и систем. Удачи.
4 февраля 2015
proteinfo.ru
20 аминокислот формулы таблица
Многие из школьной программы биологии и химии что-то припоминают об аминокислотах, что-то слышали, но вся информация настолько скудна и довольно сложна, что приступая к занятиям в тренажерном зале, представление об органических соединениях весьма размыто.
Нельзя недооценивать значение аминокислот для организма человека, ведь по факту, это основные белковые молекулы, и по шкале важности мы бы поставили их на второе место. На первом- вода.
Существует две группы аминокислот – заменимые, самостоятельно вырабатываются организмом в процессе обмена веществ, и незаменимые – то есть такие, что синтезируются на основе других аминов или принимаются в готовом виде.
Всего выделяют 20 аминокислот с индивидуальными формулами. Среди них – 9 относят к незаменимым, и соответственно, 11 – заменимые купить аминокислоты.
Ниже мы подробно расскажем о каждой из 20 аминокислот, формулы и таблицы помогут вам получить подробные сведенья о важнейших органических соединениях в организме человека.
Среди незаменимых аминокислот выделяют:
- Гистидин (His,H) – вещество входит в состав тканей организма, среди функций стоит отметить активное участие в выработке эритроцитов и лейкоцитов, обмене веществмежду тканями и центральной нервной системой.
 При недостаточном содержании гистидина ослабевает иммунная система, нарушается работа органов пищеварения, синтез желудочного сока. Запасы данных заменимых аминокислот быстро истощаются, а значит потребность организма в них постоянна.
При недостаточном содержании гистидина ослабевает иммунная система, нарушается работа органов пищеварения, синтез желудочного сока. Запасы данных заменимых аминокислот быстро истощаются, а значит потребность организма в них постоянна. - Изолейцин (Ile,L)- основная из 20 самых важных аминокислот для спортсменов. Основная роль изолейцина – обеспечение выносливости, энергии и послетренировочного восстановления.
- Лейцин (в таблице Leu,L) – способен превращаться в глюкозу, позволяет регулировать уровень сахара в крови, эффективно сжигать жировые накопления и замедлять процессы катаболизма. Мышечные волокна способны восстанавливаться именно благодаря лейцину.
- Лизин (Lys,K)- главный специалист в борьбе с простудами и вирусами, активный участник синтеза антител и роста мышц, способствует обновлениям костной ткани. При достаточном количестве лизина в организме борьба с инфекциями проходит гораздо быстрее.
- Метионин (Met,M) – помогает продуцировать таурин, глутатион и цистеин, креатин купить, с его помощью организм борется запасами жира, увеличивается выносливость и работоспособность мышц.

- Фениланин( Phe,F)- принимают, чтобы улучшить работоспособность нервной системы, побороть мышечную боль, взбодриться и поднять настроение. Часто фениланин можно встретить в рецептах для борьбы с болезнью Паркинсона и даже шизофренией.
- Треонин (таблица обозначает его как Thr,T)- незаменимый участник роста мышц, выработки коллагена и эластина. Без него невозможен белковый обмен, развитие мышечных волокон и работа иммунной и нервной систем.
- Трипотофан (Trp,W) – «счастливая» аминокислота, отвечает в организме за синтез гормона счастья серотонина и метионина. Благотворно воздействует на сон, дыхательную систему и настроение человека.
- Валинизвестен в таблице незаменимых аминокислот как Val,V)- чемпионпо важности для спортсменов. Его основные функции – восстановление организма после тренировки, обеспечение энергией, замедление катаболических процессов, нормализация работы мышц.
К важнейшим заменимым аминокислотам относят:
- Аланин (формула Ala,A) – играет важную роль для детоксикации печени,предотвращает распада мышечных тканей и заряжает энергией.

- Аргинин (Arg,R)- активный участник работы печени, помогает восстанавливать организм после изнурительных нагрузок, укрепляет иммунную систему, ускоряет метаболизм, а так поддерживает тонус мышц и состояние кожи.
- Аспарагин (в таблице Asn, N) и аспаргиновая кислота ( Asp, D) – неразрывно связаны, бок о бок трудятся в производстве аммиака, оказывают поддержку нервной системе и нормализируют обмен веществ.
- Цистеин( Cys, C) – заслужено занимает место в 20 важных аминокислот, от него зависит состояние волосяных, ногтевых и кожных покровов.Кроме того, он разрушает раковые клетки и помогает при онкозаболеваниях.
- Глютамин (формула в таблице GLN,Q) – помогает бороться с токсичными веществами в печени, способствует мышечному росту. Прием глютамина повышает выносливость и мощь, заряжает дополнительной энергией и поднимает настроение.
- Пролин (Pro,P) — основной компонент коллагена, из которго строятся все тканевые волокна, помогает расщеплять белковые соединения для последующего использования организмом.
 Так же, пролин нормализирует артериальное давление, препятствует сердечнососудистым недугам.
Так же, пролин нормализирует артериальное давление, препятствует сердечнососудистым недугам. - Глицин(Gly,G) – нужен организму и спортсмену для выработки мышечных волокон и набору массы.
- Серин (Ser,S) – нормализирует метаболические процессы в организме, укрепляет иммунную систему, участвует в синтезе гемоглобина и других важных для жизнедеятельности человека веществ.
- Тирозин( Tyr,Y) – оказывает колоссальное значение на выносливость организма, стрессоустойчивость и восстановление. Благодаря этой аминокислоте происходите как физическое, так и моральное восстановление организма.
Как видите, для нормальной здоровой жизнедеятельности организму человека нужны в достаточном количестве 20 основных аминокислот, а запасы незаменимых аминов, особенно спортсменам, необходимо пополнять самостоятельно.
Ниже представлена таблица 20 важных аминокислот, формулы и сокращения, что помогут вам узнать, как с точки зрения химии, существуют данные соединения.
Мы надеемся, что информация, изложенная в этой статье, поможет Вам изнутри понять природу мышечного роста и достичь поставленных целей гораздо качественнее и быстрее.
sportpita.com.ua
Х и м и я
Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные (-COOH) и аминные группы (-Nh4).
Строение аминокислот можно выразить приведённой ниже общей формулой, (где R – углеводородный радикал, который может содержать и различные функциональные группы).
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы (-Nh4).
В качестве примера можно привести простейшие: аминоуксусную кислоту, или глицин, и аминопропионовую кислоту или аланин:
Аминокислоты – амфотерные соединения, т.е. в зависимости от условий они могут проявлять как основные, так и кислотные свойства.
За счёт карбоксильной группы (-COOH) они образуют соли с основаниями. За счёт аминогруппы (-Nh4) образуют соли с кислотами.
Ион водорода, отщепляющийся при диссоциации от карбоксила (-ОН) аминокислоты, может переходить к её аминогруппе с образованием аммониевой группировки (Nh5+).
Таким образом, аминокислоты существуют и вступают в реакции также в виде биполярных ионов (внутренних солей).
Этим объясняется, что растворы аминокислот, содержащих одну карбоксильную и одну аминогруппу, имеют нейтральную реакцию.
Альфа-аминокислоты
Из молекул аминокислот строятся молекулы белковых веществ или белков, которые при полном гидролизе под влиянием минеральных кислот, щелочей или ферментов распадаются, образуя смеси аминокислот.
Общее число встречающихся в природе аминокислот достигает 300, однако некоторые из них достаточно редки.
Среди аминокислот выделяется группа из 20 наиболее важных. Они встречаются во всех белках и получили название альфа-аминокислот.
Альфа-аминокислоты – кристаллические вещества, растворимые в воде. Многие из них обладают сладким вкусом. Это свойство нашло отражение в названии первого гомолога в ряду альфа-аминокислот – глицина, явившегося также первой альфа-аминокислотой, обнаруженной в природном материале.
Ниже приведена таблица с перечнем альфа-аминокислот:
| Глицин | Ala | |
| Аланин | Gly | |
| Валин | Val | |
| Лейцин | Leu | |
| Изолейцин | Ile | |
| Серин | Ser | |
| Треонин | Thr | |
| Аспарагиновая кислота | Asp | |
| Глутаминовая кислота | Glu | |
| Аспарагин | Asn | |
| Глутамин | Gln | |
| Лизин | Lys | |
| Аргинин | Arg | |
| Цистеин | Cys | |
| Метионин | Met | |
| Фенилаланин | Phe | |
| Тирозин | Tyr | |
| Триптофан | Trp | |
| Гистидин | His | |
| Пролин | Pro |
Незаменимые аминокислоты
Основным источником альфа-аминокислот для животного организма служат пищевые белки.
Многие альфа-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков альфа-аминокислоты в организме не синтезируются и должны поступать извне, с продуктами питания. Такие аминокислоты называют незаменимыми. Вот их список:
| Валин | зерновые, бобовые, мясо, грибы, молочные продукты, арахис |
| Изолейцин | миндаль, кешью, куриное мясо, турецкий горох (нут), яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, соя |
| Лейцин | мясо, рыба, чечевица, орехи, большинство семян, курица, яйца, овёс, бурый (неочищенный) рис |
| Лизин | рыба, мясо, молочные продукты, пшеница, орехи, амарант |
| Метионин | молоко, мясо, рыба, яйца, бобы, фасоль, чечевица и соя |
| Треонин | молочные продукты, яйца, орехи, бобы |
| Триптофан | бобовые, овёс, бананы, сушёные финики, арахис, кунжут, кедровые орехи, молоко, йогурт, творог, рыба, курица, индейка, мясо |
| Фенилаланин | бобовые, орехи, говядина, куриное мясо, рыба, яйца, творог, молокос |
| Аргинин | семена тыквы, свинина, говядина, арахис, кунжут, йогурт, швейцарский сыр |
| Гистидин | тунец, лосось, свиная вырезка, говяжье филе, куриные грудки, соевые бобы, арахис, чечевица |
При некоторых, часто врождённых, заболеваниях перечень незаменимых кислот расширяется. Например, при фенилкетонурии человеческий организм не синтезирует ещё одну альфа-аминокислоту — тирозин, который в организме здоровых людей получается при гидроксилировании фенилаланина.
Использование аминокислот в медицинской практике
Альфа-аминокислоты занимают ключевое положение в азотистом обмене. Многие из них используются в медицинской практике в качестве лекарственных средств, влияющих на тканевый обмен.
Так, глутаминовая кислота применяется для лечения заболеваний центральной нервной системы, метионин и гистидин – лечения и предупреждения заболеваний печени, цистеин – глазных болезней.
xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai
Lekc._No1._Aminokisloty_peptidy
Лекция №1
ТЕМА: «Аминокислоты».
План лекции:
1. Характеристика аминокислот
2. Пептиды.
Характеристика аминокислот.
Аминокислоты – органические соединения, производные углеводородов, в молекулы которых входят карбоксильные и аминогруппы.
Белки состоят из остатков аминокислот, соединённых пептидными связями. Для анализа аминокислотного состава проводят гидролиз белка с последующим выделением аминокислот. Рассмотрим основные закономерности, характерные для аминокислот белков.
В настоящее время установлено, что в состав белков входят постоянно часто встречающийся набор аминокислот. Их 18. Кроме указанных, обнаружены ещё 2 амида аминокислот – аспарагин и глутамин. Все они получили название мажорных (часто встречающихся) аминокислот. Часто их образно называют «волшебными» аминокислотами. Кроме мажорных аминокислот, встречаются и редкие, те, которые не часто встречаются в составе природных белков. Их называют минорными.
Практически все аминокислоты белков относятся к α – аминокислотам (аминогруппа расположена у первого после карбоксильной группы атома углерода). Исходя из сказанного, для большинства аминокислот справедлива общая формула:
α
Nh4-CH-COOH
│
R
Где R – радикалы, имеющие различное строение.
Рассмотрим формулы белковых аминокислот, табл. 2.
Все α — аминокислоты, кроме аминоуксусной (глицина), имеют асимметрический α — углеродный атом и существуют в виде двух энантиомеров. За редким исключением, природные аминокислоты относятся к L — ряду. Лишь в составе клеточных стенок бактерий и в антибиотиках обнаружены аминокислоты D генетического ряда. Значение угла вращения составляет 20-300 градусов. Вращение может быть вправо (7 аминокислот) и влево (10 аминокислот).
COOH COOH
H― *―Nh4 h4N―*―H
D — кофигурация L-кофигурация
(природные аминокислоты)
Кислые аминокислоты. Преобладают карбоксильные (кислотные) группы над аминогруппами (основными), например, аспарагиновая, глутаминовая кислоты.
Нейтральные аминокислоты Количество групп равны. Глицин, аланин, и т. д.
Основные аминокислоты. Преобладают основные (аминогруппы) над карбоксильными (кислотными), например, лизин.
По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований. Они лучше растворяются в воде, чем в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие температуры плавления. Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твёрдом состоянии и в растворе (в широком интервале pH) находятся в цвиттер-ионной форме (т.е. как внутренние соли). Взаимное влияние групп особенно ярко проявляется у α — аминокислот, где обе группы находятся в непосредственной близости.
h4N — Ch4COOH ↔ h5N+- Ch4COO-
цвиттер-ион
Цвиттер — ионная структура аминокислот подтверждается их большим дипольным моментом (не менее 5010-30 Кл м), а также полосой поглощения в ИК- спектре твердой аминокислоты или её раствора.
Аминокислоты способны вступать в реакции поликонденсации, приводящие к образованию полипептидов разной длины, которые и составляет первичную структуру белковой молекулы.
h4N–CH(R1)-COOH + h4N– CH(R2) – COOH → h4N – CH(R1) – CO-NH– CH(R2) – COOH
Дипептид
O H
║ │
Связь С – N – называется пептидной связью.
Помимо рассмотренных выше 20 наиболее распространенных аминокислот из гидролизатов некоторых специализированных белков выделены некоторые другие аминокислоты. Все они являются, как правило, производными обычных аминокислот, т.е. модифицированными аминокислотами.
4-оксипролин, встречается в фибриллярном белке коллагене и некоторых растительных белках; 5-оксилизин найден в гидролизатах коллагена, десмозин и изодесмозин выделены из гидролизатов фибриллярного белка эластина. Похоже, что эти аминокислоты содержаться только в этом белке. Структура их необычна: 4-е молекулы лизина, соединенные своими R-группами, образуют замещенное пиридиновое кольцо. Возможно, что благодаря именно такой структуре эти аминокислоты могут образовывать 4-е радиально расходящиеся пептидные цепи. Результатом есть то, что эластин, в отличие от других фибриллярных белков, способен деформироваться (растягиваться) в двух взаимно перпендикулярных направлениях. И т.д.
Из перечисленных белковых аминокислот живые организмы синтезируют огромное количество разнообразнейших белковых соединений. Многие растения и бактерии могут синтезировать все необходимые им аминокислоты из простых неорганических соединений. В теле человека и животных примерно половина аминокислот также синтезируется Другая часть аминокислот может поступить в организм человека только с пищевыми белками.
— незаменимые аминокислоты — не синтезируются в организме человека, а поступают только с пищей. К незаменимым аминокислотам относят 8 аминокислот: валин, фенилаланин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
— заменимые аминокислоты — могут синтезироваться в организме человека из других составляющих. К заменимым аминокислотам относят 12 аминокислот.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет. Белки, в которых содержатся незаменимые аминокислоты, должны составлять в питании взрослых людей около 16-20% (20-30г при суточной норме белка 80-100г). В питании детей доля белка повышается до 30% — для школьников, и до 40% — для дошкольников. Это связано с тем, что детский организм постоянно растет и, поэтому, нуждается в большом количестве аминокислот как пластического материала для построения белков мышц, сосудов, нервной системы, кожи и всех других тканей и органов.
В наши дни быстрого питания и всеобщего увлечения фаст-фудом в рационе очень часто преобладают продукты с высоким содержанием легкоусваиваемых углеводов и жиров, а доля белковых продуктов заметно снижается. При недостатке в рационе каких — либо аминокислот или при голодании в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга. Организм человека может испытывать нехватку как незаменимых, так и заменимых аминокислот. Дефицит аминокислот, особенно незаменимых, приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям. Первыми «вестниками» нехватки аминокислот могут быть снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия. Такие проявления могут возникнуть у лиц, с целью снижения веса соблюдающих низкокалорийную несбалансированную диету с резким ограничением белковых продуктов.
Чаще других с проявлениями нехватки аминокислот, особенно незаменимых, сталкиваются вегетарианцы, намеренно избегающие включения в свой рацион полноценного животного белка.
Избыток аминокислот встречается в наши дни достаточно редко, но может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к развитию аневризмы аорты, заболеваниям суставов, ранней седине, тяжелым анемиям). В нормальных условиях функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевая кислота) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот быстро превращается в полезные компоненты и не успевает «нанести ущерб» организму. При несбалансированной диете возникает дефицит витаминов и микроэлементов, и избыток аминокислот может нарушить работу систем и органов. Такой вариант возможен при длительном соблюдении белковых или низкоуглеводных диет, а также при неконтролируемом приеме спортсменами протеиново-энергетических продуктов (аминокислотно-витаминные коктейли) для увеличения веса и развития мышц.
Содержание аминокислот в продуктах питания – очень важный показатель, он определяет биологическую ценность пищевого продукта, и отражает его способность удовлетворять потребность организма в незаменимых аминокислотах. Для ее определения используют методы оценки качества белка пищевых продуктов.
Среди химических методов наиболее распространен метод аминокислотного скора (scor — счет, подсчет). Он основан на сравнении аминокислотного состава белка оцениваемого продукта с аминокислотным составом стандартного (идеального) белка. После количественного определения химическим путем содержания каждой из незаменимых аминокислот в исследуемом белке определяют аминокислотный скор (АС) для каждой из них по формуле
АС = (mак.иссл/ mак.идеальн) • 100
mак.иссл — содержание незаменимой аминокислоты (в мг) в 1 г исследуемого белка.
mак.идеальн — содержание незаменимой аминокислоты (в мг) в 1 г стандартного (идеального) белка.
Аминокислотный образец ФАО/ВОЗ
аминокислота | содержание незаменимой аминокислоты (в мг) в 1 г идеального белка. | аминокислота | содержание незаменимой аминокислоты (в мг) в 1 г идеального белка. |
Изолейцин | 40 | Фенилаланин + тирозин | 60 |
Лейцин | 70 | Треонин | 40 |
Лизин | 55 | Триптофан | 10 |
Метионин + цистеин | 35 | Валин | 50 |
Одновременно с определением аминокислотного скора выявляют лимитирующую для данного белка незаменимую аминокислоту, то есть ту, для которой скор является наименьшим.
Две аминокислоты могут ковалентно соединяться посредством пептидной связи с образованием дипептида.
Три аминокислоты могут соединяться посредством двух пептидных связей с образованием трипептида. Несколько аминокислот образуют олигопептиды, большое число аминокислот — полипептиды. Пептиды содержат только одну -аминогруппу и одну -карбоксильную группу. Эти группы могут быть ионизованы при определенных значениях рН. Подобно аминокислотам они имеют характеристические кривые титрования и изоэлектрические точки, при которых они не двигаются в электрическом поле.
Подобно другим органическим соединениям пептиды участвуют в химических реакциях, которые определяются наличием функциональных групп: свободной аминогруппой, свободной карбоксигруппой и R-группами. Пептидные связи подвержены гидролизу сильной кислотой (например, 6М НС1) или сильным основанием с образованием аминокислот. Гидролиз пептидных связей — это необходимый этап в определении аминокислотного состава белков. Пептидные связи могут быть разрушены действием ферментов протеаз.
Многие пептиды, встречающиеся в природе, имеют биологическую активность при очень низких концентрациях.
Пептиды — потенциально активные фармацевтические препараты, есть три способа их получения:
1) выделение из органов и тканей;
2) генетическая инженерия;
3) прямой химический синтез.
В последнем случае высокие требования предъявляются к выходу продуктов на всех промежуточных стадиях.
studfiles.net
20 аминокислот: формулы и названия
Ни для кого не секрет, что человеку для поддержания жизнедеятельности на высоком уровне необходим белок – своеобразный строительный материал для тканей организма; в состав белков входят 20 аминокислот, названия которых вряд ли что-то скажут обычному офисному работнику. Каждый человек, особенно если говорить о женщинах, хоть раз слышал о коллагене и кератине – это протеины, которые отвечают за внешний вид ногтей, кожи и волос.
Аминокислоты (или же аминокарбоновые кислоты; АМК; пептиды) – органические соединения, на 16 % состоящие из аминов – органических производных аммония, — что отличает их от углеводов и липидов. Они участвуют в биосинтезе белка организмом: в пищеварительной системе под влиянием ферментов все белки, поступающие с едой, разрушаются до АМК. Всего в природе существует около 200 пептидов, но в построении организма человека участвуют всего 20 основных аминокислот, которые подразделяются на заменимые и незаменимые; иногда встречается и третий вид – полузаменимые (условно заменяемые).
Заменимые аминокислотыЗаменимыми называют те аминокислоты, которые как потребляются с продуктами питания, так и воспроизводятся непосредственно в теле человека из других веществ.
- Аланин – мономер большого числа биологических соединений и белков. Осуществляет один из главенствующих путей глюкогенеза, то есть в печени превращается в глюкозу, и наоборот. Высокоактивный участник метаболических процессов в организме.
- Аргинин – АМК, способная синтезироваться в организме взрослого, но не способная к синтезу в теле ребёнка. Содействует выработке гормонов роста и других. Единственный переносчик азотистых соединений в организме. Содействует увеличению мышечной массы и уменьшению жировой.
- Аспарагин – пептид, участвующий в азотном обмене. В ходе реакции с ферментом аспарагиназой отщепляет аммониак и превращается в аспарагиновую кислоту.
- Аспарагиновая кислота – принимает участие в создании иммуноглобулина, деактивирует аммиак. Необходим при сбоях в работе нервной и сердечно-сосудистой систем.
- Гистидин – используется для профилактики и лечения болезней ЖКТ; оказывает положительную динамику при борьбе со СПИДом. Уберегает организм от пагубного воздействия стресса.
- Глицин – нейромедиаторная аминокислота. Применяется в качестве мягкое успокоительное и антидепрессивное средство. Усиливает действие некоторых ноотропных препаратов.
- Глутамин – в большом объёме входит в состав гемоглобина. Активатор процессов восстановления тканей.
- Глутаминовая кислота – обладает нейромедиаторным действием, а также стимулирует метаболические процессы в ЦНС.
- Пролин – является одним из составляющих практически всех протеинов. Им особенно богаты эластин и коллаген, отвечающие за эластичность кожи.
- Серин – АМК, что содержится в нейронах головного мозга, а также способствует выделению большого количества энергии. Является производной глицина.
- Тирозин – составляющая тканей животных и растений. Может воспроизводиться из фенилаланина под действием фермента фенилаланингидроксилазы; обратного процесса не происходит.
- Цистеин – один из компонентов кератина, отвечающего за упругость и эластичность волос, ногтей, кожи. Ещё он является антиоксидантом. Может производиться из серина.
Аминокислоты, не способные к синтезу в организме, — незаменимые
Незаменимыми аминокислотами называют те, которые не способные генерироваться в организме человека и способны поступать только с продуктами питания.
- Валин – АМК, которая содержится практически во всех белках. Повышает координацию мышц и снижает чувствительность организма к температурным перепадам. Поддерживает гормон серотонин на высоком уровне.
- Изолейцин – естественный анаболик, который в процессе окисления насыщает энергией мышечную и мозговую ткани.
- Лейцин – аминокислота, улучшающая метаболизм. Является своеобразным «строителем» структуры белка.
- Эти три АМК входят в так называемый комплекс BCAA, особо востребованный среди спортсменов. Вещества этой группы выступают в качестве источника для увеличения объема мышечной массы, уменьшения жировой массы и поддержания хорошего самочувствия при особо интенсивных физических нагрузках.
- Лизин – пептид, ускоряющий регенерацию тканей, выработку гормонов, ферментов и антител. Отвечает за прочность сосудов, содержится в мышечном белке и коллагене.
- Метионин – пронимает участие в синтезе холина, недостаток которого может привести к усиленному накоплению жира в печени.
- Треонин – придает эластичность и силу сухожилиям. Очень положительно влияет на сердечную мышцу и зубную эмаль.
- Триптофан – поддерживает эмоциональное состояние, так как в организме преобразуется в серотонин. Незаменим при депрессиях и других психологических расстройствах.
- Фенилаланин – улучшает внешний вид кожи, нормализуя пигментацию. Поддерживает психологическое благополучие, улучшая настроение и привнося ясность в мышление.
Другие методы классификации пептидов
С научной стороны 20 незаменимых аминокислот подразделяют, основываясь на полярности их боковой цепи, то есть радикалов. Таким образом, выделяются четыре группы: неполярные, полярные (но не имеющие заряда), положительно заряженные и отрицательно заряженные.
Неполярными являются: валин, аланин, лейцин, изолейцин, метионин, глицин, триптофан, фенилаланин, пролин. В свою очередь, к полярным, имеющим отрицательный заряд относят аспарагиновую и глутаминовую кислоты. Полярными, имеющими положительный заряд, называют аргинин, гистидин, лизин. К аминокислотам, обладающим полярностью, но не имеющим заряда, относят непосредственно цистеин, глутамин, серин, тирозин, треонин, аспарагин.
20 аминокислот: формулы (таблица)
Аминокислота | Аббревиатура | Формула |
Аланин | Ala, A | C3H7NO2 |
Аргинин | Arg, R | C6h34N4O2 |
Аспарагин | Asn, N | C4H8N2O3 |
Аспарагиновая кислота | Asp, D | C4H7NO4 |
Валин | Val, V | C5h31NO2 |
Гистидин | His, H | C6H9N3O2 |
Глицин | Gly, G | C2H5N1O2 |
Глутамин | Gln, Q | С5Н10N2O3 |
Глутаминовая кислота | Glu, E | C5H9NO4 |
Изолейцин | Ile, I | C6h33O2N |
Лейцин | Leu, L | C6h33NO2 |
Лизин | Lys, K | C6h34N2O2 |
Метионин | Met, M | C5h31NO2S |
Пролин | Pro, P | C5H7NO3 |
Серин | Ser, S | C3H7NO3 |
Тирозин | Tyr, Y | C9h31NO3 |
Треонин | Thr, T | C4H9NO3 |
Триптофан | Trp, W | C11h32N2O2 |
Фенилаланин | Phe, F | C9h31NO2 |
Цистеин | Cys, C | C3H7NO2S |
Основываясь на этом, можно отметить, что все 20 аминокислот (формулы в таблице выше) имеют в своем составе углерод, водород, азот и кислород.
Аминокислоты: участие в жизнедеятельности клетки
Аминокарбоновые кислоты участвуют в биологическом синтезе белка. Биосинтез белка – процесс моделирования полипептидной («поли» — много) цепи из остатков аминокислот. Протекает процесс на рибосоме – органелле внутри клетки, отвечающей непосредственно за биосинтез.
Информация считывается с участка цепи ДНК по принципу комплементарности (А-Т, Ц-Г), при создании м-РНК (матричная РНК, или и-РНК – информационная РНК – тождественно равные понятия) азотистое основание тимин заменяется на урацил. Далее всё по тому же принципу создается т-РНК (транспортная РНК), переносящая молекулы аминокислот к месту синтеза. Т-РНК закодирована триплетами (кодонами) (пример: УАУ), и если знать, какими азотистыми основаниями представлен триплет, можно узнать, какую именно аминокислоту он переносит.
Группы продуктов питания с наибольшим содержанием АМК
В молочных продуктах и яйцах содержатся такие важные вещества, как валин, лейцин, изолейцин, аргинин, триптофан, метионин и фенилаланин. Рыба, белое мясо обладают высоким содержанием валина, лейцина, изолейцина, гистидина, метионина, лизина, фенилаланина, триптофана. Бобовые, зерновые и крупы богаты на валин, лейцин, изолейцин, триптофан, метионин, треонин, метионин. Орехи и различные семена насытят организм треонином, изолейцином, лизином, аргинином и гистидином.
Ниже приведено содержание аминокислот в некоторых продуктах.
Наибольшее количество триптофана и метионина можно обнаружить в твёрдом сыре, лизина – в мясе кролика, валина, лейцина, изолейцина, треонина и фенилаланина – в сое. При составлении рациона, основанного на поддержании АМК в норме, стоит обратить внимание на кальмаров и горох, а наиболее бедными в плане содержания пептидов можно назвать картофель и коровье молоко.
Нехватка аминокислот при вегетарианстве
То, что существуют такие аминокислоты, которые содержатся исключительно в продуктах животного происхождения, – миф. Более того, учёные выяснили, что белок растительного происхождения усваивается человеческим организмом лучше, чем животного. Однако при выборе вегетарианства как стиля жизни очень важно следить за рационом. Основная проблема такова, что в ста граммах мяса и в таком же количестве бобов содержится разное количество АМК в процентном соотношении. На первых порах необходимо вести учёт содержания аминокислот в потребляемой пище, затем уже это должно дойти до автоматизма.
Какое количество аминокислот нужно потреблять в день
В современном мире абсолютно во всех продуктах питания содержатся нужные для человека питательные вещества, поэтому не следует переживать: все 20 белковых аминокислот благополучно поступают с пищей, и этого количества хватает для человека, ведущего обычный образ жизни и хоть немного следящего за своим питанием.
Рацион спортсмена же необходимо насыщать белками, потому что без них просто невозможно построение мышечной массы. Физические упражнения ведут к колоссальному расходу запаса аминокислот, поэтому профессиональные бодибилдеры вынуждены принимать специальные добавки. При интенсивном построении мышечного рельефа количество белков может доходить до ста граммов белков в день, но такой рацион не подходит для ежедневного потребления. Любая добавка к пище подразумевает инструкцию с содержанием разных АМК в дозе, с которой перед применением препарата необходимо ознакомиться.
Влияние пептидов на качество жизни обычного человека
Потребность в белках присутствует не только у спортсменов. Например, белки эластин, кератин, коллаген влияют на внешний вид волос, кожи, ногтей, а также на гибкость и подвижность суставов. Ряд аминокислот влияет на метаболические процессы в организме, сохраняя баланс жира на оптимальном уровне, предоставляют достаточное количество энергии для повседневной жизни. Ведь в процессе жизнедеятельности даже при самом пассивном образе жизни затрачивается энергия, хотя бы для осуществления дыхания. Вдобавок невозможна и когнитивная деятельность при нехватке определенных пептидов; поддержание психоэмоционального состояния осуществляется в том числе за счет АМК.
Аминокислоты и спорт
Диета профессиональных спортсменов предполагает идеально сбалансированные питание, которое помогает поддерживать мышцы в тонусе. Очень облегчают жизнь аминокислотные комплексы, разработанные специально для тех спортсменов, которые работают на набор мышечной массы.
Как уже писалось ранее, аминокислоты – основной строительный материал белков, необходимых для роста мышц. Также они способны ускорять метаболизм и сжигать жир, что тоже важно для красивого мышечного рельефа. При усердных тренировках необходимо увеличивать потребление АМК ввиду того, что они увеличивают скорость наращивания мышц и уменьшают боли после тренировок.
20 аминокислот в составе белков могут потребляться как в составе аминокарбоновых комплексов, так и из пищи. Если выбирать сбалансированное питание, то нужно учитывать абсолютно все граммовки, что трудно реализовать при большой загруженности дня.
Что происходит с организмом человека при нехватке или переизбытке аминокислот
Основными симптомами нехватки аминокислот считаются: плохое самочувствие, отсутствие аппетита, ломкость ногтей, повышенная утомляемость. Даже при нехватке одной АМК возникает огромное количество неприятных побочных эффектов, которые значительно ухудшают самочувствие и продуктивность.
Перенасыщение аминокислотами может повлечь за собой нарушения в работе сердечно-сосудистой и нервной систем, что, в свою очередь, не менее опасно. В свой черед могут появиться симптомы, схожие с пищевым отравлением, что тоже не влечет за собой ничего приятного.
Во всем надо знать меру, поэтому соблюдение здорового образа жизни не должно приводить к переизбытку тех или иных «полезных» веществ в организме. Как писал классик, «лучшее – враг хорошего».
В статье мы рассмотрели формулы и названия всех 20 аминокислот, таблица содержания основных АМК в продуктах приведена выше.
autogear.ru
Карта сайта
Страница не найдена. Возможно, карта сайта Вам поможет.
- Главная
-
Университет
- Об университете
- Структура
- Нормативные документы и процедуры
- Лечебная деятельность
- Международное сотрудничество
-
Пресс-центр
- Новости
- Анонсы
- События
- Объявления и поздравления
- Online конференции
-
Фотоальбом
- Диалоговая площадка с депутатом Палаты представителей Олегом Сергеевичем Гайдукевичем
- Визит экспертной группы бизнес-премии «Лидер года»
- Заместитель премьер-министра Республики Беларусь Игорь Викторович Петришенко встретился со студентами ГрГМУ
- Делегация Багдадского университета с визитом в ГрГМУ
- Студенческий фестиваль национальных культур-2021
- Студент года-2021
- Занятия в симуляционном центре ГрГМУ, имитирующем «красную зону»
- Торжественная церемония вручения дипломов о переподготовке
- Праздничный концерт, посвященный Дню Матери
- Церемония подписания договора о сотрудничестве вуза и Гродненской православной епархии
- Диалоговая площадка с председателем Гродненского облисполкома Владимиром Степановичем Караником
- Выставка-презентация учреждений высшего образования «Образование будущего»
- Товарищеский турнир по мини-футболу
- Конференция «Современные проблемы радиационной и экологической медицины, лучевой диагностики и терапии»
- Посвящение в первокурсники-2021
- Встреча заместителя министра здравоохранения Д.В. Чередниченко со студентами
- Открытый диалог, приуроченный к 19-летию БРСМ
- Группа переподготовки по специальности «Организация здравоохранения»
- Собрания факультетов для первокурсников-2021
- День знаний — 2021
- Совет университета
- Студенты военной кафедры ГрГМУ приняли присягу
- День освобождения Гродно-2021
- Ремонтные и отделочные работы
- Итоговая практика по военной подготовке
- День Независимости-2021
- Студенты военной кафедры ГрГМУ: итоговая практика-2021
- Выпускной лечебного факультета-2021
- Выпускной медико-психологического и медико-диагностического факультетов-2021
- Выпускной педиатрического факультета-2021
- Выпускной факультета иностранных учащихся-2021
- Вручение дипломов выпускникам-2021
- Митинг-реквием, посвященный 80-й годовщине начала Великой Отечественной войны
- Акция «Память», приуроченная к 80-летию начала Великой Отечественной войны
- Республиканский легкоатлетический студенческий забег «На старт, молодежь!»
- Актуальные вопросы гигиены питания
- Торжественное мероприятие к Дню медицинских работников-2021
- Совет университета
- Выездное заседание Республиканского совета ректоров
- Церемония вручения медалей и аттестатов особого образца выпускникам 2021 года
- Предупреждение деструктивных проявлений в студенческой среде и влияния агрессивного информационного контента сети интернет
- Онлайн-выставка «Помнить, чтобы не повторить»
- Областная межвузовская конференция «Подвиг народа бессмертен»
- Финал первого Республиканского интеллектуального турнира ScienceQuiz
- Конференция «Актуальные вопросы коморбидности заболеваний в амбулаторной практике: от профилактики до лечения»
- День семьи-2021
- Диалоговая площадка с председателем Гродненского областного Совета депутатов
- Праздничные городские мероприятия к Дню Победы
- Областной этап конкурса «Королева студенчества-2021″
- Праздничный концерт к 9 мая 2021
- IV Республиканский гражданско-патриотический марафон «Вместе – за сильную и процветающую Беларусь!»
- Университетский кубок КВН-2021
- Музыкальная планета студенчества (завершение Дней ФИУ-2021)
- Молодёжный круглый стол «Мы разные, но мы вместе»
- Дни ФИУ-2021. Интеллектуальная игра «Что?Где?Когда?»
- Неделя донорства в ГрГМУ
- Творческая гостиная. Дни ФИУ-2021
- Открытие XVIII студенческого фестиваля национальных культур
- Передвижная мультимедийная выставка «Партизаны Беларуси»
- Республиканский субботник-2021
- Семинар «Человек внутри себя»
- Международный конкурс «Здоровый образ жизни глазами разных поколений»
- Вручение нагрудного знака «Жена пограничника»
- Встреча с представителями медуниверситета г. Люблина
- Королева Студенчества ГрГМУ — 2021
- День открытых дверей-2021
- Управление личными финансами (встреча с представителями «БПС-Сбербанк»)
- Весенний «Мелотрек»
- Праздничный концерт к 8 Марта
- Диалоговая площадка с председателем Гродненского облисполкома
- Расширенное заседание совета университета
- Гродно — Молодежная столица Республики Беларусь-2021
- Торжественное собрание, приуроченное к Дню защитника Отечества
- Вручение свидетельства действительного члена Белорусской торгово-промышленной палаты
- Новогодний ScienceQuiz
- Финал IV Турнира трех вузов ScienseQuiz
- Областной этап конкурса «Студент года-2020″
- Семинар дистанционного обучения для сотрудников университетов из Беларуси «Обеспечение качества медицинского образования и образования в области общественного здоровья и здравоохранения»
- Студент года — 2020
- День Знаний — 2020
- Церемония награждения лауреатов Премии Правительства в области качества
- Военная присяга
- Выпускной лечебного факультета-2020
- Выпускной медико-психологического факультета-2020
- Выпускной педиатрического факультета-2020
- Выпускной факультета иностранных учащихся-2020
- Распределение — 2020
- Стоп коронавирус!
- Навстречу весне — 2020
- Профориентация — 18-я Международная специализированная выставка «Образование и карьера»
- Спартакиада среди сотрудников «Здоровье-2020″
- Конференция «Актуальные проблемы медицины»
- Открытие общежития №4
- Встреча Президента Беларуси со студентами и преподавателями медвузов
- Новогодний утренник в ГрГМУ
- XIX Республиканская студенческая конференция «Язык. Общество. Медицина»
- Alma mater – любовь с первого курса
- Актуальные вопросы коморбидности сердечно-сосудистых и костно-мышечных заболеваний в амбулаторной практике
- Областной этап «Студент года-2019″
- Финал Science Qiuz
- Конференция «Актуальные проблемы психологии личности и социального взаимодействия»
- Посвящение в студенты ФИУ
- День Матери
- День открытых дверей — 2019
- Визит в Азербайджанский медицинский университет
- Семинар-тренинг с международным участием «Современные аспекты сестринского образования»
- Осенний легкоатлетический кросс — 2019
- 40 лет педиатрическому факультету
- День Знаний — 2019
- Посвящение в первокурсники
- Акция к Всемирному дню предотвращения суицида
- Турслет-2019
- Договор о создании филиала кафедры общей хирургии на базе Брестской областной больницы
- День Независимости
- Конференция «Современные технологии диагностики, терапии и реабилитации в пульмонологии»
- Выпускной медико-диагностического, педиатрического факультетов и факультета иностранных учащихся — 2019
- Выпускной медико-психологического факультета — 2019
- Выпускной лечебного факультета — 2019
- В добрый путь, выпускники!
- Распределение по профилям субординатуры
- Государственные экзамены
- Интеллектуальная игра «Что? Где? Когда?»
- Мистер и Мисс факультета иностранных учащихся-2019
- День Победы
- IV Республиканская студенческая военно-научная конференция «Этих дней не смолкнет слава»
- Республиканский гражданско-патриотический марафон «Вместе — за сильную и процветающую Беларусь!»
- Литературно-художественный марафон «На хвалях спадчыны маёй»
- День открытых дверей-2019
- Их имена останутся в наших сердцах
- Областной этап конкурса «Королева Весна — 2019″
- Королева Весна ГрГМУ — 2019
- Профориентация «Абитуриент – 2019» (г. Барановичи)
- Мероприятие «Карьера начинается с образования!» (г. Лида)
- Итоговое распределение выпускников — 2019
- «Навстречу весне — 2019″
- Торжественная церемония, посвященная Дню защитника Отечества
- Торжественное собрание к Дню защитника Отечества — 2019
- Мистер ГрГМУ — 2019
- Предварительное распределение выпускников 2019 года
- Митинг-реквием у памятника воинам-интернационалистам
- Профориентация «Образование и карьера» (г.Минск)
- Итоговая коллегия главного управления здравоохранения Гродненского областного исполнительного комитета
- Спартакиада «Здоровье — 2019»
- Итоговая научно-практическая конференция «Актуальные проблемы медицины».
- Расширенное заседание Совета университета.
- Научно-практическая конференция «Симуляционные технологии обучения в подготовке медицинских работников: актуальность, проблемные вопросы внедрения и перспективы»
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- XVI съезд хирургов Республики Беларусь
- Итоговая практика
- Конкурс «Студент года-2018»
- Совет университета
- 1-й съезд Евразийской Аритмологической Ассоциации (14.09.2018 г.)
- 1-й съезд Евразийской Аритмологической Ассоциации (13.09.2018 г.)
- День знаний
- День независимости Республики Беларусь
- Церемония награждения победителей конкурса на соискание Премии СНГ
- День герба и флага Республики Беларусь
- «Стань донором – подари возможность жить»
- VIII Международный межвузовский фестиваль современного танца «Сделай шаг вперед»
- Конкурс грации и артистического мастерства «Королева Весна ГрГМУ – 2018»
- Окончательное распределение выпускников 2018 года
- Митинг-реквием, приуроченный к 75-летию хатынской трагедии
- Областное совещание «Итоги работы терапевтической и кардиологической служб Гродненской области за 2017 год и задачи на 2018 год»
- Конкурсное шоу-представление «Мистер ГрГМУ-2018»
- Предварительное распределение выпускников 2018 года
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- II Съезд учёных Республики Беларусь
- Круглый стол факультета иностранных учащихся
- «Молодежь мира: самобытность, солидарность, сотрудничество»
- Заседание выездной сессии Гродненского областного Совета депутатов
- Областной этап республиканского конкурса «Студент года-2017»
- Встреча с председателем РОО «Белая Русь» Александром Михайловичем Радьковым
- Конференция «Актуальные вопросы инфекционной патологии», 27.10.2017
- XIX Всемирный фестиваль студентов и молодежи
- Республиканская научно-практическая конференция «II Гродненские аритмологические чтения»
- Областная научно-практическая конференция «V Гродненские гастроэнтерологические чтения»
- Праздник, посвящённый 889-летию города Гродно
- Круглый стол на тему «Место и роль РОО «Белая Русь» в политической системе Республики Беларусь» (22.09.2017)
- ГрГМУ и Университет медицины и фармации (г.Тыргу-Муреш, Румыния) подписали Соглашение о сотрудничестве
- 1 сентября — День знаний
- Итоговая практика на кафедре военной и экстремальной медицины
- Квалификационный экзамен у врачей-интернов
- Встреча с Комиссией по присуждению Премии Правительства Республики Беларусь
- Научно-практическая конференция «Амбулаторная терапия и хирургия заболеваний ЛОР-органов и сопряженной патологии других органов и систем»
- День государственного флага и герба
- 9 мая
- Республиканская научно-практическая конференция с международным участием «V белорусско-польская дерматологическая конференция: дерматология без границ»
- «Стань донором – подари возможность жить»
- «Круглый стол» Постоянной комиссии Совета Республики Беларусь Национального собрания Республики Беларусь по образованию, науке, культуре и социальному развитию
- Весенний кубок КВН «Юмор–это наука»
- Мисс ГрГМУ-2017
- Распределение 2017 года
- Общегородской профориентационный день для учащихся гимназий, лицеев и школ
- Праздничный концерт, посвященный Дню 8 марта
- Конкурсное шоу-представление «Мистер ГрГМУ–2017»
- «Масленица-2017»
- Торжественное собрание и паздничный концерт, посвященный Дню защитника Отечества
- Лекция профессора, д.м.н. О.О. Руммо
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- Меморандум о сотрудничестве между областной организацией Белорусского общества Красного Креста и региональной организацией Красного Креста китайской провинции Хэнань
- Визит делегации МГЭУ им. А.Д. Сахарова БГУ в ГрГМУ
- «Студент года-2016»
- Визит Чрезвычайного и Полномочного Посла Королевства Швеция в Республике Беларусь господина Мартина Оберга в ГрГМУ
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- День матери в ГрГМУ
- Итоговая практика-2016
- День знаний
- Визит китайской делегации в ГрГМУ
- Визит иностранной делегации из Вроцлавского медицинского университета (Республика Польша)
- Торжественное мероприятие, посвященное профессиональному празднику – Дню медицинского работника
- Визит ректора ГрГМУ Виктора Александровича Снежицкого в Индию
- Республиканская университетская суббота-2016
- Республиканская акция «Беларусь против табака»
- Встреча с поэтессой Яниной Бокий
- 9 мая — День Победы
- Митинг, посвященный Дню Государственного герба и Государственного флага Республики Беларусь
- Областная межвузовская студенческая научно-практическая конференция «1941 год: трагедия, героизм, память»
- «Цветы Великой Победы»
- Концерт народного ансамбля польской песни и танца «Хабры»
- Суботнiк ў Мураванцы
- «Мисс ГрГМУ-2016»
- Визит академика РАМН, профессора Разумова Александра Николаевича в УО «ГрГМУ»
- Визит иностранной делегации из Медицинского совета Мальдивской Республики
- «Кубок ректора Гродненского государственного медицинского университета по дзюдо»
- «Кубок Дружбы-2016» по мини-футболу среди мужских и женских команд медицинских учреждений образования Республики Беларусь
- Распределение выпускников 2016 года
- Визит Министра обороны Республики Беларусь на военную кафедру ГрГМУ
- Визит Первого секретаря Посольства Израиля Анны Кейнан и директора Израильского культурного центра при Посольстве Израиля Рей Кейнан
- Визит иностранной делегации из провинции Ганьсу Китайской Народной Республики в ГрГМУ
- Состоялось открытие фотовыставки «По следам Библии»
- «Кубок декана» медико-диагностического факультета по скалолазанию
- Мистер ГрГМУ-2016
- Приём Первого секретаря Посольства Израиля Анны Кейнан в ГрГМУ
- Спартакиада «Здоровье» УО «ГрГМУ» среди сотрудников 2015-2016 учебного года
- Визит Посла Республики Индия в УО «ГрГМУ»
- Торжественное собрание и концерт, посвященный Дню защитника Отечества
- Митинг-реквием, посвященный Дню памяти воинов-интернационалистов
- Итоговое заседание коллегии главного управления идеологической работы, культуры и по делам молодежи Гродненского облисполкома
- Итоговая научно-практическая конференция Гродненского государственного медицинского университета
- Новогодний концерт
- Открытие профессорского консультативного центра
- Концерт-акция «Молодёжь против СПИДа»
- «Студент года-2015»
- Открытые лекции профессора, академика НАН Беларуси Островского Юрия Петровича
- «Аlma mater – любовь с первого курса»
- Открытая лекция Регионального директора ВОЗ госпожи Жужанны Якаб
- «Открытый Кубок по велоориентированию РЦФВиС»
- Совместное заседание Советов университетов г. Гродно
- Встреча с Министром здравоохранения Республики Беларусь В.И. Жарко
- День города
- Дебаты «Врач — выбор жизни»
- День города
- Праздничный концерт «Для вас, первокурсники!»
- Акция «Наш год – наш выбор»
- День знаний
- Открытое зачисление абитуриентов в УО «Гродненский государственный медицинский университет»
- Принятие военной присяги студентами ГрГМУ
- День Независимости Республики Беларусь
- Вручение дипломов выпускникам 2015 года
- Республиканская олимпиада студентов по педиатрии
- Открытие памятного знака в честь погибших защитников
- 9 мая
- «Вторая белорусско-польская дерматологическая конференция: дерматология без границ»
- Мистер университет
- Мисс универитет
- КВН
- Гродненский государственный медицинский университет
- Чествование наших ветеранов
- 1 Мая
- Cовместный субботник
- Наши издания
- Медицинский календарь
- Университет в СМИ
- Видео-презентации
- Общественные объединения
- Комиссия по противодействию коррупции
- Образовательная деятельность
- Абитуриентам
- Студентам
- Выпускникам
- Слайдер
- Последние обновления
- Баннеры
- Иностранному гражданину
- Научная деятельность
- Поиск
Заменимые и незаменимые аминокислоты. Для чего они нужны?
10.06.2015
Аминокислоты являются одними из самых продаваемых продуктов спортивного питания. Существует огромное количество разных аминокислот, их выбор очень велик. Выпускают комплексные аминокислоты, в которых содержатся и заменимые аминокислоты, и незаменимые и условно-заменимые.
Также есть аминокислоты, в состав которых входит только три аминокислоты. Такие продукты называютсяВСАА.
Выпускаются и добавки в составе с двумя-тремя аминокислотами. Аминокислоты представлены на рынке в виде капсул, таблеток, в жидком виде, в порошке. Есть аминокислоты, которые нужно вводить внутривенно, они могут содержать глюкозу , а могут быть без нее. Но среди комплексных аминокислот самыми продаваемыми являются аминокислоты, выпущенные в твердой форме – это каплеты, таблетки и капсулы.
Что же такое аминокислоты? Человеческое тело насыщено огромнейшим количеством белков. Молекулы белков построены из маленьких кирпичиков – аминокислот. Белки в организме человека отвечают за то, чтобы разные ткани организма росли и восстанавливались. В процессе катаболических реакций они могут быть использованы как энергия. Когда пища переваривается белок, который поступил в желудок, сначала расщепляется на пептидные фрагменты, а потом из него образуются свободные аминокислоты, которые никак друг с другом не связаны. Эти аминокислоты распространяются с помощью кровотока ко всем органам. С помощью них восстанавливаются поврежденные мышцы и образуются новые. В составе комплексных аминокислот есть аминокислоты, которые не полностью были переварены. Чтобы они попали в кровоток нужно намного меньше времени, чем для попадания в кровоток протеинов (даже сывороточного белка). Комплексы из аминокислот рекомендован использовать для того, чтобы моментально восстановить запас протеина. Лучше всего их принимать в утреннее время или же по окончанию тренировки. Чтобы подкорректировать аминокислотный состав из обычной еды нужно принимать комплексы аминокислот после приема пищи. Следует знать о том, что аминокислотные комплексы не могут заменить протеин, то есть, они дополняют другие источники протеина. В природе есть близко 150 видов аминокислот и только 20 из них находится в пище. Эти аминокислоты делятся на незаменимые и заменимые. Незаменимые аминокислоты организм не может синтезировать и они должны поступать в организм вместе с едой. Заменимыми называют те аминокислоты, которые может выработать печень при условии нормального функционирования.
Существую и частично заменимые аминокислоты, их организм может сам синтезировать, но для этого нужно , чтобы их достаточное количество поступило извне. Незаменимые аминокислоты – лейцин, валин, изолейцин, триптофан, лизин, метионин, фенилаланин, треонин. Частично заменимые аминокислоты- гистидин и аргинин.
Заменимые аминокислоты – глютамин, аланин, глютаминовая кислота, аспарагин, серин, аспарагиновая кислота, цистин (цистеин), глицин, пролин, тирозин. Как правильно выбрать аминокислотный комплекс?
При выборе комплексных аминокислот следует обратить внимание на следующие факторы:
•Форма выпуска. Скорость усвоения зависит от формы выпуска. Мы говорим об аминокислотах выпущенных в твердой форме, но среди них также есть разные. Самыми быстрыми по усвоения считаются аминокислоты в порошке. Для усвоения аминокислот в таблетках нужно больше всего времени. Кроме того, они бывают очень больших размеров и их достаточно сложно проглотить. Самыми удобными являются капсулированные аминокислоты.
•Аминокислотный состав. Достаточно сложно определить какое оптимальное соотношение аминокислот должно быть в комплексном препарата (кроме ВСАА конечно же). Самое главное, чтобы в составе присутствовали незаменимые аминокислоты.
•Присутствие других аминокислот, минералов и витаминов.
•Источник аминокислот. Хоть и незначительно( так как в комплексах эти вещества находятся полупереваренными), но от него зависит скорость усвоения.
Также важно обращать внимание на аминокислотный состав. Как правильно принимать комплексные аминокислоты и когда это лучше делать? Лучше всего комплексные аминокислоты могут усваиваться в утреннее врем, после тренировки и перед ней. Принимать их нужно соответственно. В утреннее время при приеме аминокислот нужно обязательно подавить глюконеогенез, иначе большое количество поступивших аминокислот будет превращаться в глюкозу. Если употреблять аминокислоты после окончания тренировки, то нужно понимать, что в этом периоде очень высокая чувствительность инсулиновых рецепторов, в особенности тех, которые находятся на поверхности волокон мышц. В основном бодибилдеры не ограничиваются после тренировки приемом одних только аминокислот. Обычно они их дополняют коктейлями из углеводов и белков. Правильное потребление. В утреннее время нужно употреблять данную добавку после еды (спустя полчаса) или перед ней (тоже за полчаса), запивая при этом большим количеством жидкости. Следует придерживаться нормы, которую указывает производитель. Если превысить ее, то это может раздражать желудок или же кишечник. А во вторых – в наших интересах, чтобы много аминокислот как можно быстрее попали в кровь, а в большом количестве они могут на долгое время осесть в желудке, особенно это касается таблеток.
26.2: Структуры аминокислот
Цели
После заполнения этого раздела вы сможете:
- идентифицируют структурные особенности, присутствующие в 20 аминокислотах, обычно встречающихся в белках.
Примечание: Вы не должны помнить подробные структуры всех этих аминокислот, но вы должны быть готовы нарисовать структуры двух простейших членов, глицина и аланина.
- изобразить формулу проекции Фишера указанного энантиомера данной аминокислоты.
Примечание: Для этого вы должны помнить, что в энантиомере S карбоксильная группа появляется вверху формулы проекции, а аминогруппа находится слева.
- классифицирует аминокислоту как кислотную, основную или нейтральную, учитывая ее Kekulé, конденсированную или сокращенную структуру.
- изобразить цвиттерионную форму данной аминокислоты.
- объясняет некоторые из типичных свойств аминокислот (например, высокие температуры плавления, растворимость в воде) с точки зрения образования цвиттериона.
- напишите соответствующие уравнения, чтобы проиллюстрировать амфотерную природу аминокислот.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте следующие ключевые термины.
- α ‑ аминокислоты
- амфотерный
- незаменимых аминокислот
- цвиттерион
Учебные заметки
Это хороший момент для обзора некоторых принципов стереохимии, представленных в главе 5.Обязательно в полной мере используйте молекулярные модели, когда возникают какие-либо стереохимические проблемы.
Следует понимать, что трехбуквенный сокращенный код часто используется для обозначения отдельных аминокислот. Вам не нужно запоминать этот код.
Различие между незаменимыми и заменимыми аминокислотами не так однозначно, как можно было бы предположить. Например, аргинин часто считается несущественным.
Знакомство с аминокислотами
Аминокислоты образуют полимеры в результате нуклеофильной атаки аминогруппы аминокислоты на электрофильный карбонильный углерод карбоксильной группы другой аминокислоты.Карбоксильная группа аминокислоты должна быть сначала активирована, чтобы обеспечить лучшую уходящую группу, чем OH —. (Мы обсудим эту активацию АТФ позже в ходе курса.) Результирующая связь между аминокислотами представляет собой амидную связь, которую биохимики называют пептидной связью. В этой реакции выделяется вода. В обратной реакции пептидная связь может расщепляться водой (гидролиз).
Когда две аминокислоты соединяются вместе, образуя амидную связь, полученная структура называется дипептидом.Точно так же у нас могут быть трипептиды, тетрапептиды и другие полипептиды. В какой-то момент, когда структура достаточно длинная, ее называют белком. Существует множество различных способов представления структуры полипептида или белка, каждый из которых показывает разное количество информации.
Рисунок: Различные представления полипептида (гептапептида)
Рис.: Аминокислоты реагируют с образованием белков(Примечание: на рисунке выше представлена аминокислота в маловероятном состоянии протонирования с протонированной слабой кислотой и депротонированным слабым основанием для простоты демонстрации удаления воды при образовании пептидной связи и реакции гидролиза.) Белки представляют собой полимеры двадцати встречающихся в природе аминокислот. Напротив, нуклеиновые кислоты представляют собой полимеры всего из 4 различных мономерных нуклеотидов. И последовательность белка, и его общая длина отличают один белок от другого. Только для октапептида существует более 25 миллиардов различных возможных расположений аминокислот. Сравните это всего с 65536 различными олигонуклеотидами из 8 мономерных единиц (8мер). Следовательно, разнообразие возможных белков огромно.
Стереохимия
Все аминокислоты хиральные, за исключением глицина, боковая цепь которого представляет собой H.Как и в случае с липидами, биохимики используют номенклатуру L и D. Все встречающиеся в природе белки всех живых организмов состоят из L аминокислот. Абсолютная стереохимия связана с L-глицеральдегидом, как и в случае триацилглицеридов и фосфолипидов. Большинство встречающихся в природе хиральных аминокислот — это S, за исключением цистеина. Как показано на приведенной ниже диаграмме, абсолютная конфигурация аминокислот может быть показана с обозначением H, направленным назад, группами COOH, направленными влево, группой R вправо и группой NH 3 вверх.Вы можете запомнить это с помощью анаграммы CORN.
Рисунок: Стереохимия аминокислот.
Почему биохимики до сих пор используют D и L для сахаров и аминокислот? Это объяснение (взято из приведенной ниже ссылки) кажется разумным.
«Кроме того, однако, химики часто нуждаются в однозначном определении конфигурации в отсутствие какого-либо эталонного соединения, и для этой цели идеально подходит альтернативная (R, S) система, поскольку она использует правила приоритета для определения конфигураций.Эти правила иногда приводят к абсурдным результатам, когда они применяются к биохимическим молекулам. Например, как мы видели, все общие аминокислоты являются L, потому что все они имеют точно такую же структуру, включая положение группы R, если мы просто запишем группу R как R. Однако не все они имеют та же конфигурация в (R, S) системе: L-цистеин также является (R) -цистеином, но все остальные L-аминокислоты являются (S), но это просто отражает решение человека придать атому серы более высокий приоритет чем атом углерода, и не отражает реальной разницы в конфигурации.Более серьезные проблемы могут иногда возникать в реакциях замещения: иногда инверсия конфигурации может не привести к изменению префикса (R) или (S); а иногда сохранение конфигурации может привести к изменению префикса.
Отсюда следует, что не только консерватизм или непонимание системы (R, S) заставляет биохимиков продолжать использовать D и L: просто система DL удовлетворяет их потребности намного лучше. Как уже упоминалось, химики также используют D и L, когда они соответствуют их потребностям.Приведенное выше объяснение того, почему система (R, S) мало используется в биохимии, таким образом, почти полностью противоположно реальности. Эта система на самом деле является единственным практическим способом однозначного представления стереохимии сложных молекул с несколькими асимметричными центрами, но она неудобна для регулярных серий молекул, таких как аминокислоты и простые сахара. «
Природные α-аминокислоты
Гидролиз белков кипячением водной кислоты или основания дает набор небольших молекул, идентифицированных как α-аминокарбоновые кислоты.Выделено более двадцати таких компонентов, и наиболее распространенные из них перечислены в следующей таблице. Эти аминокислоты с названиями, окрашенными в зеленый цвет, представляют собой незаменимых диетических компонентов, поскольку они не синтезируются в процессе метаболизма человека. Лучшим источником этих питательных веществ является белок, но важно понимать, что не все белки имеют одинаковую питательную ценность. Например, арахис имеет более высокое массовое содержание белка, чем рыба или яйца, но доля незаменимых аминокислот в арахисовом белке составляет лишь треть от их двух других источников.По причинам, которые станут очевидными при обсуждении структур белков и пептидов, каждой аминокислоте присвоено одно или трехбуквенное сокращение.
Природные α-аминокислоты
Следует отметить некоторые общие черты этих аминокислот. За исключением пролина, все они являются 1º-аминами; и все они, за исключением глицина, хиральны. Конфигурации хиральных аминокислот такие же, когда они записаны в виде формулы проекции Фишера, как на рисунке справа, и это было определено Фишером как L-конфигурация .Заместитель R в этой структуре является остающимся структурным компонентом, который варьируется от одной аминокислоты к другой, а в пролине R представляет собой трехуглеродную цепь, которая соединяет азот с альфа-углеродом в пятичленном кольце. Применяя обозначение Кана-Ингольда-Прелога, все эти природные хиральные аминокислоты, за исключением цистеина, имеют конфигурацию S . Для первых семи соединений в левом столбце R-заместитель представляет собой углеводород. Последние три записи в левом столбце содержат гидроксильные функциональные группы, а первые две аминокислоты в правом столбце включают тиоловые и сульфидные группы соответственно.Лизин и аргинин имеют основные аминные функции в своих боковых цепях; гистидин и триптофан имеют менее основные азотсодержащие гетероциклические кольца в качестве заместителей. Наконец, боковые цепи карбоновых кислот являются заместителями аспарагиновой и глутаминовой кислот, а последние два соединения в правом столбце являются их соответствующими амидами.
Приведенные выше формулы для аминокислот представляют собой простые ковалентные связи, основанные на предыдущем понимании монофункциональных аналогов. На самом деле формулы неверны .Это очевидно из сравнения физических свойств, перечисленных в следующей таблице. Все четыре соединения в таблице имеют примерно одинаковый размер и все имеют растворимость в воде от умеренной до отличной. Первые две — простые карбоновые кислоты, а третья — аминоспирт. Все три соединения растворимы в органических растворителях (например, в эфире) и имеют относительно низкие температуры плавления. Карбоновые кислоты имеют pK a около 4,5, а сопряженная кислота амина имеет pK a , равное 10.Последней записью является простая аминокислота аланин. Напротив, он очень плавится (с разложением), нерастворим в органических растворителях и в миллион раз слабее кислоты, чем обычные карбоновые кислоты.
Физические свойства выбранных кислот и аминов
Соединение | Формула | Мол. Вес. | Растворимость в воде | Растворимость в эфире | Температура плавления | pK a |
|---|---|---|---|---|---|---|
| изомасляная кислота | (CH 3 ) 2 CHCO 2 H | 88 | 20 г / 100 мл | в сборе | -47 ºC | 5.0 |
| молочная кислота | CH 3 CH (OH) CO 2 H | 90 | в сборе | в сборе | 53 ºC | 3,9 |
| 3-амино-2-бутанол | CH 3 CH (NH 2 ) CH (OH) CH 3 | 89 | в сборе | в сборе | 9 ºC | 10.0 |
| аланин | CH 3 CH (NH 2 ) CO 2 H | 89 | 18 г / 100 мл | нерастворимый | ок. 300 ºC | 9,8 |
Цвиттерион
Эти различия, прежде всего, указывают на образование внутренней соли за счет переноса протона от кислой карбоксильной функции к основной аминогруппе.Полученная структура карбоксилата аммония, обычно называемая цвиттерионом , также подтверждается спектроскопическими характеристиками аланина.
| CH 3 CH (NH 2 ) CO 2 H | CH 3 CH (NH 3 ) (+) CO 2 (-) |
Как и ожидалось, исходя из его ионной природы, цвиттерион аланина является высокоплавким, нерастворимым в неполярных растворителях и имеет кислотную силу 1º-иона аммония.Примеры нескольких конкретных аминокислот также можно рассматривать в их предпочтительной нейтральной цвиттерионной форме. Обратите внимание, что в лизине аминовая функция, наиболее удаленная от карбоксильной группы, является более основной, чем у альфа-амина. Следовательно, положительно заряженный фрагмент аммония, образованный на конце цепи, притягивается к отрицательному карбоксилату, что приводит к спиральной конформации.
Структура аминокислоты позволяет ей действовать и как кислота, и как основание. Аминокислота обладает такой способностью, потому что при определенном значении pH (разном для каждой аминокислоты) почти все молекулы аминокислот существуют в виде цвиттерионов.Если кислота добавляется к раствору, содержащему цвиттерион, карбоксилатная группа захватывает ион водорода (H + ), и аминокислота становится положительно заряженной. Если добавлено основание, удаление иона H + из аминогруппы цвиттер-иона дает отрицательно заряженную аминокислоту. В обоих случаях аминокислота поддерживает pH системы, то есть удаляет добавленную кислоту (H + ) или основание (OH — ) из раствора.
Пример 26.1
- Изобразите структуру аниона, образующегося при реакции глицина (при нейтральном pH) с основанием.
- Изобразите структуру катиона, образующегося при реакции глицина (при нейтральном pH) с кислотой.
Решение
- Основание удаляет H + из протонированной аминогруппы.
- Кислота присоединяет H + к карбоксилатной группе.
Другие природные аминокислоты
Двадцать альфа-аминокислот, перечисленных выше, являются основными компонентами белков, их включение регулируется генетическим кодом.Существует много других встречающихся в природе аминокислот, и структуры некоторых из них показаны ниже. Некоторые из них, такие как гидроксилизин и гидроксипролин, представляют собой просто функционализированные производные ранее описанного соединения. Эти две аминокислоты содержатся только в коллагене, общем структурном белке. Гомосерин и гомоцистеин являются высшими гомологами своих однофамильцев. Аминогруппа в бета-аланине переместилась в конец трехуглеродной цепи. Это компонент пантотеновой кислоты, HOCH 2 C (CH 3 ) 2 CH (OH) CONHCH 2 CH 2 CO 2 H, член комплекса витаминов B и незаменимый питательное вещество.Ацетилкофермент А представляет собой пирофосфорилированное производное амида пантотеновой кислоты. Гомолог гамма-аминогруппы ГАМК является ингибитором нейротрансмиттеров и гипотензивным средством.
Многие необычные аминокислоты, включая D-энантиомеры некоторых распространенных кислот, продуцируются микроорганизмами. К ним относятся орнитин, который является компонентом антибиотика бацитрацина А, и статин, обнаруженный как часть пентапептида, который ингибирует действие пищеварительного фермента , пепсина .
Упражнения
Вопросы
Q26.1,1
Почему цистеин является единственной аминокислотой L с R-конфигурацией у альфа-углерода?
Q26.1.2
Изолейцин имеет два стереогенных центра.
(а) Изобразите проекцию Фишера изолейцина.
(b) Изобразите проекцию Фишера диастереомера изолейцина и обозначьте каждый стереоцентр буквой R или S.
Решения
S26.1.1
Атом серы в боковой цепи приводит к тому, что боковая цепь имеет более высокий приоритет, чем другие заместители.
S26.1.2
(а)
(б)
Авторы и авторство
серосодержащих аминокислот: обзор | Журнал питания
РЕФЕРАТ
Метионин, цистеин, гомоцистеин и таурин — четыре распространенных серосодержащих аминокислоты, но только первые 2 включены в белки. Сера принадлежит к той же группе в периодической таблице, что и кислород, но гораздо менее электроотрицательна.Это различие объясняет некоторые отличительные свойства серосодержащих аминокислот. Метионин — это аминокислота, инициирующая синтез практически всех эукариотических белков; N-формилметионин выполняет ту же функцию у прокариот. Внутри белков многие из остатков метионина скрыты в гидрофобном ядре, но некоторые из них подвержены окислительному повреждению. Цистеин, благодаря своей способности образовывать дисульфидные связи, играет решающую роль в структуре белка и в путях сворачивания белка.Метионин метаболизм начинается с его активации до S -аденозилметионина. Это кофактор необычайной универсальности, играющий роль в переносе метильной группы, переносе 5′-дезоксиаденозильной группы, синтезе полиамина, синтезе этилена в растениях и многих других. У животных основная масса S -аденозилметионина используется в реакциях метилирования. S -Аденозилгомоцистеин, который является продуктом этих метилтрансфераз, дает гомоцистеин. Гомоцистеин может реетилироваться в метионин или превращаться в цистеин путем транссульфурации.Метионин также может метаболизироваться путем трансаминирования. Этот путь, который имеет значение только при высоких концентрациях метионина, дает ряд токсичных конечных продуктов. Цистеин может превращаться в такие важные продукты, как глутатион и таурин. Таурин присутствует во многих тканях в более высоких концентрациях, чем любые другие аминокислоты. Это важное питательное вещество для кошек.
Метионин и цистеин можно рассматривать как основные серосодержащие аминокислоты, потому что они являются 2 из 20 канонических аминокислот, которые включены в белки.Однако гомоцистеин и таурин также играют важную физиологическую роль (рис. 1). Почему природа использует серу в своем арсенале аминокислот? Другие канонические аминокислоты состоят только из атомов углерода, водорода, кислорода и азота. Поскольку и сера, и кислород принадлежат к одной и той же группе (Группа 6) Периодической таблицы и, следовательно, способны образовывать аналогичные ковалентные связи, вопрос может быть поставлен заново: почему аналоги метионина и цистеина, в которых атом серы заменен кислородом, а не выполняет те же функции? Одно из критических различий между кислородом и серой — это более низкая электроотрицательность серы.Действительно, кислород является вторым по величине электроотрицательным элементом в периодической таблице. Это объясняет использование серы в метионине; замена серы кислородом приведет к гораздо менее гидрофобной аминокислоте. Цистеин легко образует дисульфидные связи из-за легкости, с которой он диссоциирует с образованием тиолат-аниона. С другой стороны, серин, который отличается от цистеина только замещением серы на кислород, не сразу образует диоксидные связи. Разница заключается в том, что тиолы являются гораздо более сильными кислотами, чем спирты, поэтому спиртовая группа в серине не диссоциирует при физиологическом pH.Замена серы на кислород в S -аденозилметионине дает настолько мощный метилирующий агент, что он беспорядочно метилирует клеточные нуклеофилы без необходимости в ферменте.
РИСУНОК 1
Структуры серосодержащих аминокислот.
РИСУНОК 1
Структуры серосодержащих аминокислот.
Метионин и цистеин в белках.
Хотя и метионин, и цистеин играют решающую роль в метаболизме клеток, мы предполагаем, что в целом 20 канонических аминокислот были выбраны исходя из ролей, которые они играют в белках, а не их роли в метаболизме.Поэтому важно рассмотреть роль, которую эти аминокислоты играют в белках. Метионин — одна из самых гидрофобных аминокислот. Это означает, что большинство остатков метионина в глобулярных белках находится во внутреннем гидрофобном ядре; В мембранных доменах белка часто обнаруживается, что метионин взаимодействует с липидным бислоем. В некоторых белках часть остатков метионина в некоторой степени обнажена на поверхности. Они подвержены окислению до остатков сульфоксида метионина.Левин и др. (1) рассматривают эти остатки метионина как эндогенные антиоксиданты в белках. В глутаминсинтетазе E. coli они имеют тенденцию располагаться вокруг активного сайта и могут защищать доступ к этому сайту для активных форм кислорода. Окисление этих остатков метионина мало влияет на каталитическую активность фермента. Эти остатки можно восстановить до метионина с помощью фермента метионинсульфоксидредуктазы (2). Таким образом, происходит окислительно-восстановительный цикл, в котором окисляются незащищенные остатки метионина (например,{{+}} {+} \ mathrm {H} _ {2} \ mathrm {O}. \ end {eqnarray *}Считается, что нарушение активности метионинсульфоксидредуктазы и последующее накопление остатков сульфоксида метионина связаны с возрастными заболеваниями, нейродегенерацией и сокращением продолжительности жизни (2).
Метионин — это аминокислота, инициирующая синтез эукариотических белков; N -формилметионин выполняет ту же функцию у прокариот. Поскольку большинство этих остатков метионина впоследствии удаляется, очевидно, что их роль заключается в инициации трансляции, а не в структуре белка.У эукариот инициация трансляции включает ассоциацию тРНК инициатора (met-тРНК i met ) с eIF-2 и рибосомной субъединицей 40S вместе с молекулой мРНК. Drabkin и Rajbhandary (3) предполагают, что гидрофобная природа метионина является ключом к связыванию инициаторной тРНК с eIF-2. Используя соответствующие двойные мутации (в кодоне и антикодоне), они смогли показать, что гидрофобный валин можно использовать для инициации в клетках млекопитающих, но что полярный глутамин очень беден.
Цистеин играет решающую роль в структуре белка благодаря своей способности образовывать межцепочечные и внутрицепочечные дисульфидные связи с другими остатками цистеина. Большинство дисульфидных связей обнаружено в белках, предназначенных для экспорта или проживания на плазматической мембране. Эти дисульфидные связи могут образовываться неферментативно; протеин-дисульфид-изомераза, белок эндоплазматического ретикулума, может перетасовать любые несовпадающие дисульфиды, чтобы гарантировать правильную укладку белка (4).
S -Аденозилметионин.S -Аденозилметионин (SAM) 4 является ключевым промежуточным звеном в метаболизме метионина. Открытый в 1953 г. Кантони (5) как «активный метионин», необходимый для метилирования гуанидиоацетата до креатина, теперь очевидно, что SAM является коферментом удивительной универсальности (рис. 2). Помимо своей роли донора метила, SAM служит источником метиленовых групп (для синтеза циклопропилжирных кислот), аминогрупп (при синтезе биотина), аминоизопропильных групп (при синтезе полиаминов, а также синтез этилена, используемого растениями для ускорения созревания растений) и 5′-дезоксиаденозильных радикалов.SAM также служит источником атомов серы в синтезе биотина и липоевой кислоты (6). Однако у млекопитающих основная масса SAM используется в метилтрансферазных реакциях. Ключ к полезности SAM в качестве донора метила заключается в ионе сульфония и в электрофильной природе атомов углерода, которые примыкают к атому серы. Суть этих метилтрансферазных реакций состоит в том, что положительно заряженный сульфоний делает соседнюю метильную группу бедной электронами, что облегчает ее атаку на богатые электронами акцепторы (нуклеофилы).
РИСУНОК 2
Метаболическая универсальность S-аденозилметионина.
РИСУНОК 2
Метаболическая универсальность S-аденозилметионина.
SAM может передавать свою метильную группу широкому кругу акцепторов, включая аминокислотные остатки в белках, ДНК, РНК, небольшие молекулы и даже металлу, метилированию арсенита (7,8). В настоящее время у млекопитающих идентифицировано около 60 метилтрансфераз. Однако число почти наверняка намного больше.Биоинформатический анализ ряда геномов, включая геном человека, проведенный Katz et al. (9) предположили, что SAM-зависимые метилтрансферазы класса 1 составляют 0,6–1,6% открытых рамок считывания в этих геномах. Это может указывать на около 300 метилтрансфераз класса 1 у человека в дополнение к меньшему количеству ферментов классов 2 и 3. У людей, по-видимому, основными пользователями SAM являются гуанидиноацетат N -метилтрансфераза (ответственная за синтез креатина) и фосфатидилэтаноламин N -метилтрансфераза (синтез фосфатидилхолина) (10).Кроме того, существует значительный поток через глицин N -метилтрансферазу (GNMT), когда потребление метионина велико (11). Важным свойством всех известных SAM-зависимых метилтрансфераз является то, что они ингибируются их продуктом, S -аденозилгомоцистеином (SAH).
Метионин метаболизм.
Метионин метаболизм начинается с его активации до SAM (рис. 3) метионин аденозилтрансферазой (MAT). Реакция необычна тем, что все 3 фосфата удаляются из АТФ, что указывает на «высокоэнергетическую» природу этого иона сульфония.Затем SAM отдает свою метильную группу акцептору, чтобы произвести SAH. SAH гидролизуется до гомоцистеина и аденозина гидролазой SAH. Эта последовательность реакций называется трансметилированием и повсеместно присутствует в клетках. Гомоцистеин может быть метилирован обратно в метионин повсеместно распространенной метионинсинтазой (MS), а также в печени и почках некоторых видов бетаин: гомоцистеинметилтрансферазой (BHMT). MS использует 5-метил-THF в качестве донора метила, тогда как BHMT использует бетаин, который вырабатывается во время окисления холина, а также поступает с пищей (10).И MS, и BHMT влияют на реметилирование , и комбинацию трансметилирования и реметилирование составляют метиониновый цикл , , который встречается в большинстве, если не во всех, клетках.
РИСУНОК 3
Основные пути метаболизма серосодержащих аминокислот.
РИСУНОК 3
Основные пути метаболизма серосодержащих аминокислот.
Метиониновый цикл не приводит к катаболизму метионина.Это вызвано путем транссульфурации , который превращает гомоцистеин в цистеин за счет комбинированного действия цистатионин-β-синтазы (CBS) и цистатионин-γ-лиазы (CGL). Путь транссульфурации имеет очень ограниченное распространение в тканях; он ограничен печенью, почками, кишечником и поджелудочной железой. Превращение метионина в цистеин — необратимый процесс, который объясняет хорошо известный принцип питания, согласно которому цистеин не является диетической незаменимой аминокислотой при условии наличия адекватного метионина, но метионин является диетической незаменимой аминокислотой, независимо от наличия цистеина.Этот путь катаболизма метионина предполагает парадокс: ограничен ли катаболизм метионина необходимостью реакций метилирования? Если бы это было так, метионин в диете, богатой метионином, мог бы превышать потребность в метилировании, так что полный катаболизм не мог произойти через этот путь. GNMT метилирует глицин в саркозин, который, в свою очередь, может метаболизироваться саркозиндегидрогеназой для регенерации глицина и окисления метильной группы до 5,10-метилен-ТГФ.
Применение сложной методологии индикаторов стабильных изотопов к метаболизму метионина у людей дало оценки трансметилирования, реметилирования и транссульфурации.Такие исследования выявляют важные моменты регулирования. Например, щадящий эффект цистеина на потребности в метионине проявляется в увеличении доли реметилированного пула гомоцистеина и уменьшении доли, которая подвергается транссульфурации (12). У молодых людей, принимающих диету, содержащую 1–1,5 г белка · кг -1 · сут -1 , около 43% пула гомоцистеина реметилировалось, а 57% метаболизировалось через путь транссульфурации (трансметилирование = 9.7, трансульфурация = 5,4, реметилирование = 4,4 мкм моль · кг -1 · ч -1 ) (13).
Метионин метаболизм представляет собой замечательный пример роли витаминов в химии клетки. MS использует метилкобаламин в качестве простетической группы, одного из двух ферментов млекопитающих, которые, как известно, нуждаются в витамине B-12. Метильная группа, используемая MS, поступает из пула с 1 углеродом фолиевой кислоты. Метилентетрагидрофолатредуктаза (MTHFR), которая восстанавливает 5,10-метилен-THF до 5-метил-THF, содержит FAD в качестве простетической группы.Оба фермента пути транссульфурации (CBS и CGL) содержат пиридоксальфосфат. Поэтому неудивительно, что дефицит каждого из этих витаминов (витамина B-12, фолиевой кислоты, рибофлавина и пиридоксина) связан с повышенным уровнем гомоцистеина в плазме. Окислительное декарбоксилирование α-кетобутирата, продуцируемого CGL, осуществляется пируватдегидрогеназой, поэтому ниацин (НАД), тиамин (тиаминпирофосфат) и пантотеновая кислота (кофермент А) также могут рассматриваться как необходимые для метаболизма метионина.
Для метаболизма метионина необходимы не только витамины, но и метаболизм метионина играет решающую роль в усвоении фолиевой кислоты клетками. MS выполняет 2 основные функции. Помимо своей роли в сохранении метионина, MS превращает 5-метил-THF в THF, тем самым делая его доступным для поддержки синтеза ДНК и других функций. Поскольку 5-метил-ТГФ является доминирующей циркулирующей формой, которая попадает в клетки, МС необходим для клеточной ассимиляции фолиевой кислоты. Нарушение активности рассеянного склероза (например,g., вызванный дефицитом кобаламина) приводит к накоплению коферментов фолиевой кислоты в виде 5-метил-ТГФ, так называемой метильной ловушки (14). Эта гипотеза объясняет тот факт, что дефицит витамина B-12 вызывает функциональную недостаточность клеточного фолата.
Комбинированные пути трансметилирования и транссульфурации ответственны за катаболизм большей части метионина. Однако есть также свидетельства существования SAM-независимого катаболического пути, который начинается с реакции трансаминирования (15).При нормальных обстоятельствах это очень незначительный путь, но он становится более значительным при очень высоких концентрациях метионина. Поскольку он производит сильные токсины, такие как метантиол, он считается ответственным за токсичность метионина. Идентификация инициирующей трансаминазы неясна; глутаминтрансаминаза может действовать на метионин, но считается, что это маловероятно в физиологических условиях (15). Ввиду вероятности того, что этот путь играет роль в токсичности метионина, требуется дополнительная работа над его компонентами, распределением в тканях и физиологической функцией.
Регуляция метаболизма метионина.
Основными средствами, с помощью которых регулируется метаболизм метионина, являются 1 ) аллостерическая регуляция SAM и 2 ) регуляция экспрессии ключевых ферментов. В печени SAM оказывает мощное воздействие на различные локусы. Специфический для печени MAT имеет высокий уровень K m для метионина и, следовательно, хорошо приспособлен для удаления избытка метионина с пищей. Он демонстрирует необычное свойство активации обратной связи; он активируется его продуктом, SAM (16).Это свойство было включено в компьютерную модель метаболизма метионина в печени, и очевидно, что оно делает утилизацию метионина чрезвычайно чувствительной к концентрации метионина (17). SAM также является аллостерическим активатором CBS и аллостерическим ингибитором MTHFR (18). Следовательно, повышенный уровень SAM способствует транссульфурации (окислению метионина) и ингибирует реметилирование (сохранение метионина). Активность многих ферментов, участвующих в катаболизме метионина (MAT 1, GNMT, CBS), увеличивается при приеме пищи с высоким содержанием белка (18).
Помимо своей функции в катаболизме метионина, путь транссульфурации также обеспечивает цистеин для синтеза глутатиона. Доступность цистеина часто ограничивает синтез глутатиона, и, по-видимому, в ряде клеток (например, гепатоцитах) по крайней мере половина необходимого цистеина обеспечивается транссульфурацией, даже в присутствии физиологических концентраций цистеина (19). Транссульфурация чувствительна к балансу прооксидантов и антиоксидантов; пероксиды увеличивают поток транссульфурации, тогда как антиоксиданты уменьшают его (20).Считается, что окислительно-восстановительная регуляция пути транссульфурации происходит на уровне CBS, который содержит гем, который может служить сенсором окислительной среды (21).
Таурин.
Таурин замечателен как своей высокой концентрацией в тканях животных, так и разнообразием функций, которые ему приписывают. Таурин — самая распространенная свободная аминокислота в тканях животных. Таблица 1 показывает, что, хотя таурин составляет только 3% пула свободных аминокислот в плазме, он составляет 25%, 50%, 53% и 19% соответственно этого пула в печени, почках, мышцах и головной мозг.Величина пула внутриклеточного таурина заслуживает комментария. Например, скелетная мышца содержит 15,6 мкл моль таурина на грамм ткани, что составляет внутриклеточную концентрацию около 25 мМ. В дополнение к его роли в синтезе таурохолата соли желчных кислот, таурин, как предполагалось, действует, среди прочего, как антиоксидант, внутриклеточный осмолит, стабилизатор мембраны и нейротрансмиттер. Это важное питательное вещество для кошек; у котят, рожденных от матерей, получавших диету с дефицитом таурина, наблюдается дегенерация сетчатки (24).Таурин содержится в материнском молоке, может быть условно незаменим для детей грудного возраста и обычно добавляется в большинство смесей для младенцев. Недавние исследования начали обнаруживать действие таурина на сетчатку. Похоже, что таурин, воздействуя на рецептор глицина, способствует образованию палочковых фоторецепторных клеток из клеток-предшественников сетчатки (25).
ТАБЛИЦА 1Концентрации таурина в тканях крысы (22,23)
| Плазма | 0.36 мкм моль / мл | (2,8%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Печень | 4,28 мкм моль / г | (24,6%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Почка | 8,72 мкм моль / г | 905 50,1%)||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мышца | 15,60 μ моль / г | (52,7%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мозг | 5,09 μ моль / г | (19,1%) | Плазма | 0.36 мкм моль / мл | (2,8%) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Печень | 4,28 мкм моль / г | (24,6%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Почка | 8,72 мкм моль / г | 905 50,1%)||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мышца | 15,60 μ моль / г | (52,7%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мозг | 5,09 μ моль / г | (19,1%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плазма | 0.36 мкм моль / мл | (2,8%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Печень | 4,28 мкм моль / г | (24,6%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Почка | 8,72 мкм моль / г | 905 50,1%)||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мышца | 15,60 μ моль / г | (52,7%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мозг | 5,09 μ моль / г | (19,1%) | Плазма | 0.36 мкм моль / мл | (2,8%) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Печень | 4,28 мкм моль / г | (24,6%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Почка | 8,72 мкм моль / г | 905 50,1%)||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мышцы | 15,60 μ моль / г | (52,7%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мозг | 5,09 μ моль / г | (19,1%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные физические константы Аминокислоты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Аминокислоты: формула и молекулярная масса
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Типы аминокислот, их формулы и структура
Аминокислоты — это органические соединения, которые содержат аминогруппу (-Nh3), карбоксильную группу (-COOH) и боковую цепь, называемую функциональной группой, которая специфична для каждой аминокислоты. , Предпочтительны 20 типов аминокислот, которые далее подразделяются на 3 основных типа, таких как незаменимые аминокислоты, заменимые аминокислоты и условные аминокислоты.
20 типов аминокислотДавайте узнаем подробнее О:
Что такое аминокислоты?
Аминокислоты — это карбоновые кислоты, содержащие аминогруппы.Наиболее важными типами аминокислот являются α-аминокислоты. Аминокислоты в основном образуются из углерода, азота, кислорода и водорода, а также других природных элементов. нам известно около 500 аминокислот, из которых 20 являются наиболее важными и распространенными.
они присутствуют как второй по величине компонент в организме человека, образующий мышцы и ткани вместе с водой.
Общая формула аминокислот приведена ниже на диаграмме.
Структура и формула аминокислот
возможны сотни аминокислот, но только двадцать найдены в белках и во всех этих α-аминокислотах.
20 типов аминокислот L
ist20 распространенных аминокислот приведены ниже в виде списка вместе с трехбуквенными символами и символами аминокислот. нам. эти буквы используются для быстрого обозначения аминокислот и их легко выучить.
- аланин — ala — A
- аргинин — arg — R
- аспарагин — asn — N
- аспарагиновая кислота — asp — D
- цистеин — cys — C
- глутамин — gln
- глутамин — gln — Q
- глутаминовая кислота — glu — E
- глицин — gly — G
- гистидин — his — H
- изолейцин — ile — I
- лейцин — лей — L
- лизин — lys — K
- метионин — met — M
- фенилаланин — phe — F
- пролин — pro — P
- серин — ser — S
- треонин — thr — T
- триптофан — trp — W
- тирозин — tyr — Y
- валин — Val — V
Незаменимые аминокислоты
Это аминокислоты, которые не могут быть синтезированы в нашем организме, но они необходимы для:
- Рост младенцев.
- Передача импульсов в нервной системе.
Их недостаток приводит ко многим заболеваниям. Их необходимо добавлять в наш организм с пищей. Примеры:
- Лейцин
- Изо-лейцин
- Метионин
- Треонин
- Аргинин
- Валин
Существенными являются около 10 аминокислот.
Классификация аминокислот
Аминокислоты классифицируются по их природной, кислотной или основной природе.
Они обладают амфотерной природой. Они содержат одну основную (-NH 2 ) и одну кислотную (-COOH) группу.
Кислотная аминокислота
Они обладают кислой природой. Они содержат одну основную (-NH 2 ) группу и более одной кислотной (-COOH) группы.
Основные аминокислотыОни обладают основным характером. Они содержат одну кислотную (-COOH) группу и более одной основной аминогруппы (-NH 2 ).
Цвиттерион (диполярная природа)Диполярно заряженный, но в целом электрически нейтральный ион называется цвиттерионом. В аминокислоте карбоксильная (-COOH) группа ионизируется, отдавая протон (H + ), тогда как амино (-NH 2 ) группа с неподеленной парой электронов ведет себя как акцептор протонов, то есть основание Льюиса. Следовательно, аминокислота существует больше в виде диполярного иона, то есть цвиттериона, чем в неионизированной форме.
Наиболее важной реакцией аминокислоты является образование пептидных связей, и это возможно, потому что аминогруппы одной кислоты могут реагировать с карбоксильной группой другой и наоборот.
Хотя в указанном выше соединении имеется только одна пептидная связь, оно называется дипептидом.
Типы аминокислот (основные структурные функциональные группы)- Те, которые имеют амино (-NH 2 ) группу на альфа (α), называются α-аминокислотами.
- Те, которые имеют амино (-NH 2 ) группу на бета (β), называются β-аминокислотами.
- Те, которые имеют амино (-NH 2 ) группу на гамма (ϒ), называются ϒ-аминокислотами.
Роль аминокислот в организме человека следующая:
- Аминокислоты могут быть синтезированы обратно в белок.
- Окисление может происходить с выделением энергии.
- Если в диете мало углеводов или жиров, белок тела может быть преобразован в любой из них или использован для выработки гормонов и других потребностей организма.
Содержание свободных аминокислот в детских смесях
% PDF-1.6 % 1 0 объект > / Метаданные 3 0 R / Страницы 4 0 R / StructTreeRoot 5 0 R / Тип / Каталог / ViewerPreferences 6 0 R >> эндобдж 7 0 объект > эндобдж 2 0 obj > / Шрифт> >> / Поля [] >> эндобдж 3 0 obj > транслировать pdfГармония 2.0 Linux Kernel 2.6 64bit 13 марта 2012 Библиотека 9.0.11122.1application / pdf
Анализатор аминокислот Базовый курс: Hitachi High-Tech GLOBAL
1. Принцип и основы аминокислотного анализа
Обычно органические соединения, содержащие -COOH (карбоксильная группа) и -NH 2 (аминогруппа) в молекулярной структуре, называются аминокислотами.
Рис.1 Общая структурная формула аминокислот
Отдельные органические группы связаны с R.Характеристики каждой аминокислоты различаются в зависимости от природы R.
Рис.2 Структура Proline (Pro)
Пролин имеет кольцевую структуру. Он показывает определенные оптические свойства, отличные от других аминокислот.
Аминокислоты представлены трехбуквенным кодом, который практически унифицирован во всем мире.
Таблица 1 Трехбуквенные коды аминокислот
| Асп | Аспарагиновая кислота | Вал | Валин |
|---|---|---|---|
| Thr | Треонин | Мет | метионин |
| Ser | Серин | Иль | Изолейцин |
| Асн | Аспаргин | лей | лейцин |
| клей | Глутаминовая кислота | Тир | Тирозин |
| Gln | Глютамин | Phe | Фенилаланин |
| Pro | Proline | Lys | Лизин |
| Gly | Глицин | Его | Гистидин |
| Аля | Аланин | Trp | Триптофан |
| Cys | Цистин | Арг | Аргинин |
В области аминокислотного анализа аспарагин (Asn) и глутамин (Gln) могут быть записаны как AspNh3 и GluNh3.Точно так же Cys может относиться к цистеину.
1) Стандартные аминокислоты (аминокислоты гидролизата белка)
Белки, из которых состоят все животные, состоят из аминокислот. Аминокислоты, из которых состоят белки, называются стандартными аминокислотами (аминокислоты, гидролизующие белок). На сегодняшний день идентифицировано 20 стандартных аминокислот.
Рис. 3 Принципиальная схема аминокислот, пептидов и белков
2) Аминокислоты физиологической жидкости (свободные аминокислоты)
Основными аминокислотами являются 20 стандартных аминокислот, упомянутых выше, но если вы употребляете их в пищу, они перевариваются и превращаются в различные вещества.Эти аминокислоты, включая метаболиты и предшественники, называются аминокислотами физиологической жидкости (свободными аминокислотами). Идентифицировано около 40 аминокислот физиологической жидкости.
2. Метод анализа аминокислот
Большинство аминокислот трудно разделить и обнаружить, потому что их гидрофильность высокая, а УФ-поглощение и флуоресценция низкие. С помощью постколоночного метода нингидрина анализатор аминокислот Hitachi LA8080 может обеспечить разделение и анализ примерно 50 аминокислот.
Рис.4 Блок-схема LA8080
2-1. Катионообменная колонка и разделение аминокислот
- Аминокислоты заряжаются до + в кислотном растворе, и снова возникает электрическое притяжение катионообменной смолы.
- Напротив, в основном растворе аминокислоты заряжены, так что они отталкиваются и проходят через катионообменную смолу.
(Используя это химическое свойство, мы используем раствор гидроксида натрия (щелочной раствор) для вымывания остаточных веществ в колонке после анализа. Это называется процессом регенерации (RG).) - В аминокислотном анализе разделение осуществляется путем изменения pH элюента с кислого на основной.
Рис.5 Разделение аминокислот
Катионообменная колонка обладает высокой химической прочностью и может промываться щелочными растворами.Однако у него не очень высокая физическая сила.
Внезапные колебания давления могут вызвать деградацию колонки, поэтому следует обращать внимание на давление, прикладываемое к колонке.
Рис.6 Пример хроматограммы аминокислот
Таблица 2 Необходимые элементы для буфера для аминокислотного анализа
| Состояние | Химические вещества |
|---|---|
| pH | Лимонная кислота |
| Ионная сила | NaCl, LiCl |
| буферная емкость | Цитрат натрия, цитрат лития |
Таблица 3 Другие компоненты буфера для анализа аминокислот и цель добавления
| Реактивы | Морская свинья |
|---|---|
| Этанол | отделение Thr-Ser |
| Бензиловый спирт | отделение Трп |
| β-тиодигликоль | антиокисление серосодержащих аминокислот |
| Брий-35 | Понижение давления насоса |
| Каприловая кислота | Антикоррупционный |
Буферные растворы можно приобрести на месте.Подробности можно узнать в местных отделах продаж.
Вы также можете приготовить буферные растворы в соответствии с разделом «Приготовление буферов» инструкции по эксплуатации (основной блок). Значение pH, описанное в руководстве по эксплуатации, является справочным, и регулировка pH не требуется.
Необходимо использовать реагенты особой степени чистоты или реагенты, предназначенные для анализа аминокислот.
2-2. Дериватизация аминокислот
Существует два типа дериватизации: до столбца и после столбца.Метод постколоночной дериватизации, принятый для высокоскоростного анализатора аминокислот Hitachi LA8080, имеет такие преимущества, как меньшее влияние примесей и лучшая воспроизводимость.
Рис.7 Типы дериватизации аминокислот
Рис.8 Химическая реакция аминокислоты и нингидрина
В результате реакции с нингидрином образовалось сине-фиолетовое вещество (пурпур Рухемана), оптическая плотность которого измерялась при 570 нм.


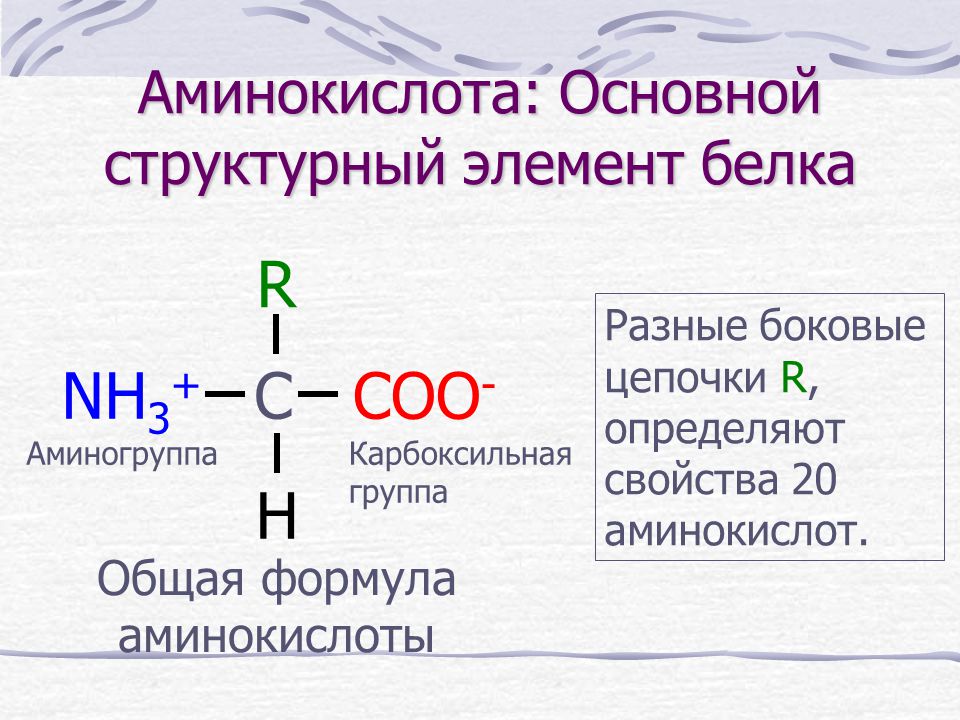

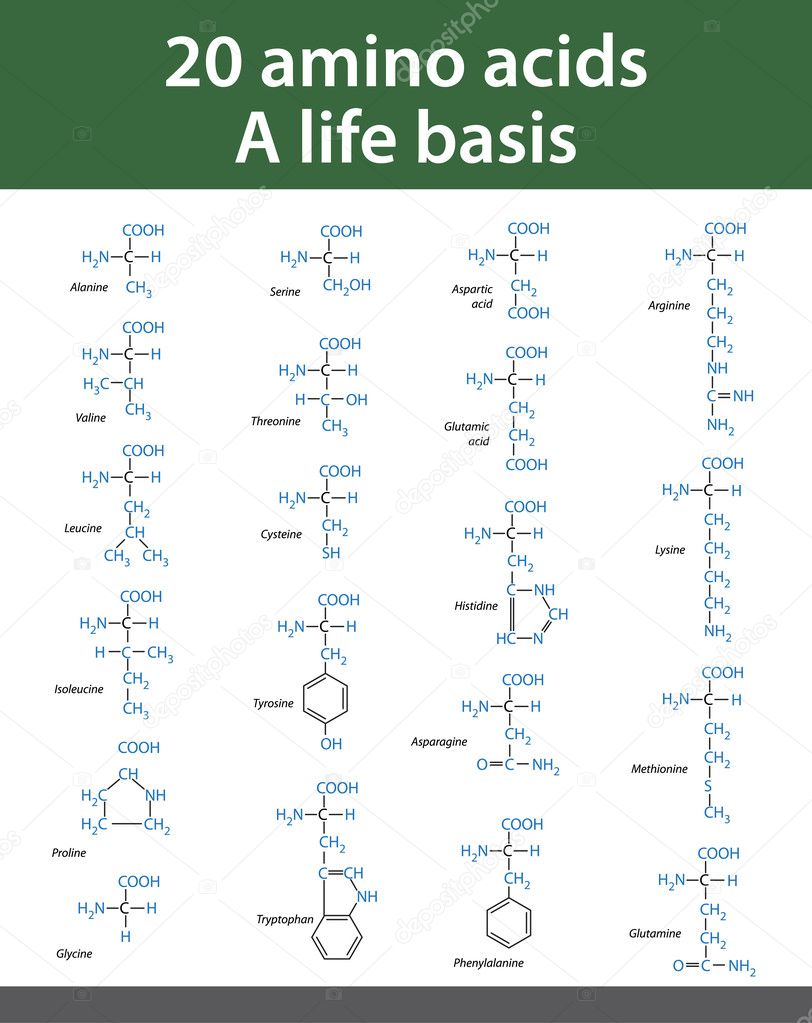 htm
htm К его особым свойствам можно отнести возможность превращения в глюкозу, что позволяет остановить катаболические процессы в организме. Кроме этого, лейцин принимает участие в восстановлении мышечных волокон, регулировании уровня сахара и сжигании жировых отложений.
К его особым свойствам можно отнести возможность превращения в глюкозу, что позволяет остановить катаболические процессы в организме. Кроме этого, лейцин принимает участие в восстановлении мышечных волокон, регулировании уровня сахара и сжигании жировых отложений. Прием данной аминокислоты способствует улучшению памяти и настроения. Часто применяется для лечения шизофрении и болезни Паркинсона.
Прием данной аминокислоты способствует улучшению памяти и настроения. Часто применяется для лечения шизофрении и болезни Паркинсона. Данные заменимые аминокислоты – это мощный источник энергии и ускоритель процессов вывода токсинов из печени. Аланин препятствует распаду мышечных тканей и продлевает время существование клеток.
Данные заменимые аминокислоты – это мощный источник энергии и ускоритель процессов вывода токсинов из печени. Аланин препятствует распаду мышечных тканей и продлевает время существование клеток.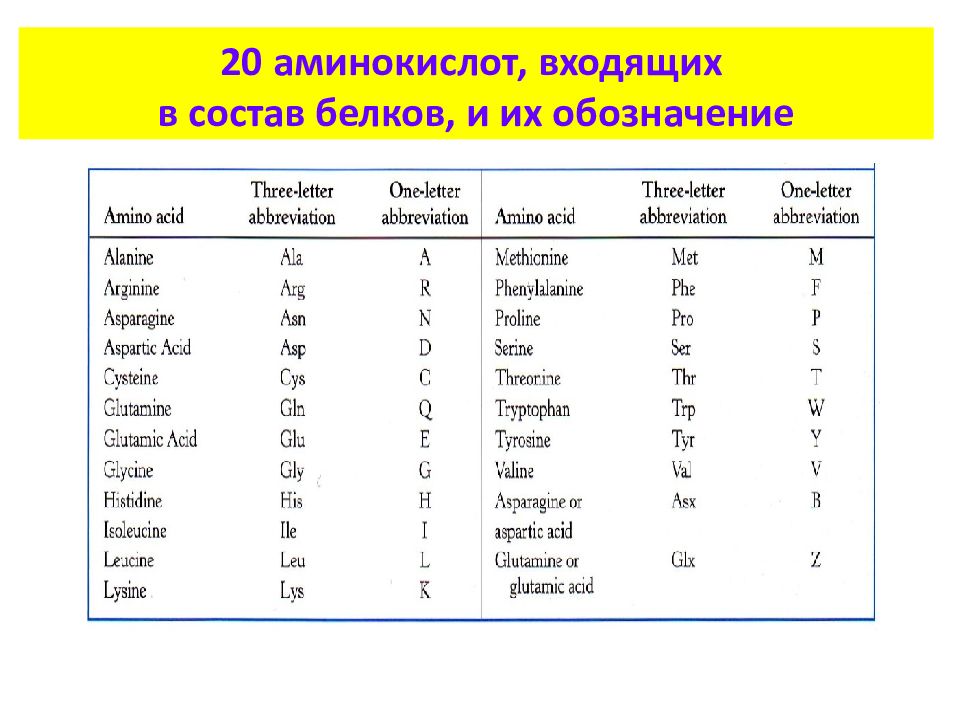 Оказывает помощь в борьбе с раком, бронхитом, септическим шоком.
Оказывает помощь в борьбе с раком, бронхитом, септическим шоком. При недостаточном содержании гистидина ослабевает иммунная система, нарушается работа органов пищеварения, синтез желудочного сока. Запасы данных заменимых аминокислот быстро истощаются, а значит потребность организма в них постоянна.
При недостаточном содержании гистидина ослабевает иммунная система, нарушается работа органов пищеварения, синтез желудочного сока. Запасы данных заменимых аминокислот быстро истощаются, а значит потребность организма в них постоянна.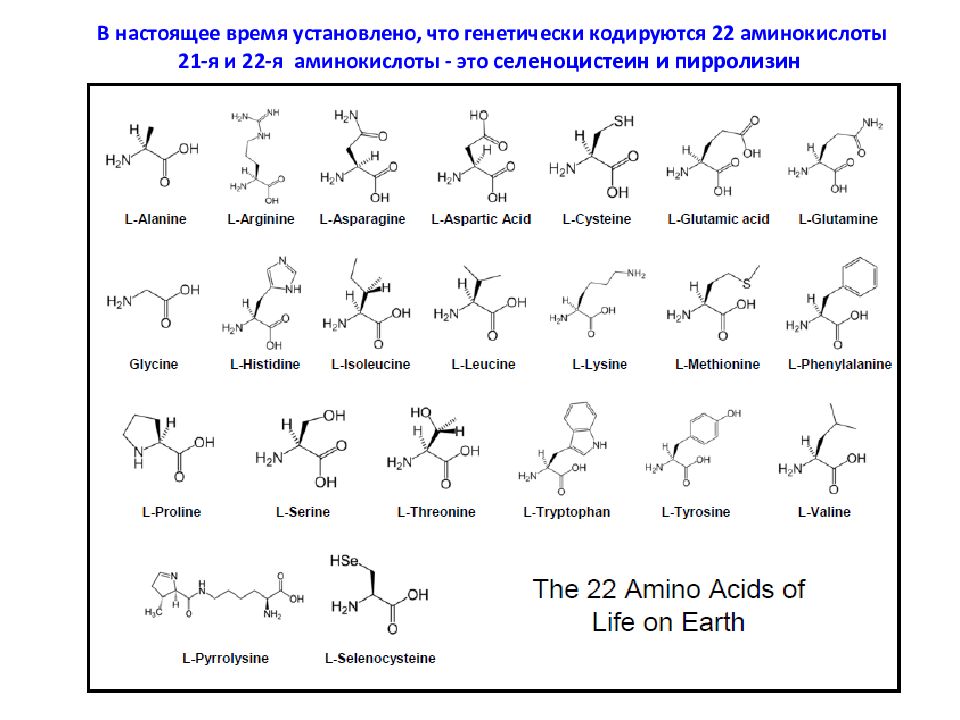
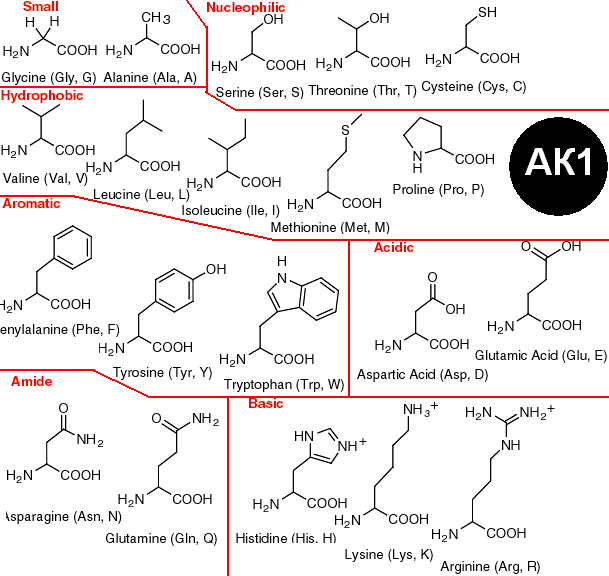
 Так же, пролин нормализирует артериальное давление, препятствует сердечнососудистым недугам.
Так же, пролин нормализирует артериальное давление, препятствует сердечнососудистым недугам.