Модификация связывания аминокислот с цитоплазматическими белками плаценты при осложненной беременности
Среди факторов, осложняющих беременность и нарушающих нормальное развитие плода, важная роль принадлежит дисфункции плаценты, сопровождающейся различными изменениями в этом органе и, как следствие, модификацией взаимосвязей во всей системе мать—плацента—плод [1]. Плацентарная недостаточность (ПН) является одной из важных проблем акушерства, пери- и неонатологии [2]. С патологией плаценты непосредственно связаны 20% случаев перинатальной смерти [3, 4]. Однако, несмотря на имеющиеся в настоящее время данные по изучению функционально-метаболических нарушений при ПН [5], частота данной патологии во всем мире до настоящего времени остается достаточно высокой [6]. Это обосновывает актуальность дальнейшего исследования клеточно-молекулярных механизмов формирования ПН.
Аминокислотный баланс в системе мать—плацента—плод и особенно в плаценте, являющейся основным поставщиком трофических компонентов плоду, во многом определяет течение гестационного периода, нормальное функционирование плаценты, процессы роста и развития плода.
Имеются лишь единичные работы, посвященные изучению при ПН свободных аминокислот, а также аминокислот, входящих в состав белковых молекул и формирующих их первичную структуру [11, 12]. Однако отсутствуют данные об аминокислотах, нековалентно связанных с белками (т.е. не входящих в состав пептидной цепи) менее прочными связями: ионными, водородными, гидрофобными и дисульфидными. Эти связанные аминокислоты, являясь регуляторами вторичной и третичной структур, стабилизируют белковую молекулу. Поддержание нативного состояния всех структурных уровней белковой молекулы служит условием сохранения физико-химических свойств белков, необходимых для выполнения их многочисленных функций: регуляторных, пластических, транспортных, ферментативных, гормональных, позволяющих белкам играть ключевую роль во всех молекулярных процессах [13, 14].
Цель настоящей работы — изучение содержания аминокислот, нековалентно связанных с цитоплазматическими белками, в плаценте при физиологической беременности и ПН для уточнения молекулярных механизмов развития этой акушерской патологии.
Материал и методы
В проспективное исследование включены 57 женщин в возрасте 24—30 лет, составившие две группы: 1-я (контрольная) группа представлена 27 практически здоровыми женщинами с неосложненным течением беременности и родов. Во 2-ю (основная) группу вошли 30 женщин, беременность которых осложнилась дисфункцией плаценты, верифицированной после родов. По возрасту, индексу массы тела, соматическому, акушерско-гинекологическому анамнезу, паритету беременностей и родов пациентки обеих групп были сопоставимы. В обеих группах преобладали первородящие женщины: в основной группе они составили 63,4%, в контрольной — 61,2%. В анамнезе прерывание беременности по желанию женщины было в 22,1 и 23,7% наблюдений соответственно в основной и контрольной группах.
Критериями исключения из исследования служили инфекционные заболевания, декомпенсированные формы соматических заболеваний, многоплодная и недоношенная беременность, признаки преэклампсии и задержки роста плода, аутоиммунная патология, отсутствие информированного согласия на расширенный протокол исследования.
Критериями при постановке диагноза (и для включения в основную группу) служили снижение фето- и маточно-плацентарного кровотока при допплерометрии без признаков централизации кровообращения.
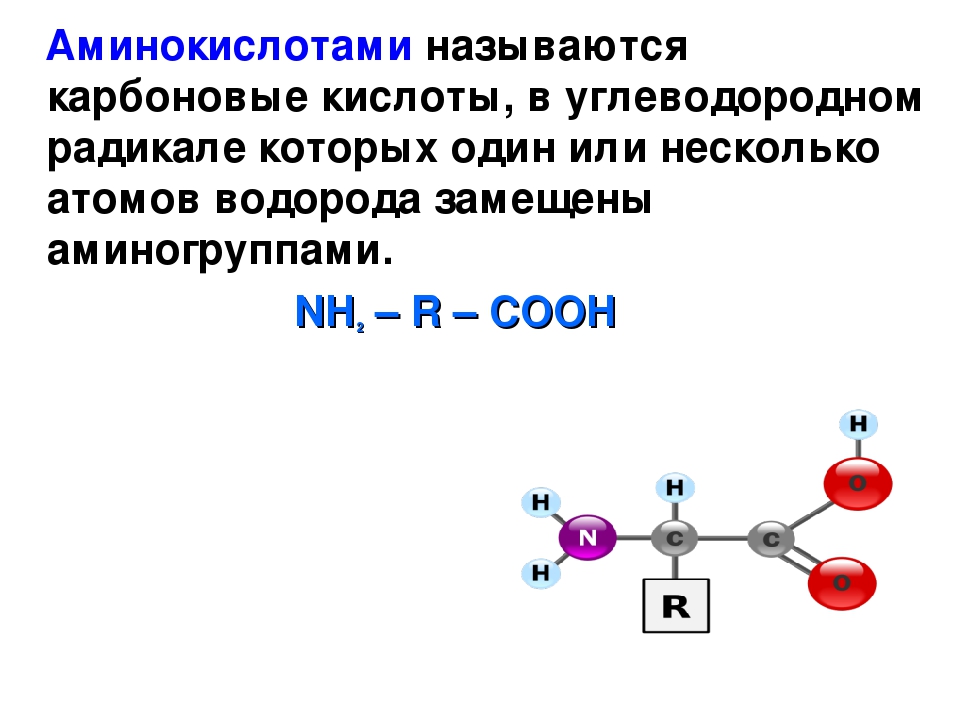 Выявленный признак считался положительным, если был отмечен более чем в 5 полях зрениях при анализе 10 полей при увеличении микроскопа ×100. Анализ исходов родов в основной группе показал, что средняя масса тела и длина новорожденного, составившие 3412±273,25 г и 52,24±2,01 см, массо-ростовой коэффициент 65,36±3,05 статистически значимо не отличались от таковых в контрольной группе (3485±286,45 г и 53,12±2,15 см, массо-ростовой коэффициент — 66,12±3,29), что сочеталось с данными ультразвуковой фетометрии. Дети у пациенток основной группы родились в асфиксии средней степени тяжести с оценкой по шкале Апгар 4—7 баллов с явлениями дыхательной недостаточности различной степени выраженности и метаболического ацидоза. У 10 новорожденных наблюдали цианоз кожных покровов и приглушенность сердечных тонов. В контрольной группе все новорожденные были клинически здоровыми с оценкой по шкале Апгар 8—10 баллов.
Выявленный признак считался положительным, если был отмечен более чем в 5 полях зрениях при анализе 10 полей при увеличении микроскопа ×100. Анализ исходов родов в основной группе показал, что средняя масса тела и длина новорожденного, составившие 3412±273,25 г и 52,24±2,01 см, массо-ростовой коэффициент 65,36±3,05 статистически значимо не отличались от таковых в контрольной группе (3485±286,45 г и 53,12±2,15 см, массо-ростовой коэффициент — 66,12±3,29), что сочеталось с данными ультразвуковой фетометрии. Дети у пациенток основной группы родились в асфиксии средней степени тяжести с оценкой по шкале Апгар 4—7 баллов с явлениями дыхательной недостаточности различной степени выраженности и метаболического ацидоза. У 10 новорожденных наблюдали цианоз кожных покровов и приглушенность сердечных тонов. В контрольной группе все новорожденные были клинически здоровыми с оценкой по шкале Апгар 8—10 баллов.Материалом для исследования служила ткань плаценты. Образцы плаценты получали сразу после родов при соблюдении холодового режима (температура 2—4 °C). Для исследования брали центральную часть макроскопически нормальных участков плацентарного диска, включая плодовую и материнскую поверхности (без крупных сосудов, кровоизлияний, кальцификации, некроза, отложений фибрина). Вырезанные образцы (10 г) промывали охлажденным изотоническим раствором натрия хлорида для удаления остатков крови и амниотической жидкости, затем гомогенизировали (при температуре 4 °C) в 0,25 М растворе сахарозы, 5 мМ MgCl 2, 1 мМ ЭДТА, 10 мМ Трис-HCl (рН 7,4) в присутствии ингибиторов протеаз с помощью гомогенизатора Ultra-Turrax. Гомогенаты подвергали дифференциальному центрифугированию, осаждали ядра и митохондрии и получали супернатант после ультрацентрифугирования при 105 000 об/мин в течение 60 мин, который служил источником цитоплазматических белков. Разделение связанных и свободных аминокислот с помощью многоступенчатой обработки солевыми растворами проводили по методу Эллиота с некоторыми модификациями [15]. Количественное определение фракций связанных и свободных аминокислот осуществляли на автоматическом анализаторе ААА-400.
Для исследования брали центральную часть макроскопически нормальных участков плацентарного диска, включая плодовую и материнскую поверхности (без крупных сосудов, кровоизлияний, кальцификации, некроза, отложений фибрина). Вырезанные образцы (10 г) промывали охлажденным изотоническим раствором натрия хлорида для удаления остатков крови и амниотической жидкости, затем гомогенизировали (при температуре 4 °C) в 0,25 М растворе сахарозы, 5 мМ MgCl 2, 1 мМ ЭДТА, 10 мМ Трис-HCl (рН 7,4) в присутствии ингибиторов протеаз с помощью гомогенизатора Ultra-Turrax. Гомогенаты подвергали дифференциальному центрифугированию, осаждали ядра и митохондрии и получали супернатант после ультрацентрифугирования при 105 000 об/мин в течение 60 мин, который служил источником цитоплазматических белков. Разделение связанных и свободных аминокислот с помощью многоступенчатой обработки солевыми растворами проводили по методу Эллиота с некоторыми модификациями [15]. Количественное определение фракций связанных и свободных аминокислот осуществляли на автоматическом анализаторе ААА-400. Подготовку проб к анализу проводили согласно инструкции к анализатору по стандартной программе с использованием трех натрий-цитратных буферных растворов с рН 3,25, 4,25, 5,28. Скорость тока — 70 мл/ч. Идентификацию аминокислот, расчет площадей пиков и определение концентрации осуществляли по результатам анализа соответствующих стандартов для калибровки прибора.
Подготовку проб к анализу проводили согласно инструкции к анализатору по стандартной программе с использованием трех натрий-цитратных буферных растворов с рН 3,25, 4,25, 5,28. Скорость тока — 70 мл/ч. Идентификацию аминокислот, расчет площадей пиков и определение концентрации осуществляли по результатам анализа соответствующих стандартов для калибровки прибора.
Статистическую обработку данных осуществляли с помощью лицензионного пакета программ Statistica (версия 6.0 фирмы «StatSoft Inc.»). Оценка характера распределения данных с помощью критерия Шапиро—Уилка свидетельствует об их нормальном распределении. Данные представлены в виде среднего значения (M) и стандартной ошибки среднего (m). Статистическую значимость различий между сравниваемыми показателями определяли по критерию Стьюдента (t-критерий) для независимых выборок. Результаты оценивали как статистически значимые при р<0,05.
Результаты и обсуждение
Полученные нами результаты свидетельствуют о том, что в плаценте, подобно другим органам, общий фонд аминокислот слагается из двух фракций: истинно свободных и нековалентно связанных с высокомолекулярными компонентами клеток, в частности с белками (см.

Присоединение связанных форм аминокислот к аминокислотам (особенно боковым), входящим в состав белковой молекулы, меняет состояние акцепторных групп протеинов. Так, увеличение при ПН заряженных полярных аминокислот: глутаминовой, аспарагиновой и лизина — по сравнению с гидрофобными метионином, аланином, валином и лейцином нарушает степень электростатических взаимодействий, что дестабилизирует структуру белка. К аналогичным последствиям приводит уменьшение в плаценте при ПН количества незаряженных полярных аминокислот — треонина, серина, глутамина. Обнаруженное снижение связанной формы цистеина может служить причиной модификации дисульфидных связей между этой формой аминокислоты и остатками концевого цистеина в белковой молекуле, что тоже вносит негативный вклад в регуляторные возможности белков.
Обнаруженное снижение связанной формы цистеина может служить причиной модификации дисульфидных связей между этой формой аминокислоты и остатками концевого цистеина в белковой молекуле, что тоже вносит негативный вклад в регуляторные возможности белков.
Что касается ароматических аминокислот, в частности гистидина, содержащего имидазольную группу, то снижение уровня его связанной формы при ПН, несомненно, понижает защищенность ряда участков полипептидной цепи к действию протеолитических ферментов, которые повреждают структуру белков. Уменьшение в плаценте женщин 2-й группы содержания связанной формы еще одной диаминокислоты — аргинина, характеризующегося сильно ионизированным гидроксильным радикалом, по-видимому, приводит к нарушению таких белковых характеристик, как величина полярности, электрокинетические свойства. Кроме того, изменение содержания связанных форм описанных диаминокислот (гистидина и аргинина) может менять доступность карбоксильных групп белков для образования водородных связей с гидроксилами фенольных радикалов тирозина [17].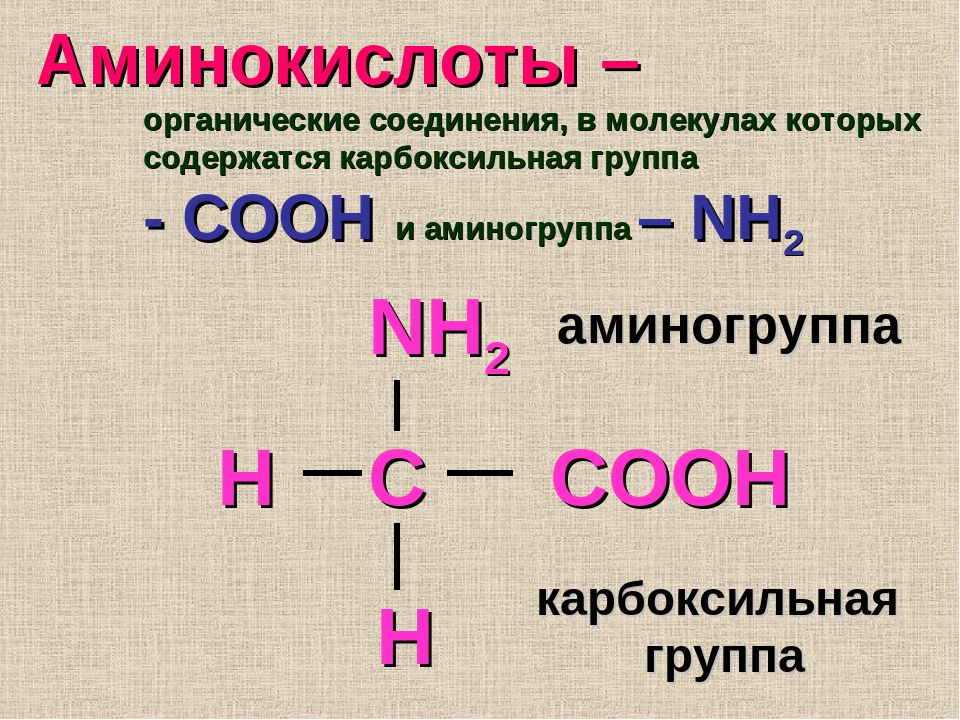 Поддержание нормальных величин данных связей, как уже указывалось, необходимо для формирования вторичной структуры белков, прежде всего, степени спирализации и растворимости, поэтому снижение их уровня приводит к нарушению важных характеристик белковой молекулы. Следует подчеркнуть, что отрицательные последствия этих изменений имеют особую значимость, когда касаются цитоплазматических белков, в состав которых входят специфические протеины беременности [18, 19].
Поддержание нормальных величин данных связей, как уже указывалось, необходимо для формирования вторичной структуры белков, прежде всего, степени спирализации и растворимости, поэтому снижение их уровня приводит к нарушению важных характеристик белковой молекулы. Следует подчеркнуть, что отрицательные последствия этих изменений имеют особую значимость, когда касаются цитоплазматических белков, в состав которых входят специфические протеины беременности [18, 19].
Все обнаруженные при ПН модификации плацентарных связанных форм аминокислот способны также нарушать комплексирование белков с другими макро- и микрокомпонентами, в частности с нуклеиновыми кислотами и нуклеотидами. Именно такие сложные белки весьма необходимы для обеспечения многих метаболических процессов [16, 20].
Резюмируя полученные данные, можно заключить, что развитие ПН происходит на фоне изменения связывания аминокислот нековалентными связями с белковыми молекулами, что модифицирует их структуру, физико-химические свойства и, следовательно, различные регуляторные функции, особенно необходимые для такого быстро развивающегося органа, как плацента. Выявленные отклонения в балансе связанных форм аминокислот и их влияние на многофункциональные цитоплазматические белки плацентарной ткани, по-видимому, являются важными звеньями в общей цепи молекулярно-биохимических нарушений при ПН не только в плаценте, но и в фетоплацентарном комплексе в целом.
Выявленные отклонения в балансе связанных форм аминокислот и их влияние на многофункциональные цитоплазматические белки плацентарной ткани, по-видимому, являются важными звеньями в общей цепи молекулярно-биохимических нарушений при ПН не только в плаценте, но и в фетоплацентарном комплексе в целом.
Результаты настоящего исследования позволяют расширить наши представления о механизмах формирования и дальнейшего развития ПН.
Содержание плацентарных аминокислот, не входящих в состав белков, но связанных с ними непрочными связями: гидроксильными, водородными, гидрофобными и др., — при ПН отличается от такового при физиологической беременности.
Увеличение связывания с цитоплазматическими белками при ПН отмечается для дикарбоновых аминокислот — глутаминовой и аспарагиновой, а также лизина и глицина. Противоположная направленность изменений при ПН обнаружена для гистидина, аргинина, треонина, серина, цистеина и метионина, уровень связанных форм которых снижается.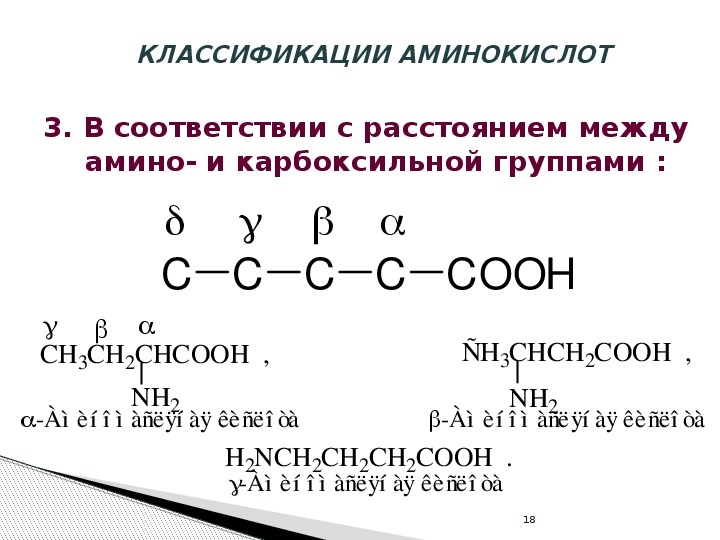
Разнонаправленные отклонения содержания гидрофобных и гидрофильных аминокислот, в том числе положительно и отрицательно заряженных, модифицируют структуру участков полипептидной цепи, с которыми аминокислоты нековалентно связываются. Эти модификации, несомненно, отражаются на свойствах белковых молекул и их функциональной активности, которые определяют механизм развития молекулярно-биохимических нарушений при плацентарной недостаточности.
Сведения об авторах
Погорелова Т.Н. — д.б.н., проф.; e-mail: [email protected]; https://orcid.org/0000-0002-0400-0652;
Гунько В.О. — к.б.н.; e-mail: [email protected]; https://orcid.org/0000-0001-8607-9052;
Никашина А.А. — к.б.н.; e-mail: [email protected]; https://orcid.org/0000-0001-8099-9093;
Каушанская Л.В. — д.м.н.; e-mail: [email protected]; https://orcid.org/0000-0001-8574-6394;
Аллилуев И.А. — м.н.с., преподаватель кафедры биохимии и микробиологии; e-mail: rniiap@yandex. ru; https://orcid.org/0000-0001-7654-0650;
ru; https://orcid.org/0000-0001-7654-0650;
Ларичкин А.В. — м.н.с.; e-mail: [email protected]; https://orcid.org/0000-0002-1207-0554
КАК ЦИТИРОВАТЬ:
Погорелова Т.Н., Гунько В.О., Никашина А.А., Каушанская Л.В., Аллилуев И.А., Ларичкин А.В. Модификация связывания аминокислот с цитоплазматическими белками плаценты при осложненной беременности. Российский вестник акушера-гинеколога. 2019;19(6):-10. https://doi.org/10.17116/rosakush301919061
В метеорите из Антарктики оказалось рекордное количество закрученных влево аминокислот
ТАСС, 21 августа. В одном из примитивных метеоритов, найденных в Антарктике, специалисты NASA обнаружили рекордно много аминокислот, молекулы которых закручены в левую сторону. Это может объяснять, почему все белки земных живых существ – «левши» с химической точки зрения. Результаты исследования опубликовал научный журнал Meteoritics and Planetary Science.
«То, что в этом метеорите, а также в некоторых других подобных находках очень много закрученных влево аминокислот, – очень необычно. Это говорит о том, что такие молекулы могли преобладать в Солнечной системе еще до того, как на Земле появилась жизнь. Теперь мы должны понять, почему это так», – рассказал один из авторов работы, астробиолог из Центра космических полетов NASA имени Годдарда (США) Дэниел Главин.
Это говорит о том, что такие молекулы могли преобладать в Солнечной системе еще до того, как на Земле появилась жизнь. Теперь мы должны понять, почему это так», – рассказал один из авторов работы, астробиолог из Центра космических полетов NASA имени Годдарда (США) Дэниел Главин.
По пока не известным причинам белки всех живых организмов на Земле состоят исключительно из тех аминокислот, молекулы которых закручены влево. С сахарами ситуация обратная – их молекулы являются «правшами». Такое явление ученые называют хиральностью.
Когда биологи попытались повторить процесс синтеза аминокислот в неживой природе, то обнаружили, что в результате появляется примерно равное количество левых и правых аминокислот. Аналогичные результаты дает изучение образцов вещества из астероидов и комет, а также облаков газа в межзвездном пространстве.
Ученые до сих пор не могут ответить на вопрос о том, как жизнь научилась различать правые и левые аминокислоты и почему ей это понадобилось. Специалисты NASA приблизились к ответу на этот вопрос, изучая метеориты из Антарктики.
Космические «левши»
Внимание астробиологов NASA привлек метеорит Aсука 12236, который несколько лет назад нашли в восточной части Антарктиды. Этот объект относится к так называемым CM-хондритов, относительно редкому типу метеоритов, которые предположительно почти целиком состоят из первичной материи Солнечной системы. Часто ученые находят в них много органики.
В отличие от многих других подобных находок, на Асука 12236 не было следов частичного переплавления и нагрева до высоких температур. Специалисты NASA отделили от него небольшой фрагмент и детально изучили его химический состав.
Интерес оказался полностью оправдан – в образце метеоритного вещества ученые нашли десятки аминокислот, в том числе серин, аланин, валин, глутаминовую и аспарагиновую кислоту. Их концентрация оказалась в несколько раз выше, чем в других CM-хондритах и метеоритах других типов.
Сравнив количество аминокислот с разной хиральностью, астробиологи обнаружили, что левых молекул серина, валина и глутаминовой кислоты было в среднем от двух до пяти раз больше, чем правых. При этом для изовалина и норвалина это не было характерно: количество левых и правых молекул этих веществ было примерно одинаково.
При этом для изовалина и норвалина это не было характерно: количество левых и правых молекул этих веществ было примерно одинаково.
Раньше ученые уже находили намеки на небольшой избыток некоторых левых аминокислот, таких как изовалин, аланин и аспарагин, в метеоритах Мёрчисон и Мюррей, найденных на территории Австралии и США. Многие ученые посчитали это аномалией, которая могла быть связана с загрязнением метеоритов следами земной органики, и не придали этому серьезного значения.
Главин считает, что еще более значительная диспропорция в Aсука 12236 должна убедить скептиков в обратном. Астробиологам и планетологам придется объяснять, как количество левых и правых аминокислот в первичной материи Солнечной системы оказалось неодинаковым.
Первые ответы на эти вопросы, как надеются специалисты NASA, можно будет получить в ближайшие годы, когда зонд OSIRIS-REx доставит на Землю образцы материи астероида Бенну. Ученые предполагают, что химический состав этого объекта не менялся с момента возникновения Солнечной системы.
Аминокислоты Whey Amino 10 000
Compress Whey Amino 10 000 предназначен для всех спортсменов, которые хотят предотвратить караболические (разрушающие мышцы) процессы в орагнизме, а также хотят достичь только анаболической (строящей мышцы) стадии.
Если вы следуете рекомендованной дневной дозировке – 3 раза в день по 4 таблетки – вы обеспечите свой организм 30 000 мг высококачественных гидролизованных аминокислот!
COMPRESS WHEY AMINO 10 000 предлагает уникальную комбинацию аминокислот в наиболее чистой форме.
Путём гидролизиции белка молочной сыворотки образуются маленькие и чистые пептидные фракции, которые не должны быть переварены протеазой (ферментами пищеварительного тракта, участвующими в расщеплении белка), что занимает больше времени и является более сложным. Белковое сырьё может быть переварено в течение нескольких часов (3 — 8 часов), однако, если вы используете COMPRESS WHEY AMINO 10000, переваривание белков будет не таким долгим. Чистый сывороточный гидролизат проходит сквозь стенки пищеварительного тракта очень быстро и почти сразу же и с минимальными потерями попадает в кровь.
Чистый сывороточный гидролизат проходит сквозь стенки пищеварительного тракта очень быстро и почти сразу же и с минимальными потерями попадает в кровь.
Уровень аминокислот в крови на протяжении дня варьируется в зависимости от вашего распорядка дня (рабочее время, тренировка, пирём пищи, стресс и т.д.). Если ваш организм испытывает недостаток аминокислот, тогда в мышцах начинается катаболический процесс. С целью предотвращения такого нежелательного эффекта мы рекомендуем регулярно принимать COMPRESS WHEY AMINO 10 000 – по 4 таблетки 3 раза в день. Одна порция продукта обеспечит вас максимальной дозировкой необходимых и эффективно усвояемых аминокислот (10000 мг).
Организм интенсивно тренирующегося спортсмена требует большой дозы белка. Однако, пищеварительный тракт не в состоянии переработать такое большое количество белка. COMPRESS WHEY AMINO 10 000 предлагает вам решение – очень простая и эффективная форма таблеток, которые не наносят вреда пищеварительному тракту, быстро всасываются и попадают прямо туда, где организм в них нуждается.
Для идеального питания ваших мышц на протяжении дня комбинируйте COMPRESS WHEY AMINO 10 000 с Long Core 80 (есть варианты 1000 ги 2200 г) Этим вы добъётесь эффективного обеспечения мышц необходимыми питательными веществами, поддержания постоянного и оптимального уровня аминокислот в крови, что в конечном итоге приведёт к взрывному росту мышечной массы.
COMPRESS WHEY AMINO 10000 обеспечивает:
- анаболический и антикатаболический эффект
- рост мышечной массы
- поддержание позитивного баланса азота в организме
- быстрое и качественное востановление мышц
- защиту мышечной массы
- 2500 мг ферментативного гидролиза в 1 таблетке.
Рекомендуемая дозировка:
- 3 раза в день по 4 таблетки,
- лучше всего между приёмами пищи, до и после тренировки или перед сном.
Упаковка:
- 100 таблеток;
- 300 таблеток
гидролизат белка сыворотки, вспомогательные вещества (сыворотка, соль натрия, стеариновая кислота, стеарат магния).
Продукт предназначен для специального питания. Продукт не предназначен для использования детьми, беременными и кормящими женщинами. Беречь от детей. Не содержит веществ, являющихся допингом. Производитель не несёт ответственности за любой вред, причинённый в результате ненадлежащего использования или хранения продукта. Без ГМО.
Пищевая ценность:| 100 г | 1 таблетка – 3215 мг | |
| Энергетическая ценность | 1913 кДж / 451 ккал | 61,5 кДж / 14,5 ккал |
| Белки | 77,8 г | 2,5 г |
| Углеводы | 28 г | 0,9 г |
| Жиры | 3 г | 0,1 г |
| Основной набор аминокислот: | ||
| L-Валин ** | 3888 мг | 125 мг |
| L-Тирозин | 2488 мг | 80 мг |
| L-Триптофан * | 1399 мг | 45 мг |
| L-Треонин * | 5443 мг | 175 мг |
| L-Серин | 3888 мг | 125 мг |
| L-Пролин | 4588 мг | 147,5 мг |
| L-Фенилаланин * | 2722 мг | 87,5 мг |
| L-Метионин * | 1633 мг | 52,5 мг |
| L-Лезин * | 6376 мг | 205 мг |
| L-Лейцин ** | 8009 мг | 257,5 мг |
| L-Изолейцин ** | 4666 мг | 150 мг |
| L-Гистидин | 1399 мг | 45 мг |
| Глицин | 1399 мг | 45 мг |
| L-глутаминовая кислота | 13219 мг | 425 мг |
| L-Цистеин | 2333 мг | 75 мг |
| L-Аспарагиновая кислота | 9176 мг | 295 мг |
| L-Аргинин | 1477 мг | 47,5 мг |
| L-Аланин | 3888 мг | 125 мг |
* EAA — незаменимые аминокислоты
** BCAA — незаменимые аминокислоты с разветвленными цепями
Аминовен Инфант 10%: инструкция, цена, аналоги | раствор для инфузий Fresenius Kabi Deutschland GmbH
фармакодинамика. Входящие в состав препарата Аминовен Инфант 10% аминокислоты являются физиологическими компонентами. После парентерального введения включаются в пул свободных аминокислот организма и участвуют во всех метаболичеcких процессах, в частности используются для синтеза белков.
Входящие в состав препарата Аминовен Инфант 10% аминокислоты являются физиологическими компонентами. После парентерального введения включаются в пул свободных аминокислот организма и участвуют во всех метаболичеcких процессах, в частности используются для синтеза белков.
Фармакокинетика. Биодоступность препарата Аминовен Инфант 10% при в/в введении составляет 100%. Аминокислоты включаются в общий пул свободных аминокислот организма и распределяются в интерстициальной жидкости и межклеточном пространстве органов и тканей. Концентрация свободных аминокислот в плазме крови и цитоплазме клеток регулируется в узких пределах в зависимости от возраста, характера питания и общего состояния больного. При правильном введении (медленно и с постоянной скоростью) Аминовен Инфант 10% не нарушает баланс аминокислот. При тяжелых нарушениях функции печени и почек регуляция баланса аминокислот нарушается. В этих случаях следует использовать другие составы р-ров аминокислот для парентерального питания. Лишь небольшая часть аминокислот элиминируется почками. T½ аминокислот из плазмы крови в значительной степени зависит от возраста.
Лишь небольшая часть аминокислот элиминируется почками. T½ аминокислот из плазмы крови в значительной степени зависит от возраста.
Аминовен Инфант 10% предназначен для частичного парентерального питания недоношенных, новорожденных и детей раннего возраста. Сочетанно с р-рами углеводов, жировыми эмульсиями, а также препаратами витаминов, электролитов и микроэлементов обеспечивает полное парентеральное питание.
Аминовен Инфант 10% предназначен для длительного капельного в/в введения, преимущественно в центральные вены.
Максимальная скорость введения: 0,1 г аминокислот на 1 кг массы тела в час, что равно 1 мл/кг массы тела в час.
Максимальная суточная доза:
- дети в возрасте до 1 года — 1,5–2,5 г аминокислот на 1 кг массы тела в сутки или 15–25 мл р-ра Аминовен Инфант 10% на 1 кг массы тела в сутки;
- дети в возрасте 2–5 лет — 1,5 г аминокислот на 1 кг массы тела в сутки или 15 мл/кг массы тела в сутки;
- дети в возрасте 6–14 лет — 1,0 г аминокислот на 1 кг массы тела в сутки или 10 мл/кг массы тела в сутки.

Аминовен Инфант 10% применяют до тех пор, пока сохраняется необходимость в парентеральном питании.
нарушения обмена аминокислот, метаболический ацидоз, гипергидратация, гиперкалиемия, повышенная чувствительность к препарату, шок, гипоксия, декомпенсированная сердечная недостаточность, почечная недостаточность при отсутствии гемодиализа или гемофильтрации, тяжелая печеночная недостаточность. При печеночной и почечной недостаточности требуется индивидуальное дозирование. С осторожностью применяют у пациентов с гипонатриемией.
при правильном применении не выявлены. Возможно развитие аллергических реакций. При введении препарата Аминовен Инфант 10% в периферические вены возможно возникновение местных реакций: гиперемия, флебит, тромбоз. Рекомендуется ежедневный контроль участка пункции.
при парентеральном питании детей раннего возраста необходимо учитывать такие показатели: азот мочи, содержание аммиака, глюкозы, электролитов, ТГ (при дополнительном введении жировых эмульсий), ферменты печени, осмолярность сыворотки крови, кислотно-щелочной баланс и водно-солевой обмен.
Слишком быстрая инфузия может привести к потере аминокислот через почки и вследствие этого к дисбалансу аминокислот.
Несовместимость. Из-за повышенного риска микробной контаминации р-ры аминокислот не следует смешивать с другими лекарственными средствами.
Необходимо избегать добавления других лекарственных средств к препарату Аминовен Инфант 10%, поскольку это может вызвать токсические реакции. В любом случае следует убедиться в совместимости препаратов, сохранении стерильности и тщательном смешивании. Р-ры с добавлением других препаратов не подлежат хранению.
Дети. Аминовен Инфант 10% предназначен для частичного парентерального питания недоношенных детей, новорожденных и детей раннего возраста.
Влияние на способность управлять транспортными средствами или работать с другими механизмами. Не изучали.
в настоящее время случаи взаимодействия Аминовена Инфант 10% с другими лекарственными средствами неизвестны.
при превышении дозирования или скорости введения препарата Аминовен Инфант 10%, как и при передозировке других р-ров аминокислот, возникают озноб, тошнота, рвота, почечный аминоацидоз. В этом случае введение препарата следует немедленно прекратить. При появлении гиперкалиемии ввести от 200 до 500 мл 5% р-ра декстрозы (глюкозы) с добавлением 1–3 МЕ инсулина на каждые 3–5 г декстрозы (глюкозы). Возможно продолжение терапии препаратом с использованием низких доз.
В этом случае введение препарата следует немедленно прекратить. При появлении гиперкалиемии ввести от 200 до 500 мл 5% р-ра декстрозы (глюкозы) с добавлением 1–3 МЕ инсулина на каждые 3–5 г декстрозы (глюкозы). Возможно продолжение терапии препаратом с использованием низких доз.
в защищенном от света месте при температуре не выше 25 °С. Не замораживать. Срок хранения — 2 года.
Дата добавления: 13.12.2021 г.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Несущественные аминокислоты — обзор
Острое повреждение почек и хроническое заболевание почек
Острое повреждение почек (AKI) связано с серьезным дефицитом питания. Большинство пациентов с ОПН являются катаболическими и их потребности в энергии на 50–100% превышают потребности в состоянии покоя, что, вероятно, является результатом других сопутствующих состояний, таких как сепсис, травмы и ожоги. Энергия предоставляется пациентам с ОПН в достаточных количествах для минимизации разложения белка, обычно в диапазоне от 25 до 35 ккал / кг / день.Липидные эмульсии для инъекций могут использоваться в качестве источника концентрированной энергии у пациентов, которым требуется ограничение жидкости.
Большинство пациентов с ОПН являются катаболическими и их потребности в энергии на 50–100% превышают потребности в состоянии покоя, что, вероятно, является результатом других сопутствующих состояний, таких как сепсис, травмы и ожоги. Энергия предоставляется пациентам с ОПН в достаточных количествах для минимизации разложения белка, обычно в диапазоне от 25 до 35 ккал / кг / день.Липидные эмульсии для инъекций могут использоваться в качестве источника концентрированной энергии у пациентов, которым требуется ограничение жидкости.
У пациентов с ОПН ускоряется потеря белка и нарушается синтез белка. Потеря аминокислот в диализате и заместительной почечной терапии усугубляет дефицит белка и увеличивает индивидуальные потребности в белке. Приблизительно от 10 до 12 г аминокислот теряется при каждой диализной терапии, в зависимости от типа диализирующей мембраны, скорости кровотока и процедуры повторного использования диализатора, и примерно от 10 до 16 г / день аминокислот теряется при непрерывной заместительной почечной терапии. (CRRT).Обеспечение протеином от 1,0 до 1,4 г / кг / день и от 1,5 до 2,5 г / кг / день рекомендуется для пациентов с ОПП, получающих гемодиализ и ПЗПТ, соответственно.
(CRRT).Обеспечение протеином от 1,0 до 1,4 г / кг / день и от 1,5 до 2,5 г / кг / день рекомендуется для пациентов с ОПП, получающих гемодиализ и ПЗПТ, соответственно.
Protein поставляется со стандартным раствором, содержащим как незаменимые, так и заменимые аминокислоты. Хотя некоторые данные предполагают, что сами по себе незаменимые аминокислоты могут быть полезны по сравнению со смесью незаменимых и заменимых аминокислот, эффективность использования растворов незаменимых аминокислот остается неопределенной. Цель состоит в том, чтобы обеспечить достаточное количество белка при агрессивном лечении пациента диализом, чтобы предотвратить накопление азотистых продуктов жизнедеятельности.
У пациентов с ОПП часто нарушается баланс жидкости и электролитов. Количество жидкости из PN, возможно, потребуется корректировать ежедневно, в зависимости от фазы AKI, от того, получает ли пациент диализ и от того, является ли диализ непрерывным или прерывистым. Уровни калия и фосфата в сыворотке крови у пациентов с ОПП обычно повышаются до начала диализа, после чего уровни могут снизиться, особенно при проведении ПП. Уровни калия, фосфата и магния нуждаются в тщательном контроле и корректировке для исправления дисбаланса.Для коррекции метаболического ацидоза можно вводить ацетатные соли калия или натрия.
Уровни калия, фосфата и магния нуждаются в тщательном контроле и корректировке для исправления дисбаланса.Для коррекции метаболического ацидоза можно вводить ацетатные соли калия или натрия.
Стандартные дозы водорастворимых витаминов и дополнительного количества фолиевой кислоты (всего 1 мг / день) и пиридоксина (витамин B 6 ) (10 мг / день) могут потребоваться в раствор для пациентов, находящихся на диализе. потому что эти витамины выводятся из организма в диализирующей ванне. Потери тиамина увеличиваются при ПЗПТ, и пациентам, получающим эту терапию, необходимо обеспечить его восполнение (100 мг / день).Дозу витамина С, возможно, придется ограничить до 100 мг / день, чтобы предотвратить отложения оксалатов. Однако пациентам, получающим ПЗПТ, следует дополнительно вводить витамин С (250 мг / день). Добавки жирорастворимых витаминов обычно не требуются, особенно у пациентов, которые также принимают пищу, поскольку выведение жирорастворимых витаминов снижается при почечной недостаточности. Например, уровни витамина А в сыворотке могут быть повышены при ОПН из-за повышенного высвобождения ретинола и ретинол-связывающего белка печенью, снижения почечного катаболизма и снижения разложения транспортного белка витамина А почками.Уровень витамина D может снижаться из-за нарушения активации 1,25-дигидроксихолекальциферола в почках. У пациентов с анурией микроэлементы могут удерживаться в растворе для ПП; тем не менее, при длительном ПП следует контролировать содержание микроэлементов и жирорастворимых витаминов и, соответственно, заменять их.
Например, уровни витамина А в сыворотке могут быть повышены при ОПН из-за повышенного высвобождения ретинола и ретинол-связывающего белка печенью, снижения почечного катаболизма и снижения разложения транспортного белка витамина А почками.Уровень витамина D может снижаться из-за нарушения активации 1,25-дигидроксихолекальциферола в почках. У пациентов с анурией микроэлементы могут удерживаться в растворе для ПП; тем не менее, при длительном ПП следует контролировать содержание микроэлементов и жирорастворимых витаминов и, соответственно, заменять их.
10 аминокислот, которые нужны вашей собаке
Это наша серия статей о чистых белковых ингредиентах корма для собак Wild Earth под названием «Ингредиенты с определенной целью». Мы понимаем, что существует МНОГО вариантов того, чем кормить собаку.Мы также понимаем, что вы хотите кормить их самой лучшей пищей, а этикетки могут сбивать с толку. Цель этой серии — дать вам представление о роли каждого ингредиента в нашей пище и о компонентах, составляющих полноценный рацион собаки. Мы разбили статьи на компоненты, из которых состоит здоровая диета собаки: Белок , Жиры и углеводы , Волокна , Витамины и минералы , Незаменимые жирные кислоты , Суперпродукты , Аминокислоты , Пребиотики и пробиотики .
Мы разбили статьи на компоненты, из которых состоит здоровая диета собаки: Белок , Жиры и углеводы , Волокна , Витамины и минералы , Незаменимые жирные кислоты , Суперпродукты , Аминокислоты , Пребиотики и пробиотики .
Аминокислоты
Выбирая корм для собак, родители домашних животных, как правило, сосредотачиваются на белке, и на то есть веские причины! Белок играет в организме множество жизненно важных ролей, в том числе:
- рост и поддержание мышц, волос и ногтей
- транспортировка питательных веществ по всему телу
- функция иммунной системы
- выработка гормонов
Глядя на гарантированный анализ корма для домашних животных, вы можете получить довольно хорошее представление от того, сколько белка содержится в пище.Действующие стандарты Ассоциации американских чиновников по контролю за кормами (AAFCO) гласят, что корм, предназначенный для содержания взрослых особей, должен содержать не менее 18% белка в пересчете на сухое вещество, в то время как минимум для роста и воспроизводства или всех стадий жизни составляет 22,5%.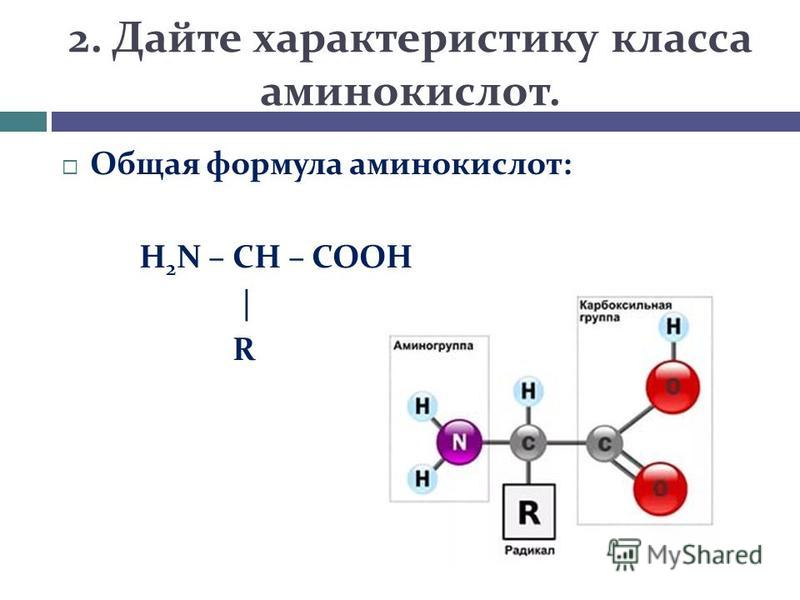 Термин «сухое вещество» относится к расчету, который учитывает, сколько воды присутствует в пище.
Термин «сухое вещество» относится к расчету, который учитывает, сколько воды присутствует в пище.
Однако гарантированный анализ не может сказать вам, обеспечивает ли присутствующий белок всеми аминокислотами, в которых нуждается ваша собака.Многие коммерческие корма для собак могут содержать больший процент содержания белка, но вы никогда не знаете, действительно ли они содержат аминокислоты, которые нужны вашей собаке.
Но зачем беспокоиться об аминокислотах? Разве не важно общее количество белка в рационе? Нет, это не так. Давайте посмотрим, почему.
Что такое аминокислоты?
Аминокислоты, как известно, являются органическими соединениями, которые обнаруживаются во всем живом, от человека до собак. Аминокислоты, как известно, являются строительными блоками белков и используются для производства белков, которые может использовать организм, но также играют важную роль в других системах, таких как регулирующие гормоны, а также нейротрансмиттеры.
Собаки напрямую не используют протеины, которые они едят. Другими словами, собака может есть мышечное мясо, но эти белки не усваиваются и не используются мышцами собаки. То, что происходит на самом деле, намного элегантнее и сложнее.
В основном белковые молекулы представляют собой цепочки, состоящие из 20 обычных аминокислот. Думайте о белках как о аминокислотных «бусинах» на нитке. Струны бывают разной длины, а бусины можно укладывать практически в любом порядке. Затем нити складываются поистине удивительным образом, что определяет, как полученный белок взаимодействует с организмом.
Но когда собаки едят белок, пищеварительная система разрушает все эти складки и звенья. Организм снова разбирает пищевые белки на их аминокислотные строительные блоки. Затем он снова собирает их в белки, которые необходимы в данный момент. Круто, а?
Половина из 20 распространенных аминокислот не имеет большого значения для питания. Собаки могут вырабатывать их самостоятельно, если в их рационе содержится достаточно азота (азот является основным компонентом всех аминокислот). Однако остальные 10 аминокислот имеют решающее значение, поскольку организм собаки не может их производить — они должны поступать с пищей.Если в рационе не хватает какой-либо из этих незаменимых аминокислот, собаки не смогут вырабатывать все типы белка, в которых нуждается их организм.
Однако остальные 10 аминокислот имеют решающее значение, поскольку организм собаки не может их производить — они должны поступать с пищей.Если в рационе не хватает какой-либо из этих незаменимых аминокислот, собаки не смогут вырабатывать все типы белка, в которых нуждается их организм.
Основные аминокислоты для собак:
- Аргинин
- Гистидин
- Изолейцин
- Лейцин
- Лизин
- Метионин
- Фенилаланин
- Треонин
- Триптофан
- Валин
На большинстве этикеток кормов для собак вы не найдете упоминаний о незаменимых аминокислотах для собак.Итак, как вы можете узнать, что конкретная диета обеспечивает их все?
Стандарты AAFCO содержат рекомендации относительно уровней всех десяти незаменимых аминокислот, которые должны содержаться в корме для собак, чтобы поддерживать здоровье собак. Убедитесь, что вы можете найти заявление AAFCO о пищевой ценности на этикетке любого корма, который вы предлагаете своей собаке. Наконец, взгляните на список ингредиентов пищи. Высококачественные источники белка, такие как дрожжи, содержат все 10 незаменимых аминокислот для собак.
Наконец, взгляните на список ингредиентов пищи. Высококачественные источники белка, такие как дрожжи, содержат все 10 незаменимых аминокислот для собак.
Первое, что мы можем сделать для наших собак, — это дать им пищу, которая позволит их телу и разуму развиваться.
Как и мы, чем здоровее образ жизни вашей собаки, тем больше у нее шансов бороться с любой болезнью или инфекцией. Часто еда, которую мы кормим наших собак, не воздает им должное. Он наполнен искусственными ароматизаторами, источниками некачественного белка и недостаточным количеством клетчатки.
Wild Earth — это корм, разработанный ветеринарами, который является источником полноценного питания с высоким содержанием белка и клетчатки. Наша еда полна бета-глюканов — мощного пищеварительного волокна, которое помогает бороться с болезнями и повышать иммунитет.Он также содержит суперпродукты, такие как нут, сладкий картофель, овес и чернику, чтобы ваша собака могла процветать!
youtube.com/embed/PY815tM0xRA» frameborder=»0″ allowfullscreen=»»/>
Термическое разложение аминокислот глицина, цистеина, аспарагиновой кислоты, аспарагина, глутаминовой кислоты, глутамина, аргинина и гистидина | BMC Biophysics
Необработанные данные
Хотя мы исследовали все 20 аминокислот, мы сообщаем результаты для тех восьми из них, для которых сумма летучих газов, NH 3 , H 2 O, CO 2 и H 2 S, соответствует потере массы, зарегистрированной термогравиметрическим методом (ТГ).Только если и масса, и баланс энтальпии точно совпадают, как в нашем случае ± 5 Да (подробности см. В Таблице 1), можно принять эти данные как доказательство правильности предложенной реакции. Это причина того, что здесь указаны только 8 из 20 аминокислот. Только по ним мы точно знаем, как они разлагаются. Для каждой аминокислоты мы показываем структуру скелета, оптические наблюдения, сигнал DSC красным цветом и сигнал TG черным, а также ионные токи для важных каналов, количественно значимыми являются только 17 Да (NH 3 , зеленый линии), 18 Da (H 2 O, синие линии) и 44 Da (CO 2 , серые линии). Логарифмическая шкала чрезмерно подчеркивает молекулярные массы. Данные ДСК приведены в Вт / г, данные ТГ — в%. Данные QMS представляют собой ионные токи [А] на образец. Все данные сведены на рис. 1 для глицина, рис. 2 для цистеина, рис. 3 для аспарагиновой кислоты, рис. 4 для аспарагина, рис. 5 для глутаминовой кислоты, рис. 6 для глутамина, рис. 7 для аргинина и Рис. 8 для гистидина.
Логарифмическая шкала чрезмерно подчеркивает молекулярные массы. Данные ДСК приведены в Вт / г, данные ТГ — в%. Данные QMS представляют собой ионные токи [А] на образец. Все данные сведены на рис. 1 для глицина, рис. 2 для цистеина, рис. 3 для аспарагиновой кислоты, рис. 4 для аспарагина, рис. 5 для глутаминовой кислоты, рис. 6 для глутамина, рис. 7 для аргинина и Рис. 8 для гистидина.
Данные по глицину. C 2 H 5 N O 2 , 75 Da, H f = −528 кДж / моль
Рис.2Данные по цистеину. C 3 H 7 N O 2 S, 121 Da, H f = −534 кДж / моль
Рис.3Данные по аспартату. C 4 H 7 N O 4 , 133 Da, H f = -973 кДж / моль
Рис. 4
4 Данные по аспарагину. C 4 H 8 N 2 O 3 , 132 Da, H f = -789 кДж / моль
Рис.5Данные по глутамату. C 5 H 9 N O 4 , 147 Da, H f = -1097 кДж / моль
Рис.6Данные по глутамину. C 5 H 10 0 N 2 O 3 , 146 Da, H f = −826 кДж / моль
Рис.7Данные по аргинину. C 6 H 14 N 4 O 2 , 174 Da, H f = −623 кДж / моль
Рис. 8
8 Данные по гистидину. C 6 H 9 N 3 O 2 , 155 Da, H f = −467 кДж / моль
Glycine, Gly, G
C 2 H 5 N O 2 , 75 Da, H f = −528 кДж / моль
Цистеин, Cys, C
C 3 H 7 N O 2 S, 121 Da, H f = −534 кДж / моль
Аспарагиновая кислота, Asp, D
C 4 H 7 N O 4 , 133 Da, H f = −973 кДж / моль
Аспарагин, Asn, N
C 4 H 8 N 2 O 3 , 132 Да, H f = −789 кДж / моль
Глутаминовая кислота, Glu, E
C 5 H 9 N O 4 , 147 Da, H f = −1097 кДж / моль
Глютамин, Gln, Q
C 5 H 10 N 2 O 3 , 146 Da, H f = −826 кДж / моль
Аргинин, Arg, R
C 6 H 14 N 4 O 2 , 174 Da, H
Гистидин, His, H
C 6 H 9 N 3 O 2 , 155 Da, H
Кривые DSC, TGA и QMS имеют одну важную особенность: в DSC есть пики при определенной температуре T пик для каждой аминокислоты, при тех же температурах они сопровождаются падениями в TGA и пики СМК. Тот простой факт, что сигналы DSC и QMS совпадают в виде колоколообразных пиков с каплей TGA, доказывает, что по существу имеет место один простой процесс разложения, а не спектр температур разложения, как это было бы для белков. Качественно это доказывает, что наблюдаемый процесс не является ни плавлением, ни сублимацией (как утверждается в литературе [5]). Наблюдаемый процесс — разложение, ни одна из восьми аминокислот не существует в жидкой форме. Тем не менее, оптические наблюдения, полученные не в вакууме, а при некотором доступе воздуха, информативны.Переходы твердое тело / жидкость при сильном кипении жидкости совпадают с пиковыми температурами для Gly, Cys, Gln, Glu, Arg и His. Только для Asn и Asp наблюдаются превращения твердое тело / твердое тело при пиковых температурах. Для Asn происходит разжижение при 280 ° C, Asp остается твердым до 320 ° C.
Тот простой факт, что сигналы DSC и QMS совпадают в виде колоколообразных пиков с каплей TGA, доказывает, что по существу имеет место один простой процесс разложения, а не спектр температур разложения, как это было бы для белков. Качественно это доказывает, что наблюдаемый процесс не является ни плавлением, ни сублимацией (как утверждается в литературе [5]). Наблюдаемый процесс — разложение, ни одна из восьми аминокислот не существует в жидкой форме. Тем не менее, оптические наблюдения, полученные не в вакууме, а при некотором доступе воздуха, информативны.Переходы твердое тело / жидкость при сильном кипении жидкости совпадают с пиковыми температурами для Gly, Cys, Gln, Glu, Arg и His. Только для Asn и Asp наблюдаются превращения твердое тело / твердое тело при пиковых температурах. Для Asn происходит разжижение при 280 ° C, Asp остается твердым до 320 ° C.
Калибровочная и количественная масс-спектрометрия
Сигналы ДСК имеют размерность удельной мощности [Вт / г], сигналы QMS — ионные токи порядка пА. Интегрирование по времени или, что то же самое, по температуре дает площади пиков, которые представляют собой удельные энергии [Дж / г] и ионные заряды порядка pC.Уменьшение веса образца, обычно 10 мг, до мольных значений тривиально. В абсолютном выражении ионные токи и ионные заряды бессмысленны, поскольку в зависимости от оборудования необходима калибровка. Доступно только одно надежное калибровочное вещество — бикарбонат натрия (NaHCO 3 ) = X1. При нагревании разлагается 2 NaHC O 3 → N a 2 C O 3 + C O 2 + H 2 O. \ (\ mathrm {\ frac {1} {2} CO_ {2}} \) моль / моль NaHCO 3 и \ (\ mathrm {\ frac {1} {2} H_ {2} O} \) моль / моль NaHCO 3 линий количественно воспроизводились в течение нескольких месяцев, в единицах пКл / моль CO 2 и пКл / моль H 2 O.Они позволили без всяких сомнений идентифицировать 1 моль CO 2 / моль Cys и \ (\ frac {1} {2} \) моль H 2 O / моль Q.
Интегрирование по времени или, что то же самое, по температуре дает площади пиков, которые представляют собой удельные энергии [Дж / г] и ионные заряды порядка pC.Уменьшение веса образца, обычно 10 мг, до мольных значений тривиально. В абсолютном выражении ионные токи и ионные заряды бессмысленны, поскольку в зависимости от оборудования необходима калибровка. Доступно только одно надежное калибровочное вещество — бикарбонат натрия (NaHCO 3 ) = X1. При нагревании разлагается 2 NaHC O 3 → N a 2 C O 3 + C O 2 + H 2 O. \ (\ mathrm {\ frac {1} {2} CO_ {2}} \) моль / моль NaHCO 3 и \ (\ mathrm {\ frac {1} {2} H_ {2} O} \) моль / моль NaHCO 3 линий количественно воспроизводились в течение нескольких месяцев, в единицах пКл / моль CO 2 и пКл / моль H 2 O.Они позволили без всяких сомнений идентифицировать 1 моль CO 2 / моль Cys и \ (\ frac {1} {2} \) моль H 2 O / моль Q. В отсутствие первичной калибровки NH 3 нам пришлось прибегнуть к вторичным веществам, глутамину, аспарагиновой кислоте и аспарагину, которые сохраняли стабильные сигналы NH 3 и H 2 O в течение нескольких месяцев. \ (\ Frac {1} {2} \) моль NH 3 / моль Q может происходить только от димера глутамина, что означает, что сигнал H 2 O от глутамина также соответствует \ (\ frac {1 } {2} \) моль H 2 O / моль Q.Для двух других соответствие между 1 моль H 2 O и 1 моль NH 3 убедительно. Таким образом, у нас было четыре последовательных контрольных точки: \ (\ frac {1} {2} \) моль H 2 O и \ (\ frac {1} {2} \) моль CO 2 из NaHCO 3 , и \ (\ frac {1} {2} \) моль NH 3 из глютамина и 1 моль NH 3 из аспарагина. Для каждого образца аминокислоты ионный ток измеряется индивидуально в каждом массовом канале от 1 до 100 Да с интервалами в 1 Да.
В отсутствие первичной калибровки NH 3 нам пришлось прибегнуть к вторичным веществам, глутамину, аспарагиновой кислоте и аспарагину, которые сохраняли стабильные сигналы NH 3 и H 2 O в течение нескольких месяцев. \ (\ Frac {1} {2} \) моль NH 3 / моль Q может происходить только от димера глутамина, что означает, что сигнал H 2 O от глутамина также соответствует \ (\ frac {1 } {2} \) моль H 2 O / моль Q.Для двух других соответствие между 1 моль H 2 O и 1 моль NH 3 убедительно. Таким образом, у нас было четыре последовательных контрольных точки: \ (\ frac {1} {2} \) моль H 2 O и \ (\ frac {1} {2} \) моль CO 2 из NaHCO 3 , и \ (\ frac {1} {2} \) моль NH 3 из глютамина и 1 моль NH 3 из аспарагина. Для каждого образца аминокислоты ионный ток измеряется индивидуально в каждом массовом канале от 1 до 100 Да с интервалами в 1 Да. Интегрирование по времени (и температуре) дает для каждой массы заряд иона на моль AA, [C / molAA], а с четырьмя калибровками — окончательные значения моль / мольAA. На рис. На фиг.9, 10 и 11 слева показаны заряды ионов, справа — количество молей. На графике для 17 Да (рис. 9) появился сигнал 20 мк Кл / моль для эталонного вещества X1. Поскольку он определенно не может содержать NH 3 , должна присутствовать систематическая ошибка 20 мк Кл / моль, хотя статистические ошибки меньше.
Интегрирование по времени (и температуре) дает для каждой массы заряд иона на моль AA, [C / molAA], а с четырьмя калибровками — окончательные значения моль / мольAA. На рис. На фиг.9, 10 и 11 слева показаны заряды ионов, справа — количество молей. На графике для 17 Да (рис. 9) появился сигнал 20 мк Кл / моль для эталонного вещества X1. Поскольку он определенно не может содержать NH 3 , должна присутствовать систематическая ошибка 20 мк Кл / моль, хотя статистические ошибки меньше.
Данные QMS для канала 17 Да. Сигналы в канале 17 Да, NH 3 для каждой из аминокислот. Ионные заряды в пиках слева, моль NH 3 / моль аминокислоты справа. Кластеризация G, C, D, Q вокруг \ (\ frac {1} {2} \) моль NH 3 на моль AA и N и R около 1 моль NH 3 на моль AA впечатляет
Рис. 10 Данные QMS для канала 18 Да. Сигналы в канале 18 Да, H 2 O, для каждой из аминокислот.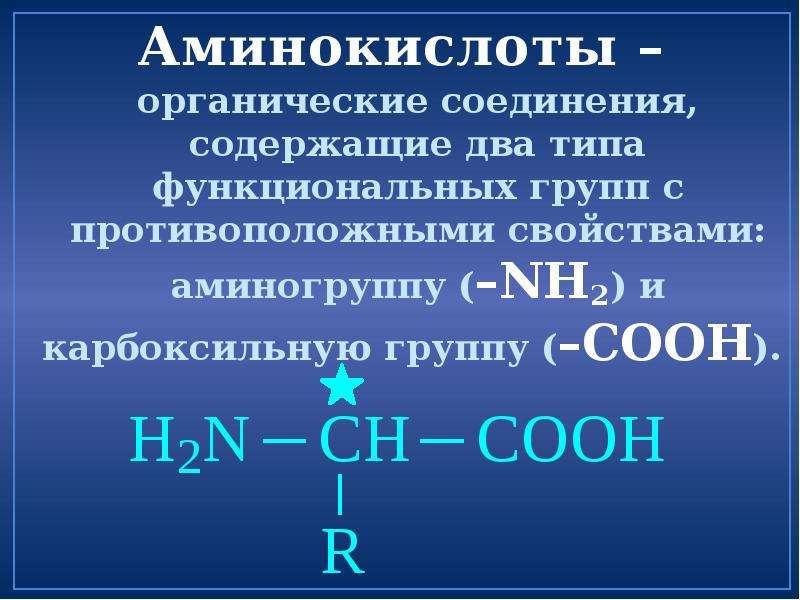 Ионные заряды в пиках слева, моль H 2 Ом / моль аминокислоты справа. Кластеризация C и Q вокруг уровня \ (\ frac {1} {2} \) моль H 2 O, N, E, R, H вокруг уровня 1 моль H 2 O и 2 молярная точка для D поразительна
Ионные заряды в пиках слева, моль H 2 Ом / моль аминокислоты справа. Кластеризация C и Q вокруг уровня \ (\ frac {1} {2} \) моль H 2 O, N, E, R, H вокруг уровня 1 моль H 2 O и 2 молярная точка для D поразительна
Данные QMS для канала 44 Да. Сигналы в 44 Да, канале CO 2 для каждой из аминокислот. Ионные заряды в пиках слева, моль CO 2 / моль аминокислоты справа.Только C производит 1 моль CO 2 , уровень остальных незначителен
Абсолютные ионные токи на рис. 9, 10 и 11 зависят от оборудования и не имеют большого значения, но относительные значения обнадеживают. Один моль NH 3 производит на 12% меньше, а CO 2 на 54% больше ионов, чем один моль H 2 O. Действительно, сечения ионизации NH 3 , H 2 O и CO 2 равны сообщается, что именно в таком порядке [6].
На рисунках 9, 10, 11 и 12 и в таблице 1 суммированы экспериментальные данные: за исключением цистеина, термическое разложение приводит к трем газам, в основном H 2 O, за исключением NH 3 и почти без CO 2 . Вес этих трех газов суммируется с потерей веса, зарегистрированной TGA, поэтому никакие другие газы не выделяются в заметных количествах — их также не видно в QMS. Близость мольфракции к целым или полуцелым значениям указывает на простые цепочки разложения. Процесс, вызывающий пики, не может быть ни плавлением (из-за потери массы), ни сублимацией (из-за сигналов QMS). Можно сделать вывод, что аминокислоты не существуют в жидкой или газообразной форме. Они разлагаются эндотермически с теплотой разложения от -72 до -151 кДж / моль при четко определенных температурах от 185 ° C до 280 ° C.
Вес этих трех газов суммируется с потерей веса, зарегистрированной TGA, поэтому никакие другие газы не выделяются в заметных количествах — их также не видно в QMS. Близость мольфракции к целым или полуцелым значениям указывает на простые цепочки разложения. Процесс, вызывающий пики, не может быть ни плавлением (из-за потери массы), ни сублимацией (из-за сигналов QMS). Можно сделать вывод, что аминокислоты не существуют в жидкой или газообразной форме. Они разлагаются эндотермически с теплотой разложения от -72 до -151 кДж / моль при четко определенных температурах от 185 ° C до 280 ° C.
Сравнение массовых балансов, зарегистрированных в экспериментах TGA и QMS. Разница между потерей массы, зарегистрированной TGA, Δ M, и летучей массой, определенной как NH 3 , H 2 O, CO 2 и H 2 S, Δ M — M газ остается ниже | 9 | Да. Это подтверждение того, что никаких других газов не производится.
Анализ данных, аминокислота за аминокислотой
Эти аминокислоты состоят из разных боковых цепей, прикрепленных к C α одной и той же основной цепи, N H 2 −Cα− ( C ∗ OOH) , но их цепочки разложения совершенно разные.Пиролитический процесс регулируется тремя законами баланса: в терминах Da массы должны складываться, химически атомные частицы должны уравновешиваться, а энтальпия образования должна равняться энтальпиям образования продуктов плюс эндотермическая теплота реакции. Количество летучих продуктов является экспериментальным значением (TGA и QMS). Для остатков экспериментальным является только масса, их состав предполагаемый. В этом разделе мы анализируем возможные пути. Хотя выбор, ограниченный соображениями состава, массы и энтальпии, убедителен, он не может быть вне всяких сомнений уникальным.Возможны альтернативы нашим предложениям, но неотличимые нами. Следовательно, анализ цепочек разложения носит предварительный или умозрительный характер. Тем не менее, они менее умозрительны, чем у Rodante et al. [7], у которых были только TGA и DSC, но не было QMS. То, что Акри и Чикос [5] называют «энтальпиями сублимации», более или менее согласуется с нашими энтальпиями разложения. Можно сделать вывод, что они должны относиться к разложению, а не просто к сублимации без изменения состава.
Тем не менее, они менее умозрительны, чем у Rodante et al. [7], у которых были только TGA и DSC, но не было QMS. То, что Акри и Чикос [5] называют «энтальпиями сублимации», более или менее согласуется с нашими энтальпиями разложения. Можно сделать вывод, что они должны относиться к разложению, а не просто к сублимации без изменения состава.
Мы использовали значения энтальпии, указанные для стандартных условий [8], без незначительных поправок на удельную теплоемкость и энтропию вплоть до фактических температур реакции.Более того, газообразный водород ускользает от нашего внимания, он слишком легкий (2 Да), чтобы регистрироваться в QMS и TGA, и он не фигурирует в сумме энтальпий, его теплота образования равна нулю по определению. За исключением водорода, баланс массы, контролируемый TGA, подтверждает, что кроме остатка и трех газов больше ничего не образуется. Настоящее ограничение — это баланс энтальпии. Для баланса энтальпии необходимо производство воды. Выражение энтальпии образования 20 аминокислот (C a H b N c О г S e ) имеет наименьшие квадраты H f (C a H b N c О г S e ) = 30. 3 a −37,8 b +16,5 c −182,4 d −71,3 e [кДж / моль]. Кислород уравновешивает остальные с -182 кДж / моль. Очевидным способом эффективного переноса энтальпии от реагентов к продуктам является образование воды с H f ( H 2 O ) = -242 кДж / моль.
3 a −37,8 b +16,5 c −182,4 d −71,3 e [кДж / моль]. Кислород уравновешивает остальные с -182 кДж / моль. Очевидным способом эффективного переноса энтальпии от реагентов к продуктам является образование воды с H f ( H 2 O ) = -242 кДж / моль.
Детальному анализу каждой аминокислоты помогает предварительная ссылка на несколько принципиально возможных реакций. Производство CO 2 в Цис, очевидно, является особым случаем.В принципе можно ожидать, что N-концы будут стабильными, что делает маловероятным образование NH 3 при дезаминировании. Другой вопрос — азот в боковых цепях, действительно, у NH 3 , продуцирующего Asn и Arg, есть азот в боковых цепях. Преобладание продукции H 2 O указывает на нестабильность C-конца за пределами атома C ∗ , где дегидратация может происходить путем n-олигомеризации, которая дает (n-1) / н моль H 2 O / моль.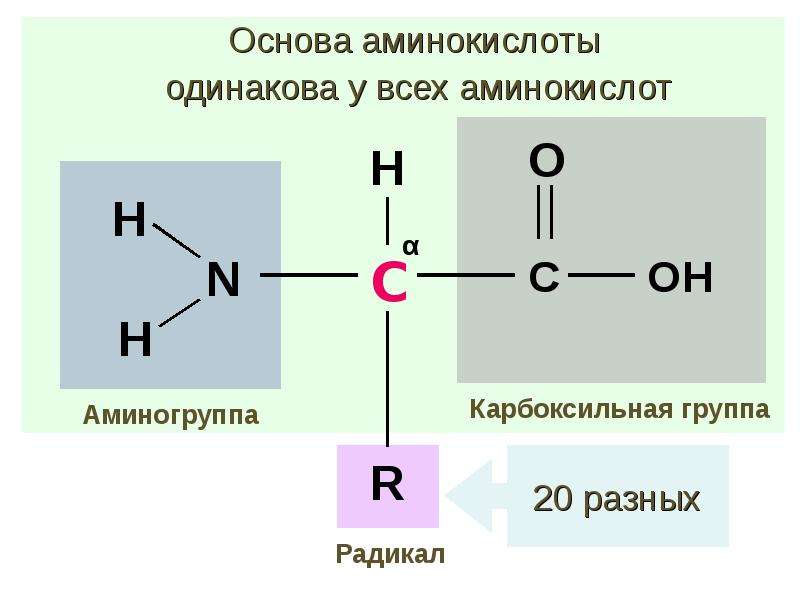 AS, от димеризации для n = 2, до 1 моль H 2 O / моль для n → ∞ при полимеризации.Особым случаем димеризации является внешняя циклизация в реакции дикетопиперазина, которая дает 1 моль H 2 O / моль AA. Они включают присоединение N- и C-концов в реакции дегидратации. Для длинных боковых цепей может быть предусмотрена также внутренняя циклизация, когда конец боковой цепи соединяется с С-концом. Целочисленные и полуцелые значения mol ограничивают выбор остатков, но не однозначно.
AS, от димеризации для n = 2, до 1 моль H 2 O / моль для n → ∞ при полимеризации.Особым случаем димеризации является внешняя циклизация в реакции дикетопиперазина, которая дает 1 моль H 2 O / моль AA. Они включают присоединение N- и C-концов в реакции дегидратации. Для длинных боковых цепей может быть предусмотрена также внутренняя циклизация, когда конец боковой цепи соединяется с С-концом. Целочисленные и полуцелые значения mol ограничивают выбор остатков, но не однозначно.
Все пики ДСК эндотермические, их площадям даны отрицательные знаки.Согласно этому соглашению эндотермическое испарение и экзотермическое производство воды записываются как
$$ \ begin {array} {@ {} rcl @ {}} {\ mathrm {H_ {2} O (l)}} & \ quad \ longrightarrow & \ quad {\ mathrm {H_ {2} O ( g)}} \\ \ mathbf {-285.5} && \ quad \ mathbf {-241.8} \ quad \ mathbf {-44} ~ \ boldsymbol {кДж / моль} \ end {array} $$
$$ \ begin {array} {ccrcl} {2} (\ mathrm {H} _ {2}) & + & \ mathrm {O} _ {2} & \ longrightarrow & 2 (\ mathrm {H} _ { 2} \ mathrm {O}) (\ mathrm {g}) \\ \ mathbf {0} & & \ mathbf {0} & & 2 \ mathbf {(- 241. 8)} + 2 \ mathbf {(241.8)} ~ \ boldsymbol {кДж / моль} \ end {array} $$
8)} + 2 \ mathbf {(241.8)} ~ \ boldsymbol {кДж / моль} \ end {array} $$
Глицин
Глицин, Gly, G, C 2 H 5 NO 2 , 75 Да, H f = -528 кДж / моль.
Простой эндотермический пик при 250 ° C, пик H = -72,1 кДж / моль.
Сигнал QMS \ (\ frac {3} {2} \) моль H 2 O / моль Gly плюс \ (\ frac {1} {2} \) моль NH 3 / моль Gly выходит за пределы Сомневаюсь, что это подтверждается потерей массы 35 Да / моль Гли. В остатке остается только 10% исходного водорода.Тройные и двойные связи в богатых углеродом C 4 HNO, C 3 HNO и C 2 HNO исключают их по энтальпии и делают вероятным отложение углерода,
$$ \ begin {array} {lclcccrcccl} {4 (\ mathrm {C} _ {2} \ mathrm {H} _ {5} \ text {NO} _ {2})} & \ longrightarrow & {6 \ , (\ mathrm {H} _ {2} \ mathrm {O})} & + & 2 {(\ text {NH} _ {3})} & + & {6 \, \ mathrm {C}} & + & 2 & {(\ text {CHNO})} \\ \ mathbf {-2112} & & \ mathbf {-1452} && \ mathbf {-92} & & \ mathbf {0} & & 2 & \ times & \ mathbf {-288} ~ \ boldsymbol {кДж / моль}, \ end {array} $$
, оставляя -280 кДж / моль = x для фрагмента CHNO, который является составом пептидной связи. В базе данных ChemSpider [9] перечислены две симметричные молекулы, полностью состоящие из пептидных связей, 1,3-диазетин-2,4-дион, C 2 H 2 N 2 O 2 , chemspider 11593418, 86 Да , (Рис. 13a) или его изомер 1,2-Диазетин-3,4-дион, C 2 H 2 N 2 O 2 , chemspider 11383421, 86 Да, Рис. 13b. Дефицит водорода таков, что даже самый мелкий лактам, 2-азиридинон, C 2 H 3 NO, 57 Da, chemspider 10574050, точка кипения 57 ° C (рис.13c) может служить остатком.
В базе данных ChemSpider [9] перечислены две симметричные молекулы, полностью состоящие из пептидных связей, 1,3-диазетин-2,4-дион, C 2 H 2 N 2 O 2 , chemspider 11593418, 86 Да , (Рис. 13a) или его изомер 1,2-Диазетин-3,4-дион, C 2 H 2 N 2 O 2 , chemspider 11383421, 86 Да, Рис. 13b. Дефицит водорода таков, что даже самый мелкий лактам, 2-азиридинон, C 2 H 3 NO, 57 Da, chemspider 10574050, точка кипения 57 ° C (рис.13c) может служить остатком.
Интерпретация данных по глицину. a , Остаток глины, C 2 H 2 N 2 O 2 , 1,3-диазетин-2,4, дион, 86 Да. b , Изомер фиг. 13а, 1,2-диазетин-3,4-дион, 86 Да. c , 2-азиридинон, C 2 H 3 NO, 57 Да. d , Промежуточный димер, глиглик, C 4 H 8 N 2 O 3 , 132 Da
$$ \ begin {array} {lclclclclll} 2 \ text {Cys} = \\ \ mathrm {C} _ {6} \ mathrm {H} _ {14} \ mathrm {N} _ {2} \ mathrm { O} _ {4} \ mathrm {S} _ {2} & \ longrightarrow & 2 \, \ text {CO} _ {2} & + & 2 \, \ mathrm {H} _ {2} \ mathrm {S } & + & \ text {NH} _ {3} & + & \ mathrm {C} _ {4} \ mathrm {H} _ {7} \ mathrm {N}, & \\ \ \ \ 2 \ mathbf { (-534)} & & \! \ mathbf {-788} & & \ mathbf {-40} & & \ mathbf {-46} & & \ mathbf {-47} & \! \! \! + & 2 \, \ mathbf {(- 96)} ~ \ boldsymbol {кДж / моль}. \ end {array} $$
\ end {array} $$
Самым простым путем кажется образование линейного глицилглицина, chemspider 10690 (рис. 13d), т. Пл. 255 ° C (то есть T пик !) C 4 H 8 N 2 O 3 , H f (s) = — 748 кДж / моль [8], из которых центральная пептидная связь — (C = O) -NH — отделяется от группы NH 2 -C α -H 2 — с одной стороны, и группа C α -H 2 -C ∗ OOH с другой стороны.Первый дает NH 3 плюс C, второй дает 2 C плюс 2 H 2 O. Этот процесс специфичен для димера глицина, в котором атомы C α не защищены соответствующими боковыми цепями, они всего — C α -H 2 — шт. Этот путь к разрыву пептидных связей представляет интерес в контексте возможного синтеза пептидных нуклеиновых кислот (ПНК) [10] через N-2-аминоэтилглицин (AEG), C 4 H 10 N 2 O 2 , chemspider 379422, который представляет собой раскисленный диглицин, 2Gly → O 2 + AEG.
Цистеин
Цистеин, Cys, C, C 3 H 7 NO 2 S: 121 Da, H f = -534 кДж / моль.
T пик = 221 ° C с потерей массы 98 Да, H пик = -96 кДж / моль.
Чистый сигнал 1 моль CO 2 не оставляет кислорода для образования H 2 O, поэтому ложная линия 18 Да должна возникать из-за систематической ошибки. Также имеется \ (\ frac {1} {2} \) моль NH 3 / моль Cys. Для H 2 S действительно есть сигнал на 34 Да.Это соответствует 1 моль, поскольку сечения ионизации H 2 S и H 2 O практически идентичны, так что применима калибровка, показанная на рис. Потеря массы 44 + 34 + 8,5 = 70% от 121 Да согласуется с TGA. Химический анализ не обнаружил в остатке серы. Не остается возможности образования дисульфидных мостиков между молекулами. Ни COS, ни CS 2 не обнаружены. Суммарная реакция
Слева –1068 кДж, справа –1113 кДж.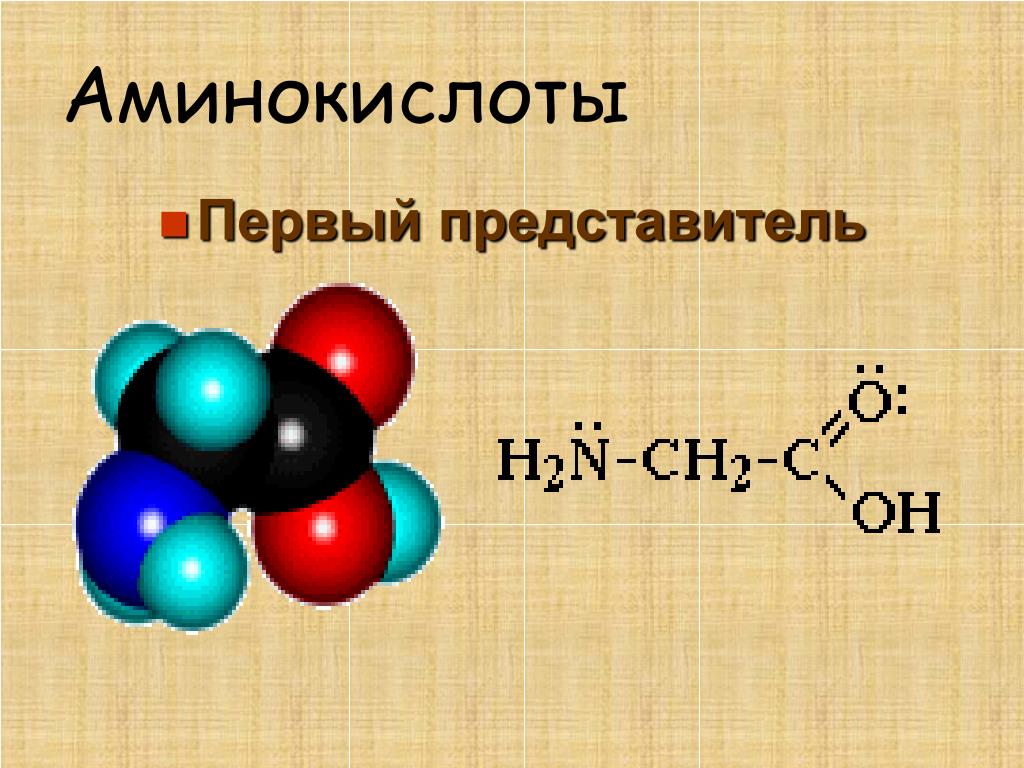 Путь к образованию C 4 H 7 N может быть выбросом карбоксильной группы — C ∗ OOH и группы -SH из Cys, оставшаяся цепь NH 2 -C α — C ∗ слишком короток для внутренней, но подходит для внешней циклизации.Два из них образуют асимметричное 5-кольцо (3-пирролидинамин, chemspider 144134), рис. 14а, от которого отрезано -NH 2 . Действительно, выброс \ (\ frac {1} {2} \) NH 3 подтверждает такую димеризацию. Остается молекула C 4 H 7 N: 2,5-дигидро-1H-пиррол, chemspider 13870958, т.кип. 90 ° C, 69 Да, H f (s) = -46,6 кДж / моль (рис. 14b), или другой пирролин с двойной связью в другом месте кольца.Действительно, за пиком наблюдается сильное кипение. Учитывая богатство водородом, несколько небольших углеводородных линий неудивительны.
Путь к образованию C 4 H 7 N может быть выбросом карбоксильной группы — C ∗ OOH и группы -SH из Cys, оставшаяся цепь NH 2 -C α — C ∗ слишком короток для внутренней, но подходит для внешней циклизации.Два из них образуют асимметричное 5-кольцо (3-пирролидинамин, chemspider 144134), рис. 14а, от которого отрезано -NH 2 . Действительно, выброс \ (\ frac {1} {2} \) NH 3 подтверждает такую димеризацию. Остается молекула C 4 H 7 N: 2,5-дигидро-1H-пиррол, chemspider 13870958, т.кип. 90 ° C, 69 Да, H f (s) = -46,6 кДж / моль (рис. 14b), или другой пирролин с двойной связью в другом месте кольца.Действительно, за пиком наблюдается сильное кипение. Учитывая богатство водородом, несколько небольших углеводородных линий неудивительны.
Интерпретация данных по цистеину.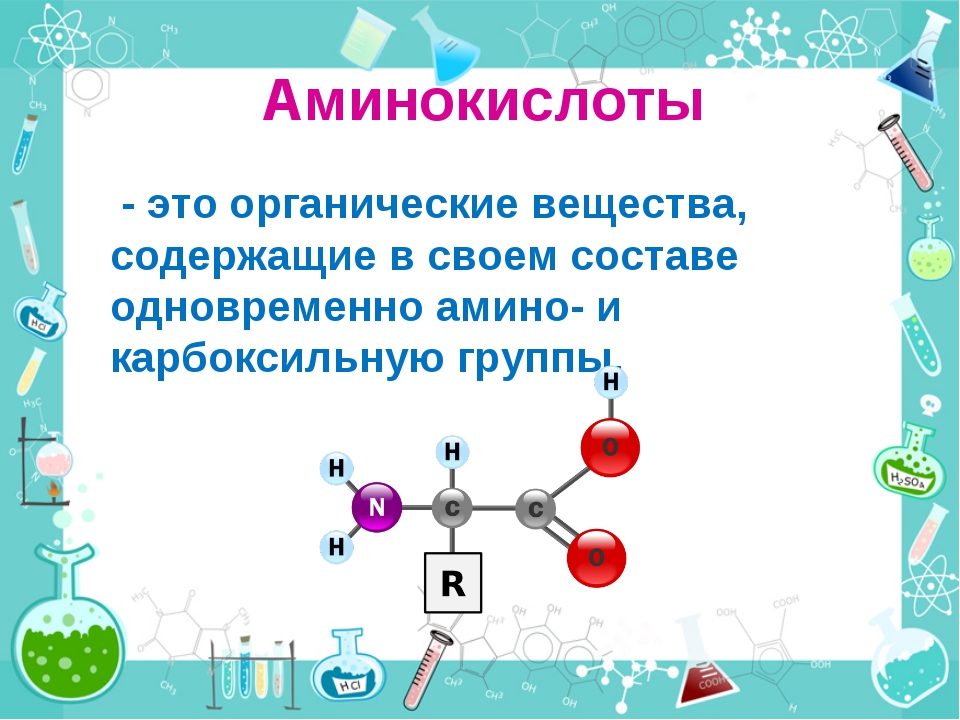 a , Промежуточное соединение: 3-пирролидинамин, Chemspider 144134, 86 Да. b , остаток Cys, C 4 H 7 N, 2,5-дигидро-1H-пиррол, химспайдер 13870958, 69 Da
a , Промежуточное соединение: 3-пирролидинамин, Chemspider 144134, 86 Да. b , остаток Cys, C 4 H 7 N, 2,5-дигидро-1H-пиррол, химспайдер 13870958, 69 Da
Аспарагиновая кислота
Аспарагиновая кислота, Asp, D, C 4 H 7 NO 4 : 133 Da, H f = -973 кДж / моль.
ДСК показывает два различных пика, при 230 ° C и при 250 ° C, в каждом из которых выбрасывается 1 моль H 2 O / моль Asp. Эндотермическая теплота составляет -64 и -61 кДж / моль соответственно. Вещество остается порошком до 294 ° C, т.е. в пике происходит преобразование твердое вещество / твердое тело. Реакция
$$ \ begin {array} {llllllcl} \ mathrm {C} _ {4} \ mathrm {H} _ {7} \ text {NO} _ {4} & \ longrightarrow & \ mathrm {H} _ { 2} \ mathrm {O} & + & \ mathrm {H} _ {2} \ mathrm {O} & + & \ mathrm {C} _ {4} \ mathrm {H} _ {3} \ text {NO} _ {2} \\ \ mathbf {-973} & & \ mathbf {-242} & & \ mathbf {-242} & & y & \! \! \ mathbf {(- 125)} ~ \ boldsymbol {кДж / моль}, \ end {array} $$
с рассчитанным y = −364 кДж / моль, что является разумным для энтальпии образования полисукцинимидного звена ( PSI). Молекулярная масса C 4 H 3 NO 2 составляет 97 Да.
Молекулярная масса C 4 H 3 NO 2 составляет 97 Да.
Состав (C 4 H 3 NO 2 ) n — полисукцинимид. Два пика подтверждают, что реакция протекает в два этапа, на первом при 230 ° C в результате реакции конденсации образуется полиаспарагиновая кислота, n Asp → H 2 O + ( A s p ) n , во втором случае при 250 ° C поли-Asp разлагается до полисукцинимида (PSI) за счет выброса еще 1 моль H. 2 O / моль Asp.О такой реакции сообщил Шифф [11]. На рис. 15 изображена молекула β, -поли-Asp, имеется изомер, α -поли-Asp, где следующий C в кольце образует связь со своим соседом. У нас нет возможности выбирать между ними.
Рис. 15Интерпретация данных по аспартату. Путь от аспарагиновой кислоты (D) к полисукцимиду (PSI). По сравнению с сукцинимидом связь N-C в полисукцинимиде экономит два атома водорода
Аспарагин
Аспарагин, Asn, N, C 4 H 8 N 2 O 3 : 132 Да, H f = -789 кДж / моль.
В широком пике при 232 ° C выбрасывается 1 моль H 2 O / моль Asn и 1 моль NH 3 / моль Asn. H пик = -122 кДж / моль. Продукт остается в виде белого порошка до 265 ° C, т.е. в реакции происходит переход твердого вещества в твердое.
$$ \ begin {array} {llllllcl} \ mathrm {C} _ {4} \ mathrm {H} _ {8} \ mathrm {N} _ {2} \ mathrm {O} _ {3} & \ longrightarrow & \ mathrm {H} _ {2} \ mathrm {O} & + & \ text {NH} _ {3} & + & \ mathrm {C} _ {4} \ mathrm {H} _ {3} \ текст {NO} _ {2} & \\ \ mathbf {-789} & & \ mathbf {-242} & & \ mathbf {-46} & & \ times & \! \! \ mathbf {(- 122)} ~ \ boldsymbol {кДж / моль}, \ end {array} $$
с расчетным значением x = −379 кДж / моль.В разложении Asp H f (C 4 H 3 NO 2 ) был рассчитан как y = -364 кДж / моль. Эти два значения согласуются, хотя из-за своей истории эти два PSI не идентичны. Если бы Asn последовал примеру Asp, он выбрасывал бы 1 моль H 2 O / моль Asn в реакции конденсации n Asn → H 2 O + ( A s n ) n , поли-N, с последующим разложением поли-N до полисукцинимида (PSI) эжекцией 1 моль NH. 3 / моль Asn.Если, однако, H 2 O реакции конденсации не выбрасывается, а сохраняется, он может заменить -NH 2 в поли-N на -OH. Согласно Asn-> NH 3 + поли-D, это составляет образование полиаспарагиновой кислоты из аспарагина путем выброса NH 3 . Поли-D затем разлагается до полисукцинимида (PSI) за счет выброса 1 моль H 2 O / моль Asn. Очевидно, имеют место обе альтернативы, показанные на рис. 16, и есть один широкий пик, содержащий как NH 3 , так и H 2 O.
3 / моль Asn.Если, однако, H 2 O реакции конденсации не выбрасывается, а сохраняется, он может заменить -NH 2 в поли-N на -OH. Согласно Asn-> NH 3 + поли-D, это составляет образование полиаспарагиновой кислоты из аспарагина путем выброса NH 3 . Поли-D затем разлагается до полисукцинимида (PSI) за счет выброса 1 моль H 2 O / моль Asn. Очевидно, имеют место обе альтернативы, показанные на рис. 16, и есть один широкий пик, содержащий как NH 3 , так и H 2 O.
Интерпретация данных по аспарагину. Два пути от аспарагина (N) к полисукцинимиду (PSI): либо через полиаспарагин (поли-N), либо через полиаспарагиновую кислоту (поли-D). По сравнению с сукцинимидом связь N-C в полисукцинимиде экономит два атома водорода
Хотя формулы для PSI, образованного из Asp и Asn, одинаковы, (C 4 H 3 NO 2 ) n , эти два остатка не обязательно должны быть идентичными. По кинетическим причинам олигомеризация или полимеризация могла протекать до различной длины в поли-Asp и поли-Asn, поэтому продукты разложения PSI могли иметь разную длину, с разной стабильностью и температурами плавления. Более того, теломеры различны: -OH для PSI от Asp и -NH 2 для PSI от Asn. Действительно, PSI из Asp остается белым порошком до 289 ° C, в то время как PSI из Asn начинает плавиться при 289 ° C.
По кинетическим причинам олигомеризация или полимеризация могла протекать до различной длины в поли-Asp и поли-Asn, поэтому продукты разложения PSI могли иметь разную длину, с разной стабильностью и температурами плавления. Более того, теломеры различны: -OH для PSI от Asp и -NH 2 для PSI от Asn. Действительно, PSI из Asp остается белым порошком до 289 ° C, в то время как PSI из Asn начинает плавиться при 289 ° C.
Глутаминовая кислота
Глутаминовая кислота, Glu, E, C 5 H 9 NO 4 : 147 Da, H f = -1097 кДж / моль; T пик = 200 ° C, H пик = -88 кДж / моль.
При 200 ° C, 1 моль H 2 O / моль Glu наблюдается в QMS, площадь DSC -121 кДж / моль, потеря массы в пике составляет 12% (17 Да). Об обезвоживании Glu известно давно [12].
$$ \ begin {array} {llllcl} \ text {C5H9NO4} & \ longrightarrow & \ text {h3O} & + & \ text {C5H7NO3 (l)} & \\ \ mathbf {-1097} & & \ mathbf {-242} & & \ times & \ mathbf {(- 121)} ~ \ boldsymbol {кДж / моль}, \ end {array} $$
с рассчитанным x = −734 кДж / моль для H f (C 5 H 7 NO 3 ), пироглутаминовая кислота, Chemspider 485, 129 Da, T m = 184 ° C, b. п. = 433 ° С (рис. 17а). Этот лактам биологически важен, но его энтальпия образования, по-видимому, неизвестна. Известен H f . (с) = -459 кДж / моль и H f (г) = -375 кДж / моль для C 4 H 5 NO 2 , сукцинимид, 99 Да, пять колец с O = и = O в качестве крыльев (структура похожа на пироглутаминовую кислоту, но с карбоксильная группа -COOH заменена на = O, показанная на рис.17б). Дополнительный O должен добавить примерно -200 кДж / моль, что делает вероятным -734 кДж / моль для пироглутаминовой кислоты. Потеря веса ТГА сверх пика — это испарение. Пироглутаминовая кислота образуется в результате внутренней циклизации E: после выброса -OH, висящего на C δ , C δ присоединяется к -NH 2 , висящему на C α . Это было предложено Москейрой и др. [13], наша работа является первым экспериментальным свидетельством этого процесса.
п. = 433 ° С (рис. 17а). Этот лактам биологически важен, но его энтальпия образования, по-видимому, неизвестна. Известен H f . (с) = -459 кДж / моль и H f (г) = -375 кДж / моль для C 4 H 5 NO 2 , сукцинимид, 99 Да, пять колец с O = и = O в качестве крыльев (структура похожа на пироглутаминовую кислоту, но с карбоксильная группа -COOH заменена на = O, показанная на рис.17б). Дополнительный O должен добавить примерно -200 кДж / моль, что делает вероятным -734 кДж / моль для пироглутаминовой кислоты. Потеря веса ТГА сверх пика — это испарение. Пироглутаминовая кислота образуется в результате внутренней циклизации E: после выброса -OH, висящего на C δ , C δ присоединяется к -NH 2 , висящему на C α . Это было предложено Москейрой и др. [13], наша работа является первым экспериментальным свидетельством этого процесса.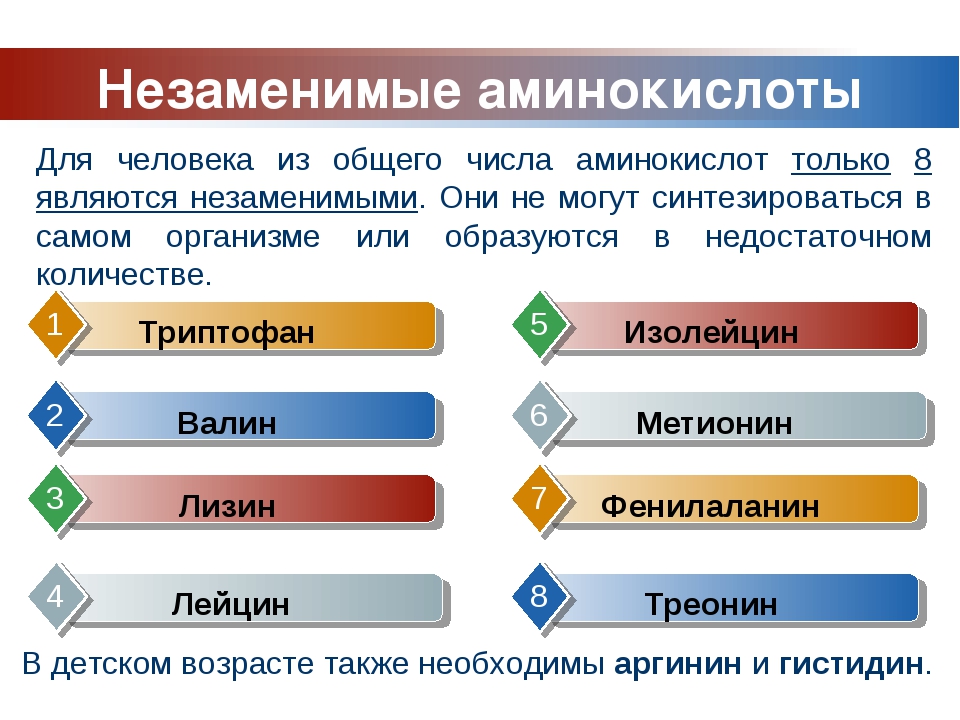 Поскольку QMS не показывает никакого CO 2 , реакция на C 4 H 7 NO, лактамный пирролидон (рис. 17c), 85 Да, T m = 25 ° C, т.кип. = 245 ° C, H f (л) = -286 кДж / моль, желтая жидкость, можно исключить, хотя отключение CO 2 является стерически заманчивым.
Поскольку QMS не показывает никакого CO 2 , реакция на C 4 H 7 NO, лактамный пирролидон (рис. 17c), 85 Да, T m = 25 ° C, т.кип. = 245 ° C, H f (л) = -286 кДж / моль, желтая жидкость, можно исключить, хотя отключение CO 2 является стерически заманчивым.
Интерпретация данных по глутамату. a , Конечный остаток Glu, пироглутаминовая кислота, C 5 H 7 N O 3 , 129 Да. b , сукцинимид, C 4 H 5 N O 2 , 99 Да. c , пирролидон, C 4 H 7 NO, 85 Da
Глутамин
Глутамин, Gln, Q, C 5 H 10 N 2 O 3 : 146 Da, H f = −826 кДж / моль.
Точные \ (\ frac {1} {2} \) мольные доли H 2 O и NH 3 в пике при T пик = 185 ° C, H пик = -77 кДж / моль, указывают на то, что димер служит промежуточной стадией, γ -глутамилглутамин (рис.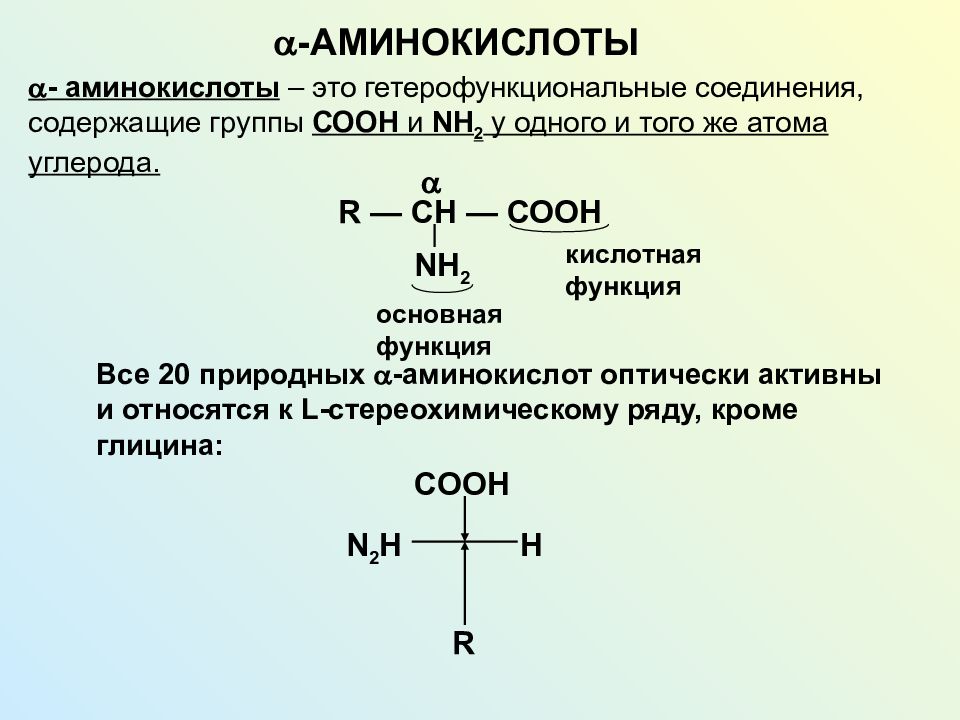 18a), C 10 H 17 N 3 O 6 , chemspider 133013, т. Н. 596 ° С:
18a), C 10 H 17 N 3 O 6 , chemspider 133013, т. Н. 596 ° С:
$$ \ mathrm {2 \ Q \ = {C_ {10} H_ {20} N_ {4} O_ {6} \ \ longrightarrow [NH_ {3} + C_ {10} H_ {17} N_ {3} O_ {6}]}.} $$
Рис. 18Интерпретация данных по глутамину. a , Промежуточная стадия, гамма-глутамилглютамин, C 10 H 17 N 3 O 6 , 275 Да. b , Остаток Gln: 5-оксо-L-пролил-L-глутамин, C 1 0 H 1 5 N 3 O 5 , 257 Да
После дальнейшего выброса H 2 O общая реакция
$$ \ mathrm {2 \ Q \ = 2 ({C_ {5} H_ {10} N_ {2} O_ {3}) \ \ longrightarrow NH_ {3} + H_ {2} O + C_ {10} H_ {15} N_ {3} O_ {5}.}} $$
В базе данных ChemSpider [9] для остатка указана подходящая молекула,
 18b), C 10 H 15 N 3 O 5 , 257 Da, bp 817 ° C, H пар = 129 кДж / моль. Выше пика при 185 ° C оптические наблюдения действительно показывают некипящую жидкость, что согласуется с указанной высокой температурой кипения.
18b), C 10 H 15 N 3 O 5 , 257 Da, bp 817 ° C, H пар = 129 кДж / моль. Выше пика при 185 ° C оптические наблюдения действительно показывают некипящую жидкость, что согласуется с указанной высокой температурой кипения.Аргинин
Аргинин, Arg, R, C 6 H 14 N 4 O 2 : 174 Da, H f = −623 кДж / моль.
Небольшой пик без потери массы при 220 ° C, −14 кДж / моль, и основной пик при 230 ° C, −52 кДж / моль, с образованием 1 моль NH 3 плюс 1 моль H 2 O в QMS, подтверждено потерей 20% веса 174 Да в TGA. Пик предшественника без потери массы при 220 ° C, -14 кДж / моль, вероятно, происходит из-за перегруппировки в гуанидиновой звезде. В большом пике происходит двойная внутренняя циклизация. Потеря аминогруппы -NH 2 в основной цепи и внутреннее циклическое присоединение N рядом с C δ в боковой цепи с C α ,
$$ \ mathrm {C_ {6} H_ {14} N_ {4} O_ {2} \ \ longrightarrow NH_ {3} + H_ {2} O + C_ {6} H_ {11} N_ {3} O_ {2}. } $$
} $$
образует промежуточное соединение, 1-карбамимидоилпролин, 157 Да, химспайдер 478133 (фиг. 19a). Это называется «..proline», потому что кольцо простирается между N и C α , хотя N не от магистрали. При потере -ОН и второй внутренней циклизации, соединяющей = NH или -NH 2 с C * , образуется тот или иной таутомер конечного остатка. Общая реакция: C 6 H 14 N 4 O 2 → N H 3 + H 2 O + C 6 H 9 N 3 O, изображенный на рис.19b, не цитируется в базе данных [9, 14].
Рис. 19 Интерпретация данных по аргинину. a ,1-карбамимидоилпролин, 157 Да, представляющий промежуточную стадию после выброса N H 3 из Arg. b , конечный остаток Arg, C 6 H 9 N 3 O, 139 Да, «креатин-пролин». Кольцо креатина сверху соединяется с кольцом пролина
Кольцо креатина сверху соединяется с кольцом пролина
Этот последний остаток примечателен.Он содержит пролиновое кольцо, гуанидиновую звезду и пептидную связь в кольце креатинина, которое представляет собой 5-кольцо с двойными связями = O и = OH. Креатинин, H f = −240 кДж / моль, т.пл. 300 ° C, C 4 H 7 N 3 O, chemspider 568, имеет несколько таутомерных форм. Рассматриваемый конечный продукт может содержать любое из этих колец. У нас нет возможности выбрать между альтернативами, но двойная кольцевая структура кажется вероятной.
Гистидин
Гистидин, His, H, C 6 H 9 N 3 O 2 : 155 Da, H f = -466 кДж / моль.
Результаты QMS ясны, His выбрасывает 1 моль H 2 O в реакцию
$$ \ mathrm {His = C_ {6} H_ {9} N_ {3} O_ {2} \ \ longrightarrow 1 \, H_ {2} O + C_ {6} H_ {7} N_ {3} O }.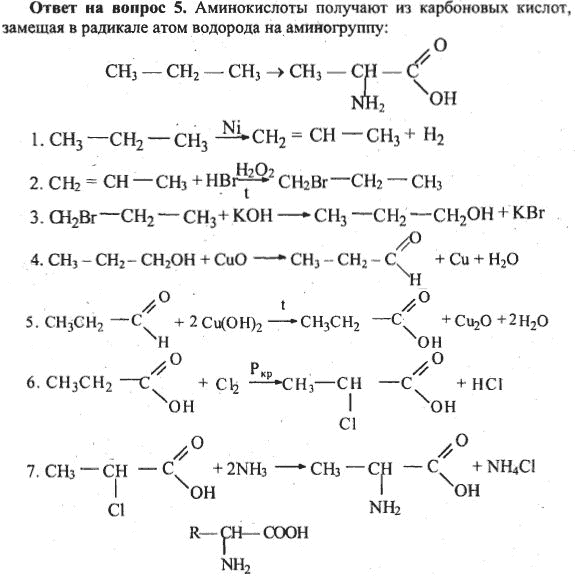 $$
$$
Наблюдаемый 1 моль H 2 O / моль His, подтвержденный потерей веса на 13% 155 Да, мог быть результатом реакции конденсации полимеризации, но наблюдаемая летучесть оптически противоречит этому варианту.Вероятна внутренняя циклизация. Если C ∗ основной цепи присоединяется к C имидазольного кольца с присоединенными снаружи = O и -NH 2 , образовавшееся 5-кольцо присоединяется к 5-кольцу имидазола. Предлагаемая конструкция представлена на рис.20.
Рис. 20Интерпретация данных гистидина. Конечный остаток His, C 6 H 9 N 3 O, 139 Da, состоящий из двух 5-колец: 2-амино-2,4-циклопентадиен-1-он ( C 5 H 5 NO, химспайдер 28719770) и имидазол
База данных MolPort [14] цитирует эту структуру, но с пиразольным кольцом (где два N являются ближайшими соседями) вместо имидазольного кольца (где два N являются следующими ближайшими соседями): 5-амино-4H, 5H, 6H -пирроло [1,2-b] пиразол-4-он, molport 022-469-240. Разделение азота энергетически выгодно: для пиразола H f (с) = +105 кДж / моль, H f (г) = +179 кДж / моль; для имидазола H f (т) = +49 кДж / моль, H f (г) = +132,9 кДж / моль [8]. Более того, исходный His имеет имидазольное, а не пиразольное кольцо, как и остаток.
Разделение азота энергетически выгодно: для пиразола H f (с) = +105 кДж / моль, H f (г) = +179 кДж / моль; для имидазола H f (т) = +49 кДж / моль, H f (г) = +132,9 кДж / моль [8]. Более того, исходный His имеет имидазольное, а не пиразольное кольцо, как и остаток.
Идентификация одиночных аминокислотных различий в однородно заряженных гомополимерных пептидах с помощью нанопор аэролизина
Lee, K.-E., Heo, J.-E., Kim, J.-M. И Хван, К.-С. Протеолитическая система правила N-конца, нацеленного на N-концевое ацетилирование: путь правила Ac / N-конца. Mol. Ячейки 39 , 169–178 (2016).
CAS Статья PubMed PubMed Central Google Scholar
Шао, С.и другие. Минимальные требования к образцу для количественного определения высоко мультиплексированного белка в клеточных линиях и тканях с помощью масс-спектрометрии PCT-SWATH. Proteomics 15 , 3711–3721 (2015).
Proteomics 15 , 3711–3721 (2015).
CAS Статья PubMed Google Scholar
Шуберт О. Т., Рёст Х. Л., Коллинз Б. К., Розенбергер Г. и Эберсолд Р. Количественная протеомика: проблемы и возможности в фундаментальных и прикладных исследованиях. Nat.Protoc. 12 , 1289–1294 (2017).
CAS Статья PubMed Google Scholar
Свитлоу, А. и Лакс, Р. Контроль качества при производстве пептидов: спецификации для пептидов GMP. Хим. Огги. 22 , 22–24 (2004).
Google Scholar
Kasianowicz, J. J., Brandin, E., Branton, D. & Deamer, D. W.Характеристика отдельных полинуклеотидных молекул с использованием мембранного канала. Proc. Natl Acad. Sci. США 93 , 13770–13773 (1996).
ADS CAS Статья PubMed PubMed Central Google Scholar

Венкатесан Б. М. и Башир Р. Сенсоры Nanopore для анализа нуклеиновых кислот. Nat. Nanotechnol. 6 , 615–624 (2011).
ADS CAS Статья PubMed Google Scholar
Мовилеану Л., Ховорка С., Браха О. и Бейли Х. Обнаружение аналитов белка, которые модулируют трансмембранное движение полимерной цепи в пределах одной поры белка. Nat. Biotechnol. 18 , 1091–1095 (2000).
CAS Статья PubMed Google Scholar
Sutherland, T.C. et al. Структура пептидов исследована методом нанопор. Nano. Lett. 4 , 1273–1277 (2004).
ADS CAS Статья Google Scholar
Мовилеану Л., Шмитчмитт Дж. П., Шольц Дж. М. и Бейли Х. Взаимодействие пептидов с порами белка. Biophys. J. 89 , 1030–1045 (2005).
CAS Статья PubMed PubMed Central Google Scholar
Stefureac, R., Long, Y.-T., Kraatz, H.-B., Howard, P.И Ли, Дж. С. Транспорт альфа-спиральных пептидов через поры альфа-гемолизина и аэролизина. Биохимия 45 , 9172–9179 (2006).
CAS Статья PubMed Google Scholar
Cheley, S., Xie, H. & Bayley, H. Генетически кодируемая пора для стохастического обнаружения протеинкиназы. Chembiochem 7 , 1923–1927 (2006).
CAS Статья PubMed Google Scholar
Oukhaled, G. et al. Разворачивание белков и длительные переходные конформации обнаруживаются с помощью записи одной нанопоры. Phys. Rev. Lett. 98 , 158101 (2007).
ADS CAS Статья PubMed Google Scholar
Вулф, А. Дж., Мохаммад, М. М., Чели, С., Бейли, Х. и Мовилеану, Л. Катализирование транслокации полипептидов посредством привлекательных взаимодействий. J. Am. Chem. Soc. 129 , 14034–14041 (2007).
J. Am. Chem. Soc. 129 , 14034–14041 (2007).
CAS Статья PubMed Google Scholar
Goodrich, C.P. et al. Электрофорез одной молекулы бета-шпилечных пептидов с помощью электрических записей и моделирования динамики Ланжевена. J. Phys. Chem. Б. 111 , 3332–3335 (2007).
CAS Статья PubMed Google Scholar
Zhao, Q., de Zoysa, R. S. S., Wang, D., Jayawardhana, D. A. & Guan, X. Мониторинг пептидного расщепления в реальном времени с помощью зонда с нанопорами. J. Am. Chem. Soc. 131 , 6324–6325 (2009).
CAS Статья PubMed Google Scholar
Биквему Р., Вулф А. Дж., Син X. и Мовилеану Л. Облегчение транслокации полипептидов через единственную нанопору. J. Phys. Конденс. Дело 22 , 454117 (2010).
ADS Статья PubMed PubMed Central Google Scholar

Куквикила М. и Ховорка С. Электрическое определение активности протеазы с помощью нанопор. J. Phys. Конденс. Дело 22 , 454103 (2010).
ADS Статья PubMed Google Scholar
Pastoriza-Gallego, M. et al. Динамика транспорта развернутого белка через поры аэролизина. J. Am. Chem. Soc. 133 , 2923–2931 (2011).
CAS Статья PubMed Google Scholar
Махендран, К. Р., Ромеро-Руис, М., Шлёзингер, А., Винтерхальтер, М. и Нуссбергер, С. Транслокация белка через Tom40: кинетика высвобождения пептида. Biophys. J. 102 , 39–47 (2012).
ADS CAS Статья PubMed PubMed Central Google Scholar
Singh, P.R. et al. Вытягивание пептидов через наноканалы: разрешение связывания и транслокации пептидов через гетероолигомерный канал из Nocardia farcinica . САУ Нано 6 , 10699–10707 (2012).
САУ Нано 6 , 10699–10707 (2012).
CAS Статья PubMed Google Scholar
Soskine, M. et al. Сконструированная нанопора ClyA обнаруживает свернутые белки-мишени путем селективной внешней ассоциации и входа в поры. Nano. Lett. 12 , 4895–4900 (2012).
ADS CAS Статья PubMed PubMed Central Google Scholar
Rotem, D., Jayasinghe, L., Salichou, M. & Bayley, H. Обнаружение белка с помощью нанопор, снабженных аптамерами. J. Am. Chem. Soc. 134 , 2781–2787 (2012).
CAS Статья PubMed PubMed Central Google Scholar
Mohammad, M. M. et al. Разработка жесткого белкового туннеля для биомолекулярного обнаружения. J. Am. Chem. Soc. 134 , 9521–9531 (2012).
CAS Статья PubMed PubMed Central Google Scholar
Payet, L. et al. Термическое разворачивание белков исследуется на уровне отдельной молекулы с помощью нанопор. Анал. Chem. 84 , 4071–4076 (2012).
CAS Статья PubMed Google Scholar
Lamichhane, U. et al. Транслокация пептидов через мезоскопический канал: кинетика связывания на уровне отдельной молекулы. Eur. Биофиз. J. 42 , 363–369 (2013).
CAS Статья PubMed Google Scholar
Mahendran, K. R., Lamichhane, U., Romero-Ruiz, M., Nussberger, S. & Winterhalter, M. Транслокация полипептидов через митохондриальный канал TOM: зависимые от температуры скорости на уровне одной молекулы. J. Phys. Chem. Lett. 4 , 78–82 (2013).
CAS Статья PubMed Google Scholar
Нивала, Дж., Маркс, Д. Б. и Акесон, М. Опосредованная унфолдазой транслокация белка через нанопору α -гемолизина. Nat. Biotechnol. 31 , 247–250 (2013).
Nat. Biotechnol. 31 , 247–250 (2013).
CAS Статья PubMed PubMed Central Google Scholar
Соскин М., Бисеманс А., Де Майер М. и Маглиа Г. Настройка размера и свойств нанопор clya с помощью направленной эволюции. J. Am. Chem. Soc. 135 , 13456–13463 (2013).
CAS Статья PubMed PubMed Central Google Scholar
Ван Меервельт, В., Соскин, М. и Маглиа, Г. Обнаружение двух конфигураций связывания изомеров в комплексе белок-аптамер с биологической нанопорой. ACS Nano 8 , 12826–12835 (2014).
Артикул PubMed PubMed Central Google Scholar
Mereuta, L. et al. Замедление движения одиночных молекул через нанопоры белка выявляет промежуточные звенья для транслокации пептидов. Sci. Отчет 4 , 3885 (2014).
Артикул PubMed PubMed Central Google Scholar
Pastoriza-Gallego, M. et al. Доказательства транслокации развернутого белка через белковые нанопоры. ACS Nano 8 , 11350–11360 (2014).
CAS Статья PubMed Google Scholar
Fahie, M., Chisholm, C. & Chen, M. Решенное обнаружение одиночных молекул отдельных видов в смеси антибиотиновых антител с использованием сконструированных мономерных нанопор. САУ Нано 9 , 1089–1098 (2015).
CAS Статья PubMed PubMed Central Google Scholar
Biesemans, A., Soskine, M. & Maglia, G. Белок ротаксан контролирует перемещение белков через нанопору ClyA. Nano. Lett. 15 , 6076–6081 (2015).
ADS CAS Статья PubMed PubMed Central Google Scholar
Соскин, М., Biesemans, A. & Maglia, G. Распознавание одиночных молекул аналита с помощью нанопор ClyA, оснащенных внутренними белковыми адаптерами. J. Am. Chem. Soc. 137 , 5793–5797 (2015).
CAS Статья PubMed PubMed Central Google Scholar
Ji, Z. et al. Фингерпринт пептидов с большим каналом упаковки ДНК бактериофага Phi29. Малый 12 , 4572–4578 (2016).
ADS CAS Статья PubMed PubMed Central Google Scholar
Hu, Y.-X. и другие. Одномолекулярное исследование начальных структурных особенностей процесса амилоидоза. Chem. Commun. 52 , 5542–5545 (2016).
CAS Статья Google Scholar
Chavis, A. E. et al. Спектрометрия нанопор одиночных молекул для обнаружения пептидов. Датчики ACS 2, (1319–1328 (2017).
Google Scholar
Хуанг, Г., Виллемс, К., Соскин, М., Влока, С. и Маглиа, Г. Электроосмотический захват и ионная дискриминация пептидных и белковых биомаркеров с помощью нанопор FraC. Nat. Commun. 8 , 935 (2017).
ADS Статья PubMed PubMed Central Google Scholar
Van Meervelt, V. et al. Конформационные изменения в реальном времени и контролируемая ориентация нативных белков внутри белкового нанореактора. J. Am. Chem. Soc . 139 , 18640–18646 (2017).
CAS Статья PubMed Google Scholar
Han, A. et al. Чувствительность белковых молекул с помощью наноразмерных пор. Заявл. Phys. Lett. 88 , 093901 (2006).
ADS Статья Google Scholar
Урам, Дж. Д. , Ке, К., Хант, А. Дж. И Майер, М. Анализы сродства без этикеток путем быстрого обнаружения иммунных комплексов в субмикрометровых порах. Angew. Chem., Int. Эд. 45 , 2281–2285 (2006).
, Ке, К., Хант, А. Дж. И Майер, М. Анализы сродства без этикеток путем быстрого обнаружения иммунных комплексов в субмикрометровых порах. Angew. Chem., Int. Эд. 45 , 2281–2285 (2006).
CAS Статья Google Scholar
Sexton, L. T. et al. Исследования белков и комплексов белок / антитело с помощью резистивных импульсов с использованием датчика из конических нанотрубок. J. Am. Chem. Soc. 129 , 13144–13152 (2007).
CAS Статья PubMed Google Scholar
Fologea, D., Ledden, B., McNabb, D. S. & Li, J. Электрические характеристики белковых молекул с помощью твердотельных нанопор. Заявл. Phys. Lett. 91 , 053901 (2007).
ADS Статья PubMed Central Google Scholar
Talaga, D. S. & Li, J. Одномолекулярный белок, разворачивающийся в твердотельных нанопорах. J. Am. Chem. Soc. 131 , 9287–9297 (2009).
J. Am. Chem. Soc. 131 , 9287–9297 (2009).
CAS Статья PubMed PubMed Central Google Scholar
Фирнкес, М., Педоне, Д., Кнежевич, Дж., Дёблингер, М. и Рант, У. Электрически облегченные транслокации белков через нанопоры нитрида кремния: совместное и конкурентное действие диффузии, электрофореза и электроосмос. Nano Lett. 10 , 2162–2167 (2010).
ADS CAS Статья PubMed Google Scholar
Oukhaled, A. et al. Динамика полностью развернутых и нативных белков через твердотельные нанопоры как функция движущей силы электрического тока. САУ Нано 5 , 3628–3638 (2011).
CAS Статья PubMed Google Scholar
Yusko, E.C. et al. Контроль транслокации белков через нанопоры с биовдохновленными жидкостными стенками. Nat. Nanotechnol. 6 , 253–260 (2011).
Nanotechnol. 6 , 253–260 (2011).
ADS CAS Статья PubMed PubMed Central Google Scholar
Cressiot, B. et al. Транспорт белка через узкую твердотельную нанопору при высоком напряжении: эксперименты и теория. САУ Нано 6 , 6236–6243 (2012).
CAS Статья PubMed Google Scholar
Japrung, D. et al. Одномолекулярные исследования внутренне неупорядоченных белков с использованием твердотельных нанопор. Анал. Chem. 85 , 2449–2456 (2013).
CAS Статья PubMed Google Scholar
Фридман, К. Дж., Хак, С. Р., Эдель, Дж. Б., Джемт, П. и Ким, М. Дж. Одномолекулярное разворачивание и растяжение белковых доменов внутри твердотельной нанопоры электрическим полем. Sci. Rep. 3 , 1638 (2013).
ADS Статья PubMed PubMed Central Google Scholar

Li, W. et al. Обнаружение одиночной молекулы белка с помощью стеклянных нанопор. САУ Нано 7 , 4129–4134 (2013).
CAS Статья PubMed Google Scholar
Розен, К. Б., Родригес-Ларреа, Д. и Бейли, Х. Одномолекулярное сайт-специфическое обнаружение фосфорилирования белка с помощью нанопоры. Nat. Biotechnol. 32 , 179–181 (2014).
CAS Статья PubMed PubMed Central Google Scholar
Steinbock, L. J. et al. Зондирование размеров белков с помощью стеклянных нанопор. Наноразмер 6 , 14380–14387 (2014).
ADS CAS Статья PubMed Google Scholar
Нир, И., Хаттнер, Д.И Меллер, А. Прямое зондирование и различение убиквитиновых и убиквитиновых цепей с использованием твердотельных нанопор. Biophys. J. 108 , 2340–2349 (2015).
ADS CAS Статья PubMed PubMed Central Google Scholar
Balme, S. et al. Влияние адсорбции на детекцию белков и амилоидов нанопорами нитрида кремния. Langmuir 32 , 8916–8925 (2016).
CAS Статья PubMed Google Scholar
Белл, Н. А. У. и Кейзер, У. Ф. Наноструктуры ДНК с цифровым кодированием для мультиплексного восприятия одномолекулярных белков с помощью нанопор. Nat. Nanotechnol. 11 , 645–651 (2016).
ADS CAS Статья PubMed Google Scholar
Waduge, P. et al. Измерения размера, флуктуаций и конформационных изменений белков на основе нанопор. САУ Нано 11 , 5706–5716 (2017).
CAS Статья PubMed Google Scholar
Wloka, C. et al. Обнаружение убиквитинирования белка в реальном времени без использования меток с помощью биологической нанопоры. САУ Нано 11 , 4387–4394 (2017).
et al. Обнаружение убиквитинирования белка в реальном времени без использования меток с помощью биологической нанопоры. САУ Нано 11 , 4387–4394 (2017).
CAS Статья PubMed PubMed Central Google Scholar
Sze, J.Ю. Ю., Иванов, А. П., Касс, А. Э. Г. и Эдель, Дж. Б. Скрининг одиночных молекул мультиплексированных нанопор-белков в сыворотке крови человека с использованием носителей ДНК, модифицированных аптамером. Nat. Commun. 8 , 1552 (2017).
ADS Статья PubMed PubMed Central Google Scholar
Xie, H., Braha, O., Gu, L.-Q., Cheley, S. & Bayley, H. Наблюдение одной молекулы каталитической субъединицы Camp-зависимой протеинкиназы связывания с ингибитор пептид. Chem. Биол. 12 , 109–120 (2005).
CAS Статья PubMed Google Scholar

Куквикила, М. и Ховорка, С. Электрическое и безметочное определение активности ферментов в сыворотке крови на основе нанопоров. Анал. Chem. 87 , 9149–9154 (2015).
CAS Статья PubMed Google Scholar
Rodriguez-Larrea, D.И Бейли, Х. Многоступенчатый белок, разворачивающийся во время транслокации нанопор. Nat. Nanotechnol. 8 , 288–295 (2013).
ADS CAS Статья PubMed PubMed Central Google Scholar
Yusko, E.C. et al. Приближение формы в реальном времени и снятие отпечатков пальцев отдельных белков с помощью нанопоры. Nat. Nanotechnol. 12 , 360–367 (2016).
ADS Статья PubMed Google Scholar
Vercoutere, W. et al. Быстрая дискриминация между отдельными молекулами шпильки ДНК при разрешении одного нуклеотида с использованием ионного канала. Nat. Biotechnol. 19 , 248–252 (2001).
Nat. Biotechnol. 19 , 248–252 (2001).
CAS Статья PubMed Google Scholar
Robertson, J. W. F. et al. Масс-спектрометрия одиночных молекул в растворе с использованием одиночной нанопоры. Proc. Natl Acad. Sci. США 104 , 8207–8211 (2007).
ADS CAS Статья PubMed PubMed Central Google Scholar
Baaken, G. et al. Дискриминация по размеру с высоким разрешением отдельных неионных синтетических полимеров с высокозаряженной биологической нанопорой. ACS Nano 9 , 6443–6449 (2015).
CAS Статья PubMed Google Scholar
Piguet, F. et al.Высокая температура расширяет диапазон различения размеров неионных полимеров биологической нанопорой. Sci. Отчет 6 , 38675 (2016).
ADS CAS Статья PubMed PubMed Central Google Scholar

Cao, C. et al. Дискриминация олигонуклеотидов разной длины с нанопорой аэролизина дикого типа. Nat. Nanotechnol. 11 , 713–718 (2016).
ADS CAS Статья PubMed Google Scholar
Лайрес, Д., Пауте, Э. и Пелта, Дж. Рефолдинг высокомолекулярного белка: влияние соли на коллапс. Biophys. J. 84 , 3904–3916 (2003).
CAS Статья PubMed PubMed Central Google Scholar
Нивала, Дж., Малруни, Л., Ли, Г., Шрайбер, Дж. И Акесон, М. Дискриминация между вариантами белка с использованием нанопор, связанных разворачиванием. ACS Nano 8 , 12365–12375 (2014).
CAS Статья PubMed Google Scholar
Kennedy, E., Dong, Z., Tennant, C. & Timp, G. Считывание первичной структуры белка с разрешением 0,07 нм 3 с использованием пор субнанометрового диаметра. Nat. Nanotechnol. 11 , 968–976 (2016).
Nat. Nanotechnol. 11 , 968–976 (2016).
ADS CAS Статья PubMed Google Scholar
Си, Д., Li, Z., Liu, L., Ai, S. & Zhang, S. Сверхчувствительное обнаружение раковых клеток, сочетающее усиление ферментативного сигнала с нанопорой аэролизина. Анал. Chem . 90 , 1029–1034 (2018).
CAS Статья PubMed Google Scholar
Parker, M. W. et al. Структура проаэролизина токсина Aeromonas в его водорастворимом и мембранноканальном состояниях. Nature 367 , 292–295 (1994).
ADS CAS Статья PubMed Google Scholar
Degiacomi, M. T. et al. Молекулярная сборка поры аэролизина показывает механизм встраивания закрученной мембраны. Nat. Chem. Биол. 9 , 623–629 (2013).
CAS Статья PubMed Google Scholar
Незаменимые аминокислоты и другие важные компоненты для развития Angiostrongylus costaricensis от личинок третьей стадии до молодых взрослых по JSTOR
Абстрактный Личинки третьей стадии Angiostrongylus costaricensis культивировались до стадии молодой взрослой особи на химически определенной среде MB 752/1 Уэймута, которая содержала 18 аминокислот, 11 витаминов, глутатион, гипоксантин и глюкозу в сбалансированном солевом растворе. Потребности в питании исследовали путем удаления отдельных компонентов из среды Уэймута. Было показано, что десять аминокислот, а именно L-аргинин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-треонин, L-триптофан и L-валин, являются необходим для развития паразита. L-аспарагиновая кислота, L-цистеин, L-цистин, L-глутаминовая кислота, L-глутамин, глицин, L-пролин и L-тирозин были несущественными. Из 11 витаминов только хлорид холина имел важное значение для развития.Удаление пиридоксина из среды отрицательно сказалось на развитии паразитов. Глюкоза также была необходима червям, но глутатион и гипоксантин не требовались для их развития. Когда 10 незаменимых L-аминокислот по отдельности были заменены D-изомерами тех же аминокислот, ни одна из них не поддерживала развитие личинок так, как L-аминокислоты.
Потребности в питании исследовали путем удаления отдельных компонентов из среды Уэймута. Было показано, что десять аминокислот, а именно L-аргинин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-треонин, L-триптофан и L-валин, являются необходим для развития паразита. L-аспарагиновая кислота, L-цистеин, L-цистин, L-глутаминовая кислота, L-глутамин, глицин, L-пролин и L-тирозин были несущественными. Из 11 витаминов только хлорид холина имел важное значение для развития.Удаление пиридоксина из среды отрицательно сказалось на развитии паразитов. Глюкоза также была необходима червям, но глутатион и гипоксантин не требовались для их развития. Когда 10 незаменимых L-аминокислот по отдельности были заменены D-изомерами тех же аминокислот, ни одна из них не поддерживала развитие личинок так, как L-аминокислоты.
Журнал паразитологии — официальное издание Американского общества паразитологов (ASP). Он издается непрерывно с 1914 года, когда его основал Генри Болдуин Уорд. Журнал специализируется на общей паразитологии, а также на паразитах, имеющих медицинское, ветеринарное и экономическое значение. Основное внимание уделяется эукариотическим паразитам, хотя векторы для прокариотических организмов и вирусы также включены. Журнал печатается в издательстве Allen Press в Лоуренсе, штат Канзас, шесть раз в год. Доступны институциональные подписки. Членство в ASP включает получение журнала Parasitology, ежеквартального информационного бюллетеня и выдержек из ежегодных собраний; студенты могут присоединиться по значительно сниженной ставке.Журнал находится в сети через BioOne. Редактором журнала является д-р Майкл В.К. Сухдео. Для получения дополнительной информации о публикации в журнале обращайтесь в редакцию журнала по адресу [email protected]. Для получения информации о членстве в ASP свяжитесь с обществом: http://amsocparasit.org/. Для получения информации о подписке обращайтесь на asp@allenpress.
Он издается непрерывно с 1914 года, когда его основал Генри Болдуин Уорд. Журнал специализируется на общей паразитологии, а также на паразитах, имеющих медицинское, ветеринарное и экономическое значение. Основное внимание уделяется эукариотическим паразитам, хотя векторы для прокариотических организмов и вирусы также включены. Журнал печатается в издательстве Allen Press в Лоуренсе, штат Канзас, шесть раз в год. Доступны институциональные подписки. Членство в ASP включает получение журнала Parasitology, ежеквартального информационного бюллетеня и выдержек из ежегодных собраний; студенты могут присоединиться по значительно сниженной ставке.Журнал находится в сети через BioOne. Редактором журнала является д-р Майкл В.К. Сухдео. Для получения дополнительной информации о публикации в журнале обращайтесь в редакцию журнала по адресу [email protected]. Для получения информации о членстве в ASP свяжитесь с обществом: http://amsocparasit.org/. Для получения информации о подписке обращайтесь на asp@allenpress. com.
com.
Allen Press играет жизненно важную роль в распространении знаний и информации. путем партнерства с организациями в научном, техническом и медицинском сообществе продвигать свои интересы и добиваться поставленных целей.Штаб-квартира в Лоуренсе, KS, Allen Press предоставляет полный спектр интегрированных услуг в широкие области управления контентом, онлайн-доставка и печать, ассоциация менеджмент и издательские услуги. Allen Press — надежный партнер научных общества, профессиональные ассоциации и корпорации по всей стране.
10 аминокислот для улучшения качества жизни
Если вы следите за обновлениями в области ухода за кожей и против старения, вы, вероятно, слышали об аминокислотах.Организм использует аминокислоты в качестве строительных блоков для образования пептидов и белков. Многие аминокислоты благотворно влияют на организм и могут положительно повлиять на ваше здоровье.
Некоторые из наиболее распространенных аминокислот включают:
Лизин
Дефицит лизина может вызывать беспокойство, вызванное стрессом, и проблемы с укреплением мышц и костей. И наоборот, достаточное количество лизина помогает биосинтезировать белки, что может помочь в наращивании здоровой мышечной массы. Лизин часто назначают в лекарственной форме для лечения герпеса и волдырей при лихорадке, и он может ускорить заживление ран, стимулируя выработку коллагена.
Гистидин
Дефицит гистидина может вызвать анемию, в то время как адекватные запасы могут способствовать росту, образованию клеток крови и восстановлению тканей. Считается, что он помогает поддерживать миелиновую оболочку — особое защитное покрытие нервных клеток. Когда организм метаболизирует гистидин, он производит гистамин, который связан с иммунитетом, репродуктивным здоровьем и пищеварением. Добавки гистидина могут снизить ИМТ и инсулинорезистентность у женщин с метаболическими нарушениями.
Треонин
Треонин, входящий в состав зубной эмали, коллагена и эластина, как полагают, способствует метаболизму жиров и может быть полезен людям с расстройством желудка, тревогой и легкой депрессией. Исследования на рыбе показали, что дефицит треонина связан с заболеванием, поэтому он также может иметь иммуностимулирующий компонент.
Глицин
Дефицит глицина может повлиять на способность печени вырабатывать желчь, которая является важным эмульгатором жира.Основным источником диетического глицина являются продукты, богатые белком, такие как мясо, рыба, молочные продукты и бобовые. Глицин — простейшая аминокислота, которая помогает защитить почки, способствует обмену веществ, снижает риск психоза и улучшает сохранение памяти.
Валин
Дефицит валина может привести к бессоннице и снижению умственной функции, но его избыток может помочь обеспечить эмоциональное спокойствие, умственную концентрацию и повышение энергии. Его часто добавляют в добавки для поддержки роста мышц и восстановления тканей.
Его часто добавляют в добавки для поддержки роста мышц и восстановления тканей.
Изолейцин
Считается, что дефицит изолейцина у пожилых людей способствует истощению мышц и тремору. Он в основном присутствует в мышечной ткани и связан с уровнем энергии, выработкой гормонов, регулированием уровня сахара в крови, заживлением ран и иммунитетом.
лейцин
Дефицит лейцина может вызвать кожную сыпь, выпадение волос и усталость. Эта аминокислота связана с заживлением ран, ростом и восстановлением мышц и костей, выработкой гормонов роста и регулированием уровня сахара в крови.
фенилаланин
Дефицит фенилаланина встречается редко, но считается, что он способствует плохой прибавке в весе у младенцев, а также к экземе, утомляемости и проблемам с памятью у взрослых. Он помогает организму использовать другие аминокислоты и может превращаться в тирозин, который необходим для определенных функций мозга. Большие дозы фенилаланина могут вызывать беспокойство и нервозность и влиять на сон. Это обычно влияет на людей, которые потребляют большое количество диетической соды, содержащей аспартам, или у которых есть редкое генетическое заболевание, называемое фенилкетонурией (ФКУ), которое делает невозможным метаболизм фенилаланина.DL-фенилаланин — это синтетическая форма, часто встречающаяся в аминокислотных добавках.
Большие дозы фенилаланина могут вызывать беспокойство и нервозность и влиять на сон. Это обычно влияет на людей, которые потребляют большое количество диетической соды, содержащей аспартам, или у которых есть редкое генетическое заболевание, называемое фенилкетонурией (ФКУ), которое делает невозможным метаболизм фенилаланина.DL-фенилаланин — это синтетическая форма, часто встречающаяся в аминокислотных добавках.
Тирозин
Как уже упоминалось, фенилаланин можно превратить в другую аминокислоту, тирозин. Тирозин помогает вырабатывать гормоны щитовидной железы и напрямую связан с когнитивными функциями, сном и реакциями бегства или борьбы. Дефицит тирозина может способствовать критически низкому уровню дофамина в головном мозге. Редкое заболевание у детей, известное как детский паркинсонизм, вызвано недостатком тирозина, который влияет на вегетативные процессы в организме.
Триптофан
Недостаток триптофана также связан с задержкой роста у младенцев и состоянием, называемым пеллагрой, которое может привести к слабоумию, кожной сыпи и проблемам с пищеварением.