Белок и всё о нём в биологии и химии
Глава 3. Химический состав белков
3.3. Аминокислоты
В настоящее время в различных объектах живой природы обнаружено до 200 различных аминокислот. В организме человека их, например, около 60. Однако в состав белков входят только 20 аминокислот, называемых иногда природными.
Аминокислоты — это органические кислоты, у которых атом водорода -углеродного атома замещен на аминогруппу — Nh3. Следовательно, по химической природе это -аминокислоты с общей формулой:
Из этой формулы видно, что в состав всех аминокислот входят следующие общие группировки: — Ch3, — Nh3, — COOH. Боковые же цепи (радикалы — R ) аминокислот различаются. Химическая природа радикалов разнообразна: от атома водорода до циклических соединений. Именно радикалы определяют структурные и функциональные особенности аминокислот.
Все аминокислоты, кроме простейшей аминоуксусной кислоты глицина () имеют хиральный атом и могут существовать в виде двух энантиомеров (оптических изомеров):
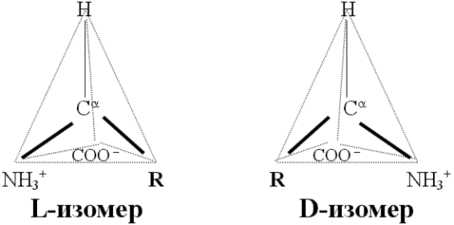
В состав всех изученных в настоящее время белков входят только аминокислоты L-ряда, у которых, если рассматривать хиральный атом со стороны атома H, группы Nh4+, COO- и радикал R расположены по часовой стрелке. Необходимость при построении биологически значимой полимерной молекулы строить ее из строго определенного энантиомера очевидна — из рацемической смеси двух энантиомеров получилась бы невообразимо сложная смесь диастереоизомеров. Вопрос, почему жизнь на Земле основана на белках, построенных именно из L-, а не D—аминокислот, до сих пор остается интригующей загадкой. Следует отметить, что D-аминокислоты достаточно широко распространены в живой природе и, более того, входят в состав биологически значимых олигопептидов.
Из двадцати основных -аминокислот строятся белки, однако остальные, достаточно разнообразные аминокислоты образуются из этих 20 аминокислотных остатков уже в составе белковой молекулы. Среди таких превращений следует в первую очередь отметить образование дисульфидных мостиков при окислении двух остатков цистеина в составе уже сформированных пептидных цепей. В результате образуется из двух остатков цистеина остаток диаминодикарбоновой кислоты цистина. При этом возникает сшивка либо внутри одной полипептидной цепи, либо между двумя различными цепями. В качестве небольшого белка, имеющего две полипептидные цепи, соединенный дисульфидными мостиками, а также сшивки внутри одной из полипептидных цепей:
Важным примером модификации аминокислотных остатков является превращение остатков пролина в остатки гидроксипролина:
Это превращение происходит, причем в значительном масштабе, при образовании важного белкового компонента соединительной ткани — коллагена.
Аминокислоты в водном растворе находятся в ионизированном состоянии за счет диссоциации амино- и карбоксильных групп, входящих в состав радикалов. Другими словами, они являются амфотерными соединениями и могут существовать либо как кислоты (доноры протонов), либо как основания (акцепторы доноров).
Все
аминокислоты в зависимости от структуры разделены на
несколько групп:
Ациклические. Моноаминомонокарбоновые аминокислоты
1. Глицин и аланин. Глицин (гликокол или аминоуксусная кислота) является оптически неактивным — это единственная аминокислота, не имеющая энатиомеров. Глицин участвует в образовании нуклеиновых и желчных кислот, гема, необходим для обезвреживания в печени токсичных продуктов. Аланин используется организмом в различных процессах обмена углеводов и энергии. Его изомер -аланин является составной частью витамина пантотеновой кислоты, коэнзима А (КоА), экстрактивных веществ мышц.
2. Серин и треонин. Они относятся к группе гидрооксикислот, т.к. имеют гидроксильную группу. Серин входит в состав различных ферментов, основного белка молока — казеина, а также в состав многих липопротеинов. Треонин участвует в биосинтезе белка, являясь незаменимой аминокислотой.
3. Цистеин и метионин. Аминокислоты, имеющие в составе атом серы. Значение цистеина определяется наличием в ее составе сульфгидрильной ( — SH) группы, которая придает ему способность легко окисляться и защищать организм о веществ с высокой окислительной способностью (при лучевом поражении, отравлении фосфором). Метионин характеризуется наличием легко подвижной метильной группы, использующейся для синтеза важных соединений в организме (холина, креатина, тимина, адреналина и др.).
4. Валин, лейцин и изолейцин. Представляют собой разветвленные аминокислоты, которые активно участвуют в обмене веществ и не синтезируются в организме.
Моноаминодикарбоновые аминокислоты имеют одну аминную и две карбоксильные группы и в водном растворе дают кислую реакцию. К ним относятся аспарагиновая и глутаминовая кислоты, аспарагин и глутамин. Они входят в состав тормозных медиаторов нервной системы.
Диаминомонокарбоновые аминокислоты в водном растворе имеют щелочную реакцию за счет наличия двух аминных групп. Относящийся к ним лизин необходим для синтеза гистонов а также в ряд ферментов. Аргинин участвует в синтезе мочевины, креатина.
Циклические. Эти аминокислоты имеют в своем составе ароматическое или гетероциклическое ядро и, как правило, не синтезируется в организме человека и должны поступать с пищей. Они активно участвуют в разнообразных обменных процессах. Так фенил-аланин служит основным источником синтеза тирозина — предшественника ряда биологически важных веществ: гормонов (тироксина, адреналина), некоторых пигментов. Триптофан помимо участия в синтезе белка, служит компонентом витамина PP, серотонина, триптамина, ряда пигментов. Гистидин необходим для синтеза белков, является предшественником гистамина, влияющего на кровяное давление и секрецию желудочного сока.
belok-s.narod.ru
взаимодействие с соляной кислотой, щелочами, друг с другом. Биологическая роль аминокислот и их применение.
⇐ ПредыдущаяСтр 4 из 4
Аминокислоты – соединения, которые содержат в молекуле одновременно аминогруппу и карбоксильную группу. Простейшим представителем аминокислот является аминоуксусная (глицин) кислота: NH
Так как аминокислоты содержат две функциональные группы, то и свойства их зависят от этих групп атомов: NH2— и –CООН. Аминокислоты – амфотерные органические вещества, реагирующие как основание и как кислота.
Физические свойства.
Аминокислоты представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде и малорастворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус.
Химические свойства
+ кислоты (проявляются основные свойства)
+основания
|
+металлы
+спирты
+ аммиак
+аминокислоты – образование пептидов
Аминокислоты не изменяют окраску индикатора, если количество аминогрупп и карбоксильных групп одинаково.
1) NH2-CH2-COOH + НCl → NH3Cl-CH2-COOH
2) NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
3) NH2-CH2-COOH + NH2-CH2-COOH → NH2-CH2-CO NH-CH2-COOH + H2O
Биологическая роль аминокислот заключается в том, что из их остатков образуется первичная структура белка. Существует 20 аминокислот, которые являются исходными веществами для производства белков в нашем организме. Некоторые аминокислоты применяются в качестве лечебных средств, например глутаминовую кислоту — при нервных заболеваниях, гистидин – при язве желудка. Некоторые аминокислоты находят применение в пищевой промышленности, их добавляют в консервы и пищевые концентраты для улучшения пищи.
Билет № 16
Анилин – представитель аминов. Химическое строение и свойства, получение и практическое применение.
Амины — это органические соединения, представляющие собой производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородный радикал.
Общая формула:
R-NH2
Физические свойства.
Анилин- бесцветная маслянистая жидкость со слабым характерным запахом, малорастворим в воде, но хорошо растворим в спирте, эфире, бензоле. Температура кипения 184°C. Анилин- сильный яд, действует на кровь.
Химические свойства.
+кислоты (реакции по аминогруппе)
+ Br2(водный раствор)
C6H5NН2 + НCl → C6H5NН3Cl
Химические свойства анилина обусловлены наличием в его молекуле аминогруппы —NH2 и бензольного ядра, которые оказывают взаимное влияние друг на друга.
Получение.
Восстановление нитросоединений – реакция Зинина
C6H5NО2 + Н2 → C6H5NН2 + Н2О
Применение.
Анилин применяется в производстве фотоматериалов, анилиновых красителей. Получают полимеры, взрывчатые вещества, лекарственные препараты.
Билет № 17
Белки — как биополимеры. Строение, свойства и биологические функции белков.
Белки (протеины, полипептиды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот.
Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из α -аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот . Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка.
· Первичная структура — последовательность аминокислот в полипептидной цепи-линейно.
· Вторичная структура — закручивание полипептидной цепи в спираль, поддерживающееся водородными связями.
· Третичная структура —упаковка вторичной спирали в клубок. Поддерживают третичную структуру: дисульфидные связи, водородные связи.
Свойства
Белки являются амфотерными веществами, также как и аминокислоты.
Отличаются по степени растворимости в воде, но большинство белков в ней растворяются.
Денатурация: Резкое изменение условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной, третичной и вторичной структур белка. Денатурация в некоторых случаях обратима.
Гидролиз: Под воздействием ферментов происходит гидрол белка до составляющих его аминокислот. Этот процесс происходит, например, в желудке человека под воздействием таких ферментов как пепсина и трипсина.
Функции белков в организме
Каталитическая функция
Ферменты — группа белков, обладающая специфическими каталитическими свойствами. Среди ферментов можно отметить такие белки : трипсин, пепсин, амилаза, липаза.
Структурная функция
Белки – это строительный материал почти всех тканей: мышечных, опорных, покровных.
Защитная функция
Белки антитела, способные обезвреживать вирусы, болезнетворные бактерии.
Сигнальная функция
Белки-рецепторы воспринимают и передают сигналы, поступившие от соседних клеток.
Транспортная функция
Гемоглобин переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким.
Запасающая функция
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных. Они служат строительным материалом.
Двигательная функция
Белки, осуществляющие сократительную деятельность это актин и миозин
Билет №18
1. Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения ( на примере полиэтилена).
Высокомолекулярные соединения (полимеры) – это вещества, макромолекулы которых состоят из многократно повторяющихся звеньев. Их относительная молекулярная масса может измеряться от нескольких тысяч до многих миллионов.
Мономер – это низкомолекулярное вещество из которого получают полимер.
Структурное звено – многократно повторяющиеся в макромолекуле полимера группы атомов.
Степень полимеризации – количество повторяющихся структурных звеньев.
nСН2=СН2 → (-СН2-СН2-)n
Полимеры могут быть получены в результате реакций полимеризации и поликонденсации.
Признаки реакции полимеризации:
1. Не образуется побочных веществ.
2. Реакция идет за счет двойных или тройных связей.
nСН2=СН2 → (-СН2-СН2-)n– реакция полимеризации этилена — образование полиэтилена.
Признаки реакции поликонденсации:
1. Образуются побочные вещества.
2. Реакция идет за счет функциональных групп.
Пример: образование фенолформальдегидной смолы из фенола и формальдегида, полипептидной связи из аминокислот. При этом образуется кроме полимера побочный продукт – вода.
Высокомолекулярные соединения имеют определенные преимущества перед другими материалами: они устойчивы к действию реагентов, не проводят ток, механически прочные, легкие. На основе полимеров получают пленки, лаки, резину, пластмассы.
Рекомендуемые страницы:
lektsia.com
Персональный сайт — Общая характеристика белков и аминокислот
Химия белков: Общая характеристика белков и аминокислот.
Общая характеристика и биологическое значение белков.
Белки являются наиболее важными и сложными органическими соединениями, входящими в состав живых организмов. Не только каждый вид живого, но и каждый орган, каждый тип клеток обладает своим специфическим набором белков.
В количественном соотношении они занимают первое место среди всех содержащихся в живой клетке макромолекул. Так, в организме человека белки составляют 40-50% из расчета на сухую массу.
Каждый индивидуум отличается от подобных своего вида собственным набором белков (биохимическая индивидуальность). Эта индивидуальность поддерживается всеми живущими организмами. При внедрении в организм чужих белков образуются защитные вещества (антитела) и разрушают чужие белки. Однако имеется и общность между определенными белками одного и того же вида, которая позволяет проводить обмен белками (например, переливание крови).
Белки – это высокомолекулярные соединения, построенные из аминокислот. В создание белков участвует 20 аминокислот. Они связываются между собой в длинные цепи, которые образуют основу белковой молекулы большой молекулярной массы.
Белки выполняют важные функции в организме:
Ø Каталитическая – практически все химические реакции, протекающие в животной клетке, катализируются специфическими веществами, называемыми ферментами. По химической природе все ферменты являются белками.
Ø Структурная – белки составляют 1/5 част, или 20% массы тела. Коллаген – структурный белок соединительной ткани.
Ø Энергетическая – при полном распаде 1 г белка выделяется 17,15 кДж (4,1 ккал) энергии, что указывает на их способность участвовать в обеспечении организма энергией. Однако использование белков для этих целей происходит только в том случае, когда отмечается недостаток основных источников энергии – углеводов и жиров.
Ø Транспортная – определенная группа белков крови обладает способностью взаимодействовать с различными соединениями и переносить их. Так транспортируются в организме нерастворимые в воде вещества (ионы, металлы, газы) или токсические продукты (билирубин, жирные кислоты и др.). Примером транспортных белков могут служить гемоглобин (переносящий кислород и углекислый газ), трансферрин (белок транспортирующий железо), липопротеиды – сложные белки транспортирующие липиды.
Ø Защитная – в процессе эволюции выработались механизмы узнавания и связывания «чужих» молекул с помощью специфических белков (антител).
Ø Регуляторная – определенные белки являются гормонами, участвуют в регуляции разнообразных процессов, протекающих в организме. Белки участвуют в регуляции важных констант крови: создают онкотическое давление крови; входят в состав буферных систем, влияют на кислотно-основное равновесие крови.
Ø Участие белков в процессах наследственности, т.е. хранении и передачи генетической информации. Эта функции выполняется сложными белками – нуклеопротеидами.
Ø Сократительная – важным признаком живого является подвижность. В основе ее лежит сократительная функция белков.
Ø Гемостатическая функция – белки участвуют в образовании тромба и предотвращении кровотечения.
Химический состав белков.
Белки являются сложными соединениями, полимерами, которые состоят из простых, низкомолекулярных веществ – мономеров.
Химический анализ показал наличие во всех белках углерода, кислорода, водорода, азота и серы, содержание которых следующее: углерода – 50-55%, водорода – 6-7%, кислорода – 21-23%, азота – 15-17%, серы – 0,3-2,5%. В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы в различных, часто очень маленьких количествах.
Содержание основных химических элементов в отдельных белках может различаться, за исключением азота, концентрация которого характеризуется наибольшим постоянством и в среднем составляет 16%.
Исходными составными частями белков являются аминокислоты, которые определяют физико-химические и биологические свойства белков.
Аминокислоты – это аминопроизводные класса карбоновых кислот.
Аминокислоты живых организмов можно разделить на протеиногенные (кодируются генетическим кодом) и непротеиногенные (не кодируются генетическим кодом). Протеиногенных аминокислот 20; 19 из них являются α-аминокислотами, что означает, что атом водорода α-углеродного атома замещен на аминогруппу (NH2). Общая формула этих аминокислот выглядит следующим образом:
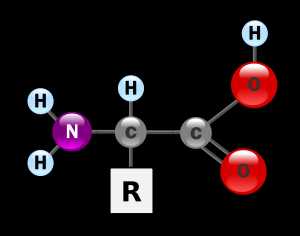
Только одна аминокислота – пролин не соответствует этой общей формуле. Ее относят к иминокислотам.
α-углеродный атом аминокислот является асимметричным (исключение составляет аминопроизводное уксусной кислоты — глицин). У каждой аминокислоты имеются как минимум два оптически активных антипода. Природа выбрала для создания белков L-форму, поэтому природные белки построены из L-α-аминокислот.
Для классификации аминокислот пользуются физико-химическими свойствами их радикалов. Существуют разные подходы к такой классификации.
Большая часть аминокислот – это алифатические соединения, две аминокислоты принадлежат к ароматическому ряду и две – к гетероциклическому.
Аминокислоты можно разделить по их свойствами на основные, нейтральные и кислые.
Они отличаются числом амино- и карбоксильных групп в молекуле. Нейтральные содержат по одной амино- и одной карбоксильной группе. Кислые имеют две карбоксильные и одну аминогруппу, основные — две аминогруппы и одну карбоксильную.
Пользуясь таким свойством аминокислот, как полярность, можно разделить их на группу неполярных (гидрофобных) аминокислот (аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, триптофан), группу полярных (гидрофильных) незаряженных аминокислот (глицин, серии, треонин, цистеин, тирозин, аспарагин, глутамин), группу отрицательно заряженных (кислых) аминокислот (аспарагиновая и глутаминовая кислоты) и группу положительно заряженных (основных) аминокислот (аргинин и лизин).

По способности человека синтезировать их из предшественников
Незаменимые: Триптофан, Фенилаланин, Лизин, Треонин, Метионин, Лейцин, Изолейцин, Валин.
Заменимые: Тирозин, Цистеин, Гистидин, Аргинин, Глицин, Аланин, Серин, Глутамат, Глутамин, Аспартат, Аспарагин, Пролин.
Некоторые заменимые аминокислоты синтезируются в организме человека в недостаточных количествах и должны поступать с пищей.
Характеристика аминокислот
Собственно алифатическими можно назвать 5 аминокислот.
Глицин (Гли), или гликокол (аминоуксусная кислота), является единственной оптически неактивной аминокислотой из-за отсутствия ассиметрического углеродного атома. Глицин участвует в синтезе белка, образовании нуклеиновых и желчных кислот (его атомы входят в состав нуклеотидов, гема и в состав важного трипептида глутатиона), а также необходим для обезвреживания в печени токсических продуктов.
Аланин (Ала) (аминопропионовая кислота) нередко используется организмом для синтеза глюкозы.
Валин (Вал) — аминоизовалериановая кислота, лейцин (Лей) — аминоизокапроновая кислота, изолейцин (Иле) — α-амино-β-этил-β-метилпропионовая кислота, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы. Активно участвуют в обмене веществ.
Гидроксиаминокислоты:
Серин (Сер) — α-амино-β-гидроксипропионовая кислота и Треонин (Тре) — α-амино-β-гидроксимасляная кислота — играют важную роль в процессах ковалентной модификации структуры белков. Их гидроксильная группа легко взаимодействует с фосфорной кислотой, что бывает необходимым для изменения функциональной активности белков. Серин входит в состав различных ферментов, основного белка молока – казеина, обнаружен в составе липопротеидов и других белков. Треонин участвует в биосинтезе белка.
Серосодержащие аминокислоты.
Цистеин (Цис) — α-амино-β-тиопропионовая кислота, благодаря активной —SH-группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков. Две молекулы цистеина, окисляясь, образуют цистин. При этом образуется дисульфидная связь.
Метионин (Мет) — α-амино-β-тиометилмасляная кислота — выполняет функцию донора подвижной метильной группы, необходимой для синтеза биологически активных соединений: холина, нуклеотидов и т. д.
Дикарбоновые аминокислоты:
Глутаминовая (Глу) — α-аминоглутаровая кислота и Аспарагиновая (Асп) — α-аминоянтарная кислота — наиболее распространенные аминокислоты белков животных организмов. Обладая дополнительной карбоксильной группой в радикале, эти аминокислоты способствуют ионному взаимодействию, придают заряд белковой молекуле. Они участвуют в биосинтезе белка, образовании важнейших соединений (тормозных медиаторов нервной системы, других аминокислот), энергетическом обмене. Эти аминокислоты могут образовывать амиды.
- Амиды дикарбоновых аминокислот: глутамин (Гли) и аспарагин (Асн) — выполняют важную функцию в обезвреживании и транспорте аммиака в организме.
Циклические аминокислоты имеют в своем радикале ароматическое или гетероциклическое ядро.
Фенилаланин (Фен) —α-амино-β-фенилпропионовая кислота и Тирозин (Тир) — α-амино-β-параоксифенилпропионовая кислота — эти две аминокислоты образуют взаимосвязанную пару, выполняющую важные функции в организме, например участие их в синтезе ряда биологически активных веществ (адреналин, тироксин). Фенилаланин служит основным источником синтеза тирозина, являющегося предшественником ряда биологически важных веществ: гормонов (тироксина, адреналина), некоторых пигментов.
Триптофан (Три) — α-амино-β-индолилпропионовая кислота используется для синтеза витамина РР, серотонина, гормонов эпифиза.
Гистидин (Гис) — α-амино-β-имидазолилпропионовая кислота может использоваться при образовании гистамина, регулирующего проницаемость капилляров и проявляющего свое действие при аллергии.
Диаминомонокарбоновые аминокислоты:
Лизин (Лиз) — диаминокапроновая кислота и Аргинин (Apг) — α-амино-β-гуанидинвалериановая кислота — имеют дополнительную аминогруппу, которая придает основные свойства белкам, содержащим много таких аминокислот. Лизин необходим для синтеза белков, в том числе гистонов, входящих в состав нуклеопротеидов; обнаружен в структуре некоторых ферментов. Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).
Иминокислота — Пролин (Про) отличается от других аминокислот по строению. Особое место отводится этой аминокислоте в структуре коллагена, где пролин в процессе синтеза коллагена может превращаться в гидроксипролин.
bioximia.narod.ru
Аминокислоты, входящие в состав белков, их строение, свойства.
Белки — полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 альфа-аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке.
Аминокислотами называются органические кислоты, содержащие одну или несколько аминогрупп.
Все α- аминокислоты, кроме аминоуксусной (глицина), имеют асимметрический α-углеродный атом и существуют в виде двух энантиомеров.Практически все белки построены из 20 α -аминокислот, принадлежащих за исключением глицина к L- ряду.
||По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований. Они
· лучше растворяются в воде, чем в органических растворителях;
· хорошо кристаллизуются;
· имеют высокую плотность
· высокие температуры плавления.
Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твёрдом состоянии и в растворе (в широком интервале рН) находятся в цвиттер-ионной форме (т.е. как внутренние соли).
Все аминокислоты отличаются характером радикала, который может быть ациклическим или циклическим. В состав радикала может входить дополнительно вторая карбоксильная группа (такие аминокислоты называются моноаминодикарбоновые МАДК) или две аминные группы (диаминомонокарбоновые ДАМК). В составе отдельных аминокислот могут находиться гидроксильные группы (серин, треонин),сульфгидрильная (цистеин), метильная (метионин).
Таблица 1. Важнейшие аминокислоты.
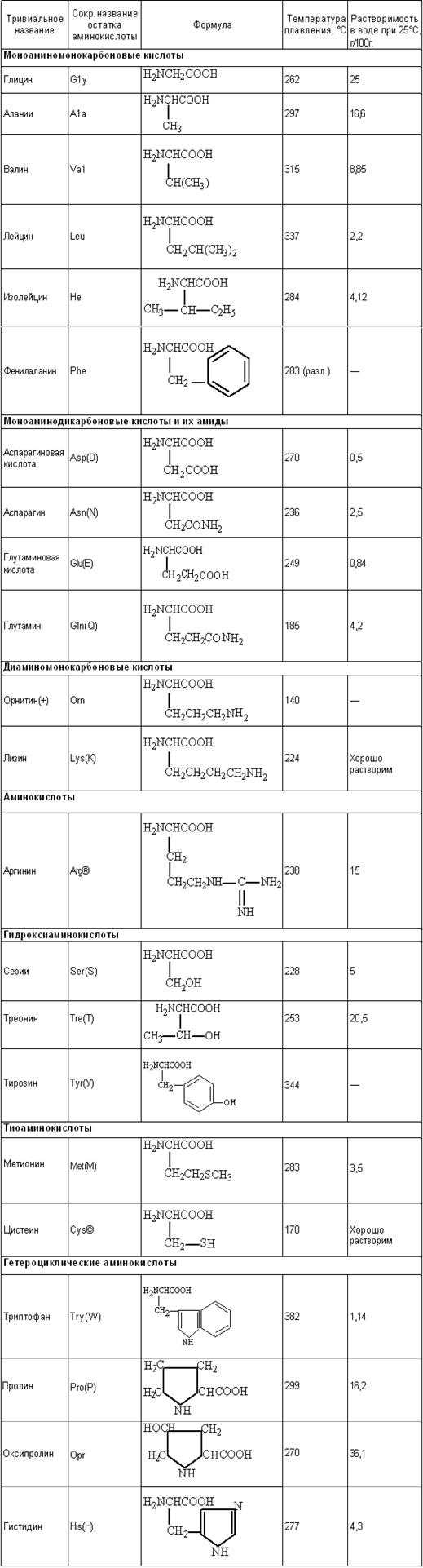
Большинство аминокислот, участвующих в обменных процессах и входящих в состав белков, могут поступать с пищей или синтезироваться в организме в процессе обмена ( из других аминокислот, поступающих в избытке). Они называются заменимыми. Некоторые аминокислоты не могут синтезироваться в организме и должны поступать с пищей — незаменимые аминокислоты. Таких аминокислот девять(гистидин, триптофан, фенилаланин, лизин, метионин, треонин, изолейцин, лейцин, валин).
4.Молекулярная масса белков. Размеры и форма белковых молекул.
Первичная структура белков в значительной степени определяет вторичную, третичную структуры и особенности четвертичной структуры. В свою очередь, первичная и пространственная структуры белков, их молекулярная масса, форма и размеры обусловливают их физико-химические свойства.
Размер белка может измеряться в числе аминокислотных остатков или в дальтонах (молекулярная масса), но из-за относительно большой величины молекулы масса белка выражается в производных единицах — килодальтонах (кДа). Молекулярная масса белков достаточно большая, поэтому они относятся к высокомолекулярным соединениям. Молекулярная масса белков колеблется от 6 000 до 1 000 000 Дальтон и выше, она зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков имеющих четвертичную структуру – от количества входящих в них протомеров (субъединиц).
Молекулярная масса некоторых белков составляет:
· инсулин — 5700Д,
· Пепсин- 35 000Д,
· гемоглобин – 65 000Д.
Молекулярную массу белка можно определить по скорости седиментации при ультрацентрифугировании, т.е. при ускорении 100000-500000 G . На основании этого определяют коэффициент седиментации, который обозначают S ( в честь шведского ученого СВЕДБЕРГА). Молекулярная масса большинства белков колеблется в пределах 1-20S.Для вычисления молекулярной массы (М), помимо константы седиментации, необходимы дополнительные сведения о плотности растворителяи белка и другие согласно уравнению Сведберга:
Другим методом определения молекулярной массы является метод гельфильтрации (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса.
Белки имеют различную форму, но выделяют две основных группы:
· глобулярные (шарообразные) .Более компактны, в этих белках гидрофильные группы расположены преимущественно снаружи, а гидрофобные – внутри, образуя ядро, водорастворимысвёртываются при нагревании, нейтральны, сравнительно трудно осаждаются растворами солей. (Глобулин, Альбумин)
· фибриллярные (веретенообразные). Образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. (Актин, Миозин)
На основе различий белков в молекулярной массе, размеров и форме их можно разделить с помощью ультрацентрифугирования (по скорости седиментации), методом гель – фильтрации (молекулярного просеивания в сефадексе).
infopedia.su
2. 3. Химический состав белков.
Белки являются сложными органическими соединениями, состоящими из аминокислот. Химический анализ показал, что белки состоят из следующих элементов:
Углерод 50-55 %
Водород 6-7 %
Кислород 21-23 %
Азот 15-17 %
Сера 0,3-2,5 %.
В составе отдельных белков обнаружены также фосфор, йод, железо, медь и др. макро- и микровещества.
Содержание основных химических элементов может различаться в отдельных белках, исключение составляет азот, среднее количество которого характеризуется наибольшим постоянством и составляет 16 %. В связи с этим существует способ определения количества белка по входящему в его состав азоту. Зная, что 6,25 грамм белка содержит 1 грамм азота, можно найти количество белка, умножив найденное количество азота на коэффициент 6,25.
2. 4. Аминокислоты.
Аминокислоты – карбоновые кислоты альфа-углеродный атом водорода которых замещен на аминогруппу. Белки состоят из аминокислот. В настоящее время известно более 200 различных аминокислот. В организме человека их около 60, а в состав белков входят только 20 аминокислот, которые называют природными или протеиногенными. 19 из них являются альфа-аминокислотами, это означает, что аминогруппа присоединена к альфа-углеродному атому карбоновой кислоты. Общая формула этих аминокислот выглядит следующим образом.
R
h3N CH COOH
Только аминокислота пролин не соответствует этой формуле, её относят к иминокислотам.
Химические названия аминокислот, для краткости сокращают, например, глутаминовая кислота ГЛУ, серин СЕР и т.д. для записи первичной структуры белков в последнее время стали пользоваться только однобуквенными символами.
Во всех аминокислотах есть общие группировки: -СН2, -NН2, -СООН, они придают общие химические свойства белкам, и радикалы, химическая природа которых разнообразна. Именно они определяют структурные и функциональные особенности аминокислот.
Классификации аминокислот основана на их физико-химических свойствах.
По строению радикалов:
Циклические — гомоциклические ФЕН, ТИР, гетероциклические ТРИ, ГИС.
Ациклические – моноаминомонокарбоновые ГЛИ, АЛА, СЕР, ЦИС, ТРЕ, МЕТ, ВАЛ, ЛЕЙ, ИЛЕЙ,НЛЕЙ, моноаминодикарбоновые АСП, ГЛУ, диаминомонокарбоновые ЛИЗ, АРГ.
По образованию в организме:
Заменимые – могут синтезироваться в организме из веществ белковой и небелковой природы.
Незаменимые – не могут синтезироваться в организме, поэтому должны поступать только с пищей – все циклические аминокислоты, ТРЕ, ВАЛ, ЛЕЙ, ИЛЕЙ.
Биологическое значение аминокислот:
Входят в состав белков организма человека.
Входят в состав пептидов организма человека.
Из аминокислот образованы в организме многие низкомолекулярные биологически активные вещества: ГАМК, биогенные амины и т.д.
Часть гормонов в организме – производные аминокислот (гормоны щитовидной железы, адреналин).
Предшественники азотистых оснований, входящих в состав нуклеиновых кислот.
Предшественники порфиринов, идущих на биосинтез гема для гемоглобина и миоглобина.
Предшественники азотистых оснований, входящих в состав сложных липидов (холина, этаноламина).
Участвуют в биосинтезе медиаторов в нервной системе (ацетилхолин, дофамин, серотонин, норадреналин и др.).
Свойства аминокислот:
Хорошо растворимы в воде.
В водном растворе существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Равновесие зависит от рН среды.
Nh4—CH—COOH Nh4—CH—COO Nh3—CH—COO
R + ОН R R + Н
Катионная форма Биполярный ион Анионная форма
Щелочная среда рН Кислая среда
Способны двигаться в электрическом поле, что используется для разделения аминокислот с помощью электрофореза.
Проявляют амфотерные свойства.
Могут играть роль буферной системы, т.к. могут реагировать как слабое основание и слабая кислота.
studfiles.net
2. 3. Химический состав белков.
Белки являются сложными органическими соединениями, состоящими из аминокислот. Химический анализ показал, что белки состоят из следующих элементов:
Углерод 50-55 %
Водород 6-7 %
Кислород 21-23 %
Азот 15-17 %
Сера 0,3-2,5 %.
В составе отдельных белков обнаружены также фосфор, йод, железо, медь и др. макро- и микровещества.
Содержание основных химических элементов может различаться в отдельных белках, исключение составляет азот, среднее количество которого характеризуется наибольшим постоянством и составляет 16 %. В связи с этим существует способ определения количества белка по входящему в его состав азоту. Зная, что 6,25 грамм белка содержит 1 грамм азота, можно найти количество белка, умножив найденное количество азота на коэффициент 6,25.
2. 4. Аминокислоты.
Аминокислоты – карбоновые кислоты альфа-углеродный атом водорода которых замещен на аминогруппу. Белки состоят из аминокислот. В настоящее время известно более 200 различных аминокислот. В организме человека их около 60, а в состав белков входят только 20 аминокислот, которые называют природными или протеиногенными. 19 из них являются альфа-аминокислотами, это означает, что аминогруппа присоединена к альфа-углеродному атому карбоновой кислоты. Общая формула этих аминокислот выглядит следующим образом.
R
h3N CH COOH
Только аминокислота пролин не соответствует этой формуле, её относят к иминокислотам.
Химические названия аминокислот, для краткости сокращают, например, глутаминовая кислота ГЛУ, серин СЕР и т.д. для записи первичной структуры белков в последнее время стали пользоваться только однобуквенными символами.
Во всех аминокислотах есть общие группировки: -СН2, -NН2, -СООН, они придают общие химические свойства белкам, и радикалы, химическая природа которых разнообразна. Именно они определяют структурные и функциональные особенности аминокислот.
Классификации аминокислот основана на их физико-химических свойствах.
По строению радикалов:
Циклические — гомоциклические ФЕН, ТИР, гетероциклические ТРИ, ГИС.
Ациклические – моноаминомонокарбоновые ГЛИ, АЛА, СЕР, ЦИС, ТРЕ, МЕТ, ВАЛ, ЛЕЙ, ИЛЕЙ,НЛЕЙ, моноаминодикарбоновые АСП, ГЛУ, диаминомонокарбоновые ЛИЗ, АРГ.
По образованию в организме:
Заменимые – могут синтезироваться в организме из веществ белковой и небелковой природы.
Незаменимые – не могут синтезироваться в организме, поэтому должны поступать только с пищей – все циклические аминокислоты, ТРЕ, ВАЛ, ЛЕЙ, ИЛЕЙ.
Биологическое значение аминокислот:
Входят в состав белков организма человека.
Входят в состав пептидов организма человека.
Из аминокислот образованы в организме многие низкомолекулярные биологически активные вещества: ГАМК, биогенные амины и т.д.
Часть гормонов в организме – производные аминокислот (гормоны щитовидной железы, адреналин).
Предшественники азотистых оснований, входящих в состав нуклеиновых кислот.
Предшественники порфиринов, идущих на биосинтез гема для гемоглобина и миоглобина.
Предшественники азотистых оснований, входящих в состав сложных липидов (холина, этаноламина).
Участвуют в биосинтезе медиаторов в нервной системе (ацетилхолин, дофамин, серотонин, норадреналин и др.).
Свойства аминокислот:
Хорошо растворимы в воде.
В водном растворе существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Равновесие зависит от рН среды.
Nh4—CH—COOH Nh4—CH—COO Nh3—CH—COO
R + ОН R R + Н
Катионная форма Биполярный ион Анионная форма
Щелочная среда рН Кислая среда
Способны двигаться в электрическом поле, что используется для разделения аминокислот с помощью электрофореза.
Проявляют амфотерные свойства.
Могут играть роль буферной системы, т.к. могут реагировать как слабое основание и слабая кислота.
studfiles.net
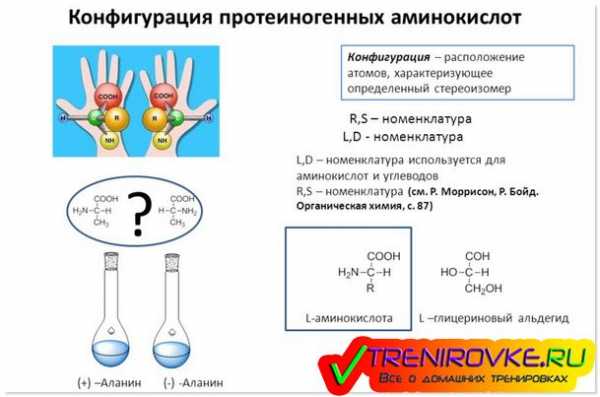
Протеиногенные аминокислоты — свойства, классификация, химический состав
 Всего 20 протеиногенных кислот Загрузка…
Всего 20 протеиногенных кислот Загрузка… Краткое содержание статьи:
Сегодня много говорится о пользе и вреде аминокислот. Безусловно, что как основная составляющая белка из которого состоят клетки – аминокислоты несут исключительно полезную функцию. Но иногда люди стараются искусственно повысить уровень протеиновых аминокислот в организме, и при частом применении они могут принести вред. Но изначально посмотрим, что из себя представляют аминокислоты с научной стороны.
Всего 20 протеиногенных кислот
Все аминокислоты можно разделить на протеиногенные и непротеиногенные. Удивительно, но среди большого количества аминокислот существует лишь 20 протеиногенных аминокислот, которые участвуют во внутреннем синтезе белков, и 19 из них называются α-аминокислотами, потому что атом водорода α-углеродного атома в них замещен на аминогруппу (Nh3). А вот единственная оставшаяся аминокислота, пролин, которая не соответствует обыденной формуле принадлежит иминокислотам.
 Всего 20 протеиногенных кислот
Всего 20 протеиногенных кислотПри этом стоит отметить, что некоторые редкие протеиногенные аминокислоты, будь то гидроксипролин или возможно аминолимонная кислота или гидроксилизин, в действительности же это результат производный все теми же 20 протеиногенными аминокислотами.
А вот оставшиеся аминокислоты ни коим образом не участвуют в создании белков. Как правило, они находятся свободно внутри клетки как некий продукт обмена, а возможно являются составляющей частью иных небелковых соединений.
Так, к примеру, такие аминокислоты как цитруллин или, например, орнитин — служат всего лишь промежуточными частями в процессе образовании аргинина, который, собственно, и является уже протеиногенной аминокислотой, но кроме этого эти две аминокислоты, цитруллин и орнитин, необходимы для участия в синтезировании мочевины.
Или вот еще один яркий пример: γ-амино-масляная кислота является важным элементом и служит медиатором в передаче нервных импульсов, и совершенно вольно находится внутри клетки. Третий пример является неотъемлемым элементом, входящим в состав пантотеновой кислоты – это β-аланин.
В какой группе относятся L-аминокислоты
Теперь сделаем акцент на формулы протеиногенных аминокислот. Аминокислоты белков содержат аминогруппу Nh3.
 В какой группе относятся L-аминокислоты
В какой группе относятся L-аминокислотыКак правило, радикал в самом простом виде обычно является атомом водорода, но может быть представлен и сложным соединением. Именно в виду данных обстоятельств, все протеиногенные аминокислоты в первую очередь отличаются по виду бокового радикала. Вполне разумно, что и определенные физико-химические свойства, которыми обладают данные радикалы, также будут различны.
Основываясь на структуре, свойствах и биологических особенностях
На сегодняшний день приняты три стандартные классификации протеиногенных аминокислот. Первоочередно стоит отметить структурную модель, которая непосредственно будет зависеть от строения бокового радикала.
Вторая классификация строится на кислотно-основных особенностях кислот и носит название электрохимической.
В третьей классификации отличительной особенностью служит состояние незаменимости конкретных аминокислот для животного организма, ее можно определить по биологической классификации, также ее называют физиологической. Примечательно, что первые две классификации универсальны, а биологическая в определенной степени носят условный характер, поскольку применима только к одному виду живых организмов, что вполне предсказуемо, ведь для каждого отдельного вида свойственен особый набор аминокислот, что в свою очередь определяется особенностями обмена.
Важные семь классов
Основываясь на вышеперечисленных свойствах можно выделить несколько классов аминокислот. К первому относятся алифатические, в него входят такие аминокислоты как аланин, валин, глицин, лейцин, изолейцин. Второй класс носит название серосодержащие, а именно это метионин и цистеин.
 Важные семь классов
Важные семь классовТретий класс аминокислот – ароматические, это фенилалин, гистидин, тирозин, триптофан. Четвертый класс объединяет серин, треонин, аспарагин, пролин, глутамин под названием «Нейтральные аминокислоты». Пятый класс состоит из единственной иминокислоты. Шестой класс включает аспарагиновую и глутаминовую кислоты, естетвенно, это категория кислых аминокислот. В седьмой класс основных аминокислот входят лизин, гистидин, аргинин.
Несколько слов об амфотерности протеиногенных аминокислот
Прежде чем начать разговор о физико-химических свойствах протеиногенных кислот, стоит отметить, что по природе своей они все относятся к разряду кислот. В силу некоторых особенностей строения протеиногенные аминокислоты обладают одним очень незаменимым и важным свойством – амфотерностью, и в связи с этим в различных обстоятельствах могут выполнять как основные, так, естественно, и кислые свойства.
 Несколько слов об амфотерности протеиногенных аминокислот
Несколько слов об амфотерности протеиногенных аминокислотЧерез диссоциацию карбоксильной группы проявляются кислые свойства, получается так, что выделяются ионы водорода с образованием аниона. А вот основные свойства появляются через протонирование аминогруппы, по факту присоединяются ионы водорода и с образованием катиона. Примечательно, что в одно и тоже время способны проявляться оба свойства, и диссоциация и протонирование, но данная реакция происходит исключительно в водном растворе.
Процент содержания в белках
Еще один интересный аспект, на котором хотелось бы остановиться – это содержание различных аминокислот в белках. В современном мире сделана расшифровка огромного количества белков не только микробного, но также и растительного, и животного происхождения. Самые встречаемые компоненты это всем известные глицин и аланин, но также и лейцин, не редко обнаруживается и серии. Но не стоит забывать, что каждый белок отличается своей структурой и составом. Последний в свою очередь отличается не собственно незаменимостью какой-то аминокислоты, а его функциональной нагрузкой. Также важно отметить, что последовательность расположения аминокислот в структуре белка обозначается генетическим кодом.
Польза аминокислот
Теперь, когда рассмотрели естественные функции аминокислот и их роль в организме живых существ, можно посмотреть на из полезные и отрицательные стороны.
- Безусловно, что о полезных свойствах аминокислот можно говорит бесконечно, поскольку каждый организм состоит из клеток, основной частью которого является белок, а он в свою очередь состоит из протеиногенных аминокислот.
Стоит сказать, что они крайне необходимы для организмов, потому что способствуют правильной работе иммунной системы, принимают участие в биохимических процессах.
 Польза аминокислот
Польза аминокислотОдни позволяют «сохранить молодость», например, такая аминокислота как аргинин, которая обуславливает синтез гормонов, благодаря чему организм восстанавливается не только внутри, но и оказывает влияние на внешний вид. Лизин способствует сжиганию жиров. Кроме того, с помощью аминокислот возможно нарастить мышечную массу, главное не переусердствовать с объемами принимаемых капсул.
Вред же заключается в том, что, как правило, аминокислоты, продаваемые в капсулах, не являются протеиногенными аминокислотами как таковыми, а это обработанный ферментами казеин. Да, при принятии данных капсул мышечная масса наращивается, но если прекратить принимать капсулы, мышцы приобретут изначальный вид. Также большая нагрузка ложится на почки, которые способны максимально эффективно перерабатывать белки, поступаемых в организм искусственным путем.
Протеиногенные аминокислоты — видео
Рекомендуем прочитать:
vtrenirovke.ru
