Классификация и строение аминокислот
Аминокислоты классифицируются несколькими способами в зависимости от признака, по которому происходит их деление на группы. Принято в основном три классификации аминокислот: структурная — по строению бокового радикала; электрохимическая — за кислото-щелочными свойствами аминокислот; биологическая (физиологическая) — по мере незаменимости аминокислот для организма.
Согласно общей формулы a-аминокислоты отличаются только строением R, согласно чем они делятся на алифатические (ациклические), циклические (см. схему). Каждая группа подразделяется на подгруппы. Так, аминокислоты алифатического ряда в зависимости от количества амино-и карбоксильных групп делятся на моноаминомонокарбонови, диаминомонокарбонови, моноаминоды-карбоновые, диаминодикарбонови. Некоторые аминокислоты, уже входя в состав белков, могут модифицироваться, т.е. испытывать определенные химических превращений, которые приводят к изменению в структуре радикала. Они не принимают непосредственного участия в синтезе белков. Но их можно найти в гидролизате белков. Так, в результате процесса гидроксилирования, который происходит в организме, в боковые радикалы лизина и пролина белка коллагена вводятся ОН-группы с образованием гидроксилизину и гидроксипролина.
Этот процесс имеет место при взаимодействии цистеиновых остатков в полипептидной цепи: как внутри его, так и между полипептидными-ми цепями наблюдается при формировании пространственной конформации белковой молекулы.
По электрохимическими (кислотно-щелочными) свойствами аминокислоты зависимости от количества Nh3-и СООН-групп в молекуле делятся на три группы: кислые — с дополнительными карбоксильными группами в боковом радикале (моноаминодикарбонови кислоты: аспарагиновая и глутаминовая) щелочные — диаминомонокарбонови (лизин, аргинин ) и гистидин; нейтральные — остальные аминокислот, в которых боковой радикал не проявляет ни кислых, ни щелочных свойств. Некоторые авторы считают, что в цистеина и тирозина сульфгидрильных и гидроксильная группы в боковом радикале имеют слабо кислые свойства.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой при физиологических значениях рН (около рН 7,0). Она включает 4 класса аминокислот:
— Неполярные (гидрофобные), боковые радикалы которых не имеют родства с водой. К ним относятся аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин;
— Полярные (гидрофильные) незаряженные — глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин;
— Полярные отрицательно заряженные — аспарагиновая и глутаминовая кислоты;
— Полярные положительно заряженные — лизин, аргинин, гистидин.
По биологическим (физиологическим) значением аминокислоты подразделяют на три группы:
— Незаменимые, которые не могут синтезироваться в организме из других соединений, поэтому должны обязательно поступать с пищевыми продуктами. Это незаменимые добавки пищи. Незаменимых аминокислот для человека восемь: трео-нин, метионин, валин, лейцин, изолейцин, лизин, фенилаланин и триптофан;
— Напивзаминни аминокислоты могут образовываться в организме, но не в достаточном количестве, поэтому частично должны поступать с пищей. Для человека такими аминокислотами являются аргинин, тирозин, гистидин;
— Заменимые аминокислоты синтезируются в организме в достаточном количестве из незаменимых аминокислот и других соединений. К ним относится остальные аминокислот. Приведенная биологическая классификация аминокислот не является универсальной в отличие от предыдущих и в определенной степени условна, так как зависит от вида организма. Однако абсолютное незаменимость восьми аминокислот является универсальной для всех видов организмов.
worldofscience.ru
Классификация а-аминокислот (Таблица)
Справочная таблица содержит классификация а-аминокислот, их функциональные группы.
Группа аминокислот | Функциональные группы | Аминокислоты | |
Гидрофильные, полярные | |||
Кислые (отрицательно заряженные при рН≈7,4) | Карбоксильная -СОО— группа | Аспарагиновая Глутаминовая | Asp Glu |
Основные (положительно заряженные при рН≈7,4) | Аминогруппа -NH3+ | Лизин Аргинин Гистидин | Lys Arg |
Нейтральные | Тиольная группа -SH | Цистеин | Cys |
Гидроксильная -ОН группа | Серин Треонин Тирозин | Ser Thr Tyr | |
Амиды -CONH2 | Аспарагин Глутамин | Asn Gln | |
Гидрофобные, неполярные | |||
Алифатические | -CH2— | Аланин Валин Лейцин Изолейцин Метионин | Ala Val Leu Ile Met |
Ароматические | -C6H5- | Фенилаланин Триптофан *(Тирозин | Phe Trp Tyr) |
Другие | Иминокислота | Пролин Глицин | Pro Gly |
* Тирозин, или гидроксифенилаланин — ароматическая, гидрофильная, полярная аминокислота.
_______________
Источник информации: Биохимия в схемах и таблицах/ О.И. Губич – Минск.: 2010.
infotables.ru
Номенклатура аминокислот и их классификация и по строению радикалов
I. a-Аминокислоты
a-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат карбоксильную и аминогруппу у одного и того же атома углерода. В большинстве АК, этот атом углерода — хиральный центр. В АК, которые являются мономерами белков, он имеет относительную — L конфигурацию. Конфигурация определяется по первому хиральному атому (a-углерод).
Все a-АК имеют общий фрагмент или “стандартный блок” и отличаются радикалом у a-углеродного атома. Отсутствует радикал только у глицина, у него вместо радикала атом водорода.
NH2 – СН – СООН
R
Номенклатура аминокислот и их классификация и по строению радикалов
Названия для АК применяют преимущественно тривиальные (глицин от слова сладкий –glykos, серин от слова serieum – шелковистый, получен из фибрина шелка), для записи используют их трехбуквенное обозначение. В составе полипептидной цепочки остаток АК, не имеющий карбоксильной группы в стандартном блоке называется с изменением окончания –ИН на –ИЛ. Например, глицил вместо глицин и т.д.
По строению углеродного скелета радикалов АК делятся на алифатические, ароматические и гетероциклические. В составе радикалов могут быть функциональные группы, придающие им специфические свойства: карбоксильная, амино-, тиольная, амидная, гидроксильная, гуанидиновая. Сами АК все в воде растворимы, но в составе белка свойства радикала оказывают влияние на растворимость белка в воде, поэтому АК с гидрофобными неполярными радикалами формируют нерастворимые белки (коллаген), АК с гидрофильными полярными радикалами формируют растворимые в воде белки (альбумины). Гидрофобные радикалы это углеводородные структуры, которые способны «склеиваться» друг с другом образуя гидрофобные связи, но не образуют водородные связи с водой и поэтому не растворяются в ней. К ним относятся радикалы с неполярными связями (углеводородные радикалы). Гидрофильные радикалы имеют полярные связи и образуют диполь-дипольные или водородные связи водой. Гидрофобные и гидрофильные радикалы АК определяют пространственное строение белка, в который они входят.
Среди полярных радикалов также выделяют с зарядом (положительно и отрицательно заряженные), они лучше растворяются в воде и незаряженные, они растворяются в воде хуже.
Таблица. Строение аминокислот – мономеров белка
Химические свойства
АК в растворе. Кислотно-основные свойства АК
Все АК хорошо растворимы в воде из-за наличия «стандартного блока». Наличие основного (аминогруппа) и кислотного (карбоксил) центра обуславливают амфотерность АК и автодиссоциацию. В растворе АК существуют в виде биполярного иона или цвиттер-иона:
NH2 – СН2 – СООН Û +NH3 – СН2 – СОО—
Орнитин
Если в радикале имеется кислотный центр это «кислые» АК. К ним относятся дикарбоновые моноаминокислоты аспарагиновая и глутаминовая, в растворе данных кислот рН <7.
NH2 – СН – СООН + Н2О Û +NH3 – СН – СОО— Н3О+
СН2 – СООН СН2 – СОО—
у кислых АК будет при рН< 7, а у основных АК при рН>7.
Образование амидной (пептидной связи)
Карбоксильная группа является электрофильным субстратом в реакции SN и взаимодействует с нуклеофильной аминогруппой, образуя амидную или пептидную связь.
5. Качественная реакция на a—аминокислоты – образование окрашенного сине-фиолетового соединения с нингидрином
Трансаминирование
АЛАНИН ЩУК
ПВК АСПАРАГИНОВАЯ КИСЛОТА
Под действием кофермента НАД+ или НАДФ+ идет окислительное дезаминирование АК in vivo, в отличие от in vitro образуются оксогруппы кетокислот
II. Белки и пептиды
Вторичная структура белков
За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру называемую «конформация белков»
Третичная структура белков.
Третичная структура возникает за счет взаимодействия пептидных связей и боковых радикалов в водном растворе. Молекула белка укладывается в пространстве в виде «глобулы» или «клубка» за счет гидрофобного взаимодействия неполярных или гидрофобных радикалов внутри глобулы, ионных связей между заряженными радикалами, дисульфидных ковалентных мостиков, образованных при окислении цистеина В ЦИСТИН, водородных связей между полярными радикалами и водой.
.
Свойства белков
1. Гидролиз в кислой и щелочной среде до АК.
2. Качественные реакции
А. на пептидную связь
– биуретовая реакция (фиолетовый хелатный комплекс с Си(ОН)2)
ОБРАЗОВАНИЕ БИУРЕТА
Б. на ароматические структуры
ксантопротеиновая реакция – взаимодействие с азотной кислотой с образованием нитробензольных производных желтого цвета.
Изоэлектрическое состояние
Белки содержат группы как кислотного, так и основного характера, поэтому они относятся к полиамфолитам. Амфотерность связана с наличием в молекуле белка катионобразующих групп – аминогрупп (NH2) и анионобразующих групп – карбоксильных групп (COOH).
Знак заряда макромолекулы зависит от:
Ø Количества и природы свободных функциональных групп, например от соотношения карбоксильных и аминогрупп в молекуле белка.
Если в макромолекуле преобладают карбоксильные группы, то при рН = 7 заряд молекулы отрицательный (проявляются свойства слабой кислоты), если преобладают аминогруппы, то заряд белка положительный (характерны основные свойства)
В условиях жизнедеятельности организма белки обычно проявляют анионактивные свойства, вследствие чего поверхность эритроцитов и клеток имеет отрицательный заряд.
Ø рН среды
 В кислой среде макромолекула приобретает положительный заряд, в щелочной — отрицательный.
В кислой среде макромолекула приобретает положительный заряд, в щелочной — отрицательный.
Состояние, при котором число разноименных зарядов в белковой молекуле одинаково, т.е. суммарный заряд полиамфолита равен нулю, называется изоэлектрическим. Значение рН раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой (pI или И.Т.). В среде с бóльшей кислотностью, чем в изоэлектрической точке (pH < pI) ионизация карбоксильных групп подавлена и белок приобретает положительный заряд. В среде с меньшей кислотностью, чем в изоэлектрической точке (pH > pI) карбоксильные группы депротонированы и белок заряжается отрицательно.
Таким образом, при рН раствора < рI, белок имеет положительный зарад; при рН раствора > рI, белок имеет отрицательный заряд. Например, определить заряд следующих белков в растворе с рН =8,5: пепсина желудочного крови, гистона клеточных ядер и лизоцима.
 рI (пепсина) = 2,0, т.к. pI меньше рН раствора, следовательно, белок имеет отрицательный заряд,
рI (пепсина) = 2,0, т.к. pI меньше рН раствора, следовательно, белок имеет отрицательный заряд,
рI (гистона) = 8,5 , т.к. pI равен рН раствора, то белок нейтрален,
рI (лизоцима) = 10,7, т.к. рI больше рН раствора, то белок имеет положительный заряд.
Свойства растворов белков
I. a-Аминокислоты
a-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат карбоксильную и аминогруппу у одного и того же атома углерода. В большинстве АК, этот атом углерода — хиральный центр. В АК, которые являются мономерами белков, он имеет относительную — L конфигурацию. Конфигурация определяется по первому хиральному атому (a-углерод).
Все a-АК имеют общий фрагмент или “стандартный блок” и отличаются радикалом у a-углеродного атома. Отсутствует радикал только у глицина, у него вместо радикала атом водорода.
NH2 – СН – СООН
R
Номенклатура аминокислот и их классификация и по строению радикалов
Названия для АК применяют преимущественно тривиальные (глицин от слова сладкий –glykos, серин от слова serieum – шелковистый, получен из фибрина шелка), для записи используют их трехбуквенное обозначение. В составе полипептидной цепочки остаток АК, не имеющий карбоксильной группы в стандартном блоке называется с изменением окончания –ИН на –ИЛ. Например, глицил вместо глицин и т.д.
По строению углеродного скелета радикалов АК делятся на алифатические, ароматические и гетероциклические. В составе радикалов могут быть функциональные группы, придающие им специфические свойства: карбоксильная, амино-, тиольная, амидная, гидроксильная, гуанидиновая. Сами АК все в воде растворимы, но в составе белка свойства радикала оказывают влияние на растворимость белка в воде, поэтому АК с гидрофобными неполярными радикалами формируют нерастворимые белки (коллаген), АК с гидрофильными полярными радикалами формируют растворимые в воде белки (альбумины). Гидрофобные радикалы это углеводородные структуры, которые способны «склеиваться» друг с другом образуя гидрофобные связи, но не образуют водородные связи с водой и поэтому не растворяются в ней. К ним относятся радикалы с неполярными связями (углеводородные радикалы). Гидрофильные радикалы имеют полярные связи и образуют диполь-дипольные или водородные связи водой. Гидрофобные и гидрофильные радикалы АК определяют пространственное строение белка, в который они входят.
Среди полярных радикалов также выделяют с зарядом (положительно и отрицательно заряженные), они лучше растворяются в воде и незаряженные, они растворяются в воде хуже.
Таблица. Строение аминокислот – мономеров белка
Химические свойства
Читайте также:
- CASE-средства. Общая характеристика и классификация
- I. 3. КЛАССИФИКАЦИЯ И ТЕРМИНОЛОГИЯ I. 3.1. Классификация
- II этап. Обоснование системы показателей для комплексной оценки, их классификация.
- Административное принуждение и его классификация.
- Акриловые материалы холодного отверждения. Классификация эластичных базисных материалов. Сравнительная оценка полимерных материалов для искусственных зубов с материалами другой химической природы.
- АКСИОМЫ СТАТИКИ. СВЯЗИ И ИХ РЕАКЦИИ. ТРЕНИЕ. КЛАССИФИКАЦИЯ СИЛ
- Аминокислотные медиаторы подразделяются на две группы: возбуждающие (глутамат, аспартат) и тормозные (гамма – аминомасляная кислота, глицин, бета – аланин и, таурин).
- Анатомо-физиологические особенности и классификация
- Анатомо-физиологические особенности кроветворения, классификация, основные синдромы.
- Анатомо-физиологические особенности, основные синдромы и классификация
- Анатомо-физиологические особенности, синдромы и классификация
- Банки второго уровня, их классификация и ф-ции.
lektsia.info
аминокислоты
СТРОЕНИЕ И СВОЙСТВА АМИНОКИСЛОТ, ВХОДЯЩИХ В СОСТАВ БЕЛКОВ. ПЕПТИДНЫЕ СВЯЗИ, СОЕДИНЯЮЩИЕ АМИНОКИСЛОТЫ В ЦЕПИ
Белки — полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 α-аминокислот.Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке. Аминокислоты можно рассматривать как буквы алфавита, при помощи которых, как в слове, записывается информация. Слово несёт информацию, например о предмете или действии, а последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка.
А. Строение и свойства аминокислот
1. Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот — наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродныматомом. R — радикал аминокислот — в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Вводных растворах при нейтральном значении рН α-аминокислотысуществуют в виде биполярных ионов.
Вотличие от 19 остальных α-аминокислот,пролин — иминокислота, радикал которой связан как с α-углеродныматомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в α-положенииасимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах — L и D. Исключение составляет глицин, который не имеет асимметричногоα-углеродногоатома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L- изомеры аминокислот.
Чистые L- или D-стереоизомерымогут за длительный срок самопроизвольно инеферментатив-нопревращаться в эквимолярную смесь L- иD-изомеров.Этот процесс называют рацемизацией. Рацемизация каждойL-аминокислотыпри данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в которомL-аспартатпереходит вD-изомерпри температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L- изомер, поэтому по содержаниюD-аспартатаможно рассчитать возраст обследуемого.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическимсвойствам радикалов, присоединённых кα-углеродномуатому.
2. Классификация аминокислот по химическому строению радикалов
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические (табл. 1-1).
В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН),амино(-Nh3),тиольная
(-SH),амидная(-CO-Nh3),гидроксильная(-ОН)и гуанидиноваягруппы.
Названия аминокислот можно построить по заместительной номенклатуре, но обычно используют тривиальные названия (табл. 1-2).
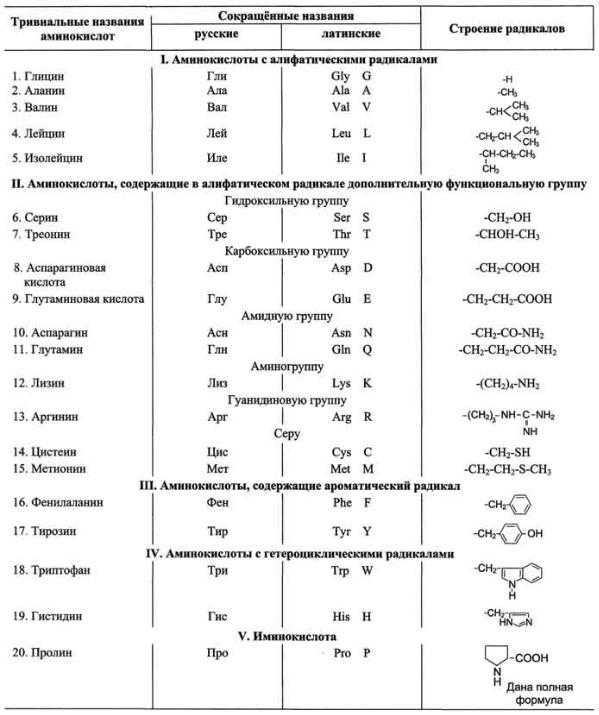
Таблица 1-1.Классификация основных аминокислот белков по их химическому строению
Таблица 1-2.Примеры названий аминокислот по заместительной номенклатуре и соответствующие тривиальные названия
Название аминокислоты | Формула аминокислоты | Тривиальное название |
по заместительной |
|
|
номенклатуре |
|
|
|
|
|
2-амино-З- |
| Серии |
гидроксипропановая кислота |
|
|
|
|
|
2-амино-4- |
| Метионин |
метилтиомасляная кислота |
|
|
|
|
|
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы (см. табл. 1-1).
Тривиальные названия часто происходят от названия источника, из которого они впервые были выделены, или от свойств данной аминокислоты. Так, серии впервые был выделен из фиброина шёлка (от лат. serieum — шелковистый), а глицин получил свое названиеиз-засладкого вкуса (от греч.glykos — сладкий).
3. Классификация аминокислот по растворимости их радикалов в воде
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
Аминокислоты с полярными незаряженными радикалами
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие
гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
Цистеин и тирозин содержат соответственно тиольную и гидроксильную группы, способные к диссоциации с образованием Н+, но при рН около 7,0, поддерживаемого в клетках, эти группы практически не диссоциируют.
Аминокислоты с полярными отрицательно заряженными радикалами
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО- и Н+. Следовательно, радикалы данных аминокислот — анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Аминокислоты с полярными положительно заряженными радикалами
Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, способная присоединять Н+, располагается в ?- положении алифатической цепи, а у аргинина положительный заряд приобретает, хуанидиновая группа, Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп — отдавать протон, теряя положительный заряд радикала. Положительно заряженные радикалы — катионы (см. схему ниже).
Наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот.
4. Изменение суммарного заряда аминокислот в зависимости от рН среды
При нейтральных значениях рН все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии.
Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, — положительный заряд (табл. 1-3).
Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд.
Напротив, увеличение концентрации ОН- групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд.

5. Модифицированные аминокислоты, присутствующие в белках
Непосредственно в синтезе белков организма человека принимают участие только 20 перечисленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты — производные одной из этих 20 аминокислот. Например, в молекуле коллагена (фибриллярного белка межклеточного матрикса) присутствуют гидроксипроизводные лизина и пролина — 5-гидроксилизини 4- гидроксипролин.
Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только
Модифицированные аминокислоты, найденные в составе белков
после окончания их синтеза. Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства,
Схема. Структура полярных заряженных аминокислот в диссоциированной форме
Таблица 1-3.Изменение суммарного заряда аминокислот в зависимости от рН среды
необходимые для выполнения ими специфических функций. Так, α-карбоксиглутаминоваякислота входит в состав белков, участвующих в свёртывании крови, и две близко лежащие карбоксильные группы в их структуре необходимы для связывания белковых факторов с ионами Са2+. Нарушение карбоксилирования глутамата приводит к снижению свёртываемости крови.
6. Химические реакции, используемые для обнаружения аминокислот
Способность аминокислот вступать в те или иные химические реакции определяется наличием в их составе функциональных групп. Так как все аминокислоты, входящие в состав белков, содержат у α-углеродногоатома амино- и карбоксильную группы, они могут вступать в характерные для всех аминокислот химические реакции. Наличие какихлибо функциональных групп в радикалах индивидуальных аминокислот определяет их способность вступать в специфичные для данных аминокислот реакции.
Нингидриновая реакция на α-аминокислоты
Для обнаружения и количественного определения аминокислот, находящихся в растворе, можно использовать нингидриновую реакцию.
Эта реакция основана на том, что бесцветный нингидрин, реагируя с аминокислотой, конденсируется в виде димера через атом азота, отщепляемый от α-аминогруппыаминокислоты. В результате образуется пигменткрасно-фиолетовогоцвета. Одновременно происходит декарбоксилирование аминокислоты, что приводит к образованию СО2 и соответствующего альдегида. Нингидриновую реакцию широко используют при изучении первичной структуры белков (см. схему ниже).
Так как интенсивность окраски пропорциональна количеству аминокислот в растворе, её используют для измерения концентрации α аминокислот.
Нингидриновая реакция, используемая для определения αаминокислот
Специфические реакции на отдельные аминокислоты
Качественное и количественное определение отдельных аминокислот возможно благодаря наличию в их радикалах особенных функциональных групп.
Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SH-группуданной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина — с помощью реакции Миллона.
Б. Пептидная связь. Строение и биологические свойства пептидов
α-Аминокислотымогут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется междуа-карбоксильнойгруппой одной аминокислоты иα-аминогруппойдругой, т.е. является амидной связью. При этом происходит отщепление молекулы воды (см. схему А).
1. Строение пептида
Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, окгапептид и т.д.
Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин «белок» часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном.
Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N- концевым и пишется слева, а имеющий свободную?-карбоксильнуюгруппу -С-концевыми пишется справа. Пептиды пишутся и читаются сN-конца.Цепь повторяющихся атомов в полипептидной цепи-NH-CH-CO-носитназвание»пептидный остов» (см. схему Б).
При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил,за исключениемС-концевойаминокислоты. Например, тетрапептидСер-Гли-Про-Алачитается как серилглицилпролилаланин.
Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот.
Серилглицилпролилаланин

Схема А. Образование дипептида
Схема Б. Строение пептидов
Сер-Гис-Про-АлаиАла-Про-Гис-Сер- два разных пептида, несмотря на то, что они имеют одинаковые количественный и качественный составы аминокислот.
2.Характеристика пептидной связи
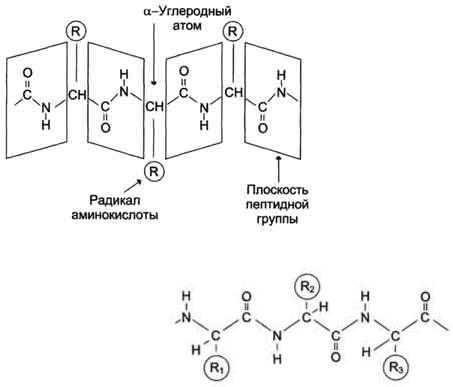
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу (рис. 1-1).
Связь между α углеродным атомом и α-аминогруппойилиα-карбоксильнойгруппой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации,т.е.α-углеродныеатомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве (рис.1-2).
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки.
В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein — белок,lysis — разрушение), называемых также протеазами, или пептидгидролазами.
Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей).
3.Биологическая роль пептидов
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью.
Рис. 1-1.Плоскости расположения пептидных групп иα-углеродныхатомов в пространстве.
Рис. 1-2.Транс-конфигурацияпептидных связей.Функциональные группы -СО- и -NH-,
образующие пептидные связи, не ионизированы, но полярны, и могут участвовать в образовании водородных связей.
Количество аминокислотных остатков в структуре биологически активных пептидов может варьировать от 3 до 50. К одним из самых «маленьких» пептидов можно отнести ти- реотропин-рилизинг-гормони глутатион (трипептиды), а также энкефалины, имеющие в своём составе 5 аминокислот. Однако большинство биологически активных пептидов имеет в своём составе более 10 аминокислот, например нейропептид Y (регулятор аппетита) содержит 36 аминокислот, а кортиколиберин — 41 аминокислоту.
Некоторые из пептидов, в частности большинство пептидных гормонов, содержат пептидные связи, образованные а-аминогруппойиа-карбоксильнойгруппой соседних аминокислот. Как правило, они синтезируются из неактивных белковых предшественников, в которых специфические протеолитические ферменты разрушают определённые пептидные связи.
Ангиотензин II — октапептид, образующийся из крупного белка плазмы крови ангиотензиногена в результате последовательного действия двух протеолитических ферментов.
Первый протеолитический фермент ренин отщепляет от ангиотензиногена с N-концапептид, содержащий 10 аминокислот, называемый ангиотензином I. Второй протеолитический фермент карбоксидипептидилпептидаза отщепляет отС-конца
studfiles.net
Номенклатура аминокислот и их классификация и по строению радикалов
Стр 1 из 2Следующая ⇒
I. a-Аминокислоты
a-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат карбоксильную и аминогруппу у одного и того же атома углерода. В большинстве АК, этот атом углерода — хиральный центр. В АК, которые являются мономерами белков, он имеет относительную — L конфигурацию. Конфигурация определяется по первому хиральному атому (a-углерод).
Все a-АК имеют общий фрагмент или “стандартный блок” и отличаются радикалом у a-углеродного атома. Отсутствует радикал только у глицина, у него вместо радикала атом водорода.
NH2 – СН – СООН
R
Номенклатура аминокислот и их классификация и по строению радикалов
Названия для АК применяют преимущественно тривиальные (глицин от слова сладкий –glykos, серин от слова serieum – шелковистый, получен из фибрина шелка), для записи используют их трехбуквенное обозначение. В составе полипептидной цепочки остаток АК, не имеющий карбоксильной группы в стандартном блоке называется с изменением окончания –ИН на –ИЛ. Например, глицил вместо глицин и т.д.
По строению углеродного скелета радикалов АК делятся на алифатические, ароматические и гетероциклические. В составе радикалов могут быть функциональные группы, придающие им специфические свойства: карбоксильная, амино-, тиольная, амидная, гидроксильная, гуанидиновая. Сами АК все в воде растворимы, но в составе белка свойства радикала оказывают влияние на растворимость белка в воде, поэтому АК с гидрофобными неполярными радикалами формируют нерастворимые белки (коллаген), АК с гидрофильными полярными радикалами формируют растворимые в воде белки (альбумины). Гидрофобные радикалы это углеводородные структуры, которые способны «склеиваться» друг с другом образуя гидрофобные связи, но не образуют водородные связи с водой и поэтому не растворяются в ней. К ним относятся радикалы с неполярными связями (углеводородные радикалы). Гидрофильные радикалы имеют полярные связи и образуют диполь-дипольные или водородные связи водой. Гидрофобные и гидрофильные радикалы АК определяют пространственное строение белка, в который они входят.
Среди полярных радикалов также выделяют с зарядом (положительно и отрицательно заряженные), они лучше растворяются в воде и незаряженные, они растворяются в воде хуже.
Таблица. Строение аминокислот – мономеров белка
Химические свойства
АК в растворе. Кислотно-основные свойства АК
Все АК хорошо растворимы в воде из-за наличия «стандартного блока». Наличие основного (аминогруппа) и кислотного (карбоксил) центра обуславливают амфотерность АК и автодиссоциацию. В растворе АК существуют в виде биполярного иона или цвиттер-иона:
NH2 – СН2 – СООН Û +NH3 – СН2 – СОО—
Орнитин
Если в радикале имеется кислотный центр это «кислые» АК. К ним относятся дикарбоновые моноаминокислоты аспарагиновая и глутаминовая, в растворе данных кислот рН <7.
NH2 – СН – СООН + Н2О Û +NH3 – СН – СОО— Н3О+
СН2 – СООН СН2 – СОО—
у кислых АК будет при рН< 7, а у основных АК при рН>7.
Образование амидной (пептидной связи)
Карбоксильная группа является электрофильным субстратом в реакции SN и взаимодействует с нуклеофильной аминогруппой, образуя амидную или пептидную связь.
5. Качественная реакция на a—аминокислоты – образование окрашенного сине-фиолетового соединения с нингидрином
Трансаминирование
АЛАНИН ЩУК
ПВК АСПАРАГИНОВАЯ КИСЛОТА
Под действием кофермента НАД+ или НАДФ+ идет окислительное дезаминирование АК in vivo, в отличие от in vitro образуются оксогруппы кетокислот
II. Белки и пептиды
Вторичная структура белков
За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру называемую «конформация белков». Вторичная структура определяется пространственным строением молекулы и представляет собой наиболее выгодную конформацию в виде правозакрученной a- спирали или складчатую b-структуру. Стабилизация вторичной структуры идет за счет водородных связей между пептидными группами.
Третичная структура белков.
Третичная структура возникает за счет взаимодействия пептидных связей и боковых радикалов в водном растворе. Молекула белка укладывается в пространстве в виде «глобулы» или «клубка» за счет гидрофобного взаимодействия неполярных или гидрофобных радикалов внутри глобулы, ионных связей между заряженными радикалами, дисульфидных ковалентных мостиков, образованных при окислении цистеина В ЦИСТИН, водородных связей между полярными радикалами и водой.
.
Свойства белков
1. Гидролиз в кислой и щелочной среде до АК.
2. Качественные реакции
А. на пептидную связь
– биуретовая реакция (фиолетовый хелатный комплекс с Си(ОН)2)
ОБРАЗОВАНИЕ БИУРЕТА
Б. на ароматические структуры
ксантопротеиновая реакция – взаимодействие с азотной кислотой с образованием нитробензольных производных желтого цвета.
Изоэлектрическое состояние
Белки содержат группы как кислотного, так и основного характера, поэтому они относятся к полиамфолитам. Амфотерность связана с наличием в молекуле белка катионобразующих групп – аминогрупп (NH2) и анионобразующих групп – карбоксильных групп (COOH).
Знак заряда макромолекулы зависит от:
Ø Количества и природы свободных функциональных групп, например от соотношения карбоксильных и аминогрупп в молекуле белка.
Если в макромолекуле преобладают карбоксильные группы, то при рН = 7 заряд молекулы отрицательный (проявляются свойства слабой кислоты), если преобладают аминогруппы, то заряд белка положительный (характерны основные свойства)
В условиях жизнедеятельности организма белки обычно проявляют анионактивные свойства, вследствие чего поверхность эритроцитов и клеток имеет отрицательный заряд.
Ø рН среды
 В кислой среде макромолекула приобретает положительный заряд, в щелочной — отрицательный.
В кислой среде макромолекула приобретает положительный заряд, в щелочной — отрицательный.
Состояние, при котором число разноименных зарядов в белковой молекуле одинаково, т.е. суммарный заряд полиамфолита равен нулю, называется изоэлектрическим. Значение рН раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой (pI или И.Т.). В среде с бóльшей кислотностью, чем в изоэлектрической точке (pH < pI) ионизация карбоксильных групп подавлена и белок приобретает положительный заряд. В среде с меньшей кислотностью, чем в изоэлектрической точке (pH > pI) карбоксильные группы депротонированы и белок заряжается отрицательно.
Таким образом, при рН раствора < рI, белок имеет положительный зарад; при рН раствора > рI, белок имеет отрицательный заряд. Например, определить заряд следующих белков в растворе с рН =8,5: пепсина желудочного крови, гистона клеточных ядер и лизоцима.
 рI (пепсина) = 2,0, т.к. pI меньше рН раствора, следовательно, белок имеет отрицательный заряд,
рI (пепсина) = 2,0, т.к. pI меньше рН раствора, следовательно, белок имеет отрицательный заряд,
рI (гистона) = 8,5 , т.к. pI равен рН раствора, то белок нейтрален,
рI (лизоцима) = 10,7, т.к. рI больше рН раствора, то белок имеет положительный заряд.
Свойства растворов белков
I. a-Аминокислоты
a-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат карбоксильную и аминогруппу у одного и того же атома углерода. В большинстве АК, этот атом углерода — хиральный центр. В АК, которые являются мономерами белков, он имеет относительную — L конфигурацию. Конфигурация определяется по первому хиральному атому (a-углерод).
Все a-АК имеют общий фрагмент или “стандартный блок” и отличаются радикалом у a-углеродного атома. Отсутствует радикал только у глицина, у него вместо радикала атом водорода.
NH2 – СН – СООН
R
Номенклатура аминокислот и их классификация и по строению радикалов
Названия для АК применяют преимущественно тривиальные (глицин от слова сладкий –glykos, серин от слова serieum – шелковистый, получен из фибрина шелка), для записи используют их трехбуквенное обозначение. В составе полипептидной цепочки остаток АК, не имеющий карбоксильной группы в стандартном блоке называется с изменением окончания –ИН на –ИЛ. Например, глицил вместо глицин и т.д.
По строению углеродного скелета радикалов АК делятся на алифатические, ароматические и гетероциклические. В составе радикалов могут быть функциональные группы, придающие им специфические свойства: карбоксильная, амино-, тиольная, амидная, гидроксильная, гуанидиновая. Сами АК все в воде растворимы, но в составе белка свойства радикала оказывают влияние на растворимость белка в воде, поэтому АК с гидрофобными неполярными радикалами формируют нерастворимые белки (коллаген), АК с гидрофильными полярными радикалами формируют растворимые в воде белки (альбумины). Гидрофобные радикалы это углеводородные структуры, которые способны «склеиваться» друг с другом образуя гидрофобные связи, но не образуют водородные связи с водой и поэтому не растворяются в ней. К ним относятся радикалы с неполярными связями (углеводородные радикалы). Гидрофильные радикалы имеют полярные связи и образуют диполь-дипольные или водородные связи водой. Гидрофобные и гидрофильные радикалы АК определяют пространственное строение белка, в который они входят.
Среди полярных радикалов также выделяют с зарядом (положительно и отрицательно заряженные), они лучше растворяются в воде и незаряженные, они растворяются в воде хуже.
Таблица. Строение аминокислот – мономеров белка
Химические свойства
Рекомендуемые страницы:
lektsia.com
Аминокислоты: биохимия, классификация
Для полноценной деятельности человеческого организма, выполнения всех функций, необходимо употреблять продукты, обогащенные белками, жирами, углеводами. Протеины и белки являются компонентами клеток, поэтому человек нуждается в белковой пище. Что представляют собой аминокислоты? Биохимия данных соединений – важный вопрос, заслуживающий детального рассмотрения и изучения.

Особенности аминокислот
Эти соединения необходимы для синтеза белковых молекул. В природе есть более ста пятидесяти различных аминокислот, но далеко не все они жизненно необходимы организму человека. Какие именно нужны нам аминокислоты? Биохимия 20 таких соединений подробно изучена отечественными и зарубежными учеными. Оказалось, что двенадцать из них способны синтезироваться внутри человеческого организма, и только восемь аминокислот человек должен получать с пищей.
Классификация
Рассмотрим некоторые аминокислоты. Биохимия, классификация этих органических соединений предполагает выделение трех основных групп:
- незаменимые, получаемые вместе с пищей. Такие вещества не могут синтезироваться в человеческом организме;
- заменимые, образующиеся в организме, попадающие в него вместе с белковой пищей;
- условно заменимые, вырабатываемые из незаменимых соединений.
Основные свойства
Какими физическими и химическими свойствами обладают аминокислоты? Биохимия этих соединений дает представление об их основных характеристиках. Аминокислоты имеют высокие температуры плавления, отлично растворяются в воде, обладают кристаллической формой.
Чем еще характеризуются аминокислоты? Биохимия, формулы их свидетельствуют о наличии в молекулах углерода, обладающего оптической активностью.

Химические характеристики
Интерес представляет их биохимия. Аминокислоты – пептиды первичной структуры. Именно при объединении нескольких аминокислотных остатков в одну линейную структуру происходит синтез белковой молекулы. При употреблении человеком глицина в виде порошка либо таблеток, происходит быстрое и легкое попадание органического вещества в кровь. Интерес представляет их биохимия. Аминокислоты, белки, углеводы, жиры – вещества, которые необходимы для функционирования живого организма. При их недостатке возникают различные заболевания.
Аминокислоты являются амфотерными соединениями, проявляющими двойственные химические свойства.
Биологическое значение
Данный класс азотсодержащих соединений отвечает за синтез белковых молекул в организме человека. В случае его дефицита возникают серьезные проблемы с нервной системой. Чем еще важны для организма аминокислоты? Биохимия этих амфотерных соединений объясняет их значение для биосинтеза в печени гликогена. Его недостаточное количество приводит к серьезным заболеваниям. Среди основных причин недостатка 20 важнейших аминокислот, врачи называют нарушения в питании, злоупотребление крепкими спиртными напитками, систематические стрессовые ситуации. Для того чтобы не допускать истощения организма (избежать белкового голодания), необходимо включать в пищу молочные, мясные, соевые продукты.

Двойственность свойств
Какими особенностями обладают аминокислоты? Биохимия данных соединений объясняется наличием в молекулах двух функциональных групп. Данные химические соединения имеют карбоксильную (кислотную) группу СООН, а также являются аминами. Такие особенности строения поясняют их химические возможности.
Сходство с органическими и минеральными кислотами проявляется в реакциях с активными металлами, основными оксидами, щелочами, солями слабых кислот. Кроме того аминокислоты способны вступать в химическое взаимодействие со спиртами, образуя сложные эфиры. Наличие аминогруппы объясняет их взаимодействие с кислотами по донорно-акцепторному механизму связи.
Классификация и номенклатура
В зависимости от расположения карбоксильной группы, возможно деление этих органических соединений на альфа-, бета-, аминокислоты. Нумерация углеродного атома при этом начинается с углерода, следующего после кислотной группы.
В органической химии выделяют аминокислоты по числу функциональных групп: основные, нейтральные, кислые.
В зависимости от характера углеводородного радикала принято подразделять все аминокислоты на жирные (алифатические), гетероциклические, ароматические, а также серосодержащие соединения. В качестве примера ароматической аминокислоты можно представить 2 аминобензойную кислоту.
По систематической номенклатуре при названии данного класса органических соединений указывают цифрой положение аминогруппы, затем добавляют название углеродной цепочки, в состав которой входит карбоксильная группа. Греческий алфавит применяется в том случае, если аминокислота будет названа по тривиальной номенклатуре.
При наличии в молекуле двух функциональных (аминогрупп), в названии применяют уточняющие приставки: диамино-, триамино-. Для многоосновных аминокислот в названии добавляют триоловая либо диоловая кислота.
Особенности изомерии и получения аминокислот
Учитывая специфику химического строения представителей данного класса органических веществ, выделяют несколько видов изомерии. Аналогично карбоновых кислотам, в этих амфотерных соединениях, существуют изомеры углеродного скелета.
Также можно составить изомеры с разным расположением функциональной аминогруппы. Интерес представляет оптическая изомерия данного класса, позволяющая объяснять их биологическое значение для живых организмов.
В качестве исходного сырья для синтеза капрона выступает аминокапроновая кислота. Путем гидролиза можно получить 25 важных аминокислот. Существуют определенные проблемы, связанные с разделением получаемой смеси амфотерных соединений. Помимо гидролиза белковых молекул, можно синтезировать аминокислоты путем взаимодействия галогенхзамещенных кислот по реакции Геля-Фольгарда-Зелинского.
Образуются аминокислоты при процессах гидролиза белков, входящих в состав продуктов питания. Именно эти вещества являются теми кирпичиками, благодаря которым происходит выстраивание растительных и животных белков, насыщение организма важнейшими компонентами для его полноценной жизнедеятельности.
Например, в случае сильного истощения организма, вызванного тяжелой операцией, пациенту назначается специальный курс аминокислот. С помощью глутаминовой кислоты осуществляется лечение нервных заболеваний, при язвах желудка необходимо употребление гистидина. В сельском хозяйстве аминокислоты применяют в качестве подкормки для животных, стимулирующих их рост и развитие.
Заключение
Аминокислоты являются амфотерными органическими соединениями, играющими важную роль в жизнедеятельности человека и животных. При недостаточном количестве одной из важнейших аминокислот, появляются серьезные проблемы со здоровьем. Полноценное белковое питание особенно важно в подростковом возрасте, а также тем людям, которые испытывают постоянные физические нагрузки, активно занимаются спортом.
fb.ru
