Состав и структура миофибриллы
Описан состав, структура и функции миофибриллы. При силовой тренировке наблюдается миофибриллярная гипертрофия – увеличение количества и объема миофибрилл. У детей гипертрофия миофибрилл происходит за счет их роста в длину, при силовой тренировке – в толщину.
Состав, структура и функции миофибриллы
Общая характеристика
Для того чтобы понять, какие механизмы лежат в основе гипертрофии мышц, нужно рассмотреть состав, структуру и функции миофибриллы.
Миофибриллы представляют собой органеллы специального назначения мышечного волокна. Это – тонкие белковые нити, расположенные вдоль мышечного волокна параллельно друг другу. Миофибриллы, в отличие от других компонентов мышечного волокна, не имеет оболочки. Роль оболочки играет саркоплазматический ретикулум, который окружает каждую миофибриллу в виде «муфточки». Миофибриллы идут от одного конца мышечного волокна до другого, их длина соответствует длине волокна.
Функции миофибриллы
Миофибриллы – основные сократительные элементы мышечного волокна, поэтому их основная функция — укорочение под воздействием нервного импульса. Вследствие этого мышца развивает определенную силу.
Состав миофибриллы
Миофибриллы состоят из элементов, имеющих цилиндрическую форму – саркомеров, которые расположены последовательно, друг за другом вдоль миофибриллы. Друг от друга саркомеры отделены Z-дисками (в плоскости – Z-линии). Миофибриллу можно сравнить со стеблем бамбука, длинные секции которого соединяются друг с другом толстыми дисками. Длина одного саркомера в среднем равна 2,5 мкм, поэтому в одной миофибрилле длиной 5 см находится до 20000 саркомеров.
Расположение в мышечном волокне
В мышечном волокне может содержаться от нескольких десятков до нескольких тысяч миофибрилл. Каждая миофибрилла в мышечном волокне «привязана» к соседней посредством белковых соединений, которые называются промежуточными филаментами. Все периферические миофибриллы имеют связь с оболочкой мышечного волокна (сарколеммой) посредством белковых структур, которые называются костамерами.
Более подробно строение и функции мышц описаны в моих книгах «Гипертрофия скелетных мышц человека» и «Биомеханика мышц»
Влияние силовой тренировки на объем и количество миофибрилл
Доказано, что под влиянием силовой тренировки в мышечном волокне увеличивается количество миофибрилл и их объем. Это явление называется миофибриллярной гипертрофией.
Увеличение количества миофибрилл называется гиперплазией миофибрилл. Увеличение объема миофибрилл называется гипертрофией миофибрилл.
У взрослых объем миофибрилл возрастает за счет изменения площади поперечного сечения миофибриллы (она становится толще). Ученый Голдспинк еще в 1970 году доказал, что при достижении миофибриллы больших размеров, она расщепляется на две миофибриллы.
Гипертрофия миофибрилл у детей
У детей происходит увеличение длины мышц, соответственно «растут» в длину и миофибриллы. Это происходит за счет добавления саркомеров на концах миофибрилл. Таким образом увеличивается объем миофибрилл, то есть происходит их гипертрофия.
Неиспользование
Если конечность травмирована, например, наложен гипс, и фиксирована длина мышцы, через несколько часов длина мышцы начинает уменьшаться. Длина миофибрилл также уменьшается. Это происходит за счет разрушения саркомеров, расположенных на краях миофибрилл. Кроме того, происходит уменьшение толщины миофибрилл и их количества.
С уважением, А.В. Самсонова
allasamsonova.ru
Микростроение мышц. Миофибриллы | Bodybuilding Вики
Мышечное волокно Править
Мышечные волокна представляют собой сильно вытянутые многоядерные клетки крупного размера длиной от 0,1 до 2-3 см, а в некоторых мышцах даже более 10 см. Толщина мышечных клеток около 0,1 -0,2 мм. Как и любая клетка, мышечное волокно содержит такие органеллы, как ядра (мышечная ткань многоядерна), митохондрии, рибосомы, цитоплазматическую сеть и клеточную оболочку (сарколемму). Особенностью мышечных клеток является наличие миофибрилл — сократительных элементов.
Миофибриллы Править
Строение мышцы
1. Миофибриллы. 2. Митохондрии 3. Постсинаптическая мембрана.
5. Пресинаптическая мембрана 8. Ядро 9. Актиновый филамент
10. Саркомер 11. Миозиновый филамент 12. Миелиновая оболочка
13. Нервные волокна 14. Клеточная мембрана (сарколемма)
17. Саркоплазматический ретикулум
Миофибри́ллы — органеллы клеток поперечнополосатых мышц, обеспечивающие ихсокращение. Служат для сокращений мышечных волокон. Миофибрилла — нитевидная структура, состоящая из саркомеров. Каждый саркомер имеет длину около 2 мкм и содержит два типа белковых филаментов: тонкие миофиламенты из
Границы между филаментами (Z-диски) состоят из особых белков, к которым крепятся концы актиновых филаментов. Миозиновые филаменты также крепятся к границам саркомера с помощью нитей из белка титина (тайтина). С актиновыми филаментами связаны вспомогательные
белки — небулин и белки тропонин-тропомиозинового комплекса.
Миофибриллы — цилиндрические нити толщиной 1 — 2 мкм, идущие вдоль от одного конца мышечного волокна до другого. Изолированная миофибрилла способна сокращаться (в присутствии АТФ), именно она и есть сократимый элемент мышечной клетки.
У человека толщина миофибрилл составляет 1-2 мкм, а их длина может достигать длины всей клетки (до нескольких сантиметров). Одна клетка содержит обычно несколько десятков миофибрилл, на их долю приходится до 2/3 сухой массы мышечных клеток.
Митохондрии Править
Митохондрии — микроскопические пузырьки размером до 2-3 мкм, окруженные двойной мембраной. В митохондриях протекает окисление углеводов, жиров и аминокислот до углекислого газа и воды с использованием кислорода. За счет энергии, выделяющейся при окислении, в митохондриях осуществляется синтез АТФ. В тренированных мышцах митохондрии многочисленны и располагаются вдоль миофибрилл.
См. также Митохондрии
Ядра Править
Ядра окружены оболочкой — нуклеолеммой и содержат генетическую информацию для синтеза белков.
Ретикулум Править
Саркоплазматический ретикулум состоит из трубочек, канальцев и пузырьков, образованных мембранами и соединенных друг с другом. Саркоплазматический ретикулум с помощью особых трубочек, называемых Т-системой, связан с оболочкой мышечной клетки — сарколеммой. В ретикулуме находятся пузырьки, называемые цистернами. Эти пузырьки в большой концентрации содержат ионы кальция.
Саркоплазма Править
Саркоплазма занимает внутреннее пространство мышечных клеток и представляет собой коллоидный раствор, содержащий белки, гликоген, жировые капли и другие включения. Белки саркоплазмы составляют 25-30% от всех белков мышц. Среди элементов саркоплазмы есть некоторые, заслуживающие особого внимания:
а)ферменты гликолиза, расщепляющие гликоген/глюкозу до пировиноградной или молочной кислоты;
б)фермент креатинкиназа, участвующий в запуске фосфогенной энергетической реакции;
в) белок миоглобин, идентичный по строении белку крови гемоглобину. Благодаря этому белку в мышечной ткани создается запас кислорода.
г) азотсодержащие небелковые вещества — АТФ, АДФ, АМФ, Крф, креатин, креатинин (продукт распада КрФ)
д) аминокислоты глутаминовая кислота и глутамин
е) углеводы. Гликоген — основной углевод мышечной ткани. В очень малой концентрации присутствует свободная глюкоза.В процессе мышечной работы в саркоплазме происходит накопление продуктов углеводного обмена — лактата и пирувата.
ж) жиры.Запасной жир накапливается в мышцах, тренируемых на выносливость.
Сарколемма Править
Сарколемма. Каждое мышечное волокно окружено клеточной оболочкой — сарколеммой. Это липопротеидная (состоящая из жиров и белков) мембрана толщиной около 10 нм.
ru.bodybuilding.wikia.com
2. Строение миофибрилл.
Сократительные элементы – миофибриллы – занимают большую часть объема миоцитов. В нетренированных мышцах миофибриллы расположены, рассеяно, а тренированных они сгруппированы в пучки, называемые
Микроскопическое изучение строения миофибрилл показало, что они имеют диаметр около 1 мкм и состоят из чередующихся светлых и темных участков или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую под микроскопом поперечную исчертанность всего мышечного волокна.
Использование электронного микроскопа с очень большим увеличением позволило расшифровать строение миофибрилл и установить причины наличия у них светлых и темных участков. Было обнаружено, что миофибриллы являются сложными структурами, построенными в свою очередь, из большого числа мышечных нитей дух типов – толстых и тонких. Толстые в два раза толще тонких, соответственно 15 и 7 нм.
Состоят миофибриллы из чередующихся пучков параллельно расположенных толстых и тонких нитей, которые концами заходят друг на друга.
Участок миофибриллы, состоящий из толстых нитей и находящимися между ними концов тонких нитей, обладает двойным лучепреломлением. Под микроскопом эти участки кажутся темными и получили название анизотропных или темных дисков (А-диски).
Тонкие участки состоят из тонких нитей и выглядят светлыми, так как не обладают двойным лучепреломлением и легко пропускают свет. Такие участки называются изотропными или светлыми дисками (I-диски).
Z Z Z
—— — —
—— — —
—— — —
I-диск А-диск
Рисунок. Схема строения миофибриллы
Диски А имеют в середине более светлую полосу – зону Н, пересекаемую более темной М – зоной.
Участок между соседними Z-линиями называется саркомер. Каждая миофибрилла состоит из нескольких сотен саркомеров (до 1000-1200).
саркомер
а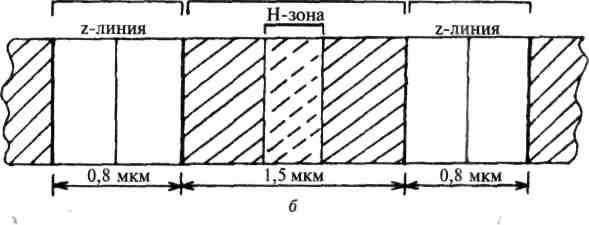
I-диск А-дискI-диск
Рисунок. Структура мышцы на разных уровнях организации: а – мышечное волокно;б – расположение миофибриллы в покоящейся мышце
Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплаз-матический ретикулум, составляющий 8—10% объема клетки; 3) несколько митохондрий. Длина саркомера обусловлена генетически и в ходе спортивной тренировки любой направленности не изменяется.
Диски I состоят только из тонких филаментов, а диски А – из филаментов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики (спайки) толщиной около 3 нм; расстояние между этими мостиками 40 нм.
Изучение химического состава миофибрилл показало, что тонкие и толстые нити образованы белками. Палочковидная молекула миозина состоит из двух идентичных основных цепей (по 200 кДа) и четырех легких цепей (по 20 кДа), общая масса миозина около 500 кДа.
Толстые нити (микрофиламенты) состоят из белка миозина. Эти белки образуют двойную спираль с глобулярной головкой на конце, присоединенной к очень длинному стержню. Стержень представляет собой двухцепочечную а-спирализованную суперспираль.
Миозиновые головки обладают АТФазной активностью, то есть способностью расщеплять АТФ. Второй участок миозина обеспечивает связь толстых нитей с тонкими. Общая структура миозина показана на рисунке.
хвост
Рисунок. Схематичное изображение молекулы миозина
Тонкие нити состоят из белков актина, тропонина и тропомиозина.
Основной белок в данном случае актин. Он обладает двумя важнейшими свойствами:
— образует фибриллярный актин, способный к быстрой полимеризации;
— актин способен соединяться с миозиновыми головками поперечными мостиками.
Актин – водорастворимый глобулярный белок с молекулярной массой 42 кДа; эта форма актина обозначается как G-актин. В мышечном волокне актин находится в полимеризованной форме, которая обозначается как F-актин. Тонкие филаменты мышцы образованы двунитчатыми актиновыми структурами, связанными между собой нековалентными связями.
Другие белки тонких нитей помогают актину осуществлять его функции.
Тропонин (Тн), молекулярная масса которого около 76 кДа. Он представляет собой сферическую молекулу, состоящую из трех разных субъединиц, получивших название в соответствии с выполняемыми функциями: тропомиозинсвязывающей (Тн-Т), ингибирующей (Тн-1) и кальцийсвязывающей (Тн-С). Каждый компонент тонких филаментов соединяется с двумя другими нековалентными связями:
F-актин — тропомиозин
Тн-1 Тн-Т
В мышце, где все рассмотренные компоненты собраны вместе в тонком филаменте (рис.), тропомиозин блокирует присоединение миозиновой головки к находящемуся рядом молекулами глобулярного актина тонких нитей (F-актину).
Молекулы миозина объединяются, образуя филаменты, состоящие примерно из 400 палочковидных молекул, связанных друг с другом таким образом, что пары головок миозиновых молекул ложатся на расстоянии 14,3 нм друг от друга; они располагаются по спирали (рис.). Миозиновые нити стыкуются «хвост к хвосту».
Рисунок. Упаковка миозиновых молекул при образовании толстого филамента
Миозин выполняет три биологически важные функции:
При физиологических значениях ионной силы и рН молекулы миозина спонтанно образуют волокно.
Миозин обладает каталитической активностью, т. е. является ферментом. В 1939 г. ВА Энгельгардт и М.Н. Любимова обнаружили, что миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения.
Миозин связывает полимеризованную форму актина — основного белкового компонента тонких миофибрилл. Именно это взаимодействие, как будет показано ниже, играет ключевую роль в мышечном сокращении.
studfiles.net
Строение миофибриллы
Миофибрилла состоит из одинаковых повторяющихся элементов — саркомеров.
Саркомер— функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т,Iи С. Диаметр тонких филаментов составляет около 6 нм.
В центре саркомера, между «тонкими» филаментами, располагаются «толстые» филаменты. «Толстые» филаменты имеют диаметр около 16нм, они образованы молекулами миозина. На поверхности «толстого» филамента с промежутками в 14 нм располагаются головки миозина, с помощью которых «толстые» филаменты взаимодействуют с актином «тонких» филаментов. В центре «толстых» филаментов на участке в 150 нм миозиновых головок нет.
Каждый «тонкий» филамент занимает симметричное положение между тремя толстыми филаментами, а каждый «толстый» филамент симметрично окружен шестью «тонкими» филаментами.

Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А(анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса Мпересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину 150 нм, в не заходят «тонкие» нити актина.
Светлый участок называется диск I(изотропная зона), он образован «тонкими» нитями актина. Размер дискаIуменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:

Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
studfiles.net
Миофибриллы
Миофибриллы
Поперечная исчерченность волокон скелетной и сердечной мышц обусловлена особым распределением в их цитоплазме многочисленных толстых и тонких «нитей» (филаментов), объединяющихся в цилиндрические пучки диаметром 1-2 мкм, — миофибриллов ( рис. 30.4 ). Мышечное волокно практически заполнено миофибриллами, они тянутся по всей его длине и на обоих его концах соединены с сухожилиями .
Миофибриллы — цилиндрические нити толщиной 1 — 2 мкм, идущие вдоль от одного конца мышечного волокна до другого. Изолированная миофибрилла способна сокращаться в присутствии АТФ , именно она и есть сократимый элемент мышечной клетки . Миофибриллы содержат сократительные- элементы — миофиламенты , среди которых различают толстые (миозиновые) , занимающие диск А, и тонкие (актиновые) , лежащие в диске I и прикрепляющиеся к телофрагмам, причем концы их проникают в диск А между толстыми филаментами.
Сократимые единицы миофибрил легко различимы в световом микроскопе, именно они обусловливают полосатость скелетных мышц . Каждая из таких единиц — саркомеров — имеет длину около 2,5 мкм. Границы саркомеров в соседних миофибриллах совпадают, поэтому вся мышечная клетка приобретает регулярную исчерченность. На продольном срезе мышцы при большом увеличении в пределах каждого саркомера видны чередующиеся светлые и темные полосы. Темные полосы называются А-дисками , светлые — I-дисками . Плотная линия в центре I-диска, отделяющая один саркомер от другого, называется Z-линией , или Z-диском . См. рис.1-6А миофибрилла сердечной мышцы
Каждый саркомер состоит из множества параллельных белковых филаментов (нитей). Существуют филаменты двух типов — толстые (длиной около 1,6 мкм м толщиной 15 нм), которые тянутся от одного края А-диска до другого, и тонкие (длиной около 1 мкм и толщиной 8 нм), которые идут от Z-линии через I-диск и заходят в А-диск в промежутки между толстыми филаментами. На участке А-диска, содержащем перекрывающиеся тонкие и толстые филаменты, толстые филаменты расположены в виде регулярной гексагональной системы, причем каждый толстый филамент окружен тонкими, тоже расположенными регулярно.
При мышечном сокращении каждый саркомер укорачивается пропорционально всей мышце. Например, если миофибрилла , состоящая из 20 тыс. саркомеров, укоротится с 5 до 4 см, (т.е. на 20%), то длина каждого саркомера уменьшится соответственно с 2,5 до 2 мкм.
При уменьшении длины саркомера сжимается только I-диск , тогда как плотный А-диск не изменяет своих размеров. Это легко объяснить, предположив, что сокращение миофибрилы происходит в результате скольжения толстых филаментов относительно тонких, причем длина тех и других остается неизменной. Эта модель скользящих нитей подтверждается экспериментальными данными. Электронно — микроскопические исследования показали, что укорочение мышцы не сопровождается изменением собственной длины филаментов. Судя по данным ренгеноструктурного анализа, характер упаковки субъединиц, образующих филаменты обоих типов, также не изменяется. Максимальная сила, развиваемая мышцей, изменяется пропорционально степени взаимного перекрывания толстых и тонких филаментов.
При помощи электронного микроскопа удалось увидеть на толстых филаментах множество боковых отростков, образующих поперечные мостики между толстыми филаментами и расположенными на расстоянии 13 нм от них тонкими филаментами. В настоящее время известно, что при сокращении мышцы толстые и тонкие нити перемещаются относительно друг друга именно с помощью этих поперечных мостиков, которые работают циклично. Взаимодействующие белки толстых и тонких филаментов были выделены и получили названия соответственно миозин и актин .
Кроме них, в миофибриллах имеется еще целый ряд вспомогательных белков. Предполагается, что белок альфа-актинин обеспечивает надлежащую упаковку филаментов в саркомере , а десмин связывает между собой соседние саркомеры.
См. « Скелетные мышцы: структура «.
Аденилосукцинатлиаза (4.3.2.2)
Ссылки:
Все ссылкиmedbiol.ru
Строение миофибрилл.
Миофибриллы состоят из упорядоченно расположенных нитей актина и миозина, представляющих собой сократительные белки. Для закрепления нитей актина и миозина служат особые структуры телофрагмы и мезофрагмы.
¨Телофрагма — это сеть белковых молекул,которые растянуты поперек клетки и прикреплены к цитолемме. На продольном срезе кардиомиоцита телофрагмы имеют вид линий толщиной около 100 нм, получившх название Z-линий. Участок миофибриллы, который располагается между двумя телофрагмами, носит название саркомера.
¨По середине саркомера располагается мезофрагма, представленная на продольном срезе в виде линии (М-линия). От мезофрагмы в направлении телофрагмы отходят нити миозина, а от телофрагмы навстречу им нити актина. Они встречаются и на некотором расстоянии идут параллельно, причем каждый миозиновый (толстый) филамент сопровождается 6-ю актиновыми (тонкими) миофиламентами,
Участок сакромера, занятый М-линией и прилежащими зонами, в которых располагаются только миозиновые нити, носит название Н-полосы (светлой зоны), а участок, в котором располагаются нити миозина и частично актина — А-полосы ( А-диска).
Участки двух соседних саркомеров, разделенные Z- линией, содержащие только нити актина, вместе образуют I-полосу (I-диск). Полосы называются так потому, что из-за различной молекулярной организации в области I-полосы преломление света изотропное, а в области А-полосы анизотропное.
Между миофибриллами локализованы митохондрии и агранулярная эндоплазматическая сеть. Митохондрии очень крупные, и образуют трехмерную сеть с очень плотным их расположением в области I-диска.
На уровне телофрагмы, цитолемма образует глубокие куполообразные впячивания, которые называются поперечными трубочками или Т-трубочками, в которые заходит и базальная мембрана. Эта система обеспечивает быстрое проведение потенциала действия к каждой миофибрилле, обеспечивая синхронность их сокращения. Канальцы агранулярной эндоплазматической сети в цитоплазме расположены между миофибриллами продольно и анастомозируют друг с другом, достигая Т-трубочек идут на некотором расстоянии параллельно с ними.
Разные концы кардиомиоцитов в области вставочных дисков оканчиваются на разных уровнях. Выступающая часть одного кардиомиоцита вдвинута в углубленную часть последующего. Поверхность контакта клеток образует пальцевидные соединения — интердигитации, и многочисленные десмосомы. В них вплетаются актиновые нити ближайшего саркомера миофибриллы. Боковые поверхности выступов тоже соприкасаются и объединяются многочисленными нексусами. При помощи интердигитаций и десмосом кардиомиоциты прочно связываются друг с другом, что обеспечивает развитие единого усилия при сокращении многих соседних клеток. При помощи нексусов осуществляются ионные и химические взаимодействия, что способствует синхронизации сокращения кардиомиоцитов.
Строение проводящих кардиомиоцитов.
Размеры — значительно крупнее рабочих (длина около 100мкм, толщина около 50мкм).
Цитоплазма содержит все органеллы общего назначения. Митохондрии мелкие и равномерно распределены в цитоплазме.
Миофибриллы немногочисленные и располагаются по периферии клетки.
Цитолемма не образует Т-систем. Проводящие кардиомиоциты соединяются в волокна не только концами, но и боковыми поверхностями. Между кардиомиоцитами формируются вставочные диски, но они более просто устроены, чем между сократительными. Интердигитации и десмосомы встречаются очень редко
Функции состоят в том, что они воспринимают управляющие сигналы от пейсмекерных элементов и передают информацию к сократительным кардиомиоцитам. Волокна, состоящие из проводящих кардиомиоцитов, ветвятся между рабочими сократительными кардиомиоцитами, доставляя им возбуждающий имульс.
Регенерация сердечной мышечной ткани невозможна вследствие того, что она не сохраняет ни стволовых клеток, ни клеток — предшественников.
studfiles.net
Изучение медицины : Мышечная ткань: СТРОЕНИЕ МИОФИБРИЛЛ
В цитоплазме имеется большое количество миофибрилл, обеспечивающих сокращение. Миофибриллы состоят из актиновых (тонких) и миозиновых (толстых) микрофибрилл.
Актиновая микрофибрилла (тонкая) представляет собой тонкую нить. Основу актиновой микрофибриллы составляет белок актин, который имеет фибриллярную структуру. На актине есть места для связывания миозина в поперечнополосатой мышечной ткани. К актину присоединены еще несколько белков, образующих тропонин-тропомиозиновый комплекс:
Тропомиозин — закрывает на молекуле актина места для связывания с миозином
Тропонин С — присоединяет ионы кальция;
После присоединения кальция сдвигает молекулу тропомиозина с ее первоначального расположения, что приводит к открытию на молекуле актина мест для связывания с миозином.
Тропонин Т и тропонин I — выполняют структурную функцию в гладкой мышечной ткани. Тропонин-тропомиозинового комплекса нет.
Актиновые микрофибриллы прикрепляются к цитоскелету клетки в области Z-линий с помощью специальных белков, таких как альфа-актинин, виментин, десмин миозиновая. Микрофибрилла (толстая) представляет собой толстую нить, построена из молекул миозина, имеется множество типов миозина с разной скоростью расщепления АТФ, что обуславливает отличия в скорости сокращения разных мышечных волокон молекула миозина.Похожа на клюшку для игры в гольф (или уж на худой конец — в хоккей), в ней различают головку (это та часть клюшки, которая ударяет по мячу или шайбе) и (рукоятка клюшки). Миозиновая микрофибрилла представляет собой пучек таких клюшек, связанных за рукоятки, причем часть головок смотрит в одну сторону, а часть — в другую (передне-заднее направление).
Участки миозиновых микрофибрилл, где находятся головки, вставлены между актиновыми микрофибриллами. Миозиновые микрофибриллы прикрепляются к цитоскелету клетки в области линии М (середина полоски Н). Головка миозина может:
1)поворачиваться,
2)прикрепляться к актину,
3)расщеплять АТФ, то есть является АТФ-азой
Головка миозина может присоединяться к актину только тогда, когда она содержит АДФ и Фосфат (продукты распада АТФ). Головка миозина, соединенная с актином, может совершать гребковое движение только в момент, когда от нее отсоединяются АДФ и Фосфат.
Головка миозина может отсоединиться от актина только тогда, когда она присоединяет к себе молекулу АТФ в гладкой мышечной ткани. Головка миозина имеет легкие цепи, которые должны сначала фосфорилироваться, для того чтобы она смогла расщеплять и присоединять АТФ и взаимодействовать с актином миофибриллы.
Строго ориентированы вдоль волокна актиновые и миозиновые микрофибриллы располагаются параллельно друг другу. Благодаря строгой ориентации миофибрилл, мышечное волокно и кардиомиоциты имеют поперечную исчерченность.
Поперечная исчерченность — это чередование светлых и темных полос или дисков на протяжении миофибрилл.
Миофибрилла устроена так, что по ее длине имеются участки актиновых микрофибрилл, между которыми располагаются участки миозионвых микрофибрилл, и миозиновые микрофибриллы на небольшое расстояние проникают в пространства между актиновыми; так, что на концах актиновых и миозиновых участков имеются области, где есть и актиновые, и миозиновые микрофибриллы. Одним концом актиновые микрофибриллы прикрепляются к цитоскелету, это место называется Z-линией, в своей середине миозиновые микрофибриллы скрепляются с цитоскелетом, это место называется М-линией. Различают следующие виды дисков, полосок и линий на миофибриллах:
I-диск (изотропный) — светлый диск, в пределах которого располагаются только актиновые микрофибриллы
А-диск (анизотропный) — темный диск, в области которого располагаются актиновые
и миозиновые микрофибриллы
Н-нолоска — светлая полоса, располагающаяся в середине А-диска, здесь имеются
только миозиновые микрофибриллы
М-линия — находится в середине Н-полоски, здесь прикрепляются миозиновые
микрофибриллы
Z-линия — находится в середине I-диска, здесь прикрепляются актиновые
микрофибриллы с помощью белков альфа-актинина, виментина и десмина
Саркомер — это участок мышечного волокна между двумя соседними Z-линиями,
структурно-функциональная единица поперечнополосатой мышечной ткани в гладкомышечных клетках миофибриллы расположены
беспорядочно, актиновые микрофибриллы одним своим концом прикрепляются к
специальным областям внутренней поверхности цитомембраны, а другим — к миозину,
миозиновые микрофибриллы прикрепляются к специальным местам в цитозоле клетки
profmed.blogspot.com
