Классификация протеиногенных аминокислот
Все протеиногенные аминокислоты имеют два названия: научное и традиционное. Научные названия аминокислот построены в соответствии с правилами, разработанными Международным союзом чистой и прикладной химии (International Union Pure and Applied Chemie — IUPAC). Согласно научной номенклатуре ИЮПАК название соединения однозначно отражает его структуру. На практике пользуются традиционными наименованиями аминокислот, происхождение которых исторически связано с названием объекта, в котором они впервые были обнаружены, или какими-либо их особыми свойствами. Используют также сокращенные трехбуквенные обозначения традиционных названий аминокислот.
Протеиногенные аминокислоты удобно классифицировать в зависимости от характера их боковых радикалов.
Простейшие аминокислоты
1. Глицин, или гликокол (аминоуксусная кислота). Сокращенное обозначение — гли.
H2N-CH2-COOH
Глицин был открыт в 1820 г. А. Браконно среди продуктов гидролиза желатина. Это простейшая протеиногенная аминокислота, не имеющая оптических изомеров. Свое название гликокол (греч. «гликис» — сладкий + «колла» — клей), или глицин, аминоуксусная кислота получила за сладкий вкус.
2. Аланин (α-аминопропионовая кислота). Сокращенное обозначение — ала.
NH2-СH(СН3)-СООН
В составе белка аланин впервые обнаружил Т. Вейл в 1888 г. при изучении продуктов гидролиза фиброина шелка.
Гидроксиаминокислоты
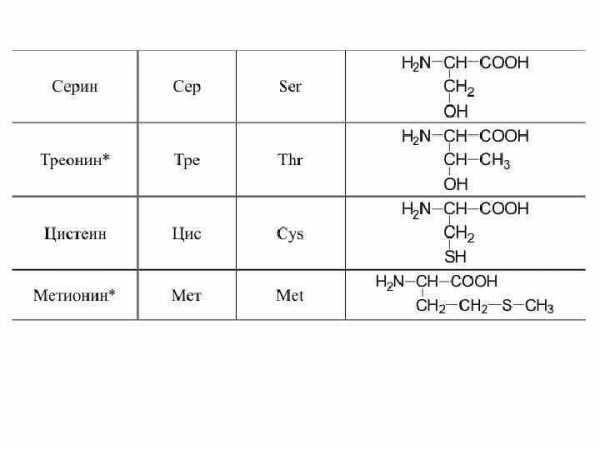
3. Серин (2-амино-3-гидроксипропионовая кислота). Сокращенное обозначение — сер.
HO2C-CH(Nh3)CH2OH
Серин (греч. «серикон» — шелк) был впервые выделен Э. Кремером из серицина шелка в 1865 г.
4. Треонин (α-амино-β-гидроксимасляная кислота). Сокращенное обозначение — тре.
Треонин впервые получили Д. Зелинский и В. Садиков в 1921 г. из кератина гусиного пера. Молекула треонина содержит два асимметрических атома углерода. Поэтому для него возможно существование четырех оптических изомеров.
Серосодержащие аминокислоты
5. Цистеин (α-амино-β-тиопропионовая кислота). Сокращенное обозначение — цис.
HO2CCH(NH2)CH2SH
Благодаря наличию сульфгидрильной группы, цистеин может легко превращаться в аминокислоту цистин (β, β-ди-тиобис-(α-аминопропионовая кислота)), не входящую в число 20 протеиногенных.
Цистин содержит дисульфидную группу -S-S-. Чтобы показать в упрощенном виде участие сульфгидрильных групп в процессе образования цистина.
Реакция превращения цистеина (восстановленная форма) в цистин (окисленная форма) — один из примеров реакций биологического окисления, чрезвычайно широко распространенных в живой природе.
Цистин (греч. «кистис» — пузырь) первым выделил В. Волластон в 1810 г. из камней мочевого пузыря. В 1901 г. Г. Эмбден впервые выделил из яичного белка цистеин.
6. Метионин (α-амино-γ-метилтиомасляная кислота). Сокращенное обозначение — мет.
HO
Метионин был впервые обнаружен в 1922 г. Ю. Мюллером в казеине молока.
Аминокислоты с разветвленным углеводородным радикалом
7. Валин (α-аминоизовалериановая кислота). Сокращенное обозначение — вал.
HO2CCH(NH2)CH(CH3)2
Валин в составе белка был впервые найден П. Шютценбергером в 1879 г. при исследовании продуктов гидролиза альбумина.
8. Лейцин (α-аминоизокапроновая кислота). Сокращенное обозначение — лей.
HO2CCH(NH2)CH2CH(CH3)2
Лейцин был открыт в 1820 г. А. Браконно как один из продуктов гидролиза белков шерсти и мышц. Лейцином (греч. «лейкос» — белый) богат яичный белок.
9. Изолейцин (α-амино-β-метилвалериановая кислота). Сокращенное обозначение — иле.
HO2CCH(NH2)CH(CH3)CH2CH3
Изолейцин обнаружил Ф. Эрлих в 1904 г. сначала в продуктах гидролиза фибрина крови, а позднее и в других белках. У изолейцина два асимметрических атома углерода и, следовательно, четыре оптических изомера.
Аминокислоты, содержащие ароматическое ядро
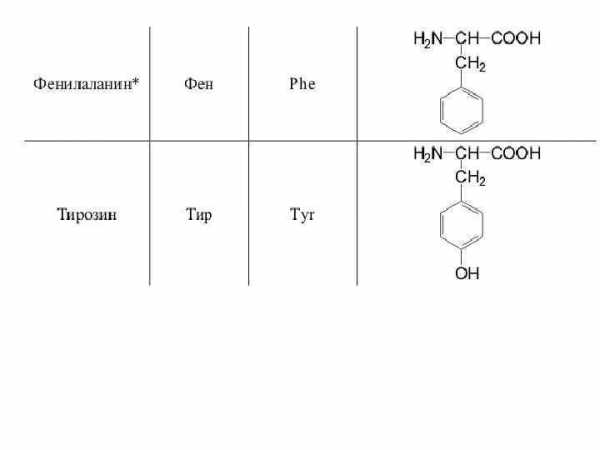
10. Фенилаланин (α-амино-β-фенилпропионовая кислота). Сокращенное обозначение — фен.
C9H11NO2
Фенилаланин был впервые выделен из продуктов гидролиза растительных белков в 1881 г. Э. Шульце и Ю. Барбьери.
11. Тирозин (α-амино-β-(п-гидроксифенил)пропионовая кислота). Сокращенное обозначение — тир.
C9H11NO3
Тирозин (греч. «тирос» — сыр) впервые получен в 1846 г. Ю. Либихом из казеина молока.
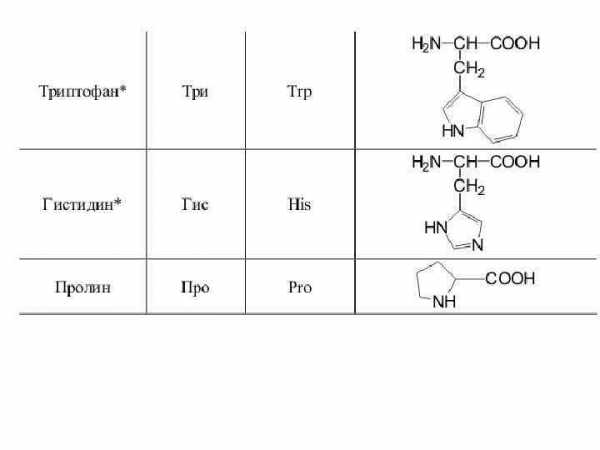
12. Триптофан (α-амино-β-(β-индолил)-пропионовая кислота). Сокращенное обозначение — три.
C11H12N2O2
В состав радикала триптофана входит гетероцикл индол. Поэтому триптофан — гетероциклическая аминокислота. Ее первыми выделили из казеина молока в 1901 г. Ф. Гопкинс и С. Кол.
13. Пролин (пирролидин-α-карбоновая кислота). Сокращенное обозначение — про.
C5H9NO2
Пролин представляет собой гетероциклическое соединение — производное пирролидина. Он является иминокислотой, так как содержит не аминную (-NH2), а иминную (-NH) группу. При взаимодействии с нингидрином пролин образует соединение желтого цвета. Пролин открыт Э. Фишером в 1901 г. при изучении продуктов гидролиза казеина молока.
Рассмотренные аминокислоты не содержат в боковых радикалах ионогенных групп, поэтому суммарный заряд их молекул в водном растворе равен нулю.
Основные аминокислоты за счет ионизации присутствующих в их боковых радикалах основных группировок обладают в водном растворе суммарным положительным зарядом.
14. Гистидин (α-амино-β-имидазолилпропионовая кислота). Сокращенное обозначение — гис.
C6H9N 3O2
В состав бокового радикала гистидина входит гетероцикл — имидазол. Наряду с триптофаном и пролином, гистидин также является гетероциклическим соединением. Азот имидазола сообщает гетероцикл) основные свойства.
Гистидин (греч. «гистос» — ткань) был впервые выделен А. Косселем из стурина — белка спермы осетра в 1896 г. и независимо от него С. Хединым из казеина молока.
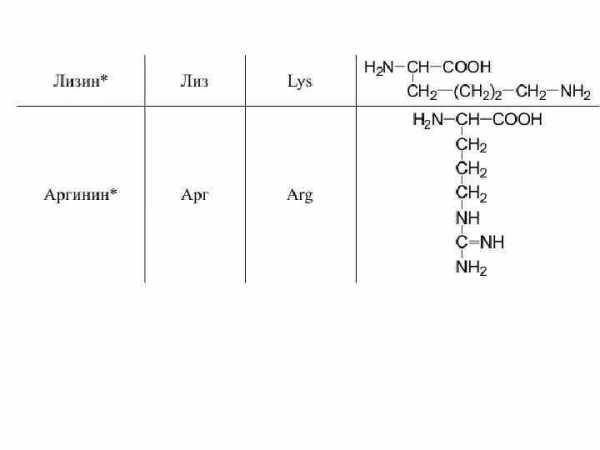
15. Лизин (2,6-диаминогексановая кислота). Сокращенное обозначение — лиз.
HO2CCH(NH2)(CH2)4NH2
Радикал лизина, содержащий аминогруппу, проявляет свойства основания при ее ионизации.
Лизин (греч. «лизис» — растворение) получил свое название из-за очень хорошей растворимости в воде. Впервые выделен из казеина молока Э. Дрекселем в 1889 г.
16. Аргинин (α-амино-δ-гуанидинвалериановая кислота). Сокращенное обозначение — арг.
(NH-C(NH2)NH(CH2)3CH(NH
Основные свойства аргинина обусловлены наличием в его радикале гуанидиновой группировки, способной присоединять ион водорода.
Аргинин (лат. «argentum» — серебро) впервые получен С. Хединым в 1895 г. из продуктов гидролиза кератина рога в виде азотносеребряной соли.
Кислые аминокислоты
Кислые аминокислоты в водном растворе обладают суммарным отрицательным зарядом за счет диссоциации карбоксильных групп боковых радикалов.
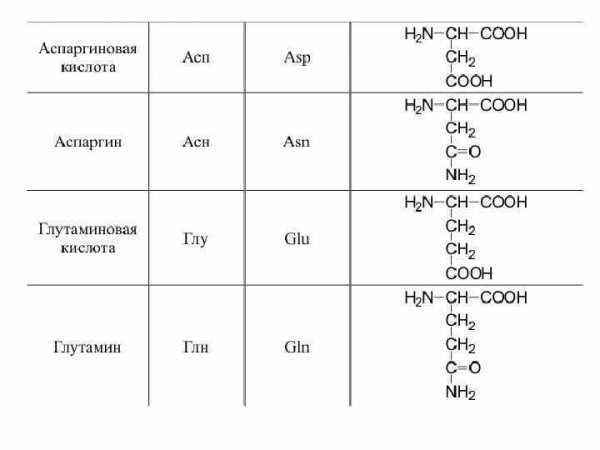
17. Аспарагиновая кислота (аминоянтарная кислота). Сокращенное обозначение — асп.
HO2CCH(NH2)CH2CO2H
Аспарагиновую кислоту первым выделил из растительного белка Г. Риттхаузен в 1868 г.
18. Глутаминовая кислота (α-аминоглутаровая кислота). Сокращенное обозначение — глу.
C5H9NO4
Глутаминовая кислота (лат. «gluten» — клей) была впервые выделена Г. Риттхаузеном в 1866 г. из продуктов гидролиза клейковинных белков зерна пшеницы.
Амиды кислых аминокислот
В белках присутствуют амиды кислых аминокислот (в карбоксильной группе их бокового радикала гидроксильная группа замещена на аминогруппу). Амидные группировки в обычных условиях не диссоциируют. Суммарный заряд молекул амидов кислых аминокислот в водном растворе равен нулю.
19. Аспарагин (β-амид аминоянтарной кислоты). Сокращенное обозначение — асн.
HOOC-CH(NH2)-CH2-CONH2
Аспарагин впервые обнаружили Л. Вокелен и П. Робике в соке спаржи (аспарагуса) в 1806 г., что и отражено в его названии. Наличие аспарагина в белках доказал М. Дамодаран и др. в 1932 г., выделив его из эдестина конопли.
20. Глутамин (γ-амид α-аминоглутаровой кислоты). Сокращенное обозначение — глн.
O=C(NH2)-CH2-CH2-CH(NH2)-COOH
Наличие глутамина в белках доказал М. Дамодаран и др. в J 932 г., выделив его из эдестина.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите
www.activestudy.info
Амиды Аминокислоты — Справочник химика 21
В природе встречаются также два амида аминокислот [c.650]Ионы металлов можно рассматривать как кислоты Льюиса. Они способны катализировать многие из реакций, катализируемых кислотами Бренстеда. Несколько лет тому назад Педерсен [34] открыл, что ионы двухвалентной меди в небольших концентрациях сильно катализируют реакцию бромирования ацетоуксусного эфира. В настояш,ее время известно, что некоторые кетокислоты легко декарбоксилируются в присутствии различных ионов металлов [35, 36], особенно ионов железа, меди и никеля, и что сложные эфиры и амиды аминокислот могут гидролизоваться в присутствии ионов двухвалентной меди со значительно большей скоростью, чем при наличии ионов водорода той же концентрации [37]. Во всех этих примерах для субстрата существенна его способность образовывать комплекс с ионом металла, хотя и не в очень сильной степени. Комплексообразование обычно протекает по карбонильному или карбоксильному кислороду аналогично способу присоединения иона водорода при кислотно-каталитической энолизации кетонов (стр. 66 , в реакциях энолизации основание затем отрывает другой протон, и, по-видимому, разумно, что образование комплекса с участием положительного иона дает тот же эффект. Таким образом, катализ реакции бромирования ацетоуксусного эфира можно описать [33] как образование промежуточного комплексного соединения V, реагирующего с основанием В [c.71]
Некоторые А. о. к. (напр., диметилформамид) применяют в качестве растворителей для многих неорганических и органических соединений, полимеров. А. о. к. используют при синтезе сульфамидных лекарственных препаратов, полимеров. Полипептиды и белки представляют собой амиды аминокислот, сульфамиды —амиды сульфокислот R—SO2Nh3.
ХИМОТРИПСИН, фермент класса гидролаз, относится к эндопептидазам. Мол. масса бычьего X. 25 300, р1 9, оптим. каталитич. активность при pH 7,5—8,0, состоит из трех цепей, связанных дисульфидными мостиками. По типу каталитяч. центра относится к группе серин-гистидиновых гидролаз. Образуется в поджелудочной железе позвоночных из предшественника (химотрипсиногена) последоват. отщеплением двух дипептидов в середине цепи. Катализирует гидролиз белков, пептидов, эфиров и амидов аминокислот проявляет специфичность к гидрофобным аминокислотам, участвует в расщеплении белков пищи в тонком кишечнике. Ингибируется ионами тяжелых металлов, борорг. к-тами, диизопропилфторфосфатом и др. Избирательно гидролизует белки пораженных тканей. Использ. для лечения тромбозов, ожогов. [c.654]
Содержание белка в цереброспинальной жидкости незначительно (0,15— 0,40 г/л), причем отношение альбумины/глобулины равно 4 липидов в сотни раз меньше, чем в плазме крови. Возможно, что липиды плазмы крови в цереброспинальной жидкости отсутствуют. Общее содержание низкомолекулярных азотсодержащих веществ, особенно аминокислот, в 2—2,5 раза меньше, чем в крови. В ткани мозга, как отмечалось, количество свободных аминокислот велико и во много раз превышает концентрацию их в крови и тем более в цереброспинальной жидкости. Установлено, что некоторые аминокислоты (например, глутаминовая кислота) почти не проникают через гематоэнцефалический барьер. В то же время амиды аминокислот (в частности, глутамин) легко преодолевают этот барьер. Содержание глюкозы в цереброспинальной жидкости относительно велико (2,50—4,16 ммоль/л), но несколько меньше, чем в крови, причем концентрация глюкозы в спинномозговой жидкости может повышаться или снижаться в зависимости от изменений содержания глюкозы в крови. [c.644]
По разности между количеством общего и белкового азота находят содержание азота в небелковых веществах. При значительном содержании небелковых азотистых веществ прибегают к отдельным определениям азота, находящегося в форме амидов, аминокислот, азотистых оснований и т. д. [c.412]
ЛАКТАМЫ (от лат, la , род. падеж la tis-молоко), внутренние амиды аминокислот, содержащие в цикле группировку [c.572]
Первоначально при синтезе амидов аминокислот свободную карбоксильную группу активировали для реакции с амином. Для этого группу —С(0)—ОН превращали обычно в группу —С(0)—О—С(0)0С2Нб действием этилхлорформиата [c.394]
Последующий рост полимерной цепи осуществляется аналогичным образом, но с участием аминогруппы амида аминокислоты [c.113]
ЛАКТАМЫ, внутренние амиды аминокислот содержат в цикле группировку —СО—NR— (R — Н или орг. радикал). В зависимости от числа атомов в цикле различают а-Л. [c.295]
Полинг и Кори в 1951 г. показали с помощью рентгеноструктурного анализа аминокислот, амидов аминокислот и простых линейных пептидов, что пептидная связь С—N укорочена по сравнению с нормальной простой связью (рис. 2-1). [c.83]
Лактамы являются внутренними (циклическими) амидами аминокислот их называют по соответствующей карбоновой кислоте С5 — валеролактам, Сб — капролактам, С — энантолактам и т.д. [c.547]
Названия амидов аминокислот, тривиальные названия которых оканчиваются на -ин, образуют, прибавляя к названию кислоты окончание -амид или -диамид. [c.272]
Лактамы — внутренние амиды аминокислот, в которых амидная связь является частью циклической структуры [c.176]
Органические ингибиторы имеют низкую себестоимость и обладают повышенной защитной способностью. Основными органическими соединениями, применяемыми в качестве ингибиторов, являются амины, амиды, аминокислоты, альдегиды, кетоны, спирты с двойными или тройными связями. Молекулы этих органических веществ содержат атом азота, серы, мышьяка или фосфора, являющийся активным центром, и с его помощью адсорбируются на поверхности металла, образуя защитную пленку. [c.330]
ТРИПСЙН, фермент класса гидролаз, катализирующий гидролиз в белках пептидных связей, образованных остатками основных аминокислот-аргинина и лизина катализирует также гидролиз сложных эфиров и амидов аминокислот (в т. ч. гидрофобных) и нек-рых карбоновых к-т. [c.639]
Подобно аминолизу протекает и аммонолиз полимеров под действием аммиака, выделяющегося в процессе поликонденсации (напр., при синтезе полиамидов из амидов аминокислот). [c.199]
Наиб, обширную группу составляют К., содержащие в активном центре цистеин (тиоловые амидгидролазы). В эту группу входят К. В и С (дипептидилпептидаза), Н, L, N и S. Они имеют мол. м. от 25 тыс. до 35 тыс. нек-рые из них гликопротеины. Оптим. каталитич. активность К. В, С, Н и L при pH 4,0-6,0, К. N и S при pH 3,5. К. этой груш1ы катализируют наряду с гидролизом пептидов гидролиз амидов аминокислот. К. С обладает также сильно выраженной транспептидазной активностью-катализирует перенос олигопептидов на пептиды или аминокислоты. [c.352]
С. стабильны при pH 5,3-6,5, автолизуются при pH > 8, быстро теряют активность при pH макс. скоростью при pH 7-8, С. arlsberg-при pH IO-II. Оба фермента катализируют гидролиз сложных эфиров и амидов аминокислот с макс. скоростью при pH ок. [c.451]
Окислы, гидроокиси Mg, Са, Зг, Ва, их ацетаты, формиаты, карбонаты, оксапаты, бораты, фосфаты, сульфаты, нитраты Первичвые, вторичные и третичные амины, их соли амиды аминокислоты фосфины Тиоэфиры, тиодиуксус-ная кислота Амины [c.37]
Лммоиолнз обычно происходит в полимерах, при синте 1е которых выделяется аммиак, напрнмер в полиамидах, синтезируемых из амидов аминокислот. [c.196]
Синтез оптически активных комплексонов на основе этилендиамина основан на восстановлении соответствующих амидов аминокислот НМгК СНС (О)МНК до аминов с последующей обработкой монобромуксусной кислотой [20] (схема 1.1.13). [c.25]
Метнл-нли метокснзамещенные дифенилметильные группы вводятся реакцией N-защищенных амидов аминокислот с соответствующим карбинолом в присутствии кислот [148] [c.122]
При взаимодействии аминокислот или некоторых их производных с аммиаком образуются амиды аминокислот. Аналогично можно представить себе образование амидной связи между двумя аминокислотами [c.799]
Примечание. Гипобромит натрия не реагирует с а-аминной группой и амидами аминокислот. [c.381]
Ускорение реакций нуклеофильного замещения у ацильной группы благодаря участию соседней гидроксильной группы имеет большое значение с биохимической точки зрения в химии аминоацил-РНК. Эфиры этого класса являются промежуточными соединениями при синтезе белка [284, 285]. Высокая свободная энергия гидролиза эфиров аминокислот растворимой РНК при нейтральных значениях pH [286—288] свойственна ьсем эфирам аминокислот и обусловлена существенными изменениями констант диссоциации образующихся аминокислот по сравнению с их эфирами [289]. Также могут быть рассмотрены амиды аминокислот [290]. [c.170]
Мардашев С. Р. Энзиматическое декарбоксилирование аминокислот.Успехи современной биологии, 1949, т. XXVIII, стр. 365 Амиды аминокислот, их обмен и физиологическая роль в животном организме. Успехи современной биологии, 1955, т. 40, стр. 8. [c.377]
chem21.info
Амид — аминокислота — Большая Энциклопедия Нефти и Газа, статья, страница 2
Амид — аминокислота
Cтраница 2
Путем сравнения с зависимостью от рН стадии, характеризующейся величиной &2, мы показали, что гидролиз соединения аиил-фермент является стадией, лимитирующей скорость в ферментативном гидролизе обычных субстратов — амидов аминокислот. В случае химотрипсина этиловый эфир ацетил — Ь — фенил-аланина гидролизуется в 1000 раз быстрее, чем соответствующий амид, а в случае трипсина этиловый эфир бензоил — Ь — аргинина гидролизуется в 300 раз быстрее, чем соответствующий амид. [16]
Карбоксильные производные аминокислот и пептидов также способны вступать в поликонденсацию. Метиловые и этиловые эфиры, а также амиды аминокислот и пептидов малоактивны и обычно образуют при нагревании термодинамически более устойчивые циклич. Выход димеров снижается при использовании активированных эфиров аминокислот и особенно трипептидов, а также при повышении концентрации р-ра вещества, вступающего в поликондеисацию. В качестве активированных эфиров аминокислот и пептидов для поликонденсации наиболее широко используют ге-нитрофенило-вые и галогензамещенные фениловые эфиры. По своей реакционной способности они располагаются в след. Для поликонденсации пригодны также тиофениловые, нитротиофениловые, N-оксисукцинимидные и др. активированные эфиры аминокислот и пептидов. [17]
Карбоксильные производные аминокислот и пептидов также способны вступать в поликонденсацию. Метиловые и этиловые эфиры, а также амиды аминокислот и пептидов малоактивны и обычно образуют при нагревании термодинамически более устойчивые циклич. Выход димеров снижается при использовании активированных эфиров аминокислот и особенно трипептидов, а также при повышении концентрации р-ра вещества, вступающего в поликонденсацию. В качестве активированных эфиров аминокислот и пептидов для поликонденсации наиболее широко используют га-нитрофенило-вые и галогензамещенные фениловые эфиры. По своей реакционной способности они располагаются в след, ряду: пентахлорфениловый2 4 5-трихлорфениловый 2 4 6-трихлорфениловый 2 4-дихлорфениловый 2 4 6-трибромфениловыйфениловый. Для поликонденсации пригодны также тиофениловые, нитротиофениловые, N-оксисукцинимидные и др. активированные эфиры аминокислот и пептидов. [18]
ВРН катализирует гидролиз белков и пептидов с макс, скоростью при рН 7 — 8, С. Оба фермента катализируют гидролиз сложных эфиров и амидов аминокислот с макс, скоростью при рН ок. [19]
Принципиально иная схема строения мочевино-формальдегидных смол была предложена Марвелем. Согласно его взглядам, мочевина ведет себя в этом процессе как амид аминокислоты. [20]
Лечебный эффект, например, L-аспарагиназы и Ь — глутамин ( аспа-рагин) азы при лейкозах, вероятнее всего, объясняется необратимым распадом как глутамина, так и аспарагина. Оказалось, что опухолевые клетки для своего роста и размножения нуждаются в аминокислотах из организма, поскольку сами лишены способности синтезировать амиды аминокислот, в то время как нормальные клетки наделены этой способностью. В частности, амидный азот глутамина оказался абсолютно необходимым и не заменимым другими аминокислотами источником атома азота минимум в 10 реакциях синтеза, например, пуриновых и пиримидиновых нуклеотидов, соответственно ДНК и РНК, АТФ, ге-ксозаминов, гистидина и др. Таким образом, не лишена основания гипотеза, что любой фермент или агент, катализирующий необратимое расщепление незаменимого для опухолевой клетки пищевого фактора ( включая аминокислоты), может в принципе быть применен в энзимотерапии опухолей, если будут устранены ограничения, связанные с белковой природой фермента. В оценке эффективности ферментов в экспериментальной и клинической онкологии имеется немало противоречий и очень много пробелов. Положительные результаты, отмеченные в ряде случаев, вселяют надежду, что приготовление стандартных ферментных препаратов ( включая создание иммобилизованных форм) в промышленных масштабах и их разумное применение в клинике, организованное на строгой научной основе, несомненно дадут в руки врачей еще одно ценное оружие в борьбе с опухолевыми заболеваниями человека. [21]
Количество получающегося амида прямо пропорционально температуре и времени контакта; такое же влияние на количество получающегося амида оказывает избыток основания. В водной среде при прочих равных условиях преимущественно образуется амипоэфпр, если же реакцию проводят в спиртовом растворе, то основным продуктом является амид аминокислоты. [22]
ХИМОТРИПСИН, фермент класса гидролаз, относится к эндопептидазам. Образуется в поджелудочной железе позвоночных из предшественника ( химотрипсиногена) последоват. Катализирует гидролиз белков, пептидов, эфиров и амидов аминокислот; проявляет специфичность к гидрофобным аминокислотам, участвует в расщеплении белков пищи в тонком кишечнике. Ингибируется ионами тяжелых металлов, борорг. Избирательно гидроли-зует белки пораженных тканей. [23]
Структуры смешанных биополимеров чрезвычайно сложны, а их подробное изучение в сущности лишь только начинается. В отличие от полисахаридов систематически описать и классифицировать типы структур смешанных биополимеров весьма затруднительно прежде всего из-за ограниченного количества надежно и полно расшифрованных структур. Укажем лишь, что связь олиго-или полисахаридной компоненты с пептидной, белковой или липидной осуществляется обычно при помощи гли-козидной связи: либо по гидроксильным группам ( например, в остатках оксиаминокислот пептидной цепи), либо по амидной группе амидов двухосновных аминокислот. Возможна также фосфодизфирная связь, подобная той, которая лежит в основе строения нуклеиновых кислот. [24]
Амидирование карбоксильной группы аминокислот было затем усовершенствовано благодаря двум методам синтеза. БОК) производное, а группу БОК можно легко снять при помощи реакции со смесью соляной и уксусной кислот. Именно поэтому для защиты аминогрупп лучше применять ягре / п-бутоксикарбокса-зид, а не карбобензоксихлорид. Ниже представлены реакции синтеза амида аминокислоты, в которых используются эти реагенты. [25]
Страницы: 1 2
www.ngpedia.ru
Амид — аминокислота — Большая Энциклопедия Нефти и Газа, статья, страница 2
Амид — аминокислота
Cтраница 2
Путем сравнения с зависимостью от рН стадии, характеризующейся величиной &2, мы показали, что гидролиз соединения аиил-фермент является стадией, лимитирующей скорость в ферментативном гидролизе обычных субстратов — амидов аминокислот. В случае химотрипсина этиловый эфир ацетил — Ь — фенил-аланина гидролизуется в 1000 раз быстрее, чем соответствующий амид, а в случае трипсина этиловый эфир бензоил — Ь — аргинина гидролизуется в 300 раз быстрее, чем соответствующий амид. [16]
Карбоксильные производные аминокислот и пептидов также способны вступать в поликонденсацию. Метиловые и этиловые эфиры, а также амиды аминокислот и пептидов малоактивны и обычно образуют при нагревании термодинамически более устойчивые циклич. Выход димеров снижается при использовании активированных эфиров аминокислот и особенно трипептидов, а также при повышении концентрации р-ра вещества, вступающего в поликондеисацию. В качестве активированных эфиров аминокислот и пептидов для поликонденсации наиболее широко используют ге-нитрофенило-вые и галогензамещенные фениловые эфиры. По своей реакционной способности они располагаются в след. Для поликонденсации пригодны также тиофениловые, нитротиофениловые, N-оксисукцинимидные и др. активированные эфиры аминокислот и пептидов. [17]
Карбоксильные производные аминокислот и пептидов также способны вступать в поликонденсацию. Метиловые и этиловые эфиры, а также амиды аминокислот и пептидов малоактивны и обычно образуют при нагревании термодинамически более устойчивые циклич. Выход димеров снижается при использовании активированных эфиров аминокислот и особенно трипептидов, а также при повышении концентрации р-ра вещества, вступающего в поликонденсацию. В качестве активированных эфиров аминокислот и пептидов для поликонденсации наиболее широко используют га-нитрофенило-вые и галогензамещенные фениловые эфиры. По своей реакционной способности они располагаются в след, ряду: пентахлорфениловый2 4 5-трихлорфениловый 2 4 6-трихлорфениловый 2 4-дихлорфениловый 2 4 6-трибромфениловыйфениловый. Для поликонденсации пригодны также тиофениловые, нитротиофениловые, N-оксисукцинимидные и др. активированные эфиры аминокислот и пептидов. [18]
ВРН катализирует гидролиз белков и пептидов с макс, скоростью при рН 7 — 8, С. Оба фермента катализируют гидролиз сложных эфиров и амидов аминокислот с макс, скоростью при рН ок. [19]
Принципиально иная схема строения мочевино-формальдегидных смол была предложена Марвелем. Согласно его взглядам, мочевина ведет себя в этом процессе как амид аминокислоты. [20]
Лечебный эффект, например, L-аспарагиназы и Ь — глутамин ( аспа-рагин) азы при лейкозах, вероятнее всего, объясняется необратимым распадом как глутамина, так и аспарагина. Оказалось, что опухолевые клетки для своего роста и размножения нуждаются в аминокислотах из организма, поскольку сами лишены способности синтезировать амиды аминокислот, в то время как нормальные клетки наделены этой способностью. В частности, амидный азот глутамина оказался абсолютно необходимым и не заменимым другими аминокислотами источником атома азота минимум в 10 реакциях синтеза, например, пуриновых и пиримидиновых нуклеотидов, соответственно ДНК и РНК, АТФ, ге-ксозаминов, гистидина и др. Таким образом, не лишена основания гипотеза, что любой фермент или агент, катализирующий необратимое расщепление незаменимого для опухолевой клетки пищевого фактора ( включая аминокислоты), может в принципе быть применен в энзимотерапии опухолей, если будут устранены ограничения, связанные с белковой природой фермента. В оценке эффективности ферментов в экспериментальной и клинической онкологии имеется немало противоречий и очень много пробелов. Положительные результаты, отмеченные в ряде случаев, вселяют надежду, что приготовление стандартных ферментных препаратов ( включая создание иммобилизованных форм) в промышленных масштабах и их разумное применение в клинике, организованное на строгой научной основе, несомненно дадут в руки врачей еще одно ценное оружие в борьбе с опухолевыми заболеваниями человека. [21]
Количество получающегося амида прямо пропорционально температуре и времени контакта; такое же влияние на количество получающегося амида оказывает избыток основания. В водной среде при прочих равных условиях преимущественно образуется амипоэфпр, если же реакцию проводят в спиртовом растворе, то основным продуктом является амид аминокислоты. [22]
ХИМОТРИПСИН, фермент класса гидролаз, относится к эндопептидазам. Образуется в поджелудочной железе позвоночных из предшественника ( химотрипсиногена) последоват. Катализирует гидролиз белков, пептидов, эфиров и амидов аминокислот; проявляет специфичность к гидрофобным аминокислотам, участвует в расщеплении белков пищи в тонком кишечнике. Ингибируется ионами тяжелых металлов, борорг. Избирательно гидроли-зует белки пораженных тканей. [23]
Структуры смешанных биополимеров чрезвычайно сложны, а их подробное изучение в сущности лишь только начинается. В отличие от полисахаридов систематически описать и классифицировать типы структур смешанных биополимеров весьма затруднительно прежде всего из-за ограниченного количества надежно и полно расшифрованных структур. Укажем лишь, что связь олиго-или полисахаридной компоненты с пептидной, белковой или липидной осуществляется обычно при помощи гли-козидной связи: либо по гидроксильным группам ( например, в остатках оксиаминокислот пептидной цепи), либо по амидной группе амидов двухосновных аминокислот. Возможна также фосфодизфирная связь, подобная той, которая лежит в основе строения нуклеиновых кислот. [24]
Амидирование карбоксильной группы аминокислот было затем усовершенствовано благодаря двум методам синтеза. БОК) производное, а группу БОК можно легко снять при помощи реакции со смесью соляной и уксусной кислот. Именно поэтому для защиты аминогрупп лучше применять ягре / п-бутоксикарбокса-зид, а не карбобензоксихлорид. Ниже представлены реакции синтеза амида аминокислоты, в которых используются эти реагенты. [25]
Страницы: 1 2
www.ngpedia.ru
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ амины аминоспирты амиды аминокислоты
 АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ амины, аминоспирты, амиды, аминокислоты
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ амины, аминоспирты, амиды, аминокислоты
 Амины — органические соединения, содержащие в своём составе аминогруппу –NH 2 или замещённую аминогруппу (-NHR или NR 2) — производные аммиака, в котором один или несколько атомов водорода замещены углеводородными радикалами
Амины — органические соединения, содержащие в своём составе аминогруппу –NH 2 или замещённую аминогруппу (-NHR или NR 2) — производные аммиака, в котором один или несколько атомов водорода замещены углеводородными радикалами
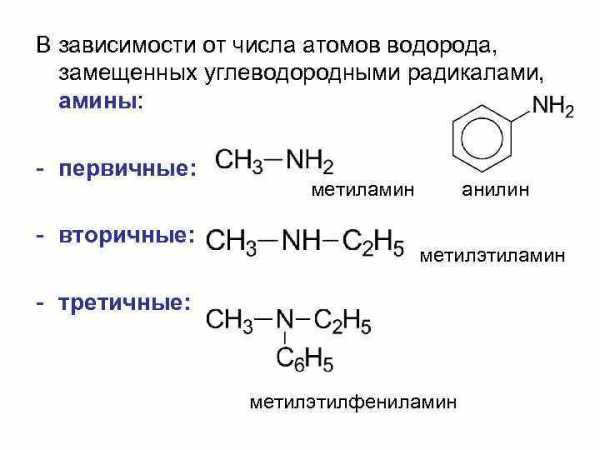 В зависимости от числа атомов водорода, замещенных углеводородными радикалами, амины: — первичные: — вторичные: метиламин анилин метилэтиламин — третичные: метилэтилфениламин
В зависимости от числа атомов водорода, замещенных углеводородными радикалами, амины: — первичные: — вторичные: метиламин анилин метилэтиламин — третичные: метилэтилфениламин
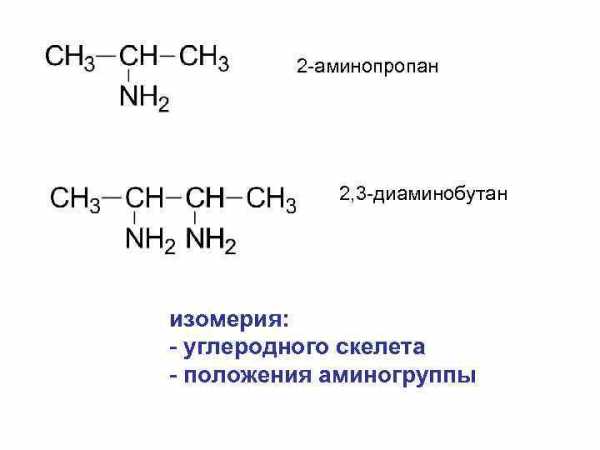 2 -аминопропан 2, 3 -диаминобутан изомерия: — углеродного скелета — положения аминогруппы
2 -аминопропан 2, 3 -диаминобутан изомерия: — углеродного скелета — положения аминогруппы
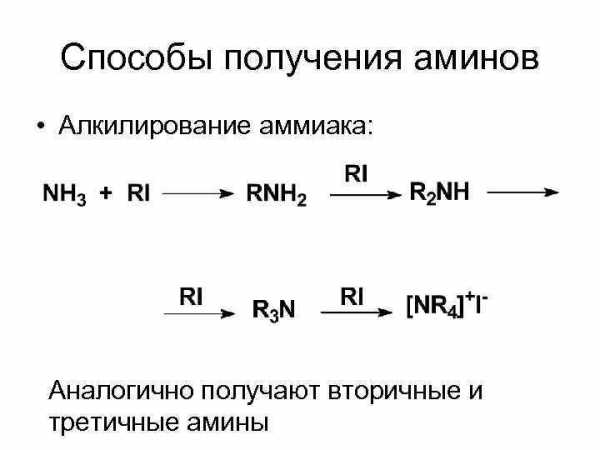 Способы получения аминов • Алкилирование аммиака: Аналогично получают вторичные и третичные амины
Способы получения аминов • Алкилирование аммиака: Аналогично получают вторичные и третичные амины
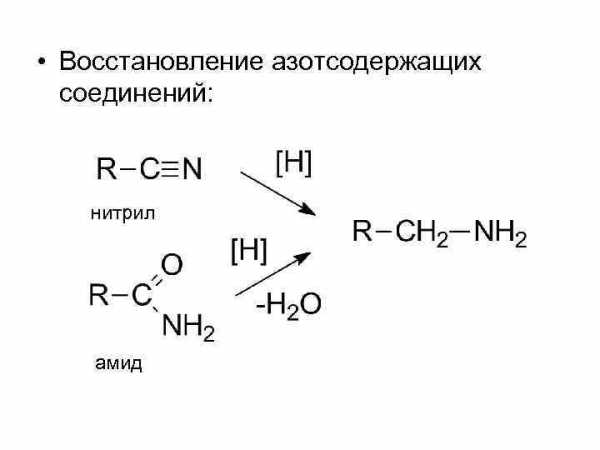 • Восстановление азотсодержащих соединений: нитрил амид
• Восстановление азотсодержащих соединений: нитрил амид
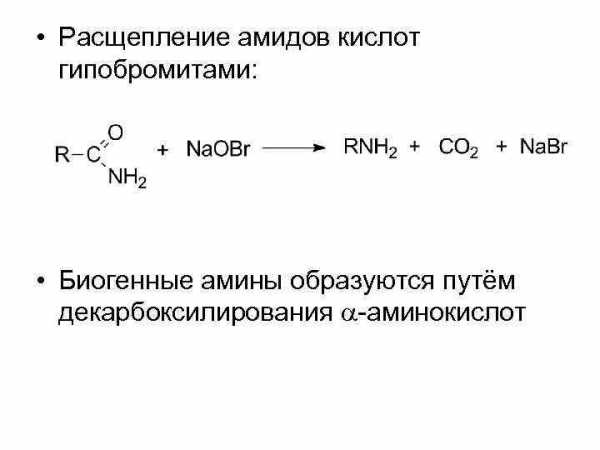 • Расщепление амидов кислот гипобромитами: • Биогенные амины образуются путём декарбоксилирования -аминокислот
• Расщепление амидов кислот гипобромитами: • Биогенные амины образуются путём декарбоксилирования -аминокислот
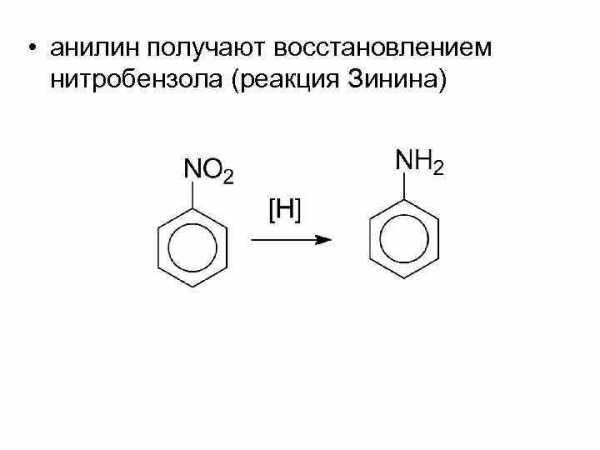 • анилин получают восстановлением нитробензола (реакция Зинина)
• анилин получают восстановлением нитробензола (реакция Зинина)
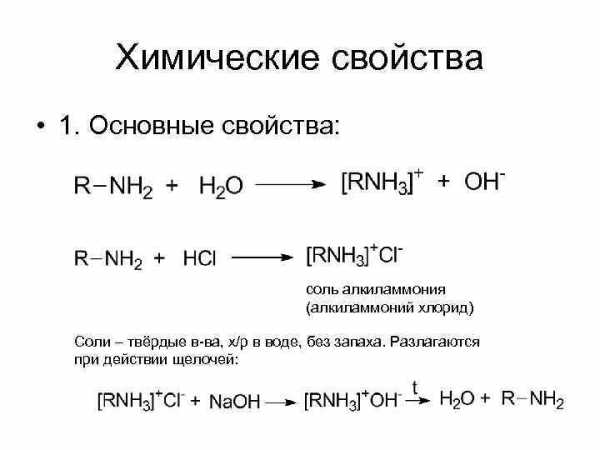 Химические свойства • 1. Основные свойства: соль алкиламмония (алкиламмоний хлорид) Соли – твёрдые в-ва, х/р в воде, без запаха. Разлагаются при действии щелочей:
Химические свойства • 1. Основные свойства: соль алкиламмония (алкиламмоний хлорид) Соли – твёрдые в-ва, х/р в воде, без запаха. Разлагаются при действии щелочей:
 • Амины жирного ряда обладают более выраженными основными свойствами, чем аммиак. • У аминов ароматического ряда основные свойства слабые. Наличие основных свойств доказывается реакцией образования солей при взаимодействии с кислотами: солянокислый анилин
• Амины жирного ряда обладают более выраженными основными свойствами, чем аммиак. • У аминов ароматического ряда основные свойства слабые. Наличие основных свойств доказывается реакцией образования солей при взаимодействии с кислотами: солянокислый анилин
 • 2. Взаимодействие с азотистой кислотой проходит с образованием различных продуктов для аминов разного строения. Это качественная реакция, позволяющая различить первичный, вторичный, третичный амины.
• 2. Взаимодействие с азотистой кислотой проходит с образованием различных продуктов для аминов разного строения. Это качественная реакция, позволяющая различить первичный, вторичный, третичный амины.
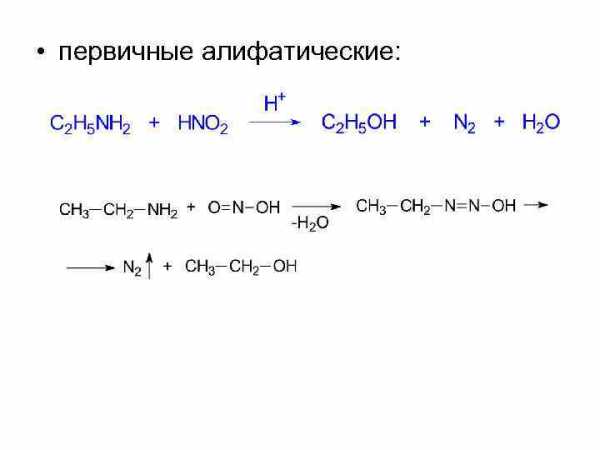 • первичные алифатические:
• первичные алифатические:
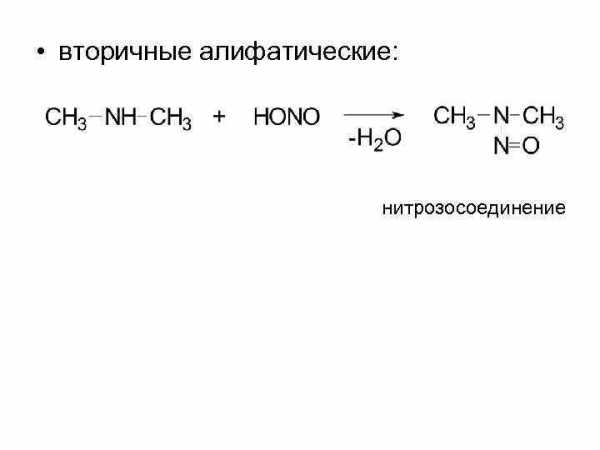 • вторичные алифатические: нитрозосоединение
• вторичные алифатические: нитрозосоединение
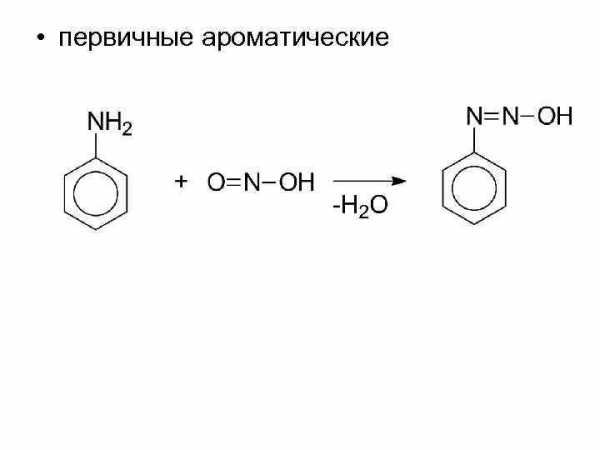 • первичные ароматические
• первичные ароматические
 • 3. Образование оснований Шиффа
• 3. Образование оснований Шиффа
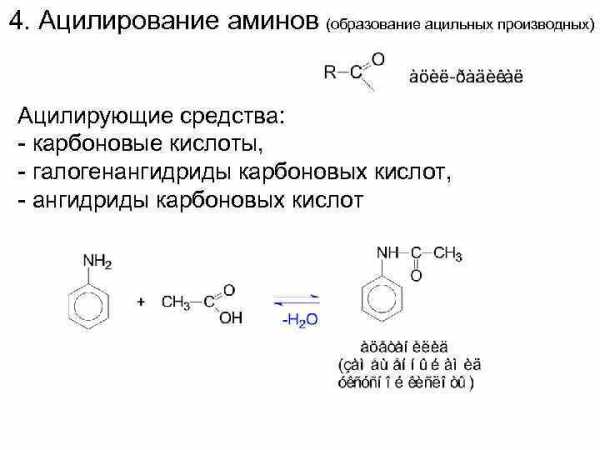 4. Ацилирование аминов (образование ацильных производных) Ацилирующие средства: — карбоновые кислоты, — галогенангидриды карбоновых кислот, — ангидриды карбоновых кислот
4. Ацилирование аминов (образование ацильных производных) Ацилирующие средства: — карбоновые кислоты, — галогенангидриды карбоновых кислот, — ангидриды карбоновых кислот
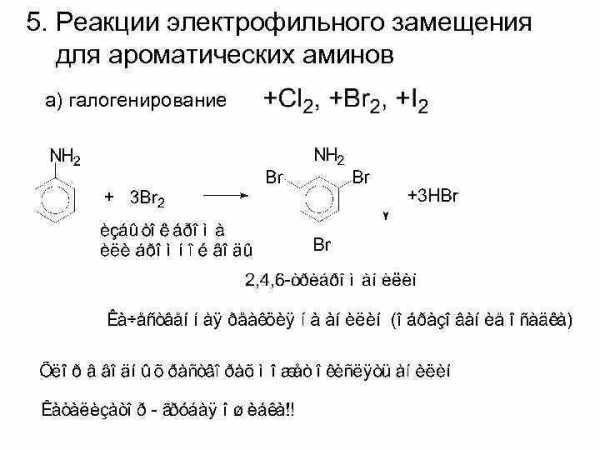 5. Реакции электрофильного замещения для ароматических аминов а) галогенирование
5. Реакции электрофильного замещения для ароматических аминов а) галогенирование
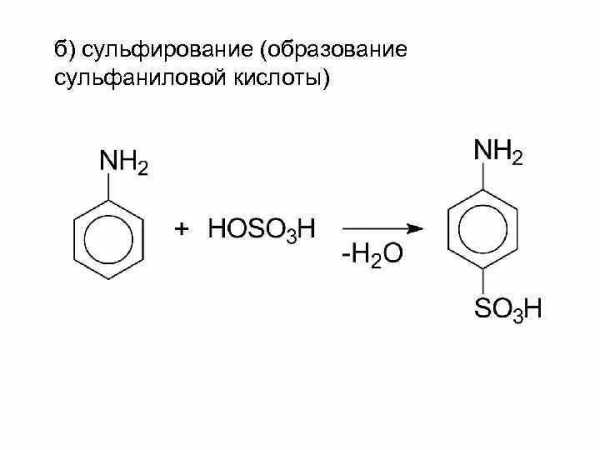 б) сульфирование (образование сульфаниловой кислоты)
б) сульфирование (образование сульфаниловой кислоты)
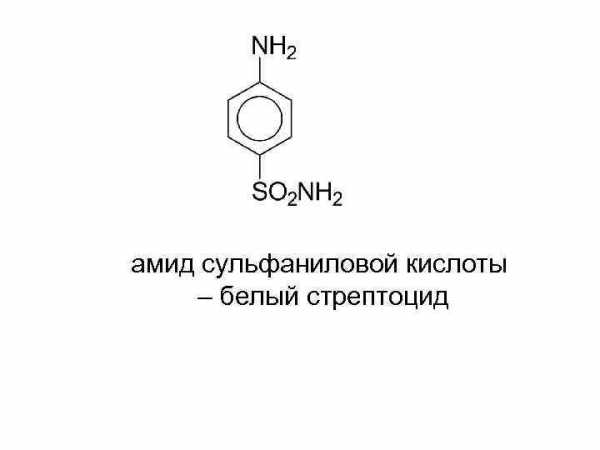 амид сульфаниловой кислоты – белый стрептоцид
амид сульфаниловой кислоты – белый стрептоцид
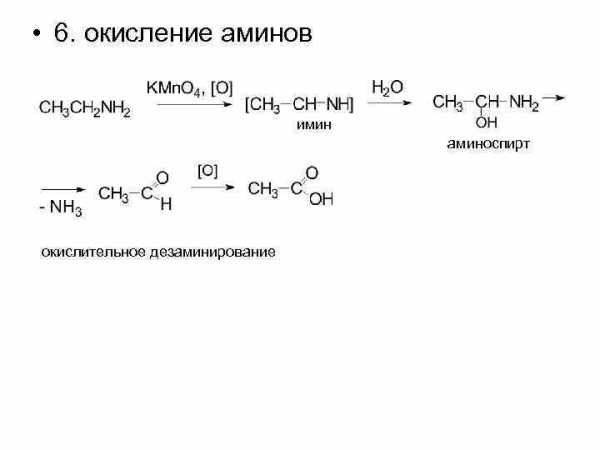 • 6. окисление аминов имин аминоспирт окислительное дезаминирование
• 6. окисление аминов имин аминоспирт окислительное дезаминирование
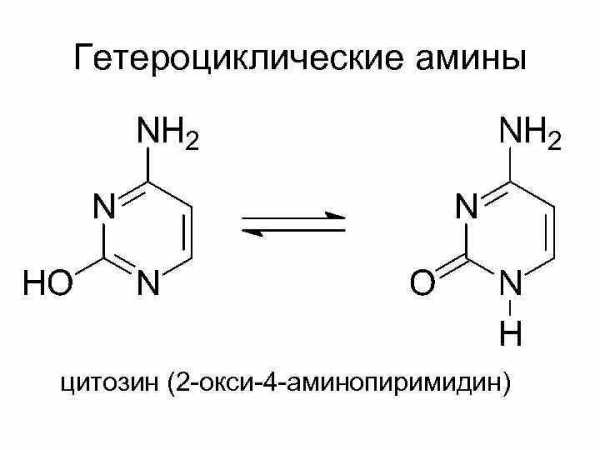 Гетероциклические амины цитозин (2 -окси-4 -аминопиримидин)
Гетероциклические амины цитозин (2 -окси-4 -аминопиримидин)
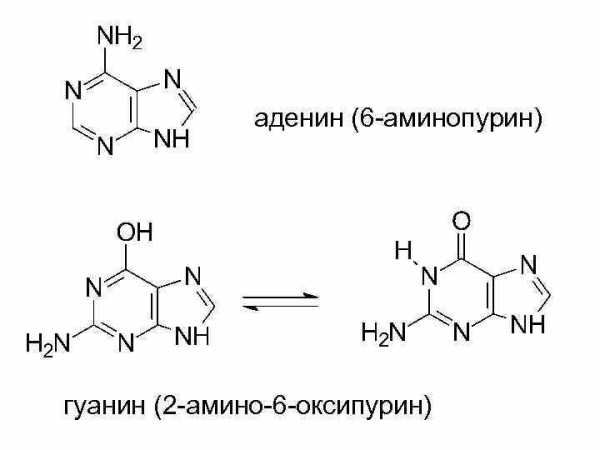 аденин (6 -аминопурин) гуанин (2 -амино-6 -оксипурин)
аденин (6 -аминопурин) гуанин (2 -амино-6 -оксипурин)
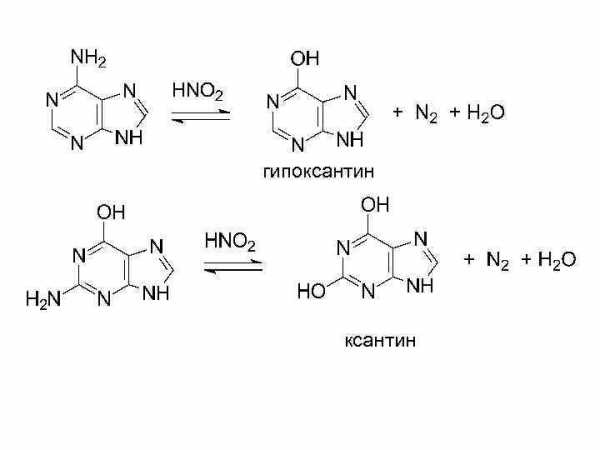 гипоксантин
гипоксантин
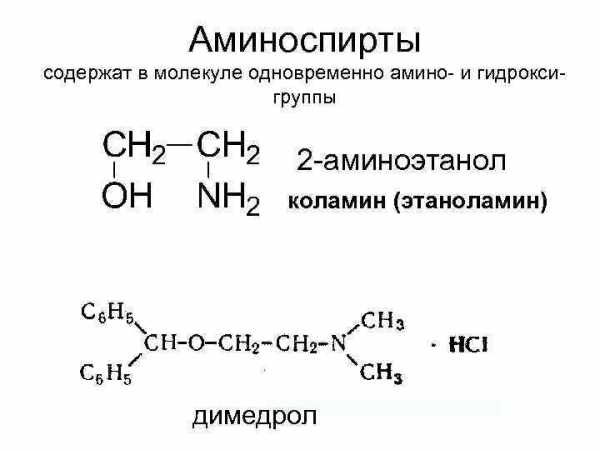 Аминоспирты содержат в молекуле одновременно амино- и гидроксигруппы 2 -аминоэтанол коламин (этаноламин) холин (триметил- -гидроксиэтилгидрат аммония): 2 димедрол
Аминоспирты содержат в молекуле одновременно амино- и гидроксигруппы 2 -аминоэтанол коламин (этаноламин) холин (триметил- -гидроксиэтилгидрат аммония): 2 димедрол
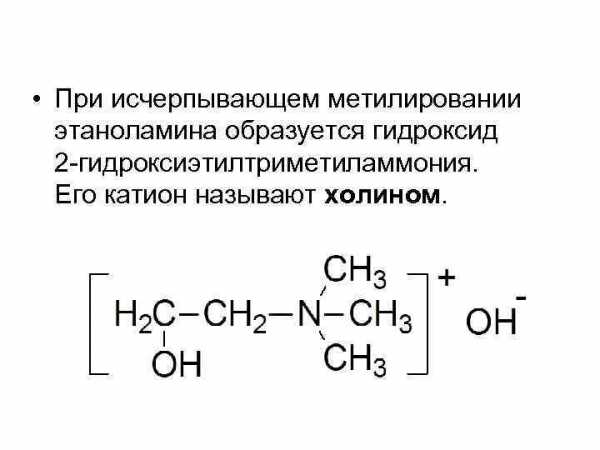 • При исчерпывающем метилировании этаноламина образуется гидроксид 2 -гидроксиэтилтриметиламмония. Его катион называют холином.
• При исчерпывающем метилировании этаноламина образуется гидроксид 2 -гидроксиэтилтриметиламмония. Его катион называют холином.
 • Холин – структурный элемент сложных липидов. Имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. В организме холин может образовываться из аминокислоты серина.
• Холин – структурный элемент сложных липидов. Имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. В организме холин может образовываться из аминокислоты серина.
 Нейрин – продукт внутримолекулярной дегидратации холина. Образуется при гниении белков. Обладает высокой токсичностью.
Нейрин – продукт внутримолекулярной дегидратации холина. Образуется при гниении белков. Обладает высокой токсичностью.
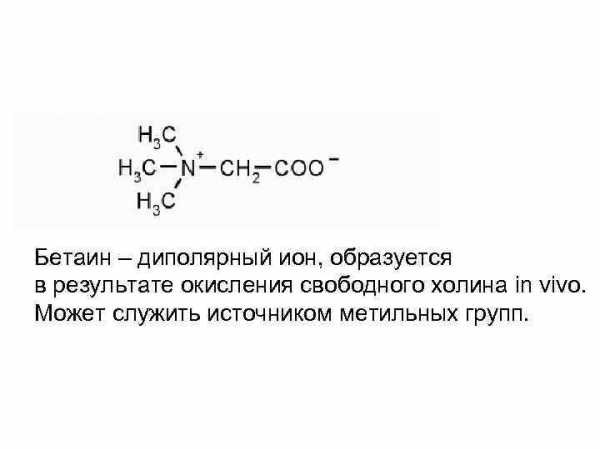 Бетаин – диполярный ион, образуется в результате окисления свободного холина in vivo. Может служить источником метильных групп.
Бетаин – диполярный ион, образуется в результате окисления свободного холина in vivo. Может служить источником метильных групп.
 ацетилхолин Ацетилхолин – сложный эфир холина и уксусной кислоты – наиболее распространённый нейромедиатор (посредник при передаче нервного возбуждения в нервных тканях)
ацетилхолин Ацетилхолин – сложный эфир холина и уксусной кислоты – наиболее распространённый нейромедиатор (посредник при передаче нервного возбуждения в нервных тканях)
 Амиды кислот • См. лекцию по карбоновым кислотам
Амиды кислот • См. лекцию по карбоновым кислотам
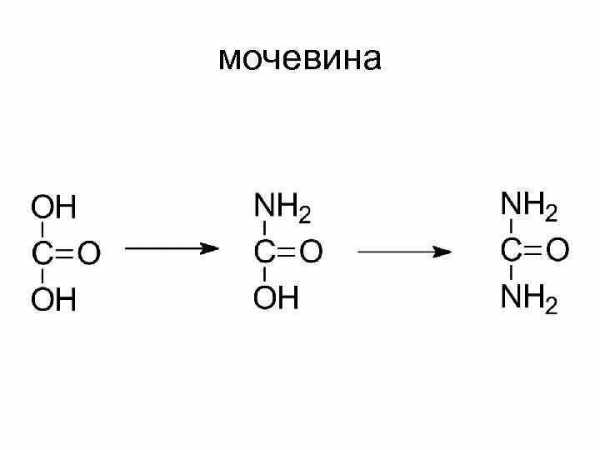 мочевина
мочевина

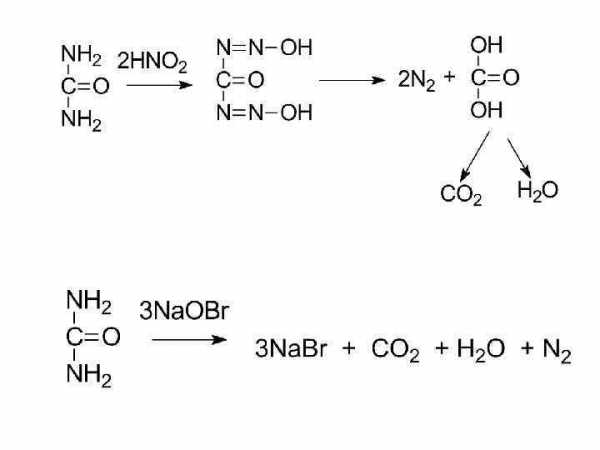
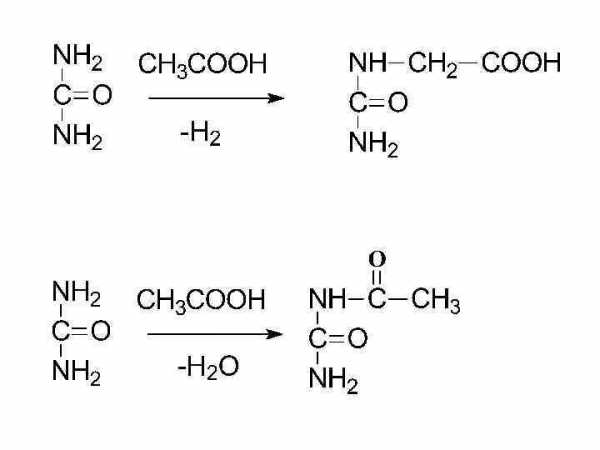
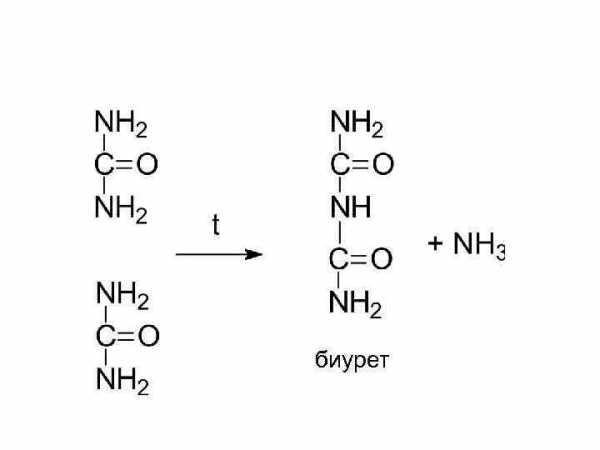 биурет
биурет
 АМИНОКИСЛОТЫ
АМИНОКИСЛОТЫ
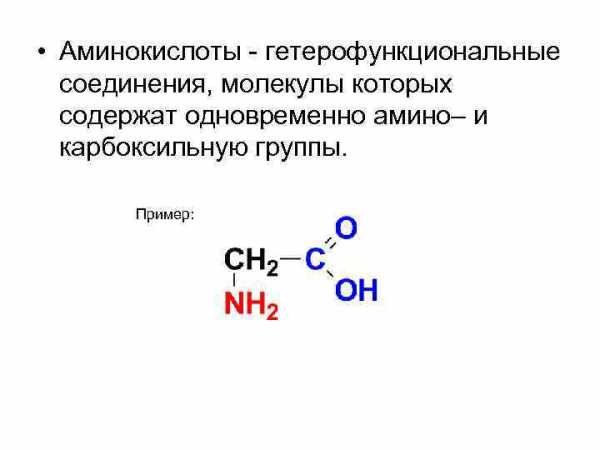 • Аминокислоты — гетерофункциональные соединения, молекулы которых содержат одновременно амино– и карбоксильную группы. Пример:
• Аминокислоты — гетерофункциональные соединения, молекулы которых содержат одновременно амино– и карбоксильную группы. Пример:
 Изомерия: • — углеродного скелета • — положения аминогруппы: • — оптическая изомерия
Изомерия: • — углеродного скелета • — положения аминогруппы: • — оптическая изомерия
 Получение аминокислот • 1. Гидролиз белков • 2. Действие аммиака на галогенкислоты:
Получение аминокислот • 1. Гидролиз белков • 2. Действие аммиака на галогенкислоты:
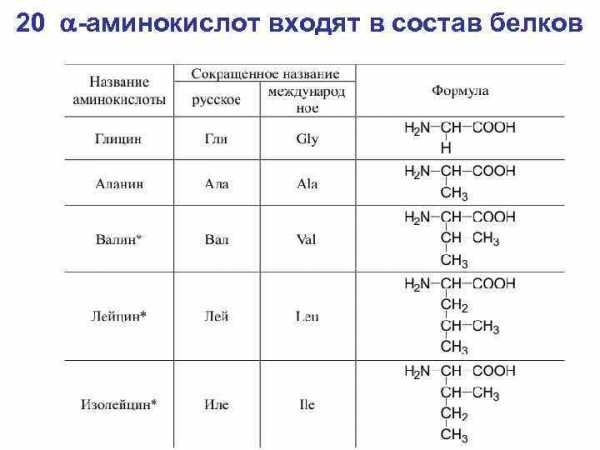 20 a-аминокислот входят в состав белков
20 a-аминокислот входят в состав белков
 Оптическая изомерия • Все полученные из белков аминокислоты оптически активны, т. к. в -положении содержат асимметрический атом С. • Все аминокислоты, полученные при гидролизе белков, принадлежат к L-ряду. L(-)-глицериновый альдегид L(+)-аланин
Оптическая изомерия • Все полученные из белков аминокислоты оптически активны, т. к. в -положении содержат асимметрический атом С. • Все аминокислоты, полученные при гидролизе белков, принадлежат к L-ряду. L(-)-глицериновый альдегид L(+)-аланин
 Физические и химические свойства аминокислот
Физические и химические свойства аминокислот
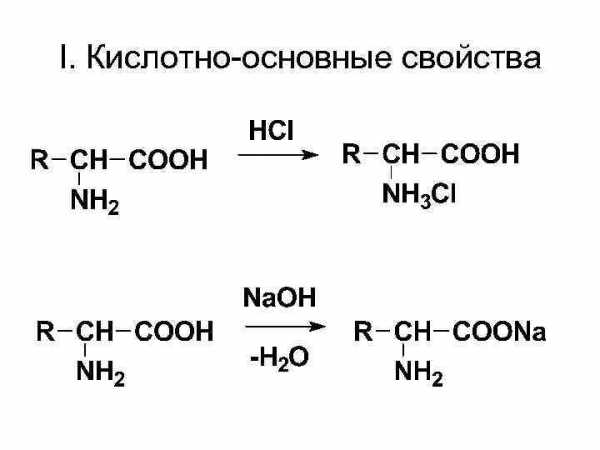 I. Кислотно-основные свойства
I. Кислотно-основные свойства
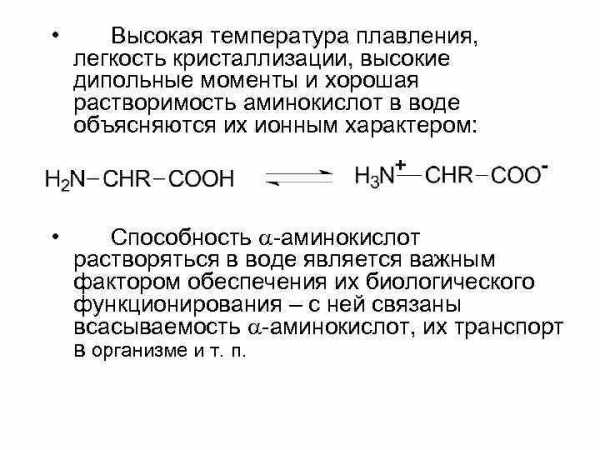 • Высокая температура плавления, легкость кристаллизации, высокие дипольные моменты и хорошая растворимость аминокислот в воде объясняются их ионным характером: • Способность -аминокислот растворяться в воде является важным фактором обеспечения их биологического функционирования – с ней связаны всасываемость -аминокислот, их транспорт в организме и т. п.
• Высокая температура плавления, легкость кристаллизации, высокие дипольные моменты и хорошая растворимость аминокислот в воде объясняются их ионным характером: • Способность -аминокислот растворяться в воде является важным фактором обеспечения их биологического функционирования – с ней связаны всасываемость -аминокислот, их транспорт в организме и т. п.
 • В твёрдом состоянии -аминокислоты существуют в виде диполярных ионов; в водном растворе – в виде равновесной смеси диполярного иона, катионной и анионной форм (обычно используемая запись строения -аминокислоты в неионизированном виде служит лишь для удобства). анион диполярный ион катион
• В твёрдом состоянии -аминокислоты существуют в виде диполярных ионов; в водном растворе – в виде равновесной смеси диполярного иона, катионной и анионной форм (обычно используемая запись строения -аминокислоты в неионизированном виде служит лишь для удобства). анион диполярный ион катион
 • Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определённых значениях р. Н существенно зависит от строения радикала, главным образом наличия в нём ионогенных групп, играющих роль кислотных и основных центров.
• Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определённых значениях р. Н существенно зависит от строения радикала, главным образом наличия в нём ионогенных групп, играющих роль кислотных и основных центров.
 • Значение р. Н, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм -аминокислоты равны, называется изоэлектрической точкой (p. I).
• Значение р. Н, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм -аминокислоты равны, называется изоэлектрической точкой (p. I).
 II. Все реакции карбоновых кислот, протекающие за счёт карбоксильной группы (-COOH), т. е. они образуют: • соли (с металлами, оксидами и гидроксидами металлов), • эфиры, • ангидриды, • галогенангидриды, • амины (реакцией декарбоксилирования)
II. Все реакции карбоновых кислот, протекающие за счёт карбоксильной группы (-COOH), т. е. они образуют: • соли (с металлами, оксидами и гидроксидами металлов), • эфиры, • ангидриды, • галогенангидриды, • амины (реакцией декарбоксилирования)
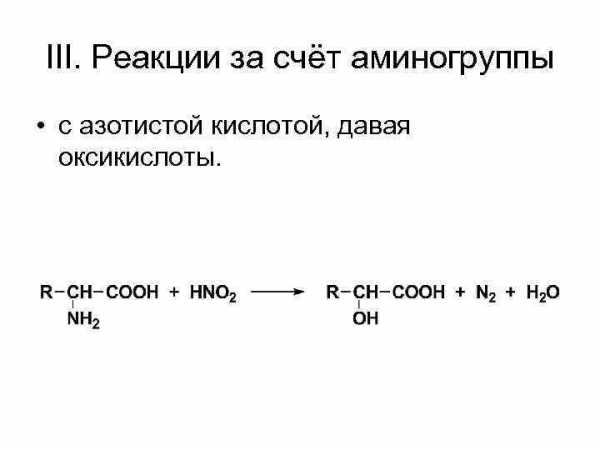 III. Реакции за счёт аминогруппы • с азотистой кислотой, давая оксикислоты.
III. Реакции за счёт аминогруппы • с азотистой кислотой, давая оксикислоты.
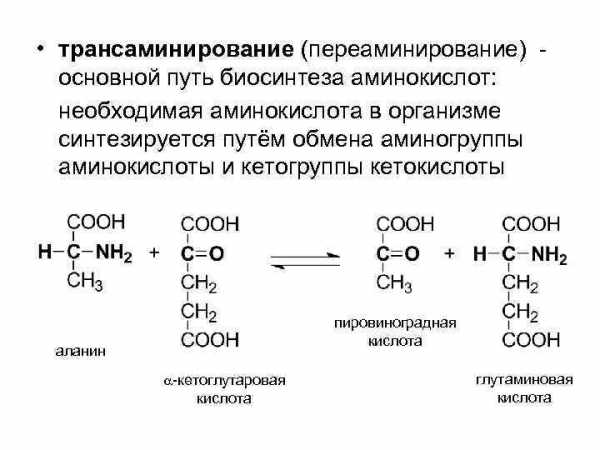 • трансаминирование (переаминирование) основной путь биосинтеза аминокислот: необходимая аминокислота в организме синтезируется путём обмена аминогруппы аминокислоты и кетогруппы кетокислоты пировиноградная кислота аланин -кетоглутаровая кислота глутаминовая кислота
• трансаминирование (переаминирование) основной путь биосинтеза аминокислот: необходимая аминокислота в организме синтезируется путём обмена аминогруппы аминокислоты и кетогруппы кетокислоты пировиноградная кислота аланин -кетоглутаровая кислота глутаминовая кислота
 • окислительное дезаминирование аминокислота иминокислота кетокислота Образующийся аммиак утилизируется в процессе биосинтеза мочевины.
• окислительное дезаминирование аминокислота иминокислота кетокислота Образующийся аммиак утилизируется в процессе биосинтеза мочевины.
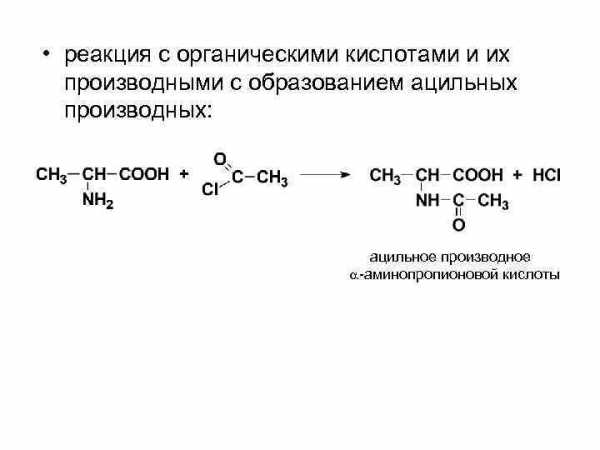 • реакция с органическими кислотами и их производными с образованием ацильных производных: ацильное производное -аминопропионовой кислоты
• реакция с органическими кислотами и их производными с образованием ацильных производных: ацильное производное -аминопропионовой кислоты
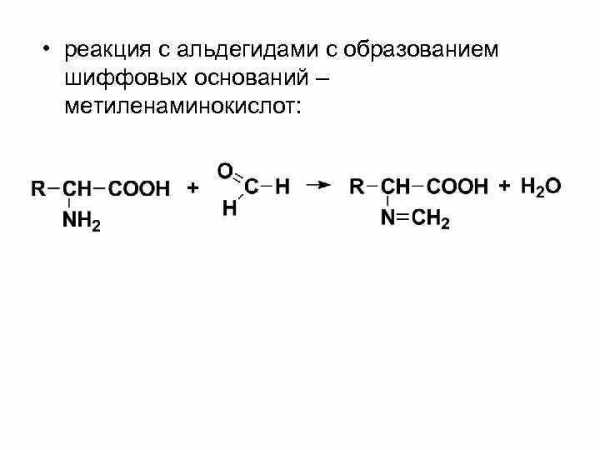 • реакция с альдегидами с образованием шиффовых оснований – метиленаминокислот:
• реакция с альдегидами с образованием шиффовых оснований – метиленаминокислот:
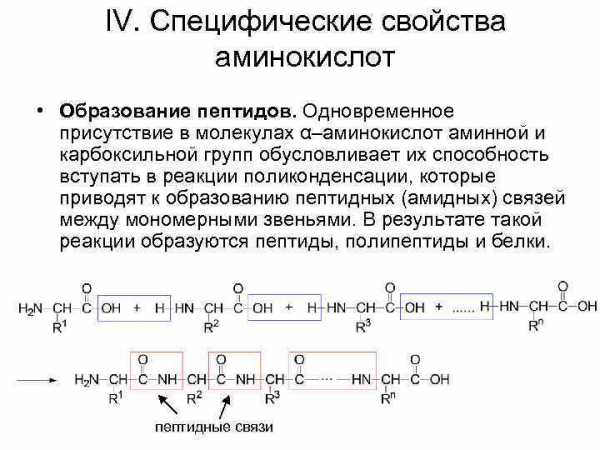 IV. Специфические свойства аминокислот • Образование пептидов. Одновременное присутствие в молекулах α–аминокислот аминной и карбоксильной групп обусловливает их способность вступать в реакции поликонденсации, которые приводят к образованию пептидных (амидных) связей между мономерными звеньями. В результате такой реакции образуются пептиды, полипептиды и белки. пептидные связи
IV. Специфические свойства аминокислот • Образование пептидов. Одновременное присутствие в молекулах α–аминокислот аминной и карбоксильной групп обусловливает их способность вступать в реакции поликонденсации, которые приводят к образованию пептидных (амидных) связей между мономерными звеньями. В результате такой реакции образуются пептиды, полипептиды и белки. пептидные связи
 Номенклатура пептидов N-концевой аминокислотный остаток (имеющий свободную аминогруппу) пишут с левой стороны формулы, а С-концевой аминокислотный остаток (имеющий свободную карбоксильную группу) с правой стороны: трипептид глицилаланилфенилаланин
Номенклатура пептидов N-концевой аминокислотный остаток (имеющий свободную аминогруппу) пишут с левой стороны формулы, а С-концевой аминокислотный остаток (имеющий свободную карбоксильную группу) с правой стороны: трипептид глицилаланилфенилаланин
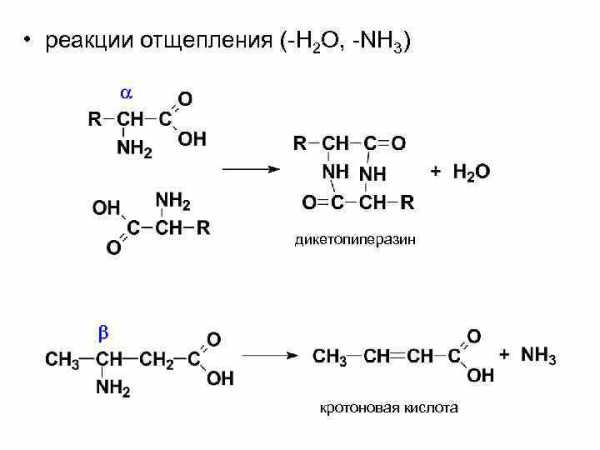 • реакции отщепления (-H 2 O, -NH 3) дикетопиперазин кротоновая кислота
• реакции отщепления (-H 2 O, -NH 3) дикетопиперазин кротоновая кислота
present5.com
Амид — аминокислота — Большая Энциклопедия Нефти и Газа, статья, страница 1
Амид — аминокислота
Cтраница 1
Амиды аминокислот, их обмен и физиологическая роль в животном организме. [1]
Амиды аминокислот восстанавливаются в диамины. [2]
Амид другой дикарбоновой аминокислоты — глутаминовой, называется глутамином. [3]
Амид Другой дикарбоновой аминокислоты — глутаминовой, называется глутамином. [4]
Названия амидов аминокислот, тривиальные названии которых оканчиваются на — ин, образуют, прибавляя к названию кислоты окончание — амид или — днамнд. [5]
Полипептиды и амиды аминокислот также подвергаются каталитическому гидролизу. Однако каталитические эффекты часто выражены не так ярко, как в случае гидролиза эфиров. [6]
Способ производства амидов аминокислот, отличающийся тем, что лактамы взаимодействуют с аминами. [7]
Первоначально при синтезе амидов аминокислот свободную карбоксильную группу активировали для реакции с амином. [8]
Если в качестве амида аминокислоты взят амид ами-номалоновой кислоты ( R CONh3), то получается амид 3-оксипиразино-вой кислоты или ее производные. [9]
АМЙДАЗЫ — ферменты, гидролитически расщепляющие амиды аминокислот. [10]
АМИД АЗЫ — ферменты, гидролитически расщепляющие амиды аминокислот. [11]
Одним из важных классов производных карбоновых кислот являются амиды аминокислоты. [12]
При взаимодействии аминокислот или некоторых их производных с аммиаком образуются амиды аминокислот. [13]
Успехи современной биологии, 1949, XXVIII, 365; Амиды аминокислот, их обмен и физиологическая роль в животном организме. [14]
При взаимодействии аминокислот или некоторых их производных с аммиаком образуются амиды аминокислот. [15]
Страницы: 1 2
www.ngpedia.ru
Аминокислоты
25
Все разнообразие белков в живой природе построено на основе 20 аминокислот, назы-ваемых также белковыми аминокислотами. Обязательным структурным элементом у них является атом углерода, к которому присоединена аминогруппа и карбоксильная группа, то есть они являются -аминокислотами. У 19 аминокислот несущий амино-группу и карбоксильную атом углерода замещен еще одним радикалом, из за чего этот атом становится асимметричным. Среди белковых аминокислот есть как левовращаю-щие (-) – гистидин, пролин, серин, треонин, фенилаланин, так и правовращающие (+) – аланин, аргинин, глютаминовая кислота, изолейцин, лизин, но все белковые амино-кислоты имеютL-конфигурацию по этому атому углерода. Величина и знак удельного вращения используются в аналитических целях, но при изучении строения производ-ных хиральных молекул гораздо важнее абсолютная конфигурация.
Первоначально Э.Фишер предложил принять, что у глицеринового альдегида в плос-костном изображении (проекции Фишера) с формильной группой в верху молекулы у изомера, вращающего плоскость поляризованного света влево, гидроксильная группа направлена влево (Lотlevo) и вправо (Dотdextro) у правовращающего. Сейчас с уче-том тетраэдрического строенияsp3-гибридизованного атома углерода методом рентге-ноструктурного анализа установлено, что при сохранении положения гидроксильной группы у левовращающего глицеринового альдегида слева формильная группа и гидр-оксиметильная группа расположены за плоскостью, проходящей через асимметри-ческий атом углерода, а атом водорода и гидроксильная группа направлены вперед.
От глицеринового альдегида можно без обращения конфигурации, заменив альдегид-ную группу на карбоксигруппу, восстановив гидроксиметильную группу до метильной и заменив гидроксигруппу на аминогруппу, перейти к простейшей аминокислоте с асимметрическим атомом углерода – аланину. При этом оказывается, что выделяемый из белков аланин соответствует по конфигурации L‑глицериновому альдегиду. То же самое оказалось действительным и для 18 других оптически активных аминокислот. Две белковых аминокислоты – треонин и изолейцин – имеют еще один асимметри-ческий атом углерода, но и здесь в живой природе встречается только один оптический изомер, хотя обычный синтез приводит с равной вероятностью к образованию четырех пространственных изомеров, представляющих собой две пары диастереомеров.
В химии аминокислот более удобно изображать их пространственное строение, поме-щая в одну плоскость аминогруппу и карбоксильную группу. Тогда атом водорода у L‑аминокислот будет расположен за этой плоскостью, а группаRперед ней
или
Идентичность белковых аминокислот по конфигурации у этого атома углерода демон-стрируется ферментными превращениями, которые специфичны по субстрату. Так, на-пример, для разделения рацемической смеси аминокислот можно использовать пред-ложенный Гринштейном прием, основанный на обработке ацетилазой смеси N‑аце-тильных производныхL- иD-аминокислоты, превращающейся при этом в легко разде-ляемую смесьL‑аминокислоты иN-ацетилзащеннойD-аминокислоты.
Существуют различные классификации белковых аминокислот по заместителям в ради-кале R, но проще всего различать аминокислоты с нейтральными, кислыми и основ-ными группами в фрагментах, соединенных с атомом углерода, несущим аминогруппу и карбоксильную группу. К аминокислотам с нейтральнымиRотносятся глицин (Гли,Gly,G), аланин (Ала,Ala,A), валин (Вал,Val,V), лейцин (Лей,Leu,L), изолейцин (Иле,Ile,I), метионин (Мет,Met,M), серин (Сер,Ser,S), треонин (Тре,Thr,T), цистеин (Цис,Cys,C), фенилаланин (Фен,Phe,F), тирозин (Тир,Tyr,Y), триптофан (Трп,Trp,W), аспарагин (Асн,Asn,N), глютамин (Глн,Gln,Q), пролин (Про,Pro,P). В некоторых классификациях эту группу подразделяют на аминокислоты с полярными и неполярны-миR, но такое выделение неизбежно будет носить субъективный характер. Аминокис-лоты с карбоксильными группами в радикалеR(кислые аминокислоты) – это аспара-гиновая кислота (Асп,Asp,D) и глютаминовая кислота (Глу,Glu,E). И, наконец аминокислоты с основными группами в радикалеR– это гистидин (Гис,His,H), лизин (Лиз,Lys,K) и аргинин (Арг,Arg,R).
В белках и пептидах аминокислоты соединены пептидными связями, которые пред-ставляют собой амидные функциональные группы, образованные карбоксильными и аминными функциональными группами у асимметричного атома углерода. То есть ‑карбоксильная группа аспарагиновой кислоты и-карбоксильная группа глютамино-вой кислоты, а равно и концевая аминогруппа лизина, в образовании пептидных связей не участвуют. Обозначения аминокислот трехбуквенными символами используются для краткого изображения олигопептидов, а для полипептидов и белков даже такие символы оказались слишком длинными и сейчас все чаще и чаще используют одно-буквенные символы.
Названия аминокислот сложились исторически. Так, глицин, выделенный из продуктов гидролиза желатина, имеет сладкий вкус, лейцин (лейкос – белый) из мышечной ткани, тирозин (тирос – сыр) из казеина, цистин – продукт окисления цистеина – был выделен из камней мочевого пузыря (кистос – пузырь) и т. д.
Роль аминокислот с алифатическими неполярными группамисводится к образова-нию гидрофобных зон и гидрофобных «карманов» в молекулах белков. Слабые гидро-фобные взаимодействия между алифатическими группами позволяют белковым моле-кулам легко перестраиваться в структуры с минимумом энергии в ответ на связывание функциональных групп на поверхности белковой молекулы с соответствующими суб-стратами. Такие структурные перестройки лежат в основе функционирования рецеп-торных участков сенсорных клеток, транспортных белков, ферментов и вообще всех проявлений роли белков в живой природе. Аланин (R=CH3), валин (R= (CH3)2CH) лейцин (R= (CH3)2CHCH2) и изолейцин (R=C2H5CH(CH3)CH):
могут быть использованы организмом в качестве источника энергии, но в первую очередь это основной материал для построения мышц.
Остаток Rметионина (R= СH3SCH2CH2) также может выполнять роль гидрофобного фрагмента. Так, например, есть две различающихся только одной аминокислотой моле-кулы нейропептида энкефалина (пентапетид, участвующий в работе центральной нервной системы) – Мет-энкефалин (Тир-Гли-Гли-Фен-Мет) и Лей-энкефалин (Тир-Гли-Гли-Фен-Лей), из чего следует, что остаткиRметионина и лейцина при всем их химическом различии в этом случае выполняют всего лишь роль гидрофобного фраг-мента. Кроме того, метионин входит в состав многих белков с каталитическими функциями. В частности, он служит донором метильных групп при биохимическом метилировании, например, аминогрупп. При этом промежуточным продуктом являетсяS-аденозилметионин с сульфониевой группой:
При взаимодействии с нуклеофильной молекулой S-аденозилметионин деметилируется и разлагается на аденозин и гомоцистеин (небелковая аминокислота, гомолог цис-теина). В растенияхS-аденозилметионин превращается в циклопропанаминокарбоно-вую кислоту, которая служит источником этилена, регулирующего процесс созревания плодов. В общем случае метионин – это источник сернистых соединений для организ-ма. Очень мало этой аминокислоты в белках сои, поэтому при составлении комбикор-мов на основе сои приходится добавлять синтетический метионин. Кстати, у метионина нет необходимости в выделенииL-изомера, поскольку егоD-изомер нетоксичен.
Триптофан также может выполнять роль аминокислоты с гидрофобным остатком, но его роль далеко выходит за эти рамки. Его индольная гетероциклическая система пред-ставляет собой донор электронов для образования комплексов с переносом заряда.
Кроме того, из триптофана образуется переносчик сигналов в ЦНС (нейромедиатор) серотонин и регулирующий сон гормон мелатонин. Экзогенный триптофан можно было бы использовать в качестве пищевой добавки со свойствами успокаивающего средства (транквилизатора), которое из-за его естественного характера, конечно, без-опаснее синтетических препаратов. На рынке лекарственных средств триптофан вытес-нял обычные транквилизаторы и фармацевтические фирмы развернули против него широкую компанию, собрав статистику сомнительного характера о повышенной часто-те заболеваний крови у тех, кто употреблял его. Тем не менее, на основании этих дан-ных FDA(FoodandDrugAdministration, США) запретила использование триптофана в качестве пищевой добавки и этот запрет действует до сих пор, хотя позже было уста-новлено, что эти противопоказания были связаны с употреблением триптофана, произ-веденного по упрощенной технологии одной японской компанией.
Ароматический цикл фенилаланина(R= С6Н5СН2) также представляет-электроны для образования комплексов с переносом заряда, но в этом он уступает триптофану. Важно, что фенилаланин – это предшественник практически всех биогенных веществ с бензольным циклом. В растениях эта аминокислота служит источником многих окра-шенных веществ – кумаринов, флаваноидов. Кроме того, из фенилаланина в клетках растений образуется лигнин – важная составляющая древесины. У животных из фенил-аланина через тирозин образуются такие регуляторные вещества, как адреналин и дофамин, гормоны щитовидной железы и другие вещества, например, меланин, окра-шивающий кожу и волосы.
Аминокислота тирозин
входит в состав многих пептидов с регуляторной и нейромедиаторной активностью. Фенилаланин в свободном виде и в составе белков легко подвергается окислению фер-ментными системами клеток с образованием тирозина. Поэтому все, что было сказано выше о фенилаланине относится и к тирозину.
Амидные группы аспарагина (R=H2NCOCH2) и глютамина (R=H2NCOCH2CH2) играют важную роль в образовании водородных связей в белковых молекулах, кроме того, амидная группа свободного, то есть не включенного в белковую молекулу глютамина участвует в детоксикации аммиака, образующегося при дезаминировании аминокислот.
Очень важна гидроксильная группа серина (R=CH2OH). В ферментах с гидролазной активностью она находится в каталитическом центре и принимает на себя ацильный остаток гидролизуемого амида или сложного эфира, а сам серин – это исходный про-дукт для образования глицина, который не только участвует в образовании белков, но и выполняет функцию нейромедиатора торможения в нейронах спинного мозга.
Участие в каталитических процессах гидроксильной группы треонина (R= СН3CHOH), входящего в состав белковой молекулы фермента, пока не подтверждено, поэтому ее роль, очевидно, заключается только в образовании водородных связей и в гидрофили-зации белка.
Аспарагиновая (R=HOOCCH2) и глютаминовая кислота(R=HOOCCH2CH2) име-ют карбоксильные группы, которые не участвуют в пептидных связях. Эти карбоксиль-ные группы представляют белкам возможность образования солей с основными груп-пами других фрагментов аминокислот, а также для связывания с основными группами субстратов в активных центрах ферментов.-Карбоксильная группа глютаминовой кислоты участвует в детоксикации эндогенного аммиака, превращаясь в амидную (глютамин), кроме того, аминная функция глютаминовой кислоты также включена в процесс обмена аммиака через кетоглутаровую кислоту. Глютаминовая кислота – это исходный продукт для образования-аминомасляной кислоты, выступающей в роли нейромедиатора торможения, а сама глютаминовая кислота – это нейромедиатор воз-буждения в ЦНС: до 70 % контактов между нейронами ЦНС обеспечиваются этой аминокислотой. Глютаминовая и аспарагиновая кислота при дезаминировании превра-щаются в кетоглутаровую и, соответственно, щавелевоуксусную кислоту, которые яв-ляются промежуточными продуктами в циклическом превращении лимонной кислоты (цикл Кребса), обеспечивающем энергетику аэробных клеток.
В составе белков аргининпредставляет для образования солевых связей самое сильное органическое основание – гуанидиновую группу (R=H2N-C(=NH)NHCH2CH2CH2). В свободном виде аргинин участвует в циклическом процессе, предназначенном для перевода токсичного аммиака в нетоксичную мочевину. Кроме того, гуанидиновая группа аргинина является единственным эндогенным источником монооксида азота. Исследования последних лет (монооксиду азота присвоено звание молекулы 1992 года) показали, что это простейшее и очень нестойкое вещество участвует в регуляции тонуса кровеносных сосудов (нитроглицерин и другие нитраты). Отмечен положи-тельный эффект диеты с повышенным содержанием аргинина на иммунитет и на состав липопротеинов крови, которые переносят холестерин. Диета для снижения веса также должна содержать повышенные количества аргинина, иначе уменьшение объема жиро-вой ткани будет сопровождаться деградацией мышечной ткани.
Еще одна аминокислота с основной группой лизин(R = H2NCH2CH2CH2CH2) участвует в построении солевых связей в белках, но во многих ферментах ее аминогруппа служит для присоединения простетических групп, выполняющих главную каталитическую функцию. В качестве пищевой добавки лизин (очень мало этой аминокислоты в составе белка зерен пшеницы) используется для профилактики остеопороза и катаракты. Диета с повышенным содержанием лизина позволяет преодолеть отрицательные воздействия стресса на мышечную ткань, а в количестве 1-3 г в день лизин значительно облегчает течение герпесных инфекций.
Аминокислота с самой слабой основной группой гистидиниграет важную роль в функционировании ферментов. С участием ее имидазольного фрагмента идет перенос протонов по схеме
Гистидин относится к незаменимым аминокислотам, однако обычно недостаток в этой аминокислоте не ощущается, в полноценной белковой пище ее вполне достаточно.
К аминокислотам, которые выполняют особую роль в организации структуры белков, можно отнести глицин, пролин и цистеин.
У глицина отсутствует боковой радикал (R = H) и поэтому в белках он обычно играет роль вставки между аминокислотами с объемными радикалами. Что касается пролина, то его пятичленный пирролидиновый цикл имеет углы связей, отличающиеся от углов в молекулах с ациклическимиsp3-гибридизованными атомами углерода. Поэтому фраг-мент пролина в молекуле белка всегда находится в точке изгиба, поворота в ее третич-ной структуре. Очень важна в организации третичной структуры белка роль цистеина. Сульфгидрильные группы двух фрагментов этой аминокислоты в составе белка легко окисляются с образованием дисульфидных связей (две молекулы цистеина, соединен-ные дисульфидной связью – это аминокислота цистин). Эти связи образуют попереч-ные сшивки между далеко отстоящими друг от друга фрагментами цистеина в пептид-ной цепи, фиксирующие ее в определенном положении. Этот эффект проще всего демонстрируется на химической завивке. Обработка белка волос кератина восстанови-телем (тиогликолевая кислота) приводит к разрыву дисульфидных связей, что позво-ляет белковым молекулам скользить по отношению друг к другу. После этого действие окислителя восстанавливает дисульфидные связи, но после смещения молекул эти дисульфидные мостики возникают уже в других точках, фиксируя таким образом новое положение этих молекул, то есть завивка обеспечивается образованием химической связи Очень важна лекарственная роль цистеина.N-Ацетилцистеин используется в качестве средства от кашля (препарат АСС), цистеином лечат колиты и потерю волос у женщин. В основе андрогенного облысения лежат мужские гормоны, а у женщин поте-ря волос чаще всего связана с недостатком серы в пище (диеты). Однако гораздо важ-нее участие цистеина в образовании трипептида глютатиона – регулятора окисли-тельно-восстановительных процессов, антиоксиданта и нейтрализатора ксенобиотиков с алкилирующей способностью (здесь используется высокая нуклеофильность атома серы в сульфгидрильной группе). Недостаток глютатиона в организме приводит к возникновению злокачественных опухолей, к обострению сердечно-сосудистых заболе-ваний, диабету и артритам. Есть данные о применении глютатиона в терапии ВИЧ-инфекций. Очень важно, чтоN-ацетилцистеин повышает уровень глютатиона даже больше, чем прием этого более дорогого трипептида. Одно из современных средств для лечения злокачественных новообразований – реконкостат – представляет собой композицию из цистеина, глютатиона и антоциановых красителей.
Цистеин является также исходным продуктом для образования небелковой аминокис-лоты таурина, Н2NCH2CH2SO3H, который регулирует транспорт субстратов через клеточные мембраны. Недостаток таурина вызывает болезни сердца, судорожные припадки и нарушения зрения.
Кроме приведенных двадцати аминокислот, получивших общее обозначение белковых, белки могут также содержать и некоторые другие аминокислоты. Так, например, в состав белка соединительной ткани коллагена входят 5-гидроксилизин и 4‑гидрок-сипролин, а участвующий в свертывании крови белок протромбин содержит ‑карб-оксиглютаминовую кислоту. Необычные аминокислоты могут входить в состав пепти-дов: антибиотик – циклический декапептид грамицидин С (S) – включает две молекулы орнитина (эта аминокислота образуется при гидролитическом отщеплении мочевины от аргинина) и две молекулыD-фенилаланина, в составе многих антибиотиков есть‑аминоизомасляная кислота. В состав витамина фолиевой кислоты входит 4-амино-бензойная кислота, а другой витамин – пантотеновая кислота – содержит‑аланин.
Многие небелковые аминокислоты (их известно около 300) токсичны. Чаще всего их токсичность основана на подобии белковым аминокислотам. Системы биосинтеза встраивают их в пептидную цепь вместо соответствующих белковых аминокислот, что приводит к образованию аномальных белков. Таковы например пары азетидин-2-кар-боновая кислота и пролин, аланин или валин и цианаланин, аргинин и его 6-оксааналог. В трипептидном антибиотике SF-1293 содержится аминокислота фосфинотрицин – фосфинатный аналог глютаминовой кислоты. Эта необычная аминокислота нарушает обмен аммиака в растениях, так как она прочно связывается с ферментом, предназна-ченным для перевода глютаминовой кислоты в глютамин, но при этом не превращается в соответствующий амид. Синтетический фосфинотрицин (его другое название глюфо-синат) является действующим началом экологически чистого гербицида БАСТА, а про-изводимый микробиологическим путемSF-1293 входит в состав гербицида биалафоса.
Организм человека не содержит биохимических систем, синтезирующих аргинин, гистидин, валин, лейцин, изолейцин, лизин, метионин, фенилаланин, треонин, триптофан.Эти аминокислоты обязательно должны поступать с пищей и их называют незаменимыми. При поступлении в организм достаточного количества фенилаланина он может превращаться в тирозин и покрывать потребность и в этой аминокислоте, а цистеин можно относить к заменимым аминокислотам только в том случае, когда пища содержит достаточное количество метионина.
С учетом этого условия к заменимым аминокислотам относится аланин, аспарагино-вая кислота, аспарагин, глютаминовая кислота, глютамин, цистеин, глицин, пролин, серин и тирозин.
Недостаток аминокислот в пище и дефицит незаменимых аминокислот приводят к сни-жению уровня белков в крови, что сопровождается замедлением образования белков в организме. Интересно, что при этом перестают вырабатываться и пищеварительные ферменты (они ведь тоже имеют белковую природу) и тогда прекращаются пищевари-тельные процессы, то есть недостаток аминокислот приводит к сокращению их поступ-ления даже в тех случаях, когда они есть в пище, но в неполноценном составе или в дефиците. Дефицит цистеина, особенно на фоне алкогольной интоксикации, вызывает некроз печени, при недостаточном поступлении гистидина и триптофана развивается катаракта, а недостаток лизина и метионина приводит к анемии. Отечные явления наб-людаются при дефиците треонина (человек «пухнет» от голода). При исключении бел-ков из рациона организм человека начинает терять до 25 г аминокислот в день, то есть замена белковых компонентов организма новыми (как бы разбор белков на запчасти) идет так, что остаются «лишние» детали. Обычно полноценная пища с достаточным количеством белков животного происхождения покрывает потребности в незаменимых аминокислотах, но в отдельных случаях, как отмечалось выше, их поступление в организм должно быть повышено.
Очень важен баланс белков пищи по аминокислотному составу. Если в потребляемой пище сильно занижено содержание даже одной какой-либо незаменимой аминокисло-ты, то все остальные аминокислоты не могут быть ассимилированы и тогда они идут на обеспечение энергетических потребностей или превращаются в жиры. При составлении рациона кормов для скота это отражается в непроизводительном расходовании белко-вой компоненты. Стоит восполнить недостаток в корме нескольких граммов такой дефицитной аминокислоты и привесы откармливаемого скота резко возрастают. В свя-зи с этим для кормовых и лекарственных целей (пищевые добавки) существует многотоннажный синтез двух аминокислот – лизина (микробиологическим путем) и метионина, который синтезируют из акролеина.
Что касается питания человека, то здесь следует принимать во внимание, что наиболее чувствительны к дефициту незаменимых аминокислот дети (квашиоркор – недостаток белковой пищи у детей, слово из африканского языка суахили), но для нормального обмена веществ и взрослые должны получать с пищей немного менее 1 г белков с оптимальным составом аминокислот на 1 кг веса тела в день. Более всего близки к оптимальному составу аминокислот белки яиц и молока. В растительной пище и в соединительной ткани животных чаще всего отсутствуют триптофан, лизин и метио-нин. Так, например, в картофеле понижено содержание триптофана и метионина, и для покрытия дефицита по этим аминокислотам человеку весом около 70 кг приходилось бы съедать 6 кг картофеля в день. Очень богаты белками семена бобовых, но они дефицитны по лизину, а кукуруза содержит сравнительно много лизина и мало трипто-фана. Комбинирование бобов и кукурузной муки (индейское блюдо суккоташ) позво-ляет резко сократить общее потребление этих продуктов питания, поскольку аминокис-лотный состав комбинированной смеси более близок к идеальному, а энергетические потребности покрываются углеводными составляющими продукта.
studfiles.net
