Выделение и растворимость клейковины
Неочищенную вязкую клейковину обычно выделяют из муки осторожным отмыванием простого водно-мучного теста в воде или в разбавленном солевом растворе до удаления из довольно упругой, резиноподобной массы большей части крахмала. Известно, что на количество и свойства получаемой клейковины влияет ряд факторов, к которым относятся свойства и количество солей в промывном растворе, температура, длина периода отлежки между замесом теста и отмыванием клейковины, различия в применяемых методах и, что наиболее важно, различия в используемой муке.
Систематическое обсуждение этих факторов представлено в статьях Дилла и Алсберга и Фишера и Хэлтона.
Выделенная этим обычным способом клейковина в действительности представляет собой грубую смесь веществ и является артефактом. Около 2/3 этой массы составляет гидратационная вода. Сухое вещество содержит, в зависимости от тщательности отмывки, от 75 до 85% белка и от 5 до 10% липидов. Эти липиды связываются с белковыми компонентами в процессе приготовления из муки теста и не могут рассматриваться как нормальные компоненты клейковины.
Хотя неочищенный клейковинный студень чувствителен к теплу и к денатурирующим воздействиям различных химических веществ, он может быть легко высушен без потери исходной способности к набуханию и хлебопекарных свойств. В лабораторных условиях для этого обычно используют лиофильную сушку или сушку при комнатной температуре на воздухе или с помощью вакуум-сушильного шкафа. В промышленных условиях клейковину можно высушивать в вакууме, а также в распыленном состоянии или даже в барабанной сушилке, однако в последнем случае необходимо добавлять некоторые защитные агенты, например уксусную кислоту, для предохранения препаратов от денатурации.
В сухом виде клейковина довольно устойчива, хотя присутствующие в ней жировые вещества со временем обычно прогоркают. В сыром виде или в растворе клейковина подвергается постепенному расщеплению присутствующими в ее массе протеазами, если предварительно они не подвергались денатурации путем кратковременной тепловой обработки для стабилизации клейковины. Однако даже и при наличии такой тепловой обработки медленная деградация клейковины все-таки продолжается.
Неочищенную клейковину можно более или менее полно диспергировать в разбавленных растворах ряда кислот и щелочей в присутствии спиртов или без них и в более концентрированных растворах таких веществ, как мочевина, гуанидин, салицилат натрия и поверхностно-активные вещества. Однако ни один из этих растворителей не является вполне удовлетворительным. Растворы щелочей могут вызывать необратимые изменения свойств клейковины, по-видимому, вследствие разрыва дисульфидных мостиков; так, нейтрализация сильно щелочного раствора клейковины приводит к выделению сероводорода, присутствие которого легко обнаруживается по характерному запаху. Мочевина, гуанидин и детергенты вызывают желатинизацию и дисперсию крахмала, мешая его легкому отделению от белка.
Мочевина, гуанидин и детергенты вызывают желатинизацию и дисперсию крахмала, мешая его легкому отделению от белка.
Однако, если препараты лишены крахмала, перечисленные вещества сохраняют свое значение для физико-химических исследований. Помимо того что растворы салицилата вызывают дисперсию крахмала, его анионы, по-видимому, соединяются с белком таким образом, что стирают электрофоретические и другие различия между этими веществами. Поэтому при использовании указанных растворителей и интерпретации полученных с их помощью результатов всегда необходима известная осторожность. Кроме того, все эти растворы могут вызывать неуловимые изменения в клейковине, которые могут проявиться только при хлебопекарных испытаниях.
В качестве растворителя при работе с клейковиной, как правило, используют разбавленную кислоту, обычно уксусную, хотя часто применяют также муравьиную и молочную кислоты. Растворы клейковины в 0,01—0,1 н. уксусной кислоте до 5%-ной концентрации легко получить путем встряхивания клейковины в растворителе, причем для лучшего ее диспергирования необходимо энергичное перемешивание, например с помощью механической мешалки.

Из растворов клейковины в кислотах путем добавления солей в присутствии (или без) спирта или путем нейтрализации растворяющей кислоты можно получить различающиеся по своему составу фракции. На количество осаждающегося белка влияют следующие факторы: рН, количество соли, концентрация белка и время. При добавлении к исходной дисперсии приблизительно равного объема этилового спирта при обычной температуре соль почти не вызывает осаждения, однако при постепенном понижении температуры происходит дробное осаждение.
Фракции с варьирующей растворимостью и другими свойствами можно получить также при постепенном добавлении сульфата магния к раствору клейковины в 8—10%-ном салицилате натрия. Хогард и Джонсон получили целую систему фракций из спиртовых растворов глиадина путем осаждения при низкой температуре и вспенивания.
Специфические свойства растворимости глиадина приписывают присутствию на поверхности его молекул незначительного количества ионизируемых групп. Несмотря на значительную способность к набуханию, глиадин при значениях рН, близких к нейтральному, обнаруживает заметную тенденцию к аггрегации за счет межмолекулярных водородных связей. Хотя вода не может успешно конкурировать с силами поперечных связей (для перевода глиадина в молекулярный раствор), оказывается достаточным приложить к белку небольшой заряд (например, титруя его раствор при рН ниже 4), чтобы сдвинуть равновесие сил в направлении увеличения притяжения к воде до такой степени, когда молекулы могут перейти в раствор. Увеличение ионной силы снижает эффективность приложенного заряда и меняет тенденцию глиадина к диспергированию в пользу сил интермолекулярного притяжения, существующих между этими белковыми молекулами. Спирты, мочевина, формамид и другие соединения, которые более, чем вода, способствуют образованию водородных связей, конкурируют с межмолекулярными водородными связями глиадина, делая растворимость белка гораздо менее чувствительной к ионной силе. Силы гидрофобного притяжения между неполярными боковыми цепями глиадина и другими молекулами клейковины также должны способствовать их нерастворимости в нейтральной водной среде. Связи такого типа обычно легче, чем «водородные» связи, разрушаются менее полярными растворителями, чем вода.
Хотя вода не может успешно конкурировать с силами поперечных связей (для перевода глиадина в молекулярный раствор), оказывается достаточным приложить к белку небольшой заряд (например, титруя его раствор при рН ниже 4), чтобы сдвинуть равновесие сил в направлении увеличения притяжения к воде до такой степени, когда молекулы могут перейти в раствор. Увеличение ионной силы снижает эффективность приложенного заряда и меняет тенденцию глиадина к диспергированию в пользу сил интермолекулярного притяжения, существующих между этими белковыми молекулами. Спирты, мочевина, формамид и другие соединения, которые более, чем вода, способствуют образованию водородных связей, конкурируют с межмолекулярными водородными связями глиадина, делая растворимость белка гораздо менее чувствительной к ионной силе. Силы гидрофобного притяжения между неполярными боковыми цепями глиадина и другими молекулами клейковины также должны способствовать их нерастворимости в нейтральной водной среде. Связи такого типа обычно легче, чем «водородные» связи, разрушаются менее полярными растворителями, чем вода.
Было предпринято много попыток выделения из клейковины и глиадина воспроизводимых и гомогенных фракций с использованием различных сочетаний солей, кислот, спиртов и т. д., однако до последнего времени не было надежного критерия для оценки успеха таких исследований. Тем не менее, было показано, что действительное отделение глютенина от глиадиновых компонентов может быть достигнуто повторным доведением рН раствора клейковины в 70%-ном этаноле, в разбавленной кислоте или буферах с низким рН до определенного значения. Так, например, глютенин выпадает в осадок из алюминий-лактатного буфера (рН 3,5), когда рН доводят до величины 4,6; повторение этого приема позволяет получить препарат, по существу свободный от глиадина. Однако наилучшие результаты получаются, по-видимому, путем создания определенного рН раствора клейковины в 0,1 н.
Глютенин и глиадины могут быть разделены также с помощью методов гелевой фильтрации. С помощью ионообменной хроматографии на колонках из карбоксиметилцеллюлозы (КМЦ) Войчик, Димлер и Сенти получили высокоочищенные отдельные компоненты клейковины, что подтверждено исследованием их электрофоретических и адсорбционно-элюционных свойств. Клейковину, растворенную в 0,01 н. уксусной кислоте (рН 3,4), адсорбировали на уравновешенной колонке из КМЦ и элюировали путем изменения рН элюирующего буфера, которое осуществляется добавлением к исходному буферу соляной кислоты, чтобы получить значения рН от 3,4 до 1,5. Градиентной элюцией не удалось выделить элюируемый белок в виде отдельных хроматографических пиков, хотя электрофоретическое исследование выбранных наугад фракций показало постепенное изменение состава их компонентов. Окончательная очистка компонентов завершалась повторным хроматографированием основных фракций в тех же самых системах. Состав фракции исследовали с помощью электрофореза с подвижными границами в алюминий-лактатном буфере (рН 3,1) при ионной силе, равной 0,1.
В связи с тем, что образование неочищенного клейковинного студня, выделенного из теста с помощью общепринятой методики отмывания, может быть артефактом, многие исследователи пытались экстрагировать компоненты клейковины прямо из муки, предварительно обезжиренной и промытой разбавленными растворами солей для удаления растворимых белков. Сравнение на крахмальном геле электрофоретических свойств компонентов клейковины, выделенных из клейковинного студня или из промытой буфером муки, в основных чертах показало сходство глиадиновых компонентов. Трудность извлечения малорастворимого белка из муки осложняла сравнение глютенинового компонента. Как уже указывалось, при осветлении разбавленных растворов клейковины, перед их изучением, путем центрифугирования оседает от 10 до 15% белковых веществ. В настоящее время нет определенного мнения относительно свойств этой части клейковины, что представляет пробел в имеющихся в нашем распоряжении сведениях о белках клейковины. Сравнение электрофоретических свойств клейковины, полученной из фракций муки, богатых промежуточным и прикрепленным белком, показало, что эти фракции электрофоретически идентичны и присутствуют в тех же относительных концентрациях.
Сравнение на крахмальном геле электрофоретических свойств компонентов клейковины, выделенных из клейковинного студня или из промытой буфером муки, в основных чертах показало сходство глиадиновых компонентов. Трудность извлечения малорастворимого белка из муки осложняла сравнение глютенинового компонента. Как уже указывалось, при осветлении разбавленных растворов клейковины, перед их изучением, путем центрифугирования оседает от 10 до 15% белковых веществ. В настоящее время нет определенного мнения относительно свойств этой части клейковины, что представляет пробел в имеющихся в нашем распоряжении сведениях о белках клейковины. Сравнение электрофоретических свойств клейковины, полученной из фракций муки, богатых промежуточным и прикрепленным белком, показало, что эти фракции электрофоретически идентичны и присутствуют в тех же относительных концентрациях.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
стоит ли его опасаться? / Блог / Клиника ЭКСПЕРТ
В последние годы набирает популярность тема «глютен и его вред для организма» в различных интерпретациях. Врачи и люди далекие от медицины, блогеры, телеведущие обсуждают потенциальный вред глютена для здоровья человека. Статей, книг, видеороликов создано столько, что обычному человеку легко запутаться и принять за истину спорные, а порой и ложные сведения.
Врачи и люди далекие от медицины, блогеры, телеведущие обсуждают потенциальный вред глютена для здоровья человека. Статей, книг, видеороликов создано столько, что обычному человеку легко запутаться и принять за истину спорные, а порой и ложные сведения.
В этой статье мы постараемся разобраться в вопросе возможного вреда глютена для желудочно-кишечного тракта.
Что такое глютен?Глютен представляет собой группу белков, которые вместе с крахмалом находятся в составе зерна некоторых злаков (пшеница, рожь, ячмень и родственные им виды и гибриды, включая полбу, тритикале и т.д.). Именно глютен (который также называют клейковиной) придает тесту тягучесть и эластичность. В пшеничном хлебе, например, 80% белков – это глютен. В пасте (макаронах) этот процент ниже. В настоящее время глютен находится во многих пищевых продуктах, а также в косметике, средствах по уходу за волосами и даже в лекарственных препаратах.
Глютен и желудочно-кишечные заболевания
Почему же внимание приковано именно к глютену, а не к другим белкам? Доказано, что существует несколько заболеваний, связанных с употреблением глютена. Прежде всего, это желудочно-кишечные заболевания, такие как целиакия и повышенная чувствительность к глютену. Кроме того, известно такое неврологическое заболевание, как глютеновая атаксия, а врачи-дерматологи могут столкнуться с герпетиформным дерматитом Дюринга. Отдельно следует отметить аллергию на пшеницу (не на глютен!).
Прежде всего, это желудочно-кишечные заболевания, такие как целиакия и повышенная чувствительность к глютену. Кроме того, известно такое неврологическое заболевание, как глютеновая атаксия, а врачи-дерматологи могут столкнуться с герпетиформным дерматитом Дюринга. Отдельно следует отметить аллергию на пшеницу (не на глютен!).
Целиакия – это заболевание, для которого характерна генетически предопределенная неспособность организма расщеплять в тонкой кишке глютен на более простые компоненты. Не до конца расщепленные фрагменты глютена вызывают повреждение слизистой оболочки тонкой кишки с развитием ее атрофии и нарушением всасывания различных питательных веществ. В разных странах частота встречаемости целиакии отличается, варьируя от 0,4% населения в странах Южной Америке до 0,8% в Европе и Океании. Данные об истинной распространенности целиакии в России отсутствуют.
В клинической картине заболевания преобладают нарушения стула (частый и неоформленный, реже нормальный стул или даже запор), снижение массы тела и развитие дефицитных состояний – железодефицит, дефицит витаминов, кальция, белка и т. д.
д.
Всем пациентам с установленным диагнозом целиакия назначается строгая пожизненная безглютеновая (аглютеновая) диета. Поскольку именно глютен (и только он!) оказывает повреждающее действие на слизистую оболочку кишки, исключение этого провоцирующего фактора из рациона в подавляющем большинстве случаев приводит к полному восстановлению слизистой кишки.
Герпетиформный дерматит Дюринга — нечастое кожное проявление, ассоциированное с целиакией и характеризующееся воспалением кожи. Это заболевание отмечается у 4% пациентов с целиакией и также требует отказа от глютена. Аглютеновая диета высокоэффективна в лечении этого заболевания и должна соблюдаться пожизненно.
Глютеновая атаксия – одна из наиболее распространенных атаксий в мире. Атаксии – это группа заболеваний, характеризующихся нарушением согласованности движений при отсутствии мышечной слабости. Глютеновая атаксия может встречаться изолированно или одновременно с поражением тонкой кишки в рамках целиакии. При этом заболевании в крови выявляются те же маркеры, что и при целиакии, а эффект от аглютеновой диеты наблюдается у большинства больных.
При этом заболевании в крови выявляются те же маркеры, что и при целиакии, а эффект от аглютеновой диеты наблюдается у большинства больных.
Вот, пожалуй, основные заболевания, при которых глютен оказывает непосредственное повреждающее действие на организм с развитием иммунного воспаления, нередко приводя к инвалидизации. В этих случаях пациентам необходимо соблюдение строгой пожизненной диеты с исключением даже небольшого количества глютена является обязательным! Исключаются не только продукты с явным глютеном (крупы, макароны, мука, хлебо-булочные изделия из запрещенных злаков), но также и т.н. «скрытый глютен», который в виде примесей содержится во многих промышленно произведенных продуктах питания, лекарственных средствах и косметике.
Еще одно заболевание, связанное с глютеном, имеет сложное длинное название: повышенная чувствительность (гиперчувствительность) к глютену, не связанная с целиакией. Этот диагноз врачи всего мира стали выделять не так давно, поэтому оно отсутствует в отечественных классификациях заболеваний и медицинских справочниках.
Этот диагноз врачи всего мира стали выделять не так давно, поэтому оно отсутствует в отечественных классификациях заболеваний и медицинских справочниках.
Что это за болезнь? За долгое время наблюдения за гастроэнтерологическими пациентами было установлено, что некоторые из них отмечают появление симптомов при употреблении продуктов, содержащих глютен. Через некоторое время после приема пищи с глютеном такие лица жалуются на боли в животе, послабление стула, тошноту и повышенное газообразование. Также могут отмечаться головная боль, боль в мышцах, кожная сыпь и другие внекишечные проявления заболевания. При этом у них отсутствуют признаки целиакии и аллергия на пшеницу. Исключение глютена из пищи быстро приводит к нормализации состояния и исчезновению симптомов. Повторное введение глютенсодержащих продуктов в рацион ведет к повторению жалоб.
По всей видимости, именно это заболевание/состояние порой неверно называется «аллергией на глютен». Как часто встречается гиперчувствительность к глютену? По разным данным в среднем 10% лиц по всему миру предъявляют гастроэнтерологические жалобы после употребления в пищу продуктов с глютеном. Иногда это истинная реакция на глютен, но порой пациенты просто связывают появление жалоб с употреблением глютена, а никакой гиперчувствительности у них нет.
Иногда это истинная реакция на глютен, но порой пациенты просто связывают появление жалоб с употреблением глютена, а никакой гиперчувствительности у них нет.
Как это удалось установить? В настоящее время имеются результаты плацебо-контролируемых исследований, в которых пациентам давали либо глютен, либо «пустышку» (плацебо). Ни в одном из этих исследований пациент не знал, что именно он принимает. Оказалось, что пациенты, которые получали плацебо, до 40% случаев отмечали появление типичных симптомов (как будто употребляли глютен) или их усиление. Такой эффект в медицине называется ноцебо – появление негативной реакции на плацебо.
Итак, не все случаи плохой переносимости глютен-содержащих продуктов, свидетельствует об истинной гиперчувствительности к глютену. Иногда это лишь следствие ожидания негативной реакции.
Одной из особенностей истинной гиперчувствительности к глютену является факт появления симптомов при употреблении в пищу значительного количества глютена. Обычно это несколько граммов: 4-8 г и более в сутки. Это кардинальным образом отличается от целиакии и вышеописанных заболеваний, для которых несколько миллиграммов глютена уже являются опасными.
Это кардинальным образом отличается от целиакии и вышеописанных заболеваний, для которых несколько миллиграммов глютена уже являются опасными.
Гиперчувствительность к глютену, в отличие от целиакии, обычно не прогрессирует и не приводит к развитию осложнений, однако может снижать качество жизни пациентов.
Отдельно следует рассмотреть аллергическую реакцию на пшеницу, которая также может вызывать появление гастроэнтерологических симптомов. Для этого состояния характерно выявление в крови специфических IgE к пшенице, а симптомы не развиваются при употреблении в пищу других злаков.
Наконец, у части лиц якобы «реакция на глютен» обусловлена наличием в глютенсодержащих злаках (пшенице, ржи, ячмене) некоторых ферментируемых углеводов, которые сами по себе могут вызвать появление симптомов. Это так называемые FODMAP-углеводы, о которых мы рассказывали в отдельной статье.
Стоит ли исключать глютен из рациона для профилактики развития симптомов?1) полностью исключить необходимо пациентам, у которых доказаны следующие заболевания: целиакия, глютеновая атаксия, герпетиформный дерматит Дюринга.
2) ограничить употребление глютена следует лицам с гиперчувствительностью глютена, у которых употребление пищи, содержащей глютен, достоверно вызывает появление желудочно-кишечных жалоб.
3) пациентам с пищевой аллергией на пшеницу следует исключить только пшеницу и продукты из нее, сохранив в рационе другие злаки.
4) изучается роль аглютеновой диеты при некоторых других заболеваниях (например, аутизм), однако эффективность ее пока не доказана.
Следует помнить, что самостоятельное, безосновательное, не контролируемое врачом-диетологом или нутрициологом соблюдение аглютеновой диеты может нанести вред организму!
Это, увы, не останавливает любителей «посидеть» на аглютеновой диете для здоровья или снижения массы тела. Так, в США в 2015 год был проведен опрос, в котором 25% участников сообщили об употреблении продуктов без глютена. По данным опроса 0,9% аргентинцев соблюдают аглютеновую диету для контроля массы тела и «общего здоровья». Исследование из Австралии (2015 год) показало, что среди 1304 опрошенных лиц 168 человек (13%!) исключили глютен для «общего здоровья» и 109 человек (8,4%!) для снижения массы тела.
Исследование из Австралии (2015 год) показало, что среди 1304 опрошенных лиц 168 человек (13%!) исключили глютен для «общего здоровья» и 109 человек (8,4%!) для снижения массы тела.
При этом многочисленные исследования показывают, что пациенты, соблюдающие аглютеновую диету, могут иметь нежелательные изменения массы тела – прибавку или, напротив, потерю веса. Это обычно сопровождается дефицитами микроэлементов, витаминов, нарушением баланса фракций холестерина и т.д. Известны работы, в которых выявлено повышение уровней токсичных металлов (ртуть, мышьяк) в биологических жидкостях человека на фоне соблюдения аглютеновой диеты. По мнению авторов это связано с преобладанием в рационе риса, коммерческие образцы которого могут содержать эти тяжелые металлы.
Обычно побочные эффекты от аглютеновой диеты развиваются ввиду недостатка знаний пациента о правилах формирования рациона питания без глютена.
И, наконец, научно доказано: здоровым лицам или лицам, не имеющих описанные выше диагнозы, глютен не наносит вред! Он не повреждает кишечник, он не вызывает развитие т. н. «дырявого кишечника», он не приводит к отравлению организма.
н. «дырявого кишечника», он не приводит к отравлению организма.
ЧТО ТАКОЕ ГЛЮТЕН? — Школа здоровья — ГБУЗ Городская поликлиника 25 г. Краснодара МЗ КК
10 августа 2017 г.
Глютен в кетчупе
Кроме этого, часто глютен содержится во многих продуктах, куда его добавляют искусственно, чтобы повысить эластичность остальной массы, придать ей форму. Он может входить в кетчупы, заправки, всевозможные подливки, чипсы, конфеты, мороженое, соевые соусы, бульонные кубики, замороженные овощи, а также ресторанный картофель фри и витамины в капсулах и таблетках.
Технология выделения глютена из зерна дешевая. Глютен практически не растворяется в воде, и чтобы получить его, пшеничную муку замешивают в воде – крахмал постепенно переходит в раствор, остается лишь нерастворимая фракция (глютен), которую затем осаждают и используют для промышленного производства.
Будьте внимательны к таким надписям на этикетках, как: “модифицированный пищевой крахмал”, “гидролизованный растительный белок” и “текстурированный растительный белок”. Под всем этим подразумевается глютен.
Под всем этим подразумевается глютен.
Он может входить даже в косметические средства. В первую очередь это касается губной помады и пудры. Также стоит обращать особое внимание на состав лосьонов для тела и кремов. Во многие косметические средства входит витамин “Е”, который обычно получают из пшеницы. Это означает, что все они могут содержать глютен, хотя этикетки будут об этом стыдливо умалчивать.
Через кожу глютен не всасывается, но всегда есть шанс, что косметическое средство, которое его содержит (например, помада), попадёт в организм, и тогда у людей с непереносимостью глютена будут проблемы.
Чем же так вреден глютен?
В организме людей с генетической предрасположенностью на одну из фракций глютена (глиадины) развивается воспалительная реакция. У больных целиакией система иммунитета распознает этот белок как чужеродный и атакует его всеми доступными средствами. Беда в том, что под удар попадает не только глютен, но и те ткани, в которых его встретили иммунные клетки. В первую очередь повреждаются стенки тонкого кишечника.
В первую очередь повреждаются стенки тонкого кишечника.
Помимо пищевого тракта страдают мозг, сердце, суставы и другие органы. Кроме того, у многих наблюдается скрытая непереносимость глютена. Симптомы слабо выражены и только в комплексе могут натолкнуть врача на правильный диагноз, который должен быть подтвержден специальной пробой.
Несмотря на то, что целиакия поражает лишь 1% населения, по некоторым оценкам у каждого третьего наблюдают те или иные иммунные реакции на глютен. Самое печальное, что во многих случаях анализ на переносимость белка не даст четкого ответа.
Однако подмечено, что многие хронически больные люди с неясным диагнозом после перехода на безглютеновую диету чувствуют себя намного лучше.
Непереносимость глютена у здоровых людей
Почему же проблема непереносимости или чувствительности глютена стоит так остро в наши дни? Дело в том, что та пшеница, которую употребляет в пищу современный человек, очень сильно отличается от той, которую ели наши предки. Последователи Мичурина на протяжении двух последних столетий специально отбирали сорта пшеницы в сторону повышенного содержания белка, а значит и глютена.
Последователи Мичурина на протяжении двух последних столетий специально отбирали сорта пшеницы в сторону повышенного содержания белка, а значит и глютена.
Неудивительно, что за последние 200 лет частота целиакии в людской популяции выросла на 400%.
С другой стороны человеческий организм не очень хорошо приспособлен для переваривания зерна – основной пищи птиц, у которых имеются все нужные ферменты для этого.
Если вас беспокоит частая боль в животе, нарушения стула, общая слабость, анемия, и вы подозреваете у себя скрытую непереносимость глютена, то пробная диета с исключением продуктов, его содержащих, поможет определится с верным диагнозом.
Однако помните, что безглютеновая диета относится к лечебным, а не к гипокалорийным. Похудеть с ее помощью без дополнительных ограничений хоть и можно, но сложно.
Да, если полностью исключить мучное, вы начнете худеть. Но если вы будете покупать специальные безглютеновые продукты, ваши надежды на снижение веса могут не оправдаться. Многие безглютеновые продукты содержат значительно больше калорий и насыщенных жиров, чем их обыкновенные аналоги. Производители пытаются сделать гречневое печенье похожим на пшеничное и добавляют чрезмерное количество сахара. Калорийность мы можете посмотреть на упаковке. Безглютеновые продукты продаются в больших супермаркетах рядом с заменителями сахара и продуктам для диабетиков.
Многие безглютеновые продукты содержат значительно больше калорий и насыщенных жиров, чем их обыкновенные аналоги. Производители пытаются сделать гречневое печенье похожим на пшеничное и добавляют чрезмерное количество сахара. Калорийность мы можете посмотреть на упаковке. Безглютеновые продукты продаются в больших супермаркетах рядом с заменителями сахара и продуктам для диабетиков.
выделение документов к уничтожению — это… Что такое выделение документов к уничтожению?
- выделение документов к уничтожению
выделение документов к уничтожению
Выявление в процессе экспертизы научной и практической ценности документов с истекшими сроками хранения, утративших практическое, научное или общественное значение, и отбор их к уничтожению.
[ГОСТ Р 51141-98]Тематики
- делопроизводство и архивное дело
Обобщающие термины
- организация документов Архивного фонда Российской Федерации
Справочник технического переводчика.
 – Интент.
2009-2013.
– Интент.
2009-2013.- выделение глютена
- выделение дополнительных средств
Выделение документов к уничтожению — 98 ВЫДЕЛЕНИЕ ДОКУМЕНТОВ К УНИЧТОЖЕНИЮ: Выявление в процессе экспертизы научной и практической ценности документов с истекшими сроками хранения, утративших практическое, научное или общественное значение, и отбор их к уничтожению… Источник: ГОСТ … Официальная терминология
выделение документов к уничтожению — 98 выделение документов к уничтожению: Выявление в процессе экспертизы научной и практической ценности документов с истекшими сроками хранения, утративших практическое, научное или общественное значение, и отбор их к уничтожению Источник: ГОСТ Р… … Словарь-справочник терминов нормативно-технической документации
ВЫДЕЛЕНИЕ ДОКУМЕНТОВ К УНИЧТОЖЕНИЮ — согласно ГОСТ Р 51141– 98 «Делопроизводство и архивное дело.
 Термины и определения», – выявление в процессе экспертизы научной и практической ценности документов с истекшими сроками хранения, утративших практическое, научное или общественное… … Делопроизводство и архивное дело в терминах и определениях
Термины и определения», – выявление в процессе экспертизы научной и практической ценности документов с истекшими сроками хранения, утративших практическое, научное или общественное… … Делопроизводство и архивное дело в терминах и определенияхвыделение — 3.1.5 выделение (outgassing): выделение материалом газов или паров. Источник: ГОСТ Р ИСО 14644 8 2008: Чистые помещения и связанные с ними контролир … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р 51141-98: Делопроизводство и архивное дело. Термины и определения — Терминология ГОСТ Р 51141 98: Делопроизводство и архивное дело. Термины и определения оригинал документа: 21 автор документа: Физическое или юридическое лицо, создавшее документ Определения термина из разных документов: автор документа 77 архив… … Словарь-справочник терминов нормативно-технической документации
система — 4.48 система (system): Комбинация взаимодействующих элементов, организованных для достижения одной или нескольких поставленных целей.
 Примечание 1 Система может рассматриваться как продукт или предоставляемые им услуги. Примечание 2 На практике… … Словарь-справочник терминов нормативно-технической документации
Примечание 1 Система может рассматриваться как продукт или предоставляемые им услуги. Примечание 2 На практике… … Словарь-справочник терминов нормативно-технической документацииМедицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Поземельная община — Содержание: I. П. община в Западной. Европе. II. П. община в Византии. III. П. община во внеевропейских странах. IV. П. община в Древней Руси и в Великороссии. V. П. община в Малороссии и в Литве. VI. П. община (современное положение; вопрос о П … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Поземельная община — Содержание: I. П. община в Западной. Европе. II. П. община в Византии. III. П. община во внеевропейских странах.
 IV. П. община в Древней Руси и в Великороссии. V. П. община в Малороссии и в Литве. VI. П. община (современное положение; вопрос о П … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
IV. П. община в Древней Руси и в Великороссии. V. П. община в Малороссии и в Литве. VI. П. община (современное положение; вопрос о П … Энциклопедический словарь Ф.А. Брокгауза и И.А. ЕфронаНПА:Кодекс Российской Федерации об административных правонарушениях:Раздел II — (в редакции, действующей по состоянию на 25.11.2013) Кодекс Российской Федерации об административных правонарушениях ГАРАНТ … Бухгалтерская энциклопедия
Смотреть что такое «выделение документов к уничтожению» в других словарях:
Непереносимость глютена | Симптомы, диагностика и лечение
Чувствительность к глютену и пшенице представляет собой неаллергическое функциональное расстройство, вызванное непереносимостью глютена.
Организм человека, обладающего повышенной чувствительностью к глютену и пшенице, реагирует на глютен или другие компоненты пшеницы с проявлением очень неспецифических симптомов. При этом такие люди не больны целиакией и не имеют аллергии на пшеницу. С учетом отсутствия специфических биомаркеров для чувствительности к глютену и пшенице, этот вид непереносимости глютена диагностируется методом исключения.
С учетом отсутствия специфических биомаркеров для чувствительности к глютену и пшенице, этот вид непереносимости глютена диагностируется методом исключения.
Гиперчувствительность к глютену или пшенице может возникнуть внезапно и в любом возрасте. Стоит отметить, что это состояние может быть временным, а общее самочувствие начнет улучшаться сразу после начала соблюдения безглютеновой диеты.
Симптомы чувствительности к глютену и пшенице
Симптомы чувствительности к глютену и пшенице могут быть весьма разнообразными и проявляться самыми различными способами, включая:
- боли в животе (в том числе в сочетании с ощущением жжения в верхней части живота), тошноту и рвоту, вздутие, ощущение переполнения желудка, запор и диарею
- усталость, онемение рук и ног, мышечные судороги и боль в суставах
- головную боль, недомогание, упадок сил, спутанность сознания, головокружение
- экзему, покраснение или припухлость языка
Так как многие из приведенных выше симптомов характерны и для других заболеваний, чувствительность к глютену и пшенице часто остается незамеченной и не подвергается лечению.
Диагностика чувствительности к глютену и пшенице
Отсутствие надежного биомаркера – иными словами, измеряемого показателя – для чувствительности к глютену и пшенице, а также наличие неспецифических симптомов, означают, что единственным способом диагностики этого заболевания является метод исключения. Поэтому особенно важно сперва однозначно исключить целиакию и аллергию на пшеницу, после чего перевести пациента на безглютеновую диету. Диагноз «чувствительность к глютену и пшенице» считается подтвержденным в том случае, если после начала соблюдения безглютеновой диеты состояние пациента значительно улучшается, а затем снова ухудшается при возобновлении потребления глютеносодержащей пищи.
Лечение чувствительности к глютену и пшенице
Лечение чувствительности к глютену и пшенице заключается в соблюдении безглютеновой диеты.
При этом, в отличие от целиакии, в данном случае не требуется столь строгое соблюдение этой диеты на постоянной основе. Пациент должен придерживаться безглютеновой диеты в течение не менее одного или двух лет. После этого срока он может начать постепенно добавлять в свой рацион питания глютен в небольших количествах. Переносимость глютена имеет непостоянный характер, поэтому к её включению в свой рацион необходимо подходить очень осторожно и взвешенно.
___________________________________________________________________________________________________________________________________
Вы врач или диетолог? За более подробной информацией о чувствительности к глютену и пшенице просьба обращаться в Dr. Schär Institute, который является платформой экспертов в области непереносимости глютена и безглютеновой диеты.
Что такое глютен, и почему некоторые покупают продукты без глютена?
Добрый день. Внесу некоторые дополнения в предыдущие ответы — они содержат достаточную краткую информацию о глютене.
Что такое глютен?
Это как уже было озвучено в предыдущих комментариях — это белковое вещество, точнее группа белков содержащихся в злаковых культурах. Попросту клейковина. Новомодное глютен — от латинского названия клейковины (gluten).
При каких состояниях рекомендованы продукты без глютена?
1) Целиакия — врожденное генетическая невосприимчивость к глютену. Опасность представляет риск преждевременной смерти. Статистика выживаемости — примерно 10 лет после появления первых симптомов. Поэтому для этой группы пациентов безглютеновая диета — это жизненно важный момент лечения, а не питания.
2) При нарушенной микрофлоре кишечника. Так например, синегнойная палочка «переваривает» глютен с выделением веществ, которые могут вызывать колиты, энтериты и другие восплительные процессы в кишечнике.
3) Пищевая аллергия к глютену.
Зачем нужен глютен?
Хотя единого мнения о необходимости данного белкового соединения нет, но есть доступные данные о том, что без потребления глютена подавляется нормальная микрофлора в кишечнике. А это сами понимаете, ключ к росту патологических микроорганизмов и проблемам не только к ЖКТ, но и ослаблению имунной защиты организма.
Кому интересно вот ссылка на исследование (англ.).
Влияние безглютеновой диеты на кишечную микробиоту и иммунную функцию у здоровых взрослых людей
С уважением. Надеюсь мой ответ был полезен.
P.S. В виду того, что данный ответ вызвал достаточный интерес, даже негативный. Предлагаю вашему вниманию более новый научный исследовательский документ от 2019 года.
Navigating the Gluten-Free Boom: The Dark Side of Gluten Free Diet
В настоящем обзоре обобщается темная сторона ограничения глютена, и сообщается о дефиците питательных веществ, токсичности, заболеваемости, смертности и проблемах психического здоровья.
(перевод описания англ.)
Продукты без глютена
Целиакия (глютеновая энтеропатия) — мультифакториальное заболевание, нарушение пищеварения, вызванное повреждением ворсинок тонкой кишки некоторыми пищевыми продуктами, содержащими глютен (и близкими к нему белками злаков таких злаков, как пшеница, рожь, ячмень и овёс).. Классические симптомы целиакии у детей — диарею, истощение, анемию и отставание в развитии — опубликовал в 1888 году Сэмюэль Ги, врач Бартоломеевского госпиталя в Лондоне. В 1950 году голландский педиатр Виллем Дике впервые связал причину целиакии у детей с глютеном — растворимой в алкоголе фракцией белка, содержащейся в пшенице. В 1952 году G. McIver и J. French впервые успешно применили аглютеновую диету для лечения этого заболевания.
Ранее считалось, что целиакия встречается довольно редко — с частотой 1:3000. Современные исследования населения показали, что ген, ответственный за предрасположенность к целиакии, встречается довольно часто, а само заболевание имеется примерно у 0,5-1 % населения. Типичная целиакия с тяжёлыми нарушениями всасывания действительно встречается редко. У преобладающего большинства отмечаются внекишечные проявления: железодефицитная анемия, афтозный стоматит, дерматит Дюринга, остеопороз, маленький рост, задержка полового развития, бесплодие, аутоиммунный сахарный диабет 1 типа и др. Подобная скрытая и субклиническая формы встречаются примерно на порядок чаще типичной классической целиакии.
Типичная целиакия с тяжёлыми нарушениями всасывания действительно встречается редко. У преобладающего большинства отмечаются внекишечные проявления: железодефицитная анемия, афтозный стоматит, дерматит Дюринга, остеопороз, маленький рост, задержка полового развития, бесплодие, аутоиммунный сахарный диабет 1 типа и др. Подобная скрытая и субклиническая формы встречаются примерно на порядок чаще типичной классической целиакии.
Целиакия характеризуется нарушением кишечного всасывания, суб- или атрофией слизистой оболочки тонкой кишки, положительной реакцией на аглютеновую диету (исключение из пищи продуктов из злаков, содержащих глютен). Среди клинических вариантов следует выделять истинную целиакию и синдром целиакии, который может развиться при самых разнообразных заболеваниях кишечника (аномалии развития, инфекции, продолжительный приём антибиотиков и др.). Начало целиакии нередко совпадает с введением прикормов, содержащих мучные изделия, в пищевой рацион ребенка в возрасте 6-12 мес. Этот период особенно опасен в плане провокации целиакии.
Этот период особенно опасен в плане провокации целиакии.
Контроль над глютеном — Практическое руководство
Когда вы видите муку в списке ингредиентов рецепта выпечки, одно можно сказать наверняка: вам придется иметь дело с глютеном.
Глютен — сильный, липкий, эластичный белок, который образуется при смешивании пшеничной муки и воды — замечательный продукт. Он придает структуру выпечке и помогает пшеничной муке превращаться во множество различных продуктов: пасту al dente, пушистые вафли, хрустящую выпечку, жевательный домашний хлеб. Но не для каждой выпечки требуется одинаковое количество глютена.
Структура дрожжевого теста в значительной степени зависит от глютена, поэтому его большое количество приветствуется. Вот почему, например, в своем рецепте теста для пиццы автор Питер Рейнхарт делает несколько шагов, чтобы стимулировать выработку глютена. Он использует небеленую хлебную муку, которая содержит больше белков, образующих глютен, чем универсальная мука. Он добавляет соль и много воды. И замешивает тесто несколько минут.
Он добавляет соль и много воды. И замешивает тесто несколько минут.
Однако стимулирование образования глютена — это последнее, что вам нужно делать при приготовлении выпечки с химической закваской, такой как торты, печенье и булочки, а также слоеной или нежной выпечки.(И если вы похожи на меня, вы выпекаете такие вещи гораздо чаще, чем дрожжевой хлеб.) Избыток глютена делает печенье свинцовым, блины эластичными, а пироги жесткими.
К счастью, ограничение содержания глютена — довольно простое дело. Вот четыре вещи, которые вы можете сделать.
1. Начните с правильной муки
Супермаркеты с большим ассортиментом продают разнообразную пшеничную муку: универсальную, жмых, цельнозерновую, хлебную. Вы также можете увидеть муку, приготовленную из зерен, отличных от пшеницы, — ржи, риса, кукурузы, овса, гречихи, — но они не образуют глютена или содержат мало глютена, поэтому мы не будем их здесь обсуждать.Однако все виды пшеничной муки содержат белки, образующие глютен, хотя качество и количество этих белков различаются (их количество см. В таблице ниже). То, что вы выпекаете, должно определять, какую муку вы выберете.
В таблице ниже). То, что вы выпекаете, должно определять, какую муку вы выберете.
Хлебная мука и манная крупа из твердых сортов (используется для макаронных изделий) содержат больше всего белка и образуют прочную высококачественную клейковину. Эта так называемая твердая мука идеально подходит для дрожжевого хлеба и макаронных изделий, поскольку сильная клейковина придает тяжелую структуру теста и готовому продукту приятно жевательную текстуру.
Мука для кондитерских изделий и тортов содержит меньше белка и образует более слабый глютен. Благодаря низкому содержанию слабой клейковины эта «мягкая мука» дает более нежный продукт, поэтому обычно ее лучше использовать для тортов, печенья, печенья и многих других пирожных.
Верная своему названию, универсальная мука — достойный выбор практически для всего. Хотя универсальная мука редко используется в пекарнях, она имеет среднее содержание белка, что позволяет ей хорошо работать в большинстве рецептов, которые захотел бы приготовить домашний пекарь.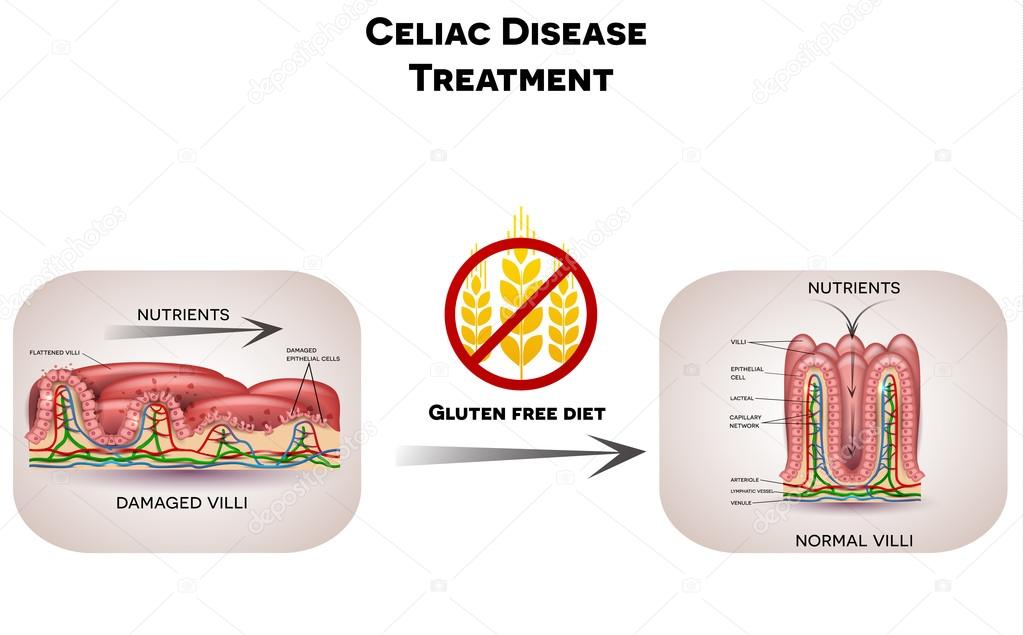 Конечно, пирожные, приготовленные из муки для выпечки, могут быть более нежными, а буханки, приготовленные из хлебной муки, могут подниматься выше, но различия тонкие.
Конечно, пирожные, приготовленные из муки для выпечки, могут быть более нежными, а буханки, приготовленные из хлебной муки, могут подниматься выше, но различия тонкие.
Цельнозерновая мука, кстати, с очень высоким содержанием глютен-образующего белка, но это не лучший выбор для высокого дрожжевого хлеба, потому что осколки отрубей в муке разрывают нити клейковины, препятствуя ее развитию.
Содержание белка в пшеничной муке
Мука содержит крахмал, белок, влагу и немного жира. Но больше всего нас интересует белок, так как его количество и качество определяют, как мука работает.(Проценты являются приблизительными, так как каждая марка муки уникальна.)
| Мука | Содержание белка (%) |
| Цельнозерновой хлеб, манная крупа твердых сортов | 12-15 |
| Универсальные * | 9-12 |
| Кондитерские изделия | 8-9 |
| Торт | 7-8 |
* Региональные марки универсальной муки на юге и северо-западе Тихого океана могут содержать меньше белка, ближе к его количеству в мучной кондитерской.
2. Остерегайтесь воды
Глютена не существует, пока мука не станет влажной. Вода — это то, что заставляет два белка пшеницы, глютенин и глиадин, объединяться и образовывать глютен. Таким образом, добавляя или удерживая воду в тесте или кляре, вы можете стимулировать или сдерживать развитие глютена. Если вы хотите максимально увеличить глютен, идеально подойдет умеренное количество воды. Но если вам нужна нежность, вы можете не поливать тесто водой или утопить его — в зависимости от того, что вы делаете.
Слоеное и нежное тесто для сдобного теста лучше избавиться от жажды. Это не просто суетливость, когда рецепт теста для пирога требует капать воду в тесто по капле; для образования излишка клейковины и плотной корки пирога нужно немного слишком много воды. То же самое и с печеньем и булочками.
Тесто для кексов и хлебное тесто нужно утопить. Когда глютен в тесте или кляре полностью гидратирован, добавление большего количества влаги фактически разбавляет и ослабляет глютен. В пирогах излишняя влажность вместе с мукой с низким содержанием белка и различными смягчающими ингредиентами способствует нежности.В домашнем хлебе избыток воды ослабляет глютеновую сетку теста, в результате чего крошка имеет большие привлекательные отверстия, а не однородную однородную текстуру.
В пирогах излишняя влажность вместе с мукой с низким содержанием белка и различными смягчающими ингредиентами способствует нежности.В домашнем хлебе избыток воды ослабляет глютеновую сетку теста, в результате чего крошка имеет большие привлекательные отверстия, а не однородную однородную текстуру.
3. Обращайтесь осторожно
Перемешивание, замешивание, складывание, перемешивание — все эти действия помогают глютену растягиваться и организовываться в сеть. Чем больше вы перемешиваете, тем сильнее становится глютен.
Дрожжевое тесто обычно выигрывает от обильного замешивания, которое удлиняет и сглаживает пряди клейковины в эластичную сеть, которая может расширяться и подниматься по мере ферментации дрожжей и выделения газов.
Однако со многими другими хлебобулочными изделиями чрезмерное перемешивание и образование слишком большого количества глютена вызывает беспокойство. Пироги и печенье особенно сложны, потому что вам нужно немного глютена для придания структуры — в противном случае корочка рассыпется и печенье осядет, — но легко переборщить и получить жесткий результат. Вообще говоря, когда желательна нежность, разумно быстро и легкой рукой перемешать. Когда дело доходит до пирогов и печенья, ничто не заменит опыт. Может потребоваться метод проб и ошибок, прежде чем вы найдете идеальный баланс между нежностью и силой.
Вообще говоря, когда желательна нежность, разумно быстро и легкой рукой перемешать. Когда дело доходит до пирогов и печенья, ничто не заменит опыт. Может потребоваться метод проб и ошибок, прежде чем вы найдете идеальный баланс между нежностью и силой.
4. Узнайте, как другие ингредиенты влияют на глютен
Жиры ослабляют глютен. Твердые жиры, масла и яичные желтки покрывают белки глютена и не позволяют им образовывать длинные прочные нити. Вы когда-нибудь задумывались, почему сокращение называется сокращением? Потому что он укорачивает глютен.
Жир также может сделать муку водостойкой. Например, при приготовлении терпкого теста первым делом нужно тщательно перемешать жир с мукой. Покрытые жиром гранулы муки не впитывают много влаги при добавлении влажных ингредиентов, таких как яйца, сливки или вода.Так образуется меньше клейковины, а корочка остается нежной.
Сахар препятствует глютену; соль ему помогает. Молекулы сахара стимулируют нежность, прикрепляясь к молекулам воды, прежде чем они смогут связываться с глютенином и глиадином. Опять же, отсутствие воды означает отсутствие глютена. С другой стороны, соль делает глютен более липким и крепким.
Опять же, отсутствие воды означает отсутствие глютена. С другой стороны, соль делает глютен более липким и крепким.
Знаете ли вы?
Магия пшеничного теста — т.е. его способность превращаться в столь разные хлебобулочные изделия — заключается в балансе двух качеств: пластичности и эластичности.Пластичность позволяет скромному шарику теста изменять свою форму, например, когда он расширяется в пухлый круглый буханку, в то время как эластичность теста или тенденция сохранять свою первоначальную форму не позволяет буханке слишком сильно расширяться и лопнуть, как надутый воздушный шар.
Руководство по глютену для начинающих
Глютен боялись и уважали, неправильно понимали и клеветали.Это основа почти для любого вида выпечки, и тем не менее … многих пекарей это тоже сбивает с толку.
Трудно говорить о глютене, не углубляясь в науку о питании, поэтому это может сбивать с толку. Но если у вас есть базовое представление о том, что такое глютен и как он работает, эти знания помогут вам (и вашей выпечке) пройти долгий путь.
Но если у вас есть базовое представление о том, что такое глютен и как он работает, эти знания помогут вам (и вашей выпечке) пройти долгий путь.
Итак, что именно
— это глютен?Распространенное заблуждение состоит в том, что глютен входит в состав муки. Технически это неправда.Клейковина образуется из муки при добавлении воды. Этот пакет с универсальной мукой на прилавке содержит два белка, необходимых для образования глютена: глютенин и глиадин. Когда к этим двум белкам добавляется вода (или жидкость, включая воду, например, молоко), они соединяются вместе, образуя глютен.
Итак, вместо того, чтобы думать о том, сколько глютена содержит определенная мука, правильнее думать о том, сколько глютен-образующего белка содержится в муке.
Содержание белка указано на лицевой стороне мешков с мукой короля Артура. (Фото Джона Шермана)
(Фото Джона Шермана)Что означает содержание протеина в муке? Это связано с глютеном?
Вы найдете содержание белка, напечатанное на пакетах с мукой короля Артура, от муки для пирожных до универсальной и хлебной муки. Чем выше содержание белка, тем больше глютен-образующего белка содержится в муке определенного типа. Можно подумать: чем больше протеина, тем «крепче» мука.
Мука для жмыха с процентным содержанием белка 10% имеет низкий потенциал развития глютена.Когда вы смешиваете тесто, приготовленное из муки для тортов, а не из универсального теста, в нем будет меньше белка; в результате в жидком тесте будет меньше глютена.
Хлебная мука, с другой стороны, содержит 12,7% протеина. Поскольку в нем больше белка, тесто способно вырабатывать больше клейковины. Это означает, что тесто, приготовленное из хлебной муки, будет крепче, чем тесто из торта или даже универсальной муки, если все они будут замесены или перемешаны одинаково.
имеет процентное содержание протеина примерно в середине этого диапазона — 11.7%, поэтому он хорошо подходит для большинства проектов по выпечке, от тортов до хлеба.
Небеленая хлебная мука King Arthur имеет содержание белка 12,7%, что делает ее «прочнее», чем универсальная мука или мука для выпечки. (Фото Кристин Тейг)Важное примечание о цельнозерновой муке: общее содержание белка в цельнозерновой муке составляет 13,8%, но поскольку цельнозерновая мука содержит все части ягод пшеницы, включая отруби и зародыши, глютен структура затронута. Это потому, что при измельчении отруби имеют острые края, которые разрезают некоторые пряди клейковины и нарушают их структуру.(Вы можете узнать больше в нашем посте о выборе подходящей муки о том, как это приводит к более короткому и плотному хлебу.)
В таком случае, как вырабатывается глютен?
Когда жидкость добавляется к глютенину и глиадину, они начинают образовывать связи, которые соединяются вместе, образуя нити глютена.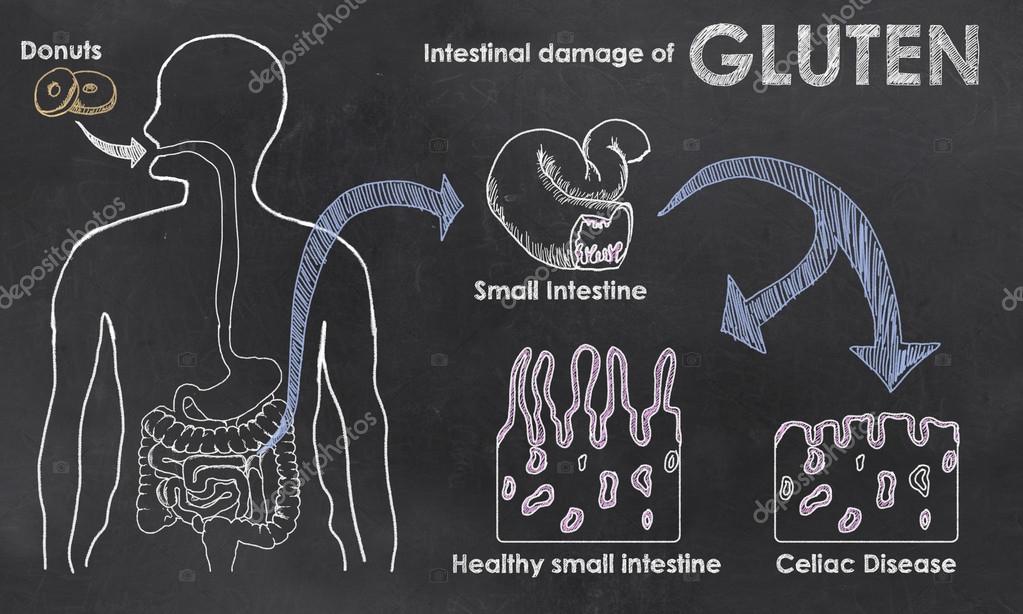
По мере того, как вы замешиваете жидкое тесто и тесто, вы стимулируете дальнейшее развитие глютена. Это потому, что это движение и возбуждение побуждают нити глютена соединяться и образовывать сеть, что делает их еще сильнее.
Помните, как в муке были обнаружены два разных типа белка? Каждый из них делает что-то немного другое с тестом по мере развития глютена. Глютенин придает тесту эластичность (так что оно может растягиваться, как резинка), а глиадин способствует растяжимости (что означает, что тесто можно растягивать).
Как клейковина влияет на выпечку?
В зависимости от типа выпечки вам может потребоваться много или как можно меньше выработки глютена.
Вы знаете ту сеть нитей глютена, о которой мы говорили, которая образуется при взбалтывании теста или теста? Это полотно способно улавливать пузырьки газа; чем он сильнее, тем больше газа он может удерживать, что приводит к увеличению количества воздуха в выпечке и, следовательно, к более высокому подъему. В то же время эти соединенные между собой пряди становятся длиннее и прочнее, чем больше образуется глютен, что приводит к большей жевательной способности и жесткости конечного продукта.
В то же время эти соединенные между собой пряди становятся длиннее и прочнее, чем больше образуется глютен, что приводит к большей жевательной способности и жесткости конечного продукта.
Для хлеба вам нужна большая прочность теста, чтобы оно могло жевать и задерживать газы при подъеме теста, в то время как для тортов и другой нежной выпечки вам нужна нежная текстура. Для достижения каждой из этих целей необходимо контролировать степень выработки глютена.
Глютен в хлебе
По словам Эллен Кинг, автора книги Heritage Baking : «Правильное развитие глютена важно для эластичности, того, как ваш хлеб будет подниматься в конце и как ваш хлеб будет держаться после того, как ему придет форма». Это достигается сначала добавлением жидкости к муке, запуском процесса образования глютена, затем замешиванием или складыванием теста для образования длинных, прочных взаимосвязанных прядей.
Иногда такое перемешивание не требуется: в хлебе без замеса выработка глютена достигается за счет гидратации и отдыха, что доказывает, что месить нужно не всегда.
Эллен говорит, что знает, что ее глютен идеально развит, когда тесто «похоже на подушку, на которой я буквально хочу спать». (Фото Маурицио Лео) Когда придет время формировать тесто, вы поймете, что глютен развился должным образом. «Если он хорошо держит форму, — говорит Эллен, — ты знаешь, что с тобой все будет в порядке». Она объясняет, что недоразвитое тесто будет слабым, а слишком развернутое — слишком сильно отскакивает. Один из способов убедиться, что вы попали в правильную золотую середину, — это следовать визуальным подсказкам для вашего теста, указанным в рецепте хлеба, и ошибаться в сторону слишком большого замешивания, а не слишком малого.(Перемешивать очень сложно. )
)
Глютен в пироге и других нежных хлебобулочных изделиях
Для любой нежной и нежной выпечки вам нужно как можно меньше развивать глютен, чтобы прочная матрица глютена не мешала текстуре. Давайте возьмем торт.
Аккуратно замешивайте тесто для торта, чтобы избежать чрезмерного перемешивания. (Фото Джона Шермана) (Но не волнуйтесь — если у вас тяжелая рука при смешивании, «у вас все равно получится отличный торт», — уверяет Одетт.)Глютен в тесте
Если ваша цель — максимизировать выработку глютена в хлебе и свести к минимуму образование глютена в тортах, то выпечка находится где-то посередине.
Если вы, например, готовите слоеное тесто, вам нужно частично развить клейковину, чтобы оно было достаточно растяжимым, чтобы его можно было скатывать и складывать, не ломаясь. В то же время его нельзя слишком разрабатывать, иначе вы не сможете его развернуть должным образом, — объясняет Мэгги Перри, член горячей линии короля Артура Бейкера.
Некоторое количество глютена позволяет легко раскатывать и складывать слоеное тесто и другое слоеное тесто. (Фото Даниэль Сайкс)
(Фото Даниэль Сайкс)Подумайте также о корочке пирога.Не следует добавлять слишком много воды или перерабатывать тесто, иначе оно станет жестким и вязким из-за слишком большого количества глютена. Мэгги объясняет, что раскатывание и растягивание корки пирога обеспечивает достаточно перемешивания, чтобы образовалась прочная, шелушащаяся корка, но она не стала жесткой.
Это было много. Вы можете подвести итог?
Вот что вам нужно знать: когда вы добавляете жидкость в муку, начинает образовываться глютен. Дополнительное перемешивание, такое как замешивание, складывание или перемешивание, продолжает вырабатывать глютен, делая белковые связи более прочными.
Уровень глютена влияет на вашу выпечку. В хлебе и других хлебобулочных изделиях с жевательной текстурой вы должны способствовать полному развитию глютена. Это включает в себя использование муки с высоким содержанием белка, такой как хлебная мука, для увеличения потенциала глютена. Чтобы приготовить нежную выпечку, например, пирог, вам нужно избежать чрезмерного образования глютена, поэтому избегайте чрезмерного перемешивания теста и используйте муку с низким содержанием белка, такую как мука для выпечки.
В хлебе и других хлебобулочных изделиях с жевательной текстурой вы должны способствовать полному развитию глютена. Это включает в себя использование муки с высоким содержанием белка, такой как хлебная мука, для увеличения потенциала глютена. Чтобы приготовить нежную выпечку, например, пирог, вам нужно избежать чрезмерного образования глютена, поэтому избегайте чрезмерного перемешивания теста и используйте муку с низким содержанием белка, такую как мука для выпечки.
Но на самом деле у Одетт самый важный вывод из всех. Она напоминает пекарям, чтобы они не особо заботились о точном выделении глютена, потому что, в конце концов, «плохой пирог остается хорошим пирогом».”
Узнайте больше о том, как выбор муки влияет на вашу выпечку, в нашей предыдущей публикации «Как правильно выбрать муку».
Фотография на обложке: Джон Шерман.
Высвобождение цитокинов после приема глютена отличает глютеновую болезнь от самооценки чувствительности к глютену
United European Gastroenterol J. 2020 Feb; 8 (1): 108–118.
, 1, 2, 3 , 4, 5, 6 , 4, 7, 8 , 9 , 1 9 9 , 9 , 9 , 4, 7, 8 , 4, 7, 8 и 9Jason A Tye-90 Din2
1 Отделение иммунологии, Институт медицинских исследований Уолтера и Элизы Холл, Департамент медицинской биологии, Мельбурнский университет, Австралия2 Детский научно-исследовательский институт Мердока, Парквилл, Австралия
3 Отделение гастроэнтерологии Королевской больницы Мельбурна, Парквилл, Австралия
Gry I Skodje
4 KG Jebsen Исследовательский центр целиакии, Университет Осло, Осло, Норвегия
5 Департамент питания, Институт фундаментальных медицинских наук, Университет Осля o, Осло, Норвегия
6 Отделение клинического питания, Отделение онкологической медицины, Университетская больница Осло, Рикшоспиталет, Осло, Норвегия
Викас К.
 Сарна
Сарна4 Исследовательский центр целиакии им. К.Г. Джебсена, Университет Осло, Осло , Норвегия
7 Отделение иммунологии, Университетская больница Осло Рикшоспиталет, Осло, Норвегия
8 Отделение гастроэнтерологии, Университетская больница Осло Рикшоспиталет, Осло, Норвегия
John L Dzuris
9 , Inc., Кембридж, США
Эми К. Рассел
1 Отделение иммунологии, Институт медицинских исследований Уолтера и Элизы Холл, Департамент медицинской биологии, Мельбурнский университет, Австралия
Гаутам Гоэль
9 ImmusanT, Inc., Кембридж, США
Suyue Wang
9 ImmusanT, Inc., Кембридж, США
Kaela E Goldstein
9 ImmusanT, Inc., Кембридж, США
Leslie J Williams
9 Immusan Inc., Кембридж, США
Людвиг М. Соллид
4 KG Jebsen Исследовательский центр целиакии, Университет Осло, Осло, Норвегия
7 Отделение иммунологии, Университетская больница Осло Рикшоспиталет, Осло, Норвегия
Отделение гастроэнтерологии, Университетская больница Осло Рикшоспиталет, Осло, Норвегия
Кнут Е.
 А. Лундин
А. Лундин4 Исследовательский центр глютеновой болезни КГ Джебсена, Университет Осло, Осло, Норвегия
7 Отделение иммунологии, Университетская больница Осло, Рикшоспитале Осло, Норвегия
8 Отделение гастроэнтерологии, Университетская больница Осло Рикшоспиталет, Осло, Норвегия
Роберт П. Андерсон
9 ImmusanT, Inc., Кембридж, США
1 Отделение иммунологии, Институт медицинских исследований Уолтера и Элизы Холл, Департамент медицинской биологии, Университет Мельбурна, Австралия
2 Детский научно-исследовательский институт Мердока, Парквилл, Австралия
3 Департамент гастроэнтерологии, Королевская больница Мельбурна, Парквилл, Австралия
4 KG Jebsen Celiac Disease Research Center, University of Oslo, Oslo, Norway
5 Департамент питания, Институт фундаментальных медицинских наук, Университет Осло, Осло, Норвегия
6 Отделение клинического питания, Отделение онкологической медицины, Университетская больница Осло Рикшоспиталет, Осло, Норвегия
7 Отделение иммунологии, Университетская больница Осло Рикшоспиталет, Осло, Норвегия
8 Отделение гастроэнтерологии Университетская клиника Осло Rikshospitalet, Осло, Норвегия
9 Imm usanT, Inc. , Кембридж, США
, Кембридж, США
Роберт П. Андерсон и Кнут Е.А. Лундин внесли равный вклад в эту статью в качестве старших авторов.
Роберт П. Андерсон, ImmusanT, Inc., One Kendall Square, Building 700, Cambridge, MA 02139, США. Электронная почта: moc.tnasummi@bobПоступила 10 июня 2019 г .; Принято 6 августа 2019 г.
Эта статья цитировалась в других статьях в PMC.Abstract
Предпосылки
Диагностика целиакии (CD) у пациентов, соблюдающих безглютеновую диету (GFD), является сложной задачей. Прием глютена повышает уровень циркулирующих интерлейкинов (ИЛ) -2, ИЛ-8 и ИЛ-10 у пациентов с БК на GFD.
Цель
Мы проверили, отличает ли высвобождение цитокинов после приема глютена пациентов с БК от пациентов с самооценкой чувствительности к глютену (SR-GS).
Методы
Австралийские пациенты с CD ( n = 26) и SR-GS ( n = 18) на GFD потребляли хлеб (оценочная клейковина 6 г). Сыворотка на исходном уровне и через 3 и 4 часа тестировалась на IL-2, IL-8 и IL-10. Отдельно у норвежских пациентов SR-GS ( n = 49) была проведена оценка цитокинов плазмы на исходном уровне и через 2, 4 и 6 часов после пищевых батончиков, содержащих глютен (5.7 g), фруктан или плацебо в предыдущем двойном слепом перекрестном исследовании.
Отдельно у норвежских пациентов SR-GS ( n = 49) была проведена оценка цитокинов плазмы на исходном уровне и через 2, 4 и 6 часов после пищевых батончиков, содержащих глютен (5.7 g), фруктан или плацебо в предыдущем двойном слепом перекрестном исследовании.
Результаты
Клейковина значительно повышала уровень сывороточных IL-2, IL-8 и IL-10 через 3 и 4 часа у пациентов с CD, но не SR-GS. Наибольшее медианное кратное изменение от исходного уровня через 4 часа было для IL-2 (8,06, IQR: 1,52–24,0; P <0,0001, критерий Вилкоксона). Две группы SR-GS включали только одного (1,5%) подтвержденного респондера IL-2, и цитокиновые ответы на фруктан и плацебо не отличались от глютена. В целом, высвобождение цитокинов после глютена присутствовало у 22 (85%) участников CD, но 2 из 4 не отвечающих на лечение оставались клинически здоровыми после 1 года на неограниченной диете.Следовательно, высвобождение цитокинов произошло у 22 (92%) из 24 «верифицированных» участников CD.
Выводы
Провокация с глютеном с высокочувствительной оценкой цитокинов отличает CD от SR-GS у пациентов с GFD и выявляет пациентов, которые могут переносить повторное введение глютена. Системное высвобождение цитокинов, указывающее на раннюю активацию иммунной системы глютеном у лиц с CD, не может быть обнаружено у лиц с SR-GS.
Ключевые слова: Целиакия, цитокины, диагностика, безглютеновая диета, интерлейкин-2, интерлейкин-8, интерлейкин-10, пероральная пища для заражения необходимо несколько месяцев, чтобы диагностировать целиакию у людей, соблюдающих безглютеновую диету.
Однократное употребление глютена увеличивает циркулирующие цитокины, особенно интерлейкин (ИЛ) -2, 8 и 10, при глютеновой болезни.
Что нового?
Высвобождение цитокинов после болюсного введения глютена отличает глютеновую болезнь от самооценки чувствительности к глютену.
Отсутствие высвобождения цитокинов после глютена является прогнозом для пациентов с глютеновой болезнью, которые могут возобновить неограниченную диету без рецидива через 1 год.

Болюсная провокация глютеном сывороткой ИЛ-2 через 3-4 часа может заменить расширенную провокацию глютена для диагностики целиакии у пациентов, уже соблюдающих безглютеновую диету.
Ранняя глютен-опосредованная активация иммунитета, присутствующая при целиакии, отсутствует у людей, которые самостоятельно сообщают о чувствительности к глютену.
Введение
Безглютеновая диета (GFD) накладывает большие затраты на лечение и может быть ненужной для людей с самооценкой «чувствительности к глютену» (SR-GS) и для тех, у кого диагностирована глютеновая болезнь (CD) на основа неоднозначных выводов. 1,2 Текущий диагноз CD, основанный на гистологии и серологии двенадцатиперстной кишки, является надежным только тогда, когда пациенты потребляют глютен, а для людей, которые приняли GFD, рекомендуется период не менее нескольких недель повторного введения глютена с пищей для точного тестирования. 3,4 Поскольку провокация глютеном может вызывать неприятные симптомы, часто быстро начинающиеся и тяжелые, она плохо переносится и неприемлема для многих пациентов. 5,6 Простой, менее навязчивый тест необходим значительному количеству людей на GFD, которым нужен диагноз CD.
5,6 Простой, менее навязчивый тест необходим значительному количеству людей на GFD, которым нужен диагноз CD.
Широко признано, что приобретенный адаптивный иммунный ответ на глютен лежит в основе БК, но во многих сообщениях также описаны отдельные врожденные иммунные эффекты глютена in vitro, которые могут быть причиной быстрого появления пищеварительных симптомов у пациентов с БК и SR-GS. 7,8 Недавно мы наблюдали, что пациенты с БК на GFD повышают циркулирующие уровни интерлейкина (ИЛ) -2, ИЛ-8 и ИЛ-10 через 2-6 часов после приема глютена или инъекции пептидов, которые активируют глютен-специфический CD4. + Т-клетки. 9 Мы предположили, что повышение уровня цитокинов в крови, например IL-2, возникающее в результате активации глютен-специфических CD4 + Т-клеток, специфично для CD и отсутствует у тех, у кого нет. Кроме того, поскольку высвобождение IL-8 использовалось в качестве маркера активации врожденного иммунитета глютеном in vitro, 10–12 мы предположили, что повышение уровня IL-8 может также присутствовать у пациентов с SR-GS на GFD. Целью этого исследования было измерить раннее повышение уровня IL-2, IL-8 и IL-10 после провокации глютеном, чтобы определить клиническую применимость этого подхода для различения пациентов с GFD с CD от пациентов с SR-GS.
Целью этого исследования было измерить раннее повышение уровня IL-2, IL-8 и IL-10 после провокации глютеном, чтобы определить клиническую применимость этого подхода для различения пациентов с GFD с CD от пациентов с SR-GS.
Материалы и методы
Участники
Когорта Melbourne CD состояла из пациентов с диагнозом атрофия ворсинок тонкой кишки на основании подтверждающих клинических и / или лабораторных данных, 13 и имеющих генотипы человеческого лейкоцитарного антигена (HLA) -DQ в соответствии с CD (HLA-DQ2.5, DQ8 или DQ2.2). 14 Когорта SR-GS состояла из субъектов, которые сами сообщили о чувствительности к глютену и имели CD, исключенный генетически (отсутствие HLA-DQ2.5, DQ8 или DQ2.2) или нормальной гистологией двенадцатиперстной кишки и / или CD- специфическая серология при употреблении глютена. Участников набирали через рекламу членов организации Celiac Australia и посетителей выставки без глютена в Мельбурне, Австралия. Участники были исключены, если они использовали иммуномодулирующие препараты или имели аллергию на пшеницу. Скрининг включал генотипирование HLA-DQA и HLA-DQB (Gen-Probe Inc., Сан-Диего, США; проведено Melbourne Pathology, Виктория, Австралия) и оценка сывороточного трансглутаминазы 2 (TG2) -специфического иммуноглобулина (Ig) A и дезамидированного пептида глиадина (DGP) -специфического IgG (QUANTA Lite R h-tTG IgA и QUANTA Lite Gliadin IgG II, Inova Diagnostics, Сан-Диего, США; выполняется Dorevitch Pathology, Виктория, Австралия).
Скрининг включал генотипирование HLA-DQA и HLA-DQB (Gen-Probe Inc., Сан-Диего, США; проведено Melbourne Pathology, Виктория, Австралия) и оценка сывороточного трансглутаминазы 2 (TG2) -специфического иммуноглобулина (Ig) A и дезамидированного пептида глиадина (DGP) -специфического IgG (QUANTA Lite R h-tTG IgA и QUANTA Lite Gliadin IgG II, Inova Diagnostics, Сан-Диего, США; выполняется Dorevitch Pathology, Виктория, Австралия).
Участники Осло состояли из участников исследования, подробно описанного Skodje et al. которые хранили плазму с первого дня недельных пищевых проблем с пищевыми батончиками, содержащими глютен или фруктан, и с соответствующим плацебо. 15 Участники были в возрасте от 18 до 80 лет, были самостоятельными учреждениями и строго соблюдали GFD в течение не менее 6 месяцев для SR-GS. CD был исключен у участников генетическим тестированием или нормальной гистологией двенадцатиперстной кишки при соблюдении глютеносодержащей диеты. Аллергия на пшеницу исключалась по отрицательному пшенице-специфическому IgE.
Продовольственные испытания
В Мельбурне испытание без маски состояло из двух и третьего ломтиков (89 г) хлеба (белый буханка, Baker’s Delight, Австралия) в течение 10 минут, который, по расчетам Осборна, содержал 6 г глютена. (содержание белка в пшеничной муке, умноженное на 0.8). 16 В Осло носителем для контрольного заражения был батончик мюсли 50 г, который не содержал глютена и с низким содержанием ферментируемых олигосахаридов, дисахаридов, моносахаридов и полиолов (FODMAP) (батончик плацебо). Батончик фруктановых мюсли содержал 2,1 г короткоцепочечных фруктанов / фруктоолигосахаридов (Orafti; Олигофруктоза, Beneo, Бельгия), а батончик мюсли с глютеном содержал 7,6 г витального пшеничного глютена (Manildra, Gladesville, Австралия), обеспечивая 5,7 г белка глютена. Батончики с фруктаном и глютеном нельзя было отличить от батончика с плацебо.
Оценка симптомов
В Мельбурне участники записали симптомы в соответствии с каждым из 11 пунктов критерия оценки результатов лечения глютеновой болезнью пациента (CeD PRO). 17 Ранее в исследовании Осло сообщалось о симптомах. 15
17 Ранее в исследовании Осло сообщалось о симптомах. 15
Оценка цитокинов
IL-2, IL-8 и IL-10 оценивались в сыворотке за 30 минут до и через 3 и 4 часа после провокации глютеном в Мельбурне, а также в плазме до и через 2, 4 и через 6 часов после приема тестируемого агента в первый день каждой из трех пищевых проб в Осло.Электрохемилюминесцентные анализы проводили в ImmusanT, Inc. в соответствии с инструкциями производителя (V-PLEX Proinflamasted Panel 1, Meso Scale Discovery, Rockville, USA) с использованием считывающего устройства для планшетов MESO Sector S600 (Meso Scale Discovery). Данные были проанализированы с помощью Discovery Workbench 4.0 (Meso Scale Discovery) и представлены как среднее трех повторностей. Расчетные значения ниже нижнего уровня количественного определения (LLOQ) были представлены как равные LLOQ. В качестве подтверждающего теста все образцы из исследования в Осло от исходного уровня и через 4 часа после заражения глютеном были повторно оценены с помощью сверхчувствительного иммуноанализа Simoa Human IL-2 (предоставленного и проведенного Quanterix Corporation, Lexington, USA). Сыворотки от исходного уровня и через 3 часа после заражения глютеном от выбранных участников исследования в Мельбурне также были повторно оценены с помощью сверхчувствительных анализов IL-2: иммуноанализа Simoa и электрохемилюминесцентного анализа S-PLEX (предоставленного и проведенного Meso Scale Discovery). Сыворотки, повторно оцененные в исследовании в Мельбурне, включали сыворотки от пациентов, не отвечающих на CD, на тесты V-PLEX IL-2, IL-8 и IL-10, а также одного участника в когорте SR-GS, который отвечал в исследовании V-PLEX IL. -2 проба. Сотрудники лаборатории не знали диагнозов участников и статус проблемы с пищей.
Сыворотки от исходного уровня и через 3 часа после заражения глютеном от выбранных участников исследования в Мельбурне также были повторно оценены с помощью сверхчувствительных анализов IL-2: иммуноанализа Simoa и электрохемилюминесцентного анализа S-PLEX (предоставленного и проведенного Meso Scale Discovery). Сыворотки, повторно оцененные в исследовании в Мельбурне, включали сыворотки от пациентов, не отвечающих на CD, на тесты V-PLEX IL-2, IL-8 и IL-10, а также одного участника в когорте SR-GS, который отвечал в исследовании V-PLEX IL. -2 проба. Сотрудники лаборатории не знали диагнозов участников и статус проблемы с пищей.
Статистический анализ
GraphPad Prism версии 7.0d и Mathworks MATLAB версии 9.4.0 использовались для анализа данных. Использовались двусторонние непараметрические тесты (критерий Вилкоксона для парных, критерий Манна-Уитни для непарных количественных данных). Скорректированные на коэффициент ложного обнаружения значения P были оценены с использованием метода Бенджамини – Хохберга для корректировки множественных сравнений. Оценки цитокинов, используемые для анализа респондеров, были исходными, через 3 и 4 часа (исследование в Мельбурне) и через 2, 4 и 6 часов (Осло).Участник исследования в Мельбурне считался ответчиком цитокинов, если их уровень через 3 или 4 часа после провокации глютеном был на> 3 SD выше среднего кратного изменения от исходного уровня в когорте SR-GS. Участника исследования в Осло считали ответчиком цитокинов, если их уровень через 2, 4 или 6 часов после пищевого заражения был> 3 SD выше среднего кратного изменения от исходного уровня для контрольного заражения плацебо. Показатели респондентов сравнивали с помощью точного критерия Фишера. Никаких официальных расчетов мощности не производилось.
Оценки цитокинов, используемые для анализа респондеров, были исходными, через 3 и 4 часа (исследование в Мельбурне) и через 2, 4 и 6 часов (Осло).Участник исследования в Мельбурне считался ответчиком цитокинов, если их уровень через 3 или 4 часа после провокации глютеном был на> 3 SD выше среднего кратного изменения от исходного уровня в когорте SR-GS. Участника исследования в Осло считали ответчиком цитокинов, если их уровень через 2, 4 или 6 часов после пищевого заражения был> 3 SD выше среднего кратного изменения от исходного уровня для контрольного заражения плацебо. Показатели респондентов сравнивали с помощью точного критерия Фишера. Никаких официальных расчетов мощности не производилось.
Результаты
Клинический и цитокиновый ответ на провокацию из глютенового хлеба при CD и SR-GS
В исследование в Мельбурне было включено 26 участников CD и 18 участников SR-GS, которые были схожими по возрасту и продолжительности на GFD ().По сравнению с когортой CD, когорта SR-GS имела значительно более высокий исходный средний общий балл симптомов (). В день введения глютена по сравнению с предыдущим днем когорта CD показала значительное ухудшение средней общей оценки симптомов (). У двух пациентов с CD возникла рвота. В когорте SR-GS у одного участника была рвота, но оценка симптомов CeD PRO не отличалась значимо в день провокации глютеном по сравнению с предыдущим днем ().
В день введения глютена по сравнению с предыдущим днем когорта CD показала значительное ухудшение средней общей оценки симптомов (). У двух пациентов с CD возникла рвота. В когорте SR-GS у одного участника была рвота, но оценка симптомов CeD PRO не отличалась значимо в день провокации глютеном по сравнению с предыдущим днем ().
Симптоматическая реакция на провокацию глютеном при глютеновой болезни (БК) и самопровозглашенной чувствительности к глютену (SR-GS) участников.Для участников CD и SR-GS в Мельбурнском исследовании показаны парные изменения в средних оценках симптомов, о которых сообщают сами пациенты, в отчете о результатах пациентов с глютеновой болезнью (CeD PRO) по 11 пунктам от исходного уровня до после заражения. Участники, которые ответили положительным высвобождением цитокинов на провокацию с глютеном, выделены красным. Парные изменения анализировали с помощью теста Вилкоксона. Базовые различия в симптомах между группами CD и SR-GS были проанализированы с помощью теста Манна-Уитни.
Таблица 1.
Характеристики участников.
| Исследование в Мельбурне | Исследование в Осло | ||
|---|---|---|---|
| Когорта | CD | SR-GS | SR-GS | Номер |
| Женщины, n (%) | 17 (65%) | 14 (78%) | 43 (88%) |
| Средний возраст в y (диапазон) | 51 (20–66 ) | 53 (27–70) | 46 (21–72) |
| БК с медицинским диагнозом, n (%) | 26 (100%) | 0 | 0 |
| Продолжительность GFD в мес, медиана (диапазон) | 66 (1–360) | 78 (0. 5–180) 5–180) | 35 (5–180) |
| GFD> 1 год, n (%) | 20 (77%) | 15 (83%) | 34 (69%) |
| Повышенный исходный уровень TG2-IgA, n (%) | 4 (15%) | 0 | 0 |
| Повышенный исходный уровень DGP-IgG, n (%) | 6 (23%) | 0 | 7 (14%) |
| HLA-DQ2.5 положительный, n (%) | 25 (96%) | 6 (33%) | 18 (37%) |
| HLA-DQ2.5, 2.2, 8 и 7 отрицательные, n (%) | 0 | 2 (11%) | 22 (45%) |
Употребление в пищу хлеба, содержащего глютен, значительно повышает сывороточные концентрации IL-2 , IL-8 и IL-10 через 3 и 4 часа в группе CD, но не в группе SR-GS (,). В когорте CD медиана кратности изменения через 4 часа относительно исходного уровня составила 8,06 для IL-2 (IQR: 1,52–24,0; P = 7,0 × 10 902 · 10 −6 , исходный уровень по сравнению с 4 часами по критерию Вилкоксона). Уровень IL-2 через 4 часа был номинально выше, чем через 3 часа в когорте CD, но разница не достигла статистической значимости.Индивидуальные ответы пациентов с БК сильно различались, поэтому был проведен анализ респондентов (). Среди 26 участников CD было 19 (73%) респондеров IL-2 в анализе V-PLEX по сравнению только с одним (5%) респондером IL-2 в когорте SR-GS ( P = 8,2 × 10 −6 , точный критерий Фишера). Примечательно, что все пациенты с CD, серопозитивные по TG2-IgA и / или DGP-IgG, включая двух участников, у которых начался GFD между 4 и 6 неделями ранее, были респондентами IL-2. В когорте SR-GS медиана кратности изменения от исходного уровня через 3 и 4 часа для IL-2, IL-8 и IL-10 находилась в пределах 0.94 и 1.0 ().
В когорте CD медиана кратности изменения через 4 часа относительно исходного уровня составила 8,06 для IL-2 (IQR: 1,52–24,0; P = 7,0 × 10 902 · 10 −6 , исходный уровень по сравнению с 4 часами по критерию Вилкоксона). Уровень IL-2 через 4 часа был номинально выше, чем через 3 часа в когорте CD, но разница не достигла статистической значимости.Индивидуальные ответы пациентов с БК сильно различались, поэтому был проведен анализ респондентов (). Среди 26 участников CD было 19 (73%) респондеров IL-2 в анализе V-PLEX по сравнению только с одним (5%) респондером IL-2 в когорте SR-GS ( P = 8,2 × 10 −6 , точный критерий Фишера). Примечательно, что все пациенты с CD, серопозитивные по TG2-IgA и / или DGP-IgG, включая двух участников, у которых начался GFD между 4 и 6 неделями ранее, были респондентами IL-2. В когорте SR-GS медиана кратности изменения от исходного уровня через 3 и 4 часа для IL-2, IL-8 и IL-10 находилась в пределах 0.94 и 1.0 ().
Ответ временного цитокина на провокацию глютеном при глютеновой болезни (CD) и самопровозглашенной чувствительности к глютену (SR-GS) участников. Парные уровни цитокинов до и после заражения (a и b) IL-2, (c и d) IL-8 и (e и f) IL-10 показаны для участников CD и SR-GS в Мельбурне. учиться. Участники, которые ответили положительным высвобождением цитокинов на провокацию с глютеном, выделены красным. Парные изменения анализировали с помощью теста Вилкоксона. Медианные значения указаны в верхней части каждой временной точки для обеих когорт.
Таблица 2.
Концентрации цитокинов в сыворотке и кратные изменения (медиана и IQR), а также частота ответа на цитокины после провокации глютеном в исследовании в Мельбурне.
| Исходный уровень | 3 часа после заражения глютеном | 4 часа после введения глютена | |||||
|---|---|---|---|---|---|---|---|
| Конц. пг / мл | Конц. пг / мл | Fold-change | Response -rate | Conc. пг / мл | Fold-change | Скорость отклика a | |
| IL-2 | |||||||
| CD | 0.09 (0,08–0,20) | 1,10 (0,25–3,50) | 6,7 (1,1–36,0) | 19 (73%) | 0,98 (0,25–3,40) | 8,1 (1,5–24,0) | 19 (73 %) |
| SR-GS | 0,07 (0,06–0,11) | 0,08 (0,06–0,14) | 1,00 (0,9–1,3) | 1 (6%) | 0,08 (0,06–0,09) | 1,0 (1,0–1,1) | 1 (6%) |
| IL-8 | |||||||
| CD | 9,00 (6,72–11,8) | 12.6 (8,95–21,4) | 1,2 (1,1–2,4) | 14 (54%) | 14,0 (8,93–31,9) | 1,6 (1,1–2,9) | 14 (54%) |
| SR- GS | 8,13 (6,57–12,8) | 9,04 (6,37–11,7) | 1,0 (0,9–1,1) | 0 (0%) | 9,03 (6,59–11,4) | 1,0 (0,9–1,1) | 0 (0%) |
| IL-10 | |||||||
| CD | 0,25 (0,14–0,38) | 0,36 (0,22–0,91) | 1,1 (0.9–2,7) | 12 (46%) | 0,38 (0,19–1,07) | 1,2 (1,0–3,3) | 12 (46%) |
| SR-GS | 0,22 (0,15–0,31) | 0,20 (0,14–0,26) | 0,9 (0,9–1,0) | 0 (0%) | 0,19 (0,14–0,23) | 0,9 (0,8–1,0) | 0 (0%) |
Хлебная провокация также повысила уровень сывороточного IL-8 (изменение в 1,63 раза, IQR: 1,09–2,93; P = 7,0 × 10 902 · 10-5 ) и IL-10 (изменение в 1,15 раза, IQR: 0.96–3,25; P = 3,2 × 10 902 · 10 −3 ) по сравнению с исходным уровнем в CD, но не в когорте SR-GS (). Анализ респондеров показал, что когорта CD включала 14 (54%) респондентов на IL-8 и 12 (46%) респондентов на IL-10 по сравнению с никем в когорте SR-GS для IL-8 ( P = 0,0001) и нет для Ил-10 ( P = 0,0005) (). Всего было 6 (23%) из 26 участников CD, которые не отвечали на IL-2, IL-8 или IL-10 после провокации глютеном (один ответил на IL-8 и IL-10, но не на IL-2. ), и 1 (6%) из 18 участников SR-GS, которые ответили (только на IL-2) в соответствии с анализами V-PLEX.
Сыворотки из крови на исходном уровне и через 3 часа от не ответивших на CD и респондеров SR-GS были повторно оценены с другими образцами CD и SR-GS с помощью двух отдельных сверхчувствительных анализов IL-2 и проведенных анализов респондеров (). Соответственно, два пациента с БК были переклассифицированы как респондеры на IL-2, но четыре пациента с БК остались нереагирующими, а один участник SR-GS остался «респондером». Четыре пациента с БК, не отвечающие на лечение, прошли повторное клиническое обследование. Единственный респондент в когорте SR-GS отказался от формальной переоценки с помощью расширенной провокации с глютеном.Этот человек был единственным членом когорты SR-GS, у которого была рвота после заражения глютеном, и ее генотип (HLA-DQ7 и DQ9.2) был связан с редкими случаями CD. 14,18
Таблица 3.
Сверхчувствительные анализы сывороточного IL-2 после провокации глютеном в исследовании в Мельбурне.
| Исходный уровень пг / мл | 3-часовой пг / мл | 3-х кратное изменение | Респондеры a | ||
|---|---|---|---|---|---|
| Среднее значение (IQ IQR) | Медиана (IQR) | Число (%) | P — значение | ||
| CD ( n = 21) | 40 | ||||
| 0.1 (0,1–0,2) | 1,0 (0,2–4,1) | 8,1 (1,1–44,1) | 15 (71%) | 4,89 × 10 −5 | |
| S-PLEX | 0,1 (0,0 –0,1) | 0,4 (0,1–1,7) | 10,1 (1,5–33,0) | 17 (81%) | 3,18 × 10 −6 |
| Simoa | 0,2 (0,2–0,3) | 2,1 (0,6–11,0) | 13,0 (1,7–52,9) | 17 (81%) | 3,18 × 10 −6 |
| SR-GS ( n = 17) | |||||
| V-PLEX | 0.1 (0,1–0,1) | 0,1 (0,1–0,1) | 1,0 (1,0–1,3) | 1 (6%) | NA |
| S-PLEX | 0,0 (0,0–0,1) | 0,0 (0,0–0,1) | 1,0 (1,0–1,1) | 1 (6%) | NA |
| Simoa | 0,2 (0,2–0,3) | 0,2 (0,2–0,3) | 1,0 (1,0– 1.0) | 1 (6%) | NA |
Клиническое наблюдение за пациентами, не отвечающими на БК, после провокации с глютеном
Четыре пациента с БК, которые не отвечали на цитокины после проведения сверхчувствительного ИЛ-2, возобновили диету содержащие не менее 6 г глютена в день.Через 6–9 недель оценивали серологию TG2-IgA и DGP-IgG и проводили гастроскопию с забором биопсии двенадцатиперстной кишки. У двух пациентов с БК были однозначные серологические и гистологические доказательства рецидива через 6 недель в одном случае и через 9 недель в другом (). Остальные два пациента, которые ранее поддерживали GFD в течение 4,5 или 30 лет, продолжали неограниченную диету в течение 12 месяцев и остаются в серологической, гистологической и клинической ремиссии, что позволяет предположить, что у них нет CD. Примечательно, что этим двум пациентам был поставлен диагноз на основании гистологии двенадцатиперстной кишки без подтверждающей серологии.Если этих двоих, у которых было установлено, что у них нет CD, исключить из общей когорты CD, высвобождение цитокинов произошло у 22 (92%) из 24 «верифицированных» участников CD.
Таблица 4.
Клиническое наблюдение лиц, не ответивших на целиакию, в исследовании в Мельбурне.
| Презентация компакт-диска и статус при входе в исследование | Результат повторного введения глютена |
|---|---|
| Мужчина в возрасте 40 лет. GFD на 1.5 г. Диагноз подсказан сильным семейным анамнезом CD; низкая минеральная плотность костной ткани.При диагностике повышенный TG2-IgA, нормальный DGP-IgG; легкая атрофия ворсинок двенадцатиперстной кишки и гиперплазия крипт и внутриэпителиальный лимфоцитоз. HLA-DQ2.5 + | Рецидив через 6 недель; повышенный TG2-IgA, нормальный DGP-IgG; частичная атрофия ворсинок двенадцатиперстной кишки, умеренная гиперплазия крипт и внутриэпителиальный лимфоцитоз |
| Женщина 27 лет. GFD на 3 г. Диагноз подсказан диареей. При постановке диагноза повышенный уровень TG2-IgA и DGP-IgG; легкая вариабельная атрофия ворсинок двенадцатиперстной кишки и, вероятно, гиперплазия крипт и пятнистый внутриэпителиальный лимфоцитоз.HLA-DQ2.5 + | Рецидив через 9 недель; повышенный TG2-IgA и DGP-IgG; частичная атрофия ворсинок двенадцатиперстной кишки и внутриэпителиальный лимфоцитоз |
| Женщина, 66 лет. GFD за 4.5 г. Диагноз на основании симптомов, подобных СРК. На момент диагностики нормальный TG2-IgA; нерегулярная, умеренная атрофия ворсинок двенадцатиперстной кишки (о криптах не сообщается), умеренное диффузное увеличение внутриэпителиальных лимфоцитов. HLA-DQ2.5 + | Нет рецидива в 1 год; нормальный TG2-IgA и DGP-IgG через 7 и 52 недели; нормальная гистология двенадцатиперстной кишки через 7 недель |
| Женщина в возрасте 53 лет.GFD на 30 л. Диагноз подсказал анемия, вялость, сестра с CD. При постановке диагноза серология не проводится; выраженное уплощение ворсинок двенадцатиперстной кишки, гиперплазия крипт и обильные внутриэпителиальные лимфоциты. HLA-DQ2.5 + | Нет рецидива в 1 год; нормальный TG2-IgA и DGP-IgG через 7, 20 и 52 недели; нормальная гистология двенадцатиперстной кишки через 7 и 20 недель |
Цитокины плазмы после пищевых проблем с глютеном, фруктаном и плацебо у пациентов SR-GS
Характеристики когорты SR-GS из Осло показаны в.После употребления в пищу батончиков мюсли с глютеном, фруктаном или плацебо когорта SR-GS не показала значительного повышения по сравнению с исходным уровнем концентраций IL-2, IL-8 или IL-10 в плазме через 2, 4 или 6 часов (). Было два (4%) ответчика на ИЛ-8 и один (2%) ответчик на ИЛ-10 после глютена, что было аналогично частоте ответа после провокации фруктаном (1 для ИЛ-8) и после провокации плацебо (2 для ИЛ-2 и 1 для ИЛ-10) ().
Таблица 5.
Концентрации цитокинов в плазме и кратные изменения (медиана и IQR), а также частота ответа на цитокины после провокации глютеном в исследовании Осло с участниками SR-GS.
| Исходный уровень | Пик после пищевого заражения a | ||||
|---|---|---|---|---|---|
| Цитокиновый анализ | Challenge | pg556 pg556 pg556 pg556 pg556 мл b | |||
| IL-2 V-PLEX | Глютен | 0,1 (0,1–0,1) | 0,1 (0,1–0,2) | 1,0 (1,0–1,6) | 0 (0% ) |
| Фруктан | 0.1 (0,1–0,1) | 0,1 (0,1–0,2) | 1,0 (1,0–1,3) | 0 (0%) | |
| Плацебо | 0,1 (0,1–0,1) | 0,1 (0,1– 0,2) | 1,0 (1,0–1,5) | 2 (4%) | |
| IL-8 V-PLEX | Глютен | 4,7 (3,7–6,1) | 5,2 (4,4–6,6) | 1,0 ( 1,0–1,2) | 2 (4%) |
| Фруктан | 5,0 (4,2–5,9) | 5,3 (4,6–6,5) | 1.0 (1,0–1,1) | 1 (2%) | |
| Плацебо | 5,0 (4,0–6,5) | 5,5 (4,5–7,2) | 1,0 (1,0–1,2) | 0 | |
| IL-10 V-PLEX | Глютен | 0,2 (0,2–0,3) | 0,2 (0,2–0,3) | 1,0 (1,0–1,1) | 1 (2%) |
| Фруктан | 0,2 (0,2–0,3) | 0,2 (0,2–0,3) | 1,0 (1,0–1,1) | 0 (0%) | |
| Плацебо | 0.3 (0,2–0,4) | 0,3 (0,2–0,4) | 1,0 (1,0–1,2) | 1 (2%) | |
| IL-2 Simoa | Глютен | 0,1 (0,1–0,2) | 0,1 (0,1–0,2) | 1,0 (1,0–1,1) | 0 (0%) |
Обсуждение
Современные определения CD подчеркивают хроническое воздействие глютена на тонкий кишечник, и этот диагноз может быть установлен только подтверждено биопсией двенадцатиперстной кишки. 3,4 После постановки диагноза CD считается состоянием, которое требует пожизненного GFD.Независимо от потребления глютена, гистологического статуса двенадцатиперстной кишки или серологического анализа TG2-IgA иммунологический «отзывный» ответ на глютен, который определяет CD, сохраняется. Рецидив CD у пациентов с GFD, по-видимому, зависит от реактивации Т-клеток долгоживущей памяти CD4 + , специфичных для глютена, присутствующего в слизистой оболочке тонкого кишечника и циркулирующего в крови. 19
Это исследование показывает, что повышение уровня IL-2, IL-8 и IL-10 после однократного введения глютена различает людей на GFD с CD и SR-GS.Эти данные предполагают, что этот подход может иметь клиническое применение при выявлении пациентов с БК, которые ранее не проходили медицинское обследование, или при переоценке пациентов с БК на ГФД, которым, возможно, был поставлен неверный диагноз. Это приложение было подчеркнуто обнаружением двух пациентов, у которых был диагностирован CD и которые сохраняли GFD в течение многих лет, у которых не было повышения сывороточного IL-2 после провокации глютеном, и впоследствии они безрезультатно переносили неограниченную диету.
Пациенты SR-GS приняли GFD, потому что они связывали симптомы с употреблением в пищу продуктов, содержащих глютен.В исследовании, проведенном в Мельбурне, пациенты SR-GS имели повышенные пищеварительные симптомы на исходном уровне и после провокации хлебом. Для пациентов SR-GS, включенных в исследование в Осло, ухудшение пищеварительных симптомов было четко продемонстрировано во время 3-дневной провокации пшеничным хлебом, проводимой в ходе клинического обследования этих пациентов. 20 До этого открытого испытания нагрузка симптомов была низкой. Таким образом, им был поставлен диагноз «не глютеновая чувствительность к пшенице». Настоящее исследование демонстрирует, что, хотя IL-8 использовался в качестве in vitro маркера активации врожденного иммунитета глютеном, 10–12 не было обнаружено никаких изменений в плазме IL-8 после провокации глютеном у лиц с SR-GS.Эти наблюдения предоставляют прямые доказательства того, что у пациентов с БК происходит быстрая активация иммунной системы после воздействия глютена; хотя постулируется, что это также происходит в SR-GS, в крови пациентов с SR-GS на GFD не обнаруживается индуцированных глютеном ответов. 7 Вероятно альтернативное объяснение симптомов у пациентов с SR-GS, например, синдром раздраженного кишечника, связанный с FODMAP. 21 Сообщается, что белки устойчивости к вредителям, называемые ингибиторами α-амилазы / трипсина (ATI) в пшенице, запускают активацию врожденного иммунитета in vitro; 11 однако необходимы контролируемые данные in vivo, чтобы определить их значение для здоровья человека.Поскольку ATI очищаются вместе с глютеном, четкое разделение содержания глютена и ATI не является легко достижимым. Таким образом, желателен носитель для исследований с пищевым провокационным глютеном, который может доставлять глютен, лишенный потенциальных эффектов FODMAP и ATI 22 , но еще не доступный для прямого определения клинической роли ATI. Напротив, системное введение синтетических пептидов глютена, которые активируют Т-клетки CD4 + , четко определило их иммунологические эффекты и способность вызывать симптомы пищеварения, подобные тем, которые возникают после приема глютена у пациентов с БК. 9,23
После того, как пациенты исключают из рациона глютен, оценка CD становится диагностической проблемой, поскольку специфические для CD серологические и гистологические отклонения исчезают. Генетическое тестирование, показывающее отсутствие HLA-DQ2.5, DQ8 и DQ2.2, — единственный тест, который может сразу исключить CD; 24 , но для большинства пациентов, которым требуется диагностическое обследование, единственный вариант — возобновить введение глютена в течение как минимум нескольких недель с целью реактивации глютен-специфического иммунитета и индуцирования диагностических изменений в серологических и гистологических исследованиях. 3,4 Однако, поскольку симптоматическая, серологическая и гистологическая реакция на глютен очень неоднородна, оптимальная продолжительность и доза глютена, необходимые для постоянного индуцирования диагностических изменений, остаются нерешенными. 6,25–27 Проба с глютеном часто плохо переносится из-за невыносимых симптомов, возникающих в течение нескольких часов или дней после повторного введения глютена. 5,6 Напротив, однократное воздействие глютена не вызывает затруднений, а измерение сывороточных цитокинов обеспечивает объективную оценку, которую может предоставить большинство служб клинической патологии.Среди трех оцениваемых цитокинов IL-2 был наиболее чувствительным маркером CD. Оптимизация анализа и более сильное заражение глютеном могут дополнительно повысить диагностическую чувствительность с использованием одного ИЛ-2.
В будущих исследованиях критерии отбора для когорт «истинно положительных» и «истинно отрицательных» должны быть тщательно рассмотрены, чтобы избежать недооценки диагностической эффективности путем включения пациентов, которым может быть поставлен неверный диагноз CD или у которых CD исключен на основании генетических факторов. тестирование. В настоящем исследовании требование диагноза БК, подтвержденного типичной гистологией, а также явное требование повышенного серологического анализа TG2 исключили бы оба цитокиновых «не отвечающих» в когорте БК.Точно так же, включая HLA-DQ7 или DQ9.2, которые иногда были связаны с CD, 18,28 среди генотипов, придающих чувствительность к CD, исключили бы одного ответчика SR-GS.
Для установления диагностических характеристик этого подхода необходимы более крупные исследования с мощным стандартизованным методом провокации глютеном у «истинно-положительных» пациентов с однозначным диагнозом БК и других «истинно-отрицательных» пациентов. Однако, основываясь на высвобождении ИЛ-2 в предыдущих исследованиях с системным введением пептидов глютена, которые активируют глютен-специфические Т-клетки CD4 + , а также на исследованиях плацебо-контролируемого кормления глютеном, чувствительность высвобождения ИЛ-2 после провокации глютеном, вероятно, снизится. быть более 90% у «истинно положительных» пациентов с БК на GFD. 9
Необходимо выяснить, требуется ли пациенту придерживаться GFD, и как долго, прежде чем глютен вызовет обнаруживаемое повышение уровня IL-2 в крови. В настоящем исследовании пациенты с CD, получавшие GFD всего в течение 5 недель, реагировали на ИЛ-2 после контрольного заражения. Исследования также должны учитывать, может ли оценка IL-2 с провокацией глютеном быть окончательным тестом на CD по сравнению с гистологией. Было обнаружено, что гистологическая оценка двенадцатиперстной кишки дает ложноположительные результаты более чем в 10% случаев диагноза БК. 29 В совокупности наши результаты повышают вероятность того, что провокация глютеном с оценкой IL-2 может быть использована для решения ошибочно диагностированной БК, что может быть особенно распространено среди «подтвержденных биопсией» случаев без подтверждающей серологии или в случаях, диагностированных только с помощью серологии. 24,30
Выявление людей с GFD без CD, которым не требуется пожизненное исключение глютена, имеет важное клиническое значение. Строгий GFD является дорогостоящим, социально ограничивающим, часто с более высоким содержанием рафинированного крахмала и жира и низким содержанием цельного зерна, 31 , и связан с усилением ишемической болезни сердца и метаболическим синдромом. 32–34 Наше открытие о том, что провокация глютеном не вызывает высвобождения ИЛ-8 у пациентов с SR-GS, добавляет дополнительный вес доказательству того, что активация иммунной системы глютеном или родственными белками злаков не является объяснением ранних симптомов и что избегание глютена не может быть оправдано по этим основаниям. Действительно, пациенты SR-GS, которых мы изучали с помощью GFD, описали тревожные пищеварительные симптомы до введения глютена, и ни австралийская, ни норвежская когорты SR-GS не показали симптоматического ухудшения после введения глютена. 15 Это согласуется с данными, показывающими, что симптоматическое ухудшение SR-GS может быть связано с диетическими FODMAP, которые часто присутствуют в злаках, содержащих глютен, в отличие от самого глютена. 15,35
Простой подход к выявлению людей после GFD с CD, которые с медицинской точки зрения выиграют от долгосрочного GFD, является неудовлетворенной потребностью. Наши результаты показывают, что измерение сывороточного IL-2 до и после провокации глютеном может удовлетворить это требование. Оценка цитокинов вскоре после острого пищевого заражения глютеном показывает, что быстрая иммунная активация специфична для пациентов с GFD, у которых есть CD, и что сопоставимые эффекты приема глютена не могут быть обнаружены у пациентов с SR-GS.
Благодарности
Авторы благодарят амбулаторную клинику питания при университетской больнице Осло за их вклад и штатного инженера Карину Хинрикс за неоценимую помощь. Мы также благодарим компанию Celiac Australia за их поддержку в наборе добровольцев, а также Кэти Пицзи и Брук Фландерс в сборе образцов. Мы признательны всем участникам исследования за то, что они провели тест на глютен и сдали образцы крови.
Вклад авторов
Исследования были разработаны RPA, KEAL, LMS, LJW и JAT-D.JAT-D, GIS и VKS провели клинические исследования и собрали клинические данные. AKR, SW, KEG и JLD выполнили иммунные анализы. Интеграция и анализ данных выполнялись GG и RPA. Таблицы и рисунки были подготовлены JAT-D, GG и RPA. LMS помогала в интерпретации результатов. Рукопись написали JAT-D, KEAL и RPA. Все авторы просмотрели и одобрили рукопись, таблицы и рисунки. Авторы приняли решение отправить рукопись для публикации и ручаются за точность данных и анализов, а также за соответствие этого отчета протоколу испытания.РПА имела полный доступ ко всем данным в исследовании и несла окончательную ответственность за решение о представлении для публикации.
Заявление о конфликте интересов
ГИС, ВКС и АКР не имеют конфликтующих интересов. GG, LJW, RPA, KEG, SW и JLD являются сотрудниками ImmusanT, Inc. JAT-D, KEAL и LMS выступают в качестве консультантов ImmusanT, Inc. RPA и JAT-D являются изобретателями патентов, принадлежащих ImmusanT, Inc. …, относящиеся к диагностическому применению заражения глютеном и использованию полученных из глютена Т-клеточных эпитопов для использования в терапевтических целях.LMS и KEAL имеют патент на методы обнаружения глютен-специфических Т-клеток. LMS, в частном порядке или через своего работодателя, выступает в качестве научного консультанта Bioniz Therapeutics, ActoBio Therapeutics, UCB Biopharma, Merck и Chugai Pharmaceutical. KEAL является научным консультантом Amyra AG, Bioniz Therapeutics и ActoBio Therapeutics, получает гонорары от Takeda и Tillots, а также гонорар за клинические испытания от Dr Falk Pharma.
Одобрение этики
Исследование в Мельбурне было одобрено Комитетом по этике исследований на людях (HREC) в Институте Уолтера и Элизы Холл (идентификатор HREC 03/4) 21 мая 2003 г. и в Мельбурнском здравоохранении (идентификатор HREC 2003 г.).009) 19 апреля 2003 г., а исследование Осло было одобрено Региональным этическим комитетом Юго-Восточной Норвегии (ссылка 2013/1237) 17 декабря 2014 г. Каждый протокол исследования соответствует этическим принципам Хельсинкской декларации 1975 г. при предварительном одобрении исследовательского комитета института.
Финансирование
Эта работа финансировалась ImmusanT, Inc., Кембридж, Массачусетс, США, а также следующими грантами: Норвежский дополнительный фонд здравоохранения и реабилитации (проект 2013-2-124) для KEAL; Управление здравоохранения Юго-Восточной Норвегии (проект 2013046) — KEAL; Схема финансирования Центра передового опыта Исследовательского совета Норвегии (проект 179573 / V40) для LMS; Stiftelsen KG Jebsen (проект SKGJ-MED-017) для KEAL и LMS; и ведущая в мире исследовательская программа Университета Осло по иммунологии человека (WL-IMMUNOLOGY) для LMS.JAT-D был поддержан стипендией Mathison Centenary Fellowship из Мельбурнского университета.
Информированное согласие
Письменное информированное согласие было получено от каждого участника, включенного в исследование.
Ссылки
1. Лернер Б.А., Грин PHR, Лебволь Б. Идем против зерна: безглютеновая диета для пациентов без целиакии — стоит или нет ?. Dig Dis Sci 2019; 64: 1740–1747. [PubMed] [Google Scholar] 2. Шах С., Акбари М., Ванга Р. и др. Восприятие пациентом бремени лечения при целиакии выше, чем при других распространенных состояниях.Am J Gastroenterol 2014; 109: 1304–1311. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Аль-Тома А., Вольта У., Ауриккио Р. и др. Руководство Европейского общества по изучению целиакии (ESsCD) по глютеновой болезни и другим заболеваниям, связанным с глютеном. Юнайтед европейский гастроэнтерол J 2019; 7: 583–613. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Людвигссон Дж. Ф., Бай Дж. К., Бьяджи Ф. и др. Диагностика и лечение целиакии у взрослых: рекомендации Британского общества гастроэнтерологов. Кишечник 2014; 63: 1210–1228.[Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Лахдеахо М.Л., Маки М., Лаурила К. и др. Изменения слизистой оболочки тонкой кишки и ответы антител после провокации низкой и средней дозой глютена при глютеновой болезни. BMC Гастроэнтерол 2011; 11: 129. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Леонард М.М., Сапон А., Катасси С. и др. Глютеновая болезнь и нечувствительность к глютену: обзор. JAMA 2017; 318: 647–656. [PubMed] [Google Scholar] 9. Goel G, Tye-Din JA, Qiao S.W. и др. Высвобождение цитокинов и желудочно-кишечные симптомы после провокации глютеном при глютеновой болезни.Sci Adv 2019, с. 5 eaaw7756. [Google Scholar] 10. Желинкова Л., Тукова Л., Цинова Дж. И др. Глиадин стимулирует человеческие моноциты к выработке IL-8 и TNF-альфа через механизм, включающий NF-kappaB. FEBS Lett 2004; 571: 81–85. [PubMed] [Google Scholar] 11. Юнкер Ю., Цейссиг С., Ким С.Дж. и др. Ингибиторы трипсина амилазы пшеницы вызывают воспаление кишечника за счет активации толл-подобного рецептора 4. J Exp Med 2012; 209: 2395–2408. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Ламмерс К.М., Ханделвал С., Чаудри Ф. и др.Идентификация нового иммуномодулирующего пептида глиадина, который вызывает высвобождение интерлейкина-8 зависимым от хемокинового рецептора CXCR3 образом только у пациентов с целиакией. Иммунология 2011; 132: 432–440. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Уокер-Смит Дж., Гуандалини С., Шмитц Дж. И др. Пересмотренные критерии диагностики целиакии. Отчет рабочей группы Европейского общества детской гастроэнтерологии и питания. Арка Дис Дитя 1990; 65: 909–911. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14.Карелл К., Лука А.С., Муди С.Дж. и др. Типы HLA у пациентов с целиакией, не несущих гетеродимер DQA1 * 05-DQB1 * 02 (DQ2): результаты Европейского генетического кластера по целиакии. Hum Immunol 2003; 64: 469–477. [PubMed] [Google Scholar] 15. Скодье Г.И., Сарна В.К., Минелле И.Х. и др. Фруктан, а не глютен, вызывает симптомы у пациентов с самооценкой чувствительности к глютену, не связанной с глютеном. Гастроэнтерология 2018; 154: 529–539, e2. [PubMed] [Google Scholar] 16. ван Овербек FM, Уил-Дитерман И.Г., Мол И.В. и др.Ежедневное потребление глютена родственниками пациентов с глютеновой болезнью по сравнению с обычным голландским населением. Eur J Гастроэнтерол Гепатол 1997; 9: 1097–1099. [PubMed] [Google Scholar] 17. Леффлер Д.А., Келли С.П., Грин PH и др. Ларазотида ацетат при стойких симптомах целиакии, несмотря на безглютеновую диету: рандомизированное контролируемое исследование. Гастроэнтерология 2015; 148: 1311–1319, e6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Бодд М., Толлефсен С., Бергсен Э. и др. Доказательства того, что HLA-DQ9 создает риск целиакии из-за присутствия DQ9-ограниченных глютен-специфических Т-клеток.Hum Immunol 2012; 73: 376–381. [PubMed] [Google Scholar] 19. Риснес Л.Ф., Кристоферсен А., Дахал-Коирала С. и др. Клонотипы CD4 + Т-клеток, вызывающие заболевание, сохраняются в течение десятилетий при глютеновой болезни. J Clin Invest 2018; 128: 2642–2650. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Скодье Г.И., Минелле И.Х., Рольфсен К.Л. и др. Оценка диеты и симптомов у взрослых с самооценкой чувствительности к глютену, не связанной с глютеном. Clin Nutr ESPEN 2019; 31: 88–94. [PubMed] [Google Scholar] 21. Халмос Е.П., Пауэр В.А., Шеперд С.Дж. и др.Диета с низким содержанием FODMAP снижает симптомы синдрома раздраженного кишечника. Гастроэнтерология 2014; 146: 67–75 e5. [PubMed] [Google Scholar] 22. Катасси С., Элли Л., Боназ Б. и др. Диагностика неглютеновой чувствительности к глютену (NCGS): критерии экспертов Салерно. Питательные вещества 2015; 7: 4966–4977. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Гоэль Г., Кинг Т., Дейвсон А.Дж. и др. Эпитоп-специфическая иммунотерапия, направленная на CD4-положительные Т-клетки при целиакии: два рандомизированных, двойных слепых, плацебо-контролируемых исследования фазы 1.Ланцет Гастроэнтерол Гепатол 2017; 2: 479–493. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Андерсон Р.П., Генри М.Дж., Тейлор Р. и др. Новый серогенетический подход определяет распространенность глютеновой болезни среди населения и дает информацию об улучшенных диагностических методах. BMC Med 2013; 11: 188. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Леффлер Д., Шуппан Д., Паллав К. и др. Кинетика гистологических, серологических и симптоматических реакций на провокацию глютеном у взрослых с глютеновой болезнью. Кишечник 2013; 62: 996–1004.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Сарна В.К., Скодье Г.И., Реймс Х.М. и др. HLA-DQ: тест на тетрамер глютена в крови дает лучшее определение пациентов с глютеновой болезнью, чем биопсия после 14-дневной провокации с глютеном. Кишечник 2018; 67: 1606–1613. [PubMed] [Google Scholar] 27. Курппа К., Коскинен О., Коллин П. и др. Изменение фенотипа целиакии после длительного воздействия глютена. J Педиатр Гастроэнтерол Нутр 2008; 47: 500–503. [PubMed] [Google Scholar] 28. Карелл К., Лука А.С., Муди С.Дж. и др. Типы HLA у пациентов с глютеновой болезнью, не несущих гетеродимера DQA1 * 05-DQB1 * 02 (DQ2): результаты европейского генетического кластера по глютеновой болезни.Hum Immunol 2003; 64: 469–477. [PubMed] [Google Scholar] 29. Arguelles-Grande C, Tennyson CA, Lewis SK, et al. Вариабельность в отчетах о гистопатологии тонкой кишки в различных условиях патологической практики: влияние на диагностику целиакии. Дж. Клин Патол 2012; 65: 242–247. [PubMed] [Google Scholar] 30. DeGaetani M, Tennyson CA, Lebwohl B, et al. Атрофия ворсинок и отрицательная серология целиакии: диагностическая и терапевтическая дилемма. Am J Gastroenterol 2013; 108: 647–653. [PubMed] [Google Scholar] 31.См. JA, Kaukinen K, Makharia GK, et al. Практические советы по безглютеновой диете. Нат Рев Гастроэнтерол Гепатол 2015; 12: 580–591. [PubMed] [Google Scholar] 32. Lebwohl B, Cao Y, Zong G, et al. Долгосрочное потребление глютена у взрослых без целиакии и риска ишемической болезни сердца: проспективное когортное исследование. BMJ 2017; 357: j1892. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Товоли Ф., Негрини Дж., Фари Р. и др. Повышенный риск неалкогольной жировой болезни печени у пациентов с глютеновой болезнью, соблюдающих безглютеновую диету: помимо традиционных метаболических факторов.Алимент Фармакол Тер 2018; 48: 538–546. [PubMed] [Google Scholar] 34. Тортора Р., Капоне П., Де Стефано Г. и др. Метаболический синдром у пациентов с глютеновой болезнью, соблюдающих безглютеновую диету. Алимент Фармакол Тер 2015; 41: 352–359. [PubMed] [Google Scholar] 35. Biesiekierski JR, Peters SL, Newnham ED, et al. Отсутствие эффектов глютена у пациентов с самооценкой чувствительности к глютену, не связанной с глютеном, после снижения с пищей сбраживаемых, плохо усваиваемых короткоцепочечных углеводов. Гастроэнтерология 2013; 145: 320-328 e1–3.[PubMed] [Google Scholar]Факторы пациента, влияющие на острую реакцию глютена и высвобождение цитокинов при лечении глютеновой болезни | BMC Medicine
Авторы благодарят пациентов и членов их семей, поддержавших это исследование. JAT-D поддерживается стипендией столетия Мельбурнского университета и грантом для исследователей Австралийского национального совета по здравоохранению и медицинским исследованиям.
‡ Исследовательская группа RESET CeD:
A. Adams (AB Clinical Trials, Лас-Вегас, Невада, США), J.Эндрюс (Королевский госпиталь Аделаиды, Аделаида, Южная Америка, Австралия), К. Беренд (Исследовательская группа Гранд Тетон, Айдахо-Фолс, Айдахо, США), Дж. Браун (Госпиталь Альфреда, Мельбурн, Виктория, Австралия), С. Чен И Мэй ( Eastern Health-Box Hill Hospital, Box Hill, VIC, AUS), A. Coates (Gastroenterology Associates of Western Michigan, PLC dba West Michigan Clinical Research Center, Вайоминг, штат Мичиган, США), AJ Дэвсон (Институт клинических исследований Кораллового моря, Северный Маккей, QLD, AUS и The Wesley Hospital — The Wesley Research Institute, Auchenflower, QLD, AUS), A.ДиМарино (Университетская больница Томаса Джефферсона, Филадельфия, Пенсильвания, США), Х. И (отделение гастроэнтерологии, Госпиталь сэра Чарльза Гэрднера, Недлендс, Вашингтон, Австралия), Д. Эллиотт (Университет Айовы, Айова-Сити, Айова, США), Р. Эпштейн (ActivMed Practices & Research, Inc., Портсмут, Нью-Хэмпшир, США), Б. Фейен (Исследование PMG клиники МакФарланд, Эймс, Айова, США), Р. Фогель (Институт клинических исследований Мичигана, Честерфилд, Мичиган, США) США), К. Фриденберг (Исследования гастроэнтерологии Великих озер, Mentor, Огайо, США), Р.Гирри (Медицинский факультет Университета Отаго, Крайстчерч, Новая Зеландия), М. Гердис (Исследования лекарств Америка, Хартсдейл, Нью-Йорк, США), М. Голдштейн (Группа исследований желудочно-кишечного тракта Лонг-Айленда, Грейт-Нек, Нью-Йорк, США), В. Гупта (Alliance Medical Research LLC, Лайтхаус-Пойнт, Флорида, США), Р. Холмс (PMG Research of Winston-Salem, LLC, Уинстон-Салем, Северная Каролина, США), Дж. Холтманн (Университет Квинсленда — Госпиталь принцессы Александры, Woolloongabba, QLD, AUS), S. Idarraga (специалисты по исследованию лояльности, Wauwatosa, WI, США), G.Джеймс (Исследования здоровья пищеварительной системы, LLC, Эрмитаж, Теннесси, США), Т. Кинг (Окленд Клинические исследования Лимитед, Окленд, Новая Зеландия), Т. Кляйн (Heartland Research Associates, LLC, Уичито, Канзас, США), С. Купфер ( Медицинский центр Чикагского университета, Чикаго, Иллинойс, США), Б. Лебволь (Центр целиакии при Колумбийском университете, Нью-Йорк, штат Нью-Йорк, США), Дж. Лоу (Институт перспективных исследований, Огден, Юта, США), Дж. Мюррей (клиника Мэйо, Рочестер, Миннесота, США), Э. Ньютон (Omega Medical Research, Уорик, Род-Айленд, США), Д. Куинн (P3 Research Limited, Веллингтон, Новая Зеландия), Д.Радин (Стэмфордский терапевтический консорциум, Стэмфорд, Коннектикут, США), Т. Риттер (консультанты по заболеваниям пищеварительной системы Техас, Саутлейк, Техас, США), Х. Стейси (Diablo Clinical Research, Inc., Уолнат-Крик, Калифорния, США), К. Strout (Исследовательский центр Coastal Carolina, Маунт-Плезант, Южная Каролина, США), R. Stubbs (P3 Research Limited, Havelock North, NZ), S. Thackwray (Центр клинических испытаний — University of the Sunshine Coast, Sippy Downs, QLD, AUS) , В. Триведи (PMG Research, Inc., d / b / a PMG Research of Piedmont Healthcare, Стейтсвилль, Северная Каролина, США), J.А. Тай-Дин (Королевская больница Мельбурна — Институт медицинских исследований Уолтера и Элизы Холл, Парквилл, Виктория, Австралия), Дж. Вебер (Центр здоровья пищеварительной системы, Трой, Мичиган, США) и С. Уилсон (Ocean State Clinical Research Partners, Линкольн, Род-Айленд, США)
Белок в кишечнике может объяснить, почему некоторые не могут заглатывать глютен: соль: NPR
Те, кто избегает глютена, в конце концов, могут и не быть фанатиками еды. Исследователи наконец нашли маркеры чувствительности к глютену в организме. JPM / Getty Images скрыть подпись
переключить подпись JPM / Getty ImagesТе, кто избегает глютена, могут и не быть модниками в еде. Исследователи наконец нашли маркеры чувствительности к глютену в организме.
JPM / Getty ImagesЕсли вы обнаружили, что чувствительны к глютену — эластичному белку, который делает пшеничный хлеб воздушным, а корки пирогов хрустящими, — возможно, вам пришлось вынести на себя всю тяжесть отрицательной реакции на безглютеновый продукт.
Согласно исследованию Mintel, около 47 процентов американских потребителей считают безглютеновую диету модной. И это отчасти потому, что существует скудное количество доказательств того, что вызывает нечувствительность к глютену, не связанную с глютеном.Что касается диагностики, нет ничего похожего на тесты по золотому стандарту, которые помогают диагностировать 1 процент населения, страдающего глютеновой болезнью.
Но те, кто избегает глютена (и не страдает глютеновой болезнью), в конце концов, могут и не быть модниками в еде. Исследователи наконец нашли маркеры чувствительности к глютену в организме. Исследование Джованни Барбары и его команды из Болонского университета, Италия, предполагает, что люди, чувствительные к глютену, могут иметь высокий уровень молекулы зонулина, связанной с воспалением.
Было показано, что уровни зонулина в крови уже высоки у больных целиакией. В исследовании Барбары уровни у людей, чувствительных к глютену, почти соответствовали таковым у больных целиакией. Хотя результаты предварительные, они указывают на обнадеживающее направление будущих тестов, которые помогут диагностировать это противоречивое состояние.
По данным гастроэнтеролога Алессио Фазано из Массачусетской больницы общего профиля в Бостоне, около 6 процентов мирового населения могут быть чувствительны к глютену.Симптомы могут быть похожи на синдром раздраженного кишечника, с болью в животе, вздутием живота, чередующейся диареей или запором. Могут быть и другие симптомы, включая «мозговой туман», головную боль, усталость, боль в суставах и мышцах.
Ввести зонулин, ступень слева. Зонулин — воспалительный белок, впервые обнаруженный Фазано и его командой в 2000 году. Он помогает регулировать неплотность кишечника, открывая и закрывая пространства или «соединения» между клетками в слизистой оболочке пищеварительного тракта. Зонулин вызывается вредными бактериями и обеспечивает важную защиту организма: если вы случайно съели пищу, зараженную сальмонеллой, вы полагаетесь на зонулин, который поможет вызвать диарею и избавиться от насекомых.
Когда патоген уходит, уровень зонулина падает, и соединения закрываются.
Так при чем здесь глютен? Оказывается, у некоторых людей глютен является мощным триггером зонулина. «Ни один человек не переваривает глютен полностью», — говорит Фазано. «И у небольшого процента из нас непереваренная глютен вызывает высвобождение зонулина», что приводит к его высокому уровню.
Чтобы проверить теорию, Джованни Барбара и группа исследователей из Болонского университета измерили уровни зонулина в крови у четырех групп людей: людей с глютеновой болезнью, людей с синдромом раздраженного кишечника, сопровождающегося диареей, и пациентов с самодиагностикой глютена. чуткость и здоровые добровольцы.И у больных целиакией, и у лиц, чувствительных к глютену, обнаружился чрезвычайно высокий уровень зонулина в крови. У людей с СРК был повышенный уровень, но менее чем вдвое меньше, чем у людей, страдающих целиакией или чувствительных к глютену. У здоровых добровольцев уровень зонулина в крови был незначительным.
Результаты были представлены в октябре в виде тезисов на 23-й Объединенной европейской гастроэнтерологической неделе в Барселоне, Испания. «Я была очень удивлена, но не только уровнем зонулина, — говорит Барбара. «В нашем исследовании люди, чувствительные к глютену, которые придерживались безглютеновой диеты, имели генетическую предрасположенность к целиакии.У них не было доказательств целиакии, но у них были уязвимые гены, которые подвергали человека риску развития целиакии ».
Несмотря на обнаружение двух потенциальных биомаркеров, Барбара предупреждает, что еще слишком рано рекомендовать какие-либо клинические испытания.« Мы. необходимы дополнительные исследования для определения клинической применимости этих маркеров. … Другим лабораториям необходимо воспроизвести наши данные, и нам нужно повторить наш собственный эксперимент с пациентами, чувствительными к глютену, которые были идентифицированы по строгим критериям в двойных слепых исследованиях.Барбара добавляет, что его центр принимает только самых тяжелых пациентов, которым не удалось найти лечение в другом месте, что, возможно, повлияло на результаты.
Фазано, который не участвовал в исследовании Барбары, говорит, что открытие зонулина является частью большего, эволюционирующая картина ». Эта молекула чрезвычайно важна при многих заболеваниях, от диабета 1 типа до других аутоиммунных заболеваний. Многие заболевания связаны с потерей барьерной функции в кишечнике ». Вскоре начнется испытание, чтобы проверить, можно ли остановить выработку зонулина в кишечнике на несколько часов.
«Было бы здорово, — говорит Фазано, — если бы у нас было безопасное лекарство, которое могло бы сдерживать эту молекулу и помочь при глютеновой болезни, чувствительности к глютену и, возможно, других состояниях».
Джилл Неймарк — писательница из Атланты, чьи работы были представлены в Discover, Scientific American, Science, Nautilus, Aeon, Psychology Today, и The New York Times.
Высвобождение цитокинов и желудочно-кишечные симптомы после введения глютена при глютеновой болезни
ВВЕДЕНИЕ
Целиакия (ЦБ) — это распространенное аутоиммунное заболевание, вызываемое проглоченными белками глютена злаков ( 1 ).Для CeD характерен приобретенный иммунный ответ на глютен, и единственным доступным лечением этого заболевания является пожизненная безглютеновая диета (GFD). Иммунный ответ на глютен в CeD управляется CD4 + Т-клетками, специфичными для дезамидированных пептидов глютена, которые однозначно связываются с ассоциированным с заболеванием лейкоцитарным антигеном человека (HLA) –DQ аллотипами ( 2 ). те, кто соблюдают строгие правила GFD, подвергаются воздействию глютенсодержащей пищи, они обычно страдают желудочно-кишечными реакциями, возникающими через 1-2 часа после воздействия глютена ( 3 ).В настоящее время нет объяснения острым индуцированным глютеном симптомам, наблюдаемым у пролеченных пациентов с ЦБ. Желудочно-кишечные проявления, аналогичные симптомам тяжелого воздействия глютена при CeD, могут быть заметными при синдроме высвобождения цитокинов после первой инфузии биопрепаратов, активирующих Т-клетки ( 4 ). Хотя глютен-стимулированные цитокиновые профили слизистой оболочки и глютен-специфические CD4 + Т-клетки в долгосрочной культуре были тщательно исследованы ( 2 ), симптомы острого воздействия глютена при ХЭ не были клинически связаны с изменениями цитокинов. ( 5 ).Интерес к высвобождению цитокинов после реактивации глютенового иммунитета был вызван исследованиями на пациентах с ЦБ, в которых оценивали клинические и иммунологические эффекты исследуемой антиген-специфической иммунотерапии (Nexvax2; ImmusanT, Кембридж, Массачусетс, США) ( 6 ). Nexvax2 представляет собой эквимолярную смесь трех растворимых пептидов, о которых сообщили Tye-Din и др. . ( 7 ) и соответствуют 15- или 16-мерным пептидным фрагментам нативных белков глютена с остатками глутамата, заменяющими глутамин в сайтах, которые, как предполагается, чувствительны к дезамидированию трансглутаминазой 2 (TG2).CD4 + Т-клетки, специфичные для перекрывающихся HLA-DQ2.5-ограниченных эпитопов в этих «глютеновых пептидах» (DQ2 · 5-глия-α1a / α2, DQ2 · 5-глия-ω1 / ω2 и DQ2.5- hor-3 / var, DQ2 · 5-glia-γ5) составляют большинство Т-клеток периферической крови и кишечника, отвечающих на глютен, гордеин (ячмень) и секалин (рожь) ( 7 , 8 ). Иммунодоминантные В-клеточные эпитопы также представлены в пептидах глютена Nexvax2 ( 9 ), но у пациентов с CeD, получающих Nexvax2, не наблюдается активации комплемента или индукции антитела против Nexvax2 ( 6 , 10 ).Пептиды Nexvax2 не оказывают известного воздействия на клетки врожденного иммунитета. Два отдельных двойных слепых плацебо-контролируемых исследования восходящей внутрикожной дозы Nexvax2 фазы 1 были завершены у пациентов с HLA-DQ2.5 + CeD с GFD и подробно описаны в другом месте ( 6 ). Дизайн и результаты двух исследований были тесно связаны, за исключением режима дозирования. В этих исследованиях тошнота, рвота и боль в животе часто возникали в течение 2-5 часов после первой дозы пептидов глютена, которая определяла максимально переносимую дозу (150 мкг).Реакции в месте инъекции, напоминающие кожный ответ на отзывный антиген ( 11 ), не наблюдались. Теперь мы сообщаем о профилях цитокинов в плазме и о том, как они коррелировали с клиническими оценками после первой и последней доз глютеновых пептидов Nexvax2. Наши наблюдения из этих исследований фазы 1 привели нас к гипотезе о том, что высвобождение цитокинов происходит после естественного воздействия глютена и может быть использовано для определения того, какие ветви иммунной системы вызывают ранние симптомы. Целью настоящего исследования было охарактеризовать профили системных цитокинов и их связь с острыми симптомами у пациентов с ЦБ после реактивации иммунитета к глютену либо путем инъекции синтетических пептидов глютена, либо путем скармливания натуральной глютена.ОБСУЖДЕНИЕ
Эти исследования касались иммунологической основы ранних пищеварительных симптомов, испытываемых пациентами с CeD после внутрикожной инъекции пептидов глютена, а также после физиологического приема глютена. Быстрое, скоординированное повышение циркулирующих цитокинов, включая IL-2, подтвердило активацию in vivo CD4 + T-клеток у пациентов с CeD после инъекции коротких антигенных пептидов глютена или приема глютена, что было тесно связано с началом и тяжестью острых пищеварительных симптомов.Эти результаты были примечательными, потому что сигнатура цитокинов после инъекции пептидов глютена, которые потенциально могут напрямую связываться с HLA-DQ2.5 на профессиональных антиген-презентирующих клетках, имитировала то, что вызвано приемом глютена, хотя пептиды, полученные в результате переваривания глютена в кишечнике, должны абсорбироваться , требуют частичного дезамидирования для иммунной презентации, более разнообразны и обладают дополнительными свойствами, заключающимися в эффективной активации гуморального иммунитета и причинения хронического поражения кишечника.
Пептиды глютена, которые мы исследовали, соответствуют частично дезамидированным 15- или 16-аминокислотным фрагментам белков α- и ω-глиадина пшеницы и белка B-гордеина ячменя, которые содержат в общей сложности шесть HLA-DQ2.5-рестриктированные эпитопы, как известно, активируют большинство глютен-специфических CD4 + Т-клеток кишечника и крови у пациентов с HLA-DQ2.5 + CeD ( 7 , 8 ). Эта смесь пептидов исследуется в качестве потенциальной иммунотерапии (Nexvax2) для CeD путем использования иммуномодулирующих свойств иммунодоминантных эпитопов Т-клеток CD4 + ( 24 ). Ранее мы подробно описывали клинические аспекты двух параллельных исследований Nexvax2 в фазе 1 с фиксированной внутрикожной возрастающей дозой ( 6 ).В отличие от нашего ограниченного понимания иммунной основы аутоиммунного заболевания, опосредованного Т-клетками, эти клинические исследования предоставили возможность проверить клинические эффекты избирательного вовлечения и активации патогенных Т-клеток CD4 + у пациентов. Для CeD этот аспект был особенно важен, потому что ранее причинный антиген, глютен, можно было вводить только в кишечник, что делало невозможным отличить прямые местные иммунотоксические эффекты от тех, которые опосредованы активированными глютен-специфическими CD4 + Т-клетками.Кроме того, наше понимание глютен-специфической функции Т-лимфоцитов CD4 + было ограничено исследованиями, основанными на анализах in vitro / ex vivo или на нечеловеческих моделях, редукционистских подходах, которые все больше изучаются ( 22 ). предоставляет окончательные доказательства быстрой иммунной активации в течение 2 часов после введения глютеновых пептидов почти у всех пациентов с HLA-DQ2.5 + CeD. Качественные и количественные оценки цитокинов, повышенных после инъекции глютеновых пептидов или пищевого заражения глютеном, осложнялись отдельными цитокинами, имеющими разные временные профили, и низкими исходными концентрациями ключевых цитокинов, таких как IL-2.В конечном итоге, были использованы три различных мультиплексных аналитических платформы для скрининга до 92 цитокинов, чтобы показать статистически значимое, скоординированное повышение уровня IL-2, IL-8, MCP-1, IL-10, MIP-1β, IP-10 и эотаксина в плазме. после инъекции глютеновых пептидов. Высокочувствительные анализы для ключевых аналитов в выбранные моменты времени показали, что самые ранние цитокины, которые поднялись и достигли пикового уровня в плазме, включали IL-2, который также был цитокином, который демонстрировал наиболее заметное повышение. Эти результаты согласуются с кинетикой активации Т-клеток CD4 + и высвобождения цитокинов при введении короткого растворимого антигенного пептида в мышиных моделях переноса Т-клеток ( 22 ).Хотя пептиды глютена не доставлялись в кишечник, наблюдались желудочно-кишечные симптомы, имитирующие симптомы после воздействия глютена, и их начало происходило при повышении уровня цитокинов в плазме. Более сильная тошнота с рвотой или без нее была связана с более высокими пиковыми уровнями цитокинов в плазме. Связь между активацией иммунной системы и симптомами была дополнительно усилена, показывая, что симптомы после приема препарата и высвобождение цитокинов уменьшались после трех еженедельных доз и отсутствовали после 16 инъекций глютеновых пептидов дважды в неделю.Эти результаты согласуются с различием в тяжести симптомов после приема глютена по сравнению с инъекцией глютенового пептида, которое связано с эффективностью воздействия антигена и активацией Т-клеток, измеренной по концентрации циркулирующего IL-2 через 4 часа.
На основании этих наблюдений мы исследовали, происходит ли системное высвобождение цитокинов у пациентов с ЦБ после однократного приема пищи, содержащей 3 или 5,7 г глютена, что эквивалентно примерно четверти или половине среднего суточного потребления глютена в организме человека. США ( 25 ).В отличие от ранее опубликованных результатов с использованием менее чувствительного формата анализа ( 5 ), высвобождение цитокинов, в котором преобладает повышение уровня IL-2, можно было обнаружить уже через 2 часа после приема глютена. Цитокины, показавшие статистически значимое повышение среди 18 протестированных групп, ограничивались ИЛ-2, ИЛ-8 и ИЛ-10. Выявление IL-2, за которым следует IL-8, их временные профили и тесная корреляция очень напоминали их высвобождение после инъекции пептидов глютена. Однако пиковые повышения цитокинов были значительно меньше после приема глютена, чем после инъекции пептидов глютена.В соответствии с глютен-специфическими Т-клетками CD4 + , ответственными за высвобождение цитокинов после воздействия глютена, повышение уровня ИЛ-2 в плазме коррелировало с частотами этих клеток в периферической крови. Мы обнаружили, что провокация глютена с 5,7 г глютена значительно усилила тошноту, пик которой наступил через 4 часа. Более сильная тошнота и рвота были связаны с более высокими концентрациями IL-2 в плазме. Ключевым механистическим вопросом является выявление клеточного источника для повышения уровня IL-2 в плазме после приема глютена или инъекций глютеновых пептидов.Активированные Т-клетки являются основным источником ИЛ-2, но ДК также могут секретировать ИЛ-2 после лигирования рецепторов распознавания специфических патогенов; тучные клетки также секретируют IL-2 после воздействия IL-33 или IL-9 ( 26 , 27 ). CeD характеризуется CD4 + T-клетками, которые распознают деамидированные эпитопы глютена ( 2 ), и большинство глютен-специфических CD4 + T-клеток в HLA-DQ2.5 + Пациенты с CeD реагируют с эпитопами. представлен в Nexvax2 ( 7 ).Повышение уровня IL-2, являющееся ранним и заметным в цитокиновой сигнатуре после инъекции глютеновых пептидов Nexvax2 пациентам с CeD, соответствует известной кинетике секреции IL-2 Т-клетками памяти CD4 + in vivo ( 20 ). CD4 + Т-клетки, специфичные для глютена, обогащены тканью кишечника и могут также присутствовать во вторичных лимфоидных органах, связанных с кишечником, но в крови пациентов с HLA-DQ2.5 + CeD с памятью GFD, CD4 + T клетки, специфичные для эпитопов в Nexvax2, имеют среднюю частоту, по оценкам, только 4 на миллион CD4 + Т-клеток ( 5 ).Эта частота намного ниже, чем в моделях переноса Т-клеток у мышей, и, вероятно, препятствует прямой оценке секреции ИЛ-2 глютен-специфическими Т-клетками CD4 + , собранными у пациентов после инъекции пептидов глютена или приема глютена. В уровнях IFN-γ в крови, цитокина, который исторически считался архетипическим маркером для активированных глютен-специфических CD4 + Т-клеток ( 2 ), после приема внутрь глютена или пептида глютена, введение могло быть вызвано относительно высоким исходные концентрации этого цитокина по сравнению с ИЛ-2.Напротив, эксперименты in vitro с активированными глютен-специфическими кишечными и полученными из крови CD4 + TCC продемонстрировали лишь временную секрецию IL-2, которая была умеренной по сравнению с устойчивой секрецией IFN-γ и некоторых других цитокинов. Вероятно, это связано с тем фактом, что ИЛ-2 является аутокринным фактором роста Т-клеток, который, в отличие от многих других цитокинов, потребляется пролиферирующими ТСС в плотных культурах in vitro ( 28 ). Кроме того, ставится под сомнение зависимость от долгосрочных TCC для прогнозирования того, как Т-клетки памяти участвуют в иммунном ответе in vivo ( 22 ).Таким образом, мы использовали свежую кровь пациентов с CeD, собранную через 6 дней после провокации глютеновой пищей, чтобы обеспечить источник свежих, неманипулированных глютен-специфических CD4 + Т-клеток, которые могут имитировать высвобождение цитокинов in vivo более точно, чем долгосрочные TCC (). 2 ). IL-2, IFN-γ и IP-10, хемокин, полученный из моноцитов, экспрессия которого тесно коррелировала с повышением IFN-γ, были выборочно повышены после 24-часовой инкубации глютеновых пептидов Nexvax2 со свежей кровью, собранной из HLA-DQ2. .5 + Пациенты с CeD после, но не до провокации с пищей с глютеном. Известные свойства IL-2 и IFN-γ и их тесно взаимосвязанная секреция в свежей крови, собранной от доноров CeD, согласуются с их источником, являющимся глютен-специфическими CD4 + Т-клетками. Та секреция цитокинов неманипулированными глютен-специфическими Т-клетками CD4 + в свежей крови пациентов с CeD, которая смещена к IL-2 и / или IFN-γ, соответствует ответам Т-клеток CD4 + на вирусные грибковые и бактериальные обратные антигены ( 29 ).Наши результаты подчеркивают, что секреция цитокинов глютен-специфическими Т-клетками CD4 + у пациентов вряд ли будет точно отражена стимуляцией TCC in vitro. Кроме того, эти данные подтверждают вывод о том, что глютен-специфические CD4 + Т-клетки являются источником повышенных уровней IL-2 и IFN-γ в крови после приема глютена или введения пептидов глютена. пептиды или прием глютена имеют какие-либо прямые внекишечные эффекты, неясно.Усталость, головная боль и «мозговой туман» — это часто сообщаемые внекишечные симптомы у пациентов с ЦБ ( 3 ). Однако симптомы, сосредоточенные в верхних отделах желудочно-кишечного тракта, предполагают, что цитокины, повышенные в крови, обладают клиническими и иммунологическими эффектами, которые избирательно влияют на ткань, из которой они происходят. Слизистая оболочка тонкой кишки при CeD инфильтрирована глютен-специфическими CD4 + Т-клетками и B-клетками и плазматическими клетками, специфичными для глютена и TG2, которые, как считается, способствуют высокоэффективной презентации глютеновых пептидов глютен-специфическим CD4 + T ячеек ( 23 ).Выявление IL-2 и отсутствие MDC / CCL22, хемокина, полученного из активированных профессиональных антигенпрезентирующих клеток, свидетельствует в пользу активированных Т-клеток CD4 + , а не В-клеток в адаптивном иммунном ответе на глютен, ответственный за инициацию цитокинов. высвобождение после инъекции глютеновых пептидов или приема глютена. Тошнота и рвота являются частыми побочными эффектами высоких доз рекомбинантного ИЛ-2, вводимых в виде болюсной инъекции ( 30 ). После подкожного введения высоких доз ИЛ-2 пиковые уровни сыворотки через 4 часа составляют примерно 4 нг / мл ( 31 ).Это в 400 раз выше порогового уровня IL-2 (10 пг / мл) через 4 часа после внутрикожного приема Nexvax2 или глютена, указанных выше, при которых рвота и более сильная тошнота были обычными. Однако, поскольку двенадцатиперстная кишка необычно богата серотонин-содержащими энтерохромаффинными клетками, а рецепторы биоактивных аминов в слизистой оболочке двенадцатиперстной кишки играют ключевую роль в контроле тошноты и рвоты ( 32 ), высокие локальные тканевые концентрации ИЛ-2 или нижестоящих медиаторов после реактивации глютенового иммунитета в слизистой оболочке двенадцатиперстной кишки может быть достаточно, чтобы вызвать эти симптомы без заметных системных эффектов.В будущих исследованиях следует проверить, действительно ли концентрации цитокинов в слизистой оболочке кишечника значительно выше, чем в крови после провокации глютеном или инъекции глютеновых пептидов, и определить, совпадают ли изменения в местных уровнях цитокинов с инфильтрацией иммунных и воспалительных клеток. Наши результаты показывают, что глютен-специфический CD4 + Т-клетки быстро активируются глютеном и позиционируют эти Т-клетки как движущие силы острых кишечно-специфических симптомов при CeD. Это исследование стало первым случаем, когда было показано, что пептиды, содержащие иммунодоминантные эпитопы для CD4 + Т-клеток при органоспецифическом иммунном заболевании, стимулируют быстрое системное высвобождение цитокинов у пациентов.Постдозовые симптомы со стороны пищеварения и высвобождение цитокинов не возникают, когда дозам Nexvax2 до 900 мкг предшествует повышение дозы с низкой начальной дозы ( 10 ). Кинетика цитокинов и симптомов, а также отсутствие местных кожных реакций на внутрикожные пептиды глютена, которые быстро выводятся в системный компартмент, контрастируют с обычными реакциями гиперчувствительности замедленного типа, например, на внутрикожный туберкулин ( 11 ). Для понимания патофизиологии CeD эти результаты имеют большое значение, потому что ранее недооцененная важность IL-2 смещает акцент на глютен-специфические Т-клетки CD4 + , ответственные за ранние иммунные события и клинические симптомы после воздействия глютена.МАТЕРИАЛЫ И МЕТОДЫ
Фаза 1 клинических испытаний Nexvax2
Подробно описаны клинические процедуры, исходы и связанные лабораторные методы для рандомизированных, двойных слепых, плацебо-контролируемых исследований фазы 1 с возрастающей дозой, 3 и 16 доз. в другом месте ( 6 ). Все участники предоставили письменное информированное согласие. Комитеты по этике одобрили трехдозовое исследование [Контрольный номер Совета по институциональной оценке Liberty (IRB) 12.07.0012, Институт по обзору институциональной комиссии по защите человеческих субъектов при Университете Оклахомы, номер IRB 1370, номер заявки Комитета по этике исследований Bellberry на человека 2013- 10-553 и Южный комитет по этике здоровья и инвалидности 13 / STH / 168] и для исследования с 16 дозами (номер утверждения Комитета по этике больницы Альфреда 118/12, номер заявки Комитета по этике исследований Bellberry на человека 2012-04-735-AA , Южный комитет по этике здоровья и инвалидности исх.NTY / 12/06/049 / AM05). Хранящиеся образцы плазмы и клинические данные были проанализированы после завершения испытаний и раскрытия данных. Вкратце, взрослые пациенты с HLA-DQ2.5 + CeD на GFD были набраны в 12 центрах в Австралии, Новой Зеландии и США. В течение периода скрининга пациенты, оцениваемые для когорт с возрастающей дозой, получали 3-дневную пробу с пищей с глютеном. Кровь, собранную до и через 6 дней после начала заражения глютеном, оценивали с помощью анализа высвобождения IFN-γ из цельной крови, подробно описанного в другом месте ( 6 ).Последней когорте в каждом исследовании была гастроскопия вместо пищевого провокации, и ее исключали, если присутствовала атрофия ворсинок. Фиксированные дозы исследуемого продукта вводили внутрикожно. Оцененные уровни доз составляли 60, 90 и 150 мкг в исследовании с тремя дозами и 150 и 300 мкг в исследовании с 16 дозами. Соответствующее плацебо представляло собой 0,1 мл стерильного 0,9% хлорида натрия. Регистрировались сроки и тяжесть нежелательных явлений. Пациенты ежедневно оценивали желудочно-кишечные симптомы, такие как боль, голодные боли, тошнота, урчание, вздутие живота и диарея, с использованием семибалльной шкалы Лайкерта, где один представлял наиболее положительный вариант, а семь — наиболее отрицательный в формате шкалы. Шкала оценки желудочно-кишечных симптомов.Кровь для оценки цитокинов плазмы собирали в пробирки Vacutainer с K2 EDTA (Becton Dickinson, Franklin Lakes, NJ), которые центрифугировали в течение 10 минут после сбора при 1100-1300 RCF (относительная центробежная сила) в течение 10 минут, а затем сохраняли плазму. при -60 ° C или ниже. Цитокины оценивали в плазме крови, собранной в течение 30 минут до (исходный уровень) и через 10, 20, 30 и 45 минут, а также через 1, 1,5, 2, 4 и 6 часов после введения дозы в первый день. Плазма в течение того же периода времени также оценивалась у пациентов после приема последней дозы из когорт, получавших максимальную переносимую дозу Nexvax2 (150 мкг).Исследования пищевых проблем с глютеном
Участники предоставили письменное информированное согласие. Комитет по этике исследований на людях Melbourne Health (2003.009) и Комитет по этике исследований на людях Института Уолтера и Элизы Холл (03/04) одобрили исследование. Подходили пациенты мужского и женского пола в возрасте от 18 до 70 лет с подтвержденным биопсией ЦБ после GFD в течение не менее 8 недель. Пациенты были исключены, если их оценка была выше 12 в тесте на приверженность к глютеновой диете ( 33 ), уровень сывороточного иммуноглобулина A (IgA) TG2 и IgG дезамидированного глиадина пептида был повышен, использовались иммуномодуляторы или иммунодепрессанты в течение предыдущих 2 месяцев, перорально или парентеральные кортикостероиды использовались в течение предыдущих 6 недель, или женщины были беременны, кормили грудью или кормили грудью.Двойной слепой тест на пищу, состоящую либо из 5 г витальной пшеничной глютеновой муки (Bob’s Red Mill Natural Foods Inc., Милуоки, штат Орегон), которая, как оценивается, содержит 3 г белка глютена в соответствии с уравнением Осборна, или не содержит глютена. тонкомолотая белая рисовая мука («Рисовая мука McKenzie’s», Ward McKenzie’s Pty Ltd., Австралия) была добавлена к одной порции (7 г) безглютеновых «Низкокалорийных лаймов Vitafresh» или «Vitafresh Low Calorie Sweet Navel Orange» ( Hansells Food Group, Новая Зеландия), смешанные в 100 мл воды в течение 2 мин.Нежелательные явления регистрировались ежечасно и оценивались в соответствии с «Общими критериями терминологии для нежелательных явлений (CTCAE) версии 4.0» (Руководство Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США для промышленности: шкала оценки токсичности). Каждый час участники заполняли модифицированную версию вопросника об исходах пациентов с CeD (CeD PRO) для оценки своего наихудшего опыта по 11 симптомам за предыдущий 1 час, оцениваемым по целочисленной шкале от 0 (нет) до 10 ( худшее из возможных) ( 34 ). Кровь собирали до и ежечасно в течение 8 часов у первых шести пациентов, а у более поздних пациентов — только на исходном уровне и через 4 и 6 часов.Кровь для плазмы собирали и обрабатывали, как описано для фазы 1 клинических исследований. Кровь для сыворотки собирали в пластиковые пробирки для сыворотки Vacutainer Plus (BD 367986). Сыворотка была отделена от крови через 2 часа при комнатной температуре путем центрифугирования при 2000 g в течение 20 минут. Клинические процедуры, результаты и соответствующие лабораторные методы для второго, отдельного контрольного заражения немаскированной пищей с глютеном подробно описаны в другом месте ( 5 ). Участники находились на GFD и в гистологической и серологической ремиссии.Количественная гистология определялась при исходной биопсии двенадцатиперстной кишки. Участники ежедневно потребляли один батончик мюсли весом 50 г, который содержал 7,6 г глютеновой муки (5,7 г белка глютена) и не содержал ферментируемых олигосахаридов, дисахаридов, моносахаридов и полиолов. Образцы крови собирали на исходном уровне и через 2, 4 и 6 часов после употребления батончика мюсли в день 1. Плазму этих образцов крови хранили замороженной при -80 ° C, а затем анализировали на цитокины с помощью анализа с магнитными шариками, и результаты сообщалось ранее ( 5 ).В настоящем исследовании анализ ECL использовался для повторной оценки IL-2, IL-8 и IL-10 в замороженных образцах плазмы с первого дня исследования. Симптомы регистрировались пациентами по визуальной аналоговой шкале вначале, а затем каждые 2 часа в течение 6 часов после употребления глютена в первый день исследования. Частота возвращающихся к кишечнику эффекторной памяти клеток CD4 + , специфичных для DQ2.5: глия-α1a, DQ2.5: глия-α2, DQ2.5: глия-ω1 и DQ2.5: глия-ω2 и DQ8 Эпитопы: glia-α1 и DQ8: glia-γ1b оценивали в крови, собранной на исходном уровне в соответствии с ранее описанными методами ( 35 ).Эти данные были ранее опубликованы ( 5 ).Периферическая кровь и кишечные глютен-реактивные TCC
Добровольцы предоставили письменное информированное согласие. Региональный комитет по этике медицинских исследований и медицинских исследований Юго-Восточной Норвегии (REK 2010/2720) одобрил исследование. Кишечные ОКР получали из биопсии двенадцатиперстной кишки от пациентов с хронической болезнью сердца, как описано ранее ( 36 ). Для получения TCC периферической крови PBMC от пациентов с CeD были окрашены HLA-DQ2.5: тетрамеры глютенового пептида (нагруженные пептидом молекулы главного комплекса гистосовместимости, pMHC), меченные фикоэритрином, отсортированы и клонированы с помощью ограниченного разведения в соответствии с ранее описанными методами ( 37 ).Шесть TCC из кишечника и шесть TCC из крови считались клональными, о чем судили по окрашиванию pMHC> 99% клеток. ТСС высевали (1,5 миллиона на лунку) в 48-луночные планшеты, предварительно покрытые анти-CD3 (5 мкг / мл; 300414, BioLegend, Сан-Диего, Калифорния), и инкубировали в течение 24 часов в 1,5 мл RPMI 1640 с добавлением 10% тепла. -инактивированная человеческая сыворотка и пенициллин-стрептомицин, содержащие анти-CD28 (1 мкг / мл; 302914, BioLegend). Среду (0,1 мл) удаляли и центрифугировали, а супернатанты замораживали.Параллельно восемь TCC также культивировали в течение 24 часов с родственным пептидом и происходящими из моноцитов DC, полученными от донора HLA-DQ2.5 + , на который не влиял CeD. ДК получали путем инкубации положительно отобранных клеток PBMC CD14 + (микрогранулы CD14; Miltenyi Biotec Inc., Сан-Диего, Калифорния) с GM-CSF (1000 ед. / Мл) и IL-4 (500 ед. / Мл). Культуры клеток пополняли через день с заменой половины среды на RPMI с добавлением 10% фетальной телячьей сыворотки, содержащей GM-CSF и IL-4.На 6 день добавляли липополисахарид (150 нг / мл) с GM-CSF и IL-4 в добавленную среду. На 7 день зрелые DC собирали, промывали, подсчитывали и ресуспендировали в RPMI + 10% сыворотке человека (0,5 млн / мл) и инкубировали в течение ночи с PBS или соответствующим родственным пептидом, либо 10 мкМ пептида DQ2 · 5-глия-γ1 ( YQQLPQPEQPQQSFPEQERPF) или 2 мкМ пептида α-глиадин-33мер (LQLQPFPQPELPYPQPELPYPQPELPYPQPQPF). Импульсные пептиды DC (0,4 миллиона) и TCC (1,2 миллиона) были добавлены в каждые 48 лунок в общем объеме 1.2 мл. Среду (0,1 мл) удаляли и центрифугировали, а супернатанты замораживали. Шесть TCC инкубировали в лунках, покрытых иммобилизованным эпитоп-специфическим pMHC ( 38 ). TCC (260 000) инкубировали со связанным с планшетом pMHC в девяти повторных лунках (225 мкл на лунку). Тридцать микролитров среды удаляли из каждой из трех лунок и объединяли, получая три объединенных образца для каждой временной точки, которые были заморожены.Линии Т-лимфоцитов периферической крови и кишечника
Добровольцы предоставили письменное информированное согласие.IRB Чикагского университета (12623B) одобрил исследование. PBMC выделяли центрифугированием Ficoll-Paque с плотностью. Для получения приобретение интраэпителиальных лимфоцитов и последующее 1-часовое механическое нарушение RPMI, содержащего коллагеназу типа IV (C5138-100, Sigma-Aldrich) ( 39 ), для приобретения лимфоцитов собственной пластинки.Положительное окрашивание клеток на анти-CD3 (PE-Cy7, 300420, UCHT1, BioLegend), TCRαβ (αβ Т-клеточный рецептор; BV421, 306722, IP26, BioLegend) и CD4 (PerCP / Cy5.5, 317428, OKT4, BioLegend) были очищены клеточной сортировкой, активируемой флуоресценцией (рис. S4). От пяти до 10000 отсортированных клеток размножали фитогемагглютинином-L (1 мкг / мл; M5030, Calbiochem / EMD Millipore, Billerica, MA) и смесью облученных гетерологичных PBMC и линий B-лимфобластоидных клеток, трансформированных вирусом Эпштейна-Барра, в RPMI + 10% человеческая сыворотка AB (S40110, Atlanta Biologicals, Norcross, GA) и поддерживалась IL-2 (100 Ед / мл; 136, Программа реагентов на СПИД Национального института здравоохранения) ( 40 ).Был проведен один раунд размножения клеток в течение 29 дней. Клетки были дважды положительными по TCRαβ / CD4 от 98,5 до 99,5%. Для стимуляции анти-CD3 (555329, BD Bioscience, Франклин Лейкс, штат Нью-Джерси) и анти-CD28 (555726, BD Bioscience) 96-луночные планшеты с плоским дном (07-200-656, Thermo Fisher Scientific) покрывали в течение ночи ( анти-CD3, 1,5 мкг / мл; анти-CD28, 1 мкг / мл) при 4 ° C. Затем клетки высевали по 200 мкл на лунку в RPMI + 10% AB сыворотки человека (S40110, Atlanta Biologicals, Norcross, GA) в концентрации 1 × 10 6 клеток / мл, подсчитывали с помощью гемоцитометра и инкубировали 24 часа при 37 °. С.Супернатанты собирали и замораживали при -80 ° C до оценки.Высвобождение цитокинов цельной кровью
Высвобождение цитокинов цельной кровью подробно описано в другом месте ( 6 ). Вкратце, 1 мл крови собирали в пробирки с нулевым контролем (QuantiFERON-TB Gold In-Tube, QIAGEN, Hilden, Германия), которые содержали 0,1 мл PBS отдельно или со смесью трех глютеновых пептидных составляющих Nexvax2 каждая в количестве 50 мкг / добавлен мл. Пептиды соответствовали α-глиадину W02-E7, ω-глиадину / C-гордеину W03-E7 и гордеину B08-E2E7, описанному Tye-Din et al .( 7 ). Пептиды имели чистоту не менее 95% по данным высокоэффективной жидкостной хроматографии и жидкостной хроматографии с масс-спектроскопией (CSBio, Menlo Park, Калифорния, США). Пробирки инкубировали при 37 ° C в течение 24 часов перед центрифугированием и отделением плазмы. Индекс стимуляции рассчитывали путем деления концентрации цитокинов при инкубации пептида Nexvax2 на PBS-контроль.В-клетки периферической крови
PBMC получали центрифугированием Ficoll-Paque с плотностью. Выделенные В-клетки получали из РВМС с использованием набора Dynabeads Untouched Human B Cells Kit (11351D, Thermo Fisher Scientific) в соответствии с протоколом, рекомендованным производителем.Чистоту суспензии В-клеток оценивали с помощью проточной цитометрии, указывая на 99% -ную популяцию клеток CD19 + , соответствующую высокой чистоте В-клеток. В-клетки ресуспендировали 0,5 млн / мл в среде RPMI 1640, содержащей 10% инактивированной нагреванием сыворотки человека, 2 мМ l-глутамина, 1 мМ Na-пирувата, 0,1 мМ заменимых аминокислот, 50 мкМ β-меркаптоэтанола, стрептомицин (100 мкг / мл) и пенициллин (100 Ед / мл), отдельно или с добавкой IL-4 (20 нг / мл; PeproTech, Rocky Hill, NJ) плюс антитела против человеческого IgA + IgG + IgM (30 мкг / мл; Jackson ImmunoResearch Laboratories, West Grove, PA) плюс sCD40L (1000 нг / мл; Enzo Life Sciences, Farmingdale, NY).В-клетки (0,1 миллиона) добавляли по 0,2 мл на лунку в 96-луночные планшеты для культивирования тканей с U-образным дном и инкубировали при 37 ° C в 5% CO 2 . Через 24 часа супернатанты собирали и замораживали до оценки.
Оценка цитокинов
Цитокины и хемокины из плазмы с ЭДТА, плазмы из инкубаций для анализа высвобождения IFN-γ из цельной крови и среды от стимуляции клеток in vitro были измерены в ImmusanT Inc. с использованием анализа на основе магнитных шариков в соответствии с протоколом производителя ( MILLIPLEX MAP Магнитная панель с человеческими цитокинами / хемокинами; EMD Millipore Corp., Биллерика, Массачусетс, США; MAGPIX, Luminex Corporation, Остин, Техас, США). Конечные концентрации представляли собой среднее значение трех измерений. Olink Proteomics (Упсала, Швеция) предоставили замороженную плазму с ЭДТА, собранную на исходном уровне через 2, 4 и 6 часов после первой дозы от трех пациентов в первой когорте и трех в последней когорте исследования с 16 дозами. Olink выполнил 92-плексный ПЭА с панелью Proseek Multiplex Inflampting I 96 × 96. Данные по цитокинам выражали как относительное кратное изменение уровней до введения дозы.IFN-γ, IL-1β, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12p70, IL-13, TNF-α, эотаксин, эотаксин-3, IL-8, IL-8 (HA), IP-10, MCP-1, MCP-4, MDC, MIP-1α, MIP-1β, TARC (тимус и хемокин, регулируемый активацией) в плазме EDTA и сыворотки измеряли в ImmusanT Inc., используя Наборы для анализа ECL (V-PLEX Proinflamasted Panel 1 Human Kit, V-PLEX Chemokine Panel 1 Human Kit или V-PLEX IL-2, IL-8 и IL-10 в виде трех сплетений; Meso Scale Discovery, Rockville, MD). Данные были проанализированы с помощью DISCOVERY WORKBENCH 4.0. Рассчитанные значения ниже LLOQ (нижний предел количественного определения) или значения на нижнем конце шкалы, которые не были достигнуты с использованием стандартных кривых, были представлены как равные концентрации LLOQ, проанализированной для каждого цитокина на каждом планшете.
Статистический анализ
Все статистические анализы были выполнены с помощью GraphPad Prism версии 7.0d и MathWorks MATLAB версии 9.5. Для оценки значимости использовались непараметрические тесты. Все значения P были скорректированы методом Бенджамини-Хохберга для проверки множественных гипотез. Сигнатура цитокинов в ответ на введение Nexvax2 определялась путем сравнения скорректированных на исходном уровне разностей кратных изменений между плацебо ( N = 28) и активной ( N = 54) группами в определенные моменты времени после дозирования для выявления последовательно активированной иерархии цитокинов. .Значения P были оценены с помощью теста Манна-Уитни U . Цитокины со средним кратным изменением более чем в 2 раза и скорректированным значением P , скорректированным на частоту ложных открытий, равным <0,05, считались значимыми. Анализ корреляции Пирсона между концентрацией IL-2 через 4 часа и концентрациями IL-8 и MCP-1 через 4 часа и IP-10 через 6 часов был использован для оценки силы и значимости корреляции. Цитокины, значимые в начале рвоты после первой дозы Nexvax2, определяли путем сравнения кратности изменения реакции Nexvax2-зависимых сигнатурных цитокинов в начале рвоты у пациентов, получавших Nexvax2 ( N = 20), с пиковым ответом, наблюдаемым в группе плацебо. пролеченных пациентов ( N = 28).Концентрацию каждого цитокина определяли путем линейной интерполяции во время рвоты для каждого пациента ( N = 20). Пиковые значения кратного изменения были использованы для пациентов, получавших плацебо ( N = 28). P значений оценивали с помощью теста Mann-Whitney U .
Для проверки связи рвоты с повышенным цитокиновым ответом использовалось линейное регрессионное моделирование смешанных эффектов. Цитокиновый ответ через 4 часа для IL-2, IL-8, MCP-1 и IP-10 моделировали как функцию девяти переменных-предикторов, включая возраст, пол, рост, вес, индекс массы тела, HLA-DQ2.5 статус гомозиготности, воздействие предыдущего заражения глютеном, уровни доз Nexvax2 и возникновение рвоты. Анализ уровней ИЛ-2 в плазме, тошноты и возникновения рвоты анализировали с использованием логистической кривой доза-ответ, подобранной для модели оценки тошноты ( Y ) в зависимости от плазменных (логарифмически преобразованных) уровней ИЛ-2 (). X ). Четырехпараметрическая логистическая кривая доза-ответ была аппроксимирована наклоном Хилла ( H ) = 2,75, нижним ( B ) и верхним ( T ) баллами тошноты 1 и 7, соответственно, и половиной максимальной эффективной концентрации ( EC 50 ) = 62.((log (EC 50 ) — X ] * H ))] был использован для оценки порога концентрации IL-2 в плазме (первое значение X , при котором Y > 1), за пределами которого значимо наблюдаются самооценка тошноты и возникновения рвоты.
В рандомизированном двойном слепом имитационном контролируемом исследовании провокации с пищей с глютеном реакции кратности изменения цитокинов через 4 часа после провокации с глютеном ( N = 11) и контрольные группы плацебо ( N = 8) сравнивали с использованием Mann- Тест Уитни U .В исследовании по изучению цитокиновой реакции на батончики мюсли, содержащие 5,7 г глютена, парные изменения концентраций цитокинов через 4 часа после заражения сравнивали с исходными уровнями с использованием знакового рангового критерия Вилкоксона. Повышение уровней циркулирующих IL-2, IL-8 и IL-10 после провокации мюсли было суммировано как площадь под кривой с использованием трапецеидального числового интегрирования от 0 до 6 часов и их корреляция с исходной частотой циркулирующих глютен-специфичных CD4 до заражения. + Т-клетки и гистология двенадцатиперстной кишки, измеренная по соотношению высоты ворсинок к глубине крипты, независимо оценивались с помощью корреляционного анализа Пирсона.
Благодарности
Мы благодарим пациентов с CeD и членов их семей за поддержку нашего исследования. Мы благодарим К. Труитта за критическое прочтение рукописи и полезные предложения. Мы благодарны Центру глютеновой болезни Чикагского университета и Исследовательскому центру целиакии им. К.Г. Джебсена Университета Осло за поддержку наших исследований. Финансирование: G.G. и R.J.X. были поддержаны Исследовательским фондом Пола и Кэти Северино. S.-W.Q., K.E.A.L. и L.M.S. были поддержаны Исследовательским советом Норвегии (грант 179573 / V40 через схему финансирования Центра передового опыта), Региональным управлением здравоохранения Юго-Восточной Норвегии (грант 2013046) и Stiftelsen KG Jebsen (SKGH-MED-017).Б.Дж. и Т.М. были поддержаны грантами Центрального исследовательского центра болезней пищеварения (DK42086) при Чикагском университете и Национального института здравоохранения США (RO1DK67180 и R01DK098435 — B.J.). J.A.T.-D. была поддержана стипендией Mathison Centenary Fellowship Мельбурнского университета. Вклад авторов: R.P.A., L.J.W., J.A.T.-D., K.E.A.L., B.J. и L.M.S. разработал исследования. J.A.T.-D. и В.К.С. провели клинические исследования и собрали клинические данные. A.K.R., T.M., C.C., S.-W.Q., S.W., K.E.G. и J.L.D. выполненные иммунные пробы. Объединение и анализ данных были выполнены G.G., R.J.X. и R.P.A. Таблицы и рисунки подготовлены Г.Г. и R.P.A. Б.Дж. и Л.М.С. помогли в интерпретации результатов. G.G., L.M.S. и R.P.A. написал рукопись. Все авторы просмотрели и одобрили рукопись, таблицы и рисунки. Авторы приняли решение отправить рукопись для публикации и ручаются за точность данных и анализов, а также за соответствие этого отчета протоколу испытания.R.P.A. имел полный доступ ко всем данным в исследовании и нес окончательную ответственность за решение о представлении для публикации. Конкурирующие интересы: G.G., L.J.W., R.P.A., K.E.G., S.W. и J.L.D. являются сотрудниками и акционерами ImmusanT Inc. J.A.T.-D., K.E.A.L., R.J.X., L.M.S. и B.J. были советниками ImmusanT Inc. R.P.A. и J.A.T.-D. являются изобретателями патентов, принадлежащих или лицензированных ImmusanT Inc., относящихся к диагностическому применению заражения глютеном, составу Nexvax2 и использованию полученных из глютена Т-клеточных эпитопов для использования в терапевтических целях.L.M.S. и K.E.A.L. имеют патент на методы обнаружения глютен-специфических Т-клеток. L.M.S. получает гонорары за научные консультации, предоставленные Regeneron, Glenmark и Celgene. Б.Дж. является научным консультантом компаний Bioniz и Celimmune. Авторы заявляют, что у них нет других конкурирующих интересов. R.P.A. является изобретателем трех заявленных патентов, связанных с этой работой, принадлежащих ImmusanT Inc. (PCT / US2O15 / 027522, дата приоритета: 24 апреля 2014 г .; PCT / US2015 / 027477, дата приоритета: 24 апреля 2015 г .; и PCT / US2018 / 063805, дата приоритета: 4 декабря 2017 г.). Доступность данных и материалов: Все данные, необходимые для оценки выводов в статье, представлены в документе и / или дополнительных материалах. Дополнительные данные, относящиеся к этой статье, могут быть запрошены у авторов.
Что нужно знать о глютене — Weekend Bakery
Без глютена или без глютена, всегда полезно испечь его самостоятельно!
Что такое глютен?
Глютен получил много плохих отзывов в прессе. Но что такое глютен? Начиная с муки: Мука — это молотые зерна.Например, цельнозерновая мука состоит из цельного зерна пшеницы, размолотого до мелкой муки. Все зерно входит в состав муки, отрубей, зародышей с большим количеством минералов и ферментов, эндосперма, состоящего из крахмала и, конечно же, глютена. Количество клейковины зависит от сорта зерна. Некоторые почти не содержат, а некоторые содержат много глютена. В пищу мы чаще всего используем пшеницу, рожь, ячмень, овес, полбу и камут. Глютен представляет собой смесь белков с вискозно-эластичными свойствами. немного напоминает жевательную резинку.
Глютен — основная структура вашего хлеба. , она задерживает воздух и придает хлебу эластичную и эластичную консистенцию. Когда вы замешиваете тесто из муки и воды, влажная клейковина сцепляется друг с другом и образует паутину. Чем дольше вы месите, тем больше образуется звеньев и тем плотнее будет ваше тесто. . Эти связи также образуются автоматически, когда влажное тесто оставляют в покое на некоторое время (процесс автолиза) и во время брожения в массе. Вот почему на этих этапах ваше тесто также становится крепче.Вырабатываемый дрожжами углекислый газ задерживается в этой паутине глютена, как воздух внутри воздушных шаров. Это то, что заставляет ваше тесто подниматься. Помимо замеса и времени, глютен также развивается и зависит от количества воды, качества воды, температуры и добавления других ингредиентов (соль, молоко, молоко) и химикатов / добавок (ферменты, кондиционеры) в рецепт.
Качество и количество клейковины
Как и воздушные шары разного качества, из некоторых видов муки получаются очень плотные шары, которые трудно надуть, а из некоторых видов муки получаются очень слабые шары, которые легко надуть, но они также могут легко сломаться.Наиболее важными белками в глютене являются глиадин и глютенин , баланс между этими белками определяет хлебопекарные свойства муки. Это означает, что тесто может быть эластичным и очень упругим, но оно также может быть очень растяжимым, в зависимости от типа / марки / вида муки. Глютенин способствует прочности и эластичности вашего теста, а глиадин способствует растяжимости . Для большинства запеканок вам нужна большая растяжимость (растяжение без разрывов) и не такая большая эластичность.Например, когда вы готовите пиццу, вам нужно получить растяжимое, но не очень эластичное тесто. Таким образом, он легко раскатывается и не отскакивает. Когда вы делаете легкие воздушные булочки, хорошо иметь прочные «воздушные шары», которые могут улавливать много углекислого газа. Для этого вам понадобится мука с большим содержанием глютена, хлебная мука с высоким содержанием белка.
Покажите мне глютен!
Чтобы получить представление о том, как глютен «выглядит и ощущается», мы провели небольшой эксперимент , вымыв муку из шарика теста.Сделать это очень просто.
Сделайте тесто, содержащее только воду и хлебную муку, без дрожжей или соли. В нашем эксперименте мы использовали хлебную муку из провинции Манитоба с содержанием белка 14%. Месить тесто в плотный шар 5 минут, накрыть крышкой и хранить 60 минут. За это время клейковина образует плотную сеть связей внутри теста.
Наполните миску холодной водой и «вымесите» шарик из теста, оставив тесто под водой. Так вы вымоете из муки весь крахмал.Через некоторое время вода станет молочно-белой. Освежите воду и продолжайте замешивать шарик из теста, пока вода не перестанет бледнеть. Медленно, но верно ваш шарик станет меньше, и вы получите шарик из чистой серовато-бежевой глютена, который скрипит, как жевательная резинка. Пусть этот шар расслабится в течение часа в миске со свежей чистой водой. По прошествии этого часа ваши цепи глютена расслабились, и теперь вы можете растянуть эту глютен до невероятных размеров. Попробуйте сами!
Ингредиенты для эксперимента с глютеном
400 г хлебной муки (мы использовали 14% хлебной муки Манитобы)
250 г воды
Итак, чем больше глютена, тем лучше?
Можно подумать, что когда дело доходит до выпечки хлеба, чем больше глютена, тем лучше.Но это слишком простое заявление. Вы не удивитесь, что, конечно, существует оптимальное количество, в зависимости от рецепта, который вы готовите. Когда хлебное тесто содержит слишком много глютена, оно теряет свою растяжимость и слишком сильно отжимается, что затрудняет работу и приводит к тому, что хлеб становится жестким, имеет меньший объем и компактную крошку. Недостаток глютена, особенно в хлебе, который выпекается произвольной формы без поддержки формы для хлеба, может привести к разрушению теста.
В нашей собственной выпечке хлеба мы убедились, что недостаток глютена приводит к разрушению свободно стоящих буханок, а слишком большое количество глютена приводит к образованию компактной крошки без столь желаемых больших отверстий.Содержание белка в муке, которую мы используем для приготовления деревенского хлеба, дает нам наилучший результат, составляет от 12 до 13%.
Крахмал и ферментация
Не вдаваясь в технические подробности, следующая часть — (чрезмерное) упрощение процессов, происходящих при приготовлении собственного хлеба. Основная масса муки состоит из крахмала, который представляет собой углеводы в форме глюкозы, связанные вместе в длинные цепи. При приготовлении хлеба во время брожения в массе эти длинные цепочки разрезаются на более мелкие кусочки.Большую часть этой работы выполняют дрожжи, ферменты и бактерии из закваски. На это уйдет пара часов. Таким образом, хлеб, который был приготовлен в спешке, как и большинство хлеба фабрики и супермаркета , все еще содержит много оригинальных длинных цепочек глюкозы, сырой муки и меньше цепочек меньшего размера. Эти длинные цепи сложнее переваривать , и это усложняет вашу внутреннюю систему. Длительное брожение в массе, использование пулов, меньшее количество дрожжей и т. Д. — все это поможет вам сделать хлеб, который легче переваривается и имеет более сложный вкус.Дрожжи, ферменты и бактерии делают тяжелую работу за вас, превращая сложные углеводы в легко усваиваемые (например) кусочки мальтозы. Фабрики компенсируют это драгоценное время большим количеством добавок, дополнительных ферментов, интенсивного замеса, ароматизации и т. Д. Все это для того, чтобы компенсировать и скрыть тот факт, что хлеб готовится слишком быстро. К сожалению, эти ярлыки и нежелательные ингредиенты создают у хлеба плохую репутацию, потому что они могут привести ко всем видам проблем со здоровьем.
Глютен против здоровья
За исключением, конечно, людей с глютеновой болезнью, аутоиммунным заболеванием, поражающим в первую очередь тонкую кишку, и людей с явной непереносимостью глютена, если вы никогда не проходили тестирование, но думаете, что у вас могут быть проблемы с перевариванием глютена, почему бы не попробовать приготовить свой собственный «Медленный» хлеб без добавок и ферментов и посмотрите, как на это отреагирует ваш организм.Потому что, если вы покупаете хлеб в супермаркете или в пекарне, в которой используются добавки и усилители хлеба, есть вероятность, что ваша внутренняя система протестует против сырой муки и других вещей, которые вам не нужны или не нужны в своем хлебе, и никогда не добавите их при выпечке собственного хлеба!
Когда должно быть без глютена
Мы абсолютно не знатоки безглютеновой выпечки , кроме лишних блинов. Мы знаем, что приготовить хорошую буханку без глютена может быть непросто, и для получения удовлетворительного результата всегда требуется смесь муки без глютена.Существует множество веб-сайтов и блогов, на которых можно найти информацию и рецепты без глютена. Ниже приведен список самых популярных безглютеновых видов муки для выпечки хлеба. Итак, если вы хотите увидеть разницу между хлебом с глютеном, который вы обычно выпекаете, и хлебом без глютена, попробуйте приготовить буханку с мукой из списка ниже.
Перечень муки безглютеновой для выпечки хлеба
- Амарантовая мука — Изготовлена из южноамериканского растения амаранта — Высокое содержание белка, кальция и железа
- Гречневая мука — Изготовлена из семян гречихи — Источник витаминов группы В и лизина
- Каштановая мука — Измельченная из сушеных жареных сладких каштанов — Источник витаминов B и C и клетчатки
- Мука из нута — Измельченная из нута — Также называется гарбанзо, бесан, чечи — Источник белка, железа и фолиевой кислоты
- Кукурузная мука — Кукурузная мука (кукурузная мука / полента) производится из цельных семян кукурузы — хороший источник витамина А, белка и клетчатки
- Люпиновая мука — Изготовлена из семян сладкого люпина — Источник омега-3 и 6, белка, клетчатки, антиоксидантов
- Пшенная мука — Пшенная мука может быть получена из ряда очень изменчивых мелкосеменных трав — Несмотря на то, что она не содержит глютена, люди с непереносимостью глютена все же могут реагировать!
- Картофельная мука — Картофельная мука из сушеного и измельченного картофеля — Источник витаминов C, B6 и меди
- Мука из киноа — Изготовлена из квиноа, представителя семейства шпинатных — Источник белка, кальция, железа, витаминов B и E
- Рисовая мука — Изготовлена из семян «oryza sativa», может быть белой или коричневой — Коричневый сорт, источник витамина B и нескольких минералов
- Соевая мука — Изготавливается путем измельчения соевых бобов — с высоким содержанием белка и жира, также содержит фолиевую кислоту, биотин и медь
- Тапиоковая мука — Изготовлена из корней маниоки.

 – Интент.
2009-2013.
– Интент.
2009-2013. Термины и определения», – выявление в процессе экспертизы научной и практической ценности документов с истекшими сроками хранения, утративших практическое, научное или общественное… … Делопроизводство и архивное дело в терминах и определениях
Термины и определения», – выявление в процессе экспертизы научной и практической ценности документов с истекшими сроками хранения, утративших практическое, научное или общественное… … Делопроизводство и архивное дело в терминах и определениях Примечание 1 Система может рассматриваться как продукт или предоставляемые им услуги. Примечание 2 На практике… … Словарь-справочник терминов нормативно-технической документации
Примечание 1 Система может рассматриваться как продукт или предоставляемые им услуги. Примечание 2 На практике… … Словарь-справочник терминов нормативно-технической документации IV. П. община в Древней Руси и в Великороссии. V. П. община в Малороссии и в Литве. VI. П. община (современное положение; вопрос о П … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
IV. П. община в Древней Руси и в Великороссии. V. П. община в Малороссии и в Литве. VI. П. община (современное положение; вопрос о П … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона (перевод описания англ.)
(перевод описания англ.)