БИОХИМИЯ МЫШЦ И МЫШЕЧНОГО СОКРАЩЕНИЯ
1. Общая характеристика мышц. Строение мышечных клеток.
2. Строение миофибрилл.
3. Механизм мышечного сокращения и расслабления.
1. Общая характеристика мышц. Строение мышечных клеток.
Учение о мышцах это важнейший раздел биохимии, имеющий исключительное значение для спортивной биохимии.
Важнейшей особенностью функционирования мышц является то, что в процессе мышечного сокращения происходит непосредственное превращение химической энергии АТФ в механическую энергию сокращения мышц. Это явление не имеет аналогов в технике и присуще только живым организмам.
При изучении скелетных мышц с помощью светового микроскопа в них обнаружили поперечную исчерченность; отсюда их название поперечно-полосатые.
В скелетной мышце выделяют сухожильную головку, которой мышца начинается на кости, мышечное брюшко, состоящее из волокон, и сухожильный хвост, которым мышца заканчивается на другой кости (рис.).
Мышечное волокно структурная единица мышцы. Известны три типа мышечных волокон: белые быстро сокращающиеся (VT), промежуточные (FR) и медленно сокращающиеся (ST). Биохимически они различаются механизмами энергетического обеспечения мышечного сокращения. Их иннервируют разные мотонейроны, чем обусловлены неодновременность включения в работу и различная скорость сокращения волокон. Разные мышцы имеют разное сочетание типов волокон.
Мышечные волокна
Сухожилие
Рисунок. Мышца
Каждая мышца состоит из нескольких тысяч мышечных волокон, объединяемых соединительными прослойками и такой же оболочкой. Мышца представляет собой многокомпонентный комплекс. Чтобы разобраться в строении мышцы следует изучить все уровни ее организации и структуры, входящие в ее состав.
У животных и человека два основных типа мышц: поперечнополосатые и гладкие, причем поперечнополосатые мышцы делятся на два вида скелетные и сердечные. Гладкие мышцы характерны для внутренних органов, кровеносных сосудов.
Поперечнополосатые мышцы состоят из тысяч мышечных клеток волокон. Волокна объединены соединительно-тканными прослойками и такой же оболочкой фасцией. Мышечные волокна миоциты — представляют собой сильно вытянутые многоядерные клетки гигантских размеров от 0,1 до 10см длиной и толщиной около 0,1 0,2 мм.
Миоцит состоит из всех обязательных компонентов клетки. Особенностью мышечного волокна является то, что внутри эта клетка содержит большое количество сократительных элементов миофибрилл. Как и другие клетки тела миоциты содержат ядро, причем, у клеток поперечнополосатых мышц ядер несколько, рибосомы, митохондрии, лизосомы, цитоплазматическую сеть.
Цитоплазматическая сеть называется в этих клетках саркоплазматической сетью. Она связана с помощью особых трубочек, называемых Т-трубочками, с клеточной мембранной сарколеммой. Особо следует выделить в саркоплазматической сети пузырьки, называемые цистернами. Они содержат большое количество ионов кальция. С помощью специального фермента кальций накачивается в цистерны. Этот механизм называется кальциевым насосом и необходим для сокращения мышцы.
Цитоплазма или саркоплазма миоцитов содержит большое количество белков. Здесь немало активных ферментов, среди которых важнейшими являются ферменты гликолиза, креатинкиназа. Немалое значение имеет белок миоглобин, сохраняющий кислород в мышцах.
Кроме белков в цитоплазме мышечных клеток содержатся фосфогены АТФ, АДФ, АМФ, а также креатинфосфат, необходимые для нормального снабжения мышцы энергией.
Основной углевод мышечной ткани гликоген. Его концентрация достигает 3%. Свободная глюкоза в саркоплазме встречается в малых концентрациях. В тренируемых на выносливость мышцах накапливается запасной жир.
Снаружи сарколемма окружена нитями белка коллагена. Мышечное волокно растягивается и возвращается в исходное состояние за счет упругих сил, возникающих в коллагеновой оболочке.
2. Строение миофибрилл.
Сократительные элементы миофибриллы занимают большую часть объема миоцитов. В нетренированных мышцах миофибриллы расположены, рассеяно, а тренированных они сгруппированы в пучки, называемые полями Конгейма.
Микроскопическое изучение строения миофибрилл показало, что они имеют диаметр около 1 мкм и состоят из чередующихся светлых и темных участков или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую под микроскопом поперечную исчертанность всего мышечного волокна.
Использование электронного микроскопа с очень большим увеличением позволило расшифровать строение миофибрилл и установить причины наличия у них светлых и темных участков. Было обнаружено, что миофибриллы являются сложными структурами, построенными в свою очередь, из большого числа мышечных нитей дух типов толстых и тонких. Толстые в два раза толще тонких, соответственно 15 и 7 нм.
Состоят миофибриллы из чередующихся пучков параллельно расположенных толстых и тонких нитей, которые концами заходят друг на друга.
Участок миофибриллы, состоящий из толстых нитей и находящимися между ними концов тонких нитей, обладает двойным лучепреломлением. Под микроскопом эти участки кажутся темными и получили название анизотропных или темных дисков (А-диски).
Тонкие участки состоят из тонких нитей и выглядят светлыми, так как не обладают двойным лучепреломлением и легко пропускают свет. Такие участки называются изотропными или светлыми дисками (I-диски).
Z Z Z
I-диск А-диск
Рисунок. Схема строения миофибриллы
В середине пучка тонких нитей (диск I) поперечно располагается тонкая пластинка из белка, которая фиксирует положение мышечных нитей в пространстве и одновременно упорядочивая расположение А- и I-дисков многих миофибрилл. Эта пластинка хорошо видна под микроскопом и названа Z-пластинкой или Z-линией.
Диски А имеют в середине более светлую полосу зону Н, пересекаемую более темной М зоной.
Участок между соседними Z-линиями называется саркомер. Каждая миофибрилла состоит из нескольких сотен саркомеров (до 1000-1200).
саркомер
а 
I-диск А-диск I-диск
Рисунок. Структура мышцы на разных уровнях организации: а мышечное волокно; б расположение миофибриллы в покоящейся мышце
Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплаз-матический ретикулум, составляющий 810% объема клетки; 3) несколько митохондрий.
Диски I состоят только из тонких филаментов, а диски А из филаментов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики (спайки) толщиной около 3 нм; расстояние между этими мостиками 40 нм.
Изучение химического состава миофибрилл показало, что тонкие и толстые нити образованы белками. Палочковидная молекула миозина состоит из двух идентичных основных цепей (по 200 кДа) и четырех легких цепей (по 20 кДа), общая масса миозина около 500 кДа.
Толстые нити состоят из белка миозина. Эти белки образуют двойную спираль с глобулярной головкой на конце, присоединенной к очень длинному стержню. Стержень представляет собой двухцепочечную а-спирализованную суперспираль.
Миозиновые головки обладают АТФазной активностью, то есть способностью расщеплять АТФ. Второй участок миозина обеспечивает связь толстых нитей с тонкими. Общая структура миозина показана на рисунке.
хвост
Рисунок. Схематичное изображение молекулы миозина
Основной белок в данном случае актин. Он обладает двумя важнейшими свойствами:
- образует фибриллярный актин, способный к быстрой полимеризации;
- актин способен соединяться с миозиновыми головками поперечными мостиками.
Актин водорастворимый глобулярный белок с молекулярной массой 42 кДа; эта форма актина обозначается как G-актин. В мышечном волокне актин находится в полимеризованной форме, которая обозначается как F-актин. Тонкие филаменты мышцы образованы двунитчатыми актиновыми структурами, связанными между собой нековалентными связями.
Другие белки тонких нитей помогают актину осуществлять его функции.
Тропонин (Тн), молекулярная масса которого около 76 кДа. Он представляет собой сферическую молекулу, состоящую из трех разных субъединиц, получивших название в соответствии с выполняемыми функциями: тропомиозинсвязывающей (Тн-Т), ингибирующей (Тн-1) и кальцийсвязывающей (Тн-С). Каждый компонент тонких филаментов соединяется с двумя другими нековалентными связями:
F-актин тропомиозин
Тн-1 Тн-Т
В мышце, где все рассмотренные компоненты собраны вместе в тонком филаменте (рис.), тропомиозин блокирует присоединение миозиновой головки к находящемуся рядом молекулами глобулярного актина тонких нитей (F-актину).
Молекулы миозина объединяются, образуя филаменты, состоящие примерно из 400 палочковидных молекул, связанных друг с другом таким образом, что пары головок миозиновых молекул ложатся на расстоянии 14,3 нм друг от друга; они располагаются по спирали (рис.). Миозиновые нити стыкуются «хвост к хвосту».
Рисунок. Упаковка миозиновых молекул при образовании толстого филамента
Миозин выполняет три биологически важные функции:
При физиологических значениях ионной силы и рН молекулы миозина спонтанно образуют волокно.
Миозин обладает каталитической активностью, т. е. является ферментом. В 1939 г. ВА Энгельгардт и М.Н. Любимова обнаружили, что миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения.
Миозин связывает полимеризованную форму актина основного белкового компонента тонких миофибрилл. Именно это взаимодействие, как будет показано ниже, играет ключевую роль в мышечном сокращении.
Строение и механизм сокращения скелетных мышц.

3. Механизм мышечного сокращения и расслабления.
Подвижность является характерным свойством всех форм жизни. Направленное движение имеет место при расхождении хромосом в процессе клеточного деления, активном транспорте молекул, перемещении рибосом в ходе белкового синтеза, сокращении и расслаблении мышц. Мышечное сокращение наиболее совершенная форма биологической подвижности. В основе любого движения, в том числе и мышечного, лежат общие молекулярные механизмы.
У человека различают несколько видов мышечной ткани. Поперечно-полосатая мышечная ткань составляет мышцы скелета (скелетные мышцы, которые мы можем сокращать произвольно). Гладкая мышечная ткань входит в состав мышц внутренних органов: желудочно-кишечного тракта, бронхов, мочевыводящих путей, кровеносных сосудов. Эти мышцы сокращаются непроизвольно, независимо от нашего сознания.
В данной главе мы рассмотрим строение и процессы сокращения и расслабления скелетных мышц, поскольку именно они представляют наибольший интерес для биохимии спорта.
Механизм мышечного сокращения до настоящего времени раскрыт не полностью.
Достоверно известно следующее.
1. Источником энергии для мышечного сокращения являются молекулы АТФ.
2. Гидролиз АТФ катализируется при мышечном сокращении миозином, обладающим ферментативной активностью.
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов кальция в саркоплазме миоцитов, вызываемое нервным двигательным импульсом.
4. Во время мышечного сокращения между тонкими и толстыми нитями миофибрилл возникают поперечные мостики или спайки.
5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
Гипотез объясняющих механизм мышечного сокращения много, но наиболее обоснованной является так называемая гипотеза (теория) «скользящих нитей» или «гребная гипотеза».
В покоящейся мышце тонкие и толстые нити находятся в разъединенном состоянии.
Под воздействием нервного импульса ионы кальция выходят из цистерн саркоплазматической сети и присоединяются к белку тонких нитей тропонину. Этот белок меняет свою конфигурацию и меняет конфигурацию актина. В результате образуется поперечный мостик между актином тонких нитей и миозином толстых нитей. При этом повышается АТФазная активность миозина. Миозин расщепляет АТФ и за счет выделившейся при этом энергии миозиновая головка подобно шарниру или веслу лодки поворачивается, что приводит к скольжению мышечных нитей навстречу друг другу.
Совершив поворот, мостики между нитями разрываются. АТФазная активность миозина резко снижается , прекращается гидролиз АТФ. Однако при дальнейшем поступлении нервного импульса поперечные мостики вновь образуются, так как процесс, описанный выше, повторяется вновь.
В каждом цикле сокращения расходуется 1 молекула АТФ.
В основе мышечного сокращения лежат два процесса:
спиральное скручивание сократительных белков;
циклически повторяющееся образование и диссоциация комплекса между цепью миозина и актином.
Мышечное сокращение инициируется приходом потенциала действия на концевую пластинку двигательного нерва, где выделяется нейрогормон ацетилхолин, функцией которого является передача импульсов. Сначала ацетилхолин взаимодействует с ацетилхолиновыми рецепторами, что приводит к распространению потенциала действия вдоль сарколеммы. Все это вызывает увеличение проницаемости сарколеммы для катионов Na+, которые устремляются внутрь мышечного волокна, нейтрализуя отрицательный заряд на внутренней поверхности сарколеммы. С сарколеммой связаны поперечные трубочки саркоплазматического ретикулума, по которым распространяется волна возбуждения. От трубочек волна возбуждения передается мембранам пузырьков и цистерн, которые оплетают миофибриллы на участках, где происходит взаимодействие актиновых и миозиновых нитей. При передаче сигнала на цистерны саркоплазматического ретикулума, последние начинают освобождать находящийся в них Са2+. Высвобожденный Са2+ связывается с Тн-С, что вызывает конформационные сдвиги, передающиеся на тропомиозин и далее на актин. Актин как бы освобождается из комплекса с компонентами тонких филамен-тов, в котором он находился. Далее актин взаимодействует с миозином, и результатом такого взаимодействия является образование спайки, что делает возможным движение тонких нитей вдоль толстых.
Генерация силы (укорочение) обусловлена характером взаимодействия между миозином и актином. На миозиновом стержне имеется подвижный шарнир, в области которого происходит поворот при связывании глобулярной головки миозина с определенным участком актина. Именно такие повороты, происходящие одновременно в многочисленных участках взаимодействия миозина и актина, являются причиной втягивания актиновых филаментов (тонких нитей) в Н-зону. Здесь они контактируют (при максимальном укорочении) или даже перекрываются друг с другом, как это показано на рисунке.
а
б 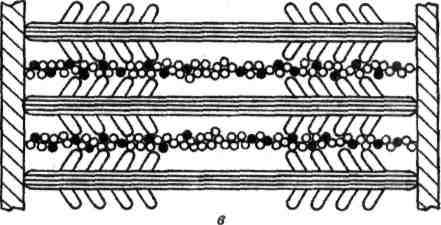 в
в
Рисунок. Механизм сокращения: а состояние покоя; б умеренное сокращение; в максимальное сокращение
Энергию для этого процесса поставляет гидролиз АТФ. Когда АТФ присоединяется к головке молекулы миозина, где локализован активный центр миозиновой АТФазы, связи между тонкой и толстой нитями не образуется. Появившийся катион кальция нейтрализует отрицательный заряд АТФ, способствуя сближению с активным центром миозиновой АТФазы. В результате происходит фосфорилирование миозина, т. е. миозин заряжается энергией, которая используется для образования спайки с актином и для продвижения тонкой нити. После того как тонкая нить продвинется на один «шаг», АДФ и фосфорная кислота отщепляются от актомиозинового комплекса. Затем к миозиновой головке присоединяется новая молекула АТФ, и весь процесс повторяется со следующей головкой молекулы миозина.
Затрата АТФ необходима и для расслабления мышц. После прекращения действия двигательного импульса Са2+ переходит в цистерны саркоплазматического ретикулума. Тн-С теряет связанный с ним кальций, следствием этого являются конформаци-онные сдвиги в комплексе тропонин-тропомиозин, и Тн-I снова закрывает активные центры актина, делая их неспособными взаимодействовать с миозином. Концентрация Са2+ в области сократительных белков становится ниже пороговой, и мышечные волокна теряют способность образовывать актомиозин.
В этих условиях эластические силы стромы, деформированной в момент сокращения, берут верх, и мышца расслабляется. При этом тонкие нити извлекаются из пространства между толстыми нитями диска А, зона Н и диск I приобретают первоначальную длину, линии Z отдаляются друг от друга на прежнее расстояние. Мышца становится тоньше и длиннее.
Скорость гидролиза АТФ при мышечной работе огромна: до 10 мк моль на 1 г мышцы за 1 мин. Общие запасы АТФ невелики, поэтому для обеспечения нормальной работы мышц АТФ должна восстанавливаться с той же скоростью, с какой она расходуется.
Расслабление мышцы происходит после прекращения поступления длительного нервного импульса. При этом проницаемость стенки цистерн саркоплазматической сети уменьшается, и ионы кальция под действием кальциевого насоса, используя энергию АТФ, уходят в цистерны. Концентрация ионов кальция в саркоплазме быстро снижается до исходного уровня.Белки вновь приобретают конформацию характерную для состояния покоя.
Таким образом, и процесс мышечного сокращения и процесс мышечного расслабления это активные процессы, идущие с затратами энергии в виде молекул АТФ,
В гладких мышцах нет миофибрилл. Тонкие нити присоединяются к сарколемме, толстые находятся внутри волокон. Ионы кальция также играют роль в сокращении, но поступают в мышцу не из цистерн, а из внеклеточного вещества, поскольку в гладких мышцах отсутствуют цистерны с ионами калькия. Этот процесс медленный и поэтому медленно работают гладкие мышцы.
Рисунок. Схема расположения толстых и тонких нией в гладких мышечных волокнах.
refleader.ru
Строение мышечного волокна — Мегаобучалка
Каждое мышечное волокно представляет собой гигантскую многоядерную клетку – симпласт, образованную в процессе эмбрионального развития организма путем слияния множества отдельных клеток – миобластов.
Строение мышечного волокна существенно отличается от строения других клеток. Важнейшие отличительные особенности — это размеры, форма, многоядерность, наличие сократительного аппарата. Строение мышечного волокна представлено на рис. 60.
Рис. 60. Важнейшие структурные элементы мышечного волокна
Остановимся на важнейших структурных элементах мышечного волокна.
Сарколемма.Снаружи мышечное волокно окружено оболочкой – сарколеммой, обладающей высокой прочностью и эластичностью. Эти свойства сарколеммы обеспечиваются присутствием в ней большого количества эластичных волокон белков коллагена и эластина, образующих густую сеть.
Сарколемма обладает избирательной проницаемостью, пропуская внутрь клетки преимущественно те вещества, для превращения которых там имеются условия – ферментные системы. В сарколемме присутствуют специальные транспортные системы, с помощью которых поддерживается, в частности, разница в концентрации ионов Na+, К+, Сl‾ внутри и снаружи мышечного волокна, что обеспечивает формирование на его поверхности мембранного потенциала.
К каждому мышечному волокну подходит окончание двигательного нерва. Место прикрепления нервного окончания к мышечному волокну называется нервно-мышечным синапсом..
Внутри мышечного волокна находятся многочисленные клеточные органеллы, важнейшими из которых являются ядра, митохондрии, рибосомы и др. Функции указанных органелл описаны в главе 2 (2.5.1). Пространство между органеллами заполнено внутриклеточной жидкостью – саркоплазмой. Среди структурных элементов мышечного волокна наибольший объем занимают сократительные нити– миофибриллы.
Миофибриллы. Миофибриллы представляют собой длинные тонкие нити, расположенные вдоль мышечного волокна. Количество миофибрилл в мышечных волокнах может колебаться в диапазоне от нескольких десятков до полутора и более тысяч. Под влиянием систематической мышечной тренировки, особенно скоростно-силовой направленности, количество миофибрилл может увеличиваться. Напротив, ограничение двигательной активности сопровождается уменьшением количества миофибрилл. Строение мышечных миофибрилл представлено на рис. 61  Рис. 61. Строение миофибрилл
Рис. 61. Строение миофибрилл
При рассмотрении в оптический микроскоп видно, что миофибриллы имеют повторяющуюся поперечную исчерченность – темные и светлые полосы (диски). Темные диски (А-диски) в центральной части имеют более светлую полосу (Н-зону). Светлые диски (I-диски) в центре пересекаются узкой темной полосой (линией Z). Участок миофибрилл между двумя линиями Z получил название саркомера. Количество саркомеров в миофибрилле зависит от длины мышечного волокна и может достигать нескольких сотен. Длина саркомеров у разных людей может различаться.
Исследование срезов мышечных волокон в электронном микроскопе показали, что каждая миофибрилла состоит из большого числа параллельно расположенных толстых и тонких нитей (филаментов), которые характеризуются строгим взаимным распределением. Толстые нити находятся в зоне А-дисков. Они построены из белка миозина. Миозин является важнейшим сократительным белком, на его долю приходится около 55% от общего количества сократительных белков. Молекула миозина имеет длинную фибриллярную (удлиненную) часть и глобулярную (округлой формы) головку. Фибриллярная часть имеет двухспиральную полипептидную конфигурацию. Функция фибриллярной части молекулы миозина связана с формированием структуры толстой миозиновой нити.
Глобулярные головки миозиновых нитей имеют два активных центра, один из которых обладает АТФ-азной активностью (способностью расщеплять молекулы АТФ), другой – способностью связываться с активными центрами на актиновых нитях (актинсвязывающий центр). Головки молекул миозина располагаются на поверхности миозиновых нитей, образуя выпячивания (отростки). При этом они строго ориентированы в пространстве – располагаются шестью продольными рядами. Толстая миозиновая нить состоит как бы из двух частей, зеркально повторяющих друг друга. Если ее разрезать по- середине, то образуются два совершенно одинаковых фрагмента.
Молекулы миозина обладают способностью связывать ионы Са2+ и Мg2+. Ионы кальция являются кофактором фермента АТФ-азы (в его отсутствии фермент не активен). Ионы магния обеспечивают миозину способность связывать молекулы АТФ и АДФ.
В зоне светлых дисков (I-дисков) расположены тонкие нити, построенные из белков актина, тропомиозина и тропонина. Актин – второй в количественном отношении сократительный белок, составляющий основу актиновых нитей. Тропомиозин – структурный белок актиновых нитей, имеющий фибриллярную форму. Сдвоенные молекулы тропомиозина обвивают актиновые нити. Тропонин является регуляторным белком актиновых нитей. Он существует в трех формах, одна из которых блокирует взаимодействие актина с миозином. Другая форма способна связывать ионы кальция, благодаря чему изменяется конформация молекул первой формы тропонина и открывается центр взаимодействия актина с миозином. Третья форма тропонина обеспечивает крепление первых двух форм на актиновой нити. Кроме того, в составе тонких актиновых нитей имеется белок актинин. Он содержится в зоне линии Z, выполняющей роль своеобразной перегородки, и обеспечивает прикрепление к ней концов актиновых нитей.
К числу важнейших структурных элементов мышечного волокна относится саркоплазматический ретикулум. Саркоплазматический ретикулум — это внутриклеточная система взаимосвязанных пузырьков и канальцев (цистерн), пронизывающих клетку и особенно плотно концентрирующихся в зоне соприкосновения актиновых и миозиновых нитей.
Саркоплазматический (в клетках других органов и тканей – эндоплазматический) ретикулум имеется в каждой клетке организма человека. Но в мышечном волокне он выполняет несколько необычные по сравнению с другими клетками функции. Основная его роль в мышечном волокне заключается в регуляции содержания ионов кальция возле актиновых и миозиновых нитей. В состоянии расслабления ретикулум связывает ионы Са2+, их концентрация в саркоплазме составляет примерно 10-7 моль·литр-1. Под воздействием двигательного импульса ионы кальция освобождаются из ретикулума и их концентрация повышается до 10-5 моль·литр-1.
Способность саркоплазматического ретикулума связывать и высвобождать в цитоплазму ионы Са2+ связана с локализацией на его внутренней поверхности особых кальций связывающих белков. На поверхности ретикулума располагаются также рибосомы – особые внутриклеточные образования, в которых осуществляется синтез белков.
Мышечное волокно имеет также систему трубчатых выпячиваний сарколеммы (Т-систему), направленных внутрь мышечного волокна и располагающихся между миофибриллами и саркоплазматическим ретикулумом. Т-система обеспечивает быстрое распространение волны возбуждения от сарколеммы вглубь волокна.
В мышечном волокне содержатся и другие внутриклеточные органеллы: митохондрии, лизосомы. Функции этих структур мышечного волокна уже были описаны в главе «Общие закономерности обмена веществ».
Мышечное волокно содержит не одно, а несколько ядер, которые располагаются не в центральной части волокна, а по периметру, непосредственно под сарколеммой
Типы мышечных волокон
В скелетных мышцах выделяют несколько типов мышечных волокон, различающихся по своим двигательным характеристикам, соотношению различных химических и структурных компонентов, особенностям структурной организации. К основным типам мышечных волокон относятся медленносокращающиеся (МС) и быстросокращающиеся (БС). Медленносокращающиеся волокна в связи с более высоким содержанием в них миоглобина называют еще красными (или тип I). Быстросокращающиеся, для которых характерно более низкое содержание миоглобина, называют белыми (или тип II). Следует сразу оговориться, что различить эти два типа волокон по цвету практически невозможно. Цвет у одних и у других красный.
Бытрые и медленные волокна более чем в два раза различаются по максимальной скорости сокращения. Так, время одиночного сокращения МС достигает 110 мс, а БС – 50 мс. Кроме того, БС более чем в два раза превышают МС по своим силовым характеристикам.
Существенно различаются разные типы волокон по уровню развития различных механизмов преобразования энергии. МС волокна имеют хорошо развитый механизм аэробного ресинтеза АТФ, что обеспечивается большим количеством митохондрий и высоким содержанием ферментов аэробного биологического окисления, а также большими запасами субстратов аэробного окисления: гликогена, жиров. В МС волокнах содержится больше белка миоглобина, благодаря которому они имеют больший запас кислорода и более благоприятные условия для перехода кислорода из крови внутрь волокна.
В БС волокнах значительно больше миофибрилл, выше АТФ-азная активность, больше концентрация ионов кальция.
Внутри БС волокон различают два подтипа: БСа и БСб. Эти два подтипа отличаются, главным образом, разным уровнем развития важнейших механизмов преобразования энергии. У волокон БСа более хорошо развит анаэробный гликолиз и несколько слабее, чем у МС волокон — аэробный путь ресинтеза АТФ. Они являются ведущими при выполнении упражнений т.н. субмаксимальной мощности, продолжительность которых колеблется в диапазоне от 30 сек до 2-3 мин, при условии выполнения работы с максимальной для данной продолжительности интенсивностью.
У волокон БСб, наряду с анаэробным гликолизом хорошо развит креатинфосфатный механизм ресинтеза АТФ. Они подключаются при выполнении упражнений максимальной и околомаксимальной интенсивности: бег на 100 м, упражнения с большими отягощениями и т.п.
Сказанное не означает, что упражнения указанной интенсивности, выполняются исключительно одним типом мышечных волокон. Речь идет о степени их вовлечения в работу, что, безусловно, определяется центральной нервной системой. Выполнение упражнений, мощность которых не превышает 20-25% от максимально возможной для данного индивидуума обеспечивается только «красными» мышечными волокнами. При работе, интенсивность которой находится в диапазоне 25-40% от максимальной, к ее выполнению подключаются волокна БСа. Если интенсивность упражнения превышает 40% от максимальной, в работу вовлекаются волокна БСб.
При повышении интенсивности упражнения в пределах каждой зоны мощности увеличивается участие в ее обеспечении волокон всех типов, но в наибольшей степени тех, которые подключаются к работе в данном диапазоне мощности.
Различные типы мышечных волокон различаются и условиями иннервации. Мотонейроны, иннервирующие БС мышечные волокна, более толстые, они имеют более разветвленную сеть нервных окончаний (ветвей аксонов), благодаря чему иннервируют значительно большее количество мышечных волокон (от300 до 500). У БС волокон больше зона прилегания нервного окончания к мышечному волокну, что создает более благоприятные условия для иннервации и возникновения потенциала действия.
megaobuchalka.ru
МЫШЕЧНАЯ ТКАНЬ — ГИСТОЛОГИЯ
МЫШЕЧНАЯ ТКАНЬ — ГИСТОЛОГИЯСТРОЕНИЕ МИОФИБРИЛЛ
- в цитоплазме имеется большое количество миофибрилл, обеспечивающих сокращение; миофибриллы состоят из актиновых (тонких) и миозиновых (толстых) микрофибрилл
- актиновая микрофибрилла (тонкая)
- представляет собой тонкую нить
- основу актиновой микрофибриллы составляет белок актин, который имеет фибриллярную структуру
- на актине есть места для связывания миозина
- в поперечнополосатой мышечной ткани к актину присоединены еще несколько белков,
образующих тропонин-тропомиозиновый комплекс:
- тропомиозин — закрывает на молекуле актина места для связывания с миозином
- тропонин С — присоединяет ионы кальция; после присоединения кальция сдвигает молекулу тропомиозина с ее первоначального расположения, что приводит к открытию на молекуле актина мест для связывания с миозином
- тропонин Т и тропонин I — выполняют структурную функцию
- в гладкой мышечной ткани тропонин-тропомиозинового комплекса нет
- актиновые микрофибриллы прикрепляются к цитоскелету клетки в области Z-линий с помощью специальных белков, таких как альфа-актинин, виментин, десмин
- миозиновая микрофибрилла (толстая)
- представляет собой толстую нить
- построена из молекул миозина, имеется множество типов миозина с разной скоростью расщепления АТФ, что обуславливает отличия в скорости сокращения разных мышечных волокон
- молекула миозина похожа на клюшку для игры в гольф (или уж на худой конец — в хоккей), в ней различают головку (это та часть клюшки, которая ударяет по мячу или шайбе) и (рукоятка клюшки)
- миозиновая микрофибрилла представляет собой пучек таких клюшек, связанных за рукоятки, причем часть головок смотрит в одну сторону, а часть — в другую (передне-заднее направление)
- участки миозиновых микрофибрилл, где находятся головки, вставлены между актиновыми микрофибриллами
- миозиновые микрофибриллы прикрепляются к цитоскелету клетки в области линии М (середина полоски Н)
- головка миозина может: 1)поворачиваться, 2)прикрепляться к актину, 3)расщеплять АТФ, то есть является АТФ-азой
- головка миозина может присоединяться к актину только тогда, когда она содержит АДФ и Фосфат (продукты распада АТФ)
- головка миозина, соединенная с актином, может совершать гребковое движение только в момент, когда от нее отсоединяются АДФ и Фосфат
- головка миозина может отсоединиться от актина только тогда, когда она присоединяет к себе молекулу АТФ
- в гладкой мышечной ткани головка миозина имеет легкие цепи, которые должны сначала фосфорилироваться, для того чтобы она смогла расщеплять и присоединять АТФ и взаимодействовать с актином
- миофибриллы строго ориентированы вдоль волокна
- актиновые и миозиновые микрофибриллы располагаются параллельно друг другу
- благодаря строгой ориентации миофибрилл мышечное волокно и кардиомиоциты имеют поперечную исчерченность
- поперечная исчерченность — это чередование светлых и темных полос или дисков на протяжении миофибрилл
- миофибрилла устроена так, что по ее длине имеются участки актиновых микрофибрилл, между которыми располагаются участки миозионвых микрофибрилл, и миозиновые микрофибриллы на небольшое расстояние проникают в пространства между актиновыми; так, что на концах актиновых и миозиновых участков имеются области, где есть и актиновые, и миозиновые микрофибриллы
- одним концом актиновые микрофибриллы прикрепляются к цитоскелету, это место называется Z-линией,
- в своей середине миозиновые микрофибриллы скрепляются с цитоскелетом, это место называется М-линией
- различают следующие виды дисков, полосок и линий на миофибриллах:
- I-диск (изотропный) — светлый диск, в пределах которого располагаются только актиновые микрофибриллы
- А-диск (анизотропный) — темный диск, в области которого располагаются актиновые и миозиновые микрофибриллы
- Н-нолоска — светлая полоса, располагающаяся в середине А-диска, здесь имеются только миозиновые микрофибриллы
- М-линия — находится в середине Н-полоски, здесь прикрепляются миозиновые микрофибриллы
- Z-линия — находится в середине I-диска, здесь прикрепляются актиновые микрофибриллы с помощью белков альфа-актинина, виментина и десмина
- саркомер — это участок мышечного волокна между двумя соседними Z-линиями, структурно-функциональная единица поперечнополосатой мышечной ткани
- в гладкомышечных клетках миофибриллы расположены беспорядочно, актиновые микрофибриллы одним своим концом прикрепляются к специальным областям внутренней поверхности цитомембраны, а другим — к миозину, миозиновые микрофибриллы прикрепляются к специальным местам в цитозоле клетки
histol.ru
|
|
Поперечно-полосатая мышца состоит из многочисленных удлиненных волокон , или мышечных клеток. Двигательные нервы входят в различных точках в мышечное волокно и передают ему электрический импульс, вызывающий сокращение. Мышечное волокно обычно рассматривают как многоядерную клетку гигантских размеров, покрытую эластичной оболочкой – сарколеммой (рис. 20.1). Диаметр функционально зрелого поперечно-полосатого мышечного волокна обычно составляет от 10 до 100 мкм, а длина волокна часто соответствует длине мышцы. В каждом мышечном волокне в полужидкой саркоплазме по длине волокна расположено, нередко в форме пучков, множество нитевидных образований – миофибрилл (толщина их обычно менее 1 мкм), обладающих, как и все волокно в целом, поперечной исчерченностью. Поперечная исчерченность волокна, зависящая от оптической неоднородности белковых веществ, локализованных во всех миофибриллах на одном уровне, легко выявляется при исследовании волокон скелетных мышц в поляризационном или фазово-контрастном микроскопе. Рис. 20.1. Структура волокна скелетной мышцы (по Гассельбаху). I — А-диск; II — I-диск; III — Н-зона; 1 — Z-линия; 2 — Т-система; 3 — саркоплазматическая сеть; 4 — устье Т-системы; 5 — гликоген; 6 — митохондрия; 7 — сарколемма. В саркоплазме мышечных волокон обнаруживается и ряд других структур: митохондрии, микросомы, рибосомы, трубочки и цистерны сарко-плазматической сети, различные вакуоли, глыбки гликогена и включения липидов, играющие роль запасных энергетических материалов, и т.д. (см. рис. 20.1). Повторяющимся элементом поперечно-полосатой миофибриллы является саркомер – участок миофибриллы, границами которого служат узкие Z-линии. Каждая миофибрилла состоит из нескольких сот саркомеров. Средняя длина саркомера 2,5–3,0 мкм. В середине саркомера находится зона протяженностью 1,5–1,6 мкм, темная в фазово-контрастном микроскопе. В поляризованном свете она дает сильное двойное лучепреломление. Эту зону принято называть диском А (анизотропный диск). В центре диска А расположена линия М, которую можно наблюдать только в электронном микроскопе. Среднюю часть диска А занимает зона Н более слабого двойного лучепреломления. Наконец, существуют изотропные диски, или диски I, с очень слабым двойным лучепреломлением. В фазово-контраст-ном микроскопе они кажутся более светлыми, чем диски А. Длина дисков I около 1 мкм. Каждый из них разделен на две равные половины Z-мембраной, или Z-линией. Рис. 20.2. Строение саркомера скелетной мышцы. а - схематическое изображение структуры саркомера; б — расположение толстых и тонких нитей (поперечное сечение). Согласно современным представлениям, в дисках А расположены толстые нити, состоящие главным образом из белка миозина, и тонкие нити, состоящие, как правило, из второго компонента актомиозиновой системы – белка актина. Тонкие (актиновые) нити начинаются в пределах каждого саркомера у Z-линии, тянутся через диск I, проникают в диск А и прерываются в области зоны Н (рис. 20.2). При исследовании тонких срезов мышц под электронным микроскопом было обнаружено, что белковые нити расположены строго упорядоченно. Толстые нити диаметром 12–16 нм и длиной примерно 1,5 мкм уложены в форме шестиугольника диаметром 40–50 нм и проходят через весь диск А. Между этими толстыми нитями расположены тонкие нити диаметром 8 нм, простираясь от Z-линии на расстояние около 1 мкм. Изучение мышцы в состоянии сокращения показало, что диски I в ней почти исчезают, а область перекрывания толстых и тонких нитей увеличивается (в скелетной мышце в состоянии сокращения саркомер укорачивается до 1,7–1,8 мкм). Согласно модели, предложенной Э. Хаксли и Р. Нидергерке, а также X. Хаксли и Дж. Хенсон, при сокращении миофибрилл одна система нитей проникает в другую, т.е. нити начинают как бы скользить друг по другу, что и является причиной мышечного сокращения. Предыдущая страница | Следующая страница СОДЕРЖАНИЕ |

|
www.xumuk.ru
Строение мышечных волокон и механизм мышечных сокращений
⇐ ПредыдущаяСтр 3 из 9Следующая ⇒Статическая сила, динамическая сила, статическая силовая выносливость, динамическая силовая выносливость… — физические качества, уровень развития которых определяет спортивный результат в подтягивании.
Миофибриллы, митохондрии, саркоплазматический ретикулум… — структурные элементы мышечной клетки, участвующие в преобразовании потенциальной химической энергии в полезную механическую работу или мышечное напряжение.
Креатинфосфатная реакция, гликолиз, аэробное окисление – механизмы энергообеспечения, которые служат делу обеспечения непрерывного ресинтеза АТФ в работающих мышцах.
Медленные окислительные, быстрые гликолитические, быстрые окислительно-гликолитические – типы мышечных волокон, отличающихся по скорости сокращения, активности ферментов ресинтеза АТФ, преимущественным механизмам энергопродукции.
Попробуем увязать между собой физические качества спортсмена, физиологию мышечного сокращения и биохимические процессы, происходящие в мышечных клетках.
Для этого предварительно рассмотрим строение мышечного волокна и механизм мышечного сокращения в той степени, в которой это необходимо для подтягиваний.
Строение и химический состав скелетных мышц
Скелетная мышца состоит из мышечных волокон (миоцитов). Мышечные волокна представляют собой гигантские многоядерные клетки длиной от 0,1 до 2-3 сантиметров, а в некоторых мышцах миоциты достигают 12 сантиметров. Площадь поперечного сечения мышечных клеток составляет от 3 до 10 квадратных микрометров.
Волокно покрыто эластичной оболочкой — сарколеммой и состоит из саркоплазмы, структурными элементами которой являются такие органоиды, как митохондрии, рибосомы, трубочки и пузырьки саркоплазматической сети (ретикулума) и так называемая Т-система а также различные включения. В саркоплазме условно выделяют две части – саркоплазматический матрикс и саркоплазматический ретикулум.
Саркоплазматический ретикулум, представляющий собой определённым образом организованную сеть соединяющихся цистерн (содержащих в большой концентрации ионы кальция) и трубочек, играет важную роль в механизмах сокращения и расслабления мышцы. Кроме того, к части ретикулума прикреплены рибосомы, специальные сферические образования, на которых и при участии которых происходит биосинтез белков. Саркоплазматическая сеть с помощью особых трубочек, называемых Т-системой, связана с оболочкой мышечной клетки. Т-система также имеет прямое отношение к мышечному сокращению, так как по ней передаётся изменение электрического потенциала поверхностной мембраны элементам ретикулума, что приводит к освобождению ионов кальция, поступающих к миофибриллам и запускающих процесс мышечного сокращения [24].

Рисунок 7.3 Строение Т-системы и саркоплазматического ретикулума мышечного волокна
[из [24] по: Кроленко, 1975].
Саркоплазматический матрикс представляет собой коллоидный раствор, содержащий белки, гликоген, жировые капли и другие включения [11]. Миофибриллы – сократительные элементы мышечных клеток – также находятся в саркоплазматическом матриксе.
Кроме того, в саркоплазме находятся ферменты гликолиза, расщепляющие гликоген или глюкозу до пировиноградной или молочной кислоты и креатинкиназа – фермент, ускоряющий креатинфосфатную реакцию. Особый белок саркоплазмы – миоглобин – обеспечивает некоторый запас кислорода в мышечной ткани, а также участвует в переносе кислорода от сарколеммы к митохондриям.
Мышечная клетка имеет не одно, а множество ядер, которые располагаются на её периферии – под сарколеммой. Внутри каждого ядра находится ДНК, являющаяся носителем носледственной информации и состоящая из генов, в которых закодирована структура всех синтезируемых мышечными волокнами белков.
Лизосомы, представляющие собой микроскопические пузырьки, содержат в растворённом виде различные ферменты, способные в условиях кислой реакции среды расщеплять различные высокомолекулярные вещества. Такая необходимость может возникать в мышечных клетках, например, при очень напряжённой мышечной деятельности.
Митохондрии
Митохондрии, одни из важнейших структурных компонентов мышечного волокна, располагаются цепочками вдоль миофибрилл (рисунок 7.3), тесно соприкасаясь с мембранами ретикулума. В митохондриях протекает аэробное окисление углеводов, жиров и аминокислот, а за счёт энергии, выделяющейся при окислении, происходит ресинтез АТФ.
Митохондрии ограничены двумя мембранами (рисунок 7.4). Наружняя митохондриальная мембрана имеет ровные контуры, не образует выпячиваний или складок. Наружную мембрану от внутренней отделяет межмембранное пространство. Внутренняя мембрана ограничивает внутреннее содержимое митохондрии, ее матрикс. Характерной чертой внутренней мембраны митохондрий является их способность образовывать многочисленные выпячивания внутрь митохондрий. Такие выпячивания чаще всего имеют вид плоских гребней, или крист, существенно увеличивая поверхность внутренней мембраны. Мембраны митохондрий построены из белка и содержащих фосфорную кислоту жироподобных веществ — фосфолипидов. На внутренней мембране в определённом порядке расположены биологические катализаторы – ферменты, при помощи которых происходят окислительные процессы, а также компоненты дыхательной цепи – главной системы превращения энергии в митохондриях. На внешней мембране митохондрий в определённом порядке расположены ферменты, не имеющие отношения к дыхательной цепи. Немало ферментов в растворённом виде содержится и в матриксе. Кроме того, матрикс митохондрий содержит рибосомы и митохондриальную ДНК.
Рисунок 7.4Схема строения митохондрии
(по А.Кузнецов, [29])
Великое множество миофибрилл, содержащихся в мышечных волокнах, требуют большого количества АТФ, которое должно быть доставлено к каждому саркомеру миофибрилл. На продольных ультратонких срезах скелетных мышц в электронном микроскопе видны многочисленные округлые мелкие сечения митохондрий, располагающихся в соседстве с саркомерами. Если же исследовать поперечные срезы мышечных волокон на уровне Z-дисков (см. п.7.2.1.2), то видно, что мышечные митохондрии представляют собой не мелкие шарики или палочки, а как бы паукообразные структуры, отростки которых могут ветвиться и простираться на большие расстояния, иногда через весь поперечник мышечного волокна. При этом разветвления митохондрий окружают каждую миофибриллу в мышечном волокне, снабжая их АТФ, необходимой для мышечного сокращения. Следовательно, в плоскости z-диска митохондрии представлены типичным митохондриальным ретикулумом – единой митохондриальной системой. Такой пласт или этаж митохондриального ретикулума повторяется дважды на каждый саркомер, а все мышечное волокно имеет тысячи поперечно расположенных поэтажных пластов митохондриального ретикулума. Было обнаружено, что между этажами вдоль миофибрилл располагаются нитчатые митохондрии, соединяющие эти митохондриальные пласты. Тем самым создается трехмерная картина митохондриального ретикулума, проходящего через весь объем мышечного волокна [28].
Предполагается, что с помощью специальных межмитохондриальных соединений или контактов может происходить функциональное объединение отдельных митохондрий и митохондриальных ретикуломов в единую энергетическую систему, позволяющую всем миофибриллам в мышечном волокне сокращаться синхронно по всей длине, поскольку механизм взаимодействия митохондрий посредством межмитохондриальных контактов может обеспечить синхронное поступление АТФ во все участки сокращающегося мышечного волокна.
Механизм кооперации и синхронизации работы митохондрий позволяет вести синтез АТФ в любой точке поверхности внутренней мембраны таких разветвлённых митохондрии, обеспечивая энергией для сокращения те участки мышечного волокна, где в этом возникает необходимость. Но связывание отдельных митохондрий в единую цепь с помощью межмитохондриальных контактов наряду с очевидными преимуществами имеет и существенный недостаток. Дело в том, что при функциональном объединении митохондрий в единую митохондриальную систему любое существенное повреждение (пробой) её внутренней мембраны приводит к потере способности к ресинтезу АТФ сразу у всей объединённой группы митохондрий.
При проведении серии развивающих тренировок по подтягиванию направленных на развитие статической выносливости мышц-сгибателей кисти нередко используется метод выполнения нагрузки «до отказа». Если тренировки разделены недостаточным для восстановления интервалом отдыха, после проведения 4-5 развивающих тренировок подряд, в ходе которых может наблюдаться существенный прирост времени виса (т.е. увеличение аэробных возможностей мышц), неожиданно наступает срыв адаптации и возврат времени виса к первоначальному уровню.
Например, если спортсмен форсирует тренировочный процесс и выполняет через день по 4-6 подходов до отказа, подняв за 2 недели вис с подтягиванием в темпе 1 раз в 8 секунд с 2 до 4 минут (такое возможно у квалифицированных спортсменов, например, после длительного вынужденного перерыва в тренировках), то внезапно – без видимых причин — время виса может упасть до прежних двух минут и даже меньше.
Долгое время было непонятно, почему так происходит. В качестве одной из возможных причин называлась перегрузка нервной системы тренировками до отказа. Но срыв адаптации обычно происходил на фоне эмоционального подъёма от быстрого прогресса тренировочных результатов и связанного с этим желания тренироваться всё больше и больше и имел мало общего с нервным срывом.
Возможно, что резкое падение результатов происходит из-за пробоя внутренней мембраны митохондриальной системы мышечного волокна, вследствие, например, чрезмерного закисления мышц на предшествующей срыву адаптации тренировке. В этом случае повреждение небольшого по площади участка любой из митохондрий, входящих в митохондриальную сеть, должно приводить к отключению механизма аэробного окисления сразу во всей сети.
Тренировки с облегчением в 5-7% от веса тела позволяют резко (в 1,5 – 2 раза) увеличить объём тренировочной работы за счёт увеличения количества подтягиваний в подходе с соответствующим увеличением времени выполнения подхода. При этом энергопродукция смещается в сторону аэробного окисления, всё в большей степени активизируя работу митохондриальной системы. Серия развивающих тренировок с облегчением без должного интервала отдыха между ними также может привести к скачкообразному падению результатов, что также может быть объяснено повреждением внутренних мембран митохондрий продуктами метаболизма.
Можно ли каким-либо образом почувствовать приближение момента срыва адаптации и, снизив нагрузку, предотвратить это нежелательное явление?
Биологическое окисление, протекающее в митохондриях, состоит в окислении органических субстратов, например глюкозы, до углекислого газа и воды с выделением около 680 ккал (в расчёте на 1 моль, т.е. 180 г глюкозы), которая в дальнейшем идёт на создание макроэнергетической связи в молекуле АТФ (фосфорилирование АДФ). Окисление и фосфорилирование – это два, в принципе, независимых процесса, которые для эффективного ресинтеза АТФ должны быть сопряжены. Сопряжение окисления и фосфорилирования происходит на внутренних мембранах митохондрий. Поэтому, когда мембраны повреждены, происходит разобщение этих процессов. Реакции окисления глюкозы продолжают идти, а ресинтез АТФ замедляется или прекращается. И сейчас даже неважно, что является причиной повреждения мембран – избыток молочной кислоты, недостаток кислорода или повышенное его потребление, свободнорадикальное окисление или это происходит по каким-то иным причинам. Важно, что при повреждении мембран митохондрий в результате чрезмерного воздействия тренировочных нагрузок нарушается процесс ресинтеза АТФ, а энергия, выделяющаяся в процессе биологического окисления, теперь может превращаться только в тепло, приводя к локальному нагреву мышечной ткани.
Но одним из отдалённых признаком перетренированности является внезапная испарина, выступающая не только на лбу, но и на рабочих мышцах спортсмена в начале выполнения даже не очень напряжённой нагрузки. Возможно, таким образом организм реагирует на начинающийся процесс разобщения окисления и фосфорилирования, связанный с повреждением мембран митохондрий. Поэтому, если после серии развивающих нагрузок на очередной тренировке вы начинаете по непонятным причинам сильно потеть, стоит задуматься: а не перебрали ли вы с нагрузкой?
В любом случае безопасным (но в то же время обеспечивающим прогресс) считается вариант, когда тяжёлые развивающие тренировки проводятся не чаще одного раза в 5 – 7 дней.
Экспериментальные данные говорят в пользу того, что увеличение числа митохондрий происходит путём роста и деления предшествующих митохондрий. Более того, митохондрии обладают собственным генетическим аппаратом, т.е. обладают полной системой авторепродукции, хотя и находящейся под генетическим контролем со стороны клеточного ядра [28].
Все митохондрии в теле человека наследуются от матери, а не от отца, поэтому способность к длительному выполнению упражнений передаётся по материнской линии.
По форме и размеру митохондрии напоминают бактерий; они содержат собственную ДНК и размножаются делением. Эти и другие факты привели к возникновению гипотезы о том, что много миллионов лет назад бактерии проникли в более высокоразвитые клетки и прочно обосновались в них, потеряв былую самостоятельность и со временем превратившись в клеточные органеллы, которые теперь называют митохондриями [30].
Миофибриллы
Сократительные элементы – миофибриллы – занимают большую часть объёма мышечных клеток. Миофибриллы состоят из многочисленных параллельно расположенных нитей – филаментов. Перегородки, называемые Z – пластинками, разделяют их на отдельные участки, называемые саркомерами. Строение саркомера мышечного волокна показано на рисунке 7.5.
Мышечные нити – филаменты бывают двух типов: толстые и тонкие.Толстые имеют диаметр около 10 нм (1 нм = 10-9 м), а тонкие – около 5 нм. Толстые нити, состоящие из белка миозина, расположены в дисках А (рис. 7.3, 7.5), а тонкие, основным белком которых является актин, находятся в дисках I, частично заходя в диск А. Середину диска I пересекает Z – пластинка, соединяющая тонкие нити между собой и с сарколеммой. В поперечном сечении толстые и тонкие нити располагаются правильными шестиугольниками так, что каждая толстая нить окружена шестью тонкими, а каждая тонкая нить может вступать в контакт с тремя толстыми [24].
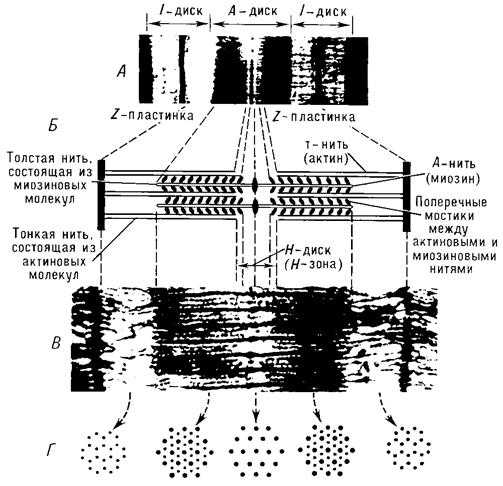
Рисунок 7.5. Строение саркомера поперечнополосатого мышечного волокна: А — электронная микрофотография (малое увеличение), на которой четко видна структура саркомера; Б — схема саркомера; В — электронная микрофотография с высокой разрешающей способностью; Г — поперечное сечение саркомера на различных уровнях, видно положение толстых и тонких нитей в различных участках покоящегося саркомера (по Х. Хаксли)
Из-за особенностей своих оптических свойств миозиновые нити, находящиеся в середине саркомера, выглядят в световом микроскопе тёмной полосой, а актиновые нити – светлой. Именно в результате такого периодического чередования светлых и тёмных полос в бесчисленных саркомерах миофибриллы выглядят поперечно-полосатыми.
infopedia.su
