Сколько аминокислот входит в состав белка
Опубликовано: 20.03.2020Время на чтение: 27 минут6054
Какие аминокислоты входят в состав белкаАминокислоты, или аминокарбоновые, кислоты (АМК) — очень крупная группа соединений. Известное на сегодня количество таких веществ, существующих природе, достигает пятисот. Но в клетках и тканях человеческого организма их намного меньше: порядка 170. А в составе белка, ответственного за передачу генетической информации, совсем «мало» — двадцать три. Наиболее важными для организма человека являются следующие аминокарбоновые соединения:
- аланин,
- аргинин,
- аспарагин,
- валин,
- гамма-аминомасляная кислота,
- глютаминовая кислота,
- глютамин,
- глютатион,
- глицин,
- гистидин,
- диметилглицин,
- изолейцин,
- карнитин,
- лейцин,
- лизин,
- метионин,
- орнитин,
- серин,
- таурин,
- треонин,
- триптофан,
- тирозин,
- фенилаланин,
- цитруллин,
- цистеин и цистин.

Каждая аминокислота играет собственную роль как в синтезе белка, так и в других процессах, определяющих здоровье человека, его уровень энергии, умственные способности и пр.
Как посчитать количество
Сколько аминокислот в белке, определяется самим белком. В полноценном протеине (он так и называется — полноценный) обнаруживается весь аминокарбоновый состав. В неполноценном отсутствует несколько АМК. Кроме того, белки могут быть простыми (в их состав входят только аминокислоты) и сложными (аминокислотный «комплекс» дополнен другими химическими соединениями). Но во всех случаях именно аминокарбоновые кислоты являются основой для построения молекулы протеина, и без этих веществ невозможна правильная работа организма.
Заменимые и незаменимые аминокислотыВесь «набор» аминокислот можно распределить в такие группы:
- Заменимые. Эти вещества, входящие в состав белка, могут синтезироваться в организме человека из веществ, которые поступают вместе с пищей.
 При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент.
При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент. - Незаменимые. Эти аминокислоты неспособны синтезироваться организмом и могут поступать в него только в готовом виде, вместе с пищей.
- Условно-незаменимые. В эту группу входят аминокислоты, которые в норме синтезируются в организме человека. Но после перенесенных заболеваний, при высоком уровне стресса, проживании в неблагоприятной экологической обстановке и др. их синтез резко снижается или прекращается вовсе.
Когда речь заходит о белке в организме человека, с ним ассоциируют набор мышечной массы. Соответственно, белок рассматривают в качестве «топлива» для мышц. Но это лишь одна из функций протеина, который в теле человека представлен огромным разнообразием. Белок — это комплекс аминокислот, соединенных между собой пептидами. В зависимости от того, как АМК распределены в молекуле протеина и каким образом они соединены, меняется структура белка, его функции и другие характеристики. Возможно, кого-то это удивит, но под протеинами следует понимать не только «кирпичики» для набора мышечной массы, но и:
В зависимости от того, как АМК распределены в молекуле протеина и каким образом они соединены, меняется структура белка, его функции и другие характеристики. Возможно, кого-то это удивит, но под протеинами следует понимать не только «кирпичики» для набора мышечной массы, но и:
- коллаген — естественный «каркас», обеспечивающий упругость кожи, входящий в состав хрящевой ткани и пр.;
- нейромедиаторы — соединения, которые обеспечивают правильную интерпретацию нервных сигналов и их передачу между всеми органами и тканями;
- гормоны — вещества, регулирующие все функции организма: от работы репродуктивной системы до психических реакций.
Этот список можно еще продолжать.
Причины дефицита аминокислот
Даже при современном уровне доступности любой информации продолжает существовать заблуждение о том, что весь набор аминокислот можно получить только из пищи животного происхождения. На самом деле, аминокарбоновые кислоты синтезируется и в растениях. Но биодоступность (усвояемость) таких АМК немного ниже, чем их продуктов животного происхождения.
На самом деле, аминокарбоновые кислоты синтезируется и в растениях. Но биодоступность (усвояемость) таких АМК немного ниже, чем их продуктов животного происхождения.
Вегетарианство. Людям, придерживающимся принципов веганства, следует более тщательно контролировать свой рацион, чтобы гарантированно получать из пищи незаменимые аминокислоты.
Высокие нагрузки. Еще одна группа риска — люди, подвергающиеся чрезмерным физическим или психическим нагрузкам. При таких обстоятельствах расход аминокислот существенно выше, так как им приходится восстанавливать клеточные и тканевые ресурсы, израсходованные во время тренировок или стресса.
Некоторые заболевания. Они также могут быть причиной дефицита аминокислот. В частности, нарушения всасывания питательных веществ, при которых определенные вещества, потребляемые вместе с пищей, проходят через организм «транзитом» и неспособны принять участие в синтезе аминокислот или восполнении их дефицита.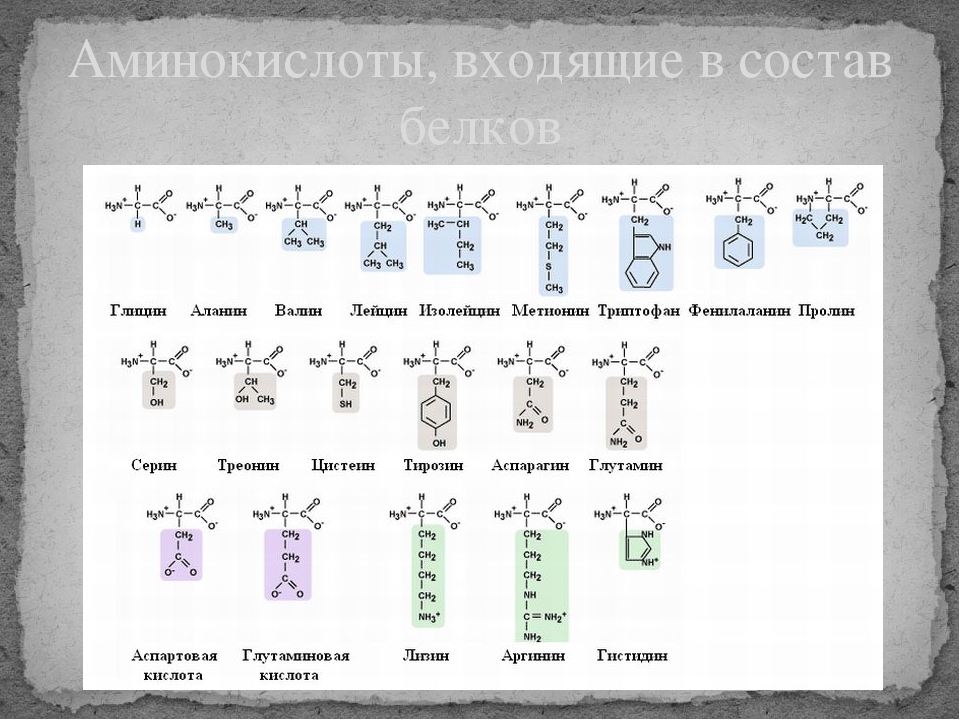
Контроль над сбалансированным и регулярным питанием — основа поддержания аминокислотного состава на нужном уровне. Но это не всегда возможно, и вот почему. Если использовать только продукты питания, невозможно положить в тарелку только аминокислоты. Приходится учитывать еще и калорийность приема пищи, содержание в блюде жиров, углеводов, клетчатки и пр. В итоге число потребленных аминокислот может ограничиваться двумя-тремя, но быть серьезно «обремененным» лишними калориями. Эта проблема особенно актуальна для спортсменов, людей, следящих за фигурой, и тех, кому жирная или калорийная пища нежелательна с точки зрения здоровья.
Niteworks от HERBALIFE Nutrition
В описанных выше ситуациях на помощь могут прийти специальные добавки, например Niteworks от HERBALIFE Nutrition*. В состав продукта входят аминокислоты, поддерживающие правильную работу сердца и сосудов, повышающие эластичность стенок сосудов.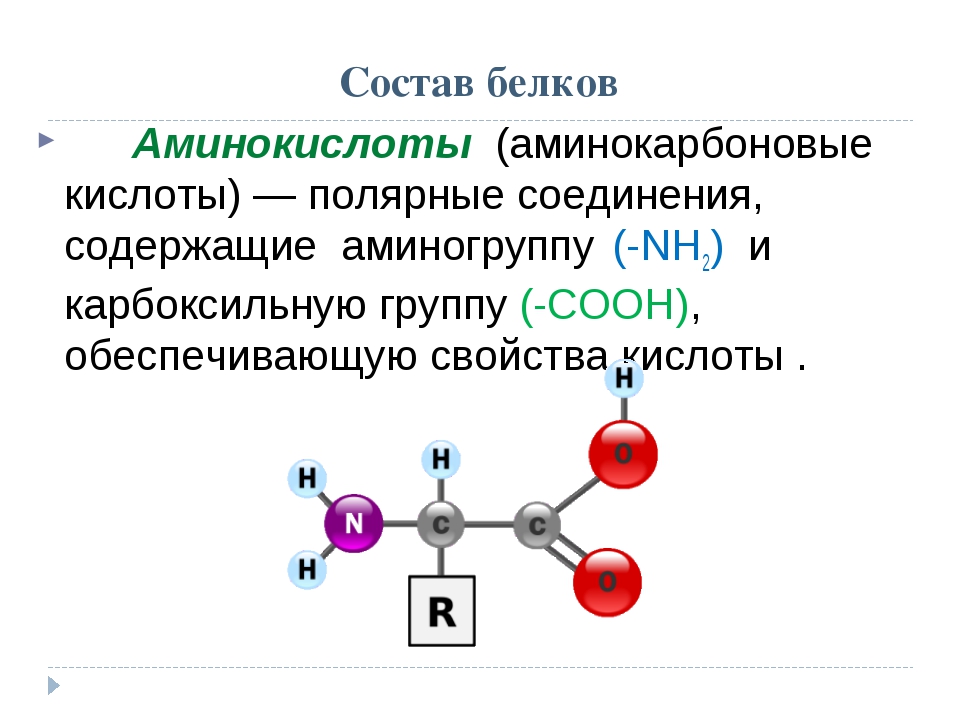 Одна порция напитка, приготовленного с этой пищевой добавкой, способна поддерживать уровень ряда важных аминокислот на нормальном уровне в течение суток*.
Одна порция напитка, приготовленного с этой пищевой добавкой, способна поддерживать уровень ряда важных аминокислот на нормальном уровне в течение суток*.
При дефиците аминокислот в организме могут возникать следующие неприятные симптомы:
- быстрая умственная и физическая утомляемость;
- мышечная слабость;
- боль в суставах, нарушение их подвижности;
- отеки;
- «необъяснимые» приступы голода;
- снижение остроты зрения;
- ухудшение состояния волос, ногтей, кожи.
На перечисленные симптомы особенно важно обратить внимание, если вы длительное время придерживаетесь ограничительной диеты, испытываете стрессы, подвергаетесь тяжелым физическим нагрузкам, перенесли какое-либо заболевание. Но во всех случаях следует предварительно проконсультироваться с врачом, так как признаки белкового дефицита неспецифичны и схожи с симптомами ряда заболеваний.
* БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
Узнайте, как питатьсясбалансированно
и контролировать
свой весУзнать больше 2020-03-20
Автор: Будь в Форме
Оцените материал!
Добавить отзыв
Отзывы
СветЛана | 19.12.2020 21:52Полезная информация
Эксперимент объяснил, почему на Земле больше левовращающих изомеров аминокислот
Испанские ученые сумели обогатить смесь из различных зеркальных изомеров (пространственно несовместимых форм) аминокислоты валина одним из них путем нагревания. Предположительно, аналогичные процессы могли протекать на молодой Земле — в живых системах аминокислоты в белках присутствуют только в одной форме. Работа исследователей пока не опубликована в рецензируемом научном журнале.
Зеркальная, или оптическая, изомерия связана со способностью некоторых молекул вращать плоскость поляризованного луча света в противоположные стороны. Различают правовращающие и левовращающие изомеры. Их молекулы никаким образом не могут быть совмещены друг с другом в пространстве (также, например, как правая и левая руки).
Оптическая изомерия крайне важна для живых систем — в частности, аминокислоты, входящие в состав белков, являются левовращающими (так называемые L-формы). У ученых до сих пор нет единой точки зрения о том, как именно произошел «перекос» в сторону L-форм. По одной из версий, избыток левовращающих изомеров связан с бомбардировкой молодой Земли метеоритами — они занесли на планету преимущественно L-формы аминокислот (недавно было показано, что на найденных на Земле метеоритах L-аминокислот на 15-18 процентов больше, чем правовращающих D-форм).
Одной из аминокислот, обнаруженных на поверхности метеоритов, является валин. Авторы новой работы решили проверить, при каких условиях в смеси равного количества право- и левовращающих изомеров (так называемая рацемическая смесь) может образоваться избыток одной из форм. Ученые нагревали смесь изомеров валина, добиваясь возгонки — перехода вещества из твердого состояния в газообразное. При этом изомеры, вращающие плоскость поляризованного луча света, в одну сторону, образовывали «чистые» кристаллы. При продолжительном нагревании оптический изомер, бывший изначально в избытке, формировал большее количество кристаллов. Аминокислоты из таких «складов» могли впоследствии войти в состав живых систем и определить их «привязанность» к L-форме.
Авторы новой работы решили проверить, при каких условиях в смеси равного количества право- и левовращающих изомеров (так называемая рацемическая смесь) может образоваться избыток одной из форм. Ученые нагревали смесь изомеров валина, добиваясь возгонки — перехода вещества из твердого состояния в газообразное. При этом изомеры, вращающие плоскость поляризованного луча света, в одну сторону, образовывали «чистые» кристаллы. При продолжительном нагревании оптический изомер, бывший изначально в избытке, формировал большее количество кристаллов. Аминокислоты из таких «складов» могли впоследствии войти в состав живых систем и определить их «привязанность» к L-форме. Процессы, подобные описанным в работе, могли протекать вблизи жерл вулканов, где наблюдался очень существенный перепад температур. До сих пор большинство исследователей, изучающих вопросы оптической изомеризации аминокислот, рассматривали, в основном, процессы перехода из твердого в жидкое состояние, которые, вероятно, были более распространены на юной Земле.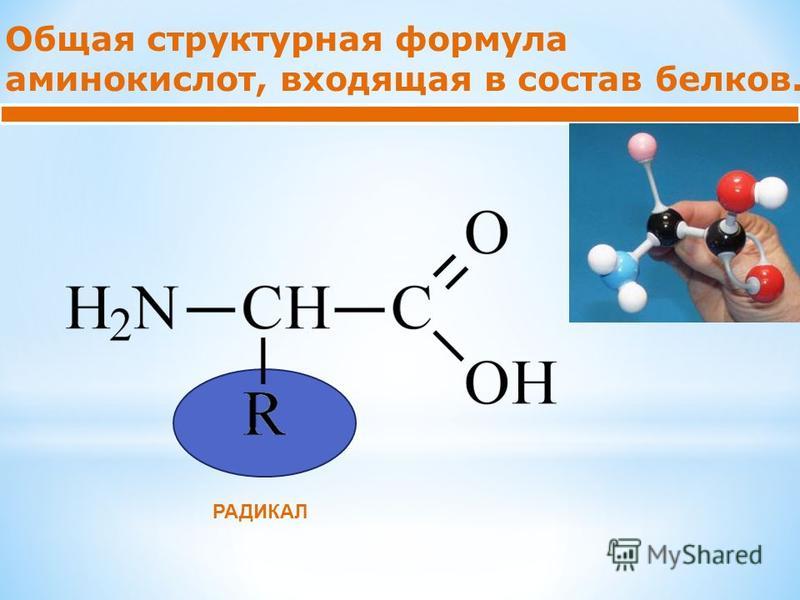
Источник: Lenta.ru
Ученые «научили» ДНК кодировать искусственные белки
Для этого ученые заставили органеллы клетки бактерий Escherichia coli, отвечающие за синтез белков, по новому «прочитывать» генетический код ДНК, а именно: распознавать нуклеотиды ДНК — единичные «буквы» генетического кода — в группах по четыре, а не по три, как это происходит во всех живых организмах.
Всего в природе существует четыре «буквы» ДНК: аденин, гуанин, тимин и цитозин, которые считываются рибосомами, органеллами, отвечающими за синтез белков в группах по три буквы. Каждое сочетание трех «букв», называемое кодоном, отвечает какой-либо одной аминокислоте или означает конец процесса синтеза белка. Всего существует 64 таких кодона, которые природа сумела приспособить для синтеза белков из 22 различных аминокислот.
Группа Чина, «научив» рибосомы клеток E.coli считывать «буквы» в кодонах, состоящих из четырех «букв», создала таким образом дополнительно 256 комбинаций нуклеотидов, не отвечающих каким-либо природным аминокислотам. Эти новые кодоны могут быть искусственно поставлены в соответствие синтетическим аминокислотам, не встречающимся в природе и обладающими уникальными свойствами. Встраивание кодонов в существующие природные белковые молекулы позволит наделить их новыми полезными свойствами.
Эти новые кодоны могут быть искусственно поставлены в соответствие синтетическим аминокислотам, не встречающимся в природе и обладающими уникальными свойствами. Встраивание кодонов в существующие природные белковые молекулы позволит наделить их новыми полезными свойствами.
«Наша работа — это начало использования совершенно нового искусственного генетического кода, параллельно существующему природному», — сказал Чин в интервью New Scientist.
Команда Чина с помощью своей разработки сумела встроить две искусственные аминокислоты в белки E.coli. Как показали исследователи в своей работе, встроенные искусственные аминокислоты оказались способны взаимодействовать между собой, уже будучи внедренными в структуру белковой молекулы. Подобные связи между аминокислотами в белках многочисленны: они позволяют им удерживать свою трехмерную структуру, обуславливающую их уникальные функциональные свойства.
Однако связи между природными аминокислотами, называемые дисульфидными мостиками, весьма непрочны и легко разрушаются под воздействием повышенной температуры или агрессивной химической среды.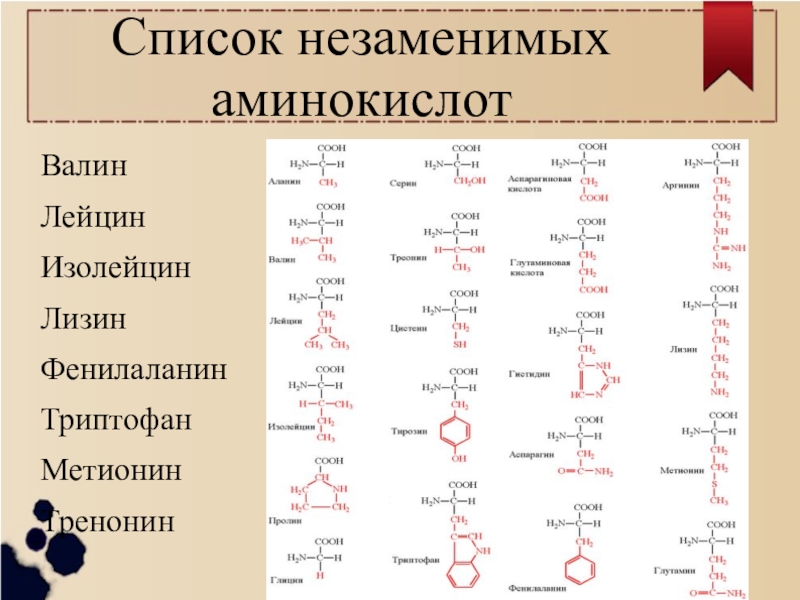
Связи между искусственными аминокислотами Чина в белках, как оказалось намного прочнее, что может быть использовано в физиологически активных белковых молекулах, применяемых в фармацевтических препаратах. Такие молекулы могут использоваться для создания лекарств для перорального применения, поскольку они устойчивы к агрессивной среде желудка.
Синтетические белки с искусственными аминокислотами, которые синтезируются внутри клеток организмов, могут найти применение и в самих организмах, наделяя их новыми возможностями. Например, организмы, обладающие в своих клетках более устойчивыми белками, по сравнению с обычными, могут быть более устойчивыми к негативным воздействиям внешней среды.
Аминокислоты обычно встречающиеся в белка
Сколько аминокислот содержится обычно в белках Какие аминокислоты встречаются чаще всего Почему возможно существование такого огромного количества белков [c.296] Различия между аминокислотами связаны с природой группы К. На рис. 25.3 показаны структурные формулы 20 аминокислот, обнаруженных в большинстве белков. Хотя некоторые аминокислоты распространены больше других, в крупных белках обычно встречается подавляющая часть всех этих аминокислот. [c.444]
На рис. 25.3 показаны структурные формулы 20 аминокислот, обнаруженных в большинстве белков. Хотя некоторые аминокислоты распространены больше других, в крупных белках обычно встречается подавляющая часть всех этих аминокислот. [c.444]
Сера широко распространена в биологических системах. Она входит в состав большинства белков в качестве компонента аминокислот цистеина и метионина (см. разд. 25.2). В отличие от нее селен редко встречается в биологических системах. Лишь недавно было обнаружено, что человеческий организм нуждается в потреблении некоторого количества этого элемента. Селен обнаружен в микроскопических количествах в большинстве овощей, особенно в шпинате. Количество селена, необходимое человеческому организму, ничтожно мало. В концентрациях, намного превышающих потребности человеческого организма, селен токсичен. Его соединения ядовиты, и если они оказываются летучими, то обычно обладают чрезвычайно неприятным запахом.
 [c.309]
[c.309] В белках всех живых организмов обычно встречается только 20 различных типов аминокислот, которые указаны в табл. 21-5. Некоторые из них имеют углеводородный состав, например валин (Вал), лейцин (Лей), изолейцин (Иле) и фенилаланин (Фен). Гидрофобные группы молекул всегда более устойчивы, если их можно удалить из водного окружения. Поэтому белковые цепи в водном растворе складываются в молекулы, у которьгх такие группы обращены вовнутрь. Некоторые остатки аминокислот оказываются заряженными например, аспарагиновая (Асп) и глутаминовая (Глу) кислоты входят в белки в ионизованной форме и несут на себе отрицательный заряд, а основания лизин (Лиз) и аргинин (Apr) при pH 7 положительно заряжены. Несмотря на то что некоторые другие группы, например аспарагин (Асн), глутамин (Глу) и серии (Сер), незаряжены, они имеют полярность и поэтому совместимы с водным окружением. Одним из наиболее важных факторов, определяющих свертывание белковой цепи в глобулярную молекулу, является устойчивость, достигаемая при ориентации гидрофобных групп вовнутрь молекулы, а заряженных групп-наружу. Хотя каждый из двух оптических изомеров, показанных на рис. 21-12, пред- [c.314]
Хотя каждый из двух оптических изомеров, показанных на рис. 21-12, пред- [c.314]
Пространственное строение решающим образом влияет на свойства и биологические функции органических веществ, участвующих в процессах жизнедеятельности. Большинство таких веществ оптически активны и встречаются в природе обычно в одной из антиподных форм это относится к белкам и образующим их аминокислотам, нуклеиновым кислотам, сахарам, стероидным гормонам, природным оксикислотам, ферментам, витаминам и др. Свойства природного каучука тесно связаны с определенной геометрической конфигурацией его полимерной цепи. Еще большее значение имеет в рассматриваемой области конформация, в особенности если речь идет о таких полимерах, как белки и нуклеиновые кислоты. Ни один вопрос биохимии не может быть решен на современном уровне без тщательного учета стереохимических факторов. [c.623]
В природе существует около 300 аминокислот, однако в белках обнаружены только 20 из них.
 В результате полного гидролиза белков высвобождается 20 Ь-а-аминокислот (табл. 3.2). Одни и те же 20 аминокислот присутствуют в белковых молекулах всех форм жизни—растений, животных и микроорганизмов. Почему это так—мы поймем позже, когда будем обсуждать универсальную природу генетического кода (гл. 30). Однако в ряде белков встречаются производные некоторых аминокислот, образующиеся уже после включения обычных аминокислот в молекулу белка (табл. 3.4). [c.21]
В результате полного гидролиза белков высвобождается 20 Ь-а-аминокислот (табл. 3.2). Одни и те же 20 аминокислот присутствуют в белковых молекулах всех форм жизни—растений, животных и микроорганизмов. Почему это так—мы поймем позже, когда будем обсуждать универсальную природу генетического кода (гл. 30). Однако в ряде белков встречаются производные некоторых аминокислот, образующиеся уже после включения обычных аминокислот в молекулу белка (табл. 3.4). [c.21] Настоящая глава посвящена рассмотрению природных аминокислот. Из них первыми стали известны аспарагин, открытый в 1806 г., и цистин, открытый в 1810 г. Начиная с этого времени было обнаружено существование более 80 аминокислот. Кривая, изображенная на фиг. 1 (пунктир), показывает, что наибольшее число новых природных аминокислот открыто за последние 10 лет. Вместе с тем после 1935 г., в котором был открыт треонин, не найдено ни одной новой аминокислоты, входящей в состав белков, что видно из сплошной кривой, также изображенной на фиг. 1. Аминокислоты, обычно обнаруживаемые в белковых гидролизатах, рассматриваются в следующем разделе. Те аминокислоты, которые редко встречаются в белках, и аминокислоты, найденные в составе соединений других типов или в свободном состоянии, обсуждаются в последних разделах настоящей главы. [c.10]
1. Аминокислоты, обычно обнаруживаемые в белковых гидролизатах, рассматриваются в следующем разделе. Те аминокислоты, которые редко встречаются в белках, и аминокислоты, найденные в составе соединений других типов или в свободном состоянии, обсуждаются в последних разделах настоящей главы. [c.10]
Все белки состоят из большого числа строительных блоков — молекул аминокислот. Обычно в составе природных белков встречается около 20 различных аминокислот. Отдельные их молекулы соединяются в цепи, образуя так называемые полипептиды [c.98]
Кроме этих, в современных белках встречаются и некоторые другие, менее распространенные аминокислоты. Очевидно, во времена неорганического фотосинтеза вполне могли возникать многие другие, сходно построенные аминокислоты. В период возникновения предбиологических систем, конечно, создавались самые разнообразные аминокислоты. По тем или иным причинам в ходе дальнейшего развития они постепенно вымерли . Не исключено, что некоторые малораспространенные сейчас аминокислоты раньше встречались гораздо чаще, а то и были преобладающими. Все обычные аминокислоты и большинство редких являются левовращающими, т. е. вращают плоскость проходящего через них поляризованного света влево. Но некоторые менее распространенные аминокислоты являются правовращающими. [c.99]
Все обычные аминокислоты и большинство редких являются левовращающими, т. е. вращают плоскость проходящего через них поляризованного света влево. Но некоторые менее распространенные аминокислоты являются правовращающими. [c.99]
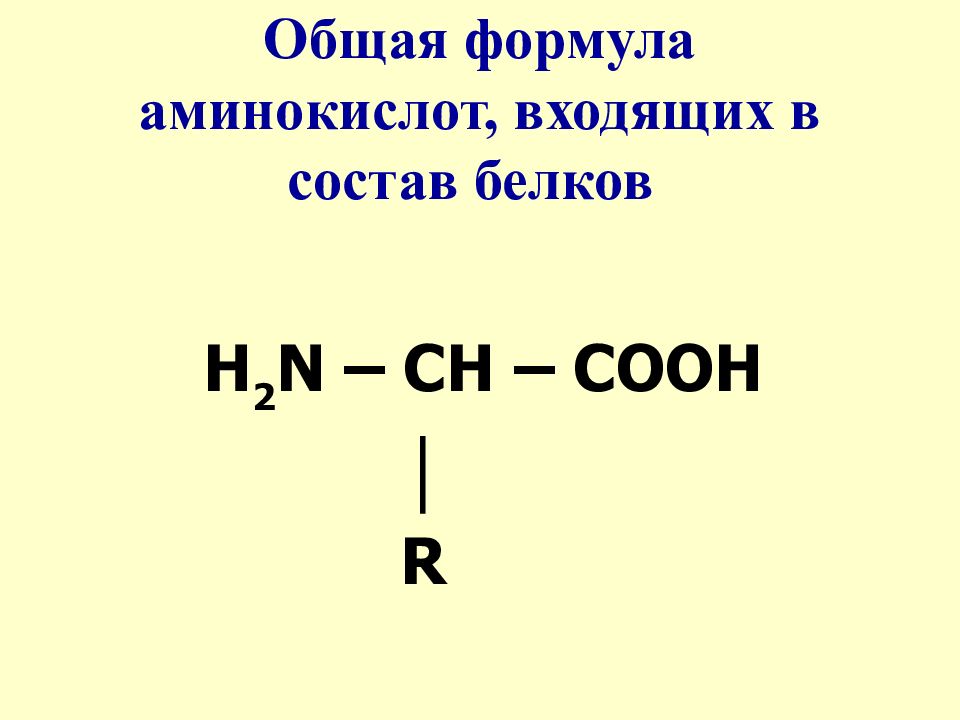
Наиболее важными для жизни органическими соединениями являются белковые вещества. Повсюду, где мы встречаем жизнь, мы находим, что она связана с -каким-либо белковым телом (Энгельс). В состав белков, кроме углерода (50—55%), водорода (6,5—7,5), кислорода (19—24) и азота (15—19), входит обычно сера (до 2,5%), а иногда и некоторые другие элементы (Р, Fe, u и т. д.). Структурные формулы природных белковых веществ известны только для отдельных их представителей. Изучение продуктов их распада показало, что основную роль при образовании белковых молекул играют органические соединения, содержащие в своем составе группы Nh3 и СООН, так называемые аминокислоты. Соединения эти, характеризующиеся одновременным наличием у них функций основной (из-за группы ЫНг) и кислотной (из-за группы СООН), способны присоединяться друг к другу, образуя сложные частицы, приближающиеся по свойствам к молекулам простейших белков. Таким образом, искусственный синтез важнейших натуральных белков еще не осуществлен, но на пути к нему уже сделаны некоторые важные шаги. [c.541]
Таким образом, искусственный синтез важнейших натуральных белков еще не осуществлен, но на пути к нему уже сделаны некоторые важные шаги. [c.541]
Белки — это сложные вещества, в состав которых входят углерод, водород, кислород, азот, сера и фосфор. В природных условиях белки легко разрушаются до исходных мономеров и аминокислот. Поэтому в неживой природе вместо высокополимерных соединений белка встречаются обычно их мономерные структурные единицы — аминокислоты. Содержание аминокислот в современных морских осадках составляет примерно 0,5 мг/л. В осадочных породах аминокислоты определены в остатках раковин моллюсков, костей рыб и т. д. Одна часть ископаемых аминокислот связана с полимерами небелкового характера (гуминовыми веществами), другая находится в адсорбированном состоянии. По-видимому, наиболее устойчивы нейтральные аминокислоты, например р-аланин НгМ—СНг—СНг— -СООН. [c.211]
НПр а-Аминокислоты (ь-конфигурация) — важнейшие составные части пептидов и белков. Встречаются и другие аминокислоты (Р-аланин, 4-аминомасляная кислота и др.). Любому живому организму необходимы определенные аминокислоты, некоторые из них являются незаменимыми и не могут быть синтезированы в организме из обычно доступных веществ. Человеку необходимо 9 таких аминокислот. [c.341]
Встречаются и другие аминокислоты (Р-аланин, 4-аминомасляная кислота и др.). Любому живому организму необходимы определенные аминокислоты, некоторые из них являются незаменимыми и не могут быть синтезированы в организме из обычно доступных веществ. Человеку необходимо 9 таких аминокислот. [c.341]
Всем живым организмам помимо источников углерода, кислорода и энергии необходим еще и источник азота. Азот требуется для биосинтеза аминокислот, а также пуриновых и пиримидиновых оснований, т. е. тех азотсодержащих строительных блоков, из которых затем производится сборка белков и нуклеиновых кислот. И здесь мы встречаем уже знакомые нам различия живые организмы сильно различаются в зависимости от того, в какой химической форме способны они усваивать азот. Почти все высшие животные должны получать по крайней мере часть необходимого им азота в виде аминокислот. Например, в рацион человека и белой крысы 10 из 20 обычных аминокислот должны входить в готовом виде, потому что их организм не способен синтезировать эти аминокислоты из более простых предшественников. Растения могут обычно использовать в качестве единственного источника азота аммиак или растворимые нитраты. Лишь сравнительно немногие организмы обла- [c.377]
Растения могут обычно использовать в качестве единственного источника азота аммиак или растворимые нитраты. Лишь сравнительно немногие организмы обла- [c.377]
Однако, прежде чем говорить о распространении или о структурных и функциональных особенностях отдельных полисахаридов, следует, вероятно, сказать несколько слов об общем состоянии структурных исследований в этой области. В последние годы здесь достигнуты большие успехи. Ежегодно удается выделить 10—20 новых полисахаридов. Определение последовательности моносахаридов в полисахаридах в некоторых отношениях легче, а в некоторых — труднее, чем определение последовательности мономеров в полипептидах или нуклеиновых кислотах. Легче оно главным образом потому, что полисахариды обычно построены из относительно небольшого числа повторяющихся единиц и каждый мономер повторяется на протяжении всей молекулы регулярным образом. В противоположность этому индивидуальные аминокислоты или нуклеотиды, по-видимому, распределены беспорядочно или почти беспорядочно в молекулах соответствующих полимерных соединений.
 Если полисахарид строго регулярен, то определения структуры повторяющейся единицы и молекулярного веса полимера достаточно для установления его полной первичной структуры. Однако в большинстве случаев встречаются некоторые особенности (например, наличие в молекуле точек разветвления), которые в значительной степени усложняют задачу. Главным осложняющим фактором в химии полисахаридов является наличие нескольких типов связей между остатками моносахаридов. В отличие от белков, в которых все аминокислотные остатки связаны пептидными связями, и от нуклеиновых кислот, в которых нуклеотиды всегда соединены между собой 3, 5 -фосфодиэфирными связями, молекулы полисахаридов могут содержать различные связи а-(1 2), р-(1 3), а-(1 4) и т. д. Что касается числа типов мономерных единиц в отдельных полисахаридах, то в этом последние более сходны с нуклеиновыми кислотами, чем с белками в пределах одной молекулы полисахарида редко встречается более четырех типов мономеров. Стоит отметить как общее правило, что установить последовательность мономеров в полимере, содержащем малое число типов мономерных звеньев,.
Если полисахарид строго регулярен, то определения структуры повторяющейся единицы и молекулярного веса полимера достаточно для установления его полной первичной структуры. Однако в большинстве случаев встречаются некоторые особенности (например, наличие в молекуле точек разветвления), которые в значительной степени усложняют задачу. Главным осложняющим фактором в химии полисахаридов является наличие нескольких типов связей между остатками моносахаридов. В отличие от белков, в которых все аминокислотные остатки связаны пептидными связями, и от нуклеиновых кислот, в которых нуклеотиды всегда соединены между собой 3, 5 -фосфодиэфирными связями, молекулы полисахаридов могут содержать различные связи а-(1 2), р-(1 3), а-(1 4) и т. д. Что касается числа типов мономерных единиц в отдельных полисахаридах, то в этом последние более сходны с нуклеиновыми кислотами, чем с белками в пределах одной молекулы полисахарида редко встречается более четырех типов мономеров. Стоит отметить как общее правило, что установить последовательность мономеров в полимере, содержащем малое число типов мономерных звеньев,.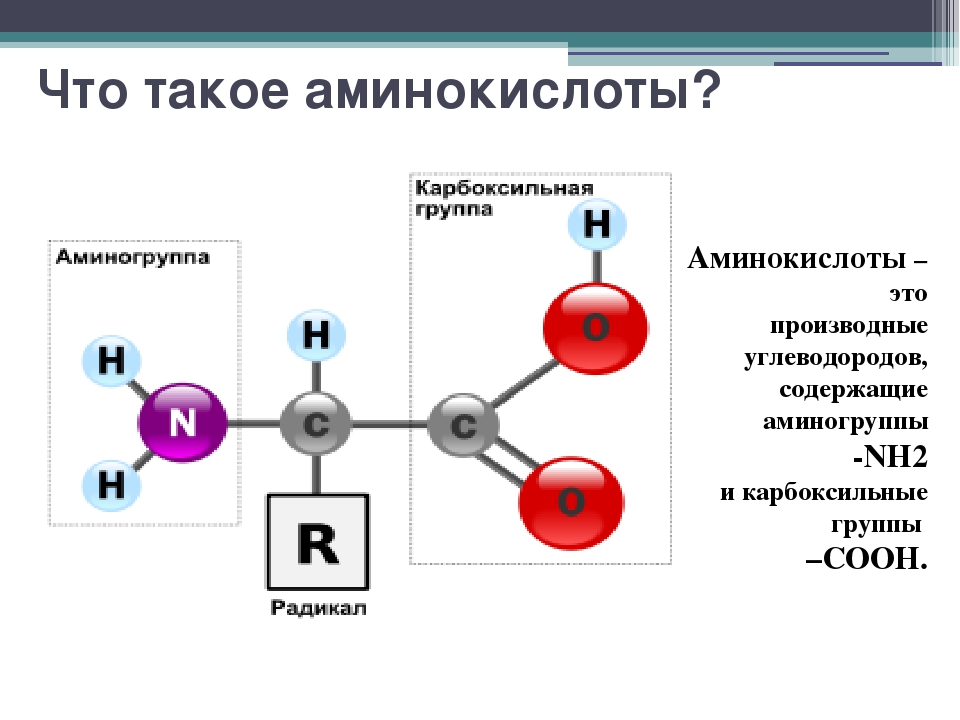 гораздо труднее при большом числе типов эта задача решается проще. [c.265]
гораздо труднее при большом числе типов эта задача решается проще. [c.265]Характерно, что молекула глицина включает в себя группу ЫНа наряду с группой СООН, присущей карбоновым кислотам. Некоторые аминокислоты, кроме того, содержат серу . Б молекулах аминокислот встречаются не только простые углеродные цепи, но и ароматические кольца, в том числе с гетероатомами. Всего к настоящему времени выделено из белков и исследовано около 30 аминокислот. Из них по меньшей мере десять незаменимы для питания человека. Организм нуждается в них для построения своих белков и сам не может их синтезировать. Белки животного и особенно растительного происхождения обычно содержат не все необходимые для жизнедеятельности аминокислоты в достаточном количестве, поэтому белковое питание человека должно быть по возможности разнообразным. Выходит, что наша склонность к разнообразной пище научно обоснована. [c.265]
Химический анализ показал, что разница в структуре белка соответствует и разнице в аминокислотном составе корпускулярные белки содержат все аминокислоты. Набор аминокислот, входящих в состав фибриллярных белков, значительно беднее. Некоторые или вообще не встречаются в фибриллярных белках, или содержатся в очень малых количествах. Обычно всего три-четыре аминокислоты составляют основную массу полипептидных цепей этих белков. [c.56]
Набор аминокислот, входящих в состав фибриллярных белков, значительно беднее. Некоторые или вообще не встречаются в фибриллярных белках, или содержатся в очень малых количествах. Обычно всего три-четыре аминокислоты составляют основную массу полипептидных цепей этих белков. [c.56]
За исключением глицина, все аминокислоты имеют асимметрический атом углерода, причем в белках у живых организмов обычно встречаются только левовращающие (Ъ-формы)аминокислоты. Ь-Аминокислоты способны попро-шествии больщого периода времени превращаться в рацемическую смесь Ь- и В-форм. Скорость рацемизации зависит от конкретного строения аминокислоты. Для аспарагиновой (а-аминоянтарной) кислоты удалось установить константу скорости рацемизации путем определения возраста костей [c.481]
Среди обычных для белков аминокислот есть и вторичные аминокислоты (т. е. иминокислоты — -пролин и гидрокси- -пролин) кроме того, в некоторых природных пептидах встречаются У-ме-тильные производные некоторых простых аминокислот.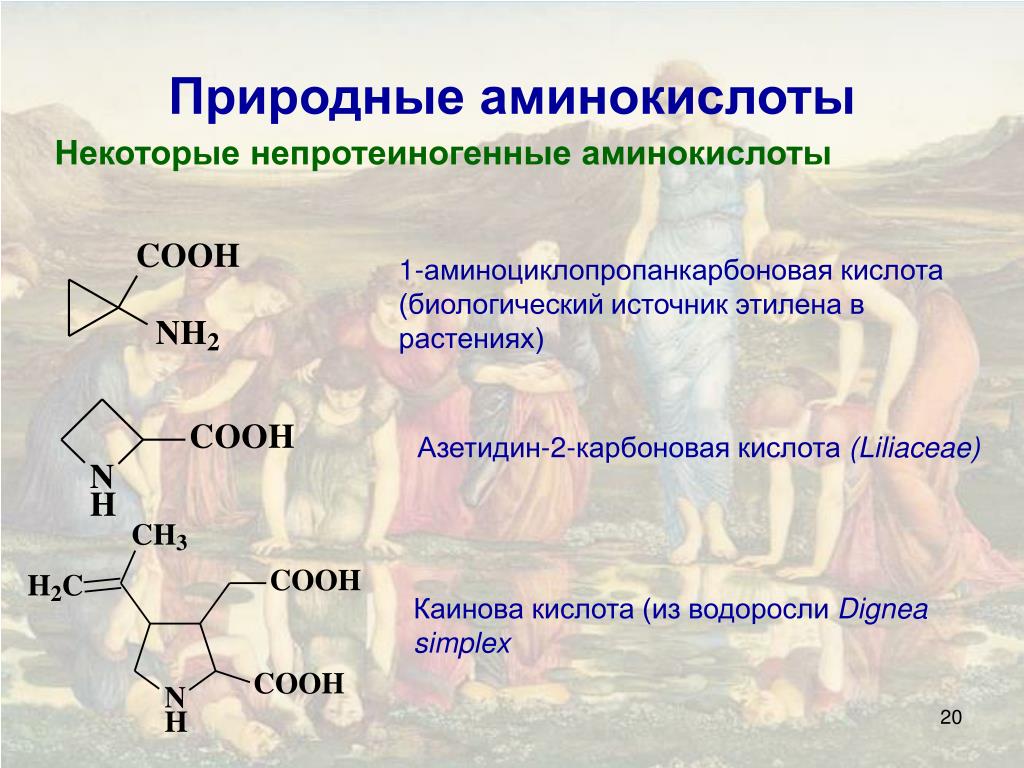 Два основных следствия замены протона группировки N—Н на углерод состоят в том, что, во-первых, такая группировка уже не может принимать участие в водородной связи, стабилизующей конформацию (что делает, например, пролин неспособным к участию в образовании а-спирали) и, во-вторых, придает относительно повыщенную устойчивость ис-амидной связи в случае третичных амидов. [c.429]
Два основных следствия замены протона группировки N—Н на углерод состоят в том, что, во-первых, такая группировка уже не может принимать участие в водородной связи, стабилизующей конформацию (что делает, например, пролин неспособным к участию в образовании а-спирали) и, во-вторых, придает относительно повыщенную устойчивость ис-амидной связи в случае третичных амидов. [c.429]
Даже в тех случаях, когда асимметрические центры находятся близко друг к другу, асимметрическая индукция для простых молекул редко достигает 100 %. Однако в биохимических системах асимметрический синтез осуществляется с высокой степенью эффективности. Фотосинтез глюкозы (ХЬУ ) в растениях из двуокиси углерода и воды дает исключительно с-энан-тиомер. ь-Энантиомер не встречается в природе и не усваивается животными организмами. Аналогичным образом все входящие в состав белков а-аминокислоты, которые могут обладать асимметрией, имеют ь-конфигурацию. п-Аминокислоты обычно не встречаются в природе.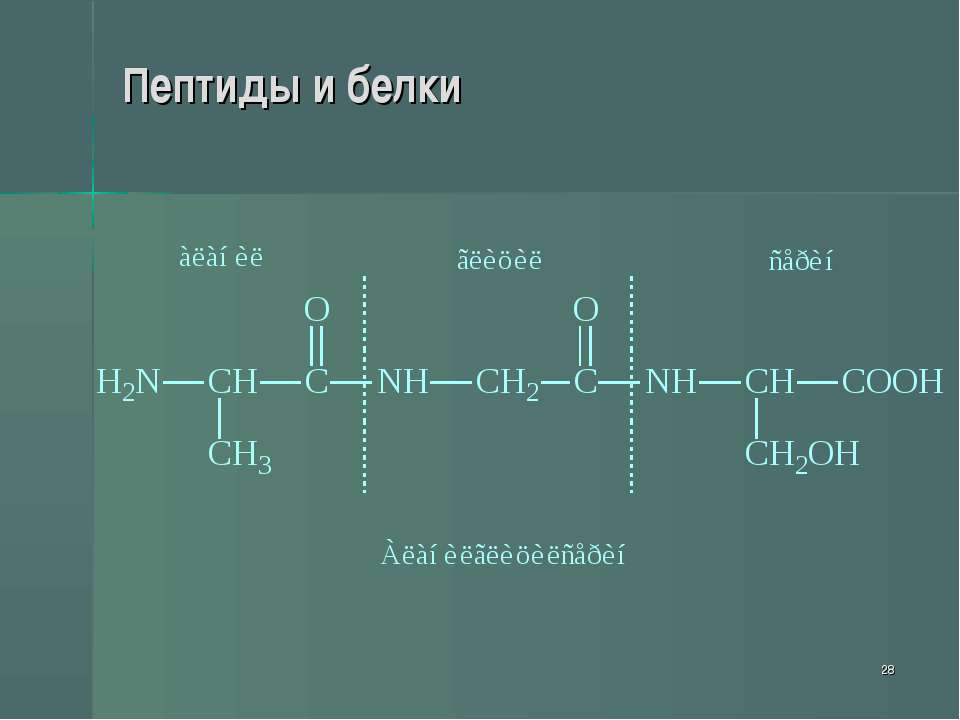 [c.534]
[c.534]
Наконец, следует остановиться на предположении, высказанном рядом исследователей относительно того, что биологическая активность антибиотиков — полипептидов, а также и некоторых других антибиотиков каким-то образом связана с наличием в их молекулах составных частей, имеющих пространственную конфигурацию, противоположную той, которая обычно встречается в веществах природного происхождения. Действительно, в настоящее время известно, что в состав пенициллинов входит -диметилцистеин, тогда как в белках найден только /-цистеин. Извгстно также, что оба моносахарида, в одящие в состав молекулы стрептомицина (N-мегилглю-козамин и стрептоза), принадлежат к /-ряду, тогда как встречающиеся в природе моносахариды обычно относятся к rf-ряду. В этой главе уже подчеркивалось, что в состав трех важнейших антибиотиков — полипептидов (грамицидина С, тироцидина и грамицидина) входят некоторые rf-аминокислоты, тогда как обычно в природных продуктах встречаются /-аминокислоты. Интересно отметить, что в состав антибиотика совершенно другою типа — глиотоксина входит остаток i/ аланина. [c.196]
Интересно отметить, что в состав антибиотика совершенно другою типа — глиотоксина входит остаток i/ аланина. [c.196]
ГЛУТАМИНОВАЯ КИСЛОТА. Аминокислота. НООССНгОНгСПКНзХ ХСООН. Плохо растворима в воде. Очень легко синтезируется в ор-ганизл1е животных. Занимает важное место в азотном обмене микробного, растительного и животного организмов и выполняет роль связующего звена в обмене углеводов и белков, а также жиров и белков. В растительных кормах обычно встречается в количествах, удовлетворяющих потребности животных. [c.74]
В настоящее время интенсивно развиваются методы автоматического анализа аминокислот. Основы этих методик заложены Спакманом и сотр. [186], которые использовали в своей работе метод ионообменной хроматографии на сильнокислотных катионитах, разработанный Муром и 111тейном [126]. В настоящее время ведутся поиски способов ускорения анализов и совершенствуются анализаторы (см. гл. 8). Разрабатывается техника анализа белков и продуктов гидролиза пептидов, а также физиологических жидкостей. Анализ соединений первой группы проще, поскольку он предусматривает разделение лишь тех 18—20 аминокислот, которые обычно встречаются в продуктах гидролиза пептидов. Анализ физиологических жидкостей слож- [c.305]
Анализ соединений первой группы проще, поскольку он предусматривает разделение лишь тех 18—20 аминокислот, которые обычно встречаются в продуктах гидролиза пептидов. Анализ физиологических жидкостей слож- [c.305]
Чтобы определить современное отношение к этому перечню, необходимо, кроме того, различать две группы аминокислот, а именносвободном состоянии в организмах высших животных, либо в бактериальных белках. В первом случае метод хроматографии на бумаге позволил определить полный состав большого числа белковых гадролизатов, причем присутствие в таких гидролизатах еще неизвестной до сих пор аминокислоты становится все менее вероятным. Основная задача, следовательно, состоит не в расширении перечня обычно. встречающихся аминокислот, а в том, чтобы снова критически проанализировать те аминокислоты, которые уже включены в этот список. В 1931 г. Викери и Шмидт [1] насчитывали двадцать две аминокислоты. Эти авторы не приняли во внимание цистеина, который действительно содержится в целом ряде белков, но включили в список дииодтирозин и тироксин, идентифицированные до сих пор только в тироглобулине. Необходимо, следовательно, уменьшить число аминокислот, первоначально приведенное Викери, до двадцати одного. Два года спустя Шмидт увеличил эту цифру до двадцати двух, предложив добавить к списку норлейцин [2]. Затем была, невидимому, окончательно отвергнута -оксиглутаминовая кислота Дэкина, а существование в белках норлейцина стало весьма сомнительным [3]. Поэтому мы должны ограничить перечень двадцатью обычно встречающимися аминокислотами, причем эта цифра никогда, вероятно, не будет значительно изменена. В число 20 аминокислот не включены аспарагин и глутамин, так как они не встречаются в химических белковых гидролизатах. Этот специальный случай будет рассмотрен на стр. 108. [c.102]
Необходимо, следовательно, уменьшить число аминокислот, первоначально приведенное Викери, до двадцати одного. Два года спустя Шмидт увеличил эту цифру до двадцати двух, предложив добавить к списку норлейцин [2]. Затем была, невидимому, окончательно отвергнута -оксиглутаминовая кислота Дэкина, а существование в белках норлейцина стало весьма сомнительным [3]. Поэтому мы должны ограничить перечень двадцатью обычно встречающимися аминокислотами, причем эта цифра никогда, вероятно, не будет значительно изменена. В число 20 аминокислот не включены аспарагин и глутамин, так как они не встречаются в химических белковых гидролизатах. Этот специальный случай будет рассмотрен на стр. 108. [c.102]
Окоигвролин, упомянутый выше в группе обычно встречающихся аминокислот, в действительности был найден только в желатине и в коллагенах однако эти белки широко распространены и содержат значительное количество окшпролина (14%). Ниже будут рассмотрены те аминокислоты, которые встречаются реже. [c.109]
[c.109]
За исключением аминокислоты глицина, все остальные а-аминокис-лоты — оптически активные вещества, так как в их молекулах имеется асимметрический атом углерода. Аминокислоты, входящие в состав всех белков, а также встречающиеся в живых организмах в свободном виде (природные аминокислоты), относятся к -ряду. Одни из этих аминокислот являются правовращающими, другие — левовращающими. В оптические антиподы природных аминокислот -ряда входят аминокислоты D-ряда. Эти аминокислоты получаются путем синтеза, в природе же они встречаются редко. Они не входят в белки и очень редко встречаются в свободном состоянии в ортанизмах. Для правильной ориентировки в оптических свойствах естественных аминокислот обычно к букве L добавляют знак -Ь для обозначения правого вращения и знак — — для левого вращения. [c.18]
Те белки цитозоля, которые должны быстро разрушаться, несут сигналы, включаюш,ие ответственный за их деградацию протеолитический механизм.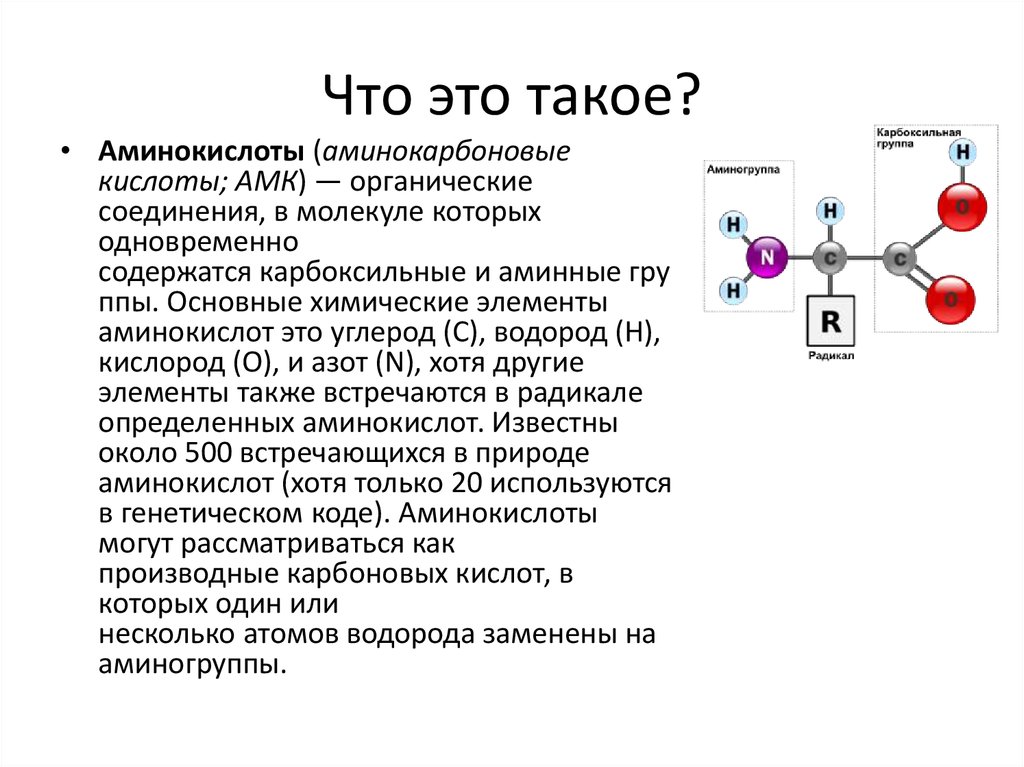 Один из таких сигналов чрезвычайно прост и представляет собой всего лишь первую аминокислоту в полипептидной цепи. Аминокислоты Met, Ser, Thr, Ala, Val, ys, Gly и Pro, когда они находятся на N-конце, являются стабилизирующими, а остальные 12 аминокислот вызывают иротеолитическую атаку. Эти дестабилизирующие аминокислоты практически никогда не встречаются на N-конце стабильных белков цитозоля. Однако они часто присутствуют на N-конце белков, переносимых в другие компартменты, например, в ЭР. Поскольку цитозольный протео литический механизм отсутствует в полости ЭР или аппарата Г ольджи. такие белки в своих компартментах обычно являются долгоживущими. Дестабилизирующая N-концевая аминокислота таких нецитозольных белков может служить в клетке для удаления гех копий, которые направляются ошибочно молекулы, которые нельзя быстро перенести из цитозоля, сразу разрушаются. Подобный же код, состоящий из одного аминокислотного остатка, видимо, существует у бактерий, где также вызывает быструю деградацию специфических белков [c.21]
Один из таких сигналов чрезвычайно прост и представляет собой всего лишь первую аминокислоту в полипептидной цепи. Аминокислоты Met, Ser, Thr, Ala, Val, ys, Gly и Pro, когда они находятся на N-конце, являются стабилизирующими, а остальные 12 аминокислот вызывают иротеолитическую атаку. Эти дестабилизирующие аминокислоты практически никогда не встречаются на N-конце стабильных белков цитозоля. Однако они часто присутствуют на N-конце белков, переносимых в другие компартменты, например, в ЭР. Поскольку цитозольный протео литический механизм отсутствует в полости ЭР или аппарата Г ольджи. такие белки в своих компартментах обычно являются долгоживущими. Дестабилизирующая N-концевая аминокислота таких нецитозольных белков может служить в клетке для удаления гех копий, которые направляются ошибочно молекулы, которые нельзя быстро перенести из цитозоля, сразу разрушаются. Подобный же код, состоящий из одного аминокислотного остатка, видимо, существует у бактерий, где также вызывает быструю деградацию специфических белков [c.21]
В некоторых микроорганизмах синтез пептидной связи происходит по более простому, примитивному, механизму. В этом случае пептидный синтез идет очень эффективно, хотя и в отсутствие высокоупорядоченного синтезирующего аппарата, обеспечиваемого структурами рибосомы и тРНК. Поэтому таким путем синтезируются лишь короткие белки (полипептиды), например грамицидин S [5]. Грамицидин S считается интересным антибиотиком по нескольким причинам. Во-первых, он содержит фенилаланин в D-конфигурации. d-Аминокислоты встречаются в природе очень редко, а в белках присутствуют только ь-аминокислоты. Во-вторых, грамицидин S содержит аминокислоту орнитин, которая обычно не входит в состав белков. [c.61]
Впрочем, суидествует также ряд просто построенных азотсодержащих природных оснований, которые из дидактических или иных соображений обычно не причисляют к алкалоидам и рассматривают в других разделах химической систематики. Например, такие простые амины, как метиламин, триметиламин и т. д., хотя они и нередко встречаются в природе, целесообразно расс.матривать в связи с другими алифатическими аминами так поступили и мы в этой книге. Мы не относили к алкалоидам и алифатические аминокислоты, многие из которых имеют явно выраженный основной характер, и этим основным веществам белков отвели место в первой части книги, где описываются алифатические соединения. Наконец, раньше уже были частично описаны (стр. 377 и сл.) различные основные соединения, получающиеся в результате простых превращений аминокислот, а также протеиногенные амины и бетаины. Эти последние группы являются переходными от простых азотсодержащих соединений к собственно алкалоидам отдельные протеиногенные амины, например тирамин, и многие бетаины (стахидрин, тригонеллин и др.) рассматриваются в разделе алкалоидов. [c.1055]
Глюкозиды — группа веществ, состоящих из сахара (обычно глюкозы) и какого-либо вещества неуглеводной природы, напр, спирта. Г. встречаются во многих растениях и нередко придают им горький вкус (напр., амигдалии). Глюкопротеиды — сложные белки, представляющие собой соединения белков с углеводами. К числу Г. относят многие слизи. При гидролизе Г. распадаются на аминокислоты, углеводы и их производные, а иногда и на некоторые кислоты (серную, уксусную и др.). [c.42]
Следующей задачей при определении строения пептидов является установление характера связи и последовательности аминокислотных остатков в молекуле пептида или белка. Эта задача, трудно выполнимая в настоящее время для белков с большим молекулярным весом, облегчается тем, что в природе встречается значительное число относительно низкомолекулярных соединений, представляющих собою пептиды. Виланд предлагает различать три группы природных пептидов олигопептиды, состоящие из 2—10 аминокис/ют, полипептиды, состоящие из 10—100 аминокислот, и макропептиды, к которым относятся собственно белки. Изучение природных пептидов представляет собой важный этап в подходе к изучению строения белка. Исследование обычно начинают с определения числа цепей, входящих в состав объекта изучения. Для этого пользуются одним из ранее приведенных методов, например диннтрофенилированием, действием азотистой кислогы или аминопептидазы для определения Н-концевой аминокислоты и восстановлением, гидразинолизом или действием карбоксипептидазы для определения С-концевого остатка (см. стр. 510 и далее). [c.514]
Исследование структурных и конформационных свойств индивидуальной полипептидной субъединицы обычно ведется по трем аспектам рассматриваются первичная, вторичная и третичная структуры, как это было предложено Линдерстрем-Лангом [И]. Организмы используют для синтеза белков основной набор из 20 аминокислот (см. гл. 23.2). Необычные аминокислоты, которые эпизодически встречаются в белковых структурах, часто являются результатом химической модификации простетической группы гема (остатки 70—80) они остались неизменными в процессе эволюции, тогда как другие части молекулы играют, по-видимому, меньшую роль для спецификаций, особенно остатки, не участвующие в агре- [c.222]
В высших растениях, особенно среди представителей семейств крестоцветных, резедовых, ирисовых и тыквенных, найдены четыре л-карбоксизамещенные ароматические аминокислоты (30) — (33) [23—24]. Эти кислоты входят в большую группу аминокислот, обнаруженных в высших растениях, и обычно не встречаются в составе белков. Химические свойства и биогенез этих аминокислот широко изучались, и пути нх биосинтеза в общих чертах представлены на схеме (14). Согласно предложенной схеме, изохоризмовая кислота (28), образующаяся из хоризмовой кислоты (9), перегруппировывается в соединение (29) по реакции, которая формально аналогична орто-кляйзеновской перегруппировке, катализируемой хоризматмутазой [25]. Аминокислоты (30) и (31) затем образуются из (29) подобно тому, как .-фенилаланин (10) и .-тирозин [c.695]
Внутримолекулярная водородная связь приводит к образованию другой стабильной конформации белка — правой ос-спирали Виток а-спирали содержит 3,6 аминокислотных остатка, каждая К-Н связь полипептидной цепи связана водородной связью с С=0 группой четвертой от нее аминокислоты (рис 25 2) а-Спираль встречается очень часто Например, а-кератин шерсти является а-спиралью на 100%, миоглобин и гемоглобин — на 75%, сывороточный альбумин — на 50% Природные белки обычно представляют собой комбинации а-спиральных, /3-складчатых и неспирали-зованных участков в различных соотношениях Теория вторичной структуры белков (Л Полинг, Р Кори, 1951, Нобелевская премия 1954 г) позволила методами рентгенострук-гурного и кристаллографического анализов определить [c.883]
N-Moнoмeтил-a-aминoки лoты ( иминокислоты ) широко распространены. Например, саркозин (Ы-метилглицин) является метаболически важным соединением, а многие другие производные (которые обычно называют полусистематическими названиями) встречаются в свободном виде и в природных продуктах, особенно в антибиотиках. Эти соединения можно получить из свободных а-аминокислот (схема (25) [73], и несмотря на некоторую рацемизацию, этот метод получил широкое распространение. Последовательность реакций, указанная на схеме (26), по-видимому, лишена этого недостатка. В природе широко распространены также циклические Ы-моноалкил-а-аминокислоты (циклические иминокислоты). Мы уже упоминали особый случай пролина в белках, однако его высшие и низшие гомологи (пипеколовая и азетидин-2-карбоновая кислоты соответственно) и многочисленные другие производные [75] также присутствуют в природе. [c.245]
Кроме аминокислот многие другие ор-гмические биомолекулы аминокислот также обладают хиральньши свойствами и содержат один или большее число асимметрических атомов углерода. Примером таких соединений может служить широко распространенный сахар глюкоза, в молекуле которой содержится не менее пяти асимметрических атомов углерода. В живых организмах хиральные молекулы присутствуют обычно только в одной из двух возможных форм. Так, аминокислоты, и в частности аланин, встречаются в белках только в одной хи-ральной форме. Аналогичным образом глюкоза, основная структурная единица крахмала, обнаруживается в биологических объектах только в одной из своих многочисленных хиральных форм. Наоборот, когда химик в лабораторных условиях синтезирует органическое соединение с одним асимметрическим атомом углерода, используя обьиные небиологические реакции, с равной вероятностью образуются обе возможные хиральные формы, в результате чего получается эк- [c.64]
Как было показано выше, обычно кирп ич1ика1ми, из которых строятся белки, являются Ь-аминокислоты. Однако в некоторых бактериях встречаются О-ами-нокислоты. [c.138]
Многие вещества, встречающиеся в растительных или животных организмах, способны существовать более чем в одной стерео изомерной форме однако обычно эти формы могут встречаться раздельно, а некоторые из них могут вообще не еуществовать в природных продуктах. Сохранение одной какой-либо стереО изомерной конфигурации в процессе многочисленных превращений, непрерывно протекающих в результате обмена веществ в клетках, связано с селективным действием энзимов. В современных теориях энзиматического действия делается предположение, что энзим образует с соединением, на которое он действует (т. е. с его субстратом), комплекс энзим-субстрат, который затем распадается на свободный энзим и продукты энзиматической реакции. Способность энзима различать стереоизомеры означает наличие согласующейся стереоизомерии в точках присоединения, или активных центрах, поверхности энзима. Эта мысль становится вполне приемлемой, если мы вспомним, что.энзимы во своей химической природе являются белками и, следовательно,.построены в значительной мере из аминокислот, обладающих Д.-конфигурацией. [c.611]
При использовании ферментов возможны различные пути. Обычно они основаны на том, что в живых организмах ферментативные системы реагируют с тем энантиомером, который встречается в природе. Например, Пастер обнаружил, что грибок плесени Peni illium glau um разрушает природную (-f)-винную кислоту, а не (—)-энантиомер, не встречающийся в природе. Если в синтетическую ( )-винную кислоту внести эту плесень, то разрушаются молекулы ( + )-кислоты и в растворе остаются молекулы (—)-кислоты таким путем из ферментированной смеси получают чистую —)-кислоту. Причина, по которой хиральный фермент реагирует только с одним из двух энантиомерных субстратов, была объяснена выше. В другом случае вместо разрушения одни из двух энантиомеров подвергается химическому превращению. Например, при расщеплении синтетических а-аминокислот на оптически активные аминокислоты (из которых построены все природные белки) рацемическую кислоту сначала ацилируют и получают рацемическую ациламинокислоту. Последнюю затем гидролизуют в присутствии фермента ацилазы, получаемого из почки свиньи. Ферментативный гидролиз затрагивает только ацетильные производные природных (обычно S) аминокислот эти аминокислоты получаются таким образом в свободном состоянии и легко отделяются от оставшихся ацетильных производных R-аминокислот. Свободные R-аминокислоты можно получить гидролизом оставшихся R-ацетиламино-кислот обычными химическими методами (например, в присутствии соляной кислоты). [c.31]
Почему белковая цепь находит единственно верную укладку среди многих вариантов
Перебор всех возможных вариантов укладки белковой цепи займет время, превышающее время жизни Вселенной. Однако белок успевает найти верный вариант в течение считаных минут. Отдел науки «Газеты.Ru» рассказывает о том, как российским ученым удалось разрешить этот парадокс и для чего нужно оценивать «быстродействие» белка.
Как сворачиваются белки
Каждая клетка нашего тела является фабрикой по производству белков. Часть из них производится для внутреннего пользования, для поддержания жизни клетки, а другая часть «идет на экспорт». Все свойства белковых молекул (в том числе способность изумительно точно катализировать превращения других молекул в клетке) зависят от пространственной структуры белка, причем структура каждого белка уникальна.
Пространственная структура образуется уникальной укладкой белковой цепи, состоящей из разных аминокислотных остатков (бусинок разных цветов — рис. 1). Последовательность аминокислот в цепи белка определяется его геномом и синтезируется рибосомой, после чего пространственная структура цепи формируется «сама собой» в ходе сворачивания белковой цепи, которая выходит из рибосомы еще практически неупорядоченной.
close
100%
Сворачивают эту цепь взаимодействия ее аминокислот, причем в одну и ту же структуру — как в организме, так и в пробирке. Разнообразие возможных укладок одной и той же цепи невообразимо велико. Но у заданной последовательности аминокислот есть, как правило, только одна стабильная («правильная») структура, которая и придает белку его уникальные свойства. Стабильна же она потому, что именно она обладает минимальной энергией.
Тот же принцип действует при образовании кристаллов: вещество приобретает ту структуру, энергия связей в которой минимальна.
Что общего у белка и Вселенной
Здесь перед учеными возник вопрос: как белковая цепь может спонтанно «найти» свою единственную стабильную структуру, если перебор колоссального числа всех вариантов (порядка 10100 для цепи из 100 аминокислотных остатков) занял бы времени больше, чем время жизни Вселенной. Этот «парадокс Левинталя», сформулированный полвека назад, был решен только теперь. Для его решения пришлось привлечь методы теоретической физики.
close
100%
Ученые из Института белка Российской академии наук (ИБ РАН) создали теорию скоростей образования пространственных структур молекул белка. Результаты работы были недавно опубликованы в журналах Atlas of Science, Chem Phys Chem и «Биофизика». Работа поддержана грантом Российского научного фонда (РНФ).
«Способность белков спонтанно формировать свои пространственные структуры за считаные секунды или минуты — давняя загадка молекулярной биологии.
В нашей работе представлена физическая теория, позволяющая оценить скорость этого процесса в зависимости от величины белков и сложности их устройства», — начинает рассказ о своей работе член-корреспондент РАН, доктор физико-математических наук, главный научный сотрудник Института белка РАН, руководитель гранта РНФ Алексей Финкельштейн.
«Давно известно, что белковая цепь приобретает свою уникальную структуру при одних условиях среды, а при других (например, при подкислении или подогреве раствора) эта структура разворачивается. На стыке этих условий уникальная структура белка находится в динамическом равновесии с развернутой формой его цепи, — продолжает он. — Процессы сворачивания и разворачивания там сосуществуют, их физика наиболее прозрачна. Поэтому мы сосредоточились именно на таких равновесных и квазиравновесных условиях — в отличие от других исследователей, которые как будто резонно (но ошибочно, как оказалось) полагали, что путь к тайне сворачивания белка надо искать там, где оно протекает наиболее быстро».
Развернуть белок — хорошее начало, но не выход
«Первый подход к проблеме Левинталя был разработан нами давно, — рассказывает Алексей Финкельштейн, — и заключался в следующем: так как теоретически проследить путь сворачивания белка очень трудно, нужно изучать процесс его разворачивания. Звучит парадоксально, но в физике существует принцип «детального равновесия», который гласит: любой процесс в равновесной системе протекает по тому же пути и с той же скоростью, что и обратный ему. И так как в динамическом равновесии скорости сворачивания и разворачивания одинаковы, мы рассмотрели более простой процесс разворачивания белка (ведь разломать проще, чем сделать) и охарактеризовали тот «барьер» (см. картинку 1), нестабильность которого определяет скорость процесса».
Следуя принципу детального равновесия, ученые из Института белка РАН оценили и «сверху», и «снизу» скорость сворачивания белков — как больших, так и маленьких, как с простой, так и со сложной укладкой цепи. Небольшие и просто устроенные белки сворачиваются быстрее (оценка скорости «сверху»), а большие и/или сложно устроенные — медленнее (оценка «снизу»). Значения всех остальных возможных скоростей сворачивания заключены между ними.
Однако не все биологи были удовлетворены полученным решением, так как, во-первых, их интересовал путь сворачивания (а не разворачивания) белка, а во-вторых, физический «принцип детального равновесия» был, по-видимому, им плохо понятен.
И работы продолжались: на этот раз учеными из ИБ РАН были произведены расчеты сложности сворачивания белка. Давно известно, что взаимодействия в белках связаны в основном с так называемыми вторичными структурами. Вторичные структуры — это стандартные, довольно крупные локальные «строительные блоки» белковой структуры, определяемые в основном локальными аминокислотными последовательностями в них. Количество возможных вариантов укладки таких блоков в структуру свернутого белка можно подсчитать, что и было сделано учеными из ИБ РАН. Число таких вариантов огромно — порядка 1010 (но далеко не 10100!) для цепи из порядка 100 аминокислот, и белковая цепь может, согласно теоретическим оценкам, «просканировать» их за минуты или — для более длинных цепей — за часы. Так была получена самая верхняя оценка времени сворачивания белка.
close
100%
Результаты, полученные двумя способами (т.е. при анализе и разворачивания, и сворачивания белка), сходятся и подтверждают друг друга.
«Наша работа имеет фундаментальное значение для конструирования в будущем новых белков для нужд фармакологии, биоинженерии, нанотехнологии, — заключает Алексей Финкельштейн.
— Вопросы скорости сворачивания белков актуальны, когда речь идет о предсказании структуры белка по его аминокислотной последовательности, а особенно — о дизайне новых, не встречающихся в природе белков».
«Что изменилось после получения гранта РНФ? Появилась возможность закупить новое современное оборудование и реактивы для работы (ведь наша лаборатория в основном экспериментальная, хотя я здесь рассказал только о нашей теоретической работе). Но главное: грант РНФ позволил специалистам заниматься наукой, а не искать подработку на стороне или в дальних краях», — говорит Алексей Финкельштейн.
Текст подготовлен в сотрудничестве с проектом «Индикатор» (Indicator.Ru).
Немецкие биохимики синтезируют новые белки | Научные открытия и технические новинки из Германии | DW
Еще совсем недавно ученым казалось, что стоит только расшифровать геном человека, и сразу же станет ясно, как функционирует человеческий организм, чем вызываются различные заболевания и как их лечить. Однако ясно стало совсем другое: ответить на эти вопросы удастся лишь в том случае, если понять, как функционируют белки. Потому что именно белки, или протеины, управляют всей жизнью организма. Генетический код, конечно, чрезвычайно важен, поскольку именно гены кодируют белки, определяет их состав и форму, но конкретные функции организма регулируются белками. И не случайно сегодня, тесня геномику — науку о геноме и генах, стремительно развивается протеомика — наука о белках.
Новые буквы, новые слова
Одно из направлений протеомных исследований ставит перед собой цель искусственного синтеза белков. Задача чрезвычайно сложная, ведь белок — это биополимер, высокомолекулярное органическое вещество, состоящее из соединенных в цепочку так называемых стандартных аминокислот, и этих аминокислот 20. Если представить себе аминокислоты буквами, а белки — словами, то понятно, что 20 букв — это достаточно богатый алфавит, и с его помощью можно написать сотни тысяч разных слов.
И все же есть исследователи, которым этих букв не хватает, и они пытаются строить новые белки из модифицированных, видоизмененных стандартных аминокислот или даже из нестандартных, то есть таких, которые вообще в составе природных белков не встречаются. Эти ученые надеются, что таким путем им удастся создать более эффективные вакцины, более действенные препараты для терапии гормональных расстройств, и тому подобное. Но пока эти попытки успехом не увенчались.
Что, в общем-то, неудивительно, — считает Армин Гайер (Armin Geyer), профессор органической химии Марбургского университета: «Подход, состоящий в том, чтобы взять совершенно новые буквы и на их основе изобретать новые языки, уводит так далеко от реально существующего в природе, что он практически обречен на провал. Поэтому мне представляется гораздо более перспективным другой подход — отталкиваясь от природной структуры, нащупывать небольшие, но эффективные изменения ее. То есть шаг за шагом, поочередно, заменять один аминокислотный фрагмент за другим соответствующими синтетическими фрагментами».
Альфа-спираль, бета-изгиб
Однако и этот подход наталкивается на серьезные сложности — прежде всего, потому, что последовательность аминокислот в белковой молекуле представляет собой лишь первичный уровень ее организации и не определяет функцию белка. Ничуть не меньшую роль играет и так называемая конформация, то есть пространственная структура белка — вторичная, третичная и четвертичная, — поясняет профессор Гайер: «Как каждая цепочка синтетического полимера, пластмассы, стремится собраться в клубок, так же ведет себя и молекула белка. При этом образуются различные по форме складки и извивы. К наиболее часто встречающимся относятся альфа-спираль и бета-изгиб. Бета-изгиб — это крутой разворот пептидной цепочки на 180 градусов, формой напоминающий шпильку для волос».
Искусственно синтезированный фрагмент пептидной цепочки, содержащий такой бета-изгиб, профессору Гайеру удалось теперь встроить в модельный белок. При этом ученого особенно интересовало, как поведет себя этот фрагмент в составе белковой молекулы. С одной стороны, он должен был придать ей определенную жесткость, несколько ограничить ее подвижность, что упростило бы прогнозирование свойств модифицированного белка; с другой стороны, он должен был проявить себя в качестве так называемого миметика, то есть выполнять функцию того пептидного фрагмента, место которого он занял.
Коллега профессора Гайера — профессор структурной биохимии Марбургского университета Ларс-Оливер Эссен (Lars-Olover Essen) — говорит: «В данной работе было показано, что этот искусственно встроенный бета-изгиб придает белку очень высокую степень организации — на удивление высокую, мы такого не ожидали. И мы увидели, почему этот так: потому что фрагмент с бета-изгибом не только точно воспроизводит форму белковой молекулы, но и не менее точно имитирует исходное взаимодействие с соседними элементами молекулы. Это главное достижение данной работы: искусственные пептид-миметики удавалось получать и раньше, но они никогда не взаимодействовали со своим окружением».
На очереди — бета-амилоидные бляшки
Взаимодействие между аминокислотами, образующими белковую молекулу, реализуется в форме так называемых пептидных связей. Это своего рода «суставы» белковой молекулы, определяющие подвижность ее пространственной структуры. Синтезированный в Марбурге искусственный фрагмент с бета-изгибом способен целенаправленно воздействовать именно на эти «суставы», поэтому авторы работы надеются, что им удалось создать универсальный «кирпичик», который сможет сходным образом модифицировать самые разные белки. В частности, профессор Гайер намерен обратиться к изучению белковых бляшек, образующихся в головном мозге пациентов, страдающих болезнью Альцгеймера.
Эти бляшки состоят преимущественно из видоизмененного бета-амилоида — одного из нормальных белков человеческого организма, — однако содержат и другие белковые структуры. Иммунная система человека способна вырабатывать антитела, подавляющие отдельные элементы бляшек, однако против бляшек в целом она бессильна. К тому же их состав и структура до сих пор плохо поддавались изучению. Теперь, возможно, ситуация изменится, — говорит профессор Гайер: «Мы намерены использовать наш жесткий фрагмент для того, чтобы разделить выделенные из бляшек пептиды на группы по два или по три и выяснить, какие из них наиболее эффективно подавляются антителами. В среднесрочной перспективе это позволит разработать новый лекарственный препарат против болезни Альцгеймера, а в краткосрочной перспективе — тест на антитела для людей, генетически предрасположенных к этому недугу».
Автор: Владимир Фрадкин
Редактор: Ефим Шуман
Аспекты аминокислотного профиля белка | ТП Биотех2030
Автор: Архипов М. Ю., кандидат технических наук по специальности Биотехнология, ведущий специалист компании ООО «ФидИндастриз»
Идеальный аминокислотный профиль
Часто можно встретить словосочетание «идеальный белок». Под ним понимают белок, обладающий белок аминокислотным составом, идеально сбалансированным для роста и развития живого организма. На практике идеального белка с постоянным составом аминокислот не существует, т.к. соотношение аминокислот, требуемых для разных живых организмов, отличается и даже для одного и того же организма не постоянно, т.к. зависит от многих факторов: возраста и состояния организма, фазы его развития: формирование скелета, наращивание мышечной массы и др. А что же такое тогда такое «идеальный белок» и зачем нужно это понятие?
Не все аминокислоты одинаково усваиваются, недостаток одних ограничивает усваивание других. Для понимания данной ситуации существует закон Либиха, иллюстрирующий как влияет лимитирующая аминокислота. Согласно закону белок можно представить в виде бочки, сбитой из досок, если одна доска короче остальных, то вода будет уходить через неё. Доски – это аминокислоты, а самая короткая – это лимитрирующая, она будет понижать ценность всего продукта, а избыточные аминокислоты будут выведены из организма.
Попробуем проанализировать аминокислотные профили нескольких белков считающихся идеальными для разных животных разных возрастных групп.
Можно заметить, что при разнообразии кривых идеальных белков, прослеживается общий характер кривой, т.к. существует общая закономерность соотношения аминокислот, следовательно, можно построить аппроксимирующую кривую обобщённого Идеального белка.
Наложив на данную кривую аминокислотные профили любого белка можно судить об оптимальности его по отклонению от этого аппроксимированного профиля «идеального» белка, считая её бочкой Либиха. А существует ли в природе белковая добавка с идеальным аминокислотным профилем?
Виды источников кормового белка
Как известно источники белка могут быть классифицированы по происхождению на 3 основные группы: животные, растительные, микробные. Иногда ещё добавляют две дополнительные группы: белки синтетического происхождения и белки насекомых, но они мало распространены.
Для каждой группы белков по происхождению характерен разный аминокислотный профиль.
Широко известно, что основной аминокислотой является лизин. Она является основным лимитирующим фактором в бочке Либиха. Если белок не содержит лизина, то ценность такого продукта низкая. Лидером в плане обеспеченности лизином считается белок животного происхождения, однако надо учитывать, что и животный белок может быть совершенно разным по АК профилю. Давайте посмотрим какой он бывает.
Ближе всего к идеальному белку по АК профилю располагается белок зародыша: яйцо, икра. В нём содержатся все аминокислоты в соответствии с потребностью универсального развития целостного живого организма. Такой белок оптимален для быстрого начального развития организма, но с его развитием потребность меняется. Поэтому его можно назвать базовым для развития всех живых организмов.
Из диаграммы видно, что АК профиль яичного белка вполне покрывает АК профиль идеального белка.
За ним идёт белок молока – это, прежде всего, казеин, содержание которого в коровьем молоке достигает 78-85%. Этот белок содержит полный набор незаменимых аминокислот, но имеет относительный провал по метионину и треонину.
К белкам животного происхождения также относятся другие белки, которые имеют аминокислотный профиль совсем далёкий от идеального. Они получены при переработке кожи, пуха, пера, костей и других отходов. В таких белках преобладают соединительные структурные белки – коллаген, эластин, кератин. Коллаген и эластин содержатся в коже, хрящах, костях, лёгких и кровеносных сосудах. Они содержат много глицина и пролина. В эластине больше валина и аланина и меньше глутаминовой кислоты и аргинина, чем в коллагене. Кератин — это фибриллярный белок, обладающий высокой механической прочностью. В основном из него состоят волосы, ногти, рога, перья и клюв птиц и др.
Как видно из диаграммы эти белки крайне бедны по основным незаменимым аминокислотам — лизину, метионину, гистидину, триптофану и далеко выпадают из профиля «идеального» белка. Гидролиз, ферментирование, концентрирование или изолирование таких белков не могут добавить им недостающих аминокислот, т.к. при дальнейшей переработке не меняется АК профиль.
Рыбная мука. АК профиль рыбной муки близок к профилю идеального белка, недостаток заметен только по метионину и фенилаланину. АК профиль рыбной муки также сильно колеблется, т.к. зависит из чего она сделана: из какой рыбы, из целой или из отходов, присутствия фальсифицирующих добавок.
Если же рыбная мука сделана из рыбных отходов, то аминокислотный профиль будет совсем иным – в нём будет провал по основным аминокислотам, в том числе лизину, из-за высокого содержания коллагенсодержащих вторичных рыбных ресурсов (головы, костей, плавников и др.).
Растительные белки. Растительные белки по сравнению с животными менее полноценны, так как они дефицитны по содержанию незаменимых аминокислот, прежде всего лизина и треонина.
Для белка пшеницы, кукурузы, также как и риса, пшена, подсолнечника первой лимитирующей аминокислотой является лизин, для бобовых — метионин. Среди растительных белков наиболее близка по АК профилю к идеальному соя, а все остальные культуры, включая горох, люпин, лён и другие уступают ей уступают, прежде всего, по содержанию лизина. Следует помнить, что аминокислотный профиль растительного белкового продукта будь это концентрат, гидролизат или изолят всегда сохраняет аминокислотный профиль исходного сырья, которое было использовано в производстве. Если же в готовом белковом продукте прослеживается значительное нарушение профиля, например завышенное содержание лизина, то это — фальсификат, в который добавляли синтетические аминокислоты или другие добавки. Такие добавки снижают питательность исходного природного белка и могут быть опасны, несмотря на более сбалансированный аминокислотный профиль.
Микробный белок. Микробный белок получают ферментаций микроорганизмов, целью которой является наработка биомассы. Обычно используют обычно дрожжи, как самый быстрорастущий м/о. В его биомассе накапливается обычно 45% белка. Аминокислотный профиль дрожжевого белка близок к идеальному, кроме содержания метионина.
Минусом такого дрожжевого белка является наличие у микроорганизмов клеточной стенки, которая сложно расщепляется ферментами живого организма.
Источник: http://soyanews.info/news/aspekty_aminokislotnogo_profilya_belka.html
Природа опасностей для человека, связанных с чрезмерным потреблением аминокислот | Журнал питания
РЕФЕРАТ
В последние годы значительно увеличилось потребление отдельных аминокислот в качестве пищевых добавок. Это произошло не только из-за использования определенных аминокислот в качестве ароматизаторов, но и из-за того, что другие аминокислоты используются для ощутимой пользы для здоровья, для улучшения физической работоспособности, а также для психологического воздействия.Существуют два обзора научной литературы, которые в основном касаются воздействия на животных, и три основных отчета рассматривают безопасность аминокислот для потребления человеком. Эта статья представляет собой краткое изложение имеющихся данных о безопасности отдельных аминокислот при приеме в избытке по сравнению с количествами, абсорбированными из пищевого белка.
Введение
В последние два десятилетия возрос интерес к безопасности отдельных аминокислот, принимаемых в дополнение к нормальному потреблению белка с пищей.Это результат быстро растущего использования отдельных аминокислот в качестве пищевых добавок для улучшения здоровья или работоспособности, а также их использования в качестве ароматизаторов. В 1970 году Харпер и др. (1) представили обзор эффектов непропорционального потребления аминокислот, и эта информация была обновлена в 1984 году Беневенгой и Стилом (2). Эти обзоры касались, в основном, воздействия определенных аминокислот, которые вводились в избытке растущим животным, и документировали выраженную депрессию роста, вызываемую некоторыми из них, особенно метионином.С тех пор, по крайней мере, три отчета были опубликованы комитетами, созданными для исследования безопасности аминокислот, включая Объединенный комитет экспертов ВОЗ / ФАО по пищевым добавкам (JECFA; ссылка 3), 3 , Отдел исследований в области наук о жизни (LSRO; ссылка 4) и Совет по пищевым продуктам и питанию Института медицины (FNB; ссылка 5). В отличие от предыдущих обзоров, которые были сосредоточены в основном на литературе, посвященной исследованиям на животных, в этих отчетах больше внимания уделялось безопасности употребления в пищу людьми. По некоторым аминокислотам существует обширная литература по исследованиям на людях и животных; в частности, глутамат, аспартат и фенилаланин широко представлены благодаря их использованию в качестве пищевых ароматизаторов [глутамат в виде глюатамата натрия (MSG) и аспартат и фенилаланин в аспартаме].Кроме того, существует информация о токсичности триптофана из-за его очевидного участия в этиологии синдрома эозинофилии-миалгии, тогда как имеется гораздо меньше данных о глутамине и аминокислотах с разветвленной цепью (BCAA), которые были изучены в отношении травм. восстановление и улучшение спортивных результатов. Для многих других аминокислот имеется гораздо меньше информации, особенно о побочных эффектах у людей. Эта статья представляет собой краткое и ни в коем случае не исчерпывающее изложение имеющихся данных о безопасности l-аминокислот.Поскольку несколько общих механизмов, по-видимому, связаны с побочными эффектами различных аминокислот, они обсуждаются в алфавитном порядке.
Аланин
Прием аланина не вызывает серьезных побочных эффектов. У крыс, соблюдающих диету с низким содержанием белка, наблюдается незначительное или полное отсутствие подавления роста и приема пищи (1). Несколько больше информации доступно для людей. Не сообщалось о явных побочных эффектах, когда до 4 г аланина в растворе для пероральной регидратации в течение 2 дней давали 48 младенцам мужского пола (6) или когда до 132 г аланина в растворе для пероральной регидратации в течение 4 дней давали 20 младенцам мужского пола. в возрасте <1 года (7).Более того, у взрослых после в / в не сообщалось о побочных эффектах. настой до 35 г аланина в течение 5 мин (8). В нескольких исследованиях пероральные нагрузки до 50 г аланина не вызывали побочных эффектов, кроме преходящей тошноты и спазмов в животе (9–11).
Аргинин
В острых исследованиях инфузия аргинина стимулировала секрецию инсулина и глюкагона у собак, лишенных пищи (12). Применение аргинина широко изучалось на предмет его очевидной способности повышать иммунитет и заживление ран (13), и никаких побочных эффектов не было отмечено.Аргинин также исследовался на животных моделях рака, где ряд исследований показал ингибирование роста опухоли (13). Однако в других исследованиях культивированных клеток или животных с иммунодефицитом (например, бестимусных голых мышей) наблюдалась стимуляция синтеза и роста опухолевого белка (14, 15). Это говорит о том, что аргинин обладает способностью либо подавлять, либо усиливать рост опухоли, возможно, в зависимости от того, активирует ли он также иммунную систему (14,15).
В нескольких исследованиях на людях, изучающих возможное повышение иммунитета и улучшение заживления ран с помощью до 30 г / день гидрохлорида аргинина, не было выявлено побочных эффектов, за исключением тошноты и диареи (13).Более того, i.v. инфузия 30 г аргинина пациентам для оценки секреции гормона гипофиза хорошо переносилась, за исключением увеличения плазменного K + у пациентов с диабетом (16). Для людей, больных раком, нет прямых измерений влияния аргинина на рост или прогрессирование опухоли. Однако у пациентов с раком груди скорость синтеза белка в опухоли и экспрессия маркера пролиферации опухоли Ki67 были увеличены после 3 дней приема добавок аргинина (30 г / день) (17).Напротив, в аналогичном исследовании пациентов с опухолями головы и шеи добавки аргинина не оказали видимых эффектов (18). В настоящее время неясно, в какой степени эти эффекты на опухоли следует рассматривать как неблагоприятные.
аспарагин
По всей видимости, информации, относящейся к безопасности аспарагина для животных или людей, нет.
Аспарагиновая кислота
Токсичность аспарагиновой кислоты была исследована, поскольку в дипептидной форме с фенилаланином она является компонентом искусственного подсластителя аспартама.У животных аспарагиновая кислота очень похожа на свой аналог глутаминовую кислоту (см. Ниже). Например, поражения гипоталамуса, которые возникли у детенышей мышей после введения глутаминовой кислоты (см. Ниже), также возникли при приеме аспарагиновой кислоты (19), а хроническое кормление растущих животных на низкобелковой диете с аспарагиновой кислотой подавляло рост (1). Однако у детенышей обезьян, получавших аспарагиновую кислоту, повреждений не наблюдалось (20). У людей введение болюсной дозы 10 г аспарагиновой кислоты не привело к секреции гормонов гипофиза (21), а введение 75-130 мг · кг -1 · сут -1 аспарагиновой кислоты в качестве добавление к режиму физических упражнений не вызывало каких-либо побочных эффектов (22-25).В обзоре литературы FNB отметил (5), что добавки до 8 г / день для людей в дополнение к ~ 3 г / день из пищи не приводили к каким-либо задокументированным побочным эффектам. Точно так же было мало доказательств токсичности у субъектов, получавших аспарагиновую кислоту в качестве аспартама (4,5).
Аминокислоты с разветвленной цепью
В исследованиях на животных, получавших диету с низким содержанием белка, было показано, что избыток лейцина вызывает снижение потребления пищи и роста (см. Ссылку 1). Однако это было исправлено предоставлением изолейцина и валина; этот эффект был объяснен антагонизмом (1).Интересно, что избыток изолейцина или валина мало влияет на рост (1). Было показано, что BCAA конкурируют с ароматическими аминокислотами за транспортировку в мозг и снижают синтез нейромедиаторов (26,27). Однако значение этого эффекта до конца не выяснено (5). Кроме того, долгосрочные исследования не предоставляют доказательств канцерогенеза в отсутствие инициирующего агента (28).
На людях не проводилось специальных исследований токсичности, хотя многие исследования до настоящего времени искали клинические или физиологические преимущества от лейцина или смесей BCAA.Сообщается о небольшом количестве побочных эффектов, если таковые имеются. Например, несколько исследователей вводили лейцин (5–6 г, в / в или перорально) и не наблюдали признаков токсичности (4,5), хотя эти дозы приводили к повышенным концентрациям аминокислот в крови. Болезнь мочи кленовым сиропом, генетическое заболевание, при котором окисление кетокислот с разветвленной цепью является недостаточным, также приводит к повышению концентрации BCAA и их кетокислот в крови и умственной отсталости. Однако нет никаких доказательств того, что прием добавок BCAA приводит к такому высокому уровню аминокислот или кетокислот в крови или к неврологическим повреждениям.
Цистеин
Было показано, что низкобелковые диеты, содержащие различные уровни цистеина (0,5–10%), снижают прибавку в весе и потребление пищи и приводят к высокой смертности животных (1). Уровни холестерина в плазме крови также изменились с увеличением у крыс на диетах с низким содержанием холестерина и уменьшением у крыс на диетах с высоким содержанием холестерина (29–31). Кроме того, постоянно сообщалось о гистопатологических изменениях в почках и печени (1). Неонатальные животные показали влияние на мозг (гипоталамус) и сетчатку, подобное тому, которое вызывается глутаминовой кислотой (32).В исследованиях на людях дозы цистеина в дозе 5–10 г вызывали тошноту, головокружение и диссоциацию (21). Кроме того, у здоровых субъектов, получавших повышенные дозы цистеина до 20 г (с транилципромином), наблюдались утомляемость, головокружение, тошнота и бессонница, которые были дозозависимыми (33).
Глутаминовая кислота
Неблагоприятные эффекты, приписываемые глутаминовой кислоте, подробно обсуждаются во многих отчетах (3–5,34,35). В исследованиях на животных была показана низкая острая токсичность глутаминовой кислоты (LD 50 , 10–20 г / кг) (3-5).Отмечена небольшая хроническая токсичность (отсутствие опухолей или бесплодия), хотя у животных на низкобелковой диете наблюдалось небольшое замедление роста (1). Однако введение новорожденным мышам больших доз глутамата впоследствии привело к увеличению жировых отложений и бесплодию, а также к повреждению гипоталамуса (36). Согласно JECFA (3), чувствительность к этим эффектам быстро снижается с возрастом и зависит от вида в следующем порядке: мыши> крысы, хомяки, морские свинки> нечеловеческие приматы. Более того, поражения возникали при парентеральном введении и введении через зонд больших доз, но не было обнаружено повреждений у животных, получавших глутамат с пищей.Поскольку глутамат является возбуждающим нейромедиатором, считается, что механизм этих эффектов заключается в чрезмерной активации возбуждающих рецепторов, расположенных на дендросомальных поверхностях нейронов (37). Это может быть результатом увеличения притока Ca 2+ через проницаемые каналы N, -метил-d-аспартат и α -амино-3-гидрокси-5-метилизоксазол-4-пропионовая кислота — селективные рецепторы глутамата. , что приводит к образованию свободных радикалов; активация протеаз, фосфолипаз и эндонуклеаз; и активация транскрипции апоптотических программ (38).Наиболее чувствительными областями мозга являются те, которые относительно не защищены гематоэнцефалическим барьером, в частности дугообразное ядро гипоталамуса.
Субхронические исследования на мышах показали увеличение массы тела, телесного жира и бесплодия самок у животных, получавших глутамат (2–4 г · кг −1 · сут −1 , подкожно) в течение первых нескольких дней жизни ( 36,39). Однако аналогичные исследования на крысах, получавших с пищей до 2,0 г · кг -1 · сут -1 глутамата, не показали влияния на вес нескольких органов или всего тела (40,41).Другие исследования не показали влияния глутамата на обучение или восстановление после шока электросудорожной терапии (42). Более длительные исследования воздействия глутамата на животных выявили несколько побочных эффектов; например, нет увеличения заболеваемости злокачественными опухолями (43,44), а также нет снижения фертильности и выживаемости молодых (45).
У людей, в / в. Введение глутамата вызывает тошноту и рвоту пропорционально уровню глутамата в сыворотке, а концентрации> 1 ммоль / л вызывают рвоту у 50% пациентов (46).Глутамат, вводимый в виде глутамата аргинина (50 г / 8 ч) в разделенных дозах, чтобы избежать рвоты, использовался для лечения интоксикации аммиаком (3). Более того, хроническое лечение детей дозой до 48 г / день в течение 6 месяцев (47) и взрослых с дозой 45 г / день в течение 11 месяцев (48) не выявило побочных эффектов.
Однако, ввиду нейротоксического действия глутамата на молодых животных, было много опасений по поводу его использования в качестве мононатриевой соли (MSG) в качестве агента, усиливающего вкус. Это было вызвано сообщениями о возникновении неблагоприятных симптомов после употребления азиатских продуктов, которые в совокупности известны как «синдром китайского ресторана», но также называются «симптоматическим комплексом глутамата натрия» (4) и «идиосинкразической непереносимостью».Симптомы, которые часто возникают после того, как человек поедает еду из азиатских ресторанов, описываются как ощущение жжения в задней части шеи, предплечьях и груди; лицевое давление или стеснение; грудная боль; Головная боль; тошнота; покалывание и слабость в верхней части тела; сердцебиение; онемение в задней части шеи, рук и спины; сонливость; и бронхоспазм (только у астматиков) (4). Исследования показали, что те, кто жаловался на восприимчивость, были чувствительны к <3 г глутамата натрия, и почти у всех наблюдались некоторые симптомы при достаточно высоких дозах (49).Однако, хотя некоторые исследования показали, что до 25-30% населения могут быть восприимчивы (50,51), более поздние работы, в которых использовались более строго контролируемые экспериментальные схемы, чтобы замаскировать характерный вкус глутамата натрия, не позволили выявить более высокую частоту неблагоприятных симптомов. после приема глутамата (1,5 или 3 г) по сравнению с плацебо (52–54). JECFA (3) пришел к выводу, что должным образом проведенные и контролируемые клинические испытания не смогли установить связь между синдромом китайского ресторана и приемом глутамата натрия.LSRO (4) согласился с этим, но признал возможное существование небольшой подгруппы здоровых людей, которые были чувствительны и проявляли симптомы при пероральном приеме 3-граммовой дозы глутамата натрия в отсутствие еды. Более поздние исследования подтвердили существование небольшой подгруппы, чувствительной к глутамата натрия (55), и показали, что ответа не было, когда глутамат натрия давали с пищей (56). Более того, было также отмечено, что не наблюдалось ни стойких, ни серьезных эффектов от глутамата натрия (56).
Индукция астмы — еще одна описанная побочная реакция на глутамат натрия (4,34,35).Однако в обзоре Stevenson (57) указано, что, хотя два одинарных слепых исследования показали связь приема глутамата натрия с бронхоспазмом у части пациентов, в последующих четырех исследованиях с использованием двойных слепых подходов не было выявлено случаев бронхоспазма после приема глутамата натрия у некоторых пациентов. всего 109 пациентов.
Глютамин
В последние годы возрос интерес к роли глутамина в поддержании гомеостаза белков, особенно в скелетных мышцах, а также к потенциальным преимуществам добавок глутамина для восстановления после травм и инфекций.Несколько исследований специально изучают побочные эффекты у здоровых животных. Однако во многих отчетах об исследованиях, связанных с введением глутамина животным, никаких побочных эффектов отмечено не было. Точно так же токсичность глутамина систематически не исследовалась у здоровых людей, хотя на сегодняшний день существует множество исследований, в которых стремятся получить клиническую пользу, и лишь немногие, если таковые имеются, сообщили о побочных эффектах. Наиболее подробная информация представлена в резюме Ziegler et al. (58) серии экспериментов, в которых глютамин давали добровольцам и пациентам в течение различных периодов времени.В четырех экспериментальных протоколах не сообщалось о побочных эффектах глутамина: наблюдение за 34 добровольцами в течение 4 часов после перорального или внутривенного введения. глутамин в дозах до 0,3 г / кг; 7 добровольцев находились под наблюдением в течение 4 ч во время в / в. настой глутамина из расчета 0,025 г · кг -1 · ч -1 ; 7 добровольцев получали полное парентеральное питание, включая глутамин в дозах 0, 0,285 и 0,570 г · кг -1 · сут -1 в течение 5 дней; и 8 пациентов с трансплантатами костного мозга, получавших полное парентеральное питание, включая глутамин в дозах 0,0.285 и 0,570 г · кг −1 · сут −1 более 30 суток. Другие исследования, в которых сообщалась информация, связанная с безопасностью, показали отсутствие побочных эффектов у 120 хирургических пациентов, получавших аланил-глутамин в течение 6 дней (59), и у 44 недоношенных новорожденных, получавших глутамин в виде 20% от общего количества аминокислот в течение 15 дней (60). Следовательно, нет никаких доказательств того, что добавление глютамина приводит к побочным эффектам. Однако ввиду широко распространенного, а иногда и хронического использования добавок глютамина как у здоровых субъектов, так и в клинической среде требуется больше информации, особенно из исследований, главной целью которых является безопасность.
Глицин
При остром исследовании собак, в / в. инфузия глицина 1 г / кг в течение 20 мин вызвала неврологические изменения (61). В более хронических исследованиях на крысах добавление глицина к низкобелковому рациону приводило к подавлению роста и приема пищи (1). Эти эффекты смягчались диетами, которые содержали больше белка или витаминов группы B (1). Кроме того, введение 200 мг / сут глицина в течение 20 недель крысам Fischer-344 увеличивало частоту опухолей мочевого пузыря (62).Однако количество обработанных животных было небольшим, контрольная группа не была описана, и наблюдение, по-видимому, не было подтверждено.
Похоже, что исследований токсичности глицина у людей не проводилось, но серьезных побочных эффектов не было отмечено при введении до 31 г / день глицина в классических исследованиях потребности в аминокислотах, проведенных Rose et al. (63). Кроме того, глицин часто назначают в качестве ирригационного средства во время трансуретральной резекции простаты, и сообщалось о тошноте, преходящей слепоте и нарушении зрения (64–67).Сообщалось, что нарушение зрения возникает при концентрации глицина в плазме> 4 мМ (64,67), тогда как симптомы со стороны центральной нервной системы возникают при абсорбции> 0,5 г / кг глицина (65). У детей в / в. инфузия 7,5 г глицина была предложена в качестве «безвредной» процедуры для выявления дефицита гормона роста (68).
Гистидин
Гистидин, по-видимому, является одной из наиболее токсичных аминокислот. Было показано, что высокие уровни гистидина в рационе приводят к потенциально серьезным побочным эффектам как у животных, так и у людей.У крыс добавление гистидина в рацион с низким содержанием белка приводит к подавлению роста и приема пищи; эти эффекты смягчаются диетами с высоким содержанием белка (1). Что еще более важно, высокое потребление гистидина животными приводило к гиперлипидемии, гиперхолестеринемии и увеличению печени (2,69,70). Сообщалось также о снижении содержания меди в плазме, и гиперхолестеринемия была купирована добавлением меди в пищу (71).
В исследованиях на людях, когда четырем субъектам с избыточным весом / ожирением давали 24–64 г гистидина в день, наблюдалось повышение содержания цинка в моче, головная боль, слабость, сонливость, тошнота, анорексия, болезненность глаз, изменение остроты зрения, спутанность сознания, плохая память. , и наступила депрессия (72).Однако явных побочных эффектов не наблюдалось при приеме до 4,5 г гистидина в день для лечения ожирения (72), ревматоидного артрита (73) и хронической уремии (74,75).
Лизин
Избыток лизина в рационе приводит к снижению роста и потребления корма у молодых животных, получающих диеты с низким содержанием белка (76). Однако не было обнаружено никаких побочных эффектов у крыс, получавших лизин в качестве 3% от рациона в течение 2 лет (77), что свидетельствует о низкой токсичности этой аминокислоты. Когда крыс кормили диетой, содержащей 5% лизина, происходило накопление триглицеридов в печени (78,79).Этот эффект был отменен добавлением аргинина в рацион (1) и является примером антагонизма между двумя основными аминокислотами (1). Это можно объяснить конкуренцией между этими аминокислотами за такие процессы, как транспорт (где можно распознать их структурное сходство), хотя механизм явно довольно сложен (1).
В исследованиях на людях лизин показал низкую токсичность и использовался для лечения вируса герпеса. У детей (10–14 лет) не было зарегистрировано побочных эффектов при введении 14–22 г гидрохлорида лизина i.v. оценить его влияние на цикл мочевины (80). Младенцы (в возрасте 4–11 мес.), Получавшие до 1 г лизина на 8 унций молока порциями в течение 3–4 дней, не показали никаких побочных эффектов (81). Кроме того, у младенцев (в возрасте 1–5 мес.) Не было выявлено побочных эффектов лизина в дозе 220 мг / кг (82). В хронических исследованиях у взрослых, получавших 40 г / день гидрохлорида лизина в течение 2–5 дней (83) или до 3 г / день в течение 6 месяцев, не было выявлено никаких побочных эффектов, за исключением расстройства желудка (84).
метионин
Харпер и др. Назвали метионин самой токсичной аминокислотой.(1) и Беневенга и Стил (2). Однократный прием пищи, содержащий 2,7% метионина, подавлял рост и потребление пищи у животных (2). Более того, у животных, получавших 10% казеиновый рацион с добавкой 0,5–0,6% метионина (в три-четыре раза превышающей их потребность), рост прекращался и потребление было заметно подавлено (85). Продолжение приема 2,7% метионина в течение до 20 дней приводило к нагрубанию эритроцитов и накоплению гемосидерина, угнетению роста и повреждению печени (86). У поросят, получавших различные уровни dl-метионина до 4% от рациона в течение 27 дней, концентрация метионина в плазме увеличивалась в 100 раз по сравнению с базальным уровнем при максимальном потреблении (87).У самок крыс, получавших диету с 5% метионином, не было успешных беременностей (88), тогда как у животных, получавших диету с низким содержанием белка с добавлением dl-метионина в течение 2 лет, развивалась гипергомоцистеинемия и признаки сердечно-сосудистых заболеваний (89). Считается, что токсическим агентом, ответственным за эти эффекты, являются смешанные дисульфиды метантиол-цистеин (2).
Исследования на людях также выявили значительные побочные эффекты. Хотя 5 г / сут метионина в течение нескольких недель были безвредными (90), у двух субъектов, получавших 30 г в / в.v., сообщалось о сильной тошноте, рвоте и нарушении функции печени (91). В другом исследовании 8 г / сут метионина давали в течение 4 дней, что привело к снижению уровня фолиевой кислоты в сыворотке и увеличению количества лейкоцитов (92). Более того, прием метионина в дозе 10–20 г / сут в течение 2 недель приводил к функциональному психозу у 7 из 11 пациентов с шизофренией (93). Как наблюдали у животных, ежедневные дозы метионина 100 мг / кг приводят к высокому уровню метионина, гомоцистеина и смешанных дисульфидов в плазме (94). Поскольку гомоцистеинемия коррелирует с сердечно-сосудистыми заболеваниями, длительное использование добавок метионина является потенциально серьезной проблемой.
фенилаланин
Обеспокоенность безопасностью фенилаланина возникает из-за аномального развития мозга, которое, как известно, встречается у людей с фенилкетонурией, что приводит к накоплению фенилаланина и его метаболитов в крови. Более того, у крыс, которым вводили 4 г / кг фенилаланина с 8-11 дней жизни, наблюдается аномальное развитие мозга (95). У животных на рационе с нормальным содержанием белка высокие уровни фенилаланина в рационе подавляют рост, но не более, чем парное кормление (2).Однако у людей, получавших однократные пероральные дозы до 10 г (96), ∼30 г в / в. (91) или 3–4 г аспартама перорально (96), побочных эффектов отмечено не было. Это говорит о том, что для людей с нормальной способностью метаболизировать фенилаланин эта аминокислота относительно безопасна, хотя информации о безопасности во время беременности и младенчества нет.
Пролайн
Дополнительный пролин приводит к небольшому замедлению роста и потребления пищи у крыс, соблюдающих диету с низким содержанием белка (1).Введение пролина с питьевой водой (50 мг / кг массы тела) в течение 1 мес не привело к гистологическим изменениям печени и почек (97). Единственная важная информация для людей — это исследование, которое не выявило явных побочных эффектов при назначении 3–10 г / сут пролина четырем пациентам с атрофией спирали в течение 2–4 лет (98).
Серин
Угнетение роста и снижение потребления пищи наблюдаются у крыс, получавших диету с низким содержанием белка и серином (1). Информация для людей скудна.О побочных эффектах не сообщалось при пероральном приеме до 15 г серина здоровыми людьми, тогда как у четырех выздоровевших психотических пациентов, получавших ту же дозу, наблюдался рецидив психотических симптомов (99). Однако аналогичное исследование 12 пациентов с психотическими расстройствами и 10 пациентов контрольной группы не выявило изменений в самооценке перцептивной или когнитивной психиатрической симптоматики (100).
Треонин
Треонин широко не изучался, но, по-видимому, является одной из наименее токсичных аминокислот.При добавлении к диетам с низким содержанием белка треонин вызывает меньшее угнетение роста, чем другие аминокислоты (1). Хотя при добавлении 5% треонина к низкобелковой диете беременных крыс подавление роста щенков было больше, чем у животных, которых кормили парой (1,101), это было меньше, чем подавление роста, вызванное гораздо меньшими количествами триптофана или гистидина. (1102). В исследованиях на людях также мало указаний на токсичность. При приеме до 6 г треонина ежедневно в течение 2 недель пациентам со спастичностью не сообщалось о серьезных побочных эффектах (103).По-видимому, нет данных для здоровых взрослых, за исключением головных болей и болей в спине, которые возникали, когда испытуемым вводили до 22,5 г треонина внутривенно. (91). У недоношенных детей повышенное потребление смеси приводило к увеличению концентрации треонина в сыворотке, особенно у тех, кто употреблял смесь на основе сыворотки (которая особенно богата треонином), но никаких побочных эффектов с этим не было (104).
Триптофан
Высокий уровень потребления триптофана снижает потребление пищи и рост у животных, получавших диету с низким, но не с высоким содержанием белка (1,2).Кроме того, взрослые крысы, получавшие 20% казеиновый рацион с добавлением 28,5% триптофана, показали быструю потерю веса (105). Однако свиньи, получавшие триптофан в качестве 1% рациона, не оказали никакого влияния на рост или потребление (106). В биохимических исследованиях у крыс, получавших 5% триптофана с пищей в течение 6 недель, было обнаружено увеличение серотонина и 5-гидроксииндолуксусной кислоты в нижних отделах ствола головного мозга (107). Более того, в исследованиях на животных наблюдались поведенческие эффекты, которые опосредуются серотонинергическими нейронами, например, снижение латентного периода сна, снижение потребления пищи, снижение двигательной активности и улучшение результатов теста лабиринта (108).Несмотря на эти зарегистрированные эффекты у животных, нет никаких доказательств серьезных побочных эффектов, связанных непосредственно с триптофаном у людей, и сообщалось о некоторых потенциально полезных эффектах, например, улучшении сна (109), поэтому триптофан широко продается в качестве снотворного. Наиболее важным отрицательным свидетельством является вспышка синдрома эозинофлии-миалгии в 1980-х годах у субъектов, принимавших добавки триптофана (110). Однако теперь считается, что это не связано с самим триптофаном; скорее, синдром, по-видимому, возник в результате загрязнения триптофана, произведенного одним поставщиком (5).
Тирозин
У молодых крыс на низкобелковой диете угнетение роста и приема пищи происходит при дополнительном введении тирозина, что сопровождается смертью при более высоких уровнях потребления тирозина. Уникальный эффект этой аминокислоты заключается в том, что она вызывает поражения роговицы и лап у крыс, получавших низкобелковую диету с 3–5% тирозина, но гистопатологические изменения также происходят во многих других тканях (1). Эти эффекты смягчаются со временем и повышением уровня диетического белка или ограничением аминокислот (1).Было показано, что очаги поражения глаз состоят из кристаллов тирозина в результате высокой концентрации и низкой растворимости тирозина в тканевых жидкостях (111, 112). Кроме того, сообщалось об изменениях функций, опосредованных катехоламинами, например, артериального давления (113). После того, как крысам-самкам давали дополнительный тирозин во время беременности, у крысят были обнаружены неврологические и поведенческие изменения (114).
Генетическое заболевание тирозинемия II связано с очень высокими уровнями тирозина в плазме из-за дефицита печеночной тирозинаминотрансферазы.Это приводит к умственной отсталости и поражениям глаз и подошв ног, аналогичным тем, о которых сообщалось в исследованиях на животных (4). Однако экспериментальные исследования высокого потребления тирозина у людей в целом не воспроизвели эти эффекты или побочные эффекты, наблюдаемые у животных. Пероральные дозы 100 мг / кг для взрослых не повлияли на кровяное давление или частоту пульса, а других побочных эффектов не было (115, 116). Хотя доза 14 г привела к увеличению концентрации адреналина, норадреналина и дофамина в плазме, никаких физических или психологических эффектов обнаружено не было (117).Более того, однократная доза тирозина 100 мг / кг привела к улучшению когнитивных и функциональных задач на большой высоте (118). В ходе этих исследований не сообщалось о побочных эффектах. Однако у младенцев может быть повод для беспокойства. Последующее исследование недоношенных детей, перенесших преходящую неонатальную тирозинемию, выявило связь между повышенным уровнем тирозина в плазме в младенчестве, нарушением функции восприятия и снижением показателей успеваемости по достижении ими возраста 7–8 лет (119). Кроме того, в исследовании преходящей неонатальной тирозинемии, связанной с формулой с высоким содержанием белка и недостатком дополнительного витамина С, дети, у которых тирозинемия сохранялась более 45 дней, показали более низкие баллы по некоторым тестам интеллектуальных способностей (120).Это говорит о том, что беременным женщинам и младенцам следует избегать дополнительного приема тирозина.
Общие выводы
Побочные эффекты проявляются у животных, когда большинство (если не все) аминокислот принимают в количествах, непропорциональных нормальному составу рациона. У растущих животных это обычно проявляется в снижении скорости роста, но величина этого эффекта и способность животного к компенсации сильно различаются. Кроме того, существуют большие различия в частоте и характере побочных эффектов, которые наблюдаются при использовании разных аминокислот у взрослых.Более того, не существует общего правила или механизма, объясняющего эффекты всех аминокислот или даже групп аминокислот. Неврологические эффекты возникают с рядом аминокислот, но, похоже, нет единого механизма. Наиболее токсичными аминокислотами для животных и человека являются метионин, цистеин и гистидин. Эти аминокислоты не только обладают острыми побочными эффектами, но и существуют доказательства того, что они могут вызывать повреждение тканей и повышать уровень гомоцистеина и / или холестерина, и поэтому могут быть связаны с хроническими заболеваниями при длительном приеме.Однако в целом данных о серьезных побочных эффектах большинства аминокислотных добавок у человека мало. Тем не менее, по многим аминокислотам данные, относящиеся к людям, очень ограничены, поэтому нельзя исключать непредвиденные неблагоприятные последствия потребления больших количеств. В частности, нет данных, которые позволили бы с уверенностью установить верхний уровень безопасного потребления какой-либо аминокислоты.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1.Харпер
,А.E.
,Benevenga
,N. J.
иWohlheuter
,R. M.
(1970
)Влияние приема внутрь непропорционального количества аминокислот
.Physiol. Ред.
50
:428
—558
. 2.Benevenga
,N. J.
&Steele
,R. D.
(1984
)Побочные эффекты чрезмерного потребления аминокислот
.Annu. Rev. Nutr.
4
:157
—181
.3.Объединенный комитет экспертов ФАО / ВОЗ по пищевым добавкам
(1988
)Токсикологическая оценка некоторых пищевых добавок и контаминантов.
Серия пищевых добавок ВОЗ, № 22.Cambridge University Press
,New York, NY
. 4.Anderson
,S. A.
иRaiten
,D. J.
(1992
)Безопасность аминокислот, используемых в качестве пищевых добавок.
Подготовлено дляУправления по санитарному надзору за качеством пищевых продуктов и медикаментов Отделом исследований в области наук о жизни, Федерация американских обществ экспериментальной биологии
,Bethesda, MD
.5.Совет по пищевым продуктам и питанию / Институт медицины
(2002
)Нормативные диетические нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белка и аминокислот (макроэлементов): предварительный отчет.
Институт медицины, Национальная академия прессы
,Вашингтон, округ Колумбия
.6.Да Коста Рибейро
,Х.
, младший иЛифшиц
,F.
(1991
)Пероральная регидратационная терапия на основе аланина для младенцев с острой диареей
.J. Pediatr.
118
:S86
–S90.7.Patra
,F. C.
,Sack
,D. A.
,Islam
,A.
,Alam
,A. N.
иMazumder
,R.N.
(1989
)Формула для пероральной регидратации, содержащая аланин и глюкозу, для лечения диареи: контролируемое исследование
.руб. Med. J.
298
:1353
—1356
. 8.Genuth
,SM
иCastro
,J.
(1974
)Влияние перорального аланина на бета-гидроксибутират крови и глюкозу в плазме, инсулин, свободные жирные кислоты и гормон роста у нормальных и диабетических предметы
.Метаболизм
23
:375
—386
.9.Koeslag
,J. H.
,Levinrad
,L. I.
иKlaff
,L. J.
(1985
)Реакция полипептида поджелудочной железы на упражнения: эффект от приема углеводов и глюкозы у спортсменов.
S. Afr. Med. J.
67
:884
—887
.10.Коэслаг
,Дж.H.
,Levinrad
,LI
,Lochner
,JD
иSive
,AA
(1985
)Кетоз после тренировки после приема пищи: влияние приема глюкозы и аланина у человека
.J. Physiol.
358
:395
—403
. 11.Genuth
,S. M.
(1973
)Эффекты перорального введения аланина у лиц с ожирением натощак
.Метаболизм
22
:927
—937
.12.Rocha
,D. M.
,Faloona
,G. R.
иUnger
,R. H.
(1972
)Глюкагон-стимулирующая активность 20 аминокислот у собак
.J. Clin. Инвестировать.
51
:2346
—2351
. 13.Барбул
,A.
(1986
)Аргинин: биохимия, физиология и терапевтическое значение
.J. Parenter. Энтерально. Nutr.
10
:227
—238
. 14.Park
,K. G. M.
(1993
)Иммунологические и метаболические эффекты l-аргинина при раке человека
.Proc. Nutr. Soc.
52
:387
—401
.15.Yeatman
,T. J.
,Risley
,G. L.
иBrunson
,M. E.
(1991
)Истощение аргинина в пище тормозит рост метастатической опухоли
.Arch. Surg.
126
:1376
—1382
. 16.Massara
,F.
,Martelli
,S.
,Ghigo
,E.
,Camanni
,F.
иMolinatti
,GM
()Аргинин-индуцированная гипофосфатемия и гиперкалиемия у человека
.Diabete Metab.
5
:297
—300
. 17.Парк
,К.
,Heys
,SD
,Blessing
,K.
,Kelly
,P.
,McNurlan
,MA
,Eremin
,O.
и & PJ (1992
)Стимуляция рака груди человека диетическим l-аргинином
.Clin. Sci. (Лондон)
82
:413
—417
. 18.Caso
,G.
,Matar
,S.
,McNurlan
,M.A.
,McMillan
,D. N.
,Eremin
,O.
иGarlick
,P.J.
(1996
злокачественные эффекты метаболизма аргина)
Clin. Nutr.
15
:89
—90
. 19.Schainker
,B.
иOlney
,J. W.
(1974
)Гипоталамо-гипофизарный синдром глутаматного типа у мышей, получавших аспартат или цистеат в младенчестве
.J. Neural. Трансм.
35
:207
—215
.20.Reynolds
,W. A.
,Filer
,L. J.
, Jr. &Pitkin
,R. M.
(1971
)Глутамат натрия: отсутствие у приматов поражений гипоталамуса при проглатывании.
Наука
172
:1342
—1344
. 21.Carlson
,H. E.
,Miglietta
,J.T.
,Roginsky
,M. S.
&Stegink
,L. D.
(1989
)Стимуляция секреции гормона гипофиза аминокислотами-нейротрансмиттерами у человека
.Метаболизм
38
:1179
—1182
. 22.Альборг
,Б.
,Экелунд
,L.-G.
иNilsson
,C.-G.
(1968
)Влияние аспартата калия-магния на способность человека к длительным физическим нагрузкам
.Acta Physiol. Сканд.
74
:238
—245
. 23.De Haan
,A.
,van Doorn
,JE
иWestra
,HG
(1985
)Влияние аспартата калия и магния на метаболизм и развитие силы мышц во время коротких интенсивных статических нагрузок упражнение
.Внутр. J. Sports Med.
6
:44
—49
. 24.Maughan
,Р.J.
иSadler
,D.J.M.
(1983
)Влияние перорального приема солей аспарагиновой кислоты на метаболический ответ на длительные изнурительные упражнения у человека
.Внутр. J. Sports Med.
4
:119
—123
. 25.Сен Гупта
,Дж. С.
иШривастава
,К. К.
(1973
)Влияние аспартата калия-магния на работу на выносливость у человека
.Indian J. Exp. Биол.
11
:392
—394
0,26.Эшли
,Д. В.
иАндерсон
,Г. Х.
(1975
)Корреляция между соотношением триптофана и нейтральных аминокислот в плазме и потреблением белка в отъемном отъеме, самостоятельно выбирающем
.J. Nutr.
105
:1412
—1421
0,27.Fernstrom
,J. D.
,Larin
,F.
иWurtman
,R.J.
(1973
)Корреляция между уровнем триптофана в мозге и уровнями нейтральных аминокислот в плазме крови после употребления пищи крысами
.Life Sci.
13
:517
—524
. 28.Kakizoe
,T.
,Nishio
,Y.
,Honma
,Y.
,Niijima
,T.
иSugimura
,T.
(1983
)l-изолейцин и l-лейцин являются промоторами рака мочевого пузыря у крыс
. В:Клеточные взаимодействия с помощью экологических промоторов опухолей: Proc. 14-го Международного симпозиума. Фонда исследования рака принцессы Такамацу
,Tokyo
(Fujiki
,H.
,Hecker
,E.
,Moore
,RE
,Sigimura
,T.
& &,И.Б.
ред.).Japan Sci. Soc. Нажмите
32
:373
—380
. 29.Rukaj
,A.
иSérougne
,C.
(1983
)Влияние избытка цистеина в пище на биодинамику холестерина у крыс
.Биохим. Биофиз. Acta
753
:1
—5
. 30.Sérougne
,C.
иRukaj
,A.
(1983
)Холестерин плазмы и липопротеинов у крыс, получавших диеты с добавлением l-аминокислот
.Ann. Nutr. Метаб.
27
:386
—395
. 31.Sérougne
,C.
,Férézou
,J.
&Rukaj
,A.
(1987
)Новая взаимосвязь между холестеринемией и синтезом холестерина, определенная в результате синтеза цистеина, полученного при введении цистеина.
.Биохим. Биофиз. Acta
921
:522
—530
. 32.Олни
,Дж. У.
(1994
)Эксайтотоксины в пищевых продуктах
.Нейротоксикология
15
:535
—544
. 33.Davis
,J. M.
,Spaide
,J. K.
иHimwich
,H.E.
(1972
)Влияние транилципромина и l-цистеина на 9000 аминокислот в плазме крови пациентов контрольной группы и пациентов с шизофренией.
г. J. Clin. Nutr.
25
:302
—310
. 34.Федерация американских обществ экспериментальной биологии
(1995
)Анализ побочных реакций на глутамат натрия (MSG)
(Raiten
,DJ
,Talbot
,JM
иJM
иKD
ред.).Отчет подготовлен для Центра безопасности пищевых продуктов и прикладного питания Управления по санитарному надзору за качеством пищевых продуктов и медикаментов.
Отдел исследований наук о жизни, Федерация американских обществ экспериментальной биологии
,Bethesda, MD
. 35.Стандарты пищевых продуктов Австралия Новая Зеландия
(2003
)Глутамат натрия: оценка безопасности [онлайн].
Серия технических отчетов № 20. http://www.foodstandards.gov.au/ [доступ 29 марта 2004 г.] 36.Olney
,J. W.
(1969
)Поражения головного мозга, ожирение и другие нарушения у мышей, получавших глутамат натрия
.Наука
164
:719
—721
. 37.Olney
,J. W.
(1989
)Глутамат, нейротоксический передатчик
.J. Child Neurol.
4
:218
—226
0,38.Goldsmith
,P.C.
(2000
)Нейроглиальные ответы на повышенный уровень глутамата в медиальном базальном гипоталамусе детенышей мыши
.J. Nutr.
130
:1032S
–1038S.39.Olney
,J. W.
(1969
)Глутамат-индуцированная дегенерация сетчатки у новорожденных мышей. Электронная микроскопия остро развивающегося очага поражения
.J. Neuropathol. Exp. Neurol.
28
:455
—474
.40.Hara
,S.
,Shibuya
,T.
иNakakawaji
,K.
(1962
)Наблюдения за фармакологическим действием и токсичностью глутамата натрия со сравнением естественного и синтетического продукция
.J. Tokyo Med. Coll.
20
:69
—100
.41.Daniel
,R. G.
иWaisman
,H.A.
(1968
)Влияние избытка аминокислот на рост молодых крыс
.Рост
32
:255
—265
.42.Stellar
,E.
иMcElroy
,W. D.
(1948
) Влияет ли глутаминовая кислота на обучение?Наука
108
:281
—283
.43.Little
,A. D.
(1953
)Отчет, представленный в International Mineral and Chemical Corp. от 13 января 1953 г .; представлены в ВОЗ в 1970 году.
44.Ebert
,A. G.
(1979
)Диетическое введение l-мононатрия глутамата, dl-мононатрия глутамата и l-глутаминовой кислоты крысам
.Toxicol. Lett.
3
:71
—78
. 45.Эберт
,А.G.
(1979
)Диетическое введение глутамата натрия или глутаминовой кислоты черным мышам C-57 в течение 2 лет
.Toxicol. Lett.
3
:65
—70
. 46.Levey
,S.
,Harroun
,JE
иSmyth
,CJ
(1949
)Уровни глутаминовой кислоты в сыворотке и возникновение тошноты и рвоты после внутривенного введения аминокислоты. смеси
.J. Lab. Clin. Med.
34
:1238
—1248
. 47.Циммерман
,F. T.
иBurgmeister
,B. B.
(1959
)Контролируемый эксперимент терапии глутаминовой кислотой; первый отчет по итогам тринадцати лет исследования
.Arch. Neurol. Психиатрия
81
:639
—648
. 48.Химвич
,W. A.
,Petersen
,I.M.
иGraves
,J. P.
(1954
)Проглоченный глутамат натрия и уровни глутаминовой кислоты в плазме
.J. Appl. Physiol.
1
:196
—199
. 49.Schaumburg
,HH
,Byck
,R.
,Gerstl
,R.
иMashman
,JH
(1969
)-фармакология глутамат натрия: его роль в фармакологии. в китайском ресторане синдром
.Наука
163
:826
—828
.50.Kenney
,R.A.
иTidball
,C. S.
(1972
)Чувствительность человека к пероральному мононатрий-l-глутамату
.г. J. Clin. Nutr.
25
:140
—146
.51.Reif-Lehrer
,L.
(1976
)Возможное значение побочных реакций на глутамат у людей
.Fed. Proc.
32
:2205
—2211
. 52.Tarasoff
,L.
иKelly
,M. F.
(1993
)L-глутамат натрия: двойное слепое исследование и обзор
.Food Chem. Toxicol.
31
:1019
—1035
. 53.Kenney
,R.A.
(1986
)Синдром китайского ресторана: новый анекдот
.Food Chem. Toxicol.
24
:2205
—2214
. 54.Wilkin
,J. K.
(1986
) Вызывает ли глутамат натрия покраснение (или просто «глутаманию»)?J. Am. Акад. Дерматол.
15
:225
—230
.55.Ян
,W. H.
,Drouin
,M. A.
,Herbert
,H.
,Mao
,Y.
иKarsh
,J.
(1997
)Симптоматический комплекс глутамата натрия: оценка в двойном слепом плацебо-контролируемом рандомизированном исследовании
.J. Allergy Clin. Иммунол.
99
:757
—762
. 56.Geha
,RS
,Beiser
,A.
,Ren
,C.
,Patterson
,R.
,Greenberger
,P.
,,Grammer
Л.C.
,Ditto
,A. M.
,Harris
,K. E.
,Shaughnessy
,M.A.
и др. (1998
)Многоцентровая, двойная слепая, плацебо-контролируемая, многократная оценка реакций на глутамат натрия
.J. Allergy Clin. Иммунол.
106
:973
—980
. 57.Стивенсон
,Д. Д.
(2000
)Глутамат натрия и астма
.J. Nutr.
130
:1067S
–1073S.58.Ziegler
,TR
,Benfell
,K.
,Smith
,RJ
,Young
,LS
,Brown
,E.
,Ferrari-Bal E.
,Lowe
,DK
иWilmore
,DW
(1990
)Безопасность и метаболические эффекты введения l-глутамина людям
.J. Parenter. Энтерально. Nutr.
14
:137S
–146S.59.Jiang
,ZM
,Wang
,LJ
,Qi
,Y.
,Liu
,TH
,Qiu
,MR
и N,Yang
,Yang
Wilmore
,DW
(1993
)Сравнение парентерального питания с добавлением l-глутамина или дипептидов глутамина
.J. Parenter. Энтерально. Nutr.
17
:134
—141
.60.Лейси
,JM
,Крауч
,JB
,Бенфелл
,K.
,Звонок
,SA
,Wilmore
,CK
,0005, &Wilmore
,DW
(1996
)Влияние парентерального питания с добавлением глутамина на недоношенных детей
.J. Parenter. Энтерально. Nutr.
20
:74
—90
.61.Ван
,J.M.-L.
,Wong
,KC
,Creel
,DJ
,Clark
,WM
иShahangian
,S.
(1985
)Влияние глицина на зрительные реакции потенциалы у собаки
.Anesth. Анальг.
64
:1071
—1077
.62.Васудеван
,S.
,Laconi
,E.
,Abanobi
,SE
,Rao
,PM
,Rajalakshmi
,S.
DSR
(1987
)Влияние глицина на индукцию оротовой ацидурии и онкогенеза мочевого пузыря у крыс
.Toxicol. Патол.
15
:194
—197
.63.Rose
,W. C.
,Wixom
,R. L.
,Lockhart
,H. B.
иLambert
,G. F.
(1955
) потребности человека в кислотах. XV. Требование валина; Резюме и заключительные замечания
.J. Biol. Chem.
217
:987
—995
0,64.Creel
,D. J.
,Wang
,J.M.-L.
иВонг
,К.C.
(1987
)Преходящая слепота, связанная с трансуретральной резекцией простаты
.Arch. Офтальмол.
105
:1537
—1539
0,65.Hahn
,JS
,Aizenman
,E.
иLipton
,SA
(1988
)Центральные нейроны млекопитающих, обычно устойчивые к токсичности глутамата, становятся чувствительными из-за повышенного уровня внеклеточного Ca + ; токсичность блокируется антагонистом N -метил-d-аспартата MK-801
.Proc. Natl. Акад. Sci. США
85
:6556
—6560
0,66.Mizutani
,AR
,Parker
,J.
,Katz
,J.
иSchmidt
,J.
(1990
)Нарушения зрения и трансмутация в сыворотке крови. резекция простаты
.J. Urol.
144
:697
—699
0,67.Ван
,Дж.М.-Л.
,Creel
,D. J.
иWong
,K. C.
(1989
)Трансуретральная резекция простаты, уровни глицина в сыворотке и вызванные глазные потенциалы
.Анестезиология
70
:36
—41
.68.Florea
,I.
,Popa
,M.
,Simionescu
,L.
,Dinulescu
,E.
иJuvina
,E.
(1976
)Клиническое применение внутривенной нагрузки глицином для диагностики дефицита гормона роста
.Clin. Эндокринол.
5
:283
—286
0,69.Kerr
,G. R.
,Wolf
,R. C.
иWaisman
,H.A.
(1965
)Гиперлипемия у детенышей обезьян, которых кормили избытком l-гистидина
.Proc. Soc. Exp. Биол. Med.
119
:561
—562
.70.Solomon
,J. K.
иGeison
,R. L.
(1978
)Влияние избытка L-гистидина в рационе на уровни холестерина в плазме у крыс-отъемышей
.J. Nutr.
108
:936
—943
. 71.Harvey
,P. W.
,Hunsaker
,H.A.
иAllen
,K.G.D.
(1981
)Гиперхолестеринемия и гипокупремия, вызванная диетой у крыс
.J. Nutr.
111
:639
—647
,72.Geliebter
,AA
,Hashim
,SA
иVan Itallie
,TB
(1981
)Орально-l-гистидин не снижает остроту вкуса и обоняния, но вызывает остроту запаха мочи. экскреция
.г. J. Clin. Nutr.
34
:119
—120
,73.Пинал
,R.S.
,Harris
,ED
,Burnett
,JB
иGerber
,DA
(1977
)Лечение ревматоидного артрита l-гистидином: рандомизированное, контролируемое, плацебо двойное слепое испытание
.J. Rheumatol.
4
:414
—419
,74.Kopple
,JD
иSwendseid
,ME
(1981
)Влияние потребления гистидина на уровни гистидина в плазме и моче, азотный баланс и выделение N τ -метилгистидина при нормальной и меновой
.J. Nutr.
111
:931
—942
.75.Giordano
,C.
,De Santo
,NG
,Rinaldi
,S.
,Acone
,D.
,Esposito
,R.
&, Gallo &B.
(1973
)Гистидин для лечения уремической анемии
.руб. Med. J.
4
:714
—716
.76.Anderson
,JO
,Combs
,GF
,Groschke
,AC
иBriggs
,GM
(1951
) Влияние на рост аминокислотных дисбалансовдиеты, содержащие низкие и адекватные уровни ниацина и пиридоксина
.J. Nutr.
45
:345
—360
.77.Лаборатория токсикологии и промышленной медицины Haskell
(1957
)Лизин для пищевых добавок.
Лаборатория Стине, Химический отдел Грасселли
,Ньюарк, DE
.78.Hevia
,P.
,Kari
,FW
,Ulman
,EA
иVisek
,WJ
(1980
)Сыворотка и липиды печени животных, получавших казеин L-лизин
.J. Nutr.
110
:1224
—1230
.79.Hevia
,П.
,Ulman
,E.A.
,Kari
,F. W.
иVisek
,W. J.
(1980
)Липиды сыворотки крови крыс, получавших избыток l-лизина и различных углеводов
.J. Nutr.
110
:1231
—1239
.80.Като
,T.
,Sano
,M.
иMizutani
,N.
(1987
)Ингибирующее действие внутривенной инфузии лизина на метаболизм цикла мочевины
.евро. J. Pediatr.
146
:56
—58
.81.Dubow
,E.
,Maher
,A.
,Gish
,D.
иErk
,V.
(1958
)Толерантность к лизину у младенцев
.J. Pediatr.
52
:30
—37
,82.Snyderman
,S. E.
,Norton
,P. M.
,Fowler
,D.I.
иHolt
,L. E.
, Jr (1959
)Потребность младенцев в незаменимых аминокислотах: лизин
.г. J. Dis. Ребенок.
97
:175
—185
,83.Lasser
,RP
,Schoenfeld
,MR
иFriedberg
,CK
(1960
)Моногидрохлорид l-лизина: клиническое исследование его действия в качестве подкисляющего диуретического хлороводорода в качестве хлороводорода.
.N. Engl. J. Med.
263
:728
—733
.84.Griffith
,RS
,Walsh
,DE
,Myrmel
,KH
,Thompson
,RW
иBehforooz
,0005 из
,0005 из
Терапия l-лизином при часто рецидивирующей инфекции простого герпеса.Dermatologica
175
:183
—190
.85.Steele
,RD
,Barber
,TA
,Lalich
,J.
иBenevenga
,NJ
(1979
)Влияние метилита на диету метаболизм, рост и кроветворение у крыс
.J. Nutr.
109
:1739
—1751
,86.Benevenga
,N. J.
,Yeh
,M. H.
иLalich
,J.J.
(1976
)Угнетение роста и реакция тканей на потребление избыточного пищевого метионина и S -метил-1-цистеина
.J. Nutr.
106
:1714
—1720
. 87.Edmonds
,M. S.
иBaker
,D. H.
(1987
)Избыток аминокислот для молодых свиней: эффекты избытка метионина, триптофана, треонина или лейцина
.J. Anim. Sci.
64
:1664
—1671
.88.Matsueda
,S.
иNiiyama
,Y.
(1982
)Влияние избытка аминокислот на поддержание беременности и рост плода у крыс
.J. Nutr. Sci. Витаминол.
28
:557
—573
0,89.Fau
,D.
,Peret
,J.
&Hadjiisky
,P.
(1988
)Последствия приема крысами рациона с высоким содержанием белка или избытка метионина в течение двух лет
.J. Nutr.
118
:128
—133
.90.Министерство здравоохранения и социального обеспечения Канады
(1990
)Отчет Консультативного комитета экспертов по аминокислотам. Каталожный № h52-2 / 40-1990.
Министр снабжения и услуг
,Оттава, Онтарио, Канада
.91.Флойд
,Дж.C.
, Jr.,Fajans
,S. S.
,Conn
,J.W.A.
,Knopf
,R. F.
иRull
,J.
(1966
)Стимуляция секреции инсулина аминокислотами
.J. Clin. Инвестировать.
45
:1487
—1502
0,92.Connor
,H.
,Newton
,D. J.
,Preston
,F. E.
иWoods
,H.F.
(1978
)Пероральная нагрузка метионином как причина острого дефицита фолиевой кислоты в сыворотке: ее значение для парентерального питания
.Аспирантура. Med. J.
54
:318
—320
0,93.Antun
,F. T.
,Burnett
,G. B.
,Cooper
,A. J.
,Daly
,R. J.
,Smythies
,A. 4,
J.
ZealK. (1971
)Эффекты l-метионина (без MAOI) при шизофрении
.J. Psychiatr. Res.
8
:63
—71
.94.Brattström
,L. E.
,Hardebo
,J. E.
иHultberg
,B.J.
(1984
)Умеренная гомоцистеинемия — возможный фактор риска
сосудистых артерий.Ход
15
:1012
—1016
.95.Prensky
,A. L.
,Fishman
,M. A.
&Daftari
,B.
(1974
)Восстановление мозга крысы от кратковременного гиперфенилаланинемического инсульта
на ранней стадии развития.Brain Res.
73
:51
—58
0,96.Ryan-Harshman
,M.
,Leiter
,L.A.
иAnderson
,G.H.
(1987
)Фенилаланин и аспартам не влияют на поведение, настроение и возбуждение у мужчин
.Physiol. Behav.
39
:247
—253
0,97.Kampel
,D.
,Kupferschmnidt
,R.
иLubec
,G.
(1990
)Токсичность d-пролина
. В:Amino Acids: Chemistry, Biology and Medicine
(Lubec
,G.
&Rosenthal
,G. A.
ред.), Стр.1164
—1171
.ESCOM
,Лейден, Нидерланды
.98.Hayasaka
,S.
,Saito
,T.
,Nakajjima
,H.
,Takahashi
,O.
иMizuno
000,K. 1985
)Клинические испытания добавок витамина B и пролина для лечения спиральной атрофии сосудистой оболочки и сетчатки
.руб. J. Ophthalmol.
69
:283
—290
.99.Pepplinkhuizen
,L.
,Bruinvels
,J.
,Blom
,W.
иMoleman
,P.
(1980
)Шизофреноподобный психоз, вызванный нарушением обмена веществ
.Ланцет
1
:454
—456
.100.Wilcox
,J.
,Waziri
,R.
,Sherman
,A.
иMott
,J.
(1985
)Поглощенная серия метаболизма психотические и непсихотические субъекты
.Biol. Психиатрия
20
:41
—49
.101.Sauberlich
,H.E.
(1961
)Исследования токсичности и антагонизма аминокислот для крыс-отъемышей
.J. Nutr.
75
:61
—72
.102.Sauberlich
,H.E.
(1956
)Аминокислотный дисбаланс в отношении потребности в метионине, изолейцине, треонине и триптофане у крыс или мышей
.J. Nutr.
59
:353
—370
.103.Growdon
,J.H.
,Nader
,T. M.
,Schoenfeld
,J.
иWurtman
,R.J.
(1991
)l-1 — лечение позвоночника.
Clin. Neuropharmacol.
14
:403
—412
.104.Ярвенпяя
,A.-L.
,Рассин
,Д.K.
,Räihä
,N.C.R.
иGaull
,G. E.
(1982
)Количество и качество молочного белка у доношенных детей. II. Воздействие на кислотные и нейтральные аминокислоты
.Педиатрия
70
:221
—230
.105.Funk
,D. N.
,Worthington-Roberts
,B.
иFantel
,A.
(1991
)Влияние дополнительного лизина или триптофана на течение и исход беременности у крыс
.Nutr. Res.
11
:501
—512
.106.Chung
,T. K.
,Gelberg
,H. B.
,Dorner
,J. L.
иBaker
,D. H.
(1991
)J. Anim. Sci.
69
:2955
—2960
.107.Fregly
,M. J.
,Rowland
,N.E.
иSumners
,C.
(1989
)Влияние хронического диетического лечения l-триптофаном на спонтанный солевой аппетит крыс
.Pharmacol. Biochem. Behav.
33
:401
—406
.108.Wurtman
,R.J.
,Hefti
,F.
иMelamed
,E.
(1981
)Контроль предшественников синтеза нейротрансмиттеров
.Pharmacol. Ред.
32
:315
—335
.109.Schneider-Helmert
,D.
иSpinweber
,C. L.
(1986
)Оценка l-триптофана для лечения бессонницы: обзор
.Психофармакология (Berl.)
89
:1
—7
.110.Blauvelt
,A.
иFalanga
,V.
(1991
)Идиопатический и связанный с l-триптофаном эозинофильный фасциит до и после заражения l-триптофаном
.Arch. Дерматол.
127
:1159
—1166
.111.Alam
,SQ
,Rogers
,QR
иHarper
,AE
(1966
)Влияние триозина и треонина на свободные аминокислоты в плазме, печени, мышцах и глазах в крыса
.J. Nutr.
89
:97
—105
.112.Rich
,L. F.
,Beard
,M.E.
иОжоги
,R. P.
(1973
)Избыточный диетический тирозин и поражения роговицы
.Exp. Eye Res.
17
:87
—97
.113.Wurtman
,R.J.
(1986
)Стратегии разработки лекарств, которые могут быть полезны при когнитивных расстройствах
.Clin. Neuropharmacol.
9
(доп. 3
):S3
–S7.114.Arevalo
,R.
,Castro
,R.
,Palarea
,MD
иRodriguez
,M.
(1987
)беременных крыс вызывает введение тирозина стойкие изменения в поведении потомков мужского пола
.Physiol. Behav.
39
:477
—481
.115.Бенедикт
,К. Р.
,Андерсон
,Г.H.
&Sole
,M. J.
(1983
)Влияние перорального приема тирозина и триптофана на катехоламины плазмы у человека
.г. J. Clin. Nutr.
38
:429
—435
.116.Меламед
,E.
,Glaeser
,B.
,Growdon
,JH
иWurtman
,RJ
(1980
)Нормальные эффекты тирозина в плазме у людей тирозин и белковые продукты
.J. Neural Transm.
47
:299
—306
.117.Rasmussen
,D. D.
,Ishizuka
,B.
,Quigley
,M. E.
иYen
,S.S.C.
(1983
)Влияние проглатывания тирозина и триптофана на концентрацию катехоламинов в плазме и 3,4-дигидроксифенилуксусной кислоты
.J. Clin. Эндокринол. Метаб.
57
:760
—763
.118.Banderet
,L.E.
иLieberman
,H.R.
(1989
)Лечение тирозином, предшественником нейромедиатора, снижает экологический стресс у человека
.Brain Res. Бык.
22
:759
—762
.119.Menkes
,J. H.
,Welcher
,D. W.
,Levi
,H. S.
,Dallas
,J.
иGretsky
,N. E.
(1972
)Взаимосвязь повышенного уровня тирозина в крови с конечными интеллектуальными возможностями недоношенных детей
.Педиатрия
49
:218
—224
. 120.Mamunes
,P.
,Prince
,P. E.
,Thornton
,N. H.
,Hunt
,P. A.
иHitchcock
,E.S.
(1976
)Интеллектуальный дефицит после преходящей тирозинемии у доношенного новорожденного
.Педиатрия
57
:675
—680
.Сокращения
BCAA
аминокислота с разветвленной цепью
FNB
Совет по пищевым продуктам и питанию Института медицины
JECFA
Объединенный комитет экспертов ВОЗ / ФАО по пищевым добавкам
293 Отдел исследований в области наук о жизниMSG
© 2004 Американское общество диетологии
Индекс для характеристики природных и неприродных аминокислот для пептидомиметиков
Цитирование: Liang G, Liu Y, Shi B, Zhao J, Zheng J (2013) Индекс для характеристики природных и неприродных аминокислот для пептидомиметиков.PLoS ONE 8 (7): e67844. https://doi.org/10.1371/journal.pone.0067844
Редактор: Пермяков Евгений Александрович, Институт биологического приборостроения РАН, Российская Федерация
Поступила: 10 апреля 2013 г .; Принято: 22 мая 2013 г .; Опубликовано: 23 июля 2013 г.
Авторские права: © 2013 Liang et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана грантами проекта Фонда естественных наук Чунцинского CSTC (номер cstc2012gg-gjhz10003), Национального фонда естественных наук Китая (номер 10
9), Фонда фундаментальных исследований для центральных университетов (номер CDJZR11 23 00). 09 и номер CQDXWL-2012-129), а также Национальным научным фондом США (CAREER Award CBET-0952624 и CBET-1158447). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Проф. Цзе Чжэн, как один из авторов-корреспондентов этой рукописи и академический редактор PLOS ONE, не заявляет об отсутствии конфликта интересов. Это не влияет на соблюдение авторами всех политик PLOS ONE в отношении обмена данными и материалами.
Введение
Природные биоактивные пептиды, такие как амилоидные пептиды, антимикробные пептиды, пептиды клеточного проникновения и гибридные пептиды, играют различные биологические роли (например,грамм. гормоны, субстраты и ингибиторы ферментов, нейротрансмиттеры, лекарства и антибиотики, а также строительные блоки самосборки) в регуляции различных биологических процессов и метаболизма [1] — [3]. Из-за пептидной природы большинство этих природных пептидов страдают низкой биодоступностью и низкой протеолитической стабильностью, что значительно ограничивает их применение in vitro и in vivo. Для устранения этих ограничений использование существующих пептидов в качестве структурных матриц и подходов к высокопроизводительному скринингу вместе с комбинаторной библиотекой и химическим синтезом аналогов широко использовались для поиска методом грубой силы и систематического создания новых стабильных и активных пептидных миметиков [4].Такие подходы позволяют (i) исследовать обширную популяцию разнообразных химических и биохимических последовательностей из других семейств белков / пептидов для увеличения разнообразия последовательностей и (ii) вводить неприродные, D-аминокислоты или β-аминокислоты для улучшения протеолитических устойчивость [5], [6]. Полученные мощные пептидные миметики обычно имеют структуру основной цепи, аналогичную их исходным пептидным матрицам, но с изменением ключевых функциональных остатков для улучшения биологических или физико-химических свойств, метаболической стабильности, а также разнообразия последовательностей и доступности [7].
Подходы клеточного фага и зеркального фага в сочетании с генетикой мутаций представляют собой мощные высокопроизводительные методы для скрининга и идентификации активных пептидов и для создания комбинаторных синтетических пептидных библиотек. Эти подходы позволили получить ряд одобренных FDA препаратов на основе пептидов, включая ингибиторы АПФ, ингибиторы протеазы ВИЧ и противораковые иммунотерапевтические средства [3], [8]. Другой распространенный подход к дизайну с использованием структурной помощи заключается в замене отдельных аминокислот неприродными аминокислотами или специфическими структурными мотивами для итеративной оптимизации дизайна [7], [9].Включение неприродных аминокислот (например, изостерических замен, производных циклических пептидов и суррогатов связей) [10] и / или конкретных структурных мотивов (например, β-поворот, спирали и β-листы) [11] в Ожидается, что миметики первого поколения будут вызывать конформационные изменения скелета и / или боковых цепей и, таким образом, давать благоприятные связывания с мишенями. Поскольку процесс разработки непрерывно переходит к следующим поколениям, варианты амина, длины боковых цепей и конформационные ограничения могут быть дополнительно оптимизированы для достижения желаемой активности.Однако, учитывая большое количество неопределенных соединений и ограниченные возможности синтеза / очистки / характеризации с помощью экспериментов, практически невозможно провести крупномасштабный поиск как последовательностей, так и структур в полном пространстве последовательностей [12]. Кроме того, такие грубые и дорогостоящие методы проверки были бы утомительными, подверженными экспериментальным ошибкам и требовали огромных затрат. Что еще более важно, эти экспериментальные подходы к скринингу предоставляют мало информации о структуре и связывании сконструированных пептидов, что часто приводит к нерациональному дизайну и множеству неактивных соединений.
Дополнение к экспериментальным подходам к скринингу, вычислительные методы виртуального скрининга, включая количественное соотношение структура-активность (QSAR) и молекулярный докинг, предоставляют ценные альтернативы для быстрого скрининга и выбора эффективных соединений. Что еще более важно, методы вычислительного скрининга стремятся проиллюстрировать структурную, динамическую и связывающую информацию на атомарном уровне, что делает это необходимым для лучшего понимания взаимосвязи последовательность-структура-активность и принципов разработки пептидных миметиков.QSAR в настоящее время вносит важный вклад в рациональную разработку лекарств, материалов, катализаторов и белков / пептидов с желаемой активностью и функциями [13] — [17]. Лежащий в основе гипотетический принцип моделей QSAR заключается в определении математических отношений между набором молекулярных дескрипторов и заданной активностью (химической, физической или биологической активностью) в качестве конечной точки для прогнозирования активности неизвестных лигандов [18] — [29] . В последние десятилетия был разработан ряд моделей 2D-QSAR для пептидов [14], [22], [24], [30] — [32].Большинство моделей 2D-QSAR используют локальные дескрипторы, например структурные параметры и параметры свойств, ортогональные двоичные коды, основные свойства и т. д. для последовательной характеристики последовательности и двумерной химической структуры пептидов на основе их аминокислотного состава и положений. Анализ главных компонентов и факторный анализ часто используются для извлечения полезной структурной информации из исходной матрицы параметров аминокислот. Как фактические пространственные структурные особенности (например, изотропная площадь поверхности, доступная для растворителя площадь поверхности, индекс электронного заряда, вторичная структурная населенность и т. Д.) лигандов хорошо охарактеризованы [20], [33], методы 3D-QSAR (например, CoMFA и CoMSIA) [34] — [36], как правило, лучше предсказывают при конструировании лигандов, чем методы 2D-QSAR. Однако в большинстве случаев трехмерные атомные структуры лигандов в наборе данных часто недоступны экспериментально; таким образом, моделирование структурной гомологии необходимо для прогнозирования трехмерных структур для конформационного выравнивания и структурной параметризации. Из-за отсутствия надежных трехмерных структур лигандов или неверно представленных биоактивных конформеров, в нескольких исследованиях сообщалось, что двумерные дескрипторы, при правильном выборе, на самом деле превосходят трехмерные [37] — [39].Кроме того, многомерные модели QSAR обычно требуют больше структурной информации для построения взаимосвязи структура-активность, например конформационный профиль лигандов для 4D-QSAR [40], индуцированный рецептором режим соответствия для 5D-QSAR [41] и сольватационная модель для 6D-QSAR [42]. По сравнению с этими многомерными моделями QSAR, дескрипторы 2D-QSAR могут быть более удобными для интерпретации некоторых ключевых структурных особенностей небольших лигандов, не требуя более неопределенных конформаций.
Быстрое развитие и значительный прогресс были достигнуты в разработке различных моделей QSAR для получения более активных пептидов и лучшего понимания механизма их действия.Однако большинство существующих методов QSAR для дизайна пептидов сосредоточены на характеристике природных аминокислот, но уделяют меньше внимания неприродным аминокислотам [31], [32]. С одной стороны, неадекватные данные о неприродных аминокислотах обеспечивают довольно ограниченный выбор структурных модификаций и делают неопределенность прогностических характеристик. С другой стороны, недавний прогресс позволяет одновременно кодировать сотни различных неприродных сайдчейнов в одном и том же организме [43]. Другой важный прогресс заключается в том, что недавно созданная база данных SwissSidechain [44] содержит молекулярные и структурные данные для 210 боковых цепей неприродных альфа-аминокислот как в L-, так и в D-конформации.Тем не менее, до сих пор остается очень сложной задачей точное описание неприродных аминокислот с помощью моделей QSAR.
В нашей предыдущей работе [24] мы разработали новый индекс 2D-QSAR шкал факторного анализа обобщенной информации об аминокислотах (FASGAI) для характеристики природных пептидов. Метод FASGAI объединяет 335 физико-химических свойств каждой из 20 природных аминокислот в 6 факторов: гидрофобность, альфа и склонность к повороту, объемные свойства, композиционные характеристики, локальную гибкость и электронные свойства, которые обычно можно использовать для характеристики любого данного пептида.Метод FASGAI успешно предсказал активность различных пептидов, включая ингибирующую активность протеазы ВИЧ типа 1 [45], аффинность связывания между доменами Sh4 амфифизина-1 человека и сконструированными лигандами [46], а также между MHC класса I и связывающие пептиды [14]. Чтобы продолжить разработку пептидных миметиков, здесь мы разработали новую структурную матрицу, Индекс природных и неприродных аминокислот (NNAAIndex), чтобы систематически охарактеризовать в общей сложности 155 физико-химических свойств 22 природных и 593 неприродных аминокислот.Затем мы разработали различные модели QSAR для создания имитаторов пептидов для трех различных классов дипептидов с горьким вкусом (BTD), ингибиторов ангиотензинпревращающего фермента (ACE) и неорганических связывающих пептидов со специфической активностью in silico.
Материалы и методы
NNAA Индексная характеристика
Мы сначала вычислили в общей сложности 384 физико-химических свойства 22 природных аминокислот и 593 неприродных аминокислот (http://www.sigmaaldrich.com/chemistry/) с использованием программ E-dragon [47] и MOE [48].Затем мы применили предварительный исследовательский факторный анализ для количественной оценки воспринимаемых структурных особенностей, который помогает идентифицировать 155 из 384 свойств, включая топологические дескрипторы, физические свойства, разделенные площади поверхности, связность Кир и Холла и индексы формы Каппа, характеристики фармакофоров, частичный заряд, площадь поверхности. , объем и форма, конформационно-зависимый заряд, геометрические дескрипторы и т. д., чтобы охарактеризовать ключевые структурные особенности 615 аминокислот. Среди 155 свойств некоторые из них могут быть связаны или взаимно коррелированы.Таким образом, чтобы улучшить интерпретируемость данных, был использован метод главных компонент с нормализованным алгоритмом Кайзера promax для идентификации и кластеризации подмножества числовых переменных для отображения всей совокупности 155 сильно взаимосвязанных физико-химических свойств. Метод факторного анализа позволил получить 6 новых факторных оценок, на которые приходится около 82,70% дисперсии 155 переменных на основе взаимосвязи между номером компонента и собственными значениями. 6-факторные векторы, названные NNAAIndex, составляют большую часть структурной информации о 155 свойствах, поэтому их можно использовать для представления структурных особенностей пептидов.Поскольку каждая природная или неприродная аминокислота представлена 6 факторами NNAAIndex, последовательность и структурные особенности любого пептида можно охарактеризовать простым построением матрицы NNAAIndex размером 6 × n , где n — количество аминокислот.
Выбор конструктивных элементов
Генетический метод частичных арифметических наименьших квадратов (GA-PLS) [49] был использован для выбора переменных, связанных с их структурными атрибутами изучаемых пептидов. В GA-PLS хромосома и ее приспособленность к виду соответствовали набору переменных и внутренней предсказательной способности производной модели PLS соответственно.Пригодность каждой хромосомы оценивается внутренней предсказательной способностью модели PLS, полученной из двоичного битового шаблона. Внутренняя прогностическая эффективность модели выражается квадратом перекрестной проверки совокупного значения множественного коэффициента корреляции ( R 2 ) (обозначается Q 2 ) и подтверждается методом исключения одного выхода (LOO). процедура выглядит следующим образом: (1) где y i и представляет наблюдаемое значение и прогнозируемое значение зависимой переменной, соответственно; — среднее наблюдаемое значение зависимой переменной; n — общее количество выборок.Эмпирические параметры в методе GA-PLS были установлены следующим образом: количество популяций — 200, максимальное количество поколений — 200, разрыв между поколениями — 0,8, частота кроссовера — 0,5, частота мутаций — 0,005.
Частично наименьшие квадраты (PLS)
Для проверки прогнозной статистической модели использовалась регрессия PLS для корреляции вариаций биологической активности с вариациями в соответствующих дескрипторах для данного набора данных. PLS особенно хорошо подходит для анализа биологических данных, поскольку алгоритм может обрабатывать зашумленные или коллинеарные сигналы [50] — [53].В регрессии PLS матрица независимых переменных регрессировала по зависимой матрице, как описано ниже. Оптимальное количество главных компонентов (ПК), соответствующее наименьшей стандартной ошибке прогноза, было определено с помощью процедуры перекрестной проверки LOO, которая дает перекрестную проверку Q 2 для измерения предсказуемости модели PLS. Используя оптимальное количество ПК, был проведен окончательный анализ PLS без перекрестной проверки для создания прогнозной модели QSAR с обычным R 2 .Алгоритм регрессии PLS состоит из внешнего отношения (блоки X и Y по отдельности) и внутреннего отношения, связывающего блоки X и Y: (2) (3) где скрытые переменные t и u коррелированы посредством внутреннего отношения приведенный ниже, который приводит к оценке y из x . (4)
Линейный дискриминантный анализ (LDA)
LDA реализует процесс классификации объектов в соответствии с множеством наблюдаемых образцов.Основная теория LDA заключается в классификации зависимых путем разделения n-мерного пространства дескрипторов на две области (два класса), которые разделены гиперплоскостью, определяемой линейной дискриминантной функцией следующим образом: Y = a 0 + a 1 X 1 + a 2 X 2 +… + a n X n , где Y — зависимая переменная, X 1 , X 2 ,… X n представляет независимая переменная (наблюдаемые значения), a 1 , a 2 ,… a n соответствует весам, связанным с соответствующей независимой переменной, которая является дискриминантными коэффициентами.Пространство независимых переменных разделено на две области через гиперплоскость, чтобы затем различать, к какой области принадлежит каждое соединение. В качестве входных данных модели LDA переменные выбираются в соответствии со значением F частичного теста F, т.е. переменная принимается моделью, когда значение F больше 3,84, но отклоняется, когда значение F меньше 2,71.
Результаты и обсуждение
Физико-химическое представление модели индекса NNAA
Общепринято для догмы Анфинсена, что нативные структуры и биологические функции пептидов или белков определяются их первичными аминокислотными последовательностями [54].Здесь мы сначала выбрали в общей сложности 155 свойств, включая топологические дескрипторы, физические свойства, разделенные площади поверхности, связность Кьера и Холла и индексы формы Каппа, характеристики фармакофоров, частичный заряд, площадь поверхности, объем и форму, конформационно-зависимый заряд, геометрические дескрипторы. и др., чтобы охарактеризовать структурные особенности 615 неприродных аминокислот. Учитывая, что большая матрица, содержащая много избыточной информации, не подходит для характеристики структурных свойств и свойств последовательности пептидов и белков, мы использовали алгоритм promax с нормализацией Кайзера для дальнейшей кластеризации 155 переменных на 6 независимых факторов.6 оценок факторов (таблица S1) составили около 82,70% структурной информации по 155 переменным.
Чтобы изучить физико-химический смысл 6 факторов, мы суммировали нагрузку и общность 155 переменных в таблице 1. Первый фактор обозначен как геометрический индекс. Параметры, относящиеся к 3D-индексу Винера, индексу типа Винера из взвешенной по электроотрицательности матрицы расстояний и взвешенной по Z матрицы расстояний, гиперобходного индекса, молекулярного топологического индекса Гутмана, централизации, индекса D / D, молекулярного топологического индекса Шульца, индекса Винера W. , так далее., производят положительную нагрузку на первый фактор; в то время как параметры, связанные с логарифмом растворимости в воде, индексом степени складчатости, массовой плотностью, общим индексом связности структуры, сферностью, индексом типа Балабана на основе электроотрицательности и взвешенной по массе матрицей расстояний и т. д., имеют отрицательную нагрузку на этот фактор.
Второй фактор в основном представляет собой индекс Н-облигаций. Параметры, например Емкость донора водородной связи, гидрофильный объем, гидрофильно-липофильный, количество донорных и акцепторных атомов водородной связи и т. Д.иметь большие положительные коэффициенты нагружения; а параметры, например log коэффициента распределения октанол / вода (включая неявные водороды), коэффициента распределения октанол-вода Гхоша-Криппена и Моригучи (logP), асферичности, числа гидрофобных атомов, приближения к сумме площадей поверхности гидрофобных атомов VDW, энергии сольватации , шероховатость поверхности, ван-дер-ваальсовый компонент потенциальной энергии, индекс ароматичности и т. д. имеют большие отрицательные коэффициенты нагрузки.
Третий фактор — это индекс связности, который представляет собой набор различных дескрипторов, связанных с размером, формой и ветвлением молекул.Как правило, чем больше индекс связности, тем больше соответствующий размер молекулы и разветвленность. Здесь третий фактор относится к переменным с высокими положительными коэффициентами гармонического топологического индекса Наруми, геометрического топологического индекса Наруми, индекса степени сворачивания, индекса формы пути / пути 5-рандического, квадратичного индекса, простого топологического индекса Наруми (log), все- индекс Винера пути, индекс ненасыщенности, индекс ароматичности и т. д. И наоборот, третий фактор также включает переменные с большими отрицательными коэффициентами нагрузки на центральном индексе Балабана, индексе 3D-Балабана, индексе связи расстояния Балабана, топологическом индексе связности Балабана, индексе типа Балабана из матрицы взвешенных расстояний и т. д.
Четвертый фактор относится к показателю доступной площади поверхности. Он в основном представляет собой доступную для воды площадь поверхности всех полярных атомов, доступную для воды площадь поверхности всех атомов с отрицательно и положительно частичными зарядами, взвешенную по заряду площадь поверхности, дипольный момент, рассчитанный на основе частичных зарядов молекулы и т. Д. Переменные изменяются обратно пропорционально величине. количество донорных атомов водородных связей, приближение к сумме площадей поверхности VDW доноров водородных связей, поперечная потенциальная энергия растяжения-изгиба связи, сферность, индекс ароматичности, гидрофильный фактор, самая низкая гидрофобная энергия, доступная для воды площадь поверхности всех гидрофобных атомы и т. д.
Пятый фактор относится к индексу интегральных моментов, который измеряет дисбаланс между центром масс молекулы и положениями гидрофильных или гидрофобных областей вокруг центра масс. Параметры с относительно большой положительной нагрузкой на пятый фактор включают момент гидрофобной интеграции, амфифильный момент, момент гидрофильной интеграции и момент гидрофобной интеграции и т.д .; в то время как параметры с относительно большой отрицательной нагрузкой включают логарифм коэффициента распределения октанол / вода, емкость доноров водородных связей, гидрофильный объем, приближение к сумме площадей поверхности VDW чистых доноров водородных связей и т. д.
Шестой фактор связан с индексом объема и формы. Параметры с положительным вкладом в шестой фактор включают в себя сумму сферности, сферности, индекса среднеквадратичного расстояния, центрического индекса срезания, эксцентрика, радиально-центрического информационного индекса, пролета R, 3-лучевого индекса формы с альфа-изменением Кира, индекса степени складывания, и средний эксцентриситет и т.д .; в то время как параметры с отрицательным вкладом в шестой фактор — это квадратичный индекс, индекс ветвления, донорная способность водородных связей, гидрофильный объем, число полярности, гравитационный индекс G1, максимальная электротопологическая положительная вариация и т. д.
В совокупности, как только были определены баллы 6 факторов индекса NNAA (т.е. геометрические характеристики, водородная связь, связность, доступная площадь поверхности, индекс интегральных моментов, а также объем и форма) для 615 аминокислот, эти баллы можно использовать для характеристики структурные особенности любого пептида для прогнозирования и конструирования новых пептидов с желаемой активностью наряду с другими методами моделирования. Как показано в таблице 1, среднее значение общности для 146 из 155 переменных составляет ∼0.929 и большинство значений общности больше 0,8, за исключением 9 переменных, например Путь / шаг 5-рандового индекса формы, приближение к сумме площадей поверхности VDW чистых доноров водородных связей, приближение к сумме площадей поверхности VDW атомов, обозначенных как «другие», потенциальная энергия углового изгиба, момент гидрофобной интеграции, гидрофильная интеграция момент, сферность, асферичность, индекс степени складчатости. Это указывает на то, что большинство переменных хорошо представлены всеми факторами вместе с высокой степенью надежности.
Корреляция и разница между шестью факторами индекса NNAA
Из-за пептидной природы может существовать определенная корреляция между различными атрибутами природных аминокислот и неприродных аминокислот. В качестве наклонного решения здесь мы использовали алгоритм promax с нормализацией Кайзера, чтобы повернуть коэффициенты для улучшения способности интерпретации полученных факторов. Коэффициенты корреляции между 6 факторами сведены в Таблицу 2. Можно видеть, что большинство корреляций демонстрируют слабую или независимую друг от друга зависимость, о чем свидетельствуют очень маленькие значения корреляции <0.4. Однако между геометрическими характеристиками (первый фактор) и коэффициентом объема и формы (шестой фактор) наблюдалась относительно значимая величина взаимной корреляции 0,382. Это неудивительно, ведь объем и форма частично отражают геометрические характеристики.
Характеризационные способности 6-ти факторных оценок для 22 природных аминокислот оценивали с помощью 2- и 3-мерного распределения 22 природных аминокислот по первым 2 и первым 3 факторам (рис. 1), соответственно.Можно видеть, что 22 аминокислоты распределены по-разному в зависимости от гидрофобности (полярности), размера и электростатического заряда, например геометрическая оценка первого фактора Gly была меньше, чем у других аминокислот, просто потому, что Gly является единственной аминокислотой без боковой цепи, что, вероятно, минимизирует потенциальные стерические препятствия при взаимодействии с другими аминокислотами. Вторым отличительным признаком была Pro, циклическая аминокислота, которая может легко образовывать амидную связь с карбоксильными группами других аминокислот, в результате чего образуется цис-пептидная связь, которая может влиять на ее стабильность и стерическую конформацию.Это просто из-за замечательной характеристики, что Pro далек от других аминокислот, как показано на рисунке 1.
Рисунок 2 показывает, что распределение баллов каждого фактора NNAAIndex как для 22 природных аминокислот, так и для 593 неприродных аминокислот. Распределение баллов разброса 593 неприродных аминокислот могло хорошо охватывать 22 природные аминокислоты, что указывает на то, что пептидные миметики могут быть специфически получены путем структурной модификации неприродными аминокислотами. После установления 6-ти факторных оценок мы можем применить метод NNAAIndex для разработки трех прогностических моделей QSAR для разработки имитаторов пептидов для трех различных типов BTD, ингибиторов АПФ и неорганических связывающих пептидов, как показано ниже.
Рисунок 2. Разница 22 природных аминокислот и 593 неприродных аминокислот по каждому фактору.
A, B, C, D, E и F — это разница геометрических характеристик, водородной связи, связности, доступной площади поверхности, индекса интегральных моментов, а также объема и формы, соответственно.
https://doi.org/10.1371/journal.pone.0067844.g002
Модель NNAAIndex QSAR для BTD
Вкус, который часто подразделяется на четыре типа: сладкий, горький, соленый и кислый, играет очень важную роль у всех млекопитающих.Среди них горький вкус и чувствительность помогают защитить людей и организмы от вредного воздействия токсичных веществ [19]. Набор данных, содержащий 48 дипептидов с горьким вкусом (BTD) [55], который широко использовался для тестирования нового метода структурной характеристики во многих различных моделях QSAR [18] — [27], был использован для обучения модели NNAAIndex QSAR. Всего 12 независимых структурных дескрипторов для каждого BTD были определены с использованием шкал NNAAIndex, в то время как активность этих BTD была выражена отрицательным логарифмом пороговых концентраций горького вкуса (pT) в качестве конечной точки [20] (Таблица S2 ).Для построения модели QSAR с использованием регрессии PLS использовались 12 дескрипторов на основе структур и 1 конечная точка на основе активности. Прогностическая эффективность модели QSAR NNAAIndex была измерена с помощью процедуры перекрестной проверки LOO, а затем сравнена с другими 13 различными методами 2D- и 3D-QSAR, включая z-шкалы [18], ISA-ECI [20], MS-WHIM. [21], FASGAI [24], SZOTT [26] и т. Д. Для достижения объективного сравнения мы использовали один и тот же набор обучающих данных и методы моделирования для всех моделей QSAR. Окончательные значения R 2 , Q 2 и среднеквадратичной ошибки ( RMS ) приведены в таблице 3.Результаты показали, что модель NNAAIndex / PLS (запись 14) достигла удовлетворительных значений R 2 = 0,863 и Q 2 = 0,765. Результаты модели NNAAIndex / PLS сопоставимы или даже превосходят результаты, сообщаемые большинством методов 2D- / 3D-QSAR / PLS (Таблица 3). После удаления 7 избыточных переменных с помощью алгоритма GA прогнозный Q 2 модели GA-PLS (запись 15) был улучшен с 0,765 (запись 14) до 0,830 на ∼8.5%. В целом, разные подходы к моделям PLS и GA-PLS показывают хорошую и последовательную предсказуемость. Дальнейшее сравнение значений Q 2 для всех моделей QSAR ясно показывает, что наши модели QSAR NNAAIndex работают лучше, чем большинство существующих моделей 2D и 3D-QSAR с использованием 1 или 2 ПК.
Для дальнейшей проверки способности NNAAIndex к характеристике мы использовали кластерный анализ k -means [56], чтобы разделить 48 BTD на две группы. Образцы каждой группы были отсортированы от низкой до высокой активности.24 нечетных образца (то есть первая, третья, пятая и т. Д.) В каждой группе были отобраны для построения обучающего набора, который использовался для построения модели QSAR. 24 четных образца (т.е. второй, четвертый, шестой и т. Д.) В качестве тестового набора использовались для проверки внешних прогностических характеристик модели QSAR. Таблица 3 показывает, что Q 2 и RMS для внутренней проверки составили 0,772 и 0,198 (запись 16), соответственно, в то время как R 2 и RMS для внешней проверки ( Q 2 доб ) были 0.806 и 0,180 соответственно. Хотя R 2 0,898 в NNAAIndex / GA-PLS было немного меньше, чем R 2 0,936 в FASGAI / GA-PLS, Q 2 и Q 2 ext в NNAAIndex / GA-PLS были больше, чем в FASGAI / GA-PLS ( Q 2 = 0,761 и Q 2 ext = 0,797 [24]), что указывает на то, что NNAAIndex / Модель GA-PLS обладает удовлетворительной внешней предсказательной способностью.
Мы также выполнили тест перестановки ответов (т. Е. Y-рандомизационный ответ), чтобы оценить надежность модели NNAAIndex QSAR. На рисунке 3 показаны результаты перестановки ответов с помощью тестов на 50 случайных перестановок для модели GA-PLS. Пересечения линий регрессии R 2 — и Q 2 с осью ординат составили -0,026 и -0,183, соответственно, что было ниже пределов R 2 <0,300 и Q 2 <0.050 [57]. Это явное свидетельство того, что на нашу модель не влияет какая-либо случайная корреляция, то есть вероятность получить аналогичную или лучшую модель с использованием случайных чисел равна нулю, и она, вероятно, будет отображать истинную линейную связь между дескрипторами NNAAIndex и значениями pT.
Рис. 3. График проверки 50 случайных перестановок для модели BTD GA-PLS.
Пересечения линий регрессии R 2 — и Q 2 с осью ординат равны −0.026 и -0,183, что ниже пределов R 2 <0,300 и Q 2 <0,050 соответственно.
https://doi.org/10.1371/journal.pone.0067844.g003
На рисунке S1 показаны центрированные и масштабированные коэффициенты модели GA-PLS, которые используются для описания степени влияния 5 независимых переменных (индекс интегральных моментов объем и форма первого остатка, геометрические характеристики, Н-связь и индекс интегральных моментов второго остатка) на активность BTD.Положительное значение коэффициента указывает на то, что переменная предпочитает улучшать BTD-активность, а — наоборот, для отрицательного значения. На рисунке S1 ясно видно, что 5-я, 6-я, 7-я и 11-я переменные, соответствующие индексу интегральных моментов, а также объему и форме первого остатка, геометрическим характеристикам и индексу интегральных моментов второго остатка, имеют положительные коэффициенты, в то время как только 8-я переменная, соответствующая индексу Н-связи второго остатка, имеет отрицательный коэффициент.
Чтобы сделать возможным рациональный дизайн новых пептидомиметиков с высокой чувствительностью к горькому вкусу, мы разработали собственную программу на C ++ для отображения предпочтений аминокислот в различных положениях последовательности на основе коэффициентов GA-PLS (рисунок S1), а также оценок 615 аминокислот (Таблица S1). Чтобы получить пептидомиметики BTD с более высокой прогностической активностью, мы альтернативно выбрали первую аминокислоту с оценкой как интегральных моментов, так и объема и формы больше 2,0, вторую аминокислоту с оценкой геометрических характеристик и интегральных моментов больше 2.0 и Н-связь меньше -0,5. Эта стратегия дизайна привела к 1178 новым молекулам с высокой прогностической активностью, и 613 из 1178 новых пептидомиметиков (Таблица S3) достигли более высокой предсказательной активности, чем 48 обучающих пептидов.
В качестве подтверждения концепции на рисунке 4 показано, что 3 различных миметика BTD (а именно 206-108, 206-439 и 206-206) обладают потенциально высокой активностью. Все эти три пептида были получены из дипептида (WW) путем замены первого остатка 206-й неприродной аминокислотой и второго остатка 108-й, 439-й или 206-й неприродной аминокислотой соответственно.Согласно взаимосвязи между переменными и активностью BTD, как обсуждалось выше, индекс интегральных моментов первого остатка, геометрические характеристики и индекс интегральных моментов второго остатка положительно влияют на активность BTD. Интегральные моменты, объем и индекс формы 206-й молекулы составили 4,692 и 4,202 (таблица S1), что является наибольшим значением для всех 615 аминокислот, соответственно. Геометрические характеристики 106-й, 437-й и 206-й молекулы также были относительно большими.Сравнивая со структурой WW, мы наблюдали, что активность 3 недавно разработанных имитаторов пептидов была значительно улучшена за счет замены двух природных остатков на неприродные остатки, что должно быть подтверждено в будущих экспериментах.
Рис. 4. Недавно разработанные пептидные миметики для BTD.
Сорок шестой образец в обучающей выборке, WW, рассматривается как шаблон для конструирования молекул. Активность WW, 206-108, 206-439 и 206-206 составляет 3,60, 9,78, 9,20 и 9,17 соответственно.
https://doi.org/10.1371/journal.pone.0067844.g004
Модель NNAAIndex QSAR для ингибиторов АПФ
Ингибиторы ангиотензинпревращающего фермента (АПФ) уже более 30 лет используются для лечения сердечно-сосудистых заболеваний. Помимо антигипертензивного действия, ингибиторы АПФ в настоящее время также широко используются при застойной сердечной недостаточности, остром инфаркте миокарда и диабетической нефропатии [58]. Однако терапия ингибиторами АПФ может также вызывать некоторые побочные эффекты, включая сухой кашель [59] и активацию ренин-ангиотензиновой системы [60].Чтобы оценить взаимосвязь между структурой и активностью ингибиторов АПФ, для построения второй модели NNAAIndex QSAR для разработки новых ингибиторов АПФ был использован набор данных из 58 дипептидов ингибиторов АПФ, как сообщили Collantes и Dunn [20]. Этот набор данных часто использовался в качестве набора моделей для тестирования и подтверждения производительности различных моделей QSAR [18] — [22], [24], [28], [29]. В этом наборе данных дипептидные последовательности характеризовались 12 баллами NNAAIndex (т.е. каждая аминокислота — 6 баллами NNAAIndex), при этом значения p IC 50 варьировались от 1.От 77 до 5,80 в качестве конечной точки. Структуры и биоактивность для 58 ингибиторов дипептидов АПФ суммированы в таблице S4. Чтобы проверить прогностическую эффективность нашего метода NNAAIndex, мы собрали статистику моделирования из других 11 различных моделей QSAR для сравнения (таблица 4). Анализ PLS с перекрестной проверкой LOO привел к R 2 = 0,749 и Q 2 = 0,719 с использованием 2 ПК, которые были сопоставимы со значениями других методов QSAR / PLS в таблице 4.Для дальнейшего повышения качества модели NNAAIndex мы использовали GA для удаления некоторых избыточных дескрипторов, что привело к улучшению как R 2 = 0,803, так и Q 2 = 0,779 (запись 13, таблица 4). В соответствии с моделью NNAAIndex для BTD, как описано выше, количество компьютеров, используемых в анализе PLS, влияет на качество моделей QSAR. Похоже, что минимальное количество ПК дает оптимальные результаты за счет минимизации переобучения данных в процессе обучения модели.
Таблица 4 показывает, что модель NNAAIndex / GA-PLS имела относительно более высокий Q 2 , чем модель NNAAIndex / PLS. Кроме того, модель Q 2 модели NNAAIndex / GA-PLS была просто меньше, чем 3D-HoVAIF [28] как подход к трехмерной структурной характеристике и Т-шкала [29] как подход к топологически структурной характеристике. Это может дать некоторые подсказки для улучшения характеристик модели NNAAIndex с учетом трехмерной структурной и / или другой топологической информации в нашей будущей работе.
Следуя тому же методу для проверки возможности характеризации набора данных BTD, мы поровну разделили 58 ингибиторов АПФ на 29 обучающих образцов для разработки модели QSAR и оставшиеся 29 тестовых образцов для проверки модели QSAR с использованием индекса NNAAIndex / GA-PLS. Q 2 = 0,832 и RMS = 0,369 для внутренней проверки и Q 2 ext = 0,731 и RMS = 0,500 для внешней проверки, соответственно, что дополнительно подтверждает, что внешняя прогностическая способность нашей модели NNAAIndex / GA-PLS превосходит модель FASGAI / GA-PLS, ранее разработанную нашей группой ( Q 2 ext = 0.706) [24].
Модель NNAAIndex была дополнительно проверена с использованием теста перестановки ответов, который был выполнен путем перестроения моделей с использованием рандомизированных действий обучающего набора с последующей оценкой статистики модели. Этот тест был повторен 50 раз, чтобы получить надежную статистику устойчивости модели. На рисунке 5 показано, что точки пересечения R 2 и Q 2 составили 0,029 и -0,270 соответственно. Это указывает на очень низкую вероятность случайной корреляции ( p <0.001), что подтверждает достоверность модели. На рисунке S2 показаны коэффициенты регрессии GA-PLS для 8 переменных. Две переменные 7 и 9, соответствующие геометрическим характеристикам и связанности второго остатка, соответственно, имели большие положительные коэффициенты регрессии. И наоборот, две переменные 3 и 10, которые представляют связность первого остатка и доступную для растворителя площадь поверхности второго остатка, соответственно, показали большие отрицательные коэффициенты. Другие 4 переменных, соответствующие геометрическим характеристикам, Н-связи, доступной площади поверхности первого остатка и Н-связи второго остатка, по-видимому, оказывают незначительное влияние на ингибирующую активность АПФ.
Рис. 5. График проверки 50 случайных перестановок для модели ингибиторов АПФ GA-PLS.
Пересечения линий R 2 — и Q 2 — с осью ординат составляют 0,029 и -0,270, что ниже пределов R 2 <0,300 и Q 2 <0,050 соответственно.
https://doi.org/10.1371/journal.pone.0067844.g005
На основе предпочтительных переменных в модели GA-PLS и оценок аминокислот на рисунке S2, всего 616 мощных пептидных миметиков АПФ Были разработаны ингибиторы, и их ингибирующая активность была оценена с помощью модели GA-PLS.В общей сложности 205 из 616 пептидов показали более высокую ингибирующую активность, чем у 58 пептидов в обучающей выборке (Таблица S5). На рис. 6 показаны три новых пептидных имитатора ингибиторов АПФ с высокой прогностической активностью. Активность ингибиторов АПФ имеет отрицательную корреляцию с индексом связности первого остатка, т.е. чем меньше значение, тем выше активность. Первый остаток дипептида (VW) заменяется 512-й молекулой с наименьшим индексом связности -4,006 среди всех аминокислот.При сравнении индекс связности 512-й молекулы значительно меньше, чем у остатка W (1,454) (таблица S1), а боковая цепь 512-й молекулы имеет несколько бензольных колец, что может привести к сложным пространственно-геометрическим характеристикам и молекулярным характеристикам. разветвление как отражение связности. Таким образом, ожидается, что мутант 512-W имеет более высокую ингибирующую способность. Геометрические характеристики второго остатка положительно коррелируют с биологической активностью ингибиторов АПФ.Второй остаток был заменен отдельно на 439-ю, 534-ю или 524-ю молекулу, геометрические показатели которых составляют 5,484, 3,388 и 3,233 соответственно. Следует отметить, что, хотя геометрические оценки 439-й, 534-й или 524-й молекулы не являются наибольшими в факторных оценках всех 615 аминокислот, новые разработанные молекулы (512-439, 512-534 и 512-524) занимают первое место. в качестве трех лучших кандидатов во всех 205 разработанных ингибиторах АПФ вместе с модификацией молекулы 510 по первому остатку, что позволяет предположить, что мутации с одним остатком недостаточно для обеспечения повышенной активности ингибиторов АПФ.
Рисунок 6. Недавно разработанные пептидные миметики для ингибиторов АПФ.
Первый образец в обучающем наборе, VW, рассматривается как шаблон для конструирования молекул. Активность VW, 512-439, 512-534 и 512-524 составляет 5,80, 8,33, 8,04 и 8,04 соответственно.
https://doi.org/10.1371/journal.pone.0067844.g006
Большой интерес представляет скрининг и изучение того, обладают ли некоторые дипептиды, полученные из полного пространства последовательностей, активностями ингибирования как BTD, так и ACE.Если какая-либо последовательность обладает двойной предсказанной активностью в отношении ингибирования БТД и АПФ, эта последовательность, вероятно, будет служить в качестве многообещающего фармацевтического ведущего соединения для экспериментальных испытаний. Для этого мы использовали модель NNAAIndex / GA-PLS для прогнозирования новых 436 (426) дипептидов, которые исключают 48 (58) последовательностей в обучающем наборе BTD (ингибитор АПФ) из полного пространства дипептидных последовательностей, состоящего из 484 последовательностей, для их активность BTD (таблица S6) или активность ингибирования ACE (таблица S7) отдельно. Однако результаты показали, что предсказанные значения pT для 436 дипептидов с использованием модели BTD NNAAIndex / GA-PLS были ниже, чем у 46-й выборки (WW) с относительной наибольшей активностью во всех 48 обучающих выборках BTD.Аналогичным образом, предсказанные значения pIC 50 для 426 дипептидов с использованием модели ингибиторов АПФ NNAAIndex / GA-PLS были ниже, чем у 1-го образца (WW) с относительной наибольшей активностью во всех 58 обучающих образцах ингибиторов АПФ. Более того, мы наблюдали, что активности разработанных пептидомиметиков для BTD и ингибиторов АПФ были значительно выше, чем активности разработанных пептидов с кодированными аминокислотами, что указывает на преимущество пептидомиметиков, теоретически разработанных с использованием шкал NNAAIndex.
Модель NNAAIndex QSAR для неорганических связывающих пептидов
Биоактивные пептиды, связывающиеся с неорганическими поверхностями, играют центральную роль во многих научных и технологических приложениях, включая синтез наночастиц [61], контроль качества поверхности [62], молекулярные линкеры [63], пептидные сенсоры [64] и самосборные наноструктуры [65]. ]. Подход фагового дисплея широко используется для открытия новых неорганических связывающих пептидов с большим количеством данных [62], но такой грубый и дорогостоящий метод очень чувствителен к экспериментальным условиям, таким как очистка пептидов, концентрация пептидов, крупномасштабные продукция пептидов и / или целлюлозная подложка.Кроме того, этот метод дает мало информации о структуре и связывании пептидов на твердых поверхностях, что отрицательно влияет на способность рационального конструирования или постинжиниринга новых последовательностей для дальнейшего улучшения их активности. Здесь всего 20 гептапептидов со сродством связывания с поверхностью слюды [66] (таблица S8) были использованы для построения третьей модели QSAR с использованием LDA, которая была использована для классификации неорганических связывающих пептидов на две группы (а именно, сильные и умеренные группы ) на основе предсказанного сродства связывания.
Из-за относительно небольшого количества доступных пептидов, для достижения значимой статистики модели, процесс проверки также был обеспечен с использованием процедуры перекрестной проверки LOO. Дискриминантные характеристики оценивались с использованием различных статистических величин: (1) точность , характеризует процент всех химических веществ, который правильно идентифицирован в каждой группе; (2) чувствительность , измеряет процентное содержание биологически активных химикатов (в данном случае, т.е.пептиды с сильным связыванием), который правильно идентифицирован; (3) специфичность , измеряет процент биологически неактивных (т.е. пептидов с умеренным связыванием), которые правильно идентифицированы; а коэффициент корреляции Мэтьюза ( MCC ), учитывающий завышенные и заниженные прогнозы, показывает, как прогнозы соотносятся с целевыми наблюдениями [67], [68]. Дискриминантная производительность при перекрестной проверке LOO достигла производительности , точность = 75,00%, чувствительность , = 75.00%, специфичность = 75,00% и MCC = 0,492. Это подтверждает, что модель NNAAIndex QSAR имеет благоприятную прогностическую способность для пептидов, связывающихся с слюдой.
Чтобы изучить, как переменные влияют на активность слюдяных пептидов, мы проанализировали стандартизованные коэффициенты канонической дискриминантной функции модели LDA (рисунок S3). Мы заметили, что только 2 из 42 переменных были выбраны моделью LDA. Две переменные с положительными коэффициентами соответствовали геометрическим характеристикам и доступной площади шестого остатка.Интерпретация модели QSAR показывает, что использование больших геометрических характеристик и доступной для растворителя площади поверхности шестого остатка гептапептидов может улучшить их способность связывать слюду. Мы разработали в общей сложности 54 слюдяных пептидомиметика in silico , модифицированных неприродными аминокислотами (таблица S9). Среди этих дизайнов 37 пептидомиметиков продемонстрировали сильную предсказуемую аффинность связывания. Мы также обнаружили недавно разработанные имитаторы пептидов с повышенной предсказуемой слюдосвязывающей активностью, приобретаемой путем модификации основной цепи и боковой цепи (рис. 7).108-я, 439-я, 534-я и 524-я молекулы имели сложные геометрические особенности, такие как протяженные боковые ароматические фрагменты и разветвление, которые положительно влияли на сродство пептидных имитаторов к связыванию слюды. Более того, большая доступная для растворителя площадь поверхности этих молекул позволяет улучшить сродство связывания недавно разработанных имитаторов пептидов.
Рисунок 7. Недавно разработанные миметики пептида, связывающегося с слюдой.
Тринадцатая выборка в обучающей выборке TLTRVGW рассматривается как шаблон для конструирования молекул.Прогнозируемая оценка TLTRVGW, TLTRV108W, TLTRV439W, TLTRV534W и TLTRV524W составляет 0,94, 1,00, 1,00 и 1,00 соответственно.
https://doi.org/10.1371/journal.pone.0067844.g007
Интересно сравнить детали и характеристики моделей QSAR между нашей предыдущей моделью FASGAI [24] и текущей моделью NNAAindex. Сравнение предыдущей работы (FASGAI) и текущей работы (NNAAindex) кажется недостаточным. Например, для BTD значение Q 2 равно 0.848 для FASGAI / GA-PLS и 0,830 для NNAAIndex / GA-PLS соответственно (таблица 3). Это могло быть связано с внутренними различиями, а именно: (1) модели FASGAI и NNAAIndex использовали разные источники для получения физико-химических свойств аминокислот, то есть FASGAI использовал базу данных AAindex [69] для получения 516 экспериментально обоснованных свойств, в то время как NNAAIndex использовал программы E-dragon [47] и MOE [48] для получения 384 вычислительных свойств просто потому, что экспериментально не было доступных физико-химических свойств для 593 неприродных аминокислот.Следовательно, вычисленные свойства могут неизбежно внести некоторые неопределенности в модель, что приведет к ограниченному улучшению метода NNAAIndex до некоторой степени. (2) В моделях FASGAI и NNAAIndex для представления аминокислот использовались разные масштабные коэффициенты, т. Е. FASGAI представляет гидрофобность, альфа и склонность к повороту, объемные свойства, композиционные характеристики, локальную гибкость и электронные свойства, тогда как NNAAIndex представляет геометрические характеристики, H- связь, связность, доступная площадь поверхности, индекс интегральных моментов, а также объем и форма.По-видимому, разные свойства факторов в обеих моделях отражают фундаментальное различие для захвата и характеристики структурных особенностей природных и неприродных аминокислот, что приводит к различным результатам и точности. (3) Что еще более важно, FASGAI охарактеризовал структурные особенности пептидов, состоящих из 20 природных аминокислот, в то время как NNAAindex охарактеризовал структурные особенности пептидов и пептидомиметиков, состоящих из 22 природных и 593 неприродных аминокислот.Следовательно, модели FASGAI и NNAAindex имеют разную характеристическую способность для разных наборов пептидных данных. Из-за этого мы не можем произвольно отрицать возможность характеризации для любой из моделей FASGAI и NNAAIndex.
Аминокислотный остаток — обзор
1 Введение
Небелковые аминокислотные остатки когда-то считались существующими только в пептидах нерибосомного происхождения. Все чаще они также обнаруживаются как посттрансляционные модификации биомолекул, синтезируемых рибосомами из стандартных l-аминокислот (Walsh, 2014).Из-за своей чувствительности и высокой информативности тандемная масс-спектрометрия (МС / МС) обычно является методом выбора для картирования таких посттрансляционных модификаций с использованием характерных массовых сдвигов в ионах фрагментации пептида (Larsen, Trelle, Thingholm, & Jensen, 2006). . Однако этот метод не работает с изобарными модификациями, такими как аминокислотные остатки d-конфигурации. Эти остатки, как известно, трудно обнаружить в белках и пептидах, поскольку эта модификация не вносит разницы в массу относительно канонических остатков с l-конфигурацией.В последние годы возросло понимание естественного присутствия d-аминокислот в пептидах с разнообразными и важными биологическими функциями, что стимулировало разработку новых аналитических методов их обнаружения (Ollivaux, Soyez, & Toullec, 2014).
Рибосомно синтезированные и посттрансляционно модифицированные пептиды (RiPP) — это новые источники биоактивных пептидов и новой энзимологии (Arnison et al., 2013; Ortega & van der Donk, 2016). Канонические природные продукты RiPP происходят из белка-предшественника, продуцируемого рибосомами, обычно состоящего из N-концевой лидерной области и C-концевой области ядра.Ядро подвергается посттрансляционным модификациям и протеолитически высвобождается с образованием зрелого соединения. Семейство протеузинов RiPP характеризуется лидерным пептидом, подобным нитрилгидратазе. Подмножество этих путей содержит радикальные S -аденозилметиониновые пептидные эпимеразы (RSPE), которые однонаправленно и региоспецифично устанавливают d-аминокислоты в ядро субстратов белка-предшественника (Freeman, Vagstad, & Piel, 2016; Freeman et al., 2012; Моринака и др., 2014).Первый охарактеризованный RSPE происходит от пути биосинтеза политеонамидов A и B (рис. 1) (Freeman et al., 2012). Эти мощные цитотоксические пептиды сильно морфированы по своему рибосомному происхождению с 28 из 49 структурных остатков ядра, подлежащих модификации, включая 18 d-аминокислот, установленных одним ферментом RSPE, PoyD, в чередующихся положениях, за исключением остатков Gly. Хотя поначалу предполагалось, что они происходят нерибосомным путем, из-за большого числа небелковых остатков политеонамиды на самом деле являются продуктом замечательно упорядоченного кластера биосинтетических генов RiPP из бактериального симбионта морской губки Theonella swinhoei (Freeman et al., 2012; Wilson et al., 2014). В политеонамидном пути набор только из шести посттрансляционных модифицирующих ферментов, кодированных в кластере биосинтетических генов с предшественником PoyA, трансформирует его основные остатки до протеолитического высвобождения зрелого продукта протеазой, специфичной для пути (Freeman, Helf, Bhushan, Morinaka, & Piel, 2017).
Рис. 1. Кластеры белков протеина, содержащие RSPE. Прекурсоры и RSPE обозначаются « A » и « D » соответственно. Синие кружки указывают остатки, эпимеризованные их соответствующими RSPE. Структуры, изображенные для кластеров генов osp , avp и plp , получены только в результате совместной экспрессии предшественника и RSPE. Политеонамиды A и B являются продуктом кластера генов poy и различаются конфигурацией сульфоксидного фрагмента.
Первоначальная характеристика кластера биосинтетических генов была проведена путем гетерологичного получения предшественника PoyA с выбранными модифицирующими ферментами в Escherichia coli с использованием восходящего подхода для определения функции фермента (Freeman et al., 2012). Пептидные продукты соэкспрессий PoyA + PoyD были подвергнуты кислотному гидролизу, дериватизации типа Марфея и хроматографическому разделению, чтобы продемонстрировать присутствие d-аминокислот, соответствующее идентичности остатков в зрелом природном продукте политеонамида (Bhushan & Bruckner, 2011; Marfey , 1984). Хроматографическое разделение дериватизированных кислотных гидролизатов обычно позволяет сравнивать с аутентичными стандартами d-аминокислот для идентификации и количественного определения; однако информация о положении в родительском пептиде теряется.В последующем исследовании три гомолога PoyD из путей протейзина цианобактерий (рис. 1) были подобным образом охарактеризованы с использованием коэкспрессий E. coli предшественников пути и RSPEs (Morinaka et al., 2014). Массовое содержание d-аминокислот в выделенных ядерных пептидах определяли анализом типа Марфея. Однако для локализации положения d-аминокислот была принята комбинация двух дополнительных методов. Продукты либо сравнивали с кандидатами на синтетические пептиды, либо анализировали на потерю дейтерия на эпимеризованных остатках с помощью МС / МС в исследованиях по мечению стабильных изотопов аминокислот.Изотопные исследования были проведены в минимальной среде на штамме с нокаутом трансаминаз (Kegler et al., 2014), который предотвращает быструю потерю метки в α-положении под действием трансаминаз в ограниченном наборе аминокислот. Три проанализированных RSPEs, действующих на родственные и сконструированные белковые субстраты-предшественники, показали высокую региоселективность, неразборчивость субстратов и необратимость для установки различных паттернов d-аминокислот (Рис. 1) (Morinaka et al., 2014). Несмотря на эти успехи, исследования синтеза пептидов и стабильных изотопов требуют дорогостоящих реагентов, длительных препаратов или ограничиваются подмножеством аминокислот, что ограничивает их общую полезность.Таким образом, было крайне желательно разработать более простой и быстрый, независимый от последовательности метод идентификации эпимеризаций, катализируемых RSPE, в различных белковых субстратах.
Radical S -аденозилметиониновые ферменты (rSAM) канонически используют промежуточный 5′-дезоксиаденозиновый радикал для извлечения водорода из субстрата для инициирования различных химических реакций (рис. 2) (Broderick, Duffus, Duschene, & Shepard, 2014). Дезоксиаденозиновый радикал возникает в результате гомолитического расщепления S -аденозилметионина, вызванного одноэлектронным восстановлением универсально консервативного кластера [4Fe – 4S] 2 + .Таким образом, 2 H-меченых субстратов подвержены потере дейтерия на стадии отвода водорода, что согласуется с потерей массы, наблюдаемой в наших экспериментах по кормлению аминокислот, меченных изотопом RSPE (Morinaka et al., 2014). Эта потеря дейтерия из меченого l-остатка и привлечение другого водорода в d-остатке продукта предполагает, что обратный водород, который влияет на эпимеризацию, вероятно, происходит из заменяемого источника. Обладая этой информацией, мы инициировали усилия по разработке эксперимента по обратному мечению, который может быть проведен in vivo и применим ко всем аминокислотам.Дальнейшая поддержка и мотивация того, что эти эксперименты будут успешными, были получены в результате исследований in vitro аминогликозидного радикала SAM-эпимеразы NeoN (Kudo, Hoshi, Kawashima, Kamachi, & Eguchi, 2014), которые показали стабильное включение дейтерия в результате эпимеризации в D 2 О. Мы предположили, что эпимеризация пептидила с помощью RSPEs будет отражать этот результат. Поэтому мы разработали ортогональную систему, которая позволяет раздельную индукцию белкового субстрата-предшественника (например, PoyA) в среде H 2 O с последующей индукцией эпимеразы (например, PoyA).g., PoyD) в среде D 2 O. Была разработана и протестирована гетерологичная система экспрессии с предшественником под контролем промотора Т7, индуцированного изопропил-β-d-1-тиогалактопиранозидом (IPTG), и эпимеразы, независимо под контролем промотора pBAD, индуцированного арабинозой.
Рис. 2. Предполагаемый радикально-опосредованный ферментный механизм RSPE. (A) Каноническая стадия инициации радикальных ферментов SAM. Одноэлектронное восстановление кластера [4Fe – 4S] облегчает гемолитическое расщепление SAM до 1-метионина (Met) и 5′-дезоксиаденозильного радикала (dAdo).Он отводит водород субстрата с образованием промежуточного радикала (R) и побочного продукта 5′-дезоксиаденозина (dAdoH). (B) В RSPE субстратом является остаток ядра пептида-предшественника ( слева, ), где отщепление водорода, как ожидается, приведет к образованию промежуточного промежуточного пептидного радикала ( в скобках , в центре ). Обмениваемый водород включается в продукт d-аминокислоты ( справа, ), обеспечивая возможность мечения дейтерием, когда реакция проводится в D 2 O.
Как и предполагалось, эпимеризация, катализируемая RSPE, действительно привела к увеличению количества дейтерия в сайтах эпимеризации в D 2 O, что позволило быстро картировать МС / МС модифицированных остатков (Morinaka, Verest, Freeman, Gugger & Piel, 2017). Используя эту ортогональную индукционную систему на основе D 2 O (ODIS), мы смогли проанализировать ряд нативных, неродных и сконструированных субстратов, чтобы быстро идентифицировать набор эпимеризованных продуктов в экспериментах по коэкспрессии. Итоговые результаты показали, что структура d-аминокислот в значительной степени, но не исключительно, определяется последовательностью корового пептида, в то время как порядок эпимеризации в большей степени зависит от пары фермент-лидер (Morinaka et al., 2017). Кроме того, было обнаружено, что RSPE обычно очень беспорядочные сексуальные отношения. RSPE хорошо переносят субстраты-предшественники, которые на N-конце снабжены His-меткой и которые необязательно мутированы, чтобы включить сайт расщепления неродной протеазой (например, фактор Ха) на стыке лидер-ядро, обеспечивая легкую очистку и высвобождение ядра, соответственно. для анализа МС / МС (Fuchs et al., 2016; Morinaka et al., 2017, 2014). Пошаговая процедура описана здесь.
Природа консервативных основных аминокислотных последовательностей, обнаруженных среди 437 гепарин-связывающих белков, определена с помощью сетевого анализа
В многоклеточных организмах большое количество белков взаимодействует с полианионными полисахаридами гепарансульфатом (HS) и гепарином.Обычно предполагается, что в этих взаимодействиях преобладают заряд-зарядовые взаимодействия между анионными карбоксилатными и / или сульфатными группами полисахарида и катионными аминокислотами белка. Главный вопрос заключается в том, существуют ли среди этих разнообразных белков консервативные аминокислотные последовательности для связывания HS / гепарина. Потенциально консервативные последовательности связывания HS / гепарина искали среди 437 белков, связывающих HS / гепарин. Аминокислотные последовательности извлекали и сравнивали с использованием метрики расстояния Levenshtein .Полученные в результате матрицы сходства были визуализированы в виде графиков, что позволило выделить сильно консервативные последовательности из сильно вариабельных первичных последовательностей, исключая короткие коровые области. Этот подход не выявил обширных консервативных последовательностей связывания HS / гепарина, а скорее ряда более коротких, более широко разнесенных последовательностей, которые могут работать в унисон, чтобы формировать сайты связывания гепарина на поверхности белков, аргументируя это конвергентной эволюцией. Таким образом, именно трехмерное расположение этих консервативных мотивов на поверхности белка, а не первичная последовательность как таковая , являются эволюционными элементами.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова?Аминокислоты 101: строительные блоки белка
Хотя в природе существует более 80 аминокислот, только 20 из них объединяются, чтобы создать различные белки в организме человека.Девять из них называются «незаменимыми аминокислотами», что означает, что они должны быть получены с пищей. Незаменимыми аминокислотами являются изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Гистидин считается частично незаменимым, потому что нам нужно получать его только из пищевых источников в младенчестве. Наше тело производит другие 11, называемые «незаменимыми аминокислотами»: аргинин, аланин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, пролин, серин и тирозин.
«Аминокислоты соединяются вместе, образуя соединение, называемое полипептидами. Длинные цепи полипептидов приводят к образованию белков», — объясняет Самер Кутуби, доктор медицинских наук, профессор кафедры питания и физических упражнений Университета Бастира в Вашингтоне. Когда мы едим белок, он расщепляется на отдельные аминокислоты, а затем снова превращается в белки в организме. Чтобы прояснить, как соединяются отдельные аминокислоты, Нельда Мерсер, лицензированный диетолог и представитель Американской диетической ассоциации, сравнивает их со строительными блоками языка.«Различные комбинации аминокислот создают разные виды белка», — говорит она. «Это похоже на то, как можно составить много разных слов, используя 26 букв алфавита».
Белки, которые образуют аминокислоты, играют важную роль в организме человека. Помимо множества функций, белок используется для построения и восстановления клеток, выработки гормонов и ферментов, регулирования жидкости, выработки антител и обеспечения энергией. «Каждый белок имеет цель и функцию, чтобы сделать нас здоровыми», — говорит Мерсер.
Хотя аминокислоты присутствуют почти во всем, что мы едим, наиболее богатыми отдельными источниками аминокислот являются продукты животного происхождения, такие как мясо, яйца и молочные продукты. «Когда пищевой белок содержит все незаменимые аминокислоты в правильном соотношении для удовлетворения потребностей человека, мы называем это полноценным белком», — объясняет Кутуби.
Соя — это неживотная пища, которая также является полноценным белком. Но веганы, которые не любят сою, могут легко получить весь необходимый им белок.Когда-то считалось, что растительные продукты необходимо комбинировать в одном приеме пищи, чтобы воспроизвести полноценный белок, недавние исследования показывают, что простое употребление разнообразных продуктов обеспечит необходимое количество белка, даже без мяса или молочных продуктов. «Вам не нужно быть таким скрупулезным, как мы когда-то думали, — говорит Мерсер, — если у вас есть запас аминокислот в течение дня».
По словам Мерсера, если вы придерживаетесь здоровой и разнообразной диеты, вы сможете получать все необходимые аминокислоты.«В Соединенных Штатах в нашей культуре будет очень редко, когда мы получаем недостаточное количество белка в нашем рационе. Если вы получаете достаточно калорий, вы получаете достаточно белка», — говорит Мерсер, который не рекомендует принимать аминокислотные добавки.
По словам Мерсера, большинству людей требуется полграмма белка на килограмм тела в день, хотя есть и другие мнения о потреблении белка. Серьезным спортсменам может потребоваться больше, поскольку они тратят очень много энергии. Хотя нам нужен белок, чтобы выжить, употребление слишком большого количества белка может привести к увеличению веса, обезвоживанию, остеопорозу и проблемам с почками.
Однако некоторые специалисты в области здравоохранения говорят, что при некоторых распространенных заболеваниях необходимо принимать аминокислотные добавки. Дэвид Зейгер, доктор медицинских наук, медицинский директор Healthworks Integrative Health Clinic в Чикаго, говорит, что он часто прописывает своим пациентам аминокислотные добавки при различных состояниях, от стенокардии и диабета до депрессии и проблем роста. Зейгер говорит, что даже нормальные, здоровые взрослые могут получить пользу от добавки глутатиона — комбинации цистеина, глицина и глутаминовой кислоты, которая помогает печени выводить токсины из организма.«Каждому человеку необходимы дополнительные аминокислоты в своем рационе, потому что сегодня мы постоянно подвергаемся воздействию токсинов, содержащихся в нашей пище и воде», — говорит он. Текущие исследования также изучают потенциальные преимущества глутатиона для пациентов, страдающих от рака, сердечных заболеваний и иммунодепрессии.
Однако Зейгер настоятельно предостерегает от самолечения. «Всегда полезно проконсультироваться с врачом, который разбирается в диетологии», — говорит он. «Если вы возьмете неправильную сумму, вы можете потерять выгоду.Или вы действительно можете навредить себе ». Аминокислоты следует принимать в сочетании друг с другом и в правильном соотношении. Несбалансированные аминокислотные добавки могут быть потенциально опасными, — говорит Зейгер, ссылаясь на пример лизина и аргинина. Соотношение, по его словам, две аминокислоты могут вызвать высыпания герпеса.
Споры по поводу аминокислотных добавок привлекли много внимания в последние годы, потому что многие спортсмены ищут аминокислоты, чтобы улучшить свои результаты.По словам Зейгера, есть доказательства того, что прием нескольких граммов аминокислот в день действительно может стимулировать эндокринную систему к выработке большего количества гормона роста, что, в свою очередь, может помочь нарастить мышцы. Но Зейгер говорит, что неправильное самолечение аминокислот в спортивном сообществе является обычным явлением и может вызвать такие состояния, как обезвоживание, гигантизм, бесплодие и гиперактивность. Были некоторые неофициальные данные о том, что прием большого количества аминокислот или производных аминокислот, таких как креатин, может вызвать спазмы желудка и диарею.И многие диетологи, в том числе Мерсер, говорят, что исследований, показывающих, что аминокислоты могут улучшить спортивные результаты, просто недостаточно, чтобы оправдать потенциально опасный дисбаланс в организме, который может вызвать этот вид добавок.
Аминокислота как натуральное средство
По словам Самера Кутуби, доктора медицины, доктора философии, доцента Бастирского университета, аминокислоты можно использовать для лечения множества заболеваний. Он рекомендует розничным торговцам напоминать потребителям, чтобы они работали с квалифицированным практикующим врачом, если они хотят исследовать эти способы использования.
- Аланин, глицин и глутаминовая кислота: доброкачественная гипертрофия предстательной железы
- Аргинин: заживление ран, бесплодие, профилактика сердечного приступа и инсульта, гипертония и хроническая усталость, особенно мышечная усталость с миалгией
- Карнитин: болезни сердца, миопатия, гиперлипидемии и алкоголизм
- Цистеин, N-ацетилцистеин (NAC) или глутатион: непереносимость ксенобиотиков, нарушения детоксикации, расстройства, связанные со свободными радикалами, легочные заболевания и СПИД
- Глютамин: восстановление желудочно-кишечного тракта, полное парентеральное питание, нарушения истощения, иммунная поддержка, побочные эффекты химиотерапии, хирургия, ожоги и алкоголизм
- Глицин: Нарушения детоксикации и заживление ран
- Гистидин: ревматоидный артрит
- Лейцин, изолейцин и валин: алкоголизм, хирургия, голодание, инфекции, наращивание мышечной массы и полное парентеральное питание
- Лизин: Простой герпес (HSV-1, HSV-2) ,00
- Фенилаланин, тирозин: депрессия и болезнь Паркинсона
- S-аденозилметионин (SAM): депрессия, остеоартрит, фибромиалгия и заболевания печени
- Таурин: непереносимость хлора, гипохлорита (отбеливателя), фенолов, нитритов, аминов или альдегидов, мальабсорбция жира при муковисцидозе, судорогах, заболеваниях глаз, заболеваниях желчного пузыря, сердечных заболеваниях и алкоголизме
- Триптофан: бессонница, депрессия, синдром беспокойных ног, алкоголизм, контроль веса и болезнь Паркинсона
—О.H-K.
Другое использование aminos
У аминокислот также есть несколько применений, не связанных со здоровьем. Спорная пищевая добавка, например, глутамат натрия, содержит глутаминовую кислоту; несахарный подсластитель, аспартам (Equal), получают из аспарагиновой кислоты и фенилалалина; и коллаген, ингредиент для ухода за кожей, разглаживающий морщины, состоит из нескольких различных аминокислот, а также естественным образом вырабатывается в организме.
—О.Х.-К.
Мерчендайзер Natural Foods том XXVI / номер 3 / стр.94, 96
Глава 3. Белки и аминокислоты
Глава 3. Белки и аминокислоты1. БЕЛКИ
2. ПИЩЕВАРЕНИЕ БЕЛКОВ И МЕТАБОЛИЗМ
3. ОБЩИЕ ТРЕБОВАНИЯ К БЕЛКАМ
4. АМИНОКИСЛОТЫ
5. КОЛИЧЕСТВО ТРЕБОВАНИЯ К АМИНОКИСЛОТЕ
6. ДОБАВКА ДИЕТЫ С АМИНОКИСЛОТАМИ
7.ССЫЛКИ
Дж. Э. Халвер
Вашингтонский университет
Сиэтл, Вашингтон
1.1 Классификация
1.2 Структура
1.3 Свойства
1.4 Химическое определение
Белки представляют собой сложные органические соединения, состоящие из многих аминокислот, связанных вместе пептидными связями и поперечно связанных между цепями сульфгидрильными связями, водородными связями и силами Ван-дер-Ваальса.Химический состав белков больше, чем у любой другой группы биологически активных соединений. Белки в различных клетках животных и растений придают этим тканям их биологическую специфичность.
1.1 Классификация
Белки можно классифицировать как:
(а) Простые белки. При гидролизе они дают только аминокислоты и иногда небольшие углеводные соединения. Примеры: альбумины, глобулины, глютелины, альбуминоиды, гистоны и протамины.(б) Конъюгированные белки. Это простые белки в сочетании с некоторыми небелковыми веществами в организме. Примеры: нуклеопротеины, гликопротеины, фосфопротеины, гемоглобины и лецитопротеины.
(c) Производные белки. Это белки, полученные из простых или конъюгированных белков физическими или химическими способами. Примеры: денатурированные белки и пептиды.
1,2 Структура
Потенциальная конфигурация белковых молекул настолько сложна, что многие типы белковых молекул могут быть сконструированы и обнаружены в биологических материалах с различными физическими характеристиками.Глобулярные белки обнаруживаются в крови и тканевых жидкостях в аморфной глобулярной форме с очень тонкими или отсутствующими мембранами. Коллагеновые белки находятся в соединительной ткани, такой как кожа или клеточные мембраны. Волокнистые белки содержатся в волосах, мышцах и соединительной ткани. Кристаллические белки представлены хрусталиком глаза и подобными тканями. Ферменты — это белки с определенными химическими функциями, которые опосредуют большинство физиологических процессов жизни. Несколько небольших полипептидов действуют как гормоны в тканевых системах, контролирующих различные химические или физиологические процессы.Мышечный белок состоит из нескольких форм полипептидов, которые позволяют мышцам сокращаться и расслабляться при физических движениях.
1.3 Недвижимость
Белки также можно охарактеризовать по их химическим реакциям. Большинство белков растворимы в воде, спирте, разбавленной основе или в различных концентрациях солевых растворов. Белки имеют характерную спиралевидную структуру, которая определяется последовательностью аминокислот в первичной полипептидной цепи и стереоконфигурацией радикальных групп, присоединенных к альфа-углероду каждой аминокислоты.Белки термолабильны, проявляя различную степень лабильности в зависимости от типа белка, раствора и температурного профиля. Белки могут быть обратимыми или необратимыми, денатурированными при нагревании, концентрации соли, замораживании, ультразвуковой нагрузке или старении. Белки подвергаются характерному связыванию с другими белками в так называемой пластеиновой реакции и соединяются со свободными альдегидными и гидроксильными группами углеводов с образованием соединений типа Майяра.
1.4 Химическое определение
Содержание азота в большинстве белков, обнаруженных в тканях животных, орехов и зерна, составляет около 16 процентов; поэтому содержание белка обычно выражается как содержание азота × 6.25.
Проглоченные белки сначала расщепляются на более мелкие фрагменты пепсином в желудке или трипсином или химотрипсином из поджелудочной железы. Эти пептиды затем дополнительно восстанавливаются под действием карбоксипептидазы, которая гидролизует одну аминокислоту за раз, начиная со свободного карбоксильного конца молекулы, или с помощью аминопептидазы, которая отщепляет одну аминокислоту за раз, начиная со свободного амино-конца полипептида. цепь. Свободные аминокислоты, высвобождаемые в пищеварительную систему, затем всасываются через стенки желудочно-кишечного тракта в кровоток, где они затем повторно синтезируются в новые тканевые белки или катаболизируются для получения энергии или фрагментов для дальнейшего тканевого метаболизма.
Валовая потребность в белке была определена для нескольких видов рыб (см. Таблицу 1). Имитация цельного яичного протеина в тестовых диетах содержит избыток незаменимых аминокислот. Эти диеты поддерживались приблизительно изокалорийными за счет корректировки общего белка и усвояемых углеводных компонентов до фиксированного количества, поскольку лечение белковыми диетами варьировалось в испытанных диапазонах. Испытания на кормлении мальков, сеголетков и годовалых рыб показали, что общие потребности в белке наиболее высоки у начальных кормовых мальков и что они уменьшаются по мере увеличения размера рыбы.Чтобы расти с максимальной скоростью, мальки должны иметь диету, в которой почти половина легкоусвояемых ингредиентов состоит из сбалансированного белка; через 6-8 недель это требование снижается примерно до 40 процентов рациона лосося и форели и примерно до 35 процентов рациона годовалых лососевых, выращенных при стандартной температуре окружающей среды (SET). См. Рисунки 1 и 2. Общие потребности в белке молоди сома, по-видимому, меньше, чем у лососевых. Первоначально кормление мальков требует, чтобы около 50 процентов усвояемых компонентов рациона составлял белок, и потребность в них уменьшается с увеличением размера.Некоторые испытания кормления лососем показали прямую связь между изменениями потребности в белке молоди рыбы и изменениями температуры воды. Лосось чавычи в воде с температурой 7 ° C требует около 40 процентов цельного яичного белка для максимального роста; той же рыбе в воде с температурой 15 ° C требуется около 50% белка. Лосось, форель и сом могут использовать больше белка, чем требуется для максимального роста, благодаря эффективному удалению азотистых отходов в виде растворимых соединений аммиака через жаберные ткани непосредственно в водную среду.Эта система удаления азота более эффективна, чем система, доступная для птиц и млекопитающих. Птица и млекопитающие потребляют энергию для синтеза мочевины, мочевой кислоты или других соединений азота, которые выводятся через ткань почек и выводятся с мочой. Усвояемые углеводы и жиры сохранят избыток белка в рационе до тех пор, пока удовлетворяются потребности в белке для максимального роста (рисунки 1 и 2).
Таблица 1 — Расчетная потребность в белке с пищей для некоторых видов рыб 1/
Виды | Уровень сырого протеина в рационе для оптимального роста (г / кг) |
Радужная форель ( Salmo gairdneri ) | 400-460 |
Карп ( Cyprinus carpio ) | 380 |
Чавыча ( Oncorhynchus tshawytscha ) | 400 |
Угорь ( Ангилья японская ) | 445 |
Камбала ( Pleuronectes platessa ) | 500 |
Золотистый лещ ( Chrysophrys aurata ) | 400 |
Белый амур ( Ctenopharyngodon idella ) | 410-430 |
Brycon sp. | 356 |
Морской лещ ( Chrysophrys major ) | 550 |
Желтохвост ( Seriola quinqueradiata ) | 550 |
1/ По материалам C.B. Cowey, 1978
Рис. 1. Потребность в белке чавычи при 47 ° F. Верхняя кривая: исходный индивидуальный средний вес рыбы, 1.5г. Нижняя кривая: исходная индивидуальная средняя масса рыбы 5,6 г.
Рис. 2. Потребность в белке чавычи при температуре 58 ° F. Верхняя кривая: исходный индивидуальный средний вес рыбы 2,6 г. Нижняя кривая: исходная индивидуальная средняя масса рыбы 5,8 г.
(Оба рисунка взяты из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J.Nutr ., 65: 589-99)
Обычно рыбе нужно давать диету, содержащую дифференцированные уровни высококачественного белка и энергии и адекватный баланс незаменимых жирных кислот, витаминов и минералов в течение длительного периода времени.Из полученной кривой доза / ответ потребность в белке обычно получают по графику Альмквиста. Считается, что эти различия в очевидной потребности в белке связаны с различиями в методах культивирования и составе рациона.
Относительно высокий уровень пищевого белка, необходимый для максимального роста некоторых рыб, таких как белый амур, Ctenopharyngodon idella, и Brycon spp. Удивительны тем, что эти рыбы всеядны. Brycon spp.выращиваются на нежелательных фруктах и другом растительном материале с низким содержанием белка, и в этих условиях, по-видимому, существенный вклад в потребление ими белка вносит естественная пищевая цепь.
Потребность в белке эвриталиновых рыб, таких как радужная форель, Salmo gairdneri, и кижуч, Oncorhynchus кисач, , выращенные в воде с соленостью 20 ppt, примерно такие же, как и в пресноводных. Нет данных о потребности этих видов в белке в морской воде с полной концентрацией.(35 п.
4.1 Essential и заменимые аминокислоты
4.2 Незаменимые Аминокислоты и качество протеина
Аминокислоты являются строительными блоками белков; около 23 аминокислот были выделены из природных белков. Десять из них незаменимы для рыб. Животное не способно синтезировать незаменимые аминокислоты и поэтому должно получать их с пищей.
4.1 Незаменимые и незаменимые аминокислоты
Корм для лосося, форели и канального сома, лишенный аргинина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, треонина, триптофана или валина, не рос (рис.3). Те же самые рыбы, которых кормили рационами, лишенными других L-аминокислот, росли так же, как и рыбы, получавшие все 18 протестированных аминокислот (рис. 4). Азотный компонент в тестируемых диетах состоял из 18 L-аминокислот по образцу цельного яичного белка. Вся тестируемая рыба быстро выздоравливала, когда в рационе была заменена недостающая аминокислота. Наклон кривой роста в группе восстановления был идентичен таковому у рыб, получавших полный тест на аминокислотный рацион.
Испытывали незаменимые аминокислоты: аланин, аспарагиновая кислота, цистин, глутаминовая кислота, глицин, пролин, серин и тирозин.Было обнаружено, что эти аминокислоты не являются необходимыми для роста лосося, форели и канального сома.
Для количественных исследований потребности в 10 незаменимых аминокислотах использовалась смесь казеина и желатина с добавлением кристаллических L-аминокислот. Тестовая диета содержала 40 процентов цельного яичного белка для азотного компонента. Эксперименты, проведенные с карпом и угрем, показали аналогичное отсутствие роста, когда в рационе отсутствовала незаменимая аминокислота.
Рис. 3. Рост рыб с дефицитом аргинина. Группа с дефицитом была разделена через шесть недель на диете с дефицитом, и недостающая аминокислота была заменена в одной из двух частей.
Рис. 4. Рост рыб с дефицитом цистина.
(Оба рисунка взяты из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J.Nutr., 65: 589-99)
4.2 Основные аминокислоты и качество белка
Если известны потребности рыбы в незаменимых аминокислотах, должно быть возможно удовлетворить эти потребности в системах культивирования различными способами за счет различных пищевых белков или комбинаций пищевых белков.
Фенилаланин избавлен от тирозина. Неизвестно, что он химически модифицирован или становится недоступным из-за суровых условий, которым обычно подвергаются кормовые белки во время обработки. Измерение фенилаланина в белках несложно, поэтому обеспечение и оценка фенилаланина в белках в практических диетах не представляет особых трудностей.
Лизин — основная аминокислота. В дополнение к -аминокислотной группе, обычно связанной пептидной связью, он также содержит вторую, -аминогруппу.Эта альфа-аминогруппа должна быть свободной и реакционной, иначе лизин, хотя и поддается химическому измерению, не будет доступен биологически. Во время обработки белков корма α-аминогруппа лизина может реагировать с небелковыми молекулами, присутствующими в корме, с образованием дополнительных соединений, которые делают лизин биологически недоступным.
Метионин избавлен от цистина. Однако измерить содержание метионина в кормовых белках непросто, поскольку аминокислота подвержена окислению во время обработки.После обработки метионин может присутствовать как таковой, или в виде сульфоксида, или в виде сульфона. Сульфоксид может образовываться из метионина во время кислотного гидролиза кормового белка перед измерением его кислотного состава, не содержащего кислоты. Кислотный гидролиз белков перед анализом нарушает исходное равновесие между двумя соединениями, так что состав гидролизата больше не отражает состав белка. При определении содержания метионина в чистых белках окисление аминокислоты до метионинсульфона обычно является количественным.В случае кормовых белков, однако, это не покажет, сколько метионина или сульфоксида метионина присутствовало в белке до его окисления и гидролиза.
Сульфоксид метионина может иметь некоторую биологическую ценность для рыб, которые могут иметь некоторую способность обратного преобразования его в метионин и, таким образом, частично восполнять часть метионина, окисленного во время обработки.
Недавно появились сообщения о методах измерения метионина в белках с использованием йодоплатинатного реагента до и после восстановления трихлоридом титана, чтобы получить значения как для метионина, так и для сульфоксида в исходном белке.Также был описан способ измерения метионина конкретно по расщеплению цианогенбромида. Оба метода еще предстоит оценить независимо. Микробиологический анализ метионина в белках кормов является ценным инструментом, хотя существует опасность того, что оксиды метионина могут различаться по своей активности в отношении микроорганизмов и искажать значения.
Количественные потребности лососевых в десяти незаменимых аминокислотах определялись путем кормления линейными приращениями одной аминокислоты за раз в тестируемой диете, содержащей аминокислотный профиль, идентичный цельному яичному белку, за исключением тестируемой аминокислоты.Повторяющиеся группы рыб подвергались диетическому лечению до тех пор, пока не появлялись большие различия в росте исследуемых партий. График реакции роста Альмквиста показывает уровень аминокислот, необходимый для максимального роста в этих конкретных условиях испытания. Рационы были разработаны таким образом, чтобы содержать белок на уровне или немного ниже оптимальной потребности в белке для данного вида и условий тестирования, чтобы гарантировать максимальное использование ограничивающей аминокислоты. Сравнение требований к десяти незаменимым аминокислотам между видами показано в таблице 2.
Недавним нововведением стало использование в тестовых диетах белков, относительно дефицитных по данной незаменимой аминокислоте. Таким образом, комбинации рыбной муки и зеина использовались в тестовых диетах для определения потребности радужной форели в аргинине. Рационы, содержащие различные относительные количества казеина и желатина, показали, что увеличение уровня связанного с белками аргинина с 11 до 17 г / кг привело к значительному увеличению роста канального сома.
Таблица 2 Потребность семи животных в аминокислотах 1/
Аминокислота | Молодь угря | Карп мальки | Канальный сом | Молодь чавычи | Цыпленок | Молодой поросенок | Крыса |
Аргинин | 3.9 (1,7 / 42) | 4,3 (1,65 / 38,5) | 6,0 (2,4 / 40) | 6,1 (1,1 / 18) | 1,5 (0,2 / 13) | 1,0 (0,2 / 19) | |
Гистидин | 1,9 (0,8 / 42) | 1,8 (0,7 / 40) | 1,7 (0,3 / 18) | 1.5 (0,2 / 13) | 2,1 (0,4 / 19) | ||
Изолейцин | 3,6 (1,5 / 42) | 2,6 (1,0 / 38,5) | 2,2 (0,9 / 41) | 4,4 (0,8 / 18) | 4,6 (0,6 / 13) | 3,9 (0,5 / 13) | |
лейцин | 4.1 (1,7 / 42) | 3,9 (1,5 / 38,5) | 3,9 (1,6 / 41) | 6,7 (1,2 / 18) | 4,6 (0,6 / 13) | 4,5 (0,9 / 19) | |
Лизин | 4,8 (2,0 / 42) | 5,1 (1,23 / 24,0) | 5,0 (2,0 / 40) | 6.1 (1.1 / 18) | 4,7 (0,65 / 13) | 5,4 (1,0 / 19) | |
метионин 2/ | 4,5 (2,1 / 42) 3/ | 3,1 (1,2 / 38,5) | 2,3 (0,56 / 24,0) | 4,0 (1,6 / 40) 3/ | 4.4 (0,8 / 18) | 3,0 (0,6 / 20) | 3,0 (0,6 / 20) |
Фенилаланин 4/ | 5,1 (2,1 / 41) 5/ | 7,2 (1,3 / 18) | 3.6 (0,45 / 13) | 5,3 (0,9 / 17) | |||
Треонин | 3,6 (1,5 / 42) | 2,2 (0,9 / 40) | 3,3 (0,6 / 18) | 3,0 (0,4 / 13) | 3,1 (0,2 / 19) | ||
Триптофан | 1,0 (0,4 / 42) | 0.5 (0,2 / 40) | 1,1 (0,2 / 18) | 0,8 (0,2 / 25) | 1,0 (0,2 / 19) | ||
Валин | 3,6 (1,5 / 42) | 3,2 (1,3 / 40) | 4,4 (0,8 / 18) | 3,1 (0,4 / 13) | 3,1 (0,4 / 13) |
1/ Выражается в процентах от диетического белка.В скобках числители — это потребности в процентах от сухого рациона, а знаменатели — это процент общего содержания белка в рационе.2/ При отсутствии цистина
3/ Метионин плюс цистин
4/ При отсутствии tyro sine
5/ Фенилаланин плюс тирозин
(по материалам: National Research Council, 1977)
Потребность радужной форели в аргинине была определена по стандартной кривой доза / реакция (рост), а также путем измерения уровней свободного аргинина в тканях (крови и мышцах) в группах форели, получавших увеличивающееся количество аргинина в рационе.После того, как диетическая потребность форели в аргинине была удовлетворена, любое дальнейшее увеличение потребления аргинина привело к увеличению концентрации свободного аргинина в крови и мышцах. Было получено хорошее согласие между двумя методами.
Данные, представленные в таблице 2, предполагают, что между видами рыб существуют реальные различия в их потребностях в определенных аминокислотах. Это приводит к трудностям при составлении белкового компонента практического рациона для тех видов, потребности которых в аминокислотах еще не известны.Возможное решение — использовать для каждой аминокислоты наивысший уровень, необходимый для любого из тех видов, по которым имеются данные. Необходимость дополнительных количественных данных о потребностях рыб в аминокислотах, особенно тех, которые действительно или потенциально могут использоваться в качестве сельскохозяйственных животных, очевидна.
Одним из решений использования белков, относительно дефицитных по одной или нескольким аминокислотам, является добавление к белку соответствующих количеств аминокислоты, необходимых в практических диетах. Рыба, по-видимому, использует свободные аминокислоты с разной степенью эффективности.
Молодой карп, Cyprinus carpio, оказался неспособным расти на диетах, в которых белковый компонент (казеин, желатин) был заменен смесью аминокислот, аналогичных по общему составу. Гидролизат трипсина казеина также оказался неэффективным. Однако, если диета, содержащая свободные аминокислоты в качестве белкового компонента, тщательно нейтрализуется NaOH до pH 6,5-6,7, то некоторый рост молоди карпа действительно происходит. Этот рост был заметно ниже, чем при сопоставимой казеиновой диете в тех же условиях.
Канальный сом также не может использовать свободные аминокислоты в качестве добавок к дефицитным белкам. При изонитрогенной замене соевого шрота на муку менхадена рост и эффективность корма канального сома существенно снизились. Добавление свободного метионина, цистина или лизина, наиболее ограничивающих аминокислот, к этим соевым заменителям не привело к увеличению веса.
Повышение уровня аргинина в рационах сома с 11 до 17 г / кг путем изонитрогенной замены желатина на казеин значительно увеличивало прибавку в весе, но добавление свободного аргинина, цистина, триптофана или метионина к казеину мало влияло на рост или преобразование пищи.
Лососевые могут использовать свободные аминокислоты для роста. Было показано, что зеин-желатиновая диета с добавлением лизина и тритофана заметно превосходит зеин-желатиновую диету для радужной форели, когда в качестве критериев использовались прибавка в весе и использование белка.
Несколько исследователей продемонстрировали возможность дополнения белков с дефицитом аминокислот ограничивающими аминокислотами в рационах лососевых. Казеин с добавкой шести аминокислот давал коэффициенты конверсии корма для атлантического лосося, аналогичные тем, которые были получены при использовании изолированного рыбного белка в качестве источника пищевого белка.Соевый шрот с добавлением пяти или более аминокислот (включая метионин и лизин) был лучшим источником белка для радужной форели по сравнению с соевым шротом. Однако однократное добавление метионина и лизина не привело к повышению ценности соевого шрота. Эти результаты позволяют предположить, что аминокислотный спектр выделенного рыбьего белка, который они использовали, может приблизительно соответствовать потребности в аминокислотах радужной форели. Пищевая ценность изолята соевого белка может быть увеличена путем добавления в него первой ограничивающей аминокислоты; я.е., метионин.
Рационы, содержащие в качестве белкового компонента рыбную муку, мясокостную муку, а также дрожжевую и соевую муку, можно улучшить, добавляя цистин (10 г / кг) и триптофан (5 г / кг) вместе. Рыбную муку можно полностью заменить без снижения конверсии корма в рационах для радужной форели смесью из субпродуктов домашней птицы и перьевой муки вместе с 17 г лизина HCL / кг, 4,8 г DL-метионина / кг и 1,44 г DL. -триптофан / кг.
Коуи, К.Б. и Дж. Р. Сардженты, 1972 Кормление рыб. Adv.Mar.Biol., 10: 383-492
Cowey, C.B., 1979 Потребности рыб в белках и аминокислотах. В Технология кормления и кормления рыб для рыб, под редакцией Дж. Э. Халвера и К. Тьюса. Материалы Всемирного симпозиума, спонсируемого EIFAC / FAO, ICES и IUNS, Гамбург, 20-23 июня 1978 г. Schr . Bundesforschungsanst . Fisch ., Hamb ., (14/15) vol. 1: 3-16
Мерц, Э.Т., 1972 г. Потребности в белке и аминокислотах. В Питание рыб, под редакцией Дж. Э. Халвера. Нью-Йорк, Academic Press, стр. 106-43.
Национальный исследовательский совет, Подкомитет по тепловодным рыбам 1977 г., Потребности теплопроводных рыб в питательных веществах. Вашингтон, округ Колумбия, Национальная академия наук (потребности домашних животных в питательных веществах) 78 стр.
Должны ли молекулы жизни всегда быть левыми или праворукими? | Космос
Должны ли быть переданы все молекулы жизни? agsandrew / iStockОдин из самых странных аспектов жизни на Земле — и, возможно, жизни в других частях космоса — это особенность, которая в равной степени озадачивает химиков, биологов и физиков-теоретиков.У каждого из молекулярных строительных блоков жизни (аминокислот и сахаров) есть двойник — не идентичный, а зеркальное отражение. Точно так же, как ваша правая рука отражает вашу левую, но никогда не поместится в перчатке для левой руки, аминокислоты и сахара бывают как в правой, так и в левой версиях. Этот феномен биологического выбора формы называется «хиральность» — от греческого «хиральность».
На Земле все характерные для жизни аминокислоты имеют «левую» форму, и их нельзя обменять на их правостороннего двойника.Между тем, все сахара, характерные для жизни на Земле, «правые». Противоположные стороны как для аминокислот, так и для сахаров существуют во Вселенной, но они просто не используются ни одной известной биологической формой жизни. (Некоторые бактерии могут фактически преобразовывать правосторонние аминокислоты в левостороннюю версию, но они не могут использовать правосторонние как есть.) Другими словами, и сахара, и аминокислоты на Земле гомохиральны: одноручные. .
Более 4 миллиардов лет назад, когда наша родная планета была в пламенной и темпераментной юности, присутствовали как биологические строительные блоки, так и их зеркальные отражения.Фактически, оба они до сих пор сосуществуют на Земле — но не в той жизни, которую мы знаем. Конечно, если вы приготовите партию аминокислот, сахаров или их молекул-предшественников в лаборатории, вы всегда получите смесь левой и правой частей в соотношении 50 на 50. Но каким-то образом, когда жизнь возникла на протяжении бесчисленных тысячелетий после формирования Земли, были выбраны только левые аминокислоты и правые сахара.
Хиральные молекулы были обнаружены даже в межзвездном пространстве. В ходе знаменательного открытия, объявленного Национальной радиоастрономической обсерваторией в июне этого года, ученые определили молекулы в центре галактики, которые можно использовать для создания как правых, так и левых сахаров.Хотя они до сих пор не знают, есть ли больше одной руки, чем другой, открытие создает основу для дальнейших экспериментов, которые могут пролить свет на происхождение руки.
По-прежнему остаются большие вопросы: как и почему жизнь выбрала только одно из двух зеркальных отражений, чтобы построить каждое существо в своем зверинце? Требуется ли жизнь для начала гомохиральность, или могут существовать формы жизни, которые используют как земные строительные блоки, так и их альтер-эго? Зародыши гомохиральности зародились в глубинах межзвездного пространства или же они развились здесь, на Земле?
Концептуальный образ OSIRIS-REx.НАСА / Годдард / Университет АризоныДжейсон Дворкин, возглавляющий лабораторию астрохимии в Центре космических полетов имени Годдарда НАСА в Гринбелте, штат Мэриленд, говорит, что одна из проблем для ученых, пытающихся ответить на эти вопросы, заключается в том, что «ранняя Земля исчезла, и у нас есть ряд очень, очень скудных доказательств. о том, на что это было похоже «. Примерно четыре миллиарда лет извержений вулканов, землетрясений, бомбардировок метеоритами и, конечно же, глубокого геологического влияния самой жизни настолько изменили планету, что почти невозможно узнать, как Земля выглядела, когда зародилась жизнь.Вот почему исследовательская группа Дворкина и многие его коллеги из НАСА сосредотачиваются на метеоритах — остатках космического мусора, которые попадают на твердую землю.
«Это капсулы времени, созданные 4,5 миллиарда лет назад», — говорит Дворкин. «То, что мы собираем в метеоритах сейчас, очень похоже на то, что тогда проливалось на Землю».
Дворкин также является ведущим правительственным ученым в миссии OSIRIS-REx к околоземному астероиду Бенну. Миссия, которая стартует в сентябре этого года, потратит около года на измерения астероида, чтобы лучше понять, как он движется через нашу солнечную систему.Когда время космического корабля с Бенну истечет, он соберет главный приз: образец с поверхности астероида, который он вернет на Землю в 2023 году, чтобы ученые могли изучить его химический состав. «Все, что мы делаем, способствует получению этого единственного образца», — говорит Дворкин.
Ученые выбрали Бенну отчасти из-за его сходства с особым типом метеорита, который дает интригующий (хотя отнюдь не окончательный) ключ к разгадке происхождения гомохиральности.Многие метеориты содержат молекулы на основе углерода, включая аминокислоты и сахара, которые являются правильными ингредиентами для жизни. Группа Дворкина проанализировала состав этих «органических» соединений в десятках метеоритов и пришла к удивительному выводу. Часто и левосторонняя, и правосторонняя версии, например, аминокислоты, были обнаружены в равных количествах — именно то, что можно было ожидать. Но во многих случаях одна или несколько органических молекул обнаруживались с избытком одной руки, иногда с очень большим избытком.В каждом из этих случаев и в каждом метеорите, изученном до сих пор другими исследователями в этой области, избыток молекулы был левой аминокислотой, которая встречается исключительно в жизни на Земле.
Дворкин говорит, что образец из Бенну может предоставить еще более убедительные доказательства этого явления. «В отличие от метеоритов, которые, один, падают на землю, а затем заражаются, а два — отделены от своего родительского тела», с Бенну, ученые будут точно знать, откуда на астероиде был взят образец.Они принимают «чрезвычайные меры», подтверждающие, что ничто из биологии Земли не может заразить образец. «Поэтому, когда мы получим эти (надеюсь) избытки аминокислот в образце Бенну в 2023 году, мы можем быть уверены, что это не из-за загрязнения», — говорит Дворкин.
Свидетельства, полученные до сих пор от метеоритов, предполагают, что, возможно, есть способ вызвать гомохиральность без жизни. Однако Дворкин говорит: «Мы не знаем, произошла ли химия, ведущая к гомохиральности и жизни, от метеоритов, от процессов на Земле или, возможно, от того и другого.Еще остается вопрос, как и почему этот избыток образовался в метеорите или его родительском астероиде, или в первую очередь на ранней Земле.
Гипотез предостаточно. Например, поляризованный свет, обнаруженный на нашей стороне галактики, может уничтожить правостороннюю версию многих аминокислот на небольшое, но заметное количество. Небольшой избыток левой аминокислоты должен быть резко увеличен, чтобы достичь уровней, обнаруженных в живых организмах на Земле.
Именно этот процесс усиления интригует Донну Блэкмонд из Исследовательского института Скриппса в Ла-Хойя, Калифорния.Блэкмонд изучала потенциальные химические источники гомохиральности почти всю свою карьеру. «Я думаю, это будет некая комбинация химических и физических процессов», — говорит она. Группа Блэкмонда в настоящее время пытается обнаружить, как химические реакции, которые могли происходить на ранней Земле, могли быть изменены, чтобы произвести только строительные блоки жизни. В 2006 году ее команда показала, что они могут усиливать только левую форму аминокислоты, начиная с небольшого избытка. В 2011 году они показали, что амплифицированная аминокислота затем может быть использована для производства огромного избытка предшественника РНК, который образуется вправо из-за присоединенного к ней сахара.(Многие ученые считают РНК исходной биологической молекулой.) Блэкмонд и многие другие химики добились успехов в этом типе химии, но им еще очень далеко до того, чтобы смоделировать все химические процессы и условия, которые могут существовать. на астероиде или молодой планете.
Блэкмонд также отмечает, что далеко не ясно, что жизнь нуждалась в полной гомохиральности, чтобы начать свое существование. «Одна настоящая крайность — это сказать, что ничего не может произойти, пока у нас не будет полностью гомохирального пула строительных блоков, и я думаю, что это, вероятно, слишком экстремально», — говорит она.«Мы могли бы начать производство полимеров информационного типа» — таких как ДНК и РНК — «возможно, до того, как у нас появится гомохиральность». На данный момент все, что могут сделать ученые, — это продолжать задавать вопросы о молекулах здесь, на Земле, и о небесных телах, которые нас окружают. В надежде разгадать еще один кусочек этой головоломки исследователи сейчас разрабатывают новые технологии, чтобы определить, есть ли излишки одной руки в межзвездном пространстве.
Тем временем жизнь на Земле будет продолжаться, как всегда, таинственная и асимметричная.
Биология Химия Космическое пространство ФизикаРекомендованные видео
.

 При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент.
При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент.