Методы гиперплазии миофибрилл в мышечных волокнах
В. Н. Селуянов, В. А. Рыбаков, М. П. Шестаков
Глава 4. Методы управления адаптационными процессами
Для управления адаптационными процессами в определенных клетках органов тела человека необходимо знать устройство органа, механизм его функционирования, факторы, обеспечивающие целевое направление адаптационных процессов. Модель организма спортсмена построена в предыдущих главах. На основе этой модели может быть реализовано теоретическое мышление в виде умозрительного или компьютерного (математического) моделирования. В ходе имитационного моделирования находятся различные варианты принятия управленческих решений, из которых в дальнейшем выбирается наиболее подходящая к данным условиям технология спортивной подготовки. Технология управления адаптационными процессами, реализуемая с помощью физических упражнений, характеризуется следующими параметрами: интенсивность сокращения мышц (ИС), средняя интенсивность упражнения (ИУ), продолжительность (П), интервал отдыха (ИО), количество повторений упражнения (КП), интервал отдыха до следующей тренировки (ИОТ). Анализ, построенной модели показал, что в мышечных волокнах можно изменить массы органелл миофибрилл, митохондрий, гликогена для изменения функциональных возможностей спортсмена. Покажем, как можно управлять синтезом (гиперплазией) этих структур.
4.1. Методы гиперплазии миофибрилл в мышечных волокнах
Цель силовой подготовки — увеличить число миофибрилл в мышечных волокнах. Силовое воздействие человека на окружающую среду есть следствие функционирования мышц. Мышца состоит из мышечных волокон — клеток. Для увеличения силы тяги МВ необходимо добиться гиперплазии (увеличения) миофибрилл. Этот процесс возникает при ускорении синтеза и при прежних темпах распада белка. Исследования последних лет позволили выявить четыре основных фактора, определяющих ускоренный синтез белка в клетке:
1. Запас аминокислот в клетке. (Аминокислоты в клетке накапливаются после потребления пищи богатой белками.)
2. Повышенная концентрация анаболических гормонов в крови как результат психического напряжения (Holloszy et al., 1971; Schants, 1986).
3. Повышенная концентрация «свободного» креатина в МВ (Walker, 1979).
4. Повышенная концентрация ионов водорода (Панин Л. Е., 1983).
Второй, третий и четвертый факторы прямо связаны с содержанием тренировочных упражнений.
Механизм синтеза органелл в клетке, в частности, миофибрилл, можно описать следующим образом.
В ходе выполнения упражнения энергия АТФ тратится на образование актин миозиновых соединений, выполнение механической работы. Ресинтез АТФ идет благодаря запасам КрФ. Появление свободного Кр активизирует деятельность всех метаболических путей, связанных с образованием АТФ (гликолиз в цитоплазме, аэробное окисление в различных митохондриях, например, миофибриллярных, а также в находящихся в ядрышке и на мембранах СПР). В быстрых мышечных волокнах (БМВ) преобладает мышечная лактат-дегидрогеназа (М ЛДГ), поэтому пируват, образующийся в ходе анаэробного гликолиза, в основном трансформируется в лактат. В ходе такого процесса в клетке накапливаются ионы Н. Мощность гликолиза меньше мощности затрат АТФ, поэтому в клетке начинают накапливаться Кр, Н, La, АДФ.
Наряду с важной ролью в определении сократительных свойств в регуляции энергетического метаболизма, накопление свободного креатина в саркоплазматическом пространстве служит мощным эндогенным стимулом, возбуждающим белковый синтез в скелетных мышцах (Walker J., 1979; Волков Н. И. с соав., 1983). Показано, что между содержанием сократительных белков и содержанием креатина имеется строгое соответствие. Свободный креатин, видимо, влияет на синтез и РНК, т. е. на транскрипцию в ядрышках МВ, либо активирует деятельность ядерных митохондрий, которые начинают в большей мере вырабатывать АТФ, которая используется для транскрипции ДНК (Walker, 1979).
Предполагается, что повышение концентрации ионов водорода вызывает лабилизацию мембран (увеличение размеров пор в мембранах, это ведет к облегчению проникновения гормонов в клетку), активизирует действие ферментов, облегчает доступ гормонов к наследственной информации, к молекулам ДНК (Панин Л. Е., 1983). В ответ на одновременное повышение концентрации Кр и Н интенсивнее образуются РНК. Срок жизни и РНК короток, несколько секунд в ходе выполнения силового упражнения плюс пять минут в паузе отдыха (Виру А. А., 1981). Затем молекулы и РНК разрушаются.
Теоретический анализ показывает, что при выполнении силового упражнения до отказа, например 10 приседаний со штангой с темпом одно приседание за 3–5 с, упражнение длится до 50 с. В мышцах в это время идет циклический процесс: опускание и подъем со штангой 1–2 с выполняется за счет запасов АТФ; за 2–3 с паузы, когда мышцы становятся малоактивными (нагрузка распространяется вдоль позвоночного столба и костей ног), идет ресинтез АТФ из запасов КрФ, а КрФ ресинтезируется за счет аэробных процессов в ОМВ и анаэробного гликолиза в ГМВ. В связи с тем, что мощность аэробных и гликолитических процессов значительно ниже скорости расхода АТФ, запасы КрФ постепенно исчерпываются, продолжение упражнения заданной мощности становится невозможным наступает отказ. Одновременно с развертыванием анаэробного гликолиза в мышце накапливаются лактат и ионы водорода (о справедливости высказываний говорят данные исследований на установках ЯМР; Sapega et al, 1987). Ионы водорода по мере накопления разрушают связи в четвертичных и третичных структурах белковых молекул, это приводит к изменению активности ферментов, лабилизации мембран, облегчению доступа гормонов к ДНК. Очевидно, что чрезмерное накопление или увеличение длительности действия кислоты даже не очень большой концентрации может привести к серьезным разрушениям, после которых разрушенные части клетки должны будут элиминироваться (Salminen et al, 1984). Заметим, что повышение концентрации ионов водорода в саркоплазме стимулирует развитие реакции перекисного окисления (Хочачка и Сомеро, 1988). Свободные радикалы способны вызвать фрагментацию митохондриальных ферментов, протекающую наиболее интенсивно при низких, характерных для лизосом, значениях рН. Лизосомы участвуют в генерации свободных радикалов, в катаболических реакциях. В частности, в исследовании А. Salminen e. a. (1984) на крысах было показано, что интенсивный (гликолитический) бег вызывает некротические изменения и 4–5-кратное увеличение активности лизосомальных ферментов. Совместное действие ионов водорода и свободного Кр приводит к активизации синтеза РНК. Известно, что Кр присутствует в мышечном волокне в ходе упражнения и в течение 30–60 с после него, пока идет ресинтез КрФ. Поэтому можно считать, что за один подход к снаряду спортсмен набирает около одной минуты чистого времени, когда в его мышцах происходит образование и РНК. При повторении подходов количество накопленной и РНК будет расти, но одновременно с повышением концентрации ионов Н; поэтому возникает противоречие, то есть можно разрушить больше, чем потом будет синтезировано. Избежать этого можно при проведении подходов с большими интервалами отдыха или тренировках несколько раз в день с небольшим числом подходов в каждой тренировке.
Вопрос об интервале отдыха между днями силовой тренировки связан со скоростью реализации и РНК в органеллы клетки, в частности, в миофибриллы. Известно (Дин, 1981; Виру А. А., 1981), что сама и РНК распадается в первые десятки минут после упражнения, однако структуры, образованные на их основе, синтезируются в органеллы на 70–80 % в течение 4–7 дней. В подтверждение можно напомнить данные о ходе структурных преобразований в мышечных волокнах и согласующихся с ними субъективных ощущениях после работы мышцы в эксцентрическом режиме: первые 3–4 дня наблюдаются нарушения в структуре миофибрилл (около Z-пластинок) и сильные болевые ощущения в мышце, затем МВ нормализуется и боли проходят (Прилуцкий Б. И., 1989; Friden, 1984, 1988). Можно привести также данные собственных исследований (Cелуянов В. Н. с соав., 1990, 1996), в которых было показано, что после силовой тренировки концентрация мочевины (Мо) в крови утром натощак в течение 3–4 дней находится ниже обычного уровня, что свидетельствует о преобладании процессов синтеза над деградацией.
Логика происходящего при выполнении силовой тренировки представляется в основном корректной, однако доказать ее истинность может лишь эксперимент. Проведение эксперимента требует затрат времени, привлечения испытуемых и др., а если логика окажется где-то порочной, то придется вновь проводить эксперимент. Понятно, что такой подход возможен, но малоэффективен. Более продуктивен подход с применением модели организма человека и имитационным моделированием физиологических функций и структурных, адаптационных перестроек в системах и органах. На ЭВМ возможно в короткое время систематически изучать процессы адаптации и проверять корректность планирования физической подготовки. Эксперимент же можно проводить уже после того, как будет ясно, что грубых ошибок в планировании не допущено.
Из описания механизма должно быть ясно, что ОМВ и БГВ должны тренироваться в ходе выполнения разных упражнений, разными методиками.
mipt.ru
Пролиферация (деление) миофибрилл
При гипертрофии мышц происходит пролиферация (деление) миофибрилл. При помощи электронного микроскопа установлено, что в некоторых средних и крупных мышечных волокнах наблюдалась высокая частота продольного расщепления миофибрилл. Измерения в дюймах с помощью электронного микроскопа показали, что миофибриллы, которые расщеплялись, были примерно в два раза большими, по сравнению с нерасщепленными миофибриллами и что эти миофибриллы разделялись более или менее по центру.
Голдспинк Г.
Пролиферация миофибрилл во время роста мышечных волокон
С помощью фазового контраста и электронной микроскопии были рассмотрены и измерены миофибриллы в мышечных волокнах различных размеров и разного возраста. Во время послеродового роста двуглавой мышцы плеча мыши количество миофибрилл в некоторых волокнах возрастает от 75 до 1200. Диапазон размеров миофибрилл составляет от 0,4 до 12 мкм. Обнаружено бимодальное распределение размеров миофибрилл в мышцах мышей всех возрастов.
При помощи электронного микроскопа установлено, что в некоторых средних и крупных мышечных волокнах наблюдалась высокая частота продольного расщепления миофибрилл. Измерения в дюймах с помощью электронного микроскопа показали, что миофибриллы, которые расщеплялись, были примерно в два раза большими, по сравнению с нерасщепленными миофибриллами и что эти миофибриллы разделялись более или менее по центру. Возможным объяснением расщепления может быть факт, что тонкие филаменты тянут слегка под углом к центральной оси миофибрилл, из-за расхождения в решетке. Когда миофибрилла достигает определенного размера сила тяги тонких филаментов достаточно сильна, чтобы повредить Z-диск.
Более подробно строение и функции мышц описаны в моих книгах «Гипертрофия скелетных мышц человека» и «Биомеханика мышц«
Из данных о размерах, форме и числу миофибрилл на разных этапах роста был сделан вывод, что посредством продольно расщепления увеличивается количество миофибрилл во время послеродового роста.
Goldspink, G. The Proliferation of Miofibrils during Muscle Fibre Grows / G. Goldspink // Journal of Cell Science, 1970. – V. 6.– P. 593-603.
Abstract
Myofibrils in muscle fibres of different sizes and different ages were examined and measured using phase-contrast and electron microscopy. During the post-natal growth of the mouse biceps brachii muscle the number of myofibrils in some fibres increases from about 75 to 1200 The range of myofibril size was from 0.4-12 µm. The distribution of myofibril sizes in muscles of all ages studied was bimodal. A high incidence of longitudinal splitting of myofibrils was observed with the electron microscope in differentiating muscle fibres and in some medium and large muscle fibres. Size measurements with the electron microscope showed that the splitting myofibrils were about twice as large as non-splitting myofibrils and that the myofibrils split more or less down the middle. A possible explanation for the splitting is that the peripheral I filaments are pulled at an angle slightly oblique to the myofibril axis, because of the discrepancy in the A and I-filament lattice spacings. When the myofibril reaches a certain size the oblique pull of the peripheral I filaments is strong enough to cause the Z disks to rip. From data on the size, shape and number of myofibrils at different stages of growth it was concluded that longitudinal splitting is the means by which the number of myofibrils increases during post-natal growth.
References
- Brandt, P., Lopez, E., Reuben, J. & Grundest, H. (1967). The relationship between myofilament packing density and sarcomere length in frog striated muscle J. Cell Biol. 33, 255-263.
- Carlsen, F. & Knappeis, G. G. (1963) Further investigations of the ultrastructure of the Z disc in skeletal muscle. Acta phystol scand. 59, 213-215
- Fischman, D. A. (1967). An electron microscope study of myofibril formation in embryonic chick skeletal muscle. J. Cell Biol. 32, 557-575.
- Golsdpink, G. (1962). Studies on post-embryonic growth and development of skeletal muscle. 1 Evidence of two phases in which striated muscle fibres are able to exist. Proc. R. It. Acad.62, В id, 135-150.
- Golsdpink, G. (1964). The combined effects of exercise and reduced food intake on skeletal muscle fibres J. cell. comp. Physiol. 63, 200-216.
- Goldspink, G. (1965). Cytological basis of decrease in muscle strength during starvation. Am. J. Physiol. 209, 100—114.
- Goldspink, G. (1968). Sarcomere length during the post-natal growth of mammalian muscle fibres. J. Cell Set. 3, 539-548.
- Goldspink, G. & Rowe, R. W. D., (1968). The growth and development of muscle fibres in normal and dystrophic mice. In Research in Muscular Dystrophy, Proceedings of the 4th Symposium, pp. 116—131. London: Pitman Medical Publishing
- Heidenhain, M. (1913). Uber die Entstehung der quergestreiften Muskelsubstanz bei der Forelle. Arch mikrosk. Anat. Ent zv Mech 83, 427-522.
- Huxley, H. E. (1957). The double array of filaments in cross-striated muscle. J. biophys. biochem. Cytol. 3, 631-648. Reedy, M. K. (1964). Remarks at a discussion on the physical and chemical basis of muscular contraction. Proc. R. Soc. В 160, 458.
- Rowe, R. W. D. & Goldspink, G. (1968). Surgically induced muscle fibre hypertrophy. Anat. Rev 161, 69-76.
- Rowe, R. W. D. & Goldspink, G. (1969). Muscle fibre growth in five different muscles in both sexes of mice. J. Anat. 104, 519-530. Steedman, H F. (i960). Section Cutting in Microscopy. Oxford: Blackwell.
allasamsonova.ru
Молекулярная структура миофибрилл. Структура и функция основных белков миофибрилл миозина, актина, тропомиозина, тропонина.
В мышечной клетке имеются миофибриллы — особым образом организованные пучки белков, располагающиеся вдоль клетки. Миофибриллы, в свою очередь, построены из белковых нитей
(филаментов) двух типов — толстых и тонких. Основным белком толстых нитей является миозин, а тонких — актин. Миозиновые и актиновые нити — главный компонент всех сократительных систем.
Электронно-микроскопическое изучение поперечных и продольных срезов мышц обнаружило строго упорядоченное расположение миоэиновых и актиновых нитей в миофибрилле. Функциональной единицей миофибриллы является саркомер — участок миофибриллы (длиной 2,5 мкм) между двумя Z-пластинками.
Саркомер включает пучок миозиновых нитей, серединой прикрепленных к М-пластинке (М-линия), и пучки актиновых нитей, прикрепленных к Z-пластинкам. Многие сотни саркомеров образуют миофибриллу.
Чередование в миофибрилле участков, содержащих толстые нити, с участками, содержащими тонкие нити (A-диски и I-диски), создает поперечную полосатость мышц.
Саркоплазма, вмещающая миофибриллы, пронизана между ними сетью цистерн и трубочек
эндоплазматического (саркоплазматического) ретикулума, а также системой поперечных трубочек, которые тесно контактируют с саркоплазматическим ретикулумом, но не сообщаются с ним.
СТРОЕНИЕ МИОЗИНОВЫХ НИТЕИ
Миозиновые нити образованы белком миозином. Миозин составляет почти половину всех белков скелетной мышцы. Молекула миозина содержит две идентичные тяжелые полипептидные цепи (молекулярная масса каждой 200 ООО) и четыре легкие цепи (молекулярная масса около 20 ООО). Каждая тяжелая цепь на большой части длины с С-конца имеет конформацию а-спирали, и обе спирали скручены друг с другом; эта часть молекулы имеет форму палочки. Противоположные концы каждой цепи (N-концы) имеют глобулярную форму, образуя ≪головки≫ молекулы. К каждой из головок нековалентно
присоединены по две легкие цепи.
Миозин катализирует гидролиз АТФ; это было установлено Энгельгардтом и Любимовой в 1939 г. Энергия гидролиза используется для сокращения мышцы. Значительно позднее выяснилось, что каталитический активный центр локализован в головках молекулы миозина. Открытие АТФазной активности миозина в высокой степени стимулировало исследования мышечного сокращения, поскольку
было первым прямым указанием на источник энергии для сокращения и на роль миозина в использовании этой энергии.
Палочкообразные хвосты молекул миозина могут соединяться друг с другом продольно, образуя пучки; головки выступают на поверхности пучка, выстраиваясь вокруг него по спирали. В области М-линии пучки стыкуются ≪хвост к хвосту≫. Так получаются миозиновые нити саркомера, каждая из которых содержит около 400 молекул миозина.
СТРОЕНИЕ АКТИНОВЫХ НИТЕЙ
В состав актиновых нитей входят белки актин, тропомиозин и тропонин. Основу нитей составляют молекулы актина. Актин — это глобулярный белок с молекулярной массой 43 ООО и шарообразными молекулами диаметром около 5 нм; такая форма актина называется G-актин (глобулярный актин). G-актин содержится и во многих немышечных клетках.
Молекулы G-актина могут нековалентно соединяться, образуя фибриллярный актин — F-актин. Форма молекул F-актина напоминает две нитки бус, скрученные друг с другом. В мышечных клетках весь актин находится в форме F-актина.
К F-актину могут присоединяться головки миозина, причем на каждой молекуле G-актина в F-актине есть центр связывания миозина. В результате такого взаимодействия в сотни раз увеличивается АТФазная активность миозина. Соединение F-актина с миозином называют актомиозином. Образование связей между миозиновыми и актиновыми нитями в саркомере имеет важное значение в процессе сокращения мышцы.
Молекулы другого белка актиновых нитей — тропомиозина — имеют форму палочек длиной 40 нм. Они располагаются вблизи желобков спиральной ленты F-актина, вдоль нее, причем каждая молекула тропомиозина соединена с семью молекулам G-актина, а концами примыкает к соседним молекулам тропомиозина.
Третий белок актиновых нитей — тропонин — имеет глобулярную форму; он построен из трех разных субъединиц. Тропонин нековалентно связан с тропомиозином и с актином; на каждую молекулу тропомиозина приходится одна молекула тропонина. Одна из субъединиц тропонина содержит Са-связывающие центры: эта субъединица по строению сходна с кальмодулином.
Тонкие нити прикреплены к Z-пластинкам, которые тоже представляют собой белковые структуры. Содержание миозина, актина, тропомиозина и тропонина в миофибриллах равно примерно 55, 25, 15 и 5 % соответственно
Б.33
cyberpedia.su
Миофибриллы — это… Что такое Миофибриллы?
[от Мио… и новолат. fibrilla (уменьшительное от лат. fibra) — волоконце, ниточка], сократимые нити в протоплазме поперечнополосатых мышечных волокон скелетной мускулатуры, сердечной мышцы и мышц с двойной косой исчерченностью. Диаметр М. от 0,5 до нескольких мкм. В поперечном сечении М. округлы, угловаты или овальны. Основную массу М. составляют тончайшие белковые нити — миофиламенты, или протофибриллы (см. рис.), двух типов — толстые миозиновые (состоят главным образом из Миозина, длина их около 1500 нм, диаметр 10—15 нм) и тонкие актиновые (состоят в основном из Актина, длина их 1000—1100 нм, диаметр 5—8 нм). Имеются в М. и другие белки: тропомиозин В (в тонких протофибриллах мышц всех типов) и тропомиозин А, или парамиозин (в толстых протофибриллах мышц с двойной косой исчерченностью), а также α- и β-актинины, тропонин и др. Тонкие протофибриллы прикрепляются к т. н. полоске Z — сложному переплёту белковых нитей. Участок М. между двумя полосками Z называется саркомером. Толстые протофибриллы образуют плотный обладающий двойным лучепреломлением участок М. — анизотропный диск (диск А). Между толстыми протофибриллами частично вдвинуты тонкие протофибриллы («зона перекрывания»). Участок саркомера по обе стороны от полоски Z, содержащий лишь тонкие протофибриллы, называется изотропным диском (диск 1). Центральная зона диска А, лишённая тонких протофибрилл, называется диском Н; в его центре обычно видна полоска М, составленная короткими (40 нм) М-нитями, расположенными вдоль длинной оси М.; длина их соответствует ширине полоски М. С обеих сторон от полоски М. расположен субдиск Н — узкая зона (Миофибриллы 130 нм), более светлая, чем остальной диск Н. Толстые протофибриллы имеют по всей длине равномерно расположенные отростки («мостики»), представляющие, по-видимому, отошедшие от протофибрилл концы миозиновых молекул. Середина толстых протофибрилл лишена отростков, чем и обусловлено возникновение светлой зоны (субдиска Н). Данная схема строения М. допускает ряд возражений, например при сильном растяжении М. тонкие протофибриллы должны полностью выйти из диска А, а саркомер — распасться на фрагменты, однако этого не происходит, т. к. допускается существование 3-го типа протофибрилл — «сверхтонких нитей», соединяющих полоски Z. См. также Мышцы, Мышечное сокращение.Лит.: Леви А., Сикевиц Ф., Структура и функции клетки, пер. с англ., М., 1971; Хилл А., Механика мышечного сокращения, пер. с англ., М., 1972.
Ультраструктура миофибриллы поперечнополосатого мышечного волокна (схема). А — в оптическом микроскопе; Б — в электронном микроскопе; 1 — полоска М; 2 — полоска Z; 3 — диск Н; 4 — диск А; 5 — диск I; 6 — толстая протофибрилла; 7 — тонкая протофибрилла; 8 — субдиск Н; 9 — мостики.
dic.academic.ru
Миофибриллы — что это?
Миофибриллы – это сократительные элементы мышечного волокна. Чем их больше в конкретном мышечном волокне, тем большую силу сокращения способно проявить данное волокно.Каждое мышечное волокно состоит из миофибрилл. Конкретному человеку дается определенное количество мышечных волокон, каждое из которых содержит определенное количество миофибрилл.
Чтобы было понятно, что такое миофибрилла. Ее можно сравнить с резиновым жгутиком внутри обыкновенной резинки. Если жгутик – это миофибрилла, то чем больше таких жгутиков, тем толще будет сама резинка, и тем сильнее она будет сокращаться из растянутого положения.
Точно так же и в мышечном волокне. Чем больше внутри него миофибрилл, тем сильнее и быстрее будет сокращение. Грубо говоря, тем больший вес и большую скорость можно развить.
Данное от природы количество миофибрилл вполне можно увеличить. В теории – почти до бесконечности. На практике – существуют определенные границы, связанные с гормональной деятельностью организма, правильными тренировками и достаточным питанием.
Для того, чтобы увеличить количество миофибрилл, необходимо подвергать конкретное мышечное волокно нагрузке. Если будут соблюдаться 4 основных принципа, необходимые для роста мускулатуры, тогда количество миофибрилл в мышечном волокне будет постепенно увеличиваться.
По мере роста количества миофибрилл, мышечное волокно начнет увеличиваться в размере. А т.к. тренируется одновременно большое количество мышечных волокон, то будет расти и общий поперечник тренируемой мышцы.
Если перестать тренировать определенные мышечные волокна, то буквально через месяц-полтора лишние миофибриллы начнут отмирать. Без тренировки количество миофибрилл очень быстро вернется к своему природному уровню.
Рост миофибрилл – это длительный процесс. Ускорить природный темп роста миофибрилл способен прием запрещенных гормональных препаратов, прежде всего, тестостерона и гормона роста.
Увеличение количества миофибрилл особенно сказывается на увеличении силовых показателей. На локальную выносливость мышечной группы почти не влияет.
bodyboom.club
3. Молекулярная структура миофибрилл. Структура и функция белков миофибрилл миозина, актина, тропомиозина, тропонина.
3. Молекулярная структура миофибрилл. Структура и функция белков миофибрилл миозина, актина, тропомиозина, тропонина.
В мышечной клетке имеются миофибриллы — особым образом организованные пучки белков, располагающиеся вдоль клетки. Миофибриллы построены из белковых нитей (филаментов) двух типов — толстых и тонких. Основным белком толстых нитей является миозин, а тонких — актин.
Функциональной единицей миофибриллы является саркомер — участок миофибриллы (длиной 2,5 мкм) между двумя Z-пластинками.
Саркомер включает пучок миозиновых нитей, серединой прикрепленных к М-пластинке (М-линия), и пучки актиновых нитей, прикрепленных к Z-пластинкам. Многие сотни саркомеров образуют миофибриллу.
Чередование в миофибрилле участков, содержащих толстые нити, с участками, содержащими тонкие нити (A-диски и I-диски), создает поперечную полосатость мышц.
Миозин составляет почти половину всех белков скелетной мышцы, катализирует гидролиз АТФ; — энергия гидролиза используется для сокращения мышцы. Значительно позднее выяснилось, что каталитический активный центр локализован в головках молекулы миозина.
В состав актиновых нитей входят белки актин, тропомиозин и тропонин. Актин — это глобулярный белок. Молекулы другого белка актиновых нитей — тропомиозина — имеют форму палочек. Тропонин — имеет глобулярную форму; он построен из трех разных субъединиц, нековалентно связан с тропомиозином и с актином;
1. Вторичная структура белков. Связи, стабилизирующие 2 структуру.
Вторичная структура белков — пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спираль и β-структура. α-Спиральная структура — наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. β -Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи. Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными.
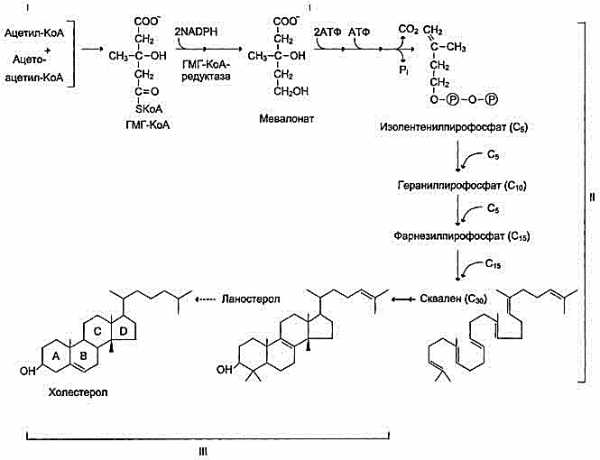
2. Холестерин. Пути поступления, использования и выведения из организма.Биосинтез холестерина, его этапы. Регуляция синтеза.
Реакции
синтеза холестерола происходят в
цитозоле клеток. 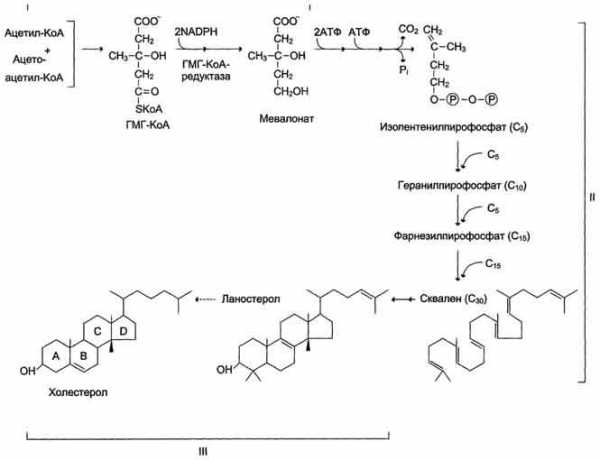
Синтез холестерола. С5 — изопентенилпирофосфат; С1 — Фарнезилпирофосфат. Все атомы углерода холестерола происходят из ацетил-КоА. Сквален — углеводород линейной структуры — превращается ферментом циклазой в ланостерол, содержащий 4 конденсированных кольца и гидроксильную группу. Ланостерол через ряд последовательных реакций превращается в холестерол (I, II, III — этапы синтеза).
У холестерола имеется насыщенная разветвлённая боковая цепь из 8 углеродных атомов в положении 17, двойная связь в кольце В между атомами углерода в положениях 5 и 6, а также гидроксильная группа в положении 3.
Выведение холестерола из организма
Структурная основа холестерола — кольца циклопентанпергидрофенантрена — не может быть расщеплена до СО2 и воды, как другие органические компоненты, поступающие с пищей или синтезированные в организме. Поэтому основное количество холестерола выводится в виде жёлчных кислот.
3. Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция в сокращении. Особенности энергетического обмена в мышцах; роль креатинфосфата.
Механизм сокращения поперечнополосатой мышечной ткани
1. Разряд мотонейрона.
2. Высвобождение нейромедиатора : из нервных окончаний ацетилхолин
3.Связывание АХ : связывается с холинорецепторами в цитоплазму ток ионов Nа (по градиенту концентрации и градиенту заряда) потенциал ПМ от -80 мВ до +40 мВ =деполяризация мембраны : а)-активация потенциалзависимых Nа-каналов-—потенциал действия по трубочкам Т-системы —мышечное сокращение; б) активация потенциалчувствительных К-каналов (ионы К+ наружу) и потенциал покоя восстанавливается.
4. Генерация потенциала действия в мышечном волокне.
5. Распространение деполяризации внутрь волокна по Т-трубочкам.
6. Высвобождение ионов Са из концевых цистерн СР и их диффузия к толстым и тонким филаментам. Передача сигнала от ПМ к мембране СР реализуется в разных типах мышц через химический тип и через конформационный тип передачи сигнала. Мембраны СР содержат Са-каналы и Са-АТФ-азу, которая активируется тем кальцием, что освобождается из ретикулума через Са-каналы и взаимодействует с регуляторными белками (ТнС, кальмодулин).
7. Связывание Са с ТнС, открывающее миозин-связывающие участки актина.
8. Образование поперечных связей между актином и миозином и скольжение тонких филаментов относительно толстых, сопровождающееся укорочением волокна.
Расслабление
Для процесса расслабления требуется энергия в виде АТФ, Mg+2-Ca+2 — АТФ-аза, находящаяся в мембране СР, активируясь под действием карнозина и анзерина, используя энергию АТФ, начинают перекачивать ионы кальция из саркоплазмы в полость цистерн.
1. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рн и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
В
пищевых продуктах содержание свободных
аминокислот очень мало. Подавляющее
их количество входит в состав белков,
которые гидролизуютсяв ЖКТ под действием
ферментов протеаз. Ферменты, относящиеся
к группе экзопептидаз, гидролизуют
пептидную связь, образованную концевыми
аминокислотами. Под действием всех
протеаз ЖКТ белки пищи распадаются на
отдельные аминокислоты, которые затем
поступают в клетки тканей. 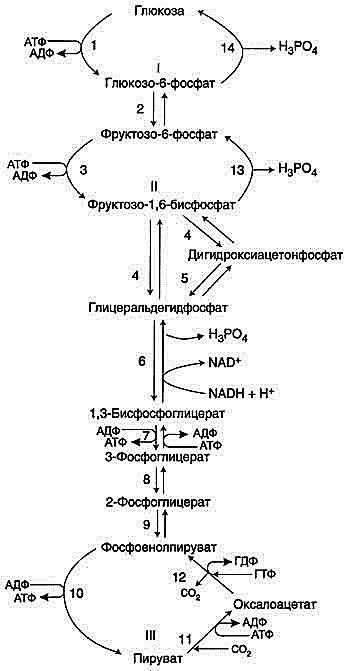
Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина.
Защита клеток от действия пептидаз: ферменты образуются в виде неактивных предшественников; слизистая оболочка покрыта слоем слизи.
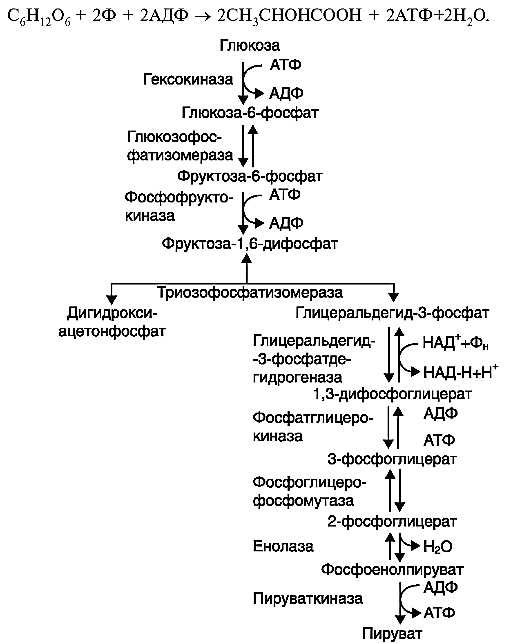
2. Биосинтез глюкозы (глюконеогенез). Цикл кори.
Гликолиз и глюконеогенез. Ферменты обратимых реакций гликолиза и глюконеогенеза: 2 — фосфоглюкоизоме-раза; 4 — альдолаза; 5 — триозофосфатизомераза; 6 — глицеральдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 — фосфоглицератмутаза; 9 — енолаза. Ферменты необратимых реакций глюконеогенеза: 11 — пируваткарбоксилаза; 12 — фосфоенолпируваткарбоксикиназа; 13 — фруктозо-1,6-бисфосфатаза; 14 -глюкозо-6-фосфатаза. I-III -субстратные циклы.
Цикл Кори (глюкозолактатный цикл).
1 — поступление лаюгата из сокращающейся мышцы с током крови в печень; 2 — синтез глюкозы из лактата в печени; 3 — поступление глюкозы из печени с током крови в работающую мышцу; 4 — использование глюкозы как энергетического субстрата сокращающейся мышцей и образование лактата.
3. Химический состав нервной ткани. Миелиновые мембраны. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы. Медиаторы нс. Физиологически активные пептиды мозга.
Функции нервной системы:
studfiles.net
Миофибриллы и митохондрии. Чем они занимаются в мышцах
Наверное, статья про миофибриллы и митохондрии – одна из самых важных для понимания процесса сокращения, роста массы и тренировки мышц.
Коротко.
Миофибриллы – это сократительные элементы мышечного волокна. Чем их больше в конкретном мышечном волокне, тем большую силу сокращения способно проявить данное волокно.
Митохондрии – это энергетические элементы мышечных волокон. Они дают энергию для сокращения. При этом, чем больше митохондрий внутри конкретного мышечного волокна, тем дольше оно способно производить сокращения – выполнять работу.
Теперь рассмотрим эти мышечные структуры немного подробнее.
Миофибриллы
1. Каждое мышечное волокно состоит из миофибрилл. Конкретному человеку дается определенное количество мышечных волокон, каждое из которых содержит определенное количество миофибрилл.
Чтобы было понятно, что такое миофибрилла. Ее можно сравнить с резиновым жгутиком внутри обыкновенной резинки. Если жгутик – это миофибрилла, то чем больше таких жгутиков, тем толще будет сама резинка, и тем сильнее она будет сокращаться из растянутого положения.
Точно так же и в мышечном волокне. Чем больше внутри него миофибрилл, тем сильнее и быстрее будет сокращение. Грубо говоря, тем больший вес и большую скорость можно развить.
2. Данное от природы количество миофибрилл вполне можно увеличить. В теории – почти до бесконечности. На практике – существуют определенные границы, связанные с гормональной деятельностью организма, правильными тренировками и достаточным питанием.
3. Для того, чтобы увеличить количество миофибрилл, необходимо подвергать конкретное мышечное волокна нагрузке. Если будут соблюдаться 4 основных принципа, необходимые для роста мускулатуры (перечислены в статье Как набрать мышечную массу), тогда количество миофибрилл в мышечном волокне будет постепенно увеличиваться.
4. По мере роста количества миофибрилл, мышечное волокно начнет увеличиваться в размере. А т.к. тренируется одновременно большое количество мышечных волокон, то будет расти и общий поперечник тренируемой мышцы.
5. Если перестать тренировать определенные мышечные волокна, то буквально через месяц-полтора лишние миофибриллы начнут отмирать. Без тренировки количество миофибрилл очень быстро вернется к своему природному уровню.
6. Рост миофибрилл – это длительный процесс. Ускорить природный темп роста миофибрилл способен прием запрещенных гормональных препаратов, прежде всего, тестостерона и гормона роста.
7. Увеличение количества миофибрилл особенно сказывается на увеличении силовых показателей. На локальную выносливость мышечной группы почти не влияет.
Митохондрии
1. Количество митохондрий, напротив, не связано с проявлением силы. Однако прямо влияет на проявление локальной выносливости – способности производить работу без утомления в течение всего времени, пока не закончится энергия.
2. В идеале, митохондрии способны полностью «облепить» миофибриллу. И больше этого количества быть уже не может.
Следовательно, митохондрии являются зависимыми от миофибрилл по пространству. Они могут появляться лишь вокруг миофибрилл до тех пор, пока есть свободное место.
3. Если в мышечном волокне каждая миофибрилл полностью оплетена митохондриями, то такое мышечное волокна является, в буквальном смысле, неутомимым. Оно будет продолжать работу доступной ему мощности до тех пор, пока организм поставляет необходимое для сокращения горючее – жиры, гликоген или глюкозу из крови. Такие мышечные волокна называются окислительными (более подробная информация в статье Типы мышечных волокон).
4. Митохондрии, в отличие от миофибрилл, растут довольно быстро. По современным данным, за полтора месяца правильной тренировки вполне возможно выйти на пик спортивной формы. Т.е. набрать максимальное для определенной мышцы количество митохондрий.
После этого тренировки по наращиванию митохондрий теряют смысл. Однако можно продолжать поддерживать уже существующее количество митохондрий.
5. Без тренировки митохондрии очень быстро стареют и уничтожаются организмом. Период полураспада составляет 10-20 суток, возможно, даже быстрее.
6. Развитие митохондрий требует своих условий для роста: правильная тренировка и избыточное белковое питание.
7. При периодизации тренировочного цикл, вначале необходимо добиваться существенного роста миофибрилл, а затем уже развивать митохондрии.
8. При одновременной тренировке, упражнения аэробной направленности на развитие митохондрий должны предшествовать силовым упражнениям на увеличение количества миофибрилл.
Вывод: Для увеличения силы необходимо сделать упор на развитие миофибрилл. Для повышения аэробных возможностей организма нужно развивать митохондрии. Развитие и миофибрилл и митохондрий повышает как силовые, так и аэробные возможности тренируемых мышц.
Несмотря на некоторую схематичность, информация, изложенная в статье, является крайне важной для понимания процессов любой тренировки.
Потому что миофибриллы и митохондрии – это почти единственное, что удачно поддается тренировке внутри мышечного волокна. (Также мы можем до некоторой степени временно влиять на количество запаса гликогена).
Понравилось? Поделитесь!
blogozdorovie.ru
