SCVP Endomyocardial Biopsy Tutorial
Малое увеличениеВ этом разделе обсуждаются гистологические находки при малом увеличени (2x до 10x). Он будет охватывать такие темы, как наблюдение за клеточной структурой, сосудами и соединительной тканью.
Адекватность Биопсии
Первым шагом для оценки биопсии на малом увеличении является оценка адекватного количества ткани миокарда.
Так как многие пациенты при пересадке сердца проходят несколько биопсий, часть или все части биопсии могут состоять из изменений на месте предыдущей биопсии. Если виден тромб, грануляционная ткань, или участки фиброза с миоцитарними изменениями, то вероятнее всего вы находитесь на предыдущем участке биопсии. Для адекватности, по крайней мере 3 участка биопсии должны присутствовать, каждый из которых по крайней мере 50% от площади, занимаемым миокардом не изменным предидущей биопсией.
Общая оценка биопсии
После определения адекватности биопсии, основной целью малого увеличения является: 1)есть или нет увеличения клеток в ткани биопсии, 2) определить место и характер клеточного инфильтрата, 3) получить общее ощущение локализации и характера воспалительного инфильтрата и 4) определение конкретных областей увеличения клеточного инфильтрата, чтобы просмотреть при большом увеличении. Гистологические изменения острого клеточного отторжения не однородны, и малое увеличение позволяет патологу, сосредоточиться на наиболее поврежденной области. Экспертиза ткани на нескольких уровнях имеет важнейшее значение для диагностической точности.
Увеличение клеточного инфильтрата в эндомиокардиальной биопсии легко выявляется в большинстве случаев. Картина распределения клеточного инфильтрата может быть либо очаговой или диффузной.
По расположению инфильтратов, и их связи с миоцитами, можно предположить, различные патологические процесы. Лимфоцитарный инфильтрат при остром клеточном отторжении (ACR) находится вокруг кардиомиоцитов (perimyocytic) или вокруг мелких артериол (периваскулярные). Если инфильтрат располагается преимущественно в ткани эндокарда или фиброзной ткани, альтернативные этиологии, такие как ишемия, Quilty инфильтраты или изменения на месте предыдущий биопсии должны быть рассмотрены. Лимфоцитарный инфильтрат в ткани эндокарда может также находиться на поверхности или вблизи поверхности эндокарда в линейном порядке. Это может быть трудно отличить от Quilty эффекта и, как правило,эти изменения следуют в связи с perimyocyte инфильтратом при более высоком уровне отторжения.
Большие, узловые, агрегаты лимфоцитов в ткани эндокарда, очень характерны для «Quilty» эффекта. Для Quilty поражений в миокарде или в миокарде и эндокарде, харатерным признаком является множественный лимфоцитарный инфильтрат с расширением границ и сравнительно резкой границей с придлежащими миоцитами. Наличие этих признаков должно предложить правильную интерпретацию при низком увеличении. Весь лимфоцитарный инфильтрат должен быть оценен при большем увеличении на наличие миоцитов повреждения.
Миоциты
Выявление «миоцитов повреждения» иногда является сложной задачей при обследовании EMB.»Повреждение» охватывает широкий спектр изменений варьрирующий от гибели клеток на одной стороне и тонкие дегенеративные изменения на другой. Большинство этих изменений должны быть видимы при большом увеличени для точного диагноза.
Косвенные доказательства миоцитрного повреждения, видемые на малом увеличени включают в себя наложения воспалительных клеток на миоциты . Инфильтрация воспалительными клетками вызывает неравномерность миоцитарных границ и искажению нормальной архитектуры миокарда. На практике, воспалительные клеток внутри или рядом с миоцитами очень удобно испрользовать как биомаркеры, которые требуют более тщательного изучения. С осторожностью следует использовать любую попытку оценить лимфоциты по отношению к миоцитам в области артефактов из за работы биотомом.
Инфильтрация воспалительными клетками вызывает неравномерность миоцитарных границ и искажению нормальной архитектуры миокарда. На практике, воспалительные клеток внутри или рядом с миоцитами очень удобно испрользовать как биомаркеры, которые требуют более тщательного изучения. С осторожностью следует использовать любую попытку оценить лимфоциты по отношению к миоцитам в области артефактов из за работы биотомом.
Иногда ишемическое повреждение (периоперационной ишемии или после в связи с васкулопатии аллотрансплантата) индуцирует очаги некроза кардиомиоцитов. Малые очаги с участием нескольких миоцитов могут быть не отличимы от ACR при малом увеличении. Большие очаги могут быть легко подтверждаться коагуляционным некрозом , как правило, с миоцитами лишенными ядра и переменной степенью резорбции. Независимо от размера, ишемические очаги часто сопровождаются макрофагоми и небольшим количеством лимфоцитов и нейтрофилов. В некоторых случаях эти участки могут быть резко разграничены и разными по форме.
Вакуолизированные миоциты могут являться результатом хронической ишемии. Нередко, наблюдаются артефакты, особенно когда миоциты находятся в поперечном сечении, все это может имитировать myocytolysis. Тщательная оценка на малом увеличении помогает заметить картину «шахматной доски». Миоциты чередующиеся с сократительными элементами,участками просветления, литическими областями. Все это должны вызывать тревогу и предположительный диагноз хронической ишемии.
Интерстиций
Кроме увеличения интерстициального инфильтрата (см. выше), изменения видимые на малом увеличении, которые можно наблюдать в интерстиции миокарда в основном отек и фиброз. Отек наблюдается при тяжелом ACR (класс 3R), сердечной недостаточности и/или поврежденной сосудистой сетке в результате повреждения антителами. Интерстиций имеет бледно-базофильный, слегка пузырчатый вид, наилучшее всего видный, в периваскулярных и/или перимиоцитарных пространствах. Эти находки должны быть сопоставлены с оценкой на большом увеличении микрососудов на наличие признаков антител опосредованных реакций оторжения. Отек не следует путать с артефактом, вызванным особеностями приготовления биопсии . Это могут быть маленькие или большие пространства между миоцитами без каких-либо признаков видимых при настоящем отеке.
Эти находки должны быть сопоставлены с оценкой на большом увеличении микрососудов на наличие признаков антител опосредованных реакций оторжения. Отек не следует путать с артефактом, вызванным особеностями приготовления биопсии . Это могут быть маленькие или большие пространства между миоцитами без каких-либо признаков видимых при настоящем отеке.
Увеличение интерстициального фиброза чаще всего в форме широких областей отсутствия миоцитов с заменой на фиброзную ткань. Эти поражения, как правило, связаны с предыдущей биопсией и видны в непосредственной близости от места биопсии . Особенности изменений ткани на месте биопси обсуждаются в другом учебнике. Рубцы, связанные с хронической ишемией миокарда могут быть трудно отличить от просто области предыдущей биопсии. Наблюдение на малом увеличении рубцов «звездчатых форм» должны вызывать последующую оценку на большом увеличении мощности для выявления дополнительных признаков хронической ишемии. Независимо от наличия этих признаков, интерстициальный фиброз не является особенностью ACR.
Наличие сосудов
Свидетельство наличия сердечной васкулопатии аллотрансплантата редко можно заметить на EMB и оно может быть легко спутано с артефактами . строения кровеносных сосудов. Большие сосуды, особенно в сочетании с жировой или нервной тканью должны оцениваться на большом увеличении для выявленя перфорации. Патологические изменения в сосудистой системе лучше всего оценивается при большом увеличении.
Общество Сердечно-Сосудистой патологии и его инернет страница, не оказывает медицинских советов или рекомендаций. Вы не должны заменить консультации с квалифицированными специалистами какой либо информацией из наших статей.
Строение миосимпласта
Миосимпласт
представляет собой совокупность
слившихся клеток.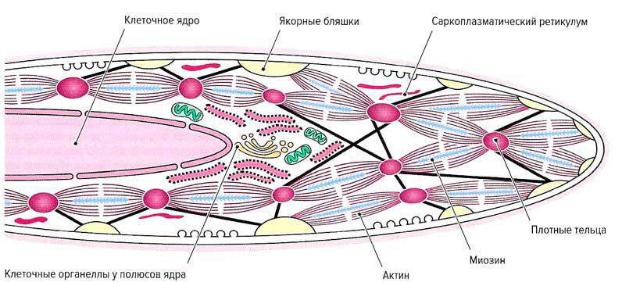
Строение миосателлитов
Миосателлиты — одноядерные клетки, прилежащие к поверхности миосимпласта. Эти клетки отличаются низкой дифференцировкой и служат взрослыми стволовыми клетками мышечной ткани. В случае повреждения волокна или длительном увеличении нагрузки клетки начинают делиться, обеспечивая рост миосимпласта.
Гладкая мышечная ткань
Это
ткань энтомезенхимного происхождения,
которая делится на два вида: висцеральную
и сосудистую. В эмбриональном гистогенезе
даже электронно-микроскопически трудно
отличить мезенхимные предшественники
фибробластов от гладких миоцитов. В
малодифференцированных гладких миоцитах
развиты гранулярная эндоплазматическая
сеть, комплекс Гольджи. Тонкие филаменты
ориентированы вдоль длинной оси клетки.
По мере развития размеры клетки и число
филаментов в цитоплазме возрастают.
Постепенно объем цитоплазмы, занятый
сократительными филаментами, увеличивается,
расположение их становится все более
упорядоченным. Пролиферативная активность
гладких миоцитов в миогенезе постепенно
снижается. Это происходит в результате
увеличения продолжительности клеточного
цикла, выхода клеток из цикла репродукции
и перехода в дифференцированное
состояние. Однако и в дефинитивном
состоянии в гладкой мышечной ткани
клеточная регенерация в виде размножения
миоцитов полностью не прекращается.
Существуют данные о том, что пролиферация
и дифференцировка в большей степени
свойственна субпопуляции малых (по
размерам) гладких миоцитов.
В эмбриональном гистогенезе
даже электронно-микроскопически трудно
отличить мезенхимные предшественники
фибробластов от гладких миоцитов. В
малодифференцированных гладких миоцитах
развиты гранулярная эндоплазматическая
сеть, комплекс Гольджи. Тонкие филаменты
ориентированы вдоль длинной оси клетки.
По мере развития размеры клетки и число
филаментов в цитоплазме возрастают.
Постепенно объем цитоплазмы, занятый
сократительными филаментами, увеличивается,
расположение их становится все более
упорядоченным. Пролиферативная активность
гладких миоцитов в миогенезе постепенно
снижается. Это происходит в результате
увеличения продолжительности клеточного
цикла, выхода клеток из цикла репродукции
и перехода в дифференцированное
состояние. Однако и в дефинитивном
состоянии в гладкой мышечной ткани
клеточная регенерация в виде размножения
миоцитов полностью не прекращается.
Существуют данные о том, что пролиферация
и дифференцировка в большей степени
свойственна субпопуляции малых (по
размерам) гладких миоцитов.
Строение гладкой мышечной ткани.
Структура дефинитивных гладких миоцитов (лейомиоцитов), входящих в состав внутренних органов и стенки сосудов, имеет много общего, но в то же время характеризуется гетероморфией. Так, в стенках вен и артерий обнаруживаются овоидные, веретеновидные, отростчатые миоциты длиной 10-40 мкм, доходящие иногда до 140 мкм.
Наибольшей
длины гладкие миоциты достигают в стенке
матки — до 500 мкм. Диаметр миоцитов
колеблется от 2 до 20 мкм. В зависимости
от характера внутриклеточных
биосинтетических процессов различают
контрактилъные и секреторные миоциты.
Первые специализированы на функции
сокращения, но вместе с тем сохраняют
секреторную активность. Плазмолемма
расслабленной клетки имеет ровную
поверхность, а при сокращении становится
складчатой. В центре клетки имеется
палочковидное ядро, которое при сокращении
клетки спиралевидно изгибается.
Практически все ядра миоцитов содержат
диплоидное количество ДНК. Гладкая
эндоплазматическая сеть занимает
примерно 2-7% объема цитоплазмы, а
гранулярная сеть в контрактильных
миоцитах выражена плохо. Митохондрии
мелкие, сферические или овоидные,
расположены у полюсов ядра. Характерной
чертой гладких миоцитов является наличие
множества впячиваний (кавеол) плазмолеммы,
содержащих ионы кальция.
Митохондрии
мелкие, сферические или овоидные,
расположены у полюсов ядра. Характерной
чертой гладких миоцитов является наличие
множества впячиваний (кавеол) плазмолеммы,
содержащих ионы кальция.
Секреторные миоциты (синтетические) по своей ультраструктуре напоминают фибробласты, однако содержат в цитоплазме пучки тонких миофиламентов, расположенные на периферии клетки. В цитоплазме хорошо развиты комплекс Гольджи, гранулярная эндоплазматическая сеть, много митохондрий, гранул гликогена, свободных рибосом и полисом. По степени зрелости такие клетки относят к малодифференцированным.
Сократительный
аппарат миоцитов представлен тонкими актиновыми
филамен-тами (гладкомышечным альфа-актином),
связанными с тропомиозином. Толстые
нити состоят из миозина, мономеры
которого располагаются вблизи филаментов
актина. Соотношение актиновых и миозиновых
филаментов в гладком миоците составляет
12 к 1. Важным компонентом контрактильного
аппарата миоцитов являются электронно-плотные
структуры — тельца прикрепления,
расположенные свободно в цитоплазме
(плотные тельца) или тесно связанные с
плазмолеммой. Основными белковыми
компонентами плотных телец являются
альфа-актинин, актин (немышечный) и
кальпонин, что позволяет расссматривать
их как функциональный эквивалент Z-линий
миофибрилл скелетной мышцы. Актиновые
филаменты фиксируются на плотных
тельцах. Промежуточные филаменты,
включающие десмин и виментин, обеспечивают
связи между плотными тельцами и
плазмолеммой, образуя прикрепительные
пластины.
Основными белковыми
компонентами плотных телец являются
альфа-актинин, актин (немышечный) и
кальпонин, что позволяет расссматривать
их как функциональный эквивалент Z-линий
миофибрилл скелетной мышцы. Актиновые
филаменты фиксируются на плотных
тельцах. Промежуточные филаменты,
включающие десмин и виментин, обеспечивают
связи между плотными тельцами и
плазмолеммой, образуя прикрепительные
пластины.
Сократительные
белки формируют решетчатую структуру,
закрепленную по окружности плазмолеммы,
поэтому сокращение выражается в
укорочении клетки, которая приобретает
складчатую форму, тогда как в состоянии
покоя клетка вытянута. При возникновении
нервного импульса, распространяющегося
по плазмолемме миоцита, происходит
повышение уровня внутриклеточного
Са2+, который поступает в цитоплазму из
кавеол, отшнуровывающихся в цитоплазму
в виде пузырьков. Высвобождение ионов
кальция приводит к каскаду реакций, в
результате которого происходит
полимеризация миозина и образование
перекрестных связей миозина вдоль
актиновых филаментов по мере развития
мышечного сокращения. Расслабление
мышцы возникает при восстановлении
концентрации исходного уровня Са2+
внутри клетки путем его перемещения
внутрь саркоплазматической сети. При
этом образовавшиеся в присутствии ионов
кальция связи между актином и миозином
нарушаются, акто-миозиновый комплекс
распадается, гладкий миоцит расслабляется.
Расслабление
мышцы возникает при восстановлении
концентрации исходного уровня Са2+
внутри клетки путем его перемещения
внутрь саркоплазматической сети. При
этом образовавшиеся в присутствии ионов
кальция связи между актином и миозином
нарушаются, акто-миозиновый комплекс
распадается, гладкий миоцит расслабляется.
Гладкие миоциты синтезируют протеогликаны, гликопротеиды, проколлаген, проэластин, из которых формируются коллагеновые и эластические волокна и основное вещество межклеточного матрикса. Взаимодействие миоцитов осуществляется с помощью цитоплазматических мостиков, взаимных впячиваний, нексусов, десмосом или простых участков мембранных контактов клеточных поверхностей.
«Только успешные ученые должны занимать лидерские позиции». Президент координационного комитета Международной ассоциации русскоговорящих ученых Игорь Ефимов — о проблемах и будущем биомедицины
[Ch.]: Игорь, виртуально мы знакомы уже больше десяти лет, со времени первых активных дискуссий о судьбе и реформах российской науки. А твои научные интересы всегда были так или иначе связаны с сердцем. В этом смысле ничего не изменилось?
А твои научные интересы всегда были так или иначе связаны с сердцем. В этом смысле ничего не изменилось?
[ИЕ]: Я веду два направления исследований. Первое — физиология и биология сердца. Все больше мы работаем с сердцем человека, и все меньше — с моделями на животных. Это стало возможным благодаря тому, что за последние десять лет мы выстроили программу, по которой получаем сердца людей-доноров, отдавших свои органы либо на пересадку, либо на научные исследования. Пересадка в приоритете, конечно, но, если сердце не подходит для этих целей, его отдают нам. Второе направление — разработка новых видов биоэлектроники. Это разного рода имплантируемые приборы, устройства для лечения аритмии и прочее.
[Ch.]: Речь идет о программе доступа к донорским органам для всей американской науки или для конкретного университета?
[ИЕ]: Конкретно для нашей лаборатории. Вообще, это уже вторая история успеха. С 2004 по 2015 год я работал в Университете Вашингтона в Сент-Луисе. За эти годы мы получили и исследовали около 400 сердец. Мы работали с организацией, которая занимается контролем оборота донорских органов. В Америке система пересадки органов жестко регламентируется государством. В каждом регионе с сильными трансплантологическими программами есть одна организация, которая контролирует эту деятельность.
За эти годы мы получили и исследовали около 400 сердец. Мы работали с организацией, которая занимается контролем оборота донорских органов. В Америке система пересадки органов жестко регламентируется государством. В каждом регионе с сильными трансплантологическими программами есть одна организация, которая контролирует эту деятельность.
После того как я переехал в Вашингтон, мы наладили контакт с аналогичной организацией, в чью зону ответственности попадают все госпитали Вашингтона и окружающих графств соседних штатов Вирджиния и Мэриленд. Для чего это сделано? Представим, что потенциальный донор перед смертью попал в какой-то госпиталь. Есть органы, доступные для пересадки. Но в этом госпитале нет реципиентов, которым подойдет, допустим, почка. А в другом госпитале такой пациент есть. У службы по контролю есть полная информация о нуждающихся. Когда появляется донор, где бы он ни находился, можно сразу сказать, где будет самая лучшая клиническая картина после пересадки органа.
[Ch. ]: Что вы делаете с органом после того, как получили его?
]: Что вы делаете с органом после того, как получили его?
[ИЕ]: Например, сравнительные молекулярно-биологические исследования. Возьмем сердце здорового человека и пациента, который умер, скажем, от сепсиса. Как правило, гибель связана с остановкой сердца. Вопрос, что произошло в сердце при сепсисе? Оказалось, что при такой смерти сильно подавлен метаболизм. Мы обнаружили несколько тысяч связанных с этим процессом РНК, которые у здоровых и больных экспрессированы по-разному. Но здесь возникает проблема. Если мы говорим о тысячах РНК, то это очень сложный процесс. Непонятно, как повлиять на него — предотвратить смертельный исход.
Для этого нужно сделать следующий шаг. Экспрессия РНК контролируется ограниченным количеством контрольных белков (транскрипционных факторов). Мы ищем участки генома, с которыми связывается такой белок. А их уже не тысячи, а единицы. Конкретный пример — это еще не опубликованная работа, совсем свежее исследование. Мы посмотрели сердца больных со стенозом аорты.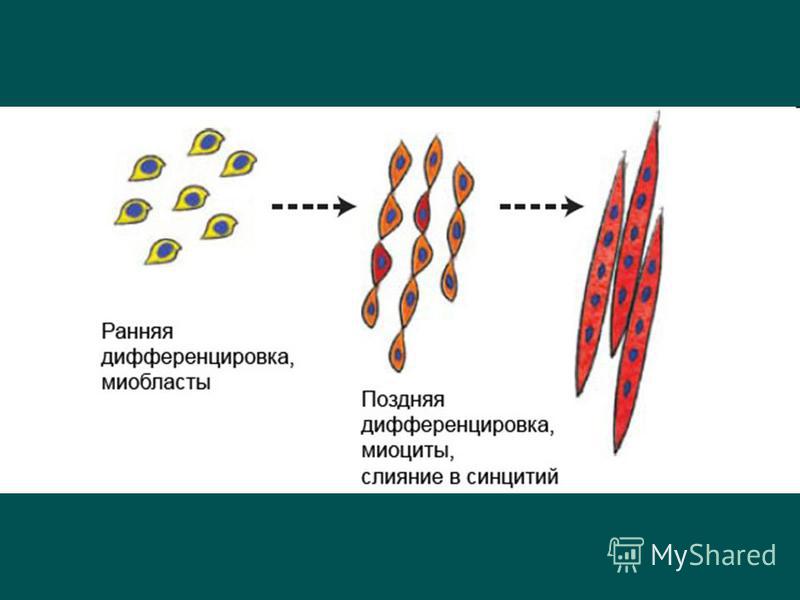 В этом случае сердце вынуждено качать кровь через сосуд, который полностью не открывается, через узкое отверстие, и это вызывает гипертрофию. Мышцы начинают работать с большей нагрузкой, что в конечном итоге ведет к сердечной недостаточности и к смерти пациентов. Мы нашли десять белков — транскрипционных факторов. Некоторые из них уже были известны, некоторые — нет. Но каждый из них контролирует десятки, сотни других генов. В этом случае можно подумать, как повлиять на эти белки, чтобы избежать заболевания.
В этом случае сердце вынуждено качать кровь через сосуд, который полностью не открывается, через узкое отверстие, и это вызывает гипертрофию. Мышцы начинают работать с большей нагрузкой, что в конечном итоге ведет к сердечной недостаточности и к смерти пациентов. Мы нашли десять белков — транскрипционных факторов. Некоторые из них уже были известны, некоторые — нет. Но каждый из них контролирует десятки, сотни других генов. В этом случае можно подумать, как повлиять на эти белки, чтобы избежать заболевания.
Или вот следующая технология, совершенно новая. Мы начали работу с Олегом Гусевым, молодым генетиком из Института физико-химических исследований RIKEN в Японии, также он работает в Казанском федеральном университете. Коллеги разработали метод анализа экспрессии генов, в котором, помимо прочего, определяются активные промотеры* и энхансеры** (см.ниже). В ряде генов не один, а два или даже три промотера. Можно посмотреть, как активируются те или иные промотеры у здорового человека и у больного. Мы уже провели базовые исследования. Взяли сердца здоровых доноров и посмотрели на отличия между мужчиной и женщиной, между клетками предсердия и желудочка — нашли тысячу ранее неизвестных промотеров. В этой области исследований все еще впереди.
Мы уже провели базовые исследования. Взяли сердца здоровых доноров и посмотрели на отличия между мужчиной и женщиной, между клетками предсердия и желудочка — нашли тысячу ранее неизвестных промотеров. В этой области исследований все еще впереди.
*Промотор в генетике — последовательность нуклеотидов ДНК, узнаваемая РНК-полимеразой как стартовая площадка для начала специфической, или осмысленной, транскрипции.
**Энхансер — небольшой участок ДНК, который после связывания с ним факторов транскрипции стимулирует транскрипцию с основных промоторов гена или группы генов.
[Ch.]: Так какой же прорыв случился в исследованиях сердца?
[ИЕ]: Скорее, мы совершили ряд важных не «открытий», а «закрытий». Существовало много теорий, объясняющих, как, например, начинается аритмогенез. Они были обоснованы наблюдениями на животных. В тот момент не было никаких данных, полученных на людях, но это были уже догмы, которые преподавали в университете кардиологам.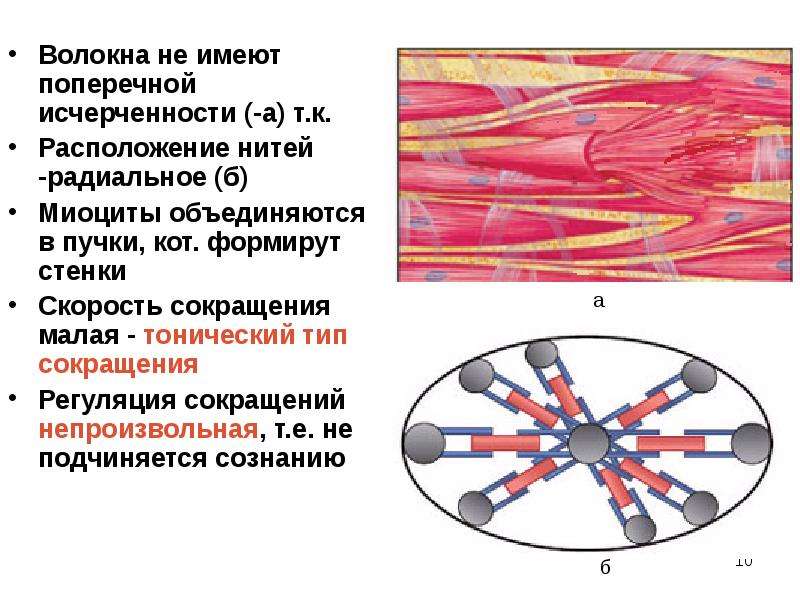 Нам удалось «закрыть» несколько таких теорий, потому что они не подтвердились.
Нам удалось «закрыть» несколько таких теорий, потому что они не подтвердились.
Нужно понимать, что многие механизмы и теории строятся на основе математических моделей. Например, существуют три конкурирующие между собой модели потенциала действия кардиомиоцита человека. Как правило, такие теории основаны на данных, которые получены не на человеке. Мы напрямую измерили потенциал действия в клетках сердца человека, посмотрели, как он реагирует на разного рода блокаторы. Оказалось, что ни одна из этих моделей не соответствует реальности.
[Ch.]: Как строятся такие модели и зачем они нужны?
[ИЕ]: Нужно изолировать миоцит, измерить параметры разных ионных каналов и написать уравнение для каждого из них. Потом свести все вместе в одной модели, чтобы описать генерацию и распространение волны возбуждения в клетках. Впервые это сделали в 1952 году Ходжкин и Хаксли. Они создали модель электрических механизмов, которые отвечают за генерацию и передачу нервного сигнала в гигантском аксоне кальмара. За эту работу в 1963 году они получили Нобелевскую премию по физиологии и медицине.
За эту работу в 1963 году они получили Нобелевскую премию по физиологии и медицине.
Миоциты сердца устроены чуть более сложно, чем нейроны. В клеточной мембране миоцита много разных ионных каналов. Одна из существующих моделей строится в основном на данных, которые были получены на животных. Для двух других уже использовали измерения, выполненные на клетках человека. Но даже две эти модели клетки человека абсолютно разные. Дело в том, что многие лаборатории в своей работе узко фокусируются на работе одного ионного канала. Известный биофизик, Йорам Руди (Yoram Rudy), которого я считаю своим ментором, метко заметил, что некоторые ученые сидят всю жизнь в поре ионного канала, никогда не выглядывая наружу. Получается, что есть узко специализированные исследования, которые даже между собой мало общаются. Чтобы интегрировать их знания, нужна математическая модель. Если она будет адекватной, с ее помощью можно, например, объяснить аритмогенез. Потом такая модель поможет описать работу всего сердца. Пока у нас недостаточно данных для разработки адекватных моделей.
Пока у нас недостаточно данных для разработки адекватных моделей.
[Ch.]: Когда вы получаете сердце человека, как долго с ним можно работать?
[ИЕ]: Сначала мы берем образцы, которые используются для молекулярной биологии. Пробы для измерения РНК, содержания различных белков можно заморозить и держать в таком виде годами. Мы зачастую используем образцы, замороженные десять лет назад. Для биомеханических исследований нужна живая ткань. В этом случае эксперимент длится не более шести-восьми часов. Последние несколько лет мы используем метод, который скопировали в нейронауках. Берем миокард, делаем срез толщиной 300 микрон — это слой, через который может пройти кислород. Если сделать чуть более толстый образец, то в середину через поверхность кислород не сможет проникнуть — там будет ишемия. Дальше этот образец помещаем в проточную камеру, через которую прокачиваем необходимые растворы, кислород. В такой камере можно исследовать метаболизм и механику, записывать электрические сигналы — делать полноценные исследованиями сердечной ткани.
В такой камере можно исследовать метаболизм и механику, записывать электрические сигналы — делать полноценные исследованиями сердечной ткани.
[Ch.]: Получается, вы разработали новую технологию для этой области исследований. Она уже тиражируется или вы продаете такие устройства?
[ИЕ]: Сейчас многие лаборатории используют такую технологию. Моя лаборатория придерживается философии открытых данных. То, что мы делаем, мы делаем совершенно открыто. Приведу пример из другой области. Мы развиваем оптическое картирование. Сначала мы красим ткани флуоресцентным красителем. После можно наблюдать, как электрический импульс распространяется по сердцу или как кальций циркулирует внутри клетки. Раньше эту технологию можно было развивать только в тех лабораториях, где есть хорошие инженеры. Мы опубликовали серию статей, в которых довели ее до такого уровня, что любой исследователь может взять и довести до эксперимента. Во-первых, наше программное обеспечение находится на открытом сервере.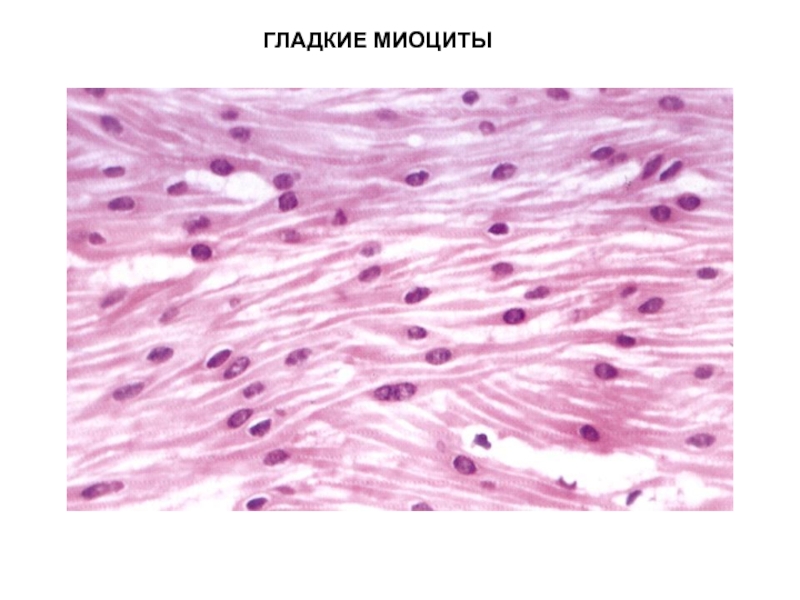 После регистрации любой пользователь может скопировать его и использовать, даже для коммерческих нужд. Мы не возражаем, главное — сослаться на нас. С недавних пор можно стало делать открытым не только программное обеспечение, но и само оборудование. Некоторые оптические приборы можно печатать на трехмерном принтере. В этом году мы опубликовали статью, где детально описали нашу систему картирования. Можно скачать все чертежи, загрузить программу в 3D-принтер и напечатать установку, аналогичную нашей. Конечно, есть расходные материалы и оптические компоненты, которые невозможно напечатать, — линзы, фильтры, камеру. Но их можно докупить и собрать полноценный экспериментальный образец. То есть мы делаем открытым и софт, и хард — пожалуйста, пользуйтесь.
После регистрации любой пользователь может скопировать его и использовать, даже для коммерческих нужд. Мы не возражаем, главное — сослаться на нас. С недавних пор можно стало делать открытым не только программное обеспечение, но и само оборудование. Некоторые оптические приборы можно печатать на трехмерном принтере. В этом году мы опубликовали статью, где детально описали нашу систему картирования. Можно скачать все чертежи, загрузить программу в 3D-принтер и напечатать установку, аналогичную нашей. Конечно, есть расходные материалы и оптические компоненты, которые невозможно напечатать, — линзы, фильтры, камеру. Но их можно докупить и собрать полноценный экспериментальный образец. То есть мы делаем открытым и софт, и хард — пожалуйста, пользуйтесь.
[Ch.]: Чем вы при этом руководствуетесь? Интересами глобальной науки?
[ИЕ]: Если бы в этой области был какой-то рынок, мы бы подумали о монетизации. Но спрос не велик. Есть фирмы, одна или две, которые зарабатывают на камерах.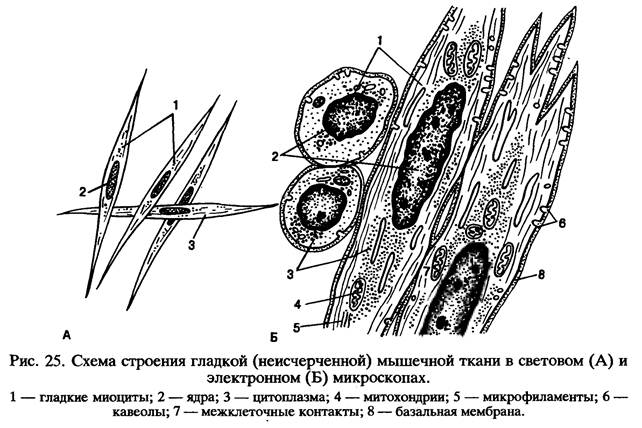 Камеры мы пока не умеем печатать. А все «железо» — в принципе дело простое. В данном случае для нас важнее, что наши статьи будут цитировать. Хотя главное даже не в этом. Студенты, которые разрабатывают приборы, находятся, как правило, на уровне бакалавра. У статьи, которую мы сейчас послали в Scientific Reports, первые два автора — студенты-бакалавры. Для них это опыт, который меняет жизнь. Они понимают, что могут внести вклад в науку. Для многих студентов это хороший пример.
Камеры мы пока не умеем печатать. А все «железо» — в принципе дело простое. В данном случае для нас важнее, что наши статьи будут цитировать. Хотя главное даже не в этом. Студенты, которые разрабатывают приборы, находятся, как правило, на уровне бакалавра. У статьи, которую мы сейчас послали в Scientific Reports, первые два автора — студенты-бакалавры. Для них это опыт, который меняет жизнь. Они понимают, что могут внести вклад в науку. Для многих студентов это хороший пример.
[Ch.]: Проектами с открытым кодом уже никого не удивишь: таких проектов много. Вы говорите об «открытом железе». Это может привести к переформатированию всего рынка научного оборудования? Ведь обычно научные приборы очень дорогие, потом что их производят и продают монополисты.
[ИЕ]: Мы в статье даже таблицу привели, во сколько обойдется установка, если ее купить и если напечатать по нашим бесплатным чертежам. Разница огромная.
Но я бы вот о чем хотел бы сейчас поговорить — о важной проблеме биомедицинских наук, воспроизводимости результатов. Известный исследователь Джон Иоаннидис (John Ioannidis) опубликовал целую серию статей, в которых показал, что в ряде направлений биомедицинской науки 80% опубликованных статей не воспроизводятся. Были даже такие примеры: производитель лекарств в области онкологии видит по публикациям, что ученые открыли какое-то соединение, способное влиять на определенный вид рака. Они выкупают лицензию, начинают клинические испытания и не получают результата. Потом пытаются воспроизвести результаты изначального исследования — ничего не получается.
Известный исследователь Джон Иоаннидис (John Ioannidis) опубликовал целую серию статей, в которых показал, что в ряде направлений биомедицинской науки 80% опубликованных статей не воспроизводятся. Были даже такие примеры: производитель лекарств в области онкологии видит по публикациям, что ученые открыли какое-то соединение, способное влиять на определенный вид рака. Они выкупают лицензию, начинают клинические испытания и не получают результата. Потом пытаются воспроизвести результаты изначального исследования — ничего не получается.
[Ch.]: В чем причина? Обман, или биологические объекты слишком сложные системы, в работе с которыми возможны ошибки? Может, что-то еще?
[ИЕ]: Не думаю, что в большинстве случаев это обман. Скорее всего, в каком-то смысле — систематическая ошибка, связанная с работой журналов и отбором публикаций. Объясню на простом примере. Представим себе гипотезу, что a+b=c. Сразу условимся: это неправильная гипотеза. Допустим, двадцать групп получили деньги на исследования, чтобы доказать, что a+b=c. Для многих биологических экспериментов ошибка в пять процентов — это нормально. Двадцать лабораторий провели эксперименты, только в одной из них получили положительный результат. Догадайтесь, кто опубликует статью? Получившие положительный результат. Одна из проблем биомедицины — очень трудно опубликовать отрицательный результат. Не было никакой подделки, просто была ошибка эксперимента. Но она опубликована и стала частью научной литературы, в отличие от 19 экспериментов с отрицательным результатом. Если кто-то попытался это воспроизвести и не смог, ему скажут: «Мы не публикуем негативные результаты». Если кто-то воспроизвел и попытался опубликовать — «Мы не публикуем подтверждающие результаты». Это, кстати, сильно отличает биологию от физики, где все наоборот.
Для многих биологических экспериментов ошибка в пять процентов — это нормально. Двадцать лабораторий провели эксперименты, только в одной из них получили положительный результат. Догадайтесь, кто опубликует статью? Получившие положительный результат. Одна из проблем биомедицины — очень трудно опубликовать отрицательный результат. Не было никакой подделки, просто была ошибка эксперимента. Но она опубликована и стала частью научной литературы, в отличие от 19 экспериментов с отрицательным результатом. Если кто-то попытался это воспроизвести и не смог, ему скажут: «Мы не публикуем негативные результаты». Если кто-то воспроизвел и попытался опубликовать — «Мы не публикуем подтверждающие результаты». Это, кстати, сильно отличает биологию от физики, где все наоборот.
В последнее время стало нормой, что многие издатели научной литературы требуют, чтобы данные были открытыми. Если вы печатаете статью, будьте добры опубликовать не только методы и красивые графики, но и исходные данные. Мы идем по пути полной открытости.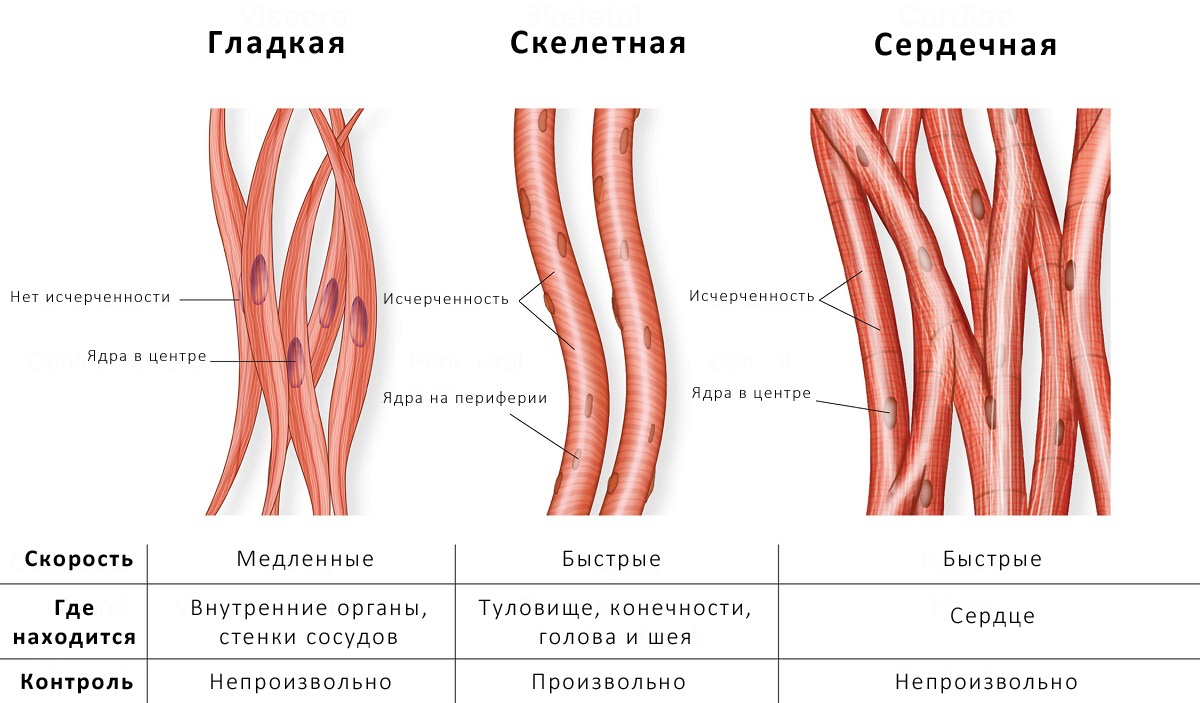 Публикуем программный код, который использовали для обработки данных. Публикуем чертежи оборудования. Если вы хотите воспроизвести наши данные, вы можете напечатать установку, которая в точности такая, как у нас. Само собой, все исходные данные тоже открытые — можете проверить, соответствуют ли наши графики реальности.
Публикуем программный код, который использовали для обработки данных. Публикуем чертежи оборудования. Если вы хотите воспроизвести наши данные, вы можете напечатать установку, которая в точности такая, как у нас. Само собой, все исходные данные тоже открытые — можете проверить, соответствуют ли наши графики реальности.
Сейчас, к сожалению, из напечатанной научной статьи часто непонятно, как обработаны данные. В одной из статей мы показали, что во многих работах в нашей области сигналы обработаны неправильно. Фильтры, которые используются для приема электрического сигнала, определенным образом искажают сигналы. Если у исследователя нет определенной инженерной подготовки, он может неверно интерпретировать полученную информацию.
[Ch.]: Ты сказал, что многие лаборатории всю жизнь занимаются исследованием одного ионного канала. Так что характерно для современной биомедицины? Идет движение широким фронтом или есть узкие точки, на которых сконцентрированы усилия?
[ИЕ]: Мне кажется, сейчас произошел принципиальный философский поворот. Предыдущее поколение исследователей фактически строило карьеру на одном белке. Я знаю много таких лабораторий. Помню, около двадцати лет назад первый раз рецензировал гранты. В заявке написано: «Ежегодно в Америке от сердечно-сосудистых заболеваний умирает миллион, лекарства не работают, мы сделаем суперлекарство, возьмем конкретный ионный канал и заблокируем его». Такие заявки до сих пор приходят. Но нет ни одного лекарства, которое было бы сделано на этом принципе.
Предыдущее поколение исследователей фактически строило карьеру на одном белке. Я знаю много таких лабораторий. Помню, около двадцати лет назад первый раз рецензировал гранты. В заявке написано: «Ежегодно в Америке от сердечно-сосудистых заболеваний умирает миллион, лекарства не работают, мы сделаем суперлекарство, возьмем конкретный ионный канал и заблокируем его». Такие заявки до сих пор приходят. Но нет ни одного лекарства, которое было бы сделано на этом принципе.
За редким исключением фокусироваться на одном белке или узком участке бессмысленно. Как правило, заболевания такого рода многофакторные. Задействованы и метаболизм, и физиология, и механика, и многое другое. Последние десять лет активно развиваются омиксные технологии — протеомика, геномика. Мы смотрим не на один белок, не на одну РНК, а на весь ансамбль. Сейчас очень интересные исследования и по микробиому. Недавно омиксные технологии стало можно применять к одной клетке. Как это делалось до последнего времени? Берете образец ткани, рубите ее в порошок, измеряете содержание белков или РНК. Это делалось на образце, в котором смесь клеток — миоциты, фибробласты и прочие. Сейчас сначала клетки с помощью какой-нибудь метки можно отсортировать по типам, а уже после проанализировать. Оказалось, что фибробластов — восемь разных типов, миоцитов — четыре.
Это делалось на образце, в котором смесь клеток — миоциты, фибробласты и прочие. Сейчас сначала клетки с помощью какой-нибудь метки можно отсортировать по типам, а уже после проанализировать. Оказалось, что фибробластов — восемь разных типов, миоцитов — четыре.
[Ch.]: Мы не уходим в бесконечную сложность?
[ИЕ]: К счастью, нет. Миоцитов всего четыре типа. Их соотношение при заболевании меняется. Это очень интересно. Можно наблюдать, как при заболевании мы переходим от здорового фенотипа к нездоровому, искать точку невозврата.
Биология стала интересной потому, что она смотрит на все большую картину. Недавно в нашей области был выдан беспрецедентный грант. Группа исследователей из Гарварда получила 75 миллионов долларов на пять лет. Идея проекта — придумать принципиально новый подход к сердечно-сосудистой науке. Все, что мы делали раньше, — это неправильный подход. Фокусируемся на одном белке — это не работает. Фокусируемся на какой-то гипотезе — защищаем ее годами любой ценой, даже если она неверна.
Очень важная идея — сломать барьеры между науками и сферами деятельности. Если посмотреть на карту смертности в США (возможно, в Российской Федерации похожая ситуация), очень четко видны регионы, где смертность от конкретного заболевания гораздо выше. Почему? Чтобы понять, нам нужен доступ к разным данным. Например, есть компании, которые продают еду. Они точно знают, что в одной деревне любят более соленые чипсы, чем в другой. У них есть линейка разных продуктов, которые они отправляют, исходя из предпочтений. Таких примеров много. Если получить доступ к данным о пищевых преференциях, можно понять, кто больше получает жиров, углеводов или каких-то пищевых добавок. Это тоже должно быть частью общей картины.
[Ch.]: Тогда нужно получать данные о качестве воздуха и о других параметрах.
[ИЕ]: Естественно. Практически ко всему, что можно измерить. В свое время в городе Фармингтон в Массачусетсе решили исследовать всех жителей города. Описали около 20 000 человек и до сих пор ведут за ними наблюдения. Для каждого жителя есть клиническая запись: его или ее генетика, все заболевания, врожденные пороки, электрокардиография, прочее. Они фиксируют данные и о погоде, качестве воздуха и многом другом. Нашли много интересного, в том числе о вредных привычках. Например, курение, как и ожирение, распространяются точно так же, как инфекционные заболевания. В обществе, где никто не курит, появляется один человек, который курит. Сначала люди начинают относиться к этому снисходительно, потом ближайшее окружение курящего тоже начинает курить. Привычка распространяется.
Для каждого жителя есть клиническая запись: его или ее генетика, все заболевания, врожденные пороки, электрокардиография, прочее. Они фиксируют данные и о погоде, качестве воздуха и многом другом. Нашли много интересного, в том числе о вредных привычках. Например, курение, как и ожирение, распространяются точно так же, как инфекционные заболевания. В обществе, где никто не курит, появляется один человек, который курит. Сначала люди начинают относиться к этому снисходительно, потом ближайшее окружение курящего тоже начинает курить. Привычка распространяется.
[Ch.]: Мне кажется, это уже область интересов социологов или психологов.
[ИЕ]: Тем не менее мы видим, что социальные явления распространяются так же, как бактериальная инфекция. Для распространения курения, ожирения, алкоголизма важны не только генетические предпосылки, но семейные традиции — во многом это социальный феномен. Если кто-то пьет рядом, с какой-то вероятностью я тоже начну. Медицина будущего должна рассматривать человека на всех уровнях — от генетики и физиологии до социальных феноменов, технологий производства пищи, качества воздуха и воды. Такой системный подход сегодня становится реальностью.
Такой системный подход сегодня становится реальностью.
[Ch.]: Это происходит за счет того, что у нас сегодня просто больше данных?
[ИЕ]: Во-первых, за счет того, что возникло понимание необходимости в таком подходе. Во-вторых, возникала наука больших данных и наука безразмерных сетей, автором которой является известный ученый Альберт Барабаши. Он, кстати, один из соисполнителей гранта, который я упомянул выше. Это большой прорыв, потому что появилась возможность количественно изучать и соотносить разные уровни знания друг с другом.
[Ch.]: Тогда должны появиться новые личности, ученые нового типа, которые будут интегрировать знания.
[ИЕ]: Не только личности. Нужны решения, в том числе на политическом уровне. Хороший пример — Дания. Эта маленькая страна стала первой в мире, где все граждане охвачены похожим проектом. Для каждого жителя есть данные о его геноме, кардиологии, онкологии, все анализы. Все собрано в единую базу. Теперь исследователи, получив соответствующий доступ, могут посмотреть на генетические, электрокардиографические, метаболические данные, чтобы начать искать корреляции между геномом и заболеваниями.
Пример из близкой мне области. Анализ кардиограмм. Кардиологов учат, что есть разные типы кривых на кардиограммах. Было четко показано, что многие наблюдаемые морфологии зависят от полиморфизмов в конкретных генах. То есть кардиология из описательной стала количественной генетической наукой. Это важно, потому что кардиограмма часто является предсказателем сердечной смерти. Так что системный многоуровневый подход к медицине — это уже настоящее. Правда, только в тех странах, где на политическом уровне было понимание важности такого подхода.
[Ch.]: Вернемся к вашим исследованиям. По крайней мере у меня сложилось мнение, что в США, даже в науке, принято зарабатывать. Из науки растут стартапы, из них — работающие предприятия, которые приносят доход. Как у вас с коммерциализацией?
[ИЕ]: Недавно мне попалась на глаза статистика, что лишь 6−7% ученых США идут по этому пути. Академическая карьера — это высокая зарплата, стабильная пожизненная позиция. Если ты занимаешься нормальной наукой, тебе нет нужды уходить в бизнес. Конечно, есть лидеры типа Стэндфорда или Массачусетского технологического института, где культура совершенно другая. Там большинство профессоров занимаются предпринимательской деятельностью. В этих университетах при найме на работу рассматриваются не только академические публикации, но и сколько у тебя патентов, сколько сотен миллионов долларов ты заработал. Но в подавляющем большинстве университетов это совершенно не так. Даже университеты, которые входят в топ-5 в области биомедицины, могут иметь очень мало стартапов. Это традиционные академические учреждения. Лидеров, которые научились транслировать знания в деньги, не так много. Все пытаются их копировать, но культуру сменить очень трудно.
Конечно, есть лидеры типа Стэндфорда или Массачусетского технологического института, где культура совершенно другая. Там большинство профессоров занимаются предпринимательской деятельностью. В этих университетах при найме на работу рассматриваются не только академические публикации, но и сколько у тебя патентов, сколько сотен миллионов долларов ты заработал. Но в подавляющем большинстве университетов это совершенно не так. Даже университеты, которые входят в топ-5 в области биомедицины, могут иметь очень мало стартапов. Это традиционные академические учреждения. Лидеров, которые научились транслировать знания в деньги, не так много. Все пытаются их копировать, но культуру сменить очень трудно.
Лично у меня есть планы довести свои исследования до практики. Я основал несколько компаний. Одна из них уже близка к выходу на рынок. Мы создаем прибор для лечения мерцательной аритмии. Уже прошли успешные клинические испытания. Когда мы покажем, что прибор работает, то выйдем на огромный рынок. По нашим расчетам — около четырех миллиардов долларов в год. Только что получили венчурное финансирование на 17 миллионов долларов. Это будет реальный вклад в медицину.
По нашим расчетам — около четырех миллиардов долларов в год. Только что получили венчурное финансирование на 17 миллионов долларов. Это будет реальный вклад в медицину.
[Ch.]: Судя по всему, это технология, не связанная с геномикой?
[ИЕ]: Реальность такова, что все мечты, которые мы только что обсуждали, пока к лечению никакого отношения не имеют. Лечение в аритмологии — это стимуляторы, дефибрилляторы, различные внешние воздействия. Работают старые, давно проверенные подходы. Идеи, которые мы сейчас внедряем, — результат двадцати лет работы. Сама компания, о которой я говорю, была основана десять лет назад. Я всегда говорю студентам, что в биомедицинской инженерии карьера состоит в следующем. Вы закончили университет, получили докторскую степень, стали доцентом и следующие десять лет работаете над фундаментальными задачами. Делаете открытия, печатаете статьи, получаете гранты — поднимаетесь по академической лестнице до полного профессора. К этому времени у вас есть открытия, которые можно запатентовать. После этого создаете фирму и, соответственно, начинаете трансляцию на практический рынок. У меня примерно так и получилось.
[Ch.]: Вернемся еще раз в прошлое, когда мы активно дискутировали о судьбе российской науки. Можешь сказать, удалось что-то изменить за эти годы?
[ИЕ]: Как раз десять лет назад была создана RASA. В этом году будем праздновать юбилей — приезжай на десятилетие в ноябре. Мне кажется, вклад диаспоры был очень важен «за кулисами». Мы помогли Министерству образования и науки создать и запустить программу мегагрантов, всегда участвовали в обсуждении реформ. Кроме того, мы создали центры RASA в Казани, Санкт-Петербурге, Томске. Они неплохо работают. В каждый центр входят лаборатории членов нашей ассоциации. В этих точках роста студенты и научные сотрудники имеют возможность работать с профессорами из ведущих университетов мира. Это могут быть и краткосрочные поездки — командировки, и стажировки в лабораториях на Западе, где ученые получают новые знания и контакты.
Как правило, для создания центра подписывается договор между RASA и соответствующим университетом. Финансирование выделяется либо в рамках программы «5−100», либо сам университет находит дополнительные источники. Важная вещь: в каждой лаборатории есть местный кадр, как правило молодой активный ученый, которого назначают заместителем директора лаборатории, и он растет до уровня завлаба. Он получает опыт работы и руководства и в России, и за рубежом. Профессор — «понаехавший», а его заместитель — местный. Мне кажется, это почти идеальный механизм роста молодых завлабов.
Сейчас, в связи со сменой министерства, динамика некоторых программ потерялась. Последние несколько лет я почти каждые полгода езжу в Москву, чтобы знакомиться с новыми людьми в министерстве. Это не совсем нормальная ситуация. Хотелось бы стабильности. В ассоциации есть костяк активных ученых, которые нацелены на развитие науки в России. Нужна государственная программа по работе российских ученых на мировом научном рынке, в ведущих университетах и лабораториях мира. Только преуспевшие в мировом научном сообществе российские ученые должны занимать лидерские позиции в России. RASA готова помочь росту ученых из России в мировом научном пространстве, но для успеха такой программы нужны механизмы возврата в Россию успешных ученых.
Егор Задереев
Разработан новый метод превращения стволовых клеток в миоциты uMEDp
Данная методика применима как к эмбриональным, так и к индуцированным плюрипотентным стволовым клеткам.По словам Сузуки, специалисты давно искали легкий способ эффективной дифференцировки стволовых клеток в мышечные клетки, пригодные для применения в клинической практике. Он считает, что его группе удалось решить эту задачу путем адаптации метода, ранее применяемого для трансформации стволовых клеток в нейроны.
Важным преимуществом нового подхода перед существующими методами получения мышечных клеток заключается в том, что он позволяет получать большое количество клеток без генетического вмешательства. Секрет заключается в выращивании клеток в виде сфер, свободно плавающих в среде, содержащей высокие концентрации двух факторов роста: фактора роста фибробластов-2 и фактора роста эпидермиса. Комбинация этих двух факторов запускает дифференцировку плюрипотентных клеток в мышечные.
Помимо этого новый протокол обладает еще целым рядом преимуществ. Во-первых, среда культивирования клеток не содержит продуктов животного происхождения, что еще больше повышает безопасность получаемых клеток с точки зрения клинического применения. Во-вторых, выращивание клеток в виде сфер значительно ускоряет их деление и наращивание количества. В-третьих, 40-60% клеток получаемой популяции являются зрелыми миоцитами или мышечными клетками-предшественниками, что значительно превышает результаты, обеспечиваемые более ранними не-генетическими методами получения мышечных клеток из иПСК или ЭСК.
В прошлом году Сузуки продемонстрировал, что трансплантация другого типа стволовых клеток человека обеспечивала определенное улучшение выживаемости и мышечной функции в крысиной модели бокового амиотрофического склероза, или болезни Шарко. (Это заболевание сопровождается деградацией мышечных волокон и утратой контроля над скелетной мускулатурой.) Получаемые с помощью предложенного авторами метода клетки-предшественники могут оказывать схожий и, возможно, значительно более выраженный эффект.
Новый метод можно также использовать для выращивания мышечных клеток из иПСК пациентов с болезнью Шарко, спинальной мышечной атрофией и другими миопатиями. Полученные в результаты культуры клеток, несущих определенные генетические мутации, можно использовать для изучения вызываемых ими заболеваний и скрининга экспериментальных препаратов.
Сузуки и его коллеги надеются, что дальнейшее усовершенствование состава среды культивирования сфер из стволовых клеток позволит еще больше увеличить численность получаемых популяций мышечных клеток, что облегчит перенос метода в клиническую практику.
Развитие ХСН у пациентов, перенесших миокардит как осложнение COVID-19
Клиническая картина вирусного миокардита значительно варьирует от минимальных симптомов до фульминантной сердечной недостаточности, кардиогенного шока, желудочковых аритмий, поствирусной кардиомиопатии и полного исчезновения без каких-либо остаточных явлений.
Миокардит возникает при широком спектре острых вирусных инфекций, включая аденовирус, вирус иммунодефицита человека (ВИЧ), вирус Эпштейна-Барр, вирус гриппа и многие другие. Данные наблюдений в сочетании с вирусологическими и молекулярными диагностическими исследованиями показывают, что энтеровирусы, включая вирус Коксаки, парвовирус и аденовирус занимают лидирующие позиции среди всех причин развития миокардита [7].
Многие вирусы, связанные с миокардитом, инфицируют сердце вторично после начального очага инфекции в легких или желудочно-кишечном тракте. Напротив, некоторые вирусы кардиотропны. Например, парвовирус-β19 может инфицировать эндотелиальные клетки венул, капилляров и артериол [1]. Далее следует активация цитокинов, вызывающая апоптоз эндотелиальных клеток, эндотелиальную дисфункцию и значительное накопление лимфоцитов в микрососудистом русле. Повреждение миоцитов – это результат нарушения перфузии, а не прямого проникновения вируса в миоциты. Миокардит после вирусной инфекции рассматривается через призму аутовоспалительного заболевания [5]. Воспалительный процесс может включать миоциты, интерстициальные элементы или сосудистую сеть сердца. Т-хелперные клетки продуцируются в ответ на антиген-презентирующие клетки с последующим высвобождением цитокинов — первичного медиатора повреждения тканей. В ответ на повреждение миоцитов происходит высвобождение аутоантигенов, что в свою очередь вызывает повреждающий аутоиммунный ответ — процесс, называемый молекулярной мимикрией [4].
Вирусные заболевания, в том числе коронавирус респираторного синдрома Ближнего Востока (MERS-CoV), были связаны с повреждением миокарда и миокардитом с повышением уровня тропонина, что, как считается, связано с повышенным физиологическим стрессом сердца, гипоксией или прямым повреждением миокарда [2,3,5,8-10]. Одним из первых сообщений о повреждении миокарда, связанном с SARS-CoV-2, было обследование 41 пациента с диагнозом COVID-19 в Ухане, Китай, где 5 пациентов (12%) имели высокочувствительный тропонин I выше порогового значения 28 пг/г [7]. Последующие исследования показали, что повреждение миокарда с повышенным уровнем тропонина может произойти у 7–17% пациентов, госпитализированных с COVID-19, и у 22–31% пациентов, госпитализированных в отделение интенсивной терапии [7–9]. Миокардит также был идентифицирован с высокой вирусной нагрузкой и мононуклеарными инфильтратами, выявленными при вскрытии некоторых пациентов с COVID-19 [7-10]. Фактически, одно исследование показало, что до 7% смертей, связанных с COVID-19, были вызваны миокардитом [6].
Острый миокардит имеет различную клиническую тяжесть и представляет собой серьезную диагностическую проблему в эпоху COVID-19. Пациенты с коронавирусной инфекцией могут испытывать боль в груди, одышку, аритмию и острую дисфункцию левого желудочка [5-9]. У пациентов с миокардитом уровни сывороточного тропонина будут отклоняться от нормы. NTpro-BNP остается нормальным.
Электрокардиограмма (ЭКГ) может имитировать острый коронарный синдром (ОКС). Нарушения ЭКГ возникают в результате воспаления миокарда и включают неспецифические отклонения ST-T, инверсию зубца T и отклонения сегмента PR и сегмента ST (депрессия и подъем). Эхокардиографическая оценка с большей вероятностью продемонстрирует аномалию движения фокальной стенки с активным значительным ОКС, в то время как тяжелые формы миокардита, связанного с COVID-19, не покажут либо дефектов движения стенок, либо дисфункции общих движений стенок [4,10]. Пациенты с сохраненной функцией левого желудочка на момент постановки диагноза, как правило, имеют хороший долгосрочный прогноз. Примерно половина пациентов с умеренно сниженной фракцией выброса левого желудочка выздоровеет в течение следующих 6–12 месяцев, 25% испытают хроническую систолическую дисфункцию и 25% будут ухудшаться и потребуют передовых методов терапии или трансплантации сердца [8].
По сравнению с контрольными группами, пациенты, выздоровевшие от COVID-19, по данным МРТ имели более низкую фракцию выброса левого желудочка, более высокие объемы левого желудочка, более высокую массу левого желудочка и повышенные изображения, взвешенные по T1 и T2.
ЭКГ и эхокардиографические отклонения на фоне COVID-19 являются маркерами тяжести заболевания и коррелируют с худшими исходами [4,29,30]. Более того, повышение уровня тропонина у пациентов с инфекцией COVID-19 напрямую связано с повышенным риском неблагоприятного исхода у пациентов с тяжелой инфекцией [5,9,10].
Общий результат показывает, что около 80% пациентов с тяжелой формой COVID-19 имеют поражение сердца и почти 25% имеют доказательства продолжающегося воспаления миокарда через три месяца после постановки диагноза.
Долгосрочные эффекты миокардита, связанного с SARS-CoV-2, не известны, но, как указано выше, вирусный миокардит может включать сердечную недостаточность, нарушение толерантности к физической нагрузке, предсердные тахиаритмии, желудочковые тахиаритмии, брадиаритмии и внезапную сердечную смерть. Субклинический миокардит может предвещать особенно высокий риск внезапной смерти при физической активности средней и высокой интенсивности, что вызывает обеспокоенность [5, 6].
Список литературы:
- Bültmann BD, Sotlar K, Klingel K (2004) Parvovirus B19. N Engl J Med 350:2006–2007
- Chen L, Li X, Chen M, Feng Y, Xiong C. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res. 2020; 116: 1097-1100
- Chen N, Zhou M, Dong X et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020; 395: 507-513
- Fujinami RS, von Herrath MG, Christen U, Whitton JL (2006) Molecular mimicry, bystander activation, or viral persistence: infections and autoimmune disease. Clin Microbiol Rev 19:80–94
- Lasrado N, Yalaka B, Reddy J (2020) Triggers of inflammatory heart disease. Front Cell Dev Biol 8:192
- Liu Y, Yang Y, Zhang C et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci China Life Sci. 2020; 63: 364-374
- Mall G, Klingel K, Albrecht M, Seemann M, Rieger P, Kandolf R (1991) Natural history of coxsackievirus B3-induced myocarditis in ACA/Sn mice: viral persistence demonstrated by quantitative in situ hybridization histochemistry. Eur Heart J 12:121–123
- Meng J, Xiao G, Zhang J et al. Renin-angiotensin system inhibitors improve the clinical outcomes of COVID-19 patients with hypertension. Emerg Microbes Infect. 2020; 9: 757-760
- Vaduganathan M, Vardeny O, Michel T, McMurray JJV, Pfeffer MA, Solomon SD. Renin-angiotensin-aldosterone system inhibitors in patients with Covid-19. N Engl J Med. 2020; 382: 1653-1659
- Zhu ZW, Tang JJ, Chai XP et al. [Comparison of heart failure and 2019 novel coronavirus pneumonia in chest CT features and clinical characteristics]. Zhonghua Xin Xue Guan Bing Za Zhi. 2020; 48 ([Chinese]): E007
Медицинская академия имени С.И. Георгиевского ФГАОУ ВО «КФУ им. В.И. Вернадского». Мышечная ткань.
МЫШЕЧНАЯ ТКАНЬ.=М.Т.
По МОРФОЛОГИЧЕСКОЙ классификации есть 2 вида МТ:1) ПОПЕРЕЧНОПОСАТАЯ (или исчерченная) МТ, 2) ГЛАДКАЯ (или НЕисчерченная) М.Т. Поперечнополосатая МТ подразделяется на 2 вида: А) поперечнополосатая СЕРДЕЧНАЯ МТ,Б) поперечнополосатая СКЕЛЕТНАЯ МТ.
Поперечнополосатая СКЕЛЕТНАЯ МТ:
Она состоит из поперечнополосатых СКЕЛЕТНЫХ мышечных ВОЛОКОН. Одно мышечное волокно состоит из 2-ух тканевых компонентов: 1) многоядерный МИОСИМПЛАСТ,2) одноядерные клетки-СПУТНИКИ, или МИОСАТЕЛЛИТОЦИТЫ.
ГЛАВНЕЙШИЙ признак миосимпласта — в общей цитоплазме лежит 10 000 ядер. Т.к. миосимпласт НЕ клетка, его цитоплазма назыв. САРКОплазма, его оболочка –САРКОлемма, его аЭПС назыв. САРКОплазматическая сеть. Ядра лежат под сарколеммой, а в центре саркоплазмы находятся МИОФИБРИЛЛЫ. Это органеллы специального значения, к-рые обеспечивают главную функцию миосимпласта – это СОКРАЩЕНИЕ. Поперечная исчерченность находится в МИОФИБРИЛЛАХ. Исчерченность – это чередующиеся темные и светлые диски. Темный диск назыв. А-диск, светлый диск назыв. I-диск.
½ I-диска+полный А-диск+1/2 I-диска образуют САРКОМЕР. Это структурная единица миофибриллы. А-диск состоит из 2-ух разных надмолекулярных комплексов: 1)АКТИНОВЫЕ миофиламанты =ТОНКИЕ миофиламенты, 2) МИОЗИНОВЫЕ миофиламенты=ТОЛСТЫЕ миофиламенты. I-диск однородный и сост. только из АКТИНОВЫХ (или, тонких) миофиламентов.
МИОСАТЕЛЛИТОЦИТЫ – это ОДНОядерные клетки, лежащие в расщеплении сарколеммы миосимпласта. Функц.: явл. источником для РЕГЕНЕРАЦИИ миосимпласта после его разрыва.
Эмбр. источник для скелетной М.Т. — это МИОТОМ сомита.
Поперечнополосатая СЕРДЕЧНАЯ М.Т.:
Она состоит из поперечнополосатых СЕРДЕЧНЫХ мышечных ВОЛОКОН. Одно мышечное волокно — это цепочка клеток, соединенных «КОНЕЦ-в-КОНЕЦ» с помощью ВСТАВОЧНЫХ ДИСКОВ. Одна клетка назыв. КАРДИОМИОЦИТ.=КМЦ. Между мышечными волокнами нах. рыхлая неоформленная соединит. ткань. Она назыв. ЭНДОМИЗИЙ. Виды КМЦ-тов: 1) СОКРАТИТЕЛЬНЫЕ КМЦ.:а) имеет ЦИЛИНДРИЧЕСКУЮ (прямоугольную) форму, 1-2 ядра, в цитоплазме очень много МИОФИБРИЛЛ. Они состоят из САРКОМЕРОВ и имеют поперечную исчерченность.Сократительные КМЦ преобладают в ЖЕЛУДОЧКАХ. Функц.: сокращение.
2) СЕКРЕТОРНЫЕ КМЦ.: а) имеют ЗВЕЗДЧАТУЮ (отросчатую) форму, б) в цитоплазме много секреторных ГРАНУЛ. Секреторные КМЦ лежат в миокарде только ПРЕДСЕРДИЙ.
Функц.: секреция в кровь гормона «НАТРИЙУРЕТИЧЕСКИЙ фактор».
Особенность регенерации: Все КМЦ-ты взрослых людей находятся в G0-периоде и никогда НЕ ДЕЛЯТСЯ митозом (отсутствует пролиферация). Поэтому в зоне некроза новые КМЦ-ты НЕ образуются, но активируются фибробласты в ЭНДОМИЗИИ и секретируют коллаген. Из него формируется СОЕДИНИТЕЛЬНОТКАННЫЙ РУБЕЦ. Регенерация КМЦ происходит путем обновления органелл – внутриклеточная регенерация.
Эмбр. источник для сердечной М.Т. – фрагмент висцерального листка спланхнотома, называемый МИОЭПИКАРДИАЛЬНАЯ ПЛАСТИНКА.
ГЛАДКАЯ МТ мезенхимного типа:
Развив. из МЕЗЕНХИМЫ. Находятся в стенке сосудов, кишечника, желудка, бронхов, матки.Состоит из ПУЧКОВ клеток, которые назыв. ГЛАДКИЕ МИОЦИТЫ. Они: а) имеют ВЕРЕТЕНОВИДНУЮ форму, б) в цитоплазме много актиновых и миозиновых миофиламентов, котоые НЕ образуют саркомеров, поэтому исчерченность отсутствует.
ГЛАДКАЯ МТ эпидермального типа.
Развив. из КОЖНОЙ ЭКТОДЕРМЫ. Находится в концевых отделах потовых, молочных и слюнных желез. Состоит из единичных клеток, к-рые назыв.МИОЭПИТЕЛИОЦИТЫ (миоэпителиальные клетки): а) имеют ЗВЕЗДЧАТУЮ (отросчтую) форму. Функ.:при сокращении секрет выводится в выводной проток.
ГЛАДКАЯ МТ нейрального типа.
Она развив. из НЕРВНОЙ ТРУБКИ. Сост. из клеток миоцитов.нейрального типа. Они лежат в РАДУЖКЕ. Функц.: суживают зрачок.Составитель – доцент В.В. Бондаренко.
МИОЦИТ это
Читать PDF336.70 кб
Миоцитстимулирующая и миоцитингибирующая активность сыворотки крови крыс в фазе проэструса и метаэст
Колчанова Ольга Владимировна, Циркин Виктор Иванович
В опытах с 78 продольными полосками рога матки 20 небеременных крыс показано, что характер влияния сыворотки их крови (в момент воздействия и после ее удаления) на спонтанную фазную сократительную активность тест-объекта зависит о
Читать PDF14.42 мб
Эндогенный активатор сократимости миоцитов и артериальная гипертензия
Циркин В. И., Демина Н. Л., Сизова Е. Н., Хлыбова С. В., Куншин А. А., Пенкина Ю. А., Кашин Р. Ю.
Читать PDF433.54 кб
Особенности фенотипической модуляции гладких миоцитов воздухоносных путей при развитии хронических н
Зашихин А. Л., Агафонов Ю. В., Бармина А. О., Быков В. П.
Проанализирован характер изменений ультраструктурных параметров гладких миоцитов бронхов и особенностей экспрессии маркерных и фенотипических белков этими клетками при развитии хронических бронхитов.
Читать PDF253.10 кб
Инволютивная изменчивость количества гладких миоцитов в мышечных пучках стенки мочеточников на этапа
Золотарева М. А.
Статья отражает обзор литературы о микроструктуре гладкой мышечной ткани в стенке мочеточников.
Читать PDF353.10 кб
Эндогенный активатор и эндогенный ингибитор сократимости миоцитов
Колчанова О. В., Циркин В. И.
Читать PDF9.80 мб
Миоцитстимулирующая активность сыворотки крови и ее изменение при беременности и в родах
Сизова Е. Н., Циркин В. И., Хлыбова С. В.
Читать PDF274.60 кб
Количественный анализ диаметров миоцитов миометрия матки первородящих женщин при различных видах род
Ботчей Вероника Микаэловна, Просвирнин Антон Викторович, Павлович Евгений Ростиславович
Проведена количественная оценка диаметров гладкомышечных клеток миометрия матки 17 первородящих женщин. Показали варьирование размеров светлых, промежуточных и темных миоцитов.
Читать PDF315.23 кб
Морфологические особенности гладких миоцитов легочной артерии у плодов и новорожденных от матерей с
Сорокина И.В., Калужина О.В., Резанова О.С.
Читать PDF221.71 кб
Перинатальное программирование и старение кардио-миоцитов
Ковтун Ольга Петровна, Цывьян Павел Борисович, Соловьева Ольга Эдуардовна
Гипотеза «программирования состояний здоровья и болезней, связанных с развитием» предполагает, что условия развития организма во внутриутробном и раннем постнатальном периодах таким образом влияют на экспрессию генов, что «програм
Читать PDF2.24 мб
Роль гладких миоцитов и протеогликанов в неоангиогенезе атеросклеротической бляшки
Тодоров С. С., Сидоров Р. В., Талалаев Е. П., Шлык И. Ф.
Цель исследования – сравнительный морфологический, гистохимический, иммуногистохимический анализ атеросклеротических бляшек для уточнения роли гладких миоцитов, протеогликанов в неоангиогенезе.
Читать PDF382.12 кб
Гладкие миоциты в патологии сердечно-сосудистой системы
Тодоров С. С.
Читать PDF406.97 кб
Полиморфизм миоцитов миометрия матки у крыс при беременности
Григорьева Юлия Владимировна, Ямщиков Николай Васильевич, Кулакова Олеся Викторовна, Бормотов Александр Васильевич
Общегистологическое и иммуногистохимическое исследование миометрия в нижнем сегменте матки в разные фазы эстрального цикла и при беременности позволило выявить полиморфизм гладких миоцитов, который становится заметным к 20 суткам
Читать PDF595.39 кб
Зависимость проявления миоцитстимулирующей активности сыворотки крови крыс от фазы эстрального цикла
Колчанова О. В., Циркин В. И.
Цель работы состояла в изучении роли половых гормонов в регуляции продукции эндогенного активатора сократимости миоцитов (ЭАСМ) и эндогенного ингибитора сократимости миоцитов (ЭИСМ) и в совершенствовании биологического способа опр
Читать PDF1,000.58 кб
Миоциты апикальной папиллы мирацидия fаsciolahepaticalinnaeus, 1758
Соколина Ф.М., Галанина А.П., Галанин И.Ф.
Мирацидий трематоды Fаsciola hepatica Linnaeus, 1758 личинка расселительная: его назначение состоит в поиске моллюска малого прудовика Lymnaea truncatula (Мuller, 1774), в гепатопанкреас которого он внедряется, развивается и прохо
Физиология, мышечный миоцит — StatPearls
Введение
Мышечная клетка, также известная как миоцит, является самой маленькой субъединицей всех мышечных тканей и органов во всем теле. Именно здесь, в миоците, происходят физиологические этапы мышечного сокращения и патофизиология многочисленных мышечных заболеваний. В теле человека есть три типа мышечных клеток: скелетные, гладкие и сердечные. Общая функция каждого специализированного миоцита — сокращение различных органов, некоторые из которых необходимы для жизни.Следовательно, нарушение регуляции этих важнейших функций может привести к значительной заболеваемости и смертности. В этой статье исследуется роль мышечных миоцитов в различных системах, физиология сокращения миоцитов и патофизиология заболеваний, связанных с миоцитами. [1] [2]
Проблемы, вызывающие озабоченность
Опишите специализированные структуры внутри миоцитов и физиологический механизм сокращения.
Краткое обсуждение миогенеза.
Обсудите функцию миоцитов в их системах органов.
Выделите некоторые заболевания, вызывающие дисфункцию миоцитов.
Клеточная
Мышечный миоцит — это клетка, которая дифференцировалась для выполнения специальной функции сокращения. Хотя сердечные, скелетные и гладкомышечные клетки имеют много общих функций, не все они имеют одинаковые черты, анатомические структуры или механизмы сокращения.
Миоцит скелетных мышц
Миобласты скелетных мышц (миоциты-предшественники) дифференцируются и сливаются в многоядерные мышечные волокна, называемые миофибриллами, которые действуют как единое целое.Эти миофибриллы, в свою очередь, состоят из перекрывающихся толстых и тонких нитей (миофиламентов), которые расположены в продольном направлении в саркомеры. Таким образом, укорочение или сокращение волокон скелетных мышц является результатом укорочения саркомера. Толстые нити состоят из миозина, который представляет собой белковый полипептид. Каждая молекула миозина имеет две глобулярные головки, которые участвуют в сокращении путем связывания тонких нитей. Тонкие нити включают актин (содержит сайт связывания для миозиновых головок), тропомиозин и тропонин (имеет три субъединицы: тропонин Т, тропонин I и тропонин С).Эти саркомерные структуры придают скелетным мышцам полосатый вид и хорошо видны при электронной микроскопии. [3] [2]
Скелетные миоциты также содержат структуры, называемые Т-канальцами, которые являются продолжением плазматической мембраны миоцитов. Они открыты для внеклеточного пространства и выполняют функцию переноса деполяризующих потенциалов во внутриклеточное пространство, обеспечивая скоординированные сокращения. Кроме того, Т-канальцы содержат рецепторы дигидропиридина, которые необходимы для сокращения после возбуждения миоцитов.Саркоплазматический ретикулум (SR) является фундаментальной структурой миоцита скелетных мышц. Это место хранения и регуляции кальция (Ca2 +) в миоците. SR содержит терминальные цистерны, которые механически соединяются с Т-канальцами и чувствительными к напряжению рецепторами рианодина, которые представляют собой каналы, выделяющие Ca2 +. SR также имеет канал Ca2 + -ATPase, который перекачивает Ca2 + обратно в SR из внутриклеточного пространства после возбуждения. В скелетных мышцах один Т-канальец связывает две терминальные цистерны в триадном расположении.[2]
Самой популярной моделью для понимания мышечного сокращения является модель скользящего филамента, которая описывает укорочение саркомера за счет повторяющихся взаимодействий миозина / актина. Во время каждого взаимодействия головки миозина работают, чтобы приблизить соседние свободные концы актина к центру саркомера. В покоящемся миоците скелетных мышц тропомиозин блокирует участки связывания миозина на актине. [4]
Когда значительный деполяризующий потенциал моторной концевой пластинки превышает порог скелетного миоцита, клетка запускает потенциал действия.
Этот деполяризующий потенциал распространяется на Т-канальцы, вызывая конформационные изменения в дигидропиридиновых рецепторах.
Механически связанные концевые цистерны также претерпевают конформационные изменения, вызывая высвобождение Ca2 + из SR и повышенную внутриклеточную концентрацию Ca2 + [Ca2 +].
Ca2 + связывается с тропонином C, вызывая конформационное изменение тропонина, которое перемещает тропомиозин из сайта связывания миозина на актине.Примечание: в присутствии Ca2 + тропонин C остается в этой конфигурации, оставляя сайт связывания миозина на актине доступным для взаимодействий с миозином.
Сначала аденозинтрифосфат (АТФ) не связывается с миозином, вызывая связывание миозина с актином (постоянный недостаток АТФ вызывает постоянное взаимодействие миозина и актина и является механизмом трупного окоченения).
Затем АТФ связывает миозин и миозин, диссоциированный с актином.
Гидролиз этого связанного АТФ до АДФ плюс неорганический фосфат вызывает изменение миозина в «взведенное положение».Примечание: к миозину остается только АДФ.
Головка миозина затем взаимодействует с актином в другом сайте связывания.
АДФ высвобождается из миозина, вызывая другое изменение, которое приводит к «силовому удару». В это время миозин связан с актином и останется связанным без дополнительного количества АТФ.
Другая молекула АТФ связывает миозин. Цикл продолжается, саркомер укорачивается по мере того, как миозин скользит по актину.
Расслабление происходит, когда наблюдается снижение потенциалов возбуждающей моторной концевой пластинки, снижение потенциалов действия и реполяризация миоцита.Ca2 + секвестрируется обратно в SR насосами Ca2 + -ATPase, уменьшая внутриклеточный [Ca2 +]. Эти миоциты также содержат обменники Na + / Ca2 + на поверхности клетки, которые используют электрохимический градиент Na + для обмена Na + в клетку в обмен на Ca2 + из клетки. Са2 + отделяется от тропонина С, и тропомиозин снова блокирует сайты связывания миозина на актине. [2]
Некоторые ключевые моменты, которые следует отметить при электронной микроскопии саркомера, заключаются в следующем. Саркомер появляется между Z-линиями, и сжатие приближается к этим Z-линиям.Сокращение приводит к укорачиванию полос H (только толстые нити) и I (только тонкие нити). Полоса А (длина толстой нити с вышележащей тонкой нитью) в саркомере всегда остается той же длины. [4]
Ниже приведены примечательные моменты относительно мышечных сокращений. Скелетные мышцы находятся под произвольным контролем, за исключением рефлексов и диафрагмы при непроизвольном дыхании. Нижние двигательные нейроны иннервируют эти миоциты спинным мозгом и отвечают на нейромедиатор ацетилхолин (ACh).Когда ACh связывает свои рецепторы на миоците, натрий (Na +) попадает в клетку, вызывая упомянутую выше деполяризацию. Максимальное напряжение мышц возникает при оптимальном перекрытии толстых и тонких нитей. То есть все миозиновые головки могут взаимодействовать с актином. Если мышечное волокно растягивается слишком далеко, взаимодействие толстых и тонких волокон уменьшается. Более того, если мышца укорачивается слишком значительно, большие миозиновые головки вытесняют друг друга, уменьшая взаимодействие миофиламентов. Наконец, максимальная скорость сокращения мышечного волокна будет уменьшаться по мере увеличения нагрузки на мышцу.[5] [6] [7]
Миоцит гладких мышц
Подобно скелетным мышцам, клетки гладких мышц также содержат толстые и тонкие нити. Однако, в отличие от скелетных мышц, эти миофиламенты не организованы в продольные саркомеры и не содержат тропонин. Отсутствие саркомеров и, следовательно, отсутствие полос дало название гладкой мускулатуре. Гладкомышечные миоциты сливаются, образуя три типа мышц. Те миоциты, которые сокращаются как отдельные единицы, называются многокомпонентными гладкими мышцами.Они находятся в радужной оболочке глаза или семявыносящем протоке. Многокомпонентная гладкая мышца обычно сильно иннервируется и находится под вегетативным контролем. Гладкомышечные клетки, которые сокращаются вместе, называются единичными гладкими мышцами. Они более распространены и могут присутствовать в желудочно-кишечном тракте, мочевом пузыре и матке. [8] [9]
В отличие от гладких мышц, состоящих из нескольких единиц, гладкомышечные клетки, состоящие из нескольких единиц, хорошо взаимодействуют для координированных сокращений. Эти клетки находятся под вегетативным контролем и модулируются гормонами или нейротрансмиттерами.Наконец, миоциты гладких мышц могут дифференцироваться в гладкие мышцы сосудов. Эти клетки также отвечают за регуляцию артериального давления. [8]
Механизм сокращения гладких мышц отличается от механизма, описанного выше для скелетных мышц. Однако, как и в клетках скелетных мышц, увеличение внутриклеточного [Ca2 +] является критическим фактором, участвующим в сокращении мышц. Множественные механизмы могут вызывать увеличение внутриклеточного [Ca2 +] в гладкомышечных миоцитах. Деполяризация миоцита после того, как ACh связывает его рецепторы на поверхности клетки, что впоследствии открывает потенциалзависимые каналы Ca2 + L-типа.Открытие Ca2 + -каналов на мембране миоцита вторично по отношению к гормону или нейротрансмиттеру, связывающему его рецептор (лиганд-зависимый). Гормоны или нейротрансмиттеры вызывают высвобождение Ca2 + из саркоплазматического ретикулума (SR) через инозитол-1,4,5-трифосфат (IP3) закрытые Ca2 + -каналы. Независимо от механизма увеличения [Ca2 +], нижестоящий механизм остается прежним. [2]
Ca2 + связывает молекулу, называемую кальмодулином.
Комплекс Ca2 + -кальмодулин впоследствии активирует фермент, называемый киназой легкой цепи миозина.(Киназы служат для фосфорилирования).
Затем киназа легкой цепи миозина фосфорилирует (добавляет фосфатную группу) к миозину.
Фосфорилированный миозин связывается с актином и начинает сокращение через цикл перекрестного связывания, упомянутый выше в разделе скелетных мышц. Примечание. Механизм использования АТФ для сокращения мышц в скелетных мышцах такой же, как и в гладких мышцах.
Снижение внутриклеточного [Ca2 +] и повышение активности фермента, называемого фосфатазой легкой цепи миозина (удаляет фосфат из миозина), вызывает релаксацию.
Внутриклеточное [Ca2 +] уменьшается за счет закачки обратно в SR насосами АТФазы или обменниками Na + / Ca2 + на поверхности клетки. [2]
Примечание. Гормоны, вызывающие сокращение или расслабление гладких мышц, делают это путем модуляции внутриклеточной [Ca2 +] или миозиновой фосфатазы легких цепей. Например, оксид азота обеспечивает релаксацию за счет увеличения активности фосфатазы легких цепей миозина [10].
Миоцит сердечной мышцы
Физиология сердечного миоцита более сложна, чем у скелетных или гладких мышц, хотя у них есть некоторые общие черты.Сердечный миоцит содержит саркомеры, как скелетные мышцы, поэтому имеет поперечно-полосатую форму. Механизм укорачивания мышечных миоцитов такой же, как и у скелетных мышц, упомянутых выше. Сердечные миоциты имеют уникальные структуры, которые жизненно важны для правильного функционирования сердца. Вставные диски, которые присутствуют на периферии клетки, поддерживают адгезию между миоцитами. Щелевые соединения, которые присутствуют на вставленных дисках, обеспечивают электрическую связь между клетками. Быстрое распространение деполяризующего потенциала между соседними клетками помогает скоординированным сокращениям, что жизненно важно для выживания.Сердечные миоциты также содержат Т-канальцы. Однако, в отличие от скелетных мышц, один Т-канальец связывает одну терминальную цистерну в виде диады. Саркоплазматический ретикулум присутствует в сердечных миоцитах и также выполняет функцию хранения Ca2 +. [11]
Потенциал действия сердечного миоцита уникален. Он состоит из фазы покоя, называемой фазой 4, которая поддерживается проницаемостью клетки для калия (K +) из клетки. За фазой 4 следует фаза 0, которая характеризуется быстрым восходящим движением / деполяризацией из-за открытия потенциалзависимых каналов Na + и притока Na + в клетку.Фаза 1 — это начальная реполяризация, вызванная закрытием каналов Na + и открытием потенциалозависимых каналов K +. Фаза 2 называется фазой плато. На Фазе 2 Ca2 + входит в клетки через управляемые по напряжению каналы Ca2 +, в то время как K + продолжает покидать клетку. Этот баланс входящих и исходящих катионов поддерживает фазу плато. В фазе 3 каналы Ca2 + закрываются, и быстрый отток через открытые каналы K + приводит к реполяризации клетки. [12]
Сердечный миоцит может получать стимул от кардиостимуляторов в SA или AV-узле, пучке His, ветвях пучка или клетках Пуркинье.
Потенциал действия этих клеток (обычно SA-узел и AV-узел) распространяется вдоль мембраны сердечных миоцитов в Т-канальцы.
Ca2 + поступает в клетку во время фазы 2 через каналы Ca2 + L-типа.
Вход Ca2 + вызывает высвобождение Ca2 + из SR, иначе называемое Ca2 + -индуцированным высвобождением Ca2 +.
Концентрации Са2 + увеличиваются, и он может связывать тропонин С и вызывать циклический переход миозин / актин поперечного мостика, упомянутый выше в разделе скелетных миоцитов.
- Релаксация происходит, когда Ca2 + поглощается SR насосами Ca2 + -ATPase или обменниками Na + / Ca2 + на клеточной мембране. [2] [13]
Напряжение сердечной мышцы и способность сокращаться прямо пропорциональны внутриклеточной концентрации Ca2 +. Таким образом, факторы, повышающие внутриклеточный Ca2 +, вызывают увеличение силы сокращения. Например, при учащении пульса Са2 + начинает накапливаться в миоцитах, что также приводит к более сильным сердечным сокращениям.Предварительная нагрузка — это термин, обозначающий конечный диастолический объем (классически связанный с давлением в правом предсердии). Когда больший объем крови заполняет камеру сердца, миоциты растягиваются и приводят к более сильным сокращениям. Это явление называется отношением Франка-Старлинга и может быть связано с увеличением концентрации Ca2 +, вызванным растяжением. Это соотношение соответствует венозному возврату к сердцу и сердечному выбросу из сердца. Постнагрузка — это давление, против которого миоциты должны сокращаться. Максимальная скорость сокращения уменьшается с увеличением постнагрузки.[12] [14]
Развитие
Во время эмбриогенеза и развития плода миоциты скелетных мышц образуются из слоя мезодермальных зародышевых клеток в процессе, называемом миогенезом. Процесс делится на три этапа.
Многопотенциальные мезодермальные клетки становятся миобластами.
Миобласты выходят из клеточного цикла.
Они дифференцируются в волокна скелетных мышц.
Многочисленные факторы, называемые миогенными регуляторными факторами (MRF) в миоците, играют жизненно важную роль в этом сложном процессе.Некоторые ключевые MRF включают Myf-5, MyoD, миогенин и MRF4. Они работают в определенных точках процесса миогенеза, чтобы влиять на транскрипцию генов и правильное функционирование миоцитов. Факторы транскрипции и сигнальные молекулы из близлежащей хорды, нервной трубки, поверхностной эктодермы и латеральной пластинки мезодермы также вызывают дифференцировку скелетных миоцитов. [15] [16]
Эмбриональное сердце — первый орган, который начинает функционировать, а развивающееся сердце показывает четыре камеры на тридцать два дня.Кардиогенная мезодерма образует сердечные миоциты в рамках процесса, называемого кардиогенезом. Через сложную сеть взаимодействий факторов роста и регуляторов транскрипции (Wnt, BMP, Nkx2.5, FGF, Gata4) кардиогенная мезодерма формирует большие части желудочков, предсердий и трактов оттока. Кардиогенная мезодерма также способствует проводящей системе, эндокарду, аортальной и легочной подушках [17].
Развитие и дифференциация миоцитов гладкой мускулатуры зависит от различных органов.Например, развитие висцеральных гладких мышц отличается от развития гладких мышц сосудов. Таким образом, были предшественники гладких мышц, происходящие преимущественно из мезодермы, но нейроэктодерма и энтодерма также вносят свой вклад. Подобно скелетным и гладкомышечным миоцитам, на развитие и дифференцировку гладкомышечных миоцитов влияют многочисленные факторы [18] [19].
Миогенез скелетных, сердечных и гладких мышц очень сложен и заслуживает отдельного внимания, выходящего за рамки данной статьи.
Функция
В сердечной мышце миоциты реагируют на потенциал действия, генерируемый SA и AV узлом, сокращением предсердий и желудочков соответственно. Например, нарушение функции сердечных миоцитов после инфаркта миокарда может привести к опасным для жизни аритмиям. Для движения необходимо сокращение волокон скелетных мышц. Важно отметить, что диафрагма состоит из скелетных мышц и отвечает за дыхание. Сокращение гладкомышечных клеток происходит в различных органах, например, в стенках желудочно-кишечного тракта, где гладкие мышцы сокращаются, продвигая пищу вперед в процессе, называемом перистальтикой.Сокращение гладких мышц сосудов отвечает за регулирование артериального давления. [13] [2]
Патофизиология
Патофизиология заболеваний, поражающих мышечные миоциты, является вторичной по отношению к мутациям в генах и дисфункции белков миоцитов.
Мышечная дистрофия Дюшенна (МДД) — это Х-сцепленное наследственное заболевание, которое влияет на белок дистрофин и является наиболее распространенным нервно-мышечным заболеванием. Белок дистрофин отвечает за закрепление внутриклеточных цитоскелетных элементов на мембране миоцитов во время сокращения.Дистрофин может полностью отсутствовать или не функционировать, в зависимости от типа наследственной мутации. Отсутствие белка приводит к гибели миоцитов. Эффекты обычно проявляются в виде скелетных мышц со слабостью мышц тазового пояса, которые постепенно вовлекают другие мышцы. Биопсия мышц может показать, что мышцы заменены жиром. МДД поражает сердечные миоциты, вызывая дилатационную кардиомиопатию, которая обычно является причиной смерти. МДД развивается в раннем возрасте, и к десяти годам дети могут стать инвалидами.Генетическое тестирование подтвердит диагноз. Лечение этого расстройства обычно заключается в применении системных кортикостероидов (преднизон или преднизолон) [20] [21].
Мышечная дистрофия Беккера (МПК) — это Х-сцепленное заболевание, которое поражает более легкую форму мышечной дистрофии Дюшенна. Мутации в МПК приводят к частично функционирующим белкам дистрофина. Начало обычно позже, чем МДД, и симптомы не столь серьезны [22].
Миотоническая мышечная дистрофия — аутосомно-доминантно наследуемое заболевание, которое приводит к экспансиям тринуклеотидных повторов CTG в гене DMPK.Этот ген кодирует фермент, называемый миотониновой протеинкиназой. Дефицит этого фермента приводит к миотонии (длительное сокращение мышц), мышечной слабости и истощению. Миотоническая мышечная дистрофия также влияет на проводящую систему сердца (приводя к аритмиям), глаза (катаракта), эндокринную систему (атрофия яичек) и центральную нервную систему. Если подозревается миотоническая мышечная дистрофия, генетическое тестирование может подтвердить диагноз. Лечение состоит из лечения вторичных осложнений. [23]
Дерматомиозит и полимиозит — это аутоиммунные заболевания, поражающие миоциты.Обычно поражаются скелетные мышцы, а болезнь поражает проксимальные мышцы плеча и бедер. Дерматомиозит имеет кожные проявления (скуловая сыпь, папулы Готтрона или гелиотропная сыпь). Дерматомиозит включает гуморальное опосредованное воспаление перимизиума мышц (оболочки, окружающей пучок мышечных волокон). Полимиозит, не имеющий кожных проявлений, включает клеточно-опосредованное воспаление эндомизия (оболочки, окружающей отдельный миоцит). Дерматомиозит и полимиозит обычно связаны со злокачественными новообразованиями и другими аутоиммунными заболеваниями.Лечение включает системные стероиды и иммунодепрессанты. [24]
Митохондриальные миопатии — это группа редких заболеваний, которые обычно проявляются миопатией и другими проявлениями. Эти нарушения имеют митохондриальную наследственность, а это означает, что только матери могут передавать митохондриальную ДНК своему потомству. Другими словами, пораженная самка передаст мутировавшую митохондриальную ДНК всему своему потомству, но пораженный самец (который заразился от своей матери) не передаст мутированную митохондриальную ДНК никому из своего потомства.Эти нарушения демонстрируют гетероплазмию, которая является вариабельной экспрессией в популяции. Представьте, что двое братьев и сестер наследуют мутировавшую митохондриальную ДНК от своей матери. Гетероплазмия означает, что один из братьев и сестер может быть поражен, а другой — нет, или степень их заболевания может быть неодинакова. Симптомы этих заболеваний включают миопатию и миалгию скелетных мышц (боль), миопатию гладких мышц (дисфагию) и кардиомиопатию. Есть много других симптомов, связанных с различными синдромами.Диагностические тесты включают биопсию мышц, которая может выявить «рваные красные волокна» (скопление патологических митохондрий) и генетическое тестирование. Никакое окончательное лечение не продемонстрировало значительной эффективности в лечении этих расстройств. [25]
Как и любой другой тип клеток в организме, миоциты могут стать неопластическими (доброкачественными или злокачественными). Скелетные миоциты претерпевают неопластические изменения, превращаясь в рабдомиому (доброкачественную) или рабдомиосаркому (злокачественную). Гладкомышечные клетки претерпевают неопластические изменения, превращаясь в лейомиому (доброкачественную) или лейомиосаркому (злокачественную).
Клиническая значимость
Антиаритмические препараты служат для контроля частоты сердечных сокращений при аритмиях или для преобразования ритма обратно в нормальный синусовый ритм. Существует четыре класса антиаритмических средств, каждый из которых воздействует на разные каналы сердца. Класс 1 (блокаторы Na + каналов) и Класс 3 (блокаторы K + каналов) влияют на каналы в миоците и проявляют эффект на потенциал действия миоцитов. Антиаритмические препараты 2-го и 4-го классов проявляют свое действие на СА и АВ-узлы. Класс 1 (блокаторы Na + каналов) влияют на Фазу 0 (ход вверх) потенциала действия сердечных миоцитов и оказывают различное влияние на Фазу 3.Цель антиаритмических средств 1 класса — контролировать ритм миокарда. Антиаритмические препараты класса 3 (блокаторы K + каналов) влияют на Фазу 3 потенциала действия сердечных миоцитов. Серьезным побочным эффектом антиаритмических средств класса 3 является полиморфная желудочковая тахикардия, называемая Torsades de pointes, из-за удлинения интервала QT. Антиаритмические препараты класса 3 также являются терапевтическими средствами для контроля ритма [26].
Злокачественная гипертермия (ЗГ) — это опасное для жизни состояние, вызванное ингаляционными анестетиками (галотаном, севофлураном, десфлураном, изофлураном) или миорелаксантом сукцинилхолином.Тип наследования этого состояния обычно аутосомно-доминантный. Патофизиология злокачественной гипертермии связана с мутациями в чувствительных к напряжению рецепторах рианодина. У восприимчивых людей ингаляционные анестетики или сукцинилхолин вызывают повышенное высвобождение Ca2 + из саркоплазматического ретикулума (в результате мутации рецептора рианодина). У пациента развивается гипертермия и сильная ригидность мышц, что может привести к рабдомиолизу. Дантролен, который связывает рианодиновый рецептор и предотвращает высвобождение Са2 + из SR, используется для лечения ЗГ.[27]
Дигоксин / дигиталис — препарат, применяемый для лечения пациентов с тяжелой сердечной недостаточностью. Было показано, что дигоксин уменьшает симптомы и количество госпитализаций без снижения смертности. Дигоксин — ионотропный агент, потому что он увеличивает сократительную способность сердца. Его основной механизм действия заключается в блокировании насосов Na + / K + АТФазы (которые выкачивают Na + и K + внутрь) на поверхности миоцитов. Блокирование этого насоса приводит к увеличению внутриклеточного Na +. Из-за увеличения внутриклеточного Na + и снижения концентрации внеклеточного Na + происходит снижение активности обменника Na + / Ca2 + на поверхности клетки, который обычно обменивает Na + в клетке на Ca2 + вне клетки.Таким образом, дигоксин в конечном итоге приводит к увеличению внутриклеточной концентрации Ca2 + и увеличению сократительной способности. Повышенный уровень Ca2 + также удлиняет фазу 2 потенциала действия сердечных миоцитов и снижает частоту сердечных сокращений. [28]
Рабдомиолиз — потенциально тяжелое состояние, которое возникает в результате повреждения скелетных мышц. Некоторые причины рабдомиолиза включают травмы, токсины, лекарства, инфекции, ишемию мышц, упражнения, злокачественный нейролептический синдром и злокачественную гипертермию — повреждение клеточных компонентов миоцитов, высвобождающих такие компоненты, как миоглобин, креатинкиназа и лактатдегидрогеназа.Рабдомиолиз может проявляться миалгиями и слабостью. Миоглобин начинает попадать в мочу (миоглобинурия), и пациенты могут описывать свою мочу как «чайного цвета». Более серьезные осложнения рабдомиолиза включают острую почечную недостаточность и диссеминированное внутрисосудистое свертывание крови. Диагностическое тестирование на рабдомиолиз включает определение уровня креатинкиназы, что очень чувствительно. Лечение в основном поддерживающее и предусматривает введение жидкости для сохранения функции почек [29].
Непрерывное обучение / обзорные вопросы
Физиология, мышечные миоциты — StatPearls
Введение
Мышечная клетка, также известная как миоцит, является самой маленькой субъединицей всех мышечных тканей и органов по всему телу.Именно здесь, в миоците, происходят физиологические этапы мышечного сокращения и патофизиология многочисленных мышечных заболеваний. В теле человека есть три типа мышечных клеток: скелетные, гладкие и сердечные. Общая функция каждого специализированного миоцита — сокращение различных органов, некоторые из которых необходимы для жизни. Следовательно, нарушение регуляции этих важнейших функций может привести к значительной заболеваемости и смертности. В этой статье исследуется роль мышечных миоцитов в различных системах, физиология сокращения миоцитов и патофизиология заболеваний, связанных с миоцитами.[1] [2]
Проблемы, вызывающие озабоченность
Опишите специализированные структуры внутри миоцитов и физиологический механизм сокращения.
Краткое обсуждение миогенеза.
Обсудите функцию миоцитов в их системах органов.
Выделите некоторые заболевания, вызывающие дисфункцию миоцитов.
Клеточная
Мышечный миоцит — это клетка, которая дифференцировалась для выполнения специальной функции сокращения.Хотя сердечные, скелетные и гладкомышечные клетки имеют много общих функций, не все они имеют одинаковые черты, анатомические структуры или механизмы сокращения.
Миоцит скелетных мышц
Миобласты скелетных мышц (миоциты-предшественники) дифференцируются и сливаются в многоядерные мышечные волокна, называемые миофибриллами, которые действуют как единое целое. Эти миофибриллы, в свою очередь, состоят из перекрывающихся толстых и тонких нитей (миофиламентов), которые расположены в продольном направлении в саркомеры.Таким образом, укорочение или сокращение волокон скелетных мышц является результатом укорочения саркомера. Толстые нити состоят из миозина, который представляет собой белковый полипептид. Каждая молекула миозина имеет две глобулярные головки, которые участвуют в сокращении путем связывания тонких нитей. Тонкие нити включают актин (содержит сайт связывания для миозиновых головок), тропомиозин и тропонин (имеет три субъединицы: тропонин Т, тропонин I и тропонин С). Эти саркомерные структуры придают скелетным мышцам полосатый вид и хорошо видны при электронной микроскопии.[3] [2]
Скелетные миоциты также содержат структуры, называемые Т-канальцами, которые являются продолжением плазматической мембраны миоцитов. Они открыты для внеклеточного пространства и выполняют функцию переноса деполяризующих потенциалов во внутриклеточное пространство, обеспечивая скоординированные сокращения. Кроме того, Т-канальцы содержат рецепторы дигидропиридина, которые необходимы для сокращения после возбуждения миоцитов. Саркоплазматический ретикулум (SR) является фундаментальной структурой миоцита скелетных мышц. Это место хранения и регуляции кальция (Ca2 +) в миоците.SR содержит терминальные цистерны, которые механически соединяются с Т-канальцами и чувствительными к напряжению рецепторами рианодина, которые представляют собой каналы, выделяющие Ca2 +. SR также имеет канал Ca2 + -ATPase, который перекачивает Ca2 + обратно в SR из внутриклеточного пространства после возбуждения. В скелетных мышцах один Т-канальец связывает две терминальные цистерны в виде тройки. [2]
Самая популярная модель для понимания мышечного сокращения — это модель скользящей нити, которая описывает укорочение саркомера за счет повторяющихся взаимодействий миозина / актина.Во время каждого взаимодействия головки миозина работают, чтобы приблизить соседние свободные концы актина к центру саркомера. В покоящемся миоците скелетных мышц тропомиозин блокирует участки связывания миозина на актине. [4]
Когда значительный деполяризующий потенциал моторной концевой пластинки превышает порог скелетного миоцита, клетка запускает потенциал действия.
Этот деполяризующий потенциал распространяется на Т-канальцы, вызывая конформационные изменения в дигидропиридиновых рецепторах.
Механически связанные концевые цистерны также претерпевают конформационные изменения, вызывая высвобождение Ca2 + из SR и повышенную внутриклеточную концентрацию Ca2 + [Ca2 +].
Ca2 + связывается с тропонином C, вызывая конформационное изменение тропонина, которое перемещает тропомиозин из сайта связывания миозина на актине. Примечание: в присутствии Ca2 + тропонин C остается в этой конфигурации, оставляя сайт связывания миозина на актине доступным для взаимодействий с миозином.
Сначала аденозинтрифосфат (АТФ) не связывается с миозином, вызывая связывание миозина с актином (постоянный недостаток АТФ вызывает постоянное взаимодействие миозина и актина и является механизмом трупного окоченения).
Затем АТФ связывает миозин и миозин, диссоциированный с актином.
Гидролиз этого связанного АТФ до АДФ плюс неорганический фосфат вызывает изменение миозина в «взведенное положение». Примечание: к миозину остается только АДФ.
Головка миозина затем взаимодействует с актином в другом сайте связывания.
АДФ высвобождается из миозина, вызывая другое изменение, которое приводит к «силовому удару». В это время миозин связан с актином и останется связанным без дополнительного количества АТФ.
Другая молекула АТФ связывает миозин. Цикл продолжается, саркомер укорачивается по мере того, как миозин скользит по актину.
Расслабление происходит, когда наблюдается снижение потенциалов возбуждающей моторной концевой пластинки, снижение потенциалов действия и реполяризация миоцита.Ca2 + секвестрируется обратно в SR насосами Ca2 + -ATPase, уменьшая внутриклеточный [Ca2 +]. Эти миоциты также содержат обменники Na + / Ca2 + на поверхности клетки, которые используют электрохимический градиент Na + для обмена Na + в клетку в обмен на Ca2 + из клетки. Са2 + отделяется от тропонина С, и тропомиозин снова блокирует сайты связывания миозина на актине. [2]
Некоторые ключевые моменты, которые следует отметить при электронной микроскопии саркомера, заключаются в следующем. Саркомер появляется между Z-линиями, и сжатие приближается к этим Z-линиям.Сокращение приводит к укорачиванию полос H (только толстые нити) и I (только тонкие нити). Полоса А (длина толстой нити с вышележащей тонкой нитью) в саркомере всегда остается той же длины. [4]
Ниже приведены примечательные моменты относительно мышечных сокращений. Скелетные мышцы находятся под произвольным контролем, за исключением рефлексов и диафрагмы при непроизвольном дыхании. Нижние двигательные нейроны иннервируют эти миоциты спинным мозгом и отвечают на нейромедиатор ацетилхолин (ACh).Когда ACh связывает свои рецепторы на миоците, натрий (Na +) попадает в клетку, вызывая упомянутую выше деполяризацию. Максимальное напряжение мышц возникает при оптимальном перекрытии толстых и тонких нитей. То есть все миозиновые головки могут взаимодействовать с актином. Если мышечное волокно растягивается слишком далеко, взаимодействие толстых и тонких волокон уменьшается. Более того, если мышца укорачивается слишком значительно, большие миозиновые головки вытесняют друг друга, уменьшая взаимодействие миофиламентов. Наконец, максимальная скорость сокращения мышечного волокна будет уменьшаться по мере увеличения нагрузки на мышцу.[5] [6] [7]
Миоцит гладких мышц
Подобно скелетным мышцам, клетки гладких мышц также содержат толстые и тонкие нити. Однако, в отличие от скелетных мышц, эти миофиламенты не организованы в продольные саркомеры и не содержат тропонин. Отсутствие саркомеров и, следовательно, отсутствие полос дало название гладкой мускулатуре. Гладкомышечные миоциты сливаются, образуя три типа мышц. Те миоциты, которые сокращаются как отдельные единицы, называются многокомпонентными гладкими мышцами.Они находятся в радужной оболочке глаза или семявыносящем протоке. Многокомпонентная гладкая мышца обычно сильно иннервируется и находится под вегетативным контролем. Гладкомышечные клетки, которые сокращаются вместе, называются единичными гладкими мышцами. Они более распространены и могут присутствовать в желудочно-кишечном тракте, мочевом пузыре и матке. [8] [9]
В отличие от гладких мышц, состоящих из нескольких единиц, гладкомышечные клетки, состоящие из нескольких единиц, хорошо взаимодействуют для координированных сокращений. Эти клетки находятся под вегетативным контролем и модулируются гормонами или нейротрансмиттерами.Наконец, миоциты гладких мышц могут дифференцироваться в гладкие мышцы сосудов. Эти клетки также отвечают за регуляцию артериального давления. [8]
Механизм сокращения гладких мышц отличается от механизма, описанного выше для скелетных мышц. Однако, как и в клетках скелетных мышц, увеличение внутриклеточного [Ca2 +] является критическим фактором, участвующим в сокращении мышц. Множественные механизмы могут вызывать увеличение внутриклеточного [Ca2 +] в гладкомышечных миоцитах. Деполяризация миоцита после того, как ACh связывает его рецепторы на поверхности клетки, что впоследствии открывает потенциалзависимые каналы Ca2 + L-типа.Открытие Ca2 + -каналов на мембране миоцита вторично по отношению к гормону или нейротрансмиттеру, связывающему его рецептор (лиганд-зависимый). Гормоны или нейротрансмиттеры вызывают высвобождение Ca2 + из саркоплазматического ретикулума (SR) через инозитол-1,4,5-трифосфат (IP3) закрытые Ca2 + -каналы. Независимо от механизма увеличения [Ca2 +], нижестоящий механизм остается прежним. [2]
Ca2 + связывает молекулу, называемую кальмодулином.
Комплекс Ca2 + -кальмодулин впоследствии активирует фермент, называемый киназой легкой цепи миозина.(Киназы служат для фосфорилирования).
Затем киназа легкой цепи миозина фосфорилирует (добавляет фосфатную группу) к миозину.
Фосфорилированный миозин связывается с актином и начинает сокращение через цикл перекрестного связывания, упомянутый выше в разделе скелетных мышц. Примечание. Механизм использования АТФ для сокращения мышц в скелетных мышцах такой же, как и в гладких мышцах.
Снижение внутриклеточного [Ca2 +] и повышение активности фермента, называемого фосфатазой легкой цепи миозина (удаляет фосфат из миозина), вызывает релаксацию.
Внутриклеточное [Ca2 +] уменьшается за счет закачки обратно в SR насосами АТФазы или обменниками Na + / Ca2 + на поверхности клетки. [2]
Примечание. Гормоны, вызывающие сокращение или расслабление гладких мышц, делают это путем модуляции внутриклеточной [Ca2 +] или миозиновой фосфатазы легких цепей. Например, оксид азота обеспечивает релаксацию за счет увеличения активности фосфатазы легких цепей миозина [10].
Миоцит сердечной мышцы
Физиология сердечного миоцита более сложна, чем у скелетных или гладких мышц, хотя у них есть некоторые общие черты.Сердечный миоцит содержит саркомеры, как скелетные мышцы, поэтому имеет поперечно-полосатую форму. Механизм укорачивания мышечных миоцитов такой же, как и у скелетных мышц, упомянутых выше. Сердечные миоциты имеют уникальные структуры, которые жизненно важны для правильного функционирования сердца. Вставные диски, которые присутствуют на периферии клетки, поддерживают адгезию между миоцитами. Щелевые соединения, которые присутствуют на вставленных дисках, обеспечивают электрическую связь между клетками. Быстрое распространение деполяризующего потенциала между соседними клетками помогает скоординированным сокращениям, что жизненно важно для выживания.Сердечные миоциты также содержат Т-канальцы. Однако, в отличие от скелетных мышц, один Т-канальец связывает одну терминальную цистерну в виде диады. Саркоплазматический ретикулум присутствует в сердечных миоцитах и также выполняет функцию хранения Ca2 +. [11]
Потенциал действия сердечного миоцита уникален. Он состоит из фазы покоя, называемой фазой 4, которая поддерживается проницаемостью клетки для калия (K +) из клетки. За фазой 4 следует фаза 0, которая характеризуется быстрым восходящим движением / деполяризацией из-за открытия потенциалзависимых каналов Na + и притока Na + в клетку.Фаза 1 — это начальная реполяризация, вызванная закрытием каналов Na + и открытием потенциалозависимых каналов K +. Фаза 2 называется фазой плато. На Фазе 2 Ca2 + входит в клетки через управляемые по напряжению каналы Ca2 +, в то время как K + продолжает покидать клетку. Этот баланс входящих и исходящих катионов поддерживает фазу плато. В фазе 3 каналы Ca2 + закрываются, и быстрый отток через открытые каналы K + приводит к реполяризации клетки. [12]
Сердечный миоцит может получать стимул от кардиостимуляторов в SA или AV-узле, пучке His, ветвях пучка или клетках Пуркинье.
Потенциал действия этих клеток (обычно SA-узел и AV-узел) распространяется вдоль мембраны сердечных миоцитов в Т-канальцы.
Ca2 + поступает в клетку во время фазы 2 через каналы Ca2 + L-типа.
Вход Ca2 + вызывает высвобождение Ca2 + из SR, иначе называемое Ca2 + -индуцированным высвобождением Ca2 +.
Концентрации Са2 + увеличиваются, и он может связывать тропонин С и вызывать циклический переход миозин / актин поперечного мостика, упомянутый выше в разделе скелетных миоцитов.
- Релаксация происходит, когда Ca2 + поглощается SR насосами Ca2 + -ATPase или обменниками Na + / Ca2 + на клеточной мембране. [2] [13]
Напряжение сердечной мышцы и способность сокращаться прямо пропорциональны внутриклеточной концентрации Ca2 +. Таким образом, факторы, повышающие внутриклеточный Ca2 +, вызывают увеличение силы сокращения. Например, при учащении пульса Са2 + начинает накапливаться в миоцитах, что также приводит к более сильным сердечным сокращениям.Предварительная нагрузка — это термин, обозначающий конечный диастолический объем (классически связанный с давлением в правом предсердии). Когда больший объем крови заполняет камеру сердца, миоциты растягиваются и приводят к более сильным сокращениям. Это явление называется отношением Франка-Старлинга и может быть связано с увеличением концентрации Ca2 +, вызванным растяжением. Это соотношение соответствует венозному возврату к сердцу и сердечному выбросу из сердца. Постнагрузка — это давление, против которого миоциты должны сокращаться. Максимальная скорость сокращения уменьшается с увеличением постнагрузки.[12] [14]
Развитие
Во время эмбриогенеза и развития плода миоциты скелетных мышц образуются из слоя мезодермальных зародышевых клеток в процессе, называемом миогенезом. Процесс делится на три этапа.
Многопотенциальные мезодермальные клетки становятся миобластами.
Миобласты выходят из клеточного цикла.
Они дифференцируются в волокна скелетных мышц.
Многочисленные факторы, называемые миогенными регуляторными факторами (MRF) в миоците, играют жизненно важную роль в этом сложном процессе.Некоторые ключевые MRF включают Myf-5, MyoD, миогенин и MRF4. Они работают в определенных точках процесса миогенеза, чтобы влиять на транскрипцию генов и правильное функционирование миоцитов. Факторы транскрипции и сигнальные молекулы из близлежащей хорды, нервной трубки, поверхностной эктодермы и латеральной пластинки мезодермы также вызывают дифференцировку скелетных миоцитов. [15] [16]
Эмбриональное сердце — первый орган, который начинает функционировать, а развивающееся сердце показывает четыре камеры на тридцать два дня.Кардиогенная мезодерма образует сердечные миоциты в рамках процесса, называемого кардиогенезом. Через сложную сеть взаимодействий факторов роста и регуляторов транскрипции (Wnt, BMP, Nkx2.5, FGF, Gata4) кардиогенная мезодерма формирует большие части желудочков, предсердий и трактов оттока. Кардиогенная мезодерма также способствует проводящей системе, эндокарду, аортальной и легочной подушках [17].
Развитие и дифференциация миоцитов гладкой мускулатуры зависит от различных органов.Например, развитие висцеральных гладких мышц отличается от развития гладких мышц сосудов. Таким образом, были предшественники гладких мышц, происходящие преимущественно из мезодермы, но нейроэктодерма и энтодерма также вносят свой вклад. Подобно скелетным и гладкомышечным миоцитам, на развитие и дифференцировку гладкомышечных миоцитов влияют многочисленные факторы [18] [19].
Миогенез скелетных, сердечных и гладких мышц очень сложен и заслуживает отдельного внимания, выходящего за рамки данной статьи.
Функция
В сердечной мышце миоциты реагируют на потенциал действия, генерируемый SA и AV узлом, сокращением предсердий и желудочков соответственно. Например, нарушение функции сердечных миоцитов после инфаркта миокарда может привести к опасным для жизни аритмиям. Для движения необходимо сокращение волокон скелетных мышц. Важно отметить, что диафрагма состоит из скелетных мышц и отвечает за дыхание. Сокращение гладкомышечных клеток происходит в различных органах, например, в стенках желудочно-кишечного тракта, где гладкие мышцы сокращаются, продвигая пищу вперед в процессе, называемом перистальтикой.Сокращение гладких мышц сосудов отвечает за регулирование артериального давления. [13] [2]
Патофизиология
Патофизиология заболеваний, поражающих мышечные миоциты, является вторичной по отношению к мутациям в генах и дисфункции белков миоцитов.
Мышечная дистрофия Дюшенна (МДД) — это Х-сцепленное наследственное заболевание, которое влияет на белок дистрофин и является наиболее распространенным нервно-мышечным заболеванием. Белок дистрофин отвечает за закрепление внутриклеточных цитоскелетных элементов на мембране миоцитов во время сокращения.Дистрофин может полностью отсутствовать или не функционировать, в зависимости от типа наследственной мутации. Отсутствие белка приводит к гибели миоцитов. Эффекты обычно проявляются в виде скелетных мышц со слабостью мышц тазового пояса, которые постепенно вовлекают другие мышцы. Биопсия мышц может показать, что мышцы заменены жиром. МДД поражает сердечные миоциты, вызывая дилатационную кардиомиопатию, которая обычно является причиной смерти. МДД развивается в раннем возрасте, и к десяти годам дети могут стать инвалидами.Генетическое тестирование подтвердит диагноз. Лечение этого расстройства обычно заключается в применении системных кортикостероидов (преднизон или преднизолон) [20] [21].
Мышечная дистрофия Беккера (МПК) — это Х-сцепленное заболевание, которое поражает более легкую форму мышечной дистрофии Дюшенна. Мутации в МПК приводят к частично функционирующим белкам дистрофина. Начало обычно позже, чем МДД, и симптомы не столь серьезны [22].
Миотоническая мышечная дистрофия — аутосомно-доминантно наследуемое заболевание, которое приводит к экспансиям тринуклеотидных повторов CTG в гене DMPK.Этот ген кодирует фермент, называемый миотониновой протеинкиназой. Дефицит этого фермента приводит к миотонии (длительное сокращение мышц), мышечной слабости и истощению. Миотоническая мышечная дистрофия также влияет на проводящую систему сердца (приводя к аритмиям), глаза (катаракта), эндокринную систему (атрофия яичек) и центральную нервную систему. Если подозревается миотоническая мышечная дистрофия, генетическое тестирование может подтвердить диагноз. Лечение состоит из лечения вторичных осложнений. [23]
Дерматомиозит и полимиозит — это аутоиммунные заболевания, поражающие миоциты.Обычно поражаются скелетные мышцы, а болезнь поражает проксимальные мышцы плеча и бедер. Дерматомиозит имеет кожные проявления (скуловая сыпь, папулы Готтрона или гелиотропная сыпь). Дерматомиозит включает гуморальное опосредованное воспаление перимизиума мышц (оболочки, окружающей пучок мышечных волокон). Полимиозит, не имеющий кожных проявлений, включает клеточно-опосредованное воспаление эндомизия (оболочки, окружающей отдельный миоцит). Дерматомиозит и полимиозит обычно связаны со злокачественными новообразованиями и другими аутоиммунными заболеваниями.Лечение включает системные стероиды и иммунодепрессанты. [24]
Митохондриальные миопатии — это группа редких заболеваний, которые обычно проявляются миопатией и другими проявлениями. Эти нарушения имеют митохондриальную наследственность, а это означает, что только матери могут передавать митохондриальную ДНК своему потомству. Другими словами, пораженная самка передаст мутировавшую митохондриальную ДНК всему своему потомству, но пораженный самец (который заразился от своей матери) не передаст мутированную митохондриальную ДНК никому из своего потомства.Эти нарушения демонстрируют гетероплазмию, которая является вариабельной экспрессией в популяции. Представьте, что двое братьев и сестер наследуют мутировавшую митохондриальную ДНК от своей матери. Гетероплазмия означает, что один из братьев и сестер может быть поражен, а другой — нет, или степень их заболевания может быть неодинакова. Симптомы этих заболеваний включают миопатию и миалгию скелетных мышц (боль), миопатию гладких мышц (дисфагию) и кардиомиопатию. Есть много других симптомов, связанных с различными синдромами.Диагностические тесты включают биопсию мышц, которая может выявить «рваные красные волокна» (скопление патологических митохондрий) и генетическое тестирование. Никакое окончательное лечение не продемонстрировало значительной эффективности в лечении этих расстройств. [25]
Как и любой другой тип клеток в организме, миоциты могут стать неопластическими (доброкачественными или злокачественными). Скелетные миоциты претерпевают неопластические изменения, превращаясь в рабдомиому (доброкачественную) или рабдомиосаркому (злокачественную). Гладкомышечные клетки претерпевают неопластические изменения, превращаясь в лейомиому (доброкачественную) или лейомиосаркому (злокачественную).
Клиническая значимость
Антиаритмические препараты служат для контроля частоты сердечных сокращений при аритмиях или для преобразования ритма обратно в нормальный синусовый ритм. Существует четыре класса антиаритмических средств, каждый из которых воздействует на разные каналы сердца. Класс 1 (блокаторы Na + каналов) и Класс 3 (блокаторы K + каналов) влияют на каналы в миоците и проявляют эффект на потенциал действия миоцитов. Антиаритмические препараты 2-го и 4-го классов проявляют свое действие на СА и АВ-узлы. Класс 1 (блокаторы Na + каналов) влияют на Фазу 0 (ход вверх) потенциала действия сердечных миоцитов и оказывают различное влияние на Фазу 3.Цель антиаритмических средств 1 класса — контролировать ритм миокарда. Антиаритмические препараты класса 3 (блокаторы K + каналов) влияют на Фазу 3 потенциала действия сердечных миоцитов. Серьезным побочным эффектом антиаритмических средств класса 3 является полиморфная желудочковая тахикардия, называемая Torsades de pointes, из-за удлинения интервала QT. Антиаритмические препараты класса 3 также являются терапевтическими средствами для контроля ритма [26].
Злокачественная гипертермия (ЗГ) — это опасное для жизни состояние, вызванное ингаляционными анестетиками (галотаном, севофлураном, десфлураном, изофлураном) или миорелаксантом сукцинилхолином.Тип наследования этого состояния обычно аутосомно-доминантный. Патофизиология злокачественной гипертермии связана с мутациями в чувствительных к напряжению рецепторах рианодина. У восприимчивых людей ингаляционные анестетики или сукцинилхолин вызывают повышенное высвобождение Ca2 + из саркоплазматического ретикулума (в результате мутации рецептора рианодина). У пациента развивается гипертермия и сильная ригидность мышц, что может привести к рабдомиолизу. Дантролен, который связывает рианодиновый рецептор и предотвращает высвобождение Са2 + из SR, используется для лечения ЗГ.[27]
Дигоксин / дигиталис — препарат, применяемый для лечения пациентов с тяжелой сердечной недостаточностью. Было показано, что дигоксин уменьшает симптомы и количество госпитализаций без снижения смертности. Дигоксин — ионотропный агент, потому что он увеличивает сократительную способность сердца. Его основной механизм действия заключается в блокировании насосов Na + / K + АТФазы (которые выкачивают Na + и K + внутрь) на поверхности миоцитов. Блокирование этого насоса приводит к увеличению внутриклеточного Na +. Из-за увеличения внутриклеточного Na + и снижения концентрации внеклеточного Na + происходит снижение активности обменника Na + / Ca2 + на поверхности клетки, который обычно обменивает Na + в клетке на Ca2 + вне клетки.Таким образом, дигоксин в конечном итоге приводит к увеличению внутриклеточной концентрации Ca2 + и увеличению сократительной способности. Повышенный уровень Ca2 + также удлиняет фазу 2 потенциала действия сердечных миоцитов и снижает частоту сердечных сокращений. [28]
Рабдомиолиз — потенциально тяжелое состояние, которое возникает в результате повреждения скелетных мышц. Некоторые причины рабдомиолиза включают травмы, токсины, лекарства, инфекции, ишемию мышц, упражнения, злокачественный нейролептический синдром и злокачественную гипертермию — повреждение клеточных компонентов миоцитов, высвобождающих такие компоненты, как миоглобин, креатинкиназа и лактатдегидрогеназа.Рабдомиолиз может проявляться миалгиями и слабостью. Миоглобин начинает попадать в мочу (миоглобинурия), и пациенты могут описывать свою мочу как «чайного цвета». Более серьезные осложнения рабдомиолиза включают острую почечную недостаточность и диссеминированное внутрисосудистое свертывание крови. Диагностическое тестирование на рабдомиолиз включает определение уровня креатинкиназы, что очень чувствительно. Лечение в основном поддерживающее и предусматривает введение жидкости для сохранения функции почек [29].
Непрерывное обучение / обзорные вопросы
Физиология, мышечные миоциты — StatPearls
Введение
Мышечная клетка, также известная как миоцит, является самой маленькой субъединицей всех мышечных тканей и органов по всему телу.Именно здесь, в миоците, происходят физиологические этапы мышечного сокращения и патофизиология многочисленных мышечных заболеваний. В теле человека есть три типа мышечных клеток: скелетные, гладкие и сердечные. Общая функция каждого специализированного миоцита — сокращение различных органов, некоторые из которых необходимы для жизни. Следовательно, нарушение регуляции этих важнейших функций может привести к значительной заболеваемости и смертности. В этой статье исследуется роль мышечных миоцитов в различных системах, физиология сокращения миоцитов и патофизиология заболеваний, связанных с миоцитами.[1] [2]
Проблемы, вызывающие озабоченность
Опишите специализированные структуры внутри миоцитов и физиологический механизм сокращения.
Краткое обсуждение миогенеза.
Обсудите функцию миоцитов в их системах органов.
Выделите некоторые заболевания, вызывающие дисфункцию миоцитов.
Клеточная
Мышечный миоцит — это клетка, которая дифференцировалась для выполнения специальной функции сокращения.Хотя сердечные, скелетные и гладкомышечные клетки имеют много общих функций, не все они имеют одинаковые черты, анатомические структуры или механизмы сокращения.
Миоцит скелетных мышц
Миобласты скелетных мышц (миоциты-предшественники) дифференцируются и сливаются в многоядерные мышечные волокна, называемые миофибриллами, которые действуют как единое целое. Эти миофибриллы, в свою очередь, состоят из перекрывающихся толстых и тонких нитей (миофиламентов), которые расположены в продольном направлении в саркомеры.Таким образом, укорочение или сокращение волокон скелетных мышц является результатом укорочения саркомера. Толстые нити состоят из миозина, который представляет собой белковый полипептид. Каждая молекула миозина имеет две глобулярные головки, которые участвуют в сокращении путем связывания тонких нитей. Тонкие нити включают актин (содержит сайт связывания для миозиновых головок), тропомиозин и тропонин (имеет три субъединицы: тропонин Т, тропонин I и тропонин С). Эти саркомерные структуры придают скелетным мышцам полосатый вид и хорошо видны при электронной микроскопии.[3] [2]
Скелетные миоциты также содержат структуры, называемые Т-канальцами, которые являются продолжением плазматической мембраны миоцитов. Они открыты для внеклеточного пространства и выполняют функцию переноса деполяризующих потенциалов во внутриклеточное пространство, обеспечивая скоординированные сокращения. Кроме того, Т-канальцы содержат рецепторы дигидропиридина, которые необходимы для сокращения после возбуждения миоцитов. Саркоплазматический ретикулум (SR) является фундаментальной структурой миоцита скелетных мышц. Это место хранения и регуляции кальция (Ca2 +) в миоците.SR содержит терминальные цистерны, которые механически соединяются с Т-канальцами и чувствительными к напряжению рецепторами рианодина, которые представляют собой каналы, выделяющие Ca2 +. SR также имеет канал Ca2 + -ATPase, который перекачивает Ca2 + обратно в SR из внутриклеточного пространства после возбуждения. В скелетных мышцах один Т-канальец связывает две терминальные цистерны в виде тройки. [2]
Самая популярная модель для понимания мышечного сокращения — это модель скользящей нити, которая описывает укорочение саркомера за счет повторяющихся взаимодействий миозина / актина.Во время каждого взаимодействия головки миозина работают, чтобы приблизить соседние свободные концы актина к центру саркомера. В покоящемся миоците скелетных мышц тропомиозин блокирует участки связывания миозина на актине. [4]
Когда значительный деполяризующий потенциал моторной концевой пластинки превышает порог скелетного миоцита, клетка запускает потенциал действия.
Этот деполяризующий потенциал распространяется на Т-канальцы, вызывая конформационные изменения в дигидропиридиновых рецепторах.
Механически связанные концевые цистерны также претерпевают конформационные изменения, вызывая высвобождение Ca2 + из SR и повышенную внутриклеточную концентрацию Ca2 + [Ca2 +].
Ca2 + связывается с тропонином C, вызывая конформационное изменение тропонина, которое перемещает тропомиозин из сайта связывания миозина на актине. Примечание: в присутствии Ca2 + тропонин C остается в этой конфигурации, оставляя сайт связывания миозина на актине доступным для взаимодействий с миозином.
Сначала аденозинтрифосфат (АТФ) не связывается с миозином, вызывая связывание миозина с актином (постоянный недостаток АТФ вызывает постоянное взаимодействие миозина и актина и является механизмом трупного окоченения).
Затем АТФ связывает миозин и миозин, диссоциированный с актином.
Гидролиз этого связанного АТФ до АДФ плюс неорганический фосфат вызывает изменение миозина в «взведенное положение». Примечание: к миозину остается только АДФ.
Головка миозина затем взаимодействует с актином в другом сайте связывания.
АДФ высвобождается из миозина, вызывая другое изменение, которое приводит к «силовому удару». В это время миозин связан с актином и останется связанным без дополнительного количества АТФ.
Другая молекула АТФ связывает миозин. Цикл продолжается, саркомер укорачивается по мере того, как миозин скользит по актину.
Расслабление происходит, когда наблюдается снижение потенциалов возбуждающей моторной концевой пластинки, снижение потенциалов действия и реполяризация миоцита.Ca2 + секвестрируется обратно в SR насосами Ca2 + -ATPase, уменьшая внутриклеточный [Ca2 +]. Эти миоциты также содержат обменники Na + / Ca2 + на поверхности клетки, которые используют электрохимический градиент Na + для обмена Na + в клетку в обмен на Ca2 + из клетки. Са2 + отделяется от тропонина С, и тропомиозин снова блокирует сайты связывания миозина на актине. [2]
Некоторые ключевые моменты, которые следует отметить при электронной микроскопии саркомера, заключаются в следующем. Саркомер появляется между Z-линиями, и сжатие приближается к этим Z-линиям.Сокращение приводит к укорачиванию полос H (только толстые нити) и I (только тонкие нити). Полоса А (длина толстой нити с вышележащей тонкой нитью) в саркомере всегда остается той же длины. [4]
Ниже приведены примечательные моменты относительно мышечных сокращений. Скелетные мышцы находятся под произвольным контролем, за исключением рефлексов и диафрагмы при непроизвольном дыхании. Нижние двигательные нейроны иннервируют эти миоциты спинным мозгом и отвечают на нейромедиатор ацетилхолин (ACh).Когда ACh связывает свои рецепторы на миоците, натрий (Na +) попадает в клетку, вызывая упомянутую выше деполяризацию. Максимальное напряжение мышц возникает при оптимальном перекрытии толстых и тонких нитей. То есть все миозиновые головки могут взаимодействовать с актином. Если мышечное волокно растягивается слишком далеко, взаимодействие толстых и тонких волокон уменьшается. Более того, если мышца укорачивается слишком значительно, большие миозиновые головки вытесняют друг друга, уменьшая взаимодействие миофиламентов. Наконец, максимальная скорость сокращения мышечного волокна будет уменьшаться по мере увеличения нагрузки на мышцу.[5] [6] [7]
Миоцит гладких мышц
Подобно скелетным мышцам, клетки гладких мышц также содержат толстые и тонкие нити. Однако, в отличие от скелетных мышц, эти миофиламенты не организованы в продольные саркомеры и не содержат тропонин. Отсутствие саркомеров и, следовательно, отсутствие полос дало название гладкой мускулатуре. Гладкомышечные миоциты сливаются, образуя три типа мышц. Те миоциты, которые сокращаются как отдельные единицы, называются многокомпонентными гладкими мышцами.Они находятся в радужной оболочке глаза или семявыносящем протоке. Многокомпонентная гладкая мышца обычно сильно иннервируется и находится под вегетативным контролем. Гладкомышечные клетки, которые сокращаются вместе, называются единичными гладкими мышцами. Они более распространены и могут присутствовать в желудочно-кишечном тракте, мочевом пузыре и матке. [8] [9]
В отличие от гладких мышц, состоящих из нескольких единиц, гладкомышечные клетки, состоящие из нескольких единиц, хорошо взаимодействуют для координированных сокращений. Эти клетки находятся под вегетативным контролем и модулируются гормонами или нейротрансмиттерами.Наконец, миоциты гладких мышц могут дифференцироваться в гладкие мышцы сосудов. Эти клетки также отвечают за регуляцию артериального давления. [8]
Механизм сокращения гладких мышц отличается от механизма, описанного выше для скелетных мышц. Однако, как и в клетках скелетных мышц, увеличение внутриклеточного [Ca2 +] является критическим фактором, участвующим в сокращении мышц. Множественные механизмы могут вызывать увеличение внутриклеточного [Ca2 +] в гладкомышечных миоцитах. Деполяризация миоцита после того, как ACh связывает его рецепторы на поверхности клетки, что впоследствии открывает потенциалзависимые каналы Ca2 + L-типа.Открытие Ca2 + -каналов на мембране миоцита вторично по отношению к гормону или нейротрансмиттеру, связывающему его рецептор (лиганд-зависимый). Гормоны или нейротрансмиттеры вызывают высвобождение Ca2 + из саркоплазматического ретикулума (SR) через инозитол-1,4,5-трифосфат (IP3) закрытые Ca2 + -каналы. Независимо от механизма увеличения [Ca2 +], нижестоящий механизм остается прежним. [2]
Ca2 + связывает молекулу, называемую кальмодулином.
Комплекс Ca2 + -кальмодулин впоследствии активирует фермент, называемый киназой легкой цепи миозина.(Киназы служат для фосфорилирования).
Затем киназа легкой цепи миозина фосфорилирует (добавляет фосфатную группу) к миозину.
Фосфорилированный миозин связывается с актином и начинает сокращение через цикл перекрестного связывания, упомянутый выше в разделе скелетных мышц. Примечание. Механизм использования АТФ для сокращения мышц в скелетных мышцах такой же, как и в гладких мышцах.
Снижение внутриклеточного [Ca2 +] и повышение активности фермента, называемого фосфатазой легкой цепи миозина (удаляет фосфат из миозина), вызывает релаксацию.
Внутриклеточное [Ca2 +] уменьшается за счет закачки обратно в SR насосами АТФазы или обменниками Na + / Ca2 + на поверхности клетки. [2]
Примечание. Гормоны, вызывающие сокращение или расслабление гладких мышц, делают это путем модуляции внутриклеточной [Ca2 +] или миозиновой фосфатазы легких цепей. Например, оксид азота обеспечивает релаксацию за счет увеличения активности фосфатазы легких цепей миозина [10].
Миоцит сердечной мышцы
Физиология сердечного миоцита более сложна, чем у скелетных или гладких мышц, хотя у них есть некоторые общие черты.Сердечный миоцит содержит саркомеры, как скелетные мышцы, поэтому имеет поперечно-полосатую форму. Механизм укорачивания мышечных миоцитов такой же, как и у скелетных мышц, упомянутых выше. Сердечные миоциты имеют уникальные структуры, которые жизненно важны для правильного функционирования сердца. Вставные диски, которые присутствуют на периферии клетки, поддерживают адгезию между миоцитами. Щелевые соединения, которые присутствуют на вставленных дисках, обеспечивают электрическую связь между клетками. Быстрое распространение деполяризующего потенциала между соседними клетками помогает скоординированным сокращениям, что жизненно важно для выживания.Сердечные миоциты также содержат Т-канальцы. Однако, в отличие от скелетных мышц, один Т-канальец связывает одну терминальную цистерну в виде диады. Саркоплазматический ретикулум присутствует в сердечных миоцитах и также выполняет функцию хранения Ca2 +. [11]
Потенциал действия сердечного миоцита уникален. Он состоит из фазы покоя, называемой фазой 4, которая поддерживается проницаемостью клетки для калия (K +) из клетки. За фазой 4 следует фаза 0, которая характеризуется быстрым восходящим движением / деполяризацией из-за открытия потенциалзависимых каналов Na + и притока Na + в клетку.Фаза 1 — это начальная реполяризация, вызванная закрытием каналов Na + и открытием потенциалозависимых каналов K +. Фаза 2 называется фазой плато. На Фазе 2 Ca2 + входит в клетки через управляемые по напряжению каналы Ca2 +, в то время как K + продолжает покидать клетку. Этот баланс входящих и исходящих катионов поддерживает фазу плато. В фазе 3 каналы Ca2 + закрываются, и быстрый отток через открытые каналы K + приводит к реполяризации клетки. [12]
Сердечный миоцит может получать стимул от кардиостимуляторов в SA или AV-узле, пучке His, ветвях пучка или клетках Пуркинье.
Потенциал действия этих клеток (обычно SA-узел и AV-узел) распространяется вдоль мембраны сердечных миоцитов в Т-канальцы.
Ca2 + поступает в клетку во время фазы 2 через каналы Ca2 + L-типа.
Вход Ca2 + вызывает высвобождение Ca2 + из SR, иначе называемое Ca2 + -индуцированным высвобождением Ca2 +.
Концентрации Са2 + увеличиваются, и он может связывать тропонин С и вызывать циклический переход миозин / актин поперечного мостика, упомянутый выше в разделе скелетных миоцитов.
- Релаксация происходит, когда Ca2 + поглощается SR насосами Ca2 + -ATPase или обменниками Na + / Ca2 + на клеточной мембране. [2] [13]
Напряжение сердечной мышцы и способность сокращаться прямо пропорциональны внутриклеточной концентрации Ca2 +. Таким образом, факторы, повышающие внутриклеточный Ca2 +, вызывают увеличение силы сокращения. Например, при учащении пульса Са2 + начинает накапливаться в миоцитах, что также приводит к более сильным сердечным сокращениям.Предварительная нагрузка — это термин, обозначающий конечный диастолический объем (классически связанный с давлением в правом предсердии). Когда больший объем крови заполняет камеру сердца, миоциты растягиваются и приводят к более сильным сокращениям. Это явление называется отношением Франка-Старлинга и может быть связано с увеличением концентрации Ca2 +, вызванным растяжением. Это соотношение соответствует венозному возврату к сердцу и сердечному выбросу из сердца. Постнагрузка — это давление, против которого миоциты должны сокращаться. Максимальная скорость сокращения уменьшается с увеличением постнагрузки.[12] [14]
Развитие
Во время эмбриогенеза и развития плода миоциты скелетных мышц образуются из слоя мезодермальных зародышевых клеток в процессе, называемом миогенезом. Процесс делится на три этапа.
Многопотенциальные мезодермальные клетки становятся миобластами.
Миобласты выходят из клеточного цикла.
Они дифференцируются в волокна скелетных мышц.
Многочисленные факторы, называемые миогенными регуляторными факторами (MRF) в миоците, играют жизненно важную роль в этом сложном процессе.Некоторые ключевые MRF включают Myf-5, MyoD, миогенин и MRF4. Они работают в определенных точках процесса миогенеза, чтобы влиять на транскрипцию генов и правильное функционирование миоцитов. Факторы транскрипции и сигнальные молекулы из близлежащей хорды, нервной трубки, поверхностной эктодермы и латеральной пластинки мезодермы также вызывают дифференцировку скелетных миоцитов. [15] [16]
Эмбриональное сердце — первый орган, который начинает функционировать, а развивающееся сердце показывает четыре камеры на тридцать два дня.Кардиогенная мезодерма образует сердечные миоциты в рамках процесса, называемого кардиогенезом. Через сложную сеть взаимодействий факторов роста и регуляторов транскрипции (Wnt, BMP, Nkx2.5, FGF, Gata4) кардиогенная мезодерма формирует большие части желудочков, предсердий и трактов оттока. Кардиогенная мезодерма также способствует проводящей системе, эндокарду, аортальной и легочной подушках [17].
Развитие и дифференциация миоцитов гладкой мускулатуры зависит от различных органов.Например, развитие висцеральных гладких мышц отличается от развития гладких мышц сосудов. Таким образом, были предшественники гладких мышц, происходящие преимущественно из мезодермы, но нейроэктодерма и энтодерма также вносят свой вклад. Подобно скелетным и гладкомышечным миоцитам, на развитие и дифференцировку гладкомышечных миоцитов влияют многочисленные факторы [18] [19].
Миогенез скелетных, сердечных и гладких мышц очень сложен и заслуживает отдельного внимания, выходящего за рамки данной статьи.
Функция
В сердечной мышце миоциты реагируют на потенциал действия, генерируемый SA и AV узлом, сокращением предсердий и желудочков соответственно. Например, нарушение функции сердечных миоцитов после инфаркта миокарда может привести к опасным для жизни аритмиям. Для движения необходимо сокращение волокон скелетных мышц. Важно отметить, что диафрагма состоит из скелетных мышц и отвечает за дыхание. Сокращение гладкомышечных клеток происходит в различных органах, например, в стенках желудочно-кишечного тракта, где гладкие мышцы сокращаются, продвигая пищу вперед в процессе, называемом перистальтикой.Сокращение гладких мышц сосудов отвечает за регулирование артериального давления. [13] [2]
Патофизиология
Патофизиология заболеваний, поражающих мышечные миоциты, является вторичной по отношению к мутациям в генах и дисфункции белков миоцитов.
Мышечная дистрофия Дюшенна (МДД) — это Х-сцепленное наследственное заболевание, которое влияет на белок дистрофин и является наиболее распространенным нервно-мышечным заболеванием. Белок дистрофин отвечает за закрепление внутриклеточных цитоскелетных элементов на мембране миоцитов во время сокращения.Дистрофин может полностью отсутствовать или не функционировать, в зависимости от типа наследственной мутации. Отсутствие белка приводит к гибели миоцитов. Эффекты обычно проявляются в виде скелетных мышц со слабостью мышц тазового пояса, которые постепенно вовлекают другие мышцы. Биопсия мышц может показать, что мышцы заменены жиром. МДД поражает сердечные миоциты, вызывая дилатационную кардиомиопатию, которая обычно является причиной смерти. МДД развивается в раннем возрасте, и к десяти годам дети могут стать инвалидами.Генетическое тестирование подтвердит диагноз. Лечение этого расстройства обычно заключается в применении системных кортикостероидов (преднизон или преднизолон) [20] [21].
Мышечная дистрофия Беккера (МПК) — это Х-сцепленное заболевание, которое поражает более легкую форму мышечной дистрофии Дюшенна. Мутации в МПК приводят к частично функционирующим белкам дистрофина. Начало обычно позже, чем МДД, и симптомы не столь серьезны [22].
Миотоническая мышечная дистрофия — аутосомно-доминантно наследуемое заболевание, которое приводит к экспансиям тринуклеотидных повторов CTG в гене DMPK.Этот ген кодирует фермент, называемый миотониновой протеинкиназой. Дефицит этого фермента приводит к миотонии (длительное сокращение мышц), мышечной слабости и истощению. Миотоническая мышечная дистрофия также влияет на проводящую систему сердца (приводя к аритмиям), глаза (катаракта), эндокринную систему (атрофия яичек) и центральную нервную систему. Если подозревается миотоническая мышечная дистрофия, генетическое тестирование может подтвердить диагноз. Лечение состоит из лечения вторичных осложнений. [23]
Дерматомиозит и полимиозит — это аутоиммунные заболевания, поражающие миоциты.Обычно поражаются скелетные мышцы, а болезнь поражает проксимальные мышцы плеча и бедер. Дерматомиозит имеет кожные проявления (скуловая сыпь, папулы Готтрона или гелиотропная сыпь). Дерматомиозит включает гуморальное опосредованное воспаление перимизиума мышц (оболочки, окружающей пучок мышечных волокон). Полимиозит, не имеющий кожных проявлений, включает клеточно-опосредованное воспаление эндомизия (оболочки, окружающей отдельный миоцит). Дерматомиозит и полимиозит обычно связаны со злокачественными новообразованиями и другими аутоиммунными заболеваниями.Лечение включает системные стероиды и иммунодепрессанты. [24]
Митохондриальные миопатии — это группа редких заболеваний, которые обычно проявляются миопатией и другими проявлениями. Эти нарушения имеют митохондриальную наследственность, а это означает, что только матери могут передавать митохондриальную ДНК своему потомству. Другими словами, пораженная самка передаст мутировавшую митохондриальную ДНК всему своему потомству, но пораженный самец (который заразился от своей матери) не передаст мутированную митохондриальную ДНК никому из своего потомства.Эти нарушения демонстрируют гетероплазмию, которая является вариабельной экспрессией в популяции. Представьте, что двое братьев и сестер наследуют мутировавшую митохондриальную ДНК от своей матери. Гетероплазмия означает, что один из братьев и сестер может быть поражен, а другой — нет, или степень их заболевания может быть неодинакова. Симптомы этих заболеваний включают миопатию и миалгию скелетных мышц (боль), миопатию гладких мышц (дисфагию) и кардиомиопатию. Есть много других симптомов, связанных с различными синдромами.Диагностические тесты включают биопсию мышц, которая может выявить «рваные красные волокна» (скопление патологических митохондрий) и генетическое тестирование. Никакое окончательное лечение не продемонстрировало значительной эффективности в лечении этих расстройств. [25]
Как и любой другой тип клеток в организме, миоциты могут стать неопластическими (доброкачественными или злокачественными). Скелетные миоциты претерпевают неопластические изменения, превращаясь в рабдомиому (доброкачественную) или рабдомиосаркому (злокачественную). Гладкомышечные клетки претерпевают неопластические изменения, превращаясь в лейомиому (доброкачественную) или лейомиосаркому (злокачественную).
Клиническая значимость
Антиаритмические препараты служат для контроля частоты сердечных сокращений при аритмиях или для преобразования ритма обратно в нормальный синусовый ритм. Существует четыре класса антиаритмических средств, каждый из которых воздействует на разные каналы сердца. Класс 1 (блокаторы Na + каналов) и Класс 3 (блокаторы K + каналов) влияют на каналы в миоците и проявляют эффект на потенциал действия миоцитов. Антиаритмические препараты 2-го и 4-го классов проявляют свое действие на СА и АВ-узлы. Класс 1 (блокаторы Na + каналов) влияют на Фазу 0 (ход вверх) потенциала действия сердечных миоцитов и оказывают различное влияние на Фазу 3.Цель антиаритмических средств 1 класса — контролировать ритм миокарда. Антиаритмические препараты класса 3 (блокаторы K + каналов) влияют на Фазу 3 потенциала действия сердечных миоцитов. Серьезным побочным эффектом антиаритмических средств класса 3 является полиморфная желудочковая тахикардия, называемая Torsades de pointes, из-за удлинения интервала QT. Антиаритмические препараты класса 3 также являются терапевтическими средствами для контроля ритма [26].
Злокачественная гипертермия (ЗГ) — это опасное для жизни состояние, вызванное ингаляционными анестетиками (галотаном, севофлураном, десфлураном, изофлураном) или миорелаксантом сукцинилхолином.Тип наследования этого состояния обычно аутосомно-доминантный. Патофизиология злокачественной гипертермии связана с мутациями в чувствительных к напряжению рецепторах рианодина. У восприимчивых людей ингаляционные анестетики или сукцинилхолин вызывают повышенное высвобождение Ca2 + из саркоплазматического ретикулума (в результате мутации рецептора рианодина). У пациента развивается гипертермия и сильная ригидность мышц, что может привести к рабдомиолизу. Дантролен, который связывает рианодиновый рецептор и предотвращает высвобождение Са2 + из SR, используется для лечения ЗГ.[27]
Дигоксин / дигиталис — препарат, применяемый для лечения пациентов с тяжелой сердечной недостаточностью. Было показано, что дигоксин уменьшает симптомы и количество госпитализаций без снижения смертности. Дигоксин — ионотропный агент, потому что он увеличивает сократительную способность сердца. Его основной механизм действия заключается в блокировании насосов Na + / K + АТФазы (которые выкачивают Na + и K + внутрь) на поверхности миоцитов. Блокирование этого насоса приводит к увеличению внутриклеточного Na +. Из-за увеличения внутриклеточного Na + и снижения концентрации внеклеточного Na + происходит снижение активности обменника Na + / Ca2 + на поверхности клетки, который обычно обменивает Na + в клетке на Ca2 + вне клетки.Таким образом, дигоксин в конечном итоге приводит к увеличению внутриклеточной концентрации Ca2 + и увеличению сократительной способности. Повышенный уровень Ca2 + также удлиняет фазу 2 потенциала действия сердечных миоцитов и снижает частоту сердечных сокращений. [28]
Рабдомиолиз — потенциально тяжелое состояние, которое возникает в результате повреждения скелетных мышц. Некоторые причины рабдомиолиза включают травмы, токсины, лекарства, инфекции, ишемию мышц, упражнения, злокачественный нейролептический синдром и злокачественную гипертермию — повреждение клеточных компонентов миоцитов, высвобождающих такие компоненты, как миоглобин, креатинкиназа и лактатдегидрогеназа.Рабдомиолиз может проявляться миалгиями и слабостью. Миоглобин начинает попадать в мочу (миоглобинурия), и пациенты могут описывать свою мочу как «чайного цвета». Более серьезные осложнения рабдомиолиза включают острую почечную недостаточность и диссеминированное внутрисосудистое свертывание крови. Диагностическое тестирование на рабдомиолиз включает определение уровня креатинкиназы, что очень чувствительно. Лечение в основном поддерживающее и предусматривает введение жидкости для сохранения функции почек [29].
Непрерывное обучение / обзорные вопросы
Типы мышечных клеток: характеристики, расположение, роли
Типы мышечных клеток: хотите узнать об этом больше?
Наши увлекательные видео, интерактивные викторины, подробные статьи и HD-атлас помогут вам быстрее достичь лучших результатов.
С чем вы предпочитаете учиться?
«Я бы честно сказал, что Kenhub сократил мое учебное время вдвое». — Прочитайте больше. Ким Бенгочеа, Университет Реджиса, Денвер
Автор:
Рэйчел Бакстер, бакалавр, магистр наук
• Рецензент:
Франческа Другган, бакалавр, магистр наук
Последний раз отзыв: 29 октября 2020 г.
Время чтения: 11 минут
Мышечные клетки , обычно известные как миоциты , представляют собой клетки, составляющие мышечную ткань. В теле человека есть 3 типа мышечных клеток; сердечная, скелетная и гладкая.Сердечные и скелетные миоциты иногда называют мышечными волокнами из-за их длинной и волокнистой формы. Клетки сердечной мышцы , или кардиомиоциты, представляют собой мышечные волокна, составляющие миокард, средний мышечный слой сердца.
Клетки скелетных мышц составляют мышечные ткани, связанные со скелетом, и играют важную роль в передвижении. Клетки гладкой мускулатуры отвечают за непроизвольные движения, такие как движения кишечника во время перистальтики (сокращение для продвижения пищи через пищеварительную систему).
| Клетка сердечной мышцы | Прямоугольная Одноядерное Содержит много митохондрий Обмен данными через вставные диски — Присутствует в миокарде (сердечной мышце) |
| Клетка скелетных мышц | Цилиндрический полосатая Многоядерный Содержит много митохондрий — Присутствует в скелетных мышцах |
| Клетка гладкой мускулатуры | В форме шпинделя Одно центральное ядро В листах — Присутствует в мышечных слоях сосудов и во внутренних органах |
Клетки скелетных мышц
Характеристики
Клетки скелетных мышц длинные, цилиндрические и поперечнополосатые .Они многоядерные, , что означает, что они имеют более одного ядра. Это потому, что они образуются в результате слияния эмбриональных миобластов. Каждое ядро регулирует метаболические потребности саркоплазмы вокруг него. Клетки скелетных мышц имеют высокие потребности в энергии, поэтому они содержат много митохондрий для выработки достаточного количества АТФ.
Клетки скелетных мышц, тип поперечно-полосатых мышечных клеток, образуют мышцу, которую мы используем для движения, и разделяются на различные мышечные ткани по всему телу, например, на двуглавую мышцу.Скелетные мышцы прикрепляются к костям с помощью сухожилий и могут достигать 30 см в длину, хотя обычно они составляют от 2 до 3 см в длину.
Структура
Анатомия мышечных клеток отличается от анатомии других клеток тела, и биологи применили определенную терминологию к различным частям этих клеток. Клеточная мембрана мышечной клетки известна как сарколемма , а цитоплазма называется саркоплазмой . Саркоплазма содержит миоглобин , место хранения кислорода, а также гликоген в форме гранул в цитозоле, которые обеспечивают источник энергии.
Саркоплазма также содержит множество трубчатых белковых структур, называемых миофибриллами , которые состоят из миофиламентов . Есть 3 типа миофиламентов; толстый, тонкий и эластичный. Толстые миофиламенты состоят из миозина, типа моторного белка, тогда как тонких миофиламентов состоят из актина, другого типа белка, используемого клетками для построения структуры. Эластичные миофиламенты состоят из упругой формы закрепляющего белка, известного как титин .Вместе эти миофиламенты создают мышечные сокращения, позволяя головкам миозинового белка ходить вдоль актиновых волокон, создавая скользящее действие. Основной единицей поперечно-полосатой (полосатой) мышцы является саркомер , состоящий из актиновых (светлые полосы) и миозиновых (темные полосы) нитей.
Нужна помощь в идентификации мышечных клеток под микроскопом? Посмотрите наш справочник по тестам на ткани.
Сокращение
Мышечные сокращения поперечно-полосатых мышечных клеток регулируются концентрацией ионов кальция , которая, в свою очередь, регулируется структурой, известной как саркоплазматический ретикулум .Эта структура похожа на гладкую эндоплазматическую сеть других типов клеток. Чтобы произвести сократительную силу, миозин связывается с актиновыми филаментами, немного вращаясь, а затем натягивая нити друг на друга, как весла, движущиеся в лодке. Клетки скелетных мышц также содержат два регуляторных белка, известных как тропонин и тропомиозин . Они предотвращают связывание актина сайта связывания миозиновой головки с миозином. Сайт связывания миозиновой головки на актиновой нити остается закрытым до тех пор, пока ионы кальция не высвободятся из саркоплазматического ретикулума (SR).Ионы кальция, высвобождаемые из SR, являются конечным результатом цепочки событий в цикле сокращения, запускаемой потенциалом действия, запускающим высвобождение ацетилхолина (ACh) , нейромедиатора.
Этот процесс усиливается структурами, известными как поперечных канальцев или Т-канальцев , которые представляют собой инвагинации сарколеммы, позволяя деполяризации быстрее достигать внутренней части клетки. Т-трубочка, окруженная увеличенными саркоплазматическими сетями, называемыми терминальными цистернами , формирует структуру, называемую триадой .Это участвует в деполяризации и активации мышечной клетки, что приводит к сокращению. Поскольку сокращение требует энергии, поперечнополосатые мышечные клетки содержат много крупных митохондрий, которые в мышечных клетках называются саркосомами .
Клетки сердечной мышцы
Характеристики
Кардиомиоциты короткие и узкие, довольно прямоугольной формы. Они имеют ширину около 0,02 мм и длину 0,1 мм (миллиметр).Кардиомиоциты содержат множество саркосом , которые обеспечивают необходимую энергию для сокращения. В отличие от клеток скелетных мышц кардиомиоциты обычно содержат одно ядро . Кардиомиоциты обычно содержат те же клеточные органеллы, что и клетки скелетных мышц, хотя они содержат больше саркосом.
Кардиомиоциты большие и мускулистые и структурно связаны вставочными дисками , которые имеют щелевых контактов для диффузии и связи.Диски выглядят как темные полосы между клетками и являются уникальным аспектом кардиомиоцитов. Они возникают из-за того, что мембраны соседних миоцитов находятся очень близко друг к другу и образуют своего рода клей между клетками. Это позволяет передавать сократительной силы между клетками по мере того, как электрическая деполяризация распространяется от клетки к клетке. Ключевая роль кардиомиоцитов — генерировать достаточную сократительную силу, чтобы сердце могло эффективно биться. Они сокращаются вместе в унисон, вызывая давление, достаточное для того, чтобы заставить кровь течь по телу.
Сателлитные соты
Кардиомиоциты не могут эффективно делиться, а это означает, что если клетки сердца потеряны, они не могут быть восстановлены. Результатом этого является то, что каждая отдельная ячейка должна работать усерднее, чтобы производить одинаковый результат. В ответ на потребность организма в увеличении сердечного выброса кардиомиоциты могут увеличиваться в размерах (этот процесс известен как гипертрофия , ). Если клетки по-прежнему не могут производить сократительную силу, необходимую организму, произойдет сердечная недостаточность.Однако в сердечной мышце присутствуют сателлитных клеток, (клетки-медсестры). Это миогенные клетки, которые заменяют поврежденные мышцы, хотя их количество ограничено. Клетки-сателлиты также присутствуют в клетках скелетных мышц.
Клетки гладкой мускулатуры
Характеристики
Гладкомышечные клетки имеют веретеновидную форму и содержат одно центральное ядро. Их длина составляет от 10 до 600 мкм (микрометров), и они представляют собой самый маленький тип мышечной клетки.Они эластичны, и поэтому важны для расширения таких органов, как почки, легкие и влагалище. Миофибриллы гладкомышечных клеток не выровнены, как в сердечных и скелетных мышцах, что означает, что они не имеют поперечной полосы, отсюда и название гладкие.
Гладкомышечные клетки расположены вместе в листах , и такая организация означает, что они могут сокращаться одновременно. У них плохо развиты саркоплазматические ретикулумы и они не содержат Т-канальцев из-за ограниченного размера клеток.Однако они действительно содержат другие нормальные клеточные органеллы, такие как саркосомы , но в меньшем количестве.
Расположение и функции
Клетки гладкой мускулатуры отвечают за непроизвольных сокращений и находятся в стенках кровеносных сосудов и полых органах, таких как желудочно-кишечный тракт, матка и мочевой пузырь. Они также присутствуют в глазу и сокращаются, изменяя форму линзы, заставляя глаз фокусироваться.Гладкая мышца также отвечает за волны сокращения во всей пищеварительной системе, заставляя пищу перемещаться по телу (перистальтика) .
Как и клетки сердца и скелетных мышц, клетки гладких мышц сокращаются в результате деполяризации сарколеммы . В гладкомышечных клетках этому способствуют щелевые соединения. Щелевые соединения — это туннели, которые позволяют передавать импульсы между ними, так что деполяризация может распространяться, заставляя миоциты сокращаться вместе в унисон.
Особенности
Клетки скелетных мышц
- Мышечные клетки, обычно известные как миоциты , представляют собой клетки, составляющие мышечную ткань. В теле человека есть 3 типа мышечных клеток; сердечная, скелетная и гладкая.
- Клетки скелетных мышц длинные, цилиндрические, многоядерные, и поперечнополосатые. Каждое ядро регулирует метаболические потребности саркоплазмы вокруг него.Клетки скелетных мышц имеют высокие потребности в энергии, поэтому они содержат много митохондрий для выработки достаточного количества АТФ. Саркоплазма состоит из миофибрилл, которые, в свою очередь, состоят из толстых и тонких миофиламентов. Эти клетки образуют мышцу, которую мы используем для движения и сокращения из-за скольжения миозиновых головок по актиновым филаментам. Этот процесс регулируется такими факторами, как кальций, тропонин, тропмиозин и Т-канальцы.
Клетки сердечной мышцы
- Кардиомиоциты короткие и узкие, довольно прямоугольной формы.Они содержат одно ядро , органеллы клетки, подобные клеткам скелетных мышц, и множество саркосом , которые обеспечивают необходимую энергию для сокращения. Кардиомиоциты структурно связаны интеркалированными дисками , которые имеют щелевых контактов для диффузии и связи. Они позволяют передавать сократительной силы между клетками по мере того, как электрическая деполяризация распространяется от клетки к клетке, что способствует равномерной сокращающей силе.Поскольку эти сердечные клетки не могут делиться, сателлитных клеток отвечают за замену поврежденных.
Клетки гладкой мускулатуры
- Клетки гладкой мускулатуры эластичны, не имеют бороздок, веретеновидной формы и содержат одно центральное ядро. Гладкомышечные клетки расположены вместе в листах , и такая организация означает, что они могут сокращаться одновременно. У них плохо развиты саркоплазматические ретикулумы и они не содержат Т-канальцев из-за ограниченного размера клеток.Однако они действительно содержат другие нормальные клеточные органеллы, такие как саркосомы , но в меньшем количестве. Клетки гладкой мускулатуры ответственны за непроизвольных сокращений , и они также содержат щелевые соединения для распространения деполяризации.
Типы мышечных клеток: хотите узнать об этом больше?
Наши увлекательные видео, интерактивные викторины, подробные статьи и HD-атлас помогут вам быстрее достичь лучших результатов.
С чем вы предпочитаете учиться?
«Я бы честно сказал, что Kenhub сократил мое учебное время вдвое.” — Прочитайте больше. Ким Бенгочеа, Университет Реджиса, Денвер
Показать ссылкиАртикул:
- Сердечная мышца. Национальный институт сердца и легких (доступ 1 августа 2016 г.)
- Э. А. Вудкок, С. Дж. Маткович : Структура, функции и ассоциированные патологии кардиомиоцитов, Международный журнал биохимии и клеточной биологии (2005), том 37, выпуск 9, с. 1746–1751
- Общая анатомия волокон скелетных мышц. Get Body Smart (по состоянию на 1 августа 2016 г.)
- Дж.L. Krans : The Sliding Filament Theory of Muscle Contraction, Nature Education (по состоянию на 31 июля 2016 г.)
- L. Al-Qusairi, J. Laporte: Биогенез Т-канальца и образование триад в скелетных мышцах и участие в заболеваниях человека. Скелетные мышцы (2011), том 1, выпуск 26
- M. Fernandez-Caggiano: Cardiomyocytes. Веб-проект Cardio Research (по состоянию на 1 августа 2016 г.)
- Мышцы. Руководство по гистологии, Университет Лидса (по состоянию на 1 августа 2016 г.)
- Структура скелетных мышц.Калифорнийский университет (по состоянию на 1 августа 2016 г.)
- Гладкие мышечные клетки. Promo Cell (по состоянию на 1 августа 2016 г.)
- Поперечно-полосатые мышцы. Университетский колледж Лондона (по состоянию на 1 августа 2016 г.)
Сердечные миоциты крыс | Научно-исследовательские лаборатории ScienCell
Сердечные миоциты — это клетки с наибольшей физической энергией.Это узкоспециализированные клетки с высоким содержанием кислорода, в которых находится большое количество митохондрий [1]. Они занимают до 75% сердечной массы, но составляют лишь около одной трети от общего числа клеток в сердце. Дифференцированные сердечные миоциты обладают небольшой способностью к пролиферации; однако было показано, что гипертрофический рост отвечает на альфа1-адренергические стимулы через путь Ras / MEK [2]. Все сердечные миоциты способны к спонтанной ритмической деполяризации и реполяризации своих мембран.Сокращение сердечных миоцитов является миогенным и не зависит от нервной стимуляции. В сердечных миоцитах существует сложная сеть сигналов, регулирующих ритмическую работу сердца [3]. Гипертрофия сердечных миоцитов и апоптоз связаны с потерей сократительной функции во время сердечной недостаточности. Лучшее понимание сердечной сигнальной сети поможет выявить клеточные механизмы, приводящие к гибели сердечных миоцитов.
RCM от ScienCell Research Laboratories выделяли из сердца крысы CD® IGS на 2-й день после рождения.6 ячеек в объеме 1 мл. ОКМ характеризуются иммунофлуоресценцией с антителами, специфичными к актину гладких мышц, сакромерному альфа-актинину и тропомиозину. RCM отрицательны на микоплазмы, бактерии, дрожжи и грибки. RCM гарантирует дальнейшее культивирование в условиях, предусмотренных исследовательскими лабораториями ScienCell; однако ОКМ не рекомендуются для размножающихся или длительных культур, поскольку клетки не размножаются в культуре.
Рекомендуемая средняя
Рекомендуется использовать бессывороточную среду Cardiac Myocyte Medium (CMM, Cat.# 6101) для культивирования RCM in vitro .
Таблицы продуктов
R6200
Сертификаты анализа
Для конкретного номера партии выполните поиск ниже:
Напишите свой собственный отзыв
Только зарегистрированные пользователи могут оставлять отзывы. Пожалуйста, авторизуйтесь или зарегистрируйтесь
В настоящее время публикации отсутствуют
ioСкелетные миоциты — скелетные миоциты, полученные из ИПСК человека (ab277612)
Для некоммерческих организаций используйте код скидки ACCESS-TMA72, чтобы получить скидку.
Некоммерческое ценообразование со скидкой
1 Маленький — 2,5×10 5 ячеек / флакон — 499 фунтов стерлингов / 619 долларов США / 605 евро
1 большой — 5×10 6 ячеек / флакон — 750 фунтов стерлингов / 975 долларов США / 1065 евро
4 Большой — всего 20×10 6 ячейки — 2330 фунтов / 2875 долларов / 2629 евро
Представляем ioSkeletal Myocytes, созданные из индуцированных человеком плюрипотентных стволовых клеток (ИПСК) с использованием opti-ox, технологии точного клеточного репрограммирования. Человеческие стволовые клетки в течение нескольких дней превращаются в устойчивые и надежные скелетные миоциты, обеспечивая высококачественную человеческую модель для исследований, моделирования заболеваний и HTS.
ioSkeletal Myocytes демонстрируют устойчивую экспрессию ключевых белков миофиламентов (Desmin, Titin, Troponin, Myosin Heavy Chain, Dystrophin) в сочетании с переходом от незрелых (MYh4 и MYH8) к зрелым изоформ тяжелой цепи миозина (MYh2) в зависимости от времени. . К 10 дню после оживления скелетные миоциты образуют полосатые многоядерные миоциты, которые сокращаются в ответ на ацетилхолин.
Скелетные миоциты человека доступны в большом масштабе, легко культивируются и готовы к экспериментам в течение нескольких дней, обеспечивая надежную модель для исследования мышечных, нервно-мышечных и связанных с ними метаболических нарушений.
В сотрудничестве с bit.bio
Кариотип: Нормальный
Плотность посева: 100000 клеток / см 2
Совместимость с посевом: Совместимость с 6, 12, 24 и 96 лунками
Контроль качества: Анализ стерильности, ICC и экспрессии генов
Приложения для исследований: Исследование мышц, Исследование нервно-мышечных соединений, Метаболические исследования, Разработка лекарств, Генетический скрининг (например,г. CRISPR-скрининг), Анализ сокращений
Этот продукт является предметом лицензий на ограниченное использование от iPS Academia Japan Inc, TET Systems GmbH, ERS Genomics Limited и Sigma-Aldrich Co. LLC и разработан с использованием запатентованной технологии Bit Bio. Полную информацию о лицензиях и патентах см. На наших страницах с лицензиями на ограниченное использование и патентами.
Транскриптомные профили в сердечных миоцитах, индуцированные механическим растяжением
Lorell, B.H. & Carabello, B.а. Клиническая кардиология: новые рубежи гипертрофии левого желудочка. 470–479, https://doi.org/10.1161/01.CIR.102.4.470 (2000).
Ван Берло, Дж. Х., Майе, М. и Молькентин, Дж. Д. Сигнальные эффекторы, лежащие в основе патологического роста и ремоделирования сердца. J. Clin. Вкладывать деньги. 123 , 37–45 (2013).
Артикул PubMed PubMed Central Google Scholar
Синь, М., Олсон, Э.Н. и Бассель-дуби, Р. Публичный доступ NIH. Nat. Rev. Mol. Cell Biol. 14 , 529–541 (2013).
CAS Статья PubMed PubMed Central Google Scholar
Эль-Армуш, А. и Эшенхаген, Т. Стимуляция β-адренорецепторов и функция миокарда при сердечной недостаточности. Сердечная недостаточность. Ред. 14 , 225–241 (2009).
CAS Статья PubMed Google Scholar
Мадд, Дж. О. и Касс, Д. А. Борьба с сердечной недостаточностью в двадцать первом веке. Природа 451 , 919–928 (2008).
ADS CAS Статья PubMed Google Scholar
Хилл, Дж. А. и Олсон, Э. Н. Пластичность сердца. N. Engl. J. Med. 358 , 1370–1380 (2008).
CAS Статья PubMed Google Scholar
Ямазаки, Т. и др. . Эндотелин-1 участвует в гипертрофии кардиомиоцитов, вызванной механическим стрессом. J. Biol. Chem. 271 , 3221–3228 (1996).
CAS Статья PubMed Google Scholar
Садошима Дж. И Изумо С. Клеточный и молекулярный ответ сердечных миоцитов. Annu. Ред. Physiol . 551–571 (1997).
Komuro, I. et al. .Растяжение сердечных миоцитов стимулирует экспрессию протоонкогенов. J. Biol. Chem. 265 , 3595–3598 (1990).
CAS PubMed Google Scholar
Hai, T. & Curran, T. Межсемейная димеризация факторов транскрипции Fos / Jun и ATF / CREB изменяет специфичность связывания ДНК. Proc. Natl. Акад. Sci. 88 , 3720–3724 (1991).
ADS CAS Статья PubMed PubMed Central Google Scholar
Хошидзима, М. и Чиен, К. Р. Смешанные сигналы при сердечной недостаточности: правила рака. J. Clin. Вкладывать деньги. 109 , 849–855 (2002).
CAS Статья PubMed PubMed Central Google Scholar
Хайнеке Дж. И Молькентин Дж. Д. Регулирование гипертрофии сердца с помощью внутриклеточных сигнальных путей. Nat. Rev. Mol. Cell Biol. 7 , 589–600 (2006).
CAS Статья PubMed Google Scholar
Ruwhof, C. & van der Laarse, A. Механическая гипертрофия сердца, вызванная стрессом: механизмы и пути передачи сигналов. Кардиоваск. Res. 47 , 23–37 (2000).
CAS Статья PubMed Google Scholar
Hasenfuss, G. Животные модели сердечно-сосудистых заболеваний, сердечной недостаточности и гипертрофии человека. Cardiovasc. Res. 39 , 60–76 (1998).
CAS Статья PubMed Google Scholar
Liang, Q. & Molkentin, J. D. Переосмысление роли передачи сигналов p38 и JNK в сердечной гипертрофии: дихотомия между культивируемыми миоцитами и моделями животных. J. Mol. Клетка. Кардиол. 35 , 1385–1394 (2003).
CAS Статья PubMed Google Scholar
Луш, В. Э., Шихан, К. А. и Вольска, Б. М. Методы выделения, культивирования и переноса генов кардиомиоцитов. J. Mol. Клетка.Кардиол. 51 , 288–298 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Сагден П. Х. и Клерк А. Клеточные механизмы гипертрофии сердца. J. Mol. Med. (Берл). 76 , 725–746 (1998).
CAS Статья PubMed Google Scholar
Адамс, Дж. У. и Браун, Дж.H. G-белки в росте и апоптозе: Уроки сердца. Онкоген 20 , 1626–1634 (2001).
CAS Статья PubMed Google Scholar
Глембоцки, К. К. Классические исследования гипертрофии кардиальных миоцитов в культуре: Интервью с трансформатором. Circ. Res. 113 , 1112–1116 (2013).
CAS Статья PubMed PubMed Central Google Scholar
Франк, Д. и др. . Паттерн экспрессии генов в биомеханически растянутых кардиомиоцитах: данные о программе генов, специфичных для растяжения. Гипертония 51 , 309–318 (2008).
CAS Статья PubMed Google Scholar
Boerma, M. et al. . Микроматричный анализ профилей экспрессии генов сердечных миоцитов и фибробластов после механического воздействия, ионизирующего или ультрафиолетового излучения. BMC Genomics 6 , 6 (2005).
Артикул PubMed PubMed Central Google Scholar
Гарднер, Д. Г., Виртц, Х. и Доббс, Л. Г. Растяжимая регуляция синтеза и секреции предсердных пептидов в культивируемых кардиоцитах предсердий. Am. J. Physiol. 263 , E239–44 (1992).
CAS PubMed Google Scholar
Лян Ф. и Гарднер Д. Г. Аутокринные / паракринные детерминанты экспрессии гена натрийуретического пептида, активированного штаммом, в культивируемых сердечных миоцитах. J.Biol.Chem. 273 , 14612–14619 (1998).
CAS Статья PubMed Google Scholar
Liang, F. & Gardner, D. G. Механический штамм активирует транскрипцию гена BNP посредством p38 / NF-kappaB-зависимого механизма. J. Clin.Вкладывать деньги. 104 , 1603–1612 (1999).
CAS Статья PubMed PubMed Central Google Scholar
Токола, Х. и др. . Изменения экспрессии гена натрийуретического пептида B-типа, вызванные механической нагрузкой. Банка. J. Physiol. Pharmacol. 79 , 646–653 (2001).
CAS Статья PubMed Google Scholar
Jc, G., Cl, M. & Rt, L. Регенеративная биология. Cold Spring Harb. Perspect Med 1 , 1–18 (2013).
Google Scholar
Дэн, X. Ф., Рокош, Д. Г. и Симпсон, П. С. Автономная и индуцированная факторами роста гипертрофия в культивируемых кардиомиоцитах новорожденных мышей. Сравнение с крысой. Circ. Res. 87 , 781–788 (2000).
CAS PubMed Google Scholar
Койвисто, Э. и др. . Характеристика регуляторных механизмов активации фактора транскрипции 3 гипертрофическими стимулами в кардиомиоцитах крыс. PLoS One 9 (2014 г.).
Tokola, H. et al. . Костный морфогенетический белок-2-A — потенциальный аутокринный / паракринный фактор, опосредующий экспрессию активированного растяжением B-типа и предсердного натрийуретического пептида в сердечных миоцитах. Мол. Клетка. Эндокринол. 399 , 9–21 (2015).
CAS Статья PubMed Google Scholar
Саккинен, Х. и др. . Митоген-активированная протеинкиназа p38 нацелена на регенерирующую островковую экспрессию 3gamma, которая активируется при воспалительном ответе сердца в сердце крысы. Physiol. Отчет 4 , 1–12 (2016).
Артикул Google Scholar
Luosujarvi, H. и др. . Новый диксин-мишень p38 MAPK быстро индуцируется механической нагрузкой на сердце. Blood Press 19 , 54–63 (2010).
Артикул PubMed Google Scholar
Франк, Д. и др. . Lmcd1 / Dyxin, новый белок LIM, связанный с Z-диском, опосредует гипертрофию сердца in vitro и in vivo . J. Mol. Клетка. Кардиол. 49 , 673–682 (2010).
CAS Статья PubMed Google Scholar
Мустонен, Э. и др. . Подобный фактору некроза опухоли слабый индуктор апоптоза (TWEAK) и его рецептор Fn14 во время ремоделирования сердца у крыс. Acta Physiol. 199 , 11–22 (2010).
CAS Статья Google Scholar
Chorianopoulos, E. et al. .FGF-индуцибельный белок 14 кДа (Fn14) регулируется с помощью киназного пути RhoA / ROCK в кардиомиоцитах и опосредует активацию ядерного фактора-kappaB посредством TWEAK. Basic Res. Кардиол. 105 , 301–313 (2010).
CAS Статья PubMed Google Scholar
Мойланен, А.-М. и др. . WDR12, член Nucleolar PeBoW-Complex, активируется при сердечной недостаточности и вызывает ухудшение сердечной функции. PLoS One 10 , e0124907 (2015).
Артикул PubMed PubMed Central Google Scholar
Rangrez, A. Y. et al. . Фактор-1 миелоидного лейкоза представляет собой новый модулятор пролиферации кардиомиоцитов новорожденных крыс. Biochim. Биофиз. Acta — Мол. Cell Res. 1864 , 634–644 (2017).
CAS Статья Google Scholar
Уилл, Р. Д. и др. . Myomasp / LRRC39, белок, специфичный для сердца и мышц, является новым компонентом саркомерной m-полосы и участвует в ощущении растяжения. Circ. Res. 107 , 1253–1264 (2010).
CAS Статья PubMed Google Scholar
Kelloniemi, A. et al. . Ген PHACTR1, связанный с ранним началом инфаркта миокарда, регулирует экспрессию гена альфа-актина в скелете и сердце. PLoS One 10 (2015).
Komuro, I. & Yazaki, Y. Контроль экспрессии сердечных генов с помощью механического стресса. Annu. Rev. Physiol. 55 , 55–75 (1993).
CAS Статья PubMed Google Scholar
Ruskoaho, H. et al. . Регуляция высвобождения натрийуретического пептида желудочков предсердий в гипертрофированном миокарде крысы. Эффекты физических упражнений.Тираж 80 , 390–400 (1989).
CAS Статья PubMed Google Scholar
Flogel, U. Недостаток миоглобина вызывает переключение в выборе сердечного субстрата. Circ. Res. 96 , e68 – e75 (2005).
Артикул PubMed Google Scholar
Taegtmeyer, H., Wilson, C.R., Razeghi, P. & Sharma, S.Метаболическая энергетика и генетика в сердце. Ann. Акад. Sci. 1047 , 208–218 (2005).
ADS CAS Статья PubMed Google Scholar
Strom, J. & Chen, Q. M. Потеря Nrf2 способствует быстрому прогрессированию сердечной недостаточности после инфаркта миокарда. Toxicol. Прил. Pharmacol. 327 , 52–58 (2017).
CAS Статья PubMed Google Scholar
Ли, Дж. и др. . Nrf2 защищает от дезадаптивных реакций сердца на гемодинамический стресс. Артериосклер. Тромб. Васк. Биол. 29 , 1843–1850 (2009).
CAS Статья PubMed Google Scholar
Кумар Р. Р. и др. . Отмена Nrf2 нарушает передачу антиоксидантных сигналов и способствует гипертрофии предсердий в ответ на физическую нагрузку высокой интенсивности. J. Transl.Med. 14 , 86 (2016).
Артикул PubMed PubMed Central Google Scholar
Шао, М. и др. . Защитный эффект сероводорода от гипертрофии миокарда у мышей. Oncotarget 8 , 22344–22352 (2017).
PubMed PubMed Central Google Scholar
Ван Б. В., Хунг Х.Ф., Чанг, Х., Куан, П. и Шю, К. Г. Механическое растяжение усиливает экспрессию гена резистина в культивируемых кардиомиоцитах через фактор некроза опухоли альфа. Am. J. Physiol. Circ. Physiol. 293 , h3305–12 (2007).
CAS Статья Google Scholar
Pan, J. et al. . Механическое растяжение активирует путь JAK / STAT в кардиомиоцитах крыс. Circ. Res . 84 (1999).
Даннмон, П. М., Иваки, К., Хендерсон, С. А., Сен, А. и Чиен, К. Р. Сложные эфиры форбола индуцируют немедленные ранние гены и активируют транскрипцию сердечных генов в клетках миокарда новорожденных крыс. J. Mol. Клетка. Кардиол. 22 , 901–910 (1990).
CAS Статья PubMed Google Scholar
Лу, Дж. и др. . Фактор регуляции интерферона 3 является негативным регулятором патологической гипертрофии сердца. Basic Res. Кардиол. 108 , 326 (2013).
ADS Статья PubMed Google Scholar
Jiang, D. S. et al. . Фактор 7, регулирующий интерферон, действует как новый негативный регулятор патологической гипертрофии сердца. Гипертония 63 , 713–722 (2014).
CAS Статья PubMed PubMed Central Google Scholar
Цусима, К. и др. . IRF3 регулирует сердечный фиброз, но не гипертрофию у мышей во время гипертензии, индуцированной ангиотензином II. FASEB J. 25 , 1531–1543 (2011).
CAS Статья PubMed Google Scholar
Au, W.-C., Yeow, W.-S. И Пита, П. М. Анализ функциональных доменов фактора регуляции 7 интерферона и его ассоциации с IRF-3. Вирусология 280 , 273–282 (2001).
CAS Статья PubMed Google Scholar
Sato, M. et al. . Различная и важная роль факторов транскрипции IRF-3 и IRF-7 в ответ на вирусы для индукции гена IFN-α / β. Иммунитет 13 , 539–548 (2000).
CAS Статья PubMed Google Scholar
Ааронсон Д. С., Курт М. и Хорват. Дорожная карта для тех, кто не знает JAK-STAT. Наука (80-.). 296 , 1653–1655 (2002).
ADS CAS Статья Google Scholar
Jiang, D.-S. и др. . Фактор регуляции интерферона 1 необходим для ремоделирования сердца в ответ на перегрузку давлением. Гипертония 64 , 77–86 (2014).
CAS Статья PubMed Google Scholar
Цзян, Д.-С. и др. . Роль фактора регуляции интерферона 4 в регуляции патологической гипертрофии сердца. Гипертония 61 , 1193–1202 (2013).
CAS Статья PubMed PubMed Central Google Scholar
Jiang, D. S. et al. . Фактор регуляции интерферона 9 защищает от гипертрофии сердца, воздействуя на миокардин. Гипертония 63 , 119–127 (2014).
CAS Статья PubMed Google Scholar
Gray, C., Li, M., Patel, R., Reynolds, CM & Vickers, MH Профили миРНК Let-7 связаны с обращением гипертрофии левого желудочка и гипертонии у взрослых потомков мужского пола от матерей. недоедает во время беременности после лечения гормоном роста перед отъемом. Эндокринология 155 , 4808–4817 (2014).
Артикул PubMed Google Scholar
Хан, М., Толи, Дж. И Абделлатиф, М. МикроРНК в сердечно-сосудистой системе. Curr. Opin. Кардиол. 26 , 181–189 (2011).
Артикул PubMed Google Scholar
Mohamed, J. S., Hajira, A., Lopez, M. A. & Boriek, A. M. Скрининг механочувствительных микроРНК (MechanomiR) в масштабе всего генома обнаруживает нарушение регуляции их регуляторных сетей в мышиной модели мышечной дистрофии mdm. Дж.Биол. Chem. 290 , 24986–25011 (2015).
CAS Статья PubMed PubMed Central Google Scholar
Herum, K., Lunde, I., McCulloch, A. & Christensen, G. Мягкое и жесткое сердце сердечных фибробластов: пути передачи сигналов механотрансдукции при фиброзе сердца. J. Clin. Med. 6 , 53 (2017).
Артикул PubMed Central Google Scholar
Russell-Puleri, S. et al. . Напряжение сдвига жидкости индуцирует повышенную регуляцию высвобождения COX-2 и PGI 2 в эндотелиальных клетках посредством пути, включающего PECAM-1, PI3K, FAK и p38. Am. J. Physiol. — Слышать. Circ. Physiol. 312 , h585 – H500 (2017).
Артикул Google Scholar
Хага, Дж. Х., Ли, Ю. С. Дж. И Чиен, С. Молекулярные основы воздействия механического растяжения на гладкомышечные клетки сосудов. J. Biomech. 40 , 947–960 (2007).
Артикул PubMed Google Scholar
Chiquet, M., Gelman, L., Lutz, R. & Maier, S. От механотрансдукции к экспрессии гена внеклеточного матрикса в фибробластах. Biochim. Биофиз. Acta — Мол. Cell Res. 1793 , 911–920 (2009).
CAS Статья Google Scholar
Serbanovic-Canic, J. et al. . Модель рыбок данио для функционального скрининга генов, чувствительных к потоку. Артериосклер. Тромб. Васк. Биол. 37 , 130–143 (2017).
CAS Статья PubMed Google Scholar
Li, Q. et al. . Защитная роль Nrf2 против апоптоза, вызванного механическим растяжением в фибробластах мыши: потенциальная терапевтическая мишень стрессового недержания мочи, вызванного механической травмой. Внутр. Урогинекол. J . 1–9, https://doi.org/10.1007/s00192-017-3545-7 (2018).
Cheng, W.-P., Wang, B.-W., Chen, S.-C., Chang, H., Shyu, K.-G. Механическое растяжение индуцирует регулятор апоптоза PUMA в гладкомышечных клетках сосудов. Cardiovasc. Res. 93 , 181–189 (2012).
CAS Статья PubMed Google Scholar
Якобсон, С. Л. и Пайпер, Х.М. Клеточные культуры взрослых кардиомиоцитов как модели миокарда. J. Mol. Клетка. Кардиол. 18 , 661–678 (1986).
CAS Статья PubMed Google Scholar
Митчесон, Дж. С., Хэнкокс, Дж. К. и Леви, А. Дж. Культивированные сердечные миоциты взрослых: будущие применения, методы культивирования, морфологические и электрофизиологические свойства. Cardiovasc. Res. 39 , 280–300 (1998).
CAS Статья PubMed Google Scholar
Матса, Э., Аренс, Дж. Х. и Ву, Дж. К. Индуцированные человеком плюрипотентные стволовые клетки как платформа для персонализированной и точной сердечно-сосудистой медицины. Physiol. Ред. 96 , 1093–1126 (2016).
Артикул PubMed Google Scholar
Trexler, C. L., Odell, A. T., Jeong, M.Ю., Доуэлл, Р. Д., Лейнванд, Л. А. На транскриптом и функциональный профиль сердечных миоцитов влияет биологический пол. КЛИНИЧЕСКАЯ ПЕРСПЕКТИВА. Circ. Кардиоваск. Genet. 10 , e001770 (2017).
CAS Статья PubMed Google Scholar
Пиккарайнен, С. и др. . GATA-4 является ядерным посредником гипертрофической программы, активируемой механическим растяжением. J. Biol. Chem. 278 , 23807–23816 (2003).
CAS Статья PubMed Google Scholar
Rysä, J., Leskinen, H., Ilves, M. & Ruskoaho, H. Отчетливая активация генов внеклеточного матрикса при переходе от гипертрофии к гипертонической сердечной недостаточности. Гипертония 45 , 927–933 (2005).
Артикул PubMed Google Scholar
Маялахти-Палвиайнен, Т. и др. .
