Каталог продукции ООО ВИННЕР | Winner, РФ
Бисглицинат Железа
Показать описаниеХелаты железа с аминокислотами, такие как хелаты железа с глицинатом, были разработаны для использования в качестве пищевых добавок и терапевтических агентов при профилактике и лечении железодефицитной анемии.
Бисглицинат Железа является наиболее изученной и используемой формой. На поглощение железа из бисглицината влияют усилители и ингибиторы всасывания железа, но в меньшей степени, чем из сульфата железа. Железа Бисглицинат лучше усваивается из молока, пшеницы, цельной кукурузной муки и предварительно приготовленной кукурузной муки, чем сульфат железа. Испытания добавок показали, что Бисглицинат Железа эффективнее при лечении железодефицитной анемии, чем минеральные соли железа.
Бисглицинат Кальция
Кальций — один из самых распространённых макроэлементов в организме растений, животных и человека, большая его часть находится в скелете и зубах.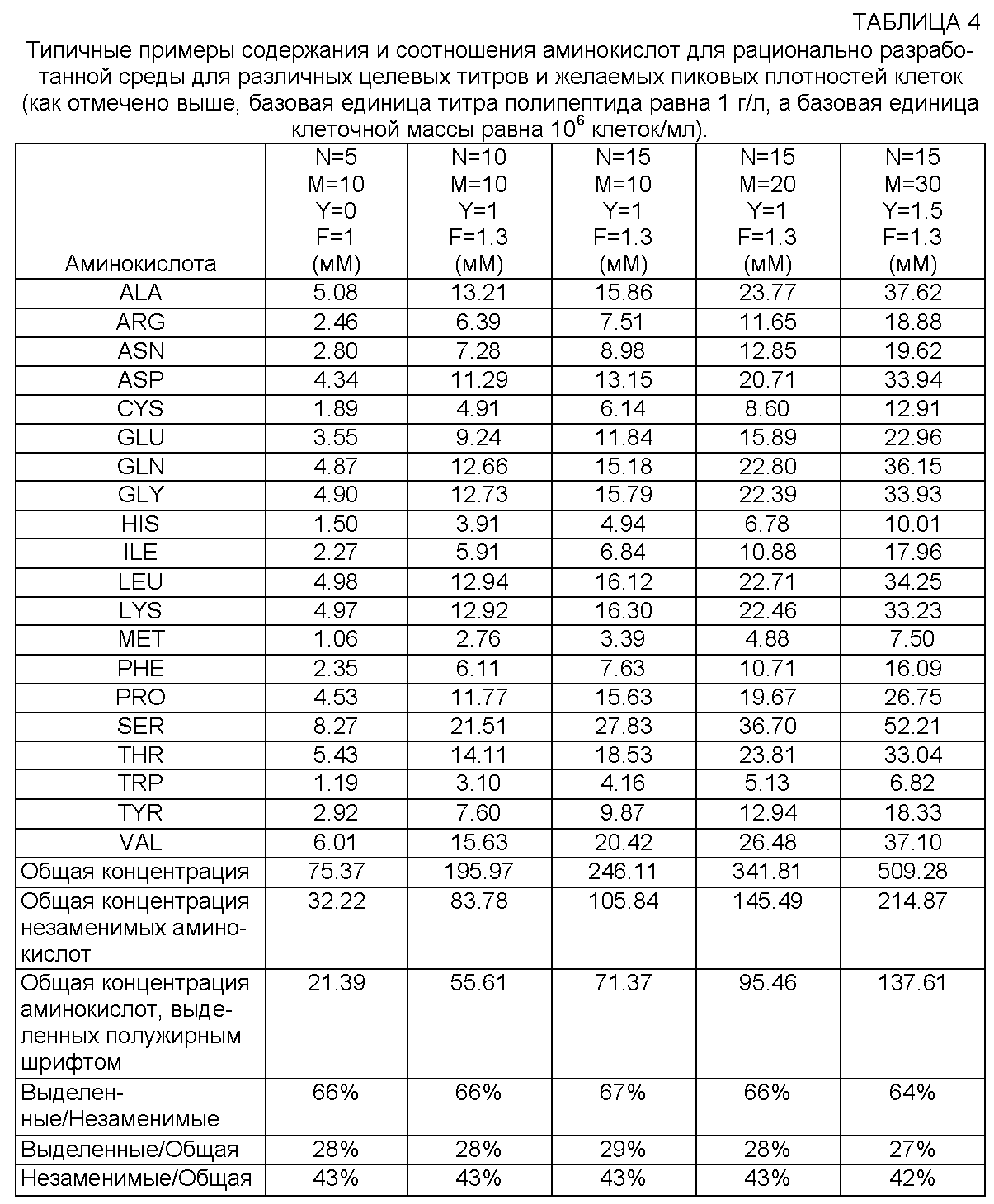 Этот химический элемент участвует в ключевых физиологических и биохимических процессах клетки. Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, в том числе секрецию гормонов и нейромедиаторов.
Этот химический элемент участвует в ключевых физиологических и биохимических процессах клетки. Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, в том числе секрецию гормонов и нейромедиаторов.
Биодоступность Кальция из лекарственных средств и БАД крайне низка. Поэтому была изобретена хелатная форма кальция, которая на сегодня является самой биодоступной формой.
Преимущества хелатной формы кальция
· Высокая биодоступность – усваиваться на 90-98%.
· Быстро восполняет дефицит кальция в организме;
· Поддерживает нормальное состояние костной ткани, зубов;
· Способствует улучшению функционального состояния сосудов и сердца
· Не оказывает влияния на слизистую желудка и уровень кислотности.
· Не вызывает вздутия и нарушения пищеварения.
· Не вызывает отложения нерастворимых солей на стенках кровеносных сосудов.
· Проникает через плацентарный барьер, что способствует лучшему развитию плода.
Бисглицинат Магния
Показать описаниеБисглицинат магния — источник магния с высокой биодоступностью, что является главной отличительной особенностью данной хелатной формы магния.
Магний необходим для метаболизма углеводов, белков и жиров, а также для здоровья костей и зубов, нормальной работы мышц и общего состояния здоровья.
Бисглицинат магния поддерживает работу сердца, нервную систему и клеточную энергию. Бисглицинат магния также оказывает поддержку мышечным спазмам, синдрому беспокойных ног, уменьшению мигрени и симптомов ПМС.
Преимущества:
- Помогает поддерживать правильную функцию мышц
- Помогает в развитии и поддержании костей и зубов
- Помогает в формировании тканей
- Помогает организму усваивать углеводы, жиры и белки
- Фактор в поддержании хорошего здоровья
Бисглицинат Цинка Показать описание Хелатные соединения минералов в настоящее время часто включаются в основные продукты питания человека. Эти особые органические формы неорганических минеральных элементов представляют собой хелаты минеральных аминокислот. Аминокислотные хелаты, используемые в минеральных добавках и в обогащении пищевых продуктов, обеспечивают полноценное органическое минеральное питание, предоставляя наибольший шанс усвоения минеральных веществ.

Хелат металла и аминокислоты — продукт, образующийся в результате реакции иона металла из растворимой соли металла с аминокислотами при молярном соотношении, составляющем один ион металла к одной – трём (предпочтительно, двум) молекулам аминокислот, с образованием ковалентно-координационных связей. Средняя молекулярная масса гидролизованных аминокислот должна составлять примерно 150, а молекулярная масса образовавшегося хелата не должна превышать 800.
Внешне соединение напоминает клешню краба и поэтому называется «хелатом» (с лат. «chele» – клешня).
Когда лиганд присоединяется к иону металла таким образом, что образует кольцо, то обнаруживается, что соединение металл-лиганд является более стабильной. Другими словами, можно сказать, что комплексы, содержащие хелатные кольца, более устойчивы, чем комплексы без колец. Это известно, как хелатный эффект.
В то время как минералы часто имеют плохой вкус, имеют низкую биодоступность и ускоряют разложение продуктов, хелатные формы показали, что они не влияют на окисление и дают минимальный вкус (отличные органолептические свойства).
Клинические исследования Бисглицината Железа показали, что такая форма минерала улучшает показатели гемоглобина и ферритина при более низких дозировках, чем сульфат железа или аскорбат железа; более низкие дозы означают меньшее количество побочных эффектов и отсутствие взаимодействия с другими питательными веществами.
Тонкий кишечник, где происходит основной процесс усвоения минералов, способен усваивать отдельные ионы минералов только при соединении их с аминокислотами. В хелатной форме ионы минералов уже находятся в оболочке аминокислоты и не требуют дополнительных превращений, т.е. готовы к усвоению клетками тонкого кишечника. Поэтому сегодня хелатная форма считается максимально усваиваемой.
Преимущества Хелатов по сравнению с неорганическими формами минеральных солей:
1. Более высокая биодоступность
2. Легче переносятся — отсутствует желудочный дискомфорт
3. Более высокая степень безопасности
4.
5. Лучшие физиологические эффекты
6. 100% питательностьАминокислотный хелат может включать железо, цинк, марганец, магний, медь, кальций и их смеси.
Хелатные соединения минералов сейчас широко используются при производстве пищевых добавок для обогащения напитков, готовой еды, молочных продуктов, кондитерских изделий; производстве спортивного питания, в косметологии и в производстве лекарственных средств.
L- и D-аминокислоты в составе биоапатита зубов и определение возраста человека
Одной из наиболее значительных проблем в судебной антропологии является идентификация возраста человеческих останков. Большинство существующих методов оценки возраста костных останков основаны на исследовании дегенеративных изменений в скелете, которые сильно зависят от образа жизни, здоровья и питания человека.
Здоровая эмаль содержит минеральной компоненты 95—97, воды 2—3 и органических веществ 1,0—2,0 мас.%, из которых на белок приходится около 0,01—1,0 мас.% [5]. Согласно данным А. Veis [6], содержание белка в зрелой эмали составляет 1—2%. Следует отметить, что такая разница объясняется неоднородностью распределения белка: его концентрация увеличивается к области эмалево-дентинного соединения.
P. Helfman и J. Bada [4] впервые в 1975 г. определили соотношение энантиомеров в белках эмали зубов и показали существование зависимости между соотношением D/L Asp и возрастом зубов человека. В настоящее время анализ содержания D-Asp в долго живущих органоминеральных агрегатах (зубы, кости) считается надежным методом оценки возраста для идентификации неизвестного физического лица в судебной практике [2, 3, 7].
Цель работы — анализ степени рацемизации аминокислот в биоапатите зубов человека и выявление зависимости количественного соотношения L/D аминокислот от его возраста и патологических изменений в физиогенных биоминеральных образованиях.
Материал и методы
Объектами исследования служили эмаль кариозных молочных моляров (n=4), эмаль без признаков кариеса постояных зубов (n=8) человека и корневой дентин с цементом (n=4) зубов, удаленных в стоматологических учреждениях по ортодонтическим показаниям и в связи с различными патологическими процессами в тканях пародонта. Возраст предоставивших биоматериал составил от 11 до 78 лет. Предварительной деминирализации биоапатита не проводили. Сколы эмали и дентина растирали в агатовой ступке, для аминокислотного анализа использовали 100 мг вещества.
Возраст предоставивших биоматериал составил от 11 до 78 лет. Предварительной деминирализации биоапатита не проводили. Сколы эмали и дентина растирали в агатовой ступке, для аминокислотного анализа использовали 100 мг вещества.
Для извлечения аминокислот из белковой составляющей применяли кислотный гидролиз в 6 М HCl при температуре 105 °С в течение 12 ч. Выделенные из гидролизата аминокислоты очищали от примесей и переводили в N-пентафторпропионовые изопропиловые эфиры соответствующих аминокислот. Разделение, идентификацию и количественное определение содержания энантиомеров аминокислот проводили на газовом хроматографе GC-17A (Shimadzu, капиллярная колонка Chirasil-L-Val) по методу, описанному С.Н. Шаниной и Е.А. Голубевым [8]. С помощью данной методики анализировали L- и D-изомеры 13 аминокислот: аланин (Ala), валин (Val), изолейцин (Ile), лейцин (Leu), аспарагиновая кислота (Asp), глутаминовая кислота (Glu), треонин (Thr), серин (Ser), фенилаланин (Phe), тирозин (Tyr), пролин (Pro), лизин (Lys), метионин (Met). Все используемые реагенты имели высокую степень чистоты (компаний Sigma, Aldrich, Fluka). Для приготовления растворов использовали бидистиллированную и деионизированную воду. Чтобы исключить попадание аминокислот из реагентов, параллельно с образцами проводили «холостой опыт».
Все используемые реагенты имели высокую степень чистоты (компаний Sigma, Aldrich, Fluka). Для приготовления растворов использовали бидистиллированную и деионизированную воду. Чтобы исключить попадание аминокислот из реагентов, параллельно с образцами проводили «холостой опыт».
Результаты и обсуждение
Анализ аминокислотного состава твердых тканей зубов показал, что глицин, пролин, глутаминовая кислота и аланин являются доминирующими аминокислотами, что согласуются с данными литературы [5, 9]. В трех образцах биоапатита эмали выявили более высокое содержание Ile, Ala и Asp.
В изученных образцах зубов D-формы обнаружили для трех аминокислот: аспарагиновой, глутаминовой и аланина. Наиболее высокое значение соотношений D/L Asp получили для биоапатита эмали пародонтитного зуба и корневого дентина зубов мудрости с ретенцией (см. таблицу). Независимо от возраста человека наблюдали разброс в значениях показателей D/L Asp в твердых тканях зубов при аномалиях в пародонте. Кроме того, прослеживалось увеличение содержания D-Asp в эмали молочных зубов, пораженных кариесом.
Кроме того, прослеживалось увеличение содержания D-Asp в эмали молочных зубов, пораженных кариесом.
Следует отметить, что для эмали зубов с воспалительными и дегенеративными процессами в пародонте высоким значениям D-Asp, как правило, соответствует повышенное значение D-Glu. Не обнаружили какой-либо закономерности в степени рацемизации аланина в биоапатите зубов в зависимости от патологических процессов в тканях пародонта. В зубах, удаленных по ортодонтическим показаниям, отметили низкие значения D/L Asp, Glu, Ala, что может указывать на фактический возраст человека.
Согласно исследованиям [1], наиболее сильная зависимость наблюдается между возрастом зуба и степенью рацемизации Asp в зубной эмали, являющейся более устойчивой к воздействию внешних факторов, а у большей части подвергнутых анализу постоянных зубов, пораженных кариесом, не зафиксировали увеличения значения D/L Asp.
Как следует из данных таблицы, эмаль молочных моляров, пораженная кариесом и отличающаяся степенью рацемизации аминокислот, вероятно, характеризуется индивидуальным энантиомерным «портретом метаболизма». Полагаем, что на концентрацию D-изомеров аминокислот в эмали влияет жизнедеятельность микроорганизмов в кариозной полости, способных продуцировать и метаболизировать D-аминокислоты.
Полагаем, что на концентрацию D-изомеров аминокислот в эмали влияет жизнедеятельность микроорганизмов в кариозной полости, способных продуцировать и метаболизировать D-аминокислоты.
Таблица. Соотношение D/L энантиомеров в составе органической составляющей биоапатита эмали и корневого дентина зубов человека
Table. The ratio of D/L enantiomers in the organic component of bioapatite enamel and root dentin of human teeth
№ образца | Зубная формула** | Возраст человека, годы | Патология | D/L Asp | D/L Glu | D/L Ala | Доминирующие АК |
175 эмаль | 14 | 14 | Ортодонтические показания | 0. | — | — | Gly, Pro, Glu, Asp |
175 корень | 14 | 14 | То же | 0.04 | 0.03 | 0.02 | Gly, Pro, Glu, Ala |
139 эмаль | 28 | 20 | » » | 0.04 | — | — | Glu, Pro, Lys, Asp |
197 корень | 38 | 21 | Ретенция | 0. | 0.02 | 0.03 | Gly, Pro, Glu, Ala |
167 эмаль | 38 | 22 | Периодонтит | 0.05 | 0.05 | 0.04 | Gly, Pro, Glu, Ala |
167 корень | 38 | 22 | » | 0.05 | 0.05 | 0.04 | Gly, Pro, Glu, Ala |
182 эмаль | 26 | 15 | » | 0. | 0.03 | 0.05 | Glu, Asp, Ala, Pro, |
207 эмаль | 48 | 27 | Полуретенция | 0.06 | 0.05 | 0.05 | Glu, Gly, Pro, Ala |
200 эмаль | 17 | 39 | Пародонтит | 0.08 | 0.09 | 0.02 | Gly, Pro, Glu, Ala |
190 корень | 23 | 39 | » | 0. | 0.03 | 0.06 | Gly, Pro, Glu, Ala |
203 эмаль | 34 | 51 | » | 0.06 | 0.06 | 0.04 | Gly, Pro, Glu, Ala |
118 эмаль | 18 | 78 | Пародонтоз | 0.07 | 0.09 | — | Glu, Ala, Gly Asp |
14 ММ* эмаль | 64 | 8 | Кариес | 0. | 0.05 | 0.05 | Gly, Pro, Glu, Asp |
32 ММ эмаль | 85 | 10 | » | 0.03 | 0.03 | — | Gly, Pro, Glu, Ala |
ММ эмаль | ? | ? | » | 0.05 | 0.02 | 0.03 | Gly, Pro, Ala, Glu |
9 ММ эмаль | ? | ? | » | 0. | 0.01 | 0.04 | Glu, Pro, Gly, Asp |
Примечание. * — ММ — молочный моляр; ** — зубная формула по международной номенклатуре.
Ранее проведенные исследования 64 образцов коронкового и корневого дентина, удаленных из человеческих останков, выявили очень высокую корреляцию между метрическим возрастом зубов и значением соотношений D/L Asp [3]. Результаты, полученные на основе метода линейной регрессии, позволили авторам высказаться о перспективности применения способа рацемизации Asp в твердых тканях зубов для идентификации личности в судебной медицине.
Сравнительный анализ [10] степени рацемизации Asp как в образце целого зуба, так и дентина показал, что отношения D/L Asp в биоапатите цельного зуба выше, чем у дентина. Авторы отметили, что использование целых зубов упрощает метод рацемизации и может послужить для стандартизации подготовки образцов, анализируемых на содержание D- и L-энантиомеров аминокислот. При исследовании эмали пяти типов зубов с различных позиций от одного индивида выявили, что степень рацемизации Asp в молярах выше, чем в резцах [11].
При исследовании эмали пяти типов зубов с различных позиций от одного индивида выявили, что степень рацемизации Asp в молярах выше, чем в резцах [11].
Известно, что значительные изменения баланса L- и D-аминокислот наблюдаются при различных патологических процессах в органах и тканях человека независимо от хронологического возраста [12]. В нашем исследовании отсутствие представительной выборки зубов не позволяет достоверно судить о влиянии возраста на степень рацемизации Asp в биоапатите твердых тканей. Следует, однако, отметить, что в изученных образцах самые низкие отношения D/L Asp также установлены у людей, чей возраст составляет 14 и 20 лет.
Таким образом, при использовании степени рацемизации аспарагиновой аминокислоты для определения точного хронологического возраста неопознанных трупов требуется разработка единого стандарта при выборе образцов биоапатита зубов человека. Эталоном может служить или эмаль, или коронковый либо корневой дентин зуба с учетом его позиции в полости рта без признаков кариеса и патологических изменений в пародонте.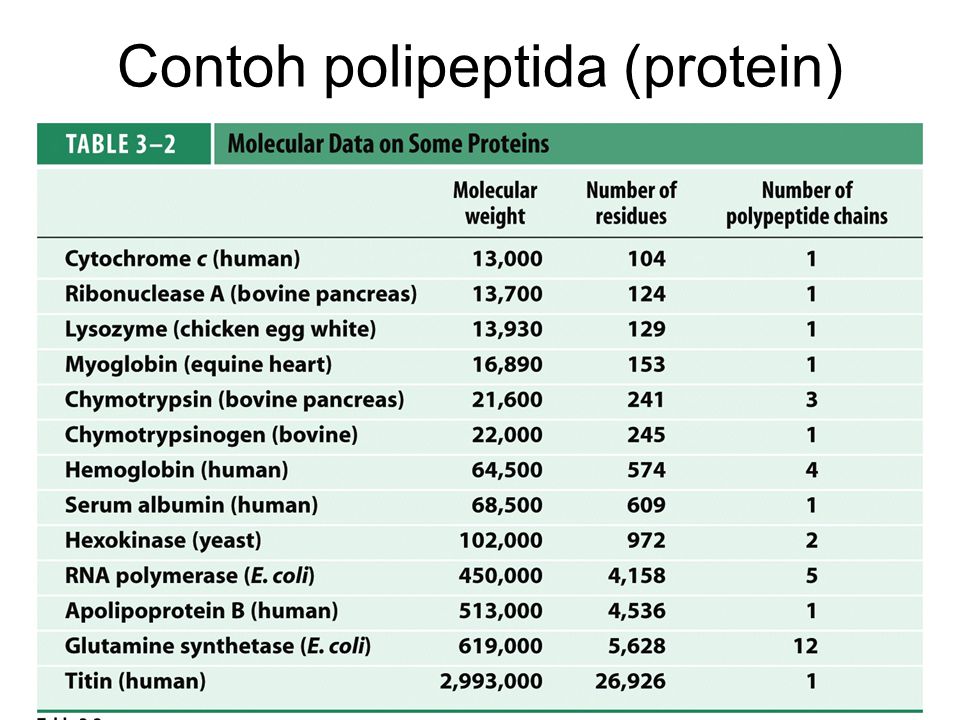
Вывод
Высокие показатели соотношений D/L Asp в белках эмали без признаков кариеса и дентина зависят от наличия патологических процессов в тканях пародонта независимо от хронологического возраста человека. Кариозные процессы в молочных молярах также способствуют повышению количества D-Asp. Низкие показатели соотношений D/L Asp, Glu и Ala определяются в зубах, удаленных по ортодонтическим показаниям.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Российские ученые нашли аминокислотные добавки, позволяющие похудеть — Газета.Ru
Добавка в диету тирозина — аминокислоты, которую спортсмены принимают для повышения выносливости — способствует росту физической активности и уменьшает аппетит, что в перспективе может быть полезно для борьбы с избыточным весом. К такому выводу российские биологи пришли, проанализировав изменение веса и поведения мышей на высококалорийной диете.
Согласно статистике, в России 54 процента мужчин старше 20 лет страдают от избыточного веса и 15 процентов — от ожирения. Среди российских женщин это значение достигает 59 и 28,5 процентов соответственно. В качестве профилактики ВОЗ рекомендует переходить на более здоровый рацион и регулярную физическую активность. Однако из-за нарушенного контроля чувства аппетита полным людям бывает сложно придерживаться диетического питания, поскольку специальные регуляторные молекулы посылают сигналы, что организм голоден.
Такими сигнальными веществами в нашем организме служит часть аминокислот и их производных. Так, из аминокислоты триптофана синтезируется серотонин, а из тирозина можно получить целое семейство нейромедиаторов, в том числе дофамин. Если первый из этих гормонов вызывает удовлетворенность после приема пищи и снижает физическую активность, то второй, напротив, способствует повышению аппетита, возникновению чувства голода, нервному и двигательному возбуждению. Благодаря нормально функционирующему балансу между количеством дофамина и серотонина наш организм способен предотвращать набор излишнего веса.
Если первый из этих гормонов вызывает удовлетворенность после приема пищи и снижает физическую активность, то второй, напротив, способствует повышению аппетита, возникновению чувства голода, нервному и двигательному возбуждению. Благодаря нормально функционирующему балансу между количеством дофамина и серотонина наш организм способен предотвращать набор излишнего веса.
Чтобы повлиять на пищевые предпочтения худеющих, можно составлять лечебные диеты с искусственно повышенным или сниженным количеством тех или иных аминокислот. Уже сейчас тирозин широко применяется как добавка в спортивном питании. Его используют для активизации набора мышечной массы, повышения силы и выносливости, облегчения восстановления организма после тренировок и соревнований.
Ученые из Федерального исследовательского центра питания, биотехнологии и безопасности пищи (Москва) проверили, как диета с повышенным содержанием жиров и углеводов в присутствии добавок тирозина влияет на поведение и набор массы мышей. Для этого исследователи разделили животных на четыре группы. Первая получала сбалансированное питание, вторая — с высоким содержанием жира и углеводов. Такая диета характерна для современных городских жителей в промышленно-развитых странах. Третья группа получали питание аналогичное второй, но с добавками тирозина с учетом веса животного, а в четвертой в качестве БАД выступал триптофан. Эксперимент проводили на мышах, генетически предрасположенных к ожирению и устойчивых к нему. На протяжении двух месяцев авторы следили за активностью и изменением веса животных, а также делали анализы крови на сахар и холестерин, изучали работу различных генов в печени.
Для этого исследователи разделили животных на четыре группы. Первая получала сбалансированное питание, вторая — с высоким содержанием жира и углеводов. Такая диета характерна для современных городских жителей в промышленно-развитых странах. Третья группа получали питание аналогичное второй, но с добавками тирозина с учетом веса животного, а в четвертой в качестве БАД выступал триптофан. Эксперимент проводили на мышах, генетически предрасположенных к ожирению и устойчивых к нему. На протяжении двух месяцев авторы следили за активностью и изменением веса животных, а также делали анализы крови на сахар и холестерин, изучали работу различных генов в печени.
Результаты показали, что устойчивые к ожирению мыши на высококалорийном рационе практически не накапливали жир, но у них наблюдались резкие повышения уровня сахара в крови. Генетически предрасположенные к ожирению животные быстро накапливали жир в брюшной полости, а масса их тела, количество жиров и холестерина в крови увеличивались и начиналось перерождение печени, аналогичное жировому гепатозу у людей.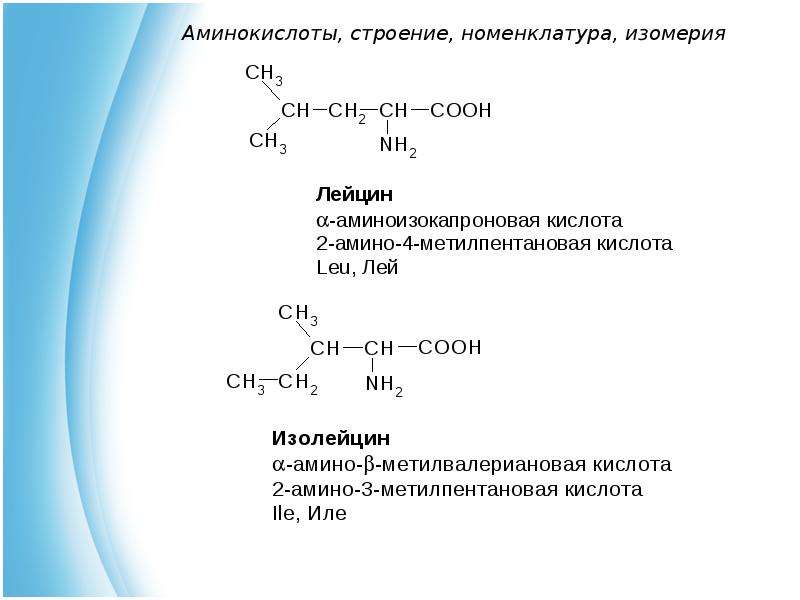 Интересно, что у наследственно устойчивых к ожирению животных добавка тирозина к рациону способствовала повышению двигательной активности, снижению показателей воспаления и нормализации активности большого числа генов. У восприимчивых к ожирению мышей действие добавки тирозина было менее выраженным.
Интересно, что у наследственно устойчивых к ожирению животных добавка тирозина к рациону способствовала повышению двигательной активности, снижению показателей воспаления и нормализации активности большого числа генов. У восприимчивых к ожирению мышей действие добавки тирозина было менее выраженным.
А триптофан, предшественник «гормона радости» серотонина, повлиял совершенно иным образом. Оказалось, что при искусственно вызванном ожирении он оказывал скорее неблагоприятное действие, приводя к усилению отложения жира в печени и усиливая тревожность. Ученые не ожидали таких результатов, поскольку триптофан обычно способствует появлению чувства покоя и насыщения.
Исследователи объяснили наблюдаемый результат тем, что в отношения «организм — диета» вмешивается еще один игрок, а именно кишечная микрофлора. В норме в нашем кишечнике обитает несколько тысяч видов микроорганизмов. Большинство из них либо никак не влияют на нас, либо полезны: к последним относятся, например, бифидо- и лактобактерии, которые синтезируют разнообразные питательные вещества, а также способствуют повышению иммунитета. Проблема, однако, заключается в том, что при неправильном питании, а также при ожирении, видовой состав микроорганизмов в нашем кишечнике может изменяться, и в нем начинают преобладать бесполезные и даже вредные микроорганизмы, вызывающие гнилостные процессы. Вследствие именно таких процессов из триптофана могут образовываться токсические вещества, оказывающие неблагоприятное воздействие на организм, в том числе на головной мозг. Поэтому для страдающих ожирением эта аминокислота скорее приносит больше вреда, чем пользы.
Проблема, однако, заключается в том, что при неправильном питании, а также при ожирении, видовой состав микроорганизмов в нашем кишечнике может изменяться, и в нем начинают преобладать бесполезные и даже вредные микроорганизмы, вызывающие гнилостные процессы. Вследствие именно таких процессов из триптофана могут образовываться токсические вещества, оказывающие неблагоприятное воздействие на организм, в том числе на головной мозг. Поэтому для страдающих ожирением эта аминокислота скорее приносит больше вреда, чем пользы.
«Проведенные исследования показали, что добавки из тирозина могут быть востребованы для профилактики избыточного веса, ожирения и снижения физической активности. Однако очень важно иметь в виду, что использование каких-либо диетических продуктов и БАД, в том числе источников аминокислот, не может рассматриваться как единственное средство лечения ожирения — необходимы также и другие меры, включая занятия физкультурой, ограничение потребление сахара, жирной пищи и спиртного», — подвел итог руководитель проекта Иван Гмошинский, доктор биологических наук, ведущий научный сотрудник ФГБУ «НИИ питания» РАМН.
Как болезни космонавтов помогают лечить нас
- Скотт Смит и Сара Зварт,
- НАСА
Автор фото, Getty Images
Подпись к фото,Астронавт Пегги Уитсон вскоре после посадки
На протяжении тысяч лет путешественники и первооткрыватели сталкивались с проблемой питания. И астронавты не являются тут исключением.
В ходе пребывания в космосе, которое часто длится месяцами, чрезвычайно важно обеспечить членов экипажа всеми необходимыми человеческому организму продуктами питания.
Но современная диетология идет гораздо дальше. Она ставит целью оптимизацию работоспособности астронавтов и в то же время защиту от вредных факторов невесомости и космического излучения.
Столь пристальное внимания к проблемам питания горстки людей, работающих в космосе, может показаться чрезмерным, но решение этих проблем имеет практическое значение для всего человечества.
Проблемы со зрением и бесплодие: что их объединяет
Некоторые астронавты и космонавты возвращаются на Землю после длительного пребывания на борту МКС с проблемами зрения. Они страдают, в частности, так называемыми «ватными пятнами» на сетчатке и воспалением оптического нерва.
Другими словами, люди отправляются в космос с отличным зрением, а по возвращении им нужно прописывать очки.
Ранее причиной этого считалось воздействие на сосудистую систему микрогравитации, в частности, колебания водного баланса организма и повышение внутричерепного давления.
Но эти теории не в состоянии объяснить, почему только 30-40% побывавших в космосе испытывают проблемы со зрением.
Считается, что функционирование сосудистой системы во многом зависит от генетических факторов.
В сочетании с резкими изменениями водного баланса организма в условиях микрогравитации это приводит к повышению проницаемости стенок кровяных сосудов в глазу.
А это приводит к повышению давления, что в свою очередь вызывает проблемы со зрением.
Автор фото, NASA
Подпись к фото,Международная космическая станция
Оказалось, что у таких людей в крови отмечается значительно более высокая концентрация аминокислоты гомоцистеина, причем не только в космосе, но и до полета.
Гомоцистеин присутствует практически в любой клетке человеческого организма. Это один из важнейших компонентов биохимических процессов на протяжении всей жизни человека. Для выработки гомоцистеина требуется присутствие нескольких типов витамина В.
Люди, которые жалуются на проблемы с глазами в ходе пребывания в космосе, нуждаются в более высоких дозах приема этих витаминов из-за своих генетических особенностей.
Автор фото, NASA
Подпись к фото,Астронавт Карен Найберг проходит обследование состояния глаз
Загадочным элементом в этой теории является тот факт, что женщины, страдающие синдромом поликистоза яичников (ПКЯ), обычно также имеют более высокий уровень гомоцистеина, а также проблемы с кровообращением, напоминающие те, которые отмечаются у астронавтов-мужчин, имеющих проблемы со зрением.
Синдром ПКЯ воздействует на работу яичников у женщин. Это основная причина бесплодия, которая затрагивает до 20% женщин.
Причины этого заболевания не до конца понятны и в настоящее время средств лечения нет. Однако вполне возможно, что женщинам с ПКЯ необходимо принимать усиленные дозы витаминов группы В.
Пока что убедительных свидетельств такой связи нет, но в настоящее время НАСА и врачи клиники Майон в Миннесоте ведут исследования в этом направлении.
Эти исследования могут не только решить проблему одного из основных факторов риска длительного пребывания человека в космосе, но и пролить свет на природу заболевания, от которого страдают миллионы людей.
Космическая медицина на койке в земной больнице
- Космическая диетология помогает не только понять механизм адаптации человека к длительному пребыванию в космосе, но и то, как мы можем улучшить наш образ жизни на Земле
- Исследования в космосе обычно проводятся в условиях ограниченных ресурсов и осложняются фактором невесомости, или, как говорят ученые, микрогравитации
- Подобные земные исследования иногда проводятся на обычных людях, которые проводят недели или месяцы лежа на больничной койке с наклоном в сторону головы
- Это имитирует воздействие микрогравитации и позволяет следить за темпами сокращения массы мускульных и костных тканей
Автор фото, NASA
Подпись к фото,Добровольцы проводят на койках целые месяцы в ходе некоторых исследований
Мало солнца
Витамин D образуется в коже человека под воздействием солнечных лучей. Этот витамин необходим для поддержания в нормальном состоянии костей, зубов и мускулов.
Этот витамин необходим для поддержания в нормальном состоянии костей, зубов и мускулов.
Астронавты не получают нужного им количества солнечных лучей на орбите, что приводит к дефициту витамина D, который не восполняется продуктами питания.
Изучая воздействие дефицита инсоляции, мы обследовали полярников, которые зимуют на американской станции Мак-Мердо в Антарктиде, где солнце уходит за горизонт на полгода.
Автор фото, Getty Images
Мы проводили там эксперименты, целью которых было установить, может ли прием витаминов D заменить собой солнечный свет.
По предварительным данным, небольшие добавки таких витаминов приводят к повышению уровня витамина D в организме, но увеличение дозы уже не приносит заметной пользы.
Мы обнаружили также, что реакция на витаминные добавки зависит от веса или массы тела. Чем выше масса тела, тем менее эффективны такие добавки.
Это объясняется тем, что жир впитывает витамин D и не дает ему оставаться в крови.
Результаты нашего исследования наряду со многими другими работами помогли ученым Национальной академии медицины США разработать рекомендации по приему витамина D для жителей северной Америки.
Автор фото, Getty Images
В рамках нашего второго исследования мы проанализировали, каким образом стресс влияет на состояние иммунной системы. Это актуально и для астронавтов, и для полярников, зимующих в Антарктиде.
Мы пришли к заключению о том, что такая связь существует. Люди, у которых наблюдаются биохимические симптомы стресса и пониженный уровень витамина D в крови, испытывают повышенную подверженность вирусным инфекциям, например, герпеса, который всегда присутствует в спящем виде в организме.
В подобных исследованиях, проводимых в обычных условиях, приходится учитывать неизбежное воздействие на испытуемых солнечного излучения, что может искажать результаты.
Наши исследования в Антарктиде позволили нам исключить этот фактор и прийти к выводу, что новые рекомендации по уровню приема витаминных добавок имеют смысл, а дальнейшие повышение дозы не приносит существенной пользы.
Плотность костной ткани
Давней проблемой космической медицины является снижение плотности костной ткани в ходе длительного пребывания в космосе. Астронавты теряют примерно 1% костной массы в месяц. Больные остеопорозом утрачивают такой объем за год.
Эта утрата массы происходит в результате уменьшения гравитационной нагрузки на скелет. Обычно на восстановление костной массы после возвращения на Землю уходят годы.
После многих лет проб и ошибок выяснилось, что некоторые изменения в космической диете оказывают положительное воздействие на состояние костной ткани.
Автор фото, NASA
Подпись к фото,Экспедиция на МКС: перерыв на обед
Астронавты, которые получали больше рыбы, — например, лосося и макрели, — медленнее теряли костную массу на орбите. Выяснилось также, что усиленное питание фруктами и овощами также содействует сохранению костной массы.
В то же время употребление продуктов с высоким содержанием соли и железа ускоряет процесс потери костной массы.
Последующие данные показали, что те астронавты, которые правильно питались, поддерживали достаточный уровень витамина D в крови и занимались физическими упражнениями, не испытывали утраты костной массы в течение полугодового пребывания в космосе.
Впервые за 50 лет космических пилотируемых полетов удалось доказать, что астронавты могут поддерживать нормальные показатели плотности костной ткани за счет диеты и физических упражнений.
Эти результаты имеют огромное значение для всех жителей Земли, так как схожие изменения в диете могут содействовать устранению многих проблем со здоровьем.
Автор фото, Getty Images
Подпись к фото,Астронавтам также прописывают богатые витаминами овощи
На пороге Солнечной системы
Сейчас, на пороге шестого десятилетия пилотируемых полетов в космос, мы готовимся к дальним космическим экспедициям.
Факторы риска остаются весьма значительными, но теперь мы знаем, что правильное питание может обеспечить сохранение здоровья экипажа корабля, который отправится к Марсу и более отдаленным планетам.
Нам необходимо смелее использовать и расширять данные о космической диетологии, полученные в XXI столетии, которые помогут не только в будущих исследованиях космоса, но и улучшат состояние здоровья миллионов обитателей нашей планеты.
Об этом материале
Этот аналитический материал был заказан Би-би-си ученым, работающим в НАСА. Доктор Скотт М. Мит и доктор Сара Р. Зварт возглавляют Лабораторию биохимии питания при Космическом центре НАСА имени Джонсона в Хьюстоне.
Основы правильного питания — Школа здоровья — ГБУЗ Городская поликлиника 25 г. Краснодара МЗ КК
25 сентября 2019 г.
Значение белков, жиров и углеводов (БЖУ) в питании человека
Значение белка в питании здорового человека
Белки – сложные азотсодержащие биополимеры, мономерами которых служат α-аминокислоты. Белки – высокомолекулярные соединения. Их молекулярная масса колеблется от 6000 до 100000 и более. Аминокислотный состав различных белков неодинаков и является важнейшей характеристикой каждого белка, а также критерием его ценности в питании. Аминокислоты – органические соединения, в которых имеются две функциональные группы – карбоксильная, определяющая кислотные свойства молекул и аминогруппа, придающая этим соединениям основные свойства.
Аминокислотный состав различных белков неодинаков и является важнейшей характеристикой каждого белка, а также критерием его ценности в питании. Аминокислоты – органические соединения, в которых имеются две функциональные группы – карбоксильная, определяющая кислотные свойства молекул и аминогруппа, придающая этим соединениям основные свойства.
Среди большого число природных аминокислот в составе белков с наибольшим постоянством обнаруживают следующие 20 аминокислот: глицин (гликокол), аланин, серин, треонин, метионин, цистин, валин, лейцин, изолейцин, глутаминовая кислота, глутамин, аспарагиновая кислота, аспарагин, аргинин, лизин, фенилаланин, тирозин, гистидин, триптофан, пролин.
Все белки принято делить на простые (протеины) и сложные (протеиды). Под простыми понимают соединения, включающие в свой состав лишь полипептидные цепи, под сложными белками – соединения, в которых наряду с белковой молекулой имеется также небелковая часть – так называемая простетическая группа. В зависимости от пространственной структуры белки можно разделить на глобулярные и фибриллярные. К числу простых глобулярных белков относятся, в частности, альбумины, глобулины, проламины и глютелины. Альбумины и глобулины широко распространены в природе и составляют основную часть белков сыворотки крови, молока и яичного белка. Проламины и глютелины относятся к растительным белкам и встречаются в семенах злаков, образуя основную массу клейковины. Эти белки нерастворимы в воде. К проламин относятся глиадин пшеницы, зеин кукурузы, гордеин ячменя. Аминокислотный состав этих белков характеризуется низким содержанием лизина, а также треонина, метионина и триптофана и чрезвычайно высоким – глутаминовой кислоты.
В зависимости от пространственной структуры белки можно разделить на глобулярные и фибриллярные. К числу простых глобулярных белков относятся, в частности, альбумины, глобулины, проламины и глютелины. Альбумины и глобулины широко распространены в природе и составляют основную часть белков сыворотки крови, молока и яичного белка. Проламины и глютелины относятся к растительным белкам и встречаются в семенах злаков, образуя основную массу клейковины. Эти белки нерастворимы в воде. К проламин относятся глиадин пшеницы, зеин кукурузы, гордеин ячменя. Аминокислотный состав этих белков характеризуется низким содержанием лизина, а также треонина, метионина и триптофана и чрезвычайно высоким – глутаминовой кислоты.
Представители структурных белков, так называемые протеиноиды, являются фибриллярными белками главным образом животного происхождения. Эти белки выполняют в организме опорную функцию. Они нерастворимы в воде и весьма устойчивы к перевариванию пищеварительными ферментами. К ним относятся кератины (белки волос, ногтей, эпидермиса), эластин (белок связок, соединительной ткани сосудов и мышц), коллаген (белок костной, хрящевой, рыхлой и плотной соединительной ткани). При длительном кипячении в воде коллаген превращается в водорастворимый белок – желатин (глютин). Коллаген содержит значительное количество необычных для других белков аминокислот оксипролина и оксилизина, но в нем отсутствует триптофан.
При длительном кипячении в воде коллаген превращается в водорастворимый белок – желатин (глютин). Коллаген содержит значительное количество необычных для других белков аминокислот оксипролина и оксилизина, но в нем отсутствует триптофан.
Основные функции белков в организме.
1. П л а с т и ч е с к а я. Белки составляют 15-20% сырой массы различных тканей (в сравнении – липиды и углеводы лишь 1-5%) и являются основным строительным материалом клетки, ее органоидов и межклеточного вещества. Белки наряду с фосфолипидами образуют остов всех биологических мембран, играющих важную роль в построении клеток и их функционировании.
2. К а т а л и т и ч е с к а я. Белки являются основным компонентом всех без исключения известных в настоящее время ферментов. При этом простые ферменты представляют собой чисто белковые соединения. В построении сложных ферментов наряду с молекулами белка участвуют и низкомолекулярные соединения (коферменты). Ферментам принадлежит решающая роль в ассимиляции пищевых веществ организмом человека и в регуляции всех внутриклеточных обменных процессов.
Ферментам принадлежит решающая роль в ассимиляции пищевых веществ организмом человека и в регуляции всех внутриклеточных обменных процессов.
3. Г о р м о н а л ь н а я. Значительная часть гормонов по своей природе является белками или полипептидами. К их числу принадлежит инсулин, гормоны гипофиза (АКТГ, соматотропный, тиреотропный и др.), паратиреоидный гормон.
4. Ф у н к ц и я с п е ц и ф и ч н о с т и. Чрезвычайное разнообразие и уникальность индивидуальных белков обеспечивают тканевую индивидуальную и видовую специфичность, лежащую в основе проявлений иммунитета и аллергии. В ответ на поступление в организм чужеродных для него белков – антигенов – в иммунокомпетентных органах и клетках происходит активный синтез антител, представляющих особый вид глобулинов (иммуноглобулины). Специфическое взаимодействие антигена с соответствующими антителами составляет основу иммунных реакций, обеспечивающих защиту организма от чужеродных агентов.
5. Т р а н с п о р т н а я. Белки участвуют в транспорте кровью кислорода (Hb), липидов (липопротеиды), углеводов (гликопротеиды), некоторых витаминов, гормонов, лекарственных веществ и др. Вместе с тем специфические белки-переносчики обеспечивают транспорт различных минеральных солей и витаминов через мембраны клеток и субклеточных структур.
Белки участвуют в транспорте кровью кислорода (Hb), липидов (липопротеиды), углеводов (гликопротеиды), некоторых витаминов, гормонов, лекарственных веществ и др. Вместе с тем специфические белки-переносчики обеспечивают транспорт различных минеральных солей и витаминов через мембраны клеток и субклеточных структур.
Белки организма – чрезвычайно динамичные структуры, постоянно обновляющие свой состав вследствие непрерывно протекающих и тесно сопряженных друг с другом процессов их распада и синтеза. Организм человека практически лишен резерва белка, причем углеводы и жиры также не могут служить его предшественниками. В связи с этим единственным источником пополнения фонда аминокислот и обеспечения равновесия процессов синтеза и распада белков в организме могут служить пищевые белки, являющиеся вследствие этого незаменимыми компонентами пищевого рациона.
Белки, содержащиеся в пищевых продуктах, не могут однако, непосредственно усваиваться организмом и должны быть предварительно расщеплены в желудочно-кишечном тракте до составляющих их аминокислот, из которых организм формирует характерные для него белковые молекулы. Из 20 аминокислот, образующихся при гидролизе белков, 8 (валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин, лизин) не синтезируются в организме человека и поэтому являются незаменимыми факторами питания. Для детей в возрасте до года незаменимой аминокислотой служит также гистидин. Другие 11 аминокислот могут претерпевать в организме взаимопревращения и не являются незаменимыми. Поскольку для построения подавляющего большинства белков организма человека требуются все 20 аминокислот, но в различных соотношениях, дефицит любой из незаменимых аминокислот в пищевом рационе неизбежно ведет к нарушению синтеза белков.
Из 20 аминокислот, образующихся при гидролизе белков, 8 (валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин, лизин) не синтезируются в организме человека и поэтому являются незаменимыми факторами питания. Для детей в возрасте до года незаменимой аминокислотой служит также гистидин. Другие 11 аминокислот могут претерпевать в организме взаимопревращения и не являются незаменимыми. Поскольку для построения подавляющего большинства белков организма человека требуются все 20 аминокислот, но в различных соотношениях, дефицит любой из незаменимых аминокислот в пищевом рационе неизбежно ведет к нарушению синтеза белков.
При нарушении сбалансированности аминокислотного состава рациона синтез полноценных белков также нарушается, что ведет к возникновению ряда патологических изменений. В связи с этим пищевые белки следует рассматривать, прежде всего, как поставщики в организм человека незаменимых аминокислот. Наряду с использованием для синтеза белковых молекул аминокислоты могут окисляться в организме и служить источником энергии.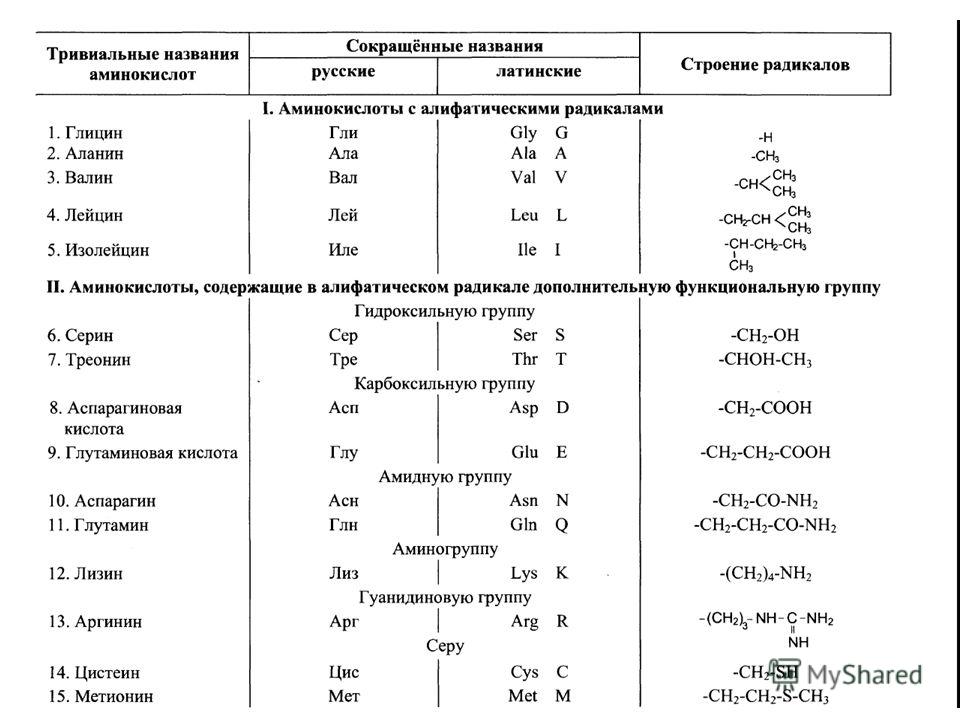 Конечными продуктами катаболизма аминокислот являются углекислый газ, вода и аммиак, который выводится из организма в виде мочевины и некоторых других менее токсичных соединений.
Конечными продуктами катаболизма аминокислот являются углекислый газ, вода и аммиак, который выводится из организма в виде мочевины и некоторых других менее токсичных соединений.
Недостаточное поступление с пищей белков нарушает динамическое равновесие процессов белкового анаболизма и катаболизма, сдвигая его в сторону преобладания распада собственных белков организма, в том числе и белков ферментов.
Избыточное поступление пищевых белков также небезразлично для организма. Оно вызывает усиленную работу пищеварительного аппарата, значительную активацию процессов межуточного обмена аминокислот и синтеза мочевины, увеличивает нагрузку на клубочковый и канальцевый аппарат почек, связанную с усиленной экскрецией конечных продуктов азотистого обмена. При этом может возникать перенапряжение указанных процессов с их последующим функциональным истощением. Избыточное поступление в организм белков может также вести к образованию в желудочно-кишечном тракте продуктов их гниения и неполного расщепления, способных вызывать интоксикацию человека.
Важным показателем качества пищевого белка может служить и степень его усвояемости, которая объединяет протеолиз в желудочно-кишечном тракте и последующее всасывание аминокислот. По скорости переваривания протеолитическими ферментами пищевые белки можно расположить в следующей последовательности: 1) рыбные и молочные, 2) мясные, 3) белки хлеба и круп.
Хлеб и хлебобулочные изделия, крупы и макаронные изделия содержат 5-12% белка; с учетом значительного потребления этих продуктов жителями нашей страны они вносят весьма существенный вклад в обеспечение человека белком. Однако белок хлебобулочных изделий и круп дефицитен по ряду аминокислот, в первую очередь по лизину, и не является достаточно полноценным.
UWPR
Таблица массы аминокислот
Вот набор моноизотопных и средних аминокислотных масс и элементных массовые значения, которые мы используем в наших разработанных здесь инструментах. Аминокислота массы основаны на сумме элементарных масс, где элементарные массы из Unimod. Вы также можете скачать эту таблицу где рассчитаны средние и моноизотопные массы для каждой аминокислоты. в таблице из перечисленных значений элементов (которые вы можете изменение).Если вы заметили ошибку, пришлите мне письмо по электронной почте!
| аминокислота | код | сокращение | состав | моно масса | средняя масса | |
|---|---|---|---|---|---|---|
| глицин | G | GLY | C 2 H 3 НЕТ | 57.021463735 | 57.05132 | |
| аланин | А | ALA | C 3 H 5 НЕТ | 71.037113805 | 71.0779 | |
| серин | S | SER | C 3 H 5 НЕТ 2 | 87.032028435 | 87.0773 | |
| пролин | -п. | ПРО | C 5 H 7 НЕТ | 97.052763875 | 97.11518 | |
| валин | В | VAL | C 5 H 9 НЕТ | 99.068413945 | 99.13106 | |
| треонин | т | THR | C 4 H 7 НЕТ 2 | 101.047678505 | 101.10388 | |
| цистеин | С | CYS | C 3 H 5 NOS | 103.00 | 05 | 103.1429 |
| лейцин | л | LEU | C 6 H 11 НЕТ | 113.084064015 | 113.15764 | |
| изолейцин | I | ILE | C 6 H 11 НЕТ | 113.084064015 | 113.15764 | |
| аспарагин | N | ASN | C 4 H 6 N 2 O 2 | 114.0420 | 114.10264 | |
| аспарагиновая кислота | D | ASP | C 4 H 5 НЕТ 3 | 115.026943065 | 115.0874 | |
| глютамин | Q | GLN | C 5 H 8 N 2 O 2 | 128.058577540 | 128.12922 | |
| лизин | К | LYS | C 6 H 12 N 2 O | 128,094963050 | 128.17228 | |
| глутаминовая кислота | E | GLU | C 5 H 7 НЕТ 3 | 129.0425 | ||
| 129.11398 | ||||||
| метионин | M | MET | C 5 H 9 NOS | 131.040484645 | 131,19606 | |
| гистидин | H | HIS | C 6 H 7 N 3 O | 137.058 | 137.13928 | |
| фенилаланин | F | PHE | C 9 H 9 НЕТ | 147.068413945 | 147,17386 | |
| селеноцистеин | U | СЕК. | C 3 H 5 NOSe | 150.953633405 | 150.3079 | |
| аргинин | R | ARG | C 6 H 12 N 4 O | 156.101111050 | 156.18568 | |
| тирозин | Y | TYR | C 9 H 9 НЕТ 2 | 163.063328575 | 163.17326 | |
| триптофан | Вт | TRP | C 11 H 10 N 2 O | 186.07 | 80186.2099 | |
| пирролизин | O | PYL | C 12 H 19 N 3 O 2 | 237.147726925 | 237.29816 |
| элемент | код | моно масса | средняя масса | |
|---|---|---|---|---|
| Водород | H | 1.007825035 | 1,00794 | |
| Углерод | С | 12,0000000 | 12.0107 | |
| Азот | N | 14.003074 | 14.0067 | |
| Кислород | O | 15.994 | 15,9994 | |
| фосфор | -п. | 30.973762 | 30.973761 | |
| сера | S | 31,9720707 | 32.065 | |
| Селен | SE | 79. | 79,96 | |
| протон | 1,00727646688 |
| модификация | остатки | моно масса | средняя масса | состав |
|---|---|---|---|---|
| фосфорилирование | STY | 79.966331 | 79.9799 | HO 3 P |
| окисление | M | 15.994915 | 15,9994 | O |
| ацетилирование | К | 42.010565 | 42,0367 | H 2 C 2 O |
| карбамидометил | С | 57.021464 | 57.0513 | H 3 C 2 НЕТ |
Таблица молекулярной массы аминокислот
Таблица молекулярной массы аминокислот| Дом Инструментарий | ||
Молекулярные массы аминокислот:
| Полное наименование | трехбуквенный код | однобуквенный код | МВт (Да) | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| аланин | Ala | A | 89 | |||||||||||||||||||
| аргинин | Arg | R | 174 | |||||||||||||||||||
| аспарагин | Asn | N | ||||||||||||||||||||
| 132 | D | 133 | ||||
| цистеин | Cys | C | 121 | |||
| глутаминовый | Gln | E | 146 | |||
| глютамин | Glu | Q | глицин | Gly | G | 75 |
| гистидин | His | H | 155 | |||
| изолейцин | Ile | I | 131 | |||
| лейцин | 131 | |||||
| лизин 9002 6 | Lys | K | 146 | |||
| метионин | Met | M | 149 | |||
| фенилаланин | Phe | F | 165 | |||
| пролин | 900 P25 Pro115 | |||||
| серин | Ser | S | 105 | |||
| треонин | Thr | T | 119 | |||
| триптофан | Trp | W | 204 | |||
| Y | 181 | |||||
| валин | Val | V | 117 |
Точный и эффективный аминокислотный анализ для количественного определения белка с использованием хроматографии гидрофильных взаимодействий, тандемной масс-спектрометрии | Заводские методы
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Измерение содержания белка с фенольным реагентом Folin. J Biol Chem. 1951; 193: 265–75.
CAS PubMed Google ученый
Bradford MM. Быстрый и чувствительный метод количественного определения количества белка в микрограммах, использующий принцип связывания белок-краситель. Анальная биохимия. 1976; 72: 248–54.
CAS Статья Google ученый
Smith PK, Krohn RI, Hermanson GT, Mallia AK, Gartner FH, Provenzano MD, Fujimoto EK, Goeke NM, Olson BJ, Klenk DC. Измерение белка с использованием бицинхониновой кислоты. Анальная биохимия. 1985; 150: 76–85.
CAS Статья Google ученый
Brenna JT, Corso TN, Tobias HJ, Caimi RJ. Высокоточная непрерывная масс-спектрометрия изотопного состава. Mass Spectrom Rev.1997; 16: 227-58.
CAS Статья Google ученый
Гибсон РБ. Определение азота по методу Кьельдаля. J Am Chem Soc. 1904; 26: 105–10.
Артикул Google ученый
Jones DB. Факторы для преобразования процентного содержания азота в продуктах питания и кормах в процентное содержание белков. Министерство сельского хозяйства США, циркуляр 1941.
Mariotti F, Tomé D, Mirand PP. Преобразование азота в белок — выше 6,25 и факторов Джонса. Crit Rev Food Sci Nutr.2008. 48: 177–84.
CAS Статья Google ученый
Simonian MH, Smith JA. Спектрофотометрическое и колориметрическое определение концентрации белка. Curr Protoc Mol Biol. 2006; 76: 10.11.11-10.11A.19.
Google ученый
Noble JE, Bailey MJA. Количественное определение белка. В: Берджесс Р.Р., редактор. Методы в энзимологии, т. 463. Deutscher MP: Academic Press; 2009 г.п. 73–95.
Google ученый
Wiechelman KJ, Braun RD, Fitzpatrick JD. Исследование протеина бицинхониновой кислоты: идентификация групп, ответственных за формирование цвета. Анальная биохимия. 1988; 175: 231–7.
CAS Статья Google ученый
Kruger NJ. Метод Брэдфорда для количественного определения белка. В: Уокер Дж. М., редактор. Справочник по белковым протоколам.Тотова, Нью-Джерси: Humana Press; 2009. с. 17–24.
Глава Google ученый
Hobohm U, Houthaeve T., Sander C. Анализ аминокислот и поиск состава в базе данных белков как быстрый и недорогой метод идентификации белков. Анальная биохимия. 1994; 222: 202–9.
CAS Статья Google ученый
Roth M, Hampaǐ A. Колоночная хроматография аминокислот с флуоресцентным детектированием.J Chromatogr A. 1973; 83: 353–6.
CAS Статья Google ученый
Gardner WS, Miller WH. Обращенно-фазовый жидкостной хроматографический анализ аминокислот после реакции с о-фталевым альдегидом. Анальная биохимия. 1980; 101: 61–5.
CAS Статья Google ученый
Rutherfurd SM, Gilani GS. Аминокислотный анализ. Curr Protoc Protein Sci. 2009; 58: 11.19.11–37.
Google ученый
Spackman DH, Stein WH, Moore S. Автоматическое записывающее устройство для использования в хроматографии аминокислот. Anal Chem. 1958; 30: 1190–206.
CAS Статья Google ученый
Кутлан Д., Мольнар-Перл I. Характеристики и стабильность производных аминокислот OPA / 3-меркаптопропионовой кислоты и OPA / N-ацетил-1-цистеина.Хроматография. 2001; 53: S188–98.
Артикул Google ученый
Аллен Д.К., Рэтклифф Р.Г. Количественная оценка изотопной метки. В: Швендер Дж., Редактор. Метаболические сети растений. Нью-Йорк, Нью-Йорк: Спрингер; 2009. с. 105–49.
Глава Google ученый
Уильямс Б.Дж., Кэмерон С.Дж., Уоркман Р., Броклинг С.Д., Самнер Л.В., Смит Дж. Т.. Аминокислотный профиль в культурах клеток растений: межлабораторное сравнение КЭ-МС и ГХ-МС.Электрофорез. 2007; 28: 1371–9.
CAS Статья Google ученый
Халкет Дж. М., Уотерман Д., Пшиборовска А. М., Патель РКП, Фрейзер П. Д., Брамли П. М.. Химическая дериватизация и масс-спектральные библиотеки в метаболическом профилировании с помощью ГХ / МС и ЖХ / МС / МС. J Exp Bot. 2005; 56: 219–43.
CAS Статья Google ученый
Даль-Лассен Р., ван Хекке Дж., Йоргенсен Х., Бух С., Андерсен Б., Шерринг Дж. К..Высокопроизводительный анализ аминокислот в растительном сырье методом одноквадрупольной масс-спектрометрии. Растительные методы. 2018; 14: 8.
Артикул Google ученый
Шаимбо П., Петритис К., Эльфакир С., Дре М. Определение 20 недериватизированных белковых аминокислот с помощью ионно-парной хроматографии и масс-спектрометрии с электрораспылением с пневматическим приводом. J Chromatogr A. 1999; 855: 191–202.
CAS Статья Google ученый
Авирам LY, McCooeye M, Mester Z. Определение недериватизированных аминокислот в микрообразцах дрожжевой пищевой добавки с помощью ЖХ-МС после кислотного гидролиза с помощью микроволн. Анальные методы. 2016; 8: 4497–503.
CAS Статья Google ученый
Джандер Г., Норрис С.Р., Джоши В., Фрага М., Рагг А., Ю С., Ли Л., Ласт РЛ. Применение высокопроизводительного анализа HPLC-MS / MS для скрининга мутантов Arabidopsis; доказательства того, что треонинальдолаза играет роль в питательном качестве семян.Плант Дж. 2004; 39: 465–75.
CAS Статья Google ученый
Гу Л., Джонс А.Д., Последний Р.Л. ЖХ — МС / МС анализ белков, аминокислот и метаболически родственных соединений для крупномасштабного скрининга метаболических фенотипов. Anal Chem. 2007. 79: 8067–75.
CAS Статья Google ученый
Хардер У., Колецко Б., Пайсснер В. Количественное определение 22 аминокислот в плазме, сочетающее дериватизацию и ион-парную ЖХ – МС / МС.J Chromatogr B. 2011; 879: 495–504.
CAS Статья Google ученый
Альперт А.Дж. Хроматография гидрофильного взаимодействия для разделения пептидов, нуклеиновых кислот и других полярных соединений. J Chromatogr A. 1990; 499: 177–96.
CAS Статья Google ученый
Бушевский Б., Нога С. Жидкостная хроматография гидрофильного взаимодействия (HILIC) — мощный метод разделения.Anal Bioanal Chem. 2012; 402: 231–47.
CAS Статья Google ученый
Чен П., Ли В., Ли Q, Ван И, Ли З, Ни Y, Койке К. Идентификация и количественная оценка нуклеозидов и азотистых оснований у геозавра и пиявки с помощью хроматографии гидрофильного взаимодействия. Таланта. 2011; 85: 1634–41.
CAS Статья Google ученый
Невилл DCA, Алонзи Д.С., Баттерс ТД.Жидкостная хроматография гидрофильного взаимодействия олигосахаридов, меченных антраниловой кислотой, с внутренним стандартом гидролизата декстрана, меченного этиловым эфиром 4-аминобензойной кислоты. J Chromatogr A. 2012; 1233: 66–70.
CAS Статья Google ученый
Джойс Р., Кузиене В., Цзоу Икс, Ван Х, Пуллен Ф., Лоо Р.Л. Разработка и валидация ультраэффективного метода квадрупольной времяпролетной масс-спектрометрии жидкостной хроматографии для быстрого количественного определения свободных аминокислот в моче человека.Аминокислоты. 2016; 48: 219–34.
CAS Статья Google ученый
Bathena SP, Huang J, Epstein AA, Gendelman HE, Boska MD, Alnouti Y. Быстрое и надежное количественное определение аминокислот и мио-инозита в мозге мыши с помощью высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии. J Chromatogr B. 2012; 893–894: 15–20.
Артикул Google ученый
Крампохова П., Брюнель Б., Моленаар Д., Куку А., Вухрер М., Ниссен WMA, Гиера М. Аминокислотный анализ с использованием хроматографии-масс-спектрометрии: исследование межплатформенного сравнения. J Pharm Biomed Anal. 2015; 114: 398–407.
CAS Статья Google ученый
Mülleder M, Bluemlein K, Ralser M. Высокопроизводительный метод количественного определения свободных аминокислот в сахаромицетах Cerevisiae с помощью хроматографии гидрофильных взаимодействий и тандемной масс-спектрометрии.В: Эндрюс Б., Бун С., Дэвис Т. Н., Филдс С., редакторы. Бутоньерные дрожжи: лабораторное руководство. Нью-Йорк: Лаборатория Колд-Спринг-Харбор Пресс; 2016. с. 608–13.
Google ученый
Гао Дж., Хельмус Р., Серли С., Янсен Б., Ван X, Калбиц К. Надежный анализ недериватизированных свободных аминокислот в почве с помощью жидкостной хроматографии гидрофильного взаимодействия в сочетании с тандемной масс-спектрометрией с электрораспылением. J Chromatogr A. 2016; 1449: 78–88.
CAS Статья Google ученый
Цочацис Э.Д., Бегоу О., Гика Х.Г., Караяннакидис П.Д., Калогианнис С. Метод гидрофильной хроматографии-тандемной масс-спектрометрии для определения профиля аминокислот в мидиях. J Chromatogr B. 2017; 1047: 197–206.
CAS Статья Google ученый
Guo S, Duan J, Qian D, Tang Y, Qian Y, Wu D, Su S, Shang E. Быстрое определение аминокислот в плодах Ziziphus jujubaby сверхвысокопроизводительная жидкость с гидрофильным взаимодействием хроматография в сочетании с трехквадрупольной масс-спектрометрией.J. Agric Food Chem. 2013; 61: 2709–19.
CAS Статья Google ученый
Zhou G, Pang H, Tang Y, Yao X, Mo X, Zhu S, Guo S, Qian D, Qian Y, Su S, et al. Ультраэффективная жидкостная хроматография гидрофильного взаимодействия в сочетании с трехквадрупольной тандемной масс-спектрометрией для высокоскоростного и чувствительного анализа недериватизированных аминокислот в функциональных пищевых продуктах. Аминокислоты. 2013; 44: 1293–305.
CAS Статья Google ученый
Prinsen HCMT, Schiebergen-Bronkhorst BGM, Roeleveld MW, Jans JJM, de Sain-van der Velden MGM, Visser G, van Hasselt PM, Verhoeven-Duif NM. Быстрое количественное определение недериватизированных аминокислот в плазме с помощью жидкостной хроматографии гидрофильных взаимодействий (HILIC) в сочетании с тандемной масс-спектрометрией. J Inherit Metab Dis. 2016; 39: 651–60.
CAS Статья Google ученый
Stokvis E, Rosing H, Beijnen JH. Стабильные меченые изотопами внутренние стандарты в количественном биоанализе с использованием жидкостной хроматографии / масс-спектрометрии: необходимость или нет? Масс-спектрометр Rapid Commun.2005; 19: 401–7.
CAS Статья Google ученый
Дарра А.Дж., Гаррик Д.Дж., Моуган П.Дж., Хендрикс У.А. Коррекция потери аминокислот при кислотном гидролизе очищенного белка. Анальная биохимия. 1996. 236: 199–207.
CAS Статья Google ученый
Ng LT, Pascaud A, Pascaud M. Гидролиз белков соляной кислотой и определение триптофана с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии.Анальная биохимия. 1987. 167: 47–52.
CAS Статья Google ученый
Puchała R, Piór H, von Keyserlingk M, Shelford JA, Barej W. Определение сульфоксида метионина в биологических материалах с помощью ВЭЖХ и его разлагаемость в рубце крупного рогатого скота. Anim Feed Sci Technol. 1994; 48: 121–30.
Артикул Google ученый
Rayner CJ. Гидролиз белков кормов для животных на содержание аминокислот.J. Agric Food Chem. 1985; 33: 722–5.
CAS Статья Google ученый
Rutherfurd SM. Точное определение содержания аминокислот в выбранных кормах. Int J Food Sci Nutr. 2009. 60: 53–62.
CAS Статья Google ученый
Вайс М., Маннеберг М., Джуранвилл Дж.Ф., Лам Х.В., Фунтулакис М. Влияние метода гидролиза на определение аминокислотного состава белков.J Chromatogr A. 1998; 795: 263–75.
CAS Статья Google ученый
Fountoulakis M, Lahm HW. Гидролиз и анализ аминокислотного состава белков. J Chromatogr A. 1998; 826: 109–34.
CAS Статья Google ученый
Сертификат: SRM 3234 — Мука соевая. https://www-s.nist.gov/srmors/view_cert.cfm?srm=3234. По состоянию на август 2018 г.
Фрэнк М.П., Пауэрс Р.В. Простой и быстрый количественный высокоэффективный жидкостный хроматографический анализ аминокислот плазмы. J Chromatogr, B: Anal Technol Biomed Life Sci. 2007; 852: 646–9.
CAS Статья Google ученый
Krömer JO, Fritz M, Heinzle E, Wittmann C. Количественное определение внутриклеточных аминокислот и промежуточных продуктов метионинового пути у Corynebacterium glutamicum in vivo. Анальная биохимия. 2005; 340: 171–3.
Артикул Google ученый
Imsande J. Селекция мутантов сои с повышенными концентрациями метионина и цистеина в семенах. Crop Sci. 2001; 41: 510–5.
CAS Статья Google ученый
Hugli TE, Moore S. Определение содержания триптофана в белках с помощью ионообменной хроматографии щелочных гидролизатов. J Biol Chem. 1972; 247: 2828–34.
CAS PubMed Google ученый
Симпсон Р.Дж., Нойбергер М.Р., Лю Т.Ю. Полный аминокислотный анализ белков из одного гидролизата. J Biol Chem. 1976; 251: 1936–40.
CAS PubMed Google ученый
Ниссен С. Анализ аминокислот в пищевых продуктах и в физиологических образцах. В: Nissen S, редактор. Современные методы белкового питания и метаболизма.Нью-Йорк: Academic Press; 1992. стр. 1–8.
Google ученый
Schegg KM, Denslow ND, Andersen TT, Bao Y, Cohen SA, Mahrenholz AM, Mann K. Количественное определение и идентификация белков с помощью аминокислотного анализа: совместное испытание ABRF-96AAA. В: Маршак Д.Р., редактор. Методы химии белков, т. 8. Нью-Йорк: Academic Press; 1997. стр. 207–16.
Google ученый
Норикоши Р., Иманиши Х., Ичимура К. Простой и быстрый метод извлечения углеводов из лепестков или чашелистиков четырех цветочных растений для определения их содержания. J Jpn Soc Hortic Sci. 2008; 77: 289–95.
CAS Статья Google ученый
Манесс Н. Экстракция и анализ растворимых углеводов. В: Сункар Р., редактор. Стрессоустойчивость растений: методы и протоколы. Тотова, Нью-Джерси: Humana Press; 2010 г.п. 341–70.
Глава Google ученый
Smith D, Paulsen GM, Raguse CA. Извлечение всех доступных углеводов из тканей травы и бобовых. Plant Physiol. 1964; 39: 960–2.
CAS Статья Google ученый
Allen DK. Оценка компартментализованного потока в метаболизме липидов с помощью изотопов. Biochimica et Biophysica Acta (BBA) — молекулярная и клеточная биология липидов.2016; 1861: 1226–42.
CAS Статья Google ученый
Аллен ДК. Количественная оценка фенотипов растений с помощью изотопной маркировки и анализа метаболических потоков. Curr Opin Biotechnol. 2016; 37: 45–52.
CAS Статья Google ученый
Прокопенко Ю., Якштас В., Свикас В., Георгиянц В., Иванаускас Л. Определение аминокислот методом МС / МС в травах Fumaria schleicheri L., Ocimum basilicum L. и листья Corylus avellana L. Nat Prod Res . 2018. https://doi.org/10.1080/14786419.2018.1477145
Массовые сдвиги мутаций
Массовые сдвиги мутаций
В этой таблице перечислены дельта-массы между различными аминокислотами, и ее можно использовать для помощи объясните, как наблюдаемое изменение массы может представлять мутацию AA.
- Остатки ВНИЗ слева указывают ОЖИДАЕМЫЕ остатки.
- Остатки ПОСЛЕ верхней части указывают на остатки МУТАНТА.
| G | A | S | P | V | T | C | L / I | N | D | Q / E K | H | F | R | Y | W | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 57 | 71 | 87 | 97 | 99 | 101 | 103 | 114 | 115 | 128 | 129 | 131 | 137 | 147 | 156 | 163 | 186 | ||||||
| ________________________________________________________________ | ||||||||||||||||||||||
| ________________________________________________________________ | ||||||||||||||||||||||
| 14 | 30 | 40 | 42 | 44 | 46 | 56 | 57 | 58 | 71 | 72 | 74 | 80 | 90 | 99 | 106 | 129 | ||||||
| A | 71 | — | 16 | 26 | 28 | 30 | 32 | 42 | 43 | 44 | 57 | 58 | 60 | 66 | 76 | 85 | 92 | 900115 | ||||
| S | 87 | -30 | -16 | 10 | 12 | 14 | 16 | 26 | 27 | 28 | 41 | 50 | 60 | 69 | 76 | 99 | ||||||
| P | 97 | -40 | -26 | -10 | 90 0092 | 4 | 6 | 16 | 17 | 18 | 31 | 32 | 34 | 40 | 50 | 59 | 66 | 89 | ||||
| V 99 | -42 | -28 | -12 | -2 | 2 | 4 | 14 | 15 | 16 | 29 | 30 | 32 | 38 | 48 | 57 | 64 | 87 | |||||
| T | 101 | -44 | -30 | -14 | -4 | -2 | 2 | 12 | 13 | 14 | 27 | 28 | 30 | 36 | 46 | 55 | 62 | 85 | ||||
| C | 103 | — 46 | -32 | -16 | -6 | -4 | -2 | 10 | 11 | 12 | 25 | 26 | 28 | 34 | 44 | 53 | 60 | 83 | ||||
| L / I | 113 | -56 | -42 | -26 | -16 | -14 | -12 | -10 | 1 | 2 | 15 | 16 | 18 | 24 | 34 | 43 | 50 | 73 | ||||
| N | 114 | -57 | -43 27 | -17 | -15 | -13 | -11 | -1 | 1 | 14 | 15 | 17 | 23 | 33 | 42 | 49 | 72 | D | 115 | -58 | -44 | -28 | -18 | -16 | -14 | -12 | -2 | -1 | 13 | 14 | 16 | 22 | 32 | 41 | 48 | 71 |
| Q / K | 128 | -71 | -57 | -41 | -31 | -31 | -31 | -31 | -29-27 | -25 | -15 | -14 | -13 | 1 | 3 | 9 | 19 | 28 | 35 | 58 | ||
| E | 129 | -72 | -58 | -42 | -32 | -30 | -28 | -26 | -16 | -15 | -14 | -1 | 2 | 8 | 1 8 | 27 | 34 | 57 | ||||
| M | 131 | -74 | -60 | -44 | -34 | -32 | -30 | -28 | -18 | -17 | -16 | -3 | -2 | 6 | 16 | 25 | 32 | 55 | ||||
| H | 137 | -80 | -66 | -50 | -40 | -38 | -36 | -34 | -24 | -23 | -22 | -9 | -8 | -6 | 10 | 19 | 26 | 49 | ||||
| F | 147 | -90 | -76 | -60 | -50 | -48 | -46 | -44 | -34 | -33 | -32 900 10 | -19 | -18 | -16 | -10 | 9 | 16 | 39 | ||||
| R | 156 | -99 | -85 | -69 | -59 | -57 | -55 | -53 | -43 | -42 | -41 | -28 | -27 | -25 | -19 | -9 | 7 | 30 | ||||
| Y | 163 | -106 | -92 | -76 | -66 | -64 | -62 | -60 | -50 | — 49 | -48 | -35 | -34 | -32 | -26 | -16 | -7 | 23 | ||||
| Вт | 186 | -129 | -115 | -99 | -89 | -87 | -85 | -83 | -73 | -72 | -71 | -58 | -57 | -55 | -49 | -39 | -30 | -23 | ||||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Характеристика и диагностическая ценность потерь нейтрали боковой цепи аминокислот после диссоциации с переносом электрона
Abstract
Используя большой набор тандемных масс-спектров ETD с высокой точностью масс и разрешением, мы охарактеризовали потери нейтралов, вызванные ETD. Из этих данных мы вывели химическую формулу для 20 из этих потерь. Многие из них ранее наблюдались в спектрах диссоциации с захватом электронов (ECD), такие как потери боковых цепей аргинина, аспарагиновой кислоты, глутаминовой кислоты, глутамина, аспарагина, лейцина, гистидина и карбамидометилированных остатков цистеина.Обладая этой информацией, мы изучили диагностическую ценность этих специфичных для аминокислот потерь. Среди 1285 совпадений пептидного спектра 92,5% имеют совпадение между аминокислотным составом нейтрального пептида, полученным в результате потери, и пептидными последовательностями. Более того, мы показываем, что пептиды можно однозначно идентифицировать, используя только точную массу предшественника и аминокислотный состав на основе нейтральных потерь; среднее количество кандидатов последовательности из точного массового запроса уменьшено с 21 до 8 за счет добавления информации о потерях боковой цепи.Помимо повышения уверенности в идентификации пептидов, наши результаты предполагают потенциальное использование этих диагностических потерь в спектрах ETD для улучшения оценки вероятности ложного обнаружения и повышения производительности функций оценки в алгоритмах поиска в базе данных.
Ключевые слова: Диссоциация с переносом электронов, Диссоциация с захватом электронов, потеря нейтрали, потеря боковой цепи, точная масса c — и z -тип ионов-фрагментов (для столкновительных [1, 2] или электронных [3–6] методов соответственно).Однако также наблюдаются потери боковых цепей аминокислот [1–3, 7–12]. Эти процессы хорошо охарактеризованы для столкновительной активации и, в последнее время, для диссоциации с захватом электронов [8–12]. Работа ECD охарактеризовала не только общую потерю боковой цепи аминокислоты, но также потерю боковой цепи, специфичную для аспарагиновой / изоаспарагиновой [13–15], глутаминовой / γ-глутаминовой кислоты [16], O-фукозилирования [17], SO 2 [18], изолейцин / лейцин [19] и остатки алкилированного цистеина [11]. В совокупности эти исследования выявили около 20 типичных потерь, характерных для ECD [8–12, 20].Помимо расширения наших фундаментальных знаний о том, как происходит диссоциация, такие исследования обещают помочь в корреляции спектра и последовательности [21].
За последние несколько лет диссоциация с переносом электрона (ETD) — ион / ионный аналог диссоциации с захватом электрона (ECD) — стала все более широко распространенной для различных протеомных приложений [6, 22–30]. В целом, спектры ETD и ECD имеют много общего; однако различия были задокументированы [31]. Прямое сравнение ECD и ETD затруднено из-за крайних различий в давлении, при котором происходит диссоциация [13].В отличие от ECD, который возникает в условиях высокого вакуума (~ 10 −9 Торр) после захвата свободного электрона многократно протонированным катионом пептида, ETD следует из переноса электрона от аниона к катиону пептида при гораздо более высоких давлениях ( ~ 10 −3 Торр). На сегодняшний день ETD обычно анализируется с помощью инструментов для улавливания с низким разрешением, в то время как ECD в основном анализируется с помощью инструментов с преобразованием Фурье с высоким разрешением. Несмотря на эти различия, те, кто сравнивал ETD и ECD, сочли это полезным [13].Насколько нам известно, не было сообщений о систематических исследованиях потерь боковых цепей, вызванных ETD. Благодаря недавнему подключению ETD к масс-анализатору Orbitrap с высоким разрешением и высокой точностью измерения массы [26, 32] такой анализ стал возможен. Используя обширный набор данных, мы каталогизируем потери 20 аминокислотных боковых цепей после ETD. О пяти из них не сообщалось ни в экспериментах ETD, ни в спектрах ECD, содержащихся в базе данных SwedECD. Далее мы исследуем частоту и специфику каждой потери.Обладая этой информацией, мы исследуем возможную диагностическую ценность целевого и крупномасштабного анализа последовательности белков.
Экспериментальная
Приготовление образцов с помощью ЖХ-МС / МС, сбор данных и поиск в базе данных
Эмбриональные стволовые клетки человека лизировали и расщепляли LysC (Wako Chemicals, Осака, Япония). Сгенерированные пептиды обессоливали, из которых 1,5 мкг загружали в капиллярную колонку, разделяли в течение 90-минутного градиента и анализировали на Thermo Scientific (Сан-Хосе, Калифорния, США) LTQ Orbitrap XL с функцией ETD.Сканы MS 1 и MS 2 были получены с разрешающей способностью 60 000. Катионы реагента флуорантена вводили как в сканирование MS 1 , так и в сканирование MS 2 , создавая внутренний калибровочный пик, имеющий значение m / z , равное 202,07770 [33]. Файлы исходных данных были очищены генератором DTA [34, 35], а затем проанализированы в объединенной базе данных людей-ловушек (IPI v3.63) с использованием алгоритма открытого масс-спектрометрического поиска (OMSSA ver. 2.1.4) [36], с карбамидометилированием цистеина в качестве фиксированной модификации, окислением метионина в качестве переменной модификации и тремя пропущенными расщеплениями. Затем совпадения пептида со спектром (PSM) были отфильтрованы до уровня ложного обнаружения 1%. Дополнительные сведения об этом программном обеспечении можно найти в Wenger et al. [35].
Образцы синтетических пептидов
Синтетические пептиды были приобретены у Thermo Fisher Scientific. Пептиды с c-концевым лизином были сильно мечены ( 13 C 6 , 15 N 2 ), в то время как внутренние остатки цистеина были карбамидометилированы.Синтетические пептиды растворяли в 50% метаноле, 2% уксусной кислоте. Пептидные растворы вводили напрямую через пико-наконечник (New Objective, Woburn, MA, USA). Спектры ETD были получены на LTQ Orbitrap Velos от компании Thermo Scientific с функцией ETD. Были получены сканы MS 2 и MS 3 с разрешающей способностью 15 000 или 30 000.
Извлечение нейтральных потерь
Информация о пиках нейтральных потерь прекурсоров была извлечена из исходных данных с помощью программного обеспечения, разработанного собственными силами («PepGate») с использованием Visual C # с Microsoft.NET Framework 3.5 и COM-библиотеки Thermo XRawfile. Извлеченная информация о пике содержит массу потерь, m / z предшественника, состояние заряда и отношение сигнал / шум. Затем нейтральные массы потерь были преобразованы в элементный состав. Затем теоретические массы этих элементных составов были снова сопоставлены с нейтральными потерями с допуском по массе ± 5 частей на миллион. Затем была сгенерирована база данных FileMaker Pro Advanced 9, содержащая PSM, нейтральные потери и сводку частоты встречаемости аминокислот.
Построение базы данных пептидов MySQL
Мы создали базу данных пептидов из человеческого IPI вер. 3.63 путем переваривания белков in silico с ферментативной специфичностью LysC, что допускает до трех пропущенных расщеплений. Полученная база данных пептидов была импортирована в MySQL (версия 5.1.19-community). Окончательная база данных MySQL включала одну таблицу «пептидов», которая состояла из трех полей: «proID» (уникальный идентификатор белка), «последовательность» (последовательность пептида) и «масса» (масса пептида). Поле «масса» индексировалось с помощью бинарной древовидной структуры.
Perl-программы для запроса к базе данных MySQL
Из файла базы данных FileMaker был экспортирован текстовый файл с разделителями табуляцией, каждая строка которого содержала информацию о каждом сканировании, такую как номер сканирования, допуск массы предшественника пептида (± 3 ppm) и содержание аминокислот определяется по пикам нейтральных потерь. Мы написали программы на Perl (ActivePerl вер. 5.10.0.1003) для построения двух операторов запроса SQL для каждого сканирования, один с информацией о содержании аминокислот, а другой без нее. Затем программа подключилась к базе данных MySQL и запросила ее с помощью пакета DBI Perl через драйвер DBD MySQL, установленный из Active State Perl Package Manager (вер.4.02). Результаты запроса были записаны в текстовый файл с разделителями табуляции, который затем был импортирован в FileMaker Pro Advanced 9 для дальнейшего анализа. R (версия 2.8.1) использовался для построения гистограмм результатов SQL-запроса.
Результаты и обсуждение
Чтобы получить большой набор данных с высоким разрешением и высокой точностью масс-спектров тандемных масс-спектров ETD, мы получили сложную смесь белков из лизированных клеток человека. Смесь расщепляли LysC, и полученные пептиды загружали в капиллярную колонку LC с обращенной фазой с нанопотоком и градиент элюировали в масс-спектрометр LTQ Orbitrap XL с функцией ETD.Анионы флуорантена использовали для индукции ETD; Катионы флуорантена, побочный продукт процесса химической ионизации, использовались в качестве внутреннего стандарта для обеспечения высокой точности определения массы [33]. После 2-часового разделения поиск в базе данных подтвердил в общей сложности 2699 PSM (1% FDR).
Мы написали специальное программное обеспечение PepGate для массового выявления любых генерируемых нейтральных потерь из этих данных. Затем были собраны нейтральные массы потерь и сопоставлены с соответствующими химическими формулами. По этим формулам были получены теоретические массы, которые были сопоставлены со всеми PSM с допуском по массе ± 5 ppm.представляет исчерпывающий отчет, содержащий все идентифицированные потери боковой цепи аминокислот, а также сводную информацию о чувствительности и специфичности каждой из них. Пятнадцать из 20 потерь боковой цепи аминокислот, представленных в, также встречаются в тандемных масс-спектрах ECD, найденных в базе данных SwedECD [3, 8–12, 20, 21, 37]. База данных SwedECD включает коллекцию тандемных масс-спектров ECD, собранных в типичных условиях реакции ECD. При альтернативных условиях ECD мы обнаружили свидетельства того, что еще три ETD наблюдали нейтральные убытки, которые отсутствовали в SwedECD [10, 15, 19, 38].Falth et al. использовал базу данных SwedECD для расчета чувствительности и специфичности нейтральных потерь ECD. Мы отмечаем в целом отличное согласие с расчетами Falth и соавторов по чувствительности и специфичности перекрывающихся потерь между ECD и ETD [12]. Такая высокая степень совпадения подтверждает, что ECD и ETD похожи. Однако существуют явные различия; например, потеря боковой цепи лизина, о которой сообщалось при ECD, не наблюдалась в наших данных ETD [3, 8–12, 20, 21, 37].Ниже мы подробно описываем пять нейтральных потерь боковой цепи, наблюдаемых в спектрах ETD, которые не наблюдаются в базе данных SwedECD: CH 2 O 2 , C 2 H 5 NO, C 2 H 7 N 2 O, C 4 H 7 N 2 и C 4 H 8 N 2 .
Таблица 1
Сводная таблица с массой, химической формулой, аминокислотным составом, чувствительностью и специфичностью каждой обнаруженной потери нейтрали.Столбец, показывающий, наблюдалась ли потеря в базе данных SwedECD, также включен [12]
| Нейтральная потеря (Да) | Химическая формула | Аминокислота | Наблюдается в базе данных SwedECD | Чувствительность ( %) | Специфичность (%) |
|---|---|---|---|---|---|
| 17.02655 | NH 3 | N-концевой амин | √ | 88 | НЕТ |
| 27.99491 | CO | D / E | √ | 31 | 91 |
| 34.05310 | N 2 H 6 | R | √ | 55 | 99 |
| 44.03745 | CH 4 N 2 | R | √ | 21 | 99 |
| 45.02146 | CH 3 NO | Q / N | √ | 62 | 96 |
| 46.00548 | CH 2 O 2 | D / E | 13 | 96 | |
| 59.03711 | C 2 H 5 NO | Q / N | 80 | ||
| 59.04835 | CH 5 N 3 | R | √ | 50 | 97 |
| 60,02113 | C 2 H 4 O 2 | R | √ | 50 | 97 |
| 60.08132 | C 3 H 10 N | L | √ | 2 | 95 |
| 73.08915 | C 4 H 11 N | L | √ | 2 | 95 |
| 75.05584 | C 2 H 7 N 2 O | C | 67 | 67 | |
| 82.05310 | H 4 6 N 2 | H | √ | 11 | 100 |
| 83.06092 | C 4 H 7 N 2 | H | 23 | 99 | |
| 84.06875 | C 4 H 8 N 2 | H | H | 10 912 | 98 |
| 89.14768 | C 3 H 7 НЕТ 2 | E | √ | 1 | 75 |
| 90.00136 | C 2 H 4 NOS | C | √ | 41 | 98 |
| 101.09530 | C 4 H 11 N 3 | R | √ | 3 | 100 |
| 107.02831 | C 3 H 9 NOS | C | √ | 30 | 98 |
| 108,05751 | C 7 H 8 O | Y | √ | 1 | 60 |
Потеря CH
2 O 2 (46.00548)Потеря CH 2 O 2 (46.00548) широко признана как происходящая от боковой цепи аспарагиновой кислоты или глутаминовой кислоты при диссоциации, активируемой столкновением [39]. Потеря боковой цепи 46 Да, наблюдаемая в исследованиях ECD, была приписана потере карбоксильной группы боковой цепи плюс один водород (HCOO) в раннем исследовании [9], но не была связана с какими-либо конкретными аминокислотами в то время. Недавняя работа Ли и соавторов предполагает, что частичная потеря боковой цепи из-за отщепления α-водорода может объяснить этот результат [31].Чтобы исключить возможность того, что эта потеря возникает из-за непреднамеренной столкновительной активации низкого уровня во время процесса подготовки и хранения ионов для ETD, мы проанализировали синтетический пептид, содержащий остаток аспарагиновой кислоты, YYNDVILHK. Трехпротонированные катионы пептида подвергали реакции ETD с присутствующими анионами флуорантенового реагента и без них. Нейтральная потеря CH 2 O 2 наблюдалась в спектре ETD MS / MS, но не присутствовала, когда ионы реагентов не могли попасть в ловушку (данные не показаны).Эти данные предполагают, что потеря CH 2 O 2 возникает в результате реакции ETD.
Потеря C
2 H 5 NO (59.03711)Зубарев и др. . предположили, что потеря C 2 H 5 NO (59.03711) происходит из боковых цепей глутамина или аспарагина [9]; однако они не заметили этого в своем крупномасштабном анализе базы данных SwedECD [12]. Потеря 58 Да описана в спектрах ECD Gln-содержащих пептидов, что объясняется потерей NO из Gln C 2 H 4 [15].Здесь мы видим, что потеря нейтрали, обнаруженная в ETD, связана с потерей еще 1 Да (либо атома H, либо атома H + ). Мы обнаружили, что 32% пептидов, содержащих остаток Gln или Asn, демонстрируют эту потерю, и 80% спектров, содержащих эту потерю, были сопоставлены с пептидами, имеющими остаток Gln или Asn.
Потеря C
2 H 7 N 2 O (75,05584 Да)Представлен спектр ETD трехпротонированного пептида, имеющего последовательность RQVLIRPCSK.Сравнивая области нейтральных потерь однозарядных и двухзарядных продуктов ETnoD, мы замечаем, что есть нейтральные потери 75,05542 из однозарядных продуктов ETnoD ([M + 3H] + •• ), но не из двухзарядных ETnoD. продукт ([M + 3H] ++ • ). При допуске массы 10 ppm масса 75,05542 Да однозначно соответствует химической формуле C 2 H 7 N 2 О. Мы предполагаем, что эта потеря вытекает из двух последовательных событий переноса электрона (Рисунок S-1, < MMC ID = 1>, который можно найти в электронной версии этой статьи).Первый перенос на первичный амин на N-конце расщепляет связь N – C α и приводит к потере NH 3 , хорошо установленному процессу в ECD [40]. Этот двухзарядный ион-продукт может затем участвовать в захвате второго электрона, который в присутствии боковой цепи карбамидометилированного цистеина может вызывать потерю 58,02929 Да (C 2 H 4 NO). Потеря 58,02929 Да наблюдается также в спектрах ЭЦП пептидов, подвергшихся карбамидометилированию [17, 38, 41].Этот двухэтапный процесс также объясняет наличие потери C 2 H 7 N 2 O только в области однозарядного продукта ETnoD (). Чтобы подтвердить эту последовательность, продукт [M + 3H — NH 3 ] ++ • ETnoD был выделен после того, как начальная реакция ETD была проведена на предшественнике [M + 3H] 3+ синтетического пептида, содержащего два карбамидометилированные остатки цистеина, LFVHNVVCHACK. Затем продукт [M + 3H — NH 3 ] ++ • ETnoD подвергали другой реакции ETD, в результате которой получали [M + 3H — C 2 H 7 N 2 O] + • • товар (данные не показаны).Это еще одно свидетельство того, что потеря C 2 H 4 NO происходит только после потери NH 3 и последующего захвата электрона. Хотя о каждом событии в этом двухэтапном процессе сообщалось отдельно в спектрах ECD, насколько нам известно, это первое объяснение механизма потери нейтрали 75,05584 Да в ETD. Доказательства потери 75,05584 Да присутствовали в 67% всех Cys-содержащих пептидов ( n = 196).
Спектр ETD трехпротонированного пептида RQVLIRPCSK с назначением пиков ионов продукта и нейтральных потерь в Да; ( a ) m / z — диапазон от массы замка до двухзарядного иона-предшественника; ( b ) Диапазон m / z от двухзарядного иона-предшественника до однозарядного иона-предшественника
Потеря C
4 H 7 N 2 и C 4 H 8 N 2 (83.05969 и 84,06875 Да)В нашем наборе данных мы наблюдали потерю C 4 H 6 N 2 (82,05310 Да) из остатков His с аналогичной чувствительностью и специфичностью (11% и 100% соответственно), по сравнению с ранее сообщенным в ECD (38% и 99% соответственно) [8, 9, 12]. Однако мы обнаружили дополнительную потерю в 1 Да. Сумма потерь боковой цепи гистидина и дополнительных потерь 1 Да (либо атом H, либо H + ) отображается либо в C 4 H 7 N 2 , либо в C 4 H 8 N 2 .Как показано на фиг.2, эти два типа потерь специфичны для гистидин-содержащих пептидов. демонстрирует пример таких потерь от пептида YELHLK. На фигуре обильный пик показывает потерю нейтрали 83,05969 из однозарядного продукта ETnoD. Потеря His82 довольно слабая; потеря 83.05969 появляется только после двух ион / ионных реакций (), а не после начальной ион / ионной реакции (). Мы предполагаем, что потеря боковой цепи His в ETD происходит в результате последовательных ион / ионных реакций. Одно событие переноса инициирует потерю H-атома (или отрыв протона), а другое событие вызывает расщепление боковой цепи с общей потерей 83 Да (C 4 H 7 N 2 ) (), а не 82 Да .
Спектр ETD трехпротонированного пептида YELHLK с отнесением пиков продуктовых ионов и нейтральных потерь в Да; ( a ) m / z — диапазон от массы замка до двухзарядного иона-предшественника; ( b ) Диапазон m / z от двухзарядного иона-предшественника до иона-предшественника с пониженным зарядом
Чтобы предложить более прямое сравнение с ECD, мы синтезировали пептид ALANGFARSHALL и собрали спектры ETD с высоким разрешением этого пептида. Купер и др. .сообщили о потере 82 Да из [M + 2H] 2+ после ECD [8]. Интересно, что мы не наблюдали потери 82 Да ни из предшественника [M + 2H] 2+ , ни из [M + 3H] 3+ после однократной ион / ионной реакции. Однако потеря 83 Да явно присутствовала после двух ион / ионных реакций трехпротонированного предшественника (). Чтобы еще раз подтвердить наше предположение, мы собрали спектры ETD девяти других His-содержащих пептидов. перечислены потери His от различных предшественников всех десяти пептидов.Девять из 10 (90%) трехзарядных предшественников показали потерю 83 Да из [M + 3H] + •• . Напротив, только два из 10 (20%) двухзарядных предшественников показали потерю 82 Да из [M + 2H] + • . Эти наблюдения подтверждают, что потерю 83 Да можно интерпретировать как сумму первоначальной потери протона или атома водорода и последующей потери боковой цепи His.
ETD-спектры ALANGFARSHALL с присвоением: ( a ) потерь от [M + 2H] + • в спектре [M + 2H] ++ , ( b ) потерь от [M + 3H] ++ • в спектре [M + 3H] +++ и (в) потери из [M + 3H] + •• в спектре [M + 3H] ++ + .Каждый спектр представляет собой среднее значение 500 сканирований. Обратите внимание, что хотя этот пептид не содержит Asp / Glu, потеря CO (27,995 Да) явно присутствует. Потеря CO из пептида, не содержащего Asp или Glu, наблюдалась Pitteri et al. [52]
Таблица 2
Сводная таблица потерь около 82 Да из синтетических гистидин-содержащих пептидов. «Потери» относятся к измеренной разнице масс между предшественником с уменьшенным зарядом и наиболее интенсивным изотопным пиком
| Пептид | Заряд предшественника | Потери от +1 заряда уменьшены | Потери от +1 заряда уменьшены | Убыток от заряда +1 уменьшен в MS 3 * | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AGAHPLESHYR | 2 | ||||||||||||||||
| 3 | 83.060 | 81.044 | 83.060 | ||||||||||||||
| 4 | 84.067 | 82.054 | 84.067 | ||||||||||||||
| ALANGFARSHALL | 83.04 a | ||||||||||||||||
| AWLNEHR | 2 | ||||||||||||||||
| 3 | 83.060 | 83.060 | |||||||||||||||
| GFSQNTSLTQHQR | 2 | ||||||||||||||||
| 3 | 83.060 | 83.060 | 83.060826 | ||||||||||||||
| 3 | 83.060 | 83.060 | |||||||||||||||
| HAAAKAAAH | 2 | 81.044 | |||||||||||||||
| 83 | 06081.046 | 83.060 | |||||||||||||||
| HAAAKAAK | 2 | ||||||||||||||||
| 3 | 83.060 | 83.060 | |||||||||||||||
| 3 | 83.059 | 83.054 | |||||||||||||||
| HTGTPLGDIPYGK | 2 | ||||||||||||||||
| 926 | |||||||||||||||||
| 926 | |||||||||||||||||
| 926 926 | |||||||||||||||||
| 3 | 83.058 |
Потеря N
2 H 6 , CH 4 N 2 , CH 5 N 3 и C 4 H 11 N 3 (34,05310, 44,03745, 59,04835 и 101,09530 Да)Среди нейтральных потерь, наблюдаемых во всех спектрах ETD, исследованных в этом эксперименте, боковая цепь аргинина является одной из наиболее распространенных и распространенных. Мы наблюдали четыре основных типа нейтральных потерь из остатков аргинина, о которых ранее сообщалось в спектрах ECD [8–12, 20, 21], а именно Arg34 (N 2 H 6 , 34.05310), Arg44 (CH 4 N 2 , 44.03745), Arg59 (CH 5 N 3 , 59.04835) и Arg101 (C 4 H 11 N 3 , 101.09530). суммирует обнаруженные частоты этих четырех типов потерь нейтрали. 16 строк в таблице исчерпывают возможности всех комбинаций этих четырех типов потери нейтрального аргинина. Эта таблица показывает, что потери Arg34 и Arg59 являются двумя наиболее частыми из боковой цепи аргинина после ETD. Кроме того, комбинация этих двух пиков показывает наивысшую обнаруженную частоту среди всех 15 возможных комбинаций этих четырех нейтральных потерь, учитывая, что любая из четырех нейтральных потерь присутствует в данном спектре.Наличие только потерь Arg44 и Arg101 довольно редко (с частотами обнаружения 19 и 0 соответственно).
Выявленная частота потерь нейтрали боковой цепи аргинина. Сумма каждой строки представляет собой количество PSM с соответствующей комбинацией потерь нейтральных сторон боковой цепи аргинина. Сумма в каждом столбце представляет частоту каждой конкретной нейтральной потери
Потеря NH
3 (17,02655 Да) Потеря 17,02655 появляется в подавляющем большинстве спектров ETD.Числовое значение 17.02655 с допуском массы ± 10 ppm соответствует исключительно NH 3 . Остается спорным, происходит ли потеря NH 3 из N-концевого амина или из боковой цепи остатка [8, 9]. В ряде случаев, когда пептиды не заканчиваются основным остатком, все же обнаруживается сильная нейтральная потеря NH 3 , что позволяет предположить, что NH 3 не происходит от С-концевого лизина. Более того, ETD N-концевого ацетилированного пептида (ac) SDKPDMAEIEKFDK (Рисунок S-2)
Согласование содержания аминокислот в нейтральных потерях с PSM
Обратите внимание, что, хотя специфичность многих потерь довольно высока (), самая высокая чувствительность потерь, специфичных для аминокислот, составляет всего 67%.Следовательно, диагностическая ценность этих потерь заключается в подтверждении, а не исключении присутствия определенных аминокислот в предшественниках пептидов. Ранее предпринимались попытки воспользоваться явлением нейтральных потерь, возникающим в экспериментах с ECD, для улучшения поиска в базе данных с помощью фильтрации данных после сбора данных [42]. В этом отчете, однако, сделан вывод о том, что использование таких потерь невыгодно для поиска в базе данных. В нашем наборе данных 1285 PSM содержали нейтральные потери, специфичные для аминокислот.Из них 1189 (92,5%) согласны с результатом поиска в базе данных. Разногласия в 7,5% могут иметь ряд причин: модифицированные пептиды, ложноположительная идентификация пептидов, обнаружение ложноположительных пиков нейтрализации и т. Д. Тем не менее, этот высокий процент согласия предполагает возможное использование этих диагностических потерь для повышения уверенности в идентификации пептидов от поиск в базе данных.
Мы пришли к выводу, что специфичность нейтральных потерь в спектрах ETD может быть полезна для контроля частоты ложных обнаружений (FDR) после поиска в базе данных.Однако включение информации о потерях в наши процедуры фильтрации на основе FDR дало лишь незначительные результаты, частично из-за отсутствия или небольшого количества потерь во многих спектрах (данные не показаны). Дальнейшая работа по программированию информации о потерях ETD в алгоритмы поиска, тем самым улучшая функции оценки, может оказаться более плодотворной.
Идентификация пептидов с использованием точной массы и нейтральных потерь
Было продемонстрировано, что пептиды можно напрямую идентифицировать путем точного измерения массы предшественников [43–51].Для дальнейшего изучения использования этих специфичных для аминокислот нейтральных потерь, перечисленных в, мы спросили, можно ли использовать сочетание высокой точности информации о массе с содержанием аминокислот, на которое указывают эти специфические нейтральные потери, для однозначной идентификации пептидных последовательностей. Для достижения этой цели мы сначала выполнили in silico LysC-переваривание базы данных белков человека с тремя пропущенными расщеплениями. Затем мы преобразовали этот список пептидов в базу данных MySQL. Например, показан список пептидов-кандидатов для запроса SQL с использованием только критериев точности по массе (± 3 ppm) предшественника, имеющего массу 1622.71992 Да. На основании данных МС / МС мы пришли к выводу, что пептид должен содержать аспарагиновую кислоту (D), цистеин (C) и либо глутамин (Q), либо аспарагин (N). Применение этих дополнительных критериев содержания аминокислот привело к уникальной идентификации пептида SVSGTDVQEECREK. Этот пример демонстрирует потенциальное использование высокой точности определения массы пептидных предшественников и диагностической ценности нейтральной потери, чтобы сделать вывод о пептидной последовательности или помочь отфильтровать ложноположительные идентификации.
Информация о содержании аминокислот, полученная из нейтральных потерь в спектре ETD, устраняет неоднозначность идентификации пептидов при точном поиске в базе данных белков на основе массы [43–51]. Имеется восемь последовательностей-кандидатов (левая панель) из базы данных пептидов LysC человека, которые прошли точную массовую фильтрацию (1622,71992 ± 3 ppm). Из тандемного масс-спектра ETD (номер сканирования 1286) мы пришли к выводу, что пептид-предшественник содержит аспарагиновую кислоту, цистеин, а также должен содержать либо глутамин, либо аспарагин.Применение этой информации отфильтровывает семь пептидов и оставляет только одного кандидата — SVSGTDVQEECREK (правая панель), который представляет собой тот же пептид, который был идентифицирован при поиске в базе данных
Чтобы получить более полное представление о значении нейтральных пиков потери для идентификации пептидов, мы выполнили крупномасштабный SQL-запрос, в котором мы использовали 1474 MS / MS-спектра для генерации SQL-запроса из каждого. Сценарий Perl был написан для подключения и запроса базы данных пептидов LysC человека. Примерно 7% этих SQL-запросов приводят к уникальной идентификации пептидов.отображает частотные гистограммы количества отдельных пептидов из запросов SQL к базе данных пептидов LysC человека. Сравнивая с SQL-запросами, использующими только массовую точность с тем же уровнем толерантности (± 3 ppm), мы наблюдаем значительный сдвиг в сторону гораздо более узкого списка последовательностей-кандидатов в результате дополнительной информации о содержании аминокислот, полученной из нейтральных потерь. . За счет добавления информации о потерях боковой цепи среднее количество кандидатов последовательности из точного массового запроса уменьшается с 21 до 8.
Гистограммы, показывающие частоту возможных последовательностей из запроса SQL по отношению к базе данных расщепленных пептидов LysC in silico человека с использованием информации либо только из точной массы (красный), либо из точной массы и аминокислотного состава, автоматически полученных из нейтральных потерь ETD (синий)
Определение уникальных аминокислотных замен в вариантах белков с помощью массового картирования пептидов с помощью FT-ICR MS
https://doi.org/10.1016/j.jasms.2005.12.006Получение прав и контентаМассовое картирование пептидов играет центральную роль в структурная характеристика вариантов белка с одиночными аминокислотными заменами.Среди 20 стандартных аминокислот, обнаруженных в живых организмах, 18, кроме Leu и Ile, отличаются друг от друга по молекулярной массе. Массовые различия между аминокислотами составляют от 0,0364 до 129,0578 Да. Масса мутировавшего пептида или разница между нормальным и мутировавшим пептидом однозначно определяет тип замены в некоторых случаях и даже точно определяет положение мутации, когда задействованный остаток обнаруживается в пептиде только один раз. Среди 75 пар аминокислотных остатков, которые могут быть заменены посредством замены одного нуклеотида, 53 показывают специфическое изменение точной массы, в то время как только 25 — номинальной массы.С другой стороны, точное измерение, по крайней мере, до третьего знака после запятой, значительно увеличивает возможности стратегии картирования пептидной массы для структурной характеристики. Это представление было подтверждено анализом трех вариантов Hb с использованием MALDI-FTICR MS. Кроме того, базовое разрешение двух пептидов 1 кДа с разницей в одну аминокислоту, Lys или Gln, которые имеют наименьшее (0,0364 Да) различие между остатками, было достигнуто путем измерения при разрешающей способности по массе 342000.

 03
03 08
08 06
06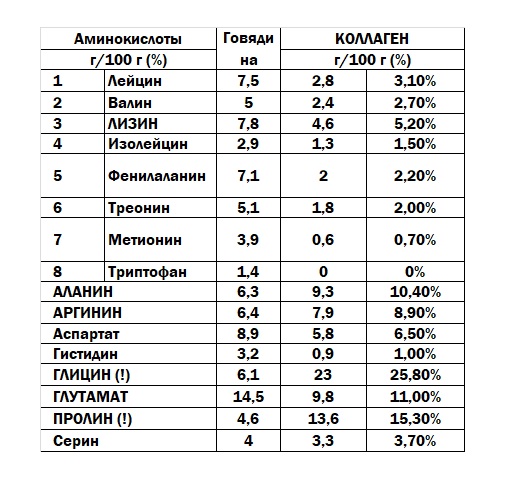 06
06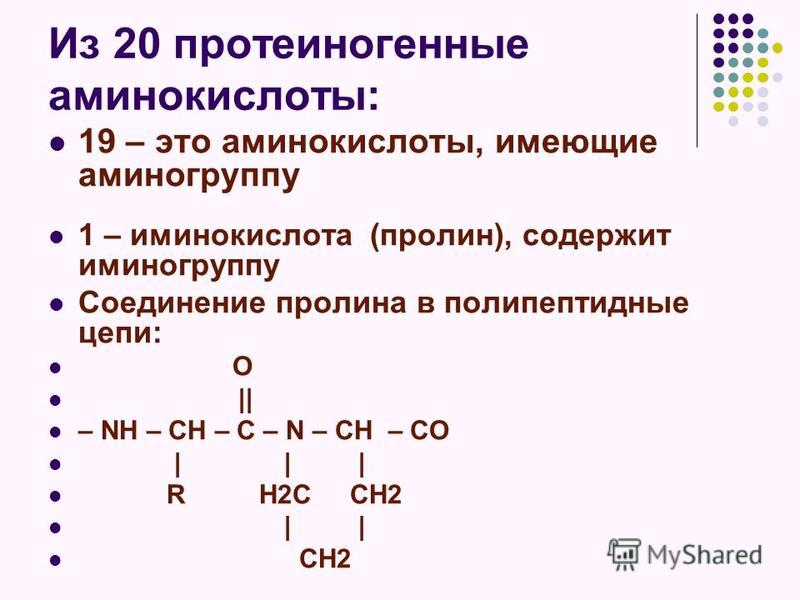 06
06 07
07