АМИНОКИСЛОТЫ | Global Pharma
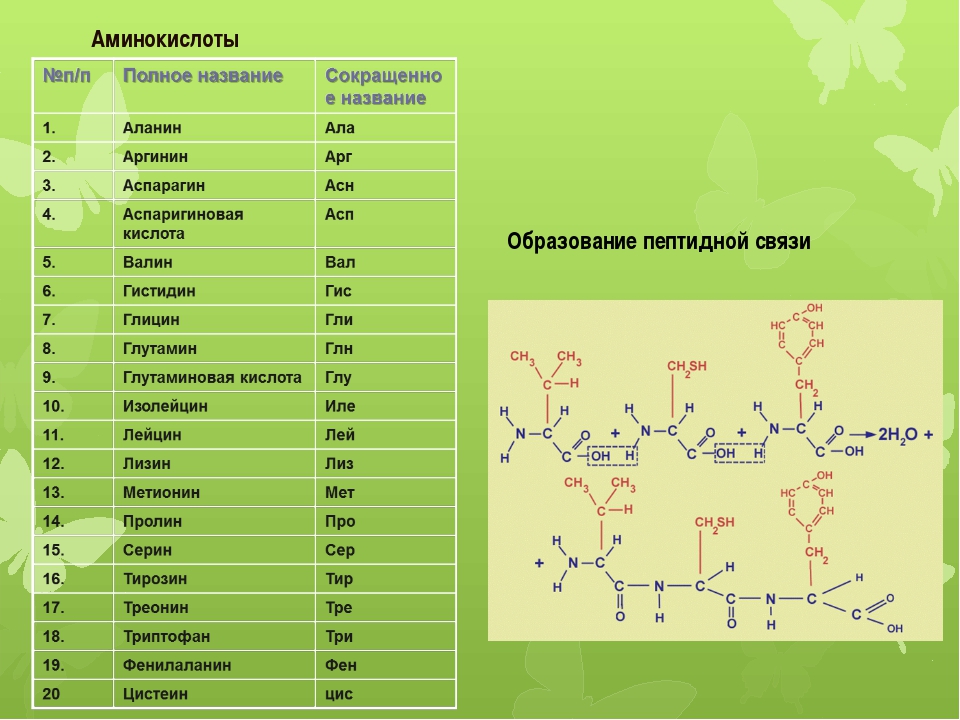
Аминокислоты – эта частицы, из которых состоит белок. Каждая из них состоит из карбонового скелета, к которому присоединяется аминовая кислотная группа, атом углерода и боковая цепочка. Всего в организме человека встречаются 18 аминокислот – 10 из них – это эндогенные аминокислоты, то есть аминокислоты, которые наш организм может самостоятельно синтезировать путем энзиматических реакций, и 8 экзогенных, которые необходимы для правильной работы, но которые организм не способен сам вырабатывать в достаточном количестве. Поэтому они должны поступать отдельно, с пищей.
К эндогенным аминокислотам относятся: аланин, цистеин, глицин, аспаргиновая кислота, глутаминовая кислота, пролин, тирозин, гистидин, аргинин, серин
К экзогенным аминокислотам относятся: фенилаланин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, валин.
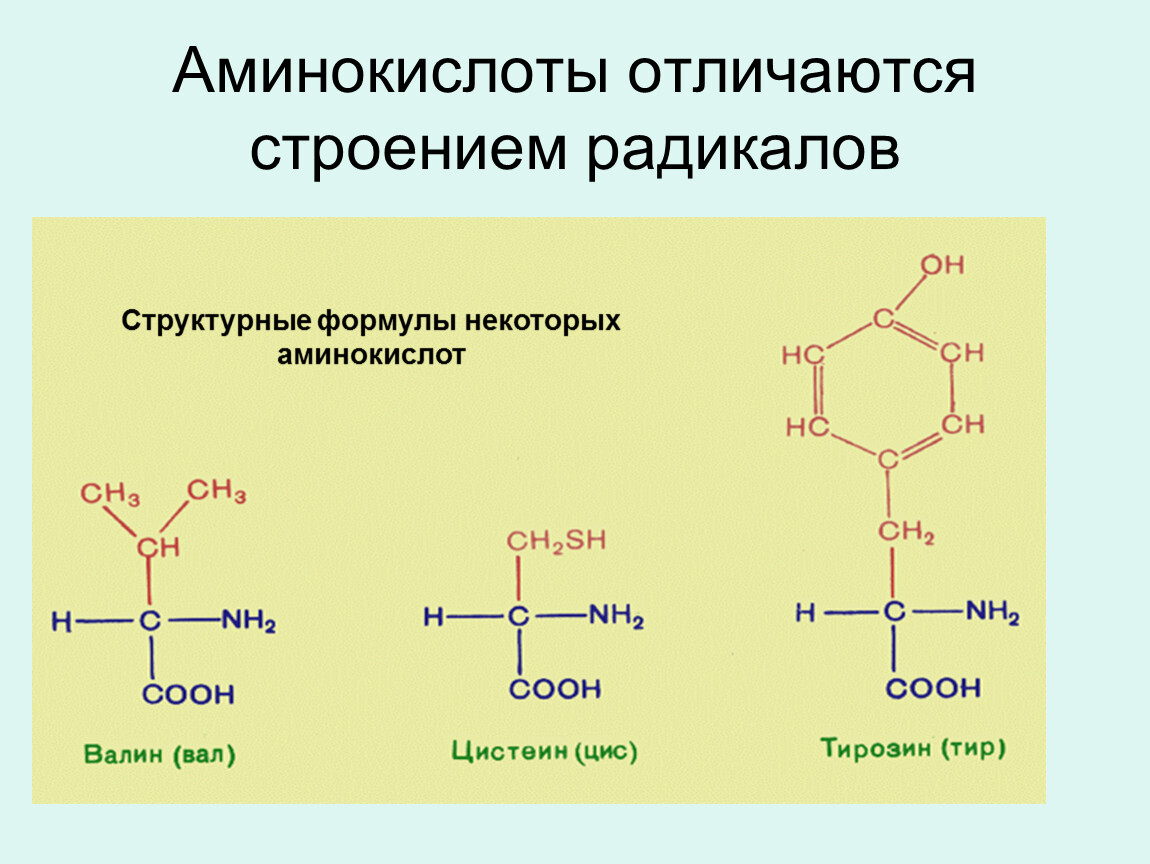
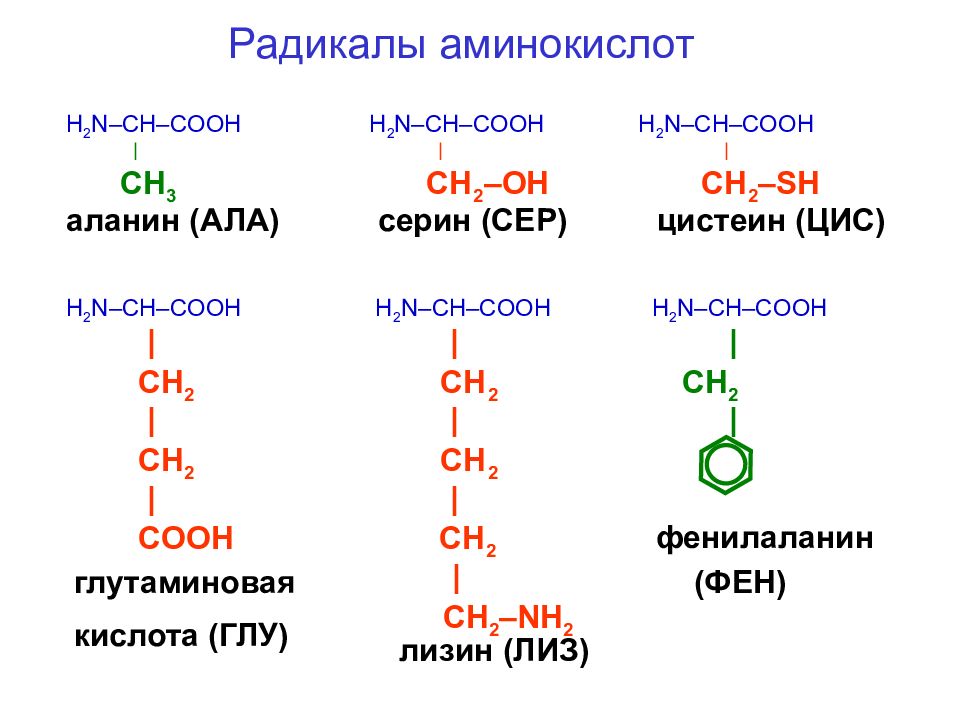
Эти кислоты отличаются друг от друга своим строением, свойствами и ролью в организме.
Мы производим препараты, содержащие аминокислоты BCAA, в том числе:
- L-лейцин,
- L-изолейцин,
- L-валин,
- L-тирозин,
- L-глутамин,
- L-триптофан,
- и многие другие.

Мы можем усилить препараты дополнительной дозой витаминов и минералов. Мы пользуемся услугами польских поставщиков сырья, предлагающих проверенные материалы самого высокого качества.
Весь производственный процесс строится на основе сертифицированной системы управления качеством ISO22000. Каждое изделие перед допуском в продажу проходит проверку по более чем десяти показателям, среди которых содержание тяжелых металлов, микробиологическая чистота, органолептические и физико-химические параметры, а также испытания, подтверждающие ожидаемое содержание вещества.
Продукцию мы можем упаковывать практически в любые упаковки, в том числе:
- дой-пак,
- капсулы,
- пакетики,
- банки,
- пластиковые и стеклянные упаковки.
Мы имеем оборудование для безопасного индукционного закрывания, а также дополнительные средства защиты термоусадочной пленкой для предотвращения открытия.
Приглашаем связаться с нами.
| Аминокислоты | |
Виды: — аминокислоты BCAA — витамины — минералы | Упаковки аминокислот BCAA: — твердые желатиновые и вегетарианские капсулы — дой-паки с замком вместимостью от 200 г до 5 кг — банки вместимостью от 200 г до 5 кг — пакетики от 7 до 30 г |
| Упаковки аминокислот BCAA | |
| |
Что такое аминокислоты и как их использовать?
Часто невозможно получить все необходимые питательные вещества с ежедневным рационом, особенно для активных людей. В долгосрочной перспективе недостаточное употребление питательных веществ может иметь множество негативных последствий не только для самочувствия, но и для здоровья.
В долгосрочной перспективе недостаточное употребление питательных веществ может иметь множество негативных последствий не только для самочувствия, но и для здоровья.
Чтобы обеспечить организм всеми необходимыми питательными веществами, стоит сделать свое меню более полноценным и приобрести пищевые добавки, в том числе белки и их ингредиенты — аминокислоты.
Аминокислоты — что это такое?Аминокислота — это органическое вещество, обладающее свойствами кислот и аминов. В сочетании с другими аминокислотами они образуют белки, из которых состоит любой организм, как животный, так и растительный. Белки, состоящие из аминокислот, составляют примерно пятую часть веса человеческого тела.
После воды вторым по важности компонентом в нашем организме являются аминокислоты и образующиеся из них белки, которые, в свою очередь, образуют ткани, а также обеспечивают процесс роста, различные биосинтетические и неврологические процессы.
Какие типы аминокислот существуют?
В природе существует множество различных аминокислот, но нашему организму необходимо 20 различных аминокислот, которые могут объединяться, образуя около 100 000 различных белков. Есть две основные группы аминокислот — незаменимые и заменимые аминокислоты.
Есть две основные группы аминокислот — незаменимые и заменимые аминокислоты.
9 аминокислот, в которых нуждается наш организм, являются незаменимыми аминокислотами. Это означает, что наш организм и его клетки не синтезируют или не могут самостоятельно создавать эти 9 аминокислот, поэтому они должны поступать в организм с пищей.
Вегетарианцам и веганам следует быть здесь особенно осторожными, поскольку лишь некоторые растительные продукты содержат все 9 незаменимых аминокислот — гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Поскольку организм не может вырабатывать незаменимые аминокислоты, необходимые организму, но они участвуют в различных процессах, важных для функций организма, особенно важно убедиться, что мы потребляем не только достаточное количество общих аминокислот, но и все незаменимые аминокислоты.
Недостаточное количество незаменимых аминокислот в рационе может вызвать серьезные проблемы со здоровьем.
Заменимые аминокислоты — 11 из 20 аминокислот, которые человеческий организм способен создавать или синтезировать из других аминокислот, поэтому количество таких аминокислот в рационе не так важно, если потребляется достаточно белка, из которого организм может синтезировать соответствующие аминокислоты.
Какую роль в нашем организме играют аминокислоты?Как уже упоминалось, одна аминокислота связывается с другой для образования белков. Эти белки являются основой не только веса нашего тела, но и других важных функций организма. Например, гемоглобин в крови — это железосодержащий белок, который содержится в эритроцитах и называется эритроцитами. Гемоглобин используется для снабжения клеток организма кислородом и доставки углекислого газа из тканей в легкие.
Аминокислоты также отвечают за гормональные аспекты здоровья, поскольку они также участвуют в производстве различных пищеварительных ферментов и гормонов. Например, инсулин, один из важнейших метаболических гормонов, состоит из аминокислот.
Например, инсулин, один из важнейших метаболических гормонов, состоит из аминокислот.
Еще одна важная функция аминокислот — обеспечение энергией. В нормальных условиях организм использует углеводы в качестве источника энергии, но в ситуации, когда используются все основные ресурсы, такие как интенсивные физические тренировки, организм также способен вырабатывать энергию из аминокислот.
Если поступает недостаточное количество аминокислот, организму не хватает «сырья» для поддержки наиболее важных жизненных процессов, что приводит к ухудшению структуры волос, кожи и ногтей, ослаблению мышц и запуску мышечной атрофии.
Это означает, что для людей, которые хотят сохранить, но особенно увеличить мышечную массу, особенно важно убедиться, что в вашем рационе достаточно аминокислот.
Основные преимущества использования аминокислот- Функция развития мышц. Поскольку масса нашего тела в значительной степени состоит из белков, которые, в свою очередь, состоят из аминокислот, достаточное количество аминокислот обеспечивает развитие мышц и силу.
 Например, на протяжении десятилетий было доказано, что креатин увеличивает мышечную массу. Увеличивая количество аминокислот в рационе, Вы можете увеличить азотный баланс в организме, что, в свою очередь, увеличивает количество аминокислот в мышцах, поэтому увеличивается мышечная масса.
Например, на протяжении десятилетий было доказано, что креатин увеличивает мышечную массу. Увеличивая количество аминокислот в рационе, Вы можете увеличить азотный баланс в организме, что, в свою очередь, увеличивает количество аминокислот в мышцах, поэтому увеличивается мышечная масса. - Востановление. Период восстановления также является неотъемлемой частью активного образа жизни. Аминокислоты способствуют восстановлению мышц после тренировки.
- Сбалансированный уровень сахара в крови. Использование аминокислот позволяет контролировать уровень сахара без дополнительного инсулина.
- Улучшается состояние кожи, волос, ногтей. В ситуации, когда организму не хватает питательных веществ, аминокислоты, которые будут использоваться для обеспечения волос, ногтей и кожи, используются для других процессов. Волосы, ногти и кожа в основном состоят из одного белка — кератина, поэтому помимо аминокислот обеспечат человеческий организм всем необходимым сырьем для успешного не только различных обменных процессов, но и здоровой кожи, волос и ногтей.

Рекомендуется употреблять аминокислоты между приемами пищи, а также до, после или во время тренировки, это во многом зависит от индивидуальных целей, для которых используются дополнительные аминокислоты.
БЕЛКИ И АМИНОКИСЛОТЫ / Косметические ингредиенты Teana Labs
Белки — это кирпичики жизни. Все ткани живых организмов на Земле, в том числе и кожа человека, построены из белков, жиров, углеводов и воды. Аминокислоты, пептиды и белки образуют группу химически родственных соединений.
Какие бывают белки?Фибриллярные белки — линейные молекулы, образуют волокна.
- Коллаген. Он составляет 30-40% всех белков в организме. Коллаген обеспечивает прочность.
 Его молекула состоит из 1000 аминокислот, одна треть из которых глицин. С возрастом постепенно увеличивается число связей в молекуле коллагена, из-за чего ее упругость уменьшается.
Его молекула состоит из 1000 аминокислот, одна треть из которых глицин. С возрастом постепенно увеличивается число связей в молекуле коллагена, из-за чего ее упругость уменьшается. - Эластин. Он может менять длину молекулы, то есть сокращаться. Определяет эластичность кожи.
- Кератин. Из него состоят роговые производные эпидермиса кожи (ногти, волосы).
Глобулярные белки — молекулы свернуты в клубок.
Такую структуру имеют ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин).
Ни один класс органических соединений не обладает таким же разнообразием и функциональностью, как белки. Поэтому они и нашли широкое применение в косметологии.
Интересно: белковая молекула очень крупная и не способна проникать в глубокие слои кожи. Для проникновения вглубь и проявления своей биоактивности белкам требуются специальные системы доставки (например, липосомы).
- Структурные. Белки образуют ткани и органы.
- Каталитические (ферменты). Обеспечивают протекание необходимых биохимических реакций.
- Транспортные. Осуществляют перенос различных веществ внутрь клетки и вовне.
- Защитные. Связаны с иммунной системой человека.
- Синтез гормонов.
- Лифтинг. Оказываясь на поверхности кожи, белки образуют пленку, коротая оказывает мгновенный, но временный лифтинг-эффект (пока пленка находится на поверхности кожи). Визуально разглаживают кожный рельеф, делая морщины менее заметными.
- Кондиционирование. Белки обладают высокой гигроскопичностью (удерживают влагу). Они образуют влажную белковую пленку, которая дает длительный увлажняющий эффект.
 При этом пропадает чувство стянутости и появляется ощущение комфорта. Кожа на ощупь становится шелковистой и гладкой. Важно, что эта белковая пленка не препятствует газообмену кожи и не закупоривает поры.
При этом пропадает чувство стянутости и появляется ощущение комфорта. Кожа на ощупь становится шелковистой и гладкой. Важно, что эта белковая пленка не препятствует газообмену кожи и не закупоривает поры. - Эксфолиация и очищение. Ферментативные очищающие средства содержат протеолитические (животного происхождения) ферменты. Они работают только на поверхности кожи, ослабляя сцепление корнеоцитов (чешуек) и разрушая связи между ними. Таким образом, облегчается отшелушивание роговых чешуек. Рельеф сглаживается, а цвет кожи становится более ровным. Кроме того, улучшается проникновение активных веществ в более глубокие слои кожи — все средства ухода работают более эффективно.
Многие аминокислоты синтезируются в организме человека. Но есть восемь аминокислот, которые наш организм не синтезирует и должен получать с пищей. Это так называемые незаменимые жирные кислоты:
- Валин
- Лейцин
- Триптофан
- Фенилаланин
- Лизин
- Аргинин
- Метионин
- Треонин
Кроме участия в построении белковых молекул, каждая аминокислота выполняет в организме свои особые функции. Например, цистеин легко взаимодействует с перекисью водорода и нейтрализует, ее, тем самым останавливая свободно-радикальные процессы. Таким образом цистеин оказывает антиоксидантный эффект.
Например, цистеин легко взаимодействует с перекисью водорода и нейтрализует, ее, тем самым останавливая свободно-радикальные процессы. Таким образом цистеин оказывает антиоксидантный эффект.
- Улучшают водный и белковый баланс кожи
- Стимулируют синтез коллагена
- Облегчают проникновение через роговой слой других БАВ (биологически активных веществ)
- Хорошо увлажняют кожу и волосы
- Некоторые аминокислоты входят в состав натурального увлажняющего фактора
Натуральный увлажняющий фактор (НУФ) — это комплекс маленьких гигроскопичных молекул. Он находится в роговом слое эпидермиса, обеспечивая его нормальное увлажнение. При дефиците НУФ развивается сухость и шелушение кожи, с которыми помогает справиться компенсирующая косметика.
Аминокислота: полезные свойства и источники питания
Что такое аминокислоты?
Аминокислоты являются строительными блоками белка. Белки представляют собой длинные цепочки аминокислот. В вашем организме есть тысячи различных белков, каждый из которых выполняет важную работу. Каждый белок имеет свою последовательность аминокислот. Последовательность заставляет белок принимать разные формы и выполнять разные функции в организме.
Белки представляют собой длинные цепочки аминокислот. В вашем организме есть тысячи различных белков, каждый из которых выполняет важную работу. Каждый белок имеет свою последовательность аминокислот. Последовательность заставляет белок принимать разные формы и выполнять разные функции в организме.
Вы можете думать об аминокислотах как о буквах алфавита. Когда вы комбинируете буквы различными способами, вы получаете разные слова.То же самое и с аминокислотами — когда вы комбинируете их различными способами, вы получаете разные белки.
Какие существуют типы аминокислот?
Ваше тело нуждается в 20 различных видах аминокислот для правильного функционирования. Эти 20 аминокислот комбинируются по-разному, чтобы в организме образовывались белки.
Ваше тело вырабатывает сотни аминокислот, но не может вырабатывать девять необходимых вам аминокислот. Это так называемые незаменимые аминокислоты. Вы должны получать их из пищи, которую едите.Девять незаменимых аминокислот:
- Гистидин : Гистидин помогает вырабатывать химическое вещество мозга (нейротрансмиттер), называемое гистамином.
 Гистамин играет важную роль в иммунной функции организма, пищеварении, сне и сексуальной функции.
Гистамин играет важную роль в иммунной функции организма, пищеварении, сне и сексуальной функции. - Изолейцин : Изолейцин участвует в мышечном метаболизме и иммунной функции организма. Это также помогает вашему телу вырабатывать гемоглобин и регулировать энергию.
- Лейцин : Лейцин помогает организму вырабатывать белок и гормоны роста.Он также помогает наращивать и восстанавливать мышечную ткань, заживлять раны и регулировать уровень сахара в крови.
- Лизин : Лизин участвует в производстве гормонов и энергии. Это также важно для кальция и иммунной функции.
- Метионин : Метионин способствует росту тканей организма, метаболизму и детоксикации. Метионин также помогает усвоению основных минералов, включая цинк и селен.
- Фенилаланин : Фенилаланин необходим для производства химических мессенджеров вашего мозга, включая дофамин, адреналин и норадреналин.
 Это также важно для производства других аминокислот.
Это также важно для производства других аминокислот. - Треонин : Треонин играет важную роль в коллагене и эластине. Эти белки обеспечивают структуру вашей кожи и соединительной ткани. Они также помогают формировать сгустки крови, которые помогают предотвратить кровотечение. Треонин играет важную роль в жировом обмене и вашей иммунной функции.
- Триптофан : Триптофан помогает поддерживать правильный баланс азота в организме. Он также помогает вырабатывать химическое вещество мозга (нейротрансмиттер), называемое серотонином.Серотонин регулирует ваше настроение, аппетит и сон.
- Валин : Валин участвует в росте мышц, регенерации тканей и выработке энергии.
Ваше тело вырабатывает остальные 11 необходимых вам аминокислот. Это так называемые незаменимые аминокислоты. Заменимыми аминокислотами являются аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин.
Некоторые заменимые аминокислоты классифицируются как условные.Это означает, что они считаются необходимыми только тогда, когда вы больны или испытываете стресс. Условные аминокислоты включают аргинин, цистеин, глютамин, тирозин, глицин, орнитин, пролин и серин.
Какова структура аминокислоты?
Аминокислота является органическим химическим веществом. Органические химические вещества содержат углерод-водородные связи. Все аминокислоты имеют одинаковую основную структуру. Каждая молекула имеет центральный атом углерода, связанный вместе с основной аминогруппой, группой карбоновой кислоты, атомом водорода и R-группой или группой боковой цепи.Группа R — это то, что отличает аминокислоты друг от друга. R-группа определяет химическую природу каждой аминокислоты. Химическая природа определяет, как он будет взаимодействовать с другими аминокислотами и окружающей средой.
Аминокислоты соединяются пептидными связями и становятся белками. Затем силы других аминокислот и эффекты их R-групп сворачивают белок в определенные трехмерные формы.
Что делают аминокислоты?
Ваше тело использует аминокислоты для производства белков.Различные типы аминокислот и способ их соединения определяют функцию каждого белка. Таким образом, аминокислоты участвуют во многих важных ролях в вашем организме. Аминокислоты помогают:
- Разбить еду.
- Рост и восстановление тканей тела.
- Вырабатывать гормоны и химические вещества мозга (нейротрансмиттеры).
- Предоставить источник энергии.
- Поддержание здоровья кожи, волос и ногтей.
- Накачать мышцы.
- Укрепите свою иммунную систему.
- Поддерживайте нормальное пищеварение.
Сколько аминокислот мне нужно?
Вам не нужно есть продукты с аминокислотами при каждом приеме пищи, но важно поддерживать их баланс в течение дня. Рекомендуемая суточная доза каждой из незаменимых аминокислот на каждые 2,2 фунта массы тела составляет:
- Гистидин : 14 миллиграммов
- Изолейцин : 19 миллиграммов
- Лейцин : 42 миллиграмма
- Лизин : 38 миллиграммов
- Метионин : 19 миллиграммов
- Фенилаланин : 33 миллиграмма
- Треонин : 20 миллиграммов
- Триптофан : 5 миллиграммов
- Валин : 24 миллиграмма
Какие продукты содержат аминокислоты?
Незаменимые аминокислоты можно найти во многих различных продуктах. Лучшие источники аминокислот содержатся в животных белках, таких как говядина, птица и яйца. Животные белки наиболее легко усваиваются и используются организмом.
Лучшие источники аминокислот содержатся в животных белках, таких как говядина, птица и яйца. Животные белки наиболее легко усваиваются и используются организмом.
Продукты, содержащие все девять незаменимых аминокислот, называются полноценными белками. Эти продукты включают говядину, птицу, рыбу, яйца, молочные продукты, сою, лебеду и гречку.
Продукты, которые содержат некоторые, но не все незаменимые аминокислоты, называются неполными белками. Эти продукты включают орехи, семена, бобы и некоторые зерна. Если вы придерживаетесь вегетарианской или веганской диеты, вам необходимо включить несколько типов неполных белков, чтобы убедиться, что вы потребляете все девять незаменимых аминокислот.
Должен ли я принимать добавки с аминокислотами?
Обычно вы можете получить все незаменимые аминокислоты, необходимые вашему организму, соблюдая здоровую сбалансированную диету. Некоторые люди принимают добавки с аминокислотами, чтобы улучшить сон, улучшить настроение и улучшить спортивные результаты. Но Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) не одобрило эти добавки. Вы должны поговорить со своим лечащим врачом, прежде чем начинать принимать какие-либо добавки, включая добавки с аминокислотами.
Но Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) не одобрило эти добавки. Вы должны поговорить со своим лечащим врачом, прежде чем начинать принимать какие-либо добавки, включая добавки с аминокислотами.
Записка из клиники Кливленда
Аминокислоты являются строительными блоками белков.Это молекулы, которые нужны всем живым существам для производства белка, и вам нужно 20 из них, чтобы ваше тело функционировало должным образом. Ваше тело производит 11 необходимых аминокислот. Хорошая новость заключается в том, что вам не нужно делать ничего особенного, чтобы получить оставшиеся девять аминокислот, в которых нуждается ваш организм. Просто нужно питаться сбалансированно. Сосредоточьтесь на полноценных белках — продуктах, содержащих все девять незаменимых аминокислот, таких как мясо, яйца и молочные продукты. Неполноценные белки, такие как орехи и бобы, тоже хороши. Поговорите со своим лечащим врачом, если вам нужна помощь или предложения по получению достаточного количества аминокислот в вашем рационе.
Аминокислоты как регуляторы и компоненты непротеиногенных путей | Журнал питания
Аннотация
Аминокислоты являются не только важными предшественниками для синтеза белков и других N-содержащих соединений, но и участвуют в регуляции основных метаболических путей. Глутамат и аспартат, например, являются компонентами малатно-аспартатного челнока, и их концентрации контролируют скорость митохондриального окисления гликолитического НАДН.Глутамат также контролирует скорость синтеза мочевины не только как предшественник аммиака и аспартата, но и как субстрат для синтеза N-ацетилглутамата, основного активатора карбамоилфосфатсинтазы. Этот механизм допускает большие вариации синтеза мочевины при относительно постоянных концентрациях аммиака. Увеличение внутриклеточной концентрации аминокислот увеличивает объем клеток. Набухание клеток само по себе оказывает анаболическое действие на белковый, углеводный и липидный обмен: усиленный синтез макромолекул компенсирует увеличение внутриклеточной осмолярности.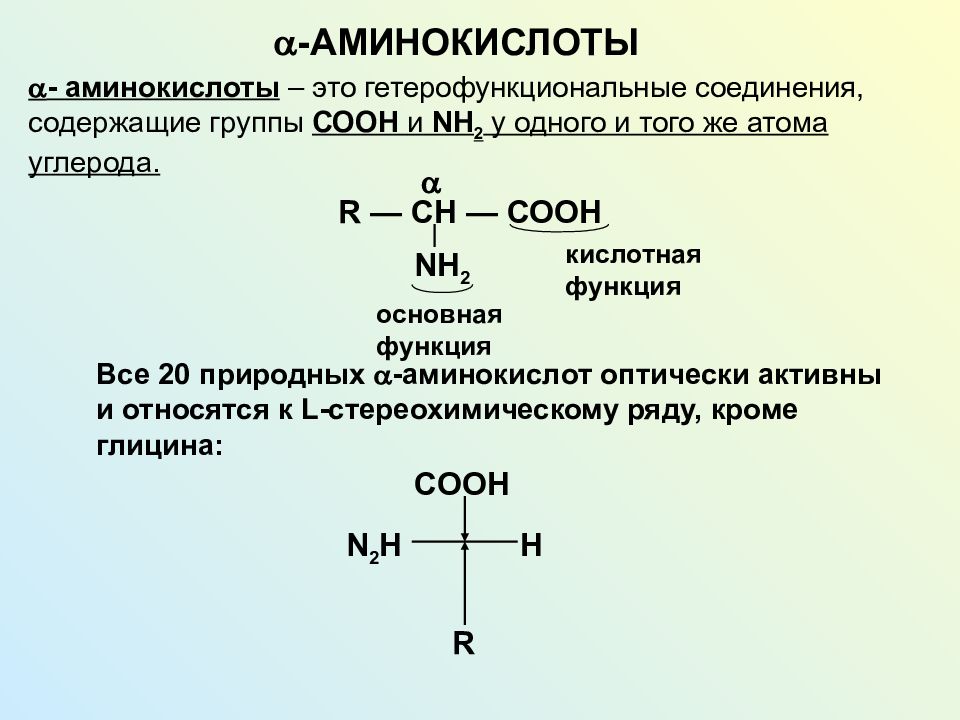 Механизмы, ответственные за вызванные набуханием клеток изменения потоков путей, включают изменения концентраций внутриклеточных ионов и передачи сигнала. Конкретные аминокислоты (например, лейцин) стимулируют синтез белка и ингибируют (аутофагическую) деградацию белка независимо от изменения объема клетки, поскольку они стимулируют mTOR (мишень рапамицина у млекопитающих), протеинкиназу, которая является одним из компонентов пути передачи сигнала. используется инсулином. Когда клеточное энергетическое состояние низкое, стимуляция mTOR аминокислотами предотвращается активацией АМФ-зависимой протеинкиназы.Аминокислотно-зависимая передача сигналов также способствует выработке инсулина β -клетками. Это еще больше усиливает анаболические свойства аминокислот. Сделан вывод, что аминокислоты являются важными регуляторами основных метаболических путей.
Механизмы, ответственные за вызванные набуханием клеток изменения потоков путей, включают изменения концентраций внутриклеточных ионов и передачи сигнала. Конкретные аминокислоты (например, лейцин) стимулируют синтез белка и ингибируют (аутофагическую) деградацию белка независимо от изменения объема клетки, поскольку они стимулируют mTOR (мишень рапамицина у млекопитающих), протеинкиназу, которая является одним из компонентов пути передачи сигнала. используется инсулином. Когда клеточное энергетическое состояние низкое, стимуляция mTOR аминокислотами предотвращается активацией АМФ-зависимой протеинкиназы.Аминокислотно-зависимая передача сигналов также способствует выработке инсулина β -клетками. Это еще больше усиливает анаболические свойства аминокислот. Сделан вывод, что аминокислоты являются важными регуляторами основных метаболических путей.
Хотя аминокислоты являются субстратами для синтеза множества азотсодержащих соединений, с годами становится все более и более очевидным, что эти питательные вещества также чрезвычайно важны как регуляторы потоков через основные метаболические пути. В этом кратком обзоре данное положение проиллюстрировано несколькими примерами, а также освещены некоторые важные недавние разработки.
В этом кратком обзоре данное положение проиллюстрировано несколькими примерами, а также освещены некоторые важные недавние разработки.
Примеры аминокислот в качестве регуляторов метаболизма
Типичным примером контроля метаболизма аминокислотами является ингибирование пируваткиназы L-типа аланином. Считается, что это имеет значение при голодании, поскольку этот регуляторный механизм, в дополнение к другим механизмам, помогает предотвратить одновременное протекание глюконеогенеза и гликолиза в гепатоцитах.
Другим известным примером является каталитическая роль глутамата и аспартата в опосредовании переноса восстанавливающих эквивалентов через митохондриальную мембрану посредством малатно-аспартатного челнока (1), например, во время аэробного гликолиза в сердце, скелетных мышцах и головном мозге, а также во время окисление этанола в печени. Действие окислительно-восстановительного челнока является однонаправленным, против направления разности окислительно-восстановительных потенциалов на митохондриальной мембране из-за свойств транслокатора глутамата / аспартата. Эта транспортная система обеспечивает отток отрицательно заряженного аспартата из митохондрий в обмен на одну молекулу глутамата и протон, который отбирается из митохондриального протонного градиента, генерируемого дыхательной цепью (2,3).
Эта транспортная система обеспечивает отток отрицательно заряженного аспартата из митохондрий в обмен на одну молекулу глутамата и протон, который отбирается из митохондриального протонного градиента, генерируемого дыхательной цепью (2,3).
Третий пример регуляции метаболизма аминокислотами лежит в основе катаболизма аминокислот, т. е. в синтезе мочевины (4). Хотя две N-донорные молекулы для синтеза одной молекулы мочевины, аммиака и аспартата образуются в результате деградации аминокислоты с глутаматом в качестве промежуточного продукта, в большинстве учебников игнорируется тот факт, что глутамат также является субстратом для синтеза N-ацетилглутамата в организме. митохондрии, основной активатор карбамоилфосфатсинтазы.Примечательно, что помимо роли компонента орнитинового цикла, аргинин ускоряет синтез N-ацетилглутамата, так как после поступления в митохондрии аргинин стимулирует активность N-ацетилглутаматсинтазы. Таким образом, увеличение запаса аминокислот в воротной вене не только увеличивает скорость продукции аммиака и аспартата для синтеза мочевины, но одновременно увеличивает активность существующих молекул карбамоилфосфатсинтазы в митохондриях.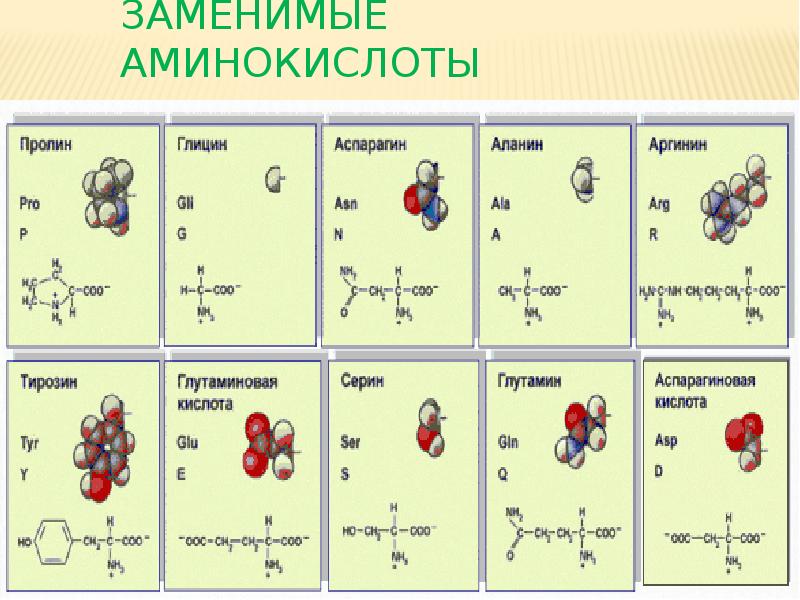 Это приводит к сигмоидальной зависимости между концентрацией аммиака в клетке печени и скоростью синтеза мочевины, что допускает большие вариации синтеза мочевины при относительно постоянных концентрациях аммиака (4).Это важно, поскольку аммиак не только токсичен для мозга, но и является важным промежуточным метаболитом.
Это приводит к сигмоидальной зависимости между концентрацией аммиака в клетке печени и скоростью синтеза мочевины, что допускает большие вариации синтеза мочевины при относительно постоянных концентрациях аммиака (4).Это важно, поскольку аммиак не только токсичен для мозга, но и является важным промежуточным метаболитом.
Четвертый и прекрасный пример регуляции метаболизма, в которой принимают участие аминокислоты, — это адаптация N-метаболизма к метаболическому ацидозу (4,5; для обзора). В этих условиях синтез мочевины снижается, чтобы сохранить бикарбонат для нейтрализации избытка протонов. В этом случае несколько механизмов управления работают одновременно. К ним относятся снижение транспорта аминокислот через плазматическую мембрану гепатоцитов, снижение синтеза N-ацетилглутамата, снижение активности карбоангидразы V (которая продуцирует CO 2 в митохондриях для карбамоилфосфатсинтазы), снижение активности печеночной глутаминазы, повышение активности синтеза глутамина в перицентральных гепатоцитах и в мышечных клетках, увеличение почечной глутаминазы (с образованием аммиака для выделения с мочой) и, наконец, усиление деградации белка в мышцах (с образованием большего количества аминокислот, которые после окисления их отрицательно заряженных карбоксилатных групп дают больше бикарбонат).
Последние разработки
Аминокислоты и изменения объема клеток.
Новый путь регуляции метаболизма аминокислотами в клетках млекопитающих был открыт более десяти лет назад, когда было обнаружено, что увеличение объема клеток, связанное либо с транспортом аминокислот, либо с метаболизмом аминокислот, оказывает инсулиноподобное воздействие на потоки через клетки млекопитающих. основные метаболические пути и что эффект может быть имитирован гипоосмотически индуцированным набуханием клеток (6-8).Представление о том, что изменения осмолярности могут влиять на метаболизм, само по себе не было новым, поскольку давно было известно, что микроорганизмы могут приспосабливаться к большим изменениям внеклеточной осмолярности за счет изменения активности ферментов и/или транспортных систем, назначение которых заключается в предотвращении большой разницы осмотического давления через клеточную мембрану (9; для обзора). Новое наблюдение, однако, заключалось в том, что тот же принцип используется клетками млекопитающих.
Новое наблюдение, однако, заключалось в том, что тот же принцип используется клетками млекопитающих.
В наших собственных исследованиях мы руководствовались старым наблюдением Katz и коллег (10), которые показали, что синтез гликогена из глюкозы в гепатоцитах зависит от присутствия аминокислот в инкубационной среде.Прошло почти 15 лет, прежде чем был разгадан механизм этого эффекта. В сотрудничестве с Baquet и Hue в Брюсселе (8; также сообщалось в ссылке 11) мы показали, что способность аминокислот стимулировать синтез гликогена в гепатоцитах связана с их способностью увеличивать объем клеток. Этот результат позже был подтвержден на мышечных клетках (12). Одновременно и независимо друг от друга Häussinger и его коллеги изучили влияние набухания клеток на деградацию гликогена в перфузируемой печени и продемонстрировали, что набухание клеток ингибирует, а сокращение клеток стимулирует гликогенолиз (6,11).Эти анаболические и антикатаболические эффекты набухания клеток позже были распространены на другие метаболические пути, такие как деградация белков (13) и синтез (14), синтез жирных кислот (15–17) и окисление (18), а также на процессы, зависящие от мембранный поток, такой как аутофагия (ингибируется), экзоцитоз (стимулируется), рецептор-опосредованный эндоцитоз (стимулируется) и поток желчи (стимулируется) (19, 20; для обзора). Эти эффекты могут быть как краткосрочными, так и долгосрочными из-за изменений в транскрипции генов (19,20).Следует подчеркнуть, что анаболические эффекты набухания клеток, вызванного аминокислотами, не ограничиваются гепатоцитами, а обнаруживаются во многих различных типах клеток (19,20).
Эти эффекты могут быть как краткосрочными, так и долгосрочными из-за изменений в транскрипции генов (19,20).Следует подчеркнуть, что анаболические эффекты набухания клеток, вызванного аминокислотами, не ограничиваются гепатоцитами, а обнаруживаются во многих различных типах клеток (19,20).
Набухание клеток, вызванное аминокислотами, обусловлено концентрационным, Na + -зависимым транспортом аминокислот через плазматическую мембрану (управляемым трансмембранным градиентом Na + , например, транспортом глутамина, аланина, таурина) и внутриклеточное производство непроницаемых катаболитов, таких как глутамат и аспартат (8, 19–22).В ответ на первоначальный набухание клетки подвергаются регуляторному уменьшению объема и высвобождению KCl в попытке восстановить свой первоначальный объем (19, 20). Механизм, ответственный за стимуляцию аминокислотами синтеза гликогена из глюкозы, может, по крайней мере частично, включать снижение уровня хлорида, который деингибирует гликогенсинтазу фосфатазу, и повышение уровня внутриклеточного глутамата, который также активирует гликогенсинтазу фосфатазу (21). ). Тот же механизм может быть ответственен за стимуляцию ацетил-КоА-карбоксилазы аминокислотами с аналогичными эффектами хлорида и глутамата на протеинфосфатазу, которая опосредует дефосфорилирование ацетил-КоА-карбоксилазы (16, 17).Существуют также различия в отношении регуляции этих двух систем аминокислотами: например, лейцин, который не вызывает набухания клеток, поскольку его транспорт не связан с Na + (8), активирует активность ацетил-КоА-карбоксилазы в гепатоцитах. но не влияет на активность гликогенсинтазы (23) или на синтез гликогена (8). Однако в мышечных клетках лейцин стимулирует синтез гликогена (24).
). Тот же механизм может быть ответственен за стимуляцию ацетил-КоА-карбоксилазы аминокислотами с аналогичными эффектами хлорида и глутамата на протеинфосфатазу, которая опосредует дефосфорилирование ацетил-КоА-карбоксилазы (16, 17).Существуют также различия в отношении регуляции этих двух систем аминокислотами: например, лейцин, который не вызывает набухания клеток, поскольку его транспорт не связан с Na + (8), активирует активность ацетил-КоА-карбоксилазы в гепатоцитах. но не влияет на активность гликогенсинтазы (23) или на синтез гликогена (8). Однако в мышечных клетках лейцин стимулирует синтез гликогена (24).
Внутриклеточный глутамат также может быть ответственным за ингибирование окисления жирных кислот в результате набухания клеток, вызванного аминокислотами, поскольку он непосредственно ингибирует карнитинпальмитоилтрансферазу (18).Было высказано предположение, что продуцируемый митохондриями глутамат может действовать как внутриклеточный мессенджер, связывающий метаболизм глюкозы с секрецией инсулина β -клетками, поскольку после выхода из митохондрий глутамат накапливается в инсулинсодержащих гранулах, вызывая их набухание. и стимулирует экзоцитоз (25,26). Хотя это очень привлекательный механизм, следует подчеркнуть, что высокие концентрации глутамата в цитозоле не всегда коррелируют с высокой скоростью выработки инсулина (27).
и стимулирует экзоцитоз (25,26). Хотя это очень привлекательный механизм, следует подчеркнуть, что высокие концентрации глутамата в цитозоле не всегда коррелируют с высокой скоростью выработки инсулина (27).
Помимо этих специфических механизмов, включающих изменения концентраций хлоридов и глутамата, набухание клеток, вызванное аминокислотами, также может влиять на метаболизм посредством изменения скученности макромолекул. Из-за их высокой внутриклеточной концентрации белки часто могут находиться в непосредственной близости друг от друга, и изменения, вызванные объемом клетки, могут влиять на их взаимодействие и, таким образом, на кинетические свойства ферментов (20). В этом контексте также возможно, что цитоскелет участвует в восприятии изменений объема клеток и что это влияет на связанные с ним ферменты (19,20).Примерами ферментов, связанных с цитоскелетом, являются гликогенсинтаза (28) и ацетил-КоА-карбоксилаза (29). Было бы очень интересно выяснить, действительно ли изменения объема клеток, вызванные аминокислотами, влияют на компартментацию ферментов в цитозоле (30).
Иллюстрацией влияния набухания клеток на выработку гликогена может служить печеночная энцефалопатия, когда астроциты синтезируют и накапливают большое количество глютамина из-за повышения уровня аммиака в крови (31). В этих условиях астроциты заполнены гликогеном (32).Поскольку гликоген содержит большое количество кристаллической воды, это может дополнительно способствовать набуханию астроцитов и, следовательно, увеличению внутричерепного давления, которое наблюдается в этих условиях.
Аминокислоты, аутофагия и передача сигналов.
Поскольку взаимосвязь между аминокислотами, сигнальной трансдукцией и синтезом белка будет рассматриваться в другом месте этого выпуска, я лишь кратко осветлю основные открытия и поместлю их в исторический контекст.
Наряду с регуляцией синтеза гликогена регуляторным механизмом, который также очень интересовал нас на протяжении многих лет, является ингибирование аутофагии аминокислотами и, в связи с этим, ингибирование протеолиза.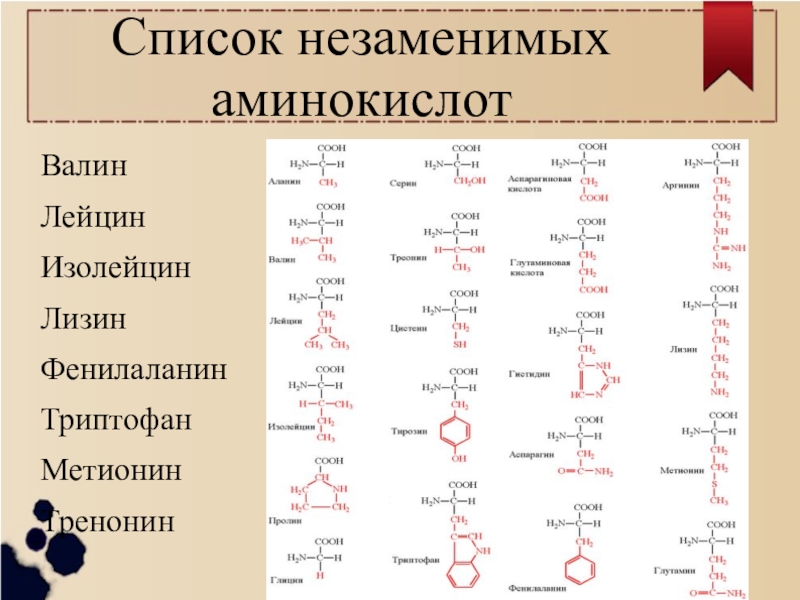 Аутофагия — очень активный процесс в печени, но он происходит во всех типах клеток. Первый этап этого сложного процесса, при котором цитоплазматический материал изолируется в аутофагосомах до слияния этих пузырьков с лизосомами, ингибируется аминокислотами (33; для обзора).Стимуляция синтеза гликогена и ингибирование аутофагии аминокислотами сильно напоминают эффекты инсулина; однако специфичность аминокислотной регуляции этих двух путей явно различна, хотя они также имеют общие элементы. Среди различных аминокислот лейцин (вместе с фенилаланином и тирозином) наиболее сильно ингибирует аутофагию (33), но, как указано выше, эта аминокислота не влияет на синтез гликогена. Хотя набухание клеток, вызванное аминокислотами, может ингибировать аутофагию само по себе (13), набухание также усиливает ингибирующий эффект низких концентраций лейцина (34).В этом контексте интересно отметить, что ранние эксперименты с перфузированными гепатоцитами в стационарных условиях показали, что низкие концентрации лейцина и аланина синергетически ингибируют аутофагический протеолиз (35).
Аутофагия — очень активный процесс в печени, но он происходит во всех типах клеток. Первый этап этого сложного процесса, при котором цитоплазматический материал изолируется в аутофагосомах до слияния этих пузырьков с лизосомами, ингибируется аминокислотами (33; для обзора).Стимуляция синтеза гликогена и ингибирование аутофагии аминокислотами сильно напоминают эффекты инсулина; однако специфичность аминокислотной регуляции этих двух путей явно различна, хотя они также имеют общие элементы. Среди различных аминокислот лейцин (вместе с фенилаланином и тирозином) наиболее сильно ингибирует аутофагию (33), но, как указано выше, эта аминокислота не влияет на синтез гликогена. Хотя набухание клеток, вызванное аминокислотами, может ингибировать аутофагию само по себе (13), набухание также усиливает ингибирующий эффект низких концентраций лейцина (34).В этом контексте интересно отметить, что ранние эксперименты с перфузированными гепатоцитами в стационарных условиях показали, что низкие концентрации лейцина и аланина синергетически ингибируют аутофагический протеолиз (35). Более того, исключение K + из перфузионной среды предотвратило ингибирование двумя аминокислотами (35). Соблазнительно заключить из этих экспериментов, что связь между опосредованным аминокислотами набуханием клеток и подавлением аутофагии есть K + .Однако не исключено также, что повышение внутриклеточного содержания хлорида было ответственно за ускорение протеолиза в этих условиях. Это может быть связано с тем, что в отсутствие внеклеточного K + насос Na + / K + будет ингибироваться, вызывая коллапс потенциала плазматической мембраны.
Более того, исключение K + из перфузионной среды предотвратило ингибирование двумя аминокислотами (35). Соблазнительно заключить из этих экспериментов, что связь между опосредованным аминокислотами набуханием клеток и подавлением аутофагии есть K + .Однако не исключено также, что повышение внутриклеточного содержания хлорида было ответственно за ускорение протеолиза в этих условиях. Это может быть связано с тем, что в отсутствие внеклеточного K + насос Na + / K + будет ингибироваться, вызывая коллапс потенциала плазматической мембраны.
Указания на то, что изменения в объеме клеток могут быть важным фактором в контроле белкового метаболизма in vivo, были предоставлены Häussinger et al. (36) и Finn et al.(37). В этих исследованиях была обнаружена четкая взаимосвязь между объемом мышечных клеток и балансом азота во всем организме у большого числа пациентов в критическом состоянии, а потеря воды мышечными клетками у этих пациентов превышала потерю белка (37).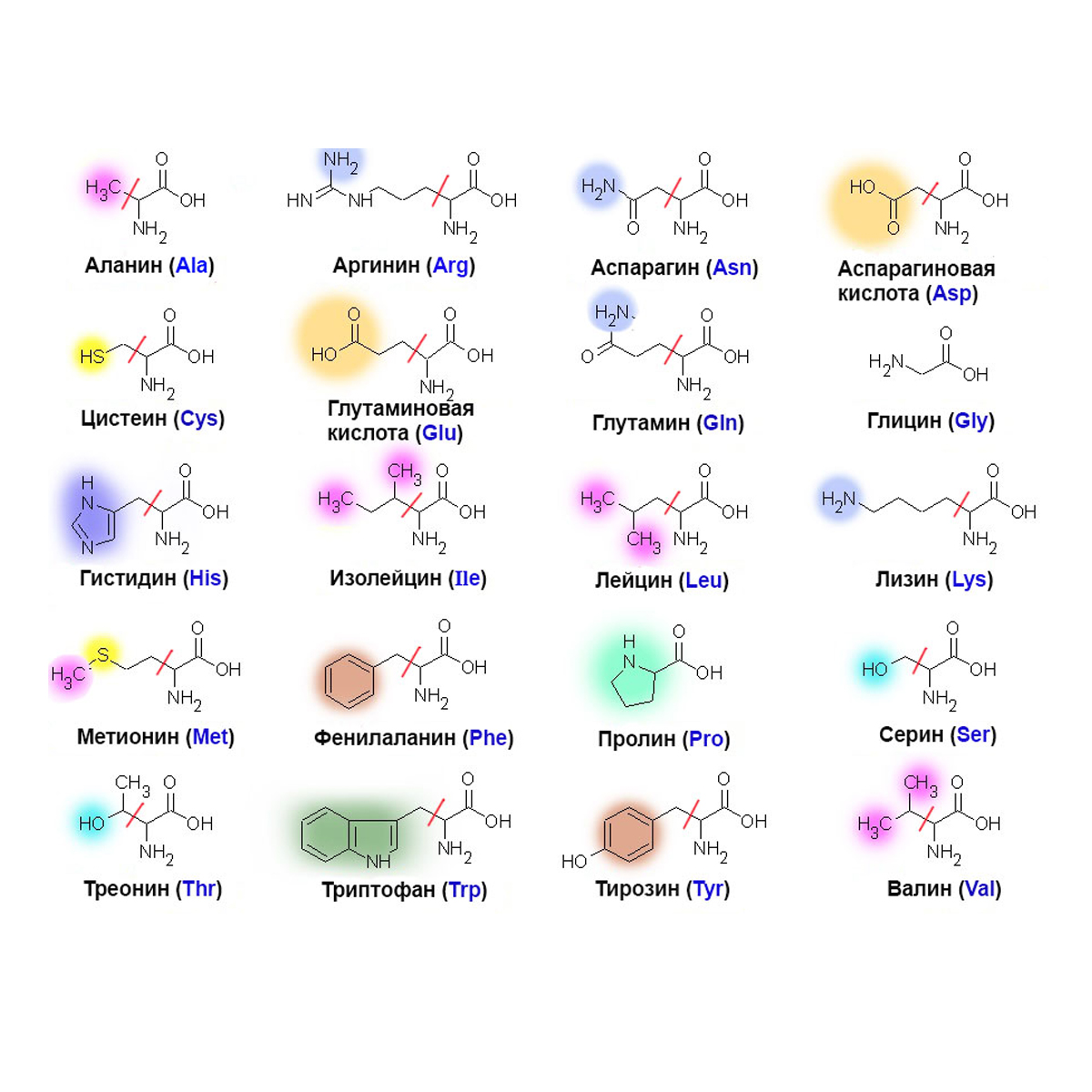 Стимуляция протеолиза за счет усадки клеток также связана с повреждением печени, вызванным консервацией на холоде, и было показано, что методы, направленные на предотвращение уменьшения объема клеток, ингибируют протеолиз и улучшают функцию трансплантата (38,39).
Стимуляция протеолиза за счет усадки клеток также связана с повреждением печени, вызванным консервацией на холоде, и было показано, что методы, направленные на предотвращение уменьшения объема клеток, ингибируют протеолиз и улучшают функцию трансплантата (38,39).
Подобно стимуляции синтеза гликогена аминокислотами, механизм, ответственный за ингибирование аутофагического протеолиза аминокислотами, оставался неясным в течение десятилетий. Хотя мы все еще далеки от понимания деталей, ключ к механизму дало наше открытие, что добавление физиологической смеси аминокислот к гепатоцитам приводит к сильному и быстрому фосфорилированию рибосомного белка S6 (40,41). Этот белок является компонентом субъединицы рибосомы 40S и является одной из конечных точек передачи сигналов инсулина; фосфорилирование S6 необходимо для трансляции класса молекул мРНК, кодирующих белки аппарата белковой трансляции (42).Однако, к нашему удивлению, инсулин сам по себе не влиял на фосфорилирование S6, но усиливал действие низких, но не высоких концентраций аминокислот. Среди различных аминокислот наиболее эффективными были лейцин в сочетании с фенилаланином и тирозином, а гипоосмотически индуцированное набухание клеток, подобно инсулину, усиливало действие низких концентраций аминокислот. В присутствии циклогексимида для предотвращения одновременного синтеза белка наблюдалась приблизительно линейная зависимость между степенью фосфорилирования S6 и процентным ингибированием аутофагического протеолиза в самых разных условиях.Стимулированное аминокислотами фосфорилирование S6 было полностью предотвращено рапамицином, что указывает на то, что серин/треониновая протеинкиназа mTOR 3 находится выше S6 в сигнальном пути аминокислоты (40,41). Более того, добавление рапамицина может частично, хотя и не полностью, преодолеть ингибирование аутофагического протеолиза аминокислотами. Объяснением частичного эффекта рапамицина может быть то, что лейцин также является ингибитором лизосомальной протонной помпы (43). Мы пришли к выводу, что один и тот же сигнальный механизм участвует в противоположном контроле синтеза белка (стимуляция аминокислотно-зависимой передачей сигналов) и белковой деградации (ингибирование аминокислотозависимой передачей сигналов), что было бы эффективным с точки зрения регуляции метаболизма.
Среди различных аминокислот наиболее эффективными были лейцин в сочетании с фенилаланином и тирозином, а гипоосмотически индуцированное набухание клеток, подобно инсулину, усиливало действие низких концентраций аминокислот. В присутствии циклогексимида для предотвращения одновременного синтеза белка наблюдалась приблизительно линейная зависимость между степенью фосфорилирования S6 и процентным ингибированием аутофагического протеолиза в самых разных условиях.Стимулированное аминокислотами фосфорилирование S6 было полностью предотвращено рапамицином, что указывает на то, что серин/треониновая протеинкиназа mTOR 3 находится выше S6 в сигнальном пути аминокислоты (40,41). Более того, добавление рапамицина может частично, хотя и не полностью, преодолеть ингибирование аутофагического протеолиза аминокислотами. Объяснением частичного эффекта рапамицина может быть то, что лейцин также является ингибитором лизосомальной протонной помпы (43). Мы пришли к выводу, что один и тот же сигнальный механизм участвует в противоположном контроле синтеза белка (стимуляция аминокислотно-зависимой передачей сигналов) и белковой деградации (ингибирование аминокислотозависимой передачей сигналов), что было бы эффективным с точки зрения регуляции метаболизма.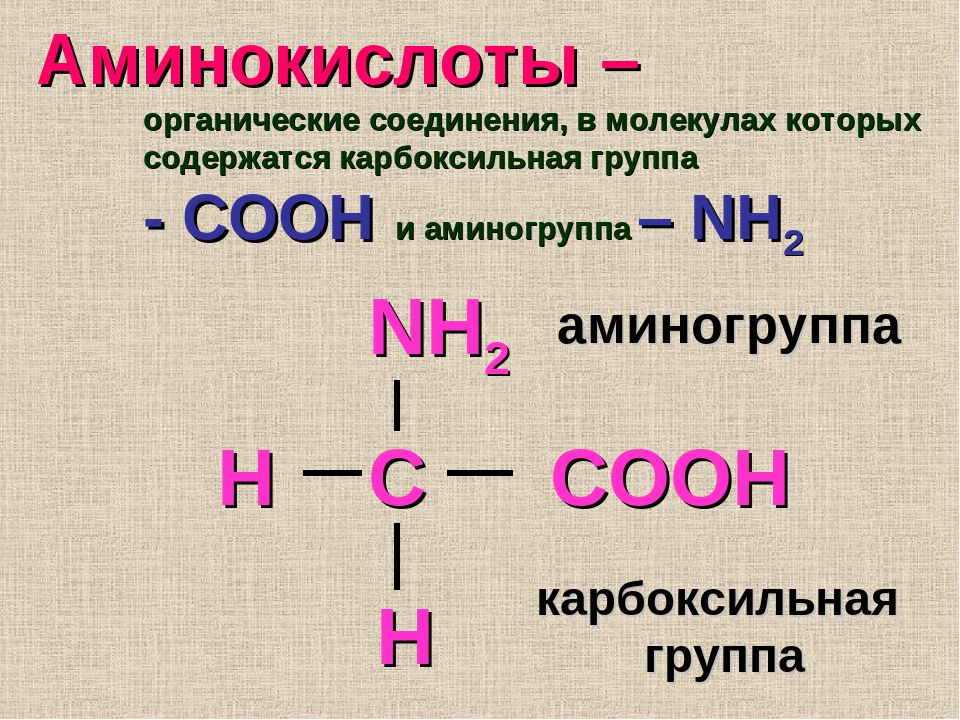 (41).Интересно, что рапамицин также стимулировал аутофагию в дрожжевых клетках в условиях, богатых питательными веществами (44), что указывает на сохранение этого механизма контроля в эволюции.
(41).Интересно, что рапамицин также стимулировал аутофагию в дрожжевых клетках в условиях, богатых питательными веществами (44), что указывает на сохранение этого механизма контроля в эволюции.
После этих первоначальных наблюдений было описано возникновение зависимой от аминокислот передачи сигналов (с лейцином в качестве наиболее активной аминокислоты) для многих типов клеток, и был подтвержден синергизм между инсулином и аминокислотами в отношении их влияния на состояние фосфорилирования. нижестоящих мишеней mTOR, включая киназу p70S6 (киназа S6 70 кДа), 4E-BP (фактор инициации трансляции эукариотических белков, 4E-связывающий белок-1) и другие белки (45, 46; для обзора).
Существует общее мнение, что аминокислоты не влияют на протеинкиназу В, в отличие от действия инсулина. До сих пор ведутся дискуссии о том, влияют ли аминокислоты на PI 3-киназу (фосфатидилинозитол 3-киназу). Путаница заключается в том, что индуцированное аминокислотами фосфорилирование нижестоящих мишеней mTOR предотвращается ингибиторами PI-3-киназы (33,45), но успешные попытки продемонстрировать активацию PI-3-киназы в присутствии аминокислот были немногочисленными и много неудачных попыток (45). Как подробно обсуждалось в другом месте (47), PI-3-киназа может находиться на пути, параллельном пути аминокислот, и активация как PI-3-киназы (инсулином), так и mTOR необходима для полной активации по крайней мере некоторых из них. нижестоящие мишени mTOR, такие как киназа p70S6 (48,49).
Как подробно обсуждалось в другом месте (47), PI-3-киназа может находиться на пути, параллельном пути аминокислот, и активация как PI-3-киназы (инсулином), так и mTOR необходима для полной активации по крайней мере некоторых из них. нижестоящие мишени mTOR, такие как киназа p70S6 (48,49).
Независимо от того, способны ли аминокислоты повышать активность PI-3-киназы, аномальное ингибирование аутофагии ингибиторами PI-3-киназы привело нас к гипотезе о том, что PI3-киназа класса III может иметь важное значение для аутофагии (33,50). .Эта липидкиназа продуцирует PI(3)P конститутивно, в отличие от PI3-киназы класса I, которая стимулируется инсулином для продукции PI(3,4,5)P 3 . В настоящее время имеются убедительные доказательства того, что PI(3)P действительно является важным компонентом аутофагической системы (51–53). В этом контексте интересно отметить, что 3-метиладенин, классический ингибитор аутофагии, оказался ингибитором PI-3-киназы (50).
Пока неясно, как аминокислоты влияют на mTOR-опосредованную передачу сигналов. Хотя наличие рецептора аминокислот на плазматической мембране было постулировано (54), недавние данные указывают на то, что необходим транспорт аминокислот через плазматическую мембрану, прежде чем аминокислоты смогут активировать mTOR (55).Привлекательный механизм включает ингибирование протеинфосфатазы аминокислотами, что объясняет синергизм между аминокислотами и инсулином (45,46; для обзора). Однако эксперименты с ингибиторами протеинфосфатазы не всегда были окончательными (47; для обзора). По самым последним данным Krause et al. (56) в сигнальном пути аминокислот присутствуют две протеинфосфатазы. Одна протеинфосфатаза расположена выше mTOR и может быть идентична глутамат-активируемой протеинфосфатазе, которая также отвечает за активацию ацетил-КоА-карбоксилазы (17) (см. выше).Вторая протеинфосфатаза расположена ниже mTOR, инактивирует киназу p70S6 и ингибируется при активации mTOR (Fig. 1). Существование двух протеинфосфатаз могло бы объяснить расхождения в результатах, полученных в литературе с ингибиторами протеинфосфатазы, потому что результат таких экспериментов зависел бы от используемого экспериментального протокола, т.
Хотя наличие рецептора аминокислот на плазматической мембране было постулировано (54), недавние данные указывают на то, что необходим транспорт аминокислот через плазматическую мембрану, прежде чем аминокислоты смогут активировать mTOR (55).Привлекательный механизм включает ингибирование протеинфосфатазы аминокислотами, что объясняет синергизм между аминокислотами и инсулином (45,46; для обзора). Однако эксперименты с ингибиторами протеинфосфатазы не всегда были окончательными (47; для обзора). По самым последним данным Krause et al. (56) в сигнальном пути аминокислот присутствуют две протеинфосфатазы. Одна протеинфосфатаза расположена выше mTOR и может быть идентична глутамат-активируемой протеинфосфатазе, которая также отвечает за активацию ацетил-КоА-карбоксилазы (17) (см. выше).Вторая протеинфосфатаза расположена ниже mTOR, инактивирует киназу p70S6 и ингибируется при активации mTOR (Fig. 1). Существование двух протеинфосфатаз могло бы объяснить расхождения в результатах, полученных в литературе с ингибиторами протеинфосфатазы, потому что результат таких экспериментов зависел бы от используемого экспериментального протокола, т.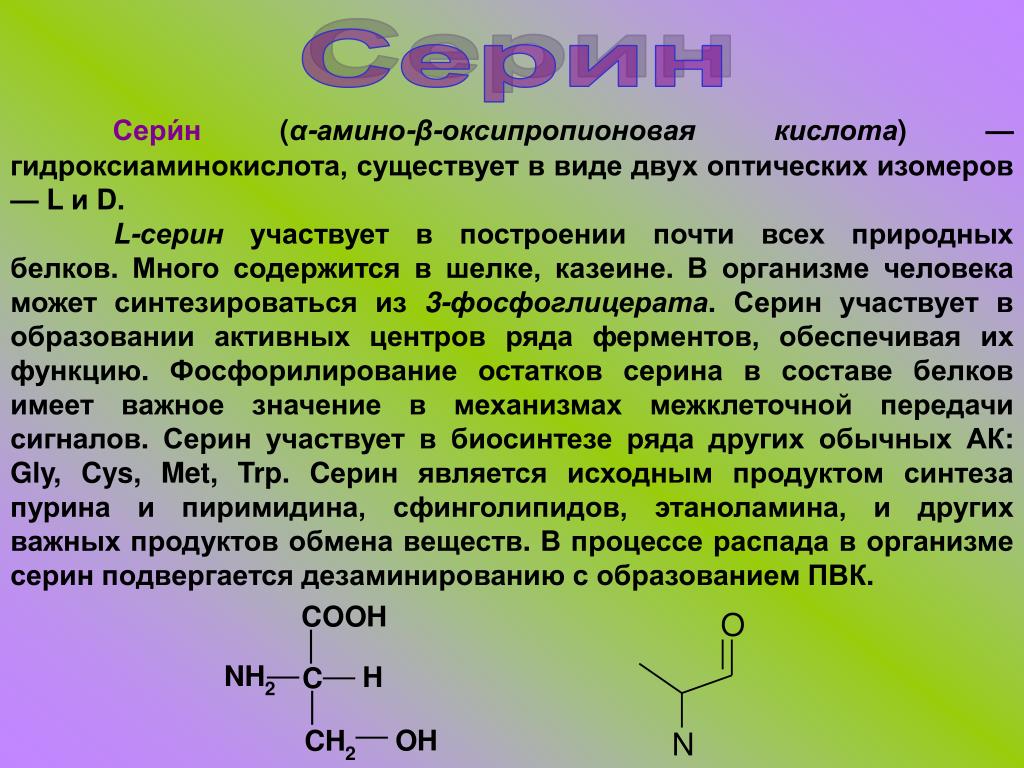 е. от того, был ли ингибитор протеинфосфатазы добавлен до или после воздействия. клеток на аминокислоты (56).
е. от того, был ли ингибитор протеинфосфатазы добавлен до или после воздействия. клеток на аминокислоты (56).
РИСУНОК 1
Аминокислоты как регуляторы метаболизма. Схема представляет собой композицию данных, обсуждаемых в этой статье и в (47). Часть схемы, относящаяся к активируемой глутаматом протеинфосфатазе, была взята из Krause et al. (56). Сокращения: ИР, инсулиновый рецептор; IRS, субстрат рецептора инсулина; PI3K, фосфатидилинозитол-3-киназа; PI3P, фосфатидилинозитол-3-фосфат; PI45P 2 , фосфатидилинозитол-4,5-бисфосфат; PI345P 3 , фосфатидилинозитол-3,4,5-трифосфат; PDK1, фосфоинозитид-зависимая киназа 1; PKB, протеинкиназа B; АК, аминокислоты; РВД, снижение нормативного объема; GS, гликогенсинтаза; АСС, ацетилКоА-карбоксилаза; AMPK, AMP-активируемая протеинкиназа; pH lys , внутрилизосомальный pH; РР2А, протеинфосфатаза 2А; GAPP, глутамат-активируемая протеинфосфатаза; АА-тРНК, аминоацил-трансферРНК.
РИСУНОК 1
Аминокислоты как регуляторы метаболизма.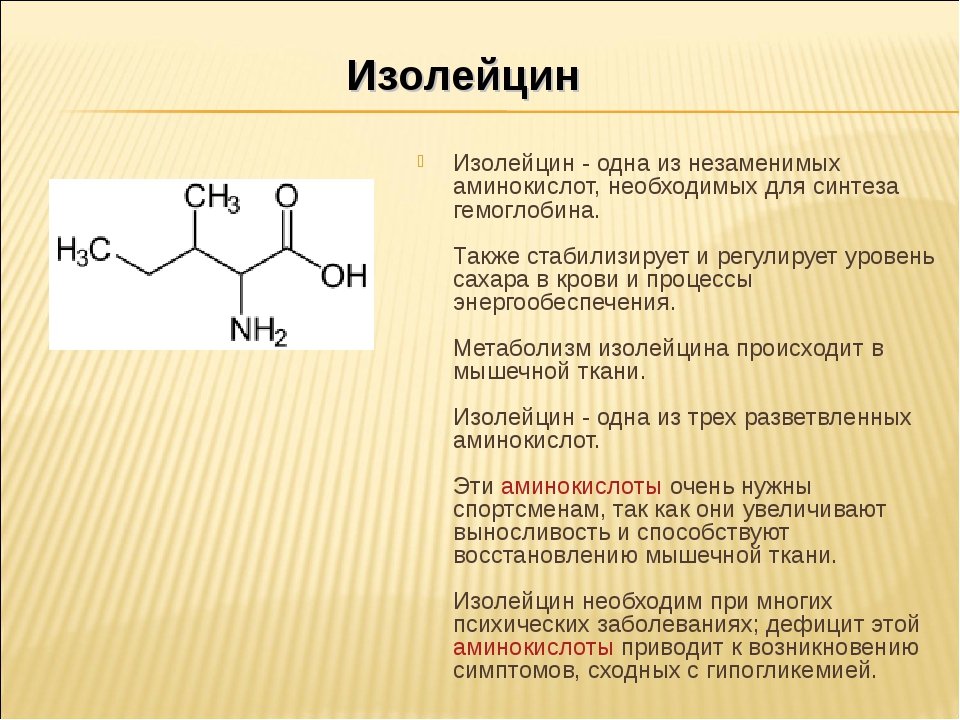 Схема представляет собой композицию данных, обсуждаемых в этой статье и в (47). Часть схемы, относящаяся к активируемой глутаматом протеинфосфатазе, была взята из Krause et al. (56). Сокращения: ИР, инсулиновый рецептор; IRS, субстрат рецептора инсулина; PI3K, фосфатидилинозитол-3-киназа; PI3P, фосфатидилинозитол-3-фосфат; PI45P 2 , фосфатидилинозитол-4,5-бисфосфат; PI345P 3 , фосфатидилинозитол-3,4,5-трифосфат; PDK1, фосфоинозитид-зависимая киназа 1; PKB, протеинкиназа B; АК, аминокислоты; РВД, снижение нормативного объема; GS, гликогенсинтаза; АСС, ацетилКоА-карбоксилаза; AMPK, AMP-активируемая протеинкиназа; pH lys , внутрилизосомальный pH; РР2А, протеинфосфатаза 2А; GAPP, глутамат-активируемая протеинфосфатаза; АА-тРНК, аминоацил-трансферРНК.
Схема представляет собой композицию данных, обсуждаемых в этой статье и в (47). Часть схемы, относящаяся к активируемой глутаматом протеинфосфатазе, была взята из Krause et al. (56). Сокращения: ИР, инсулиновый рецептор; IRS, субстрат рецептора инсулина; PI3K, фосфатидилинозитол-3-киназа; PI3P, фосфатидилинозитол-3-фосфат; PI45P 2 , фосфатидилинозитол-4,5-бисфосфат; PI345P 3 , фосфатидилинозитол-3,4,5-трифосфат; PDK1, фосфоинозитид-зависимая киназа 1; PKB, протеинкиназа B; АК, аминокислоты; РВД, снижение нормативного объема; GS, гликогенсинтаза; АСС, ацетилКоА-карбоксилаза; AMPK, AMP-активируемая протеинкиназа; pH lys , внутрилизосомальный pH; РР2А, протеинфосфатаза 2А; GAPP, глутамат-активируемая протеинфосфатаза; АА-тРНК, аминоацил-трансферРНК.
Было также высказано предположение, что внутриклеточный белок-рецептор аминокислот определяет уровень свободной от аминокислот тРНК (45, 47, 57), по аналогии с ситуацией у дрожжей, но опять же доказательства неубедительны (58, 59). ). Тем не менее, свободная от аминокислот тРНК в качестве сигнала аминокислотного голодания могла бы быть привлекательным механизмом для объяснения потенцирования передачи сигналов аминокислот за счет набухания клеток. Ионы хлора ингибируют аминоацил-тРНК-синтетазы, и падение содержания хлорида в цитозоле, сопровождающее уменьшение регуляторного объема, в этом случае активирует эти ферменты (45).
). Тем не менее, свободная от аминокислот тРНК в качестве сигнала аминокислотного голодания могла бы быть привлекательным механизмом для объяснения потенцирования передачи сигналов аминокислот за счет набухания клеток. Ионы хлора ингибируют аминоацил-тРНК-синтетазы, и падение содержания хлорида в цитозоле, сопровождающее уменьшение регуляторного объема, в этом случае активирует эти ферменты (45).
Помимо того факта, что аминокислотозависимая передача сигнала чувствительна к рапамицину, существуют также прямые доказательства того, что аминокислоты могут повышать фосфорилирование mTOR и/или активность mTOR в интактных клетках (60,61). Недавно обнаруженный белок raptor, регуляторный белок, связанный с mTOR (отсюда и его название) и необходимый для активности киназы mTOR, может быть частью механизма восприятия аминокислот (62,63).
Интересной новой разработкой является открытие того, что mTOR определяет не только внутриклеточную концентрацию аминокислот, но и концентрацию АТФ (59). Предположительно, AMP-киназа является частью сенсорного механизма, поскольку активация этой протеинкиназы сильно ингибирует аминокислотно-зависимую передачу сигналов (56, 64–66) и синтез белка (64, 65).
Предположительно, AMP-киназа является частью сенсорного механизма, поскольку активация этой протеинкиназы сильно ингибирует аминокислотно-зависимую передачу сигналов (56, 64–66) и синтез белка (64, 65).
Понижающая регуляция передачи сигналов инсулина за счет передачи сигналов, зависящих от аминокислот.
Несмотря на то, что аминокислоты и инсулин действуют синергически в активации нижестоящих мишеней mTOR, появляется все больше доказательств того, что в мышечных клетках, адипоцитах и клетках гепатомы аминокислоты вызывают чувствительное к рапамицину подавление индуцированной инсулином активации PI-3-киназы. , протеинкиназы B и транспорта глюкозы (67–71).Это вызвано повышенным ser/thr фосфорилированием IRS-1 (субстрат инсулинового рецептора-1), снижением связывания регуляторной субъединицы р85 PI-3-киназы с IRS-1 с последующей (предположительно протеасомной) деградацией IRS-1. 68,69). Поскольку индуцированное аминокислотами подавление IRS-1 вызывает ингибирование транспорта глюкозы (см. выше), этот механизм может лежать в основе сниженного потребления глюкозы при кормлении с высоким содержанием белка (67, 68).
выше), этот механизм может лежать в основе сниженного потребления глюкозы при кормлении с высоким содержанием белка (67, 68).
Таким образом, оказывается, что аминокислоты и инсулин действуют синергично в отношении активации mTOR и его нижестоящих мишеней и, таким образом, влияют на белковый метаболизм; тем не менее, аминокислоты, по-видимому, ингибируют начальную часть сигнального пути инсулина.Известно, что эта часть контролирует транспорт и метаболизм глюкозы (67,72). Как ни парадоксально, но аминокислоты стимулируют превращение глюкозы в гликоген. Хотя это сбивает с толку, парадокс может быть разрешен различиями в специфичности аминокислот. Лейцин особенно эффективен в активации mTOR-зависимой передачи сигналов и подавлении метаболизма глюкозы, тогда как аминокислоты, увеличивающие объем клеток (например, глутамин, аланин), стимулируют синтез гликогена. Интересно, что кормление рыбным белком защищает от непереносимости глюкозы и резистентности к инсулину, вызванных диетой с высоким содержанием жиров, а концентрации лейцина, тирозина и некоторых других аминокислот в плазме были значительно ниже у крыс, получавших белок трески, по сравнению с крысами, получавшими казеин (68). ; и ссылки в нем).
; и ссылки в нем).
Передача сигналов аминокислот и продукция инсулина в
β -клетках. Интересным наблюдением является то, что передача сигналов аминокислот также происходит в β -клетках и способствует выработке инсулина путем стимуляции пролиферации β -клеток (73-75). Это еще больше усиливает анаболические свойства аминокислот. Также в этих клетках лейцин эффективно стимулирует фосфорилирование нижестоящих мишеней mTOR. Возможно, не случайно в β -клетках комбинация глутамина и лейцина очень эффективно стимулирует как передачу сигналов (74) (как это происходит в гепатоцитах (23)) так и выработку инсулина (27).Как отмечалось ранее, набухание клеток синергизируется с лейцином в отношении mTOR-зависимой передачи сигналов, а глутамин способен вызывать набухание клеток. В прошлом влияние лейцина на выработку инсулина приписывалось его способности активировать глутаматдегидрогеназу и, таким образом, обеспечивать промежуточные продукты цикла лимонной кислоты и увеличивать выработку митохондриального АТФ (27,74). Интересно, что ингибирование митохондриальной продукции АТФ нарушало сигнальный путь (74). Хотя общий уровень АТФ не изменился (74), возможно, что в этих условиях повышен уровень АМФ и что за это наблюдение могла быть ответственна активация киназы АМФ.Неудивительно, если часть стимуляции продукции инсулина глюкозой была вызвана снижением активности AMP киназы (76), что приводит к активации зависимой от аминокислот передачи сигналов в β -клетках. С этой точки зрения, правильное функционирование малат-аспартатного челнока в β -клетках (77) также может способствовать поддержанию низкой активности АМФ киназы. Хотя это все еще гипотетически, это интригующие возможности, которые заслуживают изучения.
Интересно, что ингибирование митохондриальной продукции АТФ нарушало сигнальный путь (74). Хотя общий уровень АТФ не изменился (74), возможно, что в этих условиях повышен уровень АМФ и что за это наблюдение могла быть ответственна активация киназы АМФ.Неудивительно, если часть стимуляции продукции инсулина глюкозой была вызвана снижением активности AMP киназы (76), что приводит к активации зависимой от аминокислот передачи сигналов в β -клетках. С этой точки зрения, правильное функционирование малат-аспартатного челнока в β -клетках (77) также может способствовать поддержанию низкой активности АМФ киназы. Хотя это все еще гипотетически, это интригующие возможности, которые заслуживают изучения.
Заключительные замечания
Из предыдущего обсуждения ясно, что аминокислоты, помимо их роли в качестве промежуточных метаболитов, являются важными анаболическими сигналами.Механизмы основаны на способности некоторых аминокислот вызывать набухание клеток (например, глютамина и аланина) и на способности других аминокислот (в частности, лейцина) имитировать некоторые, но не все эффекты инсулина на передачу сигналов. см. рис. 1 для сводки). Способность стимулировать передачу сигналов и выработку инсулина в клетках поджелудочной железы β дополнительно усиливает анаболические свойства аминокислот.
см. рис. 1 для сводки). Способность стимулировать передачу сигналов и выработку инсулина в клетках поджелудочной железы β дополнительно усиливает анаболические свойства аминокислот.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1.Мейер
,А.J.
&van Dam
,K.
(1974
)Метаболическое значение транспорта анионов в митохондриях
.Биохим. Биофиз. Acta
346
:213
–244
.2.Lanoue
,K. F.
,K. F.
,Meijer
,A. J.
&Brouwer
,A.
(1974
)Доказательства электрогенного аспартата транспортировки в крысиной печени Mitochondria
.Арх. Биохим. Биофиз.
161
:544
–550
.3.Palmieri
,L.
,PARDO
,B.
,Lasorsa
,FM
,DEL ARCO
,A.
,Kobayashi
,K.
,IIJIMA
, М.
Рансуик
,МДж
,Уокер
,ДЖЕ
,Сахеки
,Т.
,Дж. 9005 , 0005 9004 Сатрустегуи 90.
иPalmieri
,F.
(2001
)Цитрин и аралар1 являются Са(2+)-стимулируемыми транспортерами аспартата/глутамата в митохондриях
.EMBO J.
20
:5060
–5069
.4.Meijer
,A. J.
,A. J.
,L. J.
,W. H.
иChamulaue
,R. A. F. M.
(R. A. F. M.
(1990
)азотный метаболизм азота и функция орнитина
.Физиол.
70
:701
–748
.5.Häussger
,D.
,GEROK
,W.
&,
W.
&Sies
,H.
(1984
)Печеночная роль в регулировании pH: Роль межклеточного цикла глутамина
.Тренды Биохим. науч.
9
:300
–302
.6.Lang
,F.
,Stehle
, T.
Häussinger
,D.
(1989
)Вода, K + , H + , потоки лактата и глюкозы 5 во время регуляции объема клеток печени 9.0 крыса 0
Арка Пфлюгера.
413
:209
–216
.7.Häussinger
,D.
иLang
,F.
(1991
)Объем клеток в регуляции функции печени: механизм метаболического контроля.
Биохим. Биофиз. Acta
1071
:331
–350
.8.Baque
,A.
,оттенок
,Л.
,Meijer
,AJ
,VAN WOERKOM
,GM
&PLOMP
,PJ
(1990
)Набухание гепатоцитов крысы стимулирует синтез гликогена
.Дж. Биол. хим.
265
:955
–959
.9.Csonka
,L. N.
(1989
)Физиологические и генетические реакции бактерий на осмотический стресс
.Микробиолог.
53
:121
–147
. 10.
10.KATZ
,J.
,Golden
,S.
&Wals
,P. A.
(P. A.
(1976
)Стимуляция синтеза гликогена печени на аминокислоты
.Проц. Натл. акад.науч. США
73
:3433
–3437
.11.Häussinger
,D.
иLang
,F.
(1990
)Взаимодействие объема клетки и функции клетки. Тезисы симпозиума в Муттерсе, Австрия, февраль 1990 г.
.Рен. Физиол. Биохим.
13
:162
–179
.12.Низкий
,С.Ю.
,Ренни
,М.Дж.
иТейлор
,П.M.
(1996
)Модуляция синтеза гликогена в скелетных мышцах крыс путем изменения объема клеток
.J. Physiol.
495
:299
–303
.13.HallBroucker
,C.
,VOM DAHL
,S.
,,S.
,Lang
,F.
&Häussger
,D.
(1991
) Контроль печеночного протеаса амино кислоты. Роль клетки объемом
Роль клетки объемом
евро. Дж. Биохим.
197
:717
–724
.14.Stoll
,B.
,Gerok
,W.
,Lang
,F.
&Häussger
,D.
(1992
)Громкость клеток печени и синтез белка
.Биохим. J.
287
:217
–222
.15.Baquet
,A.
,Maisin
,L.
иОттенок
,L.
(1991
)Отек гепатоцитов крысы активирует ацетил-КоА-карбоксилазу параллельно с гликогенсинтазой
.Биохим. J.
278
:887
–890
.16.Baque
,A.
,Gaussin
,V.
,Bollen
,м.
,Сталманы
,Вт
иоттенок
,Л.
(1993
)Механизм активации ацетил-КоА-карбоксилазы печени путем набухания клеток
.евро. Дж. Биохим.
217
:1083
–1089
.17.Gaussin
, V.
оттенок
,Л.
,Сталманы
,W.
&BOOLLEN
,М.
(млн.
(1996
)Активация печеночной ацетил-COA COA CARBOXYLASE глутаматом и Mg2+ опосредуется протеинфосфатазой-2A
.Биохим. J.
316
:217
–224
.18.Гусман
,М.
,Velasco
,G.
,Castro
,J.
&Zammit
,V. A.
(V. A.
(1994
)Ингибирование карнитина Palmitoyltransferase I Hepatocyte набухание
.ФЭБС Письмо.
344
:239
–241
.19.Häussinger
,D.
(1996
)Роль гидратации клеток в регуляции функции клеток
.Биохим.J.
313
:697
–710
.20.Lang
,F.
,Busch
,GL
,Ritter
,м.
,Völkl
,H.
,Waldegger
,S.
,Gulbins
, E.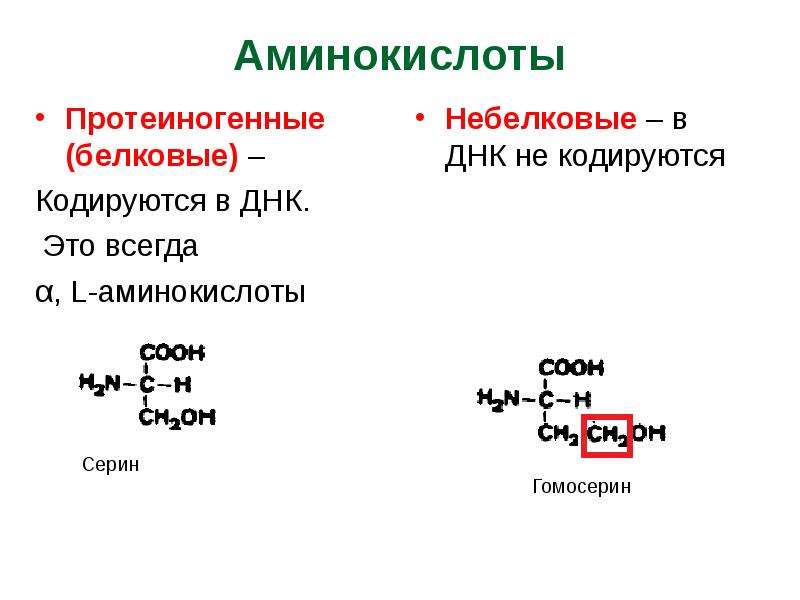
Häussinger
,D.
(1998
)Функциональное значение механизмов регуляции клеточного объема
.Физиол.
78
:247
–306
.21.Meijer
,AJ
,Baque
,A.
,Gustafson
,La
,VAN WOERKOM
,GM
&HUE
,L.
(1992
)Механизм активации гликогенсинтазы печени путем отека
.Дж. Биол. хим.
267
:5823
–5828
.22.Hansen
,S.H.
(2001
)Роль таурина в диабете и развитии диабетических осложнений
.Диабет Метаб. Res Rev.
17
:330
–346
.23.KRAUSE
,U.
,BERTRAND
,Л.
,Maisin
,L.
,ROSA
,М.
иоттенок
,Л.
(2002
)Сигнальные пути и комбинированные эффекты инсулина и аминокислот в изолированных гепатоцитах крысы
.
евро. Дж. Биохим.
269
:3742
–3750
.24.ARMSTRONG
,JL
,BONAVAUD
,SM
,,
SM
,TOOLE
,BJ
&YEAMAN
,SJ
(SJ
(2001
)Регуляция синтеза гликогена на аминокислоты в культуре мышечные клетки человека
.Дж. Биол. хим.
276
:952
–956
.25.Maechler
,P.
&Wollheim
,C. B.
(1999
)Природа
402
:685
–689
.26.RUBI
,B.
,ISHIHARA
,H.
,,H.
,Hegardt
,FG
,Wollheim
,CB
&Maechler
,P.
(2001
)Опосредованное GAD65 декарбоксилирование глутамата снижает стимулированную глюкозой секрецию инсулина в бета-клетках поджелудочной железы
.Дж. Биол. хим.
276
:36391
–36396
. 27.
27.MacDonald
,M. J.
иFahien
,L. A.
(2000
)Глутамат не является мессенджером in05 .
Дж. Биол. хим.
275
:34025
–34027
.28.Fernandez-Novell
,JM
,Bellido
,D.
,Vilaro
,,
VILALO
,S.
,JJ
(JJ
(1997
)Глюкоза индуцирует транслокацию гликогена синтазы в кору клеток гепатоцитов крысы
.Биохим. J.
321
:227
–231
.29.Geelen
,MJ
,Bijleveld
,C.
,Velasco
,G.
,,
G.
,,
,RJ
&Guzmán
,м.
(1997
)Исследования внутриклеточной локализации ацетил-КоА-карбоксилазы
.Биохим. Биофиз. Рез. коммун.
233
:253
–257
.30.Meijer
,A. J.
(2002
)Компартментация глюкозо-6-фосфата и контроль синтеза гликогена
.
Ж. Гепатол.
37
:417
–418
.31.Willard-Mack
,CL
,Koeher
,RC
,Hirata
,T.
,,
,
LC
,Takahashi
,H.
,Traystman
,Р.J.
иBrusilow
,S. W.
(1996
)Ингибирование глутаминсинтетазы уменьшает вызванное аммиаком набухание астроцитов у крыс
.Неврология
71
:589
–599
.32.Conn
,H. O.
&Lieberthal
,M. M.
(1979
)Патология порто-системной энцефалопатии5
. В:
Печеночный синдром и лактулоза.
стр.37
–45
.Williams & Wilkins
,Балтимор, Мэриленд
.33.BlommaArt
,
E. F. C.
,Luiken
,J. J. F. P.
&Meijer
,A. J.
(1997
)Автофагический протеолиза: контроль и специфика
.Гистохим. J.
29
:365
–385
. 34.
34.Мейер
,А. Дж.
,Густафсон
,Л.A.
,LUIKEN
,JJFP
,BLOMMAART
,PJ
,CARO
,LHP
,VAN WOERKOM
,GM
,SPRONK
,C.
&BOON
,L.
(1993
)Набухание клеток и чувствительность аутофагического протеолиза к ингибированию аминокислотами в изолированных гепатоцитах крысы
.евро. Дж. Биохим.
215
:449
–454
.35.Leverve
,X. M.
,X. M.
,CARO
,L. H.
,Plomp
,P. J. A. M.
,P. J. A. M.
&Meijer
,A. J.
(19875)
Контроль протеолиза в периферийных крысах гепатоцитов
.ФЭБС Письмо.
219
:455
–458
.36.Häussinger
,D.
,Roth
,E.
,Lang
,F.
иGerok
,W.
(1993
)Состояние клеточной гидратации: важная детерминанта белкового катаболизма в норме и при болезни
.
Ланцет
341
:1330
–1332
.37.FINN
,PJ
,PLANK
,LD
,CLARK
,мА
,,
мА
,Connolly
,AB
&Hill
,GL
(1996
)Прогрессивная клеточная дегидратация и протеолиз у пациентов в критическом состоянии
.Ланцет
347
:654
–656
.38.neveux
,N.
,de Bandt
,JP
,Charrueau
,C.
,Savier
,E.
,Chaumeil
,JC
,Hannoun
,Л.
,Гибоудо
,J.
&Cynober
,La
,La
(1997
)Удаление гидроксиэтилстарха из Университета раствора Висконсина вызывает усадку клеток и протеолиз во время и после холодного хранения крысиной печени
.Гепатология
25
:678
–682
.39.neveux
,N.
,de Bandt
,JP
,FATTAL
, E.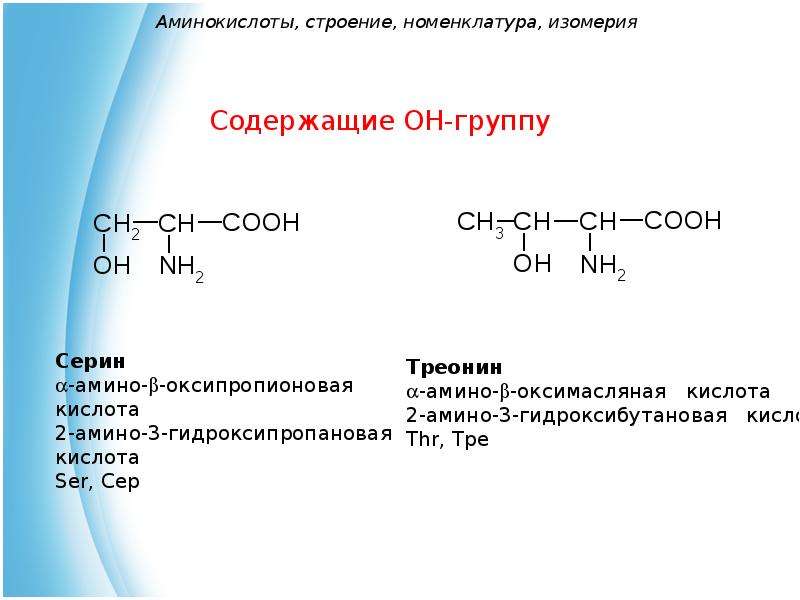
HANNOUN
,L.
,POUPON
,R
,CHAUMEIL
,JC
,DELATTRE
,J.
&Cynober
,Л.
(2000
)Травма холодной консервации у крыс печень: эффект липосомно захваченного аденозинфинфосфата
.Гепатология
33
:68
–75
.40.LUIKEN
,JJFP
,BLOMMAART
,EFC
,BOON
,L.
,VAN WOERKOM
,GM
&MEIJER
,AJ
(1994
) Экинг клеток и контроль аутофагического протеолиза в гепатоцитах: участие фосфорилирования рибосомного белка S6?Биохим. соц. Транс.
22
:508
–511
.41.BLOMMAART
,EFC
,LUIKEN
,JJFP
,BLOMMAART
,PJ
,VAN WOERKOM
,GM
&MEIJER
,AJ
(1995
)Фосфориляция рибосомальный белок S6 ингибирует аутофагию в изолированных гепатоцитах крысы
.
Дж. Биол. хим.
270
:2320
–2326
.42.Dufner
,A.
иThomas
,G.
(1999
)Передача сигналов рибосомальной киназы S6 и контроль трансляции.
Экспл. Сотовый рез.
253
:100
–109
.43.Luiken
,J. J. F. P.
,Aerts
,J. M. F. G.
&Meijer
,A. J.
(1996
)Роль INTRALYSOSOMAL PH в контроле автофагического протеолитического полюбов в крысиных гепатоцитах
.евро. Дж. Биохим.
235
:564
–573
.44.Noda
,T.
иOhsumi
,Y.
(1998
)Tor, гомолог фосфатидилинозитолкиназы,
контролей аутофагилкиназы дрожжей.
Дж. Биол. хим.
273
:3963
–3966
.45.van Sluijters
,D. A.
,Dubbelhuis
,P. F.
,Blommaart
,E.F. C.
иMeijer
, A. J.
J.
2000
)Аминокислотно-зависимая трансдукция сигнала
.Биохим. J.
351
:545
–550
.46.SHAH
,OJ
,ANTHONY
,JC
,KIMBALL
,SR
&JEFFERSON
,LS
(LS
(2000
)4E-BP1 и S6K1: трансляционные сайты интеграции для питания и гормональная информация в мышцах
.утра. Дж. Физиол. Эндокринол. Метаб.
279
:E715
–E729.47.Dubbelhuis
,P. F.
иMeijer
,A. J.
(2002
)Аминокислотно-зависимая передача сигнала 5. В:
Sensing, Signaling and Cell Adaptation
(Этаж
,KB
иЭтаж
,JM
eds.), стр.207
–019 019.005.
Elsevier
,Амстердам, Нидерланды
.48.GINGAR
,A. C.
,O. C.
,,B.
&Sonenberg
,N.
(2001
)Регулирование инициации перевода FRAP / MTOR
.
Гены Дев.
15
:807
–826
.49.Tang
,H.
,Hornstein
,E.
,STOLOVICH
,М.
,LEVY
,G.
,Livingstone
,М.
,Templeton
,D.
,AVRUCH
,J.
&,J.
&Meyuhas
,O.
(2001
)Аминокислотно-индуцированный перевод верхних МРНК полностью зависит от фосфатидилоситола 3- передача сигналов, опосредованная киназой, частично ингибируется rapamycin и не зависит от фосфорилирования S6K1 и rpS6
.Мол. Клетка. биол.
21
:8671
–8683
.50.Бломмаарт
,Э.FC
,KRAUSE
,U.
,Schellens
,JB
,Vreeling-Sindelárová
,H.
&Meijer
,AJ
(1997
)Фосфатидилоситол 3-киназа ингибиторы вортманнин и LY294002 ингибируют аутофагию в изолированных крысиных гепатоцитах
. евро. Дж. Биохим.
Биохим.
243
:240
–246
.51.Petiot
,A.
,Ogier-Denis
,E.
,BlommaArt
,EFC
,Meijer
,AJ
&CODOGONO
,P.
(2000
)Различные классы фосфатидилозитола 3′-киназы участвуют в сигнальных путях, которые контролируют макроавтофагию в Ячейки НТ-29
.Дж. Биол. хим.
275
:992
–998
.52.Codogno
,P.
иMeijer
,A. J.
(2003
)Сигнальные пути в аутофагии млекопитающих
.В:Autophagy
(Klionsky
,D. J.
ed.).Landes Bioscience
,Вашингтон, округ Колумбия
. (в печати) 53.Strømhaug
,P. E.
&Klionsky
,D. J.
(2001
)Подход к молекулярному механизму аутофагии.
Трафик
2
:524
–531
.54.Миотто
,Г.
,Венерандо
, Р.
MARIN
,O.
,SILIPRANDI
,N.
&MOTIMORE
,GE
(1994
)Ингибирование макроавтофагии и протеолиза в изолированный гепатоцит крысы неtanantable производной множественный антигенный пептид Leu8-Lys4-Lys2-Lys-beta Ala
.Дж. Биол. хим.
269
:25348
–25353
.55.Кристи
,Г. Р.
,Хайдух
,Э.
,Hundal
,HS
,,
HS
,CG
и,CG
&Taylor
, 9000 и (2002
)Внутриклеточное ощущение аминокислот в ксенопусе Лавис Оциты стимулирует P70 S6 Kinase в мишени рапамицина -зависимый способ
.Дж. Биол. хим.
277
:9952
–9957
.56.Krause
,U.
,Bertrand
,L.
иHue
,L.
(2002
)Контроль рибосомальной протеинкиназы S6 p70 и ацетил-КоА-карбоксилазы с помощью АМФ-активируемой протеинкиназы и протеинфосфатаз в изолированных гепатоцитах
.
евро. Дж. Биохим.
269
:3751
–3759
.57.IIBOSHI
,Y.
,PAPST
,P. J.
,Kawasome
,H.
,HOSOI
,H.
,Abraham
,R.T.
,Houghton
,P. J.
иTerada
,N.
(1999
)Аминокислотно-зависимый контроль p70(s6k). Участие аминоацилирования тРНК в регуляции
.Дж. Биол. хим.
274
:1092
–1099
.58.Lynch
,C.J.
,Fox
,H.L.
,Vary
,T.C.
,Jefferson
,L S.900
иKimball
,S. R.
(2000
)Регуляция чувствительной к аминокислоте передачи сигналов TOR аналогами лейцина в адипоцитах
.Дж. Сотовый. Биохим.
77
:234
–251
.59.Dennis
,PB
,Jaeschke
,A.
,,A.
,Saitoh
,м.
,Fowler
, B.
KOZMA
,SC
&THOMAS
,г .
(2001
)TOR млекопитающих: гомеостатический датчик АТФ
.Наука
294
:1102
–1105
.60.Peterson
,RT
,,
RT
,Desai
,BN
,,
BN
,Hardwick
,JS
&Schreiber
,SL
(1999
)Белка фосфатаза 2А взаимодействует с 70-кДа S6 Kinase и активируется ингибированием белка
, ассоциированного с FKBP12-рапамицином.Проц. Натл. акад. науч. США
96
:4438
–4442
.61.Navé
,BT
,OUWENS
,M.
,,
м.
,,
,
,DJ
,ALESSI
,DR
&Shepherd
,PR
(1999
)MAMMAL рапамицина является прямой мишенью для протеинкиназы B: выявление точки схождения противоположных эффектов инсулина и дефицита аминокислот на трансляцию белка
. Биохим.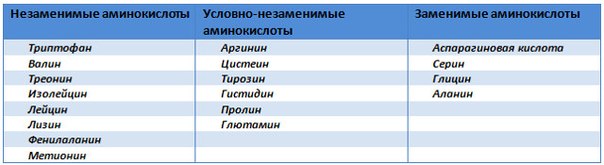 J.
J.
344
:427
–431
.62.KIM
,DH
,Sarbassov
,DD
,ALI
,см
,King
,JE
,,
,
RR
,Erdjument-Bromage
,H.
,Tempts
,P.
иSabatini
,DM
(2002
)mTOR взаимодействует с механизмом роста клеток raptor, формируя чувствительный к питательным веществам комплекс 05 9.09.
Сотовый
110
:163
–175
.63.Hara
,K.
,Maruki
,Y.
,Long
,X.
,Йошино
,к.
,oshiro
,N.
,HiDobat
S.
,TOKUNAGA
,C.
,AVRUCH
,J.
&YONEZAWA
,K.
(K.
(2002
)Raptor, связывающий партнер цели Rapamycin (Tor) , опосредует действие TOR
.Сотовый
110
:177
–189
.64.Dubbelhuis
, P. F.
F.
Meijer
,A. J.
(2002
)ФЭБС Письмо.
521
:39
–42
.65.Болстер
,D. R.
,Crozier
,S. J.
,Kimball
,S.R.
&Jefferson
,L. S.
(2002
)АМФ-активируемая протеинкиназа подавляет синтез белка в скелетных мышцах крыс посредством подавления передачи сигналов рапамицина (mTOR) у млекопитающих 5 .
Дж. Биол. хим.
277
:23977
–23980
.66.Ларсен
,А. К.
,Мёллер
,М. Т.
,Бланксон
,Х.
,Самари
5,
Самари
5, Х.R.
,HOLDEN
,L.
,L.
&SEGLEN
,P. O.
(2002
)Нариинцин-чувствительная фосфорилирование плектина, цитоскелет скрещенного белка, в изолированных гепатоцитах крысы
.Дж. Биол. хим.
277
:34826
–34835
.67.Patti
, M. E.
E.
Brambilla
,E.
,Luzi
,L.
,Landaker
,E.J.
&Kahn
,C. R.
(1998
)Двунаправленная модуляция действия инсулина аминокислотами
.Дж. Клин. Вкладывать деньги.
101
:1519
–1529
.68.Tremblay
,F.
иMarette
,A.
(2001
)Передача сигналов аминокислот и инсулина через mTOR/p70 S6 киназу. Механизм отрицательной обратной связи, приводящий к резистентности к инсулину в клетках скелетных мышц
.Дж. Биол. хим.
276
:38052
–38060
.69.Takano
,A.
,USUI
,I.
,Haruta
,T.
,Kawahara
,J.
,UNO
,T.
,Iwata
,M.
иKobayashi
,M.
(2001
) Млекопитающие-мишень рапамицинового пути регулирует передачу сигналов инсулина посредством субклеточного перераспределения субстрата рецептора инсулина 1 и интегрирует пищевые сигналы и метаболические сигналы инсулина 900 инсулина 90 .
Мол. Клетка. биол.
21
:5050
–5062
.70.Hartley
,D.
иCooper
,G. M.
(2002
)Роль mTOR в деградации IRS-1.
Дж. Сотовый. Биохим.
85
:304
–314
.71.Terruzzi
,I.
,Allibardi
,S.
,Bendinelli
,P.
,Maroni
,стр.
,Piccoletti
,R
,,
R
,Vesco
,F.
,SAMAJA
,M.
&LUZI
,L.
(2002
)Индуцированная аминокислотами и липидами резистентность к инсулину в сердце крысы: молекулярные механизмы
.Мол. Клетка. Эндокринол.
190
:135
–145
.72.Родос
,CJ
иБелый
,М.F.
(2002
)Молекулярный анализ действия и секреции инсулина
.евро. Дж. Клин. Вкладывать деньги.
32
(Дополнение 3
),3
–13
. 73.
73.XU
,G.
,Kwon
,G.
,Marshall
,CA
,LIN
,TA
,Lawrence
,JC
, JR. &McDaniel
ML
(1998
)Аминокислоты с разветвленной цепью необходимы для регуляции киназы PHAS-I и p70S6 бета-клетками поджелудочной железы.Возможная роль в трансляции белка и митогенной передаче сигналов
.Дж. Биол. хим.
273
:28178
–28184
.74.XU
,G.
,Kwon
,G.
,CRUZ
,WS
,Marshall
,CA
&McDaniel
,мл
(2001
)Метаболический регуляция лейцином инициации трансляции через сигнальный путь mTOR бета-клетками поджелудочной железы
.Диабет
50
:353
–360
0,75.Dickson
,LM
,Lingohr
,MK
,MCCUAIG
,J.
,HUGL
,SR
,Snow
,L.
,Kahn
,BB
,Myers
,MG
, Jr.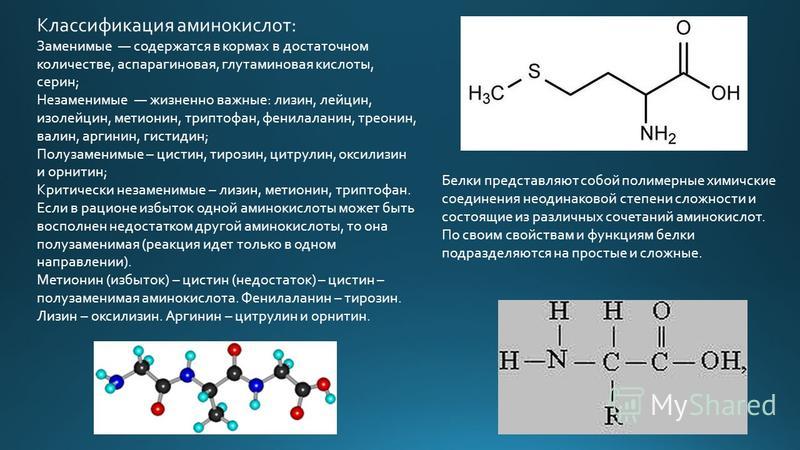 &
&Rhodes
,CJ
(2001
)Дифференциальная активация протеинкиназы B и p70(S6)K роста инсулиноподобным бета-фактором -ячейки (ИНС-1)
.Дж. Биол. хим.
276
:21110
–21120
.76.соль
,IP
,Johnson
,G.
,ASHCROFT
,SJ
&,
SJ
&Hardie
,DG
(DG
(1998
)AMP-активированная белка киназы активируется с помощью низкой глюкозы в клеточных линиях, полученных из бета-клеток поджелудочной железы, и может регулировать высвобождение инсулина
.Биохим. Дж.
335
:533
–539
.77.Eto
,K.
,Tsubamoto
,Y.
,Terauchi
,Y.
,Sugiyama
,T.
,Kishimoto
,T.
,Takahashi
,N.
,Yamauchi
,N.
,Kubota
,N.
,Murayama
, S.
Aizawa
,T.
,Akanuma
,Y.
,Aizawa
,S.
,Kasai
,H.
,Yazaki
,Y.
иKadowaki
,T.
(1999
)Роль NADH Shuttle Seather в индуцированной глюкозе активации митохондриального метаболизма и инсулина секрет
.Наука
283
:981
–985
.Сокращения
4E-BP
4E-BP
Еукариотический белковый фактор инициирования перевода 4E-связывающий белок-1
MTOR
MTR
MAMMALAL MAMMALE MAMBET RAPAMYCIN
PI 3-Kinase
фосфатидилоситол 3-киназа
PI (3) P
фосфатилинозитол 3-фосфат
PI (4,5) P 2
фосфатидиллинозитол 4,5-бисфосфат
PI (3,4,5) P 3
фосфатидилинозитол 3,4,5-трифосфат
p70S6k
© 2003 Американское общество наук о питании
Аминокислоты плазмы
Определение
adam.com»> Аминокислоты плазмы — это скрининговый тест, проводимый у младенцев, который оценивает количество аминокислот в крови.Аминокислоты являются строительным материалом для белков в организме.Альтернативные названия
Анализ крови на аминокислоты
Как проводится тест
В большинстве случаев кровь берут из вены, расположенной на внутренней стороне локтя или тыльной стороне кисти.
У младенцев и детей младшего возраста для прокола кожи можно использовать острый инструмент, называемый ланцетом.
- Кровь собирается в небольшую стеклянную пробирку, называемую пипеткой, или на предметное стекло или тест-полоску.
- На место накладывается повязка, чтобы остановить кровотечение.
Образец крови отправлен в лабораторию. Существует несколько типов методов, используемых для определения уровня отдельных аминокислот в крови.
Как подготовиться к тесту
Человек, которому предстоит тест, не должен есть за 4 часа до теста.
Ощущения при тестировании
При введении иглы может ощущаться легкая боль или покалывание. Вы также можете почувствовать некоторую пульсацию в этом месте после забора крови.Укол иглой, вероятно, вызовет плач младенца или ребенка.
Зачем проводится тест
Этот тест проводится для измерения уровня аминокислот в крови.
Повышенный уровень определенной аминокислоты является сильным признаком. Это показывает, что существует проблема со способностью организма расщеплять (метаболизировать) эту аминокислоту.
Этот тест также можно использовать для выявления сниженного уровня аминокислот в крови.
Повышение или понижение уровня аминокислот в крови может наблюдаться при лихорадке, неправильном питании и некоторых заболеваниях.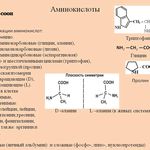
Нормальные результаты
Все измерения даны в микромолях на литр (мкмоль/л). Нормальные значения могут варьироваться в разных лабораториях. Поговорите со своим поставщиком медицинских услуг о ваших конкретных результатах теста.
Аланин:
Аланин:
- Дети: 200 до 450
- взрослых: 230 до 510
Alpha-Aminoadipic Acide:
- Дети: не обнаружены
- Взрослые: не обнаружены
Alpha-Amino-N-Butyric Кислоты:
- Дети: 8 до 37
- взрослых: 15 до 41
Аргинина:
Аргинина:
- : 44 до 120
- У взрослых: 13 до 64
- Дети: 15 до 40
- взрослых: 45 по 130
аспарагиновая кислота:
аспартиновая кислота:
- детей: 0 до 26
- взрослых: 0 до 6
бета-аланин:
- детей: 0 до 49
- взрослых: от 0 до 29
Бета-амино-изобутическая кислота:
- детей: не обнаружено
- взрослых: не обнаружено
карнозин:
1Carnosine:
- детей: не обнаружено
- взрослых: не обнаружено
CI Trulline:
- детей: 16 до 32
- взрослых: 16 до 55
Cystica:
- : 19 до 47
- Взрослые: от 19 до 47
- взрослых: от 30 до 65
Глутамная кислота:
- Дети: 32 140
- взрослых: 18 по 98
глютамина:
глютамина:
- детей: 420 до 730
- взрослых: 390 до 650
глицин:
- детей: 110 до 240
- взрослых: 170 до 330
Гистидин:
- :
- детей: 68 до 120
- взрослых: 26 до 120
- детей: 0 до 5
- Взрослые: не обнаружены
- Дети: 37 до 140
- взрослых: 42 до 100
Leucine:
Leucine:
Reucine:
- детей: 70 по 170-1902 50 до 220
Metoionine:
Metoionine:
Metoionine:
1-метилхистидин:
- детей: не обнаружены
- Взрослые: не обнаружены
3-метилхистидин:
- детей: 0 до 52
- Взрослые: 0 до 64
Орнитин:
1Орнитин:
фенилаланин:
Фосфосерин:
- Дети: 0 до 12
- У взрослых: 0 до 12
Фосфоэтаноламина:
- Дети: 0 до 12
- Взрослые: от 0 до 55
Proline:
- детей: 130 до 2902
- взрослых: 110 до 360
Serine:
- детей: 93-150
- взрослых: 56 до 140
Taurine:
- детей: 11 до 120
- взрослых: 45 до 130
- детей: 67 до 150
- Взрослые: 92-20018
Tyrosine:
- :
- Дети: 26-110
- Взрослые: От 45 до 74 лет
Валин:
- Дети: от 160 до 350 лет
- Взрослые: от 150 до 310 лет
В приведенных выше примерах показаны общие измерения результатов этих тестов.Некоторые лаборатории используют разные измерения или могут тестировать разные образцы.
Что означают ненормальные результаты
Увеличение общего уровня аминокислот в крови может быть связано с:
- Эклампсией
- Врожденным нарушением обмена веществ
- Reye Syndrome
- Лабораторная ошибка
- Корофона надпочечника
- Лихорадка
- HARTNUP ELEACH
- Врожденная погрешность метаболизма
- Huntington хорея
- Недостаточность питания
- Нефротический синдром
- Флеботомная лихорадка
- Ревматоидный артрит
- Лабораторная ошибка
Высокие или низкие количества отдельных аминокислот в плазме должны учитываться вместе с другой информацией.Аномальные результаты могут быть связаны с диетой, наследственными проблемами или действием лекарств.
Соображения
Скрининг младенцев на повышенный уровень аминокислот может помочь выявить проблемы с обменом веществ. Раннее лечение этих состояний может предотвратить осложнения в будущем.
Каталожные номера
Dietzen DJ. Аминокислоты, пептиды и белки.
 В: Рифаи Н., изд. Учебник Tietz по клинической химии и молекулярной диагностике . 6-е изд. Сент-Луис, Миссури: Elsevier; 2018: глава 28.
В: Рифаи Н., изд. Учебник Tietz по клинической химии и молекулярной диагностике . 6-е изд. Сент-Луис, Миссури: Elsevier; 2018: глава 28.Клигман Р.М., Сент-Геме Д.В., Блюм Н.Дж., Шах С.С., Таскер Р.К., Уилсон К.М. Нарушения метаболизма аминокислот. В: Kliegman RM, St. Geme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM, eds. Учебник педиатрии Нельсона . 21-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 103.
Райли Р.С., Макферсон Р.А. Базовое исследование мочи. В: Макферсон Р.А., Пинкус М.Р., ред. Клиническая диагностика Генри и лечение с помощью лабораторных методов . 23-е изд. Сент-Луис, Миссури: Elsevier; 2017: глава 28.
Аминокислоты
АминокислотыВведение к структуре белка
Аминокислоты
Белки представляют собой полимеры а-аминокислот.
Есть двадцать аминокислот, которые обычно встречаются в белках.
 Каждая аминокислота имеет сходную, но уникальную структуру (рис. 1).
Каждая аминокислота имеет сходную, но уникальную структуру (рис. 1).Рисунок 1:
Все аминокислоты (кроме пролина) имеют карбоксильную группу и аминогруппу.При физиологических значениях pH природные аминокислоты существуют в виде цвиттер-ионов с отрицательно заряженной карбоксильной группой и положительно заряженная аминогруппа.
А-углерод большинства аминокислот является хиральным. Таким образом, есть два стереоизомера большинства аминокислот.
Каждая аминокислота имеет другую боковую цепь (или группу R). Сторона цепи сильно различаются по своей сложности и свойствам. Боковая цепь глицина просто водород. Боковая цепь триптофана основана на ароматическом бициклическом индоле. группа.Аминокислоты классифицируют по химической природе их боковых цепей. Один полезный классификация аминокислот делит их на две группы, полярные (или гидрофильные) аминокислоты имеют боковые цепи, взаимодействующие с водой, в то время как неполярных (или гидрофобных) аминокислот нет.

неполярных аминокислот включают: аланин, цистеин, глицин, изолейцин, лейцин, метионин, фенилаланин, пролин, триптофан, тирозин и валин.
полярных аминокислот включают: аргинин, аспарагин, аспарагиновую кислоту (или аспартат), глутамин, глутаминовая кислота (или глутамат), гистидин, лизин, серин и треонин.
Еще одна подгруппа аминокислот – это аминокислоты с ионизируемой стороной. цепи. К ним относятся: аспартат, глутамат, гистидин, цистеин, лизин, тирозин и аргинин. Эти аминокислоты вносят вклад в заряд, проявляемый пептидами и белками
Подробные данные (включая pKa, параметры для предсказания структуры и другие свойства) можно найти на веб-сайте поддерживается Чарльзом С.Гассера из Калифорнийского университета в Дэвисе.
Copyright 1998, 1999, 2007 Фрэнк Р. Горга; Страница поддерживается Ф.Р. Горга; Последнее обновление: 12 марта 2007 г.
Что такое аминокислоты и что они делают?
Следующим по величине компонентом нашего организма после воды является белок.
 Белок вырабатывается только при наличии достаточного количества аминокислот. Аминокислоты — это то, что многие эксперты считают «кирпичиками» организма.Быть строительными блоками чего-либо — это мощная фундаментальная работа, а аминокислоты именно таковы — мощные и фундаментальные.
Белок вырабатывается только при наличии достаточного количества аминокислот. Аминокислоты — это то, что многие эксперты считают «кирпичиками» организма.Быть строительными блоками чего-либо — это мощная фундаментальная работа, а аминокислоты именно таковы — мощные и фундаментальные.Они играют решающую роль в метаболических процессах нашего организма, поскольку они связаны с ростом, восстановлением, транспортировкой, хранением и функциональностью. Аминокислоты напрямую влияют на множество элементов, включая наши мышцы, органы, пищеварение, кровь и мозговую деятельность — и это лишь некоторые из них!
Поскольку эти кислоты очень важны и сложны, мы связались с экспертом Кристи Марино, сертифицированным тренером по здоровью Института интегративного питания и тренером по кроссфиту уровня 2, чтобы расщепить аминокислоты для нас.
3 типа аминокислотЕсть 20 аминокислот, которые образуют белок в нашем организме, и они делятся на три категории: незаменимые, заменимые и условные.
1. Незаменимые аминокислоты По словам Марино, аминокислоты ответственны практически за каждую химическую реакцию в нашем организме.
По словам Марино, аминокислоты ответственны практически за каждую химическую реакцию в нашем организме.Кислоты, которые должны поступать из нашего рациона. Существует девять незаменимых аминокислот: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
2. Заменимые аминокислотыКислоты, вырабатываемые нашим организмом, включая аланин, аспарагин, аспартат и глютамин.
3. Кондициональные аминокислотыТе, которые обычно могут вырабатываться организмом, за исключением особых обстоятельств, связанных со здоровьем (таких как аутоиммунная недостаточность, стресс, молодой/пожилой возраст), и к ним относятся аргинин, цистин, тирозин, глицин, орнитин, пролин и серин.
Что делают аминокислоты?Марино говорит, что в нашем организме должен быть белок, чтобы производить новую мышечную и соединительную ткани.
 «Наше тело питается белком, — говорит она, — поэтому за рост мышц отвечают аминокислоты, но важно помнить, что вы не можете войти в мир фитнеса и ожидать результатов без здоровой диеты».
«Наше тело питается белком, — говорит она, — поэтому за рост мышц отвечают аминокислоты, но важно помнить, что вы не можете войти в мир фитнеса и ожидать результатов без здоровой диеты».С точки зрения питания, мясо, молочные продукты, яйца, бобовые, орехи и злаки особенно богаты белком, но Марино говорит, что пока мы едим цельные продукты, мы по крайней мере частично пополняем запасы белка.
«Поскольку все наши белки состоят всего из 20 аминокислот, различия между тысячами уникальных белков заключаются просто в последовательности этих аминокислот», — добавляет она.«У нас есть специализированные молекулы, которые знают, какие аминокислоты и в каком порядке соединять, чтобы получить определенный белок».
Марино потребовалось несколько секунд, чтобы описать каждую из наших клеток как привередливого Вольфганга Пака: в них должны быть все необходимые аминокислоты, все ингредиенты, прежде чем они даже подумают о том, чтобы начать производить белок.
«Скажем так, наши клетки умны и могут импровизировать и превращать одни аминокислоты в другие, если им не хватает «ингредиента», — говорит она нам.
Преимущества аминокислот для волос, кожи и ногтей «Однако девять незаменимых аминокислот необходимо употреблять в пищу, а когда вы сочетаете такие продукты, как бобы и рис или макароны и сыр, вы получаете все незаменимые аминокислоты.И очень важно, чтобы вы это сделали!»
«Однако девять незаменимых аминокислот необходимо употреблять в пищу, а когда вы сочетаете такие продукты, как бобы и рис или макароны и сыр, вы получаете все незаменимые аминокислоты.И очень важно, чтобы вы это сделали!»Аминокислоты не только жизненно важны для поддержания нашего телосложения и соблюдения здорового питания, они также полезны для наших волос, кожи и ногтей.
ВолосыМарино объясняет, что, поскольку аминокислота метионин может создавать соединительные сети, она поддерживает силу и структуру наших волос. Метионин является незаменимой аминокислотой и содержится в мясе, орехах, бобах и молочных продуктах.
Кроме того, аргинин и глютамин оказывают огромное влияние на рост волос. Аргинин может стимулировать рост волос, создавая более прочный канал для доставки крови к корням. Глютамин вырабатывается естественным путем, но с возрастом мы его производим все меньше и меньше.
Кожа «Глютамин и метионин содержат серу, поддерживающую оптимальный рост волос», — говорит Марино.
«Глютамин и метионин содержат серу, поддерживающую оптимальный рост волос», — говорит Марино.Аргинин и глютамин также способствуют росту и обновлению клеток, когда речь идет о коже, но Марино говорит, что глицин, лейцин и пролин напрямую участвуют в выработке коллагена, увлажнении и решении многих омолаживающих проблем с кожей.«Коллаген — это белок, и для его создания нам нужны аминокислоты», — говорит Марино. «Они могут предложить только неизмеримые преимущества».
Гвозди«Подобно нашим волосам, аргинин открывает проход для нашей крови, обеспечивая более здоровое кровообращение и поддержку корней», — говорит Марино. «Все это возвращается к белку. Существуют косметические продукты и добавки, в которых используются аминокислоты, и я призываю всех использовать эту возможность».
.


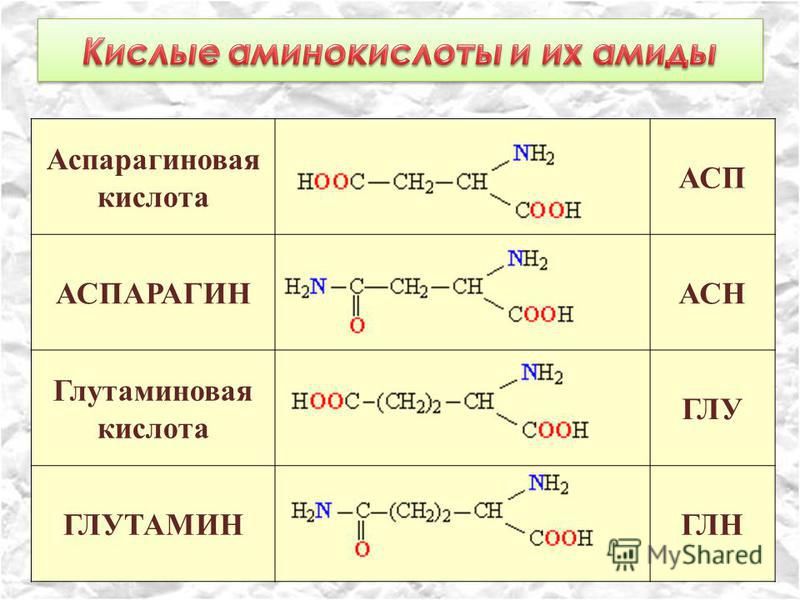 Например, на протяжении десятилетий было доказано, что креатин увеличивает мышечную массу. Увеличивая количество аминокислот в рационе, Вы можете увеличить азотный баланс в организме, что, в свою очередь, увеличивает количество аминокислот в мышцах, поэтому увеличивается мышечная масса.
Например, на протяжении десятилетий было доказано, что креатин увеличивает мышечную массу. Увеличивая количество аминокислот в рационе, Вы можете увеличить азотный баланс в организме, что, в свою очередь, увеличивает количество аминокислот в мышцах, поэтому увеличивается мышечная масса.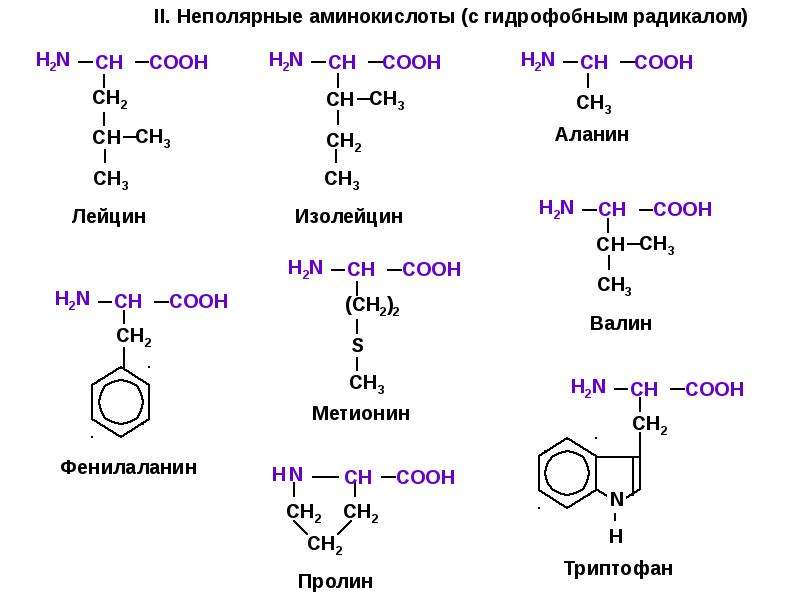
 Его молекула состоит из 1000 аминокислот, одна треть из которых глицин. С возрастом постепенно увеличивается число связей в молекуле коллагена, из-за чего ее упругость уменьшается.
Его молекула состоит из 1000 аминокислот, одна треть из которых глицин. С возрастом постепенно увеличивается число связей в молекуле коллагена, из-за чего ее упругость уменьшается.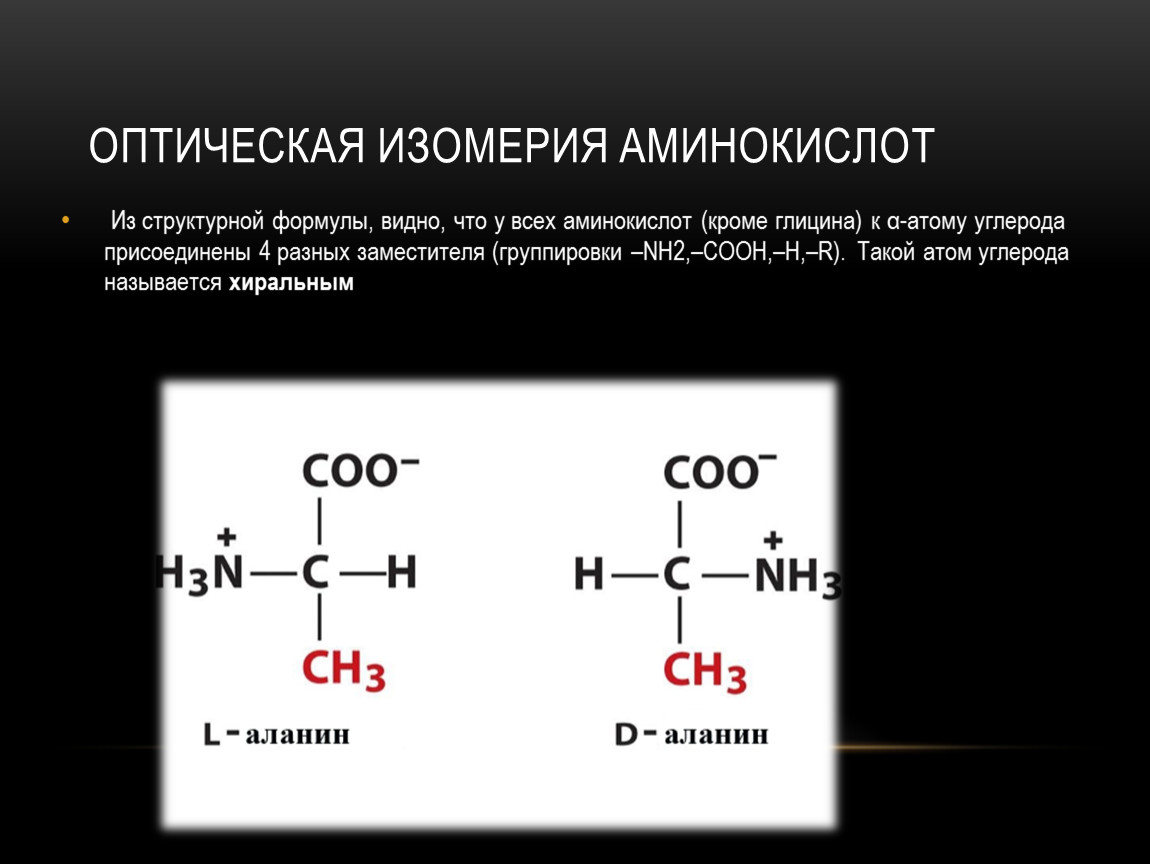 При этом пропадает чувство стянутости и появляется ощущение комфорта. Кожа на ощупь становится шелковистой и гладкой. Важно, что эта белковая пленка не препятствует газообмену кожи и не закупоривает поры.
При этом пропадает чувство стянутости и появляется ощущение комфорта. Кожа на ощупь становится шелковистой и гладкой. Важно, что эта белковая пленка не препятствует газообмену кожи и не закупоривает поры.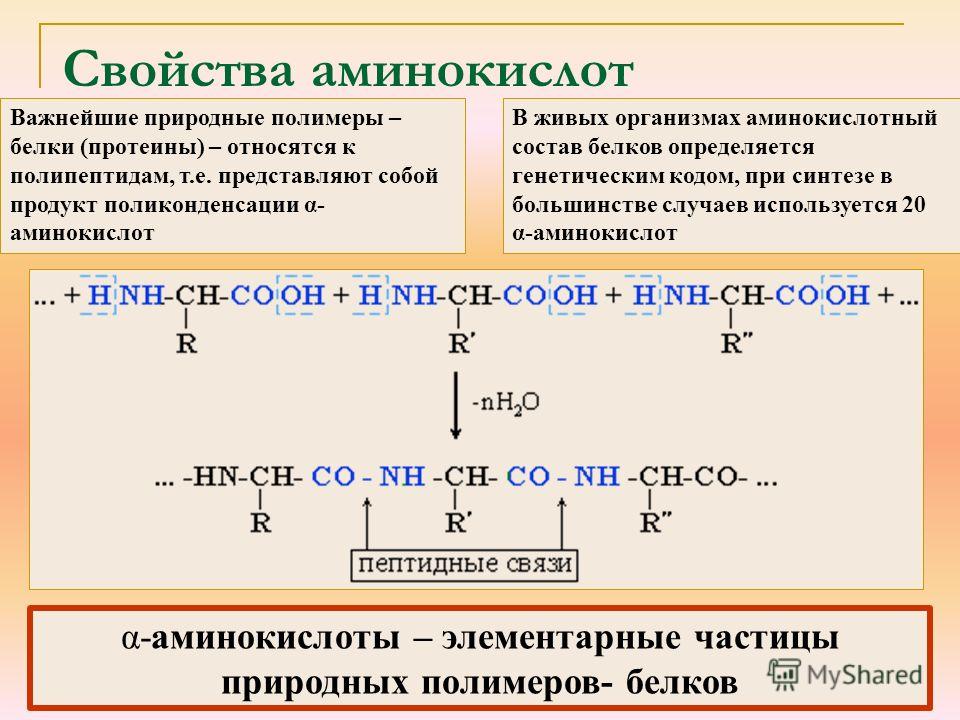 Гистамин играет важную роль в иммунной функции организма, пищеварении, сне и сексуальной функции.
Гистамин играет важную роль в иммунной функции организма, пищеварении, сне и сексуальной функции. Это также важно для производства других аминокислот.
Это также важно для производства других аминокислот. В: Рифаи Н., изд. Учебник Tietz по клинической химии и молекулярной диагностике . 6-е изд. Сент-Луис, Миссури: Elsevier; 2018: глава 28.
В: Рифаи Н., изд. Учебник Tietz по клинической химии и молекулярной диагностике . 6-е изд. Сент-Луис, Миссури: Elsevier; 2018: глава 28. Каждая аминокислота имеет сходную, но уникальную структуру (рис. 1).
Каждая аминокислота имеет сходную, но уникальную структуру (рис. 1).
 Белок вырабатывается только при наличии достаточного количества аминокислот. Аминокислоты — это то, что многие эксперты считают «кирпичиками» организма.Быть строительными блоками чего-либо — это мощная фундаментальная работа, а аминокислоты именно таковы — мощные и фундаментальные.
Белок вырабатывается только при наличии достаточного количества аминокислот. Аминокислоты — это то, что многие эксперты считают «кирпичиками» организма.Быть строительными блоками чего-либо — это мощная фундаментальная работа, а аминокислоты именно таковы — мощные и фундаментальные. По словам Марино, аминокислоты ответственны практически за каждую химическую реакцию в нашем организме.
По словам Марино, аминокислоты ответственны практически за каждую химическую реакцию в нашем организме. «Наше тело питается белком, — говорит она, — поэтому за рост мышц отвечают аминокислоты, но важно помнить, что вы не можете войти в мир фитнеса и ожидать результатов без здоровой диеты».
«Наше тело питается белком, — говорит она, — поэтому за рост мышц отвечают аминокислоты, но важно помнить, что вы не можете войти в мир фитнеса и ожидать результатов без здоровой диеты». «Однако девять незаменимых аминокислот необходимо употреблять в пищу, а когда вы сочетаете такие продукты, как бобы и рис или макароны и сыр, вы получаете все незаменимые аминокислоты.И очень важно, чтобы вы это сделали!»
«Однако девять незаменимых аминокислот необходимо употреблять в пищу, а когда вы сочетаете такие продукты, как бобы и рис или макароны и сыр, вы получаете все незаменимые аминокислоты.И очень важно, чтобы вы это сделали!» «Глютамин и метионин содержат серу, поддерживающую оптимальный рост волос», — говорит Марино.
«Глютамин и метионин содержат серу, поддерживающую оптимальный рост волос», — говорит Марино.