Аминокислотные Комплексы | АКАДЕМИЯ-Т
Все мы знаем, что белок состоит из аминокислот и все белки усваиваются в нашем организме, предварительно перевариваясь
Об аминокислотных препаратах имеются самые противоречивые мнения. Некоторые, к примеру, считают, что даже спортсмену вполне достаточно аминокислот, получаемых из белка, поступающего с пищей или белковыми концентратами.
Все мы знаем, что белок состоит из аминокислот и все белки усваиваются в нашем организме, предварительно перевариваясь в виде аминокислот. Таким образом, в этом и есть ключевое отличие аминокислотных комплексов от цельного белка, аминокислоты усваиваются максимально быстро и организму не нужно затрачивать время и энергию на их переваривание. Соответственно аминокислотные комплексы идеально подходят для применения после тренировок, чтобы быстро закрыть потребность в белке.
Известно, что свободные аминокислоты не только являются «строительным материалом» для создания белков, но и выполняют ряд других важных функций.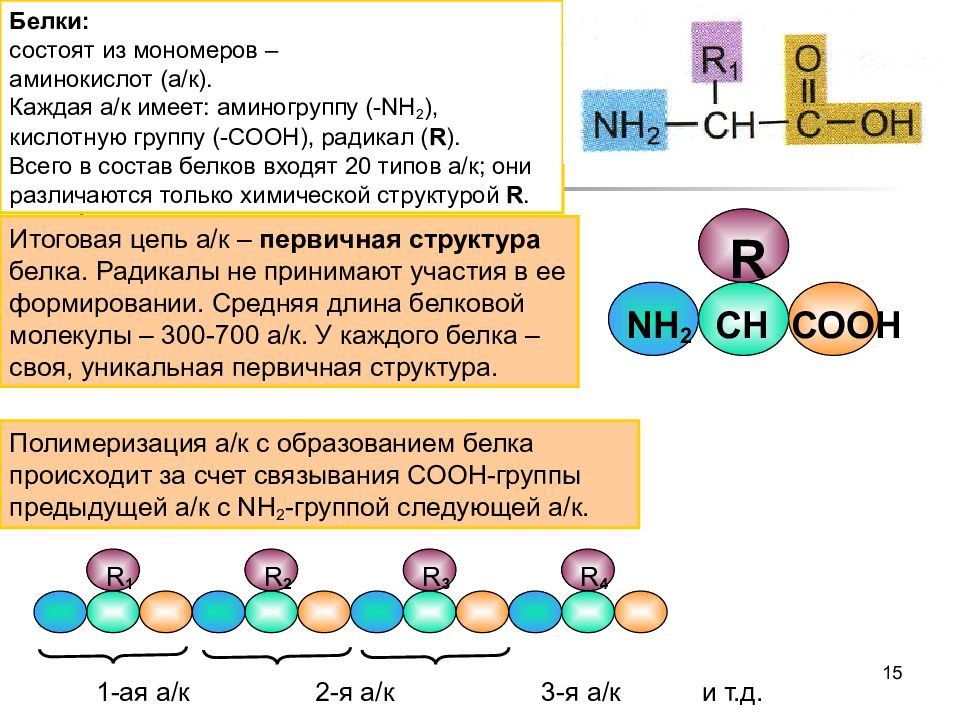
Но следует понимать, что аминокислотных комплексов на основе отдельных аминокислот на рынке нет, так как их стоимость была бы невероятно высокой. Поэтому все производители используют гидролизаты белков.
Гидролизат белка – это белок расщепленный до состояния аминокислот, ди-, трипептидов и т.д. При гидролизе белков их цепи распадаются до определенной степени, зависящей от условий реакции. При полном гидролизе белок превращается в смесь отдельных аминокислот. Однако это необязательно, тем более что частично гидролизованные белки имеют большую ценность для спортивного питания. Их усвояемость также высока, как у отдельных аминокислота, а раздражающее действие на желудок гораздо меньше.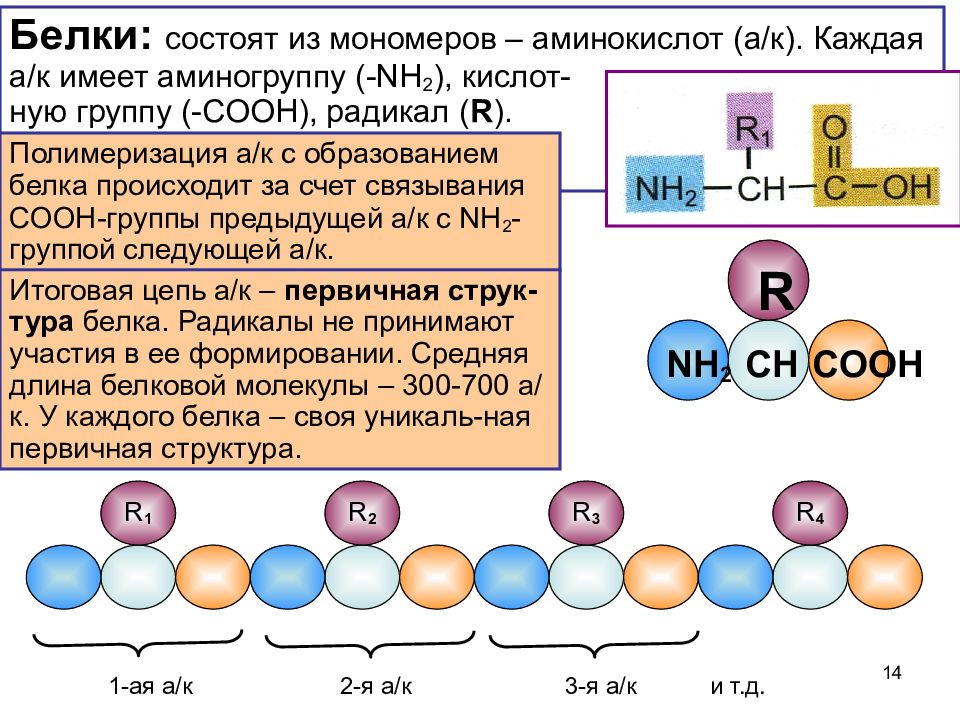
На ценность аминокислотных смесей существенно влияет метод гидролиза. Природные аминокислоты в растворе вращают плоскость поляризации влево, т.е. являются L-изомерами (кроме глицина, у которого нет оптических изомеров). Если белок гидролизуют кислотой или щелочью, условия реакции достаточно жесткие, и часть аминокислот переходит в потенциально опасную D-форму. Кроме того, последующая нейтрализация приводит к накоплению в продукте хлористого натрия. При обработке ферментами в более мягких условиях рацемизация не происходит.
Кроме того, часто в состав аминокислотных комплексов добавляют витамин В6, необходимый для построения белка в организме.
Гидролизаты каких белков используют?
В качестве источника аминокислот в комплексах используют гидролизаты как растительных (соевый) так и животных белков (коллаген, молочный, сывороточный, яичный). Наибольшее отклонение от идеального состава имеют растительные белки, к тому же они усваиваются достаточно плохо. Доказано, что правильно подобранная аминокислотная добавка способна резко повысить усвояемость белков пищи за счет «балансировки» состава, усвоение низкокачественных белков улучшается, резко снижается количество отходов, а значит, снижается нагрузка на печень. Поэтому целесообразно использовать комбинации белковых гидролизатов для получения максимального эффекта.
На основе изученных данных был разработан комплексный продукт AminoFit.
«AminoFit» — натуральный аминокислотный комплекс для восстановления мышечной ткани после физических нагрузок любой интенсивности, который состоит из гидролизатов животного и сывороточного белков, полученных методом мягкого ферментативного гидролиза, растворимых пищевых волокон и витамина B6 в оптимальном соотношении. Продукт обладает высоким энергетическим и анаболическим действием, позволяя преодолевать тренировочный стресс любого уровня.
Продукт обладает высоким энергетическим и анаболическим действием, позволяя преодолевать тренировочный стресс любого уровня.
Гидролизат животного белка — обладает высоким анаболическим действием, низким содержанием липидов и максимальным индексом усвояемости. Имеет высокую биологическую ценность и полный спектр незаменимых аминокислот.
Гидролизат сывороточного белка — источник высококачественного белка, обеспечивающий оптимальный рост мышечной массы, ускорение восстановления после физической нагрузки и укрепление иммунной системы, а также способствует расщеплению жиров и уменьшает чувство голода.
Гуммиарабик — растворимое пищевое волокно, которое способствует нормализации работы желудочно-кишечного тракта, восстанавливая положительную микрофлору кишечника, обеспечивая рост микрофлоры, повышает усвояемость белка и снижает токсичные эффекты аммиака, образование которого повышается при росте потребления белка.
Витамин В6 — витамин, увеличивающий использование запасов гликогена и снижающий расход энергосодержащего субстрата жирных кислот.
Сравнение состава АминоФит с идеальным белком:
|
Аминокислота |
Содержание в 1 г. «идеального белка», мг |
Содержание в 1 г. продукта АминоФит |
Соответствие «идеальному белку» |
|
валин |
50 |
89 |
178% |
|
изолейцин |
40 |
53 |
131% |
|
лейцин |
70 |
111 |
158% |
|
лизин |
55 |
111 |
202% |
|
метионин + цистин |
35 |
36 |
103% |
|
треонин |
40 |
64 |
160% |
|
фенилаланин + тирозин |
60 |
11 |
18% |
|
триптофан |
10 |
3 |
25% |
При этом в составе есть повышенное содержание аргинина, глицина, пролина и оксипролина, подобное сочетание аминокислот позволяет успешней сжигать жир за счет увеличения мышечной массы и ускорит процесс заживления и восстановления мышечной ткани и хрящевой ткани. Данный процесс, в свою очередь, ускоряет обмен веществ.
Данный процесс, в свою очередь, ускоряет обмен веществ.
Биологическая ценность «АминоФит»:
|
Пищевая ценность |
В 1 таблетке |
На 1 порцию (8 таблеток) |
% РСП*/АУП** |
|
Белок |
1,2 |
9,6 |
13* |
|
Незаменимые аминокислоты: |
|||
|
Валин |
0,107 |
0,32 |
1** |
|
Изолейцин |
0,063 |
0,19 |
10** |
|
Лейцин |
0,133 |
0,4 |
9** |
|
Лизин |
0,133 |
0,4 |
10** |
|
Цистеин/Цистин+ Метионин |
0,003/0,033 |
0,01/0,1 |
6** |
|
Треонин |
0,077 |
0,23 |
10** |
|
Фенилаланин+ Тирозин |
0,08/0,05 |
0,24/0,15 |
9** |
|
Триптофан |
0,003 |
0,01 |
1** |
|
Заменимые аминокислоты: |
|||
|
Аланин |
0,29 |
0,87 |
13** |
|
Аргинин |
0,25 |
0,74 |
12** |
|
Аспарагиновая кислота |
0,21 |
0,63 |
5** |
|
Глутаминовая кислота |
0,39 |
1,16 |
9** |
|
Глицин |
0,65 |
1,94 |
55** |
|
Гистидин |
0,04 |
0,12 |
6** |
|
Гидроксипролин |
0,04 |
0,12 |
- |
|
Пролин |
0,65 |
1,96 |
44** |
|
Серин |
0,117 |
0,35 |
4** |
|
Жиры |
0,0368 |
0,3 |
<1** |
|
Растворимые пищевые волокна |
0,33 |
2,64 |
132**/*** |
|
Витамин В6, мг |
0,16 |
1,28 |
64* |
|
Калорийность/Энергетическая ценность, ккал/кДж |
6/24 |
46/195 |
— |
* – % от рекомендуемого уровня суточного потребления согласно ТР ТС 022/2011 (Приложение 2).
** – % от адекватного уровня потребления согласно «Единым санитарно-эпидемиологическим и гигиеническим требованиям к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)» Таможенного союза ЕврАзЭС
*** не превышает верхний допустимый уровень потребления
Как и когда принимать аминокислоты?
Рекомендуется принимать по 4 таблетки до и после тренировки один раз в день.
Аминокислоты достаточно сильно раздражают желудочно-кишечный тракт, поэтому некоторые специалисты советует принимать их только с пищей. Можно сочетать прием аминокислот с употреблением пищи, содержащей малоценный белок.
Рекомендуемая продолжительность приема в зависимости от интенсивности нагрузок, массы тела, возраста и уровня подготовки в соответствии с программой тренировок по рекомендации специалиста
Protein Folding | Protocol (Translated to Russian)
3.
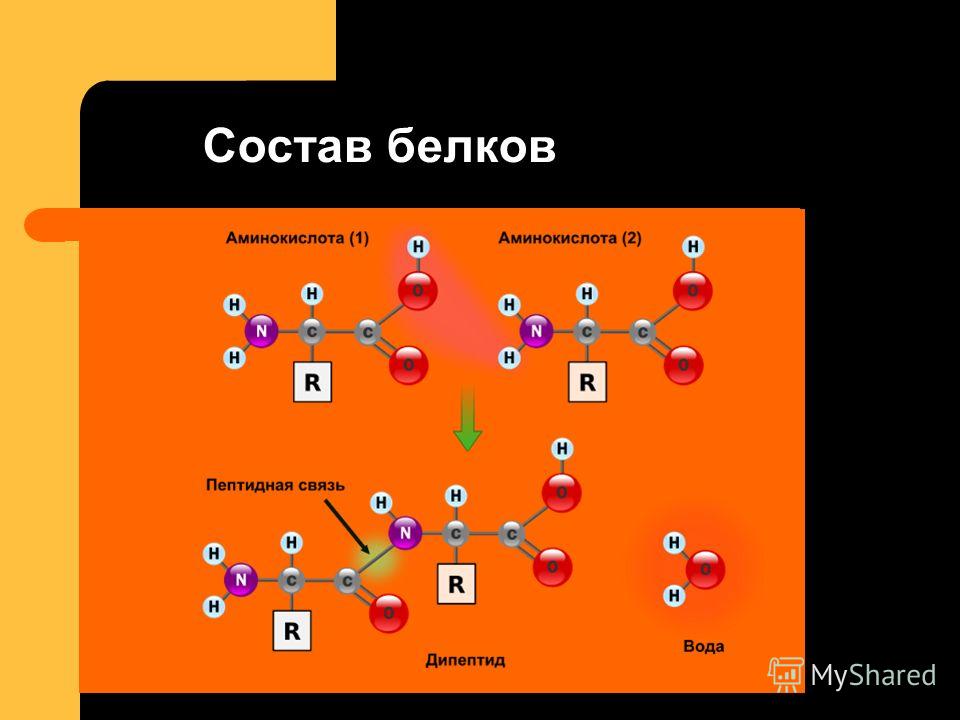 3: Сворачивание белка
3: Сворачивание белкаОбзор
Белки являются цепями аминокислот, соединенных пептидными связями. После синтеза белок складывается в трехмерную конформацию, которая имеет решающее значение для его биологической функции. Взаимодействие между составными аминокислотами направляет сворачивание белка, и, следовательно, структура белка в первую очередь зависит от его аминокислотной последовательности.
Структура протеина полностью определяет его биологическую функцию
Белки выполняют широкий спектр биологических функций, таких как катализация химических реакций, обеспечение иммунологической защиты, хранение, транспорт, сотовую связь, движение и структурную поддержку. Функция белка в основном зависит от его способности распознавать и связывать другие молекулы, аналогично замку и ключу. Поэтому специфическая активность каждого белка зависит от его уникальной трехмерной архитектуры.
Для того, чтобы белок был функциональным, он должен точно складываться.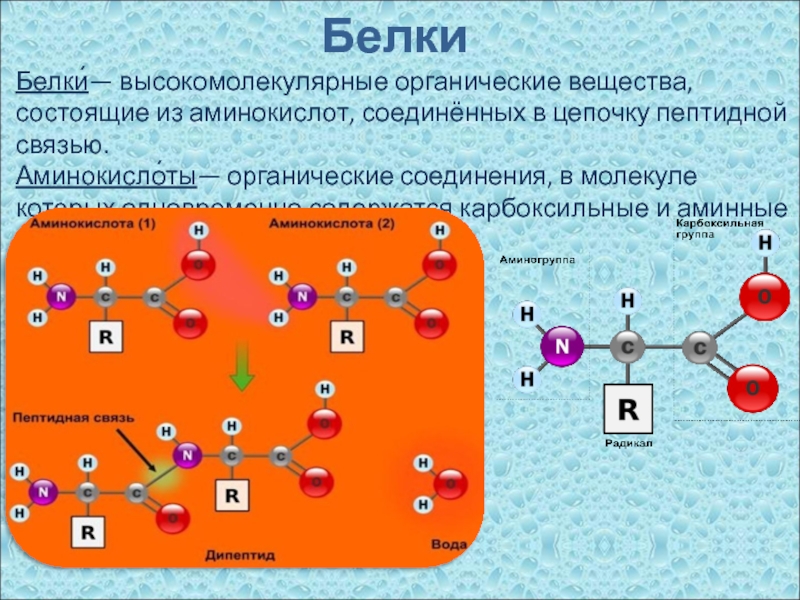 Большинство белков проходят через несколько промежуточных форм, прежде чем сложиться в наиболее стабильную, биологически активную структуру. Неправильное складывание белков пагубно сказывается на общем функционировании клетки. У людей наблюдается несколько заболеваний из-за накопления неправильно сложенных или развернутых белков. К ним относятся муковисцидоз, болезнь Альцгеймера, болезнь Паркинсона, ALS, и болезнь Крейтцфельдта-Якоба.
Большинство белков проходят через несколько промежуточных форм, прежде чем сложиться в наиболее стабильную, биологически активную структуру. Неправильное складывание белков пагубно сказывается на общем функционировании клетки. У людей наблюдается несколько заболеваний из-за накопления неправильно сложенных или развернутых белков. К ним относятся муковисцидоз, болезнь Альцгеймера, болезнь Паркинсона, ALS, и болезнь Крейтцфельдта-Якоба.
Ключевые детерминанты структуры белка
Белки состоит из одной или несколько цепей аминокислот, называемых полипептидами. Полипептид синтезируется как линейная цепь, которая быстро складывается на себя, чтобы сформировать трехмерную структуру. Термин полипептид и белок иногда используются взаимозаменяемо, но чаще всего, сложенный полипептид, который может выполнять биологическую функцию, называется белком. Белковая структура обычно описывается на четырех уровнях: первичном, вторичном, третичном и четвертичном. Большинство полипептидов складываются в общие компактные, шаровые третичные структуры, такие как гемоглобин, кислородо-несущий белок в крови.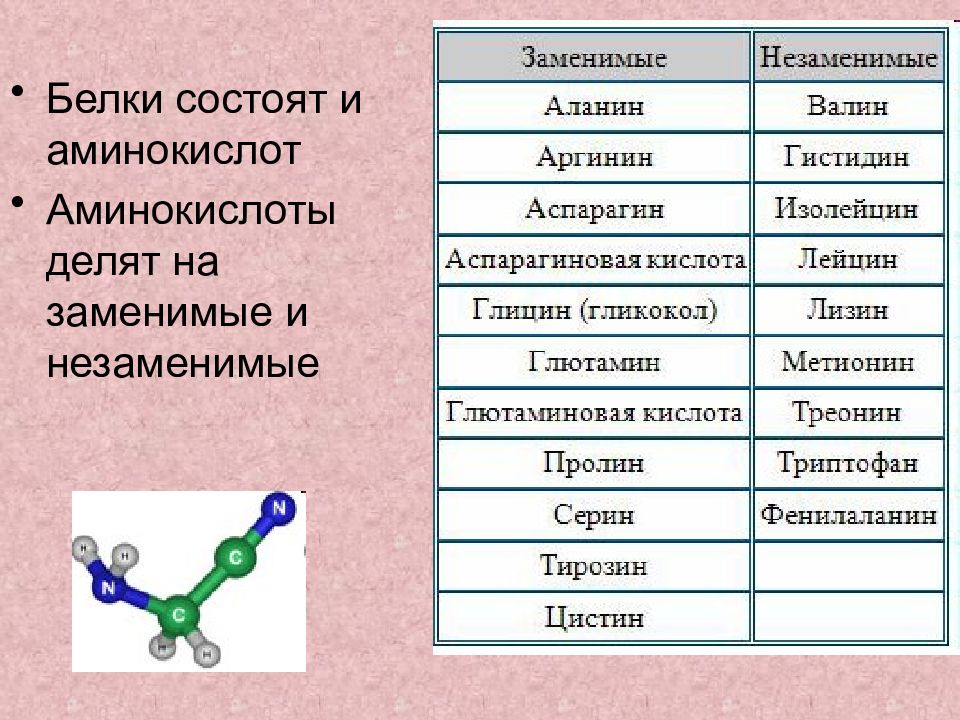 Некоторые белки, такие как кератины, могут образовывать длинные волокна, которые обычно встречаются в волосах и ногтях.
Некоторые белки, такие как кератины, могут образовывать длинные волокна, которые обычно встречаются в волосах и ногтях.
Последовательность аминокислот в цепочке полипептида является основным определяющим фактором его структуры. Аминокислотная последовательность определяет тип и расположение вторичных структур. Кроме того, общая третичная структура белка в основном стабилизируется химическими связями между аминокислотными боковыми цепями – уникальными химическими группами, которые отличают аминокислоты друг от друга. Эти боковые цепи либо положительно, либо отрицательно заряжены, либо они — полярные незаряженные или неполярные.
Аминокислоты имеют уникальные физические и химические характеристики в зависимости от их групп боковой цепи. Например, полярные и заряженные аминокислоты взаимодействуют с водой, образуют водородные связи и называются гидрофильными;в то время как неполярные аминокислоты не взаимодействуют с водой и называются гидрофобными. Поэтому, когда белок складывается в клеточной среде, боковые цепи гидрофобных аминокислот упаковываются в ядро белка вдали от водной среды, в то время как гидрофильные аминокислоты боковых цепей взаимодействуют на поверхности белка.
Плотно упакованные гидрофобные аминокислоты в белковом ядре приводят к образованию слабых взаимодействий Ван дер Ваальса между группами боковых цепей. Наличие этих сил Ван дер Ваальса придает дополнительную стабильность сложенному белку. Полярные аминокислоты, выставленные на поверхности белка, могут свободно образовывать водородные связи с молекулами воды или другими полярными аминокислотными боковыми цепями. Положительно и отрицательно заряженные аминокислоты также присутствуют на внешней стороне белка, где они образуют ионные связи с другими близлежащими, противоположно заряженными аминокислотами.
Дисульфидные связи образуются между двумя группами сульфгидрила, или SH, на аминокислотном цистеине. Это очень надежное взаимодействие, которое действует как подкрепление на сложенный белок. Наличие дисульфидных связей блокирует сложенный белок в его наиболее благоприятной трехмерной конформации. Правильное складывание белка также зависит от других факторов клеточной среды, таких как рН, концентрация соли, температура и т.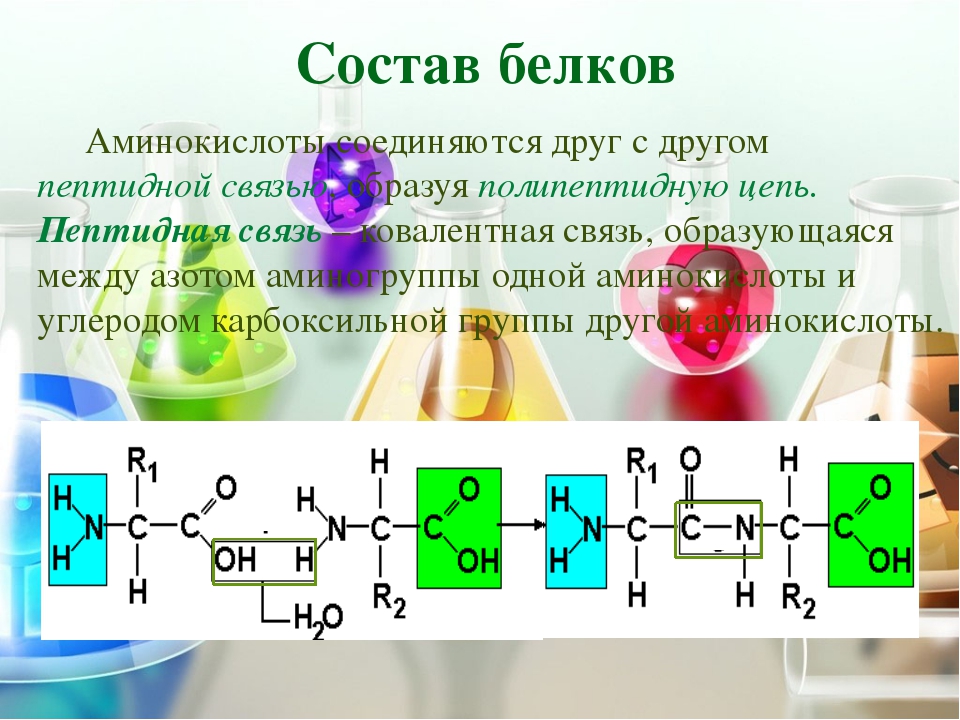 д. Изменение физических и химических условий в белковой среде влияет на химические взаимодействия, удерживающие белок вместе, и может привести к тому, что белок неправильно свернется или развернется и потеряет свою биологическую функцию – процесс, известный как денатурация белка.
д. Изменение физических и химических условий в белковой среде влияет на химические взаимодействия, удерживающие белок вместе, и может привести к тому, что белок неправильно свернется или развернется и потеряет свою биологическую функцию – процесс, известный как денатурация белка.
Литература для дополнительного чтения
Dill, Ken A., S. Banu Ozkan, M. Scott Shell, and Thomas R. Weikl. “The Protein Folding Problem.” Annual Review of Biophysics 37 (June 9, 2008): 289–316. [Source]
что могут рассказать аминокислоты о жизни на других планетах — РТ на русском
Исследователи из Университета Вальпараисо (США) приблизились к ответу на вопрос, есть ли жизнь на других планетах. Они воссоздали в лаборатории внеземные условия и поместили в эту искусственную среду аминокислоты — строительный материал для белков. Разработанная ими методика призвана выяснить, как ведут себя в экстремальных условиях эти химические соединения.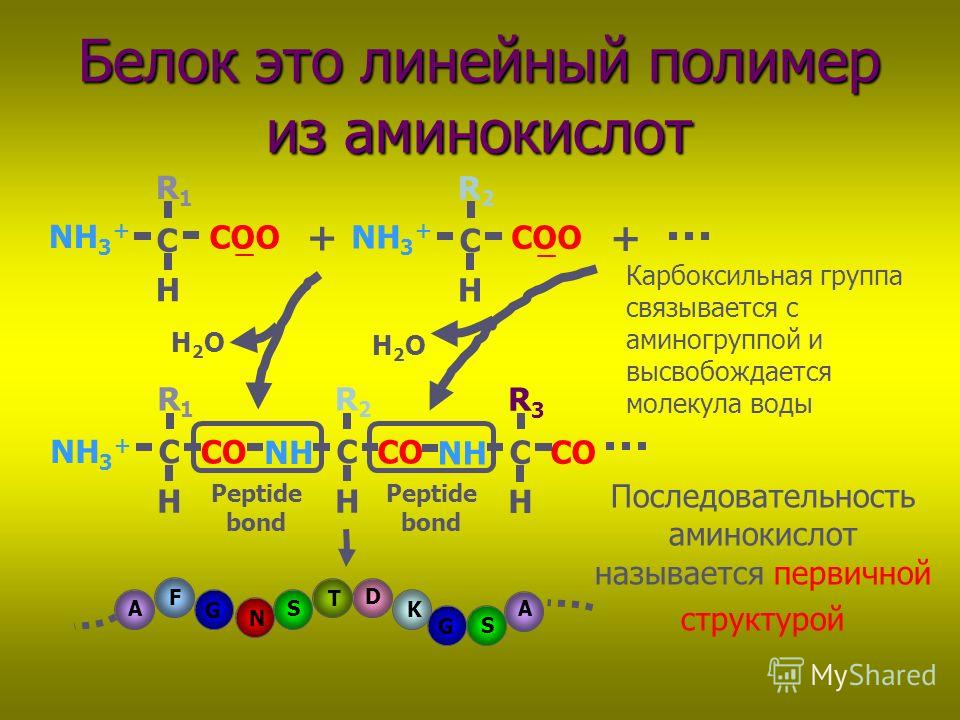
Учёные продолжают искать жизнь за пределами Земли. Но при отсутствии данных с других планет им приходится довольствоваться догадками и теориями.
Также по теме
Тайна второй планеты: чего ожидать от исследований ВенерыВ последнее время на международном уровне возрождается интерес к исследованию Венеры. Планета очень схожа с Землёй по размерам и…
Исследователи полагают, что инопланетные живые существа в чём-то похожи на землян.
«Химический состав жизни на Земле — по преимуществу производная всего нескольких избранных ингредиентов. Как и человеческое тело, вся известная жизнь на 95% состоит из водорода, кислорода и углерода. Атомы углерода охотно образуют связи как с другими атомами углерода, так и со многими другими элементами — поэтому мы и получились углеродной формой жизни. И именно поэтому изучение молекул, которые содержат углерод, — это так называемая органическая химия», — пишет в своей статье американский астрофизик Нил Деграсс Тайсон.
Однако оснований полагать, что жизнь на другой планете развивалась бы точно так же, как и на Земле, нет. Чтобы выяснить, какие варианты реальны, исследователи Университета Вальпараисо разработали новый подход к проблеме. Они решили испытать, как поведут себя земные аминокислоты в искусственно созданных «инопланетных» условиях.
«Наша главная цель — выяснить, есть ли у аминокислот структурные характеристики, которые приводят к большей устойчивости аминокислот во внеземных условиях, и что это могут быть за характеристики», — пояснила задачи исследовательской группы её руководитель Клэр Маммосер.
Суть метода состоит в следующем. Аминокислоты помещают в разную по свойствам среду. В лаборатории их подвергают воздействию ультрафиолета, очень высокой и очень низкой температуры, а также других не самых благоприятных с точки зрения земной жизни условий. Таким образом можно выяснить, как вели бы себя вещества на Марсе, Энцеладе (спутнике Сатурна) и Европе (луне Юпитера).
Строительный материал для белковВ ходе предварительных опытов исследователи подвергли различным испытаниям пять аминокислот, которые участвуют в образовании белков (а значит, способствуют развитию жизни), и десять аминокислот, которые этого не делают.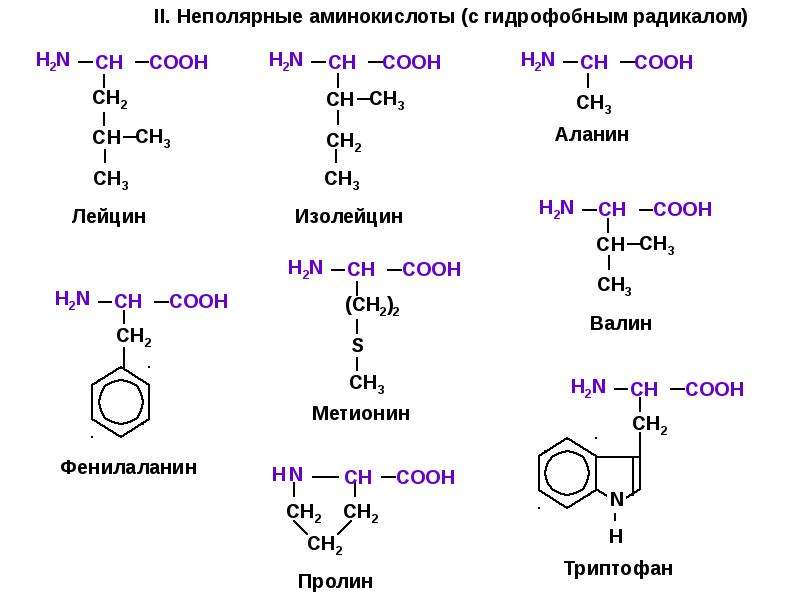
Также по теме
Как в «Звёздных войнах»: возможна ли жизнь на планете с двумя солнцамиУчёные построили компьютерную модель и выяснили, что на планете земного типа, которая обращается вокруг системы из двух звёзд, вполне…
Во время конференции по экспериментальной биологии, проводимой Американским обществом биохимии и молекулярной биологии в Чикаго, исследовательская группа заявила о первых успехах. Оказалось, что разработанный учёными метод позволяет не только отслеживать, в каких условиях и как будет вести себя аминокислота, но и определять, какие именно характеристики (например, размер) определяют её поведение. Однако конечная цель учёных не в том, чтобы проверить на прочность земные аминокислоты.
«При разных обстоятельствах вне Земли белки живых организмов не обязательно будут такими же, как у организмов на нашей планете. Это значит, что для их образования могут требоваться известные нам аминокислоты, которые, как пока считается, не участвуют в создании жизни», — поясняет Клэр Маммосер.
Следующий этап экспериментов будет включать в себя исследование аминокислот, найденных на Земле в местах падения метеоритов. И это ещё не всё. Для исследований учёные привлекут и аминокислоты, которые получались в ходе экспериментов по поиску «истоков жизни».
Один из первых таких экспериментов был проведён в 1953 году. Поместив смесь газов, предположительно соответствующую земной атмосфере в древности, Стэнли Миллер и Гарольд Юри подвергли её воздействию электрических разрядов. Они надеялись получить из неорганических молекул органические. Их эксперимент привёл к образованию нескольких аминокислот. Правда, на вопрос о том, как появилась жизнь на Земле, они так и не ответили.
Подсказки ЗемлиЕдинственное небесное тело, на которое ступал человек, за исключением Земли, — это Луна. Поэтому в поиске жизни в космосе исследователям приходится довольствоваться косвенными признаками: анализом атмосферы и попытками изучить, какие условия могут быть на той или иной планете в зависимости от её удалённости от ближайшей звезды и свойств этого местного солнца.
Чтобы сделать промежуточный вывод о том, возможно ли существование жизни на другой планете, исследователи сопоставляют данные о ней с тем, в каких условиях способны обитать хоть какие-нибудь живые организмы. Стоит отметить, что тут учёным иногда даёт подсказки Земля. Время от времени следы той или иной формы жизни находят в самых неожиданных местах. Так, в апреле 2017 года следы органики были обнаружены в минерале серпентине недалеко от Марианской впадины.
Найденные вещества производят микробы, которые обычно обитают в более доступных местах. Их обнаружение близ грязевого вулкана у самого глубокого места Тихого океана говорит о том, что живые организмы могут обитать на гораздо большей глубине, чем считалось ранее. Другими словами, сейчас известно далеко не всё об условиях, в которых может существовать жизнь. Вероятно, эксперимент американских учёных из Университета Вальпараисо расскажет и о том, из каких «кирпичиков» она может строиться на других планетах.
ничего, что наша ДНК наполовину совпадает с ДНК банана? — T&P
Биохимия — сравнительно молодая дисциплина, официально возникшая только в начале прошлого века.
 Но как наука о химическом составе организмов и процессах, лежащих в основе их жизни, она уже успела ответить на многие интересующие человечество вопросы. Аспирантка лаборатории компьютерного дизайна материалов МФТИ, PhD-студентка Сколтеха Анастасия Наумова рассказала T&P, почему именно углерод считается основой жизни и может ли азот занять его место, а также объяснила, почему нет смысла избавляться от холестерина и заниматься спортом менее получаса.
Но как наука о химическом составе организмов и процессах, лежащих в основе их жизни, она уже успела ответить на многие интересующие человечество вопросы. Аспирантка лаборатории компьютерного дизайна материалов МФТИ, PhD-студентка Сколтеха Анастасия Наумова рассказала T&P, почему именно углерод считается основой жизни и может ли азот занять его место, а также объяснила, почему нет смысла избавляться от холестерина и заниматься спортом менее получаса.Анастасия Наумова
Начнем с начала: вся жизнь на планете состоит из четырех основных типов веществ: белков, жиров, углеводов и нуклеиновых кислот. Примером такой кислоты служит всем известная молекула ДНК, которая является полимером. Самое простое объяснение структуры полимера — бусы. Как бусы состоят из бусинок, так и полимер состоит из мономеров. ДНК состоит из повторяющихся блоков — нуклеотидов, а они, в свою очередь, из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Всего существует четыре типа азотистых оснований: аденин, гуанин, тимин и цитозин, при этом аденин соединяется только с тимином, а гуанин — только с цитозином, это называется принципом комплементарности. Видовое разнообразие жизни на Земле, наши отличительные черты (цвет глаз, волос, состояние кожи и даже характер) зависят от взаимного расположения тех самых четырех азотистых оснований в цепочке ДНК. По странному стечению обстоятельств наша ДНК на 50% совпадает с ДНК банана, а на 35% — с ДНК нарцисса, но что это значит на практике для нас? Да ничего, в принципе. Сходство ДНК означает, что у нас и у банана есть определенное количество одинаковых кодирующих участков из нуклеотидов. Процессы передачи и реализации информации коротко описываются основной догмой молекулярной биологии: из ДНК синтезируется РНК, из РНК синтезируется белок. Синтез белка является одним из основных жизненно необходимых процессов: белок необходим нам для роста, развития, регенерации, и он также является ферментом.
Видовое разнообразие жизни на Земле, наши отличительные черты (цвет глаз, волос, состояние кожи и даже характер) зависят от взаимного расположения тех самых четырех азотистых оснований в цепочке ДНК. По странному стечению обстоятельств наша ДНК на 50% совпадает с ДНК банана, а на 35% — с ДНК нарцисса, но что это значит на практике для нас? Да ничего, в принципе. Сходство ДНК означает, что у нас и у банана есть определенное количество одинаковых кодирующих участков из нуклеотидов. Процессы передачи и реализации информации коротко описываются основной догмой молекулярной биологии: из ДНК синтезируется РНК, из РНК синтезируется белок. Синтез белка является одним из основных жизненно необходимых процессов: белок необходим нам для роста, развития, регенерации, и он также является ферментом.
Люди из азота
Как уже упоминалось, жизнь состоит из четырех основных типов веществ, один из которых — белок. В свою очередь, белок состоит из аминокислот. Структура аминокислоты достаточно простая: это углеродный каркас, на который крепятся атомы кислорода, азота, водорода, углерода и иногда серы.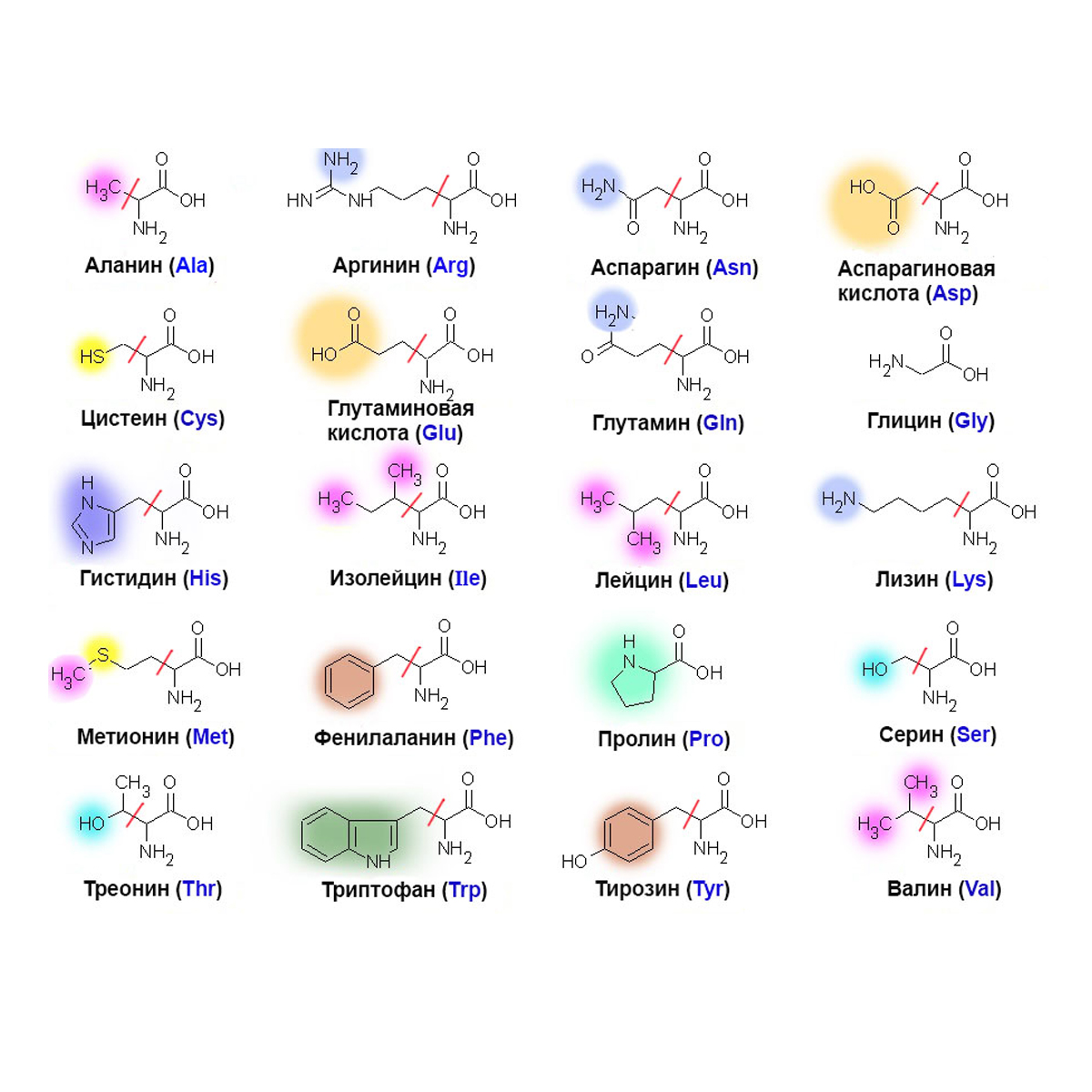 Аминокислоты крепятся одна к другой в порядке, закодированном в ДНК, составляют цепочки неограниченной длины, и получается белок. Итак: у каждой аминокислоты есть углеродный скелет, то есть белок состоит в основном из углерода, а без белка наша жизнь невозможна. Именно отсюда и появился тезис, что жизнь на нашей планете углеродная. Но в таблице Менделеева элементов больше, чем один, и возникает вопрос: может ли жизнь быть завязана на другом элементе? И если да, то на каком? Ответ напрашивается сам собой: логично было бы попробовать рассмотреть элемент, близкий к углероду, но с большим количеством электронов, а именно азот. Дополнительный электрон удобен тем, что азот имеет больше степеней окисления, — следовательно, на его основе можно создать больше соединений. Помимо этого, азот образует связи такого же типа, как и углерод. Что же будет, если мы попробуем составить из азота длинную цепочку? К сожалению, мы получим не новый тип жизни, а самую мощную из неатомных взрывчаток — ГНИВ (Гексанитрогексаазаизовюрцитан).
Аминокислоты крепятся одна к другой в порядке, закодированном в ДНК, составляют цепочки неограниченной длины, и получается белок. Итак: у каждой аминокислоты есть углеродный скелет, то есть белок состоит в основном из углерода, а без белка наша жизнь невозможна. Именно отсюда и появился тезис, что жизнь на нашей планете углеродная. Но в таблице Менделеева элементов больше, чем один, и возникает вопрос: может ли жизнь быть завязана на другом элементе? И если да, то на каком? Ответ напрашивается сам собой: логично было бы попробовать рассмотреть элемент, близкий к углероду, но с большим количеством электронов, а именно азот. Дополнительный электрон удобен тем, что азот имеет больше степеней окисления, — следовательно, на его основе можно создать больше соединений. Помимо этого, азот образует связи такого же типа, как и углерод. Что же будет, если мы попробуем составить из азота длинную цепочку? К сожалению, мы получим не новый тип жизни, а самую мощную из неатомных взрывчаток — ГНИВ (Гексанитрогексаазаизовюрцитан). Проблема в том, что полимеры азота нестабильны в условиях нашей планеты, для их стабильности необходимо гораздо более высокое давление, нежели атмосферное давление Земли. Но Вселенная огромна, и в большинстве мест давление больше, чем земное. Компьютерное моделирование атмосферы Юпитера показало, что полимеры из азота на этой планете будут даже стабильнее, чем из углерода. И таких мест с подходящими условиями гораздо больше, чем одно. Так что кто знает — может быть, во Вселенной уже давно существуют азотные люди.
Проблема в том, что полимеры азота нестабильны в условиях нашей планеты, для их стабильности необходимо гораздо более высокое давление, нежели атмосферное давление Земли. Но Вселенная огромна, и в большинстве мест давление больше, чем земное. Компьютерное моделирование атмосферы Юпитера показало, что полимеры из азота на этой планете будут даже стабильнее, чем из углерода. И таких мест с подходящими условиями гораздо больше, чем одно. Так что кто знает — может быть, во Вселенной уже давно существуют азотные люди.
Биология в быту
Помимо визионерских вопросов об азотной жизни, биохимия дает ответ на более насущные запросы — например, как правильно заниматься спортом и каким именно. Чтобы разобраться, обратимся к такой сложной схеме, как цикл Кребса. За ее открытие Ханс Кребс совместно с Фрицем Липманом в 1953 году получили Нобелевскую премию по медицине. Коротко суть схемы можно передать тезисом «жиры горят в пламени углеводов». Из этого объяснения следуют некоторые важные утверждения:
Нам необходимы углеводы
Если нет углеводов, а физическая нагрузка присутствует, организм начинает разрушать свой белок, чтобы добыть углеводы из него. Разрушение белка — это разрушение мышечной ткани, в то время как основная цель тренировок заключается в обратном. Стоит отметить, что углеводы нам нужны сложные, или медленные, состоящие из трех и более моносахаридов, единиц строения углеводов. Сложные углеводы содержатся в крупах, картофеле, печени, бобовых. Употребление этих продуктов постепенно повышает уровень глюкозы в крови, и организм успевает справляться с ее переработкой. В отличие от медленных углеводов, быстрые состоят из одного или двух моносахаридов. Они резко повышают уровень сахара в крови, а затем оседают в виде жира, потому что организм не может сразу переработать такое большое поступление глюкозы.
Разрушение белка — это разрушение мышечной ткани, в то время как основная цель тренировок заключается в обратном. Стоит отметить, что углеводы нам нужны сложные, или медленные, состоящие из трех и более моносахаридов, единиц строения углеводов. Сложные углеводы содержатся в крупах, картофеле, печени, бобовых. Употребление этих продуктов постепенно повышает уровень глюкозы в крови, и организм успевает справляться с ее переработкой. В отличие от медленных углеводов, быстрые состоят из одного или двух моносахаридов. Они резко повышают уровень сахара в крови, а затем оседают в виде жира, потому что организм не может сразу переработать такое большое поступление глюкозы.
Для поддержания горения (а по факту — окисления) жиров нам необходим кислород
С точки зрения энергетических затрат аэробные нагрузки (то есть с поступлением большого количества кислорода) в 19 раз более эффективны для сжигания жира, чем анаэробные (то есть почти бескислородные), так что польза от присутствия кислорода очевидна. Если вы все еще сомневаетесь, что для сжигания жира лучше бегать, чем поднимать штангу, то вот еще одна причина, и имя ей — пировиноградная кислота, которая является конечным продуктом распада глюкозы. Дальнейший метаболизм кислоты зависит от наличия воздуха. При аэробном варианте она вовлекается в уже упомянутый нами цикл Кребса, крутится в нем, что каждый раз дает нам энергию для продолжения тренировки. Раньше считалось, что только в анаэробном варианте, то есть без доступа кислорода, пировиноградная кислота превращается в хорошо знакомую всем молочную кислоту — именно она вызывает боль в мышцах после тренировки. Согласно последним исследованиям, виноградная кислота может появляться и при анаэробной тренировке, но только при нагрузках, превышающих 50% от максимального уровня выносливости человека. При такой интенсивной нагрузке жир снова перестает сжигаться, и разрушаются уже углеводы, что приводит к появлению молочной кислоты. Хорошая новость в том, что большинство тренировочных программ построено так, чтобы пик нагрузки не превышал тот самый порог 50% от максимума возможностей.
Если вы все еще сомневаетесь, что для сжигания жира лучше бегать, чем поднимать штангу, то вот еще одна причина, и имя ей — пировиноградная кислота, которая является конечным продуктом распада глюкозы. Дальнейший метаболизм кислоты зависит от наличия воздуха. При аэробном варианте она вовлекается в уже упомянутый нами цикл Кребса, крутится в нем, что каждый раз дает нам энергию для продолжения тренировки. Раньше считалось, что только в анаэробном варианте, то есть без доступа кислорода, пировиноградная кислота превращается в хорошо знакомую всем молочную кислоту — именно она вызывает боль в мышцах после тренировки. Согласно последним исследованиям, виноградная кислота может появляться и при анаэробной тренировке, но только при нагрузках, превышающих 50% от максимального уровня выносливости человека. При такой интенсивной нагрузке жир снова перестает сжигаться, и разрушаются уже углеводы, что приводит к появлению молочной кислоты. Хорошая новость в том, что большинство тренировочных программ построено так, чтобы пик нагрузки не превышал тот самый порог 50% от максимума возможностей.
По-настоящему аэробных вида спорта всего четыре: бег, плавание, бег на лыжах и гребля. Именно при занятии этими видами спорта задействовано более 70% от общего числа мышц, и в организм поступает достаточное количество кислорода. Помимо количества задействованных мышц, важна длительность нагрузки. В самом начале тренировки идет обратимая реакция расщепления креатинфосфата для поддержания энергии в организме. Креатинфосфат преимущественно содержится в мышечной и нервной ткани, и его запасов хватает примерно на первые 20 секунд тренировки. После разложения креатинфосфата самым простым с точки зрения организма вариантом получения энергии является расщепление глюкозы. В наших клетках глюкоза хранится в форме гликогена, который при нагрузке начинает расщепляться следом после креатинфосфата. Затем, когда организм израсходовал весь доступный запас гликогена, включается более сложная реакция расщепления жира. В среднем гликогена хватает на 20–30 минут, в зависимости от уровня подготовленности человека. Именно поэтому, если вы хотите похудеть, важно, чтобы тренировка была длительной, не менее получаса.
Именно поэтому, если вы хотите похудеть, важно, чтобы тренировка была длительной, не менее получаса.
Хороший, плохой, злой холестерин
Довольно много внимания в статье мы обращали на основные четыре элемента, но ведь мир ими не ограничивается. Например, существуют такие вещества, как жирные кислоты. Они бывают насыщенные и ненасыщенные. Основное отличие заключается в том, что насыщенные находятся в твердом состоянии, и они синтезируются в организме, то есть у нас нет необходимости в получении их извне. Ненасыщенные же находятся в жидком состоянии, они полезны для организма, но им не синтезируются. Такие жирные кислоты содержатся в тех организмах, которые дышат не так, как мы. Например, в растениях или рыбе. Помимо жирных кислот есть еще жиры, или липиды, к которым относится холестерин. Бытует мнение, что от холестерина нужно полностью избавляться, но на самом деле это совсем не так. Во-первых, холестерин входит в состав клеточных мембран и именно благодаря ему стенки клеток эластичны, то есть более устойчивы к внешним воздействиям. А во-вторых, холестерин относится к стероидным липидам и является родоначальником всех стероидных гормонов, например половых. Но несмотря на это, допускать повышенное содержание холестерина в организме не стоит, ведь всем нам хорошо известно, к чему это приводит.
А во-вторых, холестерин относится к стероидным липидам и является родоначальником всех стероидных гормонов, например половых. Но несмотря на это, допускать повышенное содержание холестерина в организме не стоит, ведь всем нам хорошо известно, к чему это приводит.
Иконки: 1) Kris Brauer, 2) Creative Stall, 3) irene hoffman — from the Noun Project.
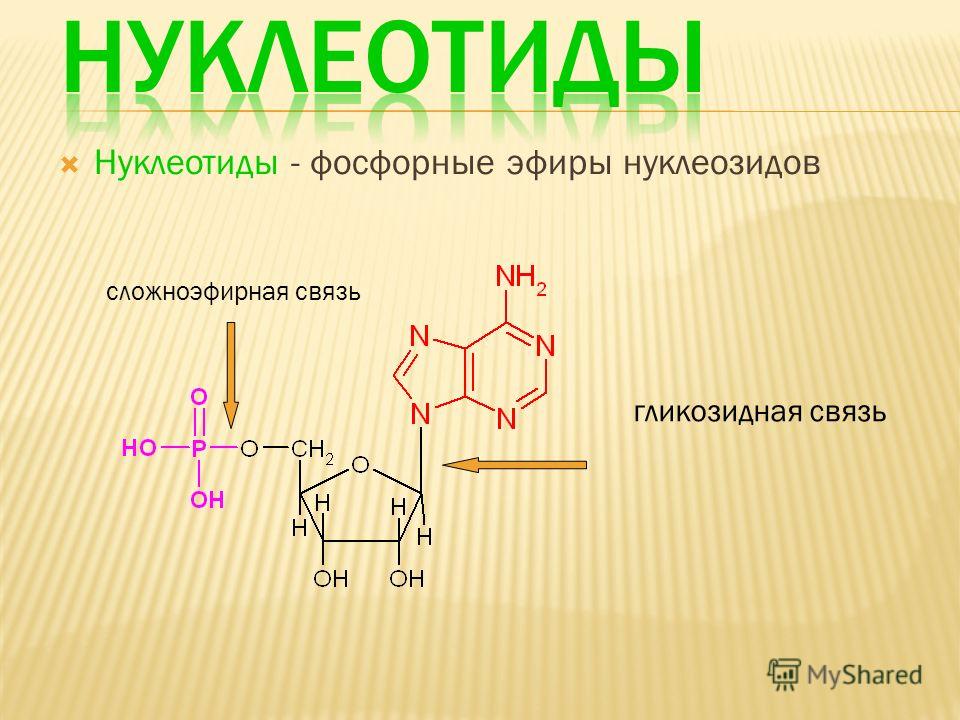
Строение белков
Среди органических веществ белки, или протеины, — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится 50 — 80% сухой массы клетки.
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты (рис. 1)
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—NH2) с основными свойствами, другая — карбоксильной группой (—COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность. через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами.
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Она уникальна для любого белка и определяет его форму, свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между —CO- и —NH- группами разных аминокислотных остатков полипептидной цепи. Водородные связи малопрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль — вторичная структура белка.
Третичная структура — трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация — глобула. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Нарушение природной структуры белка называют денатурацией. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде полипептидной цепи.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой.
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные белки
Другие заметки по биологии
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
в промышленности
Аминокислоты являются строительными блоками жизни и кодируются ДНК. Ферменты и структурные белки состоят из аминокислот и используются в качестве предшественников других важных биомолекул в организме. Кроме того, многие отрасли промышленности, от фармацевтики до пищевой промышленности, зависят от аминокислот.
Получение незаменимых аминокислот с помощью медицинских и фармацевтических препаратов
Незаменимые аминокислоты — это аминокислоты, которые организм не может производить сам, а это означает, что необходим внешний источник.Их можно получить с помощью диеты или пищевых добавок. Эти аминокислоты часто вводят в организм при внутривенной терапии, чтобы помочь в восстановлении послеоперационных пациентов.
Многие аминокислоты используются в пищевых добавках для лечения определенных состояний и расстройств. Например, триптофан применяют при нарушениях сна, депрессии, СДВГ, фенилкетонурии, нарколепсии и синдроме хронической усталости.
Аргинин часто используется в качестве ингредиента зубной пасты или других стоматологических продуктов для облегчения чувствительности зубов.Аргинин — это минерал, который действует подобно дентину и является важным регулятором чувствительности зубов. Диета, состоящая из всех аминокислот, углеводов и витаминов, рекомендуется для пациентов с дефектами пищеварительной системы или воспалительными заболеваниями кишечника
Незаменимые аминокислоты в пищевой промышленности
Усилители вкуса
Некоторые аминокислоты или их производные используются в качестве усилителей вкуса в пищевых продуктах. Например, глицин и аланин используются для усиления аромата и вкуса.Другим примером является глутамат натрия (MSG), производное глутаминовой кислоты, широко используемое в азиатских блюдах для усиления вкуса. MSG производит другой тип вкуса, называемый «умами», который жизненно важен для многих блюд.
Консерванты
Аминокислоты также широко используются в качестве консервантов в продуктах питания и напитках. Фруктовые соки часто консервируют с использованием цистеина в качестве антиоксиданта.
Фруктовые соки часто консервируют с использованием цистеина в качестве антиоксиданта.
Триптофан также используется с гистидином в качестве антиоксиданта для сохранения сухого молока.Фенилаланин и аспарагиновая кислота объединяются для получения дипептида аспартама. Аспартам примерно в 200 раз слаще сахарозы и часто используется в качестве низкокалорийной альтернативы искусственному подсластителю в безалкогольных напитках.
Повышение пищевой ценности
В некоторые продукты часто добавляют определенные аминокислоты для повышения их питательной ценности. Во многих продуктах растительного происхождения не хватает определенных аминокислот, которые можно вводить, чтобы обеспечить потребителя дополнительными питательными веществами для улучшения здоровья.Например, хлеб можно обогатить лизином, а соевые продукты — метионином. Лизин, метионин и глутаминовая кислота широко используются в кормах для животных.
Аминокислоты в химической промышленности
Многие аминокислоты используются в качестве прекурсоров для химических веществ, используемых в различных отраслях промышленности, таких как пестициды и гербициды.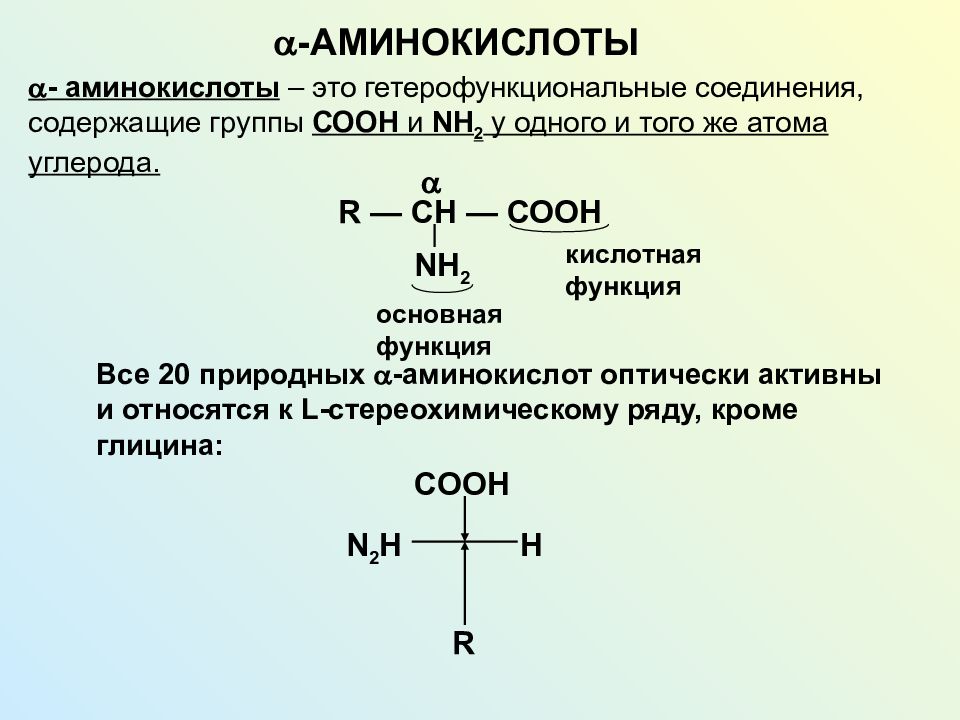 Например, треонин можно использовать для производства гербицида азтреонама, а глицин можно использовать для производства глифосата, другого гербицида.
Например, треонин можно использовать для производства гербицида азтреонама, а глицин можно использовать для производства глифосата, другого гербицида.
Аминокислоты в фитнес-индустрии
Несколько аминокислот (лейцин, валин, пролин, аланин, цистеин и изолейцин) используются в добавках для роста мышц и бодибилдинга.Наращивание мышечной массы включает в себя потребление белка и аминокислот, из которых строятся белки.
Промышленное производство аминокислот
Химический синтез
Аминокислоты могут быть получены путем химического синтеза, ферментативного катализа, экстракции из природных источников или ферментации. Химический синтез часто используется в промышленности для массового производства определенных аминокислот. Однако основным недостатком этого метода является то, что он дает две формы аминокислот, называемых энантиомерами, которые необходимо разделить, прежде чем их можно будет использовать.Таким образом, этот метод можно использовать только тогда, когда энантиомер аминокислоты не имеет значения для предполагаемого применения.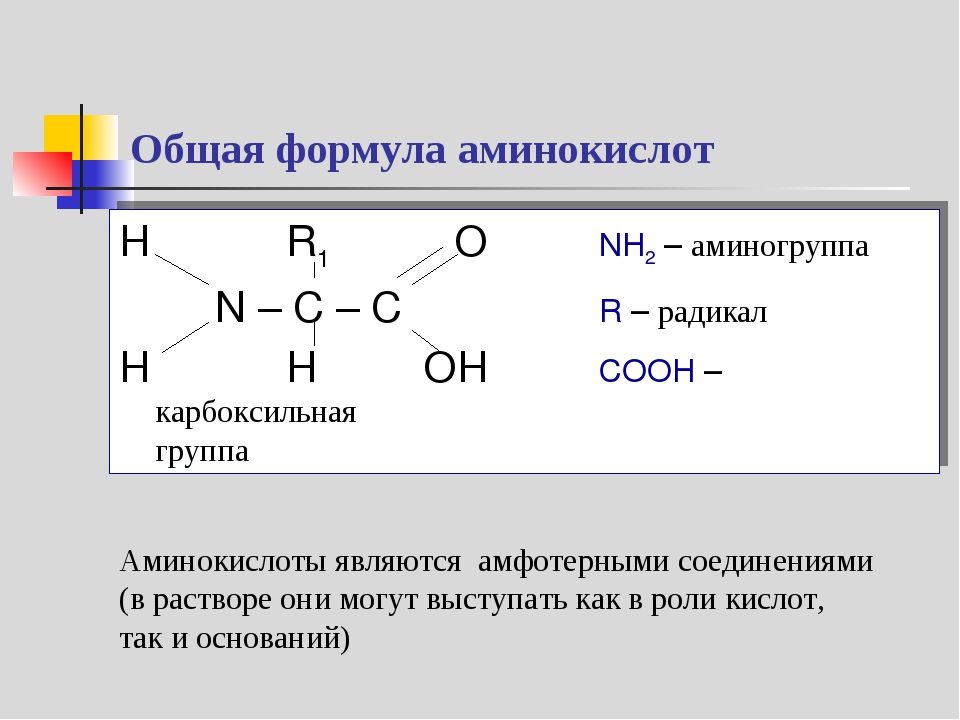
Ферментация
Ферментация в настоящее время используется только для лизина и глутаминовой кислоты, поскольку необходимы определенные штаммы мутантных бактерий, которые трудно получить. Глутаминовая кислота может быть модифицирована добавлением гидроксида натрия с получением глутамата натрия.
Дополнительное чтение
Вся жизнь на Земле состоит из одних и тех же 20 аминокислот.Ученые теперь думают, что знают, почему
Вопрос о том, как впервые возникла жизнь на Земле, люди задают себе с незапамятных времен. Хотя ученые относительно уверены в том, когда это произошло, не было однозначного ответа на вопрос, почему это произошло. Как аминокислоты, химические строительные блоки жизни, собрались примерно четыре миллиарда лет назад, чтобы создать первые белковые молекулы?
Хотя на этот вопрос до сих пор нет ответа, ученые делают новые открытия, которые могут помочь его сузить.Например, группа исследователей из Центра химической эволюции (CCT) Технологического института Джорджии недавно провела исследование, которое показало, как некоторые из самых ранних предшественников белковой молекулы могли спонтанно соединяться, образуя цепь.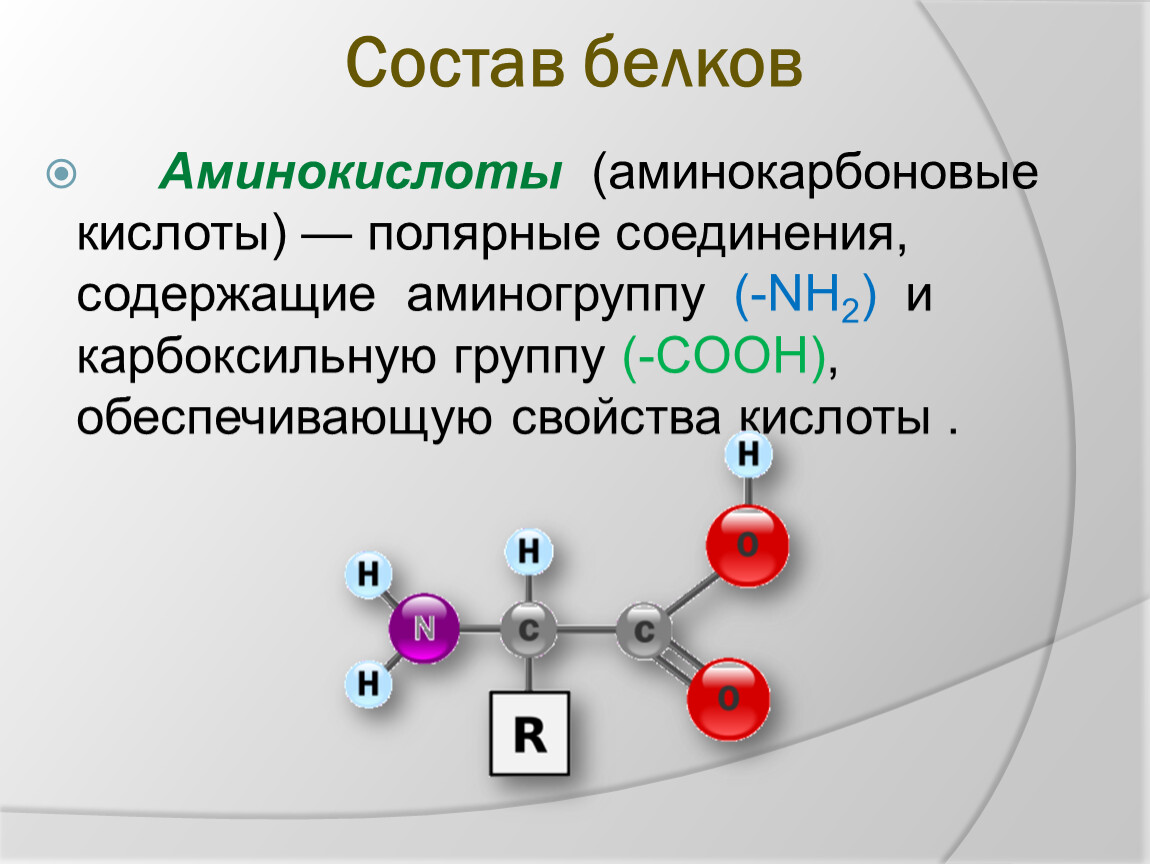
Исследование недавно появилось в журнале Proceedings of the National Academy of Sciences . Исследование проводилось под руководством доктора Морана Френкель-Пинтера из Технологического института Джорджии, в нем участвовали несколько исследователей из CCT, поддерживаемого НАСА и Национальным научным фондом (NSF), при содействии доктора.Люк Леман и доцент кафедры химии Scripps Research, некоммерческого медицинского исследовательского института.
Гадейский эон Земли для нас немного загадка, потому что геологических свидетельств того времени мало. Исследователи из Австралийского национального университета использовали крошечные зерна циркона, чтобы получить более четкое представление о ранней Земле. Предоставлено: NASAВ течение десятилетий у ученых были теории о том, как первые аминокислоты объединились, чтобы сформировать белковые молекулы. К сожалению, все попытки проверить эти теории пока не увенчались успехом.Как объяснил доктор Леман:
«Как химия привела к сложной жизни — один из самых захватывающих вопросов, над которыми задумывалось человечество.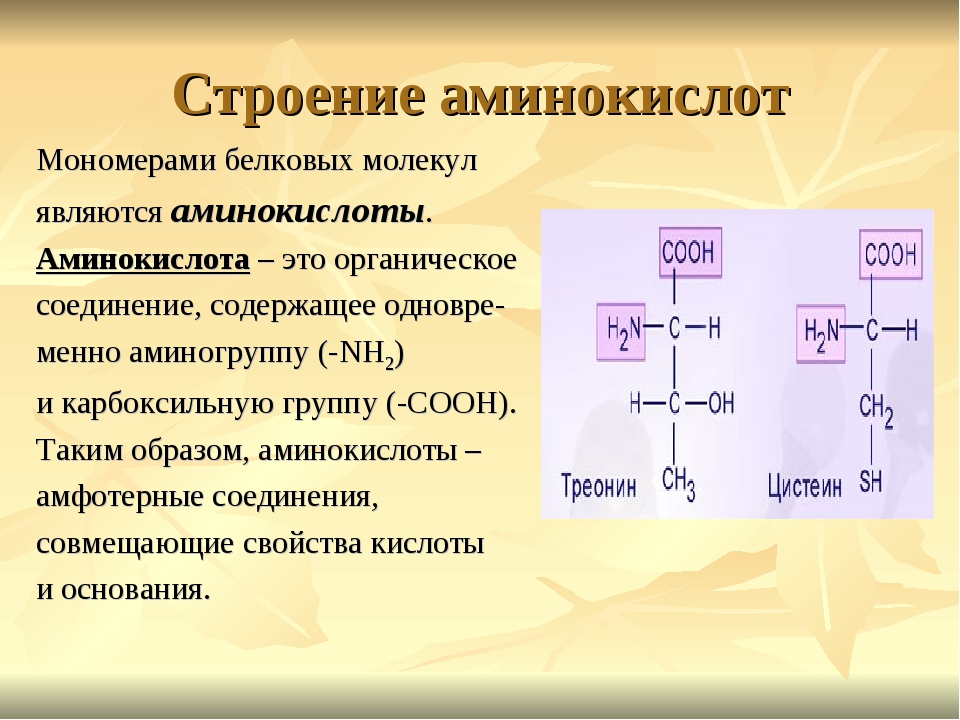 Существует много теорий о происхождении белков, но не так много экспериментальной лабораторной поддержки этих идей».
Существует много теорий о происхождении белков, но не так много экспериментальной лабораторной поддержки этих идей».
Для своего исследования исследовательская группа провела эксперимент, в котором небольшой набор аминокислот (лизин, аргинин и гистидин) был помещен вместе с тремя небиологическими аминокислотами-конкурентами. Затем кислоты подвергали воздействию условий, подобных тем, которые, как полагают, существовали на Земле во времена Гадейского эона (ок.4 миллиарда лет назад).
Это заключалось в том, что выбранные аминокислоты помещались в воду, содержащую гидроксикислоты, которые, как известно, облегчают реакции аминокислот и были бы обычным явлением на добиотической Земле. Затем смесь нагревали до 85 ° C (185 ° F), что ускорило процесс реакции и вызвало испарение воды. Полученные химические реакции были затем изучены.
Строительные блоки жизни могли образоваться на изначальной Земле спонтанно.Предоставлено: ocean.si.edu К их удивлению, биологические аминокислоты спонтанно сформировались в аккуратные сегменты, которые соединялись друг с другом с помощью групп β-аминов. Эти группы состоят из азота и водорода и весьма реакционноспособны. Однако они также являются частью ядра аминокислот, и другие амины, которые образуют боковые цепи, отходящие от ядра (которые использовались в этом эксперименте), часто более реакционноспособны. Как сказал доктор Френкель-Пинтер:
Эти группы состоят из азота и водорода и весьма реакционноспособны. Однако они также являются частью ядра аминокислот, и другие амины, которые образуют боковые цепи, отходящие от ядра (которые использовались в этом эксперименте), часто более реакционноспособны. Как сказал доктор Френкель-Пинтер:
«Нас удивило, что эта химия отдавала предпочтение связи β-амина, обнаруживаемой в белках, даже несмотря на то, что химические принципы могли привести нас к мысли, что небелковая связь будет предпочтительнее.Предпочтение белковоподобной связи над небелковой было примерно семь к одному».
Еще одним сюрпризом стало то, что биологические аминокислоты превзошли небиологические по реакционной способности. Последние кислоты, которые сегодня не встречаются в белках, могли химически реагировать так же хорошо (или лучше), чем биологические. Более того, команда ожидала, что включение этих кислот даст фору биологическим и может даже привести к созданию новых белков.
Однако реакции в основном приводили к образованию пептидов (двух или более аминокислотных строительных блоков, связанных вместе), которые были ближе к современным белкам.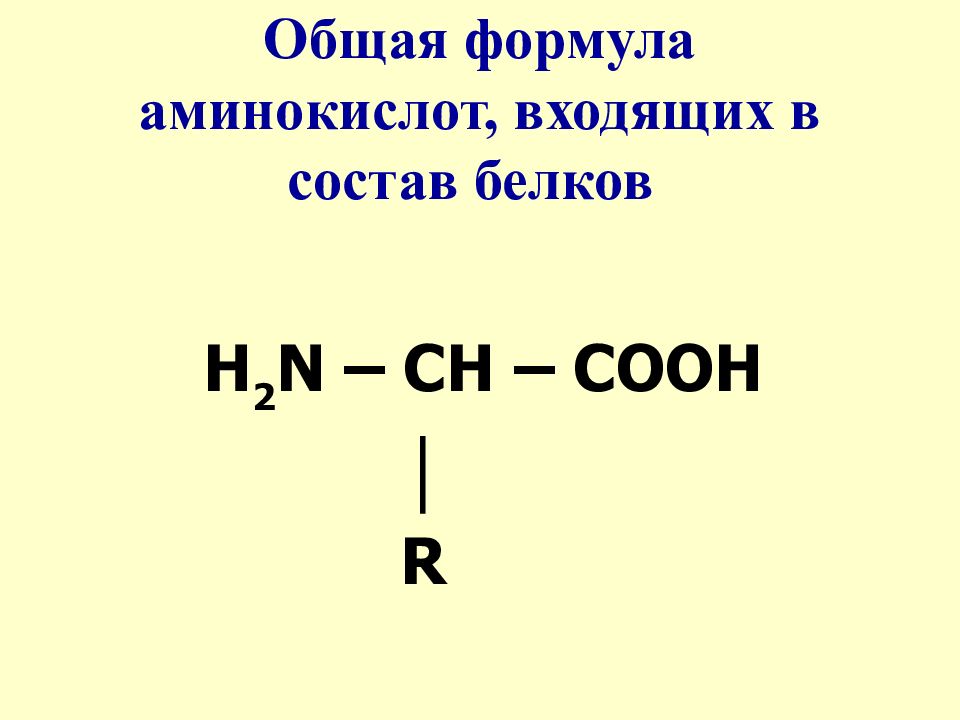 В частности, исследователи думали, что небиологические аминокислоты превзойдут биологическую аминокислоту, известную как лизин, и что лизин не сможет надежно образовывать цепи.
В частности, исследователи думали, что небиологические аминокислоты превзойдут биологическую аминокислоту, известную как лизин, и что лизин не сможет надежно образовывать цепи.
В обоих случаях они ошибались и вместо этого обнаружили, что лизин преимущественно проникает в цепи таким же образом, как это происходит с белками сегодня.Исходя из этого, команда выдвинула гипотезу о том, что предварительно изготовленные цепочки аминокислот, полезные в живых системах, развились до того, как жизнь нашла способ производить белки.
Тот факт, что их эксперимент показал, что биологические аминокислоты предпочтительнее небиологических, может также дать новое понимание того, почему только 20 аминокислот пошли на формирование жизни. Ученые считают, что во времена Гадейского эона на Земле присутствовало более 500 встречающихся в природе кислот. Как объяснила Лорен Уильямс, профессор биохимии Технологического института Джорджии:
Как объяснила Лорен Уильямс, профессор биохимии Технологического института Джорджии:
«Наша идея состоит в том, что жизнь началась со множества строительных блоков, которые были там, и выбрала их подмножество, но мы не знаем, сколько из них было отобрано на основе чистой химии или сколько биологических процессов сделали выбор.Глядя на это исследование, кажется, что современная биология может отражать эти ранние пребиотические химические реакции больше, чем мы думали».
«На добиотической Земле был бы гораздо больший набор аминокислот. Есть ли что-то особенное в этих 20 аминокислотах, или они просто застыли в какой-то момент времени в процессе эволюции?» Короче говоря, эксперимент предполагает, что виды аминокислот, используемых в белках, с большей вероятностью соединятся друг с другом, потому что они взаимодействуют более эффективно и имеют мало неэффективных побочных реакций.
Первые аминокислоты, вероятно, образовались в воде с оксикислотами, которые затем подверглись воздействию сухих условий.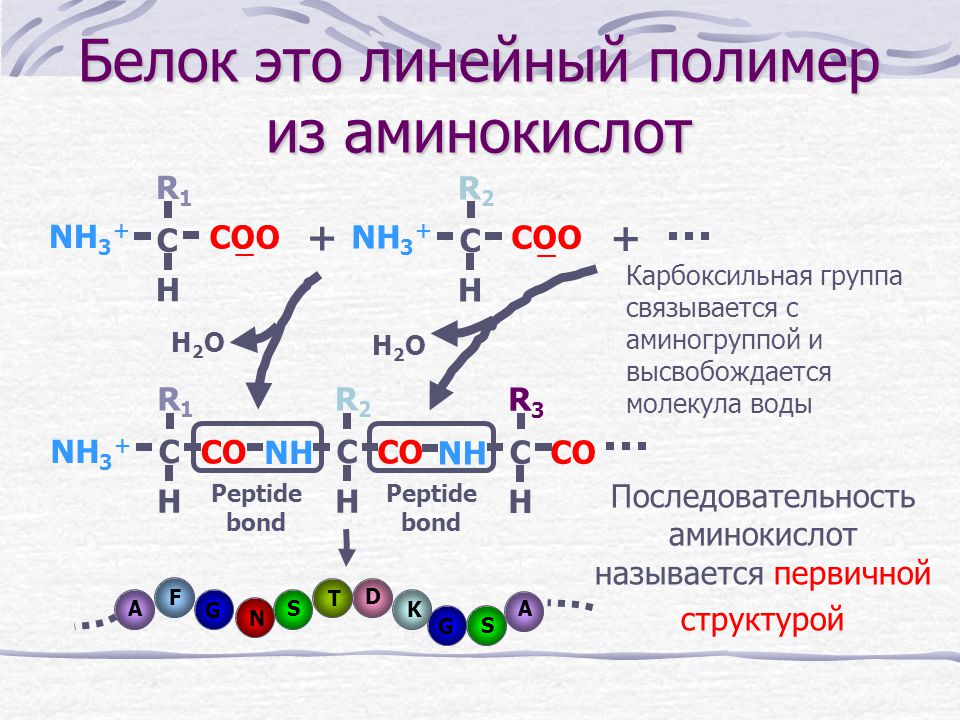 Предоставлено: Дэвид А. Агилар (CfA)
Предоставлено: Дэвид А. Агилар (CfA) . Короче говоря, эксперимент предполагает, что виды аминокислот, используемых в белках, с большей вероятностью соединятся друг с другом, потому что они реагируют вместе более эффективно и имеют мало неэффективных побочных реакций. Это также придает дополнительную достоверность теории о том, что большинство биологических полимеров образовались во влажном и сухом циклах, что исследователи CCT спорят годами.
Эта теория, утверждающая, что первые белки появились на омываемых дождем грязных равнинах или на выжженных солнцем скалах на берегу озера, расходится с более традиционным представлением о том, что строительные блоки жизни зависят от редких и катастрофических событий, а также от множества ингредиентов. чтобы всплыть. Показав, что это, вероятно, будет гораздо более простой процесс, это исследование может приблизить нас на один шаг к разгадке этой вековой тайны.
Это также может иметь значение для поиска жизни за пределами Земли.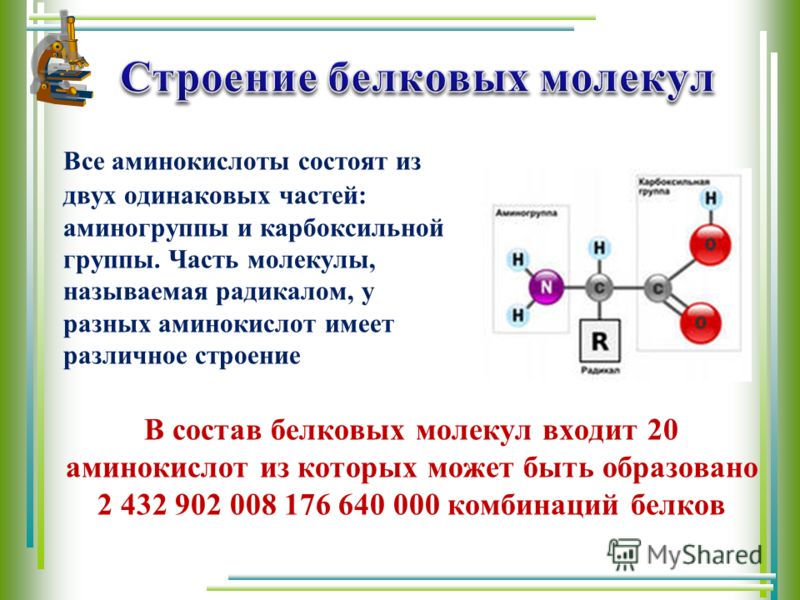 Если строительные блоки жизни реагируют по своей природе и притягиваются друг к другу, то это, вероятно, увеличивает вероятность того, что подобные химические реакции происходили где-то еще во Вселенной!
Если строительные блоки жизни реагируют по своей природе и притягиваются друг к другу, то это, вероятно, увеличивает вероятность того, что подобные химические реакции происходили где-то еще во Вселенной!
Дополнительная литература; Скриппс Исследования
Нравится:
Нравится Загрузка…
Органическая химия: Аминокислоты — это просто
Химические структуры фармацевтических препаратов на основе неприродных аминокислот. Субструктура, полученная из не встречающейся в природе аминокислоты, выделена красным цветом. Аминокислоты являются строительными блоками белков. Существует 22 различных аминокислоты, и они могут комбинироваться множеством способов, образуя огромное количество белков. Все аминокислоты, кроме глицина, являются хиральными молекулами, то есть они существуют в двух зеркальных или энантиомерных формах, только одна из которых встречается в природе. Эти неестественные энантиомеры аминокислот пользуются большим спросом у фармацевтической промышленности в качестве сырья для производства различных лекарств, в том числе антибиотика амоксициллина и апрепитанта против тошноты (см. изображение).
изображение).
Одним из методов, который широко используется для производства аминокислот, обычно является синтез Штрекера — химическая реакция, разработанная немецким химиком девятнадцатого века Адольфом Штрекером, которая объединяет альдегид, аммиак и цианистый водород для получения аминонитрила, который можно легко превратить в аминокислота. К сожалению, исходный синтез Штрекера позволяет получить только смесь энантиомерных форм аминокислоты.По этой причине многие химики проявляют интерес к разработке энантиоселективных или асимметричных каталитических реакций — реакций, в которых используется катализатор для селективного увеличения образования определенного энантиомера.
Уже сообщалось о некоторых каталитических энантиоселективных вариантах синтеза Штрекера, но есть проблемы. Многие требуют использования дорогостоящих источников цианида — обычно соединения, называемого триметилсилилцианидом, — и очень низких температур, чего трудно достичь в промышленных масштабах.
Абдул Маджид Сияд из Института химических и инженерных наук A*STAR и его коллеги разработали асимметричный протокол Штрекера, в котором в качестве источника цианида используется цианистый водород и который работает при комнатной температуре. Новая методология по-прежнему требует использования триметилсилилцианида, который, по мнению исследователей, необходим для достижения энантиоселективной реакции, но требуется лишь относительно небольшое каталитическое количество, и он регенерируется в реакции путем добавления более дешевого цианистого водорода.Сеяд и его коллеги показали, что они могут использовать свои условия для производства различных неестественных аминокислот.
Новая методология по-прежнему требует использования триметилсилилцианида, который, по мнению исследователей, необходим для достижения энантиоселективной реакции, но требуется лишь относительно небольшое каталитическое количество, и он регенерируется в реакции путем добавления более дешевого цианистого водорода.Сеяд и его коллеги показали, что они могут использовать свои условия для производства различных неестественных аминокислот.
Как и в случае с большинством разработок методологии, есть возможности для улучшения с помощью дальнейших исследований. «До сих пор мы занимались только аминокислотами с ароматическими боковыми цепями», — объясняет Саяд. «Мы хотели бы разработать процесс производства аминокислот с другими боковыми цепями. Цианистый водород стоит недорого, но он чрезвычайно токсичен, и для обращения с ним требуется специальное оборудование и обучение.Мы изучаем способы, с помощью которых мы могли бы генерировать его в реакции, что было бы намного безопаснее».
Растения и гусеницы производят один и тот же цианид
Дополнительная информация: Рамалингам, Б.
 и соавт. Замечательная асимметричная реакция Штрекера, катализируемая титаном, с использованием цианистого водорода при комнатной температуре. Advanced Synthesis and Catalysis 352, 2153–2158 (2010). dx.doi.org/10.1002/adsc.201000462
и соавт. Замечательная асимметричная реакция Штрекера, катализируемая титаном, с использованием цианистого водорода при комнатной температуре. Advanced Synthesis and Catalysis 352, 2153–2158 (2010). dx.doi.org/10.1002/adsc.201000462Предоставлено Агентство науки, технологий и исследований (A*STAR)
Цитата : Органическая химия: аминокислоты стали проще (4 мая 2011 г.) получено 7 января 2022 г. с https://физ.org/news/2011-05-chemistry-amino-acids-easy.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
новых аминокислот | Наука
Спустя шестнадцать лет после открытия 21-й аминокислоты, кодируемой ДНК, ученые обнаружили еще один из этих основных строительных блоков белка, закодированный в генах бактерий, производящих метан, обнаруженных в желудке коров.Открытие предполагает, что генетический код может быть более гибким, чем считали исследователи ранее.
В начале 1960-х годов ученые взломали генетический код, когда узнали, что четыре основания ДНК — A, T, G и C — собраны в 64 уникальных трехбуквенных слова или кодона. Первоначально исследователи думали, что кодоны могут представлять все известные аминокислоты, которые рибосомы внутри клеток связывают вместе в белки.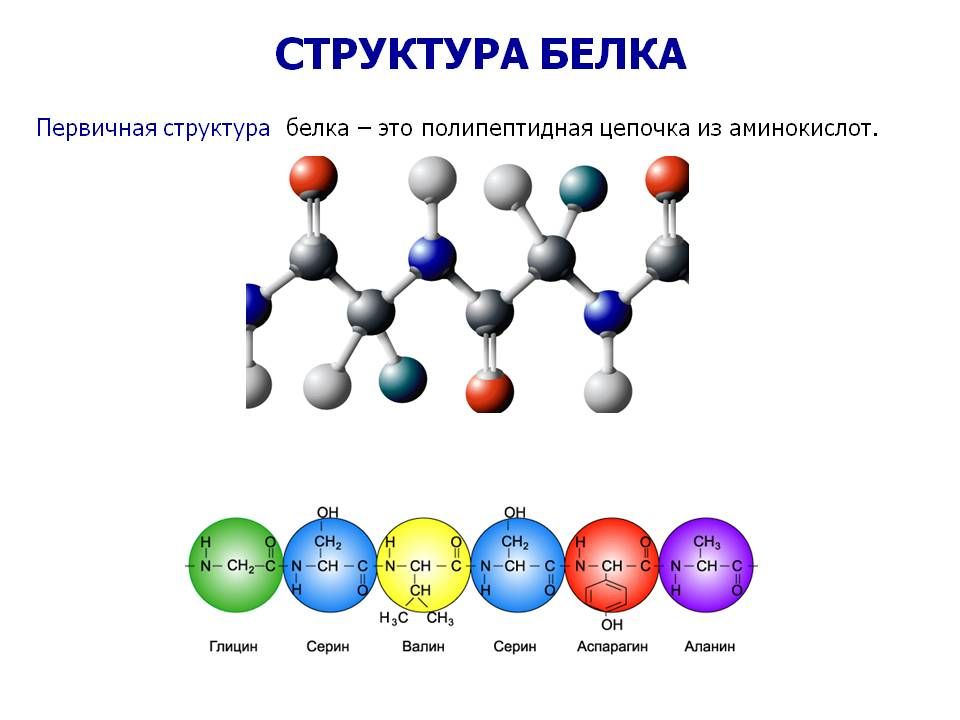 Но, как оказалось, клетки имеют кодоны кодонов только для 20 аминокислот и для простых команд, таких как «стоп», которые говорят рибосомам прекратить строить белковую цепь.Другие редкие аминокислоты, обнаруженные в белках, производятся путем переделки членов исходных 20 после того, как они были последовательно соединены с белком. Эти странные аминокислоты не закодированы в ДНК.
Но, как оказалось, клетки имеют кодоны кодонов только для 20 аминокислот и для простых команд, таких как «стоп», которые говорят рибосомам прекратить строить белковую цепь.Другие редкие аминокислоты, обнаруженные в белках, производятся путем переделки членов исходных 20 после того, как они были последовательно соединены с белком. Эти странные аминокислоты не закодированы в ДНК.
22-я аминокислота, пирролизин, отличается. Модифицированная форма лизина — одной из 20 распространенных аминокислот — пирролизина имеет собственный кодон, для которого он присвоил один из трех стоп-кодонов ДНК. Как и другие кодируемые аминокислоты, он использует специализированную молекулу транспортной РНК, чтобы доставить ее к рибосоме.Джо Кржицки и его коллеги из Университета штата Огайо в Колумбусе сообщают об открытии новой аминокислоты, ее кодона и специализированной тРНК в выпуске Science от 24 мая.
Как «стоп» стало означать «добавить пирролизин»? Генетик Джон Аткинс из Университета Юты в Солт-Лейк-Сити предполагает, что отчасти это может быть связано с тем, что рибосомному механизму требуется дополнительное время для обработки стоп-кодона.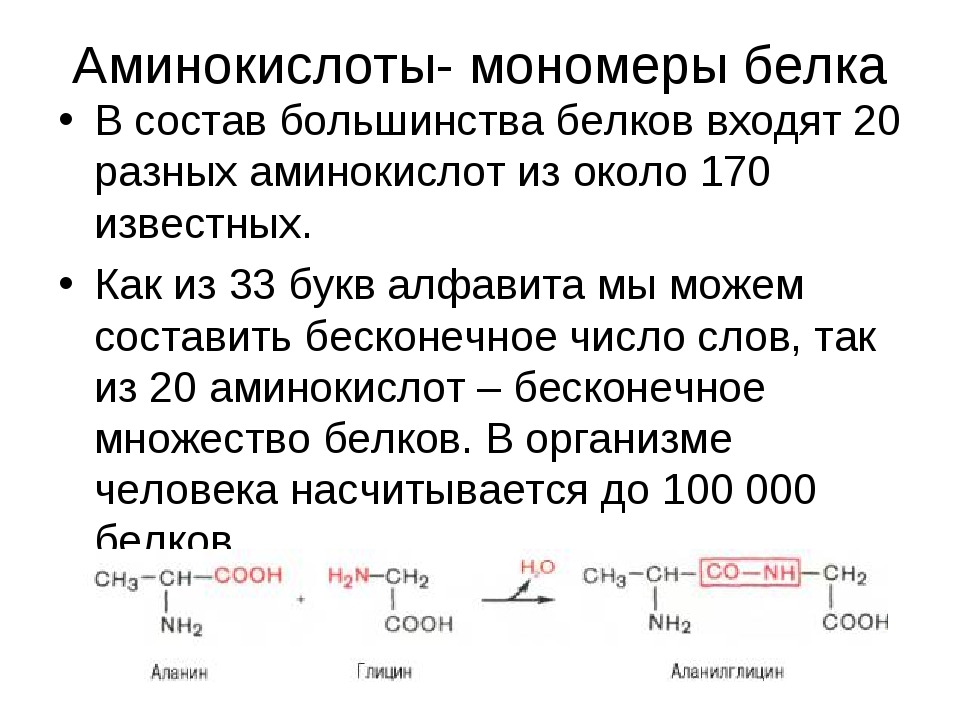 По его словам, система сборки белка может добавить 60 аминокислот к белковой цепи за время, необходимое для выполнения одной команды «стоп».Обычно встреча с пирролизиновым/стоп-кодоном отключает механизм. Но добавленное время дает тРНК, присоединенной к пирролизину, шанс вклиниться и подключиться к стоп-кодону, действие, которое добавляет пирролизин к концу цепи и перезапускает процесс построения цепи. Главный вывод, говорит Аткинс, «заключается в том, что процесс декодирования отличается разнообразием и богатством» и большей гибкостью, чем ожидалось от оригинальных декодеров ДНК в механизме конструирования белков.
По его словам, система сборки белка может добавить 60 аминокислот к белковой цепи за время, необходимое для выполнения одной команды «стоп».Обычно встреча с пирролизиновым/стоп-кодоном отключает механизм. Но добавленное время дает тРНК, присоединенной к пирролизину, шанс вклиниться и подключиться к стоп-кодону, действие, которое добавляет пирролизин к концу цепи и перезапускает процесс построения цепи. Главный вывод, говорит Аткинс, «заключается в том, что процесс декодирования отличается разнообразием и богатством» и большей гибкостью, чем ожидалось от оригинальных декодеров ДНК в механизме конструирования белков.
Похожие сайты
Сайт Кржицкого
http://www.biosci.ohio-state.edu/~microbio/jak.html
Трехмерное сравнение аминокислот
http://info.bio.cmu.edu/Courses/BiochemMols/AAViewer/AAVFrameset.htm
Рис. 3. Реакция окислительного дезаминирования D-аминокислот. Аминокислота подвергается зависимому от FAD ферментативному окислению с помощью оксидазы D-аминокислот (DAO) с образованием иминопроизводного в качестве промежуточного продукта. Затем иминокислота подвергается неферментативному гидролизу, который превращает субстрат в соответствующую α -кетокислоту и аммиак. |
Пептиды, содержащие D-аминокислоты, в биомедицинских подходах
Ссылки
1. Schleifer KH, Kandler O. Пептидогликановые типы стенок бактериальных клеток и их таксономические последствия. Бактериол Rev 1972; 36: 407–77. Search in Google Scholar
2. Dawson PE, Muir TW, Clark-Lewis I, Kent S. Синтез белков путем нативного химического лигирования. С 1994 г.; 266: 776–9.Поиск в Google Scholar
3. Милтон Рд, Милтон С., Кент С. Полный химический синтез D-фермента: энантиомеры протеазы ВИЧ-1 демонстрируют реципрокную хиральную субстратную специфичность [исправлено]. Наука 1992; 256: 1445–8. Поиск в Google Scholar
4. Шумахер Т.Н., Майр Л.М., Минор Д.Л., Милхоллен М.А., Берджесс М.В., Ким П. С. Идентификация лигандов D-пептида с помощью зеркального фагового дисплея. Наука 1996; 271: 1854–7. Поиск в Google Scholar
С. Идентификация лигандов D-пептида с помощью зеркального фагового дисплея. Наука 1996; 271: 1854–7. Поиск в Google Scholar
5. Эккерт Д.М., Малашкевич В.Н., Хонг Л.Х., Карр П.А., Ким П.С.Ингибирование проникновения ВИЧ-1: открытие ингибиторов D-пептида, нацеленных на карман gp41 спиральной спирали. Сотовый 1999; 99: 103–15. Поиск в Google Scholar
6. Liu M, Li C, Pazgier M, Li C, Mao Y, Lv Y, Gu B, Wei G, Yuan W, Zhan C, Lu WY. D-пептидные ингибиторы взаимодействия p53–MDM2 для таргетной молекулярной терапии злокачественных новообразований. Proc Natl Acad Sci USA 2010; 107: 14321–6. Поиск в Google Scholar
7. Гудман М., Хорев М. О концепции линейных модифицированных ретропептидных структур.Acc Chem Res 1979; 12: 1–7. Поиск в Google Scholar
8. Guichard G, Benkirane N, Zeder-Lutz G, Van Regenmortel M, Briand J-P, Muller S. Антигенная мимикрия природных L-пептидов с ретро-инверсо-пептидомиметиками. Proc Natl Acad Sci USA 1994; 91: 9765–9. Поиск в Google Scholar
9. Wei XL, Zhan CY, Shen Q, Fu W, Xie C, Gao J, Peng CM, Zheng P, Lu WY. D-пептидный лиганд никотин-ацетилхолиновых рецепторов для адресной доставки лекарств в головной мозг. Angew Chem Int Ed 2015; 54: 3023–7. Поиск в Google Scholar
Wei XL, Zhan CY, Shen Q, Fu W, Xie C, Gao J, Peng CM, Zheng P, Lu WY. D-пептидный лиганд никотин-ацетилхолиновых рецепторов для адресной доставки лекарств в головной мозг. Angew Chem Int Ed 2015; 54: 3023–7. Поиск в Google Scholar
10.Li C, Pazgier M, Li J, Li C, Liu M, Zou G, Li Z, Chen J, Tarasov SG, Lu WY. Ограничения ретро-инверсо-изомеризации пептидов в молекулярной мимикрии. J Биол Хим 2010; 285: 19572–81. Search in Google Scholar
11. Li J, Kuang Y, Gao Y, Du X, Shi J, Xu B. D-аминокислоты повышают селективность и образуют супрамолекулярные гидрогели нестероидных противовоспалительных препаратов. (НПВП). J Am Chem Soc 2013; 135: 542–5. Поиск в Google Scholar
12. Li JY, Gao Y, Kuang Y, Shi JF, Du XW, Zhou J, Wang HM, Yang ZM, Xu B.Дефосфорилирование производных D-пептида с образованием биофункциональных супрамолекулярных нановолокон/гидрогелей и их потенциальное применение для внутриклеточной визуализации и внутриопухолевой химиотерапии. J Am Chem Soc 2013; 135: 9907–14.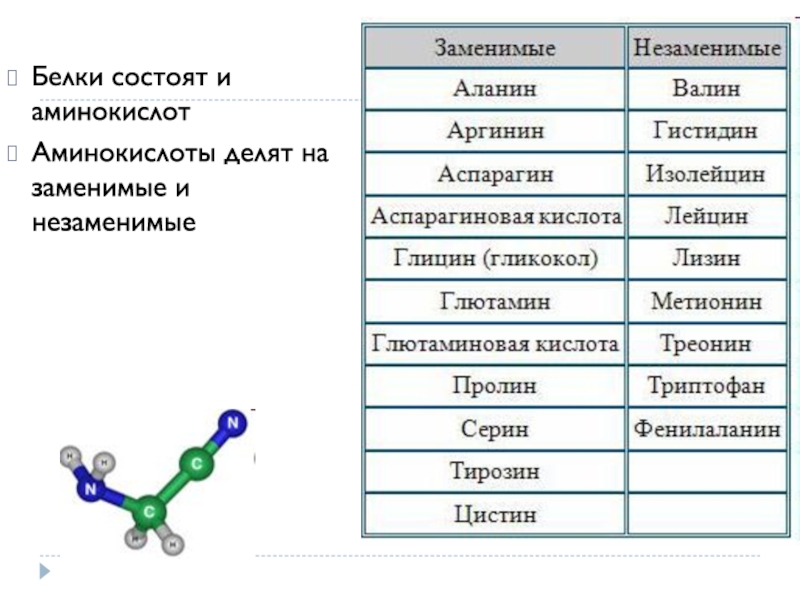 Search in Google Scholar
Search in Google Scholar
13. Yang Z, Liang G, Xu B. Ферментативное гидрогелеобразование малых молекул. Acc Chem Res 2008; 41: 315–26. Search in Google Scholar
14. Zhou J, Du XW, Li J, Yamagata N, Xu B. Таурин повышает клеточное поглощение малых D-пептидов для инструктируемой ферментами внутриклеточной молекулярной самосборки.J Am Chem Soc 2015; 137: 10040–3. Search in Google Scholar
15. Zhao F, Gao Y, Shi J, Browdy HM, Xu B. Новый анизотропный супрамолекулярный гидрогель с высокой стабильностью в широком диапазоне pH. Ленгмюр 2010; 27: 1510–2. Search in Google Scholar
16. Brückner H, Fujii N. D-аминокислоты: в химии, науках о жизни и биотехнологии. Weinheim, Germany: Wiley-VCH, 2011. Search in Google Scholar
17. Tugyi R, Uray K, Ivan D, Fellinger E, Perkins A, Hudecz F. Частичная замена D-аминокислот: улучшенная ферментативная стабильность и сохраненное распознавание антител пептида эпитопа MUC2.Proc Natl Acad Sci USA 2005; 102: 413–8. Поиск в Google Scholar
18. Уэйд Д., Боман А., Волин Б., Дрейн С., Андреу Д., Боман Х.Г., Меррифилд Р.Б. Антибиотические пептиды, образующие каналы, содержащие все аминокислоты D. Proc Natl Acad Sci USA 1990; 87: 4761–5. Search in Google Scholar
Уэйд Д., Боман А., Волин Б., Дрейн С., Андреу Д., Боман Х.Г., Меррифилд Р.Б. Антибиотические пептиды, образующие каналы, содержащие все аминокислоты D. Proc Natl Acad Sci USA 1990; 87: 4761–5. Search in Google Scholar
19. Eller M, Jarv J, Toomik R, Ragnarsson U, Ekman P, Engstrom L. Субстратная специфичность протеинкиназы-c изучена с пептидами, содержащими D-аминокислоту. остатки. Дж. Биохим, 1993; 114: 177–80. Поиск в Google Scholar
20.Меррифилд Э.Л., Митчелл С.А., Убах Дж., Боман Х.Г., Андреу Д., Меррифилд Р.Б. D-энантиомеры гибридов цекропина-мелиттина из 15 остатков. Int J Pept Protein Res 1995; 46: 214–20. Search in Google Scholar
21. Shi J, Du X, Yuan D, Zhou J, Zhou N, Huang Y, Xu B. D-аминокислоты модулируют клеточный ответ ферментативно инструктированных супрамолекулярных нановолокон небольшие пептиды. Биомакромолекулы 2014; 15: 3559–68. Поиск в Google Scholar
22. Ван Х., Ван И, Хан А, Цай Ю, Сяо Н, Ван Л, Дин Д, Ян З.Обогащение клеточных мембран самособирающимися D-пептидами для инженерии клеточной поверхности. Интерфейсы Appl Mater ACS 2014; 6: 9815–21. Поиск в Google Scholar
Интерфейсы Appl Mater ACS 2014; 6: 9815–21. Поиск в Google Scholar
23. Liang G, Yang Z, Zhang R, Li L, Fan Y, Kuang Y, Gao Y, Wang T, Lu WW, Xu B. Супрамолекулярный гидрогель D- аминокислотный дипептид для контролируемого высвобождения лекарственного средства in vivo. Ленгмюр 2009; 25: 8419–22. Поиск в Google Scholar
24. Li XM, Du XW, Li JY, Gao Y, Pan Y, Shi JF, Zhou N, Xu B. Введение D-аминокислоты или простого гликозида в небольшие пептиды для позволяют супрамолекулярным гидрогелатам противостоять протеолизу.Ленгмюр 2012; 28: 13512–7. Поиск в Google Scholar
25. д’Амур Д., Деснойерс С., д’Сильва И., Пуарье Г.Г. Реакции поли(АДФ-рибозил)ирования в регуляции ядерных функций. Биохим Дж. 1999; 342: 249–68. Поиск в Google Scholar
26. Pardridge WM. Рецепторно-опосредованный транспорт пептидов через гематоэнцефалический барьер. Эндокр, ред. 1986 г.; 7: 314–30. Поиск в Google Scholar
27. Futaki S, Suzuki T, Ohashi W, Yagami T, Tanaka S, Ueda K, Sugiura Y. Богатые аргинином пептиды.Обильный источник мембранопроницаемых пептидов, обладающих потенциалом в качестве носителей для внутриклеточной доставки белков. Дж. Биол. Хим. 2001; 276: 5836–40. Поиск в Google Scholar
Богатые аргинином пептиды.Обильный источник мембранопроницаемых пептидов, обладающих потенциалом в качестве носителей для внутриклеточной доставки белков. Дж. Биол. Хим. 2001; 276: 5836–40. Поиск в Google Scholar
28. Levine AJ, Momand J, Finlay CA. Ген-супрессор опухоли p53. Природа 1991; 351: 453–6. Поиск в Google Scholar
29. Haupt Y, Maya R, Kazaz A, Oren M. Mdm2 способствует быстрой деградации p53. Природа 1997; 387: 296–9. Поиск в Google Scholar
30. Wong C-H, Whitesides GM. Ферменты в синтетической органической химии.Cambridge, USA: Academic Press, 1994. Поиск в Google Scholar
31. Wehofsky N, Pech A, Liebscher S, Schmidt S, Komeda H, Asano Y, Bordusa F. Протеазы, специфичные для D-аминокислот, и нативные all-L- белки: удобная комбинация для полусинтеза. Angew Chem Int Ed 2008; 47: 5456–60. Поиск в Google Scholar
32. Naghavi M, Wang H, Lozano R, Davis A, Liang X, Zhou M, Vollset SE, Ozgoren AA, Abdalla S, Abd-Allah F. Global, Regional, и национальная возрастно-половая смертность от всех причин и причинно-специфическая смертность по 240 причинам смерти, 1990–2013 гг.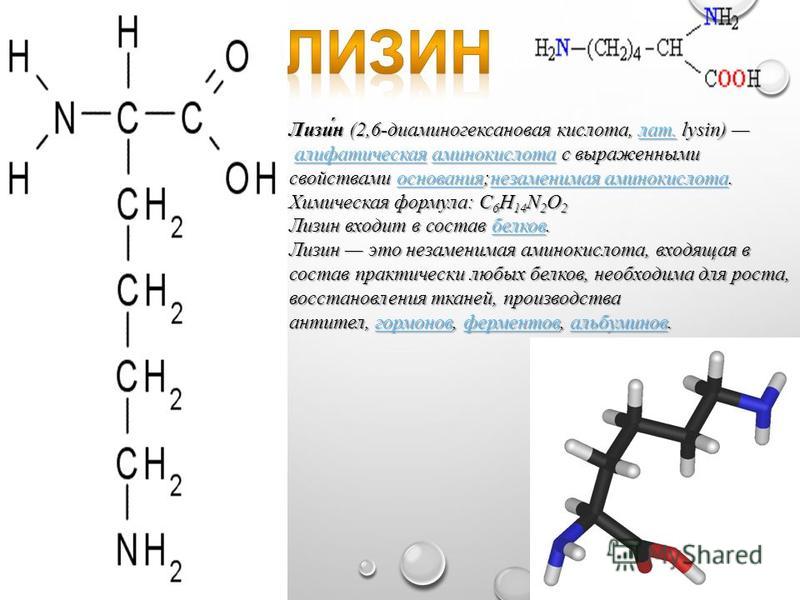 : систематический анализ для исследования глобального бремени болезней, 2013 г.Ланцет 2015; 385: 117–71. Поиск в Google Scholar
: систематический анализ для исследования глобального бремени болезней, 2013 г.Ланцет 2015; 385: 117–71. Поиск в Google Scholar
33. Чжао Ф., Ма М.Л., Сюй Б. Молекулярные гидрогели терапевтических агентов. Chem Soc Rev 2009; 38: 883–91. Поиск в Google Scholar
34. Gao Y, Kuang Y, Guo Z-F, Guo Z, Krauss IJ, Xu B. Молекулярная самосборка под руководством фермента дает нановолокна и супрамолекулярный гидрогель производного таксола. J Am Chem Soc 2009; 131: 13576–7. Поиск в Google Scholar
35. Burtis CA, Ashwood ER, Burns DE. Учебник Титца по клинической и молекулярной диагностике.Сондерс, Сент-Луис, США: Elsevier, 2006. Поиск в Google Scholar
36. Yang Z, Xu K, Guo Z, Guo Z, Xu B. Внутриклеточное ферментативное образование нановолокон приводит к гидрогелированию и регулируемой гибели клеток. Adv Mater 2007; 19: 3152–6. Поиск в Google Scholar
37. Kuang Y, Shi J, Li J, Yuan D, Alberti KA, Xu Q, Xu B. Перицеллюлярный гидрогель/нанонетки ингибируют раковые клетки. Angew Chem Int Ed 2014; 53: 8104–7. Поиск в Google Scholar
Angew Chem Int Ed 2014; 53: 8104–7. Поиск в Google Scholar
38. Li J, Kuang Y, Shi J, Zhou J, Medina JE, Zhou R, Yuan D, Yang C, Wang H, Yang Z.Управляемая ферментом внутриклеточная молекулярная самосборка для повышения активности цисплатина против устойчивых к лекарствам клеток рака яичников. Angew Chem Int Ed 2015; 127: 13505–9. Поиск в Google Scholar
39. Yang C, Chu L, Zhang Y, Shi Y, Liu J, Liu Q, Fan S, Yang Z, Ding D, Kong D. Динамическая биостабильность, биораспределение и токсичность супрамолекулярных нановолокон на основе L/D-пептидов. Интерфейсы Appl Mater ACS 2015; 7: 2735–44. Поиск в Google Scholar
40. Ou C, Zhang J, Shi Y, Wang Z, Wang L, Yang Z, Chen M.Пептидный гидрогель с допингом D-аминокислот для получения клеточной колонии. РСК Ад 2014; 4: 9229–32. Search in Google Scholar
41. Marchesan S, Easton C, Styan K, Waddington L, Kushkaki F, Goodall L, McLean K, Forsythe J, Hartley P. Эффекты хиральности в каждой позиции аминокислоты в трипептиде самосборка в гидрогелевые биоматериалы.


 Благодаря высокой биологической активности и широкому использованию их производство постоянно растет.Основными потребителями аминокислот являются пищевая, биотехнологическая, фармацевтическая промышленность, медицина и животноводство (Martínez-Rodríguez et al. 2010; Sorokina et al. 2010).
Благодаря высокой биологической активности и широкому использованию их производство постоянно растет.Основными потребителями аминокислот являются пищевая, биотехнологическая, фармацевтическая промышленность, медицина и животноводство (Martínez-Rodríguez et al. 2010; Sorokina et al. 2010).
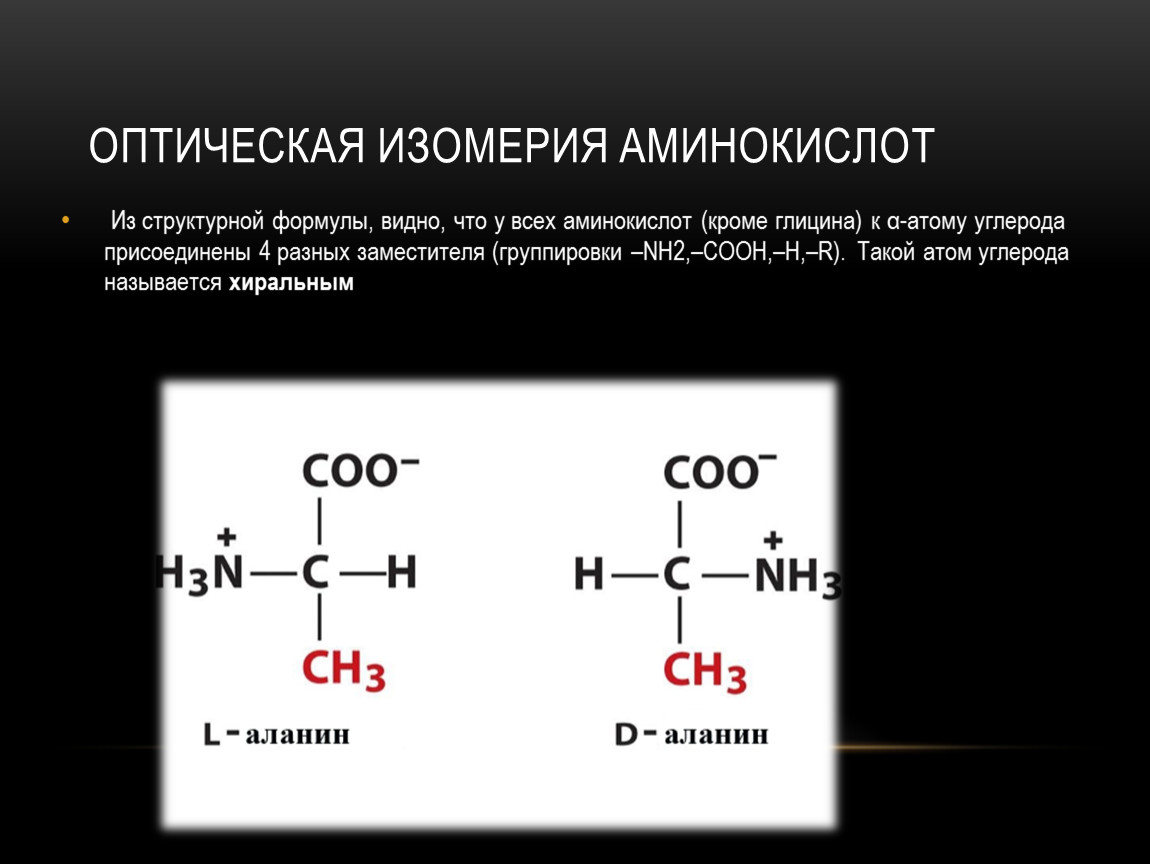
 Поэтому стереоизомеры аминокислот, соответствующие по своей конфигурации α -углеродному атому L,D-глицеральдегида, также обозначаются буквами L или D, хотя стереоизомерия аминокислот определяется расположением аминогруппы у хирального атома.Если в проекционной формуле Фишера аминогруппа расположена слева от центра хиральности, то она соответствует L-аминокислоте, иначе – ее D-стереоизомеру (см. рисунок 1).
Поэтому стереоизомеры аминокислот, соответствующие по своей конфигурации α -углеродному атому L,D-глицеральдегида, также обозначаются буквами L или D, хотя стереоизомерия аминокислот определяется расположением аминогруппы у хирального атома.Если в проекционной формуле Фишера аминогруппа расположена слева от центра хиральности, то она соответствует L-аминокислоте, иначе – ее D-стереоизомеру (см. рисунок 1). Для разделения аминокислот на оптические антиподы применяют химические, микробиологические и особенно ферментативные методы.
Для разделения аминокислот на оптические антиподы применяют химические, микробиологические и особенно ферментативные методы. е. к рацемизации, которая чаще всего ускоряется при влияние некоторых физических и химических факторов, например, в присутствии кислотных или щелочных примесей (Martínez-Rodríguez et al. 2010) (рис. 2).
е. к рацемизации, которая чаще всего ускоряется при влияние некоторых физических и химических факторов, например, в присутствии кислотных или щелочных примесей (Martínez-Rodríguez et al. 2010) (рис. 2). Экспериментально показано, что его частота для свободных и связанных аминокислот уменьшается в следующем порядке (Cartus 2012): Cys > Asp > Pro > Glu > Met > His > Leu > Lys > Phe > Ala > Tyr > Arg > Иль > Сер > Тр.
Экспериментально показано, что его частота для свободных и связанных аминокислот уменьшается в следующем порядке (Cartus 2012): Cys > Asp > Pro > Glu > Met > His > Leu > Lys > Phe > Ala > Tyr > Arg > Иль > Сер > Тр.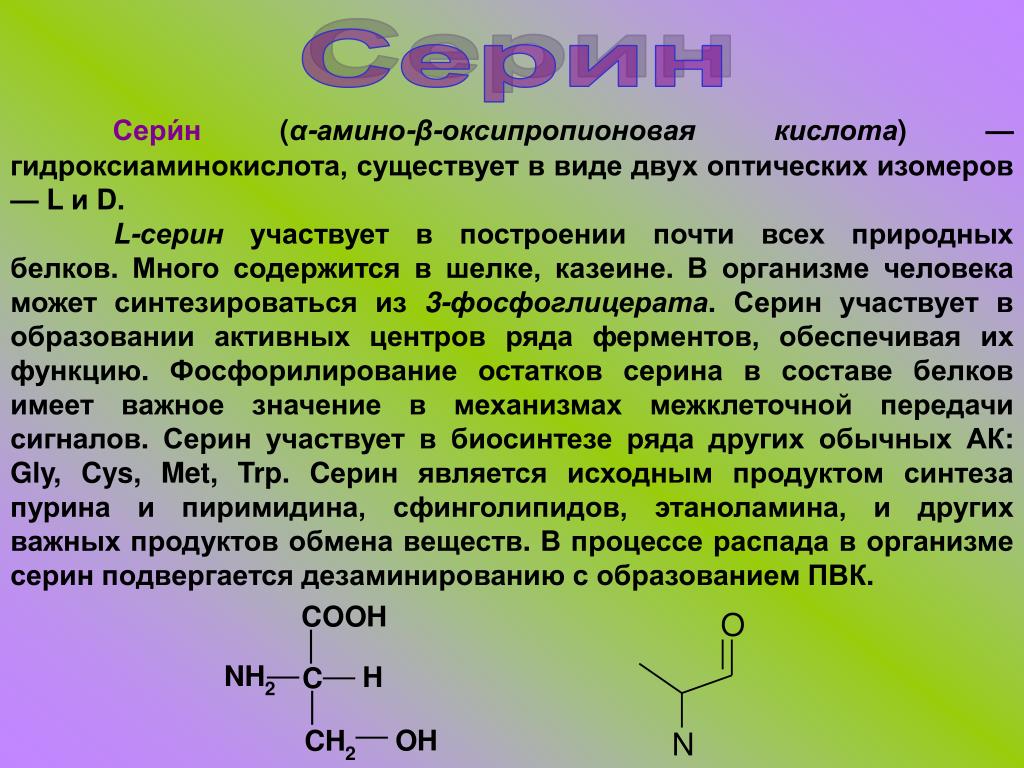 табл. 1).
табл. 1).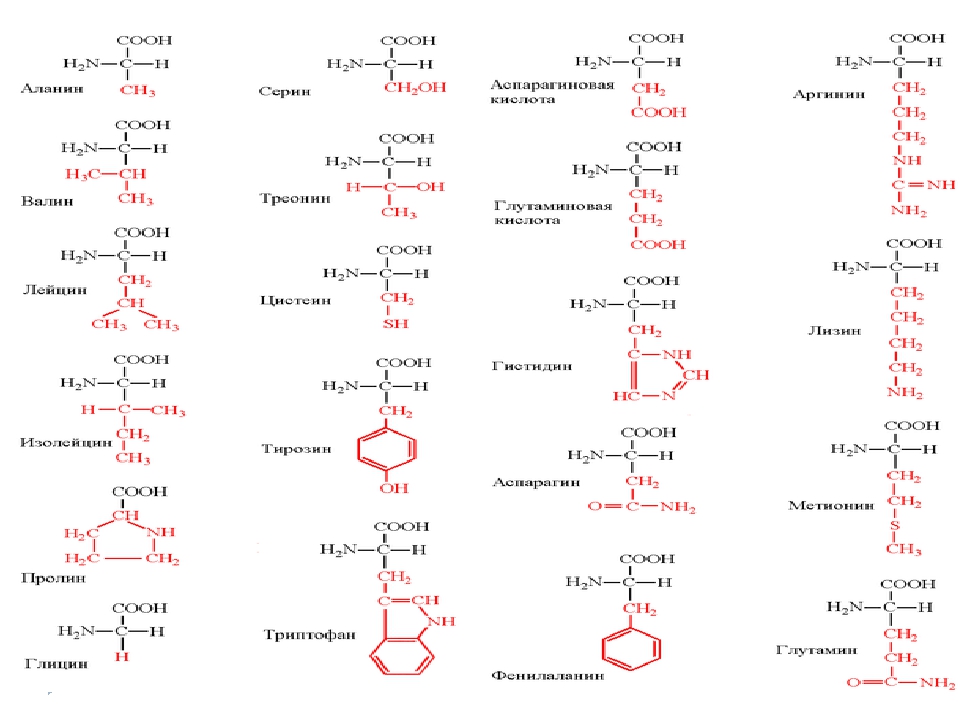 2013; Хенер и др. 2018).
2013; Хенер и др. 2018).
 Так как углеродистые хондриты, к которым относится этот метеорит, образовали 4.5 миллиардов лет назад авторы (Cronin and Pizzarello 1997) выдвинули смелую гипотезу о том, что молекулярная асимметрия аминокислот появилась задолго до возникновения жизни на Земле.
Так как углеродистые хондриты, к которым относится этот метеорит, образовали 4.5 миллиардов лет назад авторы (Cronin and Pizzarello 1997) выдвинули смелую гипотезу о том, что молекулярная асимметрия аминокислот появилась задолго до возникновения жизни на Земле. Первый механизм специфичен для прокариот, а второй встречается как в про-, так и в эукариотических клетках.D-аминокислоты в природном состоянии практически не встречаются среди рецепторов, структурных белков и белков иммунной системы. Тем не менее, их все еще можно увидеть в составе пептидных антибиотиков, гормонов, нейропептидов, гепатотоксинов и опиоидов.
Первый механизм специфичен для прокариот, а второй встречается как в про-, так и в эукариотических клетках.D-аминокислоты в природном состоянии практически не встречаются среди рецепторов, структурных белков и белков иммунной системы. Тем не менее, их все еще можно увидеть в составе пептидных антибиотиков, гормонов, нейропептидов, гепатотоксинов и опиоидов.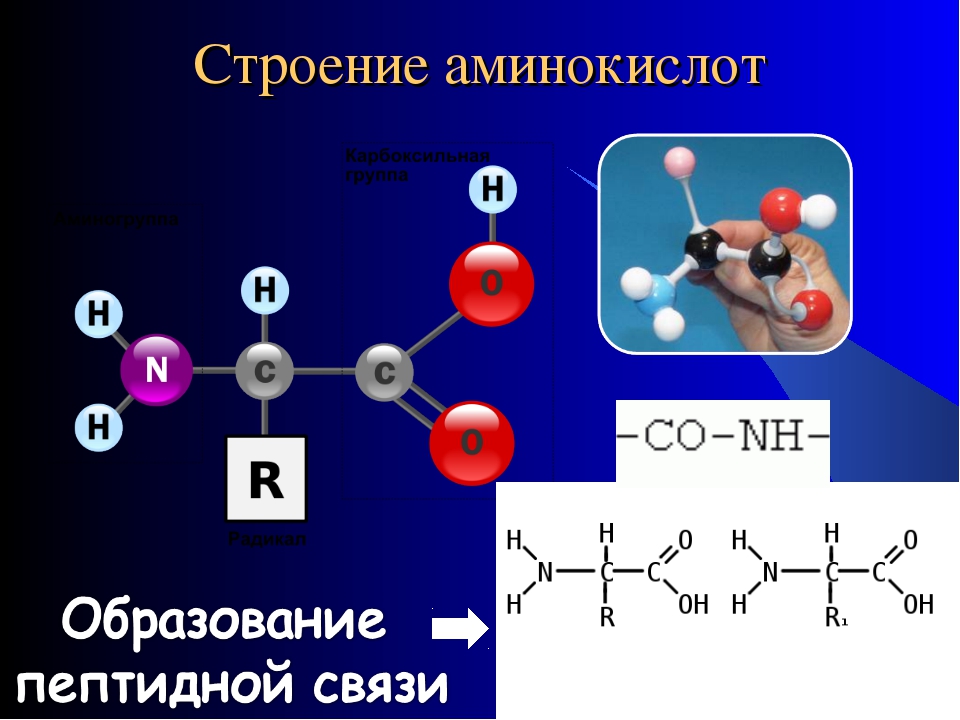 Было показано, что полинуклеотиды, содержащие стандартные D-сахара, по-разному реагируют с D- или L-аминокислотами. Расчеты показывают, что примитивные тРНК, образованные из нескольких рибонуклеотидов и способные специфически связываться с L-аминокислотой посредством водородных связей, в большинстве случаев не способны распознавать D-аминокислоты с такой же специфичностью, поскольку их латеральные группы заместителей стерически трудно укладываются в сайт связывания аминокислот тРНК (Balasubramanian 1983).Кроме того, этот процесс осложняется наличием особого фермента D-аминоацил-тРНК-деацилазы (ДТД), обладающего корректирующей активностью и удаляющего случайно связывающиеся с тРНК D-изомеры аминокислот (Kuncha et al., 2018). Таким образом, сосуществование D-рибонуклеотидов и L-аминокислот необходимо для определенных типов биологических взаимодействий. Если принять во внимание популярную гипотезу о том, что рибонуклеиновые кислоты предшествовали белкам в «пребиотическом бульоне» (Joyce 1989), становится очевидным, что эволюционный выбор в пользу L-аминокислот мог быть результатом основных свойств D-рибонуклеотидов.
Было показано, что полинуклеотиды, содержащие стандартные D-сахара, по-разному реагируют с D- или L-аминокислотами. Расчеты показывают, что примитивные тРНК, образованные из нескольких рибонуклеотидов и способные специфически связываться с L-аминокислотой посредством водородных связей, в большинстве случаев не способны распознавать D-аминокислоты с такой же специфичностью, поскольку их латеральные группы заместителей стерически трудно укладываются в сайт связывания аминокислот тРНК (Balasubramanian 1983).Кроме того, этот процесс осложняется наличием особого фермента D-аминоацил-тРНК-деацилазы (ДТД), обладающего корректирующей активностью и удаляющего случайно связывающиеся с тРНК D-изомеры аминокислот (Kuncha et al., 2018). Таким образом, сосуществование D-рибонуклеотидов и L-аминокислот необходимо для определенных типов биологических взаимодействий. Если принять во внимание популярную гипотезу о том, что рибонуклеиновые кислоты предшествовали белкам в «пребиотическом бульоне» (Joyce 1989), становится очевидным, что эволюционный выбор в пользу L-аминокислот мог быть результатом основных свойств D-рибонуклеотидов. и молекул РНК, построенных из них (Bailey 1998).
и молекул РНК, построенных из них (Bailey 1998).

 2010).
2010). , 2008; Errico et al., 2011, 2015; Horio et al. 2011).
, 2008; Errico et al., 2011, 2015; Horio et al. 2011). , 2013; Голизаде, 2015; Штраух и др., 2015). Было обнаружено, что различные растения реагируют на стресс образованием D-триптофана с последующим синтезом его малонилпроизводных (Yu et al. 2014). Согласно некоторым исследованиям, производные D-триптофана могут быть предшественниками растительных гормонов ауксинов, оказывающих мощное влияние на рост плодов и побегов высших растений (Рекославская, 1986).
, 2013; Голизаде, 2015; Штраух и др., 2015). Было обнаружено, что различные растения реагируют на стресс образованием D-триптофана с последующим синтезом его малонилпроизводных (Yu et al. 2014). Согласно некоторым исследованиям, производные D-триптофана могут быть предшественниками растительных гормонов ауксинов, оказывающих мощное влияние на рост плодов и побегов высших растений (Рекославская, 1986). 2016).
2016). Некоторые из этих аминокислот образуются в результате микробиологического синтеза в определенных видах автотрофных почвенных бактерий, а другие — в результате химического синтеза в виде хлорированных рацемических смесей, требующих последующих процедур разделения (см. выше). В большинстве случаев эта процедура не применяется из-за значительного удорожания конечного кормового продукта, поэтому сельскохозяйственным животным часто назначают Л, Д-рацематы.
Некоторые из этих аминокислот образуются в результате микробиологического синтеза в определенных видах автотрофных почвенных бактерий, а другие — в результате химического синтеза в виде хлорированных рацемических смесей, требующих последующих процедур разделения (см. выше). В большинстве случаев эта процедура не применяется из-за значительного удорожания конечного кормового продукта, поэтому сельскохозяйственным животным часто назначают Л, Д-рацематы. соединения вместе с птичьим пометом, которые могут оказывать неблагоприятное воздействие на окружающую среду в районах интенсивного птицеводства (Махешвари, 2013 г.).
соединения вместе с птичьим пометом, которые могут оказывать неблагоприятное воздействие на окружающую среду в районах интенсивного птицеводства (Махешвари, 2013 г.). Авторы исследования предполагают, что эти аминокислоты могут действовать как хелатирующие агенты, связывающие ряд важных микроэлементов, что приводит к их дефициту (Persia et al. 2003, Baker 2006).
Авторы исследования предполагают, что эти аминокислоты могут действовать как хелатирующие агенты, связывающие ряд важных микроэлементов, что приводит к их дефициту (Persia et al. 2003, Baker 2006). Ранее авторами данного обзора был предложен биотехнологический подход к созданию термостабильных кассет кормовых пептидов, обогащенных в необходимой пропорции остатками L-аминокислот, важными для метаболизма различных групп птицы (Гришин и соавт.2017, 2018).
Ранее авторами данного обзора был предложен биотехнологический подход к созданию термостабильных кассет кормовых пептидов, обогащенных в необходимой пропорции остатками L-аминокислот, важными для метаболизма различных групп птицы (Гришин и соавт.2017, 2018). 2010; Роббель и Марахиэль, 2010 г.; Гришин, Соколов, 2014). Среди них есть бактерицидные, бактериостатические средства и даже соединения с противоопухолевой активностью.
2010; Роббель и Марахиэль, 2010 г.; Гришин, Соколов, 2014). Среди них есть бактерицидные, бактериостатические средства и даже соединения с противоопухолевой активностью.
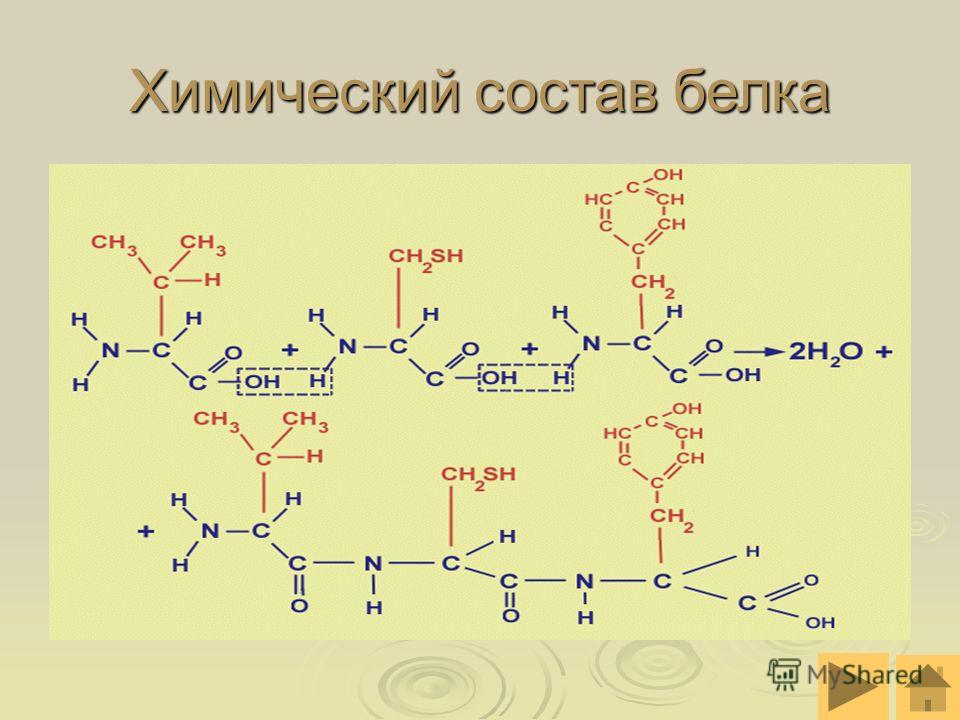 Установлено, что уровень экспрессии и ферментативной активности ДАО в мозге людей с нервно-психическими расстройствами (шизофрения, болезнь Альцгеймера, аутизм) значительно выше, чем у здоровых людей. По этой причине система считается многообещающей новой мишенью для лечения этих нервно-психических расстройств. В настоящее время одним из возможных терапевтических подходов является комбинация D-серина и ингибиторов DAO (Wolosker 2007; Rojas et al. 2016; Szilágyi et al. 2018).
Установлено, что уровень экспрессии и ферментативной активности ДАО в мозге людей с нервно-психическими расстройствами (шизофрения, болезнь Альцгеймера, аутизм) значительно выше, чем у здоровых людей. По этой причине система считается многообещающей новой мишенью для лечения этих нервно-психических расстройств. В настоящее время одним из возможных терапевтических подходов является комбинация D-серина и ингибиторов DAO (Wolosker 2007; Rojas et al. 2016; Szilágyi et al. 2018). Один из первых таких экспериментов был проведен с протеазой ретровируса ВИЧ-1 (Накатани и др., 2008; Торбеев и др., 2011). Оба энантиомера этого белка содержат 99 аминокислот и обладают противоположной специфичностью к своим субстратам.Второй пример — синтетические тета-дефензины, построенные только из D-вариантов аминокислот. Ряд исследований показывает, что эти катионные пептиды более стабильны и проявляют антиретровирусную активность in vitro, связываясь с соответствующими им рецепторами (Owen et al. 2004; Wang 2012; Falanga et al. 2017).
Один из первых таких экспериментов был проведен с протеазой ретровируса ВИЧ-1 (Накатани и др., 2008; Торбеев и др., 2011). Оба энантиомера этого белка содержат 99 аминокислот и обладают противоположной специфичностью к своим субстратам.Второй пример — синтетические тета-дефензины, построенные только из D-вариантов аминокислот. Ряд исследований показывает, что эти катионные пептиды более стабильны и проявляют антиретровирусную активность in vitro, связываясь с соответствующими им рецепторами (Owen et al. 2004; Wang 2012; Falanga et al. 2017).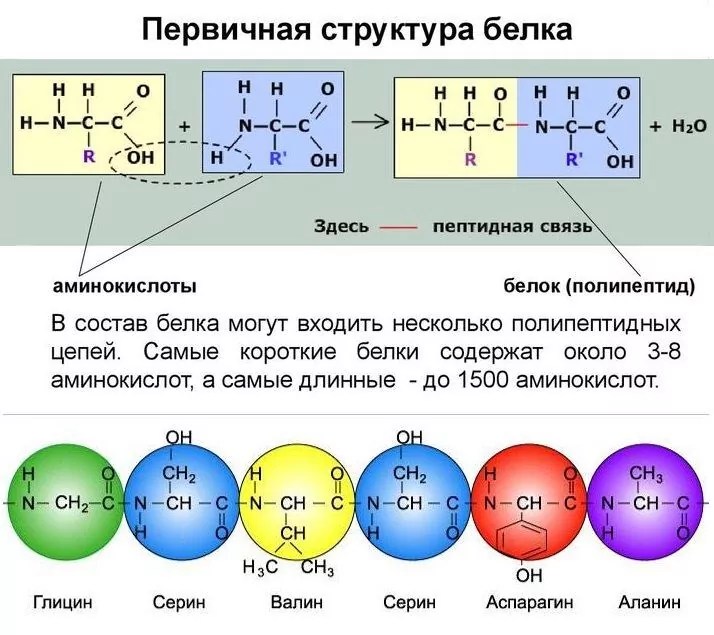 Например, наблюдается увеличение доли D-аспарагиновой кислоты в хрусталике глаза и ЦНС у пожилых людей, что некоторые исследователи связывают с показателями заболеваемости клинически диагностированной болезнью Альцгеймера и катарактой.Таким образом, очевидно, что D-аспарагиновая кислота может стать биологическим маркером старения позвоночных (Fujii and Saito 2004; Fujii 2005; Kaji et al. 2010; Chervyakov et al. 2011; Fujii et al. 2018).
Например, наблюдается увеличение доли D-аспарагиновой кислоты в хрусталике глаза и ЦНС у пожилых людей, что некоторые исследователи связывают с показателями заболеваемости клинически диагностированной болезнью Альцгеймера и катарактой.Таким образом, очевидно, что D-аспарагиновая кислота может стать биологическим маркером старения позвоночных (Fujii and Saito 2004; Fujii 2005; Kaji et al. 2010; Chervyakov et al. 2011; Fujii et al. 2018).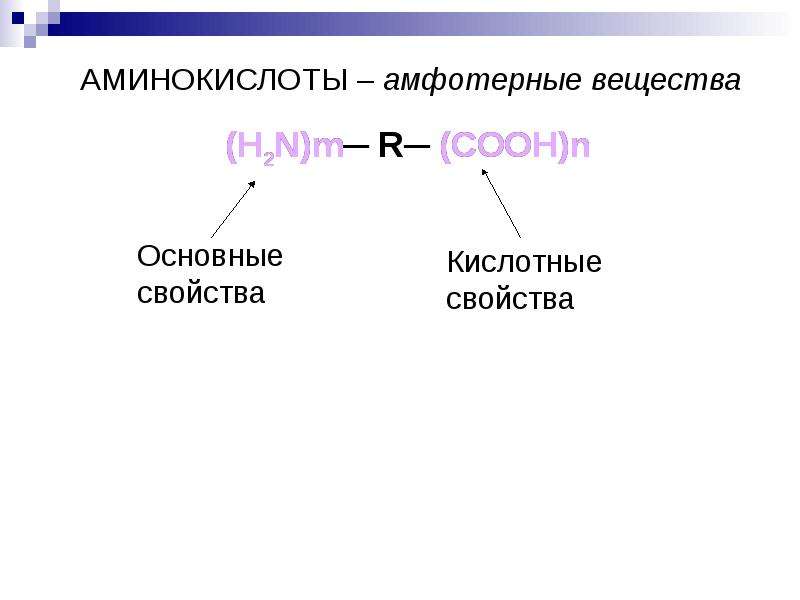 1994; Cartus 2012; Mutaguchi et al. др. 2013).
1994; Cartus 2012; Mutaguchi et al. др. 2013). Поэтому, в отличие от сельского хозяйства, производство этих вариантов аминокислот для биомедицины, вероятно, увеличится в ближайшие десятилетия.
Поэтому, в отличие от сельского хозяйства, производство этих вариантов аминокислот для биомедицины, вероятно, увеличится в ближайшие десятилетия.