Гормоны жировой ткани — Перечень анализов медицинской сети НИАРМЕДИК
> 990
исследований каждый день
1 500
видов анализов
Современное оборудование
Точные результатыМы делаем анализы на все виды общеклинических исследований, микробиологические, биохимические тесты, широкий спектр анализов на аллергены и онкомаркеры, ПЦР-диагностика инфекций, анализы на гормоны и аутоиммунные заболевания и генетические.
Мы проводим только надежные стандартизированные анализы, за результат которых можем поручиться.
Роль гормонов жировой ткани в формировании метаболических нарушений у больных с сердечно- сосудистой патологией
Kharkiv National Medical University Repository
Please use this identifier to cite or link to this item: http://repo.knmu.edu.ua/handle/123456789/3074
| Title: | Роль гормонов жировой ткани в формировании метаболических нарушений у больных с сердечно- сосудистой патологией |
| Other Titles: | The role of hormones of adipose tissue in formation of metabolic disorders in patients with cardiovascular disease |
| Authors: | Кравчун, Павло Григорович Кадикова, Ольга Ігорівна Габісонія, Тамарі Несторівна |
| Keywords: | гормоны жировой ткани артериальная гипертензия ожирение сахарный диабет hormones of adipose tissue hypertension obesity diabetes mellitus |
| Issue Date: | 2013 |
| Citation: | Кравчун П.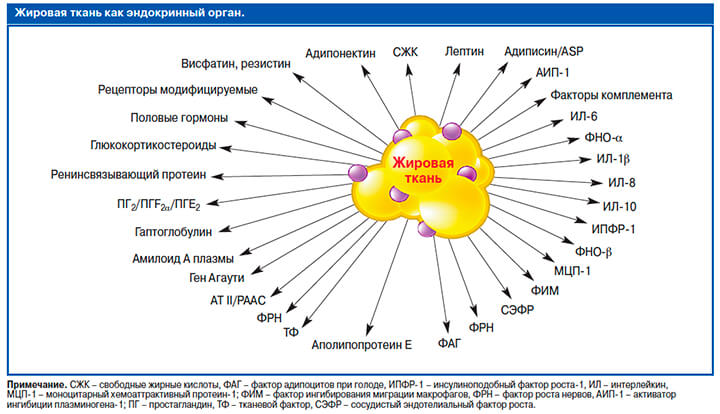 Г. Роль гормонов жировой ткани в формировании метаболических нарушений у больных с сердечно-сосудистой патологией / П. Г. Кравчун, О. И. Кадыкова, Т. Н. Габисония // Журнал научных публикаций аспирантов и докторантов. – 2013. – Вып. 1. — С. 114-118. Г. Роль гормонов жировой ткани в формировании метаболических нарушений у больных с сердечно-сосудистой патологией / П. Г. Кравчун, О. И. Кадыкова, Т. Н. Габисония // Журнал научных публикаций аспирантов и докторантов. – 2013. – Вып. 1. — С. 114-118. |
| Abstract: | У больных артериальной гипертензией (АГ), которая сочеталась с сахарным диабетом (СД) 2 типа, происходило ухудшение углеводного обмена по мере увеличения уровня глюкозы крови, а сочетание дислипидемии с гипергликемией приводило к потенцированию инсулинорезистентности (ИР) и увеличению сердечно-сосудистого риска.
В группе больных АГ с сопутствующим ожирением увеличение коэффициента ИР происходило по мере увеличения массы тела, а усиление абдоминального ожирения приводило к атерогенной перестройке липидного спектра.
Система углеводного и липидного обмена у больных с АГ без каких-либо метаболических нарушений функционирует в режиме нормокомпенсации.
Гипервисфатинемия и гиперрезистинемия на фоне гипоадипонектинемии возникают у больных АГ в результате метаболических нарушений, вызванных СД 2 типа. |
| URI: | http://repo.knmu.edu.ua/handle/123456789/3074 |
| Appears in Collections: | Наукові роботи молодих вчених. Кафедра внутрішньої медицини № 2 і клінічної імунології та алергології ім. ак. Л.Т. Малої |
Items in DSpace are protected by copyright, with all rights reserved, unless otherwise indicated.
Анализы на уровень лептина в лаборатории СИНЭВО
Важно помнить! Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
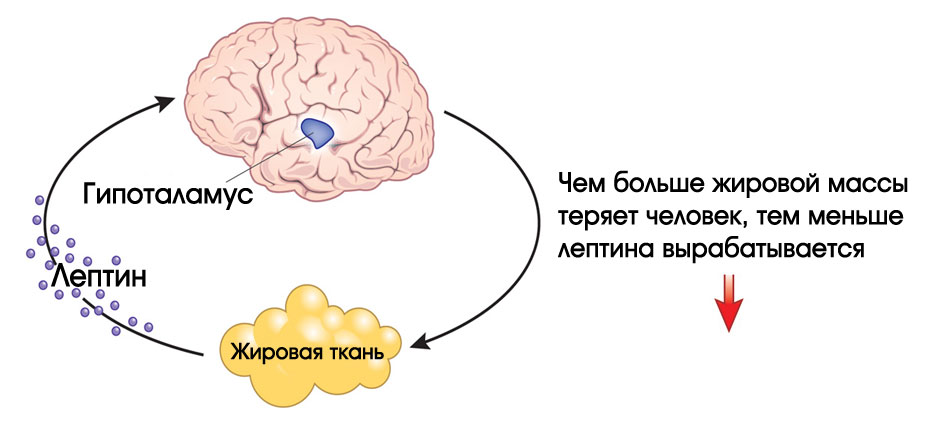
Всем без исключения известны чувства голода, а также насыщения, но откуда они появляются? В организме человека вырабатывается множество гормонов и других биологически активных веществ, одним из которых является лептин. Он представляет собой гормон белой жировой ткани, от количества которой и зависит его концентрация в крови. Именно поэтому во время голодания уровень лептина значительно снижается, а при переедании может стремительно увеличиваться. Этот гормон играет важную роль в нормальной жизнедеятельности человека и выполняет следующие функции:
Он представляет собой гормон белой жировой ткани, от количества которой и зависит его концентрация в крови. Именно поэтому во время голодания уровень лептина значительно снижается, а при переедании может стремительно увеличиваться. Этот гормон играет важную роль в нормальной жизнедеятельности человека и выполняет следующие функции:
- снижает аппетит;
- уменьшает общее потребление пищи;
- способствует формированию чувства голода;
- ускоряет липолиз или распад жиров;
- увеличивает синтез гликогена в мышечных тканях;
- способствует более быстрой утилизации глюкозы из крови;
- препятствует эктопическому отложению жиров в тканях при переедании.
Любые нарушения в процессе выработки этого важного гормона могут привести к избыточному употреблению пищи, что, в свою очередь, может стать причиной ожирения.
Среди факторов, негативно влияющих на общий уровень лептина в крови, можно выделить такие, как:
- чрезмерное употребление фруктозы;
- стрессовое состояние;
- недостаточное количество сна;
- повышенный уровень инсулина;
- чрезмерные физические нагрузки;
- большое употребление в пищу пектина или мучных изделий;
- переедание.

Стоит обязательно обратиться к врачу и пройти обследование, сдать анализы на уровень гормона в том случае, если вы заметили у себя следующие симптомы:
- очень рано появилось выраженное ожирение, что может свидетельствовать о генетическом дефиците лептина;
- нарушилась репродуктивная функция при чрезмерном снижении питания, а также слишком интенсивных физических нагрузках;
- имеются рецидивирующие тромбозы.
Определить уровень данного гормона в крови может быть полезным и при комплексном исследовании проблем, которые могут быть связаны со снижением или же повышением веса, с ранним выявлением риска различных сердечнососудистых заболеваний или же при диагностике диабета.
В качестве метода исследования лептина применяется иммуноанализ. Для проведения данной процедуры имеются определенные требования. Биоматериал, предназначенный для исследования, сдается только натощак. Причем к моменту забора крови после последнего употребления пищи должно пройти не меньше 8-12 часов.
В большинстве случаев повышение уровня рассматриваемого гормона в крови вызывается такими заболеваниями, как:
- метаболический синдром;
- алиментарное ожирение, вызванное нерегулярным и неправильным питанием;
- переедание;
- инсулинонезависимый сахарный диабет (ИНСД).
Уровень ниже нормы может наблюдаться в следующих случаях:
- неполноценное и недостаточное питание;
- нарушения функции выработки гормона;
- нарушения и сбои в процессе работы рецепторов, отвечающих за проведение необходимых гормональных сигналов.
Проведение такой процедуры, как иммуноанализ, является очень важным и необходимым, так как позволяет не только определить причины патогенеза ожирения, но и провести полноценное обследование тех больных, которые страдают от метаболического синдрома.
За уровнем лептина в крови необходимо следить, потому что его повышение может привести к появлению тромбоза, инфарктов или инсультов, особенно у людей с избыточным весом. От него зависит и уровень артериального давления, а также концентрация атерогенных липопротеидов. В связи с тем, что данный гормон оказывает существенное влияние на эластичность артерий, даже при здоровом образе жизни у человека при повышенном его содержании могут появиться серьезные проблемы с сердечнососудистой системой.
От него зависит и уровень артериального давления, а также концентрация атерогенных липопротеидов. В связи с тем, что данный гормон оказывает существенное влияние на эластичность артерий, даже при здоровом образе жизни у человека при повышенном его содержании могут появиться серьезные проблемы с сердечнососудистой системой.
Чем еще опасен лептин?
Его высокое содержание в крови активно подавляет выработку инсулина, что приводит к развитию такого заболевания, как сахарный диабет. Также при отказе от приемов пищи низкая концентрация гормона способствует появлению аменореи или отсутствию менструаций.
Исследования указывают на то, что у основной массы людей, страдающих от ожирения, наблюдается увеличение содержания данного гормона в крови в несколько раз. Причем причина этого кроется в потере чувствительности гипоталамуса к действиям вырабатываемого гормонального вещества. Мозг человека продолжает давать ложные сигналы о необходимости запасать энергию. Подобные процессы чаще всего являются генетическим дефектом. В таких случаях требуется квалифицированная помощь эндокринолога и других специалистов.
Подобные процессы чаще всего являются генетическим дефектом. В таких случаях требуется квалифицированная помощь эндокринолога и других специалистов.
Где сдать анализ лептин
Сдать анализ лептин можно в любом пункте Синэво в Минске, Барановичах, Бобруйске, Борисове, Бресте, Витебске, Ганцевичах, Гомеле, Гродно, Жлобине, Лиде, Могилеве, Мозыре, Молодечно, Новогрудке, Новополоцке, Орше, Пинске, Полоцке, Речице, Светлогорске, Слуцке, Сморгони, Солигорске.
Жир внутри нас — Клиника Марины Рябус
Изучение жира и его функций — важный медицинский тренд последнего времени. Ещё 25–30 лет назад жир считали пассивной тканью, в которой просто хранится запас энергии, но в начале девяностых появились научные работы, которые доказали, что жировая ткань — важнейший эндокринный орган. И конечно, это вызвало лавину новых исследований: патофизиологи, биологи и эндокринологи со всего мира начали изучать, что же такое жир и как он влияет на работу нейроэндокринной системы. Интерес к теме подогревался ещё и тем, что, согласно данным ООН, до трети населения Земли страдает той или иной степенью ожирения. Все эти люди находятся в группе риска и по заболеваниям, которые ожирение может спровоцировать, а значит, о влиянии жировой ткани на развитие любых патологий важно знать как можно больше.
Интерес к теме подогревался ещё и тем, что, согласно данным ООН, до трети населения Земли страдает той или иной степенью ожирения. Все эти люди находятся в группе риска и по заболеваниям, которые ожирение может спровоцировать, а значит, о влиянии жировой ткани на развитие любых патологий важно знать как можно больше.
кандидат медицинских наук, врач-эндокринолог клиники Марины Рябус
Жировая ткань — вид соединительной ткани; она состоит из жировых клеток, или адипоцитов, которые накапливают энергию и секретируют разные вещества, в том числе гормоны. Это значит, что жировая ткань выполняет в нашем организме массу задач и во многом именно благодаря ей он функционирует так, как должен. Главная функция жира — энергетическая. Триглицериды, компоненты жировой ткани, при расщеплении выделяют колоссальное количество энергии: вдвое больше, чем углеводы. В организме среднего взрослого около пятнадцати килограммов жировой ткани, или примерно 110 тысяч килокалорий. Этого запаса хватит, чтобы прожить два месяца, сжигая по 2 тысячи килокалорий в день.
Ещё одна функция жира — термоизоляционная. Здесь всё понятно: жировой слой помогает нам не терять слишком много тепла при низких температурах. Именно поэтому у представителей северных народов жировая прослойка в среднем толще, чем у южных. Следующая функция жира — опорная. Это значит, что все наши органы, например сердце и даже крупные сосуды, частично или полностью окружены жировой тканью. Это, с одной стороны, помогает закрепить органы на «правильных» местах, а с другой — защитит их от повреждений, если мы ударимся или на нас кто-то нападёт. На этом с очевидными функциями всё, переходим к более тонким материям.
Важная функция жировой ткани — регуляторная. Жировые клетки участвуют в кроветворении: они входят в состав костного мозга, формируют микроокружение эритроцитов, лейкоцитов и тромбоцитов и обеспечивают их питательными веществами, пока те развиваются. Ещё одна функция, о которой хотелось бы сказать отдельно, — иммунная. В клетках нашей иммунной системы есть рецепторы, которые «считывают» структуры опасных микробов — в ответ на это система вырабатывает защитные компоненты, в том числе цитокины и хемокины, которые направляют процесс борьбы с инфекцией. Несколько лет назад такие же рецепторы нашли и в жировых клетках.
Несколько лет назад такие же рецепторы нашли и в жировых клетках.
Ещё одна неочевидная функция жира — депонирующая: жировая ткань накапливает не только энергию, но и некоторые жирорастворимые витамины (А, D, Е, К), а ещё служит крупным депо стероидных гормонов, особенно эстрогенов. Кроме того, она содержит запас воды (да, не только у верблюдов, но и у людей), а значит, дефицит жировой ткани немедленно приведёт, например, к обезвоживанию и старению кожи.
И недостаток жировой ткани, и её избыток одинаково опасны для организма
Теперь мы, наконец, подошли к самой интересной функции жира — эндокринной. Как я уже говорила, современная наука считает жировую ткань отдельным периферическим эндокринным органом. У женщин она является, в числе прочего, источником фермента под названием ароматаза, благодаря которому наш организм синтезирует из андрогенов эстрогены (о том, зачем женскому организму эстрогены, полагаю, говорить излишне). А ещё адипоциты жировой ткани вырабатывают лептин, он необходим для полового созревания и для поддержания репродуктивной функции. Кстати, у пациенток с аменореей, то есть отсутствием месячных, из-за слишком сильных физических нагрузок уровень лептина падает, а его секреция нарушается. А в норме у женщин уровень лептина в сыворотке крови на 40 % выше, чем у мужчин.
Кстати, у пациенток с аменореей, то есть отсутствием месячных, из-за слишком сильных физических нагрузок уровень лептина падает, а его секреция нарушается. А в норме у женщин уровень лептина в сыворотке крови на 40 % выше, чем у мужчин.
Без жировой ткани наш организм просто не будет работать: она отвечает за репродуктивную функцию и половое созревание, за иммунитет и кроветворение, она служит топливом для основных обменных процессов, защищает нас от механических повреждений и переохлаждения. Значит ли это, что чем больше жировой ткани в организме, тем лучше? Конечно, нет. И недостаток жировой ткани, и её избыток одинаково опасны для организма. Есть исследования, показывающие прямую связь между нарушением баланса жировой ткани в любую сторону и уменьшением продолжительности жизни, поэтому за процентом жировой ткани в организме и за тем, как она распределяется, очень важно следить.
При этом нужно понимать, что норма содержания жира в мужском и женском организме разная: у женщин жира должно быть на 5–10 % больше.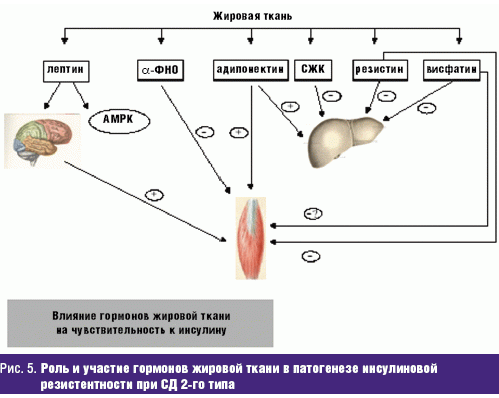 В свойствах жировой ткани и том, как она распределена, тоже есть отличия. Во-первых, у мужчин жир более плотный, а у женщин — рыхлый, поэтому у них чаще встречается целлюлит (строго говоря, его вообще можно считать вторичным половым признаком). Во-вторых, у мужчин жировая ткань распределена по телу более-менее равномерно, а у женщин откладывается в молочных железах, в области таза и бёдер. В случае нарушений жировая ткань может начать откладываться в характерных местах, например на передней брюшной стенке. Именно этот вариант ожирения врачи считают самым опасным: он напрямую связан с развитием сахарного диабета, атеросклероза, артериальной гипертензии, некоторых злокачественных опухолей, инфарктов миокарда, инсультов и великого множества других патологий.
В свойствах жировой ткани и том, как она распределена, тоже есть отличия. Во-первых, у мужчин жир более плотный, а у женщин — рыхлый, поэтому у них чаще встречается целлюлит (строго говоря, его вообще можно считать вторичным половым признаком). Во-вторых, у мужчин жировая ткань распределена по телу более-менее равномерно, а у женщин откладывается в молочных железах, в области таза и бёдер. В случае нарушений жировая ткань может начать откладываться в характерных местах, например на передней брюшной стенке. Именно этот вариант ожирения врачи считают самым опасным: он напрямую связан с развитием сахарного диабета, атеросклероза, артериальной гипертензии, некоторых злокачественных опухолей, инфарктов миокарда, инсультов и великого множества других патологий.
Ещё один крайне неблагоприятный тип ожирения — абдоминально-висцеральный, то есть когда жировая ткань откладывается вокруг внутренних органов и нарушает их работу. Оба этих типа встречаются у женщин, которые набирают вес с возрастом. С приходом менопаузы организм начинает вырабатывать меньше половых гормонов в яичниках. Чтобы как-то компенсировать дефицит эстрогенов, за их усиленное производство принимается жировая ткань — и тут же начинает под их воздействием разрастаться сама, то есть мы попадаем в замкнутый круг. Причём проблема здесь не только в ожирении, но и в том, что эстрогены, которые вырабатывает жировая ткань в перименопаузе, могут запускать в тканях патологические процессы, например гиперплазию эндометрия или рак груди.
С приходом менопаузы организм начинает вырабатывать меньше половых гормонов в яичниках. Чтобы как-то компенсировать дефицит эстрогенов, за их усиленное производство принимается жировая ткань — и тут же начинает под их воздействием разрастаться сама, то есть мы попадаем в замкнутый круг. Причём проблема здесь не только в ожирении, но и в том, что эстрогены, которые вырабатывает жировая ткань в перименопаузе, могут запускать в тканях патологические процессы, например гиперплазию эндометрия или рак груди.
Чем стабильнее вес, тем лучше для кожи, спины, суставов и всего организма в целом
С возрастом обменные процессы замедляются. Это значит, что ряд ферментов у нас всё ещё вырабатывается, но в прежнем количестве уже не расходуется. Самый простой способ их потратить — заняться перевариванием пищи, и организм командует «повысить аппетит». В итоге женщина начинает поправляться, но часто не замечает, что стала есть больше. Эта же опасность, кстати, подстерегает и тех, кто начинает пить гормональные контрацептивы: любое изменение гормонального фона временно влияет на аппетит, поэтому в первые месяцы приёма КОК лучше следить за количеством съеденного. От самих таблеток вы, конечно, не поправитесь — это миф. А вот на еду можете взглянуть другими глазами — это реальность. Набор веса в менопаузе или на фоне приёма ГК — это не норма, даже если до ожирения вам далеко. Чем стабильнее вес, тем лучше для вашей кожи, спины, суставов и всего организма в целом.
От самих таблеток вы, конечно, не поправитесь — это миф. А вот на еду можете взглянуть другими глазами — это реальность. Набор веса в менопаузе или на фоне приёма ГК — это не норма, даже если до ожирения вам далеко. Чем стабильнее вес, тем лучше для вашей кожи, спины, суставов и всего организма в целом.
Определить оптимальный баланс жировой ткани в организме не так просто. Раньше чуть ли не единственным способом было вычисление ИМТ, то есть индекса массы тела, но у этого метода есть масса недостатков. Во-первых, он не учитывает ни возраст, ни пол человека, хотя, по логике, ИМТ у мужчин должен быть выше, чем у женщин, а ИМТ у молодых — выше, чем у пожилых. Кроме того, средние значения ИМТ не зависят от страны, и если, например, применить в России показатели, рекомендованные ВОЗ, то получится, что больше половины населения страдает от избытка веса. Кроме того, формула расчёта ИМТ совершенно не годится для людей, серьёзно занимающихся спортом. Видов спорта очень много, требования к спортсменам совершенно разные, и они редко укладываются в средние показатели: ИМТ художественных гимнасток, например, близок к отметке «выраженный дефицит», а ИМТ тяжелоатлетов — к ожирению, при этом и те и другие совершенно здоровы. Поэтому любые расчёты оптимального веса и процента жировой ткани у профессиональных спортсменов — вопрос индивидуальный и эмпирический.
Поэтому любые расчёты оптимального веса и процента жировой ткани у профессиональных спортсменов — вопрос индивидуальный и эмпирический.
Один из самых достоверных на сегодняшний день способов понять оптимальный баланс жировой ткани в организме — метод биоимпедансометрии, который основан на биоэлектрическом сопротивлении тканей. С его помощью мы можем узнать не только процент жировой ткани, но и то, как она распределена. Это важно для ранней диагностики эндокринных нарушений, для которых характерен избыток жировых отложений в тех или иных областях. Это исследование достаточно простое, и его делают в ряде клиник. Кроме того, недавно был описан ещё один метод исследования баланса и распределения жира с помощью трёхмерного сканера или компьютерной томографии. Показатель, который он измеряет, называется BVI (то есть Body Volume Index, или индекс объёма тела).
Но даже без трёхмерного сканера, при наличии оборудования для биоимпедансометрии можно точно определить оптимальный баланс жира в организме. Кроме того, существуют формулы толщины жировой складки, соотношения окружности и линии таза, талии и роста, талии и руки, талии и ноги. В комплексе это позволяет делать точные и, главное, индивидуальные расчёты. Хотя здесь нужно оговориться, что важную роль играют и ощущения самого пациента. Например, если по всем расчётам оптимальный вес человека — 60 кг, а он чувствует себя лучше при 54, и анализы подтверждают, что он здоров, не факт, что ему стоит набирать вес.
Кроме того, существуют формулы толщины жировой складки, соотношения окружности и линии таза, талии и роста, талии и руки, талии и ноги. В комплексе это позволяет делать точные и, главное, индивидуальные расчёты. Хотя здесь нужно оговориться, что важную роль играют и ощущения самого пациента. Например, если по всем расчётам оптимальный вес человека — 60 кг, а он чувствует себя лучше при 54, и анализы подтверждают, что он здоров, не факт, что ему стоит набирать вес.
Ученые научились лечить ожирение сном — РБК
Увеличение продолжительности сна может стать ключом к решению проблемы ожирения, считают ученые.
Увеличение продолжительности сна может стать ключом к решению проблемы ожирения, считают ученые.
Главными «виновниками» лишнего веса принято считать неправильное питание и недостаток физической активности. Между тем, последние научные данные указывают на то, что недосып тоже является немаловажным фактором, роль которого, однако, часто недооценивается.
Невролог Карин Шпигель из французской общественной организации INSERM, оказывающей поддержку научным исследованиям с области биологии, медицины и общественного здоровья, уверена, что данная проблема заслуживает более пристального внимания. «Более долгий сон может стать идеальным способом стабилизации веса и похудения», — сказала она.
Около 30 исследований, проведенных за последние годы в семи странах, выявили связь между недостаточной продолжительностью сна и лишним весом, причем как у взрослых, так и у детей, сообщают французские СМИ.
Ученые поясняют — все дело в двух гормонах, которые вырабатывает организм человека ночью и которые помогают регулировать аппетит. Грелин — гормон, отвечающий за появление чувства голода, замедляет процесс обмена веществ и снижает способность организма сжигать жиры. Лептин — гормон, который вырабатывается в жировой ткани, регулирует жировой запас и фактически служит для контроля за аппетитом.
Лептин — гормон, который вырабатывается в жировой ткани, регулирует жировой запас и фактически служит для контроля за аппетитом.
Мужское ожирение – насущная проблема и способы ее решения – статьи о здоровье
Оглавление
Ожирение у мужчин – это болезнь?
Общепринятая точка зрения, что ожирение – во-первых, женская, а во-вторых, косметическая проблема. Еще недавно полнота считалась признаком достатка и здоровья. Последние исследования совершенно точно доказали нам, что ожирение является самостоятельным хроническим заболеванием и фактором риска для развития сахарного диабета, гипертонической болезни, нарушений в половой сфере. Причем, у мужчин проблема стоит также остро, как и у женщин, хотя обращать на нее внимание сильный пол начинает только при значительно выраженном ожирении, когда качество жизни ощутимо снижено.
Ожирение имеет множественные осложнения
- Сердечно-сосудистые:
- Артериальная гипертензия – повышенное артериальное давление
- Сердечная недостаточность – неспособность сердца полноценно выполнять свою функцию
- Инсульт – поражение головного мозга в результате острого нарушения мозгового кровообращения
- Инфаркт миокарда – гибель участка сердечной мышцы
- Варикозное расширение вен нижних конечностей
- Обменные:
- Cахарный диабет 2 типа (инсулиннезависимый) – нарушение углеводного обмена
- Гиперлипидемия и атеросклероз сосудов – нарушение жирового обмена
- Подагра – отложение солей мочевой кислоты в суставах, почках
- Дыхательные:
- Одышка – учащенное дыхание
- Синдром ночного апноэ – периодическая остановка дыхания во сне, сочетающаяся с храпом
- Опорно-двигательные:
- Артриты – воспаление и боль в суставах
- Остеохондроз позвоночника
- Желудочно-кишечные:
- Желчекаменная болезнь – образование камней в желчном пузыре
- Онкологические:
- Повышенный риск развития рака предстательной железы и прямой кишки
- Нарушение половой функции:
- Снижение полового влечения
- Эректильная дисфункция
- Снижение качества и количества спермы, часто до уровня полной стерильности
Как определить ожирение
Определить ожирение можно очень просто, с помощью портновского сантиметра измерить окружность талии. Линия талии – это линия, соединяющая точки, расположенные на боковых поверхностях туловища (середина расстояния между подвздошной костью и нижним ребром справа и слева). В норме окружность талии у мужчин не должна превышать 94 см, все, что больше – признак ожирения.
Линия талии – это линия, соединяющая точки, расположенные на боковых поверхностях туловища (середина расстояния между подвздошной костью и нижним ребром справа и слева). В норме окружность талии у мужчин не должна превышать 94 см, все, что больше – признак ожирения.
Мужская талия не должна превышать 94 см!
Особенности мужского ожирения
Есть несколько особенностей в мужском ожирении. У мужчин отложения жира формируются преимущественно в области живота (форма «яблока»), так называемое, абдоминальное ожирение, что является наиболее опасным для жизни, так как жир, скапливающийся в брюшной полости, сдавливает внутренние органы, препятствуя их функционированию. Также нарушается работа сердца, что ведет к появлению сердечно-сосудистых осложнений.
Другая особенность – это нарушение гормонального обмена. Дело в том, что жировая ткань сама по себе является эндокринным органом, с одной стороны, в ней мужские половые гормоны тестостерон и андростендион превращаются в женские – эстрадиол и эстрон, соответственно, чем больше у мужчины жировая прослойка на животе, тем больше у него женских гормонов и меньше мужских. Кроме того, жировая ткань синтезирует гормон лептин, повышенный уровень которого приводит к снижению уровня тестостерона вследствие нарушения работы яичек. В большом количестве исследований доказана обратная зависимость между уровнем тестостерона и окружностью талии у мужчин: чем шире талия, тем меньше в организме тестостерона, и, соответственно, короче его «мужская жизнь».
Кроме того, жировая ткань синтезирует гормон лептин, повышенный уровень которого приводит к снижению уровня тестостерона вследствие нарушения работы яичек. В большом количестве исследований доказана обратная зависимость между уровнем тестостерона и окружностью талии у мужчин: чем шире талия, тем меньше в организме тестостерона, и, соответственно, короче его «мужская жизнь».
Чем шире талия, тем меньше в организме тестостерона.
Третья особенность является несомненным плюсом – мужское ожирение гораздо проще вылечить, чем женское, так как мужской организм изначально менее склонен к накоплению и расстается с жировой тканью гораздо легче.
Лечение ожирения у мужчин
Лечение мужского ожирения тоже имеет особенность. Конечно, оно включает в себя классические составляющие, такие, как:
- Диета, т.е. рациональное питание и снижение количества потребляемых калорий
- Дозированная физическая нагрузка
- Медикаментозное лечение
Но, для мужчин, непременным условием, является определение исходного уровня тестостерона с последующим назначением препаратов натурального тестостерона. Анализ крови, определяющий уровень общего тестостерона, сдается в период с 7 до 11 часов утра. Возраст не является противопоказанием для начала терапии, но у возрастных пациентов важное значение имеет оценка сопутствующих заболеваний.
Анализ крови, определяющий уровень общего тестостерона, сдается в период с 7 до 11 часов утра. Возраст не является противопоказанием для начала терапии, но у возрастных пациентов важное значение имеет оценка сопутствующих заболеваний.
Роль тестостерона в жизни мужчины
Сейчас научно доказано, что мужчины, у которых низкий уровень тестостерона, живут меньше, чем представители сильного пола с нормальным уровнем гормона, так как он определяет процессы функционирования большинства органов. Специалисты отмечают, что у всех, кто страдает от излишнего веса, наблюдается абсолютное или относительное понижение количество тестостерона. Лечение мужского ожирения невозможно без нормализации уровня гормона.
В клинике Медси Санкт-Петербург можно максимально быстро и эффективно пройти необходимое обследование, получить рекомендации специалистов (эндокринолог, диетолог, реабилитолог) по данной проблеме с последующим динамическим наблюдением.
Почему убрать жир локально, можно только при помощи операции
Не иссякает народная тропа лентяев и дураков, в клиники и магазины, которые обещают «растрясти», «растопить», «убрать», «расщепить» жир в конкретном месте. Или искренне верящих, что убрать жир с живота можно, накачивая пресс. Или с боков — делая наклоны.
Или искренне верящих, что убрать жир с живота можно, накачивая пресс. Или с боков — делая наклоны.
Лучшее и авторитетное объяснение, почему нельзя убрать жир локально (только с живота, или ног, или с «бочков») дал президент «Ассоциации профессионалов фитнеса» Дмитрий Калашников, текст которого мы с удовольствием приводим.
Куда уходит жир
Жир в нашем теле в основном хранится в жировых клетках – липоцитах – в виде химического вещества под названием триглицерид. И для того, чтобы отдать его для каких-либо нужд организма (энергообеспечение, строительство клеточных оболочек, гормонов и т.п.), жировая клетка должна этот триглицерид расщепить на жирные кислоты и глицерин. Процесс называется липолиз. Жирные кислоты и глицерин выходят из жировой клетки в кровь и транспортируются к местам использования.
Сигнал к тому, чтобы запустить липолиз и поделиться запасенными жирами жировая клетка получает от гормонов. Вспомним, что гормоны – биологически активные вещества, с помощью которых организм управляет работой своих клеток. Они выделяются специальными органами – железами – в кровь, вместе с которой и путешествуют по всему организму. Проплывая мимо клетки, в деятельность которой они должны вмешаться, гормон, подобно ключу, попадающему в замочную скважину, входит в контакт с рецептором и даёт клетке нужную команду. В нашем примере – команду к расщеплению жира.
Они выделяются специальными органами – железами – в кровь, вместе с которой и путешествуют по всему организму. Проплывая мимо клетки, в деятельность которой они должны вмешаться, гормон, подобно ключу, попадающему в замочную скважину, входит в контакт с рецептором и даёт клетке нужную команду. В нашем примере – команду к расщеплению жира.
Теперь должно стать понятным, что задержать гормоны, циркулирующие в кровотоке, в каком-то конкретном месте, например, на животе или на бедрах, невозможно. Они будут контактировать и отдавать команды сразу всем жировым клеткам организма.
Гормоны и жиры
В разных ситуациях гормоны – разные. Когда наш организм готовится к нагрузке (сражайся или беги) – это адреналин. Когда мы голодны и в крови низкий уровень сахара – глюкагон. Когда очень-очень голодны, да еще и переносим тяжелую физическую или психоэмоциональную нагрузку – кортизол. Ночью, для энергообеспечения строительных процессов – гормон роста (соматотропин). Ну и так далее. Эта способность отдавать команду к расщеплению жиров называется липолитической способностью.
Эта способность отдавать команду к расщеплению жиров называется липолитической способностью.
Хотя гормоны, обладающие липолитическими способностями, перемещаются по всему организму, жир в разных местах будет уходить неравномерно. Это будет зависеть от кровоснабжения тканей (их капилляризации) и от количества и активности клеточных рецепторов.
Жировая ткань в местах, предусмотренных эволюцией для хранения жира (бедра, ягодицы, живот), будет запасать его активнее, а расставаться медленнее. В местах, где организму хранить и носить жир не очень удобно, запасаться жира будет меньше, а расщепляться он будет быстрее.
Расщепление жира — еще не похудение.
Это очень важная вещь. Расщепление жира (липолиз) – это еще не похудение. Просто жир из жировой клетки переместился в кровь и «плавает» там. Чтобы от него избавиться, нужно его «сжечь». Другими словами: использовать как топливо для каких-либо целей. Например, для мышечной работы. Если жир как топливо останется невостребованным, он поплавает-поплавает по крови и всосётся обратно в жировые клетки, в лучшем случае.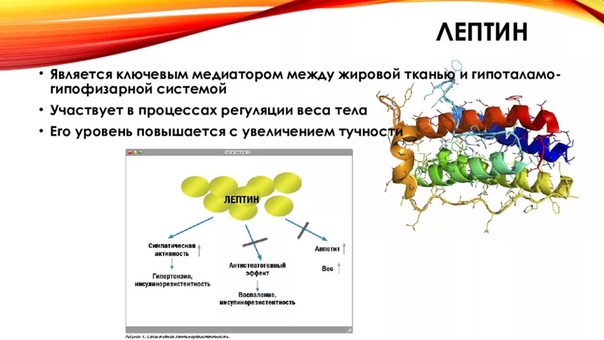 В худшем – создаст холестериновые бляшки в клетках стенок сосудов.
В худшем – создаст холестериновые бляшки в клетках стенок сосудов.
Баня, массаж и жир.
Кроме того, не забывайте, что расставание жировой клетки с запасами жира – это химическая реакция расщепления триглицеридов. Жир невозможно «раздробить», «растрясти», «растопить» или «выдавить» из жировой клетки. Все физиотерапевтические процедуры – массаж, баня и другие – в связи с целью похудеть, решают одну единственную задачу – активировать в жировых тканях кровоток, улучшить микроциркуляцию. Чем активнее кровоснабжение, тем больше до жировых клеток доплывет липолитических гормонов.
Это помогает, но ведь это лишь улучшение транспортных путей. К складам с запасами угля можно проложить десятки дорог, но если этот уголь не будет использован как топливо, он так и останется лежать на складе.
Бросьте искать волшебные упражнения и секретные режимы тренировок, чтобы «убрать живот» или «подсушить бедра». Их просто нет. Меньше ешьте, больше двигайтесь, качайте мышцы, сохраняйте терпение и настойчивость. Если же вы хотите избавиться от жира быстро и просто, обратите внимание на процедуру липосакции.
Если же вы хотите избавиться от жира быстро и просто, обратите внимание на процедуру липосакции.
Жировая ткань как эндокринный орган | Журнал клинической эндокринологии и метаболизма
Аннотация
Жировая ткань представляет собой сложный, важный и высокоактивный метаболический и эндокринный орган. Помимо адипоцитов, жировая ткань содержит соединительнотканный матрикс, нервную ткань, стромоваскулярные клетки и иммунные клетки. Вместе эти компоненты функционируют как единое целое. Жировая ткань не только отвечает на афферентные сигналы от традиционных гормональных систем и центральной нервной системы, но также экспрессирует и секретирует факторы с важными эндокринными функциями.К этим факторам относятся лептин, другие цитокины, адипонектин, компоненты комплемента, ингибитор активатора плазминогена-1, белки ренин-ангиотензиновой системы и резистин. Жировая ткань также является основным местом метаболизма половых стероидов и глюкокортикоидов. Важная эндокринная функция жировой ткани подчеркивается неблагоприятными метаболическими последствиями как избытка, так и дефицита жировой ткани. Лучшее понимание эндокринной функции жировой ткани, вероятно, приведет к более рациональной терапии этих все более распространенных заболеваний.В этом обзоре представлен обзор эндокринных функций жировой ткани.
Важная эндокринная функция жировой ткани подчеркивается неблагоприятными метаболическими последствиями как избытка, так и дефицита жировой ткани. Лучшее понимание эндокринной функции жировой ткани, вероятно, приведет к более рациональной терапии этих все более распространенных заболеваний.В этом обзоре представлен обзор эндокринных функций жировой ткани.
ТРАДИЦИОННОЕ ПРЕДСТАВЛЕНИЕ о жировой ткани как о пассивном резервуаре для хранения энергии больше не действует. Еще в 1987 году жировая ткань была идентифицирована как основное место метаболизма половых стероидов (1) и производства адипсина, эндокринного фактора, который заметно подавляется при ожирении грызунов (2). Последующая идентификация и характеристика лептина в 1994 году окончательно установили, что жировая ткань является эндокринным органом (3).В настоящее время известно, что жировая ткань экспрессирует и секретирует множество биоактивных пептидов, известных как адипокины, которые действуют как на локальном (аутокринном/паракринном), так и на системном (эндокринном) уровне (таблица 1). В дополнение к этим эфферентным сигналам жировая ткань экспрессирует многочисленные рецепторы, которые позволяют ей реагировать на афферентные сигналы от традиционных гормональных систем, а также центральной нервной системы (ЦНС) (таблица 2). Таким образом, помимо биологического репертуара, необходимого для хранения и высвобождения энергии, жировая ткань содержит метаболический механизм, обеспечивающий связь с отдаленными органами, включая ЦНС.Через эту интерактивную сеть жировая ткань неотъемлемо участвует в координации различных биологических процессов, включая энергетический обмен, нейроэндокринную функцию и иммунную функцию.
В дополнение к этим эфферентным сигналам жировая ткань экспрессирует многочисленные рецепторы, которые позволяют ей реагировать на афферентные сигналы от традиционных гормональных систем, а также центральной нервной системы (ЦНС) (таблица 2). Таким образом, помимо биологического репертуара, необходимого для хранения и высвобождения энергии, жировая ткань содержит метаболический механизм, обеспечивающий связь с отдаленными органами, включая ЦНС.Через эту интерактивную сеть жировая ткань неотъемлемо участвует в координации различных биологических процессов, включая энергетический обмен, нейроэндокринную функцию и иммунную функцию.
Важная эндокринная функция жировой ткани подчеркивается неблагоприятными метаболическими последствиями как избытка, так и дефицита жировой ткани. Избыток жировой ткани или ожирение, особенно в висцеральном отделе, связаны с резистентностью к инсулину, гипергликемией, дислипидемией, гипертонией, протромботическими и провоспалительными состояниями (4).Распространенность ожирения и связанных с ним заболеваний, известных как метаболический синдром, достигла масштабов эпидемии (4). Интересно, что дефицит жировой ткани или липодистрофия также связаны с особенностями метаболического синдрома как у людей, так и у грызунов (5). Кроме того, распространенность липодистрофии у людей увеличивается с использованием высокоактивной антиретровирусной терапии ВИЧ (5). Таким образом, как избыток, так и дефицит жировой ткани имеют вредные метаболические последствия и представляют собой серьезное медицинское и социально-экономическое бремя в современном мире.
Интересно, что дефицит жировой ткани или липодистрофия также связаны с особенностями метаболического синдрома как у людей, так и у грызунов (5). Кроме того, распространенность липодистрофии у людей увеличивается с использованием высокоактивной антиретровирусной терапии ВИЧ (5). Таким образом, как избыток, так и дефицит жировой ткани имеют вредные метаболические последствия и представляют собой серьезное медицинское и социально-экономическое бремя в современном мире.
Теперь ясно, что жировая ткань представляет собой сложный и высокоактивный метаболический и эндокринный орган (6, 7). Помимо адипоцитов, жировая ткань содержит матрикс соединительной ткани, нервную ткань, стромоваскулярные клетки и иммунные клетки (8). Хотя адипоциты экспрессируют и секретируют несколько эндокринных гормонов, таких как лептин и адипонектин, многие секретируемые белки происходят из неадипоцитарной фракции жировой ткани (9). Несмотря на это, эти компоненты функционируют как единое целое, что делает жировую ткань настоящим эндокринным органом (8). Здесь мы представляем обзор эндокринных функций жировой ткани. Эти функции делятся на две широкие категории: 1) секретируемые белки, оказывающие метаболическое действие на отдаленные клетки или ткани, и 2) ферменты, участвующие в метаболизме стероидных гормонов.
Здесь мы представляем обзор эндокринных функций жировой ткани. Эти функции делятся на две широкие категории: 1) секретируемые белки, оказывающие метаболическое действие на отдаленные клетки или ткани, и 2) ферменты, участвующие в метаболизме стероидных гормонов.
Примеры белков, полученных адипоцитом с эндокринными функциями
| цитокинов и цитокин белков | Leptin | ||
| TNFα | |||
| IL-6 | |||
| Другие иммунные Связанные белки | MCP-1 | MCP-1 | |
| белков, участвующие в фибринолитической системе | PAI-1 | ||
| фактор ткани | |||
| Комплект и дополнение, связанные с, связанные с белками | Adipsin (фактор дополнения D) | ||
| комплемента фактор В | |||
| ASP | |||
| Адипонектин | |||
| Липиды и белки для липидного обмена или транспортировки | липопротеин липазы (ЛПЛ) | ||
| Холестерин белка-переносчика эфиров (СЕТР) | |||
| аполипопротеина Е | |||
| NEFAs | |||
| ферментов, участвующих в стероидного метаболизма | цитохром Р450-зависимой ароматазы | ||
| 17βHSD | |||
| 11βHSD1 | |||
| Белки АГТ РАН | |||
| Другие белки | резистин |
| Цитокины и цитокин-родственных белков | лептина | |||||
| TNF & alpha; | ||||||
| ИЛ-6 | ||||||
| Другие белки иммунного, связанные с иммунами | MCP-1 | |||||
| белков, участвующие в фибринолитической системе | PAI-1 | PAI-1 | ||||
| Ткана ткани | ||||||
| Комплектные и дополнением белки | Adipsin ENT Factor d) | |||||
| Adiponectin | ||||||
| Lipids и белков для липидного метаболизма или транспорта | LipoProtein Lipase (LPL) | |||||
| Холестерин белка-переносчика эфиров (СЕТР) | ||||||
| аполипопротеина Е | ||||||
| NEFAs | ||||||
| ферментов, участвующих в стероидного метаболизма | цитохром Р450-зависимой ароматазы | |||||
| 17βHSD | ||||||
| 11βHSD1 | 11βHSD1 | |||||
| белков RAS | AGT | |||||
| Другие белки | резидента | |||||
| Cytokines и Cytokine белки | Leptin | |||||
| TNFα | ||||||
| IL-6 | ||||||
| Другие белки по иммунию | MCP-1 | |||||
| белков, участвующих в фибринолитической системе | PAI-1 | |||||
| тканевых фактор | ||||||
| Дополнение и дополнение, связанные с, связанными с | Adipsin (Фактор дополнения D) | |||||
| Фактор дополнения B | ||||||
| ASP | ||||||
| Липидов и белков для липидного метаболизма или транспорта | Липопротеина Липаз (LPL) | |||||
| Эстер на эфир холестерина (CETP) | аполипопротеина Е | |||||
| NEFAs | ||||||
| ферментов, участвующих в стероидного метаболизма | цитохром Р450-зависимой ароматазы | |||||
| 17βHSD | ||||||
| 11βHSD1 | ||||||
| Белки из РАН | АГТ | |||||
| Другие белки | резистин |
| Цитокины и цитокин-родственных белков | Лептин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TNF-alpha | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ИЛ-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие белки, связанные с иммунами | MCP-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| белков, участвующие в фибринолитической системе | PAI-1 | PAI-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ткани | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Комплектные и дополнением белки | Adipsin (дополнение R D) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| комплемента фактор В | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ASP | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Адипонектин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Липиды и белки для липидного обмена или транспортировки | липопротеин липазы (ЛПЛ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Холестерин белка-переносчика эфиров (СЕТР) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| аполипопротеина Е | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NEFAs | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ферментов, участвующих в стероидного метаболизма | цитохром Р450-зависимой ароматазы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17βHSD | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11βHSD1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Белки РАН | АГТ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие белки | Резистин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рецепторы для традиционных эндокринных гормонов | Инсулин рецепторов |
| Глюкагон рецептора | |
| GH-рецептор | |
| ТСГ рецептора | |
| гастрина / CCK-B-рецептор | |
| Глюкагон подобных пептида-1 рецептор | рецепторов|
| ангиотензин II типа 1 и 2 | |
| ядерные рецепторы гормонов | глюкокортикоидный рецептор |
| Рецептор витамина D | |
| рецептор гормона щитовидной железы | |
| андроген рецептор | |
| Estrogen рецептор | |
| Receptor Progesterone | цитокиновых рецепторы | лептина-рецептор |
| IL-6-рецептор | |
| ФНО-рецептор | |
| катехоламинов рецепторы | & beta; 1, & beta; 2, & beta; 3-рецепторы |
| & alpha; 1, & alpha; 2 рецепторов |
| Рецепторы для традиционных эндокринных гормонов | инсулин рецепторов | ||
| Глюкагон рецептора | |||
| GH рецептора | |||
| рецептора ТТГ | |||
| гастрина / CCK -B рецептор | |||
| глюкагона, таких как пептид-1 рецептор | |||
| Angiotensin II рецепторы типа 1 и 2 | |||
| рецепторы ядерных гормонов | глюкокортикоидные рецептор | ||
| Витамин D-рецептор | |||
| Гормон щитовидной железы рецептора | |||
| андрогенных рецепторов | |||
| Эстроген рецептора | |||
| Прогестерон рецептора | |||
| цитокиновых рецепторов рецептор | лептина | ||
| IL-6 рецептор | |||
| TNFα рецептор | |||
| Catecholamine рецепторы | β1, β2, β3 рецепторы | ||
| α1, α2 рецепторы |
| Рецепторы для традиционных эндокринных гормонов | Инсулин рецепторов |
| Глюкагон рецептора | |
| GH-рецептор | |
| ТСГ рецептора | |
| гастрина / CCK-B-рецептор | |
| Глюкагон подобных пептида-1 рецептор | рецепторов|
| ангиотензин II типа 1 и 2 | |
| ядерные рецепторы гормонов | глюкокортикоидный рецептор |
| Рецептор витамина D | |
| рецептор гормона щитовидной железы | |
| андроген рецептор | |
| Estrogen рецептор | |
| Receptor Progesterone | цитокиновых рецепторы | лептина-рецептор |
| IL-6-рецептор | |
| ФНО-рецептор | |
| катехоламинов рецепторы | & beta; 1, & beta; 2, & beta; 3-рецепторы |
| & alpha; 1, & alpha; 2 рецепторов |
| Рецепторы для традиционных эндокринных гормонов | инсулин рецепторов | ||
| Глюкагон рецептора | |||
| GH рецептора | |||
| рецептора ТТГ | |||
| гастрина / CCK -B рецептор | |||
| глюкагона, таких как пептид-1 рецептор | |||
| Angiotensin II рецепторы типа 1 и 2 | |||
| рецепторы ядерных гормонов | глюкокортикоидные рецептор | ||
| Витамин D-рецептор | |||
| Гормон щитовидной железы рецептора | |||
| андрогенных рецепторов | |||
| Эстроген рецептора | |||
| Прогестерон рецептора | |||
| цитокиновых рецепторов рецептор | лептина | ||
| IL-6-рецептора | |||
| рецептора TNF-alpha | |||
| катехоламинов рецепторы | & beta; 1, & beta; 2, & beta; 3-рецепторы | ||
| α1, & alpha; 2-рецепторы |
жировой ткани секретируемых белков
Лептин
Перед идентификацией лептина исследования парабиоза у мышей, несущих рецессивные мутации, страдающих ожирением ( ob ) и диабетом ( db ), предсказали существование циркулирующего эндокринного гормона, способного передавать информацию с периферии в ЦНС в отношении достаточности запасов энергии (10). Эти предсказания впоследствии были подтверждены идентификацией гена лептина (Lep ob ) в 1994 г. (3) и родственного ему рецептора в 1995 и 1996 гг. (Lepr db , Lepr fa ) (11–13). Лептин (от греческого leptos , что означает тонкий) представляет собой полипептид с молекулярной массой 16 кДа, содержащий 167 аминокислот со структурной гомологией цитокинов. Адипоциты секретируют лептин прямо пропорционально массе жировой ткани, а также статусу питания, и эта секреция больше из подкожной клетчатки по сравнению с висцеральной жировой тканью (9, 14).Экспрессия и секреция лептина также регулируются множеством других факторов. Например, уровень лептина повышается под действием инсулина, глюкокортикоидов, TNFα, эстрогенов и CCAAT/энхансер-связывающего белка-α и снижается под действием β3-адренергической активности, андрогенов, свободных жирных кислот, ГР и агонистов гамма-рецепторов, активируемых пролиферацией пероксисом. 15). Рецепторы лептина являются членами надсемейства цитокиновых рецепторов класса I и экспрессируются как в ЦНС, так и на периферии (16).
Эти предсказания впоследствии были подтверждены идентификацией гена лептина (Lep ob ) в 1994 г. (3) и родственного ему рецептора в 1995 и 1996 гг. (Lepr db , Lepr fa ) (11–13). Лептин (от греческого leptos , что означает тонкий) представляет собой полипептид с молекулярной массой 16 кДа, содержащий 167 аминокислот со структурной гомологией цитокинов. Адипоциты секретируют лептин прямо пропорционально массе жировой ткани, а также статусу питания, и эта секреция больше из подкожной клетчатки по сравнению с висцеральной жировой тканью (9, 14).Экспрессия и секреция лептина также регулируются множеством других факторов. Например, уровень лептина повышается под действием инсулина, глюкокортикоидов, TNFα, эстрогенов и CCAAT/энхансер-связывающего белка-α и снижается под действием β3-адренергической активности, андрогенов, свободных жирных кислот, ГР и агонистов гамма-рецепторов, активируемых пролиферацией пероксисом. 15). Рецепторы лептина являются членами надсемейства цитокиновых рецепторов класса I и экспрессируются как в ЦНС, так и на периферии (16). Хотя было идентифицировано несколько вариантов сплайсинга рецептора лептина, длинная форма опосредует большинство бесчисленных эффектов лептина (16).
Хотя было идентифицировано несколько вариантов сплайсинга рецептора лептина, длинная форма опосредует большинство бесчисленных эффектов лептина (16).
Хорошо задокументировано влияние лептина на энергетический гомеостаз (17). Многие из этих эффектов, особенно на потребление и расход энергии, опосредованы гипоталамическими путями, тогда как другие эффекты опосредованы прямым воздействием на периферические ткани, включая мышечные и β-клетки поджелудочной железы (16). Хотя первоначально лептин рассматривался как гормон против ожирения, основная роль лептина заключается в том, чтобы служить метаболическим сигналом о достаточности энергии, а не об избытке (18). Уровни лептина быстро снижаются при ограничении калорий и потере веса.Это снижение связано с адаптивными физиологическими реакциями на голодание, включая повышение аппетита и снижение расхода энергии. Такие же реакции наблюдаются у мышей и людей с дефицитом лептина, несмотря на массивное ожирение. Кроме того, эти реакции легко нормализуются при заместительной терапии низкими дозами лептина.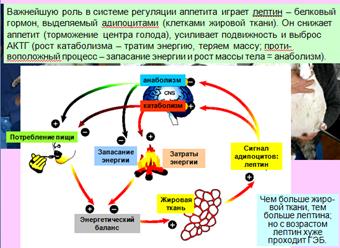 Напротив, распространенные формы ожирения характеризуются повышенным уровнем циркулирующего лептина. Ни эндогенно высокие уровни лептина, ни лечение экзогенным лептином не эффективны для облегчения этого ожирения, что соответствует состоянию резистентности к лептину (16, 19).Механизм резистентности к лептину неизвестен, но может быть результатом дефектов передачи сигналов лептина или его транспорта через гематоэнцефалический барьер (16, 19). Очевидно, что наиболее чувствительная часть кривой доза-реакция лептина находится в физиологическом диапазоне между низкими уровнями, вызванными ограничением в еде, и повышением уровней, вызванным возобновлением питания, а не в супрафизиологическом диапазоне, связанном с ожирением. Эта роль лептина как индикатора достаточности энергии имеет смысл с эволюционной точки зрения, но не дает утешения в нашей нынешней среде изобилия энергии.
Напротив, распространенные формы ожирения характеризуются повышенным уровнем циркулирующего лептина. Ни эндогенно высокие уровни лептина, ни лечение экзогенным лептином не эффективны для облегчения этого ожирения, что соответствует состоянию резистентности к лептину (16, 19).Механизм резистентности к лептину неизвестен, но может быть результатом дефектов передачи сигналов лептина или его транспорта через гематоэнцефалический барьер (16, 19). Очевидно, что наиболее чувствительная часть кривой доза-реакция лептина находится в физиологическом диапазоне между низкими уровнями, вызванными ограничением в еде, и повышением уровней, вызванным возобновлением питания, а не в супрафизиологическом диапазоне, связанном с ожирением. Эта роль лептина как индикатора достаточности энергии имеет смысл с эволюционной точки зрения, но не дает утешения в нашей нынешней среде изобилия энергии.
Помимо воздействия на энергетический гомеостаз, лептин регулирует нейроэндокринную функцию и традиционные эндокринные системы. Дефицит лептина у мышей Lep ob /Lep ob связан с активацией гипоталамо-гипофизарно-надпочечниковой (ГГН) оси и подавлением гипоталамо-гипофизарно-щитовидной и гонадной осей. Лептин снижает гиперкортизолемию у мышей Lep ob /Lep ob , ингибирует индуцированную стрессом секрецию гипоталамического CRH у мышей и ингибирует секрецию кортизола клетками коры надпочечников грызунов и человека in vitro .Роль лептина в активности HPA у человека in vivo остается неясной. Лептин также нормализует подавленные уровни гормонов щитовидной железы у мышей и людей с дефицитом лептина, частично посредством стимуляции экспрессии и секреции ТРГ нейронами гипоталамуса (16, 20). Лептин ускоряет половое созревание у нормальных мышей и восстанавливает нормальную секрецию гонадотропина и репродуктивную функцию у мышей и людей с дефицитом лептина (21). Замена лептина во время голодания предотвращает вызванные голоданием изменения в гипоталамо-гипофизарно-гонадной и щитовидной осях у здоровых мужчин (22).
Дефицит лептина у мышей Lep ob /Lep ob связан с активацией гипоталамо-гипофизарно-надпочечниковой (ГГН) оси и подавлением гипоталамо-гипофизарно-щитовидной и гонадной осей. Лептин снижает гиперкортизолемию у мышей Lep ob /Lep ob , ингибирует индуцированную стрессом секрецию гипоталамического CRH у мышей и ингибирует секрецию кортизола клетками коры надпочечников грызунов и человека in vitro .Роль лептина в активности HPA у человека in vivo остается неясной. Лептин также нормализует подавленные уровни гормонов щитовидной железы у мышей и людей с дефицитом лептина, частично посредством стимуляции экспрессии и секреции ТРГ нейронами гипоталамуса (16, 20). Лептин ускоряет половое созревание у нормальных мышей и восстанавливает нормальную секрецию гонадотропина и репродуктивную функцию у мышей и людей с дефицитом лептина (21). Замена лептина во время голодания предотвращает вызванные голоданием изменения в гипоталамо-гипофизарно-гонадной и щитовидной осях у здоровых мужчин (22).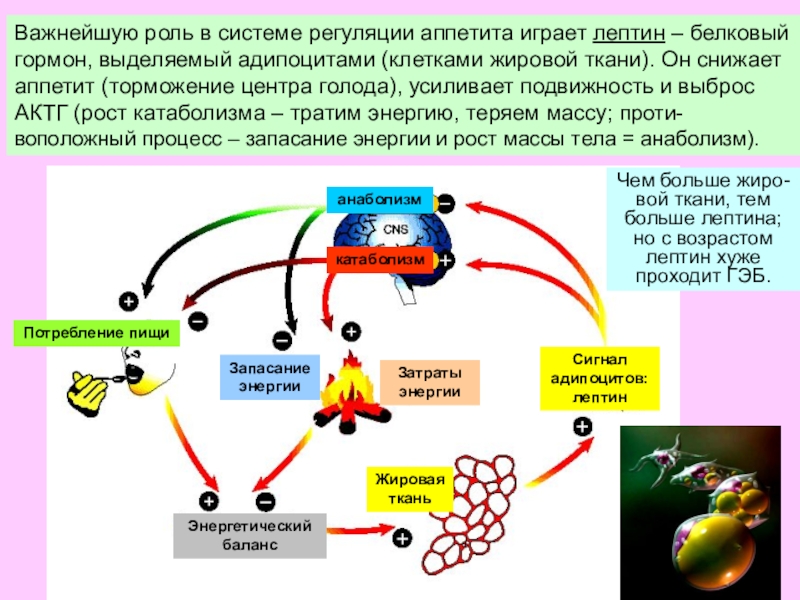 Лептин также оказывает прямое воздействие через периферические лептиновые рецепторы в яичниках, яичках, простате и плаценте (15).
Лептин также оказывает прямое воздействие через периферические лептиновые рецепторы в яичниках, яичках, простате и плаценте (15).
Несколько других важных эндокринных эффектов лептина включают регуляцию иммунной функции, гемопоэза, ангиогенеза и развития костей. Лептин нормализует подавленную иммунную функцию, связанную с недоеданием и дефицитом лептина (23). Лептин также способствует пролиферации и дифференцировке гемопоэтических клеток, изменяет продукцию цитокинов иммунными клетками, стимулирует рост эндотелиальных клеток и ангиогенез и ускоряет заживление ран (15).Важная роль лептина в развитии костей подтверждается наблюдением, что лептин-дефицитные мыши Lep ob / Lep ob имеют увеличенную костную массу, несмотря на гиперкортизолемию и гипогонадизм (24). Химические поражения специфических нейронов гипоталамуса позволяют предположить, что вентральный медиальный гипоталамус (VMH) участвует в влиянии лептина на костную массу (24). Известно, что лептин-чувствительные нейроны в VMH влияют на активность симпатической нервной системы (СНС). Действительно, мыши с дефектной активностью СНС из-за отсутствия дофамин-β-гидроксилазы имеют высокую костную массу и устойчивы к антиостеогенным эффектам лептина, тогда как трансгенная гиперэкспрессия лептина в остеобластах не влияет на костную массу (24).Эти данные свидетельствуют о том, что лептин косвенно снижает костную массу через активацию СНС (24). Лептин явно имеет разнообразную эндокринную функцию в дополнение к его влиянию на энергетический гомеостаз. В результате лептин является прототипом всех эндокринных гормонов жировой ткани.
Действительно, мыши с дефектной активностью СНС из-за отсутствия дофамин-β-гидроксилазы имеют высокую костную массу и устойчивы к антиостеогенным эффектам лептина, тогда как трансгенная гиперэкспрессия лептина в остеобластах не влияет на костную массу (24).Эти данные свидетельствуют о том, что лептин косвенно снижает костную массу через активацию СНС (24). Лептин явно имеет разнообразную эндокринную функцию в дополнение к его влиянию на энергетический гомеостаз. В результате лептин является прототипом всех эндокринных гормонов жировой ткани.
ФНОα
TNFα представляет собой цитокин, первоначально описанный как эндотоксин-индуцированный фактор, вызывающий некроз опухолей, и впоследствии было показано, что он идентичен кахексину, фактору, секретируемому макрофагами in vitro (Ref.25 и ссылки в нем). TNFα представляет собой трансмембранный белок с молекулярной массой 26 кДа, который расщепляется до биологически активного белка с молекулярной массой 17 кДа, который оказывает свое действие через рецепторы TNFα типа I и типа II. В жировой ткани TNFα экспрессируется адипоцитами и стромоваскулярными клетками (9). Экспрессия TNFα выше в подкожной клетчатке по сравнению с висцеральной жировой тканью, но этот результат может зависеть от общей и регионарной жировой массы (9, 14). Адипоциты также экспрессируют оба типа рецепторов TNFα как в связанной с мембраной, так и в растворимой формах (25).Способность TNFα индуцировать кахексию in vivo естественным образом привела к обширной оценке его роли в энергетическом гомеостазе.
В жировой ткани TNFα экспрессируется адипоцитами и стромоваскулярными клетками (9). Экспрессия TNFα выше в подкожной клетчатке по сравнению с висцеральной жировой тканью, но этот результат может зависеть от общей и регионарной жировой массы (9, 14). Адипоциты также экспрессируют оба типа рецепторов TNFα как в связанной с мембраной, так и в растворимой формах (25).Способность TNFα индуцировать кахексию in vivo естественным образом привела к обширной оценке его роли в энергетическом гомеостазе.
Хотя изначально предполагалось, что он играет роль в кахексии, в настоящее время TNFα участвует в патогенезе ожирения и резистентности к инсулину (25–27). Экспрессия TNFα в жировой ткани повышена у тучных грызунов и людей и положительно коррелирует с ожирением и резистентностью к инсулину (25–28). Хотя циркулирующие концентрации TNFα низки по сравнению с локальными концентрациями в тканях, уровни TNFα в плазме положительно коррелируют с ожирением и резистентностью к инсулину в некоторых исследованиях, но не в других (28). Хроническое воздействие TNFα вызывает резистентность к инсулину как in vitro , так и in vivo (25). Лечение нейтрализующими растворимыми рецепторами TNFα улучшает чувствительность к инсулину при ожирении у грызунов, но не у людей (25). Направленная делеция гена TNFα или его рецепторов значительно улучшает чувствительность к инсулину и циркулирующие неэтерифицированные жирные кислоты (NEFA) при ожирении у грызунов (29).
Хроническое воздействие TNFα вызывает резистентность к инсулину как in vitro , так и in vivo (25). Лечение нейтрализующими растворимыми рецепторами TNFα улучшает чувствительность к инсулину при ожирении у грызунов, но не у людей (25). Направленная делеция гена TNFα или его рецепторов значительно улучшает чувствительность к инсулину и циркулирующие неэтерифицированные жирные кислоты (NEFA) при ожирении у грызунов (29).
Описано несколько потенциальных механизмов метаболических эффектов TNFα. Во-первых, TNFα влияет на экспрессию генов в метаболически важных тканях, таких как жировая ткань и печень (30).В жировой ткани TNFα репрессирует гены, участвующие в поглощении и накоплении NEFA и глюкозы, подавляет гены факторов транскрипции, участвующих в адипогенезе и липогенезе, и изменяет экспрессию нескольких секретируемых адипоцитами факторов, включая адипонектин и IL-6 (30). В печени TNFα подавляет экспрессию генов, участвующих в поглощении и метаболизме глюкозы и окислении жирных кислот, и увеличивает экспрессию генов, участвующих в синтезе холестерина и жирных кислот de novo (30). Во-вторых, TNFα нарушает передачу сигналов инсулина. Этот эффект опосредуется активацией сериновых киназ, которые увеличивают сериновое фосфорилирование субстратов рецепторов инсулина-1 и -2, делая их плохими субстратами для киназ рецепторов инсулина и усиливая их деградацию (26). TNFα также опосредованно ухудшает передачу сигналов инсулина за счет увеличения NEFA в сыворотке, которые, как было независимо показано, индуцируют резистентность к инсулину во многих тканях (25). Таким образом, в то время как TNFα явно влияет на несколько метаболических процессов, относительный вклад прямых эндокринных эффектов может быть менее значительным, чем косвенные эффекты, возникающие в результате аутокринной или паракринной модуляции NEFA или других гормонов, полученных из жировой ткани.
Во-вторых, TNFα нарушает передачу сигналов инсулина. Этот эффект опосредуется активацией сериновых киназ, которые увеличивают сериновое фосфорилирование субстратов рецепторов инсулина-1 и -2, делая их плохими субстратами для киназ рецепторов инсулина и усиливая их деградацию (26). TNFα также опосредованно ухудшает передачу сигналов инсулина за счет увеличения NEFA в сыворотке, которые, как было независимо показано, индуцируют резистентность к инсулину во многих тканях (25). Таким образом, в то время как TNFα явно влияет на несколько метаболических процессов, относительный вклад прямых эндокринных эффектов может быть менее значительным, чем косвенные эффекты, возникающие в результате аутокринной или паракринной модуляции NEFA или других гормонов, полученных из жировой ткани.
Ил-6
IL-6 — еще один цитокин, связанный с ожирением и резистентностью к инсулину (28). IL-6 циркулирует в нескольких гликозилированных формах размером от 22 до 27 кДа. Рецептор IL-6 (IL-6R) гомологичен рецептору лептина и существует как в связанной с мембраной форме с молекулярной массой приблизительно 80 кДа, так и в виде растворимой формы с молекулярной массой приблизительно 50 кДа. Комплекс, состоящий из связанного с лигандом рецептора и двух гомодимеризованных трансмембранных молекул gp130, запускает внутриклеточную передачу сигналов с помощью IL-6.В жировой ткани IL-6 и IL-6R экспрессируются адипоцитами и матриксом жировой ткани (9). Экспрессия и секреция IL-6 в 2–3 раза выше в висцеральной ткани по сравнению с подкожной жировой тканью (9, 14). В отличие от TNFα, IL-6 циркулирует в кровотоке в больших количествах, и до одной трети циркулирующего IL-6 происходит из жировой ткани (28).
Рецептор IL-6 (IL-6R) гомологичен рецептору лептина и существует как в связанной с мембраной форме с молекулярной массой приблизительно 80 кДа, так и в виде растворимой формы с молекулярной массой приблизительно 50 кДа. Комплекс, состоящий из связанного с лигандом рецептора и двух гомодимеризованных трансмембранных молекул gp130, запускает внутриклеточную передачу сигналов с помощью IL-6.В жировой ткани IL-6 и IL-6R экспрессируются адипоцитами и матриксом жировой ткани (9). Экспрессия и секреция IL-6 в 2–3 раза выше в висцеральной ткани по сравнению с подкожной жировой тканью (9, 14). В отличие от TNFα, IL-6 циркулирует в кровотоке в больших количествах, и до одной трети циркулирующего IL-6 происходит из жировой ткани (28).
Экспрессия IL-6 в жировой ткани и концентрации циркулирующего IL-6 положительно коррелируют с ожирением, нарушением толерантности к глюкозе и резистентностью к инсулину (28).Уровни как экспрессии, так и циркуляции снижаются с потерей веса (28). Кроме того, концентрация IL-6 в плазме предсказывает развитие диабета 2 типа и сердечно-сосудистых заболеваний (28). Генетические полиморфизмы локуса IL-6 связаны с ожирением, расходом энергии, чувствительностью к инсулину и диабетом 2 типа (28). Кроме того, периферическое введение IL-6 вызывает гиперлипидемию, гипергликемию и резистентность к инсулину у грызунов и людей (28). IL-6 также снижает передачу сигналов инсулина в периферических тканях за счет уменьшения экспрессии компонентов передачи сигналов рецепторов инсулина и индукции супрессора передачи сигналов цитокинов 3 , отрицательного регулятора передачи сигналов как лептина, так и инсулина (31).IL-6 также ингибирует адипогенез и снижает секрецию адипонектина (28). Эти периферические эффекты ИЛ-6 согласуются с приведенными выше эпидемиологическими данными, предполагающими причинную роль ИЛ-6 в развитии ожирения и резистентности к инсулину.
Генетические полиморфизмы локуса IL-6 связаны с ожирением, расходом энергии, чувствительностью к инсулину и диабетом 2 типа (28). Кроме того, периферическое введение IL-6 вызывает гиперлипидемию, гипергликемию и резистентность к инсулину у грызунов и людей (28). IL-6 также снижает передачу сигналов инсулина в периферических тканях за счет уменьшения экспрессии компонентов передачи сигналов рецепторов инсулина и индукции супрессора передачи сигналов цитокинов 3 , отрицательного регулятора передачи сигналов как лептина, так и инсулина (31).IL-6 также ингибирует адипогенез и снижает секрецию адипонектина (28). Эти периферические эффекты ИЛ-6 согласуются с приведенными выше эпидемиологическими данными, предполагающими причинную роль ИЛ-6 в развитии ожирения и резистентности к инсулину.
Оценка центральной роли IL-6, однако, предполагает более сложную роль IL-6 в энергетическом гомеостазе. Уровни ИЛ-6 в ЦНС отрицательно коррелируют с жировой массой у людей с избыточным весом, что свидетельствует о центральном дефиците ИЛ-6 при ожирении. Центральное введение IL-6 увеличивает расход энергии и уменьшает жировые отложения у грызунов.Кроме того, у трансгенных мышей со сверхэкспрессией IL-6 наблюдается генерализованный дефект роста, который включает снижение массы тела и снижение массы жировых отложений (32). С другой стороны, у мышей с целевой делецией IL-6 развивается ожирение в зрелом возрасте и связанные с ним метаболические нарушения, которые устраняются заменой IL-6, что позволяет предположить, что IL-6 участвует в предотвращении, а не в возникновении этих состояний (33). . Следовательно, ИЛ-6 по-разному влияет на энергетический гомеостаз на периферии и в ЦНС.
Центральное введение IL-6 увеличивает расход энергии и уменьшает жировые отложения у грызунов.Кроме того, у трансгенных мышей со сверхэкспрессией IL-6 наблюдается генерализованный дефект роста, который включает снижение массы тела и снижение массы жировых отложений (32). С другой стороны, у мышей с целевой делецией IL-6 развивается ожирение в зрелом возрасте и связанные с ним метаболические нарушения, которые устраняются заменой IL-6, что позволяет предположить, что IL-6 участвует в предотвращении, а не в возникновении этих состояний (33). . Следовательно, ИЛ-6 по-разному влияет на энергетический гомеостаз на периферии и в ЦНС.
Макрофаги и хемоаттрактантный белок моноцитов (MCP)-1
Ожирение связано с повышенной инфильтрацией жировой ткани макрофагами (34, 34A, 34B).Активированные макрофаги секретируют воспалительные факторы, которые способствуют резистентности к инсулину, включая TNFα и IL-6. МСР-1, хемокин, который рекрутирует моноциты в места воспаления, экспрессируется и секретируется жировой тканью (34). В то время как клеточный источник экспрессии MCP-1 неясен, вовлечены как адипоциты, так и стромоваскулярные клетки (34). Экспрессия MCP-1 в жировой ткани и уровни циркулирующего MCP-1 увеличиваются при ожирении у грызунов, что позволяет предположить, что MCP-1-опосредованная инфильтрация жировой ткани макрофагами может способствовать метаболическим нарушениям, связанным с ожирением и резистентностью к инсулину (35, 36).
В то время как клеточный источник экспрессии MCP-1 неясен, вовлечены как адипоциты, так и стромоваскулярные клетки (34). Экспрессия MCP-1 в жировой ткани и уровни циркулирующего MCP-1 увеличиваются при ожирении у грызунов, что позволяет предположить, что MCP-1-опосредованная инфильтрация жировой ткани макрофагами может способствовать метаболическим нарушениям, связанным с ожирением и резистентностью к инсулину (35, 36).
МСР-1 оказывает как местное, так и эндокринное действие. Инкубация культивируемых адипоцитов с МСР-1 снижает стимулированное инсулином поглощение глюкозы и индуцированное инсулином фосфорилирование тирозина рецептора инсулина, что позволяет предположить, что МСР-1 непосредственно способствует инсулинорезистентности жировой ткани (36, 37). MCP-1 также ингибирует рост и дифференцировку адипоцитов за счет снижения экспрессии ряда адипогенных генов (36, 37). Увеличение циркулирующего MCP-1 при ожирении у грызунов связано с увеличением циркулирующих моноцитов (35).Периферическое введение МСР-1 мышам увеличивает количество циркулирующих моноцитов, способствует накоплению моноцитов в коллатеральных артериях и увеличивает образование неоинтимы (35, 38). Эти данные подтверждают эндокринную функцию MCP-1 и предполагают ее участие в развитии атеросклероза.
Эти данные подтверждают эндокринную функцию MCP-1 и предполагают ее участие в развитии атеросклероза.
Ингибитор активатора плазминогена (PAI)-1
Несколько белков системы гемостаза и фибринолиза секретируются адипоцитами, включая тканевой фактор и PAI-1 (39).PAI-1 является членом семейства ингибиторов сериновых протеаз и является основным ингибитором фибринолиза путем инактивации активатора плазминогена урокиназного типа и тканевого типа. PAI-1 также участвует во множестве других биологических процессов, включая ангиогенез и атерогенез. PAI-1 экспрессируется многими типами клеток в жировой ткани, включая адипоциты (9). Экспрессия и секреция PAI-1 выше в висцеральной по сравнению с подкожной жировой тканью (9, 14).
Уровни PAI-1 в плазме повышены при ожирении и резистентности к инсулину, положительно коррелируют с признаками метаболического синдрома и предсказывают будущий риск развития диабета 2 типа и сердечно-сосудистых заболеваний (39, 40).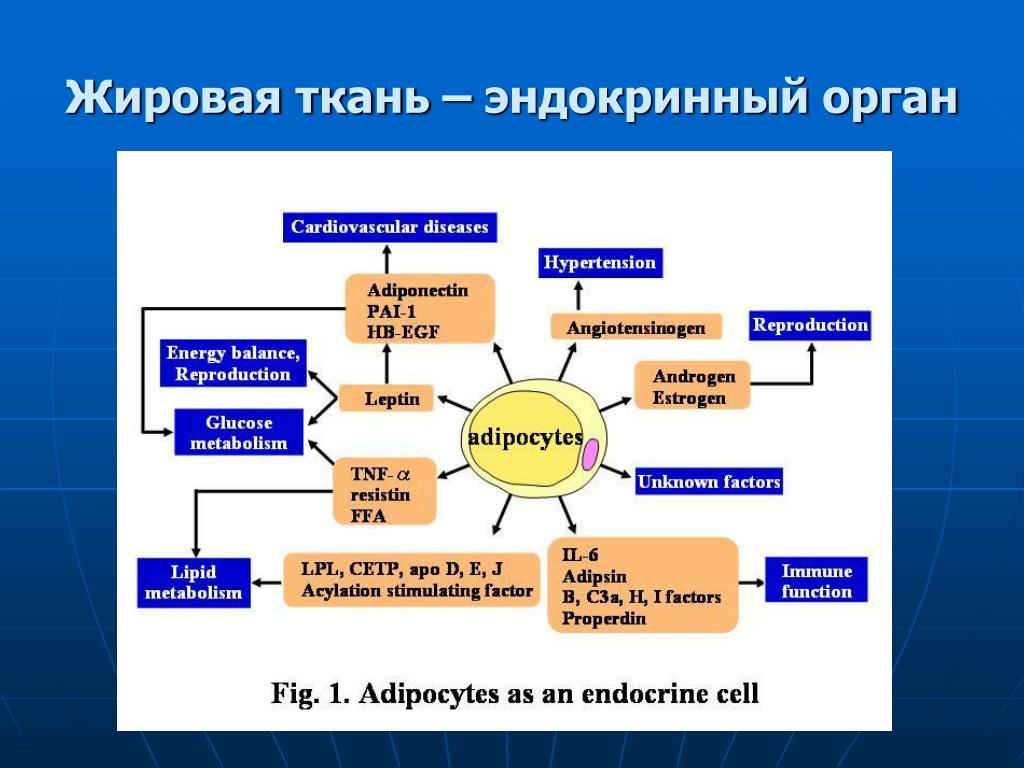 Уровни PAI-1 в плазме тесно связаны с висцеральным ожирением, которое не зависит от других переменных, включая чувствительность к инсулину, общую массу жировой ткани или возраст (14, 39). Потеря веса и улучшение чувствительности к инсулину благодаря лечению метформином или тиазоладиндионами (TZD) значительно снижают уровни циркулирующего PAI-1 (39). TNFα способствует повышению уровня PAI-1, наблюдаемому при ожирении и резистентности к инсулину (9, 39, 40). У мышей с направленной делецией PAI-1 наблюдалось снижение прибавки в весе на диете с высоким содержанием жиров, увеличение расхода энергии, улучшение толерантности к глюкозе и повышение чувствительности к инсулину (41).Точно так же направленная делеция PAI-1 у мышей Lep ob / Lep ob снижает ожирение и улучшает метаболические параметры (42). Таким образом, PAI-1 может способствовать развитию ожирения и резистентности к инсулину и может быть причинно-следственной связью между ожирением и сердечно-сосудистыми заболеваниями.
Уровни PAI-1 в плазме тесно связаны с висцеральным ожирением, которое не зависит от других переменных, включая чувствительность к инсулину, общую массу жировой ткани или возраст (14, 39). Потеря веса и улучшение чувствительности к инсулину благодаря лечению метформином или тиазоладиндионами (TZD) значительно снижают уровни циркулирующего PAI-1 (39). TNFα способствует повышению уровня PAI-1, наблюдаемому при ожирении и резистентности к инсулину (9, 39, 40). У мышей с направленной делецией PAI-1 наблюдалось снижение прибавки в весе на диете с высоким содержанием жиров, увеличение расхода энергии, улучшение толерантности к глюкозе и повышение чувствительности к инсулину (41).Точно так же направленная делеция PAI-1 у мышей Lep ob / Lep ob снижает ожирение и улучшает метаболические параметры (42). Таким образом, PAI-1 может способствовать развитию ожирения и резистентности к инсулину и может быть причинно-следственной связью между ожирением и сердечно-сосудистыми заболеваниями.
Адипонектин
Адипонектин был независимо охарактеризован в 1995 и 1996 годах четырьмя группами с использованием различных методов, отсюда и его альтернативные названия apM1 (транскрипт 1 наиболее распространенного гена жировой ткани), Acrp30 (белок, связанный с комплементом адипоцитов, 30 кДа), adipoQ и GBP28 (желатинсвязывающий белок). белок 28 кДа) (43–46).Адипонектин высоко и специфически экспрессируется в дифференцированных адипоцитах и циркулирует в больших количествах в кровотоке (47). Экспрессия адипонектина выше в подкожной клетчатке, чем в висцеральной жировой ткани (9). Адипонектин представляет собой полипептид приблизительно 30 кДа, содержащий N-концевую сигнальную последовательность, вариабельный домен, коллагеноподобный домен и С-концевой глобулярный домен (43–46). Он имеет сильную гомологию последовательностей с коллагеном типа VIII и X и компонентом комплемента C1q (43–46). Интересно, что третичная структура глобулярного домена имеет поразительное сходство с TNFα, несмотря на отсутствие гомологии в первичной последовательности (47). Посттрансляционная модификация путем гидроксилирования и гликозилирования приводит к множеству изоформ, которые собираются в тримеры, а затем в олигомерные структуры более высокого порядка (47). Продукт протеолитического расщепления, содержащий глобулярный домен адипонектина, также циркулирует в физиологически значимых количествах и обладает биологической активностью (47).
Посттрансляционная модификация путем гидроксилирования и гликозилирования приводит к множеству изоформ, которые собираются в тримеры, а затем в олигомерные структуры более высокого порядка (47). Продукт протеолитического расщепления, содержащий глобулярный домен адипонектина, также циркулирует в физиологически значимых количествах и обладает биологической активностью (47).
Были идентифицированы адипонектиновые рецепторы (AdipoR) 1 и 2 (48). Рецепторы содержат семь трансмембранных доменов, но структурно и функционально отличаются от рецепторов, связанных с G-белком.AdipoR1 экспрессируется преимущественно в мышцах и функционирует как высокоаффинный рецептор для глобулярного адипонектина и низкоаффинный рецептор для полноразмерного адипонектина. AdipoR2 экспрессируется главным образом в печени и функционирует как рецептор промежуточной аффинности как для глобулярного, так и для полноразмерного адипонектина. Таким образом, биологические эффекты адипонектина зависят не только от относительных циркулирующих концентраций и свойств различных изоформ адипонектина, но также и от тканеспецифичной экспрессии подтипов рецепторов адипонектина.
Была установлена сильная и последовательная обратная связь между адипонектином и инсулинорезистентностью и воспалительными состояниями (47, 49). Плазменный адипонектин снижается до начала ожирения и резистентности к инсулину у нечеловеческих приматов, что позволяет предположить, что гипоадипонектинемия способствует патогенезу этих состояний (50). Уровни адипонектина низкие при резистентности к инсулину из-за ожирения или липодистрофии, и введение адипонектина улучшает метаболические параметры в этих условиях (47, 49, 51).И наоборот, уровни адипонектина увеличиваются при улучшении чувствительности к инсулину, что происходит после снижения веса или лечения препаратами, повышающими чувствительность к инсулину (47, 49). Кроме того, несколько полиморфизмов в гене адипонектина связаны с ожирением и резистентностью к инсулину (47, 49). Эти эпидемиологические данные подтверждаются исследованиями на мышиных моделях с измененной экспрессией адипонектина. У мышей с дефицитом адипонектина в ответ на травму развивается преждевременная вызванная диетой непереносимость глюкозы и резистентность к инсулину, повышение НЭЖК в сыворотке и усиление пролиферации гладкой мускулатуры неоинтимы сосудов (52, 53). Этот неблагоприятный метаболический профиль возникает без существенных различий в массе тела или потреблении пищи (52, 53). Напротив, трансгенная избыточная экспрессия адипонектина у мышей приводит к улучшению чувствительности к инсулину, толерантности к глюкозе и NEFA в сыворотке (53, 54).
Этот неблагоприятный метаболический профиль возникает без существенных различий в массе тела или потреблении пищи (52, 53). Напротив, трансгенная избыточная экспрессия адипонектина у мышей приводит к улучшению чувствительности к инсулину, толерантности к глюкозе и NEFA в сыворотке (53, 54).
Описано несколько механизмов метаболических эффектов адипонектина (47, 49). В печени адипонектин повышает чувствительность к инсулину, уменьшает приток НЭЖК, увеличивает окисление жирных кислот и снижает выработку глюкозы печенью.В мышцах адипонектин стимулирует использование глюкозы и окисление жирных кислот. Внутри сосудистой стенки адипонектин ингибирует адгезию моноцитов за счет снижения экспрессии молекул адгезии, ингибирует трансформацию макрофагов в пенистые клетки за счет ингибирования экспрессии рецепторов-мусорщиков и снижает пролиферацию мигрирующих гладкомышечных клеток в ответ на факторы роста. Кроме того, адипонектин увеличивает продукцию оксида азота в эндотелиальных клетках и стимулирует ангиогенез.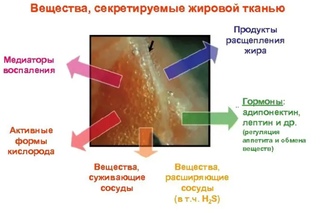 Эти эффекты опосредованы повышенным фосфорилированием рецептора инсулина, активацией AMP-активируемой протеинкиназы и модуляцией пути ядерного фактора κB (47, 49).В совокупности эти исследования показывают, что адипонектин является уникальным гормоном, происходящим из адипоцитов, с антидиабетическим, противовоспалительным и антиатерогенным действием.
Эти эффекты опосредованы повышенным фосфорилированием рецептора инсулина, активацией AMP-активируемой протеинкиназы и модуляцией пути ядерного фактора κB (47, 49).В совокупности эти исследования показывают, что адипонектин является уникальным гормоном, происходящим из адипоцитов, с антидиабетическим, противовоспалительным и антиатерогенным действием.
Адипсин и белок, стимулирующий ацилирование (ASP)
Адипсин (фактор комплемента D) является одним из нескольких компонентов комплемента, полученных из жировой ткани, которые необходимы для ферментативного производства ASP, белка комплемента, который влияет как на метаболизм липидов, так и на метаболизм глюкозы (55). Хотя первоначально было показано, что адипсин снижается при ожирении у грызунов (2), последующие исследования на людях показали, что как адипсин, так и АСП положительно коррелируют с ожирением, резистентностью к инсулину, дислипидемией и сердечно-сосудистыми заболеваниями (55). ASP влияет на метаболизм липидов и глюкозы посредством нескольких механизмов (55). ASP способствует поглощению жирных кислот за счет повышения активности липопротеинлипазы, способствует синтезу триглицеридов за счет увеличения активности диацилглицерол-ацилтрансферазы и уменьшает липолиз и высвобождение НЭЖК из адипоцитов (55). ASP также увеличивает транспорт глюкозы в адипоцитах за счет увеличения транслокации переносчиков глюкозы и усиливает стимулированную глюкозой секрецию инсулина из β-клеток поджелудочной железы (55). Неудивительно, что у мышей с направленной делецией белка комплемента С3 (облигатная недостаточность ASP) наблюдается задержка постпрандиального клиренса триглицеридов и НЭЖК.Несмотря на замедленный клиренс липидов, у этих мышей снизилась масса тела и жировая масса, улучшились стационарные профили липидов в сыворотке, улучшилась толерантность к глюкозе и чувствительность к инсулину (55). Этот улучшенный метаболический профиль частично объясняется повышенным расходом энергии и окислением жирных кислот в печени и мышцах (56).
ASP влияет на метаболизм липидов и глюкозы посредством нескольких механизмов (55). ASP способствует поглощению жирных кислот за счет повышения активности липопротеинлипазы, способствует синтезу триглицеридов за счет увеличения активности диацилглицерол-ацилтрансферазы и уменьшает липолиз и высвобождение НЭЖК из адипоцитов (55). ASP также увеличивает транспорт глюкозы в адипоцитах за счет увеличения транслокации переносчиков глюкозы и усиливает стимулированную глюкозой секрецию инсулина из β-клеток поджелудочной железы (55). Неудивительно, что у мышей с направленной делецией белка комплемента С3 (облигатная недостаточность ASP) наблюдается задержка постпрандиального клиренса триглицеридов и НЭЖК.Несмотря на замедленный клиренс липидов, у этих мышей снизилась масса тела и жировая масса, улучшились стационарные профили липидов в сыворотке, улучшилась толерантность к глюкозе и чувствительность к инсулину (55). Этот улучшенный метаболический профиль частично объясняется повышенным расходом энергии и окислением жирных кислот в печени и мышцах (56). Связанный с G-белком рецептор для ASP, известный как C5L2, был идентифицирован и экспрессируется в адипоцитах (57). Эти данные подтверждают эндокринную роль ASP и родственных компонентов комплемента в метаболизме.
Связанный с G-белком рецептор для ASP, известный как C5L2, был идентифицирован и экспрессируется в адипоцитах (57). Эти данные подтверждают эндокринную роль ASP и родственных компонентов комплемента в метаболизме.
Резистин
Резистин (резистентность к инсулину) представляет собой полипептид приблизительно 12 кДа, который принадлежит к уникальному семейству богатых цистеином белков С-концевого домена, называемых резистин-подобными молекулами, которые идентичны белкам, обнаруживаемым в зоне воспаления, отсюда и альтернативное название резистина. ФИЗЗ3 (58). Первоначально резистин был идентифицирован в 2001 году как новая мРНК, индуцируемая во время дифференцировки адипоцитов, но подавляемая TZD in vitro , и впоследствии идентифицирована другими группами с использованием независимых методов (59–61). Исследования in vivo на грызунах подтвердили специфичную для жировой ткани экспрессию резистина и подавление TZD (59). Экспрессия резистина в 15 раз выше в висцеральной ткани по сравнению с подкожной жировой тканью грызунов (58).
Экспрессия резистина в 15 раз выше в висцеральной ткани по сравнению с подкожной жировой тканью грызунов (58).
Первоначальные исследования показали, что резистин оказывает значительное влияние на действие инсулина, потенциально связывая ожирение с резистентностью к инсулину (58). Обработка культивируемых адипоцитов рекомбинантным резистином ухудшает стимулированное инсулином поглощение глюкозы, в то время как антирезистиновые антитела предотвращают этот эффект (59).Сходным образом, лечение in vivo рекомбинантным резистином у грызунов индуцирует резистентность к инсулину, тогда как иммунонейтрализация резистина оказывает противоположный эффект (59). Уровень резистина в сыворотке также повышен при ожирении грызунов (59). Кроме того, инфузия резистина в условиях эугликемической гиперинсулинемии вызывает резистентность печени к инсулину (62). Последующие исследования, однако, сообщили о противоречивых результатах, включая активацию резистина с помощью TZD и подавление, а не повышение резистина при ожирении грызунов (58). Кроме того, резистин человека имеет только 64% гомологии с резистином мыши и экспрессируется на очень низком уровне в адипоцитах (58). Наконец, многочисленные эпидемиологические исследования на людях не смогли установить четкую и последовательную связь между экспрессией резистина в жировой ткани или уровнями циркулирующего резистина и ожирением или резистентностью к инсулину (58).
Кроме того, резистин человека имеет только 64% гомологии с резистином мыши и экспрессируется на очень низком уровне в адипоцитах (58). Наконец, многочисленные эпидемиологические исследования на людях не смогли установить четкую и последовательную связь между экспрессией резистина в жировой ткани или уровнями циркулирующего резистина и ожирением или резистентностью к инсулину (58).
Недавно мыши с направленной делецией резистина позволили понять метаболические эффекты резистина у грызунов (63). Мыши, лишенные резистина, имеют такую же массу тела и жировую массу, что и мыши дикого типа, даже при соблюдении диеты с высоким содержанием жиров.Тем не менее, у мышей, лишенных резистина, значительно улучшился уровень глюкозы в крови натощак на диете чау-чау и улучшилась толерантность к глюкозе на диете с высоким содержанием жиров. Чувствительность к инсулину не нарушена. Наблюдаемое улучшение гомеостаза глюкозы у мышей, лишенных резистина, связано со снижением печеночного глюконеогенеза.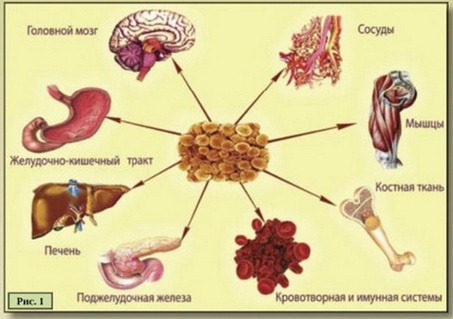 Этот эффект опосредуется, по крайней мере частично, за счет повышения активности АМФ-активируемой протеинкиназы и снижения экспрессии глюконеогенных ферментов в печени. Хотя эти данные подтверждают роль резистина в гомеостазе глюкозы во время голодания у грызунов, аналогичную роль у людей еще предстоит определить.
Этот эффект опосредуется, по крайней мере частично, за счет повышения активности АМФ-активируемой протеинкиназы и снижения экспрессии глюконеогенных ферментов в печени. Хотя эти данные подтверждают роль резистина в гомеостазе глюкозы во время голодания у грызунов, аналогичную роль у людей еще предстоит определить.
Белки ренин-ангиотензиновой системы (РАС)
Некоторые белки классической РАС также продуцируются в жировой ткани. К ним относятся ренин, ангиотензиноген (АГТ), ангиотензин I, ангиотензин II, ангиотензиновые рецепторы типа I (АТ1) и типа 2 (АТ2), ангиотензинпревращающий фермент (АПФ) и другие протеазы, способные продуцировать ангиотензин II (химаза, катепсины D и G, тонин) (64, 65). Экспрессия рецепторов AGT, ACE и AT1 выше в висцеральной по сравнению с подкожной жировой тканью (64, 65).Ангиотензин II опосредует многие хорошо задокументированные эффекты РАС, включая повышение тонуса сосудов, секрецию альдостерона надпочечниками и реабсорбцию натрия и воды в почках, все из которых способствуют регуляции артериального давления. Таким образом, РАС жировой ткани является потенциальным связующим звеном между ожирением и артериальной гипертензией.
Таким образом, РАС жировой ткани является потенциальным связующим звеном между ожирением и артериальной гипертензией.
Плазменный AGT, активность ренина плазмы, активность ACE в плазме и экспрессия AGT в жировой ткани положительно коррелируют с ожирением у людей (64, 65).Экспрессия AGT в жировой ткани снижается при голодании и увеличивается при возобновлении питания, и эти изменения сопровождаются параллельными изменениями артериального давления (64, 65). Ингибирование РАС либо путем ингибирования АПФ, либо антагонизма к рецептору АТ1 снижает вес и повышает чувствительность к инсулину у грызунов (64, 65). Хотя несколько крупных рандомизированных исследований показали, что ингибиторы АПФ снижают заболеваемость диабетом 2 типа, прямое влияние ингибирования РАС на чувствительность к инсулину у людей наблюдалось в некоторых исследованиях (66), но не в других (67).Наконец, генетическая изменчивость компонентов РАС связана с ожирением в изолированных популяциях (64, 65).
В дополнение к хорошо известному влиянию на артериальное давление, РАС влияет на развитие жировой ткани. Компоненты РАС, такие как АГТ и ангиотензин II, индуцируются во время адипогенеза (64). Ангиотензин II способствует росту и дифференцировке адипоцитов, как непосредственно, стимулируя липогенез, так и косвенно, стимулируя синтез простагландинов (64). Однако ангиотензин II из зрелых адипоцитов может ингибировать дальнейшее рекрутирование преадипоцитов (64).Ангиотензин II связывается с рецепторами не только адипоцитов, но и стромоваскулярных клеток и нервных окончаний, тем самым влияя на физиологию жировой ткани, изменяя кровоток и активность СНС (64). Ангиотензин II ингибирует липолиз, способствует липогенезу, снижает инсулинозависимое поглощение глюкозы и увеличивает глюконеогенез и гликогенолиз в печени (64). Кроме того, RAS жировой ткани регулирует экспрессию эндокринных факторов жировой ткани, включая простациклин, оксид азота, PAI-1 и лептин (64, 65).
Компоненты РАС, такие как АГТ и ангиотензин II, индуцируются во время адипогенеза (64). Ангиотензин II способствует росту и дифференцировке адипоцитов, как непосредственно, стимулируя липогенез, так и косвенно, стимулируя синтез простагландинов (64). Однако ангиотензин II из зрелых адипоцитов может ингибировать дальнейшее рекрутирование преадипоцитов (64).Ангиотензин II связывается с рецепторами не только адипоцитов, но и стромоваскулярных клеток и нервных окончаний, тем самым влияя на физиологию жировой ткани, изменяя кровоток и активность СНС (64). Ангиотензин II ингибирует липолиз, способствует липогенезу, снижает инсулинозависимое поглощение глюкозы и увеличивает глюконеогенез и гликогенолиз в печени (64). Кроме того, RAS жировой ткани регулирует экспрессию эндокринных факторов жировой ткани, включая простациклин, оксид азота, PAI-1 и лептин (64, 65).
Мышиные модели повышенной и пониженной экспрессии AGT подтверждают причинную роль RAS жировой ткани при ожирении и гипертонии. У мышей с целевой делецией AGT снижено артериальное давление и масса жировой ткани (68), тогда как у мышей с трансгенной гиперэкспрессией AGT в жировой ткани повышено артериальное давление и масса жировой ткани (69). Кроме того, у мышей с трансгенной амплификации глюкокортикоидов из-за гиперэкспрессии 11β-гидроксистероиддегидрогеназы типа 1 (11βHSD1) в жировой ткани развивается гипертензия, связанная с активацией РАС, включая повышение уровня АГТ, ангиотензина II и альдостерона в плазме (70).Это неудивительно, поскольку известно, что глюкокортикоиды увеличивают экспрессию AGT в жировой ткани. Таким образом, компоненты РАС, происходящие из адипоцитов, могут играть важную аутокринную, паракринную и эндокринную роль в патогенезе ожирения, резистентности к инсулину и артериальной гипертензии.
У мышей с целевой делецией AGT снижено артериальное давление и масса жировой ткани (68), тогда как у мышей с трансгенной гиперэкспрессией AGT в жировой ткани повышено артериальное давление и масса жировой ткани (69). Кроме того, у мышей с трансгенной амплификации глюкокортикоидов из-за гиперэкспрессии 11β-гидроксистероиддегидрогеназы типа 1 (11βHSD1) в жировой ткани развивается гипертензия, связанная с активацией РАС, включая повышение уровня АГТ, ангиотензина II и альдостерона в плазме (70).Это неудивительно, поскольку известно, что глюкокортикоиды увеличивают экспрессию AGT в жировой ткани. Таким образом, компоненты РАС, происходящие из адипоцитов, могут играть важную аутокринную, паракринную и эндокринную роль в патогенезе ожирения, резистентности к инсулину и артериальной гипертензии.
Ферменты, участвующие в метаболизме стероидных гормонов
Ферменты, участвующие в метаболизме половых стероидов
Хотя надпочечники и гонады служат первичным источником циркулирующих стероидных гормонов, жировая ткань экспрессирует полный арсенал ферментов для активации, взаимопревращения и инактивации стероидных гормонов (71, 72). Традиционно считалось, что первичными детерминантами действия стероидных гормонов являются циркулирующие концентрации свободных стероидных гормонов и тканеспецифическая экспрессия рецепторов стероидных гормонов. Дополнительным фактором, определяющим действие стероидных гормонов, является тканеспецифический пререцепторный метаболизм стероидных гормонов. В жировой ткани экспрессируется несколько стероидогенных ферментов, включая цитохром Р450-зависимую ароматазу, 3β-гидроксистероиддегидрогеназу (HSD), 3αHSD, 11βHSD1, 17βHSD, 7α-гидроксилазу, 17α-гидроксилазу, 5α-редуктазу и UDP-глюкуронозилтрансферазу 2B15 (71, 72). ).Учитывая массу жировой ткани, относительный вклад жировой ткани в метаболизм стероидов в организме весьма значителен: жировая ткань обеспечивает до 100% циркулирующего эстрогена у женщин в постменопаузе и 50% циркулирующего тестостерона у женщин в пременопаузе (71, 72). .
Традиционно считалось, что первичными детерминантами действия стероидных гормонов являются циркулирующие концентрации свободных стероидных гормонов и тканеспецифическая экспрессия рецепторов стероидных гормонов. Дополнительным фактором, определяющим действие стероидных гормонов, является тканеспецифический пререцепторный метаболизм стероидных гормонов. В жировой ткани экспрессируется несколько стероидогенных ферментов, включая цитохром Р450-зависимую ароматазу, 3β-гидроксистероиддегидрогеназу (HSD), 3αHSD, 11βHSD1, 17βHSD, 7α-гидроксилазу, 17α-гидроксилазу, 5α-редуктазу и UDP-глюкуронозилтрансферазу 2B15 (71, 72). ).Учитывая массу жировой ткани, относительный вклад жировой ткани в метаболизм стероидов в организме весьма значителен: жировая ткань обеспечивает до 100% циркулирующего эстрогена у женщин в постменопаузе и 50% циркулирующего тестостерона у женщин в пременопаузе (71, 72). .
Половой диморфизм в распределении жировой ткани у людей предполагает участие половых стероидов в регуляции ожирения и распределения жира в организме.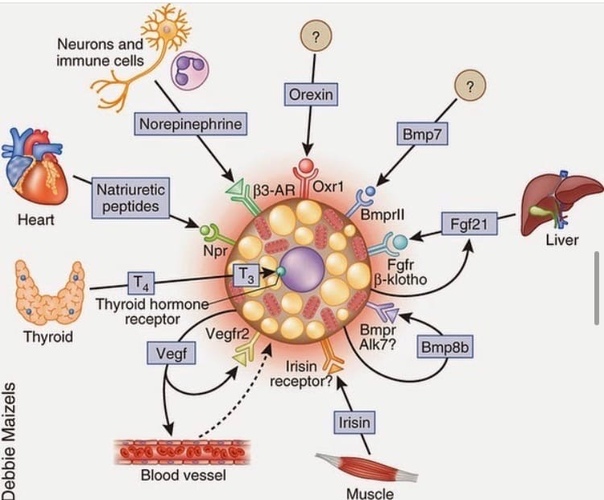 Женщины в пременопаузе, как правило, имеют повышенное ожирение нижней части тела или подкожного жира, тогда как мужчины и женщины в постменопаузе, как правило, имеют повышенное ожирение верхней части тела или висцеральное ожирение.В то время как циркулирующие половые стероиды или дифференциальная экспрессия стероидных рецепторов могут способствовать этому половому диморфизму, метаболизм половых стероидов, специфичный для жировой ткани, также может играть роль. Цитохром P450-зависимая ароматаза и 17βHSD представляют собой два фермента, которые в высокой степени экспрессируются в стромальных клетках жировой ткани и преадипоцитах. Ароматаза опосредует превращение андрогенов в эстрогены: андростендиона в эстрон и тестостерона в эстрадиол. 17βГСД опосредует превращение слабых андрогенов или эстрогенов в их более сильные аналоги: андростендион в тестостерон и эстрон в эстрадиол.Экспрессия 17βHSD снижена по сравнению с ароматазой в подкожной жировой ткани, но повышена по сравнению с ароматазой в висцеральной жировой ткани (71, 72).
Женщины в пременопаузе, как правило, имеют повышенное ожирение нижней части тела или подкожного жира, тогда как мужчины и женщины в постменопаузе, как правило, имеют повышенное ожирение верхней части тела или висцеральное ожирение.В то время как циркулирующие половые стероиды или дифференциальная экспрессия стероидных рецепторов могут способствовать этому половому диморфизму, метаболизм половых стероидов, специфичный для жировой ткани, также может играть роль. Цитохром P450-зависимая ароматаза и 17βHSD представляют собой два фермента, которые в высокой степени экспрессируются в стромальных клетках жировой ткани и преадипоцитах. Ароматаза опосредует превращение андрогенов в эстрогены: андростендиона в эстрон и тестостерона в эстрадиол. 17βГСД опосредует превращение слабых андрогенов или эстрогенов в их более сильные аналоги: андростендион в тестостерон и эстрон в эстрадиол.Экспрессия 17βHSD снижена по сравнению с ароматазой в подкожной жировой ткани, но повышена по сравнению с ароматазой в висцеральной жировой ткани (71, 72). Отношение 17βHSD к ароматазе положительно коррелирует с центральным ожирением, что указывает на повышенную местную выработку андрогенов в висцеральной жировой ткани (71, 72). Кроме того, у мышей с направленным удалением ароматазы и у людей с естественными мутациями ароматазы наблюдается повышенное висцеральное ожирение, резистентность к инсулину, дислипидемия и стеатоз печени (73–76).Таким образом, жировая ткань является важным местом как для метаболизма, так и для секреции половых стероидов.
Отношение 17βHSD к ароматазе положительно коррелирует с центральным ожирением, что указывает на повышенную местную выработку андрогенов в висцеральной жировой ткани (71, 72). Кроме того, у мышей с направленным удалением ароматазы и у людей с естественными мутациями ароматазы наблюдается повышенное висцеральное ожирение, резистентность к инсулину, дислипидемия и стеатоз печени (73–76).Таким образом, жировая ткань является важным местом как для метаболизма, так и для секреции половых стероидов.
Ферменты, участвующие в метаболизме глюкокортикоидов
Недавно внимание было сосредоточено на специфичной для жировой ткани регуляции метаболизма глюкокортикоидов (77, 78). Этот тканеспецифический метаболизм глюкокортикоидов в первую очередь определяется ферментом 11βHSD1, который катализирует превращение гормонально неактивных метаболитов 11β-кетоглюкокортикоидов (кортизона у человека и 11-дегидрокортикостерона у мышей) в гормонально активные 11β-гидроксилированные метаболиты (кортизол у человека и кортикостерон у мышей). мышей).11βHSD1 сильно экспрессируется в жировой ткани, особенно в висцеральной жировой ткани (77, 78). Хотя 11βHSD1 усиливает локальные концентрации глюкокортикоидов в жировой ткани, он не вносит значительного вклада в системные концентрации глюкокортикоидов.
мышей).11βHSD1 сильно экспрессируется в жировой ткани, особенно в висцеральной жировой ткани (77, 78). Хотя 11βHSD1 усиливает локальные концентрации глюкокортикоидов в жировой ткани, он не вносит значительного вклада в системные концентрации глюкокортикоидов.
Тканеспецифическое нарушение регуляции метаболизма глюкокортикоидов с помощью 11βHSD1 связано с целым рядом распространенных заболеваний, включая ожирение, диабет, гипертензию, дислипидемию, гипертензию, сердечно-сосудистые заболевания и синдром поликистозных яичников (77, 78).Активность 11βHSD1 снижена в печени и повышена в висцеральной жировой ткани у резистентных к лептину крыс Lepr fa /Lepr fa и лептин-дефицитных мышей Lep ob /Lep ob (77, 78). При идиопатическом ожирении человека экспрессия и активность 11βHSD1 также снижены в печени и повышены в жировой ткани и сильно коррелируют с общим и регионарным ожирением (77, 78). Полиморфизмы в гене 11βHSD1 связаны с ожирением (79, 80). Наконец, фармакологическое ингибирование 11βHSD1 у людей повышает чувствительность к инсулину (81), что указывает на потенциальную терапевтическую роль ингибирования 11βHSD1 в лечении ожирения и резистентности к инсулину.
Наконец, фармакологическое ингибирование 11βHSD1 у людей повышает чувствительность к инсулину (81), что указывает на потенциальную терапевтическую роль ингибирования 11βHSD1 в лечении ожирения и резистентности к инсулину.
Важность метаболизма глюкокортикоидов жировой ткани с помощью 11βHSD1 была выявлена в экспериментах на мышиных моделях повышенной или пониженной экспрессии 11βHSD1. Мыши с трансгенной сверхэкспрессией 11βHSD1 в адипоцитах имеют нормальные глюкокортикоиды в сыворотке и функцию гипоталамо-гипофизарно-надпочечниковой оси, но имеют повышенные локальные концентрации глюкокортикоидов в жировой ткани (82). У этих мышей развивается висцеральное ожирение и признаки метаболического синдрома, включая резистентность к инсулину, дислипидемию, гипертензию и стеатоз печени (82).Напротив, мыши с направленной делецией 11βHSD1 во всех тканях имеют благоприятный метаболический фенотип, характеризующийся снижением прибавки массы тела на диете с высоким содержанием жиров, преимущественным отложением жира в подкожно-жировой клетчатке, улучшенной толерантностью к глюкозе и чувствительностью к инсулину, а также атеропротективными липидными профилями. 83–85). Эти исследования подтверждают роль специфичного для жировой ткани метаболизма глюкокортикоидов с помощью 11βHSD1 в патогенезе висцерального ожирения и метаболического синдрома.
83–85). Эти исследования подтверждают роль специфичного для жировой ткани метаболизма глюкокортикоидов с помощью 11βHSD1 в патогенезе висцерального ожирения и метаболического синдрома.
Депо-специфические различия в эндокринной функции жировой ткани
Еще одним уровнем сложности является значительная гетерогенность различных депо жировой ткани.Депо подкожной и висцеральной жировой ткани были охарактеризованы лучше всего, особенно в отношении вклада в заболевание. Наличие висцеральной жировой ткани связано с повышенным риском многих заболеваний, включая метаболический синдром. Эта наблюдаемая разница в риске заболевания может быть связана с различиями в эндокринной функции депо жировой ткани. Анатомическое расположение каждого депо жировой ткани само по себе влияет на эндокринную функцию. Эндокринные гормоны, полученные из висцеральной жировой ткани, секретируются в портальную систему и имеют прямой доступ к печени, тогда как гормоны, полученные из подкожной жировой ткани, секретируются в системный кровоток. Следовательно, первые оказывают относительно большее влияние на метаболическую функцию печени. Кроме того, депо жировой ткани демонстрируют уникальные профили экспрессии и секреции адипокинов. Например, экспрессия и секреция IL-6 и PAI-1 относительно выше в висцеральной жировой ткани, тогда как лептина и адипонектина больше в подкожной жировой ткани. Кроме того, депо жировой ткани также демонстрируют специфические паттерны экспрессии рецепторов, которые влияют на их способность реагировать на афферентные сигналы. Например, экспрессия AT1, β3-адренергических, глюкокортикоидных и андрогенных рецепторов выше в висцеральной относительно подкожной жировой ткани.Хотя точные механизмы этих различий неясны, эта функциональная гетерогенность среди различных депо жировой ткани предполагает, что жировая ткань может быть не просто эндокринным органом, но, возможно, группой сходных, но уникальных эндокринных органов.
Следовательно, первые оказывают относительно большее влияние на метаболическую функцию печени. Кроме того, депо жировой ткани демонстрируют уникальные профили экспрессии и секреции адипокинов. Например, экспрессия и секреция IL-6 и PAI-1 относительно выше в висцеральной жировой ткани, тогда как лептина и адипонектина больше в подкожной жировой ткани. Кроме того, депо жировой ткани также демонстрируют специфические паттерны экспрессии рецепторов, которые влияют на их способность реагировать на афферентные сигналы. Например, экспрессия AT1, β3-адренергических, глюкокортикоидных и андрогенных рецепторов выше в висцеральной относительно подкожной жировой ткани.Хотя точные механизмы этих различий неясны, эта функциональная гетерогенность среди различных депо жировой ткани предполагает, что жировая ткань может быть не просто эндокринным органом, но, возможно, группой сходных, но уникальных эндокринных органов.
Будущее жировой ткани как эндокринного органа
Какое будущее у жировой ткани как эндокринного органа? Было идентифицировано несколько гормонов жировой ткани, но даже те факторы, которые относительно хорошо изучены, такие как лептин, требуют дальнейшей оценки для более точного определения их физиологической роли. В дополнение к известным генам до 40% генов, экспрессируемых в жировой ткани, являются новыми генами, и 20-30% из них могут быть секретируемыми белками (86). Продолжающаяся идентификация и характеристика этих новых генов, вероятно, откроет дальнейшее понимание эндокринной функции жировой ткани и взаимосвязи между энергетическим гомеостазом и другими физиологическими системами. Также необходимы дополнительные исследования для выяснения вклада отдельных клеточных компонентов жировой ткани, чтобы определить, как эти компоненты функционируют как единое целое.Наконец, понимание эндокринной функции жировой ткани, вероятно, позволит использовать более рациональные подходы к лечению метаболических последствий избытка и дефицита жировой ткани.
В дополнение к известным генам до 40% генов, экспрессируемых в жировой ткани, являются новыми генами, и 20-30% из них могут быть секретируемыми белками (86). Продолжающаяся идентификация и характеристика этих новых генов, вероятно, откроет дальнейшее понимание эндокринной функции жировой ткани и взаимосвязи между энергетическим гомеостазом и другими физиологическими системами. Также необходимы дополнительные исследования для выяснения вклада отдельных клеточных компонентов жировой ткани, чтобы определить, как эти компоненты функционируют как единое целое.Наконец, понимание эндокринной функции жировой ткани, вероятно, позволит использовать более рациональные подходы к лечению метаболических последствий избытка и дефицита жировой ткани.
Сокращения:
АПФ,
Ангиотензинпревращающий фермент;
AdipoR,
AGT,
ASP,
ацилирование имитационного белка;
AT1,
рецептор ангиотензина II типа I;
ЦНС,
HPA,
гипоталамо-гипофизарно-надпочечниковая;
HSD,
гидроксистероиддегидрогеназа;
11βHSD1,
11β-гидроксистероиддегидрогеназа 1 типа;
IL-6R,
MCP,
хемотаксический белок моноцитов;
НЭЖК,
неэстерифицированная жирная кислота;
PAI,
ингибитор активатора плазминогена;
РАС,
ренин-ангиотензиновая система;
СНС,
симпатическая нервная система;
TZD,
Каталожные номера
1Siiteri
PK
1987
Жировая ткань как источник гормонов.
AM J Clin Nutry
45
:277
—282
2Flier
JS
, COOKKS
,USER
P
,SPIEGELMAN
BM
1987
Серьезное нарушение экспрессии адипсина при генетическом и приобретенном ожирении.
Наука
237
:405
—408
3Zhang
Y
,,,
R
,Maffei
M
,Барон
M
,Leopold
L
,Friedman
JM
1994
Позиционное клонирование мышиного гена ожирения и его человеческого гомолога.
Nature
372
:425
—425
—432
4Grundy
,Brewer JR
HB
,Cleeman
JI
,SMITH JR
SC
,Lenfant
C
2004
Определение метаболического синдрома: отчет Национального института сердца, легких и крови/Американской кардиологической ассоциации по научным вопросам, связанным с определением.
циркуляция
109
:433
—438
—438
5Leow
MK
,,
CL
,Mantzoros
CS
CS
2003
Клинический обзор 159: Вирус иммунодефицита человека / высокоактивный метаболический синдром, ассоциированный с антиретровирусной терапией: клиническая картина, патофизиология и терапевтические стратегии.
J Clin Endcreinol Metab
88
:1961
—1976
—1976
6Ahima
RS
,Flier
js
2000
2000
Добросовестная ткань в качестве эндокринного органа.
Trends Endocrinol Metab
11
:327
–332
7Фрухбек Г., Гомес-Амбрози Дж., Мурузабал Ф.Дж., Баррелл М.А.AM J Physiol EndCrinol Metab 280: E827-E847
8FRAYN
,KN
F
,,
F
,,
BA
,MacDonald
IA
,COPPACK
SW
2003
Интегративная физиология жировой ткани человека.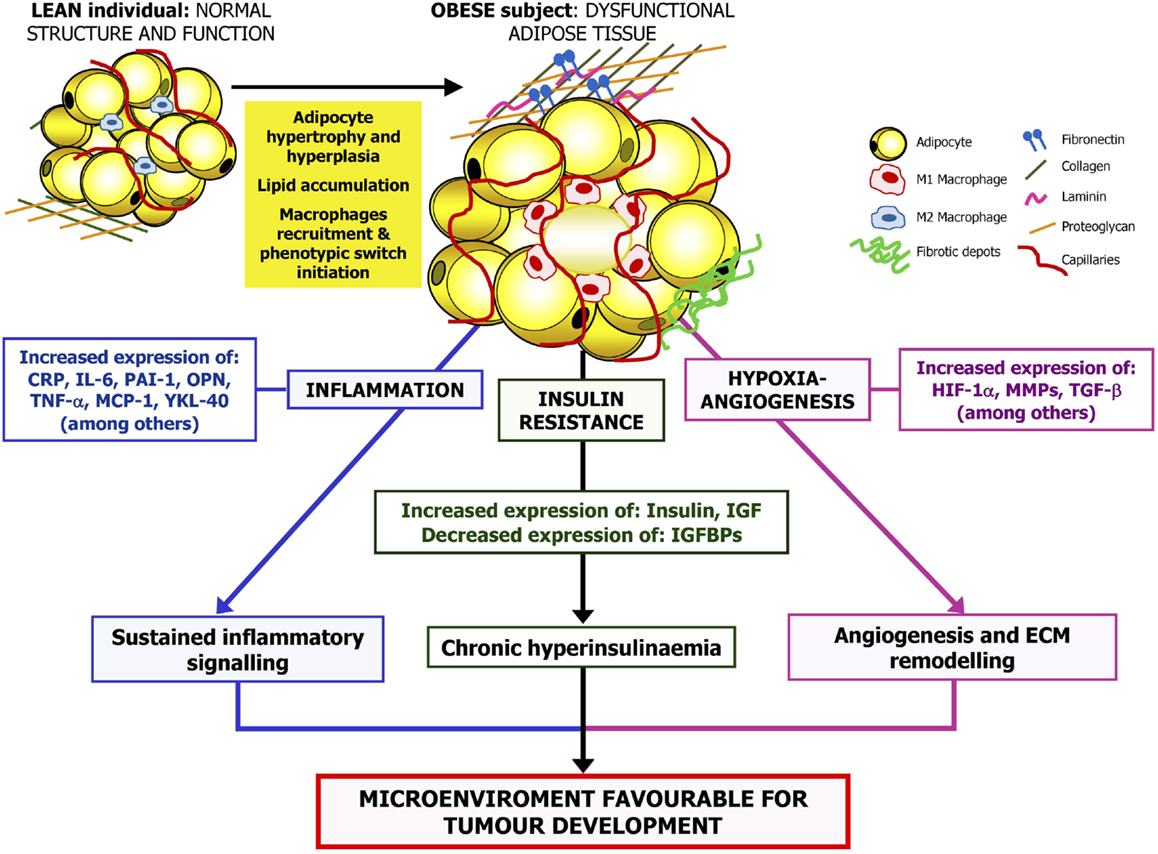
INT J Обес RELAT Metab Disond
27
:875
—875
FAIN
JN
,MADAN
AK
,HILER
ML
,Cheema
P
,Bahouth
SW
2004
Сравнение высвобождения адипокинов жировой тканью, матриксом жировой ткани и адипоцитами из висцеральной и подкожной абдоминальной жировой ткани людей с ожирением.
Эндокринология
145
:2273
—2273
—2282
102282
10COLEMAN
DL
1973
Влияние парабиоза тучных с диабетом и нормальными мышами.
диабетологии
9
: —294
11CHEN
H
,Charlat
O
,Tartaglia
La
,WOOLF
EA
,WHENG
X
,ELLIS
SJ
,LAKEY
ND
,CULPEPPER
J
,Moore
KJ
,Breitbart
Re
,Duyk
GM
,Tepper
RI
,Morgenstern
JP
1996
Доказательства того, что ген диабета кодирует рецептор лептина: идентификация мутации в гене рецептора лептина у мышей db/db.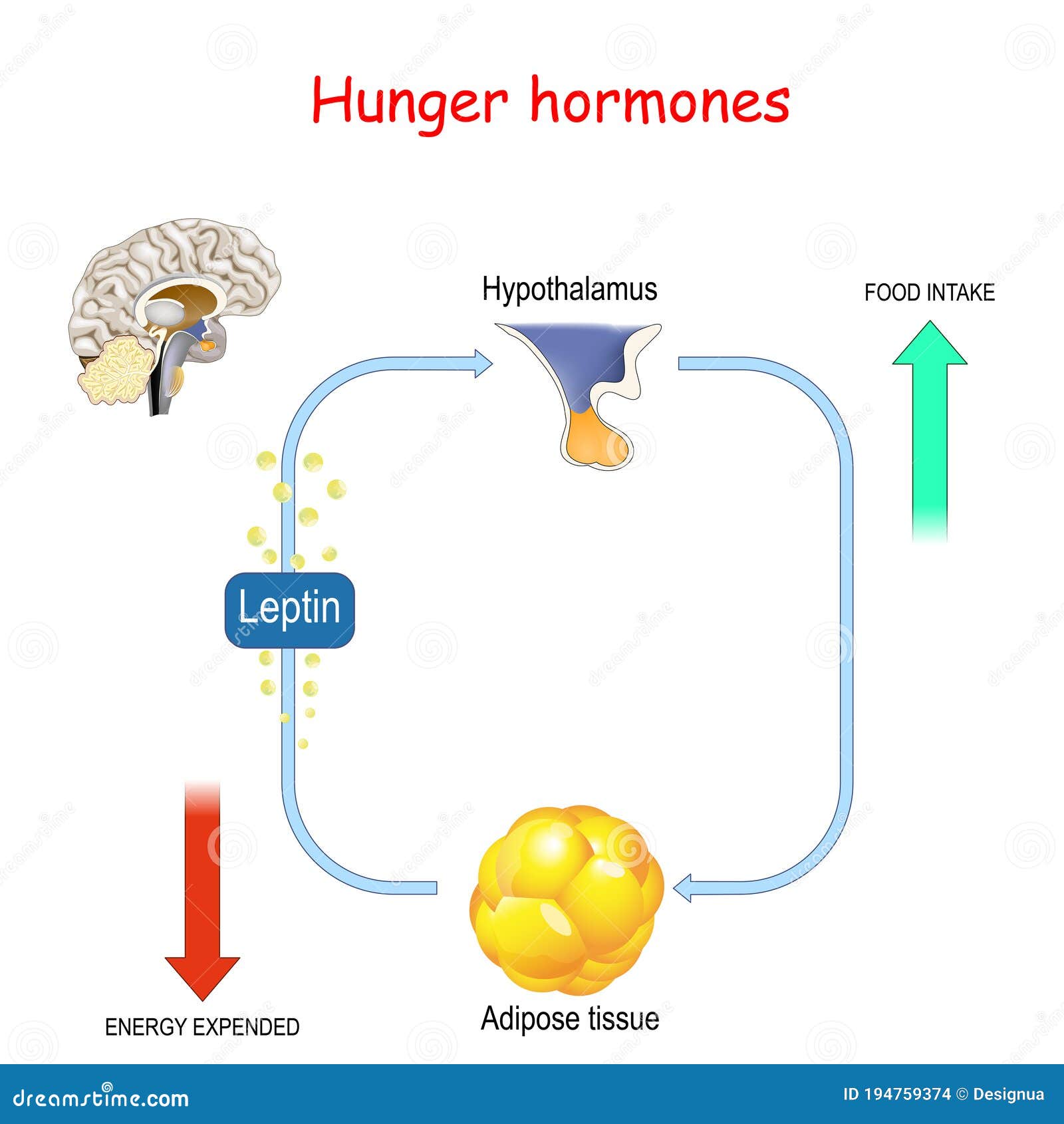
клетки
84
:491
—495
12Lee
12,
GH
,,
R
,Montez
R
,Montez
JM
,Carroll
км
,Darvishzadeh
JG
,Lee
JI
,Friedman
JM
1996
Аномальный сплайсинг рецептора лептина у мышей с диабетом.
Nature
379
:632
:635
—635
13Tartaglia
La
,La
,Dembski
M
,WONG
,
,
DENG
N
,CULPEPPER
J
,Devos
R
,R
,Richards
GJ
,CAMPFIELD
LA
,CLARK
FT
,J
, et al1995
Идентификация и выражение клонирования лептиновый рецептор, OB-R.
клетки
83
:1263
—1271
14 20004 1271 14Wajchenberg
BL
BL
2000
Подкожная и висцеральная жировая ткань: их отношение к метаболическому синдрому.
EndOrr Rev
21
:697
—70004
15Margetic
,
Gazzola
C
,PEGG
GG
,Hill
RA
2002
Лептин: обзор его периферических действий и взаимодействий.
int j abes retat metab disord
26
:1407
—1407
—1433
16 000 0004Bjorbaek
C
,KAHN
BB
2004
2004
Сигнализация лептина в центральной нервной системе и периферии .
Недавняя PROG HORM RES
59
:305
—331
17 20004331
17Friedman
JM
,Halaas
JL
1998
1998
Лептин и регулирование массы тела у млекопитающих.
Nature
395
:763
—763
—770
18Flier
JS
1998
Клинический обзор 94: Что на имя? В поисках физиологической роли лептина.
J Clin Endcreinol Metab
83
:1407
—1407
—1413
19 00044Flier
JS
js
2004
2004
Ожирение Войны: Молекулярный прогресс противостоять расширению эпидемии.
клетки
116
:337
—350
20Flier
JS
,JS
,Harris
M
,Hollenberg
AN
2000
2000
Лептин, питание и щитовидная железа: почему, почему и проводка.
J Clin Invest
105
:859
—861
—861
21Hileman
,Pierroz
DD
,Flier
JS
2000
2000
Лептин, питание и воспроизведение : время решает все.
J Clin Endcrinol Metab
85
:804
—804
—807
22Chan
JL
,K
,DEPAOLI
A
,Veldhuis
JD
,Mantzoros
CS
2003
Роль снижения уровня лептина в нейроэндокринной и метаболической адаптации к кратковременному голоданию у здоровых мужчин.
J Clin Invest
111
:1409
—1421
23LORD
GM
,GH
,MATARESE
G
,HOWARD
JK
,Baker
RJ
,Bloom
SR
,Lechler
RI
1998
Лептин модулирует Т-клеточный иммунный ответ и устраняет вызванную голоданием иммуносупрессию.
Nature
394
:897
—901
24000- 240004,TA
,AUWERX
J
J
2003
Leptin: резка жира от кости.
Lancet
362
:1572
—1574
—1574
25 25RUAN
H
,LODISH
HF
HF
2003
Устойчивость к инсулину в жировой ткани: прямые и косвенные эффекты фактора некроза опухоли а.
фактор роста цитокина REV
14
:447
—4474
—455
26Hotamisligil
GS
GS
2003
Воспалительные пути и инсулиновые действия
.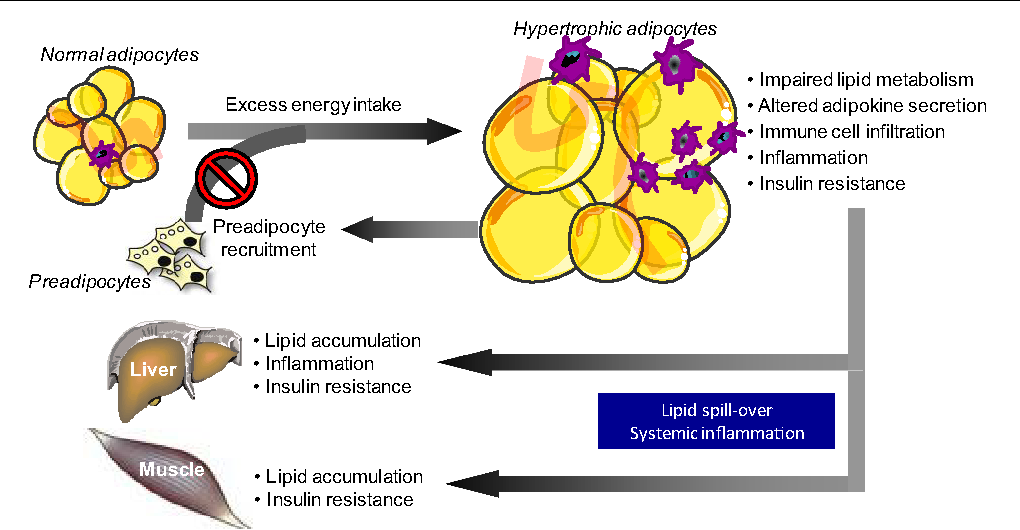
INT J Buces Relat Metab Disord
27
(SO5
):S55
—S55
27Hotamisligil
GS
,Shargill
NS
,Spiegelman
BM
1993
Жировая экспрессия фактора некроза опухоли-α: прямая роль в резистентности к инсулину, связанной с ожирением.
Наука
259
:87
—87
—91
28Fernandez-Real
JM
,RICART
W
2003
2003
Устойчивость к инсулину и хронический сердечно-сосудистый воспалительный синдром.
Endong Rev
240005 —
301
29301
29Uysal
KT
,Wiesbrock
SM
,Marino
MW
,Hotamisligil
GS
1997
Защита от резистентности к инсулину, вызванной ожирением, у мышей, лишенных функции TNF-α.
Nature
389
:610
—614
30RUAN
H
,мили
PD
,PD
,,
ROSS
CM
K
,Golub
TR
,Olefsky
JM
,Lodish
HF
2002
Профилирование транскрипции гена in vivo выявляет некроз резистентности к инсулину как непосредственный фактор резистентности к инсулину в жировой ткани.
диабет
51
:3176
—3176
—3176
31 31JJ
,Klover
PJ
,Nowak
IA
,Zimmers
TA
,Koniaris
LG
,Furlanetto
RW
,Mooney
RA
2003
Супрессор передачи сигналов цитокинов-3 (SOCS-3), потенциальный медиатор интерлейкино-зависимой инсулинорезистентности.
J Biol Chem
278
:13740
—13740
—13746
—13746
32de Benedetti
F
,Alonzi
T
,Moretta
A
,Lazzaro
D
,Costa
P
,P
,POLI
V
,V
,MARTINI
A
,CILIBERTO
G
,G
,FATTORI
E
1997
Интерлейкин 6 вызывает нарушение роста в трансгенных мышах посредством снижения инсулина -подобный фактор роста-I. Модель задержки роста у детей с хроническим воспалением.
Модель задержки роста у детей с хроническим воспалением.
J Clin Invest
99
:643
—650
33Wallenius
V
,Wallenius
K
,Ahran
B
,RUDLING
M
,CARLSTEN
H
,DICKSON
SL
,SL
,OHLSSON
C
, JANSSONJO
2002
2002
Межлейкин-6-дефицитные мыши разрабатывают зрелое ожирение.
NAT MED
8
:75
—79
34Wellen
Ke
,
KE
,GS
GS
GS
2003
Возбужденные ожирения воспалительные изменения в жировой ткани.
j Clin Invest
112
:1785
—1788
34AWeisberg
SP
,MCCANN
D
,Desai
M
,Rosenbaum
M
,Leibel
RL
,Ferrante Jr
AW
2003
Ожирение связано с накоплением макрофагов в жировой ткани.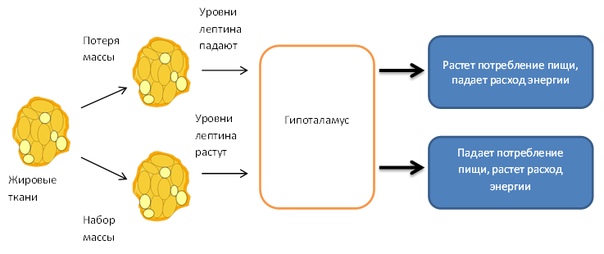
J Clin Invest
112
:1796
—1808
34BXU
H
,
H
,BARNES
GT
,Yang
Q
,Tan
G
,Yang
D
,CHOU
CJ
,SOLE
J
,J
,Nichols
A
,ROSS
JS
,Tartaglia
LA
,CHEN
H
2003
Хроническое воспаление жировой ткани играет решающую роль в развитии резистентности к инсулину, связанной с ожирением.
J Clin Invest
112
:1821
—1830
35Takahashi
K
,MIZUARAI
S
,ARAKI
H
,Mashiko
S
,ISHIHARA
A
,KANATANI
A
,A
,A
,,H
,H
,Kotani
H
H
2003
2003
Ориедья поднимает уровень плазмы MCP-1, ведущий к увеличению моноцитов в CD11B-положительстве у мышей.
j Biol Chem
J Biol Chem
278
:46654
—466660
—466660
—466660
— 36 20004Sartipy
P
,Loskutoff
DJ
2003
2003
Моноциты Хемоаттрактантный белок 1 в ожирении и сопротивлении инсулину.
Proc Natl Acqu Sci USA
100
:7265
—7270
—7270
37Gerhardt
CC
,Romero
IA
,CANCELLO
R
,CAMOIN
L
,Strosberg
AD
2001
Хемокины контролируют накопление жира и секрецию лептина культивируемыми адипоцитами человека.
моль ячейки эндокринол
175
:81
—92
38Van
Royen
N
,
Hoefer
I
,Buschmann
I
,Kostin
S
,Восктуил
M
,BODE CH, SCHAPER
W
,Piek
,Piek
JJ
JJ
2003
2003
2003
Влияние локальной белковой терапии MCP-1 на развитие кролика залога и атеросклероза в гиперлипидемических кроликах Watanabe.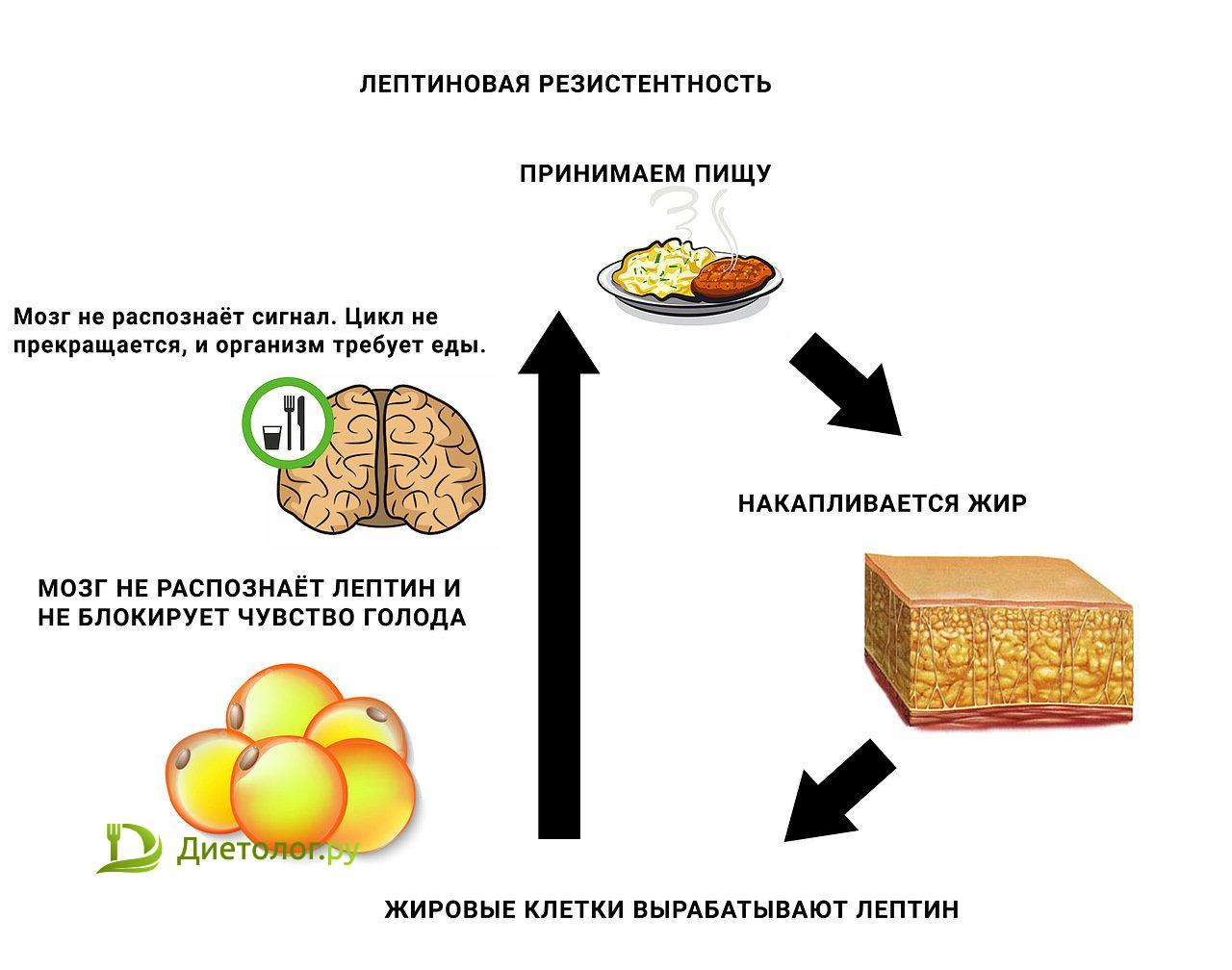
Cardiovass RES
57
:178
—185
39Mertens
Mertens
I
,VAN Gaal
LF
2002
2002
Ожирение, гемостаз и фибринолитическая система.
Обется Rev
3
:85
—101
40Juhan-swague
I
,Alessi
MC
,Mavri
A
,Morange
PE
2003
Ингибитор активатора плазминогена-1, воспаление, ожирение, резистентность к инсулину и сосудистый риск.
J Throb Haemost
1
:1575
—1579
41MA
LJ
,
MAO
SL
,
Taylor
KL
,Kanjanabuch
T
,GUAN
y
,Zhang
Y
,Y
,,Swift
LL
,McGuinness
OP
,Wasserman
DH
,VAUGHAN
DE
,FOGO
AB
2004
Профилактика ожирения и резистентности к инсулину у мышей, у которых отсутствует ингибитор активатора плазминогена 1.
Диабет
53
:336
—336
—346
42Schafer
K
,K
,Fujisawa
K
,Konstantinides
S
,Loskutoff
DJ
2001
Срывание гена ингибитора активатора плазминогена 1 снижает ожирение и улучшает метаболический профиль мышей ob/ob с генетическим ожирением и диабетом.
Faseb J
15
:1840
—1842
43Maeda
K
,okubo
K
,Shimomura
I
,Funahashi
T
,Matsuzawa
Y
,Matsubara
K
1996
Клонирование кДНК и экспрессия нового коллагеноподобного фактора, специфического для жировой ткани, apM1 (AdiPose Наиболее распространенный транскрипт гена 1).
Biochem Biophys Bioophys res Compash
221
:221
:286
—289
44Scherer
PE
,Williams
S
,Fogliano
M
,Baldini
G
,Loodish
HF
1995
Новый сывороточный белок, аналогичный C1q, вырабатываемый исключительно адипоцитами.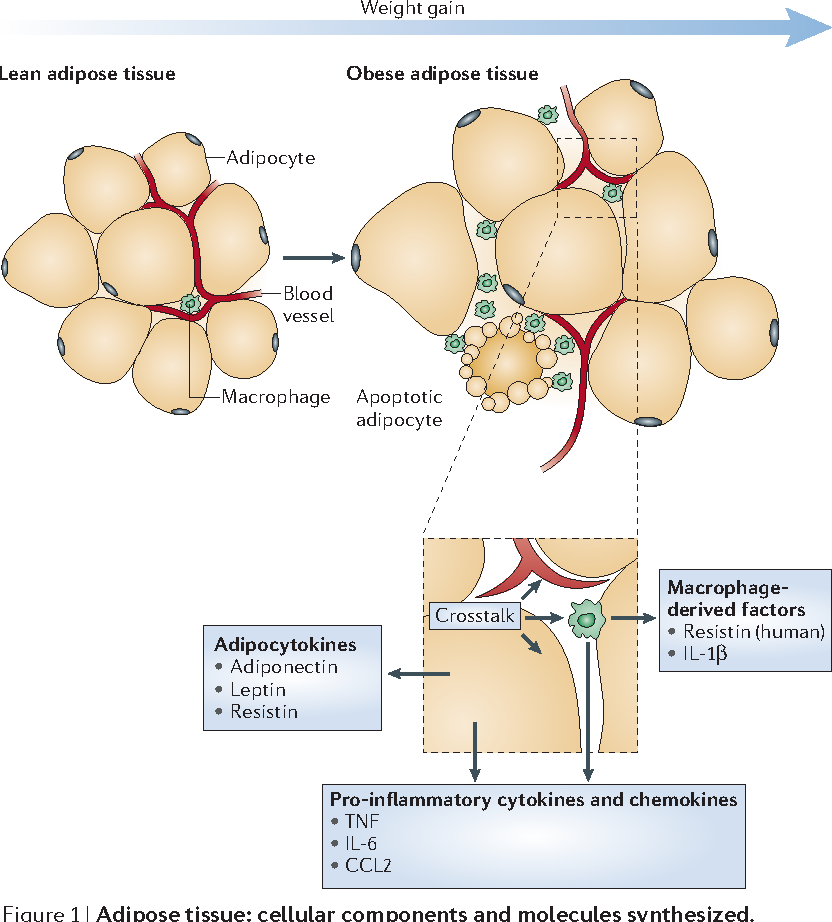
J Biol Chem
270
:26746
—26746
—26746
—26749
—26749
45Nakano
Y
,TOBE
T
,CHOI-MIURA
NH
,Mazda
T
,Tomita
M
1996
Выделение и характеристика GBP28, нового желатин-связывающего белка, очищенного из плазмы крови человека.
J Biochem (Tokyo)
120
:803
–812
46Hu
E
,Liang
P
,Spiegelman
BM
1996
AdipoQ is a novel adipose-specific gene dysregulated in obesity.
J Biol Chem
271
:10697
–10703
47Chandran
M
,Phillips
SA
,Ciaraldi
T
,Henry
RR
2003
Adiponectin: more than just another fat cell hormone?
Diabetes Care
26
:2442
–2450
48Yamauchi
T
,Kamon
J
,Ito
Y
,Tsuchida
A
,Yokomizo
T
,Kita
S
,Sugiyama
T
,Miyagishi
M
,Hara
K
,Tsunoda
M
,Murakami
K
,Ohteki
T
,Uchida
S
,Takekawa
S
,Waki
H
,Tsuno
NH
,Shibata
Y
,Terauchi
Y
,Froguel
P
,Tobe
K
,Koyasu
S
,Taira
K
,Kitamura
T
,Shimizu
T
,Nagai
R
,Kadowaki
T
2003
Cloning of adiponectin receptors that mediate antidiabetic metabolic effects.
Природа
423
:762
—769
49769
49 49Diez
JJ
,IGLEIAS
P
P
2003
Роль нового адипоцитовно-производного гормона адипонектина в заболевании человека.
EUR J EURDCRINOL
148
:293
—300
50Hotta
K
,K
,Funahashi
T
,Bodkin
NL
,Ortmeyer
HK
,Arita
Y
,Hansen
BC
,Matsuzawa
Y
2001
Концентрация циркулирующего белка адипоцитов адипонектина снижается параллельно с прогрессирующим диабетом обезьяньего типа, чувствительность к инсулину снижается2.
диабет
50
:1126
—1126
—1133
511133
51KINLAW
WB
,WB
,B
2004
2004
Adiponectin и ВИЧ-липодистрофия: принимая HAART.
Эндокринологии
145
:484
—484
52Kubota
Kubota
N
,Terauchi
Y
,Yamauchi
T
,Kubota
T
,MOROI
M
,Matsui
J
,ETO
K
,K
,yamashita
T
,Kamon
J
,J
,H
,YANO
W
,Froguel
P
,Nagai
R
,R
,KIMURA
S
,Kadowaki
T
,Noda
T
2002
Срывание адипонектина вызывает сопротивление инсулину и неожиданному образованию.
J Biol Chem
277
:25863
–25866
53Maeda
N
,Shimomura
I
,Kishida
K
,Nishizawa
H
,Matsuda
M
,Nagaretani
H
,Furuyama
N
,Kondo
H
,Takahashi
M
,Arita
Y
,Komuro
R
,Ouchi
N
,Kihara
S
,Tochino
Y
,Okutomi
K
,Horie
M
,Takeda
S
,Aoyama
T
,Funahashi
T
,Matsuzawa
Y
2002
Diet-induced insulin resistance in mice lacking adiponectin/ACRP30.
NAT MED
8
:70004 8
—737
—737
54Combs
TP
,Pajvani
UB
,UB
AH
,LIN
Y
,Jelicks
La
,laplante
м
,Nawrocki
AR
,AR
,Rajala
MW
,MW
,,
AF
,Cheeseboro
L
,DING
YY
,RUSSELL
RG
,Lindemann
D
,Hartley
A
,A
,,
GR
,obici
S
,deshaies
y
,ludgate
m
,rossetti
l
,Scherer
PE
2004
Трансгенная мышь с делецией в коллагеновом домене адипонектина d Отмечает повышенный уровень циркулирующего адипонектина и улучшенную чувствительность к инсулину.
Эндокринология
145
:367
—383
55 —383
55383
55Cianflone
K
,XIA
Z
,CHEN
LY
2003
Критический обзор ацилирования, стимулирующий белковую физиологию у человека и грызунов.
Biochim Biophys ACTA
1609
:127
—143
56XIA
Z
,STANHOPE
KL
,Digitale
E
,SIMION
OM
,CHEN
L
,Havel
P
,Cianflone
K
2004
Ацилирование-стимулирующий белок (ASP)/комплемент C3adesArg приводит к увеличению расхода энергии у мышей.
J Biol Chem
279
:4051
—4057
—4057
57Kalant
D
,Cain
SA
,MASLowska
M
,Sniderman
AD
,CianFlone
K
,Monk
PN
2003
Белок C5L2, подобный хемоаттрактантному рецептору, связывает C3a des-Arg77/стимулирующий ацилирование белок.
J Biol Chem
J Biol Chem
278
:11129
—11129
—11129
5811129
58Banerjee
RR
,Lazar
MA
MA
2003
Резидент: Молекулярная история и прогноз.
J Mol MED
81
:218
—226
59 59,Bailey
,
,
BHAT
,
,
,
S
,Brown
EJ
,Banerjee
RR
,Wright
см
,см
,PATEL
HR
,AHIMA
RS
,Lazar
MA
2001
2001
Гормон резистины ссылки на диабет.
Nature
409
:307
—312
60Kim
KH
,Lee
K
,Moon
YS
,Sul
HS
2001
A секреторный фактор жировой ткани, богатый цистеином, ингибирует дифференцировку адипоцитов.
J Biol Chem
276
:11252
—11252
—11256
—11256
61Holcomb
в
,Kabakoff
RC
,Chan
B
,Baker
TW
,Gurney
A
,Henzel
W
,Nelson
C
,C
,C
,HB
,REAGE
BD
,Skelton
NJ
,Frantz
GD
,TUMAS
Db
,jr
,fv
,fv
,shelton
dl
,dl
,hebert
CC
2000
2000
Fizz1, новый, богатый цистеином, выделяемый белок, связанный с легочным воспалением, определяет новую семью гена.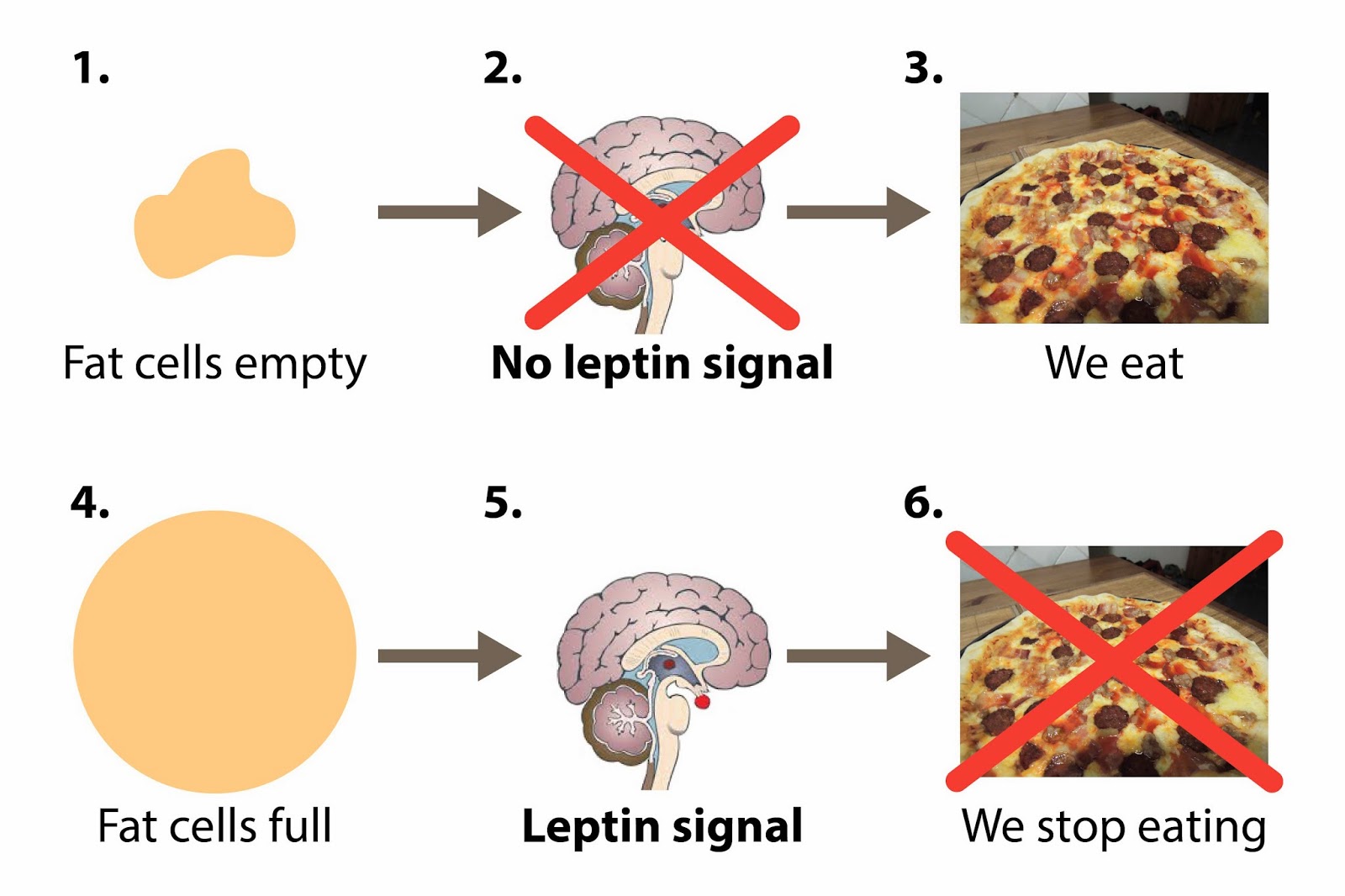
EMBO J
19
:4046
—4046
—4055
62,MW
,,
S
,Scherer
PE
,ROSPETTI
L
2003
Резистин, полученный из жировой ткани, и резистин-подобная молекула-β, полученная из кишечника, избирательно нарушают действие инсулина на выработку глюкозы.
J Clin Invest
111
:225
—230
63Banerjee
Banerjee
RR
,Rangwala
SM
,Shapiro
JS
,Rich
AS
,Rhoades
B
,QI
Y
,Wang
J
,J
,Rajala
MW
,PoCai
A
,Scherer
PE
,Степпан
см
,Ahima
RS
,Obici
S
,Rossetti
L
,Lazar
MA
2004
Регуляция резистентности к глюкозе в крови натощак.
Наука
303
:1195
—1198
—1198
64Engeli
S
,Schling
,,P
,Gorzelniak
K
,Boschmann
M
,Janke
J
,AILHAUD
,GILHAUD
G
,TEBOUL
M
,M
,Massiera
F
,Sharma
,Sharma
AM
2003
Степень ренин-ангиотензин-андиостерона: роль в метаболическом синдроме ?
INT J Biochem Cell Biol
35
:807
—825
—825
65Goossens
GH
,BLAAK
EE
,VAN Baak
MA
2003
Возможное участие Ренин-ангиотензиновая система жировой ткани в патофизиологии ожирения и связанных с ожирением расстройств.
Обес Rev
4
:43
—55
66Pollire
Pollere
T
,Lithell
H
,BERNE
C
1989
Сравнение эффектов гидрохлоротиазида и каптоприл на метаболизм глюкозы и липидов у пациентов с артериальной гипертензией.
N Engl J Med
321
:868
—868
—873
67Petry
JR
,MORRIS
AD
,UEDA
S
,Small
M
,Доннель
R
,Connell
JM
,Elliott
HL
2000
Трандолаприл не улучшает чувствительность к инсулину у пациентов с артериальной гипертензией, перекрестное слепое исследование 2 типа.
J Clin EndCrinol Metab
85
:1882
—1882
—1889
68 68F
,Seydoux
J
,Geloen
A
,quignard-Boulange
A
,TURBAN
S
,S
,Saint-Marc
P
,P
,,A
,NEGREL
R
,Ailhaud
G
,TEBOUL
M
2001
Ангиотензиноген- у мышей с дефицитом наблюдается нарушение набора веса, вызванного диетой, с изменением развития жировой ткани и повышенной двигательной активностью.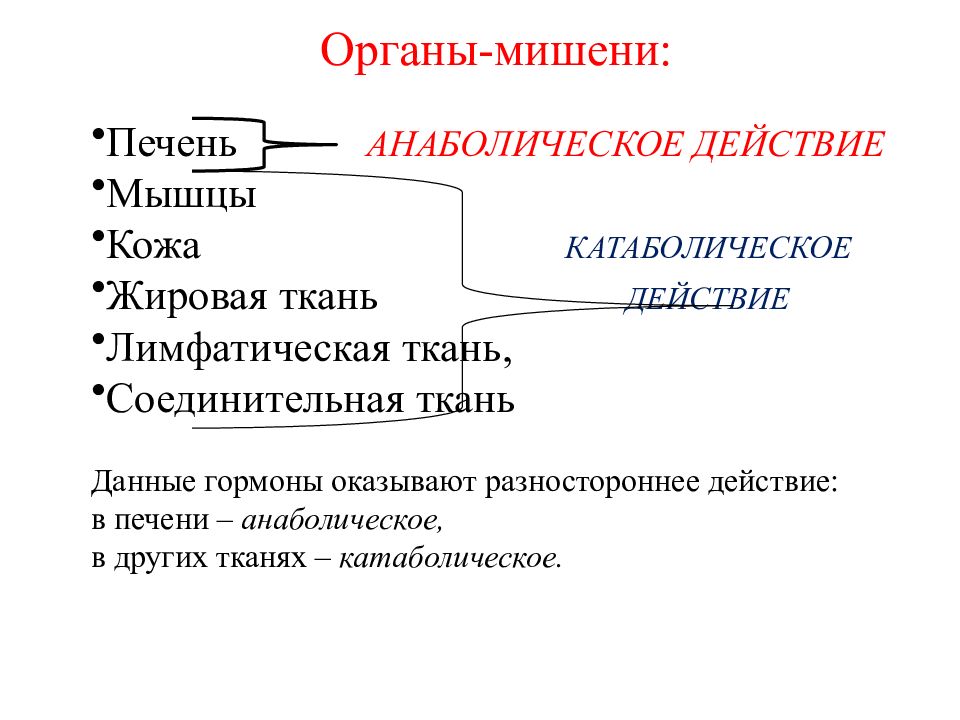
эндокринология
142
:5220
—5225
—5225
69 69F FAUR
,BLOCH-FAUR
M
,CEILER
D
,CEILER
D
,MURAKAMI
k
,fucamizu
A
,A
,GASC
JM
,JM
,AILHAUD
,,
R
,AILHAUD
G
,SEYDOUX
J
,MENETON
P
,Teboul
M
2001
Жировой ангиотензиноген участвует в росте жировой ткани и регуляции артериального давления.
FaseB J
15
:2727
—2727
—2729
70Masuzaki
H
,Yamamoto
H
,Kenyon
CJ
,Elmquist
JK
,Morton
NM
,PATERSON
JM
,Shinyama
H
,H
,Sharp
MG
,MG
,,
S
,Mullins
JJ
,SESKL
JR
,Flier
JS
2003
Трансгенное усиление действия глюкокортикоидов в жировой ткани вызывает повышение артериального давления у мышей.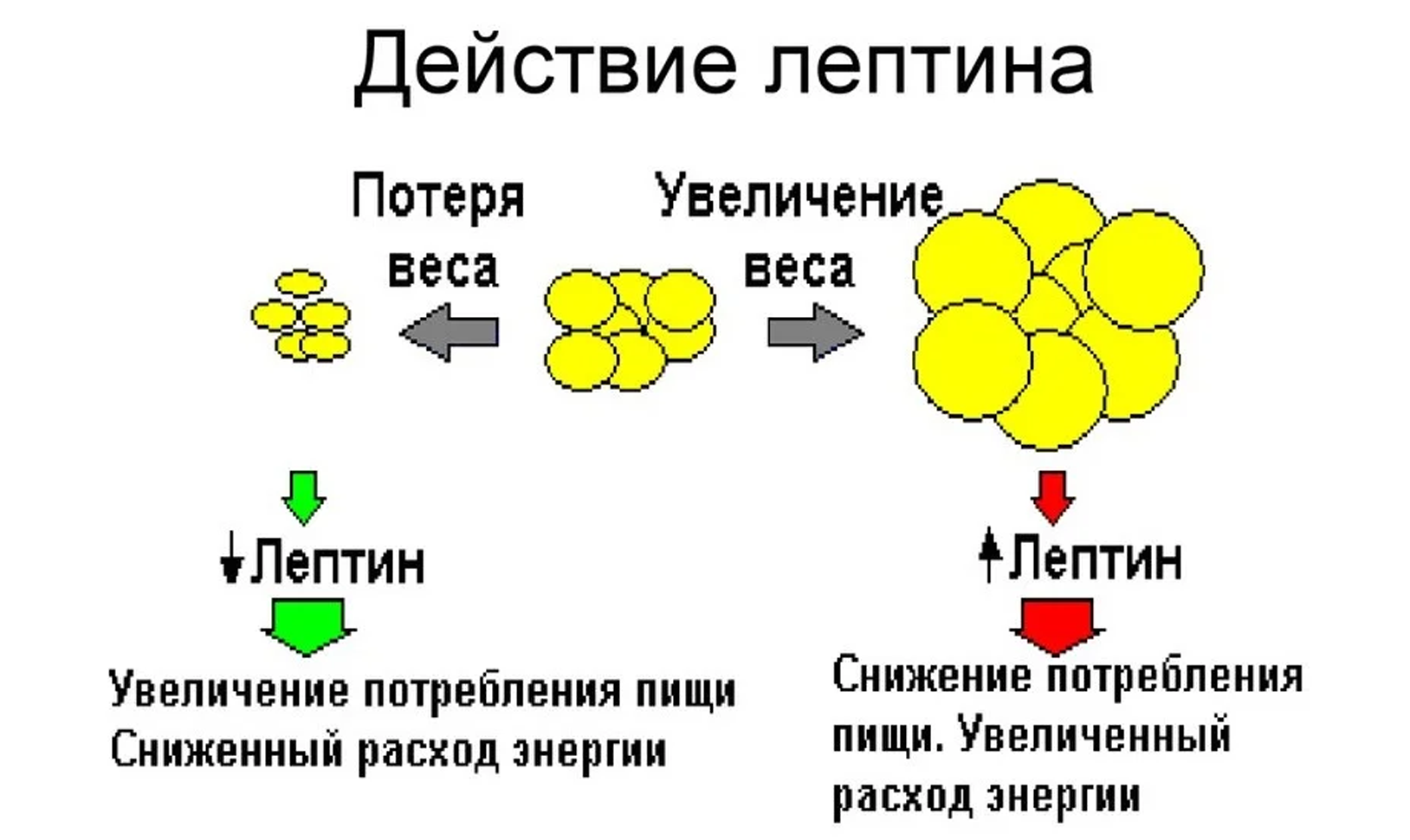
J Clin Invest
112
:83
—83
— 70005C
,Luu-The
V
,DuPont
P
,TCHERNOF
A
2002
Интракринология жировой ткани: потенциальное значение местного метаболизма андрогенов/эстрогенов в регуляции ожирения.
HOMM Metab RES
34
:737
—745
7000-945
70005A
,puche
A
,,
Cabero
C
,Cabero
A
2002
2002
Секс Стероидный биосинтез в белом режиме ткань.
HOMM Metab RES
34
:731
—736
73Jones
Me
,Thorburn
AW
,BRITT
KL
,Hewitt
KN
,Misso
мл
,WREFORD
,NG
,Proietto
J
,OZ
OK
,Leury
BJ
,Robertson
км
,Yao
S
,Simpson
ER
2001
Мыши с дефицитом ароматазы (ArKO) накапливают избыточную жировую ткань.
J стероид биохим моль биол
79
:79
:3
—9 0004,
Jones
Me
,Thorburn
AW
,BRITT
KL
,Hewitt
KN
,WREFORD
NG
,Proietto
J
,OZ
OK
,Leury
BJ
,Robertson
км
,Yao
S
,SIMPSON
ER
2000
Мыши с дефицитом ароматазы (ArKO) имеют фенотип повышенного ожирения.
Proc Natl Acqu SCI USA
97
:12735
—12744
—12744
75мл
Misso
мл
,Murata
Y
,BOON
WC
,JONES
ME
,Britt
KL
,Simpson
ER
2003
Клеточная и молекулярная характеристика жирового фенотипа мыши с дефицитом ароматазы.
эндокринологии
144
:1474
—1480
7000 —Takeda
K
,TODA
K
,Saibara
T
,Nakagawa
M
,Saika
K
,Onishi
T
,T
,T
,Sugiura
T
,Shizuta
Y
2003
2003
Прогрессивное развитие фенотипа устойчивости к инсулину в мужских мышах с полной ароматазой (CYP19).
j Эндокринол
j endxrinol
176
:237
—2375 77
STULNIG
STULNIG
TM
,Waldhausl
W
W
2004
2004
11β-гидроксистероидная дегидрогеназа Тип 1 При ожирении и диабере типа 2.
диабетологии
47
:1
—11
70005 —11
7000,
JR
,Walker
BR
2001
MiniReview: 11β-гидроксистероидная дегидрогеназа типа 1-A Cделительный усилитель глюкокортикоидного действия.
Эндокринология
140005:
1371
:1371
—1376
79Draper
N
,Echwald
SM
,,
GG
,Walker
EA
,Fraser
R
,Davies
E
,E
,Sorensen
TI
,ASTRUP
A
,ADAMSKI
J
,Hewison
M
,Connell
JM
,PADERSEN
O
,Stewart
PM
2002
Исследования ассоциации между микросателлитными маркерами в гене, кодирующем человеческую 11β-гидроксистероиддегидрогеназу типа 1, и индексом массы тела, соотношением талии и бедер и метаболизмом глюкокортикоидов.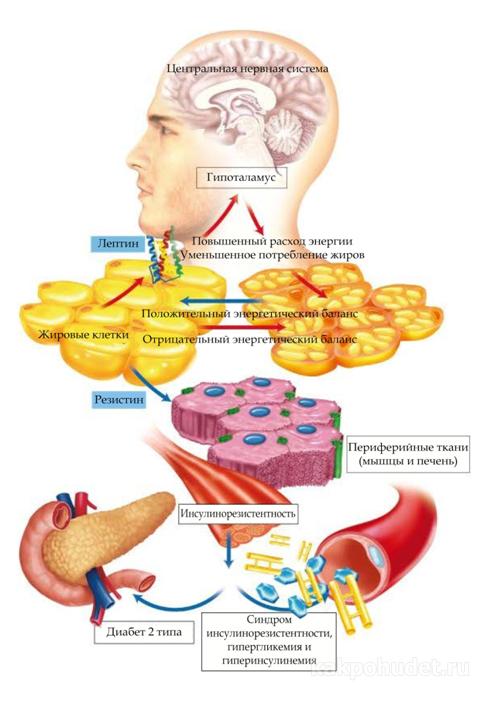
J Clin Endxrinol Metab
87
:4984
—4984
—4984
—4940
80L
,L
,Feng
N
,Sebring
NG
,Hochberg
Z
,Yanovski
JA
2003
Связь между полиморфизмом гена 11β-гидроксистероиддегидрогеназы I типа и составом тела.
INT J Обес RELAT Metab Disord
27
: — 81Walker
BR
,
Connacher
AA
,Lindsay
RM
,Webb
DJ
,Edwards
CR
1995
Карбеноксолон повышает чувствительность печени к инсулину у человека: новая роль 11-оксостероидредуктазы в усилении активации глюкокортикоидных рецепторов.
J Clin Endcrinol Metab
80
:30
:3155
—3159
—3159
—3159
82Masuzaki
H
,Paterson
J
,Shinyama
H
,Morton
NM
,Mullins
JJ
,Seckl
JR
,Flier
JS
2001
Трансгенная модель висцерального ожирения и метаболического синдрома.
Наука
294
294
:2166
—2170
83Kotelevtsev
Y
,Holmes
MC
,Burchell
A
,Houston
PM
,SCHMOLL
D
,Damieson
P
,Лучшие
R
,R
,R
,,
Edwards
CR
,,
CR
,,
JR
,Mullins
JJ
1997
11β- Мыши с нокаутом гидроксистероиддегидрогеназы типа 1 демонстрируют ослабленные реакции, индуцируемые глюкокортикоидами, и устойчивы к гипергликемии при ожирении или стрессе.
Proc Natl Acqu Sci USA
94
:14924
—14924
—14924
—14924
—14929
84Morton
NM
,Holmes
MC
,50004 MC
C
,STAELS
B
,Thailleux
A
,A
,Mullins
JJ
,SESKL
JR
2001
2001
2001
Улучшенный профиль липида и липопротеина, чувствительность к печеночной инсулине и толерантность к глюкозу в 11β-гидроксистероидной дегидрогеназе типа 1 нулевые мыши.
J Biol Chem
276
:41293
—41300
—41300
85Morton
NM
,JM
,Masuzaki
H
,Holmes
MC
,STAELS
B
,Flievet
C
,C
,C
,,
Flier
,Flier
JS
,Mullins
JJ
,SESKL
JR
2004
Новая жировая ткань-опосредованная. индуцированное диетой висцеральное ожирение у мышей с дефицитом 11β-гидроксистероиддегидрогеназы 1 типа.
Диабет
53
:931
—931
— 86Maeda
K
,Kobo
K
,Shimomura
I
,Mizuno
K
,Matsuzawa
Y
,Мацубара
К
1997
Анализ профиля экспрессии генов в жировой ткани человека.
Ген
190
:227
–235
Copyright © 2004 Эндокринное общество
Эндокринная функция жировой ткани в норме и при кардиометаболических заболеваниях
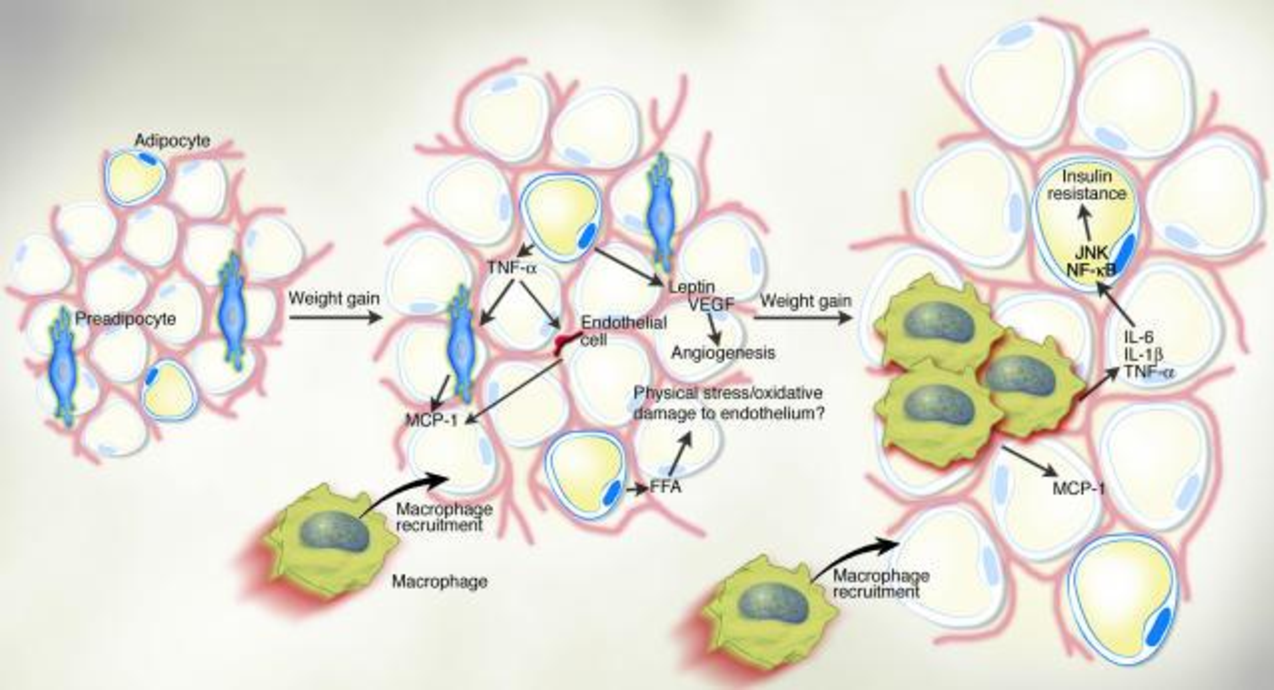
Чжан Ю. и др. Позиционное клонирование гена ожирения мыши и его человеческого гомолога. Природа 372 , 425–432 (1994).
КАС пабмед Google Scholar
Karastergiou, K. & Mohamed-Ali, V. Аутокринная и паракринная роль адипокинов. Мол. Клеточный эндокринол. 318 , 69–78 (2010).
КАС пабмед Google Scholar
Лер, С., Хартвиг, С. и Селл, Х. Адипокины: сокровищница открытия биомаркеров метаболических нарушений. Протеомика клин. заявл. 6 , 91–101 (2012).
КАС пабмед Google Scholar
Али Хан, А. и др. Сравнительный анализ секретома первичных белых и коричневых адипоцитов мыши выявил новые адипокины. Мол. Клеточная протеомика 17 , 2358–2370 (2018).
ПабМед Google Scholar

Seldin, M.M. et al. Стратегия открытия эндокринных взаимодействий с применением к метаболизму всего тела. Клеточный метаб. 27 , 1138–1155 (2018). Это исследование идентифицировало lipocalin 5 как новый адипокин, регулирующий мышечные митохондрии, с использованием беспристрастного вычислительного подхода, основанного на многоорганной транскриптомике различных линий мышей .
КАС пабмед ПабМед Центральный Google Scholar
Джордано А., Сморлези А., Фронтини А., Барбателли Г. и Чинти С. Белые, коричневые и розовые адипоциты: необычайная пластичность жирового органа. евро. Дж. Эндокринол. 170 , Р159–Р171 (2014).
КАС пабмед Google Scholar
Черноф, А. и Депре, Ж. П. Патофизиология висцерального ожирения человека: обновление. Физиол. 93 , 359–404 (2013).
КАС пабмед Google Scholar

Scheja, L. & Heeren, J. Метаболическое взаимодействие между белыми, бежевыми, коричневыми адипоцитами и печенью. Ж. Гепатол. 64 , 1176–1186 (2016).
КАС пабмед Google Scholar
Bordicchia, M. et al. Сердечные натрийуретические пептиды действуют через p38 MAPK, чтобы индуцировать термогенную программу бурого жира в адипоцитах мыши и человека. Дж. Клин. Вкладывать деньги. 122 , 1022–1036 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Crewe, C., An, Y.A. & Scherer, P.E. Зловещая триада дисфункции жировой ткани: воспаление, фиброз и нарушение ангиогенеза. Дж. Клин. Вкладывать деньги. 127 , 74–82 (2017).
ПабМед ПабМед Центральный Google Scholar
Saltiel, A.R. & Olefsky, JM. Воспалительные механизмы, связывающие ожирение и нарушение обмена веществ. Дж. Клин. Вкладывать деньги. 127 , 1–4 (2017).
Дж. Клин. Вкладывать деньги. 127 , 1–4 (2017).
ПабМед ПабМед Центральный Google Scholar
Хотамислигил Г. С. Воспаление, метавоспаление и иммунометаболические нарушения. Природа 542 , 177–185 (2017).
КАС Google Scholar
Boucher, J., Kleinridders, A. & Kahn, C.R. Передача сигналов инсулинового рецептора в нормальных и резистентных к инсулину состояниях. Гавань Колд-Спринг. Перспектива. биол. 6 , a009191 (2014).
ПабМед ПабМед Центральный Google Scholar
Xu, X. et al. Ожирение активирует программу лизосомально-зависимого метаболизма липидов в макрофагах жировой ткани независимо от классической активации. Клеточный метаб. 18 , 816–830 (2013).
КАС пабмед ПабМед Центральный Google Scholar

Petersen, M.C. & Shulman, G.I. Механизмы действия инсулина и резистентность к инсулину. Физиол. 98 , 2133–2223 (2018).
КАС пабмед Google Scholar
Kloting, N. et al. Инсулиночувствительное ожирение. Ам. Дж. Физиол. Эндокринол. Метаб. 299 , E506–E515 (2010 г.).
ПабМед Google Scholar
Карпе, Ф. и Пинник, К. Э. Биология жировой ткани верхней и нижней части тела — связь с фенотипами всего тела. Нац. Преподобный Эндокринол. 11 , 90–100 (2015).
КАС пабмед Google Scholar
Кэннон, Б. и Недергаард, Дж. Бурая жировая ткань: функция и физиологическое значение. Физиол. 84 , 277–359 (2004).
КАС пабмед Google Scholar
Li, Y. et al.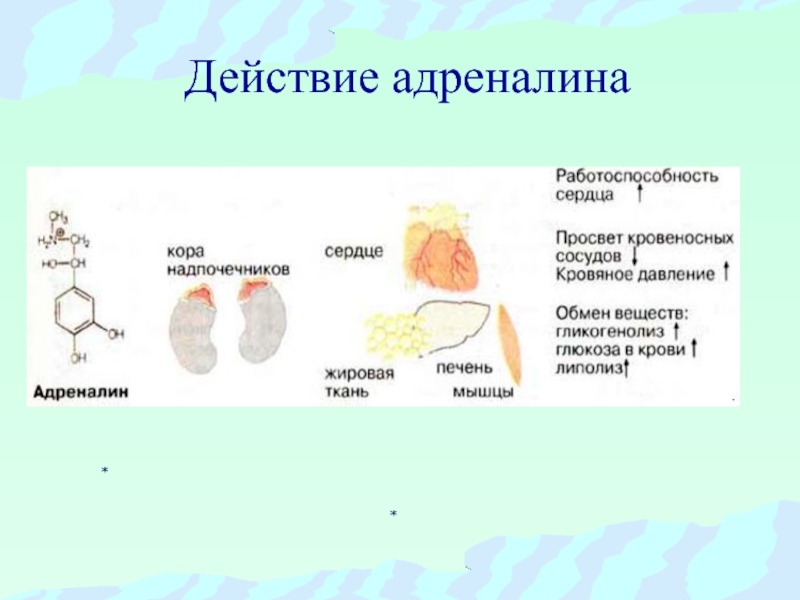 Активированный секретином бурый жир опосредует прандиальный термогенез, вызывая чувство насыщения. Cell 175 , 1561–1574 (2018).
Активированный секретином бурый жир опосредует прандиальный термогенез, вызывая чувство насыщения. Cell 175 , 1561–1574 (2018).
КАС пабмед Google Scholar
Heine, M. et al. Липолиз запускает системный инсулиновый ответ, необходимый для эффективного пополнения энергией активированной бурой жировой ткани у мышей. Клеточный метаб. 28 , 644–655 (2018).
КАС пабмед Google Scholar
Bartelt, A. & Heeren, J. Потемнение жировой ткани и метаболическое здоровье. Нац. Преподобный Эндокринол. 10 , 24–36 (2014).
КАС пабмед Google Scholar
Вильярройя Ф., Серейхо Р., Вильярройя Дж., Гавальда-Наварро А.и Гиральт, М. К пониманию того, как иммунные клетки контролируют коричневую и бежевую адипобиологию. Клеточный метаб. 27 , 954–961 (2018).
КАС пабмед Google Scholar
Takeshita, S., Fumoto, T., Naoe, Y. & Ikeda, K. Возрастной адипогенез костного мозга связан с повышенной экспрессией RANKL. J. Biol. хим. 289 , 16699–16710 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Навейрас, О. и др. Адипоциты костного мозга как негативные регуляторы гемопоэтического микроокружения. Природа 460 , 259–263 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Cawthorn, W. P. et al. Жировая ткань костного мозга является эндокринным органом, который способствует увеличению циркулирующего адипонектина при ограничении калорий. Клеточный метаб. 20 , 368–375 (2014).
КАС пабмед ПабМед Центральный Google Scholar

Коста, Р. М., Невес, К. Б., Тостес, Р. К. и Лобато, Н. С. Периваскулярная жировая ткань как соответствующее жировое депо для риска сердечно-сосудистых заболеваний при ожирении. Перед. Физиол. 9 , 253 (2018).
ПабМед ПабМед Центральный Google Scholar
Xiong, W. et al. Специфическая для бурых адипоцитов делеция PPARγ (гамма-рецептора, активируемого пролифератором пероксисом) нарушает развитие периваскулярной жировой ткани и усиливает атеросклероз у мышей. Тромб атеросклероза. Васк. биол. 38 , 1738–1747 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Антонопулос, А. С. и др. Обнаружение воспаления коронарных артерий человека путем визуализации периваскулярного жира. науч. Перевод мед. 9 , eaal2658 (2017).
ПабМед Google Scholar

Гульельми В.& Sbraccia, P. Эпикардиальная жировая ткань: в основе осложнений ожирения. Акта Диабетол. 54 , 805–812 (2017).
КАС пабмед Google Scholar
Bluher, M. & Mantzoros, C.S. От лептина к другим адипокинам в норме и болезни: факты и ожидания в начале 21 века. Метаболизм 64 , 131–145 (2015).
КАС пабмед Google Scholar
Фридман, Дж. Долгий путь к лептину. Дж. Клин. Вкладывать деньги. 126 , 4727–4734 (2016).
ПабМед ПабМед Центральный Google Scholar
Fischer, A.W., Cannon, B. & Nedergaard, J. Мыши с дефицитом лептина не гипотермичны, они анапирексичны. Мол. Метаб. 6 , 173 (2017).
КАС пабмед Google Scholar
Фаруки И. С. и О’Рахилли С. 20 лет лептина: нарушения действия лептина у человека. Дж. Эндокринол. 223 , Т63–70 (2014).
С. и О’Рахилли С. 20 лет лептина: нарушения действия лептина у человека. Дж. Эндокринол. 223 , Т63–70 (2014).
КАС пабмед Google Scholar
Боден Г., Чен X., Моццоли М. и Райан И. Влияние голодания на уровень лептина в сыворотке у здоровых людей. Дж. Клин. Эндокринол. Метаб. 81 , 3419–3423 (1996).
КАС пабмед Google Scholar
Синха, М.К. и др. Ночной подъем лептина у худых, тучных и инсулиннезависимых пациентов с сахарным диабетом. Дж. Клин. Вкладывать деньги. 97 , 1344–1347 (1996).
КАС пабмед ПабМед Центральный Google Scholar
Франсиско В. и др. Ожирение, жировая масса и иммунная система: роль лептина. Перед. Физиол. 9 , 640 (2018).
ПабМед ПабМед Центральный Google Scholar

Хубе, Ф. и др. Разница в уровнях мРНК лептина между сальниковой и подкожной абдоминальной жировой тканью у людей с ожирением. Горм. Метаб. Рез. 28 , 690–693 (1996).
КАС пабмед Google Scholar
Wrann, C.D. et al. FOSL2 способствует экспрессии гена лептина в адипоцитах человека и мыши. Дж. Клин. Вкладывать деньги. 122 , 1010–1021 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Кэрон, А., Ли, С., Элмквист, Дж. К. и Гаутрон, Л. Лептин и перекрестные помехи между мозгом и жировой тканью. Нац. Преподобный Нейроски. 19 , 153–165 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Mantzoros, C.S. et al. Активация β 3 адренорецепторов подавляет экспрессию лептина и опосредует лептин-независимое ингибирование потребления пищи у мышей.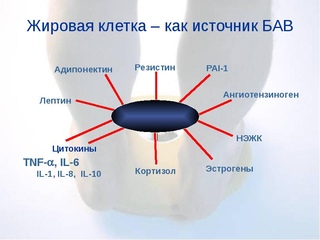 Диабет 45 , 909–914 (1996).
Диабет 45 , 909–914 (1996).
КАС пабмед Google Scholar
Trayhurn, P., Duncan, J.S., Rayner, D.V. & Hardie, L.J. Быстрое ингибирование экспрессии гена ob и уровней циркулирующего лептина у худых мышей с помощью агонистов бета-3-адренорецепторов BRL 35135A и ZD2079. Биохим. Биофиз. Рез. коммун. 228 , 605–610 (1996).
КАС пабмед Google Scholar
Коэн, П. и др. Избирательная делеция рецептора лептина в нейронах приводит к ожирению. Дж. Клин. Вкладывать деньги. 108 , 1113–1121 (2001).
КАС пабмед ПабМед Центральный Google Scholar
Zeng, W. et al. Симпатические нейро-жировые соединения опосредуют липолиз, управляемый лептином. Cell 163 , 84–94 (2015).
КАС пабмед Google Scholar

Hayes, M. R. et al. Эндогенная передача сигналов лептина в хвостовом ядре tractus solitarius и area postrema необходима для регуляции энергетического баланса. Клеточный метаб. 11 , 77–83 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Scott, M.M., Williams, K.W., Rossi, J., Lee, C.E. & Elmquist, J.K. Экспрессия рецептора лептина в нейронах Glp-1 заднего мозга регулирует потребление пищи и энергетический баланс у мышей. Дж. Клин. Вкладывать деньги. 121 , 2413–2421 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Denroche, H.C. et al. Нарушение передачи сигналов лептина в латеральном гипоталамусе и вентральном премаммилярном ядре изменяет секрецию инсулина и глюкагона и защищает от ожирения, вызванного диетой. Эндокринология 157 , 2671–2685 (2016).
КАС пабмед Google Scholar
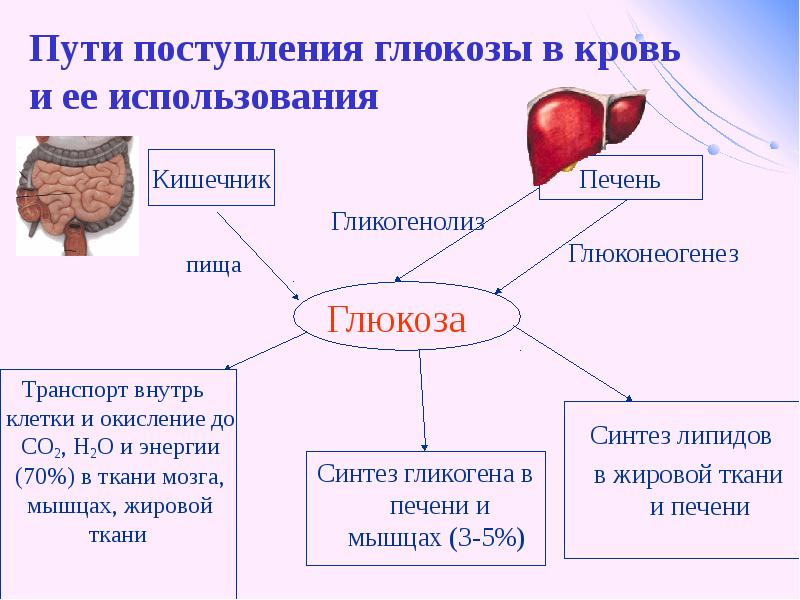
Сюй, Дж. и др. Генетическая идентификация нейронных цепей лептина в гомеостазе энергии и глюкозы. Природа 556 , 505–509 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Berglund, E.D. et al. Прямое действие лептина на нейроны РОМС регулирует гомеостаз глюкозы и чувствительность печени к инсулину у мышей. Дж. Клин. Вкладывать деньги. 122 , 1000–1009 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Хьюберт, А. и др. Селективная делеция передачи сигналов лептина в эндотелиальных клетках усиливает образование неоинтимы и фенокопирует сосудистые эффекты вызванного диетой ожирения у мышей. Артериосклероз. тромб. Васк. биол. 37 , 1683–1697 (2017). Использование специфичных эндотелиальных клеток Lepr -knockout мышей, это исследование идентифицировало передачу сигналов лептина в эндотелиальных клетках как важный механизм, противодействующий формированию неоинтимы, связанной с ожирением .
КАС пабмед Google Scholar
Wu, Y., Fortin, D. A., Cochrane, V. A., Chen, P. C. & Shyng, S. L. Рецепторы NMDA опосредуют передачу сигналов лептина и регулируют транспортировку калиевых каналов в бета-клетках поджелудочной железы. J. Biol. хим. 292 , 15512–15524 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Данмор, С.Дж. и Браун, Дж. Э. Роль адипокинов в отказе бета-клеток при диабете 2 типа. Дж. Эндокринол. 216 , Т37–45 (2013).
КАС пабмед Google Scholar
Soedling, H. et al. Ограниченное влияние на гомеостаз глюкозы делеции рецептора лептина в клетках, экспрессирующих инсулин или проглюкагон. Мол. Метаб. 4 , 619–630 (2015).
КАС пабмед ПабМед Центральный Google Scholar
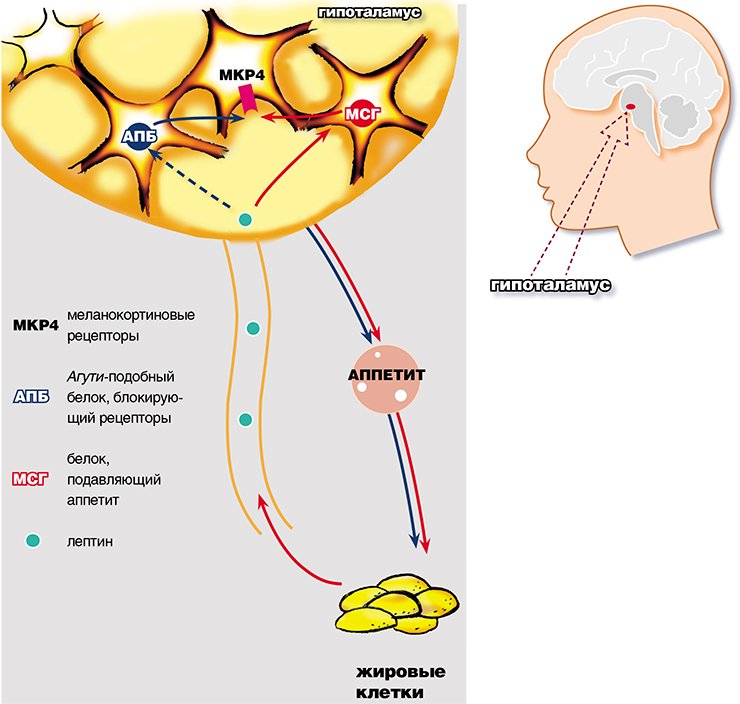
Fang, H. & Judd, RL Регулирование и функция адипонектина. Компр. Физиол. 8 , 1031–1063 (2018).
ПабМед Google Scholar
Komai, A.M. et al. Экзоцитоз адипонектина белых адипоцитов стимулируется через β3-адренергическую передачу сигналов и активацию Epac1: резистентность к катехоламинам при ожирении и диабете 2 типа. Диабет 65 , 3301–3313 (2016).
КАС пабмед Google Scholar
Кикай, М. и др. Опосредованная адренергическими рецепторами активация оси FGF-21-адипонектин оказывает атерозащитное действие на мышей apoE -/- с трансплантированной бурой жировой тканью. Биохим. Биофиз. Рез. коммун. 497 , 1097–1103 (2018).
КАС пабмед Google Scholar
Trayhurn, P. Гипоксия и функция и дисфункция жировой ткани при ожирении. Физиол. 93 , 1–21 (2013).
Физиол. 93 , 1–21 (2013).
КАС пабмед Google Scholar
Sulston, R. J. et al. Увеличение циркулирующего адипонектина в ответ на тиазолидиндионы: исследование роли жировой ткани костного мозга. Перед. Эндокринол. 7 , 128 (2016).
Google Scholar
Maeda, N. et al. Индуцированная диетой резистентность к инсулину у мышей с недостатком адипонектина/ACRP30. Нац. Мед. 8 , 731–737 (2002).
КАС пабмед Google Scholar
Kim, J.Y. et al. Связанные с ожирением улучшения метаболического профиля за счет увеличения жировой ткани. Дж. Клин. Вкладывать деньги. 117 , 2621–2637 (2007).
КАС пабмед ПабМед Центральный Google Scholar
Ямаути Т.и другие. Клонирование рецепторов адипонектина, опосредующих антидиабетические метаболические эффекты. Природа 423 , 762–769 (2003).
Клонирование рецепторов адипонектина, опосредующих антидиабетические метаболические эффекты. Природа 423 , 762–769 (2003).
КАС пабмед Google Scholar
Mao, X. et al. APPL1 связывается с рецепторами адипонектина и опосредует передачу сигналов и функцию адипонектина. Нац. Клеточная биол. 8 , 516–523 (2006).
КАС пабмед Google Scholar
Василяускайте-Брукс, И. и др. Структурное понимание рецепторов адипонектина предполагает активность церамидазы. Природа 544 , 120–123 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Ye, R., Wang, M., Wang, Q.A. & Scherer, P.E. Опосредованные адипонектином антилипотоксические эффекты при регенерации островков поджелудочной железы. Эндокринология 56 , 2019–2028 (2015).
Google Scholar
Mandal, P., Pratt, BT, Barnes, M., McMullen, MR & Nagy, LE Молекулярный механизм адипонектин-зависимой поляризации макрофагов M2: связь между метаболической и врожденной иммунной активностью полноразмерного адипонектина . J. Biol. хим. 286 , 13460–13469 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Калиджиури, А. и др. Активируемая аденозинмонофосфатом протеинкиназа модулирует активированный фенотип звездчатых клеток печени. Гепатология 47 , 668–676 (2008).
КАС пабмед Google Scholar
Okamoto, Y. et al. Адипонектин уменьшает атеросклероз у мышей с дефицитом аполипопротеина Е. Тираж 106 , 2767–2770 (2002).
КАС пабмед Google Scholar

Qiao, L. et al. Дефицит адипонектина ухудшает метаболическую адаптацию матери к беременности у мышей. Диабет 66 , 1126–1135 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Cheng, L. et al. Дефицит адипонектина приводит к бесплодию самок и дисфункции яичников у мышей. Эндокринология 157 , 4875–4887 (2016).
КАС пабмед Google Scholar
Aye, I.L., Rosario, FJ, Powell, T.L. & Jansson, T. Добавка адипонектина беременным мышам предотвращает неблагоприятное воздействие материнского ожирения на функцию плаценты и рост плода. Проц. Натл акад. науч. США 112 , 12858–12863 (2015).
КАС пабмед Google Scholar
Hu, X. et al. Дефицит MitoNEET облегчает экспериментальный алкогольный стеатогепатит у мышей за счет стимуляции эндокринной оси адипонектин-Fgf15.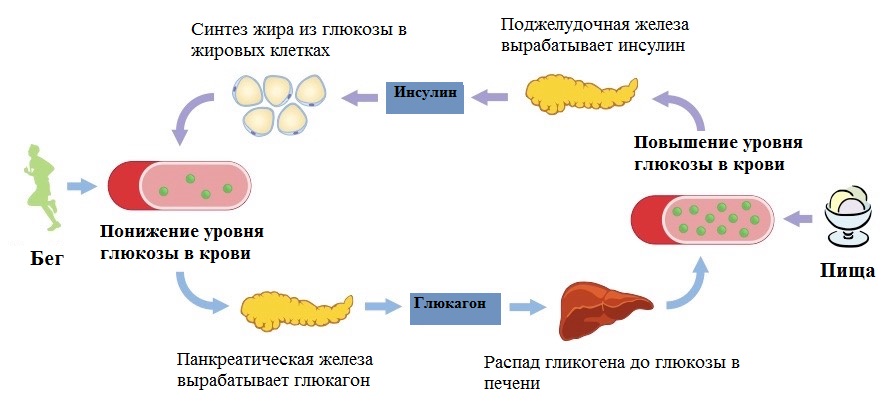 J. Biol. хим. 291 , 22482–22495 (2016).
J. Biol. хим. 291 , 22482–22495 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Wang, J. et al. Дефицит липина-1, специфичный для миелоидных клеток, стимулирует эндокринную ось адипонектин-FGF15 и улучшает вызванное этанолом повреждение печени у мышей. науч. 6 , 34117 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Кук, К.С. и др. Адипсин: циркулирующий гомолог сериновой протеазы, секретируемый жировой тканью и седалищным нервом. Наука 237 , 402–405 (1987).
КАС пабмед Google Scholar
Wu, X. et al. Вклад жирового фактора D/адипсина в активацию альтернативного пути комплемента: уроки липодистрофии. Дж. Иммунол. 200 , 2786–2797 (2018).
КАС пабмед ПабМед Центральный Google Scholar

Hertle, E. et al. Альтернативный путь комплемента лонгитюдно связан с неблагоприятными сердечно-сосудистыми исходами. Исследование CODAM. Тромб. Гемост. 115 , 446–457 (2016).
ПабМед Google Scholar
McCullough, R.L. et al. Фактор комплемента D защищает мышей от вызванного этанолом воспаления и повреждения печени. Ам. Дж. Физиол. Гастроинтест. Физиол печени. 315 , G66–G79 (2018 г.).
КАС пабмед ПабМед Центральный Google Scholar
Lo, J.C. et al. Адипсин представляет собой адипокин, который улучшает функцию бета-клеток при диабете. Cell 158 , 41–53 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Масловска М. и др. Плазменное ацилирование, стимулирующее белок, адипсин и липиды в популяции без ожирения и с ожирением.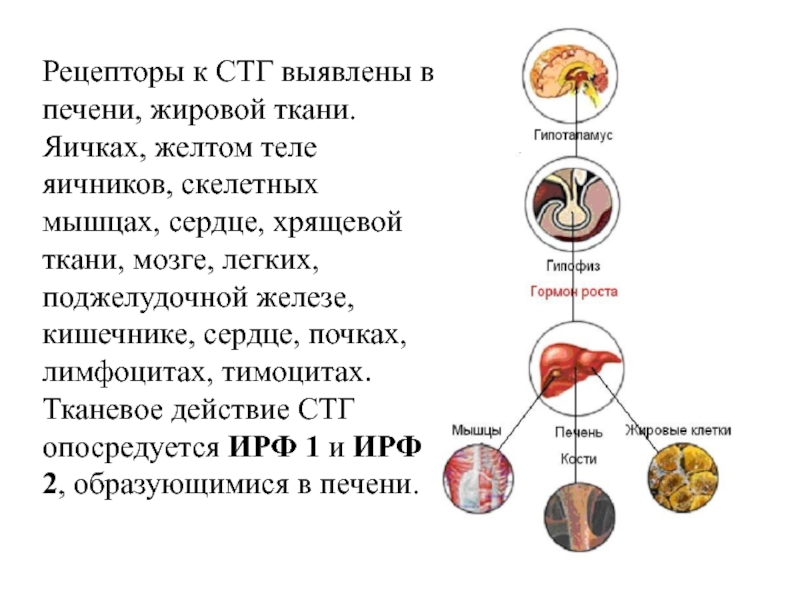 евро. Дж. Клин. Вкладывать деньги. 29 , 679–686 (1999).
евро. Дж. Клин. Вкладывать деньги. 29 , 679–686 (1999).
КАС пабмед Google Scholar
Hotamisligil, G.S. & Bernlohr, D.A. Метаболические функции FABPs—механизмы и терапевтические последствия. Нац. Преподобный Эндокринол. 11 , 592–605 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Вильнёв, Дж. и др. Нетрадиционная секреция FABP4 эндосомами и секреторными лизосомами. J. Cell Biol. 217 , 649–665 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Cao, H. et al. Липидный шаперон адипоцитов AP2 представляет собой секретируемый адипокин, регулирующий выработку глюкозы в печени. Клеточный метаб. 17 , 768–778 (2013).
ПабМед ПабМед Центральный Google Scholar

Бурак М.Ф. и соавт. Разработка терапевтического моноклонального антитела, нацеленного на секретируемый белок аР2, связывающий жирные кислоты, для лечения диабета 2 типа. науч. Перевод мед. 7 , 319ra205 (2015).
ПабМед Google Scholar
Girona, J. et al. FABP4 индуцирует пролиферацию и миграцию гладкомышечных клеток сосудов по MAPK-зависимому пути. PLOS ONE 8 , e81914 (2013).
ПабМед ПабМед Центральный Google Scholar
Wang, G. X. et al. Обогащенный бурым жиром секретируемый фактор Nrg4 сохраняет метаболический гомеостаз за счет ослабления печеночного липогенеза. Нац. Мед. 20 , 1436–1443 (2014). Это исследование показало, что воздействие холода запускает индукцию экспрессии NRG4 в BAT мышей и параллельно снижает DNL в печени посредством передачи сигналов рецептора NRG4 (ERBB3/ERBB4), предоставляя доказательства новой эндокринной оси BAT-печень .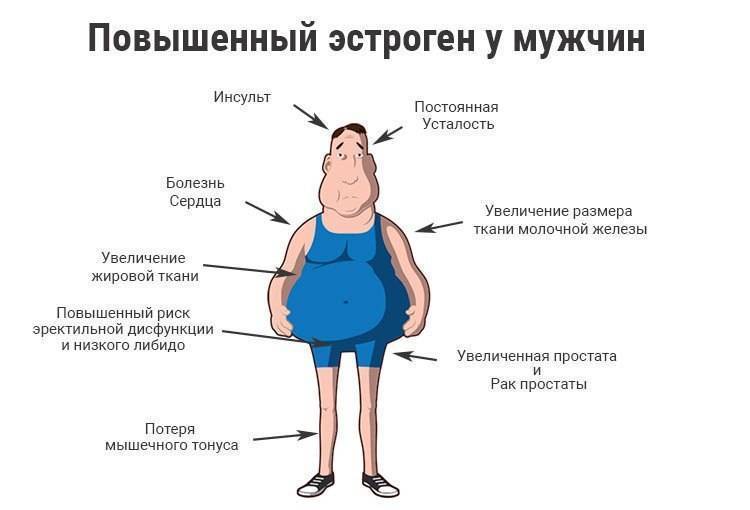
КАС пабмед ПабМед Центральный Google Scholar
Guo, L. et al. Печеночная передача сигналов нейрегулина 4 определяет эндокринную контрольную точку для прогрессирования стеатоза в НАСГ. Дж. Клин. Вкладывать деньги. 127 , 4449–4461 (2017).
ПабМед ПабМед Центральный Google Scholar
Нугрохо Д. Б., Икеда К., Каджимото К., Хирата К. И.и Эмото, Н. Активация нейрегулина-4 в адипоцитах улучшает метаболическое здоровье за счет усиления ангиогенеза жировой ткани. Биохим. Биофиз. Рез. коммун. 504 , 427–433 (2018).
КАС пабмед Google Scholar
Nugroho, D.B. et al. Нейрегулин-4 является ангиогенным фактором, который играет решающую роль в поддержании сосудистой сети жировой ткани. Биохим. Биофиз. Рез. коммун. 503 , 378–384 (2018).
КАС пабмед Google Scholar
Кристиан, М. Транскрипционная дактилоскопия «темнеющего» белого жира идентифицирует NRG4 как новый адипокин. Адипоцит 4 , 50–54 (2015).
КАС пабмед Google Scholar
Chen, Z. et al. Nrg4 способствует окислению топлива и здоровому профилю адипокинов для улучшения нарушений обмена веществ, вызванных диетой. Мол. Метаб. 6 , 863–872 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Montagner, A. et al. PPAR-альфа печени имеет решающее значение для гомеостаза жирных кислот в организме и защищает от НАЖБП. Гут 65 , 1202–1214 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Цао, Х. и др. Идентификация липокина, липидного гормона, связывающего жировую ткань с системным метаболизмом. Cell 134 , 933–944 (2008).
Cell 134 , 933–944 (2008).
КАС пабмед ПабМед Центральный Google Scholar
Chan, K.L. et al. Пальмитолеат меняет вызванную высоким содержанием жира провоспалительную поляризацию макрофагов посредством AMP-активируемой протеинкиназы (AMPK). J. Biol. хим. 290 , 16979–16988 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Cimen, I. et al. Профилактика атеросклероза биоактивным пальмитолеатом за счет подавления стресса органелл и активации воспаления. науч. Перевод мед. 8 , 358ra126 (2016). Исследование показало, что пероральный прием пальмитолеата липокина уменьшает размер атеросклеротических поражений у мышей с дефицитом аполипопротеина Е, снимая индуцированный холестерином стресс эндоплазматического ретикулума и механизмы воспаления в макрофагах .
ПабМед Google Scholar

Herman, M.A. et al. Новая изоформа ChREBP в жировой ткани регулирует системный метаболизм глюкозы. Природа 484 , 333–338 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Yang, Z.H., Miyahara, H. & Hatanaka, A. Постоянное введение пальмитолеиновой кислоты снижает резистентность к инсулину и накопление липидов в печени у мышей KK-Ay с генетическим диабетом 2 типа. Здоровье липидов Дис. 10 , 120 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Guo, X. et al. Пальмитолеат вызывает стеатоз печени, но подавляет воспалительную реакцию печени у мышей. PLOS ONE 7 , e39286 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Эйссинг, Л.и другие. Липогенез de novo в жире и печени человека связан с ChREBP-бета и метаболическим здоровьем. Нац. коммун. 4 , 1528 (2013).
Нац. коммун. 4 , 1528 (2013).
ПабМед ПабМед Центральный Google Scholar
Yore, M.M. et al. Открытие класса эндогенных липидов млекопитающих с антидиабетическим и противовоспалительным действием. Cell 159 , 318–332 (2014). В этом исследовании описывается открытие FAHFAs как нового класса липокинов, которые тесно связаны с WAT DNL и системной чувствительностью к инсулину .
КАС пабмед ПабМед Центральный Google Scholar
Vijayakumar, A. et al. Отсутствие белка, связывающего элемент ответа на углеводы, в адипоцитах вызывает системную резистентность к инсулину и нарушает транспорт глюкозы. Cell Rep. 21 , 1021–1035 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Хаммарштедт, А.и другие. Дисфункция жировой ткани связана с низким уровнем новой пальмитиновой кислоты и гидроксистеариновой кислоты. науч. Респ. 8 , 15757 (2018).
науч. Респ. 8 , 15757 (2018).
ПабМед ПабМед Центральный Google Scholar
Syed, I. et al. Гидроксистеариновые кислоты пальмитиновой кислоты активируют GPR40, который участвует в их благотворном влиянии на гомеостаз глюкозы. Клеточный метаб. 27 , 419–427 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Пфлимлин, Э. и др. Острое и повторное введение изомеров 5-ПАГСК или 9-ПАГСК не улучшает контроль уровня глюкозы у мышей. Клеточный метаб. 28 , 217–227 (2018).
КАС пабмед Google Scholar
Syed, I. et al. Методологические вопросы изучения биологии PAHSA: маскировка эффектов PAHSA. Клеточный метаб. 28 , 543–546 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Куда, О. О сложности исследования PAHSA. Клеточный метаб. 28 , 541–542 (2018).
КАС пабмед Google Scholar
Lynes, M.D. et al. Индуцированный холодом липокин 12,13-diHOME способствует транспорту жирных кислот в бурую жировую ткань. Нац. Мед. 23 , 631–637 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Стэнфорд, К.И. и др. 12,13-diHOME: липокин, вызываемый физическими упражнениями, который увеличивает поглощение жирных кислот скелетными мышцами. Клеточный метаб. 27 , 1111–1120 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Huang-Doran, I., Zhang, C.Y. & Vidal-Puig, A. Внеклеточные везикулы: новые медиаторы клеточной коммуникации при метаболических заболеваниях. Тенденции Эндокринол. Метаб. 28 , 3–18 (2017).
КАС пабмед Google Scholar
Chen, Y. et al. Концентрация экзосомальной микроРНК miR-92a в сыворотке крови отражает активность бурого жира человека. Нац. коммун. 7 , 11420 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Thomou, T. et al. Циркулирующие микроРНК жирового происхождения регулируют экспрессию генов в других тканях. Природа 542 , 450–455 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Ying, W. et al. Экзосомальные микроРНК, происходящие из макрофагов жировой ткани, могут модулировать чувствительность к инсулину in vivo и in vitro. Cell 171 , 372–384 (2017).
КАС пабмед ПабМед Центральный Google Scholar
BonDurant, L.D. & Potthoff, MJ. Фактор роста фибробластов 21: универсальный регулятор метаболического гомеостаза. Анну. Преподобный Нутр. 38 , 173–196 (2018).
КАС пабмед Google Scholar
Талукдар, С. и др. Молекула FGF21 длительного действия, PF-05231023, снижает массу тела и улучшает липидный профиль у нечеловеческих приматов и пациентов с диабетом 2 типа. Клеточный метаб. 23 , 427–440 (2016).
КАС пабмед Google Scholar
Schlein, C. et al. FGF21 снижает уровень триглицеридов в плазме за счет ускорения катаболизма липопротеинов в белой и коричневой жировой ткани. Клеточный метаб. 23 , 441–453 (2016).
КАС пабмед Google Scholar
Hansen, J.S. et al. Соотношение глюкагона и инсулина имеет решающее значение для внутренностной регуляции FGF-21 у людей. Мол. Метаб. 4 , 551–560 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Markan, K.R. et al. Циркулирующий FGF21 образуется в печени и усиливает поглощение глюкозы во время повторного кормления и перекармливания. Диабет 63 , 4057–4063 (2014). Это исследование определило печень как источник циркулирующего FGF21 и его сенсибилизирующие инсулин эффекты при остром возобновлении питания и переедании .
КАС пабмед ПабМед Центральный Google Scholar
Liang, Q. et al. FGF21 поддерживает гомеостаз глюкозы, опосредуя перекрестные помехи между печенью и мозгом во время длительного голодания. Диабет 63 , 4064–4075 (2014).
КАС пабмед Google Scholar
BonDurant, L.D. et al. FGF21 регулирует метаболизм посредством жировозависимых и -независимых механизмов. Клеточный метаб. 25 , 935–944 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Hondares, E. et al. Термогенная активация индуцирует экспрессию и высвобождение FGF21 в бурой жировой ткани. J. Biol. хим. 286 , 12983–12990 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Fisher, F.M. et al. FGF21 регулирует PGC-1альфа и потемнение белой жировой ткани в адаптивном термогенезе. Гены Дев. 26 , 271–281 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Huang, Z. et al. Ось FGF21-CCL11 опосредует образование белых жировых тканей путем связывания симпатической нервной системы с иммунитетом 2 типа. Клеточный метаб. 26 , 493–508 (2017).
КАС пабмед Google Scholar
Keipert, S. et al. Генетическое нарушение разобщающего белка 1 у мышей делает бурую жировую ткань важным источником секреции FGF21. Мол. Метаб. 4 , 537–542 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Stanford, K.I. et al. Бурая жировая ткань регулирует гомеостаз глюкозы и чувствительность к инсулину. Дж. Клин. Вкладывать деньги. 123 , 215–223 (2013).
КАС пабмед Google Scholar
Ruan, C.C. et al. Активация рецептора A2A ослабляет ремоделирование сердца при гипертонической болезни за счет стимуляции FGF21, полученного из бурой жировой ткани. Клеточный метаб. 28 , 476–489 (2018). Это исследование предоставляет доказательства того, что индуцированная гипертензией сердечная гипертрофия и фиброз контррегулируются FGF21, индуцируемым и секретируемым BAT при этом состоянии .
КАС пабмед Google Scholar
Hjortebjerg, R. et al. Рецепторы инсулина, ИФР-1 и ГР изменяются специфическим для депо жировой ткани образом у самцов мышей с модифицированным действием ГР. Эндокринология 158 , 1406–1418 (2017).
ПабМед ПабМед Центральный Google Scholar
Masternak, M.M. et al. Влияние ограничения калорийности на экспрессию генов инсулинового пути в скелетных мышцах и печени нормальных и долгоживущих мышей GHR-KO. Экспл. Геронтол. 40 , 679–684 (2005).
КАС пабмед Google Scholar
Gunawardana, S.C. & Piston, D.W. Инсулин-независимая реверсия диабета 1 типа у мышей с диабетом без ожирения с трансплантацией бурой жировой ткани. Ам. Дж. Физиол. Эндокринол. Метаб. 308 , E1043–E1055 (2015).
ПабМед ПабМед Центральный Google Scholar
Kloting, N. et al. Сывороточный ретинол-связывающий белок более выражен в висцеральной, чем в подкожной жировой ткани, и является маркером массы внутрибрюшного жира. Клеточный метаб. 6 , 79–87 (2007).
ПабМед Google Scholar
Berry, D.C. et al. Рецептор STRA6 необходим для резистентности к инсулину, индуцированной ретинол-связывающим белком, но не для поддержания гомеостаза витамина А в тканях, отличных от глаза. J. Biol. хим. 288 , 24528–24539 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Moraes-Vieira, P. M. et al. Презентация антигена и активация Т-клеток имеют решающее значение для индуцированной RBP4 резистентности к инсулину. Диабет 65 , 1317–1327 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Thompson, S.J. et al. Гепатоциты являются основным источником циркулирующего RBP4 у мышей. Диабет 66 , 58–63 (2017).
КАС пабмед Google Scholar
Preitner, F., Mody, N., Graham, T.E., Peroni, O.D. & Kahn, B.B. Длительное лечение фенретинидом предотвращает ожирение, вызванное диетой с высоким содержанием жиров, резистентность к инсулину и стеатоз печени. Ам. Дж. Физиол. Эндокринол. Метаб. 297 , E1420–E1429 (2009 г.).
КАС пабмед ПабМед Центральный Google Scholar
Fedders, R. et al. Секретируемый печенью RBP4 не нарушает гомеостаз глюкозы у мышей. J. Biol. хим. 293 , 15269–15276 (2018).
КАС пабмед Google Scholar
Lee, S.A., Yuen, JJ, Jiang, H., Kahn, B.B. & Blaner, W.S. Адипоцит-специфическая сверхэкспрессия ретинол-связывающего белка 4 вызывает стеатоз печени у мышей. Гепатология 64 , 1534–1546 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Лу, Дж., Чаттерджи, М., Шмид, Х., Бек, С. и Гаваз, М. CXCL14 как новый иммунный и воспалительный модулятор. J. Воспаление. (Лондон.) 13 , 1 (2016).
Google Scholar
Cereijo, R. et al. CXCL14, коричневый адипокин, который опосредует связь между бурым жиром и макрофагами при термогенной адаптации. Клеточный метаб. 28 , 750–763 (2018). В этом исследовании описано высвобождение CXCL14 BAT в кровоток в ответ на воздействие холода, что приводит к усилению потемнения WAT и активации BAT посредством рекрутирования макрофагов M2 .
КАС пабмед Google Scholar
Pedersen, B.K. & Febbraio, M.A. Пункт: интерлейкин-6 играет полезную роль в чувствительности к инсулину и гомеостазе глюкозы. J. Appl. Физиол. 102, (814–816 (2007).
Google Scholar
Шмидт-Аррас, Д. и Роуз-Джон, С. Путь ИЛ-6 в печени: от физиопатологии к терапии. Ж. Гепатол. 64 , 1403–1415 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Мохамед-Али, В. и др. Подкожная жировая ткань высвобождает интерлейкин-6, но не фактор некроза опухоли-альфа, in vivo. Дж. Клин. Эндокринол. Метаб. 82 , 4196–4200 (1997).
КАС пабмед Google Scholar
Zhang, W. et al. Стимулируемая липолизом адипоцитов продукция интерлейкина-6 требует активности сфингозинкиназы 1. J. Biol. хим. 289 , 32178–32185 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Мацубара Т. и др. PGRN является ключевым адипокином, опосредующим индуцированную диетой с высоким содержанием жиров резистентность к инсулину и ожирение через IL-6 в жировой ткани. Клеточный метаб. 15 , 38–50 (2012).
КАС пабмед Google Scholar
Sabio, G. et al. Сигнальный путь стресса в жировой ткани регулирует резистентность печени к инсулину. Наука 322 , 1539–1543 (2008).
КАС пабмед ПабМед Центральный Google Scholar
Wunderlich, F.T. et al. Передача сигналов интерлейкина-6 в паренхиматозных клетках печени подавляет воспаление печени и улучшает системное действие инсулина. Клеточный метаб. 12 , 237–249 (2010).
КАС пабмед Google Scholar
Mauer, J. et al. Передача сигналов с помощью IL-6 способствует альтернативной активации макрофагов для ограничения эндотоксемии и резистентности к инсулину, связанной с ожирением. Нац. Иммунол. 15 , 423–430 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Braune, J. et al. ИЛ-6 регулирует поляризацию М2 и локальную пролиферацию макрофагов жировой ткани при ожирении. Дж. Иммунол. 198 , 2927–2934 (2017).
КАС пабмед Google Scholar
Theurich, S. et al. IL-6/Stat3-зависимая индукция отдельной субпопуляции NK-клеток, ассоциированной с ожирением, ухудшает гомеостаз энергии и глюкозы. Клеточный метаб. 26 , 171–184 (2017).
КАС пабмед Google Scholar
Xu, E. et al. Временные и тканеспецифические потребности для передачи сигналов IL-6 Т-лимфоцитами при воспалении, связанном с ожирением, и резистентности к инсулину. Нац. коммун. 8 , 14803 (2017).
ПабМед ПабМед Центральный Google Scholar
Шварц, Д. Р. и Лазар, М. А. Человеческий резистин: найден в переводе с мышиного на человеческий. Тенденции Эндокринол. Метаб. 22 , 259–265 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Tan, Y. et al. Олигонуклеотид антирезистиновой РНК улучшает вызванную диетой неалкогольную жировую болезнь печени у мышей за счет ослабления провоспалительных цитокинов. Биомед. Рез. Междунар. 2015 , 414860 (2015).
ПабМед ПабМед Центральный Google Scholar
Benomar, Y. et al. Центральный резистин/TLR4 нарушает передачу сигналов адипонектина, способствуя резистентности к инсулину и FGF21. Диабет 65 , 913–926 (2016).
КАС пабмед Google Scholar
Savage, D.B. et al. Экспрессия резистина / Fizz3 в связи с ожирением и действием гамма-рецептора, активируемого пролифератором пероксисом, у людей. Диабет 50 , 2199–2202 (2001).
КАС пабмед Google Scholar
Qatanani, M., Szwergold, N. R., Greaves, D. R., Ahima, R. S. & Lazar, M. A. Человеческий резистин, полученный из макрофагов, усугубляет воспаление жировой ткани и резистентность к инсулину у мышей. Дж. Клин. Вкладывать деньги. 119 , 531–539 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Corre, J., Hebraud, B. & Bourin, P. Краткий обзор: фактор дифференцировки роста 15 в патологии: клиническая роль? Stem Cells Transl Med. 2 , 946–952 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Ding, Q. et al. Идентификация ингибирующего макрофаги цитокина-1 в жировой ткани и его секреция в виде адипокина адипоцитами человека. Эндокринология 150 , 1688–1696 (2009).
КАС пабмед Google Scholar
Lee, S.E. et al. Фактор дифференцировки роста 15 опосредует системную регуляцию уровня глюкозы цитокинами Т-хелперов 2 типа. Диабет 66 , 2774–2788 (2017).
КАС пабмед Google Scholar
Hsu, J.Y. et al. Негомеостатическая регуляция массы тела через рецептор GDF15, ограниченный стволом мозга. Природа 550 , 255–259 (2017).
ПабМед Google Scholar
Emmerson, P. J. et al. Метаболические эффекты GDF15 опосредованы орфанным рецептором GFRAL. Нац. Мед. 23 , 1215–1219 (2017).
КАС пабмед Google Scholar
Mullican, S.E. et al. GFRAL является рецептором для GDF15, и этот лиганд способствует снижению веса у мышей и нечеловеческих приматов. Нац. Мед. 23 , 1150–1157 (2017).
КАС пабмед Google Scholar
Xiong, Y. et al. Молекулы длительного действия MIC-1/GDF15 для лечения ожирения: данные от мышей до обезьян. науч. Перевод мед. 9 , eaan8732 (2017). Это исследование показало, что фармакологическое введение аналога GDF15 снижает массу тела и улучшает метаболизм у грызунов и обезьян с ожирением .
ПабМед Google Scholar
Fukuhara, A. et al. Висфатин: белок, секретируемый висцеральным жиром, имитирующий действие инсулина. Наука 307 , 426–430 (2005).
КАС пабмед Google Scholar
Carbone, F. et al. Регуляция и функция внеклеточной никотинамидфосфорибозилтрансферазы/висфатина. Компр.Физиол. 7 , 603–621 (2017).
ПабМед Google Scholar
Stromsdorfer, K.L. et al. NAMPT-опосредованный биосинтез NAD + в адипоцитах регулирует функцию жировой ткани и мультиорганную чувствительность к инсулину у мышей. Cell Rep. 16 , 1851–1860 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Ся, М. и др. Эндотелиальная активация воспаления NLRP3 и усиленное образование неоинтимы у мышей с помощью адипокина висфатина. Ам. Дж. Патол. 184 , 1617–1628 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Kieswich, J. et al. Мономерный eNAMPT в развитии экспериментального диабета у мышей: потенциальная мишень для лечения диабета 2 типа. Диабетология 59 , 2477–2486 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Wesener, D. A. et al. Распознавание микробных гликанов человеческим интелектином-1. Нац. Структура Мол. биол. 22 , 603–610 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Yang, R. Z. et al. Идентификация оментина как нового депо-специфического адипокина в жировой ткани человека: возможная роль в модулировании действия инсулина. Ам. Дж. Физиол. Эндокринол. Метаб. 290 , E1253–E1261 (2006 г.).
КАС пабмед Google Scholar
Ватанабэ Т., Ватанабэ-Коминато К., Такахаши Ю., Кодзима М. и Ватанабэ Р. Функция и регуляция сальника-1, полученного из жировой ткани. Компр. Физиол. 7 , 765–781 (2017).
ПабМед Google Scholar
Тан, Б.К. и др. Оментин-1, новый адипокин, снижается у инсулинорезистентных женщин с избыточным весом и синдромом поликистозных яичников: ex vivo и in vivo регуляция оментина-1 инсулином и глюкозой. Диабет 57 , 801–808 (2008).
КАС пабмед Google Scholar
Блюхер М. Васпин при ожирении и диабете: патофизиологическое и клиническое значение. Endocrine 41 , 176–182 (2012).
ПабМед Google Scholar
Kloting, N. et al. Экспрессия гена васпина в жировой ткани человека: связь с ожирением и диабетом 2 типа. Биохим. Биофиз. Рез. коммун. 339 , 430–436 (2006).
ПабМед Google Scholar
Fain, J. N., Buehrer, B., Bahout, S. W., Tichansky, D. S. & Madan, A. K. Сравнение распределения матричной РНК для 60 белков в жировых клетках по сравнению с нежировыми клетками сальниковой жировой ткани человека. Метаболизм 57 , 1005–1015 (2008).
КАС пабмед Google Scholar
Zieger, K. et al. Абляция калликреина 7 (KLK7) в жировой ткани улучшает метаболические последствия ожирения, вызванного диетой с высоким содержанием жиров, путем противодействия воспалению жировой ткани in vivo. Сотовый. Мол. Жизнь наук. 75 , 727–742 (2018).
КАС пабмед Google Scholar
Чоу, С. Х. и др. Лептин является эффективным средством лечения гипоталамической аменореи. Проц. Натл акад. науч. США 108 , 6585–6590 (2011).
КАС пабмед Google Scholar
Petersen, K.F. et al. Лептин устраняет резистентность к инсулину и стеатоз печени у пациентов с тяжелой липодистрофией. Дж. Клин. Вкладывать деньги. 109 , 1345–1350 (2002).
КАС пабмед ПабМед Центральный Google Scholar
Перри, Р. Дж. и др. Механизм острого инсулинонезависимого эффекта лептина по обращению вспять диабетического кетоацидоза. Дж. Клин. Вкладывать деньги. 127 , 657–669 (2017).
ПабМед ПабМед Центральный Google Scholar
Oberlin, D. & Buettner, C. Как лептин восстанавливает эугликемию при диабете с дефицитом инсулина? Дж. Клин. Вкладывать деньги. 127 , 450–453 (2017).
ПабМед ПабМед Центральный Google Scholar
Cui, H., Lopez, M. & Rahmouni, K. Клеточные и молекулярные основы устойчивости к лептину и грелину при ожирении. Нац. Преподобный Эндокринол. 13 , 338–351 (2017).
КАС пабмед Google Scholar
Левин Б.Е. и Лутц Т.А. Амилин и лептин: корегуляторы энергетического гомеостаза и развития нейронов. Тенденции Эндокринол. Метаб. 28 , 153–164 (2017).
КАС пабмед Google Scholar
Li, Z., Kelly, L., Heiman, M., Greengard, P. & Friedman, J.M. Гипоталамический амилин действует совместно с лептином, регулируя потребление пищи. Клеточный метаб. 22 , 1059–1067 (2015).
КАС пабмед Google Scholar
Roth, J.D. et al. Реакция на лептин, восстановленная агонизмом амилина при ожирении, вызванном диетой: данные доклинических и клинических исследований. Проц. Натл акад. науч. США 105 , 7257–7262 (2008 г.).
КАС пабмед Google Scholar
Lee, J. et al. Витаферин А является сенсибилизатором лептина с сильными противодиабетическими свойствами у мышей. Нац. Мед. 22 , 1023–1032 (2016). В этом исследовании молекула растительного происхождения с аферином А была идентифицирована как сенсибилизатор лептина, который снижает массу тела и улучшает гомеостаз глюкозы у мышей с ожирением, вызванным диетой .
КАС пабмед ПабМед Центральный Google Scholar
Саксена, Н.К. и Анания, Ф.А. Адипоцитокины и фиброз печени. Тенденции Эндокринол. Метаб. 26 , 153–161 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Kubota, T. et al. Пиоглитазон улучшает пролиферацию гладкомышечных клеток в неоинтимальном образовании, индуцированном манжетой, как адипонектин-зависимым, так и независимым путями. науч. Респ. 6 , 34707 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Zhou, M. et al. Розиглитазон способствует накоплению жирных ацил-КоА и избыточному запасанию гликогена в печени мышей без адипонектина. Ж. Гепатол. 53 , 1108–1116 (2010).
КАС пабмед Google Scholar
Okada-Iwabu, M. et al. Низкомолекулярный агонист AdipoR для лечения диабета 2 типа и короткой жизни при ожирении. Природа 503 , 493–499 (2013).
КАС пабмед Google Scholar
Yamashita, T. et al. Перорально активный агонист рецептора адипонектина смягчает кожный фиброз, воспаление и микроваскулярную патологию в мышиной модели системного склероза. науч. 8 , 11843 (2018).
ПабМед ПабМед Центральный Google Scholar
Menzaghi, C. & Trischitta, V. Парадокс адипонектина для смертности от всех причин и от сердечно-сосудистых заболеваний. Диабет 67 , 12–22 (2018).
КАС пабмед Google Scholar
Александрова К., Мозаффарян Д. и Пишон Т. Решение идеального шторма: биомаркеры при ожирении и патофизиология кардиометаболического риска. клин. хим. 64 , 142–153 (2018).
КАС пабмед Google Scholar
Зои, И. и др. Передача сигналов RANKL и рецепторы ErbB в канцерогенезе молочной железы. Тенденции Мол. Мед. 22 , 839–850 (2016).
КАС пабмед Google Scholar
Харитоненков А. и др. FGF-21 как новый метаболический регулятор. Дж. Клин. Вкладывать деньги. 115 , 1627–1635 (2005).
КАС пабмед ПабМед Центральный Google Scholar
Саньял, А. и др. Пегбельфермин (BMS-986036), пегилированный аналог фактора роста фибробластов 21, у пациентов с неалкогольным стеатогепатитом: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2а. Ланцет 392 , 2705–2717 (2019).
ПабМед Google Scholar
Kataoka, Y. et al. Оментин предотвращает ишемическое повреждение миокарда посредством AMP-активируемых протеинкиназ- и Akt-зависимых механизмов. Дж. Ам. Сб. Кардиол. 63 , 2722–2733 (2014).
КАС пабмед Google Scholar
Мацуо, К. и др. Оментин действует, чтобы ослабить сердечную гипертрофическую реакцию. Дж. Мол. Сотовый Кардиол. 79 , 195–202 (2015).
КАС пабмед Google Scholar
Hiramatsu-Ito, M. et al. Оментин ослабляет образование атеросклеротических поражений у мышей с дефицитом аполипопротеина Е. Кардиовасц. Рез. 110 , 107–117 (2016).
КАС пабмед Google Scholar
Юань Л. и др. Васпин защищает крыс от ишемии/реперфузии миокарда (MIRI) через сигнальный путь TLR4/NF-kappaB. евро. Дж. Фармакол. 835 , 132–139 (2018).
КАС пабмед Google Scholar
Сакамото Ю. и др. Ингибитор сериновой протеазы, полученный из висцеральной жировой ткани, предотвращает развитие монокроталин-индуцированной легочной артериальной гипертензии у крыс. Арка Пфлюгера. 469 , 1425–1432 (2017).
КАС пабмед Google Scholar
O’Neill, S.M. et al. Воздействие на жировую ткань с помощью системной генной терапии. Джин Тер. 21 , 653–661 (2014).
ПабМед ПабМед Центральный Google Scholar
Ауади, М. и др. Сайленсинг генов в макрофагах жировой ткани регулирует метаболизм всего тела у мышей с ожирением. Проц. Натл акад. науч. США 110 , 8278–8283 (2013). В этом исследовании описывается метод селективного нацеливания малых интерферирующих РНК на макрофаги эпидидимального WAT, но не подкожного WAT или других органов .
КАС пабмед Google Scholar
Чанг, Х. Р., Ким, Х. Дж., Xu, X. & Ferrante, A.W. Jr. Макрофаги и адипоциты IGF1 поддерживают гомеостаз жировой ткани во время метаболических стрессов. Ожирение (Серебряная весна) 24 , 172–183 (2016).
КАС Google Scholar
Альмурайхи С. и др. Интерлейкин-6 индуцирует нарушение подкожного адипогенеза у человека при резистентности к инсулину, связанной с ожирением. Диабетология 59 , 2406–2416 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Weiner, J. et al. Экспрессия васпинов, специфичных для бурой жировой ткани (BAT), увеличивается после диеты, вызывающей ожирение, и воздействия холода и связана с острыми изменениями метилирования ДНК. Мол. Метаб. 6 , 482–493 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Положение о жировой ткани и гормонах
Заболеваемость метаболическими заболеваниями и число пациентов с ожирением в США растет угрожающими темпами.Хотя в некоторых случаях виноваты западная диета и отсутствие физических упражнений, в основе прогрессирования ожирения во всех случаях лежат сложные биологические процессы.Три вида жировой ткани
Жир, также называемый жировой тканью, отвечает за повышенное накопление жира в виде триглицеридов в различных частях тела. Существует три различных вида жировой ткани: белый жир, бурый жир и бежевый жир. Хотя эти клетки оптимизированы для хранения энергии в виде триглицеридов, они также хранят белки, витамины, токсины и регуляторные гормоны.Кроме того, жировые клетки могут секретировать гормоны и ключевые сигнальные молекулы для регулирования метаболизма, придавая им эндокринную функцию, которая не всегда была очевидной 1 .Основные типы жировых клеток
В организме есть три основных вида жировых клеток (адипоцитов):- Белый жир — предназначен для хранения энергии в виде триглицеридов. Белый жир также выделяет гормоны и сигнальные молекулы, регулирующие реакцию инсулина на прием пищи.
- Бурый жир — тип термогенного жира, который специализируется на высвобождении энергии в виде тепла для защиты от переохлаждения.
- Бежевый жир — еще одна форма термогенного жира, но с совершенно другой экспрессией генов и чувствительностью к гормонам 2 .
Связь между гормонами, увеличением веса и жировой тканью
Несколько гормонов хранятся и секретируются жировой тканью, что влияет на общий гормональный баланс организма:- Лептин — участвует в контроле и подавлении аппетита 5
- Адипонектин — повышает чувствительность организма к инсулину и помогает контролировать уровень сахара в крови 6
- Эстроген — запасается и вырабатывается жировыми клетками, одна из причин, по которой избыточный вес является фактором риска развития рака молочной железы 7
- Ангиотензин — участвует в регуляции кровяного давления
У здоровых животных лептин помогает контролировать чувство голода, взаимодействуя с гипоталамусом, фактически сообщая мозгу, что нужно прекратить есть, как только будет съедено достаточное количество пищи. Однако у мутантных мышей, лишенных этого гормона, они не могли контролировать количество съеденного и, в свою очередь, стали в два раза крупнее контрольных животных 4 .
У пациентов с ожирением присутствует гормон лептин; однако мозг развил пониженную чувствительность к его действию.Это также приводит к увеличению потребления пищи и последующему увеличению веса.
Влияние потери веса на гормональный баланс
Потеря веса – это, как правило, потеря массы жировой ткани, а не количество адипоцитов в данной области. Это уменьшение массы приводит к секреции триглицеридов, а также накоплению гормонов, витаминов и токсинов.Адипоциты, которые потеряли значительную массу, также изменили метаболические и воспалительные характеристики. Например, уменьшение ожирения приводит к снижению уровней как лептина, так и инсулина, а также к временному снижению гормонов щитовидной железы на ранних стадиях потери веса 8 .
Хотя уменьшение размера адипоцитов полезно для организма, необходимы дополнительные исследования, чтобы сделать вывод о том, оказывают ли высвобождаемые гормоны и сигнальные молекулы положительный или отрицательный эффект на поддержание и восстановление веса.
Посмотреть веб-семинар по теме Taconic Biosciences:Ссылки:
1. Rosen, E.D.; Шпигельман, Б. М. О чем мы говорим, когда говорим о жире.
Сотовый 2014 , 156 (1-2), 20-44.2. Ву, Дж.; Бострём, П.; Спаркс, Л. М.; Е, Л.; Чой, JH; Джанг, А.-Х.; Хандекар, М.; Виртанен, К.А.; Нуутила, П.; Шаарт, Г.; и другие. Бежевые адипоциты представляют собой особый тип термогенных жировых клеток у мыши и человека.
Сотовый 2012 , 150 (2), 366-376.3. Чжан Ю.; Проэнка, Р.; Маффеи, М .; Бароне, М.; Леопольд, Л.; Фридман, Дж. М. Позиционное клонирование гена ожирения мыши и его гомолога у человека.
Природа 1994 , 372 (6505), 425-432.4. Мадхусуданан Дж. Тайная жизнь жировых клеток.
АКЦ Цент. Наука . 2018 , 4 (9), 1078-1080.5. Чжоу Ю.; Руи, Л. Сигнализация лептина и резистентность к лептину.
Фронт. Мед . 2013 , 7 (2), 207-222.6. Жировая ткань. (По состоянию на 3 июля 2019 г.).
7. Клири М.П.; Гроссманн, М.Е. Ожирение и рак молочной железы: связь с эстрогеном.
Эндокринология 2009 , 150 (6), 2537.8. Маклин, П. С.; Хиггинс, Дж. А.; Джайлз, Э. Д.; Шерк, В.Д.; Джекман, М. Р. Роль жировой ткани в наборе веса после потери веса.
Обес. Версия . 2015 , 16 Приложение 1 (Приложение 1), 45-54.6. Гормоны жировой ткани • Функции клеток и организма человека
Содержание:
1. Гормоны жировой ткани
_
Гормоны жировой ткани
Из-за своего большого количества жировая ткань представляет собой важный, но часто игнорируемый эндокринный орган .
Его клетки (адипоциты) образуют большое количество пептидных гормонов, известных как адипокины (или адипоцитокины ). В целом, они в основном регулируют энергию метаболизм и их влияние на аппетит и кормление поведение влияет на долговременную регуляцию массы тела. Помимо влияния на обмен веществ, они также модулируют иммунные функции и течение воспалительных процессов.Среди наиболее важных и известных гормонов лептин , адипонектин и резистин .
Помимо непосредственной продукции собственных гормонов жировая ткань оказывает влияние на гормоны, выделяемые другими эндокринными органами . Например, избыточное количество жировой ткани может в значительной степени способствовать формированию инсулинорезистентности, диабета 2 типа или атеросклероза.
Лептин
Существует несколько гипотез, объясняющих механизм действия адипокинов.Так называемая липостатическая гипотеза утверждает, что жировая ткань вырабатывает пропорционально ее количеству в организме сигнальные молекулы, воздействующие на гипоталамус и приводящие к увеличению расхода энергии и снижению потребления пищи . Первым открытым медиатором такого рода был лептин.
Структура и синтез
Лептин представляет собой гормон из 167 аминокислот, продукт ob гена («ob» происходит от слова «ожирение»).Его рецептор кодируется db геном , который существует в нескольких формах альтернативного сплайсинга. Различные формы этого рецептора могут быть обнаружены в разных частях тела, например. в головном мозге (преимущественно в гипоталамусе) или в периферических тканях.
Лептин синтезируется в основном адипоцитами белой жировой ткани и синтезированное количество коррелирует с количеством жировой ткани в теле . Таким образом, люди с ожирением производят больше лептина, чем люди с нормальной массой тела.Помимо белой жировой ткани, лептин в меньшей степени синтезируется и другими тканями (например, бурой жировой тканью, скелетными мышцами, желудком, печенью или плацентой).
Функция и патология
Лептин активно регулирует потребление и расход энергии , влияя на пищевое поведение, аппетит, чувство голода и энергетический обмен. Поскольку его количество в кровотоке соответствует количеству жировой ткани, он обеспечивает мозг обратной связью информацией о состоянии энергетических резервов .
Лептин проходит через гематоэнцефалический барьер и оказывает анорексигенное действие на гипоталамус, подавляя аппетит и повышая расход энергии . На периферии влияет чувствительность по отношению к инсулину . Таким образом, он действует против орексигенного действия нейропептида Y , который, наоборот, повышает аппетит и стимулирует секрецию инсулина.Лептин активирует фермент АМФ-киназу (АМРК), находящийся в миоцитах, что вызывает усиление окисления ТАГ в мышцах.
Существуют редкие случаи, когда мутации повреждают лептин рецептор или сам лептин . Они представляют собой часто болезненные обширные ожирение протекающие в малолетнем возрасте и дислипидемию, возникающую в результате неконтролируемого голода и обжорства.Повышенная продукция инсулина у этих больных приводит к развитию инсулинорезистентности.
Напротив, у большинства пациентов с ожирением дефицита лептина нет. Наоборот, поскольку лептин образуется пропорционально количеству жировой ткани в организме, у людей с ожирением обычно наблюдается скорее гиперлептинемия и резистентность к лептину. Терапевтическое введение лептина, который сначала считался универсальным лекарством от ожирения, таким образом, помогает только части пациентов (с мутацией, поражающей лептин или его рецептор).
Адипонектин
Структура и синтез
Адипонектин представляет собой белковый гормон, продуцируемый в основном адипоцитами жировой ткани. Его концентрация в крови довольно высока (на несколько порядков выше по сравнению с лептином).
Другим отличием от лептина является корреляция между количеством жира в организме и синтезом гормонов. В случае адипонектина отрицательный и поэтому тучных пациентов имеют концентрации в плазме ниже , чем у пациентов с нормальным ИМТ.
Существует несколько полимерных изоформ адипонектина в плазме крови (тримеры, гексамеры или более высокие полимерные структуры), каждая из которых оказывает различное воздействие на организм.
Функция
Адипонектин представляет собой гормон, главным образом влияющий на метаболизм сахаридов и липидов, повышающий чувствительность тканей к инсулину . Его действие приводит к усилению транспорта и утилизации глюкозы и свободных жирных кислот в мышцах, печени и жировых клетках, а также к ингибированию глюконеогенеза в печени.
Адипонектин, в то же время предотвращает развитие атеросклероза , особенно на ранних стадиях его формирования. Ингибирует превращение макрофагов в пенистые клетки и снижает экспрессию поверхностных адгезивных рецепторов.
Резистин
Как и другие адипокины, резистин принадлежит к группе белков, синтезируемых адипоцитами. Он также может образовываться клетками иммунной системы и его экспрессия регулируется главным образом присутствием провоспалительных цитокинов IL-6 и TNFα.
Эксперименты на животных показали, что введение резистина снижает толерантность к глюкозе и чувствительность к инсулину. Поэтому вероятно, что повышенная концентрация участвует в развитии резистентности к инсулину. Связь резистина с ожирением и диабетом до сих пор неясна, результаты экспериментальных исследований на людях противоречивы. Считается, что его значение для человека заключается скорее в регуляции воспалительных процессов.
Авторы подглавы: Петра Лаврикова и Йозеф Фонтана
Гормоны жировой ткани | СпрингерЛинк
Розен Э.Д., Шпигельман Б.М. Ppargamma: ядерный регулятор метаболизма, дифференцировки и роста клеток. Дж. Биол. хим. 2001, 276 : 37731–37734.
КАС пабмед Статья Google Scholar
Мохамед-Али В., Пинкни Дж.Х., Коппак С.В. Жировая ткань как эндокринный и паракринный орган. Междунар. Дж. Обес. Относ. Метаб. Беспорядок. 1998, 22 : 1145-1158.
Google Scholar
Трейхурн П., Битти Дж.Х. Физиологическая роль жировой ткани: белая жировая ткань как эндокринный и секреторный орган. проц. Нутр. соц. 2001, 60 : 329–339.
КАС пабмед Статья Google Scholar
Фрухбек Г., Гомес-Амброси Дж., Мурузабал Ф.Дж., Баррелл М.А. Адипоцит: модель интеграции эндокринной и метаболической сигнализации в регуляции энергетического метаболизма. Являюсь. Дж. Физиол. Эндокринол.Метаб. 2001, 280 : E827–E847.
КАС пабмед Google Scholar
Björntörp P. Эндокринные нарушения ожирения. Метаболизм 1995, 44 : 21–23.
ПабМед Статья Google Scholar
Масузаки Х., Патерсон Дж., Шиньяма Х. и др. Трансгенная модель висцерального ожирения и метаболического синдрома. Наука 2001, 294 : 2166–2170.
КАС пабмед Статья Google Scholar
Cassis L.A., Saye J., Peach M.J. Расположение и регуляция матричной РНК ангиотензиногена крыс. Гипертензия 1988, 11 : 591–596.
КАС пабмед Статья Google Scholar
Frederich R.C.J., Kahn B.B., Peach M.J., Flier J.S. Тканеспецифическая пищевая регуляция ангиотензиногена в жировой ткани.Гипертония 1992, 19 : 339–344.
КАС пабмед Статья Google Scholar
Massiera F., Bloch-Faure M., Ceiler D. et al. Жировой ангиотензиноген участвует в росте жировой ткани и регуляции артериального давления. FASEB J. 2001, 15 : 2727–2729.
КАС пабмед Google Scholar
Эрикссон П., Reynisdottir S., Lonnqvist F., Stemme V., Hamsten A., Arner P. Секреция жировой тканью ингибитора активатора плазминогена-1 у лиц, не страдающих ожирением и страдающих ожирением. Diabetologia 1998, 41 : 65–71.
КАС пабмед Статья Google Scholar
Самад Ф., Уйсал К.Т., Висброк С.М., Пандей М., Хотамислигил Г.С., Лоскутофф Д.Дж. Фактор некроза опухоли-а является ключевым компонентом связанного с ожирением повышения уровня ингибитора активатора плазминогена 1.проц. Натл. акад. науч. США 1999, 96 : 6902–6907.
КАС ПабМед Центральный пабмед Статья Google Scholar
Alessi M.C., Bastelica D., Morange P. et al. Ингибитор активатора плазминогена 1, трансформирующий фактор роста бета1 и ИМТ тесно связаны в жировой ткани человека при патологическом ожирении. Диабет 2000, 49 : 1374–1380.
КАС пабмед Статья Google Scholar
Керстен С., Мандард С., Тан Н.С. и др. Характеристика индуцированного голоданием жирового фактора FIAF, нового гена-мишени рецептора, активируемого пролифератором пероксисом. Дж. Биол. хим. 2000, 275 : 28488–28493.
КАС пабмед Статья Google Scholar
Юн Дж.К., Чикеринг Т.В., Розен Э.Д. и др. Ген-мишень гамма-рецептора, активируемого пролифератором пероксисом, кодирующий новый родственный ангиопоэтину белок, связанный с жировой дифференцировкой.Мол. Клеточная биол. 2000, 20 (14): 5343–5349.
КАС ПабМед Центральный пабмед Статья Google Scholar
Кук К.С., Мин Х.Ю., Джонсон Д. и др. Адипсин: циркулирующий гомолог сериновой протеазы, секретируемый жировой тканью и седалищным нервом. Наука 1987, 237 : 402–405.
КАС пабмед Статья Google Scholar
Коппак С.В. Провоспалительные цитокины и жировая ткань. проц. Нутр. соц. 2001, 60 : 349–356.
КАС пабмед Статья Google Scholar
Murray I., Sniderman A.D., Havel P.J., Cianflone K. Дефицит белка, стимулирующего ацилирование (ASP), изменяет постпрандиальный метаболизм и метаболизм жировой ткани у самцов мышей. Дж. Биол. хим. 1999, 274 : 36219–36225.
КАС пабмед Статья Google Scholar
Saleh J., Blevins J.E., Havel PJ, Barrett J.A., Gietzen D.W., Cianflone K. Острые эффекты ацилирования стимулирующего белка (ASP) на постпрандиальную липемию и потребление пищи у грызунов. Междунар. Дж. Обес. Относ. Метаб. Беспорядок. 2001, 25 : 705–713.
КАС пабмед Статья Google Scholar
Хотамислигил Г.С., Шпигельман Б.М. Фактор некроза опухоли альфа: ключевой компонент связи ожирения и диабета. Диабет 1994, 43 : 1271–1278.
КАС пабмед Статья Google Scholar
Хотамислигил Г.С., Шаргилл Н.С., Шпигельман Б.М. Жировая экспрессия фактора некроза опухоли-альфа: прямая роль в резистентности к инсулину, связанной с ожирением. Наука 1993, 259 : 87–91.
КАС пабмед Статья Google Scholar
Уйсал К.Т., Висброк С.М., Марино М.В., Хотамислигил Г.S. Защита от резистентности к инсулину, вызванной ожирением, у мышей, у которых отсутствует функция TNF-альфа. Природа 1997, 389 : 610–614.
КАС пабмед Статья Google Scholar
Сингх А.Х., Лю С., Кромби Д.Л. и др. Дифференциальные эффекты рексиноидов и тиазолидиндионов на экспрессию метаболических генов у грызунов с диабетом. Мол. Фармакол. 2001, 59 : 765–773.
Google Scholar
Керн П.А., Ранганатан С., Ли С., Вуд Л., Ранганатан Г. Фактор некроза опухоли жировой ткани и экспрессия интерлейкина-6 при ожирении человека и резистентности к инсулину. Являюсь. Дж. Физиол. Эндокринол. Метаб 2001, 280 : E745–E751.
КАС пабмед Google Scholar
Бастард Дж.П., Маачи М., Ван Ньеу Дж.Т. и др. Содержание ИЛ-6 в жировой ткани коррелирует с резистентностью к инсулину и активацией захвата глюкозы как in vivo, так и in vitro.Дж. Клин. Эндокринол. Метаб. 2002, 87 : 2084–2089.
КАС пабмед Статья Google Scholar
Валлениус В., Валлениус К., Арен Б. и др. У мышей с дефицитом интерлейкина-6 развивается ожирение в зрелом возрасте. Нац. Мед. 2002, 8 : 75–79.
КАС пабмед Статья Google Scholar
Валлениус К., Валлениус В., Сантер Д., Диксон С.Л., Янссон Дж.О. Интрацеребровентрикулярное лечение интерлейкином-6 уменьшает жировые отложения у крыс. Биохим. Биофиз. Рез. коммун. 2002, 293 : 560–565.
КАС пабмед Статья Google Scholar
Campfield L.A., Smith F.J., Burn P. Путь белка OB (лептина) — связь между массой жировой ткани и центральными нейронными сетями. Горм. Метаб. Рез. 1996, 28 : 619–632.
КАС пабмед Статья Google Scholar
Фридман Дж. М., Халаас Дж. Л. Лептин и регуляция массы тела у млекопитающих. Природа 1998, 395 : 763–770.
КАС пабмед Статья Google Scholar
Ахима Р.С., Флиер Дж.С. лептин. Анну. Преподобный Физиол. 2000, 62 : 413–437.
КАС пабмед Статья Google Scholar
Rayner D.V., Trayhurn P. Регуляция продукции лептина: взаимодействие симпатической нервной системы.Дж. Мол. Мед. 2001, 79 : 8–20.
КАС пабмед Статья Google Scholar
Zhang Y., Proenca R., Maffei M., Barone M., Leopold L., Friedman JM Позиционное клонирование мышиного гена ожирения и его человеческого гомолога [опубликованные опечатки появляются в Nature 1995, 374 (6521): 479. Nature 1994, 372 : 425–432.
КАС Статья Google Scholar
Tartaglia L.A., Dembski M., Weng X. et al. Идентификация и клонирование экспрессии рецептора лептина, OB-R. Cell 1995, 83 : 1263–1271.
КАС пабмед Статья Google Scholar
Фаруки И.С., Джебб С.А., Лангмак Г. и др. Эффекты терапии рекомбинантным лептином у ребенка с врожденным дефицитом лептина. Н. англ. Дж. Мед. 1999, 341 : 879–884.
КАС пабмед Статья Google Scholar
Клемент К., Вайс К., Лахлоу Н. и др. Мутация в гене рецептора лептина человека вызывает ожирение и дисфункцию гипофиза. Природа 1998, 392 : 398–401.
КАС пабмед Статья Google Scholar
Heymsfield S.B., Greenberg A.S., Fujioka K. et al. Рекомбинантный лептин для снижения веса у тучных и худых взрослых: рандомизированное контролируемое исследование с повышением дозы. JAMA 1999, 282 : 1568–1575.
КАС пабмед Статья Google Scholar
Ахима Р.С., Прабакаран Д., Манцорос К. и др. Роль лептина в нейроэндокринной реакции на голодание. Природа 1996, 382 : 250–252.
КАС пабмед Статья Google Scholar
Блюхер М., Майкл М.Д., Перони О.Д. и др. Селективный нокаут рецепторов инсулина в жировой ткани защищает от ожирения и непереносимости глюкозы, связанной с ожирением.Дев. Cell 2002, 3 : 25–38.
КАС пабмед Статья Google Scholar
Trayhurn P., Hoggard N., Mercer J.G., Rayner D.V. Лептин: фундаментальные аспекты. Междунар. Дж. Обес. Относ. Метаб. Беспорядок. 1999, 23 (1): 22–28.
КАС пабмед Статья Google Scholar
Марк А.Л., Коррейя М.Л., Рахмуни К., Хейнс В.Г.Селективная резистентность к лептину: новая концепция физиологии лептина с последствиями для сердечно-сосудистой системы. Дж. Гипертензии. 2002, 20 : 1245–1250.
КАС пабмед Статья Google Scholar
Берг А.Х., Комбс Т.П., Шерер П.Е. ACRP30/адипонектин: адипокин, регулирующий метаболизм глюкозы и липидов. Тенденции Эндокринол. Метаб. 2002, 13 : 84–89.
КАС пабмед Статья Google Scholar
Маэда Н., Шимомура И., Кишида К. и др. Индуцированная диетой резистентность к инсулину у мышей с недостатком адипонектина/ACRP30. Нац. Мед. 2002, 8 : 731–737.
КАС пабмед Статья Google Scholar
Мацуда М., Шимомура И., Сата М. и др. Роль адипонектина в предотвращении стеноза сосудов. Недостающее звено адиповаскулярной оси. Дж. Биол. хим. 2002, 277 : 37487–37491.
КАС пабмед Статья Google Scholar
Кубота Н., Тераучи Ю., Ямаути Т. и др. Разрушение адипонектина вызывает резистентность к инсулину и образование неоинтимы. Дж. Биол. хим. 2002, 277 : 25863–25866.
КАС пабмед Статья Google Scholar
Ма К., Кабреро А., Саха П.К. и др. Повышенное бета-окисление, но отсутствие резистентности к инсулину или непереносимости глюкозы у мышей с дефицитом адипонектина.Дж. Биол. хим. 2002, 277 : 34658–34661.
КАС пабмед Статья Google Scholar
Ямаути Т., Камон Дж., Ваки Х. и др. Гормон жиров, адипонектин, изменяет резистентность к инсулину, связанную как с липоатрофией, так и с ожирением. Нац. Мед. 2001, 7 : 941–946.
КАС пабмед Статья Google Scholar
Steppan C.M., Bailey S.T., Bhat S. et al. Гормон резистин связывает ожирение с диабетом. Природа 2001, 409 : 307–312.
КАС пабмед Статья Google Scholar
Ким К.Х., Ли К., Мун Ю.С., Сул Х.С. Богатый цистеином секреторный фактор, специфичный для жировой ткани, ингибирует дифференцировку адипоцитов. Дж. Биол. хим. 2001, 276 : 11252–11256.
КАС пабмед Статья Google Scholar
Степпан С.М., Лазарь М.А. Резистин и инсулинорезистентность, связанная с ожирением. Тенденции Эндокринол. Метаб. 2002, 13 : 18–23.
КАС пабмед Статья Google Scholar
Way J.M., Gorgun C.Z., Tong Q. et al. Экспрессия резистина в жировой ткани сильно подавлена при ожирении и стимулируется рецептором, активируемым пролифератором пероксисом? агонисты. Дж. Биол. хим. 2001, 276 : 25651–25653.
КАС пабмед Статья Google Scholar
Ле Лэй С., Буше Дж., Рей А. и др. Снижение экспрессии резистина у мышей с различной чувствительностью к диете с высоким содержанием жиров. Биохим. Биофиз. Рез. коммун. 2001, 289 : 564–567.
ПабМед Статья Google Scholar
Сэвидж Д.Б., Сьютер С.П., Кленк Э.С. и др. Экспрессия резистина/Fizz3 в связи с ожирением и действием гамма-рецептора, активируемого пролифератором пероксисом, у людей. Диабет 2001, 50 : 2199–2202.
КАС пабмед Статья Google Scholar
Абель Э.Д., Перони О., Ким Дж.К. и др. Селективное нацеливание гена GLUT4 на жировую ткань ослабляет действие инсулина в мышцах и печени. Природа 2001, 409 : 729–733.
КАС пабмед Статья Google Scholar
Гормоны жировой ткани и регулирование потребления пищи — Генри — 2008 — Журнал нейроэндокринологии
Теория липостата постулирует, что переносимые жиром факторы воздействуют на мозг, регулируя энергетический гомеостаз, контролируя уровни ожирения.В 1994 году на сцену вышел лептин, что придало этой теории большое доверие, поскольку эта молекула в основном синтезируется и секретируется из белой жировой ткани и действует на гипоталамус, регулируя потребление пищи и расход энергии. Лептин часто считают барометром тела, поддерживающим энергетический гомеостаз. С момента открытия лептина было обнаружено, что различные факторы синтезируются в жировой ткани и секретируются, чтобы действовать как гормоны. К ним относятся адипонектин, стероиды, такие как эстроген и глюкокортикоиды, резистин и висфатин, и это лишь некоторые из них (рис.1). В этом обзоре будет обсуждаться нейроэндокринная роль факторов жировой ткани в модулировании потребления и расхода энергии.
Иллюстрация различных факторов, секретируемых жировой тканью. Адипоциты способны синтезировать и секретировать лептин, адипонектин, ангиотензиноген, висфатин, простацилин, адипсин и резистин (у грызунов). Кроме того, в результате присутствия 11β-гидроксистероиддегидрогеназы 1 (11β HSD1) и ароматазы жировая ткань может преобразовывать неактивный кортизон в активный глюкокортикоид кортикостерон (у грызунов) или кортизол (у овец и людей), а также андрогены в эстрогены. .Ранее считалось, что ряд цитокинов продуцируется жировой тканью, но синтез интерлейкинов (ИЛ-1 и ИЛ-6), фактора некроза опухоли α (ФНО-α) и простагландина происходит в клетках клеточного матрикса, таких как мононуклеарные, эндотелиальные и стромальные клетки, а не адипоциты как таковые (68, 87). У человека, в отличие от грызунов, резистин синтезируется внеадипоцитарными клетками, находящимися в жировой ткани.
Лептин
Клонирование гена тучного гена и последующая идентификация его белкового продукта лептина ознаменовали важный сдвиг в нашем понимании регуляции энергетического гомеостаза факторами, производными от жира (1).Лептин в основном секретируется белыми адипоцитами и действует на гипоталамус, вызывая чувство сытости (рис. 2). Было обнаружено, что введение лептина снижает потребление пищи у всех изученных на сегодняшний день видов, включая людей (2), нечеловеческих приматов (3), грызунов (4, 5) и овец (6). Важность этой системы в поддержании энергетического гомеостаза и массы тела иллюстрируется различными генетическими моделями грызунов, в которых мутации в гене лептина или в гене соответствующего рецептора приводят к гиперфагии, снижению расхода энергии и глубокому ожирению (1, 7). , 8).У людей мутация гена лептина встречается редко, но была обнаружена в небольшой кровнородственной популяции, приводя к патологическому ожирению (9). Лептин также модулирует нейроэндокринные системы. Например, возмущение в системе лептина в результате мутации, голодания или низкой массы тела нарушает репродуктивную функцию. Такие эффекты можно обратить вспять с помощью лечения лептином (10-12). Таким образом, центральное введение лептина гипогонадотрофным тощим овцам восстанавливало секрецию лютеинизирующего гормона (11), и аналогичные результаты были обнаружены у голодающих людей (13).Таким образом, целостность лептиновой системы является фундаментальной не только для поддержания массы тела и ожирения, но и для различных физиологических систем.
Схематическая диаграмма, иллюстрирующая влияние адипокинов на обе стороны уравнения энергетического баланса, потребление пищи и расход энергии. Большинство факторов, происходящих из жира, воздействуют на мозг, препятствуя приему пищи и увеличивая расход энергии, тем самым создавая схему, предназначенную для поддержания стабильного уровня ожирения.
Помимо снижения потребления пищи, лептин также увеличивает скорость расхода энергии (рис. 2). Действительно, влияние лептина на использование энергии может иметь большее отношение к регулированию массы тела, чем влияние на потребление пищи, которое носит временный характер (14). У грызунов, получавших лептин путем хронической интрацеребровентрикулярной (icv) инфузии, наблюдается снижение потребления пищи, которое достигает надира через 5 дней, после чего эффект насыщения уменьшается, и потребление пищи возвращается к норме в течение 10 дней лечения (14).Тем не менее, длительная внутривенная инфузия лептина не связана с восстановлением массы тела, что указывает на устойчивое увеличение расхода энергии (14). Одним из способов, с помощью которого лептин увеличивает расход энергии, является термогенез в бурой жировой ткани (БЖТ) грызунов. Лептин действует в головном мозге, усиливая симпатическую активацию коричневых адипоцитов (15) и обращая вспять снижение экспрессии мРНК разобщающего белка 1 (UCP1), которое наблюдается либо натощак (16), либо в период лактации (17). Это приводит к усилению термогенеза.Однако до недавнего времени было неизвестно, имеет ли влияние лептин на термогенез отношение к видам, не являющимся грызунами, со сравнительно низкими уровнями BAT и UCP1. У грызунов имеются ограниченные отложения бурого жира в межлопаточной области, чего нет у более крупных млекопитающих, таких как люди и овцы, у которых бурые адипоциты рассеяны по всей белой жировой ткани, а уровни UCP1 в зрелом возрасте низкие (18, 19). Недавно мы продемонстрировали, что центральное введение лептина заметно усиливает постпрандиальный термогенез как в диффузных жировых отложениях (забрюшинном и ягодичном жире), так и в мышечной ткани у овец (20), тем самым идентифицируя новые участки, через которые лептин оказывает свое влияние на расход энергии.Учитывая высокую долю мышц в организме, примерно 30–40%, энергия, расходуемая этой тканью, вероятно, превосходит энергию жировой. Поскольку это представляет собой недавно обнаруженный канал, посредством которого может происходить термогенез, средства, с помощью которых лептин воздействует на мозг, регулируя скорость, с которой мышечная ткань расходует энергию, могут открыть новое направление исследований того, как можно использовать биологию лептина для контроля этого процесса. часть гомеостатического уравнения.
Лептин-активируемые пути в головном мозге
Действие лептинапо регулированию потребления пищи и расхода энергии в основном связано с гипоталамусом.У крыс периферическая инъекция лептина увеличивает количество Fos-иммунореактивных нейронов в дугообразном ядре (ARC), вентромедиальном гипоталамусе (VMH), дорсомедиальном гипоталамусе (DMH), паравентрикулярном ядре (PVN), ретрохиазматическом ядре (RCh) и вентральном преммаммиллярном ядре. (ПМВ) (21) (рис. 3). Активация областей мозга лептином частично связана с действием на нейроны внутри ARC, которые существуют за пределами гематоэнцефалического барьера (22). В дополнение к этому был продемонстрирован активный транспорт лептина через гематоэнцефалический барьер (23, 24).
Распределение активированных нейронов в гипоталамусе после лечения лептином (фиолетовые кружки), адипонектином (синие кружки) и резистином (красные кружки). Введение лептина активирует нейроны в ряде областей гипоталамуса, включая дугообразное ядро (ARC), вентромедиальный гипоталамус (VMH), дорсомедиальный гипоталамус (DMH) и паравентрикулярное ядро (PVN). Введение как резистина, так и адипонектина вызывает дискретные профили активации: было показано, что резистин индуцирует Fos-иммунореактивность только в клетках ARC, а адипонектин индуцирует Fos-иммунореактивность в клетках PVN и увеличивает фосфорилирование AMP-активируемой протеинкиназы (AMPK) в клетки АРК.Хотя латеральная область гипоталамуса (LHA) участвует в регуляции питания, эта область, по-видимому, не является местом прямого действия веществ, выделяемых жировой тканью. 3V, третий желудочек.
Внутри ARC лептин оказывает действие на нейроны, содержащие орексигенные пептиды нейропептид Y (NPY) и белок, родственный агути (AgRP), а также на нейроны, содержащие пептиды насыщения. Из этих пептидов насыщения наиболее хорошо известны меланокортины, которые являются посттрансляционными продуктами предшественника проопиомеланокортина (РОМС).Как орексигенные, так и анорексигенные пептиды транслируют сигнал лептина, оказывая двойное влияние на гомеостатические системы, а также на нейроэндокринные системы в гипоталамусе. Одна из гипотез состоит в том, что эти конкретные клетки ARC являются нейронами «первого порядка», которые передают информацию в другие центры мозга (25). Специфическая делеция гена, который кодирует лептиновый рецептор в нейронах NPY/AgRP или POMC, приводит к накоплению жировой ткани и увеличению массы тела (26, 27). Иммуногистохимические и электрофизиологические исследования показали, что клетки ARC, которые реагируют на лептин, высоко интегрированы в гипоталамическую схему, регулирующую пищевое поведение (28-31).Кроме того, клетки ARC проявляют «резистентность к лептину» при ожирении, что является дополнительным доказательством их ключевой роли в передаче сигналов лептина в ЦНС (см. ниже). Тем не менее, представление о том, что эти клетки являются единственным проводником действия лептина, остается спорным, поскольку другие клетки мозга активируются при воздействии лептина.
В то время как исследования в основном были сосредоточены на действиях лептина на клетки ARC, это только один из вовлеченных компонентов архитектуры гипоталамуса.Из областей, которые активируются после лечения лептином, VMH, по-видимому, является неотъемлемой частью эффектов лептина на энергетический баланс (32), а стероидогенный фактор SF-1, по-видимому, является критическим фактором в передаче сигналов на этом уровне (33). Связывание радиоактивного лептина снижено в различных областях мозга животных, предрасположенных к ожирению, вызванному диетой, по сравнению с животными, устойчивыми к диете, включая ARC, VMH и DMH (34), что указывает на то, что эти области действуют согласованно, определяя чувствительность к лептину.Напротив, мало что известно о прямом действии лептина в PVN или латеральной области гипоталамуса (LHA), где большинство исследований сосредоточено на действии лептина, опосредованном косвенно через меланокортины или NPY (28, 35, 36). Было показано, что у овец и грызунов PVN и LHA содержат длинную форму рецептора лептина (ObRb), хотя уровни считаются низкими или умеренными, соответственно, по сравнению с другими ядрами гипоталамуса (37, 38). Таким образом, PVN и LHA, по-видимому, не принимают значительного участия в опосредовании прямых действий лептина, но ARC, VMH и DMH явно составляют нейронную сеть, которая опосредует энергетический баланс и являются основными местами действия лептина.
Резистентность к лептину и ожирение человека
Первоначальное открытие лептина ознаменовало новую эру в гонке за разработку терапевтического агента, предотвращающего развитие ожирения или обращающего его вспять. Фармацевтическая промышленность отреагировала оценкой использования лептина в качестве средства против ожирения, но результаты оказались неутешительными из-за отсутствия эффективности при состояниях, устойчивых к лептину. Уровни циркулирующего лептина коррелируют с ожирением (39, 40) с очевидным нарушением модели липостата, поскольку у людей с ожирением нет повышенного уровня сытости.Ослабленная реакция на лептин при ожирении вызвана снижением транспорта лептина через гематоэнцефалический барьер (лептиновая недостаточность), а также снижением способности лептина инициировать клеточную активацию в головном мозге (лептинорезистентность). Передача сигналов лептином включает активацию тирозинкиназы, янус-киназы 2 (Jak2) и привлечение преобразователя сигнала и активатора транскрипции 3 (STAT3) (рис. 4). Кроме того, действие лептина было связано с сигнальным каскадом митоген-активируемой протеинкиназы (MAPK) и киназы, регулируемой внеклеточными сигналами (ERK), а также с сигнальными путями субстрата рецептора инсулина/фосфатидилинозитол-3-киназы (IRS/PI3K) (41, 42). ).Внутренняя активация рецептора контролируется ингибитором передачи сигналов, супрессором передачи сигналов цитокинов 3 (SOCS3) (42, 43).
Каскад передачи сигнала активируется после того, как лептин связывается с подтипом длинной формы рецептора лептина (ObRb). Связывание с лептином активирует Янус-киназу 2 (Jak2), что приводит к аутофосфорилированию, а также фосфорилированию (P) по тирозиновым остаткам 985 и 1138 ObRb. Активация Jak2 задействует сигнальный преобразователь и активатор транскрипции 3 (STAT3), а также путь субстрата рецептора инсулина/фосфатидилинозитол-3-киназы (IRS/PI3K).Фосфорилирование тирозина 985 задействует сигнальный путь митоген-активируемой протеинкиназы/киназы, регулируемой внеклеточным сигналом (MAPK/ERK). Таким образом, лептин активирует многомерные сигнальные каскады внутри клетки, оказывая влияние на энергетический баланс и нейроэндокринные функции. Активация сигнала лептина контролируется белками-супрессорами передачи сигналов цитокинов 3 (SOCS3), которые способны ингибировать каскад путем связывания либо с Jak2, либо с фрагментом тирозина 985.
Различные исследования продемонстрировали важность SOCS3 в определении степени чувствительности к лептину (44-46).Клетки гипоталамуса проявляют различную степень чувствительности к лептину, и нейроны ARC кажутся особенно чувствительными в этом отношении. Специфическое увеличение экспрессии SOCS3 наблюдается в нейронах ARC у мышей с ожирением, вызванным диетой, и это может быть основной причиной резистентности к лептину (47). Соответственно, у мышей, получавших диету с высоким содержанием жиров, клетки ARC демонстрируют ослабленный ответ на обработку периферическим лептином. У тучных грызунов субклеточные ответы на лечение лептином, включая индукцию c-Fos, фосфорилирование STAT3 и фосфорилирование MAPK, притупляются (48).Кроме того, после инъекции лептина концентрации дезацетил-меланоцитстимулирующего гормона (αMSH) ниже у мышей, получавших диету с высоким содержанием жиров (48), что свидетельствует о том, что передача сигналов лептина нарушена в ARC у животных, страдающих ожирением из-за диеты. Эта неэффективность лептина способствует развитию ожирения и значительно усугубляет состояние ожирения.
Помимо субклеточных дефектов в клетках ARC при ожирении также происходит изменение скорости поступления лептина в ЦНС.Лептин проникает в мозг посредством активного транспорта, который включает короткую форму рецептора лептина (ObRa) в сосудистом сплетении. Другой важной детерминантой транспорта лептина через стенки кровеносных сосудов является уровень изоформы ObRe, которая циркулирует в крови и действует как связывающий белок и, таким образом, определяет уровни биоактивного лептина, доступного для транспорта (49). Исследования на грызунах показали, что кормление животных пищей с высоким содержанием жиров снижает уровни ObRa в гипоталамусе (23, 50) и, в соответствии с этим, транспорт лептина снижается у людей с ожирением (51).Таким образом, факторы, влияющие на поступление лептина в мозг (ObRa и ObRe), также являются важными детерминантами чувствительности к лептину.
Секс и половые стероиды
Из исследований на овцах (52) и крысах (53) ясно, что самки более чувствительны к эффекту лептина, подавляющему аппетит, чем самцы, что поднимает вопрос о важности половых стероидов. Эстроген усиливает реакцию на лептин, усиливая эффект сытости (54), а также увеличивает транспорт лептина в мозг (55).Напротив, очень мало известно о влиянии тестостерона на чувствительность к лептину. Влияние пола и половых стероидов на способность лептина увеличивать расход энергии еще предстоит выяснить.
Адипонектин
Адипонектин вырабатывается исключительно зрелыми адипоцитами (56) и был назван «полезным адипокином». Уровни адипонектина снижаются при ожирении, особенно при висцеральном ожирении (57), что, как полагают, приводит к снижению чувствительности к инсулину и развитию резистентности к инсулину (58).Инсулинсенсибилизирующее действие адипонектина опосредовано прямым воздействием на периферические ткани (58).
Что касается центральных эффектов адипонектина, различные исследования на грызунах дали противоречивые данные. Действие адипонектина опосредуется через рецепторы адипонектина 1 и 2 (AdipoR1 и AdipoR2), оба из которых экспрессируются в гипоталамусе (59). Однако есть некоторые сомнения в отношении роли адипонектина в головном мозге, поскольку этот гормон не проникает через гематоэнцефалический барьер (60, 61).Тем не менее, области мозга, в которых отсутствует гематоэнцефалический барьер, такие как ARC (62) (рис. 3) и area postrema (63), реагируют на адипонектин, что указывает на то, что эти клетки могут участвовать в передаче сигнала адипонектина. в другие области мозга. Кроме того, центральное введение адипонектина индуцирует иммунореактивность Fos и увеличивает экспрессию фактора, высвобождающего кортикотропин, в PVN (64) (рис. 3). Таким образом, если транспорт через гематоэнцефалический барьер исключен, адипонектин может влиять на гипоталамические области мозга, связанные с регуляцией аппетита и энергетического гомеостаза.
Первоначальные исследования показали, что центральное введение адипонектина снижает массу тела (64). Интересно, что этот эффект в первую очередь является результатом увеличения расхода энергии с номинальным влиянием на потребление пищи. У мышей дикого типа и мышей ob/ob центральное введение адипонектина повышало уровни мРНК UCP1 в BAT и повышало внутреннюю температуру тела и потребление кислорода, не влияя на потребление пищи (64) (рис. 2). На сегодняшний день влияние адипонектина на энергетический баланс оказалось противоречивым: исследования показали либо отсутствие влияния на потребление пищи (64), либо снижение (65), либо увеличение (62) потребления пищи.Точно так же было показано, что адипонектин либо увеличивает (64), либо снижает (62) расход энергии. Эти несопоставимые результаты, однако, могут зависеть от места действия и от того, какой рецептор, AdipoR1 или AdipoR2, рекрутируется. Делеция гена AdipoR1 приводит к ожирению, вызванному снижением расхода энергии, в то время как делеция гена AdipoR2 приводит к увеличению расхода энергии и худощавому фенотипу (66), что свидетельствует о том, что AdipoR2, но не AdipoR1, участвует в ожирении. эффекты адипонектина.Напротив, исследование Kubota et al. (62) продемонстрировало, что адипонектин действует на AdipoR1 в ARC, повышая аппетит и снижая расход энергии, что связано с активностью AMP-активируемой протеинкиназы (AMPK). Ясно, что адипонектин является важным периферическим гормоном, имеющим отношение к определению уровней чувствительности к инсулину, но требуется дальнейшая работа, чтобы определить действие этого гормона в головном мозге.
Резистин
Ранние исследования на грызунах определили резистин как адипокин, продемонстрировав, что он синтезируется и секретируется жировой тканью (67).Вопреки этому первоначальному отчету, исследования на людях показали, что резистин на самом деле секретируется мононуклеарными лимфоцитами и стромальными клетками в жировой ткани, а не адипоцитами (68) (рис. 1), что отрицает его назначение адипокином. У крыс центральное введение резистина снижало потребление пищи, хотя и временно (в течение 90 минут) (69) (рис. 2), тогда как длительное лечение не имело эффекта (70). Несмотря на это, хроническая внутривенная инфузия резистина снижала массу тела и ожирение (70), что свидетельствует об увеличении расхода энергии.Генетические манипуляции с системой резистина дали противоречивые данные, при этом делеция гена не повлияла на массу тела/ожирение (71). Напротив, направленная трансгенная экспрессия доминантно-негативной формы резистина в жировой ткани увеличивала массу тела и ожирение у мышей, которых кормили либо чау-чау, либо диетой с высоким содержанием жиров (72). Этот фенотип ожирения не был связан с изменениями в потреблении пищи, потреблении кислорода или дыхательном коэффициенте, и поэтому эффекты могут быть связаны с изменениями в потреблении энергии (72).Центральное введение резистина увеличивает экспрессию белка Fos в клетках ARC (69) (рис. 3), но остается неизвестным, может ли циркулирующий резистин проникать через гематоэнцефалический барьер, вызывая такие эффекты. Кроме того, отсутствие экспрессии резистина в адипоцитах человека указывает на проблематичный перевод данных от грызунов к другим видам.
Стероиды: эстрогены и глюкокортикоиды
Глюкокортикоиды
Повышенный уровень глюкокортикоидов связан с развитием ожирения, а болезнь Кушинга обычно связана с абдоминальным ожирением.Однако связь между уровнями кортизола в плазме и приемом пищи у здоровых людей остается неоднозначной. Большинство людей увеличивают потребление пищи в ответ на стресс и повышенный уровень глюкокортикоидов, но у небольшой подгруппы пациентов наблюдается снижение потребления пищи (73). У людей степень реакции на стресс была связана с вызванными кортизолом изменениями в питании, так что у тех, кто реагировал на высокий уровень кортизола, наблюдалось повышенное потребление калорий после стресса по сравнению с пациентами, характеризующимися низким ответом на кортизол (74).Увеличение потребления калорий в первую очередь является результатом увеличения потребления продуктов с высоким содержанием жира и сахара (73). Это наблюдение согласуется с работой на грызунах, где повышенный уровень глюкокортикоидов приводил к предпочтительному потреблению пищи, богатой жирами и сахаром, хотя в целом животные ели меньше и теряли вес по сравнению с контрольной группой, не подвергавшейся стрессу (75). Однако считается, что влияние глюкокортикоидов на прием пищи происходит в гипоталамусе, поскольку специфическая делеция гена глюкокортикоидного рецептора в ЦНС приводит к худощавому фенотипу у мышей (76).
Другие исследования на грызунах показывают, что жировая ткань способна к локализованной продукции глюкокортикоидов благодаря экспрессии ферментов 11β-гидроксистероиддегидрогеназы (11β-HSD). Соответственно, исследования на людях и овцах показали, что у людей с ожирением реакция кортизола на стресс выше, чем у их худощавых сверстников (77-79). Исследования на грызунах показывают, что локальная продукция кортикостерона адипоцитами является важной детерминантой ожирения и массы тела.У мышей инактивация продукции кортикостерона адипоцитами путем делеции гена, кодирующего 11β-HSD1 (80), или сверхэкспрессии гена 11β-HSD2 (81) предотвращает развитие вызванного диетой ожирения. Такие эффекты могут быть связаны с нарушением функции жировой ткани, а не с дисбалансом в головном мозге.
Эстрогены
Жировая ткань вырабатывает эстрогены за счет экспрессии ароматазы в адипоцитах, и это основное место биосинтеза эстрогена у женщин и мужчин в постменопаузе (82).Эстрогены играют важную роль в определении строения тела, как показано при овариэктомии, что приводит к увеличению ожирения (83). Другой проблемой может быть тип жира, который преобладает у женщин, поскольку у них больше подкожного жира по сравнению с мужчинами, у которых больше висцерального жира (84). Кроме того, активность ароматазы различается в зависимости от локализации жировой ткани и выше в ягодичных областях по сравнению с висцеральным жиром (82). После менопаузы и при снижении уровня эстрогена у женщин наблюдается более мужское распределение жировой ткани с более высоким висцеральным уровнем (84).
Эстрогены оказывают широкий спектр эффектов на обмен веществ и регуляцию веса в различных тканях, включая головной мозг. Что касается нейроэндокринной системы, эстрогены снижают потребление пищи и увеличивают расход энергии (83). У самок мышей и крыс дискретное подавление рецептора эстрогена α (ERα) в VMH вызывает гиперфагию и снижает физическую активность и термогенез, что приводит к увеличению ожирения (85). Помимо действия на VMH, эстрогены могут воспроизводить эффекты лептина на нейроны в ARC.Примером является то, что эстрогены увеличивают количество возбуждающих входов в нейроны POMC, тем самым повышая тонус меланокортина (31, 86). У женщин в пременопаузе производство эстрогенов яичниками, очевидно, затмевает производство эстрогенов из жировой ткани, тогда как последние могут быть более важными в регуляции массы тела у женщин и мужчин в постменопаузе.
Резюме и выводы
Жировая ткань больше не считается инертным хранилищем энергии, а считается эндокринным органом, способным синтезировать множество адипокинов, влияющих на различные физиологические системы, включая метаболические, репродуктивные и иммунные функции.Как правило, адипокины воздействуют на мозг, подавляя потребление пищи и увеличивая расход энергии, тем самым создавая цепь обратной связи, которая в конечном итоге определяет уровень ожирения. Лептин, адипонектин, резистин и стероидные эстрогены и глюкокортикоиды вырабатываются жиром и могут воздействовать на мозг, регулируя потребление пищи и/или расход энергии.
Роль пептидов желудочно-кишечного тракта и жировой ткани в детском ожирении и изменениях после потери веса в результате вмешательства в образ жизни | Образ жизни | JAMA Педиатрия
Детское ожирение представляет собой глобальную эпидемию и связано с повышенным риском гипертонии, сахарного диабета и ишемической болезни сердца, помимо психологических расстройств.Вмешательства, такие как бариатрическая хирургия, являются высокоинвазивными, а изменение образа жизни часто оказывается безуспешным из-за нарушения восприятия сытости. Открытые в последние годы новые сигнальные пептиды, которые продуцируются в периферических тканях, таких как кишечник, жировая ткань и поджелудочная железа, взаимодействуют с мозговыми центрами энергетического гомеостаза, такими как гипоталамус и задний мозг. В этом обзоре обсуждаются основные известные гормоны, происходящие из кишечника и жировой ткани, участвующие в регуляции потребления пищи и энергетического гомеостаза, а также их уровни в сыворотке крови при детском ожирении до и после потери веса, а также их связь с последствиями ожирения.Поскольку большинство изменений желудочно-кишечных гормонов и адипокинов нормализуются при потере веса, фармакологические вмешательства, основанные на этих гормонах, скорее всего, не решат эпидемию ожирения в детском возрасте. Тем не менее, лучшее понимание того, как масса тела и прием пищи регулируют гормоны кишечника и жировой ткани, поможет найти новые стратегии лечения ожирения и его последствий.
Исследования по регуляции энергетического гомеостаза у детей приобретают все большее значение, поскольку ожирение является наиболее важным фактором риска развития метаболического синдрома и сахарного диабета 2 типа (СД2) в молодости, а рост детского ожирения и детского СД2 почти статистически параллелен . 1 В 2006 г. распространенность ожирения среди детей в США достигла 17%, и, если нынешние тенденции сохранятся, к 2010 г. детское ожирение может достичь 20%. ось мозга, регулирующая энергетический баланс организма, или более подробно описываемая как ось кишечник-центральная и периферическая нервная система-добавочный орган (например, поджелудочная железа, печень). Кишечные гормоны (энтерокины) и сигнальные молекулы жировой ткани (адипокины) взаимодействуют с мозговыми центрами в сложных, перекрывающихся механизмах потребления и хранения энергии.Эти механизмы развились во время длительных периодов голода в эволюции человека, чтобы защитить вид от вымирания. Однако сегодняшний малоподвижный образ жизни превратил это эволюционное преимущество накопления энергии в виде жира в высокий риск сердечно-сосудистых заболеваний и смертности. Ситуация усложняется тем, что, хотя вес тела точно регулируется, длительный избыток питательных веществ может изменить заданные точки энергетического баланса тела, включая оси кишечник-мозг и жировая ткань-мозг. В случаях ожирения это, по-видимому, еще больше затрудняет снижение избыточного веса, поскольку активные механизмы защиты видов поддерживают повышенный уровень жира в организме.
Понимание изменений, происходящих в конкретных регуляторах гомеостаза — гормонах и пептидах — в зависимости от сроков и методов снижения веса у детей с избыточным весом, имеет основополагающее значение для понимания педиатрического ожирения. Мы исследовали эти гомеостатические регуляторы до и после снижения веса в ходе годичного вмешательства в образ жизни «Obeldicks». 3 ,4 Вкратце, эта программа основана на физических упражнениях (1 год), обучении правильному питанию и поведенческой терапии отдельно для детей и родителей (первые 3 месяца), а также индивидуальной психологической помощи ребенку и его семье ( 4-9 месяцев).Лечебная физкультура состоит из занятий спортом, обучения физическим упражнениям в повседневной жизни и сокращения времени, проводимого за просмотром телевизора. Курс питания основан на профилактической концепции «оптимизированной смешанной диеты», в которой снижены как жиры, так и сахара, 30% потребляемой энергии составляют жиры, 15% потребляемые белки и 55% потребляемые углеводы, включая 5% потребляемой энергии сахара. 4 Это вмешательство в образ жизни было эффективным для снижения избыточной массы тела в течение как минимум 3 лет после вмешательства и улучшения сердечно-сосудистых факторов риска, таких как дислипидемия, нарушение толерантности к глюкозе и гипертония. 3 ,4 Кроме того, толщина интима-медиа 5 как предиктор ранних сердечно-сосудистых изменений была снижена у детей, участвовавших в этом вмешательстве. Все эти данные доказали клиническую значимость достигнутого снижения массы тела.
В этой статье обсуждаются основные известные пептиды, происходящие из кишечника и жировой ткани, участвующие в регуляции потребления пищи и энергетического гомеостаза, включая изменения в некоторых из этих сигнальных молекул, наблюдаемые во время увеличения и потери веса у детей с ожирением, участвующих в мероприятиях по изменению образа жизни, и опишите подсказки, которые могут быть полезны как в краткосрочной, так и в долгосрочной перспективе при лечении детского ожирения.
Модуляторы чувства голода и насыщения с периферии (желудочно-кишечный тракт и жировая ткань)
Открытие в 1994 году гормона лептина, полученного из жировой ткани, прояснило важный механизм отрицательной обратной связи энергетического баланса и то, как информация о запасах энергии передается в центральную нервную систему.Этот и другие механизмы обратной связи энергетического метаболизма интенсивно изучались на моделях грызунов. Они демонстрируют, что пептиды, продуцируемые на периферии, такие как гормоны жировой ткани (лептин, резистин, адипонектин, висфатин, ретинол-связывающий белок 4) и ограничивающие аппетит гормоны желудочно-кишечного тракта (пептид тирозин-тирозин [PYY], глюкагоноподобный пептид 1 [GLP-1], оксинтомодулин, холецистокинин) и поджелудочной железы (инсулин, панкреатический полипептид [PP], амилин), а также опосредующий голод гормон грелин являются важными афферентными сигналами, которые связываются с рецепторами в гипоталамусе и заднем мозге. Фигура). 6 -9
Желудочно-кишечные пептиды
Грелин представляет собой пептид, содержащий 28 аминокислот, и был идентифицирован в 1999 году как лиганд для секреции рецептора, стимулирующего секрецию гормона роста 10 (таблица). Грелин вырабатывается в основном желудком и, в меньшей степени, двенадцатиперстной кишкой 32 и является единственным известным циркулирующим орексигеном.Эндогенные уровни грелина увеличиваются перед едой и снижаются после приема пищи, что указывает на его роль как в начале приема пищи, так и в увеличении веса. 7 ,33 ,34 Было высказано предположение, что как гиперфагия, так и потенциально дефицит гормона роста при синдроме Прадера-Вилли могут быть связаны с нарушением регуляции грелина, поскольку при этом заболевании наблюдаются высокие уровни циркулирующего грелина. 35 Менее ясно, почему уровни грелина в сыворотке снижаются при несиндромальном простом ожирении, что может быть связано с перекармливанием и следствием метаболических изменений, связанных с ожирением, таких как резистентность к инсулину. 12 ,13,36 -38
В недавних исследованиях были получены важные сведения о том, почему одни дети, а не другие, успешно поддерживают долгосрочную потерю веса. В частности, повышенный уровень грелина во время снижения веса считается компенсаторным механизмом, ответственным за неустойчивое снижение веса. 39 Krohn et al 11 показали, что повышение уровня грелина после потери веса у детей с ожирением коррелирует с повышением чувствительности к инсулину.В испанском исследовании детей с ожирением на диете с ограничением калорий уровень грелина значительно увеличился после 3 месяцев успешного снижения веса. 13 В ходе вмешательства Obeldicks, посвященного образу жизни, мы не обнаружили существенных изменений в уровне грелина у детей, добившихся существенного снижения веса. 12 Медленное снижение веса, не вызывающее немедленного компенсаторного увеличения уровня грелина, может помочь стабилизировать и поддерживать более низкий вес тела и предотвратить быстрое увеличение веса из-за увеличения уровня грелина.Это обнадеживающие результаты, поскольку грелин является единственным известным стимулятором аппетита. 7 ,33 ,34
Обестатин представляет собой недавно идентифицированный пептид, полученный из того же гена (препрогрелин), что и грелин, и оказывает противоположное влияние на весовой статус, подавляя прием пищи и моторику желудочно-кишечного тракта. Предполагается, что обестатин противодействует действию грелина на гомеостаз и функцию желудочно-кишечного тракта. 40 Поскольку обестатин и грелин происходят из одного и того же гена, 40 одно исследование предположило, что возможной причиной ожирения является дисбаланс циркулирующих уровней обестатина и грелина. 41 Отношение грелина к обестатину до приема пищи было повышено у пациентов с ожирением по сравнению с контрольной группой, что позволяет предположить, что более высокое соотношение может быть связано с этиологией и патофизиологией ожирения; однако результаты других исследований не являются окончательными. 42 -44
Краткосрочное исследование по снижению веса в летнем лагере с участием 46 детей с ожирением продемонстрировало повышение уровней грелина и обестатина, а также отношения грелина к обестатину после снижения веса. 42 У Obeldicks уровни обестатина значительно увеличились после снижения веса, в то время как уровни грелина значительно не изменились, что может быть важно для стабилизации более низкой массы тела и предотвращения повторного увеличения массы тела. 38
Пептид YY представляет собой пептид из 36 аминокислот, первоначально выделенный и охарактеризованный в 1980 г. 45 (таблица). Существует 2 эндогенные формы, PYY 1-36 и PYY 3-36 , широко распространенные у людей. Пептид YY представляет собой гормон кишечного происхождения, высвобождаемый после приема пищи L-клетками нижнего отдела кишечника, который ингибирует секрецию желудочного сока и моторику через нервные пути. 46 -50 Пептид YY принадлежит к семейству пептидов, которое включает нейропептиды Y и PP, которые опосредуют свои эффекты через рецепторы нейропептидов Y2, Y4, Y5 и Y6, связанные с G-белком, и обнаруживают различное распределение и функции в тканях. 51 PYY 1-36 связывается со всеми известными подтипами рецепторов Y, тогда как PYY 3-36 проявляет сродство к подтипам рецепторов Y1 и Y5 и высокое сродство к подтипу ингибиторного рецептора Y2. PYY 3-36 , связываясь с рецептором подтипа Y2, ингибирует орексигенный нейропептид Y в гипоталамусе, вызывая кратковременное торможение приема пищи, особенно пищи с высоким содержанием жиров. 8 ,52 -54 Исследования на грызунах выявили области действия гипоталамуса, блуждающего нерва и ствола мозга. 55 Функциональная магнитно-резонансная томография людей с нормальным весом, которым вводили PYY 3-36 в циркулирующих концентрациях, сходных с наблюдаемыми после приема пищи, показала модулированную активность нейронов в областях гипоталамуса, ствола и среднего мозга, участвующих в обработке пищевых вознаграждений. 56 Это предполагает, что PYY 3-36 влияет на питание, воздействуя на гомеостатические и гедонистические цепи мозга. Пептид YY также может влиять на расход энергии. 57 Среди других исследований, подтверждающих этот эффект, 58 ,59 периферическая инфузия PYY 3-36 у людей показала повышенный расход энергии и скорость окисления жиров. 60
У детей с ожирением низкий уровень анорексигенного гормона PYY. После эффективной потери веса у Обельдикса уровни PYY значительно увеличились, достигнув уровней, сравнимых с людьми с нормальным весом. 14 После достижения эффективного снижения веса аноректический эффект PYY может помочь стабилизировать вес и тем самым предотвратить последующее увеличение веса у пациентов, у которых уровни PYY увеличились до нормального уровня.
Глюкагоноподобный пептид 1 представляет собой гормон кишечника, синтезируемый энтероэндокринными L-клетками тонкой и толстой кишки и секретируемый в 2 основных молекулярных формах: амид GLP-1 7-36 и GLP-1 7-37 , обладающий равной активностью. биологическая активность (таблица).Глюкагоноподобный пептид 1 связывается с рецепторами в ключевых участках, связанных с аппетитом, в гипоталамусе (например, в аркуатных и дорсомедиальных ядрах) и в стволе мозга (в частности, в ядрах солитарного тракта). 15 ,61 ,62 Это самый сильный из известных на сегодняшний день инсулин-стимулирующих гормонов, он подавляет секрецию глюкагона, опорожнение желудка и секрецию кислоты. У детей с ожирением ослабленный ответ ГПП-1 может способствовать нарушению инсулинового ответа, что приводит к СД2. 61 -63 Глюкагоноподобный пептид 1 также может снижать потребление энергии и повышать чувство сытости, вероятно, за счет вышеупомянутой задержки опорожнения желудка и специфических рецепторов ГПП-1 в центральной нервной системе. Его роль в детском ожирении плохо изучена, и в литературе сообщается о противоречивых изменениях уровня после потери веса. 15 -18,61 -68
детей с ожирением, участвовавших в Obeldicks, показали значительное снижение уровня GLP-1.В начале исследования уровни GLP-1 у детей с ожирением и худых детей существенно не различались. Уровни глюкозы оставались постоянными, а снижение уровней GLP-1 в значительной степени коррелировало со снижением уровней инсулина и показателями индекса резистентности к инсулину. 16
Оксинтомодулин представляет собой пептид из 37 аминокислот, который, как и GLP-1, является продуктом гена препроглюкагона (таблица). Он высвобождается в систему кровообращения после приема пищи и при центральном или периферическом введении на моделях грызунов или периферически у людей снижает потребление пищи. 19 Оксинтомодулин столь же эффективен, как и GLP-1, в подавлении приема пищи, хотя считается, что он делает это другим путем.
Холецистокинин был первым кишечным гормоном, участвующим в контроле аппетита за счет уменьшения потребления пищи. 21 Холецистокинин является сигналом прекращения приема пищи, высвобождаемым постпрандиально из желудочно-кишечного тракта (в основном из верхних отделов тонкой кишки), уменьшая как объем пищи, так и ее продолжительность. После еды уровень холецистокинина остается повышенным до 5 часов и стимулирует сокращение желчного пузыря, высвобождение ферментов поджелудочной железы и перистальтику кишечника, что, в свою очередь, влияет на опорожнение желудка.Рецептор алиментарного холецистокинина, CCK A , присутствует на блуждающем нерве, кишечных нейронах, стволе мозга и дорсомедиальном ядре гипоталамуса. Холецистокинин, вероятно, опосредует свое влияние на регуляцию аппетита, преодолевая гематоэнцефалический барьер, где он действует на рецепторы в дорсомедиальном ядре гипоталамуса, снижая уровни нейропептида Y, мощного стимулирующего аппетит пептида. Однако исследования у детей пока отсутствуют.
Гормоны и пептиды поджелудочной железы
Инсулин играет чрезвычайно важную роль в энергетическом гомеостазе (таблица).Рецепторы инсулина экспрессируются в разных ядрах гипоталамуса. После прохождения гематоэнцефалического барьера инсулин оказывает подавляющее действие на аппетит. На грызунах было доказано, что инсулин, введенный интрацеребровентрикулярно, ингибирует потребление пищи за счет активации пути субстрата инсулинового рецептора – фосфатидилинозитол-3-киназы (IRS-PI3K) в вентромедиальных нейронах гипоталамуса. 69 ,70 Многочисленные модели нокаута инсулина показывают, что снижение центрального эффекта инсулина приводит к фенотипу ожирения.Результаты самых последних исследований показывают, что центральная резистентность к инсулину может быть вызвана воспалением гипоталамуса из-за избытка питательных веществ, 71 вызывая снижение передачи сигналов IRS-PI3K, что, таким образом, способствует повышению аппетита и поддержанию повышенного веса тела. 72 При детском ожирении повышенный уровень инсулина в крови указывает на периферическую и центральную резистентность к инсулину. Успешное снижение избыточной массы тела приводит к уменьшению гиперинсулинемии и улучшению чувствительности к инсулину. 22 ,23
Панкреатический полипептид представляет собой пептид из 36 аминокислот, продуцируемый под вагусным контролем периферическими клетками эндокринных островков поджелудочной железы и, в меньшей степени, в экзокринной части поджелудочной железы, толстой и прямой кишках в ответ на прием пищи и индуцированную инсулином гипогликемию (табл. ). 47 ,73 Введение фармакологических доз ПП человеку снижает потребление пищи на 24 часа 74 и угнетает скорость опорожнения желудка, экзокринную секрецию поджелудочной железы и моторику желчного пузыря. 75
Изменения уровней РР и их связь с анорексигенными гормонами инсулином и лептином изучались в Obeldicks. 25 В начале исследования у лиц с ожирением концентрация PP была ниже по сравнению с контрольной группой с худощавым телосложением. 25 После изменения образа жизни концентрации PP значительно увеличились и имели тенденцию к нормализации у детей, которые добились существенной потери веса, по сравнению с детьми, которые не потеряли вес. 25 Тем не менее, изменения концентраций PP существенно не коррелировали с изменениями концентраций инсулина и лептина. 25
Амилин представляет собой полипептид, состоящий из 37 аминокислот, который синтезируется и высвобождается вместе с инсулином бета-клетками поджелудочной железы в ответ на питание и способствует контролю гликемии и аппетита (таблица). 26 ,76 Амилин — это пептид, вызывающий чувство сытости, вызывающий уменьшение размера порции и торможение опорожнения желудка. Кроме того, отложения амилоида, обнаруженные в панкреатических островках при СД2, играют центральную роль в развитии недостаточности бета-клеток при СД2. 27
У детей с ожирением уровень амилина был значительно выше по сравнению с контрольной группой. 26 Значительная потеря веса у Obeldicks привела к значительному снижению концентрации амилина. 26 Кроме того, повышение уровня амилина в детском возрасте было связано с гиперсекрецией инсулина. 26
Гормоны, секретируемые жировой тканью, и цитокины
Жировая ткань играет важную роль не только в хранении энергии, но также очень активно вырабатывает гормоны и цитокины (адипокины), которые играют роль в патогенезе заболеваний, связанных с ожирением.Провоспалительные адипокины, продуцируемые в жировой ткани, представляют собой лептин, резистин, ингибитор активатора плазминогена-1, интерлейкин-6 и фактор некроза опухоли α. Несколько исследований продемонстрировали более высокие уровни воспалительных маркеров у детей с ожирением, чем у детей с нормальным весом 77 -81 , и некоторые из них могут быть нормализованы изменением образа жизни. 77 Адипокины являются возможной связью между резистентностью к инсулину и ожирением. Производство интерлейкина 6 приводит к увеличению С-реактивного белка, который представляет собой фактор риска сердечно-сосудистых заболеваний. 82
Лептин представляет собой пептид из 167 аминокислот, образующийся в жировой ткани и передающий информацию о энергоснабжении и периферическом хранении энергии в жировой ткани в головной мозг, особенно в гипоталамус (таблица). Производство лептина стимулируется инсулином и глюкокортикоидами. Рецептор лептина представляет собой рецептор с одним трансмембранным доменом из семейства рецепторов цитокинов, который активирует янускиназы 2 в пути передачи сигнала и, подобно инсулину, активирует IRS-PI3K в нейронах вентромедиального гипоталамуса, тем самым индуцируя центральное подавление аппетита и стимулируя расход энергии путем повышение центрального симпатического тонуса.Высокая плотность лептиновых рецепторов обнаружена в дугообразном ядре гипоталамуса и вентромедиальном ядре гипоталамуса. 20 ,83 Лептин имеет растворимый рецептор, который представляет собой основной сайт связывания лептина в крови и может быть отрицательным регулятором свободного лептина. 84
Гомеостатический эффект лептинаявляется анорексигенным, вызывая чувство сытости и прекращая прием пищи. Уровни лептина, циркулирующего в крови, коррелируют с количеством массы жировой ткани.Хотя может показаться, что повышенный уровень лептина у людей с избыточным весом приведет к подавлению аппетита и снижению потребления пищи, этого не происходит, поскольку увеличение жировой массы также приводит к резистентности к лептину и снижению передачи сигналов лептина в головном мозге. 72 Это сопротивление затем может привести к неэффективному подавлению аппетита и изменению заданной точки гомеостаза энергии, что приводит к защите более высокого уровня жира в организме. Дефицит лептина у людей с ожирением встречается очень редко и вызывается гомозиготной мутацией гена ob .В литературе сообщалось лишь о нескольких пациентах и их семьях. У этих людей уровни лептина низкие, и было доказано, что терапия лептином является причинным лечением ожирения. 24 Однако у большинства людей с ожирением уровни лептина в сыворотке повышаются из-за увеличения жировой массы и резистентности к лептину, и уровни лептина падают после успешного снижения веса, 28 ,29 при снижении концентрации растворимых рецепторов в сыворотке у детей с ожирением увеличиваются после похудения. 29
Адипонектин синтезируется и секретируется исключительно жировой тканью (таблица). Он оказывает противовоспалительное действие и эффект сдерживания аппетита, а также противостоит резистентности к инсулину, тем самым предлагая защитные механизмы против развития как СД2, так и сердечно-сосудистых заболеваний. 82 Адипонектин также влияет на термогенез, а рецепторы адипонектина экспрессируются в различных периферических тканях, включая мышцы, печень и гипоталамус. 85 ,86 Центральные механизмы регулирования аппетита адипонектином еще полностью не изучены.Интересно, что уровни адипонектина снижаются при ожирении и СД2. 30 ,31 Адипонектин обладает противовоспалительными свойствами и отрицательно коррелирует с уровнями цитокинов и резистентностью к инсулину. Низкий уровень адипонектина может играть роль в развитии метаболического синдрома и сердечно-сосудистых заболеваний. 30 ,31
В Obeldicks уровни адипонектина значительно увеличились, а резистентность к инсулину значительно улучшилась параллельно у детей, которые потеряли вес. 30 В еще более недавнем исследовании Jeffery et al. 31 также изучали отрицательную корреляцию уровней адипонектина у детей с ожирением и его роль в опосредовании сердечно-сосудистых заболеваний у детей. Они обнаружили четкую связь между адипонектином и особенностями метаболического синдрома.
Резистин — еще один гормон, секретируемый жировой тканью и участвующий в чувствительности к инсулину. Было показано, что он модулирует как толерантность к глюкозе, так и метаболизм липидов in vivo и in vitro. 87 Хотя некоторые данные противоречивы, кажется, что инсулин может ингибировать секрецию резистина; однако недавние модели на животных показывают, что инсулин не является основным регулятором резистина. 88
Два продольных анализа взрослых показали, что изменения резистина в сыворотке положительно коррелируют с изменениями жировой массы или потерей веса, 89 ,90 , однако другие исследования взрослых не выявили корреляций. 91 -93 Уровни резистина в сыворотке изучались у детей с ожирением после 1 года снижения веса. 94 У девочек наблюдались более высокие концентрации резистина, чем у мальчиков, но не было различий в уровнях резистина между худыми и тучными детьми, а также не было значительных изменений после потери веса. 94
Ретинол-связывающий белок 4 (RBP4) представляет собой недавно идентифицированный адипокин, секретируемый в основном жировой тканью с некоторой секрецией печенью. Это предполагаемая связь между ожирением и резистентностью к инсулину. 95 У нормальных мышей повышенный уровень RBP4 вызывал резистентность к инсулину в мышцах и усиливал глюконеогенез в печени, тогда как мыши с нокаутом гена RBP4 имели повышенную чувствительность к инсулину. 95
У взрослых 96 ,97 и детей 79 ,98 ,99 с ожирением и СД2 повышенные уровни RBP4 коррелируют с резистентностью к инсулину. Два недавних исследования показали, что изменение образа жизни почти полностью изменило повышенный уровень RBP4 у детей с ожирением. 79 ,99 В нашем вмешательстве в образ жизни 99 детей со значительной потерей веса продемонстрировали значительное снижение уровней RBP4 параллельно с кровяным давлением и уровнями триглицеридов и инсулина.Эти данные предполагают связь между RBP4, ожирением и маркерами метаболического синдрома.
Висфатин/NAMPT представляет собой недавно идентифицированный адипоцитокин висцерального жира, который был обнаружен в более высоких концентрациях у детей с ожирением, чем у детей без ожирения. 100 Висфатин, первоначально названный фактором увеличения колоний пре-В-клеток, происходит из того же гена, который кодирует никотинамид-5-фосфорибозил-1-пирофосфаттрансферазу (NAMPT), фермент, важный для никотинамидадениндинуклеотида млекопитающих (NAD + ) биосинтез. 101 Взаимосвязь между висфатином/NAMPT и параметрами метаболизма глюкозы и резистентностью к инсулину неясна из-за противоречивых данных 102 -107 , которые потенциально могут быть связаны с различиями в специфичности иммуноанализа. 108 Последние данные указывают на то, что гаплодефицит и химическое ингибирование NAMPT могут вызывать дефекты в биосинтезе NAD + . 101 Изменения уровня НАД могут изменить активность важных ферментов в метаболических путях, таких как гликолиз или окисление жирных кислот в бета-клетках поджелудочной железы. 101 ,109
Некоторые примеры фармакологических подходов
После того, как был обнаружен подавляющий аппетит эффект лептина, появилась надежда, что введение лептина может быть лекарством от ожирения. Попытки были разочаровывающими, в основном потому, что простое ожирение приводит к резистентности к лептину.Только у очень редких пациентов с врожденным дефицитом лептина лечение лептином приводит к сильному долгосрочному снижению избыточной массы тела. 24 Некоторые кишечные гормоны, такие как GLP-1 и CCK, имеют очень короткий период полураспада в кровообращении, составляющий несколько минут, из-за быстрой деградации, что ограничивает их использование в качестве препаратов против ожирения. Однако эксендин-4 является агонистом рецептора ГПП-1 длительного действия, который недавно был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для лечения СД2 и также связан с потерей веса. 110 Предварительные данные на крысиных моделях позволяют предположить, что оксинтомодулин может быть полезен при лечении ожирения. 111 Одно такое исследование на грызунах показало, что оксинтомодулин оказывает аноректический эффект через рецептор GLP-1, поскольку он был неэффективен у мышей с нокаутом рецептора GLP-1. 112 В недавнем 4-дневном исследовании на людях оксинтомодулин не только способствовал снижению веса, но и увеличивал расход энергии более чем на 25%. 113
ГПП-1 и аналог амилина прамлинтид, по-видимому, снижают массу тела у пациентов с СД2, что является важной вторичной целью лечения этих пациентов. 114 Недавно были проведены фармацевтические исследования для изучения терапевтического потенциала амилина в лечении как ожирения, так и диабета. 114 -116 Традиционная фармакотерапия для лечения СД2 часто усугубляет ожирение, сводя на нет любые преимущества улучшения гликемического контроля, а также соблюдение пациентами режима лечения. Добавление лептина после предварительной обработки амилином вызывало еще большую потерю веса по сравнению с обоими условиями монотерапии, предоставляя как доклинические, так и клинические доказательства того, что комплексные нейрогормональные подходы к фармакотерапии ожирения могут способствовать более успешной потере веса за счет имитации естественного синергизма. 116 Сообщалось, что введение PYY людям с ожирением приводит к кратковременному снижению потребления пищи. 117 Несколько методов лечения ожирения на основе гормонов кишечника находятся на стадии клинических испытаний 2 и 3, и многие другие находятся в стадии разработки. 115 Эти кишечные пептиды необходимо вводить инъекционно. Перорально активные ингибиторы расщепляющего инкретин фермента дипептидилпептидазы-IV предлагают альтернативу. 118
Вероятно, самый важный вывод, который можно сделать из представленных здесь данных, заключается в том, что патологии, влияющие на энергетический гомеостаз у детей с ожирением, по меньшей мере в такой же степени связаны с эндокринными явлениями, которые участвуют в коммуникации между периферическими тканями (кишечник, жировая ткань) и мозг, поскольку они связаны с генетикой, социокультурными факторами и факторами образа жизни.Это означает, что решения этой серьезной, постоянно растущей угрозы как продолжительности жизни, так и качеству жизни наших детей также основаны на лучшем понимании эндокринного статуса ребенка с ожирением. Большинство изменений кишечных гормонов и адипокинов, наблюдаемых у детей с ожирением, обратимы после потери веса, и поэтому фармакологические вмешательства, основанные на этих гормонах, скорее всего, не решат эпидемию ожирения в детском возрасте. Однако успешные решения во многом зависят от продолжительности и тщательности вмешательств; не существует простых и быстрых фармацевтических решений для устойчивого снижения веса.Понимание того, как масса тела и прием пищи регулируют гормоны кишечника и жировой ткани, поможет найти лучшие ответы, которые могут эффективно бороться как с детским ожирением, так и с множеством патологий, которые оно вызывает или усугубляет.
Для переписки: Кристиан Л. Рот, доктор медицинских наук, отделение эндокринологии, Сиэтлский научно-исследовательский институт детской больницы, 1900 Девятая авеню, Сиэтл, Вашингтон, (christian.roth@seattlechildrens.орг).
Принято к публикации: 6 октября 2009 г.
Вклад авторов: Концепция и дизайн исследования : Roth. Анализ и интерпретация данных : Рот и Райнер. Составление рукописи : Roth. Критический пересмотр рукописи на предмет важного интеллектуального содержания : Рот и Райнер. Статистический анализ : Roth. Получено финансирование : Reinehr. Административная, техническая и материальная поддержка : Roth. Надзор за исследованием : Рот и Райнер.
Раскрытие финансовой информации: Не сообщалось.
1.Фагот-Кампанья А.Петтит DJEngelgau мм и другие. Диабет 2 типа среди североамериканских детей и подростков: эпидемиологический обзор и перспективы общественного здравоохранения. J Pediatr 2000;136 (5) 664- 672PubMedGoogle ScholarCrossref 2.Koplan JPed Прогресс в предотвращении детского ожирения: как нам соответствовать? Вашингтон, округ Колумбия, издательство национальных академий, 2006 г .;
3.Райнер Тэммесфельд М.Керстинг Мде Соуза ГТошке AM Четырехлетнее наблюдение за детьми и подростками, участвующими в программе вмешательства при ожирении. Int J Obes (Лондон) 2007;31 (7) 1074– 1077PubMedGoogle ScholarCrossref 4.Reinehr Тде Соуза ГТошке А.М.Андлер W Долгосрочное наблюдение за факторами риска сердечно-сосудистых заболеваний у детей после лечения ожирения. Am J Clin Nutr 2006;84 (3) 490– 496PubMedGoogle Scholar5.Вунш Рде Соуза ГТошке AMReinehr T Толщина интима-медиа у детей с ожирением до и после потери веса. Педиатрия 2006;118 (6) 2334– 2340PubMedGoogle ScholarCrossref 6.Zhang YProenca RMaffei Мбароне Леопольд Л.Фридман JM Позиционное клонирование гена ожирения мыши и его человеческого гомолога. Природа 1994;372 (6505) 425- 432PubMedGoogle ScholarCrossref 8.Баттерхэм Р.Л.Коули MASмаленький СиДжей и другие. Кишечный гормон PYY-(3-36) физиологически ингибирует потребление пищи. Природа 2002;418 (6898) 650– 654PubMedGoogle ScholarCrossref 9.Schwartz М.В.Сили Р. Дж. Кэмпфилд LABurn ПБаскин DG Идентификация мишеней действия лептина в гипоталамусе крыс. J Clin Invest 1996; 98 (5) 1101– 1106PubMedGoogle ScholarCrossref 10. Кодзима МХосода HDдата YНаказато MMatsuo Гонконг K Грелин представляет собой ацилированный пептид, высвобождающий гормон роста, из желудка. Природа 1999;402 (6762) 656– 660PubMedGoogle ScholarCrossref 11.Krohn КБочан CОтто Б и другие. Регуляция грелина связана с предполагаемой чувствительностью к инсулину у детей с ожирением. Int J Obes (Лондон) 2006;30 (10) 1482– 1487PubMedGoogle ScholarCrossref 12.Reinehr TRoth CLAlexy УКерстинг MKiess Вандлер Уровни W грелина до и после снижения избыточного веса благодаря диете с низким содержанием жиров и высоким содержанием углеводов у детей и подростков с ожирением. Международный Дж. Обес (Лондон) 2005; 29 (4) 362- 368PubMedGoogle ScholarCrossref 13.Сориано-Гильен ЛБарриос VCampos-Barros Аргенте Уровни J грелина при ожирении и нервной анорексии: эффект снижения веса или выздоровления. J Pediatr 2004;144 (1) 36- 42PubMedGoogle ScholarCrossref 14.Roth CLEnriori PJHarz КВульфле Джей Коули MRReinehr Т-пептид YY является регулятором энергетического гомеостаза у детей с ожирением до и после потери веса. J Clin Endocrinol Metab 2005; 90 (12) 6386– 6391PubMedGoogle ScholarCrossref 16.Reinehr Тде Соуза ГРот CL Глюкагоноподобный пептид-1 натощак и его связь с инсулином у детей с ожирением до и после потери веса. J Pediatr Gastroenterol Nutr 2007;44 (5) 608- 612PubMedGoogle ScholarCrossref 17.Verdich CТубро С. Бьюманн БЛисгард Мэдсен Джюль Холст Яструп A Роль постпрандиального высвобождения инсулина и инкретиновых гормонов в вызванном приемом пищи насыщении: влияние ожирения и снижение веса. Int J Obes Relat Metab Disord 2001;25 (8) 1206– 1214PubMedGoogle ScholarCrossref 18.Adam ТС Джокен JВестертерп-Плантенга MS Уменьшение высвобождения глюкагоноподобного пептида 1 после потери веса у субъектов с избыточным весом/ожирением. Obes Res 2005;13 (4) 710- 716PubMedGoogle ScholarCrossref 19.Cohen MAЭллис Смле Ру CW и другие. Оксинтомодулин подавляет аппетит и снижает потребление пищи у человека. J Clin Endocrinol Metab 2003; 88 (10) 4696– 4701PubMedGoogle ScholarCrossref 20.Мерфи КГДхилло WSBloom Пептиды SR Gut в регуляции потребления пищи и энергетического гомеостаза. Endocr Ред. 2006; 27 (7) 719- 727PubMedGoogle ScholarCrossref 21.Smith Г.П.Гиббс J Холецистокинин: предполагаемый сигнал сытости. Pharmacol Biochem Behav 1975;3 (1) ((дополнение)) 135- 138PubMedGoogle Scholar22.Savoye МШоу М.Д. Зиура Дж и другие. Влияние программы управления весом на состав тела и метаболические параметры у детей с избыточным весом: рандомизированное контролируемое исследование. JAMA 2007;297 (24) 2697– 2704PubMedGoogle ScholarCrossref 23.Reinehr TKiess ВКапеллен Тандлер W Чувствительность к инсулину у детей и подростков с ожирением в зависимости от степени потери веса. Педиатрия 2004;114 (6) 1569– 1573PubMedGoogle ScholarCrossref 24.Lustig RHSen Соберман JEVelasquez-Mieyer PA Ожирение, резистентность к лептину и эффекты снижения уровня инсулина. Int J Obes Relat Metab Disord 2004;28 (10) 1344– 1348PubMedGoogle ScholarCrossref 25.Райнер ТЭнриори PJHarz К.Коули МАРот CL Полипептид поджелудочной железы у детей с ожирением до и после снижения веса. Int J Obes (Лондон) 2006;30 (10) 1476– 1481PubMedGoogle ScholarCrossref 26.Reinehr Тде Соуза Г.Никловиц PRот CL Амилин и его связь с инсулином и липидами у детей с ожирением до и после снижения веса. Ожирение (Серебряная весна) 2007;15 (8) 2006– 2011PubMedGoogle ScholarCrossref 27.Кан SEАндрикопулос SВерчере Островковый амилоид CB: давно признанный, но недооцененный патологический признак диабета 2 типа. Диабет 1999;48 (2) 241- 253PubMedGoogle ScholarCrossref 28.Laimer М.Ебенбихлер CFKaser С и другие. Потеря веса увеличивает уровни растворимых рецепторов лептина и фракции лептина, связанной с растворимыми рецепторами. Obes Res 2002;10 (7) 597- 601PubMedGoogle ScholarCrossref 29.Райнер ТКрацш JKiess Вандлер W Циркулирующий растворимый рецептор лептина, лептин и резистентность к инсулину до и после потери веса у детей с ожирением. Международный Дж. Обес (Лондон) 2005; 29 (10) 1230– 1235PubMedGoogle ScholarCrossref 30.Reinehr TRoth CMenke Тандлер W Адипонектин до и после снижения веса у детей с ожирением. J Clin Endocrinol Metab 2004; 89 (8) 3790– 3794PubMedGoogle ScholarCrossref 32.Ариясу Hтакая КТагами Т и другие. Желудок является основным источником циркулирующего грелина, и состояние питания определяет уровни грелин-подобной иммунореактивности в плазме у людей. J Clin Endocrinol Metab 2001; 86 (10) 4753– 4758PubMedGoogle ScholarCrossref 33.Nakazato Мураками NДата Д и другие. Роль грелина в центральной регуляции питания. Природа 2001;409 (6817) 194– 198PubMedGoogle ScholarCrossref 34.Крапивник AMSмаленький CJWard ХЛ и другие. Новый гипоталамический пептид грелин стимулирует потребление пищи и секрецию гормона роста. Эндокринология 2000;141 (11) 4325– 4328PubMedGoogle ScholarCrossref 35. Каммингс DEClement КПурнелл JQ и другие. Повышенный уровень грелина в плазме крови при синдроме Прадера-Вилли. Nat Med 2002;8 (7) 643- 644PubMedGoogle ScholarCrossref 36.Williams DLGrill Х. Дж. Каммингс ДЕКаплан JM Прибавка в весе, вызванная перекармливанием, снижает уровень грелина в плазме у крыс. J Endocrinol Invest 2006;29 (10) 863– 868PubMedGoogle ScholarCrossref 37. Каммингс DE Грелин и краткосрочная и долгосрочная регуляция аппетита и массы тела. Physiol Behav 2006;89 (1) 71- 84PubMedGoogle ScholarCrossref 38.Reinehr Тде Соуза ГРот CL Уровни обестатина и грелина у детей и подростков с ожирением до и после снижения избыточного веса. Clin Endocrinol (Oxf) 2008;68 (2) 304– 310PubMedGoogle Scholar39.Де Амброджи М. Вольпе Стаманини C Грелин: центральные и периферические эффекты нового пептидилового гормона. Med Sci Monit 2003;9 (9) RA217- RA224PubMedGoogle Scholar40.Zhang JVRen П.Г.Авсян-Кретчмер О и другие. Обестатин, пептид, кодируемый геном грелина, препятствует влиянию грелина на прием пищи. Наука 2005;310 (5750) 996– 999PubMedGoogle ScholarCrossref 41.Guo ZFZheng XQin YWHu Дж.К.Чен СПЖанг Z Отношение циркулирующего препрандиального грелина к обестатину увеличивается при ожирении человека. J Clin Endocrinol Metab 2007; 92 (5) 1875– 1880PubMedGoogle ScholarCrossref 42.Zou CCLiang ЛВанг CLFu Дж. Ф. Чжао ZY Изменение уровней грелина и обестатина у детей с ожирением после снижения веса. Acta Paediatr 2009; 98 (1) 159– 165PubMedGoogle ScholarCrossref 43.Zizzari PLongchamps РЕпельбаум JBluet-Pajot МТ Обестатин частично влияет на стимуляцию грелином потребления пищи и секрецию гормона роста у грызунов. Эндокринология 2007;148 (4) 1648– 1653PubMedGoogle ScholarCrossref 44. Haider Д. Г. Шиндлер К. Прагер г и другие. Сывороточный ретинол-связывающий белок-4 снижается после потери веса у лиц с морбидным ожирением. J Clin Endocrinol Metab 2007; 92 (3) 1168– 1171PubMedGoogle ScholarCrossref 45.Tatemoto КМутт V Выделение двух новых гормонов-кандидатов с использованием химического метода обнаружения встречающихся в природе полипептидов. Природа 1980;285 (5764) 417- 418PubMedGoogle ScholarCrossref 46.Pappas TNDebas HTGoto YTaylor IL Peptide YY ингибирует стимулированную приемом пищи секрецию поджелудочной железы и желудка. Am J Physiol 1985;248 (1, часть 1) G118- G123PubMedGoogle Scholar48.Веттергрен А.Петерсен Горсков Кристиансен ДжейШейх SPХолст JJ Глюкагоноподобный пептид. Амид 17–36 и пептид YY образуют L-клетки слизистой оболочки подвздошной кишки и являются мощными ингибиторами вагусно-индуцированной секреции желудочной кислоты у человека. Scand J Gastroenterol 1994;29 (6) 501– 505PubMedGoogle ScholarCrossref 49.Chen CHRogers RC Центральное ингибирующее действие пептида YY на моторику желудка у крыс. Am J Physiol 1995;269 (4, часть 2) R787- R792PubMedGoogle Scholar50.Oh НГсон GMSin JYDing XZАдриан TE Динамика морфологических изменений и адаптации пептида YY в слизистой оболочке подвздошной кишки после петлевой илеостомии у людей. Dis Colon Rectum 2005;48 (6) 1287– 1294PubMedGoogle ScholarCrossref 51.Кабреле CBeck-Sickinger AG Молекулярная характеристика взаимодействия лиганд-рецептор семейства нейропептидов Y. J Pept Sci 2000;6 (3) 97- 122PubMedGoogle ScholarCrossref 52.Lin СБой ДГерцог Рецепторы J NPY и Y: уроки трансгенных и нокаутных моделей. Нейропептиды 2004;38 (4) 189– 200PubMedGoogle ScholarCrossref 53.Keire Д.А.Маннон Кобаяши Уолш Дж. Х. Соломон ТЕРив младший Jr Первичные структуры PYY, [Pro34]PYY и PYY-(3-36) придают различные конформации и селективность в отношении рецепторов. Am J Physiol Gastrointest Liver Physiol 2000;279 (1) G126- G131PubMedGoogle Scholar54.Stanley Свинн КБлум S Сигналы желудочно-кишечного сытости, III: глюкагоноподобный пептид 1, оксинтомодулин, пептид YY и полипептид поджелудочной железы. Am J Physiol Gastrointest Liver Physiol 2004; 286 (5) G693- G697PubMedGoogle ScholarCrossref 55.Karra EChandarana КБаттерхэм RL Роль пептида YY в регуляции аппетита и ожирении. J Physiol 2009;587 (часть 1) 19- 25PubMedGoogle ScholarCrossref 56.Batterham РЛФитче Д. Х. Розенталь ДжМ и другие. Модуляция PYY корковых и гипоталамических областей мозга предсказывает пищевое поведение у людей. Природа 2007;450 (7166) 106- 109PubMedGoogle ScholarCrossref 57.Guo YMa ЛЭнриори ПиДжей и другие. Физиологические доказательства участия пептида YY в регуляции энергетического гомеостаза у человека. Ожирение (Серебряная весна) 2006;14 (9) 1562– 1570PubMedGoogle ScholarCrossref 58.Doucet ЭЛавиолетт Мимбо ПСтричар ИРабаса-Льорет RPrud’homme D Общий пептид YY коррелирует с расходом энергии после приема пищи, но не с аппетитом или потреблением энергии у здоровых женщин. Метаболизм 2008;57 (10) 1458– 1464PubMedGoogle ScholarCrossref 59.Boey DLin SEnriquez РФ и другие.Трансгенные мыши PYY защищены от вызванного диетой и генетического ожирения. Нейропептиды 2008;42 (1) 19- 30PubMedGoogle ScholarCrossref 60.Ленивец БХолст Джей Джей Флинт Грегерсен НТАструп A Влияние PYY1–36 и PYY3–36 на аппетит, потребление энергии, расход энергии, метаболизм глюкозы и жира у тучных и худых субъектов. Am J Physiol Endocrinol Metab 2007;292 (4) E1062– E1068PubMedGoogle ScholarCrossref 61.Бояновска E Физиология и патофизиология глюкагоноподобного пептида-1 (ГПП-1): роль ГПП-1 в патогенезе сахарного диабета, ожирения и стресса. Med Sci Monit 2005;11 (8) RA271- RA278PubMedGoogle Scholar62.Gutzwiller JPDegen LHeuss ЛБеглингер C Глюкагоноподобный пептид 1 (GLP-1) и прием пищи. Physiol Behav 2004;82 (1) 17- 19PubMedGoogle ScholarCrossref 63.Cancelas Джей Санчо VВильянуэва-Пенакаррильо МЛ и другие.Содержание глюкагоноподобного пептида-1 в кишечном тракте взрослых крыс, которым вводили стрептозотоцин либо в период новорожденности, либо за 7 дней до умерщвления. Эндокринный 2002;19 (3) 279– 286PubMedGoogle ScholarCrossref 64.Rask Э. Олссон Т. Содерберг С и другие. Северная Швеция Мониторинг тенденций и детерминант сердечно-сосудистых заболеваний (MONICA). Нарушение инкретинового ответа после смешанной еды связано с резистентностью к инсулину у мужчин, не страдающих диабетом. Диабетическая помощь 2001;24 (9) 1640– 1645PubMedGoogle ScholarCrossref 65.Scrocchi LБраун TJMaClusky Н и другие. Непереносимость глюкозы, но нормальное чувство сытости у мышей с нулевой мутацией в гене рецептора глюкагоноподобного пептида 1. Nat Med 1996;2 (11) 1254– 1258PubMedGoogle ScholarCrossref 66.Ehlers МРклафф ЛЖД’Алессио Д.А. и другие. Амид рекомбинантного глюкагоноподобного пептида-1 (7-36) снижает уровень глюкозы в сыворотке натощак у широкого спектра пациентов с диабетом 2 типа. Horm Metab Res 2003;35 (10) 611- 616PubMedGoogle ScholarCrossref 67.Meier JJGallwitz Б.Шмидт WENauck MA глюкагоноподобный пептид 1 как регулятор потребления пищи и массы тела; терапевтические перспективы. Eur J Pharmacol 2002;440 (2-3) 269- 279PubMedGoogle ScholarCrossref 68.Verdich CFlint Гутцвиллер Япония и другие. Мета-анализ влияния амида глюкагоноподобного пептида 1 (7-36) на потребление жиров без ограничений у людей. J Clin Endocrinol Metab 2001; 86 (9) 4382- 4389PubMedGoogle Scholar69.Schwartz М.Вудс SCPорте Д младшийСили Р.Дж. Баскин DG Центральная нервная система контролирует прием пищи. Природа 2000;404 (6778) 661- 671PubMedGoogle Scholar70.Pardini АВНгуйен HTFiglewicz ДП и другие. Распределение субстрата инсулиновых рецепторов-2 в областях мозга, участвующих в энергетическом гомеостазе. Разрешение мозга 2006;1112 (1) 169– 178PubMedGoogle ScholarCrossref 71.Поузи KAClegg DJPrintz РЛ и другие. Гипоталамическое провоспалительное накопление липидов, воспаление и резистентность к инсулину у крыс, получавших диету с высоким содержанием жиров. Am J Physiol Endocrinol Metab 2009;296 (5) E1003– E1012PubMedGoogle ScholarCrossref 73.Schwartz TW Полипептид поджелудочной железы: гормон, находящийся под контролем блуждающего нерва. Гастроэнтерология 1983;85 (6) 1411– 1425PubMedGoogle Scholar74.Batterham RLLe Roux CWCohen Массачусетс и другие.Панкреатический полипептид снижает аппетит и потребление пищи у человека. J Clin Endocrinol Metab 2003; 88 (8) 3989– 3992PubMedGoogle ScholarCrossref 75.Hazelwood RL Семейство полипептидов поджелудочной железы (PP-fold): последствия для желудочно-кишечного тракта, сосудов и пищевого поведения. Proc Soc Exp Biol Med 1993;202 (1) 44- 63PubMedGoogle ScholarCrossref 77.Reinehr Т.Штоффель-Вагнер бульон CLAndler W Высокочувствительный С-реактивный белок, фактор некроза опухоли альфа и факторы риска сердечно-сосудистых заболеваний до и после снижения веса у детей с ожирением. Метаболизм 2005;54 (9) 1155– 1161PubMedGoogle ScholarCrossref 79.Balagopal Грэм ТЕКан ББАльтомаре АФунанаж Джордж D Снижение повышенного содержания ретинол-связывающего белка в сыворотке крови у детей с ожирением путем изменения образа жизни: связь с субклиническим воспалением. J Clin Endocrinol Metab 2007; 92 (5) 1971– 1974 PubMedGoogle ScholarCrossref 80.Maffeis CSilvagni Бонадонна Р.Греццани Банзато CTato L Размер жировых клеток, чувствительность к инсулину и воспаление у детей с ожирением. J Pediatr 2007;151 (6) 647- 652PubMedGoogle ScholarCrossref 81.Kowalska Страчковский Николаюк М.Н. А и другие. Инсулинорезистентность, сывороточный адипонектин и провоспалительные маркеры у молодых людей с метаболическим синдромом. Метаболизм 2008;57 (11) 1539– 1544PubMedGoogle ScholarCrossref 82.Weyer CFunahashi Танака С и другие. Гипоадипонектинемия при ожирении и диабете 2 типа: тесная связь с резистентностью к инсулину и гиперинсулинемией. J Clin Endocrinol Metab 2001; 86 (5) 1930– 1935 PubMedGoogle ScholarCrossref 83.Rosenbaum ММерфи EMHeymsfield SBMatthews ДЕЛайбель RL Введение низких доз лептина обращает вспять эффекты устойчивого снижения веса на расход энергии и циркулирующие концентрации гормонов щитовидной железы. J Clin Endocrinol Metab 2002; 87 (5) 2391– 2394PubMedGoogle ScholarCrossref 84.Farooqi ИСДжебб SAЛангмак г и другие.Эффекты терапии рекомбинантным лептином у ребенка с врожденным дефицитом лептина. N Engl J Med 1999;341 (12) 879– 884PubMedGoogle ScholarCrossref 85.Qi YТакахаши НХилеман СМ и другие. Адипонектин действует в головном мозге, снижая массу тела. Nat Med 2004;10 (5) 524- 529PubMedGoogle ScholarCrossref 86.Kos Харте Альда Силва НФ и другие. Адипонектин и резистин в спинномозговой жидкости человека и экспрессия рецепторов адипонектина в гипоталамусе человека. J Clin Endocrinol Metab 2007; 92 (3) 1129– 1136PubMedGoogle ScholarCrossref 87.Степпан CMBailey STBhat С и другие. Гормон резистин связывает ожирение с диабетом. Природа 2001;409 (6818) 307- 312PubMedGoogle ScholarCrossref 88.Liu Ффан HQQiu Дж и другие. Парадокс: инсулин ингибирует экспрессию и секрецию резистина, который вызывает резистентность к инсулину. World J Gastroenterol 2008;14 (1) 95– 100PubMedGoogle ScholarCrossref 89.Адзума К.Кацукава Фогучи С и другие. Корреляция между уровнем резистина в сыворотке крови и ожирением у людей с ожирением. Obes Res 2003;11 (8) 997– 1001PubMedGoogle ScholarCrossref 90. Валсамакис Дж. Мактернан ПГЧетти р и другие. Умеренная потеря веса и уменьшение окружности талии после медикаментозного лечения связаны с благоприятными изменениями уровня адипоцитокинов в сыворотке крови. Метаболизм 2004;53 (4) 430– 434PubMedGoogle ScholarCrossref 91.Ли Дж.Х.Чан JLYiannakouris Н и другие. Уровни циркулирующего резистина не связаны с ожирением или инсулинорезистентностью у людей и не регулируются голоданием или введением лептина: перекрестные и интервенционные исследования у нормальных, инсулинорезистентных и диабетических субъектов. J Clin Endocrinol Metab 2003; 88 (10) 4848– 4856PubMedGoogle ScholarCrossref 92.Monzillo ЛУХамди ОХортон ЕС и другие. Влияние модификации образа жизни на уровни адипокинов у пациентов с ожирением и резистентностью к инсулину. Obes Res 2003;11 (9) 1048– 1054PubMedGoogle ScholarCrossref 93.Vendrell Джей Брох М. Виларраса Н и другие. Резистин, адипонектин, грелин, лептин и провоспалительные цитокины: взаимосвязь при ожирении. Obes Res 2004;12 (6) 962- 971PubMedGoogle ScholarCrossref 94.Reinehr TRoth CLMenke Тандлер W Концентрации резистина до и после потери веса у детей с ожирением. Int J Obes (Лондон) 2006;30 (2) 297- 301PubMedGoogle ScholarCrossref 95.Ян КьюГрэм TEMody Н и другие. Белок 4, связывающий ретинол в сыворотке, способствует резистентности к инсулину при ожирении и диабете 2 типа. Природа 2005;436 (7049) 356- 362PubMedGoogle ScholarCrossref 96.Graham TEYang QBluher М и другие. Ретинол-связывающий белок 4 и резистентность к инсулину у худых, страдающих ожирением и больных диабетом. N Engl J Med 2006;354 (24) 2552– 2563PubMedGoogle ScholarCrossref 97.Чо YMYoun BSLee ЧАС и другие. Концентрации ретинол-связывающего белка-4 в плазме повышены у людей с нарушенной толерантностью к глюкозе и диабетом 2 типа. Диабетическая помощь 2006;29 (11) 2457– 2461PubMedGoogle ScholarCrossref 98.Lee DCLee JWIm JA Связь сывороточного ретинол-связывающего белка 4 и резистентности к инсулину у практически здоровых подростков. Метаболизм 2007;56 (3) 327- 331PubMedGoogle ScholarCrossref 99.Райнер Т.Штоффель-Вагнер бульон CL Ретинол-связывающий белок 4 и его связь с резистентностью к инсулину у детей с ожирением до и после потери веса. J Clin Endocrinol Metab 2008; 93 (6) 2287– 2293PubMedGoogle ScholarCrossref 100.Araki СДобаши ККубо К и другие. Концентрация висфатина в плазме как суррогатный маркер накопления висцерального жира у детей с ожирением. Ожирение (Серебряная весна) 2008;16 (2) 384- 388PubMedGoogle ScholarCrossref 101.Револло Й. Р. Кёрнер АМиллс КФ и другие. Nampt/PBEF/Visfatin регулирует секрецию инсулина в бета-клетках как фермент системного биосинтеза НАД. Сотовый метаб 2007;6 (5) 363– 375PubMedGoogle ScholarCrossref 102.Rongvaux Аши RJMulks МЗ и другие. Фактор увеличения колоний пре-В-клеток, экспрессия которого повышается в активированных лимфоцитах, представляет собой никотинамидфосфорибозилтрансферазу, цитозольный фермент, участвующий в биосинтезе НАД. Eur J Immunol 2002;32 (11) 3225– 3234PubMedGoogle ScholarCrossref 103.Chen MPChung FMChang ДМ и другие. Повышенный уровень в плазме висфатина/фактора роста колоний пре-В-клеток у пациентов с сахарным диабетом 2 типа. J Clin Endocrinol Metab 2006; 91 (1) 295- 299PubMedGoogle ScholarCrossref 104.Dogru Цонмез ATasci я и другие. Уровни висфатина в плазме у пациентов с впервые диагностированным и нелеченым сахарным диабетом 2 типа и нарушением толерантности к глюкозе. Диабетическая клиника, практика , 2007; 76 (1) 24- 29PubMedGoogle ScholarCrossref 105. Лопес-Бермехо АЧико-Джулия Б. Фернандес-Балселлс М и другие. Уровень висфатина в сыворотке увеличивается при прогрессирующем ухудшении состояния β-клеток. Диабет 2006;55 (10) 2871– 2875PubMedGoogle ScholarCrossref 106.Давутоглу Мозкая М. Гулер Е и другие. Концентрация висфатина в плазме при детском ожирении: взаимосвязь с инсулинорезистентностью и антропометрическими показателями. Swiss Med Wkly 2009;139 (1-2) 22- 27PubMedGoogle Scholar107.Haider Д. Г. Хольцер Г.Шаллер г и другие. Уровень адипокина висфатина заметно повышен у детей с ожирением. J Pediatr Gastroenterol Nutr 2006;43 (4) 548– 549PubMedGoogle ScholarCrossref 108.Körner Гартен А. Блюхер МТаушер Р.Кратч JKiess W Молекулярные характеристики висфатина в сыворотке и дифференциальное обнаружение с помощью иммунологических анализов. J Clin Endocrinol Metab 2007; 92 (12) 4783- 4791PubMedGoogle ScholarCrossref 109.Körner ABöttcher Енигк BKiess WStumvoll МКовач P Влияние генетической изменчивости гена висфатина (PBEF1) на ожирение, метаболизм глюкозы и артериальное давление у детей. Метаболизм 2007;56 (6) 772- 777PubMedGoogle ScholarCrossref 110.DeFronzo Р.А.Ратнер РЭХан Джей Ким DDFineman М.С.Барон AD Влияние эксенатида (экзендин-4) на гликемический контроль и массу тела в течение 30 недель у пациентов, получавших метформин, с диабетом 2 типа. Диабетическая помощь 2005;28 (5) 1092– 1100PubMedGoogle ScholarCrossref 111.Dakin CLSмаленький CJBatterham РЛ и другие. Периферический оксинтомодулин снижает потребление пищи и прибавку массы тела у крыс. Эндокринология 2004;145 (6) 2687– 2695PubMedGoogle ScholarCrossref 112.Baggio ЛЛХуанг QБраун ТиДжей Дракер DJ Оксинтомодулин и глюкагоноподобный пептид-1 по-разному регулируют потребление пищи мышами и расход энергии. Гастроэнтерология 2004;127 (2) 546– 558PubMedGoogle ScholarCrossref 113.Wynne Кпарк AJSmall СиДжей и другие. Оксинтомодулин увеличивает расход энергии в дополнение к снижению потребления энергии у людей с избыточным весом и ожирением: рандомизированное контролируемое исследование. Int J Obes (Лондон) 2006;30 (12) 1729– 1736PubMedGoogle ScholarCrossref 114. Hermansen К. Мортенсен LS Изменения массы тела, связанные с антигипергликемическими средствами при сахарном диабете 2 типа. Drug Saf 2007;30 (12) 1127– 1142PubMedGoogle ScholarCrossref 115.Field БКВрен А.М.Кук ДБлум SR Гормоны кишечника как потенциальные новые мишени для регуляции аппетита и лечения ожирения. Наркотики 2008;68 (2) 147- 163PubMedGoogle ScholarCrossref 116.Roth JDRoland БЛКоул РЛ и другие. Реакция на лептин, восстановленная агонизмом амилина при ожирении, вызванном диетой: данные доклинических и клинических исследований. Proc Natl Acad Sci U S A 2008;105 (20) 7257- 7262PubMedGoogle ScholarCrossref 117.