Виды белка (протеина) — как выбрать и какой лучший
Протеины или белки — это органические вещества, которые играют важную роль в жизнедеятельности человека. Попадая в организм, белок расщепляется на аминокислоты, а они в свою очередь берут участие в обмене веществ, построении и поддержке клеток, тканей и дают нам энергию.
Часть аминокислот тело человека продуцирует самостоятельно, но многие мы можем получить исключительно из пищи, вот почему так важно употреблять продукты богатые белком: яйца, рыбу, мясо, орехи, молочные продукты и бобовые.
Людям, которые занимаются спортом, посещают спортзал, хотят нарастить мышечную массу, часто не хватает белка в обычном рационе, поэтому приходится искать его дополнительные источники. Если вы среди таких, помните, важно не только следить за количеством протеина, но и за его качеством.
В целом протеин бывает животного и растительного происхождения, но для нашего исследования мы предложим классификацию из четырех групп:
- яичный,
- мясной,
- растительный,
- молочный.

Среди растительных самым популярным подвидом считается соевый, а среди молочных — сывороточный и казеиновый. Также существует так называемый комплексный протеин, но это всего лишь микс вышеперечисленных в разных пропорциях.
Яичный протеин
Данный вид протеина делают из белков яиц и он по праву считается лучшим по усвояемости. Яичный белок состоит из альбумина, который очень близок к мышечным тканям человека по составу аминокислот. Даже Всемирная Организация Здравоохранения установила, что яичный белок — идеал протеинового продукта питания.
Также белки яиц богаты веществами, которые улучшают кровоснабжение мышц, фолиевой кислотой, биотином, витамином В2, B3.
Принимать яичный протеин можно до и после тренировки, утром и вечером из-за средней скорости всасывания. Обычно такой процесс занимает до 3 часов, при этом организм все это время получает необходимые аминокислоты.
Кроме спортивного питания на основе яичного протеина, вы можете попробовать жидкий белок “Ясенсвит”. Он также отлично подойдет для приготовления коктейлей, белковых блюд (омлетов, например), что разнообразит ваш рацион. В одной упаковке продукта — целых 50 гр протеина и ни грамма жира. Еще, яичный белок -— находка для тех, кто не переносит лактозные продукты или чувствует тяжесть после мяса.
Он также отлично подойдет для приготовления коктейлей, белковых блюд (омлетов, например), что разнообразит ваш рацион. В одной упаковке продукта — целых 50 гр протеина и ни грамма жира. Еще, яичный белок -— находка для тех, кто не переносит лактозные продукты или чувствует тяжесть после мяса.
Соевый протеин
Как уже упоминалось выше, соевый протеин является самым популярным видом растительного белка. Получают его чаще всего из соевой муки.
Преимущество соевого белка в том, что его можно принимать вегетарианцам. Он неплохо воспринимается организмом, способствует наращиванию мышечной массы и повышению выносливости. Долгое время считалось, что в сое есть большое количество фитоэстрогенов, но сегодня эксперты утверждают, что соя не влияет на гормональную систему организма.
Плюсом данного протеина является медленное усвоение, поэтому для тех, кто хочет сохранить физическую форму на длительный период это хорошее решение. Принимают такой белок утром, вечером и между приемами пищи.
К сожалению, соевый белок, в отличии от яичного, не обладает полным набором необходимых аминокислот и усваивается не полностью, поэтому он не может быть моно добавкой или основой полноценного питания.
Молочный протеин
Два основных вида молочного протеина — сывороточный и казеиновый. Сывороточный получают из молочной сыворотки (та самая, которая остается после производства творога), казеин — из молока и молочных продуктов (сыр, творог). Эти популярные виды белков очень богаты кальцием и витаминами, но противопоказаны людям с непереносимостью лактозы. Рассмотрим детальнее каждый из них.
Сывороточный белок
Быстроусвояемый протеин, который советуют употреблять за 40 или через 30 минут после тренировки или в качестве дополнения к основному приему пищи в первой половине дня. Способствует быстрому росту мышечной массы и дает поддержку перед тренировкой. Также используют при “сушке” тела.
Казеин
В отличии от сывороточного, казеиновый белок достаточно долго усваивается. Казеин активизирует рост мышц, помогает бороться с болевыми синдромами после тренировки. Советуют принимать перед сном, так как протеин начинает перевариваться только через 90 минут после приема и полностью всасывается через 7-8 часов. Казеин также помогает тем, кто хочет набрать вес.
Казеин активизирует рост мышц, помогает бороться с болевыми синдромами после тренировки. Советуют принимать перед сном, так как протеин начинает перевариваться только через 90 минут после приема и полностью всасывается через 7-8 часов. Казеин также помогает тем, кто хочет набрать вес.
Не смотря на популярность молочных протеинов, восполнить всю норму дневного белка они не могут, поэтому их рекомендуют чередовать с яичными.
Мясной протеин
Обладает неплохой биологической доступностью и подойдет тем, кто не переносит молочные продукты. Данный вид белка чаще представлен говяжьим протеином в спортивных добавках. Говяжий белок можно употреблять как добавку к основному рациону и как отдельный прием пищи. Это очень удобно для спортсменов, которые питаются 6 и больше раз в день. Кроме этого, спортсмены часто едят много курицы, она тоже богата белком. Мясной протеин поддерживает мышцы между тренировками. Специалисты рекомендуют его как способ диверсификации и дополнение к источникам поступления белка.
Стоит учитывать, что данный вид протеина достаточно дорогой и не всегда доступен в высоком качестве. Кроме этого, белки из мяса усваиваются тяжелее ( с немалыми затратами энергии со стороны организма на их переваривание) и дольше, чем из яиц. Мясной протеин не рекомендуют перед тренировкой, это чревато чувством тяжести и дискомфорта. Лучше за 30-40 минут до занятий спортом съесть порцию яичного белка.
Очевидно, что белок действительно незаменим в рационе. Если вы не занимаетесь активно спортом и не чувствуете потребности в дополнительной порции протеинов, все равно необходимо потреблять достаточное количество белковой пищи, и яйца один из лучших ее видов.
Также помните что любой вид протеина в качестве дополнения к основному рациону можно принимать с разрешения врача и после консультации с профильным специалистом.
Протеины и протеиды — Справочник химика 21
По составу белки делятся на протеины и протеиды. Протеины — это простые белки, состоящие только из остатков аминокислот, а протеиды — более сложные белковые образования, в состав которых кроме белковых веществ входят еще и остатки небелковых соединений. [c.226]
[c.226] Об исключительной сложности строения белков можно судить прежде всего по величине молекулярных весов некоторых протеинов и протеидов (табл. 53).
Большое число протеинов и протеидов являются ферментами энзимами, биокатализаторами), В зависимости от того, какие реакции катализируют ферменты, их подразделяют на шесть основных групп. [c.658]
Протеины составляют основу запасных веществ семян, а протеиды — основу ядер протоплазмы клеток. Протеины и протеиды разделяются на ряд подгрупп. [c.266]
Протеины и протеиды, в свою очередь, подразделяются на ряд подгрупп. Здесь необходимо отметить, что в настоящее время не представляется возможным построить классификацию белков на основании их химического строения. Поэтому приходится придерживаться условной классификации, основанной на физико-химических свойствах белков, главным образом на характере их растворимости.
Эти две больших группы — протеины и протеиды — в свою очередь, делятся на ряд групп в зависимости от физических свойств, химических свойств и т. д., например альбумины, глобулины, о которых говорилось выше. Подробное изучение белковых веществ относится к области физиологической химии классификация белков на отдельные группы здесь не приводится. [c.335]
Изучение химического состава ядра показало, что 70—96% его массы составляют белки — протеины и протеиды. Общее количество ядерных белков варьирует в клетках различных тканей и в процессе онтогенеза одной и той же клетки. В то >ке время изменение окраски клеток, а также различия их внутренней структуры обусловлены динамикой качественного состава белков. Среди ядерных белковых комплексов преобладают нуклеопротеиды, в состав которых входят ДНК и РНК- Изотопным методом установлено, что в ядре присутствуют две фракции РНК хромосомная и ядерная.
Белки картофеля состоят из протеинов и протеидов. Азотисты вещества клеточного сока представлены главным образом раствор мым белком туберином, а также 18 аминокислотами. [c.10]
Азотисты вещества клеточного сока представлены главным образом раствор мым белком туберином, а также 18 аминокислотами. [c.10]
Распространение в природе. В свободном виде азот является главной составной частью во.здуха (78,1 % по объему). В связанном состоянии встречается в форме неорганических соединений, например селитры — натронной NaNOs и калийной KNO3, а также аммиака (продукта гниения). В виде органических соединений азот содержится во всех организмах белковые вещества (протеины и протеиды), нуклеиновые кислоты, конечные продукты обмена веществ — карбамид и мочевая кислота. Обнаружен азот в природных углях. [c.339]
Гейнер и протеин – что это такое, что выбрать?
Спортивное питание сегодня настолько разнообразно, что не всем под силу в нем разобраться. Очень часто перед начинающими спортсменами встает вопрос: что лучше выбрать – гейнер или протеин. Чтобы ответить на него, сперва нужно понять разницу между этими продуктами.
Что такое протеин?
Протеин – это белок, такой же как в продуктах. Этот компонент питания необходим спортсменам для быстрого восстановления мышечных тканей после тренировок и набора массы. Он почти мгновенно усваивается организмом и сразу направляется к мышцам, предупреждая катаболические процессы.
Внимание! Раньше, когда еще не существовало современного разнообразия спортивного питания, люди принимали после занятий спортом обычное сухое молоко. Затем его очистили от жира. А позднее – добавили в него витамины и минералы.
Протеины классифицируются на 2 вида – медленные и быстрые. Первые усваиваются постепенно, что обеспечивает беспрерывное поступление строительного материала. Они идеально подходят для приема после поздних тренировок. Так мышцы будут получать белок всю ночь. Вторые перевариваются моментально и используются для быстрого закрытия белково-углеводного окна.
Что такое гейнер?
Гейнеры состоят из белков, углеводов, витаминов, минералов и других добавок. Они могут иметь различное процентное содержание углеводов и протеинов. Это идеальный продукт для худощавых людей.
Углеводы в гейнерах бывают медленными и быстрыми. Первые обеспечивают длительное снабжение организма энергией и подходят для употребления после тренировки. Вторые восстанавливают энергетические потери моментально и чаще всего принимаются перед посещением тренажерного зала.
Внимание! Самое главное отличие гейнера от протеина заключается в том, что он может стать источником гликогена, откладывающегося в печени в качестве резервного запаса энергии.
Что выбрать?
Выбор между протеином и гейнером индивидуален.Если человек получает недостаточно белков и углеводов из основного рациона, то ему стоит отдать предпочтение гейнеру. Если ему просто нужно обеспечить рост мышечной массы – протеину.
Если ему просто нужно обеспечить рост мышечной массы – протеину.
Помимо этого, нужно учитывать тип телосложения. Люди делятся на эктоморфов, склонных к худощавости, эндоморфов, склонных к ожирению, и мезоморфов с нормальными пропорциями тела. Первым стоит отдать предпочтение гейнерам, вторым – протеину. А третьим можно совмещать прием обеих добавок. К примеру, если спортсмен-мезоморф хорошо питается утром и вечером, а в обед из-за высокой занятости на работе обходится чашкой кофе, то ему подойдет такой комплекс из протеина и гейнера: перекус протеином, гейнер после спортзала, смесь из добавок в обед.
Внимание!Чтобы составить идеальный рацион для тренировочных дней, проконсультируйтесь с фитнес-тренером или диетологом.
Протеин: что это, в чем есть и для чего его пьют :: Здоровье :: РБК Стиль
Вместе с эндокринологом и тренером разбираемся, кому стоит пить протеиновые коктейли и как это делать с максимальной пользой.
Материал прокомментировали:
- Алевтина Федина, терапевт, медицинский директор сервиса управления здоровьем Checkme
- Екатерина Иванова, методист тренажерного зала сети фитнес-клубов WorldClass
Белок — главный строительный материал для нашего организма. Высокобелковая диета способствует росту мышц и набору силы, поэтому она пользуется популярностью у спортсменов. Но постоянно получать много белка из обычных продуктов очень сложно. Для того чтобы сделать питание спортсменов проще и приятнее, и были придуманы белковые коктейли (protein shakes) — в России их называют просто «протеины».
Зачем нужен белок
Из белков состоят мышцы, сухожилия, кожа, соединительные ткани, волосы и ногти. Также они участвуют во множестве других процессов в организме, начиная с производства гормонов и управления метаболизмом, заканчивая поддержанием иммунитета и регуляцией уровня жидкости.
Если мы получаем белки в достаточном количестве, кожа остается упругой, суставы — здоровыми, а мышцы растут. Если белка в рационе не хватает, даже тяжелые физические нагрузки не приведут к заметному росту мускулатуры.
Если белка в рационе не хватает, даже тяжелые физические нагрузки не приведут к заметному росту мускулатуры.
Белок: функции, нормы, особенности и источники
Здоровому человеку, который не планирует быстро набрать мышечную массу и не занимается тяжелыми видами спорта, нужно потреблять 0,8 г белка на 1 кг массы тела. Их легко получить, придерживаясь обычной сбалансированной диеты. Пожилым людям, беременным и кормящим женщинам белка нужно в полтора раза больше.
Для спортсменов, которые хотят нарастить мускулатуру, необходимо потреблять уже от 1,5 до 2,2 г белка на 1 кг. Получается, что атлету весом 90 кг нужно по крайней мере 135 г белка ежедневно. Для этого он может, к примеру, съедать 100 г творога, 300 г куриной грудки и шесть яиц. Такая диета может стать как минимум испытанием, а то и настоящей пыткой. А для вегетарианцев или веганов получить такое количество белка из обычной еды почти нереально.
Что такое протеин
По-английски белок — это protein. В русском языке это слово не используется. Но «протеинами» называют смеси для коктейлей и другие специальные добавки к пище с высоким содержанием белка.
В русском языке это слово не используется. Но «протеинами» называют смеси для коктейлей и другие специальные добавки к пище с высоким содержанием белка.
Протеиновые коктейли — источник легкодоступного белка. Доказано, что они способствуют ускорению роста мышечной массы при занятиях спортом [1]. Кроме того, если пить их после тренировок, мышцы будут восстанавливаться быстрее [2]. Протеины продаются в виде порошков, которые нужно добавлять в молоко или воду. Чаще всего можно встретить ванильные, шоколадные и клубничные, но сегодня существует огромное количество других вкусов, например, дыни, сникерса или кофе.
Стандартная порция — 30 г смеси, которую разводят в 150–250 мл жидкости. В таком коктейле будет 15–29 г протеина, а также небольшое количество жиров и углеводов. Помимо порошковых коктейлей, существуют и другие высокобелковые продукты: смеси для выпечки, батончики и даже протеиновые чипсы.
В каких еще продуктах содержится протеин
Как отмечает Алевтина Федина, несмотря на удобство протеиновых коктейлей, самый лучший способ получать белки — обычная здоровая пища.
К натуральным продуктам — рекордсменам по содержанию белка относятся (на 100 г):
- птица — 27 г;
- свинина — 27 г;
- говядина — 26 г;
- тыквенные семечки — 25 г;
- рыба — 22 г;
- морепродукты — 22 г;
- красная чечевица — 18 г;
- красная фасоль — 16 г;
- маш, нут, черная фасоль — 14 г;
- гречка и цельнозерновой хлеб — 13 г;
- киноа и тофу — 8 г.
Какие бывают протеины
Есть несколько десятков разновидностей протеиновых порошков. Они различаются по двум параметрам.
Первый — способ изготовления, от которого зависит содержание белка. Здесь существуют три вида:
- Концентраты.
 Производятся с помощью экстракции белка из пищевых продуктов. Обычно они содержат 60–80% собственно протеина, а оставшиеся 20–40% приходятся на жиры и углеводы. Такие смеси менее удобны для спортсменов, зато стоят меньше остальных.
Производятся с помощью экстракции белка из пищевых продуктов. Обычно они содержат 60–80% собственно протеина, а оставшиеся 20–40% приходятся на жиры и углеводы. Такие смеси менее удобны для спортсменов, зато стоят меньше остальных. - Изоляты. Более очищенный белок, где примеси составляют 5–10%. Такие порошки хорошо подходят для набора мышечной массы и нормализации веса.
- Гидролизаты. Здесь белки с помощью химических процессов расщеплены на более мелкие цепочки аминокислот. Такой протеин усваивается быстрее всего, поэтому идеален для употребления после тренировки.
Второй параметр — продукт, из которого протеин изготовлен.
Сывороточные
Этот вид протеинов производится из молочной сыворотки. Такие смеси считаются наиболее эффективными по влиянию на рост мышц и ускорение метаболизма. Сывороточный протеин имеет самый разнообразный аминокислотный профиль, то есть с ним организм получит максимальное количество необходимых аминокислот. Кроме того, у него самая высокая биологическая усвояемость. «Все животные источники белка относятся к высокоценным по профилю аминокислот, — объясняет Екатерина Иванова. — Но в сывороточных белках содержится относительно больше аминокислот ВСАА, которые дают больший метаболический отклик в организме спортсмена, чем другие».
Кроме того, у него самая высокая биологическая усвояемость. «Все животные источники белка относятся к высокоценным по профилю аминокислот, — объясняет Екатерина Иванова. — Но в сывороточных белках содержится относительно больше аминокислот ВСАА, которые дают больший метаболический отклик в организме спортсмена, чем другие».
Наконец, у таких смесей нейтральный вкус, который позволяет делать вкусные коктейли, и высокая растворимость. Все эти свойства делают сывороточный протеин самым популярным, особенно среди спортсменов.
По-английски такой протеин называется whey — это слово на коробках и банках в спортивных магазинах можно увидеть так часто, что многие начинающие спортсмены принимают его за название бренда добавок. Сывороточный протеин не подходит людям с непереносимостью лактозы, так как содержит ее в небольшом количестве.
Говяжьи
Этот тип порошков изготавливают из говяжьего мяса. По аминокислотному профилю и скорости усвоения он похож на сывороточный, однако у него меньшая биодоступность. Кроме того, в нем ниже содержание лейцина — аминокислоты, запускающей рост мышц. Еще одна проблема — худшая растворимость и специфический привкус, который производителям приходится забивать агрессивными ароматизаторами и подсластителями.
Кроме того, в нем ниже содержание лейцина — аминокислоты, запускающей рост мышц. Еще одна проблема — худшая растворимость и специфический привкус, который производителям приходится забивать агрессивными ароматизаторами и подсластителями.
Казеиновые
Такие протеины тоже производятся из молока, но по другой технологии, чем сывороточные. Казеин, основной компонент такого порошка, — это главный белок молока, творога и сыров. Несмотря на одинаковое сырье такие коктейли — полная противоположность сывороточных. Они усваиваются дольше всего, так как обволакивают желудок, тем самым снижая аппетит. При этом они наиболее низкокалорийные, поэтому хорошо подходят для похудения. Но для спортсменов это не лучший вариант: исследования показывают, что влияние казеинового протеина на синтез мышечного белка на 132% ниже, чем сывороточного [3].
Яичные
Это не самый распространенный вид протеинов. Его воздействие пока плохо изучено, но в целом его считают несколько менее эффективным, чем сывороточный. Главные плюсы яичного протеина — отсутствие лактозы.
Его воздействие пока плохо изучено, но в целом его считают несколько менее эффективным, чем сывороточный. Главные плюсы яичного протеина — отсутствие лактозы.
Яичный белок содержит авидин — это вещество препятствует усвоению биотина, витамина B-комплекса [4]. Из обычных яиц мы получаем его слишком мало для того, чтобы он реально мог навредить. Но в протеиновых порошках из яичных белков его гораздо больше. Дефицит биотина приводит к сухости кожи, депрессии, сонливости, проблемам с сердечно-сосудистой системой и накоплением холестерина.
Веганские
Для тех, кто не может или не хочет потреблять в пищу продукты животного происхождения, существуют растительные протеины. Чаще всего встречаются соевый, гороховый и конопляный. В целом они менее эффективны, чем невеганские разновидности, поэтому для всеядных людей никаких преимуществ у растительных протеинов нет. Но для веганов такие коктейли могут стать отличным источником натурального белка, которого им часто не хватает.
Для спортсменов лучше всего подходит гороховый протеин, так как усваивается довольно быстро, хотя и медленнее, чем сывороточный, и содержит много BCAA. Одно исследование показало, что по влиянию на рост мышечной массы он сопоставим с сывороточным [5].
Конопляный протеин пока слабо исследован, однако известно, что в нем содержится множество полезных биоактивных соединений, которые повышают иммунитет, защищают сердечно-сосудистую систему и снижают окислительный стресс [6].
Соевый протеин — единственный из всех растительных — содержит весь набор незаменимых аминокислот. Тем не менее это самый спорный из всех видов протеина. Так, американский диетолог Кимберли Снайдер не рекомендует пить белковые коктейли на основе сои. Но доказательная наука не находит у такого протеина никаких серьезных противопоказаний. Ошибочно считается, что соя снижает количество тестостерона, необходимого в том числе и для быстрого роста мышц, и стимулирует производство женских половых гормонов, однако исследования опровергают это [7]. Кроме того, часто соевый протеин делают из ГМО-сои, но и здесь ученые не смогли найти никаких вредных свойств.
Кроме того, часто соевый протеин делают из ГМО-сои, но и здесь ученые не смогли найти никаких вредных свойств.
Многокомпонентные протеины
Часто можно встретить смешанные порошки, в которые входят и «быстрые», и «медленные» виды протеина. Это относительно универсальный вариант коктейля, который можно выпить и после тренировки, и в качестве высокобелкового перекуса.
«Среди порошковых белковых добавок быстрее всего усваивается гидролизат белка — сывороточный или говяжий, — рассказывает Екатерина Иванова. — Далее по удлинению времени усвоения следуют смесь гидролизата и изолята, изолят, концентрат. Если рассматривать скорость усвоения, то быстрее всего усваиваются сывороточные молочные белки, далее яичные, говяжьи, соевые и в конце иные растительные. Поэтому чаще выбор падает на сывороточные изоляты, в том числе и по соотношению с ценой. Они и представляют большую часть ассортимента белковых добавок».
Что надо знать о правильном питании: инструкция для начинающих
Гейнер
Отдельная разновидность протеина — гейнер. Это смесь, в которой, помимо белков, содержатся еще и углеводы. Это специализированное спортивное питание для профессиональных и полупрофессиональных спортсменов и бодибилдеров. Если вы о нем раньше не слышали — значит, он вам точно не понадобится.
Это смесь, в которой, помимо белков, содержатся еще и углеводы. Это специализированное спортивное питание для профессиональных и полупрофессиональных спортсменов и бодибилдеров. Если вы о нем раньше не слышали — значит, он вам точно не понадобится.
«Задачи гейнера — создать высококалорийный заменитель пищи с высоким содержанием углеводов, значительно поднять энергетическую ценность рациона и при этом хоть немного разгрузить пищеварительную систему, — объясняет Екатерина Иванова. — С подобными задачами сталкиваются исключительно профессиональные спортсмены во время продолжительных интенсивных нагрузок. При этом гейнером заменяется один из приемов пищи, чаще до или после тренировки. Всем остальным людям такие коктейли не нужны».
Как и когда принимать протеин
Как отмечает Алевтина Федина, если вы питаетесь сбалансированно, то, скорее всего, получаете достаточное количество белка из пищи, и протеиновые коктейли вам не нужны: «Если у человека недостаток массы тела, то протеин, действительно, может помочь. Разумеется, предварительно нужно проконсультироваться с врачом, ведь часто у людей с недостатком веса или анорексией начинаются проблемы с внутренними органами и их функциями. И неверная дозировка протеина может навредить».
Разумеется, предварительно нужно проконсультироваться с врачом, ведь часто у людей с недостатком веса или анорексией начинаются проблемы с внутренними органами и их функциями. И неверная дозировка протеина может навредить».
Екатерина Иванова согласна — по ее словам, принимать протеины стоит лишь в случае доказанного дефицита белка: «Сами по себе протеины малополезны по сравнению с цельной пищей, богатой белком, разве что они превосходят ее в скорости усвоения, но и это не столь важно для здорового человека. А излишний белок может привести к белковой перегрузке и интоксикации».
Есть две стратегии приема протеиновых коктейлей, которые, впрочем, допустимо сочетать. Во-первых, можно принимать их с привязкой к занятиям спортом, до или после тренировки. Как отмечает Иванова, это стоит делать лишь в случае, если у спортсмена доказана нехватка белка, а получать его в достаточном количестве с обычной пищей не получается. В таком случае нужно рассчитать количество недостающего протеина и довести его с помощью коктейлей до 1,5 г на 1 кг массы тела в сутки.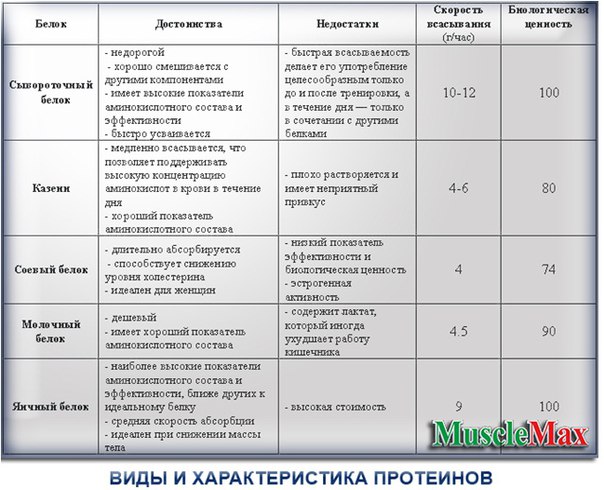
По словам специалиста, восполнять запас аминокислот, то есть получать порцию белка, необходимо каждые пять-шесть часов. Поэтому рекомендуется употреблять белок за час-два часа до тренировки, лучше вместе с другими продуктами, особенно богатыми углеводами. А следующий прием пищи надо запланировать так, чтобы он уложился в пятичасовой промежуток. При этом, как отмечает Иванова, любую пищу стоит принимать не раньше чем через 40–60 минут после тренировки — так организму будет легче адекватно и последовательно включить собственные анаболические гормоны, необходимые для роста и восстановления мышц.
Кроме того, протеиновые коктейли и другие высокобелковые продукты можно использовать как перекус. Алевтина Федина допускает такую практику, но не рекомендует систематически заменять протеиновыми коктейлями полноценные завтрак, обед или ужин: «Любой прием пищи даст вам гораздо более усваиваемые белки, жиры и углеводы. Если вы не успеваете полноценно пообедать, тогда допустимо перехватить протеиновый коктейль или батончик, но на регулярной основе так делать категорически нельзя».
Вред протеина
По словам Алевтины Фединой, протеин запрещен при заболеваниях почек и желудочно-кишечного тракта, а также тем, у кого есть аллергия на компоненты протеиновой смеси. Людям с диабетом и заболеваниями печени можно принимать его только с одобрения врача.
В целом науке неизвестно о серьезных побочных эффектах протеиновых коктейлей. При употреблении в меру и под контролем врача и тренера они считаются безвредными.
«Протеин может быть безопасным, если подобрать качественный продукт и строго соблюдать дозировки, держа на контроле показатели собственного здоровья, — продолжает врач. — Но если заменять им приемы пищи, постоянно увеличивать его количество и игнорировать обследования организма, то все может закончиться снижением функции почек».
Тем не менее есть несколько научных свидетельств о вреде протеиновых коктейлей. Главная проблема заключается в том, что их производство почти никак не регулируется ни в США, ни в России, ни в Европе. Как показали исследования, во многих порошках на американском рынке содержатся опасные тяжелые металлы, такие как свинец, мышьяк и ртуть, следы пластика бисфенола-А, пестицидов и других загрязнителей [8].
Как показали исследования, во многих порошках на американском рынке содержатся опасные тяжелые металлы, такие как свинец, мышьяк и ртуть, следы пластика бисфенола-А, пестицидов и других загрязнителей [8].
Кроме того, пока еще мало изучены риски, связанные с долговременным употреблением больших доз чистого белка. Исследование 2013 года показало, что продолжительный прием протеиновых коктейлей может повредить почкам и печени, а также нарушить баланс кальция в организме [9].
«При бесконтрольном употреблении протеина страдают почки: от повышенной нагрузки снижается их функция, начинаются воспаление и ухудшение фильтрации. Впоследствии нарушаются обмен веществ и электролитный баланс, начиная с повышения содержания азотистых продуктов, — объясняет Алевтина Федина. — Это заканчивается отравлением организма и ацидозом. Нарушение функции почек также приводит к повышенному артериальному давлению, что чревато риском инфарктов и инсультов, и часто — развитием аневризмов. Также большое количество протеина без соразмерной физической нагрузки может привести к набору веса».
Также большое количество протеина без соразмерной физической нагрузки может привести к набору веса».
Спортивные врачи — о фитнесе, лечебной физкультуре и здоровом питании
Протеин, без… — Body For Life — спортивное питание
Протеин, без преувеличения, можно назвать самой ценной и важной добавкой в спортивном питании. Ведь именно протеины (белки) являются веществами, которые отвечают за строительство мышечной структуры. Кроме того, белки отвечают за передачу генетической информации, что делает их особо ценными.
Кроме непосредственной и самой важной для нас функции улучшения роста мышечной массы, протеины купить которые вы можете в магазине Body For Life, способствуют улучшению тонуса мышц и, как следствие, приводят к отличной физической форме. Ценность протеинов для всех спортсменов также заключается в блокировке разрушения мышечных волокон, которое начинается через непродолжительное время после окончания тренировки.
Исходя из вышесказанного, ясно, что купить протеин в Киеве необходимо всем бодибилдерам, которые мечтают об идеальной фигуре, четко прорисованном прессе и мышцах Вина Дизеля.
Мы предлагаем протеин в Киеве от разных фирм-производителей, разной формы выпуска и фасовки. От этих факторов и будет зависеть окончательная цена протеина.
Поскольку спортивное питание протеины отличается многообразием функций и огромным значением в наращивании мышечной массы, решение «куплю протеин» должно быть осознанным и подкрепленным знанием о его основных видах.
На протеин цена будет зависеть от его степени усвоения: комплексный протеин, медленный и быстрый. Комплексными называются такие виды протеинов, которые насыщают организм максимально возможной концентрацией аминокислот за очень короткое время после приема, а также обеспечивают медленное усвоение белков в дальнейший период. Заказать протеин комплексного характера можно, в состав которого входят казеин, сывороточный белок, соевый белок, яичный протеин.
Медленные протеины (казеин) как следует из названия, отличаются длительным периодом расщепления, поэтому купить протеины такого типа необходимо для приема перед сном или в начале трудового дня. Иногда к категории медленных относят и комплексные протеины.
Спортивное питание протеин быстрый, который представлен сывороточным протеином, может выпускаться в форме концентрата, изолята и гидролизата, которые отличаются степенью очистки белка. На протеины цена очень сильно зависит и от этого фактора, поскольку эффективность протеина зависит от степени очищения белка.
Цены на протеин одни из самых высоких на изолят белка, поскольку это самая очищенная форма протеина, в которой процент белка достигает 97%, а полное расщепление происходит примерно за 3 часа.
Концентрат белка – наиболее доступная форма, которая отличается более длительным временем расщепления, за счет присутствия в добавке лактозы и жира.
Гидролизатом протеина называется частично ферментированный белок, благодаря чему время всасывания уменьшается до 30 минут. Это происходит за счет того, что для расщепления гидролизата организму не требуется затрачивать энергию. Именно по этой причине на данный протеин цены довольно высокие.
Это происходит за счет того, что для расщепления гидролизата организму не требуется затрачивать энергию. Именно по этой причине на данный протеин цены довольно высокие.
Прием быстрого протеина необходим людям, которым тяжело набрать вес, склонным к излишней худобе. Для таких спортсменов рекомендуется принимать быстрый протеин несколько раз в день. Для всех, кто страдает от избытка веса, лучше всего принимать быстрый протеин перед и после тренировки, а также утром.
Важно знать, что протеин, который чаще всего выпускается в форме порошка, лучше всего растворять в молоке, соке или воде.
Протеин купить в Киеве в нашем магазине очень просто – достаточно выбрать нужную вам добавку, которая полностью соответствует целям, заказать и ждать доставки.
Белок, либо протеин, является одной из фундаментальных составляющих всех живых организмов. Именно белок отвечает за сохранение и передачу генетического кода, белок является строительным материалом, основой всех тканей, в том числе и мышечной, поэтому протеин столь популярен в качестве спортивного питания.
Протеин, являющийся, пожалуй, самой важной пищевой добавкой в бодибилдинге, обладает массой полезных функций. Главной функцией протеина, конечно же, является стимуляция роста мышц, которая крайне необходима для стабильного роста мышечной массы. Кроме того, белок способствует поддержанию высокого мышечного тонуса и хорошей физической формы. Очень важной способностью протеина является упреждение разрушения мышечных волокон, что является прямым показанием для всех спортсменов и бодибилдеров.
Протеин классифицируется на животный и растительный, последний, в свою очередь, подразделяется на соевый, пшеничный, рисовый, и другие, по видам растений, из которых он добывается. Протеин животного происхождения бывает яичный, молочный и мясной, который из-за сложностей обработки и вкусовых качеств не используется в спортивном питании.
У нас вы можете купить протеин различных типов, в зависимости от ваших предпочтений и требований организма. Купить протеин можно любой фасовки, с дополнительными добавками, усиливающими действие белка.
Самым ходовым является молочный протеин – казеиновый либо сывороточный – поскольку именно белок, содержащийся в молоке, отличается наиболее сбалансированным составом аминокислот и обладает высокой биологической ценностью.
Протеин, цена которого вполне приемлема, является незаменимой добавкой, если вы нацелены на достижение видимых результатов за краткий промежуток времени.
Прежде чем купить протеин, следует определить разницу между белком казеиновым и сывороточным. Основная разница заключается в степени и скорости усвоения в организме человека. Казеин – это высокомолекулярное белковое соединение, которое усваивается на протяжении 5-6 часов. Белок из сыворотки является низкомолекулярным соединением, которое усваивается очень быстро. Таким образом, какой купить протеин – сывороточный или белковый, полностью зависит от специфики ваших тренировок. В идеале, необходимо комбинировать прием белка – в длительных перерывах между тренировками принимать протеин казеиновый, а после тренировки – сывороточный, который сразу же усвоится и выполнит свои функции – обеспечит мышцы строительным материалом, повысит тонус. Самым выгодным решением будет купить протеин комбинированный, в состав которого входят белки разных типов, который обеспечит постоянное насыщение организма питательным веществом.
Самым выгодным решением будет купить протеин комбинированный, в состав которого входят белки разных типов, который обеспечит постоянное насыщение организма питательным веществом.
В нашем магазине протеин, цена которого зависит от емкости упаковки и производителя, представлен в разных формах – в виде протеиновых коктейлей или порошков. Протеин, выпускаемый в форме коктейля, уже готов к употреблению, что очень удобно, в особенности, после тренировки. Порошкообразный протеин необходимо развести в любой жидкости – воде или соке, но лучше всего в молоке. Протеин выпускается с дополнительными вкусовыми добавками – вы можете выбирать протеиновые коктейли с любыми вкусами, что сделает их прием намного приятнее.
Цена на протеин не должна останавливать вас на пути к идеальному телу, тем более, что в нашем магазине цена протеина очень привлекательна и доступна всем.
Помните, что цена протеина может стать ценой вашей атлетической фигуры, поэтому подходите к выбору добавки очень обстоятельно.
Какие виды протеинов бывают? Выбираем подходящий.
Какие виды протеинов бывают? Выбираем подходящий
Вы активно занимаетесь в зале, прорабатываете все группы мышц, но желаемого результата так и не достигли? Вы не принимаете специализированное спортивное питание? Напрасно. Ведь для наращивания мышечной массы необходимо принимать протеин. Многие начинающие спортсмены могут запутаться при выборе подходящей спортивной добавки, потому как существует несколько видов протеинов. В этой статье ми поможем вам разобраться и выбрать именно тот вид белка, который преумножит ваши достижения в зале и создаст те рельефы о которых вы так мечтали.
Протеин или попросту белок – основной источник полезных аминокислот, которые принимают активное участие в построении мышечной ткани человека. Недостаточное количество этого вещества способствует замедлению процесса роста мышц и их истощению. Сам протеин не усваивается в ткани. Он расщепляется на аминокислоты, которые и служат «строительным материалом» для ваших мышц.
В процессе распада на составляющие, белок может выполнят ряд специфических функций: способствовать наращиванью мышечной массы, поддерживать форму спортсмена, влиять на понижение жировых отложений в организме. Для достижения желаемого результата вам нужно знать, какой вид протеина принимать. Существует 5 видов протеина за типом происхождения.
Первый, и всем известный белок – яичный. Все предыдущие поколения бодибилдеров принимали только этот продукт. В нем содержится большое количество аминокислот, что способствуют увеличению сухой мышечной массы. Почти не содержит углеводов. Можно употреблять в любое время суток.
Второй по счету, но не по значению – сывороточный протеин. Его главное преимущество – большая скорость расщепления на аминокислоты. Чаще всего этот вид протеина используют как добавку перед тренировками и после их. Сывороточный белок имеет несколько видов: концентрат сывороточного протеина, изолят, гидроизолят и казеин. Они отличаются по чистоте входящего белка.
- Концентрат – самый дешевый вид. Возможны примеси жиров и лактозы. Отлично подходит для спортсменов на первых этапах тренировок.
- Изолят протеина – быстроусвояемый вид белка. В состав не входят примеси, очень чист. Рекомендуется для атлетов, которые соблюдают низкоуглеводную диету. Можно принимать до и после тренировок.
- Гидроизолят – самый чистый вид сывороточного белка. Очень быстро усваивается организмом, благодаря пептидам, что входят в состав. Главным его недостатком является очень высокая цена из–за сложностей в производстве.
- Казеин – на протяжении значительного периода времени расщепляется на более простые составляющие. Можно использовать в качестве основного питания. Принимать лучше перед сном. Он способствует восстановлению мышц после истощительных тренировок и их росту.
Растительные белки отлично подойдут тем спортсменам, организм которых не переносит белки животного происхождения, а также атлетам – вегетарианцам. Самый популярный – соевый протеин. Он включает глютамин, BCAA – комплекс и аргинин. Эти компоненты положительно влияют на процесс восстановления мышечных тканей. Можно принимать на протяжении всего дня, до тренировки и после.
Самый популярный – соевый протеин. Он включает глютамин, BCAA – комплекс и аргинин. Эти компоненты положительно влияют на процесс восстановления мышечных тканей. Можно принимать на протяжении всего дня, до тренировки и после.
Изолят молочного белка — вид протеина, который принимают в комплексе с другими группами белков. В его состав входят казеин и сывороточный белок. Богат на аминокислоты. Употреблять можно на протяжении всего дня. Не дает видимых результатов без дополнительных компонентов.
НИИ Гигиены Питания Киева было предложено использовать изолят рыбного белка для изготовления спортивного питания. После ряда исследований ученые установили, что необходимо в несколько раз больше времени для распада протеина на аминокислоты, нежели для казеина. На сегодняшний день не применяется в изготовлении спортивного питания.
Таким образом, вы уже знаете, чем отличается тот или иной вид протеина. И можете подобрать для себя идеальный вариант, чтобы закрепить ваши результаты в зале.
Качественные протеины и спортивное питание интернет магазин Украина. Читайте подробнее в описании товаров о наших протеинах.
19.1: Полипептиды и белки — Biology LibreTexts
Цели обучения
- Определите или опишите следующее:
- аминокислота
- Группа «Р»
- пептидная связь
- пептид
- полипептид
- первичная структура белка
- вторичная структура белка
- структура третичного белка
- Четвертичная структура белка
- ген
- Опишите, как первичная структура белка или полипептида в конечном итоге определяет его окончательную трехмерную форму.
- Опишите, как порядок нуклеотидных оснований в ДНК в конечном итоге определяет окончательную трехмерную форму белка или полипептида.
Аминокислоты — строительные блоки для белков. Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH. В белках обычно содержится 20 различных аминокислот, а на молекулу белка часто приходится 300 и более аминокислот. Каждая аминокислота отличается своей группой «R». Группа «R» аминокислоты представляет собой остаток – молекулы, то есть часть, отличную от аминогруппы, кислотной группы и центрального атома углерода.Каждая аминокислота имеет уникальную группу «R», и уникальные химические свойства аминокислоты зависят от свойств ее группы «R» (рисунок \ (\ PageIndex {1} \)).
Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH. В белках обычно содержится 20 различных аминокислот, а на молекулу белка часто приходится 300 и более аминокислот. Каждая аминокислота отличается своей группой «R». Группа «R» аминокислоты представляет собой остаток – молекулы, то есть часть, отличную от аминогруппы, кислотной группы и центрального атома углерода.Каждая аминокислота имеет уникальную группу «R», и уникальные химические свойства аминокислоты зависят от свойств ее группы «R» (рисунок \ (\ PageIndex {1} \)).
Для образования полипептидов и белков аминокислоты соединяются пептидными связями, в которых амино или NH 2 одной аминокислоты связываются с карбоксильной (кислотной) или COOH-группой другой аминокислоты, как показано на (Рисунок \ ( \ PageIndex {2} \) и рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {2} \) : Пептидные связи. Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.
Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.Пептид — это две или более аминокислоты, соединенные вместе пептидными связями, а полипептид — это цепь из многих аминокислот. Белок содержит один или несколько полипептидов. Следовательно, белки представляют собой длинные цепи аминокислот, удерживаемые вместе пептидными связями.
Рисунок \ (\ PageIndex {3} \) : Образование пептидной связи.Пептидная связь образуется, когда аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты. Фактический порядок аминокислот в белке называется его первичной структурой (рисунок \ (\ PageIndex {4} \)) и определяется ДНК. Как будет показано далее в этом разделе, ДНК разделена на функциональные единицы, называемые генами. Ген представляет собой последовательность дезоксирибонуклеотидных оснований вдоль одной цепи ДНК, которая кодирует функциональный продукт — определенную молекулу информационной РНК, транспортной РНК или рибосомной РНК. Продукт обычно представляет собой информационную РНК (мРНК), и мРНК в конечном итоге приводит к синтезу полипептида или белка. Поэтому обычно говорят, что порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
Продукт обычно представляет собой информационную РНК (мРНК), и мРНК в конечном итоге приводит к синтезу полипептида или белка. Поэтому обычно говорят, что порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
Вторичная структура белка обусловлена водородными связями, которые образуются между атомом кислорода одной аминокислоты и атомом азота другой. Это придает белку или полипептиду двумерную форму альфа-спирали или бета-складчатого листа (рис. \ (\ PageIndex {5} \)).
\ (\ PageIndex {5} \)).
В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру. Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру (рисунок \ (\ PageIndex {6} \)). В некоторых белках, таких как молекулы антител и гемоглобин, несколько полипептидов могут связываться вместе, образуя четвертичную структуру (рисунок \ (\ PageIndex {7} \)).
Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру (рисунок \ (\ PageIndex {6} \)). В некоторых белках, таких как молекулы антител и гемоглобин, несколько полипептидов могут связываться вместе, образуя четвертичную структуру (рисунок \ (\ PageIndex {7} \)).

Как будет показано далее в этом разделе, во время синтеза белка порядок нуклеотидных оснований в гене транскрибируется в комплементарную цепь мРНК, которая затем транслируется тРНК в правильный порядок аминокислот для этого полипептида или белка.Следовательно, порядок дезоксирибонуклеотидных оснований в ДНК определяет порядок аминокислот в белках. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами, порядок аминокислот для каждого белка определяет его окончательную трехмерную форму, которая, в свою очередь, определяет функцию этого белка (например, с каким субстратом будет реагировать фермент, с какими эпитопами Fab антитела будет сочетаться с рецепторами, с которыми будет связываться цитокин).
Рисунок \ (\ PageIndex {7} \) : Четвертичная структура белка.Четвертичная структура белка обусловлена соединением нескольких полипептидов, как в случае молекул антител. Схематическая диаграмма базовой единицы иммуноглобулина (антитела) Fab Fc тяжелой цепи (состоит из VH, Ch2, шарнира, областей Ch3 и Ch4: от N-конца) легкой цепи (состоит из областей VL и CL: от N-конца) антигена шарнирные области сайта связывания (*) -SS- означают дисульфидные связи. (CC-SA-BY 3.0; Ы_тамбе).
(CC-SA-BY 3.0; Ы_тамбе).Сводка
- Аминокислоты — это строительные блоки для белков.В белках обычно содержится 20 различных аминокислот, а на молекулу белка часто приходится 300 и более аминокислот.
- Все аминокислоты содержат аминогруппу или группу NH 2 и карбоксильную (кислотную) группу или группу COOH.
- Для образования полипептидов и белков аминокислоты соединяются пептидными связями, в которых амино или NH 2 одной аминокислоты связываются с карбоксильной (кислотной) или COOH-группой другой аминокислоты.
- Пептид — это две или более аминокислоты, соединенные вместе пептидными связями; полипептид — это цепь из множества аминокислот; и белок содержит один или несколько полипептидов.Следовательно, белки представляют собой длинные цепи аминокислот, удерживаемые вместе пептидными связями.
- Фактический порядок аминокислот в белке называется его первичной структурой и определяется ДНК.
- Порядок дезоксирибонуклеотидных оснований в гене определяет аминокислотную последовательность конкретного белка.
 Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка. - Вторичная структура белка обусловлена водородными связями, которые образуются между атомом кислорода одной аминокислоты и атомом азота другой и придают белку или полипептиду двумерную форму альфа-спирали или бета-складчатого листа. .
- В глобулярных белках, таких как ферменты, длинная цепь аминокислот складывается в трехмерную функциональную форму или третичную структуру. Это связано с тем, что определенные аминокислоты с сульфгидрильными или SH-группами образуют дисульфидные (S-S) связи с другими аминокислотами в той же цепи.Другие взаимодействия между R-группами аминокислот, такие как водородные связи, ионные связи, ковалентные связи и гидрофобные взаимодействия, также вносят вклад в третичную структуру.
- В некоторых белках, таких как молекулы антител, несколько полипептидов могут связываться вместе с образованием четвертичной структуры.

Авторы и авторство
Углеводы, белки и жиры — нарушения питания
Белки состоят из единиц, называемых аминокислотами, связанных друг с другом в сложные образования.Поскольку белки представляют собой сложные молекулы, организму требуется больше времени, чтобы их расщепить. В результате они являются гораздо более медленным и долговечным источником энергии, чем углеводы.
Всего 20 аминокислот. Организм синтезирует некоторые из них из компонентов внутри тела, но не может синтезировать 9 аминокислот, называемых незаменимыми аминокислотами. Их необходимо употреблять в пищу. Каждому нужны 8 из этих аминокислот: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.Младенцам также нужен девятый — гистидин.
Процент белка, который организм может использовать для синтеза незаменимых аминокислот, варьируется от белка к белку. Организм может использовать 100% белка, содержащегося в яйцах, и высокий процент белков, содержащихся в молоке и мясе. Организм может использовать чуть меньше половины белка, содержащегося в большинстве овощей и злаков.
Организм может использовать чуть меньше половины белка, содержащегося в большинстве овощей и злаков.
Белок необходим организму для поддержания и замены тканей, а также для функционирования и роста. Белок обычно не используется для получения энергии. Однако, если организм не получает достаточно калорий из других питательных веществ или жира, хранящегося в организме, белок расщепляется на кетоновые тела, которые используются для получения энергии.Если белка потребляется больше, чем необходимо, организм расщепляет белок и откладывает его компоненты в виде жира.
В организме содержится большое количество белка. Белок, главный строительный блок организма, является основным компонентом большинства клеток. Например, мышцы, соединительные ткани и кожа состоят из белка.
Взрослым необходимо съедать около 60 граммов белка в день (0,8 грамма на килограмм веса или от 10 до 15% от общего количества калорий). Взрослым, которые пытаются нарастить мышцы, нужно немного больше.Детям тоже нужно больше, потому что они растут. Людям, которые ограничивают количество калорий для похудения, обычно требуется большее количество белка, чтобы предотвратить потерю мышечной массы во время похудения. Пожилым людям может потребоваться более высокий уровень белка до 1,2 г / кг массы тела. Однако это количество является чрезмерным и потенциально опасным при определенных состояниях, таких как почечная недостаточность и почечная недостаточность. Исследования также показывают, что белок более насыщает (помогает людям дольше чувствовать сытость), чем углеводы и жиры.
Людям, которые ограничивают количество калорий для похудения, обычно требуется большее количество белка, чтобы предотвратить потерю мышечной массы во время похудения. Пожилым людям может потребоваться более высокий уровень белка до 1,2 г / кг массы тела. Однако это количество является чрезмерным и потенциально опасным при определенных состояниях, таких как почечная недостаточность и почечная недостаточность. Исследования также показывают, что белок более насыщает (помогает людям дольше чувствовать сытость), чем углеводы и жиры.
Белок или ДНК? — Eniscuola
Белок или ДНК?
Сегодня белки образуются в соответствии с инструкциями, которые дает ДНК (дезоксирибонуклеиновая кислота), которая, в свою очередь, синтезируется специфическими ферментами, которые являются белками. Итак, что было раньше, белок или ДНК?
Нуклеиновые кислоты (ДНК и РНК) состоят из нуклеотидов, которые представляют собой молекулы, образованные одним сахаром с 5 атомами углерода, одной молекулой фосфорной кислоты и нитрооснованием.
Сахара с 5 атомами углерода — это рибоза, которая содержится в РНК (рибонуклеиновой кислоте), и дезоксирибоза в ДНК.Нитрооснования — это соединения с основными свойствами (что означает, что они могут получать протоны), которые имеют атомы нитро и представляют собой: аденин, цитозин, гуанин, тиамин и урацил. Мы находим первые четыре основания в ДНК, тогда как в РНК первые три и… ДНК содержит генетическую информацию всех живых организмов.
Белки — это большие молекулы, состоящие из 20 маленьких молекул, называемых аминокислотами. У всех живых организмов одни и те же 20 аминокислот, но они расположены по-разному, и это определяет различную функцию каждого белка.Белки выполняют все жизненно важные функции организма, но уникальное расположение аминокислот в них определяется определенной последовательностью нитрооснований в ДНК. РНК передает сообщение, содержащееся в ДНК, в область клетки, где синтезируется белок, и также должна будет выполнить синтез.
Итак, у живого существа нуклеиновые кислоты содержат информацию, которая передается белкам, отвечающим за многие функции, включая восстановление этих нуклеиновых кислот.
Кажется маловероятным, что две молекулы, столь важные для жизни, появились одновременно, но, с другой стороны, кажется абсурдным иметь одну без другой.
Некоторые биологи, среди которых Фрэнсис Крик и Лесли Оргел, каждый по отдельности, предположили, что существует соединение, которое может как дублироваться без помощи белков, так и катализировать каждую фазу синтеза белка. Предполагается, что это соединение является РНК, потому что это более простая молекула по сравнению с ДНК и ее легче синтезировать.
Впоследствии многие исследования подтвердили это предположение, включая открытие ферментов, состоящих из РНК, поэтому они поняли, что не все химические реакции выполняются белками.Им даже удалось модифицировать некоторые молекулы РНК с помощью ферментативных функций, чтобы они могли связывать нуклеотиды самой РНК.
До сих пор невозможно точно доказать, что у предка клетки была РНК, которая могла синтезировать белки, а также дублировать и модифицировать себя; но еще важнее понять, как родилась эта РНК.
Мы уже видели, как синтез аденина, одного из четырех азотистых оснований ДНК, был получен в лабораторных экспериментах. Впоследствии другие реакции между соединениями, существовавшими в этой древней атмосфере, создали также другие три азотистых основания нуклеиновых кислот.
Отличаются ли природные белки от полипептидов со случайной последовательностью? Классификация естественных и случайных белков с использованием эволюционной нейронной сети
Abstract
Существующие белки — прекрасный результат естественного отбора или это случайные последовательности, слегка отредактированные эволюцией? Этот вопрос долгое время озадачивал биохимиков, и несколько групп исследовали его, сравнивая природные последовательности белков с совершенно случайными, и пришли к противоречивым выводам.Предыдущие работы в литературе были сосредоточены на анализе первичной структуры в попытке определить возможную сигнатуру эволюционного редактирования. Напротив, в этой работе мы сравниваем набор из 762 природных белков со средней длиной 70 аминокислот и такое же количество полностью случайных белков сопоставимой длины на основе их структурных особенностей. Мы используем специальный алгоритм Evolutionary Neural Network Algorithm (ENNA) , чтобы оценить, редактируются ли природные белки из случайных полипептидов, и в какой степени, с использованием 11 различных переменных, связанных со структурой ( i.е. чистый заряд, объем, площадь поверхности, катушка, альфа-спираль, бета-лист, процент катушки, процент альфа-спирали, процент бета-листа, процент вторичной структуры и гидрофобность поверхности). Алгоритм ENNA способен правильно отличать натуральные белки от случайных с точностью 94,36%. Кроме того, мы изучаем структурные особенности 32 случайных полипептидов, ошибочно классифицированных как природные, чтобы выявить какое-либо структурное сходство с природными белками. Результаты показывают, что случайные белки, неправильно классифицированные алгоритмом ENNA, демонстрируют значительное кратное сходство с частями или субдоменами существующих белков при атомном разрешении.
Напротив, в этой работе мы сравниваем набор из 762 природных белков со средней длиной 70 аминокислот и такое же количество полностью случайных белков сопоставимой длины на основе их структурных особенностей. Мы используем специальный алгоритм Evolutionary Neural Network Algorithm (ENNA) , чтобы оценить, редактируются ли природные белки из случайных полипептидов, и в какой степени, с использованием 11 различных переменных, связанных со структурой ( i.е. чистый заряд, объем, площадь поверхности, катушка, альфа-спираль, бета-лист, процент катушки, процент альфа-спирали, процент бета-листа, процент вторичной структуры и гидрофобность поверхности). Алгоритм ENNA способен правильно отличать натуральные белки от случайных с точностью 94,36%. Кроме того, мы изучаем структурные особенности 32 случайных полипептидов, ошибочно классифицированных как природные, чтобы выявить какое-либо структурное сходство с природными белками. Результаты показывают, что случайные белки, неправильно классифицированные алгоритмом ENNA, демонстрируют значительное кратное сходство с частями или субдоменами существующих белков при атомном разрешении. В целом, наши результаты показывают, что природные белки в значительной степени отредактированы из случайных полипептидов, и эволюционное редактирование может быть легко обнаружено с помощью анализа структурных особенностей. Кроме того, мы также показываем, что ENNA, используя простые структурные дескрипторы, может предсказать, является ли белковая цепь естественной или случайной.
В целом, наши результаты показывают, что природные белки в значительной степени отредактированы из случайных полипептидов, и эволюционное редактирование может быть легко обнаружено с помощью анализа структурных особенностей. Кроме того, мы также показываем, что ENNA, используя простые структурные дескрипторы, может предсказать, является ли белковая цепь естественной или случайной.
Образец цитирования: De Lucrezia D, Slanzi D, Poli I, Polticelli F, Minervini G (2012) Отличаются ли природные белки от полипептидов со случайными последовательностями? Естественный vs.Классификация случайных белков с использованием эволюционной нейронной сети. PLoS ONE 7 (5): e36634. https://doi.org/10.1371/journal.pone.0036634
Редактор: Рикар В. Соле, Университет Помпеу Фабра, Испания
Поступила: 19 декабря 2011 г .; Дата принятия: 4 апреля 2012 г .; Опубликовано: 16 мая 2012 г.
Авторские права: © 2012 De Lucrezia et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа частично поддержана Fondazione di Venezia (Венеция, Италия) в рамках проекта DICE (Информационные комбинаторные эксперименты по дизайну). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Вопрос о том, являются ли существующие белки прекрасным результатом естественного отбора или, скорее, они представляют собой случайные сополимеры, слегка отредактированные эволюцией, в течение последних двадцати лет вызывал интенсивную дискуссию о его влиянии на происхождение жизни [1], макромолекулы. этиология [2], [3] и эволюция в целом [3] — [5].
этиология [2], [3] и эволюция в целом [3] — [5].
С молекулярной точки зрения эволюцию белка можно рассматривать как процесс поиска и оптимизации в пространстве последовательностей для определения подходящих последовательностей, способных выполнять функциональные требования. Кроме того, любое биологическое требование (например, катализ, связывание, структура) должно рассматриваться как многокритериальная проблема, чтобы любой функциональный белок был компромиссным решением для различных проблем, таких как функция, растворимость, стабильность и клеточная среда (например, взаимодействие с другими белками).Таким образом, существующие белки можно рассматривать как высокоспецифичный продукт долгой и сложной эволюционной истории, и, соответственно, они так же уникальны, как и эволюционный путь, который их произвел.
Эта точка зрения была оспорена несколькими авторами, которые подняли вопрос о том, являются ли белки уникальным продуктом эволюции или чистой случайностью [4] и до какой степени. Рациональное значение, выходящее за рамки этого аргумента, основывается на обширности пространства последовательностей, которое экспоненциально растет с длиной белка.Это пространство настолько астрономически велико, что исчерпывающий поиск и оптимизация невозможны [5], [6], и поэтому некоторая случайность кажется неизбежной в процессе эволюции. Более того, некоторые авторы выдвигают идею, что существующие белки являются простым результатом случайного процесса, продиктованного одновременным взаимодействием нескольких независимых причин, так что существующие белки можно рассматривать как просто замороженную случайность [1].
Рациональное значение, выходящее за рамки этого аргумента, основывается на обширности пространства последовательностей, которое экспоненциально растет с длиной белка.Это пространство настолько астрономически велико, что исчерпывающий поиск и оптимизация невозможны [5], [6], и поэтому некоторая случайность кажется неизбежной в процессе эволюции. Более того, некоторые авторы выдвигают идею, что существующие белки являются простым результатом случайного процесса, продиктованного одновременным взаимодействием нескольких независимых причин, так что существующие белки можно рассматривать как просто замороженную случайность [1].
Птицын был первым, кто выступил против общепринятого мнения, что белки являются результатом направленного отбора в ходе биологической эволюции.В своей работе он предположил, что типичные трехмерные структуры глобулярных белков являются внутренними особенностями случайных последовательностей аминокислотных остатков. Таким образом, Птицын пришел к выводу, что первичные структуры белков являются «в основном примерами случайных аминокислотных последовательностей, слегка отредактированных в ходе биологической эволюции для придания им некоторого дополнительного (функционального) значения» [7] — [9]. Эта гипотеза была подтверждена Вейссом и Герцелем, которые исследовали возможные корреляционные функции в больших наборах негомологичных белковых последовательностей.Они обнаружили, что корреляция в первичных последовательностях белков является слабой и существенно не отличается от корреляции, обнаруженной в случайных суррогатах [10]. В более поздней работе два автора изучали сложность больших наборов неизбыточных белков и набора данных случайно сгенерированных суррогатов с помощью ряда различных оценщиков для измерения энтропии Шеннона и алгоритмической сложности. Их результаты показывают, что белки довольно близки к случайным последовательностям, действительно, природные белки имеют примерно 99% сложности случайных суррогатов с таким же аминокислотным составом.Эти результаты подтверждают идею о том, что первичные последовательности белков можно рассматривать как слегка отредактированные случайные строки [11]. К таким же общим выводам пришли и другие авторы, которые подошли к той же проблеме с другой точки зрения.
Эта гипотеза была подтверждена Вейссом и Герцелем, которые исследовали возможные корреляционные функции в больших наборах негомологичных белковых последовательностей.Они обнаружили, что корреляция в первичных последовательностях белков является слабой и существенно не отличается от корреляции, обнаруженной в случайных суррогатах [10]. В более поздней работе два автора изучали сложность больших наборов неизбыточных белков и набора данных случайно сгенерированных суррогатов с помощью ряда различных оценщиков для измерения энтропии Шеннона и алгоритмической сложности. Их результаты показывают, что белки довольно близки к случайным последовательностям, действительно, природные белки имеют примерно 99% сложности случайных суррогатов с таким же аминокислотным составом.Эти результаты подтверждают идею о том, что первичные последовательности белков можно рассматривать как слегка отредактированные случайные строки [11]. К таким же общим выводам пришли и другие авторы, которые подошли к той же проблеме с другой точки зрения. Крукс и Бреннер попытались выявить корреляцию между вторичной структурой белка и содержанием аминокислот в первичных последовательностях. Результаты подтвердили вывод о том, что корреляции на уровне первичной последовательности были по существу неинформативными и что информационное содержание белковой последовательности можно эффективно объяснить, допуская случайную модель генерации белка [12].Лавель и Пирсон исследовали, влияют ли ограничения на укладку и предпочтения вторичной структуры на аминокислотный состав и использование в белках. Авторы сравнили частоты четырех- и пяти-аминокислотных участков в наборе данных неизбыточных белков с частотами, ожидаемыми для случайных последовательностей, созданных с помощью четырех независимых моделей. Их результаты показали, что аминокислотные отрезки не оказываются существенно смещенными, действительно, первичные последовательности оказываются «при очень небольшом количестве ограничений, по большей части они кажутся случайными» [13].
Крукс и Бреннер попытались выявить корреляцию между вторичной структурой белка и содержанием аминокислот в первичных последовательностях. Результаты подтвердили вывод о том, что корреляции на уровне первичной последовательности были по существу неинформативными и что информационное содержание белковой последовательности можно эффективно объяснить, допуская случайную модель генерации белка [12].Лавель и Пирсон исследовали, влияют ли ограничения на укладку и предпочтения вторичной структуры на аминокислотный состав и использование в белках. Авторы сравнили частоты четырех- и пяти-аминокислотных участков в наборе данных неизбыточных белков с частотами, ожидаемыми для случайных последовательностей, созданных с помощью четырех независимых моделей. Их результаты показали, что аминокислотные отрезки не оказываются существенно смещенными, действительно, первичные последовательности оказываются «при очень небольшом количестве ограничений, по большей части они кажутся случайными» [13].
Эти результаты подтверждают вывод о том, что первичные структуры существующих белков в основном представляют собой случайные аминокислотные последовательности, которые были только «отредактированы» и «уточнены» в ходе биологической эволюции для того, чтобы обрести стабильность и функцию.
Несмотря на эти результаты, другие авторы пришли к прямо противоположному выводу. Панке и его сотрудники попытались выделить тонкие отклонения существующих белковых последовательностей от чистой случайности путем отображения белковых последовательностей в одномерном пространстве путем декодирования первичных последовательностей белков с использованием химико-физических дескрипторов, таких как кулоновское взаимодействие, гидрофобное / гидрофильное взаимодействие и водородные связи [ 6].Используя эти три разных дескриптора, авторы обнаружили явные отклонения от чистой случайности. Авторы рассуждали, что эти отклонения свидетельствуют о физически обусловленном этапе эволюции. В частности, авторы утверждают, что эти отклонения, по-видимому, направлены на минимизацию энергетического расстройства трехмерной структуры, что свидетельствует о явном эволюционном отпечатке пальца.
Мунтяну и его сотрудники [14] использовали звездную сеть Рэндича для преобразования первичной структуры белка в топологические индексы, которые описывают реальный белок как сеть аминокислот (узлов), соединенных пептидными связями (арками). Авторы сравнили два набора белков: набор из 1046 природных белковых цепей, полученных из CulledPDB [15], и второй набор данных с таким же размером случайных аминокислотных последовательностей. Авторы впервые разработали простую модель классификации, основанную на статистических линейных методологиях, способную эффективно классифицировать природные / случайные белки с замечательной предсказательной способностью 90,77%. Таким образом, работы Панде и Мунтяну предполагают, что существующие белки действительно значительно отличаются от случайных сополимеров, а природные последовательности действительно демонстрируют четкие эволюционные признаки.
Авторы сравнили два набора белков: набор из 1046 природных белковых цепей, полученных из CulledPDB [15], и второй набор данных с таким же размером случайных аминокислотных последовательностей. Авторы впервые разработали простую модель классификации, основанную на статистических линейных методологиях, способную эффективно классифицировать природные / случайные белки с замечательной предсказательной способностью 90,77%. Таким образом, работы Панде и Мунтяну предполагают, что существующие белки действительно значительно отличаются от случайных сополимеров, а природные последовательности действительно демонстрируют четкие эволюционные признаки.
В целом существует обширная литература, конкретно посвященная вопросу о том, существенно ли существующие белки отредактированы из случайных полипептидов или, скорее, они «представляют собой запомненные случайные последовательности», однако эти работы приходят к противоречивым выводам и не дают окончательного ответа. Несмотря на разные результаты, все эти работы имеют общую черту: они пытаются решить вопрос, исследуя первичные последовательности белков.
И наоборот, в этой работе мы расширяем и уточняем предыдущее исследование [16], сравнивая набор из 762 природных белков со средней длиной 70 аминокислот и равного количества полностью случайных белков сопоставимой длины на основе их структурных особенностей. .Дальнейшее объяснение состоит в том, что в подавляющем большинстве случаев белки выполняют свои физиологические функции благодаря своей трехмерной форме, поэтому любые возможные признаки эволюционного редактирования следует искать на уровне третичной структуры, а не на уровне первичной. один. Для достижения этой цели мы использовали 11 различных переменных, связанных со структурой, для разработки алгоритма эволюционной нейронной сети (ENNA), способного правильно отличать природные белки от случайных с точностью до 94.36%. Кроме того, анализ структурных и функциональных особенностей некоторых случайных полипептидов, ошибочно классифицированных алгоритмом ENNA как естественные, выявил значительную структурную гомологию с существующими белками.
В совокупности наши результаты показывают, что природные белки в значительной степени отредактированы из случайных полипептидов, и эволюционное редактирование можно легко обнаружить, анализируя структурные особенности. Кроме того, мы также показываем, что алгоритм эволюционной нейронной сети, использующий простые структурные дескрипторы, может предсказать, является ли белковая цепочка естественной или случайной.
Результаты
Первоначально мы исследовали набор из 902 природных белков (Nat), третичная структура которых была экспериментально определена (с помощью ЯМР или рентгеновских лучей), и набор из 20494 полностью случайных последовательностей белков (Rnd), сгенерированных с использованием однородной аминокислотной частоты. распределение, не имеющее значительной гомологии с естественными. Набор данных Nat был получен из Protein Data Bank [17] и состоит из природных белков с экспериментально определенной 3D-структурой и средней длиной 70 аминокислот (в диапазоне от 55 до 95 аминокислот), сравнимой с длиной Rnd ( 70 аминокислотных длинных последовательностей). Набор данных был очищен, чтобы удалить фрагменты белка и белки, участвующие в рибосомном комплексе. Анализ набора данных Nat показал, что существует полное представление о типах складок белков, даже несмотря на то, что белки с расширенным бета-листом недостаточно представлены из-за ограничений по длине.
Набор данных был очищен, чтобы удалить фрагменты белка и белки, участвующие в рибосомном комплексе. Анализ набора данных Nat показал, что существует полное представление о типах складок белков, даже несмотря на то, что белки с расширенным бета-листом недостаточно представлены из-за ограничений по длине.
Одиннадцать различных переменных, связанных со структурой, были рассчитаны для обоих наборов данных: чистый заряд, объем, площадь поверхности, катушка, альфа-спираль, бета-лист, процент катушки, процент альфа-спирали, процент бета-листа, процент вторичной структуры и поверхности. гидрофобность.Переменные, связанные со структурой, были рассчитаны непосредственно из файла PDB для набора данных Nat, тогда как те же самые переменные были вычислены из моделей третичной структуры для набора данных Rnd.
Сначала мы выполнили предварительную обработку данных, чтобы удалить выбросы, которые могут повлиять на последующий анализ. Выбросы были идентифицированы как белки с одной или несколькими структурными переменными, заметно отклоняющимися от среднего значения. В нашем случае мы считали выбросом любой белок с одной или несколькими структурными переменными, попадающий в хвост оценочного распределения вероятностей (т.е. p <0,005 и p> 0,995). В нашей выборке мы обнаружили 140 природных белков и 2029 случайных белков с одной или несколькими структурными переменными, заметно отклоняющимися от расчетного среднего. Эти белки были удалены, уменьшив количество наблюдений до 18465 для набора случайных белков и до 762 для набора естественных белков. Два набора данных значительно различались по размеру, причем количество случайных белков значительно превышало количество естественных; таким образом, чтобы избежать любой возможной систематической ошибки, мы провели анализ, используя случайную выборку наблюдений, взятых из случайных белков, равных размеру набора данных Nat ( i.е. 762).
В нашем случае мы считали выбросом любой белок с одной или несколькими структурными переменными, попадающий в хвост оценочного распределения вероятностей (т.е. p <0,005 и p> 0,995). В нашей выборке мы обнаружили 140 природных белков и 2029 случайных белков с одной или несколькими структурными переменными, заметно отклоняющимися от расчетного среднего. Эти белки были удалены, уменьшив количество наблюдений до 18465 для набора случайных белков и до 762 для набора естественных белков. Два набора данных значительно различались по размеру, причем количество случайных белков значительно превышало количество естественных; таким образом, чтобы избежать любой возможной систематической ошибки, мы провели анализ, используя случайную выборку наблюдений, взятых из случайных белков, равных размеру набора данных Nat ( i.е. 762).
Был проведен первый исследовательский анализ данных, чтобы оценить, есть ли какие-либо существенные различия в переменных, связанных со структурой, наблюдаемых в двух наборах данных. Во-первых, мы выполнили тест распределения Гаусса для каждой отдельной переменной, который привел к отклонению гипотезы гауссовости с уровнем значимости теста 0,01 для всех переменных, за исключением процента вторичной структуры и гидрофобности поверхности для естественного набора данных, а также гидрофобности поверхности и площади поверхности для случайный набор данных по белкам.Для всех переменных мы получили меры местоположения, индекс дисперсии, матрицу корреляций, кроме того, были построены ящичные диаграммы и диаграммы разброса для сравнения двух наборов данных. Статистический анализ показал, что и среднее значение, и дисперсия значительно различались для всех переменных с уровнем значимости теста 0,01, за исключением переменных катушка, процент катушки и площадь поверхности (таблица 1). Первый поразительный результат заключается в том, что в целом природные белки демонстрируют более широкое распределение по сравнению со случайными для большинства исследованных переменных (рис. 1 и 2).
Во-первых, мы выполнили тест распределения Гаусса для каждой отдельной переменной, который привел к отклонению гипотезы гауссовости с уровнем значимости теста 0,01 для всех переменных, за исключением процента вторичной структуры и гидрофобности поверхности для естественного набора данных, а также гидрофобности поверхности и площади поверхности для случайный набор данных по белкам.Для всех переменных мы получили меры местоположения, индекс дисперсии, матрицу корреляций, кроме того, были построены ящичные диаграммы и диаграммы разброса для сравнения двух наборов данных. Статистический анализ показал, что и среднее значение, и дисперсия значительно различались для всех переменных с уровнем значимости теста 0,01, за исключением переменных катушка, процент катушки и площадь поверхности (таблица 1). Первый поразительный результат заключается в том, что в целом природные белки демонстрируют более широкое распределение по сравнению со случайными для большинства исследованных переменных (рис. 1 и 2). Эту общую особенность можно объяснить, учитывая, что случайные белки представляют собой статистические сополимеры и, следовательно, их структурные особенности сосредоточены вокруг среднего значения с дисперсией, равной ожидаемой соответствующей функцией плотности вероятности. И наоборот, переменные, связанные со структурой природных белков, значительно отличаются от ожидаемых значений из-за эффекта настройки естественного отбора. Мы рассчитали диаграммы разброса для двух классов белков для каждой пары переменных (рис. 3).Центроиды диаграмм рассеяния обычно перекрываются для двух наборов данных. Напротив, их распределение на 2D-графике заметно отличается, при этом природные белки рассредоточены более широко. Это наблюдение поддерживает идею о том, что естественная эволюция значительно улучшила структурные и химиофизические свойства белков для удовлетворения функциональных требований.
Эту общую особенность можно объяснить, учитывая, что случайные белки представляют собой статистические сополимеры и, следовательно, их структурные особенности сосредоточены вокруг среднего значения с дисперсией, равной ожидаемой соответствующей функцией плотности вероятности. И наоборот, переменные, связанные со структурой природных белков, значительно отличаются от ожидаемых значений из-за эффекта настройки естественного отбора. Мы рассчитали диаграммы разброса для двух классов белков для каждой пары переменных (рис. 3).Центроиды диаграмм рассеяния обычно перекрываются для двух наборов данных. Напротив, их распределение на 2D-графике заметно отличается, при этом природные белки рассредоточены более широко. Это наблюдение поддерживает идею о том, что естественная эволюция значительно улучшила структурные и химиофизические свойства белков для удовлетворения функциональных требований.
Рисунок 1. Описательная статистика структурных свойств случайных и природных белков.
Описательное сравнение природных и случайных белков с помощью: прямоугольной диаграммы распределения переменных в двух классах (вверху) и гистограммы распределения переменных с соответствующей оценкой плотности ядра (внизу).
https://doi.org/10.1371/journal.pone.0036634.g001
Рисунок 2. Описательная статистика структурных свойств случайных и природных белков.
Описательное сравнение природных и случайных белков с помощью: прямоугольной диаграммы распределения переменных в двух классах (вверху) и гистограммы распределения переменных с соответствующей оценкой плотности ядра (внизу).
https://doi.org/10.1371/journal.pone.0036634.g002
Рис. 3. Точечная диаграмма структурных свойств.
Перекрытие диаграмм рассеяния для двух классов белков для каждой пары переменных. Случайные белки представлены зеленым цветом, Натуральные — красным.
https://doi.org/10.1371/journal.pone.0036634.g003
Существенные различия структурных особенностей между двумя наборами данных побудили нас разработать метод классификации, позволяющий отличать природные белки от случайных.В этой работе мы использовали алгоритм классификации нейронных сетей, основанный на эволюции, называемый ENNA [18], который развивает популяции нейронных сетей, в которых входными данными являются переменные, связанные со структурой, а выходными данными — класс белка (Nat или Rnd). Вкратце, ENNA генерирует первую случайную совокупность сетей с топологией нейронных сетей с двумя скрытыми слоями. Эта совокупность формально описывается как набор последовательностей с дихотомическими переменными (каждая последовательность представляет собой вектор из нулей и единиц), представляющих вход каждой сети.Каждый элемент последовательности описывает наличие или отсутствие конкретной переменной, связанной со структурой. Топология этих сетей, включающая различные переменные составы, была выбрана случайным образом (первое поколение сетей), и ответ каждой сети был получен с использованием структуры двух классов: естественных и случайных белков. Затем в процессе создается генетический алгоритм для развития популяции сетей в нескольких поколениях для определения точного правила классификации.Мы оценили реакцию каждой сети, получив чистую степень ошибочной классификации, с помощью 10-кратной процедуры перекрестной проверки: последовательности с меньшими значениями идентифицированы как более многообещающие решения.
Вкратце, ENNA генерирует первую случайную совокупность сетей с топологией нейронных сетей с двумя скрытыми слоями. Эта совокупность формально описывается как набор последовательностей с дихотомическими переменными (каждая последовательность представляет собой вектор из нулей и единиц), представляющих вход каждой сети.Каждый элемент последовательности описывает наличие или отсутствие конкретной переменной, связанной со структурой. Топология этих сетей, включающая различные переменные составы, была выбрана случайным образом (первое поколение сетей), и ответ каждой сети был получен с использованием структуры двух классов: естественных и случайных белков. Затем в процессе создается генетический алгоритм для развития популяции сетей в нескольких поколениях для определения точного правила классификации.Мы оценили реакцию каждой сети, получив чистую степень ошибочной классификации, с помощью 10-кратной процедуры перекрестной проверки: последовательности с меньшими значениями идентифицированы как более многообещающие решения. Затем мы применили к сетевой популяции классические генетические операторы, такие как естественный отбор, кроссовер и мутация, чтобы получить следующее поколение многообещающих последовательностей. В конце эволюционного процесса мы достигли популяции нейронных сетей с меньшими показателями ошибочной классификации.Анализ последней популяции нейронных сетей показал, что для правильной классификации двух наборов данных требуется лишь ограниченное количество переменных, связанных со структурой, а именно: объем, спираль, альфа и гидрофобность поверхности. Вероятность появления этих переменных в последней популяции была близка к 1, поэтому их можно считать надежными при правильной классификации ответа (, т.е. класс Nat-Rnd). Используя эти переменные, мы построили нейронную сеть для обработки всех данных, достигнув уровня правильной классификации 94.36%.
Затем мы применили к сетевой популяции классические генетические операторы, такие как естественный отбор, кроссовер и мутация, чтобы получить следующее поколение многообещающих последовательностей. В конце эволюционного процесса мы достигли популяции нейронных сетей с меньшими показателями ошибочной классификации.Анализ последней популяции нейронных сетей показал, что для правильной классификации двух наборов данных требуется лишь ограниченное количество переменных, связанных со структурой, а именно: объем, спираль, альфа и гидрофобность поверхности. Вероятность появления этих переменных в последней популяции была близка к 1, поэтому их можно считать надежными при правильной классификации ответа (, т.е. класс Nat-Rnd). Используя эти переменные, мы построили нейронную сеть для обработки всех данных, достигнув уровня правильной классификации 94.36%.
Анализ связанных со структурой переменных, используемый нейронной сетью, согласуется с описательными статистическими характеристиками распределений переменных. В частности, содержание альфа-спирали (рисунок 1a) и объем (рисунок 2b) следуют колоколообразному распределению в наборе данных Rnd. Напротив, две структурные особенности имеют однородное распределение в ансамбле Nat. Из этой классификации явились два важных вывода. Во-первых, можно эффективно идентифицировать два разных класса белков с высокой степенью уверенности.Во-вторых, ряд случайных белков, 32 последовательности, ошибочно отнесены к естественным. Это наблюдение побудило к углубленному исследованию структуры тех случайных белков, ошибочно классифицированных как естественные.
В частности, содержание альфа-спирали (рисунок 1a) и объем (рисунок 2b) следуют колоколообразному распределению в наборе данных Rnd. Напротив, две структурные особенности имеют однородное распределение в ансамбле Nat. Из этой классификации явились два важных вывода. Во-первых, можно эффективно идентифицировать два разных класса белков с высокой степенью уверенности.Во-вторых, ряд случайных белков, 32 последовательности, ошибочно отнесены к естественным. Это наблюдение побудило к углубленному исследованию структуры тех случайных белков, ошибочно классифицированных как естественные.
Анализ кратности случайных белков, ошибочно классифицированных алгоритмом ENNA, показал, что случайные полипептиды могут принимать большое количество разнообразных конформаций, от полностью альфа до полностью бета через сложные смешанные складки. Однако наиболее характерная складка, которую мы обнаружили, была, безусловно, полностью альфа-мотивом примерно в 32% проанализированных белков.Интересно, что полное бета-фолд почти не присутствовало, составляя всего 3%. Этот результат можно объяснить, если предположить, что средней длины (70 аминокислот) случайных полипептидов недостаточно для построения полной бета-структуры. С другой стороны, можно было бы отстаивать то, что структурные требования для формирования бета-слоя (такие как плоскостность, жесткость и спаривание бета-цепей далеко друг от друга вдоль аминокислотной последовательности) создают ряд ограничений, которые не могут быть выполнены в полностью случайные последовательности, как уже было предложено в предыдущем исследовании [16].
Этот результат можно объяснить, если предположить, что средней длины (70 аминокислот) случайных полипептидов недостаточно для построения полной бета-структуры. С другой стороны, можно было бы отстаивать то, что структурные требования для формирования бета-слоя (такие как плоскостность, жесткость и спаривание бета-цепей далеко друг от друга вдоль аминокислотной последовательности) создают ряд ограничений, которые не могут быть выполнены в полностью случайные последовательности, как уже было предложено в предыдущем исследовании [16].
Мы также исследовали, принимают ли неправильно классифицированные случайные белки четко определенные трехмерные складки, которые показывают какое-либо сходство с естественными, путем оценки структурного сходства с помощью сервера DALI [19] (http://ekhidna.biocenter.helsinki.fi/dali_server/) .
Мы идентифицировали 29 случайных белков среди 32 ошибочно классифицированных ENNA, которые показали общее кратное сходство, если не почти равное, с частями или субдоменами природных белков. В некоторых случаях целые белки были в значительной степени похожи на известные природные белки.Среднее RMSD, полученное между целевым белком и запросом, характеризовалось низким значением, равным 3 Å. Кроме того, DALI ранжировал результаты с помощью Z-балла, который количественно определяет «значительное сходство» между двумя белками. Это значение является оценкой A) структурной гомологии и B) гомологии последовательностей, и в целом оно строго зависит от размера запрашиваемого белка. В качестве ориентира значение Z-score ниже 2 следует рассматривать как ложный результат [19].Полученные значения RMSD и Z-score, в целом хорошие, следует рассматривать как исключительные, если мы рассматриваем полностью случайную природу этих белков. Во всем неправильно классифицированном подмножестве 22 белка имеют Z-оценку больше 2; значение больше 4 было обнаружено для белков A00927 и A00084. Белок A00927 характеризуется наивысшим ассоциированным Z-баллом, равным 4,4. Белок представляет собой большой антипараллельный бета-лист, структурно связанный с белком-ингибитором урацил-ДНК-гликозилазы (код PDB 1UUG, цепь B), с которым он имеет 9% идентичность последовательности.
В некоторых случаях целые белки были в значительной степени похожи на известные природные белки.Среднее RMSD, полученное между целевым белком и запросом, характеризовалось низким значением, равным 3 Å. Кроме того, DALI ранжировал результаты с помощью Z-балла, который количественно определяет «значительное сходство» между двумя белками. Это значение является оценкой A) структурной гомологии и B) гомологии последовательностей, и в целом оно строго зависит от размера запрашиваемого белка. В качестве ориентира значение Z-score ниже 2 следует рассматривать как ложный результат [19].Полученные значения RMSD и Z-score, в целом хорошие, следует рассматривать как исключительные, если мы рассматриваем полностью случайную природу этих белков. Во всем неправильно классифицированном подмножестве 22 белка имеют Z-оценку больше 2; значение больше 4 было обнаружено для белков A00927 и A00084. Белок A00927 характеризуется наивысшим ассоциированным Z-баллом, равным 4,4. Белок представляет собой большой антипараллельный бета-лист, структурно связанный с белком-ингибитором урацил-ДНК-гликозилазы (код PDB 1UUG, цепь B), с которым он имеет 9% идентичность последовательности. Суперпозиция (рис. 4a) показывает высокую степень структурной гомологии на центральном бета-листе, охватывающем аминокислоты (W38-R68 случайного белка и I41-L84 природного белка), хорошая уверенность была обнаружена также для короткой альфа-спирали. присутствует в модели и в природном белке по сравнению с аминокислотами (F16-L21 случайного белка и N3-G13 природного) (рис. 4b). Из-за разнообразия аминокислотных последовательностей разумно предположить, что синтетический белок A00927 не проявляет ингибирующей активности.Аналогичные результаты были получены для белка A00084 (фиг. 5). Модель, по-видимому, структурно родственна эндонуклеазе сплайсинга Pyrobaculum aerophilum (код PDB 2ZYZ, цепь A) (Z-оценка 4,3 и 5% идентичности последовательностей). Также в этом случае DALI смог выявить значительное структурное сходство. В целом мы можем утверждать, что самые большие различия, наблюдаемые между нашими моделями и природными белками, выбранными DALI, могут быть связаны с относительно короткой длиной изученных синтетических случайных полипептидов.
Суперпозиция (рис. 4a) показывает высокую степень структурной гомологии на центральном бета-листе, охватывающем аминокислоты (W38-R68 случайного белка и I41-L84 природного белка), хорошая уверенность была обнаружена также для короткой альфа-спирали. присутствует в модели и в природном белке по сравнению с аминокислотами (F16-L21 случайного белка и N3-G13 природного) (рис. 4b). Из-за разнообразия аминокислотных последовательностей разумно предположить, что синтетический белок A00927 не проявляет ингибирующей активности.Аналогичные результаты были получены для белка A00084 (фиг. 5). Модель, по-видимому, структурно родственна эндонуклеазе сплайсинга Pyrobaculum aerophilum (код PDB 2ZYZ, цепь A) (Z-оценка 4,3 и 5% идентичности последовательностей). Также в этом случае DALI смог выявить значительное структурное сходство. В целом мы можем утверждать, что самые большие различия, наблюдаемые между нашими моделями и природными белками, выбранными DALI, могут быть связаны с относительно короткой длиной изученных синтетических случайных полипептидов. Что касается белка A00927, различная аминокислотная последовательность не позволяет сделать вывод о том, что белок A00084 обладает какой-либо эндонуклеазной активностью. Для прояснения этого аспекта необходимы дальнейшие исследования.
Что касается белка A00927, различная аминокислотная последовательность не позволяет сделать вывод о том, что белок A00084 обладает какой-либо эндонуклеазной активностью. Для прояснения этого аспекта необходимы дальнейшие исследования.
Рисунок 4. Наложение модели A00927 и 1UUG.
Схематическое изображение суперпозиции модели A00927 (голубой) и белка ингибитора урацил-ДНК-гликозилазы (красный) (код PDB 1UUG, цепь B). а) вид спереди, б) вид сзади.
https: // doi.org / 10.1371 / journal.pone.0036634.g004
Рисунок 5. Наложение моделей A00084 и 2ZYZ.
Схематическое изображение суперпозиции модели A00084 (оранжевый) и эндонуклеазы сплайсинга Pyrobaculum aerophilum (голубой) (код PDB 2ZYZ, цепь A). а) вид спереди, б) вид сверху.
https://doi.org/10.1371/journal.pone.0036634.g005
Чтобы подтвердить эти результаты, мы также проверили, что случайные белки, правильно классифицированные как неприродные, не показали какого-либо значительного структурного сходства с природными. Мы проанализировали 32 случайных белка, правильно классифицированных как неприродные, и проанализировали их структурные особенности, используя ту же процедуру, что и для ошибочно классифицированного подмножества. Правильно классифицированные случайные белки демонстрируют в меньшей степени складки, аналогичные естественным белкам со средним Z-баллом 1,7, значительно отличающимся от среднего Z-балла случайных белков, ошибочно классифицированных как естественные (таблица 2).
Мы проанализировали 32 случайных белка, правильно классифицированных как неприродные, и проанализировали их структурные особенности, используя ту же процедуру, что и для ошибочно классифицированного подмножества. Правильно классифицированные случайные белки демонстрируют в меньшей степени складки, аналогичные естественным белкам со средним Z-баллом 1,7, значительно отличающимся от среднего Z-балла случайных белков, ошибочно классифицированных как естественные (таблица 2).
В совокупности эти результаты показывают, что наш алгоритм способен эффективно отличать случайный белок от природного и что случайные белки, ошибочно классифицированные как естественные алгоритмом ENNA, демонстрируют структурные особенности, поразительно похожие на природные белки.
Обсуждение
Существующие белки — прекрасный результат естественного отбора или это случайные последовательности, слегка отредактированные эволюцией? Мы впервые решаем этот вопрос, сравнивая набор из 762 природных белков и такое же количество полностью случайных белков на основе их структурных особенностей. Первые поразительные результаты заключаются в том, что случайные белки действительно обладают структурными особенностями, сопоставимыми со структурными особенностями природных белков. Однако статистические показатели, такие как среднее значение и дисперсия, этих структурно связанных переменных значительно отличаются от показателей естественных полипептидов.В частности, случайные белки имеют более узкое распределение по сравнению с естественными. Это можно рассматривать как общую особенность случайных аминокислотных полимеров, и это можно объяснить, учитывая, что случайные белки представляют собой статистические сополимеры, и поэтому их структурные особенности сосредоточены вокруг среднего значения с дисперсией, равной ожидаемой соответствующей функцией плотности вероятности. Напротив, природные белки демонстрируют разные средние значения и значения дисперсии, причем последнее, как правило, шире, чем у случайных белков, из-за давления отбора, которое сформировало структурные особенности природного белка, что приводит к отклонению от ожидаемых значений, типичных для статистических сополимеров.
Первые поразительные результаты заключаются в том, что случайные белки действительно обладают структурными особенностями, сопоставимыми со структурными особенностями природных белков. Однако статистические показатели, такие как среднее значение и дисперсия, этих структурно связанных переменных значительно отличаются от показателей естественных полипептидов.В частности, случайные белки имеют более узкое распределение по сравнению с естественными. Это можно рассматривать как общую особенность случайных аминокислотных полимеров, и это можно объяснить, учитывая, что случайные белки представляют собой статистические сополимеры, и поэтому их структурные особенности сосредоточены вокруг среднего значения с дисперсией, равной ожидаемой соответствующей функцией плотности вероятности. Напротив, природные белки демонстрируют разные средние значения и значения дисперсии, причем последнее, как правило, шире, чем у случайных белков, из-за давления отбора, которое сформировало структурные особенности природного белка, что приводит к отклонению от ожидаемых значений, типичных для статистических сополимеров. Это наблюдение поддерживает идею о том, что естественная эволюция значительно улучшила структурные и химиофизические свойства белков для удовлетворения структурных / функциональных требований. В этом отношении существующие белки не могут рассматриваться как простые отредактированные случайные полипептиды, скорее, они ясно показывают сигнатуру селективного давления.
Это наблюдение поддерживает идею о том, что естественная эволюция значительно улучшила структурные и химиофизические свойства белков для удовлетворения структурных / функциональных требований. В этом отношении существующие белки не могут рассматриваться как простые отредактированные случайные полипептиды, скорее, они ясно показывают сигнатуру селективного давления.
Различия настолько заметны, что мы смогли построить алгоритм классификации, который эффективно отличает натуральные белки от случайных с точностью до 94.36%. Кроме того, случайные белки, ошибочно классифицированные как природные, характеризуются структурным сходством с природными белками. В частности, ошибочно классифицированные случайные белки демонстрируют значительное сходство кратности с частями или субдоменами существующих белков при атомном разрешении.
Эти результаты подтверждают идею о том, что случайные полипептиды действительно обладают внутренними структурными особенностями, которые делают их особенно подходящими для естественного отбора. В частности, элементы вторичной структуры и четко определенные складки легко обнаруживаются среди полностью случайных белков.Эти внутренние структурные характеристики затем систематически настраиваются и формируются в результате эволюционной оптимизации. Этот сценарий согласуется с экспериментальными результатами, которые показывают, что компактные и термодинамически стабильные белки могут быть легко обнаружены путем скрининга небольших библиотек полностью случайных последовательностей с помощью фагового дисплея [20], а функциональные белки могут быть отобраны in vitro [21], [22] или in vivo. [23] из библиотек случайных последовательностей за относительно небольшое количество эволюционных циклов. Аналогичный сценарий был предложен и для других биополимеров, таких как одноцепочечная РНК [24], [25].
В частности, элементы вторичной структуры и четко определенные складки легко обнаруживаются среди полностью случайных белков.Эти внутренние структурные характеристики затем систематически настраиваются и формируются в результате эволюционной оптимизации. Этот сценарий согласуется с экспериментальными результатами, которые показывают, что компактные и термодинамически стабильные белки могут быть легко обнаружены путем скрининга небольших библиотек полностью случайных последовательностей с помощью фагового дисплея [20], а функциональные белки могут быть отобраны in vitro [21], [22] или in vivo. [23] из библиотек случайных последовательностей за относительно небольшое количество эволюционных циклов. Аналогичный сценарий был предложен и для других биополимеров, таких как одноцепочечная РНК [24], [25].
Наши результаты предполагают, что случайные белки значительно отличаются от существующих, но они демонстрируют присущий им конформационный порядок, который происходит от химико-физических ограничений, а не от естественного отбора. Этот внутренний порядок представляет собой «бесплатный билет» для запуска процесса адаптации к конкретным функциям и средам.
Этот внутренний порядок представляет собой «бесплатный билет» для запуска процесса адаптации к конкретным функциям и средам.
Материалы и методы
Генерация случайных белковых последовательностей
Случайные последовательности, использованные в этом исследовании, были сгенерированы с использованием алгоритма RandomBlast, описанного в другом месте [26].Алгоритм RandomBlast состоит из двух основных модулей: модуля генерации псевдослучайной последовательности и модуля программного интерфейса Blast. Первый модуль использует алгоритм генерации псевдослучайных чисел Mersenne Twister 1973 [27] для генерации псевдослучайных чисел от 0 до 19. Каждой аминокислоте присваивается фиксированный номер, и отдельные аминокислоты затем объединяются для достижения длины последовательности В работе использовано 70 аминокислот. Каждая сгенерированная последовательность затем вводится во второй модуль RandomBlast, интерфейс к программе Blast blastall, которая вызывает следующую команду:
blastall -m 8 -p blastp -d database -b 1;
, где база данных в нашем случае обозначает базу данных NR [28], [29], а параметры –m 8 и –b 1 указывают формат выравнивания (табличная форма) и количество возвращаемых последовательностей (только первое совпадение ), соответственно. В нашем случае мы считаем действительными только те белковые последовательности, которые не обнаруживают значительного сходства с каким-либо природным белком, присутствующим в базе данных. Другими словами, в отличие от обычного использования Blast, Randomblast считает действительными только полностью случайные последовательности. Длина последовательности 70 аминокислот была выбрана как хороший компромисс между вычислительными требованиями и научными исследованиями.
В нашем случае мы считаем действительными только те белковые последовательности, которые не обнаруживают значительного сходства с каким-либо природным белком, присутствующим в базе данных. Другими словами, в отличие от обычного использования Blast, Randomblast считает действительными только полностью случайные последовательности. Длина последовательности 70 аминокислот была выбрана как хороший компромисс между вычислительными требованиями и научными исследованиями.
Прогнозирование случайной структуры белков in silico и анализ свёртки
Трехмерные модельные структуры случайных белков были предсказаны с помощью Rosetta Abinitio, программы ab initio для предсказания структуры белков, основанной на предположении, что в полипептидной цепи локальные взаимодействия искажают конформацию фрагментов последовательности, в то время как глобальные взаимодействия определяют трехмерную структуру. с минимальной энергией [30].Для каждой последовательности было предсказано 20 000 ловушек. Ловушки были сгруппированы с помощью интегрированного модуля кластеризации Rosetta. Учитывалась только первая модель, предложенная для каждой последовательности. Подробный анализ кратности был проведен только для 32 белков, ошибочно классифицированных ENNA. Использовался поисковый веб-сервер в базе данных структуры белков DALI [31]. Результат DALI характеризуется длинным списком предполагаемых результатов, ранжированных по RMSD и Z-баллу. Учитывался только лучший кандидат, получивший оценку Z-score.
Ловушки были сгруппированы с помощью интегрированного модуля кластеризации Rosetta. Учитывалась только первая модель, предложенная для каждой последовательности. Подробный анализ кратности был проведен только для 32 белков, ошибочно классифицированных ENNA. Использовался поисковый веб-сервер в базе данных структуры белков DALI [31]. Результат DALI характеризуется длинным списком предполагаемых результатов, ранжированных по RMSD и Z-баллу. Учитывался только лучший кандидат, получивший оценку Z-score.
Статистический анализ данных
Статистический анализ проводился с использованием бесплатной программной среды R-project для статистических вычислений и графики (www.r-project.org), версия R 2.10.1 GUI 1.31 Leopard build 32-bit. Мы провели исследовательский анализ с использованием стандартного пакета stats . Мы проверили предположение гауссовости для переменных, вычислив тест Шапиро. Мы сравнили среднее значение и дисперсию каждой переменной распределения в двух классах белков, используя непараметрические тесты, а именно тест Вилкоксона для среднего и тест Флиннера-Киллена для дисперсии.
Эволюционный алгоритм нейронной сети
ENNA создается в среде R путем объединения функций пакета RWeka [32], версия 0.4–1, и пакета genalg , версия 0.1.1. В частности, мы сгенерировали первую случайную совокупность сетей с топологией нейронных сетей с двумя скрытыми слоями, используя функцию make_Weka_classifier [32], фиксирующую функцию интерфейса MultilayerPerceptron. Узлы в сети являются сигмовидными, и скорость обучения для обновлений параметров была зафиксирована на 0.3. Популяция формально описывалась как набор последовательностей с дихотомическими переменными (каждая последовательность представляет собой вектор из нулей и единиц), представляющих вход каждой сети. Каждый элемент последовательности описывает присутствие или отсутствие определенного структурного компонента белка с точки зрения переменных, рассматриваемых в анализе. Топология этих сетей, включающая различные переменные составы, была выбрана случайным образом (первое поколение сетей), и ответ каждой сети был получен с использованием структуры двух классов: естественных и случайных белков. Затем мы построили генетический алгоритм, используя функцию rbga.bin {genalg}, чтобы развить популяцию сетей в нескольких поколениях, чтобы определить точное правило классификации. Мы оценили реакцию каждой сети, получив чистую степень ошибочной классификации, с помощью 10-кратной процедуры перекрестной проверки: последовательности с меньшими значениями были определены как более многообещающие решения. Затем мы применили к сетевой популяции классические генетические операторы, такие как естественный отбор, кроссовер и мутация, чтобы получить следующее поколение многообещающих последовательностей.В частности, мы приняли метод выбора колеса рулетки, в котором вероятность того, что каждая последовательность (представляющая конкретную топологию нейронной сети) будет выбрана, пропорциональна ее оценке пригодности, а именно ее степени ошибочной классификации. Следующая популяция была получена путем применения метода одноточечного кроссовера и оператора мутации. В частности, метод кроссовера использовался таким образом, что точка обмена была случайным образом установлена в двух отдельных последовательностях.
Затем мы построили генетический алгоритм, используя функцию rbga.bin {genalg}, чтобы развить популяцию сетей в нескольких поколениях, чтобы определить точное правило классификации. Мы оценили реакцию каждой сети, получив чистую степень ошибочной классификации, с помощью 10-кратной процедуры перекрестной проверки: последовательности с меньшими значениями были определены как более многообещающие решения. Затем мы применили к сетевой популяции классические генетические операторы, такие как естественный отбор, кроссовер и мутация, чтобы получить следующее поколение многообещающих последовательностей.В частности, мы приняли метод выбора колеса рулетки, в котором вероятность того, что каждая последовательность (представляющая конкретную топологию нейронной сети) будет выбрана, пропорциональна ее оценке пригодности, а именно ее степени ошибочной классификации. Следующая популяция была получена путем применения метода одноточечного кроссовера и оператора мутации. В частности, метод кроссовера использовался таким образом, что точка обмена была случайным образом установлена в двух отдельных последовательностях. Затем был применен оператор мутации, изменяющий каждый элемент последовательности с вероятностью, установленной на 0.01. Каждая популяция состояла из 30 последовательностей, которые эволюционировали в течение 10 поколений.
Затем был применен оператор мутации, изменяющий каждый элемент последовательности с вероятностью, установленной на 0.01. Каждая популяция состояла из 30 последовательностей, которые эволюционировали в течение 10 поколений.
Благодарности
Авторы хотели бы поблагодарить Пьера Луиджи Луизи за вдохновение для этой работы, Маттео Борротти, Алессандро Филизетти, Микеле Форлен и Эрика Шультеса за плодотворное обсуждение.
Вклад авторов
Задумал и спроектировал эксперименты: DDL GM. Проведены эксперименты: DDL DS GM. Проанализированы данные: DS IP FP. Написал статью: DDL GM.
Ссылки
- 1.Луизи П.Л. (2003) Случайность и детерминизм. Философские труды Лондонского королевского общества. Серия математических физико-технических наук 361: 1141–1147.
- 2. Кьярабелли С., Де Лукреция Д. (2007) Миры пребиотиков и никогда не рожденных белков. Истоки жизни и эволюция биосфер 37: 357–361.
- 3.
Кауфман С.
 А. (1992) Прикладная молекулярная эволюция. Дж. Теор Биол 157: 1–7.
А. (1992) Прикладная молекулярная эволюция. Дж. Теор Биол 157: 1–7. - 4. Джейкоб М. (1969) О симметрии и функции биологических систем.В: Энгстрем А., Строндберг Б., редакторы. Wiley Interscience, Нью-Йорк. С. 15–17.
- 5. Эйген М (1992) Шаги к жизни. Оксфорд, Англия: Издательство Оксфордского университета.
- 6. Панде В.С., Гросберг А.Ю., Танака Т. (1994) Неслучайность в белковых последовательностях — свидетельство физически обусловленной стадии эволюции. Слушания Национальной академии наук Соединенных Штатов Америки 91: 12972–12975.
- 7. Птицын О.Б. (1984) Белок как отредактированный статистический сополимер.Молекулярная биология 18: 574–590.
- 8. Птицын О.Б. (1985) Случайные последовательности и сворачивание белков. Theochem-Journal of Molecular Structure 24: 45–65.
- 9.
Птицын О.Б., Волькенштейн М.В. (1986) Белковые структуры и нейтральная теория эволюции. Журнал биомолекулярной структуры и динамики 4: 137–156.

- 10. Weiss O, Herzel H (1998) Корреляции в белковых последовательностях и кодах свойств. Журнал теоретической биологии 190: 341–353.
- 11. Weiss O, Jimenez-Montano MA, Herzel H (2000) Информационное содержание белковых последовательностей. Журнал теоретической биологии 206: 379–386.
- 12. Crooks GE, Wolfe J, Brenner SE (2004) Измерения корреляций между последовательностью белка и структурой. Функция структуры белков и биоинформатика 57: 804–810.
- 13. Lavelle DT, Pearson WR (2010) В глобальном масштабе неродственные белковые последовательности кажутся случайными. Биоинформатика 26: 310–318.
- 14.Мунтяну Ч. Р., Гонсалес-Диас Х., Борхес Ф., де Магалхаес А. Л. (2008) Модели естественной / случайной классификации белков, основанные на топологических индексах звездообразной сети. Журнал теоретической биологии 254: 775–783.
- 15.
Ван Г.Л., Данбрак Р.Л. (2003) РЫБЫ: сервер отбора белковой последовательности.
 Биоинформатика 19: 1589–1591.
Биоинформатика 19: 1589–1591. - 16. Минервини Дж., Евангелиста Дж., Вилланова Л., Сланци Д., Де Лукреция Д. и др. (2009) Прогнозирование структуры массивных неприродных белков с использованием сеточных технологий.БМС Биоинформатика 10:
- 17. Берман Х.М., Вестбрук Дж., Фенг З., Гиллиланд Дж., Бха Т.Н. и др. (2000) Банк данных о белках. Исследование нуклеиновых кислот 28: 235–242.
- 18. Поли I, Сланци Д., Вилланова Л., Де Лукреция Д., Минервини Дж. И др. (1991) Идентификация структуры неприродного белка. В: Ingrassia S, Rocci R, редакторы. Катания. Клеуп. Катания. С. 597–600.
- 19. Holm L, Kaariainen S, Rosenstrom P, Schenkel A (2008) Поиск в базах данных структуры белков с помощью DaliLite v.3. Биоинформатика 24: 2780–2781.
- 20.
Кьярабелли К., Врайблоед Дж. В., Де Лукреция Д., Томас Р. М., Стано П. и др. (2006) Исследование полностью случайных биопоследовательностей de novo. Часть II.
 О частоте сворачивания в полностью случайной библиотеке белков de novo, полученных с помощью фагового дисплея. Химия и биоразнообразие 3: 840–859.
О частоте сворачивания в полностью случайной библиотеке белков de novo, полученных с помощью фагового дисплея. Химия и биоразнообразие 3: 840–859. - 21. Keefe AD, Szostak JW (2001) Функциональные белки из библиотеки случайных последовательностей. Природа 410: 715–718.
- 22. Hayashi Y, Sakata H, Makino Y, Urabe I, Yomo T (2003) Может ли произвольная последовательность развиваться в сторону приобретения биологической функции? Журнал молекулярной эволюции 56: 162–168.
- 23. Фишер М.А., МакКинли К.Л., Брэдли Л.Х., Виола С.Р., Хехт М.Х. (2011) Разработанные De Novo белки из библиотеки искусственных последовательностей функционируют в Escherichia Coli и обеспечивают рост клеток. Plos One 6:
- 24. Schultes EA, Hraber PT, LaBean TH (1999) Оценка вклада отбора и самоорганизации во вторичную структуру РНК. Журнал молекулярной эволюции 49: 76–83.
- 25.
Schultes EA, Spasic A, Mohanty U, Bartel DP (2005) Компактный и упорядоченный коллапс случайно сгенерированных последовательностей РНК.
 Структурная и молекулярная биология природы 12: 1130–1136.
Структурная и молекулярная биология природы 12: 1130–1136. - 26. Evangelista G, Minervini G, Luisi PL, Polticelli F (2007) Randomblast инструмент для генерации случайных последовательностей «Never Born Protein». Биоалгоритмы и медицинские системы 3: 27–31.
- 27. Matsumoto M, Nishimura T (1998) Mersenne Twister: генератор псевдослучайных чисел с равномерным распределением по 623 измерениям. Транзакции ACM по моделированию и компьютерному моделированию. С. 3–30.
- 28. Прюитт К.Д., Татусова Т., Маглотт Д.Р. (2005) Справочная последовательность NCBI (RefSeq): тщательно подобранная база данных неизбыточных последовательностей геномов, транскриптов и белков.Исследование нуклеиновых кислот 33: D501 – D504.
- 29.
Прюитт К.Д., Татусова Т., Маглотт Д.Р. (2007) Справочные последовательности NCBI (RefSeq): тщательно подобранная база данных неизбыточных последовательностей геномов, транскриптов и белков. Исследование нуклеиновых кислот 35: D61 – D65.

- 30. Rohl CA, Strauss CEM, Misura KMS, Baker D (2004) Прогнозирование структуры белка с использованием розетки. Численные компьютерные методы, Pt D 383: 66− +.
- 31. Холм Л., Розенстром П. (2010) Сервер Дали: сохранение карт в 3D.Исследование нуклеиновых кислот 38: W545 – W549.
- 32. Hornik K, Buchta C, Zeileis A (2009) Машинное обучение с открытым исходным кодом: R встречает Weka. Вычислительная статистика 24: 225–232.
Четыре уровня структуры белка — физиология клетки
Структура и функции белка
Белки являются строительными блоками клеточных структур и двигателей клеточной активности. Они имеют модульную природу, и их взаимодействие с другими молекулами в клетке зависит от наличия определенных функциональных доменов.Точная форма домена, возникающая в результате наличия нековалентных связей между остатками в полипептидной цепи, определяет функцию. Наиболее известным примером взаимосвязи формы и функции является теория ферментативной функции «ключ и замок». Изменение ферментативного кармана из-за мутации или модификации аминокислотного остатка изменяет аффинность и / или специфичность фермента. Короче говоря, чем лучше подходят две молекулы, тем лучше они функционируют, тем больше связей может быть создано, тем быстрее может пройти сигнал или тем сильнее соединяются две молекулы (подумайте о молекулах адгезии).
Изменение ферментативного кармана из-за мутации или модификации аминокислотного остатка изменяет аффинность и / или специфичность фермента. Короче говоря, чем лучше подходят две молекулы, тем лучше они функционируют, тем больше связей может быть создано, тем быстрее может пройти сигнал или тем сильнее соединяются две молекулы (подумайте о молекулах адгезии).
Трехмерная конформация белка зависит от взаимодействий между аминокислотами в полипептидной цепи. Поскольку последовательность аминокислот зависит от генетического кода, форма белка закодирована в ДНК. Белки имеют четыре уровня организации. Первичная структура относится к линейной последовательности аминокислот, связанных пептидными связями. Вторичная структура состоит из локальной упаковки полипептидной цепи в α-спирали и β-листы за счет водородных связей между пептидной связью и центральной углеродной цепью. Третичная (3D) структура — это форма, полученная в результате сворачивания вторичных структур, определяемых взаимодействиями между боковыми цепями аминокислот. Четвертичная структура описывает расположение полипептидных цепей в многосубъединичном расположении.
Четвертичная структура описывает расположение полипептидных цепей в многосубъединичном расположении.
В этом видео показаны 4 уровня структуры белка.
Адаптировано из банка данных RCSBProtein по лицензии CC -BY
Все, что необходимо для придания белку уникальной формы и, следовательно, уникальной функции, «записано» во фрагменте ДНК, известном как ген.Каждый раз, когда ген транскрибируется, либо в течение жизни клетки, либо в любой клетке, имеющей одну и ту же ДНК, природную или рекомбинантную, белки появляются одинаково и принимают на себя их заранее запрограммированную функцию.
Первичная структура белков
Белки — это самый важный и универсальный класс макромолекул в клетке. Роли, которые играют эти молекулы, охватывают все: от транспорта питательных веществ, катализаторов биохимических реакций до структурных компонентов клеток или молекулярных моторов. Белки представляют собой линейные полимеры аминокислот, связанных пептидными связями. Они синтезируются из матричной цепи ДНК и содержат уникальные и специфические аминокислотные последовательности в линейной форме, известной как первичная структура .
Белки представляют собой линейные полимеры аминокислот, связанных пептидными связями. Они синтезируются из матричной цепи ДНК и содержат уникальные и специфические аминокислотные последовательности в линейной форме, известной как первичная структура .
Только двадцать аминокислот необходимы и достаточны для образования тысяч белков в клетке. Это не значит, что аминокислот всего двадцать. Это распространенное заблуждение. В мире существует бесчисленное множество аминокислот, но они участвуют в других метаболических реакциях, но не в синтезе белка.То, как индивидуальный белок приобретает свою идентичность, зависит от упорядоченной комбинации аминокислот, которая определяет все его характеристики.
Аминокислоты, которые связаны пептидной связью, называются полипептидной цепью. Полипептидная цепь состоит из последовательности и аминокислот, продиктованных геном. Последовательность аминокислотных цепей обеспечивает разнообразие, необходимое для удовлетворения потребностей жизни. Сохранение конкретных белковых последовательностей настолько важно, что в клетке есть механизмы регуляции, гарантирующие, что будут производиться только идеальные белки.Каждая отдельная последовательность имеет уникальный порядок, который передает очень уникальную функцию. Если бы вы изменили одно-единственное расположение цепочки, у этой цепочки была бы совершенно другая функция. Функция белка может быть нарушена или полностью потеряна, если последовательность нарушена. Но не все мутации или модификации белков приводят к катастрофическим последствиям. Некоторые из них заставляют клетки и организм лучше адаптироваться к давлению окружающей среды — процесс, известный как эволюция.
Сохранение конкретных белковых последовательностей настолько важно, что в клетке есть механизмы регуляции, гарантирующие, что будут производиться только идеальные белки.Каждая отдельная последовательность имеет уникальный порядок, который передает очень уникальную функцию. Если бы вы изменили одно-единственное расположение цепочки, у этой цепочки была бы совершенно другая функция. Функция белка может быть нарушена или полностью потеряна, если последовательность нарушена. Но не все мутации или модификации белков приводят к катастрофическим последствиям. Некоторые из них заставляют клетки и организм лучше адаптироваться к давлению окружающей среды — процесс, известный как эволюция.
Аминокислоты имеют одинаковую основную структуру, которая важна для правильного образования химической связи между соседними молекулами.Каждая аминокислота имеет центральный углерод, обозначенный как α-углерод. К α-углероду всегда присоединены следующие четыре группы:
- –Nh3 основная аминогруппа
- –COOH кислотная группа (известная как карбоксильная группа)
- –H атом водорода
- –R боковая цепь
-R символизирует вариабельную боковую цепь, которая представляет собой единственную химическую группу , которая различается среди всех двадцати аминокислот. По сути, боковая цепь делает аминокислоту уникальной и может считаться ее отпечатком пальца.
Наиболее важным свойством аминокислот, которое влияет на сворачивание и, следовательно, на функцию всей белковой молекулы, является их известное и предсказуемое взаимодействие с водой. Таким образом, аминокислоты можно разделить на гидрофильные и гидрофобные группы. Гидрофобные, или неполярные, аминокислоты имеют в качестве боковых цепей насыщенные углеводороды. Этими аминокислотами являются аланин, валин, метионин, лейцин и , изолейцин и две аминокислоты с ароматическими кольцами , триптофан и фенилаланин .Гидрофобные неполярные аминокислоты играют важную роль в сворачивании белков, потому что они имеют тенденцию сближаться и скапливаться от воды. Эти аминокислоты обычно образуют трансмембранные домены и обнаруживаются глубоко погребенными в гидрофобной внутренней части большинства глобулярных белков.
Гидрофильные аминокислоты легко взаимодействуют с водой. В эту группу входят аминокислоты, которые ионизируются и становятся электрически заряженными (как отрицательно, так и положительно) при диссоциации, и аминокислоты, которые полярны, но не заряжены.Аминокислоты, которые имеют боковые цепи с карбоксильной группой в дополнение к карбоксильной группе у α-углерода, используемого при образовании пептидной связи, несут отрицательный заряд. Эти остатки — это глутаминовая кислота и аспарагиновая кислота — обратите внимание, что их названия фактически содержат термин «кислота» из-за наличия ДВУХ карбоксильных групп.
Боковые цепи лизина , аргинина и гистидина имеют сильные основные группы и положительно заряжены. Полярные, но незаряженные гидрофильные аминокислоты — это аспарагин , глутамин, серин, треонин и тирозин .Гидрофильные и заряженные боковые цепи аминокислот обнажены на поверхности белка и особенно широко распространены в ферментативных карманах или транспортных молекулах. Облученные электрические заряды передают природу и активность белка другим молекулам и действуют как магниты, притягивая аналогичные силы для взаимодействия.
Несколько аминокислот вносят вклад в структуру белка из-за уникальных свойств, характерных для их боковых цепей. Структура пролина отличается от других аминокислот тем, что его боковая цепь связана с азотом, а также с центральным углеродом.Эта аминокислота химически нереактивна (гидрофобна), но из-за своего пятичленного кольца она нарушает геометрию сворачивающегося белка, вызывая резкие сдвиги в конформацию, физически создавая перегибы и изгибы полипептидной цепи. Глицин вообще не имеет боковой цепи, только второй атом водорода, присоединенный к α-углероду. Не проявляя сильного полярного характера или электроотрицательности, это обычно наблюдается в местах, где части полипептидной цепи изгибаются и приближаются друг к другу.
Цистеин — это аминокислота, широко известная тем, что она сильно влияет на структуру белка . Он имеет сульфгидрильную группу, отвечающую за образование дисульфидных связей, которые стабилизируют третичную структуру белков и вносят большой вклад в молекулярные функции, о которых вы узнаете позже в этом тексте.
Вторичная структура и все петли
Как мы узнаем, как на самом деле выглядят белки, когда они свернуты? Есть два метода, позволяющих заглянуть в структуру белка; дифракция рентгеновских лучей и ядерный магнитный резонанс (ЯМР).Метод дифракции рентгеновских лучей создает трехмерную контурную карту электронов в кристалле белка на основе того, как рентгеновские лучи отражаются, когда они проходят через образец. ЯМР измеряет расстояние между белками в насыщенном растворе, и информация об ограниченном пространстве используется для определения складчатых структур каждого белка. Эти два теста вместе помогают нам понять, какова сложенная форма белка.
Форма белка определяется исключительно аминокислотной последовательностью в полипептидной цепи.Верно; это точно так же, как ДНК, уникальный код создает уникальный дизайн. Сворачивание белка является результатом физических свойств боковых цепей аминокислот и их взаимодействия с окружающей их средой. Белки складываются в наиболее энергоэффективную форму, называемую нативным состоянием , в несколько этапов или уровней в структуре белка.
Сворачивание белка и архитектураПри воздействии условий в цитозоле или просвете ER полипептидные цепи принимают локализованную организацию, называемую вторичной структурой , которая оптимизирует взаимодействия между боковыми цепями аминокислот друг с другом и водой.Каркас полипептида складывается в спирали и ленты из α-спиралей и β-листов соответственно. Как α-спираль, так и β-лист представляют собой сегменты полипептида, которые имеют правильную геометрию и связаны между собой плавными и не очень плавными поворотами и разделены менее организованными петлями.
Альфа-спираль — это структура, которая упаковывает α-атомы углерода с вращением, обеспечивающим благоприятные углы для образования прочных водородных связей и плотной упаковки боковых цепей. Бета-листы представляют собой плоские структуры, состоящие из нескольких β-нитей, связанных с соседними β-нитями посредством водородных связей.В β-листах полипептидная цепь может идти в одном (параллельном) или противоположном направлении (антипараллельно). Водородные связи более стабильны, когда β-лист имеет антипараллельные, а не параллельные нити. Параллельные листы обычно скрываются внутри белковой структуры. Вторичные структуры соединены неструктурированными участками, образующими несколько петель.
Третичная структура белка
Есть много способов объединения вторичных структур в большую трехмерную решетку. Третичная структура белка представляет собой трехмерную комбинацию α-спиралей и β-слоев, которые складываются рядом друг с другом в результате нековалентных взаимодействий между боковыми группами аминокислот и окружающей средой, окружающей отдельный полипептид. На этом этапе белки начинают укреплять свою структуру за счет дополнительных связей, таких как дисульфидные связи между двумя цистеинами . Наиболее важной особенностью третичных структур является наличие консервативных областей со сходными функциями, известных как функциональных доменов .Третичные структуры менее стабильны, и действительно, большинство из них меняют форму в течение жизни белка, часто многократно. Конформационные изменения в этих функциональных доменах являются основой функции белка. Они могут быть постоянными во время сворачивания и созревания белка или обратимыми и служить способом регулирования активности белка в реакции в масштабе реакции. Белковые домены являются областями схожей активности. У них не обязательно должна быть сохраненная последовательность. Например, киназный домен, ответственный за присоединение фосфатной группы, имеет другую форму и последовательность, в зависимости от субстрата, к которому присоединена фосфатная группа.Вторичные структуры, образующие домены, не обязательно должны располагаться последовательно в полипептидной цепи. В случае мультимерных белков они могут даже быть частями нескольких разных полипептидов.
Мотивы представляют собой подгруппу функциональных доменов, которые имеют эволюционно консервативные последовательности , придающие им, конечно, консервативную форму. Один пример, мотивы coiled-coil — очень регулярные надстройки двух α-спиралей, спаренных, чтобы сформировать волокнистую конфигурацию, которая является основой стабильных димеров.Обычно это две идентичные α-спирали, обернутые друг вокруг друга в левой конформации и стабилизированные за счет гидрофобных взаимодействий. Межмолекулярные ионные связи между боковыми цепями в α-спирали, расстояние между которыми составляет 3,6 остатка, дают гидрофобным остаткам пространство для взаимодействия с аналогичным мотивом на противоположном белке.
Четвертичная структура
Четвертичная структура является результатом сборки двух или более полипептидов в один функциональный мультимерный белок .Субъединицы собираются посредством взаимодействий между доменами или областями в белке и удерживаются вместе гидрофобными взаимодействиями (два влажных зеркала) и дисульфидными связями. Если субъединицы одинаковые, структура описывается префиксом homo , а если они разные — префиксом гетеро (как в гомодимере мышечной гликогенфосфорилазы или как в гетеротримерных белках G )
Внутриклеточные процессы, такие как передача сигналов, зависят от взаимодействия между молекулами.Чем лучше молекулярное соответствие между двумя молекулами, тем больше связей они могут образовывать или тем сильнее взаимодействие (сродство между ними). Аминокислотная последовательность, продиктованная геном, и, в свою очередь, свойства боковых цепей аминокислот определяют форму и, в свою очередь, взаимодействия.
пептидов против белков: в чем разница?
Понимание разницы между пептидом и белком позволит вам воспользоваться преимуществами их применения для здоровья.
СВЯЗАННЫЙ: Что такое защитный комплекс тела и почему он имеет значение?
В этой статье:
- Что такое пептид?
- Что такое белки?
- Чем похожи пептиды и белки?
- Чем отличаются пептиды и белки?
- Почему исследователи так рады медицинскому применению пептидов и белков?
- Кому следует принимать добавки с пептидами или белками?
- Где можно получить эту добавку?
- Сколько существует типов пептидов?
- Каковы преимущества использования пептидов?
- Полипептид — это белок?
- Каковы побочные эффекты от использования пептидов?
- Можно ли перорально принимать пептиды?
Проложите свой путь к исцелению: разница между пептидом и белком
Что такое пептид?
Пептид содержится в каждой клетке и ткани тела.Это важный клеточный компонент, который выполняет широкий спектр функций.
Он состоит из короткой цепи аминокислот. Обычно в цепь входят две или более аминокислот.
Что такое аминокислоты? Это важные строительные блоки пептидов и белков. Существует 20 видов аминокислот, которые играют разные роли в организме, включая усвоение питательных веществ, иммунную функцию, рост тканей, восстановление мышц и производство энергии.
Функции, которые играют пептиды, будут зависеть от типа и комбинации аминокислот, которые они включают.Пептиды часто действуют как гормоны, потому что они переносят информацию из одной ткани в другую.
Пептидные гормоны можно найти в желудке, головном мозге, кишечнике и железах. Он помогает регулировать аппетит и уровень сахара в крови.
Что такое белки?
Белки — это большие молекулы, состоящие из пятидесяти и более аминокислот. Состав и последовательность аминокислот будут определять функцию белка.
Белки делают большую часть тяжелой работы в клетках.Вот несколько примеров функций белка:
- Форма ячеистой структуры — придает клеткам форму и обеспечивает общую поддержку тела
- Транспортирует молекулы и атомы — связывает и переносит молекулы и атомы внутри клетки по всему телу
- Формируют антитела — связываются с вирусами или бактериями, чтобы защитить организм от захватчиков
- Отправлять сообщения — отправляет сигналы для координации процессов между органами, тканями и клетками
- Ферменты формы — ферменты являются катализаторами, которые помогают вызывать химические реакции в клетках
- Формирование новых молекул — использует информацию ДНК для создания молекул
В целом белки помогают регулировать и формировать ткани и органы тела.
Чем похожи пептиды и белки?
Пептиды и белки имеют сходство по форме и функциям.
Функционально оба играют жизненно важную роль в широком спектре биологических функций. Они служат строительными блоками тела.
Структурно аминокислотные цепи составляют пептиды и белки. Для обоих аминокислотные цепи удерживаются вместе пептидными связями.
Чем отличаются пептиды и белки?
Если пептиды и белки состоят из одного и того же, и они оба помогают поддерживать общее состояние здоровья организма, действительно ли они разные? Самая очевидная разница между пептидами и белками — это их размер.
Для пептидов и белков размер относится к количеству содержащихся в них аминокислот. Вот чем они отличаются:
- Пептиды — 2-10 аминокислот
- Полипептиды (подкатегория пептидов) — 10-50 аминокислот
- Белки — 51 и более аминокислоты
По сути, один или несколько полипептидов составляют белки. Итак, белок — это на самом деле большой пептид.
Кроме того, поскольку белки придают клеткам их форму и структуру, пептиды обычно менее определены.Белки более сложные и могут иметь многомерную структуру.
Белки могут выполнять более сложные функции, чем пептиды, потому что они содержат больше аминокислот. Имейте в виду, что сочетание аминокислот определяет функции белков и пептидов.
СВЯЗАННЫЕ С: Различные типы суставов в теле
Почему исследователи так рады медицинскому применению пептидов и белков?
Пептиды и белки обладают высоким фармацевтическим потенциалом, поскольку они могут взаимодействовать с ферментами, вызывая химические реакции.Эти химические реакции запускают определенные биологические процессы, которые могут привести к восстановлению клеток.
Синтетические формы пептидов и белков могут имитировать натуральные компоненты организма. Кроме того, они также могут служить заменой отсутствующих или поврежденных клеточных компонентов.
Исследователи считают, что это означает, что пептиды могут более точно воздействовать на проблемные области без обычных побочных эффектов, связанных с другими лекарствами. С другой стороны, белки уже используются в лекарствах, которые лечат симптомы рака, артрита и аутоиммунных заболеваний.
Многие пептидные и белковые препараты для лечения конкретных заболеваний все еще находятся на стадии доклинических и клинических испытаний. Между тем, уже существуют добавки с последовательностью пептидного белка.
Кому следует принимать добавки с пептидами или белками?
Многие взрослые могут получить пользу от добавки Body Protective Complex, в которой используется последовательность пептидного белка. Это даже более полезно для людей, получивших травму, в частности:
- повреждение сухожилий и связок
- повреждение нерва
- мышечные разрывы
- Растяжения
Он также предотвращает и помогает излечить желудочно-кишечные проблемы, такие как:
- Язва желудка
- негерметичная кишка
- Синдром раздраженного кишечника
- Болезнь Крона
Что такое болезнь Крона? Это хроническое воспаление желудочно-кишечного тракта.Некоторые из его симптомов — стойкая диарея, спазмы в животе и запоры.
В отличие от большинства обезболивающих, эта добавка не маскирует боль. Вместо этого он помогает увеличить выработку коллагена.
Коллаген помогает уменьшить воспаление. Со временем эта добавка может помочь устранить повреждения и ускорить процесс заживления.
Дополнительный бонус: поскольку это натуральная добавка, у нее нет нежелательных побочных эффектов!
Прежде чем принимать какие-либо новые лекарства или добавки, лучше всего проконсультироваться с вашим лечащим врачом.Это особенно важно сделать, если в настоящее время вы принимаете какие-либо другие лекарства или добавки.
Где можно получить эту добавку?
После обсуждения ваших симптомов со своим врачом вы можете заказать добавки здесь. Рекомендуемая доза — две таблетки каждое утро сразу после завтрака.
Важно, чтобы добавка подействовала. Хотя результаты могут отличаться от человека к человеку, большинство пользователей сообщают об улучшении после трех недель ежедневного приема.
Вот еще некоторая информация о белках и пептидах от Дэниела Ренира:
Как уже говорилось, понимание сходства и различий между пептидами и белками поможет вам понять, какую пользу они могут принести вам. В то время как некоторые лекарства действуют для маскировки симптомов, добавка Body Protective Complex работает на клеточном уровне — она помогает вам выздороветь.
Поговорите со своим врачом, если вы имеете дело с травмой или желудочно-кишечными проблемами.Сообщите им, что вас интересуют пептидные или протеиновые добавки, которые помогут ускорить процесс заживления.
Сколько существует типов пептидов?
Есть много типов пептидов. Пептиды обычно классифицируют в зависимости от их функции и источника. Активные пептидные группы следующие;
- Пептиды антибиотиков
- Бактериальные пептиды
- Раковые и противоопухолевые пептиды
- Пептиды отрубей
- Грибковые пептиды
- Опиатные пептиды
- Эндокринные пептиды
- Сердечно-сосудистые пептиды
- Пептиды желудочно-кишечного тракта
- Пептиды беспозвоночных
- Растительные пептиды
- Почечные пептиды
- Респираторные пептиды
- Вакцинные пептиды
- Ядовитые пептиды
Каковы преимущества использования пептидов?
Известно, что пептидыобладают множеством преимуществ, таких как:
- действует как антиоксидант
- снижение артериального давления
- убивающие микробы
- уменьшает воспаление
- предотвращение образования тромбов
- повышение иммунитета
Полипептид — белок?
№Полипептид — это цепь из множества аминокислот. Белки представляют собой длинные цепочки аминокислот, связанных пептидными связями. Белок содержит один или несколько полипептидов.
Каковы побочные эффекты использования пептидов?
Пептиды полезны для вашего здоровья, но при неправильном применении пептиды могут иметь серьезные побочные эффекты.
Побочные эффекты и их тяжесть зависят от человека, который его использует. Некоторые из побочных эффектов следующие:
- Сухость во рту
- Боль в суставах
- Повышенный голод
- Повышенная задержка воды
- Зуд в области инъекции
- Похудание или прибавка
- Снижение рождаемости
- Сильная боль в почках
Тем, кто рассматривает возможность начала лечения пептидами, следует предварительно проконсультироваться с врачом.
Могу ли я принимать пептиды перорально?
Технически да, но не идеально. Наша пищеварительная система предназначена для расщепления полипептидов на аминокислоты перед всасыванием. Пероральный прием пептидов затрудняет извлечение пользы из пептидов и белков вашему организму, так как доставка задерживается.
Поговорите со своим врачом, если вы имеете дело с травмой или желудочно-кишечными проблемами. Сообщите им, что вас интересуют пептиды или протеиновые добавки, которые помогут ускорить процесс заживления.
Не могли бы вы принять добавку Body Protective Complex? Напишите нам в комментариях!
Далее:
или полный: в чем разница?
Белок — это белок, верно? А что, если этот белок полный — или неполный?
Чтобы понять разницу между полными и неполными белками, вам сначала нужно познакомиться с аминокислотами. Это молекулярные строительные блоки, которые вместе образуют каждый грамм потребляемого вами белка.Когда вы едите богатую белком пищу, ваше тело снова расщепляет эти белки на аминокислоты, объясняет Мари Спано, RD, CSCS, ведущий автор книги Nutrition for Sport, Exercise, and Health из Атланты. Затем ваше тело использует эти аминокислоты для наращивания мышц, восстановления тканей, поддержки метаболизма и помощи другим процессам в организме.
Из примерно 20 аминокислот 9 незаменимы, то есть организм не может их вырабатывать. По данным Национального института здоровья (NIH), они включают гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Единственный способ получить эти аминокислоты — через пищу. Спано объясняет, что продукты, которые содержат все они и в количествах, аналогичных тем, которые требуются организму, называются полноценными белками или полноценными источниками белка. Между тем, те, которые не содержат достаточного количества одной или нескольких незаменимых аминокислот, являются неполными.
СВЯЗАННЫЙ: 15 лучших источников постного белка
Полные и неполные белковые продуктыПо данным Harvard Health Publishing, все продукты животного происхождения, включая мясо, молочные продукты и яйца, содержат полноценный белок.Большинство источников белка растительного происхождения, таких как цельнозерновые, бобовые, семена и орехи, шпинат, брокколи и грибы, являются неполными. Однако некоторые растительные продукты, такие как соя, киноа, гречка и водоросли, являются полноценными.
Хотя обычно считается, что неполные источники белка содержат ноль хотя бы одной из девяти незаменимых аминокислот, на самом деле это не так, — объясняет Эбби Смит-Райан, доктор философии, CSCS, директор Университета Северной Каролины в Chapel Hill’s Applied. Лаборатория физиологии.
Многие неполные источники белка содержат или каждой незаменимой аминокислоты, но их недостаточно для того, чтобы этот белок мог выполнить все, что вы хотите, — говорит она. По словам Констанс Браун-Риггс, RD, CDCES, которая базируется в Massapequa Park, Нью-Йорк, лейцин, который является основным двигателем наращивания мышечной массы, имеет относительно низкий уровень в большинстве неполных источников белка.
СВЯЗАННЫЙ: Что есть до и после тренировки
Как получить все необходимые аминокислотыЕсли вы регулярно потребляете мясо или много продуктов животного происхождения, вы получаете достаточно все необходимые незаменимые аминокислоты.(Большинство американцев, по данным Гарвардского университета.) В настоящее время рекомендуемая дневная норма белка составляет 0,8 грамма (г) на килограмм массы тела. Тем не менее, многие недавние исследования, в том числе статья, опубликованная в июле 2015 года в журнале Applied Physiology, Nutrition, and Metabolism , показывают, что для оптимального здоровья мышц, особенно у пожилых людей и тех, кто пытается похудеть, необходимо большее количество, вдвое превышающее эту цифру. или наращивать мышцы.
Но что, если вы не едите мясо или продукты животного происхождения или пытаетесь сократить их количество, чтобы сосредоточиться на растительной диете? В конце концов, потребление растительных источников белка связано с улучшением общего состояния здоровья и долголетием, согласно исследованию, опубликованному в августе 2016 года в журнале JAMA Internal Medicine .(Исследователи объясняют, что это может быть связано с тем, что растения с высоким содержанием белка также, как правило, изобилуют клетчаткой, витаминами, минералами и антиоксидантами.) Источники белка: вы можете получить все аминокислоты, которые вам нужны на вегетарианской или веганской диете. Тем не менее, насколько это сложно, остается предметом споров.
СВЯЗАННЫЙ: 9 научных преимуществ соблюдения растительной диеты
Например, исследование февраля 2017 года, опубликованное в The American Journal of Clinical Nutrition , показало, что нет значительных различий в мышечной массе или силе в население в целом в зависимости от того, какую пищу люди едят, чтобы получить белок.Но другие исследования, в том числе опубликованная в марте 2017 года статья в Nutrition in Clinical Practice , предполагают, что вегетарианцам и веганам, особенно пожилым, может потребоваться немного больше общего дневного белка по сравнению с всеядными животными, чтобы пользоваться теми же преимуществами белка. Согласно статье, опубликованной в марте 2017 года, это может быть связано с тем, что организму легче переваривать, поглощать и использовать неполноценные белки.
Между тем, некоторые эксперты говорят, что для того, чтобы восполнить неполные белки, вам нужно потреблять несколько определенных дополнительных белков в одном приеме пищи.Но, как вы понимаете, запоминание того, какие растительные продукты содержат незаменимые аминокислоты и в каком количестве, а затем использовать эту информацию для приготовления каждого приема пищи на всю оставшуюся жизнь, может быть нереалистичным, говорит Браун-Риггс.
«Будет ли это иметь значение в конце концов? Это может зависеть от нескольких факторов », — говорит Спано. «Я думаю, что единственный верный способ узнать это — провести перекрестное продольное испытание со всем предоставленным питанием. Одно дорогое исследование! » Вероятно, что взрослым, придерживающимся растительной диеты, достаточно получать белок из нескольких источников в течение дня, но это может быть не идеально.«Для тех, кто хочет получить больше мускулов и максимально построить структуры в своем теле, я бы попыталась комбинировать белки в каждом приеме пищи», — говорит она.


 Производятся с помощью экстракции белка из пищевых продуктов. Обычно они содержат 60–80% собственно протеина, а оставшиеся 20–40% приходятся на жиры и углеводы. Такие смеси менее удобны для спортсменов, зато стоят меньше остальных.
Производятся с помощью экстракции белка из пищевых продуктов. Обычно они содержат 60–80% собственно протеина, а оставшиеся 20–40% приходятся на жиры и углеводы. Такие смеси менее удобны для спортсменов, зато стоят меньше остальных. Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
Поскольку определенные аминокислоты могут взаимодействовать с другими аминокислотами в одном и том же белке, эта первичная структура в конечном итоге определяет окончательную форму и, следовательно, химические и физические свойства белка.
 А. (1992) Прикладная молекулярная эволюция. Дж. Теор Биол 157: 1–7.
А. (1992) Прикладная молекулярная эволюция. Дж. Теор Биол 157: 1–7.
 Биоинформатика 19: 1589–1591.
Биоинформатика 19: 1589–1591.