Один белок может остановить старение мышц
Исследование, проведенное учеными из Стэндфордского университета, показало, что небольшие белковые молекулы позволяют восстановить силу и выносливость мышц у старых мышей. Как выяснили ученые, один определенный белок играет ведущую роль в регуляции процесса старения мышц, и блокировка этого белка позволяет восстановить функцию мышц.
В ходе исследования было показано, что блокирование активности этого белка увеличивает функциональные возможности у старых мышей, а увеличение его экспрессии вызывает у молодых мышей атрофию и снижение силы мышц
Ученые выяснили, что уровень белка, называемого 15-PGDH, повышен в старых мышцах и значительно экспрессируется также в других старых тканях. Были проведены также эксперименты с тканями человека и результаты вселяют надежду на то, что со временем можно будет лечить инволюционную мышечную слабость.
Исследование, проведенное под руководством профессора Блау и доктора Палла, было опубликовано в журнале Science.
Потеря мышечной массы при старении
Уменьшение мышечной массы в ходе старения называется саркопения. Лечение пациентов с этим состоянием обходится дорого для здравоохранения многих стран, так как люди становятся менее мобильными, часто падают и теряют способность к самообслуживанию. При старении мышц происходят изменения в структуре мышечных волокон – сокращение количества волокон и уменьшение в них митохондрий.
Профессор Блау и ее коллеги уже много лет занимаются изучением функции мышц после травм или при таких заболеваниях, как мышечная дистрофия Дюшенна. В ходе исследований было обнаружено, что физиологически активное вещество простагландин E2 может активировать стволовые мышечные клетки, которые восстанавливают структуру мышечных волокон.
Уровни простагландина E2 регулируются ферментом 15-PGDH, который расщепляет эту молекулу. Как показали измерения с помощью высокочувствительной масс-спектрометрии, уровень фермента 15-PGDH в мышцах старых животных был повышен, а уровень молекулы простагландина E2 ниже.
Аналогичные результаты были получены при изучении мышечных тканей человека. Так, в мышцах у людей старшей возрастной группе отмечалась повышенная экспрессия 15-PGDH, по сравнению с молодыми людьми.
Ингибирование 15-PGDH на экспериментальной модели животных (мышей) показало очевидное увеличение силы мышц и выносливости после введения мышам молекулы, блокирующей этот фермент.
В тоже время, в ходе обратного эксперимента — избыточная экспрессия 15-PGDH у молодых мышей — приводила к снижению силы и тонуса мышц, происходило сокращение и ослабление мышечных волокон.
Ученые также провели изучение влияния простагландина E2 на мышечные трубки человека – выращенные in vitro. Они обнаружили, что обработка мышечных трубок простагландином E2 приводила к увеличению их в диаметре и повышению синтеза белка в мышечных трубках, что явилось свидетельством того, что простагландин E2 действует избирательно на мышечные клетки.
Ученые планируют продолжать исследования функции 15-PGDH при старении и возможное его влияние на функцию других тканей в организме.
Российские ученые исправили ошибку в модели структуры важнейшего белка мышц — Наука
ТАСС, 12 февраля. Российские биологи обнаружили, что белок актин, один из важнейших компонентов мышц, по своей структуре похож не на двойную спираль, а на лестницу. Благодаря этому уточнению можно будет создать более эффективные лекарства от мышечных патологий, пишет пресс-служба Института теоретической и экспериментальной биофизики РАН.
«Исправление ошибок в модели позволит повысить эффективность разработки фармпрепаратов для лечения заболеваний, связанных с дефектами актиновых молекул. Речь идет прежде всего, об актиновой и немалиновой миопатиях – тяжелых формах генетических мышечных патологий, которые серьезно влияют на качество и продолжительность жизни», – говорится в сообщении.
Актин – один из самых распространенных компонентов клеток людей и других многоклеточных существ. Очень много этого белка находится в мышцах. Там он отвечает за активацию другого важного белка – миозина, – который непосредственно порождает мышечные сокращения.
Структуру актина ученые выяснили в 1960-х годах. Они предполагали, что по форме этот белок похож на двойную спираль. Однако в последние годы биологи начали сомневаться в этом. Дело в том, что результаты некоторых экспериментов с актином не соответствовали классической теории строения этого белка.
Российские ученые под руководством ведущего научного сотрудника ИТЭБ РАН Оксаны Галзитской проверили эти подозрения на практике. Они изучили трехмерную форму целых и частично разрушенных молекул актина с помощью трансмиссионного электронного микроскопа.
Обработав образцы белка протеазами – ферментами, которые расщепляют пептидные связи в молекулах белков, ученые следили, как появляющиеся в результате этого разрушения меняли форму молекул нитеобразной формы актина. Биологи пришли к выводу, что эти повреждения действительно не соответствовали классическим представлениям о строении актина.
В частности, оказалось, что на все участки молекулы ферменты действовали примерно одинаково. Однако если бы белок был закручен в двойную спираль, такого не могло происходить. Исследователи пришли к выводу, что на самом деле структура актина похожа на лестницу, которая состоит из наложенных друг на друга повторяющихся участков.
Однако если бы белок был закручен в двойную спираль, такого не могло происходить. Исследователи пришли к выводу, что на самом деле структура актина похожа на лестницу, которая состоит из наложенных друг на друга повторяющихся участков.
Ученые надеются, что это открытие поможет создать более эффективные лекарства от болезней мышц, которые связаны с нарушениями в работе актина, а также позволит разрешить противоречия, которые появились при изучении свойств этого белка из-за ошибочного определения его структуры.
Белки мышц и соединительных тканей
В мышце находятся коллаген и эластин, которые в противоположность собственно мышечным белкам не содержат достаточного количества незаменимых аминокислот и трудно перевариваются при действии пищеварительных ферментов. В табл. 9 (см. приложение) приведено сопоставление аминокислотного состава белков, соединительной ткани мышц и полноценного белка молока — казеина. Содержание отдельных аминокислот дано в процентах при содержании в белке 16,0 г азота. [c.233]
[c.233]
Каковы особенности строения сократительных белков мышц, белков соединительной ткани и переносчиков кислорода [c.263]
Из сопоставления видно (табл. 10, см. приложение), что повышенное содержание в мясе белков соединительной ткани снижает его пищевую ценность и поэтому определение в мясе собственно мышечных белков и белков соединительной ткани (коллаген и эластин) важно для установления питательной ценности мяса. В разных мышцах это отношение различно.
Структурообразующие белки тела человека называют фибриллярными белками (или волокнистыми, они имеют вытянутую, нитеобразную форму). Важнейшие фибриллярные белки животных — это кератин и коллаген белок кератин входит в состав волос, ногтей, мышц, рогов, игл и перьев коллаген — структурный компонент сухожилий, кожи, костей, соединительной ткани. При кипячении коллаген гидролизуется и образует растворимый в воде белок, называемый желатиной. В теле человека имеются растворимые белки, именуемые глобулярными белками. Альбумины, такие, как сывороточный альбумин, получаемый из крови животных, овальбумин яичного белка, лактальбумин молока, растворяются в холодной воде и слабом растворе соли. Глобулины, например глобулины плазмы крови, фибриноген, глобулин яичного белка, глобулин молока, растворяются в разбавленных растворах солей, но не в холодной воде. [c.384]
В теле человека имеются растворимые белки, именуемые глобулярными белками. Альбумины, такие, как сывороточный альбумин, получаемый из крови животных, овальбумин яичного белка, лактальбумин молока, растворяются в холодной воде и слабом растворе соли. Глобулины, например глобулины плазмы крови, фибриноген, глобулин яичного белка, глобулин молока, растворяются в разбавленных растворах солей, но не в холодной воде. [c.384]
Белки мышц и соединительных тканей [c.253]
Рассматривая белковый состав человеческого организма (включая волосы, ногти, мышцы, соединительные ткани), мы вправе предположить, что молекулы, составляющие сложный организм, имеют сложную природу. В таком случае необходимо исследовать природу этих молекул жизни . При обработке белка раствором кислоты или основания вместо исходной молекулы белка возникает раствор, содержащий много более простых, гораздо меньших по размеру молекул — аминокислот. Молекула белка — высокомолекулярное соединение, или биополимер, в котором мономерные единицы — аминокислоты.
В основе животного мира также лежат высокомолекулярные соединения — белки, являющиеся главной составной частью почти всех веществ животного происхождения. Мышцы, соединительные ткани, мозг, кровь, кожа, волосы, шерсть, рог состоят в основном из высокомолекулярных белковых веществ (табл. 2). [c.13]
Прежде чем рассмотреть исследования Астбери, кратко остановимся на предложенной им классификации белков, в основу которой был положен структурный признак [11, 12]. По этому признаку все белки делятся на два больших класса фибриллярных и глобулярных белков. Первые имеют вытянутую, волокнистую структуру вторые -форму глобулы (во времена Астбери они назывались корпускулярными белками).

Мясо — это в основном мышечный белок. Мышцы представляют собой пучки белковых волокон, которые собраны в блоки, окруженные соединительной тканью. Соединительная ткань тоже содержит структурные белки, в частности коллаген и эластин. Коллаген образует белые волокна , жесткие и неэластичные эластин образует эластичные желтые волокна . Мясо можно сделать более пригодным для пережевывания, другими словами, более мягким, предварительно расщепив некоторые из белков соединительной ткани и некоторые из мышечных волокон. При этом волокна укорачиваются, легче отделяются друг от друга и поэтому легче разрушаются. [c.89]
Мясо можно сделать более пригодным для пережевывания, другими словами, более мягким, предварительно расщепив некоторые из белков соединительной ткани и некоторые из мышечных волокон. При этом волокна укорачиваются, легче отделяются друг от друга и поэтому легче разрушаются. [c.89]
Гладкие мышцы по своим свойствам сушественно отличаются от скелетных расположение сократительных белков в них не упорядочено, размеры волокон меньше. Возбудимость гладких мышц значительно ниже, чем поперечнополосатых, а период мышечного сокращения длиннее. Гладкие мышцы обладают высокой способностью к автоматической деятельности. Раздражителями, возбуждающими автоматическое сокращение, являются продукты обмена веществ, вырабатываемые в мышце или доставляемые кровью. Мышечная ткань анизотропна и обладает упругими и вязкими свойствами. Вязкость обусловлена в основном миофибриллами, а упругость — соединительной тканью. [c.73]
Авитаминоз проявляется в нарушении процессов обмена в скелетных мышцах уменьшается количество сократительного белка миозина и увеличивается количество коллагена в соединительной ткани, что влияет на сократительную способность мышц ухудшается энергетика мышц за счет уменьшения содержания гликогена, креатинфосфата и АТФ. [c.112]
[c.112]
Синтез глюкозы из аминокислот в организме человека происходит практически постоянно, но особенно усиливается при голодании, преимущественно белковом питании и некоторьгх патологических состояниях (сахарный диабет). При голодании источником аминокислот для глюконеогенеза служат белки мышц, печени, соединительной и ряда других тканей. [c.412]
Фибриллярные белки представляют собою вытянутые молекулы, у которых длина значительно превышает их диаметр. К таким белкам прежде всего необходимо отнести коллаген — самый распространенный белок у человека и высших животных, на долю которого приходится 25-30% от общего количества белков организма. Коллаген обладает высокой прочностью и эластичностью. Этот белок широко распространен в организме, он входит в состав соединительной ткани, и поэтому его можно обнаружить в коже, стенках сосудов, мышцах, сухожилиях, хрящах, костях, во внутренних органах. [c.8]
Во-вторых, лизин необходим для синтеза самого распространенного в организме белка — коллагена.
 Этот белок обладает высокой прочностью и эластичностью. Он входит в состав соединительной ткани, и поэтому его можно обнаружить в коже, в стенках сосудов, в мышцах, сухожилиях, хрящах, костях, во внутренних органах. В мышцах коллаген выполняет важную роль в процессе расслабления, которое, в свою очередь, определяет скоростные качества спортсмена. В процессе синтеза коллагена вначале образуется его предшественник — проколлаген, содержащий в большом количестве аминокислоты лизин и пролин. Затем эти аминокислоты, входящие в состав проколлагена, подвергаются окислению и превращаются соответственно в оксилизин и оксипролин, что приводит к переходу проколлагена в коллаген. Это окисление протекает с участием аскорбиновой кислоты — витамина С. [c.209]
Этот белок обладает высокой прочностью и эластичностью. Он входит в состав соединительной ткани, и поэтому его можно обнаружить в коже, в стенках сосудов, в мышцах, сухожилиях, хрящах, костях, во внутренних органах. В мышцах коллаген выполняет важную роль в процессе расслабления, которое, в свою очередь, определяет скоростные качества спортсмена. В процессе синтеза коллагена вначале образуется его предшественник — проколлаген, содержащий в большом количестве аминокислоты лизин и пролин. Затем эти аминокислоты, входящие в состав проколлагена, подвергаются окислению и превращаются соответственно в оксилизин и оксипролин, что приводит к переходу проколлагена в коллаген. Это окисление протекает с участием аскорбиновой кислоты — витамина С. [c.209] Белки вездесущи в живой материи. Фибриллярные белки образуют строительный материал животных — кожу, мышцы, соединительную ткань, волокна шелка и т. д. Растворимые, или глобулярные, белки играют решающую роль во всех жизненных процессах как ферменты, нромежуточные продукты метаболизма, генетические факторы, определяющие отличительные признаки и т. д. Растворимые белки подразделяются в соответствии с их свойствами растворимости. Обычно определяются шесть грунн 1) альбумины, растворимые в чистой воде 2) глобулины, растворимые в разбавленных солевых растворах, но не в воде 3) глутелины, растворимые в разбавленных кислотах и щелочах 4) нроламины, растворимые в 80%-ном спирте, ноне в воде [c.590]
д. Растворимые белки подразделяются в соответствии с их свойствами растворимости. Обычно определяются шесть грунн 1) альбумины, растворимые в чистой воде 2) глобулины, растворимые в разбавленных солевых растворах, но не в воде 3) глутелины, растворимые в разбавленных кислотах и щелочах 4) нроламины, растворимые в 80%-ном спирте, ноне в воде [c.590]
Некоторые авторы (Гауровиц) предпочитают рассматривать белки соответственно тем функциям, которые они выполняют в организмах. Несмотря на то что часто один и тот же белок выполняет различные функции — имеет несколько специальностей , такой принцип классификации кажется более логичным. К первой группе по этой классификации относят белки плазмы крови, молока, яиц, семян, альбумины, протамины, содержащиеся в рыбах (основные белки), и гистоны, входящие в состав ядер клеток. Ко второй группе относят структурные белки, образующие соединительную ткань, мышцы, эпидермис. Они выполняют роль каркаса для клеточных и надклеточных структур. Этим белкам свойственны отнюдь не только механические функции, но все же механическая роль для них специфична. [c.60]
Этим белкам свойственны отнюдь не только механические функции, но все же механическая роль для них специфична. [c.60]
Резервные белки — это не депо, а при необходимости легкомо-билизуемые белки плазмы крови, мышц, соединительной ткани. [c.244]
Фибриллярные белки представляют собой вытянутые молекулы. Такие белки входят в состав соединительных тканей, мышц и волос. Аминокислотные цепи в фибриллярном белке обычно находятся в виде винтовых спиралей, ориентированных параллельно друг другу. Отдельные спирали удерживаются как единое целое возникающими между ними водородными связями (рис. 28.2). По-видимому, при сжатии и растяжении мышц происходит перестройка водородных связей. Помимо водородных связей, между полипеп-тидными цепями существуют также электростатические силы притяжения, а иногда серные мостиковые связи, но число водородньгх связей намного превосходит все другие типы связывающего взаимодействия между спиралями. [c.483]
Хотя структура кожи весьма различна, в зависимости от сорта и части кожи, некоторые обобщения все же возможны. Кожа делится на две различные части тонкий наружный слой — эпидермис, составляющий примерно около 1% общей толщины, и внутренний слой соединительной ткани — дерму или кориум. В кожах, поступающих для дубления, может быть и третий слой, содержащий оболочки сухожили и даже мышцы, которые относятся собственно к телу животного. Наружный слой, или эпидермис, представляет собой тонкий слой клеток, которые получают свое питание из кровеносных сосудов дермы. В то время как эти клетки воспроизводятся, старые постепенно отлшрают, высыхают, превращаются в чешуйки и легко отпадают. Через этот слой проходят волосы, растущие со дна волосяных мешочков, или фолликул, Потовые и сальные железы, выделяющие жир и пот через поры, также проходят через эпидермис. Дерма состоит из сетки плотно переплетающихся и, до некоторой степени, сросшихся волокон белка — коллагена. Кровеносные сосуды, нервы и жировые клетки расположены всюду в этой сетке из волокон, тогда как белковая соединительная ткань, называемая эластином, располагается главным образом в верхней и нижней части дермы.
Кожа делится на две различные части тонкий наружный слой — эпидермис, составляющий примерно около 1% общей толщины, и внутренний слой соединительной ткани — дерму или кориум. В кожах, поступающих для дубления, может быть и третий слой, содержащий оболочки сухожили и даже мышцы, которые относятся собственно к телу животного. Наружный слой, или эпидермис, представляет собой тонкий слой клеток, которые получают свое питание из кровеносных сосудов дермы. В то время как эти клетки воспроизводятся, старые постепенно отлшрают, высыхают, превращаются в чешуйки и легко отпадают. Через этот слой проходят волосы, растущие со дна волосяных мешочков, или фолликул, Потовые и сальные железы, выделяющие жир и пот через поры, также проходят через эпидермис. Дерма состоит из сетки плотно переплетающихся и, до некоторой степени, сросшихся волокон белка — коллагена. Кровеносные сосуды, нервы и жировые клетки расположены всюду в этой сетке из волокон, тогда как белковая соединительная ткань, называемая эластином, располагается главным образом в верхней и нижней части дермы. Находящийся под эпидермой кориум плотен и химически устойчив, образуя основу зернистой поверхности кожи. Поведение различных слоев кожи по отношению к различным химическим [c.382]
Находящийся под эпидермой кориум плотен и химически устойчив, образуя основу зернистой поверхности кожи. Поведение различных слоев кожи по отношению к различным химическим [c.382]
Белки выполняют многие биологические функции. Например, некоторые нз них, называемые структурными белками, являются важными элементами волос, шерсти, шелка, перьев, соединительной ткани и мышц. Нуклеопротсины, образующие комплек- [c.383]
V. В солевом экстракте мышцы открыть присутствие белка (миозина или актомиозина). Установить границы высаливан я миозина (см. работу 148), осаждаемость миозина при диализе солевого экстракта и при разведении его водой, установить границы высаливания хлористым натром. Проделать с раствором миозина цветные реакции на белковые аминокислоты. Остаток ткани после извлечения солевым раствором содержит белки стромы мышечного волокна и белки соединительной ткани. [c.237]
Биологические функции. Белки могут выполнять в живых организмах самые различные функции катализировать (ферменты) и регулировать (гормоны) биохимич. реакции входить в состав соединительной ткани (напр., коллаген) или мышц (актин, миозин) служить резервными питательными веществами (гранулы белка в цитоплазме) и др. Функции дезоксирибонуклеиновой к-ты — передача генетич. информации из поколения в поколение при клеточном делении. Этот Б. служит исходной матрицей при передаче информации внутри клетки. Рибонуклеиновая к-та также участвует в этом процессе, приводящем к синтезу специфич. белков клетки. Полисахариды могут служить резервными питательными веществами (напр., крахмал, гликоген), выполнять структурные функции (напр., целлюлоза полисахариды соединительной ткани), обеспечивать специфические свойства поверхности клеток (напр.1, антигенные полисахариды микроорганизмов) или защиг ту организма в целом (напрнмер, камеди и слизи растений). [c.128]
реакции входить в состав соединительной ткани (напр., коллаген) или мышц (актин, миозин) служить резервными питательными веществами (гранулы белка в цитоплазме) и др. Функции дезоксирибонуклеиновой к-ты — передача генетич. информации из поколения в поколение при клеточном делении. Этот Б. служит исходной матрицей при передаче информации внутри клетки. Рибонуклеиновая к-та также участвует в этом процессе, приводящем к синтезу специфич. белков клетки. Полисахариды могут служить резервными питательными веществами (напр., крахмал, гликоген), выполнять структурные функции (напр., целлюлоза полисахариды соединительной ткани), обеспечивать специфические свойства поверхности клеток (напр.1, антигенные полисахариды микроорганизмов) или защиг ту организма в целом (напрнмер, камеди и слизи растений). [c.128]
Легко подвергаются перевариванию в желудке водорастворимые белки мышц, миозин, актин, а также яичный белок, альбумины и глобулины животного и растительного происхождения. Медленно поддаются воздействию пепсина белки соединительной ткани — коллаген, эдастин. Совершенно не перевариваются в желудке кератины волос и шерсти. Не расщепляются пепсином сравнительно несложные по своей химической структуре и богатые диаминомонокарбоновыми кислотами белки — протамины. [c.335]
Медленно поддаются воздействию пепсина белки соединительной ткани — коллаген, эдастин. Совершенно не перевариваются в желудке кератины волос и шерсти. Не расщепляются пепсином сравнительно несложные по своей химической структуре и богатые диаминомонокарбоновыми кислотами белки — протамины. [c.335]
Структурная единица скелетной мышцы — мышечное волокно—много ядерная клетка длиною в несколько сантиметров, диаметром в 0,2—0,1 мм. Внутри волокна, в саркоплазме, расположены в виде пучков нитей миофиб-риллы —сократительные элементы мышечного волокна. Л1иофибриллы обладают видимой под микроскопом попереч1юй исчерченностью, зависяш,ей от оптической неоднородности входящих в их состав белковых веществ. Мышечное волокно покрыто соединительнотканной оболочкой — сарколеммой. Из мышечных волокон состоят мышечные пучки, содержащие некоторое количество соединительной ткани. Обычно химический состав мышцы изучается не в отдельно взятых ее микроскопических элементах, а в общей массе. Для полного представления о составных частях мышечных волокон учитывают содержание в мышце белков соединительной ткаии. [c.542]
Для полного представления о составных частях мышечных волокон учитывают содержание в мышце белков соединительной ткаии. [c.542]
Повреледения двигательных нервов, перерезка сухожилий вызывают атрофию дтышц, сон])овождающуюся уменьшением их веса и перерождением мышечной ткаии. В мышцах увеличивается содержание соединительной ткани и уменьшается содержание белков, входящих в состав мышечных волокон. Работоспособность мышц, по мере развития дистрофии, снижается благодаря наступающим изменениям в химическом составе мышц и в процессах обмена веществ в них. [c.555]
Система электромеханического сопряжения мышцы. Поперечно-полосатая скелетная мьппца состоит из продольных пучков мышечных волокон с характерным угловатым поперечным сечением. Ширина мьппечных волокон варьирует от 10 до 100 мкм, а длина часто соответствует длине мышцы, достигая в некоторых волокнах 12 см. Всю мышцу окружает тонкий чехол соединительной ткани, которая отделяет пучки мышечных волокон друг от друга и участвует в присоединении их концов к сухожилиям. Мышечное волокно (рис. XXV.1) представляет собой сложную многоядерную клетку, содержаш ую одну-две тысячи более тонких вытянутых волоконец (миофибрилл) диаметром 1-2 мкм, состояш их из элементарных сократительных единиц — саркомеров. Толстые и тонкие нити саркомеров образованы из сократительных (миозин и актин) и Са -чувствительных регуляторных белков (см. 3 этой главы). Функциональная активность белков сократительной системы зависит от концентрации ионов Са внутри саркомера. Быстрое и эффективное [c.225]
Мышечное волокно (рис. XXV.1) представляет собой сложную многоядерную клетку, содержаш ую одну-две тысячи более тонких вытянутых волоконец (миофибрилл) диаметром 1-2 мкм, состояш их из элементарных сократительных единиц — саркомеров. Толстые и тонкие нити саркомеров образованы из сократительных (миозин и актин) и Са -чувствительных регуляторных белков (см. 3 этой главы). Функциональная активность белков сократительной системы зависит от концентрации ионов Са внутри саркомера. Быстрое и эффективное [c.225]
Мышечная и соединительная ткани еще более устойчивы к действию ионизирующей радиации, чем почки. Слабая мышечная атрофия наблюдается при облучении в дозах, превышающих 50 Гр, а выраженные морфологические изменения (геморрагия, некрозы) еще при более значительных дозах радиации. Функциональные и биохимические изменения могут быть обнаружены и при развитии желудочно-кишечного синдрома, однако они выражены слабо. Так, в дозе облучения 10 Гр происходит незначительное снижение тонуса, работоспособности мышц и увеличение времени релаксации наблюдается тенденция к периодическим изменениям (или слабое снижение) таких биохимических показателей, как обмен фосфорных соединений, фосфорилазная, сукцин-дегидразная, цитохромоксидазная активность, содержание гликогена в скелетной мышце и др. Известно, что мышцы служат донаторами белков, фосфорных и пр. веществ для других органов в межтканевом обмене организма, поэтому изменения, происходящие в мышцах облученных животных, не могут совсем не сказываться на общей картине лучевой патологии. То же следует сказать и о соединительной ткани, проницаемость которой повышается спустя несколько дней после облучения животных в летальных дозах и может продолжаться в течение двух-трех недель. Повышение проницаемости связывают с радиационным повреждением основного соединительнотканного вещества, фибробластов, с повышением скорости распада мукополисахаридов, с уменьшением тучных клеток в коже. Ионизирующая радиация может оказывать прямое действие на основное вещество, вызывать деполимеризацию гиалуроновой кислоты, снижать вязкость мукополисахаридов волокон соединительной ткани кожи. [c.201]
Известно, что мышцы служат донаторами белков, фосфорных и пр. веществ для других органов в межтканевом обмене организма, поэтому изменения, происходящие в мышцах облученных животных, не могут совсем не сказываться на общей картине лучевой патологии. То же следует сказать и о соединительной ткани, проницаемость которой повышается спустя несколько дней после облучения животных в летальных дозах и может продолжаться в течение двух-трех недель. Повышение проницаемости связывают с радиационным повреждением основного соединительнотканного вещества, фибробластов, с повышением скорости распада мукополисахаридов, с уменьшением тучных клеток в коже. Ионизирующая радиация может оказывать прямое действие на основное вещество, вызывать деполимеризацию гиалуроновой кислоты, снижать вязкость мукополисахаридов волокон соединительной ткани кожи. [c.201]
Существует несколько основных типов тканей а) эпителиальная ткань — это ткань, которая входит в состав поверхности тела и внутренних органов животных и человека кожа, пищеварительный канал, кровеносные сосуды, железы (внутренней секреции, потовые, жировые), некоторые органы чувств и др. Эпителий по форме клеток делится на цилиндрический и плоский б) соединительная ткань (жировая, хрящевая и костная). Эти ткани имеют много межклеточного вещества, особенно белков коллагена и эластина в) мышечная ткань — исчерченные (поперечно-полосатые) и неисчерченные (гладкие) мышцы (часто отдельно рассматривается сердечная мышца) г) нервная ткань состоит из нейронов и глиальных клеток д) кровь можно рассматривать как ткань пятого типа (хотя это и вызывает иногда возражение гистологов). В состав крови входят следующие клетки эритроциты, лейкоциты (гранулоциты, лимфоциты и моноциты) и тромбоциты. Следует отметить, что большинство данных о плазматической мембране получены как раз на эритроцитах — крупных клетках, удобных для получения так называемых теней эритроцитов. Тень эритроцита — это плазматическая мембрана клетки без внутриклеточного содержимого. [c.83]
Эпителий по форме клеток делится на цилиндрический и плоский б) соединительная ткань (жировая, хрящевая и костная). Эти ткани имеют много межклеточного вещества, особенно белков коллагена и эластина в) мышечная ткань — исчерченные (поперечно-полосатые) и неисчерченные (гладкие) мышцы (часто отдельно рассматривается сердечная мышца) г) нервная ткань состоит из нейронов и глиальных клеток д) кровь можно рассматривать как ткань пятого типа (хотя это и вызывает иногда возражение гистологов). В состав крови входят следующие клетки эритроциты, лейкоциты (гранулоциты, лимфоциты и моноциты) и тромбоциты. Следует отметить, что большинство данных о плазматической мембране получены как раз на эритроцитах — крупных клетках, удобных для получения так называемых теней эритроцитов. Тень эритроцита — это плазматическая мембрана клетки без внутриклеточного содержимого. [c.83]
Синтез мышечного белка в ответ на питание и упражнения
J Physiol. 1 марта 2012 г .; 590 (Pt 5): 1049–1057.
Отделение метаболической физиологии, Школа аспирантуры по медицине и здоровью, Университет Ноттингема, Королевская больница Дерби, Дерби, Великобритания
Автор, ответственный за переписку П.Дж. Атертон: Школа аспирантуры по медицине и здоровью, Отделение метаболической физиологии, Ноттингемский университет , Королевский госпиталь Дерби, Уттоксетер-роуд, Дерби DE22 3DT, Великобритания.Электронная почта: [email protected]Этот обзор взят из симпозиума «Метаболизм при упражнениях » на конференции «Биомедицинские основы элитной эффективности», совместного заседания Психологического общества и Британского фармакологического общества, а также журнала The Journal of Physiology , Экспериментальная физиология, Британский журнал фармакологии и Скандинавский журнал медицины и науки в спорте , в Королевском зале Елизаветы, Лондон, 20 марта 2012 г.
Поступило 21 ноября 2011 г .; Принята в печать 25 января 2012 г.
Abstract
Синтез мышечного протеина (MPS) является движущей силой адаптивных реакций на упражнения и представляет собой широко используемый показатель для измерения хронической эффективности острых вмешательств (например, упражнений / питания). Недавние открытия в этой области были прогрессивными. Повышение MPS, обусловленное питательными веществами, имеет конечную продолжительность (~ 1,5 часа), после чего отключается, несмотря на устойчивую доступность аминокислот и внутримышечную анаболическую передачу сигналов.Интересно, что эта «уставка полной нагрузки на мышцы» задерживается упражнениями с отягощениями (т. Е. Комбинация кормление × упражнение «более анаболична», чем одно питание) даже на ≥24 ч после одной тренировки, что ставит под сомнение важность синхронизации питательных веществ по сравнению с достаточностью как таковой . Исследования, регулирующие интенсивность упражнений / рабочую нагрузку, показали, что увеличение MPS незначительно при RE на 20–40%, но является максимальным при 70–90% от максимума одного повторения, когда рабочая нагрузка согласована (в соответствии с нагрузкой × количество повторений).Однако упражнения низкой интенсивности, выполняемые до отказа, уравновешивают эту реакцию. Анализ отдельных субклеточных фракций (например, миофибриллярных, саркоплазматических, митохондриальных) может обеспечить считывание эффективности хронических упражнений в дополнение к величине эффекта в MPS per se , то есть в то время как «смешанный» MPS увеличивается аналогично с выносливостью и RE, увеличивается в миофибриллярных MPS специфичны для RE, пророка адаптации (т.е. гипертрофии). Наконец, молекулярная регуляция MPS с помощью физических упражнений и ее регуляция с помощью «анаболических» гормонов (например,г. IGF-1) был поставлен под сомнение, что привело к открытию альтернативной механочувствительной передачи сигналов для MPS.
Исследования, регулирующие интенсивность упражнений / рабочую нагрузку, показали, что увеличение MPS незначительно при RE на 20–40%, но является максимальным при 70–90% от максимума одного повторения, когда рабочая нагрузка согласована (в соответствии с нагрузкой × количество повторений).Однако упражнения низкой интенсивности, выполняемые до отказа, уравновешивают эту реакцию. Анализ отдельных субклеточных фракций (например, миофибриллярных, саркоплазматических, митохондриальных) может обеспечить считывание эффективности хронических упражнений в дополнение к величине эффекта в MPS per se , то есть в то время как «смешанный» MPS увеличивается аналогично с выносливостью и RE, увеличивается в миофибриллярных MPS специфичны для RE, пророка адаптации (т.е. гипертрофии). Наконец, молекулярная регуляция MPS с помощью физических упражнений и ее регуляция с помощью «анаболических» гормонов (например,г. IGF-1) был поставлен под сомнение, что привело к открытию альтернативной механочувствительной передачи сигналов для MPS.
Фил Атертон (слева) завершил свою докторскую диссертацию по путям передачи сигналов, регулирующих метаболизм и пластичность скелетных мышц. После этого он закончил трехлетний пост-докторантуру, обеспечивая вклад молекулярной биологии в крупномасштабную программу тренировок с физическими упражнениями, посвященную влиянию старения на физиологическую и метаболическую адаптацию к упражнениям. В 2008 году он принял участие в стипендии Исследовательского совета Великобритании (HEFCE финансируется после 2012 года) с целью развития независимой карьеры и в настоящее время продолжает работу по определению молекулярной регуляции белкового обмена с помощью питания и физических упражнений, здоровья и болезней.Особый интерес Фила заключается в обратном преобразовании «совпадений и наводок» от людей в более удобные модели in vitro с целью достижения как наблюдательного, так и механистического понимания. Кен Смит (справа) защитил докторскую диссертацию в Университете Данди под руководством профессора Майка Ренни, где в течение длительного периода своей карьеры он интересовался разработкой и применением методологий стабильных изотопов для понимания регуляции метаболизма человеческого топлива, в частности обмен аминокислот и белков в скелетных мышцах, при здоровье и болезни; с особым вниманием к роли питания и упражнений в поддержании мышечной массы и функции. В настоящее время он является главным научным сотрудником отдела метаболической физиологии в Университете Ноттингема, где он курирует центр масс-спектрометрии, ключевой компонент недавно награжденного MRC / ARUK «центра скелетно-мышечного старения».
В настоящее время он является главным научным сотрудником отдела метаболической физиологии в Университете Ноттингема, где он курирует центр масс-спектрометрии, ключевой компонент недавно награжденного MRC / ARUK «центра скелетно-мышечного старения».
Предпосылки
Скелетные мышцы — это очень пластичные ткани, которые адаптируются к повышенным двигательным и метаболическим требованиям, предъявляемым физическими упражнениями. Однако успешная адаптация к упражнениям с точки зрения измененной физиологии мышц и повышения производительности сильно зависит от выполняемых действий (например,г. сила, продолжительность и т. д.), а также генетическим составом человека, который определяет его или ее «статус респондента» (Timmons, 2011). Отсюда следует, что избирательность по количеству (то есть отдельные белки или «объемные» субфракции, такие как миофибриллярные, митохондриальные и саркоплазматические) синтезируемых мышечных белков лежит в основе изысканной адаптивной специфичности к различным режимам тренировок и, возможно, даже заметной неоднородности реакции на тренировку ( Тиммонс, 2011).
У здоровых людей, ведущих активный отдых, белки скелетных мышц демонстрируют скорость обновления ~ 1.2% день -1 и существуют в динамическом равновесии: распад мышечного белка (MPB) превышает синтез мышечного белка (MPS) в состоянии натощак, а MPS превышает MPB в состоянии сытости. В ответ на упражнения MPS временно увеличивается, тогда как MPB также увеличивается или остается неизменным (последнее при условии достаточного поступления экзогенных питательных веществ; Kumar et al. 2009 a ). Отсюда следует, что в совокупности увеличение MPS после каждой тренировки «стимулирует» адаптацию к тренировке с физической нагрузкой.
Стабильные изотопы: захват белкового обмена
in vivo Динамические измерения обмена мышечного белка могут быть определены в мышечной ткани с использованием методологий стабильных изотопов (Rennie et al. 1982; Wolfe, 1982). Стабильные изотопы — это нерадиоактивные природные «тяжелые атомы» (NB, безопасные для использования на человеке), которые по существу идентичны своим эндогенным аналогам, но могут быть различимы по разнице масс (с использованием методов масс-спектрометрии). Это позволяет нам измерить включение этих изотопных «мотивов» в биологические образцы, т. Е. Изотопно меченные аминокислоты, чтобы измерить MPS в белке, полученном из биопсийной ткани (Rennie et al. 1982; Trappe et al. 2002; Katsanos et al. др. 2005; Купман и др. 2008 г.). Однако, поскольку эти методы требуют постоянных инфузий индикаторов, они подходят только для измерения «острого» (~ часов) МПС в контролируемых лабораторных условиях. В связи с этим представляет большой интерес тот факт, что недавно были разработаны новые методы отслеживания, в которых измерение MPS возможно у свободноживущих субъектов в течение недель или месяцев.Этот метод включает прием дейтерированной воды (D 2 O) для оценки кумулятивного включения дейтерия в мышечные белки посредством обмена дейтерия через аланин (Robinson et al. 2011).
Это позволяет нам измерить включение этих изотопных «мотивов» в биологические образцы, т. Е. Изотопно меченные аминокислоты, чтобы измерить MPS в белке, полученном из биопсийной ткани (Rennie et al. 1982; Trappe et al. 2002; Katsanos et al. др. 2005; Купман и др. 2008 г.). Однако, поскольку эти методы требуют постоянных инфузий индикаторов, они подходят только для измерения «острого» (~ часов) МПС в контролируемых лабораторных условиях. В связи с этим представляет большой интерес тот факт, что недавно были разработаны новые методы отслеживания, в которых измерение MPS возможно у свободноживущих субъектов в течение недель или месяцев.Этот метод включает прием дейтерированной воды (D 2 O) для оценки кумулятивного включения дейтерия в мышечные белки посредством обмена дейтерия через аланин (Robinson et al. 2011).
Выбор меченой аминокислоты будет определять метод измерения. Использование дейтерия (вместо водорода) позволяет измерять синтез с помощью газовой хроматографии-масс-спектрометрии (ГХ-МС), тогда как использование 13 C или 15 N традиционно измеряется с помощью масс-спектрометрии изотопного отношения (IRMS) фиксированные газы, т. е.е. CO 2 или N 2 , что требует сжигания или выделения CO 2 , например путем реакции с нингидрином или, в случае 15 N, сжиганием до NO 2 с последующим восстановлением с получением N 2 . Свободные аминокислоты (АК) от гидролиза белков отделяются хроматографией (газовой или жидкой) и сжигаются перед масс-спектрометрическим анализом, например газовая хроматография – сжигание (GC-C) –IRMS или жидкостная хроматография – сжигание (LC-C) –IRMS (вводный обзор методов с использованием индикаторов см. Rennie, 1999).
е.е. CO 2 или N 2 , что требует сжигания или выделения CO 2 , например путем реакции с нингидрином или, в случае 15 N, сжиганием до NO 2 с последующим восстановлением с получением N 2 . Свободные аминокислоты (АК) от гидролиза белков отделяются хроматографией (газовой или жидкой) и сжигаются перед масс-спектрометрическим анализом, например газовая хроматография – сжигание (GC-C) –IRMS или жидкостная хроматография – сжигание (LC-C) –IRMS (вводный обзор методов с использованием индикаторов см. Rennie, 1999).
Последние достижения в стабильности и чувствительности масс-спектрометров в сочетании с доступностью аминокислот, меченных множеством «тяжелых атомов», например [1,2- 13 C 2 ] лейцин (Atherton et al. 2010), [D 5 ] — или [ 13 C 6 ] фенилаланин (Koopman et al. 2008 ; Burd et al. 2011), позволил добиться большего разрешения острых реакций MPS даже в течение 30–45 минутных периодов (Atherton et al. 2010) и, таким образом, измерение временного характера отклика MPS. Однако техническая разработка и применение методов измерения распада мышечного белка (MPB) отстают от MPS, и в результате гораздо меньше известно о реакции MPB на упражнения и питание. Однако стабильные изотопы позволяют оценить MPB путем разбавления индикатора через конечность (с использованием модели артериовенозного баланса) при оценке в сочетании с кровотоком в конечности, т. Е. Большая разница в маркировке незаменимой аминокислоты (EAA). между артериально-венозными образцами указывает на более высокую скорость высвобождения АК через MPB (Wilkes et al. 2009).
2010) и, таким образом, измерение временного характера отклика MPS. Однако техническая разработка и применение методов измерения распада мышечного белка (MPB) отстают от MPS, и в результате гораздо меньше известно о реакции MPB на упражнения и питание. Однако стабильные изотопы позволяют оценить MPB путем разбавления индикатора через конечность (с использованием модели артериовенозного баланса) при оценке в сочетании с кровотоком в конечности, т. Е. Большая разница в маркировке незаменимой аминокислоты (EAA). между артериально-венозными образцами указывает на более высокую скорость высвобождения АК через MPB (Wilkes et al. 2009).
Регулирование MPS посредством питания
Двумя основными детерминантами протеостаза скелетных мышц взрослых являются физическая активность (обсуждается ниже) и доступность питательных веществ. Анаболические эффекты питания в основном обусловлены переносом и включением аминокислот, захваченных из источников пищевого белка, в белки скелетных мышц. Целью этого является компенсация мышечного белка, который теряется в периоды голодания (после абсорбции), например, из-за окисления аминокислот и / или донорства углерода для глюконеогенеза печени (Wackerhage & Rennie, 2006).Критически важно (при условии хорошего здоровья и подвижности) именно этот динамический цикл «голод-потеря / сытость-прибыль» в протеостазе обеспечивает постоянство мышечной массы. Но каковы «анаболические компоненты» питания? После ранней работы, в которой было установлено, что анаболические эффекты смешанного кормления полностью связаны с незаменимыми аминокислотами (EAA) (Smith et al. 1992), мы и другие исследователи продемонстрировали дозозависимые и насыщаемые эффекты при употреблении 10 г. EAAs (Cuthbertson et al. 2005), эквивалентные ~ 20 г белка (Moore et al. 2009). Возможно, неудивительно, что этот анаболический ответ носит временный характер, что имеет смысл, поскольку отказавшись от адаптивного увеличения MPB, можно достичь гипертрофии, просто потребляя избыток белка! График реакции на кормление насыщенным количеством протеина выглядит следующим образом.
Целью этого является компенсация мышечного белка, который теряется в периоды голодания (после абсорбции), например, из-за окисления аминокислот и / или донорства углерода для глюконеогенеза печени (Wackerhage & Rennie, 2006).Критически важно (при условии хорошего здоровья и подвижности) именно этот динамический цикл «голод-потеря / сытость-прибыль» в протеостазе обеспечивает постоянство мышечной массы. Но каковы «анаболические компоненты» питания? После ранней работы, в которой было установлено, что анаболические эффекты смешанного кормления полностью связаны с незаменимыми аминокислотами (EAA) (Smith et al. 1992), мы и другие исследователи продемонстрировали дозозависимые и насыщаемые эффекты при употреблении 10 г. EAAs (Cuthbertson et al. 2005), эквивалентные ~ 20 г белка (Moore et al. 2009). Возможно, неудивительно, что этот анаболический ответ носит временный характер, что имеет смысл, поскольку отказавшись от адаптивного увеличения MPB, можно достичь гипертрофии, просто потребляя избыток белка! График реакции на кормление насыщенным количеством протеина выглядит следующим образом. После задержки примерно в 30 минут наблюдается значительное увеличение (примерно в 3 раза) с максимальным значением MPS примерно через 1,5 часа до возврата к исходному уровню через 2 часа (Atherton et al. 2010), несмотря на продолжающееся повышение доступности циркулирующих аминокислот и устойчивый «анаболическая передача сигналов» (Bohe et al. 2001; Atherton et al. 2010). Именно в этот момент мышца становится рефрактерной к стимуляции, несмотря на устойчивое повышение уровня АК (см.). Мы назвали это явление «заполнением мышц» (Bohe et al. 2001; Atherton et al. 2010) на основе концепции развития, представленной Джо Миллуордом, согласно которой наращивание мышечного белка физически ограничено неэластичной соединительной тканью коллагена. эндомизий, окружающий каждое волокно (гипотеза «полного мешка») (Millward et al. 1994).
После задержки примерно в 30 минут наблюдается значительное увеличение (примерно в 3 раза) с максимальным значением MPS примерно через 1,5 часа до возврата к исходному уровню через 2 часа (Atherton et al. 2010), несмотря на продолжающееся повышение доступности циркулирующих аминокислот и устойчивый «анаболическая передача сигналов» (Bohe et al. 2001; Atherton et al. 2010). Именно в этот момент мышца становится рефрактерной к стимуляции, несмотря на устойчивое повышение уровня АК (см.). Мы назвали это явление «заполнением мышц» (Bohe et al. 2001; Atherton et al. 2010) на основе концепции развития, представленной Джо Миллуордом, согласно которой наращивание мышечного белка физически ограничено неэластичной соединительной тканью коллагена. эндомизий, окружающий каждое волокно (гипотеза «полного мешка») (Millward et al. 1994).
Эффект «мускулов». Связь между MPS, AA и внутримышечной передачей сигналов
Какова роль инсулина в регуляции анаболических реакций на питание (через секрецию, индуцированную питательными веществами)? Хотя стоит отметить, что предоставление только белка (то есть без углеводов) вызывает повышение уровня инсулина, подобное тому, которое наблюдается после смешанного приема пищи (Atherton et al. 2010), инсулин, по-видимому, не влияет на анаболические эффекты EAA на MPS. . Чтобы проиллюстрировать это, инфузии EAA надежно стимулируют MPS, даже когда инсулин «зажимается» при постабсорбционных концентрациях (5 мкМЕ / мл -1 с ингибитором β-клеток октреотидом; Greenhaff et al. 2008 г.). Однако это не означает, что инсулин не играет роли постпрандиального анаболика. Действительно, помимо трехкратного увеличения MPS, есть также значительный антипротеолитический (~ 40-50%) эффект питания на скелетные мышцы, который, по-видимому, полностью связан с инсулином. Чтобы проиллюстрировать это, повышения уровня инсулина до 15 мкМЕ / мл -1 (3 × постабсорбционные концентрации) достаточно, чтобы имитировать 50% ингибирование MPB (NB, максимальный размер эффекта), вызванное смешанным приемом пищи (Wilkes et al. al. 2009). Более того, этот антикатаболический эффект нельзя воспроизвести с помощью инфузий больших доз АК (18 gh -1 в течение 3 часов), когда инсулин зажимается при постабсорбтивных концентрациях (5 мкЕд / мл -1 ) (Greenhaff et al.
2010), инсулин, по-видимому, не влияет на анаболические эффекты EAA на MPS. . Чтобы проиллюстрировать это, инфузии EAA надежно стимулируют MPS, даже когда инсулин «зажимается» при постабсорбционных концентрациях (5 мкМЕ / мл -1 с ингибитором β-клеток октреотидом; Greenhaff et al. 2008 г.). Однако это не означает, что инсулин не играет роли постпрандиального анаболика. Действительно, помимо трехкратного увеличения MPS, есть также значительный антипротеолитический (~ 40-50%) эффект питания на скелетные мышцы, который, по-видимому, полностью связан с инсулином. Чтобы проиллюстрировать это, повышения уровня инсулина до 15 мкМЕ / мл -1 (3 × постабсорбционные концентрации) достаточно, чтобы имитировать 50% ингибирование MPB (NB, максимальный размер эффекта), вызванное смешанным приемом пищи (Wilkes et al. al. 2009). Более того, этот антикатаболический эффект нельзя воспроизвести с помощью инфузий больших доз АК (18 gh -1 в течение 3 часов), когда инсулин зажимается при постабсорбтивных концентрациях (5 мкЕд / мл -1 ) (Greenhaff et al. ). 2008 г.). Таким образом, подытоживая, можно сказать, что EAA регулирует анаболические ответы посредством значительного увеличения MPS, в то время как высвобождение инсулина регулирует антикатаболические (депрессии MPB) ответы. Отсюда следует, что, поскольку изменение MPS намного больше, чем у MPB, MPS является основной движущей силой анаболизма, индуцированного питательными веществами.
). 2008 г.). Таким образом, подытоживая, можно сказать, что EAA регулирует анаболические ответы посредством значительного увеличения MPS, в то время как высвобождение инсулина регулирует антикатаболические (депрессии MPB) ответы. Отсюда следует, что, поскольку изменение MPS намного больше, чем у MPB, MPS является основной движущей силой анаболизма, индуцированного питательными веществами.
Регулирование MPS с помощью острых упражнений
Величина острой реакции мышцы на упражнения с отягощениями в терминах MPS зависит как от рабочей нагрузки, так и от интенсивности. Например, при интенсивностях ≤40% от максимума однократного повторения (1-RM) нет заметного увеличения MPS, тогда как при интенсивностях более 60% 1-RM упражнения увеличивают MPS в 2-3 раза (Kumar и др. 2009 b ). Однако это не означает, что упражнения с меньшей интенсивностью не могут дать анаболический эффект.Действительно, увеличение MPS на 30% 1-RM сопоставимой величины с группой, выполняющей 90% 1-RM, возможно, но только тогда, когда упражнение выполняется до отказа, а не когда работа соответствует от 30 до 90% 1-RM (Burd и др. 2010). По сути, это означает, что увеличение объема работы с более низкой интенсивностью может преодолеть и даже превзойти притупленный ответ MPS с подобранными с работой упражнениями низкой интенсивности, вероятно, как следствие увеличения набора волокон типа II из-за утомительного характера сокращений. (Burd et al. 2010). Таким образом, утомительные сокращения с низкой нагрузкой могут представлять собой реальный подход к стимуляции гипертрофии мышц и средство ухода от работы с тяжелыми весами.
2010). По сути, это означает, что увеличение объема работы с более низкой интенсивностью может преодолеть и даже превзойти притупленный ответ MPS с подобранными с работой упражнениями низкой интенсивности, вероятно, как следствие увеличения набора волокон типа II из-за утомительного характера сокращений. (Burd et al. 2010). Таким образом, утомительные сокращения с низкой нагрузкой могут представлять собой реальный подход к стимуляции гипертрофии мышц и средство ухода от работы с тяжелыми весами.
Что касается режима сокращения, хотя упражнения эксцентрического типа (т. Е. Удлинение сокращений, а не бег назад), как было показано, приводят к большей мышечной гипертрофии (Roig et al. 2009), измерение МПС после концентрических и эксцентрических упражнений сокращения продемонстрировали лишь относительно небольшие временные различия (Cuthbertson et al. 2006). Более того, когда общая работа согласована между эксцентрическими и концентрическими сокращениями, нет никакой разницы в гипертрофии мышц, вызванной тренировкой (Moore et al. 2011). Таким образом, повышенная внешняя нагрузка, возникающая во время эксцентрических сокращений, может объяснить большую эффективность эксцентрической тренировки, а не режима сокращения как такового .
2011). Таким образом, повышенная внешняя нагрузка, возникающая во время эксцентрических сокращений, может объяснить большую эффективность эксцентрической тренировки, а не режима сокращения как такового .
Возможно, неудивительно, что, как и в случае с «полной мышечной массой» на кормление, анаболическая реакция на упражнения также должна быть ограниченной по продолжительности.Что касается динамики ответа MPS, сразу после тренировки существует латентный период (до подъема MPS) длительностью, которая, по-видимому, связана с величиной энергии / механического стресса, связанного с упражнением. Эта предпосылка была проиллюстрирована в исследовании на грызунах, показавшем, что MPS подавляется во время интенсивного сокращения в зависимости от рабочего цикла (т. Е. Работы) (Atherton & Rennie, 2006; Rose et al. 2009). Кроме того, хотя не существует эквивалентных исследований на людях (т.е. МПС во время упражнений), в острый период восстановления после упражнений были предприняты меры, которые могут указывать на аналогичные механизмы. Например, в то время как MPS оставался неизменным в течение 3 часов после чрезвычайно утомляющих и разрушительных эксцентрических сокращений (подъем / шаг вниз с несущей нагрузкой) (Cuthbertson et al. 2006), латентный период для упражнений с меньшей интенсивностью (6 × 8 повторений) при 75% 1-RM) составляет <1 ч (Kumar et al. 2009 b ).
Например, в то время как MPS оставался неизменным в течение 3 часов после чрезвычайно утомляющих и разрушительных эксцентрических сокращений (подъем / шаг вниз с несущей нагрузкой) (Cuthbertson et al. 2006), латентный период для упражнений с меньшей интенсивностью (6 × 8 повторений) при 75% 1-RM) составляет <1 ч (Kumar et al. 2009 b ).
После этого латентного периода MPS резко возрастает между 45 и 150 минутами и может поддерживаться до 4 часов (Kumar et al. 2009 b ) в голодном состоянии (ограничено доступностью субстрата) и в присутствии повышенной доступности АК, до 24 часов и более (Cuthbertson et al. 2006). Интересно, что динамика изменения МПС во время тренировки имитирует динамику эпимизиального коллагена и коллагена сухожилий, что демонстрирует высокую степень координации между тканями опорно-двигательного аппарата в ответ на упражнения (Miller et al. 2005 ).
Упражнение × взаимодействие питательных веществ, регулирующее МПС
Ключевым аспектом, окружающим острую реакцию на упражнения и последующую адаптацию, является взаимодействие питательных веществ × упражнений. Это подтверждается тем фактом, что резкое увеличение MPS после упражнений в отсутствие питания EAA обеспечивает более длительное повышение MPB, так что чистым эффектом является отрицательный баланс мышечных белков (Biolo et al. 1995). Если такой дефицит EAA будет сохраняться на протяжении всей тренировки, это приведет к дезадаптации; вы не можете нарастить или реконструировать мышцы без аминокислот! Отсюда следует, что увеличение доступности EAA в рационе после упражнений увеличивает как величину, так и продолжительность увеличения MPS (Pennings et al. 2011). Следовательно, по сути, упражнения способны предварительно подготовить мышцы, чтобы отсрочить полное «заданное значение» мышцы (показано на рисунке). Интересно отметить, что добавление углеводов к белку не оказывает большего анаболического воздействия на обмен белка (ни увеличения MPS, ни депрессии MPB) после тренировки, подчеркивая центральную роль EAA как основных (и, возможно, единственных!) Макроэлементов, необходимых для оптимизации анаболических реакций в организме.
Это подтверждается тем фактом, что резкое увеличение MPS после упражнений в отсутствие питания EAA обеспечивает более длительное повышение MPB, так что чистым эффектом является отрицательный баланс мышечных белков (Biolo et al. 1995). Если такой дефицит EAA будет сохраняться на протяжении всей тренировки, это приведет к дезадаптации; вы не можете нарастить или реконструировать мышцы без аминокислот! Отсюда следует, что увеличение доступности EAA в рационе после упражнений увеличивает как величину, так и продолжительность увеличения MPS (Pennings et al. 2011). Следовательно, по сути, упражнения способны предварительно подготовить мышцы, чтобы отсрочить полное «заданное значение» мышцы (показано на рисунке). Интересно отметить, что добавление углеводов к белку не оказывает большего анаболического воздействия на обмен белка (ни увеличения MPS, ни депрессии MPB) после тренировки, подчеркивая центральную роль EAA как основных (и, возможно, единственных!) Макроэлементов, необходимых для оптимизации анаболических реакций в организме. обмен белков при физических упражнениях (Staples et al. 2011).
обмен белков при физических упражнениях (Staples et al. 2011).
Была проведена значительная работа по определению оптимального времени приема пищи, чтобы максимизировать MPS после тренировки и последующую адаптацию к тренировкам (Cribb & Hayes, 2006; Hoffman et al. 2009). В целом, мы считаем, что в значительной степени не имеет значения, давать корм до, во время или после тренировки. Это связано с тем, что задержка полной мышечной реакции, по-видимому, длится не менее 24 часов (Burd et al. 2011) после одного упражнения, что может помочь объяснить хронические адаптации, такие как гипертрофия / ремоделирование мышц с течением времени, независимо от режима кормления, зависящего от близости (см.).Таким образом, мы утверждаем, что достаточность питательных веществ как таковая , а не время приема, является более важным аспектом для успешной гипертрофической адаптации (это не означает, что некоторые важные преимущества производительности / восстановления могут быть получены при употреблении пищи в непосредственной близости от упражнение) (Ferguson-Stegall et al. 2011). Более того, все еще существуют пределы того, насколько сильно система может быть задействована, и увеличение белковой нагрузки до идентичного цикла упражнений по-прежнему демонстрирует насыщаемую реакцию примерно при 20 г (что эквивалентно максимальной дозе ЕАА 10 г, наблюдаемой с ЕАА в отсутствие упражнений. ), выше которого окисление аминокислот увеличивается, и, таким образом, катаболизируется избыток белка (Moore et al. 2009). Следовательно, увеличение нагрузки на ЕАА не полностью преодолевает эффект увеличения мышц, обеспечиваемый упражнениями; скорее, он продлевает анаболическое окно. Такие стратегии умеренного кормления могут быть лучше (аликвоты ~ 20 г PRO), но, возможно, более часто (частота которых еще предстоит определить, то есть как долго мышца остается невосприимчивой к анаболическим эффектам АК).
2011). Более того, все еще существуют пределы того, насколько сильно система может быть задействована, и увеличение белковой нагрузки до идентичного цикла упражнений по-прежнему демонстрирует насыщаемую реакцию примерно при 20 г (что эквивалентно максимальной дозе ЕАА 10 г, наблюдаемой с ЕАА в отсутствие упражнений. ), выше которого окисление аминокислот увеличивается, и, таким образом, катаболизируется избыток белка (Moore et al. 2009). Следовательно, увеличение нагрузки на ЕАА не полностью преодолевает эффект увеличения мышц, обеспечиваемый упражнениями; скорее, он продлевает анаболическое окно. Такие стратегии умеренного кормления могут быть лучше (аликвоты ~ 20 г PRO), но, возможно, более часто (частота которых еще предстоит определить, то есть как долго мышца остается невосприимчивой к анаболическим эффектам АК).
Задержка сигнала «заполнение мышц» в ответ на питание сохраняется даже на 24 часа после одной тренировки.
Регулирование MPS с помощью тренировок.

Влияние тренировок на MPS изучено не так хорошо.Хотя в ряде исследований отмечается увеличение «базального или постабсорбтивного» МПС в результате тренировки per se , они могут просто подтверждать длительные острые эффекты, особенно если измерения проводились менее чем через 24 часа после последней тренировки ( Hasten и др. 2000). Тем не менее, есть данные, которые предполагают, что тренировка сокращает продолжительность анаболического ответа, что может быть связано с большей острой адаптационной эффективностью (Hartman et al. 2006; Тан и др. 2008), или, возможно, законы убывающей отдачи с точки зрения адаптивных реакций.
Ответы в MPS на различные режимы упражнений
Как область, мы часто виноваты в том, что делаем упор на упражнениях с отягощениями и питании, а также на способах увеличения мышц. Тем не менее, большинство исследований подтверждают мнение о том, что ответы MPS одинаковы независимо от режима упражнений, то есть сопротивление против без сопротивления (хотя продолжительность сенсибилизации может отличаться). Например, упражнения на выносливость, такие как бег или езда на велосипеде, также связаны с повышенным синтезом смешанных мышечных белков (~ 50–60%) (Harber et al. 2010). Однако эти острые реакции не связаны со значительными изменениями мышечной массы, то есть гипертрофией, наблюдаемой при упражнениях с отягощениями. Так что же означают эти изменения? Ясно, что экстраполяция амплитуды увеличения MPS смешанной мышцы не может дать информацию об адаптации — так что же мы можем сделать? Как было сказано в начальном разделе этого обзора, для адаптации к отображению специфичности режима упражнений в мышцах должны быть разные ответы различных фракций белка (и, действительно, отдельных белков).Действительно, это предположение было элегантно продемонстрировано в исследовании, в котором одни и те же люди выполняли 10-недельную программу сопротивления (поднятие тяжестей) для одной ноги и 10-недельную программу на выносливость (езда на велосипеде) — для другой. После тренировки посттренировочный синтез миофибриллярного, а не митохондриального белка увеличивался при выполнении упражнений с отягощениями (Wilkinson et al.
Например, упражнения на выносливость, такие как бег или езда на велосипеде, также связаны с повышенным синтезом смешанных мышечных белков (~ 50–60%) (Harber et al. 2010). Однако эти острые реакции не связаны со значительными изменениями мышечной массы, то есть гипертрофией, наблюдаемой при упражнениях с отягощениями. Так что же означают эти изменения? Ясно, что экстраполяция амплитуды увеличения MPS смешанной мышцы не может дать информацию об адаптации — так что же мы можем сделать? Как было сказано в начальном разделе этого обзора, для адаптации к отображению специфичности режима упражнений в мышцах должны быть разные ответы различных фракций белка (и, действительно, отдельных белков).Действительно, это предположение было элегантно продемонстрировано в исследовании, в котором одни и те же люди выполняли 10-недельную программу сопротивления (поднятие тяжестей) для одной ноги и 10-недельную программу на выносливость (езда на велосипеде) — для другой. После тренировки посттренировочный синтез миофибриллярного, а не митохондриального белка увеличивался при выполнении упражнений с отягощениями (Wilkinson et al. 2008). Напротив, после тренировки синтез митохондриального белка увеличивался только в ноге, тренированной на выносливость, тогда как миофибрилла — нет.Эти данные, по-видимому, предполагают «соответствие» между ответами MPS и фенотипическими изменениями, то есть гипертрофией мышц при тренировках с отягощениями по сравнению с биогенезом митохондрий при тренировках на выносливость. Тем не менее, хотя было бы заманчиво прийти к выводу, что острые реакции в определенных мышечных пулах могут дать представление о последующих хронических адаптациях, ответы у нетренированного человека могут быть менее специфичными (Wilkinson et al. 2008) и больше связаны с незнакомостью упражнение как таковое (Coffey et al. 2006). Следовательно, экстраполяцию острого МПС в субфракциях на потенциальные адаптивные реакции после одного сеанса незнакомых упражнений следует интерпретировать с осторожностью.
2008). Напротив, после тренировки синтез митохондриального белка увеличивался только в ноге, тренированной на выносливость, тогда как миофибрилла — нет.Эти данные, по-видимому, предполагают «соответствие» между ответами MPS и фенотипическими изменениями, то есть гипертрофией мышц при тренировках с отягощениями по сравнению с биогенезом митохондрий при тренировках на выносливость. Тем не менее, хотя было бы заманчиво прийти к выводу, что острые реакции в определенных мышечных пулах могут дать представление о последующих хронических адаптациях, ответы у нетренированного человека могут быть менее специфичными (Wilkinson et al. 2008) и больше связаны с незнакомостью упражнение как таковое (Coffey et al. 2006). Следовательно, экстраполяцию острого МПС в субфракциях на потенциальные адаптивные реакции после одного сеанса незнакомых упражнений следует интерпретировать с осторожностью.
Чувствительность и сигнализация, регулирующая MPS
Несмотря на то, что вопрос «черного ящика», связанный с механизмами, регулирующими MPS и адаптацию к упражнениям, все еще является горячим местом для исследований, все еще остается плохо определенным. Упражнения запускают сложные механотрансдукционные и физико-химические (т. Е. Эндокринные, ауто / паракринные) сенсорные механизмы (Glass, 2010; West et al. 2010). Последующая активация рецепторных и нерецепторно-опосредованных внутримышечных сигналов модулирует клеточный аппарат, регулируя как краткосрочный посттрансляционный (фосфорилирование) контроль оборота белков и экспрессии генов (мРНК / миРНК), так и долгосрочные изменения в метаболической способности клеток.
Упражнения запускают сложные механотрансдукционные и физико-химические (т. Е. Эндокринные, ауто / паракринные) сенсорные механизмы (Glass, 2010; West et al. 2010). Последующая активация рецепторных и нерецепторно-опосредованных внутримышечных сигналов модулирует клеточный аппарат, регулируя как краткосрочный посттрансляционный (фосфорилирование) контроль оборота белков и экспрессии генов (мРНК / миРНК), так и долгосрочные изменения в метаболической способности клеток.
Но что мы знаем об этом черном ящике? Во-первых, точно установлено, что мишень рапамицина у млекопитающих (mTOR) является ключевым сигнальным путем, регулирующим изменения, вызванные физической нагрузкой / питательными веществами, при MPS (Drummond et al. 2009; Дикинсон и др. 2011). Действительно, активация mTOR в конечном итоге индуцирует фосфорилирование нескольких субстратов факторов инициации трансляции (4E-связывающий белок (4EBP1), киназу рибосомного белка S6 (p70S6K1), факторы инициации эукариот 4 G / A / B (eIF4G / A / B) и образование каркас eIF3F), чтобы способствовать сборке пре-инициаторного комплекса 48S. По параллельному пути, активация ключевого фактора обмена гуанина, эукариотический фактор инициации 2B (eIF2B) eIF2 перемещает инициаторную тРНК (Met-tRNAi) к рибосоме во время образования пре-инициаторного комплекса 48S, тем самым способствуя «глобальному» синтезу белка. и скоординированное повышение эффективности трансляции (подробные обзоры mTOR и связанной с ним передачи сигналов см. в Proud, 2009; Goodman et al. 2011).
По параллельному пути, активация ключевого фактора обмена гуанина, эукариотический фактор инициации 2B (eIF2B) eIF2 перемещает инициаторную тРНК (Met-tRNAi) к рибосоме во время образования пре-инициаторного комплекса 48S, тем самым способствуя «глобальному» синтезу белка. и скоординированное повышение эффективности трансляции (подробные обзоры mTOR и связанной с ним передачи сигналов см. в Proud, 2009; Goodman et al. 2011).
Что касается вопроса «что находится выше mTOR?», Давно известно, что нутриенты (EAA) передают сигнал через mTOR независимо от проксимальной передачи сигналов инсулина (подробные обзоры, выходящие за рамки настоящего обзора, см. В Proud, 2009, 2011). Однако влияние физических упражнений перед mTOR было более спорным. Большая часть ранних исследований животных (Stitt et al. 2004) и клеток (Rommel et al. 2001) указала на канонический сигнальный путь, посредством которого увеличивается инсулиноподобный фактор роста (IGF-1 или варианты сплайсинга, такие как механоид).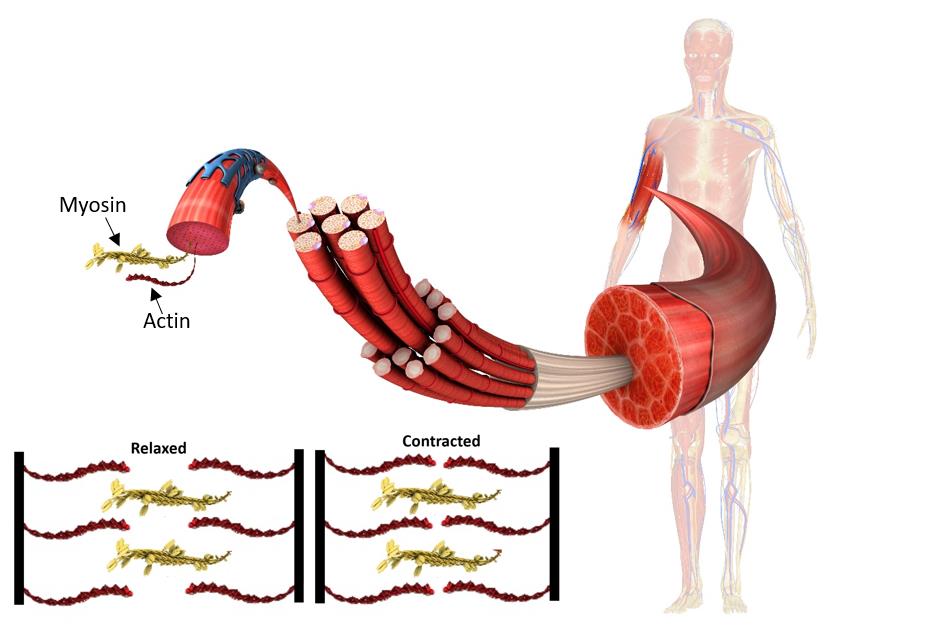 -фактор роста (MGF)) стимулирует проксимальные пути передачи сигналов инсулина (IGFr – AKT – mTOR) и, следовательно, ключевые субстраты mTOR, регулирующие инициацию трансляции.Однако существует ряд доказательств из систем in vivo и in vitro , аргументирующих противодействие такому каноническому пути IGFr – AKT – mTOR в регуляции индуцированного физической нагрузкой MPS. В элегантно разработанном исследовании упражнения с отягощениями выполнялись в мышцах рук человека в условиях либо высокой концентрации эндогенного гормона (HH; одновременные двусторонние упражнения для ног), либо низких концентраций эндогенного гормона (LH; отсутствие одновременных упражнений для ног) (West et al. 2009). ). Тем не менее, несмотря на значительные различия в концентрациях гормона роста, тестостерона и IGF-1 между группами LH и HH, не было различий в передаче сигналов mTOR, MPS или в хронической адаптации к тренировкам с точки зрения увеличения массы или силы (West et al.
-фактор роста (MGF)) стимулирует проксимальные пути передачи сигналов инсулина (IGFr – AKT – mTOR) и, следовательно, ключевые субстраты mTOR, регулирующие инициацию трансляции.Однако существует ряд доказательств из систем in vivo и in vitro , аргументирующих противодействие такому каноническому пути IGFr – AKT – mTOR в регуляции индуцированного физической нагрузкой MPS. В элегантно разработанном исследовании упражнения с отягощениями выполнялись в мышцах рук человека в условиях либо высокой концентрации эндогенного гормона (HH; одновременные двусторонние упражнения для ног), либо низких концентраций эндогенного гормона (LH; отсутствие одновременных упражнений для ног) (West et al. 2009). ). Тем не менее, несмотря на значительные различия в концентрациях гормона роста, тестостерона и IGF-1 между группами LH и HH, не было различий в передаче сигналов mTOR, MPS или в хронической адаптации к тренировкам с точки зрения увеличения массы или силы (West et al. . 2010). Эти данные предполагают, что системная индукция IGF-1 не является основной частью адаптивного процесса. Тем не менее, можно утверждать, что IGF-1 регулирует передачу сигналов AKT-mTOR посредством более «местных» ауто / паракринных механизмов передачи сигналов. Тем не менее, это также трудно согласовать, поскольку устранение IGFr не ставит под угрозу хронические адаптации, то есть гипертрофические реакции на нагрузку в доклинических моделях (Spangenburg et al. 2008; Hamilton et al. 2010).
. 2010). Эти данные предполагают, что системная индукция IGF-1 не является основной частью адаптивного процесса. Тем не менее, можно утверждать, что IGF-1 регулирует передачу сигналов AKT-mTOR посредством более «местных» ауто / паракринных механизмов передачи сигналов. Тем не менее, это также трудно согласовать, поскольку устранение IGFr не ставит под угрозу хронические адаптации, то есть гипертрофические реакции на нагрузку в доклинических моделях (Spangenburg et al. 2008; Hamilton et al. 2010).
Итак, что еще может быть выше mTOR в ответ на упражнение? Механотрансдукция — это процесс преобразования механических (т.е. упражнение) стимулы в клеточные ответы и представляет собой жизнеспособное средство, с помощью которого клетки могут различать механические воздействия и, таким образом, возможно, придают адаптивную специфичность (подробный обзор см. Hornberger, 2011). Важно отметить, что недавняя работа подчеркнула, что фосфолипаза D (PLD) и ее мембранный липидный вторичный мессенджер фосфатидовая кислота (PA) находятся выше по течению от индуцированной сокращением активации mTOR, поскольку фармакологическое ингибирование PLD эффективно отменяет активацию mTOR в ответ на сокращения ( О’Нил и др. 2009). Возможно, это представляет собой по крайней мере один из внутренних механизмов, с помощью которых мышцы могут адаптироваться независимо от системных или даже локально происходящих сигналов, основанных на мембранных рецепторах.
2009). Возможно, это представляет собой по крайней мере один из внутренних механизмов, с помощью которых мышцы могут адаптироваться независимо от системных или даже локально происходящих сигналов, основанных на мембранных рецепторах.
С точки зрения генерации фенотипа выносливости, возможно, главной сигнальной осью, участвующей в митохондриальном биогенезе, является путь коактиватора γ-рецептора, активируемого 5′-AMP-активированной протеинкиназой (AMPK) и активируемого пролифератором пероксисом (PGC-1), вероятно, активируется повышенным соотношением АМФ: АТФ из-за высоких энергозатрат (и / или стресса), связанных с выносливостью (Atherton et al. 2005) или даже незнакомые занятия (Coffey et al. 2006). Сверхэкспрессия PGC-1 способствует биогенезу митохондрий (Viscomi et al. 2011), а активация AMPK может как тормозить MPS, так и индуцировать MPB посредством протеаосомных механизмов и механизмов, связанных с аутофагией (Bolster et al. 2002).
Последнее представление о том, что контроль MPS и MPB скоординированно регулируется потоком через «пути» AMPK – AKT – mTOR, интригует, и предполагается, что баланс этих сигналов (регулируемый энергетическим и механическим воздействием) может в какой-то степени определяют адаптивную специфичность и, возможно, емкость.
Выводы и будущая работа
Как рабочие в полевых условиях, мы склонны «разбивать» режимы тренировок на «выносливость», составляя длительные малоинтенсивные нагрузки (например, продолжительный бег и езда на велосипеде) или «упражнения с сопротивлением» (Kumar и др., 2009 a ), включающие усилия высокой интенсивности (например, поднятие тяжестей). Однако эта классификация опровергает тот факт, что существуют режимы упражнений, в которых используются оба метода. Например, высокоинтенсивный тренинг (HIT) включает в себя очень короткие периоды высокоинтенсивных сокращений в стиле Вингейта, но в первую очередь вызывает адаптацию типа выносливости как его главную особенность (Burgomaster et al. 2008 г.). Более того, для Джо Паблика в тренажерном зале и, что особенно важно для элитных спортсменов, цель часто состоит в том, чтобы выполнять кросс-стилевые тренировки (также называемые параллельными тренировками), чтобы подготовиться к соревнованиям, требующим сочетания силы, выносливости и мощности, вклад каждого необходимого варьируется в зависимости от требований конкретного мероприятия (мероприятий). Тем не менее, существует ли конфликт между различными режимами тренировки на молекулярной, MPS или адаптивной основе, еще предстоит определить.
2008 г.). Более того, для Джо Паблика в тренажерном зале и, что особенно важно для элитных спортсменов, цель часто состоит в том, чтобы выполнять кросс-стилевые тренировки (также называемые параллельными тренировками), чтобы подготовиться к соревнованиям, требующим сочетания силы, выносливости и мощности, вклад каждого необходимого варьируется в зависимости от требований конкретного мероприятия (мероприятий). Тем не менее, существует ли конфликт между различными режимами тренировки на молекулярной, MPS или адаптивной основе, еще предстоит определить.
Несмотря на значительный прогресс в нашем биохимическом понимании «задействованных сигнальных путей», мы еще очень далеки от понимания их участия в адаптивной специфичности человека.Например, как очевидно похожие изменения клеточных сигналов регулируют определенные мышечные фракции (митохондриальные, миофибриллярные и т. Д.) В соответствии с характером упражнения? Действительно, даже сравнение режимов упражнений, обеспечивающих адаптацию на противоположных концах спектра (классическая выносливость против сопротивления ), не привело к консенсусу по отдельным регуляторным сигнальным событиям. Возможно, это связано с тем, что ответы во многом определяются статусом обучения (Coffey et al. 2006; Wilkinson et al. 2008; Vissing et al. 2011), генетическая гетерогенность (Timmons, 2011) и даже технические ограничения, связанные с плохим временным разрешением по «мгновенным» измерениям фосфорилирования. С другой стороны, нам, возможно, придется столкнуться с перспективой того, что поиск «главных регуляторов», таких как AMPK, AKT и mTOR у людей, наивен и что расширение наших сетей, то есть охват измерений геномной мРНК / миРНК, необходимо для истинного понимания роль белкового обмена в определении неоднородности адаптивной специфичности и способности.
Возможно, это связано с тем, что ответы во многом определяются статусом обучения (Coffey et al. 2006; Wilkinson et al. 2008; Vissing et al. 2011), генетическая гетерогенность (Timmons, 2011) и даже технические ограничения, связанные с плохим временным разрешением по «мгновенным» измерениям фосфорилирования. С другой стороны, нам, возможно, придется столкнуться с перспективой того, что поиск «главных регуляторов», таких как AMPK, AKT и mTOR у людей, наивен и что расширение наших сетей, то есть охват измерений геномной мРНК / миРНК, необходимо для истинного понимания роль белкового обмена в определении неоднородности адаптивной специфичности и способности.
Благодарности
P.J.A. является назначенным научным сотрудником Исследовательского совета Великобритании при поддержке Королевского общества и Ajinomoto Inc. Мы также признаем выдающийся и пожизненный вклад профессора Майкла Дж. Ренни, доктора философии, FRSE (почетного профессора Ноттингемского университета) в эту область. Мы любезно приносим свои извинения коллегам, чьи работы мы не смогли включить в этот обзор из-за нехватки места.
Мы любезно приносим свои извинения коллегам, чьи работы мы не смогли включить в этот обзор из-за нехватки места.
Ссылки
- Atherton PJ, Babraj J, Smith K, Singh J, Rennie MJ, Wackerhage H.Селективная активация передачи сигналов AMPK-PGC-1α или PKB-TSC2-mTOR может объяснить специфические адаптивные ответы на электрическую стимуляцию мышц, подобную тренировке на выносливость или сопротивление. FASEB J. 2005; 19: 786–788. [PubMed] [Google Scholar]
- Атертон П.Дж., Этеридж Т., Ватт П.В., Уилкинсон Д., Селби А., Рэнкин Д., Смит К., Ренни М.Дж. Полный эффект мышц после перорального приема протеина: зависящее от времени соответствие и несоответствие между синтезом мышечного протеина человека и передачей сигналов mTORC1. Am J Clin Nutr. 2010. 92: 1080–1088.[PubMed] [Google Scholar]
- Атертон П.Дж., Ренни М.Дж. Синтез белка — низкий приоритет для тренировки мышц. J Physiol. 2006; 573: 288–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Biolo G, Maggi SP, Williams BD, Tipton KD, Wolfe RR.
 Повышение скорости обмена мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol Endocrinol Metab. 1995; 268: E514 – E520. [PubMed] [Google Scholar]
Повышение скорости обмена мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol Endocrinol Metab. 1995; 268: E514 – E520. [PubMed] [Google Scholar] - Бохе Дж., Лоу Дж. Ф., Вулф Р. Р., Ренни М. Дж.. Задержка и продолжительность стимуляции синтеза мышечного белка человека при непрерывном введении аминокислот.J Physiol. 2001; 532: 575–579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bolster DR, Crozier SJ, Kimball SR, Jefferson LS. AMP-активированная протеинкиназа подавляет синтез белка в скелетных мышцах крысы посредством подавления передачи сигналов рапамицина (mTOR) млекопитающим. J Biol Chem. 2002; 277: 23977–23980. [PubMed] [Google Scholar]
- Берд Н.А., Вест Д.В., Мур Д.Р., Атертон П.Дж., Стейплз А.В., Прайор Т., Тан Дж.Э., Ренни М.Дж., Бейкер С.К., Филлипс С.М. Повышенная аминокислотная чувствительность при синтезе миофибриллярного белка сохраняется до 24 часов после упражнений с отягощениями у молодых мужчин.
 J Nutr. 2011; 141: 568–573. [PubMed] [Google Scholar]
J Nutr. 2011; 141: 568–573. [PubMed] [Google Scholar] - Burd NA, West DW, Staples AW, Atherton PJ, Baker JM, Moore DR, Holwerda AM, Parise G, Rennie MJ, Baker SK, Phillips SM. Упражнения с отягощениями с малой нагрузкой и большим объемом стимулируют синтез мышечного белка больше, чем упражнения с отягощениями с высокой нагрузкой и низким объемом, у молодых мужчин. PLoS One. 2010; 5: e12033. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Burgomaster KA, Howarth KR, Phillips SM, Rakobowchuk M, Macdonald MJ, McGee SL, Gibala MJ.Аналогичная метаболическая адаптация во время упражнений после интервалов спринта с небольшим объемом и традиционных тренировок на выносливость у людей. J Physiol. 2008; 586: 151–160. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Coffey VG, Zhong Z, Shield A, Canny BJ, Chibalin AV, Zierath JR, Hawley JA. Ранняя сигнальная реакция на расходящиеся стимулы при физической нагрузке в скелетных мышцах от хорошо тренированных людей. FASEB J.
 2006; 20: 190–192. [PubMed] [Google Scholar]
2006; 20: 190–192. [PubMed] [Google Scholar] - Крибб П.Дж., Хейс А. Влияние времени приема добавок и упражнений с отягощениями на гипертрофию скелетных мышц.Медико-спортивные упражнения. 2006; 38: 1918–1925. [PubMed] [Google Scholar]
- Катбертсон Д., Смит К., Бабрадж Дж., Лиз Дж., Уодделл Т., Атертон П., Вакерхаге Х., Тейлор П.М., Ренни М.Дж. Дефицит анаболической передачи сигналов лежит в основе аминокислотной устойчивости истощенных, стареющих мышц. FASEB J. 2005; 19: 422–424. [PubMed] [Google Scholar]
- Катбертсон Д. Д., Бабрадж Дж., Смит К., Уилкс Э., Феделе М. Дж., Эссер К., Ренни М. Анаболическая передача сигналов и синтез белка в скелетных мышцах человека после упражнений на динамическое сокращение или удлинение.Am J Physiol Endocrinol Metab. 2006; 290: E731 – E738. [PubMed] [Google Scholar]
- Дикинсон Дж. М., Фрай К. С., Драммонд М. Дж., Гундерманн Д. К., Уокер Д. К., Глинн Е. Л., Тиммерман К. Л., Дханани С., Вольпи Е., Расмуссен Б. Б.. Активация комплекса рапамицина 1 у млекопитающих необходима для стимуляции синтеза белка скелетных мышц человека незаменимыми аминокислотами.
 J Nutr. 2011; 141: 856–862. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Nutr. 2011; 141: 856–862. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Драммонд М.Дж., Фрай К.С., Глинн Э.Л., Дрейер Х.С., Дханани С., Тиммерман К.Л., Вольпи Э., Расмуссен Б.Б.Введение рапамицина людям блокирует вызванное сокращением увеличение синтеза белка скелетных мышц. J Physiol. 2009; 587: 1535–1546. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ferguson-Stegall L, McCleave E, Ding Z, Iii DoernerPG, Liu Y, Wang B, Healy M, Kleinert M, Dessard B, Lassiter DG, Kammer L, Ivy JL. Адаптация к тренировкам с аэробными упражнениями повышается за счет углеводно-белковых добавок после тренировки. J Nutr Metab. 2011; 2011: 623182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Glass DJ.Сигнальные пути, влияющие на мышечную массу. Curr Opin Clin Nutr Metab Care. 2010. 13: 225–229. [PubMed] [Google Scholar]
- Goodman CA, Mayhew DL, Hornberger TA. Недавний прогресс в понимании молекулярных механизмов, регулирующих массу скелетных мышц. Сотовый сигнал.
 2011; 23: 1896–1906. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 23: 1896–1906. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Greenhaff PL, Karagounis LG, Peirce N, Simpson EJ, Hazell M, Layfield R, Wackerhage H, Smith K, Atherton P, Selby A, Rennie MJ. Диссоциация между эффектами аминокислот и инсулина на передачу сигналов, убиквитинлигазы и обмен белка в мышцах человека.Am J Physiol Endocrinol Metab. 2008; 295: E595 – E604. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hamilton DL, Philp A, MacKenzie MG, Baar K. Ограниченная роль регуляции PI (3,4,5) P3 в контроле массы скелетных мышц в ответ на упражнения с отягощениями . PLoS One. 2010; 5: e11624. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Член парламента Харбер, Конопка А.Р., Джемиоло Б., Траппе С.В., Траппе Т.А., Рейди П.Т. Синтез мышечного белка и экспрессия генов во время восстановления после аэробных упражнений натощак и после еды.Am J Physiol Regul Integr Comp Physiol. 2010; 299: R1254 – R1262. [PubMed] [Google Scholar]
- Хартман Дж.
 У., Мур Д. Р., Филлипс С. М.. Тренировки с отягощениями снижают обмен белка во всем теле и улучшают удержание чистого белка у нетренированных молодых мужчин. Appl Physiol Nutr Metab. 2006; 31: 557–564. [PubMed] [Google Scholar]
У., Мур Д. Р., Филлипс С. М.. Тренировки с отягощениями снижают обмен белка во всем теле и улучшают удержание чистого белка у нетренированных молодых мужчин. Appl Physiol Nutr Metab. 2006; 31: 557–564. [PubMed] [Google Scholar] - Hasten DL, Pak-Loduca J, Obert KA, Yarasheski KE. Упражнения с отягощениями резко увеличивают скорость синтеза MHC и смешанного мышечного белка в возрасте 78–84 и 23–32 лет. Am J Physiol Endocrinol Metab.2000; 278: E620 – E626. [PubMed] [Google Scholar]
- Hoffman JR, Ratamess NA, Tranchina CP, Rashti SL, Kang J, Faigenbaum AD. Влияние времени приема протеиновых добавок на силу, мощность и изменения состава тела у тренирующихся с отягощениями мужчин. Int J Sport Nutr Exerc Exerc Metab. 2009; 19: 172–185. [PubMed] [Google Scholar]
- Хорнбергер Т.А. Механотрансдукция и регуляция передачи сигналов mTORC1 в скелетных мышцах. Int J Biochem Cell Biol. 2011; 43: 1267–1276. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Katsanos CS, Kobayashi H, Sheffield-Moore M, Aarsland A, Wolfe RR.
 Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005; 82: 1065–1073. [PubMed] [Google Scholar]
Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005; 82: 1065–1073. [PubMed] [Google Scholar] - Купман Р., Вердейк Л. Б., Белен М., Горселинк М., Круземан А. Н., Вагенмакерс А. Дж., Койперс Х., Лун ван Л. Дж. Совместное употребление лейцина с белком не увеличивает скорость синтеза мышечного белка после тренировки у пожилых мужчин. Br J Nutr. 2008; 99: 571–580. [PubMed] [Google Scholar]
- Кумар В., Атертон П., Смит К., Ренни М.Дж.Синтез и распад мышечного белка человека во время и после тренировки. J Appl Physiol. 2009a; 106: 2026–2039. [PubMed] [Google Scholar]
- Кумар В., Селби А., Рэнкин Д., Патель Р., Атертон П., Хильдебрандт В., Уильямс Дж., Смит К., Сейннес О., Хискок Н., Ренни М. Дж.. Возрастные различия во взаимосвязи между синтезом мышечного белка и упражнениями с отягощениями доза-реакция у молодых и пожилых мужчин. J Physiol. 2009b; 587: 211–217. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Миллер Б.
 Ф., Олесен Дж. Л., Хансен М., Доссинг С., Крамери Р. М., Веллинг Р. Дж., Лангберг Х., Фливбьерг А., Кьяер М., Бабрай Дж. А., Смит К., Ренни М. Дж..Скоординированный синтез коллагена и мышечного белка в сухожилии надколенника и четырехглавой мышце человека после тренировки. J Physiol. 2005; 567: 1021–1033. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ф., Олесен Дж. Л., Хансен М., Доссинг С., Крамери Р. М., Веллинг Р. Дж., Лангберг Х., Фливбьерг А., Кьяер М., Бабрай Дж. А., Смит К., Ренни М. Дж..Скоординированный синтез коллагена и мышечного белка в сухожилии надколенника и четырехглавой мышце человека после тренировки. J Physiol. 2005; 567: 1021–1033. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Millward DJ, Bowtell JL, Pacy P, Rennie MJ. Физическая активность, белковый обмен и потребность в белке. Proc Nutr Soc. 1994; 53: 223–240. [PubMed] [Google Scholar]
- Мур Д. Р., Робинсон М. Дж., Фрай Дж. Л., Тан Дж. Э., Гловер Е. И., Уилкинсон С. Б., Приор Т., Тарнопольский М. А., Филлипс С. М.. Дозовая реакция потребляемого белка в мышцах и синтез белка альбумина после упражнений с отягощениями у молодых мужчин.Am J Clin Nutr. 2009. 89: 161–168. [PubMed] [Google Scholar]
- Мур Д. Р., Янг М., Филлипс С. М.. Подобное увеличение размера и силы мышц у молодых мужчин после тренировки с максимальным сокращением или удлинением сокращений при совместимости с общей работой.
 Eur J Appl Physiol. 2012 (2012) [PubMed] [Google Scholar]
Eur J Appl Physiol. 2012 (2012) [PubMed] [Google Scholar] - О’Нил Т.К., Даффи Л.Р., Фрей Дж. У., Хорнбергер Т.А. Роль фосфоинозитид-3-киназы и фосфатидной кислоты в регуляции рапамицина-мишени млекопитающих после эксцентрических сокращений.J Physiol. 2009; 587: 3691–3701. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Пеннингс Б., Купман Р., Белен М., Сенден Дж. М., Сарис У.Х., ван Лун Л.Дж. Выполнение упражнений до приема протеина позволяет шире использовать аминокислоты, полученные из пищевых белков, для синтеза мышечного протеина de novo как у молодых, так и у пожилых мужчин. Am J Clin Nutr. 2011; 93: 322–331. [PubMed] [Google Scholar]
- Proud CG. Передача сигналов mTORC1 и трансляция мРНК. Biochem Soc Trans. 2009; 37: 227–231. [PubMed] [Google Scholar]
- Proud CG.Сигнализация mTOR в здоровье и болезнях. Biochem Soc Trans. 2011; 39: 431–436. [PubMed] [Google Scholar]
- Ренни MJ. Введение в использование индикаторов в питании и обмене веществ.
 Proc Nutr Soc. 1999; 58: 935–944. [PubMed] [Google Scholar]
Proc Nutr Soc. 1999; 58: 935–944. [PubMed] [Google Scholar] - Ренни М.Дж., Эдвардс Р.Х., Холлидей Д., Мэтьюз Д.Е., Вулман С.Л., Миллуорд Д.И. Синтез мышечного белка, измеренный с помощью методов стабильных изотопов у человека: влияние кормления и голодания. Clin Sci (Лондон), 1982; 63: 519–523. [PubMed] [Google Scholar]
- Робинсон М.М., Тернер С.М., Хеллерстайн М.К., Гамильтон К.Л., Миллер Б.Ф.Скорость долгосрочного синтеза ДНК и белка скелетных мышц выше во время аэробных тренировок у пожилых людей, чем у молодых людей, ведущих малоподвижный образ жизни, но не изменяется при добавлении белков. FASEB J. 2011; 25: 3240–3249. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Роиг М., О’Брайен К., Кирк Г., Мюррей Р., Маккиннон П., Шадган Б., Рид В.Д. Влияние эксцентрических и концентрических тренировок с отягощениями на силу и массу мышц у здоровых взрослых: систематический обзор с метаанализом. Br J Sports Med.2009. 43: 556–568. [PubMed] [Google Scholar]
- Rommel C, Bodine SC, Clarke BA, Rossman R, Nunez L, Stitt TN, Yancopoulos GD, Glass DJ.
 Посредничество IGF-1-индуцированной гипертрофии скелетных миотрубок с помощью путей PI 3 K / Akt / mTOR и PI 3 K / Akt / GSK3. Nat Cell Biol. 2001; 3: 1009–1013. [PubMed] [Google Scholar]
Посредничество IGF-1-индуцированной гипертрофии скелетных миотрубок с помощью путей PI 3 K / Akt / mTOR и PI 3 K / Akt / GSK3. Nat Cell Biol. 2001; 3: 1009–1013. [PubMed] [Google Scholar] - Rose AJ, Alsted TJ, Jensen TE, Kobbero JB, Maarbjerg SJ, Jensen J, Richter EA. Сигнальный каскад Ca 2+ -calmodulin-eEF2K-eEF2, но не AMPK, способствует подавлению синтеза белка скелетных мышц во время сокращений.J Physiol. 2009; 587: 1547–1563. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Smith K, Barua JM, Watt PW, Scrimgeour CM, Rennie MJ. Наполнение L- [1- 13 C] лейцином стимулирует включение человеческого мышечного белка непрерывно вводимого L- [1- 13 C] валина. Am J Physiol Endocrinol Metab. 1992; 262: E372 – E376. [PubMed] [Google Scholar]
- Spangenburg EE, Le RD, Ward CW, Bodine SC. Функциональный рецептор инсулиноподобного фактора роста не является необходимым для индуцированной нагрузкой гипертрофии скелетных мышц.
 J Physiol. 2008. 586: 283–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Physiol. 2008. 586: 283–291. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Staples AW, Burd NA, West DW, Currie KD, Atherton PJ, Moore DR, Rennie MJ, Macdonald MJ, Baker SK, Phillips SM. Углеводы не увеличивают индуцированное физическими упражнениями накопление белка по сравнению с одним белком. Медико-спортивные упражнения. 2011; 43: 1154–1161. [PubMed] [Google Scholar]
- Ститт Т.Н., Друян Д., Кларк Б.А., Панаро Ф., Тимофеева Ю., Клайн В.О., Гонсалес М., Янкопулос Г.Д., Glass DJ. Путь IGF-1 / PI3K / Akt предотвращает экспрессию индуцированных мышечной атрофией убиквитинлигаз путем ингибирования факторов транскрипции FOXO.Mol Cell. 2004; 14: 395–403. [PubMed] [Google Scholar]
- Тан Дж. Э., Перко Дж. Г., Мур Д. Р., Уилкинсон С. Б., Филлипс С. М.. Тренировки с отягощениями изменяют реакцию синтеза смешанного мышечного белка в состоянии сытости у молодых мужчин. Am J Physiol Regul Integr Comp Physiol. 2008; 294: R172 – R178. [PubMed] [Google Scholar]
- Timmons JA.
 Вариабельность адаптации скелетных мышц, вызванная тренировкой. J Appl Physiol. 2011; 110: 846–853. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вариабельность адаптации скелетных мышц, вызванная тренировкой. J Appl Physiol. 2011; 110: 846–853. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Trappe TA, White F, Lambert CP, Cesar D, Hellerstein M, Evans WJ.Влияние ибупрофена и ацетаминофена на синтез мышечного белка после тренировки. Am J Physiol Endocrinol Metab. 2002; 282: E551 – E556. [PubMed] [Google Scholar]
- Viscomi C, Bottani E, Civiletto G, Cerutti R, Moggio M, Fagiolari G, Schon EA, Lamperti C, Zeviani M. Коррекция дефицита COX in vivo путем активации AMPK / PGC- Ось 1α. Cell Metab. 2011; 14: 80–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Виссинг К., МакГи С.Л., Фаруп Дж., Кьолхеде Т., Вендельбо М.Х., Джессен Н. Дифференцированная передача сигналов mTOR, но не AMPK, после силовых и выносливых упражнений у людей, привыкших к тренировкам.Scand J Med Sci Sports. 2012 (2012) [PubMed] [Google Scholar]
- Wackerhage H, Rennie MJ. Как питание и упражнения поддерживают мышечно-скелетную массу человека.
 J Anat. 2006; 208: 451–458. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Anat. 2006; 208: 451–458. [Бесплатная статья PMC] [PubMed] [Google Scholar] - West DW, Burd NA, Tang JE, Moore DR, Staples AW, Holwerda AM, Baker SK, Phillips SM. Повышение якобы анаболических гормонов при выполнении упражнений с отягощениями не увеличивает ни вызванную тренировкой гипертрофию мышц, ни силу сгибателей локтя. J Appl Physiol.2010; 108: 60–67. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- West DW, Kujbida GW, Moore DR, Atherton P, Burd NA, Padzik JP, De LM, Tang JE, Parise G, Rennie MJ, Baker SK, Phillips SM. Повышение предполагаемых анаболических гормонов, вызванное упражнениями с отягощениями, не усиливает синтез мышечного белка или внутриклеточную передачу сигналов у молодых мужчин. J Physiol. 2009; 587: 5239–5247. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Уилкс Е.А., Селби А.Л., Атертон П.Дж., Патель Р., Рэнкин Д., Смит К., Ренни М.Дж.Снижение инсулинового ингибирования протеолиза в ногах пожилых людей может способствовать возрастной саркопении.
 Am J Clin Nutr. 2009; 90: 1343–1350. [PubMed] [Google Scholar]
Am J Clin Nutr. 2009; 90: 1343–1350. [PubMed] [Google Scholar] - Уилкинсон С.Б., Филлипс С.М., Атертон П.Дж., Патель Р., Ярашески К.Е., Тарнопольский М.А., Ренни М.Дж. Дифференциальное влияние упражнений на сопротивление и выносливость в сытом состоянии на фосфорилирование сигнальных молекул и синтез белка в мышцах человека. J Physiol. 2008; 586: 3701–3717. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wolfe RR.Подходы стабильных изотопов для изучения метаболизма энергетических субстратов. Fed Proc. 1982; 41: 2692–2697. [PubMed] [Google Scholar]
Синтез мышечного белка в ответ на питание и упражнения
J Physiol. 1 марта 2012 г .; 590 (Pt 5): 1049–1057.
Отделение метаболической физиологии, Школа аспирантуры по медицине и здоровью, Университет Ноттингема, Королевская больница Дерби, Дерби, Великобритания
Автор, ответственный за переписку П.Дж. Атертон: Школа аспирантуры по медицине и здоровью, Отделение метаболической физиологии, Ноттингемский университет , Королевский госпиталь Дерби, Уттоксетер-роуд, Дерби DE22 3DT, Великобритания. Электронная почта: [email protected]
Электронная почта: [email protected]Этот обзор взят из симпозиума «Метаболизм при упражнениях » на конференции «Биомедицинские основы элитной эффективности», совместного заседания Психологического общества и Британского фармакологического общества, а также журнала The Journal of Physiology , Экспериментальная физиология, Британский журнал фармакологии и Скандинавский журнал медицины и науки в спорте , в Королевском зале Елизаветы, Лондон, 20 марта 2012 г.
Поступило 21 ноября 2011 г .; Принята в печать 25 января 2012 г.
Copyright © 2012 Авторы. The Journal of Physiology © 2012 The Physiological SocietyЭта статья цитируется другими статьями в PMC.Abstract
Синтез мышечного протеина (MPS) является движущей силой адаптивных реакций на упражнения и представляет собой широко используемый показатель для измерения хронической эффективности острых вмешательств (например, упражнений / питания). Недавние открытия в этой области были прогрессивными. Повышение MPS, обусловленное питательными веществами, имеет конечную продолжительность (~ 1,5 часа), после чего отключается, несмотря на устойчивую доступность аминокислот и внутримышечную анаболическую передачу сигналов.Интересно, что эта «уставка полной нагрузки на мышцы» задерживается упражнениями с отягощениями (т. Е. Комбинация кормление × упражнение «более анаболична», чем одно питание) даже на ≥24 ч после одной тренировки, что ставит под сомнение важность синхронизации питательных веществ по сравнению с достаточностью как таковой . Исследования, регулирующие интенсивность упражнений / рабочую нагрузку, показали, что увеличение MPS незначительно при RE на 20–40%, но является максимальным при 70–90% от максимума одного повторения, когда рабочая нагрузка согласована (в соответствии с нагрузкой × количество повторений).Однако упражнения низкой интенсивности, выполняемые до отказа, уравновешивают эту реакцию. Анализ отдельных субклеточных фракций (например, миофибриллярных, саркоплазматических, митохондриальных) может обеспечить считывание эффективности хронических упражнений в дополнение к величине эффекта в MPS per se , то есть в то время как «смешанный» MPS увеличивается аналогично с выносливостью и RE, увеличивается в миофибриллярных MPS специфичны для RE, пророка адаптации (т.
Повышение MPS, обусловленное питательными веществами, имеет конечную продолжительность (~ 1,5 часа), после чего отключается, несмотря на устойчивую доступность аминокислот и внутримышечную анаболическую передачу сигналов.Интересно, что эта «уставка полной нагрузки на мышцы» задерживается упражнениями с отягощениями (т. Е. Комбинация кормление × упражнение «более анаболична», чем одно питание) даже на ≥24 ч после одной тренировки, что ставит под сомнение важность синхронизации питательных веществ по сравнению с достаточностью как таковой . Исследования, регулирующие интенсивность упражнений / рабочую нагрузку, показали, что увеличение MPS незначительно при RE на 20–40%, но является максимальным при 70–90% от максимума одного повторения, когда рабочая нагрузка согласована (в соответствии с нагрузкой × количество повторений).Однако упражнения низкой интенсивности, выполняемые до отказа, уравновешивают эту реакцию. Анализ отдельных субклеточных фракций (например, миофибриллярных, саркоплазматических, митохондриальных) может обеспечить считывание эффективности хронических упражнений в дополнение к величине эффекта в MPS per se , то есть в то время как «смешанный» MPS увеличивается аналогично с выносливостью и RE, увеличивается в миофибриллярных MPS специфичны для RE, пророка адаптации (т. е. гипертрофии). Наконец, молекулярная регуляция MPS с помощью физических упражнений и ее регуляция с помощью «анаболических» гормонов (например,г. IGF-1) был поставлен под сомнение, что привело к открытию альтернативной механочувствительной передачи сигналов для MPS.
е. гипертрофии). Наконец, молекулярная регуляция MPS с помощью физических упражнений и ее регуляция с помощью «анаболических» гормонов (например,г. IGF-1) был поставлен под сомнение, что привело к открытию альтернативной механочувствительной передачи сигналов для MPS.
Фил Атертон (слева) завершил свою докторскую диссертацию по путям передачи сигналов, регулирующих метаболизм и пластичность скелетных мышц. После этого он закончил трехлетний пост-докторантуру, обеспечивая вклад молекулярной биологии в крупномасштабную программу тренировок с физическими упражнениями, посвященную влиянию старения на физиологическую и метаболическую адаптацию к упражнениям. В 2008 году он принял участие в стипендии Исследовательского совета Великобритании (HEFCE финансируется после 2012 года) с целью развития независимой карьеры и в настоящее время продолжает работу по определению молекулярной регуляции белкового обмена с помощью питания и физических упражнений, здоровья и болезней. Особый интерес Фила заключается в обратном преобразовании «совпадений и наводок» от людей в более удобные модели in vitro с целью достижения как наблюдательного, так и механистического понимания. Кен Смит (справа) защитил докторскую диссертацию в Университете Данди под руководством профессора Майка Ренни, где в течение длительного периода своей карьеры он интересовался разработкой и применением методологий стабильных изотопов для понимания регуляции метаболизма человеческого топлива, в частности обмен аминокислот и белков в скелетных мышцах, при здоровье и болезни; с особым вниманием к роли питания и упражнений в поддержании мышечной массы и функции.В настоящее время он является главным научным сотрудником отдела метаболической физиологии в Университете Ноттингема, где он курирует центр масс-спектрометрии, ключевой компонент недавно награжденного MRC / ARUK «центра скелетно-мышечного старения».
Особый интерес Фила заключается в обратном преобразовании «совпадений и наводок» от людей в более удобные модели in vitro с целью достижения как наблюдательного, так и механистического понимания. Кен Смит (справа) защитил докторскую диссертацию в Университете Данди под руководством профессора Майка Ренни, где в течение длительного периода своей карьеры он интересовался разработкой и применением методологий стабильных изотопов для понимания регуляции метаболизма человеческого топлива, в частности обмен аминокислот и белков в скелетных мышцах, при здоровье и болезни; с особым вниманием к роли питания и упражнений в поддержании мышечной массы и функции.В настоящее время он является главным научным сотрудником отдела метаболической физиологии в Университете Ноттингема, где он курирует центр масс-спектрометрии, ключевой компонент недавно награжденного MRC / ARUK «центра скелетно-мышечного старения».
Предпосылки
Скелетные мышцы — это очень пластичные ткани, которые адаптируются к повышенным двигательным и метаболическим требованиям, предъявляемым физическими упражнениями. Однако успешная адаптация к упражнениям с точки зрения измененной физиологии мышц и повышения производительности сильно зависит от выполняемых действий (например,г. сила, продолжительность и т. д.), а также генетическим составом человека, который определяет его или ее «статус респондента» (Timmons, 2011). Отсюда следует, что избирательность по количеству (то есть отдельные белки или «объемные» субфракции, такие как миофибриллярные, митохондриальные и саркоплазматические) синтезируемых мышечных белков лежит в основе изысканной адаптивной специфичности к различным режимам тренировок и, возможно, даже заметной неоднородности реакции на тренировку ( Тиммонс, 2011).
Однако успешная адаптация к упражнениям с точки зрения измененной физиологии мышц и повышения производительности сильно зависит от выполняемых действий (например,г. сила, продолжительность и т. д.), а также генетическим составом человека, который определяет его или ее «статус респондента» (Timmons, 2011). Отсюда следует, что избирательность по количеству (то есть отдельные белки или «объемные» субфракции, такие как миофибриллярные, митохондриальные и саркоплазматические) синтезируемых мышечных белков лежит в основе изысканной адаптивной специфичности к различным режимам тренировок и, возможно, даже заметной неоднородности реакции на тренировку ( Тиммонс, 2011).
У здоровых людей, ведущих активный отдых, белки скелетных мышц демонстрируют скорость обновления ~ 1.2% день -1 и существуют в динамическом равновесии: распад мышечного белка (MPB) превышает синтез мышечного белка (MPS) в состоянии натощак, а MPS превышает MPB в состоянии сытости. В ответ на упражнения MPS временно увеличивается, тогда как MPB также увеличивается или остается неизменным (последнее при условии достаточного поступления экзогенных питательных веществ; Kumar et al. 2009 a ). Отсюда следует, что в совокупности увеличение MPS после каждой тренировки «стимулирует» адаптацию к тренировке с физической нагрузкой.
2009 a ). Отсюда следует, что в совокупности увеличение MPS после каждой тренировки «стимулирует» адаптацию к тренировке с физической нагрузкой.
Стабильные изотопы: захват белкового обмена
in vivo Динамические измерения обмена мышечного белка могут быть определены в мышечной ткани с использованием методологий стабильных изотопов (Rennie et al. 1982; Wolfe, 1982). Стабильные изотопы — это нерадиоактивные природные «тяжелые атомы» (NB, безопасные для использования на человеке), которые по существу идентичны своим эндогенным аналогам, но могут быть различимы по разнице масс (с использованием методов масс-спектрометрии).Это позволяет нам измерить включение этих изотопных «мотивов» в биологические образцы, т. Е. Изотопно меченные аминокислоты, чтобы измерить MPS в белке, полученном из биопсийной ткани (Rennie et al. 1982; Trappe et al. 2002; Katsanos et al. др. 2005; Купман и др. 2008 г.). Однако, поскольку эти методы требуют постоянных инфузий индикаторов, они подходят только для измерения «острого» (~ часов) МПС в контролируемых лабораторных условиях. В связи с этим представляет большой интерес тот факт, что недавно были разработаны новые методы отслеживания, в которых измерение MPS возможно у свободноживущих субъектов в течение недель или месяцев.Этот метод включает прием дейтерированной воды (D 2 O) для оценки кумулятивного включения дейтерия в мышечные белки посредством обмена дейтерия через аланин (Robinson et al. 2011).
В связи с этим представляет большой интерес тот факт, что недавно были разработаны новые методы отслеживания, в которых измерение MPS возможно у свободноживущих субъектов в течение недель или месяцев.Этот метод включает прием дейтерированной воды (D 2 O) для оценки кумулятивного включения дейтерия в мышечные белки посредством обмена дейтерия через аланин (Robinson et al. 2011).
Выбор меченой аминокислоты будет определять метод измерения. Использование дейтерия (вместо водорода) позволяет измерять синтез с помощью газовой хроматографии-масс-спектрометрии (ГХ-МС), тогда как использование 13 C или 15 N традиционно измеряется с помощью масс-спектрометрии изотопного отношения (IRMS) фиксированные газы, т.е.е. CO 2 или N 2 , что требует сжигания или выделения CO 2 , например путем реакции с нингидрином или, в случае 15 N, сжиганием до NO 2 с последующим восстановлением с получением N 2 . Свободные аминокислоты (АК) от гидролиза белков отделяются хроматографией (газовой или жидкой) и сжигаются перед масс-спектрометрическим анализом, например газовая хроматография – сжигание (GC-C) –IRMS или жидкостная хроматография – сжигание (LC-C) –IRMS (вводный обзор методов с использованием индикаторов см. Rennie, 1999).
Свободные аминокислоты (АК) от гидролиза белков отделяются хроматографией (газовой или жидкой) и сжигаются перед масс-спектрометрическим анализом, например газовая хроматография – сжигание (GC-C) –IRMS или жидкостная хроматография – сжигание (LC-C) –IRMS (вводный обзор методов с использованием индикаторов см. Rennie, 1999).
Последние достижения в стабильности и чувствительности масс-спектрометров в сочетании с доступностью аминокислот, меченных множеством «тяжелых атомов», например [1,2- 13 C 2 ] лейцин (Atherton et al. 2010), [D 5 ] — или [ 13 C 6 ] фенилаланин (Koopman et al. 2008 ; Burd et al. 2011), позволил добиться большего разрешения острых реакций MPS даже в течение 30–45 минутных периодов (Atherton et al. 2010) и, таким образом, измерение временного характера отклика MPS. Однако техническая разработка и применение методов измерения распада мышечного белка (MPB) отстают от MPS, и в результате гораздо меньше известно о реакции MPB на упражнения и питание. Однако стабильные изотопы позволяют оценить MPB путем разбавления индикатора через конечность (с использованием модели артериовенозного баланса) при оценке в сочетании с кровотоком в конечности, т. Е. Большая разница в маркировке незаменимой аминокислоты (EAA). между артериально-венозными образцами указывает на более высокую скорость высвобождения АК через MPB (Wilkes et al. 2009).
Однако стабильные изотопы позволяют оценить MPB путем разбавления индикатора через конечность (с использованием модели артериовенозного баланса) при оценке в сочетании с кровотоком в конечности, т. Е. Большая разница в маркировке незаменимой аминокислоты (EAA). между артериально-венозными образцами указывает на более высокую скорость высвобождения АК через MPB (Wilkes et al. 2009).
Регулирование MPS посредством питания
Двумя основными детерминантами протеостаза скелетных мышц взрослых являются физическая активность (обсуждается ниже) и доступность питательных веществ. Анаболические эффекты питания в основном обусловлены переносом и включением аминокислот, захваченных из источников пищевого белка, в белки скелетных мышц. Целью этого является компенсация мышечного белка, который теряется в периоды голодания (после абсорбции), например, из-за окисления аминокислот и / или донорства углерода для глюконеогенеза печени (Wackerhage & Rennie, 2006).Критически важно (при условии хорошего здоровья и подвижности) именно этот динамический цикл «голод-потеря / сытость-прибыль» в протеостазе обеспечивает постоянство мышечной массы. Но каковы «анаболические компоненты» питания? После ранней работы, в которой было установлено, что анаболические эффекты смешанного кормления полностью связаны с незаменимыми аминокислотами (EAA) (Smith et al. 1992), мы и другие исследователи продемонстрировали дозозависимые и насыщаемые эффекты при употреблении 10 г. EAAs (Cuthbertson et al. 2005), эквивалентные ~ 20 г белка (Moore et al. 2009). Возможно, неудивительно, что этот анаболический ответ носит временный характер, что имеет смысл, поскольку отказавшись от адаптивного увеличения MPB, можно достичь гипертрофии, просто потребляя избыток белка! График реакции на кормление насыщенным количеством протеина выглядит следующим образом. После задержки примерно в 30 минут наблюдается значительное увеличение (примерно в 3 раза) с максимальным значением MPS примерно через 1,5 часа до возврата к исходному уровню через 2 часа (Atherton et al. 2010), несмотря на продолжающееся повышение доступности циркулирующих аминокислот и устойчивый «анаболическая передача сигналов» (Bohe et al.
Но каковы «анаболические компоненты» питания? После ранней работы, в которой было установлено, что анаболические эффекты смешанного кормления полностью связаны с незаменимыми аминокислотами (EAA) (Smith et al. 1992), мы и другие исследователи продемонстрировали дозозависимые и насыщаемые эффекты при употреблении 10 г. EAAs (Cuthbertson et al. 2005), эквивалентные ~ 20 г белка (Moore et al. 2009). Возможно, неудивительно, что этот анаболический ответ носит временный характер, что имеет смысл, поскольку отказавшись от адаптивного увеличения MPB, можно достичь гипертрофии, просто потребляя избыток белка! График реакции на кормление насыщенным количеством протеина выглядит следующим образом. После задержки примерно в 30 минут наблюдается значительное увеличение (примерно в 3 раза) с максимальным значением MPS примерно через 1,5 часа до возврата к исходному уровню через 2 часа (Atherton et al. 2010), несмотря на продолжающееся повышение доступности циркулирующих аминокислот и устойчивый «анаболическая передача сигналов» (Bohe et al. 2001; Atherton et al. 2010). Именно в этот момент мышца становится рефрактерной к стимуляции, несмотря на устойчивое повышение уровня АК (см.). Мы назвали это явление «заполнением мышц» (Bohe et al. 2001; Atherton et al. 2010) на основе концепции развития, представленной Джо Миллуордом, согласно которой наращивание мышечного белка физически ограничено неэластичной соединительной тканью коллагена. эндомизий, окружающий каждое волокно (гипотеза «полного мешка») (Millward et al. 1994).
2001; Atherton et al. 2010). Именно в этот момент мышца становится рефрактерной к стимуляции, несмотря на устойчивое повышение уровня АК (см.). Мы назвали это явление «заполнением мышц» (Bohe et al. 2001; Atherton et al. 2010) на основе концепции развития, представленной Джо Миллуордом, согласно которой наращивание мышечного белка физически ограничено неэластичной соединительной тканью коллагена. эндомизий, окружающий каждое волокно (гипотеза «полного мешка») (Millward et al. 1994).
Эффект «мускулов». Связь между MPS, AA и внутримышечной передачей сигналов
Какова роль инсулина в регуляции анаболических реакций на питание (через секрецию, индуцированную питательными веществами)? Хотя стоит отметить, что предоставление только белка (то есть без углеводов) вызывает повышение уровня инсулина, подобное тому, которое наблюдается после смешанного приема пищи (Atherton et al. 2010), инсулин, по-видимому, не влияет на анаболические эффекты EAA на MPS. . Чтобы проиллюстрировать это, инфузии EAA надежно стимулируют MPS, даже когда инсулин «зажимается» при постабсорбционных концентрациях (5 мкМЕ / мл -1 с ингибитором β-клеток октреотидом; Greenhaff et al. 2008 г.). Однако это не означает, что инсулин не играет роли постпрандиального анаболика. Действительно, помимо трехкратного увеличения MPS, есть также значительный антипротеолитический (~ 40-50%) эффект питания на скелетные мышцы, который, по-видимому, полностью связан с инсулином. Чтобы проиллюстрировать это, повышения уровня инсулина до 15 мкМЕ / мл -1 (3 × постабсорбционные концентрации) достаточно, чтобы имитировать 50% ингибирование MPB (NB, максимальный размер эффекта), вызванное смешанным приемом пищи (Wilkes et al. al. 2009). Более того, этот антикатаболический эффект нельзя воспроизвести с помощью инфузий больших доз АК (18 gh -1 в течение 3 часов), когда инсулин зажимается при постабсорбтивных концентрациях (5 мкЕд / мл -1 ) (Greenhaff et al.
. Чтобы проиллюстрировать это, инфузии EAA надежно стимулируют MPS, даже когда инсулин «зажимается» при постабсорбционных концентрациях (5 мкМЕ / мл -1 с ингибитором β-клеток октреотидом; Greenhaff et al. 2008 г.). Однако это не означает, что инсулин не играет роли постпрандиального анаболика. Действительно, помимо трехкратного увеличения MPS, есть также значительный антипротеолитический (~ 40-50%) эффект питания на скелетные мышцы, который, по-видимому, полностью связан с инсулином. Чтобы проиллюстрировать это, повышения уровня инсулина до 15 мкМЕ / мл -1 (3 × постабсорбционные концентрации) достаточно, чтобы имитировать 50% ингибирование MPB (NB, максимальный размер эффекта), вызванное смешанным приемом пищи (Wilkes et al. al. 2009). Более того, этот антикатаболический эффект нельзя воспроизвести с помощью инфузий больших доз АК (18 gh -1 в течение 3 часов), когда инсулин зажимается при постабсорбтивных концентрациях (5 мкЕд / мл -1 ) (Greenhaff et al. ). 2008 г.). Таким образом, подытоживая, можно сказать, что EAA регулирует анаболические ответы посредством значительного увеличения MPS, в то время как высвобождение инсулина регулирует антикатаболические (депрессии MPB) ответы. Отсюда следует, что, поскольку изменение MPS намного больше, чем у MPB, MPS является основной движущей силой анаболизма, индуцированного питательными веществами.
). 2008 г.). Таким образом, подытоживая, можно сказать, что EAA регулирует анаболические ответы посредством значительного увеличения MPS, в то время как высвобождение инсулина регулирует антикатаболические (депрессии MPB) ответы. Отсюда следует, что, поскольку изменение MPS намного больше, чем у MPB, MPS является основной движущей силой анаболизма, индуцированного питательными веществами.
Регулирование MPS с помощью острых упражнений
Величина острой реакции мышцы на упражнения с отягощениями в терминах MPS зависит как от рабочей нагрузки, так и от интенсивности. Например, при интенсивностях ≤40% от максимума однократного повторения (1-RM) нет заметного увеличения MPS, тогда как при интенсивностях более 60% 1-RM упражнения увеличивают MPS в 2-3 раза (Kumar и др. 2009 b ). Однако это не означает, что упражнения с меньшей интенсивностью не могут дать анаболический эффект.Действительно, увеличение MPS на 30% 1-RM сопоставимой величины с группой, выполняющей 90% 1-RM, возможно, но только тогда, когда упражнение выполняется до отказа, а не когда работа соответствует от 30 до 90% 1-RM (Burd и др. 2010). По сути, это означает, что увеличение объема работы с более низкой интенсивностью может преодолеть и даже превзойти притупленный ответ MPS с подобранными с работой упражнениями низкой интенсивности, вероятно, как следствие увеличения набора волокон типа II из-за утомительного характера сокращений. (Burd et al. 2010). Таким образом, утомительные сокращения с низкой нагрузкой могут представлять собой реальный подход к стимуляции гипертрофии мышц и средство ухода от работы с тяжелыми весами.
2010). По сути, это означает, что увеличение объема работы с более низкой интенсивностью может преодолеть и даже превзойти притупленный ответ MPS с подобранными с работой упражнениями низкой интенсивности, вероятно, как следствие увеличения набора волокон типа II из-за утомительного характера сокращений. (Burd et al. 2010). Таким образом, утомительные сокращения с низкой нагрузкой могут представлять собой реальный подход к стимуляции гипертрофии мышц и средство ухода от работы с тяжелыми весами.
Что касается режима сокращения, хотя упражнения эксцентрического типа (т. Е. Удлинение сокращений, а не бег назад), как было показано, приводят к большей мышечной гипертрофии (Roig et al. 2009), измерение МПС после концентрических и эксцентрических упражнений сокращения продемонстрировали лишь относительно небольшие временные различия (Cuthbertson et al. 2006). Более того, когда общая работа согласована между эксцентрическими и концентрическими сокращениями, нет никакой разницы в гипертрофии мышц, вызванной тренировкой (Moore et al. 2011). Таким образом, повышенная внешняя нагрузка, возникающая во время эксцентрических сокращений, может объяснить большую эффективность эксцентрической тренировки, а не режима сокращения как такового .
2011). Таким образом, повышенная внешняя нагрузка, возникающая во время эксцентрических сокращений, может объяснить большую эффективность эксцентрической тренировки, а не режима сокращения как такового .
Возможно, неудивительно, что, как и в случае с «полной мышечной массой» на кормление, анаболическая реакция на упражнения также должна быть ограниченной по продолжительности.Что касается динамики ответа MPS, сразу после тренировки существует латентный период (до подъема MPS) длительностью, которая, по-видимому, связана с величиной энергии / механического стресса, связанного с упражнением. Эта предпосылка была проиллюстрирована в исследовании на грызунах, показавшем, что MPS подавляется во время интенсивного сокращения в зависимости от рабочего цикла (т. Е. Работы) (Atherton & Rennie, 2006; Rose et al. 2009). Кроме того, хотя не существует эквивалентных исследований на людях (т.е. МПС во время упражнений), в острый период восстановления после упражнений были предприняты меры, которые могут указывать на аналогичные механизмы. Например, в то время как MPS оставался неизменным в течение 3 часов после чрезвычайно утомляющих и разрушительных эксцентрических сокращений (подъем / шаг вниз с несущей нагрузкой) (Cuthbertson et al. 2006), латентный период для упражнений с меньшей интенсивностью (6 × 8 повторений) при 75% 1-RM) составляет <1 ч (Kumar et al. 2009 b ).
Например, в то время как MPS оставался неизменным в течение 3 часов после чрезвычайно утомляющих и разрушительных эксцентрических сокращений (подъем / шаг вниз с несущей нагрузкой) (Cuthbertson et al. 2006), латентный период для упражнений с меньшей интенсивностью (6 × 8 повторений) при 75% 1-RM) составляет <1 ч (Kumar et al. 2009 b ).
После этого латентного периода MPS резко возрастает между 45 и 150 минутами и может поддерживаться до 4 часов (Kumar et al. 2009 b ) в голодном состоянии (ограничено доступностью субстрата) и в присутствии повышенной доступности АК, до 24 часов и более (Cuthbertson et al. 2006). Интересно, что динамика изменения МПС во время тренировки имитирует динамику эпимизиального коллагена и коллагена сухожилий, что демонстрирует высокую степень координации между тканями опорно-двигательного аппарата в ответ на упражнения (Miller et al. 2005 ).
Упражнение × взаимодействие питательных веществ, регулирующее МПС
Ключевым аспектом, окружающим острую реакцию на упражнения и последующую адаптацию, является взаимодействие питательных веществ × упражнений. Это подтверждается тем фактом, что резкое увеличение MPS после упражнений в отсутствие питания EAA обеспечивает более длительное повышение MPB, так что чистым эффектом является отрицательный баланс мышечных белков (Biolo et al. 1995). Если такой дефицит EAA будет сохраняться на протяжении всей тренировки, это приведет к дезадаптации; вы не можете нарастить или реконструировать мышцы без аминокислот! Отсюда следует, что увеличение доступности EAA в рационе после упражнений увеличивает как величину, так и продолжительность увеличения MPS (Pennings et al. 2011). Следовательно, по сути, упражнения способны предварительно подготовить мышцы, чтобы отсрочить полное «заданное значение» мышцы (показано на рисунке). Интересно отметить, что добавление углеводов к белку не оказывает большего анаболического воздействия на обмен белка (ни увеличения MPS, ни депрессии MPB) после тренировки, подчеркивая центральную роль EAA как основных (и, возможно, единственных!) Макроэлементов, необходимых для оптимизации анаболических реакций в организме.
Это подтверждается тем фактом, что резкое увеличение MPS после упражнений в отсутствие питания EAA обеспечивает более длительное повышение MPB, так что чистым эффектом является отрицательный баланс мышечных белков (Biolo et al. 1995). Если такой дефицит EAA будет сохраняться на протяжении всей тренировки, это приведет к дезадаптации; вы не можете нарастить или реконструировать мышцы без аминокислот! Отсюда следует, что увеличение доступности EAA в рационе после упражнений увеличивает как величину, так и продолжительность увеличения MPS (Pennings et al. 2011). Следовательно, по сути, упражнения способны предварительно подготовить мышцы, чтобы отсрочить полное «заданное значение» мышцы (показано на рисунке). Интересно отметить, что добавление углеводов к белку не оказывает большего анаболического воздействия на обмен белка (ни увеличения MPS, ни депрессии MPB) после тренировки, подчеркивая центральную роль EAA как основных (и, возможно, единственных!) Макроэлементов, необходимых для оптимизации анаболических реакций в организме. обмен белков при физических упражнениях (Staples et al. 2011).
обмен белков при физических упражнениях (Staples et al. 2011).
Была проведена значительная работа по определению оптимального времени приема пищи, чтобы максимизировать MPS после тренировки и последующую адаптацию к тренировкам (Cribb & Hayes, 2006; Hoffman et al. 2009). В целом, мы считаем, что в значительной степени не имеет значения, давать корм до, во время или после тренировки. Это связано с тем, что задержка полной мышечной реакции, по-видимому, длится не менее 24 часов (Burd et al. 2011) после одного упражнения, что может помочь объяснить хронические адаптации, такие как гипертрофия / ремоделирование мышц с течением времени, независимо от режима кормления, зависящего от близости (см.).Таким образом, мы утверждаем, что достаточность питательных веществ как таковая , а не время приема, является более важным аспектом для успешной гипертрофической адаптации (это не означает, что некоторые важные преимущества производительности / восстановления могут быть получены при употреблении пищи в непосредственной близости от упражнение) (Ferguson-Stegall et al. 2011). Более того, все еще существуют пределы того, насколько сильно система может быть задействована, и увеличение белковой нагрузки до идентичного цикла упражнений по-прежнему демонстрирует насыщаемую реакцию примерно при 20 г (что эквивалентно максимальной дозе ЕАА 10 г, наблюдаемой с ЕАА в отсутствие упражнений. ), выше которого окисление аминокислот увеличивается, и, таким образом, катаболизируется избыток белка (Moore et al. 2009). Следовательно, увеличение нагрузки на ЕАА не полностью преодолевает эффект увеличения мышц, обеспечиваемый упражнениями; скорее, он продлевает анаболическое окно. Такие стратегии умеренного кормления могут быть лучше (аликвоты ~ 20 г PRO), но, возможно, более часто (частота которых еще предстоит определить, то есть как долго мышца остается невосприимчивой к анаболическим эффектам АК).
2011). Более того, все еще существуют пределы того, насколько сильно система может быть задействована, и увеличение белковой нагрузки до идентичного цикла упражнений по-прежнему демонстрирует насыщаемую реакцию примерно при 20 г (что эквивалентно максимальной дозе ЕАА 10 г, наблюдаемой с ЕАА в отсутствие упражнений. ), выше которого окисление аминокислот увеличивается, и, таким образом, катаболизируется избыток белка (Moore et al. 2009). Следовательно, увеличение нагрузки на ЕАА не полностью преодолевает эффект увеличения мышц, обеспечиваемый упражнениями; скорее, он продлевает анаболическое окно. Такие стратегии умеренного кормления могут быть лучше (аликвоты ~ 20 г PRO), но, возможно, более часто (частота которых еще предстоит определить, то есть как долго мышца остается невосприимчивой к анаболическим эффектам АК).
Задержка сигнала «заполнение мышц» в ответ на питание сохраняется даже на 24 часа после одной тренировки.
Регулирование MPS с помощью тренировок.

Влияние тренировок на MPS изучено не так хорошо.Хотя в ряде исследований отмечается увеличение «базального или постабсорбтивного» МПС в результате тренировки per se , они могут просто подтверждать длительные острые эффекты, особенно если измерения проводились менее чем через 24 часа после последней тренировки ( Hasten и др. 2000). Тем не менее, есть данные, которые предполагают, что тренировка сокращает продолжительность анаболического ответа, что может быть связано с большей острой адаптационной эффективностью (Hartman et al. 2006; Тан и др. 2008), или, возможно, законы убывающей отдачи с точки зрения адаптивных реакций.
Ответы в MPS на различные режимы упражнений
Как область, мы часто виноваты в том, что делаем упор на упражнениях с отягощениями и питании, а также на способах увеличения мышц. Тем не менее, большинство исследований подтверждают мнение о том, что ответы MPS одинаковы независимо от режима упражнений, то есть сопротивление против без сопротивления (хотя продолжительность сенсибилизации может отличаться).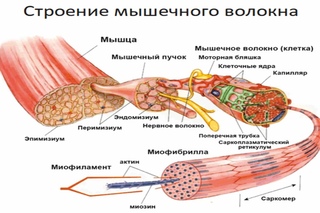 Например, упражнения на выносливость, такие как бег или езда на велосипеде, также связаны с повышенным синтезом смешанных мышечных белков (~ 50–60%) (Harber et al. 2010). Однако эти острые реакции не связаны со значительными изменениями мышечной массы, то есть гипертрофией, наблюдаемой при упражнениях с отягощениями. Так что же означают эти изменения? Ясно, что экстраполяция амплитуды увеличения MPS смешанной мышцы не может дать информацию об адаптации — так что же мы можем сделать? Как было сказано в начальном разделе этого обзора, для адаптации к отображению специфичности режима упражнений в мышцах должны быть разные ответы различных фракций белка (и, действительно, отдельных белков).Действительно, это предположение было элегантно продемонстрировано в исследовании, в котором одни и те же люди выполняли 10-недельную программу сопротивления (поднятие тяжестей) для одной ноги и 10-недельную программу на выносливость (езда на велосипеде) — для другой. После тренировки посттренировочный синтез миофибриллярного, а не митохондриального белка увеличивался при выполнении упражнений с отягощениями (Wilkinson et al.
Например, упражнения на выносливость, такие как бег или езда на велосипеде, также связаны с повышенным синтезом смешанных мышечных белков (~ 50–60%) (Harber et al. 2010). Однако эти острые реакции не связаны со значительными изменениями мышечной массы, то есть гипертрофией, наблюдаемой при упражнениях с отягощениями. Так что же означают эти изменения? Ясно, что экстраполяция амплитуды увеличения MPS смешанной мышцы не может дать информацию об адаптации — так что же мы можем сделать? Как было сказано в начальном разделе этого обзора, для адаптации к отображению специфичности режима упражнений в мышцах должны быть разные ответы различных фракций белка (и, действительно, отдельных белков).Действительно, это предположение было элегантно продемонстрировано в исследовании, в котором одни и те же люди выполняли 10-недельную программу сопротивления (поднятие тяжестей) для одной ноги и 10-недельную программу на выносливость (езда на велосипеде) — для другой. После тренировки посттренировочный синтез миофибриллярного, а не митохондриального белка увеличивался при выполнении упражнений с отягощениями (Wilkinson et al. 2008). Напротив, после тренировки синтез митохондриального белка увеличивался только в ноге, тренированной на выносливость, тогда как миофибрилла — нет.Эти данные, по-видимому, предполагают «соответствие» между ответами MPS и фенотипическими изменениями, то есть гипертрофией мышц при тренировках с отягощениями по сравнению с биогенезом митохондрий при тренировках на выносливость. Тем не менее, хотя было бы заманчиво прийти к выводу, что острые реакции в определенных мышечных пулах могут дать представление о последующих хронических адаптациях, ответы у нетренированного человека могут быть менее специфичными (Wilkinson et al. 2008) и больше связаны с незнакомостью упражнение как таковое (Coffey et al. 2006). Следовательно, экстраполяцию острого МПС в субфракциях на потенциальные адаптивные реакции после одного сеанса незнакомых упражнений следует интерпретировать с осторожностью.
2008). Напротив, после тренировки синтез митохондриального белка увеличивался только в ноге, тренированной на выносливость, тогда как миофибрилла — нет.Эти данные, по-видимому, предполагают «соответствие» между ответами MPS и фенотипическими изменениями, то есть гипертрофией мышц при тренировках с отягощениями по сравнению с биогенезом митохондрий при тренировках на выносливость. Тем не менее, хотя было бы заманчиво прийти к выводу, что острые реакции в определенных мышечных пулах могут дать представление о последующих хронических адаптациях, ответы у нетренированного человека могут быть менее специфичными (Wilkinson et al. 2008) и больше связаны с незнакомостью упражнение как таковое (Coffey et al. 2006). Следовательно, экстраполяцию острого МПС в субфракциях на потенциальные адаптивные реакции после одного сеанса незнакомых упражнений следует интерпретировать с осторожностью.
Чувствительность и сигнализация, регулирующая MPS
Несмотря на то, что вопрос «черного ящика», связанный с механизмами, регулирующими MPS и адаптацию к упражнениям, все еще является горячим местом для исследований, все еще остается плохо определенным. Упражнения запускают сложные механотрансдукционные и физико-химические (т. Е. Эндокринные, ауто / паракринные) сенсорные механизмы (Glass, 2010; West et al. 2010). Последующая активация рецепторных и нерецепторно-опосредованных внутримышечных сигналов модулирует клеточный аппарат, регулируя как краткосрочный посттрансляционный (фосфорилирование) контроль оборота белков и экспрессии генов (мРНК / миРНК), так и долгосрочные изменения в метаболической способности клеток.
Упражнения запускают сложные механотрансдукционные и физико-химические (т. Е. Эндокринные, ауто / паракринные) сенсорные механизмы (Glass, 2010; West et al. 2010). Последующая активация рецепторных и нерецепторно-опосредованных внутримышечных сигналов модулирует клеточный аппарат, регулируя как краткосрочный посттрансляционный (фосфорилирование) контроль оборота белков и экспрессии генов (мРНК / миРНК), так и долгосрочные изменения в метаболической способности клеток.
Но что мы знаем об этом черном ящике? Во-первых, точно установлено, что мишень рапамицина у млекопитающих (mTOR) является ключевым сигнальным путем, регулирующим изменения, вызванные физической нагрузкой / питательными веществами, при MPS (Drummond et al. 2009; Дикинсон и др. 2011). Действительно, активация mTOR в конечном итоге индуцирует фосфорилирование нескольких субстратов факторов инициации трансляции (4E-связывающий белок (4EBP1), киназу рибосомного белка S6 (p70S6K1), факторы инициации эукариот 4 G / A / B (eIF4G / A / B) и образование каркас eIF3F), чтобы способствовать сборке пре-инициаторного комплекса 48S. По параллельному пути, активация ключевого фактора обмена гуанина, эукариотический фактор инициации 2B (eIF2B) eIF2 перемещает инициаторную тРНК (Met-tRNAi) к рибосоме во время образования пре-инициаторного комплекса 48S, тем самым способствуя «глобальному» синтезу белка. и скоординированное повышение эффективности трансляции (подробные обзоры mTOR и связанной с ним передачи сигналов см. в Proud, 2009; Goodman et al. 2011).
По параллельному пути, активация ключевого фактора обмена гуанина, эукариотический фактор инициации 2B (eIF2B) eIF2 перемещает инициаторную тРНК (Met-tRNAi) к рибосоме во время образования пре-инициаторного комплекса 48S, тем самым способствуя «глобальному» синтезу белка. и скоординированное повышение эффективности трансляции (подробные обзоры mTOR и связанной с ним передачи сигналов см. в Proud, 2009; Goodman et al. 2011).
Что касается вопроса «что находится выше mTOR?», Давно известно, что нутриенты (EAA) передают сигнал через mTOR независимо от проксимальной передачи сигналов инсулина (подробные обзоры, выходящие за рамки настоящего обзора, см. В Proud, 2009, 2011). Однако влияние физических упражнений перед mTOR было более спорным. Большая часть ранних исследований животных (Stitt et al. 2004) и клеток (Rommel et al. 2001) указала на канонический сигнальный путь, посредством которого увеличивается инсулиноподобный фактор роста (IGF-1 или варианты сплайсинга, такие как механоид). -фактор роста (MGF)) стимулирует проксимальные пути передачи сигналов инсулина (IGFr – AKT – mTOR) и, следовательно, ключевые субстраты mTOR, регулирующие инициацию трансляции.Однако существует ряд доказательств из систем in vivo и in vitro , аргументирующих противодействие такому каноническому пути IGFr – AKT – mTOR в регуляции индуцированного физической нагрузкой MPS. В элегантно разработанном исследовании упражнения с отягощениями выполнялись в мышцах рук человека в условиях либо высокой концентрации эндогенного гормона (HH; одновременные двусторонние упражнения для ног), либо низких концентраций эндогенного гормона (LH; отсутствие одновременных упражнений для ног) (West et al. 2009). ). Тем не менее, несмотря на значительные различия в концентрациях гормона роста, тестостерона и IGF-1 между группами LH и HH, не было различий в передаче сигналов mTOR, MPS или в хронической адаптации к тренировкам с точки зрения увеличения массы или силы (West et al.
-фактор роста (MGF)) стимулирует проксимальные пути передачи сигналов инсулина (IGFr – AKT – mTOR) и, следовательно, ключевые субстраты mTOR, регулирующие инициацию трансляции.Однако существует ряд доказательств из систем in vivo и in vitro , аргументирующих противодействие такому каноническому пути IGFr – AKT – mTOR в регуляции индуцированного физической нагрузкой MPS. В элегантно разработанном исследовании упражнения с отягощениями выполнялись в мышцах рук человека в условиях либо высокой концентрации эндогенного гормона (HH; одновременные двусторонние упражнения для ног), либо низких концентраций эндогенного гормона (LH; отсутствие одновременных упражнений для ног) (West et al. 2009). ). Тем не менее, несмотря на значительные различия в концентрациях гормона роста, тестостерона и IGF-1 между группами LH и HH, не было различий в передаче сигналов mTOR, MPS или в хронической адаптации к тренировкам с точки зрения увеличения массы или силы (West et al. . 2010). Эти данные предполагают, что системная индукция IGF-1 не является основной частью адаптивного процесса. Тем не менее, можно утверждать, что IGF-1 регулирует передачу сигналов AKT-mTOR посредством более «местных» ауто / паракринных механизмов передачи сигналов. Тем не менее, это также трудно согласовать, поскольку устранение IGFr не ставит под угрозу хронические адаптации, то есть гипертрофические реакции на нагрузку в доклинических моделях (Spangenburg et al. 2008; Hamilton et al. 2010).
. 2010). Эти данные предполагают, что системная индукция IGF-1 не является основной частью адаптивного процесса. Тем не менее, можно утверждать, что IGF-1 регулирует передачу сигналов AKT-mTOR посредством более «местных» ауто / паракринных механизмов передачи сигналов. Тем не менее, это также трудно согласовать, поскольку устранение IGFr не ставит под угрозу хронические адаптации, то есть гипертрофические реакции на нагрузку в доклинических моделях (Spangenburg et al. 2008; Hamilton et al. 2010).
Итак, что еще может быть выше mTOR в ответ на упражнение? Механотрансдукция — это процесс преобразования механических (т.е. упражнение) стимулы в клеточные ответы и представляет собой жизнеспособное средство, с помощью которого клетки могут различать механические воздействия и, таким образом, возможно, придают адаптивную специфичность (подробный обзор см. Hornberger, 2011). Важно отметить, что недавняя работа подчеркнула, что фосфолипаза D (PLD) и ее мембранный липидный вторичный мессенджер фосфатидовая кислота (PA) находятся выше по течению от индуцированной сокращением активации mTOR, поскольку фармакологическое ингибирование PLD эффективно отменяет активацию mTOR в ответ на сокращения ( О’Нил и др. 2009). Возможно, это представляет собой по крайней мере один из внутренних механизмов, с помощью которых мышцы могут адаптироваться независимо от системных или даже локально происходящих сигналов, основанных на мембранных рецепторах.
2009). Возможно, это представляет собой по крайней мере один из внутренних механизмов, с помощью которых мышцы могут адаптироваться независимо от системных или даже локально происходящих сигналов, основанных на мембранных рецепторах.
С точки зрения генерации фенотипа выносливости, возможно, главной сигнальной осью, участвующей в митохондриальном биогенезе, является путь коактиватора γ-рецептора, активируемого 5′-AMP-активированной протеинкиназой (AMPK) и активируемого пролифератором пероксисом (PGC-1), вероятно, активируется повышенным соотношением АМФ: АТФ из-за высоких энергозатрат (и / или стресса), связанных с выносливостью (Atherton et al. 2005) или даже незнакомые занятия (Coffey et al. 2006). Сверхэкспрессия PGC-1 способствует биогенезу митохондрий (Viscomi et al. 2011), а активация AMPK может как тормозить MPS, так и индуцировать MPB посредством протеаосомных механизмов и механизмов, связанных с аутофагией (Bolster et al. 2002).
Последнее представление о том, что контроль MPS и MPB скоординированно регулируется потоком через «пути» AMPK – AKT – mTOR, интригует, и предполагается, что баланс этих сигналов (регулируемый энергетическим и механическим воздействием) может в какой-то степени определяют адаптивную специфичность и, возможно, емкость.
Выводы и будущая работа
Как рабочие в полевых условиях, мы склонны «разбивать» режимы тренировок на «выносливость», составляя длительные малоинтенсивные нагрузки (например, продолжительный бег и езда на велосипеде) или «упражнения с сопротивлением» (Kumar и др., 2009 a ), включающие усилия высокой интенсивности (например, поднятие тяжестей). Однако эта классификация опровергает тот факт, что существуют режимы упражнений, в которых используются оба метода. Например, высокоинтенсивный тренинг (HIT) включает в себя очень короткие периоды высокоинтенсивных сокращений в стиле Вингейта, но в первую очередь вызывает адаптацию типа выносливости как его главную особенность (Burgomaster et al. 2008 г.). Более того, для Джо Паблика в тренажерном зале и, что особенно важно для элитных спортсменов, цель часто состоит в том, чтобы выполнять кросс-стилевые тренировки (также называемые параллельными тренировками), чтобы подготовиться к соревнованиям, требующим сочетания силы, выносливости и мощности, вклад каждого необходимого варьируется в зависимости от требований конкретного мероприятия (мероприятий). Тем не менее, существует ли конфликт между различными режимами тренировки на молекулярной, MPS или адаптивной основе, еще предстоит определить.
2008 г.). Более того, для Джо Паблика в тренажерном зале и, что особенно важно для элитных спортсменов, цель часто состоит в том, чтобы выполнять кросс-стилевые тренировки (также называемые параллельными тренировками), чтобы подготовиться к соревнованиям, требующим сочетания силы, выносливости и мощности, вклад каждого необходимого варьируется в зависимости от требований конкретного мероприятия (мероприятий). Тем не менее, существует ли конфликт между различными режимами тренировки на молекулярной, MPS или адаптивной основе, еще предстоит определить.
Несмотря на значительный прогресс в нашем биохимическом понимании «задействованных сигнальных путей», мы еще очень далеки от понимания их участия в адаптивной специфичности человека.Например, как очевидно похожие изменения клеточных сигналов регулируют определенные мышечные фракции (митохондриальные, миофибриллярные и т. Д.) В соответствии с характером упражнения? Действительно, даже сравнение режимов упражнений, обеспечивающих адаптацию на противоположных концах спектра (классическая выносливость против сопротивления ), не привело к консенсусу по отдельным регуляторным сигнальным событиям. Возможно, это связано с тем, что ответы во многом определяются статусом обучения (Coffey et al. 2006; Wilkinson et al. 2008; Vissing et al. 2011), генетическая гетерогенность (Timmons, 2011) и даже технические ограничения, связанные с плохим временным разрешением по «мгновенным» измерениям фосфорилирования. С другой стороны, нам, возможно, придется столкнуться с перспективой того, что поиск «главных регуляторов», таких как AMPK, AKT и mTOR у людей, наивен и что расширение наших сетей, то есть охват измерений геномной мРНК / миРНК, необходимо для истинного понимания роль белкового обмена в определении неоднородности адаптивной специфичности и способности.
Возможно, это связано с тем, что ответы во многом определяются статусом обучения (Coffey et al. 2006; Wilkinson et al. 2008; Vissing et al. 2011), генетическая гетерогенность (Timmons, 2011) и даже технические ограничения, связанные с плохим временным разрешением по «мгновенным» измерениям фосфорилирования. С другой стороны, нам, возможно, придется столкнуться с перспективой того, что поиск «главных регуляторов», таких как AMPK, AKT и mTOR у людей, наивен и что расширение наших сетей, то есть охват измерений геномной мРНК / миРНК, необходимо для истинного понимания роль белкового обмена в определении неоднородности адаптивной специфичности и способности.
Благодарности
P.J.A. является назначенным научным сотрудником Исследовательского совета Великобритании при поддержке Королевского общества и Ajinomoto Inc. Мы также признаем выдающийся и пожизненный вклад профессора Майкла Дж. Ренни, доктора философии, FRSE (почетного профессора Ноттингемского университета) в эту область. Мы любезно приносим свои извинения коллегам, чьи работы мы не смогли включить в этот обзор из-за нехватки места.
Мы любезно приносим свои извинения коллегам, чьи работы мы не смогли включить в этот обзор из-за нехватки места.
Ссылки
- Atherton PJ, Babraj J, Smith K, Singh J, Rennie MJ, Wackerhage H.Селективная активация передачи сигналов AMPK-PGC-1α или PKB-TSC2-mTOR может объяснить специфические адаптивные ответы на электрическую стимуляцию мышц, подобную тренировке на выносливость или сопротивление. FASEB J. 2005; 19: 786–788. [PubMed] [Google Scholar]
- Атертон П.Дж., Этеридж Т., Ватт П.В., Уилкинсон Д., Селби А., Рэнкин Д., Смит К., Ренни М.Дж. Полный эффект мышц после перорального приема протеина: зависящее от времени соответствие и несоответствие между синтезом мышечного протеина человека и передачей сигналов mTORC1. Am J Clin Nutr. 2010. 92: 1080–1088.[PubMed] [Google Scholar]
- Атертон П.Дж., Ренни М.Дж. Синтез белка — низкий приоритет для тренировки мышц. J Physiol. 2006; 573: 288–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Biolo G, Maggi SP, Williams BD, Tipton KD, Wolfe RR.
 Повышение скорости обмена мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol Endocrinol Metab. 1995; 268: E514 – E520. [PubMed] [Google Scholar]
Повышение скорости обмена мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol Endocrinol Metab. 1995; 268: E514 – E520. [PubMed] [Google Scholar] - Бохе Дж., Лоу Дж. Ф., Вулф Р. Р., Ренни М. Дж.. Задержка и продолжительность стимуляции синтеза мышечного белка человека при непрерывном введении аминокислот.J Physiol. 2001; 532: 575–579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bolster DR, Crozier SJ, Kimball SR, Jefferson LS. AMP-активированная протеинкиназа подавляет синтез белка в скелетных мышцах крысы посредством подавления передачи сигналов рапамицина (mTOR) млекопитающим. J Biol Chem. 2002; 277: 23977–23980. [PubMed] [Google Scholar]
- Берд Н.А., Вест Д.В., Мур Д.Р., Атертон П.Дж., Стейплз А.В., Прайор Т., Тан Дж.Э., Ренни М.Дж., Бейкер С.К., Филлипс С.М. Повышенная аминокислотная чувствительность при синтезе миофибриллярного белка сохраняется до 24 часов после упражнений с отягощениями у молодых мужчин.
 J Nutr. 2011; 141: 568–573. [PubMed] [Google Scholar]
J Nutr. 2011; 141: 568–573. [PubMed] [Google Scholar] - Burd NA, West DW, Staples AW, Atherton PJ, Baker JM, Moore DR, Holwerda AM, Parise G, Rennie MJ, Baker SK, Phillips SM. Упражнения с отягощениями с малой нагрузкой и большим объемом стимулируют синтез мышечного белка больше, чем упражнения с отягощениями с высокой нагрузкой и низким объемом, у молодых мужчин. PLoS One. 2010; 5: e12033. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Burgomaster KA, Howarth KR, Phillips SM, Rakobowchuk M, Macdonald MJ, McGee SL, Gibala MJ.Аналогичная метаболическая адаптация во время упражнений после интервалов спринта с небольшим объемом и традиционных тренировок на выносливость у людей. J Physiol. 2008; 586: 151–160. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Coffey VG, Zhong Z, Shield A, Canny BJ, Chibalin AV, Zierath JR, Hawley JA. Ранняя сигнальная реакция на расходящиеся стимулы при физической нагрузке в скелетных мышцах от хорошо тренированных людей. FASEB J.
 2006; 20: 190–192. [PubMed] [Google Scholar]
2006; 20: 190–192. [PubMed] [Google Scholar] - Крибб П.Дж., Хейс А. Влияние времени приема добавок и упражнений с отягощениями на гипертрофию скелетных мышц.Медико-спортивные упражнения. 2006; 38: 1918–1925. [PubMed] [Google Scholar]
- Катбертсон Д., Смит К., Бабрадж Дж., Лиз Дж., Уодделл Т., Атертон П., Вакерхаге Х., Тейлор П.М., Ренни М.Дж. Дефицит анаболической передачи сигналов лежит в основе аминокислотной устойчивости истощенных, стареющих мышц. FASEB J. 2005; 19: 422–424. [PubMed] [Google Scholar]
- Катбертсон Д. Д., Бабрадж Дж., Смит К., Уилкс Э., Феделе М. Дж., Эссер К., Ренни М. Анаболическая передача сигналов и синтез белка в скелетных мышцах человека после упражнений на динамическое сокращение или удлинение.Am J Physiol Endocrinol Metab. 2006; 290: E731 – E738. [PubMed] [Google Scholar]
- Дикинсон Дж. М., Фрай К. С., Драммонд М. Дж., Гундерманн Д. К., Уокер Д. К., Глинн Е. Л., Тиммерман К. Л., Дханани С., Вольпи Е., Расмуссен Б. Б.. Активация комплекса рапамицина 1 у млекопитающих необходима для стимуляции синтеза белка скелетных мышц человека незаменимыми аминокислотами.
 J Nutr. 2011; 141: 856–862. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Nutr. 2011; 141: 856–862. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Драммонд М.Дж., Фрай К.С., Глинн Э.Л., Дрейер Х.С., Дханани С., Тиммерман К.Л., Вольпи Э., Расмуссен Б.Б.Введение рапамицина людям блокирует вызванное сокращением увеличение синтеза белка скелетных мышц. J Physiol. 2009; 587: 1535–1546. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ferguson-Stegall L, McCleave E, Ding Z, Iii DoernerPG, Liu Y, Wang B, Healy M, Kleinert M, Dessard B, Lassiter DG, Kammer L, Ivy JL. Адаптация к тренировкам с аэробными упражнениями повышается за счет углеводно-белковых добавок после тренировки. J Nutr Metab. 2011; 2011: 623182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Glass DJ.Сигнальные пути, влияющие на мышечную массу. Curr Opin Clin Nutr Metab Care. 2010. 13: 225–229. [PubMed] [Google Scholar]
- Goodman CA, Mayhew DL, Hornberger TA. Недавний прогресс в понимании молекулярных механизмов, регулирующих массу скелетных мышц. Сотовый сигнал.
 2011; 23: 1896–1906. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 23: 1896–1906. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Greenhaff PL, Karagounis LG, Peirce N, Simpson EJ, Hazell M, Layfield R, Wackerhage H, Smith K, Atherton P, Selby A, Rennie MJ. Диссоциация между эффектами аминокислот и инсулина на передачу сигналов, убиквитинлигазы и обмен белка в мышцах человека.Am J Physiol Endocrinol Metab. 2008; 295: E595 – E604. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hamilton DL, Philp A, MacKenzie MG, Baar K. Ограниченная роль регуляции PI (3,4,5) P3 в контроле массы скелетных мышц в ответ на упражнения с отягощениями . PLoS One. 2010; 5: e11624. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Член парламента Харбер, Конопка А.Р., Джемиоло Б., Траппе С.В., Траппе Т.А., Рейди П.Т. Синтез мышечного белка и экспрессия генов во время восстановления после аэробных упражнений натощак и после еды.Am J Physiol Regul Integr Comp Physiol. 2010; 299: R1254 – R1262. [PubMed] [Google Scholar]
- Хартман Дж.
 У., Мур Д. Р., Филлипс С. М.. Тренировки с отягощениями снижают обмен белка во всем теле и улучшают удержание чистого белка у нетренированных молодых мужчин. Appl Physiol Nutr Metab. 2006; 31: 557–564. [PubMed] [Google Scholar]
У., Мур Д. Р., Филлипс С. М.. Тренировки с отягощениями снижают обмен белка во всем теле и улучшают удержание чистого белка у нетренированных молодых мужчин. Appl Physiol Nutr Metab. 2006; 31: 557–564. [PubMed] [Google Scholar] - Hasten DL, Pak-Loduca J, Obert KA, Yarasheski KE. Упражнения с отягощениями резко увеличивают скорость синтеза MHC и смешанного мышечного белка в возрасте 78–84 и 23–32 лет. Am J Physiol Endocrinol Metab.2000; 278: E620 – E626. [PubMed] [Google Scholar]
- Hoffman JR, Ratamess NA, Tranchina CP, Rashti SL, Kang J, Faigenbaum AD. Влияние времени приема протеиновых добавок на силу, мощность и изменения состава тела у тренирующихся с отягощениями мужчин. Int J Sport Nutr Exerc Exerc Metab. 2009; 19: 172–185. [PubMed] [Google Scholar]
- Хорнбергер Т.А. Механотрансдукция и регуляция передачи сигналов mTORC1 в скелетных мышцах. Int J Biochem Cell Biol. 2011; 43: 1267–1276. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Katsanos CS, Kobayashi H, Sheffield-Moore M, Aarsland A, Wolfe RR.
 Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005; 82: 1065–1073. [PubMed] [Google Scholar]
Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005; 82: 1065–1073. [PubMed] [Google Scholar] - Купман Р., Вердейк Л. Б., Белен М., Горселинк М., Круземан А. Н., Вагенмакерс А. Дж., Койперс Х., Лун ван Л. Дж. Совместное употребление лейцина с белком не увеличивает скорость синтеза мышечного белка после тренировки у пожилых мужчин. Br J Nutr. 2008; 99: 571–580. [PubMed] [Google Scholar]
- Кумар В., Атертон П., Смит К., Ренни М.Дж.Синтез и распад мышечного белка человека во время и после тренировки. J Appl Physiol. 2009a; 106: 2026–2039. [PubMed] [Google Scholar]
- Кумар В., Селби А., Рэнкин Д., Патель Р., Атертон П., Хильдебрандт В., Уильямс Дж., Смит К., Сейннес О., Хискок Н., Ренни М. Дж.. Возрастные различия во взаимосвязи между синтезом мышечного белка и упражнениями с отягощениями доза-реакция у молодых и пожилых мужчин. J Physiol. 2009b; 587: 211–217. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Миллер Б.
 Ф., Олесен Дж. Л., Хансен М., Доссинг С., Крамери Р. М., Веллинг Р. Дж., Лангберг Х., Фливбьерг А., Кьяер М., Бабрай Дж. А., Смит К., Ренни М. Дж..Скоординированный синтез коллагена и мышечного белка в сухожилии надколенника и четырехглавой мышце человека после тренировки. J Physiol. 2005; 567: 1021–1033. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ф., Олесен Дж. Л., Хансен М., Доссинг С., Крамери Р. М., Веллинг Р. Дж., Лангберг Х., Фливбьерг А., Кьяер М., Бабрай Дж. А., Смит К., Ренни М. Дж..Скоординированный синтез коллагена и мышечного белка в сухожилии надколенника и четырехглавой мышце человека после тренировки. J Physiol. 2005; 567: 1021–1033. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Millward DJ, Bowtell JL, Pacy P, Rennie MJ. Физическая активность, белковый обмен и потребность в белке. Proc Nutr Soc. 1994; 53: 223–240. [PubMed] [Google Scholar]
- Мур Д. Р., Робинсон М. Дж., Фрай Дж. Л., Тан Дж. Э., Гловер Е. И., Уилкинсон С. Б., Приор Т., Тарнопольский М. А., Филлипс С. М.. Дозовая реакция потребляемого белка в мышцах и синтез белка альбумина после упражнений с отягощениями у молодых мужчин.Am J Clin Nutr. 2009. 89: 161–168. [PubMed] [Google Scholar]
- Мур Д. Р., Янг М., Филлипс С. М.. Подобное увеличение размера и силы мышц у молодых мужчин после тренировки с максимальным сокращением или удлинением сокращений при совместимости с общей работой.
 Eur J Appl Physiol. 2012 (2012) [PubMed] [Google Scholar]
Eur J Appl Physiol. 2012 (2012) [PubMed] [Google Scholar] - О’Нил Т.К., Даффи Л.Р., Фрей Дж. У., Хорнбергер Т.А. Роль фосфоинозитид-3-киназы и фосфатидной кислоты в регуляции рапамицина-мишени млекопитающих после эксцентрических сокращений.J Physiol. 2009; 587: 3691–3701. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Пеннингс Б., Купман Р., Белен М., Сенден Дж. М., Сарис У.Х., ван Лун Л.Дж. Выполнение упражнений до приема протеина позволяет шире использовать аминокислоты, полученные из пищевых белков, для синтеза мышечного протеина de novo как у молодых, так и у пожилых мужчин. Am J Clin Nutr. 2011; 93: 322–331. [PubMed] [Google Scholar]
- Proud CG. Передача сигналов mTORC1 и трансляция мРНК. Biochem Soc Trans. 2009; 37: 227–231. [PubMed] [Google Scholar]
- Proud CG.Сигнализация mTOR в здоровье и болезнях. Biochem Soc Trans. 2011; 39: 431–436. [PubMed] [Google Scholar]
- Ренни MJ. Введение в использование индикаторов в питании и обмене веществ.
 Proc Nutr Soc. 1999; 58: 935–944. [PubMed] [Google Scholar]
Proc Nutr Soc. 1999; 58: 935–944. [PubMed] [Google Scholar] - Ренни М.Дж., Эдвардс Р.Х., Холлидей Д., Мэтьюз Д.Е., Вулман С.Л., Миллуорд Д.И. Синтез мышечного белка, измеренный с помощью методов стабильных изотопов у человека: влияние кормления и голодания. Clin Sci (Лондон), 1982; 63: 519–523. [PubMed] [Google Scholar]
- Робинсон М.М., Тернер С.М., Хеллерстайн М.К., Гамильтон К.Л., Миллер Б.Ф.Скорость долгосрочного синтеза ДНК и белка скелетных мышц выше во время аэробных тренировок у пожилых людей, чем у молодых людей, ведущих малоподвижный образ жизни, но не изменяется при добавлении белков. FASEB J. 2011; 25: 3240–3249. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Роиг М., О’Брайен К., Кирк Г., Мюррей Р., Маккиннон П., Шадган Б., Рид В.Д. Влияние эксцентрических и концентрических тренировок с отягощениями на силу и массу мышц у здоровых взрослых: систематический обзор с метаанализом. Br J Sports Med.2009. 43: 556–568. [PubMed] [Google Scholar]
- Rommel C, Bodine SC, Clarke BA, Rossman R, Nunez L, Stitt TN, Yancopoulos GD, Glass DJ.
 Посредничество IGF-1-индуцированной гипертрофии скелетных миотрубок с помощью путей PI 3 K / Akt / mTOR и PI 3 K / Akt / GSK3. Nat Cell Biol. 2001; 3: 1009–1013. [PubMed] [Google Scholar]
Посредничество IGF-1-индуцированной гипертрофии скелетных миотрубок с помощью путей PI 3 K / Akt / mTOR и PI 3 K / Akt / GSK3. Nat Cell Biol. 2001; 3: 1009–1013. [PubMed] [Google Scholar] - Rose AJ, Alsted TJ, Jensen TE, Kobbero JB, Maarbjerg SJ, Jensen J, Richter EA. Сигнальный каскад Ca 2+ -calmodulin-eEF2K-eEF2, но не AMPK, способствует подавлению синтеза белка скелетных мышц во время сокращений.J Physiol. 2009; 587: 1547–1563. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Smith K, Barua JM, Watt PW, Scrimgeour CM, Rennie MJ. Наполнение L- [1- 13 C] лейцином стимулирует включение человеческого мышечного белка непрерывно вводимого L- [1- 13 C] валина. Am J Physiol Endocrinol Metab. 1992; 262: E372 – E376. [PubMed] [Google Scholar]
- Spangenburg EE, Le RD, Ward CW, Bodine SC. Функциональный рецептор инсулиноподобного фактора роста не является необходимым для индуцированной нагрузкой гипертрофии скелетных мышц.
 J Physiol. 2008. 586: 283–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Physiol. 2008. 586: 283–291. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Staples AW, Burd NA, West DW, Currie KD, Atherton PJ, Moore DR, Rennie MJ, Macdonald MJ, Baker SK, Phillips SM. Углеводы не увеличивают индуцированное физическими упражнениями накопление белка по сравнению с одним белком. Медико-спортивные упражнения. 2011; 43: 1154–1161. [PubMed] [Google Scholar]
- Ститт Т.Н., Друян Д., Кларк Б.А., Панаро Ф., Тимофеева Ю., Клайн В.О., Гонсалес М., Янкопулос Г.Д., Glass DJ. Путь IGF-1 / PI3K / Akt предотвращает экспрессию индуцированных мышечной атрофией убиквитинлигаз путем ингибирования факторов транскрипции FOXO.Mol Cell. 2004; 14: 395–403. [PubMed] [Google Scholar]
- Тан Дж. Э., Перко Дж. Г., Мур Д. Р., Уилкинсон С. Б., Филлипс С. М.. Тренировки с отягощениями изменяют реакцию синтеза смешанного мышечного белка в состоянии сытости у молодых мужчин. Am J Physiol Regul Integr Comp Physiol. 2008; 294: R172 – R178. [PubMed] [Google Scholar]
- Timmons JA. Вариабельность адаптации скелетных мышц, вызванная тренировкой. J Appl Physiol. 2011; 110: 846–853. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Trappe TA, White F, Lambert CP, Cesar D, Hellerstein M, Evans WJ.Влияние ибупрофена и ацетаминофена на синтез мышечного белка после тренировки. Am J Physiol Endocrinol Metab. 2002; 282: E551 – E556. [PubMed] [Google Scholar]
- Viscomi C, Bottani E, Civiletto G, Cerutti R, Moggio M, Fagiolari G, Schon EA, Lamperti C, Zeviani M. Коррекция дефицита COX in vivo путем активации AMPK / PGC- Ось 1α. Cell Metab. 2011; 14: 80–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Виссинг К., МакГи С.Л., Фаруп Дж., Кьолхеде Т., Вендельбо М.Х., Джессен Н. Дифференцированная передача сигналов mTOR, но не AMPK, после силовых и выносливых упражнений у людей, привыкших к тренировкам.Scand J Med Sci Sports. 2012 (2012) [PubMed] [Google Scholar]
- Wackerhage H, Rennie MJ. Как питание и упражнения поддерживают мышечно-скелетную массу человека. J Anat. 2006; 208: 451–458. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- West DW, Burd NA, Tang JE, Moore DR, Staples AW, Holwerda AM, Baker SK, Phillips SM. Повышение якобы анаболических гормонов при выполнении упражнений с отягощениями не увеличивает ни вызванную тренировкой гипертрофию мышц, ни силу сгибателей локтя. J Appl Physiol.2010; 108: 60–67. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- West DW, Kujbida GW, Moore DR, Atherton P, Burd NA, Padzik JP, De LM, Tang JE, Parise G, Rennie MJ, Baker SK, Phillips SM. Повышение предполагаемых анаболических гормонов, вызванное упражнениями с отягощениями, не усиливает синтез мышечного белка или внутриклеточную передачу сигналов у молодых мужчин. J Physiol. 2009; 587: 5239–5247. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Уилкс Е.А., Селби А.Л., Атертон П.Дж., Патель Р., Рэнкин Д., Смит К., Ренни М.Дж.Снижение инсулинового ингибирования протеолиза в ногах пожилых людей может способствовать возрастной саркопении. Am J Clin Nutr. 2009; 90: 1343–1350. [PubMed] [Google Scholar]
- Уилкинсон С.Б., Филлипс С.М., Атертон П.Дж., Патель Р., Ярашески К.Е., Тарнопольский М.А., Ренни М.Дж. Дифференциальное влияние упражнений на сопротивление и выносливость в сытом состоянии на фосфорилирование сигнальных молекул и синтез белка в мышцах человека. J Physiol. 2008; 586: 3701–3717. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wolfe RR.Подходы стабильных изотопов для изучения метаболизма энергетических субстратов. Fed Proc. 1982; 41: 2692–2697. [PubMed] [Google Scholar]
Оценка роли распада мышечного белка в ответ на питание и упражнения у людей
Методы оценки реакции MPB на физические упражнения и вмешательства в питание у людей можно в целом разделить на динамические и статические измерения . Измерения динамического отклика MPB основаны главным образом, хотя и не полностью, на методах стабильных изотопных индикаторов.Статические измерения происходят в основном из оценки изменений молекулярных сигналов в образцах мышечной биопсии. У всех методов есть свои сильные и слабые стороны. Эти соображения должны быть сбалансированы с уровнем инвазивности, требуемым для каждого метода, при выборе наилучшего способа оценки реакции MPB. Важно понимать сильные стороны и ограничения методов, используемых для измерения MPB, для оптимальной интерпретации имеющихся данных. Мы пытаемся обрисовать эти соображения для методов, обсуждаемых ниже.
Динамические измерения MPB
Методы стабильных изотопных индикаторов представляют собой мощный инструмент для определения метаболических реакций на различные нарушения, включая питание и упражнения. Забор артериовенозной (АВ) крови в сочетании с инфузией стабильных изотопно меченых аминокислот использовался для оценки MPS и MPB in vivo у людей [25]. Эта модель с двумя пулами (артериальный и венозный пулы аминокислот) позволяет рассчитать поглощение и высвобождение аминокислоты, которая не метаболизируется в мышцах (например, фенилаланин), через конечности [26, 27].Предполагается, что поглощение и высвобождение происходит непосредственно за счет MPS и MPB соответственно. Для высвобождения фенилаланина из ноги, представляющего MPB, необходимо предположить, что внешний транспорт аминокислот из мышцы в венозный бассейн эквивалентен MPB, и оба процесса находятся в устойчивом состоянии [26, 27]. Таким образом, MPB может быть недооценен количеством аминокислот, которые появляются во внутриклеточном пуле мышц, которые повторно используются для MPS и не транспортируются в венозную кровь [28, 29]. Кроме того, чтобы эта модель предлагала надежные результаты, необходимы как физиологические, так и изотопные стационарные состояния [26, 27, 30].Однако во многих исследованиях питания и физических упражнений физиологически устойчивое состояние невозможно. Например, когда болюсный прием аминокислот или белка является необходимым компонентом дизайна исследования, в результате будет происходить временное расширение пула внутриклеточных аминокислот с последующим оттоком аминокислот в пул венозной крови [31]. Это кратковременное расширение необходимо учитывать при расчете MPB. Таким образом, измерение MPB в этих ситуациях менее надежно. Следовательно, эта модель с двумя пулами для оценки MPB может быть надежной и полезной в определенных ситуациях, например.g., исследования, в которых возможны физиологические и изотопные устойчивые состояния. Однако ограничения следует тщательно учитывать, особенно в исследованиях, связанных с болюсным приемом источника аминокислот после тренировки.
Важным ограничением модели баланса AV с двумя пулами, которое необходимо учитывать, является то, что она недооценивает истинную скорость MPB в зависимости от скорости транспорта аминокислот, а также повторного использования внутриклеточных аминокислот для MPS. Так, совсем недавно была разработана модель AV для определения реальной скорости появления аминокислот во внутриклеточном пуле из MPB [28, 29].Эта модель с тремя пулами (артериальный, венозный и мышечный внутриклеточный) обеспечивает более точное приближение к истинной скорости MPB. В дополнение к образцам артериальной и венозной крови, изотопное обогащение внутриклеточных индикаторов аминокислот определяется из образцов биопсии мышц. Как и в модели с двумя пулами, в этой модели с тремя пулами предполагается как физиологическое, так и изотопное устойчивое состояние [28, 29]. Таким образом, модель с тремя пулами является уточнением модели AV с двумя пулами, но ограничения остаются.
Модели AV-баланса использовались для получения важной информации о метаболизме мышц после упражнений, включая MPB.Тем не менее, ограничения, присущие этим моделям, требуют тщательного рассмотрения при интерпретации результатов. Наиболее часто используемые конечности — это нога и предплечье. Поскольку образцы берутся из венозной крови, дренирующей всю конечность (бедренная вена дренирует всю ногу, а не только мышечную ткань), расчет MPB включает вклад немышечных тканей (например, кожи, кости и т. Д.). Biolo et al. [29] определили, что на мышцы приходится 85–90% метаболизма ноги в состоянии покоя [3, 7]. Вклад немышечной ткани, вероятно, больше в предплечье [3].Учитывая, что упражнения увеличивают метаболизм мышцы с незначительным воздействием на другие ткани, разумно предположить, что измерения, сделанные с использованием этих АВ-моделей после тренировки, отражают изменения в метаболизме мышц [3, 7]. Более того, MPS, рассчитываемый как фракционная скорость синтеза (FSR) — метод, который измеряет метаболизм только в мышечной ткани — сильно коррелирует с MPS, определенным с помощью AV-модели с тремя пулами [7], предполагая, что метаболизм мышц является основным фактором, влияющим на результаты. .Еще одно очевидное соображение — инвазивный характер отбора проб из артерии и вены, дренирующей всю конечность. В то время как образец может быть взят из любой артерии, образец должен быть взят из соответствующей вены, например, из бедренной вены для определения АВ-баланса ноги. Катетеризация артерии и глубокой вены предплечья или бедренной кости, очевидно, должна выполняться с большой осторожностью и при соответствующих клинических условиях и этических соображениях. Таким образом, использование этих моделей ограничено в основном клиническими учреждениями, что делает эти методы в значительной степени недоступными для исследований на здоровых добровольцах — как спортсменах, так и других лицах, занимающихся физическими упражнениями.
Другие модели стабильных изотопных индикаторов были разработаны для оценки MPB in vivo у людей, когда катеризация артерий может оказаться невозможной [32]. Принцип, лежащий в основе этих методов, заключается в том, что появление немеченых аминокислот из MPB будет разбавлять накопление индикаторов во внутриклеточном пуле мышц, но не в пуле артериальной крови [33]. Таким образом, соотношение обогащения мышечной внутриклеточной жидкостью и артериализированной кровью можно использовать для расчета скорости фракционного распада (FBR), т.е.э., МПБ [32]. Преимущество этой модели состоит в том, что MPS можно одновременно определять и рассчитывать NBAL. FBR может быть определен одновременно с FSR путем инфузии двух изотопов и отбора проб мышечной ткани и артериальной или артериализированной венозной крови [32, 34, 35]. Катеризация артерии не обязательна, но требуется провести две или более биопсии мышц. Совсем недавно в лаборатории Вульфа была разработана импульсно-болюсная версия для определения FBR [36]. Этот метод требует меньшего количества биопсий и не требует вливания аминокислот.Физиологическое устойчивое состояние является важным компонентом этих моделей для определения FBR. Без этого устойчивого состояния, такого как происходит при приеме источника аминокислот, взаимосвязь между MPB и транспортом аминокислот изменчива [37], и модель ломается, что приводит к ненадежным результатам. Таким образом, с помощью этих моделей невозможно определить MPB после упражнений с приемом белка или аминокислот. Недавно была разработана методика устранения этого недостатка [37], но на сегодняшний день она никогда не была проверена на людях.Итак, насколько нам известно, можно измерить MPB в ответ на инфузию или постоянный прием постоянных доз белка или аминокислот с помощью методов AV-баланса. Однако оценка реакции MPB на болюсное введение источника аминокислот остается проблематичной. Эти ограничения привели к недостатку доступных данных о MPB у людей.
Как AV-баланс, так и методы FBR для оценки MPB ограничиваются скоростью деградации смешанных мышечных белков, то есть всех белков в мышцах.Не существует разрешения распада на уровне отдельного белка или даже на уровне белковой субфракции, например, миофибриллярных белков по сравнению с митохондриальными белками. Измерение скорости синтеза белковых субфракций стало обычным делом за последнее десятилетие [2, 5, 38, 39]. Однако измерить скорость распада этих белковых субфракций сложно. Один из подходов, который пытается устранить это ограничение, — это измерение 3-метилгистидина (3MH), который представляет собой посттрансляционно метилированный гистидин, обнаруженный в миофибриллярных белках.3MH используется в качестве маркера миофибриллярного MPB, поскольку он не может подвергаться дальнейшему метаболизму и повторно использоваться для MPS. Во многих исследованиях измеряли 3MH в моче как маркер распада миофибриллярного белка всего тела. Но, конечно, 3MH обнаруживается в тканях, отличных от скелетных мышц, например, в сердечной и гладкой мышцах, поэтому повышенный уровень 3MH в моче не отражает только скелетный MPB. Более того, исследования, измеряющие 3MH, должны гарантировать, что участники соблюдают диету без мяса. Совсем недавно AV-баланс 3MH использовался для определения MPB, но этот метод использовался редко и только в клинических исследованиях [40].Интерстициальный 3MH недавно был измерен после физических упражнений и бездействия с помощью микродиализа [41–43]. Однако, помимо вышеуказанных ограничений, следует предположить, что повышенное содержание 3MH в интерстициальной жидкости появляется в результате увеличения MPB. Этот метод подвергся критике [44], и чувствительность измерения кажется недостаточной для обнаружения изменений MPB после многих форм упражнений [43]. Таким образом, эффективность использования этого метода для оценки миофибриллярного MPB после физических упражнений у людей является неопределенной, особенно с учетом сложности методов микродиализа мышц.
Совсем недавно были предприняты попытки исследовать распад отдельных белков в мышцах. Один из методов включает измерение распада изотопного обогащения отдельных белков [45, 46]. Однако этот метод еще предстоит использовать в исследованиях, связанных с физическими упражнениями и питанием. Более того, этот метод измеряет MPB только в течение как минимум нескольких дней и целых 2–3 недель. Таким образом, рассчитанные показатели MPB не могут быть сопоставимы с острыми измерениями MPS. В то время как временные рамки измерения MPB могут быть применимы к тому, что может быть получено с помощью методов дейтерированной воды для оценки MPS [47, 48], эти два метода нельзя использовать одновременно, и NBAL не может быть определен.Таким образом, применение этого метода для оценки распада отдельных белков [45] кажется довольно ограниченным.
Недавно был разработан другой метод определения распада отдельных белков в мышцах с помощью протеомного анализа. Скорость распада каждого белка рассчитывается на основе измерения синтеза каждого белка с использованием стабильных изотопных индикаторов в сочетании с изменениями в содержании белка. Об этом методе сообщалось у рыб [49], а недавно и у людей после физических упражнений во время кормления с низким содержанием углеводов и высоким содержанием жиров [50].Поскольку определение MPB является косвенным, необходимо учитывать ограничения. Сообщается, что скорость распада некоторых белков отрицательна из-за ряда факторов [50]. Таким образом, хотя этот метод предлагает способ получить некоторую важную информацию о реакции MPB на физические упражнения и питание, следует проявлять соответствующую осторожность при интерпретации результатов.
Таким образом, существует ряд методов, которые использовались для определения динамической реакции MPB на упражнения и питание.В большинстве этих методов используются методы стабильных изотопных индикаторов для оценки MPB, а различные ограничения доступных методов делают измерение MPB намного сложнее, чем MPS. Таким образом, информации о реакции MPB на физические упражнения и питание гораздо меньше. Тем не менее, из этих исследований можно почерпнуть важную механистическую информацию.
Молекулярные пути MPB
Информация об ответе MPB у людей также может быть получена из измерений изменений в ответе молекулярной передачи сигналов путей MPB.Эти измерения производятся на основе образцов мышц, взятых в конкретный индивидуальный момент времени. Таким образом, эти оценки путей MPB в ответ на физическую нагрузку в основном производятся путем изучения уровней рибонуклеиновой кислоты (РНК) или белков или индексов белковых сигнальных / активационных ответов (фосфорилирование, автолизация и т. Д.). Развитие методологии полимеразной цепи (ПЦР), а затем и количественной ПЦР в реальном времени (qRT-PCR) привело к взрыву исследований с использованием этих методов для оценки экспрессии генов [51].В то время как qRT-PCR использует подход «ген за геном», технологии глобального масштаба, такие как микроматрицы [52] и, в последнее время, секвенирование РНК (RNA-Seq) [53] также доступны для количественной оценки транскрипционной реакции мышц на упражнения. Чувствительность этих методов молекулярной биологии означает, что при подготовке образцов следует проявлять особую осторожность, чтобы предотвратить заражение экзогенной РНК, которая может искажать результаты. Эта чувствительность также означает, что требуется очень небольшое количество ткани. Уровни РНК можно оценивать наряду с другими параметрами (например,g., уровни белка, активность ферментов) в одном и том же образце ткани. Исследования физических упражнений на людях чаще всего измеряют изменения в экспрессии информационной РНК (мРНК) лигаз E3, например MuRF1 и atrogin1, чтобы предложить изменения в MPB при различных вмешательствах [6].
Основным недостатком любой оценки уровней РНК является то, что они не всегда отражают физиологические изменения в метаболизме или массе мышц [54]. Например, Reitelseder et al. [55] не сообщили об изменении показателей MPB, измеренных с помощью методов стабильных изотопных индикаторов, но экспрессия MuRF1 увеличивалась после упражнений.Кроме того, уровни мРНК кальпаина-3 были снижены через 24 часа после эксцентрических упражнений [56], в то время как автолиз кальпаина-3 и, предположительно, уровень активности были увеличены после эксцентрических упражнений в тот же момент времени [57]. Таким образом, повышенная экспрессия мРНК не всегда указывает на повышенную активность пути. Кроме того, количественная оценка уровней РНК с помощью qRT-PCR обычно является относительной, и поэтому абсолютный уровень исследуемых видов РНК обычно неизвестен. Наконец, ответ экспрессии мРНК множества белков может быть вариабельным [55, 58-60], что делает интерпретацию этих результатов проблематичной.Эти вариабельные ответы могут указывать на различные функциональные свойства белков. Тем не менее, эти ограничения следует тщательно учитывать при оценке результатов с использованием этих методов.
При использовании qRT-PCR уровни целевой РНК обычно сравниваются с нормализующей РНК, которая не должна изменяться в зависимости от условий. Также доступны другие методы нормализации [61]. Неизменная природа этой нормализующей РНК часто не исследуется явно, и выбор эталонного гена для использования в качестве нормализатора часто принимается без критической оценки [62].В ходе исследований были изучены подходящие панели эталонных генов для использования для qRT-PCR в скелетных мышцах [63], и были разработаны инструменты, которые помогут исследователям выбрать подходящие гены-нормализаторы для эксперимента qRT-PCR [64]. Отчасти в ответ на низкие показатели воспроизводимости были опубликованы рекомендации по адекватному составлению отчетов об исследованиях qRT-PCR [65]. Наряду с несколькими другими отличными рекомендациями, эти рекомендации включают явную проверку стабильности и уровня экспрессии нормализующей РНК. Действительно, вероятно, оптимально использовать более одной нормализующей РНК и соответствующие методы нормализации [66, 67].Тем не менее, для интерпретации исследований MPB или атрофии, в которых используется qRT-PCR, читатель должен знать, что некритическое использование «исходных» нормализующих видов РНК все еще широко распространено. Исследования, изучающие экспрессию «обычных» нормализующих РНК для qRT-PCR, редки, но Sunderland et al. [68] сообщили, что на экспрессию нескольких обычных нормализующих РНК может влиять как возраст субъекта, так и время после тренировки.
Microarrays [52] и RNA-Seq [53] дают общий обзор транскрипции, и эту информацию можно использовать для изучения обогащенных путей и процессов или для идентификации потенциальных маркеров для высоко или низко отвечающих.Преимущество этих технологий — широкий охват транскрипционной активности интересующих видов РНК. Микроматрицы и RNA-Seq также могут быть адаптированы для предоставления информации об эпигенетическом состоянии ДНК (то есть метилировании, ацетилировании и т. Д.). И микроматрица, и RNA-Seq очень чувствительны к загрязнению, и, как и в случае с qRT-PCR, необходимо соблюдать осторожность при подготовке образца. Тем не менее, хотя функциональные события на уровне белка не могут быть выведены напрямую, глобальный характер профилирования означает, что биологический контекст ткани может быть выведен.Глобальные методы могут возвращать большое количество (возможно, тысячи) генов или других объектов, которые различаются в зависимости от интересующего условия, и разобраться в этих списках сложно. Наиболее широко применяемый подход — метод обогащения или категориального анализа [69]. Анализ обогащения берет список идентифицированных генов и использует статистическое тестирование, чтобы спросить, обогащен ли какой-либо предварительно созданный биологический процесс, функция или путь в этом списке, и если да, то в каком направлении гены изменяются в зависимости от состояния.Прототипическим примером этого метода является анализ обогащения набора генов (GSEA) [70]. Различные курируемые репозитории предоставляют информацию о том, принадлежат ли гены к биологическим процессам или путям [71–73]. Одно предостережение в отношении расширенного анализа заключается в том, что информация в этих ресурсах постоянно меняется по мере появления новых результатов.
Оценка роли распада мышечного белка в ответ на питание и упражнения у людей
Методы оценки реакции MPB на физические упражнения и вмешательства в питание у людей можно в целом разделить на динамические и статические измерения.Измерения динамического отклика MPB основаны главным образом, хотя и не полностью, на методах стабильных изотопных индикаторов. Статические измерения происходят в основном из оценки изменений молекулярных сигналов в образцах мышечной биопсии. У всех методов есть свои сильные и слабые стороны. Эти соображения должны быть сбалансированы с уровнем инвазивности, требуемым для каждого метода, при выборе наилучшего способа оценки реакции MPB. Важно понимать сильные стороны и ограничения методов, используемых для измерения MPB, для оптимальной интерпретации имеющихся данных.Мы пытаемся обрисовать эти соображения для методов, обсуждаемых ниже.
Динамические измерения MPB
Методы стабильных изотопных индикаторов представляют собой мощный инструмент для определения метаболических реакций на различные нарушения, включая питание и упражнения. Забор артериовенозной (АВ) крови в сочетании с инфузией стабильных изотопно меченых аминокислот использовался для оценки MPS и MPB in vivo у людей [25]. Эта модель с двумя пулами (артериальный и венозный пулы аминокислот) позволяет рассчитать поглощение и высвобождение аминокислоты, которая не метаболизируется в мышцах (например, фенилаланин), через конечности [26, 27].Предполагается, что поглощение и высвобождение происходит непосредственно за счет MPS и MPB соответственно. Для высвобождения фенилаланина из ноги, представляющего MPB, необходимо предположить, что внешний транспорт аминокислот из мышцы в венозный бассейн эквивалентен MPB, и оба процесса находятся в устойчивом состоянии [26, 27]. Таким образом, MPB может быть недооценен количеством аминокислот, которые появляются во внутриклеточном пуле мышц, которые повторно используются для MPS и не транспортируются в венозную кровь [28, 29]. Кроме того, чтобы эта модель предлагала надежные результаты, необходимы как физиологические, так и изотопные стационарные состояния [26, 27, 30].Однако во многих исследованиях питания и физических упражнений физиологически устойчивое состояние невозможно. Например, когда болюсный прием аминокислот или белка является необходимым компонентом дизайна исследования, в результате будет происходить временное расширение пула внутриклеточных аминокислот с последующим оттоком аминокислот в пул венозной крови [31]. Это кратковременное расширение необходимо учитывать при расчете MPB. Таким образом, измерение MPB в этих ситуациях менее надежно. Следовательно, эта модель с двумя пулами для оценки MPB может быть надежной и полезной в определенных ситуациях, например.g., исследования, в которых возможны физиологические и изотопные устойчивые состояния. Однако ограничения следует тщательно учитывать, особенно в исследованиях, связанных с болюсным приемом источника аминокислот после тренировки.
Важным ограничением модели баланса AV с двумя пулами, которое необходимо учитывать, является то, что она недооценивает истинную скорость MPB в зависимости от скорости транспорта аминокислот, а также повторного использования внутриклеточных аминокислот для MPS. Так, совсем недавно была разработана модель AV для определения реальной скорости появления аминокислот во внутриклеточном пуле из MPB [28, 29].Эта модель с тремя пулами (артериальный, венозный и мышечный внутриклеточный) обеспечивает более точное приближение к истинной скорости MPB. В дополнение к образцам артериальной и венозной крови, изотопное обогащение внутриклеточных индикаторов аминокислот определяется из образцов биопсии мышц. Как и в модели с двумя пулами, в этой модели с тремя пулами предполагается как физиологическое, так и изотопное устойчивое состояние [28, 29]. Таким образом, модель с тремя пулами является уточнением модели AV с двумя пулами, но ограничения остаются.
Модели AV-баланса использовались для получения важной информации о метаболизме мышц после упражнений, включая MPB.Тем не менее, ограничения, присущие этим моделям, требуют тщательного рассмотрения при интерпретации результатов. Наиболее часто используемые конечности — это нога и предплечье. Поскольку образцы берутся из венозной крови, дренирующей всю конечность (бедренная вена дренирует всю ногу, а не только мышечную ткань), расчет MPB включает вклад немышечных тканей (например, кожи, кости и т. Д.). Biolo et al. [29] определили, что на мышцы приходится 85–90% метаболизма ноги в состоянии покоя [3, 7]. Вклад немышечной ткани, вероятно, больше в предплечье [3].Учитывая, что упражнения увеличивают метаболизм мышцы с незначительным воздействием на другие ткани, разумно предположить, что измерения, сделанные с использованием этих АВ-моделей после тренировки, отражают изменения в метаболизме мышц [3, 7]. Более того, MPS, рассчитываемый как фракционная скорость синтеза (FSR) — метод, который измеряет метаболизм только в мышечной ткани — сильно коррелирует с MPS, определенным с помощью AV-модели с тремя пулами [7], предполагая, что метаболизм мышц является основным фактором, влияющим на результаты. .Еще одно очевидное соображение — инвазивный характер отбора проб из артерии и вены, дренирующей всю конечность. В то время как образец может быть взят из любой артерии, образец должен быть взят из соответствующей вены, например, из бедренной вены для определения АВ-баланса ноги. Катетеризация артерии и глубокой вены предплечья или бедренной кости, очевидно, должна выполняться с большой осторожностью и при соответствующих клинических условиях и этических соображениях. Таким образом, использование этих моделей ограничено в основном клиническими учреждениями, что делает эти методы в значительной степени недоступными для исследований на здоровых добровольцах — как спортсменах, так и других лицах, занимающихся физическими упражнениями.
Другие модели стабильных изотопных индикаторов были разработаны для оценки MPB in vivo у людей, когда катеризация артерий может оказаться невозможной [32]. Принцип, лежащий в основе этих методов, заключается в том, что появление немеченых аминокислот из MPB будет разбавлять накопление индикаторов во внутриклеточном пуле мышц, но не в пуле артериальной крови [33]. Таким образом, соотношение обогащения мышечной внутриклеточной жидкостью и артериализированной кровью можно использовать для расчета скорости фракционного распада (FBR), т.е.э., МПБ [32]. Преимущество этой модели состоит в том, что MPS можно одновременно определять и рассчитывать NBAL. FBR может быть определен одновременно с FSR путем инфузии двух изотопов и отбора проб мышечной ткани и артериальной или артериализированной венозной крови [32, 34, 35]. Катеризация артерии не обязательна, но требуется провести две или более биопсии мышц. Совсем недавно в лаборатории Вульфа была разработана импульсно-болюсная версия для определения FBR [36]. Этот метод требует меньшего количества биопсий и не требует вливания аминокислот.Физиологическое устойчивое состояние является важным компонентом этих моделей для определения FBR. Без этого устойчивого состояния, такого как происходит при приеме источника аминокислот, взаимосвязь между MPB и транспортом аминокислот изменчива [37], и модель ломается, что приводит к ненадежным результатам. Таким образом, с помощью этих моделей невозможно определить MPB после упражнений с приемом белка или аминокислот. Недавно была разработана методика устранения этого недостатка [37], но на сегодняшний день она никогда не была проверена на людях.Итак, насколько нам известно, можно измерить MPB в ответ на инфузию или постоянный прием постоянных доз белка или аминокислот с помощью методов AV-баланса. Однако оценка реакции MPB на болюсное введение источника аминокислот остается проблематичной. Эти ограничения привели к недостатку доступных данных о MPB у людей.
Как AV-баланс, так и методы FBR для оценки MPB ограничиваются скоростью деградации смешанных мышечных белков, то есть всех белков в мышцах.Не существует разрешения распада на уровне отдельного белка или даже на уровне белковой субфракции, например, миофибриллярных белков по сравнению с митохондриальными белками. Измерение скорости синтеза белковых субфракций стало обычным делом за последнее десятилетие [2, 5, 38, 39]. Однако измерить скорость распада этих белковых субфракций сложно. Один из подходов, который пытается устранить это ограничение, — это измерение 3-метилгистидина (3MH), который представляет собой посттрансляционно метилированный гистидин, обнаруженный в миофибриллярных белках.3MH используется в качестве маркера миофибриллярного MPB, поскольку он не может подвергаться дальнейшему метаболизму и повторно использоваться для MPS. Во многих исследованиях измеряли 3MH в моче как маркер распада миофибриллярного белка всего тела. Но, конечно, 3MH обнаруживается в тканях, отличных от скелетных мышц, например, в сердечной и гладкой мышцах, поэтому повышенный уровень 3MH в моче не отражает только скелетный MPB. Более того, исследования, измеряющие 3MH, должны гарантировать, что участники соблюдают диету без мяса. Совсем недавно AV-баланс 3MH использовался для определения MPB, но этот метод использовался редко и только в клинических исследованиях [40].Интерстициальный 3MH недавно был измерен после физических упражнений и бездействия с помощью микродиализа [41–43]. Однако, помимо вышеуказанных ограничений, следует предположить, что повышенное содержание 3MH в интерстициальной жидкости появляется в результате увеличения MPB. Этот метод подвергся критике [44], и чувствительность измерения кажется недостаточной для обнаружения изменений MPB после многих форм упражнений [43]. Таким образом, эффективность использования этого метода для оценки миофибриллярного MPB после физических упражнений у людей является неопределенной, особенно с учетом сложности методов микродиализа мышц.
Совсем недавно были предприняты попытки исследовать распад отдельных белков в мышцах. Один из методов включает измерение распада изотопного обогащения отдельных белков [45, 46]. Однако этот метод еще предстоит использовать в исследованиях, связанных с физическими упражнениями и питанием. Более того, этот метод измеряет MPB только в течение как минимум нескольких дней и целых 2–3 недель. Таким образом, рассчитанные показатели MPB не могут быть сопоставимы с острыми измерениями MPS. В то время как временные рамки измерения MPB могут быть применимы к тому, что может быть получено с помощью методов дейтерированной воды для оценки MPS [47, 48], эти два метода нельзя использовать одновременно, и NBAL не может быть определен.Таким образом, применение этого метода для оценки распада отдельных белков [45] кажется довольно ограниченным.
Недавно был разработан другой метод определения распада отдельных белков в мышцах с помощью протеомного анализа. Скорость распада каждого белка рассчитывается на основе измерения синтеза каждого белка с использованием стабильных изотопных индикаторов в сочетании с изменениями в содержании белка. Об этом методе сообщалось у рыб [49], а недавно и у людей после физических упражнений во время кормления с низким содержанием углеводов и высоким содержанием жиров [50].Поскольку определение MPB является косвенным, необходимо учитывать ограничения. Сообщается, что скорость распада некоторых белков отрицательна из-за ряда факторов [50]. Таким образом, хотя этот метод предлагает способ получить некоторую важную информацию о реакции MPB на физические упражнения и питание, следует проявлять соответствующую осторожность при интерпретации результатов.
Таким образом, существует ряд методов, которые использовались для определения динамической реакции MPB на упражнения и питание.В большинстве этих методов используются методы стабильных изотопных индикаторов для оценки MPB, а различные ограничения доступных методов делают измерение MPB намного сложнее, чем MPS. Таким образом, информации о реакции MPB на физические упражнения и питание гораздо меньше. Тем не менее, из этих исследований можно почерпнуть важную механистическую информацию.
Молекулярные пути MPB
Информация об ответе MPB у людей также может быть получена из измерений изменений в ответе молекулярной передачи сигналов путей MPB.Эти измерения производятся на основе образцов мышц, взятых в конкретный индивидуальный момент времени. Таким образом, эти оценки путей MPB в ответ на физическую нагрузку в основном производятся путем изучения уровней рибонуклеиновой кислоты (РНК) или белков или индексов белковых сигнальных / активационных ответов (фосфорилирование, автолизация и т. Д.). Развитие методологии полимеразной цепи (ПЦР), а затем и количественной ПЦР в реальном времени (qRT-PCR) привело к взрыву исследований с использованием этих методов для оценки экспрессии генов [51].В то время как qRT-PCR использует подход «ген за геном», технологии глобального масштаба, такие как микроматрицы [52] и, в последнее время, секвенирование РНК (RNA-Seq) [53] также доступны для количественной оценки транскрипционной реакции мышц на упражнения. Чувствительность этих методов молекулярной биологии означает, что при подготовке образцов следует проявлять особую осторожность, чтобы предотвратить заражение экзогенной РНК, которая может искажать результаты. Эта чувствительность также означает, что требуется очень небольшое количество ткани. Уровни РНК можно оценивать наряду с другими параметрами (например,g., уровни белка, активность ферментов) в одном и том же образце ткани. Исследования физических упражнений на людях чаще всего измеряют изменения в экспрессии информационной РНК (мРНК) лигаз E3, например MuRF1 и atrogin1, чтобы предложить изменения в MPB при различных вмешательствах [6].
Основным недостатком любой оценки уровней РНК является то, что они не всегда отражают физиологические изменения в метаболизме или массе мышц [54]. Например, Reitelseder et al. [55] не сообщили об изменении показателей MPB, измеренных с помощью методов стабильных изотопных индикаторов, но экспрессия MuRF1 увеличивалась после упражнений.Кроме того, уровни мРНК кальпаина-3 были снижены через 24 часа после эксцентрических упражнений [56], в то время как автолиз кальпаина-3 и, предположительно, уровень активности были увеличены после эксцентрических упражнений в тот же момент времени [57]. Таким образом, повышенная экспрессия мРНК не всегда указывает на повышенную активность пути. Кроме того, количественная оценка уровней РНК с помощью qRT-PCR обычно является относительной, и поэтому абсолютный уровень исследуемых видов РНК обычно неизвестен. Наконец, ответ экспрессии мРНК множества белков может быть вариабельным [55, 58-60], что делает интерпретацию этих результатов проблематичной.Эти вариабельные ответы могут указывать на различные функциональные свойства белков. Тем не менее, эти ограничения следует тщательно учитывать при оценке результатов с использованием этих методов.
При использовании qRT-PCR уровни целевой РНК обычно сравниваются с нормализующей РНК, которая не должна изменяться в зависимости от условий. Также доступны другие методы нормализации [61]. Неизменная природа этой нормализующей РНК часто не исследуется явно, и выбор эталонного гена для использования в качестве нормализатора часто принимается без критической оценки [62].В ходе исследований были изучены подходящие панели эталонных генов для использования для qRT-PCR в скелетных мышцах [63], и были разработаны инструменты, которые помогут исследователям выбрать подходящие гены-нормализаторы для эксперимента qRT-PCR [64]. Отчасти в ответ на низкие показатели воспроизводимости были опубликованы рекомендации по адекватному составлению отчетов об исследованиях qRT-PCR [65]. Наряду с несколькими другими отличными рекомендациями, эти рекомендации включают явную проверку стабильности и уровня экспрессии нормализующей РНК. Действительно, вероятно, оптимально использовать более одной нормализующей РНК и соответствующие методы нормализации [66, 67].Тем не менее, для интерпретации исследований MPB или атрофии, в которых используется qRT-PCR, читатель должен знать, что некритическое использование «исходных» нормализующих видов РНК все еще широко распространено. Исследования, изучающие экспрессию «обычных» нормализующих РНК для qRT-PCR, редки, но Sunderland et al. [68] сообщили, что на экспрессию нескольких обычных нормализующих РНК может влиять как возраст субъекта, так и время после тренировки.
Microarrays [52] и RNA-Seq [53] дают общий обзор транскрипции, и эту информацию можно использовать для изучения обогащенных путей и процессов или для идентификации потенциальных маркеров для высоко или низко отвечающих.Преимущество этих технологий — широкий охват транскрипционной активности интересующих видов РНК. Микроматрицы и RNA-Seq также могут быть адаптированы для предоставления информации об эпигенетическом состоянии ДНК (то есть метилировании, ацетилировании и т. Д.). И микроматрица, и RNA-Seq очень чувствительны к загрязнению, и, как и в случае с qRT-PCR, необходимо соблюдать осторожность при подготовке образца. Тем не менее, хотя функциональные события на уровне белка не могут быть выведены напрямую, глобальный характер профилирования означает, что биологический контекст ткани может быть выведен.Глобальные методы могут возвращать большое количество (возможно, тысячи) генов или других объектов, которые различаются в зависимости от интересующего условия, и разобраться в этих списках сложно. Наиболее широко применяемый подход — метод обогащения или категориального анализа [69]. Анализ обогащения берет список идентифицированных генов и использует статистическое тестирование, чтобы спросить, обогащен ли какой-либо предварительно созданный биологический процесс, функция или путь в этом списке, и если да, то в каком направлении гены изменяются в зависимости от состояния.Прототипическим примером этого метода является анализ обогащения набора генов (GSEA) [70]. Различные курируемые репозитории предоставляют информацию о том, принадлежат ли гены к биологическим процессам или путям [71–73]. Одно предостережение в отношении расширенного анализа заключается в том, что информация в этих ресурсах постоянно меняется по мере появления новых результатов.
Оценка роли распада мышечного белка в ответ на питание и упражнения у людей
Методы оценки реакции MPB на физические упражнения и вмешательства в питание у людей можно в целом разделить на динамические и статические измерения.Измерения динамического отклика MPB основаны главным образом, хотя и не полностью, на методах стабильных изотопных индикаторов. Статические измерения происходят в основном из оценки изменений молекулярных сигналов в образцах мышечной биопсии. У всех методов есть свои сильные и слабые стороны. Эти соображения должны быть сбалансированы с уровнем инвазивности, требуемым для каждого метода, при выборе наилучшего способа оценки реакции MPB. Важно понимать сильные стороны и ограничения методов, используемых для измерения MPB, для оптимальной интерпретации имеющихся данных.Мы пытаемся обрисовать эти соображения для методов, обсуждаемых ниже.
Динамические измерения MPB
Методы стабильных изотопных индикаторов представляют собой мощный инструмент для определения метаболических реакций на различные нарушения, включая питание и упражнения. Забор артериовенозной (АВ) крови в сочетании с инфузией стабильных изотопно меченых аминокислот использовался для оценки MPS и MPB in vivo у людей [25]. Эта модель с двумя пулами (артериальный и венозный пулы аминокислот) позволяет рассчитать поглощение и высвобождение аминокислоты, которая не метаболизируется в мышцах (например, фенилаланин), через конечности [26, 27].Предполагается, что поглощение и высвобождение происходит непосредственно за счет MPS и MPB соответственно. Для высвобождения фенилаланина из ноги, представляющего MPB, необходимо предположить, что внешний транспорт аминокислот из мышцы в венозный бассейн эквивалентен MPB, и оба процесса находятся в устойчивом состоянии [26, 27]. Таким образом, MPB может быть недооценен количеством аминокислот, которые появляются во внутриклеточном пуле мышц, которые повторно используются для MPS и не транспортируются в венозную кровь [28, 29]. Кроме того, чтобы эта модель предлагала надежные результаты, необходимы как физиологические, так и изотопные стационарные состояния [26, 27, 30].Однако во многих исследованиях питания и физических упражнений физиологически устойчивое состояние невозможно. Например, когда болюсный прием аминокислот или белка является необходимым компонентом дизайна исследования, в результате будет происходить временное расширение пула внутриклеточных аминокислот с последующим оттоком аминокислот в пул венозной крови [31]. Это кратковременное расширение необходимо учитывать при расчете MPB. Таким образом, измерение MPB в этих ситуациях менее надежно. Следовательно, эта модель с двумя пулами для оценки MPB может быть надежной и полезной в определенных ситуациях, например.g., исследования, в которых возможны физиологические и изотопные устойчивые состояния. Однако ограничения следует тщательно учитывать, особенно в исследованиях, связанных с болюсным приемом источника аминокислот после тренировки.
Важным ограничением модели баланса AV с двумя пулами, которое необходимо учитывать, является то, что она недооценивает истинную скорость MPB в зависимости от скорости транспорта аминокислот, а также повторного использования внутриклеточных аминокислот для MPS. Так, совсем недавно была разработана модель AV для определения реальной скорости появления аминокислот во внутриклеточном пуле из MPB [28, 29].Эта модель с тремя пулами (артериальный, венозный и мышечный внутриклеточный) обеспечивает более точное приближение к истинной скорости MPB. В дополнение к образцам артериальной и венозной крови, изотопное обогащение внутриклеточных индикаторов аминокислот определяется из образцов биопсии мышц. Как и в модели с двумя пулами, в этой модели с тремя пулами предполагается как физиологическое, так и изотопное устойчивое состояние [28, 29]. Таким образом, модель с тремя пулами является уточнением модели AV с двумя пулами, но ограничения остаются.
Модели AV-баланса использовались для получения важной информации о метаболизме мышц после упражнений, включая MPB.Тем не менее, ограничения, присущие этим моделям, требуют тщательного рассмотрения при интерпретации результатов. Наиболее часто используемые конечности — это нога и предплечье. Поскольку образцы берутся из венозной крови, дренирующей всю конечность (бедренная вена дренирует всю ногу, а не только мышечную ткань), расчет MPB включает вклад немышечных тканей (например, кожи, кости и т. Д.). Biolo et al. [29] определили, что на мышцы приходится 85–90% метаболизма ноги в состоянии покоя [3, 7]. Вклад немышечной ткани, вероятно, больше в предплечье [3].Учитывая, что упражнения увеличивают метаболизм мышцы с незначительным воздействием на другие ткани, разумно предположить, что измерения, сделанные с использованием этих АВ-моделей после тренировки, отражают изменения в метаболизме мышц [3, 7]. Более того, MPS, рассчитываемый как фракционная скорость синтеза (FSR) — метод, который измеряет метаболизм только в мышечной ткани — сильно коррелирует с MPS, определенным с помощью AV-модели с тремя пулами [7], предполагая, что метаболизм мышц является основным фактором, влияющим на результаты. .Еще одно очевидное соображение — инвазивный характер отбора проб из артерии и вены, дренирующей всю конечность. В то время как образец может быть взят из любой артерии, образец должен быть взят из соответствующей вены, например, из бедренной вены для определения АВ-баланса ноги. Катетеризация артерии и глубокой вены предплечья или бедренной кости, очевидно, должна выполняться с большой осторожностью и при соответствующих клинических условиях и этических соображениях. Таким образом, использование этих моделей ограничено в основном клиническими учреждениями, что делает эти методы в значительной степени недоступными для исследований на здоровых добровольцах — как спортсменах, так и других лицах, занимающихся физическими упражнениями.
Другие модели стабильных изотопных индикаторов были разработаны для оценки MPB in vivo у людей, когда катеризация артерий может оказаться невозможной [32]. Принцип, лежащий в основе этих методов, заключается в том, что появление немеченых аминокислот из MPB будет разбавлять накопление индикаторов во внутриклеточном пуле мышц, но не в пуле артериальной крови [33]. Таким образом, соотношение обогащения мышечной внутриклеточной жидкостью и артериализированной кровью можно использовать для расчета скорости фракционного распада (FBR), т.е.э., МПБ [32]. Преимущество этой модели состоит в том, что MPS можно одновременно определять и рассчитывать NBAL. FBR может быть определен одновременно с FSR путем инфузии двух изотопов и отбора проб мышечной ткани и артериальной или артериализированной венозной крови [32, 34, 35]. Катеризация артерии не обязательна, но требуется провести две или более биопсии мышц. Совсем недавно в лаборатории Вульфа была разработана импульсно-болюсная версия для определения FBR [36]. Этот метод требует меньшего количества биопсий и не требует вливания аминокислот.Физиологическое устойчивое состояние является важным компонентом этих моделей для определения FBR. Без этого устойчивого состояния, такого как происходит при приеме источника аминокислот, взаимосвязь между MPB и транспортом аминокислот изменчива [37], и модель ломается, что приводит к ненадежным результатам. Таким образом, с помощью этих моделей невозможно определить MPB после упражнений с приемом белка или аминокислот. Недавно была разработана методика устранения этого недостатка [37], но на сегодняшний день она никогда не была проверена на людях.Итак, насколько нам известно, можно измерить MPB в ответ на инфузию или постоянный прием постоянных доз белка или аминокислот с помощью методов AV-баланса. Однако оценка реакции MPB на болюсное введение источника аминокислот остается проблематичной. Эти ограничения привели к недостатку доступных данных о MPB у людей.
Как AV-баланс, так и методы FBR для оценки MPB ограничиваются скоростью деградации смешанных мышечных белков, то есть всех белков в мышцах.Не существует разрешения распада на уровне отдельного белка или даже на уровне белковой субфракции, например, миофибриллярных белков по сравнению с митохондриальными белками. Измерение скорости синтеза белковых субфракций стало обычным делом за последнее десятилетие [2, 5, 38, 39]. Однако измерить скорость распада этих белковых субфракций сложно. Один из подходов, который пытается устранить это ограничение, — это измерение 3-метилгистидина (3MH), который представляет собой посттрансляционно метилированный гистидин, обнаруженный в миофибриллярных белках.3MH используется в качестве маркера миофибриллярного MPB, поскольку он не может подвергаться дальнейшему метаболизму и повторно использоваться для MPS. Во многих исследованиях измеряли 3MH в моче как маркер распада миофибриллярного белка всего тела. Но, конечно, 3MH обнаруживается в тканях, отличных от скелетных мышц, например, в сердечной и гладкой мышцах, поэтому повышенный уровень 3MH в моче не отражает только скелетный MPB. Более того, исследования, измеряющие 3MH, должны гарантировать, что участники соблюдают диету без мяса. Совсем недавно AV-баланс 3MH использовался для определения MPB, но этот метод использовался редко и только в клинических исследованиях [40].Интерстициальный 3MH недавно был измерен после физических упражнений и бездействия с помощью микродиализа [41–43]. Однако, помимо вышеуказанных ограничений, следует предположить, что повышенное содержание 3MH в интерстициальной жидкости появляется в результате увеличения MPB. Этот метод подвергся критике [44], и чувствительность измерения кажется недостаточной для обнаружения изменений MPB после многих форм упражнений [43]. Таким образом, эффективность использования этого метода для оценки миофибриллярного MPB после физических упражнений у людей является неопределенной, особенно с учетом сложности методов микродиализа мышц.
Совсем недавно были предприняты попытки исследовать распад отдельных белков в мышцах. Один из методов включает измерение распада изотопного обогащения отдельных белков [45, 46]. Однако этот метод еще предстоит использовать в исследованиях, связанных с физическими упражнениями и питанием. Более того, этот метод измеряет MPB только в течение как минимум нескольких дней и целых 2–3 недель. Таким образом, рассчитанные показатели MPB не могут быть сопоставимы с острыми измерениями MPS. В то время как временные рамки измерения MPB могут быть применимы к тому, что может быть получено с помощью методов дейтерированной воды для оценки MPS [47, 48], эти два метода нельзя использовать одновременно, и NBAL не может быть определен.Таким образом, применение этого метода для оценки распада отдельных белков [45] кажется довольно ограниченным.
Недавно был разработан другой метод определения распада отдельных белков в мышцах с помощью протеомного анализа. Скорость распада каждого белка рассчитывается на основе измерения синтеза каждого белка с использованием стабильных изотопных индикаторов в сочетании с изменениями в содержании белка. Об этом методе сообщалось у рыб [49], а недавно и у людей после физических упражнений во время кормления с низким содержанием углеводов и высоким содержанием жиров [50].Поскольку определение MPB является косвенным, необходимо учитывать ограничения. Сообщается, что скорость распада некоторых белков отрицательна из-за ряда факторов [50]. Таким образом, хотя этот метод предлагает способ получить некоторую важную информацию о реакции MPB на физические упражнения и питание, следует проявлять соответствующую осторожность при интерпретации результатов.
Таким образом, существует ряд методов, которые использовались для определения динамической реакции MPB на упражнения и питание.В большинстве этих методов используются методы стабильных изотопных индикаторов для оценки MPB, а различные ограничения доступных методов делают измерение MPB намного сложнее, чем MPS. Таким образом, информации о реакции MPB на физические упражнения и питание гораздо меньше. Тем не менее, из этих исследований можно почерпнуть важную механистическую информацию.
Молекулярные пути MPB
Информация об ответе MPB у людей также может быть получена из измерений изменений в ответе молекулярной передачи сигналов путей MPB.Эти измерения производятся на основе образцов мышц, взятых в конкретный индивидуальный момент времени. Таким образом, эти оценки путей MPB в ответ на физическую нагрузку в основном производятся путем изучения уровней рибонуклеиновой кислоты (РНК) или белков или индексов белковых сигнальных / активационных ответов (фосфорилирование, автолизация и т. Д.). Развитие методологии полимеразной цепи (ПЦР), а затем и количественной ПЦР в реальном времени (qRT-PCR) привело к взрыву исследований с использованием этих методов для оценки экспрессии генов [51].В то время как qRT-PCR использует подход «ген за геном», технологии глобального масштаба, такие как микроматрицы [52] и, в последнее время, секвенирование РНК (RNA-Seq) [53] также доступны для количественной оценки транскрипционной реакции мышц на упражнения. Чувствительность этих методов молекулярной биологии означает, что при подготовке образцов следует проявлять особую осторожность, чтобы предотвратить заражение экзогенной РНК, которая может искажать результаты. Эта чувствительность также означает, что требуется очень небольшое количество ткани. Уровни РНК можно оценивать наряду с другими параметрами (например,g., уровни белка, активность ферментов) в одном и том же образце ткани. Исследования физических упражнений на людях чаще всего измеряют изменения в экспрессии информационной РНК (мРНК) лигаз E3, например MuRF1 и atrogin1, чтобы предложить изменения в MPB при различных вмешательствах [6].
Основным недостатком любой оценки уровней РНК является то, что они не всегда отражают физиологические изменения в метаболизме или массе мышц [54]. Например, Reitelseder et al. [55] не сообщили об изменении показателей MPB, измеренных с помощью методов стабильных изотопных индикаторов, но экспрессия MuRF1 увеличивалась после упражнений.Кроме того, уровни мРНК кальпаина-3 были снижены через 24 часа после эксцентрических упражнений [56], в то время как автолиз кальпаина-3 и, предположительно, уровень активности были увеличены после эксцентрических упражнений в тот же момент времени [57]. Таким образом, повышенная экспрессия мРНК не всегда указывает на повышенную активность пути. Кроме того, количественная оценка уровней РНК с помощью qRT-PCR обычно является относительной, и поэтому абсолютный уровень исследуемых видов РНК обычно неизвестен. Наконец, ответ экспрессии мРНК множества белков может быть вариабельным [55, 58-60], что делает интерпретацию этих результатов проблематичной.Эти вариабельные ответы могут указывать на различные функциональные свойства белков. Тем не менее, эти ограничения следует тщательно учитывать при оценке результатов с использованием этих методов.
При использовании qRT-PCR уровни целевой РНК обычно сравниваются с нормализующей РНК, которая не должна изменяться в зависимости от условий. Также доступны другие методы нормализации [61]. Неизменная природа этой нормализующей РНК часто не исследуется явно, и выбор эталонного гена для использования в качестве нормализатора часто принимается без критической оценки [62].В ходе исследований были изучены подходящие панели эталонных генов для использования для qRT-PCR в скелетных мышцах [63], и были разработаны инструменты, которые помогут исследователям выбрать подходящие гены-нормализаторы для эксперимента qRT-PCR [64]. Отчасти в ответ на низкие показатели воспроизводимости были опубликованы рекомендации по адекватному составлению отчетов об исследованиях qRT-PCR [65]. Наряду с несколькими другими отличными рекомендациями, эти рекомендации включают явную проверку стабильности и уровня экспрессии нормализующей РНК. Действительно, вероятно, оптимально использовать более одной нормализующей РНК и соответствующие методы нормализации [66, 67].Тем не менее, для интерпретации исследований MPB или атрофии, в которых используется qRT-PCR, читатель должен знать, что некритическое использование «исходных» нормализующих видов РНК все еще широко распространено. Исследования, изучающие экспрессию «обычных» нормализующих РНК для qRT-PCR, редки, но Sunderland et al. [68] сообщили, что на экспрессию нескольких обычных нормализующих РНК может влиять как возраст субъекта, так и время после тренировки.
Microarrays [52] и RNA-Seq [53] дают общий обзор транскрипции, и эту информацию можно использовать для изучения обогащенных путей и процессов или для идентификации потенциальных маркеров для высоко или низко отвечающих.Преимущество этих технологий — широкий охват транскрипционной активности интересующих видов РНК. Микроматрицы и RNA-Seq также могут быть адаптированы для предоставления информации об эпигенетическом состоянии ДНК (то есть метилировании, ацетилировании и т. Д.). И микроматрица, и RNA-Seq очень чувствительны к загрязнению, и, как и в случае с qRT-PCR, необходимо соблюдать осторожность при подготовке образца. Тем не менее, хотя функциональные события на уровне белка не могут быть выведены напрямую, глобальный характер профилирования означает, что биологический контекст ткани может быть выведен.Глобальные методы могут возвращать большое количество (возможно, тысячи) генов или других объектов, которые различаются в зависимости от интересующего условия, и разобраться в этих списках сложно. Наиболее широко применяемый подход — метод обогащения или категориального анализа [69]. Анализ обогащения берет список идентифицированных генов и использует статистическое тестирование, чтобы спросить, обогащен ли какой-либо предварительно созданный биологический процесс, функция или путь в этом списке, и если да, то в каком направлении гены изменяются в зависимости от состояния.Прототипическим примером этого метода является анализ обогащения набора генов (GSEA) [70]. Различные курируемые репозитории предоставляют информацию о том, принадлежат ли гены к биологическим процессам или путям [71–73]. Одно предостережение в отношении расширенного анализа заключается в том, что информация в этих ресурсах постоянно меняется по мере появления новых результатов.
Оценка роли распада мышечного белка в ответ на питание и упражнения у людей
Методы оценки реакции MPB на физические упражнения и вмешательства в питание у людей можно в целом разделить на динамические и статические измерения.Измерения динамического отклика MPB основаны главным образом, хотя и не полностью, на методах стабильных изотопных индикаторов. Статические измерения происходят в основном из оценки изменений молекулярных сигналов в образцах мышечной биопсии. У всех методов есть свои сильные и слабые стороны. Эти соображения должны быть сбалансированы с уровнем инвазивности, требуемым для каждого метода, при выборе наилучшего способа оценки реакции MPB. Важно понимать сильные стороны и ограничения методов, используемых для измерения MPB, для оптимальной интерпретации имеющихся данных.Мы пытаемся обрисовать эти соображения для методов, обсуждаемых ниже.
Динамические измерения MPB
Методы стабильных изотопных индикаторов представляют собой мощный инструмент для определения метаболических реакций на различные нарушения, включая питание и упражнения. Забор артериовенозной (АВ) крови в сочетании с инфузией стабильных изотопно меченых аминокислот использовался для оценки MPS и MPB in vivo у людей [25]. Эта модель с двумя пулами (артериальный и венозный пулы аминокислот) позволяет рассчитать поглощение и высвобождение аминокислоты, которая не метаболизируется в мышцах (например, фенилаланин), через конечности [26, 27].Предполагается, что поглощение и высвобождение происходит непосредственно за счет MPS и MPB соответственно. Для высвобождения фенилаланина из ноги, представляющего MPB, необходимо предположить, что внешний транспорт аминокислот из мышцы в венозный бассейн эквивалентен MPB, и оба процесса находятся в устойчивом состоянии [26, 27]. Таким образом, MPB может быть недооценен количеством аминокислот, которые появляются во внутриклеточном пуле мышц, которые повторно используются для MPS и не транспортируются в венозную кровь [28, 29]. Кроме того, чтобы эта модель предлагала надежные результаты, необходимы как физиологические, так и изотопные стационарные состояния [26, 27, 30].Однако во многих исследованиях питания и физических упражнений физиологически устойчивое состояние невозможно. Например, когда болюсный прием аминокислот или белка является необходимым компонентом дизайна исследования, в результате будет происходить временное расширение пула внутриклеточных аминокислот с последующим оттоком аминокислот в пул венозной крови [31]. Это кратковременное расширение необходимо учитывать при расчете MPB. Таким образом, измерение MPB в этих ситуациях менее надежно. Следовательно, эта модель с двумя пулами для оценки MPB может быть надежной и полезной в определенных ситуациях, например.g., исследования, в которых возможны физиологические и изотопные устойчивые состояния. Однако ограничения следует тщательно учитывать, особенно в исследованиях, связанных с болюсным приемом источника аминокислот после тренировки.
Важным ограничением модели баланса AV с двумя пулами, которое необходимо учитывать, является то, что она недооценивает истинную скорость MPB в зависимости от скорости транспорта аминокислот, а также повторного использования внутриклеточных аминокислот для MPS. Так, совсем недавно была разработана модель AV для определения реальной скорости появления аминокислот во внутриклеточном пуле из MPB [28, 29].Эта модель с тремя пулами (артериальный, венозный и мышечный внутриклеточный) обеспечивает более точное приближение к истинной скорости MPB. В дополнение к образцам артериальной и венозной крови, изотопное обогащение внутриклеточных индикаторов аминокислот определяется из образцов биопсии мышц. Как и в модели с двумя пулами, в этой модели с тремя пулами предполагается как физиологическое, так и изотопное устойчивое состояние [28, 29]. Таким образом, модель с тремя пулами является уточнением модели AV с двумя пулами, но ограничения остаются.
Модели AV-баланса использовались для получения важной информации о метаболизме мышц после упражнений, включая MPB.Тем не менее, ограничения, присущие этим моделям, требуют тщательного рассмотрения при интерпретации результатов. Наиболее часто используемые конечности — это нога и предплечье. Поскольку образцы берутся из венозной крови, дренирующей всю конечность (бедренная вена дренирует всю ногу, а не только мышечную ткань), расчет MPB включает вклад немышечных тканей (например, кожи, кости и т. Д.). Biolo et al. [29] определили, что на мышцы приходится 85–90% метаболизма ноги в состоянии покоя [3, 7]. Вклад немышечной ткани, вероятно, больше в предплечье [3].Учитывая, что упражнения увеличивают метаболизм мышцы с незначительным воздействием на другие ткани, разумно предположить, что измерения, сделанные с использованием этих АВ-моделей после тренировки, отражают изменения в метаболизме мышц [3, 7]. Более того, MPS, рассчитываемый как фракционная скорость синтеза (FSR) — метод, который измеряет метаболизм только в мышечной ткани — сильно коррелирует с MPS, определенным с помощью AV-модели с тремя пулами [7], предполагая, что метаболизм мышц является основным фактором, влияющим на результаты. .Еще одно очевидное соображение — инвазивный характер отбора проб из артерии и вены, дренирующей всю конечность. В то время как образец может быть взят из любой артерии, образец должен быть взят из соответствующей вены, например, из бедренной вены для определения АВ-баланса ноги. Катетеризация артерии и глубокой вены предплечья или бедренной кости, очевидно, должна выполняться с большой осторожностью и при соответствующих клинических условиях и этических соображениях. Таким образом, использование этих моделей ограничено в основном клиническими учреждениями, что делает эти методы в значительной степени недоступными для исследований на здоровых добровольцах — как спортсменах, так и других лицах, занимающихся физическими упражнениями.
Другие модели стабильных изотопных индикаторов были разработаны для оценки MPB in vivo у людей, когда катеризация артерий может оказаться невозможной [32]. Принцип, лежащий в основе этих методов, заключается в том, что появление немеченых аминокислот из MPB будет разбавлять накопление индикаторов во внутриклеточном пуле мышц, но не в пуле артериальной крови [33]. Таким образом, соотношение обогащения мышечной внутриклеточной жидкостью и артериализированной кровью можно использовать для расчета скорости фракционного распада (FBR), т.е.э., МПБ [32]. Преимущество этой модели состоит в том, что MPS можно одновременно определять и рассчитывать NBAL. FBR может быть определен одновременно с FSR путем инфузии двух изотопов и отбора проб мышечной ткани и артериальной или артериализированной венозной крови [32, 34, 35]. Катеризация артерии не обязательна, но требуется провести две или более биопсии мышц. Совсем недавно в лаборатории Вульфа была разработана импульсно-болюсная версия для определения FBR [36]. Этот метод требует меньшего количества биопсий и не требует вливания аминокислот.Физиологическое устойчивое состояние является важным компонентом этих моделей для определения FBR. Без этого устойчивого состояния, такого как происходит при приеме источника аминокислот, взаимосвязь между MPB и транспортом аминокислот изменчива [37], и модель ломается, что приводит к ненадежным результатам. Таким образом, с помощью этих моделей невозможно определить MPB после упражнений с приемом белка или аминокислот. Недавно была разработана методика устранения этого недостатка [37], но на сегодняшний день она никогда не была проверена на людях.Итак, насколько нам известно, можно измерить MPB в ответ на инфузию или постоянный прием постоянных доз белка или аминокислот с помощью методов AV-баланса. Однако оценка реакции MPB на болюсное введение источника аминокислот остается проблематичной. Эти ограничения привели к недостатку доступных данных о MPB у людей.
Как AV-баланс, так и методы FBR для оценки MPB ограничиваются скоростью деградации смешанных мышечных белков, то есть всех белков в мышцах.Не существует разрешения распада на уровне отдельного белка или даже на уровне белковой субфракции, например, миофибриллярных белков по сравнению с митохондриальными белками. Измерение скорости синтеза белковых субфракций стало обычным делом за последнее десятилетие [2, 5, 38, 39]. Однако измерить скорость распада этих белковых субфракций сложно. Один из подходов, который пытается устранить это ограничение, — это измерение 3-метилгистидина (3MH), который представляет собой посттрансляционно метилированный гистидин, обнаруженный в миофибриллярных белках.3MH используется в качестве маркера миофибриллярного MPB, поскольку он не может подвергаться дальнейшему метаболизму и повторно использоваться для MPS. Во многих исследованиях измеряли 3MH в моче как маркер распада миофибриллярного белка всего тела. Но, конечно, 3MH обнаруживается в тканях, отличных от скелетных мышц, например, в сердечной и гладкой мышцах, поэтому повышенный уровень 3MH в моче не отражает только скелетный MPB. Более того, исследования, измеряющие 3MH, должны гарантировать, что участники соблюдают диету без мяса. Совсем недавно AV-баланс 3MH использовался для определения MPB, но этот метод использовался редко и только в клинических исследованиях [40].Интерстициальный 3MH недавно был измерен после физических упражнений и бездействия с помощью микродиализа [41–43]. Однако, помимо вышеуказанных ограничений, следует предположить, что повышенное содержание 3MH в интерстициальной жидкости появляется в результате увеличения MPB. Этот метод подвергся критике [44], и чувствительность измерения кажется недостаточной для обнаружения изменений MPB после многих форм упражнений [43]. Таким образом, эффективность использования этого метода для оценки миофибриллярного MPB после физических упражнений у людей является неопределенной, особенно с учетом сложности методов микродиализа мышц.
Совсем недавно были предприняты попытки исследовать распад отдельных белков в мышцах. Один из методов включает измерение распада изотопного обогащения отдельных белков [45, 46]. Однако этот метод еще предстоит использовать в исследованиях, связанных с физическими упражнениями и питанием. Более того, этот метод измеряет MPB только в течение как минимум нескольких дней и целых 2–3 недель. Таким образом, рассчитанные показатели MPB не могут быть сопоставимы с острыми измерениями MPS. В то время как временные рамки измерения MPB могут быть применимы к тому, что может быть получено с помощью методов дейтерированной воды для оценки MPS [47, 48], эти два метода нельзя использовать одновременно, и NBAL не может быть определен.Таким образом, применение этого метода для оценки распада отдельных белков [45] кажется довольно ограниченным.
Недавно был разработан другой метод определения распада отдельных белков в мышцах с помощью протеомного анализа. Скорость распада каждого белка рассчитывается на основе измерения синтеза каждого белка с использованием стабильных изотопных индикаторов в сочетании с изменениями в содержании белка. Об этом методе сообщалось у рыб [49], а недавно и у людей после физических упражнений во время кормления с низким содержанием углеводов и высоким содержанием жиров [50].Поскольку определение MPB является косвенным, необходимо учитывать ограничения. Сообщается, что скорость распада некоторых белков отрицательна из-за ряда факторов [50]. Таким образом, хотя этот метод предлагает способ получить некоторую важную информацию о реакции MPB на физические упражнения и питание, следует проявлять соответствующую осторожность при интерпретации результатов.
Таким образом, существует ряд методов, которые использовались для определения динамической реакции MPB на упражнения и питание.В большинстве этих методов используются методы стабильных изотопных индикаторов для оценки MPB, а различные ограничения доступных методов делают измерение MPB намного сложнее, чем MPS. Таким образом, информации о реакции MPB на физические упражнения и питание гораздо меньше. Тем не менее, из этих исследований можно почерпнуть важную механистическую информацию.
Молекулярные пути MPB
Информация об ответе MPB у людей также может быть получена из измерений изменений в ответе молекулярной передачи сигналов путей MPB.Эти измерения производятся на основе образцов мышц, взятых в конкретный индивидуальный момент времени. Таким образом, эти оценки путей MPB в ответ на физическую нагрузку в основном производятся путем изучения уровней рибонуклеиновой кислоты (РНК) или белков или индексов белковых сигнальных / активационных ответов (фосфорилирование, автолизация и т. Д.). Развитие методологии полимеразной цепи (ПЦР), а затем и количественной ПЦР в реальном времени (qRT-PCR) привело к взрыву исследований с использованием этих методов для оценки экспрессии генов [51].В то время как qRT-PCR использует подход «ген за геном», технологии глобального масштаба, такие как микроматрицы [52] и, в последнее время, секвенирование РНК (RNA-Seq) [53] также доступны для количественной оценки транскрипционной реакции мышц на упражнения. Чувствительность этих методов молекулярной биологии означает, что при подготовке образцов следует проявлять особую осторожность, чтобы предотвратить заражение экзогенной РНК, которая может искажать результаты. Эта чувствительность также означает, что требуется очень небольшое количество ткани. Уровни РНК можно оценивать наряду с другими параметрами (например,g., уровни белка, активность ферментов) в одном и том же образце ткани. Исследования физических упражнений на людях чаще всего измеряют изменения в экспрессии информационной РНК (мРНК) лигаз E3, например MuRF1 и atrogin1, чтобы предложить изменения в MPB при различных вмешательствах [6].
Основным недостатком любой оценки уровней РНК является то, что они не всегда отражают физиологические изменения в метаболизме или массе мышц [54]. Например, Reitelseder et al. [55] не сообщили об изменении показателей MPB, измеренных с помощью методов стабильных изотопных индикаторов, но экспрессия MuRF1 увеличивалась после упражнений.Кроме того, уровни мРНК кальпаина-3 были снижены через 24 часа после эксцентрических упражнений [56], в то время как автолиз кальпаина-3 и, предположительно, уровень активности были увеличены после эксцентрических упражнений в тот же момент времени [57]. Таким образом, повышенная экспрессия мРНК не всегда указывает на повышенную активность пути. Кроме того, количественная оценка уровней РНК с помощью qRT-PCR обычно является относительной, и поэтому абсолютный уровень исследуемых видов РНК обычно неизвестен. Наконец, ответ экспрессии мРНК множества белков может быть вариабельным [55, 58-60], что делает интерпретацию этих результатов проблематичной.Эти вариабельные ответы могут указывать на различные функциональные свойства белков. Тем не менее, эти ограничения следует тщательно учитывать при оценке результатов с использованием этих методов.
При использовании qRT-PCR уровни целевой РНК обычно сравниваются с нормализующей РНК, которая не должна изменяться в зависимости от условий. Также доступны другие методы нормализации [61]. Неизменная природа этой нормализующей РНК часто не исследуется явно, и выбор эталонного гена для использования в качестве нормализатора часто принимается без критической оценки [62].В ходе исследований были изучены подходящие панели эталонных генов для использования для qRT-PCR в скелетных мышцах [63], и были разработаны инструменты, которые помогут исследователям выбрать подходящие гены-нормализаторы для эксперимента qRT-PCR [64]. Отчасти в ответ на низкие показатели воспроизводимости были опубликованы рекомендации по адекватному составлению отчетов об исследованиях qRT-PCR [65]. Наряду с несколькими другими отличными рекомендациями, эти рекомендации включают явную проверку стабильности и уровня экспрессии нормализующей РНК. Действительно, вероятно, оптимально использовать более одной нормализующей РНК и соответствующие методы нормализации [66, 67].Тем не менее, для интерпретации исследований MPB или атрофии, в которых используется qRT-PCR, читатель должен знать, что некритическое использование «исходных» нормализующих видов РНК все еще широко распространено. Исследования, изучающие экспрессию «обычных» нормализующих РНК для qRT-PCR, редки, но Sunderland et al. [68] сообщили, что на экспрессию нескольких обычных нормализующих РНК может влиять как возраст субъекта, так и время после тренировки.
Microarrays [52] и RNA-Seq [53] дают общий обзор транскрипции, и эту информацию можно использовать для изучения обогащенных путей и процессов или для идентификации потенциальных маркеров для высоко или низко отвечающих.Преимущество этих технологий — широкий охват транскрипционной активности интересующих видов РНК. Микроматрицы и RNA-Seq также могут быть адаптированы для предоставления информации об эпигенетическом состоянии ДНК (то есть метилировании, ацетилировании и т. Д.). И микроматрица, и RNA-Seq очень чувствительны к загрязнению, и, как и в случае с qRT-PCR, необходимо соблюдать осторожность при подготовке образца. Тем не менее, хотя функциональные события на уровне белка не могут быть выведены напрямую, глобальный характер профилирования означает, что биологический контекст ткани может быть выведен.Глобальные методы могут возвращать большое количество (возможно, тысячи) генов или других объектов, которые различаются в зависимости от интересующего условия, и разобраться в этих списках сложно. Наиболее широко применяемый подход — метод обогащения или категориального анализа [69]. Анализ обогащения берет список идентифицированных генов и использует статистическое тестирование, чтобы спросить, обогащен ли какой-либо предварительно созданный биологический процесс, функция или путь в этом списке, и если да, то в каком направлении гены изменяются в зависимости от состояния.Прототипическим примером этого метода является анализ обогащения набора генов (GSEA) [70]. Различные курируемые репозитории предоставляют информацию о том, принадлежат ли гены к биологическим процессам или путям [71–73]. Одно предостережение в отношении расширенного анализа заключается в том, что информация в этих ресурсах постоянно меняется по мере появления новых результатов.
Синтез мышечного белка | Encyclopedia.com
Синтез мышечного белка необходим для постоянного роста, восстановления и поддержания групп скелетных мышц организма.Другие типы мышечной ткани человека, сердечная мышца и гладкие мышцы, которые являются частью структуры внутренних органов, образуются посредством различных клеточных процессов.
Белки — это соединения, состоящие из аминокислот — строительных блоков для формирования тканей в организме. Синтез белка — это метод, с помощью которого строятся мышцы. Человеческое тело быстро синтезирует белок из рациона, в то время как организм растет в подростковом возрасте и становится взрослым.Скорость синтеза белка значительно снижается после 20 лет. Именно по этой причине даже у активных, хорошо тренированных взрослых фактическая скорость роста мышц будет намного меньше, чем у здорового подростка.
У взрослого спортсмена синтез мышечного белка также связан с тем, как мышцы тренируются. За исключением постоянного восстановления и поддержания существующих мышечных тканей, которые могут быть повреждены в ходе повседневной жизни, скелетные мышцы человека никогда не станут больше или сильнее из-за малоподвижного образа жизни или употребления определенных продуктов или добавок.Мышечная активность является предпосылкой полноценного развития мышц, основанного на синтезе белка.
Все формы физической активности направляют определенную нагрузку на мышцу. В таких видах спорта, как бег на длинные дистанции или езда на велосипеде, нагрузки являются кумулятивными, объединенным эффектом повторяющихся движений, которые имеют относительно более низкий уровень интенсивности. В упражнениях, включающих взрывные и сильно сфокусированные движения (например, силовые тренировки), силы, направленные на мышцы, намного более значительны, и они возникают в течение гораздо более короткого промежутка времени.
В любых обстоятельствах мышца разрушается естественным образом — процесс, известный как «катаболизм». Разрушение включает физическое разделение волокон, составляющих мышечную структуру. Последующее восстановление поврежденной мышцы — это «анаболизм», наращивание и рост существующих и ранее поврежденных волокон. Анаболические стероиды получили свое название из-за их вклада в наращивание мышц. Синтез белка — это механизм, с помощью которого организм влияет на это восстановление и рост мышц: в очень общем случае, когда организм производит больше синтезированного белка, чем потребляет за счет своих катаболических процессов, мышцы будут развиваться.
Существуют измеримые способы определения баланса в организме на постоянной основе между его катаболическим и анаболическим состояниями. Незаменимая аминокислота лейцин используется в качестве индикатора состояния этого баланса в более сложных анализах спортивной науки. Положительный баланс лейцина свидетельствует о том, что эта кислота присутствует в клетках, что соответствует анаболизму белков. Лейцин входит в состав многочисленных коммерческих протеиновых добавок, принимаемых для стимуляции дальнейшего синтеза протеина в организме.
Синтез мышечного белка также рассматривается в контексте болезненных, поврежденных или чрезмерно загруженных мышц. Спортивные исследования в этой области были сосредоточены не столько на том, будет ли употребление протеина полезным для спортсмена, сколько на том, в какой момент после тренировки следует употреблять протеин, чтобы тело могло получить максимальное восстановление и наращивание мышц. эффект. Комбинированные эффекты потребления углеводов и белков также были тщательно изучены в последние годы.
Сообщество спортивной науки поддерживает полезность замены углеводов сразу после тренировки. Такая замена имеет тенденцию быстрее доставлять гликоген к пораженным мышцам; Кроме того, весь организм получает пополнение запасов углеводов, за счет которых может быть восстановлена вся опорно-двигательная система. Когда белки потребляются вместе с углеводами сразу после тренировки, катаболический процесс в пораженных мышцах не останавливается; немедленно стимулируется процесс синтеза белка (выражение «толчок» обычно используется в исследованиях для описания эффекта).

 Повышение скорости обмена мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol Endocrinol Metab. 1995; 268: E514 – E520. [PubMed] [Google Scholar]
Повышение скорости обмена мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol Endocrinol Metab. 1995; 268: E514 – E520. [PubMed] [Google Scholar] J Nutr. 2011; 141: 568–573. [PubMed] [Google Scholar]
J Nutr. 2011; 141: 568–573. [PubMed] [Google Scholar] 2006; 20: 190–192. [PubMed] [Google Scholar]
2006; 20: 190–192. [PubMed] [Google Scholar] J Nutr. 2011; 141: 856–862. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Nutr. 2011; 141: 856–862. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2011; 23: 1896–1906. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 23: 1896–1906. [Бесплатная статья PMC] [PubMed] [Google Scholar] У., Мур Д. Р., Филлипс С. М.. Тренировки с отягощениями снижают обмен белка во всем теле и улучшают удержание чистого белка у нетренированных молодых мужчин. Appl Physiol Nutr Metab. 2006; 31: 557–564. [PubMed] [Google Scholar]
У., Мур Д. Р., Филлипс С. М.. Тренировки с отягощениями снижают обмен белка во всем теле и улучшают удержание чистого белка у нетренированных молодых мужчин. Appl Physiol Nutr Metab. 2006; 31: 557–564. [PubMed] [Google Scholar] Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005; 82: 1065–1073. [PubMed] [Google Scholar]
Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005; 82: 1065–1073. [PubMed] [Google Scholar] Ф., Олесен Дж. Л., Хансен М., Доссинг С., Крамери Р. М., Веллинг Р. Дж., Лангберг Х., Фливбьерг А., Кьяер М., Бабрай Дж. А., Смит К., Ренни М. Дж..Скоординированный синтез коллагена и мышечного белка в сухожилии надколенника и четырехглавой мышце человека после тренировки. J Physiol. 2005; 567: 1021–1033. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ф., Олесен Дж. Л., Хансен М., Доссинг С., Крамери Р. М., Веллинг Р. Дж., Лангберг Х., Фливбьерг А., Кьяер М., Бабрай Дж. А., Смит К., Ренни М. Дж..Скоординированный синтез коллагена и мышечного белка в сухожилии надколенника и четырехглавой мышце человека после тренировки. J Physiol. 2005; 567: 1021–1033. [Бесплатная статья PMC] [PubMed] [Google Scholar] Eur J Appl Physiol. 2012 (2012) [PubMed] [Google Scholar]
Eur J Appl Physiol. 2012 (2012) [PubMed] [Google Scholar] Proc Nutr Soc. 1999; 58: 935–944. [PubMed] [Google Scholar]
Proc Nutr Soc. 1999; 58: 935–944. [PubMed] [Google Scholar]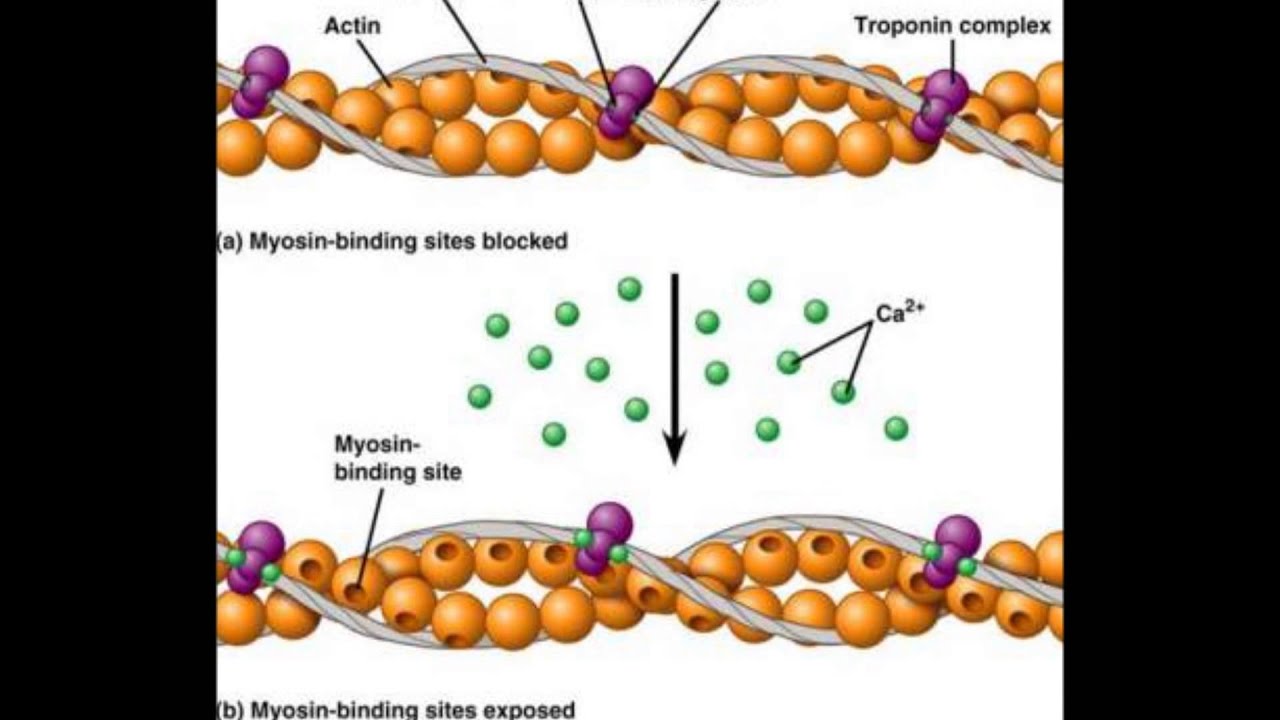 Посредничество IGF-1-индуцированной гипертрофии скелетных миотрубок с помощью путей PI 3 K / Akt / mTOR и PI 3 K / Akt / GSK3. Nat Cell Biol. 2001; 3: 1009–1013. [PubMed] [Google Scholar]
Посредничество IGF-1-индуцированной гипертрофии скелетных миотрубок с помощью путей PI 3 K / Akt / mTOR и PI 3 K / Akt / GSK3. Nat Cell Biol. 2001; 3: 1009–1013. [PubMed] [Google Scholar] J Physiol. 2008. 586: 283–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Physiol. 2008. 586: 283–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]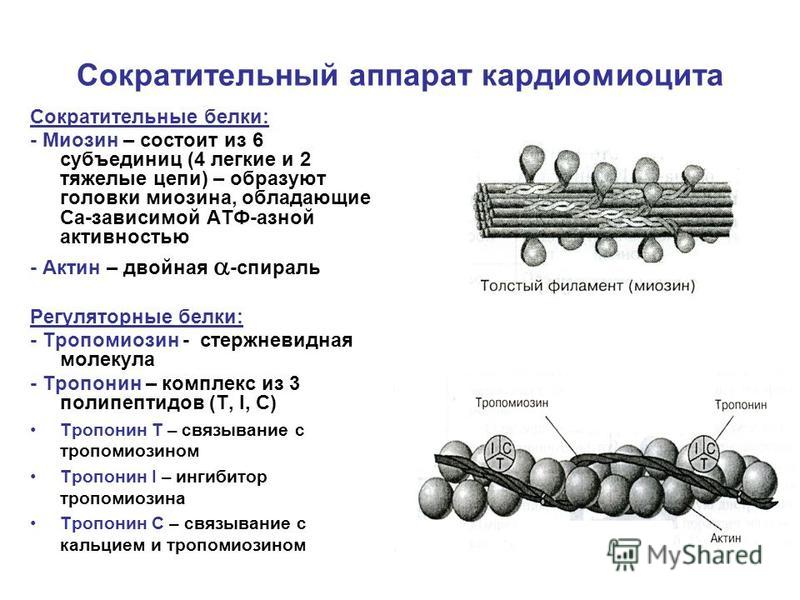 Вариабельность адаптации скелетных мышц, вызванная тренировкой. J Appl Physiol. 2011; 110: 846–853. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вариабельность адаптации скелетных мышц, вызванная тренировкой. J Appl Physiol. 2011; 110: 846–853. [Бесплатная статья PMC] [PubMed] [Google Scholar] J Anat. 2006; 208: 451–458. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Anat. 2006; 208: 451–458. [Бесплатная статья PMC] [PubMed] [Google Scholar] Am J Clin Nutr. 2009; 90: 1343–1350. [PubMed] [Google Scholar]
Am J Clin Nutr. 2009; 90: 1343–1350. [PubMed] [Google Scholar] Повышение скорости обмена мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol Endocrinol Metab. 1995; 268: E514 – E520. [PubMed] [Google Scholar]
Повышение скорости обмена мышечного белка и транспорта аминокислот после упражнений с отягощениями у людей. Am J Physiol Endocrinol Metab. 1995; 268: E514 – E520. [PubMed] [Google Scholar] J Nutr. 2011; 141: 568–573. [PubMed] [Google Scholar]
J Nutr. 2011; 141: 568–573. [PubMed] [Google Scholar] 2006; 20: 190–192. [PubMed] [Google Scholar]
2006; 20: 190–192. [PubMed] [Google Scholar] J Nutr. 2011; 141: 856–862. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Nutr. 2011; 141: 856–862. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2011; 23: 1896–1906. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 23: 1896–1906. [Бесплатная статья PMC] [PubMed] [Google Scholar] У., Мур Д. Р., Филлипс С. М.. Тренировки с отягощениями снижают обмен белка во всем теле и улучшают удержание чистого белка у нетренированных молодых мужчин. Appl Physiol Nutr Metab. 2006; 31: 557–564. [PubMed] [Google Scholar]
У., Мур Д. Р., Филлипс С. М.. Тренировки с отягощениями снижают обмен белка во всем теле и улучшают удержание чистого белка у нетренированных молодых мужчин. Appl Physiol Nutr Metab. 2006; 31: 557–564. [PubMed] [Google Scholar] Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005; 82: 1065–1073. [PubMed] [Google Scholar]
Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005; 82: 1065–1073. [PubMed] [Google Scholar] Ф., Олесен Дж. Л., Хансен М., Доссинг С., Крамери Р. М., Веллинг Р. Дж., Лангберг Х., Фливбьерг А., Кьяер М., Бабрай Дж. А., Смит К., Ренни М. Дж..Скоординированный синтез коллагена и мышечного белка в сухожилии надколенника и четырехглавой мышце человека после тренировки. J Physiol. 2005; 567: 1021–1033. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ф., Олесен Дж. Л., Хансен М., Доссинг С., Крамери Р. М., Веллинг Р. Дж., Лангберг Х., Фливбьерг А., Кьяер М., Бабрай Дж. А., Смит К., Ренни М. Дж..Скоординированный синтез коллагена и мышечного белка в сухожилии надколенника и четырехглавой мышце человека после тренировки. J Physiol. 2005; 567: 1021–1033. [Бесплатная статья PMC] [PubMed] [Google Scholar] Eur J Appl Physiol. 2012 (2012) [PubMed] [Google Scholar]
Eur J Appl Physiol. 2012 (2012) [PubMed] [Google Scholar] Proc Nutr Soc. 1999; 58: 935–944. [PubMed] [Google Scholar]
Proc Nutr Soc. 1999; 58: 935–944. [PubMed] [Google Scholar] Посредничество IGF-1-индуцированной гипертрофии скелетных миотрубок с помощью путей PI 3 K / Akt / mTOR и PI 3 K / Akt / GSK3. Nat Cell Biol. 2001; 3: 1009–1013. [PubMed] [Google Scholar]
Посредничество IGF-1-индуцированной гипертрофии скелетных миотрубок с помощью путей PI 3 K / Akt / mTOR и PI 3 K / Akt / GSK3. Nat Cell Biol. 2001; 3: 1009–1013. [PubMed] [Google Scholar] J Physiol. 2008. 586: 283–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Physiol. 2008. 586: 283–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]