Аминокислоты сокращения — Справочник химика 21
Аминокислота Сокращенное обозначение Формул Темпе- ратура плав- Кислотно-основные свойства Растворимость в во- [c.794]
Фенилкетонурия-заболевание, вызываемое недостаточным количеством в организме фермента фенилаланингидроксилазы. Этот фермент катализирует превращение фенилаланина в тирозин (оба эти соединения являются аминокислотами). Указанное заболевание может приводить к серьезной задержке умственного развития, а) Напишите сокращенные структурные формулы фенилаланина и тирозина б) вь[-скажите предположение относительно происхождения названия указанного фермента. [c.469]
Современная рациональная классификация аминокислот основана на полярности радикалов (К-групп), т.е. способности их к взаимодействию с водой при физиологических значениях pH (близких к pH 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы 1) неполярные (гидрофобные) 2) полярные (гидрофильные) 3) ароматические (большей частью неполярные) 4) отрицательно заряженные и 5) положительно заряженные.
Аминокислота (сокращения см. в табл. 103) Одномерная хроматограмма с растворителем н-пропанол — вода (70+30) Двумерная хроматограмма смеси аминокислот (рис. 161) Аминокислота (сокращения см. в табл. 103) Одномерная хроматограмма с растворителем к-пропа-нол — вода (70+30) Двумерная хроматограмма смеси аминокислот (рис. 161) [c.404]
Схема. Классификация аминокислот (их структура, названия и сокращения)
[c.9] К пептидным гормонам относятся инсулин, продуцируемый поджелудочной железой, регулирующий метаболизм углеводов, жиров и белков, содержащий 51 аминокислотный остаток секретин, вырабатываемый в желудочно-кишечном тракте, определяющий секреторную функцию желудочно-кишечного тракта, содержащий 21 аминокислотный остаток в передней доле гипофиза вырабатываются адренокор-тикотропин (34 аминокислоты), контролирующий активность коры надпочечников, пролактин (198 аминокислот), влияющий на рост грудных желез и секрецию молока в задней доле гипофиза вырабатываются вазопрессин (9 аминокислот), действующий как диуретик и сосудосуживающее, и окси-тоцин (9 аминокислот), стимулирующий сокращение гладкой мускулатуры. Это только иллюстративный перечень гормонов пептидной структуры — их значительно больше, многие из них еще изучены не полностью, как в плане строения, так и функциональности. Особенно важно и проблематично исследование связи их строения с активностью. Данные по связи структура — активность позволяют иногда получать синтетические полипептиды с активностью, превосходящей природные. Так, варьируя аминокислотный состав нейрогипофизных гормонов (схема 4.4.1) было получено около 200 аналогов, из которых один, [4-ТИг]-оксито-цин оказался высокоактивным.
Это только иллюстративный перечень гормонов пептидной структуры — их значительно больше, многие из них еще изучены не полностью, как в плане строения, так и функциональности. Особенно важно и проблематично исследование связи их строения с активностью. Данные по связи структура — активность позволяют иногда получать синтетические полипептиды с активностью, превосходящей природные. Так, варьируя аминокислотный состав нейрогипофизных гормонов (схема 4.4.1) было получено около 200 аналогов, из которых один, [4-ТИг]-оксито-цин оказался высокоактивным.
Аминокислота Сокращение Мол. вес аминокислоты Мол. вес БОК-аминокислоты [c.164]
Правилами ШРАС/ШВ [12] приняты английские трехбуквенные сокращения тривиальных названий аминокислот, начинающиеся с прописной буквы Gly, Ala, Туг и т. д. (применяемые либо для всей молекулы аминокислоты, либо для ее радикала) особенно часто такие сокращения применяются для описания аминокислотной последовательности в пептидах и белках.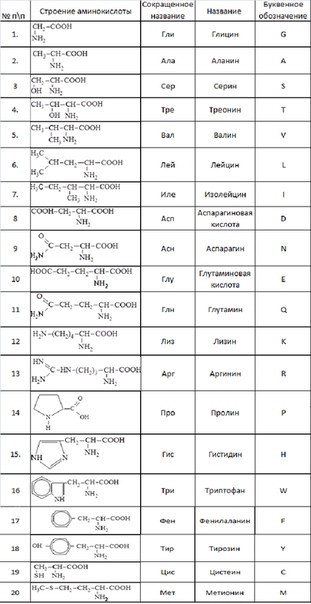
ВАЗОПРЕССИН — гормон, выделенный из задней доли гипофиза животных представляет собой циклический пептид, содержащий по 8 остатков -аминокислот. Синтезом установлено строение В. крупного рогатого скота С4вН85М1501а32 и свиней 46HJ5NlзOl2S2. В.— гигроскопические кристаллы хорошо растворим в воде. Вызывает повышение кровяного давления, снижение мочеотделения, сокращение матки, выделение молока молочной железой в период лактации животных. Применяют В. при лечении несахарного диабета и заболеваний, связанных с недостаточностью В. в организме. [c.51]
В зависимости от природы заместителя R аминокислоты делятся на несколько групп (в скобках приведены употребляемые обычно трехбуквенные и однобуквенные сокращения)
 187]
187]В принципе любое соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой. Однако чаще всего этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в а-положении по отношению к карбоксильной группе. Ни один из известных нам живых организмов не обходится без аминокислот. Аминокислоты, как правило, входят в состав полимеров — белков. Белки служат питательными веществами, регулируют обмен веществ, способствуют поглощению кислорода, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения и главным опорным материалом живых организмов, участвуют в передаче генетической информации и т. д. [c.382]
Все синтезируемые в процессе трансляции белки построены из остатков 20 аминокислот (т. наз. кодируемых). Какой именно кодон ответствен за включение той или иной аминокислоты, можно определить по таблице, в к-рой буквы А, Г, У, Ц обозначают основания, входящие в нуклеотиды (соотв. аденин, гуанин, урацил, цитозин) в вертикальном ряду слева-в первый нуклеотид кодона, в горизонтальном ряду сверху-во второй, в вертикальном ряду справа-в третий. Трехбуквенные сочетания, напр, фен, сер, лей,-сокращенные назв. аминокислот. Прочерки в таблице означают, что три кодона-УАА, УАГ и УГА в нормальных условиях не кодируют к.-л. аминокислоты. Такие кодоны наз. бессмысленными , или нонсенс-кодонами. Оии являются сигналами остановки синтеза полипептидной цепи. [c.518]
аденин, гуанин, урацил, цитозин) в вертикальном ряду слева-в первый нуклеотид кодона, в горизонтальном ряду сверху-во второй, в вертикальном ряду справа-в третий. Трехбуквенные сочетания, напр, фен, сер, лей,-сокращенные назв. аминокислот. Прочерки в таблице означают, что три кодона-УАА, УАГ и УГА в нормальных условиях не кодируют к.-л. аминокислоты. Такие кодоны наз. бессмысленными , или нонсенс-кодонами. Оии являются сигналами остановки синтеза полипептидной цепи. [c.518]
Вместо названий и формул аминокислот часто используют специальные символы. Существуют две системы таких символов. В первой из них, обычно используемой для формул-последовательностей, каждая аминокислота обозначается трехбуквенным сокращением (обычно это три первых буквы тривиального названия аминокислоты). Первую букву пишут или печатают прописной, остальные две — строчными. Подразумевается, что аминокислоты имеют -конфигурацию, если не приводят иных указаний.

В табл. 2-2 приведены структурные формулы боковых цепей аминокислот, обычно встречающихся в белках (формула пролина приведена полностью). Даны также сокращенные трехбуквенные обозначения аминокислот, используемые при выписывании аминокислотных последовательностей пептидов и белков, а также однобуквенные сокращения, принятые в работах по эволюции белков и при составлении программ для вычислительных машин.
[c.83]Аминокислота Сокращен- ное обозначе- ние Формула Изоэлек трическа ч точка [c.644]
Гидролиз белков дает смесь этих и других аминокислот с аминогруппой при С-2. Обычно их называют -аминокислотами. Сокращенная линейная структурная формула а-аминокислот КСН(ЫН2)С00Н. [c.196]
С другой стороны, заслуживает внимания то обстоятельство, что тРНК образуется но Механизму транскрипции . Как показано на рис. П.47, дезоксирибонуклеиновая кислота (ДНК) представляет собой полимерную церочку того же состава, что и РНК, в которой вместо урациловых оснований находятся тиминовые (Т). Однако этот полимер состоит пе из одной, а, из двух цепочек, которые образуют так называемую двойную спираль. Такая спиральная Структура из двух цепей стабилизируется водородными связями между мономерными единицами, расположенными напротив друг друга, причем водородные связи могут возникнуть только между А и Т, или же между G и С. Следовательно, если первая полимерная цепочка исчезнет, вторая может служить матрицей для ее воспроизведения. Таким образом, смысл названия наследственная тактическая сополимеризация состоит в том, что оно отражает передачу способности к указанному воспроизведению от родителей к потомству. Полученная путем редупликации ДНК, как показано на рис. 11.48, отщепляет тРНК, которая участвует в синтезе белков (сополимеры, образованные остатками двадцати аминокислот). Сокращенные названия аминокислот на рис.
Как показано на рис. П.47, дезоксирибонуклеиновая кислота (ДНК) представляет собой полимерную церочку того же состава, что и РНК, в которой вместо урациловых оснований находятся тиминовые (Т). Однако этот полимер состоит пе из одной, а, из двух цепочек, которые образуют так называемую двойную спираль. Такая спиральная Структура из двух цепей стабилизируется водородными связями между мономерными единицами, расположенными напротив друг друга, причем водородные связи могут возникнуть только между А и Т, или же между G и С. Следовательно, если первая полимерная цепочка исчезнет, вторая может служить матрицей для ее воспроизведения. Таким образом, смысл названия наследственная тактическая сополимеризация состоит в том, что оно отражает передачу способности к указанному воспроизведению от родителей к потомству. Полученная путем редупликации ДНК, как показано на рис. 11.48, отщепляет тРНК, которая участвует в синтезе белков (сополимеры, образованные остатками двадцати аминокислот). Сокращенные названия аминокислот на рис.
Изображая строение грамицидина С, мы воспользовались принятыми в химии белков сокращенными обозначениями аминокислот (лей — лейцин, фал — фенилаланин, про— пролин, вал — валин, ори — орнитин). При такой записи считают, что начало сокращенного обозначения соответствует аминному концу молекулы, конец— ее карбоксильрюму концу, т. е. обозначение, например, вал расшифровывается как —ЫН—СН(СзН7)—СО—. [c.343]
Аминокислоты Сокращенные обозначения аминокислот Чувствител при одномерной хроматографии в системе н. пропанол— вода (7 3) [ьность, мпг при двумерной хроматографии в системах H I3- h4OH— -17″/ -й Nh4 (2 2 1) и фенол—вода (3 1) [c.308]
Синтетические поли-а-аминокислоты можно приготовить в лаборатории, если инициировать полимеризацию N-кар-боксиангидрида аминокислоты (сокращенно N-KA) [c.
В природе встречается свыше 70 аминокислот, но только 20 из них играют важную роль в живых системах. Названия этих кислот (и их сокращения, которые также часто используются) вместе со структурными формулами приведены в табл. 25-1. Все аминокислоты, за исключением пролина и окси-пролина (см. табл. 25-1), имеют структуру К— И(NИ2) 02И различия между аминокислотами определяются природой радикала. В некоторых случаях отличия между радикалами незначительны так, а-аминокислоты глутамин и аспарагин являются моноамидами соответственно глутаминовой и аспарагиновой кислот. [c.382]
Полипептиды называются как производные С-концевой аминокислоты, причем первой пишут название N-концевой аминокислоты, а последней — С-концевую аминокислоту. В таком порядке пишут как полные названия составляющих аминокислот, так и их сокращенные обозначения. Так, гли-цилаланин — это дипептид, состоящий из глицина (N-концевая аминокислота) и аланина (С-концевая аминокислота). В сокращенном виде его название пишут так gly-ala. Аланилглицин (ala-gly) — это изомерный дипептид, в котором N-концевой аминокислотой является аланин, а С-концевой — глицин. [c.400]
В сокращенном виде его название пишут так gly-ala. Аланилглицин (ala-gly) — это изомерный дипептид, в котором N-концевой аминокислотой является аланин, а С-концевой — глицин. [c.400]
Окситоцин и вазопрессин — это гормоны полипептидной природы, которые выделяются гипофизом. Окситоцин контролирует сокращение матки и выделение молока, а вазопрессин поддерживает баланс жидкости в организме, действуя в качестве анти диуретического агента. Поскольку окситоцин вызывает сокращение гладкой мускулатуры, в частности матки, его применяют в медицине для стимуляции родов. Вазопрессин и окситоцин, вопреки своей различной физиологической активности, содержат одни и те же шесть аминокислот (из восьми) и замкнутое кольцо благодаря наличию дисульфидной связи. Если разрушить (восстановить) эту дисульфидную связь, то образуется нециклическая структура, не обладающая биологической активностью этих гормонов. [c.401]
Линейные пептиды, состоящие из 13 и большего числа остатков, индексируются по сокращенным названиям, выражающим последовательность аминокислот и похожим на систематические названия пептидов, но без знаков выделения и локантов.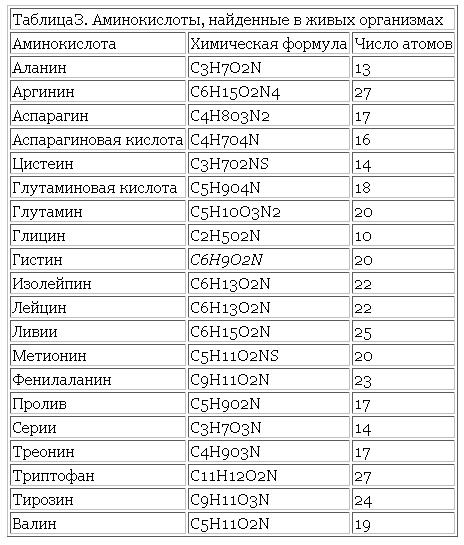 [c.265]
[c.265]
Заметим, что этот трипептид, как и каждая аминокислота, является биполярным ионом. Та же структура в сокращенном виде записывается следующим образом А1а-Уа1-Ме1. В такой записи N-кoнцeвoй аминокислотный остаток ставится слева, а С-концевой — справа. [c.85]
Для удобства написания пептидных фрагментов предложено пользоваться сокращенными названиями аминокислотных остатков, которые состоят из первых трех букв тривиального названия аминокислоты, например Ala для L-аланина и Met для L-метионина (сокращения для других аминокислот см. в табл. 1-1). Оптическая конфигурация аминокислоты указывается символами, причем специально отмечаются только о- и DL-амино-кислоты, например о-А1а и DL-Met. длло-Соединения обозначаются символом а , например alle для алло-ь-изолейцина. [c.11]
В химии белков и полипептидов для сокращения принято писать формулы, обозначая остатки аминокислот буквами (таблица с такими обозначениями приведена на стр. 485). Например, Glu — обозначение глутаминовой кислоты, Суз—SH—цистеина, Gly — глицина и т. д. Сокращенная формула глутатиона будет в таком изображении [c.507]
485). Например, Glu — обозначение глутаминовой кислоты, Суз—SH—цистеина, Gly — глицина и т. д. Сокращенная формула глутатиона будет в таком изображении [c.507]
Первая система сокращений для аминокислот и пептидов была опубликована Брандом и Эдсалом в 1947 г. Система графического изображения амииокнслот, предложенная Беллнером и Мейстером, учитывает структурные особенности аминокислотных цепей (рис. 1-2). [c.13]
При сокращенной записи замещение боковой цепи обозначают, помещая аббревиатуру этого заместителя выще или ниже символа соответствующей аминокислоты илн же в скобках непосредственно после него, например для пентапептида ь-аланил-ь-аспарагил-( -трет-бутиловый эфир)глицил-Ы -трет-бутилоксикарбонил-ь-лизил-О-трет-бутил-ь-тирозина [c.86]
Циклические гетеродетногомомерные пептиды при сокращенной записи изображаются аналогично замещенным аминокислотам. [c.88]
Если порядок расположения аминокислот в пептиде известен, то при написании структурной формулы сокращения разделяются точками.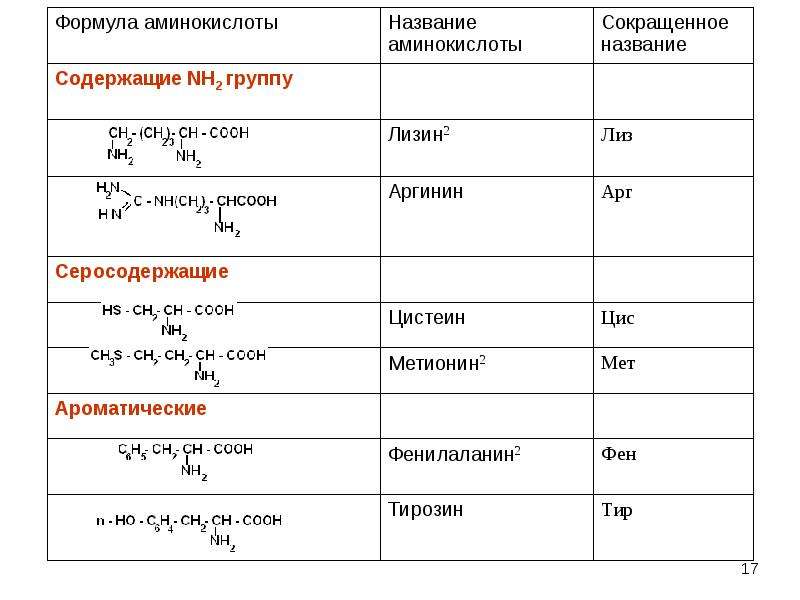 Например, Н. Гли.Ала.ОН обозначает дипептид глицилаланин. Сокращение Н. Гли. (А.ла. Лей.) ОН соответствует пептиду, в котором N-концевая группа представляет собой глицин (гликокол), а порядок расположения аланина и лейцина не известен [266]. Если нет оговорки, то все оптически активные аминокислоты относятся к /-ряду. [c.167]
Например, Н. Гли.Ала.ОН обозначает дипептид глицилаланин. Сокращение Н. Гли. (А.ла. Лей.) ОН соответствует пептиду, в котором N-концевая группа представляет собой глицин (гликокол), а порядок расположения аланина и лейцина не известен [266]. Если нет оговорки, то все оптически активные аминокислоты относятся к /-ряду. [c.167]
Роль аминокислот в программах омоложения
Аминокислоты — мономеры белков.В состав белков входят 20 разновидностей АК. Они связываются между собой пептидными связями и образуют молекулу полимера — полипептид.
Как воздействуют аминокислоты на процессы похудения?
Помощь белковых «кирпичиков» состоит в следующем:
- «разгоняют» скорость метаболизма;
- сжигают излишки жира в зонах его скопления;
- снижают аппетит;
- уменьшают количество холестерина и сахара;
- являются источником дополнительной энергии;
- относятся к группе антиоксидантов;
- наращивают мышечные ткани, вместо жировых прослоек;
- помогают сбросить вес в ходе тренировок.

Какие же аминокислоты жизненно необходимы для человека?
1) Незаменимые аминокислоты:
- Валин
- Лейцин
- Изолейцин
- Лизин
- Метионин
- Треонин
- Фенилаланин
- Триптофан
- Гликокол
- Аланин
- Цитруллин
- Серин
- Цистин
- Аспарагиновая кислота
- Глютаминовая кислота
- Тирозин
- Пролин
- Оксипролин
- Аргинин
- Гистидин

L-карнитин же, который принято считать жиросжигателем, тоже относится формально к аминокислотам. На самом деле, он участвует в процессе похудения, доставляя жиры к месту их расщепления интенсивнее, чем этот процесс идет обычно, потому и усиливает эффект физических нагрузок для похудения.
Триптофан и тирозин подавляют чувство голода, регулируя уровень гормона инсулина в крови. Потому эти аминокислоты можно применять для похудения без тренировок, только на фоне ограниченного питания. К тому же, триптофан обладает некоторым успокаивающим действием, что позволяет снизить уровень стресса, который вызывают диеты и переживания о лишнем весе.
«Содержание незаменимых аминокислот в пищевых продуктах»:
- Лизин: злаковые и молочные продукты, яйца, орехи, рыба
- Гистидин: бобовые и мясные продукты
- Триптофан: кунжут, финики, бананы
- Треонин: яйца и молочные продукты
- Фенилаланин: крупы, бобовые, мясные продукты
Убихинон (Q10) — присутствует в любой клетке организма.
 Защищает организм от воздействия свободных радикалов. Обязательная составляющая часть программ лечения ожирения, гипертонии, диабета. Но главное, способно замедлять процессы старения
Защищает организм от воздействия свободных радикалов. Обязательная составляющая часть программ лечения ожирения, гипертонии, диабета. Но главное, способно замедлять процессы старенияТерапевтический эффект после 45 лет — 60-90 мг в сутки
Креатин — белок, поставляющий энергию для сокращения мышц;
Организм синтезирует этот белок из аминокислот аргинина, глицина, метионина. Терапевтический эффект наступает при приеме 20 г в сутки.
Повышение качества жизни и энергичности
Следить за рационом питания, в котором, в котором много белка и мало простых сахаров
Необходимы: Магний 400-800 мг, Глутатион 0,5-1г, Витамин С3-5 г, Витамин Е 600-1000 МЕ (высвобождает эстроген из жировых клеток).
Целлюлит — это интоксикация соединительно -тканного матрикса дермы и гиподермы. Причина — нарушение клеточного дренажа, циркуляторного,иммунного, гормонального нарушения в организме.
Необходимо улучшить крово-и лимфообращение, стимулировать метаболизм адипоцитов, проводить детоксикации подкожно-жировой клетчатки, активизировать липолиз, нормализовать гормональную сферу.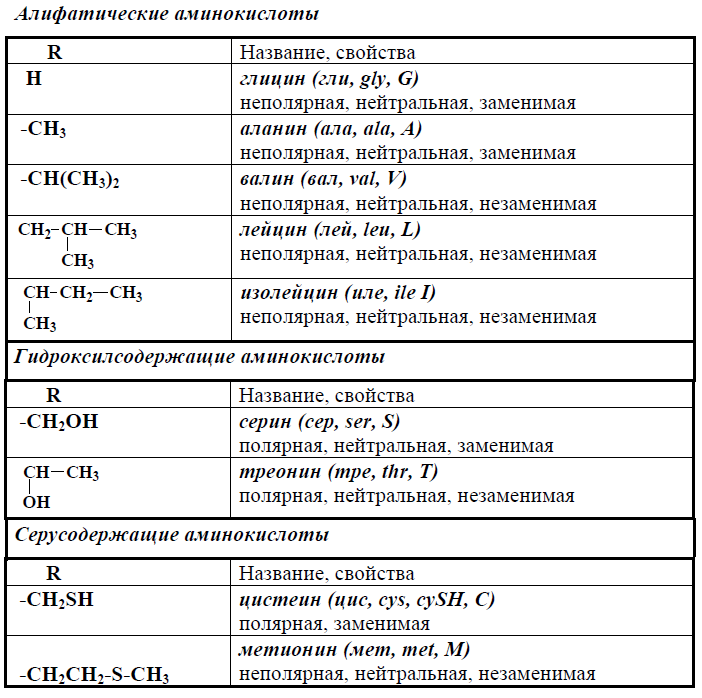
Посмотреть бесплатный вебинар о роли аминокислот в программах омоложения и коррекции фигуры.
Компоненты гамкергической системы и ее функция в эндокринных железах | Мишунина
В первые годы после открытия в мозге позвоночных гамма-аминомасляной кислоты (ГАМК), которая позже была признана основным тормозным медиатором ЦНС, считали, что она локализована исключительно в клетках нервной системы. Повышение чувствительности методов определения ГАМК позволило позже установить присутствие аминокислоты, ферментов ее обмена, систем транспорта, а также рецепторов и в клетках иных тканей и органов. Механизм действия ГАМК на периферии опосредован как мембранными рецепторами (в случае передачи нервного импульса или при трофическом действии), так и без их участия (при регуляции внутриклеточных процессов) [34, 35]. Кроме медиаторной функции, ГАМК в ненейрональных тканях может играть трофическую и паракринную роль в процессах секреции и транспорта биологически активных соединений, подвижности сперматозоидов и их способности к оплодотворению, сокращения матки и маточных труб, механизмах клеточной пролиферации. (по величине молекулярной массы). Изоферменты различаются по нуклеотидной последовательности, клеточной и субклеточной локализации, иммунореактивности, факторам, контролирующим их активность, и нейрохимическим функциям. При экстремальных условиях определенное значение могут приобретать альтернативные пути синтеза аминокислоты, например образование ее из путресцина.
(по величине молекулярной массы). Изоферменты различаются по нуклеотидной последовательности, клеточной и субклеточной локализации, иммунореактивности, факторам, контролирующим их активность, и нейрохимическим функциям. При экстремальных условиях определенное значение могут приобретать альтернативные пути синтеза аминокислоты, например образование ее из путресцина.
В дальнейшем метаболизме ГАМК принимает участие ГАМК-аминотрансфераза (ГАМК-Т). Фермент состоит из 2 идентичных субъединиц и локализуется в основном в постсинаптической зоне и несинаптосомальных митохондриях. Следующий фермент обмена ГАМК — дегидрогеназа полуальдегида янтарной кислоты (ДПЯК), которая катализирует реакцию окисления образовавшегося вследствие переаминирования полуальдегида янтарной кислоты. Анализ очищенной ДПЯК показал наличие в составе фермента только 1 субъединицы. На синаптических мембранах нейронов, а также мембранах глиальных клеток идентифицировано до 4 систем транспорта ГАМК и ряда ее аналогов.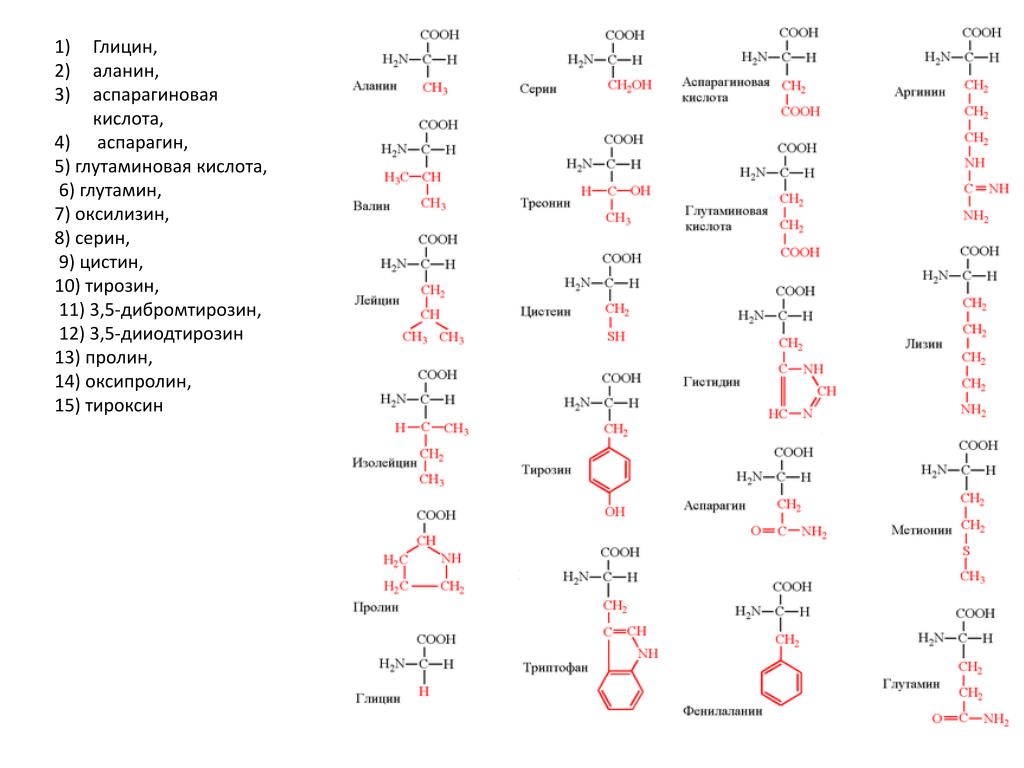 ГАМК-транспортеры (ГАМК-Тр) Na+ и СГ -зависимы и играют важную роль в реализации ГАМКергической нейротрансмиссии, регулируя высвобождение медиатора в синаптическую щель и обратный захват его нейронами и глиальными клетками.
ГАМК-транспортеры (ГАМК-Тр) Na+ и СГ -зависимы и играют важную роль в реализации ГАМКергической нейротрансмиссии, регулируя высвобождение медиатора в синаптическую щель и обратный захват его нейронами и глиальными клетками.
В ЦНС присутствует несколько типов ГАМК- рецепторов (ГАМК-Р). Медиатор действует в основном через постсинаптический ГАМКЛ-Р, который является составной частью олигомерного рецепторного комплекса ГАМКа—бензодиазепин— СГ-канал (ГАКМа — БД —СГ -РК). Активность его модулируется рядом соединений, в том числе бензодиазепинами, барбитуратами, конвульсанта- ми, нейростероидами. Клонирование генов, которые отвечают за синтез 5 классов субъединиц (а, р, у, ст, р), составляющих этот рецептор, выявило более чем 17 генов млекопитающих, кодирующих функциональное взаимодействие подклассов субъединиц ГАМКа-Р. Комбинация этих субъединиц обусловливает различные функциональные и фармакологические свойства ГАМКа-Р. что, собственно, во многом и определяет многогранную роль ГАМК в регуляции разнообразных функций мозга. Установлено, что у-субъединица этого рецептора связана с тубулярными структурами синапса через так называемые ГАМКА-Р-ассоциированные белки.
что, собственно, во многом и определяет многогранную роль ГАМК в регуляции разнообразных функций мозга. Установлено, что у-субъединица этого рецептора связана с тубулярными структурами синапса через так называемые ГАМКА-Р-ассоциированные белки.
ГАМКВ-Р в большинстве своем пресинаптиче- ские, они ассоциируются с Са2+— или К+-каналами через GTP-связывающие белки и модулируют высвобождение иных медиаторов. Известно, что ГАМКВ-Р является димером. Внеклеточный домен ГАМКВ|-Р играет роль в связывании лиганда, а аналогичная структура ГАМКВ2-Р способствует стабилизации рецептора на поверхности мембраны и отвечает за его активацию, повышая аффинность к агонистам. Трансмембранный домен ГАМКВ2-Р имеет место связывания G-белков, а ГАМКВ,-Р экспрессируется в виде ряда изоформ, которые различаются по молекулярной массе.
Не так давно описан еще один тип ГАМК-Р — С, функция которого близка к функции ГАМКД-Р.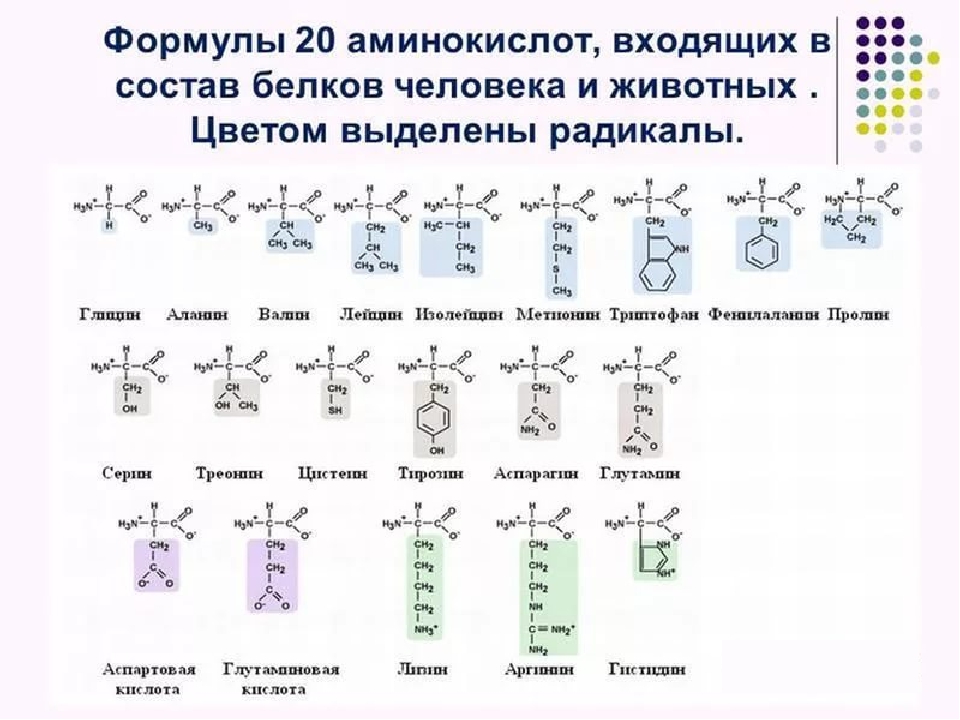 субъедини- цы ГАМКС-Р с меньшей интенсивностью, чем в сетчатке, происходит во всех регионах мозга, а экспрессия р2-субъединины — только в сетчатке.
субъедини- цы ГАМКС-Р с меньшей интенсивностью, чем в сетчатке, происходит во всех регионах мозга, а экспрессия р2-субъединины — только в сетчатке.
Присутствие всех или нескольких компонентов ГАМК-системы показано во многих ненейрональных тканях. Установлено как определенное подобие, так и отличие в строении функциональных, иммунологических и иных характеристик метаболических и рецеторных составляющих ГАМК-системы, которые были выделены из мозга и периферических органов, в частности из эндокринных желез.
Поджелудочная железа
Присутствие достаточно высокой, имеющей видовые отличия, концетрации ГАМК в поджелудочной железе установлено уже более, чем 2 десятилетия тому назад [34]. Последующие иммунологические исследования по изучению взаимосвязи между ГДК поджелудочной железы и развитием инсулинзависимого диабета вызвали повышенный интерес к физиологической роли ГАМК в железе. В настоящее время считают, что ГДК является одной из важнейших мишеней для антигена в развитии аутоиммунных процессов в поджелудочной железе, возможно, в связи с идентичностью аминокислотных последовательностей ГДК и вируса Коксаки [76], который эпидемиологически связывают с развитием инсулинзависимого диабета.
В железе присутствует как ненейрональная, так и нейрональная ГАМК. Последняя в парасимпатическом ганглии железы находится исключительно в глиальных клетках; на мембранах нейронов, однако, присутствуют ГАМКД-Р. Остается неизвестным источник аминокислоты в глиальных клетках, так как они не содержат ГДК [72]. ГАМК локализуется на периферии островков вместе с нервными окончаниями, которые простираются в покров первых [71, 76]. Нервные элементы в островках вместе с ГАМК содержат нейропептид У, что показано и для мозга [71]. В р-клетках островков Лангерганса аминокислота ассоциируется с везикулярным ком- партментом, который отделен от гранул, содержащих инсулин [52, 71, 76].
В р-клетках присутствуют обе формы ГДК [34], которые по своим иммунологическим и биохимическим характеристикам подобны таковым мозга [47]. В большинстве р-клеток ГДК определяется в уникальных тубулоцистернальных комплексах, открытых в сторону комплекса Гольджи [76]. Существует определенная видовая специфика присутствия разных форм фермента: в поджелудочной железе человека, овцы и крысы превалирующей формой является ГДК65 [69, 76], тогда как у мышей в основном экспрессируется ГДКб7 [73].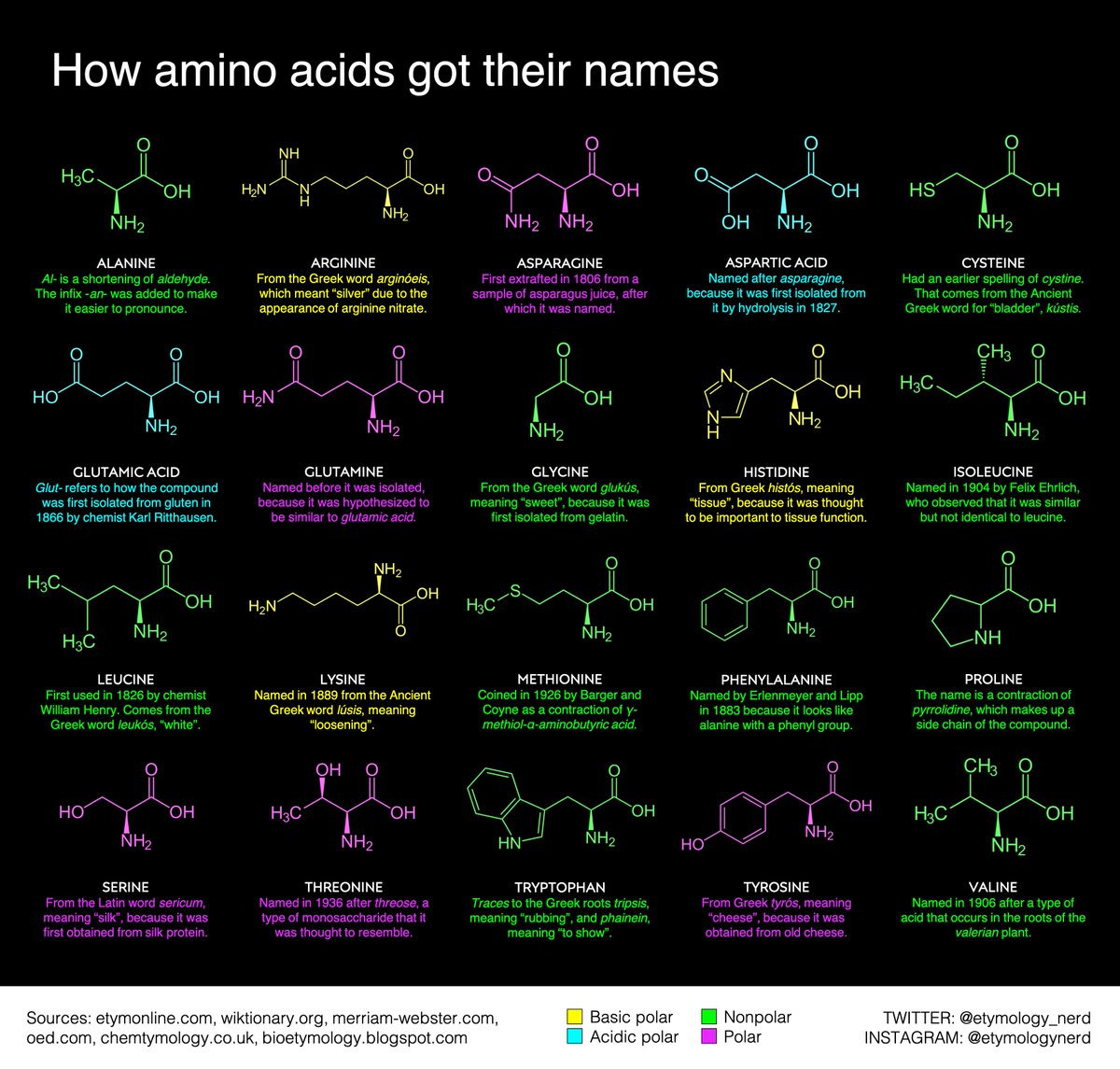 локализовано на мембранах малых везикул р-клеток и только 5% фермента находится в глюкагон- и соматостатинсекретирую- щих клетках островков овцы [69]. Экспрессия ГДК65 в поджелудочной железе нормальных мышей и мышей с диабетом снижается с возрастом, у молодых она также имеет половые различия; экспрессия ГДК67 при этом не зависит от возраста [65].
локализовано на мембранах малых везикул р-клеток и только 5% фермента находится в глюкагон- и соматостатинсекретирую- щих клетках островков овцы [69]. Экспрессия ГДК65 в поджелудочной железе нормальных мышей и мышей с диабетом снижается с возрастом, у молодых она также имеет половые различия; экспрессия ГДК67 при этом не зависит от возраста [65].
ГАМК-Т-иммунореактивный материал локализуется в р-, но не в а- или 5-клетках островков поджелудочной железы [76]; о ферментах дальнейшего метаболизма ГАМК в железе данных нет.
В опытах на культуре клеток поджелудочной железы млекопитающих и опухолях железы человека установлено присутствие на мембранах р-клеток системы транспорта ГАМК низкой аффинности, чувствительной к АТФ. Высвобождение ГАМК из малых везикул увеличивалось при стимуляции эк- зоцитоза [7], повышении уровня глюкозы [36, 74], но не было связано с секрецией инсулина [74]. В то же время известны данные о снижении высвобождения ГАМК из р-клеток при повышении концентрации или метаболизма глюкозы, что связывают с АТФ-зависимой активацией активности клетки в этих условиях [78].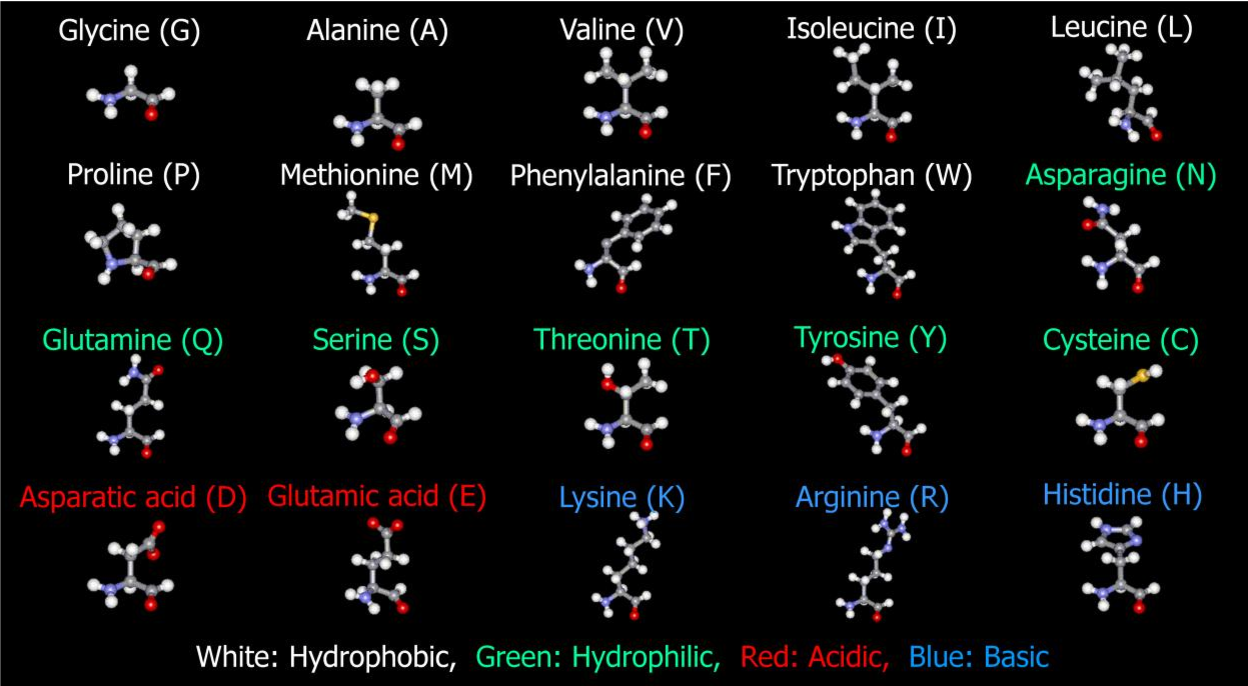
Существование ГАМКа-Р в поджелудочной железе показано в условиях использования моноклональных антител [70]. По одним данным ГАМКа-Р поджелудочной железы крыс состоит преимущественно из СС|-, р3— и у3-субъединиц [13], по другим — в ней, а также в клетках инсуломы определяются мРНК, кодирующие синтез а,-, а2-, а3-, р,-, Р2-, рз-, 5- и у2-субъединиц ГАМКа-Р, а ткань поджелудочной железы человека содержит только мРНК а2-, Р3— и у-субъединиц [76]. В поджелудочной железе имеет место также экспрессия ГАМКА-Р-ассоции- рованных белков [79], а в р-клетках поджелудочной железы человека, крысы и в культуре р-клеток MIN6 установлено присутствие ГАМКВ1а— и ГАМКВ2-Р [16].
Содержание ГАМК в поджелудочной железе крыс с аллоксановым диабетом составило только 15%, а активность ГДК — 50% от уровня у интактных животных [55], что связано со значительной деструкцией р-клеток вследствие действия аллоксана.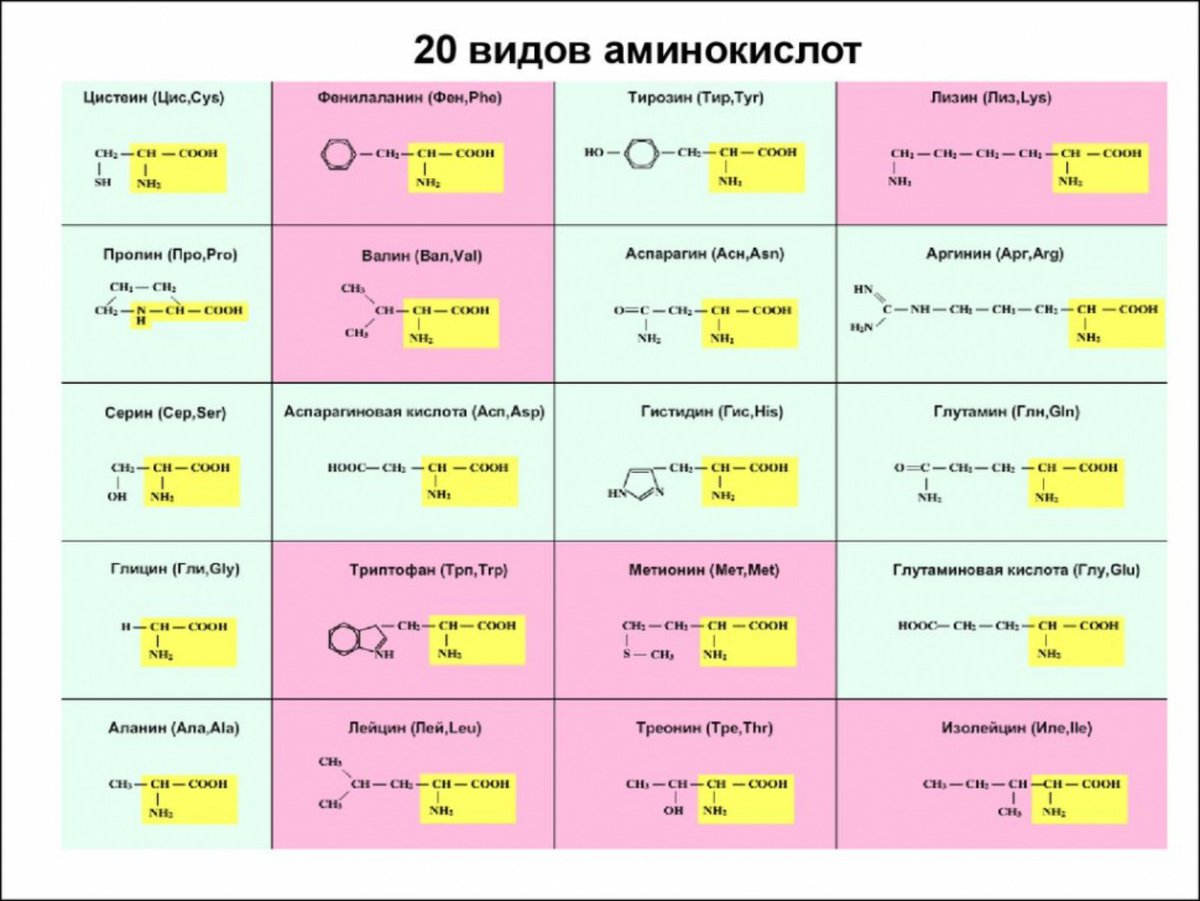 у мышей с диабетом в 5 раз выше, чем у контрольных животных [65].
у мышей с диабетом в 5 раз выше, чем у контрольных животных [65].
На первых этапах изучения функции ГАМК в поджелудочной железе предполагали, что ГАМК- шунт может быть альтернативным источником энергии для процесса синтеза инсулина [34]. О возможной роли ГАМК в механизмах секреции свидетельствуют данные о присутствии аминокислоты в малых везикулах, субклеточная локализация которых, спектр белков, содержащихся в них, и состав их мембран указывают на участие этих органел в экзоцитозе [52, 57]. Роль везикулярных белков в механизмах высвобождения ГАМК и инсулина различна [59].
В условиях ингибирования ГАМ К-Т поджелудочной железы гамма-винил-ГАМК внутриклеточное содержание аминокислоты повышалось на 77%, а интенсивность синтеза инсулина — на 69%. В то же время перфузия ГАМК изолированной железы собаки приводила к угнетению секреции инсулина [34], а в случае перфузии другим ингибитором ГАМК-Т — гамма-ацетилен-ГАМК стимуляции глюкозой секреции инсулина не происходило, хотя высвобождение гормона, стимулированное вследствие перфузии 3-фенилпируватом, было сниженным.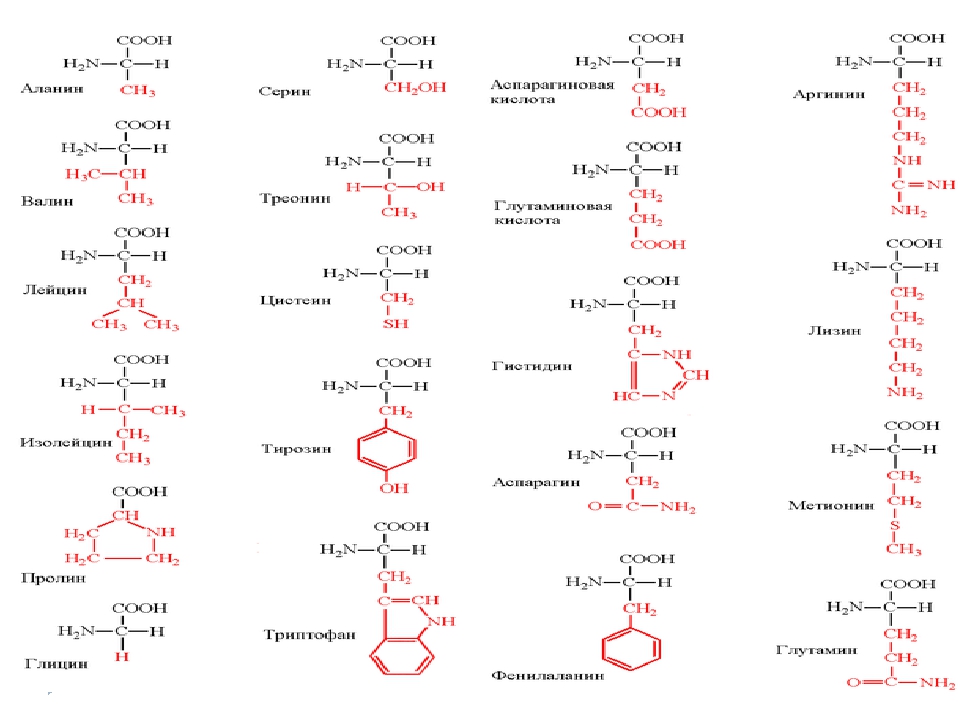 Авторы предположили, что ГАМК может влиять на секрецию инсулина только при низких концентрациях глюкозы [76]. Внесение в среду культивирования ГАМК или агонистов ГАМКа-Р или ГАМКВ-Р мусцимола и баклофена соответственно не влияло на содержание и секрецию инсулина в клетках островков поджелудочной железы [76]. По другим данным, активация ГАМКВ-Р вследствие действия баклофена угнетала секрецию инсулина, однако эффект этот наблюдался лишь в присутствии глюкозы. Считают, что возможный механизм участия ГАМК в регуляции секреции инсулина включает в себя прямое влияние аминокислоты на Са2+— и К+-каналы, на последние посредством модуляции активности G- белков [16]. Во время секреции инсулина в поджелудочной железе крыс повышалась экспрессия ГДКИ [63]. Кроме того, на трансгенных мышах, экспрессирующих ГДК65 человека, было показано, что у животных с нормальной толерантностью к глюкозе интенсивность экспрессии ферментного белка была наименьшей по сравнению с таковой у животных со сниженным уровнем секреции инсулина или с нарушением толерантности к глюкозе.
Авторы предположили, что ГАМК может влиять на секрецию инсулина только при низких концентрациях глюкозы [76]. Внесение в среду культивирования ГАМК или агонистов ГАМКа-Р или ГАМКВ-Р мусцимола и баклофена соответственно не влияло на содержание и секрецию инсулина в клетках островков поджелудочной железы [76]. По другим данным, активация ГАМКВ-Р вследствие действия баклофена угнетала секрецию инсулина, однако эффект этот наблюдался лишь в присутствии глюкозы. Считают, что возможный механизм участия ГАМК в регуляции секреции инсулина включает в себя прямое влияние аминокислоты на Са2+— и К+-каналы, на последние посредством модуляции активности G- белков [16]. Во время секреции инсулина в поджелудочной железе крыс повышалась экспрессия ГДКИ [63]. Кроме того, на трансгенных мышах, экспрессирующих ГДК65 человека, было показано, что у животных с нормальной толерантностью к глюкозе интенсивность экспрессии ферментного белка была наименьшей по сравнению с таковой у животных со сниженным уровнем секреции инсулина или с нарушением толерантности к глюкозе. Результаты этих исследований позволили высказать предположение о том, что ГАМК может функционировать как отрицательный регулятор первой фазы секреции инсулина в ответ на увеличение уровня глюкозы [73].
Результаты этих исследований позволили высказать предположение о том, что ГАМК может функционировать как отрицательный регулятор первой фазы секреции инсулина в ответ на увеличение уровня глюкозы [73].
Секреция соматостатина вследствие перфузии поджелудочной железы ГАМК снижалась, однако внесение аминокислоты в среду инкубации островков поджелудочной железы повышало высвобождение гормона. Последний эффект снимался антагонистом ГАМК.а-Р бикукуллином [34]. В случае культивирования изолированных островков с ГАМК или мусцимолом установлено, что содержание соматостатина в них было выше, а высвобождение гормона ниже, чем в контрольной культуре. В то же время* повышение уровня ГАМК в среде культивирования вследствие действия гамма-ви- нил-ГАМК или аминоуксусной кислоты не влияло на высвобождение соматостатина. В других исследованиях было показано, что ГАМК, мусцимол и баклофен не влияли на базальное или стимулированное высвобождение соматостатина и электрическую активность р-клеток, хотя экзогенная ГАМК и мусцимол снижали секрецию глюкагона, стимулированную низким уровнем глюкозы или аргинином [76].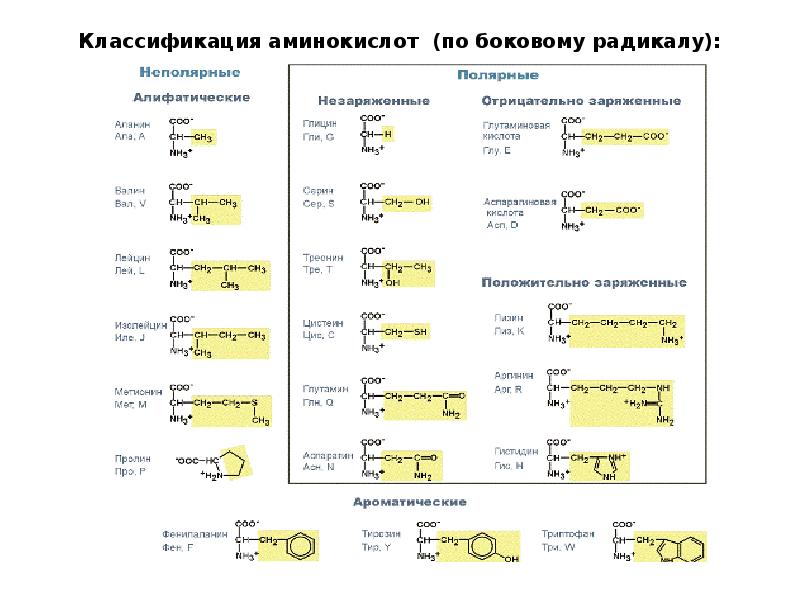 Кроме того, бикукуллин не предотвращал угнетение секреции глюкагона под влиянием низких концентраций глюкозы. Принимая во внимание эти данные, авторы сделали вывод о том, что нет серьезных подтверждений гипотезы об участии ГАМК в торможении глюкозой высвобождения глюкагона. Это мнение не поддерживают другие исследователи, установившие угнетение секреции глюкагона при инкубации линии р-клеток в присутствии ГАМК, которое предотвращалось внесением в среду инкубации бикукуллина [36].
Кроме того, бикукуллин не предотвращал угнетение секреции глюкагона под влиянием низких концентраций глюкозы. Принимая во внимание эти данные, авторы сделали вывод о том, что нет серьезных подтверждений гипотезы об участии ГАМК в торможении глюкозой высвобождения глюкагона. Это мнение не поддерживают другие исследователи, установившие угнетение секреции глюкагона при инкубации линии р-клеток в присутствии ГАМК, которое предотвращалось внесением в среду инкубации бикукуллина [36].
При исследовании возможных механизмов участия ГАМК в регуляции секреции гормонов поджелудочной железы были получены данные, позволяющие предположить, что аминокислота гипер- поляризует мембраны клеток и предупреждает образование потенциала действия, что совпадает по времени с развитием потока ионов С1_ наружу и снижением активности Са2+-каналов. Последнее приводит к снижению концентрации внутриклеточного Са2+ и ингибированию секреции глюкагона. Все эти эффекты предупреждались бикукуллином и пикротоксином [70].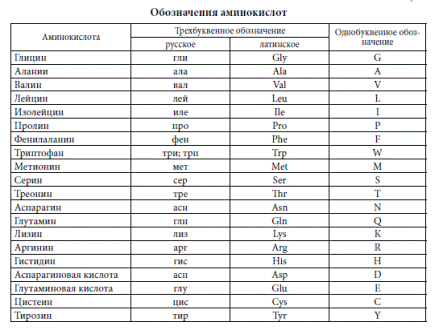 В то же время, по данным других исследователей, ГАМК продуцировала повышение секреции глюкагона в изолированной ткани поджелудочной железы интактных крыс и крыс с диабетом [6].
В то же время, по данным других исследователей, ГАМК продуцировала повышение секреции глюкагона в изолированной ткани поджелудочной железы интактных крыс и крыс с диабетом [6].
В литературе есть сведения об изменении уровня инсулина, глюкагона, соматостатина и С-пеп- тида в крови людей и животных после введения ГАМК, агонистов и антагонистов ее рецепторов [34, 35]. Считают, что влияние этих веществ in vivo на секрецию гормонов поджелудочной железы может быть опосредовано через ЦНС. Доказательством этого, в частности, являются данные о стимуляции секреции гормонов в условиях инфузии мозга средой, содержащей бикукуллин. Однако у больных инсулинзависимым диабетом прием баклофена или ингибитора ферментов метаболизма ГАМК вальпроата натрия не изменял в крови уровень инсулина, С-пептида, глюкагона, соматостатина, а также толерантность к глюкозе [68].
Ряд работ посвящен изучению возможности терапевтического применения ГАМК и препаратов, изменяющих активность ее системы, в механизмах коррекции функции поджелудочной железы.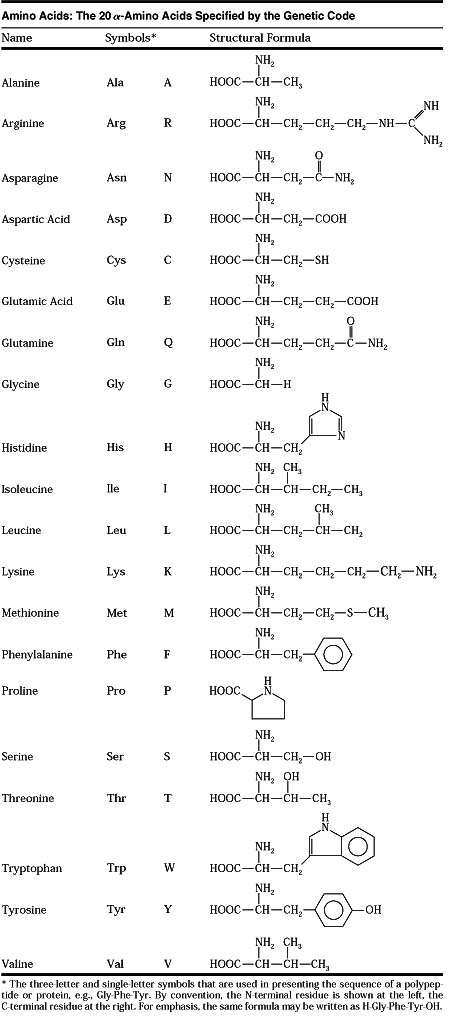 Так, культивирование изолированных островков в присутствии различных концентраций глюкозы приводило к 4—5-кратному повышению экспрессии ГДК65; уровень ГАМК при этом оставался неизменным. Считают, что нормализация гликемии может снижать интенсивность экспрессии аутоантигена в островках, что будет предотвращать их деструкцию [48]. Это мнение поддерживается другими исследователями: инкубация островков в среде, содержащей высокую концентрацию глюкозы, приводила к повышению активности ГДК и уровня ферментативных белков ГДК65 и ГДК67. Этот эффект глюкозы тормозился гамма-винил-ГАМ К. Учитывая эти данные, для уменьшения интенсивности экспрессии аутоантигена, приводящей к торможению аутоиммунного ответа (3-клеток при инсулинзависимом диабете, теоретически предложено применение ингибиторов ГАМК-Т [64].
Так, культивирование изолированных островков в присутствии различных концентраций глюкозы приводило к 4—5-кратному повышению экспрессии ГДК65; уровень ГАМК при этом оставался неизменным. Считают, что нормализация гликемии может снижать интенсивность экспрессии аутоантигена в островках, что будет предотвращать их деструкцию [48]. Это мнение поддерживается другими исследователями: инкубация островков в среде, содержащей высокую концентрацию глюкозы, приводила к повышению активности ГДК и уровня ферментативных белков ГДК65 и ГДК67. Этот эффект глюкозы тормозился гамма-винил-ГАМ К. Учитывая эти данные, для уменьшения интенсивности экспрессии аутоантигена, приводящей к торможению аутоиммунного ответа (3-клеток при инсулинзависимом диабете, теоретически предложено применение ингибиторов ГАМК-Т [64].
С целью разработки превентивной терапии инсулинзависимого диабета уже проведены экспериментальные исследования по применению ГАМ- Кергических препаратов для нормализации уровня инсулина и гликемии.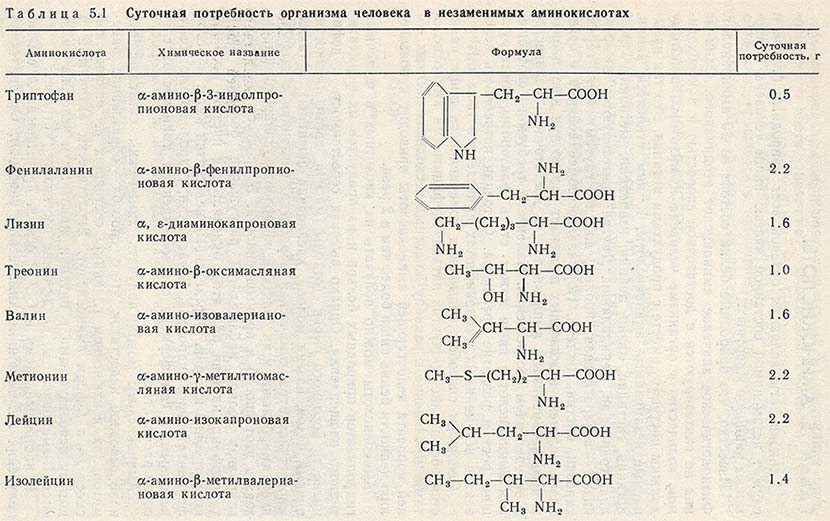 Показано, что введение метаболита ГАМК — гамма-оксимасляной кислоты одновременно с никотинамидом в период действия стрептозотоцина предотвращало развитие экспериментального диабета у мышей. При инкубации изолированных островков поджелудочной железы в среде, содержащей стрептозотоцин, гамма-окси- масляную кислоту и никотинамид, секреция инсулина в ответ на внесение в среду глюкозы не нарушалась, что обычно наблюдали при действии одного стрептозотоцина [14]. Следует, однако, подчеркнуть, что в опытах in vivo и in vitro сама гамма- оксимасляная кислота, как и сам никотинамид такого превентивного эффекта не давали. При изучении влияния баклофена было установлено, что прием препарата мышами, у которых развитие диабета запрограммировано генетически, приводило к задержке времени начала заболевания, хотя степень выраженности инсулитов и активность ГДК в поджелудочной железе не изменялись. Авторы считают баклофен перспективным препаратом, действие которого направлено на активацию ГАМКер- гической системы, локализованной в островках поджелудочной железы, с которой ассоциируются как экспрессия аутоантигена, так и модуляция секреции инсулина [10].
Показано, что введение метаболита ГАМК — гамма-оксимасляной кислоты одновременно с никотинамидом в период действия стрептозотоцина предотвращало развитие экспериментального диабета у мышей. При инкубации изолированных островков поджелудочной железы в среде, содержащей стрептозотоцин, гамма-окси- масляную кислоту и никотинамид, секреция инсулина в ответ на внесение в среду глюкозы не нарушалась, что обычно наблюдали при действии одного стрептозотоцина [14]. Следует, однако, подчеркнуть, что в опытах in vivo и in vitro сама гамма- оксимасляная кислота, как и сам никотинамид такого превентивного эффекта не давали. При изучении влияния баклофена было установлено, что прием препарата мышами, у которых развитие диабета запрограммировано генетически, приводило к задержке времени начала заболевания, хотя степень выраженности инсулитов и активность ГДК в поджелудочной железе не изменялись. Авторы считают баклофен перспективным препаратом, действие которого направлено на активацию ГАМКер- гической системы, локализованной в островках поджелудочной железы, с которой ассоциируются как экспрессия аутоантигена, так и модуляция секреции инсулина [10].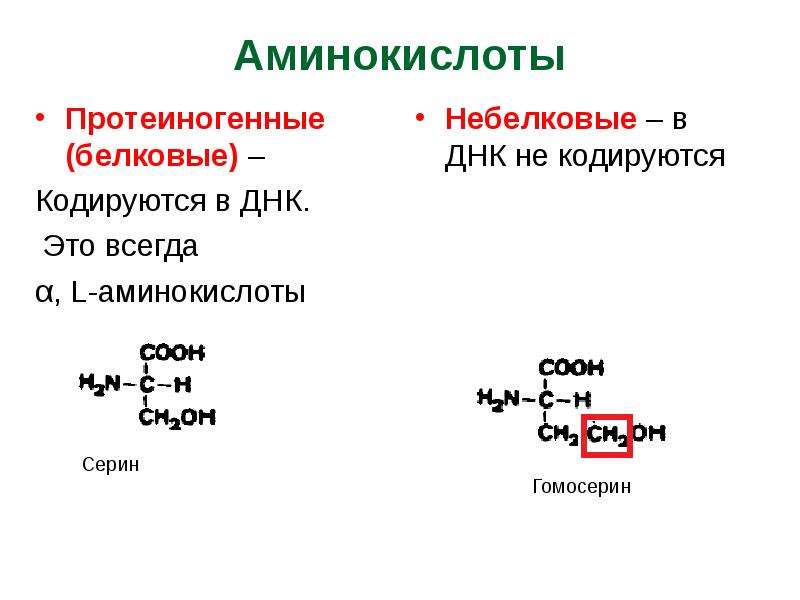
Следовательно, несмотря на многочисленность исследований, роль ГАМК в регуляции секреции гормонов поджелудочной железы остается еще в значительной степени неясной [69].
Надпочечники
Концентрация аминокислоты в надпочечниках невелика, активность ГДК и ГАМК-Т также находится на низком, как для периферических тканей, уровне [34]. Однако пересадка ткани мозгового слоя надпочечников в стриатум крыс, у которых эта структура мозга была разрушена вследствие введения каиновой кислоты, вполне компенсировала дефицит ГАМКергических нейронов, что способствовало нормализации нарушенного поведения крыс [46].
ГАМК в мозговом слое надпочечников локализуется в клетках вместе с адреналином и норадре-
налином [31]. В 1-ю неделю после рождения ни в одной из хромаффинных клеток мышат, как и у плодов, ГАМК-иммунореактивный материал не определялся; до 2-ю неделю жизни количество его повышалось до величины, характерной для надпочечников взрослых животных [44]. в надпочечниках человека и крыс [76]. Данные последних лет свидетельствуют о том, что в надпочечниках человека, мыши и крысы экспрессируются все 3 формы ГДК — 65, 67 и 25 [25]. При определении активности ГДК биохимическими методами показано ее присутствие в ткани надпочечников крыс, кроликов, человека, коры надпочечников человека, морских свинок, мозговом слое надпочечников коров [1,2, 34]. Часть ГАМК в надпочечниках синтезируется из путресцина [75].
в надпочечниках человека и крыс [76]. Данные последних лет свидетельствуют о том, что в надпочечниках человека, мыши и крысы экспрессируются все 3 формы ГДК — 65, 67 и 25 [25]. При определении активности ГДК биохимическими методами показано ее присутствие в ткани надпочечников крыс, кроликов, человека, коры надпочечников человека, морских свинок, мозговом слое надпочечников коров [1,2, 34]. Часть ГАМК в надпочечниках синтезируется из путресцина [75].
Что касается ГАМК-Т, то хотя она иммунологически и выявляется в культуре хромаффинных клеток быка [76], однако основной катаболизм ГАМК в надпочечниках, похоже, происходит при участии других механизмов. Биофизические и кинетические показатели ГАМК-Т мозгового слоя надпочечников быка близки к таковым для фермента мозга [60], но блокатор ГАМК-Т 2-аминоук- сусная кислота не способна повысить уровень ГАМК в органе, как это происходит в мозге или, например, в поджелудочной железе [76].
‘Из мозгового слоя надпочечников быка была частично очищена ДПЯК, фермент подобен нейрональному в отношении pH-оптимума, локализации (в митохондриях), чуствительности к АТФ, аффинности к субстрату и кофактору. Клетки мозгового слоя надпочечников содержат также систему транспорта ГАМК и ее специфические рецепторы, что, как считают, вместе с данными, характеризующими функционирование ферментов обмена ГАМК, может свидетельствовать о регуляторной роли аминокислоты в хромаффинных клетках [76]. ГАМКа-Р здесь связаны с бензодиазепиновыми, и функциональные характеристики этого комплекса очень близки таковым в мозге. В составе ГАМКа-Р определяют а,-, а4-, р,-, р2-, р2— и у2-субъединицы [61], а длинная субъединица ГАМКВ-Р экспрессируется в надпочечниках в виде 2 изоформ — ГАМКВ1аи ГАМКВ|Ь [11, 21].
Клетки мозгового слоя надпочечников содержат также систему транспорта ГАМК и ее специфические рецепторы, что, как считают, вместе с данными, характеризующими функционирование ферментов обмена ГАМК, может свидетельствовать о регуляторной роли аминокислоты в хромаффинных клетках [76]. ГАМКа-Р здесь связаны с бензодиазепиновыми, и функциональные характеристики этого комплекса очень близки таковым в мозге. В составе ГАМКа-Р определяют а,-, а4-, р,-, р2-, р2— и у2-субъединицы [61], а длинная субъединица ГАМКВ-Р экспрессируется в надпочечниках в виде 2 изоформ — ГАМКВ1аи ГАМКВ|Ь [11, 21].
Выяснено, что высвобождение ГАМК и норадреналина происходит параллельно, хотя ГАМК высвобождается всегда в меньшем количестве. Стимулированное никотином и К+ высвобождение ГАМК зависит от Са2+, а при действии вератридина наблюдали Са2+-независимый, но зависящий от 1Ча+-компонент, который блокировался ингибиторами захвата ГАМК.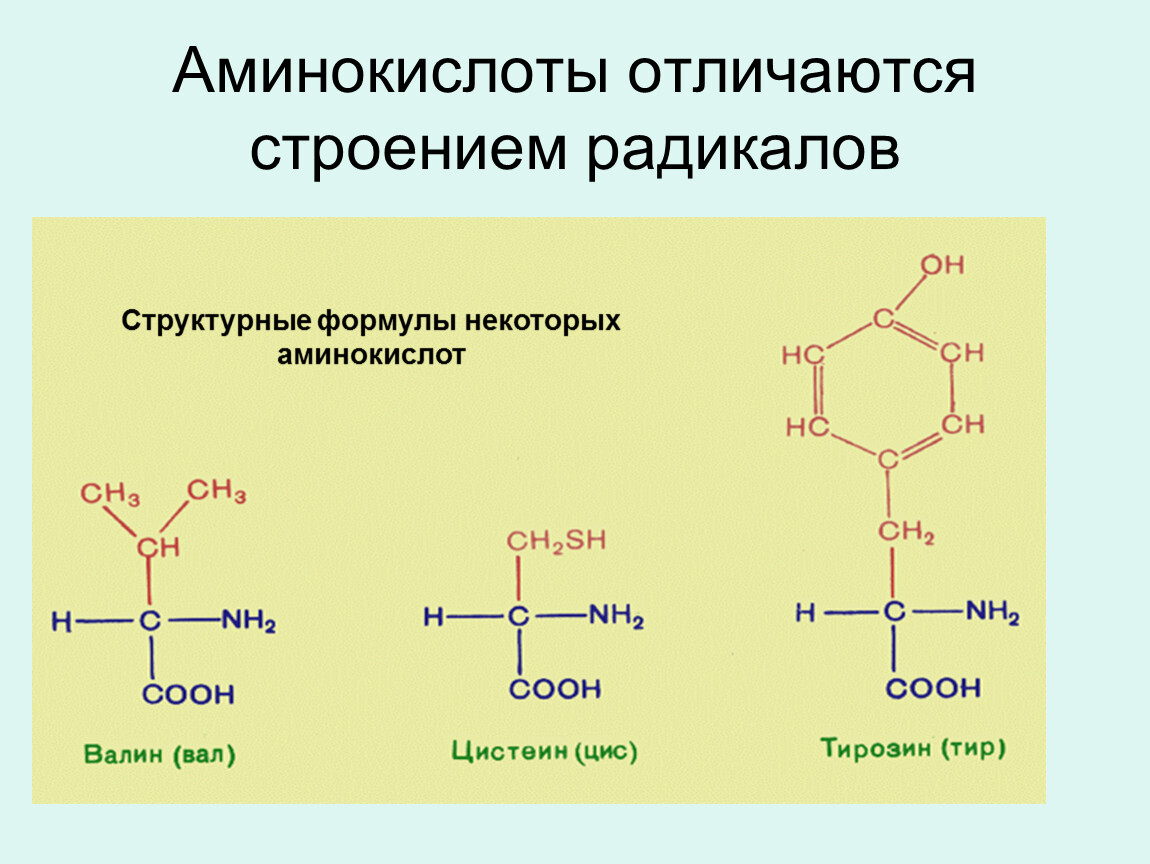 Считают, что оба эти механизма могут принимать участие в ГАМКергическом контроле секреции катехоламинов [60].
Считают, что оба эти механизма могут принимать участие в ГАМКергическом контроле секреции катехоламинов [60].
Представление об этой функции ГАМК сформировалось на основании данных о влиянии аминокислоты и ее миметиков на высвобождение катехоламинов и состояние тех процессов, которые непосредственно задействованы в регуляции секреции. ГАМК вызывала Са2+-зависимое повышение высвобождения катехоламинов, что имело дозозависимый характер и составляло 2/3 от уровня никотинстимулированного [76]. Предполагают существование двойной регуляции секреции катехоламинов: активация ее опосредована ГАМКа-Р, а торможение — ГАМКВ-Р. Этот вывод базировался на результатах, свидетельствующих об имитации мусцимолом действия ГАМК, которая в свою очередь снималась бикукуллином и баклофеном. Последний подавлял как никотин- и КС1-стимулиро- ванное, так и базальное высвобождение катехоламинов [49]. Мусцимол одновременно с влиянием на секрецию катехоламинов вызывал также вход Са2+ в клетки; считают, что этот процесс важен именно для инициации высвобождения гормонов [39]. Поскольку повышение уровня внутриклеточного Са2+ зависит от внеклеточной его концентрации, влияние ГАМК на вход Са2+ в клетки может быть опосредовано хотя бы частично потенциал- чувствительными Са2+-каналами [49]. Кроме этого, показано, что ГАМК ингибирует спонтанные колебания концентрации и высвобождения Са2+ в хромаффинных клетках надпочечников крыс. Такое же действие оказывает и мусцимол, но не баклофен. Эффект аминокислоты и агониста ГАМКа— Р снимался бикукуллином [17, 58]. Принимая во внимание эти данные, а также способность ГАМК деполяризировать мембраны хромаффинных клеток, авторы считают значительной ее роль в физиологической регуляции функции мозгового слоя надпочечников [17].
Поскольку повышение уровня внутриклеточного Са2+ зависит от внеклеточной его концентрации, влияние ГАМК на вход Са2+ в клетки может быть опосредовано хотя бы частично потенциал- чувствительными Са2+-каналами [49]. Кроме этого, показано, что ГАМК ингибирует спонтанные колебания концентрации и высвобождения Са2+ в хромаффинных клетках надпочечников крыс. Такое же действие оказывает и мусцимол, но не баклофен. Эффект аминокислоты и агониста ГАМКа— Р снимался бикукуллином [17, 58]. Принимая во внимание эти данные, а также способность ГАМК деполяризировать мембраны хромаффинных клеток, авторы считают значительной ее роль в физиологической регуляции функции мозгового слоя надпочечников [17].
В опытах in vivo баклофен, введенный перед началом плавания, предотвращал стрессовое повышение секреции адреналина и значительно снижал в крови крыс концентрацию дофамина. В то же время введение баклофена животным, находящимся в состоянии покоя, вызывало повышение секреции катехоламинов [4], как и внесение этого агониста ГАМКВ-Р в среду инкубации хромаффинных клеток in vitro [62].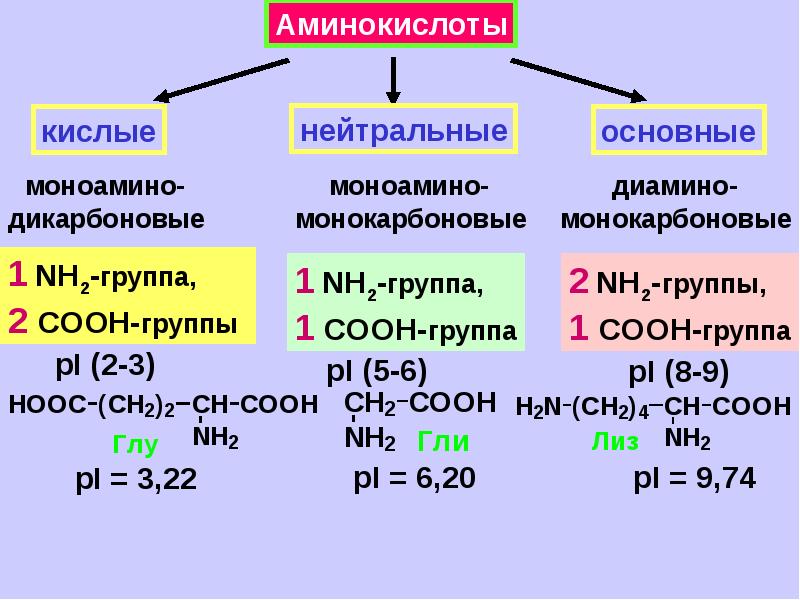 Следовательно, эффект активации ГАМКВ-Р на процессы секреции катехоламинов, а также роль первых в регуляции функции клеток мозгового слоя надпочечников остаются до конца не ясными.
Следовательно, эффект активации ГАМКВ-Р на процессы секреции катехоламинов, а также роль первых в регуляции функции клеток мозгового слоя надпочечников остаются до конца не ясными.
Интересными представляются результаты исследований влияния вальпроата натрия: ингибитор ферментов обмена ГАМК, внесенный в среду культивирования хромаффинных клеток быка, вызывал повышение синтеза белка, экспрессии одной из субъединиц К’ат-каналов, спонтанной и стимулированной активности последних, а также Са2+-ка- налов и секреции катехоламинов. Выводом из этих
данных явилось предположение о том, что вальп- роат натрия (или повышенный уровень ГАМК ?) регулирует экспрессию или активность ионных каналов плазматических мембран хромаффинных клеток, вследствие чего повышается секреция катехоламинов [80].
Модулирующее влияние метаболитов прогестерона на активность ГАМКа—БД—СГ-РК было показано при изучении субмаксимального потока ионов в целых клетках культуры хромаффинной ткани надпочечников быка. Интенсивность этого процесса повышалась в условиях внесения в среду культивирования прегнандиона или 5[3-прегнан- За-ол-20-она, но не прогестерона [18]. Все указанные вещества вызывали в клетке, находящейся под напряжением, внутренний ток, который, как и в случае индукции ГАМК, обратимо блокировался бикукуллином и усиливался фенобарбиталом. Пре- гнанолон также повышал мусцимолстимулирован- ную секрецию катехоламинов в изолированных хромаффинных клетках [61].
Интенсивность этого процесса повышалась в условиях внесения в среду культивирования прегнандиона или 5[3-прегнан- За-ол-20-она, но не прогестерона [18]. Все указанные вещества вызывали в клетке, находящейся под напряжением, внутренний ток, который, как и в случае индукции ГАМК, обратимо блокировался бикукуллином и усиливался фенобарбиталом. Пре- гнанолон также повышал мусцимолстимулирован- ную секрецию катехоламинов в изолированных хромаффинных клетках [61].
Данных о локализации и функции компонентов ГАМК-системы в коре надпочечников значительно меньше. Здесь определяются активность фермента синтеза ГАМК и специфическое связывание аминокислоты плазматическими мембранами, которые, как и в мозге, подвержены сезонным изменениям [1]. Кроме того, активность ГДК и интенсивность связывания аминокислоты изменяются в надпочечниках в условиях физиологической или гормональной модификации интенсивности стероидогенеза, а также при патологии коры надпочечников человека [1—3].
Половые железы
В яичниках животных концентрация ГАМК находится на среднем, как для периферических органов, уровне, в гранулярных клетках она отсутствует. Активность ГДК и ГАМК-Т низка [34]. Считают, что последнее, а также неспособность ингибиторов ГАМК-Т повысить уровень ГАМК в яичниках могут свидетельствовать о наличии в ткани этого органа альтернативных путей метаболизма ГАМК. Аминокислота тут может образовываться из путресцина, однако неизвестно, происходит ли катаболизм ГАМК до спермидина, как неизвестно и присутствие в яичниках ДПЯК.
Активность ГДК и ГАМК-Т низка [34]. Считают, что последнее, а также неспособность ингибиторов ГАМК-Т повысить уровень ГАМК в яичниках могут свидетельствовать о наличии в ткани этого органа альтернативных путей метаболизма ГАМК. Аминокислота тут может образовываться из путресцина, однако неизвестно, происходит ли катаболизм ГАМК до спермидина, как неизвестно и присутствие в яичниках ДПЯК.
На мембранах яичников человека и крыс определены специфические высокоаффинные места связывания ГАМК, плотность которых очень высока и может быть сравнима с плотностью мест связывания ГАМК в мозге [8, 34]. С помощью специфических фармакологических препаратов эти места были идентифицированы как ГАМКД-Р, входящие в ГАМКа—БД—СГ-РК и ГАМКВ-Р, причем характеристики их оказались очень близкими к таковым для ГАМК-Р мозга [34]. Интересно, что в яичниках экспрессируются мРНК pi-субъединицы ГАМКа-Р, которые встречаются в некоторых периферических органах и отсутствуют в мозге [41], а также ГАМКд-Р-ассоциированные белки, экспрессия одного из них существенна [79]. мРНК ГАМК- В1-Р экспрессируется в яичниках в виде 2 изоформ [21 ], а интенсивность экспрессии и функция в яичниках ГАМК-Тр, характеристики которого близки к таковым для мозгового, контролируются многими внутриклеточными сигнальными системами, в частности тирозинкиназой и протеинкиназой С [51].
мРНК ГАМК- В1-Р экспрессируется в яичниках в виде 2 изоформ [21 ], а интенсивность экспрессии и функция в яичниках ГАМК-Тр, характеристики которого близки к таковым для мозгового, контролируются многими внутриклеточными сигнальными системами, в частности тирозинкиназой и протеинкиназой С [51].
Результаты немногочисленных экспериментов указывают на зависимость концентрации ГАМК и активности ферментов ее обмена в яичниках от уровня половых гормонов. Установлено, что содержание ГАМК в яичниках изменяется в течение эс- трального цикла [35]; гипофизэктомия или овари- эктомия вызывали существенное уменьшение активности ГДК и уровня ГАМК, а беременность сопровождалась прогрессивным увеличением ее содержания [34].
Концентрация ГАМК в семенниках составляет около 2% от таковой в мозге. Среди изоферментов ГДК в сперматоцитах и сперматозоидах, но не в клетках Лейдига или Сертоли присутствует лишь ГДК67, которая по данным гибридизации, иммунологических исследований и определения аминокислотной последовательности очень близка к ферменту мозга [34, 76]. Следует отметить, что в яичках человека экспрессируется и короткая форма ГДК67 — ГДК25 [25]. Как и ГДК, ГАМК-Т из яичка человека подобна ферменту из мозга [34].
Следует отметить, что в яичках человека экспрессируется и короткая форма ГДК67 — ГДК25 [25]. Как и ГДК, ГАМК-Т из яичка человека подобна ферменту из мозга [34].
Существование ГАМКД-Р на мембранах семенников показано в опытах in vitro при определении влияния ГАМК, агонистов и антагонистов ГАМКД— и ГАМКВ-Р на функцию этого органа [21], а также в серии молекулярно-биологических исследований по клонированию разных форм ГАМК-Р [21, 40, 79]. Так, было установлено, что в семенниках взрослых крыс экспрессируется только мРНК длинной субъединицы ГАМКВ-Р, которая выявляется в 2 [11] или 3 [40] изоформах. В семенниках крыс имеет место экспрессия у,- (но не у2— или у3-) субъединицы ГАМКа-Р. Присутствие исключительно у,-субъединицы ГАМКЛ-Р в семенниках может свидетельствовать об ее специфической функциональной роли [42]. В яичках человека установлена экспрессия всех ГАМКд-Р-ассоциированных белков, связанных с у-субъединицей ГАМКД-Р; интенсивность экспрессии одного из них существенна [79].
В семенниках мышей процесс транскрипции ГАМК-Тр имеет ряд особенностей, которые отличаются от характера его транскрипции в мозге [45, 54]. Этот транспортер также локализован на мембранах сперматидов и сперматозоидов [42]. Транспорт ГАМК Na+— и СГ-зависим, интенсивность его имеет значительные индивидуальные отличия [5].
В опытах на хомяках было показано, что уровень ГАМК в семенниках значительно повышался в препубертатном периоде. Это происходило до начала повышения концентрации тестостерона и одновременно с увеличением концентрации предшественника ГАМК глутаминовой кислоты [32]. При содержании хомяков на протяжении 9—22 нед в условиях короткого светового периода на фоне прогрессирующей инволюции семенников, а также снижения концентрации тестостерона уровень ГАМК и глутаминовой кислоты между 12-й и 18-й неделями наблюдения был резко сниженным. Поз-
же, в период максимальной инволюции репродуктивных органов хомяков, концентрация ГАМК значительно повышалась, тогда как уровень глутаминовой кислоты оставался сниженным.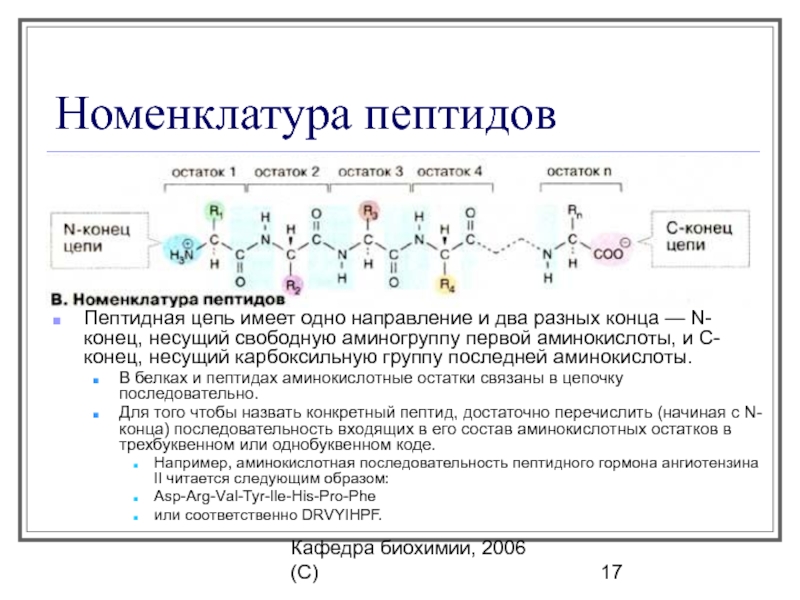 Активность ГДК в семенниках начинала возрастать, начиная с 14-й недели содержания животных в подобных экспериментальных условиях. Авторы считают, что изменение содержания ГАМК в семенниках животных, репродуктивная функция которых зависит от длительности фотопериода, может быть важным ауто- или паракринным модуляторным сигналом для регуляции процессов стероидогенеза в семенниках [33].
Активность ГДК в семенниках начинала возрастать, начиная с 14-й недели содержания животных в подобных экспериментальных условиях. Авторы считают, что изменение содержания ГАМК в семенниках животных, репродуктивная функция которых зависит от длительности фотопериода, может быть важным ауто- или паракринным модуляторным сигналом для регуляции процессов стероидогенеза в семенниках [33].
Щитовидная железа
Исследование компонентов ГАМК-системы и ее роли в функционировании щитовидной железы проводили в очень ограниченном объеме и только на первых этапах изучения ненейрональной ГАМК (последние работы датированы 1981 г.). Показано, что в щитовидной железе ГАМК может синтезироваться с помощью ГДК и метаболизироваться с помощью ГАМК-Т. Концетрания аминокислоты, как и величина активности ферментов в железе, низка [34].Специфическая система высокоаффинного транспорта ГАМК по своим характеристикам подобна таковой в мозге, локализуется в основном на мембранах фолликулярных и отсутствует на мембранах С-клеток и тучных клеток.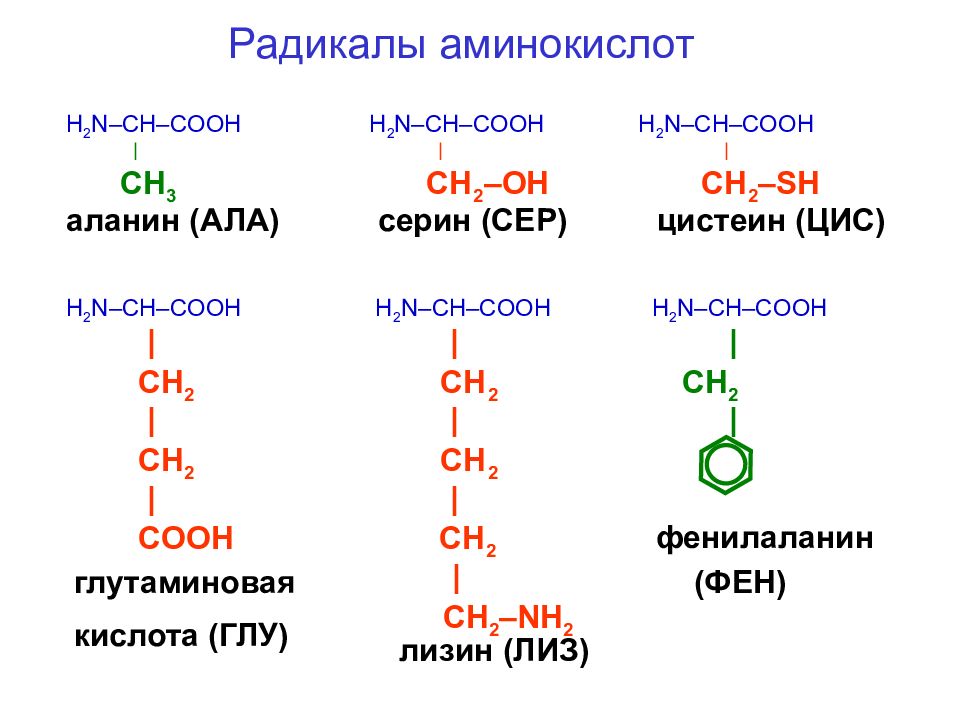 In vivo ГАМК не влияла на синтез тиреоидных гормонов и содержание йодида в железе. В то же время при гипотиреозе активность ГАМК-Т повышалась за счет увеличения скорости реакции, тогда как при гипертиреозе она была сниженной, одновременно с этим имела место интенсификация высокоаффинного захвата аминокислоты. Существование активной системы транспорта ГАМК, модуляция ее активности, как и активности ферментов обмена аминокислоты, позволили авторам предположить, что ГАМК может играть определенную роль в функционировании щитовидной железы [37, 38]. Сведения о ГАМК-Р щитовидной железы в литературе отсутствуют.
In vivo ГАМК не влияла на синтез тиреоидных гормонов и содержание йодида в железе. В то же время при гипотиреозе активность ГАМК-Т повышалась за счет увеличения скорости реакции, тогда как при гипертиреозе она была сниженной, одновременно с этим имела место интенсификация высокоаффинного захвата аминокислоты. Существование активной системы транспорта ГАМК, модуляция ее активности, как и активности ферментов обмена аминокислоты, позволили авторам предположить, что ГАМК может играть определенную роль в функционировании щитовидной железы [37, 38]. Сведения о ГАМК-Р щитовидной железы в литературе отсутствуют.
Тимус
О присутствии ГАМК в тимусе известно давно [34], но первые сведения о ферментах ее обмена в железе появились лишь в последние годы. Синтез ГДК происходит в специализированных клетках железы человека [67], а в тимусе 7-дневных мышат со спонтанным диабетом установлена экспрессия только одного из изоферментов — ГДК67, который считают потенциальным аутоантигеном [66].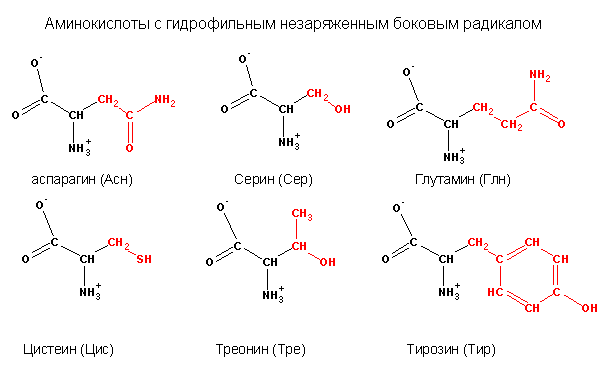 Применение биохимических и гистоэнзиматических методов позволило выяснить, что большая часть активности ГАМК-Т в тимусе крыс локализована в стенках кровеносных и лимфатических сосудов, а меньшая ассоциируется с субкапсулярной и медуллярной частью паренхимы. В условиях стимуляции интерлейкином иммунного ответа активность ГАМК-Т повышалась в различных структурах тимуса [23]. В тимусе человека показана низкая экспрессия ГАМКА-Р-ассоциированных белков [79].
Применение биохимических и гистоэнзиматических методов позволило выяснить, что большая часть активности ГАМК-Т в тимусе крыс локализована в стенках кровеносных и лимфатических сосудов, а меньшая ассоциируется с субкапсулярной и медуллярной частью паренхимы. В условиях стимуляции интерлейкином иммунного ответа активность ГАМК-Т повышалась в различных структурах тимуса [23]. В тимусе человека показана низкая экспрессия ГАМКА-Р-ассоциированных белков [79].
Среди возможных функций ГАМК в тимусе одновременно с нейромедиаторной [22] рассматривают и значение молекулы в осуществлении связи между функциями нервной и иммунной систем [24]. Роль ГАМК в эндокринной функции тимуса неизвестна.
Гипофиз
Известно, что ГАМК играет важную роль в регуляции секреции гормонов гипофиза, однако характерные детали функционирования собственно медиаторной системы в гипофизе исследованы недостаточно. Количественно ГАМК определяется в передней, промежуточной и задней долях, но синтезируется, по данным ранних исследований, исключительно в двух последних [9, 77]. Величина активности ГДК составляет лишь около 10% от активности фермента в мозге [56]. В то же время активность ГАМК-Т в передней доле превышает таковую как в иных долях гипофиза, так и в гипоталамусе. Эти биохимические различия содержания ГАМК и активности ферментов ее обмена в разных долях гипофиза связаны с существованием неодинаковых морфофункциональных связей между ними и гипоталамусом, а отсутствие в передней доле ГДК позволило сделать вывод о том, что аденогипофиз секвестирует ГАМК из крови.
Величина активности ГДК составляет лишь около 10% от активности фермента в мозге [56]. В то же время активность ГАМК-Т в передней доле превышает таковую как в иных долях гипофиза, так и в гипоталамусе. Эти биохимические различия содержания ГАМК и активности ферментов ее обмена в разных долях гипофиза связаны с существованием неодинаковых морфофункциональных связей между ними и гипоталамусом, а отсутствие в передней доле ГДК позволило сделать вывод о том, что аденогипофиз секвестирует ГАМК из крови.
Результаты исследований последних лет, однако, свидетельствуют о том, что в клетках аденогипофиза, секретирующих гормон роста, как и во всех эндокринных клетках промежуточной доли гипофиза, экспрессируется ГДК67. С помощью им- муноэлектронной микроскопии установлено, что экспрессия этих белков в соматотропах происходит во внутриклеточных органеллах, запасающих гормон. В клеточной культуре Gh4, продуцирующей гормон роста, были идентифицированы гены, кодирующие синтез ГДК^ [56].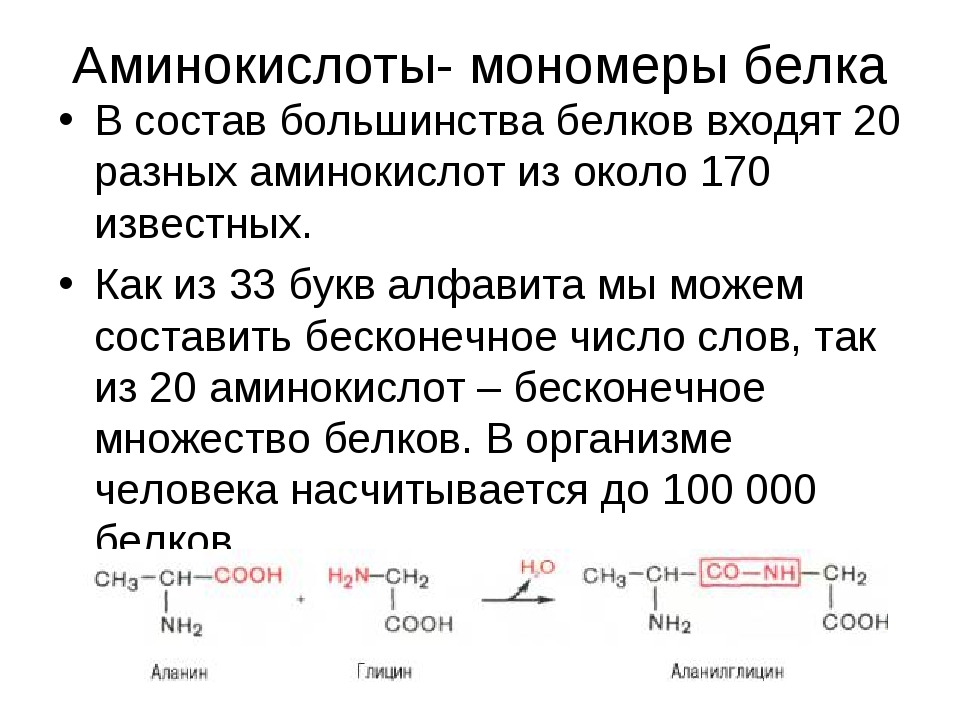
Следовательно, существуют 3 источника ГАМК в гипофизе: транспорт из гипоталамуса по системе портальных сосудов в переднюю долю, прямая гипоталамическая иннервация задней и промежуточной долей и синтез из глутамата, который наблюдается не только в двух последних, но и в некоторых клетках передней доли [56]. Следует также отметить, что гипофиз интенсивно накапливает и аминокислоту из периферической крови, в случае когда уровень ее в циркуляции повышен [50]. При изучении процесса интернализации меченой ГАМК в гипофизе крыс было показано, что лактотропы и соматотропы являются единственными клетками аденогипофиза, в которых накапливается меченая аминокислота. При этом метка локализуется в различных внутриклеточных органеллах: плазматических мембранах, комплексе Гольджи, митохондриях и секреторных гранулах [29].
В гипофизе присутствуют все 3 типа ГАМК-Р, локализующиеся (по крайней мере ГАМКа— и ГАМКВ-Р) на всех типах клеток гипофиза и играющие важную роль в регуляции секреции всех гипофизарных гормонов. Выяснение тонких деталей локализации субтипов ГАМК-Р, их структуры и механизмов регуляции — задача дальнейших исследований. В настоящее время известно, что фос-
Выяснение тонких деталей локализации субтипов ГАМК-Р, их структуры и механизмов регуляции — задача дальнейших исследований. В настоящее время известно, что фос-
формирование р2— и р3-субъединиц ГАМКа-Р является важнейшим моментом в проявлении тормозного действия протеинкиназы G на функцию ГАМКа-Р в культуре меланотропов промежуточной доли гипофиза [19]. Протеинкиназа G вовлечена и в механизм влияния оксида азота на функцию ГАМКД-Р’в железе [20].
Фармакологические и функциональные характеристики ГАМКВ-Р гипофиза крыс подобны таковым в мозге [53]. По одним данным, в гипофизе экспрессируется только длинная субъединица ГАМКВ-Р [11], по другим — обе [12]. Активация ГАМКВ-Р гипофиза ингибирует секрецию гормонов in vitro. В основе такого действия лежит отрицательное взаимодействие между ГАМКВ-Р и Са2+— каналами, опосредованное G-белками [53]. Существуют возрастные, а также зависящие от пола модуляции уровня ГАМКВ-Р в передней доле гипофиза. Так, количество связывающих мест у 4-дневных самок существенно выше, чем у самцов этого же возраста, тогда как аффинность их одинакова в гипофизе крыс разного пола. Экспрессия ГАМКв,а-Р и ГАМКВ1в-Р уменьшается в гипофизе самок, начиная с 4-го дня после рождения и до взрослого возраста, при этом экспрессия ГАМКВ1а— Р на ранних стадиях развития значительно превышала таковую ГАМКВ|в-Р. Экспрессия ГАМКВ2-Р незначительна. У самцов характер изменений экспрессии ГАМКВ1а-Р был аналогичен таковому у самок, хотя интенсивность ее была ниже, чем у самок на ранних стадиях развития. Экспрессия ГАМКВ]Ь— Р и ГАМКВ2-Р в гипофизе самцов очень низка [12].
Так, количество связывающих мест у 4-дневных самок существенно выше, чем у самцов этого же возраста, тогда как аффинность их одинакова в гипофизе крыс разного пола. Экспрессия ГАМКв,а-Р и ГАМКВ1в-Р уменьшается в гипофизе самок, начиная с 4-го дня после рождения и до взрослого возраста, при этом экспрессия ГАМКВ1а— Р на ранних стадиях развития значительно превышала таковую ГАМКВ|в-Р. Экспрессия ГАМКВ2-Р незначительна. У самцов характер изменений экспрессии ГАМКВ1а-Р был аналогичен таковому у самок, хотя интенсивность ее была ниже, чем у самок на ранних стадиях развития. Экспрессия ГАМКВ]Ь— Р и ГАМКВ2-Р в гипофизе самцов очень низка [12].
В гипофизе морских свинок и крыс экспрессируются обе р-субъединицы ГАМКС-Р, мРНК рг субъединицы в гипофизе крыс превалирует. При использовании антител, специфичных к субъединице ГАМКС-Р, показана совместная клеточная локализация р,-субъединицы и ТТГ. Предполагают, что ГАМКС-Р принимают активное участие в регуляции секреции ТТГ и что структура и биохимическая регуляция этих рецепторов в гипофизе отличаются от таковых в сетчатке, где они были впервые идентифицированы [15].
Предполагают, что ГАМКС-Р принимают активное участие в регуляции секреции ТТГ и что структура и биохимическая регуляция этих рецепторов в гипофизе отличаются от таковых в сетчатке, где они были впервые идентифицированы [15].
С помощью современных методов исследования было показано, что во всех эндокринных клетках промежуточной доли гипофиза, а также соматотро- пах передней доли локализуется везикулярный ГАМК-Тр [56]. Изучение процессов регуляции транспорта ГАМК показало, что интерлейкин-6 не влиял на высвобождение ГАМК из задней доли гипофиза, однако повышал интенсивность этого процесса в условиях предварительной деполяризации мембран клеток. Эффект интерлейкина-6 снижался при инкубации ткани с ингибитором циклооксигеназы, что свидетельствует в пользу медиаторной роли простагландинов в процессе высвобождения ГАМК [28].
По последним данным, по крайней мере 2 типа клеток, а именно клетки промежуточной доли, секретирующие пропиомеланокортин, и соматотропы передней доли гипофиза, способны синтезировать, запасать и секретировать ГАМК. Данные о совместной локализации ГАМК, фермента ее синтеза, ГАМК-Тр, а также гормона роста в одних и тех же субклеточных органеллах позволили предположить, что ГАМК, образовавшаяся в соматотропах, может контролировать высвобождение гормона по паракринному типу регуляции, а присутствие ГАМК-Р на мембранах этих клеток свидетельствует и о возможном аутокринном характере контроля [56]. Сформулирована концепция многоуровневой ГАМКергической регуляции секреции гормонов гипофиза: 1) гипоталамический непрямой механизм, опосредованный ГАМКергическим контролем секреции гипоталамических рилизинг-факто- ров; 2) гипоталамический прямой с вовлечением ГАМК, выделившейся из аксонов нейронов гипоталамуса непосредственно в задней и промежуточной долях; 3) гипоталамический нейрогумораль- ный при участии ГАМК, которая поступает в аденогипофиз по системе портальных сосудов; 4) па- ра/аутокринный с участием ГАМК, которая синтезируется и высвобождается собственно в эндокринной клетке гипофиза. Для решения вопроса о возможном существовании последнего механизма и в других клетках гипофиза необходимы дальнейшие исследования.
Данные о совместной локализации ГАМК, фермента ее синтеза, ГАМК-Тр, а также гормона роста в одних и тех же субклеточных органеллах позволили предположить, что ГАМК, образовавшаяся в соматотропах, может контролировать высвобождение гормона по паракринному типу регуляции, а присутствие ГАМК-Р на мембранах этих клеток свидетельствует и о возможном аутокринном характере контроля [56]. Сформулирована концепция многоуровневой ГАМКергической регуляции секреции гормонов гипофиза: 1) гипоталамический непрямой механизм, опосредованный ГАМКергическим контролем секреции гипоталамических рилизинг-факто- ров; 2) гипоталамический прямой с вовлечением ГАМК, выделившейся из аксонов нейронов гипоталамуса непосредственно в задней и промежуточной долях; 3) гипоталамический нейрогумораль- ный при участии ГАМК, которая поступает в аденогипофиз по системе портальных сосудов; 4) па- ра/аутокринный с участием ГАМК, которая синтезируется и высвобождается собственно в эндокринной клетке гипофиза. Для решения вопроса о возможном существовании последнего механизма и в других клетках гипофиза необходимы дальнейшие исследования.
Следовательно, метаболизм и транспорт ГАМК, как и структура ее рецепторов в эндокринных железах значительно отличаются от аналогичных показателей в мозге. Возможно, это является особенно важным для реализации тех функций, которые осуществляет ГАМК в указанных органах. Наряду с нейромедиаторной следует отметить роль аминокислоты в регуляции ряда внутриклеточных и мембранных процессов, участвующих в синтезе и секреции гормонов. Выяснение всех аспектов этой проблемы приблизит решение вопроса о возможной коррекции нарушений функции эндокринных желез препаратами, влияющими на активность ГАМКергической системы
1. MuutyHina Т. М., Кононенко В. Я., MiKoiua О. С., Тронь- ко М. Д. И Ф1зюл. журн. — 1994. — N 3. — С. 9-15.
2. Muiuynina Т. М., Кононенко В. Я., Рибаков С. Й. // Ендок- ринолопя. — 2000. — Т. 5, N 1. — С. 16-21.
— 2000. — Т. 5, N 1. — С. 16-21.
3. Muiuynina Т. М., Кононенко В. Я. // Пробл. эндокринол. —2001- N 3. — С. 33-36.
4. Muiuynina Т. М., Калииченко О. В. // Ф1зюл. журн. — 2001.Т. 47, N 5. — С. 47-53.
5. Aanesen A., Fried G., Anderson Е., Gottlieb С. // Biol. Reprod.1996. — Vol. 54, N 4. — P. 841-846.
6. Adeghate E., Ponery A., Pallet D., Singh J. // Tissue Cell. —2000- Vol. 32, N 3. — P. 266-274.
7. Ahnerthilger G., Stadtbaumer A., Strubing C. et al. // Gastroen¬terology. — 1996. — Vol. 110, N 5. — P. 1595-1604.
8. Akinci M., Schofield P. // Neurosci. Res. — 1999. — Vol. 35, N 2. — P. 145-153.
9. Apud J., Cocchi D., Locatelli Y. et al. // Psychoneuroendo- crinology. — 1989. — Vol. 14, N 1—2. — P. 3-17.
10. Beales P., Hawa M., Williams A. et al. // Acta Diabetol. — 1995. — Vol. 32, N 1. — P. 53-56.
11. Belley M., Sullivan R., Reeves A. et al. // Bioorg. Med. Chem.1999. — Vol. 7, N 12. — P. 2697-2704.
12. Bianchi M., Rey-Roldan E., Better B. et al. // Neuropharma¬cology. — 2001. — Vol. 40, N 2. — P. 185-192.
13. Borboni P.. De Steforpus P., Fusco A. et al. // Diabetes. — 1992. — Vol. 41. — Suppl. 1. — P. 46.
14. Bouix O., Reynier M., Guintrandhugret R., Orsetti A. // Horm. Metab. Res. -1995. — Vol. 27, N 5. — P. 216-220.
15. Boue-Grabot E., Taupignon A., Tramu G., Garret M. // Endo¬crinology. — 2000. — Vol. 141. — P. 1627-1632.
16. Brice N., Varadi A., Ashcroft S., Molnar E. // Diabetologia. —2002- Vol. 45, N 2. — P. 242-252.
17. Busik J., Nakamura M., Abe Y. et al. // Brain Res. — 1996. — Vol. 739, N 1-2. — P. 97-103.
18. Callahan H., Cottrell G., Hather N. et al. // J. Physiol. — 1986. — Vol. 281. — P. 117.
19. Castel H., Louiset E., Anouar Y. et al. // J. Neuroendocrinol.2000. — Vol. 12, N 1. — P. 41-52.
20. Castel H., Jegou S., Tonon M., Vandry H. // Endocrinology. — 2000. — Vol. 141, N 9. — P. 3451-3460.
21. Castelli V., Ingianni A., Stefanini E., Gessa G. // Life Sci. —1999- Vol. 64, N 15. — P. 1321-1328.
22. Cavallotti D., Artico M., De Sand S., Cavallotti C. // Hum. Im¬munol. — 1999. — Vol. 60, N 11. — P. 1072-1079.
23. Cavallotti D., Artico M., Cavallotti C. // Int. J. Immunophar- macol. — 2000. — Vol. 22, N 9. — P. 719-728.
24. Cavallotti D., Artico M., D’Andrea V, Cavallotti C. // Hum. Immunol. — 2000. — Vol. 61, N 7. — P. 697-704.
25. Chessler S., Lernmark A. // J. Biol. Chem. — 2000. — Vol. 275, N 7. — P. 5188-5192.
26. Cram D., Faulner-Jones B., Kun J., Harrison L. // Endocrinol¬ogy. — 1995. — Vol. 136, N 3. — P. 1111-1119.
27. Delasheras M., Valcarcel A., Peres L. // Biol. Reprod. — 1997.Vol. 56, N 4. — P. 964-968.
28. De Laurentiis A., Pisera D., Lasaga M. et al. // Neuroimmu- nomodulation. — 2000. — Vol. 7, N 2. — P. 77-83.
29. Duvilanski D., Perez R, Seilicovich A. et al. // Tissue Cell. —2000- Vol. 32, N 4. — P. 284-292.
30. Eaton M., Martinez M., Normally S. et al. // Cell. Transplant.2000. — Vol. 9, N 5. — P. 637-656.
31. Eranzoni M., Sapei M., Beltramo M., Calas A. // Neuroendo¬crinology. — 1990. — Vol. 52. — Suppl. 1. — P. 51.
32. Frungieri M., Gonzalezcalvar S., Chabdrashekar V. et al. // Int. J. Androl. — 1996. — Vol. 19, N 3. — P. 164-170.
33. Frungieri M., Gonzalezcalvar S., Calandra R. // Int. J. Androl.1996. — Vol. 19, N 3. — P. 171-178.
34. GABA-Ergic Mechanisms in Mammalian Periphery / (Eds S. Erdo, N. Bowery. — New York, 1986.
35. GABA Outside the CNS / Ed. S. Erdo — New York, 1992.
36. Gaskins H., Baldeon M., Selassie L., Beverly J. // J. Biol. Chem. — 1995. — Vol. 270, N 51. — P. 30286-30289.
37. Gebauer H, Crailsheim K. // Acta Endocrinol. — 1981. — Vol. 97. — Suppl. 243. — P. 58.
38. Gebauer H, Pabst A. // Cell Tissue Res. — 1981. — Vol. 220, N 4. — P. 873-879.
39. Gonzalez M., Oset-Gasque M., Castro E. et al. // Neuro¬science. — 1992. — Vol. 47, N 2. — P. 487-494.
40. He X., Hu J., Wu Q. et al. // Biochem. Biophys. Res. Com¬mun. — 2001. — Vol. 283, N 1. — P. 243-247.
41. Hedblom E., Kirkness E. // J. Biol. Chem. — 1997. — Vol. 272, N 24. — P. 15246-15350.
42. Hu J., He X, Yan Y. Ц Cell Res. — 2000. — Vol. 10, N 1. — VP. 51-58.
43. Hu J., Yan Y. // Cell Res. — 2002. — Vol. 12, N 1. — P. 33- 37.
44. Iwasa K, Oomori Y., Tanaka H. // Arch. Histol. Cytol. —1998- Vol. 61, N 4. — P. 373-382.
45. Jin X., Huang F., Yang N. et al. // Cell Res. — 2001. — Vol. 11, N 2. — P. 161-163.
46. Jousselin-Hosaja M., Venault P., Tobin C. et al. // Behav. Brain Res. — 2001. — Vol. 121, N 1-2. — P. 29-37.
47. Katoh J., Taniguchi H., Ogura M. et al. // Experientia. — 1995. — Vol. 51, N 3. — P. 217-219.
48. Katoh J., Taniguchi H.. Kasuga M. // Life Sci. — 1995. — Vol. 56, N 21. — P. 1799-1805.
49. Kitayama S., Morita K, Dohi T., Tsujimoto A. // Biochim. Bio¬phys. Acta. — 1990. — Vol. 1053, N 2-3. — P. 189-194.
50. Kuroda E., Watanabe V., Tamayama T., Shimada M. 11 Mi- crosc. Res. Tech. — 2000. — Vol. 48, N 2. — P. 116-126.
51. Law R., Stafford A., Quick M. // J. Biol. Chem. — 2000. — Vol. 275, N 31. — P. 23986-23991.
52. Llona I. // Neurochem. Int. — 1995. — Vol. 27, N 3. — P. 219-226.
53. Lux-Lantos V., Becu-Villalobos D., Bianchi M. et al. // Neu¬roendocrinology. — 2001. — Vol. 73, N 5. — P. 334-343.
54. Ma Y„ Hu J., Zhou X. et al. // Cell Res. — 2000. — Vol. 10, N 1. — P. 59-69.
55. Malaisse-Lagae E, Giroix M., Malaisse W. // Med. Sci. Res.1992. — Vol. 20, N 13. — P. 489-490.
56. Mayerhofer A., Hohne-Zell B., Gamel-Didelon K. et al. // FASEB. J. — 2001. — Vol. 15, N 6. — P. 1089-1091.
57. Nagamatsu S., Nakamichi Y, Watanabe T. et al. // J. Cell Sci.2001. — Vol. 114. N 1. — P. 219-227.
58. Nakamura M. // Jpn. J. Vet. Res. — 1995. — Vol. 43, N 1. — P. 43.
59. Ohara-Imaizumi M., Nakamichi Y., Ozawa S. et al. // Bio¬chem. Biophys. Res. Commun. — 2001. — Vol. 283, N 5. — P. 1025-1030.
60. Oset-Gasque M., Castro E., Gonzalez M. // J. Neurosci. Res.1990. — Vol. 26, N 2. — P. 181-187.
61. Parramon M., Gonzalez M., Oset-Gasgue M. // Br. J. Pharma¬col. — 1995. — Vol. 116, N 2. — P. 1875-1881.
62. Parramon M., Gonzales M., Herrero M., Oset-Gasque M. // J. Neurosci. Res. — 1995. — Vol. 41, N 1. — P. 65-72.
63. Petersen J., Russel S., Marshall M. // Diabetes. — 1993. — Vol. 42, N 3. — P. 484-495.
64. Petersen J., Rimvall K., Jorgensen P. et al. // Diabetologia. —1998- Vol. 41, N 5. — P. 530-535.
65. Pleau J., Esling A., Van Acker C., Dardenne M. // Biochem. Biophys. Res. Commun. — 1996. — Vol. 254, N 3. — P. 747-753.
66. Pleau J., Esling A., Geutkens S. et al. // Biochem. Biophys. Res. Commun. — 2001. — Vol. 283, N 4. — P. 843-848.
67. Pugliese A., Brown D., Garza D. et al. // J. Clin. Invest. —1999- Vol. 107, N 5. — P. 555-564.
68. Quatraro A., Consoli G., Stante A. et al. // Acta Diabetol. — 1986. — Vol. 23, N 1. — P. 23-28.
69. Reddy S., Elliott R., Poole C., Ross J. // Gen. Compar. Endo¬crinol. — 1997. — Vol. 106, N 3. — P. 301-309.
70. Rorsman P., Ashrroft F., Berggren P. // Biochem. Pharmacol.1991. — Vol. 41, N 12. — P. 1783-1790.
71. Saraviafemandez E, Faveeuw C., Blasquezbulant C. et al. // Endocrinology. — 1996. — Vol. 137, N 8. — P. 3497-3506.
72. Sha L., Miller S., Szurzewski J. // Am. J. Physiol. — 2001. — Vol. 280, N 3. — P. G324-G331.
73. Shi Y, Kanaani J., Menard-Rose V. et al. // Am. J. Physiol. — 2000. — Vol. 279, N 3. — P. E684-E694.
74. Smismans A., Schuit E, Pipeleer D. // Diabetologia. — 1997.Vol. 40, N 12. — P. 1411-1415.
75. Testore G., Cravanzola C., Bedino S. // Int. J. Biochem. —2000- Vol. 31, N 7. — P. 777-786.
76. Tillakaratne N., Medina-Kauwe L., Gibson R. // Comp. Bio¬chem. Physiol. — 1995. — Vol. 112, N 2. — P. 247-263.
77. Trabucchi M., Chartrel N., Pelletier G. et al. // J. Comp. Neu¬rol. — 2000. — Vol. 419, N 2. — P. 223-232.
78. Winnock E, Ling Z., De Proft R. et al. // Am. J. Physiol. —1999- Vol. 282, N 4. — P. E937-E942.
79. Xin Y., Yu L., Chen Z. et al. // Genomics. — 2001. — Vol. 74, N 3. — P. 408-413.
80. Yamamoto R., Yanagita T., Kobayashi H. et al. // J. Neuro¬chem. — 1997. — Vol. 68, N 4. — P. 1655-1662.
аминопоиск
Синтаксис
aminolookup
aminolookup(SeqAA)
aminolookup('Code', CodeValue)
aminolookup('Integer', IntegerValue)
aminolookup('Abbreviation', AbbreviationValue)
aminolookup('Name', NameValue)
Описание
aminolookup отображает таблицу кодов аминокислоты, целых чисел, сокращений, имен и кодонов.
Поиск аминокислоты
| Код | Целое число | Сокращение | Имя аминокислоты | Кодоны |
|---|---|---|---|---|
A | 1 | Ala | Аланин | GCU GCC GCA GCG |
R | 2 | Arg | Аргинин | CGU CGC CGA CGG AGA AGG |
N | 3 | Asn | Аспарагин | AAU AAC |
D | 4 | Asp | Кислота аспарагиновой кислоты (Аспартат) | GAU GAC |
C | 5 | Cys | Цистеин | UGU UGC |
Q | 6 | Gln | Glutamine | CAA CAG |
E | 7 | Glu | Глутаминовая кислота (Глутамат) | GAA GAG |
G | 8 | Gly | Глицин | GGU GGC GGA GGG |
H | 9 | His | Гистидин | CAU CAC |
I | 10 | Ile | Изолейцин | AUU AUC AUA |
L | 11 | Leu | Лейцин | UUA UUG CUU CUC CUA CUG |
K | 12 | Lys | Лизин | AAA AAG |
M | 13 | Met | Метионин | AUG |
F | 14 | Phe | Фенилаланин | UUU UUC |
P | 15 | Pro | Пролин | CCU CCC CCA CCG |
S | 16 | Ser | Серин | UCU UCC UCA UCG AGU AGC |
T | 17 | Thr | Треонин | ACU ACC ACA ACG |
W | 18 | Trp | Триптофан | UGG |
Y | 19 | Tyr | Тирозин | UAU UAC |
V | 20 | Val | Valine | GUU GUC GUA GUG |
B | 21 | Asx | Аспарагин или кислота Аспарагиновой кислоты (Аспартат) | AAU AAC GAU GAC |
Z | 22 | Glx | Glutamine или Glutamic acid (Глутамат) | CAA CAG GAA GAG |
X | 23 | Xaa | Любая аминокислота | Все кодоны |
* | 24 | END | Кодон завершения (остановка перевода) | UAA UAG UGA |
- | 25 | GAP | Разрыв неизвестной длины | NA |
aminolookup( преобразует между однобуквенными кодами и трехбуквенными сокращениями от последовательности аминокислот. Если вход является вектором символов или строкой однобуквенных кодов, то выход является вектором символов трехбуквенных сокращений. Если вход является вектором символов или строкой трехбуквенных сокращений, то выход является вектором символов соответствующих однобуквенных кодов.SeqAA)
Если вы вводите один из неоднозначных однобуквенных кодов BZ, или X, эта функция отображает соответствующее сокращение от неоднозначного символа аминокислоты.
aminolookup('abc')
ans =
AlaAsxCysaminolookup('Code', отображает соответствующую аминокислоту трехбуквенное сокращение и имя.CodeValue)
aminolookup('Integer', отображает соответствующую аминокислоту однобуквенный код, трехбуквенное сокращение и имя.IntegerValue)
aminolookup('Abbreviation', отображает соответствующую аминокислоту однобуквенный код и имя.AbbreviationValue)
aminolookup('Name', отображает соответствующую аминокислоту однобуквенный код и трехбуквенное сокращение.NameValue)
Незаменимые аминокислоты. Справка — РИА Новости, 28.02.2011
Валин необходим для метаболизма в мышцах, он активно участвует в процессах восстановления поврежденных тканей. Помимо этого, он может быть использован мышцами в качестве дополнительного источника энергии. Валином богаты зерновая пища, мясо, грибы, молочные продукты, а также арахис.
Лизин необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых. Лизин участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Лейцин защищает мышечные ткани и может являться источником энергии. Его наличие способствует восстановлению костей, кожи, мышечной ткани. Снижает уровень холестерина. К пищевым источникам лейцина относятся бурый рис, бобовые, мясо, орехи.
Изолейцин необходим для синтеза гемоглобина, увеличивает выносливость и способствует восстановлению мышц. К пищевым источникам изолейцина относятся куриное мясо, кешью, яйца, рыба, чечевица, мясо, рожь, миндаль, нут (турецкий горох), печень, соя.
Треонин способствует поддержанию нормального белкового обмена в организме, помогая при этом работе печени. Необходим организму для правильной работы иммунной системы. Содержится в яйцах, молочных продуктах, бобах и орехах.
Метионин способствует нормальному пищеварению, сохранению здоровой печени, участвует в переработке жиров, защищает от воздействия радиации. Метионин содержится в бобовых, яйцах, чесноке, луке, йогурте мясе.
Фенилаланин является нейромедиатором для нервных клеток головного мозга. Эффективно помогает при депрессии, артрите, мигрени, ожирении. Не усваивается организмом, которому не хватает витамина С. Содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке, а также является составной частью синтетического сахарозаменителя — аспартама.
Триптофан используется организмом для синтеза в головном мозге серотонина, который в свою очередь является важнейшим нейромедиатором. Необходим при бессоннице, депрессии и для стабилизации настроения. Снижает вредное воздействие никотина. В пище эта аминокислота находится в буром рисе, деревенском сыре, мясе, бананах, йогурте, сушеных финиках, курице, кедровых орехах и арахисе.
Потребность человека в незаменимых аминокислотах составляет от 250 до 1100 миллиграммов в сутки. Существуют биологически активные добавки, содержащие необходимые дозы этих веществ. Особо внимание восполнению их в организме рекомендуется уделять вегетарианцам (поскольку некоторые незаменимые аминокислоты в необходимых количествах содержатся только в продуктах животного происхождения), беременным женщинам и спортсменам.
Материал подготовлен на основе информации открытых источников
Смотрите полный выпуск программы «Сытые и стройные» с Маргаритой Королевой: «Пища для мозга, или Что надо есть, чтобы ничего не забывать» >>
Новые научные данные: найдена доступная альтернатива старению
Результаты исследований, о которых мало кто знает. Совершенно незаметно прошла мимо широкого внимания сенсация, случившаяся на конференции по долголетию в начале октября 2014 года в Базеле, Швейцария
А ведь новые научные данные, обнародованные там, касаются каждого! Ученые из команды Эндрю Маркса из Колумбийского университета (Нью-Йорк) объявили, что одной из главных причин старения (а отнюдь не следствием) является возрастная потеря мышечной массы. Их данные подтверждают и специалисты Калифорнийского университета США, которые обнаружили, что вероятность умереть от сердечно-сосудистых заболеваний возрастает прямо пропорционально уменьшению мышечной массы в организме.
Согласно последней возрастной классификации Всемирной организации здравоохранения, молодой возраст заканчивается в 44 года, однако возрастная потеря мышечной массы начинается уже с 25 лет. Каждый мужчина в возрасте от 25 до 45 лет теряет мышечную массу и силу в среднем чуть менее 1% в год. Это число кажется небольшим, но в дальнейшем скорость потери растет.
Таким образом, если ничего специально не предпринимать, то к пожилому возрасту из-за этих процессов теряется до 60% изначальной мышечной массы, и любая болезнь способна заметно ускорить этот процесс.
Мышцы являются единственным местом, где тело может хранить существенные запасы своего главного строительного материала — аминокислот, из которых синтезируются различные белки. Таким образом, когда нам плохо, организм может оперативно взять в мышцах требуемые аминокислоты для восстановления органов. Если же мышечной массы мало, то шансы выздороветь и восстановиться могут снижаться. И каждый эпизод болезни может забирать вашу мышечную массу и уменьшать ваш ресурс сопротивления болезням с возрастом. Мышечное депо играет важную роль и в других важнейших процессах обмена. Сокращение доступного запаса аминокислот с возрастом приводит и к дефициту коллагена — белка, определяющего упругость кожи.
Сокращение объема мышц с возрастом, особенно объема важных скелетных мышц, приводит к уменьшению скорости основного обмена, и это создает заметную склонность к накоплению жира и лишнего веса. В масштабном исследовании 2010 г.* было протестировано более 8 тысяч людей разного возраста. Выяснилось, что у взрослых после 40 лет тело в состоянии покоя сжигает на 50–60 килокалорий в день меньше. Кажется, что это не слишком много, но, если не изменить уровень физической активности и пищевые привычки, вы набираете три килограмма за год!
Замещение с возрастом мышечной ткани на жировую является важной особенностью, маскирующей остроту проблемы потери мышц. С возрастом внешний вид и вес человека может почти не меняться, но при этом объем мышечной массы может заметно сократиться. Происходит увеличение объема внутреннего (висцерального) жира и снижение подкожно-жирового слоя. Происходящая жировая инфильтрация мышц сопровождается снижением объема и силы мышц. Чем меньше в организме мышц и больше жира, тем тяжелее двигаться и тем меньше стремление к физической активности. Чем дольше откладываются занятия спортом, тем сложнее решиться на них в дальнейшем. И это замкнутый круг, приковывающий нас к любимому дивану. Слабые мышцы приводят к потере чувства удовольствия от движения и со временем вызывают все более доминирующее ощущение усталости и раскоординированности — как тут найти силы для активных физических нагрузок?
Совсем недавно считалось, что регулярные легкие и умеренные физические нагрузки, такие как пешие прогулки, бег трусцой, спокойная ходьба на лыжах, медленное плавание, тренировки на беговых дорожках, способны оптимально поддерживать тренированность и являются некоторой профилактикой старости. Однако оказалось, что уменьшение объема мышц с возрастом обусловлено в основном уменьшением количества «быстрых» мышечных волокон — эти волокна отвечают за высокоинтенсивную физическую активность. Таким образом, обернуть процесс мышечной деградации вспять могут в основном относительно высокоинтенсивные тренировки, ориентированные на «быстрые» мышечные волокна, например, быстрый и рваный бег в игровых видах спорта, функциональный тренинг и грамотная работа всех групп мышц в тренажерном зале. А тренировки, направленные на «медленные» волокна, для борьбы с возрастными изменениями почти бесполезны.
Более того, бег или длительные кардиотренировки на беговой дорожке, например, способны легко привести к заметной потере мышечной массы! В этой связи повальное увлечение бегом трусцой и многочасовые забеги, бездумное увлечение кардиотренажерами кратковременно повышают уровень тренированности мышц ног и сердца, но не будут эффективными в плане борьбы с возрастной потерей мышечной массы и замещением ее жиром, не отложат старение. Для эффективной борьбы с возрастом и весом нужен тренажерный зал.
С возрастом следует тщательно подходить к выбору тренажерного зала — хорошо оснащенного и располагающего грамотными профессионалами, с которыми можно путем разносторонних упражнений построить заново красивое тело и после 50 лет. В возрасте на этот процесс может потребоваться целый год и немало денег, но это позволяет снизить непоправимый вред, который можно нанести организму, выполняя упражнения неумело, без знания всех необходимых тонкостей, не понимая состояния сердца, позвоночника и суставов, не владея техникой упражнений и необходимыми знаниями в области биохимии и эндокринологии, физиологии и реабилитации.
На сегодняшний день только один фитнес-центр в Новосибирске следует концепции «научного фитнеса», отвечает всем требованиям по работе с возрастными клиентами и располагает соответствующими тренерами и оборудованием — это новый фитнес-клуб EDGE, открывшийся в 2018 г.* Это единственный фитнес-клуб города, в котором работает команда сертифицированных реабилитологов*. Только в этом клубе в Новосибирске установлена система кардиомониторинга MyZone для непрерывного отслеживания оптимальной зоны кардионагрузок на тренировках**.
В EDGE также установлен единственный в Новосибирске аппарат InBody770 для измерения 75 показателей мышечной массы, висцерального и подкожного жира, состояния клеток, позволяющий четко и точно диагностировать любые изменения, включая возрастные, и отслеживать эффективность занятий***.
Генеральный директор EDGE Premium Fitness Club Максим Частковский:«В клубе собраны наиболее квалифицированные специалисты города в области фитнеса, тренеры с медицинским образованием, нутрициологи, реабилитологи — рассказывает управляющий клуба EDGE Premium Fitness Максим Частковский. — Здесь способны разработать для клиента индивидуальную программу питания и занятий для эффективного набора мышечной массы и потери жира без вреда для здоровья. Полгода занятий в клубе EDGE под руководством опытного тренера гарантированно дадут вам больше, чем несколько лет в обычном фитнес-клубе»
Эксперт по фитнесу и реабилитации, специалист по спортивной медицине, преподаватель в Сибирской Академии фитнеса, бодибилдинга и спорта, фитнес-директор EDGE Premium Fitness Александр Филимонов:«В хорошем клубе можно построить заново красивое тело и после 50 лет, — уверен Александр — На это может потребоваться целый год и это стоит денег, но это позволяет избежать непоправимого вреда, который можно нанести организму, выполняя упражнения некорректно, без знания тонкостей, не понимая состояния сердца, позвоночника и суставов, не владея техникой упражнений и необходимыми знаниями в области биохимии и эндокринологии, физиологии и реабилитации»
«Чем больше научно обоснованных методов в фитнесе, тем он эффективнее и безопаснее, — комментирует Александр Филимонов. — Изучение физиологии, спортивной медицины, прикладных программ тренировок позволит сделать тренировки намного более результативными и полезными для здоровья». По мнению Александра, особенно важен «научный» подход к тренировкам для зрелых людей.
Узнайте подробнее об эксклюзивных условиях членства с гарантией результата по тел. 8-800-234-00-57
Фитнес-клуб EDGE:
пр. Карла Маркса, 57
тел. 8-800-234-00-57
Instagram: @edgepremiumfitness
edgepremiumfitness.ru
Справка: Фитнес-клуб EDGE оснащен премиальными линейками самых современных на сегодняшний день тренажеров компании Life Fitness (США). Life Fitness внес клуб в список лучших проектов компании. Также клубу присвоен международный почетный статус официального тренировочного центра Hammer Strength. Это новый полноценный фитнес-клуб с бассейном, один из самых больших в Новосибирске. Он способен предложить необыкновенно высокий уровень оснащенности, гигиеничности, комфорта, сервиса, качества и профессионализма. Клуб признан самым стильным клубом Урала, Сибири и Дальнего Востока и входит в топ-5 фитнес-клубов России по данным авторитетного международного журнала AD.
Только факты:
1. Более 4000 кв. м, 10 фитнес-залов, бассейн, хамам, сауна и более 50 видов групповых программ.
2. Наивысшие стандарты гигиеничности и безопасности: каучуковые спортивные полы без запаха, противоскользящая плитка, сверхскоростная очистка воды в бассейне. Только сенсорная сантехника. Мощные системы кондиционирования.
3. Самое передовое оборудование в отрасли и новейшие инструменты фитнес-тестирования.
4. Сильный тренерский состав. EDGE — единственный в Новосибирске фитнес-клуб с командой сертифицированных реабилитологов.
5. Две большие бесплатные парковки, удобная транспортная развязка для жителей всех районов
6. Spa концепция. Ультрасовременный 18-метровый бассейн из нержавеющей стали с цветомузыкальной подсветкой, римской лестницей, гейзерами, водопадами и аэромассажем. Инновационный мраморный хаммам KLAFS длиной более 7 метров, с 4 системами парового удара. Роскошная дизайнерская сауна из канадского кедра площадью почти 16 кв.м.
7. Люксовые детали: полотенца и халаты в свободном доступе, охлажденные мини-полотенца, кнопочные души с термостатами, отсутствие турникетов, интерактивные тренажеры с самыми большими FHD экранами в отрасли.
8. Ультрасовременный дизайнерский интерьер. Открытое многоуровневое пространство с атриумом и панорамными окнами. Передовые решения и технологии, эксклюзивные материалы.
9. Клубная атмосфера: лобби, удобные общие зоны. Бар с DJ-сессиями и концертами только для членов клуба.
*По данным Новосибирской региональной общественной организации «Федерация фитнес-аэробики».
**По данным LifeFitness
***По данным InBody
Витамины и микроэлементы, влияющие на состояние сердечно-сосудистой системы (K, Na, Сa, Mg, P, Fe, Zn, Mn, Cu, витамины B1, B5, E, B9, B12)
Комплексное исследование, позволяющее оценить содержание витаминов и микроэлементов, влияющих на состояние и функционирование сердечно-сосудистой системы человека.
Синонимы русские
Витамины; микроэлементы; сердечно-сосудистая система.
Синонимы английские
Vitamins; minerals; cardiovascular system.
Метод исследования
Высокоэффективная жидкостная хроматография.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Нормальное состояние и функционирование сердечно-сосудистой системы зависит от множества причин. Большую роль в нормальной работе системы играют микроэлементы и витамины. Они обеспечивают постоянство клеточного состава, работу кардиомиоцитов, процессов сокращения сердечной мышечной ткани, проведении нервного импульса, состояние сосудистой стенки. К наиболее значимым микроэлементам, влияющим на функционирование сердечно-сосудистой системы, относятся калий (K), натрий (Na), кальций (Сa), магний (Mg), фосфор (P), железо (Fe), цинк (Zn), марганец (Mn), медь (Cu).
Калий является основным внутриклеточным катионом, участвующим в водно-электролитном обмене, поддержании кислотно-основного равновесия. Он взаимодействует с другими электролитами (натрием, хлором, бикарбонатом) и участвует в поддержании заряда мембран клеток, механизмах возбуждения мышечных и нервных волокон. Натрий представляет собой катион, который присутствует во всех жидкостях и тканях организма человека. В наибольшей концентрации, около 96 %, он содержится во внеклеточной жидкости и крови. Изменение уровня калия в сыворотке крови имеет важное клиническое значение, требует своевременных мер диагностики и лечения. Гипокалиемия и гиперкалиемия характеризуются изменениями со стороны работы сердечно-сосудистой системы и имеют специфические проявления при электрокардиографическом исследовании. Повышение уровня калия может приводить к серьезным нарушениям ритма, вплоть до прогрессирующей фибрилляции желудочков сердца.
Кальций к числу важнейших минералов организма человека. Около 99 % ионизированного кальция сосредоточено в костях и лишь менее 1 % циркулирует в крови. Концентрация кальция в цитоплазме значительно превышает его количество во внеклеточной жидкости. Он необходим для нормального сокращения сердечной мышцы, поперечно-полосатых мышц, для передачи нервного импульса, является компонентом свертывающей системы крови, каркаса костной ткани и зубов. Нарушение регуляции метаболизма кальция могут приводить к отклонениям в проводимости нервного импульса, мышечной возбудимости, сократительной способности миокарда и гладких мышц сосудистой стенки. Магний также является компонентом костной ткани, участвует в механизмах мышечных сокращений и проведении нервного импульса. По ряду эффектов является антагонистом кальция. При гипомагниемии возможно появление нарушений сердечного ритма в виде желудочковой экстрасистолии. При гипермагниемии – возникновение брадикардии, атриовентрикулярных блокад. Фосфор в составе органических и неорганических соединений участвует в метаболизме костной ткани, осуществлении нервно-мышечных сокращений, поддержании кислотно-щелочного баланса, в энергетическом обмене. Около 70-80 % фосфора в организме связано с кальцием, формируя каркас костей и зубов, 10 % находится в мышцах и около 1 % в нервной ткани. Клиническая симптоматика при гиперфосфатемии, как правило, обусловлена одновременно развивающейся гипокальциемией.
Железо является микроэлементом, входящим в состав гемоглобина, миоглобина, некоторых ферментов и других белков, которые участвуют в обеспечении тканей кислородом. В плазме крови ионы железа связаны с транспортным белком трансферрином. При дефиците железа развивается такое состояние, как анемия. Она характеризуется слабостью, головокружением, головными болями, одышкой. При повышении концентрации железа наряду с общими симптомами могут отмечаться нарушения сердечного ритма. Цинк – это микроэлемент, необходимый для нормального роста и дифференцировки клеток. Он является кофактором множества ферментов, входит в состав некоторых транскрипционных факторов и стабилизирует клеточные мембраны. При увеличении концентрации цинка отмечаются слабость, лихорадка, симптомы общей интоксикации организма, миалгии, нарушение сердечной деятельности. Марганец – это микроэлемент, необходимый для нормального формирования костной ткани, синтеза белков и регуляции клеточного метаболизма. При его повышении в крови могут отмечаться симптомы общей интоксикации, поражается множество систем и органов, в том числе печень, нервная и сердечно-сосудистая система. Отмечаются нарушения нервно-мышечной проводимости, характеризующиеся различными нарушениями ритма. Медь входит в состав многих ферментов, которые принимают участие в метаболизме железа, формировании соединительной ткани, выработке энергии на клеточном уровне, в нормальном функционировании нервной системы. При избытке меди отмечаются симптомы интоксикации. Недостаток меди может привести к развитию тяжелой анемии, характеризующейся наличием дефектных эритроцитов.
Витамины – это органические низкомолекулярные биологические вещества, которые не синтезируются в организме человека и поэтому должны поступать с пищей. Они обеспечивают нормальные метаболические процессы в организме и играют большую роль в профилактике и лечении многих заболеваний. По биохимическим свойствам все витамины делятся на две группы: жирорастворимые и водорастворимые. Жирорастворимые витамины способны всасываться в кишечнике только при наличии липидов и желчных кислот. Водорастворимые витамины не накапливаются в тканях, и их избыток удаляется из организма с мочой.
Витамин В1 (тиамин-пирофосфат) относится к водорастворимым витамином, является кофактором в реакциях декарбоксилирования аминокислот, превращения пирувата в ацетилкоэнзим А; играет роль в углеводном обмене; принимает участие в передаче нервного импульса. Нарушения в сердечно-сосудистой системе проявляются одышкой, тахикардией, повышением артериального давления, отеками.
Витамин В5 (пантотеновая кислота) является водорастворимым, входит в состав коэнзима А, необходимого для обмена жиров, углеводов, синтеза холестерола, стероидных гормонов, гемоглобина. При недостатке этого витамина поражаются практически все системы и органы организма человека, развивается слабость, потеря веса, анемии, появляются симптомы поражения нервной и костно-мышечной систем.
Витамин В9 (фолиевая кислота) – водорастворимый витамин, необходимый для синтеза нуклеиновых кислот, некоторых аминокислот, белков, фосфолипидов, повышает всасывание витамина В12. При нехватке фолиевой кислоты могут отмечаться нарушения в виде мегалобластной анемии, глоссита, эзофагита, атрофического гастрита, энтерита. Отмечается слабость сосудистой стенки, проявляющаяся кровоточивостью слизистых оболочек.
Витамин В12 (цианокобаламин) относится к группе водорастворимых витаминов. Он необходим для синтеза нуклеиновых кислот, образования эритроцитов, клеточного и тканевого обменов, участвует в поддержании нормального функционирования нервной системы. Недостаточность витамина приводит к развитию злокачественной (пернициозной) макроцитарной анемии.
Витамин Е (токоферол) представляет собой группу из нескольких соединений, относится к группе жирорастворимых витаминов и содержится в растительных маслах, зернах злаковых растений, орехах, зеленых овощах. Данный витамин входит в состав всех органов и тканей организма человека, больше всего его в жировой ткани, печени, мышцах и нервной системе. Витамин Е обладает антиоксидантной функцией, предохраняет от окисления ненасыщенные жирные кислоты, защищая от повреждения липидные структуры клеточных мембран и субклеточные структуры. Участвует в образовании гемоглобина, снижает риск развития атеросклероза и тромбозов. При дефиците данного витамина, в первую очередь, страдают ткани с высокой пролиферативной активностью и высокой интенсивностью процессов окисления: нервная ткань, мышечная ткань, эпителий половых желез, эндометрий, структуры печени, почек. Витамин Е необходим для профилактики и лечения злокачественных опухолей, сердечно-сосудистых заболеваний, атеросклероза. При гипервитаминозе отмечаются нарушения в свертывающей системе крови, тромбоцитопатии.
Для определения количественного состава микроэлементов и витаминов в сыворотке крови используется метод высокоэффективной жидкостной хроматографии. Он относится к современным хроматографическим методам анализа. Хроматография – это метод разделения и определения веществ, основанный на распределении компонентов между двумя фазами – подвижной и неподвижной. Жидкостная хроматография – метод разделения и анализа сложных смесей веществ, в котором подвижной фазой является жидкость. Он позволяет разделить и выявить количественно более широкий круг веществ с различной молекулярной массой и размерами.
Для чего используется исследование?
- Для диагностики концентрации микроэлементов и витаминов, влияющих на состояние и функционирование сердечно-сосудистой системы человека;
- для диагностики недостатка или избытка исследуемых микроэлементов/витаминов.
Когда назначается исследование?
- При симптомах недостатка микроэлементов и/или витаминов, характеризующихся нарушением деятельности сердечно-сосудистой системы;
- при симптомах токсического действия витаминов и микроэлементов при их избыточном содержании;
- при клинических признаках моно- или поливитаминной недостаточности, недостаточности микроэлементов в результате нарушения питания, нарушения всасывания, гипотрофиях, при парентеральном питании.
Что означают результаты?
Референсные значения
Селен в сыворотке: 23 — 190 мкг/л
Кобальт в сыворотке: 0,1 — 0,4 мкг/л
Хром в сыворотке: 0,05 — 2,1 мкг/л
Цинк в сыворотке: 650 — 2910 мкг/л
Никель в сыворотке: 0,6 — 7,5 мкг/л
Марганец в сыворотке: 0 — 2 мкг/л
Железо в сыворотке: 270 — 2930 мкг/л
Витамин В12 (цианокобаламин): 189 — 833 пг/мл
Витамин B9 (фолиевая кислота): 2,5 — 15 нг/мл
Витамин А (ретинол): 0,3 — 0,8 мкг/мл
Витамин С (аскорбиновая кислота): 4 — 20 мкг/мл
Фосфор: 22 — 517,1 мг/л
Причины повышения:
- нарушение метаболизма микроэлементов и витаминов;
- избыточное поступление микроэлементов;
- нарушение баланса микроэлементов;
- пероральное или парентеральное введение препаратов витаминов.
Причины понижения:
- недостаточное поступление микроэлементов в организм человека;
- недостаточное поступление и всасывание витаминов в организме;
- повышенное использование микроэлементов, нарушение их баланса в организме;
- повышенное использование витаминов в метаболизме.
Что может влиять на результат?
- Прием некоторых лекарственных препаратов может влиять на содержание электролитов в исследуемом биоматериале;
- прием витаминов и витаминсодержащих лекарственных препаратов влияет на истинный результат исследования.
Также рекомендуется
[06-250] Витамины и микроэлементы, участвующие в регуляции функции поджелудочной железы и углеводного обмена (Cr, K, Mn, Mg, Cu, Zn, Ni, витамины A, B6)
[06-251] Витамины и микроэлементы, участвующие в регуляции функции щитовидной железы (I, Se, Mg, Cu, витамин B6)
[06-244] Витамины и микроэлементы, влияющие на состояние кожи, ногтей, волос (K, Na, Ca, Mg, Fe, Cu, Zn, S, P, витамины A, C, E, B1, B2, B3, B5, B6, B9, B12)
[06-230] Комплексный анализ на витамины (A, D, E, K, C, B1, B5, B6)
[06-245] Витамины и микроэлементы, влияющие на состояние костной системы (K, Ca, Mg, Si, S, P, Fe, Cu, Zn, витамины K, D, B9, B12)
[06-246] Витамины и микроэлементы, влияющие на состояние мышечной системы (K, Na, Ca, Mg, Zn, Mn, витамины B1, B5)
[06-247] Витамины и микроэлементы, влияющие на состояние женской репродуктивной системы (Fe, Cu, Zn, Se, Ni, Co, Mn, Mg, Cr, Pb, As, Cd, Hg, витамины A, C, E, омега-3, омега-6 жирные кислоты)
Кто назначает исследование?
Терапевт, врач общей практики, кардиолог, гематолог, невролог, дерматолог.
Литература
- Taguchi K, Fukusaki E, Bamba T Simultaneous analysis for water- and fat-soluble vitamins by a novel single chromatography technique unifying supercritical fluid chromatography and liquid chromatography. / J Chromatogr A. 2014 Oct 3;1362:270-7.
- Долгов В.В., Меньшиков В.В. Клиническая лабораторная диагностика: национальное руководство. – Т. I. – М. : ГЭОТАР-Медиа, 2012. – 928 с.
- Камышников В.С. и др. Методы клинических лабораторных исследований / под ред. В.С. Камышникова.- 3-е изд., перераб. и доп. – М.: МеУДпресс-информ, 2009. – 752 с.: ил.
- Fauci, Braunwald, Kasper, Hauser, Longo, Jameson, Loscalzo Harrison’s principles of internal medicine, 17th edition, 2009.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
(PDF) Удобное восстановление α-аминокислот до 1,2-аминоспиртов с сохранением оптической чистоты
Удобное восстановление
-аминокислот The Open Organic Chemistry Journal, 2008, том 2 109
мин, раствор охлаждали до 0 oC и одной порцией добавляли раствор NaBh5
(190 мг, 5 ммоль) в h3O (5 мл).
Затем раствор перемешивали в течение 30 мин. К этому добавляли
1 н. HCl (50 мл) и раствор экстрагировали EtOAc
(2 х 200 мл).Объединенные экстракты промывали нас.
NaHCO3 (50 мл), рассол (50 мл), высушенный (MgSO4) и
пропустили через короткий слой силикагеля, получив белое твердое вещество
(1,20 г, 88%). РС; ES + m / z 455 (M + H +).
БЛАГОДАРНОСТИ
Авторы благодарят Кена Фарбера за хиральный анализ методом ВЭЖХ.
СПИСОК СОКРАЩЕНИЙ
Ala = аланин
Asp = аспарагиновая кислота
CDI = 1,1′-карбонилдиимидазол
Cha = циклогексилаланин
Chg = циклогексилаланин
Chg = циклогексилглицинская кислота
000 диапропутиновая кислота диапропутинная кислотаhomoLeu = гомолейцин
homoPhe = гомофенилаланин
Ile = изолейцин
Leu = лейцин
Lys = лизин
Nle = норлейцин
-nitro000 3′-NO = пролинTle = трет-бутиллейцин
Val = валин
ССЫЛКИ
[1] Pridgen, L.N .; Prol Jr., J .; Александр, Б .; Gillyard, L. J. Org.
Chem., 1989, 54, 3231.
[2] Giannis, A .; Сандхофф, К. Энгью. Chem. Int. Эд. Engl., 1989, 28,
218.
[3] Gage, J.R .; Эванс, Д.А. Орг. Synth., 1989, 68, 77.
[4] Abiko, A .; Masamune, S. Tetrahedron Lett., 1992, 33, 5517.
[5] McKennon, M.J .; Мейерс, A.I .; Драуз, К .; Schwarm, M. J. Org.
Chem., 1993, 58, 3568.
[6] Narasimhan, S .; Мадхаван, С.; Прасад, К. Synth. Commun.,
1996, 26, 703.
[7] Anand, R.C .; Vimal Tetrahedron Lett., 1998, 39, 917.
[8] Quagliato, D.A .; Andrae, P.M .; Matelan, E.M. J. Org. Chem.,
,, 2000, 65, 5037.
,[9] García, M .; Serra, A .; Rubiralta, M .; Diez, A .; Segarra, V .; Лозоя,
Е .; Ryder, H .; Palacios, J.M. Tetrahedron: Asymm., 2000, 11, 991.
[10] Narasimhan, S .; Balakumar, R. Synth. Commun., 2000, 30, 4387.
[11] Кокотос, Г.Synthesis, 1990, 299.
[12] Rodriguez, M .; Llinares, M .; Doulut, S .; Heitz, A .; Martinez, J.
Tetrahedron Lett., 1991, 32, 923.
[13] Moree, W .; Van der Marel, G.A .; Liskamp, R.M.J. Tetrahedron
Lett., 1992, 33, 6389.
[14] Ho, M .; Chung, J. K. K .; Tang, N. Tetrahedron Lett., 1993, 34,
6513.
[15] Wei, Z. –Y .; Knaus, E. E. J. Org. Chem., 1993, 58, 1586.
[16] Ouerfelli, O .; Исида, М.; Shinozaki, H .; Nakanishi, K. Ohfune, Y.
Synlett, 1993, 409.
[17] Ravikumar, K.S .; Chandrasekaran, S.J. Org. Chem., 1996, 61, 826.
,[18] Kokotos, G .; Noula, C.J. Org. Chem., 1996, 61, 6994.
,[19] Falorni, M .; Giacomelli, G .; Прочедду, А .; Taddei, M. J. Org.
Chem., 1999, 64, 8962.
[20] McGeary, R.P. Tetrahedron Lett., 1998, 39, 3319.
[21] Herbert, J.M .; Hewson, A.T .; Peace, J. E. Synth. Commun., 1998,
28, 823.
[22] Falorni, M .; Porcheddu, A .; Taddei, M. Tetrahedron Lett., 1999,
40, 4395.
[23] Feng, X .; Эдстрем, Э. Tetrahedron: Asymm., 1999, 10, 99.
[24] Kim, H.-O .; Kahn, M. Synlett, 1999, 1239.
[25] Saha, A.K .; Schultz, P .; Rapoport, H. J. Am. Chem. Soc., 1989,
111, 4856.
[26] Skiles, J. W .; Fuchs, V .; Леонард, С. Ф. Биоорг. Med. Chem. Lett.,
1991, 1, 69.
[27] Mickelsonm J. W .; Jacobson, E. J. Tetrahedron Asymm., 1995, 6,
19.
[28] Kim, H. –O .; Kahn, M. Synlett, 1995, 549.
[29] Gomez, -Monterry, I .; Gonzalez-Muniz, R .; Herranz, R .; Gracia-
Lopez, M. T. Tetrahedron Lett., 1993, 34, 3593.
[30] Schuda, P. F .; Greenlee, W. J .; Chakravarty, P.K .; Eskola, P.J.
Org. Chem., 1988, 53, 873.
[31] Harris, B.D .; Bhat, K. L .; Джули, М. М. Tetrahedron Lett., 1987,
26, 2837.
Поступила: 29 августа 2008 г. Доработана: 16 октября 2008 г. Принята: 16 октября 2008 г.
© Hwang et al .; Лицензиат Bentham Open.
Это статья с открытым доступом, лицензированная в соответствии с условиями некоммерческой лицензии Creative Commons Attribution
(http://creativecommons.org/licenses/by-nc/3.0/), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования работы
.
Аминокислоты, образующиеся при одноэлектронной активации диоксида углерода
План разработки α-карбоксилирования аминов CO2. а. Образование углерод-углеродной связи с CO2 обычно основывается на двухэлектронных реакциях с расширенной π-системой или сильным нуклеофилом. Кат., Катализатор. б) Одноэлектронное восстановление диоксида углерода и его реакция с α-аминорадикалом с образованием α-аминокислоты. c: Установка непрерывного потока для фотоокислительного каталитического синтеза α-аминокислот.Реагенты вводили с помощью газонепроницаемого шприца, который содержал раствор аминового субстрата, основания и катализатора. Газ CO2 был дозирован в систему с помощью контроллера массового расхода (MFC). Эти два потока были объединены Т-смесителем перед облучением ультрафиолетовой лампой. Давление CO2 контролируется регулятором противодавления (BPR). Кредит: (c) Nature Chemistry (2016). DOI: 10.1038 / nchem.2690(Phys.org) — Двуокись углерода, распространенный парниковый газ, очень трудно использовать в качестве источника углерода для образования углерод-углеродных связей.CO 2 очень стабилен и инертен, требует чрезвычайно сложных или токсичных реагентов для образования углеродных связей.
Хиовон Сео, Мэтью Х. Катчер и Тимоти Ф. Джемисон из Массачусетского технологического института разработали систему с непрерывным потоком, которая позволяет одноэлектронное восстановление CO 2 , который объединяется с различными аминами с образованием α- аминокислоты.Их методология включает использование фотоокислительного катализатора и, используя их проточную систему, оптимизированные условия реакции для получения региоселективных α-аминокислот с высокими выходами. Их работа опубликована в журнале « Nature Chemistry ».
Ключом к методике этой группы являются фотоокислительный катализатор и способность точно настраивать условия реакции с помощью их системы непрерывного потока. При определении подходящего фотоокислительного катализатора Seo et al. протестировали пара-терфенил на основе предшествующей работы группы Янагида.Этот катализатор был привлекательным, потому что он имеет достаточно высокий восстановительный потенциал для снижения CO 2 .
Катализатор фотоокислительного восстановления служил для удаления электрона из амина, а также для катализа восстановления CO 2 . Затем эти две радикальные молекулы объединяются с образованием связи C-C в бензильном C-H N-бензильного соединения, в результате чего образуется α-аминокислота. Дополнительные эксперименты показали, что эта реакция хорошо работает с различными аминами, включая те, которые не имеют бензильного углерода.
Второй важный аспект этого механизма реакции — установка непрерывного потока. Газообразный диоксид углерода смешивают с жидким аспиратором амина и катализатора. Эта система позволяла контролировать поток CO 2 , что, в свою очередь, допускало контролируемую комбинацию радикала амина и радикала CO 2 . Seo et al. смогли оптимизировать давление и поток CO 2 для получения максимального выхода. Дополнительным преимуществом этой установки была короткая длина пути света, которая также помогала контролировать, когда он активирует катализатор и вызывает окислительно-восстановительную реакцию.
Используя N-бензилпиперидин в качестве модели реакции, Seo et al. сначала протестировали свой аппарат, используя условия реакции, о которых сообщила группа Янагида. Затем они оптимизировали условия, чтобы в конечном итоге получить желаемую α-аминокислоту с выходом 92%. Среди своих изменений они добавили основание трифторацетат калия (KOCOCF 3 ), что помогло с выходами и региоселективностью. Хотя механистические исследования не показали, как именно используется основание, Seo et al. предположили, что он служил стабилизатором соли.
Кроме того, Seo et al. оптимизировали их реакцию с помощью УФ-фильтра. Это предотвратило образование нежелательных побочных продуктов в результате коротковолнового облучения. При этом они получили 92% выход желаемой α-аминокислоты. Перед использованием УФ-фильтра они получили бы два разных регио-изомера, но после фильтра они увидели почти исключительную региоселективность для желаемого продукта (т.е. карбоксилирование в бензильном положении).
Достигнув оптимальных условий реакции, они попытались получить различные α-аминокислоты.Примечательно, что все случаи показали региоселективность более 20 к 1 в пользу желаемой α-аминокислоты. Среди своих результатов они обнаружили, что N-бензилпипердины с орто-, мета- и пара-алкильным замещением работают хорошо, приводя к желаемым α-аминокислотам, так же как и хлорарены и различные амины. Амины с несколькими типами гетероциклов и конденсированных колец хорошо переносили условия реакции.
N-бензиламинов с электронно-бедными аренами не помогли, как и спирты, кетали или первичные амины.Однако могут быть получены замаскированные версии спиртов и кеталей, и реакция действительно допускает аналоги 4-пиперидона в качестве возможной бис-защитной группы для первичных аминов. Также их реакция прошла хорошо при тестировании на известном фармацевтическом ингредиенте с гетероциклом и без бензильной связи C-H (тиклопидин).
«Нам очень интересна фундаментальная химия анион-радикала диоксида углерода, который мы предложили в качестве ключевого промежуточного соединения в этом процессе», — говорит профессор Тимоти Джеймисон.«Некоторые из наших текущих усилий направлены на использование этой поддерживающей платформы в качестве средства для достижения этой цели».
Региоселективное гидроарилирование алкинов с образованием орто-, пара- и метапродуктов.
Дополнительная информация: Hyowon Seo et al.Фотоокислительная активация диоксида углерода для синтеза аминокислот в непрерывном потоке, Nature Chemistry (2016). DOI: 10.1038 / nchem.2690
Аннотация
Хотя диоксид углерода (CO2) широко распространен, его низкая реакционная способность ограничивает его использование в химическом синтезе. В частности, методы образования углерод-углеродных связей обычно основываются на двухэлектронных механизмах активации CO2 и требуют высокоактивированных партнеров по реакции. В качестве альтернативы радикальные пути, доступ к которым осуществляется посредством фотоокислительного катализа, могут обеспечить новую реакционную способность в более мягких условиях.Здесь мы демонстрируем прямое связывание СО2 и аминов посредством одноэлектронного восстановления СО2 для непрерывного проточного синтеза α-аминокислот с фотоокислительным катализатором. Используя преимущества использования газов и фотохимии в потоке, коммерчески доступный органический фотоокислительный катализатор осуществляет селективное α-карбоксилирование аминов, которые несут различные функциональные группы и гетероциклы. Предварительные механистические исследования подтверждают активацию CO2 и образование углерод-углеродных связей посредством одноэлектронных путей, и мы ожидаем, что эта стратегия вдохновит на новые перспективы использования этого химического сырья в органическом синтезе.
© 2017 Phys.org
Ссылка : Аминокислоты, образовавшиеся в результате одноэлектронной активации диоксида углерода (2017, 12 января) получено 2 июня 2021 г. с https: // физ.org / news / 2017-01-amino-acid-single-electronic-carbon-dioxide.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
«Сокращенный алфавит пребиотических аминокислот оптимально кодирует конфор» Армандо Д.Солис
Аннотация
Фон
Существует широкое согласие с тем, что только часть из двадцати стандартных аминокислот пребиотически существовала в концентрациях, достаточных для образования функциональных полипептидов. Мы спрашиваем, как это подмножество, постулируемое как {A, D, E, G, I, L, P, S, T, V}, могло образовывать структуры, достаточно стабильные, чтобы обнаруживать метаболические пути. Вдохновленные экспериментами по сокращению алфавита, мы провели вычислительный анализ, чтобы измерить поведение структурного кодирования последовательностей, упрощенных сокращенными алфавитами.Мы стремились определить характеристики набора пребиотиков, которые наделяли бы его уникальными свойствами, относящимися к структуре, стабильности и складчатости.
Результаты
Опираясь на большой набор данных однодоменных белков, мы использовали теоретико-информационную меру, чтобы оценить, насколько хорошо набор пребиотических аминокислот сохраняет информацию о складках по сравнению со всеми другими возможными наборами из десяти аминокислот. Обширная процедура виртуального мутагенеза показала, что набор пребиотиков отлично сохраняет информацию, зависящую от последовательности, как в отношении конформации остова, так и в матрице третичного контакта белков.Мы заметили, что сохранение информации зависит от класса складок: набор пребиотиков в достаточной степени кодирует структурное пространство складок α / β и α + β и, в меньшей степени, складок всех α и всех β. Набор пребиотиков оказался недостаточным для кодирования малых белков. Оценивая, насколько хорошо набор пребиотиков различает нативные и неправильные соответствия структуры последовательности, мы обнаружили, что складки α / β и α + β демонстрируют более выраженные энергетические разрывы с набором пребиотиков, чем почти со всеми альтернативами.
Выводы
Набор пребиотиков оптимально кодирует локальные каркасные структуры, которые появляются в свернутой среде, и почти оптимально кодирует третичную контактную матрицу существующих белков.Паттерны, специфичные для класса складок, наблюдаемые в результате нашего структурного анализа, подтверждают постулируемую временную шкалу появления складок в протеогенезе, полученную из анализа протеомной последовательности. Полипептиды, возникающие в пребиотической среде, скорее всего, будут образовывать α / β- и α + β-подобные складки, если вообще будут. Мы делаем вывод, что прогрессивное расширение алфавита позволило повысить конформационную стабильность и функциональную специфичность более поздних складок, включая все-α, все-β и небольшие белки. Наши результаты показывают, что пребиотические последовательности подвержены мутациям, которые значительно снижают нативную конформационную энергию и увеличивают дискриминацию среди неправильных складок.Это свойство могло способствовать возникновению функциональных протоферментов до расширения полного аминокислотного алфавита.
Прием витаминов для снижения уровня аминокислот в крови не снижает риск повторного инсульта
Согласно исследованию, проведенному у пациентов с перенесенным инсультом, снижение уровня гомоцистеина (который, как считается, способствует развитию сердечных заболеваний) в крови при терапии высокими дозами витаминов не снижает риск повторного инсульта, сердечных заболеваний или смерти. выпуск от 4 февраля Журнал Американской медицинской ассоциации (JAMA).Предыдущие исследования показали связь между повышенным уровнем общего гомоцистеина и инсультом и сердечными заболеваниями, согласно справочной информации в статье. Фолиевая кислота, пиридоксин (витамин B6) и кобаламин (витамин B12) снижают уровень гомоцистеина в плазме. Эффективность терапии, снижающей уровень гомоцистеина, для снижения риска инсульта не подтверждена рандомизированными исследованиями.
Джеймс Ф. Тул, доктор медицинских наук, Медицинский факультет Университета Уэйк-Форест, Уинстон-Салем, штат Нью-Йорк.С. и его коллеги провели двойное слепое рандомизированное контролируемое исследование с сентября 1996 г. по май 2003 г., чтобы определить, снижают ли высокие дозы фолиевой кислоты, витамина B6 и витамина B12 риск дополнительного инсульта в течение 2-летнего периода, по сравнению с низкими дозами этих витаминов. В исследование были включены 3680 взрослых, перенесших инсульт, не приводящий к инвалидности. Он проводился в 56 больницах при университетах, общественных больницах, частных неврологических клиниках и медицинских центрах по делам ветеранов в США, Канаде и Шотландии.
Пациенты были случайным образом распределены для приема один раз в день высокодозного препарата (n = 1827), содержащего 25 мг витамина B6, 0,4 мг витамина B12 и 2,5 мг фолиевой кислоты; или состав с низкой дозой (n = 1853), содержащий 200 микрограммов витамина B6, 6 микрограммов витамина B12 и 20 микрограммов фолиевой кислоты.
Среднее снижение общего гомоцистеина было больше в группе с высокими дозами витаминов, чем в группе с низкими дозами, но никакого эффекта лечения не было ни в одной конечной точке.Вероятность события (инсульт, ИБС [ишемическая болезнь сердца] или смерть) в течение 2 лет составляла 18,0 процента в группе высокой дозы и 18,6 процента в группе низкой дозы. Риск ишемического инсульта в течение 2 лет составил 9,2 процента для групп с высокой дозой и 8,8 процента для групп с низкой дозой.
Тем не менее, авторы обнаружили, что «существует устойчивая и дифференцированная связь между исходным уровнем общего гомоцистеина и результатами. Более низкий уровень общего гомоцистеина на 3 микромоль / литр был связан с 10-процентным снижением риска инсульта, на 26 процентов меньшим риском развития инсульта. События ИБС, а также снижение риска смерти на 16% в группе низких доз и незначительно меньший риск в группе высоких доз на 2% для инсульта, 7% для событий ИБС и 7% для смерти.»
«Таким образом, [это] исследование показало, что умеренное снижение общего уровня гомоцистеина после ишемического инсульта не оказало влияния на сосудистые исходы в течение 2 лет наблюдения. Однако из-за постоянных результатов ассоциации общего уровня гомоцистеина с сосудистым инсультом. риск, дальнейшее изучение гипотезы оправдано, и могут потребоваться более длительные испытания в различных популяциях с повышенным уровнем общего гомоцистеина », — заключают исследователи.
###
Примечание редактора: это исследование было поддержано Национальным институтом неврологических расстройств и инсульта.Сырье для витаминов было поставлено компанией Roche Inc, Paramus, N.J.
. РЕДАКЦИЯ: ЗАДАЧА ПРОФИЛАКТИКИ ИНСУЛЬТА
В сопроводительной редакционной статье Дэниел Ф. Хэнли, доктор медицины из Медицинских учреждений Джона Хопкинса, Балтимор, исследует тему профилактики инсульта.
«Отказ от курения, физические упражнения и снижение артериального давления — все это уместные и важные меры по снижению риска инсульта. В настоящее время доступно еще больше доказательств того, что агрессивное лечение этих индивидуальных факторов риска приводит к уменьшению инсульта.Несмотря на осведомленность о пользе, клиницисты, по-видимому, еще не согласились с необходимостью агрессивной оптимизации медицинских и поведенческих факторов, ведущих к снижению риска.
«Одно из направлений исследований, заслуживающее серьезного внимания, — это поиск новых средств устранения установленных, неулучшенных факторов риска инсульта с помощью проверенных схем лечения. Такой подход должен учитывать несколько факторов одновременно, но его следует изучить, чтобы улучшить период самостоятельной жизни для стареющего населения. есть риск инсульта », — пишет он.
(JAMA. 2004; 291: 621-622. Доступно после эмбарго на JAMA.com.)
Заявление об ограничении ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.
% PDF-1.6 % 1675 0 obj> эндобдж xref 1675 91 0000000016 00000 н. 0000003937 00000 н. 0000004074 00000 н. 0000004453 00000 п. 0000004506 00000 н. 0000004697 00000 н. 0000004979 00000 п. 0000005029 00000 н. 0000005107 00000 н. 0000005515 00000 н. 0000006315 00000 н. 0000006585 00000 н. 0000049149 00000 п. 0000051843 00000 п. 0000051881 00000 п. 0000052680 00000 п. 0000064217 00000 п. 0000064291 00000 п. 0000064383 00000 п. 0000064483 00000 п. 0000064539 00000 п. 0000064665 00000 п. 0000064721 00000 п. 0000064897 00000 п. 0000065235 00000 п. 0000065291 00000 п. 0000065427 00000 н. 0000065604 00000 п. 0000065749 00000 п. 0000065805 00000 п. 0000065970 00000 п. 0000066117 00000 п. 0000066239 00000 п. 0000066294 00000 п. 0000066455 00000 п. 0000066638 00000 п. 0000066773 00000 п. 0000066828 00000 п. 0000066988 00000 п. 0000067099 00000 п. 0000067147 00000 п. 0000067240 00000 п. 0000067288 00000 п. 0000067386 00000 п. 0000067434 00000 п. 0000067527 00000 н. 0000067575 00000 п. 0000067630 00000 н. 0000067846 00000 п. 0000067901 00000 п. 0000068093 00000 п. 0000068148 00000 п. 0000068328 00000 п. 0000068383 00000 п. 0000068616 00000 п. 0000068671 00000 п. 0000068939 00000 п. 0000068994 00000 н. 0000069049 00000 н. 0000069105 00000 п. 0000069316 00000 п. 0000069372 00000 п. 0000069663 00000 п. 0000069719 00000 п. 0000069908 00000 н. 0000069963 00000 н. 0000070157 00000 п. 0000070212 00000 п. 0000070417 00000 п. 0000070472 00000 п. 0000070669 00000 п. 0000070724 00000 п. 0000070779 00000 п. 0000070835 00000 п. 0000070989 00000 п. 0000071045 00000 п. 0000071249 00000 п. 0000071305 00000 п. 0000071479 00000 п. 0000071535 00000 п. 0000071805 00000 п. 0000071861 00000 п. 0000072070 00000 п. 0000072126 00000 п. 0000072182 00000 п. 0000072238 00000 п. 0000072495 00000 п. 0000072551 00000 п. 0000072607 00000 п. 0000003725 00000 н. 0000002179 00000 п. трейлер ] >> startxref 0 %% EOF 1765 0 obj> поток 3JE78, Wo.g ׁ bɔ * 2qcga-eTu4o «dEB8D7j / \ w @ & = FonK2cm, Ͻuh27Mh`oD`0q UtcXhM> 😯 {Q LJ / f? {2n ͻӆ? ǴWGr3r> V
Влияние добавок аминокислот с пониженным содержанием сырого протеина в рационе на выбросы парниковых газов у свиней
Питомник Методы исследований | Результаты | Публикации
Методы исследования выращивания и финиша | Результаты | Публикации
Методы баланса азота | Результаты
Валидационное исследование (крупномасштабное) для методов питомниководства и выращивания растений | Результаты (доступны в начале 2016 г.)
Включение этих данных в модели
Контактная информация
Др.Чарльз Максвелл, доктор Дженни Попп и доктор Ричард Ульрих — Университет Арканзаса; Доктор Скотт Рэдклифф — Университет Пердью и доктор Марк Ханиган — Технологический институт Вирджинии
Зачем изучать сырой белок и углеродный след?
Было показано, что максимальное использование аминокислот кормового качества (FGAA) и снижение содержания сырого протеина в рационах свиней резко снижает экскрецию азота как в питомниках, так и в выращиваемых / откормочных свиньях, что может существенно снизить выбросы закиси азота (N 2 O), связанные с использование навоза в свиноводстве.Потенциал глобального потепления N 2 O примерно в 298 раз выше, чем у CO 2 (двуокись углерода). Также неоднократно было показано, что снижение содержания сырого протеина (CP) в рационах гроверов и откормашек улучшает качество туши за счет увеличения внутримышечного жира. Хотя некоторые кристаллические аминокислоты уже широко используются в производстве свинины, максимальный уровень снижения CP в сочетании с оптимальной скоростью включения аминокислот не был в достаточной степени определен для широкого применения в свиноводстве.
Цели проекта:
Гипотеза: Снижение диетической ХП при поддержании аминокислот (AA) на эквивалентных уровнях стандартизированной перевариваемости подвздошной кишки (SID) за счет добавления AA в корм уменьшит экскрецию азота (N) и выбросы парниковых газов (ПГ) (N 2 O из навоза) без ущерба для продуктивности свиней или выхода туш.
- Определите практические пределы снижения ЦП в рационах поросят на разведении и откорме.
- Подтвердить эффективность пониженного содержания азота в рационе как стратегии снижения выбросов парниковых газов.
- Предоставляет данные для валидации модели физиологии животных, способной прогнозировать продуктивность свиней и соответствующие характеристики навоза (количество и состав для DNDC навоза).
- Сравните стратегии составления ME и NE в отношении отложения постной ткани и накопления жира.
- Определите влияние уровней аминокислот в пище на передачу сигналов при регуляции роста тканей.
- [Годовые отчеты за 2014 и 2015 годы указали, что была добавлена еще одна цель] Оценить сокращение выделения азота из навоза с помощью исследования баланса азота.
Исследования проводились на нескольких объектах. Одно из них было в Университете Арканзаса, а второе — в Центре экологических исследований свиней Purdue (SERB). Смотрите видео выше, чтобы узнать больше об этих объектах). Полученные данные были использованы при моделировании в Технологическом институте Вирджинии. В конечном итоге модель была включена в Калькулятор экологического следа свиней.
Питомник
Что мы сделали? (Методы или экспериментальный план)
Эксперимент 1
Чтобы оценить максимальную замену CP на FGAA, 320 свиней-отъемышей были распределены в загоны сбалансированного пола в помещении для отъема до конца (8 свиней на загон).Внутри блоков загоны были случайным образом назначены на 1 из 5 диетических процедур. Диеты были составлены таким образом, чтобы поддерживать постоянный уровень ME и SID Lys во время лечения с использованием SID Lys, установленного на уровне 95% (PIC Nutrient Specification Manual, 2011). Рационы были составлены таким образом, чтобы соответствовать рекомендациям по соотношению SID AA для других незаменимых AA (SID) для поросят до 6-го ограничивающего AA (PIC Nutrient Specifications Manual, 2011). Для каждой фазы рационы Ctrl не содержали FGAA, тогда как Lys HCl добавлялся равными порциями за счет CP (SBM, рыбная мука [FM] и мука из птицы [PM] в фазе 1, FM и PM в фазе 2, и SBM в фазе 3).В результате этой процедуры составления рационы были ниже требований His и Phe / Tyr SID для наивысшего уровня снижения CP. Уровни включения CP и Lys были проанализированы.
Эксперимент 2
Второе трехфазное исследование в питомнике было проведено со свиньями, отлученными от груди в 21 день, для дальнейшей оценки пределов снижения CP в рационах для питомников и сравнения эффективности рационов свиней, получавших корм на основе состава, на основе ME и NE. В исследовании участвовало 7 свиней на загон и 7 повторов на обработку. Пищевые ингредиенты были аналогичны тем, которые использовались в эксперименте 1, за исключением того, что вместо рыбной муки использовался концентрат соевого белка.Диетические процедуры включали: 1) контрольный рацион, составленный на основе ME и с использованием FGAA для достижения «заданного значения Trp» без добавления Trp кормового качества в фазах 1 и 2 и 0,02% добавленного Trp в фазе 3; 2) Рацион, составленный на основе ME и отвечающий «его заданному значению» без добавления сорта корма His; 3) Как 2 с диетами, составленными на основе NE.
Питомник Что мы узнали (результаты)?
Эксперимент 1
Свиньи, получавшие рационы RCP 1, RCP 2 и RCP 3 в фазах 1, 2 и 3, и для общего исследования имели аналогичные ADG и BW, но показатели роста снизились у свиней, получавших рационы RCP 4 (Таблица 5; Квадратичный эффект, P <0.01). Подобный ответ наблюдался в ADFI во все периоды времени, кроме фазы 1, где ADFI был одинаковым для всех видов лечения. В фазе 1 отношение G: F соответствовало аналогичной реакции (квадратичный эффект, P <0,01), но линейно уменьшалось в фазе 2 (P <0,08), 3 и в целом (P <0,01). Следует отметить, что диета RCP 4 была ниже требований для SID His: Lys и Phe / Tyr: Lys, что могло бы объяснить снижение работоспособности. Результаты этого исследования устанавливают, что высокое включение Lys кормового качества за счет интактных белков можно скармливать без снижения ADG и ADFI, за исключением самого высокого уровня FGAA, когда не выполнялись требования для всех IDAA.Однако G: F обычно снижалось при более высоких уровнях включения FGAA, особенно в фазе 3.
Эксперимент 2
Не наблюдалось различий в ADG, ADFI или G: F (Таблица 6) ни в одной фазе или в целом в рационы свиней, получавшие корм, составленный на основе агрессивного включения FGAA (His Set Point) на основе ME (Trt.2) или NE (Trt. 3), по сравнению со свиньями, получавшими уровни включения AA, используемые в настоящее время в свиноводстве (Trt. 1). Эти результаты показывают, что у поросят в разведении следует иметь возможность использовать заданное значение His при составлении рационов на основе АК, не заботясь о продуктивности свиней.
Предыдущий эксперимент в питомнике (Эксперимент 1; Bass et al., 2013), проведенный для оценки кормления кормовых свиней с пониженным содержанием ЦП с наивысшими уровнями FGAA, привел к плохим показателям роста, особенно соотношению G: F в фазе 3 и в целом в питомнике период. В предыдущем исследовании экспериментальные рационы были составлены таким образом, чтобы удовлетворять 95% потребности в SID Lys для поросят-доращивании. Кроме того, RCP 4, который был составлен с наивысшим уровнем FGAA, не отвечал требованиям Lys / NE для His и Phe.
Заключение
В заключение, в отличие от предыдущего исследования, на показатели роста поросят не повлиял более высокий уровень FGAA и более низкий диетический CP.Это может быть связано с разными соотношениями SID His: Lys и SID Phe + Tyr: Lys, используемыми в рецептуре рациона, или разными источниками белка, используемыми в каждом исследовании. Во втором исследовании в питомнике все рационы были составлены на основе 100% или превышения потребности в SID Lys для свиней-питомников и составлены таким образом, чтобы удовлетворять требованиям His и Phe + Tyr. Кроме того, концентрат соевого белка (SPC) был использован во втором исследовании в фазе 1 и 2, заменив рыбную муку менхаден, использованную в первом исследовании питомника.
Публикации
Исследования Grow-Finish
Что мы сделали? (Методы)
Каждый эксперимент проводился в соответствии с протоколом из пяти этапов роста и окончания.Свиней скармливали 1 из 4 или 5 рационов, и 10 ppm Paylean давали в течение заключительной 3-недельной фазы откорма — фазы 5. Во время фазы 1–5 измеряли BW отдельной свиньи и исчезновение корма в загонах для каждой фазы, чтобы сделать расчет. ADG, ADFI и G: F по фазам. Измерения десятого ребра, средней линии спины и площади мышц поясницы оценивали в начале исследования и в конце каждой фазы с помощью ультразвука, чтобы можно было оценить прирост мяса туши. Когда среднее значение для всех блоков составляло 129–134 кг, всех свиней индивидуально взвешивали, наносили татуировку, перевозили и собирали на заводе по упаковке коммерческой свинины в соответствии с принятыми в отрасли процедурами.Глубину длиннейшей мышцы (LM) и толщину жира на 10-м ребре измеряли в режиме онлайн с помощью датчика Fat-O-Meater, и регистрировали индивидуальный вес горячей тушки.
Эксперимент 1
Всего 420 свиней были заблокированы в пределах пола и случайным образом распределены по загонам с 6 свиньями на загон. Внутри блоков загоны со свиньями случайным образом распределялись по 1 из 5 диетических процедур (7 повторений / лечение / пол). Диеты были составлены путем постепенного увеличения уровней Lys с соответствующим снижением CP. Свиньи случайным образом распределили на следующие рационы:
- Ctrl: Корма кукуруза-SBM-DDGS без FGAA,
- RCP 1 (с пониженным содержанием сырого протеина 1)
- RCP 2
- RCP3
- RCP 4 — был сбалансирован по требованию 7-го ограничивающего AA, His (PIC Nutrient Specifications Manual, 2011), который считался практическим пределом наивысшего уровня RCP из-за ограничений доступности. Затем составляли
RCP 1–4 для ступенчатого и равномерно распределенного увеличения Lys с соответствующим снижением CP между RCP 1 и 4. Рационы 2–4 дополнялись FGAA по мере необходимости для удовлетворения потребностей в AA на основе минимальных соотношений AA. Были проанализированы диетические уровни включения CP и Lys.
Рацион был составлен с учетом 95% средней потребности в SID Lys для курганов и свинок (PIC Nutrient Specifications Manual, 2011) и превышал рекомендации по соотношению SID AA / Lys для других IDAA на 2 процентных пункта.
Дистилляторные сушеные зерна с растворимыми веществами (DDGS) были включены во все рационы на уровне 20%, за исключением рационов для завершения фазы 5, которые не содержали DDGS.
Эксперимент 2
В эксперименте 1 рационы были составлены на основе ME, и, поскольку соевый шрот был уменьшен в рационах, расчетный Lys / NE снизился, что может объяснить некоторое увеличение отложения жира у свиней, получавших рационы на основе ME, составленные уменьшение соевого шрота и включение высоких уровней FGAA. Таким образом, эксперимент 2 был проведен для установления эффективности использования «требования SID заданного значения» для последовательного снижения CP путем добавления FGAA для соответствия соотношению SID IDAA / Lys в качестве средства установления практических пределов снижения CP и замены AA без воздействия показатели роста, состав туши или качество свиней на доращивании и откорме, получающих рационы RCP на основе NE.Диеты были составлены, начиная с диеты Ctrl, которая приблизительно соответствует приемлемым уровням включения FGAA, используемым в настоящее время в промышленности, с последующим последовательным составлением трех дополнительных диетических процедур, каждое из которых основано на следующем ограничивающем AA. Диеты в этом исследовании были сформулированы на постоянной основе NE внутри фазы. DDGS был включен во все диеты. Потребность SID His в рационе с самым высоким RCP удовлетворялась на каждой фазе без добавления His кормового сорта.
Всего было 9 повторов / лечение со свиньями, содержащими 6 свиней / загон.Секс в загоне был уравновешен. Диеты были составлены, как в эксперименте 1, а именно:
- Лечение 1, Ctrl: Обычные диеты для фаз с 1 по 5, которые приблизительно соответствуют приемлемым уровням FGAA, используемым в настоящее время в промышленности. Предполагается, что большинству представителей отрасли комфортно использовать Thr и Met кормового качества для удовлетворения предлагаемых соотношений SID Thr / Lys и Met / Lys в рационах, составленных для удовлетворения требований SID Trp / Lys без добавления Trp кормового качества. Это называется уставкой Trp.
- Лечение 2, RCP 1: рационы были составлены таким образом, чтобы соответствовать следующему ограничивающему AA. В фазах 1 и 5 следующим ограничивающим AA был Val, в то время как Ile следовал за ограничением в фазах 2, 3 и 4. Это называется «заданное значение Val или Ile». Обратите внимание, что ни Val, ни Ile не добавлялись ни на одном этапе.
- Лечение 3, RCP 2: рационы были составлены таким образом, чтобы соответствовать следующему ограничивающему AA. В фазах 1 и 5 следующим ограничивающим AA был Ile, в то время как Val следовал за ограничением в фазах 2, 3 и 4. Это упоминается как «Уставка Val и Ile».Обратите внимание, что Val, но не Ile, был добавлен в корм на этапах 1 и 5, а Ile, но не Val, был добавлен на этапах 2, 3 и 4.
- Лечение 4, RCP 3: рационы были составлены так, чтобы соответствовать следующему (7-му) ограничивающему AA, His. Это называется «его уставкой».
Все диеты были дополнены FGAA, чтобы соответствовать рекомендуемым уровням IDAA. Обратите внимание, что корм сорта His не добавлялся ни в один рацион.
Исследования Grow-Finish — чему мы научились?
Эксперимент 1
Масса тела свиней линейно уменьшалась с уменьшением диетического CP во время фазы 1, 2 и 3 (P <0.01; Таблица 7). Кроме того, BW увеличивался, а затем уменьшался квадратично во время фазы 3 (P = 0,09), 4 (P <0,04) и 5 (P <0,01), при этом BW значительно снижался у свиней, получавших RCP 4. Когда Paylean был включен в рационы фазы 5. у курганов, получавших рацион Ctrl, был более высокий ADG, чем у свинок, получавших Ctrl, но у свинок, получавших RCP 1, RCP 2 и RCP 3, был более высокий ADG, чем у их кастрированных собратьев-самцов (квадратичный пол × диета с уменьшенным CP, P = 0,08; Рисунок 1A) И ADG, и G: F линейно уменьшались (P ≤ 0,06) во время фазы 1 и 2.Кроме того, эффективность прироста увеличилась на 4,6% у свинок между Ctrl и RCP 2, а затем снизилась до аналогичных значений G: F между Ctrl и RCP 4; тем не менее, G: F оставался относительно неизменным в кургане после 5 диетических процедур (квадратичный пол × диета с пониженным КП, P = 0,04; рисунок 1B).
На протяжении всего испытания кормления ADG увеличивался только на 2% между Ctrl и RCP3, но упал на 6% между RCP3 и RCP4 (квадратичный, P <0,01). С другой стороны, ADFI имеет тенденцию к линейному снижению (P = 0,09) по мере снижения CP в рационах свиней.Эффективность прироста увеличилась на 4,6% у свинок между Ctrl и RCP2, а затем снизилась до аналогичных значений между Ctrl и RCP4; тем не менее, G: F оставался относительно неизменным в кургане после 5 диетических процедур (квадратичный пол × диета с пониженным КП, P = 0,04; рис. 1C).
Снижение диетического CP и оптимизация использования FGAA оказали ограниченное (P ≥ 0,21) влияние на медработников, процент повязки или глубину LM; однако толщина жира 10-го ребра увеличивалась линейно (P <0,01), а процент обезжиренного постного мяса по окончании исследования линейно снижался по мере снижения CP в рационах свиней (P <0.02; Рисунок 1D).
Эксперимент 2
Эффекты диетического лечения (Trt.) Показали, что ADG линейно снижался с увеличением диетического FGAA в фазе 3 (таблица 8, P <0,05), 4 (P <0,10), 5 (P <0,01) и в целом. (P <0,01). Аналогичным образом, ADFI линейно снижался в фазе 4 (P <0,05), 5 (P <0,01) и в целом (P <0,01) с увеличением FGAA. По сравнению со свиньями, получавшими контрольный рацион (Trt. 1), G: F в фазе 1 увеличивался у свиней, получавших повышенные уровни FGAA при более низких уровнях включения (Trt.2 и 3) до снижения до контрольного уровня на самом высоком уровне включения (Тр. 4, квадратичный эффект, P <0,05). Во время фазы 3 наблюдалось небольшое, но значительное снижение G: F с увеличением уровней FGAA (линейный эффект, P <0,05). Однако для всего исследования наблюдалась тенденция к увеличению G: F (линейный эффект, P <0,06). BW увеличивалась в конце фазы 2 с увеличением уровня FGAA (квадратичный эффект, P <0,06). Однако, в соответствии с ADG, BW уменьшалась с увеличением диетического FGAA в конце фазы 3, 4 и 5 (линейный эффект, P <0.05, P <0,01 и P <0,01 соответственно).
Как и следовало ожидать на основании BW, HCW уменьшалась с увеличением включения в рацион FGAA (линейный эффект, P <0,01). Задник десятого ребра был ниже у свиней, получавших рационы, составленные с заданными значениями Val или Ile (Trt. 2) или His Set Point (Trt. 4), по сравнению с рационами, полученными с рационами, составленными с заданными значениями Val и Ile (Trt. 3). ).
Публикации — G / F (испытание 1)
Встреча Американского общества зоотехники Среднего Запада (ASAS), 2013 г., Резюме 0224, стр. 73 (характеристики и состав туши)
Значение.Эта информация своевременна, поскольку стоимость соевого шрота приближается к рекордным уровням, что делает замену интактного белка синтетическими аминокислотами более экономически целесообразной.
Исследование баланса азота (N)
Что мы сделали? (Методы)
Тридцать два тележки использовались для оценки влияния кормления с пониженным содержанием CP и рационами с добавлением АК на выведение питательных веществ и ЛЖК. Свиньи случайным образом распределили на следующие рационы:
- Контроль: рационы кукуруза-SBM-DDGS без FGAA,
- Снижение CP в 1 раз,
- сокращение CP в 2 раза и
- Снижение CP в 3 раза.Эта диета была сбалансирована на 7-е ограничение АА на каждой фазе.
Диеты 2 и 3 были составлены таким образом, чтобы обеспечивать ступенчатое и равномерно распределенное снижение CP между диетами 1 и 4. Диеты 2-4 были дополнены FGAA по мере необходимости для удовлетворения потребностей в AA на основе минимальных соотношений NRC 2012 AA. Подкармливали четыре фазы выращивания и 5 фаз окончания роста (21d фазы). Свиней содержали в загонах для метаболизма из нержавеющей стали, оборудованных ниппельной поилкой и кормушкой из нержавеющей стали. Сборы начинали с 3-й фазы доращивания, а в период доращивания свиньям давали восьмидневный период корректировки рациона с последующим 3-дневным общим сбором фекалий, мочи и коров.Во время фаз роста и окончания свиней акклиматизировали к рациону в течение первых 10 дней каждой фазы, а затем в течение 3 дней собирали фекалии, мочу и птицу.
Баланс азота — чему мы научились? (Результатов)
В целом, с 14 по 147 день после отъема ADFI линейно увеличивался по мере снижения диетического CP, но не наблюдалось влияния концентрации CP в рационе на ADG или G: F (таблица 9). Фекальная экскреция (DM) имела тенденцию отвечать квадратичным (P = 0,08) образом снижением фекальной экскреции (DM) до двукратного снижения CP, но затем увеличивалась у свиней, которых кормили в 3 раза.И DE, и ME (ккал / кг) линейно (P <0,01) снижались по мере снижения диетического CP. Линейное (P <0,01) снижение потребления азота у свиней, получавших рацион с пониженным содержанием CP, сопровождалось линейным (P <0,01) снижением как количества азота, выделяемого с мочой, так и общего количества азота, выводимого из организма. Усвояемость азота (%) линейно снижалась (P <0,01), а задержка азота линейно (%) увеличивалась (P <0,01) с уменьшением диетического CP. В целом, наблюдалось линейное (P <0,03) снижение содержания аммония в фекалиях по мере того, как диета CP была снижена. Общее потребление углерода (C) и общее выделение углерода с фекалиями имеют тенденцию к снижению (P = 0.06), чтобы ответить квадратично увеличением как потребления C, так и экскреции C до диеты с пониженным в 1 раз CP, с последующим уменьшением потребления C и увеличением выведения C на диету 3X, создавая линейное (P <0,05) снижение усвояемости C. поскольку диетический CP был снижен.
Публикации
Значение. Возможность добавлять общие сборы фекалий и мочи при диетах с манипуляциями с азотом для всех масс тела, протестированных в Университете Арканзаса до того, как диеты были проверены на выбросы парниковых газов в Университете Пердью, улучшила оценку соединений, выделяемых в свежем навозе, а затем преобразование эти питательные вещества и соединения выделялись во время хранения в типичных глубоких ямах навоза под помещениями для свиней (как было измерено во время исследования помещения Purdue 12).Этот исследовательский проект предоставил данные для критической связи между выделением, хранением и внесением в землю.
Проверка исследований питомников, отделки выращивания и измерений выбросов парниковых газов
В настоящее время проводятся крупномасштабные испытания для проверки результатов испытаний в питомнике и окончании выращивания, проведенных в Арканзасе. Масштаб предприятия Purdue больше похож на систему коммерческого производства. Измерение и мониторинг газов, а также отдельные системы обработки навоза для каждой комнаты позволили провести прямые измерения, с которыми можно было сравнить предыдущие оценки.
Схема обработки для эксперимента:
- Обычный рацион, содержащий ~ 0,15% Lys-HCl
- 1-кратное снижение CP с дополнительными синтетическими аминокислотами
- 2-кратное снижение CP с дополнительными синтетическими аминокислотами
Все диеты дополнялись рактопамином в течение последних 3-4 недель испытания, а концентрации аминокислот были увеличены на основании предполагаемого увеличения прироста мышечной ткани. Однако общая структура лечения останется прежней.В эксперименте участвовало 24 загона по 10 свиней в каждой обработке, из расчета 8 навозных ям на одну птицу и 4 помещения на одну птицу. Пен был экспериментальной единицей для всех показателей роста, потребления корма и туши. Яма была экспериментальной единицей для данных по выделению навоза, а комната — экспериментальной единицей для данных о выбросах.
Мониторинг температуры воздуха в реальном времени, включая относительную влажность, углекислый газ (CO 2 ), метан (CH 4 ), закись азота (N 2 O), аммиак (NH 3 ) и сероводород. (H 2 S).Общее количество взвешенных частиц контролировали с помощью гравиметрических пробоотборников. Данные по выбросам и продуктивности животных были значительно более точными в этом воспроизводимом здании с экологическим контролем, чем это возможно в коммерческих целях, но все же имитировали коммерческие условия.
Навоз из каждой ямы был полностью удален на внешнее хранилище для определения объема, тщательного перемешивания и отбора проб в конце каждого испытания. Кроме того, в конце каждой фазы выращивания были получены образцы керна навоза по сетке.Объем навоза в каждой яме определяли при смене фазы рациона путем проведения шести измерений глубины между решетчатым полом с координатной сеткой. Пробы навоза были проанализированы на pH, сухое вещество, золу, общий азот (N), аммоний N, фосфор (P), углерод (C) и серу (S). Данные, определяющие взаимосвязь между снижением содержания ХП в рационе и уменьшением содержания азота в навозе, и другими изменениями характеристик навоза, необходимы для разработки модели воздействия этой стратегии смягчения последствий на выбросы парниковых газов. Дополнительным преимуществом будет определение пределов этой стратегии без влияния на показатели роста животных в условиях, в которых участвуют заинтересованные стороны отрасли.
Валидационное исследование — что мы узнали (результаты)?
Скоро в продаже! (первое полугодие 2016 года)
Моделирование данных
[См. Также: Моделирование в Технологическом институте штата Вирджиния] Текущие модели потребностей в питании свиней сосредоточены на разделении пищевой энергии и аминокислот на поддержание, рост, беременность и лактацию. Мало внимания уделяется прогнозированию экскреции питательных веществ, и поэтому эти модели не могут использоваться в качестве исходных данных для модели выбросов. Были разработаны модели, предсказывающие экскрецию энергии, белка и фосфора, но их точность не оценивалась; и проведенные оценки сосредоточены на прогнозировании роста и состава тела, а не на экскреции питательных веществ.
Выбросы парниковых газов от хранилищ навоза можно прогнозировать по составу навоза, что подчеркивает необходимость в надежной модели животных, способной прогнозировать как продуктивность животных, так и выделение питательных веществ. Прогнозирование выбросов парниковых газов из свиного навоза требует знаний о содержании азота и летучих твердых веществ, ни один из которых не предоставляется текущими прогнозами NRC.
Данные исследований по смягчению воздействия азота на рост и выделение азота были использованы для улучшения модели животных, способной прогнозировать продуктивность свиней и выделение азота, углерода и летучих твердых веществ (входные данные, необходимые для модели DNDC).Модель роста, разработанная сотрудниками Калифорнийского университета в Дэвисе, и недавно выпущенное одиннадцатое пересмотренное издание «Потребности свиней в питательных веществах» (NRC) будут использоваться в качестве отправной точки для разработки модели. Уравнения, описывающие реакцию на добавление белков и аминокислот в рацион, будут оцениваться на предмет точности, а влияние Paylean на продуктивность животных и выход питательных веществ навоза будет закодировано и проверено на точность. Эта работа должна предшествовать и использовать данные из исследования UA и литературных источников.Модель будет дополнительно оценена на 5-м курсе с использованием набора данных Purdue.
Контактная информация
Доктор Скотт Рэдклифф
jradclif@purdue.edu
Телефон: (765) 496-7718
Д-р Брайан Ричерт
brichert@purdue.edu
Телефон: (765)494-4837
Родственные проекты
Благодарности:
Эта информация является частью программы «Интегрированный инструмент управления ресурсами для снижения углеродного следа свиней, производимых в США».

