Аминокислоты и ацилкарнитины как потенциальные метаболомные маркеры шизофрении: новые подходы к диагностике и терапии | Меднова
1. Davalieva K., Maleva Kostovska I., Dwork A.J. Proteomics research in schizophrenia. Frontiers in Cellular Neuroscience. 2016; 10: 18. DOI: 10.3389/fncel.2016.00018.
2. Guest F.L., Guest P.C., Martins-de-Souza D. The emergence of point-of-care blood-based biomarker testing for psychiatric disorders: enabling personalized medicine. Biomarkers in Medicine. 2016; 10 (4): 431–443. DOI: 10.2217/bmm-2015-0055.
3. Li C., Wang A., Wang C., Ramamurthy J., Zhang E., Guadagno E., Trakadis Y. Metabolomics in patients with psychosis: a systematic review. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics. 2018; 177 (6): 580–588. DOI: 10.1002/ajmg.b.32662.
2018; 177 (6): 580–588. DOI: 10.1002/ajmg.b.32662.
4. Pedrini M., Cao B., Nani J.V.S., Cerqueira R.O., Mansur R.B., Tasic L., Hayashi M.A.F., McIntyre R.S., Brietzke E. Advances and challenges in development of precision psychiatry through clinical metabolomics on mood and psychotic disorders. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 2019; 93: 182–188. DOI: 10.1016/j.pnpbp.2019.03.010.
5. Бойко А.С., Бохан Н.А. Бунева В.Н., Ветлугина Т.П., Зозуля С.А., Иванова С.А., Клюшник Т.П., Корнетова Е.Г., Лосенков И.С., Олейчик И.В., Семке А.В., Смирнова Л.П., Узбеков М.Г., Федоренко О.Ю. Биологические маркеры шизофрении: поиск и клиническое применение / под. ред. Н.А. Бохана, С.А. Ивановой. Новосибирск: Изд-во СО РАН, 2017: 146.
6. Hisamatsu T.
7. Van de Kerkhof N.W., Fekkes D., van der Heijden F.M., Hoogendijk W.J., Stцber G., Egger J.I., Verhoeven W.M. Cycloid psychoses in the psychosis spectrum: evidence for biochemical differences with schizophrenia. Neuropsychiatric Disease and Treatment. 2016; 12: 1927–1933.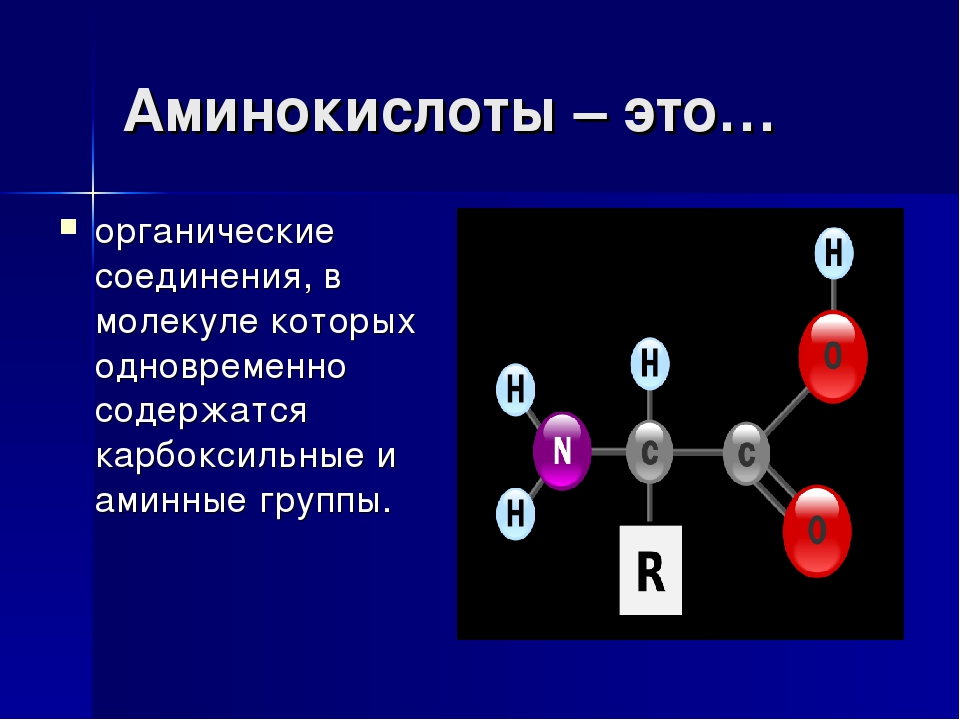
8. Nagai T., Kirihara K., Tada M., Koshiyama D., Koike S., Suga M., Araki T., Hashimoto K., Kasai K. Reduced mismatch negativity is associated with increased plasma level of glutamate in first-episode psychosis. Scientific Reports. 2017; 7 (1): 2258. DOI: 10.1038/s41598-017-02267-1.
9. Steen N.E., Dieset I., Hope S., Vedal T.S.J., Smeland O.B., Matson W., Kaddurah-Daouk R., Agartz I., Melle I., Djurovic S., Jцnsson E.G., Bogdanov M., Andreassen O.A. Metabolic dysfunctions in the kynurenine pathway, noradrenergic and purine metabolism in schizophrenia and bipolar disorders. Psychological Medicine. 2019; 1–12. DOI: 10.1017/S0033291719000400.
10. McDonald J.W., Johnston M.V. Physiological and pathophysiological roles of excitatory amino acids during central nervous system development. Brain Research Reviews. 1990; 15 (1): 41–70. DOI: 10.1016/0165-0173(90)90011-C.
Brain Research Reviews. 1990; 15 (1): 41–70. DOI: 10.1016/0165-0173(90)90011-C.
11. Macciardi F., Lucca A., Catalano M., Marino C., Zanardi R., Smeraldi E. Amino acid patterns in schizophrenia: some new findings. Psychiatry Research. 1990; 32 (1): 63–70. DOI: 10.1016/0165-1781(90)90136-s.
12. Oresic M., Tang J., Seppanen-Laakso T., Mattila I., Saarni S.E., Saarni S.I., Lonnqvist J., Sysi-Aho M., Hyotylainen T., Perala J., Suvisaari J. Metabolome in schizophrenia and other psychotic disorders: a general population-based study. Genome Medicine. 2011; 3 (3): 19. DOI: 10.1186/gm233.
13. Yang J., Chen T., Sun L., Zhao Z., Qi X., Zho K., Cao Y., Wang X., Qiu Y., Su M., Zhao A., Wang P., Yang P., Wu J., Feng G., He L., Jia W., Wan C. Potential metabolite markers of schizophrenia.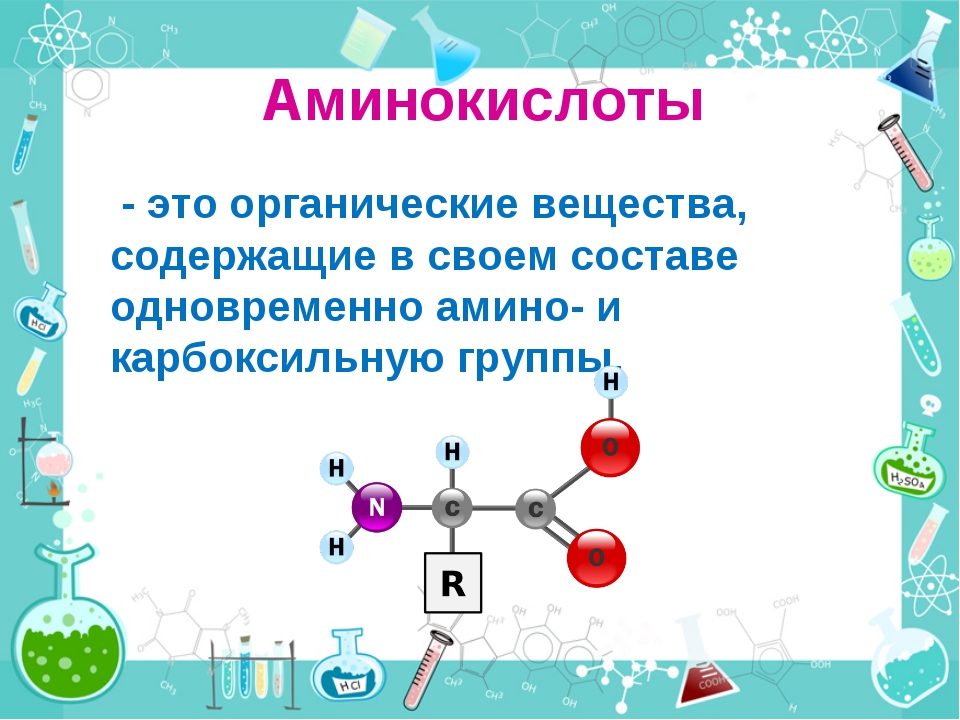 Molecular Psychiatry. 2013; 18 (1): 67–78. DOI: 10.1038/mp.2011.131.
Molecular Psychiatry. 2013; 18 (1): 67–78. DOI: 10.1038/mp.2011.131.
14. Van der Heijden F.M.M.A., Fekkes D., Tuinier S., Sijben A.E.S., Kahn R.S., Verhoeven W.M.A. Amino acids in schizophrenia: evidence for lower tryptophan availability during treatment with atypical antipsychotics? Journal of Neural Transmission. 2005; 112 (4): 577–585. DOI: 10.1007/s00702-004-0200-5.
15. Madeira C., Alheira F.V., Calcia M.A., Silva T.C., Tannos F.M., Vargas-Lopes C., Fisher M., Goldenstein N., Brasil M.A., Vinogradov S., Ferreira S.T., Panizzutti R. Blood levels of glutamate and glutamine in recent onset and chronic schizophrenia. Frontiers in Psychiatry. 2018; 9: 713. DOI: 10.3389/fpsyt.2018.00713.
16. Fukushima T., Iizuka H., Yokota A., Suzuki T., Ohno C., Kono Y.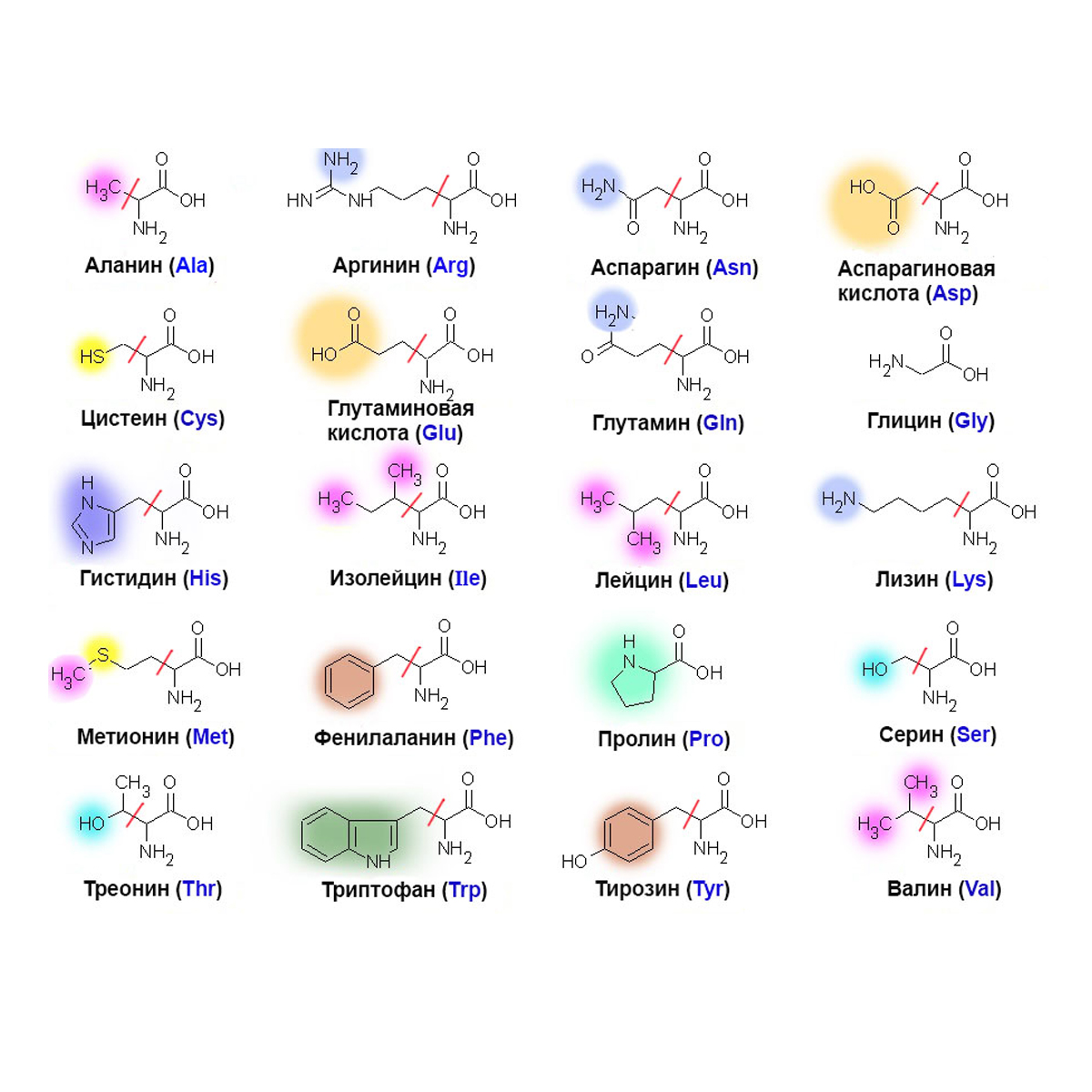 , Nishikiori M., Seki A., Ichiba H., Watanabe Y., Hongo S., Utsunomiya M., Nakatani M., Sadamoto K., Yoshio T. Quantitative analyses of schizophrenia-associated metabolites in serum: serum D-lactate levels are negatively correlated with gamma-glutamylcysteine in medicated schizophrenia patients. PLoS One. 2014; 9 (7): e101652. DOI: 10.1371/journal.pone.0101652.
, Nishikiori M., Seki A., Ichiba H., Watanabe Y., Hongo S., Utsunomiya M., Nakatani M., Sadamoto K., Yoshio T. Quantitative analyses of schizophrenia-associated metabolites in serum: serum D-lactate levels are negatively correlated with gamma-glutamylcysteine in medicated schizophrenia patients. PLoS One. 2014; 9 (7): e101652. DOI: 10.1371/journal.pone.0101652.
17. Ivanova S.A., Boyko A.S., Fedorenko O.Y., Krotenko N.M., Semke A.V., Bokhan N.A. Glutamate concentration in the serum of patients with schizophrenia. Procedia Chemistry. 2014; 10: 80–85. DOI: 10.1016/j.proche.2014.10.015.
18. Smith Q.R. Transport of glutamate and other amino acids at the blood-brain barrier. The Journal of Nutrition. 2000; 130 (4): 1016–1022S. DOI: 10.1093/jn/130.4.1016S.
19. Shulman Y., Grant S., Seres P., Hanstock C., Baker G., Tibbo P. The relation between peripheral and central glutamate and glutamine in healthy male volunteers. Journal of Psychiatry and Neuroscience. 2006; 31 (6): 406–410.
Shulman Y., Grant S., Seres P., Hanstock C., Baker G., Tibbo P. The relation between peripheral and central glutamate and glutamine in healthy male volunteers. Journal of Psychiatry and Neuroscience. 2006; 31 (6): 406–410.
20. McGale E.H.F., Pye I.F., Stonier C., Hutchinson E.C., Aber G.M. Studies of the inter-relationship between cerebrospinal fluid and plasma amino acid concentrations in normal individuals. Journal of Neurochemistry. 1977; 29 (2): 291–297. DOI: 10.1111/j.1471-4159. 1977.tb09621.x.
21. Alfredsson G., Wiesel F.A., Lindberg M. Glutamate and glutamine in cerebrospinal fluid and serum from healthy volunteers-analytical aspects. Journal of Chromatography B: Biomedical Sciences and Applications. 1988; 424 (2): 378–384. DOI: 10.1016/S0378-4347(00)81116-0.
22. Bjerkenstedt L., Edman G., Hagenfeldt L., Sedvall G., Wiesel F.A. Plasma amino acids in relation to cerebrospinal fluid monoamine metabolites in schizophrenic patients and healthy controls. The British Journal of Psychiatry. 1985; 147 (3): 276–282. DOI: 10.1192/bjp.147.3.276.
Bjerkenstedt L., Edman G., Hagenfeldt L., Sedvall G., Wiesel F.A. Plasma amino acids in relation to cerebrospinal fluid monoamine metabolites in schizophrenic patients and healthy controls. The British Journal of Psychiatry. 1985; 147 (3): 276–282. DOI: 10.1192/bjp.147.3.276.
23. Misiak B., Wisniewski J., Fleszar M.G., Frydecka D. Alterations in l-arginine metabolism in first-episode schizophrenia patients: Further evidence for early metabolic dysregulation. Schizophrenia Research. 2016; 178 (1–3): 56–57. DOI: 10.1016/j.schres.2016.08.032.
24. Sumiyoshi T., Anil A.E., Jin D., Jayathilake K., Lee M., Meltzer H.Y. Plasma glycine and serine levels in schizophrenia compared to normal controls and major depression: relation to negative symptoms. International Journal of Neuropsychopharmacology. 2004; 7 (1): 1–8. DOI: 10.1017/S1461145703003900.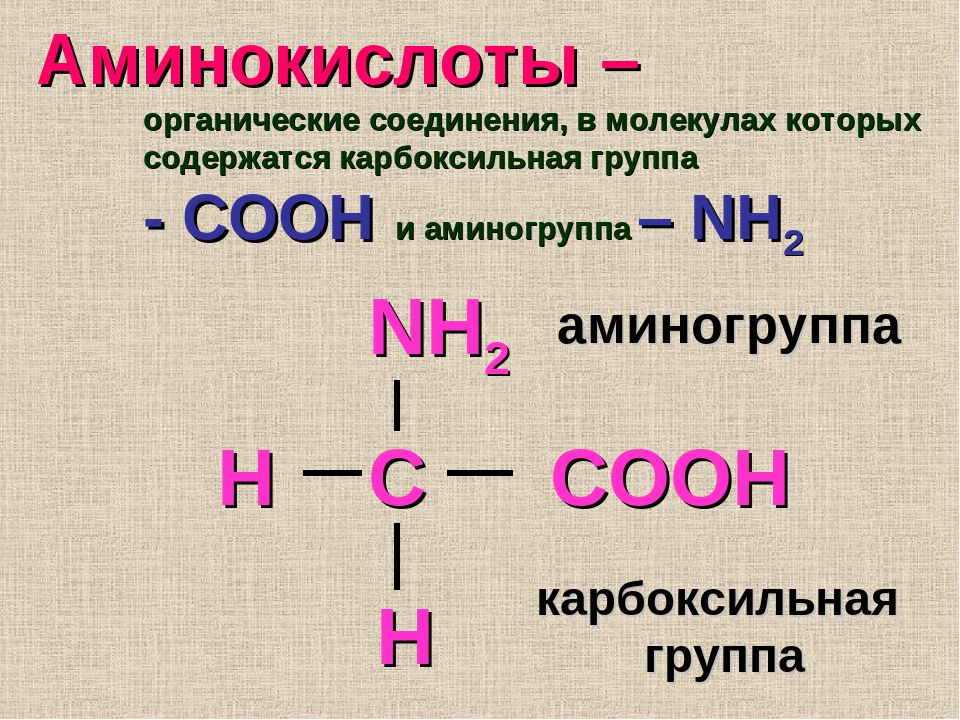
25. Calcia M.A., Madeira C., Alheira F.V., Silva T.C., Tannos F.M., Vargas-Lopes C., Goldenstein N., Brasil M.A., Ferreira S.T., Panizzutti R. Plasma levels of D-serine in Brazilian individuals with schizophrenia. Schizophrenia Research. 2012; 142 (13): 83–87. DOI: 10.1016/j.schres.2012.09.014.
26. Hashimoto K., Fukushima T., Shimizu E., Komatsu N., Watanabe H., Shinoda N., Nakazato M., Kumakiri C., Okada S., Hasegawa H., Imai K., Masaomi I. Decreased serum levels of D-serine in patients with schizophrenia: evidence in support of the N- methyl-D-aspartate receptor hypofunction hypothesis of schizophrenia. Archives of General Psychiatry. 2003; 60 (6): 572–576. DOI: 10.1001/archpsyc.60.6.572.
27. Takano Y., Ozeki Y., Sekine M., Fujii K., Watanabe T., Okayasu H. , Shinozaki T., Aoki A., Akiyama K., Homma H., Shimoda K. Multi-regression analysis revealed a relationship between l-serine and methionine, a component of one-carbon metabolism, in the normal control but not in the schizophrenia. Annals of General Psychiatry. 2016; 15 (1): 23. DOI: 10.1186/s12991-016-0113-3.
, Shinozaki T., Aoki A., Akiyama K., Homma H., Shimoda K. Multi-regression analysis revealed a relationship between l-serine and methionine, a component of one-carbon metabolism, in the normal control but not in the schizophrenia. Annals of General Psychiatry. 2016; 15 (1): 23. DOI: 10.1186/s12991-016-0113-3.
28. Bendikov I., Nadri C., Amar S., Panizzutti R., De Miranda J., Wolosker H., Agam G. A CSF and postmortem brain study of D-serine metabolic parameters in schizophrenia. Schizophrenia Research. 2007; 90 (1–3): 41–51. DOI: 10.1016/j.schres.2006.10.010.
29. Hashimoto K., Engberg G., Shimizu E., Nordin C., Lindstrцm L.H., Iyo M. Reduced D-serine to total serine ratio in the cerebrospinal fluid of drug naive schizophrenic patients. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 2005; 29 (5): 767–769. DOI: 10.1016/j. pnpbp.2005.04.023.
pnpbp.2005.04.023.
30. Reveley M.A., De Belleroche J., Recordati A., Hirsch S.R. Increased CSF amino acids and ventricular enlargement in schizophrenia: a preliminary study. Biological Psychiatry. 1987; 22 (4): 413–420. DOI: 10.1016/0006-3223(87)90163-6.
31. El-Tallawy H.N., Saleem T.H., El-Ebidi A.M., Hassan M.H., Gabra R.H., Farghaly W.M., El-Maal N.A., Sherkawy H.S. Clinical and biochemical study of D-serine metabolism among schizophrenia patients. Neuropsychiatric Disease and Treatment. 2017; 13: 1057–1063. DOI: 10.2147/NDT.S126979.
32. Genchi G. An overview on D-amino acids. Amino Acids. 2017; 49 (9): 1521–1533. DOI: 10.1007/s00726-017-2459-5.
33. Saleem S., Shaukat F. , Gul A., Arooj M., Malik A. Potential role of amino acids in pathogenesis of schizophrenia. International Journal of Health Sciences. 2017; 11 (3): 63–68.
, Gul A., Arooj M., Malik A. Potential role of amino acids in pathogenesis of schizophrenia. International Journal of Health Sciences. 2017; 11 (3): 63–68.
34. Ozeki Y., Sekine M., Fujii K., Watanabe T., Okayasu H., Takano Y., Shinozaki T., Aoki A., Akiyama K., Homma H., Shimoda K. Phosphoserine phosphatase activity is elevated and correlates negatively with plasma D-serine concentration in patients with schizophrenia. Psychiatry Research. 2016; 237: 344–350. DOI: 10.1016/j.psychres.2016.01.010.
35. He Y., Yu Z., Giegling I., Xie L., Hartmann A.M., Prehn C., Adamski J., Kahn R., Li Y., Illig T., Wang-Sattler R., Rujescu D. Schizophrenia shows a unique metabolomics signature in plasma. Translational Psychiatry. 2012; 2: e149. DOI: 10.1038/tp.2012.76.
36. Cao B., Wang D., Brietzke E., McIntyre R.S., Pan Z., Cha D., Rosenblat J.D., Zuckerman H., Liu Y., Xie Q., Wang J. Characterizing amino-acid biosignatures amongst individuals with schizophrenia: a case-control study. Amino Acids. 2018; 50(8): 1013–1023. DOI: 10.1007/s00726-018-2579-6.
Cao B., Wang D., Brietzke E., McIntyre R.S., Pan Z., Cha D., Rosenblat J.D., Zuckerman H., Liu Y., Xie Q., Wang J. Characterizing amino-acid biosignatures amongst individuals with schizophrenia: a case-control study. Amino Acids. 2018; 50(8): 1013–1023. DOI: 10.1007/s00726-018-2579-6.
37. Chiappelli J., Postolache T.T., Kochunov P., Rowland L.M., Wijtenburg S.A., Shukla D.K., Tagamets M., Du X., Savransky A., Lowry C.A., Can, A., Fuchs D., Hong L.E. Tryptophan metabolism and white matter integrity in schizophrenia. Neuropsychopharmacology. 2016; 41 (10): 2587–2595. DOI: 10.1038/npp.2016.66.
38. Giesbertz P., Ecker J., Haag A., Spanier B., Daniel H. An LC-MS/MS method to quantify acylcarnitine species including isomeric and odd-numbered forms in plasma and tissues. Journal of Lipid Research. 2015; 56 (10): 2029–2039. DOI: 10.1194/jlr. D061721.
D061721.
39. Liu M.L., Zhang X.T., Du X.Y., Fang Z., Liu Z., Xu Y., Zheng P., Xu X.J., Cheng P.F., Huang T., Bai S.J., Zhao L.B., Qi Z.G., Shao W.H., Xie P. Severe disturbance of glucose metabolism in peripheral blood mononuclear cells of schizophrenia patients: a targeted metabolomics study. Journal of Translational Medicine. 2015; 13 (1): 226. DOI: 10.1186/s12967-015-0540-y.
40. Cao B., Wang D., Pan Z., Brietzke E., McIntyre R.S., Musial N., Mansur R.B., Subramanieapillai M., Zeng J., Huang N., Wang J. Characterizing acyl-carnitine biosignatures for schizophrenia: a longitudinal pre- and post-treatment study. Translational Psychiatry. 2019; 9 (1): 19. DOI: 10.1038/s41398-018-0353-x.
41. Rao M.L., Gross G., Strebel B., Brдunig P., Huber G., Klosterkцtter J. Serum amino acids, central monoamines, and hormones in drug-naive, drug-free, and neuroleptic-treated schizophrenic patients and healthy subjects. Psychiatry Research. 1990; 34 (3): 243–257. DOI: 10.1016/0165-1781(90)90003-n.
Serum amino acids, central monoamines, and hormones in drug-naive, drug-free, and neuroleptic-treated schizophrenic patients and healthy subjects. Psychiatry Research. 1990; 34 (3): 243–257. DOI: 10.1016/0165-1781(90)90003-n.
42. Wei J., Xu H., Ramchand C. N., Hemmings G.P. Low concentrations of serum tyrosine in neuroleptic-free schizophrenics with an early onset. Schizophrenia Research. 1995; 14 (3): 257–260. DOI: 10.1016/0920-9964(94)00080-R.
43. Tortorella A., Monteleone P., Fabrazzo M., Viggiano A., De Luca B., Maj M. Plasma concentrations of amino acids in chronic schizophrenics treated with clozapine. Neuropsychobiology. 2001; 44 (4): 167–171. DOI: 10.1159/000054937.
44. Evins A.E., Amico E.T., Shih V., Goff D.C. Clozapine treatment increases serum glutamate and aspartate compared to conventional neuroleptics. Journal of Neural Transmission. 1997; 104 (6–7): 76–766. DOI: 10.1007/BF01291892.
Journal of Neural Transmission. 1997; 104 (6–7): 76–766. DOI: 10.1007/BF01291892.
45. Yamamori H., Hashimoto R., Fujita Y., Numata S., Yasuda Y., Fujimoto M., Ohi K., Umeda-Yano S., Ito A., Ohmorie T., Hashimoto, K., Takeda M. Changes in plasma D-serine, L-serine, and glycine levels in treatment-resistant schizophrenia before and after clozapine treatment. Neuroscience Letters. 2014; 582: 93–98. DOI: 10.1016/j.neulet.2014.08.052.
46. Neeman G., Blanaru M., Bloch B., Kremer I., Ermilov M., Javitt D.C., Heresco-Levy U. Relation of plasma glycine, serine, and homocysteine levels to schizophrenia symptoms and medication type. American Journal of Psychiatry. 2005; 162 (9): 1738–1740. DOI: 10.1176/appi.ajp.162.9.1738.
47. Xuan J., Pan G., Qiu Y., Yang L., Su, M. , Liu Y., Chen J., Feng G., Fang Y., Jia W., Xing Q., He L. Metabolomic profiling to identify potential serum biomarkers for schizophrenia and risperidone action. Journal of Proteome Research. 2011; 10 (12): 5433–5443. DOI: 10.1021/pr2006796.
, Liu Y., Chen J., Feng G., Fang Y., Jia W., Xing Q., He L. Metabolomic profiling to identify potential serum biomarkers for schizophrenia and risperidone action. Journal of Proteome Research. 2011; 10 (12): 5433–5443. DOI: 10.1021/pr2006796.
48. Cao B., Jin M., Brietzke E., McIntyre R.S., Wang D., Rosenblat J.D., Ragguett R.M., Zhang C., Sun X., Rong C., Wang J. Serum metabolic profiling using small molecular water-soluble metabolites in individuals with schizophrenia: A longitudinal study using a pre-post-treatment design. Psychiatry and Clinical Neurosciences. 2019; 73 (3): 100–108. DOI: 10.1111/pcn.12779.
49. Misiak B., Frydecka D., Laczmanski., Slezak R., Kiejna A. Effects of second-generation antipsychotics on selected markers of one-carbon metabolism and metabolic syndrome components in first-episode schizophrenia patients. European Journal of Clinical Pharmacology. 2014; 70 (12): 1433–1441. DOI: 10.1007/s00228-014-1762-2.
European Journal of Clinical Pharmacology. 2014; 70 (12): 1433–1441. DOI: 10.1007/s00228-014-1762-2.
50. Leppik L., Kriisa K., Koido K., Koch K., Kajalaid K., Haring L., Vasar E., Zilmer M. Profiling of amino acids and their derivatives biogenic amines before and after antipsychotic treatment in first-episode psychosis. Frontiers in Psychiatry. 2018; 9: 155. DOI: 10.3389/fpsyt.2018.00155.
51. Ivanova S.A., Loonen A.J.M., Pechlivanoglou P., Freidin M.B., Al Hadithy A.F.Y., Rudikov E.V., Zhukova I.A., Govorin N.V., Sorokina V.A., Fedorenko O.Y., Alifirova V.M., Semke A.V., Brouwers J.R., Wilffert B. NMDA receptor genotypes associated with the vulnerability to develop dyskinesia. Translational Psychiatry. 2012; 2: e67. DOI: 10.1038/tp.2011.66.
52. Ward K. M., Yeoman L., McHugh C., Kraal A.Z., Flowers S.A., Rothberg A.E., Karnovsky A., Das A.K., Ellingrod V.L., Stringer K.A. Atypical antipsychotic exposure may not differentiate metabolic phenotypes of patients with schizophrenia. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy. 2018; 38 (6): 638–650. DOI: 10.1002/phar.2119.
M., Yeoman L., McHugh C., Kraal A.Z., Flowers S.A., Rothberg A.E., Karnovsky A., Das A.K., Ellingrod V.L., Stringer K.A. Atypical antipsychotic exposure may not differentiate metabolic phenotypes of patients with schizophrenia. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy. 2018; 38 (6): 638–650. DOI: 10.1002/phar.2119.
53. Javitt D.C., Silipo G., Cienfuegos A., Shelley A.M., Bark N., Park M., Lindenmayer J.P., Suckow R., Zukin S.R. Adjunctive high-dose glycine in the treatment of schizophrenia. International Journal of Neuropsychopharmacology. 2001; 4 (4): 385–391. DOI: 10.1017/S1461145701002590.
54. Javitt D.C. Glycine transport inhibitors in the treatment of schizophrenia. Novel Antischizophrenia Treatments. 2012; 367–399. DOI: 10.1007/978-3-642-25758-2_12.
55. Heresco-Levy U., Ermilov M., Lichtenberg P., Bar G., Javitt D. C. High-dose glycine added to olanzapine and risperidone for the treatment of schizophrenia. Biological Psychiatry. 2004; 55 (2): 165–171. DOI: 10.1016/S0006-3223(03)00707-8.
Heresco-Levy U., Ermilov M., Lichtenberg P., Bar G., Javitt D. C. High-dose glycine added to olanzapine and risperidone for the treatment of schizophrenia. Biological Psychiatry. 2004; 55 (2): 165–171. DOI: 10.1016/S0006-3223(03)00707-8.
56. Greenwood L.M., Leung S., Michie P.T., Green A., Nathan P.J., Fitzgerald P., Johnston P., Solowij N., Kulkarni J., Croft R.J. The effects of glycine on auditory mismatch negativity in schizophrenia. Schizophrenia Research. 2018; 191: 61–69. DOI: 10.1016/j.schres.2017.05.031.
57. Kato Y., Hin N., Maita N., Thomas A.G., Kurosawa S., Rojas C., Yorita K., Slusher B.S., Fukui K., Tsukamoto T. Structural basis for potent inhibition of d-amino acid oxidase by thiophene carboxylic acids. European Journal of Medicinal Chemistry. 2018; 159: 23–34. DOI: 10.1016/j.ejmech.2018.09.040.
58. Koсyigit Y., Yoca G., Karahan S., Ayhan Y., Yazici M.K. L-arginine add-on treatment for schizophrenia: a randomized, double-blind, placebo-controlled, crossover study. Turk Psikiyatri Dergisi. 2018; 29 (3): 147–153. DOI: 10.5080/u22702.
Koсyigit Y., Yoca G., Karahan S., Ayhan Y., Yazici M.K. L-arginine add-on treatment for schizophrenia: a randomized, double-blind, placebo-controlled, crossover study. Turk Psikiyatri Dergisi. 2018; 29 (3): 147–153. DOI: 10.5080/u22702.
59. Tayeb H.O., Murad H.A., Rafeeq M.M., Tarazi F.I. Pharmacotherapy of schizophrenia: toward a metabolomic-based approach. CNS Spectrums. 2018; 24 (3): 1–6. DOI: 10.1017/S1092852918000962.
60. Serrita J., Ralevski E., Yoon G., Petrakis I. A pilot randomized, placebo-controlled trial of glycine for treatment of schizophrenia and alcohol dependence. Journal of Dual Diagnosis. 2019; 15 (1): 1–10. DOI: 10.1080/15504263.2018.1549764.
61. MacKay M.B., Kravtsenyuk M., Thomas R., Mitchell N.D., Dursun S.M., Baker G.B. D-serine: potential therapeutic agent and/or biomarker in schizophrenia and depression? Frontiers in Psychiatry. 2019; 10: 25. DOI: 10.3389/fpsyt.2019.00025.
2019; 10: 25. DOI: 10.3389/fpsyt.2019.00025.
62. Tsai G., Yang P., Chung L.C., Lange N., Coyle J.T. D-serine added to antipsychotics for the treatment of schizophrenia. Biological Psychiatry. 1998; 44 (11): 1081–1089. DOI: 10.1016/S0006-3223(98)00279-0.
63. Heresco-Levy U., Javitt D.C., Ebstein R., Vas A., Lichtenberg P., Bar G., Catinari S., Ermilov M. D-serine efficacy as add-on pharmacotherapy to risperidone and olanzapine for treatment-refractory schizophrenia. Biological Psychiatry. 2005; 57 (6): 577–585. DOI: 10.1016/j.biopsych.2004.12.037.
64. Kantrowitz J.T., Malhotra A.K., Cornblatt B., Silipo G., Balla A., Suckow R.F., Souza C.D., Saksa J., Woods S.W., avitt D.C. High dose D-serine in the treatment of schizophrenia. Schizophrenia Research. 2010; 121 (1–3): 125–130. DOI: 10.1016/j.schres.2010.05.012.
DOI: 10.1016/j.schres.2010.05.012.
65. Kantrowitz J.T., Epstein M.L., Lee M., Lehrfeld N., Nolan K.A., Shope C., Petkova E., Silipo G., Javitt D.C. Improvement in mismatch negativity generation during d-serine treatment in schizophrenia: correlation with symptoms. Schizophrenia Research. 2018; 191: 70–79. DOI: 10.1016/j.schres.2017.02.027.
66. Weise M., Heresco-Levy U., Davidson M., Javitt D.C., Werbeloff N., Gershon A.A., Abramovich Y., Amital D., Doron A., Konas S., Levkovitz Y., Liba D., Teitelbaum A., Mashiach M., Zimmerman Y. A multicenter, addon randomized controlled trial of low-dose d-serine for negative and cognitive symptoms of schizophrenia. The Journal of Clinical Psychiatry. 2012; 73 (6): 728–734.
67. DOI: 10.4088/JCP.11m07031. 68. Tsai G. E., Yang P., Chang Y.C., Chong M.Y. D-alanine added to antipsychotics for the treatment of schizophrenia. Biological Psychiatry. 2006; 59 (3): 230–234. DOI: 10.1016/j.biopsych.2005.06.032.
E., Yang P., Chang Y.C., Chong M.Y. D-alanine added to antipsychotics for the treatment of schizophrenia. Biological Psychiatry. 2006; 59 (3): 230–234. DOI: 10.1016/j.biopsych.2005.06.032.
68. Umbricht D., Alberati D., Martin-Facklam M., Borroni E., Youssef E.A., Ostland M., Wallace T.L., Knoflach F., Dorflinger E., Wettstein J.G., Bausch, A., Garibaldi G., Santarelli L. Effect of bitopertin, a glycine reuptake inhibitor, on negative symptoms of schizophrenia: a randomized, double-blind, proof-of-concept study. JAMA Psychiatry. 2014; 71 (6): 637–646. DOI: 10.1001/jamapsychiatry.2014.163.
69. Lane H.Y., Lin C.H., Green M.F., Hellemann G., Huang C.C., Chen P.W., Tun R., Chang Y.C., Tsai G.E. Addon treatment of benzoate for schizophrenia: a randomized, double-blind, placebo-controlled trial of D-amino acid oxidase inhibitor. JAMA Psychiatry. 2013; 70 (12): 1267–1275. DOI: 10.1001/jamapsychiatry.2013.2159.
70. Bruno A., Pandolfo G., Crucitti M., Lorusso S., Zoccali R.A., Muscatello M.R.A. Acetyl-L-carnitine augmentation of clozapine in partial-responder schizophrenia: a 12-week, open-label uncontrolled preliminary study. Clinical Neuropharmacology. 2016; 39 (6): 277–280. DOI: 10.1097/WNF.0000000000000170.
71. Chen A.T., Chibnall J.T., Nasrallah H.A. A meta-analysis of placebo-controlled trials of omega-3 fatty acid augmentation in schizophrenia: Possible stage-specific effects. Annals of Clinical Psychiatry. 2015; 27 (4): 289–296.
72. Sethi S., Brietzke E. Omics-based biomarkers: application of metabolomics in neuropsychiatric disorders. International Journal of Neuropsychopharmacology. 2015; 19 (3): pyv096. DOI: 10.1093/ijnp/pyv096.
73. Chan M.K., Gottschalk M.G., Haenisch F., Tomasik J., Ruland T., Rahmoune H., Guest P. C., Bahn S. Applications of blood-based protein biomarker strategies in the study of psychiatric disorders. Progress in Neurobiology. 2014; 122: 45–72. DOI: 10.1016/j.pneurobio.2014.08.002.
74. Nascimento J.M., Martins-de-Souza D. The proteome of schizophrenia. NPJ Schizophrenia. 2015; 1: 14003. DOI: 10.1038/npjschz.2014.3.
Ученые выяснили, почему одни группы людей подвержены коронавирусу больше других
Одни группы населения больше других подвержены заражению SARS-CoV-2 из-за особых механизмов формирования связей между аминокислотами и клеточного окисления, считают канадские ученые. Это же позволяет вирусу поражать и некоторые виды животных. Если догадки ученых окажутся верны, можно будет снизить тяжесть течения COVID-19 антиоксидантами.
Наиболее уязвимые для SARS-CoV-2 группы людей, а также подверженные заражению животные имеют определенные сходства на клеточном уровне, выяснили специалисты Университета Макгилла в Канаде. Исследование было опубликовано в журнале Computational and Structural Biotechnology Journal.
В мире более 60 миллионов человек заразились COVID-19, более 1,5 млн умерли. Также оказалось, что от него могут пострадать животные. Но разные виды животных и разные группы людей подвержены заражению в разной степени, и надежного этому объяснения пока что нет, отмечают авторы работы.
«Мы знаем, что вирус может поразить людей, кошек, собак и хорьков, но не коров и свиней. Кроме того, COVID-19 поражает пожилых людей и людей с сопутствующими заболеваниями более серьезно, чем молодых и здоровых. До сих пор причины этого не были ясны», — говорит профессор Джасвиндер Сингх, один из авторов исследования.
Вирус проникает в клетки, используя расположенный на их поверхности рецептор ACE2. Анализируя белки и составляющие их аминокислоты, исследователи обнаружили, что у восприимчивых к вирусу животных есть несколько общих черт. У людей, кошек и собак в рецепторах ACE2 две цистеиновые аминокислоты, которые образуют особую дисульфидную связь, сохраняющуюся за счет окислительной клеточной среды. Эта связь служит «якорем» для вируса.
«ACE2 — известный регулятор оксидативного стресса, — пишут авторы работы. — Усиление клеточного окисления с возрастом или из-за болезни — наиболее вероятное объяснение повышенной уязвимости пожилых людей и людей с сопутствующими заболеваниями перед COVID-19».
«Наш анализ показывает, что более сильное клеточное окисление у пожилых людей или людей с сопутствующими заболеваниями может предрасполагать их к более сильным инфекциям, репликации и болезням», — уточняет профессор биологии Раджиндер Дхиндса, соавтор исследования.
У животных, устойчивых к вирусу, есть только одна цистеиновая аминокислота, поэтому дисульфидная связь не может образоваться. В результате вирусу не удается прикрепиться к клетке.
Если помешать «якорю» формироваться, можно защитить пациентов, считают исследователи. Одним из способов может быть нарушение окислительной среды, которая позволяет дисульфидным связям сохраняться.
«Антиоксиданты могут снизить тяжесть COVID-19, препятствуя проникновению вируса в клетки и его выживанию после этого», — предполагает Сингх.
Исследователям еще предстоит проверить эту теорию. Например, можно поэкспериментировать с редактированием генома животных, с изменением белковых последовательностей, чтобы больше узнать о проникновении вируса в клетки. Также ученые планируют изучить другие белки рядом с рецептором ACE2, чтобы выяснить, могут ли они облегчать проникновение вируса в клетку.
Ранее израильские ученые обратили внимание, что с COVID-19 реже сталкиваются астматики — у них SARS-CoV-2 выявляется на треть реже, чем у остального населения.
Причины этого, впрочем, до конца не ясны.
Во-первых, причиной такого разрыва могут быть глюкокортикостероиды — их в ингаляционной форме используют больные астмой. Глюкокортикостероиды оказывают противовоспалительный эффект и снижают выработку цитокинов. Вероятно, свойства препаратов снижали способность вируса размножаться или как-то еще мешали его проникновению в клетки.
Кроме того, астматики могли уделять больше внимания состоянию своего здоровья и более ответственно подходить к защите от SARS-CoV-2, зная о возможных рисках осложнений.
Также дело может быть в рецепторе ACE2, «входных воротах» для вируса. Респираторные заболевания, в том числе астма, приводят к снижению выработки ACE2, что уменьшает и вероятность заражения.
Вопрос о том, могут ли ингаляционные глюкокортикостероиды защитить от SARS-CoV-2 или, наоборот, способствуют проникновению вируса в легкие, пока остается открытым, заключают ученые. Будущие наблюдения позволят точнее определить причину пониженного риска заражения и, возможно, использовать эти данные во благо пациентов без астмы. Врачам же пока следует лечить пациентов с астмой так же, как и раньше, в соответствии с существующими клиническими рекомендациями.
Растереть на аминокислоты
«Нужно обязательно употреблять белки!» — подобные рекомендации хотя бы раз в жизни слышал каждый. По идее, эти вещества мы можем спокойно получить из пищи — организм тут же займется расщеплением для дальнейшего усвоения. А что делать людям, желудочно-кишечный тракт которых не способен переработать их самостоятельно? Или любителям спорта, не успевающим «заправиться» после активных упражнений?Несбалансированное питание является важной проблемой для организма. Недостаточное или избыточное употребление белков, жиров, углеводов, микроэлементов приводит к нарушению обмена веществ и тяжелым заболеваниям: сахарному диабету, болезням сердца и сосудов. Кроме того, люди нередко испытывают значительный дефицит микронутриентов (питательных веществ) — до 80 % населения РФ, как показывают исследования Роспотребнадзора.
— Немаловажное значение в регуляции обмена веществ играют аминокислоты и олигопептиды, — рассказывает старший научный сотрудник Института химии твердого тела и механохимии СО РАН кандидат химических наук Алексей Леонидович Бычков. — Аминокислоты — это органические соединения, из которых состоят все белки, а олигопептиды — промежуточные соединения, где находится до 7—10 аминокислот.
Заменимые аминокислоты способны синтезироваться в организме, а вот незаменимые человек получает только из пищи, содержащей полноценные белки. Однако желудок не всегда может расщеплять их до более коротких молекул из-за ряда расстройств или после хирургического вмешательства. Для этого и разрабатывается питание с уже разделенными на части белками.
Чтобы получить востребованный продукт должного качества, нужны консультации экспертов из других областей. Ученые ИХТТМ СО РАН сотрудничают с двумя организациями: кафедрой технологии организации пищевых производств Новосибирского государственного технического университета и Институтом экспериментальной ветеринарии Сибири и Дальнего Востока Россельхозакадемии. Уже были проведены предварительные эксперименты: исследователи извлекли и расщепили белки из гороха, пищевики сделали супы-пюре и хлебцы, а в ИЭВСиДВ продукты испытали на животных (спойлер — всё прошло хорошо).
— Человек не может синтезировать все аминокислоты самостоятельно: приходится искать их в пище, — поясняет Алексей Бычков. — Есть такая научная шутка: как химику узнать, из чего состоит рояль? Нужно его растворить! Однако проблема в том, что не все вещества могут растворяться и реагировать друг с другом с нужной скоростью. В таких случаях и помогает химия твердого тела: проводя механохимическую обработку, можно добиться повышения реакционной способности материала. Здесь прежде всего необходимо не измельчение, а более тонкие процессы, меняющие структуру объекта.
При механическом воздействии с помощью специальных мельниц-активаторов в твердом теле возникает напряжение: в результате появляется трещина и происходит разрыв, деформация. Кроме того, разрушается кристаллическая структура вещества, рвутся химические связи. «Перемешав» кристаллические решетки, какую-то часть связей легче порвать. Структура аморфизуется, и ферменты относительно легко гидролизуют субстраты. Происходит химическая реакция, итог которой — образование новых соединений (в том числе необходимых аминокислот и олигопептидов).
— Если смешать зеленый и красный пластилин и помять его, даже не измельчая, в итоге кусок станет разноцветным, — рассказывает Алексей Бычков. — То же с растительным сырьем: нам больше интересно не измельчение, а получаемая внутренняя структура: как упакованы полимеры, упорядочены они или нет, взаимодействуют они между собой. Это во многом определяет реакционную способность.
Сибирские исследователи направляют свои разработки на тех людей, у которых есть потребность в подобных продуктах по состоянию здоровья. Другой вариант — спортивное питание, ведь в России практически нет своих производств.
— Большая часть потребителей спортпита — люди, которые ходят в тренажерный зал, — добавляет ученый. — В основном этот рынок представлен либо изолятами (белки, выделенные из сырья без расщепления), либо гидролизатами. Последние более эффективны, потому что в них молекулы расщеплены, но при этом дороже и не столь доступны обыкновенным спортсменам-энтузиастам.
На разработку ученых ИХТТМ выделен грант РНФ (в рамках президентской программы поддрежки исследований — прим. ред. сайта rscf.ru). Полученные данные позволят не только создавать компоненты продуктов функционального и лечебно-профилактического питания, но будут востребованы при решении проблем переработки других природных веществ — полимеров.
Аминокислоты и их производные входит в группу A16AA
Анатомо-Терапевтически-Химическая (АТХ) система классификации (ATC)
АТХ код: A16AA
Входит в группу: A16A — Другие препараты для лечения заболеваний ЖКТ и нарушений обмена веществНазвание: Аминокислоты и их производные
Латинское название: Amino Acids and Derivatives
Препараты группы
| Глутаминовая кислота | Таб., покрытые оболочкой, 250 мг: 60 шт. рег. №: ЛП-002250 от 26.09.13 | |||
| Глютаминовая кислота | Таб., покр. кишечнораств. обол., 250 мг: 10, 20, 40 или 1000 шт. рег. №: Р N003127/01 от 24.11.08 | |||
| Метионин | Таб., покр. оболочкой, 250 мг: 50 шт. рег. №: ЛСР-002112/09 от 19.03.09 | |||
| Метионин | Таб., покр. оболочкой, 250 мг: 50 шт. рег. №: ЛП-002011 от 25.02.13 | |||
| Метионин | Таб., покр. пленочной оболочкой, 250 мг: 10, 20 или 50 шт. рег. №: ЛС-001209 от 23.03.11 | |||
| Метионин | Таб., покр. пленочной оболочкой, 250 мг: 10, 20, 25, 30, 40, 50, 60, 75, 80, 100, 125, 150, 200, 250, 300, 400 или 500 шт. рег. №: ЛС-001630 от 09.12.11 Дата перерегистрации: 14.01.19 | |||
| Метионин | Таб., покр. пленочной оболочкой, 250 мг: 50 шт. рег. №: ЛС-002343 от 28.06.10 |
Другие подгруппы по коду АТХ: A16A — Другие препараты для лечения заболеваний ЖКТ и нарушений обмена веществ
Аминокислоты и ацилкарнитины в крови (42 показателя, метод ВЭЖХ-МС)
Согласие на обработку персональных данных
Согласие на обработку персональных данных Настоящим в соответствии с Федеральным законом № 152-ФЗ «О персональных данных» от 27.07.2006 года свободно, своей волей и в своем интересе выражаю свое безусловное согласие на обработку моих персональных данных ООО «Трэвел Лайн Групп, зарегистрированным в соответствии с законодательством РФ по адресу: Российская Федерация, 424003, Республика Марий Эл, г.Йошкар-Ола, пер.Заводской, д.3а, эт. 4, каб. 2 (далее по тексту — Оператор). Персональные данные — любая информация, относящаяся к определенному или определяемому на основании такой информации физическому лицу. Настоящее Согласие выдано мною на обработку следующих персональных данных: — Имя; — E-MAIL. Согласие дано Оператору для совершения следующих действий с моими персональными данными с использованием средств автоматизации и/или без использования таких средств: сбор, систематизация, накопление, хранение, уточнение (обновление, изменение), использование, обезличивание, а также осуществление любых иных действий, предусмотренных действующим законодательством РФ как неавтоматизированными, так и автоматизированными способами. Данное согласие дается Оператору для обработки моих персональных данных в следующих целях: — предоставление мне услуг/работ; — направление в мой адрес уведомлений, касающихся предоставляемых услуг/работ; — подготовка и направление ответов на мои запросы; — направление в мой адрес информации, в том числе рекламной, о мероприятиях/товарах/услугах/работах Оператора. Настоящее согласие действует до момента его отзыва путем направления соответствующего уведомления на электронный адрес [email protected]. В случае отзыва мною согласия на обработку персональных данных Оператор вправе продолжить обработку персональных данных без моего согласия при наличии оснований, указанных в пунктах 2 – 11 части 1 статьи 6, части 2 статьи 10 и части 2 статьи 11 Федерального закона №152-ФЗ «О персональных данных» от 27.07.2006 г.
Принимаю Не принимаю
Что такое аминокислоты, и насколько они необходимы человеку?
Многие люди, связанные со спортом, неоднократно слышали про аминокислоты. Эти вещества считаются витаминами силы и выносливости. При активных физических нагрузках их необходимо принимать дополнительно в виде биологически активных добавок или спортивного питания.
Что такое аминокислоты?
Аминокислоты — это частицы, из которых состоит белок. Всего в организме их больше 20, каждая из которых помогает синтезировать свой вид белка. Они участвуют в процессе создания ферментов, гормонов, белков.
Это основной строительный материал, который отвечает за большинство процессов в организме:
- настроение;
- концентрацию внимания;
- качество сна;
- сексуальную активность;
- восстановление тканей;
- восстановление и наращивание мышечных волокон;
- красивый вид волос и ногтей.
Высокое содержание качественного белка (21 г) в каждой порции и приятный привкус ванили вам подарит Сывороточный протеин Fitness Catalyst (ванильное мороженое). Концентрат сывороточного протеина с отличным аминокислотным профилем без искусственных подсластителей, разрыхлителей, усилителей вкуса и консервантов подходит для поклонников активного образа жизни и профессиональных атлетов.
Если хотя бы один вид соединений недоступен человеку или не потребляется в нужном количестве, это может сказаться на здоровье.
Симптомы недостатка?
Аминокислоты — органические кирпичики, из которых строится белок. Если их не хватает, то замедляются многие процессы в организме. Могут наблюдаться следующие проблемы:
- артрит;
- снижение полового влечения;
- плохое состояние кожи, волос, ногтей;
- бессонница;
- резкие перепады настроения;
- пониженный вес тела;
- гипертония.
Внимание! Важность этих соединений для организма крайне высока. Они нужны не только бодибилдерам или профессиональным спортсменам, но и тем, кто хочет быть здоровым и крепким.
Какие бывают аминокислоты?
Все аминокислоты делятся на 3 группы. Это незаменимые, заменимые, а также те, которые человеческий организм вырабатывает самостоятельно, но в небольших количествах.
Незаменимые аминокислоты:
- Фенилаланин. Участвует в синтезе дофамина, который проявляет антидепрессивное действие, в синтезе гормонов тироксина и адреналина, которые регулируют деятельность щитовидной железы и надпочечников соответственно.
- Валин, изолейцин и лейцин. Целая группа веществ, которые не дают мышцам разрушаться во время физических нагрузок.
- Треонин. Укрепляет сердце, а также связки в организме. Помогает производить коллаген и эластин. Способствует расщеплению жиров и предотвращает накопление жиров в печени. Дефицит треонина вызывает задержку роста и снижение массы тела.
- Триптофан. Улучшает состояние сна. Для спортсменов полезен тем, что способствует лучшей адаптации к жестким тренировкам и боли. Участвует в биосинтезе белков сыворотки крови и гемоглобина.
- Метионин. Участвует в синтезе холина, адреналина, нуклеиновых кислот, креатина, коллагена, иммунных клеток. Активизирует действие фолиевой кислоты и витамина B12. Регулирует уровень холестерина в крови. Дефицит метионина приводит к накоплению жира в печени. Избыток метионина может вызвать гемолитическую анемию, печеночную и сердечную недостаточность. .
- Лизин. Способствует синтезу антител, попаданию кальция в кости, стимулирует выделение гормонов эндокринной системой. При недостатке лизина возникают дистрофические изменения в мышцах, в печени и в легких, нарушается рост костей. .
Валин, изолейцин и лецин содержит Комплекс аминокислот BCAA из линейки спортивного питания Siberian Super Natural Sport, который обеспечивает мышцы питательными веществами, помогает быстрее восстанавливаться, замедляет процессы катаболизма и устраняет ощущение перетренированности.
Заменимые соединения: аланин, аспарагиновая кислота, аспартат, глютамин, глутамат, глицин, пролин, серин..
Условно-незаменимые:
- Аргинин. Помогает синтезировать азот. Расширяет сосуды. Позволяет легче переносить тяжелые физические тренировки.
- Гистидин. Предшественник гистамина.
- Тирозин. Увеличивает параметры работоспособности, а также скорость восстановления мышечных тканей.
- Цистеин. Способствует заживлению ожогов и ран, регенерации кожи, стимулирует иммунную систему.
Внимание! Условно-незаменимые аминокислоты в малых дозировках вырабатываются в организме, но слишком быстро тратятся, особенно при физических нагрузках. Поэтому необходим дополнительный прием препаратов с аминокислотами, чтобы была возможность переносить долгие и тяжелые тренировки.
Как принимать аминокислоты?
Чтобы получить максимальную пользу от аминокислот, их нужно правильно принимать. Тонкости приема зависят от желаемого результата, вида тренировок (аэробные, анаэробные) и интенсивности физических нагрузок. Существует несколько разных мнений по времени приема аминокислот. Кто-то считает, что если соединения принимают для спорта, чтобы набрать мышечную массу, то их следует употреблять примерно за час до занятий, во время тренировок и сразу после тренировки, в течение одного или двух часов, чтобы восполнить потери аминокислот, потраченные на мышечную работу. В некоторых случаях назначают дополнительный прием с утра. Другое мнение гласит, что во время интенсивной тренировки не следует принимать аминокислоты или протеины, т. к. большая часть крови, до 65%, уходит на кровоснабжение мышц. Поэтому ухудшается кровоснабжение желудочно-кишечного тракта и, соответственно, снижается всасывание выпитых аминокислот. Еще одна гипотеза состоит в том, что важно не время приема, а количество принятых аминокислот, поэтому можно их принять в любое время дня.
Поскольку избыток белка и аминокислот вреден для организма, в частности, нагружает печень и почки, то полезно делать перерывы в приеме.
При диетах для сброса лишнего веса также рекомендуется принимать больше аминокислот. Если, помимо диеты, существуют физические нагрузки, в таком случае прием препаратов обеспечит сброс веса при сохранении мышечной массы. Принимать его нужно до и после похода в спортзал, а также утром.
Для тех, кто считает калории, представляем Питательный коктейль Ванильная лукума — Yoo Gо, содержащий витамины, аминокислоты и полезные жиры. Каждая порция — это полезный набор пищевых волокон, омега-3 ПНЖК, белка и L-карнитина. Сбалансированный состав обеспечивает организм жизненно важными нутриентами и помогает сохранить ощущение сытости долгое время.
Следует учитывать следующие детали:
- Дозировка рассчитывается по массе тела.
- Суточную норму приема нужно делить на 2-5 приемов, в зависимости от того, когда Вы предпочитаете принимать аминокислоты.
Побочные действия возникают редко. Для этого необходимо в несколько раз превысить суточную норму. У лиц 55-60 лет и старше в связи с возрастом ухудшается работа желудочно-кишечного тракта, поэтому для них нежелательна высокобелковая или монобелковая диета, а необходима диета со сбалансированным содержанием белков, жиров и углеводов. Поэтому следует внимательно читать инструкцию и консультироваться с врачом.
как принимать, виды и типы аминокислот, полезные свойства
Активный рост мышц спортсмена нельзя представить без дополнительных аминокислот. Они являются строительными частицами белков в организме, что и делает тело спортсмена рельефным и очень привлекательным. Кроме этого немаловажного достоинства, аминокислоты укрепляют мышечную ткань, восстанавливают организм после тяжелых нагрузок и активно положительно влияют на похудение.
Виды аминокислот и их предназначение
По своей сути аминокислоты являются белками, расщепленными на частицы. Когда белок распадается (например, в процессе пищеварения), он образовывает эти питательные вещества.
Все аминокислоты можно разделить на три вида:
- заменимые (которые могут вырабатываться в организме человека) – это аланин, аспаргин, глицин, пролин, глютамин, серин;
- условно заменимые (вырабатываются только в благоприятных условиях или только у взрослых людей) – аргинин, цистеин, тирозин;
- все остальные аминокислоты относятся к категории незаменимых (они не вырабатываются самостоятельно и поступают в организм только с продуктами рациона).
В организме эти нутриенты выполняют множество функций:
- отвечают за создание новых клеток, а также регенерацию мышечных волокон;
- обеспечивают организм дополнительной энергией;
- способствуют нормальному обмену веществ, поддержанию здорового гормонального фона;
- улучшают память, повышают концентрацию внимания, влияют на состояние нервной системы;
- поддерживают иммунную систему;
- подавляют аппетит и способствуют избавлению от лишнего веса;
- играют важную роль при формировании мышечного рельефа;
- улучшают состояние волос, ногтей и кожи.
Если вы занимаетесь спортом, отдельное внимание следует обратить на комплекс ВСАА. Он состоит из трех незаменимых аминокислот – лейцина, изолейцина и валина, препятствующих распаду мышечных волокон (катаболизму). Принимайте этот вид спортпита, чтобы защитить мышцы во время интенсивной тренировки или сразу после нее.
Аминокислоты одинаково важны и для мужчин, и для женщин. Но если представители сильного пола используют их для прироста мышечной массы, то женщины таким образом избавляются от избытков жировой ткани. Таким образом, аминокислотные комплексы практически не требуют времени для усвоения организмом, и быстрее проникают в мышечные клетки, питая и восстанавливая их.
Типы аминокислотных комплексов
- Свободная форма – это такие аминокислоты, которые моментально всасываются в кровеносные сосуды и не требуют дополнительное переваривание пищеварительной системой. За счет этого они способны очень быстро проникнуть в мышцы и предвидеть мышечный катаболизм.
- Гидролизованная форма – самые быстрые в усвоении организмом, активно питают мышечную ткань и являются основной всех анаболических реакцией.
- BCAA, которые еще называют «мышечными аминокислотами», ведь именно они наиболее положительно влияют на рост мышечной ткани.
- Ди- и трипептидные аминокислоты питают мышцы и активируют анаболические реакции.
Любые аминокислоты отлично комбинируются с другими продуктами спортпита, но далеко не все можно вместе употреблять и тем более смешивать. Для дополнительной консультации лучше обратиться к специалистам нашего магазина спортивного питания Bcaa.
Польза аминокислот
- они отлично повышают силы и выносливость на тренировке, что ускоряет набор мышечной массы;
- быстро восстанавливают организм, устраняют боли после тренировки;
- отлично обогащают рацион питания полезными компонентами;
- активно устраняют чувство голода;
- сжигают лишнюю жировую прослойку, ускоряя метаболизм.
Как принимать аминокислотные комплексы?
Правильный прием зависит от вашей цели. Если вы хотите нарастать мышечную массу и выглядеть лучше, идеальное время для употребления аминокислот – это до и после тренировки, после пробуждения утром. Если вам нужно быстро похудеть, продукт стоить принимать чаще. Универсальная дозировка – не менее 5 грамм.
Самые популярные продукты
Ассортимент аминокислот на рынке спортивного питания поражает, но вот процесс выбора качественного и полезного комплекса часто оказывается большой проблемой. Какие же продукты считаются самыми популярными и завоевали доверие профессионалов? Это такие аминокислоты, как Whey Amino Tabs 2000 и Amino Max Hydrolysate от Maxler, Mega Amino 3200 от бренда BioTech и таблетки Amino 5600 от известного производителя Scitec Nutrition.
Другие полезные статьи:
Аминокислоты — обзор
3.25.3.5.1 Аминокислоты и белки
Содержание свободных аминокислот в зеленых кофейных зернах варьируется от 0,001% для метионина в робусте до 0,1% для глутаминовой кислоты в арабике. Зеленые бобы арабики и робусты по половине свободных аминокислот значительно различаются. В обжаренном кофе свободные аминокислоты не обнаруживаются.
Аминокислоты входят в состав пептидов и белков; их индивидуальный вклад может быть проанализирован как «общее количество аминокислот» после соответствующего аналитического гидролиза. 137 Сумма аминокислот примерно соответствует содержанию белка.
Содержание белка требуется для деклараций пищевой ценности продуктов, 138 , что фактически является необязательным.
Традиционное определение протеина в пище путем пересчета общего азота в содержание протеина с легальным (!) Эмпирическим коэффициентом 6,25 (азотный метод Кьельдаля) не дает правильных значений протеина для кофе, если не было внесено несколько поправок — для азот кофеина и тригонеллина, другой небелковый азот и те компоненты, которые в случае жареного кофе не достигают напитка потребителей. В таблице 8 приведены результаты определения свободных и общих аминокислот зеленого кофе арабика и робуста, взятые из двух докторских диссертаций; добавлены данные об общем количестве жареного и вареного кофе Арабика. Траутвайн использовал образцы разного происхождения; большой разброс был обнаружен в каждом наборе данных, 139 , что не очевидно в общем среднем. По общему количеству аминокислот результаты арабики и робусты широко перекрываются, как показывает Таблица 8 .
Таблица 8. Содержание свободных и общих аминокислот в кофе, зеленом, жареном, пивоваренном, из разных источников
| Аминокислоты | Зеленая арабика без AA a | Робуста зеленая без AA a | Всего зеленая робуста AA a | зеленая всего арабика AA b | Обжарка арабики всего AA b | Варка арабики всего AA b | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| % DW | % DW | %.DW | % DW | % DW | % DW | |||||||
| Аланин | 0,025 | 0,034 | 0,53 | 0,58 | 0,61 | 035 | ||||||
| Аргинин | 0,008 | 0,018 | 0,72 | 0,64 | 0,00 | 0,00 | ||||||
| Аспарагиновая кислота | 0,033 | 0,033 | 1,03 | 1,22 | 1,15 | 0.73 | ||||||
| Цистеин | н.о. | н.о. | 0,26 | н.о. | н.о. | н.о. | ||||||
| гамма-аминомасляная кислота | 0,028 | 0,047 | 0,05 | |||||||||
| Глутаминовая кислота | 0,102 | 0,047 | 2,20 | 2,43 | 2.47 | 2,06 | 0003 | 0,006 | 0.69 | 1,14 | 103 | 0,71 |
| Гистидин | 0,004 | 0,004 | 0,35 | 0,29 | 0,24 | 0,15 | ||||||
| Илейцин | 0,005 | 0,008 | 0,45 | 0,50 | 0,26 | |||||||
| Лейцин | 0,006 | 0,010 | 0,93 | 1,09 | 1,11 | 0,57 | ||||||
| Лизин | 0.006 | 0,011 | 0,69 | 0,81 | 0,11 | 0,00 | ||||||
| Метионин | 0,002 | 0,001 | 0,14 | 0,11 | 0,07 | |||||||
| 0,017 0,60 | 0,61 | 0,63 | 0,32 | |||||||||
| Пролин | 0,64 | 0,62 | 0,45 | |||||||||
| Серин | 0.017 | 0,016 | 0,57 | 0,49 | 0,24 | 0,15 | ||||||
| Треонин | 0,003 | 0,005 | 0,40 | 044 | 0,27 | 0,12 | ||||||
| Триптофан | н.о. | н.о. | ||||||||||
| Тирозин | 0,005 | 0,011 | 0,43 | 0,34 | 0,28 | 0,18 | ||||||
| Валин | 0.009 | 0,017 | 0,58 | 0,65 | 0,72 | 0,28 | ||||||
| Сумма | 0,27 | 0,29 | 10,5 | 12,0 | 10,1 | 6,4 | ||||||
| Среднее значение | 0,02 | 0,0 | 0,66 | 0,75 | 0,63 | 0,40 |
nd не обнаруживается; АК, аминокислоты.
Свободные аминокислоты зеленого кофе в значительной степени трансформируются при обжарке.Они принимают участие в реакции Майяра, в результате чего образуются компоненты, которые определяют вкус и цвет кофейного напитка. В обжаренном кофе остается лишь незначительное количество. 140
- —
Аминокислоты серы, цистин, цистеин и метионин в зеленом кофе, в основном связанные с белками, разлагаются при обжарке и взаимодействуют с редуцирующими сахарами и промежуточными продуктами Майяра с образованием сильно ароматических летучих веществ, например фурфурилтиола. , соединение, влияющее на аромат, с очень низким пороговым значением аромата, а также тиофены и тиазолы.
- —
Гидроксиламинокислоты серин и треонин реагируют с сахарозой с образованием летучих гетероциклических соединений, среди прочего, алкилпиразинов.
- —
Пролин и гидроксипролин реагируют с промежуточными продуктами Майяра с образованием пирролов, пирролизинов и пиридинов, а также алкил-, ацил- и фурфурилпирролов.
- —
Триптофан превращается в серотонин в последние недели развития зерна.
Содержание белка в зеленом кофе составляет около 10–13%.Белковый профиль кофе изменяется во время обжарки; белки и фрагментированы, и полимеризованы, и интегрированы в меланоидины. В конечном итоге их концентрация в пиве составляет около 6–7%, и эта цифра актуальна для расчета пищевой ценности. 137
Основной белок зеленого кофе — запасной белок типа 11S. Он биосинтезируется в эндосперме 141 во время созревания и составляет около половины содержания белка. 142 Белок 11S имеет α- и β-ветви разной длины с дисульфидным мостиком и позволяет ковалентно связываться с хлорогеновыми кислотами на более реакционноспособной β-ветви 143 при обжаривании.Сообщалось также о белках 7S- и 2S-типов. Сам белок 11S и ДНК, кодирующие его экспрессию, являются объектами европейских и американских патентов. 144
Белки и аминокислоты | Thermo Fisher Scientific
Стандартный генетический код
| U | C | A | G | ||
|---|---|---|---|---|---|
| U | UUU Phe (F) UUC Phe (F) UUA 9UA Leu (L) Leu (L) | UCU Ser (S) UCC Ser (S) UCA Ser (S) UCG Ser (S) | UAU Tyr (Y) UAC Tyr (Y) UAA Stop UAG Stop | UGU Cys (C) UGC Cys (C) UGA Stop UGG Trp (Вт) | U G |
| C | CUU Leu (L) CUC Leu (L) CUA Leu (L) CUG Leu (L) | CCU Pro (P) CCC Pro (P) CCA Pro (P) CCG Pro (P) | CAU His (H) CAC His (H) CAA Gln (Q) CAG Gln (Q) | CGU Arg (R) CGC Arg (R) CGA Arg (R) CGG Arg (R) | U C A G |
| A | Ile0004 AU AUC Ile (I) AUA Ile (I) AUG Met (M) | ACU Thr (T) ACC Thr (T) ACA Thr (T) ACG Thr (T) | AAU Asn (N) AAC Asn (N) AAA Lys (K) AAG Lys (K) | AGU Ser (S) AGC Ser (S) AGA Arg (R) AGG Arg (R) | U C A 9000 5 G |
| G | GUU Val (V) GUC Val (V) GUA Val (V) GUG Val (V) | GCU Ala (A) GCC Ala (A) GCA Ala (A) GCG Ala (A) | GAU Asp (D) GAC Asp (D) GAA Glu (E) GAG Glu (E) | GGU Gly (G) GGC Gly (G) GGA Gly (G) GGG Gly (G) | U C A G |
| Аминокислота | Трехбуквенный код | Однобуквенный код | Молекулярный вес (г / моль) |
|---|---|---|---|
| Аланин | Ala | A | 89.1 |
| Аргинин | Arg | R | 174,2 |
| Аспарагин | Asn | N | 132,1 |
| Аспартат | Asp | D | 133,1 |
| C | 121,2 | ||
| Глутамат | Glu | E | 147,1 |
| Глютамин | Gln | Q | 146.2 |
| Глицин | Gly | G | 75,1 |
| Гистидин | His | H | 155,2 |
| Изолейцин | Ile | I | 131,2 | 900uc53
| Lex Leu | L | 131,2 | |
| Лизин | Lys | K | 146,2 |
| Метионин | Met | M | 149.2 |
| Фенилаланин | Phe | F | 165,2 |
| Пролин | Pro | P | 115,1 |
| Серин | Ser | S | 105,1 |
| Треонин | 105,1 | ||
| Треонин Thr | T | 119,1 | |
| Триптофан | Trp | W | 204,2 |
| Тирозин | Tyr | Y | 181.2 |
| Валин | Вал | В | 117,1 |
Приблизительный молекулярный вес белка
M.W. белка = # аминокислот x 110 Да
D-аминокислоты в нервной и эндокринной системах
Аминокислоты являются важными компонентами пептидов и белков и действуют как передатчики сигналов. Для млекопитающих, включая человека, необходимы только L-аминокислоты.Однако у млекопитающих обнаружены различные D-аминокислоты, такие как D-серин, D-аспартат, D-аланин и D-цистеин. Постепенно выясняется физиологическая роль этих D-аминокислот не только в нервной, но и в эндокринной системе. Рецепторы N-метил-D-аспартата (NMDA) связаны с обучением и памятью. D-серин, D-аспартат и D-аланин могут связываться с рецепторами NMDA. H 2 S, образующийся из D-цистеина, уменьшает дисульфидные связи в рецепторах и усиливает их активность.Аберрантная активность рецепторов связана с заболеваниями центральной нервной системы (ЦНС), такими как болезнь Альцгеймера, боковой амиотрофический склероз и шизофрения. Кроме того, D-аминокислоты обнаруживаются в частях эндокринной системы, таких как шишковидная железа, гипоталамус, гипофиз, поджелудочная железа, надпочечники и яички. D-аспартат исследуется на предмет регуляции высвобождения гормонов из различных эндокринных органов. Здесь мы сосредоточились на недавних открытиях, касающихся синтеза и физиологических функций D-аминокислот в нервной и эндокринной системах.
1. Введение
Аминокислоты важны не только как важные компоненты для строительных блоков пептидов и белков, но также как биохимические регуляторы, такие как нейротрансмиттеры [1–4] и регуляторы аутофагии [5–8]. D-аминокислоты являются энантиомерами L-аминокислот и долгое время считались отсутствующими и неприродными аминокислотами у млекопитающих. Однако недавнее развитие чувствительных аналитических методов выявило присутствие D-аминокислот, таких как D-серин, D-аспартат и D-аланин, у млекопитающих [9–11].Более того, исследования ферментов, которые синтезируют или метаболизируют D-аминокислоты, также прояснили локализацию и функции D-аминокислот в нервной и эндокринной системах и обнаружили, что синтез и метаболизм D-аминокислот регулируются физиологически [12-15] . Здесь мы сосредоточились на последних достижениях в понимании синтеза, метаболизма и физиологической роли D-аминокислот в нервной и эндокринной системах.
2. D-серин
Отмеченные уровни D-серина были обнаружены в центральной нервной системе (ЦНС) грызунов и людей.Областями ЦНС, богатыми D-серином, были кора головного мозга, гиппокамп и полосатое тело. Кроме того, D-серин также обнаруживается в других регионах, таких как средний мозг, мозжечок и спинной мозг, у грызунов и людей [16–19]. Внеклеточные уровни D-серина в медиальной префронтальной коре и полосатом теле крыс составляют примерно 20% от общего уровня серина [20]. D-серин биосинтезируется серинрацемазой (SR) в ЦНС грызунов и человека [21–23]. Кроме того, уровень D-серина в ЦНС значительно снижен у мышей с нокаутом Sr [24, 25].
Было показано, что SR локализуется как в астроцитах, так и в нейронах, и D-серин высвобождается из обоих [22, 23, 26–29]. Кроме того, D-серин в нейронах генерируется из L-серина, полученного из астроцитов [27]. Модель D-серинового челнока описывает оптимальную D-серин-опосредованную активность рецептора N-метил-D-аспартата (NMDA), предполагая, что D-серин транспортируется между нейронами и астроцитами [30, 31]. Эта модель челнока D-серина выглядит следующим образом. Астроциты захватывают глюкозу из кровеносных сосудов через переносчик глюкозы 1, а затем через 3-фосфоглицератдегидрогеназу (Phgdh), которая в основном локализуется в астроцитах и превращает глюкозу в L-серин.L-серин экспортируется из астроцитов и импортируется в нейроны через транспортеры аланина / серина / цистеина / треонина (ASCT). В нейроне L-серин превращается в D-серин с помощью SR. D-серин высвобождается из нейронов через транспортер аланин-серин-цистеин-1 (Asc-1) или другими путями в синапс, где он может регулировать активность рецептора NMDA. Высвобожденный D-серин также может быть импортирован в астроциты через ASCT. Способность SR рацемизировать L-серин в D-серин положительно регулируется пиридоксаль-5′-фосфатом (PLP), двухвалентными катионами и АТФ [22, 32, 33].С другой стороны, активность SR ингибируется его перемещением из цитозоля на мембраны, содержащие фосфатидилинозитол-4,5-бисфосфат (PIP 2 ), такие как ядерный, эндоплазматический ретикулум (ER) и плазматические мембраны [34 –37]. SR также регулируется посредством взаимодействия с другими белками (рис. 1). Было обнаружено, что белок 1, взаимодействующий с глутаматным рецептором (GRIP1) [38], и белок, взаимодействующий с С-киназой (PICK1) [39, 40], активируют SR, взаимодействуя с ним в астроцитах грызунов.GRIP1 связывается с рецептором α -амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты (AMPA) и высвобождается после стимуляции L-глутаматом. Освободившийся GRIP1 связывает и активирует SR [38]. Было обнаружено, что белок постсинаптической плотности 95 (PSD95) / Discs large / ZO-1 (PDZ) в С-концевой области GRIP1 отвечает за взаимодействие с SR [38, 41]. PICK1 имеет домен PDZ, который связывается с SR [39], и домен Bin / amphiphysin / Rvs (BAR), который взаимодействует с мембранами [42]. PICK1 связывается с эритропоэтин-продуцирующим гепатоцеллюлярным рецептором (Eph) B3 или EphA4 в астроцитах.После того, как ephrinB3, который экспрессируется на постсинаптических нейронах, связывается с рецептором EphB3 или EphA4, PICK1 высвобождается в цитозоль. Усиление ассоциации между высвобожденным PICK1 и SR увеличивает синтез D-серина в астроцитах мышей [40]. Старгазин и белок 22, содержащий только F-бокс (FBXO22), также регулируют активность SR, влияя на субклеточную локализацию SR. Старгазин образует комплекс с покоящимся рецептором AMPA, PSD-95 и SR, ингибируя активность SR, способствуя локализации мембран в нейронах мышей.После активации рецептора AMPA SR высвобождается из старгазина и плазматической мембраны, что приводит к активации SR [43]. FBXO22 связывает и активирует SR, предотвращая его связывание с мембраной ER в нейронах и астроцитах крыс. FBXO22 может блокировать липид-связывающую область SR [35].
D-серин катализируется SR и оксидазой D-аминокислот (DAO). SR обладает α , β -элиминирующей и рацемизационной активностями. SR превращает D-серин и L-серин в пируват и аммиак путем удаления воды из этих аминокислот путем α , β -элиминирования [44].Следовательно, SR может регулировать физиологический уровень D-серина за счет рацемической активности для синтеза D-серина и за счет активности α , β -элиминации для разрушения D-серина. DAO — это флавопротеин, который превращает D-серин с образованием соответствующей альфа-кетокислоты, перекиси водорода и аммиака [11].
Было обнаружено, что распределение D-серина в ЦНС сходно с распределением рецепторов NMDA, которые являются ионотропными рецепторами глутамата (iGluR) [18, 45], а для активации рецепторов NMDA требуется связывание как глутамата, так и D -серин или глицин.Активированные рецепторы NMDA индуцируют поток Ca 2+ , что приводит к регуляции долговременной потенциации (LTP) и долговременной депрессии (LTD) в различных областях ЦНС. Таким образом, регуляция рецепторов NMDA тесно связана с синаптической активностью, обучением и памятью [46–49].
Рецептор NMDA в основном состоит из двух субъединиц GluN1 и двух субъединиц GluN2 одной и той же или разных субъединиц GluN2. Глутамат связывается с GluN2, тогда как D-серин или глицин связываются с GluN1 [50–52].Хотя D-серин или глицин могут действовать как коагонист рецепторов NMDA [46], снижение уровня D-серина снижает активность рецептора NMDA, а добавление D-серина отменяет эту инактивацию, приводя к LTP [46, 53]. Более того, D-серин индуцирует LTP, а деградация D-серина под действием DAO приводит к подавлению этой индукции [49]. Следовательно, D-серин играет важную роль в регуляции синаптической активности, обучения и памяти, регулируя активацию рецепторов NMDA.Однако сообщалось о нейротоксических эффектах D-серина. По сравнению с мышами дикого типа, сниженные уровни D-серина у взрослых мышей с нокаутом Sr снижали нейротоксичность, опосредованную рецептором NMDA и β -амилоид 1–42 [24]. Более того, повышенные уровни D-серина у взрослых мышей с нокаутом Dao приводили к дегенерации двигательных нейронов [54]. Аберрантные уровни D-серина связаны с заболеваниями, вызванными аномальной активностью рецепторов NMDA. Сообщалось, что уровни D-серина в спинномозговой жидкости (CSF) пациентов с болезнью Альцгеймера выше, чем у нормальных контролей [55, 56].Кроме того, нейротоксичность, вызванная бета-амилоидом, подавляется у мышей с нокаутом Sr , которые показали снижение уровня D-серина в головном мозге на 90% [24]. Шизофрения связана с гипофункцией рецепторов NMDA [57]. Снижение уровня D-серина приводит к гипофункции рецепторов NMDA, что приводит к симптомам шизофрении [25, 58]. Более того, введение D-серина улучшает положительные, отрицательные и когнитивные симптомы у пациентов с шизофренией [59]. Боковой амиотрофический склероз (БАС) связан с повышенным уровнем D-серина [60, 61].Следовательно, контроль уровня D-серина может быть одной из терапевтических целей при этих заболеваниях.
С другой стороны, D-серин связывается с глутаматным рецептором δ 2-типа (GluD2), который представляет собой iGluR, и вызывает уменьшение количества рецепторов AMPA в клетках Пуркинье в мозжечке за счет эндоцитоза. Это приводит к продвижению ООО мозжечок. Более того, связывание D-серина с GluD2 приводит к приобретению двигательного обучения у мышей [62]. Недавно сообщалось, что возрастное увеличение активности пируваткарбоксилазы в глиальных клетках вызывает снижение уровня D-серина, что приводит к возрастному ухудшению памяти у мух [63].Пируваткарбоксилаза образует щавелевоуксусную кислоту, которая может быть преобразована в аспарагиновую кислоту. И щавелевоуксусная кислота, и аспарагиновая кислота могут ингибировать SR, что приводит к снижению уровня D-серина [64].
D-серин также был обнаружен в эндокринных органах, таких как надпочечники и гипофиз, поджелудочная железа и семенники, крыс [65, 66]. Однако уровни D-серина в эндокринной системе намного ниже, чем в ЦНС, и физиологическая роль D-серина в эндокринных системах остается неясной.
3. D-аспартат
D-аспартат обнаружен в ЦНС грызунов и людей [16, 19, 67–72], а также в эндокринных органах, включая шишковидную железу [69, 72, 73], гипофиз. железы [68, 69, 71, 72, 74], поджелудочной железы [66], надпочечников [19, 67, 72, 74, 75] и семенников крыс [74, 76]. D-аспартат активирует рецепторы NMDA посредством связывания с сайтом агониста субъединиц GluN2 (2A – D) [77–79], а также может активировать метаботропный рецептор глутамата 5 (mGlu5) [80]. Хотя фермент, который генерирует D-аспартат, еще не идентифицирован [81–83], образование D-аспартата может зависеть от PLP [67].
С другой стороны, было продемонстрировано, что D-аспартат разлагается до оксалоацетата, пероксида водорода и аммония пероксисомальной флавопротеин D-аспартатоксидазой (DDO) [84–86]. Хотя D-аспартат в изобилии присутствует в мозге грызунов и людей во время развития, уровни D-аспартата сильно снижаются на постнатальных стадиях, и это снижение сохраняется на протяжении всей взрослой жизни [16, 67, 68, 71, 87, 88]. Напротив, активность DDO и его мРНК чрезвычайно низки на постнатальных стадиях и увеличиваются после рождения у грызунов [88, 89].Более того, было показано, что уровни D-аспартата были значительно повышены в ЦНС мышей с нокаутом по Ddo [88, 90–93]. Кроме того, D-аспартат обнаружен исключительно в нейронах крыс [67]. Улучшение пространственной памяти было продемонстрировано у мышей с нокаутом Ddo [77, 78]. Более того, мыши, получавшие D-аспартат, и мыши с нокаутом Ddo продемонстрировали усиление LTP [77–79] и увеличение длины дендритов и плотности шипов в нейронах префронтальной коры и гиппокампа [94].Следовательно, значительное увеличение уровней D-аспартата, усиление LTP и увеличение длины дендритов и плотности шипов нейронов у взрослых мышей с нокаутом Ddo указывают на то, что D-аспартат также может генерироваться и функционировать в ЦНС во взрослом возрасте. Однако стойкое повышение уровней D-аспартата у взрослых мышей с нокаутом Ddo имеет нейротоксические эффекты, такие как активация каспазы-3 и апоптоз в нейронах [88]. Экспрессия мРНК Ddo в посмертном мозге пациентов с шизофренией была значительно выше, чем у контрольных лиц [95].Более того, сообщалось, что уровни D-аспартата были значительно снижены в посмертном мозге пациентов с шизофренией по сравнению с таковыми в контрольной группе [96]. Мыши с нокаутом Ddo демонстрируют сниженное шизофреническое поведение, индуцированное фенциклидином, такое как двигательная гиперактивность и предымпульсное торможение [95]. Эти данные показывают, что аномальный уровень D-аспартата может быть связан с шизофренией.
В эндокринной системе D-аспартат контролирует синтез и высвобождение гормонов.D-аспартат подавляет синтез мелатонина в шишковидной железе крысы [97], а также снижает высвобождение мелатонина из культивируемых пинеалоцитов крысы [98]. В гипоталамусе крысы D-аспартат индуцирует экспрессию генов окситоцина и вазопрессина [99] и может увеличивать высвобождение гонадотропин-рилизинг-гормона [100]. D-аспартат также вызывает высвобождение пролактина [101], гормона роста и лютеинизирующего гормона [100, 102] из передней доли гипофиза крысы. Напротив, повышение уровней D-аспартата связано со значительным снижением проопиомеланокортина и α -меланоцит-стимулирующего гормона в промежуточной доле мыши [93].В семенниках крыс D-аспартат индуцирует синтез и высвобождение тестостерона [102–104]. Повышенная экспрессия андрогенов и пониженная экспрессия рецепторов эстрогена при введении D-аспартата были показаны в семенниках крыс [104]. Более того, пероральный прием D-аспартата вызывает высвобождение тестостерона в сыворотке человека [102] и улучшает количество и подвижность сперматозоидов у человека [105]. Следовательно, ожидается, что D-аспартат может быть кандидатом для лечения бесплодия.
4.Другие D-аминокислоты
Различные D-аминокислоты, кроме D-серина и D-аспартата, также были обнаружены в нервной и эндокринной системах.
D-Аланин обнаружен в головном мозге, гипофизе, поджелудочной железе, надпочечниках и семенниках грызунов [106]. Кроме того, он обнаруживается также в головном мозге человека [107]. Большая часть D-аланина у грызунов происходит из кишечных бактерий [108, 109]. D-аланин метаболизируется DAO [11], а уровень D-аланина у грызунов зависит от циркадного ритма [9, 110].Кроме того, сообщалось, что D-аланин связывается с рецептором NMDA и улучшает симптомы у пациентов с шизофренией [111].
D-Цистеин оказался одним из источников H 2 S в головном мозге (рис. 2). D-цистеин, вероятно, хотя бы частично абсорбируется с пищей, хотя источник D-цистеина в организме до сих пор не выяснен [112]. В ЦНС D-цистеин расщепляется DAO с образованием 3-меркаптопирувата (3MP). Затем 3-МП катализируется 3-меркаптопируват-серотрансферазой (3MST) с образованием H 2 S [113].3MST обнаружен в синаптосомах и нейронах мозга мышей [114]. Более того, полисульфиды водорода (H 2 ; –5) обнаруживаются в мозге мышей и также генерируются 3MST из 3MP [115]. H 2 S усиливает активность рецепторов NMDA за счет уменьшения дисульфидных связей в рецепторах NMDA и индуцирует LTP у крыс [116, 117]. Напротив, H 2 активирует каналы A1 переходного рецепторного потенциала (TRP) в астроцитах грызунов и индуцирует поток Ca 2+ [118].Активация каналов TRPA1 приводит к высвобождению D-серина из астроцитов грызунов и усиливает зависимый от рецептора NMDA LTP [119]. Кроме того, Паркин является одним из ключевых факторов болезни Паркинсона [7], а H 2 S усиливает активность Паркина и приводит к защитным эффектам против болезни Паркинсона [120]. В эндокринной системе H 2 S ингибирует индуцированное глюкозой высвобождение инсулина из клеток поджелудочной железы β [121].
D-лейцин и D-пролин обнаружены в головном мозге, шишковидной железе и гипофизе грызунов [122, 123].D-глутамат обнаружен в головном мозге грызунов [70, 124]. Однако детальные физиологические роли этих аминокислот остаются неясными.
5. Выводы
Считается, что только L-аминокислоты используются у млекопитающих, включая человека. Однако из-за недавней разработки чувствительных и селективных аналитических методов для обнаружения хиральных аминокислот [125] в тканях млекопитающих были обнаружены различные D-аминокислоты. Физиологические функции этих D-аминокислот постепенно выясняются.Было продемонстрировано, что D-аминокислоты, такие как D-серин, D-аспартат, D-аланин и D-цистеин, играют важную роль в нервной и эндокринной системах. Поэтому очень важно, чтобы механизмы синтеза и метаболизма, а также физиологические функции D-аминокислот были дополнительно исследованы. Эти исследования предоставят новые терапевтические и диагностические стратегии для заболеваний, связанных с нервной и эндокринной системами.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
2.2: Структура и функции — аминокислоты
Источник: BiochemFFA_2_1.pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
.Все белки на Земле состоят из одних и тех же 20 аминокислот. Связанные вместе в длинные цепи, называемые полипептидами, аминокислоты являются строительными блоками для огромного ассортимента белков, обнаруженных во всех живых клетках.
«Это одно из наиболее ярких обобщений биохимии…. что двадцать аминокислот и четыре основания, с небольшими оговорками, одинаковы во всей Природе «. — Фрэнсис Крик
Все аминокислоты имеют одинаковую основную структуру, показанную на рисунке 2.1. В «центре» каждой аминокислоты находится углерод, называемый α углеродом, и к нему присоединены четыре группы — водород, α-карбоксильная группа, α-аминогруппа и R-группа, иногда называемая боковая цепь. Α-углеродная, карбоксильная и аминогруппы являются общими для всех аминокислот, поэтому R-группа является единственной уникальной особенностью каждой аминокислоты.(Незначительным исключением из этой структуры является пролин, в котором конец R-группы присоединен к α-амину.) За исключением глицина, у которого есть R-группа, состоящая из атома водорода, все аминокислоты в белках имеют четыре разные группы, присоединенные к ним, и, следовательно, могут существовать в двух зеркальных формах, L и D. За очень небольшими исключениями каждая аминокислота, обнаруженная в клетках и в белках, находится в L-конфигурации.
Рисунок 2.1 — Общая структура аминокислотВ белках содержатся 22 аминокислоты, из которых только 20 определены универсальным генетическим кодом.Другие, селеноцистеин и пирролизин, используют тРНК, которые способны образовывать пары оснований со стоп-кодонами в мРНК во время трансляции. Когда это происходит, эти необычные аминокислоты могут быть включены в белки. Ферменты, содержащие селеноцистеин, например, включают глутатионпероксидазы, тетрайодтиронин-5′-дейодиназы, тиоредоксинредуктазы, формиатдегидрогеназы, глицинредуктазы и селенфосфатсинтетазу. Белки, содержащие пирролизин, встречаются гораздо реже и в основном встречаются в архее.
Существенные и второстепенные
Диетологи делят аминокислоты на две группы — незаменимые аминокислоты (должны присутствовать в рационе, потому что клетки не могут их синтезировать) и заменимые аминокислоты (могут производиться клетками). Эта классификация аминокислот имеет мало общего со структурой аминокислот. Незаменимые аминокислоты значительно различаются от одного организма к другому и даже различаются у людей, в зависимости от того, взрослые они или дети. Таблица 2.1 показывает незаменимые и заменимые аминокислоты в организме человека.
Некоторые аминокислоты, которые обычно не являются незаменимыми, в определенных случаях может потребоваться получить с пищей. Людям, которые не синтезируют достаточное количество аргинина, цистеина, глутамина, пролина, селеноцистеина, серина и тирозина, например, из-за болезни, могут потребоваться пищевые добавки, содержащие эти аминокислоты.
Таблица 2.1 — Незаменимые и заменимые аминокислоты
Небелковые аминокислоты
Есть также α-аминокислоты, обнаруженные в клетках, которые не включены в белки.Общие включают орнитин и цитруллин. Оба эти соединения являются промежуточными продуктами цикла мочевины. Орнитин является метаболическим предшественником аргинина, а цитруллин может вырабатываться при расщеплении аргинина. Последняя реакция производит оксид азота, важную сигнальную молекулу. Цитруллин — это побочный продукт метаболизма. Иногда его используют в качестве пищевой добавки для снижения мышечной усталости.
Химия группы R
Таблица 2.2 — Категории аминокислот (на основе свойств R-группы)
Мы разделяем аминокислоты на категории на основе химического состава их R-групп.Если вы сравните группы аминокислот в разных учебниках, вы увидите разные названия категорий и (иногда) одну и ту же аминокислоту, классифицируемую разными авторами по-разному. Действительно, мы относим тирозин как к ароматической аминокислоте, так и к гидроксиламинокислоте. Полезно классифицировать аминокислоты на основе их R-групп, потому что именно эти боковые цепи придают каждой аминокислоте ее характерные свойства. Таким образом, можно ожидать, что аминокислоты с (химически) подобными боковыми группами будут функционировать аналогичным образом, например, во время сворачивания белка.
Неполярные аминокислоты
- Аланин (Ala / A) — одна из самых распространенных аминокислот, обнаруживаемых в белках, по распространенности уступающая только лейцину. D-форма аминокислоты также содержится в стенках бактериальных клеток. Аланин несущественен, легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG.
- Глицин (Gly / G) — это аминокислота с самой короткой боковой цепью, имеющая R-группу, соответствующую только одному водороду. В результате глицин — единственная нехиральная аминокислота.Его небольшая боковая цепь позволяет ему легко вписываться как в гидрофобную, так и в гидрофильную среду.
- Глицин определяется в генетическом коде посредством GGU, GGC, GGA и GGG. Для людей это несущественно.
- Изолейцин (Ile / I) — незаменимая аминокислота, кодируемая AUU, AUC и AUA. У него гидрофобная боковая цепь, а также хиральная боковая цепь.
- Лейцин (Leu / L) представляет собой аминокислоту с разветвленной цепью, которая является гидрофобной и незаменимой.Лейцин является единственной диетической аминокислотой, которая, как сообщается, напрямую стимулирует синтез белка в мышцах, но следует соблюдать осторожность, поскольку 1) существуют противоречивые исследования и 2) токсичность лейцина опасна, что приводит к «четырем D»: диарее, дерматиту, деменции. и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG.
- Метионин (Met / M) — незаменимая аминокислота, которая является одной из двух серосодержащих аминокислот, другой — цистеином. Метионин неполярен и кодируется исключительно кодоном AUG.Это «инициатор» аминокислоты в синтезе белка, поскольку она первая включается в белковые цепи. В прокариотических клетках первый метионин в белке формилируется.
- Пролин (Pro / P) — единственная аминокислота, обнаруженная в белках с R-группой, которая соединяется со своей собственной α-аминогруппой, образуя вторичный амин и кольцо. Пролин является незаменимой аминокислотой и кодируется CCU, CCC, CCA и CCG. Это наименее гибкая из аминокислот белка и, таким образом, придает конформационную жесткость, когда присутствует в белке.Присутствие пролина в белке влияет на его вторичную структуру. Это разрушитель α-спиралей и β-цепей. Пролин часто гидроксилирован в коллагене (для реакции требуется витамин С — аскорбат), что увеличивает конформационную стабильность белка. Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и направляет HIF на разрушение при избытке кислорода.
- Валин (Val / V) — незаменимая неполярная аминокислота, синтезируемая в растениях.Это примечательно в отношении гемоглобина, поскольку, когда он заменяет глутаминовую кислоту в позиции номер шесть, он вызывает аномальную агрегацию гемоглобина в условиях низкого содержания кислорода, что приводит к серповидно-клеточной анемии. Валин закодирован в генетическом коде GUU, GUC, GUA и GUG.
Карбоксиламинокислоты
- Аспарагиновая кислота (Asp / D) — это заменимая аминокислота с карбоксильной группой в ее R-группе. Его легко получить переаминированием оксалоацетата. При pKa 3,9 боковая цепь аспарагиновой кислоты отрицательно заряжена при физиологическом pH.Аспарагиновая кислота указана в генетическом коде кодонами GAU и GAC.
- Глутаминовая кислота (Glu / E), кодируемая GAA и GAG, представляет собой заменимую аминокислоту, легко получаемую путем трансаминирования α-кетоглутарата. Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (pKa = 4,1) при физиологическом pH.
Аминокислоты
- Аргинин (Arg / R) — это аминокислота, которая в некоторых случаях является незаменимой, а в других — несущественной.Недоношенные дети не могут синтезировать аргинин. Кроме того, хирургическая травма, сепсис и ожоги увеличивают потребность в аргинине. Однако большинству людей добавки аргинина не нужны. Боковая цепь аргинина содержит сложную гуанидиниевую группу с pKa более 12, что делает ее положительно заряженной при клеточном pH. Он кодируется шестью кодонами — CGU, CGC, CGA, CGG, AGA и AGG.
- Гистидин (His / H) — единственная из белковых аминокислот, которая содержит имидазольную функциональную группу. Это незаменимая аминокислота для человека и других млекопитающих.С pKa боковой цепи, равным 6, его заряд может легко измениться при небольшом изменении pH. Протонирование кольца приводит к двум структурам NH, которые можно представить как две одинаково важные резонансные структуры.
- Лизин (Lys / K) — незаменимая аминокислота, кодируемая AAA и AAG. Он имеет группу R, которая может легко ионизироваться с зарядом +1 при физиологическом pH и может быть посттрансляционно модифицирована с образованием ацетиллизина, гидроксилизина и метиллизина.Он также может быть убиквитинирован, сумоилирован, неддилирован, биотинилирован, карбоксилирован и пупилирован, и. О-гликозилирование гидроксилизина используется для маркировки белков для экспорта из клетки. Лизин часто добавляют в корм для животных, поскольку он является ограничивающей аминокислотой и необходим для оптимизации роста свиней и цыплят.
Ароматические аминокислоты
Рисунок 2.6 — Ароматические аминокислоты- Фенилаланин (Phe / F) — неполярная незаменимая аминокислота, кодируемая UUU и UUC.Это метаболический предшественник тирозина. Неспособность метаболизировать фенилаланин возникает из-за генетического нарушения, известного как фенилкетонурия. Фенилаланин входит в состав искусственного подсластителя аспартама.
- Триптофан (Trp / W) — незаменимая аминокислота, содержащая индольную функциональную группу. Это метаболический предшественник серотонина, ниацина и (в растениях) фитогормона ауксина. Хотя считается, что он используется в качестве снотворного, четких результатов исследований, указывающих на это, нет.
- Тирозин (Tyr / Y) — это незаменимая аминокислота, кодируемая UAC и UAU.Он является мишенью для фосфорилирования белков тирозиновыми протеинкиназами и играет роль в процессах передачи сигналов. В дофаминергических клетках головного мозга тирозингидроксилаза превращает тирозин в l-допа, непосредственный предшественник дофамина. Дофамин, в свою очередь, является предшественником норадреналина и адреналина. Тирозин также является предшественником гормонов щитовидной железы и меланина.
Гидроксиламинокислоты
- Серин (Ser / S) — одна из трех аминокислот, содержащих R-группу с гидроксилом (другие — треонин и тирозин).Он кодируется UCU, UCC, UCA, UGC, AGU и AGC. Обладая водородной связью с водой, он классифицируется как полярная аминокислота. Для человека это несущественно. Серин является предшественником многих важных клеточных соединений, в том числе пуринов, пиримидинов, сфинголипидов, фолиевой кислоты и аминокислот глицина, цистеина и триптофана. Гидроксильная группа серина в белках является мишенью для фосфорилирования некоторыми протеинкиназами. Серин также является частью каталитической триады сериновых протеаз.
- Треонин (Thr / T) — полярная аминокислота, которая является незаменимой. Это одна из трех аминокислот, несущих гидроксильную группу (серин и тирозин — другие), и, как таковая, она является мишенью для фосфорилирования белков. Он также является мишенью для гликозилирования белков. Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного пути биосинтеза для производства глицина. В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге.Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
Тирозин — см. ЗДЕСЬ.
Рисунок 2.8 — Аминокислотные свойства ВикипедияДругие аминокислоты
- Аспарагин (Asn / N) — это незаменимая аминокислота, кодируемая AAU и AAC. Его карбоксиамид в R-группе придает ему полярность. Аспарагин участвует в образовании акриламида в продуктах, приготовленных при высоких температурах (жарка во фритюре), когда он реагирует с карбонильными группами. Аспарагин может быть произведен в организме из аспартата путем реакции амидирования амином из глутамина.При распаде аспарагина образуется малат, который может окисляться в цикле лимонной кислоты.
- Цистеин (Cys / C) — единственная аминокислота с сульфгидрильной группой в боковой цепи. Это несущественно для большинства людей, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями. Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой группой. Цистеин не только содержится в белках, но и входит в состав трипептида, глутатиона.Цистеин определяется кодонами UGU и UGC.
- Глютамин (Gln / Q) — это аминокислота, которая обычно не является незаменимой для людей, но может быть у людей, проходящих интенсивные спортивные тренировки или страдающих желудочно-кишечными расстройствами. Он имеет карбоксиамидную боковую цепь, которая обычно не ионизируется при физиологических значениях pH, но придает полярность боковой цепи. Глутамин кодируется CAA и CAG и легко образуется путем амидирования глутамата.Глютамин — самая распространенная аминокислота в циркулирующей крови и одна из немногих аминокислот, способных преодолевать гематоэнцефалический барьер.
- Селеноцистеин (Sec / U) — компонент селенопротеинов, обнаруженных во всех сферах жизни. Он является компонентом нескольких ферментов, включая глутатионпероксидазы и тиоредоксинредуктазы. Селеноцистеин включается в белки по необычной схеме, включающей стоп-кодон UGA. Клетки, выращенные в отсутствие селена, прекращают синтез белка на UGA.Однако, когда присутствует селен, некоторые мРНК, которые содержат последовательность вставки селеноцистеина (SECIS), вставляют селеноцистеин при обнаружении UGA. Элемент SECIS имеет характерные нуклеотидные последовательности и вторичные структуры спаривания оснований. Двадцать пять белков человека содержат селеноцистеин.
- Пирролизин (Pyl / O) — двадцать вторая аминокислота, но редко встречается в белках. Как и селеноцистеин, он не закодирован в генетическом коде и должен быть включен необычными способами.Это происходит по стоп-кодонам UAG. Пирролизин содержится в метаногенных архейских организмах и, по крайней мере, в одной метан-продуцирующей бактерии. Пирролизин входит в состав ферментов, производящих метан.
Ионизирующие группы
ЗначенияpKa для боковых цепей аминокислот очень зависят от химической среды, в которой они присутствуют. Например, карбоксил R-группы, обнаруженный в аспарагиновой кислоте, имеет значение pKa 3,9 в свободном состоянии в растворе, но может достигать 14 в определенных средах внутри белков, хотя это необычно и экстремально.Каждая аминокислота имеет по крайней мере одну ионизируемую аминогруппу (α-амин) и одну ионизируемую карбоксильную группу (α-карбоксил). Когда они связаны пептидной связью, они больше не ионизируются. Некоторые, но не все аминокислоты имеют R-группы, которые могут ионизировать. Заряд белка тогда возникает из-за зарядов α-аминогруппы, α-карбоксильной группы. и сумма зарядов ионизированных R-групп. Титрование / ионизация аспарагиновой кислоты показано на рисунке 2.10. Ионизация (или деионизация) в структуре белка может иметь значительное влияние на общую конформацию белка и, поскольку структура связана с функцией, большое влияние на активность белка.
Рисунок 2.10 — Кривая титрования аспарагиновой кислоты Изображение Пенелопы ИрвингБольшинство белков имеют относительно узкие диапазоны оптимальной активности, которые обычно соответствуют окружающей среде, в которой они находятся (рисунок 2.11). Стоит отметить, что образование пептидных связей между аминокислотами удаляет ионизируемые водороды как из α-аминных, так и из α-карбоксильных групп аминокислот. Таким образом, ионизация / деионизация в белке происходит только от 1) аминоконца; 2) карбоксильный конец; 3) R-группы; или 4) другие функциональные группы (такие как сульфаты или фосфаты), добавленные к аминокислотам посттрансляционно — см. ниже.
Карнитин
Не все аминокислоты в клетке находятся в белках. Наиболее распространенные примеры включают орнитин (метаболизм аргинина), цитруллин (цикл мочевины) и карнитин (рис. 2.12). Когда жирные кислоты, предназначенные для окисления, перемещаются в митохондрии с этой целью, они перемещаются через внутреннюю мембрану, прикрепленную к карнитину. Из двух стереоизомерных форм L-форма является активной. Молекула синтезируется в печени из лизина и метионина.
Фигура 2.12 — L-карнитинИз экзогенных источников жирные кислоты должны активироваться при входе в цитоплазму путем присоединения к коферменту A. Часть CoA молекулы заменяется карнитином в межмембранном пространстве митохондрии в реакции, катализируемой карнитином. ацилтрансфераза I. Образовавшаяся в результате молекула ацилкарнитина переносится через внутреннюю митохондриальную мембрану карнитинацилкарнитинтранслоказой, а затем в матриксе митохондрии карнитинацилтрансфераза II заменяет карнитин коферментом A (Рисунок 6.88).
Рисунок 2.11 — Активность фермента изменяется при изменении pH Изображение Aleia KimКатаболизм аминокислот
Мы классифицируем аминокислоты как незаменимые и несущественные в зависимости от того, может ли организм их синтезировать. Однако все аминокислоты могут расщепляться всеми организмами. Фактически, они являются источником энергии для клеток, особенно во время голодания или для людей, соблюдающих диету с очень низким содержанием углеводов. С точки зрения распада (катаболизма) аминокислоты классифицируются как глюкогенные, если они производят промежуточные соединения, которые могут быть превращены в глюкозу, или кетогенные, если их промежуточные соединения превращаются в ацетил-КоА.На рис. 2.13 показана метаболическая судьба катаболизма каждой из аминокислот. Обратите внимание, что некоторые аминокислоты являются как глюкогенными, так и кетогенными.
Рисунок 2.13 — Катаболизм аминокислот. У некоторых есть более одного пути. Изображение Пера ЯкобсонаПост-трансляционные модификации
После того, как белок синтезирован, боковые цепи аминокислот в нем могут быть химически модифицированы, что приведет к большему разнообразию структуры и функций (рис. 2.14). Общие изменения включают фосфорилирование гидроксильных групп серина, треонина или тирозина.Лизин, пролин и гистидин могут иметь гидроксильные группы, добавленные к аминам в их R-группах. Другие модификации аминокислот в белках включают добавление жирных кислот (миристиновой кислоты или пальмитиновой кислоты), изопреноидных групп, ацетильных групп, метильных групп, йода, карбоксильных групп или сульфатов. Они могут иметь эффекты ионизации (добавление фосфатов / сульфатов), деионизации (добавление ацетильной группы к амину R-группы лизина) или вообще не влиять на заряд. Кроме того, N-связанные и O-связанные гликопротеины содержат углеводы, ковалентно присоединенные к боковым цепям аспарагина и треонина или серина соответственно.
Некоторые аминокислоты являются предшественниками важных соединений в организме. Примеры включают адреналин, гормоны щитовидной железы, Ldopa и дофамин (все из тирозина), серотонин (из триптофана) и гистамин (из гистидина).
Рисунок 2.14 — Посттрансляционно модифицированные аминокислоты. Изменения показаны зеленым цветом. Изображение Пенелопы Ирвинг Рисунок 2.15 — Фосфорилированные аминокислотыСтроительные полипептиды
Хотя аминокислоты выполняют другие функции в клетках, их наиболее важная роль — это составляющие белков.Белки, как мы уже отмечали ранее, представляют собой полимеры аминокислот.
Аминокислоты связаны друг с другом пептидными связями, в которых карбоксильная группа одной аминокислоты соединяется с аминогруппой следующей с потерей молекулы воды. Дополнительные аминокислоты добавляются таким же образом путем образования пептидных связей между свободным карбоксилом на конце растущей цепи и аминогруппой следующей аминокислоты в последовательности. Цепь, состоящая всего из нескольких связанных вместе аминокислот, называется олигопептидом (олиго = несколько), а типичный белок, состоящий из множества аминокислот, называется полипептидом (поли = много).Конец пептида, который имеет свободную аминогруппу, называется N-концом (для Nh3), а конец со свободным карбоксилом называется C-концом (для карбоксила).
Рис. 2.16. Формирование пептидной связиКак мы уже отмечали ранее, функция зависит от структуры, и цепочка аминокислот должна складываться в определенную трехмерную форму или конформацию, чтобы образовался функциональный белок. Сворачивание полипептидов в их функциональные формы — тема следующего раздела.
Молекулярных выражений: Коллекция аминокислот
Аланин — вторая простейшая аминокислота, но больше всего используется в белках.
бета -Аланин — единственная встречающаяся в природе аминокислота бета .
Аргинин — Аминокислота, часто используемая в активных центрах ферментов.
Аспарагин — Амидное производное аспарагиновой кислоты.
Аспарагиновая кислота — важный промежуточный продукт в цикле лимонной кислоты.
Карнитин — Необычная аминокислота, переносящая жирные кислоты в митохондрии.
Цитруллин — аминокислота, которая выводит токсины и устраняет нежелательный аммиак.
Цистеин — Тиолсодержащая аминокислота, участвующая в активных центрах и определении третичной структуры белка.
Цистин — продукт окисления цистеина, который удерживает белки вместе.
гамма -аминомасляная кислота — декарбоксилированная аминокислота, которая помогает расслабиться.
Глутаминовая кислота — Отрицательно заряженная аминокислота, обнаруженная на поверхности белков.
Глютамин — единственная аминокислота, способная легко преодолевать барьер между кровью и тканями мозга.
Глутатион — небольшой пептид, который помогает избавляться от свободных радикалов.
Глицин — Простейшая аминокислота, которая также действует как антагонист нейромедиатора.
Гистидин — Аминокислота, отвечающая за биосинтез гистамина.
Гидроксипролин — важная аминокислота, используемая в структурных белках, таких как коллаген.
Изолейцин — гидрофобная аминокислота, используемая почти исключительно в производстве белков и ферментов.
Лейцин — Еще одна гидрофобная аминокислота, используемая почти исключительно для создания белков и ферментов.
Лизин — незаменимая аминокислота с положительным зарядом на алифатической боковой цепи.
Метионин — незаменимая аминокислота, которая помогает инициировать синтез белка.
Орнитин — важнейший член аминокислот в цикле мочевины.
Фенилаланин — Наиболее распространенная ароматическая аминокислота, содержащаяся в белках.
Пролин — Циклическая алифатическая аминокислота, используемая в синтезе коллагена.
Серин — Аминокислотный спирт, обнаруженный в активном центре сериновых протеаз.
Таурин — Меркаптан-содержащая аминокислота, участвующая в биохимии желчных кислот.
Треонин — Аминокислотный спирт, участвующий в метаболизме порфиринов.
Триптофан — Ароматическая аминокислота наименее часто используется в белках.
Тирозин — гидроксифениламинокислота, которая используется для создания нейротрансмиттеров и гормонов.
Валин — гидрофобная алифатическая аминокислота, используемая для связывания белков.
Вопросы или комментарии? Отправить нам письмо.
© 1995-2021, автор — Майкл В. Дэвидсон и Государственный университет Флориды. Все права защищены. Никакие изображения, графика, программное обеспечение, сценарии или апплеты не могут быть воспроизведены или использованы каким-либо образом без разрешения правообладателей. Использование этого веб-сайта означает, что вы соглашаетесь со всеми юридическими положениями и условиями, изложенными владельцами.
Этот веб-сайт обслуживается нашим
Команда разработчиков графики и веб-программирования
в сотрудничестве с оптической микроскопией в Национальной лаборатории сильного магнитного поля
.
Последнее изменение: пятница, 13 ноября 2015 г., 14:18
Счетчик доступа с 1 апреля 1998 г .: 1045661
Микроскопы предоставлены:
Current Opinion in Clinical Nutrition & Metabolic Care
Основная функция 20 распространенных аминокислот — встраиваться в белки.Однако, помимо этого, аминокислоты играют много разных ролей; действительно, они являются наиболее универсальными питательными веществами. Это является следствием их очень разных боковых цепей, которые допускают широкий спектр химических модификаций и реакций, гораздо больше, чем в случае с другими питательными веществами. Конечно, эти разные боковые цепи играют в белках особую и критическую роль. Аминокислоты с разветвленной цепью открывают возможности для гидрофобных взаимодействий в ядрах глобулярных белков. Остатки глицина вносят гибкость в конформацию пептидных цепей, тогда как пролин вносит излом.Остатки со спиртовыми группами, такими как серин, треонин и тирозин, обеспечивают локус для введения фосфорильных групп. Есть много других примеров. Эта универсальность функции различных аминокислотных остатков в белках отражается в небелковых функциях аминокислот. Многие из этих «вспомогательных» функций касаются передачи сигналов либо напрямую, либо посредством использования в качестве субстратов для синтеза ключевых сигнальных молекул. Вряд ли случайно, что три из четырех известных газовых сигнальных молекул образуются из аминокислот или их производных: этилен из S-аденозилметионина, оксид азота из аргинина и сероводород из S-содержащих аминокислот.Другие важные функции свободных аминокислот включают роль аминокислот и их производных в качестве нейротрансмиттеров (например, глутамата и ГАМК), их роль в качестве сигнальных агентов (например, активацию mTOR) и, через S-аденозилметионин, их роль в широком спектре реакций метилирования. Возможно, самым заметным достижением в физиологии аминокислот за последнее десятилетие или около того стало появление роли ряда D-аминокислот. За исключением глицина, все аминокислоты являются хиральными молекулами, и один из ключевых вопросов, с которыми сталкиваются исследователи, заключается в том, играет ли только горстка D-аминокислот функциональную роль или существует гораздо более широкая, хотя и нераспознанная физиология D- аминокислоты.
Эти темы, касающиеся аминокислот как субстратов для синтеза белка и предшественников ключевых регуляторных молекул, хорошо представлены в исследованиях в этом разделе журнала. В двух обзорах исследуется синтез белка при патологических ситуациях, сердечной недостаточности и диабете 2 типа. Два обзора касаются метаболизма метионина, один — об изменении метаболизма этой аминокислоты при алкогольном поражении печени, а другой — о пищевой и метаболической нагрузке, связанной с реакциями метилирования.Два обзора специально исследуют синтез и функцию ключевых сигнальных молекул (оксида азота и D-серина). Наконец, два обзора касаются различных аспектов передачи сигналов: один вводит новые концепции о роли, которую играет транспорт аминокислот в передаче сигналов; В этом обзоре также представлены новые концепции относительно роли лизосом в аминокислотной активации mTOR. Другой исследует интеграцию пищевых, молекулярных и нейрофизиологических подходов, которые так сильно продвинули наши знания об адаптации животных к недостатку аминокислот.Аминокислоты всегда открывали новые горизонты и концепции; они продолжают делать.
Благодарности
Нет .
Конфликт интересов
Нет конфликта интересов.
Что такое аминокислоты?
Спортсмены, такие как бодибилдеры и другие спортсмены, занимающиеся силовыми тренировками, уделяют пристальное внимание потреблению аминокислот. Некоторые даже принимают добавки, чтобы увеличить потребление и получить правильный баланс аминокислот, особенно аминокислот с разветвленной цепью (BCAA).
Полезно знать факты об этих важных пептидах и понимать, что они могут и что не могут делать в вашем организме, чтобы сбалансировать потребление питательных веществ и достичь ваших целей в области здоровья и фитнеса.
Что такое аминокислоты?
Аминокислоты — это органические соединения, которые при соединении образуют белки. Белки обеспечивают основные структурные компоненты наших мышц, мозга, нервной системы, крови, кожи и волос. Белок также необходим для кислотно-щелочного и жидкостного баланса в организме и помогает транспортировать кислород, жиры и важные витамины и минералы.
Аминокислоты известны как строительные блоки белка. Белки, в свою очередь, необходимы для многих структур и функций нашего тела.
Что делают аминокислоты?
Белок — важный макроэлемент, который мы потребляем с такими продуктами, как мясо и птица. Организм человека использует аминокислоты из белка для выполнения важных функций организма, таких как:
- Расщеплять пищу : Когда белок потребляется и расщепляется в процессе пищеварения, в организме остаются аминокислоты.
- Способствует росту мышц : Анимокислоты метаболизируются в мышцах для увеличения силы и выносливости.
- Ремонтная ткань : Если мышечная ткань повреждается в результате физической активности, вырабатываются аминокислоты, стимулирующие синтез мышечного белка и способствующие восстановлению.
Нашему организму требуется 20 различных аминокислот. Вместе эти аминокислоты секвенируются и складываются, чтобы объединяться практически бесконечным количеством способов. Длинные цепи аминокислот связаны пептидными связями.Способ, которым связаны узы, называется их первичной структурой и определяет ее функцию в организме. Пептидные связи также имеют вторичную, третичную и четвертичную структуру. Конечная четвертичная структура — это белок.
Аминокислоты составляют ферменты, которые облегчают бесчисленные химические реакции в нашем организме. Они переносят питательные вещества и другие необходимые молекулы через нашу кровь и через клеточные мембраны и передают сигналы от одной части тела к другой. Кроме того, антитела, которые защищают нас от болезней, являются белками.В конце концов, задач белков слишком много, чтобы их сосчитать.
Типы аминокислот
Незаменимые аминокислоты
Из 20 аминокислот, которые нам нужны, наш организм может производить 11 из них. Остальные девять мы должны пройти через нашу диету. Они называются незаменимыми аминокислотами, потому что мы должны их есть. Девять незаменимых аминокислот включают:
- Гистидин
- Изолейцин
- лейцин
- Лизин
- метионин
- Фенилаланин
- Треонин
- Триптофан
- Валин
Заменимые аминокислоты
11 заменимых аминокислот вырабатываются организмом.К ним относятся:
- Аланин
- Аспарагин
- Аспарагиновая кислота
- Цистеин
- Глутаминовая кислота
- Глютамин
- Глицин
- Пролин
- Серин
- Тирозин
Аминокислоты с разветвленной цепью
Есть некоторые аминокислоты, которые называются «аминокислотами с разветвленной цепью» или BCAA. Возможно, вы слышали, что спортсмены и бодибилдеры ссылаются на добавки BCAA или продукты, содержащие аминокислоты с разветвленной цепью.
Структура BCAA включает «боковую цепь» или «группу R», состоящую из одного атома углерода и трех атомов водорода. Аминокислота с разветвленной цепью включает три незаменимые аминокислоты: лейцин, валин и изолейцин. Эти аминокислоты метаболизируются в мышцах и, как считается, оказывают наибольшее влияние на развитие мышц.
Условные аминокислоты
Также существует ситуация, в которой аминокислота или другие питательные вещества могут быть «условно незаменимыми».«Это означает, что аминокислота стала незаменимой, потому что организм испытывает трудности с ее выработкой из-за расстройства, болезни или старения.
Цистеин иногда считается условной аминокислотой в некоторых группах населения, включая младенцев, пожилых людей и людей с определенными заболеваниями.
Польза аминокислот для здоровья
Научные исследования изучали преимущества аминокислот, особенно аминокислот с разветвленной цепью, в организме. Большинство этих исследований сосредоточено на добавлении BCAA и на том, необходимо ли оно для оптимальной спортивной функции или производительности.
Строительство мышц
Наиболее широко рекламируемое преимущество аминокислот с разветвленной цепью — улучшение мышечного развития. Во многих отчетах, в том числе в одном исследовании, опубликованном в 2018 году изданием Frontiers in Physiology, было обнаружено, что добавка BCAA дает преимущества. Результаты согласуются с другими исследованиями и показали, что, когда спортсмены употребляют напиток, содержащий BCAA, сразу после тренировки с отягощениями, они улучшают мышечную функцию.
Однако другие отчеты об исследованиях ставят под сомнение степень преимущества, ссылаясь на влияние массовой индустрии пищевых добавок на научные исследования. Кроме того, исследователи расходятся во мнениях относительно того, могут ли BCAA приносить какую-либо пользу в периоды ограничения калорийности.
Хотя добавки BCAA широко распространены как эффективный метод для достижения оптимального роста мышц, важно помнить, что простая покупка и употребление добавок не заставит ваши мышцы набрать силу и размер.Необходимо соблюдать комплексный план тренировок и питания.
Включение аминокислот с разветвленной цепью в комплексную программу силовых тренировок и питания может помочь улучшить стимуляцию синтеза мышечного белка и ускорить развитие мышц.
Восстановление мышц
Также широко распространено мнение, что аминокислоты с разветвленной цепью улучшают восстановление мышц после занятий спортом или интенсивных упражнений. Отсроченная болезненность мышц (DOMS) — это состояние, с которым сталкиваются многие люди, занимающиеся тяжелыми физическими упражнениями в течение 24–48 часов после напряженной тренировки.DOMS может снижать производительность, особенно когда это серьезно.
Исследования показали, что добавление BCAA может быть полезной стратегией для ускорения восстановления мышц и уменьшения DOMS после напряженных силовых тренировок. Другое исследование показало, что добавка BCAA может помочь спортсменам, работающим на выносливость, уменьшить повреждение мышц.
Кроме того, обзор исследования, опубликованный в 2017 году Nutrition , показал, что использование BCAA лучше, чем пассивное восстановление или отдых после различных форм изнурительных и разрушительных упражнений.
Однако важно помнить о преимуществах BCAA. Всесторонний обзор, опубликованный в 2017 году Nutrients , пришел к выводу, что, хотя известно, что BCAA полезны для развития мышц, их способность уменьшать повреждение мышц, вызванное тренировками с отягощениями, эффективна только при определенных условиях. Эти условия включали высокое потребление BCAA, прием добавок в течение 10 или более дней и повреждение мышц, которое было описано как слабое или умеренное.
Есть некоторые свидетельства того, что добавки BCAA могут помочь уменьшить мышечное повреждение, вызванное силовыми тренировками или тренировками на выносливость.
Иммунная функция и лечение заболеваний
Исследователи изучили роль аминокислот с разветвленной цепью на иммунную функцию и лечение заболеваний.
Например, в исследовании, опубликованном в 2018 году Nutrition and Metabolism , рассматривается роль BCAA в нарушениях мышечной атрофии. Исследователи пришли к выводу, что они могут иметь терапевтический эффект при хронической почечной недостаточности.
Необходимы новые стратегии и дальнейшие исследования, чтобы понять роль этих аминокислот в случаях цирроза печени, нарушений цикла мочевины, ожогов, травм, сепсиса и рака.
Улучшение функции печени
Есть некоторые свидетельства того, что аминокислоты могут улучшать функцию печени. Исследование 2013 года, опубликованное в World Journal of Gastroenterology , показывает, что добавление аминокислот с разветвленной цепью может помочь людям с хроническим заболеванием печени справиться с их симптомами. Пациенты с запущенным заболеванием печени и низкими концентрациями BCCA, которые получали клиническую добавку BCAA, показали положительные результаты.
Рекомендуемое потребление
Согласно рекомендациям Национальной академии медицины, взрослые должны потреблять минимум 0.8 граммов протеина на каждый килограмм веса в день. Это означает, что вы должны потреблять около семи граммов на каждые 20 фунтов веса тела. Вы не поверите, но большинство из нас потребляет достаточно белка.
Количество каждой из девяти аминокислот различно. Рекомендуемая суточная норма RDA) для 2,2 фунта (1 кг) массы тела включает:
- Гистидин: 14 мг
- Изолейцин: 19 мг
- Лейцин: 42 мг
- Лизин: 38 мг
- Метионин (и цистеин): 19 мг
- Фенилаланин (и тирозин): 33 мг
- Треонин: 20 мг
- Триптофан: 5 мг
- Валин: 24 мг
Хотя маловероятно, что вы сможете контролировать (и различать) потребление определенных аминокислот, вы можете убедиться, что вы потребляете достаточно общего белка, и выбрать разумные источники белка.
Продукты с высоким содержанием аминокислот
Хотя основная часть исследований незаменимых аминокислот, особенно аминокислот с разветвленной цепью, сосредоточена на добавках, многие эксперты по питанию скажут вам, что лучший способ употребления BCAA — это ежедневный рацион.
Когда вы потребляете продукты с аминокислотами, вы не только получаете пользу от других питательных веществ, которые содержит эта пища, но также получаете уверенность в том, что точно знаете, что вы потребляете.
Пища, содержащая все незаменимые кислоты в количествах, пропорциональных нашим потребностям, называется полноценными белками.Хорошие источники полноценных белков обычно включают:
- Продукты животного происхождения, такие как мясо, птица, яйца, морепродукты и молочные продукты
- Семена чиа
- Соя
- Киноа
Хотя большинство полноценных белков получают из продуктов животного происхождения, те, кто придерживается вегетарианской диеты, могут полагаться на определенные растительные белки для удовлетворения своих потребностей. Ключевым моментом является объединение дополнительных неполных белков для создания полноценного белка.
Если вы хотите специально увеличить потребление аминокислот с разветвленной цепью, есть несколько вариантов растительного происхождения на выбор.Хорошие источники BCAA растительного и животного происхождения включают:
- Коричневый рис
- Нут
- Чечевица
- Лимская фасоль
- Мясные продукты
- Молоко (особенно сыворотка в молоке)
- Орехи (миндаль, бразильские орехи и кешью)
- Соевый белок
Несмотря на то, что большинство из нас потребляет достаточно белка , мы не можем выбирать источники, которые обеспечивают все незаменимые аминокислоты.
Часто задаваемые вопросы
Чем полезны аминокислотные добавки?
Поскольку эксперты в области здравоохранения рекомендуют удовлетворять вашу потребность в аминокислотах из пищевых источников, аминокислотные добавки могут вам не понадобиться, если их не порекомендует ваш врач.Если вы решите принимать добавки с аминокислотами, вы сможете повысить уровень азота в своем организме. Аминокислотные добавки также могут помочь поддерживать адекватный уровень аминокислот в ваших мышцах.
Чем одна аминокислота отличается от другой?
20 различных аминокислот или боковых цепей (группы R) также делятся на две основные группы: полярные и неполярные. Эти две основные группы описывают, как боковые цепи взаимодействуют с окружающей средой.
Могут ли аминокислоты быть вредными для вас?
Эксперты в области здравоохранения предупреждают, что добавление аминокислот в пищу может быть опасно для вашего здоровья.Однако фармакологические или клинические добавки под наблюдением врача должны быть безопасными.
Слово Verywell
Аминокислоты играют важную роль в вашем теле, особенно когда речь идет о развитии мышц. Незаменимые аминокислоты особенно важны, потому что мы должны потреблять их в нашем рационе. Аминокислоты с разветвленной цепью представляют особый интерес для спортсменов из-за их предполагаемого влияния на рост и восстановление мышц.
