Аминокислоты сокращения — Справочник химика 21
Аминокислота Сокращенное обозначение Формул Темпе- ратура плав- Кислотно-основные свойства Растворимость в во- [c.794]
Фенилкетонурия-заболевание, вызываемое недостаточным количеством в организме фермента фенилаланингидроксилазы. Этот фермент катализирует превращение фенилаланина в тирозин (оба эти соединения являются аминокислотами). Указанное заболевание может приводить к серьезной задержке умственного развития, а) Напишите сокращенные структурные формулы фенилаланина и тирозина б) вь[-скажите предположение относительно происхождения названия указанного фермента. [c.469]
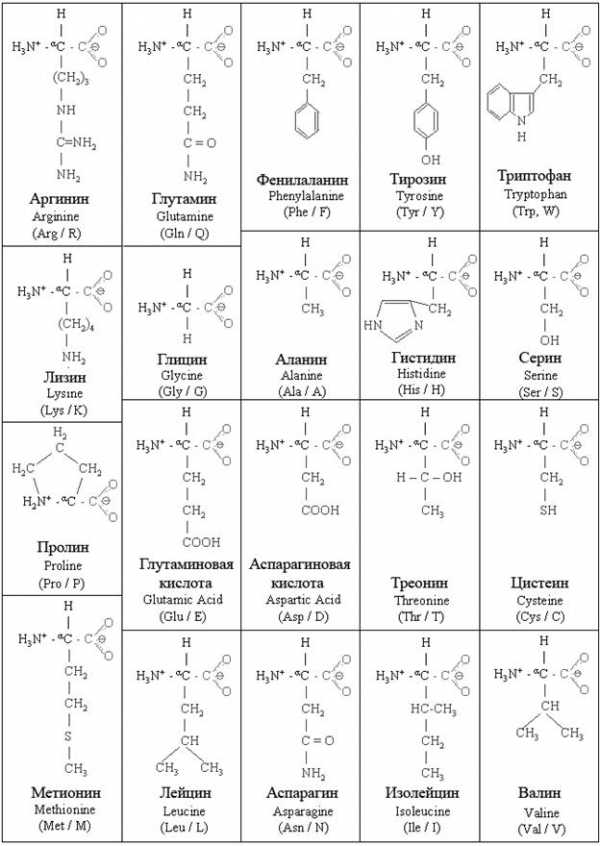
Современная рациональная классификация аминокислот основана на полярности радикалов (К-групп), т.е. способности их к взаимодействию с водой при физиологических значениях pH (близких к pH 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы 1) неполярные (гидрофобные) 2) полярные (гидрофильные) 3) ароматические (большей частью неполярные) 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (р1) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.
Аминокислота (сокращения см. в табл. 103) Одномерная хроматограмма с растворителем н-пропанол — вода (70+30) Двумерная хроматограмма смеси аминокислот (рис. 161) Аминокислота (сокращения см. в табл. 103) Одномерная хроматограмма с растворителем к-пропа-нол — вода (70+30) Двумерная хроматограмма смеси аминокислот (рис. 161) [c.404]
Схема. Классификация аминокислот (их структура, названия и сокращения) [c.9]
К пептидным гормонам относятся инсулин, продуцируемый поджелудочной железой, регулирующий метаболизм углеводов, жиров и белков, содержащий 51 аминокислотный остаток секретин, вырабатываемый в желудочно-кишечном тракте, определяющий секреторную функцию желудочно-кишечного тракта, содержащий 21 аминокислотный остаток в передней доле гипофиза вырабатываются адренокор-тикотропин (34 аминокислоты), контролирующий активность коры надпочечников, пролактин (198 аминокислот), влияющий на рост грудных желез и секрецию молока в задней доле гипофиза вырабатываются вазопрессин (9 аминокислот), действующий как диуретик и сосудосуживающее, и окси-тоцин (9 аминокислот), стимулирующий сокращение гладкой мускулатуры. Это только иллюстративный перечень гормонов пептидной структуры — их значительно больше, многие из них еще изучены не полностью, как в плане строения, так и функциональности. Особенно важно и проблематично исследование связи их строения с активностью. Данные по связи структура — активность позволяют иногда получать синтетические полипептиды с активностью, превосходящей природные. Так, варьируя аминокислотный состав нейрогипофизных гормонов (схема 4.4.1) было получено около 200 аналогов, из которых один, [4-ТИг]-оксито-цин оказался высокоактивным.
Аминокислота Сокращение Мол. вес аминокислоты Мол. вес БОК-аминокислоты [c.164]
Правилами ШРАС/ШВ [12] приняты английские трехбуквенные сокращения тривиальных названий аминокислот, начинающиеся с прописной буквы Gly, Ala, Туг и т. д. (применяемые либо для всей молекулы аминокислоты, либо для ее радикала) особенно часто такие сокращения применяются для описания аминокислотной последовательности в пептидах и белках. Разрешена также [13] и однобуквенная система сокращений, но она применяется гораздо реже. Имеются также правила номенклатуры, касающиеся часто применяемых сокращений для синтетических пептидов [14], для синтетических модификаций природных пептидов [15], пептидных гормонов [16] и белков, содержащих железо и серу [17]. [c.187]
ВАЗОПРЕССИН — гормон, выделенный из задней доли гипофиза животных представляет собой циклический пептид, содержащий по 8 остатков -аминокислот. Синтезом установлено строение В. крупного рогатого скота С4вН85М1501а32 и свиней 46HJ5NlзOl2S2. В.— гигроскопические кристаллы хорошо растворим в воде. Вызывает повышение кровяного давления, снижение мочеотделения, сокращение матки, выделение молока молочной железой в период лактации животных. Применяют В. при лечении несахарного диабета и заболеваний, связанных с недостаточностью В. в организме. [c.51]
В зависимости от природы заместителя R аминокислоты делятся на несколько групп (в скобках приведены употребляемые обычно трехбуквенные и однобуквенные сокращения) [c.187]
В принципе любое соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой. Однако чаще всего этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в а-положении по отношению к карбоксильной группе. Ни один из известных нам живых организмов не обходится без аминокислот. Аминокислоты, как правило, входят в состав полимеров — белков. Белки служат питательными веществами, регулируют обмен веществ, способствуют поглощению кислорода, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения и главным опорным материалом живых организмов, участвуют в передаче генетической информации и т. д.
Все синтезируемые в процессе трансляции белки построены из остатков 20 аминокислот (т. наз. кодируемых). Какой именно кодон ответствен за включение той или иной аминокислоты, можно определить по таблице, в к-рой буквы А, Г, У, Ц обозначают основания, входящие в нуклеотиды (соотв. аденин, гуанин, урацил, цитозин) в вертикальном ряду слева-в первый нуклеотид кодона, в горизонтальном ряду сверху-во второй, в вертикальном ряду справа-в третий. Трехбуквенные сочетания, напр, фен, сер, лей,-сокращенные назв. аминокислот. Прочерки в таблице означают, что три кодона-УАА, УАГ и УГА в нормальных условиях не кодируют к.-л. аминокислоты. Такие кодоны наз. бессмысленными , или нонсенс-кодонами. Оии являются сигналами остановки синтеза полипептидной цепи. [c.518]
Вместо названий и формул аминокислот часто используют специальные символы. Существуют две системы таких символов. В первой из них, обычно используемой для формул-последовательностей, каждая аминокислота обозначается трехбуквенным сокращением (обычно это три первых буквы тривиального названия аминокислоты). Первую букву пишут или печатают прописной, остальные две — строчными. Подразумевается, что аминокислоты имеют -конфигурацию, если не приводят иных указаний. Во второй системе каждая аминокислота обозначается одной заглавной буквой. Как можно убедиться из табл. 5.4, символы из одной буквы меньше напоминают о названиях.
В табл. 2-2 приведены структурные формулы боковых цепей аминокислот, обычно встречающихся в белках (формула пролина приведена полностью). Даны также сокращенные трехбуквенные обозначения аминокислот, используемые при выписывании аминокислотных последовательностей пептидов и белков, а также однобуквенные сокращения, принятые в работах по эволюции белков и при составлении программ для вычислительных машин. [c.83]
Аминокислота Сокращен- ное обозначе- ние Формула Изоэлек трическа ч точка [c.644]
Гидролиз белков дает смесь этих и других аминокислот с аминогруппой при С-2. Обычно их называют -аминокислотами. Сокращенная линейная структурная формула а-аминокислот КСН(ЫН2)С00Н. [c.196]
С другой стороны, заслуживает внимания то обстоятельство, что тРНК образуется но Механизму транскрипции . Как показано на рис. П.47, дезоксирибонуклеиновая кислота (ДНК) представляет собой полимерную церочку того же состава, что и РНК, в которой вместо урациловых оснований находятся тиминовые (Т). Однако этот полимер состоит пе из одной, а, из двух цепочек, которые образуют так называемую двойную спираль. Такая спиральная Структура из двух цепей стабилизируется водородными связями между мономерными единицами, расположенными напротив друг друга, причем водородные связи могут возникнуть только между А и Т, или же между G и С. Следовательно, если первая полимерная цепочка исчезнет, вторая может служить матрицей для ее воспроизведения. Таким образом, смысл названия наследственная тактическая сополимеризация состоит в том, что оно отражает передачу способности к указанному воспроизведению от родителей к потомству. Полученная путем редупликации ДНК, как показано на рис. 11.48, отщепляет тРНК, которая участвует в синтезе белков (сополимеры, образованные остатками двадцати аминокислот). Сокращенные названия аминокислот на рис. 11.47 соответствуют полным названиям, приведенным в таблице. Следовательно, для того, чтобы понять механизм наследственной тактической сополимеризации, необходимо
Изображая строение грамицидина С, мы воспользовались принятыми в химии белков сокращенными обозначениями аминокислот (лей — лейцин, фал — фенилаланин, про— пролин, вал — валин, ори — орнитин). При такой записи считают, что начало сокращенного обозначения соответствует аминному концу молекулы, конец— ее карбоксильрюму концу, т. е. обозначение, например, вал расшифровывается как —ЫН—СН(СзН7)—СО—. [c.343]
Аминокислоты Сокращенные обозначения аминокислот Чувствител при одномерной хроматографии в системе н. пропанол— вода (7 3) [ьность, мпг при двумерной хроматографии в системах H I3- h4OH— -17″/ -й Nh4 (2 2 1) и фенол—вода (3 1) [c.308]
Синтетические поли-а-аминокислоты можно приготовить в лаборатории, если инициировать полимеризацию N-кар-боксиангидрида аминокислоты (сокращенно N-KA) [c.483]
В природе встречается свыше 70 аминокислот, но только 20 из них играют важную роль в живых системах. Названия этих кислот (и их сокращения, которые также часто используются) вместе со структурными формулами приведены в табл. 25-1. Все аминокислоты, за исключением пролина и окси-пролина (см. табл. 25-1), имеют структуру К— И(NИ2) 02И различия между аминокислотами определяются природой радикала. В некоторых случаях отличия между радикалами незначительны так, а-аминокислоты глутамин и аспарагин являются моноамидами соответственно глутаминовой и аспарагиновой кислот. [c.382]
Полипептиды называются как производные С-концевой аминокислоты, причем первой пишут название N-концевой аминокислоты, а последней — С-концевую аминокислоту. В таком порядке пишут как полные названия составляющих аминокислот, так и их сокращенные обозначения. Так, гли-цилаланин — это дипептид, состоящий из глицина (N-концевая аминокислота) и аланина (С-концевая аминокислота). В сокращенном виде его название пишут так gly-ala. Аланилглицин (ala-gly) — это изомерный дипептид, в котором N-концевой аминокислотой является аланин, а С-концевой — глицин.
Окситоцин и вазопрессин — это гормоны полипептидной природы, которые выделяются гипофизом. Окситоцин контролирует сокращение матки и выделение молока, а вазопрессин поддерживает баланс жидкости в организме, действуя в качестве анти диуретического агента. Поскольку окситоцин вызывает сокращение гладкой мускулатуры, в частности матки, его применяют в медицине для стимуляции родов. Вазопрессин и окситоцин, вопреки своей различной физиологической активности, содержат одни и те же шесть аминокислот (из восьми) и замкнутое кольцо благодаря наличию дисульфидной связи. Если разрушить (восстановить) эту дисульфидную связь, то образуется нециклическая структура, не обладающая биологической активностью этих гормонов. [c.401]
Линейные пептиды, состоящие из 13 и большего числа остатков, индексируются по сокращенным названиям, выражающим последовательность аминокислот и похожим на систематические названия пептидов, но без знаков выделения и локантов. [c.265]
Заметим, что этот трипептид, как и каждая аминокислота, является биполярным ионом. Та же структура в сокращенном виде записывается следующим образом А1а-Уа1-Ме1. В такой записи N-кoнцeвoй аминокислотный остаток ставится слева, а С-концевой — справа. [c.85]
Для удобства написания пептидных фрагментов предложено пользоваться сокращенными названиями аминокислотных остатков, которые состоят из первых трех букв тривиального названия аминокислоты, например Ala для L-аланина и Met для L-метионина (сокращения для других аминокислот см. в табл. 1-1). Оптическая конфигурация аминокислоты указывается символами, причем специально отмечаются только о- и DL-амино-кислоты, например о-А1а и DL-Met. длло-Соединения обозначаются символом а , например alle для алло-ь-изолейцина. [c.11]
В химии белков и полипептидов для сокращения принято писать формулы, обозначая остатки аминокислот буквами (таблица с такими обозначениями приведена на стр. 485). Например, Glu — обозначение глутаминовой кислоты, Суз—SH—цистеина, Gly — глицина и т. д. Сокращенная формула глутатиона будет в таком изображении [c.507]
Первая система сокращений для аминокислот и пептидов была опубликована Брандом и Эдсалом в 1947 г. Система графического изображения амииокнслот, предложенная Беллнером и Мейстером, учитывает структурные особенности аминокислотных цепей (рис. 1-2). [c.13]
При сокращенной записи замещение боковой цепи обозначают, помещая аббревиатуру этого заместителя выще или ниже символа соответствующей аминокислоты илн же в скобках непосредственно после него, например для пентапептида ь-аланил-ь-аспарагил-( -трет-бутиловый эфир)глицил-Ы -трет-бутилоксикарбонил-ь-лизил-О-трет-бутил-ь-тирозина [c.86]
Циклические гетеродетногомомерные пептиды при сокращенной записи изображаются аналогично замещенным аминокислотам. [c.88]
Если порядок расположения аминокислот в пептиде известен, то при написании структурной формулы сокращения разделяются точками. Например, Н. Гли.Ала.ОН обозначает дипептид глицилаланин. Сокращение Н. Гли. (А.ла. Лей.) ОН соответствует пептиду, в котором N-концевая группа представляет собой глицин (гликокол), а порядок расположения аланина и лейцина не известен [266]. Если нет оговорки, то все оптически активные аминокислоты относятся к /-ряду. [c.167]
chem21.info
⇐ ПредыдущаяСтр 16 из 17Следующая ⇒
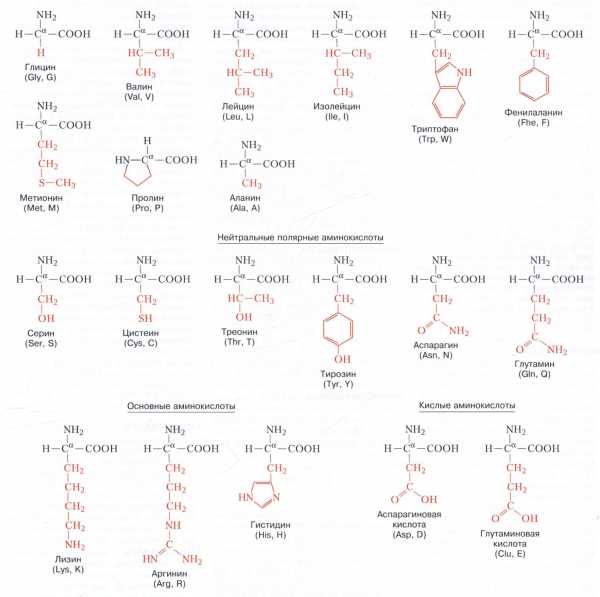
*- незаменимые аминокислоты Гидрофобные аминокислоты: Валин, лейцин, изолейцин, метионин, пролин, триптофан, фенилаланин. Гидрофильные аминокислоты: Аланин, аргинин, аспарагиновая кислота, аспарагин, гистидин, глицин, глутаминовая кислота, глутамин, лизин, серин, тирозин, треонин, цистеин.
Приложение 2 Физико-химические константы аминокислот
Приложение 3 Структурные формулы важнейших модифицированных аминокислот и биогенных аминов организма Модифицированные аминокислоты
Биогенные амины H2N-CH2-CH2-OH коламин (этаноламин) H2N-CH2-CH2-COOH β-аланин H2N-(CH2)3-COOH γ-аминомасляная кислота (ГАМК) H2N-(CH2)5-NH2 кадаверин H2N-CH2-CH2-SH меркамин Приложение к теме VIII БЕЛКИ Изоэлектрические точки белков
Приложения к теме IХ Углеводы. МОНОСАХАРИДЫ Приложение 1 Моносахариды
Приложения к теме X Углеводы. ДиСАХАРИДЫ. ПОЛИСАХАРИДЫ Приложение 1 Таблица 1 Дисахариды
Приложение 2 Таблица 2 |
cyberpedia.su
Формулы аминокислот в химии
Аминокислоты можно рассматривать как производные карбоновых кислот, в которых один или несколько атомов водорода замещены на аминогруппы.
Различают -аминокислоты, в молекулах которых аминогруппа и карбоксильная группа связаны с одним атомом углерода, и -,-, -аминокислоты, функциональные группы которых разделены нескольким атомам углерода.
Структурные формулы аминокислот
Общая структурная формула -аминокислот:
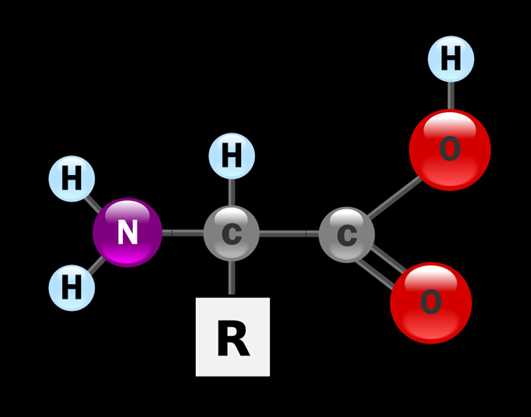
Все аминокислоты являются амфотерными соединениями, кислотные свойства обусловлены карбоксильной группой –COOH, а основные – аминогруппой – NH2. Благодаря этому водные растворы аминокислот обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей:
Такая форма молекулы аминокислоты называется цвиттер-ионом. В этой форме молекула обладает значительным дипольным моментом при суммарном нулевом заряде. Кристаллы большинства аминокислот построены именно из таких молекул.
Изоэлектрическая точка аминокислоты – значение pH, при котором максимум молекул обладает нулевым зарядом. При таком значении pH аминокислота наименее подвижна в электрическом поле. Это свойство можно использовать для разделения аминокислот, белков и пептидов методом электрофореза.
Группы аминокислот
В зависимости от кислотно-основных свойств, обусловленных строением радикала, аминокислоты делятся на четыре группы:
- Неполярные или гидрофобные (аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан).
- Полярные незаряженные (заряды компенсируются) при pH=7 (серин, треонин, цистеин, аспарагин, глутамин, тирозин).
- Полярные и заряженные отрицательно при pH=7 (аспарагиновая кислота, глутаминовая кислота)
- Полярные заряженные положительно при pH=7 (лизин, аргинин, гистидин)
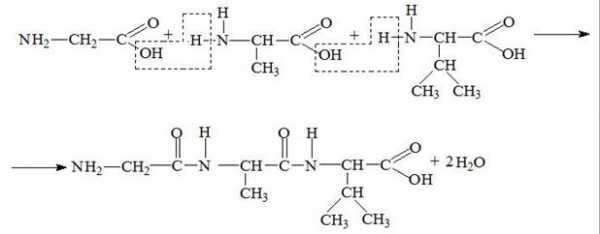
Важнейшим свойством аминокислот является их способность к реакциям поликонденсации с образованием пептидов:

Пример образования трипептида (глицил – аланил – валин):
Формулы 20 аминокислот
В живых организмах при синтезе белков (полипептидов) в большинстве случаев используется 20 стандартных (протеиногенных) аминокислот:
Примеры решения задач
ru.solverbook.com
Сокращения названий аминокислот — Справочник химика 21
| Рис. 7. Генетический код. Первая буква кодона расположена в центральном круге, вторая — в первом кольце и третья — во втором, В наружном кольце записаны сокращенные названия аминокислот. |
О сокращении названий аминокислот см. [19]. [c.409]
А. СОКРАЩЕНИЯ НАЗВАНИЙ АМИНОКИСЛОТ [c.9]
| Рис. 176. Тонкослойная ионофоретическая хроматограмма смеси аминов и аминокислот на силикагеле Г (пластинка 20 X 20 см). Проба 2 дл водного раствора, содержащего по 1—8 дг веществ. Сокращенные названия аминокислот см. в табл. 103, цис — цистеин, К — кадаверин, В — диметиламин, Г—гистамин, М — метиламин, Мц — мецкалин, Н — норадреналин, ф — фенилэтиламин, П — 1,3-нронилендиамин. |
УФ-фотокопия (см. стр. 425) Пробы по 0,5 цг растворитель н-бутанол — 34%-ный аммиак (80 + 20) сокращенные названия аминокислот см. в табл. 103, тау—таурин, цит — цитруллин. [c.417]
Данные величины являются среднеарифметическими из 6 измерений, б Сокращение названий аминокислот см. в табл. 103. [c.419]
Сокращенное наименование обозначает остаток аминокислоты, входящий в пептидную цепь, поэтому N-концевая аминокислота записывается Н—глиц-, а С-концевая — глиц—ОН. С-Концевая аминокислота в форме амида изображается сокращенно глиц-МНг, а для остатков а.мидов дикарбоновых аминокислот (например, глутамина, аспарагина) над или под сокращенным названием аминокислоты ставят символ Nh3 [c.810]
За исключением нескольких случаев, сокращенное название состоит из первых трех букв тривиального наименования аминокислоты (см. таблицу сокращений в конце этого раздела). В тех случаях, когда аминокислота не имеет тривиального наименования, используется английское химическое название и сокращенное обозначение включает первые три буквы этого названия. Структурно родственные аминокислоты имеют родственные сокращения. Первая буква сокращенного названия аминокислоты в обозначениях как отдельных аминокислот, так и пептидов всегда выделяется в виде заглавной. [c.9]
А. СОКРАЩЕНИЯ НАЗВАНИИ АМИНОКИСЛОТ [c.9]
Различают первичную структуру белков, т.е. аминокислотный состав белка и последовательность чередования аминокислот в полимерной цепи. На одном конце цепи находится аминокислота, в которой свободной является аминогруппа — М-концевая аминокислота. На другом конце цепи расположена аминокислота, в которой аминогруппа соединена с цепочкой полимера, а карбоксильная группа свободна -С-концевая аминокислота. Первичная структура белков записывается как последовательность аминокислот, причем их перечисление начинают с К-конца и заканчивают С-концом. При этом обычно используют сокращенные названия аминокислот (табл. 32.1). [c.532]
Свойства радикала Полное и сокращенное название аминокислот Строение амино- кислот Название функцио- нальных групп радикалов [c.8]
С другой стороны, заслуживает внимания то обстоятельство, что тРНК образуется но Механизму транскрипции . Как показано на рис. П.47, дезоксирибонуклеиновая кислота (ДНК) представляет собой полимерную церочку того же состава, что и РНК, в которой вместо урациловых оснований находятся тиминовые (Т). Однако этот полимер состоит пе из одной, а, из двух цепочек, которые образуют так называемую двойную спираль. Такая спиральная Структура из двух цепей стабилизируется водородными связями между мономерными единицами, расположенными напротив друг друга, причем водородные связи могут возникнуть только между А и Т, или же между G и С. Следовательно, если первая полимерная цепочка исчезнет, вторая может служить матрицей для ее воспроизведения. Таким образом, смысл названия наследственная тактическая сополимеризация состоит в том, что оно отражает передачу способности к указанному воспроизведению от родителей к потомству. Полученная путем редупликации ДНК, как показано на рис. 11.48, отщепляет тРНК, которая участвует в синтезе белков (сополимеры, образованные остатками двадцати аминокислот). Сокращенные названия аминокислот на рис. 11.47 соответствуют полным названиям, приведенным в таблице. Следовательно, для того, чтобы понять механизм наследственной тактической сополимеризации, необходимо [c.144]
Белок представляет собой полимерную молекулу, мономерными звеньями, кирпичиками которой служат аминокислотные остатки (рис. 2). Аминокислотные остатки располагаются всегда строго линейно, плечом к плечу, подобно солдатам, стоящим по стойке смирно . Но так устроен и биологически активный белок, и белок, нагретый, скажем, до 60 °С, когда он уже полностью теряет свою биологическую активность. Значит, одного химического строения белка, т. е. последовательности аминокислотных остатков, недостаточно для того, чтобы белок был биологически активен. Необходима еще совершенно определенная укладка в пространстве групп, закодированных на рис. 2 в виде сокращенных названий аминокислот, которые на самом деле вовсе не кружочки и не шарики, а имеют каждая свою весьма причудливую форму. Бот за то, чтобы определять пространственную структуру всей молекулы белка по рентгенограммам типа приведенной на рис. 1, и велась затяжная борьба в стенах Кавендишской лаборатории. Лишь в середине 50-х годов Джону Кендрю и Максу Перуцу удалось добиться успеха — они научились определять трехмерную структуру белков. Это случилось уже после того, как была решена проблема устройства геиа — к чему, как оказалось, белки отношения вовсе не имеют. [c.16]
Название П. образуют путем последовательного перечисления названий аминокислотных остатков, начиная с N-кoнцeвoгo, напр. глицил-Б-лейцил-Ь-аланин (сокращенно — Н-гли-В-лей-Ь-ала-ОН о сокращениях названий аминокислот см. Аминокислоты). При этом название С-концевого остатка имеет окончание ин , остальных — ил . Символами Ь и В (по системе Фишера) или соответственно 8 и К (по системе Кана — Ингольда — Прелога) обозначают конфигурацию асимметрич. а-углеродного атома каждого оптически активного аминокислотного остатка. [c.13]
chem21.info
Аминокислоты — «Энциклопедия»
АМИНОКИСЛОТЫ, органические соединения, содержащие карбоксильные СООН и аминогруппы NH2. Исключение составляет пролин. Обладают свойствами и кислот и оснований. В зависимости от положения аминогруппы в углеродной цепи относительно карбоксильной группы различают α-, β-, γ- и др. аминокислоты. У ω-аминокислот аминогруппа находится на конце цепи. Участвуют в обмене азотистых веществ всех организмов, являясь исходными соединениями при биосинтезе белков, пептидов, пуриновых и пиримидиновых оснований, ряда витаминов, пигментов, алкалоидов и др.
Классификация. Описано свыше 150 природных аминокислоты, среди которых особенно важны 20 α-аминокислоты (табл.), входящих в состав белков, кодируемых генетическим кодом; общая формула:
В зависимости от природы боковой цепи R α-аминокислоты подразделяют на две группы: аминокислоты с неполярными (гидрофобными) и аминокислоты с полярными (гидрофильными) боковыми цепями. К 1-й группе относятся шесть аминокислот с алифатической боковой цепью аланин, валин, лейцин, изолейцин, метионин, пролин и две с ароматической — фенилаланин и триптофан. Среди представителей 2-й группы боковые цепи семи аминокислот содержат группировки, способные нести отрицательные или положительный заряд. В аспарагиновой и глутаминовой кислотах β- и γ-карбоксильные группы при pH 7,0 заряжены отрицательно. К основным аминокислотам относятся лизин, аргинин и гистидин. ε-аминогруппа лизина и гуанидиновая группировка аргинина несут положительный заряд (протонированы) в нейтральной среде, а имидазольная группировка гистидина — в кислой. В щелочных условиях отрицательные заряды могут приобретать боковые группы тирозина и цистеина. Характерной особенностью остатков цистеина является их способность в составе молекулы белка подвергаться окислению с образованием остатков цистина. Аминокислотам присвоены сокращённые трёхбуквенные и однобуквенные обозначения, используемые в научной литературе. В 1986 году в ряде белков архебактерий, истинных бактерий (эубактерий) и животных была обнаружена α-аминокислота — селеноцистеин (ей присвоены символы Sec и U), в 2002 — открыт пирролизин (пока обнаружен только у одного вида метанобразующих архей). Обе эти аминокислоты кодируются триплетами, которые обычно служат «стоп-кодонами» (т. е. оповещают об окончании синтеза белка на рибосомах): селеноцистеин — триплетом UGA, а пирролизин — UAG.
Реклама
Пирролизин (где R = CH3, NH2 или ОН)
Большая часть аминокислот, обнаруженных в тканях живых организмов, но не входящих в состав белков, могут выполнять важные функции. Так, орнитин и цитрулин участвуют в обмене веществ, в частности в синтезе мочевины у животных, 2,4-дигидрооксифенилаланин (ДОФА) образуется в качестве промежуточного продукта в ходе распада фенилаланина и тирозина в организме и является медиатором центральной нервной системы. Кроме того, имеются аминокислоты, функция которых пока не ясна. В ряде белков (уже после их синтеза на рибосомах) боковые группы аминокислот претерпевают изменения в ходе посттрансляционной модификации. Например, в составе молекулы коллагена пролин и лизин превращаются соответственно в 4-гидроксипролин и 5-гидроксилизин, в миозине присутствует N-метиллизин, только в эластине встречается ферментативно модифицированный лизин — десмозин. Помимо α-аминокислот в свободном виде и в составе некоторых биологически важных пептидов, встречаются аминокислоты, аминогруппа которых связана не с α-углеродным атомом. К их числу относятся β-аланин, входящий в состав пантотеновой кислоты, γ-аминомасляная кислота, играющая важную роль в функционировании нервной системы, δ-аминолевулинован кислота, являющаяся промежуточным продуктом синтеза порфиринов.
Физические и химические свойства.
Аминокислоты — бесцветные кристаллические вещества, растворимые в воде; температура плавления — 220-315°С. В кристаллах и водных растворах при нейтральных значениях pH α-аминокислоты существуют преимущественно в виде диполярных ионов (цвиттер-ионов), у которых аминогруппы протонированы (NH+3), а карбоксильные группы диссоциированы (СОО—). аминокислоты являются амфолитами; ионизация их молекул зависит от pH раствора:
Значения pH, при котором концентрация катионов аминокислоты равна концентрации анионов, называется изоэлектрической точкой (pI). Аминогруппа аминокислоты ионизирована в несколько меньшей степени, чем карбоксильная группа, поэтому водный раствор аминокислоты имеет слабокислый характер. Все α-аминокислоты, кроме глицина, имеют асимметрический (хиральный) α-углеродный атом и существуют в виде двух энантиомеров. У изолейцина и треонина хиральными являются также и β-углеродные атомы.
За редким исключением природные α-аминокислоты относятся к L-ряду и только в оболочках бактерий, в составе некоторых антибиотиков и в метаболитах грибов, а также в коже некоторых видов южноамериканских лягушек и корне женьшеня обнаружены аминокислоты D-ряда.
В результате взаимодействия α-аминогруппы одной аминокислоты с α-карбоксильной группой другой аминокислоты в процессе биосинтеза белка (трансляции) происходит образование пептидной связи.
Таблица. Важнейшие аминокислоты, входящие в состав белков (цветом обозначены боковые цепи)
Нейтральные гидрофобные аминокислоты
Превращения аминокислот в организмах. Высшие растения и хемосинтезирующие организмы все необходимые им аминокислоты синтезируют из аммониевых солей и нитратов, а также из кето- или гидроксикислот — продуктов дыхания и фотосинтеза. Человек и животные синтезируют большинство аминокислот из обычных безазотистых продуктов обмена и аммониевого азота. Это так называемые заменимые аминокислоты.
Но ряд аминокислот — незаменимых — они должны получать в готовом виде с пищей. Для человека, например, незаменимыми аминокислотами являются валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин, а для детей также аргинин и гистидин. Недостаток в организме той или иной аминокислоты приводит к нарушению обмена веществ, замедлению роста и развития. Аминокислоты участвуют в поддержании азотистого баланса в организме. Окислительный распад аминокислот путём дезаминирования приводит к образованию кето- и гидроксикислот — промежуточных продуктов цикла трикарбоновных кислот; далее они превращаются в углеводы, новые аминокислоты и т. д. или окисляются до СО2 и Н2О с выделением энергии. У животных азот в виде аммониевых солей, мочевины или мочевой кислоты выводится из организма. У растений усвоение аминокислоты происходит таким образом, что азотистые отходы практически отсутствуют. Некоторые аминокислоты являются предшественниками важных гормонов и нейромедиаторов: тирозин и фенилаланин дофамина и адреналина, триптофан серотонина, гистидин — гистамина, глутаминовая кислота — γ-аминомасляной кислоты, аргинин — оксида азота (NO).
Практическое использование. Смеси L-α-аминокислот, а также отдельные аминокислоты применяют в медицине для лечения больных с заболеваниями пищеварительных органов (гистидин, метионин), при малокровии, ожогах (метионин), нервно-психических заболеваниях (глицин и глутаминовая кислота), при сосудистых заболеваниях головного мозга (γ-аминомасляная кислота) и т. д. Для обогащения кормов в животноводстве и лечения животных используются лизин, метионин, треонин, триптофан, в пищевой промышленности — глутамат натрия и лизин. ω-аминокислоты и их лактамы служат для промышленного производства полиамидов. Ароматические аминокислоты нашли применение в синтезе красителей и лекарственных препаратов. Некоторые L-α-аминокислоты получают микробиологическим синтезом (лизин, триптофан, треонин, глутаминовая кислота) или выделяют из гидролизатов богатых ими белков (пролин, аргинин, гистидин, глутаминовая кислота, тирозин).
Лит.: Гринштейн Дж., Виниц М. Химия аминокислот и пептидов. М., 1965; Meister А. Biochemistry of the amino acids. 2nd ed. N. Y., 1965. Vol. 2; Chemistry and biochemistry of the amino acids. L., 1984; Cohn W. Е. Nomenclature and symbolism of α-amino acids // Methods Enzymology. 1984. Vol. 106. № 3; Amino acids and peptides. L., 1985; IUPAC-IUB. Joint commission on biochemical nomenclature. Amino acids section, www.chem.qmw.ac.uk/ iupac/AminoAcid/
В. М. Липкин, И. Л. Родионов.
knowledge.su
Аминокислоты — Циклопедия
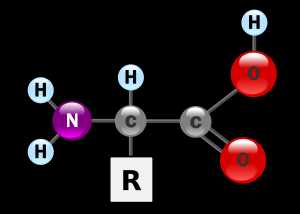 Схема строения аминокислот Биохимия. Урок 2. Аминокислоты и пептиды. Строение и свойства. Значение в промышленности и медицине // Образование для всех [45:56]
Схема строения аминокислот Биохимия. Урок 2. Аминокислоты и пептиды. Строение и свойства. Значение в промышленности и медицине // Образование для всех [45:56]Аминокислоты — органические соединения, которые одновременно содержат в своем составе амино- и карбоксильную группы. Аминокислоты являются мономерными единицами белков, в составе которых остатки аминокислот соединены пептидными связями. Большинство белков построены из комбинации девятнадцати «первичных» аминокислот, то есть содержащих первичную аминогруппу, и одной «вторичной» аминокислоты (содержит вторичную аминогруппу) пролина, кодируемой генетическим кодом. Их называют стандартными или протеиногенными аминокислотами. Помимо стандартных, в живых организмах встречаются другие аминокислоты, которые могут входить в состав белков или выполнять другие функции.
В зависимости от того, к какому атому углерода присоединена аминогруппа, аминокислоты делятся на α-, β-, γ- и т. п. α-атомом считается тот атом углерода, к которому присоединена карбоксильная группа, если у него же расположена и аминогруппа, такая аминокислота называется α-аминокислотой. Если аминогруппа присоединена к следующему (β) атому углерода, это будет β-аминокислота и т. д. Все протеиногенные аминокислоты являются α-аминокислотами.
Каждая из 20 стандартных, и многие из нестандартных аминокислот имеют тривиальные названия. Часть этих названий связана с источниками, из которых впервые было выделено соединение: например, аспарагин выделен из спаржи, глутамин — из глютена пшеницы, тирозин — из сыра. Для сокращенной записи протеиногенные аминокислоты обозначают трехбуквенным кодом, используя первые три буквы тривиального названия.
В момент появления биоинформатики ЭВМ использовали перфокарты, из-за чего появилась потребность записывать аминокислотные последовательности более компактно. Для этого Маргарет Оукли Дейгофф разработала однобуквенную номенклатуру. Для обозначения шести аминокислот использованы их начальные буквы (в английском языке), поскольку они являются уникальными (CHIMSV). Еще в пяти (AGLPT) первые буквы не уникальны, но обозначают более распространенные аминокислоты (например, буква L обозначает лейцин, поскольку он встречается чаще лизина). Еще для четырех использованы фонетически наводящие буквы (RFYW: R — aRginine, F — Fenilalanine, Y — tYrosine, W — tWiptophan), для четырех — буквы, которые есть в составе их названий или которые можно там услышать (DNEQ: D — asparDic acid, N — asparagiNe, E — glutamEke acid, Q — Q-tamin). Лизин обозначают буквой K, поскольку в алфавите она близка к L.
[править] Химическое строение
Все аминокислоты содержат карбоксильную и аминогруппу. В α-аминокислотах они присоединены к одному и тому же атому углерода. Остальные молекулы называют боковой цепью или R-группой. Эти группы отличаются по размеру, форме, гидрофильности, электрическому заряду, склонностью формировать водородные связи и общей реакционной способностью, предоставляя каждой аминокислоте уникальных свойств. В самой маленькой аминокислоте — глицине — боковой цепи нет, у α-атома углерода, кроме карбоксильной и аминогруппы, расположены два атома водорода.
[править] Оптическая изомерия
Молекулы D- и L-аланинаВо всех стандартных аминокислотах, кроме глицина, α-атом углерода образует ковалентные связи с четырьмя различными группами: карбоксильной, аминогруппы, боковой цепью и атомом водорода. Так что этот атом относится к хиральному центру. Таким образом, возможно образование двух оптических изомеров, являющихся зеркальными отражениями друг друга. Они не отличаются по химическим свойствам, но обращают плоскость поляризации света в разные стороны. Такие изомеры называются энантиомерами.
Для обозначения абсолютной конфигурации четырех групп вокруг хирального атома углерода используется d/l-система номенклатуры, разработанная Эмилем Фишером. Он взял за основу глицеральдегид. Соединения, которые имеют абсолютную конфигурацию, похожую на таковую в l-глицеральдегиде, называются l-изомерами, в d-глицеральдегиде — d-изомерами. Хотя исторически буквы l и d использовались как сокращение от levorotatory (левовращающий) и dextrorotatory (правовращающий), все l-аминокислоты обращают плоскость поляризации света влево и наоборот.
Почти все белки содержат только l-изомер аминокислот. D-аминокислоты найдены в составе некоторых полипептидов, образующихся в организме морских брюхоногих моллюсков, и в составе клеточных стенок бактерий и некоторых пептидных антибиотиках. Для формирования стабильных повторяющихся структур в белках необходимо, чтобы все аминокислоты, входящие в их состав, были представлены только одним энантиомером — l или d. В отличие от обычных химических реакций, в которых преимущественно образуются рацемические смеси стереоизомеров, продуктом реакций биосинтеза в клетках является только одна из форм. Такой результат достигается благодаря ферментам, которые имеют несимметричные активные центры, а следовательно является стереоспецифической.
[править] Классификация на основе полярности боковых цепей
Свойства аминокислотных остатков в составе белков являются решающими для структуры и функционирования последних. В частности аминокислоты существенно отличаются по полярности боковых цепей, а следовательно и особенностями взаимодействия с молекулами воды. На основе этих различий протеиногенные аминокислоты разделяют на четыре группы: аминокислоты с неполярными боковыми цепями, аминокислоты с полярными незаряженными боковыми цепями (иногда разделяют на аминокислоты с неполярными алифатическими и неполярными циклическими боковыми цепями), аминокислоты с положительно заряженными боковыми цепями и аминокислоты с отрицательно заряженными боковыми цепями (иногда последние две группы объединяют в одну).
[править] Аминокислоты с неполярными боковыми группами
В эту группу объединяют девять аминокислот, боковые группы которых неполярны и гидрофобны. Наименьшей из них является глицин, не имеющий боковой цепи (около α-атома углерода, кроме карбоксильной и аминогруппы, размещены два атома водорода). Хотя глицин классифицируют как неполярную аминокислоту, он не оказывает никакого вклада в обеспечение гидрофобных взаимодействий в молекулах боковых серосодержащих аминокислот, его боковая цепь представлена неполярным тиоловым эфиром. Пролин содержит характерную пиролидиновую циклическую структуру, в составе которой вторичная аминогруппа содержится в фиксированной конформации. Поэтому участки полипептидных цепей, содержащих пролин, наименее гибки. В состав молекул фенилаланина и триптофана входят громоздкие неполярные циклические боковые группы: фенильная и индольная.
Аминокислоты с неполярными боковыми цепями вносят вклад в структуру полипептидов благодаря гидрофобным взаимодействиям. Например, в составе водорастворимых глобулярных белков они группируются внутри молекулы. Неполярные группы этих аминокислот также образуют поверхности контакта интегральных мембранных белков с гидрофобными частями липидных мембран.
[править] Аминокислоты с полярными незаряженными боковыми группами
Серин и теронин содержат гидроксильную группу, аспарагин и глутамин — амидную, тирозин — фенольную. В состав цистеина входит тиольная группа -SH, благодаря чему две молекулы (или их остатки в составе пептидов) этого вещества могут соединяться дисульфидной связью, которая формируется путем окисления -SH групп. Такие связи важны для формирования и поддержания структуры белков. Поскольку две молекулы цистеина соединены дисульфидной связью, ранее он считался отдельной аминокислотой, это соединение называли цистином, теперь этот термин употребляется редко.
[править] Аминокислоты с отрицательно заряженными боковыми группами
Две аминокислоты имеют суммарный отрицательный заряд при pH > 7: аспарагиновая и глутаминовая кислоты. Обе имеют по дополнительной карбоксильной группе. Их ионизированные формы называют аспартатом и глутаматом соответственно. Амиды этих аминокислот — аспрагин и глутамин — также входят в состав белков.
[править] Аминокислоты с положительно заряженными боковыми группами
Три протеиногенные аминокислоты имеют положительно заряженные боковые группы при физиологических значениях pH: лизин, аргинин и гистидин. Лизин имеет дополнительную первичную аминогруппу в ε-положении. В состав аргинина входит гуанидиновые группировки, а гистидин содержит имидазоловое кольцо. Из всех протеиногенных аминокислот только гистидин имеет группу, ионизирующуюся при физиологическом pH (pK a = 6,0). Поэтому его боковая цепь при pH 7,0 может быть нейтральной или положительно заряженной. Благодаря этому свойству гистидин входит в состав активных центров многих ферментов и участвует в катализе химических реакций как донор/акцептор протонов.
[править] Нестандартные аминокислоты
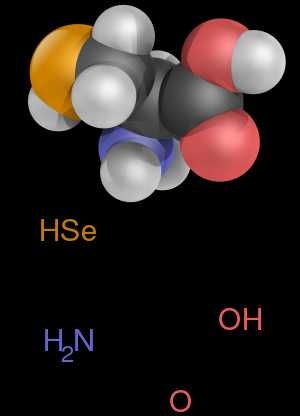 Молекула селеноцистеина
Молекула селеноцистеинаКроме 20 «стандартных» аминокислот, кодируемых генетическим кодом, в живых организмах также образуется большое количество так называемых нестандартных аминокислот.
В составе готовых полипептидных цепей некоторые остатки аминокислот могут модифицироваться. Таким образом, например, образуются нестандартные аминокислоты 5-гидроксилизин и 4-гидроксипролин. Обе входят в состав белка соединительной ткани коллагена, а гидроксипролин найден также в клеточных стенках растений. 6-N-метиллизин является составной сократительного белка миозина. Некоторые белки, связывающие ионы кальция, например, протромбин, содержащие γ-карбоксиглутамат. Десмозин — сложная аминокислота, которая образуется из четырех остатков лизина и найдена в фибриллярном белке эластине. Многие остатки аминокислот могут быть временно модифицированы с целью регуляции функции белков.
Особый случай составляет редкая аминокислота селеноцистеин, производное цистеина, но вместо атома серы содержащее селен. В отличие от многих других нестандартных аминокислот, входящих в состав белков, селеноцистеин образуется не в результате модификации остатка в уже готовом полипептидной цепи, а включается в него во время трансляции. Селеноцистеин кодируется кодоном УГА, что при обычных условиях означает конец синтеза. Подобно селеноцистеину пиролизин, используемый некоторыми метаногенными бактериями при выработке метана, кодируется в этих организмов стоп-кодоном, но в этом случае — УАГ.
Бактерии и растения синтезируют необычные аминокислоты, которые могут входить в состав пептидных антибиотиков (низин, аламетицин) лантионин — моносульфидный аналог цистина — совместно с ненасыщенными аминокислотами входит в состав лантибиотиков (пептидные антибиотики бактериального происхождения). D-аминокислоты входят в состав коротких (до 20 остатков) пептидов, синтезируемых энзиматически, а не на рибосомах. Эти пептиды в большом количестве встречаются в составе клеточных стенок бактерий, благодаря чему последние являются менее чувствительными к действию протеазы. D-аминокислоты содержат некоторые пептидные антибиотики, например валиномицин, грамицидин A, актиномицин D.
Всего в живых клетках встречается около 700 различных аминокислот, выполняющих самостоятельные функции. Некоторые из аминокислот также найдены и в метеоритах, особенно в карбоновых хондритах.
[править] Незаменимые аминокислоты
Растения и некоторые микроорганизмы могут производить все аминокислоты, необходимые им для синтеза клеточного белка. Животные способны синтезировать только 10 протеиногенных аминокислот. Последние 10 не могут быть получены с помощью биосинтеза и должны постоянно поступать в организм в виде пищевых белков. Отсутствие их в организме приводит к угрожающим жизни явлениям. К таким аминокислотам относятся: аргинин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин.[1]
[править] Функции аминокислот
В дополнение к синтезу белков, стандартные и нестандартные аминокислоты в животном организме выполняют много других важных биологических функций. Глицин и глутамат (анион глутаминовой кислоты) используются как нейромедиаторы при нервной передаче через химические синапсы, нейромедиаторами также являются нестандартная гамма-аминомасляная кислота, которая является продуктом декарбоксилирования глутамата, дофамин — производное тирозина, и серотонин, который образуется из триптофана. Гистидин является предшественником гистамина — локального медиатора воспалительных и аллергических реакций. Йодосодержащий гормон щитовидной железы тироксин образуется из тирозина. Глицин является одним из метаболических предшественников порфиринов (таких как дыхательный пигмент гем).
[править] Образование пептидной связи
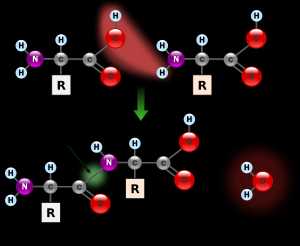
Между карбоксильной группой одной α-аминокислоты и аминогруппой другой может происходить реакция конденсации, продуктами которой являются дипептид и молекула воды. В образованном дипептиде остатки аминокислот соединены между собой CO-NH связью, которую называют пептидной или амидной.
Пептидную связь независимо друг от друга описали в 1902 году Эмиль Фишер и Франц Гофмейстер.
Дипептид имеет два конца: N-, на котором размещена аминогруппа, и C-, на котором размещена карбоксильная группа. Каждый из них потенциально может участвовать в следующей реакции конденсации с образованием линейных три-, тетра-, пента- и т. д. пептидов. Цепочки, содержащие 40 и более последовательно соединенных пептидными связями остатков аминокислот, называются полипептидами. Молекулы белков состоят из одной или нескольких полипептидных цепей.
cyclowiki.org
аминокислоты
СТРОЕНИЕ И СВОЙСТВА АМИНОКИСЛОТ, ВХОДЯЩИХ В СОСТАВ БЕЛКОВ. ПЕПТИДНЫЕ СВЯЗИ, СОЕДИНЯЮЩИЕ АМИНОКИСЛОТЫ В ЦЕПИ
Белки — полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 α-аминокислот.Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке. Аминокислоты можно рассматривать как буквы алфавита, при помощи которых, как в слове, записывается информация. Слово несёт информацию, например о предмете или действии, а последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка.
А. Строение и свойства аминокислот
1. Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот — наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродныматомом. R — радикал аминокислот — в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Вводных растворах при нейтральном значении рН α-аминокислотысуществуют в виде биполярных ионов.
Вотличие от 19 остальных α-аминокислот,пролин — иминокислота, радикал которой связан как с α-углеродныматомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в α-положенииасимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах — L и D. Исключение составляет глицин, который не имеет асимметричногоα-углеродногоатома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L- изомеры аминокислот.
Чистые L- или D-стереоизомерымогут за длительный срок самопроизвольно инеферментатив-нопревращаться в эквимолярную смесь L- иD-изомеров.Этот процесс называют рацемизацией. Рацемизация каждойL-аминокислотыпри данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в которомL-аспартатпереходит вD-изомерпри температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L- изомер, поэтому по содержаниюD-аспартатаможно рассчитать возраст обследуемого.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическимсвойствам радикалов, присоединённых кα-углеродномуатому.
2. Классификация аминокислот по химическому строению радикалов
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические (табл. 1-1).
В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН),амино(-Nh3),тиольная
(-SH),амидная(-CO-Nh3),гидроксильная(-ОН)и гуанидиноваягруппы.
Названия аминокислот можно построить по заместительной номенклатуре, но обычно используют тривиальные названия (табл. 1-2).
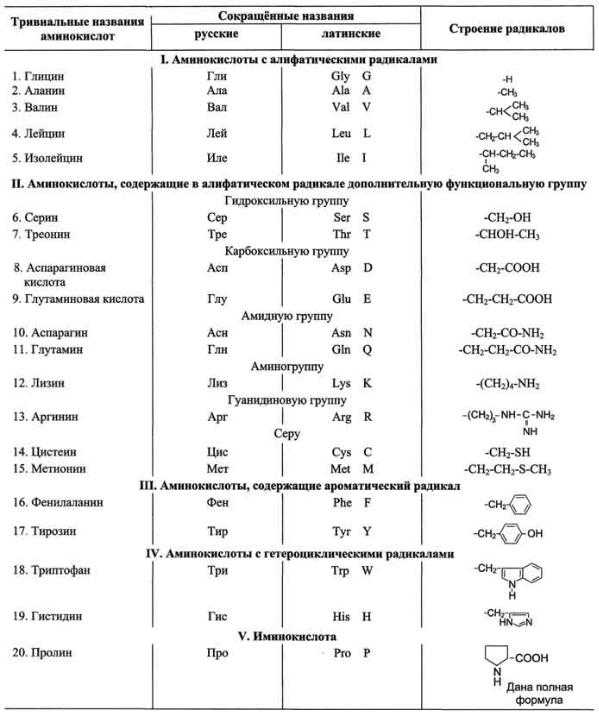
Таблица 1-1.Классификация основных аминокислот белков по их химическому строению
Таблица 1-2.Примеры названий аминокислот по заместительной номенклатуре и соответствующие тривиальные названия
Название аминокислоты | Формула аминокислоты | Тривиальное название |
по заместительной |
|
|
номенклатуре |
|
|
|
|
|
2-амино-З- |
| Серии |
гидроксипропановая кислота |
|
|
|
|
|
2-амино-4- |
| Метионин |
метилтиомасляная кислота |
|
|
|
|
|
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы (см. табл. 1-1).
Тривиальные названия часто происходят от названия источника, из которого они впервые были выделены, или от свойств данной аминокислоты. Так, серии впервые был выделен из фиброина шёлка (от лат. serieum — шелковистый), а глицин получил свое названиеиз-засладкого вкуса (от греч.glykos — сладкий).
3. Классификация аминокислот по растворимости их радикалов в воде
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
Аминокислоты с полярными незаряженными радикалами
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие
гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
Цистеин и тирозин содержат соответственно тиольную и гидроксильную группы, способные к диссоциации с образованием Н+, но при рН около 7,0, поддерживаемого в клетках, эти группы практически не диссоциируют.
Аминокислоты с полярными отрицательно заряженными радикалами
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО- и Н+. Следовательно, радикалы данных аминокислот — анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Аминокислоты с полярными положительно заряженными радикалами
Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, способная присоединять Н+, располагается в ?- положении алифатической цепи, а у аргинина положительный заряд приобретает, хуанидиновая группа, Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп — отдавать протон, теряя положительный заряд радикала. Положительно заряженные радикалы — катионы (см. схему ниже).
Наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот.
4. Изменение суммарного заряда аминокислот в зависимости от рН среды
При нейтральных значениях рН все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии.
Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, — положительный заряд (табл. 1-3).
Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд.
Напротив, увеличение концентрации ОН- групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд.

5. Модифицированные аминокислоты, присутствующие в белках
Непосредственно в синтезе белков организма человека принимают участие только 20 перечисленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты — производные одной из этих 20 аминокислот. Например, в молекуле коллагена (фибриллярного белка межклеточного матрикса) присутствуют гидроксипроизводные лизина и пролина — 5-гидроксилизини 4- гидроксипролин.
Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только
Модифицированные аминокислоты, найденные в составе белков
после окончания их синтеза. Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства,
Схема. Структура полярных заряженных аминокислот в диссоциированной форме
Таблица 1-3.Изменение суммарного заряда аминокислот в зависимости от рН среды
необходимые для выполнения ими специфических функций. Так, α-карбоксиглутаминоваякислота входит в состав белков, участвующих в свёртывании крови, и две близко лежащие карбоксильные группы в их структуре необходимы для связывания белковых факторов с ионами Са2+. Нарушение карбоксилирования глутамата приводит к снижению свёртываемости крови.
6. Химические реакции, используемые для обнаружения аминокислот
Способность аминокислот вступать в те или иные химические реакции определяется наличием в их составе функциональных групп. Так как все аминокислоты, входящие в состав белков, содержат у α-углеродногоатома амино- и карбоксильную группы, они могут вступать в характерные для всех аминокислот химические реакции. Наличие какихлибо функциональных групп в радикалах индивидуальных аминокислот определяет их способность вступать в специфичные для данных аминокислот реакции.
Нингидриновая реакция на α-аминокислоты
Для обнаружения и количественного определения аминокислот, находящихся в растворе, можно использовать нингидриновую реакцию.
Эта реакция основана на том, что бесцветный нингидрин, реагируя с аминокислотой, конденсируется в виде димера через атом азота, отщепляемый от α-аминогруппыаминокислоты. В результате образуется пигменткрасно-фиолетовогоцвета. Одновременно происходит декарбоксилирование аминокислоты, что приводит к образованию СО2 и соответствующего альдегида. Нингидриновую реакцию широко используют при изучении первичной структуры белков (см. схему ниже).
Так как интенсивность окраски пропорциональна количеству аминокислот в растворе, её используют для измерения концентрации α аминокислот.
Нингидриновая реакция, используемая для определения αаминокислот
Специфические реакции на отдельные аминокислоты
Качественное и количественное определение отдельных аминокислот возможно благодаря наличию в их радикалах особенных функциональных групп.
Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SH-группуданной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина — с помощью реакции Миллона.
Б. Пептидная связь. Строение и биологические свойства пептидов
α-Аминокислотымогут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется междуа-карбоксильнойгруппой одной аминокислоты иα-аминогруппойдругой, т.е. является амидной связью. При этом происходит отщепление молекулы воды (см. схему А).
1. Строение пептида
Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, окгапептид и т.д.
Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин «белок» часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном.
Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N- концевым и пишется слева, а имеющий свободную?-карбоксильнуюгруппу -С-концевыми пишется справа. Пептиды пишутся и читаются сN-конца.Цепь повторяющихся атомов в полипептидной цепи-NH-CH-CO-носитназвание»пептидный остов» (см. схему Б).
При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил,за исключениемС-концевойаминокислоты. Например, тетрапептидСер-Гли-Про-Алачитается как серилглицилпролилаланин.
Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот.
Серилглицилпролилаланин
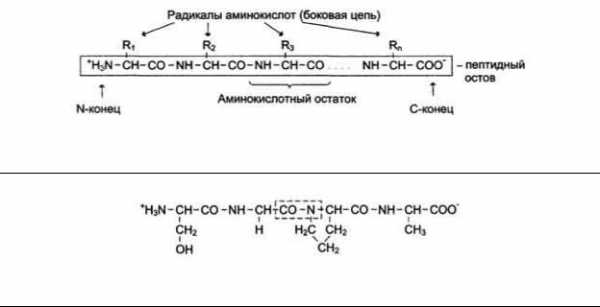
Схема А. Образование дипептида
Схема Б. Строение пептидов
Сер-Гис-Про-АлаиАла-Про-Гис-Сер- два разных пептида, несмотря на то, что они имеют одинаковые количественный и качественный составы аминокислот.
2.Характеристика пептидной связи
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу (рис. 1-1).
Связь между α углеродным атомом и α-аминогруппойилиα-карбоксильнойгруппой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации,т.е.α-углеродныеатомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве (рис.1-2).
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки.
В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein — белок,lysis — разрушение), называемых также протеазами, или пептидгидролазами.
Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей).

3.Биологическая роль пептидов
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью.
Рис. 1-1.Плоскости расположения пептидных групп иα-углеродныхатомов в пространстве.
Рис. 1-2.Транс-конфигурацияпептидных связей.Функциональные группы -СО- и -NH-,
образующие пептидные связи, не ионизированы, но полярны, и могут участвовать в образовании водородных связей.
Количество аминокислотных остатков в структуре биологически активных пептидов может варьировать от 3 до 50. К одним из самых «маленьких» пептидов можно отнести ти- реотропин-рилизинг-гормони глутатион (трипептиды), а также энкефалины, имеющие в своём составе 5 аминокислот. Однако большинство биологически активных пептидов имеет в своём составе более 10 аминокислот, например нейропептид Y (регулятор аппетита) содержит 36 аминокислот, а кортиколиберин — 41 аминокислоту.
Некоторые из пептидов, в частности большинство пептидных гормонов, содержат пептидные связи, образованные а-аминогруппойиа-карбоксильнойгруппой соседних аминокислот. Как правило, они синтезируются из неактивных белковых предшественников, в которых специфические протеолитические ферменты разрушают определённые пептидные связи.
Ангиотензин II — октапептид, образующийся из крупного белка плазмы крови ангиотензиногена в результате последовательного действия двух протеолитических ферментов.
Первый протеолитический фермент ренин отщепляет от ангиотензиногена с N-концапептид, содержащий 10 аминокислот, называемый ангиотензином I. Второй протеолитический фермент карбоксидипептидилпептидаза отщепляет отС-конца
studfiles.net

