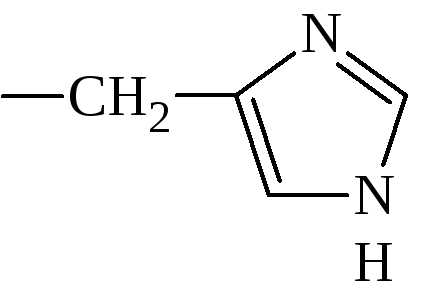
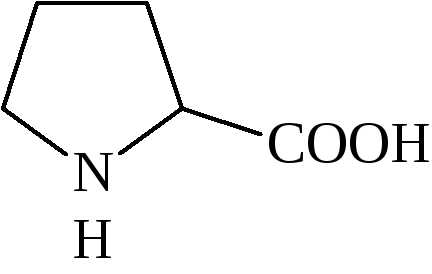
Аминокислоты объединяют в несколько классов
| Аминокислоты – это строительные блоки макромолекул белков. По строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Таким образом, в аминокислотах обязательно присутствует карбоксильная группа (СООН),аминогруппа (NH2), асимметричный атом углерода и боковая цепь (радикал R). Строением боковой цепи аминокислоты и отличаются друг от друга. Именно радикал придает аминокислотам большое разнообразие строения и свойств. |
Классификация аминокислот
Классификация аминокислот может проводиться в зависимости от какого-либо свойства или качества аминокислот. Выделяют следующие классы аминокислот:
1. В зависимости от положения аминогруппы по отношению к С2 (α-углеродный атом) на α-аминокислоты, β-аминокислоты и др.
2. По абсолютной конфигурации молекулы на L- и D-стереоизомеры.
3. По оптической активности в отношении плоскости поляризованного света – на право- и левовращающие.
4. По участию аминокислот в синтезе белков – протеиногенные и непротеиногенные.
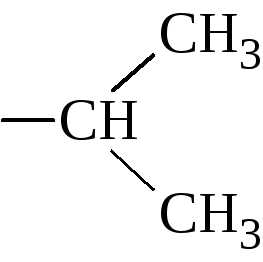
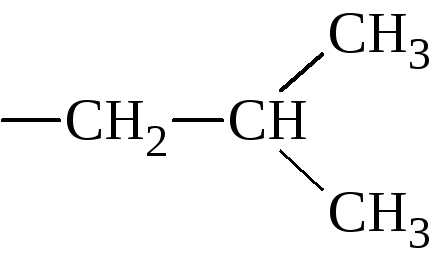
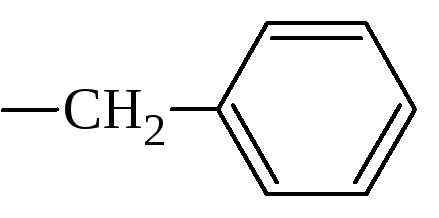
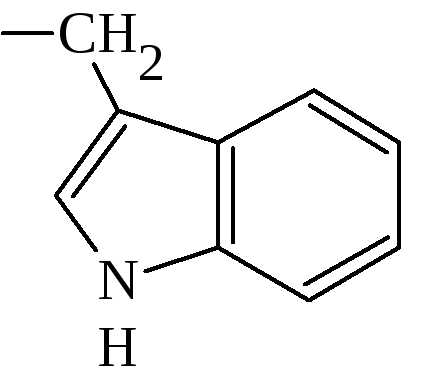
5. По строению бокового радикала – ароматические, алифатические, содержащие дополнительные СООН- и NH2-группы.
6. По кислотно-основным свойствам – нейтральные, кислые, основные.
7. По необходимости для организма – заменимые и незаменимые.
Двадцать аминокислот необходимы для синтеза белка
Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот.
Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения. Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты.
По строению бокового радикала
Выделяют
· алифатические(аланин, валин, лейцин, изолейцин, пролин, глицин),
· ароматические(фенилаланин, тирозин, триптофан),
· серусодержащие(цистеин, метионин),
· содержащие ОН-группу (серин, треонин, опять тирозин),
· содержащие дополнительную СООН-группу (аспарагиновая и глутаминоваякислоты),
· дополнительную NH2-группу (лизин, аргинин
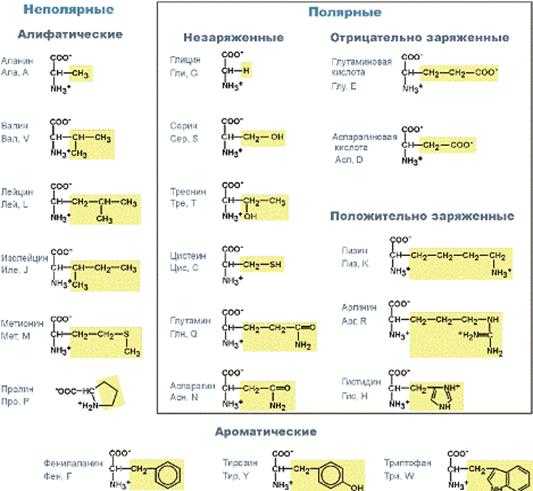
Строение протеиногенных аминокислот
По полярности бокового радикала
Существуют неполярныеаминокислоты (ароматические, алифатические) и полярные(незаряженные, отрицательно и положительно заряженные).
По кислотно-основным свойствам
По кислотно-основным свойствам подразделяют нейтральные(большинство), кислые(аспарагиновая и глутаминовая кислоты) и основные(лизин, аргинин, гистидин) аминокислоты.
По незаменимости
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей –
незаменимыеаминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимымотносят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей.Аминокислоты обладают изомерией
Изомерия аминокислот в зависимости от положения аминогруппы
В зависимости от положенияаминогруппы относительно 2-го атома углерода выделяют α-, β-, γ- и другие аминокислоты.
α- и β- формы аланина
Для организма млекопитающих наиболее характерны α-аминокислоты.
Изомерия по абсолютной конфигурации
По абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в α-положении. Имеется только два возможных расположения химических групп вокруг него.
Две конформации тетраэдра
В белке любого организма содержится только один стереоизомер, для млекопитающих это L-аминокислоты.
L- и D-формы аланина
Однако оптические изомеры претерпевают самопроизвольную неферментативнуюрацемизацию, т.е. L-форма переходит в D-форму. Данное обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии).
infopedia.su
Подробная классификация аминокислот — Zygar
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
| Аминокислота | Аббревиатура | Способность организма к синтезу | Характер катаболизма | мнемоническое правило | Полярность | Углеводородный радикал | Класс | Пути синтеза, семейство | Генетический код | Mr | Vw (Å3) | pI | шкала гидрофобности | частота в белках (%) | Год открытия | Источник | Впервые выделен |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Аланин | Ala, A | заменимая | глюкогенная | Alanine | Неполярные | нейтральные гидрофобные алифатические | 2 | пируват | GCU, GCC, GCA, GCG | 89.094 | 67 | 6.01 | 1.8 | 8.76 | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Аргинин | Arg, R | заменимая условно незаменимая | глюкогенная | aRginine | Полярные | заряженные положительно | 1 | глутамат | CGU, CGC, CGA, CGG, AGA, AGG | 174.203 | 148 | 10.76 | −4.5 | 5.78 | 1895 | Вещество рога | С. Гедин |
| Аспарагин | Asn, N | заменимая | глюкогенная | asparagiNe | Полярные | незаряженные амиды | 2 | аспартат | AAU, AAC | 132.119 | 96 | 5.41 | −3.5 | 3.93 | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Аспарагиновая, аспартат | Asp, D | заменимая | глюкогенная | asparDic acid | Полярные | заряженные отрицательно | 2 | аспартат | GAU, GAC | 133.104 | 91 | 2.85 | −3.5 | 5.49 | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен [en] |
| Валин | Val, V | незаменимая | глюкогенная | Valine | Неполярные | нейтральные гидрофобные алифатические | 1 | пируват | GUU, GUC, GUA, GUG | 117.148 | 105 | 6.00 | 4.2 | 6.73 | 1901 | Казеин | Э. Фишер |
| Гидроксилизин | Hyl, hK | заменимая | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1925 | Белки рыб | С. Шрайвер и др. | ||
| Гидроксипролин | Hyp, hP | заменимая | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1902 | Желатин | Э. Фишер | |
| Гистидин | His, H | заменимая условно незаменимая | глюкогенная | Histidine | Полярные | заряженные положительно гетероциклические | 2 | пентоз | CAU, CAC | 155.156 | 118 | 7.60 | −3.2 | 2.26 | 1896 | Стурин, гистоны | А. Коссель [3] , С. Гедин |
| Глицин | Gly, G | заменимая | глюкогенная | Glycine | Неполярные | незаряженные R-группа алифатические | 2 | серин | GGU, GGC, GGA, GGG | 75.067 | 48 | 6.06 | −0.4 | 7.03 | 1820 | Желатин | А. Браконно |
| Глутамин | Gln, Q | заменимая | глюкогенная | Q-tamine | Полярные | незаряженные амиды | 1 | глутамат | CAA, CAG | 146.146 | 114 | 5.65 | −3.5 | 3.9 | 0 | 0 | 0 |
| Глутаминовая, глутамат | Glu, E | заменимая | глюкогенная | gluEtamic acid | Полярные | заряженные отрицательно | 1 | глутамат | GAA, GAG | 147.131 | 109 | 3.15 | −3.5 | 6.32 | 1866 | Растительные белки | Г. Риттхаузен [de] |
| Изолейцин | Ile, I | незаменимая | глюко-кетогенная | Isoleucine | Неполярные | нейтральные гидрофобные алифатические | 1 | аспартат | AUU, AUC, AUA | 131.175 | 124 | 6.05 | 4.5 | 5.49 | 1904 | Фибрин | Ф. Эрлих |
| Лейцин | Leu, L | незаменимая | кетогенная | Leucine | Неполярные | нейтральные гидрофобные алифатические | 1 | пируват | UUA, UUG, CUU, CUC, CUA, CUG | 131.175 | 124 | 6.01 | 3.8 | 9.68 | 1820 | Мышечные волокна | А. Браконно |
| Лизин | Lys, K | незаменимая | кетогенная | before L | Полярные | заряженные положительно | 07.08.1900 | аспартат | AAA, AAG | 146.189 | 135 | 9.60 | −3.9 | 5.19 | 1889 | Казеин | Э. Дрексель |
| Метионин | Met, M | незаменимая | глюкогенная | Methionine | Неполярные | нейтральные гидрофобные серосодержащие | 1 | аспартат | AUG | 149.208 | 124 | 5.74 | 1.9 | 2.32 | 1922 | Казеин | Д. Мёллер |
| Пролин | Pro, P | заменимая | глюкогенная | Proline | Неполярные | нейтральные гидрофобные гетероциклические | 2 | глутамат | CCU, CCC, CCA, CCG | 115.132 | 90 | 6.30 | −1.6 | 5.02 | 1901 | Казеин | Э. Фишер |
| Серин | Ser, S | заменимая | глюкогенная | Serine | Полярные | незаряженные ОН-группа оксимоноаминокарбоновые | 2 | серин | UCU, UCC, UCA, UCG, AGU, AGC | 105.093 | 73 | 5.68 | −0.8 | 7.14 | 1865 | Шёлк | Э. Крамер |
| Тирозин | Tyr, Y | заменимая | глюко-кетогенная | tYrosine | Полярные | незаряженные ОН-группа ароматические | 1 | пентоз | UAU, UAC | 181.191 | 141 | 5.64 | −1.3 | 2.91 | 1848 | Казеин | Ю. фон Либих |
| Треонин | Thr, T | незаменимая | глюкогенная | Threonine | Полярные | незаряженные ОН-группа оксимоноаминокарбоновые | 2 | аспартат | ACU, ACC, ACA, ACG | 119.119 | 93 | 5.60 | −0.7 | 5.53 | 1925 | Белки овса | С. Шрайвер и др. |
| Триптофан | Trp, W | незаменимая | глюко-кетогенная | tWo rings | Неполярные | нейтральные гидрофобные ароматические | 1 | пентоз | UGG | 204.228 | 163 | 5.89 | −0.9 | 6.73 | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Фенилаланин | Phe, F | незаменимая | глюко-кетогенная | Fenylalanine | Неполярные | нейтральные гидрофобные ароматические | 2 | пентоз | UUU, UUC | 165.192 | 135 | 5.49 | 2.8 | 3.87 | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Цистеин | Cys, C | заменимая | глюкогенная | Cysteine | Полярные | незаряженные HS-группа серосодержащие | 1 | серин | UGU, UGC | 121.154 | 86 | 5.05 | 2.5 | 1.38 | 1899 | Вещество рога | К. Мёрнер |
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серосодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты аминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (R-групп)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серосодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серосодержащие: метионин
— иминокислота: пролин.
2. Полярные незаряженные
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
3. Заряженные отрицательно при рН-7 (кислые)
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.
В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:
VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
VII. По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
- Глюкогенные — при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат
- Кетогенные — распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды
- Глюко-кетогенные — при распаде образуются метаболиты обоих типов
Кетеновое тело — ацетон, ацетоноуксусная кислота
zygar.ru
Аминокислоты
Аминокислотами называют бифункциональные производные углеводородов, которые содержат карбоксильную группу COOH и аминогруппу NH2.
Номенклатура
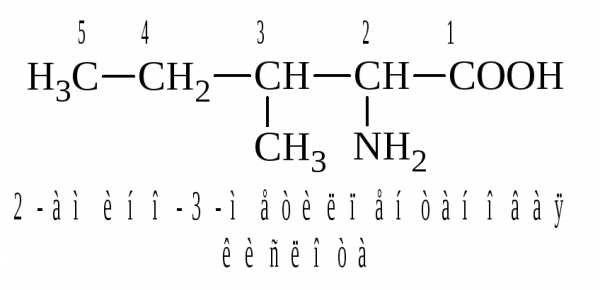
По систематической номенклатуре аминокислоты называют, по соответствующей карбоновой кислоте добавляя приставку амино-. Положение аминогруппы в углеродной цепи указывают цифрой:
Подробнее номенклатурные правила для названий аминокислот изложены в пособии Левина И.Ю., Берлянд А.С. «Номенклатура, классификация и электронное строение химических связей в органических соединениях», раздел 4.3.
В зависимости от положения аминогруппы по отношению к карбоксильной группе различают α, β, γ и так далее аминокислоты:
Все природные аминокислоты содержат аминогруппу только в α-положении и имеют общую формулу:
Помимо систематической, для природных аминокислот широко распространена тривиальная номенклатура (аланин, валин, лизин и т.д.). Иногда запись аминокислот осуществляют, используя трёх- буквенные сокращения (Ala , Val , Lys и др.).
Классификация аминокислот
В настоящее время единой классификации аминокислот не существует.
Аминокислоты делят на природные (содержатся в растительных и животных организмах) и синтетические – получены икусственным путем.
Организм синтезирует аминокислоты главным образом из пищевых белков. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты называют
незаменимыми. К ним относятся (валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин и триптофан) Такие аминокислоты должны поступать в организм извне.
В настоящее время известно свыше 150 аминокислот, но только 20 из них входят в состав белков.
По природе радикала аминокислоты делят на:
1. Моноаминомонокарбоновые.
Строение радикала кислоты R | Название | Условное обозна-чение | |
Тривиальное | Cистематическое | ||
H | Глицин | аминоэтановая | Гли Gly |
CH3 | Аланин | 2-аминопропановая | Ала Ala |
| Валин | 2-амино-3-метил-бутановая | Вал Val |
| Лейцин | 2-амино-4-метил-пентановая | Лей Leu |
Изолейцин | 2-амино-3-метил-пентановая | Иле Ile | |
2. Гидроксилсодержащие:
Строение радикала кислоты R | Название | Условное обозна-чение | |
Тривиальное | Cистематическое | ||
Серин | 2-амино-3-гидрокси-пропановая | Сер Ser | |
Треонин | 2-амино-3-гидрокси-бутановая | Тре Thr | |
Тирозин | 2-амино-3-(4-гидро-ксифенил)пропановая | Тир Tyr | |
3. Серусодержащие:
Строение радикала кислоты R | Название | Условное обозна-чение | |
Тривиальное | Cистематическое | ||
Цистеин | 2-амино-3-мер-каптопропановая | Цис Cys | |
Метионин | 2-амино-4-метил-тиобутановая | Мет Met | |
4. Аминокислоты, содержащие в радикале дополнительную аминогруппу или гуанидильный остаток.
Строение радикала кислоты R | Название | Условное обозна-чение | |
Тривиальное | Cистематическое | ||
Лизин | 2,6-диамино-гексановая | Лиз Lys | |
Аргинин (содержит гунидиновую группу) | 2-амино-5-гуанидил-пентановая | Арг Arg | |
5. Аминокислоты, которые содержат в радикале дополнительную карбоксильную или амидную группы:
Строение радикала кислоты R | Название | Условное обозна-чение | |
Тривиальное | Cистематическое | ||
Аспарагиновая | 2-аминобутан-диовая | Асп Asp | |
Глутаминовая | 2-аминопентан-диовая | Глу Glu | |
Аспарагин | 2-амино-3-карбоксамидо-пропановая | Асн Asn | |
Глутамин | 2-амино-4-карбоксамидо-бутановая | Глн Gln | |
6. Ароматические и гетероциклические аминокислоты:
Строение радикала кислоты R | Название | Условное обозна-чение | |
Тривиальное | Cистематическое | ||
| Фенилаланин | 2-амино-3-фенил-пропановая | Фен Phe |
| Триптофан | 2-амино-3-индол-илпропановая | Три Trp |
| Гистидин (иминокислота) | 2-амино-3-имидо-золилпропановая | Гис His |
| Пролин (полная форма) | 2-пирролидин-карбоновая | Про Pro |
Современная рациональная классификация основана на полярности радикалов. Полярность радикала во многом определяет такое важное свойство аминокислот как растворимость в воде и в других полярных растворителях. Полярные группы радикала (COOH, NH2, OH и др.) притягивают воду и тем самым повышают растворимость аминокислот в воде, неполярные радикалы, наоборот, отталкивают воду и снижают растворимость аминокислот в воде.
В этой связи различают:
studfiles.net
Классификация аминокислот
РАЗЛИЧИЯ В СТРОЕНИИ АМИНОКИСЛОТ
Радикалы аминокислот могут значительно отличаться друг от друга по строению.
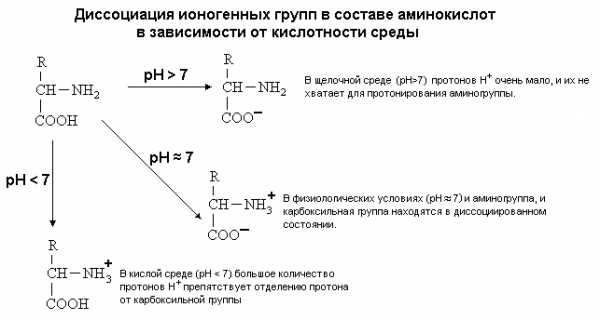
Если есть дополнительные карбоксильные группы в радикале, то заряд молекулы в нейтральной среде отрицателен, а ИЭТ такой молекулы находится в кислой среде.
Аминокислота, в радикале которой есть дополнительная аминогруппа (NH2-группа), в нейтральной среде заряжена положительно. ИЭТ такой аминокислоты находится в щелочной среде (pI>7). К таким аминокислотам относятся лизин, аргинин и гистидин.
Аминокислота, в радикале которой есть дополнительная карбоксильная группа (COOH-группа), в нейтральной среде заряжена отрицательно. ИЭТ такой аминокислоты находится в кислой среде (pI<7). К ним относятся аспарагиновая кислота и глутаминовая кислота.
С помощью значения рН внешней среды характеризуют соотношение -СООН и -NH2 групп. Это относится и к пептидам, и к белкам.
Различные функциональные группы, содержащиеся в радикалах аминокислот, придают им способность к взаимодействию с образованием разных типов соединений. Приведем примеры таких взаимодействий.
В связи с различиями в строении радикалов различны и физико-химические свойства аминокислот.
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ.
Существуют три типа классификации:
I. ФИЗИКО-ХИМИЧЕСКАЯ – основана на различиях в физико-химических свойствах аминокислот.
1) Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы, где равномерно распределена электронная плотность и нет никаких зарядов и полюсов. В их составе могут присутствовать и электроотрицательные элементы, но все они находятся в углеводородном окружении. Например, в радикале метионина сера окружена углеводородными группировками, которые не позволяют этому элементу проявлять своих электроотрицательных свойств: -(CH2)2-S-CH3. Аналогичная ситуация наблюдается, например, и в отношении азота, находящегося в составе радикала триптофана.
2) Гидрофильные незаряженные (полярные) аминокислоты. Радикалы таких аминокислот содержат в своем составе полярные группировки:
Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них.
3) Отрицательно заряженные аминокислоты. Сюда относятся аспарагиновая и глутаминовая кислоты. Имеют дополнительную СООН-группу в радикале — в нейтральной среде приобретают отрицательный заряд.
Все они гидрофильны.
4) Положительно заряженные аминокислоты: аргинин, лизин и гистидин. Имеют дополнительную NH2-группу (или имидазольное кольцо, как гистидин) в радикале — в нейтральной среде приобретают положительный заряд.
Все они также являются гидрофильными.
Такие свойства характерны для свободных аминокислот. В белке же ионогенные группы общей части аминокислот участвуют в образовании пептидной связи, и все свойства белка определяются только свойствами радикалов аминокислот.
Не все аминокислоты, принимающие участие в построении белков человеческого тела, способны синтезироваться в нашем организме. На этом основана еще одна классификация аминокислот — биологическая.
II. Биологическая классификация.
а) Незаменимые аминокислоты, их еще называют «эссенциальные». Они не могут синтезироваться в организме человека и должны обязательно поступать с пищей. Их 8 и еще 2 аминокислоты относятся к частично незаменимым.
Незаменимые: метионин, треонин, лизин, лейцин, изолейцин, валин, триптофан, фенилаланин.
Частично незаменимые: аргинин, гистидин.
а) Заменимые (могут синтезироваться в организме человека). Их 10: глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин.
III. Химическая классификация — в соответствии с химической структурой радикала аминокислоты (алифатические, ароматические).
Белки синтезируются на рибосомах, не из свободных аминокислот, а из их соединений с транспортными РНК (т-РНК).
Этот комплекс называется «аминоацил-т-РНК».
biofile.ru
Виды аминокислот и их характеристика
Всем привет! Так как вас интересуют аминокислоты — рад вас посвятить в эту тему. Статья не будет интересной, будет очень скучно. Даже картинок не будет! Да, вот так вот… Да и в общем не статья это, а техническая информация для тех кого это интересует. Итак…
Существует три группы аминокислот.
- Незаменимые аминокислоты — эти виды аминокислот не могут синтезироваться организмом, поэтому они должны поступать с пищей.
- Заменимые аминокислоты — эти виды аминокислот могут синтезироваться организмом из других составляющих.
- Условно заменимые аминокислоты — эти виды аминокислот обычно синтезируются организмом, но в условиях стресса (физические нагрузки, болезнь) вырабатываются в недостаточных количествах или же не синтезируются вообще.
Незаменимые
Валин — является одной из трёх аминокислот, которая имеет разветвлённые боковые цепочки. Очень активно используется мышцами. Входит в состав BCAA добавок. Содержится в зерновых, грибах, мясе, сое, арахисе, в молочных продуктах.
Изолейцин — является одной из трёх аминокислот, которая имеет разветвлённые боковые цепочки. Обеспечивает мышцы энергией. Эта аминокислота помогает избавится от чувства усталости в мышцах. Входит в состав BCAA добавок. Играет большую роль в производстве гемоглобина в организме. Содержится в миндале, кешью, курином мясе, яйцах, рыбе, чечевице, печени, мясе, ржи, большинстве семян, сое.
Гистидин — применяется в лечении аллергических заболеваний, язвы кишечника, артритов, язвы желудка, анемии. Необходим для производства в организме белых и красных кровяных телец. Может поглощать ультрафиолетовые лучи. Содержится в тунце, лососе, свиной вырезке, говяжьем филе, куриных грудках, соевых бобах, арахисе, чечевице.
Лейцин — используется как источник энергии. Входит в состав BCAA добавок. Помогает заживлению ран, улучшает сращивание костей, и замедляет распад мышечного белка. Содержится в мясе, рыбе, буром рисе, чечевице, орехах, большинстве семян.
Треонин — не даёт жиру накопиться в печени и очень активно способствует выводу токсинов. Содержится в молочных продуктах и яйцах, а также в бобах и орехах.
Лизин — нехватка лизина в организме замедляет синтез протеина в мышцах. Витамин С вместе с лизином образуют в печени новую аминокислоту L-карнитин. Во время тренировки карнитин способствует сжиганию жира в организме, потому что использует его как топливо для работы мышц. Лизин способствует уменьшению жировой прослойки, укреплению суставов и росту костей. Лизин помогает вырабатывать коллаген, который входит в состав сухожилий и суставов. Содержится в рыбе, молочных продуктах, мясе, пшенице, орехах.
Метионин — является предшественником креатина и цистина в организме. Снижает уровень холестерина в крови. В то же время увеличивает уровень глютамина, который выступает в роли антиоксиданта в организме. Улучшает заживление тканей и выводит токсины из печени и почек. Содержится в молоке, мясе, рыбе, яйцах, бобах, фасоли, сое и чечевице.
Фенилаланин — стимулирует деятельность мозга, улучшает память и концентрацию внимания. Является одним из основных элементов в производстве коллагена. Увеличивает настроение и подавляет аппетит. Содержится в говядине, соевых бобах, рыбе, курином мясе, яйцах, молоке, твороге.
Триптофан — успокаивает и стимулирует выработку гормона роста. Содержится в мясе, бананах, овсе, сушёных финиках, арахисе, индейке, кунжуте, кедровых орехах, молоке, йогурте, твороге, рыбе, курятине.
Заменимые
Аланин — является главным компонентом всех соединительных тканей в нашем организме. Позволяет снабжать мышцы энергией из аминокислот, повышает иммунитет.
Глутаминовая кислота — необходимая кислота для деятельности мозга и для всевозможных обменных процессов. Считается потенциальным энергетиком.
Глицин — участвует в формировании организмом новых заменимых аминокислот, является компонентом структуры гемоглобина и ферментов, которые участвуют в вырабатывании энергии. Стимулирует выработку глюкагона, который активизирует гликоген. Очень успокаивает и подавляет желание есть сладкое.
О нём есть отельная статья на блоге — читайте здесь!
Аспаргиновая кислота — участвует в преобразовании углеводов в энергию для работы мышц. Снижает уровень аммиака в организме после длительных тренировок. Является стройматериалом для иммуноглобулинов и антител.
Глутамин — очень важная кислота для иммунитета. Служит источником энергии для почек, кишечника и мозга. Серьезно стимулирует деятельность мозга, улучшает память и концентрацию внимания. Есть отдельная статья про глютамин и глютаминовую кислоту.
Серин — способствует укреплению иммунной системы нашего организма. Участвует в производстве клеточной энергии. Стимулирует функции нервной системы.
Орнитин — если его принимать в больших дозах, то он увеличивает выработку гормона роста. Выводит токсины и яды из печени, стимулирует иммунитет.
Таурин — стимулирует поглощение и сжигание подкожных слоёв жира. В некоторых случаях действует как нейропередатчик в определённых участках головного мозга.
Пролин — является основным элементом, который способствует образованию всех соединительных тканей в организме.
Цистин — очень активно участвует в заживлении ранений. Укрепляет соединительные ткани. Крайне важная аминокислота для здоровья наших волос и кожи. Стимулирует антиокислительные процессы. Улучшает работоспособность белых и красных кровяных телец.
Условно заменимые
Аргинин — стимулирует гормон роста. Служит основным источником окиси азота в организме. Повышает высвобождение глюкагона и инсулина. Положительно влияет на выработку мужских гормонов, помогает образовывать коллаген и стимулировать иммунную систему. Так же имеет ярко выраженное заживляющие действие. Содержится в медикаментозных препаратах и пищевых добавках для спортсменов и добавках, применяемых для стимулирования иммунитета.
Цистеин — понижает негативное действие табака и алкоголя. Стимулирует работу красных и белых кровяных телец. Содержится во многих белках, из которых получается путем гидролиза.
Тирозин — улучшает настроение. Его недостатка обычно не возникает, потому что она в достаточном количестве поступает в организм с белками пищи.
Это все основные виды аминокислот, которые используются в спортивном питании. Возможно эта информация была для вас полезной. Удачи, друзья!
comments powered by HyperCommentsP.S. Подписывайтесь на обновление блога, чтобы ничего не упустить! Если вы хотите приобрести какие-либо спорттовары, спортивное питание или добавки — можете воспользоваться этой специальной страницей!
Этой статьей стоит поделиться
pumping-effect.ru
Аминокислоты, содержащие в радикале дополнительную аминогруппу или гуанидильный остаток.
ЛЕКЦИЯ № 26
А М И Н О К И С Л О Т Ы
Аминокислотами называют бифункциональные производные углеводородов, которые содержат карбоксильную группу -COOH и аминогруппу -NH2.
Номенклатура
По систематической номенклатуре аминокислоты называют, по соответствующей карбоновой кислоте добавляя приставку амино-. Положение аминогруппы в углеродной цепи указывают цифрой:
Подробнее номенклатурные правила для названий аминокислот изложены в пособии Левина И.Ю., Берлянд А.С. «Номенклатура, классификация и электронное строение химических связей в органических соединениях», раздел 4.3.
В зависимости от положения аминогруппы по отношению к карбоксильной группе различают α, β, γ и так далее аминокислоты:
Все природные аминокислоты содержат аминогруппу только в
α-положении и имеют общую формулу:
Помимо систематической, для природных аминокислот широко распространена тривиальная номенклатура (аланин, валин, лизин и т.д.). Иногда запись аминокислот осуществляют, используя трёх- буквенные сокращения (Ala, Val , Lys и др.).
Классификация аминокислот
В настоящее время единой классификации аминокислот не существует.
Аминокислоты делят на природные (содержатся в растительных и животных организмах) и синтетические – получены искусственным путем.
Организм синтезирует аминокислоты главным образом из пищевых белков. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты называют незаменимыми. К ним относятся (валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин и триптофан) Такие аминокислоты должны поступать в организм извне.
В настоящее время известно свыше 150 аминокислот, но только 20 из них входят в состав белков.
По природе радикала аминокислоты делят на:
Моноаминомонокарбоновые.
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| -H | Глицин | аминоэтановая | Гли Gly |
| -CH3 | Аланин | 2-аминопропановая | Ала Ala |
| Валин | 2-амино-3-метил-бутановая | Вал Val | |
| Лейцин | 2-амино-4-метил-пентановая | Лей Leu | |
| Изолейцин | 2-амино-3-метил-пентановая | Иле Ile |
2.Гидроксилсодержащие:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| Серин | 2-амино-3-гидрокси-пропановая | Сер Ser | |
| Треонин | 2-амино-3-гидрокси-бутановая | Тре Thr | |
| Тирозин | 2-амино-3-(4-гидро-ксифенил)пропановая | Тир Tyr |
3. Серусодержащие:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| Цистеин | 2-амино-3-мер-каптопропановая | Цис Cys | |
| Метионин | 2-амино-4-метил-тиобутановая | Мет Met |
Стереоизомерия аминокислот
Все природные α-аминокислоты, кроме глицина (NH2 — CH2 — COOH), имеют асимметрический атом углерода (α-углеродный атом), а некоторые из них даже два хиральных центра, например, треонин. Таким образом, все аминокислоты могут существовать в виде пары несовместимых зеркальных антиподов (энантиомеров).
За исходное соединение, с которым принято сравнивать строение
α-аминокислот, условно принимают D- и L-молочные кислоты, конфигурации которых, в свою очередь, установлены по D- и L-глицериновым альдегидам.
Все превращения, которые осуществляются в этих рядах при переходе от глицеринового альдегида к α-аминокислоте, выполняются в соответствии с главным требованием — они не создают новых и не разрывают старых связей у асимметрического центра.
Для определения конфигурации α-аминокислоты в качестве эталона часто используют серин (иногда аланин). Конфигурации их так же выведены из D- и L-глицериновых альдегидов:
Природные аминокислоты, входящие в состав белков, относятся к L-ряду.
D-формы аминокислот встречаются сравнительно редко, они синтезируются только микроорганизмами и называются «неприродными» аминокислотами. Животными организмами D-аминокислоты не усваиваются. Интересно отметить действие D- и L-аминокислот на вкусовые рецепторы: большинство аминокислот L-ряда имеют сладкий вкус, а аминокислоты D-ряда — горькие или безвкусные.
Без участия ферментов самопроизвольный переход L-изомеров в D-изомеры с образованием эквимолярной смеси (рацемическая смесь) осуществляется в течение достаточно длительного промежутка времени.
Рацемизация каждой L-кислоты при данной температуре идет с определенной скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, например, в твердой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст человека или животного.
Физические свойства аминокислот
Хотя аминокислоты обычно изображают как соединения, содержащие амино- и карбоксильную группы (H2N — CHR — COOH), некоторые их свойства, как физические, так и химические, не согласуются с этой структурой. Присутствие в молекуле у одного атома углерода двух функциональных групп приводит к появлению ряда специфических свойств.
Во-первых, в противоположность аминам и карбоновым кислотам аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при близких и довольно высоких температурах, поэтому идентификации аминокислот по температурам плавления достаточно затруднительна.
Во-вторых, аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде.
В-третьих, в водных растворах аминокислоты имеют высокие дипольные моменты.
В-четвертых, константы кислотности и основности для групп СООН и NH2 необычайно малы. Так, для глицина константа кислотности Ka = 1,6×10—10, а константа основности Kb = 2,5×10—12; в то время как для большинства карбоновых кислот Ka » 10—5 а для алифатических аминов Kb » 10—4.Все эти свойства вполне объяснимы,если принять во внимание тот факт, что аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью.
Кислотно-основные свойства также становятся понятными, если учесть, что измеряемая Ka в действительности относится к кислотности иона RNH3+:
а константа основности (Kb) в действительности относится к основности карбоксилат-иона.
При подщелачивании раствора аминокислоты диполярный ион I превращается в анион II, так как более сильное основание (гидроксильный ион) отрывает протон от иона аммония и образуется более слабое основание — амин.
Если подкислить раствор аминокислоты, ион I превратится в катион III, так как более сильная кислота Н3О+ отдает протон карбоксилат-иону и образуется более слабая кислота:
Необходимо отметить, что ионы II и Ш, содержащие свободную аминогруппу или свободную карбоксильную группу, находятся в равновесии с диполярным ионом:
Однако следует иметь в виду, что в данном равновесии участвует также определенное (хотя и небольшое) количество незаряженных молекул аминокислот.
Амфотерность аминокислот
Наличие в молекуле аминокислоты функциональных групп кислотного и основного характера обусловливает амфотерность аминокислот. Подобно любому амфотерному соединению, аминокислоты образуют соли как при действии кислоты, так и при действии щелочи.
Аминокислоты, будучи гетерофункциональными соединениями, должны проявлять свойства как одной, так и другой функциональной группы.
Образование хлорангидридов.
Эту реакцию часто называют реакцией «активации» карбоксильной группы. Хлорангидриды α-аминокислот получают действием на аминокислоты тионилхлорида (SOCl2) или хлорида фосфора (V) (PCl5). Полученные хлорангидриды неустойчивы и существуют только в виде солей:
Поэтому реакцию обычно проводят, предварительно защитив аминогруппу ацилированием.
Образование амидов аминокислот.
Такие амиды получают действием аммиака или первичных аминов на хлорангидриды с защищённой аминогруппой. В случае использования реакции с аминами получают замещённые по азоту амиды аминокислот:
Реакции аминогруппы
Реакция ацилирования. Образование N-замещённых амидов.
N-замещенные амиды часто рассматривают как N-ацильные производные. Эта реакция была отмечена ранее как реакция защиты аминогруппы. Её можно рассматривать как процесс ацилирования аминогруппы хлорангидридами или ангидридами кислот:
Реакция протекает лучше в щелочной среде. Примером может служить получение N-бензоилаланина в присутствии водного раствора гидроксида натрия. Этот метод получения N-ацильных производных называют ацилированием по Шоттен-Бауману:
Щёлочь необходима для связывания выделяющегося хлороводорода, т.к. в кислой среде N-ацильные производные легко гидролизуются, освобождая исходную аминокислоту:
Это общепринятый способ удаления защитной группы. Однако в некоторых случаях невозможно удалять защитную группу гидролизом в кислой среде. Например, при гидролизе пептидов будет разрушаться пептидная связь. В этих случаях защиту проводят такими реагентами, удаление которых можно провести не гидролизом, а каким-либо другим методом. Например, аминогруппу можно защищать реакцией с карбобензоксихлоридом (бензиловый эфир хлормуравьиной кислоты). Карбобензоксигруппа удаляется затем каталитическим гидрогенолизом:
Алкилирование аминокислот.
Аминокислоты можно алкилировать по аминогруппе галоидными алкилами (обычно иодистыми алкилами). Например, алкилированием глицина можно получить метиламиноуксусную кислоту — саркозин, которая в связанном виде содержится в некоторых белках.
При избытке иодистого метила образуется четвертичная аммонийная соль:
Взаимодейстивие с динитрофторбензолом (ДНФБ).
Важной реакцией α-аминогруппы является её реакция с
2,4-динитрофторбензолом (ДНФБ) в слабощелочном растворе, которую впервые использовал Фредерик Сенгер для количественного введения метки в аминогруппы аминокислот и пептидов. Эта реакция протекает по механизму нуклеофильного замещения.
Продукт реакции окрашен в интенсивно желтый цвет. Эта реакция представляет исключительную ценность для идентификации N-концевых аминокислот полипептидных цепей.
Все вышеперечисленные реакции аминогруппы аминокислот можно представить следующей схемой:

Реакции аминокислот in vivo
Простые аминокислоты, как и многие другие простые «биологические молекулы», не накапливаются в клетке: как правило, их избыток разрушается при помощи реакций, которые снабжают живую систему энергией. Три основные реакции, катализируемые ферментами, благодаря которым осуществляется превращение аминокислот в клетке, это реакции дезаминирования, переаминирования и декарбоксилирования.
Дезаминирование аминокислот
В организме дезаминирование может осуществляться как неокислительным, так и окислительным путём.
Неокислительное дезаминированиевстречается, в основном, у бактерий и грибов. Например, превращение аспарагиновой кислоты в фумаровую под действием фермента аспартазы.
Окислительное дезаминирование — протекает при участии фермента оксидазы. Для того чтобы полностью прошла реакция окислительного дезаминирования, фермент, катализирующий эту реакцию, нуждается в окислительном (дегидрирующем) агенте. Обычно акцептором водорода в таких системах служит ФАД (флавинадениндинуклеотид), который затем переходит в восстановленную форму, сокращённо обозначаемую ФАД-Н2.
Окислительное дезаминирование осуществляется через стадию образования промежуточного имина.
Рассмотрим процесс превращения аланина в пировиноградную кислоту.
Реакции дезаминирования позволяют организму удалять избыток аминокислот, однако при этом повышается концентрация нежелательных азотистых веществ. Высокие концентрации аммиака и его производных токсичны для организма, который поэтому стремится освободиться от них, выделяя лишний азот в виде мочевины или мочевой кислоты.
Мочевая кислота образуется в организме взрослого человека в качестве побочного продукта. Высокое содержание мочевой кислоты приводит к мочекаменной болезни. Мочевая кислота в виде кристаллов мононатриевой соли образует камни в почках и в мочевом пузыре. Соли мочевой кислоты в суставах вызывают болезненные симптомы подагры — очень широко распространенного заболевания человека. Содержание мочевой кислоты и её солей в организме человека может представлять интерес с точки зрения эволюционной теории, поскольку большинство животных полностью разлагают мочевую кислоту до её выделения из организма. Было высказано предположение о том, что присутствие мочевой кислоты в организме человека предоставляет людям некоторое эволюционное преимущество. Эта гипотеза ещё не доказана, но она может быть интересным связующим звеном между биохимическими свойствами вещества и поведением живых организмов.
Альдольное расщепление.
Реакция протекает с α-аминокислотами, содержащими гидроксильную группу в β-положении углеводородного радикала.
Рассмотрим, например, реакцию расщепления серина, в результате которой образуются глицин и формальдегид.
В результате этой реакции расщепляется С-С связь между α- и
β-углеродными атомами. Образующийся формальдегид не выделяется, а связывается с другим коферментом — тетрагидрофолиевой кислотой и в качестве одноуглеродного фрагмента участвует далее в синтезе многих важных соединений.
ПЕПТИДЫ
Полипептиды образуются в результате реакции конденсации, протекающей между аминогруппой одной кислоты и карбоксильной группой другой:
Пептид, образованный двумя аминокислотами, называется дипептид, тремя — трипептид и.т.д. Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами. Часто в названии таких молекул указывают число аминокислот, входящих в состав данного олигопетида: дипептид, трипептид, тетрапептид, октапептид и.т.д.
Пептиды, содержащие более 10 аминокислот, называют полипептидами. А полипептиды, содержащие более 50 аминокислотных остатков, обычно называют белками. Однако такие градации весьма условны: например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном. Гормоны окситоцин и вазопрессин содержат всего по 9 аминокислотных остатков.
Поэтому более удачным следует считать различие, проводимое на уровне структуры полимера, более сложном, чем простая аминокислотная последовательность и количественный состав пептида. Полипептиды представляют собой линейные, довольно гибкие молекулы, а длинные цепи белков свернуты в клубок или иную структуру. Многие белки могут иметь в своем составе группы небелкового характера (простетические группы), связанные с полиамидной цепью.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот. Например, тетрапептиды сер-гис-про-ала и ала-гис-про-сер — это два разных пептида, несмотря на то, что они имеют одинаковый качественный и количественный состав.
Hоменклатура пептидов
При названии полипептида к названию всех аминокислотных остатков, кроме последнего, добавляют суффикс —ил, концевая аминокислота имеет окончание —ин. Например, пептид мет-асп-вал-про имеет полное название метиониласпарагилвалилпролин.
ЛЕКЦИЯ № 26
А М И Н О К И С Л О Т Ы
Аминокислотами называют бифункциональные производные углеводородов, которые содержат карбоксильную группу -COOH и аминогруппу -NH2.
Номенклатура
По систематической номенклатуре аминокислоты называют, по соответствующей карбоновой кислоте добавляя приставку амино-. Положение аминогруппы в углеродной цепи указывают цифрой:
Подробнее номенклатурные правила для названий аминокислот изложены в пособии Левина И.Ю., Берлянд А.С. «Номенклатура, классификация и электронное строение химических связей в органических соединениях», раздел 4.3.
В зависимости от положения аминогруппы по отношению к карбоксильной группе различают α, β, γ и так далее аминокислоты:
Все природные аминокислоты содержат аминогруппу только в
α-положении и имеют общую формулу:
Помимо систематической, для природных аминокислот широко распространена тривиальная номенклатура (аланин, валин, лизин и т.д.). Иногда запись аминокислот осуществляют, используя трёх- буквенные сокращения (Ala, Val , Lys и др.).
Классификация аминокислот
В настоящее время единой классификации аминокислот не существует.
Аминокислоты делят на природные (содержатся в растительных и животных организмах) и синтетические – получены искусственным путем.
Организм синтезирует аминокислоты главным образом из пищевых белков. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты называют незаменимыми. К ним относятся (валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин и триптофан) Такие аминокислоты должны поступать в организм извне.
В настоящее время известно свыше 150 аминокислот, но только 20 из них входят в состав белков.
По природе радикала аминокислоты делят на:
Моноаминомонокарбоновые.
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| -H | Глицин | аминоэтановая | Гли Gly |
| -CH3 | Аланин | 2-аминопропановая | Ала Ala |
| Валин | 2-амино-3-метил-бутановая | Вал Val | |
| Лейцин | 2-амино-4-метил-пентановая | Лей Leu | |
| Изолейцин | 2-амино-3-метил-пентановая | Иле Ile |
2.Гидроксилсодержащие:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| Серин | 2-амино-3-гидрокси-пропановая | Сер Ser | |
| Треонин | 2-амино-3-гидрокси-бутановая | Тре Thr | |
| Тирозин | 2-амино-3-(4-гидро-ксифенил)пропановая | Тир Tyr |
3. Серусодержащие:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| Цистеин | 2-амино-3-мер-каптопропановая | Цис Cys | |
| Метионин | 2-амино-4-метил-тиобутановая | Мет Met |
Аминокислоты, содержащие в радикале дополнительную аминогруппу или гуанидильный остаток.
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| Лизин | 2,6-диамино-гексановая | Лиз Lys | |
| Аргинин (содержит гунидиновую группу) | 2-амино-5-гуанидил-пентановая | Арг Arg |
5. Аминокислоты, которые содержат в радикале дополнительную карбоксильную или амидную группы:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| Аспарагиновая | 2-аминобутан-диовая | Асп Asp | |
| Глутаминовая | 2-аминопентан-диовая | Глу Glu | |
| Аспарагин | 2-амино-3-карбоксамидо-пропановая | Асн Asn | |
| Глутамин | 2-амино-4-карбоксамидо-бутановая | Глн Gln |
6. Ароматические и гетероциклические аминокислоты:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| Фенилаланин | 2-амино-3-фенил-пропановая | Фен Phe | |
| Триптофан | 2-амино-3-индол-илпропановая | Три Trp | |
| Гистидин (иминокислота) | 2-амино-3-имидо-золилпропановая | Гис His | |
| Пролин (полная форма) | 2-пирролидин-карбоновая | Про Pro |
Современная рациональная классификация основана на полярности радикалов. Полярность радикала во многом определяет такое важное свойство аминокислот как растворимость в воде и в других полярных растворителях. Полярные группы радикала (-COOH, -NH2, -OH и др.) притягивают воду и тем самым повышают растворимость аминокислот в воде, неполярные радикалы, наоборот, отталкивают воду и снижают растворимость аминокислот в воде.
Стереоизомерия аминокислот
Все природные α-аминокислоты, кроме глицина (NH2 — CH2 — COOH), имеют асимметрический атом углерода (α-углеродный атом), а некоторые из них даже два хиральных центра, например, треонин. Таким образом, все аминокислоты могут существовать в виде пары несовместимых зеркальных антиподов (энантиомеров).
За исходное соединение, с которым принято сравнивать строение
α-аминокислот, условно принимают D- и L-молочные кислоты, конфигурации которых, в свою очередь, установлены по D- и L-глицериновым альдегидам.
Все превращения, которые осуществляются в этих рядах при переходе от глицеринового альдегида к α-аминокислоте, выполняются в соответствии с главным требованием — они не создают новых и не разрывают старых связей у асимметрического центра.
Для определения конфигурации α-аминокислоты в качестве эталона часто используют серин (иногда аланин). Конфигурации их так же выведены из D- и L-глицериновых альдегидов:
Природные аминокислоты, входящие в состав белков, относятся к L-ряду.
D-формы аминокислот встречаются сравнительно редко, они синтезируются только микроорганизмами и называются «неприродными» аминокислотами. Животными организмами D-аминокислоты не усваиваются. Интересно отметить действие D- и L-аминокислот на вкусовые рецепторы: большинство аминокислот L-ряда имеют сладкий вкус, а аминокислоты D-ряда — горькие или безвкусные.
Без участия ферментов самопроизвольный переход L-изомеров в D-изомеры с образованием эквимолярной смеси (рацемическая смесь) осуществляется в течение достаточно длительного промежутка времени.
Рацемизация каждой L-кислоты при данной температуре идет с определенной скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, например, в твердой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст человека или животного.
Физические свойства аминокислот
Хотя аминокислоты обычно изображают как соединения, содержащие амино- и карбоксильную группы (H2N — CHR — COOH), некоторые их свойства, как физические, так и химические, не согласуются с этой структурой. Присутствие в молекуле у одного атома углерода двух функциональных групп приводит к появлению ряда специфических свойств.
Во-первых, в противоположность аминам и карбоновым кислотам аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при близких и довольно высоких температурах, поэтому идентификации аминокислот по температурам плавления достаточно затруднительна.
Во-вторых, аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде.
В-третьих, в водных растворах аминокислоты имеют высокие дипольные моменты.
В-четвертых, константы кислотности и основности для групп СООН и NH2 необычайно малы. Так, для глицина константа кислотности Ka = 1,6×10—10, а константа основности Kb = 2,5×10—12; в то время как для большинства карбоновых кислот Ka » 10—5 а для алифатических аминов Kb » 10—4.Все эти свойства вполне объяснимы,если принять во внимание тот факт, что аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью.
Кислотно-основные свойства также становятся понятными, если учесть, что измеряемая Ka в действительности относится к кислотности иона RNH3+:
а константа основности (Kb) в действительности относится к основности карбоксилат-иона.
При подщелачивании раствора аминокислоты диполярный ион I превращается в анион II, так как более сильное основание (гидроксильный ион) отрывает протон от иона аммония и образуется более слабое основание — амин.
Если подкислить раствор аминокислоты, ион I превратится в катион III, так как более сильная кислота Н3О+ отдает протон карбоксилат-иону и образуется более слабая кислота:
Необходимо отметить, что ионы II и Ш, содержащие свободную аминогруппу или свободную карбоксильную группу, находятся в равновесии с диполярным ионом:
Однако следует иметь в виду, что в данном равновесии участвует также определенное (хотя и небольшое) количество незаряженных молекул аминокислот.
infopedia.su
аминогруппу – Nh3 и карбоксильную группу – COOH, связанные с углеводородным радикалом. — КиберПедия
Строение первого представителя данного класса – аминоуксусной кислоты
СН2 – С = О
| |
NH2 ОН
Изомерия и номенклатура:
Правила тривиальной и систематической номенклатуры
Исторические названия незаменимых аминокислот
-Какие виды изомерии характерны для этих соединений?
1. изомерия углеводородного скелета
2. изомерия положения функциональной группы
3. оптическая изомерия
Оптически активные вещества встречаются в виде пар антиподов-изомеров, физические и химические свойства которых одинаковы, за исключением одного – способности вращать плоскость поляризованного луча в противоположные стороны.
Различают D-аминокислоты и L-аминокислоты.
Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запах.
Классификация аминокислот.
Аминокислоты делят на:
• Природные
Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот – незаменимые(не синтезируются в организме человека), поступают с пищей.
• Синтетические
Получают кислотным гидролизом белков, либо из карбоновых кислот, воздействуя на них галогеном, а затем аммиаком.
2) Химические свойства аминокислот: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации).
1) Образование солей это амфотерные соединения, поэтому они способны образовывать соли как с кислотами, так и с основаниями.-. Аминокислоты
-Аминокислоты способны также образовывать устойчивые комплексные соли с ионами некоторых двухвалентных металлов: Cua2+, Ni2+, Zn2+, Co2+. С ионами Cu2+ получаются кристаллические хелатные соли синего цвета, которые используются для выявления, выделения и очистки аминокислот (качественная реакция).
2) Реакции по карбоксильной группе
3) Реакции по аминогруппе
4) Реакции аминокислот под действием ферментов
5. Аминокислоты взаимодействуют друг с другом
NH2 –CH2 –COOH + NH2 –CH2 –COOH → NH2 –CH2 –CO-NH–CH2 –COOH + Н2О
дипептид
-СО–NH – пептидная группа (амидная группа)
3) Пептидная связь и полипептиды.
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей.Карбоксильная группа одной аминокислоты ковалентно связывается с аминогруппой другой аминокислоты. При этом возникает R-CO-NH-R связь, называемая пептидной связью. При этом происходит отщепление молекулы воды .
При помощи пептидных связей из аминокислот образуются белки и пептиды. Пептиды, содержащие до 10 аминокислот, называют олигопептиды.Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды»,а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки».Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную C-карбоксильную группу — С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца.
Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве. Пептидные связи очень прочны и являются ковалентными.
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью. Такими являются целый ряд гормонов – окситоцин (9 аминокислотных остатков), вазопрессин (9), брадикинин (9) регулирующий тонус сосудов, тиреолиберин (3), антибиотики – грамицидин, пептиды, обладающие обезболивающим действием (энкефалины(5) и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
4) Применение аминокислот на основе свойств.
Аминокислоты, преимущественно α-аминокислоты, необходимы для синтеза белков в живых организмах. Нужные для этого аминокислоты человек и животные получают в виде пищи, содержащей различные белки. Последние подвергаются в пищеварительном тракте расщеплению на отдельные аминокислоты, из которых затем синтезируются белки, свойственные данному организму. Некоторые аминокислоты применяются в медицинских целях. Многие аминокислоты служат для подкормки животных.
Производные аминокислот используются для синтеза волокна, например капрона.
Вопросы для самоконтроля
ü Что такое кислота?
ü Что такое функциональная группа?
ü Какие вы помните функциональные группы?
ü Что такое аминогруппа?
ü Какими свойствами обладает аминогруппа?
ü Какими свойствами обладает кислота?
ü Как вы считаете, какую реакцию среды будет давать молекула, содержащая кислотную и основную группу?
ü ТЕСТ
ü 1 вариант.
ü 1) В состав аминокислот входят функциональные группы:
ü а) -Nh3 и –ОН
ü б) -Nh3 и –СОН
ü в) -Nh3 и –СООН
ü г) -ОH и –СООН
ü 2. Аминокислоты можно рассматривать как производные:
ü а) алкенов;
ü б) спиртов;
ü в) карбоновых кислот;
ü г) углеводов.
ü 3. Аминокислоты вступают в реакцию
ü а) полимеризацию;
ü б) поликондесацию;
ü в) нейтрализацию.
ü 4.Связь между аминокислотами в полимере:
ü а) водородная;
ü б) ионная;
ü в) пептидная.
ü 5. Незаменимые аминокислоты — это …
ü 2 вариант.
ü 1.Общая формула аминокислот:
ü а)R-СН2 (Nh3)-СООН;
ü б) R-СООН;
ü в) R-СОН;
ü г) R-ОН.
ü 2. В растворе аминокислот среда
ü а) щелочная;
ü б) нейтральная;
ü в) кислотная .
ü 3. Аминокислоты могут взаимодействовать друг с другом при этом образуя:
ü а) углеводы;
ü б) нуклеиновые кислоты;
ü в) полипептиды;
ü г)крахмал.
ü 4. Аминокислоты – это…
ü а) органические основания;
ü б) кислоты
ü в) органические амфотерные соединения.
ü 5. Аминокислоты применяют в …
ü Из каких неорганических веществ можно получить аминоуксусную кислоту? Напишите соответствующие уравнения реакций.
ü Задача.Определите формулу аминокислоты, если массовые доли углерода, водорода, кислорода и азота соответственно равны: 48%, 9,34%, 42,67% и 18, 67%. Напишите все возможные структурные формулы и назовите их
ПЛАН ЗАНЯТИЯ № 19
Дисциплина:Химия.
Тема:Белки.
Цель занятия: Изучить первичную, вторичную, третичную структуры белков. Химические свойства белков: горение, денатурация, гидролиз, цветные реакции. Биологические функции белков.
Планируемые результаты
Предметные: сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
Метапредметные: использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи;
Личностные: чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1. Белки. Первичная, вторичная, третичная структуры белков.
2. Химические свойства белков: горение, денатурация, гидролиз, цветные реакции.
3. Биологические функции белков.
Оснащение:Учебник.
Литература:
1. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 — изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель:Тубальцева Ю.Н.
Тема 19. Белки.
План:
1. Белки. Первичная, вторичная, третичная структуры белков.
2. Химические свойства белков: горение, денатурация, гидролиз, цветные реакции.
3. Биологические функции белков.
1) Белки. Первичная, вторичная, третичная структуры белков.
1 – Состав белка: С – 54%, О – 23%, Н – 7%, N – 17%, S – 2% и другие: Zn, P, Fe, Cu, Mg, Mn
В 1903 г. немецкий ученый Э.Г.Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO. Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. русским ученым А.Я.Данилевским.
2 — Белки – ВМС – протеины
“Протос” от греческого – “первичный, важнейший”. Белки – природные полимеры, состоящие из АК.
Mr (альбумина)=36000
Mr (миозина)=150000
Mr (гемоглобина)=68000
Mr (коллагена)=350000
Mr (фибриногена)=450000
Формула белка молока – казеина C1894H3021O576N468S21
Белки – это природные высокомолекулярные природные соединения (биополимеры), построенные из альфа-аминокислот, соединенных особой пептидной связью. В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков.
Число аминокислотных остатков, входящих в молекулы, различно: инсулин – 51, миоглобин – 140. Отсюда M r белка от 10 000 до нескольких миллионов.
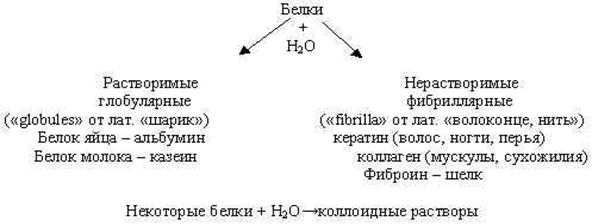
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки).
3 —
4 —20 АК – “кирпичики” белкового здания, соединяя их в разном порядке, можно выстроить неисчислимое множество веществ с самыми разными свойствами. Химики пытаются расшифровать строение белковых молекул-великанов. Задача эта очень трудная: природа тщательно прячет “чертежи”, по которым выстроены эти частицы.
В 1888 году русский биохимик А.Я. Данилевский указал на то, что в молекулах белков содержатся повторяющиеся пептидные группы атомов –С–N–
В начале ХХ столетия немецкому ученому Э.Фишеру и другим исследователям удалось синтезировать соединения, в молекулы, которых входило 18 остатков различных АК, соединенных пептидными связями.
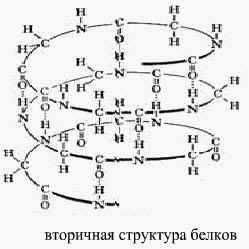 5 — Первичная структура белка – это последовательное чередование АК (полипептидная цепь ППЦ). Пространственная конфигурация белковой молекулы, напоминающая спираль образуется благодаря многочисленным водородным связям между группами.
5 — Первичная структура белка – это последовательное чередование АК (полипептидная цепь ППЦ). Пространственная конфигурация белковой молекулы, напоминающая спираль образуется благодаря многочисленным водородным связям между группами.
– СО– и –NH–
Такая структура белка называется вторичной. В пространстве закрученная спираль ППЦ образует третичную структуру белка, которая поддерживается взаимодействием разных функциональных групп ППЦ.
–S–S– (дисульфидный мостик)
–СООН и –ОН (сложноэфирный мостик)
–СООН и –NH2 (солевой мостик)
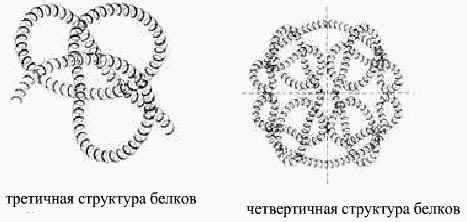 Некоторые белковые макромолекулами могут соединяться друг с другом и образовывать крупные молекулы. Полимерные образования белков называются четвертичными структурами (гемоглобин только при такой структуре способен присоединять и транспортировать О2 в организм)
Некоторые белковые макромолекулами могут соединяться друг с другом и образовывать крупные молекулы. Полимерные образования белков называются четвертичными структурами (гемоглобин только при такой структуре способен присоединять и транспортировать О2 в организм)
2) Химические свойства белков: горение, денатурация, гидролиз, цветные реакции.
1. Для белков характерны реакции, в результате которых выпадает осадок. Но в одних случаях полученный осадок при избытке воды растворяется, а в других – происходит необратимое свертывание белков, т.е. денатурация.
Денатурация – это изменение третичной и четвертичной структур белковой макромолекулы под влиянием внешних факторов (повышение или понижение температуры, давления, механического воздействия, действия химических реагентов, УФ – излучения, радиации, ядов, солей тяжелых металлов (свинец, ртуть и др.))
cyberpedia.su