Иле аминокислота – Популярные диеты
Ни для кого не секрет, что человеку для поддержания жизнедеятельности на высоком уровне необходим белок – своеобразный строительный материал для тканей организма; в состав белков входят 20 аминокислот, названия которых вряд ли что-то скажут обычному офисному работнику. Каждый человек, особенно если говорить о женщинах, хоть раз слышал о коллагене и кератине – это протеины, которые отвечают за внешний вид ногтей, кожи и волос.
Аминокислоты – что это такое?
Аминокислоты (или же аминокарбоновые кислоты; АМК; пептиды) – органические соединения, на 16 % состоящие из аминов – органических производных аммония, – что отличает их от углеводов и липидов. Они участвуют в биосинтезе белка организмом: в пищеварительной системе под влиянием ферментов все белки, поступающие с едой, разрушаются до АМК. Всего в природе существует около 200 пептидов, но в построении организма человека участвуют всего 20 основных аминокислот, которые подразделяются на заменимые и незаменимые; иногда встречается и третий вид – полузаменимые (условно заменяемые).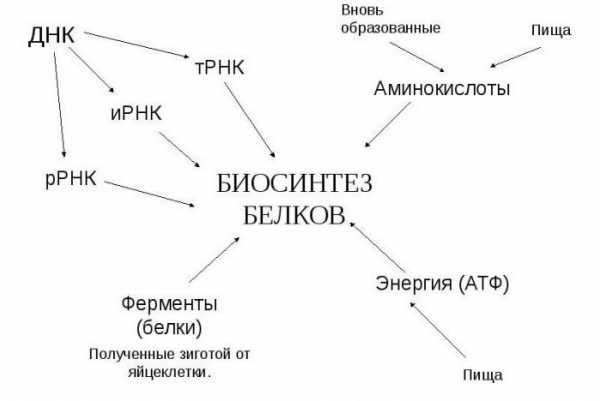
Заменимые аминокислоты
Заменимыми называют те аминокислоты, которые как потребляются с продуктами питания, так и воспроизводятся непосредственно в теле человека из других веществ.
- Аланин – мономер большого числа биологических соединений и белков. Осуществляет один из главенствующих путей глюкогенеза, то есть в печени превращается в глюкозу, и наоборот. Высокоактивный участник метаболических процессов в организме.
- Аргинин – АМК, способная синтезироваться в организме взрослого, но не способная к синтезу в теле ребёнка. Содействует выработке гормонов роста и других. Единственный переносчик азотистых соединений в организме. Содействует увеличению мышечной массы и уменьшению жировой.
- Аспарагин – пептид, участвующий в азотном обмене. В ходе реакции с ферментом аспарагиназой отщепляет аммониак и превращается в аспарагиновую кислоту.
- Аспарагиновая кислота – принимает участие в создании иммуноглобулина, деактивирует аммиак. Необходим при сбоях в работе нервной и сердечно-сосудистой систем.
- Гистидин – используется для профилактики и лечения болезней ЖКТ; оказывает положительную динамику при борьбе со СПИДом. Уберегает организм от пагубного воздействия стресса.
- Глицин – нейромедиаторная аминокислота. Применяется в качестве мягкое успокоительное и антидепрессивное средство. Усиливает действие некоторых ноотропных препаратов.
- Глутамин – в большом объёме входит в состав гемоглобина. Активатор процессов восстановления тканей.
- Глутаминовая кислота – обладает нейромедиаторным действием, а также стимулирует метаболические процессы в ЦНС.
- Пролин – является одним из составляющих практически всех протеинов. Им особенно богаты эластин и коллаген, отвечающие за эластичность кожи.
- Серин – АМК, что содержится в нейронах головного мозга, а также способствует выделению большого количества энергии. Является производной глицина.
- Тирозин – составляющая тканей животных и растений. Может воспроизводиться из фенилаланина под действием фермента фенилаланингидроксилазы; обратного процесса не происходит.
- Цистеин – один из компонентов кератина, отвечающего за упругость и эластичность волос, ногтей, кожи. Ещё он является антиоксидантом. Может производиться из серина.
Аминокислоты, не способные к синтезу в организме, – незаменимые
Незаменимыми аминокислотами называют те, которые не способные генерироваться в организме человека и способны поступать только с продуктами питания.
- Валин – АМК, которая содержится практически во всех белках. Повышает координацию мышц и снижает чувствительность организма к температурным перепадам. Поддерживает гормон серотонин на высоком уровне.
- Изолейцин – естественный анаболик, который в процессе окисления насыщает энергией мышечную и мозговую ткани.
- Лейцин – аминокислота, улучшающая метаболизм. Является своеобразным «строителем» структуры белка.
- Эти три АМК входят в так называемый комплекс BCAA, особо востребованный среди спортсменов. Вещества этой группы выступают в качестве источника для увеличения объема мышечной массы, уменьшения жировой массы и поддержания хорошего самочувствия при особо интенсивных физических нагрузках.
- Лизин – пептид, ускоряющий регенерацию тканей, выработку гормонов, ферментов и антител. Отвечает за прочность сосудов, содержится в мышечном белке и коллагене.
- Метионин – пронимает участие в синтезе холина, недостаток которого может привести к усиленному накоплению жира в печени.
- Треонин – придает эластичность и силу сухожилиям. Очень положительно влияет на сердечную мышцу и зубную эмаль.
- Триптофан – поддерживает эмоциональное состояние, так как в организме преобразуется в серотонин. Незаменим при депрессиях и других психологических расстройствах.
- Фенилаланин – улучшает внешний вид кожи, нормализуя пигментацию. Поддерживает психологическое благополучие, улучшая настроение и привнося ясность в мышление.
Другие методы классификации пептидов
С научной стороны 20 незаменимых аминокислот подразделяют, основываясь на полярности их боковой цепи, то есть радикалов. Таким образом, выделяются четыре группы: неполярные, полярные (но не имеющие заряда), положительно заряженные и отрицательно заряженные.
Неполярными являются: валин, аланин, лейцин, изолейцин, метионин, глицин, триптофан, фенилаланин, пролин. В свою очередь, к полярным, имеющим отрицательный заряд относят аспарагиновую и глутаминовую кислоты. Полярными, имеющими положительный заряд, называют аргинин, гистидин, лизин. К аминокислотам, обладающим полярностью, но не имеющим заряда, относят непосредственно цистеин, глутамин, серин, тирозин, треонин, аспарагин.
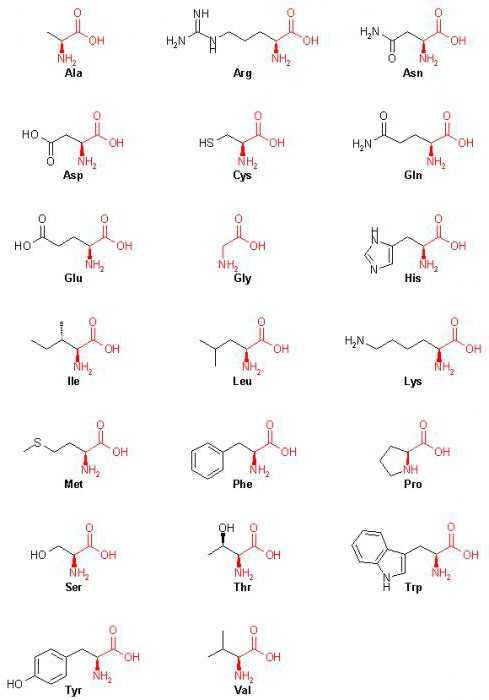
20 аминокислот: формулы (таблица)
| Аминокислота | Аббревиатура | Формула |
Аланин | Ala, A | C3H7NO2 |
Аргинин | Arg, R | C6h24N4O2 |
Аспарагин | Asn, N | C4H8N2O3 |
Аспарагиновая кислота | Asp, D | C4H7NO4 |
Валин | Val, V | C5h21NO2 |
Гистидин | His, H | C6H9N3O2 |
Глицин | Gly, G | C2H5N1O2 |
Глутамин | Gln, Q | С5Н10N2O3 |
Глутаминовая кислота | Glu, E | C5H9NO4 |
Изолейцин | Ile, I | C6h23O2N |
Лейцин | Leu, L | C6h23NO2 |
Лизин | Lys, K | C6h24N2O2 |
Метионин | Met, M | C5h21NO2S |
Пролин | Pro, P | C5H7NO3 |
Серин | Ser, S | C3H7NO3 |
Тирозин | Tyr, Y | C9h21NO3 |
Треонин | Thr, T | C4H9NO3 |
Триптофан | Trp, W | C11h22N2O2 |
Фенилаланин | Phe, F | C9h21NO2 |
Цистеин | Cys, C | C3H7NO2S |
Основываясь на этом, можно отметить, что все 20 аминокислот (формулы в таблице выше) имеют в своем составе углерод, водород, азот и кислород.
Аминокислоты: участие в жизнедеятельности клетки
Аминокарбоновые кислоты участвуют в биологическом синтезе белка. Биосинтез белка – процесс моделирования полипептидной («поли» – много) цепи из остатков аминокислот. Протекает процесс на рибосоме – органелле внутри клетки, отвечающей непосредственно за биосинтез.
Информация считывается с участка цепи ДНК по принципу комплементарности (А-Т, Ц-Г), при создании м-РНК (матричная РНК, или и-РНК – информационная РНК – тождественно равные понятия) азотистое основание тимин заменяется на урацил. Далее всё по тому же принципу создается т-РНК (транспортная РНК), переносящая молекулы аминокислот к месту синтеза. Т-РНК закодирована триплетами (кодонами) (пример: УАУ), и если знать, какими азотистыми основаниями представлен триплет, можно узнать, какую именно аминокислоту он переносит.
Группы продуктов питания с наибольшим содержанием АМК
В молочных продуктах и яйцах содержатся такие важные вещества, как валин, лейцин, изолейцин, аргинин, триптофан, метионин и фенилаланин. Рыба, белое мясо обладают высоким содержанием валина, лейцина, изолейцина, гистидина, метионина, лизина, фенилаланина, триптофана. Бобовые, зерновые и крупы богаты на валин, лейцин, изолейцин, триптофан, метионин, треонин, метионин. Орехи и различные семена насытят организм треонином, изолейцином, лизином, аргинином и гистидином.
Ниже приведено содержание аминокислот в некоторых продуктах.
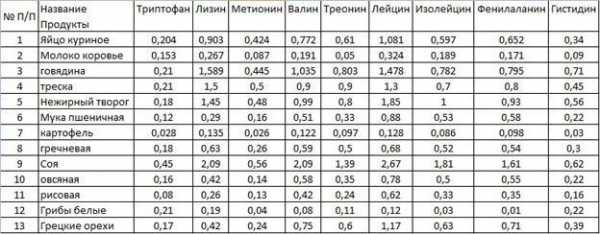
Наибольшее количество триптофана и метионина можно обнаружить в твёрдом сыре, лизина – в мясе кролика, валина, лейцина, изолейцина, треонина и фенилаланина – в сое. При составлении рациона, основанного на поддержании АМК в норме, стоит обратить внимание на кальмаров и горох, а наиболее бедными в плане содержания пептидов можно назвать картофель и коровье молоко.
Нехватка аминокислот при вегетарианстве
То, что существуют такие аминокислоты, которые содержатся исключительно в продуктах животного происхождения, – миф. Более того, учёные выяснили, что белок растительного происхождения усваивается человеческим организмом лучше, чем животного. Однако при выборе вегетарианства как стиля жизни очень важно следить за рационом. Основная проблема такова, что в ста граммах мяса и в таком же количестве бобов содержится разное количество АМК в процентном соотношении. На первых порах необходимо вести учёт содержания аминокислот в потребляемой пище, затем уже это должно дойти до автоматизма.
Какое количество аминокислот нужно потреблять в день
В современном мире абсолютно во всех продуктах питания содержатся нужные для человека питательные вещества, поэтому не следует переживать: все 20 белковых аминокислот благополучно поступают с пищей, и этого количества хватает для человека, ведущего обычный образ жизни и хоть немного следящего за своим питанием.

Рацион спортсмена же необходимо насыщать белками, потому что без них просто невозможно построение мышечной массы. Физические упражнения ведут к колоссальному расходу запаса аминокислот, поэтому профессиональные бодибилдеры вынуждены принимать специальные добавки. При интенсивном построении мышечного рельефа количество белков может доходить до ста граммов белков в день, но такой рацион не подходит для ежедневного потребления. Любая добавка к пище подразумевает инструкцию с содержанием разных АМК в дозе, с которой перед применением препарата необходимо ознакомиться.
Влияние пептидов на качество жизни обычного человека
Потребность в белках присутствует не только у спортсменов. Например, белки эластин, кератин, коллаген влияют на внешний вид волос, кожи, ногтей, а также на гибкость и подвижность суставов. Ряд аминокислот влияет на метаболические процессы в организме, сохраняя баланс жира на оптимальном уровне, предоставляют достаточное количество энергии для повседневной жизни. Ведь в процессе жизнедеятельности даже при самом пассивном образе жизни затрачивается энергия, хотя бы для осуществления дыхания. Вдобавок невозможна и когнитивная деятельность при нехватке определенных пептидов; поддержание психоэмоционального состояния осуществляется в том числе за счет АМК.
Аминокислоты и спорт
Диета профессиональных спортсменов предполагает идеально сбалансированные питание, которое помогает поддерживать мышцы в тонусе. Очень облегчают жизнь аминокислотные комплексы, разработанные специально для тех спортсменов, которые работают на набор мышечной массы.
Как уже писалось ранее, аминокислоты – основной строительный материал белков, необходимых для роста мышц. Также они способны ускорять метаболизм и сжигать жир, что тоже важно для красивого мышечного рельефа. При усердных тренировках необходимо увеличивать потребление АМК ввиду того, что они увеличивают скорость наращивания мышц и уменьшают боли после тренировок.
20 аминокислот в составе белков могут потребляться как в составе аминокарбоновых комплексов, так и из пищи. Если выбирать сбалансированное питание, то нужно учитывать абсолютно все граммовки, что трудно реализовать при большой загруженности дня.
Что происходит с организмом человека при нехватке или переизбытке аминокислот
Основными симптомами нехватки аминокислот считаются: плохое самочувствие, отсутствие аппетита, ломкость ногтей, повышенная утомляемость. Даже при нехватке одной АМК возникает огромное количество неприятных побочных эффектов, которые значительно ухудшают самочувствие и продуктивность.
Перенасыщение аминокислотами может повлечь за собой нарушения в работе сердечно-сосудистой и нервной систем, что, в свою очередь, не менее опасно. В свой черед могут появиться симптомы, схожие с пищевым отравлением, что тоже не влечет за собой ничего приятного.
Во всем надо знать меру, поэтому соблюдение здорового образа жизни не должно приводить к переизбытку тех или иных «полезных» веществ в организме. Как писал классик, «лучшее – враг хорошего».
В статье мы рассмотрели формулы и названия всех 20 аминокислот, таблица содержания основных АМК в продуктах приведена выше.
Source: fb.ru
marmolesreynoso.com
Аминокислоты | Биология
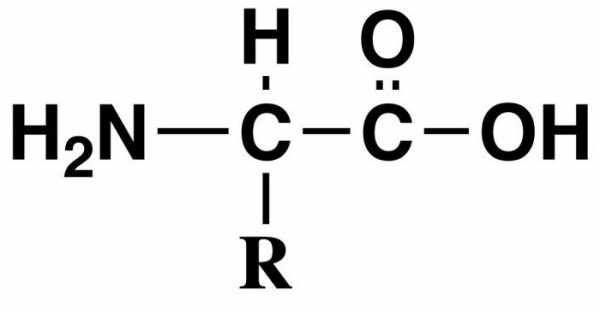
АМИНОКИСЛОТЫ, низкомолекулярные органические соединения, содержащие одну или две карбоксильные группы (—СООН) и одну или две аминогруппы (—NH 2 ). Аминокислоты широко представлены в клетках и тканях живых организмов. Общая формула важнейших природных аминокислот
где радикал R может быть водородом (как в случае простейшей аминокислоты глицина), метильной группой – СН 3 (как у аланина) или обладать более сложным строением.
Поскольку аминокислоты амфотерны, т. е. обладают свойствами и кислот, и оснований, они вступают в реакции друг с другом. Атом углерода карбоксильной группы одной аминокислоты соединяется с атомом азота аминогруппы другой с образованием т. н. пептидной связи, при этом отщепляется вода.
Если соединяются две аминокислоты, образуется дипептид, если три – трипептид, если 20 и более аминокислот – полипептид (см. Пептиды ). В живых организмах встречается ок. 150 аминокислот, но только 20 из них участвуют в построении полипептидных цепей белков – трансляции. Последовательность аминокислот в синтезирующейся полипептидной цепи определяется генетическим кодом.
Из 20 необходимых для построения белков аминокислот в организме животных и человека синтезируются из более простых веществ лишь т. н. заменимые аминокислоты. Остальные – незаменимые аминокислоты – должны поступать с пищей. У разных животных набор незаменимых аминокислот различен. Для человека это 8 аминокислот – валин, лейцин, лизин, метионин и др. Отсутствие или недостаток одной или нескольких незаменимых аминокислот в организме человека приводит к нарушениям обмена веществ и различным заболеваниям. Растения и хемосинтезирующие микроорганизмы сами синтезируют все необходимые аминокислоты.
Помимо построения белков аминокислоты (в т. ч. не входящие в белки) служат исходными веществами при синтезе в клетках витаминов, азотистых оснований, медиаторов и других биологически активных соединений.
Аминокислоты используются в медицине, в качестве пищевых добавок, для обогащения кормов и для других целей. В промышленных масштабах их получают путём микробиологического синтеза (см. Биотехнология ).
При изучении возможных путей возникновения жизни ряд аминокислот был получен при пропускании электрических разрядов через смесь газов, воссоздающих первичную атмосферу Земли. Таким образом была показана возможность абиогенного (без участия организмов) синтеза важнейших органических соединений.
ebiology.ru
Аминокислота | Формула | Сокращение | |
3-х букв. | 1 букв. | ||
Алифатические аминокислоты Моноаминомонокарбоновые кислоты | |||
1. Глицин (гликокол) аминоуксусная кислота | Gly | G | |
| 2. Аланин, -амино-пропионовая кислота | Ala | A | |
| 3. Валин, -амино-изовалериановая кислота | Val | V | |
| 4. Лейцин, -амино-изокапроновая кислота | Leu | L | |
| 5.
Изолейцин, -амино- изокапроновая кислота | Ile | I | |
| 6. Серин, -амино- -гидроксипропионовая кислота | Ser | S | |
| 7. Треонин, -амино— -гидроксимасляная кислота | Thr | T | |
Диаминомонокарбновые кислоты | |||
| 8. Лизин, , ,-диаминокапроновая кислота | Lys | K | |
9.
Гидрокси- | Hyl | ||
| 10.
Аргинин, -амино-
-гуаниди- валериановая кислота | Arg | R | |
| Моноаминодикарбоновые кислоты и их амиды | |||
| 11. Аспарагиновая кислота, -аминоянтарная кислота | Asp | D | |
12. Аспарагин, | Asn | N | |
| 13.
Глутаминовая кислота, -амино- глутаровая кислота | Glu | E | |
13. Глутамин, | Q | ||
Серусодержащие аминокислоты | |||
| 14. Цистеин, -амино—тиопропионовая кислота | Cys | C | |
15. Цистин (модификация цистеина) | Cys | C | |
| 16. Метионин, -амино- -тиометил-масляная кислота | Met | M | |
| 17.
Фенилаланин, -амино-
-фенил- пропионовая кислота | Phe | F | |
| 18.
Тирозин, пара-гидроксифенил- аланин | Tyr | Y | |
| 19. Триптофан, -амино—индолил-пропионовая кислота | Try, Trp | W | |
| 20.
Гистидин, -амино—имида-золилпропионовая кислота | His | H | |
Иминокислоты | |||
| 21. Пролин | Pro | P | |
belok-s.narod.ru
Лекция № 16. Аминокислоты. Пептиды
Лекция № 1765
АМИНОКИСЛОТЫ. ПЕПТИДЫ
План
Лекция № 16
АМИНОКИСЛОТЫ. ПЕПТИДЫ
План
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав белков.
- Пептиды
Аминокислоты – гетерофункциональные соединения, содержащие
карбоксильную и аминогруппы. По взаимному расположению функциональных групп
различают a -,b -, g — и т.д. аминокислоты.
Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
1. Методы получения
!) Аммонолиз галогензамещенных кислот.
Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при
взаимодействии альдегида с HCN и NH3 c последующим гидролизом его в аминокислоту. В качестве
реагента применяют смесь NaCN и NH4Cl.
Метод применим для синтеза только a -аминокислот.
3) Восстановительное аминирование
оксокислот
4) Присоединение аммиака к a ,b -непредельным карбоновым кислотам.
Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетонов
перегруппировкой Бекмана.
Метод используется для синтеза w -аминокислот.
2. Химические
свойства
Аминокислоты дают реакции, характерные для карбоксильной
и аминогрупп, и, кроме того, проявляют специфические свойства, которые
определяются наличием двух функциональных групп и их взаимным
расположением.
2.1. Кислотно-основные
свойства
Аминокислоты содержат кислотный и основный
центры и являются амфотерными соединениями. В кристаллическом состоянии они
существуют в виде внутренних солей (биполярных ионов), которые образуются в
результате внутримолекулярного переноса протона от более слабого основного
центра (СОО—) к более сильному
основному центру (NH2).
Ионное строение аминокислот подтверждается их
физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с
высокими температурами плавления. Они нерастворимы в неполярных органических
растворителях и растворимы в воде. Их молекулы обладают большими дипольными
моментами.
Форма существования аминокислот в водных
растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и
существуют преимущественно в виде катионов. В щелочной среде биполярный ион
отдает протон и превращается в анион.
При некотором значении рН, строго определенном
для каждой аминокислоты, она существует преимущественно в виде биполярного иона.
Это значение рН называют изоэлектрической точкой (рI). В
изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей
растворимостью в воде. Катионная форма аминокислоты содержит два кислотных
центра (COOH и NH3+) и
характеризуется двумя константами диссоциации рКа1 и рКа2.
Значение рI определяется по уравнению:
2.2. Реакции по
аминогруппе
Дезаминирование
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам
взаимодействуют с азотистой кислотой с выделением азота. При этом происходит
замещение аминогруппы на гидроксильную.
RCH(NH2)COOH + HNO2® RCH(OH)COOH + N2 + H2O
Реакция используется для количественного
определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и
арилирование
При взаимодействии аминокислот с избытком
алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются
внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом
(ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в
активированном ароматическом кольце.
Реакция используется для установления
аминокислотной последовательности в пептидах.
Ацилирование
Аминокислоты взаимодействуют с ангидридами и
хлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы в
синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно,
гидролизуются в жестких условиях. При разработке методов синтеза пептидов были
найдены защитные группы, которые легко удаляются путем гидролиза или
гидрогенолиза.
Карбобензоксизащита:
трет-Бутоксикарбонильная защита
(БОК-защита).
Легкость снятия защиты обусловлена устойчивостью
бензил- и трет-бутил-катионов, которые образуются в качестве
интермедиатов.
2.3. Реакции по карбоксильной
группе
Декарбоксилирование
При сухой перегонке в присутствии гидроксида
бария аминокислоты декарбоксилируются с образованием аминов.
Этерификация
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как
катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры
– легко летучие соединения и могут быть разделены путем перегонки или
газожидкостной хроматографии, что используется для анализа и разделения смесей
аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и
ангидридов
При действии на защищенные по аминогруппе
аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной
группы при нуклеофильном замещении. Чаще для этой цели получают смешанные
ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в
синтезе пептидов.
2.4. Специфические реакции
аминокислот
Реакции с одновременным участием карбоксильной и
аминогрупп идут, как правило, с образованием продуктов, содержащих
термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
Комплексообразование
a -Аминокислоты
образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr
и др.).
Отношение аминокислот к
нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения
карбоксильной и аминогруппы и определяются возможностью образования
термодинамически стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты
вступают в реакцию межмолекулярного самоацилирования. При этом образуются
циклические амиды – дикетопиперазины.
b -Аминокислоты при
нагревании переходят a ,b -непредельные кислоты.
g — и d -Аминокислот претерпевают
внутримолекулярное ацилирование с образованием циклических амидов – лактамов.
Нингидриновая реакция
При взаимодействии a -аминокислот с трикетоном – нингидрином происходит одновременное окислительное
дезаминирование и декарбоксилирование с образованием альдегида и окрашенного
продукта конденсации.
Реакция используется для количественного анализа
аминокислот методом фотометрии.
- a -Аминокислоты,
входящие в состав белков
3.1. Строение и
классификация
Природные аминокислоты отвечают общей формуле RCH(NH2)COOH и отличаются строением радикала R. Формулы и
тривиальные названия важнейших аминокислот приведены в таблице. Для
биологического функционирования аминокислот в составе белков определяющим
является полярность радикала R. По этому признаку аминокислоты разделяют на
следующие основные группы (см. таблицу).
Таблица. Важнейшие a -аминокислоты
RCH(NH2)COOH
Формула | Название | Обозначение | pI |
Аминокислоты, содержащие неполярный радикал R | |||
Глицин | Gly | 5,97 | |
Аланин | Ala | 6,0 | |
Валин | Val | 5,96 | |
Лейцин | Leu | 5,98 | |
Изолейцин | Ile | 6,02 | |
Фенилаланин | Phe | 5,48 | |
Триптофан | Trp | 5,89 | |
Пролин | Pro | 6,30 | |
Метионин | Met | 5,74 | |
Цистин | (Cys)2 | 5,0 | |
Аминокислоты, содержащие полярный неионогенный радикал R | |||
Серин | Ser | 5,68 | |
Треонин | Thr | 5,60 | |
Гидроксипролин | Hyp | 5,8 | |
Аспаргин | Asn | 5,41 | |
Глутамин | Gln | 5,65 | |
Аминокислоты, содержащие полярный положительно заряженный радикал R | |||
Лизин | Lys | 9,74 | |
5-Гидроксилизин | 9,15 | ||
Аргинин | Arg | 10,76 | |
Гистидин | His | 7,59 | |
Аминокислоты, содержащие полярный отрицательно заряженный радикал R | |||
Аспаргиновая кислота | Asp | 2,77 | |
Глутаминовая кислота | Gly | 3,22 | |
Тирозин | Tyr | 5,66 | |
Цистеин | Cys | 5,07 | |
Аминокислоты, содержащие неполярный радикал
R. Такие группы располагаются внутри
молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный
неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не
способные к ионизации в водной среде (спиртовый гидроксил, амидная группа).
Такие группы могут располагаться как внутри, так и на поверхности молекулы
белка. Они участвуют в образовании водородных связей с другими полярными
группами.
Аминокислоты, содержащие радикал R, способный
к ионизации в водной среде с образованием положительно или отрицательно
заряженных групп. Такие аминокислоты содержат в боковом радикале
дополнительный основный или кислотный центр, который в водном растворе может
соответственно присоединять или отдавать протон.

В белках ионогенные группы этих аминокислот
располагаются, как правило, на поверхности молекулы и обуславливают
электростатические взаимодействия.
3.2.
Стереоизомерия.
Все природные a-аминокислоты (кроме глицина)
являются хиральными соединениями. По конфигурации хирального центра в положении
2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся к
L-ряду.
Большинство аминокислот содержат один хиральный
центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин,
гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют
(кроме цистина) 4 стереоизомера, из которых только один встречается в составе
белков.
Так, из 4-х стереоизомеров треонина в
природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только
одного вида стереоизомеров имеет важное значение для формирования их
пространственной структуры и обеспечения биологической активности.
a -Аминокислоты,
полученные синтетическим путем, представляют рацемические смеси, которые
необходимо разделять. Наиболее предпочтительным является ферментативный способ
разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные
производные только L-a -аминокислот. Ферментативное расщепление проводят по
следующей схеме.
Сначала рацемическую аминокислоту ацилируют
уксусным ангидридом:
Затем рацемическую смесь ацетильных производных
подвергают ферментативной обработке. При этом гидролизуется ацетильное
производное только L-аминокислоты:
Полученная после ферментативного смесь легко
разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в
щелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основные
свойства.
По кислотно-основным свойствам аминокислоты
разделяют на три группы.
Нейтральные аминокислоты не содержат в
радикале R дополнительных кислотных или основных центров, способных к ионизации
в водной среде. В кислой среде они существуют в виде однозарядного катиона и
являются двухосновными кислотами по Бренстеду. Как видно на примере аланина,
изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале
5,5 – 6,3.
pI=1/2(2,34+9,69)=6,01
Основные аминокислоты содержат в
радикале R дополнительный основный центр. К ним относятся лизин, гистидин и
аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными
кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере
лизина, лежит в области рН выше 7.
pI= 1/2(9,0+10,05)=9,74
Кислые аминокислоты содержат в
радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и
глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются
трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области
рН много ниже 7.
pI= 1/2(2,09+3,86)=2,77
Тирозин и цистеин содержат в боковых радикалах
слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при
физиологическом значении рН (~7) ни одна аминокислота не находится в
изоэлектрической точке. В организме все аминокислоты ионизированы, что
обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах
используется для разделения аминокислот методом электрофореза и ионообменной
хроматографии. При данном значении рН разные аминокислоты могут иметь разный по
величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и
движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а
аланин находится в изоэлектрической точке и не перемещается в электрическом поле. Таким образом при рН6 они могут быть
разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной
хроматографии используют катионообменные смолы (сульфированный полистирол).
Процесс ведут в кислой среде, когда аминокислоты находятся катионной
форме.
Скорость продвижения аминокислот по
хроматографической колонке зависит от силы их электростатических и гидрофобных
взаимодействий со смолой. Наиболее прочно связываются со смолой основные
аминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислые
аминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислоты
с неполярными боковыми радикалами, особенно ароматическими. Таким образом,
порядок элюирования аминокислот следующий. Легче других элюируются кислые
аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные
неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются
аминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и в
последнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
3.4. Реакции аминокислот in
vivo
Восстановительное аминирование – метод
синтеза a -аминокислот из a -оксокислот при участии кофермента НАД Н в качестве
восстанавливающего реагента.
Трасаминирование – основной
путь биосинтеза аминокислот. При трансаминировании происходит взаимообмен двух
функциональных групп – аминной и карбонильной между аминокислотой и кетокилотой.
При этом нужная для организма аминокислота 1 синтезируется из аминокислоты 2,
имеющейся в клетках в избыточном коичестве. Реакция осуществляется при участии
ферментов трансаминаз и кофермента пиридоксальфосфата.
Содержащий альдегидную группу пиридоксальфосфат
служит переносчиком аминогруппы в виде основания Шиффа.
Декарбоксилирование
Аминокислоты декарбоксилируются под действием
ферментов декарбоксилаз при участи кофермента пиридоксальфосфата. При этом
образуются биогенные амины.
Биогенные амины обладают ярко выраженной
биологической активностью. Важнейшими из них являются — коламин (предшественник
в синтезе холина и нейромедиатора ацетилхолина), гистамин (обеспечивает
аллергические реакции организма), g -аминомасляная кислота (нейромедиатор), адреналин
(гормон надпочечников, нейромедиатор)
Дезаминирование
Неокислительное дезаминирование происходит путем
отщепления аммиака под действием ферментов с образованием a ,b -непредельных кислот.
Окислительное дезаминирование происходит
при участии ферментов оксидаз и кофермента НАД+, который выступает в качестве окислителя. В результате
выделяется аммиак и образуется соответствующая кетокислота.
С помощью реакций дезаминирования снижается
избыток аминокислот в организме.
4. Пептиды
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в
молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д.
Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами.
Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
4.1. Строение
пептидов
Формально пептиды можно рассматривать как продукты поликонденсации
аминокислот.
Аминокислотные остатки в пептиде связаны
амидными (пептидными) связями. Один конец цепи, на котором находится
аминокислота со свободной аминогруппой, называют N-концом. Другой конец,
на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с
N-конца.
Название пептида строят на основе тривиальных
названий, входящих в его состав аминокислотных остатков, которые перечисляют,
начиная с N-конца. При этом в названиях всех аминокислот за исключением
С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения
пептидов используют трехбуквенные обозначения входящих в его состав
аминокислот.
Пептид характеризуется аминокислотным
составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть
установлен путем полного гидролиза пептида (расщепления до аминокислот) с
последующим качественным и количественным анализом образовавшихся аминокислот
методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот.
Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н.
HCl.
Одному и тому же аминокислотному составу
отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено
2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот
n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают
следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val
Ala-Val-Glu
Таким образом, для полной характеристики пептида
необходимо знать его аминокислотный состав и аминокислотную
последовательность.
4.2. Определение аминокислотной
последовательности
Для определения аминокислотной
последовательности используют комбинацию двух методов: определение концевых
аминокислот и частичный гидролиз.
Определение N-концевых
аминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а
затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют
ДНФ-производное N-концевой аминокислоты.

Метод Эдмана состоит во
взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде.
При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от
цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ)
производного.

Преимущество этого метода состоит в том, что при
отщеплении N-концевой аминокислоты пептид не разрушается и операцию по
отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе –
секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления,
идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной
хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с
образованием более коротких цепей. Частичный гидролиз проводят с помощью
ферментов, которые гидролизуют пептидные связи избирательно, например, только с
N-конца (аминопептидазы) или только с С-конца (карбоксипептидазы).
Существуют ферменты, расщепляющие пептидные связи только между определенными
аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные
фрагменты, которые перекрываются по составляющим их аминокислотным остаткам.
Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного
пептида. Рассмотрим простейший пример установления структуры трипептида.
Частичный гидролиз по двум разным направлениям трипептида неизвестного строения
дает продукты представленные на схеме.
Единственный трипептид, структура которого не
противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности
пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная
задача, которая требует комбинации различных методов.
4.3. Синтез
петидов
Синтез пептида с заданной аминокислотной
последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза
дипептида из 2-х разных аминокислот возможно образование 4-х разных
продуктов.
В настоящее время разработана стратегия синтеза
пептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтеза
дипептида включает следующие стадии:
- защита аминогруппы N-концевой
аминокислоты; - активация карбоксильной группы N-концевой
аминокислоты; - конденсация модифицированных
аминокислот - снятие защитных групп

Таким образом, последовательно присоединяя
аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень
длителен, трудоемок и дает низкий выход конечного продукта. Основные потери
связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее
время твердофазный синтез пептидов. На первой стадии защищенная по
аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе
(полистироле, модифицированном введением групп –CH2Cl). После снятия защиты проводят ацилирование
аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая
содержит активированную карбоксильную и защищенную аминогруппу. После снятия
защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей
проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с
носителя действием бромистоводородной кислоты. Твердофазный синтез
автоматизирован и проводится с помощью приборов – автоматических
синтезаторов.
;
Методом твердофазного синтеза получено большое
количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе
инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных
остатка).
studentik.net
