Классификация аминокислот | Химия онлайн
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных группВ зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
2. Полярные незаряженные
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
3. Заряженные отрицательно при рН-7 (кислые)
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.
В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствамВ зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных группАминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:
VI.
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
Кислые аминокислота — Большая Энциклопедия Нефти и Газа, статья, страница 2
Кислые аминокислота
Cтраница 2
Нейтральными называют аминокислоты, боковые цепи которых имеют нейтральный характер; у кислых аминокислот боковые цепи содержат карбоксильные группы; у основных — группы, обладающие основными свойствами. [16]
Нейтральными называют аминокислоты, боковые цепи которых имеют нейтральный характер; у кислых аминокислот боковые цепи содержат карбоксильные группы; у основных — группы, обладающие основными свойствами. [17]
[17]
По сравнению с фенолом в крезолах уменьшаются и сближаются между собой значения Rt кислых аминокислот, однако лучше разделяются соединения с высоким значением R. Иногда рекомендуют применять 80 % — ную масляную или изомасляную кислоты, так как они не образуют являющийся помехой цветной фронт. О добавках органических кислот к спиртовым растворителям будет сказано ниже. [18]
Многие авторы [25, 28, 33, 35] исследовали возможность использования ионного обмена для разделения аминокислот на три группы: кислые аминокислоты, извлекающиеся из раствора кислыми смолами; основные аминокислоты, извлекающиеся катионньши обменниками, и нейтральные аминокислоты, которые, как можно ожидать, не будут извлекаться обменными адсорбентами. [19]
Этот факт противоречит сообщению Фрейденберга и его сотрудников [21], согласно которому только нейтральные или кислые аминокислоты могут быть отделены от оснований с помощью водного раствора пиридина.
Белки свеклы имеют кислотные свойства ( точка коагуляции при рН 3 5), содержат больше кислых аминокислот — глутаминовую, аспарагиновую и др. Они гидролизу-ют с образованием низкомолекулярных пептидов и аминокислот: аланин; валин, гликокол, лейцин, изолейцин, фенилаланин, — у-аминомасляная, тирозин, серии, треонин, цистин, метионин, пролин, триптофан, аспарагиновая, глу-таминовая, гистидин. [21]
При этом в фильтрат собираются, главным образом, основные аминокислоты с рН 10 — 11, а нейтральные и кислые аминокислоты задерживаются на смоле. Первые промывные воды, доведенные раствором аммиака до рН 5 8, выдерживают при температуре 0 — 5 в течение 3 часов. При этом выпадает в осадок сырой, технический тирозин, а в растворе остаются лейцин, валин и др. Сырой тирозин отфильтровывают и подвергают очистке.
Для анализа аминокислот по классической методике Штейна и Мура используются колонки со смолой Амберлит IR-120 или Дауэкс 50X8, высота слоя которой составляет 150 см для нейтральных и кислых аминокислот, 15 см для основных аминокислот и 50 см для анализа биологических жидкостей. При этом длина стеклянной трубки колонки должна превышать на 5 см высоту слоя смолы. [23]
При рН, характерном для природных вод, катионит сорбирует большинство аминокислот ( глицин, аланин, аргинин, гистидин и др.), а анионит поглощает избирательно только кислые аминокислоты, такие, как глутамин и аспарагин.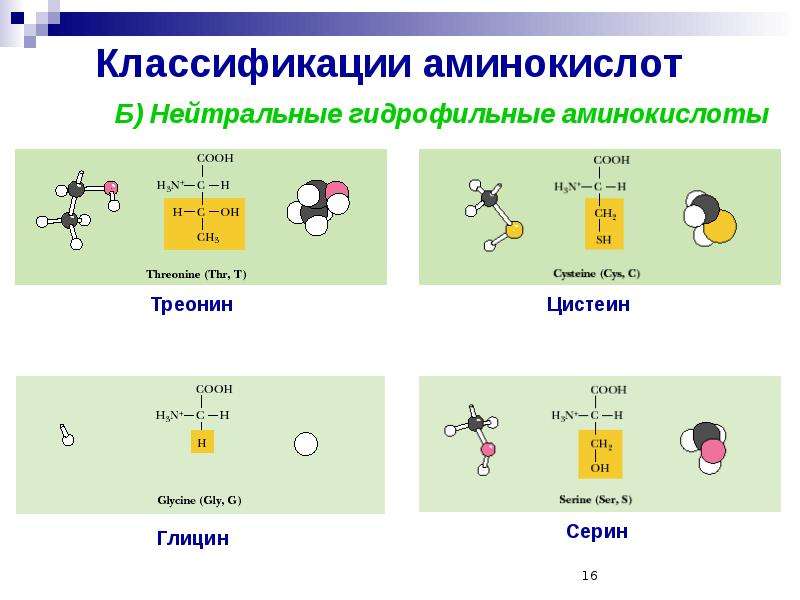 Чисто ионообменный процесс в этих условиях не реализуется, и взаимодействие с ионитами протекает по функциональным группам сорбента за счет образования водородных связей.
[24]
Чисто ионообменный процесс в этих условиях не реализуется, и взаимодействие с ионитами протекает по функциональным группам сорбента за счет образования водородных связей.
[24]
Его аминокислотный, состав включает два остатка метионина ( что ограничивает использование гидрогенолиза в процессе синтеза), два остатка чувствительного к кислотной обработке триптофана и шесть остатков кислых аминокислот. Глициновый остаток в положении 13 служил обычной точкой сшивки, поскольку он представляет собой нерацемизующийся остаток на С-конце одного пептидного фрагмента. Сшивка в точке 5 была выбрана потому, что наличие в этом месте остатка метионина не дает возможности проводить гидрогенолиз в процессе построения нужной последовательности остатков в центре молекулы. [25]
Следует отметить, что аргинин и лизин двигались в сторону катода ( аргинин двигался с большой скоростью), в то время как гистидин с нейтральными аминокислотами своей группы и кислые аминокислоты двигались в соответствии со своими изоэлектри-ческими точками в сторону анода. Объяснить указанное поведение аргинина и лизина нам пока не представляется возможным.
[26]
Объяснить указанное поведение аргинина и лизина нам пока не представляется возможным.
[26]
Элюирование проводят в ступенчатом градиенте. Кислые аминокислоты элюируются кислыми буферными растворами ( рН 2 5 — 3 5), имеющими относительно небольшую ионную силу. В ходе разделения за 3 — 4 приема повышают рН ( до 5 — 8) и ионную силу. Обычно в ходе анализа повышают температуру в несколько ступеней от 35 — 40 до 65 — 80 С. По завершении разделения, которое длится 1 — 2 ч с помощью 0 4, М раствора NaOH проводят регенерацию колонки, после чего уравновешивают ее первым буферным раствором. [27]
Теперь рассмотрим электролиз смеси основных, нейтральных и кислых аминокислот в сосуде, поделенном на три камеры двумя мембранами, расположенными перпендикулярно направлению электрического тока. Кислые аминокислоты концентрируются у анода, нейтральные — в средней части, а основные — в катодной камере. [28]
[28]
Впрочем, величина Rf может изменяться в присутствии постороннего вещества незначительно. Так, например, Rf увеличивается для кислых аминокислот в растворителе и-пропанол — вода ( 70 30), если эти кислоты находятся в смеси с другими аминокислотами. Для смесей ДНФ-аминокислот также установлено значительное влияние на величину Rf соотношения количеств, причем, как это известно из бумажной хроматографии [45], в особенности мешает динитрофенол. [30]
Страницы: 1 2 3 4
Аминокислоты кислые — Справочник химика 21
Натион аминокислоты (кислая среда) [c.409] По методу Пье и Морриса [82] все аминокислоты (кислые, нейтральные и основные) определяются на одной колонке за один цикл анализа с помощью градиентного элюирования. При использовании техники градиентного элюирования отпадает стадия регенерации колонки, необходимая при двухколоночном методе анализа, поскольку все аминокислоты элюируются из колонки . Кроме того, при таком способе анализа не требуются соленоидные клапаны для переключения буферов и отпадает необходимость в некоторых других деталях анализатора (например, в насосах). [c.16]
При использовании техники градиентного элюирования отпадает стадия регенерации колонки, необходимая при двухколоночном методе анализа, поскольку все аминокислоты элюируются из колонки . Кроме того, при таком способе анализа не требуются соленоидные клапаны для переключения буферов и отпадает необходимость в некоторых других деталях анализатора (например, в насосах). [c.16]
Продолжительность полного анализа аминокислот (кислых, нейтральных и основных) удается сократить до 2 ч, если анализ на обеих колонках, короткой и длинной, начинается одновременно. При этом пока идет анализ основных аминокислот на короткой колонке, длинная колонка работает в положении крана на слИв . [c.60]
Для одноколоночного метода анализа всех аминокислот (кислых, нейтральных и основных) используют колонку размером 33,5-0,9 см. Колонку заполняют так, как описано в разд. [c.60]
На основе полученных эмпирических закономерностей можно провести следующий расчет распределения молей аминокислот (кислых, нейтральных и основных) в конце процесса электродиализа по камерам. [c.84]
[c.84]
В этих условиях разделение аминокислот (кислых, нейтральных и основных) происходило за 21 час. В указанной колонке высокого разрешения были проанализированы 186 нингидрин-положительных соединений (рис. 11). Использование чувствительного фотометра, работаюш,его в области 95—100%-го пропускания, уменьшение ширины пиков аминокислот за счет снижения поперечного сечения колонки и уменьшения диаметра частиц смолы позволило анализировать до 10″ моль аминокислот с точностью 5%, при этом максимальная чувствительность составляла 10 моль. [c.159]
Аминокислоты кислого характера и их амиды. В старых работах, по-видимому, имелись противоречии по вопросу о пептидах аспарагиновой и глутаминовой кислот. Более современные технические приемы бумажной хроматографии и противо-точного распределения показали, что в тех .-iyiiaHx, когда [c.189]
Аминокислоты кислого характера поглощаются на сильноосновных ОН-анионитах типа АВ-17, АВ-16.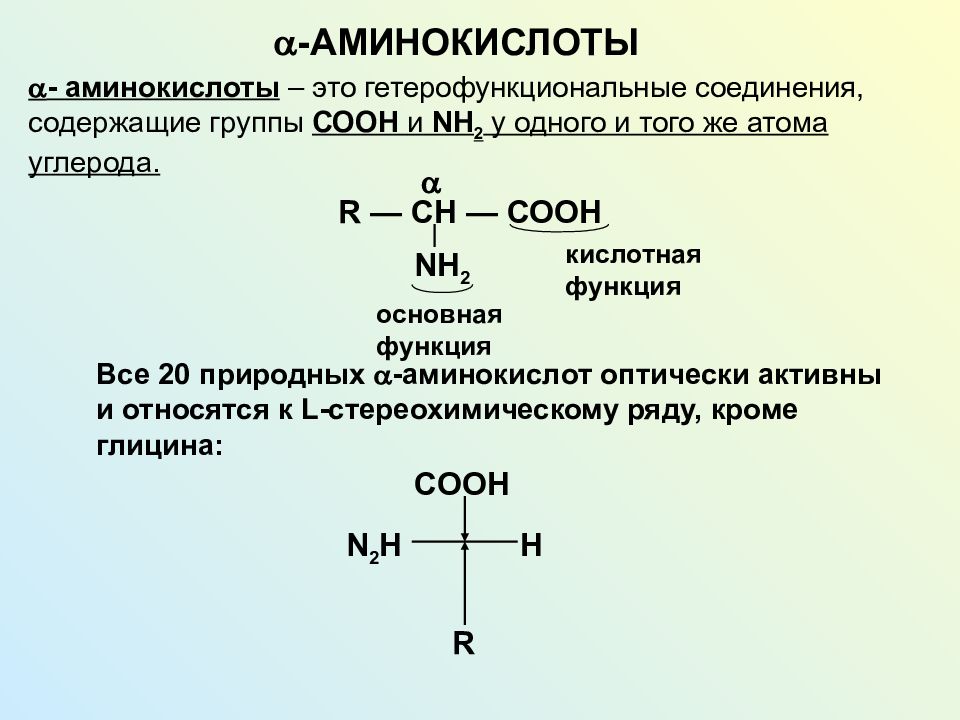 Они также поглощаются слабоосновными анионитами типа АН-2Ф и ЭДЭ-10. На этих анионитах хорошо поглон1аются дикарбоновые аминокислоты, тогда как аминокислоты нейтрального характера практически не поглощаются анионитами и катионитами. [c.191]
Они также поглощаются слабоосновными анионитами типа АН-2Ф и ЭДЭ-10. На этих анионитах хорошо поглон1аются дикарбоновые аминокислоты, тогда как аминокислоты нейтрального характера практически не поглощаются анионитами и катионитами. [c.191]
Акцептором служит кислород L-аминокислота кисло- Оксидаза L-амино- j L-аминокислота+02 род—оксидорадукта- кислот -f HgO = 2-оксокисло- [c.191]
Разделение аминокислот из их смеси производят на катионообменной синтетической смоле типа Во уех50 -Х8. Удобно пользоваться готовыми пластинками типа Р1х1оп50-Х8 (Венгрия), на которые нанесен сильный катионит в натриевой форме. При нанесении образца на пластинку все аминокислоты должны сорбироваться в стартовой позиции путем их обмена с катионом натрия. Следовательно, все аминокислоты в исходной пробе должны быть в форме катионов, что достигается доведением наносимого раствора до pH аминокислот смолой зависит от степени диссоциации основных и кислотных групп аминокислот (т. е. от величины их рК), от числа этих групп в молекуле, от способности к гидрофобным взаимодействиям со смолой и некоторых других условий. Ароматические и основные аминокислоты (арг, гис, лиз, фен, тир), а также лейцин прочно удерживаются на катионите. Для их разделения применяют пропускание нитратного буфера pH 5,25 с концентрацией Ка+ 0,35 моля через слой смолы. В этих условиях все остальные аминокислоты (кислые и нейтральные) приобретают высокую подвижность и идут с фронтом растворителя. Для выявления отдельных аминокислот пластинку опрыскивают раствором нингидрина. Появляются фиолетовые пятна аминокислот, располагающиеся по всей длине пластинки по степени возрастания подвижности аминокислот. Полуколичественная оценка содержания аминокислоты в смеси достигается путем сравнения величины пятна из анализируемого образца с пятном соответствующей стандартной аминокислоты. [c.55]
е. от величины их рК), от числа этих групп в молекуле, от способности к гидрофобным взаимодействиям со смолой и некоторых других условий. Ароматические и основные аминокислоты (арг, гис, лиз, фен, тир), а также лейцин прочно удерживаются на катионите. Для их разделения применяют пропускание нитратного буфера pH 5,25 с концентрацией Ка+ 0,35 моля через слой смолы. В этих условиях все остальные аминокислоты (кислые и нейтральные) приобретают высокую подвижность и идут с фронтом растворителя. Для выявления отдельных аминокислот пластинку опрыскивают раствором нингидрина. Появляются фиолетовые пятна аминокислот, располагающиеся по всей длине пластинки по степени возрастания подвижности аминокислот. Полуколичественная оценка содержания аминокислоты в смеси достигается путем сравнения величины пятна из анализируемого образца с пятном соответствующей стандартной аминокислоты. [c.55]
алифатические, ароматические, гетероциклические. Заменимые и незаменимые α-Аминокислоты.
 Привести примеры.
Привести примеры.α-Аминокислоты — гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
Многие α-аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми
К незаменимым α-аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонин фенилаланин
Алифатические α-аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
• нейтральные аминокислоты — по одной группе Nh3 и СООН;
• основные аминокислоты — две группы Nh3 и одна группа
СООН;
•
кислые
аминокислоты — одна группа Nh3 и две группы
СООН.
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
• гидроксильная — серин, треонин;
• карбоксильная — аспарагиновая и глутаминовая кислоты;
• тиольная — цистеин;
• амидная — аспарагин, глутамин.
Ароматические α-аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН2-.
Гетероциклические
α-аминокислоты. Относящиеся к этой
группе гистидин и триптофан содержат
гетероциклы — имидазол и индол
соответственно. Строение и свойства
этих гетероциклов рассмотрены ниже
(см.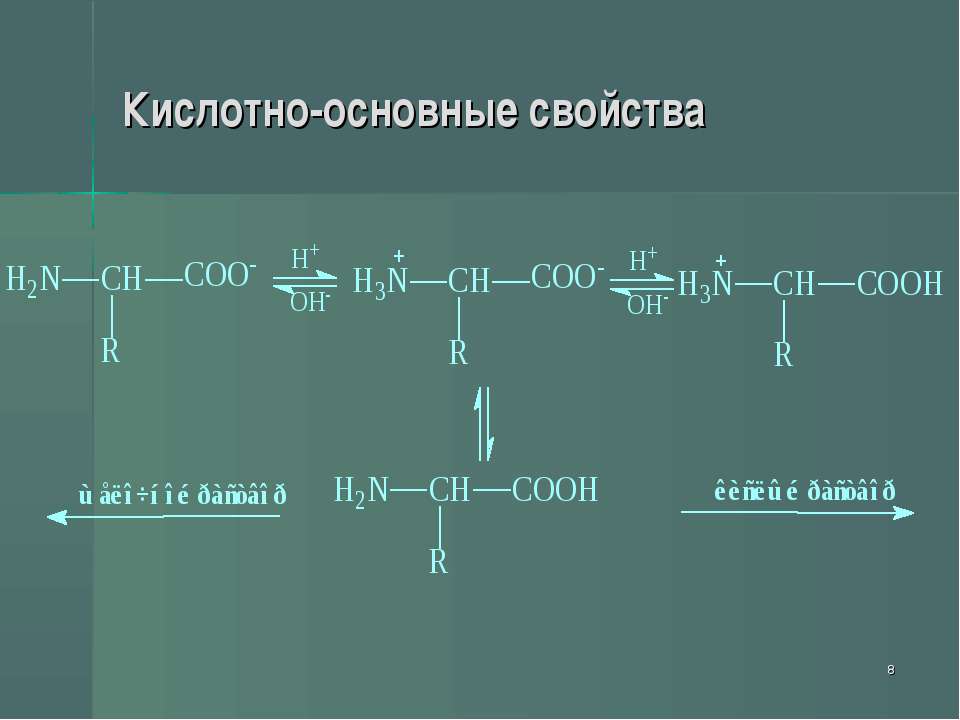 13.3.1; 13.3.2). Общий принцип построения
гетероциклических аминокислот такой
же, как и ароматических.
13.3.1; 13.3.2). Общий принцип построения
гетероциклических аминокислот такой
же, как и ароматических.
Гетероциклические и ароматические α-аминокислоты можно рассматривать как β-замещенные производные аланина.
К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового
18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
Пояснить на конкретном примере.
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (Nh3) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.
В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы h4N+ — CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В
водном растворе аминокислоты существуют
в виде равновесной смеси диполярного
иона, катионной и анионной форм.
Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион- ные — в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200 ?С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
Значение
рН, при котором концентрация диполярных
ионов максимальна, а минимальные
концентрации катионных и анионных форм
аминокислоты равны, называется
изоэлектрической точкой (p/).
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы Nh3. Например, у аланина изоэлектрическая точка находится при рН 6,0.
Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рКа, как это видно на примере аспарагиновой кислоты (р/ 3,0).
У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12.1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные
α-аминокислоты. В случае основных
аминокислот изоэлектрические точки
находятся в области рН выше 7. В сильно-
кислой среде эти соединения также
представляют собой трехосновные кислоты,
этапы ионизации которых показаны на
примере лизина (р/ 9,8).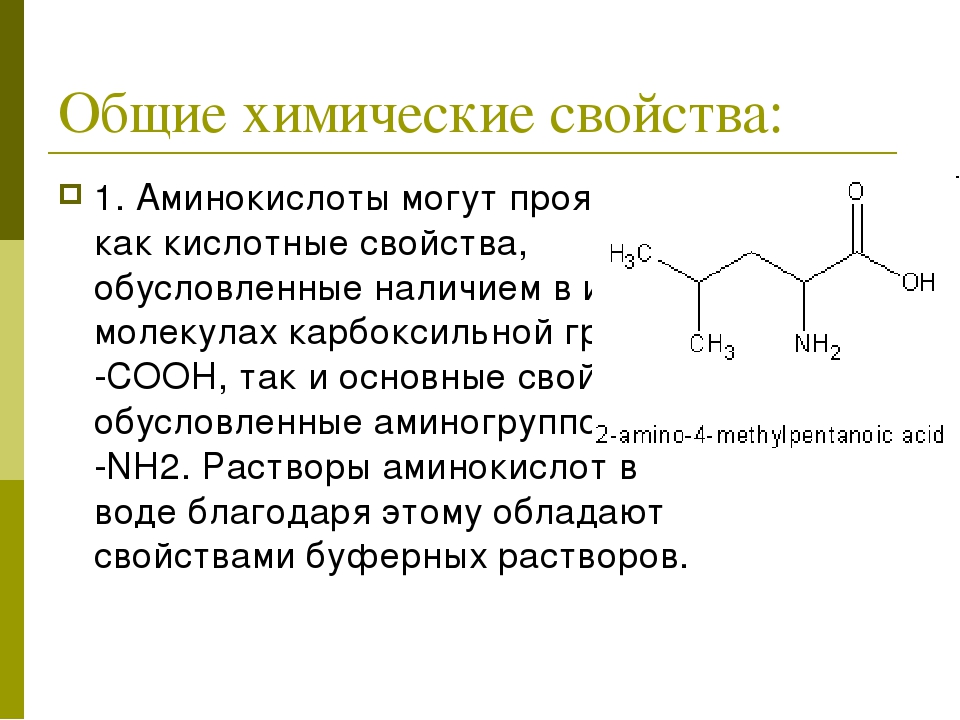
В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α-аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
19. Биологически важные реакции α-Аминокислот: а) трансаминирование; б) декарбоксилирование; в) дезаминирование: окислительное, восстановительное, внутримолекулярное, гидролитическое; г) образование пептидов.
В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким пре- вращениям относятся трансаминирование, декарбоксилирование, элиминирование, альдольное расщепление, окислительное дезаминирование, окисление тиольных групп.
Трансаминирование
является основным путем биосинтеза
α-ами- нокислот из α-оксокислот. Донором
аминогруппы служит аминокислота,
имеющаяся в клетках в достаточном
количестве или избытке, а ее акцептором
— α-оксокислота. Аминокислота при этом
превращается в оксокислоту, а оксокислота
— в аминокислоту с соответствующим
строением радикалов. В итоге
трансаминирование представляет обратимый
процесс взаимообмена амино- и оксо-
групп. Пример такой реакции — получение
l-глутаминовой кислоты из 2-оксоглутаровой
кислоты. Донорной аминокислотой может
служить, например, l-аспарагиновая
кислота.
Аминокислота при этом
превращается в оксокислоту, а оксокислота
— в аминокислоту с соответствующим
строением радикалов. В итоге
трансаминирование представляет обратимый
процесс взаимообмена амино- и оксо-
групп. Пример такой реакции — получение
l-глутаминовой кислоты из 2-оксоглутаровой
кислоты. Донорной аминокислотой может
служить, например, l-аспарагиновая
кислота.
α-Аминокислоты содержат в α-положении к карбоксильной группе электроноакцепторную аминогруппу (точнее, протонированную аминогруппу Nh4+), в связи с чем способны к декарбоксилированию.
Окислительное дезаминирование может осуществляться с участием ферментов и кофермента НАД+ или НАДФ+. α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из l-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегид- рирование (окисление) глутаминовой кислоты до α-иминоглутаровой
кислоты. На второй стадии происходит гидролиз,
в результате которого получаются
α-оксоглутаровая кислота и аммиак.
Стадия гидролиза протекает без участия
фермента.
На второй стадии происходит гидролиз,
в результате которого получаются
α-оксоглутаровая кислота и аммиак.
Стадия гидролиза протекает без участия
фермента.
В обратном направлении протекает реакция восстановительного аминирования α-оксокислот. Всегда содержащаяся в клетках α-оксоглутаровая кислота (как продукт метаболизма углеводов) превращается этим путем в L-глутаминовую кислоту.
Внутримолекулярное дезаминирование
Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в печени и коже.
Гидролитиическое дезаминирование происходит при помощи фермента аденозин дезаминаза и выглядит следующим образом:
R-CH(NH2)-COOH + H2O—-> R-CH(OH)-COOH +NH3
В результате образуются, как мы уже поняли, гидроксикислоты…
Пептидную и белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с обра- зованием пептидной (амидной) связи между мономерными звеньями
20. Аминоспирты: коламин (2-аминоэтанол),
холин. Бетаин как продукт окисления
холина. Строение, биологическая роль.
Аминофенолы. Катехоламины: дофамин,
норадреналин, адреналин. Строение,
биологическая роль.
Аминоспирты: коламин (2-аминоэтанол),
холин. Бетаин как продукт окисления
холина. Строение, биологическая роль.
Аминофенолы. Катехоламины: дофамин,
норадреналин, адреналин. Строение,
биологическая роль.
Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксигруппы.
Эти две функциональные группы непрочно удерживаются у одного атома углерода, в результате чего происходит отщепление аммиака или воды. Простейшим представителем аминоспиртов является 2-аминоэтанол — соединение, в котором обе группы расположены у соседних атомов углерода. 2-Аминоэтанол (тривиальное название коламин) является структурным компонентом сложных липидов — фосфатидилэтаноламинов (см. 10.4.1).
С сильными кислотами 2-аминоэтанол образует устойчивые соли.
Четвертичное аммониевое основание — гидроксид (2-гидрокси- этил)триметиламмония [HOCh3Ch3N+(Ch4)3]OH- — имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. Его катион называют холином
В
организме холин образуется с участием
кофермента S-аде- нозилметионина (SAM),
являющегося переносчиком метильных
групп. В молекуле этого кофермента
метильная группа «активирована»
вследствие того, что находится в составе
сульфониевой группировки.
В молекуле этого кофермента
метильная группа «активирована»
вследствие того, что находится в составе
сульфониевой группировки.
При метилировании коламина в реакции участвует атом азота, более нуклеофильный, чем атом кислорода
В результате окисления холина in vivo образуется диполярный ион бетаин, который также может служить источником метильных групп, входящих в состав аммониевой группировки.
Сложноэфирные производные холина выполняют в организме различные биологические функции. Замещенные фосфаты холина являются структурной основой фосфолипидов — фосфатидилхолинов — важнейшего строительного материала клеточных мембран (см. 10.4.1). Сложный эфир холина и уксусной кислоты — ацетилхолин — наиболее распространенный посредник при передаче нервного возбуждения в нервных тканях (нейромедиатор). Он образуется в организме при ацетилировании холина с помощью ацетилкофермента А
Важная
роль в организме принадлежит аминоспиртам,
содержащим в качестве структурного
фрагмента остаток пирокатехина. Они
носят общее название катехоламинов. К
этой группе относятся представители
образующихся в организме биогенных
аминов. К катехоламинам принадлежат
дофамин, норадреналин и адреналин,
выполняющие, как и ацетилхолин, роль
нейромедиаторов. Адреналин участвует
в регуляции сердечной деятельности,
при физиологических стрессах он
выделяется в кровь («гормон страха»).
Они
носят общее название катехоламинов. К
этой группе относятся представители
образующихся в организме биогенных
аминов. К катехоламинам принадлежат
дофамин, норадреналин и адреналин,
выполняющие, как и ацетилхолин, роль
нейромедиаторов. Адреналин участвует
в регуляции сердечной деятельности,
при физиологических стрессах он
выделяется в кровь («гормон страха»).
В ароматическом ряду основу важных природных биологически активных соединений и синтетических лекарственных средств составляют и-аминофенол, и-аминобензойная, салициловая и сульфаниловая кислоты.
и-Аминофенол и его производные. Как гетерофункциональное соединение п-аминофенол может образовывать производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. Сам п-аминофенол ядовит; интерес для медицины представляет его производное — парацетамол, оказывающий анальгетическое (обезболивающее) и жаропонижающее действие.
АМИНОКИСЛОТЫ • Большая российская энциклопедия
АМИНОКИСЛО́ТЫ, органич. соединения, содержащие карбоксильные COOH и аминогруппы NH2. Исключение составляет пролин. Обладают свойствами и кислот и оснований. В зависимости от положения аминогруппы в углеродной цепи относительно карбоксильной группы различают α-, β-, γ- и др. А. У ω-А. аминогруппа находится на конце цепи. Участвуют в обмене азотистых веществ всех организмов, являясь исходными соединениями при биосинтезе белков, пептидов, пуриновых и пиримидиновых оснований, ряда витаминов, пигментов, алкалоидов и др.
соединения, содержащие карбоксильные COOH и аминогруппы NH2. Исключение составляет пролин. Обладают свойствами и кислот и оснований. В зависимости от положения аминогруппы в углеродной цепи относительно карбоксильной группы различают α-, β-, γ- и др. А. У ω-А. аминогруппа находится на конце цепи. Участвуют в обмене азотистых веществ всех организмов, являясь исходными соединениями при биосинтезе белков, пептидов, пуриновых и пиримидиновых оснований, ряда витаминов, пигментов, алкалоидов и др.
Классификация
Описано свыше 150 природных А., среди которых особенно важны 20 α-А. (табл.), входящих в состав белков, кодируемых генетическим кодом; общая формула:
В зависимости от природы боковой цепи R α-А. подразделяют на две группы: А. с неполярными (гидрофобными) и А.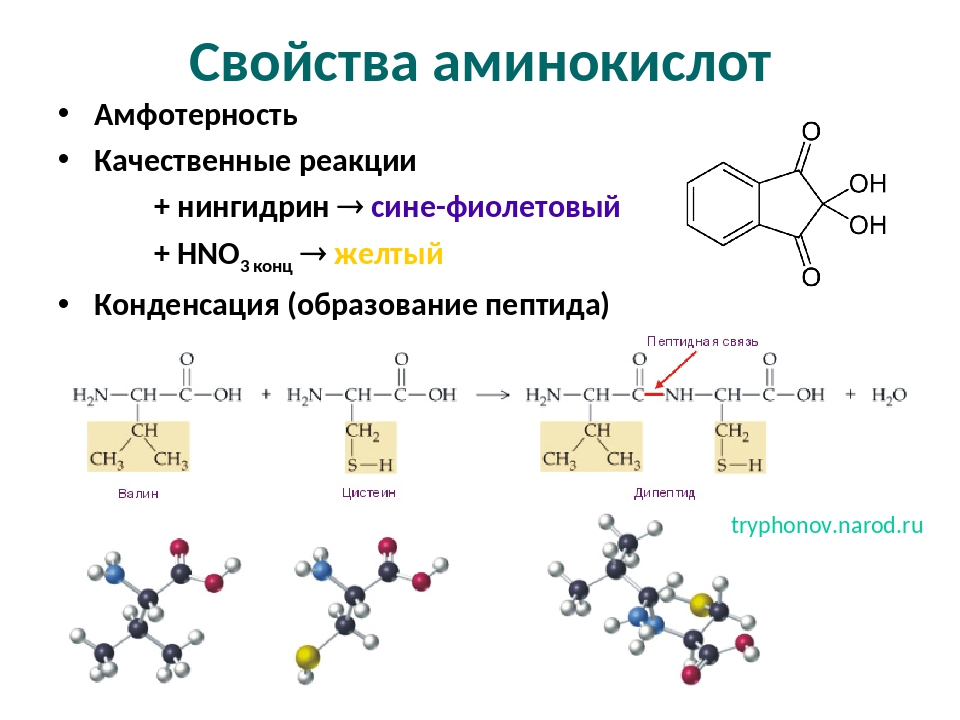 с полярными (гидрофильными) боковыми цепями. К 1-й группе относятся шесть А. с алифатич. боковой цепью – аланин, валин, лейцин, изолейцин, метионин, пролин и две с ароматической – фенилаланин и триптофан. Среди представителей 2-й группы боковые цепи семи А. содержат группировки, способные нести отрицат. или положит. заряд. В аспарагиновой и глутаминовой кислотах β- и γ-карбоксильные группы при рН 7,0 заряжены отрицательно. К осно́вным А. относятся лизин, аргинин и гистидин. ε-Аминогруппа лизина и гуанидиновая группировка аргинина несут положит. заряд (протонированы) в нейтральной среде, а имидазольная группировка гистидина – в кислой. В щелочных условиях отрицат. заряд могут приобретать боковые группы тирозина и цистеина. Характерной особенностью остатков цистеина является их способность в составе молекулы белка подвергаться окислению с образованием остатков цистина. А. присвоены сокращённые трёхбуквенные и однобуквенные обозначения, используемые в науч. литературе. В 1986 в ряде белков архебактерий, истинных бактерий (эубактерий) и животных была обнаружена α-А. – селеноцистеин (ей присвоены символы Sec и U), в 2002 открыт пирролизин (пока обнаружен только у одного вида метанобразующих архей). Обе эти А. кодируются триплетами, которые обычно служат «стоп-кодонами» (т. е. оповещают об окончании синтеза белка на рибосомах): селеноцистеин – триплетом UGA, а пирролизин – UAG.
с полярными (гидрофильными) боковыми цепями. К 1-й группе относятся шесть А. с алифатич. боковой цепью – аланин, валин, лейцин, изолейцин, метионин, пролин и две с ароматической – фенилаланин и триптофан. Среди представителей 2-й группы боковые цепи семи А. содержат группировки, способные нести отрицат. или положит. заряд. В аспарагиновой и глутаминовой кислотах β- и γ-карбоксильные группы при рН 7,0 заряжены отрицательно. К осно́вным А. относятся лизин, аргинин и гистидин. ε-Аминогруппа лизина и гуанидиновая группировка аргинина несут положит. заряд (протонированы) в нейтральной среде, а имидазольная группировка гистидина – в кислой. В щелочных условиях отрицат. заряд могут приобретать боковые группы тирозина и цистеина. Характерной особенностью остатков цистеина является их способность в составе молекулы белка подвергаться окислению с образованием остатков цистина. А. присвоены сокращённые трёхбуквенные и однобуквенные обозначения, используемые в науч. литературе. В 1986 в ряде белков архебактерий, истинных бактерий (эубактерий) и животных была обнаружена α-А. – селеноцистеин (ей присвоены символы Sec и U), в 2002 открыт пирролизин (пока обнаружен только у одного вида метанобразующих архей). Обе эти А. кодируются триплетами, которые обычно служат «стоп-кодонами» (т. е. оповещают об окончании синтеза белка на рибосомах): селеноцистеин – триплетом UGA, а пирролизин – UAG.
Селеноцистеин
Цистин
Пирролизин (где R=Ch4, Nh3 или OH)
Большая часть А., обнаруженных в тканях живых организмов, но не входящих в состав белков, могут выполнять важные функции. Так, орнитин и цитрулин участвуют в обмене веществ, в частности в синтезе мочевины у животных, 2,4-дигидрооксифенилаланин (ДОФА) образуется в качестве промежуточного продукта в ходе распада фенилаланина и тирозина в организме и является медиатором центральной нервной системы. Кроме того, имеются А., функция которых пока не ясна. В ряде белков (уже после их синтеза на рибосомах) боковые группы А. претерпевают изменения в ходе посттрансляционной модификации. Напр., в составе молекулы коллагена пролин и лизин превращаются соответственно в 4-гидроксипролин и 5-гидроксилизин, в миозине присутствует N-метиллизин, только в эластине встречается ферментативно модифицированный лизин – десмозин. Помимо α-А. в свободном виде и в составе некоторых биологически важных пептидов, встречаются А., аминогруппа которых связана не с α-углеродным атомом. К их числу относятся β-аланин, входящий в состав пантотеновой кислоты, γ-аминомасляная кислота, играющая важную роль в функционировании нервной системы, δ-аминолевулиновая кислота, являющаяся промежуточным продуктом синтеза порфиринов.
Физические и химические свойства
А. – бесцветные кристаллич. вещества, растворимые в воде; темп-ры плавления 220–315 °C. В кристаллах и водных растворах при нейтральных значениях рН α-А. существуют преим. в виде диполярных ионов (цвиттер-ионов), у которых аминогруппы протонированы , а карбоксильные группы диссоциированы (СОО—). А. являются амфолитами; ионизация их молекул зависит от рН раствора:
Значения pH, при котором концентрация катионов А. равна концентрации анионов, называется изоэлектрической точкой (pI). Аминогруппа А. ионизирована в неск. меньшей степени, чем карбоксильная группа, поэтому водный раствор А. имеет слабокислый характер. Все α-А., кроме глицина, имеют асимметрический (хиральный) α-углеродный атом и существуют в виде двух энантиомеров. У изолейцина и треонина хиральными являются также и β-углеродные атомы.
За редким исключением природные α-А. относятся к L-ряду и только в оболочках бактерий, в составе некоторых антибиотиков и в метаболитах грибов, а также в коже некоторых видов южноамериканских лягушек и корне женьшеня обнаружены А. D-ряда.
В результате взаимодействия α-аминогруппы одной А. с α-карбоксильной группой другой А. в процессе биосинтеза белка (трансляции) происходит образование пептидной связи.
Превращения аминокислот в организмах
Высшие растения и хемосинтезирующие организмы все необходимые им А. синтезируют из аммониевых солей и нитратов, а также из кето- или гидроксикислот – продуктов дыхания и фотосинтеза. Человек и животные синтезируют большинство А. из обычных безазотистых продуктов обмена и аммониевого азота. Это т. н. заменимые А. Но ряд А. – незаменимых – они должны получать в готовом виде с пищей. Для человека, напр., незаменимыми А. являются валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин, а для детей также аргинин и гистидин. Недостаток в организме той или иной аминокислоты приводит к нарушению обмена веществ, замедлению роста и развития. А. участвуют в поддержании азотистого баланса в организме. Окислит. распад А. путём дезаминирования приводит к образованию кето- и гидроксикислот – промежуточных продуктов цикла трикарбоновных кислот; далее они превращаются в углеводы, новые А. и т. д. или окисляются до СО2 и Н2О с выделением энергии. У животных азот в виде аммониевых солей, мочевины или мочевой кислоты выводится из организма. У растений усвоение А. происходит т. о., что азотистые отходы практически отсутствуют. Некоторые А. являются предшественниками важных гормонов и нейромедиаторов: тирозин и фенилаланин – дофамина и адреналина, триптофан – серотонина, гистидин – гистамина, глутаминовая кислота – γ-аминомасляной кислоты, аргинин – оксида азота (NO).
Практическое использование
Таблица. Важнейшие аминокислоты, входящие в состав белков (цветом обозначены боковые цепи)
Смеси L-α-А., а также отдельные А. применяют в медицине для лечения больных с заболеваниями пищеварит. органов (гистидин, метионин), при малокровии, ожогах (метионин), нервно-психич. заболеваниях (глицин и глутаминовая кислота), при сосудистых заболеваниях головного мозга (γ-аминомасляная кислота) и т. д. Для обогащения кормов в животноводстве и лечения животных используются лизин, метионин, треонин, триптофан, в пищевой пром-сти – глутамат натрия и лизин. ω-А. и их лактамы служат для пром. произ-ва полиамидов. Ароматич. А. нашли применение в синтезе красителей и лекарственных препаратов. Некоторые L-α-А. получают микробиологич. синтезом (лизин, триптофан, треонин, глутаминовая кислота) или выделяют из гидролизатов богатых ими белков (пролин, аргинин, гистидин, глутаминовая кислота, тирозин).
В чем разница между кислотой и основными аминокислотами — Разница Между
главное отличие между кислыми и основными аминокислотами является то, что кислые аминокислоты содержат кислотные боковые цепи при нейтральном pH, тогда как основные аминокислоты содержат основные боко
главное отличие между кислыми и основными аминокислотами является то, что кислые аминокислоты содержат кислотные боковые цепи при нейтральном pH, тогда как основные аминокислоты содержат основные боковые цепи при нейтральном pHpH, Кроме того, боковая цепь кислой аминокислоты содержит группы карбоновых кислот, в то время как боковая цепь основных аминокислот содержит аминогруппы.
Кислые, основные и нейтральные аминокислоты представляют собой три типа аминокислот, которые характеризуются на основе их полярности боковой цепи или органической группы R. Обычно аминокислота содержит аминогруппу (-Nh3), карбоновую группу (-COOH), органическую группу R и атом водорода, связанный с центральным атомом углерода.
Ключевые области покрыты
1. Что такое кислотные аминокислоты
— Определение, Боковая цепь, Важность
2. Что такое основные аминокислоты
— Определение, Боковая цепь, Важность
3. Каковы сходства между кислотой и основными аминокислотами
— Краткое описание общих черт
4. В чем разница между кислотой и основными аминокислотами
— Сравнение основных различий
Основные условия
Аминокислоты, аминокислоты, основные аминокислоты, группы карбоновых кислот, полярность
Что такое кислотные аминокислоты
Кислые аминокислоты представляют собой тип полярных аминокислот, которые содержат карбоксильные группы (-СООН) в своих боковых цепях. Это означает; эти аминокислоты содержат две карбоксильные группы в структуре аминокислоты: одну карбоксильную группу в боковой цепи и другую, присоединенную к центральному атому углерода. Таким образом, это уменьшает pKa в растворе. Следовательно, кислые аминокислоты могут терять протоны из своих карбоксильных групп в боковых цепях с образованием кислого раствора.
Рисунок 1: Свойства аминокислот
Два основных типа кислых аминокислот — глутаминовая кислота и аспарагиновая кислота.
Каковы основные аминокислоты
Основные аминокислоты — это другой тип полярных аминокислот. Они содержат аминогруппу (-Nh3) в своей боковой цепи. Здесь также основные аминокислоты содержат две аминогруппы. Одна аминогруппа находится в боковой цепи, а вторая присоединена к центральному атому углерода. В отличие от кислых аминокислот, основные аминокислоты, следовательно, состоят из высокого pKa. Таким образом, это позволяет получать протоны к аминогруппе в боковой цепи, получая основной раствор.
Рисунок 2: Взаимодействие между кислотой и основными аминокислотами
Три типа основных аминокислот: лизин, аргинин и орнитин.
Сходство между кислотой и основными аминокислотами
- Кислые и основные аминокислоты представляют собой два типа аминокислот, характеризующихся в зависимости от свойств органической группы R.
- Органическая группа R состоит из различных полярностей в этих аминокислотах.
- Водородные связи между кислотными и основными аминокислотами важны во время формирования бета-листов.
- Кроме того, эти аминокислоты объединяют белковые субъединицы, образуя третичную структуру белков.
- Кроме того, оба типа аминокислот служат в качестве каталитических центров, стабилизируя различные метаболиты и кислотные или основные промежуточные соединения в ходе ферментативного катализа биологических реакций. Более того, они стабилизируют гидролиз АТФ, служа вторичным сайтом связывания.
Разница между кислотой и основными аминокислотами
Определение
Кислые аминокислоты относятся к аминокислоте со вторым кислотным фрагментом, тогда как основные аминокислоты относятся к аминокислоте, содержащей вторую основную группу (обычно аминогруппу).
Боковая цепь / органическая группа R
Основное различие между кислотными и основными аминокислотами состоит в том, что кислотные аминокислоты содержат кислотные боковые цепи при нейтральном pH, в то время как основные аминокислоты содержат основные боковые цепи при нейтральном pH.
Компоненты боковой цепи
Боковая цепь кислотных аминокислот содержит группы карбоновых кислот (-COOH), в то время как боковая цепь основных аминокислот содержит аминогруппы (-Nh3). Таким образом, это еще одно различие между кислыми и основными аминокислотами.
рКа
Кроме того, кислые аминокислоты состоят из низких значений pKa, которые позволяют терять протоны, в то время как основные аминокислоты состоят из высоких значений pKa, которые позволяют им связывать протоны.
Обвинять
Их заряд также является разницей между кислотными и основными аминокислотами. Кислые аминокислоты несут отрицательный заряд в своей боковой цепи, в то время как основные аминокислоты несут положительный заряд в своей боковой цепи.
Примеры
Некоторые кислотные аминокислоты представляют собой глутаминовую кислоту и аспарагиновую кислоту, в то время как основными типами аминокислот являются лизин, аргинин и орнитин.
Заключение
Кислые аминокислоты содержат карбоксильные группы в своей боковой цепи, что позволяет им нести отрицательный заряд. С другой стороны, основные аминокислоты содержат аминогруппы в своей боковой цепи, что позволяет нести положительный заряд. Эти заряды как на кислых, так и на основных аминокислотах важны для формирования вторичных структур белков. Они важны и при ферментативном катализе биохимических реакций. Следовательно, основное различие между кислотными и основными аминокислотами заключается в типе функциональных групп, присутствующих в их боковых цепях.
Ссылка:
1. Ophardt, Charles E. «Характеристики и свойства аминокислот».ВЕРТУАЛЬНЫЙ ХИМБУК, 2003,
Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
| первичные | вторичные | третичные |
| R-NH2 |
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
C6H5-NO2 + 3Fe + 7HCl = [C6H5-NH3]+Cl- + 3FeCl2 + 2H2O
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
[C6H5-NH3]+Cl— + NaOH = C6H5-NH2 + NaCl + H2O
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
С6H5−Cl + 2NH3 → C6H5NH2 + NH4Cl
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH2CH2COOH + CH3OH → NH2CH2COOCH3+ H2O
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
NH2CH2COOH + HCl → [NH3CH2COOH]+Cl—
2. Взаимодействие с азотистой кислотой
NH2-CH2-COOH + HNO2 → НО-CH2-COOH + N2↑ + H2O
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
3. Алкилирование
NH2CH2COOH + CH3I → [CH3NH2CH2COOH]+I—
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
И аланина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
Cl-CH2-COOH + 2NH3 = NH2-CH2-COOH + NH4Cl
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Аминокислоты — обзор
Электролитные и кислотно-основные свойства
Аминокислоты — это амфолиты; т.е. они содержат как кислотные, так и основные группы. Свободные аминокислоты никогда не могут встречаться в виде неионных молекул. Вместо этого они существуют как нейтральные цвиттерионы , которые содержат как положительно, так и отрицательно заряженные группы. Цвиттерионы электрически нейтральны и поэтому не мигрируют в электрическом поле. В кислом растворе (ниже pH 2,0) преобладающая разновидность аминокислоты заряжена положительно и мигрирует к катоду.В щелочном растворе (pH выше 9,7) преобладающая разновидность аминокислоты заряжена отрицательно и мигрирует к аноду.
Изоэлектрическая точка (pI) аминокислоты — это pH, при котором молекула имеет нулевой средний суммарный заряд и, следовательно, не перемещается в электрическом поле. PI рассчитывается путем усреднения значений pK ‘для двух функциональных групп, которые вступают в реакцию, когда цвиттерион попеременно становится одновалентным катионом или одновалентным анионом.
При физиологическом pH моноаминомонокарбоновые аминокислоты, e.g., глицин и аланин, существуют в виде цвиттерионов. То есть при pH 6,9–7,4 α-карбоксильная группа (pK ‘= 2,4) диссоциирует с образованием отрицательно заряженного карбоксилатного иона (COO — ), в то время как α-аминогруппа (pK ′ = 0,7 ) протонируется с образованием аммониевой группы (NH 3 + ). Значение pK ‘α-карбоксильной группы значительно ниже, чем у сопоставимой алифатической кислоты, например, уксусной кислоты (pK’ = 4,6). Эта более сильная кислотность обусловлена захватом электронов положительно заряженным ионом аммония и, как следствие, повышенной склонностью карбоксильного водорода к диссоциации в виде H + .Группа α-аммония, соответственно, является более слабой кислотой, чем алифатический ион аммония, например этиламин (pK ‘= 9,0), поскольку индуктивный эффект отрицательно заряженного карбоксилат-аниона имеет тенденцию предотвращать диссоциацию H + . Профиль титрования глицина (рис. 3.6) почти идентичен профилям всех других моноаминомонокарбоновых аминокислот с неионизируемыми R-группами (Ala, Val, Leu, Ile, Phe, Ser, Thr, Gln, Asn, Met и Pro). .
Рисунок 3.6. Профиль титрования глицина, моноаминомонокарбоновой кислоты.
Титрование глицина имеет следующие основные особенности. Титрование инициируют гидрохлоридом глицина, Cl — (H 3 + NCH 2 COOH), который является полностью протонированной формой аминокислоты. В этой форме молекула содержит две кислотные функциональные группы; следовательно, для полного титрования 1 моля гидрохлорида глицина требуется два эквивалента основания. Имеются два значения pK ‘: pK’1 из-за реакции карбоксильной группы и pK’2 из-за реакции аммониевой группы.Добавление 0,5 экв. Основания к 1 моль гидрохлорида глицина повышает pH 2,34 (pK’1), тогда как добавление 1,5 экв. Дополнительно увеличивает pH до 9,66 (pK’2). При низких значениях pH (например, 0,4) молекулы представляют собой преимущественно катионы с одним положительным зарядом; при значениях pH 5–7 у большинства молекул чистый заряд равен нулю; при высоких значениях pH (например, 11,7) все молекулы по существу являются анионами с одним отрицательным зарядом. Середина между двумя значениями pK ‘[т.е. при pH = (2,34 + 9,66) / 2= 6,0] — это pI. Таким образом, pI — это среднее арифметическое значений pK′1 и pK′2 и точка перегиба между двумя сегментами профиля титрования.
Буферная способность слабых кислот и слабых оснований максимальна при их значениях pK ‘. Таким образом, моноаминомонокарбоновые кислоты проявляют наибольшую буферную способность в двух диапазонах pH, близких к двум их значениям pK ‘, а именно, pH 2,3 и pH 9,7 (рис. 3.6). Ни эти аминокислоты, ни α-амино- или α-карбоксильные группы других аминокислот (которые имеют аналогичные значения pK ‘) не обладают значительной буферной способностью в нейтральном (физиологическом) диапазоне pH. Единственными аминокислотами с R-группами, которые обладают буферной способностью в физиологическом диапазоне pH, являются гистидин (имидазол; pK ‘= 6.0) и цистеин (сульфгидрил; pK ‘= 8,3). Значения pK и pI для выбранных аминокислот перечислены в таблице 3.2. Значения pK ‘для R-групп меняются в зависимости от ионного окружения.
Таблица 3.2. Значения pK ‘и pI выбранных свободных аминокислот при 25 ° C *
| Аминокислота | pK’1 (α-COOH) | pK’2 | pK’3 | pI |
|---|---|---|---|---|
| Аланин | 2,34 | 9,69 (β-Nh4 +) | 6,00 | |
| Аспарагиновая кислота | 2.09 | 3,86 (γ-COOH) | 9,82 (α-Nh4 +) | 2,98 (pK′1 + pK′22) |
| Глутаминовая кислота | 2,19 | 4,25 (γ-COOH) | 9,67 ( α-Nh4 +) | 3,22 (pK’1 + pK’22) |
| Аргинин | 2,17 | 9,04 (α-Nh4 +) | 12,48 (Гуанидиний) | 10,76 (pK’2 + pK’32) |
| Гистидин | 1,82 | 6,00 (имидазолий) | 9,17 (Nh4 +) | 7,59 (pK’2 + pK’32) |
| Лизин | 2.18 | 8,95 (α-Nh4 +) | 10,53 (ε-Nh4 +) | 9,74 (pK′2 + pK′32) |
| Цистеин | 1,71 | 8,33 (SH) | 10,78 (α-Nh4 + ) | 5,02 (pK’1 + pK’22) |
| Тирозин | 2,20 | 9,11 (α-Nh4 +) | 10,07 (фенол OH) | 5,66 (pK’1 + pK’22) |
| Серин | 2,21 | 9,15 (α-Nh4 +) | 13,6 (Alcohol OH) | 5,68 (pK′1 + pK′22) |
Значения pK ′ для функциональных групп в белках могут значительно различаться. от значений свободных аминокислот.R-группы ионизируются при физиологическом pH и имеют анионные и катионные группы соответственно.
Аминокислоты
Введение:
Каждая аминокислота имеет по крайней мере одну аминную и одну кислотную функциональную группу. группа, как следует из названия. Различные свойства являются результатом вариации в строении различных R-групп. Группа R часто называют боковой цепью аминокислоты. Аминокислоты имеют специальные общеупотребительные имена, однако сокращенное трехбуквенное поскольку имя используется большую часть времени.Вторая аббревиатура , одна буква, используется в длинных белковых структурах. таблица слева для структуры, названий и сокращений 20 аминокислот.
Существует четыре основных класса аминокислот.
определяется разными боковыми цепями: (1) неполярными и нейтральными,
(2) полярный и нейтральный, (3) кислый и полярный, (4) основной и полярный.
Принципы полярности:
Чем больше разница в электроотрицательности между атомов в связи, более полярная связь.Частичные отрицательные заряды находятся на наиболее электроотрицательных атомах, остальные частично положительный. Проверьте полярность функциональных группы.
Неполярные боковые цепи:
Боковые цепи, содержащие чистых углеводородных алкильных группы (алкановые ответвления) или ароматические (бензольные кольца) неполярные . Примеры включают валин, аланин, лейцин, изолейцин, фенилаланин.
Число алкильных групп также влияет на полярность. Чем больше присутствует алкильных групп, тем неполярнее аминокислота. будет. Этот эффект делает валин более неполярным, чем аланин; лейцин более неполярен, чем валин.
QUES. Перечислите все аминокислоты с неполярными боковыми цепями.
| Распределите следующие по возрастанию
неполярность i.е. 1 = наименее неполярный, 4 = наиболее неполярный. лей; phe; val; аля | Ответ 1 = аля 2 = val 3 = лей 4 = phe Рейтинг основан на увеличивающиеся числа CHs. |
Полярные боковые цепи:
Боковые цепи, которые имеют различные функциональные группы, такие как кислоты, амиды, спирты и амины придадут более полярный символ к аминокислоте.Рейтинг полярности будет зависеть об относительном ранжировании полярности для различных функциональных групп как определено в функциональных группах. Кроме того, количество атомов углерода в алкане или ароматическая часть боковой цепи должна рассматриваться вместе с с функциональной группой.
Пример: аспарагиновая кислота более полярна, чем серин, потому что кислотная функциональная группа более полярна, чем спиртовая группа.
Пример: серин более полярен, чем треонин, поскольку треонин имеет на одну метильную группу больше, чем серин. Метильная группа дает немного более неполярный характер треонину.
Пример: серин более полярен, чем тирозин, поскольку тирозин имеет углеводородное бензольное кольцо.
QUES. Перечислите все аминокислоты по аббревиатуре, которые считаются
несколько полярными.
| Оцените следующие аминокислоты по
возрастающая полярность.т.е. 1 = более неполярный. ser; glu; жерех; лиз; ала; gln | Ответ 1 = аля 2 = лиз 3 = сер 4 = глю 5 = жерех 6 = gln |
| Какая аминокислота наиболее нерастворима
в воде: изолейцин или аланин? | Ответ Изолейцин имеет больше CHs, поэтому больше нерастворим, чем ала. |
| Какая аминокислота наиболее растворима в воде: лиз или сер? | Ответ Сер, алкогольная группа более полярен, чем амин в лиз. |
Гидрофобные, гидрофильные, полярные и заряженные
Каждая из 20 наиболее распространенных аминокислот имеет свои специфические химические характеристики и свою уникальную роль в структуре и функции белка.Например, исходя из склонности боковой цепи к контакту с водой, аминокислоты можно классифицировать как гидрофобные (низкая склонность к контакту с водой), полярные и заряженные (энергетически благоприятные контакты с водой).
Заряженные аминокислоты
Легко увидеть, какие аминокислоты заряжены, просто потому, что при нейтральном pH (около 7) они содержат один заряд. Их четыре: две основные аминокислоты, лизин (Lys) и аргинин (Arg) с положительным зарядом при нейтральном pH, и две кислые, аспартат (Asp) и глутамат (Glu), несущие отрицательный заряд при нейтральном pH.Было обнаружено, что так называемые солевые мостики, которые образуются в результате взаимодействия между положительно и отрицательно заряженными боковыми цепями аминокислот, важны для стабилизации трехмерной структуры белка. Например, заряженные аминокислоты в белках термофильных организмов (организмов, которые живут при повышенных температурах, до 80-90 ° C или даже выше) часто образуют обширную сеть солевых мостиков на поверхности этих белков, способствуя их термостабильности и предотвращение денатурации при высоких температурах.Связывание ионов металлов в белках — еще одна функция отрицательно заряженных карбоксильных групп Asp и Glu. Металлопротеины и связывание металлов — увлекательная область структурной биологии. Я надеюсь, что когда-нибудь в будущем я дополню этот сборник главой о связывании металлов в белках.
Полярные аминокислоты
При рассмотрении полярности некоторые аминокислоты легко назначить, в то время как в других случаях могут возникнуть разногласия. Например, серин (Ser), треонин (Thr) и тирозин (Tyr) явно полярны, поскольку они несут гидроксильную (-OH) группу.Эта полярная группа может участвовать в образовании водородной связи с другой полярной группой, отдавая или принимая протон. Аспарагин (Asn) и глутамин (Gln) также полярны, они несут полярную амидную группу. С другой стороны, гистидин (His) может быть как полярным, так и заряженным, в зависимости от окружающей среды и pH. Он имеет две группы –NH со значением pKa около 6. Когда обе группы протонированы, боковая цепь имеет заряд +1. PKa может модулироваться белковой средой таким образом, что боковая цепь может отдавать протон и становиться нейтральной или принимать протон, становясь заряженным.Эта способность делает гистидин полезным в активных центрах ферментов, когда в химической реакции требуется экстракция протонов. Ароматические аминокислоты триптофан (Trp) и ранее упомянутый Tyr, а также неароматический метионин (Met) иногда называют амфипатическими из-за их способности иметь как полярный, так и неполярный характер. Эти остатки можно найти рядом с границей раздела между белком и растворителем. Здесь следует отметить, что боковые цепи гистидина, тирозина, фенилаланина и триптофана также способны образовывать слабые водородные связи типов OH-π и CH-O, используя электронные облака внутри своих кольцевых структур.Для обсуждения типов водородных связей OH-π и CH-O см. Scheiner et al., 2002.
Гидрофобные аминокислоты
Гидрофобные аминокислоты включают аланин (Ala, A), валин (Val, V), лейцин (Leu, L), изолейцин (Ile, I), пролин (Pro, P), фенилаланин (Phe, F) и цистеин (Cys). Эти остатки обычно расположены внутри ядра белка, изолированного от растворителя. Они участвуют в ван-дер-ваальсовых взаимодействиях, которые необходимы для стабилизации белковых структур.Кроме того, остатки Cys участвуют в стабилизации трехмерной структуры за счет образования дисульфидных (S-S) мостиков, которые могут соединять разные части белковой структуры или даже разные субъединицы в комплексе. Здесь следует отметить, что и в случае Cys существуют некоторые разногласия по поводу его отнесения к гидрофобной группе. Например, согласно некоторым схемам, он является гидрофобным, в то время как другие считают его полярным, поскольку он часто находится рядом с поверхностью белков или на их поверхности.
Глицин и пролин
Глицин (Gly), являясь одной из распространенных аминокислот, не имеет боковой цепи. Он часто находится на поверхности белков, в областях петель или клубков (без определенной вторичной структуры), обеспечивая высокую гибкость полипептидной цепи. Эта гибкость требуется для облегчения резких поворотов полипептидов в областях петель. С другой стороны, пролин обычно неполярен и имеет свойства, противоположные свойствам Gly, он обеспечивает жесткость полипептидной цепи, накладывая определенные торсионные углы на сегмент структуры (Morgan & Rubenstein, 2013).Причина этого в том, что его боковая цепь создает ковалентную связь с основной цепью, которая ограничивает угол фи полипептида в этом месте (см. Часть графика Рамачандрана). Иногда Pro называют разрушителем спирали, поскольку он часто находится в конце α-спирали и по очереди. Важность Gly и Pro в сворачивании белков обсуждается в (Krieger et al., 2005).
Ниже перечислены 20 наиболее распространенных аминокислот в белках с их трехбуквенным и однобуквенным кодами:
Charged ( боковых цепей часто образуют солевые мостики ):
• Аргинин — Arg — R
• Лизин — Lys — K
• Аспарагиновая кислота — Asp — D
• Глутаминовая кислота — Glu — E
Polar ( образуют водородные связи в качестве доноров или акцепторов протонов ):
• Глутамин — Gln — Q
• Аспарагин — Asn — N
• Гистидин — His — H
• Серин — Ser — S
• Треонин — Thr — T
• Тирозин — Tyr — Y
• Цистеин — Cys — C
Амфипатический ( часто встречается на поверхности белков или липидных мембран, иногда также классифицируется как полярный ):
• Триптофан — Trp — W
• Тирозин — Tyr — Y
• Метионин — Met — M (может действовать как лиганд для ионов металлов)
Гидрофобный ( обычно находится внутри ядра белка) :
• Аланин — Ala — A
• Изолейцин — Ile — I
• Лейцин — Leu — L
• Метионин — Met — M
• Фенилаланин — Phe — F
• Валин — Val — V
• Пролин — Pro — P
• Глицин — Gly — G
Понимание характеристик боковой цепи аминокислот для MCAT
Аминокислоты являются строительными блоками живых существ.Длинные цепи аминокислот составляют белки, которые, в свою очередь, составляют многие структурные и функциональные компоненты клетки.
Мне нравится думать о клетке как о замкнутом городе, где ядро является столицей, митохондрии — электростанцией и так далее. Но затем у вас есть рабочие, транспортная система и сама структура клеточного города, которые состоят из белков, которые, в свою очередь, состоят из аминокислот.
Сложность структуры белка определяется последовательностью аминокислот и химической природой их боковых цепей вариабельных групп.MCAT требует понимания природы полярных и неполярных боковых цепей, а также скручивания и конформации, вызванных гидрофобными и гидрофильными взаимодействиями
И да, вы должны запомнить каждую аминокислоту для MCAT. Сюда входит боковая цепочка, полное имя, трехбуквенное имя и однобуквенное сокращение. Но не стоит просто наклеивать слова и структуры на карточки, надеясь, что они навсегда останутся в вашей памяти. Вам нужно активно заниматься каждой аминокислотой индивидуально.
Для получения краткого справочного списка загрузите мою бесплатную шпаргалку по аминокислотам
.- Напишите полное имя
- Изобразите аминокислотную структуру и вариабельную группу
- Запишите трехбуквенные и однобуквенные сокращения
- Расскажите вслух что-нибудь уникальное об этой конкретной боковой цепи! Чем веселее и безумнее связь, тем легче вы ее запомните.
- Повторите процесс наименования / рисования один раз НЕМЕДЛЕННО
- Повторяйте еженедельно, пока не почувствуете себя ТВЕРДЫМ с этой информацией
Основная структура аминокислоты
Аминокислота получила свое название от двух основных функциональных групп.Аминокислота имеет центральный хиральный углерод, называемый альфа-углеродом (черным). К центральному атому углерода присоединен атом водорода (серый), амино- или Nh3-группа (зеленый) и COOH-группа карбоновой кислоты (фиолетовый). Наконец, у нас есть группа R (красная), которая представляет собой переменную боковую цепь.
Существует 20 различных аминокислот, отличающихся уникальными боковыми цепями. Они варьируются от простого атома водорода (глицин) до сложной резонирующей ароматической системы с 2 кольцами (триптофан).
Хотя приведенная выше полностью нейтральная версия — это то, как большинство студентов изучают аминокислоты, и форму, которую мы будем использовать в этой статье, имейте в виду, что это технически неверно.
Аминокислота в форме цвиттериона
Поскольку карбоксильная группа является кислой, а аминогруппа основной, они будут существовать в виде цвиттериона в их сопряженных заряженных формах при физиологическом pH. Подробнее о зарядах цвиттериона и аминокислот читайте в моей следующей статье (ссылка ниже).
Последняя концепция, прежде чем мы разберем отдельные аминокислоты, — это трехмерная структура белка. В биологической системе структура определяет функцию , поэтому понимание характеристик аминокислот является ключом к пониманию структуры и, в конечном итоге, функции белка.
Первичная структура трехмерного белка
Первым и наиболее важным фактором, определяющим структуру белка, является последовательность аминокислот. Если полипептидная цепь присоединена в другом порядке, вы получите совсем другую общую структуру.
Вторичная структура 3-D белка
Вторичная структура происходит от взаимодействий водородных связей в основной цепи. Пептидная связь превращает каждую бывшую карбоксильную и аминогруппу в амидную функциональную группу.Вторичная структура альфа-спирали и бета-складчатых листов происходит из водородных связей между частично отрицательным кислородом на карбониле и частично положительным водородом на азоте.
Третичная структура 3-D белка
Третичная структура — это то место, где происходит реальное трехмерное сворачивание, и это первый раз, когда вы заметите взаимодействия боковых цепей. В ЭТОМ критически важны знания и понимание боковых цепей аминокислот.
Позвольте мне повторить, третичная структура — это первый раз, когда вы увидите взаимодействия вариабельной боковой цепи R-группы на полипептидной цепи. Многие студенты путают это со вторичной структурой, которая представляет собой только позвоночные взаимодействия.
Четвертичная структура трехмерного мульти-полипептидного белка
Четвертичная структура относится к вариабельным групповым взаимодействиям между различными полипептидами с образованием единого более крупного белка.
Четвертичные структуры встречаются не в каждом белке.Если белок содержит только одну аминокислотную цепь, то наивысший уровень сворачивания — это его третичная структура. Однако, если белок состоит из нескольких полипептидных субъединиц, то четвертичная структура — это то, что удерживает вместе разные полипептиды.
Теперь, когда вы понимаете значение характеристик боковых цепей, давайте перейдем к аминокислотам. Имейте в виду, что, поскольку родительские амино- и карбоксильные группы «заняты» первичной / вторичной структурой, они НЕ анализируются при изучении свойств и характеристик боковой цепи.
Это означает, что вы игнорируете любую потенциальную полярность как карбоксильных, так и аминогрупп и смотрите ТОЛЬКО на боковые цепи.
Неполярные гидрофобные аминокислоты
Гидрофобный, как следует из названия, гидрофобный , фобический — боязнь . Гидрофобные аминокислоты имеют небольшую полярность в своих боковых цепях или вообще не имеют ее. Отсутствие полярности означает, что у них нет возможности взаимодействовать с высокополярными молекулами воды, что заставляет их бояться воды.
Только пять атомов появятся в ваших группах аминокислотных переменных: H, C, N, O и S.
Учитывайте полярность, только если у вас есть N, O, S как «мажоритарный» фактор. Я буду указывать на них по мере их появления. Однако, если вы видите только Cs и Hs, вы должны автоматически распознать водобоязненную аминокислоту.
Глицин
Gly
G
Глицин — уникальная аминокислота, поскольку в ней действительно нет группы R. Когда вы думаете о «переменной R-группе», вы должны думать об углероде, присоединенном к другим атомам. Но глицин имеет водород только в положении боковой цепи.Поскольку глицин имеет 2 атома водорода, по одному в родительской и боковой цепи, это единственная симметричная и, следовательно, ахиральная аминокислота. Поскольку водород неполярен, глицин является гидрофобной аминокислотой. Боковая цепь водорода делает глицин самой маленькой аминокислотой.
Аланин
Ала
А
Аланин — простая аминокислота, которая имеет только метильную группу или группу Ch4 в качестве боковой цепи. Поскольку вы не видите ничего, кроме углерода и водорода, аланин — неполярная гидрофобная аминокислота.Важно понимать, что это очень маленькая аминокислота, способная «вклиниваться» в плотные петли или цепи.
Валин
Вал
В
Валин — еще одна простая аминокислота с вариабельной изопропильной группой. Как и в случае с аланином, мы не видим ничего, кроме углерода и водорода, что делает валин неполярной гидрофобной аминокислотой.
Лейцин
Лей
L
Вы можете распознать, что лейцин имеет ту же группу переменных, что и валин, но с дополнительной группой Ch3.Или вы можете просто распознать его изобутиловую боковую цепь.
Посмотрите это видео, если вы не знакомы с разветвленными боковыми цепями, такими как изопропил или втор-бутил. Поскольку лейцин содержит только Cs и Hs, он боится неполярных аминокислот.
Изолейцин
Иль
I
Изолейцин, как следует из названия, является изомером лейцина. Разница заключается в размещении Ch4 для втор-бутильной, а не для изобутильной боковой цепи. Как и его изомер, изолейцин неполярен и гидрофобен.
Метионин
Met
M
Метионин — первая потенциально опасная аминокислота. Его боковая цепь содержит в основном Cs и Hs, но со встроенным атомом серы. Вы можете подумать, что он гидрофильный, но обратите особое внимание на расположение атома серы. Сера, встроенная в цепь и прикрепленная только к атомам углерода, частично «скрыта» от внешней среды.
Хотя вам не нужно знать значения электроотрицательности для MCAT, это помогает понять, что S = 2.58 и C = 2,55. Поскольку разница в электроотрицательности меньше 0,5, на этой боковой цепи НЕТ полярности.
Вы также должны распознать метионин как стартовый кодон AUG при трансляции РНК в белки.
Фенилаланин
Phe
F
Чтобы помочь вам запомнить, что фенилаланин — это F, помните, что «ph» произносится как «F». Не путайте это с P для пролина.
Обратите внимание на структуру фенилаланина. Он имеет одну углеродную группу с присоединенным бензольным кольцом.Фенил — это название бензольного заместителя, и эта молекула имеет бензол (фенил), присоединенный к структуре аланина. Поскольку в ароматической боковой цепи фенилаланина нет ничего, кроме Cs и Hs, он неполярен и гидрофобен.
Триптофан
Trp
W
Это непростой вопрос. Обратите внимание на NH в этой боковой цепи. N-H должен быть полярным и способен образовывать водородные связи. Однако есть две причины, по которым эта аминокислота все еще неполярная и гидрофобная.
- Группа N-H представляет собой крошечную часть очень большой боковой цепи.
- Внимательно посмотрите на азот и, что более важно, на его неподеленные пары. Электроны азота являются неотъемлемой частью сопряженной ароматичности боковой цепи триптофана. Другими словами, думайте о его электронах как о «слишком отвлеченных» резонансом, чтобы уделять много внимания внешней водной среде.
MCAT требует от вас признать, что это большая и объемная аминокислота. Но поскольку это экзамен с несколькими вариантами ответов, вы можете просто запомнить, что триптофан — ЕДИНСТВЕННАЯ аминокислота с ДВУМЯ конденсированными кольцами.
На самом деле, он настолько велик, что может TRIP (trp) через себя и выкрикивать Waaaaaa (W)
(Примечание по мнемонике: чем смешнее, страннее или грязнее мнемоника, тем больше вероятность, что вы ее запомните. Имейте это в виду для мед. школы.)
Proline
Pro
P
Пролин — уникальная аминокислота, поскольку это ЕДИНСТВЕННАЯ ОДНА, которая включает скелет в свою боковую цепь. Боковая цепь пролина представляет собой 3-углеродную цепь, которая образует петлю и присоединяется к родительской аминогруппе. Это означает, что в отличие от других аминокислот, пролин НЕ имеет атома водорода на своем азоте, когда он является частью полипептидной цепи.
Однако нельзя забывать, что азот НЕ ДЕЙСТВИТЕЛЬНО входит в группу переменных, что означает, что он не может вносить никакой полярности. Поскольку у нас есть всего 3 группы Ch3 для анализа, мы получаем неполярную гидрофобную боковую цепь. Эта родительская петля создает выпуклость и не позволяет цепочке, содержащей пролин, быть линейной, что означает, что вы часто найдете ее в петлях и в конце альфа-спирали.
Полярные гидрофобные аминокислоты
* Это липкий раздел, а в зависимости от того, где вы исследуете, вы можете найти следующие категории, которые классифицируются как полярные или неполярные, гидрофильные или гидрофобные. Обратите внимание на присутствие полярных групп, которые являются небольшими по сравнению с общей боковой цепью или очень слабо полярными и, следовательно, гидрофобными.
Цистеин
Cys
C
Цистеин имеет слегка полярный S-H, но его полярность настолько мала, что цистеин не может должным образом взаимодействовать с водой, что делает его гидрофобным.
Цистеин — очень важная аминокислота, когда речь идет о третичной и четвертичной структуре. Большинство взаимодействий боковых цепей включают полярные / заряженные взаимодействия или неполярную дисперсию Ван-дер-Ваальса и Лондона.Однако боковая цепь цистеина способна образовывать дисульфидный мостик, который представляет собой ковалентные связи между 2 атомами серы посредством окисления боковой цепи и удаления 2 атомов водорода. Эта ковалентная связь намного прочнее и долговечнее по сравнению со стандартными третичными и четвертичными взаимодействиями.
Это также причина экспериментальной ошибки при определении размера / длины белка для белков с множеством субъединиц.
Тирозин
Тир
Y
Некоторые студенты видят в этом утечку OH из шины (tyr).
Внимательно посмотрите на тирозин. Что ты видишь? Это похоже на ароматический фенилаланин с группой ОН в пара-положении (орто / мета / пара 2-е видео).
С одной стороны, у нас очень полярная группа ОН, способная образовывать водородные связи, но с другой стороны, ОН крошечный по сравнению с размером бензильной группы (Ch3-фенил). Эта загадка — частый источник путаницы, но если вы это поймете, вы поймете, что тирозин, хотя и полярный, все же является гидрофобной аминокислотой.
Полярные гидрофильные аминокислоты
Hydrophilic, как следует из названия, происходит от hydro-water и philic — loving .
Полярность возникает из-за разницы в электроотрицательности между связанными атомами 0,5–1,9. Хотя вам не обязательно знать эти значения для MCAT, вы должны понимать, что полярные связи будут существовать, когда N и O связаны с неуглеродными атомами.
Разницы в электроотрицательности достаточно, чтобы создать небольшое разделение заряда или полярности.И поскольку подобное притягивает подобное, эти частично заряженные группы будут притягиваться противоположно заряженными или частично заряженными группами, такими как вода. Эти группы будут скручивать полипептидную цепь, чтобы взаимодействовать друг с другом и с водой.
Гидрофобные группы откручиваются от этих боковых цепей.
Серин
Сер
S
Думайте о серине как о аланине с присоединенной группой ОН. В отличие от тирозина, ОН составляет большинство в этой молекуле, и его полярности достаточно, чтобы влиять на всю группу.Это делает серию полярной и очень гидрофильной.
Треонин
Thr
T
Есть несколько способов взглянуть на эту группу. Вы можете представить его как серин с дополнительной метильной группой или как валин, но с ОН, заменяющим одну из метильных групп. Я помню, что THREEonine имел 3 разные группы: CH, Ch4 и OH.
Подобно серину, эта переменная группа является полярной и гидрофильной.
Аспарагин
Asn
N
Попробуйте следующее: очень быстро сделайте невнятную речь, произнося «аспарагин».Похоже, вы говорите AS… N, именно так я запомнил трехбуквенное сокращение для этой аминокислоты. Nh3 в конце этой молекулы заставляет вас думать «основа», но посмотрите на ее соседа. Nh3 рядом с карбонилом образует амид, который не любит действовать как кислота или основание в стандартных физиологических условиях. Однако с частичными зарядами и способностью к Н-связыванию как у карбонильного кислорода, так и у групп Nh3 мы получаем полярную гидрофильную аминокислоту.
Глютамин
Gln
Q
Я считаю, что обе «перенасыщенные» аминокислоты «съели» лишнюю группу Ch3.Глютамин имеет ту же структуру, что и аспарагин, но с дополнительным прожорливым Ch3 в его цепи. Как и аспарагин, он полярный и гидрофильный.
Боковые цепи кислотных и основных аминокислот
Кислотность и основность аминокислот — еще один источник недоумения среди студентов. Если он начинается как кислота, становится ли он основанием? Как мне найти заряд? И так далее.
Вот уловка: карбоновая КИСЛОТА в боковой цепи даст вам кислую аминокислоту. Когда карбоксильная группа депротонирована, вы получаете СОЛЬ конъюгата с основанием.Поэтому, если вы видите солевой вариант боковой цепи карбоновой кислоты, хотя ТЕХНИЧЕСКИ это «конъюгированное основание», мы будем просто называть его солевым вариантом кислой аминокислоты. То же и с базой. Обратите внимание на «неотвлекающие» атомы азота в боковой цепи.
Кислотные аминокислоты
Кислые аминокислоты должны выглядеть очень знакомо по сравнению с аспарагином и глутамином. И это потому, что все в них одинаково, за исключением конечной функциональной группы. Амиды (обсуждаемые выше) полярны, но если Nh3 заменить на группу ОН, вы получите кислую карбоксильную группу.
Аспарагиновая кислота / аспартат
Asp
D
Аспарагиновая кислота относится к протонированной кислотной форме аминокислоты. При депротонировании вы часто будете видеть конъюгированную основную соль, называемую аспартатом. Это стандартная номенклатура карбоновых кислот.
Подумайте об этановой кислоте. Его обычное название — уксусная кислота. При депротонировании вы получаете ацетат. Кислоты очень стабильны в воде, поскольку они частично заряжены в своей протонированной форме и полностью заряжены в своей депротонированной форме.Это делает их очень гидрофильными.
Глутаминовая кислота / глутамат
Glu
E
И снова у нас есть аминокислота «обжора» с дополнительной группой Ch3. Глутаминовая кислота относится к протонированной кислотной форме, а глутамат относится к форме депротонированного конъюгата основание / соль.
Подобно аспарагиновой кислоте, глутаминовая кислота очень устойчива в воде и, следовательно, гидрофильна.
Основные аминокислоты
Основные аминокислоты содержат атом азота с неподеленной парой электронов, способный атаковать атом водорода.Когда основная аминокислота подвергается воздействию низкого (кислого) pH, она захватывает один из свободных протонов в растворе с образованием соли конъюгированной кислоты. Их легко узнать по положительному азоту в боковой цепи. В отличие от кислых аминокислот, для этих солей конъюгатов не существует «общепринятых названий», которые можно было бы запомнить.
Лизин
Лиз
K
Лизин — простая основная аминокислота. Несмотря на длинную и потенциально гидрофобную цепь, на конце у нее есть основной Nh3. В своей основной депротонированной форме лизин является нейтральным и гидрофильным; однако, если лизин обнаружен при физиологическом pH, он улавливает H + из раствора с образованием соли Nh4 +.Соли заряженные и поэтому определенно гидрофильные
Аргинин
Арг
R
Аргинин сбивает с толку и заставляет меня сказать ARGh или R для краткости. Почему? Основная часть этой группы переменных состоит из NH, C = N-H и Nh3.
Два атома азота с одинарной связью могут использовать свои неподеленные пары для резонанса с углеродом и атомом азота с двойной связью. Это делает их электроны НЕДОСТУПНЫМИ для использования в качестве базы. Однако азот с двойной связью использует свою пи-связь для резонанса, оставляя свою свободную неподеленную пару (показана черным), чтобы действовать как основной азот в этой группе.
Аргх!
Гистидин
Гис
H
Гистидин — еще одно сложное основание по той же причине, что и аргинин. КАКОЙ азот является основным? Посмотрите на рисунок здесь, особенно на неподеленные пары двух атомов азота. Гистидиновое кольцо представляет собой гетероциклическое ароматическое соединение. Верхний атом азота не имеет пи-связи. Это означает, что он должен использовать свои неподеленные пары для участия в резонансе.
Нижний атом азота уже имеет резонирующую пи-связь. Это оставляет его одинокие электроны (показаны черным) свободными для захвата протона, что делает его основным атомом.
Заключение
Аминокислоты являются важным компонентом биологических структур и вашего понимания биологии и биохимии на MCAT. И поэтому, когда вы пытаетесь запомнить все об этих 20 аминокислотах, важно, чтобы вы также понимали, почему у вас есть полярные и неполярные аминокислоты, что делает переменную группу гидрофобной или гидрофильной, и, конечно же, логику протонированных / депротонированных кислот. и основные аминокислоты.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Лекция 26
Лекция 26 Лекция 27 АминокислотыВ 1820-х годах было обнаружено, что нагревание целлюлозы в кислоте заставил его разбиться на более мелкие составляющие.Это было «открытие» гидролиза . Французский ученый, Анри Браконно попробовал такое же лечение на желатине . Он кипятил его несколько дней в кислоте и сумел выделить белый кристаллический Вещество он назвал глицином. Это первая аминокислота . кислота , которую необходимо выделить и охарактеризовать. При pH = 7,0 он имеет структура, показанная ниже.
Она называется аминокислотой по довольно очевидным причинам.Он имеет как карбоновую кислоту, так и функцию . в виде функции амина и .
Все аминокислоты, продуцируемые живыми системами, называются a. аминокислоты. Атом углерода, связанный с карбоновой кислотой углерод называется углеродом, C . Если остаток амина связан с C a , тогда это а-аминокислота.
Все аминокислоты из белков являются L-энантиомерами . В По проекции Фишера наиболее окисленный углерод помещен вверху. Если остаток амина находится слева, это L-энантиомер.
В целом структура аминокислот такова:
где R может быть H , в случае глицина алкил группа или гетероциклическое кольцо (циклическая группа с не углеродные члены).Все аминокислоты, кроме глицина, будут хиральных соединений , потому что C a связаны до четырех различных заместителей, группа R, карбоксильная группа, аминогруппа и водород.
Физические свойстваАминокислоты представляют собой твердые кристаллические вещества с очень высокими температурами плавления, свыше 200 o C. Они хорошо растворимы в воде. Все это говорит о том, что они существуют как ионных, разновидностей.При нейтральных значениях pH они существуют как цвиттериона , с карбоксильная группа депротонирована, а аминогруппа протонирована.
Кислотно-основная химия аминокислот суммирована ниже:
При низком pH аминокислота протонируется при и аминные и карбоксильные функции. При этом pH он несет нетто. положительный заряд и может рассматриваться как дипротонная кислота , кислота с двумя ПК и .
При высоком уровне pH как карбоксильная, так и аминогруппа депротонируются. При этих значениях pH аминокислота несет отрицательный результат заряда , а это двухосновных .
При некотором промежуточном pH , pH , аминокислота представляет собой цвиттерионы, и несет без начислений . Это называется изоэлектриком . точка аминокислот и обозначена как pH I .
При этом значении pH аминокислота будет неподвижна в электрическом поле. При низком pH аминокислота несет положительный заряд и перейдет на катод . При высоком pH отрицательно заряженная аминокислота переместится к аноду. Это процедура используется для анализа и очистки аминокислот и белков. Это называется электрофорез . Раствор аминокислот или белков помещаются при заданном pH на целлюлозную опору, зажатую до источник.Затем аминокислоты перемещаются по целлюлозе в соответствии с к их pH I и напряженности электрического поля.
Титрование аминокислотТитрируем раствор аминокислоты аланин с помощью R = СН 3 .
Значения pK a двух кислотных групп, COOH и NH 3 + , 2.34 и 9,69 соответственно. Эти значения типичны для pK a карбокси и аминогрупп на a углерод. Начинаем титрование при достаточно низком pH (ниже 2,0). чтобы гарантировать, что аминокислота полностью протонирована. Мы будем титровать раствор аланина с сильным основанием NaOH. Титрование кривая показана ниже. Обратите внимание на две «волны» поскольку мы титруем дипротоновую кислоту .
Когда мы добавляем ОН, мы начинаем депротонировать более сильную из двух кислоты, карбоксильная группа, группа с низшим pK a .Когда мы депротонировали половину COOH, pH = pK a = 2,34. Это потому, что Хендерсон-Хассельбах уравнение сводится к этому, когда [A — ] = [HA]. Это точка на полпути на кривой титрования для этого функционала группа, COOH.
В начале титрования аминокислота имела формальный заряд +1 , как указано в верхней части кривой титрования.Когда мы вдвое добавляем на один эквивалент OH — , один моль основания на каждый моль аланина, мы полностью депротонировали COOH. Это первая точка эквивалентности в этом титрование, когда весь нижний pK и кислота были нейтрализован. Значение pH, при котором это происходит, можно рассчитать как приблизительно среднее значение pK a COOH и NH 3 + , (2.34 + 9,69) / 2 = 6. При этом pH, аланин будет нести без чистого заряда . Карбоксил группы будут нести отрицательный заряд, но аминогруппа все еще будет быть полностью протонированным и иметь положительный заряд. Это изоэлектрическая точка аланина.
Дальнейшее добавление OH — начинает депротонировать второй кислотная функция, NH 3 + . Когда половина амин депротонирован, мы достигли промежуточной точки для второго кислого вида.Опять же, pH = pK a , что для амина — 9,69. Это вторая буферная область кривая титрования с относительно пологим наклоном из-за наличия слабой кислоты (NH 3 + ) и ее соли (NH 2 )
Изоэлектрическая точка около pH — 6,0 характерна для аминокислот. которые не имеют кислотных или основных групп R .
А как насчет аминокислоты, глутаминовой кислоты , с R = C 2 H 4 COOH ?
рК а1 = 3.20 (а-COOH)
pK a2 = 4,25 (R — COOH)
pK a3 = 9,67 (a-NH 3 + )
Он подвергнется следующей серии кислотно-основных реакций:
Обратите внимание, что при низком pH, ниже pH = 2,0, глутаминовая кислота несет чистый положительный заряд . После добавления один эквивалент базового , самого низкого pK группа будет иметь депротонирован, давая нет чистый заряд на глутаминовой кислота.Точка на полпути этой первой волны титрования будет при pH = pK 1 = 3,2 и pH первого эквивалента точка будет происходить примерно при pH = (3,2 + 4,25) / 2 = 3,7, среднее из первых двух ПК и гг. Это тоже изоэлектрик точка глутаминовой кислоты, pH I . Дополнение более OH — начинает удалять второй кислый протон, из COOH R-группы.Ниже показана кривая титрования. для глутаминовой кислоты с сильным основанием NaOH .
При физиологическом pH (7,0) эта аминокислота несет формальный отрицательный заряжать. Его изоэлектрическая точка находится при pH = 3,7.
Если бы мы посмотрели при титровании аминокислоты с основной группой R , мы бы обнаружили, что изоэлектрическая точка появилась позже в титрование.Ниже показано краткое изложение химического состава кислоты / основания. основной аминокислоты, имеющей только одну группу COOH , на C a , но два NH 3 + группы , один на C a и другие по R-группе. Эта аминокислота представляет собой лизин с pK a1 = 2,18 (a-COOH), pK a2 = 8,95 (a-NH 3 ) и pK a3 = 10.53 (R-NH 3 ). .
При низком pH основные аминокислоты несут чистый заряд , равный +2 , которая затем уменьшается по мере депротонирования групп. Для пример выше, изоэлектрическая точка появится после добавления из два эквивалента основания с приблизительным pH 9,74, (8,95 + 10,53) / 2.Каждая аминокислота имеет характерную изоэлектрическую точку. Белки состоят из аминокислот, поэтому имеют изоэлектрические точки, сумма всех составляющих их аминокислот.Как белки не несут чистого заряда формы в своей изоэлектрической точке, становящиеся менее растворим в водных растворах и склонен к осаждению . Без чистого заряда молекулы белка больше не электростатически отталкивается. Это хорошо видно на примере процесса изготовления сыра. Казеин — это молочный белок с pH , I = 4,7 . Молоко обычно имеет pH около 6,3. Бактерии добавлены в молоко вырабатывают молочную кислоту, которая снижает pH.По мере приближения pH 4.7, молекулы казеина теряют свой отрицательный заряд и выпадают в осадок, изготовление творога.
Есть 20 аминокислот, имеющих биологическое значение. Они классифицируются в соответствии с природой их R-групп. Одна группа имеет неполярные группы R , в основном алкильные группы. Эти амино кислоты имеют изоэлектрическую точку около 6,0, как мы видели с аланином.
Второй класс аминокислот имеет полярных боковых цепи, R группы, содержащие дипольные моменты.
Третий и четвертый классы аминокислот — это аминокислоты с кислотностью. или основные R-группы. Все они кратко изложены на страницах 186 и 187 вашего учебника и страницы 94-96 Syllabus.
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота AlaАланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость.В биосинтезе белков участвует только l-стереоизомер.
Аминокислота ArgВ организме человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован организмом в оксид азота, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования по этим направлениям все еще продолжаются.Аргинин также может быть получен синтетическим путем, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аминокислота AsnВ 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника.Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих. Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота AspОбнаруженная в белках в 1868 году аспарагиновая кислота обычно содержится в белках животных, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.
Аминокислота CysЦистеин особенно богат белками волос, копыт и кератином кожи, который был выделен из мочевого камня в 1810 году и из рога в 1899 году. Впоследствии он был химически синтезирован. и структура решена в 1903–1904 гг.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка.Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере в белках млекопитающих.
Люди с генетическим заболеванием цистинурия не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.
Аминокислота GlnГлутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году. Глютамин — самая распространенная в нашем организме аминокислота, которая выполняет несколько важных функций. У людей глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Аминокислота GluГлутаминовая кислота была выделена из глютена пшеницы в 1866 году и химически синтезирована в 1890 году.Обычно встречается в белках животных, только l-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из обычного промежуточного продукта α-кетоглутаровой кислоты. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты может действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками.Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота Gly
Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной неактивной оптически (без d- или l-стереоизомеров ). Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
Аминокислота His
Гистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Аминокислота Ile
Изолейцин был выделен из сахарной патоки свеклы в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые она включена.
У людей, страдающих редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, есть дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина.Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Аминокислота лей
Лейцин был выделен из сыра в 1819 году и из мышц и шерсти в его кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер присутствует в белке млекопитающих и может расщепляться на более простые соединения ферментами организма.Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Аминокислота Lys
Лизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была выяснена в 1902 году. Лизин важен для связывания ферментов с коферментами и играет важную роль в способ функционирования гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете.Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Аминокислота Met
Метионин был выделен из казеина молочного белка в 1922 году, и его структура была решена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие продукты из соевого шрота.
Аминокислота Phe
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году. Человеческий организм обычно способен расщеплять фенилаланин на тирозин, однако У людей с наследственной фенилкетонурией (ФКУ) фермент, который выполняет это преобразование, неактивен.Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому переход на диету с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Профи-аминокислота
В 1900 году пролин был синтезирован химическим путем. На следующий год он был выделен из казеина из молочного белка, и его структура оказалась такой же. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих.Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Аминокислота Ser
Серин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года.Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем объединения с остатком серина в активном центре ацетилхолинэстеразы, полностью ингибируя фермент. Активность эстеразы важна для расщепления нейромедиатора ацетилхолина, в противном случае повышается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Аминокислота Thr
Треонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Аминокислота Trp
Структура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих.В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота Tyr
В 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории и его структура была определена в 1883 году.Присутствующий только в l-стереоизомере в белках млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие тяжелым генетическим заболеванием фенилкетонурия (ФКУ) неспособны превращать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится отчетливой и темнеет на воздухе.
