38.4.Структура миофибриллы

Миофибриллы имеют вид нитей диаметром 12 мкм и длиной, сопоставимой с протяженностью волокна. Их количество в отельном волокне варьирует в широких пределах (от нескольких десятков до 2000 и более). Они обладают собственной поперечной исчерченностью, причем в мышечном волокне они располагаются столь упорядоченно, что А- и I-диски одних миофибрилл точно совпадают с аналогичными дисками других, обусловливая поперечную исчерченность всего волокна. Структурно-функциональной единицей миофибриллы является саркомер (миомер).
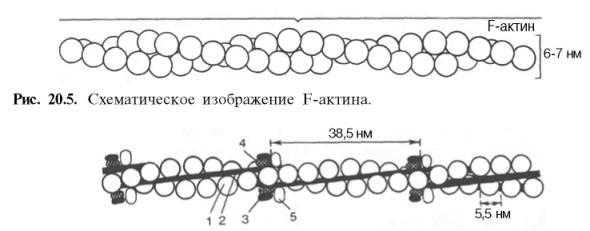
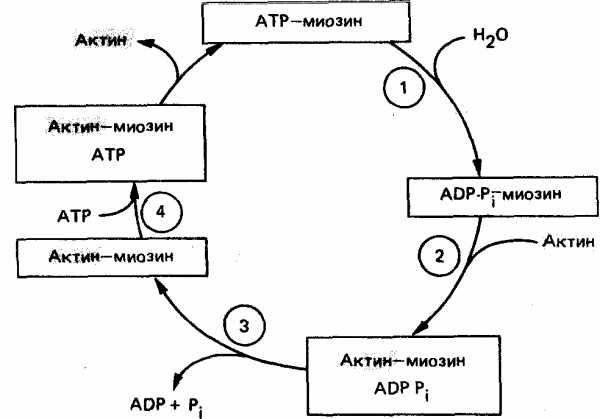
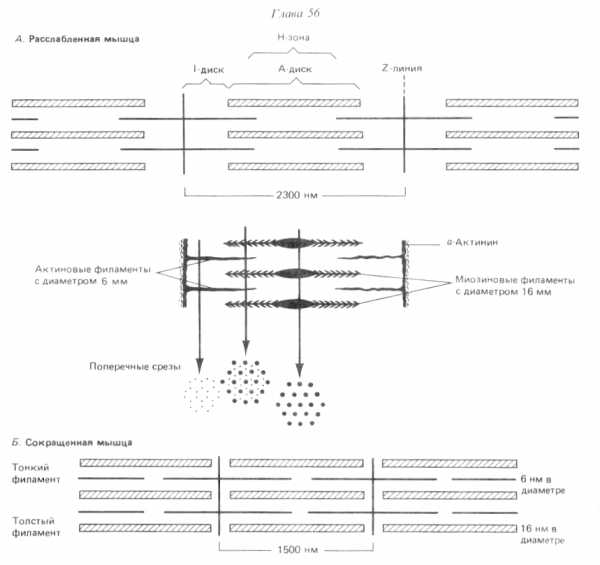
Саркомер (миомер) представляет собой участок миофибриллы, расположенный между двумя телофрагмами (Z-линиями) и включающий A-диск и две половины I-дисков по одной половине с каждой стороны. В расслабленной мышце длина саркомера составляет около 2-3 мкм, а ширина его участков выражается соотношением Н : А : I = 1:3:2; при сокращении мьшшы саркомер укорачивается до 1.5 мкм. Миофибрилла типичного мышечного волокна человека длиной около 5 см насчитывает порядка 20 тыс. последовательно расположенных саркомеров.
Структура саркомера представлена упорядоченной системой толстых и тонких белковых нитей (миофиламентов). Толстые нити (диаметром около 10-12 нм и длиной 1.5-1.6 мкм) связаны с мезофрагмой и сосредоточены в А-диске, а тонкие (диаметром 7-8 нм и длиной 1 мкм) прикреплены к телофрагмам, образуют I-диски и частично проникают в А-диски между толстыми нитями (более светлый участок А-диска, свободный от тонких волокон, называется полоской Н). В саркомере насчитывается несколько сотен толстых нитей. По сечению саркомера толстые и тонкие нити располагаются высокоорганизованно в узлах гексагональной решетки. Каждая толстая нить окружена шестью тонкими, каждая из тонких нитей частично входит в окружение трех соседних толстых.
38.5.Механизм сокращения мышечного волокна
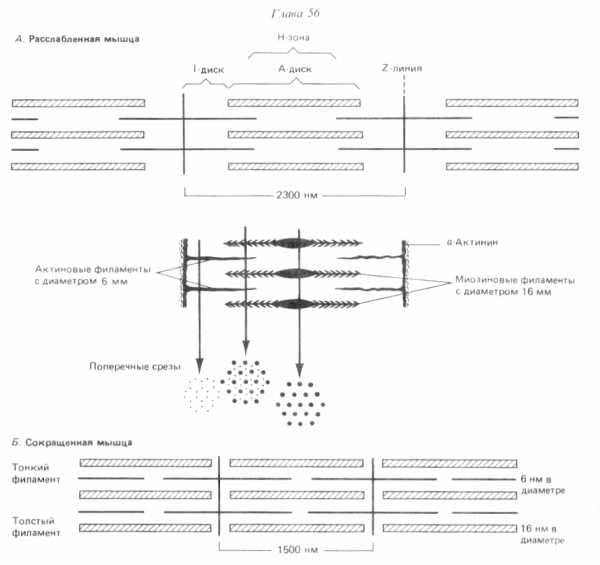
Кроме Са2+ , для взаимодействия актиновых и миозиновых миофиламент, как отмечалось, необходим АТФ (аденозинтрифосфат) –низкомолекулярное вещество, служащее источником энергии. При этом взаимодействии АТФ разрушается (до АДФ и фосфата), благодаря АТФазной активности миозина. В свою очередь, АТФ образуется в реакциях распада гликогена и других энергетических субстратов.Механизм участия атф в сокращении
Условие: закончился очередной цикл взаимодействия тонких и толстых МФ, но между ними ещё сохраняются мостики
1)Связывание АТФ и разрыв мостиков
Молекулы АТФ связываются с головками миозина (в соотношении 1:1), и только это приводит к отсоединению головок от тонких МФ (т.е. разрыву мостиков). Поэтому после смерти развивается трупное окоченение: в отсутствие АТФ мостики между МФ (образовавшиеся в результате гидролиза последних запасов АТФ) не могут разорваться.
2)Гидролиз АТФ и изменение конформации миозина
Головки миозина гидролизуют АТФ до АДФ и фосфата; при этом каждая головка принимает напряжённую конформацию (за счёт энергии гидролиза АТФ) и сохраняет связь с АДФ.
3)Замыкание мостиков Изменение конформации головок делает возможным их взаимодействие с тонкими МФ — замыкание мостиков.
4)Перемещение МФ Головки миозина, стремясь вернуться в ненапряжённое состояние, развивают тянущее усилие, которое приводит к перемещению толстых и тонких МФ друг относительно друга. Одновременно диссоциирует АДФ, что делает возможным в следующем цикле связывание очередных молекул АТФ и разрыв мостиков.
Таким образом, энергия гидролиза АТФ вначале переходит в энергию напряжённой конформации миозина, которая затем используется для совершения механической работы (относительного перемещения МФ).
studfiles.net
110. Молекулярная структура миофибрилл. Структура и функция основных белков миофибрилл миозина, актина, тропомиозина, тропонина. Основные белки миофибрилл
Белок | Доля белка % | Его мол. масса, kDa | Его функция |
Миозин | 44 | 510 | Главный компонент толстых филаментов. Образует связи с актином. Движется по актину за счёт гидролиза АТФ. |
Актин | 22 | 42 | Главный компонент тонких филаментов. Во время сокращения мышцы по нему движется миозин. |
Титин | 9 | 2500 | Большой гибкий белок, образующий цепь для связывания миозина с Z-диском. |
Тропонин | 5 | 78 | Комплекс из трёх белков, регулирующий сокращение при связывании с ионами Ca2+. |
Тропомиозин | 5 | 64 | Связанный с актиновыми филаментами стержневидный белок, блокирующий движение миозина. |
Небулин | 3 | 600 | Длинный нерастяжимый белок, связанный с Z-диском и идущий параллельно актиновым филаментам. |
К группе миофибриллярных белков относятся миозин, актин и актомиозин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц
Молекулярная масса миозина скелетных мышц около 500000. Молекула миозина (рис. 20.3) имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с мол. массой 205000–210000 и несколько коротких легких цепей, мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы), способную соединяться с актином. Эти «головки» выдаются из основного стержня молекулы. Легкие цепи, находящиеся в «головке» миозиновой молекулы и принимающие участие в проявлении АТФазной активности миозина, гетерогенны по своему составу.
Строение молекулы миозина
Актин, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Известны две формы актина: глобулярный актин (G-актин) и фибриллярный актин (F-актин). Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полимеризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой (рис. 20.5). Актиомиозин образуется при соединении миозина с F-актином. Актиомиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2+и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны. Как отмечалось, кроме рассмотренных основных белков, в миофибриллах содержатся также тропомиозин, тропонин и некоторые другие регуляторные белки.
Структура тонкого филамента. 1 — актин; 2 — тропомиозин; 3 — тропонин С; 4 — тропонин I; 5 — тропонин Т.
Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4–7% всех белков миофибрилл. Тропонин – глобулярный белок, открытый С. Эбаси в 1963 г.; его мол. масса 80000. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозин-связывающий) обеспечивает связь с тропомиозином.
Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+ . Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии цАМФ-зависимых протеинкиназ.
studfiles.net
Строение миофибриллы
Миофибрилла состоит из одинаковых повторяющихся элементов — саркомеров.
Саркомер— функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т,Iи С. Диаметр тонких филаментов составляет около 6 нм.
Каждый «тонкий» филамент занимает симметричное положение между тремя толстыми филаментами, а каждый «толстый» филамент симметрично окружен шестью «тонкими» филаментами.
Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А(анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса Мпересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину 150 нм, в не заходят «тонкие» нити актина.
Светлый участок называется диск I(изотропная зона), он образован «тонкими» нитями актина. Размер дискаIуменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:
Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
studfiles.net
10. Строение миофибрилл, структура саркомера, сократительные белки. Молекулярно-клеточные механизмы мышечного сокращения (модель скользящих нитей), стадии цикла поперечных мостиков.
Миофибриллы — это сократимые волокна, находящиеся в структуре сердца и поперечно-полосатых мышц. Диаметр миофибриллы от 0,5 до нескольких мкм. В поперечном сечении миофибриллы округлы, угловаты или овальны. Миофибриллы входят в состав всех мышечных (сокращающихся) тканей. Основная часть миофибриллы представляят собой тончайшие нити — миофиламенты. Они разделяются на два типа: актиновые (состоящие из актина, длина этих нитей достигает от 1000, до 1100 нанометров) и миозиновые (состоят из миозина, длина 1500 нанометров). На продольном разрезе мышцы, видны чередующие светлые и тёмные полосы. Тёмные — это А-диски, светлые- I-диски. Имеются в миофибриллах и другие белки: тропомиозин В (в тонких протофибриллах мышц всех типов) и тропомиозин А, или парамиозин (в толстых протофибриллах мышц с двойной косой исчерченностью), а также a и b актинины, тропонин и др.
Саркомер (повторяющийся сегмент миофибриллы) состоит из двух половин светлого, оптически изотропного диска (I) и одного темного, анизотропного (H) диска. Соотношение тонких и толстых нитей в саркомере составляет 2:1. Миозиновые и актиновые нити саркомера расположены так, что тонкие нити могут свободно входить между толстыми, т. е. «задвигаться» в A-диск, что и происходит при сокращении мышцы. В силу этого длина светлой части саркомера — I-диска — может быть разной: при пассивном растяжении мышцы она увеличивается до максимума, при сокращении может уменьшаться до нуля.
Сократительные белки: миозин и актин. Миозин является одним из основных сократительных белков мышц, составляющий около 55% от общего количества мышечных белков. Из него состоят толстые нити (филаменты) миофибрилл. Актин – второй сократительный белок мышц, который составляет основу тонких нитей. Известны две его формы – глобулярный G-актин и фибриллярный F-актин. На его долю приходится около 25% общей массы мышечного белка.
Сокращение происходит согласно распространенной модели А. Хаксли (модель скольжения или «модель скользящий филамент – вращающийся мостик»), за счет скольжения актиновых нитей в промежутках между миозиновыми. Этот процесс осуществляется поперечными мостиками миозина. Поперечные мостики представляют собой головы миозина (миозин состоит из 2-х субъединиц – легки меромиозин – хвост миозиновой нити и тяжелый меромиозин). Тяжелый меромиозин заканчивается субъединицей С-1 – головкой миозиновой молекулы. Головка соединена с телом миозиновой нити с помощью субфрагмента С-2 (шейка), который может изгибаться. Головка обладает АТФ-азной активностью, которая проявляется, однако, в присутствии актина, когда головка будет непосредственно прикреплена к актиновой нити.
В условиях покоя мостик (головка) не прикреплен к актиновой нити – мешает тропомиозин (фибриллярный белок). На кончике мостика находится молекула АТФ. Когда появляется кальций и отодвигается тропомиозин от актиновой нити (снимается экранировка), мостик под углом 90° цепляется к актиновой нити. Тут же происходит активация АТФ-азной активности и как следствие – гидролиз АТФ с выделением порции энергии. Эта энергия используется для того, чтобы создать крутящийся момент («гребок»), в результате которого мостик проталкивает актиновую нить примерно на 10 нм (это меньше 1% длины саркомера). Если рядом с мостиком имеется свободная молекула АТФ, то она встраивается на вершину мостика и обеспечивает отрыв мостика от актиновой нити. Если в среде много кальция, то актиновая молекула по-прежнему свободна от экрана (от тропомиозина), и потому мостик вновь прикрепляется к нити, но уже в другом месте, и вновь повторяется цикл. За период укорочения (напряжения) мостик успевает совершить 50 циклов («гребков»), в результате чего длина саркомера уменьшается примерно на 50%. Если уровень кальция снижается (в результате активности кальциевого насоса и прекращения выхода кальция из терминальной цистерны), то наступает процесс расслабления (удлинения). В случае, когда АТФ исчерпана, наступает ригор мышцы – нет расцепления между актиновой и миозиновой нитями. Это имеет место, например, при трупном окоченении.
Последовательность событий, начиная от связывания поперечного мостика с тонким филаментом и до момента, когда система готова к повторению процесса, называется рабочим циклом поперечных мостиков. Каждый цикл состоит из четырех стадий:
— прикрепление поперечного мостика к тонкому филаменту;
— движение поперечного мостика, создающее напряжение тонкого филамента;
— отсоединение поперечного мостика от тонкого филамента;
— получение поперечным мостиком энергии, после чего он снова готов к связыванию с тонким филаментом и повторению цикла.
Каждый поперечный мостик совершает свой рабочий цикл независимо от других мостиков; в любой момент процесса сокращения лишь некоторые из них связаны с прилегающими тонкими филаментами и создают тянущее усилие, тогда как другие находятся в стадии отсоединения.
studfiles.net
Строение миофибриллы
Миофибрилла состоит из одинаковых повторяющихся элементов — саркомеров.
Саркомер— функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т,Iи С. Диаметр тонких филаментов составляет около 6 нм.
В центре саркомера, между «тонкими» филаментами, располагаются «толстые» филаменты. «Толстые» филаменты имеют диаметр около 16нм, они образованы молекулами миозина. На поверхности «толстого» филамента с промежутками в 14 нм располагаются головки миозина, с помощью которых «толстые» филаменты взаимодействуют с актином «тонких» филаментов. В центре «толстых» филаментов на участке в 150 нм миозиновых головок нет.
Каждый «тонкий» филамент занимает симметричное положение между тремя толстыми филаментами, а каждый «толстый» филамент симметрично окружен шестью «тонкими» филаментами.
Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А(анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса Мпересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину 150 нм, в не заходят «тонкие» нити актина.
Светлый участок называется диск I(изотропная зона), он образован «тонкими» нитями актина. Размер дискаIуменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:
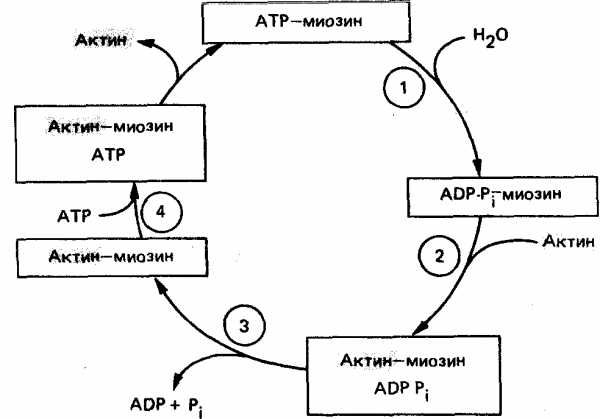
Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
studfiles.net
Строение миофибриллы
Миофибрилла состоит из одинаковых повторяющихся элементов — саркомеров.
Саркомер— функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т,Iи С. Диаметр тонких филаментов составляет около 6 нм.
В центре саркомера, между «тонкими» филаментами, располагаются «толстые» филаменты. «Толстые» филаменты имеют диаметр около 16нм, они образованы молекулами миозина. На поверхности «толстого» филамента с промежутками в 14 нм располагаются головки миозина, с помощью которых «толстые» филаменты взаимодействуют с актином «тонких» филаментов. В центре «толстых» филаментов на участке в 150 нм миозиновых головок нет.
Каждый «тонкий» филамент занимает симметричное положение между тремя толстыми филаментами, а каждый «толстый» филамент симметрично окружен шестью «тонкими» филаментами.
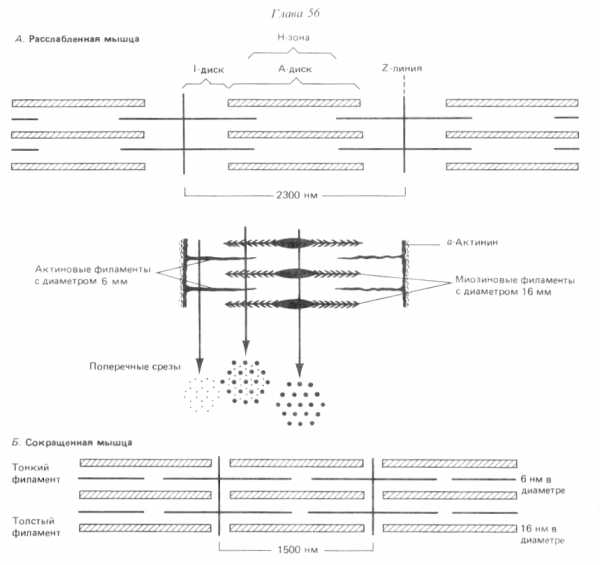
Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А(анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса Мпересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину 150 нм, в не заходят «тонкие» нити актина.
Светлый участок называется диск I(изотропная зона), он образован «тонкими» нитями актина. Размер дискаIуменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:
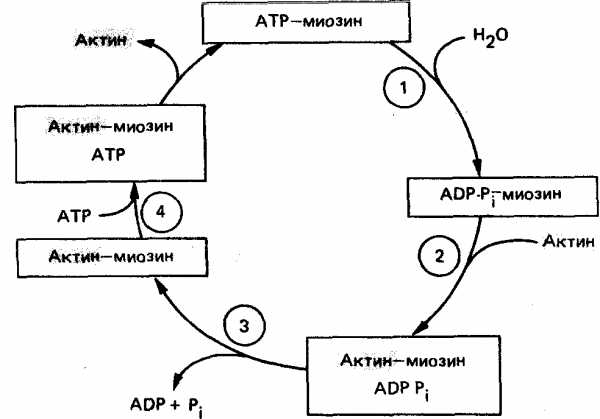
Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
studfiles.net
Строение миофибриллы
Миофибрилла состоит из одинаковых повторяющихся элементов — саркомеров.
Саркомер— функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т,Iи С. Диаметр тонких филаментов составляет около 6 нм.
В центре саркомера, между «тонкими» филаментами, располагаются «толстые» филаменты. «Толстые» филаменты имеют диаметр около 16нм, они образованы молекулами миозина. На поверхности «толстого» филамента с промежутками в 14 нм располагаются головки миозина, с помощью которых «толстые» филаменты взаимодействуют с актином «тонких» филаментов. В центре «толстых» филаментов на участке в 150 нм миозиновых головок нет.
Каждый «тонкий» филамент занимает симметричное положение между тремя толстыми филаментами, а каждый «толстый» филамент симметрично окружен шестью «тонкими» филаментами.
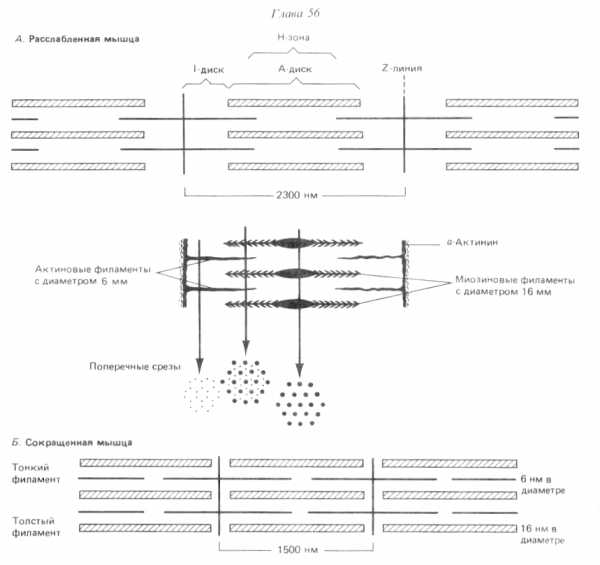
Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А(анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса Мпересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину 150 нм, в не заходят «тонкие» нити актина.
Светлый участок называется диск I(изотропная зона), он образован «тонкими» нитями актина. Размер дискаIуменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:

Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
studfiles.net
