Микростроение мышц. Миофибриллы | Bodybuilding Вики
Мышечное волокно Править
Мышечные волокна представляют собой сильно вытянутые многоядерные клетки крупного размера длиной от 0,1 до 2-3 см, а в некоторых мышцах даже более 10 см. Толщина мышечных клеток около 0,1 -0,2 мм. Как и любая клетка, мышечное волокно содержит такие органеллы, как ядра (мышечная ткань многоядерна), митохондрии, рибосомы, цитоплазматическую сеть и клеточную оболочку (сарколемму). Особенностью мышечных клеток является наличие миофибрилл — сократительных элементов.
Миофибриллы Править
Строение мышцы
1. Миофибриллы. 2. Митохондрии 3. Постсинаптическая мембрана.
5. Пресинаптическая мембрана 8. Ядро 9. Актиновый филамент
10. Саркомер 11. Миозиновый филамент 12. Миелиновая оболочка
13. Нервные волокна 14. Клеточная мембрана (сарколемма)
17. Саркоплазматический ретикулум
Миофибри́ллы — органеллы клеток поперечнополосатых мышц, обеспечивающие ихсокращение. Служат для сокращений мышечных волокон. Миофибрилла — нитевидная структура, состоящая из саркомеров. Каждый саркомер имеет длину около 2 мкм и содержит два типа белковых филаментов: тонкие миофиламенты из
Границы между филаментами (Z-диски) состоят из особых белков, к которым крепятся концы актиновых филаментов. Миозиновые филаменты также крепятся к границам саркомера с помощью нитей из белка титина (тайтина). С актиновыми филаментами связаны вспомогательные
белки — небулин и белки тропонин-тропомиозинового комплекса.
Миофибриллы — цилиндрические нити толщиной 1 — 2 мкм, идущие вдоль от одного конца мышечного волокна до другого. Изолированная миофибрилла способна сокращаться (в присутствии АТФ), именно она и есть сократимый элемент мышечной клетки.
У человека толщина миофибрилл составляет 1-2 мкм, а их длина может достигать длины всей клетки (до нескольких сантиметров). Одна клетка содержит обычно несколько десятков миофибрилл, на их долю приходится до 2/3 сухой массы мышечных клеток.
Митохондрии Править
Митохондрии — микроскопические пузырьки размером до 2-3 мкм, окруженные двойной мембраной. В митохондриях протекает окисление углеводов, жиров и аминокислот до углекислого газа и воды с использованием кислорода. За счет энергии, выделяющейся при окислении, в митохондриях осуществляется синтез АТФ. В тренированных мышцах митохондрии многочисленны и располагаются вдоль миофибрилл.
См. также Митохондрии
Ядра Править
Ядра окружены оболочкой — нуклеолеммой и содержат генетическую информацию для синтеза белков.
Ретикулум Править
Саркоплазматический ретикулум состоит из трубочек, канальцев и пузырьков, образованных мембранами и соединенных друг с другом. Саркоплазматический ретикулум с помощью особых трубочек, называемых Т-системой, связан с оболочкой мышечной клетки — сарколеммой. В ретикулуме находятся пузырьки, называемые цистернами. Эти пузырьки в большой концентрации содержат ионы кальция.
Саркоплазма Править
Саркоплазма занимает внутреннее пространство мышечных клеток и представляет собой коллоидный раствор, содержащий белки, гликоген, жировые капли и другие включения. Белки саркоплазмы составляют 25-30% от всех белков мышц. Среди элементов саркоплазмы есть некоторые, заслуживающие особого внимания:
а)ферменты гликолиза, расщепляющие гликоген/глюкозу до пировиноградной или молочной кислоты;
б)фермент креатинкиназа, участвующий в запуске фосфогенной энергетической реакции;
в) белок миоглобин, идентичный по строении белку крови гемоглобину. Благодаря этому белку в мышечной ткани создается запас кислорода.
г) азотсодержащие небелковые вещества — АТФ, АДФ, АМФ, Крф, креатин, креатинин (продукт распада КрФ)
д) аминокислоты глутаминовая кислота и глутамин
е) углеводы. Гликоген — основной углевод мышечной ткани. В очень малой концентрации присутствует свободная глюкоза.В процессе мышечной работы в саркоплазме происходит накопление продуктов углеводного обмена — лактата и пирувата.
ж) жиры.Запасной жир накапливается в мышцах, тренируемых на выносливость.
Сарколемма Править
Сарколемма. Каждое мышечное волокно окружено клеточной оболочкой — сарколеммой. Это липопротеидная (состоящая из жиров и белков) мембрана толщиной около 10 нм.
bodybuilding.fandom.com
Строение миофибриллы
Миофибрилла состоит из одинаковых повторяющихся элементов — саркомеров.
Саркомер — функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т, I и С. Диаметр тонких филаментов составляет около 6 нм.
В центре саркомера, между «тонкими» филаментами, располагаются «толстые» филаменты. «Толстые» филаменты имеют диаметр около 16нм, они образованы молекулами миозина. На поверхности «толстого» филамента с промежутками в 14 нм располагаются головки миозина, с помощью которых «толстые» филаменты взаимодействуют с актином «тонких» филаментов. В центре «толстых» филаментов на участке в 150 нм миозиновых головок нет.
Каждый «тонкий» филамент занимает симметричное положение между тремя толстыми филаментами, а каждый «толстый» филамент симметрично окружен шестью «тонкими» филаментами.

Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А (анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса М пересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину 150 нм, в не заходят «тонкие» нити актина.
Светлый участок называется диск I (изотропная зона), он образован «тонкими» нитями актина. Размер диска I уменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:
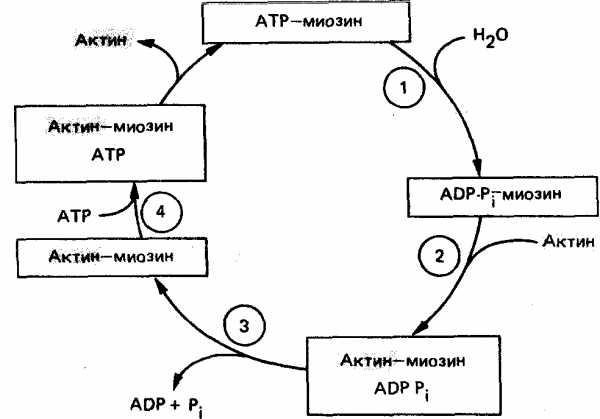
Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
studfiles.net
Строение и химический состав миофибрилл
Строение миофибрилл.
Сократительные элементы – миофибриллы – занимают большую часть объема миоцитов. В нетренированных мышцах миофибриллы расположены, рассеяно, а тренированных они сгруппированы в пучки, называемые полями Конгейма.
Микроскопическое изучение строения миофибрилл показало, что они имеют диаметр около 1 мкм и состоят из чередующихся светлых и темных участков или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую под микроскопом поперечную исчертанность всего мышечного волокна.
Использование электронного микроскопа с очень большим увеличением позволило расшифровать строение миофибрилл и установить причины наличия у них светлых и темных участков. Было обнаружено, что миофибриллы являются сложными структурами, построенными в свою очередь, из большого числа мышечных нитей дух типов – толстых и тонких.Толстые в два раза толще тонких, соответственно 15 и 7 нм.
Состоят миофибриллы из чередующихся пучков параллельно расположенных толстых и тонких нитей, которые концами заходят друг на друга.
Участок миофибриллы, состоящий из толстых нитей и находящимися между ними концов тонких нитей, обладает двойным лучепреломлением. Под микроскопом эти участки кажутся темными и получили название анизотропных или темных дисков (А-диски).
Тонкие участки состоят из тонких нитей и выглядят светлыми, так как не обладают двойным лучепреломлением и легко пропускают свет. Такие участки называются изотропными или светлыми дисками (I-диски).
Z Z Z
— — — —
— — — —
— — — —
I-диск А-диск
Рисунок. Схема строения миофибриллы
В середине пучка тонких нитей (диск I) поперечно располагается тонкая пластинка из белка, которая фиксирует положение мышечных нитей в пространстве и одновременно упорядочивая расположение А- и I-дисков многих миофибрилл. Эта пластинка хорошо видна под микроскопом и названа Z-пластинкой или Z-линией.
Диски А имеют в середине более светлую полосу – зону Н, пересекаемую более темной М – зоной.
Участок между соседними Z-линиями называется саркомер.Каждая миофибрилла состоит из нескольких сотен саркомеров (до 1000-1200).
саркомер
а
I-диск А-диск I-диск
Рисунок. Структура мышцы на разных уровнях организации: а –мышечное волокно; б – расположение миофибриллы в покоящейся мышце
Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплаз-матический ретикулум, составляющий 8—10% объема клетки; 3) несколько митохондрий. Длина саркомера обусловлена генетически и в ходе спортивной тренировки любой направленности не изменяется.
Диски I состоят только из тонких филаментов, а диски А – из филаментов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики (спайки) толщиной около 3 нм; расстояние между этими мостиками 40 нм.
Изучение химического состава миофибрилл показало, что тонкие и толстые нити образованы белками. Палочковидная молекула миозина состоит из двух идентичных основных цепей (по 200 кДа) и четырех легких цепей (по 20 кДа), общая масса миозина около 500 кДа.
Толстые нити (микрофиламенты) состоят из белка миозина.Эти белки образуют двойную спираль с глобулярной головкой на конце, присоединенной к очень длинному стержню. Стержень представляет собой двухцепочечную а-спирализованную суперспираль.
Миозиновые головки обладают АТФазной активностью, то есть способностью расщеплять АТФ. Второй участок миозина обеспечивает связь толстых нитей с тонкими. Общая структура миозина показана на рисунке.
хвост
Рисунок. Схематичное изображение молекулы миозина
Тонкие нити состоят из белков актина, тропонина и тропомиозина.
Основной белок в данном случае актин. Он обладает двумя важнейшими свойствами:
— образует фибриллярный актин, способный к быстрой полимеризации;
— актин способен соединяться с миозиновыми головками поперечными мостиками.
Актин–водорастворимый глобулярный белок с молекулярной массой 42 кДа; эта форма актина обозначается как G-актин. В мышечном волокне актин находится в полимеризованной форме, которая обозначается как F-актин. Тонкие филаменты мышцы образованы двунитчатыми актиновыми структурами, связанными между собой нековалентными связями.
Другие белки тонких нитей помогают актину осуществлять его функции.
Тропонин(Тн), молекулярная масса которого около 76 кДа. Он представляет собой сферическую молекулу, состоящую из трех разных субъединиц, получивших название в соответствии с выполняемыми функциями: тропомиозинсвязывающей (Тн-Т), ингибирующей (Тн-1) и кальцийсвязывающей (Тн-С). Каждый компонент тонких филаментов соединяется с двумя другими нековалентными связями:
F-актин — тропомиозин
Тн-1 Тн-Т
В мышце, где все рассмотренные компоненты собраны вместе в тонком филаменте (рис.), тропомиозин блокирует присоединение миозиновой головки к находящемуся рядом молекулами глобулярного актина тонких нитей (F-актину).
Молекулы миозина объединяются, образуя филаменты, состоящие примерно из 400 палочковидных молекул, связанных друг с другом таким образом, что пары головок миозиновых молекул ложатся на расстоянии 14,3 нм друг от друга; они располагаются по спирали (рис.). Миозиновые нити стыкуются «хвост к хвосту».
Рисунок. Упаковка миозиновых молекул при образовании толстого филамента
Миозин выполняет три биологически важные функции:
• При физиологических значениях ионной силы и рН молекулы миозина спонтанно образуют волокно.
• Миозин обладает каталитической активностью, т. е. является ферментом. В 1939 г. ВА Энгельгардт и М.Н. Любимова обнаружили, что миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения.
• Миозин связывает полимеризованную форму актина — основного белкового компонента тонких миофибрилл. Именно это взаимодействие, как будет показано ниже, играет ключевую роль в мышечном сокращении.
Дата добавления: 2015-10-19; просмотров: 2065;
ПОСМОТРЕТЬ ЕЩЕ:
Сократительные элементы – миофибриллы занимают бóльшую часть объёма мышечных клеток, их диаметр около 1 мкм. В нетренированных мышцах миофибриллы расположены рассеянно, а в тренированных они сгруппированы в пучки, называемые полями Конгейма.
Микроскопическое изучение строения миофибрилл показало, что они состоят из чередующихся светлых и темных участков или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую в микроскопе поперечную исчертанность всᴇᴦο мышечного волокна (рис. 9).
Рис 9. Электронная микрофотография продольного среза
участка мышечного волокна (увеличение в 10000 раз)
( Л. Страйер, 1985)
Использование электронного микроскопа с очень большим увеличением позволило расшифровать строение миофибрилл и установить причины наличия у них светлых и темных участков. Было обнаружено, что миофибриллы являются сложными структурами, построенными, в свою очередь, из большого числа мышечных нитей (протофибрилл или филаментов) двух типов – толстых и тонких.Толстые нити имеют диаметр 15 нм, тонкие – 7 нм.
Состоят же миофибриллы из чередующихся пучков параллельно расположенных толстых и тонких нитей, которые концами заходят друг в друга. На рис. 10 представлена схема строения миофибриллы.
Рис. 10. Схема строение миофибриллы
Участок миофибриллы, состоящий из толстых нитей и находящихся между ними концов тонких нитей, обладает двойным лучепреломлением. При микроскопии ϶тот участок задерживает видимый свет или поток электронов (в случае электронного микроскопа) и по϶тому кажется темным. Такие участки получили название анизотропныеили темные диски(А-диски).
Светлые участки миофибрилл состоят из центральных частей тонких нитей. Они сравнительно легко пропускают лучи света или поток электронов, так как не обладают двойным лучепреломлением и называются изотропными или светлыми дисками(I-диски).В середине пучка тонких нитей поперечно располагается тонкая пластинка из белка, которая фиксирует положение мышечных нитей в пространстве. Эта пластинка хорошо видна в микроскопе в виде линии, идущей поперек I-диска, и названа Z-пластинкойили Z-линией(рис. 8 и 9).
Участок миофибриллы между соседними Z-линиями получил название саркомер. Его длина 2,5-3 мкм. Важно отметить, что каждая миофибрилла состоит из нескольких сотен саркомеров (до 1000).
Изучение химического состава миофибрилл показало, что толстые и тонкие нити образованы белками.
Толстые нити состоят из белка миозина. Миозин – белок с молекулярнои̌ массой около 500 кДа, содержащий две очень длинные полипептидные цепи. Данные цепи образуют двойную спираль, но на одном конце эти нити расходятся и формируют шаровидное образование — глобулярную головку. По϶тому в молекуле миозина различают две части – глобулярную головку и хвост (рис. 11).
Рис. 11. Схема строения молекулы миозина
В состав толстой нити входит около 300 миозиновых молекул, а на поперечном срезе толстой нити обнаруживается 18 молекул миозина. Миозиновые молекулы в толстых нитях переплетаются своими хвостами, а их головки выступают из толстой нити по правильнои̌ спирали (рис.12).
Рис. 12. Схема строения толстой нити
(А. Уайт и др., 1981)
В головках миозина имеются два важных участка (центра). Один из них катализирует гидролитическое расщепление АТФ, т.е. соответствует активному центру фермента. АТФ-азная активность миозина впервые обнаружена отечественными биохимиками Энгельтардтом и Любимовой. Второй участок головки миозина обеспечивает во время мышечного сокращения связь толстых нитей с белком тонких нитей — актином.
Тонкие нити состоят из трех белков: актина, тропонинаи тропомиозина.
Основнои̌ белок тонких нитей – актин. Актин – глобулярный белок с молекулярнои̌ массой 42 кДа. Данный белок обладает двумя важнейшими свойствами. Во-первых, проявляет высокую способность к полимеризации с образованием длинных цепей, называемых фибриллярным актином (можно сравнить с нитью бус). Во вторую очередь, как уже отмечалось, актин может соединяться с миозиновыми головками, что приводит к образованию между тонкими и толстыми нитями поперечных мостиков или спаек.
Основой тонкой нити является двойная спираль из двух цепей фибриллярного актина, содержащая около 300 молекул глобулярного актина (как бы две нити бус, закрученные в двойную спираль. Важно отметить, что каждая бусинка соответствует глобулярному актину). На рис. 13 приведена схема строения двойнои̌ спирали из нитей фибриллярного актина.
Рис. 13. Схема строения двойнои̌ спирали из фибриллярного актина
Еще один белок тонких нитей — тропомиозин аналогичным образом имеет форму двойнои̌ спирали, но эта спираль образована полипептидными цепями и по размеру гораздо меньше двойнои̌ спирали актина. Тропомиозин располагается в желобке двойнои̌ спирали фибриллярного актина. Третий белок тонких нитей — тропонин присоединяется к тропомиозину и фиксирует ᴇᴦο положение в желобке актина, при котором блокируется взаимодействие миозиновых головок с молекулами глобулярного актина тонких нитей (рис. 14).
Рис.
Микроскопическое строение мышц. По порядку, если можно
14. Схема строения тонкой нити
(А. Уайт и др., 1981)
Строение мышечного волокна
Каждое мышечное волокно представляет собой гигантскую многоядерную клетку – симпласт, образованную в процессе эмбрионального развития организма путем слияния множества отдельных клеток – миобластов.
Строение мышечного волокна существенно отличается от строения других клеток. Важнейшие отличительные особенности — это размеры, форма, многоядерность, наличие сократительного аппарата. Строение мышечного волокна представлено на рис. 60.
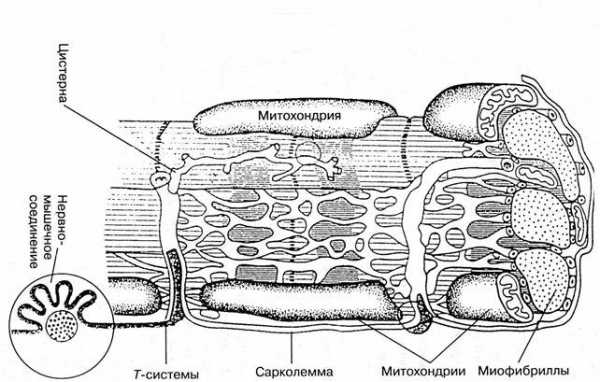
Рис. 60. Важнейшие структурные элементы мышечного волокна
Остановимся на важнейших структурных элементах мышечного волокна.
Сарколемма.Снаружи мышечное волокно окружено оболочкой – сарколеммой, обладающей высокой прочностью и эластичностью. Эти свойства сарколеммы обеспечиваются присутствием в ней большого количества эластичных волокон белков коллагена и эластина, образующих густую сеть.
Сарколемма обладает избирательной проницаемостью, пропуская внутрь клетки преимущественно те вещества, для превращения которых там имеются условия – ферментные системы. В сарколемме присутствуют специальные транспортные системы, с помощью которых поддерживается, в частности, разница в концентрации ионов Na+, К+, Сl‾ внутри и снаружи мышечного волокна, что обеспечивает формирование на его поверхности мембранного потенциала.
К каждому мышечному волокну подходит окончание двигательного нерва. Место прикрепления нервного окончания к мышечному волокну называется нервно-мышечным синапсом..
Внутри мышечного волокна находятся многочисленные клеточные органеллы, важнейшими из которых являются ядра, митохондрии, рибосомы и др. Функции указанных органелл описаны в главе 2 (2.5.1). Пространство между органеллами заполнено внутриклеточной жидкостью – саркоплазмой. Среди структурных элементов мышечного волокна наибольший объем занимают сократительные нити– миофибриллы.
Миофибриллы. Миофибриллы представляют собой длинные тонкие нити, расположенные вдоль мышечного волокна. Количество миофибрилл в мышечных волокнах может колебаться в диапазоне от нескольких десятков до полутора и более тысяч. Под влиянием систематической мышечной тренировки, особенно скоростно-силовой направленности, количество миофибрилл может увеличиваться. Напротив, ограничение двигательной активности сопровождается уменьшением количества миофибрилл. Строение мышечных миофибрилл представлено на рис. 61 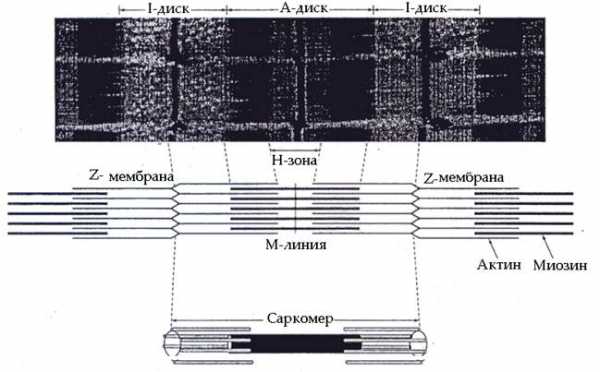 Рис. 61. Строение миофибрилл
Рис. 61. Строение миофибрилл
При рассмотрении в оптический микроскоп видно, что миофибриллы имеют повторяющуюся поперечную исчерченность – темные и светлые полосы (диски). Темные диски (А-диски) в центральной части имеют более светлую полосу (Н-зону). Светлые диски (I-диски) в центре пересекаются узкой темной полосой (линией Z). Участок миофибрилл между двумя линиями Z получил название саркомера. Количество саркомеров в миофибрилле зависит от длины мышечного волокна и может достигать нескольких сотен. Длина саркомеров у разных людей может различаться.
Исследование срезов мышечных волокон в электронном микроскопе показали, что каждая миофибрилла состоит из большого числа параллельно расположенных толстых и тонких нитей (филаментов), которые характеризуются строгим взаимным распределением. Толстые нити находятся в зоне А-дисков. Они построены из белка миозина. Миозин является важнейшим сократительным белком, на его долю приходится около 55% от общего количества сократительных белков. Молекула миозина имеет длинную фибриллярную (удлиненную) часть и глобулярную (округлой формы) головку. Фибриллярная часть имеет двухспиральную полипептидную конфигурацию. Функция фибриллярной части молекулы миозина связана с формированием структуры толстой миозиновой нити.
Глобулярные головки миозиновых нитей имеют два активных центра, один из которых обладает АТФ-азной активностью (способностью расщеплять молекулы АТФ), другой – способностью связываться с активными центрами на актиновых нитях (актинсвязывающий центр). Головки молекул миозина располагаются на поверхности миозиновых нитей, образуя выпячивания (отростки). При этом они строго ориентированы в пространстве – располагаются шестью продольными рядами.
Скелетная мышечная ткань (микроскопическое строение скелетных мышц)
Толстая миозиновая нить состоит как бы из двух частей, зеркально повторяющих друг друга. Если ее разрезать по- середине, то образуются два совершенно одинаковых фрагмента.
Молекулы миозина обладают способностью связывать ионы Са2+ и Мg2+. Ионы кальция являются кофактором фермента АТФ-азы (в его отсутствии фермент не активен). Ионы магния обеспечивают миозину способность связывать молекулы АТФ и АДФ.
В зоне светлых дисков (I-дисков) расположены тонкие нити, построенные из белков актина, тропомиозина и тропонина. Актин – второй в количественном отношении сократительный белок, составляющий основу актиновых нитей. Тропомиозин – структурный белок актиновых нитей, имеющий фибриллярную форму. Сдвоенные молекулы тропомиозина обвивают актиновые нити. Тропонин является регуляторным белком актиновых нитей. Он существует в трех формах, одна из которых блокирует взаимодействие актина с миозином. Другая форма способна связывать ионы кальция, благодаря чему изменяется конформация молекул первой формы тропонина и открывается центр взаимодействия актина с миозином. Третья форма тропонина обеспечивает крепление первых двух форм на актиновой нити. Кроме того, в составе тонких актиновых нитей имеется белок актинин. Он содержится в зоне линии Z, выполняющей роль своеобразной перегородки, и обеспечивает прикрепление к ней концов актиновых нитей.
К числу важнейших структурных элементов мышечного волокна относится саркоплазматический ретикулум. Саркоплазматический ретикулум — это внутриклеточная система взаимосвязанных пузырьков и канальцев (цистерн), пронизывающих клетку и особенно плотно концентрирующихся в зоне соприкосновения актиновых и миозиновых нитей.
Саркоплазматический (в клетках других органов и тканей – эндоплазматический) ретикулум имеется в каждой клетке организма человека. Но в мышечном волокне он выполняет несколько необычные по сравнению с другими клетками функции. Основная его роль в мышечном волокне заключается в регуляции содержания ионов кальция возле актиновых и миозиновых нитей. В состоянии расслабления ретикулум связывает ионы Са2+, их концентрация в саркоплазме составляет примерно 10-7 моль·литр-1. Под воздействием двигательного импульса ионы кальция освобождаются из ретикулума и их концентрация повышается до 10-5 моль·литр-1.
Способность саркоплазматического ретикулума связывать и высвобождать в цитоплазму ионы Са2+ связана с локализацией на его внутренней поверхности особых кальций связывающих белков. На поверхности ретикулума располагаются также рибосомы – особые внутриклеточные образования, в которых осуществляется синтез белков.
Мышечное волокно имеет также систему трубчатых выпячиваний сарколеммы (Т-систему), направленных внутрь мышечного волокна и располагающихся между миофибриллами и саркоплазматическим ретикулумом. Т-система обеспечивает быстрое распространение волны возбуждения от сарколеммы вглубь волокна.
В мышечном волокне содержатся и другие внутриклеточные органеллы: митохондрии, лизосомы. Функции этих структур мышечного волокна уже были описаны в главе «Общие закономерности обмена веществ».
Мышечное волокно содержит не одно, а несколько ядер, которые располагаются не в центральной части волокна, а по периметру, непосредственно под сарколеммой
Предыдущая42434445464748495051525354555657Следующая
Дата добавления: 2015-10-29; просмотров: 903;
ПОСМОТРЕТЬ ЕЩЕ:
Мышцы как орган. Микроскопическое строение мышц
Мышцы как орган. Микроскопическое строение мышц
Мы́шцы или му́скулы (от лат. musculus — мышца (mus — мышка, маленькая мышь)) — органы тела животных и человека, состоящие из упругой, эластичной мышечной ткани, способной сокращаться под влиянием нервных импульсов. Предназначены для выполнения различных действий: движения тела, сокращения голосовых связок, дыхания Микроскопическое строение волокна скелетной мышцы. Скелетные мышцы состоят из волокон, длиной до 13 см, толщиной – 40-80 мкм. Волокно содержит много ядер и сократительные миофибриллы.
Классификация мышц
1. По форме: а) длинные — располагаются на конечностях; б) короткие — располагаются там, где размах движений небольшой, например, межостистые мышцы; в) широкие — располагаются в области туловища и поясов конечностей и имеют большую площадь прикрепления.
2. По направлению волокон: бывают мышцы, с параллельными, косыми, поперечными и круговыми волокнами.
3. По функции: сгибатели и разгибатели; приводящие — аддукторы и отводящие — абдукторы; вращатели кнутри — пронаторы и кнаружи — супинаторы; сжиматели — сфинктеры и расширители — дилататоры.
4. По отношению к суставам, через которые перекидываются мышцы: одно-, двух- и многосуставные.
5. По положению в теле: поверхностные и глубокие; латеральные и медиальные; наружные и внутренние.
6. По количеству головок: двух-, трёх — и четырёхглавые.
7. По отношению к другим мышцам: мышцы, совместно действующие в одной функциональной группе, называются синергисты, в противоположных функциональных группах — антагонисты.
Мышцы головы делятся на мимические и жевательные
Вспомогательные аппараты мышц
Это анатомические образования, которые способствуют и облегчают мышечные сокращения. В наиболее подвижных местах конечностей (области кистей и стоп) формируются фиброзные и костно – фиброзные каналы (трубки). Внутри них залегают синовиальные влагалища сухожилий, которые определяют скольжение сухожилий в строго определенных направлениях. Их образуют наружный и внутренний листки, которые смазаны синовием, что способствует свободному движению сухожилий. Оба листка соединяются мезотендием. В местах, где движения мышц очень сильное, находятся синовиальные сумки – это полости заполненные жидкостью для уменьшения трения. Сумки, которые залегают под мышечными сухожилиями называются подсухожильными синовиальными сумками. Если сумка находится между кожей и выступающей костью, то она называется подкожная синовиальная сумка.
Блок мышц – это покрытая хрящом выемка на кости, где через нее перекидывается мышечное сухожилие, которое чаще всего меняет здесь направление, но благодаря блоку не смещается в сторону. Такую же функцию выполняют сесамовидныекости. Они располагаются в толще сухожилий мышц, которые обеспечивают движения в некоторых блоковидных суставах.
Как отдельные мышцы, так и группы мышц покрыты фасциями – Это соединительнотканные пластинки, разной толщены и протяженности, которые содержат большое количество коллагеновых и эластических волокон
4) Мышцы синергисты, агонисты, антагонисты. Привести примеры взаимодействия мышц из своей специализации.
Прежде всего необходимо выделить сустав, в котором совершается какое-то конкретное движение. Мышцы, совершающие его, называются агонистами, а мышцы, препятствующие этому, -— антагонистами(Оба термина имеют греческое происхождение: «агонист» означает «борец», а «антагонист» — его соперник.). Взаимодействие этой пары мышц обычно управляется нервной системой на уровне спинного мозга. Если одна мышца из пары активизируется, вторая получает команду расслабиться или оказать сопротивление. Это взаимодействие называется реципрокной иннервацией. Не все пары агонистов и антагонистов имеют непосредственную связь со спинным мозгом. Некоторые из них взаимодействуют друг с другом на основе сложившихся моделей повторяющихся движений, которые управляются головным мозгом.
Деление мышц на агонисты и антагонисты весьма условно, так как эти роли не являются постоянными и меняются при изменении характера движения в суставе. Вопрос о том, является мышца агонистом или антагонистом, зависит от того, какое именно действие совершается в суставе и откуда исходит сопротивление ему
Мышцы, оказывающие помощь агонистам и антагонистам, называются синергистами. Помощь может выражаться, в частности, в том, что они сводят к минимуму избыточные действия или стабилизируют какую-то часть тела, чтобы создать прочную опору для движений. В последнем случае синергисты носят название фиксаторов. Кроме того, синергистами иногда называют группу мышц, которые совместно совершают какое-то действие. Работа синергистов имеет большое значение для сбалансированности суставов.
Деление мышц на агонисты и антагонисты полезно в том случае, когда мы имеем дело с изолированным движением, совершаемым в конкретном суставе. Там же, где в движении участвует несколько суставов, работу мышц приходится анализировать исходя из других критериев.
Круговое движение плеча
При поочередном действии всех мышц, расположенных в окружности плечевого сустава, в нем происходит круговое движение. Рассматривая эти мышцы, нетрудно заметить, что они лежат неравномерно, а именно: снутри и снизу от этого сустава мышц нет, вместо них имеется углубление, называемое подмышечной ямкой.
Подмышечная ямкапо своей форме несколько напоминает пирамиду, обращенную основанием книзу и кнаружи, а вершиной кверху и кнутри. Она имеет три стенки, из которых передняя образована большой и малой грудными мышцами, задняя — подлопаточной, большой круглой и широчайшей мышцей спины, а внутренняя — передней зубчатой мышцей. В углублении между передней и задней стенками лежат клювовидно-плечевая мышца и короткая головка двуглавой мышцы плеча.
Мышцы, производящие движения в локтевом суставе В локтевом суставе при фиксированном плече возможны:1)сгибание и разгибание предплечья; 2)пронация и супинация предплечья.
Разгибание предплечьяРазгибание предплечья производят мышцы, пересекающие поперечную ось локтевого сустава и находящиеся сзади от нее. Этих мышц две:
1. трехглавая мышца плеча и
2. локтевая.
Пронация предплечья Пронацию предплечья производят мышцы:
1.круглый пронатор 2.квадратный пронатор 3.плечелучевая мышца.
Супинация предплечья Супинаторами предплечья являются:
двуглавая мышца плеча; мышца-супинатор; плечелучевая мышца
Мышцы, поднимающие и опускающие пояс верхней конечности. Подобрать упражнение для их развития.
Движения назад производят мышцы, пересекающие эту же ось вращения, однако лежащие сзади от нее, а именно: трапециевидная мышца, большая и малая ромбовидные мышцы, а также широчайшая мышца спины.
Пояс верхних конечностей поднимается при сокращении мышц, идущих сверху вниз. В этом движении принимает участие ряд мышц: верхние пучки трапециевидной мышцы, мышца, поднимающая лопатку, ромбовидная мышца и грудино-ключично-сосцевидная мышца при фиксированном положении головы и шеи.
Движение вниз пояса верхних конечностей происходит под действием тяжести верхней конечности при расслаблении мышц, отвечающих за поднимание пояса. Его активному опусканию способствует ряд мышц: малая грудная мышца, нижние пучки трапециевидной мышцы, нижние зубцы передней зубчатой мышцы, нижние пучки большой грудной мышцы и нижние пучки широчайшей мышцы спины.
Мышцы, участвующие во вращении лопатки.
1) верхняя и нижняя части трапециевидной мышцы ,
2) нижние зубцы передней-зубчатой мышцы .
3) круглая мышца
4) большая трехглавая мышца плеча
5) малая грудная мышца
6) нижний участок ромбовидной мышцы
Глубокие мышцы шеи
Боковая группа мышц шеи
Передняя лестничная мышца (m. scalenus anterior) располагается в боковой части шеи, кнутри от m. sternocleidomastoideus и m. omohyoideus. Начинается от поперечных отростков III—V шейных позвонков, затем направляется вниз и латерально, прикрепляясь к I ребру в области tuberculum scaleni. По происхождению лестничные мышцы относятся к аутохтонным мышцам шеи. В результате редукции шести шейных ребер, межреберные мышцы преобразуются в шейные, которые иннервируются CV—VII. Эти сегменты иннервируют и переднюю лестничную мышцу. Передняя лестничная мышца участвует в образовании трех пространств, через которые проходят крупнейшие кровеносные сосуды и нервы.
Мышцы как орган. Микроскопическое строение мышц
1. Предлестничное пространство (spatium antescalenum) спереди ограничено m. sternohyoideus и m. sternothyroideus, сзади — m. scalenus anterior. Через него проходит v. subclavia. 2. Межлестничное пространство — spatium interscalenum; впереди него располагается m. scalenus anterior, сзади — m. scalenus posterior, снизу — I ребро. В этом пространстве размещаются подключичная артерия и ветви плечевого сплетения. 3. Лестнично-позвоночный треугольник (trigonum scalenovertebrale) латерально ограничен m. scalenus anterior, медиально — m. longus colli, снизу—париетальная плевра, выстилающая apertura thoracis superior. В треугольнике располагаются a. et v. vertebrales.
Средняя лестничная мышца (m. scalenus medius) находится позади передней лестничной мышцы. Также начинается от поперечных отростков I — VI шейных позвонков, прикрепляется к I ребру, отступя на 1 см от места прикрепления передней лестничной мышцы, между которыми формируется межлестничное пространство (spatium interscalenum). Через него проходят подключичная артерия и ветви плечевого сплетения.
Задняя лестничная мышца (m. scalenus posterior) менее развитая, чем предыдущие. Начинается от поперечных отростков V—VII шейных позвонков и прикрепляется на середине II ребра. Функция. Все лестничные мышцы поднимают I и II ребра. Таким образом, во время вдоха к I и II ребрам подтягиваются другие ребра за счет последовательного сокращения межреберных мышц.
Предпозвоночные мышцы шеи Длинная мышца головы (m. longus capitis) располагается непосредственно на боковой поверхности позвонков. Начинается от передних бугорков поперечных отростков III—VI шейных позвонков, прикрепляясь к базилярной части затылочной кости по сторонам от tuberculum pharyngeum. Функция. Наклоняет вперед шейный отдел позвоночника.
Длинная мышца шеи (m. longus colli), так же как и предыдущая, располагается на боковой поверхности шейных позвонков. Начинается от тел и межпозвоночных дисков III — I грудного и VII—V шейных позвонков; прикрепляется одна часть пучков к IV — II шейным позвонкам, другая — к передней дуге атланта и телу II позвонка, а третья — к передним бугоркам реберно-поперечных отростков V — VII шейных позвонков. Функция. При двустороннем сокращении сгибает шейный отдел позвоночника. Собственные мышцы затылка. Собственные мышцы затылка короткие, располагаются кнутри от m. semispinalis capitis. Разделяются на две прямые и две косые мышцы.
а) Большая задняя прямая мышца головы (m. rectus capitis posterior major) (начинается от верхушки остистого отростка II шейного позвонка и прикрепляется к латеральной части затылочной кости.
б) Малая задняя прямая мышца головы (m. rectus capitis posterior minor) начинается от заднего бугорка I шейного позвонка и прикрепляется ниже и медиальнее предыдущей мышцы.
в) Верхняя косая мышца головы (m. obliquus capitis superior) (рис. 177) начинается от поперечного отростка I шейного позвонка и прикрепляется к латеральной части linea nuchae inferior. Функция всех трех мышц заключается в разгибании атланто-затылочного сустава.
г) Нижняя косая мышца головы (m. obliquus capitis inferior) (рис. 177) начинается от остистого отростка II шейного позвонка, идет латерально и прикрепляется к поперечному отростку I шейного позвонка. Функция. Вместе с черепом вращает атлант в articulatio atlantoaxillis mediana.
д) Передняя прямая мышца головы (m. rectus capitis anterior) (рис. 181) короткая. Начинается от передней поверхности поперечного отростка и от massae laterales atlantis и прикрепляется к переднему краю затылочного отверстия. Функция. При сокращении происходит сгибание в атланто-затылочном суставе.
е) Боковая прямая мышца головы (m. rectus capitis lateralis) начинается от реберно-поперечного отростка атланта и прикрепляется к processus jugularis затылочной кости. Функция. Наклоняет голову в сторону сокращения мышцы.
Паховый и бедренный канал
Паховый канал: это щелевидный промежуток, расположенный между глубоким и поверхностным паховыми кольцами.Стенки пахового канала: передняя стенка – апоневроз наружной косой мышцы живота, задняя – поперечная фасция, верхняя – нижние пучки внутренней косой мышцы живота и поперечной мышцы живота, нижняя стенка – паховая связка.
Отверстия пахового канала:
Поверхностное паховое кольцо. Границы: сверху – медиальная ножка, снизу – латеральная ножка, латерально – межножковые волокна, медиально – загнутая связка.
Глубокое паховое кольцо (внутреннее отверстие пахового канала) расположено на задней стенке пахового канала.
Бедренный канал.
Бедренный канал – это короткий промежуток (1-2 см) между внутренним бедренным кольцом и подкожной щелью.
Стенки(пер-паховая связка и верхний рог широкой фасции бедра,лат-бедренная вена,зад-гребенчатая фасция)
Мышцы как орган. Микроскопическое строение мышц
Мы́шцы или му́скулы (от лат. musculus — мышца (mus — мышка, маленькая мышь)) — органы тела животных и человека, состоящие из упругой, эластичной мышечной ткани, способной сокращаться под влиянием нервных импульсов. Предназначены для выполнения различных действий: движения тела, сокращения голосовых связок, дыхания Микроскопическое строение волокна скелетной мышцы. Скелетные мышцы состоят из волокон, длиной до 13 см, толщиной – 40-80 мкм. Волокно содержит много ядер и сократительные миофибриллы.
Классификация мышц
1. По форме: а) длинные — располагаются на конечностях; б) короткие — располагаются там, где размах движений небольшой, например, межостистые мышцы; в) широкие — располагаются в области туловища и поясов конечностей и имеют большую площадь прикрепления.
2. По направлению волокон: бывают мышцы, с параллельными, косыми, поперечными и круговыми волокнами.
3. По функции: сгибатели и разгибатели; приводящие — аддукторы и отводящие — абдукторы; вращатели кнутри — пронаторы и кнаружи — супинаторы; сжиматели — сфинктеры и расширители — дилататоры.
4. По отношению к суставам, через которые перекидываются мышцы: одно-, двух- и многосуставные.
5. По положению в теле: поверхностные и глубокие; латеральные и медиальные; наружные и внутренние.
6. По количеству головок: двух-, трёх — и четырёхглавые.
7. По отношению к другим мышцам: мышцы, совместно действующие в одной функциональной группе, называются синергисты, в противоположных функциональных группах — антагонисты.
Мышцы головы делятся на мимические и жевательные
magictemple.ru
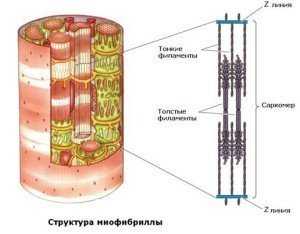
Строение миофибриллы
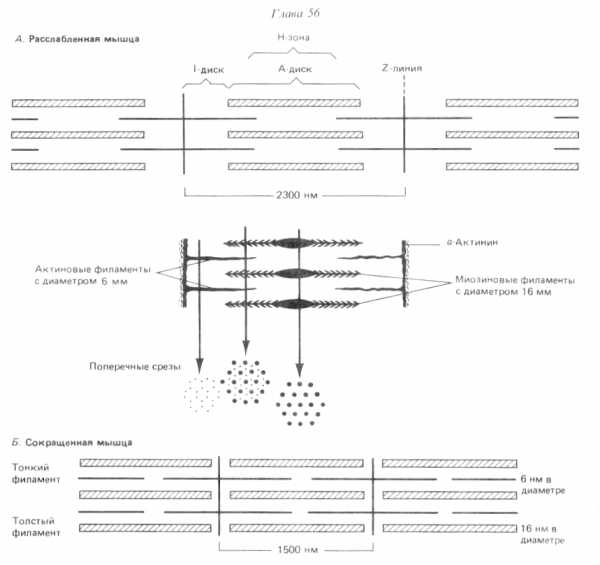
Миофибрилла состоит из одинаковых повторяющихся элементов — саркомеров.
Саркомер— функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т,Iи С. Диаметр тонких филаментов составляет около 6 нм.
В центре саркомера, между «тонкими» филаментами, располагаются «толстые» филаменты. «Толстые» филаменты имеют диаметр около 16нм, они образованы молекулами миозина. На поверхности «толстого» филамента с промежутками в 14 нм располагаются головки миозина, с помощью которых «толстые» филаменты взаимодействуют с актином «тонких» филаментов. В центре «толстых» филаментов на участке в 150 нм миозиновых головок нет.
Каждый «тонкий» филамент занимает симметричное положение между тремя толстыми филаментами, а каждый «толстый» филамент симметрично окружен шестью «тонкими» филаментами.
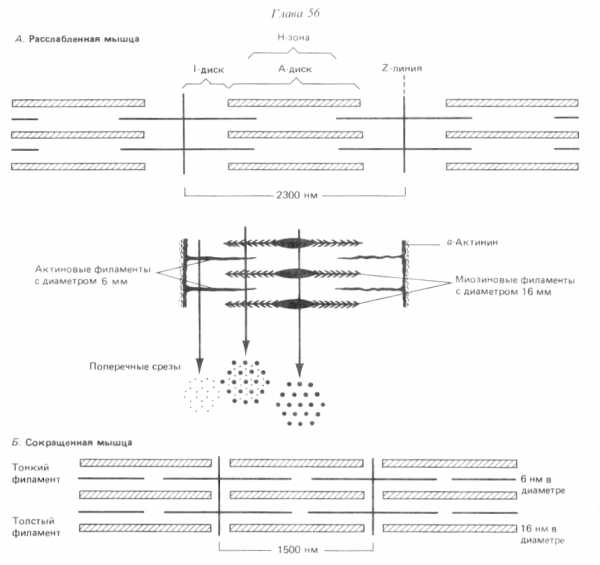
Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А(анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса Мпересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину 150 нм, в не заходят «тонкие» нити актина.
Светлый участок называется диск I(изотропная зона), он образован «тонкими» нитями актина. Размер дискаIуменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:
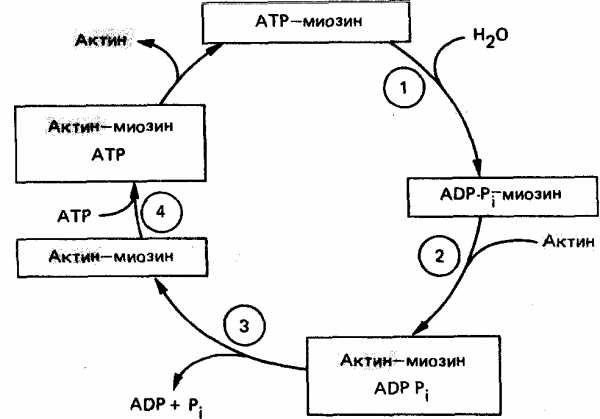
Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
studfiles.net
Строение миофибриллы
A – анизотропные диски, I – изотропные диски, Z – поперечная мембрана.
1) актиновые нити, 2) миозиновые нити.
В процессе сокращения мышцы актиновые нити вдвигаются в промежутки между миозиновыми протофибриллами. Поэтому ширина изотропных дисков уменьшается. Причина перемещения протофибрилл – работа сложно организованного ферментативного механизма, в основе которого лежит сопряжения электрических и механических процессов, в результате возбуждения мышечного волокна.
Все мышцы обладают общими физиологическими свойствами: раздражимостью, возбудимостью, проводимостью, сократимостью, лабильностью. Специфическим свойством мышечной ткани является сократимость, т.е. способность отвечать на раздражение сокращением.
Сокращение — это процесс, возникающий в мышце под действием раздражителя, характеризующийся укорочением мышечных волокон или повышением их механического напряжения.
В зависимости от условий, в которых выполняется работа, выделяют три режима мышечных сокращений:
1) изометрический,
2) изотонический,
3) ауксотонический.
Изометрический режим характеризуется увеличением механического напряжения мышечных волокон без изменения их длины. Изометрическое сокращение происходит при жесткой фиксации обоих концов мышцы и наблюдается при попытке поднять непосильный груз.
Изотонический режим сокращения характеризуется укорочением мышечных волокон без изменения их механического напряжения. Изотоническое сокращение наблюдаются в том случае, если жестко закреплен только один конец мышцы. Примером изотонического сокращения является сократительная деятельность мышц языка и мимической мускулатуры.
В естественных условиях большинство мышц организма сокращаются в смешанном (ауксотоническом) режиме, который характеризуется как уменьшением в процессе сокращения длины, так и увеличением напряжения мышечных волокон.
Различают два вида мышечных сокращений — одиночное (ОМС) и тетаническое (ТС). ОМС возникает при действии на мышцу одиночного раздражителя и включает в себя три фазы: 1) латентный период, 2) фаза укорочения, 3) фаза расслабления.
График одиночного мышечного сокращения
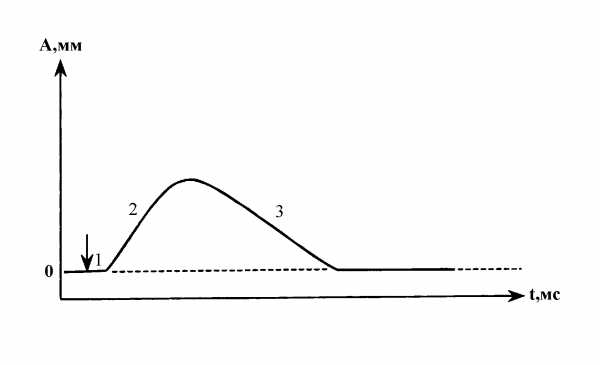
1) латентный период, 2) фаза укорочения, 3) фаза расслабления.
Латентный (скрытый) период продолжается от начала раздражения до начала укорочения или увеличения напряжения мышцы. В этом периоде в мышце активируются процессы обмена веществ и энергии, увеличивается теплопродукция. Мышца готовится к сокращению.
Период укорочения характеризуется уменьшением длины и/или увеличением механического напряжения мышечных волокон.
Период расслабления характеризуется увеличением длины и/или уменьшением механического напряжения мышечных волокон.
Возбуждение по каждому мышечному волокну в составе поперечно-полосатой скелетной мышцы проводится изолированно и не переходит на соседние волокна. Амплитуда одиночного сокращения мышечного волокна не зависит от силы раздражения и подчиняется закону «все или ничего». При этом подпороговый раздражитель не вызывает возбуждения и сокращения одиночного мышечного волокна («ничего»), а пороговый и надпороговые вызывают сокращение одинаковой максимальной амплитуды («все»).
Амплитуда сокращения скелетной мышцы в целом зависит от силы раздражения и подчиняется градуальному закону: чем больше сила надпорогового раздражителя, тем больше амплитуда сокращения. На подпороговые по силе раздражители мышца не реагирует сокращением. При действии пороговых стимулов сократительная реакция минимальна. Это обусловлено вовлечением в процесс возбуждения и сокращения только отдельных, наиболее возбудимых мышечных волокон. По мере увеличения интенсивности стимула амплитуда сокращения мышцы возрастает. Это связано с тем, что в процесс возбуждения и сокращения вовлекается все большее количество менее возбудимых мышечных волокон. При максимальном сокращении в процесс возбуждения и сокращения вовлечены все волокна мышцы. Поэтому дальнейшее повышение интенсивности стимула не сопровождается повышением амплитуды сокращения.
studfiles.net
Строение миофибриллы
Миофибрилла состоит из одинаковых повторяющихся элементов — саркомеров.
Саркомер— функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т,Iи С. Диаметр тонких филаментов составляет около 6 нм.
В центре саркомера, между «тонкими» филаментами, располагаются «толстые» филаменты. «Толстые» филаменты имеют диаметр около 16нм, они образованы молекулами миозина. На поверхности «толстого» филамента с промежутками в 14 нм располагаются головки миозина, с помощью которых «толстые» филаменты взаимодействуют с актином «тонких» филаментов. В центре «толстых» филаментов на участке в 150 нм миозиновых головок нет.
Каждый «тонкий» филамент занимает симметричное положение между тремя толстыми филаментами, а каждый «толстый» филамент симметрично окружен шестью «тонкими» филаментами.
Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А(анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса Мпересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок. Полоса М имеет длину 150 нм, в не заходят «тонкие» нити актина.
Светлый участок называется диск I(изотропная зона), он образован «тонкими» нитями актина. Размер дискаIуменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:
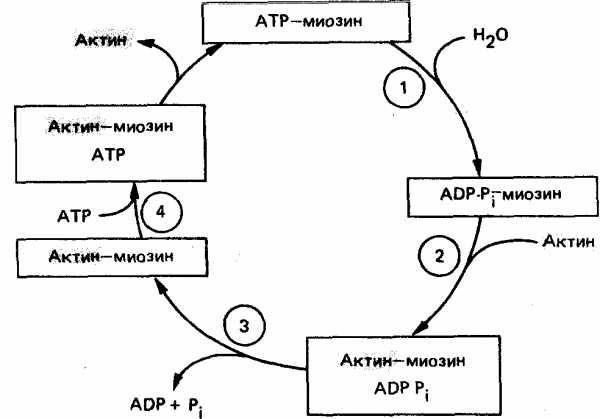
Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°. Актин значительно ускоряется АТФ-азную активность миозина, в результате весь АТФ гидролизует до АДФ и Фн.
У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается длина каждого саркомера (укорачиваются Н-зона и I-диски) и всей мышцы в целом. При такой системе генерации движения, получившей название системы скользящих нитей, длина филаментов не изменяется. Напряжение, развивающееся при сокращении мышцы, пропорционально степени перекрывают филаментов и, следовательно, числу поперечных мостиков. Эффективность такого сокращения около 50%, а двигателя внутреннего сгорания — менее 20%.
studfiles.net
Строение мышц: ликбез по анатомии
Это то, чего мы все хотим — роста мышц. Как запустить его, основываясь исключительно на науке?
Начнем с истоков.
Строение мышц
Любая мышца состоит из:
- аксона. Аксон — провод, по которому от мозга поступает нервный испульс.
- нервно-мышечного соединения
- мышечного волокна
- миофибрилл (то, из чего состоит клетка мышечной ткани. Они травмируются и растут, благодаря чему после тренировок вы «увеличиваетесь в размерах»).
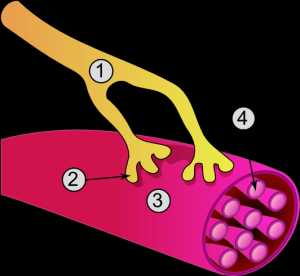
Строение миофибрилл
Миофибриллы длиной достигают всей длины мышцы, а их толщина — 1-2 мкм. Состоят они из белка — актина и миозина. В каждой мышечной клетке — несколько десятков миофибрилл. Итого каждый мускул на 2/3 состоит из них, поэтому они так важны. А сами микрофибриллы состоят из саркомер. Саркомеры расположены последовательно, друг за другом.
Сокращение
На картинке видно, что «головка» миозина тянет на себя актин, вследствие чего и происходит сокращение.
Топливо
Мускулы «питаются» АТФ, но в свободном содержании его хватает только на 10-12 секунд мышечных сокращений. Дальше им приходится добывать его из других веществ. Это достигается тремя вариантами:
- расщеплением креатинфосфата
- расщеплением гликогена
- окислением.
При кардио, аэробной нагрузке, движениях с высокой интенсивностью используются первые два способа. Сначала используется креатинфосфат. Но так как его запас тоже ограничен, организм переходит к расщеплению гликогена. Это уже более надежный и длительный источник АТФ.
При слабой нагрузке (ходьбе) АТФ добывается путем окисления.
Одна молекула глюкозы дает две молекулы АТФ. Молекула, достигая головки миозина, тянет на себя актин. Потом происходит еще один гребок — и новая молекула тянет на себя актин. Но при расщеплении глюкозы на АТФ выделяется также и кислота. Она мешает процессу поступления АТФ к головке, в результате чего не все головки успевают вовремя отцепиться и вследствие этого рвутся. Это и становится причиной мышечной боли на следующий день после тренировки. Этого не стоит бояться — эти микротравмы и помогают мышцам расти.
Типы мышечных волокон
Существует два типа: белые и красные. Белые — сильные и быстрые, красные — выносливые и слабые.
Красные как раз-таки и добывают АТФ путем окисления глюкозы, в результате чего из одной молекулы глюкозы выделяется 38 молекул АТФ. Волокна красные потому, что насыщены сосудами — при процессе окисления важен кислород. В этих волокнах мало миофибрилл и гликогена. Окисление происходит в митохондриях, они как раз и служат в клетках для добывания кислорода. Но этот процесс получения АТФ — очень медленный. Зато в результате этого процесса не происходит накопления молочной кислоты.
Белые используются тогда, когда усилий красных недостаточно. Они содержат мало митохондрий, зато много миофибрилл, креатинфосфата, гликогена. Им кислород не нужен. Тренировки, задействующие белые мышечные волокна, поэтому и называются анаэробными. Гликоген в белых волокнах быстро расщепляется на АТФ, но в отличие от процесса в красных волокнах, дает всего две молекулы АТФ (против 38 молекул АТФ в красных). Побочный эффект: появление кислоты в результате расщепления креатинфосфата и гликогена. Это не только боль, это еще и эффект, когда из-за перехода среды из-за щелочной в кислотную организм начинает постепенно накапливать усталость.
Есть также и розовые — нечто среднее: они выносливее и насыщеннее кислородом белых, но слабее красных.
Чтобы от тренировок эффект был максимальным, надо задействовать все типы мышечных волокон. Рост мускулов провоцируется микротравмами.
Видео по теме:
[videos file=»http://www.youtube.com/watch?v=fHCgUReUgss»][/videos]
wefit.ru
