Классификация аминокислот и для чего они нужны
Аминокислоты представляют собой структурные химические единицы, образующие белки, и на 16% состоят из азота. Важность аминокислот для организма определяется той огромной ролью, которую играют белки во всех процессах жизнедеятельности.
Каждый белок в организме уникален и существует для специальных целей. Белки не являются взаимозаменяемыми. Они синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Именно аминокислоты являются наиболее ценными элементами питания.
Некоторые аминокислоты выполняют роль нейромедиаторов (нейротрансмиттеров) или являются их предшественниками. Нейромедиаторы — это химические вещества, передающие нервный импульс с одной нервной клетки на другую, и, следовательно, некоторые аминокислоты необходимы для нормальной работы головного мозга. Аминокислоты способствуют тому, что витамины и минералы адекватно выполняют свои функции.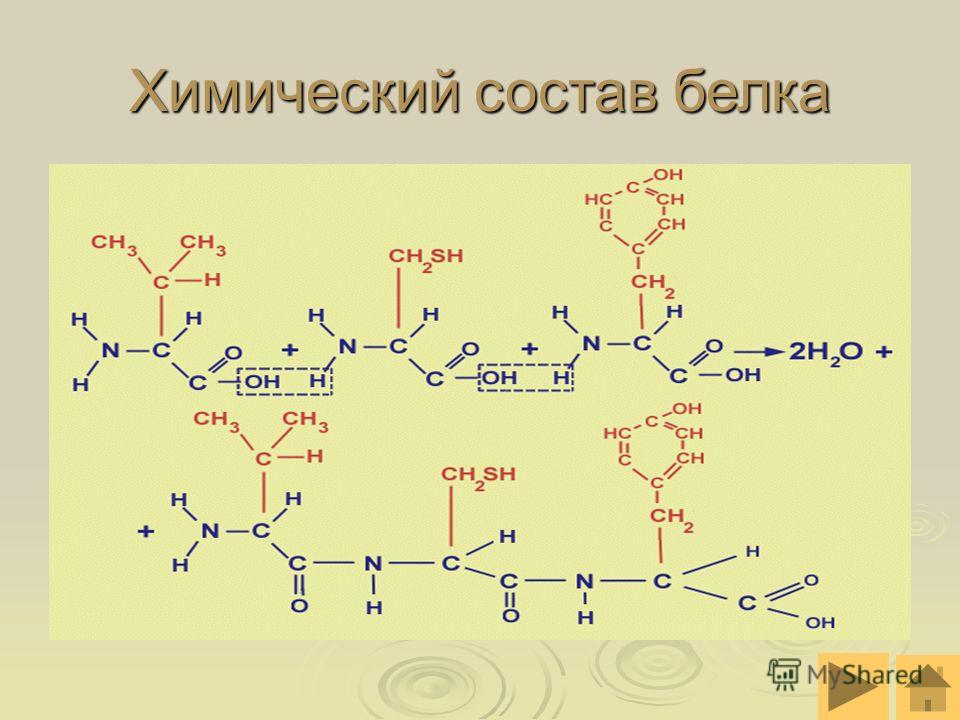
Процесс синтеза белков постоянно идет в организме. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным проблемам — от нарушения пищеварения до депрессии и замедления роста.
К дефициту аминокислот могут привести нарушение процессов всасывания из желудочно-кишечного тракта, инфекционные заболевания, травмы, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме (даже если вы потребляете достаточное количество белка).
В настоящее время можно получать незаменимые и заменимые аминокислоты в виде биологически активных пищевых добавок. Это особенно важно при различных заболеваниях и при применении редукционных диет. Вегетарианцам необходимы такие добавки, содержащие незаменимые аминокислоты, чтобы организм получал все необходимое для нормального синтеза белков.
Имеются разные виды биологически активных пищевых добавок, содержащих аминокислоты. Аминокислоты входят в состав некоторых поливитаминов, белковых смесей и в состав других продуктов, которые содержат комплексы аминокислот или содержащие одну или две аминокислоты, и эти продукты представлены в различных формах (в капсулах, таблетках, жидкостях и порошках). Большинство этих аминокислот получены из белков животного или растительного происхождения, а также из дрожжевых протеинов.
При выборе добавки, содержащей аминокислоты, предпочтение следует отдавать продуктам, содержащим L-кристаллические аминокислоты, стандартизированные по Американской Фармакопее (USP). Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин. D означает dextra (правая на латыни), a L — levo (соответственно, левая). Эти термины обозначают направление вращения спирали, являющейся химической структурой данной молекулы. Белки животных и растительных организмов созданы в основном L-формами аминокислот (за исключением фенилаланина, который представлен D,L- формами). Таким образом, пищевые добавки, содержащие L-аминокислоты, могут считаться более подходящими.
Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин. D означает dextra (правая на латыни), a L — levo (соответственно, левая). Эти термины обозначают направление вращения спирали, являющейся химической структурой данной молекулы. Белки животных и растительных организмов созданы в основном L-формами аминокислот (за исключением фенилаланина, который представлен D,L- формами). Таким образом, пищевые добавки, содержащие L-аминокислоты, могут считаться более подходящими.
топ-14 аминокислот — Ozon Клуб
Абсолютно каждая система в мужском организме нуждается в поддержке. Правильное и сбалансированное питание необходимо для нормальной работы всего организма. Организм мужчины нуждается в сложных углеводах, белках, полезных жирах. Соблюдение режима питания избавит от лишнего веса.Помимо правильного питания, рекомендуется совершать регулярную физическую активность в виде несложных и простых упражнений.
Не у всех есть возможность соблюдать правильное питание и активный образ жизни.
Но.. как помочь организму облегчить этот процесс ? Есть другой, более простой и надежный способ — прием Аминокислот.
Аминокислоты — частицы, из которых состоит белок. Другими словами, строительные части для человеческого организма. Благодаря аминокислотам наш организм строит новые клетки и восстанавливает все поврежденные участки.
Главное отличие Аминокислот от витаминов состоит в том , что витамины не служат источником энергии и не являются строительным материалом для нашего организма.
Рассмотрим ряд важных Аминокислот для мужского организма подробнее.
Аминокислоты для занятий спортом и другой физической активностью
Лейцин — незаменимая Аминокислота необходима для набора мышечной массы, стимулируя синтез белка.
Усиливает сжигание жира.
Стимулирует выделение гормона роста.
Способствует повышению силовых показателей и выносливости.
Способствует сохранению и регенерации мышечной массы.
Повышает силовые показатели.
Способствует росту и набору мышечной массы.
Ускоряет восстановление после тяжелых тренировок.
Повышает концентрацию внимания и работоспособность, улучшает настроение.
Способствует переработке жиров и жирных кислот.
Повышенные дозы Треонина необходимы при восстановлении после операций и различных травм.
Метионин — незаменимая аминокислота, способствует росту мышц.
Основной поставщик серы в организм.
Участвует в выводе тяжелых металлов из организма.
Анаболическое действие метионина способствует эффективному набору мышечной массы.
Способствует понижению уровня холестерина в организме.
Способствует снижению уровня жиров в печени и их окисление.
Поддерживает рост волос и укрепляет волосяные луковицы.
Аргинин – это условно незаменимая аминокислота, имеющая значительную важность для организма.
Способствует улучшению функций печени и репродуктивной системы.
Увеличивает выносливость и физическую силу.
Способствует росту и формированию мышечной массы.
Нормализует артериальное давление, уровень холестерина в крови.
Участвует в жировом обмене, ускоряет метаболизм и помогает сжечь лишний жир.
Глютамин (глутамин) – аминокислота, участвует в синтезе нуклеиновых кислот и других аминокислот в организме. Основной компонент мышечных волокон.
Нормализует метаболизм, укрепляет иммунитет, положительно влияет на эндокринную и нервную системы.
Участвует в нормализации уровня сахара, повышает работоспособность мозга.
Принимает активное участие в борьбе с усталостью организма.
Аминокислоты для улучшения мозговой активности
Теанин — аминокислота, улучшает работу мозга и благоприятно действует на центральную нервную систему.
Уменьшает чувство тревоги, раздражительность, стресс и улучшает настроение.
Повышает концентрацию внимания.
Повышает интеллектуальные способности, активность.
Глицин — аминокислота, оказывающая положительное влияние на мозг и нервную систему в целом. Входит в состав биологически активных соединений и многих белков.
Повышает умственную работоспособность.
Улучшает концентрацию, внимание и память.
Снижает тревожность и стресс, успокаивает.
Благотворно влияет на сон.
Активно участвует в обеспечении кислородом процесса образования новых клеток.
Играет важную роль в работе сердечно-сосудистой системы, мышц, сетчатки и центральной нервной системы.
Ускоряет скорость реакции, мыслительные процессы и принимает активное участие в образовании клеток головного мозга в зоне, отвечающей за память.
Повышает чувствительность к инсулину.
Оказывает антиатерогенное и гепатопротекторное действие.
Снижает артериальное давление при гипертонической болезни.
Аминокислоты для снижения лишнего веса
Отвечает за обеспечение организма энергией.
Улучшает насыщение клеток кислородом.
Оказывает положительное влияние на иммунитет, усиливая защитные силы организма.
Участвует в преобразовании жира в энергию, улучшая обмен веществ и нормализуя деятельность сердечно-сосудистой системы.
Повышает физическую выносливость, иммунитет и сокращает период восстановления.
Орнитин — заменимая аминокислота, способствующая расщеплению жиров, а также увеличению мышечной массы при физических нагрузках.
Генерирует большое количество энергии за счет расщепления жиров.
Стимулирует выработку гормона роста (соматотропина). За счет этого наблюдается увеличение мышечной ткани и сжигание жира.
Тирозин (л тирозин) — это аминокислота, используемая клетками организма для выработки белков и производства ряда биологически активных веществ: норадреналина, дофамина и адреналина.
Способствует похудению, благодаря уменьшению накопления жира и подавлению чрезмерного аппетита.
Повышает концентрацию внимания, поддерживает умственную и физическую работоспособность.
Уменьшает стресс, нервные расстройства и головные боли.
Способствует поднятию настроения, улучшает тонус сосудов, укрепляет сердечную мышцу.
Нормализации функций щитовидной железы, поддерживает функцию надпочечников и гипофиза.
Пустырника трава обладает мочегонными свойствами, нормализует работу сердечной мышцы и понижает артериальное давление.
Брусники лист стимулирует выведение с мочой хлора и натрия, уменьшает воспаление, способствует укреплению стенок кровеносных сосудов.
Одуванчика корни помогает сохранять электролитный баланс калия в организме, применяется также для возбуждения аппетита.
Липы цветки оказывают мочегонное действие, потогонный и противовоспалительный эффект.
Все эти Аминокислоты и добавки можно принимать как по отдельности, так и в комплексной терапии. Вместе их свойства дополняют друг друга, отчего эффект от применения только усиливается.
Eurosnab | Новости
Аминокислоты — это структурные соединения из которых состоит белок.
Для взрослых незаменимыми являются 8-мь аминокислот (для детей 10-ть + аргинин и гистидин): лизин, метионин, треонин, триптофан, фенилаланин, лейцин, изолейцин, валин. Три из которых (лейцин, валин, изолейцин) обладают специфической молекулярной структурой: разветвленной боковой цепью («алифатической боковой цепочкой»). Именно эти три аминокислоты и называются BCAA.
Соотношение лейцина, изолейцина и валина принято за 2:1:1, что позволяет достичь наибольших результатов в синтезе белка.
-BCAA составляют примерно треть аминокислот в
мышечной ткани.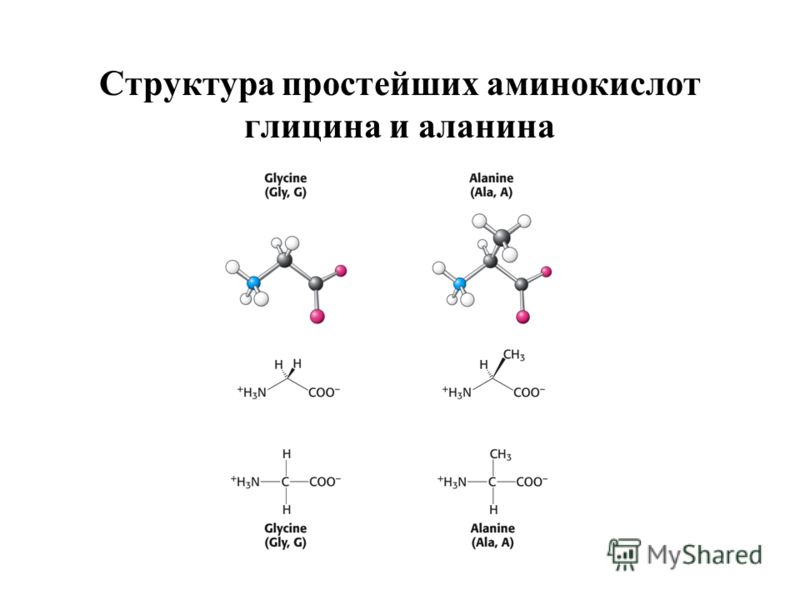
-BCAA представляет собой мощные усилители эффективности и создают огромный источник энергии для работающих мышц, благодаря своему уникальному метаболизму.
-BCAA так же повышают окисление жиров там, где недостает гликогена.
-BCAA позволяет не только тренироваться интенсивнее и дольше, но и способствует скорейшему восстановлению.
Основные преимущества
• В виде порошка.
• Для производства таблетирования и капсулирования BCAA
• Доступность кастомизирования любых форм.
Интересные предложения для клиентов:
использовать в чистом виде
-Без ГМО, вегетарианский и гипоаллергенный.
-Растворяется быстро и полностью в воде — приводит к лучшей усвояемости аминокислот организмом.
-Комбинирование с другими видами спортивного питания.(с протеином, креатином, глютамином и другими добавками).
-Снижен горький привкус.
-98% аминокислот.
или использовать готовую вкусоароматическую смесь
-Синтез белка, клеточный метаболизм и рост мышц
-Противодействие катаболизму — «разрушению мышц»
-Усиливает выработку инсулина
-Укрепляет иммунитет
-Энергия во время тренировки
-Сжигание жира
L-цистин
Общие сведения
Цистин (3,3′-дитио-бис-2-аминопропионовая кислота, дицистеин). Каждая молекула цистина состоит из двух молекул цистеина.
Каждая молекула цистина состоит из двух молекул цистеина.
L-Цистин — заменимая некодируемая аминокислота, не включается в пептидную цепь при ее биосинтезе, а образуется в результате ферментативного окисления остатков двух молекул цистеина (в т. ч. из разных полипептидных цепей).
Цистин – представляет собой бесцветные кристаллы, растворимые в воде. Образуется при окислении цистеина кислородом воздуха в щелочных растворах.
Аминокислоты метионин, цистеин и цистин метаболически тесно связаны друг с другом. Благодаря наличию в составе цистеина высокореактивной SH-группы в тканях легко осуществляется ферментативная окислительно-восстановительная реакция между цистеином и цистином. Цистеин образует с цистином окислительно-восстановительную пару, причем цистин играет роль восстановителя.
Основные источники
В форме кислоты входят в состав многих белков и природных пептидов. Особенно высоко содержание цистина в кератинах, которые в свою очередь явaляются производным белка ногтей, кожи и волос.
Особенно высоко содержание цистина в кератинах, которые в свою очередь явaляются производным белка ногтей, кожи и волос.
Пищевые источники цистина: рыба, овес, соя, рис, пшеница, яичный желток, лук и чеснок.
Функции в организме
-
Участвует в формировании пространственных структур ряда белков и пептидов, например инсулина, соматостатина и иммуноглобулинов.
-
Участвует в процессах формирования тканей кожи, способствует формированию коллагена и улучшает эластичность и текстуру кожи.
-
Помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации.
-
Является антиоксидантом, причем его антиоксидантное действие усиливается при одновременном приеме витамина С и селена.

-
Является предшественником глютатиона – вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, содержащихся в сигаретном дыме.
Показания к применению
-
Необходимость улучшить состояние кожных покровов,
-
Ускорение регенерации волос и ногтевых пластинок,
-
Медленное заживление ран, царапин, ссадин.
В составе комплексной терапии
-
при анемиях различного происхождения,
-
болезнях дыхательной системы,
-
алкоголизме, курении,
-
белковом голодании и тяжелых инфекционных болезнях,
-
ревматоидном артрите,
-
атеросклерозе,
-
болезнях кожи, ломкости волос, алопециях.

Безопасность
Применение аминокислоты противопоказано при цистинурии. Во время беременности и в период грудного вскармливания вещество следует употреблять с осторожностью.
Особенности приема и взаимодействия
Совместное применение цистина и витаминов В1 и С снижает эффективность инсулина. При сахарном диабете принимать только по назначению врача.
Аминокислоты в продуктах питания | Незаменимые и заменимые аминокислоты
Обратно в Состав продуктовВо всех живых системах первоочередное значение имеют белки, они же протеины. Все химические и биохимические процессы, поддерживающие жизнь клетки и организма, выполняют исключительно ферменты, молекулы белковой природы. Белки также выполняют строительную функцию, как на уровне клеток, так и на уровне организма в целом. Функциональное разнообразие протеинов обусловлено их пространственной структурой, расположением, но прежде всего их химическим составом.
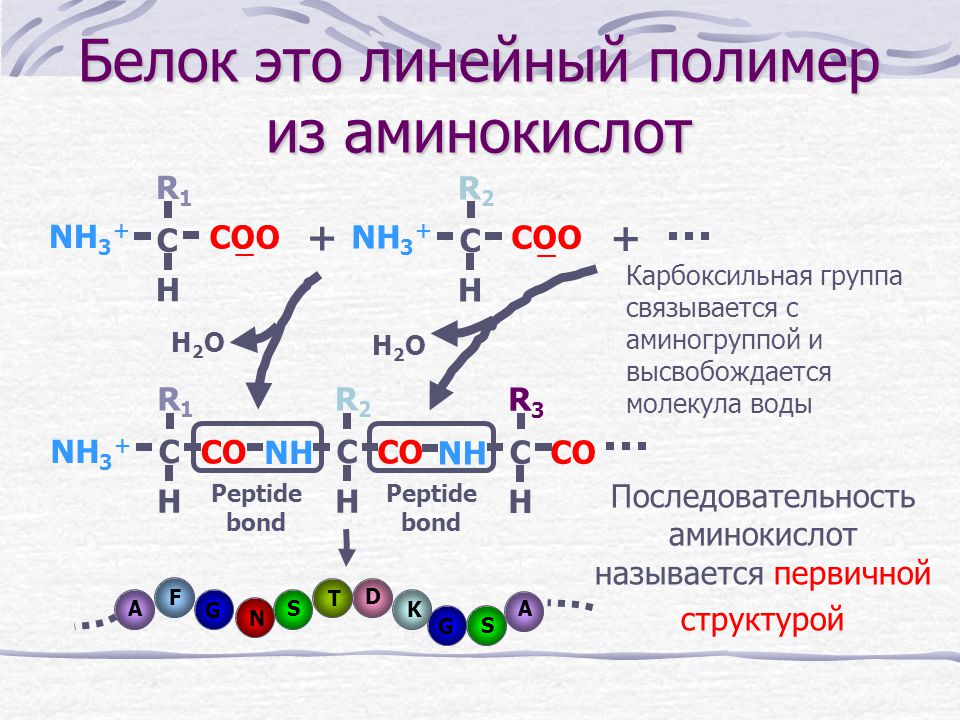
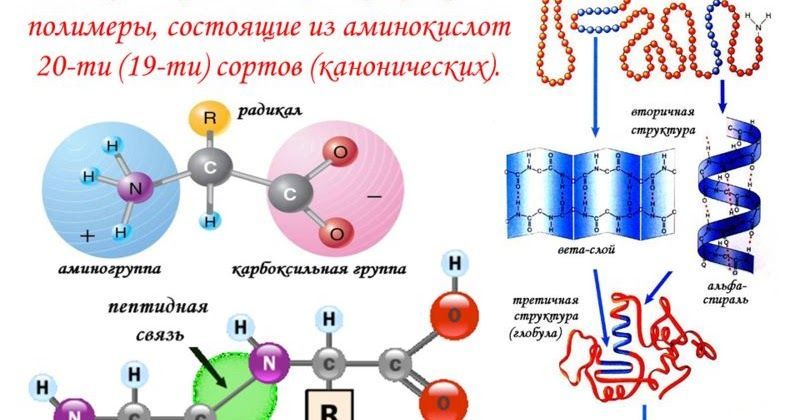
С химической точки зрения белки являются полимерами, состоящими из аминокислот. Данное название отражает структуру этих веществ, содержащих, по меньшей мере, одну аминогруппу -Nh3 и одну карбоксильную группу -COOH. Различаются они только по строению своего радикала, который, собственно, и определяет их индивидуальные физико-химические свойства.
Природные протеиногенные аминокислоты
Общее число аминокислот в природе составляет около 300, в организме человека – более 60. Однако число аминокислот, из которых происходит синтез белка, всего около 20 (иногда насчитывают 21-22), и их называют протеиногенными аминокислотами, или природными. Из них в процессе синтеза белка и формирования его структуры образуются другие аминокислоты. Эти природные 20 аминокислот запрограммированы в генетическом коде любого организма, от вируса до человека, и именно их последовательность в белковой молекуле-цепочке определяет уникальность всех форм жизни на Земле.
В органах и тканях человека основная роль этих соединений – участие в белковом синтезе, на это уходит подавляющая часть всех поступивших или образовавшихся аминокислот. Но есть и отдельные аминокислоты, которые обладают самостоятельными функциями. Так, тирозин является ответственным за окраску волос, кожи, глаз, придает темный цвет пищевым продуктам, например, ржаному хлебу, так как с его участием синтезируются темноокрашенные пигменты – меланины. Ряд представителей данного класса играет роль медиаторов – веществ, ответственных за передачу нервных импульсов от одной нервной клетки к другой (ацетилхолин, глутаминовая и аспарагиновая кислота, глицин, ГАМК, гистамин, серотонин, норадреналин). Аминокислота глутамин обеспечивает перенос продуктов азотистого обмена в крови человека.
Помимо протеинов, из аминокислот состоят более короткие молекулы, играющие важную роль в организме: олигопептиды. Среди них есть и не очень короткие цепочки аминокислотных остатков, например, гормон инсулин, и совсем короткие, вплоть до дипептидов (или бипептидов), которые состоят всего из двух аминокислотных остатков (для сравнения: белки насчитывают сотни аминокислотных остатков). Важнейшими дипептидами являются карнитин и карнозин, сильнейший природный антиоксидант.
Заменимые и незаменимые аминокислоты
Источником аминокислот в пищевых продуктах являются белки. Все белки пищевых продуктов различаются по своему аминокислотному составу. Это имеет большое значение в подборе полноценных рационов в связи с тем, что ряд аминокислот являются незаменимыми (эссенциальными) — они могут быть получены только с пищевыми продуктами. К незаменимым протеиногенным аминокислотам относятся валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан. В отличие от них, заменимые аминокислоты могут быть синтезированы в организме человека из предшественников. Это глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин. К частично заменимым относят аргинин и гистидин, так как в организме они синтезируются довольно медленно.
Дефицит или полное отсутствие в рационе даже одной незаменимой аминокислоты приводит к отрицательному азотистому балансу, что в свою очередь со временем вызывает тяжелые клинические последствия типа авитаминоза: нарушение деятельности центральной нервной системы, остановку роста и т.д.
Крайне важно отметить, что если в дефиците какая-то одна незаменимая аминокислота, то это приводит к неполному усвоению других. Данная закономерность подчиняется закону Либиха, по которому развитие живых организмов определяется тем незаменимым веществом, которое присутствует в наименьшем количестве.
В каких же продуктах питания содержатся незаменимые аминокислоты? Это все пищевые ингредиенты, богатые белком.
Продукты питания как источники незаменимых аминокислот
Крайне редко аминокислоты представлены в свободном виде. Последнее встречается в специальных пищевых продуктах, например, спортивном питании, куда их непосредственно добавляют в свободном состоянии для более быстрого и полного усвоения. В основном же они поступают в организм в составе белков и затем высвобождаются в ходе гидролиза последних. Высвободившиеся в результате гидролиза аминокислоты или небольшие пептиды уже могут всасываться в кишечнике.
Наиболее важными источниками незаменимых аминокислот в необходимом соотношении являются следующие продукты питания, где содержатся легкоусвояемые протеины: молоко, молочные продукты, яйца, мясо и мясопродукты, рыба, морепродукты, соя, бобовые (горох, чечевица, фасоль, соя), крупы, хлеб, картофель и др.
Наряду с аминокислотным составом, биологическая ценность протеинов определяется и степенью их усвоения после переваривания. Степень переваривания, в свою очередь, зависит, с одной стороны, от состояния организма (активности ферментов, глубины гидролиза в желудочно-кишечном тракте), и с другой стороны, от вида предварительной обработки белков в процессах приготовления пищи (тепловой, гидротермической, СВЧ и проч.). Тепловая обработка, разваривание, протирание и измельчение ускоряют переваривание белка, особенно растительного, тогда как нагревание до очень высоких температур свыше 100°С его затрудняет.
Обратно в Состав продуктов
% PDF-1.4 % 956 0 объект > эндобдж xref 956 76 0000000016 00000 н. 0000002969 00000 н. 0000003128 00000 п. 0000004350 00000 н. 0000004387 00000 п. 0000004424 00000 н. 0000004538 00000 н. 0000007455 00000 н. 0000010332 00000 п. 0000013197 00000 п. 0000016040 00000 п. 0000018928 00000 п. 0000019184 00000 п. 0000019641 00000 п. 0000020087 00000 п. 0000020660 00000 п. 0000020792 00000 п. 0000021223 00000 п. 0000021747 00000 п. 0000022248 00000 п. 0000022498 00000 п. 0000023019 00000 п. 0000023579 00000 п. 0000023835 00000 п. 0000024365 00000 п. 0000024624 00000 п. 0000024736 00000 п. 0000024764 00000 п. 0000025311 00000 п. 0000025575 00000 п. 0000026027 00000 н. 0000026297 00000 п. 0000026807 00000 п. 0000027436 00000 н. 0000030347 00000 п. 0000030488 00000 п. 0000030905 00000 п. 0000031257 00000 п. 0000031295 00000 п. 0000031545 00000 п. 0000031801 00000 п. 0000033514 00000 п. 0000035664 00000 п. 0000425499 00000 н. 0000428150 00000 н. 0000430801 00000 п. 0000430907 00000 н. 0000456913 00000 н. 0000457179 00000 н. 0000457707 00000 н. 0000486591 00000 н. 0000511927 00000 н. 0000530800 00000 н. 0000530871 00000 н. 0000553922 00000 н. 0000572758 00000 н. 0000614656 00000 п. 0000633782 00000 н. 0000647954 00000 н. 0000648025 00000 н. 0000648111 00000 п. 0000653745 00000 н. 0000654021 00000 н. 0000654194 00000 н. 0000654223 00000 п. 0000654524 00000 н. 0000654978 00000 н. 0000655356 00000 н. 0000709478 00000 н. 0000709519 00000 п. 0002589988 00000 н. 0002593554 00000 п. 0002632521 00000 п. 0002636553 00000 п. 0000002769 00000 н. 0000001854 00000 н. трейлер ] / Назад 4735498 / XRefStm 2769 >> startxref 0 %% EOF 1031 0 объект > поток h ތ SkHQ ~] 4MXjVcP | ٴ m & 2MfAw) KWYZ`h: irVJ3V # * 1?, I} s
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Какие из следующих крупных сложных органических соединений, состоящих из мономеров аминокислот? а.Углеводы b. Белки c. Липиды d. Нуклеиновые кислоты
Пол П.
задано • 23.01.19Более
БЕЛКОВ соответствуют этому описанию
Все еще ищете помощь? Получите правильный ответ быстро.
ИЛИ
Найдите онлайн-репетитора сейчасВыберите эксперта и познакомьтесь онлайн. Никаких пакетов или подписок, платите только за необходимое время.
¢ € £ ¥ ‰ µ · • § ¶ SS ‹ › « » < > ≤ ≥ — — ¯ ‾ ¤ ¦ ¨ ¡ ¿ ˆ ˜ ° — ± ÷ ⁄ × ƒ ∫ ∑ ∞ √ ∼ ≅ ≈ ≠ ≡ ∈ ∉ ∋ ∏ ∧ ∨ ¬ ∩ ∪ ∂ ∀ ∃ ∅ ∇ * ∝ ∠ ´ ¸ ª º † ‡ А Á Â Ã Ä Å Æ Ç È É Ê Ë Я Я Я Я Ð Ñ Ò Ó Ô Õ Ö Ø Œ Š Ù Ú Û Ü Ý Ÿ Þ à á â ã ä å æ ç è é ê ë я я я я ð ñ ò ó ô х ö ø œ š ù ú û ü ý þ ÿ Α Β Γ Δ Ε Ζ Η Θ Ι Κ Λ Μ Ν Ξ Ο Π Ρ Σ Τ Υ Φ Χ Ψ Ω α β γ δ ε ζ η θ ι κ λ μ ν ξ ο π ρ ς σ τ υ φ χ ψ ω ℵ ϖ ℜ ϒ ℘ ℑ ← ↑ → ↓ ↔ ↵ ⇐ ⇑ ⇒ ⇓ ⇔ ∴ ⊂ ⊃ ⊄ ⊆ ⊇ ⊕ ⊗ ⊥ ⋅ ⌈ ⌉ ⌊ ⌋ 〈 〉 ◊
Proten Structure Ver.5.0
Proten Structure Ver. 5.0Биология 2960 Компьютерная лаборатория
Пептидные связи и структура белка
| Это компьютерное лабораторное упражнение поможет вам лучше понять структуру белка. В первой части этого упражнения вы пройдете два кратких руководства; (а) пептидных связей и (б) структура белка . Во второй части этого упражнения вы изучите три примера белков, которые могут содержать вторичные структуры, используя FirstGlance, упрощенную программу просмотра Jmol. |
Пептидные облигации
| Пептиды — это линейный комплекс аминокислот. Аминокислоты соединяются вместе с образованием простых пептидов и, в конечном итоге, длинных (50–2000 аминокислот) полипептидных цепей (белков). На рисунке справа показана реакция конденсации (синтез дегидратации, потеря воды), показывающая образование ковалентной пептидной связи между двумя аминокислотами. | |
| На рисунке слева аминокислоты показаны в обобщенном виде, поэтому R-группы указаны только как R1 и R2.Как и аминокислоты, пептиды имеют амино- и карбоксильный конец или конец. Пептидная связь лежит в плоскости с α-атомами углерода, заставляя R-группы аминокислот выступать из плоскости пептида в разные координаты в пространстве. Эта плоская характеристика пептидной связи допускает две возможные конформации по отношению к α-углеродам, конформации транс и цис . Когда два α-атома углерода находятся на противоположных сторонах пептидной связи, считается, что R-группы находятся в конформации транс .Напротив, когда два α-атома углерода находятся на одной стороне пептидной связи, считается, что R-группы находятся в конформации цис . Транс-конформация является очень предпочтительной из-за стерических затруднений, встречающихся в цис-конформации. | |
| В отличие от пептидной связи, вращения разрешены в связях между аминогруппой и карбонильной группой с α-углеродом. Угол поворота между аминогруппой и α-углеродом известен как угол поворота φ.Угол поворота между карбонильной группой и α-углеродом известен как угол поворота ψ. |
| Наконец, белок может быть ковалентно связан («сшит») с другим белком, находящимся дальше на той же полипептидной цепи или на другой полипептидной цепи, посредством окисления двух остатков цистеина. Эти связи называются дисульфидными связями. Эти ограничения структуры пептида участвуют в сворачивании белков и формировании вторичных белковых структур, таких как α-спирали и β-цепи / листы. |
Структура белка
| Существует четыре уровня белковой структуры: |
| Первичная структура относится к последовательности аминокислотных остатков в полипептидной цепи, записанной слева направо от N-конца до C-конца. Вторичные структуры представляют собой упорядоченные структуры, образованные внутренней водородной связью между аминокислотными остатками. Обычными вторичными структурами являются α-спираль, β-нить, а также различные петли и повороты.Более подробная информация о вторичных структурах представлена ниже. Третичная структура полипептида — это трехмерная конформация, образующая отдельные, независимо свернутые области, называемые доменами . Домен на рисунке ниже — это «карман связывания гема» для β-субъединицы гемоглобина. Четвертичная структура применима только к белкам, которые состоят из более чем одной полипептидной цепи. Каждый из полипептидов называется субъединицей. |
Вторичная структура Белки состоят из аминокислот, объединенных в пептидные цепи. Из-за нехватки места эти две связи имеют ограниченные диапазоны, в которых они допускают вращение. Наиболее распространенными формами вторичной структуры белка являются α-спираль и β-складчатый лист (или β-лист ). |
| α-спирали Теоретически α-спираль может быть как правой, так и левой.Α-спирали, обнаруженные в белках, почти всегда правые. В идеальной α-спирали шаг (продвижение за один полный оборот) составляет 0,54 нм, подъем (продвижение на аминокислоту) составляет 0,15 нм, а количество аминокислотных остатков, необходимых для одного полного поворота, составляет 3,6. |
| Внутри α-спирали каждый карбонильный кислород (остаток n) основной цепи полипептида связан водородными связями с амидным водородом основной цепи четвертого остатка дальше по направлению к С-концу (остаток n + 4).Водородные связи, которые стабилизируют спираль, почти параллельны длинной оси спирали. Одиночная внутриспиральная водородная связь не может обеспечить заметной структурной стабильности, но кумулятивный эффект многих водородных связей внутри α-спирали стабилизирует эту конформацию. Водородные связи между аминокислотными остатками особенно стабильны в гидрофобной внутренней части белка, где молекулы воды закупорены и поэтому не могут конкурировать за водородные связи. Боковые цепи аминокислот в α-спирали направлены наружу от цилиндра спирали.На стабильность α-спирали влияет идентичность боковых цепей. Некоторые аминокислотные остатки чаще других встречаются в конформациях. Например, аланин имеет небольшую незаряженную боковую цепь и хорошо вписывается в α-спиральную конформацию. Остатки аланина преобладают в α-спиралях всех классов белков. Напротив, тирозин и аспарагин с их объемными боковыми цепями менее распространены в α-спиралях. Глицин, боковая цепь которого представляет собой единственный атом водорода, дестабилизирует α-спиральные структуры, поскольку вращение вокруг его α-углерода настолько неограниченно.По этой причине многие спирали начинаются или заканчиваются остатками глицина. Пролин — наименее распространенный остаток в α-спирали, поскольку его жесткая циклическая боковая цепь нарушает конформацию правой спирали. Кроме того, в пролине отсутствует атом водорода на амидном азоте и он не может полноценно участвовать во внутриспиральных водородных связях. По этим причинам остатки пролина чаще обнаруживаются на концах α-спиралей, чем внутри. Белки различаются по содержанию α-спирали. У некоторых большая часть остатков находится в спиралях.Другие белки содержат очень мало структуры. Среднее содержание спиралей в белках оценивается в 26%. Длина спирали в белке может составлять от 4 или 5 до более 40 остатков, но в среднем составляет около 12. |
| β-листы Когда две соседние β-нити выстраиваются в линию, они могут образовываться мостиками водородных связей. Это создает очень стабильную структуру, известную как β-лист. Одиночные β-цепи редко встречаются в белках, потому что структура не намного стабильнее, чем случайный клубок.Есть два способа позиционирования β-нитей для образования β-листа. Они могут быть в ориентации параллельно или антипараллельно . Ориентация β-нитей влияет на структуру водородных связей и общую структуру и функциональность β-листа. В примере, показанном справа, три параллельных β-нити выстраиваются вплотную друг к другу, образуя высокостабильный лист с множественными водородными связями (показан желтым цветом). |
В антипараллельном листе углеродные атомы кислорода основной цепи и протоны амида основной цепи идеально выстроены в линию, поэтому они образуют прямые водородные связи.Карбонильный кислород и амидный водород (протон) расположены прямо напротив его партнера по водородной связи. Боковые цепи указывают перпендикулярно плоскости листа. Антипараллельная конформация более устойчива и встречается чаще. Параллельные β-листы |
*** ОТВЕТЬТЕ НА ВОПРОСЫ ОТЧЕТА ЛАБОРАТОРИИ №1 — 6 ***
Учебный центр естественных наук
Вашингтонский университет — факультет биологии
Авторские права © 2011 Вильгельм С. Круз
Все права защищены
Физиология, Белки Артикул
Введение
Белки — это биополимерные структуры, состоящие из аминокислот, 20 из которых являются общими для биологической химии.Белки служат структурной опорой, биохимическими катализаторами, гормонами, ферментами, строительными блоками и инициаторами клеточной смерти. Далее белки можно определить по четырем структурным уровням: первичный, вторичный, третичный и четвертичный.
Первый уровень — это первичная структура, потому что это самый базовый уровень структуры белка. Он состоит из аминокислотных остатков линейного порядка. Все остатки соединяются пептидными связями. Эти связи обозначены положениями атомов углерода альфа, бета и гамма, которые соответствуют конкретным положениям относительно пептидной связи.Эта структура также носит название белкового остова.
Второй уровень структуры белка — это вторичная структура, и она состоит из различных форм, образующихся за счет водородных связей. Эти формы включают альфа-спираль, бета-гофрированный лист и бета-виток. Как указывалось ранее, водородные связи стабилизируют все эти формы.
Третий уровень структуры белка — это третичная структура. Он состоит из трехмерной формы, которая будет формироваться, когда «каркас» полипептидной цепи взаимодействует с водной средой, которая немедленно начинает формироваться, когда вновь синтезированная полипептидная цепь выходит из терминального конца комплекса рибосомных субъединиц.Полипептидная цепь изолирует гидрофобные остатки и обнажает те, которые являются гидрофильными; все это для достижения термодинамической стабильности. Эта термодинамическая стабильность дополнительно обусловлена множеством химических взаимодействий, включая водородные связи, силы Вандерволла и ионные связи (термин ионная связь включает электростатические взаимодействия и солевые мостики). Энергия, которую могут производить эти взаимодействия, колеблется от 0,1 до 3 килокалорий на моль. Четвертый и последний уровень структуры белка называется четвертичной структурой.На этом уровне комплексы образуются из нескольких полипептидных цепей, называемых субъединицами. Примером этого является гемоглобин и то, как формируется его тетрамерная структура, когда две альфа- и две бета-субъединицы удерживаются вместе за счет химических взаимодействий. Поэтому уместно сказать, что четвертичная структура — это трехмерное расположение двух или более полипептидов в белке, каждый из которых сворачивается независимо от другого. Важно отметить, что термин субъединица взаимозаменяем с протомером.[1] Примером клинического значения является серповидноклеточная анемия, при которой произведенный белок гемоглобина содержит аминокислоты, которые нерастворимы в водной среде, заставляя дефектный гемоглобин агрегироваться, чтобы скрыть вновь образованные гидрофобные остатки и достичь термодинамической благоприятности. Эти измененные молекулы гемоглобина затем образуют полимеры, которые проявляются в виде длинных негибких стержней. Эти макромолекулы продолжают удлиняться, пока они в конечном итоге не осаждаются и не деформируют плазматическую мембрану красных кровяных телец в классическую форму серпа, наблюдаемую при кризисе серповидно-клеточного синдрома.
Проблемы, вызывающие озабоченность
Денатурация
Меркаптоэтанол — это химическое вещество, которое может разрушать дисульфидные связи. Он «разрезает» белки справа от карбоксильной группы предпоследней аминокислоты. Это разрезание может происходить только на дисульфидных связях, потому что эти связи могут принимать электроны от спиртовых групп бета-меркаптоэтанола, поэтому это вещество также известно как восстанавливающий агент. Проблема, вызывающая беспокойство, проявляется через гормональную денатурацию.Гормоны известны как белки с большим количеством дисульфидных связей. Поэтому, если их поместить в водную среду, богатую спиртовыми группами, гормоны денатурируют и теряют биологическую функциональность. Это состояние, по-видимому, является причиной того, почему матери, страдающие алкогольным расстройством и кормящие грудью, могут перестать кормить грудью (из-за денатурированного пролактина), почему у алкоголиков через некоторое время развивается диабет (из-за денатурированного инсулина) и почему подростки, чрезмерно употребляющие алкоголь, перестают расти (из-за денатурированный гормон роста).[2]
Сотовая связь
Транспортировка
Белки, продуцируемые на рибосомах грубого эндоплазматического ретикулума, переносятся в гладкий эндоплазматический ретикулум, где они превращаются в пузырьки для внутриклеточного транспорта. Белки также несут ответственность за нацеливание на везикулы посредством ряда взаимодействий, которые включают взаимодействия рецепторов и субстратов. Аппарат Гольджи состоит из цис-, медиальной, транс- и транс-сети Гольджи.Джеймс Ротман предположил в 1980-х годах, что белки, обрабатываемые аппаратом Гольджи, переносятся из одного мешочка в другой в пузырьках. Эта концепция важна, потому что не было хорошо известно, как белки могут оставаться и действовать как специфические ферменты Гольджи, тем более что практически все ферменты Гольджи являются мембранными белками. Это предложение привело к трем различным теоретическим путям, с помощью которых белки обрабатываются и транспортируются. [3]
Три пути:
- Секреторный
- Лизосомальный
- Регулируемый
Секреторный транспорт
Конститутивная секреция — это непрерывный путь, который происходит во всех клетках.Считается, что именно так клетки производят новые плазматические мембраны. Так же происходит экзоцитоз. Везикулы цитозоля сливаются с плазматической мембраной. Жидкие мембраны способствуют слиянию мембран по принципу «подобное растворяется в подобном». Эта теория утверждает, что сигнал и рецептор комплемента (который находится на Гольджи) необходимы для сортировки в Гольджи. Эта теория основана на хорошо известной концепции, согласно которой сигнал и его рецептор комплемента являются фундаментальными компонентами всей внутриклеточной везикулярной сортировки.[4]
Лизосомный транспорт
Эта теория, определяемая как конститутивный лизосомный путь, утверждает, что транспортные везикулы, содержащие лизосомальные ферменты, образуют лизосомы, когда внутриклеточные везикулы сливаются с везикулами, образованными из плазматической мембраны во время эндоцитоза. Лизосома — это участок внутри клетки, где макромолекулы распадаются на соответствующие мономеры. (например, белки, полисахариды, полинуклеотиды и липиды. Это основные строительные блоки: аминокислоты, моносахариды, нуклеотиды.Для липидов не существует единого строительного блока, но жирные кислоты подходят ближе всего. Клетка повторно использует строительные блоки для создания новых макромолекул. [5]
Регулируемый транспорт
Этот регулируемый секреторный путь имеет место только в клетках, специализирующихся на секреции. (например, В-лимфоциты секретируют антитела). Везикула, содержащая специализированные белки для зачатка секреции области транс-сети Гольджи аппарата Гольджи. В этом случае секреторный пузырь остается в цитозоле. Лиганд связывается с сайтом связывания лиганда на внеклеточном матриксе, обращенном к трансмембранному рецепторному белку.(-6) М. Затем цитозольные секреторные везикулы перемещаются к плазматической мембране для экзоцитоза. [6]
Пептидные связи
Пептидные связи образуются, когда карбоксильная группа аминокислоты слева атакует аминогруппу аминокислоты справа. Аминоконец всегда слева. Карбокси-конец всегда справа. Полярность каждой аминокислоты обусловлена ее R-группой. Пептидная связь имеет три особенности: подошвенную, ограниченную подвижность и транс-конфигурацию.Рестрикционные ферменты часто используются в лабораторных процедурах для определения последовательности белков. История секвенирования белков выходит за рамки данной статьи [7].
Дисульфидные связи
Они также известны как дисульфидные мостики; эти связи образуются близлежащими остатками цистеина в белке. Остаток цистеина имеет неполярную группу R, более конкретно, сульфгидрильную группу. Эта связь составляет примерно 60 килокалорий на моль энергии. Эти прочные ковалентные связи являются результатом химического взаимодействия, связанного с белками, которые сворачиваются в грубую эндоплазматическую сеть — это потому, что восстановители разрушают дисульфидные связи, а относительно высокая концентрация восстановителей в цитозоле разрывает связи серы, как только связи образуются. .Основным восстанавливающим агентом цитозоля является трипептид, называемый глутатионом. В основе этого понимания лежит классический эксперимент Анфинсена. В эксперименте использовалась рибонуклеаза, функциональное представление зрелой структуры с многочисленными дисульфидными связями. В эксперименте к рибонуклеазе применяли восстанавливающие агенты, которые денатурируют белок, в частности, мочевину, которая разрывает все слабые химические связи в белке. Еще одним используемым восстановителем был бета-меркаптоэтанол. В результате получился белок, не обладающий биологической активностью, поскольку у него больше не было активного сайта.Говорят, что это денатурированная форма белка рибонуклеазы. Затем белок помещали в воду с денатурирующим агентом и диализной трубкой. Они несколько раз заменяли внешнюю диализную среду, чтобы удалить как можно больше денатурирующих молекул. После диализа они обнаружили, что рибонуклеаза ренатурировала до 100% функционального статуса, что привело к заключению, что первичная структура определяет третичную структуру [7].
Биохимические реакции
Самые важные белки в организме — это те, которые помогают в реакциях.Они называются ферментами, и их основная задача — помочь организму вырабатывать энергию. Реакция всегда возможна, но не всегда благоприятна. Примерно 90% реакций, которые происходят в организме, не будут происходить с надлежащей скоростью, необходимой для жизни. Таким образом, ферменты действуют как «катализаторы». Примерно 80% реакций в организме не произошло бы, если бы не присутствовал фермент, катализирующий реакцию. Ферменты делают реакции более вероятными, облегчая их возникновение. Они объединяют субстраты в пространстве и времени.Ферменты снижают свободную энергию активации, что приводит к меньшему количеству энергии, необходимой для возникновения реакции. Ферменты также стабилизируют высокоэнергетический промежуточный субстрат в реакции и не расходуются в реакции. Фермент можно классифицировать как глобулярный, если это сильно свернутый полипептид, который часто имеет сферическую форму и стабилизируется слабыми химическими взаимодействиями. [8]
Источники
Белок является жизненно важной частью рациона человека и присутствует в различных продуктах питания, таких как яйца, мясо, молочные продукты, морепродукты, бобовые, орехи и семена.Независимо от источника потребляемого белка, он расщепляется и превращается в новые белки в нашем организме. Эти белки делают все: от борьбы с инфекциями до помощи клеткам в делении. L-изомер каждой аминокислоты обычно является более биологически релевантной формой по сравнению с D-изомером.
Классификация аминокислот
Хотя в природе существуют сотни аминокислот, люди используют только 20 из них. Один из способов их дальнейшей классификации — определить, какие из них здоровые тела могут вырабатывать, а какие — нет.
Три класса белков:
- Несущественные
- Условно необходимое
- Essential
Незаменимые аминокислоты
Существуют пять аминокислот, которые называют несущественными, потому что они могут быть получены из продуктов питания, а также вырабатываются в организме.
Незаменимые аминокислоты:
- Аланин
- Аспарагин
- Аспарагиновая кислота
- Глутаминовая кислота
- Серин
Условно незаменимые аминокислоты
Существует шесть аминокислот, которые называются условно незаменимыми, потому что здоровые тела могут вырабатывать их в нормальных физиологических условиях.Они становятся необходимыми при определенных условиях, таких как голодание или врожденные нарушения обмена веществ.
Условно незаменимыми аминокислотами являются:
- Аргинин
- Цистеин
- Глютамин
- Глицин
- Proline
- Тирозин
Незаменимые аминокислоты
Девять аминокислот называют незаменимыми, потому что они не могут быть произведены в организме. Следовательно, диетический белок обеспечивает эти аминокислоты, которые необходимы для выработки определенных гормонов и других важных молекул.
Незаменимые аминокислоты:
- Гистидин
- Изолейцин
- лейцин
- Лизин
- метионин
- Фенилаланин
- Треонин
- Триптофан
- Валин
Развитие
Четыре уровня структуры белка:
- Первичная структура
- Вторичная структура
- Третичная структура
- Четвертичная структура
Первичная структура
По сути, белок представляет собой цепь аминокислот, связанных друг с другом пептидными связями.Подобно нитке бусинок, эти нити могут скручиваться и складываться в окончательную форму белка. Когда кто-то ест белок, он расщепляется на аминокислоты. Эти аминокислоты состоят из центрального атома углерода, связанного с «амино» или азотсодержащей группой, и карбоновой «кислотной» группы, отсюда и название «аминокислота». Углерод также имеет один атом водорода и боковую цепь или «R-группу», которая уникальна для каждой аминокислоты. Исключением является пролин, имеющий кольцевую структуру.
Вторичный Структура
Вторичная структура — это уровень структуры белка, на котором происходят два общих подтверждения, альфа-спираль и бета-складчатые листы.Биологически этот уровень можно подразделить на три общие структуры. Третий — комбинация альфа-спиралей и бета-пластин, которые могут образовывать некоторые ферменты.
Первый — это альфа-спирали, которые могут присутствовать в таких белках, как гемоглобин и промежуточные филаменты. Альфа-спирали — это аминокислоты в форме спирали или спирали, позволяющие образовывать водородные связи между азотом и водородом, иначе известные как нитратные группы одной аминокислоты с карбоксильной группой другой аминокислоты на четыре остатка ранее.Некоторые аминокислоты более склонны к образованию альфа-спиралей. Некоторыми примерами являются метионин, глутамин, цистеин, гистидин и лизин.
Второй — бета-складчатые листы, которые появляются в белках, транспортирующих жирные кислоты, и антителах. Бета-складчатые листы представляют собой аминокислоты в серии соседних рядов, что позволяет образовывать боковые водородные связи между аминокислотной группой с карбоксильной группой другой аминокислоты. Если на рисунке имеется перегиб, это указывает на то, что в этом положении находится аминокислота пролина.Некоторые аминокислоты более склонны к образованию бета-складок. Некоторыми примерами являются изолейцин, тирозин, триптофан и валин.
Кроме того, есть две биологические характеристики вторичной структуры — функциональные и острофазовые.
Костный мозг и печень делают их функциональными. Костный мозг производит иммуноглобулины. В печени вырабатываются альбумин, фибриноген и альфа-1-антитрипсин. Печень производит примерно 90% белков, которые служат осмотическим градиентом в сыворотке.Осмотический градиент необходим для втягивания жидкости в капилляры и из них.
Реагенты острой фазы — это белки, вырабатываемые во время воспаления. Они неспецифичны и используются для отслеживания наличия воспаления в организме. Примеры включают трансферрин и церулоплазмин. [9]
Третичная структура
Наиболее важным фактором, влияющим на третичную структуру, являются ее гидрофобные и гидрофильные взаимодействия. Гидрофобные жирорастворимые аминокислоты в белке будут складываться «внутрь» белка и от контакта с водой.Напротив, гидрофильные водорастворимые аминокислотные остатки будут сворачиваться по направлению к «внешней стороне» белка, по направлению к контакту с водой. Кроме того, третичный — это уровень образования ковалентных связей. Все эти характеристики способствуют формированию трехмерной формы. [10]
Четвертичная структура
Четвертичная структура — это уровень, на котором два или более белков взаимодействуют друг с другом, и называется кооперативностью.
Когда кооперативность применяется к композиции ферментов, она классифицируется как аллостерический фермент.А аллостерические ферменты обычно являются ферментами, ограничивающими скорость. Это белки, которые контролируют определенный этап пути. Следовательно, фермент, ограничивающий скорость, участвует в стадии, которая называется «стадией ограничения скорости». Если ограничивающий скорость фермент становится медленнее, то последующие или последующие шаги также замедляются. Верно и обратное. Если ограничивающий скорость фермент станет более эффективным, он увеличит скорость реакции, потому что последующие стадии в конечном итоге происходят раньше.Таким образом, по определению, ограничивающий скорость фермент должен быть самым медленным катализатором реакции. Следует также упомянуть, что большинство генетических состояний, которые являются клинически значимыми, влияют на ограничивающий скорость фермент биохимической реакции.
Кинетическая кривая фермента будет иметь определенную форму, если белок является аллостерическим. Наиболее вероятное подтверждение — сигмовидное, что имеет значение при элиминации первого порядка. Хотя фармакокинетические аспекты выходят за рамки данной статьи, необходимо понимать, что выведение первого порядка связано с концентрацией субстрата и Vmax.Когда белки имеют несколько активных центров, их Vmax увеличивается. Говорят, что белки насыщены, когда субстрат занимает все активные центры. Клинически это то, как белковые каналы и переносчики влияют на скорость клубочковой фильтрации [11].
Вовлеченные системы органов
Диета
В целом, белковые продукты животного происхождения, такие как яйца, молочные продукты, мясо и морепродукты, содержат все девять незаменимых аминокислот в достаточном количестве.Продукты на основе сои уникальны, потому что они безвкусны и содержат все девять незаменимых аминокислот в достаточном количестве. Большинство других растительных продуктов, включая цельнозерновые, орехи, бобовые и семена, содержат высокий уровень одних аминокислот и низкий уровень других. Было бы неправильно предполагать, что продукты животного происхождения содержат больше белка, чем продукты растительного происхождения. Чашка тофу содержит столько же граммов белка, сколько 30 грамм стейка, курицы или рыбы. Полстакана чечевицы содержит больше граммов белка, чем яйцо.Не все растительные продукты содержат одни и те же аминокислоты, поэтому употребление разнообразных растительных продуктов может обеспечить все девять основных компонентов. Например, сочетание источников белка, таких как рис и бобы, хумус и лаваш, или овсянка с миндальным маслом. Однако, с точки зрения объема, может потребоваться употребление большего количества продуктов растительного происхождения, чтобы получить такое же количество белков и аминокислотный профиль, обеспечиваемый белками животного происхождения. [12]
Пищеварение
Когда пища достигает желудка, соляная кислота денатурирует белок, разворачивая его и делая аминокислотную цепь более доступной для ферментативного действия.Затем пепсин, белок, продуцируемый главными клетками желудка, расщепляет любой доступный белок на более мелкие олигопептидные цепи, которые затем перемещаются в двенадцатиперстную кишку. Второй набор пищеварительных ферментов, вырабатываемых поджелудочной железой, дополнительно расщепляет олигопептиды на трипептиды, дипептиды и отдельные аминокислоты. Все эти продукты могут поглощаться клетками кишечника, где дипептиды и трипептиды превращаются в аминокислоты. Некоторые аминокислоты являются частью процесса синтеза кишечных ферментов и новых клеток.Большинство из них попадает в кровоток и переносится в другие части тела.
Брутто Анатомическое проявление
Волосы — это белок, который содержит множество изгибов и поворотов. Поэтому неудивительно, что волосы содержат множество дисульфидных связей. Тепло денатурирует белки; вот почему люди могут распаривать волосы, чтобы «расслабиться» и выпрямить очень вьющиеся волосы. Системы органов в организме, обладающие бета-складчатыми листами, требуют плоских тканей, таких как плоские кости и кожа.[13]
Функция
Белки играют важную роль в биохимии человека . Основная роль заключается в обеспечении строительных блоков тела. Они являются предшественниками нескольких биологически значимых молекул. Следовательно, избыток или недостаток белка может привести к заболеванию, которое может привести к дефектам нервной системы, метаболическим проблемам, отказу органов и даже смерти.
Биохимические функции
Ферментные белки ускоряют реакцию в качестве катализатора.Катализированные реакции протекают в миллион или более раз быстрее. Ферменты обычно имеют в названии суффикс «-аза». Исключение составляют ферменты, обнаруженные до начала схемы наименования. Каждый фермент регулируется конкурентными и неконкурентными ингибиторами и / или аллостерическими молекулами. Ферменты могут катализировать пути производства или разрушения биологических молекул. Изменения ферментов могут привести к заболеванию или лечению. Определенные аминокислоты образуют сайт связывания субстрата фермента. Сайт связывания субстрата — это «активный сайт».«Это служит в химических реакциях. Субстраты могут быть гидрофобными, гидрофильными, заряженными, незаряженными, нейтральными или их комбинациями. Мутации, которые изменяют аминокислоты в активном центре, изменяют активность фермента. Субстрат присоединяется к ферменту, который выстлан совместимыми аминокислотами. кислоты. Если эти аминокислоты изменяются, субстрат может не соединяться, что делает фермент нефункциональным. То, как субстрат взаимодействует с активным центром, означает «сродство» этого фермента. Более высокое сродство означает, что для добиться реакции.Мутация, изменяющая активный сайт, может повышать или понижать аффинность. [14]
Структурные функции
Белки служат структурными элементами клеток и тканей — белки актин и тубулин образуют актиновые филаменты и микротрубочки. В мышцах актин обеспечивает «основу», на которой миозин может вызывать сокращение мышц. [15]
Кинетический Функции
Моторные белки транспортируют молекулы внутри клетки, обеспечивают движение определенных частей отдельных клеток, участвующих в специализированных функциях, генерируют крупномасштабные движения жидкостей и полутвердых веществ, такие как циркуляция крови и движение пищи через пищеварительный тракт и, наконец, обеспечивают движение человеческого тела через свои скелетные мышцы.Миозин — это белок с гидрофобным хвостом, головной группой, которая может присоединяться и отделяться от актиновых нитей, и «шарнирной» частью, которая перемещает головную группу вперед и назад, приводя к движению [16].
Каналы
Каналы необходимы для транспортировки питательных веществ в клетки и из них, а также для нервных сигналов и избирательной фильтрации молекул в почках. Это проиллюстрировано тем, что внутриклеточная концентрация калия в клетке млекопитающего составляет приблизительно 140 миллимолей на клетку, а натрия — от 5 до 15 миллимолей.Внеклеточная среда имеет концентрацию калия 5 моль и концентрацию натрия 145 миллимоль. специфические для калия каналы отвечают за регулирование этих концентраций в своих соответствующих компартментах [17].
Механизм
Трансляция
Синтез белка инициируется GTP, который заставляет рибосомные единицы собираться и запускать процесс элонгации, который превращает первичный транскрипт в аминокислотную последовательность, формирующую фундаментальную структуру белка.Эукариотические рибосомные субъединицы — это 40-е и 60-е, тогда как прокариотические рибосомные субъединицы — 30-е и 50-е. Рибосомная субъединица эукариот — это 80-е гг. Прокариотическая рибосомная субъединица 70-х гг. S не представляет размер субъединиц, поэтому не следует предполагать, что общая сумма для комплекса субъединиц является суммой двух отдельных субъединиц. «S» представляет собой коэффициент седиментации, при котором каждый белок проявляет при центрифугировании. Процесс удлинения — это то, как создается первичная структура белка, который также известен как транслокация.ТРНК связывается с определенной позицией, называемой сайтом. Затем TRNA перемещается в сайт гороха, где доставляет аминокислоту в конец растущей полипептидной цепи. Наконец, тРНК перемещается на электронный сайт, откуда и выходит.
Сопутствующие испытания
Секвенирование белков
Существует несколько лабораторных методов, используемых для определения характеристик белка. Это тесты, которые определяют тип, количество и заряд аминокислот в белке.
Кислотный гидролиз
- Используется для определения типов аминокислот в белке.
- Этот метод не может определить последовательность.
- Кислотный гидролиз выполняется путем погружения белка в кислоту, которая денатурирует белок. [18]
Гель-электрофорез
- Использует агарозный гель для разделения белков в основном по размеру.
- Он также может разделять их по заряду, если добавлены электроды.
- Более мелкие белки мигрируют дальше.
- Более крупные белки остаются ближе к стартовому сайту.
- Не секвенирует белки.
- Электрофоретическая картина существует для любого полипептида; поэтому для его обнаружения можно использовать гель-электрофорез. [19]
Нингидрин Реакция
- Это химическая реакция, которая реагирует с аминокислотой на амино-конце (слева).
- Реагирует со всеми аминокислотами, образуя пурпурный цвет.
- Реакция пролина дает желтый цвет.
- Используется для подсчета количества пролинов в конкретном белке. [20]
Деградация Эдмана
- Использует реагент, называемый фенилизотиоцианатом.
- Реагирует с любой аминокислотой, начиная с амино-конца.
- Аминокислоты идентифицируются с помощью тонкослойной хроматографии или высокоэффективной жидкостной хроматографии.
- Процедура точна только до 30 аминокислот.[21]
Рестрикционные пептидазы
- Определяет последовательность путем разделения белка на наборы аминокислот.
- Пептидазы ограничены в том, что они могут распознавать и вырезать.
- Затем используется обратный инжиниринг, чтобы выяснить, как они должны были быть связаны. [22]
- Используется для секвенирования белков.
- Необходимо вывести последовательность.
- Сначала необходимо знать, какие аминокислоты распознают ферменты.
- Трипсин отрезается справа от LYS и ARG.
- Химотрипсин разрезает справа ароматические аминокислоты, PHE, TRP.
- Эластаза разрезает справа от GLY, ALA, SER, трех самых маленьких аминокислот.
- Цианобромид сокращается справа от МЕТ.
- Аминопептидаза разрезает справа от любой аминокислоты на амино-конце.
- Меркаптоэтанол разрушает дисульфидные связи.
- Карбоксипептидаза разрезает слева от любой аминокислоты на карбоксильном конце.
Патофизиология
Дисфункциональный белок может привести к различным заболеваниям и, часто, к смерти. Дисфункциональные белки могут привести к ожирению у детей , разрушению сетчатки, ведущему к слепоте, потере слуха и диабету 2 типа.
Возьмем, к примеру, белковые реснички и то, как проявляется их дисфункция.
- Недостаточные реснички в жгутиках приводят к нарушению подвижности сперматозоидов.
- Дефект ресничек дыхательных путей приводит к хроническим легочным инфекциям.
- Дисфункция ресничек евстахиевой трубы вызывает хронические инфекции уха и потерю слуха.
- Дисфункциональные реснички маточных труб вызывают бесплодие.
Инфекционные
Многие инфекционные агенты действуют, имитируя дополнительные белки человека и связываясь с факторами удлинения. Хотя бактерии ингибируют белки, вирусы фактически «захватывают» и используют аппарат синтеза белка хозяина для размножения и дальнейшего заражения. Инфекционные, неправильно свернутые белки, называемые «прионами», сокращенно от «белковые и инфекционные вирионы», инфицируются как нормально свернутый белок, затем реплицируются и неправильно складываются в β-листы, называемые «амилоидная складка».«Они собираются в амилоидные бляшки и создают« дыры »в ткани, создавая« губчатый »вид. Прионы поражают нервную ткань, вызывая опасные и смертельные неврологические симптомы. [23]
Хрящевые
Мутации, изменяющие структуру коллагена, способствуют частым переломам , легкие синяки, слабые суставы и потеря слуха из-за аномалии костей внутреннего уха. [24]
Enzymatic
Генетическое заболевание может вызвать дефицит фермента, необходимого для преобразования аминокислот в нейротрансмиттеры и пигмент кожи.Заболевание возникает не из-за снижения уровня аминокислот, а из-за их высокой концентрации. Это способствует активности второстепенного ферментативного пути, производящего токсичные продукты. Наличие этих продуктов в крови проверяется в рамках стандартного неонатального тестирования. Пациенты обычно проявляют признаки альбинизма, светлые волосы, бледно-голубые глаза и запах токсичных продуктов в их поте, моче, коже и волосах. Лечение этого заболевания заключается в соблюдении диеты с низким содержанием определенных аминокислот.[25]
Мышечный
Заболевания белков скелетных мышц могут вызывать быстрое разрушение, что приводит к неспособности ходить. [26]
Осмотический
Неправильно свернутые белки могут вызывать множество клинически значимых заболеваний. В частности, это муковисцидоз, аутосомно-рецессивное заболевание, вызванное дефектом белка CFTR хлоридного канала, который регулирует движение воды, хлоридов и выработку слизи. Обычно этот белок является каналом, по которому хлорид выходит из клеток, чтобы сбалансировать тонус соли и воды.Натрий — это ион, который движется противотоком, чтобы сбалансировать осмоляльность между компартментами. Это важно для железистых тканей, которые выделяют большие концентрации хлорида натрия. Слизистые пробки, рецидивирующие инфекции, бесплодие и желудочно-кишечная дисфункция — частые проявления. [27]
Многофакторный
Реагенты острой фазы, вызываемые в основном ИЛ-6, производимыми макрофагами, а также Т-хелперами. Слишком много белков острой фазы может откладываться в любом месте тела.Неспецифическое отложение называется амилоидозом. Отложение в сосудистой сети нарушает их целостность. Уменьшается соответствие стенок кровеносных сосудов, что приводит к меньшей растяжимости; это увеличивает вероятность разрыва кровеносного сосуда при повышении давления — массивное внутримозговое кровоизлияние у молодого человека, у которого в анамнезе не было гипертонии или травм. Диагностическое подтверждение подтверждается окрашиванием конго красным, которое показывает характерное двойное лучепреломление яблочно-зеленого цвета [28].
Бета-амилоид или тау-белок присутствует как при возрастной, так и при связанной с синдромом Дауна болезни Альцгеймера (бета-липопротеин E4 более специфичен для болезни Альцгеймера).У населения в целом этот белок окисляется, вызывая болезнь Альцгеймера. Нейрофибриллярные клубки — это проявление тау-белка, подвергающегося окислению и агрегации. При синдроме Дауна организм не может отщеплять бета-липопротеин от белка-предшественника амилоида. В результате накапливается бета-липопротеин, который вызывает раннее начало болезни Альцгеймера.
Клиническая значимость
Признаки и симптомы
- Недоедание
- Деменция
- Пеллагра (The 3 Ds)
- Депрессия
- Дерматит
- Диарея
- Психические изменения
- Анорексия
- Похудание
- Глосситис
- Энцефалопатия
- Путаница
- Кома
- Астериксис
- Fetor hepaticus [29]
- Энтеропатия
- Кишечная дисфункция
- История трансплантации органов
- Сосудистый застой
- Язвенный отек
- Асцит
- Альфа-1 дефицит антитрипсина
- Недавняя сцинтиграфия Tm99
Фармакотерапия
- Цефалоспорины могут связываться с пенициллин-связывающими белками, тем самым подавляя синтез клеточной стенки бактерий.
- Макролиды и Линкозамид оба связываются с 50-й рибосомной субъединицей, которая ингибирует синтез бактериального белка
- Аминогликозиды и Тетрациклины оба связываются с 30-й рибосомной субъединицей, которая блокирует связывание аминоацил-тРНК, тем самым подавляя синтез бактериального белка. [30]
Лабораторная медицина
- Концентрация белка в плазме и сыворотке составляет примерно 7.0 г / дл / л
- Концентрация белка в спинномозговой жидкости составляет приблизительно 0,48 г / дл / л
- Концентрация белка в моче составляет примерно 1,5 г / день
- Концентрация белка в сыворотке составляет примерно 140 мэкв / л
- Примерно 50% сывороточного белка составляет альбумин.
- Гипоальбуминемия составляет примерно <2,5 г / дл.
- Примерно 48% сывороточного белка составляет глобулин. [31] Состав такой:
- Alpha 1: примерно 5.7%
- Alpha 2: примерно 9,4%
- Бета: примерно 11,6%
- Гамма: приблизительно 17%
Скорость оседания эритроцитов и реактивный белок
Если в плазме слишком много белков, это может быть отражено в лабораторных исследованиях по повышенной скорости оседания эритроцитов (СОЭ) или С-реактивному белку (СРБ). СОЭ — это анализ крови, который определяет скорость осаждения эритроцитов во время центрифугирования за один час.CRP — это опсонин, который связывается с поверхностью мертвых клеток для активации системы комплемента. Повышение CRP указывает на неспецифическое воспаление. Повышенная СОЭ не указывает, какие белки увеличились. Другими факторами, влияющими на СОЭ, являются микроцитарная анемия, серповидно-клеточная анемия и полицитемия. Ценность СОЭ заключается в ее способности определять воспалительный или невоспалительный процесс.
Представьте себе флакон с плазмой пациента. Встряхните и переверните вверх дном.Подсчитайте, сколько времени нужно, чтобы один эритроцит опустился на дно. Как только он достигает дна, часы останавливаются. Если он достигает дна быстро, то скорость осаждения низкая.
Если белки мешают, эритроциты будут подпрыгивать, пока не достигнут дна; это вызовет высокую скорость осаждения. Анемия вызовет ложно высокую скорость оседания, потому что во флаконе очень мало клеток; только по чистой случайности человеку понадобится много времени, чтобы, наконец, уплыть на дно.
Может возникнуть ложно низкая скорость оседания, если флакон уже заполнен эритроцитами.Следовательно, нет необходимости проводить оценку для пациента с полицитемией, поскольку подсчет клеток будет искажать результат. Серповидная форма красных кровяных телец позволяет клеткам быстрее достигать дна флакона, что делает скорость оседания ложно низкой. [32]
Preventive Health
Диабет
Диеты с высоким содержанием белка могут способствовать снижению веса за счет повышенной чувствительности к инсулину, повышенного окисления жирных кислот, повышения и подавления аппетита, увеличивая чувство сытости.Однако людям с диабетом и подагрой необходимо соблюдать осторожность, поскольку белок может повышать уровень ниацина, что может усугубить симптомы, связанные с подагрой.
Скрининг
Определенные комбинации белков могут быть полезны при обследовании состояния здоровья. Например, определенные комбинации белков имеют более высокую чувствительность для выявления рака, чем тестирование только на один конкретный белок. [33]
TSRI — Новости и обзоры
Зловещие аминокислоты или невинные жертвы эволюции?
Джейсон Сократ Барди
Вырасти левшой сегодня может быть не так сложно, как в прошлые эпохи, когда это считалось признаком гнусности (слово «зловещий» на латыни означает левый).
Тем не менее, поскольку в этом месяце школы по всей стране приступят к своим первым занятиям, определенный процент детей обнаружит, что в мире, где преобладают правши, по-прежнему трудно расти левшами — слишком мало левых парт в большинстве классов, например.
К счастью, у белков никогда не бывает таких проблем.
Белки, как и другие биологические полимеры, состоят из строительных блоков, которые имеют «хиральные» центры — то, что стало называться хиральностью, — в которых атомы расположены асимметрично, так что молекула не может быть наложена на ее зеркальное отображение (точно так же, как левую руку нельзя накладывать поверх правой).Фактически, все строительные блоки аминокислот, из которых состоят натуральные белки, являются левыми.
Но почему? Правые аминокислоты не менее стабильны и не обладают большей реакционной способностью, так почему же природа использует только левосторонние аминокислоты для производства белков?
Один из возможных ответов на этот вопрос может лежать несколько миллиардов лет назад в том, что, по предположениям ученых, могло быть ранним миром пребелковой РНК. Согласно этой теории, существовал древний мир РНК, в котором ферменты РНК были главными каталитическими молекулами, а нуклеотиды РНК были строительными блоками, хранящими генетическую информацию.
Позже, согласно теории, по мере того, как мир РНК эволюционировал в современный мир ДНК-РНК-белков, молекулы РНК начали связывать аминокислоты в белки. Белки гораздо более универсальны в химическом отношении и были бы полезны для форм жизни на основе РНК, которые могли бы их синтезировать. А современный синтез белка, соединение аминокислот — это наследие этого раннего мира РНК.
Хотя это был заманчивый аргумент в течение ряда лет, никто так и не дал экспериментальной поддержки этой концепции.Но теперь научный сотрудник Скриппса Коджи Тамура и профессор Пол Шиммель, который является профессором Эрнеста и Джин Хан и заведующим кафедрой молекулярной биологии и химии, а также членом Института химической биологии Скэггса при Исследовательском институте Скриппса, сделали именно это.
В статье, опубликованной в недавнем выпуске журнала Science , Тамура и Шиммель описывают, как они синтезировали основанную на РНК систему аминоацилирования (присоединения аминокислоты к молекуле РНК) с использованием как левой, так и правой РНК.
Сахарный каркас цепей РНК хиральный — они состоят только из правосторонних сахаров рибозы — и хиральность эволюционно более старой РНК, возможно, определила хиральность аминокислот, используемых для создания эволюционно более молодых белков. Молекулы РНК, которые захватывали аминокислоты, были правосторонними, и в системе, реконструированной Тамурой и Шиммелем, это заставляло их предпочтительно выбирать аминокислоты, которые были левосторонними.
Экспериментально они обнаружили, что правая РНК предпочитает левые аминокислоты, а левосторонняя РНК зеркально отображает правосторонние аминокислоты.Это подтверждает мнение о том, что предпочтение природы левым аминокислотам было определено направленностью РНК в том раннем, пребелковом мире РНК.
Тем не менее, знание того, что левши доминируют на микроскопической сцене, может быть мало утешением для сегодняшних школьников-левшей, которые оказываются отодвинутыми на эти одинокие, обветренные, левши в углу.
Статья Коджи Тамура и Пола Шиммеля «Хирально-селективное аминоацилирование миниспирали РНК» опубликована в номере журнала Science от 27 августа 2004 г.См. Http://dx.doi.org/10.1126/science.1099141.
Отправляйте комментарии по адресу: [email protected]
Первичная структура — биохимия
Explanation:Этот вопрос представляет нам сценарий, в котором белок переводится в сильно кислый раствор, значение pH которого выходит за пределы оптимального диапазона белка. В такой ситуации мы могли бы ожидать, что белок претерпит конформационные изменения, которые изменят его функцию.Вопрос, однако, в том, какие уровни структуры белка будут изменены таким изменением pH.
Первый уровень структуры, заслуживающий рассмотрения, — это первичная структура. Первичная структура белка относится к последовательности отдельных аминокислот, составляющих белок. При переводе в кислый раствор белок действительно разворачивается, но не распадается на отдельные аминокислоты. Таким образом, развернутый белок остается одной длинной цепью, но последовательность его аминокислот остается неизменной.Таким образом, нет никаких изменений в первичной структуре.
Вторичная структура белка относится к локальным конформациям, обнаруженным внутри свернутого белка. Такие локальные конформации включают некоторые обычно встречающиеся структурные мотивы, такие как альфа-спирали и бета-складчатые листы. Эти локальные конформационные структуры удерживаются вместе различными внутримолекулярными связями между аминокислотными остатками. Эти внутримолекулярные взаимодействия включают, среди прочего, водородные связи и силы Ван-дер-Ваальса.При переходе в кислый раствор эти внутримолекулярные силы нарушаются и, как следствие, вызывают нарушение вторичной структуры белка.
Третий уровень структуры белка — это третичная структура, которая относится к общей конформации одной цепи аминокислот, иногда называемой полипептидом. Общая трехмерная конформация полипептида удерживается вместе некоторыми из тех же внутримолекулярных сил, участвующих во вторичной структуре, таких как водородные связи, ван-дер-ваальсовы взаимодействия и дисульфидные связи.Поскольку высококислотный раствор препятствует этим взаимодействиям, на третичный уровень структуры белка действительно влияют изменения pH.
И, наконец, последний уровень структуры белка, который необходимо рассмотреть, — это четвертичная структура. Не все белки обладают этим уровнем структуры, потому что для того, чтобы иметь этот уровень структуры, две или более полипептидных цепей должны объединиться и взаимодействовать посредством межмолекулярных связей, чтобы сформировать окончательный, законченный белок. Пример такого уровня структуры можно увидеть в белке гемоглобине, в котором две альфа-цепи и две бета-цепи объединяются и взаимодействуют с образованием гемоглобина.Как и в случае с вторичными и третичными структурами, введение высококислотного раствора может нарушить эти межмолекулярные взаимодействия, вызывая нарушение четвертичной структуры белка, состоящего из двух или более полипептидных цепей.
.