Строение миофибрилл.
Миофибриллы состоят из упорядоченно расположенных нитей актина и миозина, представляющих собой сократительные белки. Для закрепления нитей актина и миозина служат особые структуры телофрагмы и мезофрагмы.
¨Телофрагма — это сеть белковых молекул,которые растянуты поперек клетки и прикреплены к цитолемме. На продольном срезе кардиомиоцита телофрагмы имеют вид линий толщиной около 100 нм, получившх название Z-линий. Участок миофибриллы, который располагается между двумя телофрагмами, носит название саркомера.
¨По середине саркомера располагается мезофрагма, представленная на продольном срезе в виде линии (М-линия). От мезофрагмы в направлении телофрагмы отходят нити миозина, а от телофрагмы навстречу им нити актина. Они встречаются и на некотором расстоянии идут параллельно, причем каждый миозиновый (толстый) филамент сопровождается 6-ю актиновыми (тонкими) миофиламентами,
Участок
сакромера, занятый М-линией и прилежащими
зонами, в которых располагаются только
миозиновые нити, носит название Н-полосы (светлой зоны), а участок, в котором
располагаются нити миозина и частично
актина — А-полосы ( А-диска).
Участки двух соседних саркомеров, разделенные Z- линией, содержащие только нити актина, вместе образуют I-полосу (I-диск). Полосы называются так потому, что из-за различной молекулярной организации в области I-полосы преломление света изотропное, а в области А-полосы анизотропное.
Между миофибриллами локализованы митохондрии и агранулярная эндоплазматическая сеть. Митохондрии очень крупные, и образуют трехмерную сеть с очень плотным их расположением в области I-диска.
На
уровне телофрагмы, цитолемма образует
глубокие куполообразные впячивания,
которые называются поперечными
трубочками или Т-трубочками,
в которые заходит и базальная мембрана.
Эта система обеспечивает быстрое
проведение потенциала действия к каждой
миофибрилле, обеспечивая синхронность
их сокращения. Канальцы агранулярной
эндоплазматической сети в цитоплазме
расположены между миофибриллами
продольно и анастомозируют друг с
другом, достигая Т-трубочек идут на
некотором расстоянии параллельно с
ними.
Разные концы кардиомиоцитов в области вставочных дисков оканчиваются на разных уровнях. Выступающая часть одного кардиомиоцита вдвинута в углубленную часть последующего. Поверхность контакта клеток образует пальцевидные соединения — интердигитации, и многочисленные десмосомы. В них вплетаются актиновые нити ближайшего саркомера миофибриллы. Боковые поверхности выступов тоже соприкасаются и объединяются многочисленными
Строение проводящих кардиомиоцитов.
Размеры — значительно крупнее рабочих (длина около 100мкм, толщина около 50мкм).
Цитоплазма содержит
все органеллы общего назначения. Митохондрии мелкие и равномерно
распределены в цитоплазме.
Митохондрии мелкие и равномерно
распределены в цитоплазме.
Миофибриллы немногочисленные и располагаются по периферии клетки.
Цитолемма не образует Т-систем. Проводящие кардиомиоциты соединяются в волокна не только концами, но и боковыми поверхностями. Между кардиомиоцитами формируются вставочные диски, но они более просто устроены, чем между сократительными. Интердигитации и десмосомы встречаются очень редко
Функции состоят в том, что они воспринимают управляющие сигналы от пейсмекерных элементов и передают информацию к сократительным кардиомиоцитам. Волокна, состоящие из проводящих кардиомиоцитов, ветвятся между рабочими сократительными кардиомиоцитами, доставляя им возбуждающий имульс.
Регенерация сердечной мышечной ткани невозможна вследствие того, что она не сохраняет ни стволовых клеток, ни клеток — предшественников.
Строение миофибриллы
Миофибрилла состоит из одинаковых
повторяющихся элементов — саркомеров.
Саркомер— функциональная единица миофибриллы, он имеет длину от 1500 до 2300 нм.
Саркомер ограничен с двух сторон Z-дисками, образованные α-актинином.
К Z-дискам присоединены «тонкие» филаменты. Тонкие филаменты гладких мышц образованы F-актином и тропомиозином, а поперечнополосатых — F-актином, тропомиозином и тропонинами Т,Iи С. Диаметр тонких филаментов составляет около 6 нм.
В центре саркомера, между «тонкими» филаментами, располагаются «толстые» филаменты. «Толстые» филаменты имеют диаметр около 16нм, они образованы молекулами миозина. На поверхности «толстого» филамента с промежутками в 14 нм располагаются головки миозина, с помощью которых «толстые» филаменты взаимодействуют с актином «тонких» филаментов. В центре «толстых» филаментов на участке в 150 нм миозиновых головок нет.
Каждый «тонкий» филамент занимает
симметричное положение между тремя
толстыми филаментами, а каждый «толстый»
филамент симметрично окружен шестью
«тонкими» филаментами.
Расположение филаментов в поперечнополосатой мышце (по Р. Марри, 1993).
В скелетной мышечной ткани мышечные волокна выстраивается таким образом, что саркомеры миофибрилл располагаются параллельно. При этом на срезах наблюдается правильное чередование светлых и темных участков, благодаря которым скелетные мышцы называют поперечнополосатыми.
Темный участок – называется диск А(анизотропная зона), он образован «толстыми» нитями миозина. Его размер постоянен.
Центральная область диска А называется зона Н, она выглядит менее плотной, чем остальная его часть. В зоне Н нет «тонких» нитей актина, в отличие от более темной части, которая образована и «толстыми» и «тонкими» нитями. Размер зоны Н уменьшается при сокращении мышцы.
Полоса Мпересекает центральную область диска А, она образована толстыми нитями, в которых миозин не имеет головок.
 Полоса М имеет длину 150 нм, в не заходят
«тонкие» нити актина.
Полоса М имеет длину 150 нм, в не заходят
«тонкие» нити актина.Светлый участок называется диск I(изотропная зона), он образован «тонкими» нитями актина. Размер дискаIуменьшается при сокращении мышцы.
Диск I делит пополам очень плотная и узкая линия Z, которая образована Z-дисками α-актинина.
Механизмы мышечного сокращения
Мышечное сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Биохимический цикл мышечного сокращения состоит из пяти стадий:
Миозиновая головка может спонтанно гидролизовать АТФ до АДФ и Фн, при этом АДФ и Фн остаются в составе головки. Миозиновая головка, содержащая АТФ или АДФ и Фн, свободно вращается под большими углами.
При достижении нужного положения миозиновая головка с АТФ или АДФ и Фн может связываться с F-актином, образуя актин-миозиновый комплекс, в котором головка миозина располагается к оси фибриллы под углом 90°.
 Актин значительно
ускоряется АТФ-азную активность
миозина, в результате весь АТФ
гидролизует до АДФ и Фн.
Актин значительно
ускоряется АТФ-азную активность
миозина, в результате весь АТФ
гидролизует до АДФ и Фн.У АДФ и Фн низкое сродство к актин-миозиновому комплексу, поэтому они от него отделяются. При этом головка миозина изменяет свой угол к оси фибриллы с 90° на примерно 45°, продвигая актин (на 10—15 нм) в направлении центра саркомера.
Новая молекула АТФ присоединяется к актин-миозиновому комплексу.
Комплекс актин-миозин-АТФ обладает низким сродством к актину, поэтому миозиновая головка с АТФ отделяется от F-актина. При этом наступает расслабление. Далее цикл возобновляется.
Вследствие такого движения уменьшается
длина каждого саркомера (укорачиваются
Н-зона и I-диски) и всей
мышцы в целом. При такой системе генерации
движения, получившей название системы
скользящих нитей, длина филаментов не
изменяется. Напряжение, развивающееся
при сокращении мышцы, пропорционально
степени перекрывают филаментов и,
следовательно, числу поперечных
мостиков. Эффективность такого сокращения
около 50%, а двигателя внутреннего сгорания
— менее 20%.
Эффективность такого сокращения
около 50%, а двигателя внутреннего сгорания
— менее 20%.
Миофибрилла – определение, функция и структура
Определение миофибрилл
Миофибрилла является компонентом животного скелетная мышца, Миофибриллы – это длинные нити, которые идут параллельно друг другу, образуя мускул (мио) волокна. Длина миофибрилл и получаемых миофибрилл может составлять несколько сантиметров. Мышечные волокна представляют собой единичные многоядерные клетки, которые объединяются в мышцы. Миофибриллы состоят из повторяющихся субъединиц, называемых саркомерами. Эти саркомеры ответственны за сокращения мышц.
Структура миофибрилл
Миофибриллы состоят из двух типов нитей: тонких нитей и толстых нитей. Тонкие нити состоят из нитей белка актина и регулирующего белка, скрученных вместе, тогда как толстые нити состоят из нитей белка миозина. Тонкие и толстые нити образуют частично перекрывающиеся слои, которые расположены в функциональных единицах, называемых саркомерами.
Функция миофибрилл
Миофибриллы состоят из саркомеров, функциональных единиц мышцы. Функция миофибрилл заключается в сокращении мышц с помощью модели со скользящей нитью. Когда мышцы находятся в состоянии покоя, между тонкими и толстыми филаментами происходит неполное перекрытие, при этом некоторые области содержат только один из двух типов. Когда мышца сокращается, саркомеры укорачиваются в длину из-за того, что толстые и тонкие филаменты скользят друг над другом, что приводит к большему перекрытию между филаментами и укорочению H-зоны и I-полосы. Хотя длина саркомера уменьшается во время сокращения мышц, длина самих миофиламентов не изменяется.
Когда мышца сокращается, саркомеры укорачиваются в длину из-за того, что толстые и тонкие филаменты скользят друг над другом, что приводит к большему перекрытию между филаментами и укорочению H-зоны и I-полосы. Хотя длина саркомера уменьшается во время сокращения мышц, длина самих миофиламентов не изменяется.
Движение миофиламента обеспечивается гидролизом АТФ в АДФ и неорганический фосфат. В состоянии покоя, спс молекула прикрепляется к шаровидному миозину глава на толстой нити. Когда АТФ гидролизуется, головка миозина меняет конформацию и образует вложение, известное как поперечный мостик с тонкой нитью. Когда молекулы ADP и фосфата высвобождаются, головка миозина снова меняет конформацию и толкает тонкую нить к центру саркомера. Когда новая молекула АТФ связывается с головкой миозина, головка возвращается к своей первоначальной конформации и высвобождает тонкую нить в новом положении ближе к центральной М-линии. Затем цикл повторяется: новая молекула АТФ гидролизуется в АДФ и неорганический фосфат, а головка миозина меняет конформацию, в результате чего тонкая нить выталкивается к центру саркомера.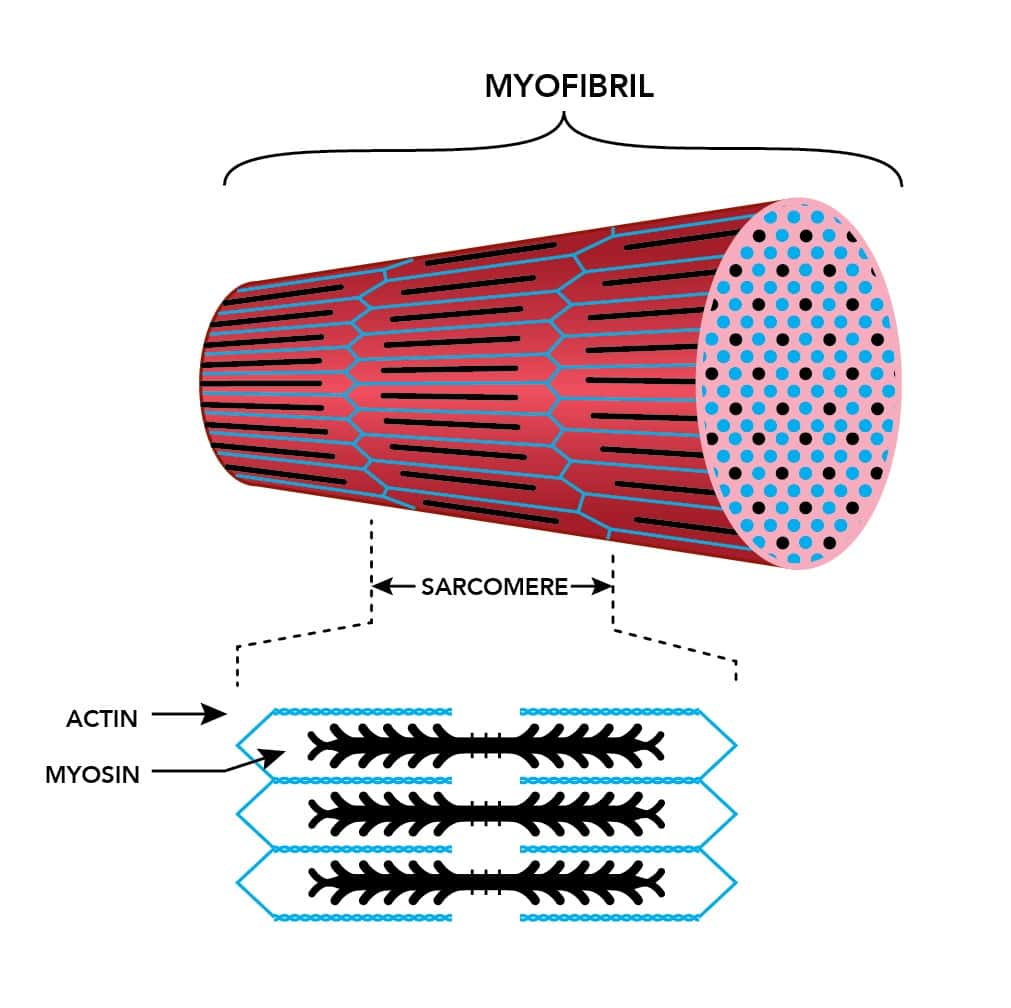 Каждая толстая нить содержит несколько сотен головок миозина, которые могут образовывать поперечные мостики с тонкими нитями примерно пять раз в секунду. Постоянные сокращения миофибрилл приводя�� к сокращению мышц.
Каждая толстая нить содержит несколько сотен головок миозина, которые могут образовывать поперечные мостики с тонкими нитями примерно пять раз в секунду. Постоянные сокращения миофибрилл приводя�� к сокращению мышц.
Мышечные сокращения приводятся в действие АТФ. Так как само мышечное волокно хранит очень небольшое количество АТФ, энергия поступает из двух других соединений, хранящихся в мышцах: креатинфосфат и гликоген, АТФ, хранящийся в мышечном волокне, и АТФ, который может быть образован креатинфосфатом, используются для кратковременных всплесков энергии; они могут обеспечивать энергией до 15 секунд. Гликоген может обеспечить долгосрочный источник энергии, поскольку гликоген расщепляется до глюкозы, которая затем превращается в АТФ через гликолиз и аэробного дыхания.
викторина
1. Сколько типов миофиламентов находится в миофибриллах?A. 1B. 2C. 4D. никто
Ответ на вопрос № 1
В верно.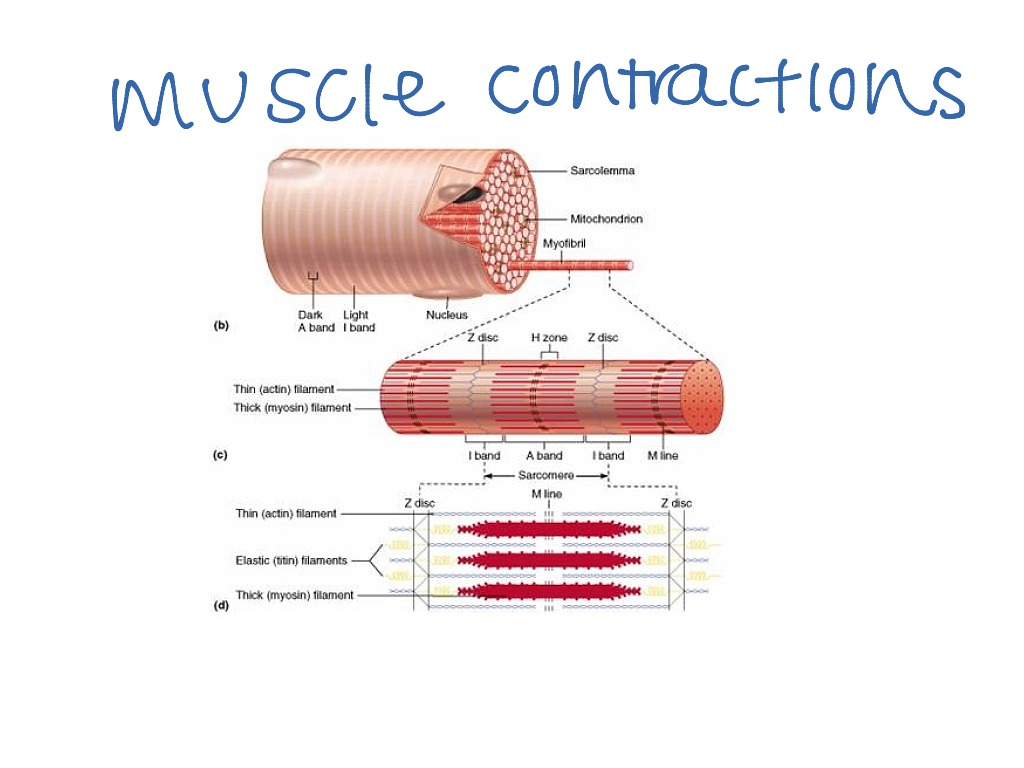 Существует два типа миофиламентов в миофибриллах: толстые нити, которые состоят из миозина, и тонкие нити, которые состоят из актина.
Существует два типа миофиламентов в миофибриллах: толстые нити, которые состоят из миозина, и тонкие нити, которые состоят из актина.
2. Какая структура действует как граница между саркомерами?A. ГруппаB. Н-зонаC. M-линияD. Z-линии
Ответ на вопрос № 2
D верно. Z-линия, также известная как Z-диск, действует как граница между саркомерами. Это также точка крепления для тонких нитей.
3. Каков наилучший долгосрочный источник энергии для сокращения мышц?A. ATPB. крахмалC. гликогенD. креатинфосфат
Ответ на вопрос № 3
С верно. В то время как мышечные сокращения приводятся в действие АТФ, мышцы будут иметь только очень небольшой запас АТФ, готовый к использованию. Гликоген превращается в АТФ для длительного использования через аэробного дыхания,
Ссылки
- Кэмпбелл, Н.
 А. и Рис, Дж. Б. (2005). Биология, 7-й. редактор Глава 49. Сан-Франциско, Калифорния: Бенджамин Каммингс. ISBN: 0-8053-7171-0.
А. и Рис, Дж. Б. (2005). Биология, 7-й. редактор Глава 49. Сан-Франциско, Калифорния: Бенджамин Каммингс. ISBN: 0-8053-7171-0. - Рэндалл Д., Бурггрен В. и Френч К. (2002). Эккерт животное физиология : механизмы и приспособления, 5-й. редактор Глава 10. Нью-Йорк, Нью-Йорк: W.H. Фримен и Компания. ISBN: 0-7167-3863-5.
Медицинская академия имени С.И. Георгиевского ФГАОУ ВО «КФУ им. В.И. Вернадского». Мышечная ткань.
МЫШЕЧНАЯ ТКАНЬ.=М.Т.
По МОРФОЛОГИЧЕСКОЙ классификации есть 2 вида МТ:1) ПОПЕРЕЧНОПОСАТАЯ (или исчерченная) МТ, 2) ГЛАДКАЯ (или НЕисчерченная) М.Т. Поперечнополосатая МТ подразделяется на 2 вида: А) поперечнополосатая СЕРДЕЧНАЯ МТ,Б) поперечнополосатая СКЕЛЕТНАЯ МТ.
Поперечнополосатая СКЕЛЕТНАЯ МТ:
Она состоит из поперечнополосатых СКЕЛЕТНЫХ мышечных ВОЛОКОН. Одно мышечное волокно состоит из 2-ух тканевых компонентов: 1) многоядерный МИОСИМПЛАСТ,2) одноядерные клетки-СПУТНИКИ, или МИОСАТЕЛЛИТОЦИТЫ.
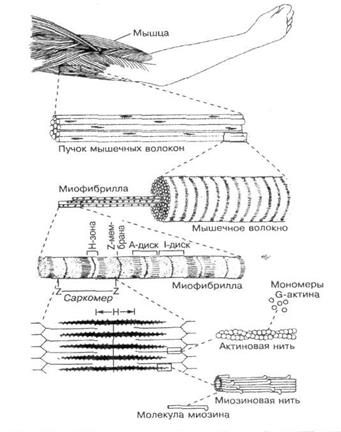
ГЛАВНЕЙШИЙ признак миосимпласта — в общей цитоплазме лежит 10 000 ядер. Т.к. миосимпласт НЕ клетка, его цитоплазма назыв. САРКОплазма, его оболочка –САРКОлемма, его аЭПС назыв. САРКОплазматическая сеть. Ядра лежат под сарколеммой, а в центре саркоплазмы находятся МИОФИБРИЛЛЫ. Это органеллы специального значения, к-рые обеспечивают главную функцию миосимпласта – это СОКРАЩЕНИЕ. Поперечная исчерченность находится в МИОФИБРИЛЛАХ. Исчерченность – это чередующиеся темные и светлые диски. Темный диск назыв. А-диск, светлый диск назыв. I-диск.
½ I-диска+полный А-диск+1/2 I-диска образуют САРКОМЕР. Это структурная единица миофибриллы. А-диск состоит из 2-ух разных надмолекулярных комплексов: 1)АКТИНОВЫЕ миофиламанты =ТОНКИЕ миофиламенты, 2) МИОЗИНОВЫЕ миофиламенты=ТОЛСТЫЕ миофиламенты.
 I-диск однородный и сост. только из АКТИНОВЫХ (или, тонких) миофиламентов.
I-диск однородный и сост. только из АКТИНОВЫХ (или, тонких) миофиламентов.МИОСАТЕЛЛИТОЦИТЫ – это ОДНОядерные клетки, лежащие в расщеплении сарколеммы миосимпласта. Функц.: явл. источником для РЕГЕНЕРАЦИИ миосимпласта после его разрыва.
Эмбр. источник для скелетной М.Т. — это МИОТОМ сомита.
Поперечнополосатая СЕРДЕЧНАЯ М.Т.:
Она состоит из поперечнополосатых СЕРДЕЧНЫХ мышечных ВОЛОКОН. Одно мышечное волокно — это цепочка клеток, соединенных «КОНЕЦ-в-КОНЕЦ» с помощью ВСТАВОЧНЫХ ДИСКОВ. Одна клетка назыв. КАРДИОМИОЦИТ.=КМЦ. Между мышечными волокнами нах. рыхлая неоформленная соединит. ткань. Она назыв. ЭНДОМИЗИЙ. Виды КМЦ-тов: 1) СОКРАТИТЕЛЬНЫЕ КМЦ.:а) имеет ЦИЛИНДРИЧЕСКУЮ (прямоугольную) форму, 1-2 ядра, в цитоплазме очень много МИОФИБРИЛЛ. Они состоят из САРКОМЕРОВ и имеют поперечную исчерченность.
Сократительные КМЦ преобладают в ЖЕЛУДОЧКАХ. Функц.: сокращение.
2) СЕКРЕТОРНЫЕ КМЦ.: а) имеют ЗВЕЗДЧАТУЮ (отросчатую) форму, б) в цитоплазме много секреторных ГРАНУЛ. Секреторные КМЦ лежат в миокарде только ПРЕДСЕРДИЙ.
Функц.: секреция в кровь гормона «НАТРИЙУРЕТИЧЕСКИЙ фактор».
Особенность регенерации: Все КМЦ-ты взрослых людей находятся в G0-периоде и никогда НЕ ДЕЛЯТСЯ митозом (отсутствует пролиферация). Поэтому в зоне некроза новые КМЦ-ты НЕ образуются, но активируются фибробласты в ЭНДОМИЗИИ и секретируют коллаген. Из него формируется СОЕДИНИТЕЛЬНОТКАННЫЙ РУБЕЦ. Регенерация КМЦ происходит путем обновления органелл – внутриклеточная регенерация.
Эмбр. источник для сердечной М.Т. – фрагмент висцерального листка спланхнотома, называемый МИОЭПИКАРДИАЛЬНАЯ ПЛАСТИНКА.
ГЛАДКАЯ МТ мезенхимного типа:
Развив. из МЕЗЕНХИМЫ. Находятся в стенке сосудов, кишечника, желудка, бронхов, матки.
Находятся в стенке сосудов, кишечника, желудка, бронхов, матки.Состоит из ПУЧКОВ клеток, которые назыв. ГЛАДКИЕ МИОЦИТЫ. Они: а) имеют ВЕРЕТЕНОВИДНУЮ форму, б) в цитоплазме много актиновых и миозиновых миофиламентов, котоые НЕ образуют саркомеров, поэтому исчерченность отсутствует.
ГЛАДКАЯ МТ эпидермального типа.
Развив. из КОЖНОЙ ЭКТОДЕРМЫ. Находится в концевых отделах потовых, молочных и слюнных желез. Состоит из единичных клеток, к-рые назыв.МИОЭПИТЕЛИОЦИТЫ (миоэпителиальные клетки): а) имеют ЗВЕЗДЧАТУЮ (отросчтую) форму. Функ.:при сокращении секрет выводится в выводной проток.
ГЛАДКАЯ МТ нейрального типа.
Она развив. из НЕРВНОЙ ТРУБКИ. Сост. из клеток миоцитов.нейрального типа. Они лежат в РАДУЖКЕ. Функц.: суживают зрачок.Составитель – доцент В.В. Бондаренко.
Молекулярная структура миофибрилл. Структура и функция основных белков миофибрилл миозина, актина, тропомиозина, тропонина
В мышечной клетке имеются миофибриллы — особым образом организованные пучки белков, располагающиеся вдоль клетки. Миофибриллы, в свою очередь, построены из белковых нитей
Миофибриллы, в свою очередь, построены из белковых нитей
(филаментов) двух типов — толстых и тонких. Основным белком толстых нитей является миозин, а тонких — актин. Миозиновые и актиновые нити — главный компонент всех сократительных систем.
Электронно-микроскопическое изучение поперечных и продольных срезов мышц обнаружило строго упорядоченное расположение миоэиновых и актиновых нитей в миофибрилле. Функциональной единицей миофибриллы является саркомер — участок миофибриллы (длиной 2,5 мкм) между двумя Z-пластинками.
Саркомер включает пучок миозиновых нитей, серединой прикрепленных к М-пластинке (М-линия), и пучки актиновых нитей, прикрепленных к Z-пластинкам. Многие сотни саркомеров образуют миофибриллу.
Чередование в миофибрилле участков, содержащих толстые нити, с участками, содержащими тонкие нити (A-диски и I-диски), создает поперечную полосатость мышц.
Саркоплазма, вмещающая миофибриллы, пронизана между ними сетью цистерн и трубочек
эндоплазматического (саркоплазматического) ретикулума, а также системой поперечных трубочек, которые тесно контактируют с саркоплазматическим ретикулумом, но не сообщаются с ним.
СТРОЕНИЕ МИОЗИНОВЫХ НИТЕИ
Миозиновые нити образованы белком миозином. Миозин составляет почти половину всех белков скелетной мышцы. Молекула миозина содержит две идентичные тяжелые полипептидные цепи (молекулярная масса каждой 200 ООО) и четыре легкие цепи (молекулярная масса около 20 ООО). Каждая тяжелая цепь на большой части длины с С-конца имеет конформацию а-спирали, и обе спирали скручены друг с другом; эта часть молекулы имеет форму палочки. Противоположные концы каждой цепи (N-концы) имеют глобулярную форму, образуя ≪головки≫ молекулы. К каждой из головок нековалентно
присоединены по две легкие цепи.
Миозин катализирует гидролиз АТФ; это было установлено Энгельгардтом и Любимовой в 1939 г. Энергия гидролиза используется для сокращения мышцы. Значительно позднее выяснилось, что каталитический активный центр локализован в головках молекулы миозина. Открытие АТФазной активности миозина в высокой степени стимулировало исследования мышечного сокращения, поскольку
было первым прямым указанием на источник энергии для сокращения и на роль миозина в использовании этой энергии.
Палочкообразные хвосты молекул миозина могут соединяться друг с другом продольно, образуя пучки; головки выступают на поверхности пучка, выстраиваясь вокруг него по спирали. В области М-линии пучки стыкуются ≪хвост к хвосту≫. Так получаются миозиновые нити саркомера, каждая из которых содержит около 400 молекул миозина.
СТРОЕНИЕ АКТИНОВЫХ НИТЕЙ
В состав актиновых нитей входят белки актин, тропомиозин и тропонин. Основу нитей составляют молекулы актина. Актин — это глобулярный белок с молекулярной массой 43 ООО и шарообразными молекулами диаметром около 5 нм; такая форма актина называется G-актин (глобулярный актин). G-актин содержится и во многих немышечных клетках.
Молекулы G-актина могут нековалентно соединяться, образуя фибриллярный актин — F-актин. Форма молекул F-актина напоминает две нитки бус, скрученные друг с другом. В мышечных клетках весь актин находится в форме F-актина.
К F-актину могут присоединяться головки миозина, причем на каждой молекуле G-актина в F-актине есть центр связывания миозина. В результате такого взаимодействия в сотни раз увеличивается АТФазная активность миозина. Соединение F-актина с миозином называют актомиозином. Образование связей между миозиновыми и актиновыми нитями в саркомере имеет важное значение в процессе сокращения мышцы.
В результате такого взаимодействия в сотни раз увеличивается АТФазная активность миозина. Соединение F-актина с миозином называют актомиозином. Образование связей между миозиновыми и актиновыми нитями в саркомере имеет важное значение в процессе сокращения мышцы.
Молекулы другого белка актиновых нитей — тропомиозина — имеют форму палочек длиной 40 нм. Они располагаются вблизи желобков спиральной ленты F-актина, вдоль нее, причем каждая молекула тропомиозина соединена с семью молекулам G-актина, а концами примыкает к соседним молекулам тропомиозина.
Третий белок актиновых нитей — тропонин — имеет глобулярную форму; он построен из трех разных субъединиц. Тропонин нековалентно связан с тропомиозином и с актином; на каждую молекулу тропомиозина приходится одна молекула тропонина. Одна из субъединиц тропонина содержит Са-связывающие центры: эта субъединица по строению сходна с кальмодулином.
Тонкие нити прикреплены к Z-пластинкам, которые тоже представляют собой белковые структуры. Содержание миозина, актина, тропомиозина и тропонина в миофибриллах равно примерно 55, 25, 15 и 5 % соответственно
Содержание миозина, актина, тропомиозина и тропонина в миофибриллах равно примерно 55, 25, 15 и 5 % соответственно
Б.33
Аутоиммунный полигландулярный синдром взрослых: современные представления о предикторах развития поражения миокарда и диагностике компонентов заболевания | Паневин
Введение
Аутоиммунный полигландулярный синдром (АПС) характеризуется поражением двух и более эндокринных желез, приводящим чаще всего к развитию их гормональной недостаточности. Помимо поражения органов эндокринной системы в состав АПС может входить аутоиммунное поражение неэндокринных органов. По механизму развития выделяют два типа данного синдрома.
АПС 1-го типа является моногенным заболеванием, в основе его – дефект аутоиммунного гена-регулятора (AIRE), который расположен в длинном плече 21-й хромосомы. В подавляющем большинстве случаев данное заболевание развивается в детском возрасте, характеризуется первичной хронической надпочечниковой недостаточностью (1-ХНН), гипопаратиреозом, кандидозом кожи и слизистых оболочек. В некоторых случаях данной триаде сопутствуют сахарный диабет 1-го типа (СД 1), аутоиммунное поражение щитовидной железы, первичное бесплодие, а также аутоиммунное поражение неэндокринных органов (пернициозная анемия, первичный билиарный цирроз, целиакия, алопеция).
АПС 2-го типа является полигенным заболеванием, в его основе – генетическая предрасположенность к аутоиммунному поражению ткани в результате наличия специфических генов системы HLA (DR3, DR4, B8, DQA1 и др.). Классический АПС 2-го типа характеризуется наличием 1-ХНН и аутоиммунного поражения щитовидной железы – болезни Грейвса (БГ) или гипотиреоза в исходе аутоиммунного тиреоидита (АИТ). Данное сочетание принято называть синдромом Шмидта, сочетание 1-ХНН с поражением щитовидной железы и СД 1 – синдромом Карпентера.
Зарубежные исследователи (Betterle) модифицировали данную классификацию, добавив АПС 3-го и 4-го типов, которые по своему патогенезу идентичны АПС 2-го типа, однако характеризуются сочетаниями аутоиммунных поражений, отличных от АПС 2-го типа.
АПС 3-го типа характеризуется любым сочетанием аутоиммунных поражений, исключая 1-ХНН и гипопаратиреоз. Выделяют 4 подтипа АПС 3-го типа (табл. 1). АПС 4-го типа включает 1-ХНН в сочетании с различными второстепенными компонентами АПС.
Таблица 1. Классификация АПС 3-го типа
Основой большей части аутоиммунных эндокринных заболеваний является лимфоидная и макрофагальная инфильтрация органа-мишени в результате нарушения Т-клеточного иммунитета, дефекта регуляторных Т-лимфоцитов, модулирующих иммунный ответ посредством регуляции функции Т-эффекторных клеток (Т-хелперов и цитотоксических лимфоцитов). Высокая активность Т-киллеров и Т-хелперов приводит к развитию деструкции ткани, атрофии органа и недостаточной продукции вырабатываемого гормона. Помимо этого В-лимфоциты продуцируют аутоантитела к структурным компонентам эндокринных желез, чаще всего к ферментам, участвующим в синтезе гормонов [1] (табл. 2).
Таблица 2. Спектр аутоантигенов компонентов АПС
Зачастую у пациентов с одним аутоиммунным заболеванием другие составляющие АПС проявляются после некоторого латентного периода. В связи с тем что развитию клинической картины заболевания предшествует длительная фаза скрытых изменений на клеточном уровне, наиболее целесообразным является скрининг на наличие циркулирующих антител (АТ), характерных для других компонентов АПС: определение АТ к тиреопероксидазе (TПO), тиреоглобулину (ТГ), АТ к GAD IСА, АТ к тирозинфосфатазе, АТ к глиадину, париетальным клеткам желудка – в момент выявления одного из компонентов АПС, далее каждые 2–3 года [2].
Некоторые авторы помимо манифестной формы выделяют неполную (латентную) форму АПС, которая включает в себя субклиническую и потенциальную [3]. Субклиническая форма характеризуется наличием одного аутоиммунного заболевания в сочетании с одним и более серологическими маркерами других основных компонентов АПС при наличии субклинического нарушения функции второго органа-мишени. Потенциальная форма АПС – это наличие одного эндокринного аутоиммунного заболевания при выявленных антителах к другим органам, не сопровождающееся нарушением их функции. Распространенность латентных форм существенно выше манифестных [4].
Наиболее хорошо изучено на сегодняшний день поражение миокарда при заболеваниях щитовидной железы, особенно при БГ и в меньшей степени при хронической надпочечниковой недостаточности и СД 1. Изменения миокарда при БГ могут быть связаны с аутоиммунным миокардитом, хотя механизмы, лежащие в основе развития данного состояния, требуют уточнения. Учитывая, что БГ может сочетаться с эндокринной офтальмопатией (ЭОП), претибиальной микседемой, развитие которых обусловлено действием АТ к рецептору тиреотропного гормона в тканях, можно предположить, что кардиомиопатия при диффузном токсическом зобе (ДТЗ) может иметь аутоиммунную составляющую, а не быть следствием действия только тиреоидных гормонов. Описаны случаи идиопатической кардиомиопатии, при которых определяются АТ к структурным компонентам миокарда, в том числе к β1-адренорецепторам. Кардиомиопатия, связанная с аутоиммунным поражением щитовидной железы, может быть более распространена, чем диагностируется, из-за того что она может протекать в легкой и субклинической форме [5–7].
Состояние миокарда при атоиммунной эндокринной патологии
Хотя поражение сердечно-сосудистой системы не выделено в составе АПС, в некоторых клинических случаях описывается развитие поражения миокарда с развитием сердечной недостаточности при отсутствии предшествующего клинически проявляющегося поражения сердца [8].
Поражение миокарда при БГ является наиболее распространенным в связи с токсическим действием избытка тиреоидных гормонов на миокард. Однако в связи с иммунной природой поражения ЩЖ при БГ ранее высказывались предположения о вкладе аутоиммунных механизмов и в развитие поражения сердца. В качестве аргумента приводились сообщения об обнаружении при биопсии миокарда дегенеративных изменений, лимфоцитарной инфильтрации, накопления мукополисахаридов с последующим формированием фиброза у пациентов с БГ. Схожие изменения имели место у пациентов с сопутствующей ЭОП и претибиальной микседемой при посмертном гистологическом исследовании указанных органов-мишеней [9].
При изучении распространенности миксоматозной дегенерации клапанного аппарата сердца у пациентов с аутоиммунными заболеваниями щитовидной железы и многоузловым токсическим зобом выявлена более частая встречаемость этого состояния при БГ (35%) и тиреоидите Хашимото (25%) в сравнении с многоузловым токсическим зобом (7,5%) [10–12].
В проспективных исследованиях обнаружена повышенная частота развития легочной гипертензии (более чем в 2 раза) у пациентов с БГ, чем у пациентов с тиреотоксикозом неаутоиммунного генеза [13–15].
Отмечалось наличие легочной гипертензии у пациентов с другими аутоиммунными заболеваниями (склеродермия, системная красная волчанка, диффузные заболевания соединительной ткани) так же, как и у пациентов с аутоиммунными заболеваниями щитовидной железы, сопровождающимися нарушениями ее функции (гипертиреоз, гипотиреоз) [16].
A.W. Nathan в 1983 г. установил, что миокардиодистрофия при БГ связана, помимо воздействия на миокард катехоламинов, с присутствием аутоантител к кардиомиоцитам, обладающих стимулирующим действием на миокард, способствуя входному току кальция в его клетки [17].
Однако V. Fatourechi и W.D. Edwards при проведении биопсии миокарда правого желудочка у пациентов с БГ показали, что лимфоидная инфильтрация ткани, характерная для миокардита, была выявлена лишь у 18% обследованных пациентов [18].
Описаны случаи развития кардиомиопатии Такоцубо (ТКМП) и гигантоклеточного миокардита на фоне АПС, в клинической картине которых доминировала надпочечниковая недостаточность.
Кардиомиопатия Такоцубо – преходящее снижение сократимости миокарда апикальной части левого желудочка. Были предложены различные причины, провоцирующие ее развитие: эмоциональный стресс, тяжелые физические нагрузки, хирургические вмешательства, медикаменты, общая анестезия, тиреотоксикоз, синдром множественной эндокринной неоплазии, гипогликемические состояния, преходящая гипотензия [19].
Большое внимание к проблеме ТКМП в последние годы стали проявлять в связи с тем, что у людей, перенесших тиреотоксикоз, даже при радикальном излечении выявлено повышение смертности по сравнению с остальной популяцией именно от сердечно-сосудистых причин [20]. Наиболее вероятной причиной повышения смертности является именно ТКМП, формирование которой происходит в период тиреотоксикоза.
Обращает на себя внимание относительно высокий процент сопутствующих аутоиммунных заболеваний у больных миокардитом: у 19% больных гигантоклеточным миокардитом и у 11% всех больных с морфологически доказанным миокардитом, что подчеркивает роль нарушений аутореактивности в патогенезе воспалительных заболеваний миокарда [21].
Более чем в 20% случаев гигантоклеточный миокардит может сочетаться с другими аутоиммунными заболеваниями: имеется несколько сообщений о сочетании с болезнью Крона (Cooper et al., 1995, 1997), неспецифическим язвенным колитом (Cooper et al., 1997; Ariza et al., 1995; McKeon, 1986), миозитом орбитальных мышц и скелетной мускулатуры (Leib et al., 1994; Klein et al., 1998), аутоиммунным тиреоидитом (Benish and Josephson, 1973; Davies et al., 1975) и артеритом Такаясу (Kennedy et al., 1971; Roberts, 1966). Единичные случаи сочетания с ревматоидным артритом, тотальной алопецией.
Верификация аутоиммунного поражения сердца при СД 1 затруднена из-за развития с течением времени при неудовлетворительном контроле гликемии автономной сердечно-сосудистой полинейропатии.
Описан случай острого дебюта идиопатического СД 1 в сочетании с фульминантным вирусным миокардитом [22].
Также возможно сочетание рассеянного склероза с СД 1, АИТ и идиопатической дилатационной кардиомиопатией (ДКМП). Указанное сочетание нашло подтверждение в экспериментах на животных путем индуцирования нарушения иммунной регуляции T-клеточного звена [23].
Приводится описание развития миокардита у пациентов с СД 1 после перенесенного инфаркта, который в данном случае являлся триггером аутоиммунного воспаления в результате компонентов миокарда и выработки к ним антител, в частности к альфа-миозину [24].
Истинную распространенность легких форм миокардита трудно установить, поскольку заболевание может протекать без какой-либо клинической симптоматики [25]. Отсутствие точных данных о частоте встречаемости миокардита связано с недостаточной чувствительностью диагностических методов и относительно недавним применением эндомиокардиальной биопсии (ЭМБ) с полимеразной цепной реакцией и иммуногистохимическим анализом препаратов сердечной мышцы [26].
В основе патогенетических механизмов миокардита лежит комплекс факторов – активация процессов апоптоза, а также реакций первичного и вторичного иммунного ответа, ремоделирование сократительного аппарата сердечной мышцы [27]. Эти процессы, как правило, проходят три последовательные фазы [28]. В начальной фазе происходит повреждение миокарда через активацию первичного иммунного ответа [29]. Макрофаги и натуральные киллеры усугубляют повреждение сердечной мышцы, уничтожая пораженные кардиомиоциты, а также поддерживают активное воспаление в миокарде, продуцируя провоспалительные цитокины [30]. Вторая фаза миокардита характеризуется активацией реакций вторичного (специфического) иммунитета с выработкой специфичных антимиокардиальных иммуноглобулинов классов G, M и A плазматичеcкими клетками и пролиферацией клонов антигенспецифичных Т-лимфоцитов [31]. Кроме того, происходит стимуляция хемотаксиса лейкоцитов, что сопровождается их миграцией в очаг воспаления и адгезией к эндотелиоцитам, нарушением микроциркуляции и выраженным повреждением сократительного аппарата сердца. Основными провоспалительными цитокинами, которые вырабатываются иммунными клетками в очаге воспаления в этой фазе заболевания, являются: γ-интерферон, фактор некроза опухоли α (ФНО-α), интерлейкин (ИЛ) 1, ИЛ-2, ИЛ-6, ИЛ-17А, ИЛ-23 [32]. В случае длительного воспалительного процесса в сердечной мышце происходит переход заболевания в третью, хроническую фазу, в которой основным патологическим процессом является ремоделирование сердечной мышцы с прогрессирующей ее дилатацией и развитием хронической сердечной недостаточности [33]. При этом нарушаются энергообразующая функция миокардиоцитов (окислительное фосфорилирование, гликолиз), внутриклеточный метаболизм (синтез белковых структур), сократительная функция миофибрилл [34].
Признаки воспаления в миокарде при гистологическом исследовании могут не выявляться, однако глубокие структурно-функциональные изменения сократительного аппарата сердца с развитием фиброза, как правило, необратимы. Впоследствии может происходить трансформация заболевания в ДКМП [35].
По данным аутопсий, проведенных 27 пациентам с БГ, зафиксированы умеренный отек, инфильтрация миокарда и незначительный интерстициальный и периваскулярный фиброз, отмечалась гипертрофия кардиомиоцитов; у одного пациента был диагностирован лимфоцитарный миокардит, еще у одного – пограничный миокардит. Кроме того, сообщалось о двух случаях с тяжелым лимфоцитарным миокардитом [36].
Возможности лабораторной диагностики
Для лабораторной диагностики миокардита используются как в экспериментальных работах, так и на практике АТ к следующим антигенным структурам сердца: сарколемме, в частности β1-адренорецепторам и холинергическим рецепторам; антимитохондриальные антитела; антисаркоплазматические антитела, АТ, повреждающие транспортный белок Са2+-АТФазу; антимикросомальные антитела; антитела к миофибриллам – актину и тяжелой цепи миозина; антитела к структурам межклеточного пространства – ламинину, виментину, десмину, фибронектину, коллагену [37].
У пациентов с ДКМП также обнаруживаются антитела к структурным компонентам миокарда: адренорецепторам, мускариновым рецепторам, ламинину, виментину, десмину, кератину, актину, тяжелым цепям миозина и митохондриальным белкам. Одна из ключевых ролей в развитии кардиомиопатии отводится антителам к адренорецепторам миокарда, которые обнаруживаются у 30–40% больных ДКМП [38].
Аутоиммунная теория развития ДКМП подтверждается обнаружением циркулирующих антител к миокарду не только у больных, но и у их родственников. Возможность использования антител к миокарду в качестве ранних маркеров заболевания остается предметом для дискуссии [39].
Наличие органоспецифичных антител (IgG) к миозину и другим, менее известным антигенам при миокардите и ДКМП имеет место не менее чем у 1/3 пациентов [40]. В большинстве случаев у пациентов с наличием указанных антител в крови в последующем данные маркеры не определяются. Это может означать, что антимиокардиальные антитела являются ранним маркером поражения миокарда. Отсутствие антител в крови у оставшейся части пациентов свидетельствует о преобладании у них клеточных механизмов аутоиммунных реакций или неиммуноопосредованном поражении миокарда [41].
Для диагностики аутоиммунного поражения сердца в рамках АПС рекомендуется использовать лабораторные и инструментальные методы исследования, применяемые для диагностики миокардита и ДКМП.
Увеличение СОЭ и лейкоцитоз крайне редко встречаются у пациентов с миокардитом. Наиболее информативный маркер острого воспаления – С-реактивный белок. Несмотря на высокую специфичность метода определения активности МВ-изоформы креатинкиназы (100%) для диагностики повреждений миокарда при воспалительных заболеваниях сердца, чувствительность его не превышает 6% [42].
Дополнительную информацию о степени тяжести миокардита можно получить при исследовании цитокинового профиля: уровня ИЛ-10, ФНО-α, неоптерина.
В клинической практике возможно широкое использование определения антител к миокарду методом непрямой иммунофлюоресценции, а также с помощью стандартизованных иммуноферментных тест-систем ELISA, полученных методом хроматографии [43].
Возможности инструментальной диагностики
На ЭКГ могут регистрироваться нарушения реполяризации диффузного характера по типу уплощения или инверсии зубца Т. Вовлечение в процесс перикарда может сопровождаться изменением сегмента ST. У 31% больных активным миокардитом встречаются инфарктоподобные варианты течения заболевания, при которых наряду с развитием интенсивного болевого синдрома в прекардиальной области регистрируются элевация сегмента ST в двух и более отведениях (54%) или его депрессия (27%), а также низковольтажный патологический зубец Q (18–27%) [44]. Чувствительность ЭКГ-методов в диагностике миокардита не превышает 47% [45].
МРТ – наиболее информативный для диагностики воспалительных заболеваний миокарда метод, так как идеально передает мозаичность состава ткани в условиях воспаления [46]. Кино-МРТ позволяет выявить функциональные изменения в миокарде, и эти данные носят неспецифичный характер и фактически дублируют эхокардиографические показатели. Дополнительную и порой решающую информацию в диагностике миокардитов обеспечивает МРТ с контрастным усилением, в качестве которого используются вещества, содержащие тяжелый парамагнитный металл гадолиний. Наиболее распространенным является метод позднего контрастного усиления (late gadolinium enhancement, LGE), при котором МРТ проводится через 15–20 мин после введения контрастного вещества. Нормальный миокард достаточно быстро накапливает контрастное вещество и быстро его выводит. Отсутствие выведения контрастного вещества в отсроченную фазу отражает наличие необратимых процессов в миокарде, таких как некроз кардиомиоцитов и фиброз. Для миокардита наиболее характерно поражение боковой, передней и нижней стенок левого желудочка. Кроме того, повреждение миокарда при воспалительных заболеваниях, как правило, располагается субэпикардиально, реже трансмурально или интрамурально [21].
Эндомиокардиальная биопсия показана в случае персистирующей или прогрессирующей дисфункции миокарда, ишемический генез которой исключен после проведения коронарной ангиографии [6]. Однако следует помнить, что миокардит может развиваться и у пациентов с исходным поражением коронарных артерий. ЭМБ выполняется под местной анестезией с помощью гибких биотомов из стандартных доступов: правожелудочковая – через v. jugularis и v. femoralis, а левожелудочковая – через a. femoralis, под контролем флуороскопии, эхокардиографии, а также МРТ или компьютерной томографии. Из одного региона получают более 1 биоптата (оптимально 5–10) размером 2–3 мм. ЭМБ в случае, если она выполняется в специализированных центрах, относительно безопасная процедура [21].
Заключение
Хотя пациенты с АПС имеют относительно молодой возраст, в связи с потенциально возможным аутоиммунным поражением миокарда необходимо учитывать у них высокий риск развития поражения сердечно-сосудистой системы. Таким образом, вопрос о необходимости проведения лабораторно-инструментальных исследований у больных АПС при отсутствии клинических признаков поражения миокарда остается открытым и нуждается в подробном изучении.
Дополнительная информация
Источники финансирования. Поисково-аналитическая работа выполнена в рамках гранта Российского научного фонда № 17-75-30035 “Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркеры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация”.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящих рекомендаций, о которых необходимо сообщить.
Участие авторов. Все авторы внесли существенный вклад в проведение работы и подготовку статьи, прочли и одобрили финальную версию текста перед публикацией.
1. Van den Driessche A, Eenkhoorn V, Van Gaal L, De Block C. Type 1 diabetes and autoimmune polyglandular syndrome: a clinical review. Neth J Med. 2009;67(11):376-387.
2. Kahaly GJ. Polyglandular autoimmune syndromes. Eur J Endocrinol. 2009;161(1):11-20. doi: 10.1530/EJE-09-0044.
3. Betterle C, Zanchetta R. Update on autoimmune polyendocrine syndromes (APS). Acta Biomed. 2003;74(1):9-33.
4. Ларина А.А., Трошина Е.А., Иванова О.В. Аутоиммунные полигландулярные синдромы взрослых: генетические и иммунологические критерии диагностики. // Проблемы эндокринологии. – 2014. – Т. 60. – № 3. – С. 43-52. [Larina AA, Troshina EA, Ivanova OV. Autoimmune polyglandular syndromes in the adults: the genetic and immunological diagnostic criteria. Problems of endocrinology. 2014;60(3):43-52. (In Russ.)] doi: 10.14341/probl201460343-52.
5. Drvota V, Janson A, Norman C, et al. Evidence for the presence of functional thyrotropin receptor in cardiac muscle. Biochem Biophys Res Commun. 1995;211(2):426-431. doi: 10.1006/bbrc.1995.1831.
6. Cooper DS. Antithyroid drugs. N Engl J Med. 1984;311(21): 1353-1362. doi: 10.1056/nejm198411223112106.
7. Jahns R, Boivin V, Hein L, et al. Direct evidence for a beta1-adrenergic receptor-directed autoimmune attack as a cause of idiopathic dilated cardiomyopathy. J Clin Invest. 2004;113(10): 1419-1429. doi: 10.1172/JCI20149.
8. Sezai A, Hata M, Minami K. Hypertrophic obstructive cardiomyopathy with Schmidt’s syndrome: report of a case. Thorac Cardiovasc Surg. 2010;58(5):314-316. doi: 10.1055/s-0029-1185884.
9. Шульгина В.Ю., Фадеев В.В., Мельниченко Г.А. Поражения миокарда при тиреотоксикозе: особенности течения, исходы, отдаленный прогноз. // Клиническая и экспериментальная тиреоидология. – 2006. – Т. 2. – № 4. – С. 21-30. [Shul’gina VY, Fadeev VV, Mel’nichenko GA. Myocardial lesion in hyperthyroidism: natural history, outcomes, prognosis. Clinical and experimental thyroidology. 2006;2(4):21-30. (In Russ.)] doi: 10.14341/ket20062421-30.
10. Nishimura RA, McGoon MD, Shub C, et al. Echocardiographically documented mitral-valve prolapse. Long-term follow-up of 237 patients. N Engl J Med. 1985;313(21):1305-1309. doi: 10.1056/NEJM198511213132101.
11. Kahaly G, Mohr-kahaly S, Beyer J, Meyer J. Prevalence of myxomatous mitral valve prolapse in patients with lymphocytic thyroiditis. Am J Cardiol. 1995;76(17):1309-1310. doi: 10.1016/s0002-9149(99)80363-4.
12. Channick BJ, Adlin EV, Marks AD, et al. Hyperthyroidism and mitral-valve prolapse. N Engl J Med. 1981;305(9):497-500. doi: 10.1056/NEJM198108273050906.
13. Ma RC, Cheng AY, So WY, et al. Thyrotoxicosis and pulmonary hypertension. Am J Med. 2005;118(8):927-928. doi: 10.1016/j.amjmed.2005.03.038.
14. Siu CW, Zhang XH, Yung C, et al. Hemodynamic changes in hyperthyroidism-related pulmonary hypertension: a prospective echocardiographic study. J Clin Endocrinol Metab. 2007;92(5): 1736-1742. doi: 10.1210/jc.2006-1877.
15. Marvisi M, Brianti M, Marani G, et al. Hyperthyroidism and pulmonary hypertension. Respir Med. 2002;96(4):215-220. doi: 10.1053/rmed.2001.1260.
16. Li JH, Safford RE, Aduen JF, et al. Pulmonary hypertension and thyroid disease. Chest. 2007;132(3):793-797. doi: 10.1378/chest.07-0366.
17. Nathan AW, Longmore DB, Havard CW, Dandona P. The effects of plasma from patients with Graves’ disease on foetal mouse hearts in organ culture. Br J Exp Pathol. 1983;64(5):474-478.
18. Fatourechi V, Edwards WD. Graves’ disease and low-output cardiac dysfunction: implications for autoimmune disease in endomyocardial biopsy tissue from eleven patients. Thyroid. 2000; 10(7):601-605. doi: 10.1089/thy.2000.10.601.
19. Ohwada R, Hotta M, Kimura H, et al. Ampulla cardiomyopathy after hypoglycemia in three young female patients with anorexia nervosa. Intern Med. 2005;44(3):228-233. doi: 10.2169/internalmedicine.44.228.
20. Vanderpump M. Cardiovascular and cancer mortality after radioiodine treatment of hyperthyroidism. J Clin Endocrinol Metab. 2007;92(6):2033-2035. doi: 10.1210/jc.2007-0837.
21. Моисеева О.М., Митрофанова Л.Б., Пахомов А.В., и др. Спорные вопросы диагностики миокардитов. // Сердце: журнал для практикующих врачей. – 2010. – Т. 9. – №4. – С. 234-241. [Moiseeva OM, Mitrofanova LB, Pakhomov AV, et al. Spornye voprosy diagnostiki miokarditov. Serdtse. 2010; 9(4):234-241. (In Russ.)]
22. Deretzi G, Kountouras J, Zavos C, et al. Multiple sclerosis, idiopathic dilated cardiomyopathy, and insulin-dependent diabetes mellitus: a common mechanism of irregular immune regulation. Neurologist. 2011;17(3):172-175. doi: 10.1097/NRL.0b013e3182173552.
23. Gottumukkala RV, Lv H, Cornivelli L, et al. Myocardial infarction triggers chronic cardiac autoimmunity in type 1 diabetes. Sci Transl Med. 2012;4(138):138ra180. doi: 10.1126/scitranslmed.3003551.
24. Дерюгин М.В., Бойцов С.А. Хронические миокардиты. – СПб: ЭЛБИ-СПб; 2005. [Deryugin MV, Boytsov SA. Khronicheskie miokardity. Saint-Petersburg: ELBI-SPb; 2005. (In Russ.)]
25. Pankuweit S, Maisch B. Das Herz bei viralen Infektionen. Internist (Berl). 2010;51(7):836-843. doi: 10.1007/s00108-009-2559-8.
26. Badorff C, Knowlton KU. Dystrophin disruption in enterovirus-induced myocarditis and dilated cardiomyopathy: from bench to bedside. Med Microbiol Immunol. 2004;193(2-3):121-126. doi: 10.1007/s00430-003-0189-7.
27. Rose NR. Myocarditis: infection versus autoimmunity. J Clin Immunol. 2009;29(6):730-737. doi: 10.1007/s10875-009-9339-z.
28. Kawai C. From myocarditis to cardiomyopathy: mechanisms of inflammation and cell death: learning from the past for the future. Circulation. 1999;99(8):1091-1100. doi: 10.1161/01.cir.99.8.1091.
29. Cooper LT. Myocarditis from bench to bedside. New Jersey: Humana Press Totowa; 2003.
30. Поляков В.П., Николаевский Е.Н., Пичко А.Г. Некоронарогенные и инфекционные заболевания сердца. – Самара; 2010. [Polyakov VP, Nikolaevskiy EN, Pichko AG. Nekoronarogennye i infektsionnye zabolevaniya serdtsa. Samara; 2010. (In Russ.)]
31. Aukrust P, Gullestad L, Ueland T, et al. Inflammatory and anti-inflammatory cytokines in chronic heart failure: Potential therapeutic implications. Ann Med. 2009;37(2):74-85. doi: 10.1080/07853890510007232.
32. Mahrholdt H, Wagner A, Deluigi CC, et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation. 2006;114(15):1581-1590. doi: 10.1161/CIRCULATIONAHA.105.606509.
33. Dillmann WH. Biochemical basis of thyroid hormone action in the heart. Am J Med. 1990;88(6):626-630. doi: 10.1016/0002-9343(90)90530-q.
34. Caforio AL, Tona F, Bottaro S, et al. Clinical implications of anti-heart autoantibodies in myocarditis and dilated cardiomyopathy. Autoimmunity. 2008;41(1):35-45. doi: 10.1080/08916930701619235.
35. Shirani J, Barron MM, Pierre-Louis M-LY, Roberts WC. Congestive heart failure, dilated cardiac ventricles, and sudden death in hyperthyroidism. Am J Cardiol. 1993;72(3):365-368. doi: 10.1016/0002-9149(93)90691-5.
36. Коваленко В.Н., Несукай Е.Г., Чернюк С.В. Миокардит: современный взгляд на этиологию и патогенез заболевания. // Украинский кардиологический журнал. – 2012. – №2. – С. 84-91. [Kovalenko VN, Nesukai YG, Cherniuk SV. Myocarditis: a contemporary look on the etiology and pathogenesis of the disease. Ukrainskiy kardiologicheskiy zhurnal. 2012;(2):84-91. (In Russ.)]
37. Magnusson Y, Wallukat G, Waagstein F, et al. Autoimmunity in idiopathic dilated cardiomyopathy. Characterization of antibodies against the beta 1-adrenoceptor with positive chronotropic effect. Circulation. 1994;89(6):2760-2767. doi: 10.1161/01.cir.89.6.2760.
38. Neumann DA, Lynne Burek C, Baughman KL, et al. Circulating heart-reactive antibodies in patients with myocarditis or cardiomyopathy. J Am Coll Cardiol. 1990;16(4):839-846. doi: 10.1016/s0735-1097(10)80331-6.
39. Caforio ALP, Mahon NJ, Tona F, McKenna WJ. Circulating cardiac autoantibodies in dilated cardiomyopathy and myocarditis: pathogenetic and clinical significance. Eur J Heart Fail. 2002; 4(4):411-417. doi: 10.1016/s1388-9842(02)00010-7.
40. Latif N, Baker CS, Dunn MJ, et al. Frequency and specificity of antiheart antibodies in patients with dilated cardiomyopathy detected using SDS-PAGE and western blotting. J Am Coll Cardiol. 1993;22(5):1378-1384. doi: 10.1016/0735-1097(93)90546-d.
41. Caforio AL, Goldman JH, Baig MK, et al. Cardiac autoantibodies in dilated cardiomyopathy become undetectable with disease progression. Heart. 1997;77(1):62-67. doi: 10.1136/hrt.77.1.62.
42. Greaves K, Oxford JS, Price CP, et al. The prevalence of myocarditis and skeletal muscle injury during acute viral infection in adults. Arch Intern Med. 2003;163(2):165. doi: 10.1001/archinte.163.2.165.
43. Полетаев А.Б. Новые подходы в раннем выявлении патологических изменений в организме человека (иммунохимический скрининг как основа стратегии перехода от лечебной к превентивной медицине): методическое руководство для врачей. – М.: МИЦ Иммункулус; 2011. [Poletaev AB. Novye podkhody v rannem vyyavlenii patologicheskikh izmeneniy v organizme cheloveka (immunokhimicheskiy skrining kak osnova strategii perekhoda ot lechebnoy k preventivnoy meditsine): metodicheskoe rukovodstvo dlya vrachey. Moscow: MITs Immunkulus; 2011. (In Russ.)]
44. Cooper LT, Jr. Myocarditis. N Engl J Med. 2009;360(15): 1526-1538. doi: 10.1056/NEJMra0800028.
45. Morgera T, Di Lenarda A, Dreas L, et al. Electrocardiography of myocarditis revisited: Clinical and prognostic significance of electrocardiographic changes. Am Heart J. 1992;124(2):455-467. doi: 10.1016/0002-8703(92)90613-z.
46. Hundley WG, Bluemke DA, Finn JP, et al. ACCF/ACR/AHA/NASCI/SCMR 2010 expert consensus document on cardiovascular magnetic resonance: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. J Am Coll Cardiol. 2010;55(23):2614-2662. doi: 10.1016/j.jacc.2009.11.011.
строение и функции / Справочник :: Бингоскул
Ткань — сочетание похожих по строению клеток, выполняющих общие функции. Мышечная ткань в организме многоклеточного животного и человека отвечает за движения, механическую прочность и защиту внутренних органов. Ходьба, продвижение пищи, биение сердца — функции, выполняемые различными мышцами.
Строение и функции
Клеточные элементы мышечной ткани вытянуты в длину, за что получили название «волокна». Цитоплазма клеток содержит тонкие белковые нити миофибриллы, которые могут удлиняться и укорачиваться (табл. 1). Специальные органеллы, выработка энергии митохондриями обеспечивают сокращение и растяжение волокон.
Таблица 1.
Строение и функции мышечной ткани
Виды мышечной ткани | Строение | Функции | Расположение в организме |
Поперечно-полосатая | Состоит из длинных и толстых волокон (рис. 1). Они образованы путем слияния отдельных клеток. Ядер много. Полосатая исчерченность вызвана чередованием светлых и темных дисков. Волокна объединяются в пучки. | Произвольные движения тела, дыхание, мимика лица и ряд других действий. | Основа скелетных мышц, языка, глотки, начальной части пищевода. |
Гладкая | Отдельные веретеновидные клетки имеют небольшие размеры, объединены в пучки (по 5–10 шт.). В каждой клетке одно ядро (рис. 1). Тонкие миофибриллы протянулись между концами клетки. Ткань лишена поперечной полосатости. | Непроизвольные сокращения стенок внутренних органов с под влиянием нервных импульсов. | Мышечные слои кожи и внутренних органов (пищеварительной системы, мочевого пузыря, кровеносных и лимфатических сосудов, матки). |
Поперечно-полосатая сердечная | Клетки удлиненные, разветвленной формы, с небольшим количеством ядер, образуют единую сеть (рис. 1). Поперечная полосатость возникает за счет блестящих полосок на соединениях между клетками. | «Двигатель» кровообращения. Непроизвольные сокращения сердечной мышцы могут происходить под управлением вегетативного отдела нервной системы. | Основная масса сердца. |
Мышечные ткани обеспечивает передвижение организма в пространстве. Сокращения мышц необходимы для изменения положения отдельных частей тела. Мышцы, помимо двигательной, выполняют защитную и теплообменную функции.
Свойства
Мышечное волокно растягивается, но в состоянии покоя возвращается к своим первоначальным размерам. Это свойство — результат взаимодействия белковых нитей миофибрилл в цитоплазме клеток. Каждая миофибрилла состоит из протофибрилл: тонких, образованных актином, и более толстых — из миозина.
Свойства мышечной ткани:
- электрическая возбудимость;
- сократимость;
- проводимость;
- растяжимость;
- эластичность.
Мышечная ткань способна к произвольным или непроизвольным сокращениям в ответ на нервные импульсы. Происходит взаимодействие фибриллярных белков — актина и миозина. В этом процессе обязательно участвуют неорганические ионы кальция. При сокращении тонкие нити актина скользят по толстым протофибриллам миозина.
Сравнительная характеристика видов мышечной ткани
В теле позвоночных животных и человека три типа мышечной ткани: поперечнополосатая, гладкая, сердечная. В организме низших животных мышцы состоят из гладкой ткани. У позвоночных животных и человека этот тип ткани образует стенки внутренних органов, кроме сердца (рис. 2).
Рис. 2. Сравнение видов мышечной ткани
Гладкая мышечная ткань
Медленные и продолжительные сокращения мышц контролирует вегетативная нервная система. Задача таких движений — сохранить или изменить объем полых органов против сил растяжения. Гладкие мышцы сокращаются и растягиваются больше, чем другие типы мышечной ткани. Сокращение длится намного дольше, что связано со скоростью прохождения ионов кальция, регулирующих процесс.
Свойства гладких мышц:
- сокращаются в 10–20 раз медленнее, чем скелетные;
- способны к длительным сокращениям;
- не затрачивают много энергии;
- медленнее наступает утомление.
Сокращения гладкой мышечной ткани происходят непроизвольно, то есть независимо от воли человека. Сигнал нервной системы проходит через всю массу клеток, что объясняется особенностями иннервации гладкой мускулатуры.
Поперечнополосатая ткань
Клетки имеют толщину от 10 до 100 мкм, длину от 10 до 40 см. Цитоплазма содержит большое количество ядер и миофибрилл, занимающих центральное положение (рис. 2). В зрелых клетках насчитывается сотни миофибрилл, более 100 ядер. Актиновые и миозиновые нити внутри миофибрилл сцеплены друг с другом (рис. 3). Способность к быстрому сокращению у этой ткани выше, чем у других.
Рис. 3. Строение скелетной мышцыМышечные волокна покрыты оболочкой — сарколеммой. Есть чередующиеся пластинки белков разной плотности, обладающие неодинаковыми коэффициентами преломления света. В оптический микроскоп такие мышцы кажутся исчерченными поперек. Сократительные элементы объединены в мышечные пучки, покрытые соединительнотканной оболочкой. Скелетные мышцы хорошо снабжены кровеносными сосудами и нервами.
Поперечнополосатая сердечная ткань
Особые свойства сердечной мышцы обусловлены строением волокон. Клетки длиной до 100 мкм встречаются только в сердце, не сливаются, как в поперечнополосатой мышечной ткани (рис. 2). Расположение актина и миозина, диски в мышце сердца такие же, как в волокнах скелетной мышечной ткани. Отличительная особенность — наличие глянцевых полосок в местах соединения клеток. Благодаря соединению волокон в единую сеть, возбуждение на одном участке быстро охватывает мышечную массу, участвующую в сокращении.
Мышечная ткань сердца способна к автоматической работе. Между сокращениями наступает рефракторный период, когда мышца находится в покое. При сокращении происходит уменьшении просвета полостей сердца — предсердий и желудочков.
Сердечная поперечнополосатая ткань сокращается в 10–15 раз дольше, чем скелетные мышцы. В нормальных условиях у человека сокращение и расслабление происходит 70–80 раз в минуту. Сокращение вызывают электрические импульсы, возникающие в самом сердце. Этот процесс связан носителем энергии — аденозинтрифосфатом (АТФ).
Полностью автономная работа, непрерывная ритмическая активность — физиологические отличия сердечной мышцы от скелетных. Нервные импульсы вегетативной нервной системы, иннервирующей сердце, не требуются для бесперебойной работы органа.
Миофибриллы — определение, функция и структура
Определение миофибрилл
Миофибрилла — это компонент скелетных мышц животного. Миофибриллы — это длинные волокна, которые проходят параллельно друг другу и образуют мышечные (мио) волокна. Миофибриллы и, как следствие, миофибриллы могут иметь длину несколько сантиметров. Мышечные волокна представляют собой одиночные многоядерные клетки, которые вместе образуют мышцу. Миофибриллы состоят из повторяющихся субъединиц, называемых саркомерами. Эти саркомеры отвечают за сокращение мышц.
Структура миофибрилл
Миофибриллы состоят из волокон двух типов: тонких и толстых. Тонкие филаменты состоят из нитей протеина актина и регуляторного протеина, свернутых вместе, тогда как толстые филаменты состоят из нитей протеина миозина. Тонкие и толстые нити образуют частично перекрывающиеся слои, которые расположены в функциональных единицах, называемых саркомерами. Из-за того, как расположены миофиламенты, миофибриллы имеют темные и светлые полосы, что придает мышцам полосатый вид.Темные полосы известны как полосы А и состоят из толстых нитей и некоторых тонких нитей. В центре полосы A находится H-зона, где присутствуют только толстые нити, и M-линия, которая содержит ферменты, участвующие в энергетическом обмене. Световые полосы, известные как I-полосы, представляют собой области, содержащие только тонкие волокна, и находятся между полосами A. Полосы I расположены в центре области, известной как Z-линия, диска, состоящего из белка α-актинина, который закрепляет тонкие актиновые филаменты и действует как граница между субъединицами саркомера.
Функция миофибриллы
Миофибриллы состоят из саркомеров, функциональных единиц мышцы. Функция миофибриллы заключается в сокращении мышц с помощью модели скользящей нити. Когда мышцы находятся в состоянии покоя, тонкие и толстые нити перекрываются не полностью, а некоторые области содержат только один из двух типов. Когда мышца сокращается, саркомеры укорачиваются в длину из-за скольжения толстых и тонких волокон друг над другом, что приводит к большему перекрытию волокон и укорачиванию H-зоны и I-полосы.В то время как длина саркомера уменьшается во время сокращения мышц, длина самих миофиламентов не изменяется.
Движение миофиламентов происходит за счет гидролиза АТФ в АДФ и неорганический фосфат. В состоянии покоя молекула АТФ прикреплена к глобулярной миозиновой головке на толстой нити. Когда АТФ гидролизуется, миозиновая головка изменяет конформацию и образует соединение, известное как поперечный мостик с тонкой нитью. Когда молекулы АДФ и фосфата высвобождаются, головка миозина снова меняет конформацию и подталкивает тонкую нить к центру саркомера.Когда новая молекула АТФ затем связывается с головкой миозина, головка возвращается к своей исходной конформации и высвобождает тонкую нить в своем новом положении ближе к центральной M-линии. Затем цикл повторяется: новая молекула АТФ гидролизуется до АДФ и неорганического фосфата, и головка миозина меняет конформацию, в результате чего тонкая нить подталкивается к центру саркомера. Каждая толстая нить содержит несколько сотен миозиновых головок, которые могут образовывать поперечные мостики с тонкими нитями примерно пять раз в секунду.Непрерывные сокращения миофибрилл приводят к сокращению мышц.
Мышцы сокращаются за счет АТФ. Поскольку само мышечное волокно хранит очень небольшое количество АТФ, энергия поступает из двух других соединений, хранящихся в мышцах: креатинфосфата и гликогена. АТФ, хранящийся в мышечном волокне, и АТФ, который может быть образован креатинфосфатом, используются для кратковременных всплесков энергии; они могут обеспечивать энергией до 15 секунд. Гликоген может служить долгосрочным источником энергии, поскольку гликоген распадается на глюкозу, которая затем превращается в АТФ посредством гликолиза и аэробного дыхания.
На этом рисунке изображен саркомер, часть миофибриллы. На нем показаны тонкие актиновые филаменты и толстые миозиновые филаменты, а также то, как их положение меняется при сокращении мышцы.
Викторина
1. Сколько типов миофиламентов содержится в миофибрилле?
A. 1
B. 2
C. 4
D. нет
Ответ на вопрос № 1
B правильный. В миофибрилле есть два типа миофиламентов: толстые волокна, состоящие из миозина, и тонкие волокна, состоящие из актина.
2. Какая структура служит границей между саркомерами?
A. A-диапазон
B. H-зона
C. M-line
D. Z-line
Ответ на вопрос № 2
D правильный. Z-линия, также известная как Z-диск, действует как граница между саркомерами. Это также точка крепления тонких нитей.
3. Какой источник энергии для сокращения мышц является лучшим долгосрочным?
А. ATP
B. крахмал
C. гликоген
D. креатинфосфат
Ответ на вопрос № 3
C правильный. В то время как сокращения мышц приводятся в действие АТФ, в мышцах будет только очень небольшой запас АТФ, готовый к использованию. Гликоген превращается в АТФ для длительного использования посредством аэробного дыхания.
Список литературы
- Кэмпбелл, Н. А., и Рис, Дж. Б. (2005). Биология, 7-я.изд. Ch. 49. Сан-Франциско, Калифорния: Бенджамин Каммингс. ISBN: 0-8053-7171-0.
- Рэндалл Д., Бурггрен В. и Френч К. (2002). Физиология животных Эккерта: механизмы и адаптации, 5th. изд. Ch. 10. Нью-Йорк, штат Нью-Йорк: W.H. Фримен и компания. ISBN: 0-7167-3863-5.
Миофибрилла — обзор | Темы ScienceDirect
Миофибриллы
Отдельные миофибриллы четко видны на рис. 2.3 и рис. 2.4. Наиболее яркой особенностью сердечных миофибрилл является их разветвленная природа (рис.2.7A) и, как следствие, их переменный диаметр (от 0,1 до 3,5 мкм только в желудочке лягушки). Однако конструкция миофибриллы и ее саркомерная организация очень похожа на то, что наблюдается в скелетных мышцах (Рис. 2.7B). Хорошо видны обычные полосы A и I, диск Z и зона H, что свидетельствует о двухъединичной системе взаимного пересечения миофиламентов. Из данных, собранных вместе в Таблице 2.3, можно видеть, что актиновые и миозиновые филаменты и их орбитальные конфигурации в сердечной мышце как у позвоночных, так и у беспозвоночных мало отличаются от диапазона, обнаруженного в скелетных мышцах, и никаких дальнейших комментариев не требуется.
РИС. 2.7. Миофибриллы желудочкового волокна лягушки. A, обзорная микрофотография, показывающая саркомерное строение миофибриллы; B — одиночный саркомер, явно состоящий из толстых и тонких нитей с полосами A и I, диском Z и зоной H. Увеличение при печати: A, × 7000; Б, × 60 000. H. Huddart, ранее не публиковалось.
ТАБЛИЦА 2.3. НЕКОТОРЫЕ ХАРАКТЕРИСТИКИ МИОФИБРИЛЛЯРНЫХ БЕЛКОВ СЕРДЕЧНЫХ МЫШЕЧНЫХ КЛЕТОК
| Животное | Диаметр актина (Å) | Диаметр миозина (Å) | Актин / миозиновая орбита | Кат. 70 | 100–150 | 6: 1 | Фосетт и МакНатт (1969) | |
|---|---|---|---|---|---|---|---|---|
| Pleuronectes (Teleost) | 50–80 | 180–250 | 6: 1 | и Cobb 1972)|||||
| Limulus (Arachnida) | 50 | 200 | 7–8: 1 | Sperelakis (1971) | ||||
| Hyalophora (Insecta) | –12: 1Сэнгер и Макканн (1968a) | |||||||
| Лобстер (Crustaceae) | 50–70 | 150–200 | 6: 1 | Смит и Андерссон (1972) | ||||
| Unto (Mollusca) | 50 | 300 | 10: 1 | Kawaguti (1963e) |
В своем важном исследовании желудочковой папиллярной мышцы кошки, Fawcet и McN69 дали полезные данные о тонкой структуре миофиламентов.Как и в летающих мышцах насекомых и других быстрых скелетных мышцах, толстые нити желудочковых волокон кошек имеют гексагональную упаковку с относительно постоянным межцентровым расстоянием 400–450 Å. В более толстом центральном сегменте миозиновой нити (составляющем зону M-полосы), шириной около 850-900 A, можно увидеть пять тонких линий толщиной 30-50 мкм, расположенных на расстоянии около 220 A друг от друга. Эти периодические линии представляют собой межмиозиновые поперечные мостики, образованные из материала с совершенно другими ферментативными свойствами, чем миозин (Karnovsky and Hug, 1963).По обе стороны от полосы M на расстоянии около 180 Å миозиновая нить голая, и это, вероятно, все еще находится в области примыкания мономеров миозина «хвост к хвосту». Шарнирные головки миозина, составляющие поперечные мостиковые структуры для взаимодействия с актином, заполняют остальную часть филамента, расположенного по спирали. Актиновые нити сердечной мышцы и их связь с Z-диском и его субструктурой кажутся похожими на таковые в скелетных мышцах, описанные в предыдущей главе.
В активно дифференцирующихся прекардиальных клетках цыплят была описана третья и несколько гетерогенная группа филаментов в диапазоне размеров 85–130 Å (Rash et al. , 1970). Эти нити остаются после химического разрушения нормальных толстых и тонких нитей, и ясно, что их нельзя легко приравнять к какой-либо из миофибриллярных составляющих взрослых сердечных клеток. Ни функция, ни судьба этих филаментов не изучены — они могут участвовать в синтезе микротрубочек, или они могут деградировать или взаимно превращаться в поддерживающую ткань скелета для взрослой клетки.
В то время как кардиальный миозин, по-видимому, подобен скелетному миозину на общем структурном уровне, между ними есть некоторые важные биохимические различия, особенно касающиеся их соответствующих АТФазных активностей (см. Barany et al. , 1964). Например, в скелетном миозине, актомиозине и миофибриллах активность Са-АТФазы, Са-ИТФазы и ЭДТА-АТФазы примерно в три раза выше, чем у сердечного миозина, актомиозина и миофибрилл, а активность сердечной АТФазы, в отличие от активности скелетных мышц. , не увеличивайте резко при значениях pH выше 8.0. Однако способность сердечного и скелетного миозина соединяться с актином как при высокой, так и при низкой ионной силе по существу одинакова. Есть также некоторые различия в аминокислотном составе между двумя миозинами. Сердечный миозин, например, содержит гораздо меньше остатков цистеина, чем скелетный миозин.
Гладкие мышцы | Безграничная анатомия и физиология
Волокна скелетных мышц
Скелетные мышцы состоят из поперечно-полосатых субъединиц, называемых саркомерами, которые состоят из миофиламентов актина и миозина.
Цели обучения
Обрисовать структуру волокна скелетных мышц
Основные выводы
Ключевые моменты
- Мышцы состоят из длинных пучков миоцитов или мышечных волокон.
- Миоциты содержат тысячи миофибрилл.
- Каждая миофибрилла состоит из множества саркомеров, функциональной сократительной области поперечно-полосатой мышцы. Саркомеры состоят из миофиламентов миозина и актина, которые взаимодействуют, используя модель скользящей нити и цикл поперечного мостика для сокращения.
Ключевые термины
- саркоплазма : цитоплазма миоцита.
- саркоплазматическая сеть : эквивалент гладкой эндоплазматической сети в миоците.
- сарколемма : клеточная мембрана миоцита.
- саркомер : Функциональная сократительная единица миофибриллы поперечно-полосатой мышцы.
Структура волокон скелетных мышц
Миоциты, иногда называемые мышечными волокнами, образуют основную массу мышечной ткани.Они связаны перимизием, оболочкой из соединительной ткани, в пучки, называемые пучками, которые, в свою очередь, соединяются вместе, образуя мышечную ткань. Миоциты содержат многочисленные специализированные клеточные структуры, которые способствуют их сокращению и, следовательно, сокращению мышцы в целом.
Высокоспециализированная структура миоцитов привела к созданию терминологии, которая отличает их от общих клеток животных.
- Родовые клетки> Миоциты
- Цитоплазма> Саркоплазма
- Клеточная мембрана> Sarcolemma
- Гладкая эндоплазматическая сеть> Саркоплазматическая сеть
Структура миоцитов
Миоциты могут быть невероятно большими, диаметром до 100 микрометров и длиной до 30 сантиметров.Саркоплазма богата гликогеном и миоглобином, которые хранят глюкозу и кислород, необходимые для выработки энергии, и почти полностью заполнена миофибриллами, длинными волокнами, состоящими из миофиламентов, которые способствуют сокращению мышц.
Сарколемма миоцитов содержит многочисленные впячивания (ямки), называемые поперечными канальцами, которые обычно перпендикулярны длине миоцита. Поперечные канальцы играют важную роль в снабжении миоцитов ионами Ca + , которые играют ключевую роль в сокращении мышц.
Каждый миоцит содержит несколько ядер из-за того, что они произошли от нескольких миобластов, клеток-предшественников, которые дают начало миоцитам. Эти миобласты расположены на периферии миоцита и уплощены, чтобы не влиять на сокращение миоцитов.
Миоцит: клетка скелетных мышц : клетка скелетных мышц окружена плазматической мембраной, называемой сарколеммой, с цитоплазмой, называемой саркоплазмой. Мышечное волокно состоит из множества миофибрилл, собранных в упорядоченные единицы.
Структура миофибрилл
Каждый миоцит может содержать многие тысячи миофибрилл. Миофибриллы проходят параллельно миоциту и обычно проходят по всей его длине, прикрепляясь к сарколемме с обоих концов. Каждая миофибрилла окружена саркоплазматической сетью, которая тесно связана с поперечными канальцами. Саркоплазматический ретикулум действует как приемник ионов Ca + , которые высвобождаются при передаче сигналов из поперечных канальцев.
Саркомеры
Саркомер : Саркомер — это функциональная сократительная область миоцита, определяющая область взаимодействия между набором толстых и тонких нитей.
Миофибриллы состоят из длинных миофиламентов актина, миозина и других связанных белков. Эти белки организованы в области, называемые саркомерами, функциональной сократительной областью миоцита. Внутри саркомерного актина и миозина миофиламенты переплетаются друг с другом и скользят друг по другу посредством модели сокращения скользящей нити. Регулярная организация этих саркомеров придает скелетным и сердечным мышцам характерный полосатый вид.
Миофиламенты (толстые и тонкие)
Миофибриллы состоят из более мелких структур, называемых миофиламентами.Существует два основных типа миофиламентов: толстые нити и тонкие нити. Толстые филаменты состоят в основном из белков миозина, хвосты которых соединяются вместе, оставляя головки открытыми для переплетенных тонких нитей. Тонкие нити состоят из актина, тропомиозина и тропонина. Молекулярная модель сокращения, которая описывает взаимодействие между актином и миозиновыми миофиламентами, называется циклом перекрестных мостиков.
Сборка и поддержание миофибрилл в поперечно-полосатой мышце
В этой главе мы представляем текущие знания о сборке, росте и динамике поперечно-полосатых миофибрилл de novo, функциональных архитектурных элементах, развивающихся в скелетных и сердечных мышцах.Данные были получены при исследовании миофибрилл, сформированных в культурах скелетных мышин и мышечных трубок перепелов, в сомитах живых эмбрионов рыбок данио, а также в клетках сердца новорожденных и перепелов. Полученный сравнительный взгляд показал, что сборка поперечно-полосатых миофибрилл представляет собой трехступенчатый процесс, прогрессирующий от премиофибрилл к зарождающимся миофибриллам и к зрелым миофибриллам. Этот процесс определяется добавлением новых структурных белков, расположением миофибриллярных компонентов, таких как актин и миозиновые филаменты с их спутниками, в так называемые саркомеры и их точным выравниванием.Формирование зрелых миофибрилл сопровождается снижением динамического поведения собирающихся белков. Белки наиболее динамичны в премиофибриллах на ранней стадии и наименее динамичны в зрелых миофибриллах на заключительной стадии миофибриллогенеза. Вероятно, это связано с усилением взаимодействия между белками в процессе созревания. Динамические свойства миофибриллярных белков обеспечивают механизм обмена более старыми белками или изменения изоформ без нарушения структурной целостности, необходимой для функции миофибрилл.Важным аспектом сборки миофибрилл является роль актин-нуклеирующих белков в формировании, поддержании и саркомерном расположении миофибриллярных актиновых филаментов. Это очень активная область исследований. Мы также сообщаем о нескольких мутациях актина, которые приводят к мышечным заболеваниям человека.
Ключевые слова: Актин; DNase1; Формин; Гельсолин; I-диапазоны; Джасплакинолид; Латрункулин А; Лейомодин; Зрелая миофибрилла; Мышечный миозин II; Мышечный миозин-связывающий протеин C; Миофибриллогенез; Миомезин; Миозин; Зарождающаяся миофибрилла; Немышечный миозин II; Премиофибрилла; Тропомодулин; Тропомиозин; Белок, связывающий витамин D; Z-полосы; Z-тела; α-Актинин.
Введение
Мышцы — многоклеточные сократительные единицы. Они делятся на три типа:
- скелетная мышца
- гладкие мышцы
- сердечная мышца
Читая о каждом типе мышц, подумайте о сходствах и различиях между ними с точки зрения структуры и функции.
Скелетные мышцы
Скелетные мышцы в основном отвечают за движение скелета, но также встречаются в таких органах, как глазное яблоко и язык.Это произвольная мышца, поэтому она находится под сознательным контролем. Скелетные мышцы специализируются на быстром и сильном кратковременном сокращении.
Каждая мышечная клетка определяется клеточной мембраной (сарколеммой) и содержит множество ядер по своей длине. Ядра смещены периферически в поперечном сечении цитоплазмы (саркоплазма), в то время как большое количество продольных миофибрилл, групп упорядоченных сократительных белков, занимают большую часть центрального пространства. Миофибрилла содержит несколько важных гистологических ориентиров:
- Миофибрилла состоит из чередующихся полос.I-полосы (изотропные в поляризованном свете) кажутся светлыми, а A-полосы (анизотропные в поляризованном свете) кажутся темными. Чередование этих полос приводит к появлению полосатых скелетных мышц.
- Z-линии (Zwischenschieben) делят I-полосы пополам.
- Легкая полоса, называемая H-диапазоном (Heller), находится внутри каждого A-диапазона.
- M-линия (Mittelschiebe) делит пополам каждую A-полосу (и при этом делит пополам каждую H-полосу).
Каждую миофибриллу можно понять как серию сократительных единиц, называемых саркомерами, которые содержат два типа филаментов: толстые филаменты, состоящие из миозина, и тонкие филаменты, состоящие из актина.Отдельные нити не изменяются по длине во время сокращения мышц; скорее тонкие нити скользят по толстым нитям, чтобы укорачивать саркомер. Природу этих филаментов можно понять в контексте гистологических ориентиров миофибрилл.
- Толстые нити представляют собой биполярный массив полимеризованных миозиновых двигателей. Двигатели на одной стороне нити накала ориентированы в одном направлении, тогда как двигатели на другой стороне нити накала ориентированы в противоположном направлении.В центре нити нет двигателей; он содержит только спиральную область миозинов. Набор белков связывает каждую миозиновую нить со своими соседями в центре нити. Эти белки составляют М-линию.
- Тонкие нити прикреплены к дискообразной зоне, которая гистологически выглядит как Z-линия. Z-линии содержат белки, которые связывают и стабилизируют положительные концы актиновых филаментов. Z-линии также определяют границы каждого саркомера.
- I- и H-полосы — это области, где толстые и тонкие нити не перекрываются (вот почему эти полосы кажутся более бледными под микроскопом).I-полоса содержит исключительно тонкие волокна, тогда как H-полоса содержит исключительно толстые волокна.
Скелетные мышцы делятся на два типа мышечных волокон:
- Медленно сокращающиеся (тип I) мышечные волокна сокращаются медленнее и зависят от аэробного метаболизма. Они содержат большое количество митохондрий и миоглобина, молекулы, запасающей кислород. Красноватый цвет миоглобина является причиной того, что эти волокна можно назвать красными волокнами. Эти мышцы могут поддерживать непрерывное сокращение и полезны при таких действиях, как поддержание осанки.
- Быстро сокращающиеся (тип II) мышечные волокна сокращаются быстрее из-за наличия более быстрого миозина. Волокна типа II можно разделить на те, которые имеют большое количество митохондрий и миоглобина, и те, которые имеют мало митохондрий и мало миоглобина. Первые в основном используют аэробное дыхание для выработки энергии, тогда как вторые полагаются на гликолиз. Недостаток миоглобина приводит к более бледному цвету, чем у медленно сокращающихся мышц, и поэтому быстро сокращающиеся волокна могут называться белыми волокнами.Эти мышцы важны при интенсивных, но спорадических сокращениях; например, те, которые имеют место в бицепсах.
Большинство мышц содержат смесь этих крайних типов волокон. У людей типы волокон невозможно различить на основе общего исследования, но для дифференциации волокон требуется специальная окраска или обработка.
Нервно-мышечные соединения и активация клеток скелетных мышц
Клетки скелетных мышц иннервируются двигательными нейронами. Двигательная единица определяется как нейрон и волокна, которые он снабжает.Некоторые двигательные нейроны иннервируют одну или несколько мышечных клеток, тогда как другие двигательные нейроны могут иннервировать сотни мышечных клеток. Мышцы, требующие точного контроля, имеют двигательные нейроны, которые иннервируют меньшее количество мышечных клеток; мышцы, которые участвуют в менее контролируемых движениях, могут иметь множество волокон, иннервируемых каждым нейроном. Моторные аксоны оканчиваются нервно-мышечным соединением на поверхности волокон скелетных мышц. Нервно-мышечное соединение состоит из пресинаптического нервного окончания и постсинаптического мышечного волокна.После деполяризации пресинаптические везикулы, содержащие нейромедиатор ацетилхолин, сливаются с мембраной, высвобождая ацетилхолин в щель. Ацетилхолин связывается с рецепторами на постсинаптической мембране и вызывает деполяризацию мышечного волокна, что приводит к его сокращению. Обычно один потенциал действия в нейроне высвобождает достаточно нейромедиатора, чтобы вызвать одно сокращение мышечного волокна.
В мышечных клетках сарколемма или плазматическая мембрана простирается поперек саркоплазмы, окружая каждую миофибриллу, создавая систему Т-канальцев.Эти Т-канальцы обеспечивают синхронное сокращение всех саркомеров миофибриллы. Т-канальцы находятся на стыке А- и I-полос, и их просветы непрерывны с внеклеточным пространством. В таких местах Т-канальцы находятся в тесном контакте с саркоплазматической сетью, которая образует сеть, окружающую каждую миофибриллу. Часть саркоплазматической сети, связанная с Т-канальцами, называется терминальными цистернами из-за ее уплощенного цистернального расположения.Когда сигнал возбуждения достигает нервно-мышечного соединения, деполяризация сарколеммы быстро проходит через систему Т-канальцев и вступает в контакт с саркоплазматической сетью, вызывая высвобождение кальция и приводя к сокращению мышц.
Гладкие мышцы
Гладкая мышца образует сократительную часть стенки пищеварительного тракта от средней части пищевода до внутреннего сфинктера заднего прохода. Он обнаруживается в стенках протоков желез, связанных с пищеварительным трактом, в стенках дыхательных путей от трахеи до альвеолярных протоков, а также в мочевых и половых путях.Стенки артерий, вен и крупных лимфатических сосудов также содержат гладкие мышцы.
Гладкая мышца предназначена для медленных и продолжительных сокращений небольшой силы. Вместо двигательных единиц все клетки в составе гладкой мускулатуры сокращаются вместе. Гладкой мускулатуре свойственна сократимость, и вегетативная нервная система, гормоны и местные метаболиты могут влиять на ее сокращение. Поскольку это не находится под сознательным контролем, гладкая мышца является непроизвольной мышцей.
Гладкие мышечные волокна представляют собой удлиненные веретеновидные клетки с одним ядром.Как правило, они намного короче клеток скелетных мышц. Ядро расположено по центру, а саркоплазма заполнена фибриллами. Толстые (миозин) и тонкие (актиновые) филаменты разбросаны по саркоплазме и связаны с плотностями адгезии на клеточной мембране и фокусными плотностями внутри цитоплазмы. Поскольку сократительные белки этих клеток не организованы в миофибриллы, как в скелетных и сердечных мышцах, они выглядят скорее гладкими, чем полосатыми.
Гладкие мышечные волокна связаны друг с другом в нерегулярные ветвящиеся пучки, расположение которых варьируется от органа к органу.Эти пучки являются функциональными сократительными единицами. Между волокнами и пучками существует также сеть поддерживающих коллагеновых тканей.
Сердечная мышца
Сердечная мышца имеет важные характеристики как скелетных, так и гладких мышц. Функционально сердечная мышца производит сильные сокращения, как скелетные мышцы. Тем не менее, ему присущи механизмы для инициирования непрерывного сокращения, такие как гладкие мышцы. Скорость и сила сокращения не подлежат произвольному контролю, но зависят от вегетативной нервной системы и гормонов.
Гистологически сердечная мышца выглядит поперечно-полосатой, как скелетная мышца, из-за расположения сократительных белков. Также он имеет несколько уникальных структурных характеристик:
- Волокна сердечной мышцы не расположены просто параллельно. Вместо этого они разветвляются на концах, образуя соединения с несколькими соседними ячейками, в результате чего получается сложная трехмерная сеть.
- Волокна сердечной мышцы — это длинные цилиндрические клетки с одним или двумя ядрами.Ядра расположены в центре, как и у гладких мышц.
- Саркоплазма сердечной мышцы имеет большое количество митохондрий для удовлетворения энергетических потребностей.
Коллагеновые ткани окружают отдельные волокна сердечной мышцы. В этой поддерживающей ткани наблюдается обильная васкуляризация, которая необходима для удовлетворения высоких метаболических потребностей сердечной мышцы.
Волокна сердечной мышцы соединены встык с помощью специализированных узловых областей, называемых вставными дисками.Вставные диски обеспечивают фиксацию миофибрилл и позволяют быстро распространять сократительные стимулы между клетками. Такое быстрое распространение сокращения позволяет сердечным мышцам действовать как функциональный синцитий. Вставные диски содержат три типа межмембранного контакта:
- прикрепленных фасций, которые связаны с актиновыми филаментами для передачи сокращения
- десмосомы, которые соединяются с промежуточными филаментами цитоскелета
- щелевых переходов, которые представляют собой участки с низким электрическим сопротивлением, которые допускают распространение возбуждения
В дополнение к сократительным клеткам существует специализированная система, состоящая из модифицированных мышечных клеток, функция которых состоит в том, чтобы генерировать стимул для сердцебиения и проводить импульс в различных частях миокарда.Эта система состоит из синоатриального узла, атриовентрикулярного узла, пучка Гиса и волокон Пуркинье.
Сборка и динамика миофибрилл
Мы рассматриваем некоторые проблемы при определении того, как могут быть собраны миофибриллы, и, что не менее важно, как эта сократительная структура может обновляться саркомерными белками, перемещающимися между саркомером и цитоплазмой. В этом личном обзоре мы также обращаемся к недавним свидетельствам, указывающим на то, что сборка и динамика миофибрилл сохраняются независимо от того, анализируются ли клетки in situ или в условиях культуры ткани.Мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли он in situ или in vitro .
1. Введение
Миофибриллы поперечно-полосатой мышцы характеризуются группами белков, организованными в сократительные единицы, или саркомеры, которые состоят из отдельных субъединиц, повторяющихся по длине мышечной клетки. Хотя саркомеры поперечно-полосатых мышц различаются у разных видов по длине и по некоторым белковым составляющим, все они имеют сходное расположение субъединиц из трех основных компонентов: тонких нитей, толстых нитей и Z-полос, каждая из которых формируется в результате множественных взаимодействий между белками, производящими и контролировать сокращение (рис. 1).Скелет позвоночных и сердечные саркомеры в состоянии покоя имеют длину 2,5 микрона, тогда как саркомеры поперечно-полосатых мышц в мире беспозвоночных широко варьируются от одного микрона у медузы [1] до 25 микрон в глотке силлидного червя [2]. Длина А-полосы толстых нитей и длина тонких нитей зависят от размера саркомера: самая короткая — 0,6 мкм и 0,5 мкм соответственно у медуз, самая длинная — 20 мкм и 12 мкм, соответственно, у силлидного червя и 1 .6 мкм и 1,0 мкм в скелетных мышцах позвоночных [3]. В желудочковых мышцах позвоночных длина тонких филаментов варьируется до одного микрона [4].
Несмотря на все, что известно о связывании миофибриллярных белков друг с другом в биохимических анализах, многое неизвестно о множественности взаимодействий, которые поддерживают образование и стабильность миофибрилл в живой клетке. Важность взаимодействий миофибриллярных белков для здоровья сердца была подтверждена осознанием того, что мутировавшие саркомерные белки участвуют во все большем числе кардиомиопатий [9, 10].Взаимодействия основных белков, ответственных за производство силы в субъединицах тонких и толстых филаментов, были подробно описаны [11]. Белки Z-полосы, области саркомера, где все еще открываются новые белки и новые взаимодействия известных белков [12, 13], представляют собой особенно сложную сеть потенциальных множественных взаимодействий, многие из которых были определены биохимическими методами. не методами внутри живой клетки (рис. 2). Z-полоса функционирует как каркас, который последовательно связывает саркомерные сократительные единицы, закрепляя тонкие и титиновые филаменты соседних саркомеров.Z-полосы также закрепляют концы миофибрилл в специализированных соединениях, называемых интеркалированными дисками в клетках сердечной мышцы, и они соединяют саркомеры латерально с клеточной мембраной через костамерные белки [14, 15]. Многофункциональная природа Z-полосы отражается в разнообразии белков, которые колокализуются в этой структуре: каналы, сигнальные молекулы, ферменты, комплекс цитоскелетных филаментов, который взаимодействует с клеточной мембраной, и саркомерные филаменты, необходимые для сокращения (рис. 2) [11]. , 16, 17].Два из самых неожиданных недавних сообщений о новых белках Z-диапазона касаются (а) белков теплового шока в скелетных мышцах рыбок данио (обзор приведен в [12]) и (б) белка CLOCK, который участвует в регуляции циркадных ритмов в кардиомиоцитах новорожденных крыс. (рассмотрено в [13]).
2. Формирование миофибрилл
По мере того, как список белков миофибрилл и их реакций связывания растет, пути сборки, по которым взаимодействующие белковые комплексы образуют миофибриллы, имеют все большее значение для понимания проблем аберрантного образования и поддержания миофибрилл, содержащих мутировавшие саркомерные белки [9, 10, 16, 18].В начале 1900-х годов Хайденхайн [19] исследовал фиксированные мышцы в световом микроскопе и заметил гладкие волокна около клеточной мембраны развивающихся скелетных мышц форели до того, как были обнаружены поперечно-полосатые структуры, которые, как мы теперь знаем, были Z-полосами и A-полосами. Электронные микрофотографии формирующихся мышц цыплят также показали гладкие волокна около клеточной мембраны до появления полосатых миофибрилл (см. Обзор Sanger et al. [6]). Рост длины А-полосы до зрелого размера также наблюдали с помощью электронной микроскопии мышц эмбриональной мухи, фиксируемой с ежедневными интервалами.Первые наблюдаемые волокна были гладкими с плотными телами, но без толстых нитей, за ними следовали волокна с Z-полосами и короткими A-полосами, а затем волокна с A-полосами длины зрелой мышцы [20]. Поперечно-полосатые саркомеры в формировании мышц клещей, которые были проанализированы с помощью поляризованного света у живых животных, увеличились за 30-часовой период с 2,2 до 4 микрон в длину, что сопровождалось увеличением длины А-полосы с 1,4 до 3 микрон [21] .
Появление зондов для флуоресцентного обнаружения белков внутри клеток позволило охарактеризовать волокна в немышечных клетках и эмбриональных мышечных клетках.В немышечных клетках многие стрессовые волокна, ранее описанные как гладкие в [22, 23], как было показано, состоят из повторяющихся концентраций альфа-актинина и немышечного миозина II, распределенных в чередующихся полосах вдоль перекрывающихся актиновых филаментов [24-28]. В краткой презентации трехстраничный отчет, опубликованный в книге, описывающей протоколы коротких бесед в честь покойного Джона Маршалла, Куликовски и Манасека [29], описывает, как зародышевые культивированные кардиомиоциты цыплят появляются при окрашивании мышечно-специфическими антителами к миозину II. через разные периоды времени в культуре.Они отметили появление гладких непрерывных миозиновых волокон в кардиомиоцитах в первые дни культивирования. Эти волокна были описаны как имеющие «морфологию стрессовых волокон». В более старых культурах авторы регистрировали типичные миофибриллы с A-полосами. Они пришли к выводу, что миофибриллы могут «собираться заново через промежуточные соединения, подобные стрессовым волокнам, в культивируемых сердечных миоцитах».
Было впервые показано, что немышечная изоформа миозина II присутствует в клетках скелетных мышц рядом с мембраной в волокнах, отличных от зрелых миофибрилл [30].Эти волокна позже были названы «наподобие стрессовых волокон» Dlugosz et al. [31]. Три изоформы немышечного миозина II были с тех пор обнаружены в волокнах поперечнополосатых мышечных клеток позвоночных [32–34]. Последующие исследования различались по поводу роли, которую эти «стрессовые волокна» могут играть в миофибриллогенезе. Лаборатория Хольцера предложила им функционировать как шаблоны, по которым мышечные белки собираются и образуют поперечно-полосатые миофибриллы [31]. Предполагалось, что шаблоны затем будут разобраны с повторной сборкой субъединиц в другой области ячейки, чтобы перезапустить процесс создания шаблона.Таким образом, одна структура, подобная стрессовому волокну, была предложена в качестве шаблона для каждой новой миофибриллы миофибрилл.
Было обнаружено, что волокна, которые были гладкими при окрашивании F-актина фаллоидином, образовывали мини-саркомеры, когда флуоресцентный альфа-актинин вводили в живые клетки или перфузировали в проницаемые мышечные клетки [35–37]. Небольшие точки альфа-актинина располагались с интервалом от 0,3 до 1,5 микрон. В живых клетках, инъецированных флуоресцентным альфа-актинином, расстояние между точками увеличивается со временем [37], как было подтверждено более поздним исследованием на эмбриональных клетках сердца, трансфицированных GFP-альфа-актинином, в которых маленькие точки альфа-актинина выровнены латерально и Z- полосы сначала выглядели как бусинки, а потом стали гладкими [38].Были обнаружены полосы немышечного миозина II, чередующиеся с плотностями саркомерного альфа-актинина (z-тела) в этих волокнах [39]. Идентичные минисаркомерные паттерны чередующихся z-тел (саркомерный альфа-актинин) и полос немышечного миозина II были также обнаружены в эксплантатах прекардиальной мезодермы цыплят [5] и в окрашенных интактных сердцах ранних куриных эмбрионов [40]. Таким образом, не было различий между культивированными и интактными сердцами в обнаружении пути миофибриллогенеза (рис. 1).Мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли он in situ или in vitro .
Немышечные легкие цепи миозина II, которые были флуоресцентно мечены и введены в культивируемые клетки из эмбриональных мышц птиц, также локализовались в небольших периодически расположенных полосах вдоль самых тонких волокон актина около клеточной мембраны [27]. Кроме того, легкие цепи также локализованы в А-полосах миофибрилл в эмбриональных клетках и в виде гладкого рисунка по длине других актиновых волокон [27].Гладкий узор представляет собой зарождающиеся миофибриллы (рис. 1). Неровный узор является результатом перекрывания толстых филаментов в формирующихся миофибриллах [5-7]. При делении кардиомиоцитов птиц Conrad et al. [41] обнаружили, что немышечный миозин II, но не мышечный миозин II, присутствует в бороздах дробления. В настоящее время известно, что немышечный миозин II в кардиомиоцитах птиц является изоформой IIB [39, 42]. Антитело к II A не реагирует с эмбриональными кардиомиоцитами цыплят [39], и ранние сообщения показали, что волокна с минисаркомерными полосами немышечного миозина не присутствовали в кардиомиоцитах птиц [43, 44]), потому что использовались антитела к II A.Малый диаметр и гладкий внешний вид волокон с окрашивающими фаллоидином волокнами напоминают таковые у стресс-волокон, отсюда и термин «стрессовые волокноподобные структуры» [31]. Однако теперь мы знаем, что большинство белков в этих волокнах являются мышечно-специфическими белками, например, альфа-актинином, актином, тропомиозином и так далее [7, 39, 45, 46]. Они также менее чувствительны, чем стрессовые волокна, к ряду различных ингибиторов (гельсолин [47], ДНКаза1, витамин-D-связывающий белок [48] и латрункулин-A [49]).J. M. Sanger и J. W. Sanger [50] продемонстрировали, что борозды дробления содержат противоположно поляризованные актиновые филаменты, пересекающиеся с немышечными II-подобными филаментами в минисаркомерных структурах, подобных таковым в стрессовых волокнах интерфазных клеток.
Мы предположили, что волокна с минисаркомерными полосами немышечного миозина II в мышечных клетках являются премиофибриллами, предшественниками миофибрилл (см. [7, 39]; Рисунок 1). Мы рассматриваем мелкие точки z-телец альфа-актинина, предшественников Z-полос.Паттерны локализации миозина II в эмбриональных кардиомиоцитах цыплят, зафиксированные в разное время после распространения и реформирования миофибрилл в культуре, указывают на три типа волокон (рис. 1). Премиофибриллы состоят из тонких нитей с периодическими мини-А-полосами, расположенными между точками альфа-актинина (z-тельцами). Возникающие миофибриллы обладают двумя типами окрашивания миозина II: небольшими периодическими мини-А-полосами немышечного миозина IIB и несвязанным окрашиванием мышечно-специфичного миозина II. Зрелые миофибриллы окрашивают только один тип миозина II, то есть мышечно-специфический миозин II в A-полосах. Таким образом, исходное несвязанное окрашивание волокон фаллоидином, которое Dlugosz et al. [31], первоначально названные стрессовыми волокнами, представляют собой как пре-, так и зарождающиеся миофибриллы. Последующие наблюдения группы Хольцера за формированием мышц в фиксированных эмбриональных птичьих миоцитах привели их к предложению дополнительной модели, в которой сборка миофибрилл происходила посредством независимой сборки толстых нитей и Z-полос, связанных с их связанными тонкими нитями (кистями IZI) [43, 44 ].Было предложено связать Титина с кистями I-Z-I, захватить мышечные волокна миозина II и выровнять их в A-полосы, а также соединить A-полосы и I-Z-I кисти в саркомерные единицы без вовлечения стрессовых волоконоподобных структур. Однако теперь известно, что предшественники Z-полос (z-тельца) и связанный с ними актин не разбросаны в клетке, а выровнены минисаркомерным расположением немышечных миозинов II, то есть премиофибрилл (рис. 1; [7]). , 39, 51]). Минисаркомерное устройство борозд дробления, стресс-волокон и премиофибрилл, по-видимому, возникло очень рано [27, 28, 50, 52, 53].Визуализация живых клеток позволила нам проследить миофибриллогенез от отложения премиофибрилл в формирующиеся миофибриллы до зрелых миофибрилл в культивируемых кардиомиоцитах, клетках скелетных мышц и у живых рыбок данио [37, 38, 49, 53–56]. Визуализация живых клеток мышечных клеток, трансфицированных усеченными участками Z-полосы тайтина, продемонстрировала важность тайтина для миофибриллогенеза [57, 58]. Нам удалось использовать воздействие на ранние миобласты различных концентраций этилметансульфоната для остановки миофибриллогенеза на стадии премиофибрилл или зарождающейся миофибриллы [55].Удаление этого ингибитора привело к возобновлению процесса сборки, что привело к образованию зрелых миофибрилл (рис. 1). Роль немышечного миозина II, по-видимому, важна для выравнивания тонких филаментов в премиофибриллах и возникающих миофибриллах [5, 6, 49]. Нарушение образования немышечных филаментов миозина II с помощью ингибитора фосфорилирования легких цепей миозина, которые необходимы для сборки филаментов, приводит к потере премиофибрилл и неорганизованному массиву миозиновых толстых филаментов [5].Удаление ингибитора ML-7 привело к реформированию премиофибрилл и возникающих миофибрилл и к сборке упорядоченных массивов толстых филаментов в A-полосах зрелых миофибрилл [5].
Как перекрывающиеся толстые филаменты, состоящие из гексамеров мышечного миозина II в формирующихся миофибриллах, выстраиваются в A-полосы зрелых миофибрилл, не ясно. Было высказано предположение, что титин, белки M-диапазона и другие белки, такие как обскурин, играют роль в этом процессе [59–62]. Есть миофибриллы, у которых отсутствуют М-полосы, но при этом их А-полосы полностью выровнены.Lange et al. [63] недавно сообщили, что A-Bands и миофибриллы обычно образуются у мышей с нокаутом, скрывающих видимость. Они действительно обнаружили, что продольные массивы саркоплазматического ретикулума (SR) были изменены, поддерживая роль соединения SR с миофибриллами.
Модель премиофибрилл (Рис. 1) не была принята повсеместно, потому что она кажется несовместимой с несколькими опубликованными статьями (см. Обзор Sanger et al. [7]). В частности, один из двух отчетов лаборатории Адельштейна показал, что мыши с нулевым уровнем немышечного миозина IIB [64], если они доживали до рождения, имели аномальные сердце и мозг и умирали в день рождения.Тем не менее, аномальные сердца действительно содержали нормальные миофибриллы, что позволяет предположить, что немышечный миозин IIB не был необходим для образования всех миофибрилл. Однако западные исследования геля на нескольких выживших животных показали, что у половины выживших новорожденных изоформа миозина IIA была активирована, и, таким образом, изоформа IIA могла занять место изоформы IIB. Эмбриональные клетки скелетных мышц имеют обе изоформы немышечного миозина IIA и IIB. Таким образом, клетки скелетных мышц были нормальными при этих нокаутах IIB, предположительно из-за присутствия IIA.Недавняя статья Лу и др. [34] сообщает, что обе изоформы немышечного миозина II, A и B, присутствуют в ранних сердцах мышей. В другой статье группа Adelstein сообщила, что немышечный миозин II является белком Z-диапазона как в клетках сердечных (IIB), так и в скелетных (A и B) мышечных клетках [65]. Они также сообщили в той же статье, что изоформа IIB была локализована во вставленных дисках фиксированных и окрашенных клеток сердечной мышцы. После публикации этих двух исследований из лабораторий Адельштейна была открыта третья изоформа немышечного миозина IIC [32, 33].Эта изоформа также присутствует в сердце, скелетных мышцах и некоторых органах. Роль немышечного миозина IIC в миофибриллогенезе еще предстоит изучить. Использование нами антител, направленных против немышечных II A или B в клетках сердечных и скелетных мышц, никогда не обнаружило эти антигены ни в Z-полосах, ни в интеркалированных дисках [5, 39, 40, 56]. Наши предварительные результаты показывают, что клетки сердца и скелетных мышц котрансфицировались церулеановым флуоресцентным белком (CeFP) и одной из трех изоформ немышечного миозина II (зеленый флуоресцентный белок (GFP) — немышечный миозин II A или B или C), что противоречит результатам Takeda et al.[65] бумага. GFP-немышечные миозины II не были локализованы в Z-полосах ни одного типа мышечных клеток, ни во вставленных дисках клеток сердечной мышцы. Три немышечные изоформы миозина II были локализованы в областях клеток в линейных массивах, в чередующихся массивах с z-тельцами, содержащими CeFP-альфа-актинин, то есть премиофибриллами.
Есть две другие статьи, которые были названы несовместимыми с премиофибриллярной моделью миофибриллогенеза. Ehler et al. [59] и Rudy et al.[66] сообщили об их неспособности обнаружить присутствие премиофибрилл или возникающих миофибрилл ни в интактных фиксированных эмбриональных сердцах птиц, ни в эксплантатах прекардиальной мезодермы. Однако улучшенная фиксация и иммунофлуоресцентные методы привели к обнаружению немышечного миозина II B в организованных массивах в обоих типах препаратов [5, 40], которые были идентичны премиофибриллам и возникающим миофибриллам, первоначально обнаруженным в культивируемых эмбриональных кардиомиоцитах [39]. Кроме того, Du et al. [5] смогли обратимо ингибировать сборку зрелых миофибрилл с помощью ML-7, ингибитора киназы легких цепей миозина, фермента, который отвечает за фосфорилирование немышечных легких цепей и является необходимым условием для способности немышечный миозин II с образованием филаментов.Удаление этого ингибитора привело к реформированию премиофибрилл с их массивами мини-А-полос немышечного миозина II B и возобновлению миофибриллогенеза, что привело к образованию зрелых миофибрилл. Все эти результаты подтверждают общую модель миофибриллогенеза в кардиомиоцитах, будь то в интактном сердце, эксплантатах прекардиальной мезодермы или в культуре ткани, как показано на рисунке 1. Нити немышечного миозина II могут связывать актиновые нити, прикрепленные к z-тельцам, с образуют организованные линейные массивы, которые мы назвали премиофибриллами [7, 39], первая ступень, которая приводит к образованию зрелых миофибрилл (Figure 1).
3. Оптические методы исследования миофибриллогенеза
Флуоресцентная микроскопия флуоресцентно меченных саркомерных белков (красителей или меток GFP) позволила обнаружить сборку миофибрилл в живых клетках сердца и скелетных мышц [37, 38, 49]. Методика восстановления флуоресценции после фотообесцвечивания (FRAP) показала, что наложение на добавление вновь синтезированных белков к комплексам z-тела и Z-полосы представляет собой активный обмен между молекулами в цитоплазматическом пуле и молекулами одного и того же вида, находящимися в z- тела и Z-полосы [46, 56, 67–69].В общем, степень и половина времени обмена флуоресцентными молекулами, анализируемые с помощью методов FRAP, являются функцией связывающего взаимодействия белка в клеточном комплексе, где он сконцентрирован, причем более короткое время восстановления указывает на более низкое сродство [70]. Wang et al. [46] продемонстрировали, что семь различных белков Z-полосы обмениваются независимо друг от друга и что обмен не зависит от синтеза белка и молекулярной массы. Кроме того, динамика тех же белков в z-тельцах премиофибрилл была снижена в Z-полосах зрелых миофибрилл.Было высказано предположение, что это снижение связано с включением дополнительных белков в формирование Z-полосы (рис. 1; [46]). Эти наблюдения были распространены на клетки скелетных мышц у живых рыбок данио [56], где отслеживались пять различных Z-полос (актин, альфа-актинин, FATZ, миотилин и телетонин). Их порядок обмена был подобен обмену тех же белков в культивируемых клетках скелетных мышц перепела, что указывает на то, что поведение в условиях культивирования было сравнимо с поведением в клетках живого животного.Рисунки 3 и 4 представляют собой примеры этого процесса обмена в клетках скелетных мышц по бокам рыбок данио с использованием YFP-миотилина. Модель премиофибрилл с ее постулатами о трех стадиях образования миофибрилл предполагает механизмы репозиции молекул, когда премиофибриллы трансформируются в зрелые миофибриллы в течение нескольких часов [7, 38]. Обмен молекулами в формирующиеся миофибриллы и из них может позволить эту трансформацию (Рис. 1).
Хотя флуоресцентная микроскопия широко используется для изучения колокализации белков в клетках, предел разрешения микроскопии в видимом свете составляет порядка 200 нм, что намного больше, чем шкала длины межбелковых связей.В последние годы появилась техника визуализации с флуоресцентным резонансным переносом энергии (FRET) как способ улучшить разрешение обычной световой микроскопии [10, 71]. FRET был назван «спектроскопической линейкой», потому что с помощью соответствующей теории можно сделать вывод о расстоянии между донором и акцептором из полученных сигналов FRET в фиксированных и живых клетках. Обычно измеримые сигналы FRET возникают только тогда, когда донор и акцептор находятся в пределах 10 нм друг от друга.По мере развития технологии флуоресцентной визуализации растет интерес к использованию FRET для картирования меж- и внутримолекулярных взаимодействий в клетках. Стаут и др. [8] использовали методы FRET на живых клетках скелетных мышц, чтобы продемонстрировать, что существуют перестройки молекул альфа-актинина и FATZ, когда z-тела сливаются и перестраиваются с образованием Z-полос. Эти результаты FRET подтверждают интерпретацию экспериментов FRAP во время миофибриллогенеза [46] и модель премиофибрилл (Рисунок 1). Текущее развитие микроскопов, которые нарушают дифракционный предел света [72], должно раскрыть дальнейшее понимание расположения белковых сетей в миофибриллах и изменений, которым они подвергаются в процессах сборки и разборки.
Таким образом, наша цель состоит в том, чтобы понять, как миофибриллы собираются, реконструируются и поддерживаются (Рисунки 1 и 3). Мы используем белки дикого типа и мутировавшие саркомерные белки для исследования сборки (конфокальный и деконволюционный микроскопы), динамики и ремоделирования (FRAP) и взаимодействий (FRET) белков в миофибриллах в живом состоянии. Стандартные анализы биохимического связывания будут использоваться для подтверждения недавно выявленных взаимосвязей FRET, обнаруженных в живых мышечных клетках. Мы также сможем проверить идею о том, что миофибриллогенез имеет один и тот же путь и молекулярные саркомерные взаимодействия, независимо от того, происходит ли сборка в культуре ткани или у живого животного, такого как рыбки данио.Другими словами, мы предполагаем, что миофибриллогенез является фундаментально консервативным процессом, сравнимым с синтезом белка, митозом или цитокинезом, независимо от того, исследовали ли in situ или in vitro .
Выражение признательности
Эта работа была поддержана грантами NIH Жану М. Сэнгеру и Джозефу В. Сэнгеру.
Структура и функции волокон скелетных мышц
Каждое волокно скелетных мышц представляет собой клетку скелетных мышц. Внутри каждого мышечного волокна находится миофибриллы, длинных цилиндрических структур, которые лежат параллельно мышечному волокну.Миофибриллы проходят по всей длине мышечного волокна. На своих концах они прикрепляются к плазматической мембране, называемой колеммой sa, r , , так что по мере укорачивания миофибрилл сокращается вся мышечная клетка (рис. 16.18).
Рис. 16.18 Волокно скелетных мышц окружено плазматической мембраной, называемой сарколеммой, с цитоплазмой, называемой саркоплазмой. Мышечное волокно состоит многих фибрилл, упакованных в упорядоченные единицы.Упорядоченное расположение белков в каждой единице, показанное красными и синими линиями, придает клетке полосатый вид.
Поперечно-полосатый вид ткани скелетных мышц является результатом повторяющихся полос белков актина и миозина, которые встречаются по длине миофибрилл.
Миофибриллы состоят из более мелких структур, называемых миофиламентами . Существует два основных типа миофиламентов: толстые нити и тонкие нити.Толстые нити состоят из белка миозина. Основным компонентом тонких филаментов является белок актин.
Толстые и тонкие волокна чередуются друг с другом в структуре, называемой , , , , , , , , , . Саркомер — это единица сокращения мышечной клетки. Сокращение стимулируется электрохимическим сигналом от нервной клетки, связанной с мышечным волокном. Чтобы мышечная клетка сократилась, саркомер должен укорачиваться.Однако толстые и тонкие нити не укорачиваются. Вместо этого они скользят друг по другу, заставляя саркомер укорачивайте, пока нити остаются той же длины. Скольжение достигается, когда молекулярное расширение миозина, называемое миозиновой головкой, временно связывается с актиновой нитью рядом с ней. и, изменяя конформацию, изгибается, таща две нити в противоположных направлениях. Затем миозиновая головка высвобождает актиновую нить, расслабляется, а затем повторяет процесс, перетаскивая две нити дальше друг от друга.Комбинированная активность многих участков связывания и повторяющиеся движения внутри саркомера заставляют его сокращаться. Скоординированные схватки многих саркомеры в миофибрилле приводят к сокращению всей мышечной клетки и, в конечном итоге, самой мышцы. Движение головки миозина требует АТФ, который обеспечивает энергию для сокращение.
Посмотрите эту анимацию (http://openstaxcollege.org/l/skeletal_muscl2) , чтобы увидеть как устроены мышечные волокна.
.
 Полоса М имеет длину 150 нм, в не заходят
«тонкие» нити актина.
Полоса М имеет длину 150 нм, в не заходят
«тонкие» нити актина. Актин значительно
ускоряется АТФ-азную активность
миозина, в результате весь АТФ
гидролизует до АДФ и Фн.
Актин значительно
ускоряется АТФ-азную активность
миозина, в результате весь АТФ
гидролизует до АДФ и Фн. А. и Рис, Дж. Б. (2005). Биология, 7-й. редактор Глава 49. Сан-Франциско, Калифорния: Бенджамин Каммингс. ISBN: 0-8053-7171-0.
А. и Рис, Дж. Б. (2005). Биология, 7-й. редактор Глава 49. Сан-Франциско, Калифорния: Бенджамин Каммингс. ISBN: 0-8053-7171-0.