Сухожилия и связки
Высокий риск травмы
- Сухожилия
Мышечные волокна переходят в сухожилия, которые прочно прикрепляются к костям и являются промежуточным звеном в передаче мышечного усилия. Сухожилия состоят из множества тончайших волокон особого типа коллагена, что делает очень прочными и практически нерастяжимыми. - Влагалище сухожилия
Некоторые сухожилия имеют специальную оболочку, которая называется влагалище сухожилия. Внутри влагалища находится особая жидкость, уменьшающая трение сухожилия при движении. Сухожилия окружены влагалищами в местах, где они меняют направление и/или перекидываются через костные выступы, т.к. в местах наибольшей нагрузки. - Связки
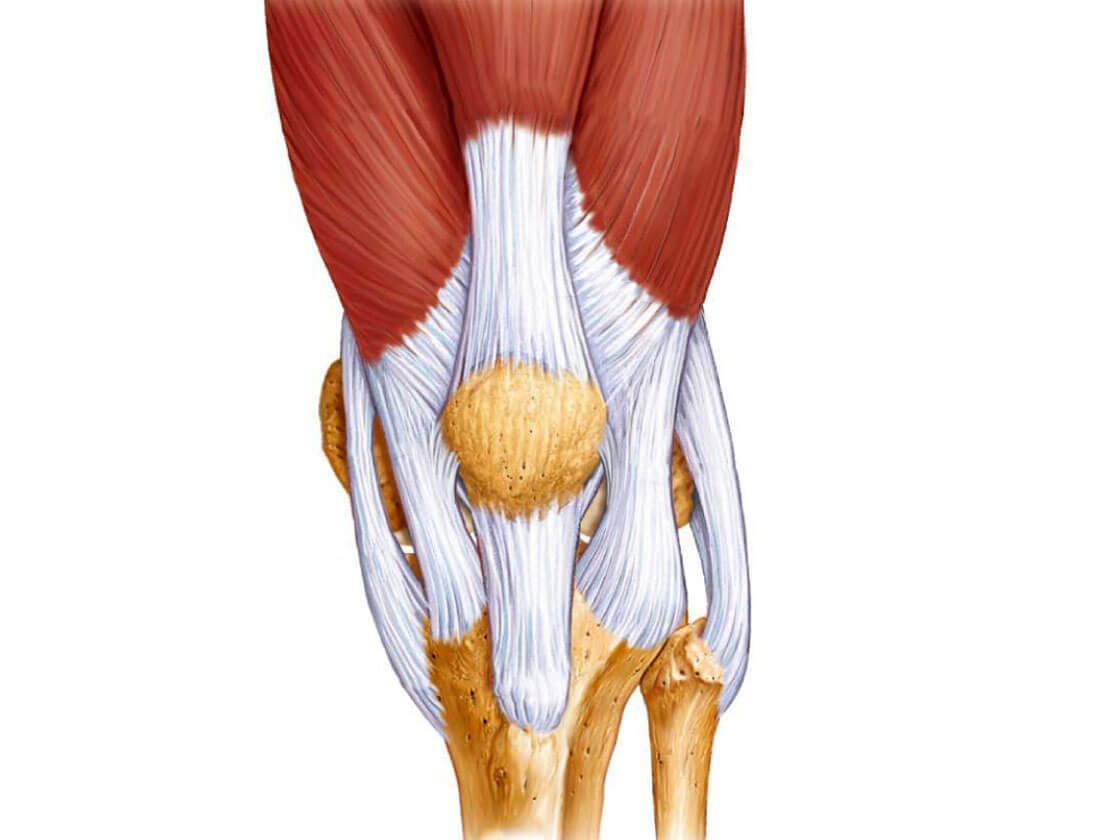
Кости, образующие суставы, соединены с помощью связок. Связка представляет собой пучок плотной фиброзной ткани, который стабилизирует сустав.
Повреждение связок коленного сустава является наиболее распространенной спортивной травмой. Повреждение связок происходит в результате прямой или непрямой травмы. Пример прямой травмы – это удар, непрямой – разрыв связок при подвороте ноги.
Повреждение связок голеностопного аппарата также часто происходит во время занятий спортом. Наиболее частой причиной является быстрый перенос тяжести на стопу, отклоненную от оси нижней конечности, т.е. в момент касания земли создаются условия для подвывиха или вывиха стопы.
Здоровый образ жизни
Узнайте о том, какой вид спорта подходит вам больше всегоСпорт и отдых
Сухожилия, связки — Справочник химика 21
Ф кции соединительной ткани 1) опорная (соединительная) — хрящевая, костная ткани, сухожилия, связки 2) барьерная (защитная).
Аскорбиновая кислота (витамин С) является участником многих окислительно-восстановительных реакций. В частности, аскорбиновая кислота принимает участие в реакциях гидроксилирования. В организме путем гидроксилирования происходит включение атомов кислорода в синтезируемые вещества. Таким синтезом является образование коллагена — самого распространенного белка организма. Выще отмечалось, что в процессе синтеза коллагена вначале образуется его предшественник — проколлаген, содержащий в больщом количестве аминокислоты лизин и пролин. Затем эти аминокислоты, находящиеся в составе проколлагена, подвергаются гидроксилированию и превращаются соответственно в оксилизин и оксипролин, что приводит к переходу проколлагена в коллаген.
 Это окисление протекает с участием аскорбиновой кислоты — витамина С. Учитывая широкое распространение коллагена в организме, его присутствие в связках, сухожилиях, участие в процессе мышечной релаксации, можно полагать, что введение в организм дополнительного количества витамина С должно вызывать повышение мышечной работоспособности. Гидроксилирование с участием аскорбиновой кислоты еще встречается при синтезе гормонов надпочечников — адреналина и кортикостероидов, выделяющихся при выполнении физических нагрузок и вызывающих благоприятные для мышечной деятельности изменения в организме на биохимическом и физиологическом уровнях. [c.211]
Это окисление протекает с участием аскорбиновой кислоты — витамина С. Учитывая широкое распространение коллагена в организме, его присутствие в связках, сухожилиях, участие в процессе мышечной релаксации, можно полагать, что введение в организм дополнительного количества витамина С должно вызывать повышение мышечной работоспособности. Гидроксилирование с участием аскорбиновой кислоты еще встречается при синтезе гормонов надпочечников — адреналина и кортикостероидов, выделяющихся при выполнении физических нагрузок и вызывающих благоприятные для мышечной деятельности изменения в организме на биохимическом и физиологическом уровнях. [c.211] Белки соединительной ткани. Соединительная ткань (сухожилия, связки, органическая часть костей, хрящи, подкожная клетчатка, роговица глаза и др.) выполняет строительную и опорную функции, объединяет клетки в определенные структуры, придает им прочность и эластичность, что играет большую роль в мышечной деятельности. Основными ее компонентами являются белки коллаген и эластин.
В результате применения метода меченых атомов выявлена исключительная динамичность белковых веществ. Белки, больше чем какие-либо иные вещества, подвергаются в организме обновлению, распаду и синтезу. Далее было установлено, что постоянному обновлению в известной мере подвергаются составные части таких, казалось бы, инертных образований, как сухожилия, связки, зубная эмаль и др. Все эти данные в значительной мере расширили наши представления об обмене веществ между организмами и окружающей их средой и поставили перед исследователями ряд новых проблем. [c.12]
Суставы пальцев рук Связки, сухожилия [c.305]
Наибольшую группу имплантатов составляют ортопедические устройства — искусственные суставы, связки, сухожилия и т. д. Использование в этой области полимерных материалов позволило значительно повысить их качество, так как применявшиеся ранее металлы вызывали у пациентов нежелательные реакции, нарушение метаболизма и распад окружающих тканей. [c.305]
[c.305]
Белковое вещество сухожилий и связок носит название эластина. Особенно много эластина содержит, например, выйная связка. Этот протеи-ноид несколько легче поддается действию пищеварительных соков, чем коллаген. [c.52]
Эластин содержится в сухожилиях и соединительной ткани. Особенно много его в шейных связках. [c.218]
При замещении сухожилия или его пересадке мы многократно применяли перлоновую тесьму. Этот же метод мы применяем для пластики крестовидных связок коленного сустава здесь вместо сухожилия мы применяем для восстановления крестовидной связки тонкую перлоновую тесьму, протянутую через наружный мыщелок. Перлоновая ткань предохраняет от опасности отторжения или рассасывания, что наблюдается при применении полосок из широкой связки бедра или других материалов. [c.47]
Структурные белки Коллаген Кератин Эластин Белки оболочки вирусов Компонент соединительной ткани, костей, сухожилий, хряща Кожа, перья, ногти, волосы, рога Эластическая соединительная ткань (связки) Обертка нуклеиновой кислоты вируса [c. 131]
131]
Связки, сухожилия и мышцы являются важнейшими элементами, участвующими в креплении и перемещении частей организма. [c.159]
Искусственные сухожилия и связки [c.498]
Результат идентификации поврежденного гена несколько удивителен, поскольку коллаген типа I, компонентом которого является продукт данного гена, обнаруживается главным образом в коже, сухожилиях, костях, связках и внутренних органах. Основным коллагеном в кровеносных сосудах является коллаген типа III (см. МБК, табл. 14-3). По-видимому, коллаген типа [c.496]
Эластин обнаруживается в большинстве типов соединительной ткани наряду с коллагеном и полисахаридами.
Глютиновые клеи. Основное сырье в этих клеях — коллаген. Дословно по-гречески коллаген означает рождающий клей, так как колло — клей. Коллаген входит в состав коллагеновых волокон соединительных тканей сухожилиях, связках, хрящах, а также в коже и костях. При нагревании в воде при 80—90 °С коллаген постепенно превращается в глютин (в быту он больше известен под названием желатин). Разбавленные кислоты значительно ускоряют процесс варки. Бульон также разливают, охлаждают, разрезают на пластины и сушат.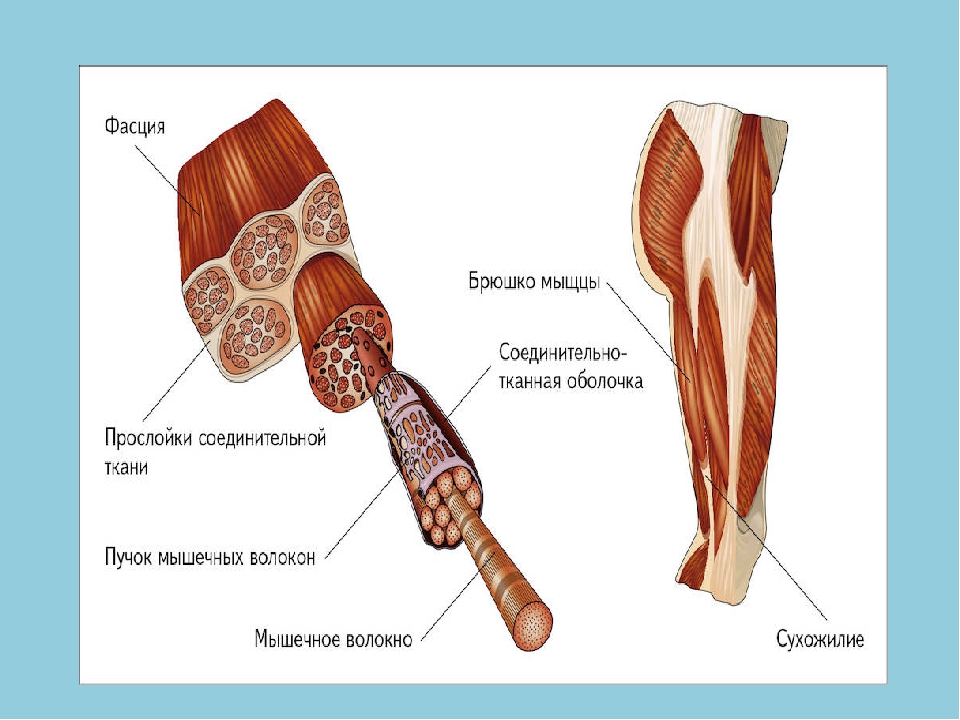
Соединительная ткань состоит из межклеточных элементов, вьшолняющих структурные и опорные функции на ее долю приходится значительная часть всего органического вещества, содержащегося в теле высших животных. Сухожилия, связки, хрящи и органический матрикс костей-это наиболее знакомые нам элементы соединительной ткани. Соединительная ткань окружает кровеносные сосуды, образует важную в структурном отношении подкожную клетчатку, связьшает между собой клетки отдельных тканей и заполняет пространство между клетками так называемым основным веществом. Существуют три главных молекулярных компонента соединительной ткани два фибриллярных белка-коллаген и эластин, которые в разных соотношениях присутствуют в большинстве соединительных тканей, и протеогликаны-семейство гибридных молекул, представляющих собой белки, ковалентно связанные с полисахаридами.
Нужно разъяснить, что основным элементом этих материалов является белок — кератин. Такой широко известный материал, как шерсть, тоже состоит из кератина. Преподаватель называет вторую группу склеропротеи-нов — кожа, кости, сухожилия, связки, хрящи, чешуя рыб, которые состоят из белка — коллагена. Третий основной тип склеропротеинов — фиброин является волокнистой составной частью натурального шелка. [c.145]
Каждую секунду в нашем организме погибает около трех миллионов красных кровяных телец. Можно сказать и иначе каждую секунду в нем рождается три миллиона новых эритроцитов, ибо организм непрерывно мобилизует свои резервы, чтобы сохранить обшее число эритроцитов на одном и том же уровне. Все эритроциты организма человека замещаются новыми примерно за три месяца, а жизненный цикл молекул плазмы крови занимает еще меньше времени. Этот быстрый круговорот молекул происходит не только в крови, но и в относительно плотных тканях. Отложения жира, которые когда-то считали складами для хранения запасов пищи, в сущности, больше напоминают магазины в период предпраздничной бойкой торговли. В них кипит непрерывная деятельность, непрерывные процессы распада и синтеза, тонко уравновешивающие друг друга, так что к исходу нескольких месяцев старые запасы жира полностью обновляются. То же происходит и в соединительной ткани, сухожилиях и связках, стенках сосудов и мышцах. Быстрые изменения происходят даже в костях, где в процессе непрерывного обмена разбиваются и вновь возникают звенья молекулярных цепей. [c.166]
В них кипит непрерывная деятельность, непрерывные процессы распада и синтеза, тонко уравновешивающие друг друга, так что к исходу нескольких месяцев старые запасы жира полностью обновляются. То же происходит и в соединительной ткани, сухожилиях и связках, стенках сосудов и мышцах. Быстрые изменения происходят даже в костях, где в процессе непрерывного обмена разбиваются и вновь возникают звенья молекулярных цепей. [c.166]
В систему соединительной ткани объединяются весьма различные ПО строению и предназначению ткани. Обычно выделяется рыхлая неоформленная и плотная оформленная соединительная ткань. К первому типу относится подкожная клетчатка, межорганные прослойки, межмышечные фасциальные прослойки, строма паренхиматозных органов. Ко второму типу относятся дермальный слой кожи, сухожилия, связки, плотные фасции и апоневрозы, наружные капсулы внутренних органов, костная ткань, хрящевая ткань всех видов (суставные хрящи, межпозвонковые диски, реберные хрящи, мениски, хрящи гортани, носа, ушной раковины, слухового аппарата), фиброзные капсулы суставов, кла паны сердца, кровеносные сосуды.
 К специальным видам соединительной ткани относят также синовиальные и серозные оболочки, под слизистый слой стенки полых органов, дентин, пульпу и эмаль зуба, роговицу, склеру и стекловидное тело глаза, базальные мембраны сосудов и эпителия, систему нейроглии головного мозга. В условиях патологии образуются и другие виды соединительной ткани грануляционная и рубцовая ткань, костная мозоль, фиброзная ткань при склерозе и циррозе органов, отложения гналина, амилоида. [c.5]
К специальным видам соединительной ткани относят также синовиальные и серозные оболочки, под слизистый слой стенки полых органов, дентин, пульпу и эмаль зуба, роговицу, склеру и стекловидное тело глаза, базальные мембраны сосудов и эпителия, систему нейроглии головного мозга. В условиях патологии образуются и другие виды соединительной ткани грануляционная и рубцовая ткань, костная мозоль, фиброзная ткань при склерозе и циррозе органов, отложения гналина, амилоида. [c.5] По-видимому, специализированных структур межклеточного матрикса не меньше, чем фенотипически различающихся клеток и разных органов. Например, соединительная ткань в роговице глаза обеспечивает ее прозрачность, в структурах уха — восприятие звука, в коже, сухожилиях, связках — прочность, в хрящах суставных поверхностей — рессорные свойства, в легких — эластичность. В мышцах межклеточный матрикс окружает мышечные волокна, соединяя их вместе в функциональную анатомическую единицу, и служит для передачи силы сокращения мышцы. [c.444]
[c.444]
Коллаген, наиболее широко распространенный белок в организме, составляющий большую часть органической массы кожи, сухожилий, кровеносных сосудов, костей, роговицы и стекловидного тела глаз, а также мембран. Близкий по свойствам белок эластин был обнаружен в эластичных фибрилах соединительных тканей, содержащихся в связках и в стенках кровеносных сосудов. Коллаген синтезируется фиброб-ластами и выделяется в межклеточное пространство, где он полимери-зуется, образуя прочный долгоживущий материал [38а]. Внутриклеточный предшественник коллагена — проколлаген, так же как и зрелый коллаген (гл. 2, разд. Б, 3,в), содержит три цепи. Основная же форма коллагена в большинстве тканей большинства видов (коллаген I) содержит две а1(1)-цепи и одну а2-цепь, в связи с чем его обозначают как [а1(1)]2а2. Коллаген хрящей (коллаген II) содержит три а -це-пи и обозначается как [а1(П)]з. Коллаген III, обнаруживаемый в различных тканях, особенно эмбрионов, имеет строение [а1(1И)]з [38Ь]. [c.497]
[c.497]
Эластин, эластичность которого сходна с эластичностью каучука, образует волокнистую ткань артерий и некоторых сухожилий, например выйной связки быка (связка nu hae она содержит, однако, и коллагеновое волокно). Эластин не превращается в желатину при кипячении с водой и переваривается трипсином. Подобно коллагену, волокна эластина состоят из простых аминокислот, главным образом из лейцина, гликоколя и пролина, и не содержат оксипролина, аланина, дикарбоновых аминокислот, триптофана и гистидина. [c.451]
Многие белки образуют волокна, навитые друг на друга или уложенные плоским слоем они вьшолняют опорную или защитную функцию, скрепляя биологические структуры и придавая им прочность. Главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий очень высокую прочность на разрыв. Выделанная кожа представляет собой почти чистый коллаген. Связки содержат элаетин-струк- [c.139]
М у к о и д ы встречаются в различных тканях и носят соответственно названия хондромукоиды (из хряща), остеомукоиды (из костей), овомукоиды (из яичного белка). Мукоиды находятся также в связках и сухожилиях. [c.68]
Мукоиды находятся также в связках и сухожилиях. [c.68]
Хондроитинсульфат В, или дерматансульфат, вначале был выделен из кожи свиньи, а затем обнаружен в сухожилиях, клапанах сердца и аорте. Он содержится также в селезенке, мозге, выйкой связке, где составляет 50% общего количества кислых полисахаридов. Содержание дерматансульфата, по-видимому, увеличивается с возрастом. [c.165]
Строение тела животных дает многочисленные примеры использования природой физических и химических свойств разнообразных полимерных материалов. Уже были упомянуты мышцы, которые построены из связок волокон, представляющих собой одну из форм белка. Главной функцией мышц является, конечно, перевод химической энергии, полученной из пищи, в механическую работу, но поскольку мышцы обладают некоторыми эластическими свойствами каучуков, то мышечная система выполняет функции прокладки, амортизирующей удары и защищающей внутренние органы от повреждений. Клей и желатину получают из другого фибриллярного белка — коллагена, основного белка кожи. Коллаген име-л тся также в сухожилиях (связывающих мышцы со ске-о том), связках и т. д., входит он и в состав костей. Йрочность кож, которой добиваются химической обра-с боткой (дубление) шкур, обусловлена сеткой составляю- даих их коллагеновых волокон. [c.17]
Коллаген име-л тся также в сухожилиях (связывающих мышцы со ске-о том), связках и т. д., входит он и в состав костей. Йрочность кож, которой добиваются химической обра-с боткой (дубление) шкур, обусловлена сеткой составляю- даих их коллагеновых волокон. [c.17]
ГО, но достаточно мощного лука наиболее подходила для стрельбы с колесниц или для конницы. Имеются сведения [4], что монгольские луки изготавливались из большого количества различных материалов, в том числе из сухожилий животных, древесины и шелка, соединенных с помощью клея. Аналогично, стволы дамасских пушек и японские церемониальные мечи изготавливались из композиционных материалов. Природный лак, при очистке которого получают шеллак, использовался в Индии и Китае в течение нескольких тысячелетий (об этом упоминается в Веде, написанной около 1000 лет до н. э.). Этот лак животного происхождения (продукт жизнедеятельности насекомых) представляет собой сложную полимерную композицию, содержащую наряду с прочими компонентами простые и сложные полиэфиры. В Индии этот лак использовали для заполнения рукояток мечей и для изготовления точильных камней смешением его с мелким песком. Последний пример является прообразом современных шлифовальных кругов на полимерной связке. В 500-х годах до н. э. греки делали триремы (суда с тремя рядами весел), кили которых были значительно длиннее любого ствола дерева. Без сомнения, отдельные части такого судна представляли собой композиционные конструкции . Между 500 г. до н. э. и 500 г. н. э. практически не появилось никаких новых типов материалов, хотя были достигнуты большие успехи в вопросах конструирования. Другими словами, человек в это время стремился улучшить технику и экономику использования имеющихся материалов, но не искал пути и возможности их комбинирования — в противоположность современному развитию полимерного материаловедения. В настоящее время промышленность редко доводит производство новых полимеров до масштабов ПВХ или ПЭНП и значительно больше производит новые композиции на основе известных полимеров (например, вспененный ПВХ).
В Индии этот лак использовали для заполнения рукояток мечей и для изготовления точильных камней смешением его с мелким песком. Последний пример является прообразом современных шлифовальных кругов на полимерной связке. В 500-х годах до н. э. греки делали триремы (суда с тремя рядами весел), кили которых были значительно длиннее любого ствола дерева. Без сомнения, отдельные части такого судна представляли собой композиционные конструкции . Между 500 г. до н. э. и 500 г. н. э. практически не появилось никаких новых типов материалов, хотя были достигнуты большие успехи в вопросах конструирования. Другими словами, человек в это время стремился улучшить технику и экономику использования имеющихся материалов, но не искал пути и возможности их комбинирования — в противоположность современному развитию полимерного материаловедения. В настоящее время промышленность редко доводит производство новых полимеров до масштабов ПВХ или ПЭНП и значительно больше производит новые композиции на основе известных полимеров (например, вспененный ПВХ). Поэтому многие изобретения древности не могли быть реализованы из-за отсутствия требуемых материалов. Типичным примером является изобретение грека Ктесибиуса, произведшего революцию в артиллерии. Точно также бесчисленное количество насосов, рычагов, воротов, двигателей легендарного Архимеда без сомнения были бы значительно более эффективными, если бы изготавливались из более подходящих материалов. По-видимому, величайшими новаторами и перенимателями чужих идей в древности были римляне. Фактически большинство грандиозных общественных зданий [c.15]
Поэтому многие изобретения древности не могли быть реализованы из-за отсутствия требуемых материалов. Типичным примером является изобретение грека Ктесибиуса, произведшего революцию в артиллерии. Точно также бесчисленное количество насосов, рычагов, воротов, двигателей легендарного Архимеда без сомнения были бы значительно более эффективными, если бы изготавливались из более подходящих материалов. По-видимому, величайшими новаторами и перенимателями чужих идей в древности были римляне. Фактически большинство грандиозных общественных зданий [c.15]
Дерматансульфат, полисахарид, состоящий из чередующихся остатков а-ь-идопиранозилуроповой кислоты и 2-ацетамидо-2-дезокси-Р-1> галактопиранозил-4-сульфата, связанных (1 3)- и (1 4)-связями соответственно [1], был выделен из кожи свиньи [2, 3] и из легочной ткани рогатого скота [4]. Он был также обнаружен в сухожилиях, сердечном клапане, аорте [5], селезенке, мозгу и затылочной связке [3]. У больных, страдающих синдромом Гелера, болезнью, поражающей соединительную ткань человека, дерматансульфат накапливается в больших количествах в тканях и выделяется с мочой [6]. [c.350]
[c.350]
Такое эндопротезирование применяется при различных травмах и заболеваниях, например при восстановлении связок коленного и плечевого суставов, разрыве ахиллова сухожилия, сухожилий прямой мышцы бедра. При этом, хотя механические свойства материала играют важнейшую роль, большой вклад в общую прочность системы кость—связка-кость играет также метод крепления материала к кости. [c.160]
Структурная функция. Высокая упругость кожи, хрящей и сухожилий обусловлена наличием в них фибриллярного белка коллагена, а аналогичные свойства связкам придает эластин. Химический состав волос, ногтей (коггей) и перьев определяется в основном кератином. Шелковые нити и паутина построены из белка фиброина. [c.82]
Соединительная ткань пронизывает все тело позвоночных. В конечности соединительная ткань формирует кости и хрящи, сухожилия и связки, кожу, оболочк мыщц, внешние слои стенок кровеносных сосудов и оболочки нервов и промежуточную ткань, связывающую воедино все эти компоненты. Эти формы соединительной ткани образованы фибробластами и близкородственными клетками, которые погружены в обогащенный коллагеном внеклеточный матрикс, секретируемый ими. И все эти разнообразные клетки развиваются из мезенхимы недифференцированной зародышевой ткани, заполняющей зачаток эмбриональной конечности ее нроисхождение можно проследить вплоть до мезодермы боковой пластинки, соседствующей с сомитами раииих эмбрионов (см. рис. 16-15). Кроме покрывающего конечность эпидермиса, все остальные комноненты конечности являются производными популяции мигрирующих клеток, ие являющихся производными боковой пластиики Прежде чем достигнуть места назначения и принять участие в формировании структуры взрослого животного, эти клетки должны совершить длительное путешествие по эмбриональной соединительной ткани. [c.139]
Эти формы соединительной ткани образованы фибробластами и близкородственными клетками, которые погружены в обогащенный коллагеном внеклеточный матрикс, секретируемый ими. И все эти разнообразные клетки развиваются из мезенхимы недифференцированной зародышевой ткани, заполняющей зачаток эмбриональной конечности ее нроисхождение можно проследить вплоть до мезодермы боковой пластинки, соседствующей с сомитами раииих эмбрионов (см. рис. 16-15). Кроме покрывающего конечность эпидермиса, все остальные комноненты конечности являются производными популяции мигрирующих клеток, ие являющихся производными боковой пластиики Прежде чем достигнуть места назначения и принять участие в формировании структуры взрослого животного, эти клетки должны совершить длительное путешествие по эмбриональной соединительной ткани. [c.139]
I [al(I)],a2(I) Фибрилла Мало гидроксилизи-на, мало углевода, толстые фибриллы Кожа, сухожилия, кости, связки, роговица, внутренние органы (составляет 90% все- [c. 222]
222]
Одним из протеолитических ферментов, получаемых в промышленных количествах, является коллагеназа lostridium histolyti um. Субстратом коллагеназы служат коллаген-белковая основа коллагеповых волокон соединительной ткани (сухожилия, сетчатый слой кожи, хрящи, связки). Пепсин, химотрипсиы, трипсин, проназа отщепляют концевые пептидные группы коллагена, но не действуют на нативный коллаген. [c.366]
Биомеха,н и ческая (опорная) функция является важнейшей для соединительной тка НИ. Из этой ткани состоит скелет (кости, хрящи, связки, сухожилия), играющий роль каркаса тела и обеспечивающий вместе с мышечной системой двигательную способность. Кроме того, соединительная ткань образует каркас внутренних органов, связывая между со бой их отдельные структурные элементы, а также сами эти органы, стабилизируя их положение и защищая от механических повреждений. [c.7]
Соединительная ткань, подобно любой ткани, наряду с межклеточным веществом содержит клетки, главными из которых являются фибробласты и их разновидности (остеобласты, хондробласты, кератобласты и др.). Клетки соединительной ткани не связаны с базальными мембранами они покоятся или мигрируют непосредственно в толще межклеточного вещества. Соединительную ткань отличают от других тканей большие промежутки между клетками и, соответственно, большое количество межклеточного вещества. Более 80 % всего коллагена тела находится в коже, костях, связках, сухожилиях, хрящах. Поэтому основные компоненты межклеточного матрикса были впервые обнаружены именно в соединительной ткани и долгое время считались характерными только для этой ткани. [c.433]
Восстановление (регенерация) хрящевой ткани суставов
Структура ФункцииПричиныСимптомыЛечениеПрепараты
Хрящевая ткань присутствует во многих органах, но наибольшим нагрузкам она подвергается в суставах. Хрящ покрывает уязвимые участки костей в суставах и обеспечивает амортизацию, а также устойчивость к нагрузкам, благодаря чему мы даже не задумываемся, какие испытания выпадают на долю суставов в жизни обычного человека, не говоря уже о категориях людей, подвергающих свой организм чрезмерным нагрузкам. К сожалению, хрящ со временем может разрушаться в силу различных причин, что приводит к ограничению движений в суставах, болям и дискомфорту. Поэтому так важно вовремя предпринимать необходимые меры для восстановления хрящевой ткани суставов.
Структура хрящевой ткани
Хрящ — это разновидность соединительной ткани, и в организме существует три его вида:
- Гиалиновый (стекловидный) — имеет голубоватый цвет, с высоким содержанием тонких волокон коллагена, покрывает суставные поверхности костей;
- Эластический (сетчатый) — отличается повышенной упругостью и гибкостью, в нем преобладают волокна эластина, он формирует мелкие бронхи, ушные раковины;
- Волокнистый — соединяет сухожилия и связки с гиалиновым хрящом суставной поверхности.
Как и любая ткань, хрящевая состоит из клеток и межклеточного вещества (матрикса), доля последнего в ней значительно преобладает. Матрикс содержит много воды, которая не сжимается, не растягивается, при этом свободно циркулирует в межклеточном пространстве. Именно вода обеспечивает высокую упругость хрящевой ткани, распределяя нагрузки и амортизируя. Еще один важный компонент матрикса — белковые волокна: коллагеновые и эластические. В гиалиновом хряще суставных поверхностей преобладает коллаген, обеспечивающий высокую прочность. Его крупные молекулы, закрученные в тройную спираль, устойчивы к любым деформациям и быстро возвращаются в исходное состояние. Также матрикс содержит глюкозаминогликаны, протеогликаны, гиалуроновую кислоту, которые удерживают воду и участвуют в обменных процессах.
Клетки хряща — хондроциты и их молодые формы хондробласты — играют не менее важную роль: синтезируют все компоненты матрикса и суставной жидкости. Хондроцитов очень мало, всего 1-5%, но именно на них лежит задача по обновлению и восстановлению хряща.
Одно из главных отличий хрящевой ткани – отсутствие сосудов. Как следствие, хрящи должны получать питание альтернативным способом. Синовиальная, или суставная, жидкость снижает трение между суставными поверхностями и обеспечивает питание хрящевой ткани. Поэтому доставку питательных веществ и выведение продуктов распада обеспечивает синовиальная жидкость.
Функции хрящевой ткани
Какие функции выполняет хрящевая ткань в суставах:
- Амортизация: перераспределение всех видов нагрузок (сжатие, растяжение) с преобразованием их в максимально физиологичные;
- Защита: хрящ устойчив к механическим повреждениям, синовиальная жидкость и гладкая поверхность препятствуют износу суставов даже при постоянных движениях и больших нагрузках;
- Соединение сухожилий и связок с суставной поверхностью.
Причины разрушения хрящевой ткани
Хрящ в суставах подвергается значительным нагрузкам, и в определенных обстоятельствах он не выдерживает: начинает разрушаться. Особенно, если в организме происходят изменения, снижающие его регенеративные способности. В этом случае развивается остеоартрит — заболевание, вызванное дистрофическими изменениями или разрушением хрящевой и костной тканей суставов. Раньше использовалось еще одно название данного состояния — остеоартроз, подчеркивающее возрастной характер изменений. Но, так как на фоне разрушения костно-хрящевых структур неизбежно развиваются воспалительные процессы, и именно они вызывают характерные симптомы, сейчас преимущественно используется термин «остеоартрит», а согласно международной классификации болезней (МКБ-10) оба эти диагноза считаются синонимами. В отношении дистрофических изменений, связанных с разрушением хрящевой и костной тканей позвоночника, принято использовать термин «остеохондроз».
Причины разрушения хрящевой ткани разнообразны:
Слушать (1 951 Кб): Плотная волокнистая соединительная тканьПлотные волокнистые соединительные ткани (textus connectivus collagenosus compactus) характеризуются относительно большим количеством плотно расположенных волокон и незначительным количеством клеточных элементов и основного аморфного вещества между ними. В зависимости от характера расположения волокнистых структур эта ткань подразделяется на плотную неоформленную и плотную оформленную соединительную ткань. Плотная неоформленная соединительная ткань характеризуется неупорядоченным расположением волокон (как, например, в нижних слоях кожи). В плотной оформленной соединительной ткани расположение волокон строго упорядочено и в каждом случае соответствует тем условиям, в каких функционирует данный орган. Оформленная волокнистая соединительная ткань встречается в сухожилиях и связках, в фиброзных мембранах. Сухожилие (tendo)Сухожилие состоит из толстых, плотно лежащих параллельных пучков коллагеновых волокон. Между этими пучками располагаются фиброциты и небольшое количество фибробластов и основного аморфного вещества. Тонкие пластинчатые отростки фиброцитов входят в промежутки между пучками волокон и тесно соприкасаются с ними. Фиброциты сухожильных пучков называются сухожильными клетками — тендиноцитами. Каждый пучок коллагеновых волокон, отделенный от соседнего слоем фиброцитов, называется пучком первого порядка. Несколько пучков первого порядка, окруженных тонкими прослойками рыхлой волокнистой соединительной ткани, составляют пучки второго порядка. Прослойки рыхлой волокнистой соединительной ткани, разделяющие пучки второго порядка, называются эндотенонием. Из пучков второго порядка слагаются пучки третьего порядка, разделенные более толстыми прослойками рыхлой соединительной ткани — перитенонием. Иногда пучком третьего порядка является само сухожилие. В крупных сухожилиях могут быть и пучки четвертого порядка. В перитенонии и эндотенонии проходят кровеносные сосуды, питающие сухожилие, нервы и проприоцептивные нервные окончания, посылающие в центральную нервную систему сигналы о состоянии натяжения ткани сухожилий. Некоторые сухожилия в местах прикрепления к костям заключены во влагалища, построенные из двух волокнистых соединительнотканных оболочек, между которыми находится жидкость (смазка), богатая гиалуроновой кислотой. Фиброзные мембраныК этой разновидности плотной волокнистой соединительной ткани относят фасции, апоневрозы, сухожильные центры диафрагмы, капсулы некоторых органов, твердую мозговую оболочку, склеру, надхрящницу, надкостницу, а также белочную оболочку яичника и яичка и др. Фиброзные мембраны трудно растяжимы вследствие того, что пучки коллагеновых волокон и лежащие между ними фибробласты и фиброциты располагаются в определенном порядке в несколько слоев друг над другом. В каждом слое волнообразно изогнутые пучки коллагеновых волокон идут параллельно друг другу в одном направлении, не совпадающем с направлением в соседних слоях. Отдельные пучки волокон переходят из одного слоя в другой, связывая их между собой. Кроме пучков коллагеновых волокон, в фиброзных мембранах есть эластические волокна. Такие фиброзные структуры, как надкостница, склера, белочная оболочка яичка, капсулы суставов и др., характеризуются менее правильным расположением пучков коллагеновых волокон и большим количеством эластических волокон по сравнению с апоневрозами. Некоторые термины из практической медицины:
|
Как прыгать выше, бегать быстрее и достигать максимальных результатов. Nike RU
«Представьте, что фасция — это динамический, непрерывный рулон пластиковой обертки, которая разбивает, разделяет по сегментам, направляет движения и позволяет рассматривать совокупность мышц, нервов, кровеносных сосудов и органов не как случайный набор, а как единое целое», — объясняет Ребекка Пратт, доктор наук, профессор анатомии Медицинской школы Уильяма Бомонта Оклендского университета. «К фасции также относятся сухожилия, суставные капсулы, связки и внутримышечные соединительные ткани», — говорит Роберт.
Он поясняет: «Сухожилия состоят из волнообразных гофрированных волокон. Чем больше волокон в сухожилии, тем больше энергии оно может сохранить». Рассмотрим, например, бег. Когда стопа ударяется о землю, нагрузка на ахиллово сухожилие приводит к временному выпрямлению волокон в сухожилии для сохранения кинетической энергии. При отталкивании от земли волокна притягивают к себе сухожилие, высвобождая силу для движения вперед. Чем выше способность сухожилия сохранять энергию, тем больше энергии доступно для движения.
«Исследования животных показывают, что после трех месяцев регулярных беговых тренировок объем волокон сухожилий увеличивается», — говорит Роберт. Это означает, что подобно тому, как силовые тренировки со временем увеличивают размер мышц, можно увеличить количество волокон сухожилий и, следовательно, способность фасции обеспечивать энергию для движения.
И бег — это не единственный способ улучшить емкость кинетической энергии фасции. «Люди, которые занимаются плиометрикой [упражнениями с прыжками], обучают свои мышцы сокращаться меньше при более эффективном сохранении энергии», — говорит Роберт. Это связано с тем, что при прыжке или подскоке фасция быстро удлиняется и сокращается, наращивая волокна. Согласно исследованиям, после трех месяцев регулярных плиометрических тренировок (которые обычно проводят не реже одного раза в 48 часов) сухожилия наращивают волокна для большей отдачи энергии. Даже несколько серий прыжков «пого» по 10 секунд несколько раз в неделю могут улучшить работу фасции.
Вот еще три других способа, как увеличить объем волокон и сохранить здоровье фасции.
Связки и сухожилия
Связки и сухожилия
Обеспечивают на возможность поддерживать наше тело и двигаться. Вместе с костями, мышцами и суставами они образуют опорно-двигательный аппарат человека. Без связок и сухожилий мы не имели бы возможности двигаться.
В чем различие между связками и сухожилиями?
Связки служат для соединения костей, а сухожилия – для соединения кости и мышцы.
Как функционируют сухожилия? Сухожилия состоят из компактных пучков коллагеновых волокон, по своей структуре отдаленно напоминают канат. Вопреки широко распространенному мнению, они могут растягиваться на 10-15% структуры ткани. В ненагруженном состоянии они расположены слегка волнисто и смягчают передачу мышечных усилий костям.
Чтобы передать мышечное усилие неподвижному по своей сути скелету и привести его в движение, сухожилия срощены одним концом с мышечными волокнами, а другим – соединены с костями.
В некоторых местах – например, на запястье – они пролегают под углом и подвержены высокому натяжению. Чтобы при движении избежать сильного трения между сухожилием и костью, они защищаются структурами ткани со своего рода защитной смазкой.
Когда мы двигаемся, вначале сокращаются мышцы. Затем этот импульс передается сухожилиям, которые – подобно веревочкам, которыми приводится в движение кукла-марионетка – передают движение костям. Как результат мы можем, например, поднять ногу или сжать пальцы руки в кулак.
Как функционируют связки? В то время, как сухожилия служат для передачи мышечных усилий костям и делают нас подвижными, задача связок – стабилизировать и поддерживать суставы. Связки это плотные образования из соединительной ткани, скрепляющие между собой части скелета (кости). Состоят в основном из колагена. Они не являются эластичными, могут растягиваться и даже рваться. Но связки и должны быть такими, т.к. они стабилизируют наши суставы как изнутри, так и снаружи и ограничивают их подвижность до некой функционально разумной степени. Таким образом они защищают мышцы и сухожилия от растяжения. Какие проблемы могут возникнуть?
Повреждения связок могут произойти как при занятиях спортом, так и в быту и являются, в первую очередь, следствием неудачных движений. Если связки неестественно сильно растягиваются, например, когда мы подворачиваем ногу, они могут повредиться. К типичным спортивным травмам относятся растяжение и разрыв связок. Повреждение связок, если не лечить, может иметь далеко идущие последствия. Суставы могут оставаться длительное время нестабильными, и , как следствие, это может привести к новым травмам и повреждениям.
Когда говорим о повреждениях связок, часто имеем в виду их разрыв. Может иметь место травма (повреждение связок острым режущим предметом). Часто связки рвутся от их резкого и сильного натяжения. Так называемый разрыв сухожилия может произойти при игровых видах спорта,, например — с мячом. Если связка полностью разорвана, то, тем самым, разрушено соединение мышцы с костью, что существенно ограничивает подвижность. Зачастую не обойтись без операции.
Менее драматично тендовагинит. Если связка в течении длительного времени односторонне либо чрезмерно нагружена, она может болезненно воспалиться. Часто это происходит в местах крепления связки.При этом каждое движение вызывает боль. Тендовагинит на суставе кисти (запястье) является типичным заболеванием офисных сотрудников.
Сидячая работа в комбинации с недостатком движения или однобокая перенагрузка приводит к возникновению слабых мест. Если длительное время ничего не предпринимать, то чрезмерно растянутые связки в комбинации с укороченными сухожилиями могут, точно так же, как и в случае перенапряжения мышц, привести к болям и проблемам спины.
Как в повседневной жизни можно оздоровить связки и сухожилия?
Помимо регулярных занятий физкультурой и фитнесом можно и в повседневной жизни принести немало пользы для своего тела в целом, в т.ч. и для связок + сухожилий. Избежание поз с неправильной осанкой и частая смена позиций во время сидения помогают укрепить мускулатуру, стабилизировать суставы и, тем самым, — уменьшить нагрузку на связки. Тренировка удержания равновесия и координации также полезна, т.к. улучшает «сыгранность» мускулатуры в движении.
Активно-динамические стулья от aeris способствуют интуитивным и естественным движениям тела и всячески стимулируют и поддерживают их. swopper и 3Dee например являются трехмерно-подвижными и непрерывно подстраиваются под все естественные движения сидящего. Благодаря активно-динамическому стилю сидения суставы постоянно подвижны. Это поддерживает в тонусе связки и сухожилия, предотвращает преждевременный износ суставов. Тем самым вы автоматически вносите хороший вклад в укрепление собственного здоровья.
Соединительная ткань — это… Что такое Соединительная ткань?
Соедини́тельная ткань — это ткань живого организма, не отвечающая непосредственно за работу какого-либо органа или системы органов, но играющая вспомогательную роль во всех органах, составляя 60—90 % от их массы. Выполняет опорную, защитную и трофическую функции. Соединительная ткань образует опорный каркас (строму) и наружные покровы (дерму) всех органов. Общими свойствами всех соединительных тканей является происхождение из мезенхимы, а также выполнение опорных функций и структурное сходство.
Большая часть твёрдой соединительной ткани является фиброзной (от лат. fibra — волокно): состоит из волокон коллагена и эластина. К соединительной ткани относят костную, хрящевую, жировую и другие. К соединительной ткани относят также кровь и лимфу. Поэтому соединительная ткань — единственная ткань, которая присутствует в организме в 4-х видах — волокнистом (связки), твёрдом (кости), гелеобразном (хрящи) и жидком (кровь, лимфа, а также межклеточная, спинномозговая и синовиальная и прочие жидкости).
Фасции, мышечные влагалища, связки, сухожилия, кости, хрящи, сустав, суставная сумка, сарколемма и перемизий мышечных волокон, синовиальная жидкость, кровь, лимфа, сосуды, капилляры, сало, межклеточная жидкость, внеклеточный матрикс, склера, радужка, микроглия и многое другое — это всё соединительная ткань.
Соединительная ткань состоит из внеклеточного матрикса и нескольких видов клеток. Клетки, относящиеся к соединительной ткани:
- фибробласты — производят коллаген и другие вещества внеклеточного матрикса, способны делиться.
- фиброкласты — клетки, способные поглощать и переваривать межклеточный матрикс; являются зрелыми фибробластами, к делению не способны.
- меланоциты — сильно разветвлённые клетки, содержащие меланин, присутствуют в радужной оболочке глаз и коже (по происхождению — эктодермальные клетки, производные нервного гребня)
- макрофаги — клетки, поглощающие болезнетворные организмы и отмершие клетки ткани (по происхождению моноциты крови)
- эндотелиоциты — окружают кровеносные сосуды, производят внеклеточный матрикс и продуцируют гепарин. Эндотелий по большинству признаков относят к эпителию.
- тучные клетки — продуцируют метахроматические гранулы, которые содержат гепарин и гистамин.
- мезенхимные клетки — клетки эмбриональной соединительной ткани
Межклеточное вещество соединительных тканей (внеклеточный матрикс) содержит множество разных органических и неорганических соединений, от количества и состава которых зависит консистенция ткани. Кровь и лимфа, относимые к жидким соединительным тканям, содержат жидкое межклеточное вещество — плазму. Матрикс хрящевой ткани — гелеобразный, а матрикс кости, как и волокна сухожилий — нерастворимые твердые вещества.
Биохимия соединительной ткани
Соединительная ткань — это внеклеточный матрикс вместе с клетками различного типа (фибробласты, хондробласты, остеобласты, тучные клетки, макрофаги) и волокнистыми структурами. Межклеточный матрикс (ВКМ — внеклеточный матрикс) представлен белками — коллагеном и эластином, гликопротеидами и протеогликанами, гликозаминогликанами (ГАГ), а также неколлагеновыми структурными белками — фибронектином, ламинином и др. Соединительная ткань подразделяется на:
- собственно соединительную ткань,
- скелетную ткани — костную и хрящевую,
- соединительную ткани со специфическими свойствами — жировую, слизистую, пигментную, ретикулярную.
Соединительная ткань определяет морфологическую и функциональную целостность организма. Для неё характерны:
- универсальность,
- тканевая специализация,
- полифункциональность,
- многокомпонентность и полиморфизм,
- высокая способность к адаптации.
Основными клетками соединительной ткани являются фибробласты. В них осуществляется синтез коллагена и эластина, протеогликанов, ферментов.
Заболевания, связанные с соединительной тканью
В связи со слабостью связочного аппарата, недостаточной прочностью коллагеновых волокон могут развиваться такие заболевания, как
Нарушения иммунитета тоже можно отнести к заболеваниям соединительной ткани, так как за иммунитет отвечает тоже преимущественно она, в основном — лимфатическая и кровеносная системы, которые к ней относятся.
Заболевания и пороки соединительной ткани
См. также
Анатомия, соединительная ткань — StatPearls
Введение
Соединительная ткань, как следует из названия, обозначает несколько различных тканей тела, которые служат для соединения, поддержки и связывания других тканей тела. Соединительную ткань можно разделить на три категории: рыхлая соединительная ткань, плотная соединительная ткань и специализированная соединительная ткань. Рыхлая соединительная ткань удерживает органы на месте и состоит из внеклеточного матрикса и коллагеновых, эластичных и ретикулярных волокон.Плотная соединительная ткань состоит из сухожилий и связок и состоит из более плотных коллагеновых волокон. Примерами специализированных соединительных тканей являются жировая ткань, хрящ, кость, кровь и лимфа.
Структура и функции
Рыхлая и плотная соединительная ткань состоит из следующих трех волокон: коллагеновых волокон, ретикулярных волокон и эластиновых волокон.
Коллагеновые волокна состоят из плотно расположенных тонких коллагеновых фибрилл, которые волнообразно движутся в тканях.Эти параллельные фибриллы представляют собой связки с гибкими протеогликанами, которые обладают важным механическим свойством. Они обладают гибким, но мощным сопротивлением тяговому усилию. В частности, в рыхлой соединительной ткани коллаген проходит параллельным курсом, а затем соединяется, образуя более крупный пучок. Они отделяются друг от друга и снова соединяются в разных местах, создавая трехмерную сетку. Плотная соединительная ткань, такая как связки и сухожилия, поражена в основном плотно упакованными коллагеновыми волокнами.[1]
Ретикулярные волокна, также называемые аргирофильными волокнами, имеют ограниченное количество в организме человека. Они в основном присутствуют в базальной эпителиальной ткани, жировых клетках, шванновских и мышечных клетках, лимфоидной ткани и эндотелии синусоидов печени. Под микроскопом эти ретикулярные волокна представляют собой тонкие темные волокна, которые являются продолжением описанных выше волокон коллежа. Расположение этих волокон образует сеть, лежащую в основе базального слоя ламины. Эти волокна прочно прикреплены к базальной пластинке, что указывает на то, что вместе с коллагеновыми волокнами эти волокна создают функциональную и структурную единицу, которая служит для поддержки тканей.Неплотное расположение этих волокон также обеспечивает пространство для молекулярного движения во внеклеточной жидкости [1].
Последним обсуждаемым компонентом являются эластиновые волокна. Эти волокна обладают характерным свойством упругой отдачи. Обычно в рыхлой соединительной ткани эластин представляет собой рыхлую сеть. Их организация и распространение зависят от типа ткани. Концентрические волокна эластина присутствуют в стенке сосудов, чтобы поддерживать равномерное кровяное давление. Волокна также присутствуют в растяжимых и сжимаемых органах, таких как легкие и мочевой пузырь.[1]
Эмбриология
Соединительная ткань возникает из соматической мезодермы. Индуктивные сигналы от ближайшего склеротома и миотома вызывают повышенную экспрессию ключевого фактора транскрипции в теногенной и лигаментогенной дифференцировке, называемой склераксисом. Некоторые факторы фибробластов, а также трансформирующий фактор роста бета участвуют в регуляции развития сухожилий. Клетки-предшественники сухожилий начинают откладывать коллагеновые фибриллы, и эти фибриллы растут в разных направлениях и начинают формировать пучок сухожилия.Фибробласты сухожилий располагаются между коллагеновыми волокнами. Слой соединительной ткани, называемый эпитеноном, окружает эти пучки сухожилий, образуя целостную ткань сухожилия. [2]
Кровоснабжение и лимфатика
Различные типы соединительной ткани имеют переменное кровоснабжение. В частности, сухожилия и связки выглядят частично бессосудистыми. Они состоят в основном из плотно упакованных коллагеновых волокон, которые не подвергаются метаболической активности и не нуждаются в кровоснабжении. В этих коллагеновых волокнах спрятаны живые клетки, которым требуется кровоснабжение; однако их объем минимален по сравнению с сухожилиями в целом.[3]
Нервы
Все периферические нервные волокна состоят из трех слоев соединительной ткани, которые служат защитной соединительной оболочкой. Эпиневрий — это самый внешний слой плотной соединительной ткани, который охватывает весь периферический нерв. В эпиневрии есть несколько нервных пучков, которые индивидуально окружены промежностью. Эти пучки состоят из отдельных миелинизированных нервных волокон, окруженных эндоневрием. [4]
Мышцы
Отдельные клетки мышц сгруппированы вместе, образуя волокно.Эти волокна далее связываются вместе, образуя пучок, и несколько из этих пучков группируются вместе, образуя целую мышцу. Соединительная ткань существует между каждой мышечной клеткой, волокном и пучком. На молекулярном уровне каждая мышечная клетка связана с другими мышечными клетками коллагеновой базальной мембраной, называемой эндомизием. Пучки окружены перимизием, который далее соединяется с эпимизием, который охватывает всю скелетную мышцу и продолжается с сухожилием.Коллагеновая сеть, начинающаяся на уровне эндомизия, непрерывна с перимизием и сухожилием, что обеспечивает эффективное и мощное сокращение мышц. [5]
Клиническая значимость
Ниже приводится пара примеров клинически значимых состояний соединительной ткани:
Смешанное заболевание соединительной ткани
Смешанное заболевание соединительной ткани (MCTD) — это аутоиммунное заболевание соединительной ткани, характеризующееся аутоантителами к рибонуклеопротеину (RNP).Клинически он проявляется как СКВ, системный склероз и полимиозит. Диагностические критерии основаны на серологии анти-RNP с миозитом или синовитом плюс два из следующих: отек рук, феномен Рейно, склеродактилия / акросклероз. Легочные симптомы преобладают у пациентов с MCTD. Пациенты могут жаловаться на кашель, одышку или плевритную боль в груди. Легочная гипертензия является наиболее тяжелым легочным последствием и часто приводит к преждевременной смерти. [6]
Травма ротаторной манжеты
Ротаторная манжета состоит из четырех сухожилий, расположенных в области плеча.Эти сухожилия происходят от следующих мышц: подлопаточной, надостной, подостной и малой круглой. Травмы вращательной манжеты плеча могут проявляться изнуряющей болью, снижением подвижности и функции плеча и слабостью плеча. Первоначально лечение начинают с физиотерапии и инъекций кортикостероидов. Хирургические методы доступны также пациентам, которые не прошли консервативную терапию; однако исследования продемонстрировали неоднозначную пользу хирургического подхода. Пациенты с травмами сухожилия вращательной манжеты плеча подвергаются повышенному риску повторных разрывов в течение всей жизни.[2]
Рисунок
Мочеточники, поперечный разрез мочеточника, фиброзная ткань, продольные мышечные волокна, круговые мышечные волокна, субэпителиальная соединительная ткань, переходный эпителий. Предоставлено Gray’s Anatomy Plates
Рисунок
Соединительная ткань, плотная, жировая, ареолярная, компактная кость, кровь. Иллюстрация Эммы Грегори
Ссылки
- 1.
- Ушики Т. Коллагеновые волокна, ретикулярные волокна и эластичные волокна. Комплексное понимание с морфологической точки зрения.Arch Histol Cytol. 2002 июн; 65 (2): 109-26. [PubMed: 12164335]
- 2.
- Ян Дж., Ротрафф ББ, Туан Р.С. Регенерация и восстановление сухожилий и связок: клиническая значимость и парадигма развития. Врожденные дефекты Res C Embryo Today. 2013 сентябрь; 99 (3): 203-222. [Бесплатная статья PMC: PMC4041869] [PubMed: 24078497]
- 3.
- EDWARDS DA. Кровоснабжение и лимфодренаж сухожилий. J Anat. 1946 Июль; 80: 147-52. [PubMed: 20996686]
- 4.
- Лю Цюй, Ван Х, Йи С.Патофизиологические изменения физических барьеров периферических нервов после травмы. Front Neurosci. 2018; 12: 597. [Бесплатная статья PMC: PMC6119778] [PubMed: 30210280]
- 5.
- Light N, Champion AE. Характеристика мышечного эпимизия, перимизиума и эндомизия коллагена. Biochem J. 1 мая 1984 г .; 219 (3): 1017-26. [Бесплатная статья PMC: PMC1153576] [PubMed: 6743238]
- 6.
- Pepmueller PH. Недифференцированное заболевание соединительной ткани, смешанное заболевание соединительной ткани и синдромы перекрытия в ревматологии.Mo Med. 2016 март-апрель; 113 (2): 136-40. [Бесплатная статья PMC: PMC6139943] [PubMed: 27311225]
Что такое связки? — InformedHealth.org
Наши кости, мышцы и суставы работают вместе согласованно, чтобы двигать нашим телом и придавать ему устойчивость. Здесь также важную роль играют сухожилия и связки: сухожилия соединяют мышцы с костями, позволяя нам двигаться, а связки помогают удерживать предметы на месте.
Что такое связки и для чего они нужны?
Связки состоят из соединительной ткани, содержащей множество прочных коллагеновых волокон.В теле они встречаются в разных формах и размерах. Некоторые выглядят как отрезки веревки, другие — как узкие или широкие полосы. Есть еще дугообразные связки.
Связки часто соединяют две кости вместе, особенно в суставах: подобно прочным, прочно прикрепленным ремням или веревкам, они стабилизируют сустав или удерживают концы двух костей вместе. Это гарантирует, что кости в суставе не будут слишком сильно перекручиваться, не будут слишком далеко расходиться друг от друга и не смещаются.
Подобно прочным ремням или веревкам, связки стабилизируют верхний голеностопный сустав
Но есть также некоторые связки, которые не связаны с костями.Например, некоторые следят за тем, чтобы внутренние органы оставались на месте. Типичный пример — матка, которую связки удерживают в правильном положении в тазу. Связки также могут соединять друг с другом два или более органов. Например, печень, кишечник и желудок удерживаются связками в брюшной полости. Эти связки часто имеют чувствительные структуры, такие как кровеносные сосуды или протоки желез. Прочная соединительная ткань связок защищает эти структуры и предотвращает их изгиб, скручивание или разрыв.
Независимо от того, соединяют ли они кости или органы друг с другом, связки помогают поддерживать стабильность в теле. Их функция отражена в их названии, которое происходит от «ligare» — латинского слова, означающего «связывать» или «связывать».
Источники
Lippert H. Lehrbuch Anatomie. Мюнхен: Урбан и Фишер; 2003.
Niethard FU, Pfeil J, Biberthaler P. Duale Reihe Orthopädie und Unfallchirurgie. Штутгарт: Тиме; 2014.
Пщырембель.Klinisches Wörterbuch. Берлин: Де Грюйтер; 2017.
Информация о здоровье IQWiG написана с целью помочь люди понимают преимущества и недостатки основных вариантов лечения и здоровья услуги по уходу.
Поскольку IQWiG — немецкий институт, некоторая информация, представленная здесь, относится к Немецкая система здравоохранения. Пригодность любого из описанных вариантов в индивидуальном случай можно определить, посоветовавшись с врачом. Мы не предлагаем индивидуальных консультаций.
Наша информация основана на результатах качественных исследований. Это написано команда медицинские работники, ученые и редакторы, а также рецензируются внешними экспертами. Вы можете найти подробное описание того, как создается и обновляется наша медицинская информация в наши методы.
Сухожилие против связок: в чем разница?
Два типа мягкой волокнистой соединительной ткани в теле, поддерживающей мышцы и кости, известны как сухожилия и связки .В чем разница между сухожилием и связкой ?
Самый простой способ запомнить разницу между сухожилиями и связками довольно прост:
- Связки прикрепляют кость к кости
- Сухожилия удерживают мышцу и кость вместе
В начале любого повреждения мягких тканей , большинство из нас обычно больше сосредоточено на боли и неудобствах травмы, чем на чем-либо еще. Но понимание разницы между связкой и сухожилием важно для быстрого восстановления и возвращения к действию, особенно для спортсменов.
В связках фиброзная ткань переплетается крест-накрест , подобно волокнам в прочной веревке. Этот тип соединительного узора обеспечивает гибкость, стабильность и прочность, необходимые для оптимальной эффективности костных суставов.
С другой стороны, волокна в сухожилиях проходят параллельно, что обеспечивает поддержку, но обеспечивает большую эластичность . Когда мышцы начинают работать, сухожилия приводят в действие кость.
Эта комбинация мягких тканей обеспечивает кости и мышцы достаточной амортизацией и поддержкой, чтобы они начали действовать в один скоординированный момент.
Однако с травмой связки или сухожилия способность тела реагировать и действовать как обычно может варьироваться от значительно сниженной производительности до совершенно невозможной для использования.
Травмы сухожилий и связок
Большинство соединительных тканей, таких как сухожилия и связки, состоят из коллагена, и со временем организм вырабатывает его меньше. Старение — ключевая причина, по которой старшие спортсмены-ветераны и люди в целом получают больше травм по мере взросления, и снижение выработки коллагена играет определенную роль.
Повреждения связок и сухожилий имеют много общего, но есть заметные различия в типах травм и причинах.
Травмы и растяжения связок
В человеческом теле примерно 900 связок , от связки стопы до шеи и челюсти. Хотя связки необходимы для предотвращения трения между костями, они обладают ограниченной способностью к растяжению.
Растяжение или разрыв связок считается «растяжением».”
Растяжение связок может произойти в результате сильного столкновения или удара, слишком резкого или сильного скручивания сустава или в результате особенно сильного падения.
В каждом из этих случаев удар чрезмерно растягивает связку и вызывает ее повреждение.
Некоторые из наиболее распространенных растяжений связок включают:
- Растяжение связок голеностопного сустава
- Растяжение коленного сустава
- Растяжение запястья
Растяжение связок может быть невероятно болезненным и изнурительным.Они варьируются от относительно легкой гиперэкстензии до частичного разрыва или тяжелого растяжения связок, когда полный разрыв связки оставляет сустав полностью без поддержки.
Даже повторяющиеся легкие растяжения одного сустава могут привести к ослаблению связки, что означает, что она теряет способность должным образом заживать и смягчать сустав.
Травмы и деформации сухожилий
В зависимости от размера и мышечной массы человека в человеческом теле около 4000 сухожилий . Хотя они более эластичны, чем связки, они также могут быть повреждены при чрезмерном растяжении, что иногда приводит к разрыву.
Повреждения сухожилий обычно называют «растяжениями», а иногда определенные типы называются «тендинитом».
Во многих случаях травмы сухожилий являются результатом чрезмерного использования при повторении. Повторяющиеся спортивные движения, такие как гольф, теннис, бейсбол и другие виды спорта, часто приводят к растяжению сухожилий или тендиниту.
Повторяющиеся движения, приводящие к травмам, не ограничиваются спортивными занятиями, а также часто возникают в некоторых профессиях, таких как строительство и производство, где постоянная нагрузка на сухожилия может привести к растяжению или тендиниту.
В некоторых случаях в момент травмы из-за подвывиха можно почувствовать щелчок или услышать или почувствовать хлопок.
Подвывих возникает, когда сухожилие соскальзывает или смещается из своего нормального положения из-за травмы сухожилия.
Некоторые из наиболее распространенных деформаций сухожилий включают:
Симптомы травм сухожилий и связок
Одна из причин, по которой может быть трудно определить разницу между травмой сухожилия и связки , заключается в том, что оба имеют сходные симптомы, такие как боль, воспаление и возможное уменьшение диапазона движений.
Иногда растяжения и растяжения настолько легкие, что человек едва замечает легкий дискомфорт и продолжает заниматься деятельностью, которая создает дополнительную нагрузку на мягкие ткани.
Со временем это может усугубить то, что изначально было незначительной проблемой, поэтому важно поговорить с врачом или другим медицинским работником при первых признаках возможной травмы.
Показывают ли рентгеновские снимки повреждение сухожилий?
К сожалению, рентгеновские снимки НЕ показывают повреждений сухожилий или связок .По данным Американской академии ортопедической спортивной медицины (AAPSM), рентгеновские лучи в основном предназначены для выявления повреждений костей и суставов, но не для выявления участков мягких тканей, таких как сухожилия, связки или хрящи.
Иногда врачи могут диагностировать растяжение сухожилий или тендинит, осматривая пациента, анализируя симптомы и учитывая его недавнюю физическую активность.
В других случаях врач может запросить МРТ (магнитно-резонансную томографию), которая дает изображения мягких тканей, таких как сухожилия и связки, а также костей, суставов и хрящей.
Ультразвук (сонография) — еще один метод диагностики повреждений мягких тканей сухожилий и связок с использованием высокочастотных звуковых волн.
МРТ и ультразвук — это безболезненные методы визуализации, которые более безопасны и точны, чем рентгеновские лучи, и не производят никакого излучения, что делает их более эффективными процедурами для исследования повреждений связок и сухожилий.
Типы лечения травм сухожилий и связок
При первых признаках травмы крайне важно получить правильный диагноз от медицинского работника, чтобы определить тип травмы, чтобы соблюдался соответствующий режим лечения и травма не была повреждена. Хуже.
Необходимо определить, является ли травма воспалением от тендинита, острым или дегенеративным разрывом, подвывихом или чем-то еще. Знание этого поможет определить методы лечения, которые будут использоваться, и приблизительное время, необходимое для надлежащего заживления и восстановления.
Вот 6 типов методов лечения травм сухожилий и связок:
1. RICE (отдых, лед, компрессия, подъем)
При травмах сухожилий или связок от легкой до средней степени первым подходом к лечению обычно является RICE Method (Отдых, Лед, Сжатие, Высота).Это наиболее эффективно сразу после травмы, хотя серьезные травмы, вероятно, потребуют более комплексного плана лечения.
Основы метода RICE включают:
- Отдых дает время для уменьшения воспаления и боли и дает очень необходимый перерыв в пораженной области
- Лед уменьшает отек и иногда помогает облегчить боль
- Сжатие повязкой бинт или ремешок обездвиживают травму от дополнительного повреждения и могут уменьшить отек и улучшить заживление
- Поднятие травмы над сердцем иногда уменьшает боль и отек
2.Противовоспалительное лекарство
В случае хронического тендинита для уменьшения воспаления и боли могут быть полезны безрецептурные противовоспалительные препараты , такие как ибупрофен, содержащийся в мотрине или адвиле.
Кортикостероиды или просто стероиды можно вводить перорально или путем инъекции в пораженный участок, чтобы уменьшить воспаление и ускорить заживление.
3. Ударно-волновая терапия EPAT при травмах сухожилий и связок
Во время выздоровления EPAT Therapy является одним из наиболее эффективных методов сокращения времени, необходимого для заживления поврежденных сухожилий или связок.
EPAT-терапия — это метод регенеративного лечения, который доставляет импульсные волны давления глубоко в поврежденные мягкие ткани, поэтому его иногда называют «ударно-волновой терапией».
Во время сеанса EPAT процедура разрушает рубцовую ткань в пораженном суставе, стимулирует приток крови к этой области и уменьшает боль и воспаление.
Поскольку лечение EPAT не хирургическое, не требуется анестезия, рубцы и риск инфекции. В некоторых случаях спортсмены действительно могут проходить сеансы лечения, сохраняя при этом высокий уровень производительности, даже если они продолжают восстанавливаться после травмы.
Благодаря множеству положительных преимуществ при лечении и лечении боли и травм, EPAT-терапия быстро набирает популярность среди специалистов в области спортивной медицины, в дополнение к программам обучения в колледжах и профессиональных спортсменов.
4. Хирургия
При разрыве или разрыве связок операция иногда является лучшим вариантом для восстановления соединения мягких тканей или добавления дополнительной поддержки в пораженный участок. Подвывих иногда требует хирургического вмешательства в тяжелых случаях.
Хирургия обычно применяется только при самых тяжелых травмах связок и сухожилий и вызывает наибольшее время простоя у спортсменов.
5. Физиотерапия
Физиотерапия может использоваться для укрепления поврежденных тканей и обучения пациента правильным приемам движений, которые уменьшают вероятность продолжения травм в будущем. Он также используется в качестве метода реабилитации после хирургических вмешательств при тяжелых травмах.
6. Повязка или скоба
Иногда травма кисти или стопы может быть недостаточно серьезной, чтобы потребовать хирургического вмешательства, но все же серьезной и требует полной иммобилизации для правильного заживления.
Сильно разорванная связка на стопе может потребовать гипсовой повязки , а также разорванного сухожилия на запястье . Заживление таких травм может занять от 6 до 8 недель.
В этих случаях необходима гипсовая повязка, шина или скоба, чтобы травмированная область не двигалась и не заживала соответствующим образом. После снятия гипса физиотерапия или процедуры EPAT могут еще больше ускорить процесс восстановления.
Травмы сухожилий и связок могут начинаться с незначительной боли в пораженной области и часто остаются незамеченными в течение определенного периода времени, пока боль не станет более заметной и не повлияет на работоспособность.
Если травма не будет устранена своевременно, она, как правило, будет продолжать вызывать проблемы и может перейти в более серьезное состояние до тех пор, пока не будет устранена или пока не будет исправлена.
Лучший способ избавиться от боли в сухожилиях и связках — поговорить с тренером или врачом при первых признаках боли, чтобы устранить проблему и не допустить ее перехода к чему-то более серьезному.
Изображения связок и сухожилий предоставлены Scientific Animations
Сухожилия — обзор | Темы ScienceDirect
2.2 Сухожилие
Сухожилия и остальные соединительнотканные элементы конечности также происходят из латеральной пластинки мезодермы (Kieny & Chevallier, 1979). Фактор транскрипции bHLH, Scleraxis ( Scx ), является самым ранним известным маркером сухожилия и впервые обнаруживается в зачатке конечности на ~ E10,5 (Brent, Braun, & Tabin, 2005; Schweitzer et al., 2001) . Аналогично образованию скелетного зачатка, индукция предшественников сухожилий в конечности происходит проксимально и дистально, поскольку Scx -положительные предшественники сухожилий возникают внутри мезенхимы зачатка конечности в дорсальных и вентральных субэктодермальных доменах, прилегающих к конденсирующемуся зачатку скелета. (Мерчисон и др., 2007; Schweitzer et al., 2001). Эктодермальные сигналы участвуют в индукции предшественников сухожилий, поскольку удаление эктодермы до начала экспрессии Scx приводит к полному прекращению экспрессии Scx . Эктодермальный сигнал не требуется для поддержания экспрессии Scx , однако, поскольку удаление эктодермы после начала экспрессии не влияет на развитие сухожилий (Schweitzer et al., 2001). Также есть свидетельства того, что индукция предшественников сухожилий и уплотнение скелета тесно связаны, поскольку увеличение или уменьшение числа пальцев приводит к соответствующему увеличению или уменьшению образования связанных сухожилий (Huang, Riordan, et al., 2015). Было обнаружено, что после индукции передача сигналов TGFβ имеет решающее значение для сохранения предшественников сухожилий. В Tgfb2 — / — ; Tgfb3 — / — конечности мутантных мышиных эмбрионов, Scx -положительные предшественники сухожилий обычно появляются на E11.5, но теряются в течение следующих 24 часов, приводя к полному прекращению развития сухожилий (Pryce et al., 2009). Помимо передачи сигналов Scx и TGFβ, роли для Mohawk ( Mkx ), теномодулина ( Tnmd ), тромбоспондина 2 и 4 ( Thbs-2), дифференцировка роста фактор-5 ( Gdf-5 ) были продемонстрированы (Alberton et al., 2015; Брент, Швейцер и Табин, 2003; Дочева, Хунцикер, Фасслер и Брандау, 2005; Фролова и др., 2014; Ито и др., 2010; Koda et al., 2017; Kyriakides et al., 1998; Лю и др., 2010, 2014; Мендиас, Бахурин и Фолкнер, 2008; Микич, 2004; Микич, Шале, Кларк, Гашен и Ханзикер, 2001; Onizuka et al., 2014).
Начальная спецификация сухожилия и раннее формирование паттерна являются тканевыми автономными, однако непрерывное поддержание предшественников сухожилий требует взаимодействия с мышцами и скелетом (Bonnin et al., 2005; Havis et al., 2016; Кардон, 1998). Интересно, что потребность во взаимодействии сухожилий с мышцами и сухожилий с хрящом различается вдоль проксимальной и дистальной оси конечности (Bonnin et al., 2005; Havis et al., 2016; Huang, Lu, & Schweitzer, 2015; Kardon, 1998). ). В безмышечных моделях конечностей как у цыплят, так и у мышей, поддержание проксимальных предшественников сухожилий требует присутствия предшественников мышц, в то время как на развитие дистальных сухожилий не влияет отсутствие мускулов (Bonnin et al., 2005; Kardon, 1998; Schweitzer et al., 2001). Напротив, индукция и поддержание сухожилий аутоподов требует наличия зачатков скелета пальцев (Huang, Riordan, et al., 2015). Любопытно, что в конечности есть несколько длинных сухожилий, которые берут начало в zeugopod, но прикреплены к скелету внутри аутопода, что позволяет предположить, что в пределах одного сухожилия уникальные программы развития регулируют дифференцировку предшественников вдоль проксимальной к дистальной оси. Тщательное исследование развития сухожилий при переходе от мышечно-независимой фазы (до E12.5) в мышечно-зависимую фазу (после E12.5) выявил пространственный модульный механизм развития сухожилий. Первоначально предшественники коротких сухожилий интегрируются с дистальным концом отдельных мышечных масс в zeugopod. По мере продолжения разрастания конечностей короткие сухожилия образуют связи со своими аналогами, которые возникают внутри аутопода, модульно формируя дифференцированное линейное сухожилие (Huang, Riordan, et al., 2015). После интеграции сухожилий зевгопода и автопода в запястье, мышечные сокращения, по-видимому, необходимы для дальнейшего расщепления сухожилий автопода.
33.2B: Соединительные ткани: рыхлые, волокнистые и хрящевые
Соединительная ткань находится по всему телу, обеспечивая поддержку и амортизацию тканей и костей.
Цели обучения
- Различать разные типы соединительной ткани
Ключевые моменты
- Фибробласты — это клетки, которые генерируют любую соединительную ткань, которая нужна организму, поскольку они могут перемещаться по телу и могут подвергаться митозу для создания новых тканей.
- Белковые волокна проходят через соединительную ткань, обеспечивая стабильность и поддержку; они могут быть коллагеновыми, эластичными или ретикулярными волокнами.
- Рыхлая соединительная ткань не особенно прочна, но окружает кровеносные сосуды и поддерживает внутренние органы.
- Фиброзная соединительная ткань, которая состоит из параллельных пучков коллагеновых волокон, находится в дерме, сухожилиях и связках.
- Гиалиновый хрящ образует скелет эмбриона, прежде чем он превратится в кость; У взрослого человека он находится на кончике носа и вокруг концов длинных костей, где предотвращает трение в суставах.
- Фиброхрящ — самая прочная из соединительных тканей; он обнаруживается в тех частях тела, которые испытывают большие нагрузки и требуют высокой степени амортизации, например, между позвонками.
Ключевые термины
- хондроцит : клетка, составляющая ткань хряща
- подвижный : способность двигаться спонтанно
- фибробласт : клетка, обнаруженная в соединительной ткани, которая производит волокна, такие как коллаген
Соединительные ткани
Соединительные ткани состоят из матрицы, состоящей из живых клеток и неживого вещества, называемого основным веществом.Основное вещество состоит из органического вещества (обычно белка) и неорганического вещества (обычно минерала или воды). Основная клетка соединительной ткани — это фибробласт, незрелая клетка соединительной ткани, которая еще не дифференцировалась. Эта клетка производит волокна почти во всех соединительных тканях. Фибробласты подвижны, способны выполнять митоз и синтезировать любую соединительную ткань, которая необходима. Макрофаги, лимфоциты и, иногда, лейкоциты могут быть обнаружены в некоторых тканях, в то время как другие могут иметь специализированные клетки.Матрикс соединительной ткани придает ткани ее плотность. Когда соединительная ткань имеет высокую концентрацию клеток или волокон, она имеет пропорционально менее плотный матрикс.
Органическая часть или белковые волокна в соединительных тканях представляют собой коллагеновые, эластичные или ретикулярные волокна. Волокна коллагена придают ткани прочность, предотвращая ее разрыв или отделение от окружающих тканей. Эластичные волокна состоят из протеина эластина; это волокно может растягиваться на половину своей длины, возвращаясь к своему первоначальному размеру и форме.Эластичные волокна придают тканям гибкость. Ретикулярные волокна, третий тип белковых волокон, содержащихся в соединительных тканях, состоят из тонких коллагеновых нитей, которые образуют сеть волокон, поддерживающих ткань и другие органы, с которыми она связана.
Свободная (ареолярная) соединительная ткань
Рыхлая соединительная ткань, также называемая ареолярной соединительной тканью, содержит образцы всех компонентов соединительной ткани. В рыхлой соединительной ткани есть фибробласты, хотя присутствуют и макрофаги.Волокна коллагена относительно широкие и имеют светло-розовый цвет, тогда как эластичные волокна тонкие и окрашиваются в темно-синий или черный цвет. Пространство между формованными элементами ткани заполняется матрицей. Материал соединительной ткани придает ей рыхлую консистенцию, похожую на разорванный ватный диск. Вокруг каждого кровеносного сосуда находится рыхлая соединительная ткань, которая помогает удерживать сосуд на месте. Ткань также находится вокруг большинства органов тела и между ними. Таким образом, ареолярная ткань жесткая, но гибкая и состоит из мембран.
Рисунок \ (\ PageIndex {1} \): Рыхлая соединительная ткань : Рыхлая соединительная ткань состоит из рыхлых волокон коллагена и эластичных волокон. Волокна и другие компоненты матрикса соединительной ткани секретируются фибробластами.Волокнистая соединительная ткань
Волокнистые соединительные ткани содержат большое количество коллагеновых волокон и небольшое количество клеток или матриксного материала. Волокна могут быть расположены нерегулярно или регулярно с параллельными прядями. Неправильно расположенные волокнистые соединительные ткани находятся в областях тела, где напряжение возникает со всех сторон, например, на дерме кожи.Обычная волокнистая соединительная ткань находится в сухожилиях (которые соединяют мышцы с костями) и связках (которые соединяют кости с костями).
Рисунок \ (\ PageIndex {1} \): Волокнистая соединительная ткань : Волокнистая соединительная ткань из сухожилия имеет тяжи коллагеновых волокон, выстроенных параллельно. Такое расположение помогает ткани противостоять растяжению, возникающему со всех сторон.Хрящ
Хрящ — это соединительная ткань. Клетки, называемые хондроцитами (зрелые хрящевые клетки), составляют матрикс и волокна ткани.Хондроциты находятся в промежутках внутри ткани, называемых «лакунами». ”
Хрящ с небольшим количеством коллагеновых и эластичных волокон — это гиалиновый хрящ. Лакуны беспорядочно разбросаны по ткани, а матрица приобретает молочный или потертый вид с обычными пятнами. У акул хрящевой скелет, как и у почти всего человеческого скелета на некоторых этапах предродового развития. Остаток этого хряща сохраняется во внешней части человеческого носа. Гиалиновый хрящ также находится на концах длинных костей, уменьшая трение и смягчая суставы этих костей.
Рисунок \ (\ PageIndex {1} \): Гиалиновый хрящ : Гиалиновый хрящ состоит из матрицы, в которую встроены клетки, называемые хондроцитами (показаны здесь). Хондроциты существуют в полостях матрикса, называемых лакунами.Эластичный хрящ имеет большое количество эластичных волокон, придающих ему огромную гибкость. Этот хрящ содержится в ушах большинства позвоночных животных, а также в частях гортани или голосового аппарата. Напротив, волокнистый хрящ содержит большое количество коллагеновых волокон, придающих ткани огромную прочность.Фиброхрящи составляют межпозвоночные диски у позвоночных животных, которые должны выдерживать огромные нагрузки. Хрящ также может трансформироваться из одного типа в другой. Например, гиалиновый хрящ, обнаруженный в подвижных суставах, таких как колено и плечо, часто повреждается в результате возраста или травм. Поврежденный гиалиновый хрящ заменяется волокнистым хрящом, в результате чего суставы становятся жесткими.
Достижения в области инженерии сухожилий и связок: перспективы материалов
Введение .Сухожилия представляют собой специализированные разнородные соединительные ткани, которые представляют серьезную проблему для здоровья после травм. Первичное хирургическое вмешательство — это золотой стандарт лечения; однако это сильно зависит от степени травм. Тканевая инженерия представляет собой альтернативное решение для хорошей интеграции и регенерации тканей. В этом обзоре мы рассмотрим передовые композитные биоматериалы, используемые для улучшения роста клеток, обеспечивая при этом соответствующие механические свойства для восстановления сухожилий и связок. Методология . Всесторонний поиск литературы был сосредоточен на передовых композитных биоматериалах для тканевой инженерии сухожилий и связок. Исследования были разделены на категории в зависимости от приложения. Результатов . В литературе ряд природных и / или синтетических материалов комбинируется для создания композитных каркасов для инженерии тканей сухожилий и связок. Оценка in vitro и in vivo демонстрирует многообещающую клеточную интеграцию с достаточной механической прочностью. Биологические свойства были улучшены за счет добавления факторов роста в композиционные материалы.Большинство исследований in vivo было проведено на небольших моделях животных. Выводы . Современные композитные материалы представляют собой многообещающее решение проблем, связанных с тканевой инженерией сухожилий и связок. Тем не менее, эти подходы по-прежнему демонстрируют ограничения, в том числе необходимость крупномасштабных моделей на животных для облегчения будущего клинического перевода и комплексной оценки тканевого ответа после имплантации.
1. Введение
Травмы сухожилий и связок представляют собой серьезные проблемы для здравоохранения и экономики будущего.Примечательно, что от этих травм страдают 110 миллионов человек в США [1], а неполное восстановление связано с различными формами инвалидности и хроническими последствиями [2, 3].
Сухожилие представляет собой специализированную соединительную ткань, в которой коллаген I типа составляет ~ 80% от чистой сухой массы. В сочетании с протеогликанами и эластином коллаген обеспечивает высокую механическую прочность сухожилий [4, 5]. Кроме того, сухожилия демонстрируют уникальную структурную иерархию, в которой молекулы коллагена производят фибриллы коллагена, которые группируются вместе, образуя волокна коллагена.Мультикомпозитные единицы сухожилия состоят из нескольких коллагеновых волокон, известных как тропоколлаген (рис. 1) [3, 4, 6].
Связки — это еще одна форма вязкоупругой соединительной ткани с высокоорганизованным составом, в которой коллагены (типы I, III и V) составляют основную массу. Также экспрессируются протеогликаны и хондроитинсульфат, что позволяет ткани связок набухать в водной среде [7]. В организме прикрепление сухожилий и связок к кости включает переходную зону с неминерализованным и минерализованным волокнистым хрящом [3, 8].В дальнейшем сухожилия могут прикрепляться к мышцам через фасции [4]. Определение структурной организации сухожилий и связок улучшило понимание того, как эти гетерогенные ткани функционируют в синергии [9].
Хирургическое восстановление сухожилий и связок с помощью первичного шва или аутотрансфера считается золотым стандартом лечения. Однако эти решения часто связаны с проблемами, включая снижение механической прочности из-за образования рубцовой ткани, инфекции, заболеваемость донорским участком и ограниченную доступность аутотрансплантатов [10].Кроме того, требуются специализированные протоколы физиотерапии для улучшения свойств места восстановления и ограничения образования рубцовой ткани [11].
Чтобы преодолеть эту клиническую проблему, в литературе были исследованы дополнительные терапевтические возможности, включающие использование синтетических протезов или тканеинженерных конструкций из биоматериалов [12]. Различные синтетические протезы были описаны как заменители тканей сухожилий и связок. Неабсорбируемый и биосовместимый полиэфир-полиэтилентерефталат (ПЭТ) был исследован как потенциальный материал для протезирования тканей сухожилий и связок с подходящими механическими и тканевыми интегративными свойствами [13, 14].Другие материалы, такие как политетрафторэтилен (ПТФЭ), также были исследованы в качестве заменителей ткани связки или в трансплантатах для увеличения сухожилий из-за их биологически инертных и сильных механических характеристик [15, 16]. Однако при использовании этих материалов наблюдались такие ограничения, как несостоятельность трансплантата, низкая прочность, плохая интеграция тканей и синовит инородного тела [17]. Тканевая инженерия представляет собой альтернативный вариант с возможностью правильной тканевой интеграции имплантатов.
Различные синтетические или природные материалы были исследованы в качестве каркасов, которые позволяют интегрировать клетки и последующее отложение матрикса.Среди материалов природного происхождения коллаген и хитозан были тщательно исследованы на предмет развития каркаса из-за их оптимальной биосовместимости и потенциала интеграции в ткань [18]. Тем не менее, эти материалы обладают такими ограничениями, как низкая механическая прочность, изменчивость партий и сложность обработки с латентной иммуногенностью [19].
Синтетические материалы, включая полимолочную кислоту (PLA), полигликолевую кислоту (PGA) и сополимер молочной и гликолевой кислот (PLGA), широко исследовались для восстановления сухожилий и связок [20].Синтетика обладает рядом преимуществ, связанных с крупномасштабным производством, ограниченной передачей болезней, контролируемой деградацией и лучшей интеграцией с тканями хозяина. Есть также ограничения, связанные с синтетическими биоматериалами; интеграция клеток затруднена без дальнейшей обработки материала, продукты, связанные с деградацией, могут быть цитотоксичными, а материалы механически слабее, чем здоровые скелетно-мышечные ткани [18, 21].
Были описаны новые подходы к тканевой инженерии с использованием композитных материалов для имитации сложной, негомогенной среды в сухожилиях и связках.В этих композитных материалах специализированные клетки были объединены с биоматериалами для создания сложных гетерогенных каркасов с контролируемыми механическими свойствами [1, 9]. В этом обзоре будет представлен обзор различных описанных подходов к использованию композитных каркасов для инженерии тканей сухожилий и связок. Подробно обсуждается всесторонняя критика механических свойств, интеграции клеток / тканей, критериев успеха и ограничений.
2. Материалы и методология
Был проведен всесторонний поиск литературы в базах данных PubMed, Medline, Web of Science и Google Scholar.В процессе поиска использовались различные комбинации ключевых слов, в том числе «сухожилие», «связка», «ткань», «инженерия», «гибрид», «композит», «каркас», «материал», «биоматериал», «трансплантат». »И« полимер ». Были включены только публикации на английском языке, и не было ограничений по году публикации, поскольку не было обнаружено предыдущих обзоров, охватывающих использование композитных материалов в инженерии тканей сухожилий и связок одновременно. Был осуществлен доступ ко всем соответствующим рукописям, и были включены статьи, сочетающие подходы тканевой инженерии как для сухожилий, так и для связок.Статьи, в которых обсуждались различные подходы к тканевой инженерии на границе сухожилия / связки и кости, также были исключены из-за широты темы и большого количества обзорных статей по этой теме [8, 22–24].
3. Результаты и обсуждение
3.1. Композитные каркасы для инженерии тканей сухожилий и связок
Травмы сухожилий представляют собой серьезные проблемы для здравоохранения из-за медленных темпов заживления, потери функции и образования рубцовой ткани вокруг участков травмы [12].В тяжелых случаях были изготовлены каркасы с тканевой инженерией, чтобы заменить утраченные ткани. Эти искусственные трансплантаты могут состоять из натуральных или синтетических биоматериалов [49]. Идеальный каркас в инженерии ткани сухожилия должен проявлять особые свойства, такие как контролируемая скорость разложения, соответствующие механические свойства, неиммуногенность и способность к сшиванию. Кроме того, желательна легкая обработка и изготовление массы, имитирующая естественную тканевую среду [12].
3.2. Синтетические композитные материалы
Один из примеров материалов, используемых для тканевой инженерии сухожилий, включал изготовление композитных гетерогенных каркасов из полигликолевой кислоты (PGA) и полимолочной кислоты (PLA) [44]. Наружная поверхность состояла из трикотажного каркаса, изготовленного из смеси волокон PGA и PLA в соотношении 4: 2. Внутри конструкция содержала продольно расположенные нетканые волокна PGA. Вся конструкция была сложена и закреплена швами на каждом конце, чтобы получить структуру корда, и была протестирована как in vitro, так и in vivo.Результаты показали, что каркас, засеянный стволовыми клетками, полученными из жировой ткани (ADSC), способствовал отложению матрикса и образованию зрелых коллагеновых фибрилл. Эти каркасы обладают субфизиологическими механическими свойствами. Хотя исследование показало многообещающие результаты, оценка теногенной дифференциации ADSC не проводилась.
Другой метод производства был предложен Бейкером Б. М. и др., Которые исследовали использование метода соэлектроспиннинга различных полимеров для получения композитного каркаса с различными методами разрушения [28].Они оценили использование волокон PCL в качестве медленно поглощающих элементов, в то время как волокна PLGA (50:50 полимолочная / гликолевая кислота) или волокна PCL / PLGA применялись для промежуточных скоростей разложения в одном каркасе. Водорастворимый полиэтиленоксид (ПЭО) использовался в качестве расходуемого волокнистого элемента с высокой скоростью поглощения и был направлен на увеличение пористости каркаса с минимальным влиянием на целостность каркаса. Механическая оценка конструкций PCL / PLGA / PEO показала максимальный выход при напряжении около 3,5 МПа при деформации 0,08%.Модуль упругости составлял около 100 МПа, а деформация текучести составляла 0,026. Каркасы PCL / PLGA-PCL / PEO показали максимальный выход при напряжении 2 МПа при деформации 0,12%. Начальный модуль материала составлял 25 МПа и упал до 12,5 МПа после 63-дневной инкубации в культуральной среде. Штамм увеличился с 0,065% до 0,12% после инкубации. Уменьшение массы композитного каркаса на 22% после гидратации было вызвано растворением компонента PEO. Однако изменение механических свойств после гидратации и растворения ПЭО заслуживает дальнейшего объяснения.
Было высказано предположение, что тканые каркасы лучше подходят для интеграции тканей из-за их взаимосвязанных пористых структур. Тем не менее, они требуют сложных методов посева клеток и сложных систем доставки клеток [4, 5]. Sahoo S. et al. исследовали использование тканых каркасов из PLGA или PLLA [29]. Оба каркаса f были покрыты PCL, нановолокном PLGA или коллагеном типа I, чтобы получить композитные каркасы, и были засеяны МСК свиного костного мозга. Некоторые покрытые коллагеном каркасы были засеяны дермальными фибробластами человека для проверки эффективности посева клеток и интеграции.Результаты показали, что тканые каркасы на основе PLLA хуже прикрепляются к клеткам. Это было связано с гидрофобной природой материала PLLA. Кроме того, покрытие PCL обоих типов вязанных каркасов было связано с более высокой механической прочностью, но с уменьшением прикрепления клеток. Это также было связано с большей гидрофобностью PCL, чем у других полимеров.
Поскольку механическая прочность особенно важна, подход с использованием PLA с графеновыми нанопластинками (GNP) и PLA с углеродными нанотрубками, функционализированными карбоксильными группами (CNT-COOH), был предложен Pinto et al.[25, 26]. Оценка композита in vitro оказалась нетоксичной для фибробластов человека. Оценка in vivo с использованием модели на мышах не показала какой-либо токсичности или местного или системного воспалительного ответа. Добавление нанонаполнителей улучшает механические свойства полимерных пленок PLA, достигая модуля Юнга 4,86 ± 0,47 ГПа для каркасов CNT-COOH и 4,92 ± 0,15 ГПа для каркасных групп GNP. Однако прочность на растяжение в каркасах из PLA / CNT-COOH была в основном повышена до 72,22 ± 1,52 МПа.Однако авторы не исследовали влияние имплантации in vivo на связанные с ней механические свойства, имитирующие реальные клинические условия.
3.3. Биологические композитные каркасы
Коллагеновый композитный каркас типа I также исследовали на предмет включения резилин-подобного белка. Ресилин — это белок членистоногих с эластичной и легко растягивающейся структурой. Санами М. и др. [27] исследовали изготовление такого композита. Каркас был изготовлен путем экструзии композиционного раствора, содержащего коллаген и резилин в различных концентрациях, в полиэтиленгликолевый буфер.Затем волокна были сшиты с использованием раствора тетрасукцинимидилглутарата 4-звенного эфира поли (этиленгликоля). Механическая оценка показала, что резилин в каркасе из неперекрестно-сшитого коллагена значительно снижает напряжение при разрыве и значения модуля Юнга, при этом значительно увеличивая деформацию разрыва. Сшитый каркас из коллагена / резилина показал значительное увеличение значений напряжения и деформации и значительно снизились значения модуля Юнга. Это показывает интересный эффект резилина, проявляющего свои природные свойства.In vitro полученный каркас поддерживал 100% пролиферацию и выравнивание фибробластов по сравнению с 80% в контроле из коллагеновых волокон.
Каркасы, сделанные из коллагена и гликозаминогликана (ГАГ), были признаны за их роль в поддержке клеточной пролиферации и дифференцировки. Однако у этого типа каркаса отсутствуют механические характеристики, необходимые для инженерии ткани сухожилия. Caliari et al., 2011, предложили концепцию разработки композиционных материалов типа ядро-оболочка с необходимыми механическими свойствами [30].Группа изготовила каркасы, состоящие из высокопористых, выровненных изотропных ядер GAG, окруженных прочными изотропными мембранами GAG высокой плотности. Для повышения механической прочности лесов была предложена конструкция «ядро-оболочка». Материал был изготовлен с использованием метода испарения для создания мембран и сублимационной сушки для включения ядра в оболочку мембраны. Дегидротермическое (DTH) сшивание использовалось для увеличения интеграции материала, а также улучшения механических свойств. Оценка in vitro с использованием теноцитов лошади продемонстрировала хорошее прикрепление, пролиферацию и жизнеспособность клеток в течение 14 дней после посева.Каркасы демонстрируют высокую пористость и соответствующие механические свойства в зависимости от толщины мембраны. Однако некоторые факторы требуют дальнейшего изучения, такие как функциональная оценка клеток (например, экспрессия белка), природа и содержание коллагена после посева клеток, а также механические свойства каркаса в различных состояниях (например, влажное или сухое).
Хитозан — это полисахарид природного происхождения с прекрасным потенциалом для применения в тканевой инженерии. Благодаря биосовместимости и клеточным адгезионным свойствам хитозана, полисахарид был исследован для регенерации ткани сухожилия [9–11].В одном примере композитные каркасы, изготовленные из хитозана и альгинатов, получали методом прядения / коагуляции с получением каркаса с содержанием альгината 0,1% хитозана. Альгинат представляет собой анионный полисахарид с кальциевой цепью, интеграция в который хитозан улучшает его биосовместимость и адгезионный потенциал клеток, а также снижает скорость его разложения. Оценка in vitro с использованием фибробластов сухожилия надколенника кролика показала, что каркасы с содержанием альгината 0,1% хитозана имели значительно более высокую адгезию клеток и отложение матрикса по сравнению с контрольными образцами, содержащими только альгинат и полиглактин 910.Материал с содержанием альгината 0,1% хитозана был оценен механически и показал более низкие прочность на разрыв и деформацию при разрушении, чем группа полиглактина [33]. Хитозан также был изготовлен с гиалуроновой кислотой с последующим мокрым прядением и гибридизацией для повышения механических свойств конструкции. Были исследованы различные концентрации гиалуроновой кислоты, и было показано, что комбинация хитозана с 0,1% гиалуроновой кислотой показала лучшее прикрепление клеток. Конечные композитные конструкции стерилизовали с использованием газообразного этиленоксида перед оценкой in vitro с фибробластами надколенника кролика.Механические свойства материалов снизились в течение первых 2 часов после посева, но последующий модуль сохранялся в течение 28 дней культивирования. Количественная оценка пролиферации клеток с использованием анализа содержания ДНК показала значительное улучшение в композициях хитозан-0,1% гиалуроновой кислоты по сравнению с другими каркасами на основе хитозана. Чтобы определить клинический потенциал композитных каркасов, авторы оценили композиты хитозан-0,1% гиалуроновой кислоты in vivo, лечя повреждения вращательной манжеты кролика с помощью каркасов с засеянными клетками [31].Каркасы культивировали с фибробластами сухожилия надколенника кролика в течение 4 недель перед имплантацией. Кроме того, авторы протестировали потенциал тканевой инженерии связок, используя модель повреждения медиальной коллатеральной связки кролика. Они использовали каркасы, засеянные фибробластами, адаптированными из ахиллова сухожилия кроликов, за 2 недели до имплантации. Для модели сухожилия результаты показали отложение коллагена в засеянных клетками каркасах со значительным улучшением механических свойств через 4–12 недель после имплантации.Для модели инженерии связок авторы показали отсутствие интеграции тканей с прикреплением костного туннеля с 60% восстановлением при разрушающей нагрузке по сравнению со здоровой связкой. Дополнительные исследования каркасов хитозан-гиалуроновая кислота имели целью понять влияние механической стимуляции на реакцию фибробластов [35]. Было обнаружено, что применение поворотов на 90 градусов и 5% растяжения при 0,5 Гц было связано с повышенной экспрессией фибромодулина и коллагенов I и III. Дальнейшей оценки общего механического влияния культивируемых матриц в динамических условиях не проводилось.
Кроме того, были изготовлены композитные каркасы из экструдированного сшитого бычьего коллагена I типа и хондроитин-6-сульфата [36]. Конструкции на основе коллагена прошли ряд стадий сшивания с использованием карбодиимида, 1-этил-3- (3-диметиламинопропил) карбодиимида (EDC) и N-гидроксисукцинимида (NHS). Сшивание объединяли с сушкой вымораживанием для включения пористого хондроитин-6-сульфата. Конечные конструкции имели открытую и взаимосвязанную пористость со средним размером пор 100 мкм мкм и выровненными по оси коллагеновыми волокнами.Механическая оценка показала, что сшитые композитные каркасы могут выдерживать 61,94 ± 15,54 Н по сравнению с 11,75 ± 2,62 Н без сшивки. Максимальная деформация составила 30,17 ± 7,17% с поперечносшитыми волокнами, а без нее — 15,40 ± 3,22%. Композиты со сшитыми волокнами показали предел прочности на разрыв 1,55 ± 0,30 МПа по сравнению с 0,24 ± 0,08 МПа для несшитых волокон. Важно отметить, что пористость каркаса обратно пропорциональна механической прочности, и необходимы дальнейшие исследования для оценки клеточного ответа такой конструкции для применения в инженерии тканей сухожилий и связок.
Желатин также использовался для изготовления композитного каркаса для инженерии тканей сухожилия. В процессе изготовления использовался соэлектроспиннинг выровненного поли- ε -капролактона (PCL) и метакрилированного желатина (mGLT) с последующим фото-поперечным сшиванием [34]. Сначала были изготовлены каркасные пленки, а затем были засеяны ADSC, после чего было выполнено фото-сшивание 5 слоев с использованием УФ-излучения для получения многослойного каркаса, имитирующего естественную структуру сухожилий.Оценка in vitro показала биосовместимость полученного композита, в котором ADSC были ориентированы вдоль продольного доступа выровненной волокнистой конструкции и экспрессировали маркеры, связанные с сухожилиями (склераксис и тенасцин-C), после стимуляции TGF β -3. Однако механическая оценка засеянных клетками поперечно-сшитых каркасов была намного хуже для потенциального клинического применения (подробности в таблице 1).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Другие группы объединили коллаген типа I с шелком для улучшения свойств каркаса для применения на сухожилиях [37]. Белок серицин экстрагировали из шелковых волокон, произведенных с помощью Bombyx mori , и смешивали с раствором коллагена для заполнения пробелов в сетке из шелковых волокон.Кроме того, адгезия и механическая прочность были увеличены за счет сшивания DTH. Мезенхимальные стволовые клетки, полученные из эмбриональных стволовых клеток человека (hEC-MSCs), были использованы в моделях in vitro и in vivo и показали, что механически нагруженные вязаные каркасы из шелковых / коллагеновых микрогубок могут индуцировать теногенную дифференцировку в мезенхимальных стволовых клетках и поддерживать регенерацию сухожилий до 360 градусов. дней после имплантации (таблица 1).
В дополнительном исследовании те же композитные каркасы были протестированы с добавлением рекомбинантного фактора-1 альфа, происходящего из стромальных клеток человека (rhSDF-1 альфа), к губкам с коллагеном I типа [38].SDF-1 — это хемокин, который способствует привлечению клеток и ускоряет регенерацию тканей. На модели ахиллова сухожилия мышей авторы показали, что этот подход обеспечивает более высокую экспрессию коллагена через одну неделю после имплантации, что указывает на ускоренное начало заживления сухожилия. Кроме того, механические свойства были незначительно выше, чем у каркасов без обработки rhSDF-1 альфа.
Чтобы улучшить механические свойства и регенерацию сухожилий, Chen X. et al. использовали те же композитные каркасы с чЕС-МСК [39].Клетки были генетически сконструированы для сверхэкспрессии гена склераксиса (SCX). SCX является фактором транскрипции, идентифицированным за его роль в качестве маркера теноцитов и вышестоящего регулятора генов, связанных с сухожилиями. Результаты in vitro и in vivo показали улучшенную регенерацию сухожилий и более качественное формирование неотендонов по сравнению с предыдущими исследованиями с теми же каркасами. Важно отметить, что остеогенная, хондрогенная и адипогенная дифференцировка SCX-hEC-MSC была меньше по сравнению с негенетически модифицированными MSC.Механические свойства ахиллова сухожилия мыши через восемь недель после имплантации были хуже, чем у нативной ткани сухожилия. Это исследование подчеркивает, что свойства каркаса важны для инженерии ткани сухожилия, но такие факторы, как используемые типы клеток, могут влиять на механические и гистологические результаты.
3.4. Синтетические и биологические композитные каркасы
Другие также сосредоточились на включении PLGA с материалами, полученными из шелка, для инженерии тканей сухожилий [40]. Композитный каркас состоял из микроволокон из дегуммированного шелка, покрытого электропряденым PLGA.Авторы рафинировали шелковые волокна, чтобы добиться более эффективного удаления серицина. Это привело к более гладкой поверхности волокон и сохранению общих механических свойств шелка. Исследования in vitro с использованием МСК, полученных из костного мозга кролика, показали хорошую жизнеспособность клеток в зависимости от применяемой техники посева (одинарный или двойной посев) и от того, имели ли скаффолды плоскую или свернутую / цилиндрическую морфологию. Скрученные структуры имели более низкую пролиферацию клеток по сравнению с другими конструкциями, но в целом электропряденый полимер PLGA обеспечивал большую площадь поверхности для пролиферации клеток.Чтобы увеличить дифференцировку теноцитов в MSCs, происходящих из костного мозга, авторы сообщили об модифицированном протоколе, в котором каркас имеет 1-недельное высвобождение основного фактора роста фибробластов (bFGF) [45]. bFGF смешивали с PLGA и бычьим сывороточным альбумином перед электропрядением с вязанными шелковыми волокнами. Результаты показали, что включение bFGF было связано с активацией теногенных маркеров во время дифференцировки МСК. Экспрессия коллагена также была увеличена, и это способствовало улучшению механических свойств каркаса.Комбинированный эффект включения фактора роста вместе с динамическими условиями культивирования может представлять интерес из-за его влияния на дифференцировку МСК и включение конструкции в целом.
Шарифи-Агдам М. и др. [46] исследовали композитный каркас, состоящий из трикотажного шелка, покрытого электропрядеными нановолокнами коллаген-I / полиуретан. Основная цель этого подхода состояла в том, чтобы включить слой полиуретанового полимера для увеличения прикрепления коллагена к шелковым волокнам. Тестирование in vitro с использованием засеянных человеческих фибробластов показало, что композитный каркас поддерживает адекватную клеточную метаболическую активность.Оценка механических свойств показала, что профиль предельного напряжения достигает 13,5 ± 1,5 МПа, а модуль Юнга — 21,7 ± 4 МПа. Однако дальнейшая оценка засеянных конструкций на их биосовместимость и функцию клеток не проводилась.
Исследовательская работа показала объединение шелка с нановолокнами, полученными либо из поликапролактона (PCL), либо из поли (3-гидроксибутирата) (P3HB) [41]. Композитный каркас был изготовлен методом электроспиннинга из различных полимерных материалов поверх скрученных волокон из фиброина шелка.Основная цель этого подхода состояла во внедрении нановолоконных структур в композитный каркас для увеличения отношения поверхности к объему и, следовательно, увеличения прикрепления клеток. Авторы продемонстрировали композитный каркас без токсического действия засеянных фибробластов с хорошей клеточной жизнеспособностью до 3-го дня после посева. Механическая оценка изготовленной конструкции показала максимальную нагрузку 97,6 ± 11,4 Н для фиброина шелка / P3HB и 110,5 ± 6,6 Н для фиброина шелка / PCL без статистической разницы между ними.Авторы, однако, не исследовали далее влияние клеточных функций или продукции матрикса или влияние посева клеток на связанные механические свойства.
Другие сосредоточились на модификации шелка для производства каркасов для регенерации сухожилий [42]. Дегуммированные сетки из фиброина шелка были объединены с сердцевинами из фиброина шелка, выровненными методом электропрядения [42]. При оценке in vitro с использованием МСК кроликов изучались эффекты согласованных методов изготовления по сравнению со случайным изготовлением в статических и динамических условиях культивирования.Результаты показали, что эффекты механической стимуляции МСК усиливались во время культивирования на выровненных каркасах из фиброина шелка. Динамический эффект применялся как в поступательном, так и во вращательном движении, чтобы имитировать среду in vivo. Это усиливает клеточную пролиферацию и ремоделирование с общим улучшением механических свойств. Помимо используемого материала, было доказано, что наличие выровненного ядра каркаса является важным для этих положительных эффектов по сравнению с такими же каркасами без выравнивания.Несколько авторов показали подобный эффект, когда топография была введена на поверхность полимерного каркаса с улучшением клеточного выравнивания и содержания коллагена, а также экспрессии различных белков внеклеточного матрикса, связанных с сухожилиями [43, 50].
В другом месте коллаген был объединен с различными полимерами с помощью ряда производственных технологий, чтобы имитировать неоднородную природу тканей сухожилий. Коллаген I типа был электроспряден с синтетическим поли (L-лактид-со-капролактоном) в соотношении 10:90 соответственно [47].Волокна были скручены в нанонити для получения 150 каркасов толщиной мкм и толщиной м. Каркасы, выровненные случайным образом или в нановолокнах, тестировали на пористость, морфологию поверхности и адгезию теноцитов. Результаты показали улучшенную пролиферацию клеток в каркасах из нанонити, но с плохими механическими свойствами, которые не пригодны для будущего клинического применения.
В последующем исследовании стволовые клетки, полученные из сухожилий (TDSC), были собраны из сухожилий надколенника кролика и засеяны на волокнистые каркасы [48].Оценка in vitro и in vivo в статических и динамических условиях показала, что композитные каркасы, засеянные TDSC, являются многообещающим средством для формирования неотендонов. Кроме того, механическая динамическая стимуляция засеянных клетками конструкций может значительно способствовать регенерации сухожилий по сравнению со статическими условиями культивирования.
Sensini A. et al. исследовали электроспряденный скаффолд, содержащий PLA и коллаген I типа [51]. Этот каркас имел достаточные механические свойства со смесями, содержащими PLA / коллаген 75:25, достигая модуля Юнга 98.6 ± 12,4 МПа в виде спиральных пучков и 205,1 ± 73,0 МПа после 14 дней погружения в PBS. Максимальное напряжение составляло 14,2 ± 0,7 МПа для скрученных пучков и 6,8 ± 0,6 МПа после 14 дней погружения в PBS. Теноциты были метаболически активными с хорошим выравниванием клеток, больше в смесях, содержащих соотношение PLA / коллаген 50:50.
Коллаген типа I был интегрирован также с другими композиционными смесями синтетических полимеров. Поликапролактон (PCL) / коллаген и поли-L-лактид (PLLA) / коллаген были оценены как потенциальные композитные материалы для тканевой инженерии сухожильно-мышечного соединения [52].Были изготовлены трехфазные каркасы с областями, в основном состоящими из PCL / коллагена в одной части, PLLA / коллагена в другой части и смеси обоих композитов в середине. Все конструкции обладали хорошей биоразлагаемостью и биосовместимостью. PCL поддерживал рост миобластов из-за его низкого профиля жесткости, а более высокая жесткость PLLA способствовала пролиферации фибробластов. Каркасы были изготовлены с использованием техники электропрядения в сочетании с сшивкой глутаральдегидом и коллагеном для увеличения механической прочности и прикрепления клеток соответственно.In vitro каркасы демонстрируют хорошую интеграцию клеток, жизнеспособность и образование мышечных трубок, как те, что обнаруживаются в соединениях сухожилий и мышц in vivo. Выровненные коллагеновые каркасы были изготовлены с поверхностным покрытием, содержащим нанопластинки из полидиоксанона (PDS) [32]. Оценка ахиллова сухожилия кролика продемонстрировала ту же биосовместимость, что и ранее протестированные электроспряденные коллагеновые каркасы. Дальнейшая детальная оценка композита с PDS и без нее показала значительное улучшение поглощения и выпуска воды.Гистологическая оценка показала хорошее выравнивание теноцитов, формирование неотендона и первоначальное усиление воспалительного клеточного ответа. Добавление листов PDS привело к уменьшению перитендиновых спаек с увеличением количества зрелых теноцитов и увеличению выравнивания коллагеновых фибрилл. Также наблюдались улучшенные механические свойства конструкции по сравнению с каркасами, изготовленными только из коллагеновых волокон [32, 50].
PLLA также использовался для изготовления композитного каркаса, в котором процесс электроспиннинга использовался для формирования выровненных нановолокон, которые позже были поперечно сшиты с хитозан-коллагеновым гидрогелем, имитирующим внеклеточный матрикс нативных сухожилий [53].Каркас скатывали и покрывали на внешней поверхности альгинатным гелем с целью создания антиадгезионного слоя вокруг конструкции. Каркас поддерживал выравнивание клеток и пролиферацию теноцитов без токсического эффекта. Кроме того, тесты на адсорбцию показали значительно меньше прикрепленных белков на поверхности с покрытием по сравнению с поверхностью без покрытия. Механическая оценка изготовленных каркасов не показала влияния процесса нанесения покрытия на прочность на разрыв изготовленных каркасов с влиянием на количество слоев, имеющее значение около 2 МПа для двухслойных каркасов с покрытием и без покрытия, тогда как оно составляло около 6 МПа для непокрытых каркасов и 4 МПа для покрытые 3-х слойные леса.Профиль деградации каркаса также был исследован и показал, что каркасы сохраняли 50% своего вещества через 21 день после инкубации с PBS, содержащим 10 4 единиц / мл раствора лизоцима.
E.C. Green et al. [54] исследовали изготовление композитного каркаса коллаген-I / наноуглеродные волокна для потенциального применения в тканевой инженерии сухожилий. Волокна были изготовлены методом гелевого прядения с использованием наполнения 0,5 и 5 мас.%. Затем следовало удлинение волокна со скоростью деформации 0.02 мм / с и последующее сшивание глутаральдегидом (GA). Характеристики материала показали, что полученная волокнистая конструкция похожа на нативный коллаген сухожилия с улучшенными механическими свойствами.
3.5. Сходства и различия между сухожилиями и связками
Сухожилия и связки имеют схожие структуры с различными фундаментальными свойствами и функциями. Сухожилия — это волокнистые неэластичные структуры, которые соединяют мышцы с костями в суставах, в то время как связки представляют собой волокнистые, но гибкие структуры, важные для поддержки костей и хрящей.На структурном уровне обе соединительные ткани плотны с различными клеточными и протеомными элементами. Механический анализ сухожилий и связок человека показал, что максимальная прочность на разрыв составляет от 4,4 до 660 МПа в зависимости от местоположения [55, 56]. Было показано, что максимальная деформация этих соединительных тканей составляет от 18 до 30%. Было показано, что модуль Юнга находится в диапазоне от 0,2 до 1,5 ГПа [57, 58]. Структурно сухожилия преимущественно состоят из матрикса коллагена I типа, содержащего теноциты и тенобласты.Напротив, связки содержат гликозаминогликан и более низкие уровни коллагена по сравнению с тканью сухожилия, при этом фибробласты являются основным клеточным элементом (рис. 2) [59, 60]. Kharaz Y. et al. сравнили состав внеклеточного матрикса как естественных, так и тканевых, сухожилий и связок [61]. Результаты показали, что, хотя тканеинженерные конструкции имеют тот же состав с нативной тканью в различных пропорциях, существуют фундаментальные различия. Специфические белки, такие как аспорин и теномодулин, были ограничены сухожилиями, тогда как версикан, протеогликан 4 и SOD3 были специфичными для связок (рис. 1).Выявление различий в экспрессии структурных белков указывает на то, что подходы к тканевой инженерии должны быть нацелены на воспроизведение этих различий на протеомном уровне. На сегодняшний день так было не всегда, и термины «сухожилие» и «связки» часто используются в литературе как синонимы. Это происходит главным образом потому, что две соединительные ткани обладают схожими функциональными и механическими свойствами [12]. Важно помнить, что источник клеток является основополагающим в определении типа производимого матрикса [61].Это подчеркивает внутреннюю клеточную память, которая различается между сухожилиями и связками. Для тканевой инженерии этих конкретных тканей важно учитывать их функциональные различия, чтобы можно было достичь биомимикрии. В конечном итоге это поможет улучшить интеграцию и восстановить функцию при замене поврежденного сухожилия или связок. Из этого ясно, что, хотя эти две ткани имеют несколько общих черт, разница существует.
4. Заключение и будущие направления
В этом обзоре обобщены текущие стратегии, основанные на использовании композитных биоматериалов для тканевой инженерии сухожилий и связок.Этот подход представляет собой способ решить проблему неоднородности сухожилий и связок. Хотя обе структуры обладают сходными механическими свойствами, их составляющие типы клеток и состав внеклеточного матрикса различаются. В настоящее время для инженерии ткани сухожилия необходимо решить несколько проблем. Во-первых, отсутствует необходимость в единой стандартной оценке, определяющей механические требования для успешной регенерации сухожилия. Что особенно важно, это должно включать в себя различные формы механической оценки (включая деформацию и вращение) с различными подходами к тканевой инженерии для имитации естественной среды.Этого сложно достичь и реализовать из-за неоднородной природы сухожилий. Вторая задача — решить и контролировать реакцию окружающей ткани на имплантированный каркас. До настоящего времени это ограничивалось наблюдением за внутренней реакцией заживления при применении in vivo. Кроме того, в большинстве исследований по использованию композитных материалов для инженерии тканей сухожилий и связок используются небольшие животные, такие как кролики, а не более крупные модели, такие как овцы или лошади [62].Такие ограничения основаны на значительном весе и различиях, связанных с механикой, между моделями in vivo и естественными тканями человека. Кроме того, при испытании модели следует учитывать возможность фиксации изготовленной конструкции на месте (с помощью швов, анкеров) и наличие срока хранения. Фактически, поверхность раздела каркас-сухожилие или каркас-кость представляет собой место, подверженное риску разрыва после имплантации, а не сами каркасы.
Описанные проблемы представляют собой потенциальную проблему для будущего клинического применения тканевых инженерных решений для сухожилий и связок.Требуются дальнейшие исследования роли композитных материалов, чтобы имитировать соответствующие структурные, механические и функциональные характеристики сухожилий и связок. В то время как синтетические материалы в настоящее время используются в клинической практике для восстановления сухожилий и связок, важно будет механически сопоставить их свойства с нативной тканью. Имитация механических свойств сухожилия особенно важна, так как это позволит ускорить физиотерапию и, следовательно, уменьшить образование рубцовой ткани, которое может развиться в суставную жесткость.Более того, это улучшит интеграцию и заживление в месте повреждения. Использование определенных факторов роста, таких как основной фактор роста фибробластов (bFGF) [45], также может применяться во время операции для улучшения интеграции тканей. Однако это требует строгого контроля и регулируемой среды. Поскольку современные композитные материалы могут быть адаптированы для соответствия различным механическим свойствам нативной ткани, они могут быть объединены с факторами роста и использоваться с клетками и без них, обеспечивая большое количество возможностей для их клинического использования в зависимости от места и степени повреждения.
Конфликт интересов
Ни один из авторов не имеет коммерческих ассоциаций или финансовых отношений, которые могли бы создать конфликт интересов с работой, представленной в этой статье.
Благодарности
Это исследование финансировалось Royal Free Charity (Премия № 167275).
Сухожилия и связки — структура и травма
Каждый владелец лошади знает, что сухожилия и связки являются жизненно важным компонентом конечностей нашей лошади и что здоровье сухожилий и связок очень важно для их прочности.Если вы все время задавались вопросом, из чего состоят сухожилия и связки или что на самом деле происходит при их травме, продолжайте читать.
Конская конечность содержит несколько сухожилий и даже больше связок. Сухожилия прикрепляют мышцы к костям, а связки прикрепляют кости к костям. Сухожилия часто называют в честь их функции. Например, сухожилие поверхностного сгибателя пальцев проходит вдоль задней части конечности от колена до того места, где оно прикрепляется к пястным костям. У него много функций, но одна из них — сгибать нижнюю конечность.Отсюда и название сухожилия «сгибатель». Сухожилия разгибателей находятся на передней части конечности и расширяют конечность. Поддерживающая связка — одна из важнейших связок конечности. Он простирается от задней части колена или скакательного сустава до сесамовидных костей, которые расположены в задней части суставного пальца. Многие связки довольно короткие, например, боковые связки, которые помогают стабилизировать почти каждый сустав.
Сухожилия и связки представляют собой сложные структуры. Они состоят из тысяч сложных молекул, называемых фибриллами коллагена.Фибриллы коллажа соединены с другими фибриллами, чтобы образовать коллагеновое волокно. Волокна соединяются вместе, образуя пучок. Маленькие пучки соединяются вместе, образуя все более крупные группы пучков, пока вы не создадите сухожилие. Эта очень структурированная внутренняя система организации — это то, что придает сухожилию его уникальную силу и функцию 1 . Коллаген — самая распространенная молекула в сухожилиях, но они также содержат другие молекулы, такие как протеогликаны. Коллаген и другие молекулы составляют основу сухожилия.Внутри этого каркаса живут три разных типа теноцитов или клеток сухожилий. Сухожилия также содержат большое количество воды. Семьдесят процентов веса сухожилия составляет вода 1,3 . По большей части способность сухожилия растягиваться происходит от скольжения пучков (помните, что это связки коллагена и клеток сухожилия) друг за другом. Небольшая часть способности сухожилия растягиваться обусловлена растяжением самих молекул коллагена. Ход сухожилия не всегда прямой. Подумайте о сухожилии глубокого сгибателя пальцев, которое начинается сразу за коленом, а затем, прежде чем прикрепиться к стопе, проходит вокруг задней части путового сустава.Когда сухожилия должны пересекать костный выступ, такой сустав, они обычно заключаются в оболочку сухожилия. Оболочка сухожилия содержит синовиальную жидкость, которая почти идентична жидкости, содержащейся в суставах. Это помогает уменьшить трение, когда сухожилие скользит по костной точке или по суставу. Оболочка сухожилия пальцевого сгибателя на тыльной стороне фетального сустава помогает облегчить прохождение глубокого сухожилия пальцевого сгибателя за фетровым суставом.
Сухожилия и связки выполняют множество функций.Они передают силы для движения, поддерживают нижнюю конечность, накапливают энергию и обеспечивают поддержку суставов. Сухожилия вязкоупругие, что означает, что они имеют разные свойства материала, поскольку к ним действуют разные силы. Чтобы перевести предложение на английский, одно и то же усилие не всегда приводит к одинаковому растяжению сухожилий. Когда сила сначала применяется к сухожилию, оно немного растягивается, так как сами пучки растягиваются. По мере того как к сухожилию прилагается больше силы, пучки начинают скользить друг мимо друга, и величина растяжения на единицу силы меньше, чем была изначально.Таким образом, сухожилие становится более жестким. Это предсказуемое соотношение увеличения силы, приводящего к увеличению растяжения сухожилий, происходит до тех пор, пока нагрузка не станет слишком большой, и структуры сухожилий не начнут разрушаться. Это называется пределом текучести. Как только это происходит, сухожилию наносится непоправимый ущерб, и происходит его повреждение 1,3 .
Существует два основных типа травм сухожилий и связок; внешние травмы и травмы от перенапряжения. К внешним травмам относятся удары ногами, чрезмерные травмы и порезы.Травмы от перенапряжения возникают по двум основным причинам. Один из них — внезапная большая перегрузка сухожилия, которая раньше была нормальной. Чаще встречается второй тип травм. Этот тип травмы представляет собой хроническое постепенное нарастание деградации сухожилий или микротравм. Это повреждение накапливается бесшумно, без каких-либо внешних признаков, пока повреждение не станет слишком сильным и сухожилие внезапно не выйдет из строя, что приведет к серьезной травме.
Повреждения сухожилий и связок приводят к нарушению высокоорганизованной внутренней организации этих структур.Первоначально происходит кровоизлияние или кровотечение в сухожилие или связке. Далее следует период значительного воспаления. Приток крови к пораженному участку увеличивается, возникает отек или припухлость, а в месте повреждения скапливаются лейкоциты. Вы видите это внешне как увеличенное, горячее и болезненное сухожилие или связку. Это первый этап восстановления сухожилия или связки, предназначенный для удаления мертвых волокон и клеток сухожилия, однако воспаление может выйти из-под контроля и привести к еще большему повреждению.Лечение во время этой фазы направлено на уменьшение воспаления с помощью таких действий, как обледенение или обливание водой из шланга, или введение противовоспалительных препаратов, таких как фенилбутазон. Воспалительная фаза короткая, длится несколько дней и перекрывается со следующей стадией заживления сухожилий, то есть репаративной фазой. Во время этой фазы внутри сухожилия откладывается новая ткань. Эта рубцовая ткань имеет другой состав, чем нормальная ткань сухожилия. Одно из самых больших различий — это тип коллагена (помните, что коллаген составляет основную часть сухожилия или связки).В нормальном неповрежденном сухожилии преобладает коллаген I типа. Новая ткань, отложившаяся после травмы, имеет преобладание коллагена III типа и по существу представляет собой рубцовую ткань сухожилия 4 . Эти разные коллагены имеют разные структурные свойства, что означает, что новое сухожилие не так прочно, как старое. Точно так же, как шрам на вашей коже не такой прочный, как нормальная кожа, сухожилие рубца не так прочно, как нормальное сухожилие. Следующая фаза заживления сухожилия, фаза ремоделирования, может длиться до 18 месяцев после травмы.Во время этой фазы количество коллагена I типа постепенно увеличивается, но никогда не возвращается к исходной концентрации. Тело способно восстановить травму, но рубцовая ткань никогда не будет такой же, как исходная ткань сухожилия 4 . Оно более жесткое, чем нормальное сухожилие (не растягивается при нагрузке) и более склонно к повторным травмам 1 . Зоны перехода между нормальной тканью сухожилия и рубцовой тканью — это другие области, склонные к последующим травмам. Несмотря на то, что рубцовая ткань сухожилия никогда не будет такой же, как неповрежденное сухожилие, можно оптимизировать тип развивающейся рубцовой ткани с помощью тщательного управления типами и количеством сил, прикладываемых к сухожилию или связке во время фазы заживления.Вот почему работа с вашим ветеринаром для разработки и проведения тщательно спланированной реабилитационной программы отдыха с постепенно увеличивающимися контролируемыми упражнениями так важна для заживления сухожилий и связок.
Здоровые сухожилия и связки чрезвычайно важны для работоспособности наших конных спортсменов. Повреждение этих структур является существенной причиной хромоты у лошадей. По мере того, как мы лучше понимаем структуру и функцию этих тканей, мы можем лучше лечить и, надеюсь, предотвращать травмы.Следите за обновлениями, чтобы увидеть следующую статью, посвященную лечению травм сухожилий и связок.
Список литературы
- Avella CS, Smith RKW. Диагностика и лечение заболеваний сухожилий и связок. Хирургия лошадей. Эд Ауэр JA, Stick JA.
- Stanley RL, Edwards LJ, Goodship AE, Firth EC, Paterson-Kane JC. Влияние упражнений на клеточность теноцитов и морфологию ядра теноцитов в незрелых и зрелых сухожилиях пальцев рук лошади. Ветеринар для лошадей J . (2008) 40 (2) 141-146
- Clegg PD.Заболевания и травмы опорно-двигательного аппарата сейчас и в будущем. Часть 2: Травмы сухожилий и связок. Ветеринар для лошадей J .

