Растительный Белок в Продуктах — Фитогаленика — официальный сайт
Если вы хотите получать больше белка из растительных источников, то вот самые эффективные продукты-источники растительного белка:
- СОЕВЫЕ ПРОДУКТЫ: Эдамаме, Спаржа, Тофу, Йофу
- БОБОВЫЕ: Фасоль, Чечевица и Горох
- СЕЙТАН
- КАШИ: Киноа, Овсянка, Гречка, Бурый Рис
- СЕМЕЧКИ: Тыквенные, Подсолнечные, Кунжутные, Чиа
- ОРЕХИ: Арахис, Миндаль, Кешью, Грецкие и другие
Далее в этой статье мы подробно расскажем о растительном белке и продуктах — его источниках.
Норма Потребления |Дефицит |Продукты |Соевые Продукты |Бобовые |Сейтан |Каши |Семечки |Орехи |Обогащенные продукты |Добавки |Усвояемость |Переизбыток
Норма Потребления Растительного Белка
 Она равна 50-117 г в сутки для мужчин и 50-87 г в сутки для женщин. Для детей норма составляет 2,2-2,9 г белка на килограмм массы тела для детей до года, и 36-87 г в сутки для детей старше одного года.
Она равна 50-117 г в сутки для мужчин и 50-87 г в сутки для женщин. Для детей норма составляет 2,2-2,9 г белка на килограмм массы тела для детей до года, и 36-87 г в сутки для детей старше одного года.Многие специалисты считают, что для оптимального функционирования организма необходимо несколько больше этого количества. Одна из рекомендаций: 0,8 г на килограмм веса для взрослого и 1-1,5 г на килограмм веса для пожилых.
В этой статье использована Рекомендованная Норма Потребления (РСН) белка — 50 грамм в сутки.
При этом рекомендуется, чтобы доля белков растительного происхождения в рационе не превышала для взрослых — 50%, а для детей — 40%. Это связано с намного более низкой усвояемостью растительных белков по сравнению с белками животного происхождения.
О продуктах с высоким содержанием животного белка см. в статье «Белок в продуктах«.
Дефицит Белка
Дефицит белка — один из основных аргументов против вегетарианской диеты. Поэтому включение в рацион растительных продуктов, богатых белком, имеет в этом случае большое значение.
В организме белок расщепляется на 20 аминокислот, необходимых различным системам и органам. В белке растительного происхождения часто отсутствуют одна или более из необходимых аминокислот, поэтому при вегетарианской диете необходимо использовать разнообразные источники растительного белка для получения всех необходимых аминокислот.
Дефицит необходимых аминокислот в организме может привести к серьёзным проблемам со здоровьем: отёкам, ожирению печени, повышенному риску переломов и инфекций, снижению мышечной массы и проблемами с ростом, лишнему весу, а также ухудшению состояния кожи, волос и ногтей.
Продукты Питания с Высоким Содержанием Растительного Белка
Из натуральных продуктов больше всего растительного белка содержится в различных соевых продуктах, а также бобах, зёрнах и семенах.
Таблица: Растительный Белок в Одной Порции Приготовленных Продуктов
| Продукт | Порция | Содержание Растительного Белка |
|---|---|---|
| Сыр Тофу | 252 г (стакан кубиков, 363 ккал) | 43,5 г (87 % РСН) |
| Соевые Бобы Эдамаме | 172 г (cтакан, 296 ккал) | 31,3 г (63% РСН) |
| Соевая Спаржа | 85 г (150 ккал) | 21 г (42% РСН) |
| Чечевица | 198 г (стакан, 230 ккал) | 17,9 г (36% РСН) |
| Фасоль Адзуки | 230 г (стакан, 294 ккал) | 17,3 г (35% РСН) |
| Сейтан | 76 г (90 ккал) | 17 г (34% РСН) |
| Горох | 196 г (стакан, 231 ккал) | 16,3 г (33% РСН) |
| Белая Фасоль | 198 г (стакан, 254 ккал) | 16,1 г (32% РСН) |
| Фасоль Пинто | 171 г (стакан, 245 ккал) | 15,4 г (31% РСН) |
| Фасоль Кидни | 177 г (стакан, 225 ккал) | 15,3 г (31% РСН) |
| Чёрная Фасоль | 172 г (стакан, 227 ккал) | 15,2 г (30% РСН) |
| Нут | 164 г (стакан, 269 ккал) | 14,5 г (29% РСН) |
| Фасоль Маш | 202 г (стакан, 212 ккал) | 14,2 г (28% РСН) |
| Фасоль Лима | 170 г (стакан, 209 ккал) | 11,6 г (23% РСН) |
| Зелёный Горошек | 160 г (cтакан, 134 ккал) | 8,6 г (17% РСН) |
| Тыквенные Семечки | 28 г (163 ккал) | 8,5 г (17% РСН) |
| Каша Киноа | 185 г (стакан, 222 ккал) | 8,1 г (16% РСН) |
| Арахис | 28 г (161 ккал) | 7,3 г (15% РСН) |
| Миндаль | 28 г (164 ккал) | 6 г (12% РСН) |
| Соевый Йогурт | 170 г (160 ккал) | 6 г (12% РСН) |
| Овсяная Каша | 234 г (стакан, 166 ккал) | 5,9 г (12% РСН) |
| Гречневая Каша | 168 г (стакан, 155 ккал) | 5,7 г (11% РСН) |
| Бурый Рис | 202 г (чашка, 248 ккал) | 5,5 г (11% РСН) |
| Семечки | 28 г (165 ккал) | 5,5 г (11% РСН) |
| Шпинат | 180 г (стакан, 41 ккал) | 5,3 г (11% РСН) |
| Листовая Капуста | 190 г (стакан, 63 ккал) | 5,1 г (10% РСН) |
| Тыква Хаббард | 205 г (стакан нарезки, 71 ккал) | 5,1 г (10% РСН) |
| Сладкий Картофель | 255 г (cтакан пюре, 258 ккал) | 5 г (10% РСН) |
| Кунжутные Семечки | 18 г (чайная ложка, 160 ккал) | 4,8 г (10% РСН) |
| Семена Чиа | 28 г (138 ккал) | 4,7 г (9% РСН) |
| Курага | 130 г (стакан, 313 ккал) | 4,4 г (9% РСН) |
| Кешью | 28 г (порция орехов кешью, 163 ккал) | 4,3 г (9% РСН) |
| Свёкла | 170 г (74 ккал) | 2,9 г (6% РСН) |
1.
 Соевые Продукты
Соевые ПродуктыСоевые продукты — эдамаме (соевые бобы), соевая спаржа, тофу (соевый сыр) и йофу (соевый йогурт) — отличные источники растительного белка.
Соевые бобы Эдамаме
Соевые бобы Эдамаме — незрелые соевые бобы со сладким и немного травянистым вкусом.
Cтакан вареных бобов Эдамаме (172 г, 296 ккал) содержит 31,3 г растительного белка (63% РСН).
Эта порция также содержит клетчатку (41% РСН), медь (78% РСН), железо (49% РСН), магний (35% РСН), фосфор (34% РСН), селен (23% РСН), калий (19% РСН), цинк (18% РСН) и кальций (13% РСН).
Бобы эдамаме можно варить или готовить на пару. Они используются в качестве гарнира или как добавка к супам, соусам и салатам. Эдамаме нужно замачивать 8-10 часов и варить 3-3,5 часа.
Сыр Тофу
Тофу производят из соевого творога по технологии, похожей на сыроварение.
Один стакан кубиков тофу (252 г, 363 ккал) содержит 43,5 г растительного белка (87% РСН).
Эта порция также содержит растительную омега-3 (92% РСН), омега-6 (64% РСН), клетчатку (23% РСН), витамин В1 (33% РСН), витамин В2 (20% РСН), фолиевую кислоту (18% РСН), витамин В6 (14% РСН), кальций (132% РСН), медь (106% РСН), селен (80% РСН), фосфор (38% РСН), железо (37% РСН), цинк (36% РСН), магний (35% РСН) и калий (13% РСН).
Тофу почти безвкусный, однако хорошо вбирает вкус и запах тех ингредиентов, вместе с которыми его готовят. Его можно жарить и использовать в супах и соусах.
Соевая спаржа
Соевая спаржа — продукт из Азии. Его получают из пенки, образующейся на поверхности кипящего насыщенного соевого молока.
Порция соевой спаржи (85 г, 150 ккал) содержит 21 г растительного белка (42% РСН).
Эта порция также содержит клетчатку (12% РСН) и железо (15% РСН).
Её используют как отдельную закуску, а также добавляют в салаты и другие блюда.
Соевый йогурт (Йофу)
Соевый йогурт (йофу) — низкокалорийный продукт на основе соевого белка с добавлением полезных молочнокислых микроорганизмов.
Порция соевого йогурта (170 г, 160 ккал) содержит 6 г растительного белка (12% РСН).
Эта порция также содержит кальций (23% РСН) и железо (6% РСН).
Соевый йогурт йофу, как и обычный йогурт, можно есть отдельно или добавлять в различные салаты, холодные и горячие блюда.
2. Бобовые
Чечевица
Чечевица — вид бобовых. Она одна из лучших источников растительного белка.
Один стакан готовой чечевицы (198 г, 230 ккал) содержит 17,9 г растительного белка (36% РСН).
Эта порция также содержит клетчатку (63% РСН), фолиевую кислоту (90% РСН), витамин В1 (28% РСН), витамин В4 (25% РСН), витамин В6 (21% РСН), витамин В3 (13% РСН), витамин В2 (11% РСН), медь (55% РСН), железо (37% РСН), фосфор (29% РСН), цинк (23% РСН), магний (17% РСН), калий (16% РСН) и селен (10% РСН).
Чечевица не требует замачивания и прекрасно подходит для гарниров, супов и пюре.
Горох
Горох — мелкие круглые бобы, которые могут быть разного цвета, в зависимости от сорта.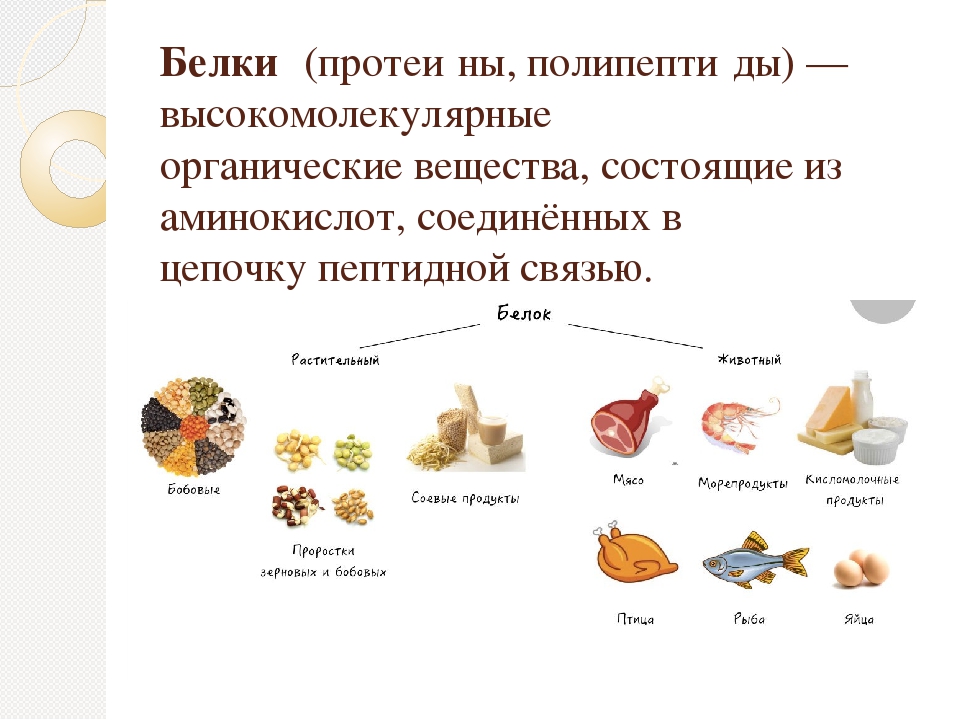
Стакан приготовленного гороха (196 г, 231 ккал) содержит 16,3 г растительного белка (33% РСН).
Эта порция также содержит клетчатку (65% РСН), фолиевую кислоту (32% РСН), витамин В1 (31% РСН), витамин В4 (23% РСН), витамин В3 (11% РСН), медь (39% РСН), цинк (18% РСН), магний (17% РСН), фосфор (16% РСН), калий (15% РСН) и железо (14% РСН).
Горох едят в основном в варёном виде. Перед варкой сушёный горох нужно замочить на пару часов. Из него готовят супы, пюре, начинки для пирожков, консервы, используют как добавку при выпечке пшеничного хлеба.
Нут
Нут — крупные семена, внешне напоминающие бараньи головы, богатые белком и другими питательными элементами.
Один стакан вареного нута (164 г, 269 ккал) содержит
Эта порция также содержит клетчатку (50% РСН), фолиевую кислоту (71% РСН), витамин В1 (16% РСН), витамин В6 (13% РСН), медь (64% РСН), железо (26% РСН), цинк (23% РСН), фосфор (22% РСН), магний (19% РСН), селен (11% РСН) и кальций (6% РСН).
Нут используют в приготовлении различных супов, салатов, плова, рагу, фалафеля и хумуса. Нут нужно замачивать в течение 4-х часов и варить 2,5 часа.
Фасоль адзуки
Адзуки — красная мелкая фасоль, очень популярная в азиатских странах.
Один стакан готовой адзуки (230 г, 294 ккал) содержит 17,3 г растительного белка (35% РСН).
Эта порция также содержит клетчатку (67% РСН), фолиевую кислоту (70% РСН), витамин В1 (22% РСН), витамин В4 (20% РСН), витамин В6 (13% РСН), витамин В2 (11% РСН), витамин В3 (10% РСН), цинк (37% РСН), фосфор (31% РСН), магний (28% РСН), железо (26% РСН) и калий (26% РСН).
Адзуки не требует замачивания и годится для многих блюд. Из неё готовят гарниры, соусы и супы, а также красную бобовую пасту для десертов. Её также можно проращивать и добавлять в салаты в качестве витаминной добавки.
Белая фасоль
Белая фасоль — самый распространённый вид бобовых, используемый во всём мире.
Стакан готовой белой фасоли (198 г, 254 ккал) содержит 16,1 г растительного белка (32% РСН).
Такая порция также содержит растительную омега-3 (14% РСН), клетчатку (74% РСН), фолиевую кислоту (61% РСН), витамин В1 (35% РСН), витамин В6 (13% РСН), медь (30% РСН), магний (29% РСН), железо (28% РСН), фосфор (24% РСН), калий (18% РСН), цинк (18% РСН) и кальций (10% РСН).
Белую фасоль можно использовать в супах, гарнирах, а также салатах и закусках. С ней выпекают пироги и лепёшки. Употребляют для обогащения колбасных изделий, приготовления салатов, супов борщей, щей, паштетов, котлет, тушёных овощей, лобио, грибов. Её готовят в томатах, сметане и майонезе. При варке её нужно предварительно замачивать в течение 4-х часов затем промыть проточной водой и варить 2 часа.
Фасоль пинто
Фасоль пинто (пёстрая фасоль) — мелкая золотистая фасоль с красными пятнышками, популярная в Северной и Латинской Америке.
Стакан готовой фасоли пинто (171 г, 245 ккал) содержит 15,4 г растительного белка (31% РСН).
Эта порция также содержит растительную омега-3 (15% РСН), клетчатку (62% РСН), фолиевую кислоту (74% РСН), витамин В1 (28% РСН), витамин В6 (23% РСН), витамин Е (11% РСН), медь (42% РСН), магний (20% РСН), железо (20% РСН), фосфор (20% РСН), селен (19% РСН), калий (16% РСН) и цинк (15% РСН).
Фасоль пинто можно добавлять салат, супы и горячие блюда. При варке пинто нужно предварительно замачивать в течение 4-х часов, затем промыть проточной водой и варить 1-1,5 часа или готовить на сковороде около 30 минут.
Фасоль кидни
Фасоль кидни — мелкая тёмно-красная фасоль.
Один стакан готовой фасоли кидни (177 г, 225 ккал) содержит 15,3 г растительного белка (31% РСН).
Эта же порция содержит растительную омега-3 (19% РСН), клетчатку (45% РСН), фолиевую кислоту (58% РСН), витамин В1 (24% РСН), витамин К (12% РСН), витамин В6 (12% РСН), медь (42% РСН), железо (22% РСН), фосфор (20% РСН), магний (18% РСН), цинк (16% РСН) и калий (15% РСН).
Фасоль кидни — основа латиноамериканской кухни, например, блюда Чили Кор Корне. Она хорошо подходит для рагу, фаршированных овощей, гарниров, соусов и супов. При варке её нужно предварительно замачивать в течение 4-х часов затем промыть проточной водой и варить 1-1,5 часа.
Чёрная фасоль
Чёрная фасоль — мелкие чёрные бобы, популярные в Мексике.
Один стакан приготовленной черной фасоли (172 г, 227 ккал) содержит 15,2 г растительного белка (30% РСН).
Эта порция также содержит растительную омега-3 (11% РСН), клетчатку (60% РСН), фолиевую кислоту (64% РСН), витамин В1 (35% РСН), медь (40% РСН), магний (29% РСН), железо (20% РСН), фосфор (19% РСН), цинк (18% РСН) и калий (13% РСН).
Чёрная фасоль обладает нежным грибным вкусом. Она хорошо подходит для различных мексиканских рецептов, а также для блюд из рыбы и морепродуктов. Маш нужно замачивать в течение 4-х часов и варить 1,5 часа.
Фасоль маш
Маш — зернобововая культура родом из Индии. Её вырарщивают также в Юго-Восточной Азии и Японии. Маш бывает зелёной и красной.
Её вырарщивают также в Юго-Восточной Азии и Японии. Маш бывает зелёной и красной.
Стакан готовой фасоли маш (202 г, 212 ккал) содержит 14,2 г растительного белка (28% РСН).
Эта порция также содержит клетчатку (61% РСН), фолиевую кислоту (80% РСН), витамин В1 (28% РСН), витамин В4 (17% РСН), медь (35% РСН), магний (23% РСН), железо (16% РСН), фосфор (16% РСН), цинк (15% РСН) и калий (11% РСН).
Из фасоли маш готовят многие традиционные блюда различных национальных кухонь. Его также добавляют в салаты, первые и вторые блюда. Маш нужно замачивать в течение 4-х часов и варить 1 час.
Фасоль лима
Фасоль лима — крупные белые бобы с кремообразной структурой и мягким вкусом.
Стакан готовой лима (170 г, 209 ккал) содержит 11,6 г растительного белка (23% РСН).
Эта порция также содержит растительную омега-3 (5% РСН), клетчатку (37% РСН), витамин В1 (20% РСН), витамин В6 (19% РСН), витамин С (19% РСН), витамин В2 (13% РСН), фолиевую кислоту7 (11% РСН), витамин В3 (11% РСН), медь (58% РСН), магний (30% РСН), калий (21% РСН), железо (21% РСН), фосфор (18% РСН) и цинк (12% РСН).
Фасоль можно использовать в супах, овощных гарнирах, а также для тушения и запекания. Её нужно замачивать в течение 4-х часов и варить 1-1,5 часа.
Зелёный горошек
Зелёный горошек — незрелый горох сразу после сбора. В продаже он встречается в свежем, мороженом, сушёном и консервированном виде.
Cтакан вареного зеленого горошка (160 г, 134 ккал) содержит 8,6 г растительного белка (17% РСН).
Эта порция также содержит клетчатку (35% РСН), витамин К (35% РСН), витамин В1 (35% РСН), витамин С (25% РСН), фолиевую кислоту (25% РСН), витамин В3 (20% РСН), витамин В2 (18% РСН), медь (31% РСН), цинк (17% РСН), магний (15% РСН), фосфор (15% РСН) и железо (14% РСН).
Из зелёного горошка готовят суп-пюре, паштет с тресковой печенью, гороховый суп с яблоками, с грибами, гороховый кисель, салаты и многое другое.
3. Сейтан
Сейтан
Сейтан — популярный источник белка для вегетарианцев и веганов.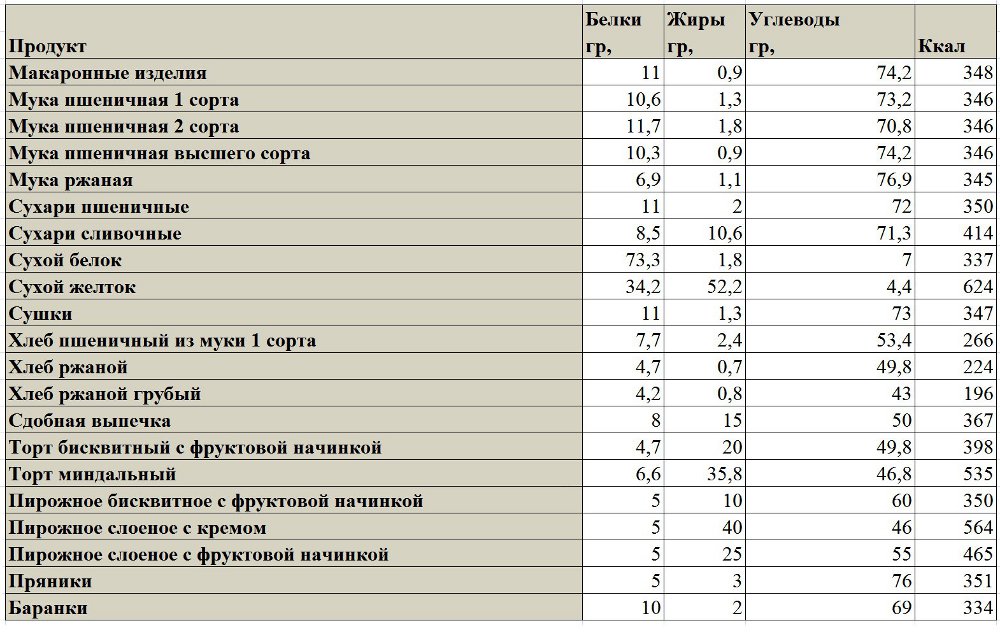 Он готовится из глютена (клейковины) — пшеничного белка. В отличие от соевого белка, после приготовления он напоминает по структуре обычное мясо.
Он готовится из глютена (клейковины) — пшеничного белка. В отличие от соевого белка, после приготовления он напоминает по структуре обычное мясо.
Одна порция сейтана (76 г, 90 ккал) содержит 17 г растительного белка (34% РСН) и железо (45% РСН).
Сейтан продаётся в виде сырых, вяленых и копчёных кусков, колбасы, котлет для бургера и пр. Его можно жарить, тушить и даже жарить на гриле, поэтому его удобно использовать в различных блюдах.
4. Каши
Каша киноа
Киноа — низкокалорийная крупа с высоким содержанием белка родом из Латинской Америки.
Стакан готовой каши киноа (185 г, 222 ккал) содержит 8,1 г растительного белка (16% РСН).
Эта порция также содержит клетчатку (21% РСН), фолиевую кислоту (19% РСН), витамин В2 (16% РСН), витамин В1 (16% РСН), витамин В6 (13% РСН), витамин Е (8% РСН), медь (39% РСН), магний (28% РСН), фосфор (22% РСН), цинк (18% РСН), железо (15% РСН) и селен (9% РСН).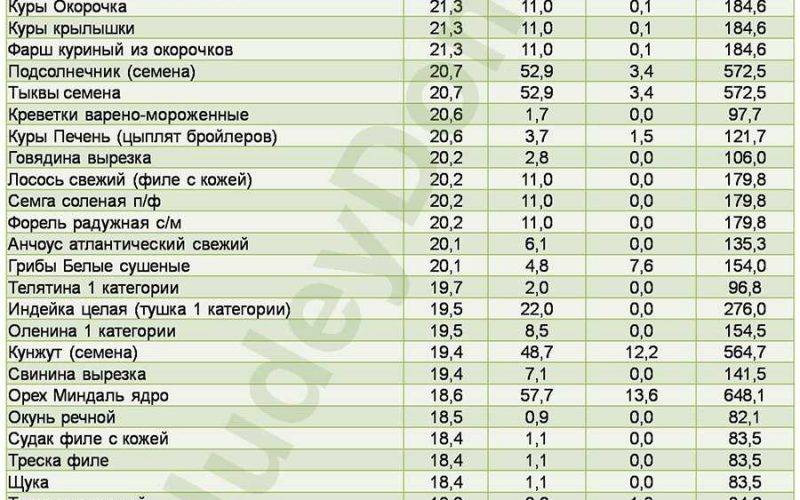
По вкусу каша киноа напоминает рис. Она быстро варится (15-20 минут) и хорошо подходит для гарниров, супов и салатов.
Овсяная каша
Овсяные хлопья — одна из самых полезных зерновых продуктов. Они содержат много клетчатки, железа, магния, цинка, витамина В1 и другие полезные элементы.
Стакан готовой овсянки (234 г, 166 ккал) содержит 5,9 г растительного белка (12% РСН).
Такая порция также содержит клетчатку (16% РСН), витамин В1 (15% РСН), витамин В4 (15% РСН), селен (23% РСН), цинк (21% РСН), медь (19% РСН), магний (15% РСН), фосфор (14% РСН) и железо (12% РСН).
Из овсяных круп готовят каши, варят супы, кисели.
Гречневая каша
Гречка крупа гречихи посевной — распространённой крупяной хлебной культуры.
Стакан готовой гречки (168 г, 155 ккал) содержит 5,7 г растительного белка (11% РСН).
Эта порция также содержит клетчатку (18% РСН), витамин В4 (12% РСН), витамин В3 (10% РСН), медь (27% РСН), магний (20% РСН) и железо (7% РСН).
Гречневая крупа используется для приготовления гречневой каши, запеканок, супов. Гречневую муку добавляют при выпечке хлеба, блинов, оладий и лепёшек. Её также используют в производстве различных макаронных изделий.
Бурый рис
Бурый рис более питательный и содержит намного больше клетчатки, чем обычный белый рис. Замена обычного риса бурым в рационе может принести существенную пользу для здоровья.
Чашка готового бурого риса (202 г, 248 ккал) содержит 5,5 г растительного белка (11% РСН).
Эта порция также содержит клетчатку (13% РСН), витамин В3 (32% РСН), витамин В1 (30% РСН), витамин В6 (15% РСН), витамин В4 (15% РСН), витамин В2 (11% РСН), медь (24% РСН), селен (21% РСН), магний (19% РСН), фосфор (17% РСН) и цинк (13% РСН).
Бурый рис используется для приготовления каш, пловов, запеканок, пудингов, как гарнир к многочисленным мясным и овощным блюдам, как начинка для изделий из теста.
5.
 Семечки
СемечкиТыквенные семечки
Семена тыквы — полезный продукт, богатый витаминами и минеральными веществами. Их широко используют в кулинарии, а также выжимают из них тыквенное масло.
Небольшая порция очищенных тыквенных семечек (28 г, 163 ккал) содержит 8,5 г растительного белка (17% РСН).
Эта порция также содержит омега-6 (33% РСН), клетчатку (7% РСН), медь (40% РСН), магний (37% РСН), фосфор (27% РСН), цинк (20% РСН) и железо (13% РСН).
Тыквенные семечки едят в натуральном виде, добавляют в салаты, выпечку, первые и вторые блюда. При выборе следует убедиться, что тыквенные семечки сухие, а кожица — без тёмных пятен.
Семечки
Семечки — высушенные семена подсолнечника, используемые в основном для производства подсолнечного масла. Выведены сорта, содержащие до 80% масла. Лишь небольшая часть семян подсолнечника употребляется в натуральном виде.
Небольшая порция жареных семечек (28 г, 165 ккал) содержит 5,5 г растительного белка (11% РСН).
Эта порция также содержит омега-6 (55% РСН), клетчатку (13% РСН), витамин Е (49% РСН), витамин В4 (40% РСН), фолиевую кислоту (17% РСН), витамин В6 (13% РСН), витамин В3 (12% РСН), медь (58% РСН), селен (41% РСН), фосфор (26% РСН), цинк (14% РСН) и магний (9% РСН).
В большинстве стран семечки продаются лущёными и используются для различных блюд. Из них также готовят заменитель кофе, халву, конфеты и другие десерты. Выбирать лучше необжаренные семечки, так как в них больше полезных веществ, чем в обжаренных.
Кунжутные семечки
Кунжутное семя известно с незапамятных времён. Сегодня его используют во всём мире, добавляя в различные блюда. Кунжут бывает белый и чёрный.
Чайная ложка кунжутных зерен (18 г, 160 ккал) содержит 4,8 г растительного белка (10% РСН).
Эта порция также содержит омега-6 (35% РСН), омега-3 (6% РСН), клетчатку (16% РСН), витамин В1 (19% РСН), витамин В6 (13% РСН), медь (78% РСН), магний (24% РСН), железо (23% РСН), кальций (22% РСН), селен (18% РСН), цинк (18% РСН) и фосфор (14% РСН).
Кунжут обладает выраженным ореховым вкусом. Его добавляют в выпечку, холодные и горячие блюда из мяса, рыбы и морепродуктов.
Семена чиа
Семена чиа родом из Южной Америки. Они хорошо утоляют голод и часто используются в диетах для похудения.
Порция семян чиа (28 г, 138 ккал) содержит 4,7 г растительного белка (9% РСН).
Эта порция также содержит растительную омега-3 (316% РСН), омега-6 (10% РСН), клетчатку (39% РСН), витамин В3 (16% РСН), витамин В1 (15% РСН), медь (29% РСН), селен (29% РСН), магний (23% РСН), фосфор (20% РСН), кальций (14% РСН), железо (12% РСН) и цинк (12% РСН).
Семена чиа используют как овсяные хлопья для завтрака: заливают горячим молоком или йогуртом. Их можно проращивать, а полученные ростки добавлять в супы и салаты. Из семян чиа готовят десерты и приправы.
6. Орехи
Арахис
Арахис — плоды растения семейства бобовые. Они напоминают орешки, но находятся в сухом стручке, как у других бобовых.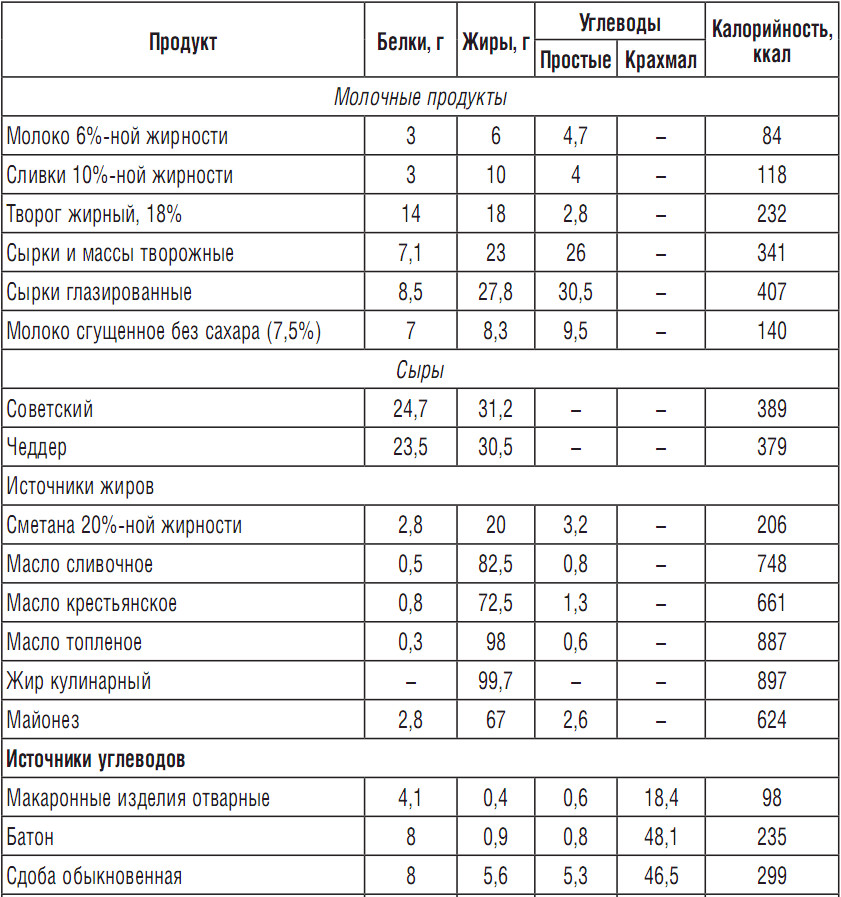
Порция арахиса (28 г, 161 ккал) содержит 7,3 г растительного белка (15% РСН).
Эта порция также содержит омега-6 (26% РСН), клетчатку (10% РСН), витамин В3 (21% РСН), фолиевую кислоту (17% РСН), витамин Е (16% РСН), витамин В1 (15% РСН), витамин В4 (10% РСН), медь (36% РСН), магний (11% РСН) и фосфор (9% РСН).
Достоинство арахиса — его низкая цена, поэтому он часто используется как заменитель более дорогих орехов. Его добавляют в сладости, салаты, другие холодные и горячие блюда. Выбирать следует более свежий арахис с запасом до истечения срока годности.
Миндаль
Миндаль, строго говоря, не орех, а плод растений рода слива. Он произрастает во многих странах и широко используется в кулинарии.
Порция миндаля (28 г, 164 ккал) содержит 6 г растительного белка (12% РСН).
Эта порция также содержит омега-6 (21% РСН), клетчатку (14% РСН), витамин Е (49% РСН), витамин В2 (25% РСН), медь (33% РСН), магний (18% РСН), фосфор (11% РСН), цинк (8% РСН), кальций (6% РСН) и цинк (% РСН).
Миндаль едят отдельно и добавляют в разные блюда. Он хорошо сочетается с другими орехами, шоколадом, фруктами и выпечкой. Покупать лучше целиковый миндаль, так как молотый и расколотый быстро портится.
Кешью
Орехи кешью крупные орехи родом из Бразилии. По сравнению с другими орехами они очень редко вызывают аллергию.
Порция орехов кешью (28 г, 163 ккал) содержит 4,3 г растительного белка (9% РСН).
Эта порция также содержит омега-6 (13% РСН), витамин К (8% РСН), медь (70% РСН), магний (18% РСН), цинк (14% РСН), фосфор (11% РСН) и железо (9% РСН).
В продаже кешью встречается в сыром или обжаренном виде, целый или расколотый на половинки. Кешью едят отдельно, а также добавляют в салаты, соусы, десерты и другие горячие и холодные блюда. Его также широко используют в азиатской кухне как добавку к различным блюдам и основы для соусов. Хранить кешью лучше в холодильнике до 2-3 месяцев или в морозильнике — до года.
Фундук
Фундук — лесной орех. Ядра лесного ореха — ценный, вкусный и высокопитательный продукт.
Порция фундука (28 г, 186 ккал) содержит 4,3 г растительного белка (9% РСН).
Эта порция также содержит клетчатку (8% РСН), медь (50% РСН) и магний (11% РСН).
Фундук употребляют в пищу свежим, поджаренным, в составе начинок в торты, пироги, блины и т.д. Незрелые орехи используются для изготовления варенья и маринадов.
7. Продукты, Обогащённые Растительным Белком
Лучший путь получения достаточного количества белка — обычные продукты, богатые белком. К обогащённым белком продуктам стоит прибегать лишь в особых случаях: при необходимости набора мышечной массы, интенсивных тренировках и пр.
Добавки к Питанию с Растительным Белком
Соевый протеиновый порошок
Соевый изолят — концентрированный белковый порошок, полученный из соевых бобов. В основном он используется как растительная альтернатива сывороточному протеиновому порошку. Его аминокислотный состав и усвояемость близки к белкам животного происхождения.
Его аминокислотный состав и усвояемость близки к белкам животного происхождения.
Одна мерная ложка соевого протеинового порошка (45 г, 175 ккал) содержит 25 г растительного белка (50% РСН).
Эта порция также содержит растительную омега-3 (9% РСН), омега-6 (6% РСН), клетчатку (12% РСН), фолиевую кислоту (33% РСН), витамин В1 (11% РСН), медь (131% РСН), фосфор (46% РСН), железо (30% РСН), цинк (27% РСН) и калий (9% РСН).
Соевый протеин, как и сывороточный, обычно добавляют в коктейли с молоком, кефиром, соком или водой.
БАДы с растительным белком
В продаже имеется большой выбор БАДов на основе соевого белка.. В состав таких БАДов также вводятся элементы, повышающие его усвояемость, пищевые волокна, а также другие целевые микро- и макроэлементы.
Необходимо учитывать, что БАДы имеют противопоказания. Перед приёмом белковых БАДов рекомендуется проконсультироваться с врачом.
Усвояемость и Биодоступность Растительного Белка
Белки растительного происходения усваиваются организмом на 62-80%. Для грибов этот показатель ещё ниже — 20-40%.
Для грибов этот показатель ещё ниже — 20-40%.
Кроме того, в бобовых содержатся ингибиторы протеиназ, которые снижают усвоение белка из них.
Переизбыток и Непереносимость Растительного Белка
Избыточное потребление белка в долгосрочной перспективе может повышать риск остеопороза и болезней почек в зависимости от происхождения белков и сопутствующих продуктов.
В России верхним (максимальным) уровнем потребления белка считается 117 грамм в сутки для мужчин и 87 грамм в сутки для женщин.
Белковые продукты с глютеном противопоказаны людям с болезнями желудочно-кишечного тракта, а также с непереносимостью глютена. Также следует обращать внимание на возможное содержание в соевых продуктах генномодифицированного сырья.
Продукты с наибольшим содержанием белка: список и таблица
16 августа 2016 23926
Далеко не всем известно, что собой представляет белок, какую роль он играет в деятельности человеческого организма и какие функции выполняет.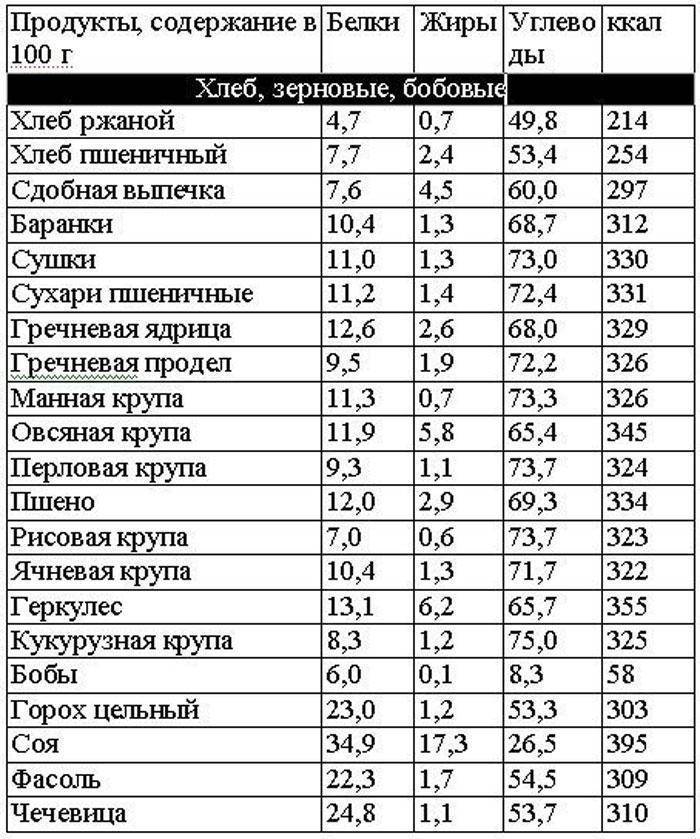
Попробуем ответить на эти вопросы, а также рассмотрим, в каких продуктах самое большое содержание белков насколько они могут быть полезны или вредны для человека.
Польза и вред от употреблений продуктов с высоким содержанием белка
Белок (протеин) — это вещество, которое состоит из аминокислот. Поскольку наш организм способен образовывать не все аминокислоты, некоторая часть из них поступает к нам именно с белком.
Протеин — важная часть в рационе любого человека. Он является самым важным строительным материалом, так как принимает участие в создании мышечной ткани. Именно поэтому белок так ценится спортсменами и теми, кто просто хочет набрать мышечную массу.
По этой же причине он важен для ребенка, поскольку белок помогает правильно и быстро развиваться подрастающему организму.
При нехватке белка у человека может нарушиться работа желез внутренней секреции. Также может поменяться кровяной состав, ухудшиться мозговая деятельность, упасть выносливость и снизиться иммунитет.
На первый взгляд может показаться, что протеин является исключительно полезным веществом.
Но он, как и жир, и углеводы может навредить организму, если употреблять его в слишком больших пропорциях.
Все дело в том, что наш организм усваивает такое количество белка, которое необходимо ему в течение определенного времени. Если нужно не более 150 грамм, то он будет усваивать такой объем, а остальное просто переработает.
На реализацию этого процесса организм тратит кальций, и, если вы не будете получать его через пищу в необходимом количестве, то он будет браться из костей, что в итоге может привести к остеопорозу.
И даже если вы будете принимать различные витамины, содержащие кальций, это вас не спасет.
Также из-за переизбытка употребления протеина, идет серьезная нагрузка на почки, что может вызывать разные заболевания. Такое явление можно часто наблюдать в благополучных странах, где в меню у многих людей присутствует слишком большое количество белковой пищи.
Употребляя продукты животного происхождения, которые содержат в себе белок, нужно быть осторожным, потому что чаще всего там присутствует большое количество холестерина и жиров, а также, зачастую, они высококалорийны.
Продукты с наибольшим содержанием белка
Для того, чтобы правильно регулировать количество белка в своем рационе питания, нужно знать, в каких продуктах он содержится, и где его больше всего. Приведем в пример продукты, часто встречающиеся на столе у большинства людей:
- Яйца. Идеальный и самый доступный по цене источник белка для человека. В них содержится большое количество протеина (около семнадцати процентов), а также они обладают высокой биологической ценностью, поскольку в их составе много незаменимых аминокислот;
- Творог. Продукт, без которого не обходится рацион любого спортсмена, в нем содержится четырнадцать процентов белка Его преимущество в том, что он, в отличие от тех же яиц, долго усваивается, поэтому его хорошо принимать перед сном, тогда организм будет обеспечен энергией на всю ночь. Но стоит знать, что в твороге большое присутствие жиров, так что лучше всего покупать обезжиренный вариант;
- Молоко. Для многих, наряду с яйцами, это главный источник протеина. Оно также богато аминокислотами, а его биологическая ценность даже выше, чем у яиц. Знайте, что не обязательно приобретать обезжиренное молоко, если жирность не будет превышать 2,5%, это существенно не повлияет на ваш организм;
- Сыр. Обладает высокой калорийностью, но зато в нем содержится целых тридцать процентов белка;
- Мясо птицы. Имеет низкую калорийность и при этом высокое содержание протеина. Плюс ко всему, это достаточно легкий для усвоения организмом продукт;
- Говядина. Содержит хороший для усвоения животный белок. В пищу лучше всего употреблять вареную или тушеную говядину, Наиболее полезна и питательна для употребления говядина молодого возраста, от года до двух лет;
- Печень. В печени содержится двадцать пять процентов белка, этот продукт обладает низкой калорийностью и невысокой стоимостью;
- Рыба. Диетический продукт, в котором наличие протеина составляет от пятнадцати до двадцати пяти процентов, в зависимости от вида. Наиболее высокое количество белка можно встретить в лососе, тунце, скумбрии, кефали.
Это самые распространенные и популярные варианты рациона питания человека, однако, помимо этого, существует еще целый ряд продуктов с самым большим содержанием белка. Рассмотрим данный список в таблице.
Таблица
Для наглядности приведем таблицу с содержанием белка на сто грамм веса продукта.
| Название продукта | Количество белка | |
|---|---|---|
| Гусятина | 29 | |
| Индейка | 24 | |
| Баранина | 24 | |
| Говядина | 23 | |
| Курятина | 25 | |
| Говяжья печень | 19 | |
| Свинина | 19 | |
| Утка | 17,6 | |
| Белуга | 24 | |
| Горбуша | 21 | |
| Кефаль | 21,4 | |
| Креветки | 20 | |
| Окунь морской | 20 | |
| Сардина | 23,7 | |
| Копченая семга | 25,4 | |
| Скумбрия | 18 | |
| Судак | 21 | |
| Треска копченая | 23,5 | |
| Тунец | 23 | |
| Щука | 18 | |
| Брынза | 18 | |
| Сыры | 30 | |
| Творог | 14 | |
| Яйцо | 12 | |
| Телятина | 22 | |
| Свиная печень | 18 | |
| Лещ | 21 | |
| Крабы | 19 | |
| Копченая треска | 24 | |
| Язь | 18 | |
| Угорь | 17 | |
| Устрицы | 14 | |
| Свиное/говяжье сердце | 15 | |
| Минтай | 17 | |
Помимо вышеперечисленных, есть еще огромное разнообразие продуктов, в которых содержится белок, но в значительно меньших количествах.
Норма и переизбыток протеина в организме
Как вы уже узнали выше, белок не только оказывает пользу организму, но также может ему и навредить. Все зависит от того, в каких объемах человек принимает его ежедневно. Какое же количество белка необходимо для человеческого организма?
Прежде всего, нужно знать, что существует определенная суточная норма потребления белка.
- Взрослый человек должен употреблять не менее сорока грамм за сутки и опускаться ему за эту границу не рекомендуется, иначе это чревато проблемами со здоровьем;
- В среднем девяносто грамм – это хорошее значение, которое усвоит любой здоровый организм;
- Максимальная же норма белка составляет около ста двадцати грамм в 24 часа. Потребление большей массы, может повлечь за собой отравление и дальнейшие осложнения в работе организма. Также, может появляться неприятный запах изо рта и постоянные газы.
Стоит помнить, что в среднем, больше тридцати граммов белка организм за один прием пищи усвоить не способен.
Необходимое количество белка на килограмм массы тела:
- 1,2 грамма необходимо для спортсменов и людей, ведущих активный образ жизни;
- Около двух грамм для тех, кто занимается спортом три и более раза в неделю и 1,6 грамма для тех, кто посещает спортзал один-два раза;
- 2 грамма для тех, кто худеет и питается низкокалорийной пищей.
Белка нужно принимать больше:
- При каком-либо заболевании, в особенности, после хирургического вмешательства, а также в период выздоровления;
- Во время активного роста и развития организма человека;
- Если человек занимается спортом и ведет активный образ жизни;
- Зимой, потому что в это время года, организму человека приходится расходовать больше калорий для сохранения тепла и энергии тела.
Потребность в протеине меньше:
- В теплые времена года, поскольку организму не нужно тратить большой объем калорий;
- В пожилом возрасте, так как в организме старого человека не происходит такое количество обновлений, как в молодом;
- При появлении подагры и других заболеваний, связанных с усвоением белка.
Организм переваривает белки намного дольше тех же углеводов, которые усваиваются практически моментально. Происходит это из-за его достаточно больших молекул, с которыми организм справляется не сразу.
В этом есть и преимущество белковой пищи, она задерживается в организме человека гораздо дольше и переваривается медленнее, и поэтому, чувство насыщения сохраняется на более длительное время.
По длительности усвоения белка, продукты могут быть медленными или быстрыми. К медленным относят, прежде всего, творог и свинину, к быстрым — яйца, молоко, кефир.
Прежде чем высчитывать суточную норму протеина и налегать на продукты с большим содержанием белка, лучше всего проконсультироваться перед этим с врачом и пройти полное обследование организма, чтобы убедиться, что у вас отсутствует заболевание почек, печени или желудка.
В противном случае вы рискуете навредить самому себе. Особенно нужно быть осторожным тем, у кого были проблемы с почками, или в чьем организме есть недостаток ферментов, которые расщепляют белок.
Также необходимо обратить свое внимание на переносимость продуктов, содержащих белок, так как многим по этой причине запрещено употреблять, к примеру, кисломолочные и другие продукты.
Советы диетологов по употреблению протеина для похудения
Во время диеты многие люди включают в свой рацион большое количество белковой пищи. Рассмотрим некоторые советы, которые обычно дают диетологи в подобных случаях:
- Как правило, диета предполагает понижение таких питательных веществ, как жиры и углеводы. Но одновременно с ними убывает и количество белка, что может негативно сказаться на работе организма. Поэтому в период диеты нужно внимательнее следить за потребляемой нормой протеина. Запомните, что всего в вашем меню должно присутствовать около тридцати процентов белковой пищи;
- При похудении необходимо обязательно включить в свой рацион мясо, рыбу, орехи, кисломолочные и другие продукты, в составе которых достаточное присутствие белка;
- Белковая пища, по мнению многих диетологов, очень хорошо усваивается с углеводами и жирами, которые являются основными поставщиками энергии для организма. Также, для более быстрого и хорошего усвоения, ее стоит употреблять без хлеба и вместе с овощами и зеленью;
- Помимо натуральных продуктов, можно использовать спортивные добавки или протеиновый порошок, но рассматривать их в качестве основного источника белка нельзя, потому что наиболее качественно организм усваивает белок из мяса и других продуктов животного происхождения;
- При этом необходимо употреблять пищу в вареном виде или на пару, при этом исключив из рациона жареные блюда. Также ее лучше солить не во время готовки, а непосредственно перед самым приемом.
Итак, из всего вышесказанного можно сделать вывод, что белок очень важен для организма человека, но для того чтобы оставаться здоровым и сильным нужно употреблять его в правильных количествах и постоянно за этим следить.
Оценить статью:
26
Вконтакте
Одноклассники
Google+
Что еще почитать:
Сайт первой республиканской больницы УР, Ижевск
Уважаемые жители Удмуртской Республики! С 1 марта 2021 года на базе БУЗ УР «1 РКБ МЗ УР» начинает работу Центр профессиональной патологии. Подробная информация по тел.: 46-23-95 |
Прием посетителей:четверг с 14-00 час. до 16-00 час.по предварительной записи по телефону (3412) 46-32-70
Адрес: 426039, г.Ижевск, ул.Воткинское шоссе, 57
Эл.адрес: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript
Отдел документац. обеспечения: (3412) 45-46-29, 46-86-36 (факс)
Справочное бюро (стационар): (3412) 46-57-93
Приемное отделение: (3412) 46-54-82
Диспетчер по ДТП: (3412) 46-56-82
Регистратура (гинекологи ПЦ): (3412) 693-511
Регистратура (медико-генетич. консульт.): (3412) 46-87-71
Регистратура (поликлиника): (3412) 46-54-83, 46-55-74
Поликлиника: понедельник-пятница с 7-00 до 16-18 час.
прием врачей: с 8-00 до 15-06 час. (по графику работы)
Стационар: круглосуточно
прием экстренных пациентов — круглосуточно.
- (3412) 20-47-00, 20-48-00, 20-55-77 — цены, порядок оказания платных услуг
- (3412) 20-47-00, 20-48-00, 20-55-77 — запись на консультации врачей
- (3412) 20-47-00, 20-48-00, 20-55-77 — запись на обследования (КТ, МРТ, УЗДГ сосудов, электромиография, дуплексное сканирование сосудов)
- (3412) 44-54-70 — кабинет ДМС
- (3412) 46-23-95 — вопросы проведения медицинских осмотров
Эл.адрес: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript
Реквизиты БУЗ УР «1 РКБ МЗ УР»: скачать
Сведения об учредителе: Министерство здравоохранения Удмуртской Республики,
Адрес: 426008, г.Ижевск, пер.Интернациональный, д.15.
Телефон приемной: (3412) 22-00-66 (доб.202)
Управление лечебно-профилактической помощи населению: (3412) 22-00-66 (доб.236)
Управление медицинской помощи детям и родовспоможения: (3412) 22-00-66 (доб.248)
Отдел по работе с обращениями граждан: (3412) 22-00-66 (доб.241)
Эл.адрес: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript
Результаты проведения независимой оценки качества
УВАЖАЕМЫЕ ПАЦИЕНТЫ!
Интересующие Вас вопросы по эндопротезированию суставов и артроскопическим операциям на суставах можно задать главному специалисту МЗ УР по травматологии и ортопедии
Ежову Евгению Сергеевичу
по телефону 8-912-459-63-26 с 13-00 до 18-00 час. с понедельника по пятницу.
Телефон «горячей линии» по вопросам формирования здорового образа жизни и «он-лайн кабинета врача» в БУЗ УР «1 РКБ МЗ УР» | |
Номер телефона | (3412) 45-11-75 |
Время приема звонков | с 9-00 до 12-00 часов |
Ответственный за прием звонков и консультирование | Смирнова Галина Иннокентьевна |
Электронный адрес «он-лайн кабинета врача» | Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript |
Ответственный за прием вопросов и ответы в «он-лайн кабинете врача» | Смирнова Галина Иннокентьевна |
Белки в каких продуктах содержатся таблица
Каждому интересующемуся здоровым питанием человеку не раз доводилось слышать и читать о важности белка, который часто называют основой жизни. Это не преувеличение, а соответствующая действительности реальность. Следя за рационом, всегда нужно учитывать то, что количество белка в нем должно составлять не менее 30%. Аналогичное число должно приходиться на жиры, а на углеводы — 40%.
Составление сбалансированного меню требует знания того, в каких продуктах больше всего белка, как правильно рассчитать суточную норму. Кроме того, немаловажным аспектом правильного рациона является и грамотное сочетание продуктов друг с другом.
Суточная норма употребления белка
Для женщин она составляет один грамм на каждый килограмм собственного веса. И если представительница прекрасного пола весит 60 килограмм, ей необходимо 60 грамм белка. Количество увеличивается до 1,2 грамма, когда посещают спортивный зал.
Мужчины, которые не занимаются спортом, должны употреблять 1,2 грамма белка на каждый килограмм своей массы. Это количество увеличивается, если речь идет об активном образе жизни, подразумевающем посещение тренажерного зала.
Обеспечить организм требуемым количеством белка в течение суток позволяет знание того, какие продукты богаты этим важным для человека соединением.
Список богатых белком продуктов
10 продуктов с наибольшим содержанием белка
- Мясо птицы – от 17 до 22 грамм (на 100 грамм продукта)
- Мясо – от 15 до 20 грамм
- Рыба — от 14 до 20 грамм
- Морепродукты – от 15 до 18 грамм
- Бобовые – от 20 до 25 грамм
- Орехи – от 15 до 30 грамм.
- Яйца – 12 грамм
- Твердый сыр – от 25 до 27 грамм
- Творог – от 14 до 18 грамм
- Крупы – от 8 до 12 грамм
Белки мяса таблица
| Продукт питания | Белок (в граммах) |
|---|---|
| Курица | 20,8 |
| Индейка | 21,6 |
| Говядина | 18,9 |
| Свинина | 11,4-16,4 |
| Баранина | 16,3 |
| Колбаса вареная | 10,1-13,7 |
| Колбаса копченая | 16,2-28,2 |
Белки рыбы и морепродуктов
| Продукт питания | Белок (в граммах) |
|---|---|
| Кальмар | 18,0 |
| Краб | 16,0 |
| Креветки | 18,0 |
| Скумбрия | 18,0 |
| Камбала | 16,1 |
| Горбуша | 21,0 |
| Мойва | 13,4 |
| Сельдь | 17,7 |
| Судак | 19,0 |
| Треска | 17,5 |
| Осетр | 16,4 |
| Лещ | 17,1 |
| Минтай | 15,9 |
| Семга | 20,8 |
| Рыбные консервы в масле | 17,4-20,7 |
| Рыбные консервы в томате | 12,8-19,7 |
| Рыбные консервы в собственном соку | 20,9-28,7 |
Молочные белки
| Продукт питания | Белок (в граммах) |
|---|---|
| Молоко | 2,8 |
| Кефир | 2,8-3,0 |
| Сметана | 2,8-3,0 |
| Йогурт | 5,0 |
| Сливки | 2,8-3,0 |
| Сыр | 23,4-26,8 |
| Творог | 14,0-18,0 |
Крупы
| Продукт питания | Белок (в граммах) |
|---|---|
| Овсяная | 11,0 |
| Гречневая | 10,8 |
| Рисовая | 7,0 |
| Пшенная | 11,5 |
| Перловая | 9,3 |
| Манная | 11,3 |
| Геркулесовая | 13,1 |
Приводимые данные в таблицах представляют собой абсолютную величину, но процент усвоения белка организмом не у всех достигает стопроцентной отметки.
Таблица усвояемости белка
| Источник белка | Коэффициент усвояемости |
|---|---|
| Молоко | 100% |
| Изолированный соевый белок Супро | 100% |
| Говядина | 92% |
| Рыба | 92% |
| Другой изолированный соевый белок | 92% |
| Мясо птицы механической обвалки | 70% |
| Фасоль консервированная | 68% |
| Овес | 57% |
| Рис | 54% |
| Арахис | 42% |
| Кукуруза | 42% |
| Пшеничная клейковина | 27% |
Чтобы найти, сколько белка поступает в организм, к приведенному выше вычислению прибавляют 50%, что составит 90 грамм, то есть 65х1+50%.
Распределение белка в течение суток
Происходит по двум основным схемам:
Первая. Предполагает распределение пищи с высоким содержанием белка на пять порций, которые съедают в течение дня.
Вторая. На завтрак и ужин съедают по 20%, а на обед — 45% белка. Остальная суточная норма распределяется по 5% на перекусы, после главных приемов пищи.
Независимо от выбранной схемы, следует учитывать то, что каждая порция должна быть не более 300-350 г. Главное, подобрать для себя продукты, которые больше всего по вкусу.
Примерное дневное меню
К завтраку можно подать постный кусочек мяса, белковый (протеиновый) коктейль, целое яйцо или белок, йогурт греческий.
На ужин и обед отлично подойдет тофу, мясо индейки, куриные грудка и колбаса, постный фарш из говядины, лосось, креветки, тунец и треска.
В качестве перекуса можно покушать очищенные семечки, выпить протеиновый коктейль, съесть орехи, что-либо из бобовых.
- 13 Апреля, 2019
- Здоровье
- Максим Новичков
Прежде чем смотреть, сколько содержится белка в продуктах питания, неплохо бы узнать об этом веществе немного больше. Все мы знаем, что белок необходим для поддержания и роста мышц, но разве только этой функцией ограничивается компонент, являющийся важной частью любого живого организма?
Строение белков
Белки являются органическими веществами полимерного строения. Относительная масса их молекул очень высока. Белки состоят из аминокислот, которые так необходимы нашему организму. В генетический код закладывается обычно 20 основных аминокислот. Их бесконечные комбинации создают различные молекулы белка, которые выполняют множество функций в живом организме.
Важные функции белка в организме человека
Молекулы белка занимают в организме человека значимое место и выполняют много важных для жизнедеятельности функций.
- Каталитическая функция. Белки – ферменты выполняют роль катализаторов в нашем организме. То есть помогают множественным непрерывным химическим функциям проходить быстрее.
- Защитная функция. Защиту нашего тела осуществляет белок коллаген. Благодаря ему соединительная ткань в хрящах, костях и дерме имеет упругую структуру. Белок кератин составляет основу волос, ногтей. Белок тромбин участвует в свертываемости крови. Также белок помогает быстрее выводить токсины из организма и справляться с вирусами и бактериями.
- Двигательная функция. Моторные белки обеспечивают сокращение мышц.
- Структурная функция. Структурные белки придают форму клеткам.
- Запасная функция. Есть отдельный класс резервных белков, которые запасаются в яйцеклетках как источник энергии. Другие запасные белки используются как источники аминокислот.
Все равно ли, откуда получать белки?
Функций у белков в организме человека невероятно много. Примечательно, что за усвояемость белков отвечают тоже белки. Если белковые вещества в организме человека образуются из базовых 20 аминокислот, то только 8 из них являются для него незаменимыми. Эти аминокислоты организм не вырабатывает. Поэтому 8 незаменимых аминокислот необходимо получать с пищей. Еще 6 аминокислот – условно незаменимые. То есть эти кислоты могут вырабатываться или нет в зависимости от состояния организма. Белки в продуктах питания содержат разные наборы аминокислот. Поэтому выбирать один продукт как источник белка не рационально.
Содержание белков в разных группах продуктов
Почти все группы продуктов содержат белок. Но наборы аминокислот в разных продуктах питания могут сильно отличаться друг от друга. Помимо этого, проблема белка в том, что организмом он может усваиваться не полностью. Коэффициент усвояемости различен у пищи разного происхождения (животного, растительного). Поэтому, если вы интересуетесь темой белковой пищи, важно не только знать таблицу белка в продуктах питания, но и запомнить коэффициенты усвоения белка разных групп продуктов.
Таблица продуктов с высоким уровнем усвояемости белка (90 — 100%)
| Продукт | |
| Сыр | 20 — 30 г |
| Кефир | 2 — 5 г |
| 15 — 20 г | |
| Творог 9% | 10 -15 г |
| Молоко | 2 — 5 г |
| Яйца | 10 — 15 г |
| Птица | 20 — 25 г |
| Говядина | 15 — 20 г |
| Рыба | 20 — 25 г |
| Соевый белок | 30 — 50 г |
Проблема растительного белка
Хотя многие растения содержат немалое количество белка, человеческий организм усваивает такой белок не полностью. Также в нем нет всех незаменимых аминокислот. Проблема вегетарианцев в том, что получить необходимое для здоровой жизнедеятельности количество белка и аминокислот из растительной пищи сложнее, чем из животной.
Таблица содержания белка в продуктах со средним коэффициентом усвояемости (65 – 70%)
| Продукт | |
| Фасоль | 20 — 25 г |
| Орехи | 10 — 25 г |
| Горох сухой | 20 — 25 г |
| Картофель | 2 — 3 г |
| Чечевица | 20 — 25 г |
| Фрукты и овощи | 2 — 3 г |
| Гречка | 10 — 15 г |
Остальные растительные продукты имеют в составе белок, который усваивается нашим организмом еще хуже.
Количество белка, необходимое человеку
Так как коэффициент усвояемости многих продуктов невысок, восполнить ими недостаток белка может быть проблематично. Бывает сложно выяснить, сколько белка усвоит организм, например, из 200 граммов чечевицы или 100 граммов говяжьего мяса. Чтобы легче ориентироваться в продуктах, богатых белком, нужно узнать свою суточную норму потребления белка.
По распространенным версиям, количество белка должно составлять около 1,5 грамма на килограмм веса. Такое количество должен получать среднестатистический человек, не сидящий на диете и не стремящийся набрать мышечную массу. В зависимости от нагрузки, количество белка на килограмм веса может варьироваться от 1,0 до 3,0 граммов и более. Например, человеку весом 70 килограммов, не занятому регулярными физическими нагрузками, в день следует съедать не менее 105 г чистого белка. Откуда брать хороший белок – уже другой вопрос.
Полезные и недорогие источники белка
Не каждый день получается готовить и съедать мясо и рыбу, богатые белком и аминокислотами. Конечно, животный белок считается главным источником незаменимых аминокислот для человека, но не все и не всегда могут его употреблять в пищу. В таблице содержания белка в продуктах перечислены основные доступные источники белка.
Аминокислоты
К аминокислотам, которые не умеет синтезировать наш организм, относят триптофан, изолейцин, лизин, метионин, валин, треонин, лейцин и фенилаланин. Эти восемь соединений необходимо получать во время приема пищи. При нехватке аминокислот может снизиться аппетит, появится вялость и сонное состояние. Начинают выпадать волосы. Сильный недостаток незаменимых кислот проявляется потемнением в глазах и обмороками. Если по каким-то причинам аминокислот в организме слишком много, может нарушиться секреция щитовидной железы. Гипертония и болезни суставов тоже могут быть возможными симптомами повышенного содержания аминокислот. Поэтому лучше знать, какие аминокислоты содержит белок в продуктах питания. Таблица информирует о каждой из восьми незаменимых кислот.
Таблица содержания незаменимых аминокислот в пищевых продуктах
| Аминокислота | Содержание в продуктах |
| Триптофан | Мясо, молочные продукты, Бананы, финики, кунжут, рыба, бобовые. |
| Изолейцин | Рыба, мясо, морепродукты. Яйца и молочка. Соя, кешью, миндаль, чечевица, рожь. |
| Лизин | Твердый сыр, животный белок. Молочные продукты, бобовые, орехи. |
| Метионин | Яйца, молочная продукция, злаки, зерновые, кунжут, орехи. Особенно бразильский. |
| Валин | Животный белок, соя, орехи, грибы. |
| Треонин | Горох, животный белок. |
| Лейцин | Мясо, молочка, рыба, все орехи, семена. |
| Фенилаланин | Сыр, молоко, творог, сушеные грибы, яйца, мясо, морепродукты, рыба. |
Комбинации продуктов
Чтобы каждый день получать все аминокислоты в нужном объеме, хорошо чередовать и комбинировать продукты – источники белка. Мясо лучше усваивается, если есть его с овощами и зеленью. Молоко можно сочетать с углеводами – продуктами, содержание белка в которых тоже существенно (крупами, макаронами, хлебом, картофелем). В таком случае углеводы из обеих групп будут усваиваться лучше. Фасоль хорошо смешивать с кукурузой, бобовые с орехами, а картошку – с яйцами.
Сбалансированное меню
Как понять, сколько и каких продуктов мы должны съедать за день, чтобы пополнить норму белка и незаменимых аминокислот? Разобраться в этом поможет пример сбалансированного меню. В меню в основном будут использованы белки из продуктов питания, таблицы с которыми даны выше.
Меню на 1500 ккал с содержанием 120 г белков
- 100 г обезжиренного творога;
- «Геркулес» — 20 г;
- банан среднего размера.
Итого: 21,6 г белка.
- 300 г минтая;
- 50 г бурого риса;
- зеленый горох — 50 г;
- 100 г лука;
- 1 ст. л. растительного масла.
Итого: 58,9 г белков
- Творожная запеканка — 200 г.
Итого: 24 г белка
- Омлет из одного яичного желтка и трех белков;
- помидор — 1 шт;
- лук — 100 г;
- растительное масло — 1 ст. л.
Итого: 15,5 г белка
Всего за день вы потребляете ровно 120 граммов белка. Только помните, что они не усваиваются организмом полностью.
Морепродукты
Отдельно бы хотелось упомянуть морепродукты, как продукты, богатые белком. Таблица самых питательных морских обитателей представлена ниже. Морепродукты – деликатесная пища, но если вам повезло жить рядом с морем, не скупитесь иногда покупать богатых белками морских животных и водоросли.
Дополнительные источники белка
Не всегда получается получать норму белка или аминокислот из тех продуктов, которые входят в наш рацион. Поэтому уже несколько лет в продаже доступны продукты, содержание белка в которых выше, чем в мясе и молочной продукции. Это так называемые искусственные протеины. Они знакомы людям, занимающимся силовыми тренировками. Также есть белковые добавки, которые принимают для того, чтобы пополнить запас незаменимых аминокислот и витаминов. Например, водоросль спирулина.
Протеин для спортсменов
Отдельную нишу занимают протеины для людей, которые набирают мышечную массу. Но нет ничего страшного в том, если белковую сыворотку будет принимать человек, не преследующий цель прибавить вес за счет мышц. Только такой прием пищи в большинстве случаев ему не нужен. Белок в добавках для спортсменов ничем не отличается от белка в таблице продуктов питания. Знающие утверждают, что спортивные порошки содержат все аминокислоты, которые требуются нашему организму.
Спирулина
Спирулина — водоросль, в сухом виде содержащая 57 г белка. Помимо этого, в ней содержатся все необходимые витамины (А, С, группа В, D, Е), полезные жирные кислоты и элементы. Спирулина продается в интернете в виде темно-зеленого порошка или таблеток.
Белковая пища необходима для поддержания работоспособности органов и формирования мускулатуры. Белок – это главный «строительный материал» в организме, поэтому он нужен любому человеку, независимо от возраста, пола и состояния здоровья. Нехватка аминокислот приводит к развитию серьезных заболеваний. Достаточное количество продуктов с высоким содержанием белка в рационе поможет избежать ожирения, сделает фигуру красивой.
Молекула белка собирается из 20 базовых аминокислот, 12 из них синтезируются непосредственно в организме.
Норма белка для современного человека составляет 1 г на килограмм веса. Люди, испытывающие сильные физические нагрузки, и спортсмены должны получать 2 г протеина на килограмм массы тела.
Треть употребляемых калорий человек должен получать из белковой пищи животного и растительного происхождения.
В природе нет протеинов, которые были бы идеальны для человеческого организма, но определенные виды усваиваются полнее.
Коэффициент усвоения белка:
- молоко –1,0;
- изолят сои –1,0;
- яйца –1,0;
- говядина – 0,92;
- горох – 0,69;
- фасоль – 0,68;
- овес – 0,57;
- арахис – 0,52.
Важная характеристика аминокислот – незаменимость. Большую часть этих соединений организм не может вырабатывать самостоятельно, они должны поступать извне.
Для взрослого человека незаменимы всего 8 аминокислот. Они содержатся в белковых продуктах:
Белки содержатся в продуктах растительного и животного происхождения. Любой протеин – растительный и животный – легче усваивается после термической обработки.
В рационе вегетарианцев присутствуют только аминокислоты, содержащиеся в чечевице, фасоли и других бобовых культурах. У таких соединений есть серьезный недостаток — низкая усвояемость, поэтому они не настолько полезны, как полученные из животных продуктов.
Но животные продукты содержат много жира, поэтому способствуют отложению на стенках сосудов холестерина. Выбирая белковую пищу, нужно предпочитать обезжиренные сорта: постное мясо, куриное филе, молочные напитки с пониженным содержанием жира.
Следует внимательно относиться к такому продукту, как яйца. Они исключительно богаты белком и в тоже время в них содержится желток, состоящий из большого количества жира.
Если нужно повысить содержание в рационе высокоусвояемых аминокислот и при этом не набрать вес, желток рекомендуется не есть. Так делают спортсмены на этапе набора мышечной массы.
Молочные продукты по концентрации белка уступают мясу, но содержат кальций. Этот элемент необходим для организма в любом возрасте.
Кисломолочные продукты не только снабжают организм кальцием и аминокислотами, но и улучшают микрофлору кишечника. Их можно включать в рацион в качестве белковой пищи, особенно обезжиренные виды.
Мясо птицы, кроликов и крупного рогатого скота – идеальный высокобелковый продукт, если приготовить его любым способом, кроме обжаривания.
Свинина – противоречивый сорт мяса. В ней содержится много жира. Однако если срезать сало, оставшееся мясо будет достаточно безопасным, чтобы включать его в меню. В свиной вырезке содержится ненамного меньше белка, чем в говядине.
Субпродукты – печень, язык и другие внутренние органы – содержат меньше белка, но больше микроэлементов. Людям, следящим за здоровьем, нельзя обходить их стороной. Их нужно обязательно включать в рацион в качестве источника протеинов и других полезных веществ.
Много аминокислот содержится в рыбе и особенно в икре. Кроме этого, в них достаточно полезного фосфора.
Икра недорогих сортов рыб, таких как мойва, почти не уступает в полезных свойствах осетровой. Это дешевый источник легко усваиваемых незаменимых аминокислот.
Горох и фасоль содержат достаточно белка, чтобы человек, не занимающийся спортом или тяжелым физическим трудом, съедающий ежедневно 100-200 г зерен, не испытывал дефицита. Если аминокислот требуется больше, в рацион можно включить изолят сои – специально обработанный продукт, содержащий рекордный для растительной пищи процент протеинов – до 35.
Изолят соевого белка используется как спортивное питание. Этот растительный протеин усваивается быстрее, чем молоко или мясо.
В данной группе «рекордсменом» по содержанию белков является гречневая. Крупы ценны тем, что достаточно хорошо усваиваются организмом – на 50-60 %.
Столько же протеина содержится в овсяной и перловой крупе. Рис, который часто используют в качестве диетического продукта, почти в три раза уступает гречневой крупе в содержании белка.
На последнем месте по количеству протеинов стоят фрукты и овощи. Их нельзя назвать белковыми продуктами, но в некоторых содержится немного больше аминокислот, чем в остальных.
Почти любой природный продукт в той или иной степени содержит аминокислоты. Но белковой пищей называют только ту, в которой эти соединения содержатся в большом количестве — более 20 % от полного химического состава. Исключение – говядина и телятина. В этих видах мяса содержится меньше 20 % белка, но благодаря полноценному составу он усваивается на 100 %. Благодаря высокой усвояемости специалисты причисляют мясо крупного рогатого скота к белковой пище.
Перечень продуктов с высоким содержанием белка представлен в таблице:
Продукт
Содержание белка в %
Сыр твердых сортов
Белковая пища больше чем любая другая помогает поддерживать фигуру стройной. Особенно важно количество протеинов в дневном рационе для тех, кто хочет похудеть или накачать мощные мышцы.
Количество аминокислот в рационе увеличивают при соблюдении специальных диет — спортивных или направленных на снижение массы тела.
Чтобы не изнурять себя голодом и сбросить несколько килограммов, достаточно увеличить в ежедневном рационе долю белковой пищи. Она долго переваривается, избавляет от чувства голода, способствует насыщению. На протеиновых диетах ускоряется метаболизм и уменьшается жировой слой, а чувства голода нет — поэтому они так популярны.
Основа рациона в белковых диетах – яйца, отварное куриное мясо, рыба. Важно, чтобы этих продуктов в меню было больше, чем жиров и углеводов.
Аминокислоты для снижения веса не обязательно брать из мяса. Этот продукт употребляют 2-3 раза в неделю. В остальное время нужно есть:
- рыбу нежирных сортов;
- орехи;
- семечки;
- фасоль;
- горох;
- обезжиренные молочные продукты;
- яйца без желтка.
Перечисленные в списке продукты достаточно калорийны, но похудеть без них невозможно. Они ускоряют обмен веществ, помогают организму сжигать жир, а не разрушать мышцы. На переработку белковых продуктов пищеварительная система тратит много энергии. Это значит, что организм затрачивает больше калорий, что позволяет человеку, употребляющему достаточно протеинов, быстро худеть.
Правила приема белковой пищи для похудения:
- нельзя полностью исключать из рациона углеводы – их небольшое количество необходимо для нормальной работы организма;
- ограничения в питании не должны длиться более 2 недель;
- есть нужно через каждые 3 часа;
- с каждым приемом пищи нужно употреблять белковую пищу;
- для гарнира надо использовать не картофель и крупы, а овощи с минимальным количеством крахмала – листовые, помидоры, огурцы;
- углеводную пищу разрешается есть только до 2 часов дня;
- все углеводы должны быть представлены сложными полисахаридами (крупы), простые полисахариды (сахар, хлеб) запрещены.
Низкоуглеводный способ питания противопоказан при заболеваниях печени, почек, и беременности.
Сушкой тела в бодибилдинге называется процесс придания мускулатуре рельефности. В это время соблюдают специальную диету, направленную на сжигание подкожного жира.
Сушка — это не обычное похудение, а профессиональная спортивная мера, которая предполагает соблюдение строгих правил.
Употребление белков при сушке поддерживают на уровне 1,5 г на килограмм массы тела. Превышение этой дозы не рекомендуется.
На сушке избегают молочных продуктов, так как в них содержится много жира. Даже обезжиренный творог считается слишком калорийным и жирным. Нужное количество протеинов получают за счет морепродуктов, морской рыбы, постной телятины.
Чтобы набрать мышечную массу, требуется небольшой избыток белка в сочетании с силовыми тренировками. В этот период спортсмен должен употреблять 2-2,5 грамма протеинов на килограмм веса в сутки.
Все продукты должны содержать полноценные белки, то есть быть животного происхождения. Растительные протеины (кроме соевого изолята) не способствуют набору мышечной массы.
Аллергология компонента или молекулярная аллергология – SYNLAB Eesti
Аллергология компонента или молекулярная дает возможность более точного выяснения характера и причины перекрестной активности. В этом случае происхождение аллергии выясняется на уровне компонента. Компонентами аллергена являются белки, которые по своей структуре являются очень схожими (гомологичными) и относятся к тому же «белковому семейству», будучи в то же время совершенно другого происхождения.
Диагностирование аллергии на молекулярном уровне вносит ясность в такой сложный вопрос – насколько специфична аллергическая реакция по отношению к данному источнику аллергии (береза, земляной орех и т.д.) или же имеет место соприкосновение с гомологичным элементом, относящимся к тому же «белковому семейству», и индуцированная им аллергическая реакция значительно слабее. Интенсивность аллергической реакции зависит от того, к какому «белковому семейству» относится данный аллергический компонент. Самую сильную реакцию (в том числе анафилаксию) дают аллергены, относящиеся к группе так называемых запасных белков (storage protein).
Семейства белков и их клиническое значение
- PR-10 белки – распадаются в пищеварительном тракте и при нагревании. При тепловой обработке, как правило, хорошо переносимы. Они являются гомологами молекулы Bet v1 и способствуют возникновению локальных симптомов, таких как оральный аллергический синдром (ОАС) у аллергиков на пыльцу березы бородавчатой, при употреблении в пищу овощей, фруктов и лесных орехов (возникает больше у жителей Северной Европы).
- Запасные белки (Storage Protein) – устойчивые к нагреванию и перевариванию белки. Аллергические реакции могут возникать и на пищевые продукты, предварительно подвергшиеся тепловой обработке. Дополнительно к местным симптомам аллергии (ОАС) могут вызывать серьезные системные реакции.
- LTP (Lipid Transfer Protein) – Содержится в семенах и орехах. Устойчивые к нагреванию и перевариванию белки. Вызывают серьезные системные реакции. Дополнительно могут вызывать местную симптоматику (ОАС) при употреблении в пищу овощей и фруктов (возникает больше у жителей Северной Европы).
- Профилины – Распадаются в пищеварительном тракте и при нагревании. После тепловой обработки переносятся, как правило, хорошо. Имеются во всех видах пыльцы и растительной пище. Вызывают в большом количестве перекрестную реакцию между достаточно отдаленными типами аллергенов из-за их схожести друг с другом. Редко имеют какие-либо клинические проявления, хотя у некоторых пациентов могут вы- зывать местные достаточно сильные реакции.
- Парвальбумины – Устойчивые к нагреванию и перевариванию белки. Алларегические реакции отмечаются также и после тепловой обработки. Дополнительно к местным симптомам аллергии (ОАС) могут вызывать серьезные системные реакции.
Основной аллерген содержится в рыбе. Способствуют возникновению перекрестной реактивности между разными видами рыбы.
- Tропомиозины – белки мышечной ткани, связывающие актин. Способствуют возникновению перекрестной реактивности между ракообразными, пылевыми клещами и тараканами.
- Полкальцины (белки, связывающие кальций) – вызывают в большом количестве перекрестные реакции между разными видами пыльцы, на пищевые продукты влияния не оказывают.
- CCD (Cross-reactive Carbohydrate Determinants) – молекулы углеводов, связанные с белками. Вызывают в большом количестве перекрестные реакции. Представлены во всех растениях, видах пыльцы и ядах насекомых. С клинической симптоматикой связывают достаточно редко. У некоторых пациентов могут вызывать неприятные реакции.
Компоненты аллергенов
ПИЩЕВЫЕ ПРОДУКТЫ
- Земляной орех, компоненты аллергена
- f422 rAra h 1 запасной белок (7S)
- f423 rAra h 2 запасной белок (2S)
- f424 rAra h 3 запасной белок (11S)
- f352 rAra h 8 PR-10 белок (Bet v 1 гомолог)
- Яичный белок, компоненты аллергена
- f233 nGal d 1 овомукоид (устойчив к нагреванию)
- Соевые бобы, компоненты аллергена
- f353 rGly m 4 PR-10 белок (Bet v 1 гомолог)
- f431 nGly m 5 запасной белок (7S)
- f432 nGly m 6 запасной белок (11S)
- Рыба и креветки, компоненты аллергена
- f355 rCyp c 1 карп, парвальбумин
- f426 rGad c 1 треска, парвальбумин
- f351 rPen a 1 креветка, парвальбумин
- Коровье молоко, компоненты альбумина
- f76 nBos d 4 α-лактоальбумин
- f77 nBos d 5 ß-лактоглобулин
- f78 nBos d 8 kaзеин
- Пшеница, компоненты аллергена
- f416 rTri a 19 омега – 5-глиадин
- Лесной орех, компонент аллергена
- f425 rCor a 8 LTP белок
ДЕРЕВЬЯ И РАСТЕНИЯ
- Tимофеевка луговая, компоненты аллергена
- g205 rPhl p 1
- g215 rPhl p 5b
- Береза бородавчатая, компоненты аллергена
- t215 rBet v 1 PR-10 белок
- t216 rBet v 2 профилин
- t220 rBet v 4 полкальцин
НАСЕКОМЫЕ
- Пчела, компоненты аллергена
- i208 rApi m 1 фосфолипаза A2
- Оса, компоненты аллергена
- i211 rVes v 1 фосфолипаза A1
- i209 rVes v 5 aнтиген 5
ДОМАШНИЕ ЖИВОТНЫЕ
- Кошка, компоненты аллергена
- e94 rFel d 1 специфичный к кошке
- e220 nFel d 2 альбумин сыворотки кошки
- Собака, компоненты аллергена
- e101 rCan f 1 специфичный к собаке
- e221 nCan f 3 альбумин сыворотки собаки
Fel d 2 и Can f 3 дают между собой перекрестную реакцию, а аткже с другими животными, например, лошадь, кролик и т.д.
в каких овощах много белка? Таблица продуктов
Таблица калорийности (овощи, зелень, фрукты, ягоды, грибы, бобовые)
Делишис – кулинария, рецепты, салаты, суп / Полезное
| Овощи и зелень | ||||
| Продукт | Ккал/ 100 гр | Белки | Жиры | Углеводы |
| Баклажаны | 24 | 0,6 | 0,1 | 5,5 |
| Брюква | 37 | 1,2 | 0,1 | 8,1 |
| Горошек зеленый | 72 | 5,0 | 0,2 | 13,3 |
| Кабачки | 27 | 0,6 | 0,3 | 5,7 |
| Капуста белокочанная | 28 | 1,8 | – | 5,4 |
| Капуста краснокочанная | 31 | 1,8 | – | 6,1 |
| Капуста цветная | 29 | 2,5 | – | 4,9 |
| Картофель | 83 | 2 | 0,1 | 19,7 |
| Лук зеленый (перо) | 22 | 1,3 | – | 4,3 |
| Лук порей | 40 | 3 | – | 7,3 |
| Лук репчатый | 43 | 1,7 | – | 9,5 |
| Морковь красная | 33 | 1,3 | 0,1 | 7 |
| Огурцы грунтовые | 15 | 0,8 | – | 3 |
| Огурцы парниковые | 10 | 0,7 | – | 1,8 |
| Перец зеленый сладкий | 23 | 1,3 | – | 4,7 |
| Перец красный сладкий | 27 | 1,3 | – | 5,7 |
| Петрушка (зелень) | 45 | 3,7 | – | 8,1 |
| Петрушка (корень) | 47 | 1,5 | – | 11 |
| Ревень (черешковый) | 16 | 0,7 | – | 2,9 |
| Редис | 20 | 1,2 | – | 4,1 |
| Редька | 34 | 1,9 | – | 7 |
| Репа | 28 | 1,5 | – | 5,9 |
| Салат | 14 | 1,5 | – | 2,2 |
| Свекла | 48 | 1,7 | – | 10,8 |
| Томаты (грунтовые) | 19 | 0,6 | – | 4,2 |
| Томаты (парниковые) | 14 | 0,6 | – | 2,9 |
| Зелёная фасоль | 32 | 4 | – | 4,3 |
| Хрен | 71 | 2,5 | – | 16,3 |
| Черемша | 34 | 2,4 | – | 6,5 |
| Чеснок | 106 | 6,5 | – | 21,2 |
| Шпинат | 21 | 2,9 | – | 2,3 |
| Щавель | 28 | 1,5 | – | 5,3 |
| Фрукты и сухофрукты, ягоды | ||||
| Продукт | Ккал/ 100 гр | Белки | Жиры | Углеводы |
| Абрикосы | 46 | 0,9 | – | 10,5 |
| Авокадо | 223 | 1,9 | 23,5 | 6,7 |
| Айва | 38 | 0,6 | – | 8,9 |
| Алыча | 34 | 0,2 | – | 7,4 |
| Ананас | 48 | 0,4 | – | 11,8 |
| Апельсин | 38 | 0,9 | – | 8,4 |
| Арбуз | 38 | 1 | – | 8 |
| Бананы | 91 | 1,5 | – | 22,4 |
| Брусника | 40 | 0,7 | – | 8,6 |
| Виноград | 69 | 0,4 | – | 17,5 |
| Вишня | 49 | 0,8 | – | 11,3 |
| Вишня (сушёная) | 292 | 1,5 | – | 73 |
| Голубика | 37 | 1 | – | 7,7 |
| Гранат | 52 | 0,9 | – | 11,8 |
| Грейпфрут | 35 | 0,9 | – | 7,3 |
| Груша | 42 | 0,4 | – | 10,7 |
| Груша (сушёная) | 246 | 2,3 | – | 62,1 |
| Ежевика | 33 | 2 | – | 5,3 |
| Земляника | 41 | 1,8 | – | 8,1 |
| Изюм с косточкой (сушёный) | 276 | 1,8 | – | 70,9 |
| Изюм кишмиш (сушёный) | 279 | 2,3 | – | 71,2 |
| Инжир | 56 | 0,7 | – | 13,9 |
| Калина | 32 | 0,5 | – | 4,6 |
| Киви | 61 | 1 | – | 11 |
| Кизил | 45 | 1 | – | 9,7 |
| Клюква | 28 | 0,5 | – | 4,8 |
| Крыжовник | 44 | 0,7 | – | 9,9 |
| Курага | 272 | 5,2 | – | 65,9 |
| Лимон | 31 | 0,9 | – | 3,6 |
| Мандарин | 38 | 0,8 | – | 8,6 |
| Малина | 41 | 0,8 | – | 9 |
| Морошка | 31 | 0,8 | – | 6,8 |
| Облепиха | 30 | 0,9 | – | 5,5 |
| Персики | 44 | 0,9 | – | 10,4 |
| Персики (сушёные) | 275 | 3,0 | – | 68,5 |
| Рябина садовая | 58 | 1,4 | – | 12,5 |
| Рябина черноплодная | 54 | 1,5 | – | 12 |
| Слива садовая | 43 | 0,8 | – | 9,9 |
| Слива сушёная (чернослив) | 264 | 2,3 | – | 65,6 |
| Смородина белая | 39 | 0,3 | – | 8,7 |
| Смородина красная | 38 | 0,6 | – | 8 |
| Смородина черная | 40 | 1,0 | – | 8,0 |
| Урюк | 278 | 5 | – | 67,5 |
| Финики | 281 | 2,5 | – | 72,1 |
| Хурма | 62 | 0,5 | – | 15,9 |
| Черешня | 52 | 1,1 | – | 12,3 |
| Черника | 40 | 1,1 | – | 8,6 |
| Шиповник свежий | 101 | 1,6 | – | 24 |
| Шиповник (сушеный) | 253 | 4,0 | – | 60 |
| Шелковица | 53 | 0,7 | – | 12,7 |
| Яблоки | 46 | 0,4 | – | 11,3 |
| Яблоки (сушёные) | 273 | 3,2 | – | 68 |
| Грибы и бобовые | ||||
| Продукт | Ккал/ 100 гр | Белки | Жиры | Углеводы |
| Белые (свежие) | 25 | 3,2 | 0,7 | 1,6 |
| Белые (сушёные) | 209 | 27,6 | 6,8 | 10 |
| Бобы | 58 | 6 | 0,1 | 8,3 |
| Горох лущеный | 323 | 23 | 1,6 | 57,7 |
| Горох цельный | 303 | 23 | 1,2 | 53,3 |
| Подберезовики (свежие) | 31 | 2,3 | 0,9 | 3,7 |
| Подосиновики (свежие) | 31 | 3,3 | 0,5 | 3,4 |
| Соя | 395 | 34,9 | 17,3 | 26,5 |
| Сыроежки (свежие) | 17 | 1,7 | 0,3 | 1,4 |
| Фасоль | 309 | 22,3 | 1,7 | 54,5 |
| Чечевица | 310 | 24,8 | 1,1 | 53,7 |
Хлебобулочные изделия, мука
Так как хлебобулочные изделия считаются высококалорийными, при похудении их надо употреблять в малых количествах. Ржаной хлеб – вот чему надо отдать предпочтение. Желательно, чтобы сдоба вообще не фигурировала в рационе. Бездрожжевая выпечка – враг стройности!
Как все знают в хлебе содержатся углеводы в больших количествах. Хлеб + белок является плохим сочетанием.
Специалисты не рекомендуют употреблять молоко или мясо с хлебом.
| Продукт | Вода | Белки | Жиры | Углеводы | ккал |
| Хлеб ржаной | 42,4 | 4,7 | 0,7 | 49,8 | 214 |
| Хлеб пшеничный из муки I сорта | 34,3 | 7,7 | 2,4 | 53,4 | 254 |
| Сдобная выпечка | 26,1 | 7,6 | 4,5 | 60 | 297 |
| Баранки | 17,0 | 10,4 | 1,3 | 68,7 | 312 |
| Сушки | 12,0 | 11,0 | 1,3 | 73,0 | 330 |
| Сухари пшеничные | 12,0 | 11,2 | 1,4 | 72,4 | 331 |
| Сухари сливочные | 8,0 | 8,5 | 10,6 | 71,3 | 397 |
| Мука пшеничная высшего сорта | 14,0 | 10,3 | 0,9 | 74,2 | 327 |
| Мука пшеничная I сорта | 14,0 | 10,6 | 1,3 | 73,2 | 329 |
| Мука пшеничная II сорта | 14,0 | 11,7 | 1,8 | 70,8 | 328 |
| Мука ржаная | 14,0 | 6,9 | 1,1 | 76,9 | 326 |
Бобы эдамаме
Эти крошки, полные белка, уже, наверно, проделали свой путь на вашу тарелку или, в любом случае, сервировались вам в качестве гарнира к суши в вашем любимом японском ресторане. Вы, наверно, и не знали, как они богаты белком, но не дайте малому размеру обмануть вас – они очень полезны.
Эдамаме – это несозревшие соевые бобы, которые варят или готовят на пару прямо в стручках – содержат 22 г белка на 1 чашку. Сочетайте их вместе со своим любимым белковым блюдом, и у вас не возникнет проблем с достижением рекомендованных 30 г белка на 1 прием пищи.
Содержание белка: 16,9 г на чашку (в приготовленном виде).
Рыба и морепродукты
Рыба и морепродукты являются источником полезных полиненасыщенных жиров Омега-3, витаминов A и D, а также фтора, фосфора и йода. Благодаря полезным свойствам и низкой калорийности, морепродукты включены в состав многих диет для похудения или сушки тела.
В зависимости от жирности выделяют три категории рыбы: жирную, средней жирности и нежирную. Для обеспечения организма необходимым количеством жирных кислот Омега-3 достаточно употреблять 3 порции жирных или средне жирных сортов рыбы в неделю.
| Продукты | Ккал на 100 г | Белки | Жиры | Углеводы |
|---|---|---|---|---|
| Белуга | 147 | 21 | 0 | 0 |
| Бычки | 86 | 14 | 1 | 3 |
| Вобла свежая | 97 | 18 | 2 | 0 |
| Горбуша маринованная | 136 | 20 | 5 | 0 |
| Горбуша свежая | 142 | 20 | 6 | 0 |
| Соленая горбуша | 169 | 22 | 9 | 0 |
| Дорадо | 96 | 18 | 3 | 0 |
| Ерш | 88 | 17 | 2 | 0 |
| Камбала | 83 | 15 | 1 | 0 |
| Карась | 87 | 17 | 1 | 0 |
| Карп | 112 | 16 | 5 | 0 |
| Кета | 138 | 22 | 5 | 0 |
| Кефаль | 124 | 21 | 0 | 0 |
| Килька балтийская | 137 | 14 | 9 | 0 |
| Килька каспийская | 191 | 18 | 13 | 0 |
| Соленая килька | 137 | 17 | 7 | 0 |
| Лещ | 105 | 17 | 4 | 0 |
| Лосось свежий | 187 | 20 | 11 | 0 |
| Филе минтая | 72 | 16 | 1 | 0 |
| Мойва | 157 | 13 | 10 | 0 |
| Навага | 73 | 15 | 1 | 0 |
| Налим | 80 | 18 | 0 | 0 |
| Морской окунь | 79 | 15 | 1 | 0 |
| Речной окунь | 130 | 14 | 6 | 0 |
| Осетр | 163 | 17 | 10 | 0 |
| Палтус | 102 | 18 | 3 | 0 |
| Плотва | 88 | 17 | 2 | 0 |
| Сайда | 92 | 19 | 0 | 0 |
| Сельдь соленая | 217 | 19 | 15 | 0 |
| Скумбрия | 191 | 18 | 13 | 0 |
| Сом маринованный | 116 | 10 | 7 | 0 |
| Толстолобик | 86 | 19 | 0 | 0 |
| Треска | 201 | 12 | 12 | 0 |
| Тунец соленый | 139 | 24 | 4 | 0 |
| Тюлька соленая | 191 | 19 | 12 | 0 |
| Форель | 119 | 20 | 3 | 0 |
| Хек | 86 | 16 | 1 | 0 |
| Икра | 230 | 31 | 11 | 0 |
| Кальмары | 98 | 19 | 2 | 0 |
| Крабовое мясо | 140 | 15 | 6 | 10 |
| Крабовые палочки | 73 | 6 | 1 | 10 |
| Креветки очищенные замороженные | 60 | 14 | 1 | 0 |
| Свежие креветки | 97 | 22 | 1 | 0 |
| Морская капуста | 49 | 0 | 5 | 0 |
| Раки речные свежие | 76 | 15 | 1 | 1 |
| Рыбный фарш | 96 | 16 | 0 | 0 |
ТОП 100 продуктов и блюд богатых белком
Таблица белков в продуктах на 100 грамм очень удобна в использовании. В ней вы найдёте топ из наиболее белковых продуктов и перечень популярных готовых блюд с указанием их калорийности. Нужно помнить о том, что на питательность блюд оказывает влияние способ их приготовления. Используя наш сервис, вы сможете грамотно определить состав пищи, убрать из рациона лишние элементы и калории, и составлять только полезное меню для себя и своей семьи.
| Название продуктов и блюд | Белки | Жиры | Углеводы |
| Сухой белок | 73,3 | 1,8 | 7,0 |
| Яичный порошок | 45,0 | 37,3 | 7,1 |
| Соя | 34,9 | 17,3 | 26,5 |
| Сухой желток | 34,2 | 52,2 | 4,4 |
| Куриное филе вареное | 30,4 | 3,5 | 0,0 |
| Бифштекс | 27,8 | 29,6 | 1,7 |
| Грибы белые сушеные | 27,6 | 6,8 | 10,0 |
| Арахис | 26,3 | 45,2 | 9,7 |
| Молоко сухое цельное | 26,0 | 25,0 | 37,5 |
| Сыр голландский | 26,0 | 26,8 | 0,0 |
| Сыр пошехонский | 26,0 | 26,5 | 0,0 |
| Сыр швейцарский | 24,9 | 31,8 | 0,0 |
| Чечевица | 24,8 | 1,1 | 53,7 |
| Сыр российский | 24,1 | 29,5 | 0,3 |
| Горох лущеный | 23,0 | 1,6 | 57,7 |
| Горох цельный | 23,0 | 1,2 | 53,3 |
| Тунец | 22,7 | 0,7 | 0,0 |
| Ветчина | 22,6 | 20,9 | 0,0 |
| Фасоль | 22,3 | 1,7 | 54,5 |
| Кета | 22,0 | 5,6 | 0,0 |
| Индейка | 21,6 | 12,0 | 0,8 |
| Куриные бедра | 21,3 | 11,0 | 0,1 |
| Куры | 20,8 | 8,8 | 0,6 |
| Семга | 20,8 | 15,1 | 0,0 |
| Кролик | 20,7 | 12,9 | 0,0 |
| Семя подсолнечника | 20,7 | 52,9 | 5,0 |
| Горбуша | 20,5 | 6,5 | 0,0 |
| Сайра мелкая | 20,4 | 0,8 | 0,0 |
| Конина | 20,2 | 7,0 | 0,0 |
| Телятина | 19,7 | 1,2 | 0,0 |
| Угорь морской | 19,1 | 1,9 | 0,0 |
| Эскалоп | 19,0 | 42,8 | 6,8 |
| Сиг | 19,0 | 7,5 | 0,0 |
| Судак | 19,0 | 0,8 | 0,0 |
| Говядина | 18,9 | 12,4 | 0,0 |
| Палтус | 18,9 | 3,0 | 0,0 |
| Печень свиная | 18,8 | 3,6 | 0,0 |
| Налим | 18,8 | 0,6 | 0,0 |
| Цыплята | 18,7 | 7,8 | 0,4 |
| Сырник творожный | 18,6 | 3,6 | 18,2 |
| Сайра крупная | 18,6 | 20,8 | 0,0 |
| Миндаль | 18,6 | 57,7 | 13,6 |
| Окунь речной | 18,5 | 0,9 | 0,0 |
| Ставрида | 18,5 | 5,0 | 0,0 |
| Сазан | 18,4 | 5,3 | 0,0 |
| Щука | 18,4 | 0,8 | 0,0 |
| Котлеты из курицы | 18,2 | 10,4 | 13,8 |
| Язь | 18,2 | 1,0 | 0,0 |
| Скумбрия | 18,0 | 9,0 | 0,0 |
| Кальмар | 18,0 | 0,3 | 0,0 |
| Креветка | 18,0 | 0,8 | 0,0 |
| Брынза (сыр из коровьего молока) | 17,9 | 20,1 | 0,0 |
| Карась | 17,7 | 1,8 | 0,0 |
| Сельдь | 17,7 | 19,5 | 0,0 |
| Запеканка творожная | 17,6 | 4,2 | 14,2 |
| Окунь морской | 17,6 | 5,2 | 0,0 |
| Треска | 17,5 | 0,6 | 0,0 |
| Говяжья Печень | 17,4 | 3,1 | 0,0 |
| Салака | 17,3 | 5,6 | 0,0 |
| Творог 5% нежирный | 17,2 | 5,0 | 1,8 |
| Лещ | 17,1 | 4,1 | 0,0 |
| Стерлядь | 17,0 | 6,1 | 0,0 |
| Сыр плавленый | 16,8 | 11,2 | 23,8 |
| Говядина тушеная | 16,8 | 18,3 | 0,0 |
| Сом | 16,8 | 8,5 | 0,0 |
| Бефстроганов из говядины | 16,7 | 11,3 | 5,9 |
| Творог 9% полужирный | 16,7 | 9,0 | 2,0 |
| Хек | 16,6 | 2,2 | 0,0 |
| Творог обезжиренный | 16,5 | 0,0 | 1,3 |
| Утки | 16,5 | 61,2 | 0,0 |
| Камбала | 16,5 | 1,8 | 0,0 |
| Буженина вареная | 16,4 | 18,3 | 1,0 |
| Свинина нежирная | 16,4 | 27,8 | 0,0 |
| Осетр | 16,4 | 10,9 | 0,0 |
| Баранина | 16,3 | 15,3 | 0,0 |
| Гуси | 16,1 | 33,3 | 0,0 |
| Навага | 16,1 | 1,0 | 0,0 |
| Путассу | 16,1 | 0,9 | 0,0 |
| Фундук | 16,1 | 66,9 | 9,9 |
| Баранки | 16,0 | 1,0 | 70 |
| Карп | 16,0 | 5,6 | 0,0 |
| Краб | 16,0 | 0,5 | 0,0 |
| Минтай | 15,9 | 0,7 | 0,0 |
| Корюшка | 15,4 | 4,5 | 0,0 |
| Грецкий орех | 15,2 | 61,3 | 10,2 |
| Сердце свиное | 15,1 | 3,2 | 0,0 |
| Салат Цезарь | 15,0 | 10,0 | 9,0 |
| Говяжье Сердце | 15,0 | 3,0 | 0,0 |
| Свинина тушеная | 14,9 | 32,2 | 0,0 |
| Угорь | 14,5 | 30,5 | 0,0 |
| Язык свиной | 14,2 | 16,8 | 0,0 |
| Говяжий гуляш | 14,0 | 9,2 | 2,6 |
| Говяжий Язык | 13,6 | 12,1 | 0,0 |
| Мойва | 13,4 | 11,5 | 0,0 |
| Макрурус | 13,2 | 0,8 | 0,0 |
| Угольная рыба | 13,2 | 11,6 | 0,0 |
| Хлеб ржаной | 13,0 | 3,0 | 40,0 |
| Яйцо куриное | 12,7 | 10,9 | 0,7 |
| Гречневая крупа ядрица (гречка) | 12,6 | 3,3 | 62,1 |
| Геркулес | 12,5 | 6,2 | 61,0 |
Овощи
Если вы хотите сбросить лишний вес, вам следует кушать овощи в больших количествах. В них много клетчатки, витаминов и других полезных компонентов. Большинство из них – низкокалорийные продукты. Это в свою очередь, тоже способствует сжиганию жиров.
Овощи + белки = хорошее сочетание.
| Продукт | Вода | Белки | Жиры | Углеводы | ккал |
| Баклажаны | 91,0 | 0,6 | 0,1 | 5,5 | 24 |
| Брюква | 87,5 | 1,2 | 0,1 | 8,1 | 37 |
| Горошек зеленый | 80 | 5,0 | 0,2 | 13,3 | 72 |
| Кабачки | 93,0 | 0,6 | 0,3 | 5,7 | 27 |
| Капуста белокочанная | 90 | 1,8 | — | 5,4 | 28 |
| Капуста краснокочанная | 90 | 1,8 | — | 6,1 | 31 |
| Капуста цветная | 90,9 | 2,5 | — | 4,9 | 29 |
| Картофель | 76,0 | 2,0 | 0,1 | 19,7 | 83 |
| Лук зеленый (перо) | 92,5 | 1,3 | — | 4,3 | 22 |
| Лук порей | 87,0 | 3,0 | — | 7,3 | 40 |
| Лук репчатый | 86,0 | 1,7 | — | 9,5 | 43 |
| Морковь красная | 88,5 | 1,3 | 0,1 | 7,0 | 33 |
| Огурцы грунтовые | 95,0 | 0,8 | — | 3,0 | 15 |
| Огурцы парниковые | 96,5 | 0,7 | — | 1,8 | 10 |
| Перец зеленый сладкий | 92,0 | 1,3 | — | 4,7 | 23 |
| Перец красный сладкий | 91,0 | 1,3 | — | 5,7 | 27 |
| Петрушка (зелень) | 85,0 | 3,7 | — | 8,1 | 45 |
| Петрушка (корень) | 85,0 | 1,5 | — | 11,0 | 47 |
| Ревень (черешковый) | 94,5 | 0,7 | — | 2,9 | 16 |
| Редис | 93,0 | 1,2 | — | 4,1 | 20 |
| Редька | 88,6 | 1,9 | — | 7,0 | 34 |
| Репа | 90,5 | 1,5 | — | 5,9 | 28 |
| Салат | 95,0 | 1,5 | — | 2,2 | 14 |
| Свекла | 86,5 | 1,7 | — | 10,8 | 48 |
| Томаты (грунтовые) | 93,5 | 0,6 | — | 4,2 | 19 |
| Томаты (парниковые) | 94,6 | 0,6 | — | 2,9 | 14 |
| Зеленая фасоль (стручок) | 90 | 4,0 | — | 4,3 | 32 |
| Хрен | 77,0 | 2,5 | — | 16,3 | 71 |
| Черемша | 89,0 | 2,4 | — | 6,5 | 34 |
| Чеснок | 70 | 6,5 | — | 21,2 | 106 |
| Шпинат | 91,2 | 2,9 | — | 2,3 | 21 |
| Щавель | 90 | 1,5 | — | 5,3 | 28 |
Фрукты и ягоды
О ягодах и фруктах забывать не стоит. Они должны присутствовать в рационе. Диетологи считают, что вместо тортиков и пирожных, на десерт, лучше употреблять фрукты. В некоторых сладких фруктах зафиксировано высокое содержание калорий. Значит от их употребления нужно отказаться если вы хотите похудеть.
| Продукт | Вода | Белки | Жиры | Углеводы | ккал |
| Абрикосы | 86,0 | 0,9 | — | 10,5 | 46 |
| Айва | 87,5 | 0,6 | — | 8,9 | 38 |
| Алыча | 89,0 | 0,2 | — | 7,4 | 34 |
| Ананас | 86,0 | 0,4 | — | 11,8 | 48 |
| Бананы | 74,0 | 1,5 | — | 22,4 | 91 |
| Вишня | 85,5 | 0,8 | — | 11,3 | 49 |
| Гранат | 85,0 | 0,9 | — | 11,8 | 52 |
| Груша | 87,5 | 0,4 | — | 10,7 | 42 |
| Инжир | 83,0 | 0,7 | — | 13,9 | 56 |
| Кизил | 85,0 | 1,0 | — | 9,7 | 45 |
| Персики | 86,5 | 0,9 | — | 10,4 | 44 |
| Рябина садовая | 81,0 | 1,4 | — | 12,5 | 58 |
| Рябина черноплодная | 80,5 | 1,5 | — | 12,0 | 54 |
| Слива садовая | 87,0 | 0,8 | — | 9,9 | 43 |
| Финики | 20 | 2,5 | — | 72,1 | 281 |
| Хурма | 81,5 | 0,5 | — | 15,9 | 62 |
| Черешня | 85,0 | 1,1 | — | 12,3 | 52 |
| Шелковица | 82,7 | 0,7 | — | 12,7 | 53 |
| Яблоки | 86,5 | 0,4 | — | 11,3 | 46 |
| Апельсин | 87,5 | 0,9 | — | 8,4 | 38 |
| Грейпфрут | 89,0 | 0,9 | — | 7,3 | 35 |
| Лимон | 87,7 | 0,9 | — | 3,6 | 31 |
| Мандарин | 88,5 | 0,8 | — | 8,6 | 38 |
| Брусника | 87,0 | 0,7 | — | 8,6 | 40 |
| Виноград | 80,2 | 0,4 | — | 17,5 | 69 |
| Голубика | 88,2 | 1,0 | — | 7,7 | 37 |
| Ежевика | 88,0 | 2,0 | — | 5,3 | 33 |
| Земляника | 84,5 | 1,8 | — | 8,1 | 41 |
| Клюква | 89,5 | 0,5 | — | 4,8 | 28 |
| Крыжовник | 85,0 | 0,7 | — | 9,9 | 44 |
| Малина | 87,0 | 0,8 | — | 9,0 | 41 |
| Морошка | 83,3 | 0,8 | — | 6,8 | 31 |
| Облепиха | 75,0 | 0,9 | — | 5,5 | 30 |
| Смородина белая | 86,0 | 0,3 | — | 8,7 | 39 |
| Смородина красная | 85,4 | 0,6 | — | 8,0 | 38 |
| Смородина черная | 85,0 | 1,0 | — | 8,0 | 40 |
| Черника | 86,5 | 1,1 | — | 8,6 | 40 |
| Шиповник свежий | 66,0 | 1,6 | — | 24,0 | 101 |
| Шиповник сушеный | 14,0 | 4,0 | — | 60 | 253 |
НАШИ ПОЛЕЗНОСТИ
- Таблица калорийности
- Группа “Эмульгаторы” Е(5xx)
- Кулинарные термины
- Сравнительная таблица мер и веса некоторых продуктов
- Группа “Стабилизаторы и загустители” Е (4хх)
- Группа “Консерванты” Е (2хх)
- Группа “Красители” Е (1xx)
- Группа “Антиокислители” Е (3хх)
- Группа “Усилители вкуса и аромата” Е(6xx)
- Группа “Пеногасители” Е(9xx)
- Группа “Эмульгаторы, глазирователи, стабилизаторы, загустители, подсластители, разрыхлители, регуляторы кислотности” Е(1ххх)
- Таблица калорийности (овощи, зелень, фрукты, ягоды, грибы, бобовые)
- Таблица калорийности (мясо, мясные продукты, птица, рыба, яйца)
В каких овощах есть белок
Все овощи, а также орехи, грибы, зерновые, бобовые и просто съедобная зелень имеют в своём составе белок. Овощами с большим содержанием белка считаются приведенные ниже.
Соя
Соя занимает первое место в рейтинге белковых овощей, не уступая мясным продуктам содержанием белков. Соевый белок отлично усваивается человеческим организмом. Соевые продукты широко используются в диетическом и детском питании. Подходят для употребления людьми со склонностью к аллергическим реакциям, рекомендуются в рацион женщинам в период менопаузы и климакса.
Те, кто столкнулся с проблемой непереносимости казеина или имеет другие противопоказания к употреблению молочных продуктов, может найти им достойную замену в соевом молоке и сыре тофу.
Соевая мука подойдёт противникам глютена и тем, кто ограничивает хлебобулочные изделия из пшеницы.
Производители предлагают всё больше наименований соевой продукции, выпускаемой в виде полуфабрикатов. Стоит обращать внимание на состав продукта и наличие соответствия ГОСТу на этикетке.
Обратите внимание! Особенно удобен в использовании сухой соевый фарш. После непродолжительного замачивания в воде продукт полностью пригоден для приготовления всеми любимых блюд, например, голубцов или макарон «по-флотски».
Бобовые
Продолжают список бобовые, среди которых самое высокое содержание белка у чечевицы. Эта крупа выгодно отличается от фасоли и гороха непродолжительным временем варки (от 15 до 20 минут). Она подходит для приготовления супов и гарниров. Можно сварить её как самостоятельное блюдо, приправив растительным маслом, чесноком и зеленью петрушки. Также чечевица замечательно сочетается с бурым рисом и тушёными овощами, например, тыквой или цукини.
Бобовые содержат белок
Немного больших усилий требует приготовление нута. Зато польза и удовольствие от дегустации блюд превзойдут все ожидания. Главное – замочить горошины за несколько часов до начала готовки. Становясь мягче от впитавшейся в него воды, нут легко перемелется на мясорубке вместе с картофелем или морковью, превратившись в высокобелковый фарш. Котлетки формуются из нута без добавления яиц, поэтому подойдут даже строгим вегетарианцам. Можно использовать отварной нут в качестве основы для приготовления необычных лёгких и сытных салатов.
Полезный совет! Чтобы избежать «музыкального эффекта» при употреблении бобов и гороха, необходимо обильно приправлять их свежим укропом, препятствующим излишнему газообразованию.
Грибы
Отличный источник протеина. Сочетаются практически со всеми овощами. Используются для приготовления супов, запеканок, салатов, жульенов, подлив и начинок для пирогов. Грибы трудно усваиваются. Для облегчения пищеварительных процессов их необходимо мелко резать. Легче всего переваривается грибной порошок, приготовленный из сушёных лесных грибов.
Кулинарная хитрость! При жарке грибов лучше добавлять соль в конце готовки, чтобы избежать появления ненужной жидкости.
Шпинат
Еще один продукт, восполняющий норму белка в организме. Его вполне заслуженно называют «метлой для желудка». Благодаря высокому содержанию пищевых волокон в своём составе продукт легко переваривается и, покидая кишечник, прихватывает вместе с собой скопившиеся в нём токсины и шлаки.
Внимание! Чем свежее шпинат, тем больше его ценность. Максимально сохранить пользу продукта помогает заморозка. В замороженном виде сохраняется более 90 % полезных веществ.
Замороженный шпинат легко использовать для приготовления супов. Не только вкусным, но и красивым выглядит картофельное пюре с добавлением в него шпинатной зелени. Листья в свежем виде добавляют вкус и цвет салатам. Заморозка очень быстро готовится и поэтому подходит для яичниц и омлетов. Шпинат может удачно использоваться для приготовления и завтрака, и обеда, и ужина. Он сочетается с тыквой, грибами и различными фруктами.
Шпинат
Капуста
Брокколи, брюссельская, пекинская и цветная капуста, салат руккола, мангольд, кольраби – это также овощи, богатые белком. Они одинаково вкусны в сыром виде и после тепловой обработки. В сочетании с крупами и макаронными изделиями они разнообразят рацион и насытят его необходимым количеством протеина.
Сколько надо получать белка?
Итак, белковая пища очень полезна, и важной составной частью ее являются овощи. Минимально допустимое вхождение в 1 прием пищи, по мнению диетологов, составляет 30 гр, при этом минимальное дневное поступление должно быть от 45 гр. Женщинам, чтобы более точно оценить потребность, нужно умножать количество килограммов на 1-1,2 гр белка. Для мужчин коэффициент составляет уже 1,5 гр. Важно: для систематически занимающихся спортом или выполняющих тяжелую физическую работу норма увеличивается до 2 гр на 1 кг массы тела.
По мнению профессионалов, примерно 40% потребности в белке должно восполняться за счет растительной пищи. Это позволит, наряду с удовлетворением нужд организма, исключить перегрузку желудочно-кишечного тракта мясом, рыбой и птицей. Грибы, ягоды и фрукты почти не дают такой возможности. Потому овощам принадлежит особая роль в полноценном питании, даже если люди живут там, где могут круглый год есть свежие плоды.
Кроме того, получая белки вместе с овощами, люди не просто предотвращают чувство тяжести в желудке. Это позволяет исключить переедания. А оно способно — незаметно и исподволь — подорвать здоровье, спровоцировать хронические заболевания.
Стоит помнить, что предельная суточная доза белка не должна превышать физиологическую норму больше чем на 50%. Это обстоятельство тоже учитывают при выработке рациональной диеты.
В следующем видео вас ждет ТОП-10 растительных продуктов, богатых протеинами (белками).
6. Зелень горчицы
Зелень горчицы принадлежит семейству Капустные. Она очень похожа на капусту, но имеет ярко выраженный горчичный вкус.
Зелень горчицы имеет следующее содержание белка (30):
- Стандартная 55-граммовая порция нарезанной зелени горчицы содержит 1,6 грамма белка.
- В 100 граммах зелени горчицы содержится 2,9 грамма белка и 27 калорий.
- Белок составляет 42% ее калорий.
В 55-граммовой порции зелени горчицы также содержится 144 мкг витамина K, что составляет более 100% от рекомендованной суточной нормы потребления для человека (2).
Она является богатым источником витамина C, а также содержит кальций, калий и витамины группы B. Она также является хорошим источником витамина E.
Зелень горчицы, как и многие другие растения, содержит фенольные соединения, которые наделяют ее антиоксидантными свойствами (22, 31).
Исследование в пробирке показало, что приготовление зелени горчицы на пару увеличивает ее способность связываться с желчными кислотами. Это может помочь вам снизить уровень холестерина (32).
В том же исследовании также было установлено, что приготовление на пару может оказывать аналогичное положительное влияние на листовую капусту, кудрявую капусту, огородную капусту, зеленый перец и брокколи.
Вы можете готовить зелень горчицы на пару, варить или обжаривать, или можете просто есть ее в сыром виде.
Молочные продукты
Отсутствие достаточного количества белка в организме сделает тело худым и рыхлым, ну уж никак не позволит добиться качественной массы тела.
Многие специалисты рекомендуют начинать сгонку лишнего веса и сжигание жиров, если килограммов не слишком много, с наращивания мышечной массы. Этот подход достаточно эффективен, так как мышцы энергоёмкая ткань организма. Если в вашем теле есть достаточно проработанной мускулатуры, то даже в состояние покоя количество потребляемых организмом калорий будет высоким. Это связано с тем, что мышцы буквально пронизаны кровеносной системой и требуют постоянного питания и дыхания, а значит и затраты энергии на их содержание в организме высокие. Жировая ткань напротив не требует больших затрат энергии на своё содержание, так как это экстренное депо энергии “на чёрный день”. Повысить содержание белков и правильных углеводов в питании поможет та же таблица энергетической ценности и калорийности продуктов. Рассчитать суточное значение необходимых организму калорий можно общим способом путём не сложных вычислений.
| ПРОДУКТ | БЕЛКИ | ЖИРЫ | УГЛЕВОДЫ | ККАЛ |
|---|---|---|---|---|
| Йогурт 1.5% | 4,3 | 1,5 | 8,4 | 65 |
| Йогурт 3.2% | 5 | 3,2 | 8,9 | 87 |
| Кефир 0% | 2,8 | 0 | 3,8 | 29 |
| Кефир 1% | 2,8 | 1 | 4,0 | 37 |
| Кефир 2,5% | 3 | 2,5 | 4,0 | 51 |
| Кефир 3,2% | 3,2 | 3,2 | 4,1 | 57 |
| Молоко 0% | 2,8 | 0 | 4,6 | 34 |
| Молоко 1% | 2,8 | 1 | 4,6 | 43 |
| Молоко 2,5% | 2,8 | 2,5 | 4,6 | 53 |
| Молоко 3,2% | 2,8 | 3,2 | 4,6 | 58 |
| Молоко козье сырое | 3,1 | 4,2 | 4,7 | 71 |
| Молоко коровье сырое | 3,2 | 3,6 | 4,7 | 63 |
| Молоко обезжиренное | 2,1 | 0,1 | 4,5 | 30 |
| Молоко сухое цельное | 25,2 | 25 | 39,6 | 477 |
| Молоко сгущенное | 7,3 | 7,7 | 9,7 | 139 |
| Простокваша 3,2% | 2,9 | 3,2 | 4,0 | 57 |
| Ряженка 2,5% | 2,9 | 2,5 | 4,1 | 53 |
| Ряженка 4,0% | 2,9 | 4 | 4,1 | 68 |
| Сливки 10% | 2,8 | 10 | 4,1 | 121 |
| Сливки 20% | 2,8 | 20 | 3,9 | 209 |
| Сметана 10% | 3 | 10 | 2,9 | 118 |
| Сметана 15% | 3 | 15 | 2,9 | 163 |
| Сметана 20% | 3 | 20 | 2,9 | 208 |
| Сырки из творожной массы | 7,3 | 23 | 27,6 | 344 |
| Сыр голландский | 26,4 | 26,5 | 0 | 352 |
| Сыр пошехонский | 26,4 | 26,3 | 0 | 348 |
| Сыр российский | 24,1 | 29,8 | 0,4 | 366 |
| Сыр сулугуни | 20 | 24,2 | 0 | 293 |
| Творог жирный | 14 | 18 | 1,9 | 236 |
| Творог нежирный | 18,2 | 0,6 | 1,8 | 89 |
| Творог полужирный | 16,5 | 9 | 1,9 | 156 |
Яйца
В состав яиц входит легкоусвояемый белок и незаменимые витамины A, E, D, B12, фолиевая кислота, биотин, холин, а также лейцин, селен, магний. Одно яйцо содержит около 5% от суточной нормы железа, кальция и цинка, но, при этом, не стоит употреблять больше 4-5 яиц в день.
| Продукты | Ккал на 100 г | Белки | Жиры | Углеводы |
|---|---|---|---|---|
| Яйцо куриное | 157 | 12 | 10 | 0 |
| Яйцо перепелиное | 168 | 11 | 13 | 0 |
| Яйцо индюшиное | 165 | 13 | 10 | 0 |
| Яйцо утиное | 185 | 14 | 14 | 0 |
| Яйцо гусиное | 185 | 13 | 13 | 1 |
| Омлет | 184 | 9 | 15 | 1 |
| Яичница глазунья | 192 | 10 | 15 | 0 |
| Куриное яйцо вкрутую | 160 | 12 | 11 | 0 |
| Яичный порошок | 542 | 46 | 37 | 4 |
Примерное дневное меню
К завтраку можно подать постный кусочек мяса, белковый (протеиновый) коктейль, целое яйцо или белок, йогурт греческий.
На ужин и обед отлично подойдет тофу, мясо индейки, куриные грудка и колбаса, постный фарш из говядины, лосось, креветки, тунец и треска.
В качестве перекуса можно покушать очищенные семечки, выпить протеиновый коктейль, съесть орехи, что-либо из бобовых.
Тыквенные семечки
После того как мякоть вы определили в чудесный пирог, возникает вопрос – а что делать с семечками тыквы? Если их пожарить, это будет прекрасной альтернативой чипсам, но знаете ли вы, что 30 г семечек – это почти 5 г белка, что даже больше чем в половинке яйца?
Это не только высокобелковая растительная бомба: диета, богатая тыквенными семечками, позволяет сократить риск возникновения рака желудка, груди, легких и кишечника.
Тыквенные семечки также богаты антиоксидантами, которые помогают сократить окислительные процессы в организме.
Столкнулись с бессонницей? L-триптофан в тыквенных семечках помогает справиться с бессонными ночами.
Содержание белка: 5,2 г на порцию в 30 г (в жареном виде).
Крупы и бобовые
Крупы и бобовые – самые питательные продукты растительного происхождения в связи со значительным количеством углеводов в составе. Из таблицы видно, что крупы и бобовые имеют одинаково высокую калорийности на 100 грамм продукта, но отличаются по содержанию полезных веществ в зависимости от технологической обработки.
При формировании рациона правильного питания следует отдавать предпочтение цельнозерновым крупам, которые являются медленными углеводами и содержат много клетчатки.
| Продукты | Ккал на 100 г | Белки | Жиры | Углеводы |
|---|---|---|---|---|
| Пшено | 348 | 10 | 3 | 69 |
| Рис белый | 334 | 6 | 0 | 78 |
| Коричневый рис | 337 | 7 | 1 | 72 |
| Рис для суши | 342 | 7 | 0 | 75 |
| Рис красный нешлифованный | 362 | 10 | 2 | 70 |
| Дикий рис | 101 | 4 | 0 | 21 |
| Манка | 328 | 10 | 1 | 73 |
| Булгур | 342 | 12 | 1 | 57 |
| Гречневая крупа ядрица | 306 | 9 | 2 | 62 |
| Кукурузная крупа | 337 | 8 | 1 | 75 |
| Овсяная крупа | 342 | 12 | 6 | 59 |
| Пшеничная крупа | 316 | 11 | 1 | 62 |
| Пророщенная пшеница | 198 | 7 | 1 | 41 |
| Кус-кус | 376 | 12 | 0 | 72 |
| Овсяные хлопья | 350 | 14 | 7 | 56 |
| Гречневые хлопья | 330 | 9 | 2 | 67 |
| Ячменные хлопья | 355 | 9 | 3 | 79 |
| Ржаные хлопья | 343 | 6 | 3 | 82 |
| Кукурузные хлопья | 363 | 6 | 2 | 83 |
| Рисовые хлопья | 360 | 7 | 2 | 77 |
| Перловка | 320 | 9 | 1 | 73 |
| Полба | 337 | 14 | 2 | 61 |
| Киноа | 368 | 14 | 6 | 57 |
| Овсяные отруби | 320 | 18 | 7 | 45 |
| Пшеничные отруби | 296 | 15 | 3 | 53 |
| Ржаные отруби | 221 | 11 | 3 | 32 |
| Рисовые отруби | 316 | 13 | 20 | 28 |
| Нут | 364 | 19 | 6 | 61 |
| Маш | 300 | 23 | 2 | 46 |
| Киноа | 368 | 14 | 6 | 57 |
| Зеленая чечевица | 248 | 24 | 1 | 42 |
| Красная чечевица | 314 | 21 | 1 | 48 |
| Горох лущеный | 323 | 23 | 1 | 57 |
| Фасоль белая | 102 | 7 | 0 | 16 |
| Фасоль красная | 93 | 8 | 0 | 13 |
| Фасоль черная | 132 | 8 | 0 | 23 |
| Бобы | 57 | 6 | 0 | 8 |
| Зеленые бобы | 60 | 6 | 0 | 10 |
| Соя | 381 | 34 | 17 | 17 |
| Арахис | 551 | 26 | 45 | 9 |
| Сушеный арахис | 611 | 29 | 50 | 10 |
Фрукты и ягоды
| Продукты | Ккал на 100 г | Белки | Жиры | Углеводы |
|---|---|---|---|---|
| Яблоки | 47 | 0 | 0 | 9 |
| Груши | 42 | 0 | 0 | 10 |
| Банан | 95 | 1 | 0 | 21 |
| Апельсин | 36 | 0 | 0 | 8 |
| Мандарин | 33 | 0 | 0 | 7 |
| Грейпфрут | 29 | 0 | 0 | 6 |
| Лимон | 16 | 0 | 0 | 3 |
| Лайм | 16 | 0 | 0 | 3 |
| Арбуз | 25 | 0 | 0 | 5 |
| Дыня | 33 | 0 | 0 | 7 |
| Абрикос | 41 | 0 | 0 | 10 |
| Вишня | 52 | 0 | 0 | 11 |
| Черешня | 50 | 1 | 0 | 10 |
| Персик | 46 | 0 | 0 | 11 |
| Сливы | 42 | 0 | 0 | 9 |
| Нектарин | 48 | 0 | 0 | 10 |
| Гранат | 52 | 0 | 0 | 13 |
| Киви | 48 | 1 | 0 | 10 |
| Манго | 67 | 0 | 0 | 10 |
| Авокадо | 208 | 2 | 20 | 7 |
| Хурма | 66 | 0 | 0 | 15 |
| Клубника | 41 | 0 | 0 | 7 |
| Малина | 46 | 0 | 0 | 8 |
| Виноград | 65 | 0 | 0 | 16 |
| Крыжовник | 43 | 0 | 0 | 12 |
| Тутовник | 52 | 0 | 0 | 13 |
| Черная смородина | 44 | 1 | 0 | 7 |
| Красная смородина | 43 | 0 | 0 | 7 |
| Алыча | 27 | 0 | 0 | 6 |
| Ананас | 49 | 0 | 0 | 10 |
| Черника | 44 | 1 | 0 | 7 |
Орехи
Орехи помогают быстро и надолго утолить голод, а также обогатить организм ценными компонентами. Однако орехи отличаются высокой калорийностью, поэтому от их употребления стоит воздержаться во время диеты.
Человек на диете не должен злоупотреблять употреблением орехов.
| Продукт | Вода | Белки | Жиры | Углеводы | ккал |
| Фундук | 4,8 | 16,1 | 66,9 | 9,9 | 704 |
| Миндаль | 4 | 18,6 | 57,7 | 13,6 | 645 |
| Грецкий орех | 5 | 13,8 | 61,3 | 10,2 | 648 |
| Арахис | 10 | 26,3 | 45,2 | 9,7 | 548 |
| Семя подсолнечника | 8 | 20,7 | 52,9 | 5 | 578 |
Яйца
| ПРОДУКТ | БЕЛКИ | ЖИРЫ | УГЛЕВОДЫ | ККАЛ |
|---|---|---|---|---|
| Омлет | 9,7 | 15,5 | 1,7 | 181 |
| Яйцо куриное | 12,7 | 11,1 | 0,6 | 153 |
| Яйцо перепелиное | 11,9 | 13,3 | 0,8 | 170 |
| Яйцо страусиное | 12,4 | 11,5 | 0,8 | 118 |
| Яйцо утиное | 13,5 | 14,1 | 0,2 | 176 |
| Яичный порошок | 45,3 | 37,3 | 5,1 | 545 |
ЭТИ СТАТЬИ ПОМОГУТ ВАМ ПОХУДЕТЬ
Ваш отзыв на статью:
(
471
оценок, среднее:
4,50
из 5)
Загрузка…
Новости фитнес-клуба POWERHOUSE GYM РЕУТОВ
30.11.2017
Производители протеиновых коктейлей предлагают современному человеку большой выбор высокобелковых смесей. Каждый человек должен подобрать продукт, который подходит ему оптимальным образом.
Протеин подбирают по нескольким параметрам. Откидываем все добавки, и остается выявить процентное соотношение углеводов и жиров в продукте.
Следующим шагом остается определиться, с какой целью вы собираетесь употреблять высокобелковые смеси. Современный протеиновый коктейль имеет несколько разновидностей.
Сывороточный протеин.
· Имеет максимальную скорость усвоения, по сравнению с остальными продуктами. Кроме того, он на четверть состоит из аминокислот ВСАА. Это позволяет использовать данный вид протеина после тренировок, когда мышцам необходим строительный материал для восстановления. Чем чище сыворотка, тем выше ее стоимость.
Изолят сывороточного протеина.
· Считается самой чистой протеиновой сывороткой. В нем практически не содержится жира и углеводов, но и обходится дороже. Если вы стараетесь избегать лишних углеводов или находитесь на стадии сушки, то данный продукт незаменим.
Гидролизат протеина.
· Включает большее количество белковых фракций, которые разбиты на более мелкие компоненты. Это обеспечивает более быстрое усвоение продукта и поступление белков в мышцы. Гидролизный протеин принимают после тренировок, но это не дешевое удовольствие.
Комплексный протеин.
· Выгодно отличается от всех протеинов, так как является универсальным протеином из за содержания разных типов белка. Как правило, эти белки с разной скоростью усваивания — низкий, средний и высокий. Поэтому такие протеины имеют пролонгированное действие. Прием таких протеинов даст вашему организм непрерывный поток незаменимых аминокислот для восстановления и набора мышечной массы.
Казеиновый протеин.
· Усваивается организмом постепенно. На усвоение смеси уходит примерно 6 часов. Следовательно, на протяжении этого времени организм получает белок, который ему необходим. Если организм не получает протеина, то он начинает брать его из мышц, заменяя жиром. Когда необходимо увеличить содержание белка в рационе питания, казеиновый протеин становится оптимальным решением.
Яичный протеин.
· Изготавливается из яичного белка. Обычно он входит в состав продуктов, а как самостоятельный компонент встречается редко.
Соевый протеин.
· Ряд исследований указывает на то, что изолят соевого протеина влияет на выработку тиреоидных гормонов у человека. Идеально подходит для рациона вегетарианцев.
Растительный протеин.
· Очень популярен у вегетарианцев. В нем содержатся аминокислоты в достаточных количествах, чтобы поддержать развитие организма в целом.
Готовый к употреблению протеин.
· Для людей у которых нет времени на приготовления протеиновых коктейлей. Но онинуждаются в дополнительном источнике белка. Выпускается в разных видах и фасовках : тетра пак, бутылки, также бывает пудинг и в виде геля.
Таблица времени усваивания белков.· 2-3 часа: яичный белок, ультра фильтрованный концентрат сывороточного белка, микрофильтрованный изолят сывороточного протеина.
· 4-6 часа: концентрат молочного белка.
· 6-8 часов: казеинат кальция, мицеллярный альфа-и бета-казеин и казеинаты.
Protein — Better Health Channel
Белок — это питательное вещество, необходимое вашему организму для роста и восстановления клеток и правильной работы. Белок содержится в самых разных продуктах питания, и важно, чтобы вы ежедневно получали достаточное количество белка в своем рационе. Сколько белка вам нужно из своего рациона, зависит от вашего веса, пола, возраста и состояния здоровья. Удовлетворение потребности в белке легко достигается за счет употребления разнообразных продуктов. Пищевой белок поступает из растительных и животных источников, таких как мясо и рыба, яйца, молочные продукты, семена и орехи, а также бобовые, такие как бобы и чечевица.Белки состоят из аминокислот
Белки состоят из строительных блоков, называемых аминокислотами. Существует около 20 различных аминокислот, которые соединяются в разных комбинациях. Ваше тело использует их для производства новых белков, таких как мышцы и кости, и других соединений, таких как ферменты и гормоны. Он также может использовать их в качестве источника энергии.
Некоторые аминокислоты могут быть произведены вашим организмом — их 11, и они известны как заменимых аминокислот .Есть девять аминокислот, которые ваше тело не может производить, и они известны как незаменимых аминокислот . Вы должны включить их в свой рацион в достаточном количестве, чтобы ваше тело могло нормально функционировать.
Пищевая ценность протеина
Пищевая ценность протеина измеряется количеством незаменимых аминокислот, которые он содержит.
Различные продукты содержат разное количество незаменимых аминокислот. Обычно:
- Продукты животного происхождения (например, курица, говядина или рыба и молочные продукты) содержат все незаменимые аминокислоты и известны как «полный» белок (или идеальный или высококачественный белок).
- Соевые продукты, киноа и семена листовой зелени, называемой амарантом (потребляемой в Азии и Средиземноморье), также содержат все незаменимые аминокислоты.
- Растительные белки (бобы, чечевица, орехи и цельные зерна) обычно не имеют хотя бы одной из незаменимых аминокислот и считаются «неполными» белками.
Людям, соблюдающим строгую вегетарианскую или веганскую диету, необходимо каждый день выбирать различные источники белка из сочетания растительных продуктов, чтобы получать достаточное количество незаменимых аминокислот.
Если вы придерживаетесь вегетарианской или веганской диеты, при условии, что вы едите самые разные продукты, вы обычно можете получать необходимый белок. Например, еда, содержащая злаки и бобовые, такие как запеченная фасоль на тосте, содержит все незаменимые аминокислоты, содержащиеся в типичном мясном блюде.
Белковые продукты
Некоторые пищевые источники диетического белка включают:
- нежирное мясо — говядину, баранину, телятину, свинину, кенгуру
- домашнюю птицу — курицу, индейку, утку, эму, гусь, кустарниковую птицу
- рыба и морепродукты — рыба, креветки, крабы, омары, мидии, устрицы, гребешки, моллюски
- яйца
- молочные продукты — молоко, йогурт (особенно греческий йогурт), сыр (особенно творог)
- орехи (включая ореховые пасты) и семена — миндаль, кедровые орехи, грецкие орехи, макадамия, фундук, кешью, семена тыквы, кунжут, семена подсолнечника
- бобовые и фасоль — все бобы, чечевица, нут, горох колотый, тофу.
Некоторые зерновые и зерновые продукты также являются источниками белка, но, как правило, содержат меньше белка, чем мясо и мясные альтернативные продукты.
Как получить свои потребности в белке
Суточные потребности в белке можно легко удовлетворить, следуя рекомендациям по питанию Австралии. В Рекомендациях продукты сгруппированы по пяти различным группам продуктов, каждая из которых содержит основные питательные вещества.
Двумя основными группами пищевых продуктов, которые вносят вклад в белок, являются:
- «нежирное мясо и птица, рыба, яйца, тофу, орехи и семена и бобовые / фасоль» группа
- «молоко, йогурт, сыр и / или альтернативы. (в основном с пониженным содержанием жира) ».
В рамках здорового питания Рекомендации рекомендуют определенные порции в день из каждой из пяти пищевых групп (см. Таблицу 1).
Организм человека не может накапливать белок и выделяет его избыток, поэтому наиболее эффективный способ удовлетворить суточную потребность в белке — есть небольшое количество белка при каждом приеме пищи.
Таблица 1. Рекомендуемые ежедневные порции «нежирного мяса и птицы, рыбы, яиц, тофу, орехов и семян и бобовых / бобов» и «молока, йогурта, сыра и / или альтернатив (в основном с пониженным содержанием жира)» для взрослых
| Человек | Рекомендуемое среднесуточное количество порций нежирного мяса и птицы, рыбы, яиц, орехов и семян, бобовых / бобов | Рекомендуемое среднесуточное количество порций молока, йогурта, сыра и / или альтернативы (в основном с пониженным содержанием жира) |
| Мужчины в возрасте 19–50 лет | 3 | 2 1/2 |
| Мужчины в возрасте 51–70 лет | 2 1/2 | 2 1/2 |
| Мужчины в возрасте 70+ лет | 2 1/2 | 3 1/2 |
| Женщины в возрасте 19–50 лет | 2 1/2 | 2 1/2 |
| Женщины в возрасте от 51 года –70 лет | 2 | 4 |
| Женщины старше 70 лет | 2 | 4 |
| Беременные | 3 1/2 | 2 1/2 |
| Кормящие женщины | 2 1/2 | 2 1/2 |
Итак, что такое подача? Стандартный размер порции «нежирного мяса и птицы, рыбы, яиц, орехов и семян, бобовых / бобов» составляет один из:
- 65 г приготовленного нежирного мяса, такого как говядина, баранина, телятина, свинина, козлятина или кенгуру (около От 90 до 100 г сырого)
- 80 г приготовленного нежирного мяса птицы, такого как курица или индейка (100 г сырого)
- 100 г приготовленного рыбного филе (около 115 г сырого веса) или одна маленькая банка рыбы
- 2 больших яйца
- 1 чашка (150 г) вареные сушеные бобы, чечевица, нут, горох или консервированные бобы (желательно без добавления соли)
- 170 г тофу
- 30 г орехов, семян, арахисового или миндального масла, тахини или другой пасты из орехов или семян (без добавления соли).
Порция «молока, йогурта, сыра и / или альтернатив (в основном с пониженным содержанием жира)» может включать:
- 250 мл (1 стакан) свежего, ультрапастеризованного молока длительного хранения, восстановленное сухое молоко или пахта
- 120 мл (1 / 2 стакана) сгущенного молока
- 200 г (3/4 стакана или 1 маленькая упаковка) йогурта
- 40 г (2 ломтика) твердого сыра, такого как чеддер
- 120 г (1/2 стакана) сыра рикотта.
Получение большего количества белка в день, естественно
Если вы ищете способы увеличить количество белка в своем рационе, вот несколько советов:
- Попробуйте бутерброд с арахисовым маслом. Не забудьте использовать натуральное арахисовое масло (или любую другую ореховую пасту) без добавления соли, сахара или других наполнителей.
- Нежирный творог или сыр рикотта с высоким содержанием белка, поэтому его можно добавлять в яичницу, запеканку, картофельное пюре или пасту. Или намазывайте его на тост утром.
- Орехи и семена великолепны в салатах, с овощами и подаются с карри.Попробуйте поджарить кедровые орехи или миндальные хлопья и добавить их в зеленый салат.
- Фасоль отлично подходит для супов, запеканок и соусов для пасты. Попробуйте опрокинуть высушенную банку фасоли каннеллини в свой любимый рецепт овощного супа или запеканку.
- Тарелка хумуса и свежие овощные палочки в качестве закуски или хумус, намазанный на бутерброд, легко дадут вам дополнительный белок в обеденное время.
- Греческий йогурт — это богатый белком продукт, который можно употреблять в течение дня. Добавьте немного в ваши любимые хлопья для завтрака, положите ложку на тарелку тыквенного супа или подавайте в качестве десерта со свежими фруктами.
- Яйца — это универсальный и простой вариант, которым можно наслаждаться отдельно или смешивать с различными блюдами.
Получение слишком малого количества белка (дефицит белка)
Недостаток белка означает недостаточное количество белка в вашем рационе. Дефицит белка в Австралии встречается редко, поскольку австралийская диета обычно включает гораздо больше белка, чем нам на самом деле нужно. Однако дефицит белка может возникнуть у людей с особыми потребностями, таких как пожилые люди и люди, соблюдающие строгие вегетарианские или веганские диеты.
Симптомы белковой недостаточности включают:
- истощение и сокращение мышечной ткани
- отек (скопление жидкости, особенно в стопах и лодыжках)
- анемия (неспособность крови доставлять достаточное количество кислорода к клеткам, обычно вызвано диетическим дефицитом, таким как недостаток железа)
- медленный рост (у детей).
Белок — поддержание мышечной массы с возрастом
Примерно с 50 лет люди начинают постепенно терять скелетные мышцы.Это известно как саркопения и часто встречается у пожилых людей. Потеря мышечной массы усугубляется хроническими заболеваниями, неправильным питанием и малоподвижностью.
Ежедневное рекомендуемое потребление белка может помочь вам сохранить мышечную массу и силу. Это важно для поддержания вашей способности ходить и снижения риска травм при падениях.
Для поддержания мышечной массы пожилым людям важно «эффективно» употреблять белок. Это означает употребление высококачественной белковой пищи, например нежирного мяса.
Протеиновые коктейли, порошки и добавки
Протеиновые коктейли, порошки и добавки не нужны для большинства медицинских нужд австралийцев. Согласно последнему общенациональному исследованию питания, 99% австралийцев получают достаточное количество белка с пищей, которую они едят.
Любой белок, который вы едите сверх того, что нужно вашему организму, будет либо выводиться из организма в виде отходов, либо сохраняться в виде набора веса.
Лучший способ получить необходимый белок — это употреблять широкий выбор продуктов, богатых белком, как указано в Австралийских диетических рекомендациях, как часть сбалансированной диеты.Но если вы все еще заинтересованы в использовании протеиновых коктейлей, порошков и добавок, поговорите со своим врачом.
Белок и упражнения
Вскоре после тренировки рекомендуется съесть порцию высококачественного белка (например, стакан молока или тазик йогурта) с углеводной пищей, чтобы поддерживать белковый баланс в организме. Исследования показали, что это полезно для вас даже после легких или умеренных аэробных упражнений (таких как ходьба), особенно для пожилых людей.
Людям, которые активно тренируются или пытаются набрать мышечную массу, не нужно потреблять дополнительный белок.Диеты с высоким содержанием белка не приводят к увеличению мышечной массы. Это стимуляция мышечной ткани с помощью физических упражнений, а не дополнительных диетических белков, что приводит к росту мышц.
Исследования показывают, что силовые тренажеры, которые не потребляют лишний белок (ни в пище, ни в протеиновых порошках), все равно набирают мышечную массу с той же скоростью, что и силовые тренажеры, которые дополняют свой рацион белком.
Диеты с очень высоким содержанием белка опасны
Некоторые модные диеты способствуют очень высокому потреблению белка — от 200 до 400 г в день.Это более чем в пять раз превышает количество, рекомендованное в Австралийских диетических рекомендациях.
Рекомендации по белку в Руководстве обеспечивают достаточное количество белка для наращивания и восстановления мышц даже для бодибилдеров и спортсменов.
Диета с очень высоким содержанием белка может вызвать нагрузку на почки и печень. Это также может вызвать чрезмерную потерю минерального кальция, что может увеличить риск остеопороза.
Куда обратиться за помощью
6.1: Введение в белки — медицина LibreTexts
Цели обучения
- Опишите строение аминокислот.
- Отличие незаменимой аминокислоты от несущественной аминокислоты.
- Опишите синтез белка.
Что такое белок?
Белки — это большие сложные молекулы, которые являются важными компонентами всех тканей человека (например, костей, крови, гормонов, ферментов, антител). Белки содержат элементы углерод, водород и кислород так же, как углеводы и липиды, но белки являются единственным макроэлементом, содержащим азот. Белки — это макромолекулы, состоящие из аминокислот.Аминокислоты обычно называют «строительными блоками» белка. Аминокислоты содержат пять элементов (Рисунок \ (\ PageIndex {1} \)). Каждая аминокислота состоит из центрального атома углерода (C), соединенного с боковой цепью (R), водорода (H), азотсодержащей амино группы (NH 2 ) и карбоновой кислоты группы ( COOH) — отсюда и название «аминокислота». Аминокислоты отличаются друг от друга тем, какая конкретная боковая цепь (R) связана с углеродным центром. Боковая цепь аминокислоты может быть такой же простой, как одна водородная связь с углеродным центром (глицин; рисунок \ (\ PageIndex {2a} \)), или более сложной, как лейцин (рисунок \ (\ PageIndex {2b} \)). .
Рисунок \ (\ PageIndex {1} \): аминокислотная структура. (CC BY 3.0; автор Tyagi.anuj через Wikimedia Commons)Незаменимые и заменимые аминокислоты
Существует двадцать различных аминокислот, и мы требуем, чтобы все они производили множество различных белков, встречающихся в организме. Аминокислоты можно разделить на незаменимые и заменимые (Таблица \ (\ PageIndex {1} \)). Одиннадцать аминокислот считаются несущественными, потому что организм может синтезировать их посредством трансаминирования (которое представляет собой процесс переноса аминогруппы от одной аминокислоты к другой кислотной группе и боковой цепи).Однако девять из аминокислот называются незаменимыми аминокислотами, потому что мы не можем синтезировать их вообще или в достаточных количествах. Эти незаменимые аминокислоты должны быть получены с пищей. Иногда в младенчестве, росте и в болезненных состояниях организм не может синтезировать достаточное количество некоторых заменимых аминокислот, и с пищей требуется их большее количество. Эти типы аминокислот называются условно незаменимыми аминокислотами.
| Essential | Несущественное |
|---|---|
| Гистидин | Аланин |
| Изолейцин | аргинин * |
| лейцин | Аспарагин |
| Лизин | Аспарагиновая кислота |
| метионин | Цистеин * |
| фенилаланин | Глутаминовая кислота |
| Треонин | Глютамин * |
| Триптофан | Глицин * |
| Валин | Пролин * |
| Серин | |
| тирозин * | |
| * Условно незаменимая | |
Построение белков с помощью аминокислот (синтез белков)
Белок состоит из нескольких аминокислот.Производятся разные белки, потому что есть 20 аминокислот, которые можно объединить в уникальные последовательности. Каждая аминокислота связана со следующей аминокислотой специальной химической связью, называемой пептидной связью (рисунок \ (\ PageIndex {3} \)). Пептидная связь образуется между группой карбоновой кислоты одной аминокислоты и аминогруппой другой, высвобождая молекулу воды. Когда аминокислоты соединяются вместе, они образуют пептиды и называются в зависимости от количества аминокислот в пептиде. Например, дипептид содержит 2 аминокислоты, трипептид содержит 3 аминокислоты, олигопептид содержит 4-9 аминокислот, а полипептид содержит 10 или более аминокислот.
Каждый белок в организме человека отличается по аминокислотной последовательности. Гены регулируют связывание аминокислот (ген — это участок ДНК, который действует как матрица для синтеза белка). Синтез белка также включает транскрипцию и трансляцию.
- Транскрипция: информационная РНК (мРНК) копирует (транскрибирует) информацию из ДНК в ядре и переносится в рибосомы в цитоплазме
- Трансляция: информация из мРНК преобразуется (транслируется) в растущую цепь аминокислот, которые связываются вместе с образованием определенного белка.
Существующие белки можно расщепить, чтобы получить аминокислоты для синтеза новых белков. Вновь синтезированный белок структурирован для выполнения определенной функции в клетке. Трехмерная форма белка (третичная структура) имеет решающее значение для его функции. Если белок теряет форму, он теряет свою функцию. Денатурация — это термин, используемый для описания потери формы белком. Воздействие тепла, кислот, щелочей, тяжелых металлов, алкоголя может денатурировать белки.
Синтез белка может быть ограничен отсутствием аминокислот.Аминокислота, которая отсутствует или находится в минимальном количестве, называется ограничивающей аминокислотой. Без необходимого количества незаменимых аминокислот невозможно синтезировать белки, которые могут повлиять на функции организма.
Основные выводы
- Аминокислоты — это строительные блоки белков. Структура аминокислот включает центральный атом углерода, атом водорода, группу амино , карбоновую группу кислоты и боковую цепь.
- Некоторые аминокислоты не являются необходимыми в диете, потому что организм может их синтезировать, а некоторые необходимы в диете, потому что организм не может их вырабатывать.
- Белки представляют собой цепочки аминокислот, удерживаемые вместе пептидными связями.
белков | Биология для майоров I
Опишите структуру и функции белков
Белки представляют собой полимеры аминокислот. Каждая аминокислота содержит центральный атом углерода, водород, карбоксильную группу, аминогруппу и переменную группу R. Группа R указывает, к какому классу аминокислот она принадлежит: электрически заряженные гидрофильные боковые цепи, полярные, но незаряженные боковые цепи, неполярные гидрофобные боковые цепи и особые случаи.
Белки имеют разные «слои» структуры: первичный, вторичный, третичный, четвертичный.
Белки выполняют в клетках самые разные функции. Основные функции включают действие в качестве ферментов, рецепторов, транспортных молекул, белков, регулирующих экспрессию генов, и так далее. Ферменты — это биологические катализаторы, которые ускоряют химическую реакцию без постоянных изменений. У них есть «активные центры», где связывается субстрат / реагент, и они могут быть либо активированы, либо ингибированы (конкурентные и / или неконкурентные ингибиторы).
Цели обучения
- Продемонстрировать знакомство с мономерными единицами белков: аминокислоты
- Определите различные слои структуры белка
- Определите несколько основных функций белков
Аминокислоты
Белки являются одной из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами.Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры из аминокислот , расположенных в линейной последовательности.
Рис. 1. Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (Nh3), карбоксильной группой (COOH) и атомом водорода. .Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 1).
Название «аминокислоты» происходит от того факта, что они содержат как аминогруппу, так и карбоксильную кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 аминокислот. Десять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и они получают с пищей.
Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 2).
Практический вопрос
Рис. 2. В белках обычно встречаются 20 общих аминокислот, каждая из которых имеет свою R-группу (вариантная группа), которая определяет его химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
Показать ответПолярные и заряженные аминокислотные остатки (остаток после образования пептидной связи) с большей вероятностью будут обнаружены на поверхности растворимых белков, где они могут взаимодействовать с водой, и неполярные (например,g., боковые цепи аминокислот) с большей вероятностью будут обнаружены внутри, где они изолированы от воды. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, в то время как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако бывают исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в кармане связывания лиганда.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты.Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, а у людей они включают изолейцин, лейцин и цистеин.Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Рис. 3. Образование пептидной связи — это реакция синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка.Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь является пептидной связью (рис. 3).
Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется больше аминокислот, полученная цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце.Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Эволюционное значение цитохрома c
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона.Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился. Секвенирование белков показало, что существует значительная гомология аминокислотной последовательности цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты.Для каждой молекулы цитохрома с от разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции. Например, фермент может связываться со специфическим субстратом в сайте, известном как активный сайт. Если этот активный сайт изменяется из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи — это ее первичная структура. Например, инсулин поджелудочной железы имеет две полипептидные цепи, А и В, и они связаны между собой дисульфидными связями. N-концевой аминокислотой A-цепи является глицин, а C-концевой аминокислотой — аспарагин (рис. 4). Последовательности аминокислот в цепях A и B уникальны для инсулина.
Рис. 4. Инсулин бычьей сыворотки — это белковый гормон, состоящий из двух пептидных цепей: A (длиной 21 аминокислота) и B (длиной 30 аминокислот).В каждой цепи первичная структура обозначена трехбуквенными сокращениями, которые представляют названия аминокислот в порядке их присутствия. Аминокислота цистеин (cys) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи A и B вместе, а третья помогает цепи A складываться в правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности показаны разные размеры.
Уникальная последовательность каждого белка в конечном итоге определяется геном, кодирующим этот белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка. При серповидно-клеточной анемии цепь гемоглобина β (небольшая часть которой показана на рисунке 5) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка.
Рис. 5. Бета-цепь гемоглобина имеет длину 147 остатков, однако единственная аминокислотная замена приводит к серповидно-клеточной анемии. В нормальном гемоглобине аминокислота в седьмом положении — глутамат. В серповидно-клеточном гемоглобине этот глутамат заменен валином.
В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Примечательно, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот.Таким образом, молекула содержит около 600 аминокислот. Структурное различие между нормальной молекулой гемоглобина и молекулой серповидноклеточных клеток — что резко снижает продолжительность жизни — состоит в одной из 600 аминокислот. Что еще более примечательно, так это то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, а мутация вызвано одним изменением основания (точечной мутацией), 1 из 1800 оснований.
Рис. 6. В этом мазке крови, визуализированном при 535-кратном увеличении с помощью светлопольной микроскопии, серповидные клетки имеют форму полумесяца, а нормальные клетки имеют форму диска.(кредит: модификация работы Эда Усмана; данные шкалы от Мэтта Рассела)
Из-за этого изменения одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные красные кровяные тельца и принимают форму полумесяца или «серпа», что закупоривает артерии (рис. 6). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у людей, страдающих этим заболеванием.
Вторичная структура
Локальное сворачивание полипептида в некоторых областях приводит к вторичной структуре белка.Наиболее распространенными являются α -спиральные и β -складчатые листовые структуры (рис. 7). Обе структуры представляют собой структуру α -спираль — спираль, форма которой удерживается водородными связями. Водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рис. 7. α-спираль и β-складчатый лист — это вторичные структуры белков, которые образуются из-за образования водородных связей между карбонильной и аминогруппой в основной цепи пептида.Некоторые аминокислоты имеют склонность к образованию α-спирали, а другие — к образованию β-складчатого листа.
Каждый виток альфа-спирали содержит 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из -спиральной цепи . В листе с складками β «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи. Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки.Гофрированные сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе основной цепи пептида. α -спиральные и β -складчатые листовые структуры обнаружены в большинстве глобулярных и волокнистых белков, и они играют важную структурную роль.
Третичная структура
Уникальная трехмерная структура полипептида — это его третичная структура (рис. 8).Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, присутствующих в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка, тогда как гидрофильные группы R лежат снаружи.Первые типы взаимодействий также известны как гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, образующуюся во время сворачивания белка.
Рис. 8. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар.Инсулин начинается как отдельный полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи. Шелк (волокнистый белок), однако, имеет складчатую листовую структуру β , которая является результатом водородной связи между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на Рисунке 9.
Рисунок 9.На этих иллюстрациях можно увидеть четыре уровня белковой структуры. (кредит: модификация работы Национального исследовательского института генома человека)
Денатурация и сворачивание белка
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе за счет химических взаимодействий. Если белок подвержен изменениям температуры, pH или воздействию химикатов, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в так называемой денатурации.Денатурация часто обратима, поскольку первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, позволяя белку возобновить свою функцию. Иногда денатурация необратима, что приводит к потере функции. Одним из примеров необратимой денатурации белка является жарение яйца. Белок альбумина в жидком яичном белке денатурируется при помещении на горячую сковороду. Не все белки денатурируются при высоких температурах; например, бактерии, которые выживают в горячих источниках, содержат белки, которые функционируют при температурах, близких к температуре кипения.Желудок также очень кислый, имеет низкий pH и денатурирует белки как часть процесса пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции. Первоначально считалось, что сами белки несут ответственность за процесс сворачивания. Только недавно было обнаружено, что часто они получают помощь в процессе сворачивания от белков-помощников, известных как шапероны (или шаперонины), которые связываются с целевым белком во время процесса сворачивания.Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и отделяются от белка, как только целевой белок сворачивается.
Чтобы получить дополнительную информацию о белках, просмотрите этот анимационный ролик под названием «Биомолекулы: белки».Функция белков
Основные типы и функции белков перечислены в таблице 1.
| Таблица 1. Типы и функции белков | ||
|---|---|---|
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи за счет катаболизма питательных веществ до мономерных единиц |
| Транспорт | Гемоглобин, альбумин | Переносит вещества в крови или лимфе по всему телу |
| Строительный | Актин, тубулин, кератин | Создавать различные структуры, такие как цитоскелет |
| Гормоны | Инсулин, тироксин | Координировать деятельность различных систем организма |
| Оборона | Иммуноглобулины | Защитите организм от инородных патогенов |
| Контрактиль | Актин, миозин | Эффект сокращения мышц |
| Хранилище | Запасные белки бобовых, яичный белок (альбумин) | Обеспечить питание на ранних этапах развития зародыша и проростка |
Два специальных и распространенных типа белков — это ферменты и гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Гормоны — это химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые действуют, чтобы контролировать или регулировать определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается многими различными типами химических связей. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки состоят из 20 одних и тех же аминокислот по-разному.
Резюме: Белки
Белки — это класс макромолекул, которые выполняют широкий спектр функций для клетки. Они помогают метаболизму, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеров) являются аминокислоты. Каждая аминокислота имеет центральный углерод, связанный с аминогруппой, карбоксильной группой, атомом водорода и R-группой или боковой цепью.Существует 20 обычно встречающихся аминокислот, каждая из которых отличается по группе R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Белки подразделяются на четыре уровня: первичный, вторичный, третичный и (необязательно) четвертичный. Первичная структура — это уникальная последовательность аминокислот. Локальное сворачивание полипептида с образованием таких структур, как α спираль и β -складчатый лист, составляет вторичную структуру.Общая трехмерная структура — это третичная структура. Когда два или более полипептида объединяются, чтобы сформировать полную структуру белка, такая конфигурация известна как четвертичная структура белка. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменениями температуры или pH, может привести к денатурации белка и потере функции.
Проверьте свое пониманиеОтветьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.В этой короткой викторине , а не засчитываются в вашу оценку в классе, и вы можете пересдавать ее неограниченное количество раз.
Используйте этот тест, чтобы проверить свое понимание и решить, следует ли (1) изучить предыдущий раздел дальше или (2) перейти к следующему разделу.
Глава 2: Структура белка — химия
Глава 2: Структура белка 2.1 Структура и свойства аминокислот 2.2 Образование пептидных связей и структура первичного белка 2.3 Структура вторичного белка 2.4 Супервторичная структура и белковые мотивы2,5 Структура третичного и четвертичного белка 2.6 Сворачивание, денатурация и гидролиз белков 2.7 Список литературы
2.1 Структура и свойства аминокислот
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул.Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры альфа-аминокислот, расположенные в линейной последовательности и связанные друг с другом ковалентными связями.
Структура альфа-аминокислотОсновными строительными блоками белков являются альфа (α) аминокислот .Как следует из их названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина. Обозначение альфа используется, чтобы указать, что эти две функциональные группы отделены друг от друга одной углеродной группой. Помимо амина и карбоновой кислоты, альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белка используются 20 аминокислот.Они отличаются друг от друга только положением R-группы. Основная структура аминокислоты показана ниже:
Рисунок 2.1 Общая структура альфа-аминокислоты
Всего 20 альфа-аминокислот обычно включаются в белковые структуры (рис. 2.x). Различные R-группы имеют разные характеристики в зависимости от природы атомов, включенных в функциональные группы. Есть R-группы, которые преимущественно содержат углерод и водород и очень неполярны или гидрофобны.Другие содержат полярные незаряженные функциональные группы, такие как спирты, амиды и тиолы. Некоторые аминокислоты являются основными (содержащие функциональные аминогруппы) или кислотными (содержащими функциональные группы карбоновых кислот). Эти аминокислоты способны образовывать полные заряды и могут взаимодействовать с ионами. Каждая аминокислота может быть сокращена с использованием трехбуквенного и однобуквенного кода.
Рис. 2.2 Структура 20 альфа-аминокислот, используемых в синтезе белка. R-групп обозначены обведенными / окрашенными участками каждой молекулы. Цвета указывают на определенные классы аминокислот: гидрофобные — зеленый и желтый, гидрофильные полярные незаряженные — оранжевый, гидрофильные кислые — синие, гидрофильные основные — розовые.
Щелкните здесь, чтобы загрузить версию таблицы аминокислот
Неполярные (гидрофобные) аминокислоты
Неполярные аминокислоты можно в значительной степени подразделить на два более конкретных класса: алифатические аминокислоты , , и ароматические аминокислоты , , , ., алифатических аминокислот (глицин, аланин, валин, лейцин, изолейцин и пролин) , как правило, содержат разветвленные углеводородные цепи, от самого простого глицина до более сложных структур лейцина и валина. Пролин также классифицируется как алифатическая аминокислота, но обладает особыми свойствами, поскольку углеводородная цепь циклизовалась с концевым амином, создавая уникальную 5-членную кольцевую структуру. Как мы увидим в следующем разделе, посвященном первичной структуре, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь и обычно находится в областях белка, где возникают складки или повороты.
Ароматические аминокислоты , (фенилаланин, тирозин и триптофан), , как следует из их названия, содержат ароматические функциональные группы в своей структуре, что делает их в значительной степени неполярными и гидрофобными из-за высокого содержания углерода / водорода. Однако следует отметить, что гидрофобность и гидрофильность представляют собой скользящую шкалу, и каждая из различных аминокислот может иметь разные физические и химические свойства в зависимости от их структуры. Например, гидроксильная группа, присутствующая в тирозине, увеличивает его реакционную способность и растворимость по сравнению с фенилаланином.
Метионин, одна из серосодержащих аминокислот , обычно классифицируется как неполярные, гидрофобные аминокислоты, поскольку концевая метильная группа создает функциональную группу тиоэфира, которая обычно не может образовывать постоянный диполь внутри молекулы и сохраняет низкую растворимость.
Полярные (гидрофильные) аминокислотыПолярные гидрофильные аминокислоты можно подразделить на три основных класса: полярные незаряженные, кислотные и основные функциональные группы.В пределах полярного незаряженного класса боковые цепи содержат гетероатомы (O, S или N), которые способны образовывать постоянные диполи в R-группе. К ним относятся гидроксил- и сульфоксил-содержащих аминокислот, серин, треонин и цистеин и амидосодержащих аминокислот, глутамин и аспаригин. Две аминокислоты, глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат) составляют кислые аминокислоты и содержат боковые цепи с функциональными группами карбоновых кислот, способными полностью ионизоваться в растворе.Основные аминокислоты , лизин, аргинин и гистидин содержат функциональные аминогруппы, которые можно протонировать, чтобы нести полный заряд.
Многие из аминокислот с гидрофильными R-группами могут участвовать в активном сайте ферментов. Активный центр является частью фермента, которая напрямую связывается с субстратом и осуществляет реакцию. Белковые ферменты содержат каталитических группы , состоящих из R-групп аминокислот, которые способствуют образованию и разрушению связей.Аминокислоты, которые играют важную роль в специфичности связывания активного сайта, обычно не примыкают друг к другу в первичной структуре, а образуют активный сайт в результате сворачивания при создании третичной структуры, как вы увидите позже в глава.
Белковые структуры, построенные из основных аминокислот, могут состоять из сотен аминокислот. Таким образом, для простоты 20 аминокислот, используемых для синтеза белка, имеют аббревиатуры как трехбуквенного, так и однобуквенного кода (Таблица 2.1). Эти сокращения обычно используются для обозначения белковых последовательностей в биоинформатических и исследовательских целях.
Таблица 2.1 Сокращения α-аминокислотМысленный вопрос: Триптофан содержит функциональную группу амина, почему триптофан не является основным?
Ответ: Триптофан содержит индольную кольцевую структуру, которая включает функциональную группу амина. Однако из-за близости и электроноакцепторной природы ароматической кольцевой структуры неподеленная пара электронов на азоте недоступна для принятия протона.Вместо этого они участвуют в образовании пи- связей в нескольких различных резонансных структурах, возможных для индольного кольца. На рис. 2.3A показаны четыре возможные резонансные структуры для индола. И наоборот, в структуре имидазольного кольца, обнаруженной в гистидине, есть два атома азота, один из которых участвует в образовании резонансных структур (азот № 1 на рисунке 2.3B) и не может принимать протон, а другой (азот № 3 ), которая имеет неподеленную пару электронов, которая может принять протон.
Рис. 2.3 Сравнение структурной доступности неподеленной пары электронов на азоте для принятия протона в кольцевой структуре индола и иммидизола . (A) Показаны четыре резонансные структуры индольной кольцевой структуры, демонстрирующие, что неподеленная пара электронов на азоте участвует в образовании пи-связей . (B) Кольцевая структура имидазола имеет один азот (1), который участвует в резонансных структурах (не показаны) и не может принимать протон, в то время как второй азот (3) имеет неподеленную пару электронов, доступных для принятия протона. как показано.
Работай самостоятельно:В приведенном выше примере опишите с помощью химической диаграммы, почему амидные атомы азота, содержащиеся в аспарагине и глутамине, не являются основными.
Альфа-аминокислоты — хиральные молекулы
Если вы изучите структуру альфа-углерода в каждой из аминокислот, вы заметите, что все аминокислоты, за исключением глицина, являются хиральными молекулами (Рисунок 2.4) Хиральная молекула — это молекула, которая не накладывается на свое зеркальное отображение. Подобно левой и правой руке, у которых есть большой палец и пальцы в одном порядке, но являются зеркальными, а не одинаковыми, к хиральным молекулам прикреплены одни и те же предметы в одном и том же порядке, но они являются зеркальными, а не одинаковыми. Варианты зеркального отображения хиральных молекул имеют физические свойства, которые почти идентичны друг другу, что очень затрудняет их различение или разделение.Из-за этой природы им дано специальное название стереоизомера — энантиомеры , и фактически сами соединения получили такое же название! Эти молекулы действительно различаются тем, как они вращают простой поляризованный свет, и тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правостороннем направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого.D- и L-формы аланина показаны на рисунке 2.4B.
Хотя большинство аминокислот могут существовать как в левосторонней, так и в правосторонней формах, жизнь на Земле состоит почти исключительно из левосторонних аминокислот. Протеогенные аминокислоты, включенные в белки рибосомами, всегда находятся в L-конформации. Некоторые бактерии могут включать D-аминокислоты в пептиды, не кодируемые рибосомами, но D-аминокислоты в природе используются редко. Интересно, что когда мы обсудим структуру сахаров в главе XX, мы обнаружим, что сахара, которые включены в углеводные структуры, почти исключительно находятся в D-конформации.Никто не знает, почему это так. Однако доктор. Джон Кронин и Сандра Пиццарелло показали, что из аминокислот, которые падают на Землю из космоса на метеоритах, больше находится в L-конформации, чем в D-конформации. Таким образом, тот факт, что мы состоим преимущественно из L-аминокислот, может быть вызван аминокислотами из космоса.
Почему аминокислоты в космосе благоприятствуют L-конформации? Никто точно не знает, но известно, что излучение также может существовать в левосторонней и правосторонней формах. Итак, существует теория под названием гипотеза Боннера , которая предполагает, что преобладающие формы излучения в космосе (т. Е.от вращающейся нейтронной звезды, например) может привести к селективному образованию гомохиральных молекул, таких как L-аминокислоты и D-сахара. Это все еще спекулятивно, но недавние открытия метеоритов делают эту гипотезу гораздо более правдоподобной.
Рисунок 2.4 Хиральность аминокислот. За исключением простейшей аминокислоты, глицина, все другие аминокислоты, которые включены в белковые структуры, имеют хиральную природу. (A) Демонстрирует хиральность структуры основной альфа-аминокислоты при использовании неспецифической R-группы.(B) Пара энантиомеров D- и L-аланина, верхняя диаграмма представляет модель шара и клюшки, а нижняя диаграмма представляет линейную структуру.
Изображение (A) из NASA
Обратите внимание, что обозначения D и L — это особые термины, используемые для того, как молекула вращает простой поляризованный свет. Это не означает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию. E.грамм. R или S , имея в виду Rectus или Sinister соответственно.
Абсолютные конфигурации хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии. Альтернативными методами являются оптическая вращательная дисперсия, колебательный круговой дихроизм, использование реагентов хирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. После получения абсолютной конфигурации назначение R или S основано на правилах приоритета Кан – Ингольда – Прелога, , которые можно просмотреть, перейдя по ссылке и на рисунке 2.5. Все хиральные аминокислоты, кроме цистеина, также находятся в S-конформации. Цистеин содержит атом серы, из-за чего R-группа имеет более высокий приоритет, чем функциональная группа карбоновой кислоты, что приводит к R-конформации для абсолютной стереохимии. Однако цистеин действительно вращает простой поляризованный свет в левовращающем или левовращающем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Рисунок 2.5 Абсолютная конфигурация определяется обозначениями Rectus (R) и Sinister (S). В системе Кан-Ингольда Прелога для наименования хиральных центров группы, присоединенные к хиральному центру, ранжируются в соответствии с их атомным номером, причем наивысший атомный номер получает наивысший приоритет (A на диаграмме выше), а наименьший атомный номер получает наименьший приоритет (D на диаграмме выше). Затем зритель с самым низким приоритетом не видит, чтобы правильно сориентировать молекулу для дальнейшей оценки.Затем отслеживается путь приоритетов №1, №2 и №3 (соответствующих A, B и C выше). Если путь идет по часовой стрелке, хиральному центру присваивается R-обозначение, тогда как если путь идет против часовой стрелки, ему присваивается S-обозначение.
Изображение из Википедия
Аминокислоты — цвиттерионы
В химии цвиттерион представляет собой молекулу с двумя или более функциональными группами, из которых по крайней мере одна имеет положительный, а другая отрицательный электрический заряд, а общий заряд всей молекулы равен нулю при определенном pH.Поскольку они содержат по крайней мере один положительный и один отрицательный заряд, цвиттерионы также иногда называют внутренними солями . Заряды на различных функциональных группах уравновешивают друг друга, и молекула в целом может быть электрически нейтральной при определенном pH. PH, при котором это происходит, известен как изоэлектрическая точка .
В отличие от простых амфотерных соединений, которые могут образовывать только или катионные или анионные частицы, цвиттерион одновременно имеет оба ионных состояния.Аминокислоты являются примерами цвиттерионов (рис. 2.6). Эти соединения содержат аммонийную и карбоксилатную группы, и их можно рассматривать как возникающие в результате своего рода внутримолекулярной кислотно-основной реакции: аминогруппа депротонирует карбоновую кислоту.
Рисунок 2.6 Аминокислоты — это цвиттерионы. Аминокислота содержит как кислотные (фрагмент карбоновой кислоты), так и основные (фрагмент амина) центры. Изомер справа — это цвиттерионная форма.
Поскольку аминокислоты являются цвиттерионами, а некоторые из них также содержат потенциал для ионизации в своих R-группах, их состояние заряда in vivo , и, таким образом, их реакционная способность может варьироваться в зависимости от pH, температуры и статуса сольватации локальных микросреда, в которой они расположены.Таблица стандартных значений pK и для аминокислот показана в таблице 2.1 и может использоваться для прогнозирования состояния ионизации / заряда аминокислот и получаемых ими пептидов / белков. Однако следует отметить, что статус сольватации в микроокружении аминокислоты может изменять относительные значения pK и этих функциональных групп и обеспечивать уникальные реактивные свойства в активных центрах ферментов (таблица 2.1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Таблица 2.1Версия для печати значений pKa
Как видно из таблицы 2.1, семь аминокислот содержат R-группы с ионизируемыми боковыми цепями и обычно находятся в активных центрах ферментов. Напомним, что pK a определяется как pH, при котором ионизированная и неионизированная формы ионизируемой функциональной группы в молекуле существуют в равных концентрациях. Таким образом, когда функциональная группа сдвигается выше или ниже ее значения pK — , произойдет сдвиг в концентрациях ионизированных и неионизированных форм в пользу одного состояния по сравнению с другим.На рис. 2.7 показаны различные R-группы в их неионизированном и ионизированном состояниях и их предпочтительные состояния выше или ниже значения pK a .
Рисунок 2.7 Ионизируемые функциональные группы в общих аминокислотах. Во всех аминокислотах как функциональная группа карбоновой кислоты (C-конец), так и функциональная группа амина (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах.Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих значений pK a .
Обычно ионизируемая группа будет благоприятствовать протонированному состоянию в условиях pH ниже ее соответствующих значений pK a и будет благоприятствовать депротонированному состоянию в условиях pH выше ее соответствующего значения pK a . Таким образом, значения pK a могут использоваться для помощи в прогнозировании общих зарядовых состояний аминокислот и их результирующих пептидов / белков в определенной среде.Например, если мы посмотрим на кривую титрования основной аминокислоты, гистидина (рис. 2.8). При достижении каждого pK a состояние заряда аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком pH (полностью протонированный) до общего заряда -1 при очень высоком pH (полностью депротонирован).
Рис. 2.8 Состояние ионизации гистидина в средах с различным pH. (A) Кривая титрования гистидина от низкого pH до высокого pH.Указывается каждая точка эквивалентности (pK a ). (B) Показывает благоприятное состояние ионизации гистидина после прохождения каждого значения pK .
Изображение адаптировано из L. Van Warren
Дополнительная практика:
Изобразите глутаминовую кислоту и спрогнозируйте общее состояние заряда аминокислоты при pH = 1, pH = 3, pH = 7 и pH = 12.
Образование цистеиновых и дисульфидных связей
Цистеин также является уникальной аминокислотой, так как эта боковая цепь способна подвергаться обратимой окислительно-восстановительной ( редокс ) реакции с другими остатками цистеина, создавая ковалентную дисульфидную связь в окисленном состоянии (Рисунок 2.9). Вспомните, что когда молекулы окисляются, они теряют электроны, а когда молекулы восстанавливаются, они приобретают электроны. Во время биологических окислительно-восстановительных реакций ионы водорода ( протонов, ) часто удаляются с электронами из молекулы во время окисления и возвращаются во время восстановления. Таким образом, если реакция теряет или набирает протоны, это хороший признак того, что она также теряет или приобретает электроны и что происходит окислительно-восстановительная реакция.Таким образом, получение или потеря протонов может быть простым способом идентифицировать этот тип реакции.
Дисульфидные связи являются неотъемлемой частью образования трехмерной структуры белков и, следовательно, могут сильно влиять на функцию получаемого белка. В клеточных системах образование / разрыв дисульфидной связи является ферментно-опосредованной реакцией и может использоваться в качестве механизма для контроля активности белка. Дисульфидные связи будут обсуждаться более подробно в разделе 2.xx данной главы и в главе XX.
Рис. 2.9 Цистеин может окисляться с образованием дисульфидных связей. Во время образования дисульфидной связи два цистеина окисляются с образованием молекулы цистина. Это требует потери двух протонов и двух электронов.
обратно в начало2.2 Образование пептидных связей и структура первичного белка
В клеточных системах белки связаны между собой большим ферментным комплексом, который содержит смесь РНК и белков.Этот комплекс называется рибосомой , , , . Таким образом, поскольку аминокислоты связаны друг с другом с образованием определенного белка, они размещаются в очень определенном порядке, который диктуется генетической информацией, содержащейся в молекуле информационной РНК (мРНК). Этот специфический порядок аминокислот известен как первичная последовательность белка . Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно обсуждаться в главе XX.В этой главе основное внимание будет уделено химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов / белков.
Первичная последовательность белка связана вместе с использованием дегидратационного синтеза (потеря воды), которые объединяют карбоновую кислоту вышележащей аминокислоты с аминогруппой нижележащей аминокислоты с образованием амидной связи (рис. 2.10). ). Аналогично, обратная реакция — это гидролиз и требует включения молекулы воды для разделения двух аминокислот и разрыва амидной связи.Примечательно, что рибосома служит ферментом, который опосредует реакции синтеза дегидратации, необходимые для создания белковых молекул, тогда как класс ферментов, называемых протеазами , , необходим для гидролиза белка.
В белковых структурах амидная связь между аминокислотами известна как пептидная связь . Последующие аминокислоты будут добавлены на конце карбоновой кислоты растущего белка.Таким образом, белки всегда синтезируются направленным образом, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Направленность синтеза белка определяется рибосомой и известна как синтез N- в C .
Рисунок 2.10 Формирование пептидной связи. Добавление двух аминокислот для образования пептида требует синтеза дегидратации.
Как отмечалось выше в разделе цвиттер-ионов, амидные связи имеют резонансную структуру, которая не позволяет атомной неподеленной паре электронов действовать как основание (рис. 2.11).
Рисунок 2.11 Резонансная структура амида. Во время амидного резонанса неподеленные пары электронов азота участвуют в образовании pi -связи с карбонильным углеродом, образующим двойную связь. Таким образом, амидные атомы азота не являются основными. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи pi- .
Изображение В.К. Чанг
Вместо этого они участвуют в образовании связи — с карбонильным углеродом. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи pi- . Это создает фиксированные физические положения R-групп в растущем пептиде в конформациях цис или транс . Поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в конформации trans .Конформация цис предпочтительна только с одной конкретной аминокислотой, пролином . Это связано с циклической структурой R-группы пролина и стерическими препятствиями, которые возникают, когда пролин принимает конформацию trans (рис. 2.12). Таким образом, остатки пролина могут иметь большое влияние на трехмерную структуру полученного пептида.
Рисунок 2.12 Конформация Cis и Trans R-групп аминокислот. На верхней диаграмме показаны конформации цис и транс двух соседних аминокислот, обозначенных как X и Y, которые обозначают любую из 20 аминокислот, за исключением пролина. В конформации trans R-группа из аминокислоты X повернута в сторону и находится на другой стороне молекулы по сравнению с R-группой из аминокислоты Y. Эта конформация дает наименьшее количество стерических препятствий по сравнению с cis конформация, в которой R-группы расположены с одной стороны и в непосредственной близости друг от друга.На нижней диаграмме любая аминокислота X расположена перед остатком пролина. Из-за циклизации пролиновой R-группы с амидным азотом в основной цепи это смещает положение пролиновой R-группы, чтобы быть ближе к R-группе от аминокислоты X, когда она принимает конформацию trans . Таким образом, пролин отдает предпочтение конформации цис-, которая имеет меньшие стерические препятствия.
Белки представляют собой очень большие молекулы, содержащие множество аминокислотных остатков, связанных вместе в очень определенном порядке.Размер белков варьируется от 50 аминокислот до самого большого известного белка, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как пептидов (рис. 2.13).
Рис. 2.13 Пептиды и белки — это макромолекулы, состоящие из длинных цепочек аминокислот, соединенных вместе амидными связями. Порядок и природа аминокислот в первичной последовательности белка определяют структуру укладки белка на основе окружающей среды белка (то есть, если он находится внутри клетки, он, вероятно, окружен водой в очень полярной среде. , тогда как если белок встроен в плазматическую мембрану, он будет окружен очень неполярными углеводородными хвостами).
Благодаря большому количеству аминокислот, которые могут быть включены в каждое положение в белке, существуют миллиарды различных возможных комбинаций белков, которые можно использовать для создания новых белковых структур! Например, подумайте о трипептиде, полученном из этого пула аминокислот. В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее возможное количество образующихся трипептидов будет 20 X 20 X 20 или 20 3 , что равно 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот.Будет 20 40 вариантов или ошеломляющая 1,09 X 10 52 возможных вариантов последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой.
Характер аминокислот по всему белку помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма требуется для функциональной активности белка (т. Е. форма белка = функция белка ). Для белков, находящихся в водной среде клетки, гидрофобные аминокислоты часто находятся внутри структуры белка, тогда как водолюбивые гидрофильные аминокислоты будут на поверхности, где они могут связываться водородом и взаимодействовать с молекулами воды. Пролин уникален, потому что он имеет единственную R-группу, которая образует циклическую структуру с аминогруппой в основной цепи. Эта циклизация заставляет пролин принимать конформацию цис , а не конформацию транс внутри остова.Этот сдвиг в структуре часто означает, что пролины представляют собой положения, в которых происходят изгибы или изменения направления внутри белка. Метионин уникален тем, что он служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и, таким образом, могут окисляться другими остатками цистеина с образованием ковалентных дисульфидных связей в структуре белка (рис. 2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто требуются для правильного сворачивания и функционирования белка (Рисунок 2.14).
Рисунок 2.14 Дисульфидные связи. Дисульфидные связи образуются между двумя остатками цистеина в пептидной или белковой последовательности или между различными пептидными или белковыми цепями. В приведенном выше примере изображены две пептидные цепи, которые образуют гормон инсулин. Дисульфидные мостики между двумя цепями необходимы для правильного функционирования этого гормона, регулирующего уровень глюкозы в крови.
Изображение предоставлено: CNX OpenStax через Wikimedia Commons
Форма и функция белка
Первичная структура каждого белка приводит к уникальному паттерну сворачивания, который характерен для этого конкретного белка.Таким образом, первичная последовательность — это линейный порядок аминокислот, поскольку они связаны вместе в белковой цепи (рис. 2.15). В следующем разделе мы обсудим сворачивание белка, которое приводит к образованию вторичных, третичных, а иногда и четвертичных белковых структур.
Рис. 2.15. Первичная структура белка представляет собой линейную последовательность аминокислот.
(кредит: модификация работы Национального исследовательского института генома человека)
обратно в начало2.3 Структура вторичного белка
В предыдущем разделе мы отметили жесткость, создаваемую связью CN в амидной связи, когда аминокислоты соединяются друг с другом, и узнали, что это приводит к тому, что R-группы аминокислот благоприятствуют конфромации транс (за исключением пролина, который поддерживает конформацию цис ). Эта жесткость каркаса белка ограничивает потенциал сворачивания и структуру получаемого белка. Однако связи, прикрепленные к α-углероду, могут свободно вращаться и вносить свой вклад в гибкость и уникальные паттерны сворачивания, наблюдаемые внутри белков.Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряются торсионные углы Phi (Φ) и Psi (ψ). Угол кручения Phi (Φ) измеряет вращение вокруг связи α-углерод-азот, оценивая угол между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз по связи α-углерод-азот в плоскость бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод — карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо вниз на связь α-углерод — карбонильный углерод (Рисунок 2.16).
Рисунок 2.16 Торсионные углы Phi (Φ) и Psi (ψ). (A) Торсионный угол Phi (Φ) является мерой вращения вокруг связи между α-углеродом и амидным азотом. Он измеряется как угол между двумя карбонильными атомами углерода, примыкающими к связи, показанный на нижней панели. (B) Торсионный угол Psi (ψ) является мерой вращения вокруг связи между α-углеродом и карбонильным углеродом. Он измеряется как угол между двумя атомами азота, примыкающими к связи, показанный на нижней панели.
В то время как связи вокруг α-углерода могут свободно вращаться, предпочтительные торсионные углы ограничены меньшим набором возможностей, поскольку соседние атомы избегают конформаций, которые имеют связанные с ними высокие стерические препятствия. Г. Рамачандран создал компьютерные модели малых пептидов для определения стабильных конформаций торсионных углов Phi (Φ) и Psi (ψ). На основе своих результатов он создал так называемый график Рамачандрана, который графически отображает области перекрытия наиболее благоприятных торсионных углов Phi (Φ) и Psi (ψ) (Рисунок 2.17)
Рисунок 2.17 График Рамачандрана. Благоприятный и очень благоприятный торсионные углы Phi (Φ) и Psi (ψ) показаны желтым и красным соответственно. Указаны углы связи для общих вторичных белковых структур.
Изображение изменено с: J. Cooper
Внутри каждого белка небольшие участки белка могут принимать специфические повторяющиеся паттерны сворачивания. Эти конкретные мотивы или узоры называются вторичной структурой .Двумя наиболее распространенными вторичными структурными особенностями являются альфа-спираль и бета-гофрированный лист (рис. 2.18). Внутри этих структур внутримолекулярные взаимодействия, особенно водородная связь между амином основной цепи и карбонильными функциональными группами, имеют решающее значение для поддержания трехмерной формы.
Рис. 2.18. Вторичные структурные особенности в структуре белка. Правая альфа-спираль и бета-складчатый лист являются общими структурными мотивами, обнаруженными в большинстве белков.Они удерживаются вместе за счет водородной связи между амином и карбонильным кислородом в основной цепи аминокислоты.
Изображение изменено из: The School of Biomedical Sciences Wiki
Альфа Спираль
Для альфа-спиральных структур очень распространена правая спираль, тогда как левые спирали очень редки. Это связано с торсионными углами Phi (Φ) и Psi (ψ), необходимыми для получения левой альфа-спиральной структуры.Чтобы получить правильную ориентацию левой спирали, белку придется складываться и закручиваться под множеством неблагоприятных углов. Таким образом, они не очень распространены в природе.
Для правой альфа-спирали каждый виток спирали содержит 3,6 аминокислотных остатка (рис. 2.19). Группы R (вариантные группы) полипептида выступают из -спиральной цепи . Основная цепь полипептида образует повторяющуюся спиральную структуру, которая стабилизируется водородными связями между кислородом карбонила и водородом амина.Эти водородные связи возникают с регулярными интервалами, по одной водородной связи на каждую четвертую аминокислоту, и заставляют основную цепь полипептида образовывать спираль. Каждая аминокислота продвигает спираль вдоль своей оси на 1,5 Å. Каждый виток спирали состоит из 3,6 аминокислот; следовательно, шаг спирали составляет 5,4 Å. На спираль приходится в среднем десять аминокислотных остатков. Различные аминокислоты по-разному склонны к образованию α -спирали. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин.Пролин и глицин почти не склонны к образованию спиралей.
Рис. 2.19. Структура правой альфа-спирали. (A) Модель шара и рукояти, вид сбоку. Всего для образования одного витка -спирали требуется 3,6 аминокислоты. Водородная связь между кислородом карбонила и азотом 4-й аминокислоты стабилизирует спиральную структуру. На показанной структуре черные атомы представляют собой альфа-углерод, серый — карбонильные углероды, красный — кислород, синий — азот, зеленый — R-группы и светло-фиолетовый — атомы водорода.(B) Расширенный вид сбоку, линейная структура и модель заполнения пространства (C) Расширенный вид сверху, линейная структура и модель заполнения пространства
Изображение A изменено с: Максим Изображение B и C предоставлено: Генри Якубовски
Ключевые моменты об альфа-спирали:
- Альфа-спираль более компактна, чем полностью вытянутая полипептидная цепь с углами phi / psi 180 o
- В белках среднее количество аминокислот в спирали равно 11, что дает 3 витка.
- Левая альфа-спираль, хотя и разрешенная при осмотре графика Рамачандрана, наблюдается редко, поскольку аминокислоты, используемые для построения структуры белка, являются L-аминокислотами и смещены в сторону образования правой спирали. Когда левосторонние спирали все же образуются, они часто имеют решающее значение для правильного сворачивания белка, стабильности белка или непосредственно участвуют в формировании активного центра.
Рисунок 2.20 Левосторонняя структура альфа-спирали. На этой диаграмме левая альфа-спираль, показанная желтым цветом, является частью витка шпильки в структуре белка и стабилизирована двумя дисульфидными мостиками, показанными желтым цветом.
Рисунок из: Annavarapu, S., Nanda, V. (2009) BMC Struct Biol 9, 61
- Сердцевина спирали плотно упакована. В спирали нет отверстий и пор.
- Все R-группы простираются наружу и от оси спирали. R-группы могут быть гидрофильными или гидрофобными и могут располагаться в определенных положениях на спирали, образуя амфипатические области на белке, или полностью гидрофобные спирали могут также проходить через плазматическую мембрану, как показано на рисунке 2.21
Рис. 2.21. Расположение R-групп в альфа-спиральных структурах. R-групп могут быть расположены внутри альфа-спирали для создания амфипатических областей в белке, где гидрофильные остатки расположены с одной стороны спирали, а гидрофобные — с другой, как показано на виде сбоку (A) или сверху вниз ( ДО Н.Э).R-группы также могут быть полностью гидрофобными в альфа-спиралях, охватывающих плазматическую мембрану, как показано на (D).
Рисунок изменен по: Khara, J.S., et al. (2017) Acta Biomat 57: 103-114 и Ryu, H., et al. (2019) Int J Mol Sci 20 (6) 1437
- Некоторые аминокислоты чаще встречаются в альфа-спиралях, чем другие. Вот аминокислоты, которые обычно НЕ встречаются в альфа-спиральных структурах: Gly слишком мал и конформационно гибок, чтобы его можно было найти с высокой частотой в альфа-спиралях, в то время как Pro слишком жесткий и в цис -конформация. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с боковыми цепями, которые могут связывать H-связь ( Ser, Asp, и Asn ) и не слишком долго действуют как конкуренты донора и акцептора H-связи основной цепи и дестабилизируют альфа спирали. R-группы с ранним ветвлением, такие как Val и Ile, , дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали.
- Краткое изложение склонности аминокислот к альфа-спиралям (а также к бета-структуре)
- Альфа-кератины, основной компонент волос, кожи, меха, клювов и ногтей, почти полностью представляют собой альфа-спираль.
Jmol: обновлено Изолированная спираль из антифриза белка Jmol14 (Java) | JSMol (HTML5)
Бета-гофрированный лист: В β-складчатом листе «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи.Группы R присоединены к атомам углерода и проходят выше и ниже складок складки в конформации trans . Складчатые сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе остова пептида (рис. 2.21).
Рисунок 2.21 Структура листа с бета-гофрировкой. β-гофрированный лист может быть ориентирован в параллельной или антипараллельной ориентации, как показано на (A) выше, с β-гофрированным листом, представленным красными стрелками.Направление стрелки указывает ориентацию белка, при этом стрелка проходит в направлении от N к C. Водородная связь между карбонилом основной цепи и функциональными аминогруппами основной цепи стабилизировала как антипараллельные (B слева), так и параллельные (B справа) β-складчатые листовые структуры.
Изображение (A) с: Xenoblast Изображение (B) с: Fvasconcellos
Другие мотивы вторичной структуры:
Другие важные вторичные конструкции включают витков, петель, шпилек и гибких линкеров .Существует множество различных классификаций витков в структуре белка, включая α-витков, β-витков, γ-витков, δ-витков и π-витков . β-витки (наиболее распространенная форма) обычно содержат четыре аминокислотных остатка (рис. 2.22). Пролин и глицин обычно встречаются в поворотных мотивах, поскольку цис-конформация пролина способствует более резким конформационным изгибам, в то время как минимальная боковая цепь глицина позволяет более плотно упаковывать аминокислоты, чтобы способствовать структуре поворота.
Рисунок 2.22 Схема β-витков типа I и II.
Изображение из: Muskid
ω-петля — это универсальный термин для более длинных, расширенных или нерегулярных петель без фиксированной внутренней водородной связи. Шпилька — это особый случай поворота, при котором направление основной цепи белка меняется на противоположное и фланкирующие элементы вторичной структуры взаимодействуют. Например, шпилька beta соединяет две антипараллельные β-нити с водородными связями.Иногда повороты обнаруживаются внутри гибких линкеров или петель, соединяющих белковые домены. Линкерные последовательности различаются по длине и обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединительным доменам свободно скручиваться и вращаться для рекрутирования своих связывающих партнеров через динамику белковых доменов.
обратно в начало2.4 Супервторичная структура и белковые мотивы
Между вторичной структурой и третичной структурой белков находятся более крупные трехмерные особенности, которые были идентифицированы во множестве различных белковых структур.Они известны как супервторичная структура и как мотивы белка . Супервторичная структура обычно состоит из двух вторичных структур, связанных между собой витком, и включает спираль-виток-спираль, спираль-петля-спираль, α-α-углы, β-β-углы и β-шпилька-β (рис. 2.23).
Рисунок 2.23 Примеры сверхвторичных структур. (A) β-шпилька-β-структуры характеризуются резким поворотом шпильки, который не нарушает водородные связи двух β-складчатых листовых структур.(B) Предполагаемая структура спирали-поворот-спираль белка Taspase1, (C) угловая структура α-α, присутствующая в белке Myoglobin.
Изображение A предоставлено: Isabella Daidone Изображение B: Johannes van den Boom, et al. (2016) PLosONE 11 (3): e0151431
Изображение C изменено с: Belles14104
Белковые мотивы представляют собой более сложные структуры, созданные из вторичных и супервторичных структурных компонентов, которые являются повторяющимися модальностями, визуализированными во многих белковых структурах.
Бета-нити имеют тенденцию закручиваться в правильном направлении, чтобы минимизировать конформационную энергию. Это приводит к образованию интересных структурных мотивов, обнаруженных во многих типах белков. Две из этих структур включают скрученные листы или опоры, а также бета-стволы (рис. 2.24)
Рис. 2.24 Общие структурные мотивы бета-нити. (A) Скрученный лист для правой руки, вид сверху и сбоку, (B) Вид сбоку бета-ствола и (C) Вид сверху бета-ствола
Автор изображения: Генри Якубовски
Структурные мотивы могут выполнять определенные функции в белках, такие как обеспечение связывания субстратов или кофакторов.Например, складка Россмана отвечает за связывание с кофакторами нуклеотидов, такими как никотинамидадениндинуклеотид (NAD + ) (рис. 2.25). Складка Россмана состоит из шести параллельных бета-нитей, которые образуют протяженный бета-лист. Первые три нити соединены α-спиралями, в результате чего получается структура бета-альфа-бета-альфа-бета. Этот образец дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом жилы расположены в порядке 321456 (1 = N-концевой, 6 = C-концевой).Пять многонитевых складок, подобных Россманну, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный сэндвич, в котором начинка состоит из удлиненного бета-листа, а два ломтика хлеба образованы соединяющимися параллельными альфами. спирали.
Рис. 2.25. Фолд Россмана. (A) Структура никотинамидадениндинуклеотида (NAD + ) (B) Диаграмма складки Россмана (спирали A-F красные и нити 1-6 желтые) из E.coli фермент малатдегидрогеназа. Показано, что кофактор NAD + связывается как молекула, заполняющая пространство. (C) Схематическая диаграмма шестицепочечной складки Россмана.
Изображение изменено с: Boghog
Одной из особенностей складки Россмана является ее специфичность связывания кофакторов. Наиболее консервативный сегмент складок Россмана — это первый бета-альфа-бета сегмент. Поскольку этот сегмент находится в контакте с частью ADP динуклеотидов, таких как FAD, NAD и NADP, его также называют «ADP-связывающей бета-бета складкой».
Интересно, что подобные структурные мотивы не всегда имеют общего эволюционного предка и могут возникнуть в результате конвергентной эволюции. Так обстоит дело с TIM Barrel, консервативной белковой складкой, состоящей из восьми α-спиралей и восьми параллельных β-цепей, которые чередуются вдоль пептидного остова. Структура названа в честь триозофосфатизомеразы, консервативного метаболического фермента. Бочки TIM — одна из самых распространенных белковых складок. Одна из самых интригующих особенностей представителей этого класса белков заключается в том, что хотя все они демонстрируют одну и ту же третичную складку, между ними очень мало сходства последовательностей.По крайней мере 15 различных семейств ферментов используют этот каркас для создания соответствующей геометрии активного сайта, всегда на С-конце восьми параллельных бета-цепей цилиндра.
Рисунок 2.26 Ствол TIM. цилиндров TIM рассматриваются как α / β белковые складки, потому что они включают в себя чередующийся паттерн α-спиралей и β-цепей в одном домене. В цилиндре TIM спирали и нити (обычно по 8 штук) образуют соленоид, который изгибается вокруг себя и замыкается в форме пончика, топологически известной как тороид.Параллельные β-нити образуют внутреннюю стенку бублика (следовательно, β-бочонок), тогда как α-спирали образуют внешнюю стенку бублика. Каждая β-нить соединяется со следующей смежной нитью в цилиндре через длинную правую петлю, которая включает одну из спиралей, так что раскрашивание ленты N-C на виде сверху (A) происходит в радужном порядке вокруг бочка. Ствол TIM также можно рассматривать как состоящий из 8 перекрывающихся правосторонних супервторичных структур β-α-β, как показано на виде сбоку (B).
Изображение изменено с: WillowW
Хотя ленточная диаграмма TIM Barrel показывает отверстие в центральном ядре белка, боковые цепи аминокислот на этом изображении не показаны (рис. 2.26). Ядро белка на самом деле плотно упаковано, в основном с объемными гидрофобными аминокислотными остатками, хотя необходимо несколько глицинов, чтобы дать пространство для маневра для сильно ограниченного центра из 8 приблизительных повторов, чтобы соответствовать друг другу. В упаковочных взаимодействиях между цепями и спиралями также преобладает гидрофобность, и разветвленные алифатические остатки валина, лейцина и изолейцина составляют около 40% от общего количества остатков в β-цепях.
По мере того, как наши знания о бесчисленном множестве структурных мотивов, обнаруженных в сокровищнице природы белковых структур, продолжают расти, мы продолжаем понимать, как структура белка связана с функцией, и мы можем лучше охарактеризовать вновь приобретенные последовательности белка с помощью in silico технологии.
обратно в начало2,5 Структура третичного и четвертичного белка
Полная трехмерная форма всего белка (или сумма всех вторичных структурных мотивов) известна как третичная структура белка и является уникальной и определяющей особенностью этого белка (рис.27). В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур, таких как альфа-спираль. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Незаряженные неполярные боковые цепи могут образовывать гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина может приводить к образованию дисульфидных связей.
Рисунок 2.27 Структура третичного белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Изображение предоставлено: School of Biomedical Sciences Wiki
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он обычно больше не функционирует.
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру . Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар.Инсулин начинается как единый полипептид и теряет некоторые внутренние последовательности во время клеточного процессинга, которые образуют две цепи, удерживаемые вместе дисульфидными связями, как показано на рисунке 2.14. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 2.28). Гексамерная форма инсулина — это способ для организма хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
Рисунок 2.28 Гормон инсулина — хороший пример четвертичной структуры. Инсулин вырабатывается и хранится в организме в виде гексамера (единица из шести молекул инсулина), а активной формой является мономер. Гексамер представляет собой неактивную форму с долговременной стабильностью, которая служит средством защиты высокореактивного инсулина, но при этом остается легкодоступным.
Рисунок: Исаак Йонемото
Предсказание паттерна сворачивания белка на основе его первичной последовательности — чрезвычайно сложная задача из-за присущей гибкости аминокислотным остаткам, которые можно использовать для образования различных вторичных признаков.Как описано Fujiwara и др., Классификация SCOP (структурная классификация белков) и SCOPe (расширенная версия) являются основными базами данных, предоставляющими подробные и всесторонние описания всех известных структур белков. Классификация SCOP основана на иерархических уровнях: первые два уровня, семейство и суперсемейство , описывают близкие и дальние эволюционные отношения, тогда как третий, кратное , описывает геометрические отношения и структурные мотивы внутри белка.В рамках схемы складчатой классификации большинство белков отнесено к одному из четырех структурных классов: (1) все α-спирали, (2) все β-листы, (3) α / β для белков с дисперсными структурами и (4) α + β для белков с участками, в которых преобладает тот или иной тип паттерна.
На основании их формы, функции и местоположения белки в широком смысле могут быть охарактеризованы как волокнистые, глобулярные, мембранные или неупорядоченные.
Волокнистые белки характеризуются удлиненными белковыми структурами.Эти типы белков часто объединяются в филаменты или пучки, образуя структурные каркасы в биологических системах. У животных два наиболее распространенных семейства волокнистых белков — это α-кератин и коллаген.
α-кератин α-кератин — ключевой структурный элемент, из которого состоят волосы, ногти, рога, когти, копыта и внешний слой кожи. Благодаря своей плотно намотанной структуре, он может функционировать как один из самых прочных биологических материалов и находить различные применения у млекопитающих, от хищных когтей до волос для тепла.α-кератин синтезируется путем биосинтеза белка с использованием транскрипции и трансляции, но когда клетка созревает и наполняется α-кератином, она умирает, создавая прочную несосудистую единицу ороговевшей ткани.
Первые последовательности α-кератинов были определены Ханукоглу и Фуксом. Эти последовательности показали, что существует два различных, но гомологичных семейства кератинов, которые были названы кератином типа I и кератином типа II. У человека 54 гена кератина, 28 из которых кодируют тип I, а 26 — тип II. Белки типа I являются кислыми, что означает, что они содержат больше кислых аминокислот, таких как аспарагиновая кислота, в то время как белки типа II являются основными, что означает, что они содержат больше основных аминокислот, таких как лизин. Эта дифференциация особенно важна для α-кератинов, потому что при синтезе его субъединицы димера, спиральной спирали , одна белковая спираль должна быть типа I, а другая — типа II (рис. 2.29). Даже в пределах типа I и II есть кислые и основные кератины, которые особенно дополняют друг друга в каждом организме.Например, в коже человека K5, α-кератин типа II, соединяется в основном с K14, α-кератином I типа, с образованием комплекса α-кератина клеточного слоя эпидермиса кожи.
Димеры Coiled-coil затем собираются в протофиламенты, очень стабильный левосторонний сверхспиральный мотив, который далее мультимеризуется, образуя филаменты, состоящие из множества копий мономеров кератина (рис. 2.29). Основная сила, которая удерживает структуры coiled-coil, связанные друг с другом, — это гидрофобные взаимодействия между аполярными остатками вдоль спиральных сегментов кератина.
Рисунок 2.29. Формирование промежуточной нити. Промежуточные филаменты состоят из супспирального комплекса α-кератина. Первоначально два мономера кератина (A) образуют структуру димера спиральной спирали (B) Два димера спиральной спирали соединяются, образуя шахматный тетрамер (C), тетрамеры начинают соединяться вместе (D), в конечном итоге формируя лист из восьми тетрамеров (E ). Затем лист из восьми тетрамеров скручивают в левую спираль, образуя конечную промежуточную нить (E). Электронная микрофотография промежуточной нити показана в верхнем левом углу.
Автор изображения: Правительство США
Коллаген
Волокнистый белок, Коллаген , является наиболее распространенным белком у млекопитающих, составляя от 25% до 35% от общего содержания белка в организме. Он находится преимущественно во внеклеточном пространстве в различных соединительных тканях организма. Коллаген содержит уникальную четвертичную структуру из трех белковых цепей, соединенных вместе, образуя тройную спираль.В основном он находится в фиброзных тканях, таких как сухожилия, связки и кожа.
В зависимости от степени минерализации коллагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент от жесткого к податливому (хрящ). Его также много в роговице, кровеносных сосудах, кишечнике, межпозвонковых дисках и дентине зубов. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6% веса сильных сухожильных мышц.Фибробласт — наиболее распространенная клетка, вырабатывающая коллаген. Желатин, который используется в пище и промышленности, представляет собой необратимо гидролизованный коллаген. Кроме того, в качестве пищевых добавок используются порошки частично или полностью гидролизованного коллагена. Коллаген имеет множество медицинских применений при лечении костей и кожи.
Название коллаген происходит от греческого ( kólla ), что означает «клей», и суффикса -gen , что означает «производство». Это относится к раннему использованию соединения в процессе кипячения кожи и сухожилий лошадей и других животных для получения клея.
Более 90% коллагена в организме человека относится к типу I. Однако по состоянию на 2011 год было идентифицировано, описано и разделено на несколько групп в соответствии с формируемой ими структурой 28 типов коллагена. Пять наиболее распространенных типов:
- Тип I: кожа, сухожилие, сосудистая сеть, органы, кость (основной компонент органической части кости)
- Тип II: хрящ (основной коллагеновый компонент хряща)
- Тип III: сетчатый (основной компонент ретикулярных волокон), обычно встречается вместе с типом I
- Тип IV: образует базальную пластинку, секретируемый эпителием слой базальной мембраны
- Тип V: поверхности клеток, волосы и плацента
Здесь мы сосредоточимся на уникальных свойствах коллагена типа I.Коллаген I типа имеет необычный аминокислотный состав и последовательность:
.- Глицин присутствует почти в каждом третьем остатке.
- Пролин составляет около 17% коллагена. Коллаген
- содержит две необычные производные аминокислоты, не вставленные непосредственно во время трансляции. Эти аминокислоты находятся в определенных местах относительно глицина и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора (рис. 2.30).
- Гидроксипролин, производный от пролина
- Гидроксилизин, полученный из лизина — в зависимости от типа коллагена различное количество гидроксилизинов гликозилировано (в основном с присоединенными дисахаридами).
Рисунок 2.30. Гидроксилирование пролина и лизина во время посттрансляционной модификации коллагена типа I. Ферменты пролилгидроксилаза и лизилгидроксилаза необходимы для гидроксилирования остатков пролина (A) и лизина (B) соответственно. (Примечание: хотя положение 3 показано выше, пролиловые остатки альтернативно могут быть гидроксилированы в положении 4). Ферменты гидроксилазы модифицируют аминокислотные остатки после того, как они были включены в белок в качестве посттрансляционной модификации, и требуют витамина С (аскорбата) в качестве кофактора.(C) Дальнейшая модификация остатков гидроксилизина путем гликозилирования может привести к включению дисахарида (галактоза-глюкоза) в гидрокси-кислород.
Большинство коллагена образуется аналогичным образом. Процесс синтеза коллагена типа I описан ниже и демонстрирует сложность сворачивания и обработки белка (рис. 2.31).
- Внутри клетки
- Два типа альфа-цепей образуются во время трансляции на рибосомах вдоль шероховатого эндоплазматического ретикулума (RER): альфа-1 и альфа-2 цепи.Эти пептидные цепи (известные как препроколлаген) имеют регистрирующие пептиды на каждом конце и сигнальный пептид.
- Полипептидные цепи высвобождаются в просвет RER.
- Сигнальные пептиды расщепляются внутри RER, и теперь эти цепи известны как про-альфа-цепи.
- Внутри просвета происходит гидроксилирование аминокислот лизина и пролина. Этот процесс зависит от кофактора аскорбиновой кислоты (витамина С).
- Происходит гликозилирование определенных остатков гидроксилизина.
- Тройная альфа-спиральная структура образована внутри эндоплазматического ретикулума из двух цепей альфа-1 и одной цепи альфа-2.
- Проколлаген доставляется в аппарат Гольджи, где он упаковывается и секретируется путем экзоцитоза.
- Вне камеры
- Регистрационные пептиды расщепляются, а тропоколлаген образуется проколлагеновой пептидазой.
- Множественные молекулы тропоколлагена образуют фибриллы коллагена посредством ковалентного сшивания (альдольная реакция) лизилоксидазой, которая связывает остатки гидроксилизина и лизина.Множественные коллагеновые фибриллы образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин, ламинин, фибулин и интегрин.
Рисунок 2.31. Синтез коллагена типа I. Полипептидные цепи синтезируются в эндоплазматическом ретикулуме и высвобождаются в просвет, где они гидроксилируются и гликозилируются. Тройная спираль проколлагена образуется и транспортируется через аппарат Гольджи, где подвергается дальнейшей обработке.Проколлаген секретируется во внеклеточный матрикс, где расщепляется на тропоколлаген. Тропоколлаген собирается в коллагеновые фибриллы, где происходит сшивание и водородные связи с образованием конечного коллагенового волокна.
Изображение изменено: E.V. Вонг и Британская энциклопедия
Дефицит витамина С вызывает цингу, серьезное и болезненное заболевание, при котором дефектный коллаген препятствует образованию прочной соединительной ткани. Десны портятся и кровоточат, с потерей зубов; кожа меняет цвет, а раны не заживают.До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
Аутоиммунное заболевание, такое как красная волчанка или ревматоидный артрит, может поражать здоровые коллагеновые волокна. Кортизол стимулирует расщепление коллагена до аминокислот, предполагая, что стресс может усугубить эти болезненные состояния.
Многие бактерии и вирусы выделяют факторы вирулентности, такие как фермент коллагеназа, который разрушает коллаген или препятствует его производству.
обратно в началоГлобулярные белки
Глобулярные белки или сферопротеины представляют собой сферические («шарообразные») белки и являются одним из распространенных типов белков. Глобулярные белки в некоторой степени растворимы в воде (образуют коллоиды в воде), в отличие от волокнистых или мембранных белков. Существует несколько классов складок глобулярных белков, поскольку существует множество различных архитектур, которые могут складываться в примерно сферическую форму.
Термин глобин может более конкретно относиться к белкам, включая глобиновую складку. Глобиновая складка представляет собой обычную трехмерную складку в белках и определяет суперсемейство глобиноподобных белков (рис. 2.32). Эта складка обычно состоит из восьми альфа-спиралей, хотя некоторые белки имеют дополнительные продолжения спиралей на концах. Глобиновая складка встречается в одноименных семействах глобиновых белков: гемоглобинах и миоглобинах, а также в фикоцианинах.Поскольку миоглобин был первым белком, структура которого была решена, глобиновая складка была, таким образом, первой обнаруженной белковой складкой. Поскольку глобиновая складка содержит только спирали, она классифицируется как полностью альфа-белковая складка.
Рисунок 2.32 Глобиновая складка. (A) Пример глобиновой складки, переносящего кислород белка миоглобина (PBD ID 1MBA) из моллюска Aplysia limacina. (B) Структура тетрамерного белка гемоглобина, содержащего в общей сложности четыре глобиновых складки.
Изображение A: Википедия Изображение B: Zephyris
Термин глобулярный белок довольно старый (датируется, вероятно, 19 веком) и сейчас несколько архаичен, учитывая сотни тысяч белков и более элегантный и описательный словарь структурных мотивов. Сферическая структура индуцируется третичной структурой белка. Неполярные (гидрофобные) аминокислоты молекулы связаны внутри молекулы, тогда как полярные (гидрофильные) аминокислоты связаны снаружи, что позволяет диполь-дипольным взаимодействиям с растворителем, что объясняет растворимость молекулы.
В отличие от волокнистых белков, которые выполняют преобладающую структурную функцию, глобулярные белки могут действовать как:
- Ферменты, катализируя органические реакции, происходящие в организме в мягких условиях и с высокой специфичностью. Эту роль выполняют разные эстеразы.
- Посланники, передающие сообщения для регулирования биологических процессов. Эту функцию выполняют гормоны, например, инсулин и т. Д.
- Транспортеры других молекул через мембраны
- Запасы аминокислот.
- Регуляторные роли также выполняются глобулярными белками, а не волокнистыми белками.
- Структурные белки, например, актин и тубулин, которые являются глобулярными и растворимыми как мономеры, но полимеризуются с образованием длинных жестких волокон
Многие из белков, которые будут подробно описаны в следующих главах, относятся к этому классу белков.
Мембранные белкиМембранные белки — это белки, которые являются частью биологических мембран или взаимодействуют с ними.Они включают: 1) интегральные мембранные белки, которые являются частью мембраны или постоянно прикреплены к ней, и 2) периферические мембранные белки, которые временно прикрепляются к мембране через интегральные белки или липидный бислой. Интегральные мембранные белки далее классифицируются как трансмембранные белки, которые проходят через мембрану, или интегральные монотопные белки, которые прикрепляются только к одной стороне мембраны.
Мембранные белки, такие как растворимые глобулярные белки, волокнистые белки и неупорядоченные белки, являются обычными. Мембранные белки, имеющие символическое значение в медицине, являются мишенью для более 50% всех современных лекарственных препаратов. Подсчитано, что 20–30% всех генов в большинстве геномов кодируют мембранные белки. По сравнению с другими классами белков, определение структур мембранных белков остается проблемой в значительной степени из-за сложности создания экспериментальных условий, которые могут сохранить правильную конформацию белка в изоляции от его нативной среды (рис. 2.33).
Мембранные белки выполняют множество функций, жизненно важных для выживания организмов:
- Белки мембранных рецепторов передают сигналы между внутренней и внешней средой клетки.
- Транспортные белки перемещают молекулы и ионы через мембрану. Их можно разделить на категории в соответствии с базой данных классификации транспортеров.
- Мембранные ферменты могут обладать многими видами активности, такими как оксидоредуктаза, трансфераза или гидролаза.
- Молекулы клеточной адгезии позволяют клеткам идентифицировать друг друга и взаимодействовать.Например, белки, участвующие в иммунном ответе.
Рис. 2.33. Схематическое изображение трансмембранных белков. 1. одиночная трансмембранная α-спираль (битопический мембранный белок) 2. политопный трансмембранный α-спиральный белок 3. политопный трансмембранный β-листовой белок. Мембрана представлена светло-коричневым цветом.
Интегральные мембранные белки постоянно прикреплены к мембране. Такие белки можно отделить от биологических мембран только с использованием детергентов, неполярных растворителей или иногда денатурирующих агентов.Их можно классифицировать в зависимости от их отношения к бислою:
.- Интегральные политопные белки — это трансмембранные белки, которые проходят через мембрану более одного раза. Эти белки могут иметь различную трансмембранную топологию. Эти белки имеют одну из двух структурных архитектур:
- белков спирального пучка, которые присутствуют во всех типах биологических мембран;
- бета-цилиндрических белков, которые обнаруживаются только во внешних мембранах грамотрицательных бактерий и внешних мембранах митохондрий и хлоропластов.
- Битопические белки — это трансмембранные белки, которые проходят через мембрану только один раз. Трансмембранные спирали из этих белков имеют значительно отличающиеся распределения аминокислот от трансмембранных спиралей политопных белков.
- Интегральные монотопные белки — это интегральные мембранные белки, которые прикреплены только к одной стороне мембраны и не охватывают весь путь.
Рисунок 2.34 Схематическое изображение различных типов взаимодействия между монотопными мембранными белками и клеточной мембраной. 1. взаимодействие амфипатической α-спирали, параллельной плоскости мембраны (плоская спираль мембраны) 2. взаимодействие гидрофобной петлей 3. взаимодействие ковалентно связанного липида мембраны ( липидирование ) 4. электростатические или ионные взаимодействия с мембранные липиды.
Автор изображения: : Foobar
Белки периферической мембраны временно присоединяются либо к липидному бислою, либо к интегральным белкам за счет комбинации гидрофобных, электростатических и других нековалентных взаимодействий.Периферические белки диссоциируют после обработки полярным реагентом, например раствором с повышенным pH или высокой концентрацией соли.
Интегральные и периферические белки могут быть посттрансляционно модифицированы с добавлением жирных кислот, диацилглицерина или пренильных цепей или GPI (гликозилфосфатидилинозитол), который может быть закреплен в липидном бислое.
Неупорядоченные белкиВнутренне неупорядоченный белок ( IDP ) — это белок, не имеющий фиксированной или упорядоченной трехмерной структуры (Рисунок 2.35). IDP охватывают спектр состояний от полностью неструктурированного до частично структурированного и включают случайные клубки, (предварительно) расплавленные глобулы и большие многодоменные белки, соединенные гибкими линкерами. Они составляют один из основных типов белков (наряду с глобулярными, волокнистыми и мембранными белками).
Рис. 2.35. Конформационная гибкость белка SUMO-1 (PDB: 1a5r). Центральная часть показывает относительно упорядоченную структуру. Напротив, N- и C-концевые области (левая и правая соответственно) демонстрируют «внутреннее нарушение», хотя короткая спиральная область сохраняется в N-концевом хвосте.Были преобразованы десять альтернативных моделей ЯМР. Элементы вторичной структуры: α-спирали (красные), β-тяжи (синие стрелки).
Автор изображения: Лукаш Козловски
Открытие IDP бросило вызов традиционной парадигме структуры белка, согласно которой функция белка зависит от фиксированной трехмерной структуры. Эта догма была поставлена под сомнение в течение последних двадцати лет в результате все большего количества данных из различных областей структурной биологии, предполагающих, что динамика белков может иметь большое значение для таких систем.Несмотря на отсутствие стабильной структуры, IDP представляют собой очень большой и функционально важный класс белков. В некоторых случаях IDP могут принимать фиксированную трехмерную структуру после связывания с другими макромолекулами. В целом, IDP во многом отличаются от структурированных белков и, как правило, обладают различными свойствами с точки зрения функции, структуры, последовательности, взаимодействий, эволюции и регуляции.
В 1930-1950 годах первые структуры белка были решены с помощью кристаллографии белков.Эти ранние структуры предполагали, что фиксированная трехмерная структура может обычно требоваться для обеспечения биологических функций белков. Утверждая, что белки имеют только одну однозначно определенную конфигурацию, Мирски и Полинг не признали, что работа Фишера поддержала бы их тезис с его моделью «Замок и ключ» (1894). Эти публикации закрепили центральную догму молекулярной биологии в том, что последовательность определяет структуру, которая, в свою очередь, определяет функцию белков.В 1950 году Каруш написал о «конфигурационной адаптивности», что противоречит всем предположениям и исследованиям XIX века. Он был убежден, что белки имеют более одной конфигурации на одном уровне энергии и могут выбирать одну при связывании с другими субстратами. В 1960-х годах парадокс Левинталя предположил, что систематический конформационный поиск длинного полипептида вряд ли приведет к единственной свернутой структуре белка в биологически значимых временных масштабах (то есть от секунд до минут). Любопытно, что для многих (небольших) белков или белковых доменов можно наблюдать относительно быструю и эффективную рефолдинг in vitro .Как указано в «Догме Анфинсена» 1973 года, фиксированная трехмерная структура этих белков уникально кодируется в их первичной структуре (аминокислотной последовательности), является кинетически доступной и стабильной в ряде (близких) физиологических условий и, следовательно, может рассматриваться как нативное состояние таких «упорядоченных» белков.
Однако в последующие десятилетия многие крупные белковые области не могли быть отнесены к рентгеновским наборам данных, что указывает на то, что они занимают несколько позиций, которые усредняются на картах электронной плотности.Отсутствие фиксированных уникальных положений относительно кристаллической решетки предполагало, что эти области были «неупорядоченными». Спектроскопия ядерного магнитного резонанса белков также продемонстрировала наличие больших гибких линкеров и концов во многих решенных структурных ансамблях. В настоящее время общепринято, что белки существуют как ансамбль подобных структур с некоторыми областями более ограниченными, чем другие. Внутренне неструктурированные белки (IUP) занимают крайний конец этого спектра гибкости, тогда как IDP также включают белки со значительной тенденцией к локальной структуре или гибкими многодоменными сборками.Эти высокодинамичные неупорядоченные области белков впоследствии были связаны с функционально важными явлениями, такими как аллостерическая регуляция и ферментативный катализ.
Многие неупорядоченные белки обладают аффинностью связывания со своими рецепторами, регулируемыми посттрансляционной модификацией, поэтому было высказано предположение, что гибкость неупорядоченных белков облегчает различные конформационные требования для связывания модифицирующих ферментов, а также их рецепторов. Внутреннее нарушение особенно обогащено белками, участвующими в передаче клеточных сигналов, транскрипции и ремоделировании хроматина.
Гибкие линкерыНеупорядоченные области часто встречаются в виде гибких линкеров или петель, соединяющих домены. Линкерные последовательности сильно различаются по длине, но обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющим доменам свободно скручиваться и вращаться, чтобы рекрутировать своих связывающих партнеров через динамику белковых доменов. Они также позволяют своим партнерам по связыванию вызывать более крупномасштабные конформационные изменения с помощью аллостерии на большие расстояния.
Линейные мотивыЛинейные мотивы — это короткие неупорядоченные сегменты белков, которые опосредуют функциональные взаимодействия с другими белками или другими биомолекулами (РНК, ДНК, сахарами и т. Д.).). Многие роли линейных мотивов связаны с клеточной регуляцией, например, с контролем формы клеток, субклеточной локализацией отдельных белков и регулируемым обменом белков. Часто посттрансляционные модификации, такие как фосфорилирование, настраивают сродство (не редко на несколько порядков величины) отдельных линейных мотивов к специфическим взаимодействиям. В отличие от глобулярных белков IDP не имеют пространственно расположенных активных карманов. Тем не менее, в 80% IDP (~ 3 дюжины), подвергнутых детальной структурной характеристике с помощью ЯМР, присутствуют линейные мотивы, называемые PreSMos (предварительно структурированные мотивы), которые являются временными вторичными структурными элементами, примированными для распознавания мишени.В нескольких случаях было продемонстрировано, что эти временные структуры становятся полными и стабильными вторичными структурами, например спиралями, после связывания мишени. Следовательно, PreSMos являются предполагаемыми активными сайтами IDP.
Фальцовка и переплет с сопряжениемМногие неструктурированные белки претерпевают переходы в более упорядоченные состояния при связывании со своими мишенями. Спаренная укладка и связывание могут быть локальными, с участием только нескольких взаимодействующих остатков, или с участием всего белкового домена.Недавно было показано, что спаренная укладка и связывание позволяют захоронить большую площадь поверхности, что было бы возможно только для полностью структурированных белков, если бы они были намного больше. Более того, определенные неупорядоченные области могут служить «молекулярными переключателями» в регулировании определенных биологических функций, переключаясь на упорядоченную конформацию при молекулярном распознавании, например, при связывании малых молекул, связывании ДНК / РНК, ионных взаимодействиях.
Нарушение связанного состояния (нечеткие комплексы)Внутренне неупорядоченные белки могут сохранять свою конформационную свободу, даже если они специфически связываются с другими белками.Структурный беспорядок в связанном состоянии может быть статическим или динамическим. В нечетких комплексов структурная множественность необходима для функционирования, и манипулирование связанной неупорядоченной областью изменяет активность. Конформационный ансамбль комплекса модулируется посредством посттрансляционных модификаций или белковых взаимодействий. Специфичность ДНК-связывающих белков часто зависит от длины нечетких областей, которая варьируется путем альтернативного сплайсинга. Внутренне неупорядоченные белки адаптируют множество различных структур in vivo в соответствии с условиями клетки, создавая структурный или конформационный ансамбль.
Следовательно, их структуры сильно связаны с функциями. Однако только несколько белков полностью неупорядочены в своем нативном состоянии. Нарушение в основном обнаруживается в внутренне неупорядоченных областях (IDR) внутри хорошо структурированного белка. Термин «внутренне неупорядоченный белок» (IDP), следовательно, включает белки, которые содержат IDR, а также полностью неупорядоченные белки.
Наличие и вид белкового нарушения кодируется его аминокислотной последовательностью.В целом, IDP характеризуются низким содержанием объемных гидрофобных аминокислот и высокой долей полярных и заряженных аминокислот, обычно называемой низкой гидрофобностью. Это свойство приводит к хорошему взаимодействию с водой. Кроме того, высокие чистые заряды способствуют беспорядку из-за электростатического отталкивания, возникающего из-за одинаково заряженных остатков. Таким образом, неупорядоченные последовательности не могут в достаточной степени скрыть гидрофобное ядро, чтобы сложиться в стабильные глобулярные белки. В некоторых случаях гидрофобные кластеры в неупорядоченных последовательностях дают ключи для идентификации областей, которые подвергаются сопряженной укладке и связыванию (см. Биологические роли).
Многие неупорядоченные белки обнаруживают области без какой-либо регулярной вторичной структуры. Эти области можно назвать гибкими по сравнению со структурированными петлями. В то время как последние являются жесткими и содержат только один набор углов Рамачандрана, IDP включают несколько наборов углов. Термин гибкость также используется для хорошо структурированных белков, но описывает другое явление в контексте неупорядоченных белков. Гибкость структурированных белков связана с равновесным состоянием, в то время как у ВПЛ это не так.Многие неупорядоченные белки также обнаруживают последовательности низкой сложности, то есть последовательности с избыточным представлением нескольких остатков. В то время как последовательности низкой сложности являются сильным признаком нарушения, обратное не обязательно верно, то есть не все неупорядоченные белки имеют последовательности низкой сложности. Неупорядоченные белки имеют низкое содержание предсказанной вторичной структуры.
обратно в начало2.6 Сворачивание, денатурация и гидролиз белков
Сворачивание белка — это физический процесс, с помощью которого белковая цепь приобретает свою естественную трехмерную структуру, конформацию, которая обычно является биологически функциональной, быстрым и воспроизводимым образом (Рисунок 2.36). Это физический процесс, с помощью которого полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного клубка. Каждый белок существует в виде развернутого полипептида или случайной спирали при трансляции из последовательности мРНК в линейную цепочку аминокислот. У этого полипептида отсутствует какая-либо стабильная (долговечная) трехмерная структура (левая часть первого рисунка). Поскольку полипептидная цепь синтезируется рибосомой, линейная цепь начинает складываться в свою трехмерную структуру.Сворачивание начинает происходить даже при трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Полученная трехмерная структура определяется аминокислотной последовательностью или первичной структурой (догма Анфинсена).
Рисунок 2.36 Белок до и после сворачивания
Автор изображения: DrKjaergaard
Правильная трехмерная структура важна для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми или, как в случае IDP, оставаться гибкими, поэтому важна динамика белков.Неспособность свернуться в нативную структуру обычно приводит к образованию неактивных белков, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсичную функциональность. Считается, что несколько нейродегенеративных и других заболеваний являются результатом накопления неправильно свернутых белков, таких как амилоидные фибриллы, обнаруженные у пациентов с болезнью Альцгеймера.
Сворачивание — это спонтанный процесс, который в основном управляется гидрофобными взаимодействиями, образованием внутримолекулярных водородных связей, силами Ван-дер-Ваальса, и ему противостоит конформационная энтропия.Процесс сворачивания часто начинается совместно с трансляцией, так что N-конец белка начинает сворачиваться, в то время как C-концевой участок белка все еще синтезируется рибосомой; однако молекула белка может самопроизвольно складываться во время или после биосинтеза. Хотя эти макромолекулы можно рассматривать как «складывающиеся сами по себе», процесс также зависит от растворителя (вода или липидный бислой), концентрации солей, pH, температуры, возможного присутствия кофакторов и молекулярных шаперонов.Белки будут иметь ограничения на их способность к складыванию из-за ограниченных углов изгиба или возможных конформаций, как описано в графике Рамачандрана.
Рисунок 2.37 Гидрофобный коллапс. В компактной складке (справа) гидрофобные аминокислоты (показаны черными сферами) схлопываются к центру, чтобы защитить себя от водной среды.
Автор изображения: Tomixdf
Сворачивание белка должно быть термодинамически благоприятным внутри клетки, чтобы реакция была спонтанной.Поскольку известно, что сворачивание белка является спонтанной реакцией, оно должно принимать отрицательное значение свободной энергии Гиббса. Свободная энергия Гиббса при сворачивании белка напрямую связана с энтальпией и энтропией. Для возникновения отрицательной ΔG и для того, чтобы сворачивание белка стало термодинамически благоприятным, тогда либо энтальпия, либо энтропия, либо оба условия должны быть благоприятными.
Сведение к минимуму количества гидрофобных боковых цепей, подверженных воздействию воды, является важной движущей силой процесса складывания. Гидрофобный эффект (рис. 2.37) — это явление, при котором гидрофобные цепи белка схлопываются в ядро белка (вдали от гидрофильной среды). В водной среде молекулы воды имеют тенденцию к агрегированию вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки из упорядоченных молекул воды. Упорядочение молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (уменьшению энтропии в системе).Молекулы воды фиксируются в этих водных клетках, что приводит к гидрофобному коллапсу или сворачиванию внутрь гидрофобных групп (рис. 2.38).
Рис. 2.38. Образование клатрата воды. Хлороформ является гидрофобным соединением, поэтому, когда он растворяется в воде с образованием гидрата, гидрофобная гидратация сопровождается отрицательным изменением энтропии из-за повышенного порядка в окружающей воде и положительного изменения теплоемкости, часто вызывая положительное значение ΔG. Подобные водные клетки могут объединяться вокруг гидрофобных белковых остатков перед правильным сворачиванием.
Гидрофобный коллапс возвращает энтропию в систему за счет разрушения водяных клеток, что освобождает упорядоченные молекулы воды. Множество гидрофобных групп, взаимодействующих внутри ядра глобулярного свернутого белка, вносит значительный вклад в стабильность белка после сворачивания из-за сильно накопленных сил Ван-дер-Ваальса (в частности, сил Лондонской дисперсии).Гидрофобный эффект существует как движущая сила в термодинамике только при наличии водной среды с амфифильной молекулой, содержащей большую гидрофобную область. Прочность водородных связей зависит от их окружения; таким образом, водородные связи, заключенные в гидрофобное ядро, вносят больший вклад, чем водородные связи, находящиеся в водной среде, для стабильности нативного состояния.
ШапероныМолекулярные шапероны представляют собой класс белков, которые помогают в правильном сворачивании других белков in vivo (Рисунок 2.39). Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, чтобы позволить сформироваться нативной трехмерной конформации белка; однако сами шапероны не включены в окончательную структуру белка, которому они помогают. Шапероны могут способствовать сворачиванию, даже когда возникающий полипептид синтезируется рибосомой. Молекулярные шапероны действуют путем связывания для стабилизации нестабильной в других отношениях структуры белка в его пути фолдинга, но шапероны не содержат необходимой информации, чтобы знать правильную нативную структуру белка, которому они помогают; скорее, шапероны работают, предотвращая неправильные складчатые конформации.
Рисунок 2.39 Вид сверху комплекса бактериальных шаперонов GroES / GroEL, модель
Автор изображения: Википедия
Таким образом, шапероны на самом деле не увеличивают частоту отдельных шагов, участвующих в пути сворачивания к нативной структуре; вместо этого они работают, уменьшая возможные нежелательные агрегации полипептидной цепи, которые в противном случае могли бы замедлить поиск подходящего промежуточного соединения, и они обеспечивают более эффективный путь для полипептидной цепи, чтобы принять правильные конформации.Шапероны не следует путать с катализаторами сворачивания, которые на самом деле катализируют медленные в противном случае этапы пути сворачивания. Примерами катализаторов фолдинга являются протеин-дисульфидные изомеразы и пептидил-пролилизомеразы, которые могут участвовать в образовании дисульфидных связей или взаимном превращении между цис- и транс- стереоизомерами соответственно.
Показано, что шапероныимеют решающее значение в процессе сворачивания белка in vivo , потому что они обеспечивают белок с помощью, необходимой для принятия его надлежащих выравниваний и конформаций, достаточно эффективно, чтобы стать «биологически релевантными».Это означает, что полипептидная цепь теоретически может складываться в свою нативную структуру без помощи шаперонов, как продемонстрировали эксперименты по укладке белков, проведенные in vitro ; , однако, этот процесс оказывается слишком неэффективным или слишком медленным, чтобы существовать в биологических системах; следовательно, шапероны необходимы для сворачивания белка in vivo. Наряду с их ролью в содействии формированию нативных структур, шапероны, как было показано, участвуют в различных ролях, таких как транспорт белков, деградация, и даже позволяют денатурированным белкам, подвергшимся воздействию определенных внешних денатурирующих факторов, возможность повторно складываться в их правильные нативные структуры.
Денатурация белкаПолностью денатурированный белок не имеет ни третичной, ни вторичной структуры, однако последовательность первичного белка остается нетронутой, и белок существует в виде случайной спирали (рис. 2.39). При определенных условиях некоторые белки могут складываться заново; однако во многих случаях денатурация необратима. Клетки иногда защищают свои белки от денатурирующего воздействия тепла с помощью ферментов, известных как белков теплового шока (тип шаперона), , которые помогают другим белкам как в сворачивании, так и в том, чтобы оставаться свернутыми (Рисунок 2.40). Белки теплового шока экспрессируются в ответ на повышенные температуры или другие стрессы. Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки, чтобы их укладка не прерывалась взаимодействиями с другими белками, либо помогают разворачивать неправильно свернутые белки, позволяя им повторно складываться в правильную нативную структуру. Эта функция имеет решающее значение для предотвращения риска осаждения в нерастворимые аморфные агрегаты.
Рисунок 2.40 Денатурация белка. На рисунке (1) изображен правильно свернутый интактный белок. На этапе (2) к системе подводится тепло, превышающее порог поддержания внутримолекулярных белковых взаимодействий. На этапе (3) показан развернутый или денатурированный белок. Цветные области денатурированного белка соответствуют окрашенным участкам природного свернутого белка, показанного на (1).
Схема предоставлена: Scurran15
К внешним факторам, участвующим в денатурации белка или нарушении нативного состояния, относятся температура, внешние поля (электрические, магнитные), скученность молекул и даже ограничение пространства, которые могут иметь большое влияние на сворачивание белков.Высокие концентрации растворенных веществ, экстремальные значения pH, механические силы и присутствие химических денатурирующих веществ также могут способствовать денатурации белка. Эти отдельные факторы вместе классифицируются как стрессы. Показано, что шапероны существуют в возрастающих концентрациях во время клеточного стресса и помогают правильному сворачиванию возникающих белков, а также денатурированных или неправильно свернутых.
При некоторых условиях белки не будут сворачиваться в свои биохимически функциональные формы.Температуры выше или ниже диапазона, в котором обычно живут клетки, вызывают разворачивание или денатурирование термически нестабильных белков (вот почему кипячение делает яичный белок непрозрачным). Однако термостабильность белков далеко не постоянна; например, были обнаружены гипертермофильные бактерии, которые растут при температурах до 122 ° C, что, конечно, требует, чтобы их полный набор жизненно важных белков и белковых ансамблей был стабильным при этой температуре или выше.
ГидолизГидролиз — это разрушение последовательности первичного белка путем добавления воды для преобразования отдельных мономерных звеньев аминокислот (Рисунок 2.41).
Рисунок 2.41 Гидролиз белков. В реакции гидролиза вода добавляется через амидную связь, включающую группу -ОН с карбонильным углеродом и реформируя карбоновую кислоту. Водород из воды преобразовывает амин.
Белки участвуют во многих клеточных функциях. Белки могут действовать как ферменты, которые увеличивают скорость химических реакций. Фактически, 99% ферментативных реакций внутри клетки опосредуются белками.Таким образом, они являются неотъемлемой частью процессов создания или разрушения клеточных компонентов. Белки также могут действовать как структурный каркас внутри клетки, помогая поддерживать клеточную форму. Белки также могут участвовать в клеточной передаче сигналов и коммуникации, а также в переносе молекул из одного места в другое. В экстремальных обстоятельствах, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
обратно в начало2.7 источников
OpenStax, Белки. OpenStax CNX. 30 сентября 2016 г. http://cnx.org/contents/bf17f4df-605c-4388-88c2-25b0f000b0ed@2.
Файл: Хиральность руками.jpg. (2017, 16 сентября). Wikimedia Commons, бесплатное хранилище мультимедиа . Получено 17:34, 10 июля 2019 г. с сайта https://commons.wikimedia.org/w/index.php?title=File:Chirality_with_hands.jpg&oldid=258750003.
авторов Википедии. (2019, 6 июля). Цвиттерион. В Википедия, Бесплатная энциклопедия .Получено 21:48, 10 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Zwitterion&oldid=9721
.авторов Википедии. (2019, 8 июля). Абсолютная конфигурация. В Википедия, Бесплатная энциклопедия . Получено в 15:28, 14 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Absolute_configuration&oldid=
2423.Структурная биохимия / фермент / активный сайт. (2019, 1 июля). Викиучебники, проект бесплатного учебника . Получено 16:55, 16 июля 2019 г., с сайта https: // en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Enzyme/Active_Site&oldid=3555410.
Структурная биохимия / Белки. (2019, 24 марта). Викиучебники, проект бесплатного учебника . Получено в 19:16, 18 июля 2019 г., с сайта https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Proteins&oldid=3529061.
Fujiwara, K., Toda, H., and Ikeguchi, M. (2012) Зависимость склонности аминокислот к α-спирали и β-слою от общего типа белковой складки. BMC Структурная биология 12:18.Доступно по адресу: https://bmcstructbiol.biomedcentral.com/track/pdf/10.1186/1472-6807-12-18
авторов Википедии. (2019, 16 июля). Кератин. В Википедия, Бесплатная энциклопедия . Получено 17:50, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Keratin&oldid=8340
.авторов Википедии. (2019, 13 июля). Альфа-кератин. В Википедия, Бесплатная энциклопедия . Получено в 18:17, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php? title = Альфа-кератин & oldid =
Инициатива открытого обучения. (2019) Покровные уровни организации. Университет Карнеги Меллон. В анатомии и физиологии. Доступно по адресу: https://oli.cmu.edu/jcourse/webui/syllabus/module.do?context=43480020ca6010f804da8baf7ba.
авторов Википедии. (2019, 16 июля). Коллаген. В Википедия, Бесплатная энциклопедия . Получено в 03:42, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Collagen&oldid=9954
.авторов Википедии.(2019, 2 июля). Россманн фолд. В Википедия, Бесплатная энциклопедия . Получено в 16:01, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Rossmann_fold&oldid=
8788
.авторов Википедии. (2019, 30 мая). Ствол ТИМ. В Википедия, Бесплатная энциклопедия . Получено в 16:46, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=TIM_barrel&oldid=899459569
.авторов Википедии. (2019, 16 июля). Сворачивание белков. В Википедия, Бесплатная энциклопедия .Получено 18:30, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Protein_folding&oldid=4145
.авторов Википедии. (2019, 11 июня). Глобулярный белок. В Википедия, Бесплатная энциклопедия . Получено в 18:49, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Globular_protein&oldid=
авторов Википедии. (2019, 11 июля). Внутренне неупорядоченные белки. В Википедия, Бесплатная энциклопедия . Получено 19:52, 20 июля 2019 г., с https: // en.wikipedia.org/w/index.php?title=Intrinsically_disordered_proteins&oldid=2287
3.4 Белки — Биология для курсов AP®
Цели обучения
В этом разделе вы исследуете следующие вопросы:
- Каковы функции белков в клетках и тканях?
- Какая связь между аминокислотами и белками?
- Каковы четыре уровня белковой организации?
- Какая связь между формой и функцией белка?
Соединение для AP
® КурсыБелки представляют собой длинные цепи различных последовательностей из 20 аминокислот, каждая из которых содержит аминогруппу (-NH 2 ), карбоксильную группу (-COOH) и вариабельную группу.(Подумайте, сколько белковых «слов» можно составить из 20 «букв» аминокислот). Каждая аминокислота связана со своим соседом пептидной связью, образованной в результате реакции дегидратации. Длинная цепь аминокислот известна как полипептид. Белки выполняют в клетках множество функций. Они действуют как ферменты, которые катализируют химические реакции, обеспечивают структурную поддержку, регулируют прохождение веществ через клеточную мембрану, защищают от болезней и координируют сигнальные пути клетки. Структура белка организована на четырех уровнях: первичном, вторичном, третичном и четвертичном.Первичная структура — это уникальная последовательность аминокислот. Изменение только одной аминокислоты может изменить структуру и функцию белка. Например, серповидно-клеточная анемия возникает в результате замены одной аминокислоты в молекуле гемоглобина, состоящей из 574 аминокислот. Вторичная структура состоит из локального сворачивания полипептида за счет образования водородной связи; приводящие к конформации α-спирали и β-складчатого листа. В третичной структуре различные взаимодействия, например водородные связи, ионные связи, дисульфидные связи и гидрофобные взаимодействия между группами R, способствуют укладке полипептида в различные трехмерные конфигурации.Большинство ферментов имеют третичную конфигурацию. Если белок денатурируется, теряет свою трехмерную форму, он может больше не функционировать. Условия окружающей среды, такие как температура и pH, могут денатурировать белки. Некоторые белки, такие как гемоглобин, образованы из нескольких полипептидов, и взаимодействия этих субъединиц образуют четвертичную структуру белков.
Представленная информация и примеры, выделенные в разделе, вспомогательные концепции и цели обучения, изложенные в Большой идее 4 Структуры учебной программы по биологии AP ® .Цели обучения, перечисленные в структуре учебной программы, обеспечивают прозрачную основу для курса биологии AP ® , лабораторного опыта на основе запросов, учебных мероприятий и вопросов экзамена AP ® . Цель обучения объединяет требуемый контент с одной или несколькими из семи научных практик.
| Большая идея 4 | Биологические системы взаимодействуют, и эти системы и их взаимодействия обладают сложными свойствами. |
| Постоянное понимание 4.A | Взаимодействия внутри биологических систем приводят к появлению сложных свойств. |
| Основные знания | 4.A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 7,1 Учащийся может связывать явления и модели в пространственных и временных масштабах. |
| Цель обучения | 4,1 Учащийся может объяснить связь между последовательностью и подкомпонентами биологического полимера и его свойствами. |
| Основные знания | 4.A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 1.3 Студент может уточнить представления и модели природных или антропогенных явлений и систем в своей области. |
| Цель обучения | 4,2 Учащийся может уточнить представления и модели, чтобы объяснить, как подкомпоненты биологического полимера и их последовательность определяют свойства этого полимера. |
| Основные знания | 4.A.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 6,1 Студент может обосновать свои претензии доказательствами. |
| Научная практика | 6,4 Студент может делать утверждения и предсказания о природных явлениях на основе научных теорий и моделей. |
| Цель обучения | 4,3 Учащийся может использовать модели для прогнозирования и обоснования того, что изменения в подкомпонентах биологического полимера влияют на функциональность молекул. |
Поддержка учителей
Двадцать аминокислот могут быть преобразованы в практически неограниченное количество различных белков. Последовательность аминокислот в конечном итоге определяет окончательную конфигурацию белковой цепи, придавая молекуле ее специфическую функцию.
Поддержка учителей
Подчеркните, что белки выполняют в организме множество функций. Таблица 3.1 содержит несколько примеров этих функций. Обратите внимание, что не все ферменты работают в одинаковых условиях.Амилаза работает только в щелочной среде, например, в слюне, в то время как пепсин действует в кислой среде желудка. Обсудите другие материалы, которые могут переноситься белками в жидкостях организма в дополнение к веществам, перечисленным в тексте для транспортировки. Белки также переносят нерастворимые липиды в организме и заряженные ионы, такие как кальций, магний и цинк. Обсудите еще один важный структурный белок, коллаген, который содержится во всем теле, в том числе в большинстве соединительных тканей. Подчеркните, что не все гормоны являются белками и что гормоны на основе стероидов обсуждались в предыдущем разделе.
Аминогруппа аминокислоты теряет электрон и становится положительно заряженной. Карбоксильная группа легко получает электрон, становясь отрицательно заряженным. Это приводит к амфипатическим характеристикам аминокислот и придает соединениям растворимость в воде. Присутствие обеих функциональных групп также позволяет дегидратационному синтезу объединять отдельные аминокислоты в пептидную цепь.
Структура белка объясняется так, как будто она состоит из трех-четырех дискретных этапов.В действительности структурные изменения, которые приводят к появлению функционального белка, происходят непрерывно. Поскольку первичная структура формируется из рибосом, полипептидная цепь претерпевает изменения, пока не будет достигнута окончательная конфигурация. Предложите учащимся представить себе нитку спагетти, готовящуюся в прозрачной посуде. Изначально прядь прямая (в этом примере не обращайте внимания на жесткость). Во время приготовления нить будет изгибаться, скручиваться и (опять же, в этом примере) складываться в неплотный шар, состоящий из нити макаронных изделий.Полученная прядь имеет особую форму. Спросите студентов, какие типы химических связей или сил могут влиять на структуру белка. Эти формы продиктованы положением аминокислот вдоль нити. Другие силы завершат складывание и поддержат конструкцию.
Проблемные вопросы по научной практике содержат дополнительные тестовые вопросы для этого раздела, которые помогут вам подготовиться к экзамену AP. Эти вопросы касаются следующих стандартов:
[APLO 1.14] [APLO 2.12] [APLO 4.1] [APLO 4.3] [APLO 4.15] [APLO 4.22]
Типы и функции белков
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Ферменты, которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Гормоны — это химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.Основные типы и функции белков перечислены в таблице 3.1.
Типы и функции белков
| Тип | Примеры | Функции |
|---|---|---|
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи путем катаболизма питательных веществ до мономерных единиц |
| Транспорт | Гемоглобин, альбумин | Переносит вещества в крови или лимфе на протяжении всего организма. тело |
| Структурная | Актин, тубулин, кератин | Создавать различные структуры, такие как цитоскелет |
| Гормоны | Инсулин, тироксин | Координировать деятельность различных систем организма |
| Защита | Иммуноглобулины | Защитить организм от чужеродных патогенов |
| Сократимость | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечить питание в раннем развитии эмбриона и саженец 9 0076 |
Таблица 3.1
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается многими различными типами химических связей. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки состоят из 20 наиболее распространенных типов аминокислот.
Аминокислоты
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атом водорода. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (Рисунок 3.24).
Рис. 3.24. Аминокислоты имеют центральный асимметричный атом углерода, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).
Название «аминокислоты» происходит от того факта, что они содержат как аминогруппу, так и карбоксильно-кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 общих аминокислот. Девять из них считаются незаменимыми аминокислотами у человека, потому что человеческий организм не может их производить, и они получают с пищей.Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 3.25).
Визуальное соединение
Рис. 3.25. Обычно в белках содержится 20 общих аминокислот, каждая из которых имеет свою группу R (группа вариантов), которая определяет его химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри?
- Полярные и заряженные аминокислоты будут обнаружены на поверхности.Неполярные аминокислоты можно найти в интерьере.
- Полярные и заряженные аминокислоты будут найдены в интерьере. Неполярные аминокислоты будут обнаружены на поверхности.
- Неполярные и незаряженные белки могут быть найдены как на поверхности, так и внутри.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R.Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (Рисунок 3.25).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, а у людей они включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь является пептидной связью (рис. 3.26).
Рис. 3.26. Образование пептидной связи — это реакция синтеза дегидратации.Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется больше аминокислот, полученная цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец.Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению или фосфорилированию или могут потребовать добавления других химических групп.Только после этих модификаций белок становится полностью функциональным.
Ссылка на обучение
Просмотрите этапы синтеза белка в этом интерактивном руководстве.
Почему процесс синтеза белка так важен для жизни?
- Белок является предпочтительным источником энергии для организма для быстрого производства энергии.
- Белок хранится в печени и мышцах, обеспечивая энергию для использования в будущем.
- Белок необходим для образования тканей и состоит из гормонов и ферментов.
- Белки необходимы для усвоения всех жирорастворимых витаминов.
Evolution Connection
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона. Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился.Секвенирование белков показало, что существует значительная гомология аминокислотной последовательности цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с от разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с.Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Белковая последовательность цитохрома с шимпанзе и человека идентична. Последовательность белка цитохрома с макак-резусов отличается от последовательности человека на одну аминокислоту.Что предлагают эти сравнения?
- Обезьяны-резусы более близки к людям, чем шимпанзе.
- Шимпанзе более тесно связаны с макаками-резусами, чем с людьми.
- Люди родственны шимпанзе, но не связаны с макаками-резусами.
- Шимпанзе более тесно связаны с людьми, чем макаки-резусы.
Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции.Например, фермент может связываться со специфическим субстратом в сайте, известном как активный сайт. Если этот активный сайт изменяется из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи — это ее первичная структура.Например, инсулин поджелудочной железы имеет две полипептидные цепи, А и В, и они связаны между собой дисульфидными связями. N-концевой аминокислотой A-цепи является глицин, а C-концевой аминокислотой — аспарагин (рис. 3.27). Последовательности аминокислот в цепях A и B уникальны для инсулина.
Рис. 3.27. Инсулин бычьей сыворотки — это белковый гормон, состоящий из двух пептидных цепей: A (длиной 21 аминокислота) и B (длиной 30 аминокислот). В каждой цепи первичная структура обозначена трехбуквенными сокращениями, которые представляют названия аминокислот в порядке их присутствия.Аминокислота цистеин (cys) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи A и B вместе, а третья помогает цепи A складываться в правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности показаны разные размеры.
Уникальная последовательность каждого белка в конечном итоге определяется геном, кодирующим этот белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка.При серповидно-клеточной анемии цепь гемоглобина β (небольшая часть которой показана на рисунке 3.28) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Примечательно, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Таким образом, молекула содержит около 600 аминокислот.Структурное различие между нормальной молекулой гемоглобина и молекулой серповидноклеточных клеток — что резко снижает продолжительность жизни — состоит в одной из 600 аминокислот. Что еще более примечательно, так это то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, а мутация вызвано одним изменением основания (точечной мутацией), 1 из 1800 оснований.
Рис. 3.28. Бета-цепь гемоглобина имеет длину 147 остатков, однако единственная аминокислотная замена приводит к серповидно-клеточной анемии.В нормальном гемоглобине аминокислота в седьмом положении — глутамат. В серповидно-клеточном гемоглобине этот глутамат заменен валином.
Из-за этого изменения одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные эритроциты и заставляют их принимать серповидную или серповидную форму, что закупоривает кровеносные сосуды ( Рисунок 3.29). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у людей, страдающих этим заболеванием.
Рис. 3.29. В этом мазке крови, визуализированном при 535-кратном увеличении с использованием светлопольной микроскопии, серповидные клетки имеют форму полумесяца, тогда как нормальные клетки имеют форму диска. (кредит: модификация работы Эда Усмана; данные шкалы от Мэтта Рассела)
Вторичная структура
Локальное сворачивание полипептида в некоторых областях приводит к вторичной структуре белка. Наиболее распространены листовые структуры α -спираль и β -складки (рис.30). Обе структуры удерживаются вместе водородными связями. В структуре α -спираль водородные связи образуются между атомом кислорода в карбонильной группе в одной аминокислоте и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рис. 3.30. Спираль α и складчатый лист β являются вторичными структурами белков, которые образуются из-за водородных связей между карбонильными и аминогруппами в основе пептида. Некоторые аминокислоты имеют склонность образовывать α -спираль, в то время как другие имеют склонность образовывать складчатый лист β .
Каждый виток в альфа-спирали содержит 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из -спиральной цепи . В листе с складками β «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи. Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки. Гофрированные сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе основной цепи пептида.Спиральные α и складчатые листовые структуры β обнаружены в большинстве глобулярных и волокнистых белков, и они играют важную структурную роль.
Третичная структура
Уникальная трехмерная структура полипептида — это его третичная структура (рис. 3.31). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка.Природа групп R, присутствующих в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка, тогда как гидрофильные группы R лежат снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, образующуюся во время сворачивания белка.
Рис. 3.31. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар. Инсулин начинается как отдельный полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи.Шелк (волокнистый белок), однако, имеет складчатую листовую структуру β , которая является результатом водородной связи между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на рис. 3.32.
Рис. 3.32 На этих иллюстрациях можно увидеть четыре уровня белковой структуры. (кредит: модификация работы Национального исследовательского института генома человека)
Денатурация и сворачивание белка
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе за счет химических взаимодействий.Если белок подвержен изменениям температуры, pH или воздействию химикатов, структура белка может измениться, потеряв форму без потери своей первичной последовательности в так называемой денатурации. Денатурация часто обратима, поскольку первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, позволяя белку возобновить свою функцию. Иногда денатурация необратима, что приводит к потере функции. Одним из примеров необратимой денатурации белка является жарение яйца.Белок альбумина в жидком яичном белке денатурируется при помещении на горячую сковороду. Не все белки денатурируются при высоких температурах; например, бактерии, которые выживают в горячих источниках, содержат белки, которые функционируют при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки как часть процесса пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции.Первоначально считалось, что сами белки несут ответственность за процесс сворачивания. Только недавно было обнаружено, что часто они получают помощь в процессе сворачивания от белков-помощников, известных как шапероны (или шаперонины), которые связываются с целевым белком во время процесса сворачивания. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и отделяются от белка, как только целевой белок сворачивается.
Ссылка на обучение
Чтобы получить дополнительную информацию о белках, просмотрите этот анимационный ролик под названием «Биомолекулы: белки.”
Веганы — это люди, которые не употребляют в пищу продукты животного происхождения. Почему веганам нужно уделять особое внимание белку, который они едят?
- Растительные белки содержат все незаменимые и заменимые аминокислоты.
- Сложнее получить все незаменимые аминокислоты из отдельных растительных источников.
- Растительные белки содержат только незаменимые аминокислоты.
- Белки растений не содержат всех незаменимых аминокислот, но содержат незаменимые аминокислоты.
Подключение к научной практике для курсов AP®
Подумай об этом
- Предскажите, что произойдет, если даже одна аминокислота будет заменена на другую в полипептиде, и представьте конкретный пример.
- Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой мембраны плазматической клетки?
Активность
Сворачивание — важное свойство белков, особенно ферментов.Белки имеют узкий диапазон условий, в которых они правильно сворачиваются; вне этого диапазона белки могут разворачиваться (денатурироваться) и часто не могут складываться заново и снова становиться функциональными. Изучите одно заболевание, которое возникает из-за неправильного сворачивания белка. Опишите причины разворачивания и последствия для молекулярной структуры полипептида, которые приводят к заболеванию.
Поддержка учителей
Первый вопрос «Подумай об этом» — это применение цели обучения 4.3 и научных практик 6.1 и 6.4, потому что студенты предсказывают, как изменение подкомпонентов молекулы может повлиять на свойства молекулы.
Второй вопрос «Подумай об этом» — это применение Задачи обучения 4.2 и Научной практики 1.3, потому что студенты используют представления молекул вместе с моделью клеточной мембраны, чтобы описать, как молекулярная структура аминокислот определяет их расположение с белком или другим. структура, такая как бислой фосфолипидов.
Это упражнение является применением Задачи обучения 4.1 и научная практика 7.1, цель обучения 4.2 и научная практика 1.3, а также цель обучения 4.3 и научная практика 6.1 и 6.4, потому что студентов просят объяснить, как факторы окружающей среды могут изменить молекулярную структуру белка и как это изменение может привести к изменению в функции, то есть болезни.
Биологические строительные блоки | CancerQuest
Клетка — основная единица жизни. Все организмы состоят из одной или нескольких клеток.Как будет показано ниже, люди состоят из многих миллионов клеток. Чтобы понять, что происходит при раке, важно понимать, как работают нормальные клетки. Первый шаг — обсудить структуру и основные функции клеток.
Сначала мы познакомимся с общими строительными блоками ячеек. Все клетки, независимо от их функции или расположения в организме, имеют общие черты и процессы. Удивительно, но клетки почти полностью состоят всего из четырех основных типов молекул.Выше показана клетка, окруженная примерами этих молекул строительных блоков.
Поскольку они присутствуют в живых существах, эти строительные блоки называются биомолекулами. В следующих разделах описываются структуры и функции каждого из этих основных строительных блоков. Дополнительную информацию по темам на этой странице также можно найти в большинстве вводных учебников по биологии, мы рекомендуем «Биология Кэмпбелла», 11-е издание.
Углеводы
Первый класс биомолекул, который мы обсудим, — это углеводы.Эти молекулы состоят из элементов углерода (C), водорода (H) и кислорода (O). Обычно эти молекулы известны как сахаров . Углеводы могут иметь размер от очень маленького до очень большого. Как и все другие биомолекулы, углеводы часто выстраиваются в длинные цепочки, связывая вместе более мелкие единицы. Это похоже на добавление бусинок к браслету, чтобы сделать его длиннее. Общий термин для отдельного звена или шарика — мономер . Термин для длинной цепочки мономеров — , полимер .
Примеры углеводов включают сахара, содержащиеся в молоке (лактоза) и столовый сахар (сахароза). Ниже представлена структура мономера сахара глюкозы, основного источника энергии для нашего тела.
Сфера Палка Поверхность Повернуть
Углеводы выполняют в клетках несколько функций. Они являются отличным источником энергии для множества различных процессов, происходящих в наших клетках. Некоторые углеводы могут иметь структурную функцию.Например, материал, который заставляет растения стоять высоко и придает дереву жесткие свойства, представляет собой полимерную форму глюкозы, известную как целлюлоза. Другие типы сахарных полимеров составляют запасенные формы энергии, известные как крахмал и гликоген. Крахмал содержится в растительных продуктах, таких как картофель, а гликоген — в животных. Ниже показана короткая молекула гликогена. Вы можете сами манипулировать молекулой, чтобы хорошо рассмотреть.
Палка Линия Заполнение пространства Повернуть
Углеводы необходимы клеткам для взаимодействия друг с другом.Они также помогают клеткам прилипать друг к другу и к материалу, окружающему клетки в организме. Способность организма защищаться от вторжения микробов и удаления инородных материалов из тела (например, улавливание пыли и пыльцы слизью в носу и горле) также зависит от свойств углеводов.
Узнайте больше о том, как доктор Майкл Пирс использует углеводы для исследования рака.
Белки
Как и углеводы, белки состоят из более мелких единиц.Мономеры, из которых состоят белки, называются аминокислотами . Существует около двадцати различных аминокислот. Структура простейшей аминокислоты, глицина, показана ниже.
Сфера Палка Повернуть
Белки выполняют множество функций в живых организмах, включая следующие:
- Они помогают формировать многие структурные элементы тела, включая волосы, ногти и мышцы.Белки являются основным структурным компонентом клеток и клеточных мембран.
- Они помогают транспортировать материалы через клеточные мембраны. Примером может служить захват глюкозы клетками из кровотока. Мы вернемся к этой важной способности, когда обсудим устойчивость раковых клеток к химиотерапевтическим агентам.
- Они действуют как биологические катализаторы. Большая группа белков, известных как ферменты, способна ускорять химические реакции, необходимые для правильной работы клеток.Например, существует множество ферментов, которые участвуют в расщеплении пищи, которую мы едим, и обеспечении доступности питательных веществ.
- Взаимодействия между клетками очень важны для поддержания организации и функционирования клеток и органов. Белки часто отвечают за поддержание контакта между соседними клетками и между клетками и их локальной средой. Хорошим примером может служить взаимодействие клеток: клетки, которые удерживают клетки нашей кожи вместе. Эти взаимодействия зависят от белков соседних клеток, которые плотно связываются друг с другом.Как мы увидим, изменения в этих взаимодействиях необходимы для развития метастатического рака.
- Белки работают, чтобы контролировать активность клеток, включая решения относительно деления клеток. Раковые клетки неизменно имеют дефекты в этих типах белков. Мы вернемся к этим белкам более подробно, когда будем говорить о регуляции деления клеток.
- Многие гормоны, сигналы, которые проходят по телу и изменяют поведение клеток и органов, состоят из белка.Ниже показан инсулин, небольшой белковый гормон, регулирующий усвоение глюкозы из кровотока.
Заполнение пространства Лента Проволочная рама Повернуть
Липиды
Термин липид относится к широкому спектру биомолекул, включая жиры, масла, воски и стероидные гормоны. Независимо от их структуры, местоположения или функции в клетке / теле, все липиды имеют общие черты, которые позволяют группировать их вместе.
- Не растворяются в воде; они гидрофобны.
- Как и углеводы, они состоят в основном из углерода, водорода и кислорода.
Гидрофобная природа липидов обуславливает их применение в биологических системах. Жиры являются хорошим источником накопленной энергии, а масла и воски используются для образования защитных слоев на нашей коже, предотвращая заражение. Некоторые липиды, стероидные гормоны, являются важными регуляторами клеточной активности. Мы вернемся к этому во время обсуждения информационного потока в ячейках.Активность стероидных гормонов, таких как эстроген, связана с раком женской репродуктивной системы. Процедуры, основанные на этих знаниях, будут подробно обсуждаться в разделе лечения на сайте.
Заполнение пространства Палка Проволочная рама Повернуть
Изображенный выше пример триацилглицерина или жира. Три длинные цепи состоят только из углерода и водорода, что придает молекуле гидрофобные свойства.Когда вы читаете о содержании насыщенных и ненасыщенных жиров на этикетке пищевых продуктов, они имеют в виду различия в этих длинных углеводородных цепях.
Основная функция липидов — образование биологических мембран. Клетки окружены тонким слоем липидов. Слой состоит из липидов особого типа, которые обладают как гидрофобными, так и гидрофильными свойствами. Гидрофильные концы этих молекул обращены к заполненной водой среде внутри клеток и водной среде вне клеток.Внутри двух слоев существует гидрофобная область. Мембрана, окружающая клетки, богата белками и другими липидами, такими как холестерин.
Большинство химических веществ не могут проникать через липидный бислой. Вода и некоторые другие небольшие молекулы могут свободно проходить через мембрану, в то время как другие молекулы должны активно транспортироваться через белковые каналы, встроенные в мембрану. Мембраны также содержат комбинацию биомолекул, которые были описаны до сих пор. Как видно выше, белки могут быть связаны с углеводами с образованием гликопротеинов.Гликопротеины играют важную роль в клетке: клеточные взаимодействия обсуждались ранее, и изменения количества или типов этих белков наблюдаются при раке. Точно так же сочетание липидов и углеводов приводит к образованию гликолипидов.
Нуклеиновые кислоты
Вся информация, необходимая для управления и построения клеток, хранится в этих молекулах.
Существует два основных типа нуклеиновых кислот: дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК).Обе эти молекулы являются полимерами. Они состоят из мономерных субъединиц, подобных ранее описанным углеводам и белкам. Мономеры, используемые для создания нуклеиновых кислот, называются нуклеотидами. Нуклеотиды часто обозначаются однобуквенными аббревиатурами A, C, G, T и U. Как и все мономеры, описанные до сих пор, мономеры, используемые для построения ДНК, похожи друг на друга, но не совсем похожи. Одно из различий между ДНК и РНК — это подмножество нуклеотидов, используемых для создания полимеров.ДНК содержит A, C, G и T, в то время как РНК содержит A, C, G и U.
Дезоксирибонуклеиновая кислота (ДНК)
ДНКсостоит из двух длинных цепочек (полимеров) нуклеотидов, скрученных друг вокруг друга и образующих спиральную или спиральную структуру, показанную ниже. Скрученные молекулы расположены определенным образом, причем определенные нуклеотиды всегда находятся напротив друг друга. Нуклеотид, содержащий аденин (A), всегда соединяется с нуклеотидом, содержащим тимин (T).Точно так же гуанин (G) всегда соединяется с цитозином (C). Если вы внимательно посмотрите на график ниже, вы увидите, что пары нуклеотидов взаимодействуют в середине спирали. Полимеры, образующие ДНК, могут быть очень длинными, достигая миллионов нуклеотидов на каждую отдельную молекулу ДНК. На следующем рисунке изображена короткая цепь двухцепочечной ДНК.
Сфера Палка Поверхность Повернуть
ДНКнаходится в ядре клетки, структура которой будет описана в следующем разделе сайта.Все ядерные клетки человеческого тела имеют одинаковое содержание ДНК независимо от их функции. Разница в том, какие части ДНК используются в той или иной клетке. Например, клетки, из которых состоит печень, содержат ту же ДНК, что и клетки, из которых состоят мышцы. Резко различающиеся активности этих двух типов клеток зависят от участков ДНК, которые активны в клетках. ДНК — это форма хранения генетической информации, которая действует как образец для клеток. Как мы увидим, изменения в последовательности ДНК могут приводить к изменениям в поведении клеток.Нерегулируемый рост, а также многие другие изменения, наблюдаемые при раке, в конечном итоге являются результатом мутаций, изменений в структуре ДНК.
Рибонуклеиновая кислотаРибонуклеиновая кислота (РНК) во многом похожа на ДНК. Это полимер нуклеотидов, который несет информацию, содержащуюся в генах. Помимо некоторых химических различий между РНК и ДНК, существуют важные функциональные различия.
- РНК копируется из ДНК в ядре, и большая часть ее отправляется в цитозоль.
- РНК — это рабочая форма информации, хранящейся в ДНК.
- РНК одноцепочечная, а не двухцепочечная
Информация, хранящаяся в ДНК, работает для клеток так же, как архитектор использует план. Конкретное производство РНК позволяет клетке использовать только те страницы «плана», которые требуются в любой конкретный момент. Очень важно производить правильные РНК в правильное время. При раке производство или регуляция определенных РНК не происходит должным образом.Точно так же, как неправильное прочтение чертежа приведет к возникновению дефектов в здании, неправильное производство РНК вызывает изменения в поведении клеток, которые могут привести к раку. Эта важная тема будет подробно рассмотрена в разделе, посвященном функции генов. Сначала мы исследуем более сложные формы биомолекул, а затем познакомимся с некоторыми ключевыми функциональными компонентами эукариотических клеток.
Комбинации
Теперь мы познакомились с основными классами биомолекул.
- углеводы
- липиды
- белков
- нуклеиновых кислот
Эти биомолекулы работают вместе, чтобы выполнять определенные функции и создавать важные структурные особенности клеток. Например, в разделе, посвященном липидам, мы впервые увидели схему мембраны ниже.
Помимо липидного бислоя, состоящего из липидов особого типа, мембрана содержит множество белков и сахаров. Как показано, белки и сахара можно комбинировать с образованием гликопротеинов.К липидам также можно добавлять сахара для образования гликолипидов.
Многие из белков, которые важны для развития и / или выявления рака, являются гликопротеинами. Например, диагностические тесты на рак простаты включают тестирование образцов крови на наличие гликопротеина, называемого специфическим антигеном простаты или ПСА. Рак яичников можно контролировать по выработке другого гликопротеина, называемого СА-125. CA означает связанный с раком.
Подробнее о тесте CA-125
Часто многие белки и другие биомолекулы соединяются вместе, образуя функциональные структуры в клетках.Далее мы исследуем некоторые из этих более сложных структур, называемых органеллами.
Сводка
Все живые существа, включая клетки, составляющие человеческое тело, состоят из небольшого подмножества различных биомолекул. Существует четыре основных класса, как описано ниже:
- Углеводы
- Углеводы состоят из элементов углерода (C), водорода (H) и кислорода (O).
- Сахар — это обычные углеводы.
- Углеводы внутри клеток выполняют несколько функций:
- Основной источник энергии
- Обеспечить структуру
- Связь
- Клеточная адгезия
- Защита от посторонних предметов и удаление посторонних предметов
- Белки
- Белки состоят из аминокислот.
- Белки внутри живых существ выполняют несколько функций:
- Структура волос, мышц, ногтей, компонентов клеток и клеточных мембран
- Транспорт клеток
- Биологические катализаторы или ферменты
- Поддержание контакта ячейки
- Контрольная активность клеток
- Передача сигналов через гормоны
- Липиды
- Широкий спектр биомолекул, включая жиры, масла, воски и стероидные гормоны.
- Липиды не растворяются в воде (они гидрофобны) и в основном состоят из углерода (C), водорода (H) и кислорода (O).
- Липиды выполняют в живых организмах несколько функций:
- Форма биологических мембран
- Жиры могут храниться в качестве источника энергии
- Масла и воски обеспечивают защиту путем покрытия участков, которые могут быть заражены микробами (например, кожа или уши)
- Стероидные гормоны регулируют активность клеток, изменяя экспрессию генов
- Нуклеиновые кислоты
- Вся информация, необходимая для управления и построения клеток, хранится в этих молекулах.
- Нуклеиновые кислоты состоят из нуклеотидов, обозначенных аббревиатурой A, C, G, T и U.
- Существует два основных типа нуклеиновых кислот, дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК):
- ДНК
- ДНК имеет структуру двойной спирали, состоящей из нуклеотидов A, C, G и T. ДНК
- находится в ядре клетки.
- ДНК — это форма хранения генетической информации.
- РНК
- РНК обычно одноцепочечная и состоит из нуклеотидов A, G, C и U. РНК
- скопирована с ДНК и является рабочей формой информации. РНК
- производится в ядре, а мРНК экспортируется в цитозоль.
- ДНК
Дополнительные биомолекулы могут быть получены путем объединения этих четырех типов. Например, многие белки модифицируются путем добавления углеводных цепей. Конечный продукт называется гликопротеином.
Если материал окажется для вас полезным, разместите ссылку на наш веб-сайт.
Обзор методов анализа белков | Thermo Fisher Scientific
Количественное определение концентрации белка является неотъемлемой частью любого лабораторного рабочего процесса, включающего экстракцию, очистку, маркировку или анализ белка. Тесты Pierce Protein Assays предоставляют широкий спектр возможностей для точного определения концентрации белка на основе времени анализа, чувствительности, совместимости, линейности стандартной кривой и вариации от белка к белку. Хотя в этой статье в качестве примеров используются продукты Pierce Protein Assay, обсуждаемые принципы и химический состав в целом применимы к большинству доступных колориметрических или флуориметрических методов анализа белка.
Вступление
Количественное определение белка часто необходимо перед обработкой образцов белка для выделения, разделения и анализа с помощью хроматографических, электрофоретических и иммунохимических методов. В зависимости от требуемой точности, количества и чистоты доступного белка для определения концентрации белка подходят разные методы.
Самый простой и прямой метод определения концентрации белка в растворе — это измерение оптической плотности при 280 нм (УФ-диапазон).Аминокислоты, содержащие ароматические боковые цепи (т. Е. Тирозин, триптофан и фенилаланин), обладают сильным поглощением УФ-света. Белки и пептиды поглощают УФ-свет пропорционально содержанию в них ароматических аминокислот и общей концентрации. Другой метод, традиционно используемый в аминокислотном анализе с помощью ВЭЖХ, заключается в маркировке всех первичных аминов (то есть N-конца и боковой цепи остатков лизина) цветным или флуоресцентным красителем, таким как нингидрин или о-фталевый альдегид (OPA). Подходы с прямым поглощением УФ-света и реагентами ВЭЖХ имеют особые недостатки, которые делают эти методы непрактичными для использования с типичными образцами белков в рабочих процессах протеомики.Метод УФ-поглощения не идеален для белковых смесей, поскольку разные белки имеют разное содержание ароматических аминокислот, что приводит к разным характеристикам поглощения. Кроме того, любое небелковое вещество, поглощающее УФ-свет, будет мешать измерениям.
Для преодоления этих недостатков было разработано несколько колориметрических и флуоресцентных методик анализа белков на основе реагентов, которые используются почти в каждой лаборатории, занимающейся исследованиями белков. К реагенту добавляют образцы белка, вызывая изменение цвета или усиление флуоресценции пропорционально добавленному количеству.Концентрацию протеина определяют по стандартной кривой, состоящей из известных концентраций очищенного эталонного протеина. Эти методы анализа белка можно разделить на две группы в зависимости от типа химии.
Таблица 1. Типы, преимущества, недостатки и примеры методов определения белка.
| Метод | Преимущества | Недостатки | Пример реагентов для анализа |
|---|---|---|---|
| Поглощение УФ-излучения |
|
| |
| Биуретовые методы: Белок-медное хелатирование и вторичное обнаружение восстановленной меди |
|
| BCA Assays Lowry Assays |
| Колориметрический краситель методы: Связывание белок-краситель и прямое определение изменения цвета |
|
| Брэдфорд (Кумасси) |
| Методы флуоресцентного окрашивания: Связывание белок-краситель и прямое обнаружение увеличения флуоресценции, связанного с связанный краситель |
|
| Флуоресцентный анализ EZQ Qubit Protein Assay |
Выбор анализа белка
Ни один реагент не может считаться идеальным или лучшим методом анализа белка.У каждого метода есть свои преимущества и недостатки. Выбор среди доступных анализов белка обычно основан на совместимости метода анализа белка с образцами. Кроме того, необходимо учитывать потенциальные мешающие вещества, включенные в образцы, которые могут повлиять на определенные методы анализа, а также на точность, воспроизводимость и желаемое время инкубации. Следовательно, успешное использование анализов белка включает выбор метода, который наиболее совместим с анализируемыми образцами, выбор подходящего стандарта анализа, а также понимание и контроль конкретных допущений и ограничений, которые остаются.
Цель состоит в том, чтобы выбрать метод, который требует наименьшего количества манипуляций или предварительной обработки образцов для размещения веществ, которые мешают анализу. У каждого метода есть свои преимущества и недостатки. Поскольку ни один реагент не может считаться идеальным или лучшим методом анализа белка для всех обстоятельств, большинство исследователей имеют в своих лабораториях более одного типа анализа белка.
Важными критериями для выбора анализа являются:
- Совместимость с типом образца и компонентами
- Диапазон анализа и требуемый объем образца
- Однородность белка к белку (см. Ниже)
- Скорость и удобство для количества образцов подлежит тестированию
- Наличие спектрофотометра или планшет-ридера, необходимого для измерения цвета (оптической плотности) при анализе
Некоторые распространенные вещества, которые потенциально мешают методам анализа белка, представляют собой восстанавливающие агенты (например.я. DTT) и моющие средства (например, Triton X-100). Как правило, образцы, содержащие восстанавливающие агенты или хелатирующие медь агенты, предпочтительно анализируются с помощью тестов на основе красителя Кумасси (метод Брэдфорда). Это связано с тем, что анализы на основе красителя Кумасси, такие как анализы Пирса Кумасси (Брэдфорд) и Пирса Кумасси Плюс (Брэдфорд), совместимы с восстанавливающими агентами и не требуют реакций связывания медь-белок. Для тех образцов, которые содержат детергенты, лучше всего подходят анализы на основе белка на основе меди, такие как анализ BCA Pierce Rapid Gold, поскольку они не ингибируются низкими или умеренными количествами детергента.
Помимо совместимости образцов, анализы белка также обычно группируются по диапазону концентраций белка, которые они могут обнаружить. Для образцов, в которых ожидается низкая концентрация белка (<20 мкг / мл), может потребоваться использование альтернативного протокола анализа на микропланшете или специализированного анализа, такого как анализ белка Pierce Micro BCA, который специально разработан для разбавленные образцы. Если общая концентрация белка в образцах высока (> 2000 мкг / мл), часто можно использовать разбавление образца для преодоления любых проблем с известными мешающими веществами.Иногда образец содержит вещества, которые делают его несовместимым с любым из методов анализа белка. Предпочтительный метод борьбы с этими типами мешающих веществ — просто удалить их.
Анализ белков BCA Pierce Rapid Gold и анализ белка Кумасси (Брэдфорд) дополняют друг друга и обеспечивают два основных метода анализа большинства образцов. Различные дополнительные реагенты и альтернативные версии этих двух анализов позволяют удовлетворить многие другие потребности в образцах.
Выбор стандарта белка
Поскольку белки различаются по аминокислотному составу, каждый из них по-разному реагирует на каждый тип анализа белка. Таким образом, лучший выбор для эталонного стандарта — это очищенная, известная концентрация белка, наиболее распространенного в образцах. Обычно этого невозможно достичь, и это редко бывает удобно или необходимо. Во многих случаях цель состоит в том, чтобы просто оценить общую концентрацию белка, и небольшая вариабельность между белками является допустимой.
Если высокоочищенная версия интересующего белка недоступна или слишком дорога для использования в качестве стандарта, альтернативой является выбор белка, который будет давать очень похожую кривую цветового отклика в выбранном методе анализа белка и легко доступны для любой лаборатории в любое время. Как правило, бычий сывороточный альбумин (BSA) хорошо подходит для стандарта белка, поскольку он широко доступен в высокой степени чистоты и относительно недорог. В качестве альтернативы, бычий гамма-глобулин (BGG) является хорошим стандартом при определении концентрации антител, поскольку BGG дает кривую цветового ответа, которая очень похожа на кривую иммуноглобулина G (IgG).
Для максимальной точности оценки общей концентрации белка в неизвестных образцах важно включать стандартную кривую каждый раз при проведении анализа. Это особенно верно для методов анализа белка, которые дают нелинейные стандартные кривые. Выбор количества стандартов и повторов, используемых для определения стандартной кривой, зависит от степени нелинейности стандартной кривой и требуемой степени точности. Как правило, требуется меньше точек для построения стандартной кривой, если цветовая характеристика является линейной.Обычно стандартные кривые строятся с использованием как минимум двух повторов для каждой точки кривой.
Подготовка проб для анализа белка
Перед анализом образца на общее содержание белка его необходимо растворить, обычно в забуференном водном растворе. Часто принимаются дополнительные меры предосторожности, чтобы подавить рост микробов или избежать случайного загрязнения образца посторонними предметами, такими как пыль, волосы, кожные или телесные масла.
В зависимости от исходного материала, который используется в процедурах перед проведением анализа белка, образец будет содержать множество небелковых компонентов.Знание этих компонентов имеет решающее значение для выбора подходящего метода анализа и оценки причины аномальных результатов. Например, ткани и клетки обычно лизируются буферами, содержащими поверхностно-активные вещества (детергенты), биоциды (антимикробные агенты) и ингибиторы протеаз. Также могут быть включены различные соли, денатурирующие агенты, восстанавливающие агенты и хаотропы. После фильтрации или центрифугирования для удаления клеточного мусора типичные образцы по-прежнему будут включать нуклеиновые кислоты, липиды и другие небелковые соединения.
На каждый тип анализа белка негативно влияют вещества того или иного вида. Компоненты белкового раствора считаются мешающими веществами в анализе белка, если они искусственно подавляют ответ, усиливают ответ или вызывают повышенный фон на произвольно выбранную степень (например, на 10% по сравнению с контролем).
Неточность из-за небольшого количества мешающего вещества может быть устранена путем приготовления стандарта белка в том же буфере, что и анализируемый белок.Для более высоких, несовместимых уровней мешающих веществ необходимы другие стратегии:
- Выберите другой метод анализа белка или версию того же метода анализа, которая включает компоненты для преодоления помех.
- Диализируйте или обессолите образец для удаления мелких мешающих веществ (т.е. менее 1000 дальтон), таких как восстановители.
- Осаждение белка в TCA или другом подходящем реагенте, удаление раствора, содержащего мешающий компонент, и повторное растворение белка для анализа.На этой иллюстрации представлен обзор того, как методы диализа белка используются для удаления веществ, которые могут загрязнять образцы белка и мешать последующим применениям.
Рис. 1. На схеме показано, как диализную кассету можно использовать для очистки от белка. 3 мл 1 мг / мл IgG в 0,1 М трис-буфере, pH 7, внутри диализной кассеты помещают в 1000 мл 100 мМ PBS, с pH 7,6. Старый диализат удаляют и заменяют 1000 мл 100 мМ PBS с pH 7.6. IgG слишком велик для проникновения в поры мембраны; следовательно, количество IgG внутри кассеты остается постоянным. Концентрация трис-буфера внутри кассеты падает ниже 0,01 М по мере диффузии трис-буфера и диффузии буфера PBS. Снова старый диализат отбрасывается и заменяется 1000 мл 100 мМ PBS с pH 7,6. IgG внутри кассеты остается постоянным. Уровень трис-буфера внутри кассеты падает почти до неопределяемого уровня. Буфер внутри кассеты представляет собой 100 мМ PBS с pH 7.6.
Различия между белками
Каждый белок в образце отвечает уникальным образом в данном анализе белка. Такое изменение от белка к белку относится к различиям в степени окраски (оптической плотности), получаемой при одновременном анализе одной и той же массы различных белков одним и тем же методом. Эти различия в цветовой реакции связаны с различиями в аминокислотной последовательности, изоэлектрической точке (pI), вторичной структуре и присутствием определенных боковых цепей или простетических групп.
В зависимости от типа образца и цели проведения анализа, вариация от белка к белку является важным фактором при выборе метода анализа белка и при выборе подходящего стандарта анализа (например, BSA по сравнению с BGG). Методы анализа белков, основанные на аналогичном химическом составе, имеют схожие вариации от белка к белку.
Рисунок 2. Стандартные кривые. Примеры стандартных кривых с использованием очищенного BSA и BGG с набором для анализа белков Pierce BCA, иллюстрирующие различия в интенсивности окраски двух разных белков.
Вариация белково-белковых анализов на белок
Протеиновые анализы различаются по своей химической основе для обнаружения специфичных для белков функциональных групп. Некоторые методы анализа обнаруживают пептидные связи, но ни один анализ не делает этого исключительно. Вместо этого каждый анализ белка обнаруживает одну или несколько различных конкретных аминокислот с большей чувствительностью, чем другие. Следовательно, белки с различным аминокислотным составом дают окраску с разной скоростью или интенсивностью в любом данном анализе белка.
В следующей таблице сравнивается вариабельность цветового ответа от белка к белку в нескольких анализах протеина Thermo Scientific Pierce. Эти данные служат в качестве общего руководства для оценки различий в ответах между образцами белка. Однако, поскольку сравнения проводились с использованием одной концентрации белка и буфера, их не следует использовать в качестве точных калибровочных коэффициентов.
Эта информация о вариабельности полезна при выборе стандарта белка. Например, когда анализируемый образец представляет собой очищенное антитело, бычий гамма-глобулин (BGG, белок № 5) будет более точным стандартом, чем бычий сывороточный альбумин (BSA, белок № 1).Эти данные также указывают на важность определения того, какой стандарт анализа использовался при сообщении результатов анализа белка.
Для каждого из представленных здесь анализов белков было проанализировано 14 белков с использованием стандартного протокола пробирки. Было рассчитано чистое (скорректированное на холостое значение) среднее поглощение для каждого белка. Чистое поглощение для каждого белка выражается как отношение к чистому поглощению для BSA (например, отношение 0,80 означает, что белок дает 80% цвета, полученного для эквивалентной массы BSA).Все концентрации белка составляли 1000 мкг / мл, за исключением анализа Micro BCA, концентрация которого составляла 10 мкг / молоко.
Таблица 2. Обзор протеиновых анализов.
| Результаты | BCA (Примечание 1) | Micro BCA | Modified Lowry | Coomassie4 plus 9 | Pierce 660 нм | |||||||||
| Относительная однородность | Высокая | Высокая | Высокая | Средняя | Низкая (Примечание 2) | Низкая | ||||||||
| Коэффициент вариации 14.7% | 11,4% | 11,9% | 28,8% | 38,2% | 37% | |||||||||
| Стандартное отклонение | 0,15 | 0,12 | 0,13 | 0,21 | 0,26 | 0,27 900 Среднее соотношение | 1,02 | 1,05 | 1,09 | 0,73 | 0,68 | 0,74 | ||
| Протестированные белки | ||||||||||||||
| 1. Альбумин, бычья сыворотка | 1.00 | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | ||||||||
| 2. Альдолаза, мышца кролика | 0,85 | 0,80 | 0,94 | 0,74 | 0,76 | . альфа-химотрипсиноген | 1,14 | 0,99 | 1,17 | 0,52 | 0,48 | — | ||
| 4. Цитохром С, сердце лошади | 0,83 | 1.11 | 0,94 | 1,03 | 1,07 | 1,22 | ||||||||
| 5. Гамма-глобулин, бычий | 1,11 | 0,95 | 1,14 | 0,58 | 0,56 | 0,51 8 | 1,21 | 1,12 | 1,29 | 0,63 | 0,58 | — | ||
| 7. IgG, человеческий | 1,09 | 1,03 | 1,13 | 0,66 | 0.63 | 0,57 | ||||||||
| 8. IgG, мышь | 1,18 | 1,23 | 1,20 | 0,62 | 0,59 | 0,48 | ||||||||
| 9. IgG, кролик | 1,12 | 1,12 | 0,43 | 0,37 | 0,38 | |||||||||
| 10. IgG, овцы | 1,17 | 1,14 | 1,28 | 0,57 | 0,53 | — | ||||||||
| 11. Инсулин, поджелудочная железа крупного рогатого скота 1 | 81,22 | 1,12 | 0,67 | 0,60 | 0,81 | |||||||||
| 12. Миоглобин, сердце лошади | 0,74 | 0,92 | 0,90 | 1,15 | 1,19 | 1,18 | 1,19 | . Яичный альбумин | 0,93 | 1,08 | 1,02 | 0,68 | 0,32 | 0,54 |
| 14. Трансферрин человеческий | 0,89 | 0,98 | 0.92 | 0,90 | 0,84 | 0,8 | ||||||||
| 15. Альфа-лактальбумин | — | — | — | — | — | 0,82 | ||||||||
| 16. Лизоцим | — | — | — | — | 0,79 | |||||||||
| 17. Ингибитор трипсина, соя | — | — | — | — | — | 0,38 | ||||||||
| Вариация от белка к белку анализов Thermo Scientific Pierce Protein Assays Примечания: 1.Анализ совместимости с восстанавливающими агентами (BCA-RAC) также показал низкий коэффициент вариации. 2. Анализ протеинов Bio-Rad Bradford, протестированный с теми же белками, что и наш анализ Кумасси (Брэдфорд), показал очень высокий коэффициент вариации (46%), соответствующий очень низкой относительной однородности. | ||||||||||||||
Расчеты и анализ данных
В большинстве анализов на белок концентрации белка в образце определяются путем сравнения их результатов анализа с ответами на серию разведений стандартов, концентрации которых известны.Образцы белка и стандарты обрабатываются таким же образом, смешивая их с реагентом для анализа и используя спектрофотометр для измерения оптической плотности. Отклики стандартов используются для построения или расчета стандартной кривой. Затем значения абсорбции неизвестных образцов интерполируются на график или формулу для стандартной кривой для определения их концентраций.
Очевидно, что наиболее точные результаты возможны только тогда, когда неизвестные и стандартные образцы обрабатываются одинаково.Это включает их анализ в одно и то же время и в одних и тех же буферных условиях, если это возможно. Поскольку задействованы различные этапы дозирования, повторения необходимы, если кто-то хочет рассчитать статистику (например, стандартное отклонение, коэффициент вариации) для учета случайной ошибки.
Рис. 3. Сравнение стандартных кривых для двухточечной и линейной аппроксимации. Интерполяция и расчет для исследуемого образца, имеющего оптическую плотность 0,6, приводят к значительно разным значениям концентрации белка.В этом случае метод «точка-точка» явно обеспечивает более точную контрольную линию для расчета тестового образца.
Хотя большинство современных спектрофотометров и планшет-ридеров имеют встроенное программное обеспечение для анализа данных анализа белков, технические специалисты часто неправильно понимают некоторые факторы. Потратив несколько минут на изучение и правильное применение принципов, задействованных в этих расчетах, можно значительно расширить возможности разработки анализов, дающих наиболее точные результаты (см. Соответствующие технические советы и ссылки).
Количественный анализ пептидов
Для рабочих процессов, использующих протеомику с использованием масс-спектрометрии, важно измерить концентрацию пептидов после этапов переваривания, обогащения и / или очистки C18, чтобы нормализовать вариации от образца к образцу. В частности, для экспериментов с использованием изобарической маркировки критически важно обеспечить маркировку равных количеств образца перед смешиванием, чтобы получить точные результаты.
Подобно методам анализа белка, доступны различные варианты определения концентрации пептида.Исторически для измерения концентраций пептидов использовались методы анализа белков в УФ-видимой области (A280) или колориметрические, основанные на реагентах. Часто используются анализы BCA и микро-BCA. Хотя эти стратегии хорошо работают с образцами белков, эти реагенты не предназначены для точного определения пептидов. Альтернативно, количественные анализы пептидов — в колориметрическом или флуорометрическом формате — доступны для специфического количественного определения смесей пептидов. При выборе формата колориметрического или флуорометрического анализа на микропланшете для количественного анализа пептидов необходимо учитывать следующие важные критерии:
- Совместимость с типом образца, компонентами и рабочими процессами
- Диапазон анализа и требуемый объем образца
- Скорость и удобство для количество образцов для тестирования
- Наличие спектрофотометра или флуорометра, необходимого для измерения результатов анализа
Эти репрезентативные данные сравнивают результаты, полученные с помощью колориметрического и флуориметрического анализов.
Рис. 4. Количественное сравнение колориметрического и флуориметрического анализа пептидов. Триптические пептидные гидролизы получали из двенадцати клеточных линий. Концентрации перевариваемых пептидов определяли с использованием количественного колориметрического анализа пептидов Thermo Scientific Pierce и наборов для количественного флуориметрического анализа пептидов Pierce в соответствии с инструкциями. Каждый образец анализировали в трех экземплярах, и концентрацию каждого гидролизата рассчитывали по стандартной кривой, построенной с использованием стандарта анализа протеинового переваривания.
Рекомендуемая литература
- Брэдфорд, ММ. (1976) Быстрый и чувствительный метод количественного определения количества белка в микрограммах, использующий принцип связывания белок-краситель. Аналитическая биохимия. 72, 248-254.
- Смит П.К., Крон Р.И., Хермансон Г.Т. и др. (1987) Измерение белка с использованием бицинхониновой кислоты. Аналитическая биохимия. 150, 76-85.
- Крон, Р.И. (2002). Колориметрическое определение и количественное определение общего белка, Current Protocols in Cell Biology, A.3H.1-A.3H.28, John Wiley & Sons, Inc.
- Крон, Р.И. (2001). Колориметрическое определение общего белка, Текущие протоколы аналитической химии пищевых продуктов, B1.1.1-B1.1.27, John Wiley & Sons, Inc.
- Lowry, O.H., Rosebrough, N.
